Агент для связывания жиров, полученный из биомассы, образующейся в процессе пивоварения - RU2608233C2
Код документа: RU2608233C2
Чертежи
Описание
Настоящее изобретение относится к области медицины и питания, в частности к пищевым добавкам для применения для контроля за массой тела и снижения уровня жиров, негативно влияющих на сердечно-сосудистую систему.
УРОВЕНЬ ТЕХНИКИ
Нездоровые пищевые привычки и образ жизни нашего общества привели к все возрастающей проблеме, связанной со здоровьем населения. Согласно существующей градации в рамках рекомендуемой пирамиды ежедневного приема пищи, наиболее критическими моментами, как было обнаружено, является избыточное потребление насыщенных жирных кислот и холестерина. Рекомендуется 7% насыщенных жирных кислот с точки зрения потребляемой энергии и <250 мг/день холестерина, хотя в реальности указанные значения достигают 15% и 350 мг/день, соответственно. Избыток потребляемой энергии обусловлен, главным образом, избыточным потреблением насыщенных жиров, тогда как избыточное потребление холестерина вызвано избыточным потреблением животных продуктов.
Все эпидемиологические исследования свидетельствуют, что чрезмерное потребление богатой жиром пищи, сопровождающееся уменьшением расхода энергии за счет физической активности, приводит к появлению ряда широко распространенных расстройств здоровья, избыточному весу/ожирению и гиперхолестеринемии, причисляемым к наиболее серьезным расстройствам. Наряду с ухудшением качества жизни, избыточный вес и ожирение связывают в качестве причинных факторов с серьезными неблагоприятными состояниями здоровья, включающими сердечно-сосудистые заболевания, сахарный диабет 2 типа, проблемы с мышечно-скелетной системой и рак. С другой стороны, полагают, что гиперхолестеринемия, поскольку она приводит к атеросклерозу, является основным фактором риска развития коронарных заболеваний сердца - основной причины смерти в развитых странах.
В связи с вышеизложенным, отпускаемые без рецепта гиполипидемические средства, которые могли бы способствовать уменьшению массы тела и понижению уровня холестерина, становятся все более популярными. В результате, независимо от их варьирующей и не всегда в полной мере обоснованной эффективности, на рынке продается множество безрецептурных гиполипидемических пищевых добавок. Среди указанных добавок хитозан, доступный в форме капсул и таблеток, рекламируется как препарат, способный как понизить холестерин, так и вызвать быструю потерю веса.
Хитозан представляет собой полиаминосахарид, полученный из хитина. Хитин, один из наиболее обильно возобновляемых органических ресурсов в природе, обнаруживаемый, главным образом, в наружном скелете ракообразных, с химической точки зрения представляет собой линейный полимер, состоящий из N-ацетил-D-глюкозаминовых звеньев и D-глюкозаминовых звеньев, связанных β-(1-4)-гликозидной связью, причем N-ацетил-D-глюкозаминовые звенья в такой полимерной цепи преобладают. Деацетилированную форму хитина называют хитозаном. Хитин обычно относят к сополимеру со степенью ацетилирования более 40% [т.е. количеством N-ацетил-D-глюкозамина более 40% и количеством D-глюкозамина менее 60%], при этом хитин нерастворим в разбавленных кислотах. Название хитозан применяют для сополимера с степенью ацетилирования (DA) менее 40% [т.е. СД (степень деацетилирования) более 60%, количество N-ацетил-D-глюкозамина менее 40% и количество D-глюкозамина более 60%], который в большинстве случаях будет растворим в разбавленной кислоте. Хитин и хитозан с химической точки зрения можно рассматривать как аналоги целлюлозы, в которой гидроксилы при углероде-2 были заменены на ацетамидо- и аминогруппы, соответственно. Хитозан обладает ярко выраженными химическими и биологическими свойствами, связанными с присутствием нескольких аминогрупп в его молекулах. Его можно использовать в различных процессах, включая медицинское лечение, что возможно благодаря отличной биосовместимости и физиологической инертности хитозана.
Хитин и хитозан обнаружены в качестве придающих жесткость материалов у многих водных организмов (в раковинах креветок и крабов и в костяных пластинах кальмаров и каракатиц), у многих насекомых, у наземных ракообразных (Armadillidium vulgare, Porcellio scaber), у нематод, в грибах, и в некоторых микроорганизмах (дрожжах, грибках и водорослях). Раковины водных животных содержат приблизительно 30-40% белка, 30-50% карбоната кальция и 20-30% хитина в пересчете на сухое вещество. Указанные пропорции меняются в зависимости от вида ракообразного и сезона. Традиционно хитин производят путем декальцинации и депротеинизации раковин крабов или креветок, что включает растворение карбоната кальция в растворе кислоты и удаление белков в щелочной среде или с помощью ферментов, соответственно. Хитозан также можно получить путем деацетилирования хитина с помощью горячего щелочного раствора и на стадии изменения окраски. Такой способ получения хитозана характеризуется рядом неблагоприятных особенностей. Например, указанный способ требует применения дорогостоящей тепловой энергии и едкой щелочи, которая представляет собой потенциальную опасность для здоровья. Указанный способ также приводит к образованию больших количеств отходов, что, тем самым, требует значительных расходов на их удаление. Кроме того, поставка раковин креветок или крабов сильно зависит от сезонных и экологических факторов, что приводит к непредсказуемым ограничениям производственной мощности и нестабильным физико-химическим характеристикам конечных продуктов, предназначенных для использования в медицине и сельском хозяйстве. Кроме того, хитозан, полученный из раковин креветок, может передавать в конечный продукт антигены, что может вызвать аллергии у потребителя. Таким образом, хотя хитозан клинически хорошо переносится, его нельзя рекомендовать людям, имеющим аллергию на ракообразных. Указанные проблемы можно обойти путем выделения хитозана из других источников.
Настоящее исследование направлено на извлечение чистого хитозана из компонентов клеточных стенок грибков. С этой целью N. Nwe с соавторами исследовал связь между хитозаном и глюканом в грибковой клеточной стенке для разработки ферментативного способа получения очень чистого хитозана из грибка Gongroella butleri с высоким выходом (N. Nwe et al. 2010, «Production of fungal chitosan by enzymatic method and applications in plant tissue culture and tissue engineering: eleven years of our progress, present situation and future prospects» Biopolymers, edited by Magdy Elnashar, published: September 28, 2010, chapter 7, pp. 135-162).
В ЕР 1483299 описан способ, позволяющий отделить хитин от β-глюканов контролируемым путем без разрушения или превращения хитиновых цепей. Указанный способ основан на приведении в контакт грибковых клеток Aspergillus niger с щелочным раствором, приведении в контакт нерастворимой в щелочи фракции с кислым раствором, и, тем самым, получение суспензии подкисленной нерастворимой в щелочи фракции, содержащей указанные производные клеточной стенки, и в конце приведение в контакт указанной суспензии с β-глюканазными ферментами с получение продукта, представляющего собой хитин, или с хитиндезацетилазой с получение продукта, представляющего собой хитозан.
Одним из применений хитозана является применение в качестве пищевой антилипидемической добавки, при котором вследствие ограниченного гидролиза под действием пищеварительных ферментов человека хитозан проходит по пищеварительной системе до толстой кишки практически интактным, эффективно действуя подобно пищевому волокну. Как полагают, хитозан уменьшает всасывание жиров из желудочно-кишечного тракта путем связывания с анионными карбоксильными группами жирных и желчных кислот и препятствует эмульгированию нейтральных липидов (т.е. холестерина, других стеринов) путем их связывания с помощью гидрофобных связей. Антигиперлипидемический потенциал хитозана был изучен как in vivo, так и in vitro. Исследования in vivo включают испытания, проводимые как на животных, так на людях, и состоят из определения различных параметров, главным образом, массы тела, уровней липидов в сыворотке и концентраций липидов в экскрементах. Удивительно, но приведенные данные являются противоречивыми. Хотя испытания на животных в основном показали уменьшение влияния хитозана на массу тела и уровни холестерина (Н. Yao et al., «Effect of chitosan on plasma lipids, hepatic lipids, and fecal bile acid in hamsters human trials failed to show these effects» J. Food Drug Anal. 2006, vol. 14, pp. 183-189), испытания на людях не показали такие эффекты (M.D. Gades et al., «Chitosan supplementation and fat absorption in men and women» J. Am. Diet. Assoc. 2005, vol. 105, pp. 72-77, C.N. Mhurchu et al., «Effect of chitosan on weight loss in overweight and obese individuals: a systematic review of randomized controlled trials» Obes. Rev. 2005, vol. 6, pp. 35-42).
Составы пищевых добавок на основе хитозана похожи, но не идентичны. Сам хитозан представляет собой продукт химического деацетилирования сырьевого материала - хитина, при этом степень деацетилирования продукта меняется в зависимости от условий реакции. Некоторые факторы при обработке, такие как степень деацетилирования и молекулярная масса молекул, соотношение хитин/хитозан, растворимость, ионная сила, рН, размер частиц, и температура, влияют на получение хитозана и его свойства. Можно ожидать, что эффективность хитозана будет зависеть от его физико-химических свойств. Однако не было установлено корреляции между связывающей способностью и измеренными физико-химическими свойствами хитозана. Наряду с прочим, это указано в исследовании, в котором описана способность связывать желчные кислоты, способность связывать жиры, способность к набуханию, степень деацетилирования и вязкость 11 выбранных препаратов хитозана в растворе (K. Zhou et al., «In vitro binding of bile acids and triglycerides by selected chitosan preparations and their physico-chemical properties» Food Science and Technology 2006, vol. 39, pp. 1087-1092).
Пищевые добавки на основе хитозана продают в качестве «ловушек жира» и «жировых магнитов». Рекламные утверждения в отношении некоторых из указанных добавок могут дать потребителю несбыточные ожидания. Хотя согласно рекламным объявлениям такие добавки способны как понизить холестерин, так и привести к быстрой потере массы тела, они одновременно могут вызвать антипитательные эффекты вследствие их способности также улавливать молекулы на основе липидов, которые являются полезными для здоровья человека, такие как растворимые в жирах витамины А, D, Е, K, холестерин липопротеинов высокой плотности, растительные стерины и полиненасыщенные жирные кислоты, такие как омега жирные кислоты 3 и 6.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении предложена богатая полисахаридами композиция, содержащая бета-глюкан, хитин и хитозан, извлеченные из клеточной стенки Saccharomyces cerevisiae из биомассы, представляющей собой побочный продукт процесса пивоварения, способ получения указанной композиции и ее применение. Так как композиция согласно изобретению богата полисахаридами (хитином, хитозаном и бета-глюканом), в настоящем описании ее называют «богатой полисахаридами композицией». «Композиция», «продукт» и «композиция согласно изобретению» также используют взаимозаменяемо и относятся к композиции согласно настоящему изобретению.
Соответственно, первый аспект настоящего изобретения относится к способу получения богатой полисахаридами композиции, содержащей бета-глюкан, хитин и хитозан, извлеченные из клеточной стенки Saccharomyces cerevisiae из биомассы, представляющей собой побочный продукт процесса пивоварения, включающему следующие стадии:
i) подготовку реактора с помощью раствора NaOH при концентрации от 0,25 до 3 М при перемешивании и температуре от 50 до 95°С;
ii) добавление к указанному раствору биомассы, полученной в процессе пивоварения;
iii) поддержание указанных условий в течение по меньшей мере 1 ч;
iv) охлаждение указанного раствора до комнатной температуры;
v) нейтрализация раствора путем по меньшей мере однократного добавления кислого раствора или воды до достижения рН 7, причем в случае проведения более чем однократного добавления между добавлениями осуществляют стадию отделения твердого продукта от указанного раствора;
vi) отделение твердого продукта, полученного на стадии (v), от указанного раствора;
vii) после проведения нейтрализации на стадии (v) путем добавления кислого раствора передачу твердого продукта на по меньшей мере однократную промывку водой и отделение полученного твердого продукта; и
viii) сушку твердого продукта до постоянной массы и тонкое измельчение.
Другой аспект настоящего изобретения состоит в обеспечении композиции, получаемой по способу, описанному выше.
С учетом оказания на человека нескольких положительных эффектов, композицию согласно изобретению можно применять в качестве терапевтического или профилактического средства. Таким образом, другой аспект настоящего изобретения относится к композиции согласно изобретению для применения в качестве профилактического и/или терапевтического средства. В частности, композиция применима для предотвращения и/или лечения у животного, в том числе, у человека, расстройства, выбранного из группы, состоящей из избыточного веса, ожирения, гиперхолестеринемии, гипертриглицеридемии, гипертонии и сердечно-сосудистых расстройств. В настоящем изобретении описано применение композиции для производства лекарственного средства для предотвращения и/или лечения упомянутых выше расстройств. Этот аспект можно альтернативно сформулировать как способ предотвращения и/или лечения у животного, в том числе, у человека, расстройства, выбранного из группы, состоящей из избыточного веса, ожирения, гиперхолестеринемии, гипертриглицеридемии, гипертонии и сердечно-сосудистых расстройств, включающий введение указанному животному, нуждающемуся в этом, эффективного количества композиции согласно изобретению.
Еще один аспект настоящего изобретения относится к композиции согласно изобретению для применения в качестве средства для связывания жиров в пищеварительном тракте.
В другом аспекте композицию согласно изобретению можно применять в качестве детоксицирующего средства.
В другом аспекте композицию согласно изобретению можно применять в качестве иммуностимулирующего средства.
Другой аспект настоящего изобретения относится к фармацевтическому и/или ветеринарному средству, содержащему эффективное количество композиции, описанной выше, совместно с подходящими количествами фармацевтически или ветеринарно приемлемых вспомогательных веществ. В настоящей заявке термин «эффективное количество» означает количество активного вещества, достаточно высокое для обеспечения требуемого благоприятного воздействия, но достаточно низкое для избежания побочных эффектов в рамках медицинских представлений.
Дополнительный аспект настоящего изобретения относится к съедобному продукту, содержащему эффективное количество композиции согласно изобретению совместно с подходящими количествами других съедобных ингредиентов.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Клеточные стенки Saccharomyces cerevisiae могут содержать от 20 до 30% сухой клеточной массы. Указанная масса главным образом состоит из маннопротеинов и бета-глюканов и меньших количеств хитина и липидов. Соотношение указанных компонентов может варьировать в зависимости от штаммов и условий культивирования. Как было описано выше, в данной области техники существуют способы выделения хитозана из компонентов грибковых клеточных стенок. С другой стороны, в данной области техники также описаны способы получения бета-глюканов из дрожжей и, в частности, из Saccharomyces cerevisiae. В WO 91/03495 описаны способы получения растворимых глюканов для стимулирования выработки тромбоцитов. Один из способов начинается с обработки целых глюкановых частиц, предварительно полученных из высушенных пекарских дрожжей согласно процедуре, описанной Jamas с соавторами в US 4810646, и включает дополнительные стадии растворения нерастворимых глюкановых частиц. Другой способ, описанный в примере 2 указанной патентной заявки, относится к последовательности стадий обработки для получения растворимых глюканов из выбранного штамма S.cerevisiae.
Таким образом, несмотря на то, что в данной области техники описаны способы получения с одной стороны хитина/хитозана и с другой стороны бета-глюканов из дрожжей, качество и количество конечного продукта, извлеченного из грибного мицелия, зависят от происхождения гриба, условий его роста (состава сбраживаемой среды: источника и концентрации углерода, источника и концентрации азота, а также ионов металлов и их концентрации; и условий брожения: размера инокулята, времени сбора, температуры сбраживания); и от стадий процесса извлечения.
В настоящем изобретении описан промышленный способ получения богатой полисахаридами композиции. Указанный способ включает стадии, описанные в предыдущем разделе. Реактор получают с применением раствора NaOH при концентрации от 0,25 до 3 М при перемешивании и температуре от 50 до 95°С. Согласно конкретным вариантам реализации настоящего изобретения концентрацию NaOH выбирают из 0,25, 0,50, 0,75, 1,0, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9 и 3 М. В частности, концентрация NaOH составляет от 0,25 до 1,5 М. Более конкретно, концентрация NaOH составляет 0,25 М. Согласно другому конкретному варианту реализации изобретения концентрация NaOH составляет 1 М.
Согласно другому варианту реализации настоящего изобретения обработку раствором NaOH в реакторе выполняют при температуре, выбранной из 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94 и 95°С. В частности, температура составляет от 65 до 85°С, и более конкретно 80°С.
Согласно одному из вариантов реализации настоящего изобретения после охлаждения раствора (стадия (iv)), раствор нейтрализуют путем добавления кислого раствора для достижения рН 7 и твердую фазу отделяют от раствора. В частности, кислый раствор представляет собой раствор фосфорной кислоты, раствор HCl или раствор уксусной кислоты. Далее, твердый продукт передают на по меньшей мере одну промывку водой. Между промываниями твердый продукт отделяют от раствора.
Согласно другому варианту реализации настоящего изобретения стадию нейтрализации осуществляют путем по меньшей мере однократного добавления воды, в частности дистиллированной воды. Если осуществляют более чем однократное добавление, стадию отделения твердого продукта от раствора осуществляют в промежутке между добавлениями. При осуществлении нейтрализации путем добавления воды нет необходимости промывать твердую фазу после нейтрализации, но такую промывку можно выполнить при необходимости получения более чистого твердого продукта.
Согласно конкретному варианту реализации настоящего изобретения до проведения нейтрализации указанный способ включает стадию, которая состоит в отделении твердого продукта от раствора после охлаждения. Отделение осуществляют, например, путем центрифугирования. При промышленном масштабе партия 2, например, была сделана при добавлении такой стадии.
Согласно конкретному варианту реализации настоящего изобретения биомассу, полученную в процессе пивоварения, добавляют в реактор в количестве от 1:2 до 1:5. В частности, это количество составляет 1:3. Указанное количество выражено как влажная биомасса: раствор NaOH. Как видно из примеров, таким способом были приготовлены партии 2-4 при добавлении биомассы в количествах 1:3 (партия 2 и 3) и 1:2 (партия 4). Если указанные количества выразить в пересчете на высушенный продукт, количества, применяемые в указанном примере, будут составлять 1:39 и 1:23, соответственно.
Таким образом, биомассу, представляющую собой побочный продукт процесса пивоварения, можно добавить в реактор вместе с раствором NaOH, направляя непосредственно из процесса пивоварения. Соответственно, такая биомасса является влажной (в настоящей заявке ее называют «влажной биомассой»), поскольку содержит примеси процесса пивоварения.
Биомассу, представляющую собой побочный продукт процесса пивоварения, можно также ввести в реактор в высушенном виде. Следовательно, согласно другому варианту реализации изобретения способ дополнительно включает предварительную обработку биомассы, полученной в процессе пивоварения, перед добавлением биомассы к раствору NaOH. Предварительная обработка включает следующие стадии: (а) просеивание биомассы для отделения биомассы Saccharomyces cerevisiae от примесей процесса пивоварения; (b) сушку биомассы S.cerevisiae, полученной на стадии (а); и (с) измельчение продукта S.cerevisiae, полученного на стадии (b). В этом случае высушенный продукт S.cerevisiae добавляют в реактор в количестве от 1:20 до 1:40 мас./об. В частности, указанное количество составляет 1:30 мас./об. Как видно из примеров, таким способом была приготовлена партия 1 при добавлении биомассы в количестве 1:30.
Указанные условия в реакторе поддерживают в течение по меньшей мере 1 часа. В частности, условия поддерживают от 5 до 20 ч и, предпочтительно в течение 16 ч. Согласно другому варианту реализации изобретения реакция заняла 10 ч (см., например, партию 4).
Конечный продукт сушат и в конце подвергают тонкому измельчению. Продукт предпочтительно помещают в стеклянные лотки и сушат в вакуумной печи при 60°С до постоянной массы и затем подвергают тонкому измельчению. Сушку можно выполнить под вакуумом для уменьшения длительности процесса. Согласно конкретному варианту реализации изобретения сушку осуществляют путем распылительной сушки продукта до содержания растворителя ниже 5% по массе.
Настоящее изобретение охватывает все возможные комбинации конкретных условий, описанных в настоящей заявке. Приведенные ниже примеры (партии 1-4) показывают, что определенные условия реакции и стадии процесса могут варьировать без значительного изменения характеристик продукта (как можно видеть в разделе 9.4 при описании примеров).
В результате указанного процесса получают композицию, содержащую бета-глюкан, хитин и хитозан, полученные из клеточной стенки S.cerevisiae. Согласно одному из вариантов реализации настоящего изобретения соотношение хитозана, хитина и бета-глюкана в композиции составляет от 1:10:80 до 1:20:150. Согласно другому варианту реализации настоящего изобретения растворимость композиции при рН 3,5 в дистиллированной воде составляет от 650 до 800 мг/л. Согласно другому варианту реализации настоящего изобретения процентное содержание на основе атомной массы углерода, водорода и азота в композиции составляет, соответственно, от 36 до 44% для углерода, от 5,5 до 7% для водорода и от 0,2 до 0,8% для азота.
Согласно конкретному варианту реализации настоящего изобретения процесс получения композиции осуществляют при концентрации NaOH 0,25 М при 80°C с применением в реакторе высушенного продукта S.cerevisiae в количестве 1:30 мас./об. при времени реакции 16 ч. Химические свойства композиции, полученной при указанных условиях, описаны ниже в разделе 2 ПРИМЕРЫ. В частности, соотношение хитозана, хитина и бета-глюкана в композиции составляет 1:14:116; растворимость композиции при рН 3,5 в дистиллированной воде составляет 710 мг/л; и процентное содержание на основе атомной массы углерода, водорода и азота в композиции составляет 40,32, 6,35 и 0,24%, соответственно.
Согласно конкретному варианту реализации настоящего изобретения процесс получения композиции проводят при концентрации NaOH 0,25 М, при 80°C с применением в реакторе влажной биомассы S.cerevisiae в количестве 1:3, при времени реакции 16 ч. Перед стадией нейтрализации продукт отделяют от раствора после охлаждения. Согласно конкретному варианту реализации изобретения полученный продукт имеет свойства, описанные в разделе 9.4 Партия 2.
Согласно конкретному варианту реализации настоящего изобретения процесс получения композиции проводят при концентрации NaOH 0,25 М, при 80°C с применением в реакторе влажной биомассы S.cerevisiae в количестве 1:3 при времени реакции 16 ч. После гидролиза смесь сразу же нейтрализуют путем добавления кислого раствора (без первого центрифугирования реакционной смеси). После нейтрализации смесь центрифугируют и затем промывают. Согласно конкретному варианту реализации изобретения полученный продукт имеет свойства, описанные в разделе 9.4 Партия 3.
Согласно конкретному варианту реализации настоящего изобретения процесс получения композиции проводят при концентрации NaOH 0,32 М при 80°C с применением в реакторе влажной биомассы S.cerevisiae в количестве 1:2 при времени реакции 10 ч. После гидролиза смесь сразу же нейтрализуют путем добавления кислого раствора (без первого центрифугирования реакционной смеси). После нейтрализации смесь центрифугируют и затем промывают. Согласно конкретному варианту реализации изобретения полученный продукт имеет свойства, описанные в разделе 9.4 Партия 4.
β-Глюканы известны как модификаторы биологического отклика благодаря их способности активировать иммунную систему. Кроме того, Европейское агентство по безопасности продуктов питания (EFSA) согласно недавнему научно-обоснованному мнению пришло к выводу, что между потреблением бета-глюканов и снижением концентраций холестерина в крови можно установить причинно-следственную связь. Пищевым компонентом, который подвергался исследованию, были бета-глюканы, которые представляли собой растворимые злаковые волокна. Что касается контроля за массой тела, ни одна из ссылок, предоставленных EFSA, не касается влияния потребления бета-глюкана на массу тела, поэтому экспертная группа пришла к выводу, что между потреблением бета-глюканов и поддержанием или достижением нормального веса причинно-следственную связь не была установлена (Scientific Opinion on the substantiation of health claims related to beta glucans and maintenance of normal blood cholesterol concentrations (ID 754, 755, 757, 801, 1465, 2934) and maintenance or achievement of a normal body weight (ID 820, 823) pursuant to Article 13(1) of Regulation (EC) №1924/2006 EFSA Journal 2009; vol. 7(9) pp. 1254 [18 pp.]).
Неожиданно оказалось, что в клинических испытаниях на людях композиция согласно изобретению на основе смеси бета-глюканов и хитина/хитозана, выделенных из биомассы Saccharomyces cerevisiae, полученной в процессе пивоварения, проявляла липид-специфический снижающий эффект, а также эффект понижения массы тела и уменьшение окружности талии.
Демонстрационные примеры, приведенные ниже, показали, что композиция согласно изобретению приводила к значительному усилению способности улучшать липидный профиль потребления. Согласно конкретному варианту реализации настоящего изобретения композиция имеет жиросвязывающую способность, по меньшей мере в 10 раз большую ее массы, как определено согласно анализу, включающему: i) приведение хлопкового масла в контакт с композицией в кислом растворе в течение двух часов при 37°С и при постоянном перемешивании; ii) центрифугирование раствора для отделения хлопкового масла, связанного с композицией, от несвязанного хлопкового масла, присутствующего в надосадочной жидкости; iii) смешивание надосадочной жидкости с гексаном и центрифугирование смеси; и iv) извлечение верхней фазы центрифугированной смеси, что позволяет гексану испаряться, и взвешивание несвязанного хлопкового масла. Указанный анализ также подробно описан в разделе 3 ПРИМЕРЫ.
Кроме того, описанные ниже демонстрационные примеры показали, что животные, которых кормили продуктом согласно настоящему изобретению, проявляли меньшее увеличение массы тела по сравнению с похожими коммерческими связывателями жиров, используемыми в качестве контрольных групп. Эффективность потребления энергии (г прибавленного веса на ккал съеденного корма) представляет собой величину, которая четко показывает эффективность продукта с точки зрения уменьшения всасывания. В этом случае продукт согласно настоящему изобретению понижал общее всасывание жиров, измеряемое как общая эффективность питания, по сравнению с контрольными группами. Потребление продукта согласно настоящему изобретению не приводило к значительному увеличению фекальной экскреции у животных. Такой же вывод нельзя сделать для группы, принимавшей коммерческий продукт (хитозан S). Продукт хитозан S приводил к чрезвычайно высоким значениям экскреции и сухого вещества. Этот факт, в отличие от того, что происходит с продуктом согласно настоящему изобретению, означает, что имеется неселективный эффект в случае продукта хитозан S, который не будет специфически связывать жир, но связывает многие другие питательные вещества. Таким образом, продукт согласно настоящему изобретению имеет преимущество, состоящее в отсутствии антипитательных эффектов, оказываемых другими коммерческими связывателями жиров, как показано в приведенных примерах. Селективное связывание жиров представляет большой интерес, поскольку экскреция насыщенных жирных кислот значительно возрастала после потребления продукта DAMM. Далее и по всему тексту настоящего документа продукт, получаемый в результате процесса, описанного в разделе ПРИМЕР 1, также называют «продуктом DAMM» или «партией 1». Экскреция мононенасыщенных жирных кислот возрастала, хотя результаты не были статистически значимыми, тогда как экскреция полиненасыщенных жирных кислот не увеличивается.
Жиросвязывающее действие продукта согласно настоящему изобретению было также продемонстрировано in vivo на людях. Результаты функциональных клинических испытаний на людях показали снижение массы тела на 0,7 кг и уменьшение окружности талии на 2 см, в то время, как группа, принимавшая плацебо, в целом демонстрировала увеличение на 1,4 кг после лечения в течение 3 месяцев. После приема продукта наблюдали уменьшение общего содержания жира в организме на 0,82%. Наблюдали перераспределение жира, в результате которого происходило уменьшение ее накопления в брюшной области. Такое перераспределение связано с потенциальным положительным воздействием, направленным на уменьшение факторов риска сердечно-сосудистых заболеваний, гипертензии и диабета. На основании указанных результатов можно сделать вывод, что предложенный продукт способствует потере массы тела, при этом общее уменьшение массы составляет 2,1 кг и уменьшение окружности талии составляет 2 см после 3 месяцев лечения. Указанные результаты являются клинически значимыми, поскольку результаты уменьшения массы и окружности талии были получены в отсутствии специальной ограничительной диеты и в течение короткого времени лечения (3 месяцев).
Помимо действия в виде селективного уменьшения всасывания входящих в рацион жиров, композиция согласно изобретению также проявляла биофункциональные возможности при метаболизме глюкозы. В пероральных тестах толерантности к глюкозе на животной модели максимальная концентрация глюкозы в крови, в частности, в момент непосредственно после приема пищи, продемонстрировала снижение по сравнению с отрицательным контролем и одинаковый порядок при положительном контроле с применением коммерческого препарата.
Продукт согласно настоящему изобретению также продемонстрировал, что его можно использовать в качестве детоксицирующего агента, поскольку он захватывает различные соответствующие токсичные вещества: микотоксин афлатоксин В1, ртуть, полихлорированные бифенилы (ПХБ 209) и фуран.
Другие воспроизведения способа получения композиции позволили получить гомогенный продукт, который сохранял такие же описанные биологические функциональные свойства. Таким образом, преимущество способа и продукта согласно изобретению состоит в том, что свойства и полезность конечного продукта не зависят от сырьевого материала, как это имеет место в случае хитина/хитозана, извлеченного из ракообразных. Дополнительным и важным преимуществом является то, что с помощью способа согласно настоящему изобретению можно получать идентичный материал в течение всего года; и извлеченная композиция не содержит тяжелые металлы, такие как никель, медь, которые присутствуют в композициях, выделенных из ракообразных.
Согласно другому варианту реализации изобретения способ получения богатой полисахаридами композиции включает вторую термощелочную обработку для изменения степени деацетилирования хитина. Таким образом, после нейтрализации и отделения твердого продукта, полученного в результате первой реакции, продукт направляют на вторую обработку с применением NaOH при концентрации от 25 до 50% при температуре от 40 до 80°С и при времени реакции от 30 до 240 минут. В частности, концентрацию NaOH выбирают из 25, 37,5 и 50%. Температуру реакции выбирают между 40, 60 и 80°С; и время выбирают между 30, 120, 135 и 240 минутами. Как показано ниже в демонстрационных примерах (раздел 7), продукты, полученные в результате такой обработки, применимы в качестве детоксицирующих агентов, поскольку они способны захватывать различные важные токсичные вещества: микотоксин афлатоксин В1, ртуть, полихлорированные бифенилы (ПХБ 209) и фуран.
Согласно другому варианту реализации изобретения фракции, полученные в результате такой второй термощелочной обработки, можно применять в качестве иммуностимулирующих средств, как показано ниже в демонстрационном примере (раздел 7). В частности, в исследовании in vivo, принимающие добавки животные проявляли улучшенные защитные свойства против бактериальных инфекций вследствие увеличения процентного содержания активированных клеток с окислительной активностью. Конкретная композиция, применимая в качестве иммуностимулирующего средства, представляет собой композицию, полученную путем гидролиза исходного продукта в течение 30 минут с применением 25% NaOH при 40°С, полученную способом, описанным в разделе 1 ПРИМЕРЫ.
В настоящем изобретении также предложены фармацевтические и/или ветеринарные продукты, которые содержат эффективное количество композиции согласно изобретению совместно с соответствующими количествами фармацевтически или ветеринарно приемлемых вспомогательных веществ. В этом отношении фармацевтический продукт можно получить для перорального введения в форме таблеток, пилюль, капсул, микрокапсул, гранул, суспензий, сиропов, сухих порошков, жидких препаратов и т.п. Выбор вспомогательных веществ и наиболее подходящих способов приготовления с учетом конкретной цели композиции находится в рамках компетенции обычных специалистов в области технологии фармацевтического производства. Пероральное введение является предпочтительным.
В настоящей заявке термин «фармацевтически приемлемый» относится к соединениям, материалам, композициям и/или лекарственным формам, которые в рамках разумных медицинских представлений подходят для применения при контакте с тканями субъекта (например, человека), не вызывая избыточной токсичности, раздражения, аллергической реакции или другой проблемы или осложнения, в соответствии с разумным соотношением польза/риск. Каждый носитель, вспомогательное вещество и т.п. также должен быть "приемлемым» в смысле совместимости с другими ингредиентами состава. Подходящие носители, вспомогательные вещества и т.п. можно обнаружить в стандартных фармацевтических текстах. Подобным образом, термин "ветеринарно приемлемый" означает подходящий для применения при контакте с тканями животных, не относящихся к человеку.
Кроме того, композиция согласно изобретению может включать различные съедобные продукты, такие как молочный продукт, йогурт, творог, сыр (например, кварк, творожный сыр, обработанный, мягкий и твердый), кисломолочный продукт, сухое молоко, сброженный продукт на основе молока, мороженое, сброженный продукт на основе зерновых, порошок на основе молока, напиток, заправка и корм для животных. В настоящей заявке термин "съедобный продукт" применяют в самом широком смысле, включающем любой вид продукта, изготовленный в любой форме, которую животное может принять вовнутрь, но за исключением фармацевтических и ветеринарных средств. Примерами других съедобных продуктов являются мясные продукты (например, печеночный паштет, сосиска и колбасы типа салями или мясные пасты), шоколадные пасты, начинки (например, трюфельные, сливочные) и глазури, шоколад, кондитерские изделия (например, карамель, помадки или тоффи), хлебобулочные изделия (кексы, кондитерская выпечка), соусы и супы, фруктовые соки и забеливатели кофе. Особенно интересными съедобными продуктами являются пищевые добавки и детские смеси. С точки зрения настоящего изобретения, пищевые добавки также включают нутрицевтики, которые, как известно, представляют собой экстракты из пищевых продуктов, оказывающие лечебный эффект на здоровье человека. В объем настоящего изобретения также включены фуражные растения для корма для животных. Композиции согласно настоящему изобретению также можно использовать в качестве ингредиента в других продуктах питания. Соответственно, в другом аспекте настоящего изобретения, предложен съедобный продукт, содержащий композицию согласно изобретению совместно с подходящими количествами съедобных ингредиентов. Композиция согласно изобретению предпочтительно представляет собой пищевую добавку. При применении композиции согласно настоящему изобретению в качестве пищевой добавки, она может быть введена сама по себе или ее можно смешать с подходящей пригодной для питья жидкостью, такой как вода, йогурт, молоко или фруктовый сок, или указанную композицию можно смешать с твердой или жидкой пищей. В этом контексте пищевая добавка может находиться в форме таблеток, пилюль, капсул, гранул, порошков, суспензий, саше, пастилок, конфет, плиток, сиропов и соответствующих лекарственных форм, обычно в форме однократной дозы. Композицию согласно изобретению предпочтительно вводят в форме порошка в капсуле или формируя пилюлю, изготавливаемую общепринятыми способами получения фармацевтических продуктов. Согласно другому предпочтительному варианту реализации изобретения композиция присутствует в форме порошка внутри колпачка флакона и ее можно легко растворить в пригодной для питья жидкости. Специалист в данной области техники может установить подходящие режимы введения композиции согласно изобретению. Композицию согласно изобретению можно вводить один раз в день, один раз в неделю, несколько дней в неделю или несколько раз в день.
Композицию согласно настоящему изобретению можно приготовить в виде съедобного, фармацевтического или ветеринарного продукта, в котором композиция представляет собой единственное действующее вещество или ее смешивают с одним или более другими действующими веществами и/или ее смешивают с фармацевтически или ветеринарно приемлемыми вспомогательными веществами (в случае фармацевтического или ветеринарного средства) или соответствующими добавками (в случае съедобного продукта).
Таким образом, понятно, что субъект может получить пользу благодаря функциональным возможностям продукта согласно настоящему изобретению независимо от формы введения, т.е. съедобного, фармацевтического или ветеринарного продукта. Указанные биологические функциональные возможности представляют собой свойства, рассмотренные в настоящем описании, и включают эффекты по связыванию жиров и их соответствующее применение для предотвращения и/или лечения расстройства, такого как избыточная масса тела, ожирение, гиперхолестеринемия, гипертриглицеридемия, гипертония и сердечно-сосудистые расстройства. Биофункциональные возможности также включают эффект связывания глюкозы, детоксицирующее действие и иммуностимулирующее действие.
В приведенных ниже разделах подробно описан способ получения композиции согласно изобретению, а также свойства композиции, в том числе их жиросвязывающие эффекты, исследованные с помощью анализов in vitro и анализов in vivo на животных и людях. Следующие примеры и чертежи приведены для иллюстрации и не предполагают ограничить настоящее изобретение. Полученные результаты демонстрируют, что композиция согласно изобретению имеет улучшенные свойства по сравнению с другими коммерческими продуктами, представляющими собой связыватели жиров.
Если не указано иное, все технические и научные термины, применяемые в настоящей заявке, имеют те же значения, которые обычно понимает специалист в области техники, к которому относится указанное изобретение. Способы и материалы, аналогичные или эквивалентные способам и материалам, описанным в настоящей заявке, можно использовать при практической реализации настоящего изобретения. В описании и формуле изобретения слово «содержит» и его варианты не предназначены для исключения других технических свойств, добавок, компонентов или стадий. Дополнительные предметы, преимущества и особенности настоящего изобретения будут очевидны специалистам в данной области техники после рассмотрения описания или могут быть изучены при практической реализации настоящего изобретения. Кроме того, настоящее изобретение охватывает все возможные комбинации конкретных и предпочтительных вариантов реализации изобретения, описанных в настоящей заявке.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
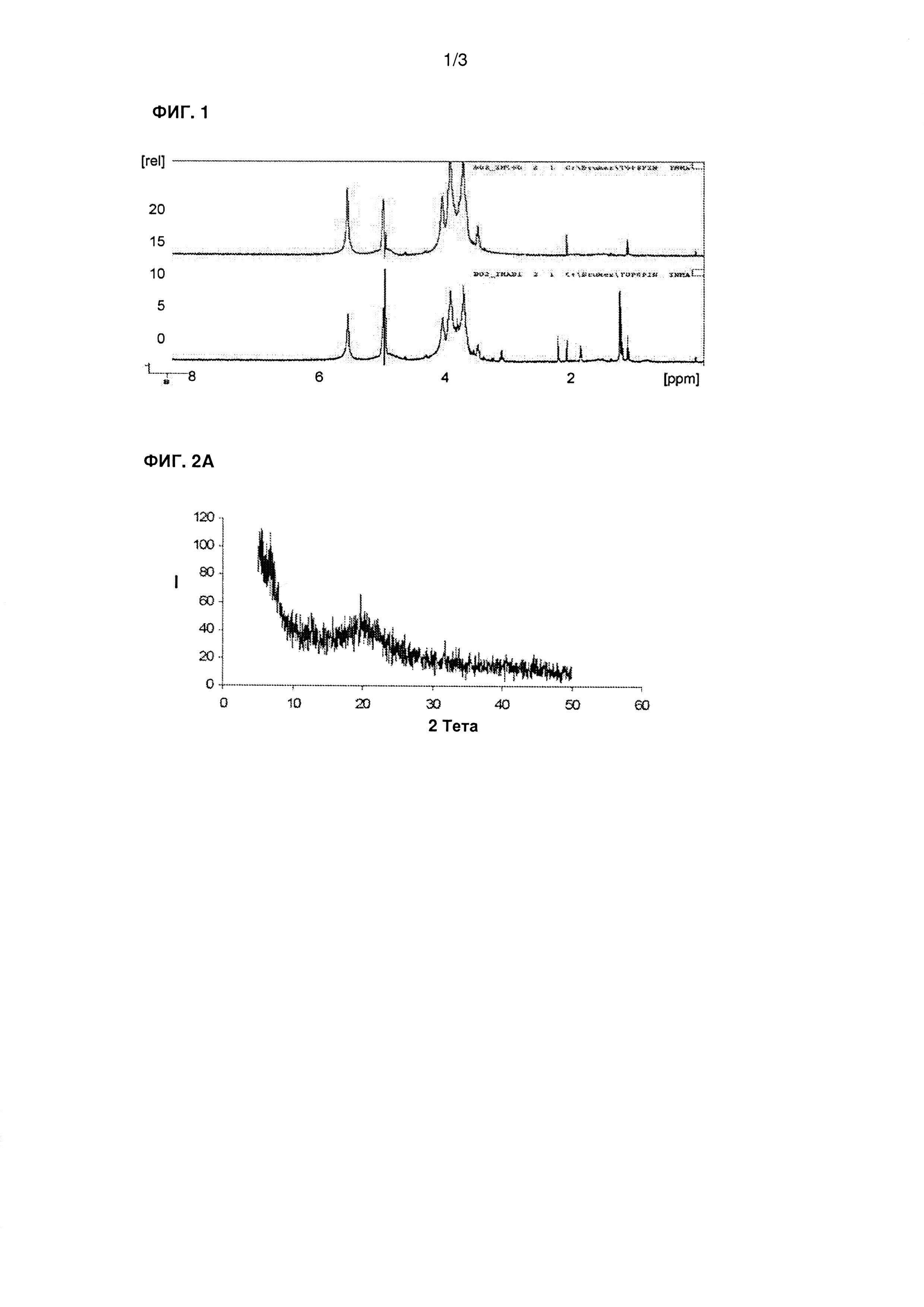
На фиг. 1 показан1Н-ЯМР спектр продукта DAMM (нижний спектр) по сравнению с продуктом, предварительно полученным в лабораторных масштабах (С60, верхний спектр).
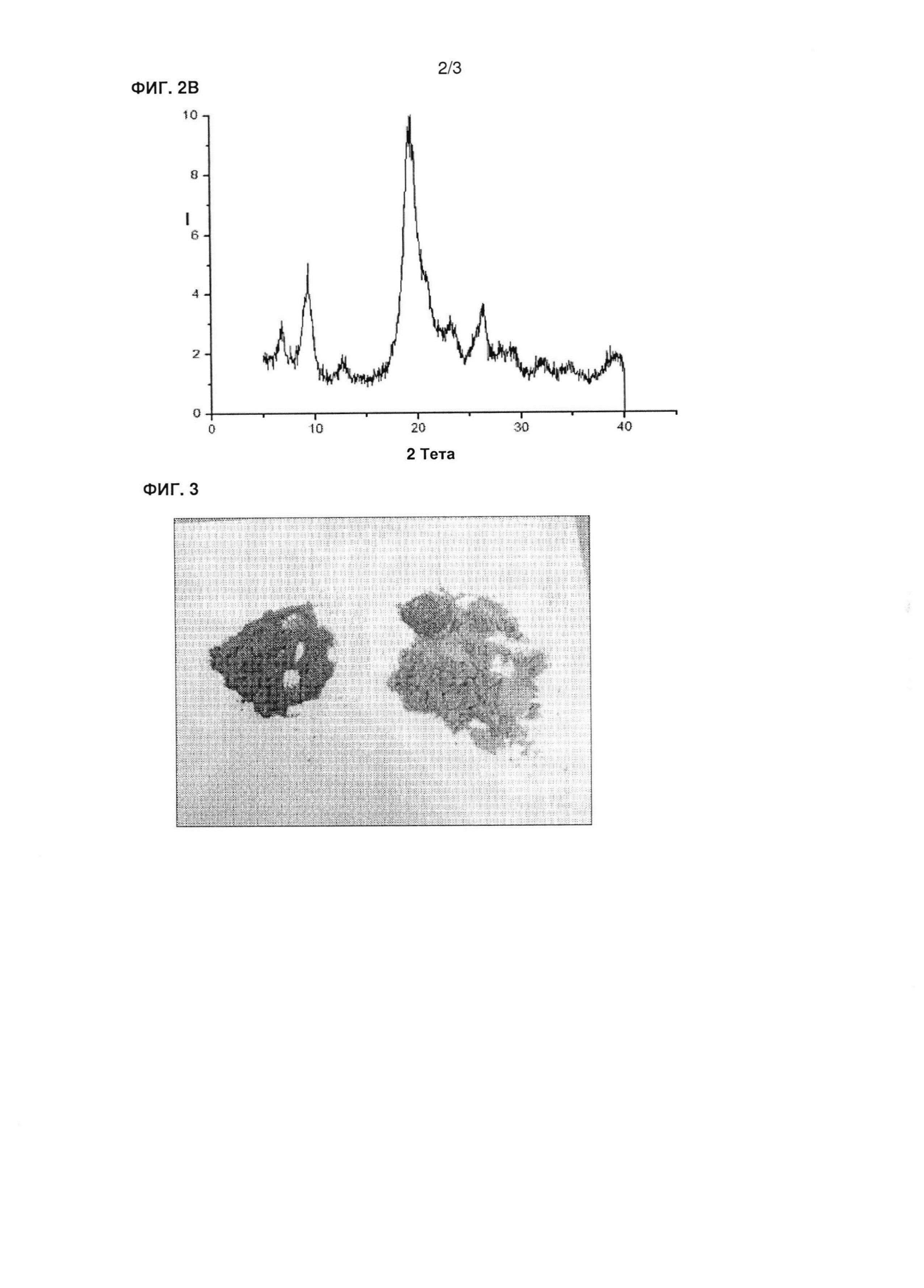
На фиг. 2 показаны дифрактограммы (рентгеновские) продукта DAMM (фиг. 2А) и чистого хитина (хитин из раковин крабов Sigma, С3641) (фиг. 2В).
На фиг. 3 показан конечный продукт в форме светло-коричневого мелкодисперсного порошка.
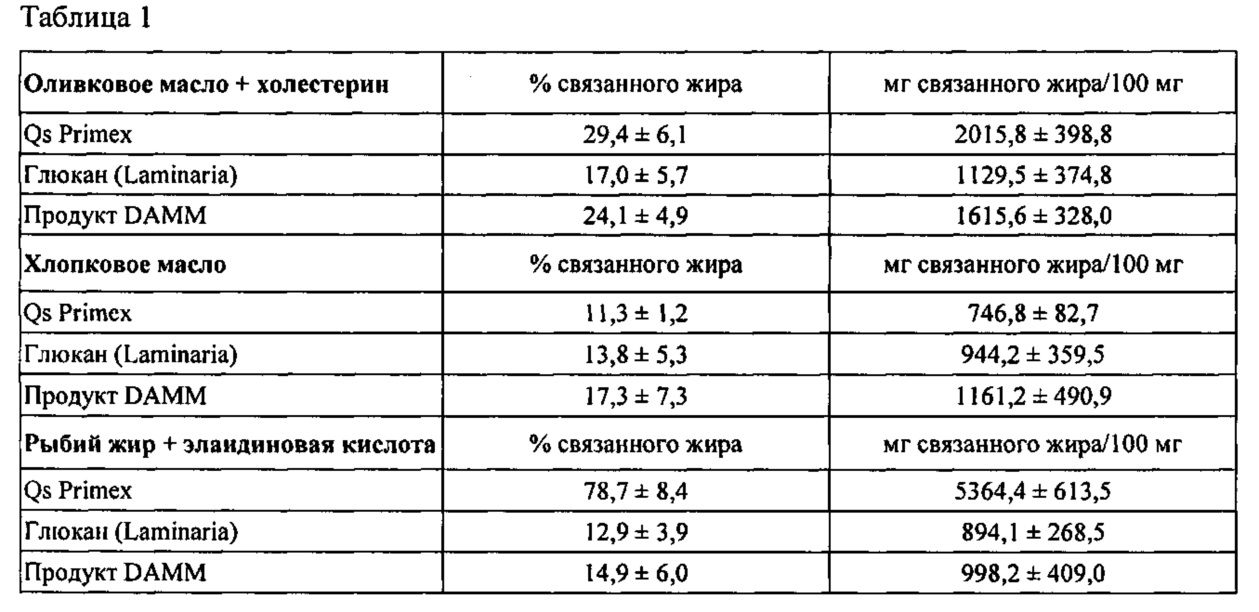
На фиг. 4 показаны1Н-ЯМР спектры продуктов партии 4 (верхний спектр), партии 3 (средний спектр) и партии 2 (нижний спектр).
ПРИМЕРЫ
ПРИМЕР 1. Способ получения богатой полисахаридами композиции («продукт РАММ»)
Источник Saccharomyces cerevisiae, применяемый в качестве исходного материала, получали при его повторном восьмикратном использовании в процессе пивоварения. Данный побочный продукт процесса пивоварения просеивали через сито 1 мм для отделения биомассы S.cerevisiae от примесей процесса пивоварения. Полученную биомассу S.cerevisiae сушили в нагревателе и измельчали с получением порошка.
Влажность дрожжевой биомассы определяли с помощью анализатора влажности IR Sartorius МА30. Приготавливали реакционную среду путем загрузки реактора дистиллированной водой, установки скорости перемешивания при 150 об/мин, добавления количества NaOH, необходимого для получения 1 М раствора NaOH, и затем нагревания реакционной среды при 80°С. Дрожжевую биомассу взвешивали до соотношения сухая дрожжевая биомасса/объем реакционной среды 1/30. Дрожжевую биомассу добавляли в горячую реакционную среду и реакцию поддерживали в течение 16 ч. После окончания времени реакции продукт охлаждали до комнатной температуры. Далее, полученный объем реакционной смеси загружали в инертный контейнер. Регулировали рабочие условия для непрерывного центрифугирования, установив время центрифугирования 120 секунд и время загрузки (разгрузки) 2 секунд. Центрифугирование осуществляли путем загрузки центрифуги (Centrifuge GEA Westfalia СТС 1 (WhisperFuge™)) продуктом реакции из контейнера при комнатной температуре, используя перистальтический насос (расход 3 л/мин). После такого первого центрифугирования полученную твердую фазу собирали в контейнер и нейтрализовали дистиллированной водой. С этой целью последовательно добавляли объемы дистиллированной воды при постоянном перемешивании и регулировании рН смеси. Конечный объем смеси составлял примерно 50% объема реакционной смеси, и значение рН составляло от 9 до 10. Полученный объем нейтрализованной смеси снова центрифугировали и процесс нейтрализации-центрифугирования повторяли, как описано выше, до достижения рН 7. Пять циклов центрифугирования/нейтрализации было достаточно для достижения рН 7. Конечный продукт при рН 7 промывали дистиллированной водой при перемешивании до полного растворения твердой фазы. Конечный объем такого раствора составлял приблизительно 25% от объема реакционной смеси. Полученный объем смеси снова центрифугировали при комнатной температуре и при расходе 3 л/мин, как описано выше. Продукт, полученный на описанной выше стадии, концентрировали путем прерывистого центрифугирования с применением центрифуги Eppendorf 5804R. В конце, полученный продукт подвергали распылительной сушке при следующих рабочих условиях и технических характеристиках распылительной сушилки: размер камеры распыления = Ø 1200×745 мм; материал в контакте с продуктом =нержавеющая сталь AIS 316; наружный материал: AISI 304; циклон = Ø 300; частота вращения = 24400 об/мин; мощность вращения = 3,5 кВт вращения; максимальный расход воздуха (всасываемый воздух) = 990 м3/ч; максимальная температура всасываемого воздуха = 250°С; максимальная мощность батарей для подачи воздуха = 27 кВт; перистальтический насос для введения жидкости: автоматическая/ручная регулировка скорости.
В следующих экспериментах продукт, полученный способом, описанным в этом разделе, также называют "продуктом DAMM" или «партией 1».
Процесс проводили в полупромышленных условиях при варьировании концентрации NaOH от 1 М до 0,25 М. Для оценки возможности сохранения биофункциональных свойств продукта при изменении масштаба проводили тесты на связывание жиров in vitro, и данные тесты имели положительные результаты.
ПРИМЕР 2. Определение характеристик продукта
Результаты1Н-ЯМР анализа, представленные на фиг. 1, показали, что продукт DAMM, полученный в полупромышленных условиях (нижний спектр) содержит одинаковые функциональные группы по сравнению с продуктом, полученным предварительно в лабораторных условиях (верхний спектр) (на чертеже такой продукт называют «C60»). На фиг. 2 показаны дифрактограммы (рентгеновские) продукта DAMM (фиг. 2А) и чистого хитина (фиг. 2В). На фиг. 3 приведен внешний вид продукта DAMM.
Химический анализ показал, что соотношение хитозана, хитина и бета-глюкана в продукте DAMM составляло 1:14:116 и процентное содержание на основе атомной массы углерода, водорода и азота составляло 40,32, 6,35 и 0,24% соответственно. Растворимость продукта при рН 3,5 в дистиллированной воде составляла 710 мг/л.
ПРИМЕР 3. Жиросвязываюшие эффекты: анализы селективности in vitro
Анализы на связывание жиров и селективность при улавливании жиров посредством ГЖХ-МС выполняли с применением следующих липидов:
- Оливковое масло + холестерин (25 мг холестерина/мл оливкового масла)
- Хлопковое масло
- Рыбий жир + элаидиновая кислота (2,5 мг элаидиновой кислоты/мл рыбьего жира)
Аргументы в пользу использования указанных, а не других жиров, были следующими:
- Указанные жиры представляют собой сложные смеси липидов, так что получают информацию о большем или меньшем сродстве в отношении различных типов жирных кислот. Кроме того, указанная ситуация близка к реальному потреблению.
- Применение рыбьего жира представляет большой интерес для исследования степени сродства в отношении докозагексаеновой кислоты (DHA) и эйкозапентаеновой кислоты (ЕРА), что вследствие их значительной полезности для здоровья представляет интерес с точки зрения избежания их иммобилизации.
- Введение холестерина в пробы с оливковым маслом предоставляет информацию о способности связывать один из наиболее опасных жиров из животного источника.
- При применении указанных продуктов можно оценить степень сродства в отношении захвата в общей сложности 16 жирных кислот, более или менее полезных или вредных для здоровья сердечно-сосудистой системы.
Исследуемыми «жиросвязывающими» продуктами были продукт DAMM, коммерческий хитозан с 82% степенью деацетилирования от компании Primex («Chitoclear», Исландия) («Qs Primex») и глюкан от компании Laminaria (Laminaria digitata Sigma, L9634).
Применяемый протокол был следующим: Для каждого жиросвязывающего продукта, подлежащего исследованию, приготавливали 12 мл раствора (мас./об.) при рН 2 с применением 0,5 М HCl. К такому раствору добавляли 3 г липидов и перемешивали при 300 об/мин в течение 3 ч при 37°С. Затем рН раствора увеличивали с помощью ОД М NaOH сначала до рН 6,2 и затем до максимального значения рН 6,5 и поддерживали при перемешивании при 37°С в течение 2,5 ч. Затем раствор центрифугировали при 2000 g при 37°С для отделения жира, не связанного с продуктом. Несвязанный жир удаляли пипеткой, соблюдая осторожность, чтобы не засосать водную фазу. Раствор подкисляли с помощью 0,5 М HCl для растворения жиросвязывающего продукта и выделения как можно большего количества жира. Водную фазу экстрагировали три раза с помощью 5 мл гексана и в конце объединяли три органических экстракта для испарения при 40°С во взвешенном контейнере. В конце высушенный жир взвешивали для определения количества жира, которое связыватели жира не смогли связать. Результаты показаны в таблице 1.
Продукт DAMM показал заметно более низкую жиросвязывающую способность по сравнению с Qs Primex в случае рыбьего жира + элаидиновой кислоты. Такой результат очень важен, поскольку он представляет интерес с точки зрения избежания иммобилизации компонентов рыбьего жира (DHA и ЕРА) полезных для здоровья.
В экспериментах по селективному связыванию жира, было приведено конечное значение улучшения в %. Это значение получено из вычитания % каждой жирной кислоты %, приведенного для контрольного необработанного образца. Результаты показаны в таблицах 2, 3 и 4. Приведенные величины имели положительный или отрицательный знак в зависимости от целебной силы или токсичности каждого жира. В приведенных ниже таблицах, «сл.» означает следы; ненас. = ненасыщенный; нас. = насыщенный; мононенас. = мононенасыщенный; полиненас. = полиненасыщенный.
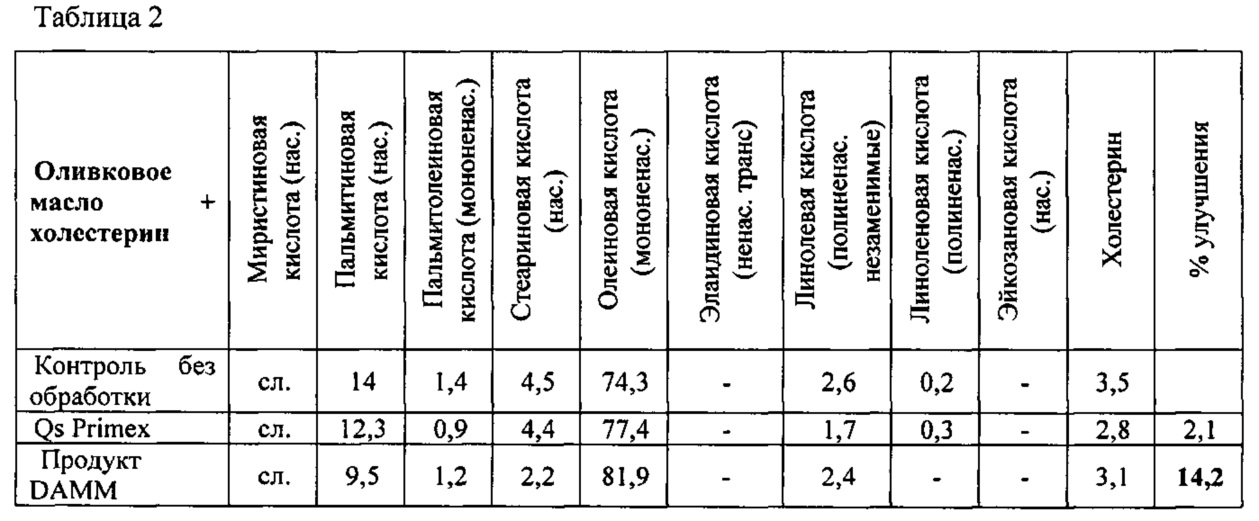

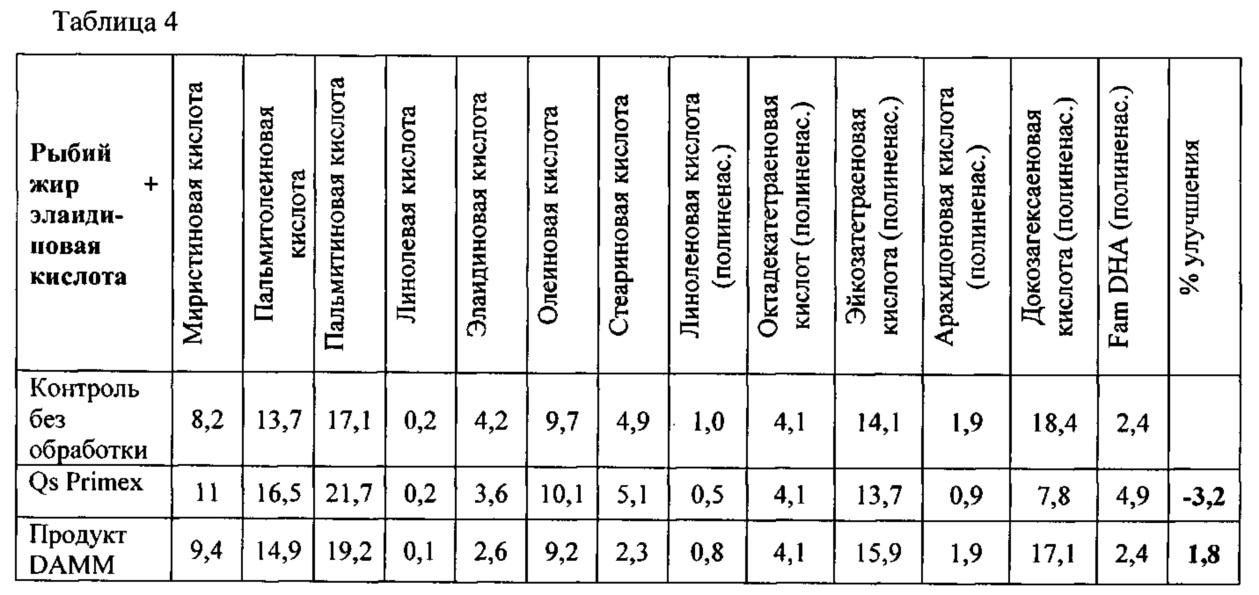
Продуктом, демонстрирующим более существенные улучшения в отношении липидного профиля усвоения (и, следовательно, режима питания), является продукт DAMM.
ПРИМЕР 4. Жиросвязывающие эффекты: испытания на животных in vivo
4.1. Испытания на животных in vivo
Исследования на животных выполняли для оценки способности селективного связывания жиров. Выбранной животной моделью были морские свинки Dunkin Hartley женского пола, поскольку такая модель имеет профиль липидного метаболизма, в частности, в случае холестерина ЛПВП, холестерина ЛПНП и холестерина ЛПОНП, очень похожий на профиль человека. Возраст морских свинок составлял от 5 до 6 недель и вес составлял от 300 до 400 г. Животных разделили на различные группы, в каждой группе n=8:
- Отрицательная контрольная группа, принимавшая целлюлозу (продукт без жиросвязывающей способности).
- Положительная группа, принимавшая Oat Bran Santiveri® ("Crusca di Avena", растворимое волокно; с предполагаемой способностью к уменьшению всасывания жиров).
- Группа, принимавшая продукт хитозан S (низкая молекулярная масса, 50-1000 кДа, незначительная вязкость, DG 70% минимум, Primex, Исландия).
- Группа, принимавшая продукт хитозан L (высокая молекулярная масса, 500-5000 кДа, DG 70% минимум, Primex, Исландия).
Анализ занял 35 дней, включая 7 дней акклиматизации и 28 дней экспериментирования. Животные находились в открытых отдельных клетках, при 12 ч циклах чередования света и темноты и при неограниченном доступе к воде и пище. Чтобы максимизировать наблюдаемые различия, индивидуальная гиперкалорийная диета, добавляемая в пищу и богатая жирами и простыми сахарами, составляла: 4,7 ккал относительно 3,8 ккал. В случае добавления 12% каждого из продуктов, подлежащих исследованию (целлюлоза/Santiveri®/продукт DAMM/хитозан S/хитозан L) основной корм использовали для максимизирования возможных эффектов каждого из экспериментальных продуктов. Результаты показаны в таблице 5.
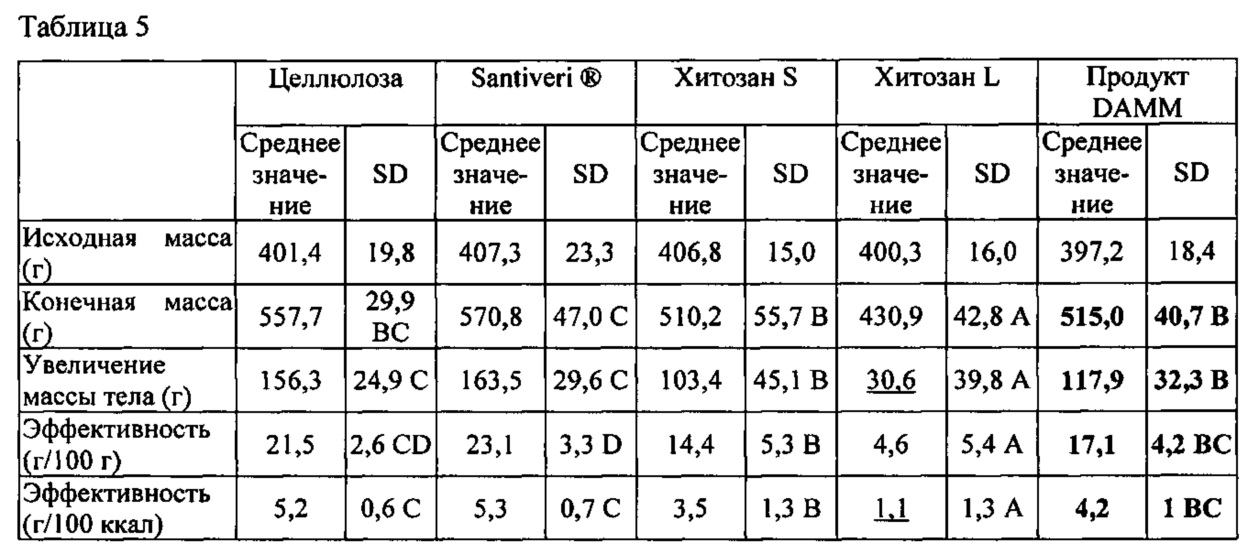
Эффективность кормления (г/100 г) представляет собой увеличение массы тела животного в граммах на 100 г съеденного корма. Эффективность кормления в г/100 ккал представляет собой увеличение массы тела животного в граммах на 100 ккал съеденного корма. Сравнение результатов проводили с применением групп для кросс-секционного анализа. Применяемое статистическое испытание представляло собой множественное сравнение Дункана (р≤0,05). Пробы, обозначенные разными буквами, демонстрируют статистически значимые различия.
Как можно видеть в таблице 5, влияние продукта хитозан L на увеличение массы тела и эффективность (результаты, выделенные подчеркиванием) было аномально высоким, граничащим с токсичностью. Хитозан L вызывал значительные интестинальные проблемы у животных и диарею. Таким образом, можно сказать, что хитозан L оказывает антипитательные нежелательные эффекты. Этот факт означает, что включение указанной группы в анализ маскирует полученные результаты. Соответственно, было решено исключить группу, принимавшую хитозан L, из статистического анализа.
Результаты, обобщенные в таблице 5, показывают, что животные, которых кормили продуктом DAMM, проявляли меньшее увеличение массы тела по сравнению с контрольными группами, принимавшими Santiveri® и целлюлозу. Эффективность потребления энергии (г набранной массы на ккал съеденного корма) представляет собой величину, которая четко показывает эффективность продукта с точки зрения снижения всасывания. Указанная величина в ккал устраняет возможные различия между кормами, обусловленные их составом. Таким образом, продукт DAMM уменьшал суммарное всасывание жиров, измеренное как общая эффективность кормления (г набранного веса на ккал съеденной пищи), по сравнению с целлюлозой и положительным контролем. Хитозан S показал существенное снижение по сравнению с продуктом DAMM, но продукт DAMM продемонстрировал самое незначительное отклонение указанных величин. Можно видеть, что Santiver® и отрицательный контроль имеют похожие характеристики.
4.2. Анализ экскрементов
Указанное исследование сопровождалось анализом экскрементов для подтверждения способности продуктов уменьшать всасывание жиров и выявления способности предпочтительного связывания одного или другого жира. Были проанализированы следующие значения:
- Продуцирование экскрементов: интересно сделать вывод о рабочем механизме и потенциальном неудобстве для потребителей.
- Кажущееся всасывание: рассчитывается как граммы абсорбированного сухого вещества на 100 г потребленного сухого корма.
- Общая экскреция: рассчитывается как граммы выведенного из организма сухого вещества на 100 грамм потребленного сухого вещества.
- Анализ жирных кислот в экскрементах: рассчитывается как концентрация жирных кислот и количество, выведенное из организма в течение разных недель эксперимента.
Сравнение результатов проводили с применением групп для кросс-секционного анализа. Используемое статистическое испытание представляло собой множественное сравнение Дункана (р≤0,05). Результаты выражали как граммы выведенных из организма свежих экскрементов на морскую свинку и на день (n=8) в случае экскреции и как граммы экскрементов в пересчете на сухую массу на морскую свинку и на день (n=8) в случае сухого вещества. Результаты показаны в таблице 6.
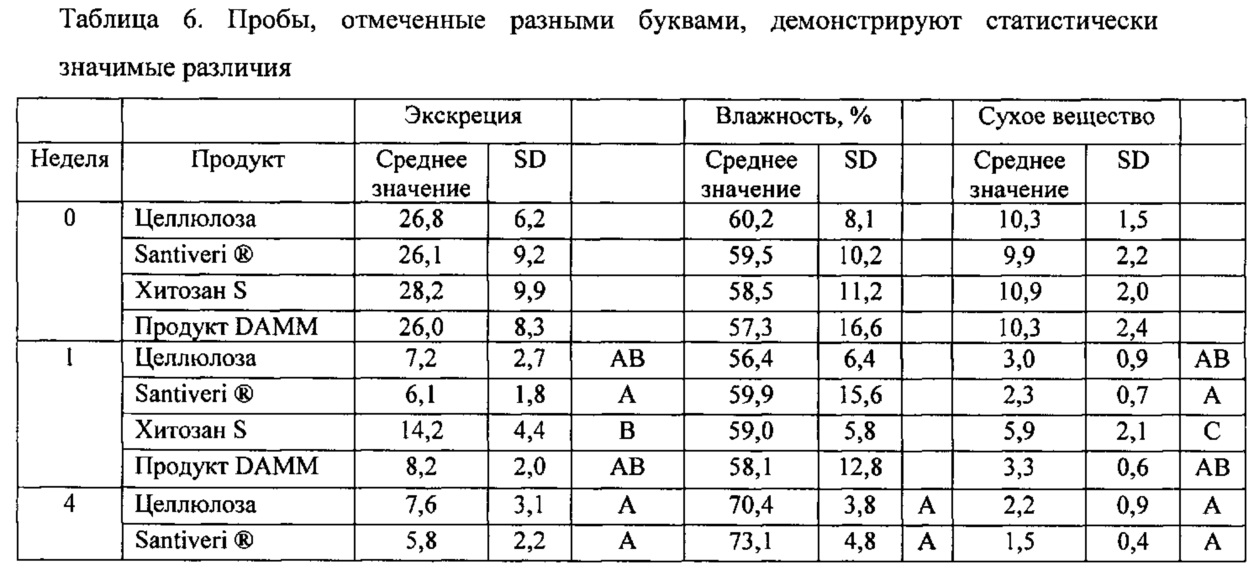

Потребление продукта DAMM не приводило к значительному увеличению фекальной экскреции у животных. Экстраполяция этого результата на потенциальное потребление человеком означает, что не будет никакого неудобства в этом отношении. Также важно отметить, что стул был оформленным. Этого нельзя сказать в случае группы, принимавшей хитозан S (см. таблицу 6).
На неделе в каждом из случаев не наблюдали статистически значимых различий. На 1 неделю в столбце "Экскреция" продукт DAMM не отличался от любой другой группы. Продукт DAMM не показывал различий в величине сухого вещества по сравнению с группой, принимавшей хитозан S. На 4 неделю группа, принимавшая DAMM, группа, принимавшая целлюлозу, и группа, принимавшая Santiveri®, значительно отличались от группы, принимавшей хитозан S. Таким образом, потребление корма с продуктом DAMM, хотя и несколько увеличивало экскрецию, но такое увеличение не было статистически значимым в отличие от продукта хитозан S. Это интересный момент, поскольку увеличение выделения экскрементов не является негативным фактором, но только в пределах нормальных параметров, чего нельзя сказать в случае продукта хитозан S.
Продукт хитозан S проявлял чрезвычайно высокие величины экскреции и сухого вещества. Этот факт, в отличие от того, что происходило с продуктом DAMM, означает, что существует неселективный эффект, кроме воздействия физическими методами: продукт хитозан S не будет специфически связывать жир, но будет связывать многие другие питательные вещества. Следовательно, экскреция увеличивается, и прибавка массы тела уменьшается. С учетом высоких значений в сухом веществе, полученных в группе, принимавшей хитозан S, очевидно, что его биофункциональные возможности обусловлены увеличением вязкости пищевого комка. Это представляет собой физический способ, включающий повышенное удаление жира и пониженную возможность всасывания. Следовательно, хитозан S относится к продукту, не обладающему специфической жиросвязывающей способностью, который может привести к антипитательным эффектам.
Поскольку значения в сухом веществе в случае отрицательного контроля (целлюлозы), группы, принимавшей коммерческий препарат (Santiveri®), и группы DAMM очень похожи (различаются не значительно) и с другой стороны, величины прибавки массы, как показано, различаются, можно сделать вывод, что экскреция жира действительно выше в группе, принимавшей DAMM. Значения для группы, принимавшей хитозан S, еще раз подтвердили неспецифичность экскреции вследствие физических методов.
4.3. Липидный состав экскрементов
В заключение был проведен анализ липидного состава экскрементов животных для оценки их различий в отношении степени экскреции определенных липидов. Статистический анализ выполняли согласно критерию множественного сравнения Дункана (р≤0,05).
На 0 неделе различия между группами не наблюдалось, то есть исходный уровень был одинаковым для всех состояний и каждой из групп. Результаты анализа на жирные кислоты на 4 неделе показаны в таблице 7, в которой полученные результаты выражены как мг жирных кислот на г экскрементов, и в таблице 8, в которой полученные результаты выражены как мг выведенных из организма жирных кислот на животное и на день.
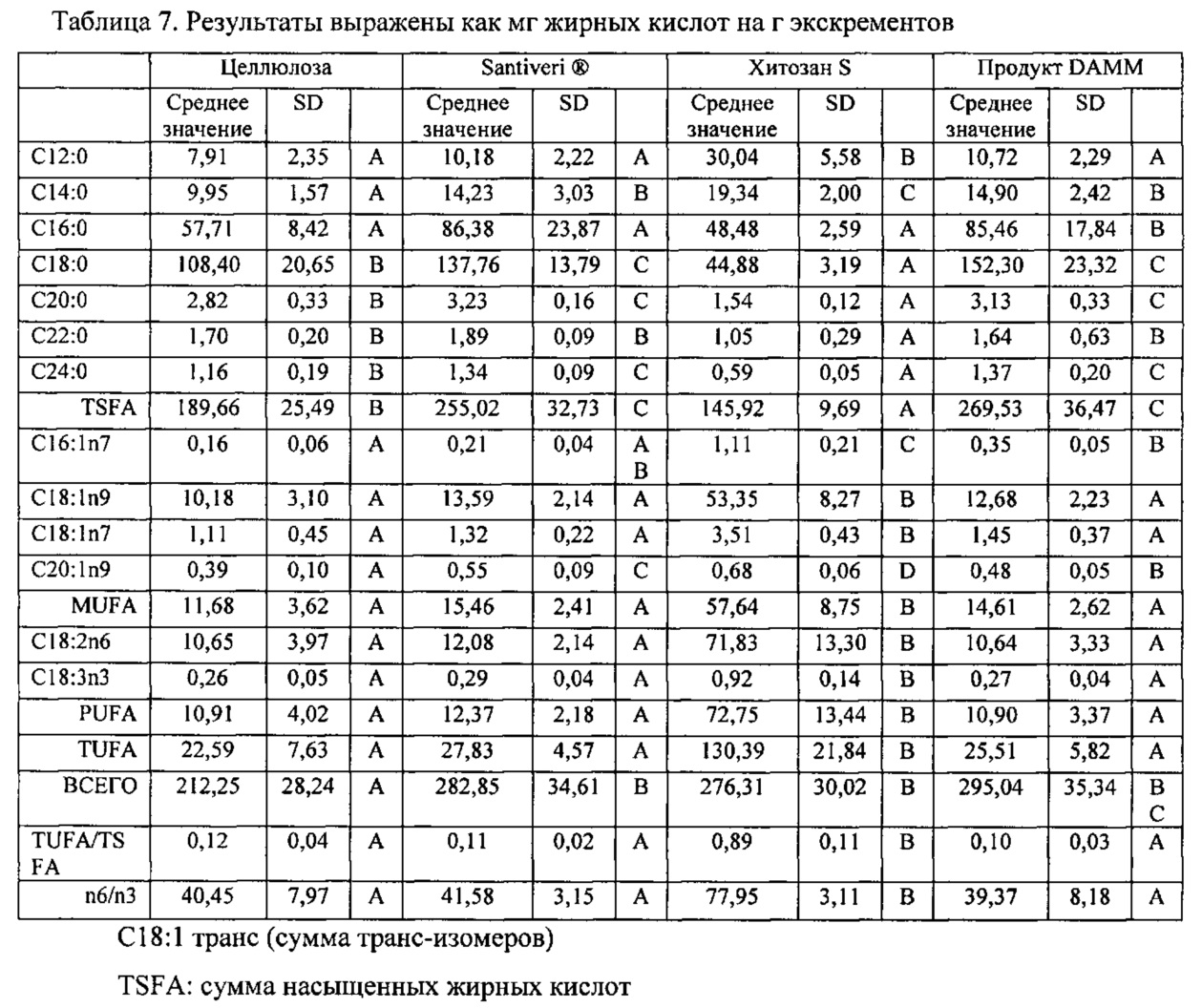
C18:1 транс (сумма транс-изомеров)
TSFA: сумма насыщенных жирных кислот
MUFA: сумма мононенасыщенных жирных кислот (не транс)
PUFA: сумма полиненасыщенных жирных кислот (не транс)
TUFA: сумма ненасыщенных жирных кислот
По сравнению с отрицательным контролем (целлюлозой) продукт DAMM демонстрировал более высокие значения жирных кислот, которые оказывают отрицательный потенциальный эффект на здоровье (насыщенные кислоты). Напротив, большинство мононенасыщенных и полиненасыщенных жирных кислот не проявляли значительных различий.
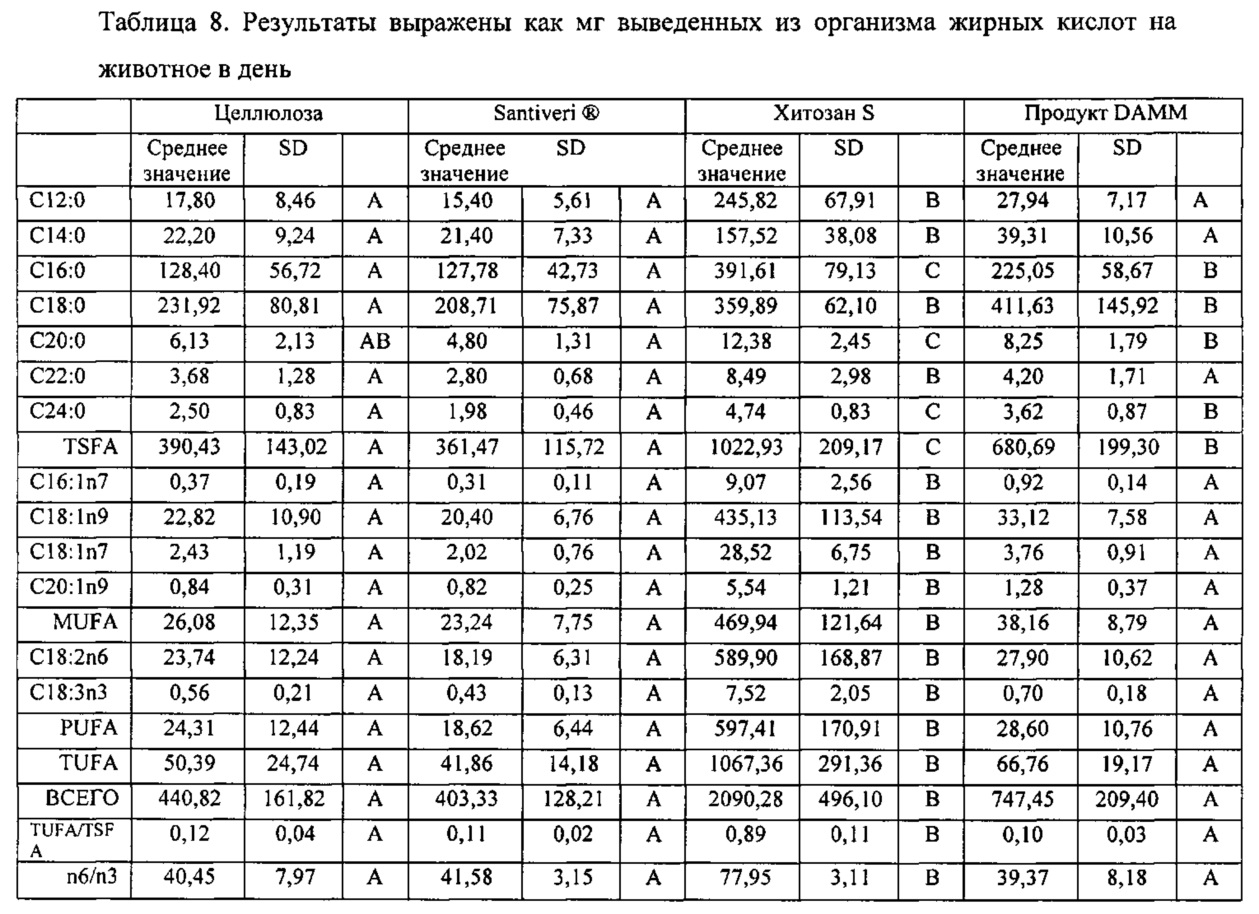
Экскреция насыщенных жирных кислот значительно возрастала после потребления продукта DAMM. Экскреция мононенасыщенных жирных кислот увеличивалась, хотя полученные результаты не были статистически значимыми, тогда как экскреция полиненасыщенных жирных кислот не увеличивалась.
С учетом полученных результатов продукт DAMM приводит к более высокой экскреции насыщенной жирной кислоты: С14:0/С16:0/С18:0/С20:0/С22:0 (миристиновая кислота, пальмитиновая, стеариновая, арахиновая, бегеновая кислоты). Такая экскреция имеет положительное значение, поскольку уменьшение всасывания насыщенных жирных кислот приводит к улучшению питательного профиля указанной диеты. Как следствие этого сокращения, было обнаружено статистически значимое снижение всасывания общего количества насыщенных жирных кислот (TSFA).
Что касается линолевой кислот (С18:2n6) и α-линоленовой кислоты (С18:3n3), статистически значимого увеличения в группе, принимавшей DAMM, не наблюдали. Такое свойство представляет собой еще одну интересную биофункциональную возможность для продукта, селективного связывающего жиры, поскольку линолевая и линоленовая кислоты представляют собой жирные незаменимые кислоты и являются важными для здоровья. Для подкрепления наблюдаемых значений, полученные результаты подтверждают, что не наблюдается повышенная экскреция общего количества полиненасыщенных и ненасыщенных жирных кислот. Наоборот, имеет место абсолютное сокращение общего всасывания жирных кислот, так что продукт DAMM представляет собой продукт, который уменьшает всасывание жиров, но не увеличивает экскрецию жирных кислот, полезных для здоровья.
Продукт Santiveri имеет хорошие характеристики (подобно продукту DAMM) в отношении селективности, как видно из статистических результатов обработки величин, выраженных как мг жирных кислот на грамм экскрементов. Однако с точки зрения ежедневных уровней экскреции поведение указанного продукта нежелательно: их величины экскреции низкие, что объясняет отсутствие эффекта, наблюдаемого в случае значений Эффективность кормления и Увеличение массы. Продукт хитозан S проявлял свойство, противоположное свойству, наблюдаемому при потреблении продукта Santiveri®, в отношении анализа жирных кислот: жиросвязывающая способность неселективна, и указанный продукт приводит к большим количествам выведенного из организма жира при высоком продуцировании экскрементов.
ПРИМЕР 5. Жиросвязывающие эффекты: функциональный клинический анализ на людях
Указанное исследование представляло собой клиническое, рандомизированное, двойное слепое, контролируемое плацебо исследование в параллельных группах для изучения эффективности и безопасности продукта DAMM в качестве пищевой добавки при контроле за массой тела. Объем выборки составлял 60 пациентов, поделенных на две параллельные группы по 30 участников, одна группа получала активное вещество (продукт DAMM), растворенное в воде, тогда как другая группа получала плацебо, растворенное в воде. Участвующие в исследовании пациенты были взрослыми людьми с индексом массы тела, варьирующим от избыточного веса до ожирения (25-34,99 кг/м2), без расстройств пищевого поведения, при этом указанные пациенты не соблюдали или соблюдали низкокалорийную диету в течение трех предыдущих месяцев. Набор пациентов для исследования проходил нелегко вследствие упомянутых требований, пациенты должны были быть людьми, которые впервые пришли на консультацию и, если нет, людьми, которым безусловно не была прописана диета или определенный вид вмешательства в рацион питания. Трудности с наймом привели к необходимости проводить многоцентровое исследование. Клинический протокол был одобрен комитетом по этике клинической больницы Барселоны, Клинико-диагностическим центром Мадрида и Европейским медицинским институтом ожирения Мадрида.
Задача исследования состояла в демонстрации того факта, что потребление продукта DAMM снижает массу тела людей (и, в конечном счете, индекс массы тела). Для обеспечения соответствующего наблюдения за изменением пациентов исследование было завершено за 12 недель (84 дня) при промежуточной оценке через 42 дня. К исследованию было привлечено 60 участников (11 мужчин и 49 женщин со средним возрастом 48 лет (от 22 до 65 лет)). 44 из них завершили исследование. Из тех пациентов, которые отказались от исследования, большинство руководствовалось личными причинами. Общие рекомендации придерживаться здоровой диеты средиземноморского типа (эукалорийной диеты) были даны участникам, которые следовали им в течение 1 месяца перед началом экспериментальной фазы, отмечая отклонения от диеты, которой они подвергались. Анализ ANOVA показал отсутствие статистически значимых различий в демографических показателях или в клинических исходных характеристиках участников. Таким образом, результаты, полученные в конце испытания, представляют собой результат действия продукта в отсутствие влияния распределения пациентов.
Продукт DAMM находился в завинчивающихся колпачках, соответствующих флаконам с жидкостью. Исследуемыми продуктами были (состав на завинчивающийся колпачок):
- Экспериментальный продукт: 1 г продукта DAMM + 35 мг краситель «caramelina» (Е-102/124/132 16%).
- Контроль: Плацебо: 1 г микрокристаллической целлюлозы + 17,5 мг красителя (Е-102/124/132 16%).
Каждый субъект растворял 2 колпачка во флаконе, содержащем 500 мл воды, и принимал указанную дозу с обедом и растворял 1 колпачок во флаконе, содержащем 500 мл, и принимал указанную дозу с ужином. Процедуру повторяли ежедневно в течение 12 недель. Во время экспериментальной фазы каждый участник 3 раза посещал исследовательский центр, один раз при времени 0 (посещение 0 или исходный уровень), промежуточное посещение и одно посещение в конце исследования. При каждом посещении анализировали различные параметры, такие как показатели массы тела и роста, антропометрические измерения (окружность талии и бедер), процент жира в организме (измеряется с применением двухэнергетической рентгеновской абсорбциометрии) и анализы крови.
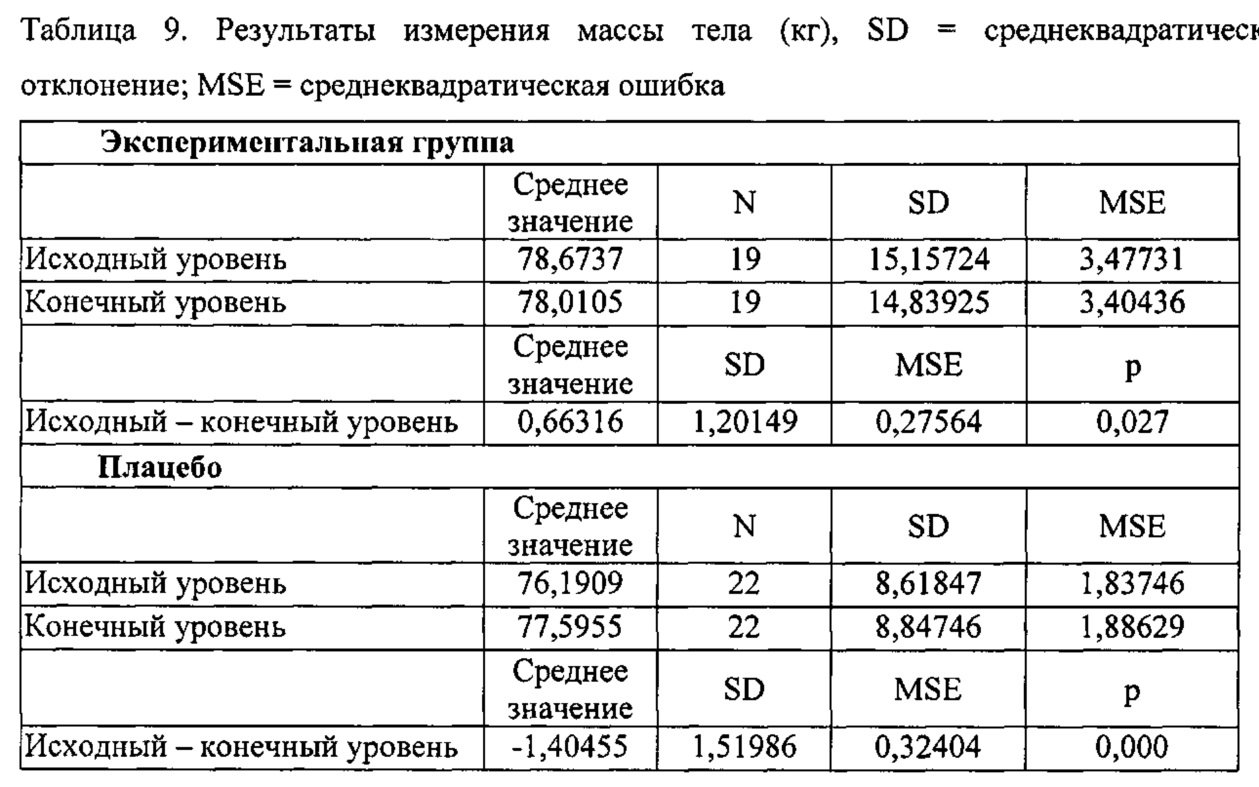
Внутригрупповое сравнение: После приема продукта DAMM в течение 3 месяцев, наблюдалось снижение массы тела на 0,7 кг. Различие между исходным уровнем и конечными значениями было статистически значимым при р=0,027. В группе, принимавшей плацебо, статистически значимые различия существовали, но в случае увеличения массы тела при р=0,000.
Межгрупповое сравнение: При сравнении различий в массе тела участников, принимающих продукт DAMM, по сравнению с участниками, принимающими плацебо, было обнаружено, что указанные различия были статистически значимыми при р=0,000.
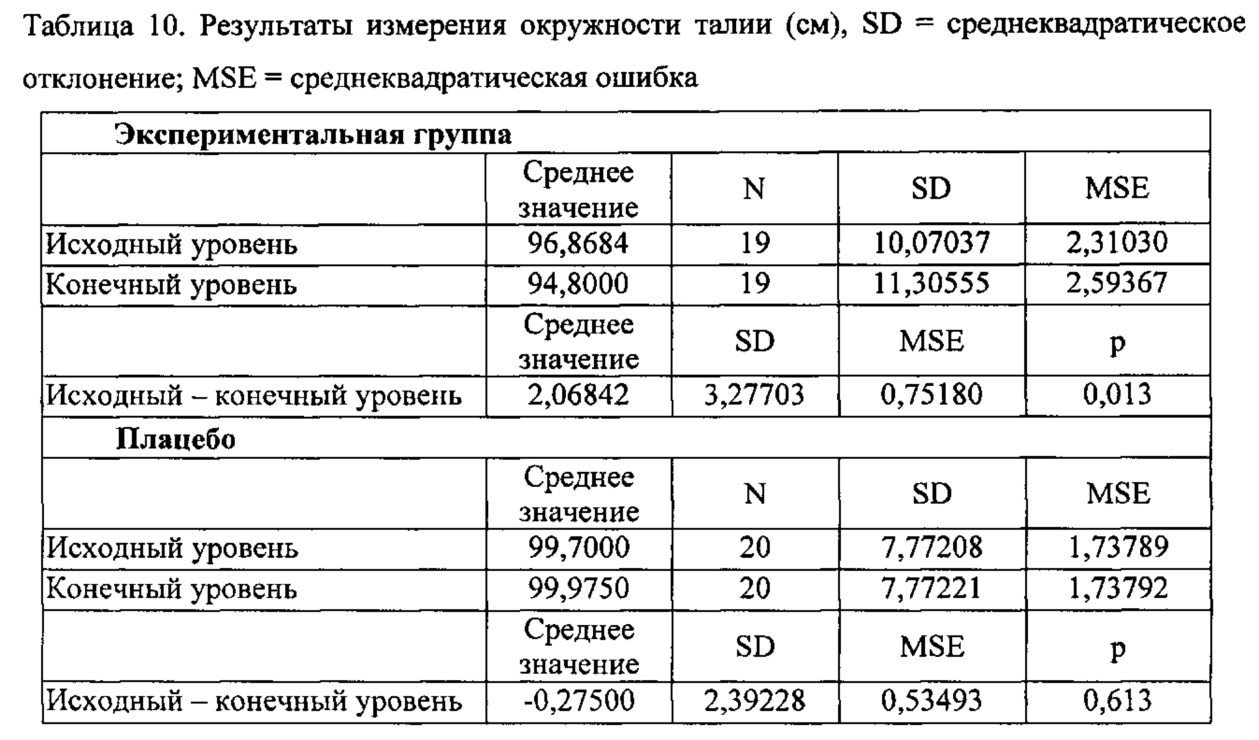
Внутригрупповое сравнение: после приема продукта DAMM имело место уменьшение окружности талии. Различия, состоявшие в уменьшении на 2 см окружности талии, между исходными уровнями и конечными значениями были статистически значимым при р=0,013. Для группы, получавшей плацебо, статистически значимых различий не наблюдалось.
Межгрупповое сравнение: При сравнении различий в окружности талии участников, принимавших продукт DAMM, по сравнению с участниками, принимавшими плацебо, было обнаружено, что указанные различия были статистически значимыми при р=0,015.

После приема продукта DAMM наблюдали уменьшение на 0,82% общего содержания жира в организме. Такое уменьшение обычно имело статистическую значимость при р=0,067. Для группы, получавшей плацебо, статистически значимых различий в содержании жира в организме не наблюдалось.
Наблюдали уменьшение на 1% жировой ткани андроидного типа (верхняя часть тела) в группе, принимавшей продукт DAMM, но такое различие не было статистически значимым, р=0,101. Продукт также приводил к снижению процентного содержания жира в организме, т.е. к 0,8% потере жира и уменьшению почти на 1% жировой ткани андроидного типа. Указанные результаты не были статистически значимыми, поскольку объем выборки не был достаточно большим для обнаружения различий между группами, но является клинически важными. Уменьшение содержания жира в организме и процентного содержания жировой ткани андроидного типа соответствует перераспределению жира и приводит к уменьшению его накопления в брюшной области. Такое перераспределение связано с потенциальной пользой с точки зрения уменьшения факторов риска сердечно-сосудистых заболеваний, гипертензии и диабета. Возможно, значительные различия можно было бы обнаружить в случае большего N. После приема продукта DAMM и в группе, принимавшей плацебо, статистических значимых изменений в обхвате бедер и в содержании жировой ткани ганоидного типа (нижняя часть тела) не наблюдалось. С учетом указанных результатов можно сделать вывод, что продукт DAMM способствует потере массы тела, при этом происходит снижение массы на приблизительно 2,1 кг и уменьшение окружности талии на 2 см через 3 месяца лечения. Указанные результаты являются клинически важными, поскольку результаты в виде уменьшения массы тела и окружности талии были получены в отсутствии специальной ограничительной диеты и в течение короткого времени лечения (3 месяца). Опрос о продукте, который давали участникам, показал, что они были довольны вкусом и приятным запахом продукта.
ПРИМЕР 6. Эффект связывания глюкозы: пероральный тест толерантности к глюкозе на животной модели
Эксперименты типа «пероральный тест толерантности к глюкозе» (OGTT) позволяют проанализировать действие некоторых соединений в ответ на прием внутрь глюкозы. Несмотря на название («пероральный») эксперименты можно также проводить путем внутрижелудочного введения, как в этом случае. Протокол был следующим: 24 крысы Sprague-Dawley мужского пола с массой тела от 250 до 300 г оставляли без еды на всю ночь (от 14 до 16 ч). Пищу удаляли и животных перемещали в чистые клетки, чтобы предотвратить потребление стула. В течение всего эксперимента у животных был неограниченный доступ к воде. В день эксперимента после голодания животных взвешивали. Соединения, подлежащие исследованию, смешивали в заранее установленных количествах с дозой глюкозы, выбранной для конечного внутрижелудочного введения и составляющей 1 мл лекарственного средства/200 г животного (т.е. 2 г глюкозы/кг животного). В качестве положительного контроля использовали гуаровую смолу, поскольку указанная смола представляет собой общепринятый связыватель глюкозы. Группы испытуемых были следующими.
- Положительный контроль: гуаровая смола ((6 мг/мл) + глюкоза (400 мг/мл) до 1 мл на 200 г животного); n=8
- Отрицательный контроль: глюкоза (400 мг/мл до 1 мл на 200 г животного); n=8
- Группа, принимавшая DAMM: продукт DAMM (6 мг/мл) + глюкоза (400 мг/мл до 1 мл на 200 г животного); n=8
После приготовления растворов, величину исходной гликемии всех животных (соответствующую времени 0) определяли с применением Glucometer® Elite. Каждой группе животных вводили различные лекарственные средства путем внутрижелудочного введения. После введения первому животному в каждой группе включали таймер. Уровни глюкозы определяли через 15, 30, 60 и 120 мин. После последнего измерения гликемии кормление животных было возобновлено согласно инструкциям комитета по этике.

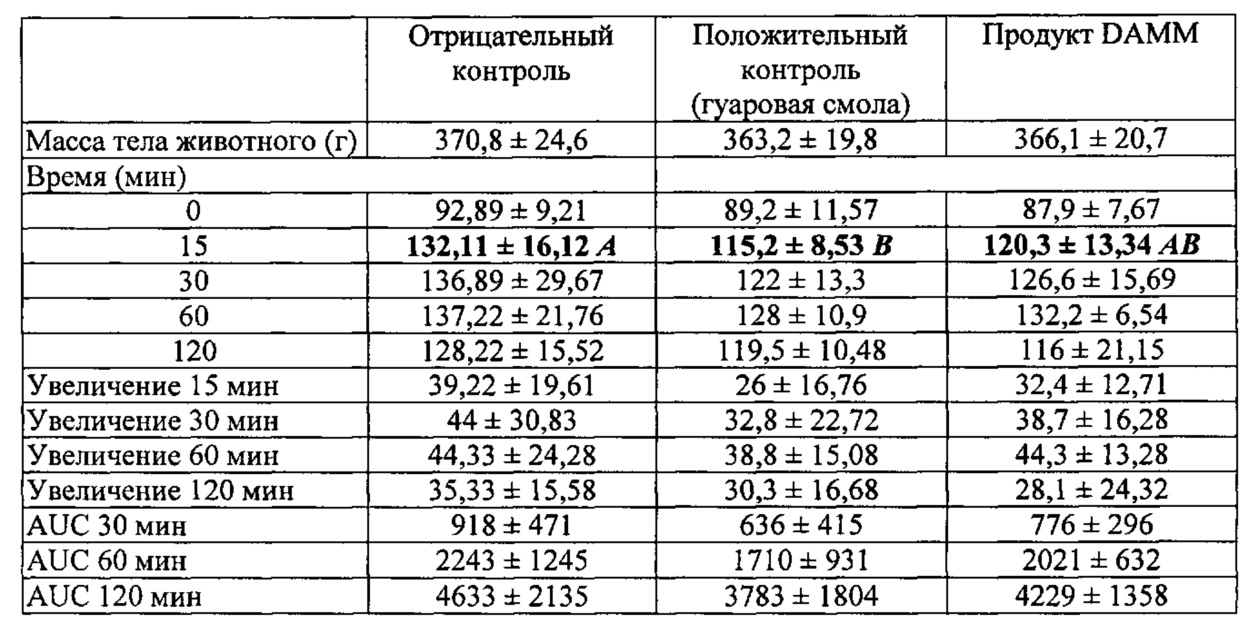
Различия между значениями, наблюдаемыми в первых точках кинетических величин, продемонстрировали статистическую значимость: указанная точка представляет больший интерес при выявлении различий между группами, так как она представляет собой пик, когда увеличение концентрации сахара относительно предыдущей точки (исходного уровня) является наиболее четко выраженным. Именно в это постпрандиальное время пики глюкозы демонстрируют большее увеличение и, следовательно, представляют серьезный риск для здоровья. Даже не обеспечивая статистическую значимость, можно ясно видеть, что через 90 и 120 мин наблюдается инверсия относительных положений кривых, относящихся к положительному контролю и продукту DAMM.
Продукт DAMM не проявляет большего эффекта с точки зрения уменьшения содержания глюкозы относительно положительного контроля с применением гуаровой смолы, но полученные результаты являются удовлетворительными, поскольку продукт DAMM способен регулировать уровни глюкозы. Продукт DAMM имеет важное преимущество по сравнению с гуаровой смолой, так как последняя очень сильно увеличивает вязкость растворов, поэтому она представляет собой «механическое улавливание», которому подвергается глюкоза, что объясняет такое уменьшение пика глюкозы в крови. Напротив, продукт DAMM не изменяет вязкость раствора, что является очень важным фактом в технологии пищевых продуктов. Указанный продукт подходит для диабетиков, поскольку демонстрирует более низкий пик глюкозы, и для спортсменов, поскольку указанный пик является более продолжительным по времени.
ПРИМЕР 7. Детоксицирующее действие
Была проанализирована секвестрирующая способность продукта DAMM в отношении различных токсичных веществ. Также были исследованы различные фракции, полученные в результате второй термощелочной обработки, начиная с продукта DAMM, на их детоксицирующую способность. Название каждой фракции указывает конкретные условия указанной второй термощелочной обработки. Во всех случаях % секвестированного соединения определяли с помощью следующего расчета: % секвестированного соединения =100(1-XFx/Xref)×100.
XFx представляет собой экспериментальную концентрацию соединения для каждой фракции х и Xref представляет собой теоретическую концентрацию соединения. Количество секвестированного соединения на мг фракции продукта DAMM определяли согласно следующей формуле
(XFx-Xref)×Vx/Mr=X нг секвестированного соединения/мг фракции продукта DAMM
Vx представляет собой объем фракции и Mr представляет собой молекулярную массу исследуемого соединения.
7.1. Анализ на афлатоксин В1
Афлатоксин B1 (AFB1) представляет собой подтип микотоксина, продуцируемый членами рода Aspergillus, такими как Aspergillus flavus и Aspergillus parasiticus. Он может относиться к загрязняющей примеси в некоторых продуктах питания. Метаболизм AFB1 приводит к образованию одного из наиболее сильных канцерогенов. Для анализа каждую из фракций продукта DAMM диспергировали (в независимых экспериментах) в пробирке при концентрации 1 мг/мл в дистиллированной воде. К конечному объему 17,9 мл добавляли 0,9 мл стандартного раствора AFB1 (0,9 мг AFB1). Теоретическая конечная концентрация AFB1 в исследуемой суспензии составляла 50,3 мкг/мл (50,3 ppm). В качестве контрольных проб приготавливали три одинаковые пробирки без добавления фракций продукта DAMM. Смесь инкубировали при 37°С при перемешивании при 300 об/мин в течение 3 часов. Затем продукт фильтровали через шприц с диаметром пор 0,45 мкм. В заключение с помощью ВЭЖХ-ФД (высокоэффективной жидкостной хроматографии и флуоресцентного детектирования) определяли секвестированный AFB1.
7.2. Анализ на ртуть (Hg)
Каждую из фракций диспергировали (две реплики) в пробирке при концентрации 1 мг/мл в дистиллированной воде (20 мг каждой фракции с 19 мл дистиллированной воды). Затем добавляли 1 мл раствора хлористой ртути (0,560 мг Hg), доводя конечный объем исследуемого раствора до 20 мл. Теоретическая конечная концентрация Hg в исследуемом растворе составляла 28,00 мкг/мл (28,00 ppm). В качестве контрольных проб приготавливали три одинаковые пробирки без добавления фракций продукта DAMM. Смесь инкубировали при 37°С при перемешивании при 300 об/мин в течение 3 часов. Затем продукт фильтровали через шприц с диаметром пор 0,45 мкм. В заключение определяли секвестированный Hg. Величины секвестрации Hg были удивительно высокими, как показано в таблице 13.
7.3. Полихлорированные бифенилы
Соединение ПХБ 209 (декахлоробифенил) применяли в качестве модели таких полихлорированных бифенилов (ПХБ), обнаруживаемых в окружающей среде, так как он представляет собой одно из наиболее широко распространенных и токсичных веществ. Каждую из фракций диспергировали (две реплики) в пробирке при концентрации 1 мг/мл в дихлорметане (10 мг каждой фракции с 10 мл дихлорметана). К ранее полученному раствору добавляли 0,1 мл исходного раствора ПХБ 209 (55 мкг ПХБ 209). Теоретическая конечная концентрация ПХБ 209 в исследуемом растворе составляла 5,5 мкг/мл. В качестве контрольных проб приготавливали три одинаковые пробирки без добавления фракций продукта DAMM. Смесь инкубировали при 30°С при перемешивании при 300 об/мин в течение 3 часов. Затем продукт фильтровали через шприц с диаметром пор 0,45 мкм. В заключение определяли секвестированный ПХБ 209.
7.4. Фуран
Каждую из фракций диспергировали (в независимых экспериментах) в пробирке при концентрации 1 мг/мл в дихлорметане (10 мг каждой фракции с 10 мл дихлорметана). К ранее полученному раствору добавляли 0,1 мл исходного раствора фурана (55 мкг фурана). Теоретическая конечная концентрация фурана в исследуемом растворе составляла 5,5 мкг/мл. В качестве контрольных проб приготавливали три одинаковые пробирки без добавления фракций продукта DAMM. Смесь инкубировали при 30°С при перемешивании при 300 об/мин в течение 3 часов. Затем продукт фильтровали через шприц с диаметром пор 0,45 мкм. В заключение определяли секвестированный фуран. Результаты для всех анализируемых токсичных веществ показаны в таблице 13.
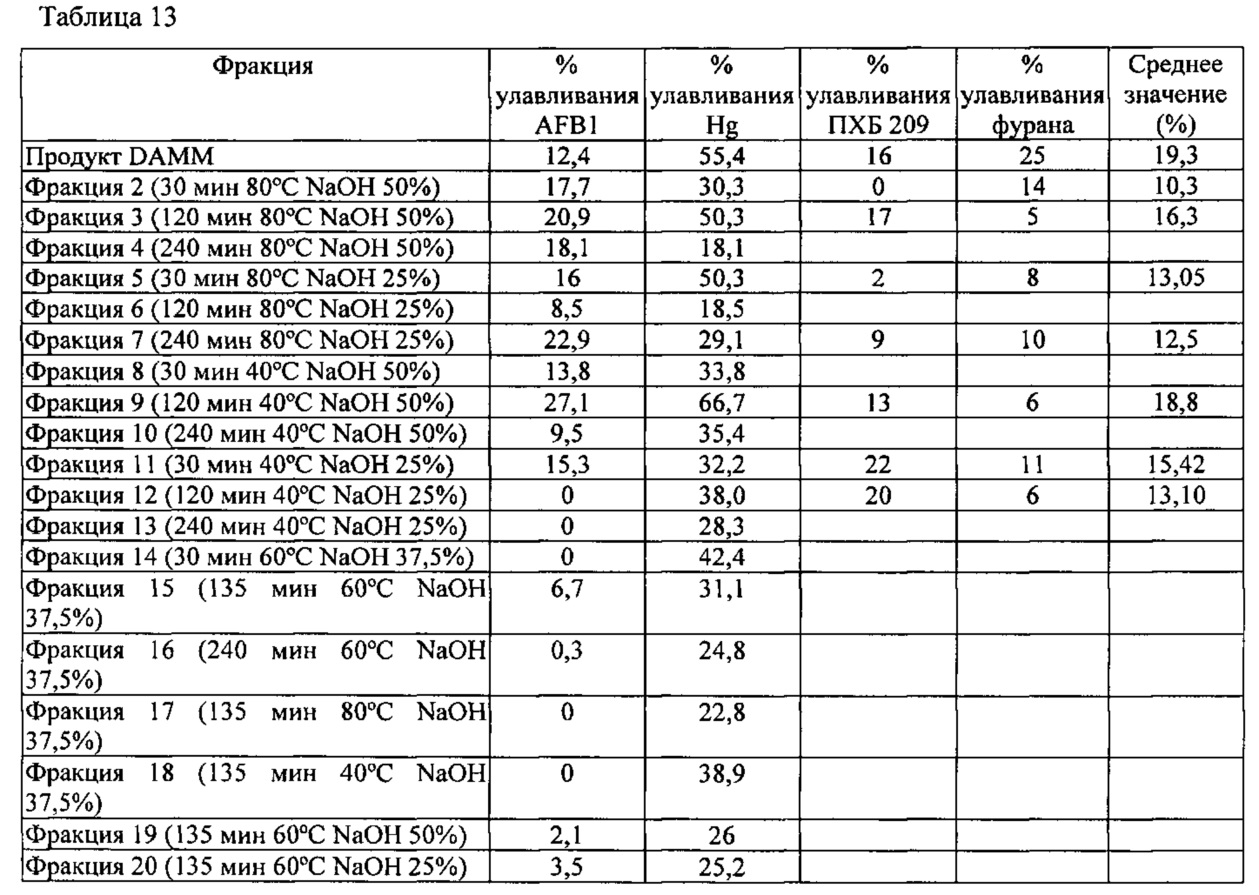
Как видно из данной таблицы, не все фракции исследовали относительно всех токсичных веществ. Несмотря на этот факт, указанные фракции нельзя игнорировать, поскольку они могут представлять интерес, будучи активными в отношении конкретного токсичного вещества. Например, фракция 4 является вполне эффективной в отношении AFB1 и Hg; фракции 8, 10, 15, 19 и 20 являются активными в отношении AFB1 и очень эффективными в отношении Hg; и фракции 12, 13, 14, 17 и 18 не проявляют захват AFB1, но очень хорошо захватывают Hg.
7.6. Биодоступность фракций
В дополнение к детоксицирующему действию, следующей задачей была проверка пригодности указанных фракций для требуемого применения: для предотвращения всасывания токсичных веществ, присутствующих в продукте питания. С этой целью было исследовано, что указанные фракции имели низкую биодоступность, чтобы быть абсорбированными интестинальным эпителием. Указанная оценка была проведена в планшетах Трансвелла способом на основе дифференциации М клеток в модели эпителиальных раковых клеток толстой кишки с применением индукции белка MIF (фактора ингибирования миграции макрофагов).
Получение М клеток
Эпителиальные раковые клетки толстой кишки культивировали на планшетах Трансвелла. Клетки выращивали в течение 14 дней при 37°С, 5% СО2 до полной дифференциации. В процессе выращивания контролировали трансэндотелиальное электрическое сопротивление (TEER) до величины 250 Ом·см2 при добавлении белка MIF при концентрации 0,3 мкг/мл надосадочной жидкости. Раствор инкубировали в течение 5 ч при 37°С и 5% CO2.
Введение метки DTAF (дихлортриазиниламинофлюоресцеина) во фракции продукта DAMM
Сначала фракции измельчали до получения мелкодисперсного порошка. 20-25 мг порошка разбавляли в 1 мл боратного буфера с рН 9. Смесь подвергали воздействию ультразвуком в течение 10 мин при комнатной температуре. Затем добавляли 1 мл DTAF 1 мг/мл и выдерживали при постоянном перемешивании всю ночь. Конечный раствор центрифугировали при 4000 об/мин в течение 10 мин с последующими промываниями с применением 5 мл PBS (фосфатно-солевого буферного раствора). Разные меченые фракции помещали в верхнюю часть планшетов Трансвелла и инкубировали в течение 3 ч.
Измерение выполняли с помощью флюориметра в режиме сканирования лунок 520(Em)-490(Ех). Для каждой из фракций использовали разбавления 1/50 и 1/100. Анализ выполняли в двух параллельных испытаниях и получали среднее значение. В каждом случае оценивали % проникновения фракции в модель интестинального эпителия. Результаты измерения биодоступности вместе с предыдущими результатами исследования захвата показаны в таблице 14.
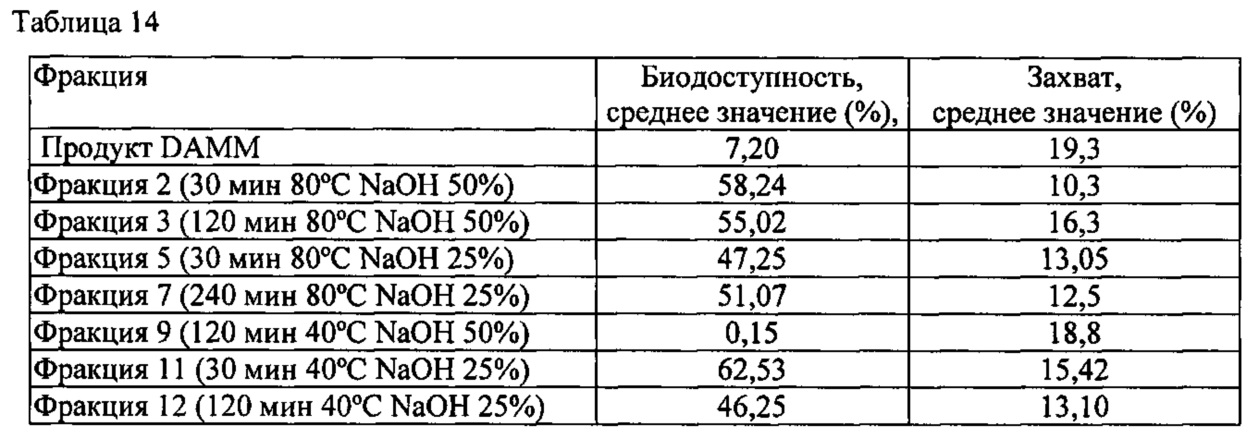
Имеется значительное наложение между фракциями, что свидетельствует о большем захвате и меньшем всасывании, что является идеальным случаем для целей детоксикации.
ПРИМЕР 8. Иммуностимулирующее действие
Для определения влияния продукта на иммунную систему выполняли серию экспериментов:
- «Тест на бактериофаги»: количественное определение фагоцитарной активности моноцитов и гранулоцитов в гепаринизированной крови.
- «Тест на повторную иммунизацию»: определение окислительной активности моноцитов и гранулоцитов в гепаринизированной крови.
Крыс Wistar разделяли на две группы, в каждой из которых n=8; одна группа принимала экспериментальный продукт и другая группа была контрольной. Экспериментальный продукт представлял собой фракцию 2, описанную в предыдущем разделе 7 и полученную посредством гидролиза в течение 30 минут при применении 25% NaOH при 40°С. Анализ занял три недели. Крыс содержали при 12 ч циклах чередования света и темноты, предоставляя неограниченный доступ к пище и питью. Основа корма была одинаковой и была модифицирована продуктом, подлежащим исследованию:
- Контрольная диета: стандартный корм для крыс (Teklad Global Diet, 2014).
- Экспериментальная диета: стандартный корм для крыс (Teklad Global Diet, 2014), дополненный 1,2 г экспериментального продукта. Иммуностимулирующая доза составляла 100 мг экспериментального продукта/кг массы животного (30 мг/день).
В ходе экспериментирования массу тела животного и количество потребленного корма контролировали на постоянной основе вместе с показателями, указывающими на состояние иммунной системы в каждой из групп. Отбор проб выполняли на дни 0 и 12 (общая продолжительность составляла 22 дня) путем анестезирования животных с помощью изофлурана и отбора пробы крови из подкожной вены. В последний день животных подвергали анестезии и умерщвляли, получая максимальный объем крови путем пункции сердца.
8.1. Тест на бактериофаги
Тест на бактериофаги позволяет определить процентное содержание лимфоцитов, проявляющих фагоцитирующую способность, и количество бактерий, фагоцитированных каждым лимфоцитом, который проявляет указанную активность.
100 мкл крови охлаждали до 0°С в бане со льдом и добавляли 20 мкл охлажденной флуоресцентно меченной суспензии Escherichia coli. Пробы инкубировали при 37°С в водяной бане в течение 10 мин. Затем пробы охлаждали. Добавляли 100 мкл раствора хелатирующего агента для удаления не интернализированных бактерий, но прилипших к поверхности клетки. Добавляли 3 мл буферного раствора для промывания и пробы центрифугировали 5 мин при 250 г при 4°С. Пренебрегали надосадочной жидкостью и добавляли лизирующий буфер. Пробы инкубировали для удаления неиммунных клеток. К полученной фракции лейкоцитов добавляли 200 мкл раствора для мечения ДНК. Через менее 1 ч от времени мечения клетки анализировали с применением проточной цитометрии. ДНК-мечение клеток лейкоцитов, испускающих флуоресценцию в красном диапазоне, позволяло отличить объекты (клетки), которые представляли собой лейкоциты, от других объектов. Применяя свойства световой рефракции каждого типа клеток, была построена гистограмма, позволяющая различать нейтрофилы и моноциты. Результаты, полученные в тесте на бактериофаги, показаны в таблице 15.
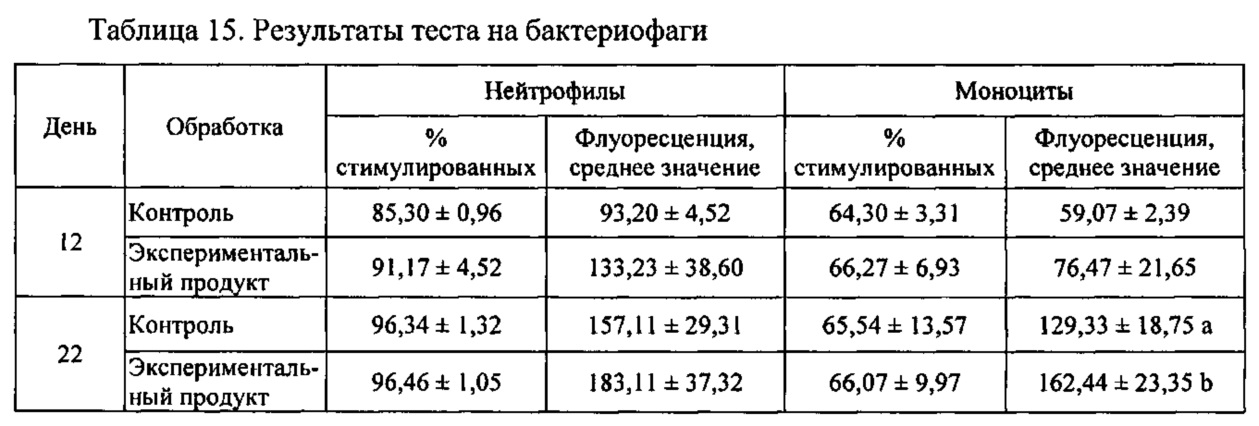
Результаты на день 0 были недоступны вследствие недостаточного количества крови. Результаты выражали в виде среднего значения (S.D. для n=3 (пробы крови объединяли в один пул из-за недостаточного количества пробы) на день 12 и n=9 на день 22. Пробы, отобранные в один и тот же день и расположенные в одном и том же столбце, обозначенные разными буквами, проявляли статистически значимые различия (р<0,05).
Можно видеть, что количество проб на день 12 было не достаточно большим, чтобы установить статистически значимые различия между способами лечения в отношении количества клеток. Однако в экспериментальной группе наблюдали статистическую значимость в отношении увеличения средней флуоресценции нейтрофилов и моноцитов относительно контрольной пробы. На день 22 различия в процентном содержании стимулированных нейтрофилов и моноцитов, т.е. в количестве клеток, способных проявлять фагоцитарную активность, не наблюдалось. Что касается моноцитов, экспериментальный продукт значительно увеличивал их активность относительно контрольной группы (р<0,01). Соответственно, процентное содержание моноцитов, проявляющих фагоцитирующую способность, не отличалось в зависимости от способов лечения, но моноциты у тех животных, которых кормили экспериментальным продуктом, демонстрировали способность фагоцитировать или усваивать большее количество бактерий Е.coli на единицу стимулированных моноцитов.
8.2. Тест на повторную иммунизацию
Тест на повторную иммунизацию позволяет определить способность клеток иммунной системы проявлять окислительную активность, т.е. потенциал для удаления частиц активатора посредством зависящих от кислорода механизмов.
Для каждой пробы 100 мкл крови добавляли в 3 разные пробирки, которые охлаждали в бане со льдом при 0°С. В одну из 3 пробирок добавляли 20 мкл буферного раствора (отрицательный контроль), тогда как различные активаторы окислительной активности добавляли в другие пробирки: частицы Е.Coli и лиганд протеинкиназы С-форбол-13-миристат-12-ацетата (РМА) в качестве контроля высокого уровня. Пробы смешивали и инкубировали при 37°С в водяной бане 10 мин. Добавляли 20 мкл дегидрородаминового субстрата 123 (DHR), который может окисляться, испуская зеленую флуоресценцию. Полученную пробу инкубировали еще 10 мин. Добавляли 2 мл лизирующего раствора и пробы инкубировали при 25°С для удаления эритроцитов. Пробы промывали буфером. К полученной фракции лейкоцитов добавляли 200 мкл раствора для мечения ДНК. Через менее 1 ч от времени мечения клетки анализировали с применением проточной цитометрии. Объем выборки на дни 0 и 12 был не достаточно большим для определения статистически значимых различий между способами лечения. Соответственно, анализ данных был направлен главным образом на последний день лечения.
Основываясь на полученных результатах, при применении сильного стимулирования (РМА) значимых различий в активности нейтрофилов не наблюдалось. Однако в экспериментальной группе, как правило, наблюдалось увеличение интенсивности флуоресценции, обнаруживаемой в моноцитах, что указывает на тенденцию увеличения их активности. Когда пробы подвергали воздействию конкретного стимула (Е. coli), животные, которых кормили экспериментальным продуктом, демонстрировали небольшую, но не значимую тенденцию к увеличению процентного содержания нейтрофилов, демонстрирующих окислительную способность. Что касается моноцитов, экспериментальная группа демонстрировала более высокий процент клеток, проявляющих окислительную способность (р<0,05). Соответственно, как и при тесте на бактериофаги, потребление экспериментального продукта вызывает, главным образом, увеличение реакции моноцитов. Результаты теста на повторную иммунизацию показаны в таблице 16.
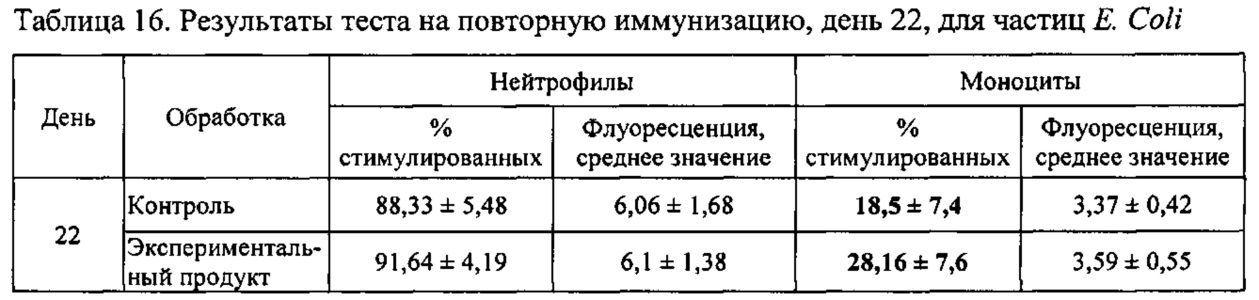
В заключение, экспериментальный продукт оказывал значительный эффект на усиление иммунной реакции. Такая активность, главным образом, направлена на способность продукта увеличивать реакцию моноцитов против потенциального инфекционного процесса. Потребление указанного продукта приводило, как правило, к увеличению фагоцитарной активности нейтрофилов и статистически значимому увеличению фагоцитарной активности моноцитов. Потребление предложенного продукта не увеличило долю лейкоцитов, проявляющих активность, но те лейкоциты, которые проявляли активность, демонстрировали способность поглощать большее количество патогенов. Продукт повышал долю моноцитов, проявляющих окислительную активность при воздействии конкретного стимула, такого как E.coli. Соответственно, продукт приводил к увеличению количества бактерий, поглощенных моноцитом, что позволяет большему количеству моноцитов проявлять окислительную активность. Экстраполяция на потребление человеком для выявления тех же биофункциональных возможностей, соответствовала бы 5-6 граммам ежедневно.
ПРИМЕР 9. Производство в промышленном масштабе
Различные партии продукта получали промышленным способом и сравнивали с продуктом, полученным, как описано в примере 1 («продукт DAMM», называемый в настоящей заявке партией 1).
Для производства в промышленном масштабе в качестве сырьевого материала использовали влажную биомассу Saccharomyces cerevisiae, представляющую побочный продукт процесса пивоварения.
9.1 Партия 2
После сушки продукта при 105°С количество сухого материала во влажной биомассе составляло приблизительно 17%. Из этих 17, 13% соответствовало нерастворимой твердой фазе (клетки Saccharomyces cerevisiae) и 4% соответствовало растворимой твердой фазе.
Приготавливали реакционную среду, загружая реактор 300 кг дистиллированной воды и добавляя 4 кг NaOH. Сто килограммов влажной биомассы добавляли в реакционную среду, что соответствует соотношению влажная биомасса: реакционная среда 1:3. Учитывая, что влажная биомасса содержала 13% дрожжей, указанное соотношение составляло 1:39, если его выразить как сухие дрожжи: реакционная среда. Конечная концентрация NaOH составляла 0,25 М.
Смесь нагревали до 80°С и проводили реакцию при постоянном перемешивании при указанной температуре в течение 16 ч. После окончания времени реакции продукт охлаждали до комнатной температуры. Смесь центрифугировали для отделения нерастворимой фракции в основной среде с помощью центрифуги Gea Westfalia (модель SC 6-01-576, Hidrostop). Центрифугирование выполняли при скоростях течения, варьирующих от 100 до 300 л/ч. Образовавшийся остаток повторно суспендировали с применением 370 л дистиллированной воды и нейтрализовали путем добавления 3 М HCl до рН=7,1. Далее, смесь центрифугировали, как описано выше. В конце полученный остаток промывали путем добавления 360 л воды и центрифугирования. Полученный продукт сушили посредством распылительной сушки. Для этой цели водную суспензию выдерживали в распылительной сушилке при добавлении 4,5 л воды и постоянном перемешивании во время процесса. Входная и выходная температуры составляли 180°С и 93-94°С, соответственно. Продукт, полученный в результате такого процесса, представлял собой мелкодисперсный порошок, называемый в настоящей заявке партией 2.
9.2. Партия 3
Продукт получали согласно способу, применяемому для получения партии 2, при незначительных модификациях. В частности, после гидролиза при 0,25 М NaOH при 80°С в течение 16 в смесь сразу же нейтрализовали путем добавления 3 М HCl (без первого центрифугирования реакционной смеси). После нейтрализации смесь центрифугировали и следовали процедуре, описанной выше. Таким образом, по сравнению с партией 2, указанная процедура позволяла избежать одну стадию центрифугирования, что дает возможность оптимизировать промышленные издержки. В настоящей заявке полученный продукт называют партией 3.
9.3. Партия 4
Количество сухого материала во влажной биомассе составляло приблизительно 18%. Их этих 18%, 11% соответствовало нерастворимой твердой фазе (клетки Saccharomyces cerevisiae) и 7% соответствовало растворимой твердой фазе.
Продукт получали, как описано в случае получения партии 3, при незначительных модификациях. Приготавливали реакционную среду, загружая реактор 300 кг дистиллированной воды и добавляя 5,7 кг NaOH. Вместо 100 кг использовали 143 кг влажной биомассы. Указанное количество добавляли в реакционную среду, что означает, что соотношение влажная биомасса:реакционная среда составляло 1:2. Учитывая, что влажная биомасса содержала 11% дрожжей, указанное соотношение составляло 1:23, если его выразить как сухие дрожжи : реакционная среда. Конечная концентрация NaOH составляла 0,32 М. Время гидролиза было уменьшено с 16 до 10 ч. Таким образом, по сравнению с партией 3 указанная процедура приводила к уменьшению времени гидролиза. В настоящей заявке полученный продукт называют партией 4.
9.4. Определение характеристик продукта
Пищевые волокна определяли согласно официальному способу АОАС 991.43 (AOAC Official Method 991.43. Total, Soluble and Insoluble Dietary Fiber in foods. Enzymatic-Gravimetric Method, MES-TRIS Buffer). Количество простых Сахаров определяли методом ВЭЖХ с рефрактометрическим детектором. Результаты показаны в таблице 17.

Глюканы определяли согласно способу со ссылкой на K-YBGL 07/11, используя набор от Megazyme, описанный далее. В указанном способе применяли следующие реагенты.
Флакон 1: экзо-1,3-β-глюканаза (100 ед./мл) плюс суспензия β-глюкозидазы (20 ед./мл), 2,0 мл. Во флакон 1 добавляли 8 мл 200 мМ натрий-ацетатного буфера (рН 5,0) (т.е. разбавляя содержимое флакона до 10 мл). Полученный раствор разделили на аликвоты подходящего размера, которые хранили в полипропиленовых пробирках при -20°С и на льду во время применения.
Флакон 2: Амилоглюкозидаза (1630 ед./мл) плюс раствор инвертазы (500 ед./мл) в 50% об./об. глицерине, 20 мл.
Флакон 3: Буферный реактив GOPOD. Буфер (48 мл, рН 7,4), п-оксибензойная кислота и азид натрия (0,4% мас./об.). Содержимое флакона 3 разбавляли до 1,0 л дистиллированной или деионизированной водой.
Флакон 4: Реагент GOPOD на основе ферментов. Глюкооксидаза плюс пероксидаза и 4-аминоантипирин. Содержимое флакона 4 растворяли в разбавленном содержимом флакона 3 (см. предыдущий реагент). Затем такую смесь реагентов (реагент GOPOD) разделяли на аликвоты требуемого объема для хранения.
Флакон 5: Стандартный раствор D-глюкозы (5 мл, 1,00 мг/мл) в 0,2% мас./об. бензойной кислоты.
Флакон 6: Контрольный препарат на основе полученного из β-глюкана дрожжей ((2 г, содержание β-глюкана указано на этикетке на флаконе).
Измерение общего содержания глюкана (α-глюкана + β-глюкана) плюс D-глюкозы в олигосахаридах. сахарозе и свободной β-глюкозе
(а) Солюбилизация и частичный гидролиз общего глюкана: пробы измельчали и пропускали через 0,5 мм сито, используя центрифужную мельницу Retsch. Измельченную пробу (100 мг) помещали в культуральную пробирку Fisher Brand размером 20×125 мм. Пробирку слегка постукивали, чтобы убедиться, что вся проба упала на дно пробирки. В каждую пробирку добавляли 1,5 мл концентрированной HCl (37% об./об.), пробирки закрывали крышечками и энергично перемешивали в вихревой мешалке. Пробирки помещали в водяную баню при 30°С в течение 45 мин и перемешивали в вихревой мешалке каждые 15 мин (для обеспечения полного растворения β-глюкана). В каждую пробирку добавляли 10 мл воды, пробирки закрывали крышечками и перемешивали в вихревой мешалке. Крышечки приоткрывали и помещали пробирки в кипящую водяную баню (~100°С). Через 5 мин крышечки плотно закрывали и продолжали инкубацию в течение 2 ч. Пробирки охлаждали до комнатной температуры, крышечки осторожно приоткрывали и добавляли 10 мл 2 N КОН. Содержимое каждой пробирки количественно переносили в 100 мл мерную колбу, используя 200 мМ натрий-ацетатный буфер (рН 5,0) для промывания пробирки и регулирования объема. Полученный раствор тщательно перемешивали путем опрокидывания. Аликвоту из каждой суспензии центрифугировали при 1500 g в течение 10 мин.
(b) Измерение общего глюкана плюс D-глюкозы в сахарозе и свободной D-глюкозе: 0,1 мл аликвоты (в двух параллельных испытаниях) из центрифугированного экстракта переносили на дно стеклянных пробирок (16×100 мм). На дно каждой пробирки помещали 0,1 мл смеси экзо-1,3-β-глюканазы (20 ед./мл) плюс β-глюкозидазы (4 ед./мл) в 200 мМ натрий-ацетатном буфере (рН 5,0); содержимое пробирок перемешивали вихревой мешалке и инкубировали при 40°С в течение 60 мин. В каждую пробирку добавляли 3,0 мл смеси глюкооксидазы/пероксидазы (GOPOD) и инкубировали при 40°С в течение 20 мин. Оптическую плотность всех растворов измеряли при 510 нм относительно холостого раствора.
Измерение α-глюкана плюс D-глюкозы в сахарозе и свободной β-глюкозе
Измельченную пробу (100 мг) помещали в культуральную пробирку Fisher Brand размером 20×125 мм. Пробирку слегка постукивали, чтобы убедиться, что вся проба упала на дно пробирки. Вводили стержень магнитной мешалки (5×15 мм), а затем в каждую пробирку добавляли 2 мл 2 М КОН и гранулы повторно суспендировали путем перемешивания в течение приблизительно 20 мин в ледяной/водяной бане посредством магнитной мешалки. В каждую пробирку добавляли при перемешивании 8 мл 1,2 М натрий-ацетатного буфера (рН 3,8). Сразу же добавляли 0,2 мл амилоглюкозидазы (1630 ед./мл) плюс инвертазу (500 ед./мл) и хорошо перемешивали и помещали пробирки в водяную баню при 40°С. Пробирки инкубировали при 40°С в течение 30 мин при периодическом перемешивании в вихревой мешалке. Содержимое каждой пробирки количественно переносили в 100 мл мерную колбу и регулировали объем с помощью воды. Полученную смесь хорошо перемешивали и аликвоту раствора центрифугировали при 1500 g в течение 10 мин. В стеклянные пробирки переносили 0,1 мл аликвоты (в двух параллельных испытаниях) или разбавленных, или неразбавленных надосадочных жидкостей, добавляли 0,1 мл натрий-ацетатного буфера (200 мМ, рН 5,0) плюс 3,0 мл реагента GOPOP и инкубировали при 40°С в течение 20 мин. Оптическую плотность всех растворов измеряли при 510 нм относительно холостого раствора.
Холостой раствор состоял из 0,2 мл натрий-ацетатного буфера (200 мМ, рН 5,0) + 3,0 мл реагента глюкооксидаза/пероксидаза. Стандартный раствор β-глюкозы состоял из 0,1 мл стандартного раствора β-глюкозы (1 мг/мл) + 0,1 мл натрий-ацетатного буфера (200 мМ, рН 5,0) + 3,0 мл реагента глюкооксидаза/пероксидаза.
Расчеты
Общее содержание глюкана (% мас./мас.)=ΔЕ×F×100/0,1×1/1000×100/W×162/180=ΔЕ×F/W×90,
α-Глюкан (% мас./мас.)=ΔЕ×F×1000×1/1000×100/W×162/180=ΔЕ×F/W×90 (конечный объем 100 мл)=ΔЕ×F/W×9527 (конечный объем 10,3 мл)
β-Глюкан = Общее содержание глюкана - α-глюкан
где ΔЕ = оптическая плотность реакции - оптическая плотность холостого раствора.
F = фактор для конвертирования оптической плотности в мкг D-глюкозы = 100 (мкг стандартного раствора D-глюкозы)/оптическая плотность GOPOD для 100 мкг стандартного раствора D-глюкозы.
100/0,1 = фактор корректировки объема; для общего содержания глюкана (дрожжей) (был проанализирован 0,1 мл из 100 мл).
1000 = фактор корректировки объема; для α-глюкана (был проанализирован 0,1 мл из 100 мл).
1/1000 = перевод из мкг в миллиграммы.
100/W = перевод обратно в 100 мг пробы (т.е. как % мас./мас.).
W = масса анализируемой пробы.
162/180 = фактор для конвертирования свободной D-глюкозы, которую определяют, в ангидроглюкозу, которая встречается в β-глюкане.
Результаты показаны в таблице 18. Следует отметить, что ферментативный способ позволяет определить количество глюкозы, поступающей из других неглюкановых олигосахаридов, хотя результат приведен как % всех глюканов.
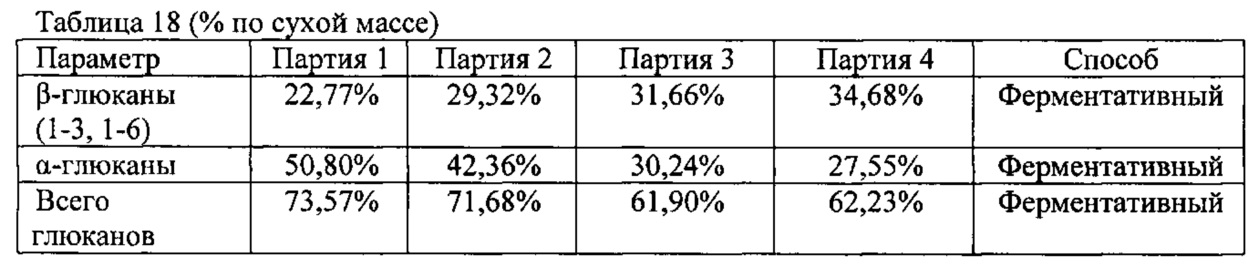
β-глюканы (1-3, 1-6) включены в категорию «пищевое волокно», поскольку они представляют собой неусвояемые полисахариды. Эта категория также будет включать, среди прочего, хитин/хитозан. α-Глюканы наоборот представляют собой усвояемые полисахариды и, таким образом, они не включены в «пищевое волокно». Количество простых Сахаров незначительно во всех партиях. В партии 3, в которой продукт нейтрализовали до первого центрифугирования, содержание в β-глюканах сохранялось по сравнению с партией 2, но экстрагировалось меньшее количество α-глюканов. Это не представляет собой проблему, поскольку биофункциональную возможность продукта связывают с пищевым волокном, включающим β-глюканы и хитин/хитозан.
Элементный состав (среднее значение из 3 реплик)
Партия 2: 0,27% N, 42,99% С, 6,67% Н
Партия 3: 0,50% N, 43,79% С, 6,77% Н
Партия 4: 0,75% N, 42,82% С, 6,83% Н
Указанные значения имеют тот же порядок, что и значения, полученные во всех других процессах. 1 мг пробы направляли на сжигание при 1200°С и анализировали с применением микроанализатора.
Спектры ЯМР
1Н-ЯМР спектры получали путем растворения проб в D2O при концентрации 20 мг/мл и подкисления 30 мкл DCl до полного растворения проб. Добавляли 5 мкл раствора ТМСП (20 мг/мл в D2O) в качестве внутреннего стандарта (0 ppm). Спектры получали при 70°С для избежания перекрывания сигнала воды с сигналом H1 хитозана. Прибор Bruker Avance 600 МГц использовали при следующих условиях анализа: zgpr (импульс 90 при предварительном насыщении сигнала воды), количество накоплений: 128; спектральная ширина: 12 ppm; предварительное насыщение 2-4.
На фиг. 4 показаны спектры ЯМР партий 2, 3 и 4. В области от 3,5 до 4 ppm показаны все пики, связанные с протонами полисахаридов (глюкана, хитина, хитозана), которые являются наиболее интенсивными в спектрах, поскольку они представляют собой основной компонент продукта. H1 хитозана можно видеть на всех спектрах около 5,3 ppm. Сигнал бета протона можно видеть непосредственно перед сигналом воды и сигнал альфа протона - после сигнала воды. В этой области спектра сигналы очень похожи по интенсивности, так что доля различных полисахаридов в трех партиях должна быть очень похожей. В то же время указанные спектры совпадают с ЯМР спектром партии 1 (фиг. 1).
ССЫЛКИ, ЦИТИРУЕМЫЕ В НАСТОЯЩЕЙ ЗАЯВКЕ
1. N. Nwe et al. 2010, "Production of fungal chitosan by enzymatic method and applications in plant tissue culture and tissue engineering: 11 years of our progress, present situation and future prospects" Biopolymers, edited by Magdy Elnashar, published: September 28, 2010, chapter 7, pp. 135-162.
2. H. Yao et al., "Effect of chitosan on plasma lipids, hepatic lipids, and fecal bile acid in hamsters human trials failed to show these effects" J. Food Drug Anal. 2006, vol. 14, pp. 183-189.
3. M.D. Gades et al., "Chitosan supplementation and fat absorption in men and women" J. Am. Diet. Assoc. 2005, vol. 105, pp. 72-77.
4. C.N. Mhurchu et al., "Effect of chitosan on weight loss in overweight and obese individuals: a systematic review of randomized controlled trials" Obes. Rev. 2005, vol. 6, pp. 35-42.
5. K. Zhou et al., "In vitro binding of bile acids and triglycerides by selected chitosan preparations and their physico-chemical properties" Food Science and Technology 2006, vol. 39, pp. 1087-1092.
6. EP 1483299.
7. WO 91/03495.
8. US 4810646.
Реферат
Изобретение относится к богатой полисахаридами композиции, содержащей бета-глюкан, хитин и хитозан, извлеченные из клеточной стенки Saccharomyces cerevisiae из биомассы, представляющей собой побочный продукт процесса пивоварения. Способ получения композиции включает следующие стадии: подготовку реактора с помощью раствора NaOH с концентрацией от 0,25 до 3 М при перемешивании и температуре от 50 до 95°С, добавление к указанному раствору биомассы, полученной в процессе пивоварения, поддержание указанных условий в течение по меньшей мере 1 часа. Далее проводят охлаждение указанного раствора до комнатной температуры, нейтрализацию раствора путем по меньшей мере однократного добавления кислого раствора или воды до достижения рН 7. Причем в случае проведения более чем однократного добавления между добавлениями осуществляют стадию отделения твердого продукта от указанного раствора. Затем осуществляют передачу твердого продукта на по меньшей мере однократную промывку водой и отделение полученного твердого продукта, сушку твердого продукта до постоянной массы и тонкое измельчение. Полученную композицию можно приготовить в виде съедобного, фармацевтического или ветеринарного продукта. Изобретение позволяет получить композицию, которая обладает способностью селективного связывания жиров, и поэтому ее можно применять для предотвращения и/или лечения заболеваний, таких как избыточный вес, ожирение, гиперхолестеринемия, гипертриглицеридемия, гипертония и сердечно-сосудистые расстройства. 5 н. и 8 з.п. ф-лы, 5 ил., 18 табл., 9 пр.

Комментарии