Способ обнаружения и лечения рака легких - RU2114430C1
Код документа: RU2114430C1
Чертежи
Описание
Изобретение относится к применению порфиринов для обнаружения рака легких, а более конкретно к способу использования тетра-арилпорфиринов, примером которых является 5,10,15,20-тетракис(4-карбоксифенил)порфин, для обнаружения и лечения рака легких. Это изобретение является результатом контракта N W-7405-ENG -36, заключенного между руководством Калифорнийского университета и Министерства энергетики США ("Юнайтед Стейтс Департамент оф Энерджи").
Рак легких является одной из первостепенных мировых проблем в области здравоохранения и остается неизлечимым заболеванием. Установлено, что в 1986 г. злокачественные заболевания легких привели к смерти в три раза большее количество людей, чем рак толстой кишки и рак груди у женщин. Несмотря на огромные затраты средств на протяжении последнего десятилетия в лучшем случае можно сказать, что успехи в лечении рака легких минимальны. В действительности в 1988 г. ежегодная смертность от рака легких в США составляла примерно 110000 человек. Кроме того, в том же 1988 г. диагностика установила 150000 новых случаев заболевания раком легких, что вывело рак легких на первое место по смертности среди всех раковых заболеваний. Попытки массового исследования групп повышенного риска также оказались безуспешными.
Лечение рака легких в основном является безуспешным, а иногда и спорным. Среднегодовое значение процента выживших среди пациентов, заболевших раком легких, все еще составляет менее 10%. Практика хирургического вмешательства в опухоль является наиболее успешной среди всех вариантов лечения, однако в большинстве случаев злокачественные образования появляются вновь или приводят к образованию метастаз. Использование радиотерапии и хемотерапии также дает ограниченный успех с точки зрения увеличения продолжительности выживания пациентов, пораженных раком легких. Действительно, средняя продолжительность жизни пациентов с малой клеточной карциномой легких, прошедших курс обработки хемотерапией как совместно с радиотерапией, так и без нее, составила 10 - 15 месяцев для пациентов с "ограниченным" поражением и 7 - 11 месяцев для пациентов с "обширным" поражением.
Взаимосвязь между раком легких и сигаретным дымом хорошо установлена, однако другие факторы состояния окружающей среды также играют свою роль при возникновении рака легких. Одним из подобных факторов окружающей среды является радон-222, благородный газ, который существует в любой окружающей среде. Он образуется в результате распада радия, который в свою очередь получается при распаде урана. Уран присутствует в земной оболочке во всех районах земного шара. Газообразный радон образуется на поверхности земли в процессе распада урана и диффундирует в атмосферу, где и становится фактором, угрожающим здоровью. При распаде радона в атмосфере его короткоживущие производные (изотопы полония, висмута и свинца) оседают на частичках пыли, находящихся в воздухе. Эти радиоактивные частицы, наряду с неосевшими производными радона, вдыхаются в легкие. Радон и его производные дают альфа-, бета- и гамма-излучение. Установлено, что производные радона дают свыше 95% дозы облучения альфа-излучением базальных клеток трахеобронхиального эпителия легких.
Эпидемиологические исследования установили, что подверженность воздействию радона и его производным приводит к увеличению риска возникновения бронхиальных карцином. В начале 60-х гг. была разработана Цитологическая методика обнаружения рака легких у шахтеров урановых разработок, которые в результате различных процессов подвергаются значительному проникновению радона и его производных в дыхательные пути (и в бронхиальный эпителий) на протяжении многих лет. Кроме того, было установлено, что подверженность раку легких у курящих шахтеров в 10 раз выше, чем у некурящих. Описанные методики, основанные на цитопатологии легких, являются весьма чувствительными с точки зрения обнаружения ненормальных (раковых) клеток у членов групп повышенного риска, например у шахтеров урановых рудников, однако с момента обнаружения клеток новообразований задача локализации карциномы легких становится затруднительной, а во многих случаях и невозможной проблемой. Поскольку большинство заболеваний не могут быть обнаружены in situ невооруженным глазом, подобные заболевания необходимо локализировать посредством селективного получения соскребов с легких и взятию проб биопсией "вслепую". Подобные диагностические процедуры требуют общей анестезии и по меньшей мере 2 - 3 ч на их проведение. Обнаружение подобных новообразований на ранней стадии имеет большое значение для лечения рака легких. Многие специалисты разделяют мнение, что для того, чтобы лечение рака легких было успешным, процедура лечения должна начинаться на ранних стадиях развития рака (in situ). Для успешного обнаружения этих ранних злокачественных поражений легких необходима разработка новых соединений, которые можно использовать в обычной клинической практике для обнаружения небольших поражений легких.
Порфирины, в частности гематопорфирин, в течение ряда лет известны в качестве веществ, обладающих значительным сродством к злокачественным раковым клеткам, и нашли свое место в качестве диагностических маркеров. Раковые клетки, захватившие гематопорфирин, флуоресцируют при облучении УФ-излучением. Однако специфичность захвата порфиринов, использовавшихся в предшествующие годы, недостаточно полна, как этого следовало бы желать, то есть, существует значительный "фон" флуоресценции от нераковых клеток, который сопровождает флуоресценцию от интересующих медиков клеток. Впоследствии для визуализации новообразований в мочевом пузыре человека стали использовать гематопорфирин. Методика включает эндоскопическое исследование места предполагаемой опухоли посредством инструментария, детектирующего флуоресцентное излучение, обусловленное возбуждением порфиринов посредством светового излучения с длиной волны 400 нм.
Порфирины используют также при диагностике и локализации малых, неясных при радиологическом обследовании опухолевых легких [1; Х.Като с сотр. Ранняя диагностика рака легких посредством флуоресценции с использованием производных гематопорфина и лазерного фотоизлучения. Clin. Chest Med., 6, 237, 1985). В указанных работах для локализации и идентификации ранних чешуйчатых клеточных карцином у пациентов с нормальными радиограммами грудной клетки используют систему детектирования, основанную на сочетании фотоэлектрической флуоресценции и обычного бронхоскопа. Был установлен тот факт, что злокачественные клетки могут быть обнаружены в образцах мокроты пациентов, пораженных раком легких, при введении в указанных образцах производных гематопорфирина. В данных работах злокачественные клетки, наряду с некоторыми незлокачественными клетками, флуоресцируют на протяжении до 9 сут после внутривенного введения порфирина. Захват порфирина нормальными клетками не является исключением, поскольку другие ткани, например эмбриональные и травмированные ткани, по известным сообщениям также способствуют локализации производных гематопорфирина. (К.Б.Пател с сотр. Флуоресценция клеток в мокроте после парентерального ХПД. В сборнике "Прогресс в клинических и биологических исследованиях", т. 170; Т.Дойрон и С.Гуомер (изд.) "Порфирины в локализации и лечении опухолей", с. 521-530, 1984).
Локализация злокачественных образований с использованием описанных выше методик зависит от визуального наблюдения красного флуоресцентного эмиссионного излучения порфирина. В большинстве методик это обследование сопровождается и дополняется сканированием легкого посредством бронхоскопа, приспособленного для испускания светового излучения с длиной волны 400 нм, которое возбуждает молекулы порфирина. Ограничивающий фактор для использования данной методики состоит в том, что она требует для своего осуществления много времени и наличия высокопрофессионального персонала при обследовании всех областей легкого на предмет обнаружения злокачественных образований. Поскольку флуоресцентное излучение от всех указанных небольших очагов поражения очень слабо и трудно обнаружимо, указанные малые очаги могут быть легко пропущены. Кроме того, для визуального обнаружения флуоресценции порфирина указанный порфирин должен присутствовать на поверхности опухоли, а опухоль должна находиться на поверхности легкого. Любой материал, например слизистое покрытие, или ситуация, при которой опухоль располагается глубоко, препятствует наблюдению флуоресценции порфирина. В результате порфирин нельзя успешно использовать в качестве диагностического средства при обнаружении неясных очагов поражения в легких.
Цель изобретения состоит в разработке способа локализации малых неясных злокачественных опухолевых масс в легких пациентов.
Другая цель изобретения состоит в разработке способа селективного облучения малых неясных злокачественных опухолевых масс в легких пациентов.
Еще одна цель данного изобретения состоит в разработке быстрого и высококонтрастного способа обнаружения наличия злокачественных клеток in vitro.
Прочие цели, преимущества и отличительные особенности согласно изобретению частично содержатся в последующем описании, а частично становятся ясными для специалиста в данной области после изучения описания или в результате применения изобретения на практике. Цели и преимущества изобретения могут быть реализованы и достигнуты, в частности, в результате использования инструментария и вариантов, приведенных в формуле изобретения.
Для достижения указанных выше и прочих целей и в соответствии с задачами изобретения, выраженными и описанными в широком смысле в данном описании, способ обнаружения рака легких in vitro включает получение одноклеточной суспензии клеток легких, обработку одноклеточной суспензии клеток легких тетра-арилпорфирином, в частности 5,10,15,20-тетракис(4-карбоксифенил)порфином, на протяжении промежутка времени, достаточного для уверенного захвата его клетками новообразований легких, содержащихся в указанной одноклеточной суспензии клеток легких, выдерживание обработанной клеточной суспензии под ультрафиолетовым излучением с целью вызвать флуоресценцию 5,10,15, 20-тетракис(4-карбоксифенил)порфина, захваченного клетками новообразований, и оценку суспензии на предмет обнаружения флуоресцирующих клеток.
Предпочтительно одноклеточную суспензию фиксируют либо посредством карбовакса и спирта, либо посредством параформальдегида.
В соответствии с другим аспектом изобретения и согласно его целям и задачам, предусматривается способ лечения рака легких, включающий введение пациенту образца комплекса67Cu тетра-арилпорфирина, в частности 5,10,15,20-тетракис (4-карбоксифенил)порфина. Следует отметить, что согласно обычно используемой химической номенклатуре порфирины в форме свободных оснований обозначаются как "порфины", тогда как закомплексованные порфирины носят обозначение "порфинатов".
В соответствии с другим аспектом изобретения и согласно его целям и задачам предусматривается способ локализации мест злокачественных образований в легких in vivo, включающий введение пациенту образца комплекса67Cu или64Cu тетра-арилпорфирина, в частности 5,10,15,20- тетракис- (4-карбоксифенил)порфина, и проведение анализа изображений в испускаемом гамма-излучении или анализа методом позитронной томографии в испускаемом позитронном излучении, соответственно.
Преимущества и выгоды согласно изобретению включают эффективную, удобную и экономичную идентификацию клеток рака легких в образцах мокроты и биопсии при бронхоскопическом исследовании легких, а также визуализацию с использованием гамма-излучения или позитронной томографии, и местную селективную обработку ионизирующим излучением масс, пораженных раком легких, без применения хирургического вмешательства.
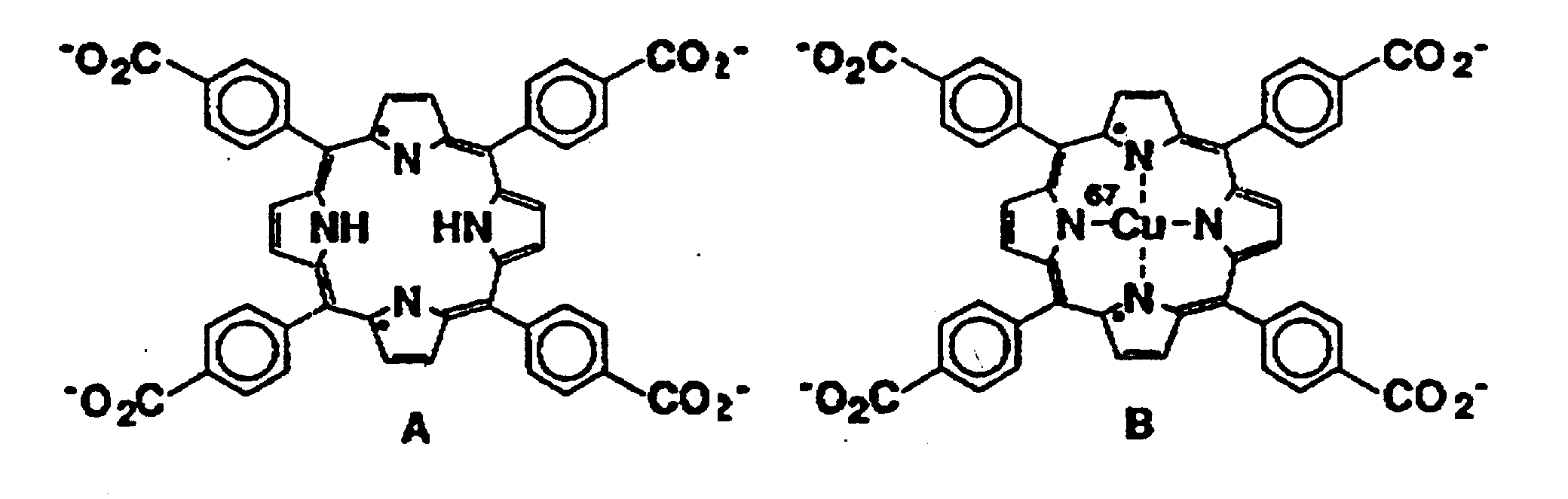
На чертеже представлена структурная формула 5,10,15, 20-тетракис(4-карбоксифенил)порфина (A) и структурная формула комплекса данного порфина с67Cu (B).
Кратко говоря, изобретение включает использование тетраарилпорфиринов, в частности 5,10,15,20-тетракис(4-карбоксифенил)порфина (TCPP), в качестве флуоресцентного трасера для клеток рака легких, а также в качестве радиотрасера указанных клеток в виде комплекса с67Cu. Данный комплекс является также источником бета-излучения для селективного разрушения злокачественных образований в легких, а также гамма-излучения, используемого при визуализации изображений мест поражения, например полученных компьютерной томографией, использующей принцип эмиссии фотонов. Изотоп67Cu может быть заменен на64Cu в случаях, когда интерес представляют только его свойства в качестве радиотрассера. Изотоп меди-64 представляет собой источник позитронов и в этом случае для обнаружения масс злокачественной ткани можно использовать широко известный способ компьютерной томографии, использующей принцип эмиссии позитронов. Положенный в основу способа принцип основан на средстве TCPP и других представителей семейства порфиринов к злокачественным образованиям в легких в случае, когда указанные вещества вводят в непосредственной близости от пораженных клеток.
Далее приводится подробное описание предпочтительного варианта изобретения, пример которого иллюстрируется чертежом.
Вначале проводят исследования на тему определения возможности локализации TСРР в клетках новообразований из образцов мокроты шахтеров урановых рудников в условиях, когда процесс их появления проявляется в максимальной степени. Затем проводят исследования по локализации TCСР в различных типах клеток рака легких (в клетках эпителия, малых клетках, метастазах липомы легких и аденокарциномы), а также возможно диагностирование рака легких у подобных пациентов с использованием TСРР.
В данном исследовании определяют 5 параметров: 1) воздействие различных методик обработки мокрых на захват порфирина клетками мокроты; 2) сравнение TСРР и трех других порфиринов, обладающих свойством захвата опухолевыми клетками; 3) время, необходимое для оптимального захвата порфирина клетками мокроты; 4) степень захвата порфирина испытываемыми и контрольными образцами мокроты; 5) проверка факта локализации TCРР в злокачественных клетках мокроты.
В каждом из указанных опытов захват порфирина клетками мокроты оценивают посредством флуоресцентного микроскопа. Неметаллизированный порфирин флуоресцирует при длине волны примерно 650 нм. Образцы мокроты оценивают на предмет: 1) числа флуоресцирующих клеток в мокроте; 2) интенсивности флуоресценции порфирина.
Образцы мокроты требуют дополнительной обработки для получения одноклеточной суспензии клеток легких. Образцы мокроты собирают у испытуемых и контрольных пациентов и обрабатывают их спиртом и карбоваксом, только спиртом, забуференным фосфатным буфером солевым раствором (фосфатно-солевой буфер, ФСБ) или не подвергают никакой обработке. Все образцы смешивают в смесителе в течение 1 мин после обработки, вслед за чем помещают в чашки Петри, содержащие различные порфирины. Образцы мокроты, обработанные спиртом и карбоваксом или спиртом в отсутствии карбовакса, содержат большее количество клеток, свободных от слизи по сравнению с образцами, обработанными ФСБ или вообще не прошедшими обработки. Клетки необработанной мокроты прилипают к дну чашки Петри, причем только небольшая часть клеток свободна от слизи. Образцы мокроты после обработки ФСБ содержат наибольшее количество живых клеток по сравнению с образцами, обработанными спиртом или спиртом с карбоваксом, однако клетки мокроты, прошедшие обработку спиртом или спиртом с карбоваксом, дают наибольший захват TCPP, что наталкивает на предложение о том, что TCPP может иметь определенное средство к неживым клеткам, прошедшим подобную обработку.
В данном исследовании на предмет способности к обнаружению злокачественных клеток в мокроте используют 4 порфирина, для которых известно наличие средства к клеткам новообразований. Клетки мокроты, полученные в результате каждой из описанных выше методик обработки, обрабатывают одним из перечисленных ниже производных гематопорфирина (ПГП), 5,10,15, 20-тетракис(4-карбоксифенил)порфином, TCPP, 5,10,15,20-тетракис(4-сульфонатфенил)порфином, TTPS или уропорфирином, УPO. Во всех опытах порфирины растворяют в культурной клеточной среде О в концентрации 200 мкг/мл. После добавления порфирина образцы выдерживают при 37oC в течение определенного промежутка времени.
По истечении времени выдерживания каждый из образцов мокроты исследуют на предмет захвата порфирина посредством флуоресцентного микроскопа. В ряде опытов фоновая флуоресценция, обусловленная захватом порфирина незлокачественными клетками, меньше, чем в других опытах. Образцы мокроты, выдерживаемые с TCPP, дают наибольшее количество флуоресцирующих клеток, обеспечивают наибольший контраст (яркость) между флуоресцирующими злокачественными клетками и фоновой флуоресценцией, что указывает на значительную степень захвата порфирина злокачественными образованиями. Образцы мокроты, обработанные ПГП и TPPC, дают умеренную степень захвата порфирина, а образцы, прошедшие обработку УPO, дают наименьший эффект в отношении захвата порфирина.
Каждый из образцов мокроты выдерживают при 37oC с каждым из порфиринов в течение 6 или 24 ч, после чего определяют степень захвата порфирина посредством флуоресцентного микроскопа. При времени выдерживания 6 ч клетки начинают локализовать порфирины, однако в случае, когда клетки мокроты промывают ФСБ, флуоресценция заметно уменьшается. Это позволяет предложить, что порфирин еще не прочно связался с клетками. Напротив, спустя 24 ч захват порфирина клетками мокроты значительно увеличивается. Этот факт иллюстрируется количеством клеток, захваченных порфирином, и интенсивностью флуоресценции порфирина. В случае, когда клетки мокроты, выдерживаемые в течение 24 ч, были промыты ФСБ, порфирин остается закрепленным на клетках. Более продолжительное время выдерживания не исследовалось.
Контрольные образцы мокроты не содержат клеток новообразований. Однако в них содержится значительное количество воспалительных клеток. При сравнении захвата порфирина испытываемыми и контрольными образцами (по такому параметру, как количество флуоресцирующих клеток мокроты) захват порфирина в контрольных образцах значительно ниже, чем захват в испытываемых образцах. Кроме того, интенсивность флуоресценции тех немногих флуоресцирующих контрольных образцов ниже, чем интенсивность флуоресценции испытываемых образцов. Наиболее заметное различие между захватом порфирина контрольными и испытываемыми образцами клеток наблюдается в образцах, выдержанных с TCPP.
С целью облегчения идентификации клеток новообразований образцы мокроты, обладающие наибольшей степенью захвата TCPP, окрашивают посредством красителя PAP, обычно используемого в цитологии для идентификации клеток новообразований. Клетки, идентифицированные как клетки новообразования при использовании красителя PAP, маркируют и вновь подвергают исследованию на предмет захвата TCPP с применением флуоресцентного микроскопа. Хотя интенсивность флуоресценции TCPP уменьшается в процессе окрашивания PAP, флуоресценция от TCPP заметна в каждой из клеток новообразований.
Исследования проводят на пациентах, имеющих твердо установленную чешуйчатую легочную карциному, овсяную клеточную легочную карциному, легочную аденокарциному и развившуюся метастазирующую лифому (метастаза легких), с использование описанной выше методики. При использовании в качестве меры числа флуоресцирующих клеток в образце мокроты, умноженного на интенсивность флуоресценции клеток, обнаружено, что значение в случае образцов мокроты раковых больных в 3 - 6 раз превышает значение, полученное для пациентов, не пораженных раком. Эти исследования подтверждают также, что TCPP и карбовакс и этанол приводят к наивысшей степени захвата порфирина клетками новообразований мокроты.
Дополнительные исследования позволяют определить, что TCPP также локализуется в раковых клетках легких, выращиваемых в культурах тканей. Кроме того, клетки чешуйчатой карциномы, выращиваемые в культуральной среде и обработанные TCPP, могут быть легко обнаружены с использованием цитометрии в потоке, а автофлоуресценция контрольных клеток, не подвергнутых обработке TCPP, пренебрежимо мала по сравнению с флуоресценцией клеток, подвергавшихся воздействию TCPP. Расширив исследования на другие типы клеток легких, обнаружено, что малые клетки карциномы легких у человека ("ячменные" клетки) адсорбируют TCPP в 2 - 3 раза меньших количествах, чем линия чешуйчатых клеток, однако и это значение все еще значительно выше, чем захват нормальными клетками. Обнаружено также, что нормальные клетки легких концентрируют TCPP на уровне, лишь незначительно превышающем автофлуоресценцию или фоновый уровень, т. е. дают во много раз меньшую концентрацию, чем концентрация TCPP в исследуемой линии клеток новообразований. Выдерживание клеток в течение 24 ч в TCPP более, чем достаточно для максимальной локализации ТСРР, а фиксирование клеток перед выдерживанием с TCPP увеличивает захват TCPP. Использование параформальдегида в качестве фиксатора несколько увеличивает захват TCPP клетками по сравнению с клетками, фиксированными спиртом и карбоваксом.
Получение меди-67 включает облучение мишени из окиси цинка протонами с энергией 600 - 800 МэВ в течение нескольких суток. Реакция распада в мишени дает не только67Cu, но также и ряд других изотопов с меньшей чем у цинка массой. Процедура очистки является сложной и включает отделение67Cu от цинка и других металлов посредством электрохимической обработки [2]. Получение67Cu и TCPP осуществляют либо исходя из N - bzHTCPP, либо из TCPP посредством радиометаллирования67CuCl2.
Важным фактором при разработке радиопрепарата для медицины является стабильность комплекса67Cu - TCPP в отношении потери радиоизотопа67Cu in vivo. Для испытания стабильности67Cu - TCPP разработан флуоресцентный способ, основанный на факте, что медные производные порфиринов не дают флуоресценцию до тех пор, пока не происходит их деметаллизация. В соответствии с этим способом потеря меди может быть измерена при моделировании физиологических условий (см. Дж. С.Роберто с сотр. Получение и характеристики конъюгатов медь-67-порфирин-антитело. J. Immunol. Methods 105, 153, 1987). Обнаружено, что стабильность Cu-TCРР в альбумине сыворотки человека и двух хелатообразующих агентах (ЭЛТУК и ЛТФА) настолько высока, что наблюдается менее 1% превращения (на уровне передачи чувствительности метода) на протяжении времени выдерживания до 12 сут. Кроме того, не замечено измеримой перекомплексации с другими ионами металлов, о чем свидетельствуют данные УФ-видимой спектроскопии.
Стерильную дозу67Cu-TCPP (1,0•10-6 г) вводят внутривенно в хвостовую вену у крыс. Установлено, что печень и почки этих животных (не пораженных раком) являются основными органами, в которых происходит локализация67Cu-TCPP. Из полученных результатов можно сделать вывод о том, что67Cu-TCPP пригоден для обнаружения и лечения раковых тканей легких in vivo, поскольку нормальная легочная ткань не захватывает сколь-нибудь значительных количеств67Cu-TCPP, что делает отношение степени захвата раковыми тканями и нормальными тканями значительным. Биологические исследования времени полураспада свидетельствуют о том, что67Cu-TCPP удаляется у животных биологическим путем в соответствии с обычным экспотенциальным законом убывания при времени полураспада 108 ч.
Предшествующее описание некоторых предпочтительных вариантов изобретения предназначено для иллюстрации и пояснений. Оно не ограничивает и не исчерпывает изобретение точным соблюдением описанного варианта. Очевидно, что может существовать много различных вариантов и модификаций в духе описанного выше способа. Так, например, для любого специалиста в области обнаружения и лечения рака после изучения приведенного описания становится очевидным, что способ локализации мест злокачественных образований в легких in vivo может включать введение образца комплекса64Cu 5,10,15, 20-тетракис(4-карбоксифенил)порфина в поток крови или применение аэрозоля, содержащего указанный комплекс, для введения его в легкие пациента, проходящего диагностирование, с последующим проведением позитронной томографии (см. Г.Фирнау с сотр. Введение меченного64Cu производного гематопорфирина для недеструктивного измерения in vivo степени захвата его опухолями. В сборнике "Прогресс в клинических и биологических исследованиях", т. 170, под ред. Л.Дойрона и С. Гомера; статья "Локализация порфирина и лечение опухолей", с. 629 - 636 1984). В случае введения радиоизотопных меток с использованием изотопов, имеющих большое время полураспада, для специалиста в данной области очевидно, что эффективным будет также введение комплексов64Cu в ткань с целью последующей диффузии в поток крови. Для рядового специалиста в данной области очевидно также, что образцы можно получать из биопсии ткани также, как из образцов мокроты, для проведения диагностики in vivo.
Данные варианты выбраны и описаны с целью наилучшего понимания принципов изобретения и его практического применения, что позволяет специалистам в данной области использовать наилучшим образом способ в его различных вариантах и с различными модификациями с учетом конкретных вариантов использования. Очевидно, что пределы изобретения определены в приведенной формуле изобретения.
Реферат
Изобретение может быть использовано в медицине, в частности в онкологии для обнаружения и лечения рака легких. Способ высококонтрастный для быстрого обнаружения наличия злокачественных клеток in vitro и селективного облучения малых неясных злокачественных опухолевых масс в легких пациента. Исследуют биологический материал на наличие флуоресцирующих клеток, при этом получают одноклеточную суспензию клеток легких, обрабатывают ее 5,10,15,20-тетракис(4-карбоксифенил)порфином в течение промежутка времени, достаточного для захвата существенного его количества злокачественными клетками легких, выдерживают обработанную клеточную суспензию под ультрафиолетовым облучением и обнаруживают злокачественные клетки легких по наличию флуоресцирующих клеток в ней. Для лечения в части второго способа вводят в организм радиоизотоп, и производное порфирина, а именно комплекс67Cu 5,10,15,20-тетракис-(4-карбоксифенил)порфина. 8 с. и 12 з.п.ф-лы, 1 ил.

Комментарии