Способ получения производных мевалоновой кислоты,ингибирующих гмг-соа редуктазу - RU2335500C2
Код документа: RU2335500C2
Описание
Изобретение относится к способу получения ингибиторов ГМГ-СоА редуктазы, стадиям способа, новым промежуточным соединения и новым катализаторам.
Под ингибиторами ГМГ-СоА редуктазы (называемыми также ингибиторами β-гидрокси-β-метилглутарил-кофермент А редуктазы, а также статинами) подразумевают такие активные агенты, которые могут быть предпочтительно использованы для снижения уровней липидов, включая холестерин, в крови и могут быть использованы, например, для профилактики или лечения гиперлипидемии и атеросклероза.
Класс ингибиторов ГМГ-СоА редуктазы включает в себя соединения, имеющие различные структурные характеристики. В качестве примера можно назвать соединения, выбранные из группы, состоящей из аторвастатина, церивастатина, флувастатина, ловастатина, питавастатина (первоначальное название итавастатин), правастатина, розувастатина и симвастатина или, в каждом случае, их фармацевтически приемлемые соли.
Предпочтительными ингибиторами ГМГ-СоА редуктазы являются те агенты, которые были выпущены на рынок, наиболее предпочтительные из них представлены флувастатином, аторвастатином, питавастатином, в особенности их кальциевой солью, или симвастатином, либо его фармацевтически приемлемой солью.
Аторвастатин формулы

описан в патенте US 5273995 и является его объектом.
Церивастатин формулы

описан в патенте US 5177080 и является его объектом.
(+)-(5S,3R)-Форма флувастатина формулы

описана в патенте US 5345772 и является его объектом.
Ловастатин формулы

описан в патенте US 4231938 и является его объектом.
Питавастатин формулы

описан в патенте US 5856336 и является его объектом.
Правастатин формулы

описан в патенте US 4410629 и является его объектом.
Розувастатин формулы

описан в патенте US 5260440 и является его объектом.
Симвастатин формулы

описан в патенте US 4444784 и является его объектом.
Структуру активных агентов, идентифицированных выше или далее в данном контексте с помощью родовых или торговых наименований, можно найти в текущем издании стандартного справочника (компендиума) "The Merck Index" или в базах данных, например, международных патентов или LifeCycle Patents International соответственно (например, IMC World Publications). Соответствующее их содержание включено в данный контекст в качестве ссылок. Любой специалист в данной области техники имеет возможность идентифицировать активные агенты и, основываясь на данных ссылках, может их получить и протестировать фармацевтические показания и свойства на стандартных тест-моделях как in vitro, так и in vivo.
Кислотные производные ингибиторов ГМГ-СоА редуктазы разработаны и выпускаются в форме солей, например, флувастатин в форме натриевой соли, а питавастатин в форме кальциевой соли.
Соответствующие активные ингредиенты или их фармацевтически приемлемые соли могут также применяться в форме сольвата, такого как гидрат, или включать в себя другие растворители, используемые для кристаллизации.
В основном, статины включают в себя такие составные части, как циклическое ядро и боковую цепь формулы

(фрагмент 3,5-дигидроксигепт-6-еновой кислоты), которые могут образовывать соответствующий лактон с фрагментом структурной формулы

или

(производное 3,5-дигидроксигептановой кислоты), которое может образовать соответствующий лактон с фрагментом структурной формулы

В указанных фрагментах боковой цепи (А) или (С) важнейшими характерными чертами являются структура 3,5-син-диола и R-конфигурация при атоме С-3, поскольку соответствующие статины с данными специфическими фрагментами проявляют самую высокую биологическую активность.
Задачей настоящего изобретения является разработка энантиоселективного способа получения соединений формулы (I) с высоким выходом и, кроме того, обеспечивающего сведение к минимуму экологических загрязнений окружающей среды и экономически привлекательного, например, за счет использования меньшего количества стадий последовательности превращений в процессе получения соединений формулы (I) и приводящего, главным образом, к энантиомерно чистым целевым продуктам и продуктам, обладающим хорошей кристаллизуемостью. Более того, другой задачей настоящего изобретения является разработка способа, который можно осуществлять в большем объеме и который, таким образом, может быть использован в соответствующем производственном процессе. Кроме этого, необходимо избегать любых стадий разделения каких-либо стереоизомеров.
Неожиданным образом, в способе, предлагаемом в настоящем изобретении, успешно решены упомянутые выше задачи. Способ относится к энантиоселективному синтезу с использованием по сути так называемого метода смещенного гидрирования. Например, может быть достигнут избыток энантиомера (иэ) соединения формулы (I) ≥95%, предпочтительно ≥98% и наиболее предпочтительно ≥99%.
Изобретение относится к способу получения производного мевалоновой кислоты формулы (Ia) - ингибитора редуктазы ГМГ-СоА

или его соли, прежде всего фармацевтически приемлемой соли с основанием, либо его лактона, в котором
элемент

Соль соединения формулы (I) представляет собой, например, соль с основанием, предпочтительно его соответствующую фармацевтически приемлемую соль.
Лактон соединения формулы (I) представлен общими формулами (Ia) и (Ib)


Соответствующий циклический остаток R включает в себя циклический остаток, выбранный из группы, состоящей из остатков








Анализ многочисленных экспериментальных данных неожиданно привел к последовательности стадий способа получения, который удовлетворяет упомянутым выше критериям, иллюстрирующим обозначенные преимущества способа.
В процессе получения питавастатина (NK- 104), описанном в журнале Bioorganic & Medicinal Chemistry Letters, т, 9, сс, 2977-2982, 1999, необходимо получить рацемическую смесь сложного эритро-β,δ-дигидроксиэфира, который подвергают гидролизу с образованием соответствующей кислоты. Используя α-метилбензиламин, получают диастереомерную смесь образующихся солей, которые нужно превращать в различные диастереомерные соли. Явным недостатком данного подхода является то, что приходится разрушать половину исходного материала. Соответственно, предлагаемый в настоящем изобретении способ можно осуществить, минуя подобную процедуру разложения диастереомеров на составные части.
Способ получения соединения формулы

или его соли, либо лактона, где элемент

в соответствии с настоящим изобретением, заключается в том, что
(а) осуществляют взаимодействие соединения формулы (IIa)

где R1, R2 и R3 независимо друг от друга обозначают фенил, незамещенный или замещенный одним или несколькими заместителями, выбранными из группы, содержащей С1-С7алкил, гидроксигруппу, С1-С7алкоксигруппу, С2-С8алканоилоксигруппу, галоген, нитрогруппу, цианогруппу и CF3, а R4обозначает алифатический, циклоалифатический, арилалифатический или ароматический остаток,
с соединением формулы R-CH(=O) (IIb), где R обозначает циклический остаток;
(б) восстанавливают полученное соединение формулы (IIc)

где R и R4 имеют значения, определенные выше, в присутствии восстанавливающего агента, выбранного из группы, содержащей соединения формул (IId), (IId'), (IId''), (IId'''), (IId''''), (IId'''''), (IId'''''') и (IId''''''')








где M обозначает Ru, Rh, Ir, Fe, Co или Ni;
L1 обозначает водород;
L2 обозначает арил или арилалифатический остаток;
Hal обозначает галоген;
R5 обозначает алифатический, циклоалифатический, циклоалифатический-алифатический, арильный или арилалифатический остаток, который в каждом случае может быть связан с полимером;
каждый из R6 и R7 независимо обозначает алифатический, циклоалифатический, циклоалифатический-алифатический, арильный или арилалифатический остаток;
каждый из остатков R8 и R9 обозначает фенил или R8 и R9 совместно с атомом углерода, к которому они присоединены, образуют циклогексановое или циклопентановое кольцо и
R15 обозначает водород, галоген, амино-, нитро- или С1-С7алкоксигруппу;
причем любой ароматический остаток соединения формулы (IId), (IId'), (IId''), (IId'''), (IId''''), (IId'''''), (IId'''''') или (IId''''''') является незамещенным или замещенным, при этом для соединений формул (IId''), (IId'''), (IId''''), (IId'''''), (IId'''''') или (IId''''''') возможны также комбинации с (R)- или (S)-BINAP (2,2'-бис(дифенилфосфино)-1,1'-бинафтилом);
(в) конденсируют полученное соединение формулы (IIe)

где R и R4 имеют значения, определенные выше,
с соединением формулы (IIf)

в котором R16 обозначает алифатический остаток;
(г) восстанавливают полученное соединение формулы (IIg)

в котором R и R16 имеют значения, определенные выше;
(д) гидролизуют полученное соединение формулы (IIh)

в котором R и R16 имеют значения, определенные выше, и
(е)выделяют полученное соединение формулы (I) или его соль и при необходимости превращают полученную свободную кислоту формулы (I) в ее соль или лактон формулы (Ia) или (Ib), соответственно, или превращают полученный лактон формулы (Ia) или (Ib) в кислоту формулы (I) или ее соль, либо превращают полученное соединение формулы (I), в котором элемент


Общие понятия, используемые в данном контексте выше и далее, если не определено иначе, подразумевают следующие значения.
С1-С7алкил означает, например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил или соответствующие остатки пентил, гексил или гептил. С1-С4алкил является предпочтительным, особенно метил или трет-бутил.
С1-С7алкоксигруппа означает, например, метокси-, этокси-, н-пропилокси-, изопропилокси-, н-бутилокси-, изобутилокси-, втор-бутилокси-, трет-бутилоксигруппу или соответствующие остатки пентилокси-, гексилокси- или гептилоксигруппы, С1-С4алкоксигруппа является предпочтительной. Особенно предпочтительными являются метокси- и трет-бутоксигруппа.
Остаток С2-С8алканоил в С2-С8алканоилоксигруппе означает, прежде всего, ацетил, пропионил, бутирил, изобутирил или пивалоил. С2-С5алканоилгруппа является предпочтительной.
Галоген означает, прежде всего, галоген с атомным номером до 35 включительно, то есть фтор, хлор или бром, и в более широком смысле включает в себя иод. Предпочтительными являются фтор или хлор.
Остаток алифатического углеводорода означает, например, С1-С7алкил, С2-С7алкенил или, во вторую очередь, С2-С7алкинил.
С2-С7алкенил означает, прежде всего, С3-С7алкенил, например 2-пропенил или 1-, 2- или 3-бутенил. Предпочтительным является С3-С5алкенил.
С2-С7-алкинил означает, прежде всего, С3-С7алкинил и предпочтительно пропаргил.
Циклоалифатический остаток обозначает, например, С3-С8циклоалкил или, во вторую очередь, С3-С8циклоалкенил.
С3-С8циклоалкил означает, например, циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Остатки циклопентил и циклогексил являются предпочтительными.
С3-С8циклоалкенил означает, прежде всего, С3-С7циклоалкенил и предпочтительно обозначает остатки циклопент-2-енил и циклопент-3-енил или циклогекс-2-енил и циклогекс-3-енил.
Циклоалифатический-алифатический остаток обозначает, например, С3-С8циклоалкил-С1-С7алкил, предпочтительно С3-С6-циклоалкил-С1-С4алкил. Предпочтительным является циклопропилметил.
Арилалифатический остаток означает, прежде всего, фенил-С1-С7алкил, а также фенил-С2-С7алкенил или фенил-С2-С7алкинил.
Ароматический остаток обозначает, например, карбоциклический или гетероциклический ароматический остаток, в частности фенил или, главным образом, соответствующий 5- или 6-членный моноциклический остаток, который содержит до четырех одинаковых или разных гетероатомов, таких как атомы азота, кислорода или серы, предпочтительно один, два, три или четыре атома азота, атом кислорода или атом серы. Соответствующие 5-членные гетероарильные остатки представлены, например, моноаза-, диаза-, триаза-, тетрааза-, моноокса- или монотиациклическими арильными радикалами, такими как пирролил, пиразолил, имидазолил, триазолил, тетразолил, фурил и тиенил, в то время как подходящим соответствующим 6-членным остатком является, прежде всего, пиридил.
Пирролил представляет собой, например, 2- или 3-пирролил. Пиразолил представляет собой 3- или 4-пиразолил. Имидазолил представляет собой 2- или 4-имидазолил. Триазолил представляет собой, например, 1,3,5-1Н-триазол-2-ил или 1,3,4-триазол-2-ил. Тетразолил представляет собой, например, 1,2,3,4-тетразол-5-ил, фурил представляет собой 2- или 3-фурил, а тиенил представляет собой 2- или 3-тиенил, в то время как подходящий остаток пиридила представлен 2-, 3- или 4-пиридилом.
Соответствующие полициклические остатки представлены антраценилом, фенантрилом, бензо[1,3]диоксолом или пиренилом. Ароматический остаток может быть монозамещенным такой группой, как NH2, ОН, SO3Н, СНО, или дизамещенным такими группами, как ОН или СНО и SO3Н.
Любой ароматический остаток предпочтительно является незамещенным или замещенным, например, одним или несколькими, в частности двумя или тремя остатками, такими как выбранные из группы, содержащей С1-С7алкил, гидроксигруппу, С1-С7алкоксигруппу, С2-С8алканоилоксигруппу, галоген, нитрогруппу, цианогруппу и CF3.
Полимеры могут быть представлены полистиролами (ПС), поперечно сшитыми ПС(ПСПС), полиэтиленгликолем (ПЭГ) или остатком силикагеля (Si). В качестве примеров можно привести NH-R15, где R15 обозначает С(O)(СН2)n-ПС или С(O)NH(СН2)n-ПС, и -O-Si-(R14)2(CH2)n R16, где n означает целое число от 1 до 7, R14 обозначает С1-С6алкил, напримерэтил, а R16 обозначает ПС, ПСПС, ПЭГ или Si (полученные от фирмы Aldrich, Швейцария).
В общих формулах формул (IId), (IId'), (IId''), (IId'''), (IId''''), (IId'''''), (IId'''''') или (IId''''''') следующие значения являются предпочтительными независимо, совместно или в любых комбинациях либо субкомбинациях:
М представляет собой Ru, Rh, Ir, предпочтительно Ru,
L2 представляет собой изопропилметилбензол, бензол, гексаметилбензол, мезитилен, предпочтительно изопропилметилбензол,
R5 представляет собой 2- или 3-, или 4-пиридил, 4-хлор-4-феноксифенил, 4-феноксифенил, 5-диметил(или этил)амино-1-нафтил, 5-нитро-1-нафтил, 2-, 3-, 4-нитрофенил, 4-винилфенил, 4-бифенилил, 9-антраценил, 2-,3- или 4-гидроксифенил, толил, фенантрил, бензо[1,3]диоксол, диметил(нафталин-1-ил)амин, от моно- до трис-трифторметилфенил, хризенил, периленил или пиренил, либо 2-фенилэтен.
Каждый из R6 и R7 независимо представляет собой фенил, 4-метилфенил или 3,5-диметилфенил, предпочтительно фенил.
Каждый из R8 и R9 представляет собой фенил или циклогексил, либо замещенный фенил, предпочтительно фенил.
Предпочтительный галоген представлен хлором.
Предпочтительный R15 обозначает водород.
L1 определен выше.
В предпочтительном аспекте изобретения предложен способ получения соединения формулы I'a или I'b.
Реакции, описанные выше или далее в вариантах осуществления, проводят, например, в отсутствие или обычно в присутствии подходящего растворителя или разбавителя, либо их смеси, при необходимости реакции проводят с охлаждением, при комнатной температуре или с нагреванием, например, в интервале температур от приблизительно -80°С до точки кипения реакционной смеси, предпочтительно от приблизительно -10 до приблизительно +200°С и, при необходимости, в закрытом сосуде, под давлением, в атмосфере инертного газа и/или в безводных условиях.
Предпочтительно в способе, предлагаемом в настоящем изобретении, используют соединения формул (IIa), (IIc), (IIe), (IIf), (IIg) и (IIh), где R4 или R16 соответственно обозначает С1-С4алкил, предпочтительно метил или этил, либо наиболее предпочтительно трет-бутил.
Стадия (а)
На реакционной стадии (а) взаимодействие соединения формулы (IIa) с соединением формулы (IIb) проводят в подходящем инертном растворителе, таком как нитрил, прежде всего, ацетонитрил или пропионитрил, и в диапазоне температур, например, от -78°С до точки кипения растворителя, предпочтительно при температуре кипения растворителя.
Стадия (б)
Реакционная стадия (б) представляет собой асимметричное смещенное гидрирование, в частности, с использованием хирального катализатора Ru(II) формулы (IId) и донора водорода.
Стадию (б) осуществляют в подходящем инертном растворителе, таком как простой эфир, например тетрагидрофуран, сложный эфир, например этилацетат, нитрил, прежде всего, ацетонитрил, формамид, прежде всего, диметилформамид, и в диапазоне температур, например, от -78°С до точки кипения растворителя, предпочтительно при комнатной температуре.
Предпочтительные катализаторы представлены следующими соединениями:



где L1 представляет собой водород, a L2 обозначает алифатический, циклоалифатический-алифатический, арильный или арилалифатический остаток; Hal обозначает галоген; R5, R6 и R7 независимо друг от друга обозначают алифатический, циклоалифатический, циклоалифатический-алифатический, арильный или арилалифатический остаток, причем в каждом случае любой ароматический остаток соединения формул (IId), (IId') и (IId'') является незамещенным или замещенным.
Предпочтительными Ru (II)-содержащими катализаторами формулы (IId) являются такие, в которых L1 обозначает водород и L2 обозначает изопропилфенил, а R5 означает толил.
Предпочтительным донором водорода является, например, NEt3/H3PO2/H2O, дифенилсилан/МеОН или система, содержащая 2-пропанол, 3-пентанол или наиболее предпочтительно НООСН в присутствии амина, такого как триэтиламин, ДБУ (DBU - 1,8-диазабицикло[5.4.0]ундец-7-ен), или другие третичные амины. Донор водорода также может быть использован в качестве инертного растворителя, прежде всего, 2-пропанол и наиболее предпочтительно НСООН. Альтернативным донором водорода является 2-пропанол в присутствии различных катализаторов и основания, например Ru[(1S,2S)-p-TsNCH(С6H5)CH(С6H5)NH](η6-p-кумен) и основание или in situ [Ru(η6-p-кумен)Cl2]2 с хиральным лигандом (R,R- или S,S-TsDPEN, аминоспирт) и основание. Предпочтительные основания представлены трет-BuOK, КОН или изо-PrOK.
Предпочтительным донором водорода является, например, система, содержащая НООСН в присутствии амина, такого как триэтиламин, или наиболее предпочтительно 2-пропанол. Донор водорода также может быть использован в качестве инертного растворителя, прежде всего НСООН и наиболее предпочтительно 2-пропанол.
Стадию (б) также можно проводить посредством гидрирования водородом в присутствии катализатора формулы (IId') или (IId''), (IId''), (IId'''), (IId''''), (IId'''''), (IId'''''') или (IId''''''') соответственно. Подходящий инертный растворитель представлен, например, простым эфиром, таким как ТГФ, сложным эфиром, таким как этилацетат, или спиртом, таким как (С1-С4)спирт, например изопропанол.
Предпочтительный галоген представлен хлором.
Стадия (в)
Стадию конденсации (в) осуществляют в присутствии конденсирующей системы и подходящего инертного растворителя, такого как простой эфир, прежде всего ТГФ или трет-бутиловый эфир, и в диапазоне температур от, например, -78°С до точки кипения растворителя, предпочтительно при комнатной температуре.
Подходящей конденсирующей системой является, например, основание, такое как алкан щелочного металла, прежде всего бутиллитий, или гидрид, например, гидрид натрия, или их смесь. Особенно предпочтительным является использование конденсирующей системы - бутиллитий в присутствии диизопропиламина.
Стадия (г)
Предпочтительный восстанавливающий агент представлен, например, гидридом, например борогидридом щелочного металла, прежде всего борогидридом натрия, предпочтительно в присутствии ди-(С1-С7алкил)С1-С7алкоксиборана, наиболее предпочтительно диэтилметоксиборана.
Восстановление проводят в инертном растворителе, таком как простой эфир, предпочтительно в ТГФ при низких температурах, например от -78 до 0°С, предпочтительно при -78°С. Для разрушения соответствующего сложного эфира бороновой кислоты реакционную смесь затем окисляют окислителем, таким как пероксид, прежде всего перекисью водорода. Окисление проводят в инертном растворителе, например в простом эфире, предпочтительно ТГФ, в интервале температур, например, от 0°С до точки кипения растворителя, предпочтительно в интервале от 0 до 20°С.
Стадия (д)
Стадию омыления (д) осуществляют, например, обработкой сложного эфира формулы (IIh) сильным основанием, таким как гидроксид щелочного металла, предпочтительно NaOH или Са(ОН)2, и подкислением полученной реакционной смеси.
Стадия (е)
Стадию выделения (е) соединения формулы (I) осуществляют в соответствии с традиционными методами выделения, такими как кристаллизация полученного соединения формулы (I) из реакционной смеси или посредством хроматографии реакционной смеси.
Под инертными растворителями подразумевают те растворители, которые не вступают во взаимодействие с реагирующими веществами.
Более того, настоящее изобретение относится к новому соединению формулы (IIc). Особенно предпочтительными являются соединения формулы (IIc), в которых R обозначает группу формулы

элемент

Подобно этому, настоящее изобретение относится к новому соединению формулы (IIc). Особенно предпочтительными являются соединения формулы (IIc), в которых R обозначает группу формулы

элемент

Из уровня техники известно, что асимметрическое смещенное гидрирование с использованием Ru(II)-содержащего катализатора (прежде всего, катализатора Нойори) осуществляют в отсутствие воды в атмосфере инертного газа. Удивительно, что стадию смещенного гидрирования в соответствии с настоящим изобретением можно проводить в системе растворителей, содержащей воду, и в отсутствие инертного газа. Это означает, что реакция хорошо проходит даже в том случае, если используемый растворитель содержит воду (например, 3% по Карлу-Фишеру).
Более того, ввиду наличия этерифицированной карбоксильной группы соединение формулы (IIc) могло бы быть также лигандом Ru(II)-содержащего катализатора. Неожиданно было доказано, что соединение формулы (IIc) не образует лиганда к Ru(II)-содержащему катализатору.
Известно, что хинолиновые фрагменты дезактивируют катализаторы гидрирования, особенно в случае получения соединения формулы (I), представляющего собой питавастатин. Специалист в данной области вполне мог бы ожидать, что хинолиновая группа дезактивирует Ru-содержащий катализатор. Неожиданно было установлено, что стадия асимметричного смещенного гидрирования в соответствии с настоящим изобретением успешно может быть проведена, минуя дезактивацию катализатора формул (IId), (IId'), (IId''), (IId'''), (IId''''), (IId'''''), (IId'''''') или (IId''''''').
Соответственно, настоящее изобретение относится также к реакционной стадии (б), в особенности с использованием Ru(II)-содержащего катализатора формул (IId), (IId') или (IId'') соответственно


где М, L1, L2, R8 и R9 имеют значения, определенные выше, а R5 обозначает группу формулы














где n означает 0, 1, 2, 3, 4, 5, 6 или 7;
X обозначает О или S;
R10 обозначает полистирол;
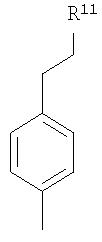
R11 обозначает силикагель;
R12 обозначает поперечно сшитый полистирол;
R13 обозначает полиэтиленгликоль;
R14 обозначает С1-С6алкил и
m означает 1, 2 или 3.
Предпочтительными являются следующие соединения формулы (IId), (IId'), (IId'''''') или (IId''''''), в которых L1, L2 и R5 имеют значения, определенные выше:




Соединения формулы (IId), (IId'), (IId'''''') или (IId'''''') могут быть получены традиционным способом при взаимодействии соединения формулы VII

где R5, R8 и R9 определены выше, с [MCl2(р-кумен)]2.
Гидрирование можно проводить в подходящем инертном растворителе, таком как простой эфир, например ТГФ, сложный эфир, например, этилацетат, галогенированный растворитель, например метиленхлорид, суперкритический СО2, ионные жидкости, нитрил, прежде всего ацетонитрил, амид, например диметилформамид или диметилацетамид, и в диапазоне температур, например, от -78°С до точки кипения растворителя, предпочтительно при комнатной температуре.
Предпочтительными катализаторами формулы (IId) являются те, в которых L1 обозначает водород и L2 обозначает фенил или фенил, замещенный одним, двумя, тремя, четырьмя или пятью алкильными остатками, в особенности одновременно изопропилом, такой как 4-изопропилфенил, а R5 обозначает фенил или фенил, замещенный одним, двумя, тремя, четырьмя или пятью алкильными остатками, прежде всего фенил, толил, 3,5-диметилфенил или 2,3,4,5,6-пентаметилфенил. Особенно предпочтительным является катализатор формулы (IId) или (Id'), в котором L1 обозначает водород, L2 обозначает изопропилфенил, a R5 обозначает толил.
Настоящее изобретение относится также к предпочтительным катализаторам формулы (IId), а именно к тем, в которых L1 обозначает водород и L2 обозначает фенил или фенил, замещенный одним, двумя, тремя, четырьмя или пятью алкильными остатками, в особенности одновременно изопропилом, такой как изопропилфенил, а R5 обозначает остаток, выбранный из группы, содержащей остатки 2- или 3-, или 4-пиридила, 4-хлор-4-феноксифенила, 4-феноксифенила, 5-диметиламино-1-нафтила, 5-нитро-1-нафтила, 2-, 3-, 4-нитрофенила, 4-винилфенила, 4-бифенилила, 2-фенилэтена и 9-антраценила.
Особенно предпочтительными являются те катализаторы формулы (IId), в которых лиганды L1 и L2 находятся в S- или R-конфигурации и/или в которых соответствующие фенильные кольца, присоединенные к 1,2-диаминоэтильному фрагменту, находятся в R,R-конфигурации или S,S-конфигурации.
Предпочтительными катализаторами формулы (IId') и (IId''') являются такие катализаторы, в которых Hal в каждом случае обозначает хлор; R6 и R7 в каждом случае обозначают фенил или фенил, замещенный одним или несколькими С1-С7алкилами, прежде всего 3,5-диметилфенил. Подобно этому настоящее изобретение относится к соответствующим соединениям формулы (IId'). Особенно предпочтительными являются те катализаторы формулы (IId'), в которых фрагмент BINAP имеет R- или S-конфигурацию.
Предпочтительными катализаторами формулы (IId'') и (IId'''') являются такие катализаторы, в которых Hal в каждом случае обозначает хлор; R6 и R7 в каждом случае обозначают фенил или фенил, замещенный одним или несколькими С1-С7алкилами, прежде всего 3,5-диметилфенил. Подобно этому настоящее изобретение относится к соответствующим соединениям формулы (IId'''') и (IId'''''). Особенно предпочтительными являются те катализаторы формулы (IId'''') и (IId'''''), в которых фрагмент BINAP имеет R- или S-конфигурацию. Наиболее предпочтительные представлены соответствующими соединениями формулы (IId''''') и (IId''''').
Подобно этому предпочтительными являются соединения формулы

Точно также настоящее изобретение относится к новым соединениям, например исходным или промежуточным веществам соответственно, как описано в разделе «Примеры осуществления».
Подобно этому настоящее изобретение относится к конкретным продуктам, которые получены непосредственно с помощью последовательно проведенных стадий заявленного способа либо с помощью одной из стадий заявленного способа, прежде всего к соответствующим продуктам, которые находятся преимущественно в энантиомерно чистой форме.
Превращение кислоты формулы (I) в соль осуществляют способом, который как таковой известен.
Так, например, соль с основанием соединений формулы I получают обработкой основанием. Соли можно превратить в свободные соединения обычным способом, а соли с основанием могут быть превращены, например, обработкой подходящим кислым веществом в свободную кислоту.
Превращение кислоты формулы (I) в соответствующий лактон формулы (Ia) или (Ib), соответственно, осуществляют в присутствии кислоты, предпочтительно минеральной кислоты, в подходящем, например, протонном или апротонном растворителе, таком как этанол или ацетонитрил. Превращение осуществляют в температурном диапазоне, зависящем от вида кислоты, например от -78°С до точки кипения растворителя. Наиболее предпочтительным является использование Н3PO4 в ацетонитриле при 60°С.
Превращение лактона формулы (Ia) или (Ib) соответственно в соль кислоты формулы (I) проводят, например, в смеси протонного растворителя, такого как этанол, и воды с использованием гидроксида щелочного металла, такого LiOH, NaOH или Са(ОН)2. Альтернативно, лактон может быть гидролизован при использовании гидроксида щелочного металла, такого LiOH, NaOH, и полученная соль может быть превращена в кальциевую соль кислоты питавастатина посредством добавления водного раствора CaCl2 в воде.
Вариант способа, соответствующего настоящему изобретению, включает непосредственное образование лактона соединения формулы (I). Образование указанного лактона может быть осуществлено обработкой соединения формулы (I) или (IIh) кислотой, например минеральной кислотой, предпочтительно Н3PO4.
Превращение полученного соединения формулы (I), где элемент


Вместо превращения полученного соединения формулы (I), где элемент


Например, способ получения соединений формулы (I) и их солей может быть проиллюстрирован с помощью следующей схемы реакций получения питавастатина:

или

Способ получения соединений формулы (I) и их солей, например, может быть проиллюстрирован с помощью следующей схемы реакций получения флувастатина:

Примеры осуществления
Получение исходного материала для питавастатина
Получение хлорида (3-этоксикарбонил-3-оксопропил)трифенилфосфония
В соответствии с литературными данными: С.М.Moorhoff; J.C.S.Perkin Trans., т.I, c.1987 (1997).
К раствору этил-4-хлорацетоацетата (16,46 г, 100 ммоль) в 50 мл безводного толуола добавляют трифенилфосфин (26,25 г, 100 ммоль) в атмосфере аргона при комнатной температуре (к.т.) и перемешивают в течение 4 дней. Суспензию фильтруют и промывают толуолом 3×30 мл. Бесцветные кристаллы сушат под вакуумом и получают хлорид (3-этоксикарбонил-3-оксопропил)трифенилфосфония. МС: 426,88.
Пример 1
а) Получение этил-3-оксо-4-(трифенилфосфоранилиден)бутаноата
К раствору хлорида (3-этоксикарбонил-3-оксопропил)трифенилфосфония (11 г, 25,77 ммоль) в 100 мл дихлорметана в течение 30 минут (мин) при интенсивном перемешивании добавляют карбонат натрия (3,38 г, 27,36 ммоль) в 100 мл воды при комнатной температуре и перемешивают в течение 4 часов (ч). Органическую фазу желтого цвета отделяют, промывают 30 мл воды и сушат над безводным сульфатом натрия. Растворитель упаривают и маслянистый остаток высушивают под вакуумом, чтобы сохранить воскообразную массу. После добавления диэтилового эфира воск кристаллизуется с образованием кристаллов светло-желтого цвета 3-оксо-4-(трифенилфосфоранилиден)бутаноата. МС 390,43.
1Н-ЯМР (CDCl3, 400М Гц):
δ=7,56 (m, 6H, орто Н-фенил), 7,44 (m, 3Н, пара Н-фенил), 7,35 (m, 6H, мета Н-фенил), 4,08 (q, 2Н, OCH2СН3), 3,72 (d, 1Н, Н-4), 3,26 (d, 2H, Н-2), 1,17 (t, 3H, ОСН2СН3).
б) Этиловый эфир 5-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]-3-оксопент-4-еновой кислоты
Илид 3-оксо-4-(трифенилфосфоранилиден)бутаноат (4,82 г, 12,36 ммоль) растворяют в атмосфере аргона в 100 мл ацетонитрила. Добавляют пятью порциями при интенсивном перемешивании 2-циклопропил-4-(4-фторфенил)хинолин-3-карбальдегид (3 г, 10,3 ммоль) и затем нагревают с обратным холодильником до кипения. Через 50 ч реакционную смесь охлаждают до комнатной температуры. Растворитель светло-коричневого цвета упаривают и остаток высушивают под вакуумом с получением воскообразного коричневого масла. Хроматографией на силикагеле с использованием в качестве элюента смеси гексан :этилацетат (4:1, об./об.) получают этиловый эфир 5-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]-3-оксопент-4-еновой кислоты в виде желтого масла. МС 403,45.
в) Рацемат этилового эфира 5-[2-пиклопропил-4-(4-фторфенил)хинолин-3-ил]-3-гидроксипент-4-еновой кислоты
Этиловый эфир 5-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]-3-оксопент-4-еновой кислоты (85,8 мг, 0,21 ммоль) растворяют в 10 мл этанола в атмосфере аргона и охлаждают до -15°С. Борогидрид натрия (8,58 мг, 0,22 ммоль) добавляют при интенсивном перемешивании. В процессе реакции цвет смеси становится бледно-желтым. Через 3 ч температура реакционной смеси достигает комнатной, и смесь перемешивают в течение еще 1,5 ч. Затем к смеси добавляют 15 мл насыщенного раствора хлорида аммония. После экстрагирования диэтиловым эфиром (3×15 мл) объединенные органические слои промывают водой (15 мл), высушивают над сульфатом натрия, фильтруют и упаривают под вакуумом с получением рацемата этилового эфира 5-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]-3-гидроксипент-4-еновой кислоты в виде желтого масла. МС: 405,47.
Аналитическая ЖХВД: хирацель-OD 10 мкм, длина 250 мм, внутренний диаметр 4,6 мм; изократический н-гексан : 2-пропанол, 96:4; скорость потока 0,6 мл/мин; температура колонки 35°С; УФ-детекция с длиной волны 230 нм; время хроматографирования 45 мин; объем пробы 10 мкл (1,022 мг/мл в смеси н-гексан:2-пропанол, 96:4).
Время удерживания 1: 16,17 мин; 51,52% (по площади).
Время удерживания 2: 18,00 мин; 48,48% (по площади).
г) Метод энантиоселективного смещенного гидрирования сложного этилового эфира (Е)-5-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]-3-гидроксипент-4-еновой кислоты
I: Смесь этилового эфира (E)-5-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]-3-оксопент-4-еновой кислоты (105,8 мг, 0,262 ммоль) и Ru[(1R,2R)-p-TsNCH(C6H5)CH-(C6H5)NH](η6-p-кумен) (6,2 мг, 0,104 ммоль) в 2-пропаноле (2,6 мл) перемешивают при 23°С в течение 72 ч. Реакционную смесь концентрируют при пониженном давлении. Остаток очищают экспресс-хроматографией на силикагеле с использованием в качестве элюента смеси гексан-МТБЭ (метил-трет-бутиловый эфир), 4:1 с получением этилового эфира (E)-5-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]-3-гидроксипент-4-еновой кислоты.
II: Раствор этилового эфира (Е)-5-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]-3-оксопент-4-еновой кислоты (1,6 г, 3,97 ммоль), Ru[(1R,2R)-p-TsNCH(C6H5)CH(C6H5)NH2]Cl(η6-p-кумен) (12,6 мг, 0,02 ммоль) и смесь НСООН (1,095 г, 23,8 ммоль) / NEt3 (0,963 г, 9,52 ммоль) нагревают в диметилформамиде (ДМФ) (6,0 мл) при 50°С в течение 20 ч. После этого раствор разбавляют МТБЭ (5 мл) и нейтрализуют с помощью NaHCO3 (4 мл). Стандартной водной обработкой с использованием раствора NaCl, экстрагированием МТБЭ и удалением растворителя получают сырой продукт. Хроматография на силикагеле с использованием в качестве элюента смеси гексан-МТБЭ, 4:1, приводит к этиловому эфиру (Е)-5-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]-3-гидроксипент-4-еновой кислоты.
1H-ЯМР (400 М Гц, CDCl3): 7,96 (d,2J:8,4 Гц, 1Н), 7,60 (t,2J:6,6 Гц, 1Н), 7,38-7,28 (m, 2H), 7,25-7,15 (m, 4H), 6,61 (d,2J:16,3 Гц, 1Н), 5,65 (dd,2J:16,2, 5,7 Гц, 1Н), 4,57-4,51 (m, 1H), 4,17 (q,2J:7,1 Гц, 2H), 3,10 (br s, 1H), 2,44-2,37 (m, 1H), 2,36 (t,2J:9,4 Гц, 2H), 1,41-1,25 (m, 2H), 1,29 (t,2J:7,2 Гц, 3Н), 1,04 (dd.2J:8,1 Гц, 2H).
13С ЯМР (100 М Гц, CDCl3): 172,2, 163,6, 161,1, 160,7, 146,9, 144,4, 138,2, 133,4, 132,0, 131,9, 131,9, 131,8, 129,0, 128,9, 126,5, 126,1, 125,5, 115,5, 115,3, 68,8, 41,1, 16,1, 14,2, 10,4, 10,3. МС 405,47.
Литература по приготовлению катализатора: K.-J.Haack, S.Hashiguchi, A.Fujii, T.Ikariya, R.Noyori, Angew. Chem. Int. Ed. Engl., 36, cc.285-288, 1997.
д) трет-Бутиловый эфир (E)-(S)-7-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]-5-гидрокси-3-оксогепт-6-еновой кислоты
К раствору диизопропиламина (0,93 г, 9,20 ммоль) в тетрагидрофуране (ТГФ) (10 мл) добавляют в течение 10 мин при 0°С n-BuLi (5,55 мл, 8,88 ммоль 1,6 М раствора в гексане). Через 30 мин раствор охлаждают до - 78°С и добавляют трет-бутилацетат (1,03 г, 8,88 ммоль) в течение 10 мин. Через 30 мин выдерживания при -78°С полученный раствор превращается в раствор этилового эфира (E)-5-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]-3-гидроксипент-4-еновой кислоты (0,90 г, 2,22 ммоль) в ТГФ (11 мл) при 0°С. Раствор перемешивают 3 ч при комнатной температуре (к.т.) и добавляют раствор NH4Cl (3 мл). Смесь выливают в воду (5 мл) и экстрагируют посредством МТБЭ (50 мл). Объединенные органические экстракты высушивают над Na2SO4, фильтруют, концентрируют, а остаток очищают экспресс-хроматографией (гексан/МТБЭ, 5:1) с получением кетоэфира, представляющего собой трет-бутиловый эфир (E)-(S)-7-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]-5-гидрокси-3-оксогепт-6-еновой кислоты. МС 475,57.
е) трет-Бутиловый эфир (Е)-(3R,5S)-7-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]-3,5-дигидроксигепт-6-еновой кислоты
К раствору кетоэфира, представляющего собой трет-бутиловый эфир (Е)-(S)-7-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]-5-гидрокси-3-оксогепт-6-еновой кислоты (0,80 г, 1,68 ммоль), в ТГФ (20 мл) и МеОН (4 мл) при -78°С добавляют диэтилметоксиборан (2,10 мл 1 М раствора в ТГФ, 2,096 ммоль). Через 1 ч добавляют NaBH4 (0,127 г, 3,36 ммоль). Спустя еще 3 ч при - 78°С добавляют буфер с рН 7 (5 мл) с последующим добавлением МеОН (6 мл). Через 10 мин медленно добавляют раствор МеОН (6 мл) и 30% водн., Н2О2 (6 мл). Охлаждающую баню удаляют и раствор перемешивают в течение 1,5 ч. Смесь выливают в NaHCO3 (60 мл) и экстрагируют с помощью CH2Cl2 (3×50 мл).
Органические экстракты высушивают над Na2SO4, фильтруют и концентрируют. Остаток растворяют в горячем этилацетате (EtOAc) (10 мл), фильтруют и перемешивают в течение 12 ч при к.т.. В результате фильтрования получают диол, представляющий собой трет-бутиловый (E)-(3R,5S)-7-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]-3,5-дигидроксигепт-6-еновой кислоты. МС 477,58.
ж) трет-Бутиловый эфир (Е)-(3S,5S)-7-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]-3,5-дигидроксигепт-6-еновой кислоты
К охлажденному (-35°С) раствору Ме4NHB(ОАс)3 (1,38 г, 5,26 ммоль) в MeCN/AcOH (15 мл, 1:1) добавляют раствор кетоэфира, представляющего собой трет-бутиловый эфир (E)-(S)-7-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]-5-гидрокси-3-оксогепт-6-еновой кислоты (0,50 г, 1,05 ммоль), в CH3CN (2 мл). Смесь перемешивают при -35°С в течение 3 ч и при 0°С в течение 30 мин, а затем добавляют раствор калий-натрий тартрата (10 мл). Через 10 мин суспензию выливают в CH2Cl2 (30 мл) и осторожно добавляют раствор Na2СО3 (7 мл). Органический слой отделяют, а водный слой экстрагируют CH2Cl2 (2×50 мл). Объединенные органические экстракты высушивают над Na2SO4, фильтруют, концентрируют и очищают остаток с помощью экспресс-хроматографии (гексан/МТБЭ, 1:1) или кристаллизацией (EtOAc) с получением диола, представляющего собой трет-бутиловый эфир (E)-(3R,5S)-7-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]-3,5-дигидроксигепт-6-еновой кислоты. МС:477,58.
з) Кальциевая соль (E)-(3R,5S)-7-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]-3,5-дигидроксигепт-6-еновой кислоты
К раствору диола, представляющего собой трет-бутиловый эфир (Е)-(3R,5S)-7-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]-3,5-дигидроксигепт-6-еновой кислоты (1,0 г, 2,09 ммоль), в EtOH (5 мл) добавляют водный раствор NaOH (10 мл, 1 М) и полученную суспензию перемешивают до исчезновения сложного эфира. По окончании гидролиза добавляют водный раствор HCl (15 мл, 1 М) и растворитель удаляют под вакуумом. Затем добавляют CH2Cl2 (10 мл) и отделяют органический слой. Водный слой экстрагируют с помощью CH2Cl2 (2×30 мл) и объединенные органические экстракты упаривают под вакуумом. Остаток растворяют в Н2О (20 мл) и порциями добавляют раствор CaCl2 (8 мл, 0,1 М). Раствор реакции перемешивают в течение ночи и полученный осадок белого цвета отфильтровывают с получением кальциевой соли (E)-(3R,5S)-7-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]-3,5-дигидроксигепт-6-еновой кислоты. МС 880,98.
Получение исходного материала для флувастатина
и) Этиловый эфир (Е)-5-[3-(4-фторфенил)-1-изопропил-1H-индол-2-ил]-3-оксопент-4-еновой кислоты
Илид 3-оксо-4-(трифенилфосфоранилиден)бутаноат (5,0 г, 12,8 ммоль) растворяют в атмосфере аргона в 100 мл ацетонитрила. Добавляют при интенсивном перемешивании 3-(4-фторфенил)-1-изопропил-1H-индол-2-карбальдегид (4,2 г, 10,7 ммоль) пятью порциями и затем нагревают до кипения. Через 50 ч реакционную смесь охлаждают до комнатной температуры. Светло-коричневый растворитель упаривают, а остаток высушивают под вакуумом с получением воскообразного масла коричневого цвета. После хроматографии на силикагеле с использованием смеси гексан : этилацетат (4:1, об./об.) получают этиловый эфир (Е)-5-[3-(4-фторфенил)-1-изопропил-1H-индол-2-ил]-3-оксопент-4-еновой кислоты в виде масла желтого цвета. МС 393,46.
к) Этиловый эфир (Е)-(S)-5-[3-(4-фторфенил)-1-изопропил-1H-индол-2-ил]-3-гидроксипент-4-еновой кислоты
Раствор этилового эфира (Е)-(S)-5-[3-(4-фторфенил)-1-изопропил-1H-индол-2-ил]-3-оксопент-4-еновой кислоты (2,0 г, 5,08 ммоль), Ru[(1R,2R)-p-TsNCH(C6H5)CH(C6H5)NH2]Cl(η6-p-кумен) (12,8 мг, 0,025 ммоль) и смеси НСООН (1,40 г, 30,5 ммоль) / NEt3 (1,23 г, 12,2 ммоль) нагревают в течение 21 ч в ДМФ (8,0 мл) при 50°С. Затем раствор разбавляют МТБЭ (5 мл) и нейтрализуют с помощью NaHCO3 (4 мл). Стандартной водной обработкой с использованием раствора NaCl, экстрагированием с помощью МТБЭ с последующим удалением растворителя получают сырой продукт. Хроматография на силикагеле с использованием в качестве элюента смеси гексан-МТБЭ, 4:1, приводит к этиловому эфиру (Е)-(S)-5-[3-(4-фторфенил)-1-изопропил-1H-индол-2-ил]-3-гидроксипент-4-еновой кислоты. МС 395,48.
л) трет-Бутиловый эфир (Е)-(S)-7-[3-(4-фторфенил)-1-изопропил-1H-индол-2-ил]-5-гидрокси-3-оксогепт-6-еновой кислоты
К раствору диизопропиламина (0,96 г, 9,53 ммоль) в ТГФ (10 мл) добавляют n-BuLi (6,32 мл, 10,12 ммоль 1,6 М раствора в гексане) в течение 10 мин при 0°С. Через 30 мин раствор охлаждают до - 78°С и добавляют трет-бутилацетат (1,17 г, 10,12 ммоль) в течение 10 мин. Спустя 30 мин перемешивания полученного раствора при -78°С он превращается в раствор этилового эфира (E)-(S)-5-[3-(4-фторфенил)-1-изопропил-1H-индол-2-ил]-3-гидроксипент-4-еновой кислоты (1,0 г, 2,53 ммоль) в ТГФ (12 мл) при 0°С. Раствор перемешивают в течение 3 ч при комнатной температуре (к.т.) и добавляют раствор NH4Cl (3 мл). Смесь выливают в воду (5 мл) и экстрагируют МТБЭ (50 мл). Объединенные органические экстракты высушивают над Na2SO4, фильтруют, концентрируют и остаток очищают при помощи экспресс-хроматографии (гексан/МТБЭ, 5:1) с получением кетоэфира, представляющего собой трет-бутиловый эфир (E)-(S)-7-[2-циклопропил]-4-(4-фторфенил)хинолин-3-ил]-5-гидрокси-3-оксогепт-6-еновой кислоты. МС 465,57.
м) трет-Бутиловый эфир (Е)-(3R,5S)-7-[3-(4-фторфенил)-1-изопропил-1H-индол-2-ил]-3,5-дигидроксигепт-6-еновой кислоты
К раствору кетоэфира, представляющего собой трет-бутиловый эфир (Е)-(S)-7-[3-(4-фторфенил)-1-изопропил-1H-индол-2-ил]-5-гидрокси-3-оксогепт-6-еновой кислоты (1,0 г, 2,15 ммоль), в ТГФ (22 мл) и МеОН (4 мл) добавляют при -78°С диэтилметоксиборан (2,70 мл, 2,682 ммоль 1 М раствора в ТГФ). Через 1 ч добавляют NaBH4 (0,163 г, 4,30 ммоль), а спустя еще 3 ч при - 78°С добавляют буфер с рН 7 (6 мл) с последующим добавлением МеОН (7 мл). Через 10 мин медленно добавляют раствор МеОН (6 мл) и 30% водн. Н2О2 (6 мл), удаляют охлаждающую баню и раствор перемешивают в течение 1,5 ч. Реакционную смесь выливают в NaHCO3 (70 мл) и экстрагируют СН2Cl2 (3×50 мл). Органические экстракты высушивают над Na2SO4, фильтруют и концентрируют. Остаток растворяют в горячем этилацетате (10 мл), фильтруют и перемешивают в течение 12 ч при к.т. После фильтрования получают диол, представляющий собой трет-бутиловый эфир (Е)-(3R,5S)-7-[3-(4-фторфенил)-1-изопропил-1H-индол-2-ил]-3,5-дигидроксигепт-6-еновой кислоты. МС 467,58.
н) трет-Бутиловый эфир (Е)-(3S,5S)-7-[3-(4-фторфенил)-1-изопропил-1H-индол-2-ил] -3,5 -дигидроксигепт-6-еновой кислоты
К охлажденному (-35°С) раствору Ме4NHB(ОАс)3 (1,38 г, 5,26 ммоль) в MeCN/AcOH (15 мл, 1:1) добавляют раствор кетоэфира, представляющего собой трет-бутиловый эфир (Е)-(S)-7-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]-5-гидрокси-3-оксогепт-6-еновой кислоты (0,50 г, 1,07 ммоль), в СН3CN (2 мл). Реакционную смесь перемешивают в течение 3 ч при -35°С и в течение 30 мин при 0°С, после чего добавляют раствор калий-натрий тартрата (10 мл). Через 10 мин суспензию выливают в CH2Cl2 (30 мл) и осторожно добавляют раствор Na2CO3 (7 мл). Органический слой отделяют и водный слой экстрагируют при помощи CH2Cl2 (2×50 мл). Объединенные органические экстракты высушивают над Na2SO4, фильтруют, концентрируют и остаток очищают с помощью экспресс-хроматографии (гексан/МТБЭ, 1:1) или кристаллизацией (EtOAc) с получением диола, представляющего собой трет-бутиловый эфир (E)-(3S,5S)-7-[3-(4-фторфенил)-1-изопропил-1H-индол-2-ил]-3,5-дигидроксигепт-6-еновой кислоты. МС 467,58.
о) Натрий (Е)-(3R,5S)-7-[3-(4-фторфенил)-1-изопропил-1H-индол-2-ил]-3,5-дигидроксигепт-6-еноат
К 30 г трет-бутилового эфира (Е)-(S)-7-[3-(4-фторфенил)-1-изопропил-1H-индол-2-ил]-5-гидрокси-3-оксогепт-6-еновой кислоты в 150 мл этанола добавляют при перемешивании 63 мл раствора гидроксида натрия, поддерживая температуру ниже 12°С. Раствор перемешивают в течение 1 ч, смесь концентрируют при 25 мм рт.ст. и 45°С, затем добавляют 220 мл воды и перегоняют до объема кубового остатка 100 мл, после чего добавляют 280 мл воды и промывают раствор посредством 450 мл МТБЭ, разделенных на 3 порции. Водный слой концентрируют при 25 мм рт.ст. и 45°С до объема приблизительно-200 мл, добавляют 150 мл воды и прозрачный водный раствор подвергают лиофилизации в течение 3 дней. МС 433,21.
Реферат
Изобретение относится к улучшенному способу получения производных мевалоновой кислоты общей формулы I

или его фармацевтически приемлемой соли с основанием, или его лактона, где

взаимодействием соединения общей формулы IIa

где R1, R2, R3, R4 имеют указанные в формуле изобретения значения,
с соединением общей формулы IIb: R-CH(=O) где R - циклический остаток, с восстановлением полученного соединения IIc

в присутствии восстанавливающего агента, предпочтительно соединения формулы IId

где М - Ru, Rh, Ir, Fe, Co, Ni, L1 - H, L2 - арил, R5 - алифатический остаток, R8 и R9 - С6Н5 или совместно с атомом С, к которому они присоединены, образуют циклогексановое или циклопентановое кольцо с последующим рядом стадий. Способ позволяет получать энантиомерно чистый продукт с высоким выходом. 3 н. и 1 з.п. ф-лы.
Формула







































Комментарии