Четырехзамещенные бензолы - RU2527177C2
Код документа: RU2527177C2
Чертежи
Описание
УРОВЕНЬ ТЕХНИКИ
Болезнь Альцгеймера (AD) является самой распространенной формой деменции. Она представляет собой нейродегенеративное нарушение, которое связано (хотя не исключительно) со старением. Нарушение клинически характеризуется прогрессивной потерей памяти, снижением способности к познанию, рассуждению и суждению, что приводит к чрезвычайному ухудшению умственных способностей и, в конечном счете, к смерти. Это нарушение патологически характеризуется отложением внеклеточных бляшек и присутствием нейрофибриллярных клубков. Считается, что эти бляшки играют важную роль в патогенезе заболевания.
Эти бляшки главным образом включают фибриллярные агрегаты β-амилоидного пептида (Aβ), которые являются продуктами предшественника амилоидного белка (АРР), белка из 695 аминокислот. АРР первоначально процессируется β-секретазой, образуя секретированный пептид и мембраносвязанный фрагмент C99. Фрагмент C99 затем процессируется протеолитической активностью γ-секретазы. Множественные сайты протеолиза на фрагменте C99 приводят к продукции ряда пептидов меньшего размера (Aβ 37-42 аминокислоты). Могут также происходить усечения N-конца, например, Aβ (4-42, 11-42), для удобства Aβ40 и Aβ42 в рамках изобретения включают их усеченные по N-концу пептиды. После секреции пептиды Aβ первоначально образуют растворимые агрегаты, которые, в конечном счете, приводят к формированию нерастворимых осадков и бляшек. Считается, что Aβ42 является самым нейротоксичным, более короткие пептиды имеют меньшую склонность к агрегации и образованию бляшек. Бляшки Aβ в мозге также связаны с церебральной амилоидной ангиопатией, наследственной церебральной геморрагией с амилоидозом, мультиинфарктной деменцией, деменцией боксеров, миозитом с тельцами включения и синдромом Дауна.
γ-секретаза представляет собой ассоциацию четырех белков: Aph1, никастрина, пресенилина и Pen-2 (рассматриваются De Strooper 2003, Neuron 38, 9). Aβ42 селективно повышен у пациентов, являющихся носителями специфических мутаций в одном из этих компонентов, пресенилине. Эти мутации коррелируют с ранним началом семейной AD. Ингибирование γ-секретазы, приводящее к понижению Aβ42, является желательной активностью для фармацевтического сообщества, и многочисленные ингибиторы были найдены, например, Thompson et al. (Bio. Org. and Med. Chem. Letters 2006, 16, 2357-63), Shaw et al. (Bio. Org. and Med. Chem. Letters 2006, 17, 511-16) и Asberom et al. (Bio. Org. and Med. Chem. Letters 2007, 15, 2219-2223). Тем не менее, ингибирование γ-секретазы связано с некоторыми побочными эффектами, некоторые из которых являются следствием процессинга γ-секретазным комплексом других субстратов, нежели C99, например, Notch. Более желательный подход состоит в модуляции протеолитической активности γ-секретазного комплекса таким образом, чтобы снизить уровень Aβ42 в пользу более коротких пептидов без значительного воздействия на активность γ-секретазы на такие субстраты, как Notch.
Соединения, которые продемонстрировали модуляцию γ-секретазы, включают некоторые нестероидныепротивовоспалительные лекарственные средства (NSAID), например флурбипрофен, (Stock et al. Bio. Org. and Med. Chem. Letters 2006, 16, 2219-2223). Другие публикации, в которых раскрыты средства, которые понижают Aβ42 через модуляцию γ-секретазы, включают: WO 04/074232, WO 05/054193, Perreto et al. Journal of Medicinal Chemistry 2005, 48 5705-20, WO05/108362, WO 06/008558, WO 06/021441, WO 06/041874, WO 06/045554, WO04110350, WO 06/043964, WO 05/115990, EP1847524, WO 07/116228, WO 07/110667, WO 07/124394, EP 184752, EP 01849762, WO 07/125364.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Описаны четырехзамещенные соединения бензола формул (I) и (II) и их фармацевтически приемлемые соли
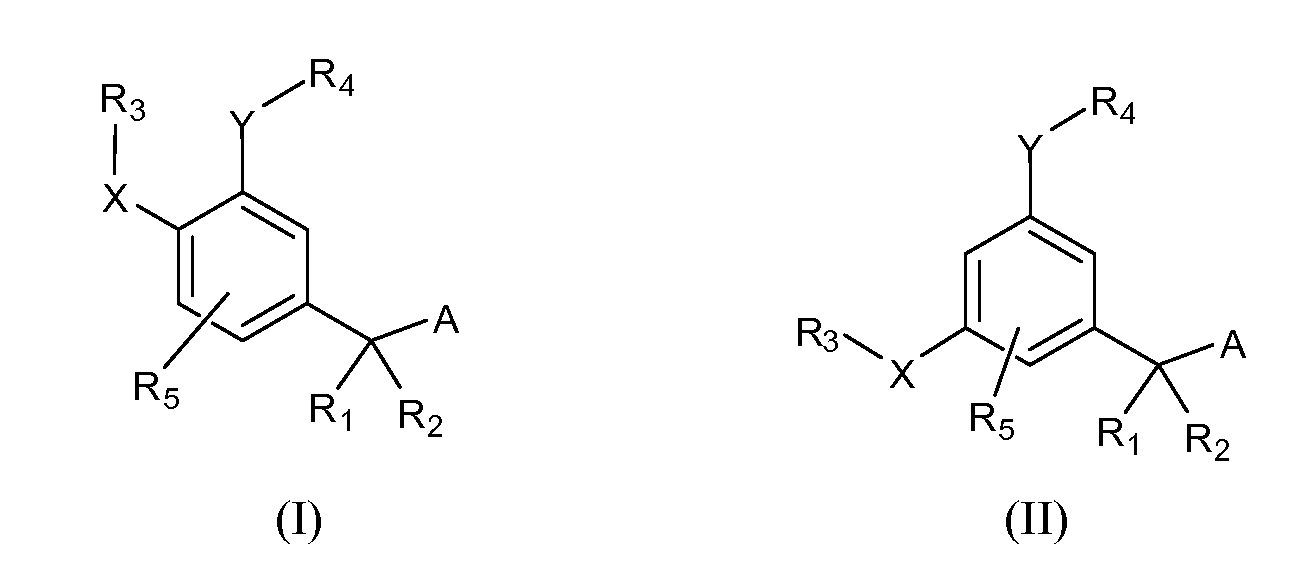
в которых:
A обозначает CO2H или тетразол;
R1 иR2 независимо выбраны из: (a) H, (b) F, (c) OH, (d) OR6, (e) SR6, (f) NHR7, (g) N(R7)2 (h) NHC(O)R6, (i) NHCO2R6, (j) (C2-C6)алкила, (k) (C0-C3)алкил-(C3-C7)циклоалкила, (l) C1-C6 алкила, который независимо прерван одной или более групп -O-, -S-, -S(O)- или -S(O)2-, (m)(C3-C7)циклоалкила, (n)(C0-C3)алкил-(C3-C7)циклоалкила, (o) гетероциклоалкилалкила и (p)(CH2)nQ, где n=0-2 и где Q обозначает моно- или бициклическую ароматическую или гетероароматическую кольцевую систему, имеющую от 5 до 10 кольцевых атомов, независимо выбранных из C, N, O и S, при условии, что не больше 3 кольцевых атомов в любом отдельном кольце отличаются от C, и где Q может быть независимо замещен 3 группами, выбранными из алкила, галогена,CF3, OH, OCF3, алкокси, OCH2CH2OCH3, NH2, алкиламино, диалкиламино, морфолино, CN,NO2, алкилтио и алкилсульфонила,
и причем каждый алкил или циклоалкилR1 иR2 может быть независимо замещен одним или более заместителями, выбранными из галогена, гидрокси, оксо, циано,CF3,C1-C4 алкила,
при условии, чтоR1 иR2 не обозначают одновременно водород,
или
R1 иR2 вместе образуют 3-7-членный циклоалкил или гетероциклоалкил, который может быть независимо однократно или многократно замещен галогеном, гидрокси, оксо, циано,CF3,C1-C4 алкилом,
или
R1 иR2 вместе образуют 3-7-членный циклоалкил, замещенный R20 иR21, гдеR20 иR21 вместе образуют 3-7-членный циклоалкил, причем каждый циклоалкил может быть независимо однократно или многократно замещен галогеном, гидрокси, оксо, циано,CF3,C1-C4 алкилом;
R6 выбран из:
(a) C1-C6 алкила, в случае необходимости независимо прерванного одной или более групп -O-, -S-, -S(O) или -S(O)2-,
(b) (C3-C7)циклоалкила,
(c) (C0-C3)алкил-(C3-C7)циклоалкила,
(d) гетероциклоалкилалкила и
(e) (CH2)nQ, где n=0-2 и где Q обозначает моно- или бициклическую ароматическую или гетероароматическую кольцевую систему, имеющую от 5 до 10 кольцевых атомов, независимо выбранных из C, N, O и S, при условии, что не больше 3 кольцевых атомов в любом отдельном кольце отличается от C, и где Q может быть независимо замещен 3 группами, выбранными из алкила, галогена,CF3, OH, OCF3, алкокси, OCH2CH2OCH3, NH2, алкиламино, диалкиламино, морфолино, CN,NO2, алкилтио и алкилсульфонила;
R7 независимо выбран из алкила, алкоксиэтила, циклоалкила, циклоалкилалкила, гетероциклоалкилалкила или(CH2)nQ, где n=0-2 и где Q обозначает моно- или бициклическую ароматическую или гетероароматическую кольцевую систему, имеющую от 5 до 10 кольцевых атомов, независимо выбранных из C, N, O и S, при условии, что не больше 3 кольцевых атомов в любом отдельном кольце отличаются от C и где Q может быть замещен 3 группами, независимо выбранными из алкила, галогена,OH, OCF3, алкокси, OCH2CH2OCH3, NH2, алкиламино, диалкиламино, морфолино, CN,NO2, алкилтио, алкилсульфонила; или в случае, когда дваR7 присоединены к тому же самому N и оба обозначают алкил, они могут вместе образовывать 5-членное или 6-членное кольцо, в случае необходимости содержащее O, S, N(H) или N-алкил;
X обозначает связь или двухвалентную связующую группу, выбранную из -O-, -OCH2-, -OCH(R7)-, -OCH2CH2-, -CH2-, -C(O)-, -CH=CH-, -CH2CH2-, -CH2O-, -CH2OCH2-, -CH2CH2O-, -S-, -SCH2-, CH2S-, -CH2SCH2-, -C(O)NH-, -C(O)N(R7)-, -NHC(O)-, -N(R7)C(O)-, -S(O)-, -S(O2)-, -S(O)2N(H)-, -S(O)2N(R7)-, -N(H)S(O)2-, -N(R7)S(O)2-, причем место присоединения двухвалентных связующих групп X кR3 в Формулах I и II находится справа;
Y обозначает связь или двухвалентную связующую группу, выбранную из -O-, -OCH2-, -OCH(R7), -OCH2CH2-, -CH2-, -C(O)-, -CH=CH-, -CH2CH2-, -CH2O-, -CH2OCH2-, -CH2CH2O-, -S-, -SCH2-, CH2S-, -CH2SCH2-, -C(O)NH-, -C(O)N(R7)-, -NHC(O)-, -N(R7)C(O)-, -S(O)-, -S(O2)-, -S(O)2N(H)-, -S(O)2N(R7)-, -N(H)S(O)2-, -N(R7)S(O)2-, причем место присоединения двухвалентных связующих групп Y кR4 в Формулах I и II находится справа;
R3 обозначает (a)C1-C7 алкил, в случае необходимости независимо прерванный одной или более групп -O-, -S-, -S(O)- и -S(O)2-,
(b) (C0-C3)алкил-(C3-C7)циклоалкил,
(c) гетероциклоалкилалкил или
(d) группу Z, причем Z обозначает моно- или бициклическую кольцевую систему, имеющую от 3 до 10 кольцевых атомов, независимо выбранных из C, N, O и S, при условии, что не больше 3 кольцевых атомов в любом отдельном кольце отличаются от C, причем указанная кольцевая система может нести до 3 заместителей, независимо выбранных из галогена,R6,CF3, CN,NO2, ОН, C1-C4 алкокси, арилокси, гетероарилокси,OCH2CH2OCH3,OC(O)R6,OC(O)OR6,OC(O)NHR7, OC(O)N(R7)2, SR6, S(O)R6, S(O)2R6, S(O)2NHR7,S(O)2N(R7)2, NHR7, N(R7)2, NHC(O)R6, N(R7)C(O)R6, NHC(O)OR6, N(R7)C(O)OR6,N(R7)C(O)NH(R7), N(R7)C(O)NH(R7)2, C(O)NH2, C(O)NHR7, C(O)N(R7)2, CO2H, CO2R6, COR6. В случае, когдаR3 обозначает моно- или бициклическую кольцевую систему, имеющую от 5 до 10 кольцевых атомов, участок присоединения может быть или на атоме углерода, или атоме азота моно- или бициклической кольцевой системы, при условии, что только три связи образованы с азотом;
R4 обозначает (a)C1-C7 алкил, в случае необходимости независимо прерванный одной или более групп -O-, -S-, -S(O)- или -S(O)2-,
(b) (C0-C3)алкил-(C3-C7)циклоалкил,
(c) гетероциклоалкилалкил или
(d) группу Z, причем Z обозначает моно- или бициклическую кольцевую систему, имеющую от 5 до 10 кольцевых атомов, независимо выбранных из C, N, O и S, при условии, что не больше 3 кольцевых атомов в любом отдельном кольце отличаются от C, причем указанная кольцевая система может нести до 3 заместителей, независимо выбранных из галогена,R6,CF3, CN,NO2, ОН, C1-C4 алкокси, арилокси, гетероарилокси,OCH2CH2OCH3,OC(O)R6,OC(O)OR6,OC(O)NHR7, OC(O)N(R7)2, SR6, S(O)R6, S(O)2R6, S(O)2NHR7,S(O)2N(R7)2, NHR7, N(R7)2, NHC(O)R6, N(R7)C(O)R6, NHC(O)OR6, N(R7)C(O)OR6,N(R7)C(O)NH(R7), N(R7)C(O)NH(R7)2, C(O)NH2, C(O)NHR7, C(O)N(R7)2, CO2H, CO2R6, COR6. В случае, когдаR4 обозначает моно- или бициклическую кольцевую систему, имеющую от 5 до 10 кольцевых атомов, участок присоединения может быть или на атоме углерода, или атоме азота моно- или бициклической кольцевой системы, при условии, что только три связи образованы с азотом; и
R5 выбран из NO2,NH2, арила, гетероарила, F, Cl, Br, CN, OH,C1-C4 алкокси,SR6, S(O)2R6, S(O)2N(R7)2,(C1-C4)алкила,(C0-C3)алкил-(C3-C7)циклоалкила, -O-(C0-C3)алкил-(C3-C7)циклоалкила и(C2-C4)алкинила, причем каждый алкил или циклоалкил может быть независимо замещен одним или более заместителями, выбранными из галогена, гидрокси, оксо, циано,CF3,C1-C4 алкила,
при условии, что один или оба R3 иR4 обозначают Z.
В одном варианте осуществленияR1 иR2 вместе образуют 3-7-членный циклоалкил или гетероциклоалкил. В другом варианте осуществленияR1 обозначает водород, иR2 обозначает F, R6,OH, OR6, SR6, NHR7, N(R7)2, NHC(O)R6, NHCO2R6, причемR6 иR7 имеют значения, определенные выше. В другом варианте осуществленияR1 обозначает водород, иR2 обозначаетR6,OR6 илиSR6. В дополнительном варианте осуществленияR1 обозначает водород, иR2 обозначает алкил, алкокси или тиоалкил. В другом варианте осуществленияR1 обозначает водород, иR2 обозначаетR6. В другом варианте осуществленияR1 обозначает водород, иR2 обозначает C1-C4 алкил.
В одном варианте осуществления X обозначает связь. В другом варианте осуществления X обозначает двухвалентную связующую группу, выбранную из -O-, -OCH2-, -OCH(R7)-, -OCH2CH2-, -CH2-, -C(O)-, -CH=CH-, -CH2CH2-, -CH2O-, -CH2OCH2-, -CH2CH2O-, -S-, -SCH2-, CH2S-, -CH2SCH2-, -C(O)NH-, -C(O)N(R7)-, -NHC(O)-, -N(R7)C(O)-, -S(O)-, -S(O2)-, -S(O)2N(H)-, -S(O)2N(R7)-, -N(H)S(O)2-, -N(R7)S(O)2-, причем место присоединения двухвалентных связующих групп X кR3 в Формулах I и II находится справа. В другом варианте осуществления X обозначает -O-, -OCH2-, -OCH(R7)-, CH2O-, -S-, -S(O)2-, -S(O)2N(H)-, -S(O)2N(R7)-, -C(O)NH- или -C(O)N(R7)-. В другом варианте осуществления X обозначает -O-, -S(O)2-, -S(O)2N(H)- или -S(O)2N(R7)- В другом варианте осуществления X обозначает -O- или -S(O)2-.
В одном варианте осуществления Y обозначает связь. В другом варианте осуществления Y обозначает двухвалентную связующую группу, выбранную из -O-, -OCH2-, -OCH(R7)-, -OCH2CH2-, -CH2-, -C(O)-, -CH=CH-, -CH2CH2-, -CH2O-, -CH2OCH2-, -CH2CH2O-, -S-, -SCH2-, CH2S-, -CH2SCH2-, -C(O)NH-, -C(O)N(R7)-, -NHC(O)-, -N(R7)C(O)-, -S(O)-, -S(O2)-, -S(O)2N(H)-, -S(O)2N(R7)-, -N(H)S(O)2-, -N(R7)S(O)2-, причем место присоединения двухвалентных связующих групп X кR4 в Формулах I и II находится справа. В другом варианте осуществления Y обозначает -O-, -OCH2-, -OCH(R7), -CH2O-, -S-, -S(O)2-, -S(O)2N(H)-, -S(O)2N(R7)-, -C(O)NH- или -C(O)N(R7)-. В другом варианте осуществления Y обозначает -O-, -S(O)2-, -S(O)2N(H)- или -S(O)2N(R7)-. В другом варианте осуществления Y обозначает -O- или -S(O)2-.
В одном варианте осуществленияR3 обозначает C1-C7 алкил, в случае необходимости прерванный группами -O-, -S-, -S(O)- или -S(O)2-. В другом варианте осуществленияR3 обозначает C1-C7 алкил. В другом варианте осуществленияR3 обозначает C1-C4 алкил, примеры этих групп включают, но не ограничены ими, метил, этил, циклопропилметил, трифторэтил. В другом варианте осуществленияR3 обозначает циклоалкилалкил, примеры включают, но не ограничены ими, циклопропилметил, циклобутилметил, циклопентилметил и циклогексилметил. В другом варианте осуществленияR3 обозначает гетероциклоалкилалкил. В другом варианте осуществленияR3 обозначает группу Z, как определено выше, причем Z обозначает моно- или бициклическую кольцевую систему, имеющую от 5 до 10 кольцевых атомов, независимо выбранных из C, N, O и S, при условии, что не больше 3 кольцевых атомов в любом отдельном кольце отличаются от C, причем указанная кольцевая система может нести до 3 заместителей, независимо выбранных из галогена,R6,CF3, CN,NO2, ОН, C1-C4 алкокси, арилокси, гетероарилокси,OCH2CH2OCH3, OC(O)R6, OC(O)OR6,OC(O)NHR7, OC(O)N(R7)2, SR6, S(O)R6, S(O)2R6, S(O)2NHR7, S(O)2N(R7)2, NHR7, N(R7)2, NHC(O)R6, N(R7)C(O)R6, NHC(O)OR6, N(R7)C(O)OR6, N(R7)C(O)NH(R7), N(R7)C(O)NH(R7)2, C(O)NH2, C(O)NHR7, C(O)N(R7)2, CO2H, CO2R6, COR6. В последнем варианте осуществления Z включает моно- или бициклическую кольцевую систему, которая, кроме того, может быть полностью насыщенной, частично насыщенной или ароматической. Примеры моноциклических кольцевых систем, которые являются полностью насыщенными, включают, но не ограничены ими, 5-6-членные кольцевые системы, такие как циклогексил, циклопентанил, пиперазинил, тетрагидрофуранил и пиперидинил. Примеры моноциклических кольцевых систем, которые являются частично насыщенными, включают, но не ограничены ими, 5-6-членные кольцевые системы, такие как циклогексенил, циклопентенил, дигидрофуранил и тетрагидропиридинил, пиперидинил. Примеры моноциклических кольцевых систем, которые являются ароматическими, включают, но не ограничены ими, 5-6-членные кольцевые системы, такие как фенил, пиридил, пиримидил, пиразолил, тиофенил, фуранил, оксадиазолил, тиадизолил, триазолил, оксазолил и тиазолил. Примеры бициклических кольцевых систем, которые являются полностью насыщенными, включают, но не ограничены ими, 9-10-членные бициклические кольцевые системы, такие как декалинил, декагидрохинолинил и декагидроизохинолинил. Примеры бициклических кольцевых систем, которые являются частично насыщенными, включают, но не ограничены ими, 9-10-членные бициклические кольцевые системы, такие как тетрагидронафтил, тетрагидрохинолинил и тетрагидроизохинолинил. Примеры бициклических кольцевых систем, которые являются ароматическими, включают, но не ограничены ими, 9-10-членные бициклические кольцевые системы, такие как нафтил, индолил, индазолил, бензимидазолил, бензотиадиазолил и имидазопиридинил. В одном дальнейшем варианте осуществления моно- или бициклическая кольцевая система включает до 2 атомов азота и до 1 атома серы или кислорода.
В одном варианте осуществленияR4 обозначает C1-C7 алкил, в случае необходимости прерванный группами -O-, -S-, -S(O)- или -S(O)2-. В другом варианте осуществленияR4 обозначает C1-C7 алкил. В другом варианте осуществленияR4 обозначает C1-C4 алкил, примеры этих групп включают, но не ограничены ими, метил, этил, циклопропилметил, трифторэтил. В другом варианте осуществленияR4 обозначает циклоалкилалкил, примеры включают, но не ограничены ими, циклопропилметил, циклобутилметил, циклопентилметил и циклогексилметил. В другом варианте осуществленияR4 обозначает гетероциклоалкилалкил. В другом варианте осуществленияR4 обозначает группу Z, как определено выше, причем Z обозначает моно- или бициклическую кольцевую систему, имеющую от 5 до 10 кольцевых атомов, независимо выбранных из C, N, O и S, при условии, что не больше 3 кольцевых атомов в любом отдельном кольце отличаются от C, причем указанная кольцевая система может нести до 3 заместителей, независимо выбранных из галогена,R6,CF3, CN,NO2, ОН, C1-C4 алкокси, арилокси, гетероарилокси,OCH2CH2OCH3, OC(O)R6, OC(O)OR6, OC(O)NHR7, OC(O)N(R7)2, SR6, S(O)R6, S(O)2R6, S(O)2NHR7, S(O)2N(R7)2, NHR7, N(R7)2, NHC(O)R6, N(R7)C(O)R6, NHC(O)OR6, N(R7)C(O)OR6, N(R7)C(O)NH(R7), N(R7)C(O)NH(R7)2, C(O)NH2, C(O)NHR7, C(O)N(R7)2, CO2H, CO2R6, COR6. В последнем варианте осуществления Z включает моно- или бициклическую кольцевую систему, которая, кроме того, может быть полностью насыщенной, частично насыщенной или ароматической. Примеры моноциклических кольцевых систем, которые являются полностью насыщенными, включают, но не ограничены ими, 5-6-членные кольцевые системы, такие как циклогексил, циклопентанил, пиперазинил, тетрагидрофуранил и пиперидинил. Примеры моноциклических кольцевых систем, которые являются частично насыщенными, включают, но не ограничены ими, 5-6-членные кольцевые системы, такие как циклогексенил, циклопентенил, дигидрофуранил и тетрагидропиридинил, пиперидинил. Примеры моноциклических кольцевых систем, которые являются ароматическими, включают, но не ограничены ими, 5-6-членные кольцевые системы, такие как фенил, пиридил, пиримидил, пиразолил, тиофенил, фуранил, оксадиазолил, тиадизолил, триазолил, оксазолил и тиазолил. Примеры бициклических кольцевых систем, которые являются полностью насыщенными, включают, но не ограничены ими, 9-10-членные бициклические кольцевые системы, такие как декалинил, декагидрохинолинил и декагидроизохинолинил. Примеры бициклических кольцевых систем, которые являются частично насыщенными, включают, но не ограничены ими, 9-10-членные бициклические кольцевые системы, такие как тетрагидронафтил, тетрагидрохинолинил и тетрагидроизохинолинил. Примеры бициклических кольцевых систем, которые являются ароматическими, включают, но не ограничены ими, 9-10-членные бициклические кольцевые системы, такие как нафтил, индолил, индазолил, бензимидазолил, бензотиадиазолил и имидазопиридинил. В одном дальнейшем варианте осуществления моно- или бициклическая кольцевая система включает до 2 атомов азота и до 1 атома серы или кислорода.
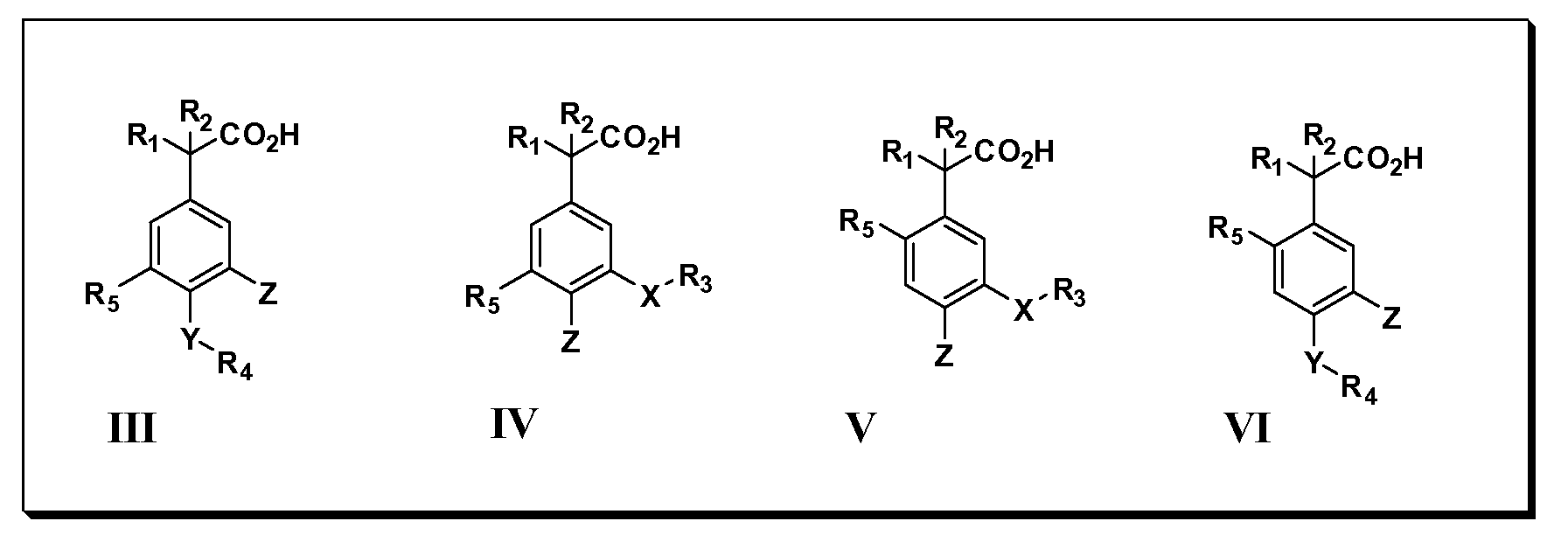
Другие варианты осуществления включают соединения Формул III, IV, V и VI и их фармацевтически приемлемые соли, в которыхR1,R2,R3,R4,R5, X, Y и Z имеют значения, определенные выше.
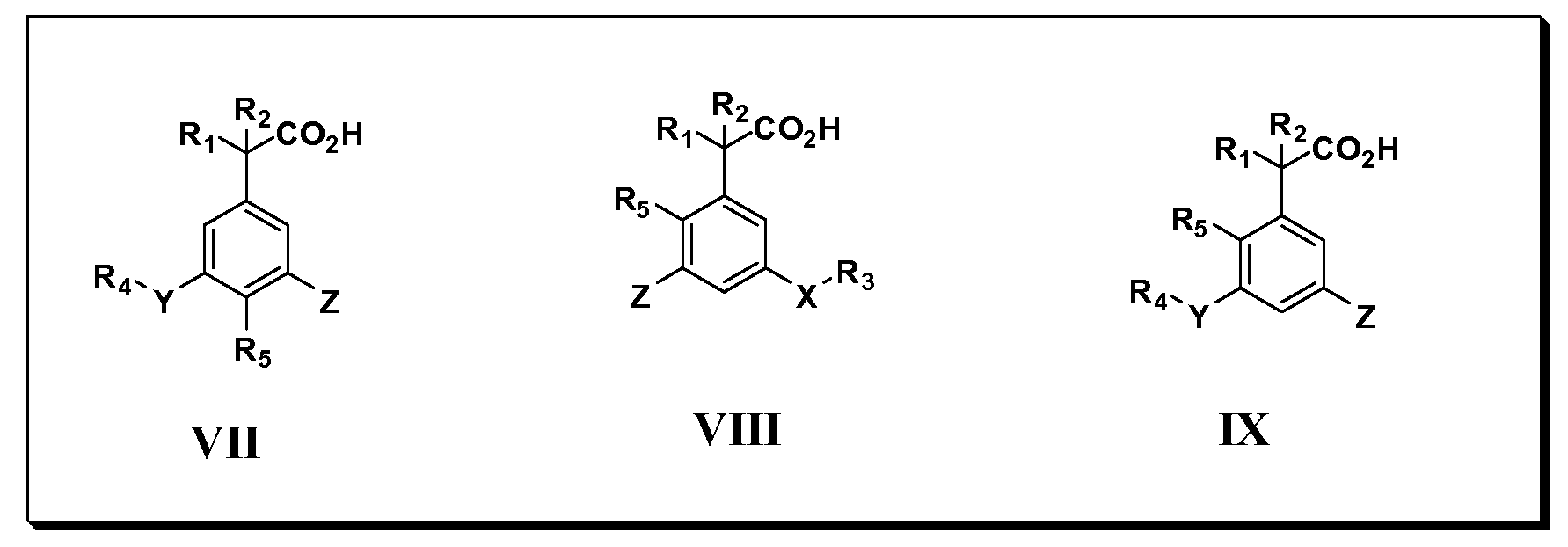
Другие варианты осуществления включают соединения Формул VII, VIII, IX и X и их фармацевтически приемлемые соли, в которыхR1,R2,R3,R4, R5, X, Y и Z имеют значения, определенные выше.
Другие варианты осуществления включают соединения Формул III, IV, V и VI, в которыхR2,R3,R4,R5, X, Y и Z имеют значения, определенные выше, иR1 обозначает водород. Другие варианты осуществления включают соединения Формул III, IV, V и VI, в которыхR3,R4,R5 и Z имеют значения, определенные выше;R1 обозначает водород, иR2 обозначает C1-C4 алкил.
Другие варианты осуществления включают соединения Формул III, IV, V и VI, в которыхR1,R2,R3, R4 и R5 и Z имеют значения, определенные выше, и X и Y независимо выбраны из связи, -O-, -OCH2-, -C(O)-, -S-, -S(O)2-, -S(O)2N(R7)- и -N(R7)S(O)2-. Другие варианты осуществления включают соединения Формул III, IV, V и VI, в которыхR1,R2,R3,R4 иR5, и Z имеют значения, определенные выше, и X и Y независимо выбраны из связи, -O-, -S(O)2- и -S(O)2N(R7). Другой вариант осуществления включает соединения Формул III, IV, V и VI, в которыхR1,R2,R3,R4 иR5 и Z имеют значения, определенные выше, и X и Y независимо выбраны из связи, -O- и S(O)2N(R7). Другой вариант осуществления включает соединения Формул III, IV, V и VI, в которыхR1,R2,R3,R4,R5 и Z имеют значения, определенные выше, и X и Y независимо выбраны из связи и -O-.
Другие варианты осуществления включают соединения Формул III, IV, V и VI, в которыхR1,R2,R5, X, Y и Z имеют значения, определенные выше, иR3 иR4 независимо выбраны из C1-C7 алкила, в случае необходимости независимо прерванного одной или более групп -O-, -S-, -S(O)- и -S(O)2-, циклоалкилалкила и гетероциклоалкилалкила. Другие варианты осуществления включают соединения Формул III, IV, V и VI, в которыхR1,R2,R5, X, Y и Z имеют значения, определенные выше, иR3 иR4 независимо выбраны из C1-C4 алкила и циклопропилметила. Другие варианты осуществления включают соединения Формул III, IV, V и VI, в которыхR1,R2,R5, Z имеют значения, определенные выше, и X, Y независимо выбраны из связи, -S-, -SO2- и -O-, иR3 иR4 независимо выбраны из C1-C4 алкила и циклопропилметила. Другие варианты осуществления включают соединения Формул III, IV, V и VI, в которыхR1,R2,R5, X, Y и Z имеют значения, определенные выше, иR3 иR4 независимо выбраны из группы Z, причем Z имеет значения, определенные выше.
Другие варианты осуществления включают соединения Формул III, IV, V и VI, в которыхR1,R2,R3,R4 иR5, X и Y имеют значения, определенные выше, и Z обозначает фенил, несущий до 3 заместителей, независимо выбранных из галогена,R6,CF3, CN,NO2, ОН, C1-C4 алкокси, арилокси, гетероарилокси,OCH2CH2OCH3, OC(O)R6, OC(O)OR6, OC(O)NHR7, OC(O)N(R7)2, SR6, S(O)R6, S(O)2R6, S(O)2NHR7, S(O)2N(R7)2, NHR7, N(R7)2, NHC(O)R6, N(R7)C(O)R6, NHC(O)OR6, N(R7)C(O)OR6, N(R7)C(O)NH(R7), N(R7)C(O)NH(R7)2, C(O)NH2, C(O)NHR7, C(O)N(R7)2, CO2H, CO2R6, COR6. Другие варианты осуществления включают соединения Формул III, IV, V и VI, в которыхR1,R2,R3,R4 иR5, X и Y имеют значения, определенные выше, и Z обозначает моно- или бициклическую кольцевую систему, имеющую от 5 до 10 кольцевых атомов, независимо выбранных из C, N, O и S, при условии, что не больше 3 кольцевых атомов в любом отдельном кольце отличаются от C, причем указанная кольцевая система может нести до 3 заместителей, независимо выбранных из галогена,R6,CF3, CN,NO2, ОН, C1-C4 алкокси, арилокси, гетероарилокси,OCH2CH2OCH3, OC(O)R6, OC(O)OR6, OC(O)NHR7, OC(O)N(R7)2, SR6, S(O)R6, S(O)2R6, S(O)2NHR7, S(O)2N(R7)2, NHR7, N(R7)2, NHC(O)R6, N(R7)C(O)R6, NHC(O)OR6, N(R7)C(O)OR6, N(R7)C(O)NH(R7), N(R7)C(O)NH(R7)2, C(O)NH2, C(O)NHR7, C(O)N(R7)2, CO2H, CO2R6, COR6.
Другие варианты осуществления включают соединения Формул III, IV, V и VI, в которыхR1,R2,R3,R4, X, Y и Z имеют значения, определенные выше, иR5 обозначаетNO2,NH2, F, Cl, Br, CN, OH, C1-C4 алкокси, SR6, S(O)2R6 или S(O)2N(R7)2. Другие варианты осуществления включают соединения Формул III, IV, V и VI, в которых R1,R2,R3,R4, X, Y и Z имеют значения, определенные выше, иR5 обозначает арил или гетероарил. Другие варианты осуществления включают соединения Формул III, IV, V и VI, в которых R1,R2,R3,R4, X, Y и Z имеют значения, определенные выше, иR5 обозначает хлор или фтор.
Другие варианты осуществления включают соединения Формул VII, VIII, IX и X, в которыхR2,R3,R4,R5, X, Y и Z имеют значения, определенные выше, иR1 обозначает водород. Другие варианты осуществления включают соединения Формул VII, VIII, IX и X, в которыхR3,R4,R5 и Z имеют значения, определенные выше;R1 обозначает водород, иR2 обозначает C1-C4 алкил.
Другие варианты осуществления включают соединения Формул VII, VIII, IX и X, в которыхR1,R2,R3,R4 иR5 и Z имеют значения, определенные выше, и X и Y независимо выбраны из связи, -O-, -OCH2-, -C(O)-, -S-, -S(O)2-, -S(O)2N(R7)- и -N(R7)S(O)2-. Другие варианты осуществления включают соединения Формул VII, VIII, IX и X, в которыхR1,R2,R3,R4 иR5 и Z имеют значения, определенные выше, и X и Y независимо выбраны из связи, -O-, -S(O)2- и -S(O)2N(R7). Другие варианты осуществления включают соединения Формул VII, VIII, IX и X, в которыхR1,R2,R3,R4 иR5 и Z имеют значения, определенные выше, и X и Y независимо выбраны из связи, -O- и S(O)2N(R7). Другие варианты осуществления включают соединения Формул VII, VIII, IX и X, в которыхR1,R2,R3,R4 иR5 и Z имеют значения, определенные выше, и X и Y независимо выбраны из связи и -O-.
Другие варианты осуществления включают соединения Формул VII, VIII, IX и X, в которыхR1,R2,R5, X, Y и Z имеют значения, определенные выше, иR3 иR4 независимо выбраны из C1-C7 алкила, в случае необходимости независимо прерванного одной или более групп -O-, -S-, -S(O)- и -S(O)2-, циклоалкилалкила и гетероциклоалкилалкила. Другие варианты осуществления включают соединения Формул III, IV, V и VI, в которыхR1,R2,R5, X, Y и Z имеют значения, определенные выше, иR3 иR4 независимо выбраны из C1-C4 алкила и циклопропилметила. Другие варианты осуществления включают соединения Формул VII, VIII, IX и X, в которыхR1,R2,R5, Z имеют значения, определенные выше, и X, Y независимо выбраны из связи, -S-, -SO2- и -O-, иR3 иR4 независимо выбраны из C1-C4 алкила и циклопропилметила. Другие варианты осуществления включают соединения Формул VII, VIII, IX и X, в которыхR1,R2,R5, X, Y и Z имеют значения, определенные выше, иR3 иR4 независимо выбраны из группы Z, причем Z имеет значения, определенные выше.
Другие варианты осуществления включают соединения Формул VII, VIII, IX и X, в которыхR1,R2,R3,R4 иR5, X и Y имеют значения, определенные выше, и Z обозначает фенил, несущий до 3 заместителей, независимо выбранных из галогена,R6,CF3, CN,NO2, ОН, C1-C4 алкокси, арилокси, гетероарилокси,OCH2CH2OCH3, OC(O)R6, OC(O)OR6, OC(O)NHR7, OC(O)N(R7)2, SR6, S(O)R6, S(O)2R6, S(O)2NHR7, S(O)2N(R7)2, NHR7, N(R7)2, NHC(O)R6, N(R7)C(O)R6, NHC(O)OR6, N(R7)C(O)OR6, N(R7)C(O)NH(R7), N(R7)C(O)NH(R7)2, C(O)NH2, C(O)NHR7, C(O)N(R7)2, CO2H, CO2R6, COR6. Другие варианты осуществления включают соединения Формул VII, VIII, IX и X, в которыхR1,R2,R3,R4 иR5, X и Y имеют значения, определенные выше, и Z обозначает моно- или бициклическую кольцевую систему, имеющую от 5 до 10 кольцевых атомов, независимо выбранных из C, N, O и S, при условии, что не больше 3 кольцевых атомов в любом отдельном кольце отличаются от C, причем указанная кольцевая система может нести кольцо, несущее до 3 заместителей, независимо выбранных из галогена,R6,CF3, CN,NO2, ОН, C1-C4 алкокси, арилокси, гетероарилокси,OCH2CH2OCH3, OC(O)R6, OC(O)OR6, OC(O)NHR7, OC(O)N(R7)2, SR6, S(O)R6, S(O)2R6, S(O)2NHR7, S(O)2N(R7)2, NHR7, N(R7)2, NHC(O)R6, N(R7)C(O)R6, NHC(O)OR6, N(R7)C(O)OR6, N(R7)C(O)NH(R7), N(R7)C(O)NH(R7)2, C(O)NH2, C(O)NHR7, C(O)N(R7)2, CO2H, CO2R6, COR6.
Другие варианты осуществления включают соединения Формул VII, VIII, IX и X, в которыхR1,R2,R4, X, Y и Z имеют значения, определенные выше, иR5 обозначаетNO2,NH2, F, Cl, Br, CN, OH, C1-C4 алкокси, SR6, S(O)2R6 или S(O)2N(R7)2. Другие варианты осуществления включают соединения Формул VII, VIII, IX и X, в которыхR1,R2,R4, X, Y и Z имеют значения, определенные выше, иR5 обозначает арил или гетероарил. Другие варианты осуществления включают соединения Формул VII, VIII, IX и X, в которыхR1,R2,R4, X, Y и Z имеют значения, определенные выше, иR5 обозначает хлор или фтор.
Считается, что соединения формул I-IX изменяют активность γ-секретазы и могут быть использованы для лечения болезни Альцгеймера и других нейродегенеративных нарушений.
В другом варианте осуществления A обозначает CO2H.
В другом варианте осуществления выбрано соединение формулы (I).
В другом варианте осуществления выбрано соединение формулы (II).
В другом варианте осуществления выбрано соединение формулы (III).
В другом варианте осуществления выбрано соединение формулы (IV).
В другом варианте осуществления выбрано соединение формулы (V).
В другом варианте осуществления выбрано соединение формулы (VI).
В другом варианте осуществления выбрано соединение формулы (VII).
В другом варианте осуществления выбрано соединение формулы (VIII).
В другом варианте осуществления выбрано соединение формулы (IX).
В другом варианте осуществленияR1 иR2 независимо выбраны из Н,(C1-C6)алкила,(C0-C3)алкил-(C3-C7)циклоалкила,C1-C6 алкила, который независимо прерван одной или более групп -O-, -S-, -S(O)- или -S(O)2-, или гетероциклоалкилалкила, причем каждый алкил или циклоалкил может быть независимо однократно или многократно замещен галогеном, гидрокси, циано, оксо,CF3,C1-C4 алкилом, при условии, чтоR1 иR2 одновременно не обозначают Н,
или
R1 иR2 вместе образуют 3-7-членный циклоалкил или гетероциклоалкил, который может быть независимо однократно или многократно замещен галогеном, гидрокси, циано,CF3,C1-C4 алкилом,
или
R1 иR2 вместе образуют 3-7-членный циклоалкил, замещенныйR20 иR21, гдеR20 иR21 вместе образуют 3-7-членный циклоалкил, причем каждый циклоалкил может быть независимо однократно или многократно замещен галогеном, гидрокси, оксо, циано,CF3, C1-C4 алкилом.
В другом варианте осуществленияR1 иR2 независимо выбраны из Н,(C1-C6)алкила,(C0-C3)алкил-(C3-C7)циклоалкила, причем каждый алкил или циклоалкил может быть независимо однократно или многократно замещен галогеном, гидрокси, циано,CF3,C1-C4 алкилом, при условии, чтоR1 иR2 одновременно не обозначают Н.
В другом варианте осуществленияR1 иR2 независимо выбраны из Н,(C1-C6)алкила, причем алкил может быть независимо однократно или многократно замещен галогеном, гидрокси, оксо, циано,CF3,C1-C4 алкилом, при условии, чтоR1 иR2 одновременно не обозначают Н.
В другом варианте осуществленияR1 иR2 независимо выбраны из Н,(C3-C6)алкила, причем алкил может быть независимо однократно или многократно замещен галогеном, гидрокси, оксо, циано,CF3,C1-C4 алкилом, при условии, чтоR1 иR2 одновременно не обозначают Н.
В другом варианте осуществленияR1 иR2 независимо выбраны из Н, н-пропила, изопропила, изобутила, н-бутила, изопентила и н-пентила, причем алкил может быть независимо однократно или многократно замещен галогеном, гидрокси, оксо, циано,CF3,C1-C4 алкилом, при условии, чтоR1 иR2 одновременно не обозначают Н.
В другом варианте осуществленияR1 обозначает Н.
В другом варианте осуществленияR1 обозначает Н, иR2 обозначает н-пропил.
В другом варианте осуществленияR1 обозначает Н, иR2 обозначает изобутил.
В другом варианте осуществленияR1 обозначает Н, иR2 обозначает н-бутил.
В другом варианте осуществленияR1 обозначает Н, иR2 обозначает изопентил.
В другом варианте осуществленияR1 обозначает Н, иR2 обозначает н-пентил.
В другом варианте осуществленияR1 иR2 независимо выбраны из Н,(C0-C3)алкил-(C3-C7)циклоалкила, причем циклоалкил может быть независимо однократно или многократно замещен галогеном, гидрокси, оксо, циано,CF3,C1-C4 алкилом, при условии, чтоR1 иR2 одновременно не обозначают Н.
В другом варианте осуществленияR1 иR2 независимо выбраны из Н,(C0-C1)алкил-(C3-C7)циклоалкила, причем циклоалкил может быть независимо однократно или многократно замещен галогеном, гидрокси, оксо, циано,CF3,C1-C4 алкилом, при условии, чтоR1 иR2 одновременно не обозначают Н.
В другом варианте осуществленияR1 иR2 независимо выбраны из Н,(C0-C1)алкил-(C3-C5)циклоалкила, причем циклоалкил может быть независимо однократно или многократно замещен галогеном, гидрокси, оксо, циано,CF3,C1-C4 алкилом, при условии, чтоR1 иR2 одновременно не обозначают Н.
В другом варианте осуществленияR1 обозначает Н, иR2 выбран из циклопентила, циклопропилметила и циклобутилметила.
В другом варианте осуществленияR1 обозначает Н, иR2 обозначает циклопентил.
В другом варианте осуществленияR1 обозначает Н, иR2 обозначает циклопропилметил.
В другом варианте осуществленияR1 обозначает Н, иR2 обозначает циклобутилметил.
В другом варианте осуществленияR1 иR2 вместе образуют 3-7-членный циклоалкил или гетероциклоалкил, который может быть независимо однократно или многократно замещен галогеном, гидрокси, оксо, циано,CF3,C1-C4 алкилом,
или
R1 иR2 вместе образуют 3-7-членный циклоалкил, замещенныйR20 иR21, гдеR20 иR21 вместе образуют 3-7-членный циклоалкил, причем каждый циклоалкил может быть независимо однократно или многократно замещен галогеном, гидрокси, оксо, циано,CF3,C1-C4 алкилом.
В другом варианте осуществленияR1 иR2 вместе образуют 3-7-членный циклоалкил или гетероциклоалкил, который может быть независимо однократно или многократно замещен галогеном, гидрокси, оксо, циано,CF3,C1-C4 алкилом.
В другом варианте осуществленияR1 иR2 вместе образуют 3-7-членный циклоалкил, который может быть независимо однократно или многократно замещен галогеном, гидрокси, оксо, циано,CF3,C1-C4 алкилом.
В другом варианте осуществленияR1 иR2 вместе образуют циклопропил.
В другом варианте осуществленияR1 иR2 вместе образуют циклобутил.
В другом варианте осуществленияR1 иR2 вместе образуют циклопентил.
В другом варианте осуществленияR1 иR2 вместе образуют циклогексил.
В другом варианте осуществленияR1 иR2 вместе образуют 3-7-членный циклоалкил, замещенныйR20 иR21, гдеR20 иR21 вместе образуют 3-7-членный циклоалкил, причем каждый циклоалкил может быть независимо однократно или многократно замещен галогеном, гидрокси, оксо, циано,CF3,C1-C4 алкилом.
В другом варианте осуществленияR1 иR2 вместе образуют 3-7-членный циклоалкил, замещенный на одном и том же атоме углеродаR20 иR21, гдеR20 иR21 вместе образуют 3-7-членный циклоалкил, причем каждый циклоалкил может быть независимо однократно или многократно замещен галогеном, гидрокси, оксо, циано,CF3,C1-C4 алкилом.
В другом варианте осуществленияR1 иR2 вместе образуют спиро[2.3]гексановую, спиро[3.3]гептановую или спиро[3.4]октановую кольцевую систему.
В другом варианте осуществленияR1 иR2 вместе образуют спиро[2.3]гексановую кольцевую систему.
В другом варианте осуществленияR1 иR2 вместе образуют спиро[3.3]гептановую кольцевую систему.
В другом варианте осуществленияR1 иR2 вместе образуют спиро[3.4]октановую кольцевую систему.
В другом варианте осуществленияR1 иR2 вместе образуют 5,5-двузамещенную спиро[2.3]гексановую кольцевую систему.
В другом варианте осуществленияR1 иR2 вместе образуют 2,2-двузамещенную спиро[3.3]гептановую кольцевую систему.
В другом варианте осуществленияR1 иR2 вместе образуют 2,2-двузамещенную спиро[3.4]октановую кольцевую систему.
В другом варианте осуществленияR1 иR2 независимо выбраны из H, F,OH, OR6, SR6, NHR7, N(R7)2, NHC(O)R6 или NHCO2R6, при условии, чтоR1 иR2 одновременно не обозначают Н.
В другом варианте осуществленияR1 иR2, если они не обозначают Н, являются незамещенными, за исключением того, что, когдаR1 иR2 вместе с углеродом, к которому они присоединены, образуют кольцоC3-C7, это кольцо может быть замещено R20 иR21, которые сами являются незамещенными.
В другом варианте осуществленияR1 иR2, если они не обозначают Н, могут быть однократно или многократно независимо замещены галогеном, гидрокси, оксо, циано,CF3,C1-C4 алкилом.
В другом варианте осуществленияR1 иR2, если они не обозначают Н, однократно или многократно независимо замещены галогеном, гидрокси, оксо, циано,CF3,C1-C4 алкилом.
В другом варианте осуществленияR6 обозначает C1-C6 алкил, в случае необходимости независимо прерванный одной или более групп -O-, -S-, -S(O)- или -S(O)2-,(C3-C7)циклоалкил,(C4-C8)циклоалкилалкил, гетероциклоалкилалкил.
В другом варианте осуществленияR6 обозначает C1-C6 алкил, в случае необходимости независимо прерванный одной или более групп -O-, -S-, -S(O)- или -S(O)2-.
В другом варианте осуществленияR6обозначает (C3-C7)циклоалкил.
В другом варианте осуществленияR6 обозначает (C0-C3)алкил-(C3-C7)циклоалкил.
В другом варианте осуществленияR6 обозначает гетероциклоалкилалкил.
В другом варианте осуществленияR6 обозначает (CH2)nQ.
В другом варианте осуществленияR6 обозначает -CH2-Q.
В другом варианте осуществления Q обозначает арил.
В другом варианте осуществления Q обозначает гетероарил.
В другом варианте осуществления Q обозначает моноциклический гетероарил.
В другом варианте осуществления Q обозначает бициклический гетероарил.
В другом варианте осуществления X обозначает связь или двухвалентную связующую группу, выбранную из -O-, -OCH2-, -OCH(R7)-, -OCH2CH2-, -CH2-, -C(O)-, -CH=CH-, -CH2CH2-, -CH2O-, -CH2OCH2-, -CH2CH2O-, -S-, -SCH2-, CH2S- или -CH2SCH2-.
В другом варианте осуществления X обозначает связь или двухвалентную связующую группу, выбранную из -O-, -OCH2-, -OCH(R7)-, -OCH2CH2-, -CH2O-, -CH2OCH2- или -CH2CH2O.
В другом варианте осуществления X обозначает связь или двухвалентную связующую группу, выбранную из -CH2-, -C(O)-, -CH=CH- или -CH2CH2-.
В другом варианте осуществления X обозначает связь или двухвалентную связующую группу, выбранную из -S-, -SCH2-, CH2S- или -CH2SCH2-.
В другом варианте осуществления X обозначает связь или двухвалентную связующую группу, выбранную из -O- или -S-.
В другом варианте осуществления X обозначает связь.
В другом варианте осуществления X обозначает двухвалентную связующую группу -O-.
В другом варианте осуществления X обозначает двухвалентную связующую группу -S-.
В другом варианте осуществления Y обозначает связь или двухвалентную связующую группу, выбранную из -O-, -OCH2-, -OCH(R7)-, -OCH2CH2-, -CH2-, -C(O)-, -CH=CH-, -CH2CH2-, -CH2O-, -CH2OCH2-, -CH2CH2O-, -S-, -SCH2-, CH2S- или -CH2SCH2-.
В другом варианте осуществления Y обозначает связь или двухвалентную связующую группу, выбранную из -O-, -OCH2-, -OCH(R7)-, -OCH2CH2-, -CH2O-, -CH2OCH2- или -CH2CH2O.
В другом варианте осуществления Y обозначает связь или двухвалентную связующую группу, выбранную из -CH2-, -C(O)-, -CH=CH- или -CH2CH2-.
В другом варианте осуществления Y обозначает связь или двухвалентную связующую группу, выбранную из -S-, -SCH2-, CH2S- или -CH2SCH2-.
В другом варианте осуществления Y обозначает связь или двухвалентную связующую группу, выбранную из -O- или -S-.
В другом варианте осуществления Y обозначает связь.
В другом варианте осуществления Y обозначает двухвалентную связующую группу -O-.
В другом варианте осуществления Y обозначает двухвалентную связующую группу -S-.
В другом варианте осуществленияR3 обозначаетC1-C4 алкил.
В другом варианте осуществленияR3 обозначаетC1-C3 алкил.
В другом варианте осуществленияR3 обозначаетC2-C3 алкил.
В другом варианте осуществленияR3 выбран из этила, н-пропила, изопропила, трифторэтила или трифторпропила.
В другом варианте осуществленияR3 обозначаетэтил.
В другом варианте осуществленияR3 обозначаетн-пропил.
В другом варианте осуществленияR3 обозначаетизопропил.
В другом варианте осуществленияR3 обозначаеттрифторэтил.
В другом варианте осуществленияR3 обозначаеттрифторпропил.
В другом варианте осуществленияR3 обозначает(C4-C10)циклоалкилалкил.
В другом варианте осуществленияR3 обозначает(C0-C3)алкил-(C3-C7)циклоалкил.
В другом варианте осуществленияR3 обозначает(C3-C7)циклоалкил.
В другом варианте осуществленияR3 обозначает(C1-C3)алкил-(C3-C7)циклоалкил.
В другом варианте осуществленияR3 обозначает(C1)алкил-(C3-C7)циклоалкил.
В другом варианте осуществленияR3 обозначает(C1)алкил-(C3-C4)циклоалкил.
В другом варианте осуществленияR3 обозначаетциклопропилметил.
В другом варианте осуществленияR3 обозначаетциклобутилметил.
В другом варианте осуществленияR3 обозначаетгетероциклоалкилалкил.
В другом варианте осуществленияR3 представлен группой Z.
В другом варианте осуществленияR3 не обозначаетциклопропилметил.
В другом варианте осуществления Z является моноциклическим.
В другом варианте осуществления Z является бициклическим.
В другом варианте осуществления Z обозначаетгетероарил.
В другом варианте осуществления Z обозначаетнезамещенный гетероарил.
В другом варианте осуществления Z обозначаетбензо[b]тиофенил, бензо[c][1,2,5]оксадиазолил, бензо[c][1,2,5]тиадиазолил или бензо[d]тиазолил.
В другом варианте осуществления Z обозначаетбензо[b]тиофенил или бензо[d]тиазолил.
В другом варианте осуществления Z обозначаетбензо[c][1,2,5]оксадиазолил или бензо[c][1,2,5]тиадиазолил.
В другом варианте осуществления Z обозначаетбензо[b]тиофенил.
В другом варианте осуществления Z обозначаетбензо[c][1,2,5]оксадиазолил.
В другом варианте осуществления Z обозначаетбензо[c][1,2,5]тиадиазолил.
В другом варианте осуществления Z обозначаетбензо[d]тиазолил.
В другом варианте осуществления Z обозначаетарил.
В другом варианте осуществления Z обозначаетзамещенный фенил.
В другом варианте осуществления Z обозначает4-замещенный фенил.
В другом варианте осуществления Z может быть замещен 3 заместителями, независимо выбранными из галогена,R6,CF3, CN,NO2, ОН,C1-C4 алкокси, арилокси, гетероарилокси,OCH2CH2OCH3, OC(O)R6, OC(O)OR6, OC(O)NHR7, OC(O)N(R7)2, SR6, S(O)R6, S(O)2R6, S(O)2NHR7, S(O)2N(R7)2, NHR7, N(R7)2, NHC(O)R6, N(R7)C(O)R6, NHC(O)OR6, N(R7)C(O)OR6, N(R7)C(O)NH(R7), N(R7)C(O)NH(R7)2, C(O)NH2, C(O)NHR7, C(O)N(R7)2, CO2H, CO2R6 или COR6.
В другом варианте осуществления Z может быть замещен 3 заместителями, независимо выбранными из галогена,R6,CF3, CN,NO2,C1-C4 алкокси, арилокси, гетероарилокси,OCH2CH2OCH3, OC(O)R6, OC(O)OR6, SR6, NHR7, N(R7)2CO2H, CO2R6 или COR6.
В другом варианте осуществления Z может быть замещен 3 заместителями, независимо выбранными из галогена,R6,CF3, CN,NO2,C1-C4 алкокси, арилокси,OCH2CH2OCH3, OC(O)R6, OC(O)OR6 или SR6.
В другом варианте осуществления Z может быть замещен 3 заместителями, независимо выбранными из галогена,R6,CF3, CN,NO2, C1-C4 алкокси, OCH2CH2OCH3, OC(O)R6, OC(O)OR6 или SR6.
В другом варианте осуществления Z может быть замещен 3 заместителями, независимо выбранными из галогена, C1-C6 алкила,(C0-C3)алкил-(C3-C7)циклоалкила, CF3, C1-C4 алкокси илиSR6.
В другом варианте осуществления Z может быть замещен 3 заместителями, независимо выбранными из F, Cl, C1-C3 алкила, (C3-C6)циклоалкила,CF3, C1-C4 алкокси, S-(C1-C4)алкила или S-(C0-C3)алкил-(C3-C7)циклоалкила.
В другом варианте осуществления Z может быть замещен 3 заместителями, независимо выбранными из F, Cl, C1-C3 алкила, (C3-C6)циклоалкила, CF3, C1-C4 алкокси или S-(C1-C3)алкила.
В другом варианте осуществления Z замещенCF3, OCF3, OCH2CF3, F, Cl, SMe, Me, Et, iPr.
В другом варианте осуществления Z замещен F.
В другом варианте осуществления Z замещен Cl.
В другом варианте осуществления Z замещен C1-C3 алкилом.
В другом варианте осуществления Z замещен (C3-C6) циклоалкилом.
В другом варианте осуществления Z замещен CF3.
В другом варианте осуществления Z замещен C1-C4 алкокси.
В другом варианте осуществления Z замещен S-(C1-C3)алкилом.
В другом варианте осуществленияR4 обозначаетC1-C7 алкил.
В другом варианте осуществленияR4 обозначаетC1-C4 алкил.
В другом варианте осуществленияR4 обозначаетC1-C3 алкил.
В другом варианте осуществленияR4 обозначаетC2-C3 алкил.
В другом варианте осуществленияR4 выбран из этила, н-пропила, изопропила, трифторэтила или трифторпропила.
В другом варианте осуществленияR4 обозначаетэтил.
В другом варианте осуществленияR4 обозначаетн-пропил.
В другом варианте осуществленияR4 обозначаетизопропил.
В другом варианте осуществленияR4 обозначаеттрифторэтил.
В другом варианте осуществленияR4 обозначаеттрифторпропил.
В другом варианте осуществленияR4 обозначает(C4-C10)циклоалкилалкил.
В другом варианте осуществленияR4 обозначает(C0-C3)алкил-(C3-C7)циклоалкил.
В другом варианте осуществления R4 обозначает (C3-C7)циклоалкил.
В другом варианте осуществления R4 обозначает (C1-C3)алкил-(C3-C7)циклоалкил.
В другом варианте осуществления R4 обозначает (C1)алкил-(C3-C7)циклоалкил.
В другом варианте осуществленияR4 обозначает(C1)алкил-(C3-C4)циклоалкил.
В другом варианте осуществленияR4 обозначаетциклопропилметил.
В другом варианте осуществленияR4 обозначаетциклобутилметил.
В другом варианте осуществленияR4 обозначаетгетероциклоалкилалкил.
В другом варианте осуществленияR4 представлен группой Z.
В другом варианте осуществленияR4 не обозначаетциклопропилметил.
В другом варианте осуществленияR5 обозначает F, Cl, Br, CN,C1-C4 алкокси,SR6,(C1-C4)алкил,(C0-C3)алкил-(C3-C7)циклоалкил, -(C3-C7)циклоалкил или(C2-C4)алкинил, где каждый алкил или циклоалкил может быть независимо однократно или многократно замещен галогеном, гидрокси, циано,CF3,C1-C4 алкилом.
В другом варианте осуществленияR5 обозначает F, Cl, Br, CN,C1-C4 алкокси,SR6,(C1-C4)алкил,(C0-C3)алкил-(C3-C7)циклоалкил, -(C3-C7)циклоалкил или(C2-C4)алкинил, где каждый алкил или циклоалкил может быть независимо однократно или многократно замещен галогеном, гидрокси, циано,CF3,C1-C4 алкилом.
В другом варианте осуществленияR5 обозначаетF, Cl, Br, CN,C1-C4 алкокси, -S-(C1-C4)алкил или(C1-C4)алкил, где каждый алкил может быть независимо однократно или многократно замещен галогеном, гидрокси, циано,CF3,C1-C4 алкилом.
В другом варианте осуществленияR5 обозначаетF, Cl, Br, CN,C1-C3 алкокси -S-(C1-C3)алкил или(C1-C3)алкил, где каждый алкил может быть независимо однократно или многократно замещен галогеном, гидрокси, циано,CF3,C1-C4 алкилом.
В другом варианте осуществленияR5 обозначаетF, Cl, Br или CN.
В другом варианте осуществленияR5 обозначаетF или Cl.
В другом варианте осуществленияR5 обозначаетF.
В другом варианте осуществленияR5 обозначаетCl.
В другом варианте осуществленияR5 обозначаетбром.
В другом варианте осуществленияR5 обозначаетCN.
В другом варианте осуществленияR5 обозначаетC1-C3 алкокси, -S-(C1-C3)алкил или(C1-C3)алкил.
В другом варианте осуществленияR5 обозначаетC1-C3 алкокси.
В другом варианте осуществленияR5 обозначаеттрифторэтокси или трифторпропокси.
В другом варианте осуществленияR5 обозначает(C1-C3)алкил.
В другом варианте осуществленияR5 обозначаетCF3.
В другом варианте осуществленияR5 обозначает-S-(C1-C3)алкил.
В другом варианте осуществленияR5 обозначает-S-Me, -S-Et или -S-CH2CF3.
В другом варианте осуществленияR5 обозначаетSR6.
В другом варианте осуществленияR5 обозначает(C0-C3)алкил-(C3-C7)циклоалкил,(C2-C4)алкинил или -(C3-C7)циклоалкил.
В другом варианте осуществленияR5 обозначает(C0-C3)алкил-(C3-C7)циклоалкил.
В другом варианте осуществленияR5 обозначает(C2-C4)алкинил.
В другом варианте осуществленияR5 обозначаеттрифторэтинил.
В другом варианте осуществленияR5 обозначает(C3-C7)циклоалкил.
В другом варианте осуществленияR5 обозначаетциклопропил.
В другом варианте осуществленияR5 обозначаетNO2 илиNH2.
В другом варианте осуществленияR5 обозначаетарил или гетероарил.
В другом варианте осуществления соединение представляет собой соединение, выбранное из примеров 100-3217.
В другом варианте осуществления выбрано рацемическое соединение, описанное в разделе раскрытия.
В другом варианте осуществления выбран единственный энантиомер согласно предыдущим вариантам осуществления.
В другом варианте осуществления выбран единственный энантиомер конфигурации (R) согласно предыдущим вариантам осуществления.
В другом варианте осуществления выбран единственный энантиомер конфигурации (S) согласно предыдущим вариантам осуществления.
В другом варианте осуществления выбран сольват соединения формулы (I-IX).
В другом варианте осуществления выбран полиморф соединения формулы (I-IX).
В отдельном варианте осуществления представлена фармацевтическая композиция, включающая соединение согласно предыдущим вариантам осуществления и фармацевтически приемлемый носитель.
В отдельном варианте осуществления представлен способ лечения нейродегенеративного нарушения, включающий введение пациенту эффективного количества фармацевтической композиции согласно предыдущим вариантам осуществления.
В другом варианте осуществления представлен способ лечения болезни Альцгеймера, включающий введение пациенту эффективного количества фармацевтической композиции согласно предыдущим вариантам осуществления.
В некоторых случаях соединения Формулы (I-IX) могут содержать центры асимметрии и существовать как различные энантиомеры или диастереомеры. Все энантиомерные или диастереомерные формы входят в рамки изобретения.
Соединения, описанные в настоящем раскрытии, например, соединения Формул I-IX, могут быть в форме фармацевтически приемлемых солей. Фраза “фармацевтически приемлемый” относится к солям, полученным из фармацевтически приемлемых нетоксичных оснований и кислот, включая неорганические и органические основания и неорганические и органические кислоты. Соли, полученные из неорганических оснований, включают литий, натрий, калий, магний, кальций и цинк. Соли, полученные из органических оснований, включают аммиак, первичные (например, трометамин), вторичные и третичные амины и аминокислоты (например, лизин). Соли, полученные из неорганических кислот, включают серную, хлористоводородную, фосфорную, метансульфоновую, бромистоводородную. Соли, полученные из органических кислот, включаютC1-6 алкилкарбоновые кислоты, дикарбоновые кислоты и трикарбоновые кислоты, такие как уксусная кислота, пропионовая кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, винная кислота, адипиновая кислота и лимонная кислота, и алкилсульфоновые кислоты, такие как метансульфоновая, и арилсульфоновые кислоты, такие какп-толуолсульфоновая кислота и бензолсульфоновая кислота. В отношении детализированного списка солей см. P.H. Stahl and C.G. Wermuth (eds.) “Handbook of Pharmaceutical Salts, Properties, Selection and Use” Wiley-VCH (ISBN 3-906390-26-8).
Соединения и их фармацевтически приемлемые соли могут быть в форме сольватов. Это происходит, когда соединение формулы (I-IX) кристаллизуется таким образом, что включает молекулы растворителя в кристаллическую решетку. Примерами растворителей, образующих сольваты, являются вода (гидраты), MeOH, EtOH, iPrOH и ацетон. Формулы I-IX охватывают все сольваты изображенных соединений.
Соединения, описанные в настоящем раскрытии, могут существовать в различных кристаллических формах, известных как полиморфы.
Специалисту в данной области понятно, что некоторые химические группы могут существовать во множестве таутомерных форм. Настоящее раскрытие включает все такие таутомерные формы. Например, тетразол может существовать в двух таутомерных формах, 1-H тетразол и 2-H тетразол. Это показано на рисунке ниже. Этот пример не является ограничением таутомерных форм.
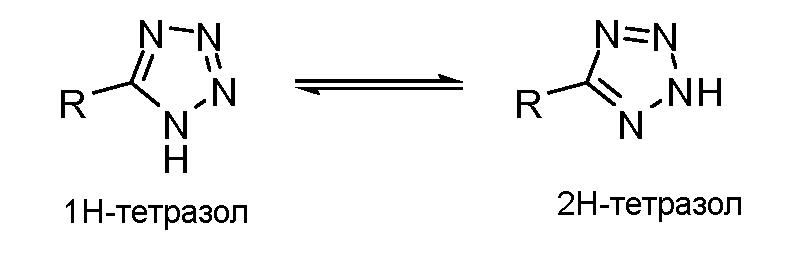
Специалисту в данной области понятно, что некоторые электрофильные кетоны могут существовать в гидратированной форме. Настоящее раскрытие включает все такие гидратированные формы. Например, трифторметилкетон может существовать в гидратированной форме, образующейся в результатедобавления воды к карбонильной группе. Это показано на рисунке ниже. Этот пример не является ограничением гидратированных форм.
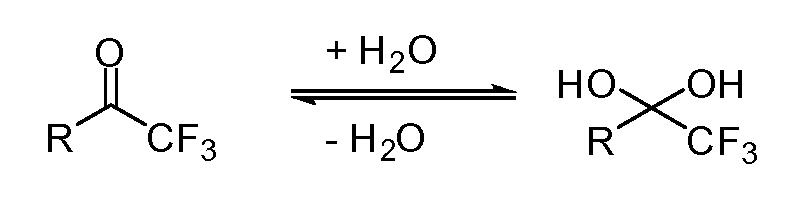
Аббревиатуры, используемые в следующих примерах и примерах получения, включают:
ОПИСАНИЕ ФИГУРЫ
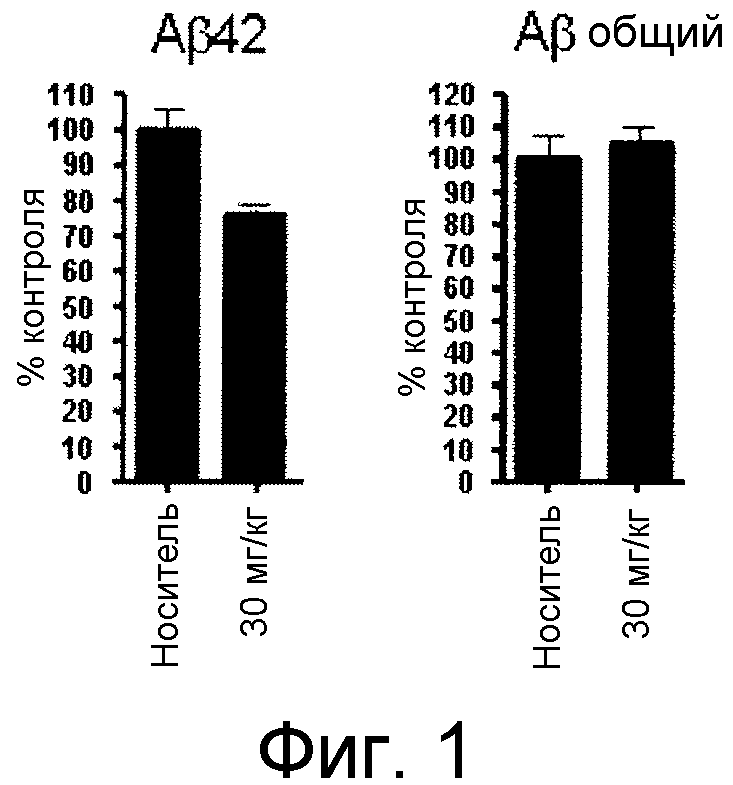
Фигура 1 демонстрирует желаемый эффект на Aβ после введения примера 1301 (2-(5-хлор-4'-изопропил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилпропановая кислота) мышам C57BL/6 в виде одной дозы из расчета 30 мг/кг в составе Solutol HS 15: Этанол: Вода (15:10:75) (измерение Aβ в момент времени 3 часа).
ПОДРОБНОЕ ОПИСАНИЕ
Ниже описаны соединения, подпадающие под Формулы I и II, а также способы получения соединений и применение соединений для лечения одного или более симптомов болезни Альцгеймера. Соединения по изобретению являются модуляторами гамма-секретазы (GSM), то есть соединениями, действие которых заключается в изменении относительных уровней пептидов Aβ, продуцируемых γ-секретазой. В некоторых случаях соединения изменяют относительные уровни пептидов Aβ, продуцируемых γ-секретазой, не изменяя значительно общий уровень продуцированных пептидов Aβ.
Общие схемы реакций
Четырехзамещенные соединения бензола Формул I и II могут быть получены специалистом в области органического синтеза путем многостадийного органического синтеза из известных фторнитробензолов и хлорнитробензолов в качестве исходных материалов, например, 2,4-дифторнитробензола, 4-фтор-2-циано-нитробензола, 3-нитро-4-хлорбензола, 2,4,5-трифторнитробензола, 2,4,5-трихлорнитробензола или, альтернативно, из 4-гидроксифенил- и 4-аминофенилуксусной кислоты, с использованием обычных процедур органического синтеза.
Группа уксусной кислоты в положении 1, общая для соединений Формул I и II, в форме непосредственно свободной кислоты или ее эфирного производного, уже присутствует в случае 4-гидроксифенилуксусной кислоты или эфира 4-гидроксифенилуксусной кислоты в качестве исходных материалов. В случае 4-фторнитробензольных исходных материалов или промежуточных соединений, группа уксусной кислоты может быть введена стандартным нуклеофильным ароматическим замещением 4-фтора незамещенным эфиром малоновой кислоты (например, диэтиловым эфиром малоновой кислоты) или производным эфира малоновой кислоты, уже несущим группуR1 (например, 2-изобутилдиэтилмалонатом). Введение группX-R3 и Y-R4 или промежуточных групп, которые далее превращаются вX-R3 и Y-R4, может быть осуществлено замещением или манипуляцией подходящих функциональных групп в положении 3 или 4 в подходящих исходных материалах или промежуточных соединениях для получения Формул I и II, соответственно. В случаях, где X или Y обозначает связь, галоген в положении 3 или 4 или трифлатную группу заменяют арилом или гетероарилом в реакции образования углерод-углеродной связи, обычно реакции сочетания Suzuki. В случаях, где X или Y обозначают O, S или N, реакцию замещения галогена в положении 3 или 4 (например, соответствующей группы 2-фтор 2,4-дифторнитробензольного исходного материала) осуществляют, используяHO-R3 или HS-R3или H2N-R3 и основание (например, NaH,K2CO3) в подходящем растворителе (например, DMF). Соединения, где X или Y обозначает -S(O)- или -S(O2)-, получают окислением соединений, где X или Y обозначает S. Соединения, где X или Y обозначает -S(O)2N(H)-, -S(O)2N(R5)-, могут быть получены преобразованием нитрогруппы в положении 3 или 4 (например, нитрогруппы исходного нитробензольного материала) в сульфонилхлорид реакцией Sandmeyer с последующим добавлением соответствующего амина. Соединения, где X или Y обозначает N(H)S(O)2- или -N(R5)S(O)2, могут быть получены восстановлением нитрогруппы в положении 3 или 4 до соответствующего анилина с последующей реакцией с соответствующим сульфонилхлоридом. Соединения, где X или Y обозначает NHC(O)- или -N(R5)C(O)-, могут быть получены восстановлением нитрогруппы в положении 3 или 4 до соответствующего анилина с последующей реакцией с соответствующим хлоридом карбоновой кислоты. Соединения, где X или Y обозначает -C(O)-, могут быть получены добавлением металлоорганического реагента (например, реактива Гриньяра или органолития) к цианогруппе в положении 3 или 4 непосредственно или в 2-стадийной последовательности с добавлением металлоорганического реагента к карбоксальдегидной группе в положении 3 или 4 с последующим окислением. Соединения, где X или Y обозначает -C(O)NH- или C(O)N(R5)-, могут быть получены добавлением соответствующего амина к карбоновой кислоте в положении 3 или 4, которая, в свою очередь, может быть получена гидролизом цианогруппы в положении 3 или 4. Как ароматическое нуклеофильное замещение промежуточного соединения 2-фтор-1-нитробензола, так и алкилирование промежуточного соединения 3- или 4-гидроксибензола соответствующим алкилбромидом или трифлатом могут использоваться для получения соединений Формул I и II, где группаR4 обозначаетOCH2CF3, C2-C4 алкокси или циклопропилоксиметил. Соединения, в которых группаR4 обозначает алкил, арил или гетероарил, присоединенный углерод-углеродной связью, могут быть получены реакцией сочетания Suzuki. В этом процессе арил- или гетероарилбороновая кислота или сложный эфир бората вводят в реакцию с промежуточным соединением, имеющим галоген в положении 3 или 4 или трифлатную группу. Этот способ приводит к замене галогена или трифлатной группы арилом или гетероарилом, который затем присоединяется к промежуточному соединению на атоме углерода, ранее несшем бороновую кислоту или сложноэфирную группу. Соединения, в которых группаR4 обозначает гетероарил, присоединенный связью углерод-азот, могут быть получены реакцией 3- или 4-йодзамещенного промежуточного соединения с гетероароматическим гетероциклом, имеющим кислую группу N-H, в условиях реакции Ulman или реакции, катализируемой медью.
Соединения Формул I и II, в которых А = тетразол, могут быть получены из их соответствующих нитрилов А = CN, которые могут быть получены дегидрированием соответствующих первичных амидов А =CONH2, получение которых описано выше. Таким образом, обрабатывают нитрил азидом, таким как азид натрия или трибутилстанилазид(Bu3SnN3), при температуре 20-100°C, в случае необходимости с растворителем, таким как DMF, THF или диметилсульфоксид.
Соединения Формулы III по изобретению, в которойR1 обозначаетR8 алкил, циклоалкилалкил, гетероциклоалкилалкил, алкоксиалкил, гетероарилалкил или арилалкил,R2 обозначаетR9 водород, алкил, циклоалкилалкил, гетероциклоалкилалкил, алкоксиалкил, гетероарилалкил или арилалкил, Y обозначает O, X обозначает связь,R3 обозначает Z,R4 иR5 имеют значения, определенные выше, и таким образом имеющие общую Формулу XXIV, могут быть получены в целом, как показано на Схеме 1.
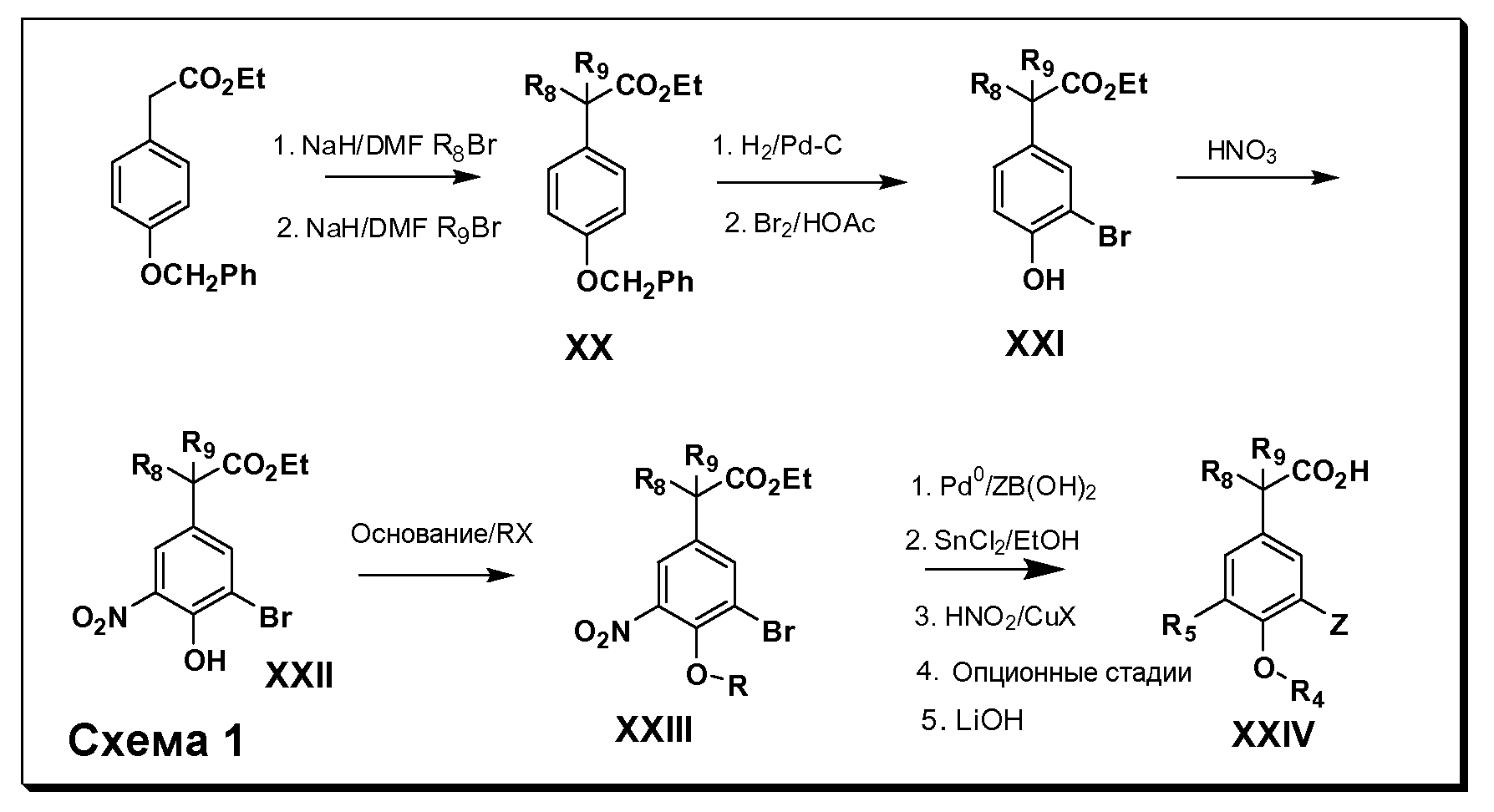
Таким образом, как показано на Схеме 1, алкил, циклоалкилалкил, гетероциклоалкилалкил, алкоксиалкил, гетероарилалкил или арилалкил, как группуR8, вводят на первой стадии, обрабатывая 4-бензилоксифенилэтилацетат одним эквивалентом подходящего депротонирующего основания, такого как гидрид натрия, в подходящем органическом растворителе с последующим добавлением соответствующего реакционноспособного алкилбромидаR8Br, такого как изобутилбромид, получая XX, гдеR9 обозначает водород. В случаях, где присутствует вторая алкильная или аралкильная группа, эту стадию алкилирования повторяют, используяR9Br в качестве алкилирующего агента. В случаях, где спироциклическое кольцо образованоR8 иR9 (например, циклопропил), тогда используют подходящий дибромид (например, дибромэтан в случае циклопропила). Бензильную группу затем удаляют в стандартных условиях каталитического гидрирования, и полученный фенол обрабатывают бромом в уксусной кислоте, получая промежуточное бромфенольное соединение XXI. Нитрование XXI приводит затем к нитрофенольному промежуточному соединению XXII, которое затем подвергают стандартной опосредуемой основанием реакции алифатического или ароматического нуклеофильного замещения алкил- или арилгалогенидомR4-X, получая промежуточное соединение XXIII, гдеR4 обозначает алкил, циклоалкилалкил, гетероциклоалкилалкил, алкоксиалкил, арилалкил, гетероарилалкил, арил или гетероарил. Затем вводят группу Z стандартными реакциями. Такие реакции иллюстрируются обычным сочетанием по Suzuki замещенного производного арил- или гетероарилбороновой кислоты Z-B(ОН)2 с использованием подходящего катализатора на основе палладия(0), обычно несущего фосфиновые лиганды (например, Pd(PPh3)4 или тетракистрифенилфосфин) в случае, где Z связан углерод-углеродной связью, и опосредуемой медью (например, CuI) сочетания типа Ulman гетероарильного кольца, несущего активную группу N-H, где Z обозначает гетероарил, связанный связью азот-углерод.
После введения группы Z нитрогруппа превращается в соответствующий анилин любым числом стандартных условий восстановления (например, восстановлениемSnCl2). Это сопровождается превращением полученного анилина в соль диазония, которую затем превращают “in situ” вR5 либо непосредственно, в случае, гдеR5 обозначает F, Cl, Br, CN, OH, C1-C4 алкокси илиSR6, при использовании подходящей соли меди, то есть CuCl, CuBr, CuCN, или нуклеофила, то есть воды, спирта или тиола, или на последующей стадии, например, окисления (например, с MCPBA) продукта сочетания тиола, когдаR5 обозначает S(O)2R6; например, сочетания Suzuki бромидного продукта, когдаR5 обозначает гетероарил, например, обработкой промежуточного соединения сульфонилхлорида, полученного в условияхCuCl/SO2 с амином HN(R7)2, когдаR5 обозначает S(O)2N(R7)2, например, реакцией трифторметилирования по Burton йодидного продукта (Burton, D. J.; Wiemers, D. M. J. Am. Chem. Soc. 1985, 107, 5014 and 1986, 108, 832; Miller, J.A., Coleman, M. C.; Matthews, R. S. J. Org. Chem. 1993, 58, 2637), когдаR5 обозначает CF3. Стандартный гидролиз сложных эфиров приводит к соединениям Формулы XXIV.
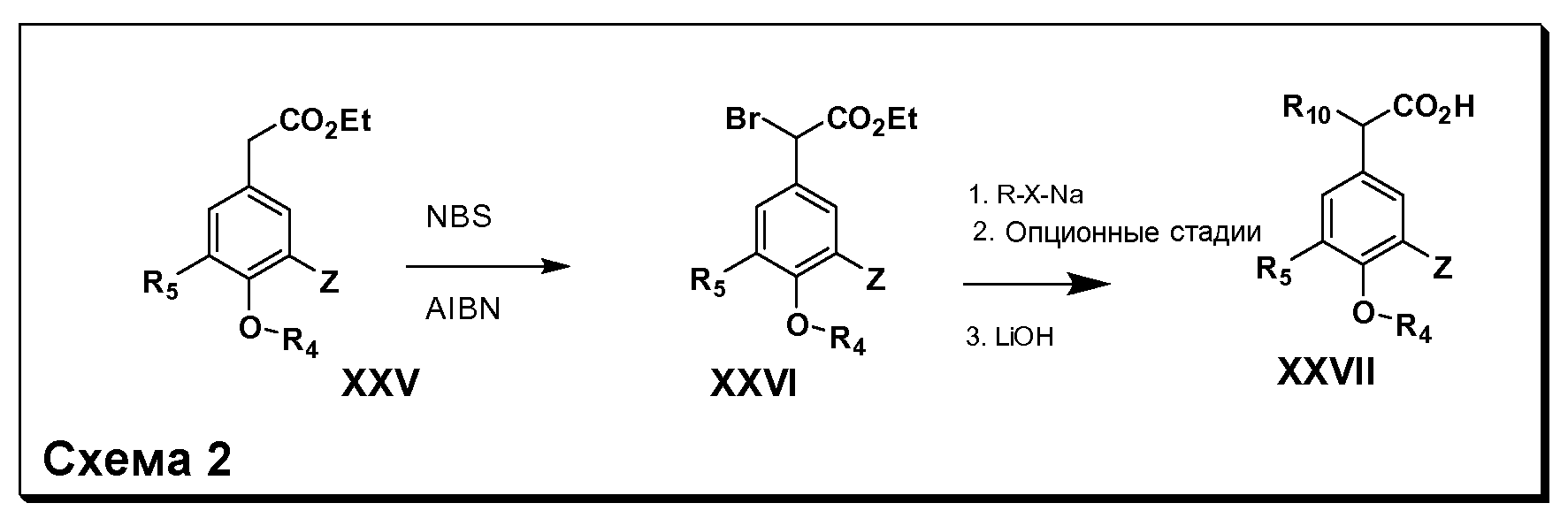
Соединения Формулы III по изобретению, в которойR1 обозначает OH, OR6, SR6, NHR7, N(R7)2, NHC(O)R6 или NHCO2R6;R2 обозначает Н; Y обозначает O, X обозначает связь,R3 обозначает Z,R4 иR5 имеют значения, определенные выше, и таким образом имеющие общую Формулу XXVII, могут быть получены в целом, как изображено на Схеме 2. Таким образом, как изображено на Схеме 2, бромирование промежуточных соединений общей Формулы XXV, полученных согласно Схеме 1, например, с использованием N-бромсукцинимида (NBS), приводит к промежуточному соединению XXVI. На последующей стадии атом брома заменяют подходящим алкоголятом, тиолатом или защищенным нуклеофильным амином (например, азидом илиN3). Продукт последней реакции либо непосредственно подвергают гидролизу сложного эфира, либо далее обрабатывают на дополнительных стадиях (например, превращением защищенного амина в аминогруппу с последующим восстановительным аминированием с получением производных моно- или диалкиламина, и в случае необходимости, с ацилированием или карбамоилированием таких производных амина), и затем подвергают финальному гидролизу сложного эфира, получая соединения Формулы XXVII, в которойR10 обозначает OH, OR6, SR6, NHR7, N(R7)2, NHC(O)R6 или NHCO2R6.
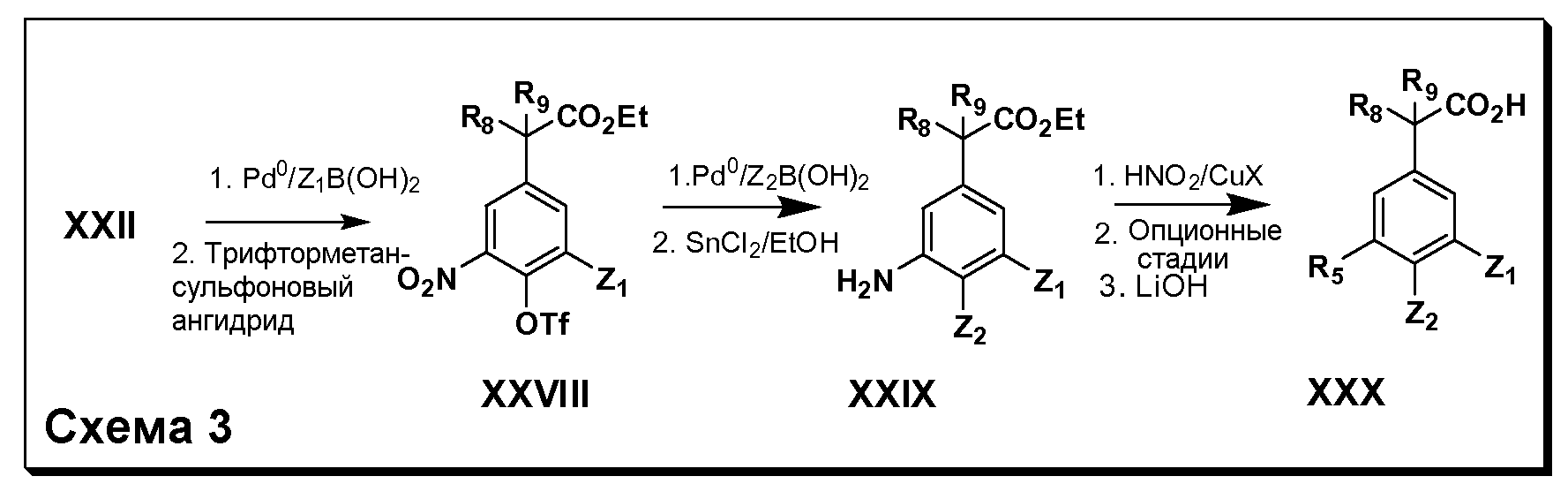
Соединения Формул III и IV по изобретению, в которыхR1 обозначаетR8 алкил, циклоалкилалкил, гетероциклоалкилалкил, алкоксиалкил, гетероарилалкил или арилалкил,R2 обозначаетR9 водород, алкил, циклоалкилалкил, гетероциклоалкилалкил, алкоксиалкил, гетероарилалкил, X и Y обозначают связь,R3 иR4 обозначают, соответственно,Z1 иZ2, независимо обозначающие выбранные группы Z, определенные выше, иR5 имеет значения, определенные выше, и таким образом имеющие общую Формулу XXX, могут быть получены в целом, как изображено на Схеме 3, исходя из соединений общей Формулы XXII, которые могут быть получены, как описано на Схеме 1.
Соединения Формулы V, в которойR1 обозначаетR8 алкил, циклоалкилалкил, гетероциклоалкилалкил, алкоксиалкил, гетероарилалкил или арилалкил,R2 обозначаетR9 водород, алкил, циклоалкилалкил, гетероциклоалкилалкил, алкоксиалкил, гетероарилалкил; X обозначает Q = O, S илиSO2;R5 обозначает F или Cl;R3 и Z имеют значения, определенные выше, и таким образом имеющие общую Формулу XXXIV, могут быть получены в целом, как изображено на Схеме 4. Соответственно, 4-галоген в 2,4,5-трифторнитробензоле или 2,4,5-трихлорнитробензоле селективно вытесняется в реакции с 2-замещенным диэтилмалонатомR8YCH(CO2Et)2 в основных условиях (например, NaH/DMF) с последующим гидролизом и этерификацией с получением промежуточного соединения XXXI. Затем 2-галоген подвергают реакции нуклеофильного ароматического замещения обработкой соединениемR3-J-H (в котором J обозначает O, S) в основных условиях (например, NaH/DMF) с последующим восстановлением и реакцией Sandmeyer с получением йодида XXXII.
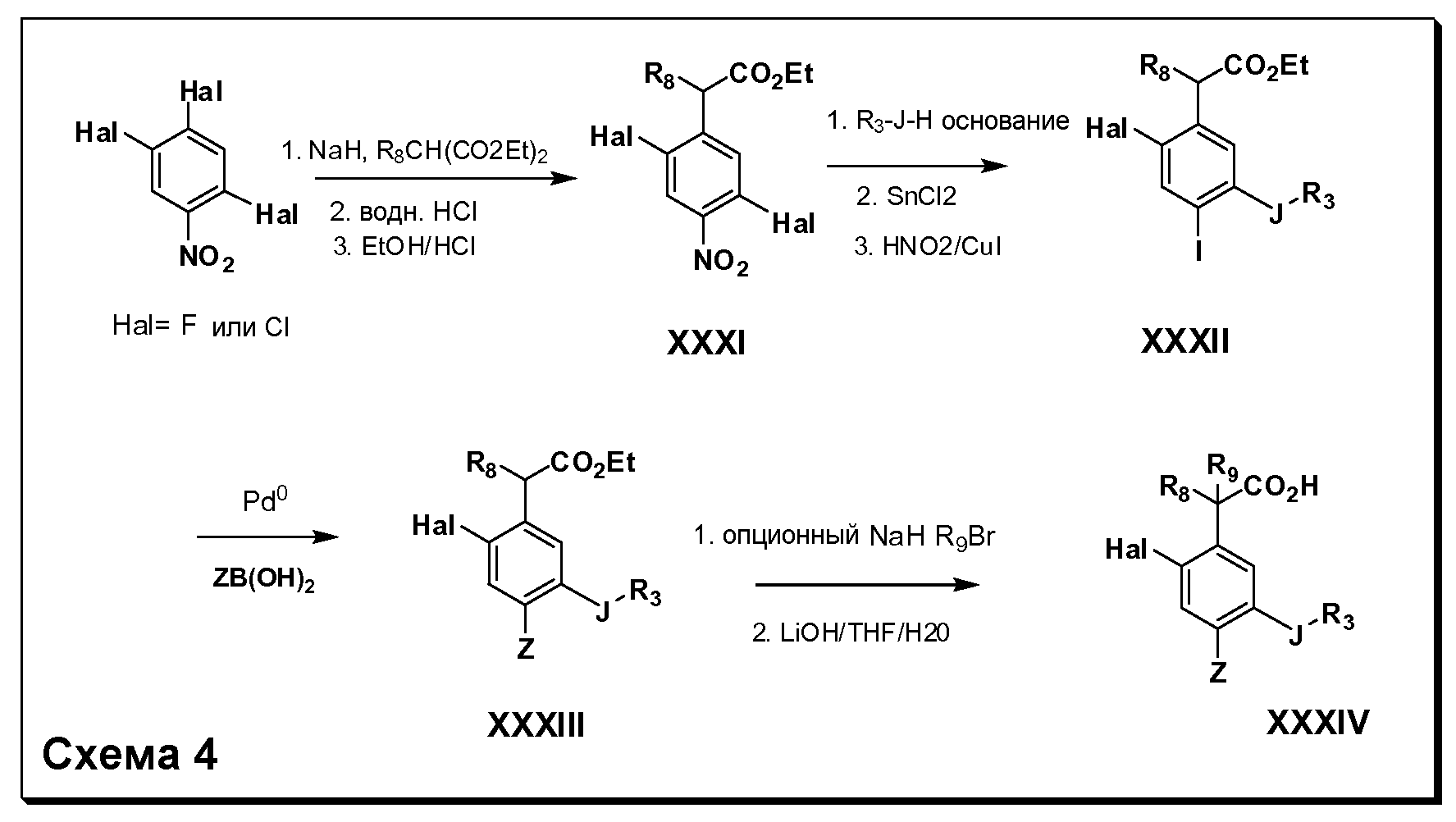
Реакция сочетания Suzuki затем дает промежуточные соединения общей формулы XXXIII. Введение группыR9 можно осуществить, используя условия алкилирования, описанные выше. Соединения, в которых J обозначаетSO2, могут быть получены стандартным окислением промежуточных соединений XXXIII, в которых J обозначает S. Конечные продукты, имеющие общую Формулу XXXIV, получают затем стандартным гидролизом сложного эфира.
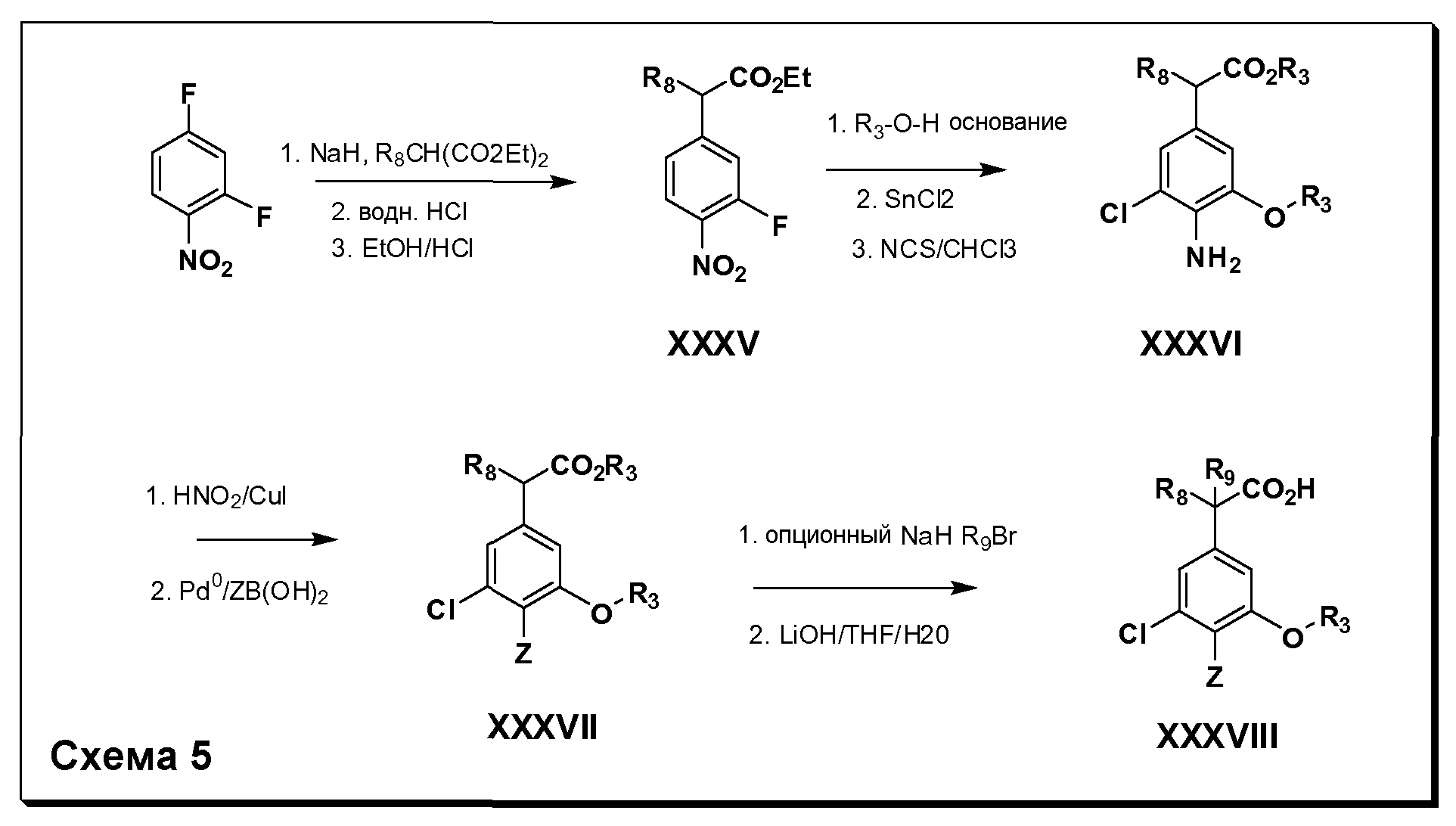
Соединения Формулы IV, в которойR1 обозначаетR8 алкил, циклоалкилалкил, гетероциклоалкилалкил, алкоксиалкил, гетероарилалкил или арилалкил,R2 обозначаетR9 водород, алкил, циклоалкилалкил, гетероциклоалкилалкил, алкоксиалкил, гетероарилалкил; X обозначает O;R5 обозначает Cl;R3 и Z имеют значения, определенные выше, и таким образом имеющие общую Формулу XXXVIII, могут в целом быть получены, как изображено на Схеме 5. Соответственно, 4-фтор в 2,4-дифторнитробензоле селективно вытесняется реакцией с 2-замещенным диэтилмалонатомR8CH2(CO2Et)2 в основных условиях (например, NaH/DMF) с последующим гидролизом и этерификацией с получением промежуточного соединения XXXV. Затем 2-галоген подвергают реакции нуклеофильного ароматического замещения обработкой соединением R3-O-H в основных условиях (например, NaH/DMF) с последующим восстановлением и реакцией хлорирования (например, с использованием N-хлорсукцинимида), с получением промежуточных хлоранилиновых соединений общей формулы XXXVI. Реакция йодирования по Sandmeyer с последующим сочетанием по Suzuki приводит затем к промежуточным соединениям общей формулы XXXVII. Введение группыR9 можно осуществить, используя условия алкилирования, описанные выше. Конечные продукты, имеющие общую Формулу XXXVIII, получают затем стандартным гидролизом сложного эфира.
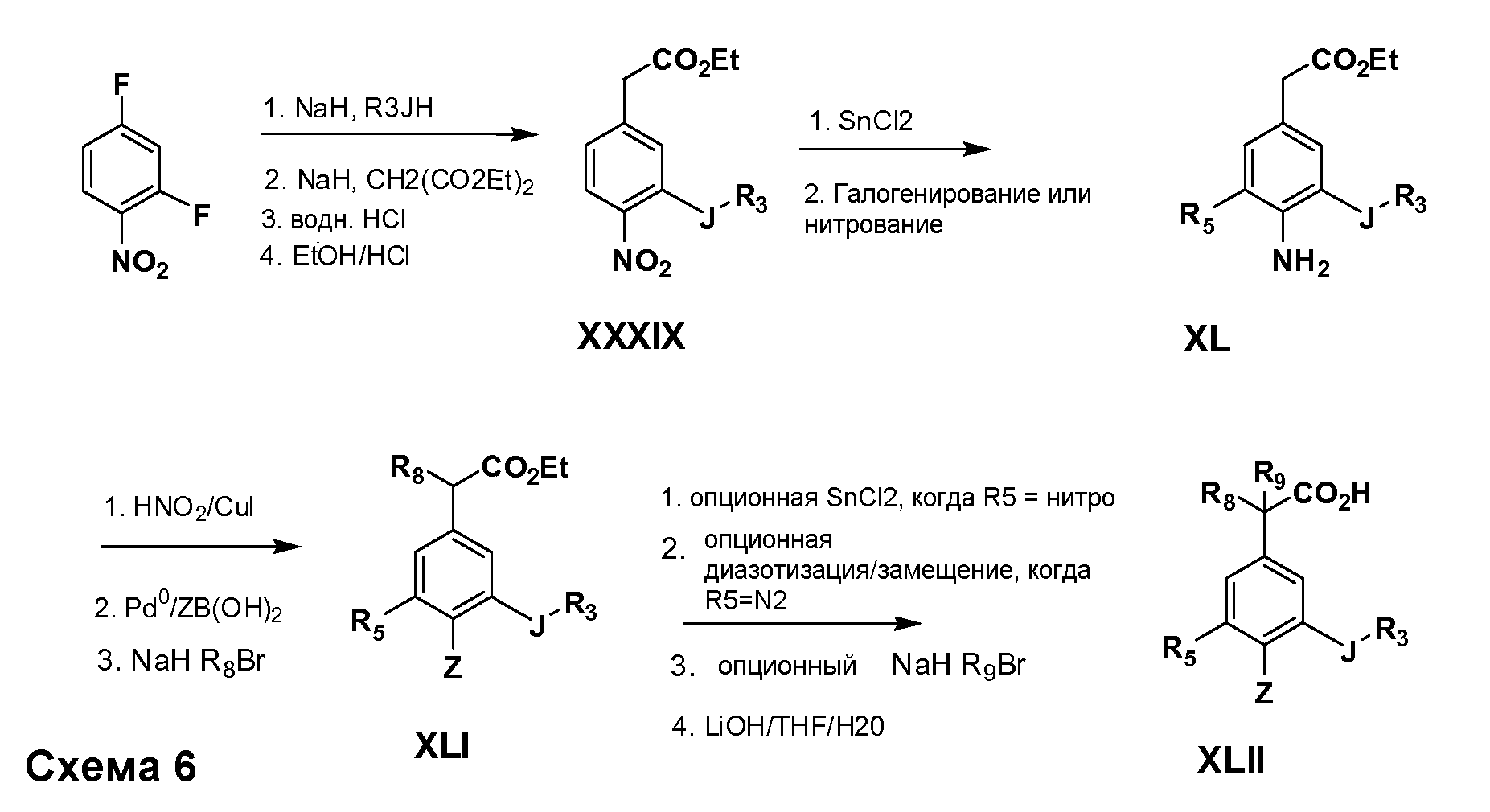
Соединения Формулы IV, в которойR1 обозначаетR8 алкил, циклоалкилалкил, гетероциклоалкилалкил, алкоксиалкил, гетероарилалкил или арилалкил,R2 обозначаетR9 водород, алкил, циклоалкилалкил, гетероциклоалкилалкил, алкоксиалкил, гетероарилалкил; X обозначает J = O, S;R5 обозначаетNO2,NH2, CN,SR6, SO2R6, SO2N(R7)2, F, Cl, Br;R3 и Z имеют значения, определенные выше, и таким образом имеющие общую Формулу XLII, могут быть получены в целом, как изображено на Схеме 6. Соответственно, 2-фтор в 2,4-дифторнитробензоле селективно вытесняется реакцией со спиртом или тиолом формулыR3-J-H в основных условиях (например, NaH/DMF). 4-Фтор полученного продукта замещают диэтилмалонатом в основных условиях (например, NaH/DMF) с последующим гидролизом и этерификацией, получая промежуточные соединения Формулы XXXIX. Восстановление нитрогруппы XXXIX с последующим нитрованием полученного анилина дает промежуточные нитроанилиновые соединения Формулы XL. Реакция йодирования по Sandmeyer с последующим сочетанием по Suzuki, и наконец, реакция алкилирования для введенияR8 дает промежуточные соединения общей Формулы XLI. Нитрогруппа XLI может быть в случае необходимости восстановлена с использованием любого числа стандартных условий восстановления (например,SnCl2) до анилина, который может, в свою очередь, быть преобразован в различные другие группыR5 либо непосредственно, либо в рамках многостадийных процедур. Таким образом, в случае, гдеR5 обозначает F, Cl, Br, CN, OH, C1-C4 алкокси или SR6, диазотирование анилина сопровождается прямым “in situ” преобразованием вR5 с использованием подходящей соли меди, то есть CuCl, CuBr, CuCN, или нуклеофила, то есть воды, спирта или тиола. Промежуточные соединения, гдеR5 обозначает S(O)2R6, могут быть получены последующей стадией окисления (например, с использованием MCPBA) указанных продуктов сочетания тиола, в которыхR5 обозначает SR6. Промежуточные соединения, гдеR5 обозначает, например, гетероарил, C2-C4 алкинил или циклопропил, могут быть получены последующим сочетанием по Suzuki указанных продуктов, гдеR5 обозначает Br или I. Промежуточные соединения, гдеR5 обозначает CF3, могут быть получены реакцией Burton указанных продуктов, в которыхR5 обозначает I. Промежуточные соединения, гдеR5 обозначает S(O)2N(R7)2, могут быть получены последующей реакцией указанных прямых сульфонилхлоридных продуктов (полученных с использованием условийCuCl/SO2) с амином HN(R7)2. Конечные продукты, имеющие общую Формулу XLII, получают затем дополнительной реакцией алкилирования для введенияR9 с последующим стандартным гидролизом сложного эфира.
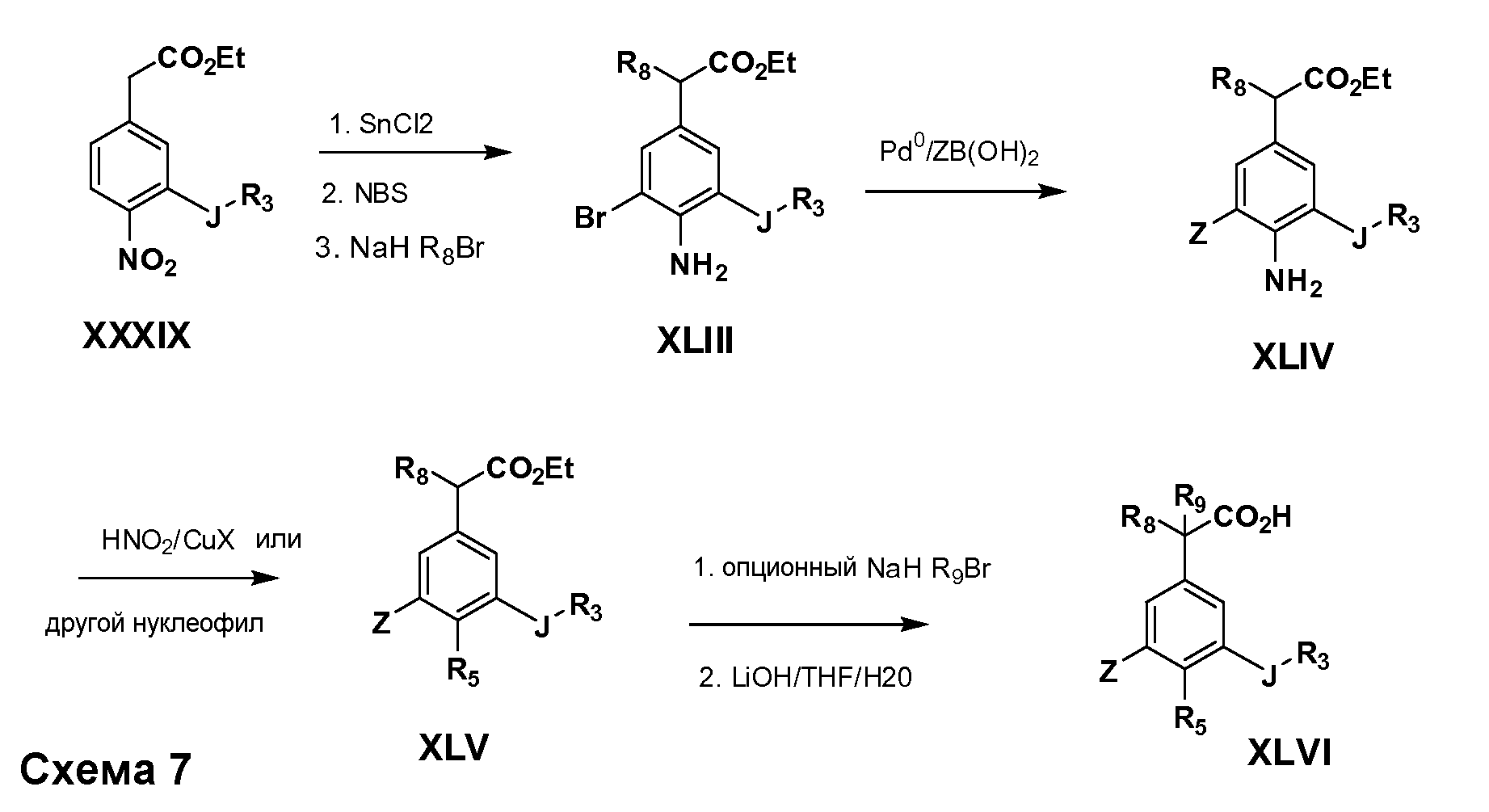
Соединения Формулы VII, в которойR1 обозначаетR8 алкил, циклоалкилалкил, гетероциклоалкилалкил, алкоксиалкил, гетероарилалкил или арилалкил,R2 обозначаетR9 водород, алкил, циклоалкилалкил, гетероциклоалкилалкил, алкоксиалкил, гетероарилалкил; X обозначает J = O, S;R5 обозначаетNO2,NH2, CN,SR6, SO2R6, SO2N(R7)2, F, Cl, Br;R3 и Z имеют значения, определенные выше, и таким образом имеющие общую Формулу XLV, могут быть получены в целом, как изображено на Схеме 7. Восстановление нитрогруппы XXXIX с последующим бромированием (например, с использованием NBS) полученного анилина и полученного l реакцией алкилирования для введенияR9 дает промежуточные соединения броманилина Формулы XLIII. Реакция сочетания по Suzuki с заменой Br группами Z приводит к промежуточным соединениям общей Формулы XLIV. Анилиновая группа в промежуточных соединениях Формулы XLIV может, в свою очередь, в случае необходимости быть преобразована в различные другие группыR5 либо непосредственно, либо в рамках многостадийных процедур. Таким образом, в случае, гдеR5 обозначает F, Cl, Br, CN, OH, C1-C4 алкокси илиSR6, диазотирование анилина сопровождается прямым “in situ” преобразованием вR5с использованием подходящей соли меди, то есть,CuCl, CuBr, CuCN, или нуклеофила, то есть воды, спирта или тиола. Промежуточные соединения, гдеR5 обозначает S(O)2R6, могут быть получены последующей стадией окисления (например, с использованием MCPBA) указанных продуктов сочетания тиола, в которых R5 обозначаетSR6. Промежуточные соединения, гдеR5 обозначает, например, гетероарил, C2-C4 алкинил или циклопропил, могут быть получены последующим сочетанием по Suzuki указанных продуктов, в которыхR5 обозначает Br или I. Промежуточные соединения, гдеR5 обозначает CF3, могут быть получены реакцией Burton указанных продуктов, в которыхR5 обозначает I. Промежуточные соединения, гдеR5 обозначает S(O)2N(R7)2, могут быть получены последующей реакцией указанных прямых сульфонилхлоридных продуктов (полученных с использованием условийCuCl/SO2) с амином HN(R7)2. Конечные продукты, имеющие общую Формулу XLII, получают затем дополнительной реакцией алкилирования для введенияR9 с последующим стандартным гидролизом сложного эфира.
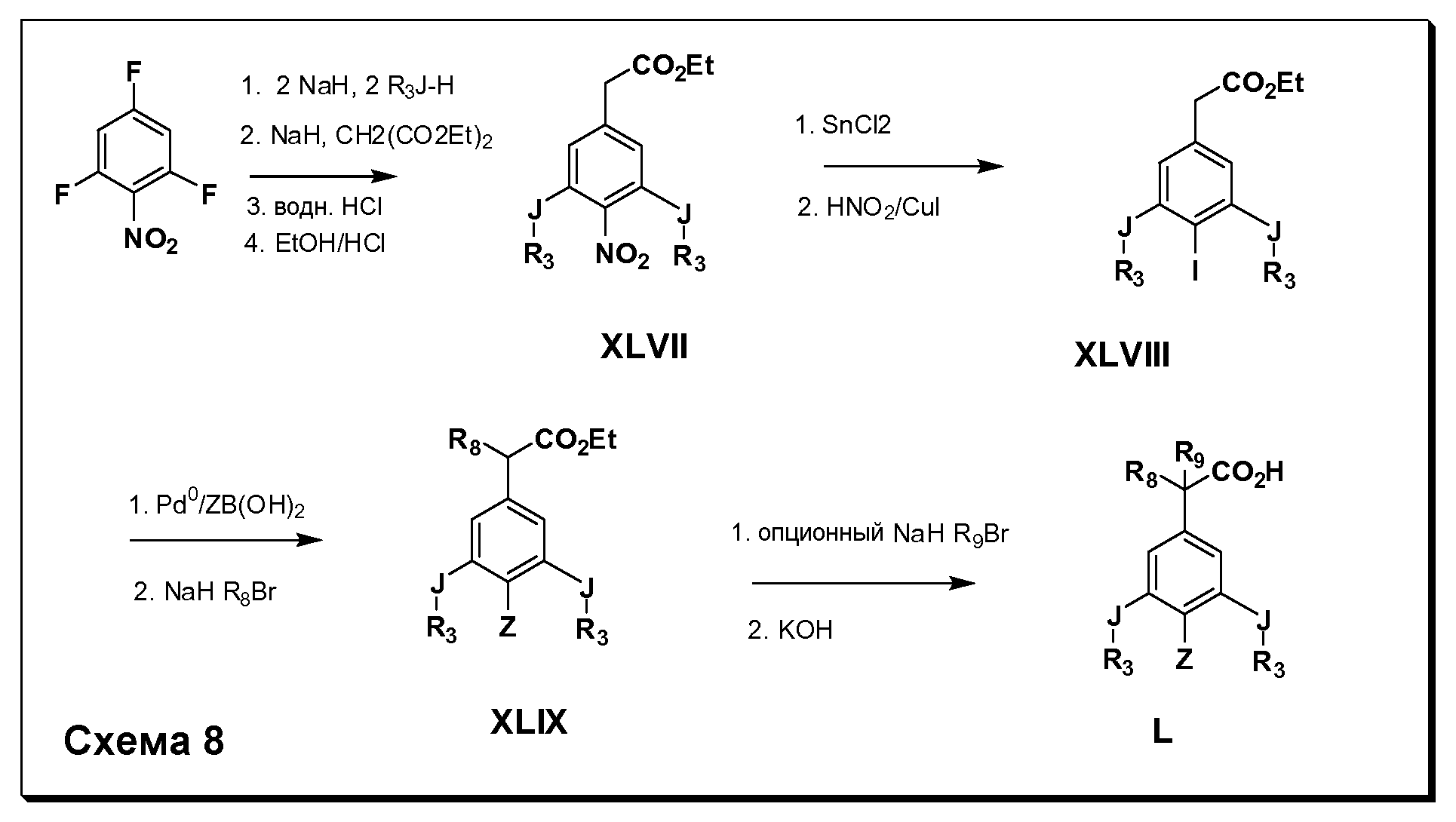
Соединения Формулы IV, в которойR1 обозначаетR8 алкил, циклоалкилалкил, гетероциклоалкилалкил, алкоксиалкил, гетероарилалкил или арилалкил,R2 обозначаетR9 водород, алкил, циклоалкилалкил, гетероциклоалкилалкил, алкоксиалкил, гетероарилалкил;X-R3 иR5 являются одинаковыми (J-R3 в Схеме 8) и обозначают либо C1-C4 алкокси, либоSR6; и Z имеет значения, определенные выше, и таким образом имеющие общую Формулу L, могут быть получены в целом, как изображено на Схеме 8. Соответственно, 2- и 6-фтор в 2,4,6-трифторнитробензоле селективно вытесняются реакцией со спиртом или тиолом формулыR3-J-H в основных условиях (например, NaH/DMF). 4-Фтор полученного продукта замещают диэтилмалонатом в основных условиях (например, NaH/DMF) с последующим гидролизом и этерификацией с получением промежуточных соединений Формулы XLVIII. Восстановление нитрогруппы с последующей реакцией йодирования по Sandmeyer полученного анилина дает промежуточные соединения Формулы XLVIII. Сочетание по Suzuki с последующей реакцией алкилирования для введенияR8 дает промежуточные соединения общей Формулы XLIX. Конечные продукты, имеющие общую Формулу L, получают затем дополнительной реакцией алкилирования для введенияR9 с последующим стандартным гидролизом сложного эфира.
Энантиоселективные способы
Схема 9
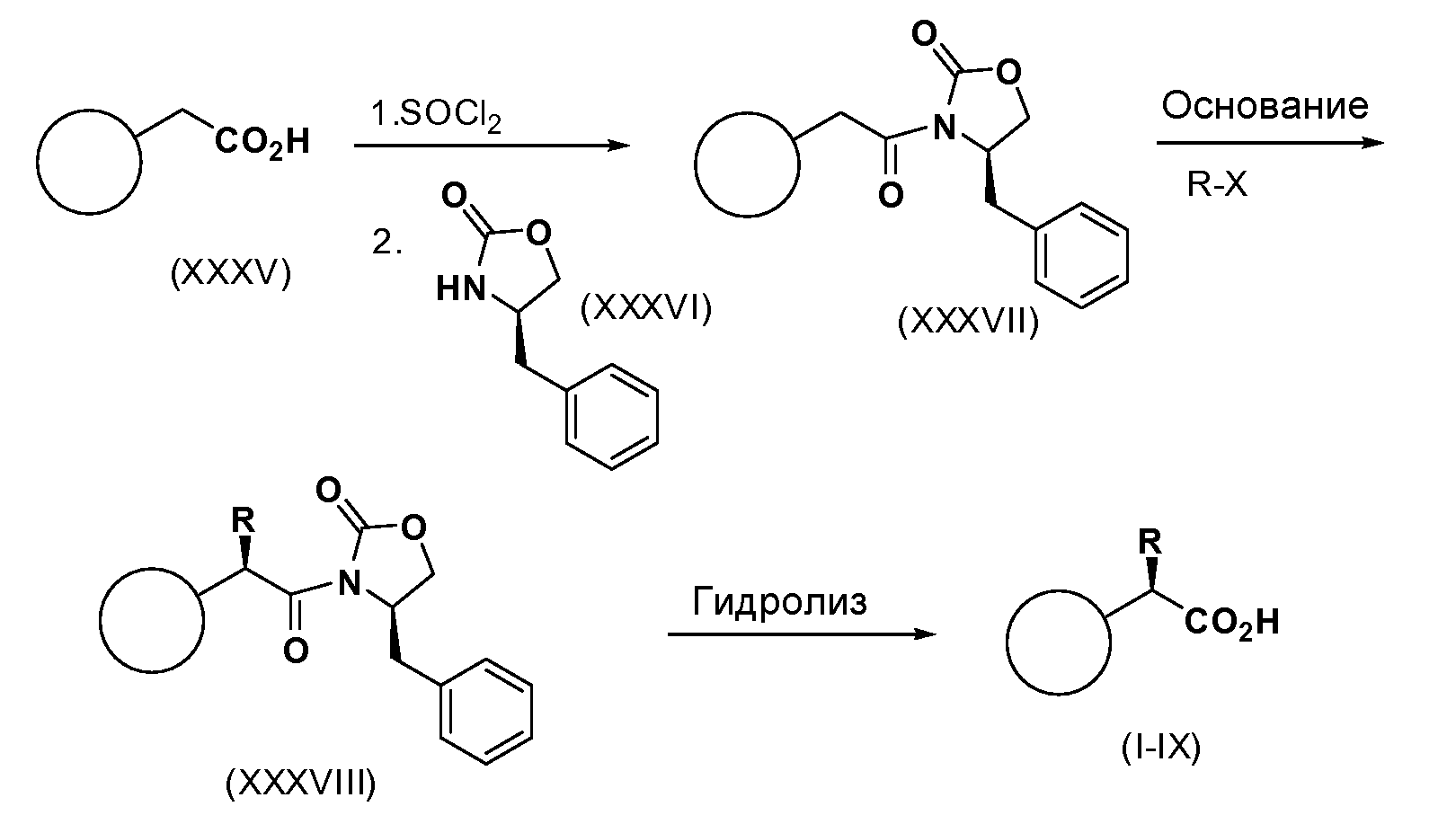
Соединения формул, I-IX могут быть получены энантиоселективно, это может быть осуществлено разделениемс помощью хиральной ВЭЖХ (CHIRALPAK-AD H (250x4,6 мм, 5 мкм). Мобильная фаза: гексан (0,1%TFA):IPA (93:7), объемная скорость потока 0,8 мл/мин., разбавитель гексан:IPA (90:10); температура колонки 40°C) илиасимметричного синтеза. Фенилуксусные кислоты формулы (XXXV) превращают в соответствующие хлорангидриды кислоты путем обработки с использованиемSOCl2 или оксалилхлорида с каталитическим количеством DMF. Реакцию проводят в инертном растворителе, таком какCH2Cl2, CHCl3, THF или толуол, при температуре 0-80°C. Хлорангидрид кислоты обрабатывают либо (R)-, либо (S)-4-бензилоксазолидин-2-оном (R-изомер изображен как XXXXVI), получая оксазолидинон (XXXVII). Оксазолидинон затем обрабатывают основанием, таким как NaHMDS, LiHMDS, KHMDS, BuLi или KOtBu, в инертном растворителе, таком как THF, Ме-THF илиEt2O, при температуре от -78 до 0°C. Полученный енолат затем обрабатывают подходящим электрофилом, получая алкилированный оксазолидинон (XXXVIII). Хиральные вспомогательные соединения затем удаляют в таких условиях, какLiOH/H2O2 с последующей восстановительной обработкой таким реагентом, как бисульфит натрия, получая желаемые продукты формул (I-IX).
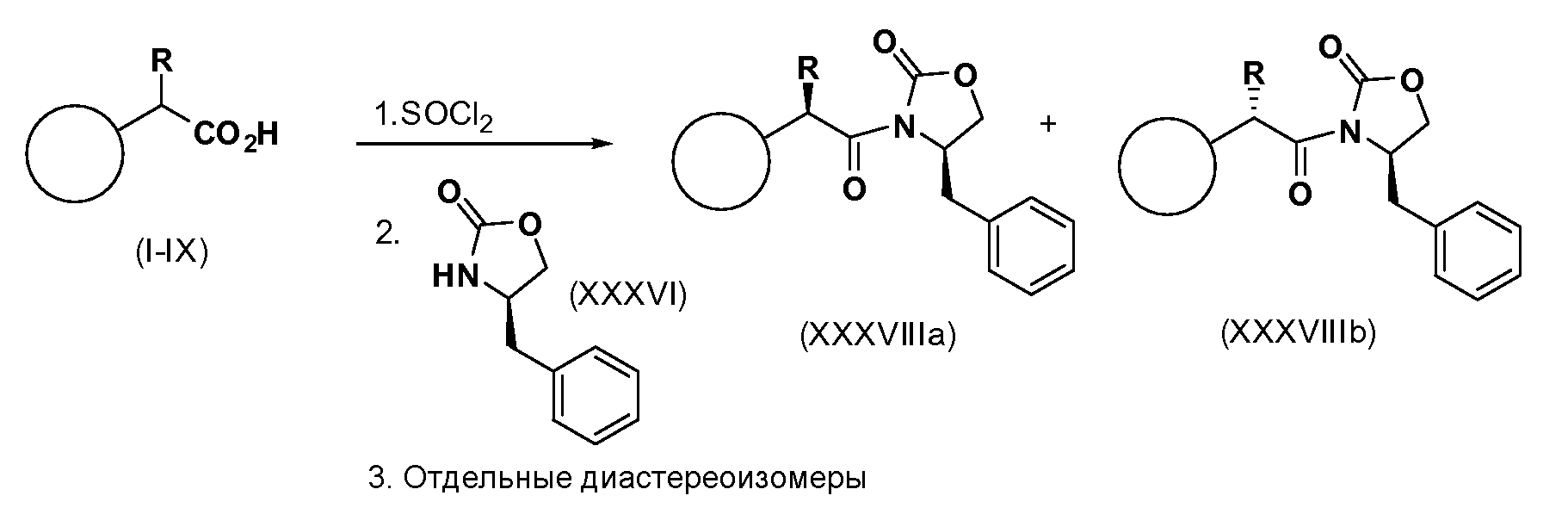
Альтернативно рацемическое соединение формул (1-IX) может быть подвергнуто сочетанию с хиральным оксазолидиноном Эвансачерез промежуточное соединение, такое как соответствующий хлорангидрид кислоты. После завершения сочетания реакция дает смесь диастереоизомеров, которые могут быть разделены такими способами, как флэш-хроматография или кристаллизация, с получением отдельных диастереоизомеров или смесей, обогащенных одним диастереоизомером по отношению к другому (см. схему 10). Вспомогательные соединения могут быть удалены, как описано выше.
Схема 10
Примеры энантиомеров включают, но не ограничены ими, следующие соединения;
(R)-2-(3-(бензо[c][1,2,5]оксадиазол-5-ил)-4-(2,2,2-трифторэтокси)-5-(трифторметил)фенил)-3-циклопропилпропановая кислота
(S)-2-(3-(бензо[c][1,2,5]оксадиазол-5-ил)-4-(2,2,2-трифторэтокси)-5-(трифторметил)фенил)-3-циклопропилпропановая кислота
(R)-2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-2-циклопентилуксусная кислота
(R)-2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-циклобутилпропановая кислота
(R)-2-(6-хлор-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилпропановая кислота
(S)-2-(6-хлор-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилпропановая кислота
(R)-4-метил-2-(5-(2,2,2-трифторэтокси)-4',6-бис(трифторметил)бифенил-3-ил)пентановая кислота
(S)-4-метил-2-(5-(2,2,2-трифторэтокси)-4',6-бис(трифторметил)бифенил-3-ил)пентановая кислота
(R)-2-(3-(бензо[c][1,2,5]оксадиазол-5-ил)-4-(2,2,2-трифторэтокси)-5-(трифторметил)фенил)-4-метилпентановая кислота
(S)-2-(3-(бензо[c][1,2,5]оксадиазол-5-ил)-4-(2,2,2-трифторэтокси)-5-(трифторметил)фенил)-4-метилпентановая кислота
(R)-4-метил-2-(6-(2,2,2-трифторэтокси)-4',5-бис(трифторметил)бифенил-3-ил)пентановая кислота
(S)-4-метил-2-(6-(2,2,2-трифторэтокси)-4',5-бис(трифторметил)бифенил-3-ил)пентановая кислота
(R)-3-циклопропил-2-(6-(2,2,2-трифторэтокси)-4',5-бис(трифторметил)бифенил-3-ил)пропановая кислота
(S)-3-циклопропил-2-(6-(2,2,2-трифторэтокси)-4',5-бис(трифторметил)бифенил-3-ил)пропановая кислота
(R)-3-циклопропил-2-(5-(2,2,2-трифторэтокси)-4',6-бис(трифторметил)бифенил-3-ил)пропановая кислота
(S)-3-циклопропил-2-(5-(2,2,2-трифторэтокси)-4',6-бис(трифторметил)бифенил-3-ил)пропановая кислота
(R)-2-(3-(бензо[c][1,2,5]оксадиазол-5-ил)-5-(2,2,2-трифторэтокси)-4-(трифторметил)фенил)-3-циклопропилпропановая кислота
(S)-2-(3-(бензо[c][1,2,5]оксадиазол-5-ил)-5-(2,2,2-трифторэтокси)-4-(трифторметил)фенил)-3-циклопропилпропановая кислота
(R)-2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилпропановая кислота
(S)-2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилпропановая кислота
(R)-2-(3-(бензо[c][1,2,5]оксадиазол-5-ил)-5-(2,2,2-трифторэтокси)-4-(трифторметил)фенил)-4-метилпентановая кислота
(S)-2-(3-(бензо[c][1,2,5]оксадиазол-5-ил)-5-(2,2,2-трифторэтокси)-4-(трифторметил)фенил)-4-метилпентановая кислота
(R)-2-(2-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-4-ил)-3-циклопропилпропановая кислота
(S)-2-(2-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-4-ил)-3-циклопропилпропановая кислота
(R)-3-циклопропил-2-(2-(2,2,2-трифторэтокси)-4',6-бис(трифторметил)бифенил-4-ил)пропановая кислота
(S)-3-циклопропил-2-(2-(2,2,2-трифторэтокси)-4',6-бис(трифторметил)бифенил-4-ил)пропановая кислота
(R)-2-(4-(бензо[c][1,2,5]оксадиазол-5-ил)-3-(2,2,2-трифторэтокси)-5-(трифторметил)фенил)-3-циклопропилпропановая кислота
(S)-2-(4-(бензо[c][1,2,5]оксадиазол-5-ил)-3-(2,2,2-трифторэтокси)-5-(трифторметил)фенил)-3-циклопропилпропановая кислота
(R)-2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-4-метилпентановая кислота
(S)-2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-4-метилпентановая кислота
(R)-2-(4-(бензо[c][1,2,5]оксадиазол-5-ил)-3-(2,2,2-трифторэтокси)-5-(трифторметил)фенил)-4-метилпентановая кислота
(S)-2-(4-(бензо[c][1,2,5]оксадиазол-5-ил)-3-(2,2,2-трифторэтокси)-5-(трифторметил)фенил)-4-метилпентановая кислота
(S)-2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-2-циклопентилуксусная кислота
(S)-2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-циклобутилпропановая кислота
(R)-2-(5-хлор-4'-(метилтио)-6-(2,2,2-трифторэтокси)бифенил-3-ил)-2-циклопентилуксусная кислота
(S)-2-(5-хлор-4'-(метилтио)-6-(2,2,2-трифторэтокси)бифенил-3-ил)-2-циклопентилуксусная кислота
(R)-2-(5-хлор-4'-(метилтио)-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклобутилпропановая кислота
(S)-2-(5-хлор-4'-(метилтио)-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклобутилпропановая кислота
(R)-2-(5-хлор-4'-(метилтио)-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилпропановая кислота
(S)-2-(5-хлор-4'-(метилтио)-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилпропановая кислота
(R)-2-(5-хлор-4'-(метилтио)-6-(2,2,2-трифторэтокси)бифенил-3-ил)-4-метилпентановая кислота
(S)-2-(5-хлор-4'-(метилтио)-6-(2,2,2-трифторэтокси)бифенил-3-ил)-4-метилпентановая кислота
(R)-2-(5-хлор-4'-изопропил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-2-циклопентилуксусная кислота
(S)-2-(5-хлор-4'-изопропил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-2-циклопентилуксусная кислота
(R)-2-(2-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-4-ил)-4-метилпентановая кислота
(S)-2-(2-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-4-ил)-4-метилпентановая кислота
(R)-2-(5-хлор-4'-изопропил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклобутилпропановая кислота
(S)-2-(5-хлор-4'-изопропил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклобутилпропановая кислота
(R)-2-(5-хлор-4'-изопропил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилпропановая кислота
(S)-2-(5-хлор-4'-изопропил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилпропановая кислота
(R)-2-(5-хлор-4'-изопропил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-4-метилпентановая кислота
(S)-2-(5-хлор-4'-изопропил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-4-метилпентановая кислота
(R)-2-(3-(бензо[c][1,2,5]тиадиазол-5-ил)-4-(2,2,2-трифторэтокси)-5-(трифторметил)фенил)-3-циклопропилпропановая кислота
(S)-2-(3-(бензо[c][1,2,5]тиадиазол-5-ил)-4-(2,2,2-трифторэтокси)-5-(трифторметил)фенил)-3-циклопропилпропановая кислота
(R)-2-(3-(бензо[c][1,2,5]тиадиазол-5-ил)-4-(2,2,2-трифторэтокси)-5-(трифторметил)фенил)-4-метилпентановая кислота
(S)-2-(3-(бензо[c][1,2,5]тиадиазол-5-ил)-4-(2,2,2-трифторэтокси)-5-(трифторметил)фенил)-4-метилпентановая кислота
(R)-2-(6-хлор-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-4-метилпентановая кислота
(S)-2-(6-хлор-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-4-метилпентановая кислота
(R)-2-(3-(бензо[c][1,2,5]тиадиазол-5-ил)-5-(2,2,2-трифторэтокси)-4-(трифторметил)фенил)-3-циклопропилпропановая кислота
(S)-2-(3-(бензо[c][1,2,5]тиадиазол-5-ил)-5-(2,2,2-трифторэтокси)-4-(трифторметил)фенил)-3-циклопропилпропановая кислота
(R)-2-(3-(бензо[c][1,2,5]тиадиазол-5-ил)-5-(2,2,2-трифторэтокси)-4-(трифторметил)фенил)-4-метилпентановая кислота
(S)-2-(3-(бензо[c][1,2,5]тиадиазол-5-ил)-5-(2,2,2-трифторэтокси)-4-(трифторметил)фенил)-4-метилпентановая кислота
(R)-2-(4-(бензо[c][1,2,5]тиадиазол-5-ил)-3-(2,2,2-трифторэтокси)-5-(трифторметил)фенил)-3-циклопропилпропановая кислота
(S)-2-(4-(бензо[c][1,2,5]тиадиазол-5-ил)-3-(2,2,2-трифторэтокси)-5-(трифторметил)фенил)-3-циклопропилпропановая кислота
(R)-2-(4-(бензо[c][1,2,5]тиадиазол-5-ил)-3-(2,2,2-трифторэтокси)-5-(трифторметил)фенил)-4-метилпентановая кислота
(S)-2-(4-(бензо[c][1,2,5]тиадиазол-5-ил)-3-(2,2,2-трифторэтокси)-5-(трифторметил)фенил)-4-метилпентановая кислота
(R)-4-метил-2-(2-(2,2,2-трифторэтокси)-4',6-бис(трифторметил)бифенил-4-ил)пентановая кислота
(S)-4-метил-2-(2-(2,2,2-трифторэтокси)-4',6-бис(трифторметил)бифенил-4-ил)пентановая кислота
В следующем аспекте соединения по изобретению раскрыты с помощью различных примеров, перечисленных в таблицах, приведенных ниже.
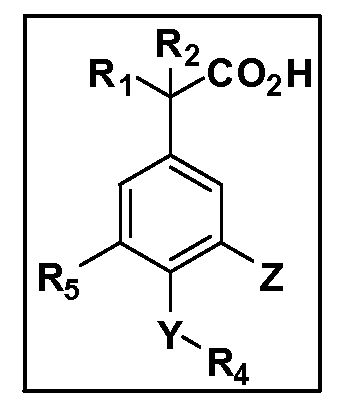
Формула III
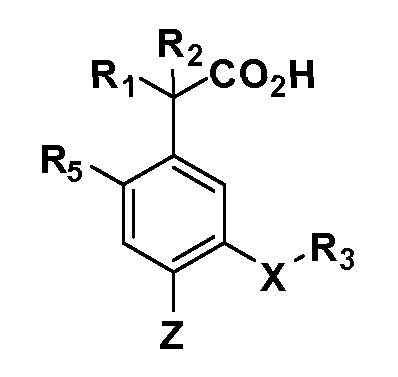
Формула V
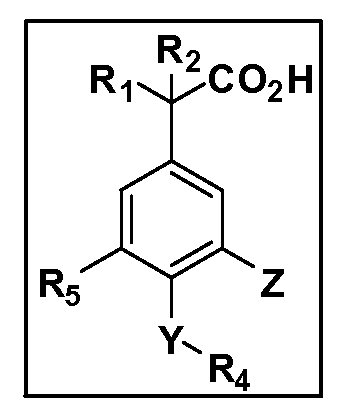
Формула III
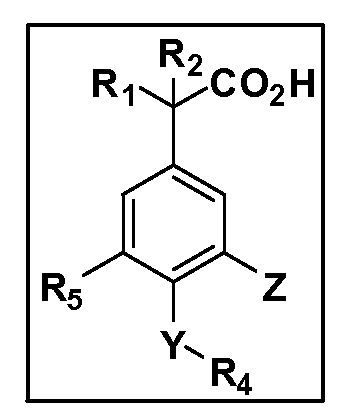
Формула III
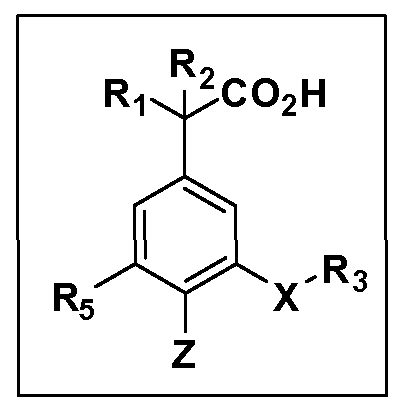
Формула IV
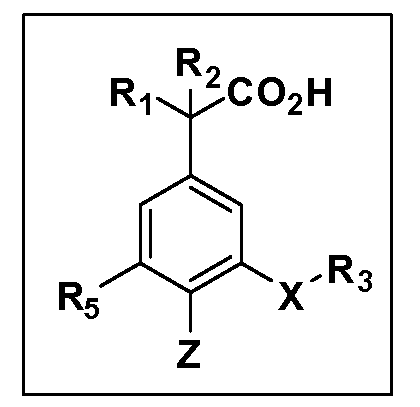
Формула IV
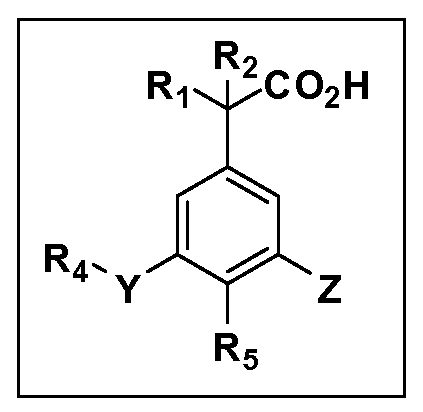
Формула VII
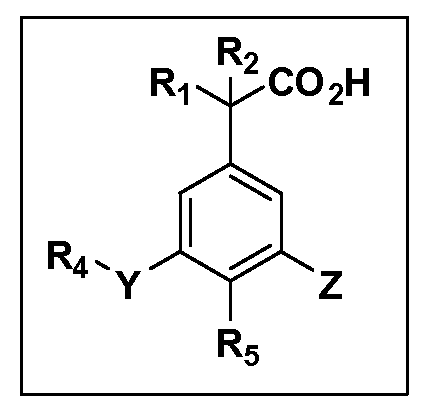
Формула VII
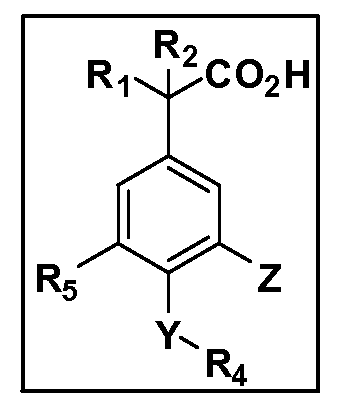
Формула III
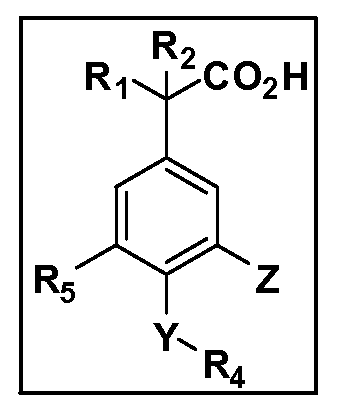
Формула III
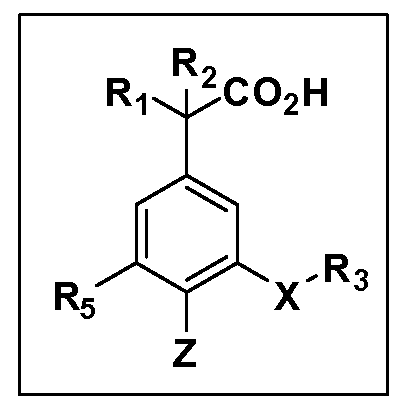
Формула IV
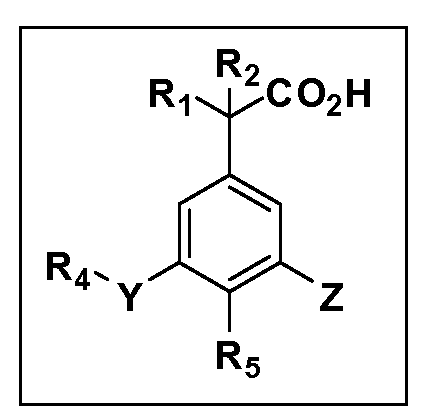
Формула VII
Экспериментальные процедуры:
Пример 534: 2-(6-циклопропилметокси)-5-нитро-4'-(трифторметил)бифенил-3-ил)-4-метилпентановая кислота
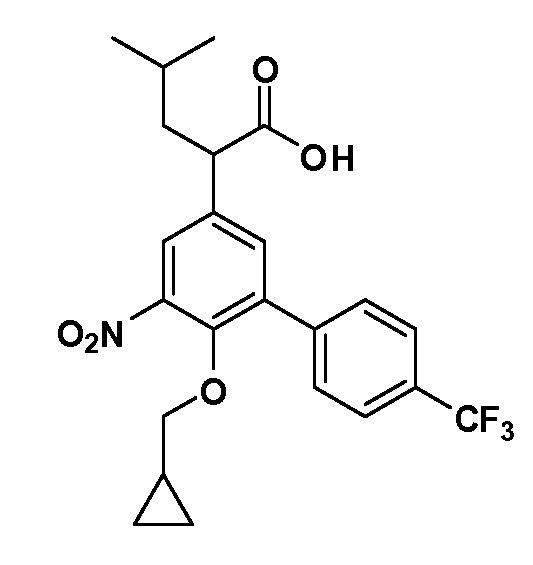
Стадия 1:
2-(3-бром-4-гидроксифенил)-4-метилпентаноат
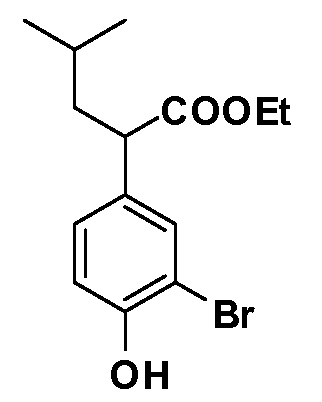
К перемешиваемому раствору 2-(4-гидроксифенил)-4-метилэтилпентаноата E-9 (15 г, 63,55 ммоль) в 100 мл ледяной уксусной кислоты при 0°C медленно добавляли бром (20,26 г, 64,14 моль) и перемешивали при той же самой температуре в течение 2,5 часов. После завершения реакции реакционную смесь лили в воду и нейтрализовали насыщенным раствором карбоната натрия и экстрагировали этилацетатом (300 мл × 3). Органический слой промывали водой, насыщенным раствором бикарбоната натрия и солевым раствором. Органический слой затем отгоняли, получая продукт 2-(3-бром-4-гидроксифенил)-4-метилэтилпентаноат. Выход: (16 г, 80%).1H ЯМР(CDCl3): δ 7,20 (м, 2H), 6,80 (д,J=7,9 Гц, 1H), 4,90 (ушир.с, 1H), 4,15 (кв., 2H), 3,60 (т, 1H), 1,95-2,00 (м, 1H), 1,75-1,80 (м, 1H), 1,45-1,50 (м, 1H), 1,20 (т, 3H), 1,00 (м, 6H). Масс-спектр: (315, M+1, 100%).
Стадия 2:
2-(3-бром-4-гидрокси-5-нитрофенил)-4-метилпентановая кислота
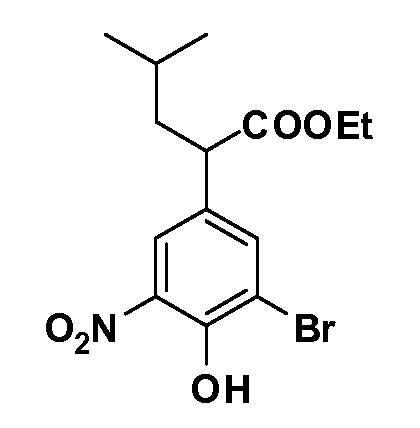
2-(3-бром-4-гидроксифенил)-4-метилэтилпентаноат (16 г) помещали в уксусную кислоту (100 мл) и добавляли по каплям 70%-ую азотную кислоту (10 мл) при температуре ниже 15°C. Реакционную смесь перемешивали в течение 2 часов. После завершения реакции смесь лили в 300 мл воды со льдом и экстрагировали этилацетатом (300 мл × 3). Этилацетатный слой промывали раствором бикарбоната, водой и наконец концентрированным солевым раствором. Органический слой затем отгоняли, и сырой остаток очищали хроматографией на колонках, используя этилацетат:гексан (2:3) в качестве элюента, получая 12 г 2-(3-бром-4-гидрокси-5-нитрофенил)-4-метилпентановой кислоты. Кислоту помещали в 50 мл абсолютного этанола и 2 мл концентрированной серной кислоты и нагревали с обратным холодильником в течение 1 часа. Этанольный слой отгоняли, промывали водой и высушивали, получая 13 г 2-(3-бром-4-гидрокси-5-нитрофенил)-4-метилэтилпентаноата как промежуточное соединение.1H ЯМР(CDCl3): δ 8,20 (s 1H), 7,20 (с, 1H), 4,90 (ушир.с, 1H), 4,15 (кв., 2H), 3,60 (т, 1H), 1,95-2,00 (м, 1H), 1,75-1,80 (м, 1H), 1,45-1,50 (м, 1H), 1,20 (т, 3H), 1,00 (м, 6H). Масс-спектр: (360, M+1, 100%).
Стадия 3
2-(3-бром-4-(циклопропилметокси)-5-нитрофенил)-4-метилэтилпентаноат
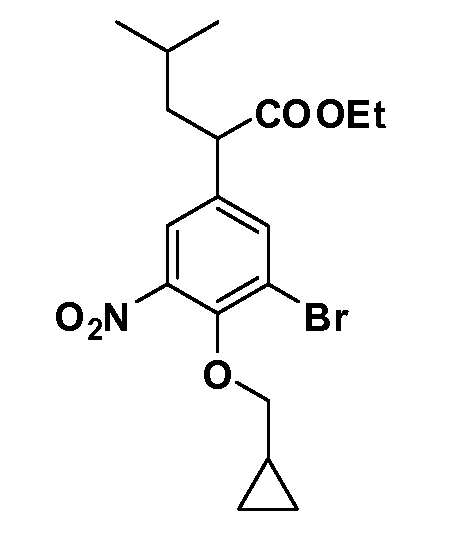
Раствор 2-(3-бром-4-гидрокси-5-нитрофенил)-4-метилэтилпентаноата (4,1 г, 11,26 ммоль) помещали в 50 мл ДМСО и добавляли Cs2CO3 (3,02 г, 12,39 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 15 минут и затем по каплям добавляли циклопропилметил бромид (1,67 г, 12,39 ммоль). После завершения добавления реакционную смесь перемешивали при 70°C в течение 4 ч. После завершения реакции смесь лили в воду (200 мл) и экстрагировали этилацетатом (100 мл × 3). Этилацетатный слой промывали 1 н. HCl, водой и, наконец, концентрированным солевым раствором. Органический слой затем отгоняли, и сырой остаток очищали хроматографией на колонках, используя этилацетат:гексан (1:3) в качестве элюента, получая 3 г 2-(3-бром-4-(циклопропилметокси)-5-нитрофенил)-4-метилэтилпентаноата.1H ЯМР(CDCl3): δ 8,20 (с, 1H), 7,20 (с, 1H), 4,15 (кв., 2H), 3,60 (т, 1H), 3,45 (д, 2H), 1,95-2,00 (м, 1H), 1,75-1,80 (м, 1H), 1,45-1,50 (м, 1H), 1,20 (т, 3H), 1,00 (м, 6H), 0,35-0,25 (м, 5H). Масс-спектр: (414, M+1, 100%).
Стадия 4
2-(6-(циклопропилметокси)-5-нитро-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноат
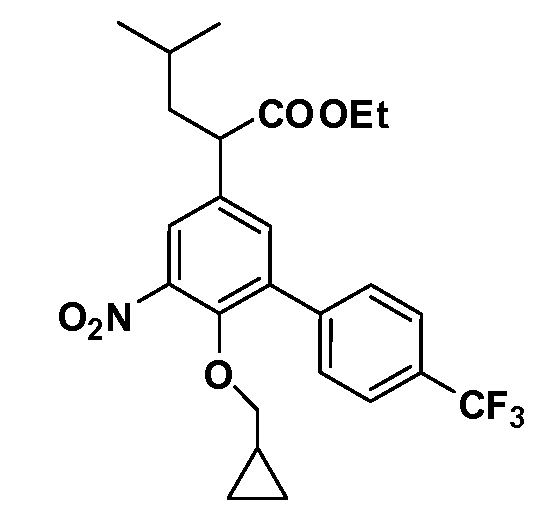
К раствору 2-(3-бром-4-(циклопропилметокси)-5-нитрофенил)-4-метилэтилпентаноата(2 г, 4,83 ммоль) в 30 мл смеси DMF/вода (25:5 мл) добавляли Pd(PPh3)4 (558 мг, 0,483 ммоль),Cs2CO3 (5,5 г, 16,9 ммоль) и 4-CF3-PhB(ОН)2 (1,01 г, 5,31 ммоль), и реакционную смесь перемешивали при 90°C в течение 12 часов. После завершения реакции смесь лили в воду (100 мл) и экстрагировали этилацетатом (100 мл × 3). Этилацетатный слой промывали 1 н. HCl, водой и, наконец, концентрированным солевым раствором. Органический слой затем отгоняли, и сырой остаток очищали хроматографией на колонках, используя этилацетат:гексан (2:3) в качестве элюента, получая 1,3 г 2-(6-(циклопропилметокси)-5-нитро-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноата.1H ЯМР(CDCl3): δ 8,20 (с, 1H), 7,40-7,20 (м, 5H), 4,15 (кв., 2H), 3,60 (т, 1H), 3,45 (д, 2H), 1,95-2,00 (м, 1H), 1,75-1,80 (м, 1H), 1,45-1,50 (м, 1H), 1,20 (т, 3H), 1,00 (м, 6H), 0,35-0,25 (м, 5H). Масс-спектр: (480, M+1, 100%).
Стадия 5
2-(6-(циклопропилметокси)-5-нитро-4'-(трифторметил)бифенил-3-ил)-4-метилпентановая кислота
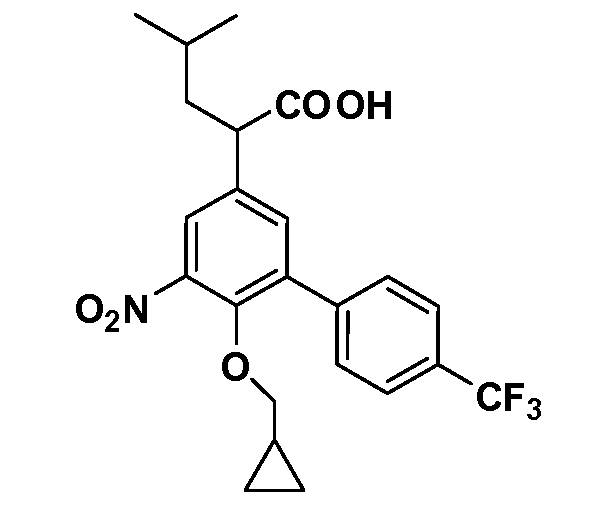
2-(6-(Циклопропилметокси)-5-нитро-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноат (100 мг, 0,208 ммоль) помещали в смесь MeOH:THF:вода (30 мл, 10:10:2) и к этому добавляли LiOH (30 мг, 0,7 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 3 часов. После завершения реакции смесь лили в воду (50 мл) и экстрагировали этилацетатом (100 мл × 2). Этилацетатный слой промывали 1 н. HCl, водой и, наконец, концентрированным солевым раствором. Органический слой затем отгоняли, и сырой остаток очищали хроматографией на колонках, используя этилацетат:гексан (1:1) в качестве элюента, получая 70 мг 2-(6-(циклопропилметокси)-5-нитро-4'-(трифторметил)бифенил-3-ил)-4-метилпентановой кислоты.1H ЯМР(CDCl3): δ 8,20 (с, 1H), 7,40-7,20 (м, 5H), 3,60 (т, 1H), 3,45 (д, 2H), 1,95-2,00 (м, 1H), 1,75-1,80 (м, 1H), 1,45-1,50 (м, 1H), 1,00 (м, 6H), 0,35-0,25 (м, 5H). Масс-спектр: (452, M+1, 100%).
Пример 554: 2-(6-циклопропилметокси)-5-амино-4'-(трифторметил)бифенил-3-ил)-4-метилпентановая кислота
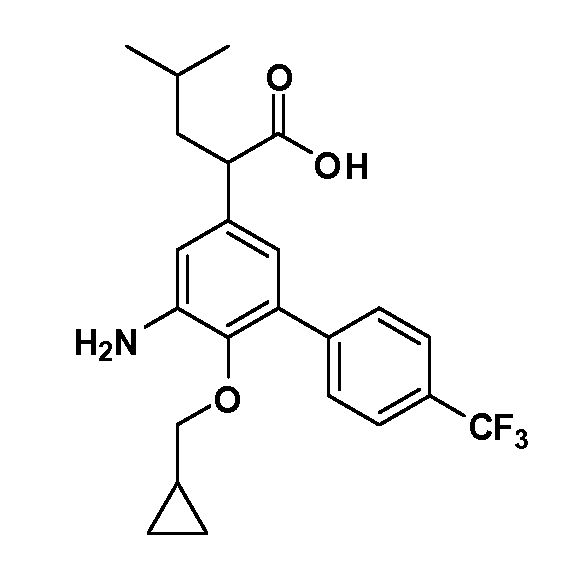
Стадия 1
2-(5-амино-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноат
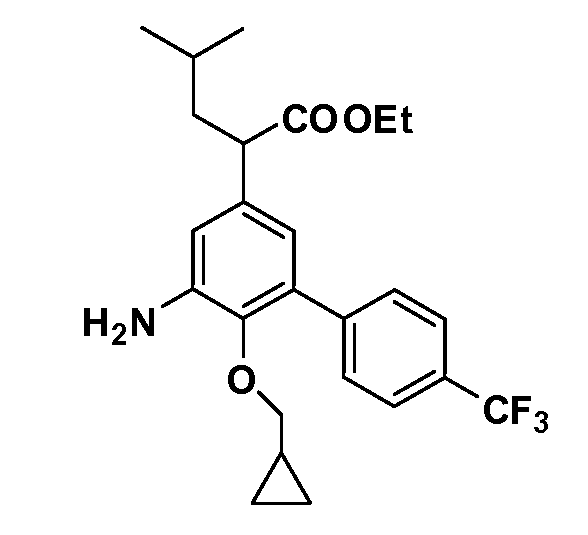
2-(6-(Циклопропилметокси)-5-нитро-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноат (300 мг, 0,626 ммоль) забирали в 30 мл смеси толуол:вода (1:1) и добавляли порошок Fe (203 мг, 3,62 ммоль), формиат аммония (228 мг, 3,62 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 3 часов и затем фильтровали через целит. Толуол отгоняли при пониженном давлении, и сырой остаток очищали хроматографией на колонках, используя этилацетат:гексан (2:3) в качестве элюента, получая 220 мг 2-(5-амино-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноата.1H ЯМР(CDCl3): δ 7,40-7,20 (м, 5H), 6,90 (с, 1H), 4,50 (ушир.с, 2H), 4,15 (кв., 2H), 3,60 (т, 1H), 3,45 (д, 2H), 1,95-2,00 (м, 1H), 1,75-1,80 (м, 1H), 1,45-1,50 (м, 1H), 1,20 (т, 3H), 1,00 (м, 6H), 0,35-0,25 (м, 5H). Масс-спектр: (450, M+1, 100%).
Стадия 3
2-(5-амино-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4-метилпентановая кислота
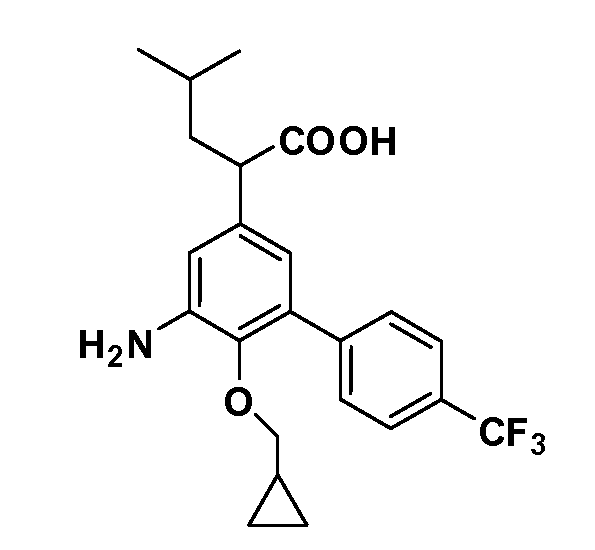
2-(5-Амино-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноат. (120 мг, 0,267 ммоль) помещали в смесь MeOH:THF:вода (30 мл, 10:10:2) и добавляли LiOH (30 мг, 0,7 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 3 часов. После завершения реакции смесь лили в воду (50 мл) и экстрагировали этилацетатом (100 мл ×2). Этилацетатный слой промывали 1 н. HCl, водой и, наконец, концентрированным солевым раствором. Органический слой затем отгоняли, и сырой остаток очищали хроматографией на колонках, используя этилацетат:гексан (1:1) в качестве элюента, получая 80 мг 2-(5-амино-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4-метилпентановой кислоты.1H ЯМР(CDCl3): δ 7,40-7,20 (м, 5H), 7,00 (с, 1H), 3,60 (т, 1H), 3,45 (д, 2H), 1,95-2,00 (м, 1H), 1,75-1,80 (м, 1H), 1,45-1,50 (м, 1H), 1,00 (м, 6H), 0,35-0,25 (м, 5H). Масс-спектр: (422, M+1, 100%).
Пример 484: 2-(6-циклопропилметокси)-5-хлор-4'-(трифторметил)бифенил-3-ил)-4-метилпентановая кислота
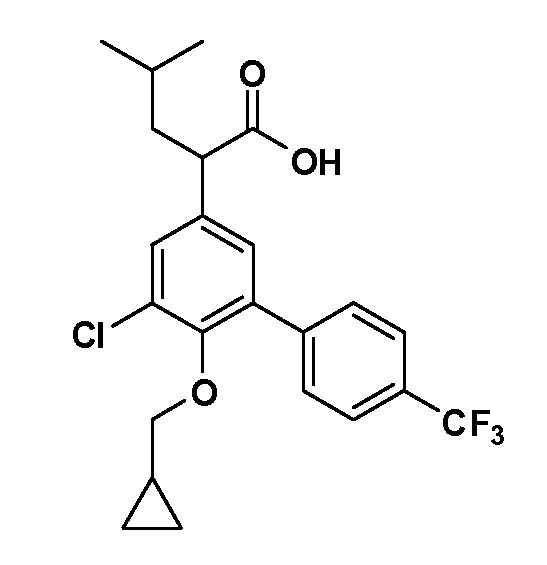
Стадия 1
2-(6-циклопропилметокси)-5-хлор-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноат
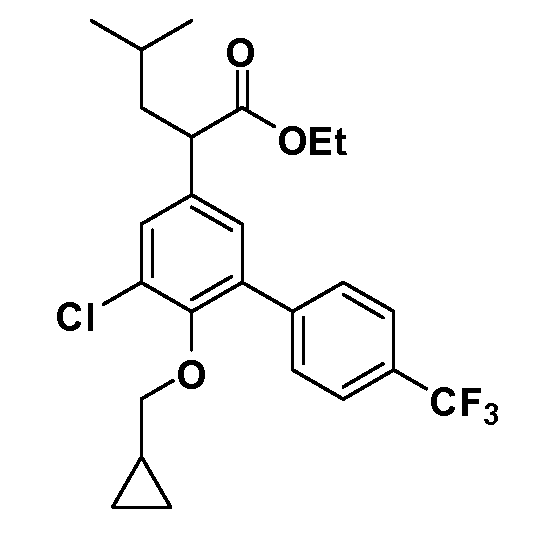
2-(6-Циклопропилметокси)-5-амино-4'-(трифторметил)бифенил-3-ил)-4-метилпентановую кислоту (150 мг, 0,33 ммоль) забирали в 10 мл 6н. HCl, и при 0°C добавляли раствор нитрита натрия (30 мг, 0,40 ммоль, 5 мл в воде). Реакционную смесь перемешивали в течение 15 минут при 0°C и затем вливали в насыщенный раствор хлорида меди(II) в воде (25 мл), реакционную смесь затем нагревали при 70°C в течение 3 часов. Смесь охлаждали до температуры окружающей среды и экстрагировали этилацетатом (2×100 мл). Объединенные органические слои высушивали(MgSO4) и концентрировали при пониженном давлении. Полученный сырой остаток очищали хроматографией на колонках, используя этилацетат:гексан (2:3) в качестве элюента, получая 120 мг 2-(6-циклопропилметокси)-5-хлор-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноата.1H ЯМР(CDCl3): δ 7,60-7,45 (м, 5H), 7,20 (с, 1H), 4,15 (кв., 2H), 3,60 (т, 1H), 3,45 (д, 2H), 1,95-2,00 (м, 1H), 1,75-1,80 (м, 1H), 1,45-1,50 (м, 1H), 1,20 (т, 3H), 1,00 (м, 6H), 0,35-0,25 (м, 5H). Масс-спектр: (470, M+1, 100%).
Стадия 2
2-(6-Циклопропилметокси)-5-хлор-4'-(трифторметил)бифенил-3-ил)-4-метилпентановая кислота
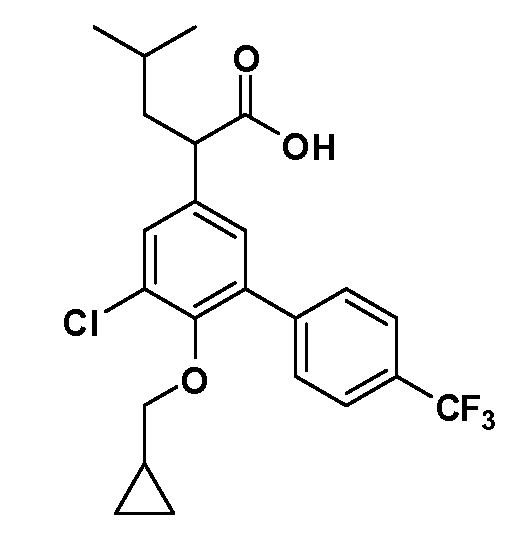
2-(6-Циклопропилметокси)-5-хлор-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноат (120 мг, 0,207 ммоль) забирали в смесь MeOH:THF:вода (30 мл, 10:10:2) и добавляли LiOH (42 мг, 0,7 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 3 часов. После завершения реакции смесь лили в воду (50 мл) и экстрагировали этилацетатом (2×100 мл). Объединенные экстракты промывали 1 н. HCl, водой и, наконец, концентрированным солевым раствором. Объединенные органические слои высушивали (MgSO4) и концентрировали при пониженном давлении. Полученный сырой остаток очищали хроматографией на колонках, используя этилацетат:гексан (1:1) в качестве элюента, получая 105 мг 2-(6-циклопропилметокси)-5-хлор-4'-(трифторметил)бифенил-3-ил)-4-метилпентановую кислоту.1H ЯМР(CDCl3): δ 7,65-7,40 (м, 5H), 7,20 (с, 1H), 3,60 (т, 1H), 3,45 (д, 2H), 1,95-2,00 (м, 1H), 1,75-1,80 (м, 1H), 1,45-1,50 (м, 1H), 1,00 (м, 6H), 0,35-0,25 (м, 5H). Масс-спектр: (442, M+1, 100%). Чистота ВЭЖХ (99%).
Пример 264: 2-(6-циклопропилметокси)-5-фтор-4'-(трифторметил)бифенил-3-ил)-4-метилпентановая кислота
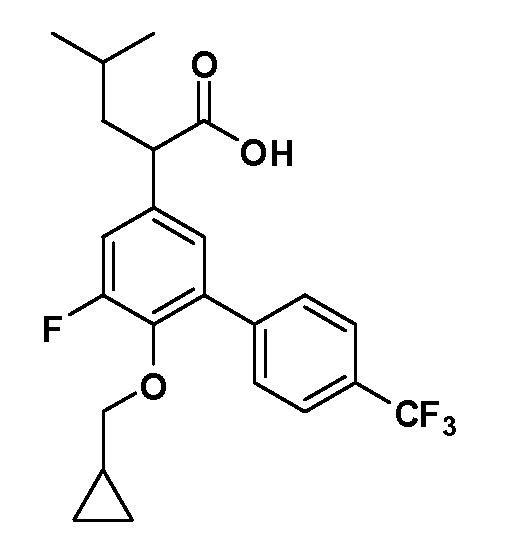
Стадия 1
2-(6-циклопропилметокси)-5-амино-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноат
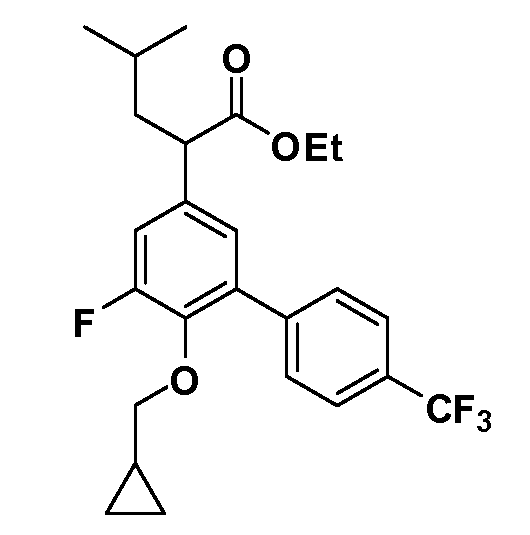
2-(6-Циклопропилметокси)-5-амино-4'-(трифторметил)бифенил-3-ил)-4-метилпентановую кислоту (200 мг, 0,53 ммоль) забирали в 5 мл 1,2-дихлорбензола и при 0°C добавляли раствор BF3-эфирата (1,5M, 5 мл). Реакционную смесь перемешивали в течение 15 минут при 0°C, и нитрит трет-бутила (1,5M, 3 мл) добавляли по каплям. Реакционную смесь затем нагревали при 100°C в течение 1 часа. Реакционную смесь охлаждали до температуры окружающей среды и экстрагировали этилацетатом (2×100 мл). Объединенные органические слои высушивали(MgSO4) и концентрировали при пониженном давлении. Полученный сырой остаток очищали хроматографией на колонках, используя этилацетат:гексан (2:3) в качестве элюента, получая 120 мг 2-(6-циклопропилметокси)-5-амино-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноата.1H ЯМР(CDCl3): δ 7,60-7,35 (м, 5H), 7,20 (с, 1H), 4,15 (кв., 2H), 3,60 (т, 1H), 3,45 (д, 2H), 1,95-2,00 (м, 1H), 1,75-1,80 (м, 1H), 1,45-1,50 (м, 1H), 1,20 (т, 3H), 1,00 (м, 6H), 0,35-0,25 (м, 5H). Масс-спектр: (453, M+1, 100%).
Стадия 2
2-(6-циклопропилметокси)-5-фтор-4'-(трифторметил)бифенил-3-ил)-4-метилпентановая кислота
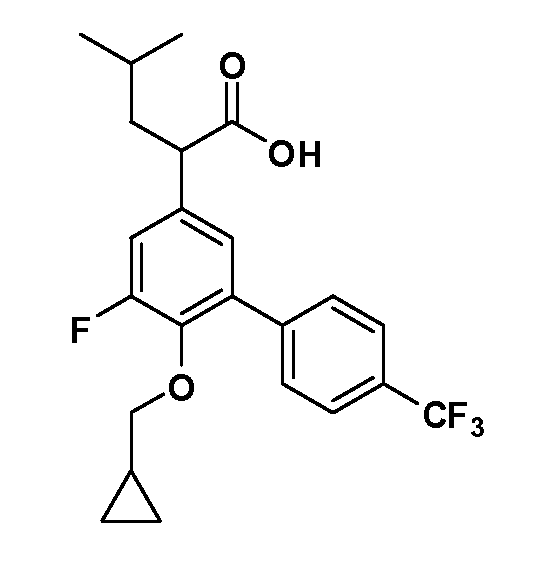
Указанный 2-(6-циклопропилметокси)-5-амино-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноат(120 мг, 0,267 ммоль) забирали в смесь MeOH:THF:вода (20 мл, 10:10:2) и добавляли LiOH (42 мг, 0,7 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 3 часов. После завершения реакционную смесь лили в воду (50 мл) и экстрагировали этилацетатом (2×100 мл). Объединенные этилацетатные слои промывали 1 н. HCl, водой и, наконец, концентрированным солевым раствором. Объединенные органические слои высушивали (MgSO4) и концентрировали при пониженном давлении. Полученный сырой остаток очищали хроматографией на колонках, используя этилацетат:гексан (1:1) в качестве элюента, получая 85 мг 2-(6-циклопропилметокси)-5-фтор-4'-(трифторметил)бифенил-3-ил)-4-метилпентановой кислоты.1H ЯМР(CDCl3): δ 7,55-7,30 (м, 5H), 7,10 (с, 1H), 3,60 (т, 1H), 3,45 (д, 2H), 1,95-2,00 (м, 1H), 1,75-1,80 (м, 1H), 1,45-1,50 (м, 1H), 1,00 (м, 6H), 0,35-0,25 (м, 5H). Масс-спектр: (425, M+1, 100%). Чистота ВЭЖХ (97%).
Пример 724: 2-(2-циклопропилметокси-5-фтор-4'-трифторметил-бифенил-4-ил)-4-метилпентановая кислота
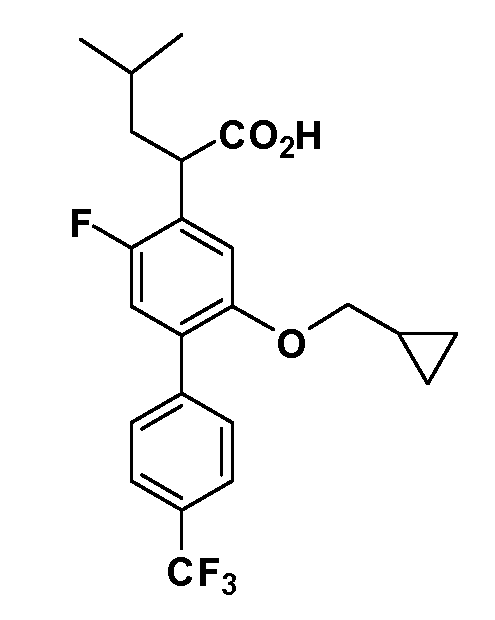
Стадия 1
Диэтил 2-(2,5-дифтор-4-нитрофенил)-2-изобутилмалонат
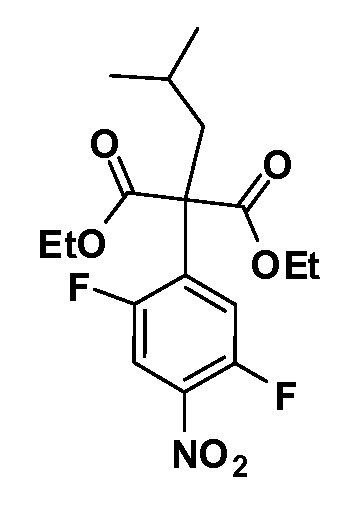
Диэтиловый эфир 2-изобутилмалоновой кислоты (40,0 г, 0,185 моль) в DMF (50 мл) добавляли по каплям к перемешиваемой суспензии гидрида натрия (60% в минеральном масле, 8,0 г, 0,33 моль) в 200 мл DMF (200 мл) за 20 мин при 0°C под азотом. Смесь перемешивали в течение 0,5 часов при температуре окружающей среды, охлаждали до 0°C, и добавляли по каплям 1,2,4-трифтор-5-нитробензол (30,0 г, 169,5 ммоль) в DMF (150 мл). Полученную реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч, вливали в воду со льдом (200 мл) и экстрагировали EtOAc (3×100 мл). Объединенные органические фазы промывали водой (3×100 мл), солевым раствором (100 мл) и высушивали (MgSO4). Выпаривание растворителя при пониженном давлении дало коричневое масло, которое очищали хроматографией на колонках с силикагелем (гептан-EtOAc, градиент), получая 57,0 г (90%) диэтилового эфира 2-(2,5-дифтор-4-нитрофенил)-2-изобутилмалоновой кислоты в форме желтого масла.1H ЯМР (300 МГц,CDCl3/TMS): δ 7,87 (дд, J=12,3, 6,0 Гц, 1H), 7,79 (дд, J=10,1, 6,4 Гц, 1H), 4,30-4,18 (м, 4H), 2,27 (д, J=5,8 Гц, 2H), 1,60-1,50 (м, 1H), 1,26 (т, J=7,1 Гц, 6H), 0,82 (д, J=7,0 Гц, 6H); 13C ЯМР (75 МГц, CDCl3/TMS): δ 168,2, 155,1 (д, 1JCF = 252,3 Гц), 150,9 (д, 1JCF = 263,2 Гц), 135,7, 135,1, 120,0 (дд, 2JCF = 26,0, 3JCF = 4,0 Гц), 113,0 (д, 2JCF = 29,0 Гц), 62,3, 43,1, 24,9, 23,8, 13,8.
Стадия 2
2-(2,5-дифтор-4-нитрофенил)-4-метилпентановая кислота
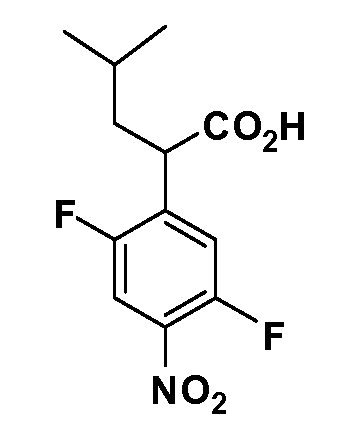
Указанный диэтиловый эфир 2-(2,5-дифтор-4-нитрофенил)-2-изобутилмалоновой кислоты (57,0 г, 152,8 ммоль) растворяли в смеси AcOH/H2O/EtOH (400 мл/120 мл/50 мл) и реакционную смесь нагревали с обратным холодильником в течение 96 ч. После охлаждения растворитель выпаривали при пониженном давлении и добавляли воду (200 мл). Реакционную смесь экстрагировали EtOAc (3×100 мл), и объединенные экстракты промывали водой (3×100 мл), солевым раствором (100 мл) и высушивали(MgSO4). Выпаривание растворителя при пониженном давлении дало желтое масло, которое кристаллизовалось при отстаивании, давая 27 г 2-(2,5-дифтор-4-нитрофенил)-4-метилпентановой кислоты. Хроматография остаточного масла (градиент гептан-EtOAc) дала дополнительные 3 г продукта (72% объединенный выход).1H ЯМР (300 МГц,CDCl3/TMS): δ 9,63 (ушир.с, 1H), 7,82 (дд, J=8,8, 6,0 Гц, 1H), 7,38 (дд, J=11,0, 5,8 Гц, 1H), 4,14-4,08 (м, 1H), 2,05-1,95 (м, 1H), 1,76-1,66 (м, 1H), 1,52-1,43 (м, 1H), 0,95-0,92 (м, 6H); 13C ЯМР (75 МГц, CDCl3/TMS): δ 177,6, 158,2 (д, 1JCF = 232,5 Гц), 150,9 (д, 1JCF = 262,5 Гц), 136,0, 134,7, 119,0 (д, 2JCF = 20,0, Гц), 113,1 (д, 2JCF = 29,4 Гц), 41,7, 41,3, 26,0, 22,6, 21,9.
Стадия 3
этиловый эфир 2-(2,5-дифтор-4-нитрофенил)-4-метилпентановой кислоты
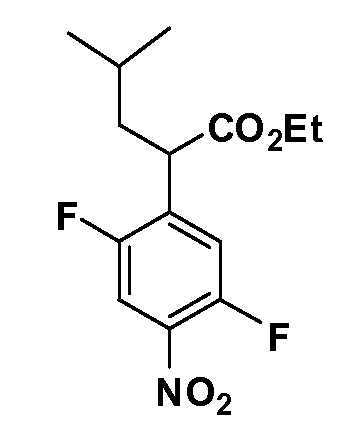
2-(2,5-Дифтор-4-нитрофенил)-4-метилпентановую кислоту (29,0 г, 0,11 моль) растворяли в EtOH (200 мл) и добавляли 10 мл H2SO4 (96%). Реакционную смесь нагревали с обратным холодильником в течение 3ч, и растворитель выпаривали, получая масло, которое растворяли в EtOAc. Добавляли воду (150 мл), и реакционную смесь экстрагировали EtOAc (3×100 мл). Органические фазы промывали насыщеннымNaHCO3 (50 мл), водой (100 мл) и солевым раствором (100 мл), затем высушивали над MgSO4. Выпаривание растворителя при пониженном давлении дало этиловый эфир 2-(2,5-дифтор-4-нитро-фенил)-4-метил-пентановой кислоты в форме желтого масла 32,0 г, (97%), которое использовали для следующей стадии без очистки.1H ЯМР (300 МГц,CDCl3/TMS): δ 7,81 (дд,J=8,8, 6,2 Гц, 1H), 7,41 (дд,J=11,1, 5,6 Гц, 1H), 4,23-4,05 (м, 3H), 2,04-1,94 (м, 1H), 1,71-1,62 (м, 1H), 1,51-1,42 (м, 1H), 1,25 (т,J=7,1 Гц, 3H), 0,95-0,92 (м, 6H);13C ЯМР (75 МГц,CDCl3/TMS): δ 171,6, 155,0 (д,1JCF = 246,0 Гц), 151,5 (д,1JCF = 261,3 Гц), 145,5, 135,7, 118,8 (дд,2JCF = 24,0,3JCF = 4,0 Гц), 113,0 (д,2JCF = 20,0 Гц), 61,6, 41,8, 26,1, 22,5, 22,0, 14,1.
Стадия 4
циклопропилметиловый эфир 2-(5-циклопропилметокси-2-фтор-4-йодфенил)-4-метилпентановой кислоты
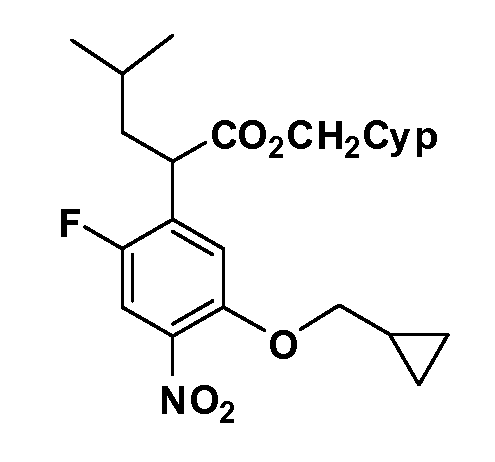
Циклопропилметанол (10,0 г, 138,8 ммоль) обрабатывали n-BuLi (2,5M в гексане 7,4 г, 46 мл, 115,6 ммоль) при -15°C под азотом, и реакционную смесь перемешивали 1 ч при 25°C. К смеси по каплям при 25°C добавляли этиловый эфир 2-(2,5-дифтор-4-нитрофенил)-4-метилпентановой кислоты (29 г, 96 ммоль) в циклопропилметаноле (30 мл), и реакционную смесь перемешивали в течение дополнительных 16 ч. Добавляли воду (100 мл), и реакционную смесь экстрагировали EtOAc (3×100 мл). Объединенные органические фазы промывали водой (3×100 мл), солевым раствором (100 мл) и высушивали (MgSO4). Выпаривание растворителя при пониженном давлении дало коричневое масло, которое очищали хроматографией на колонках с силикагелем (градиент гептан-EtOAc), получая 29,5 г, (81%) циклопропилметилового эфира 2-(5-циклопропилметокси-2-фтор-4-нитрофенил)-4-метилпентановой кислоты в форме желтого масла.1H ЯМР (300 МГц,CDCl3/TMS): δ 7,60 (д,J=9,0 Гц, 1H), 7,15 (д,J=5,7 Гц, 1H), 4,07 (т,J=7,7 Гц, 1H), 4,00-3,80 (м, 4H), 2,01-1,92 (м, 1H), 1,68-1,60 (м, 1H), 1,52-1,43 (м, 1H), 1,34-1,20 (м, 1H), 1,19-1,00 (м, 1H), 0,94 (д,J=6,3 Гц, 6H), 0,65 (д,J=7,7 Гц, 2H), 0,54 (д,J=7,7 Гц, 2H), 0,39 (д,J=4,4 Гц, 2H), 0,25 (д,J=4,4 Гц, 2H);13C ЯМР (75 МГц,CDCl3/TMS): δ 172,6, 152,7 (д,1JCF = 243,4 Гц), 148,8, 138,1, 133,3 (д,2JCF = 15,7 Гц), 115,8, 112,6 (д,2JCF = 29,5 Гц), 75,1, 70,0, 42,1, 41,7, 26,1, 22,5, 22,2, 10,0, 9,8, 3,4.
Стадия 5
циклопропилметиловый эфир 2-(5-Циклопропилметокси-2-фтор-4-аминофенил)-4-метилпентановой кислоты
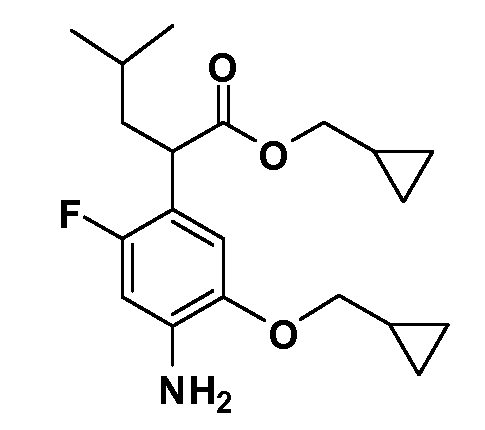
Циклопропилметиловый эфир 2-(5-циклопропилметокси-2-фтор-4-нитрофенил)-4-метилпентановой кислоты (10,0 г, 26,4 ммоль) растворяли в EtOH (200 мл) и гидрировали при 50 psi, 25°C в течение 24 ч с 10% Pd-C (1 г). Смесь фильтровали, и растворитель выпаривали, получая сырое коричневое масло, которое очищали хроматографией на колонках с силикагелем (градиент гептан-EtOAc), получая 6,7 г (72%) циклопропилметилового эфира 2-(5-циклопропилметокси-2-фтор-4-аминофенил)-4-метилпентановой кислоты в форме желтого масла.1H ЯМР (300 МГц,CDCl3/TMS): δ 6,73 (д,J=6,9 Гц, 1H), 6,40 (д,J=11,0 Гц, 1H), 4,00-3,70 (м, 5H), 1,91-1,81 (м, 1H), 1,65-1,56 (м, 1H), 1,51-1,39 (м, 1H), 1,28-1,18 (м, 1H), 1,12-1,00 (м, 1H), 0,90 (д,J=6,6 Гц, 6H), 0,63-0,57 (м, 2H), 0,53-047 (м, 2H), 0,35-0,28 (м, 2H), 0,25-0,18 (м, 2H);13C ЯМР (75 МГц,CDCl3/TMS): δ 174,2, 154,8 (д,1JCF = 236,0 Гц), 142,6, 136,6 (д,3JCF = 11,5 Гц), 114,1 (д,2JCF = 16,8 Гц), 111,6 (д,3JCF = 4,8 Гц), 101,6 (д,2JCF = 28,2 Гц), 73,8, 69,2, 42,1, 40,8, 25,9, 22,7, 22,2, 10,5, 9,8, 3,2.
Стадия 6
циклопропилметиловый эфир 2-(5-циклопропилметокси-2-фтор-4-йодфенил)-4-метилпентановой кислоты
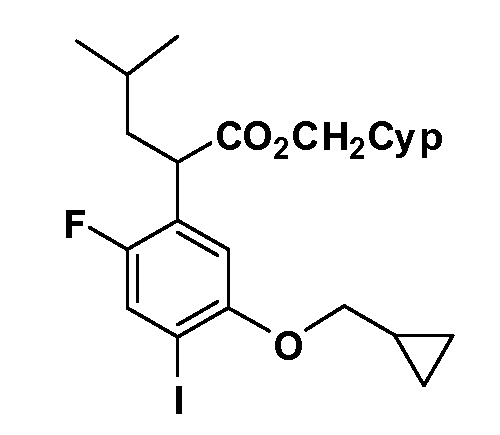
Циклопропилметиловый эфир 2-(5-циклопропилметокси-2-фтор-4-аминофенил)-4-метилпентановой кислоты (2,9 г, 8,3 ммоль) растворяли в смеси EtOH/H2O/H2SO4 (96%) 50 мл/100 мл/2,5 мл при 0°C. РастворNaNO2 (0,63 г, 9,1 ммоль) в воде (20 мл) добавляли по каплям при 0°C, и реакционную смесь перемешивали в течение 20 мин. Раствор KI (4,0 г, 24,1 ммоль) в воде (20 мл) добавляли по каплям при 0°C, и реакционную смесь нагревали при 50-60°C в течение 2,5 ч. Реакционную смесь экстрагировали EtOAc (3×50 мл). Объединенные органические слои промывали 10%-ным тиосульфатом натрия (30 мл), затем солевым раствором (30 мл) и затем высушивали надMgSO4, и растворитель выпаривали, получая сырое коричневое масло, которое очищали хроматографией на колонках с силикагелем (градиент гептан-EtOAc), получая 2,2 г (57%) циклопропилметилового эфира 2-(5-циклопропилметокси-2-фтор-4-йодфенил)-4-метилпентановой кислоты в форме желтого масла.1H ЯМР (300 МГц,CDCl3/TMS): δ 7,46 (д,J=8,8 Гц, 1H), 6,83 (д,J=6,3 Гц, 1H), 4,01-3,83 (м, 5H), 1,96-1,86 (м, 1H), 1,69-1,58 (м, 1H), 1,51-1,39 (м, 1H), 1,28-1,18 (м, 1H), 1,12-1,00 (м, 1H), 0,91 (д,J=6,3 Гц, 6H), 0,66-0,60 (м, 2H), 0,55-0,47 (м, 2H), 0,42-0,34 (м, 2H), 0,26-0,18 (м, 2H);13C ЯМР (75 МГц,CDCl3/TMS): δ 173,2, 154,3 (д,1JCF = 243,4 Гц), 154,1, 127,1 (д,2JCF = 16,2 Гц), 125,5 (д,2JCF = 26,4 Гц), 112,3 (д,3JCF = 3,6 Гц), 84,6 (д,3JCF = 8,4 Гц), 74,5, 69,6, 41,9, 41,5, 26,0, 22,7, 22,2, 10,2, 9,8, 3,3.
Стадия 7
циклопропилметиловый эфир 2-(2-циклопропилметокси-5-фтор-4'-трифторметил-бифенил-4-ил)-4-метилпентановой кислоты
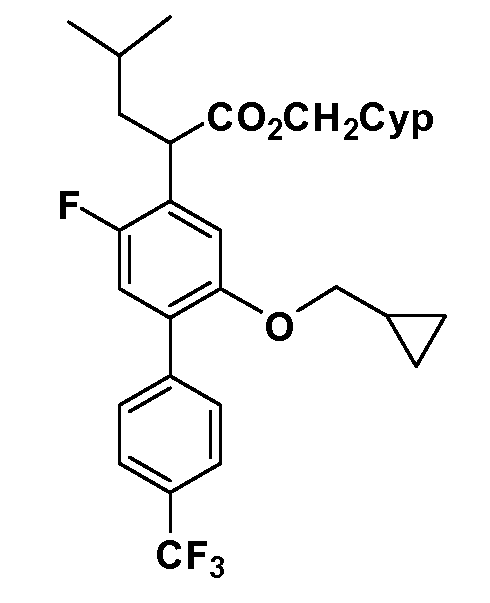
К раствору циклопропилметилового эфира 2-(5-циклопропилметокси-2-фтор-4-йодфенил)-4-метилпентановой кислоты (0,2 г, 0,43 ммоль) в безводном DME (10 мл) под аргоном добавляли 4-трифторметилфенилбороновую кислоту (0,1 г, 0,53 ммоль), CsF (0,16 г, 1,05 ммоль) и Pd(PPh3)4 (0,015 г, 0,013 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 18 ч, добавляли смесь вода/EtOAc 15/15 мл, и органическую фазу отделяли и высушивали надMgSO4. Растворитель затем выпаривали, получая желтое масло, которое очищали хроматографией на колонках с силикагелем (градиент гептан-EtOAc), получая 0,18 циклопропилметилового эфира 2-(2-циклопропилметокси-5-фтор-4'-трифторметил-бифенил-4-ил)-4-метилпентановой кислоты в форме светло-желтого масла.1H ЯМР (300 МГц,CDCl3/TMS): δ 7,70-7,64 (м, 4H), 7,05 (д,J=10,4 Гц, 1H), 7,01 (д,J=6,1 Гц, 1H), 4,09 (т,J=7,7 Гц, 1H), 4,02-3,87 (м, 2H), 3,78 (д,J=6,6 Гц, 2H), 2,04-1,90 (м, 1H), 1,74-1,65 (м, 1H), 1,60-1,45 (м, 1H), 1,25-1,05 (м, 2H), 0,95 (д,J=6,3 Гц, 6H), 0,60-0,40 (м, 4H), 0,30-0,10 (м, 4H).13C ЯМР (75 МГц,CDCl3/TMS): δ 173,5, 154,3 (д,1JCF = 239,7 Гц), 151,9, 140,7, 132,0, 129,5, 126,6 (д,2JCF = 16,9 Гц), 124,8 (кв.,3JCF = 3,7 Гц), 124,0 (кв.,1JCF = 271,6 Гц), 117,0 (д,2JCF = 24,6 Гц), 113,6, 74,1, 69,6, 41,1, 41,5, 26,1, 22,7, 22,2, 10,2, 9,8, 3,2.
Стадия 8
2-(2-циклопропилметокси-5-фтор-4'-трифторметил-бифенил-4-ил)-4-метилпентановая кислота
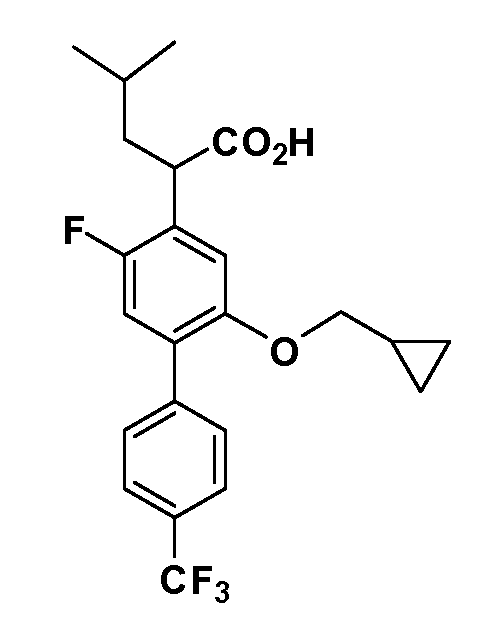
Циклопропилметиловый эфир 2-(2-циклопропилметокси-5-фтор-4'-трифторметил-бифенил-4-ил)-4-метилпентановой кислоты (0,14 г, 0,29 ммоль) растворяли в смеси EtOH/H2O (9 мл/1 мл) и добавляли 0,3 г KOH. Реакционную смесь нагревали с обратным холодильником в течение 2 часов, и после охлаждения растворитель выпаривали. Добавляли воду (10 мл), и реакционную смесь экстрагировали EtOAc (3×10 мл). Объединенные органические экстракты высушивали надMgSO4 и упаривали при пониженном давлении до масла, которое очищали хроматографией на колонках с силикагелем (градиент гептан-EtOAc), получая 0,12 г твердого вещества белого цвета. Вторая хроматография твердого вещества дала 0,03 г (25%) чистой 2-(2-циклопропилметокси-5-фтор-4'-трифторметил-бифенил-4-ил)-4-метилпентановой кислоты в форме кристаллического твердого вещества белого цвета. Т.пл.=110-111°C,1H ЯМР (300 МГц,CDCl3/TMS): δ 8,99 (ушир.с, 1H), 7,66 (ушир.с, 4H), 7,05 (д,J=9,9 Гц, 1H), 6,94 (д,J=5,2 Гц, 1H), 4,08 (т,J=7,7 Гц, 1H), 3,76 (д,J=6,6 Гц, 2H), 2,04-1,90 (м, 1H), 1,81-1,65 (м, 1H), 1,60-1,45 (м, 1H), 1,32-1,05 (м, 2H), 0,94 (д,J=6,0 Гц, 6H), 0,54 (д,J=7,4 Гц, 2H), 0,24 (д,J=3,9 Гц, 2H).13C ЯМР (75 МГц,CDCl3/TMS): δ 179,2, 154,7 (д,1JCF = 239,8 Гц), 152,0, 140,6, 132,0, 129,9, 129,6, 125,7 (д,2JCF = 16,2 Гц), 124,8 (кв.,3JCF = 3,6 Гц), 124,0 (кв.,1JCF = 270 Гц), 117,2 (д,2JCF = 25,2 Гц), 113,9, 74,2, 41,3, 29,8, 25,9, 22,8, 22,1, 10,3, 3,2.
Пример 485: 2-(5-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилпропановая кислота
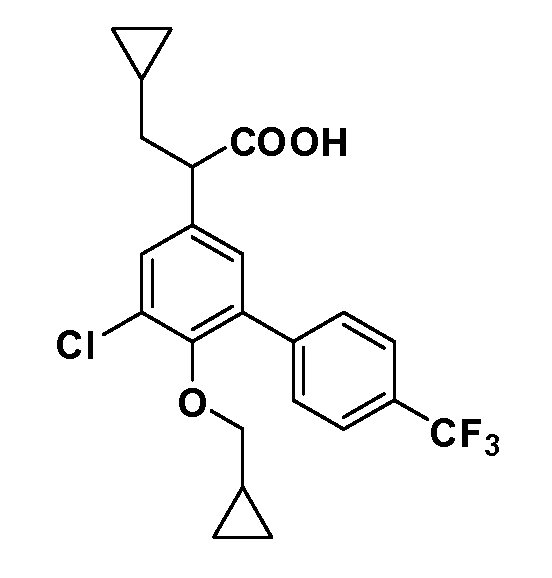
Стадия 1
2-(3-бром-4-гидроксифенил)этилацетат
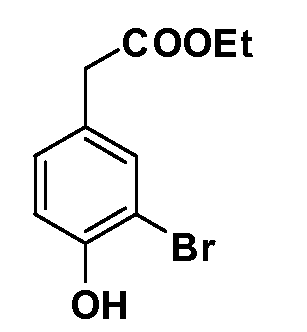
К перемешиваемому раствору 2-(4-гидроксифенил)этилацетата (20 г, 0,11 моль) в 200 мл CCl4 при 0°C в течение 30 мин медленно добавляли бром (18,8 г, 0,11 моль), растворенный в 10 мл CCl4. Реакционную массу перемешивали в течение еще 30 мин при 0°C. После завершения реакции смесь лили на измельченный лед и экстрагировали DCM (x2). Объединенные органические слои промывали водой и 10%-ным раствором бисульфита натрия, высушивали надNa2SO4, фильтровали и концентрировалив вакууме, получая 2-(3-бром-4-гидроксифенил)этилацетат с 78%-ным выходом (22,4 г).1H ЯМР (CDCl3): 7,42 (с, 1H); 7,14 (д, 1H); 6,97 (д, 1H); 5,53 (ушир.с, 1H); 4,13 (кв., 2H); 3,52 (с, 2H); 1,16 (т, 3H).
Стадия 2
2-(3-бром-5-хлор-4-гидроксифенил)этилацетат
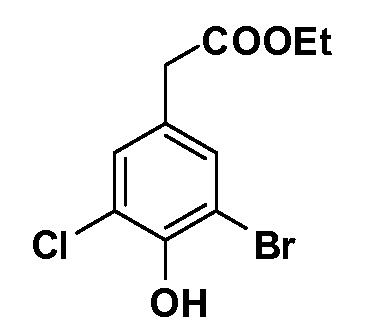
К перемешиваемому раствору 2-(3-бром-4-гидроксифенил)этилацетата (20 г, 0,076 моль) в 200 мл DCM добавляли MeOH (3,4 мл, 0,84 моль), и смесь нагревали с обратным холодильником. Сульфурил хлорид (6,8 мл, 0,846 моль) медленно добавляли в течение 10 мин. Реакционную смесь нагревали с обратным холодильником в течение еще 5 ч. После завершения реакции смесь лили на измельченный лед и экстрагировали DCM (x2). Объединенный органический слой промывали10%-ным раствором NaHCO3 и водой, высушивали надNa2SO4, фильтровали и упаривали под вакуумом, получая 2-(3-бром-5-хлор-4-гидроксифенил)этилацетат с 60%-ным выходом (13,6 г).1H ЯМР (CDCl3): 7,37 (с, 1H); 7,27 (с, 1H); 5,68 (ушир.с, 1H); 4,16 (кв., 2H); 3,48 (с, 2H); 1,29 (т, 3H).
Стадия 3
2-(3-бром-5-хлор-4-(циклопропилметокси)фенил)этилацетат
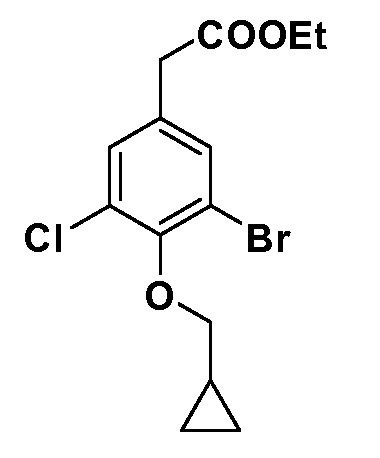
К перемешиваемому раствору 2-(3-бром-5-хлор-4-гидроксифенил)этилацетата(4 г, 0,011 моль) и K2CO3 (2,8 г, 0,02 моль) в 100 мл ДМСО при температуре окружающей среды медленно добавляли циклопропилметилбромид (1,46 мл, 0,017 моль). После завершения добавления реакционную смесь нагревали при 60°C в течение 4 ч. После завершения реакции смесь лили на воду и экстрагировали EtOAc (x2). Объединенные органические слои промывали водой, высушивали надNa2SO4, фильтровали и концентрировали в вакууме, получая 2-(3-бром-5-хлор-4-(циклопропилметокси)фенил)этилацетат с 72%-ным выходом (93,4 г).1H ЯМР (CDCl3): 7,38 (ушир.с, 1H); 7,28 (с, 1H); 4,16 (кв., 2H); 3,87 (д, 2H); 3,58 (с, 2H); 1,38 (м, 1H); 1,28 (т, 3H); 0,63 (м, 2H); 0,38 (м, 2H).
Стадия 4
2-(5-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)этилацетат
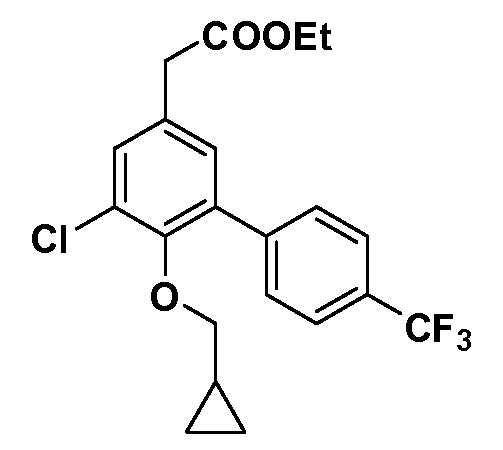
Смесь 2-(3-бром-5-хлор-4-(циклопропилметокси)фенил)этилацетата (4 г, 0,011 моль), 4-трифторметилфенилбороновой кислоты (2,6 г, 0,012 моль), тетракис(трифенилфосфин)палладия (1,3 г, 0,001 моль), карбоната цезия (13,1 г, 0,04 моль) в смеси DMF/вода (100 мл/5 мл) перемешивали в течение ночи при 100°C. После завершения реакции осадок удаляли фильтрацией. Фильтрат разбавляли водой и экстрагировали дважды EtOAc. Объединенные органические слои промывали водой и солевым раствором, высушивали надNa2SO4 и концентрировалив вакууме. Остаток очищали флэш-хроматографией на колонке, получая 2-(5-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)этилацетат с 57%-ным выходом (2,7 г).1H ЯМР (CDCl3): 7,69 (ушир.с, 4H); 7,36 (с, 1H); 7,17 (с, 1H); 4,18 (кв., 2H); 3,59 (с, 2H); 3,39 (д, 2H); 1,28 (т, 3H); 0,96 (м, 1H); 0,41 (м, 2H); 0,01 (м, 2H).
Стадия 5
2-(5-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилэтилпропаноат
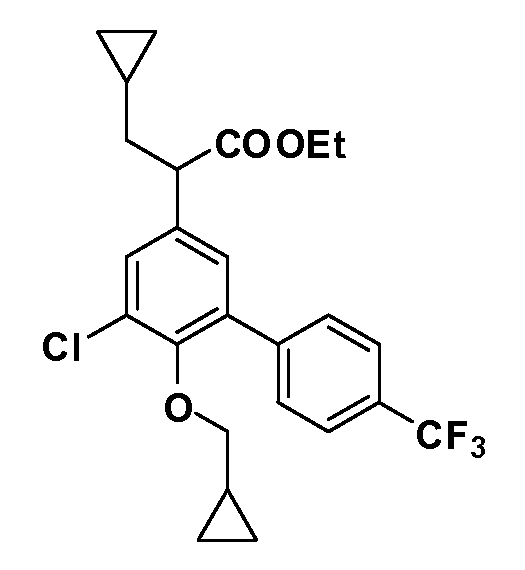
К суспензии NaH (37 мг, 50%-ая суспензия, 0,79 ммоль) в 25 мл DMF медленно добавляли смесь 2-(5-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)этилацетата (300 мг, 0,719 ммоль) и циклопропилметил бромида (108 мг, 0,782 ммоль) в 20 мл DMF при 0°C в течение 15 мин в атмосфере азота. После завершения добавления смесь перемешивали в течение 15 мин при 0°C. Реакционную смесь лили на измельченный лед и экстрагировали EtOAc (x2). Объединенные органические слои промывали водой и солевым раствором, высушивали надNa2SO4 и концентрировалив вакууме. Остаток очищали флэш-хроматографией на колонке, получая 2-(5-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилэтилпропаноат с 62%-ным выходом (0,210 г).1H ЯМР (CDCl3): 7,69 (с, 4H); 7,41 (с, 1H); 7,21 (с, 1H); 4,19 (кв., 2H); 3,63 (т, 1H); 3,41 (д, 2H); 1,94 (м, 1H); 1,78 (м, 1H); 1,27 (т, 3H); 0,97 (ушир.с, 1H); 0,72 (ушир.с, 1H); 0,42 (м, 4H); 0,13 (м, 2H); 0,1 (м, 2H).
Стадия 6
2-(5-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилпропановая кислота
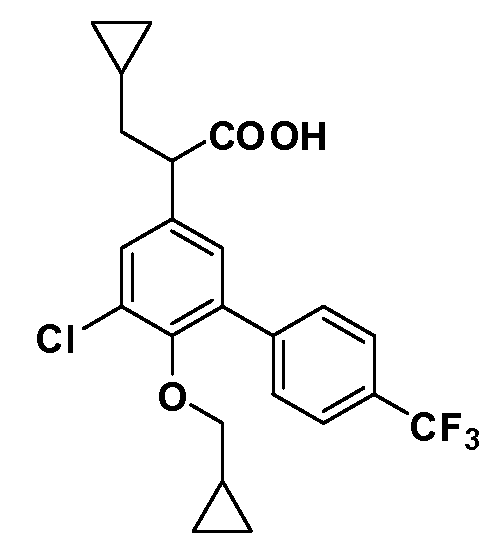
Смесь 2-(5-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилэтилпропаноата (100 мг, 0,214 ммоль) и моногидрата гидроксида лития (27 мг, 0,642 ммоль) в смеси растворителей MeOH/THF/вода (5 мл/5 мл/5 мл) перемешивали в течение 3 ч при температуре окружающей среды. После завершения реакции летучие компоненты удаляли при пониженном давлении. Остаток разбавляли водой, подкисляли 5% раствором HCl и экстрагировали EtOAc (x2). Объединенные органические слои промывали водой, высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали флэш-хроматографией на колонке, получая 2-(5-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилпропановую кислоту с 56%-ным выходом (52,6 мг).1H ЯМР (CDCl3): 7,71 (с, 4H); 7,42 (с, 1H); 7,23 (с, 1H); 3,68 (т, 1H); 3,41 (д, 2H); 1,93 (м, 1H); 1,77 (м, 1H); 0,97 (ушир.с, 1H); 0,71 (ушир.с, 1H); 0,42 (м, 4H); 0,12 (м, 2H); 0,1 (м, 2H).
Пример 414: 2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-4-метилпентановая кислота
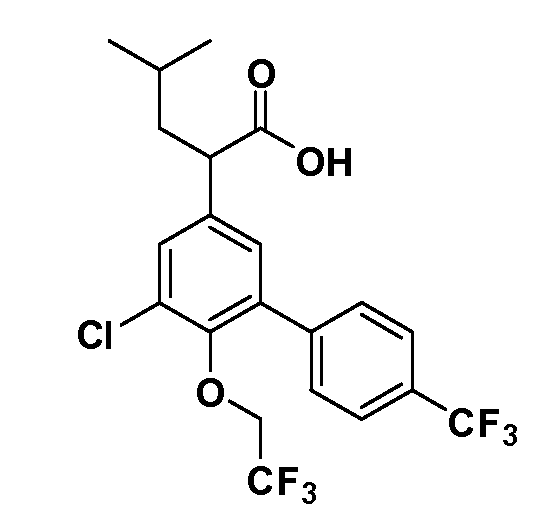
Стадия 1
2-(3-амино-5-бром-4-гидроксифенил)-4-метилэтилпентаноат
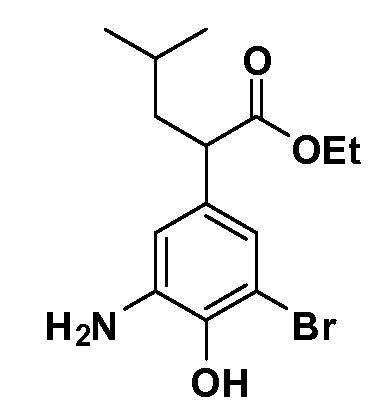
К перемешиваемому раствору 2-(3-бром-4-гидрокси-5-нитрофенил)-4-метилэтилпентаноата (6 г) в сухом метаноле (100 мл) в атмосфере азота добавляли Pd(О)2. Реакционную смесь перемешивали в течение 5 часов в атмосфере водорода. Реакционную смесь фильтровали через Целит™, промывали метанолом и концентрировали досуха при пониженном давлении. Сырой материал очищали хроматографией на колонках, получая 2-(3-амино-5-бром-4-гидроксифенил)-4-метилэтилпентаноат (4 г, 72%).1H ЯМР (CDCl3, 200 МГц): 6,80 (с, 1H); 6,62 (с, 1H); 5,35 (ушир.с, 1H); 4,13 (кв., 2H); 3,41 (т, 1H); 1,93-1,56 (м, 2H); 1,51 (м, 1H); 1,21 (т, 3H), 0,97 (д, 6H).
Стадия 2
2-(3-бром-5-хлор-4-гидроксифенил)-4-метилэтилпентаноат
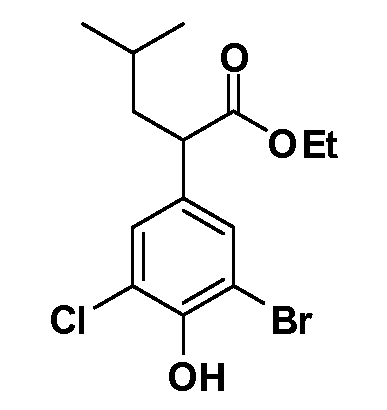
2-(3-амино-5-бром-4-гидроксифенил)-4-метилэтилпентаноат 1 (4 г, 0,012 моль) растворяли в смеси ACN/H2O/HCl 60 мл/30 мл/8 мл при 0°C. РастворNaNO2 (0,919 г, 1,1 экв.) в воде (10 мл) добавляли по каплям при 0°C, и реакционную смесь перемешивали в течение 1 ч при 0°C. Раствор CuCl (5,99 г, 0,060 моль) в воде (10 мл) добавляли по каплям к реакционной смеси при 0°C. Реакционную смесь затем нагревали до 50°C в течение 2,5 ч, после чего смесь лили в воду со льдом, экстрагировали этилацетатом (3×100 мл). Объединенные органические слои промывали водой (200 мл) и солевым раствором (100 мл), высушивали надNaSO4 и концентрировалив вакууме, получая сырое черное масло, которое очищали хроматографией на силикагеле (гексан/EtOAc), получая 2-(3-бром-5-хлор-4-гидроксифенил)-4-метилэтилпентаноат в форме желтого масла 2,2 г, (47,3%).1H ЯМР (CDCl3, 200 МГц): 7,38 (с, 1H); 7,4 (с, 1H); 5,80 (ушир.с, 1H); 4,13 (кв., 2H); 3,51 (т, 1H); 1,93-1,56 (м, 2H); 1,51 (м, 1H); 1,21 (т, 3H), 0,97 (д, 6H).
Стадия 3
2-(3-бром-5-хлор-4-(2,2,2-трифторэтокси)фенил)-4-метилэтилпентаноат
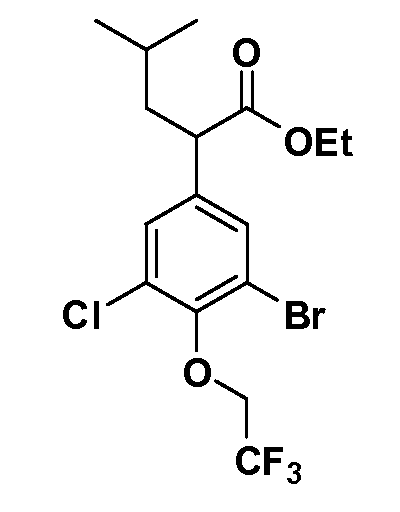
К перемешиваемому раствору 2-(3-бром-5-хлор-4-гидроксифенил)-4-метилэтилпентаноата(2 г, 0,57 ммоль) и K2CO3 (1,58 г, 0,011 моль) в сухом DMF (20 мл) при температуре окружающей среды медленно добавляли трифторэтилйодид (7,2 г, 3,39 мл, 0,034 моль). После завершения добавления реакционную смесь медленно нагревали до 100°C в течение 4 ч. После завершения реакционную смесь лили в воду и экстрагировали этилацетатом (2×50 мл). Объединенный органический слой промывали водой, высушивали надNa2SO4 и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке на силикагеле (гексан/EtOAc), получая 2-(3-бром-5-хлор-4-(2,2,2-трифторэтокси)фенил)-4-метилэтилпентаноат (1,4 г, 60%-ый выход).1H ЯМР (CDCl3, 400 МГц): 7,43 (с, 1H); 7,34 (с, 1H); 4,4 (кв., 2H), 4,13 (кв., 2H); 3,55 (т, 1H); 1,93 (м, 1H), 1,58 (м, 1H); 1,45 (м, 1H); 1,24 (т, 3H), 0,92 (д, 6H).
Стадия 4
2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноат
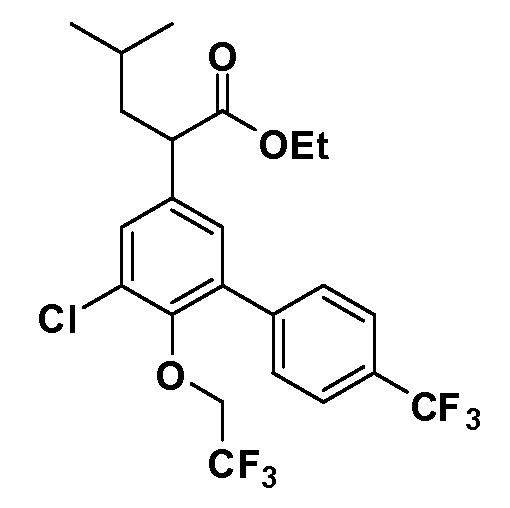
Смесь 2-(3-бром-5-хлор-4-(2,2,2-трифторэтокси)фенил)-4-метилэтилпентаноата (1 г, 1 экв.), 4-трифторметилфенилбороновой кислоты (2,6 г, 1,4 экв.), Pd(PPh3)4 (1,3 г, 0,1 экв.) и фторида цезия (13,1 г, 2 экв.) в DME (30 мл) перемешивали в течение ночи при 100°C. После завершения осадок удаляли фильтрацией. Фильтрат разбавляли водой и экстрагировали этилацетатом (2×50 мл). Объединенные органические слои промывали водой, затем солевым раствором, высушивали надNa2SO4 и концентрировали в вакууме. Остаток очищали флэш-хроматографией на колонке, получая 2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноат с 74%-ным выходом (1,08 г).1H ЯМР (CDCl3, 400 МГц): 7,68 (м, 5H), 7,43 (с, 1H); 7,24 (с, 1H); 4,4 (кв., 2H), 4,13 (кв., 2H); 3,55 (т, 1H); 1,93 (м, 1H), 1,58 (м, 1H); 1,45 (м, 1H); 1,24 (т, 3H), 0,92 (д, 6H).
Стадия 5
2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-4-метилпентановая кислота
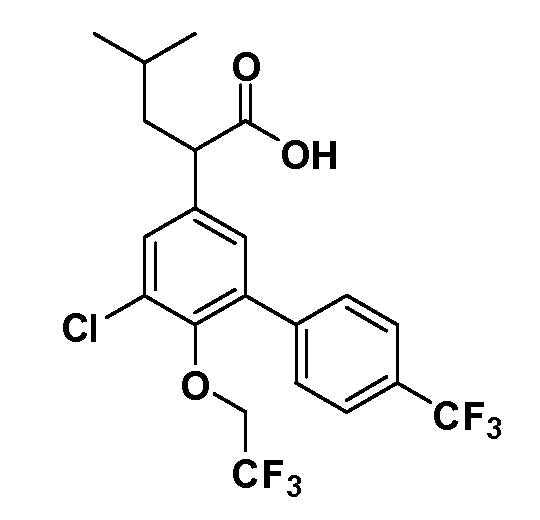
Смесь 2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноата (800 мг, ммоль) и моногидрата гидроксида лития (27 мг, 0,642 ммоль) в смеси растворителей MeOH/THF/вода (5 мл/5 мл/ 5 мл) перемешивали в течение 3 ч при температуре окружающей среды. После завершения реакции летучие компоненты удаляли при пониженном давлении. Остаток разбавляли водой, подкисляли 5% раствором HCl и экстрагировали этилацетатом (3×50 мл). Объединенные органические слои промывали водой, высушивали над Na2SO4, фильтровали и упаривали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке, получая 2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-4-метилпентановую кислоту с 88%-ным выходом (670 мг).
Или, альтернативно, пример 414 может синтезироваться с помощьюследующих процедур:
Стадия 1
2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноат
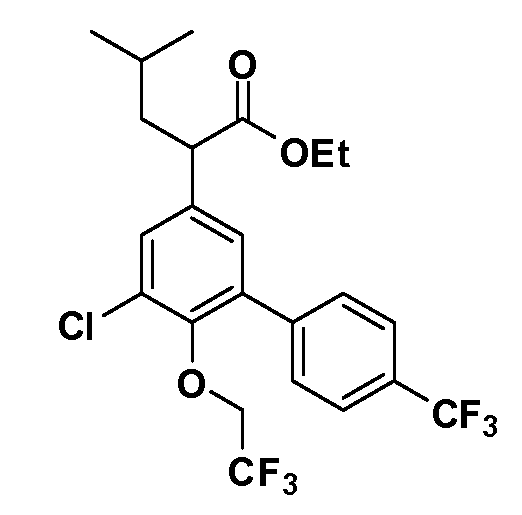
2-(5-Хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)этилацетат (0,75 г, 1,70 ммоль) растворяли в безводном DMF (20 мл), NaH (60 вес.% в парафиновом масле, 0,049 г, 2,04 ммоль) добавляли при 0°C. Реакционную смесь перемешивали в течение 30 минут при температуре окружающей среды, после чего изобутил бромид (0,2 мл, 1,87 ммоль) добавляли по каплям при 0°C. Реакционную смесь перемешивали дополнительно 1 час при 0°C и затем добавляли насыщенный раствор (10 мл)NH4Cl. Реакционную смесь экстрагировали EtOAc (3×20 мл), и объединенные органические слои промывали водой (2x10 мл) и солевым раствором (10 мл), высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении, получая бесцветное масло, которое очищали флэш-хроматографией на колонке, получая 2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноат (0,5 г, 59%-ый выход) в форме вязкой жидкости.
Стадия 2
2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-4-метилпентановая кислота
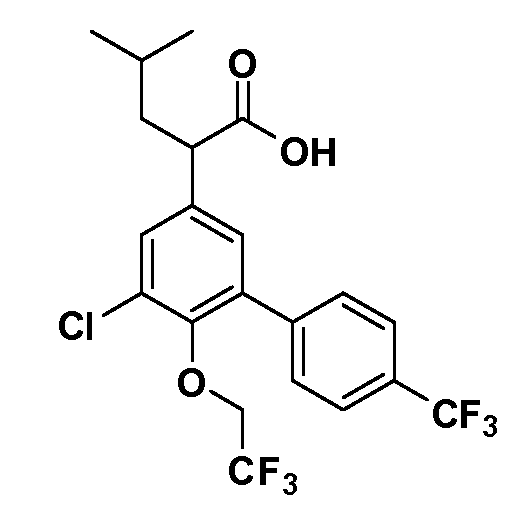
Смесь 2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноата (0,6 г, 1,21 ммоль) и моногидрата гидроксида лития (0,509 г, 12,1 ммоль) в смеси растворителей MeOH/THF/вода (10 мл/10 мл/10 мл) перемешивали в течение 4 часов при температуре окружающей среды. После завершения реакции летучие компоненты удаляли при пониженном давлении. Остаток разбавляли водой, подкисляли 5% раствором HCl и экстрагировали этилацетатом (3×20 мл). Объединенные органические слои промывали водой, высушивали над Na2SO4, фильтровали и упаривали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке, получая 2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-4-метилпентановую кислоту (0,4 г, 72%-ный выход) в форме твердого вещества белого цвета.
Пример 1055: 2-(6-циклопропилметокси-5,4'-бис-трифторметил-бифенил-3-ил)-4-метилпентановая кислота
Стадия 1
2-изобутил-2-(4-нитро-3-(трифторметил)фенил)диэтилмалонат
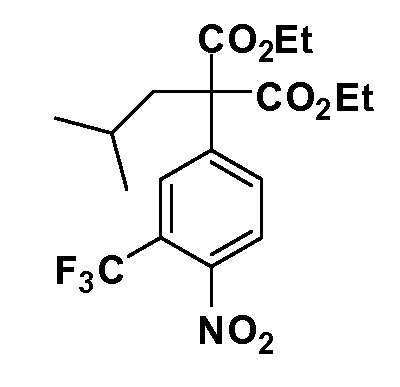
К раствору изобутилдиэтилмалоната (50,0 г, 231 ммоль) в безводном DMF (200 мл), охлажденном в ванне со льдом, небольшими частями добавляли NaH (60%, 11,1 г, 277 ммоль). После добавления реакционную смесь перемешивали при 0°C в течение 10 минут и затем при температуре окружающей среды в течение 30 мин. 5-Хлор-2-нитробензотрифторид (47,3 г, 210 ммоль) в безводном DMF (50 мл) добавляли по каплям, и смесь перемешивали при температуре окружающей среды в течение двух дней. DMF удаляли под высоким вакуумом, и остаток разбавляли этилацетатом (400 мл). Воду (400 мл) добавляли по каплям; добавляли хлорид аммония (25 г), и слои разделяли. Органический слой промывали солевым раствором (400 мл), высушивали над сульфатом натрия и концентрировали при пониженном давлении, получая красно-коричневое масло, которое очищали флэш-хроматографией на силикагеле, элюируя смесью гептан/этилацетат (12:1), получая желаемый 2-изобутил-2-(4-нитро-3-(трифторметил)фенил)диэтилмалонат (74,4 г, 87%) в форме желтого масла:1H ЯМР (300 МГц,CDCl3): δ 8,07 (с, 1H), 7,94 (д, 2Н,J=8,7 Гц), 7,88 (д, 2Н,J=8,7 Гц), 4,25 (м, 4H), 2,33 (д, 2Н,J=6,6 Гц), 1,51 (м, 1H), 1,26 (т, 6Н,J=7,2 Гц), 0,84 (д, 6Н,J=6,6 Гц);13C ЯМР (75 МГц,CDCl3): δ 169,23, 146,71, 142,86, 132,94, 127,94 (кв.,J=5 Гц), 124,55, 123,12 (кв.,J=33 Гц), 121,79 (кв.,J=272 Гц), 62,19, 61,59, 44,16, 24,66, 23,66, 13,89.
Стадия 2
4-метил-2-(4-нитро-3-трифторметилфенил)пентановая кислота
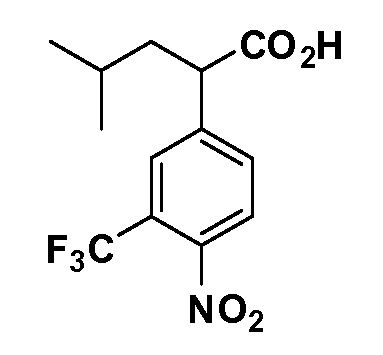
К раствору 2-изобутил-2-(4-нитро-3-(трифторметил)фенил)диэтилмалоната (74,4 г, 184 ммоль) в уксусной кислоте (500 мл) добавляли воду (157 мл) и аккуратно добавляли концентрированную H2SO4 (55 мл). Реакционную смесь нагревали с обратным холодильником в течение трех дней и затем концентрировали при пониженном давлении. Остаток разбавляли водой (400 мл) и экстрагировали этилацетатом (6×100 мл). Объединенные органические экстракты промывали водой (400 мл), высушивали над сульфатом натрия и концентрировали при пониженном давлении, получая коричневое масло. Остаток очищали флэш-хроматографией на силикагеле, элюируя смесью гептан/EtOAc (5:1 и затем 2:1), получая 4-метил-2-(4-нитро-3-трифторметилфенил)пентановую кислоту (42,5 г, 76%) в форме желтоватого масла:1H ЯМР (300 МГц,CDCl3): δ 11,51 (с, 1Н, ушир.), 7,87 (д, 1Н,J=8,4 Гц), 7,78 (с, 1H), 7,71 (д, 1Н,J=8,4 Гц), 3,84 (т, 1Н,J=7,8 Гц), 2,06 (м, 1H), 1,72 (м, 1H), 1,49 (м, 1H), 0,95 (д, 3Н,J=6,6. Гц), 0,94 (д, 3Н,J=6,3 Гц);13C ЯМР (75 МГц,CDCl3): δ 178,76, 147,09, 143,94, 132,66, 127,70 (кв.,J=5 Гц), 125,40, 123,95 (кв.,J=34 Гц), 121,74 (кв.,J=271 Гц), 42,16, 25,96, 22,44, 22,09.
Стадия 3
этиловый эфир 4-метил-2-(4-нитро-3-трифторметилфенил)пентановой кислоты
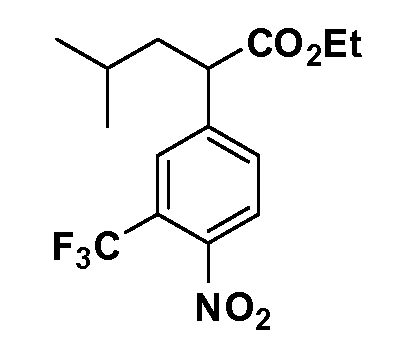
К раствору 4-метил-2-(4-нитро-3-трифторметилфенил)пентановой кислоты (42,3 г, 139 ммоль) в абсолютном этаноле (300 мл) добавляли концентрированную серную кислоту (95-98%, 9,0 мл) и раствор нагревали с обратным холодильником в течение ночи. Реакционную смесь концентрировали при пониженном давлении; остаток обрабатывали раствором карбоната натрия (5%, 300 мл), и смесь экстрагировали этилацетатом (300 мл). Органический слой промывали солевым раствором (300 мл), высушивали над сульфатом натрия и концентрировали при пониженном давлении. Очистка флэш-хроматграфией на силикагеле с элюированием смесью гептан/EtOAc (10:1) дала этиловый эфир 4-метил-2-(4-нитро-3-трифторметил-фенил)-пентановой кислоты (38,4 г, 83%) в форме желтоватого масла:1H ЯМР (300 МГц,CDCl3): δ 7,90 (д, 1Н,J=8,4 Гц), 7,82 (с, 1H), 7,74 (дд, 1Н,J=8,4, 1,5 Гц), 4,18 (м, 2H), 3,83 (т, 1Н,J=7,5 Гц), 2,06 (м, 1H), 1,70 (м, 1H), 1,50 (м, 1H), 1,27 (т, 3Н,J=7,2 Гц), 0,97 (д, 3Н,J=6,6 Гц), 0,96 (д, 3Н,J=6,3 Гц);13C ЯМР (75 МГц,CDCl3): ( 172,24, 146,83, 145,04, 132,40, 127,51 (кв., J=5 Гц), 125,28, 123,80 (кв., J=32 Гц), 121,78 (кв., J=272 Гц), 61,45, 49,45, 42,65, 26,03, 22,41, 22,17, 14,10.
Стадия 4
этиловый эфир 2-(4-амино-3-трифторметилфенил)-4-метилпентановой кислоты
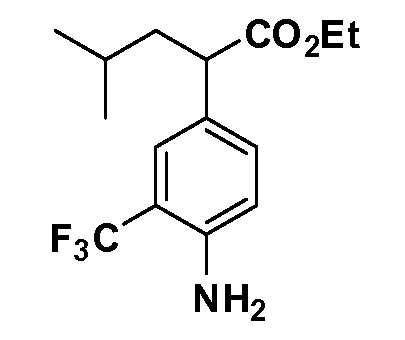
Суспензию этилового эфира 4-метил-2-(4-нитро-3-трифторметилфенил)пентановой кислоты (38,3 г, 115 ммоль), хлорида олова(II) (87,2 г, 460 ммоль) и воды (16,6 г, 920 ммоль) в этаноле (500 мл) нагревали с обратным холодильником в течение четырех часов. Реакционную смесь концентрировали при пониженном давлении; остаток обрабатывали этилацетатом (300 мл) и водным раствором NaOH (1 н., 2,5 л). Водный слой экстрагировали этилацетатом (3×600 мл). Объединенные органические слои промывали солевым раствором (1 л), высушивали над Na2SO4 и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на силикагеле, элюируя смесью гептан/этилацетат (10:1), получая этиловый эфир 2-(4-амино-3-трифторметилфенил)-4-метилпентановой кислоты (31,1 г, 89%) в форме желтого масла:1H ЯМР (300 МГц,CDCl3): δ 7,35 (д, 1Н,J=2,1 Гц), 7,27 (дд, 1Н,J=8,4, 2,1 Гц), 6,69 (д, 1Н,J=8,4 Гц), 4,10 (м, 4H), 3,54 (т, 1Н,J=7,8 Гц), 1,91 (м, 1H), 1,58 (м, 1H), 1,44 (м, 1H), 1,21 (т, 3Н,J=6,9 Гц), 0,90 (д, 3Н,J=6,6 Гц), 0,89 (д, 3Н,J=6,6 Гц);13C ЯМР (75 МГц,CDCl3): δ 174,14, 143,45, 132,22, 128,58, 125,91 (кв.,J=4 Гц), 124,80 (кв.,J=271 Гц), 117,35, 113,60 (кв.,J=29 Гц), 60,60, 48,54, 42,35, 25,77, 22,46, 22,18, 14,04.
Стадия 5
этиловый эфир 2-(4-гидрокси-3-нитро-5-трифторметилфенил)-4-метилпентановой кислоты
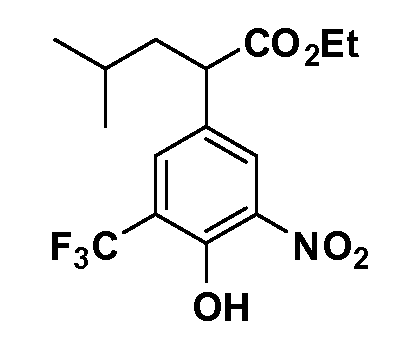
К серной кислоте (95-98%, 20,0 мл) добавляли этиловый эфир 2-(4-амино-3-трифторметилфенил)-4-метилпентановой кислоты (6,06 г, 20,0 ммоль). Смесь охлаждали до 0°C и по каплям добавляли воду (30,0 мл). РастворNaNO2 (1,66 г, 24,0 ммоль) в воде (12 мл) добавляли по каплям, и смесь перемешивали в течение дополнительных 20 мин. Несколько кристаллов мочевины добавляли для разложения любого избыткаNaNO2. Добавляли раствор нитрата меди (2) (466 г, 2,00 моль) в воде (880 мл) с последующим добавлениемCu2O (2,86 г, 20,0 ммоль). Смесь перемешивали в течение 5 минут и добавляли простой диэтиловый эфир (1 л). Органический экстракт промывали солевым раствором (500 мл), высушивали надNa2SO4 и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на силикагеле, элюируя смесью гептан/этилацетат (20:1), получая этиловый эфир 2-(4-гидрокси-3-нитро-5-трифторметилфенил)-4-метилпентановой кислоты (2,20 г, 31%) в форме желтого масла: HRMS (DIP-CI-MS): рассчит. дляC15H19NO5F3 (M+H)+: 350,1215, найдено 350,1240;1H ЯМР (300 МГц,CDCl3): δ 11,13 (с, 1H), 8,29 (с, 1H), 7,90 (с, 1H), 4,15 (м, 2H), 3,69 (т, 1Н,J=7,8 Гц), 2,00 (м, 1H), 1,62 (м, 1H), 1,47 (м, 1H), 1,25 (т, 3Н,J=7,2 Гц), 0,94 (д, 3Н,J=6,3 Гц), 0,93 (д, 3Н,J=6,6 Гц);13C ЯМР (75 МГц,CDCl3): δ 172,75, 152,45, 134,67 (кв.,J=5 Гц), 134,29, 131,40, 127,90, 122,35, (кв.,J=271 Гц), 121,42 (кв.,J=32 Гц), 61,51, 48,76, 42,76, 26,23, 22,60, 22,42, 14,32.
Стадия 6
этиловый эфир 2-(4-циклопропилметокси-3-нитро-5-трифторметилфенил)-4-метилпентановой кислоты
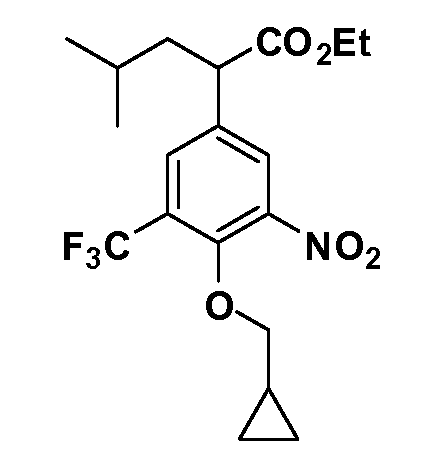
К раствору этилового эфира 2-(4-гидрокси-3-нитро-5-трифторметилфенил)-4-метилпентановой кислоты (2,66 г, 7,62 ммоль), циклопропанметанола (0,60 г, 8,38 ммоль) и трифенилфосфина (2,40 г, 9,14 ммоль) в безводном THF (32 мл) добавляли по каплям диэтилазодикарбоксилат (раствор 40 вес.% в толуоле, 3,98 г, 9,14 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение двух дней и затем концентрировали при пониженном давлении. Остаток растирали со смесью THF/гексан (1:5, 3×15 мл). Объединенные экстракты концентрировали при пониженном давлении, получая твердое вещество желтого цвета, которое очищали флэш-хроматографией на силикагеле, элюируя смесью гептан/этилацетат (60:1 и затем 10:1), получая этиловый эфир 2-(4-циклопропилметокси-3-нитро-5-трифторметилфенил)-4-метилпентановой кислоты (1,89 г, 61%) в форме бесцветного масла:1H ЯМР (300 МГц,CDCl3): δ 7,92 (с, 1H), 7,73 (с, 1H), 4,06 (м, 2H), 3,79 (д, 2Н,J=7,2 Гц), 3,64 (т, 1Н,J=7,5 Гц), 1,93 (м, 1H), 1,55 (м, 1H), 1,40 (м, 1H), 1,24 (м, 1H), 1,17 (т, 3Н,J=6,9 Гц), 0,86 (м, 6H), 0,56 (д, 2Н,J=6,6 Гц), 0,27 (м, 2H);13C ЯМР (75 МГц,CDCl3): δ 172,49, 149,98, 144,40, 135,55, 130,96 (кв.,J=5 Гц), 128,29, 126,77, (кв.,J=31 Гц), 122,37 (кв.,J=272 Гц), 82,03, 61,37, 48,74, 42,66, 26,04, 22,36, 22,32, 14,14, 10,66, 3,39.
Стадия 7
этиловый эфир 2-(3-амино-4-циклопропилметокси-5-трифторметилфенил)-4-метилпентановой кислоты
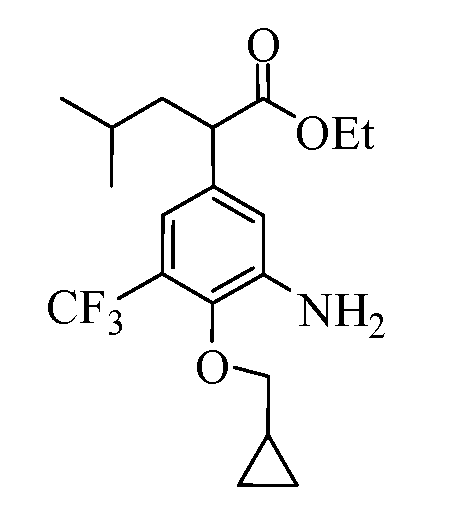
Смесь этилового эфира 2-(4-циклопропилметокси-3-нитро-5-трифторметилфенил)-4-метилпентановой кислоты (1,85 г, 4,59 ммоль) и Pd/C (1,85 г) в этаноле и 1 н. HCl (4,60 мл) гидрировали под 36 psiH2 в аппарате Парра. Через 4 часа реакционную смесь фильтровали через Целит 521®. Фильтрат концентрировали при пониженном давлении, получая желтое масло. Остаток обрабатывали водным раствором карбоната натрия (3 г в 100 мл воды), и полученный раствор экстрагировали этилацетатом (100 мл). Органический слой высушивали над сульфатом натрия и концентрировали при пониженном давлении, получая коричневое масло, которое очищали флэш-хроматографией на силикагеле, элюируя градиентом гептан/этилацетат (от 10:1 до 2:1), получая этиловый эфир 2-(3-амино-4-циклопропилметокси-5-трифторметилфенил)-4-метилпентановой кислоты (0,88 г, 51%) в форме светло-розового масла:1H ЯМР (300 МГц,CDCl3): δ 6,83 (с, 1H), 6,80 (с, 1H), 4,04 (м, 2H), 3,85 (с, 2H), 3,66 (д, 2Н,J=6,9 Гц), 3,45 (т, 1Н,J=7,8 Гц), 1,84 (м, 1H), 1,49 (м, 1H), 1,39 (м, 1H), 1,22 (м, 1H), 1,14 (т, 3Н,J=7,2 Гц), 0,82 (м, 6H), 0,56 (д, 2Н,J=7,5 Гц), 0,27 (д, 2Н,J=4,5 Гц);13C ЯМР (75 МГц,CDCl3): δ 173,61, 142,71, 141,25, 135,51, 123,75 (кв.,J=30 Гц), 123,52 (кв.,J=271 Гц), 118,46, 115,52 (кв.,J=5 Гц), 77,88, 60,70, 49,03, 42,53, 25,86, 22,40, 22,31, 14,07, 10,98, 3,19.
Стадия 8
этиловый эфир 2-(4-циклопропилметокси-3-йод-5-трифторметилфенил)-4-метилпентановой кислоты
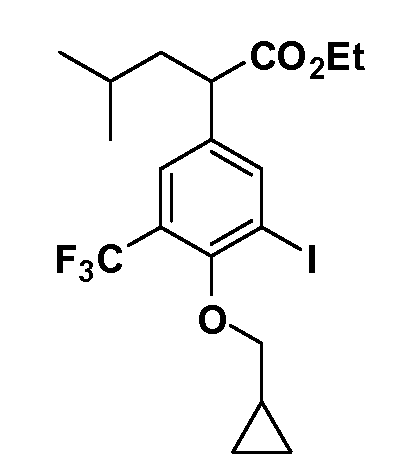
К раствору моногидратап-толуолсульфоновой кислоты (0,308 г, 1,62 ммоль) в ацетонитриле (2,3 мл) добавляли этиловый эфир 2-(3-амино-4-циклопропилметокси-5-трифторметилфенил)-4-метилпентановой кислоты (0,20 г, 0,54 ммоль). Полученную суспензию соли амина охлаждали в ванне со льдом. Раствор нитрита натрия (0,0745 г, 1,08 ммоль) в воде (0,32 мл) добавляли по каплям с последующим добавлением раствора KI (1,79 г, 10,8 ммоль) в воде (2,0 мл). Реакционную смесь перемешивали в ванне со льдом в течение одного часа и затем при температуре окружающей среды в течение одного часа. TLC показала, что реакция была завершена. Добавляли воду (20 мл) и затем водный раствор бикарбоната натрия (1 M), чтобы установить рН 8. Этилацетат (20 мл) добавляли для экстракции. Органический слой промывали водным растворомNa2S2O4 (10%, 20 мл) и солевым раствором (20 мл), высушивали надNa2SO4 и концентрировали при пониженном давлении, получая коричневое масло, которое очищали флэш-хроматографией на силикагеле, элюируя смесью гептан/этилацетат (30:1), получая этиловый эфир 2-(4-циклопропилметокси-3-йод-5-трифторметилфенил)-4-метилпентановой кислоты (0,15 г, 57%) в форме желтоватого масла:1H ЯМР (300 МГц,CDCl3): δ 7,93 (с, 1H), 7,52 (с, 1H), 4,11 (м, 2H), 3,83 (д, 2Н,J=7,2 Гц), 3,59 (т, 1Н,J=7,5 Гц), 1,95 (м, 1H), 1,50 (м, 3H), 1,22 (т, 3Н,J=6,9 Гц), 0,91 (д, 3Н,J=6,3 Гц), 0,90 (д, 3Н,J=6,3 Гц), 0,64 (м, 2H), 0,43 (м, 2H);13C ЯМР (75 МГц,CDCl3): δ 172,96, 155,55, 142,66, 136,98, 126,94 (кв.,J=5 Гц), 124,87 (кв.,J=30 Гц), 122,64 (кв., J=272 Гц), 93,73, 79,79, 61,06, 48,53, 42,65, 26,01, 22,39, 14,16, 10,75, 3,36.
Стадия 9
этиловый эфир 2-(6-циклопропилметокси-5,4'-бис-трифторметил-бифенил-3-ил)-4-метилпентановой кислоты
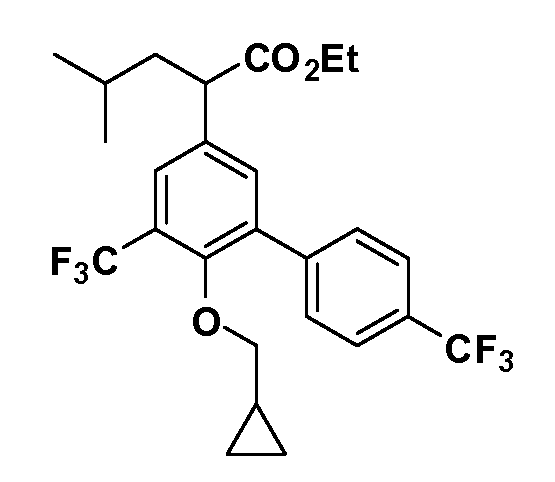
Смесь этилового эфира 2-(4-циклопропилметокси-3-йод-5-трифторметилфенил)-4-метилпентановой кислоты (0,14 г, 0,29 ммоль), 4-(трифторметил)бензолбороновой кислоты (0,089 г, 0,47 ммоль), Pd(dppf)Cl2 (0,023 г, 0,031 ммоль) и водного раствора карбоната натрия (2 М, 0,31 мл, 0,62 ммоль) в 1,4-диоксане (4 мл) дегазировали и нагревали при 100°C в течение десяти дней. Реакционную смесь концентрировали при пониженном давлении; остаток обрабатывали водой (30 мл) и этилацетатом (30 мл). Органический слой промывали солевым раствором (30 мл), высушивали над сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на силикагеле, элюируя смесью гептан/этилацетат (100:1), получая бесцветное масло (0,11 г), которое затем очищали флэш-хроматографией на силикагеле 100C18-обратная фаза с элюированием смесью MeOH/H2O (от 5:1 до 20:3), получая этиловый эфир 2-(6-циклопропилметокси-5,4'-бис-трифторметил-бифенил-3-ил)-4-метилпентановой кислоты (0,05 г, 34%) в форме твердого вещества белого цвета:1H ЯМР (300 МГц,CDCl3/TMS): δ 7,73 (м, 4H), 7,58 (с, 1H), 7,48 (с, 1H), 4,13 (м, 2H), 3,70 (т, 1Н,J=7,5 Гц), 3,27 (д, 2Н,J=7,2 Гц), 2,00 (м, 1H), 1,67 (м, 2H), 1,51 (м, 1H), 1,25 (т, 3Н,J=7,2 Гц), 0,93 (м, 8H), 0,45 (д, 2Н,J=7,5 Гц);13C ЯМР (75 МГц,CDCl3/TMS): δ 173,35, 153,80, 140,99, 135,48, 135,40, 134,05, 130,05 (кв.,J=32 Гц), 129,88 (кв.,J=32 Гц), 129,42, 126,41 (кв.,J=5 Гц), 125,33 (кв.,J=4 Гц), 124,06 (кв.,J=270 Гц), 123,48 (кв.,J=270 Гц), 79,47, 60,98, 49,21, 42,87, 26,19, 22,46, 14,22.
Стадия 10
2-(6-циклопропилметокси-5,4'-бис-трифторметил-бифенил-3-ил)-4-метилпентановая кислота
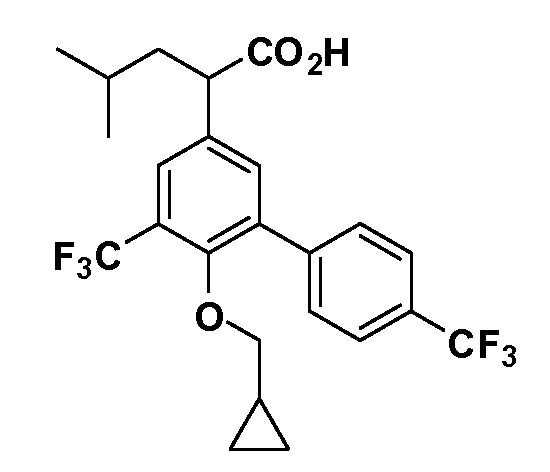
Смесь этилового эфира 2-(6-циклопропилметокси-5,4'-бис-трифторметил-бифенил-3-ил)-4-метилпентановой кислоты (0,04 г, 0,08 ммоль) и водного раствора KOH (1,4 М, 0,4 мл) в этаноле (5 мл) перемешивали при температуре окружающей среды в течение двух дней. После удаления растворителя при пониженном давлении, остаток разбавляли водой (30 мл), подкисляли 1 н. HCl до рН 1 и затем экстрагировали этилацетатом (30 мл). Органический слой высушивали над сульфатом натрия, концентрировали при пониженном давлении и высушивали сублимацией в течение ночи, получая желаемую карбоновую кислоту, представляющую собой 2-(6-циклопропилметокси-5,4'-бис-трифторметил-бифенил-3-ил)-4-метилпентановую кислоту (0,04 г, 100%) в форме твердого вещества белого цвета: Т.пл.=148-149°C; HRMS (ESI-TOF): рассчит. для C24H23O3F6Na2 (M-H + 2 Na)+: 519,1341, найдено 519,1366;1H ЯМР (300 МГц,CDCl3/TMS): δ 7,72 (м, 4H), 7,59 (с, 1H), 7,48 (с, 1H), 3,73 (м, 1H), 3,27 (д, 2Н,J=6,9 Гц), 2,02 (м, 1H), 1,69 (м, 1H), 1,56 (м, 1H), 1,28 (м, 1H), 0,94 (м, 8H), 0,46 (м, 2H); протон COOH не наблюдался;13C ЯМР (75 МГц,CDCl3/TMS): δ 178,95, 154,12, 140,82, 135,61, 134,49, 134,24, 130,18 (кв.,J=32 Гц), 129,44 (кв.,J=32 Гц), 129,40, 126,50 (кв.,J=5 Гц), 125,39 (кв.,J=4 Гц), 124,04 (кв.,J=270 Гц), 123,40 (кв.,J=271 Гц), 79,55, 48,91, 42,35, 26,07, 22,49, 22,35, 10,58, 3,15; чистота ВЭЖХ: 95,2%, время удерживания = 11,78 мин.
Пример 754: 2-(4-(бензо[c][1,2,5]оксадиазол-5-ил)-5-(циклопропилметокси)-2-фторфенил)-4-метилпентановая кислота
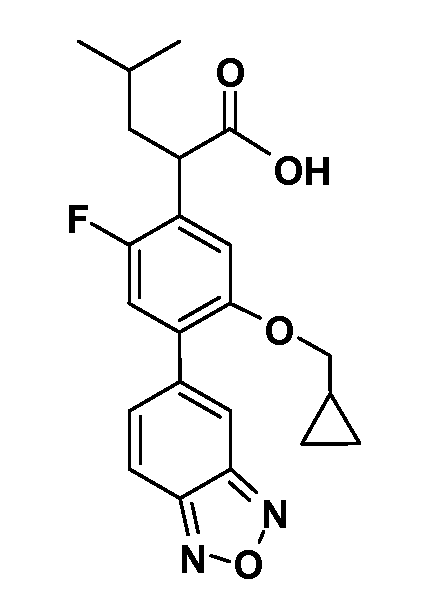
Стадия 1
2-(4-(бензо[c][1,2,5]оксадиазол-5-ил)-5-(циклопропилметокси)-2-фторфенил)-4-метилциклопропилметилпентаноат
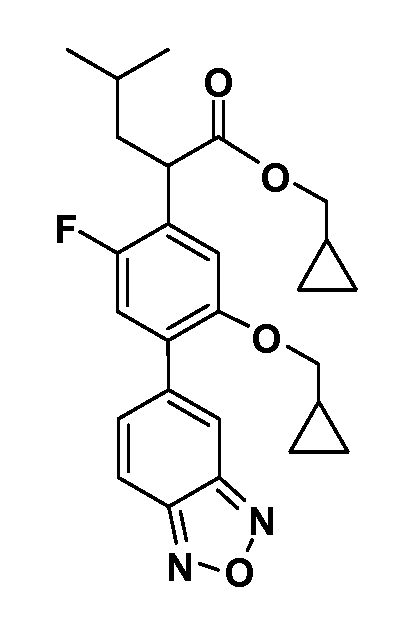
К раствору циклопропилметилового эфира 2-(5-циклопропилметокси-2-фтор-4-йодфенил)-4-метилпентановой кислоты (0,2 г, 0,43 ммоль) в DME (безводный, 10 мл) в атмосфере аргона добавляли 4-трифторметилфенилбороновую кислоту (0,1 г, 0,53 ммоль), CsF (0,16 г, 1,05 ммоль) и Pd(PPh3)4 (0,015 г, 0,013 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 18 часов (масляная баня, 100°C). Добавляли смесь воды и EtOAc (15 мл/15 мл), и слои разделяли. Органическую фазу высушивали надMgSO4 и упаривали, получая сырое желтое масло, которое очищали хроматографией на колонке с градиентом силикагеля, используя гептан-EtOAc (от 60:1 до 9:1), получая 2-(4-(бензо[c][1,2,5]оксадиазол-5-ил)-5-(циклопропилметокси)-2-фторфенил)-4-метилциклопропилметилпентаноат в форме желтоватого масла (0,18 г, 90%).1H ЯМР (300 МГц,CDCl3/TMS): δ 7,70-7,64 (м, 4H), 7,05 (д,J=10,4 Гц, 1H), 7,01 (д,J=6,1 Гц, 1H), 4,09 (т,J=7,7 Гц, 1H), 4,02-3,87 (м, 2H), 3,78 (д,J=6,6 Гц, 2H), 2,04-1,90 (м, 1H), 1,74-1,65 (м, 1H), 1,60-1,45 (м, 1H), 1,25-1,05 (м, 2H), 0,95 (д,J=6,3 Гц, 6H), 0,60-0,40 (м, 4H), 0,30-0,10 (м, 4H).13C ЯМР (75 МГц,CDCl3/TMS): δ 173,5, 154,3 (д,1JCF = 239,7 Гц), 151,9, 140,7, 132,0, 129,5, 126,6 (д,2JCF = 16,9 Гц), 124,8 (кв.,3JCF = 3,7 Гц), 124,0 (кв.,1JCF = 271,6 Гц), 117,0 (д,2JCF = 24,6 Гц), 113,6, 74,1, 69,6, 41,1, 41,5, 26,1, 22,7, 22,2, 10,2, 9,8, 3,2.
Стадия 2
2-(4-бензо[1,2,5]оксадиазол-5-ил-5-циклопропилметокси-2-фторфенил)-4-метилпентановая кислота
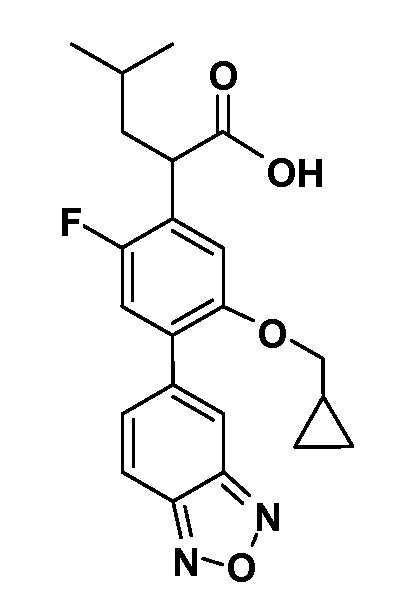
2-(4-(бензо[c][1,2,5]оксадиазол-5-ил)-5-(циклопропилметокси)-2-фторфенил)-4-метилциклопропилметилпентаноат (0,14 г, 0,29 ммоль) растворяли в смеси EtOH/H2O (9 мл/1 мл) и добавляли KOH (0,3 г). Реакционную смесь нагревали с обратным холодильником в течение 2 часов, и после охлаждения растворитель выпаривали. Затем добавляли 6н. HCl, чтобы установить рН 5, и реакционную смесь экстрагировали EtOAc (3×10 мл). Объединенные органические фазы высушивали надMgSO4 и упаривали при пониженном давлении, получая бесцветное масло. Очистка хроматографией на колонках с градиентом силикагеля с использованием смеси гептан-EtOAc (от 50:1 до 9:1) дала 2-(4-(бензо[c][1,2,5]оксадиазол-5-ил)-5-(циклопропилметокси)-2-фторфенил)-4-метилпентановую кислоту в форме твердого вещества белого цвета (0,12 г, количественные); чистая часть (0,03 г, 25%); белые микрокристаллы: Т.пл.=110-111°C,1H ЯМР (300 МГц,CDCl3/TMS): δ 8,99 (ушир.с, 1H), 7,66 (ушир.с, 4H), 7,05 (д,J=9,9 Гц, 1H), 6,94 (д,J=5,2 Гц, 1H), 4,08 (т,J=7,7 Гц, 1H), 3,76 (д,J=6,6 Гц, 2H), 2,04-1,90 (м, 1H), 1,81-1,65 (м, 1H), 1,60-1,45 (м, 1H), 1,32-1,05 (м, 2H), 0,94 (д,J=6,0 Гц, 6H), 0,54 (д,J=7,4 Гц, 2H), 0,24 (д,J=3,9 Гц, 2H).13C ЯМР (75 МГц,CDCl3/TMS): δ 179,2, 154,7 (д,1JCF = 239,8 Гц), 152,0, 140,6, 132,0, 129,9, 129,6, 125,7 (д,2JCF = 16,2 Гц), 124,8 (кв.,3JCF = 3,6 Гц), 124,0 (кв.,1JCF = 270 Гц), 117,2 (д,2JCF = 25,2 Гц), 113,9, 74,2, 41,3, 29,8, 25,9, 22,8, 22,1, 10,3, 3,2.
Пример 2959: 2-(4-бензо[1,2,5]оксадиазол-5-ил-3-хлор-5-циклопропилметоксифенил)-4-метилпентановая кислота
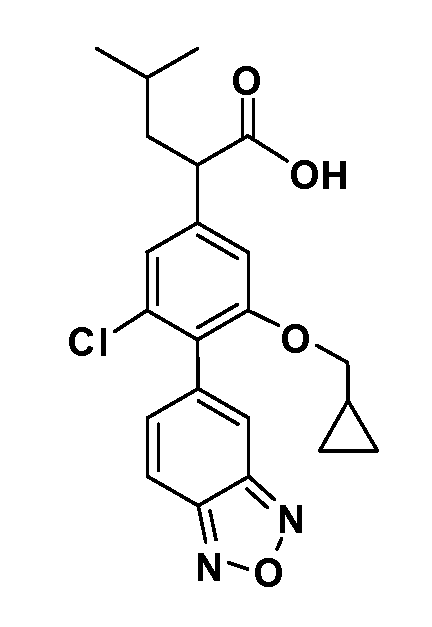
Стадия 1
диэтиловый эфир 2-(3-фтор-4-нитрофенил)-2-изобутилмалоновой кислоты
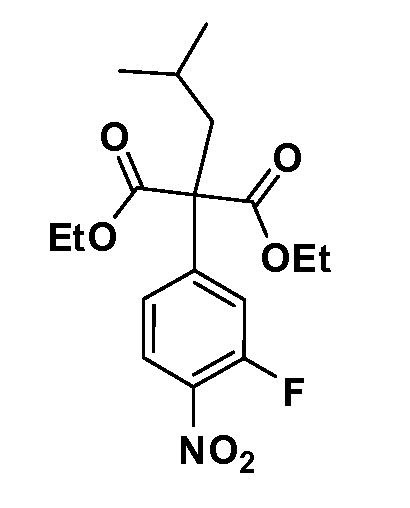
К раствору диэтилового эфира 2-изобутилмалоновой кислоты (75,0 г, 0,35 моль) в DMF (200 мл) добавляли гидрид натрия (60% в минеральном масле, 13,0 г, 0,57 моль) за 20 мин при 0°C. Реакционную смесь перемешивали при 0°C в течение 0,5 часа, затем нагревали до 25°C. Реакционную смесь снова охлаждали до 0°C, и раствор 2,4-дифторнитробензол (50,0 г, 0,31 моль) в DMF (150 мл) добавляли по каплям при 0°C. Реакционную смесь перемешивали при 25°C в течение 16 часов. После охлаждения реакционную смесь лили в воду со льдом (200 мл) и экстрагировали EtOAc (3×100 мл). Объединенные органические фазы промывали водой (3×100 мл), солевым раствором (100 мл) и высушивали (MgSO4). Выпаривание растворителя при пониженном давлении дало коричневое масло. Сырой продукт (92,0 г, 82%) использовали для следующей стадии без очистки.1H ЯМР (300 МГц,CDCl3/TMS): δ 8,03 (т,J=8,4 Гц, 1H), 7,70 (дд,J=12,9, 1,7 Гц, 1H), 7,47 (д,J=8,5 Гц, 1H), 4,25-4,18 (м, 4H), 2,28 (д,J=6,3 Гц, 2H), 1,54-1,45 (м, 1H), 1,25 (т,J=7,0 Гц, 6H), 0,82 (д,J=7,0 Гц, 6H);13C ЯМР (75 МГц,CDCl3/TMS): δ 169,2, 154,5 (д,1JCF = 263,1 Гц), 146,9 (д, неразделенный), 125,3, 124,1 (д,3JCF = 3,6 Гц), 118,6 (д,2JCF = 23,3 Гц), 62,0, 60,3, 44,1, 24,7, 23,6, 13,9.
Стадия 2
2-(3-фтор-4-нитрофенил)-4-метилпентановая кислота
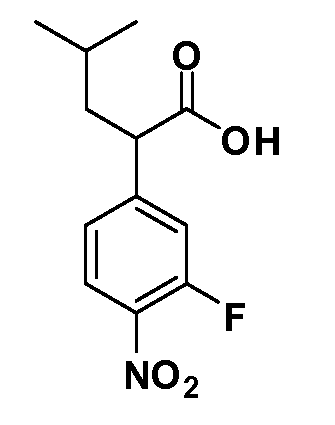
Диэтиловый эфир 2-(3-фтор-4-нитрофенил)-2-изобутилмалоновой кислоты (92,0 г, 0,26 моль) растворяли в смеси AcOH/H2O/H2SO4 (96%) (500 мл/200 мл/70 мл), и реакционную смесь нагревали с обратным холодильником в течение 24 часов. После охлаждения и упаривания добавляли воду (300 мл). Реакционную смесь экстрагировали EtOAc (3×100 мл). Объединенные органические фазы промывали водой (3×100 мл), солевым раствором (100 мл) и высушивали(MgSO4). Выпаривание растворителя при пониженном давлении дало коричневое масло (61 г, количественный), которое использовали для следующей стадии без очистки.1H ЯМР (300 МГц,CDCl3/TMS): δ 8,07-8,01 (м, 1H), 7,33-7,26 (м, 2H), 3,79-3,73 (м, 1H), 2,05-1,95 (м, 1H), 1,76-1,66 (м, 1H), 1,52-1,43 (м, 1H), 0,95-0,92 (м, 6H);13C ЯМР (75 МГц,CDCl3/TMS): δ 178,3, 156,0 (д,1JCF = 232,5 Гц), 147,0, 136,0, 126,2, 124,3, 118,1 (д,2JCF = 30 Гц), 49,3, 42,0, 25,8, 22,4, 22,0.
Стадия 3
этиловый эфир 2-(3-фтор-4-нитрофенил)-4-метилпентановой кислоты
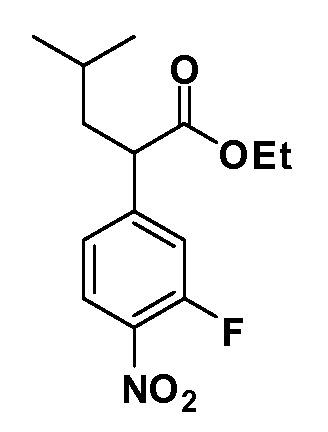
2-(3-Фтор-4-нитрофенил)-4-метилпентановую кислоту (29,0 г, 0,12 ммоль) растворяли в EtOH (100 мл) и добавляли H2SO4 (96%, 5 мл). Реакционную смесь нагревали с обратным холодильником в течение 3 часов и выпаривали растворитель. Добавляли воду (100 мл), и реакционную смесь экстрагировали EtOAc (3×100 мл). Объединенные органические фазы промывали насыщенным растворомNaHCO3 (50 мл), водой (100 мл) и солевым раствором (100 мл) и затем высушивали надMgSO4. Выпаривание растворителя при пониженном давлении дало коричневое масло (31,0 г, 97%), которое использовали для следующей стадии без очистки.1H ЯМР (300 МГц,CDCl3/TMS): δ 8,03 (т,J=8,4 Гц, 1H), 7,33-7,26 (м, 2H), 4,17-4,11 (м, 2H), 3,73 (т,J=7,6 Гц, 1H), 2,10-1,94 (м, 1H), 1,71-1,62 (м, 1H), 1,51-1,42 (м, 1H), 1,25 (т,J=7,0 Гц, 3H), 0,95-0,92 (м, 6H);13C ЯМР (75 МГц,CDCl3/TMS): δ 172,2, 155,3 (д,1JCF = 265,0 Гц), 148,3 (д,3JCF = 8,4 Гц), 136,5, 126,1, 124,1 (д,3JCF = 3,6 Гц), 117,8 (д,2JCF = 21,6 Гц), 61,3, 49,4, 42,3, 25,9, 22,5, 22,1, 14,1.
Стадия 4
циклопропилметиловый эфир 2-(3-циклопропилметокси-4-нитрофенил)-4-метилпентановой кислоты
Циклопропилметанол (80,0 г, 1,11 моль) обрабатывали n-BuLi (2,5 М в гексане, 9,1 г, 57 мл, 0,14 моль) при температуре в пределах от -15 до 0°C. Реакционную смесь перемешивали в течение 1 часа при 25°C. Затем при 25°C добавляли раствор этилового эфира 2-(3-фтор-4-нитрофенил)-4-метилпентановой кислоты в циклопропилметаноле (30 мл), и реакционную смесь перемешивали в течение 16 часов. Добавляли воду (100 мл), и реакционную смесь экстрагировали EtOAc (3×100 мл). Объединенные органические фазы промывали водой (3×100 мл), солевым раствором (100 мл) и высушивали (MgSO4). Выпаривание растворителя при пониженном давлении дало коричневое масло, которое очищали хроматографией на колонках с градиентом силикагеля при помощи смеси гептан-EtOAc (от 9:1 до 4:1), получая циклопропилметиловый эфир 2-(3-циклопропилметокси-4-нитрофенил)-4-метилпентановой кислоты в форме желтого масла (34,0 г, 93%).1H ЯМР (300 МГц,CDCl3/TMS): δ 7,78 (д,J=8,4 Гц, 1H), 7,06 (с, 1H), 6,97 (д,J=8,4 Гц, 1H), 4,00-3,83 (м, 4H), 3,69 (т,J=8,0 Гц, 1H), 2,07-1,92 (м, 1H), 1,69-1,60 (м, 1H), 1,52-1,42 (м, 1H), 1,32-1,20 (м, 1H), 1,19-1,00 (м, 1H), 0,92 (д,J=6,3 Гц, 6H), 0,68-0,62 (м, 2H), 0,56-0,48 (м, 2H), 0,42-0,38 (м, 2H), 0,26-0,21 (м, 2H);13C ЯМР (75 МГц,CDCl3/TMS): δ 172,9, 152,3, 146,2, 138,8, 125,6, 119,8, 114,4, 74,2, 69,8, 49,8, 42,6, 26,0, 22,5, 22,2, 10,0, 9,7, 3,3.
Стадия 5
циклопропилметиловый эфир 2-(4-амино-3-циклопропилметоксифенил)-4-метилпентановой кислоты
Циклопропилметиловый эфир 2-(3-циклопропилметокси-4-нитрофенил)-4-метилпентановой кислоты (34,0 г, 94,2 ммоль) растворяли в AcOH (300 мл) и воде (20 мл). Затем частями добавляли порошок цинка (60,0 г, 923 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 1 часа, и после охлаждения осадок фильтровали. Растворитель выпаривали и добавляли воду (150 мл). Реакционную смесь экстрагировали EtOAc (3×100 мл), и объединенные органические фазы промывали водой (3×100 мл) и солевым раствором (100 мл). Высушивание органической фазы осуществляли с использованием сульфата магния. Выпаривание растворителя дало сырой продукт в форме коричневого масла, которое очищали хроматографией на колонках с градиентом силикагеля при помощи смеси гептан-EtOAc, получая циклопропилметиловый эфир 2-(4-амино-3-циклопропилметоксифенил)-4-метилпентановой кислоты в форме желтого масла (23 г, 75%).1H ЯМР (300 МГц,CDCl3/TMS): δ 6,73-6,61 (м, 3H), 3,94-3,78 (м, 6H), 3,53 (т,J=7,7 Гц, 1H), 1,94-1,85 (м, 1H), 1,65-1,56 (м, 1H), 1,52-1,43 (м, 1H), 1,28-1,18 (м, 1H), 1,11-1,03 (м, 1H), 0,90 (д,J=6,6 Гц, 6H), 0,64-0,58 (м, 2H), 0,53-0,47 (м, 2H), 0,36-0,33 (м, 2H), 0,24-0,21 (м, 2H);13C ЯМР (75 МГц,CDCl3/TMS): δ 174,6, 146,4, 135,3, 129,3, 120,5, 114,6, 111,2, 73,1, 69,0, 49,2, 42,7, 25,8, 22,6, 22,4, 10,4, 9,8, 3,2.
Стадия 6
циклопропилметиловый эфир 2-(4-амино-3-хлор-5-циклопропилметоксифенил)-4-метилпентановой кислоты
Циклопропилметиловый эфир 2-(4-амино-3-циклопропилметоксифенил)-4-метилпентановой кислоты (16,3 г, 49,1 ммоль) растворяли в хлороформе (200 мл) и добавляли N-хлорсукцинимид (5,3 г, 0,75 экв., 39,6 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 1 часа и после охлаждения обрабатывали 10%-ным раствором карбоната калия (100 мл). Реакционную смесь экстрагировали EtOAc (3×50 мл), и объединенные органические фазы высушивали над сульфатом магния. Выпаривание растворителя дало сырой продукт в форме коричневого масла, которое очищали хроматографией на колонках с градиентом силикагеля при помощи смеси гептан-EtOAc, получая циклопропилметиловый эфир 2-(4-амино-3-хлор-5-циклопропилметоксифенил)-4-метилпентановой кислоты в форме желтого масла (5 г, 36%).1H ЯМР (300 МГц,CDCl3/TMS): δ 6,85 (с, 1H), 6,66 (с, 1H), 3,95-3,80 (м, 4H), 3,49 (т,J=7,7 Гц, 1H), 1,94-1,82 (м, 1H), 1,63-1,52 (м, 1H), 1,50-1,40 (м, 1H), 1,28-1,18 (м, 1H), 1,11-1,03 (м, 1H), 0,90 (д,J=6,6 Гц, 6H), 0,66-0,58 (м, 2H), 0,53-0,47 (м, 2H), 0,37-0,32 (м, 2H), 0,25-0,20 (м, 2H);13C ЯМР (75 МГц,CDCl3/TMS): δ 174,2, 146,8, 132,6, 128,7, 120,6, 118,3, 109,4, 73,6, 69,3, 49,0, 42,6, 25,9, 22,6, 22,4, 10,4, 9,8, 3,3.
Стадия 7
циклопропилметиловый эфир 2-(3-хлор-5-циклопропилметокси-4-йодфенил)-4-метилпентановой кислоты
Циклопропилметиловый эфир 2-(4-амино-3-хлор-5-циклопропилметоксифенил)-4-метилпентановой кислоты (5,0 г, 13,7 ммоль) растворяли в смеси EtOH/H2O/H2SO4 (96%) (65 мл/100 мл/2,5 мл) и реакционную смесь охлаждали до 0°C. РастворNaNO2 (0,95 г, 13,7 ммоль) в воде (5 мл) добавляли по каплям при 0°C, и реакционную смесь перемешивали в течение 30 мин. Раствор KI (7,0 г, 42,2 ммоль) в воде (20 мл) добавляли по каплям при 0°C. Реакционную смесь нагревали до 50-60°C в течение 2,5 часов. Реакционную смесь экстрагировали EtOAc (3×50 мл). Органические слои объединяли и промывали 10%-ным раствором тиосульфата натрия (30 мл), затем солевым раствором (30 мл). Органическую фазу высушивали надMgSO4, и растворитель выпаривали, получая сырое коричневое масло, которое очищали хроматографией на колонках с градиентом силикагеля при помощи смеси гептан-EtOAc (от 20:1 до 9:1), получая циклопропилметиловый эфир 2-(3-хлор-5-циклопропилметокси-4-йодфенил)-4-метилпентановой кислоты в форме желтого масла (4,0 г, 62%).1H ЯМР (300 МГц,CDCl3/TMS): δ 7,07 (с, 1H), 6,66 (с, 1H), 3,95-3,80 (м, 4H), 3,58 (т,J=7,7 Гц, 1H), 1,96-1,89 (м, 1H), 1,66-1,52 (м, 1H), 1,50-1,40 (м, 1H), 1,28-1,18 (м, 1H), 1,11-1,03 (м, 1H), 0,91 (д,J=6,6 Гц, 6H), 0,67-0,61 (м, 2H), 0,56-0,50 (м, 2H), 0,45-0,40 (м, 2H), 0,26-0,21 (м, 2H);13C ЯМР (75 МГц,CDCl3/TMS): δ 173,2, 159,2, 141,6, 139,4, 121,4, 109,8, 90,4, 74,0, 69,7, 49,4, 42,5, 26,0, 22,6, 22,3, 10,2, 9,8, 3,3.
Стадия 8
циклопропилметиловый эфир 2-(4-бензо[1,2,5]оксадиазол-5-ил-3-хлор-5-циклопропилметоксифенил)-4-метилпентановой кислоты
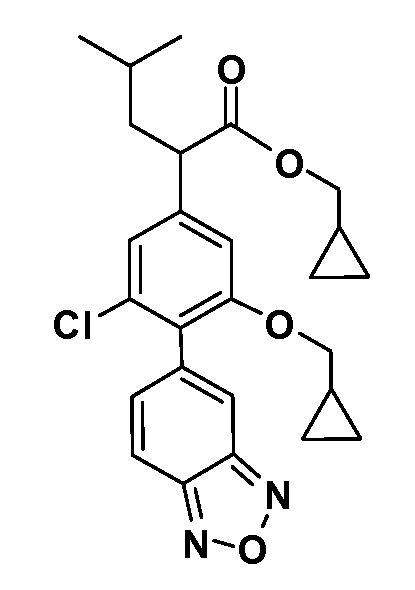
К раствору циклопропилметилового эфира 2-(3-хлор-5-циклопропилметокси-4-йодфенил)-4-метилпентановой кислоты (0,27 г, 0,57 ммоль) в DME (безводный, 10 мл) в атмосфере аргона добавляли 5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-бензо[1,2,5]оксадиазол (0,15 г, 0,61 ммоль), CsF (0,2 г, 1,32 ммоль) и [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (0,021 г, 0,029 ммоль,для завершения реакции необходимо 0,06 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 18 часов (масляная баня, 100°C). Добавляли смесь вода/EtOAc (15 мл/15 мл), и слои разделяли. Органическую фазу высушивали надMgSO4, затем упаривали, получая сырое желтое масло, которое очищали хроматографией на колонках с градиентом силикагеля, используя гептан-EtOAc (от 20:1 до 9:1), получая циклопропилметиловый эфир 2-(4-бензо[1,2,5]оксадиазол-5-ил-3-хлор-5-циклопропилметоксифенил)-4-метилпентановой кислоты (0,11 г, 41%) в форме желтоватого масла.1H ЯМР (300 МГц,CDCl3/TMS): δ 7,83 (д,J=9,3 Гц, 1H), 7,77 (с, 1H), 7,36-7,33 (м, 1H), 7,11 (с, 1H), 6,91 (с, 1H), 4,02-3,81 (м, 4H), 3,67 (т,J=7,7 Гц, 1H), 2,03-1,96 (м, 1H), 1,74-1,65 (м, 1H), 1,60-1,45 (м, 1H), 1,20-1,05 (м, 2H), 0,96 (д,J=6,3 Гц, 6H), 0,57-0,47 (м, 4H), 0,28 (ушир.с, 2H), 0,19 (ушир.с, 2H).13C ЯМР (75 МГц,CDCl3/TMS): δ 173,4, 157,0, 149,2, 148,3, 142,0, 138,7, 135,4, 133,5, 126,4, 121,6, 117,4, 114,9, 110,6, 73,4, 69,8, 49,8, 42,8, 26,1, 22,5, 22,4, 10,0, 9,8, 3,3, 3,1.
Стадия 9
2-(4-бензо[1,2,5]оксадиазол-5-ил-3-хлор-5-циклопропилметоксифенил)-4-метилпентановая кислота
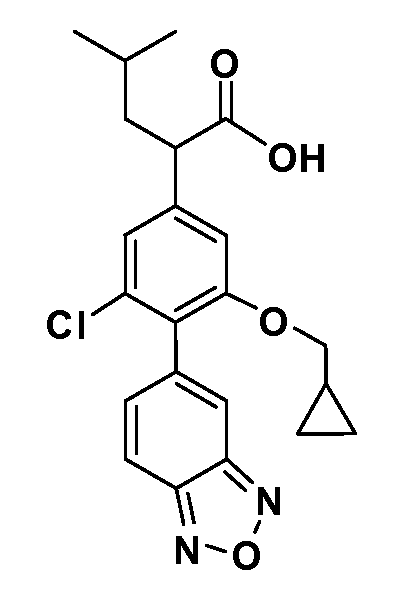
Циклопропилметиловый эфир 2-(4-бензо[1,2,5]оксадиазол-5-ил-3-хлор-5-циклопропилметоксифенил)-4-метилпентановой кислоты (0,11 г, 0,23 ммоль) растворяли в смеси EtOH/H2O (9 мл/1 мл) и добавляли KOH (0,1 г, 1,76 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 2 часов, и после охлаждения растворитель выпаривали. Затем добавляли 6н. HCl, чтобы установить рН 5, и реакционную смесь экстрагировали EtOAc (3×10 мл). Объединенные органические фазы высушивали надMgSO4 и упаривали при пониженном давлении, получая 2-(4-бензо[1,2,5]оксадиазол-5-ил-3-хлор-5-циклопропилметоксифенил)-4-метилпентановую кислоту в форме желтого масла (0,068 г, 70%).1H ЯМР (300 МГц,CDCl3/TMS): δ 8,40 (ушир.с, 1H), 7,70 (д,J=9,3 Гц, 1H), 7,62 (с, 1H), 7,19 (д,J=9,3 Гц, 1H), 6,97 (с, 1H), 6,73 (с, 1H), 3,67 (д,J=6,6 Гц, 2H), 3,52 (т,J=7,7 Гц, 1H), 1,90-1,81 (м, 1H), 1,62-1,53 (м, 1H), 1,50-1,39 (м, 1H), 0,98-0,68 (м, 1H), 0,81 (д,J=6,1 Гц, 6H), 0,37-0,31 (м, 2H), 0,15-0,10 (м, 2H).13C ЯМР (75 МГц,CDCl3/TMS): δ 179,1, 157,1, 149,1, 148,3, 141,0, 138,6, 135,3, 133,7, 126,8, 121,6, 117,4, 115,0, 110,9, 73,4, 49,4, 41,9, 25,9, 22,6, 22,3, 10,0, 3,1.
Пример 2995: 2-(4-бензо[1,2,5]тиадиазол-5-ил-3-хлор-5-циклопропилметоксифенил)-4-метилпентановая кислота
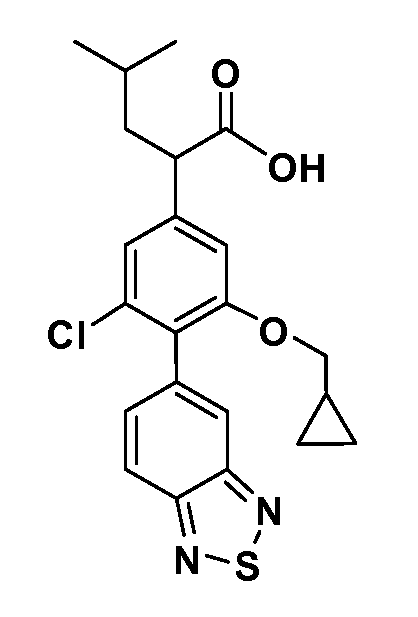
Стадия 1
циклопропилметиловый эфир 2-(4-бензо[1,2,5]тиадиазол-5-ил-3-хлор-5-циклопропилметоксифенил)-4-метилпентановой кислоты
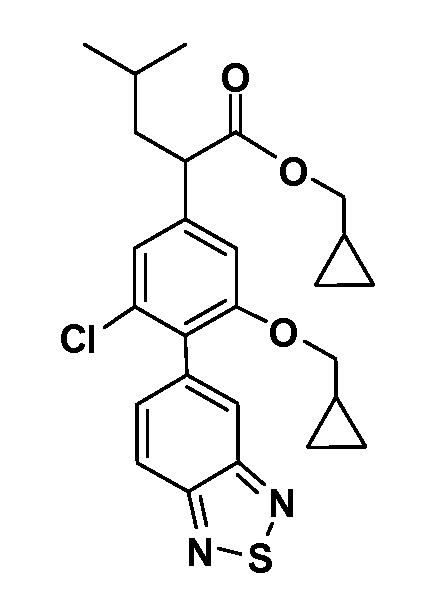
К раствору циклопропилметилового эфира 2-(3-хлор-5-циклопропилметокси-4-йодфенил)-4-метилпентановой кислоты (0,18 г, 0,38 ммоль) в DME (безводный, 10 мл) в атмосфере аргона добавляли 5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-бензо[1,2,5]тиодиазол (0,15 г, 0,57 ммоль), CsF (0,14 г, 0,92 ммоль) и [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (0,02 г, 0,027 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 18 часов (масляная баня, 100°C). Добавляли смесь воды и EtOAc (15 мл/15 мл), и слои разделяли. Объединенные органические фазы высушивали надMgSO4 и упаривали, получая сырое желтое масло, которое очищали хроматографией на колонках с градиентом силикагеля при помощи смеси гептан-EtOAc (от 20:1 до 9:1), получая циклопропилметиловый эфир 2-(4-бензо[1,2,5]тиадиазол-5-ил-3-хлор-5-циклопропилметоксифенил)-4-метилпентановой кислоты (0,08 г, 50%) в форме желтого масла.1H ЯМР (300 МГц,CDCl3/TMS): δ 7,83 (д,J=9,3 Гц, 1H), 7,77 (с, 1H), 7,36-7,33 (м, 1H), 7,11 (с, 1H), 6,91 (с, 1H), 4,02-3,81 (м, 4H), 3,67 (т,J=7,7 Гц, 1H), 2,03-1,96 (м, 1H), 1,74-1,65 (м, 1H), 1,60-1,45 (м, 1H), 1,20-1,05 (м, 2H), 0,96 (д,J=6,3 Гц, 6H), 0,57-0,47 (м, 4H), 0,28 (ушир.с, 2H), 0,19 (ушир.с, 2H).13C ЯМР (75 МГц,CDCl3/TMS): δ 173,5, 157,1, 154,7, 154,0, 141,4, 136,8, 133,7, 132,9, 126,9, 122,8, 121,6, 120,0, 110,8, 73,3, 69,7, 49,7, 42,7, 26,1, 22,5, 22,5, 10,0, 9,8, 3,3, 3,1.
Стадия 2
2-(4-бензо[1,2,5]тиадиазол-5-ил-3-хлор-5-циклопропилметоксифенил)-4-метилпентановая кислота
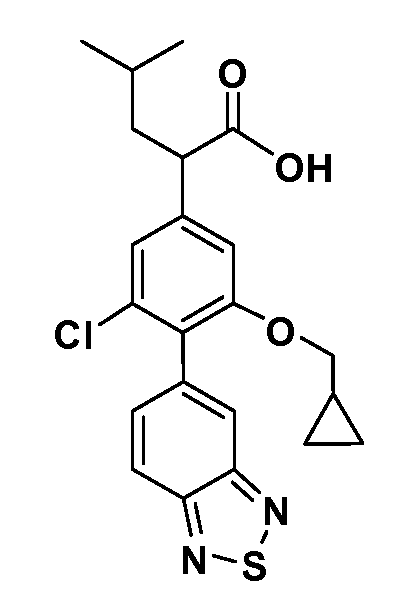
Циклопропилметиловый эфир 2-(4-бензо[1,2,5]тиадиазол-5-ил-3-хлор-5-циклопропилметоксифенил)-4-метилпентановой кислоты (0,08 г, 0,19 ммоль) растворяли в смеси EtOH и H2O (9 мл/1 мл), и добавляли KOH (0,1 г, 1,76 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 2 часов, и после охлаждения растворитель выпаривали. Затем добавляли 6н. HCl, чтобы установить рН 5, и реакционную смесь экстрагировали EtOAc (3×10 мл). Объединенные органические фазы высушивали надMgSO4 и упаривали при пониженном давлении, получая 2-(4-бензо[1,2,5]тиадиазол-5-ил-3-хлор-5-циклопропилметоксифенил)-4-метилпентановую кислоту в форме желтого масла (0,038 г, 55%).1H ЯМР (300 МГц,CDCl3/TMS): δ 8,02 (д,J=9,0 Гц, 1H), 7,96 (с, 1H), 7,53 (д,J=9,0 Гц, 1H), 7,13 (с, 1H), 6,89 (с, 1H), 3,81 (д,J=6,4 Гц, 2H), 3,68 (т,J=7,6 Гц, 1H), 2,04-1,96 (м, 1H), 1,78-1,69 (м, 1H), 1,63-1,55 (м, 1H), 1,10-1,00 (м, 1H), 0,97 (д,J=6,4 Гц, 6H), 0,50-0,39 (м, 2H), 0,22-0,12 (м, 2H).13C ЯМР (75 МГц,CDCl3/TMS): δ 179,1, 157,2, 154,6, 154,0, 140,5, 136,7, 134,0, 132,9, 127,8, 122,9, 121,6, 120,1, 111,0, 73,4, 49,4, 42,0, 25,9, 22,6, 22,3, 10,0, 3,1.
Пример 1904: 2-(2-хлор-6-циклопропилметокси-4'-трифторметил-бифенил-4-ил)-4-метилпентановая кислота
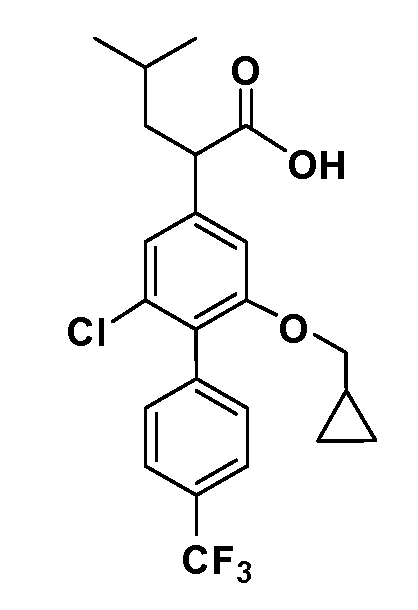
Стадия 1
циклопропилметиловый эфир 2-(2-хлор-6-циклопропилметокси-4'-трифторметил-бифенил-4-ил)-4-метилпентановой кислоты
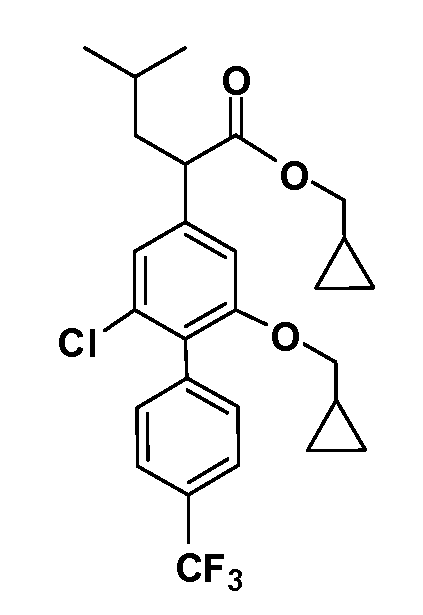
К раствору циклопропилметилового эфира 2-(3-хлор-5-циклопропилметокси-4-йодфенил)-4-метилпентановой кислоты (0,09 г, 0,19 ммоль) в DME (безводный, 10 мл) в атмосфере аргона добавляли 4-трифторметилфенилбороновую кислоту (0,04 г, 0,2 ммоль), CsF (0,07 г, 0,46 ммоль) и [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (0,06 г, 0,08 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 18 часов (масляная баня, 100°C). Добавляли смесь воды и EtOAc (15 мл/15 мл), и слои разделяли. Органическую фазу высушивали надMgSO4, затем упаривали, получая сырое желтое масло, которое очищали хроматографией на колонках с градиентом силикагеля при помощи смеси гептан-EtOAc (от 20:1 до 9:1), получая циклопропилметиловый эфир 2-(2-хлор-6-циклопропилметокси-4'-трифторметил-бифенил-4-ил)-4-метилпентановой кислоты (0,063 г, 70%) в форме желтоватого масла.1H ЯМР (300 МГц,CDCl3/TMS): δ 7,66 (д,J=8,0 Гц, 2H), 7,43 (д,J=8,0 Гц, 2H), 7,08 (с, 1H), 6,88 (с, 1H), 4,01-3,86 (м, 2H), 3,77 (д,J=6,6 Гц, 2H), 3,65 (т,J=7,9 Гц, 1H), 2,04-1,95 (м, 1H), 1,71-1,62 (м, 1H), 1,59-1,48 (м, 1H), 1,20-1,02 (м, 2H), 0,96-0,94 (м, 6H), 0,56-0,46 (м, 4H), 0,27-0,25 (м, 2H), 0,16-0,15 (м, 2H).13C ЯМР (75 МГц,CDCl3/TMS): δ 173,5, 157,0, 141,2, 138,9, 133,6, 130,8 (два сигнала), 127,8, 124,5 (кв.), 124,3 (кв.,1JCF = 271,0 Гц), 121,6, 111,0, 73,3, 69,7, 49,6, 42,7, 26,1, 22,6, 22,4, 10,0, 9,8, 3,3, 3,1.
Стадия 2
2-(2-хлор-6-циклопропилметокси-4'-трифторметил-бифенил-4-ил)-4-метилпентановая кислота
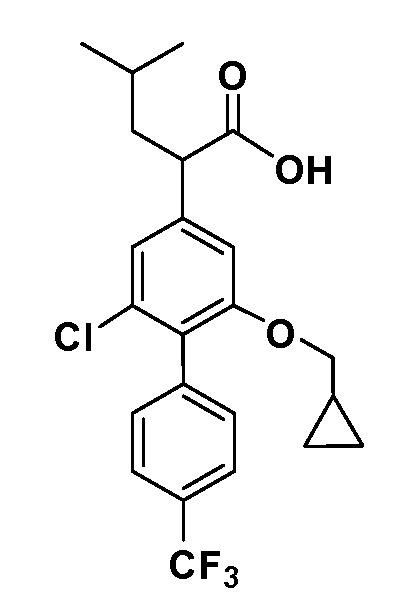
Циклопропилметиловый эфир 2-(2-хлор-6-циклопропилметокси-4'-трифторметил-бифенил-4-ил)-4-метилпентановой кислоты (0,06 г, 0,12 ммоль) растворяли в смеси EtOH и H2O (9 мл/1 мл), и добавляли KOH (0,1 г, 1,76 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 2 часов, и после охлаждения растворитель выпаривали. Затем добавляли 6н. HCl, чтобы установить рН 5, и реакционную смесь экстрагировали EtOAc (3×10 мл). Объединенные органические фазы высушивали надMgSO4 и упаривали при пониженном давлении, получая 2-(2-хлор-6-циклопропилметокси-4'-трифторметил-бифенил-4-ил)-4-метилпентановую кислоту в форме твердого вещества желтоватого цвета (0,046 г, 85%). Т.пл.=115-116°C.1H ЯМР (300 МГц,CDCl3/TMS): δ 7,67 (д,J=8,0 Гц, 2H), 7,42 (д,J=8,0 Гц, 2H), 7,08 (с, 1H), 6,85 (с, 1H), 3,77 (д,J=6,4 Гц, 2H), 3,65 (т,J=7,7 Гц, 1H), 2,04-1,94 (м, 1H), 1,75-1,66 (м, 1H), 1,60-1,52 (м, 1H), 1,15-0,89 (м, 1H), 0,95 (д,J=6,4 Гц, 6H), 0,54-0,40 (м, 2H), 0,20-0,10 (м, 2H).13C ЯМР (75 МГц,CDCl3/TMS): δ 179,0, 157,1, 140,3, 138,8, 133,8, 130,8, 129,3 (кв.), 128,2, 124,6, 124,3 (кв.,1JCF = 271,0 Гц), 121,6, 111,2, 73,4, 49,4, 42,0, 25,9, 22,6, 22,3, 10,0, 3,0.
Пример 3200: 2-(2,4'-дихлор-6-циклопропилметокси-бифенил-4-ил)-4-метилпентановая кислота
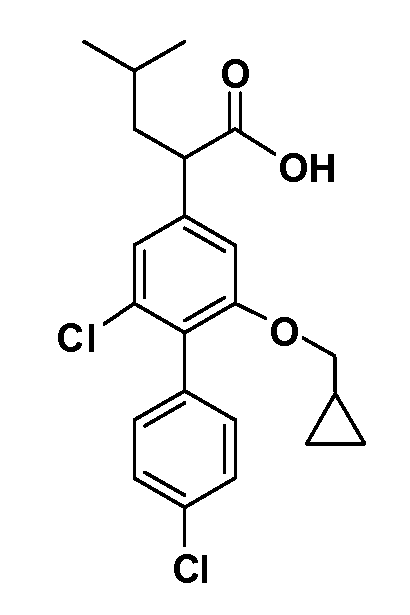
Стадия 1
циклопропилметиловый эфир 2-(2,4'-дихлор-6-циклопропилметокси-бифенил-4-ил)-4-метилпентановой кислоты
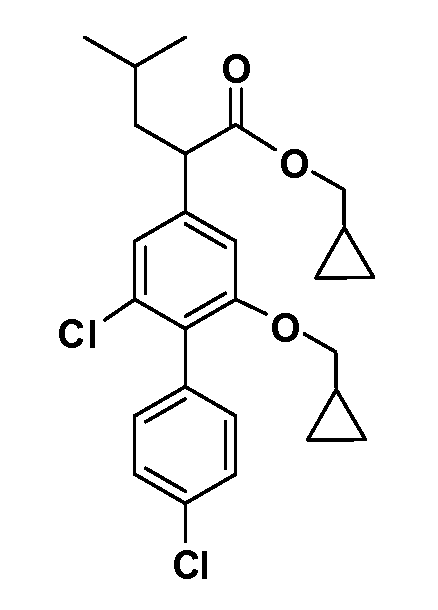
К раствору циклопропилметилового эфира 2-(3-хлор-5-циклопропилметокси-4-йодфенил)-4-метилпентановой кислоты (0,32 г, 0,67 ммоль) в DME (безводный, 20 мл) в атмосфере аргона добавляли 4-хлорфенилбороновую кислоту (0,13 г, 0,83 ммоль), CsF (0,24 г, 1,58 ммоль) и [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (0,05 г, 0,07 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 18 часов (масляная баня, 100°C). Добавляли смесь воды и EtOAc (15 мл/15 мл), и слои разделяли. Органическую фазу высушивали надMgSO4 и упаривали, получая сырое желтое масло, которое очищали хроматографией на колонках с градиентом силикагеля при помощи смеси гептан-EtOAc (от 20:1 до 9:1), получая циклопропилметиловый эфир 2-(2,4'-дихлор-6-циклопропилметокси-бифенил-4-ил)-4-метилпентановой кислоты (0,26 г, 87%) в форме желтоватого масла.1H ЯМР (300 МГц,CDCl3/TMS): δ 7,37 (д,J=8,0 Гц, 2H), 7,24 (д,J=8,2 Гц, 2H), 7,07 (с, 1H), 6,86 (с, 1H), 3,96-3,89 (м, 2H), 3,76 (д,J=6,3 Гц, 2H), 3,63 (т,J=7,7 Гц, 1H), 2,04-1,95 (м, 1H), 1,71-1,48 (м, 2H), 1,21-1,00 (м, 2H), 0,94 (д,J=6,3 Гц, 6H), 0,55-0,48 (м, 4H), 0,27-0,15 (м, 4H).13C ЯМР (75 МГц,CDCl3/TMS): δ 173,5, 157,1, 140,8, 133,7, 133,5, 133,0, 131,8, 128,1, 127,8, 121,5, 111,1, 73,2, 69,6, 49,6, 42,6, 26,1, 22,6, 22,5, 10,0, 9,8, 3,3, 3,0.
Стадия 2
2-(2,4'-дихлор-6-циклопропилметокси-бифенил-4-ил)-4-метилпентановая кислота
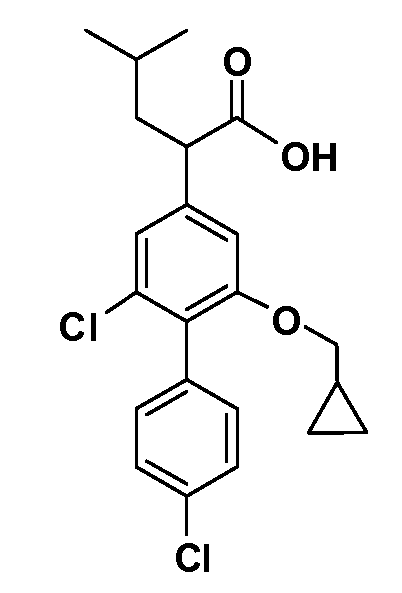
Циклопропилметиловый эфир 2-(2,4'-дихлор-6-циклопропилметокси-бифенил-4-ил)-4-метилпентановой кислоты (0,18 г, 0,36 ммоль) растворяли в смеси EtOH и H2O (9 мл/1 мл), и добавляли KOH (0,2 г, 3,6 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 2 часов, и после охлаждения растворитель выпаривали. Затем добавляли 6н. HCl, чтобы установить рН 5, и реакционную смесь экстрагировали EtOAc (3×10 мл). Органическую фазу высушивали надMgSO4 и упаривали при пониженном давлении, получая 2-(2,4'-дихлор-6-циклопропилметокси-бифенил-4-ил)-4-метилпентановую кислоту в форме твердого вещества желтоватого цвета (0,15 г, 93%). Т.пл.=52-53°C.1H ЯМР (300 МГц,CDCl3/TMS): δ 10,60 (ушир.с, 1H), 7,37 (д,J=8,4 Гц, 1H), 7,22 (д,J=8,4 Гц, 1H), 7,07 (с, 1H), 6,83 (с, 1H), 3,75 (д,J=6,3 Гц, 2H), 3,63 (т,J=7,3 Гц, 1H), 1,99-1,93 (м, 1H), 1,74-1,65 (м, 1H), 1,59-1,51 (м, 1H), 1,11-1,00 (м, 1H), 0,94 (д,J=6,3 Гц, 6H), 0,54-0,40 (м, 2H), 0,22-0,12 (м, 2H).13C ЯМР (75 МГц,CDCl3/TMS): δ 179,7, 157,2, 139,7, 134,0, 133,4, 133,1, 131,8, 128,5, 127,9, 121,6, 111,3, 73,3, 49,4, 42,0, 25,9, 22,6, 22,3, 10,0, 3,0.
Пример 3201: 4-метил-2-(2,3',4'-трихлор-6-циклопропилметокси-бифенил-4-ил)пентановая кислота
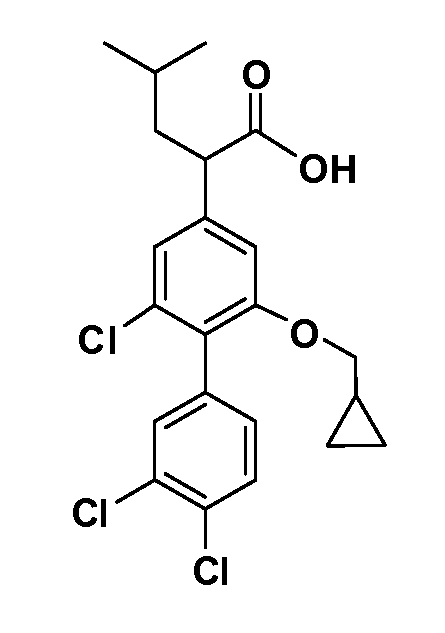
Стадия 1
циклопропилметиловый эфир 4-метил-2-(2,3',4'-трихлор-6-циклопропилметокси-бифенил-4-ил)-пентановой кислоты
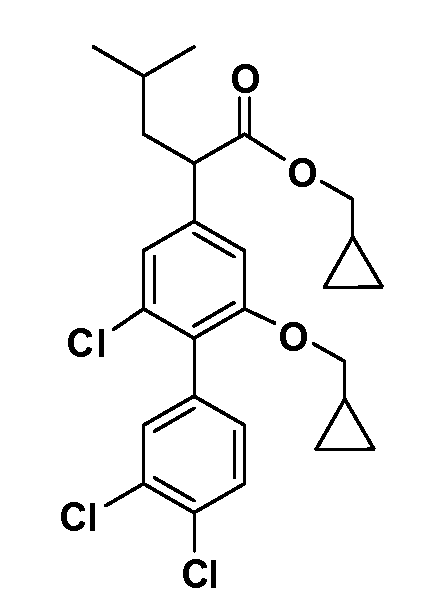
К раствору циклопропилметилового эфира 2-(3-хлор-5-циклопропилметокси-4-йодфенил)-4-метилпентановой кислоты (0,53 г, 1,11 ммоль) в DME (безводный, 20 мл) в атмосфере аргона добавляли 4-хлорфенилбороновую кислоту (0,25 г, 1,30 ммоль), CsF (0,41 г, 2,70 ммоль) и [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (0,24 г, 0,33 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 18 ч (масляная баня, 100°C). Добавляли смесь воды и EtOAc (15 мл/15 мл), и слои разделяли. Органическую фазу высушивали надMgSO4 и упаривали, получая сырое желтое масло, которое очищали хроматографией на колонках с градиентом силикагеля при помощи смеси гептан-EtOAc (от 20:1 до 9:1), получая циклопропилметиловый эфир 4-метил-2-(2,3',4'-трихлор-6-циклопропилметокси-бифенил-4-ил)пентановой кислоты (0,37 г, 70%) в форме желтоватого масла.1H ЯМР (300 МГц,CDCl3/TMS): δ 7,48-7,42 (м, 2H), 7,17-7,14 (м, 2H), 7,07 (с, 1H), 6,86 (с, 1H), 4,07-3,87 (м, 2H), 3,78 (д,J=6,3 Гц, 2H), 3,64 (т, J=7,7 Гц, 1H), 2,03-1,93 (м, 1H), 1,70-1,49 (м, 2H), 1,21-1,00 (м, 2H), 0,95-0,93 (м, 6H), 0,56-0,49 (м, 4H), 0,27-0,19 (м, 4H).13C ЯМР (75 МГц,CDCl3/TMS): δ 173,4, 156,9, 141,3, 134,9, 133,6, 132,5, 131,6, 131,2, 129,9, 129,5, 126,6, 121,5, 110,8, 73,2, 69,6, 49,6, 42,6, 26,1, 22,6, 22,4, 10,0, 9,8, 3,3, 3,1.
Стадия 2
4-метил-2-(2,3',4'-трихлор-6-циклопропилметокси-бифенил-4-ил)пентановая кислота
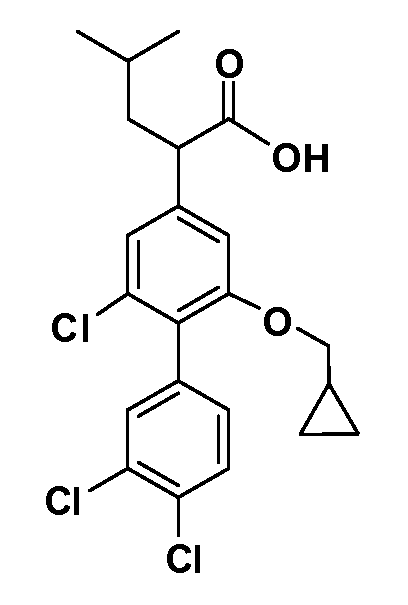
Циклопропилметиловый эфир 4-метил-2-(2,3',4'-трихлор-6-циклопропилметокси-бифенил-4-ил)пентановой кислоты (0,37 г, 0,75 ммоль) растворяли в смеси EtOH и H2O (9 мл/1 мл), и добавляли KOH (0,2 г, 3,6 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 2 часов, и после охлаждения растворитель выпаривали. Затем добавляли 6н. HCl, чтобы установить рН 5, и реакционную смесь экстрагировали EtOAc (3×10 мл). Органическую фазу высушивали надMgSO4 и упаривали при пониженном давлении, получая 4-метил-2-(2,3',4'-трихлор-6-циклопропилметокси-бифенил-4-ил)пентановую кислоту в форме твердого вещества белого цвета (0,30 г, 90%). Т.пл.=118-119°C.1H ЯМР (300 МГц,CDCl3/TMS): δ 9,70 (ушир.с, 1H), 7,47 (д,J=8,3 Гц, 1H), 7,42 (д,J=1,6 Гц, 1H), 7,53 (дд,J=8,2, 1,4 Гц, 1H), 7,07 (с, 1H), 6,83 (с, 1H), 3,78 (д,J=6,3 Гц, 2H), 3,63 (т,J=7,3 Гц, 1H), 2,02-1,93 (м, 1H), 1,74-1,65 (м, 1H), 1,59-1,51 (м, 1H), 1,11-1,00 (м, 1H), 0,94 (д,J=6,3 Гц, 6H), 0,54-0,47 (м, 2H), 0,24-0,16 (м, 2H).13C ЯМР (75 МГц,CDCl3/TMS): δ 179,4, 157,0, 140,3, 134,8, 133,9, 132,5, 131,6, 131,3, 129,9, 129,6, 127,0, 121,5, 111,1, 73,3, 49,4, 42,0, 25,9, 22,6, 22,3, 10,0, 3,1.
Пример 1976: 2-[2,6-бис-(2,2,2-трифторэтокси)-4'-трифторметил-бифенил-4-ил]-4-метилпентановая кислота
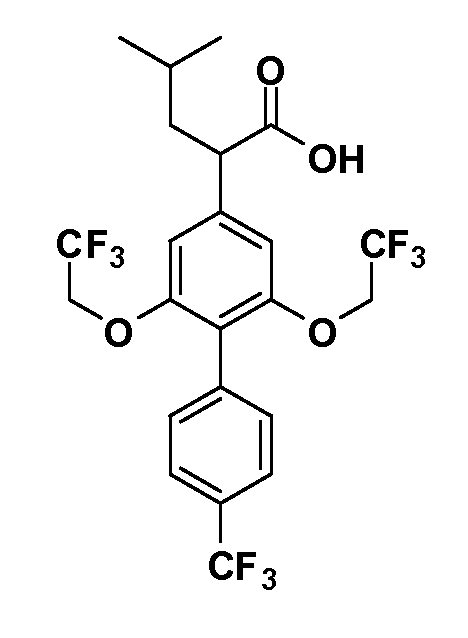
Стадия 1
5-фтор-2-нитро-1,3-бис-(2,2,2-трифторэтокси)бензол
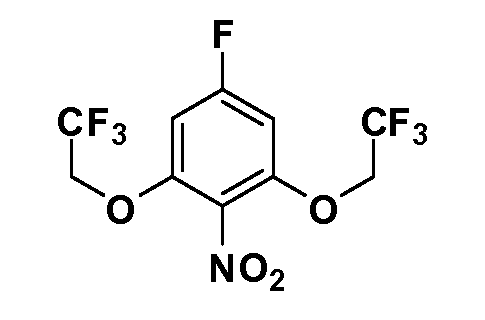
К раствору 2,2,2-трифторэтанола (28,2 г, 282,0 ммоль) в толуоле (120 мл) при 0°C добавляли n-BuLi (1,6 М в гексане, 8,0 г, 80 мл, 125,0 ммоль), и реакционную смесь нагревали до 25°C. По каплям добавляли раствор 1,3,5-трифторнитробензола (10,0 г, 56,5 ммоль) в толуоле (50 мл). Реакционную смесь нагревали с обратным холодильником в течение 30 часов и затем вливали в воду (100 мл). Реакционную смесь экстрагировали EtOAc (3×100 мл). Органические слои объединяли и высушивали надMgSO4. Растворитель выпаривали при пониженном давлении, получая 5-фтор-2-нитро-1,3-бис-(2,2,2-трифторэтокси)бензол в форме коричневого масла (18,0 г, 95%). Продукт использовали для следующей стадии без очистки.1H ЯМР (300 МГц,CDCl3/TMS): δ 6,47 (д,J=9,4 Гц, 2H), 4,40 (кв.,J=8,0 Гц, 4H).
Стадия 2
диэтиловый эфир 2-[4-нитро-3,5-бис-(2,2,2-трифторэтокси)фенил]малоновой кислоты
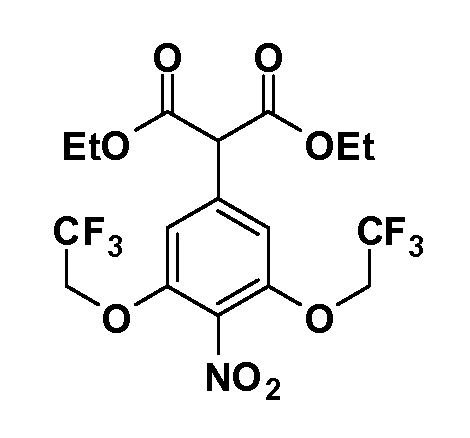
К раствору диэтилового эфира малоновой кислоты (18,0 г, 114,9 ммоль) в DMF (50 мл) при 0°C добавляли гидрид натрия (60% в минеральном масле, 3,0 г, 125,0 ммоль). Реакционную смесь перемешивали при 25°C в течение 0,5 часа, и по каплям добавляли раствор 5-фтор-2-нитро-1,3-бис-(2,2,2-трифторэтокси)бензола (18,0 г, 53,4 ммоль) в DMF (30 мл). Реакционную смесь нагревали 100°C в течение 24 часов. После охлаждения реакционную смесь лили в воду (300 мл) и экстрагировали EtOAc (3×50 мл). Объединенные органические фазы промывали водой (3×100 мл), солевым раствором (100 мл) и высушивали (MgSO4). Выпаривание растворителя при пониженном давлении дало диэтиловый эфир 2-[4-нитро-3,5-бис-(2,2,2-трифторэтокси)фенил]малоновой кислоты в форме коричневого масла (20,8 г, 80%). Сырой продукт использовали для следующей стадии без очистки.1H ЯМР (300 МГц,CDCl3/TMS): δ 6,91 (с, 2H), 4,62 (с, 1H), 4,48 (кв., J=8,0 Гц, 4H), 4,28-4,16 (м, 4H), 1,31-1,25 (м, 6H).13C ЯМР (75 МГц,CDCl3/TMS): δ 166,4, 149,2, 136,7, 132,3, 122,3 (кв.,1JCF = 276,6 Гц), 109,5 (два сигнала), 67,0 (кв.,2JCF = 36,7 Гц), 61,4, 41,6, 14,0.
Стадия 3
этиловый эфир [4-нитро-3,5-бис-(2,2,2-трифторэтокси)фенил]уксусной кислоты
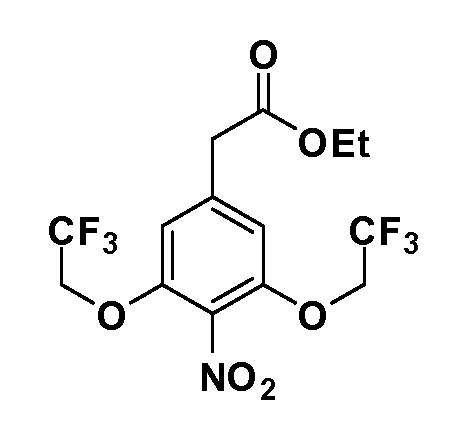
Сырой диэтиловый эфир 2-[4-нитро-3,5-бис-(2,2,2-трифторэтокси)фенил]малоновой кислоты (20,8 г, 43,6 ммоль) растворяли в смеси AcOH/12н. HCl (150 мл/150 мл), и реакционную смесь нагревали с обратным холодильником в течение 16 часов. Растворитель выпаривали, и добавляли воду (100 мл). Реакционную смесь экстрагировали EtOAc (3×100 мл). Органические слои объединяли, промывали водой (3×100 мл) и высушивали надMgSO4. Растворитель выпаривали при пониженном давлении, получая твердое вещество коричневого цвета, которое промывали смесью гептан/Et2O (100 мл/100 мл), получая этиловый эфир [4-нитро-3,5-бис-(2,2,2-трифторэтокси)фенил]уксусной кислоты в форме твердого вещества (10,0 г, 57%).1H ЯМР (300 МГц,CDCl3/TMS): δ 6,71 (с, 2H), 4,45 (кв.,J=7,7 Гц, 4H), 4,18 (кв.,J=7,2 Гц, 2H), 3,63 (с, 2H), 1,28 (т,J=7,1 Гц, 6H).13C ЯМР (75 МГц,CDCl3/TMS): δ 169,7, 149,6, 138,5, 132,4, 122,4 (кв.,1JCF = 277,6 Гц), 109,4 (два сигнала), 67,0 (кв.,2JCF = 37,2 Гц), 61,6, 41,4, 14,2.
Стадия 4
этиловый эфир [4-амино-3,5-бис-(2,2,2-трифторэтокси)фенил]уксусной кислоты
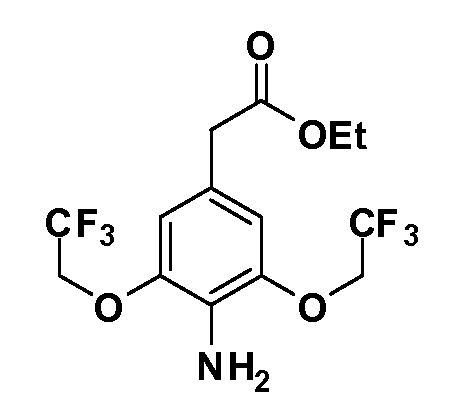
Этиловый эфир [4-нитро-3,5-бис-(2,2,2-трифторэтокси)фенил]уксусной кислоты (10,0 г, 24,7 ммоль) растворяли в EtOH (200 мл) и гидрировали при 50 psi, 25°C в течение 16 часов в присутствии катализатора Pd-C (10%, 1 г). Катализатор отфильтровывали, и растворитель выпаривали, получая сырое коричневое масло, которое очищали хроматографией на колонках с градиентом силикагеля при помощи смеси гептан-EtOAc, получая этиловый эфир [4-амино-3,5-бис-(2,2,2-трифторэтокси)фенил]уксусной кислоты в форме желтого масла (8,3 г, 90%).1H ЯМР (300 МГц,CDCl3/TMS): δ 6,52 (с, 2H), 4,37 (кв.,J=8,0 Гц, 4H), 4,14 (кв.,J=7,2 Гц, 2H), 3,90 (ушир.с, 2H), 3,48 (с, 2H), 1,25 (т,J=7,2 Гц, 3H).13C ЯМР (75 МГц,CDCl3/TMS): δ 171,4, 145,0, 126,3, 123,2, (кв.,1JCF = 277,6 Гц), 122,6, 110,0, 109,8 (два сигнала), 66,8 (кв.,2JCF = 35,5 Гц), 61,0, 41,0, 14,2.
Стадия 5
этиловый эфир [4-йод-3,5-бис-(2,2,2-трифторэтокси)фенил]уксусной кислоты
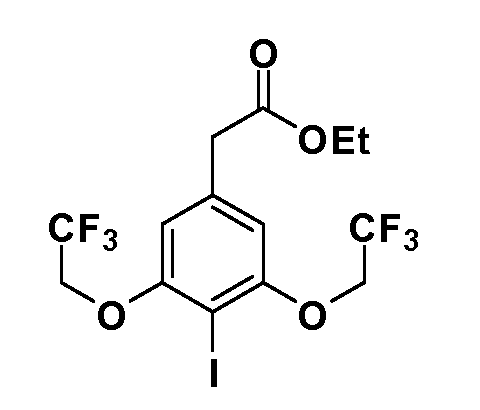
Этиловый эфир [4-амино-3,5-бис-(2,2,2-трифторэтокси)фенил]уксусной кислоты (7,1 г, 18,9 ммоль) растворяли в MeCN (50 мл), идобавлялип-TsOH×H2O (11,0 г, 57,9 ммоль). Реакционную смесь охлаждали до -15°C и добавлялиNaNO2 (1,6 г, 23,2 ммоль) в воде (1 мл). Реакционную смесь перемешивали при -15°C в течение 0,5 часа; затем добавляли раствор KI (15,0 г, 93,8 ммоль) в воде (10 мл). Реакционную смесь перемешивали при -15°C в течение еще 0,5 часа и гасили 1 н. растворомNaHCO3 до рН 9-10. После добавления 10%-го раствораNaHSO3 (20 мл) реакционную смесь экстрагировали EtOAc (3×50 мл). Объединенные органические фазы промывали насыщенным раствором NaCl, высушивали(MgSO4) и упаривали, получая сырое коричневое масло (9,0 г), которое очищали хроматографией на колонках с градиентом силикагеля, элюируя смесью гептан-EtOAc (от 9:1 до 3:1), получая этиловый эфир [4-йод-3,5-бис-(2,2,2-трифторэтокси)фенил]уксусной кислоты в форме твердого вещества белого цвета (3,8 г, 41%).1H ЯМР (300 МГц,CDCl3/TMS): δ 6,53 (с, 2H), 4,40 (кв.,J=8,0 Гц, 4H), 4,16 (кв.,J=7,1 Гц, 2H), 3,56 (с, 2H), 1,26 (т,J=7,2 Гц, 3H).13C ЯМР (75 МГц,CDCl3/TMS): δ 170,3, 157,7, 136,7, 122,8 (кв.,1JCF = 277,6 Гц), 108,9 (два сигнала), 78,3, 67,0 (кв.,2JCF = 36,0 Гц), 61,3, 41,2, 14,2.
Стадия 6
этиловый эфир [2,6-бис-(2,2,2-трифторэтокси)-4'-трифторметил-бифенил-4-ил]уксусной кислоты
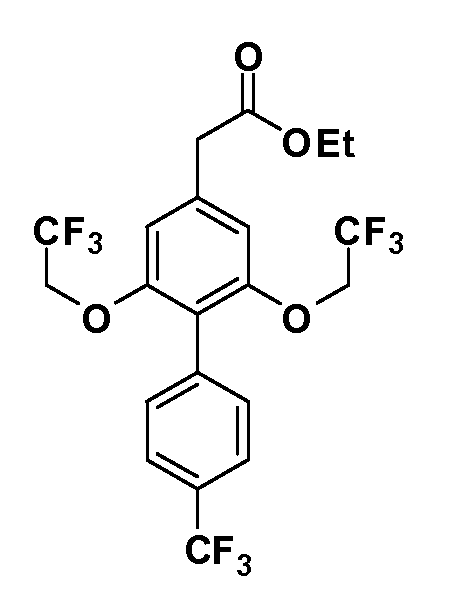
К раствору этилового эфира [4-йод-3,5-бис-(2,2,2-трифторэтокси)фенил]уксусной кислоты (0,8 г, 1,65 ммоль) в DME (безводный, 15 мл) в атмосфере аргона добавляли 4-трифторметилфенилбороновую кислоту (0,4 г, 2,10 ммоль), CsF (0,6 г, 3,95 ммоль) и Pd(PPh3)4 (0,3 г, 0,26 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 18 часов (масляная баня, 100°C). Добавляли смесь воды и EtOAc (15 мл/15 мл), и слои разделяли. Органическую фазу высушивали надMgSO4 и упаривали, получая сырое желтое масло, которое очищали хроматографией на колонках с градиентом силикагеля при помощи смеси гептан-EtOAc (от 20:1 до 9:1), получая этиловый эфир [2,6-бис-(2,2,2-трифторэтокси)-4'-трифторметил-бифенил-4-ил]уксусной кислоты (0,54 г, 70%) в форме желтоватого масла.1H ЯМР (300 МГц,CDCl3/TMS): δ 7,64 (д,J=8,2 Гц, 2H), 7,46 (д,J=8,0 Гц, 2H), 6,68 (с, 2H), 4,28-4,16 (6H), 3,63 (с, 2H), 1,29 (т,J=7,2 Гц, 3H).13C ЯМР (75 МГц,CDCl3/TMS): δ 170,6, 155,3, 136,1, 135,5, 131,0, 129,4, 129,0, 124,4 (кв.,3JCF = 3,9 Гц), 124,2, 122,9, 119,0, 109,2 (два сигнала), 66,5 (кв.,2JCF = 35,5 Гц), 61,3, 41,5, 14,2.
Стадия 7
2-[2,6-бис-(2,2,2-трифторэтокси)-4'-трифторметил-бифенил-4-ил]-4-метилпентановая кислота
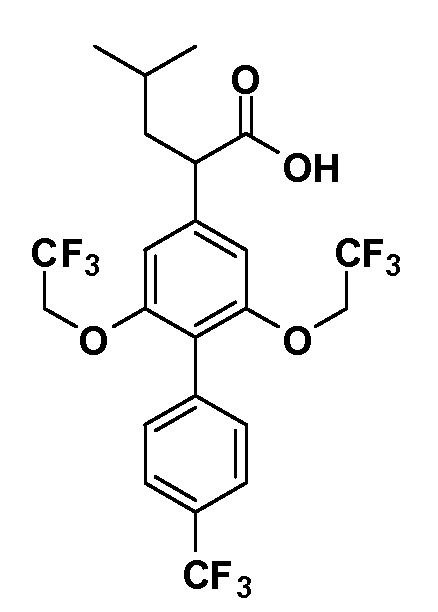
Этиловый эфир [2,6-бис-(2,2,2-трифторэтокси)-4'-трифторметил-бифенил-4-ил]уксусной кислоты (0,52 г, 1,03 ммоль) растворяли в безводном DMF (5 мл) и при 0°C добавляли гидрид натрия (60% в масле, 0,05 г, 2,08 ммоль). Реакционную смесь перемешивали при 0°C в течение 20 минут и добавляли изобутил бромид (0,15 г, 1,09 ммоль). Реакционную смесь перемешивали в течение 1 часа при той же самой температуре и при 25°C в течение 15 мин, после чего добавляли насыщенный раствор хлорида аммония (10 мл). Реакционную смесь экстрагировали этилацетатом (2×20 мл), и объединенные органические фазы промывали водой (3×20 мл), насыщенным раствором хлорида натрия (10 мл) и высушивали над сульфатом магния. Упаривание дало сырое желтое масло (0,56 г), которое очищали хроматографией на колонках силикагеля со смесью гептан/EtOAc, получая твердое вещество белого цвета (0,24 г). Полученное твердое вещество растворяли в EtOH (10 мл) и добавляли H2O (1 мл) и гидроксид калия (0,2 г). Реакционную смесь нагревали с обратным холодильником в течение 2 часов и выпаривали растворитель. Затем добавляли 6н. HCl, чтобы установить рН 3-5, и смесь экстрагировали EtOAc (3×10 мл). Объединенные органические фазы высушивали надMgSO4 и упаривали, получая 2-[2,6-бис-(2,2,2-трифторэтокси)-4'-трифторметил-бифенил-4-ил]-4-метилпентановую кислоту в форме твердого вещества белого цвета (0,2 г, 40%).1H ЯМР (300 МГц,CDCl3/TMS): δ 7,65 (д,J=8,1 Гц, 2H), 7,46 (д,J=8,1 Гц, 2H), 6,72 (с, 2H), 4,24 (кв.,J=8,0 Гц, 4H), 3,69 (т,J=7,7 Гц, 1H), 2,03-1,96 (м, 1H), 1,76-1,67 (м, 1H), 1,60-1,52 (м, 1H), 0,96 (д,J=6,3 Гц, 6H).13C ЯМР (75 МГц,CDCl3/TMS): δ 179,3, 155,4, 140,6, 135,3, 130,9, 129,6, 129,1, 124,5 (кв.,3JCF = 4 Гц), 124,2 (кв.,1JCF = 272 Гц), 122,9 (кв.,1JCF = 278 Гц), 119,8, 107,9, 66,5 (кв.,2JCF = 36 Гц), 49,7, 42,2, 25,9, 22,6, 22,3.
Пример 2420: 2-[6-хлор-5-(2,2,2-трифторэтокси)-4'-трифторметил-бифенил-3-ил]-3-циклобутилпропионовая кислота.
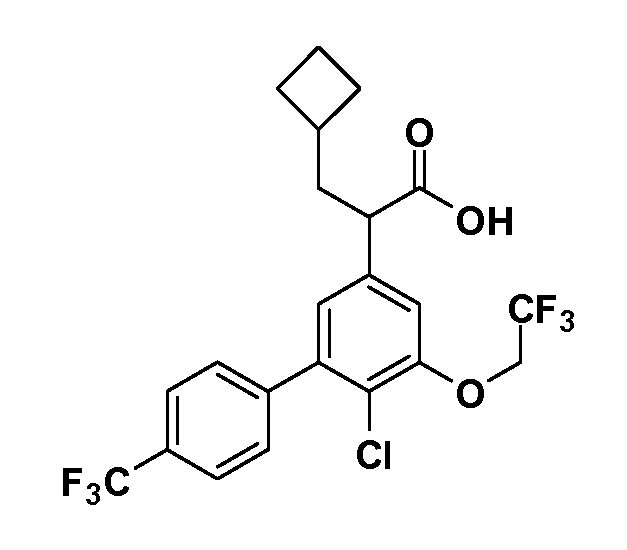
Стадия 1
4-фтор-1-нитро-2-(2,2,2-трифторэтокси)бензол
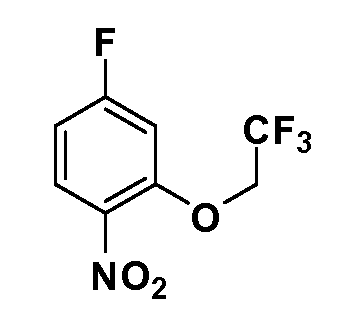
К раствору 2,4-дифторнитробензола (300,0 г, 1,89 моль) и 2,2,2-трифторэтанола (245,0 г, 2,45 моль) в толуоле (600 мл) добавляли гидроксид натрия (90,5 г, 2,26 моль) частями за 30 минут, поддерживая температуру от 30 до 40°C. После понижения температуры до 30°C реакционную смесь нагревали до 45-50°C с использованием масляной бани в течение дополнительных 16 часов. После охлаждения добавляли воду (500 мл) и 2,5н.H2SO4 (200-300 мл, для подкисления до рН 5), и органический слой отделяли. Водный слой экстрагировали EtOAc (2×300 мл). Объединенные органические слои промывали насыщенным раствором хлорида натрия (100 мл) и высушивали над сульфатом магния. Растворитель выпаривали, получая желтое масло, которое отвердевало за 30 минут, образуя твердое вещество желтоватого цвета (450,0 г, количественные). Сырой продукт использовали на следующей стадии без очистки.1H ЯМР (300 МГц,CDCl3/TMS): δ 8,03-7,98 (м, 1H), 6,93-6,82 (м, 2H), 4,49 (кв.,J=7,7 Гц, 2H).13C ЯМР (75 МГц,CDCl3/TMS): δ 165,0 (д,1JCF = 259,6 Гц), 152,3 (д,3JCF = 13,1 Гц), 128,2 (д,3JCF = 11,9 Гц), 122,4 (д,1JCF = 273,4 Гц), 110,1 (д,2JCF = 22,5 Гц), 105,9 (кв.,1JCF = 242,6 Гц), 104,3 (д,2JCF = 26,1 Гц), 67,6 (кв.,1JCF = 36,7 Гц).
Стадия 2
[4-нитро-3-(2,2,2-трифторэтокси)фенил]уксусная кислота
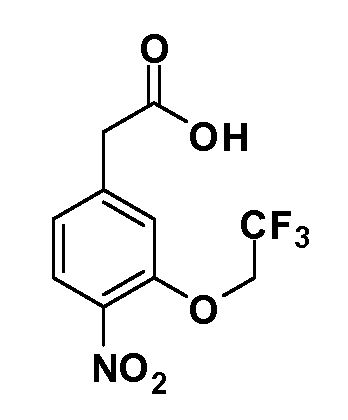
Гидроксид калия (≥85%, 176 г, ≥2,67 ммоль) добавляли частями к раствору 4-фтор-1-нитро-2-(2,2,2-трифторэтокси)бензола (412 г, чистота ~90%, 1,56 ммоль) и диэтилмалоната (503,0 г, 3,14 ммоль) в ДМСО (700 мл), поддерживая температуру ~40°C. Реакционная смесь приобрела глубокий красный цвет. Реакционную смесь перемешивали при 40°C в течение ночи. Контроль осуществляли с помощью TLC (EtOAc:гепт., 1:3).
Уксусную кислоту (1 л) добавляли к теплой реакционной смеси, после чего добавляли смесь концентрированной серной кислоты (325 мл) в воде (1 л) в виде одной части. Осадок, образующийся сначала, растворяли в конце добавления. Для этой реакции необходимо эффективное перемешивание. Реакционную смесь нагревали с обратным холодильником в течение ночи. Реакционную смесь охлаждали до температуры окружающей среды и добавляли EtOAc (1000 мл) и воду (1000 мл). Органический слой (нижний слой) отделяли. Водный раствор экстрагировали EtOAc (500 мл), органические фазы объединяли, промывали водой (3×2000 мл), солевым раствором (500 мл) и высушивали надMgSO4 с активированным углем. Растворитель выпаривали, и твердый остаток промывали, перемешивая со смесью гептан/EtOAc (20:1, 500 мл). Твердое вещество отфильтровывали и высушивали в вакууме. Выход 2-(4-нитро-3-(2,2,2-трифторэтокси)фенил)уксусной кислоты составил 256 г (65%).1H ЯМР (300 МГц,CDCl3/TMS): δ 7,80 (д,J=8,3 Гц, 1H), 7,25 (с, 1H), 7,10 (д,J=8,3 Гц, 1H), 5,07 (с, 1H), 4,67 (кв.,J=8,2 Гц, 2H), 3,70 (с, 2H).13C ЯМР (75 МГц,CDCl3/TMS): δ 175,0, 151,5, 144,0, 140,3, 126,4, 125,0, 122,2 (д,1JCF = 273,0 Гц), 118,0, 67,6 (кв.,1JCF = 36,0 Гц), 42,5.
Стадия 3
метиловый эфир [4-нитро-3-(2,2,2-трифторэтокси)фенил]уксусной кислоты
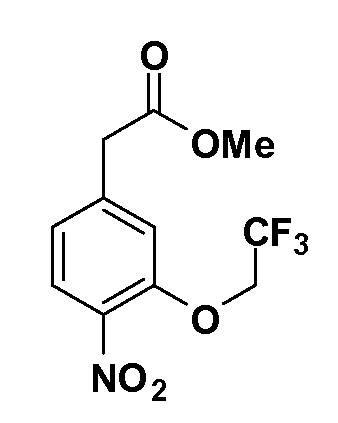
Концентрированную серную кислоту (50 мл) медленно добавляли к раствору 2-(4-нитро-3-(2,2,2-трифторэтокси)фенил)уксусной кислоты (180 г, 0,64 моль) в MeOH (500 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение ночи. Метанол выпаривали и добавляли EtOAc (500 мл). Раствор промывали водой (2×200 мл) и солевым раствором и высушивали надMgSO4. Растворитель выпаривали, твердый остаток перемешивали с гептаном (200 мл), и твердое вещество отфильтровывали. Выход 182,2 г (96%).1H ЯМР (300 МГц,CDCl3/TMS): δ 7,82 (д,J=8,7 Гц, 1H), 7,07-7,05 (м, 2H), 4,47 (кв.,J=8,0 Гц, 2H), 3,68 (с, 3H), 3,67 (с, 2H).13C ЯМР (75 МГц,CDCl3/TMS): δ 170,1, 150,4, 141,2, 139,4, 125,9, 123,9, 122,6 (д,1JCF = 277,6 Гц), 117,5, 67,6 (кв.,1JCF = 36,7 Гц), 52,4, 41,0.
Стадия 4
метиловый эфир 3-циклобутил-2-[4-нитро-3-(2,2,2-трифторэтокси)фенил]пропионовой кислоты
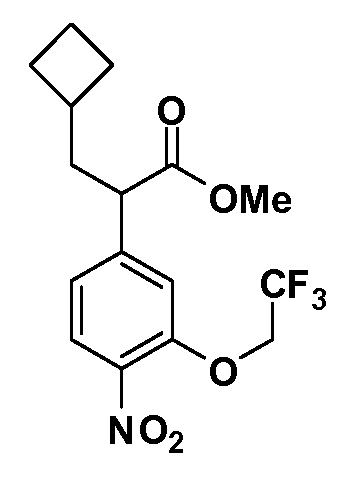
Метиловый эфир [4-нитро-3-(2,2,2-трифторэтокси)фенил]уксусной кислоты (33 г, 94,5 ммоль) и (бромметил)циклобутан (17 г, 114,1 ммоль) смешивали в ДМСО (50 мл), и KOH (6,4 г, 114,1 ммоль) добавляли частями за 15 мин. Реакционную смесь перемешивали в течение 16 часов и добавляли воду (100 мл). Реакционную смесь экстрагировали EtOAc (3×50 мл). Объединенные органические фазы высушивали надMgSO4 и упаривали, получая сырое желтое масло, которое очищали хроматографией на колонках с градиентом силикагеля, используя смесь гептан-EtOAc (от 9:1 до 4:1), получая 15 г (40%) продукта в форме желтого масла. (Синтез повторяли, поддерживая температуру 40°C в течение 16 часов, получая продукт с количественным выходом). 1H ЯМР (300 МГц,CDCl3/TMS): δ 7,86 (д,J=8,0 Гц, 1H), 7,12-7,09 (м, 2H), 4,50 (кв.,J=7,7 Гц, 2H), 3,68 (с, 3H), 3,55 (т,J=7,3 Гц, 1H), 2,22-2,10 (м, 2H), 2,03-1,75 (м, 5H), 1,70-1,55 (м, 2H).13C ЯМР (75 МГц,CDCl3/TMS): δ 172,9, 150,5, 146,4, 139,4, 126,0, 122,7, 122,6 (д,1JCF = 277,6 Гц), 116,0, 67,5 (кв.,1JCF = 36,7 Гц), 52,3, 49,6, 40,7, 33,9, 28,2, 27,9, 18,4.
Стадия 5
метиловый эфир 2-[4-амино-3-(2,2,2-трифторэтокси)фенил]-3-циклобутилпропионовой кислоты.
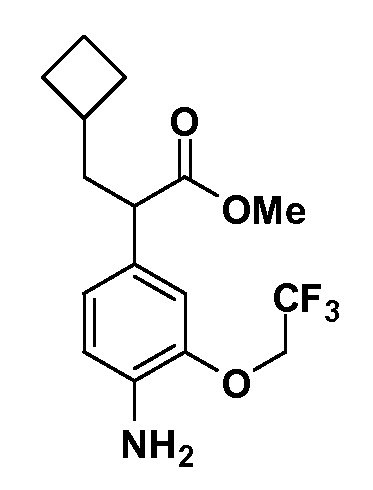
Раствор метилового эфира 3-циклобутил-2-[4-нитро-3-(2,2,2-трифторэтокси)фенил]пропионовой кислоты (15 г, 36,0 ммоль) в EtOH (150 мл) гидрировали при 50 psi и 25°C в течение 16 часов в присутствии катализатора Pd-C (10%, 1,5 г). На следующий день катализатор отфильтровывали, и растворитель выпаривали, получая сырой продукт (12,3 г, 88%) в форме желтого масла, которое использовали без очистки для следующей стадии.1H ЯМР (300 МГц,CDCl3/TMS): δ 6,79-6,73 (м, 2H), 6,66 (д,J=8,0 Гц, 1H), 4,36 (кв.,J=8,3 Гц, 2H), 3,80 (ушир.с, 2H), 3,63 (с, 3H), 3,35 (т,J=7,7 Гц, 1H), 2,20-1,86 (м, 4H), 1,85-1,70 (м, 3H), 1,67-1,51 (м, 2H).13C ЯМР (75 МГц,CDCl3/TMS): δ 174,7, 146,7, 135,7, 129,1, 123,3 (д,1JCF = 277,6 Гц), 122,7, 115,4, 112,2, 66,4 (кв.,1JCF = 35,4 Гц), 51,9, 48,9, 40,8, 34,0, 28,3, 28,1, 18,5.
Стадия 6
метиловый эфир 2-[4-амино-3-бром-5-(2,2,2-трифторэтокси)фенил]-3-циклобутилпропионовой кислоты
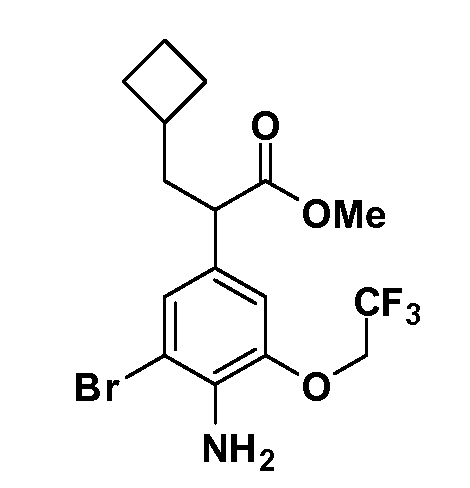
К раствору метилового эфира 2-[4-амино-3-(2,2,2-трифторэтокси)фенил]-3-циклобутилпропионовой кислоты (12,3 г, 31,8 ммоль) в хлороформе (150 мл) добавляли N-бромсукцинимид (7 г, 39,3 ммоль). Реакционную смесь перемешивали при 25°C в течение 16 часов и добавляли смесь воды и метиленхлорида (100 мл/100 мл). Реакционную смесь экстрагировали метиленхлоридом (2×50 мл), и органические фазы разделяли. Объединенные органические фазы высушивали надMgSO4 и упаривали, получая сырое желтое масло, которое очищали хроматографией на коротких колонках с силикагелем, элюируя смесью гептан-EtOAc (4:1), получая продукт (13,9 г, 94%) в форме желтоватого масла.1H ЯМР (300 МГц,CDCl3/TMS): δ 7,06 (д,J=1,1 Гц, 1H), 6,70 (д,J=1,2 Гц, 1H), 4,37 (кв.,J=8,0 Гц, 2H), 4,21 (ушир.с, 2H), 3,64 (с, 3H), 3,31 (т,J=7,7 Гц, 1H), 2,20-1,89 (м, 4H), 1,81-1,75 (м, 3H), 1,67-1,51 (м, 2H).13C ЯМР (75 МГц,CDCl3/TMS): δ 174,2, 144,6, 134,4, 128,9, 125,7, 123,0 (д,1JCF = 277,6 Гц), 110,9, 108,7, 66,5 (кв.,1JCF = 36,0 Гц), 52,0, 48,6, 40,7, 33,9, 28,3, 28,0, 18,5.
Стадия 7
метиловый эфир 2-[6-амино-5-(2,2,2-трифторэтокси)-4'-трифторметил-бифенил-3-ил]-3-циклобутилпропионовой кислоты
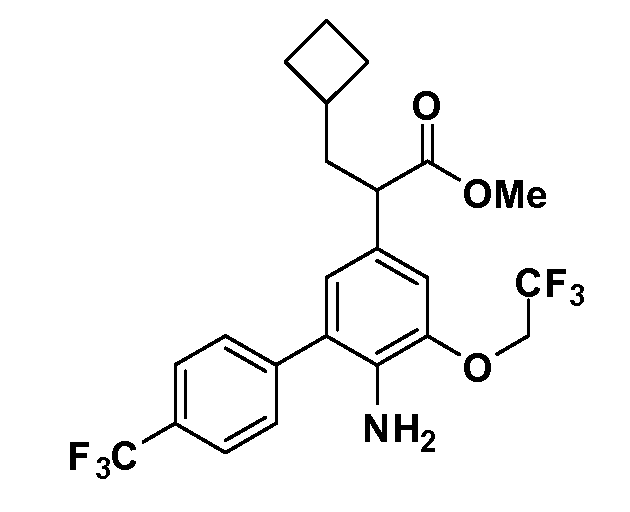
К раствору метилового эфира 2-[4-амино-3-бром-5-(2,2,2-трифторэтокси)фенил]-3-циклобутилпропионовой кислоты (13,8 г, 29,6 ммоль) в DME (безводный, 100 мл) в атмосфере аргона добавляли 4-трифторметилфенилбороновую кислоту (6,8 г, 35,8 ммоль), CsF (11 г, 72,3 ммоль) и Pd(PPh3)4 (3,4 г, 2,94 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 18 часов (масляная баня, 100°C). На следующий день добавляли смесь воды и EtOAc (100 мл/100 мл), и слои разделяли. Органическую фазу высушивали надMgSO4 и упаривали, получая сырое желтое масло, которое очищали хроматографией на коротких колонках с силикагелем при помощи смеси гептан-EtOAc (4:1), получая продукт (14,7 г, 94%) в форме желтоватого масла.1H ЯМР (300 МГц,CDCl3/TMS): δ 7,70 (д,J=8,2 Гц, 2H), 7,59 (д,J=8,0 Гц, 2H), 6,78 (дд,J=9,6, 1,4 Гц, 2H), 4,43 (кв.,J=8,0 Гц, 2H), 3,95 (ушир.с, 2H), 3,66 (с, 3H), 3,39 (т,J=7,7 Гц, 1H), 2,25-2,07 (м, 2H), 2,03-1,91 (м, 2H), 1,88-1,75 (м, 3H), 1,69-1,52 (м, 2H).13C ЯМР (75 МГц,CDCl3/TMS): δ 174,6, 144,8, 133,1, 129,2, 128,6, 126,3, 125,7 (кв.,3JCF = 3,6 Гц), 123,8, 123,3 (кв.,1JCF = 277,6 Гц), 111,4, 66,5 (кв.,1JCF = 35,4 Гц), 52,0, 49,0, 40,9, 34,1, 28,3, 28,1, 18,5.
Стадия 8
метиловый эфир 2-[6-хлор-5-(2,2,2-трифторэтокси)-4'-трифторметил-бифенил-3-ил]-3-циклобутилпропионовой кислоты
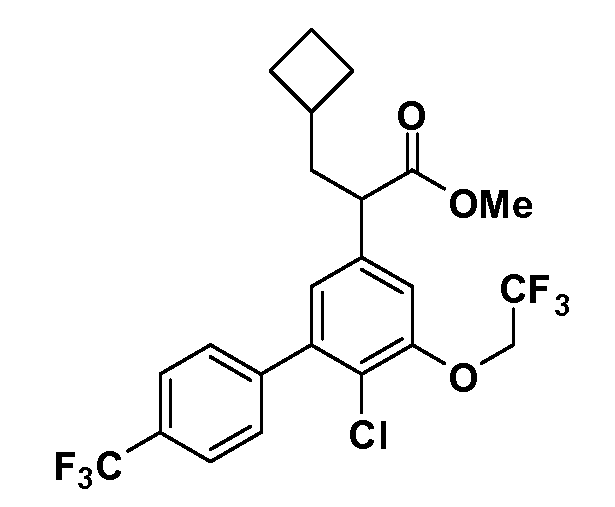
К раствору метилового эфира 2-[6-амино-5-(2,2,2-трифторэтокси)-4'-трифторметил-бифенил-3-ил]-3-циклобутилпропионовой кислоты (14,7 г, 27,7 ммоль) в смеси MeCN и H2O (120 мл/120 мл) добавляли концентрированную HCl (25 мл). Реакционную смесь охлаждали до 0-5°C и по каплям добавляли растворNaNO2 (2,9 г, 42,0 ммоль) в воде (3 мл). Реакционную смесь перемешивали при 0-5°C в течение 40 минут и сразу добавляли CuCl(I) (27 г, 272,7 ммоль). Реакционную смесь нагревали при 50°C в течение дополнительных 3 часов, и растворитель выпаривали. Реакционную смесь экстрагировали EtOAc (3×50 мл), и объединенные органические фазы промывали водой (200 мл) и солевым раствором (100 мл). Органическую фазу высушивали надMgSO4 и упаривали, получая продукт (14,5 г, 95%) в форме желтого масла.1H ЯМР (300 МГц,CDCl3/TMS): δ 7,70 (д,J=8,2 Гц, 2H), 7,53 (д,J=8,0 Гц, 2H), 6,98 (дд,J=6,1, 1,6 Гц, 2H), 4,47 (кв.,J=8,0 Гц, 2H), 3,68 (с, 3H), 3,48 (т,J=7,7 Гц, 1H), 2,20-2,10 (м, 2H), 2,03-1,75 (м, 5H), 1,70-1,52 (м, 2H).13C ЯМР (75 МГц,CDCl3/TMS): δ 173,6, 153,5, 142,2, 141,0, 138,9, 129,7, 125,0 (кв.,3JCF = 3,6 Гц), 124,8, 124,0 (кв.,1JCF = 271,6 Гц), 126,6 (кв.,1JCF = 278,8 Гц), 121,4, 114,0, 67,3 (кв.,1JCF = 35,4 Гц), 52,2, 49,3, 40,8, 34,0, 28,3, 28,0, 18,5.
Стадия 9
2-[6-хлор-5-(2,2,2-трифторэтокси)-4'-трифторметил-бифенил-3-ил]-3-циклобутилпропионовая кислота
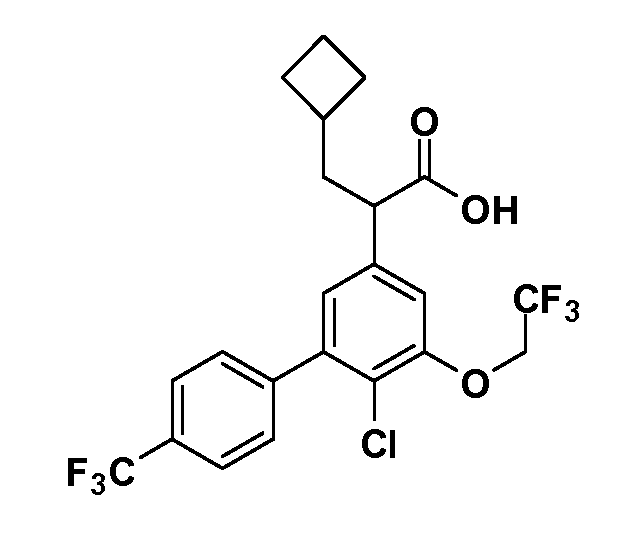
К раствору метилового эфира 2-[6-хлор-5-(2,2,2-трифторэтокси)-4'-трифторметил-бифенил-3-ил]-3-циклобутилпропионовой кислоты (8,0 г, 14,5 ммоль) в смеси EtOH (100 мл) и H2O (15 мл) добавляли гидроксид калия (10 г, 178,5 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 3 часов и выпаривали растворитель. Затем добавляли 6н. HCl, чтобы установить рН 3-5, и смесь экстрагировали EtOAc (3×50 мл). Объединенные органические фазы высушивали надMgSO4 и упаривали, получая 2-[6-хлор-5-(2,2,2-трифторэтокси)-4'-трифторметил-бифенил-3-ил]-3-циклобутилпропионовую кислоту в форме твердого вещества белого цвета (7,0 г, 90%).1H ЯМР (300 МГц,CDCl3/TMS): δ 7,70 (д,J=8,2 Гц, 2H), 7,53 (д,J=8,2 Гц, 2H), 6,98 (с, 2H), 4,47 (кв.,J=8,0 Гц, 2H), 3,49 (т,J=7,7 Гц, 1H), 2,27-2,13 (м, 2H), 2,06-1,73 (м, 5H), 1,71-1,52 (м, 2H).13C ЯМР (75 МГц,CDCl3/TMS): δ 179,1, 153,6, 142,1, 141,2, 138,0, 129,7, 125,0 (кв.,3JCF = 3,6 Гц), 124,9, 124,0 (кв.,1JCF = 262,5 Гц), 123,0 (кв.,1JCF = 277,6 Гц), 121,8, 114,3, 67,3 (кв.,1JCF = 36,0 Гц), 49,3, 40,3, 33,9, 28,3, 28,0, 18,5.
Пример 415: 2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилпропановая кислота
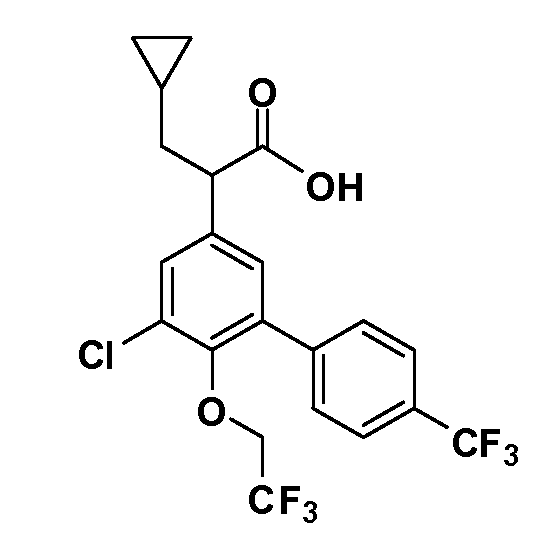
Стадия 1
2-(3-хлор-4-гидроксифенил)этилацетат
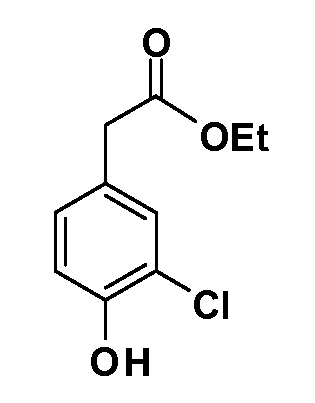
К перемешиваемому раствору 2-(4-гидроксифенил)этилацетата (20 г, 0,076 моль) в 200 мл DCM добавляли MeOH (3,4 мл, 0,84 моль). Смесь нагревали с обратным холодильником, и за 10 минут медленно добавляли сульфурил хлорид (6,8 мл 0,846 моль), растворенный в DCM (50 мл). Реакционную смесь нагревали с обратным холодильником еще 5 ч, после чего реакционную смесь лили на измельченный лед и экстрагировали DCM (x2). Объединенные органические слои промывали10% раствором NaHCO3 и водой. Органический слой высушивали надNa2SO4, фильтровали и упаривали под вакуумом, получая 2-(3-хлор-4-гидроксифенил)этилацетат с 60%-ным выходом (13,6 г).
Стадия 2
2-(3-бром-5-хлор-4-гидроксифенил)этилацетат
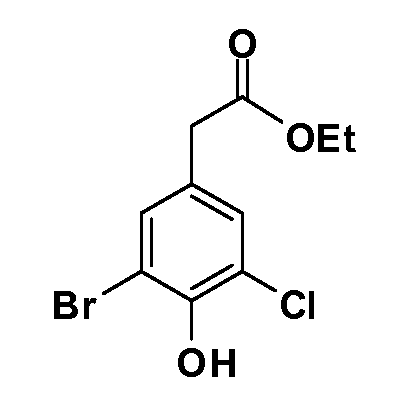
К перемешиваемому раствору 2-(3-хлор-4-гидроксифенил)этилацетата (11 г, 51 ммоль) в 200 мл CCl4 медленно добавляли бром (8,22 г, 51 ммоль) в виде раствора в CCl4 (100 мл) при 0°C в течение 30 мин. Реакционную смесь перемешивали в течение еще 30 минут при 0°C. После этого реакционную смесь лили на измельченный лед и экстрагировали DCM (2×100 мл). Объединенные органические слои промывали водой, затем 10%-ным раствором бисульфита натрия, высушивали надNa2SO4, фильтровали и упаривали при пониженном давлении, получая 2-(3-бром-5-хлор-4-гидроксифенил)этилацетат (12,2 г) в форме твердого вещества белого цвета с 80%-ным выходом.1H ЯМР(CDCl3): 7,37 (с, 1H), 7,27 (с, 1H), 5,68 (ушир.с, 1H), 4,16 (кв., 2H), 3,48 (с, 2H), 1,29 (т, 3H).
Стадия 3
2-(3-бром-5-хлор-4-(2,2,2-трифторэтокси)фенил)этилацетат
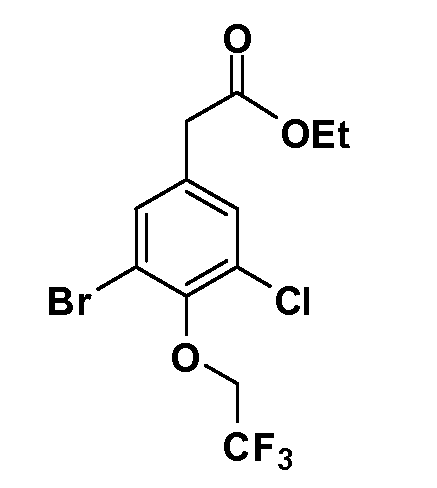
К перемешиваемому раствору 2-(3-бром-5-хлор-4-гидроксифенил)этилацетата(2 г, 6,8 ммоль), карбоната калия (2,35 г, 17,0 ммоль) в сухом DMF (20 мл) при температуре окружающей среды медленно добавляли трифторэтилйодид (8,58 г, 4,0 мл, 40,8 ммоль), реакционную смесь медленно нагревали до 100°C, и нагревание продолжали в течение 4 ч. После этого реакционную смесь лили на воду и экстрагировали этилацетатом (2×50 мл). Объединенные органические слои промывали водой, высушивали надNa2SO4 и упаривали при пониженном давлении. Очистка хроматографией на колонках с силикагелем (гексан/EtOAc) дала 2-(3-бром-5-хлор-4-(2,2,2-трифторэтокси)фенил)этилацетат (0,750 г, 30%-ый выход).1H ЯМР (CDCl3, 400 МГц): 7,43 (с, 1H), 7,34 (с, 1H), 4,4 (кв., 2H), 4,13 (кв., 2H), 3,55 (т, 1H), 1,93 (м, 1H), 1,58 (м, 1H), 1,45 (м, 1H), 1,24 (т, 3H), 0,92 (д, 6H).
Стадия 4
2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)этилацетат
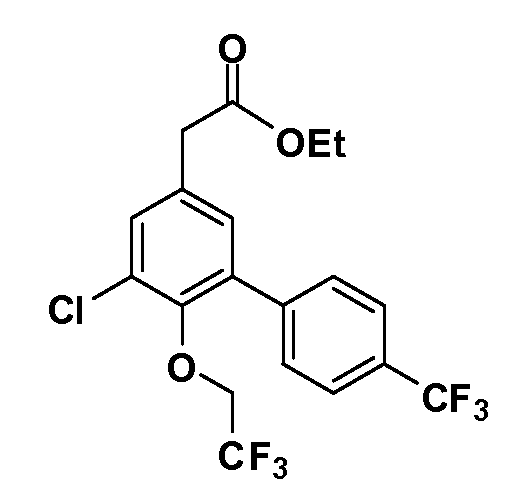
Смесь 2-(3-бром-5-хлор-4-(2,2,2-трифторэтокси)фенил)ацетата (0,750 г, 2,0 ммоль), 4-трифторметилфенилбороновой кислоты (0,567 г, 3,0 ммоль), Pd(PPh3)4 (0,231 г, 0,2 ммоль), фторида цезия (0,604 г, 4,0 ммоль) в DME (10 мл) перемешивали в течение ночи при 100°C, после чего осадки удаляли фильтрацией. Фильтрат разбавляли водой и экстрагировали этилацетатом (2×50 мл). Объединенные органические слои промывали водой, затем солевым раствором и высушивали надNa2SO4. Сырой остаток очищали флэш-хроматографией на колонке, получая 2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)этилацетат(0,525 г, 73,6%) в форме твердого вещества грязно-белого цвета.
Стадия 5
2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилэтилпропаноат
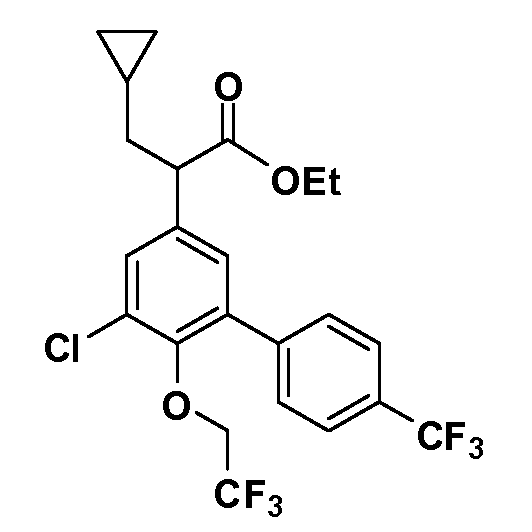
2-(5-Хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)этилацетат (1,0 г, 2,27 ммоль) растворяли в безводном DMF (80 мл), при 0°C добавляли NaH (60 вес.% в парафиновом масле, 0,109 г, 2,72 ммоль). Реакционную смесь перемешивали в течение 30 минут при температуре окружающей среды, после чего циклопропилметилбромид (0,24 мл, 2,5 ммоль) добавляли по каплям при 0°C. Реакционную смесь перемешивали дополнительно 1 ч при 0°C, после чего добавляли насыщенный раствор (10 мл)NH4Cl. Реакционную смесь экстрагировали EtOAc (3×50 мл), и объединенные органические фазы промывали водой (3×20 мл) и солевым раствором (20 мл), высушивали надNa2SO4, фильтровали и упаривали при пониженном давлении, получая бесцветное масло, которое очищали флэш-хроматографией на колонке, получая 2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилэтилпропаноат (0,68 г).
Стадия 6
2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилпропановая кислота
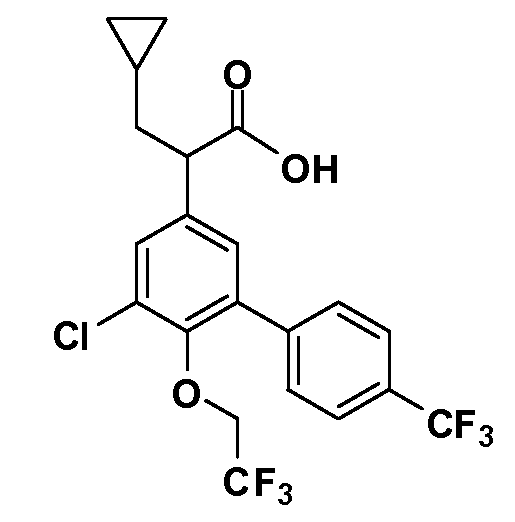
Смесь 2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилэтилпропаноата (0,68 г, 0,4 ммоль) и моногидрата гидроксида лития (100 мг, 4,6 ммоль) в смеси растворителей MeOH/THF/вода (15 мл/15 мл/15 мл) перемешивали в течение 3 ч при температуре окружающей среды. После завершения реакции летучие компоненты удаляли при пониженном давлении. Остаток разбавляли водой, подкисляли 5% раствором HCl и экстрагировали этилацетатом (3×50 мл). Объединенные органические слои промывали водой, высушивали над Na2SO4, фильтровали и упаривали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке, получая 2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилпропановую кислоту с 88%-ным выходом (0,4 г). 1H-ЯМР (CDCl3, 500 МГц): 7,72 (д, 2H), 7,65 (д, 2H), 7,43 (с, 1H), 7,24 (с, 1H), 3,98 (кв., 2H), 3,72 (т, 1H), 1,94 (м, 1H), 1,78 (м, 1H), 0,71 (м, 1H), 0,46 (м, 2H), 0,02-0,19 (м, 2H).
Пример 1269: 1-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклобутанкарбоновая кислота
Стадия 1
1-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклобутанэтилкарбоксилат
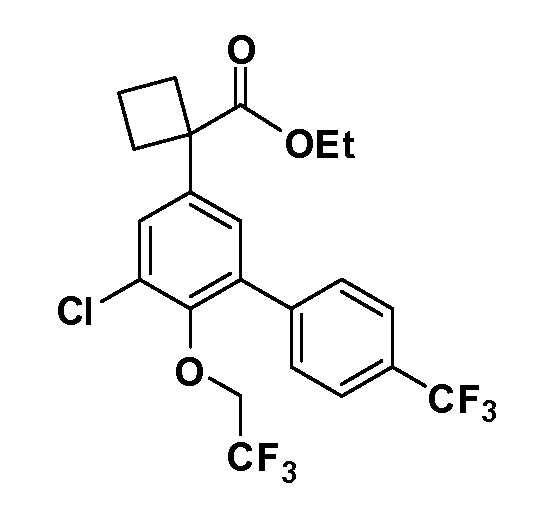
2-(5-Хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)этилацетат (1,5 г, 3,4 ммоль) растворяли в безводном DMF (30 мл), при 0°C добавляли NaH (60 вес.% в парафиновом масле, 0,163 г, 6,8 ммоль). Реакционную смесь перемешивали в течение 30 минут при температуре окружающей среды, и 1,3-дибромпропан (0,757 г, 3,7 ммоль) добавляли по каплям при 0°C. Реакционную смесь перемешивали в течение еще 1 ч при 0°C и добавляли насыщенный раствор (10 мл)NH4Cl. Реакционную смесь экстрагировали EtOAc (3×20 мл), и объединенные органические фазы промывали водой (3×20 мл) и солевым раствором (20 мл) и высушивали надMgSO4. Летучие компоненты удаляли при пониженном давлении, и остаток очищали флэш-хроматографией на колонке, получая 1-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклобутанэтилкарбоксилат (400 мг).
Стадия 2
1-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклобутанкарбоновая кислота
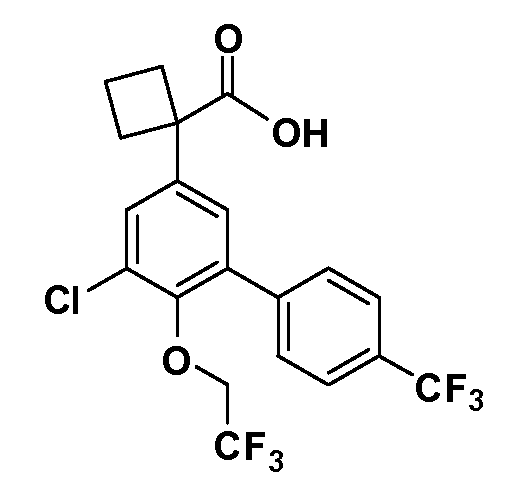
Смесь 1-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклобутанэтилкарбоксилата (400 мг, 0,83 ммоль) и моногидрата гидроксида лития (0,2 г, 8,3 ммоль) в смеси растворителей MeOH/THF/вода (10 мл/10 мл/10 мл) перемешивали в течение 3 ч при температуре окружающей среды. После завершения реакции летучие компоненты удаляли при пониженном давлении. Остаток разбавляли водой, подкисляли 5% раствором HCl и экстрагировали этилацетатом (3×50 мл). Объединенные органические слои промывали водой, высушивали над Na2SO4, фильтровали и упаривали при пониженном давлении. Остаток очищали хроматографией на колонках, получая 1-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклобутанкарбоновую кислоту с 88%-ным выходом (0,21 г). 1H-ЯМР (CDCl3, 400 МГц): 7,72 (д, 2H), 7,65 (д, 2H), 7,39 (с, 1H), 7,26 (с, 1H), 3,98 (кв., 2H), 2,86 (м, 2H), 2,52 (м, 2H), 2,16 (м, 1H), 1,91 (м, 1H).
Пример 419: 1-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклопентанкарбоновая кислота
Стадия 1
1-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклопентанэтилкарбоксилат
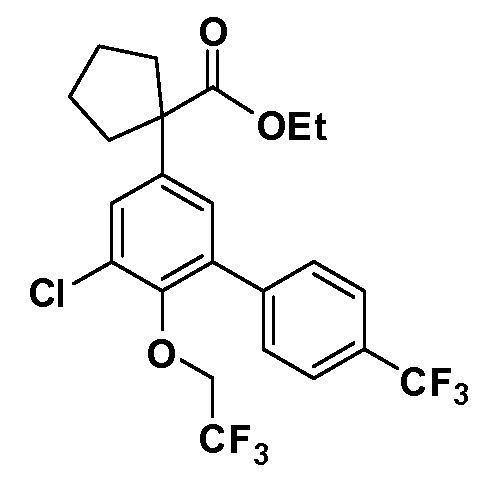
2-(5-Хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)этилацетат (0,8 г, 1,81 ммоль) растворяли в безводном DMF (30 мл), при 0°C добавляли NaH (60 вес.% в парафиновом масле, 0,109 г, 4,5 ммоль). Реакционную смесь перемешивали в течение 30 минут при температуре окружающей среды, и 1,4-дибромбутан (0,432 г, 1,99 ммоль) добавляли по каплям при 0°C. Реакционную смесь перемешивали дополнительно 1 ч при 0°C, после чего добавляли насыщенный раствор (10 мл)NH4Cl. Реакционную смесь экстрагировали EtOAc (3×20 мл), и объединенные органические фазы промывали водой (3×20 мл) и солевым раствором (20 мл) и высушивали надMgSO4. Летучие компоненты удаляли при пониженном давлении, и остаток очищали флэш-хроматографией на колонке, получая 1-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклопентанэтилкарбоксилат (400 мг) в форме вязкой жидкости.
Стадия 2
1-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклопентанкарбоновая кислота
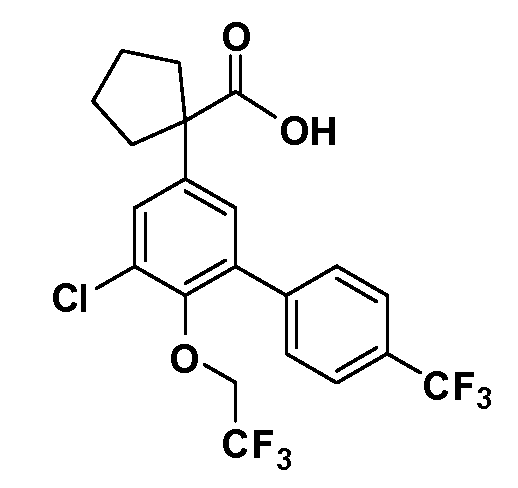
Смесь 1-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклопентанэтилкарбоксилата (100 мг, 0,21 ммоль) и моногидрата гидроксида лития (96 мг, 2,1 ммоль) в смеси растворителей MeOH/THF/вода (5 мл/5 мл/5 мл) перемешивали в течение 3 ч при температуре окружающей среды. После завершения реакции летучие компоненты удаляли при пониженном давлении. Остаток разбавляли водой, подкисляли 5% раствором HCl и экстрагировали этилацетатом (3×50 мл). Объединенные органические слои промывали водой, высушивали над Na2SO4, фильтровали и упаривали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке, получая 1-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклопентанкарбоновую кислоту (0,05 г). 1H-ЯМР (CDCl3, 500 МГц): 7,72 (д, 2H), 7,65 (д, 2H), 7,56 (с, 1H), 7,34 (с, 1H), 3,98 (кв., 2H), 2,68 (м, 2H), 1,94 (м, 2H), 1,78 (м, 4H).
Пример 3202: 4-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)тетрагидро-2H-пиран-4-карбоновая кислота
Стадия 1
4-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)тетрагидро-2H-пиран-4-этилкарбоксилат
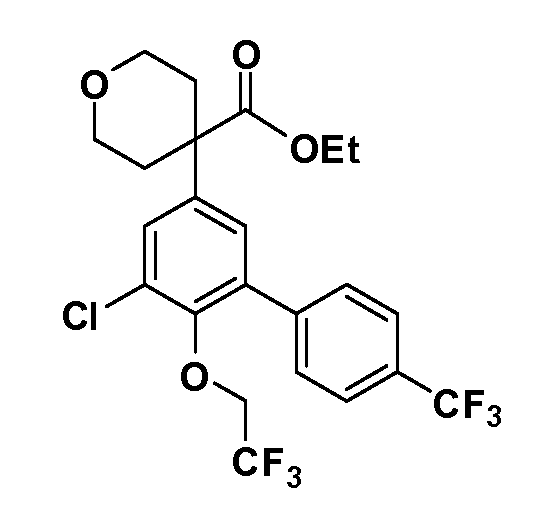
2-(5-Хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)этилацетат (0,4 г, 3,4 ммоль) растворяли в безводном DMF (30 мл), при 0°C добавляли NaH (60 вес.% в парафиновом масле, 0,163 г, 6,8 ммоль). Реакционную смесь перемешивали в течение 30 минут при температуре окружающей среды, и 1-йод-2-(2-йодэтокси)этан (1,2 г, 3,7 ммоль) добавляли по каплям при 0°C. Реакционную смесь перемешивали дополнительно 1 ч при 0°C и добавляли насыщенный раствор (10 мл)NH4Cl. Реакционную смесь экстрагировали EtOAc (3×20 мл), и объединенные органические фазы промывали водой (3×20 мл) и солевым раствором (20 мл) и высушивали надMgSO4. Летучие компоненты удаляли при пониженном давлении, и остаток очищали флэш-хроматографией на колонке, получая 4-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)тетрагидро-2H-пиран-4-этилкарбоксилат (400 мг).
Стадия 2
4-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)тетрагидро-2H-пиран-4-карбоновая кислота
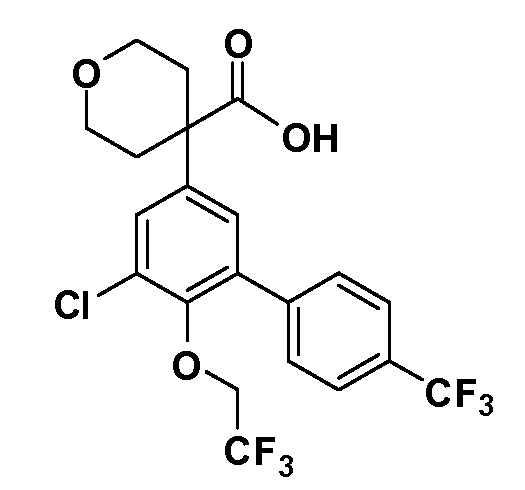
Смесь 4-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)тетрагидро-2H-пиран-4-этилкарбоксилата (400 мг, 0,78 ммоль) и моногидрата гидроксида лития (0,188 г, 7,8 ммоль) в смеси растворителей MeOH/THF/вода (5 мл/5 мл/5 мл) перемешивали в течение 3 ч при температуре окружающей среды. После завершения реакции летучие компоненты удаляли при пониженном давлении. Остаток разбавляли водой, подкисляли 5% раствором HCl и экстрагировали этилацетатом (3×50 мл). Объединенный органический слой промывали водой, высушивали над Na2SO4, фильтровали и упаривали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке, получая 4-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)тетрагидро-2H-пиран-4-карбоновую кислоту (100 мг).1H-ЯМР (CDCl3, 400 МГц): 7,72 (д, 2H), 7,65 (д, 2H), 7,56 (с, 1H), 7,34 (с, 1H), 3,98 (кв., 2H), 3,61 (т, 2H), 2,53 (дд, 2H), 1,99 (м, 2H).
Пример 3203: 1-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-4,4-диметилциклогексанкарбоновая кислота
Стадия 1
1-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-4,4-диметилциклогексанэтилкарбоксилат
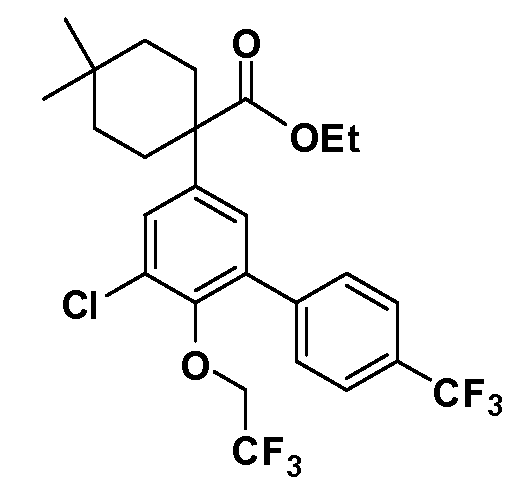
2-(5-Хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)этилацетат (0,5 г, 1,13 ммоль) растворяли в безводном DMF (30 мл), при 0°C добавляли NaH (60 вес.% в парафиновом масле, 0,113 г, 2,8 ммоль). Реакционную смесь перемешивали в течение 30 минут при температуре окружающей среды, и 3,3-диметил-1,5-дибромпентан (0,322 г, 1,25 ммоль) добавляли по каплям при 0°C. Реакционную смесь перемешивали дополнительно 1 ч при 0°C и добавляли насыщенный раствор (10 мл)NH4Cl. Реакционную смесь экстрагировали EtOAc (3×20 мл), и объединенные органические фазы промывали водой (3×20 мл) и солевым раствором (20 мл) и высушивали надMgSO4. Летучие компоненты удаляли при пониженном давлении, и остаток очищали флэш-хроматографией на колонке, получая 1-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-4,4-диметилциклогексанэтилкарбоксилат (230 мг).
Стадия 2
1-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-4,4-диметилциклогексанкарбоновая кислота
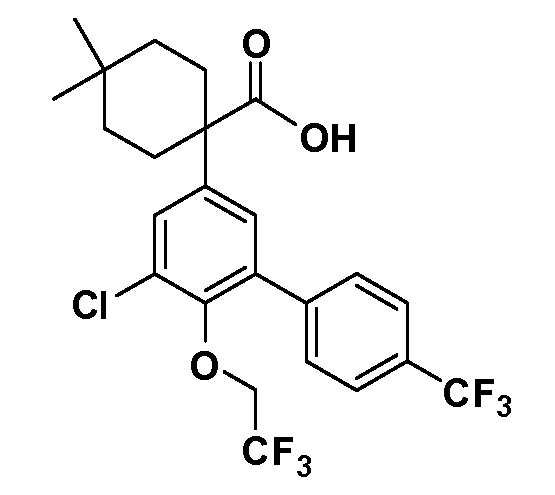
Смесь 1-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-4,4-диметилциклогексанэтилкарбоксилата (200 мг, 0,37 ммоль) и моногидрата гидроксида лития (88 мг, 3,7 ммоль) в смеси растворителей MeOH/THF/вода (5 мл/5 мл/5 мл) перемешивали в течение 3 ч при температуре окружающей среды. После завершения реакции летучие компоненты удаляли при пониженном давлении. Остаток разбавляли водой, подкисляли 5% раствором HCl и экстрагировали этилацетатом (3×50 мл). Объединенные органические слои промывали водой, высушивали над Na2SO4, фильтровали и упаривали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке, получая 1-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-4,4-диметилциклогексанкарбоновую кислоту с 67%-ным выходом (150 мг).1H-ЯМР (CDCl3, 400 МГц): 7,72 (д, 2H), 7,65 (д, 2H), 7,56 (с, 1H), 7,34 (с, 1H), 3,98 (кв., 2H), 2,48 (дд, 2H), 1,88 (м, 2H), 1,41 (м, 4H), 0,98 (с, 3H), 0,91 (с, 3H).
Пример 1270: 1-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклогексанкарбоновая кислота
Стадия 1
1-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклогексанэтилкарбоксилат
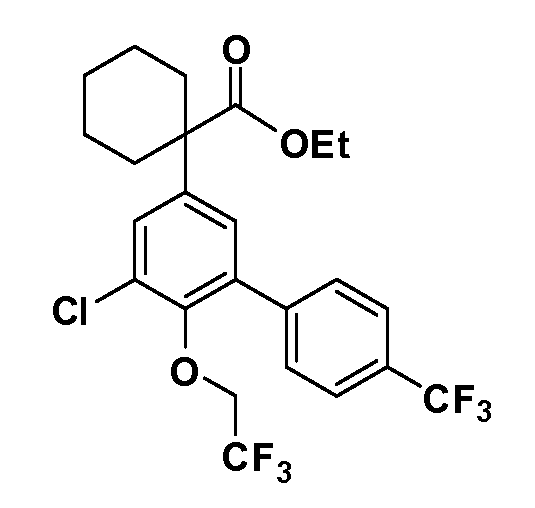
2-(5-Хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)этилацетат (0,5 г, 1,13 ммоль) растворяли в безводном DMF (30 мл), при 0°C добавляли NaH (60 вес.% в парафиновом масле, 0,113 г, 2,8 ммоль). Реакционную смесь перемешивали в течение 30 минут при температуре окружающей среды, и 1,5-дибромпентан (0,19 г, 1,24 ммоль) добавляли по каплям при 0°C. Реакционную смесь перемешивали дополнительно 1 ч при 0°C и добавляли насыщенный раствор (10 мл)NH4Cl. Реакционную смесь экстрагировали EtOAc (3×20 мл), и объединенные органические фазы промывали водой (3×20 мл) и солевым раствором (20 мл) и высушивали надMgSO4. Летучие компоненты удаляли при пониженном давлении, и остаток очищали флэш-хроматографией на колонке, получая 1-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-циклогексанэтилкарбоксилат (0,37 г) в форме вязкой жидкости.
Стадия 2
1-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклогексанкарбоновая кислота
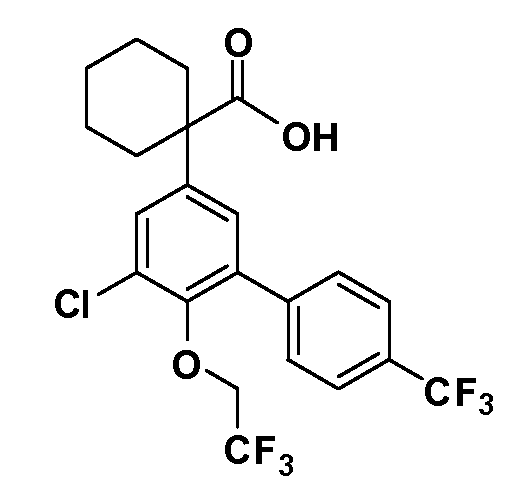
Смесь 1-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-циклогексанэтилкарбоксилата (0,37 г, 0,72 ммоль) и моногидрата гидроксида лития (0,174 г, 7,28 ммоль) в смеси растворителей MeOH/THF/вода (10 мл/10 мл/10 мл) перемешивали в течение 3 ч при температуре окружающей среды. После завершения реакции летучие компоненты удаляли при пониженном давлении. Остаток разбавляли водой, подкисляли 5% раствором HCl и экстрагировали этилацетатом (3×50 мл). Объединенные органические слои промывали водой, высушивали над Na2SO4, фильтровали и упаривали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке, получая 1-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-циклогексанкарбоновую кислоту (0,25 г) в форме твердого вещества белого цвета.1H-ЯМР (CDCl3, 400 МГц): 7,72 (д, 2H), 7,65 (д, 2H), 7,55 (с, 1H), 7,34 (с, 1H), 3,98 (кв., 2H), 2,48 (дд, 2H), 1,52-1,81 (м, 6H), 1,33 (м, 2H).
Пример 1271: 5-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-спиро[2,3]гексан-5-карбоновая кислота
Стадия 1
5-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-спиро[2,3]гексан-5-этилкарбоксилат
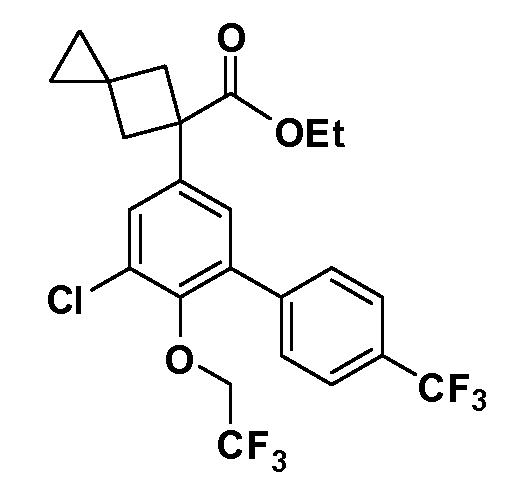
2-(5-Хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)этилацетат (0,6 г, 1,36 ммоль) растворяли в безводном DMF (30 мл), при 0°C добавляли NaH (60 вес.% в парафиновом масле, 0,136 г, 3,4 ммоль). Реакционную смесь перемешивали в течение 30 минут при температуре окружающей среды, и 1,1-бис(бромметил)циклопропан (0,482 г, 1,4 ммоль, в отношении получения см. J. Org. 1993 Chem, 58, 4122-26) добавляли по каплям при 0°C. Реакционную смесь перемешивали дополнительно 1 ч при 0°C и добавляли насыщенный раствор (10 мл)NH4Cl. Реакционную смесь экстрагировали EtOAc (3×20 мл), и объединенные органические фазы промывали водой (3×20 мл) и солевым раствором (20 мл) и высушивали надMgSO4. Летучие компоненты удаляли при пониженном давлении, и остаток очищали флэш-хроматографией на колонке, получая 5-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-спиро[2,3]гексан-5-этилкарбоксилат (150 мг) в форме твердого вещества с низкой температурой плавления.
Стадия 2
5-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-спиро[2,3]гексан-5-карбоновая кислота
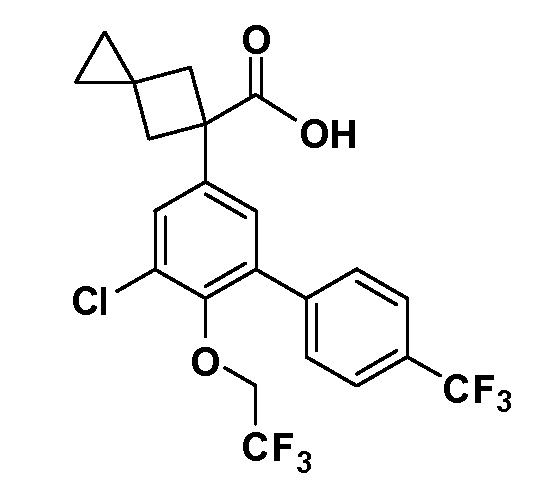
Смесь 5-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-спиро[2,3]гексан-5-этилкарбоксилата (0,5 г, 0,9 ммоль) и моногидрата гидроксида лития (0,415 г, 9,88 ммоль) в смеси растворителей MeOH/THF/вода (10 мл/10 мл/10 мл) перемешивали в течение 3 ч при температуре окружающей среды. После завершения реакции летучие компоненты удаляли при пониженном давлении. Остаток разбавляли водой, подкисляли 5% раствором HCl и экстрагировали этилацетатом (3×50 мл). Объединенный органический слой промывали водой, высушивали над Na2SO4, фильтровали и упаривали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке, получая 5-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-спиро[2,3]гексан-5-карбоновую кислоту (0,29 г).1H-ЯМР (CDCl3, 400 МГц): 7,72 (д, 2H), 7,65 (д, 2H), 7,41 (с, 1H), 7,21 (с, 1H), 3,98 (кв., 2H), 2,95 (д, 2H), 2,75 (д, 2H), 0,58 (т, 2H), 0,48 (т, 2H).
Пример 1268: 2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-циклобутилпропановая кислота
Стадия 1
2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-циклобутилэтилпропаноат
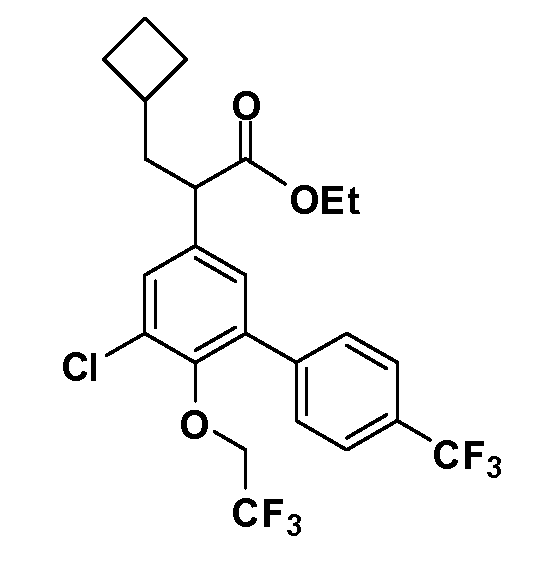
2-(5-Хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)этилацетат (0,6 г, 0,49 ммоль) растворяли в безводном DMF (30 мл), при 0°C добавляли NaH (60 вес.% в парафиновом масле, 0,039 г, 1,69 ммоль). Реакционную смесь перемешивали в течение 30 минут при температуре окружающей среды, и циклобутилметил бромид (0,223 г, 1,49 ммоль) добавляли по каплям при 0°C. Реакционную смесь перемешивали дополнительно 1 ч при 0°C и добавляли насыщенный раствор (10 мл)NH4Cl. Реакционную смесь экстрагировали EtOAc (3×20 мл), и объединенные органические фазы промывали водой (3×20 мл) и солевым раствором (20 мл) и высушивали надMgSO4, летучие компоненты удаляли при пониженном давлении, и остаток очищали флэш-хроматографией на колонке, получая 2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-циклобутилэтилпропаноат (0,25 г) в форме бесцветной жидкости.
Стадия 2
2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-циклобутилпропановая кислота
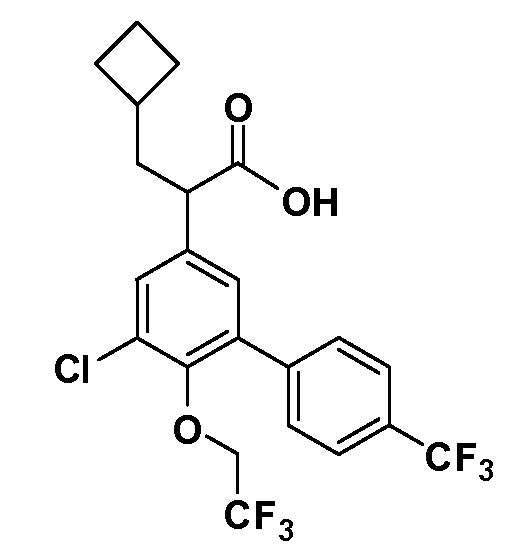
Смесь 2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-циклобутилэтилпропаноата (0,25 г, 0,49 ммоль) и моногидрата гидроксида лития (0,206 г, 4,9 ммоль) в смеси растворителей MeOH/THF/вода (10 мл/10 мл/10 мл) перемешивали в течение 3 ч при температуре окружающей среды. После завершения реакции летучие компоненты удаляли при пониженном давлении. Остаток разбавляли водой, подкисляли 5% раствором HCl и экстрагировали этилацетатом (3×50 мл). Объединенные органические слои промывали водой, высушивали над Na2SO4, фильтровали и упаривали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке, получая 2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-циклобутилпропановую кислоту (0,106 г) в форме твердого вещества белого цвета.1H-ЯМР (CDCl3, 400 МГц): 7,72 (д, 2H), 7,65 (д, 2H), 7,41 (с, 1H), 7,18 (с, 1H), 3,98 (кв., 2H), 3,51 (т, 1H), 2,15-2,28 (м, 2H), 1,55-2,15 (м, 7H).
Пример 1272: 2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-2-циклопентилуксусная кислота
Стадия 1
2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-2-циклопентилэтилацетат
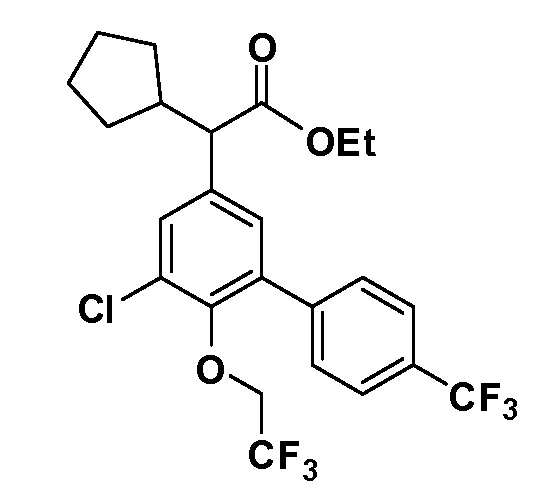
2-(5-Хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)этилацетат (0,8 г, 1,8 ммоль) растворяли в безводном DMF (40 мл), при 0°C добавляли NaH (60 вес.% в парафиновом масле, 0,052 г, 2,18 ммоль). Реакционную смесь перемешивали в течение 30 минут при температуре окружающей среды, и циклопентилбромид (0,298 г, 1,99 ммоль) добавляли по каплям при 0°C. Реакционную смесь перемешивали дополнительно 1 ч при 0°C и добавляли насыщенный раствор (10 мл)NH4Cl. Реакционную смесь экстрагировали EtOAc (3×50 мл), и объединенные органические фазы промывали водой (3×20 мл) и солевым раствором (20 мл) и высушивали надMgSO4. Летучие компоненты удаляли при пониженном давлении, и остаток очищали флэш-хроматографией на колонке, получая 2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-2-циклопентилэтилацетат (0,4 мг) в форме вязкой жидкости.
Стадия 2
2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-2-циклопентилуксусная кислота
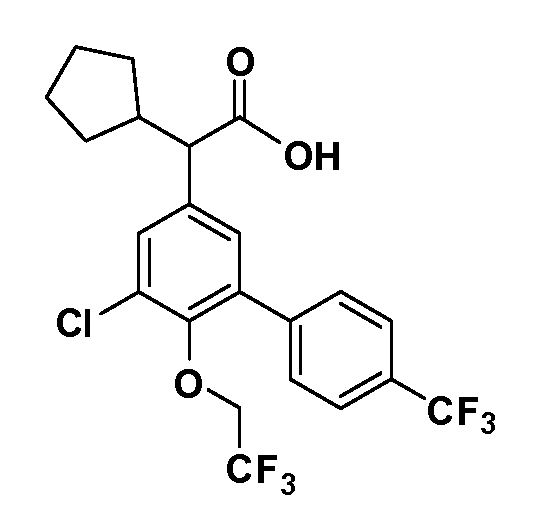
Смесь 2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-2-циклопентилэтилацетата (400 мг, 0,78 ммоль) и моногидрата гидроксида лития (0,330 г, 7,87 ммоль) в смеси растворителей MeOH/THF/вода (10 мл/10 мл/10 мл) перемешивали в течение 3 ч при температуре окружающей среды. После завершения реакции летучие компоненты удаляли при пониженном давлении. Остаток разбавляли водой, подкисляли 5% раствором HCl и экстрагировали этилацетатом (3×50 мл). Объединенные органические слои промывали водой, высушивали над Na2SO4, фильтровали и упаривали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке, получая 2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-2-циклопентилуксусную кислоту (0,08 г).1H-ЯМР (CDCl3, 400 МГц): 12,5 (с, 1H), 7,84 (д, 2H), 7,70 (д, 2H), 7,55 (с, 1H), 7,35 (с, 1H), 4,22 (кв., 2H), 3,3,35 (д, 1H), 1,82 (м, 1H), 1,18-1,68 (м, 7H), 1,08 (м, 1H).
Пример 3204: 2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-(4-фторфенил)пропановая кислота
Стадия 1
2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-(4-фторфенил)этилпропаноат
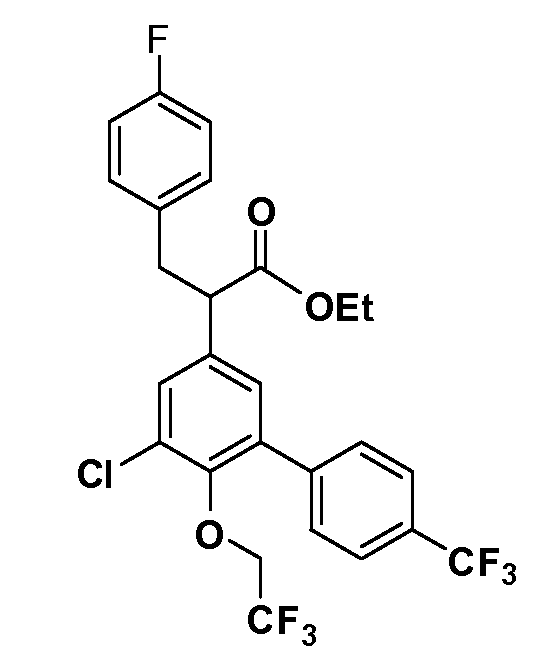
2-(5-Хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)этилацетат (0,6 г, 1,36 ммоль) растворяли в безводном DMF (30 мл), при 0°C добавляли NaH (60 вес.% в парафиновом масле, 0,039 г, 1,36 ммоль). Реакционную смесь перемешивали в течение 30 минут при температуре окружающей среды, и циклопентилбромид (0,283 г, 1,49 ммоль) добавляли по каплям при 0°C. Реакционную смесь перемешивали дополнительно 1 ч при 0°C и добавляли насыщенный раствор (10 мл)NH4Cl. Реакционную смесь экстрагировали EtOAc (3×20 мл), и объединенные органические фазы промывали водой (3×20 мл) и солевым раствором (20 мл) и высушивали надMgSO4. Летучие компоненты удаляли при пониженном давлении, и остаток очищали флэш-хроматографией на колонке, получая 2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-(4-фторфенил)этилпропаноат (0,29 г) в форме бесцветной жидкости.
Стадия 2
2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-(4-фторфенил)пропановая кислота
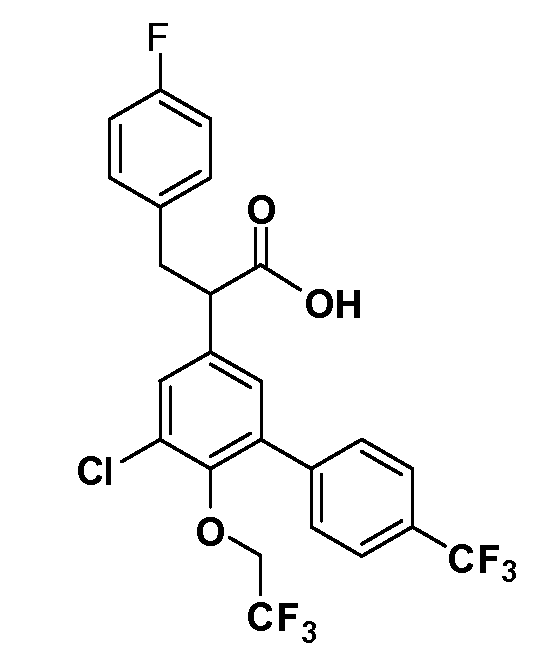
Смесь 2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-(4-фторфенил)этилпропаноата (400 мг, 0,719 ммоль) и моногидрата гидроксида лития (0,306 г, 7,29 ммоль) в смеси растворителей MeOH/THF/вода (10 мл/10 мл/10 мл) перемешивали в течение 3 ч при температуре окружающей среды. После завершения реакции летучие компоненты удаляли при пониженном давлении. Остаток разбавляли водой, подкисляли 5% раствором HCl и экстрагировали этилацетатом (3×50 мл). Объединенные органические слои промывали водой, высушивали над Na2SO4, фильтровали и упаривали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке, получая 2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-(4-фторфенил)пропановую кислоту (0,1 г).1H-ЯМР (CDCl3, 400 МГц): 7,55-7,78 (м, 4H), 7,42 (с, 1H), 7,18 (с, 1H), 6,92-7,16 (м, 4H), 3,98 (кв., 2H), 3,84 (т, 1H), 3,41 (дд, 1H), 3,02 (дд, 1H).
Пример 1905: 2-(2-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-4-ил)-3-циклопропилпропановая кислота
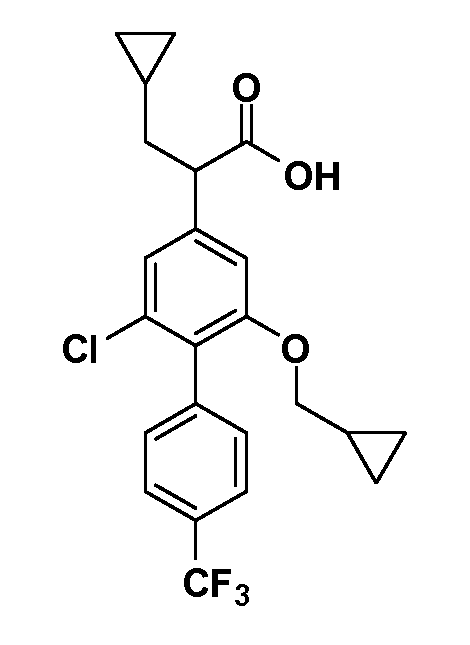
Стадия 1
2-(циклопропилметокси)-4-фтор-1-нитробензол
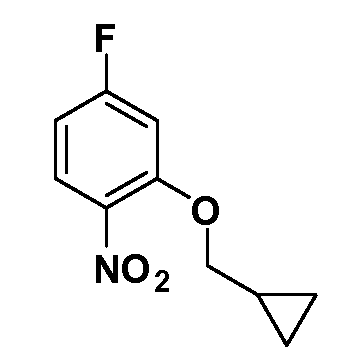
Циклопропилметанол (15 г, 207 ммоль) добавляли к перемешиваемой суспензии NaH (60% в минеральном масле, 8,37 г) в 200 мл THF в течение 15 минут при 0°C в атмосфере азота. Реакционной смеси давали нагреться до температуры окружающей среды и перемешивали в течение 1 ч при температуре окружающей среды. Смесь охлаждали до 0°C и добавляли по каплям раствор 2,4-дифтор-1-нитробензол (30 г, 187 ммоль) в 200 мл THF. Реакционную смесь перемешивали при 0°C в течение 2 ч и затем лили на воду со льдом. Смесь экстрагировали этилацетатом (3×100 мл). Объединенные органические слои высушивали надMgSO4 и концентрировали при пониженном давлении, получая 22,0 г 2-(циклопропилметокси)-4-фтор-1-нитробензола в форме оранжевого масла (86%).
Стадия 2
2-(3-(циклопропилметокси)-4-нитрофенил)диэтилмалонат
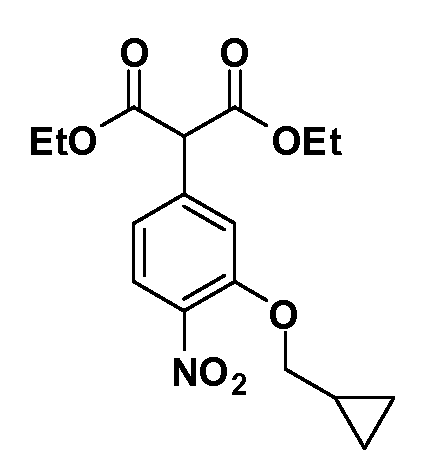
Диэтилмалонат (9,8 г, 1,1 экв.) добавляли за 15 минут при 0°C под азотом к перемешиваемой суспензии гидрида натрия (60% в минеральном масле, 2,09 г) в DMF (88 мл). Реакционной смеси давали нагреться до температуры окружающей среды и перемешивали в течение 1 ч. Раствор 2-циклопропилметокси-4-фтор-1-нитробензол (10 г, 1 экв.) в DMF (88 мл) добавляли по каплям при 0°C, и реакционную смесь нагревали до 100°C в течение 3 часов. Реакционной смеси давали охладиться до температуры окружающей среды, вливали в воду со льдом и экстрагировали EtOAc (3×100 мл). Объединенные органические фазы промывали водой (3×100 мл) и солевым раствором (100 мл), высушивали (MgSO4) и фильтровали. Выпаривание летучих компонентов при пониженном давлении дало 10,0 г сырого продукта, который очищали хроматографией на силикагеле (гексан/EtOAc) с получением 2-(3-(циклопропилметокси)-4-нитрофенил)диэтилмалоната (7,0 г).1H-ЯМР (CDCl3, 200 МГц): 0,4 (м, 2H), 0,71 (м, 2H), 1,3 (м, 1H), 1,3 (т, 6H), 3,96 (д, 2H), 4,25 (кв., 4H), 4,5 (с, 1H), 7,02 (д, 1H), 7,18 (с, 1H), 7,81 (д, 2H).
Стадия 3
2-(3-(циклопропилметокси)-4-нитрофенил)уксусная кислота
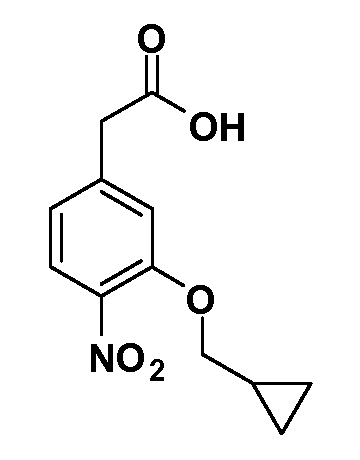
2-(3-(Циклопропилметокси)-4-нитрофенил)диэтилмалонат (10 г) растворяли в 100 мл этанола и охлаждали до 0°C, к реакционной смеси приблизительно за 15 минут медленно добавляли раствор (4 экв.) NaOH. Реакционную смесь мягко нагревали до 60°C в течение 5 часов. Развитие реакции проверяли анализом TLC. После полного преобразования исходного материала растворитель выпаривали при пониженном давлении, остаток растворяли вH2O, подкисляли с использованием 6н. HCl до рН 2. Отфильтрованный твердый материал промывали водой, высушивали при пониженном давлении, получая 2-(3-(циклопропилметокси)-4-нитрофенил)уксусную кислоту (6,5 г) в форме твердого вещества желтого цвета.1H-ЯМР (CDCl3, 200 МГц): 0,36 (м, 2H), 0,58 (м, 2H), 1,28 (м, 1H), 3,71 (с, 2H), 4,01 (д, 2H), 7,02 (д, 1H), 7,23 (с, 1H), 7,81 (д, 1H).
Стадия 4
2-(3-(циклопропилметокси)-4-нитрофенил)этилацетат
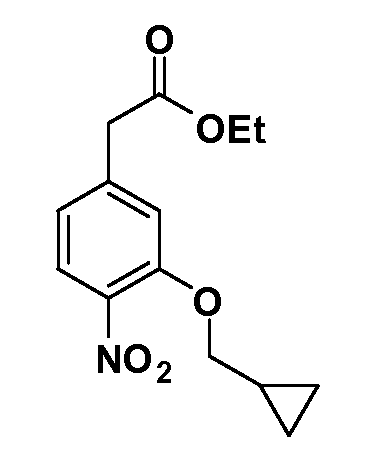
2-(3-(Циклопропилметокси)-4-нитрофенил)уксусную кислоту (40 г, 143 ммоль) растворяли в 20%-ном растворе (200 мл) EtOH-HCl и нагревали с обратным холодильником в течение 3 часов, чтобы преобразовать исходный материал в сложный эфир. Летучие компоненты удаляли при пониженном давлении, и остаток экстрагировали этилацетатом (×2). Объединенные органические экстракты промывали водой, высушивали (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой материал очищали перекристаллизацией, получая 2-(3-(циклопропилметокси)-4-нитрофенил)этилацетат (38 г) в форме твердого вещества светло-желтого цвета.
Стадия 5
2-(4-амино-3-(циклопропилметокси)фенил)этилацетат
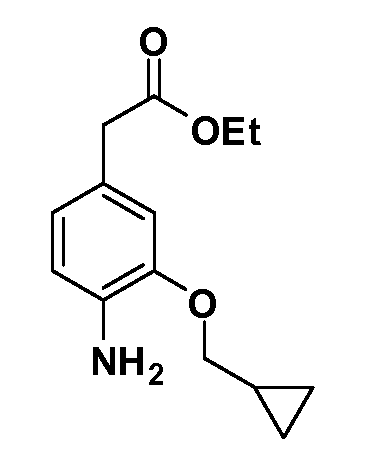
К перемешиваемому раствору 2-(3-(циклопропилметокси)-4-нитрофенил)этилацетата (10 г) в сухом MeOH (100 мл) добавляли Pd(ОН)2 (2 г), и смесь восстанавливали в атмосфереH2 в течение 6 часов при температуре окружающей среды. Смесь фильтровали через Целит™, промывая MeOH. Объединенные фильтраты концентрировали при пониженном давлении, получая 2-(4-амино-3-(циклопропилметокси)фенил)этилацетат (7,5 г) в форме вязкой жидкости.1H-ЯМР (CDCl3, 200 МГц): 0,38 (м, 2H), 0,61 (м, 2H), 1,23 (м, 1H), 1,23 (т, 3H), 3,51 (с, 2H), 3,80 (д, 2H), 4,16 (кв., 2H), 6,72 (м, 3H).
Стадия 6
2-(4-амино-3-хлор-5-(циклопропилметокси)фенил)этилацетат
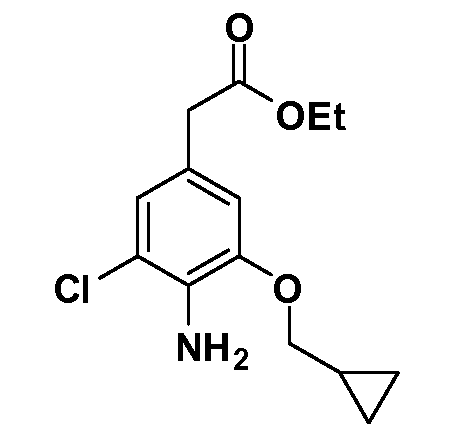
К перемешиваемому раствору 2-(4-амино-3-(циклопропилметокси)фенил)этилацетата (1,2 г, 4,0 ммоль) в сухомCCl4 (60 мл) при 0°C добавляли NCS (0,427 г, 3,2 ммоль). Реакционную смесь перемешивали в течение 3 часов при температуре окружающей среды. Реакционную смесь разбавляли водой и экстрагировали DCM (2×50 мл). Объединенные органические слои высушивали надNa2SO4, фильтровали, и летучие компоненты удалялив вакууме. Сырую реакционную смесь очищали хроматографией на колонках, получая 2-(4-амино-3-хлор-5-(циклопропилметокси)фенил)этилацетат (920 мг) в форме твердого вещества желтого цвета.
Стадия 7
2-(3-хлор-5-(циклопропилметокси)-4-йодфенил)этилацетат
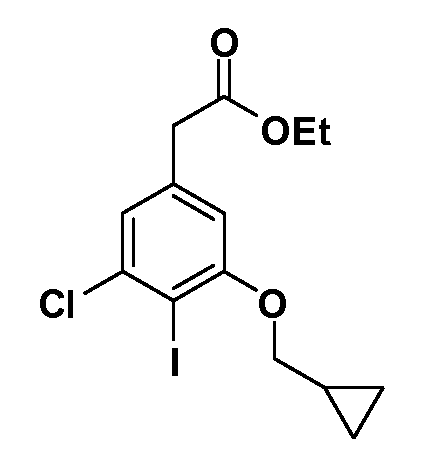
2-(4-Амино-3-хлор-5-(циклопропилметокси)фенил)этилацетат (2,5 г, 10,0 ммоль) растворяли в смеси EtOH/H2O/H2SO4 (96%) 200 мл/400 мл/10 мл при 0°C. РастворNaNO2 (3,2 г, 1,16 экв.) в воде (40 мл) добавляли по каплям при 0°C, и реакционную смесь перемешивали в течение 40 минут при той же самой температуре. Раствор KI (30 г, 30,1 ммоль) в воде (80 мл) добавляли по каплям при 0°C. Реакционную смесь нагревали до 50°C в течение 2,5 часов, после чего летучие компоненты удаляли при пониженном давлении. Реакционную смесь экстрагировали EtOAc (3×50 мл), и объединенные органические слои промывали 10%-ным тиосульфатом натрия (2×50 мл), водой (300 мл) и солевым раствором (300 мл). Органический раствор высушивали надNa2SO4 и концентрировали при пониженном давлении, получая сырое черное масло, которое очищали хроматографией на силикагеле (гексан/EtOAc), получая 2-(3-хлор-5-(циклопропилметокси)-4-йодфенил)этилацетат в форме желтого масла (8,7 г).
Стадия 8
2-(2-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-4-ил)этилацетат
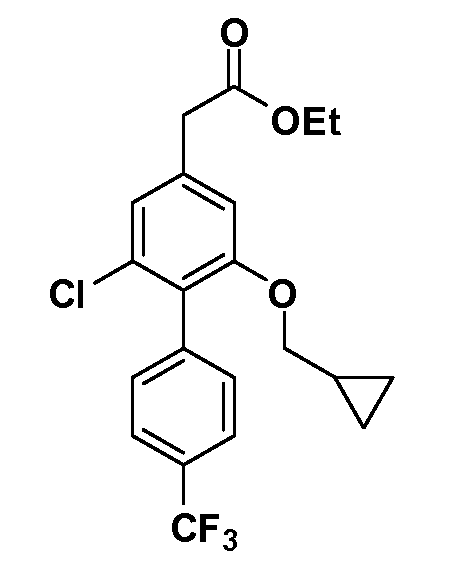
Смесь 2-(3-хлор-5-(циклопропилметокси)-4-йодфенил)этилацетата (5,1 г, 14 ммоль), 4-трифторметилфенилбороновой кислоты (3,36 г, 17 ммоль), CsF (0,28 г, 1,84 ммоль) и Pd(PPh3)4 (0,410 г, 0,4 ммоль) в безводном 1,2-диметоксиэтане (75 мл) нагревали с обратным холодильником в течение 8 часов под аргоном. Реакционную смесь охлаждали до температуры окружающей среды и добавляли 75 мл EtOAc и 75 мл воды. Органическую фазу отделяли, высушивали надNaSO4, фильтровали и концентрировали при пониженном давлении, получая желтое масло. Масло очищали хроматографией на силикагеле (гексан/EtOAc), получая 2-(2-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-4-ил)этилацетат (4,6 г) в форме желтого масла.1H-ЯМР (CDCl3, 200 МГц): 0,41 (м, 2H), 0,62 (м, 2H), 1,22 (т, 3H), 1,23 (м, 1H), 3,58 (с, 2H), 3,89 (д, 2H), 4,17 (кв., 2H), 6,96 (м, 2H), 7,31 (с, 1H), 7,64 (м, 4H).
Стадия 9
2-(2-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-4-ил)-3-циклопропилпропановая кислота
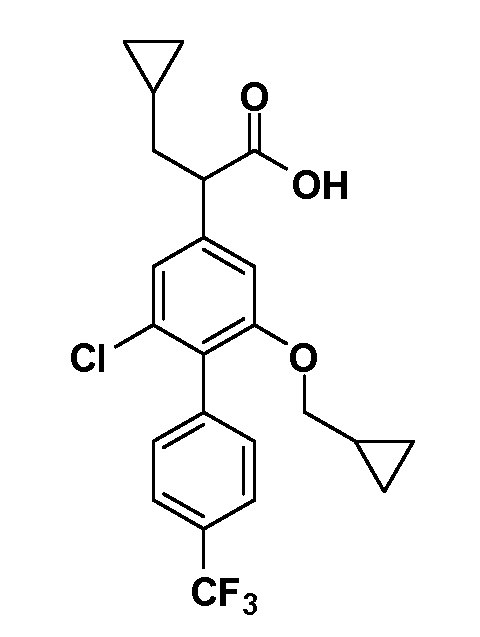
2-(2-Хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-4-ил)этилацетат (1,1 г, 2,4 ммоль) растворяли в 10 мл безводного DMF и при 0°C добавляли NaH (60 вес.% в масле, 0,9 г). Реакционную смесь перемешивали в течение 0,5 ч при 25°C, и циклопропилметилбромид (1,25 мл) добавляли по каплям при 0°C. Реакционную смесь перемешивали в течение дополнительного 1 ч при 0°C, после чего добавляли насыщенный раствор (10 мл)NH4Cl. Реакционную смесь экстрагировали EtOAc (3×20 мл), и объединенные органические фазы промывали водой (3×20 мл) и солевым раствором (20 мл) и высушивали надMgSO4, фильтровали, и летучие компоненты удаляли при пониженном давлении, получая 0,85 г бесцветного масла. Масло растворяли в 10 мл смеси EtOH/H2O (9:1, об./об.) и добавляли (1,0 г) LiOH. Реакционную смесь нагревали с обратным холодильником в течение 5 часов и концентрировали при пониженном давлении. Добавляли воду (10 мл), и реакционную смесь экстрагировали EtOAc (3×10 мл). Объединенные органические фазы высушивали надMgSO4 и упаривали при пониженном давлении. Очистка хроматографией на колонках с силикагелем (гексан/EtOAc 9:1) дала 2-(2-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-4-ил)-3-циклопропилпропановую кислоту (0,42 г) в форме твердого вещества белого цвета, L-21-1 (56%).1H ЯМР (300 МГц,CDCl3): δ 7,65 (д, 2H), 7,38 (д, 2H), 7,08 (с, 1H), 6,83 (с, 1H), 3,75 (д, 2H), 3,62 (т, 1H), 1,96 (м, 1H), 1,08 (м, 1H), 0,84 (м, 1H), 0,44 (м, 4H), 0,16 (м, 4H).
Пример 1908
1-(2-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-4-ил)-циклобутанкарбоновая кислота
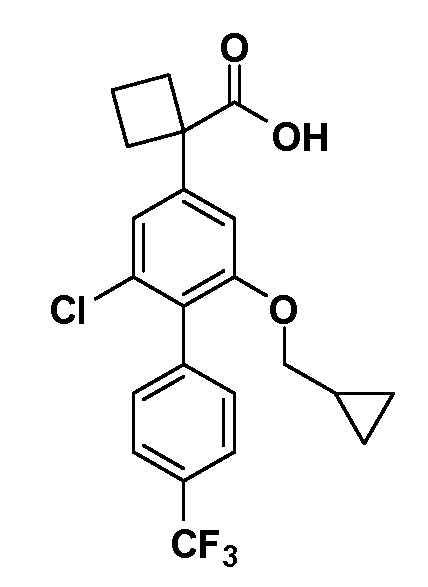
2-(2-Хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-4-ил)этилацетат (0,5 г) растворяли в 10 мл безводного DMF и при 0°C добавляли NaH (60 вес.% в масле, 0,13 г, ммоль). Реакционную смесь перемешивали в течение 0,5 ч при 25°C, и 1,3-дибромпропан (1,5 мл) добавляли по каплям при 0°C. Реакционную смесь перемешивали при 0°C в течение 1 ч и после этого добавляли насыщенный раствор (10 мл)NH4Cl. Реакционную смесь экстрагировали EtOAc (3×20 мл), и объединенные органические фазы промывали водой (3×20 мл) и солевым раствором (20 мл) и высушивали надMgSO4, фильтровали и концентрировали при пониженном давлении, получая 240 мг бесцветного масла. Масло растворяли в 10 мл смеси EtOH/H2O (9:1, об./об.) и добавляли 0,42 г LiOH. Реакционную смесь нагревали с обратным холодильником в течение 5 часов и концентрировали при пониженном давлении. Добавляли воду (10 мл), и реакционную смесь экстрагировали EtOAc (3×10 мл). Объединенные органические фазы высушивали надMgSO4, фильтровали и концентрировали при пониженном давлении. Остаток очищалихроматографией на колонках с силикагелем (гексан/EtOAc 9:1), получая 1-(2-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-4-ил)-циклобутанкарбоновую кислоту (0,210 г) в форме твердого вещества белого цвета (выход 52%).1H ЯМР (300 МГц,CDCl3): δ 7,68 (д, 2H), 7,41 (д, 2H), 7,06 (с, 1H), 6,89 (с, 1H), 3,78 (д, 2H), 2,88 (м, 2H), 2,58 (м, 2H), 2,16 (м, 1H), 1,97 (м, 1H), 1,03 (м, 1H), 0,46 (м, 2H), 0,18 (м, 2H).
Пример 1909
1-(2-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-4-ил)циклопентанкарбоновая кислота
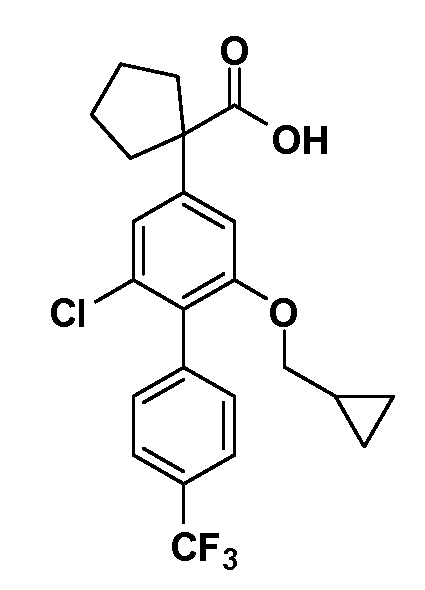
2-(2-Хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-4-ил)этилацетат (0,5 г) растворяли в 10 мл безводного DMF и добавляли при 0°C NaH (60 вес.% в масле, 0,13 г, ммоль). Реакционную смесь перемешивали в течение 0,5 ч при 25°C, и 1,4-дибромбутан (0,24 г) добавляли по каплям при 0°C. Реакционную смесь перемешивали при 0°C в течение 1 ч, и добавляли насыщенный раствор NH4Cl (10 мл). Реакционную смесь экстрагировали EtOAc (3×20 мл), и объединенные органические фазы промывали водой (3×20 мл) и солевым раствором (20 мл) и высушивали надMgSO4, фильтровали и концентрировали при пониженном давлении, получая 380 мг бесцветного масла. Масло растворяли в 10 мл смеси EtOH/H2O (9:1, об./об.) и добавляли 1,0 г LiOH. Реакционную смесь нагревали с обратным холодильником в течение 5 часов и концентрировали при пониженном давлении. Добавляли воду (10 мл), и реакционную смесь экстрагировали EtOAc (3×10 мл). Объединенные органические фазы высушивали надMgSO4, фильтровали и концентрировали при пониженном давлении. Очистка хроматографией на колонках с силикагелем (гексан/EtOAc 9:1) дала 1-(2-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-4-ил)-циклопентанкарбоновую кислоту (0,210 г) в форме твердого вещества белого цвета (60%).1H ЯМР (500 МГц,CDCl3): δ 7,68 (д, 2H), 7,41 (д, 2H), 7,16 (с, 1H), 6,91 (с, 1H), 3,78 (д, 2H), 2,66 (м, 2H), 1,97 (м, 2H), 1,79 (м, 4H), 1,03 (м, 1H), 0,46 (д, 2H), 0,18 (д, 2H).
Пример 2491: 2-(6-хлор-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилпропановая кислота
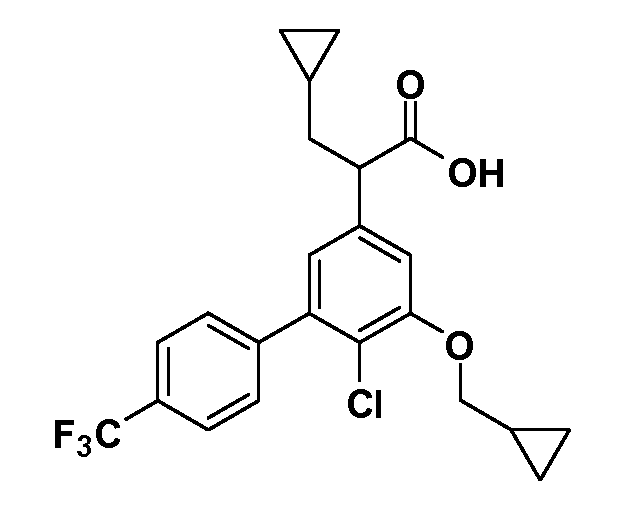
Стадия 1
3-циклопропил-2-(3-(циклопропилметокси)-4-нитрофенил)этилпропаноат
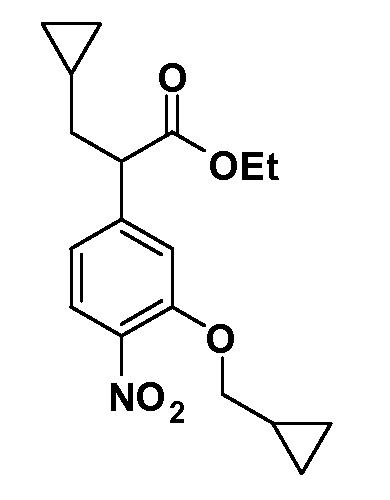
2-(3-(Циклопропилметокси)-4-нитрофенил)этилацетат (5 г, 17,9 ммоль) растворяли в безводном DMF (50 мл), при 0°C добавляли NaH (60 вес.% в масле, 0,475 г, 19,7 ммоль). Реакционную смесь перемешивали в течение 0,5 ч при 25°C, и циклопропилметилбромид (2,67 г, 19,7 ммоль) добавляли по каплям при 0°C. Реакционную смесь перемешивали при 0°C в течение 1 ч, и добавляли насыщенный раствор (10 мл)NH4Cl. Реакционную смесь экстрагировали EtOAc (3×20 мл), и объединенные органические фазы промывали водой (3×20 мл) и солевым раствором (20 мл), высушивали надMgSO4, фильтровали и концентрировали при пониженном давлении, получая 3-циклопропил-2-(3-(циклопропилметокси)-4-нитрофенил)этилпропаноат (4 г) в форме бесцветного масла.
Стадия 2
2-(4-амино-3-(циклопропилметокси)фенил)-3-циклопропилэтилпропаноат
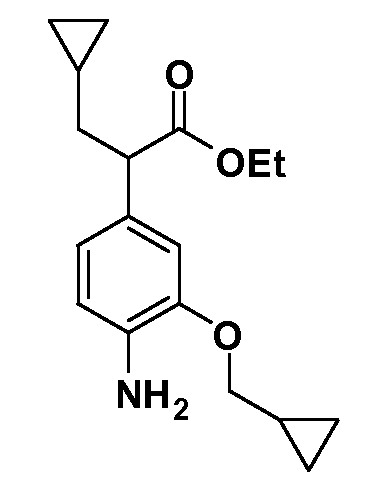
К перемешиваемому раствору 3-циклопропил-2-(3 (циклопропилметокси)-4-нитрофенил)этилпропаноата (4,0 г) в сухом MeOH (100 мл) добавляли Pd(ОН)2 (2 г), и смесь восстанавливали в атмосфереH2 в течение 6 часов при температуре окружающей среды. Реакционную смесь фильтровали через слой Целита™, промывая MeOH. Объединенные фильтраты концентрировали при пониженном давлении, получая 2-(4-амино-3-(циклопропилметокси)фенил)-3-циклопропилэтилпропаноат (3,5 г) в форме вязкой жидкости.
Стадия 3
2-(4-амино-3-бром-5-(циклопропилметокси)фенил)-3-циклопропилэтилпропаноат
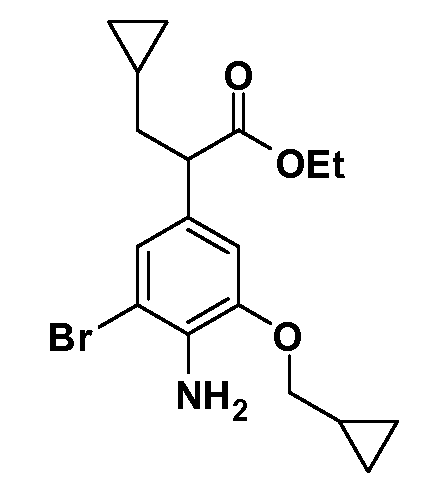
К перемешиваемому раствору 2-(4-амино-3-(циклопропилметокси)фенил)-3-циклопропилэтилпропаноата (3,0 г, 9,8 ммоль) в сухомCHCl3 (50 мл) добавляли при 0°C NBS (1,4 г, 7,8 ммоль). Реакционную смесь перемешивали в течение 3 часов при температуре окружающей среды. Реакционную смесь разбавляли водой и экстрагировали DCM (2×50 мл). Объединенные органические экстракты высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении. Сырую реакционную смесь очищали хроматографией на колонках, получая 2-(4-амино-3-бром-5-(циклопропилметокси)фенил)-3-циклопропилэтилпропаноат (1,5 г) в форме твердого вещества желтого цвета.
Стадия 4
2-(6-амино-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилэтилпропаноат
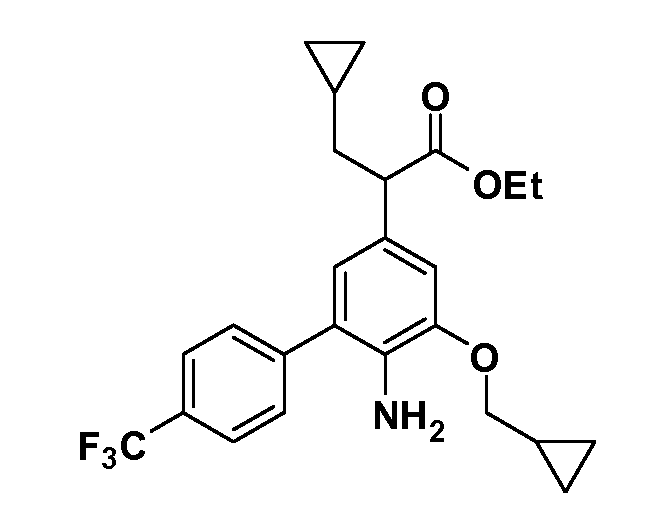
Смесь 2-(4-амино-3-бром-5-(циклопропилметокси)фенил)-3-циклопропилэтилпропаноата (2,8 г, 7,2 ммоль), 4-трифторметилфенилбороновой кислоты (2,05 г, 18,8 ммоль), CsF (2,19 г, 14,5 ммоль) и Pd(PPh3)4 (0,837 г, 0,72 ммоль) в безводном 1,2-диметоксиэтане (30 мл) нагревали с обратным холодильником в течение 8 часов под аргоном. Реакционную смесь охлаждали до температуры окружающей среды и добавляли 75 мл EtOAc и 75 мл воды. Органическую фазу отделяли, высушивали надNaSO4, фильтровали и концентрировали при пониженном давлении, получая желтое масло. Масло очищали хроматографией на силикагеле (гексан/EtOAc), получая 2-(6-амино-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилэтилпропаноат (2,5 г) в форме желтого масла.
Стадия 5
2-(6-хлор-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилэтилпропаноат
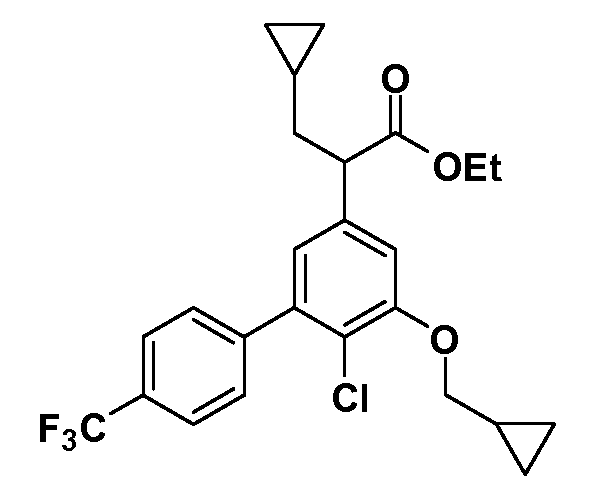
2-(6-Амино-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилэтилпропаноат (1 г, 2,2 ммоль) растворяли в смеси MeCN/H2O/HCl 30 мл/30 мл/2 мл при 0°C. РастворNaNO2 (0,200 г, 2,9 ммоль) в воде (10 мл) добавляли по каплям при 0°C, и реакционную смесь перемешивали в течение 40 минут при той же самой температуре. Раствор CuCl (1,1 г, 11,1 ммоль) в воде (10 мл) добавляли по каплям при 0°C. Реакционную смесь нагревали до 90°C в течение 2,0 часов, и смесь концентрировали при пониженном давлении. Реакционную смесь экстрагировали EtOAc (3×50 мл), объединенные органические слои промывали водой (50 мл), затем солевым раствором (50 мл), высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении, получая сырое черное масло. Масло очищали хроматографией на силикагеле (гексан/EtOAc), получая 2-(6-хлор-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилэтилпропаноат (1,1 г) в форме желтого масла.
Стадия 6
2-(6-хлор-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилпропановая кислота
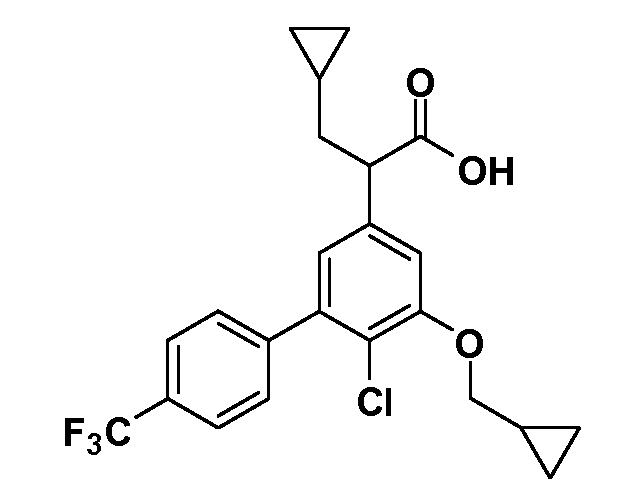
2-(6-Хлор-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилпропаноат (80 мг) растворяли в 10 мл MeOH/THF/H2O (10 мл/10 мл/5 мл) и добавляли LiOH (57 мг). Реакционную смесь перемешивали при температуре окружающей среды в течение 5 часов и затем концентрировали при пониженном давлении. Добавляли воду (10 мл), и реакционную смесь экстрагировали EtOAc (3×10 мл). Объединенные органические фазы высушивали надMgSO4, фильтровали и концентрировали при пониженном давлении. Очистка хроматографией на колонках с силикагелем (гексан/EtOAc 9:1) дала 2-(6-хлор-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилпропановую кислоту (45 мг) в форме твердого вещества белого цвета.1H-ЯМР (500 МГц,CDCl3): 7,71 (д, 2H), 7,54 (д, 2H), 6,95 (д, 1H), 6,87 (с, 1H), 3,97 (д, 2H), 3,64 (т, 1H), 2,55 (м, 2H), 1,96 (м, 1H), 1,08 (м, 1H), 0,84 (м, 1H), 0,44 (м, 4H), 0,16 (м, 4H).
Пример 2494: 1-(6-хлор-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)циклобутанкарбоновая кислота
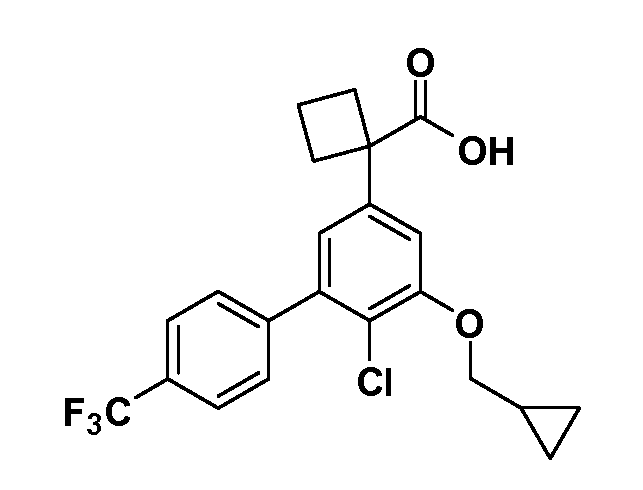
Стадия 1
1-(3-(циклопропилметокси)-4-нитрофенил)циклобутанэтилкарбоксилат
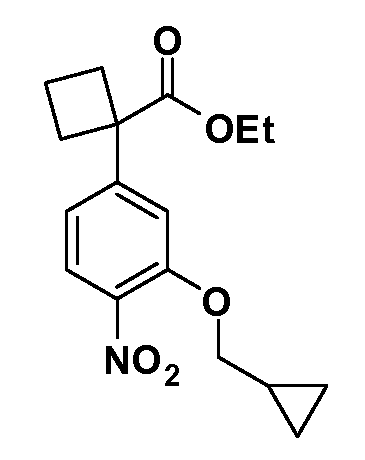
2-(3-(Циклопропилметокси)-4-нитрофенил)этилацетат (5 г, 17,9 ммоль) растворяли в безводном DMF (50 мл), NaH (60 вес.% в масле, 1,43 г, 35,9 ммоль) добавляли при 0°C. Реакционную смесь перемешивали в течение 0,5 ч при 25°C, и 1,3-дибромпропан (1,91 мл, 17,9 ммоль) добавляли по каплям при 0°C. Реакционную смесь перемешивали при 0°C в течение 1 ч, и добавляли насыщенный раствор (10 мл)NH4Cl. Реакционную смесь экстрагировали EtOAc (3×20 мл), и объединенные органические фазы промывали водой (3×20 мл) и солевым раствором (20 мл), высушивали надMgSO4, фильтровали и концентрировали при пониженном давлении, получая 1-(3-(циклопропилметокси)-4-нитрофенил)циклобутанэтилкарбоксилат (2,8 г) в форме бесцветного масла.
Стадия 2
1-(4-амино-3-(циклопропилметокси)фенил)циклобутанэтилкарбоксилат
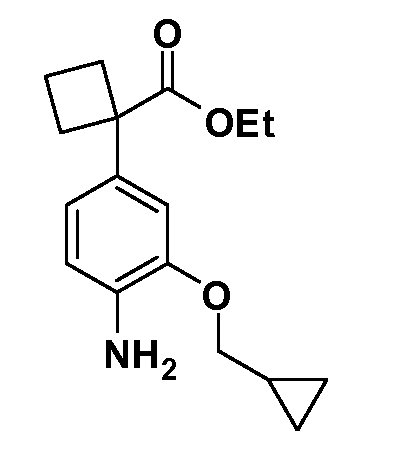
К перемешиваемому раствору 1-(3-(циклопропилметокси)-4-нитрофенил)циклобутанэтилкарбоксилата (2,8 г) в сухом MeOH (100 мл) добавляли Pd(ОН)2 (1,2 г), и реакционную смесь восстанавливали в атмосфереH2 в течение 6 часов при температуре окружающей среды. Реакционную смесь фильтровали через слой Целита™, промывая MeOH. Объединенные фильтраты концентрировали при пониженном давлении, получая 1-(4-амино-3-(циклопропилметокси)фенил)циклобутанэтилкарбоксилат (2,4 г) в форме вязкой жидкости.
Стадия 3
1-(4-амино-3-бром-5-(циклопропилметокси)фенил)циклобутанэтилкарбоксилат
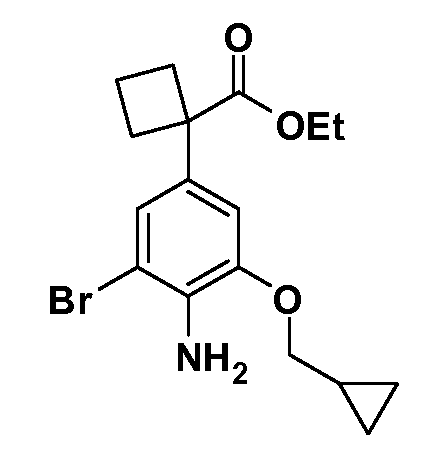
К перемешиваемому раствору 1-(4-амино-3-(циклопропилметокси)фенил)циклобутанэтилкарбоксилата (2,4 г, 8,3 ммоль) в сухомCHCl3 (50 мл) добавляли NBS (1,4 г, 7,8 ммоль) 0°C. Реакционную смесь перемешивали в течение 3 часов при температуре окружающей среды. Реакционную смесь разбавляли водой, экстрагировали DCM (2×50 мл), объединенные органические экстракты высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении. Сырую реакционную смесь очищали хроматографией на колонках, получая 1-(4-амино-3-бром-5-(циклопропилметокси)фенил)циклобутанэтилкарбоксилат (1,5 г) в форме твердого вещества желтого цвета.
Стадия 4
1-(6-амино-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)циклобутанэтилкарбоксилат
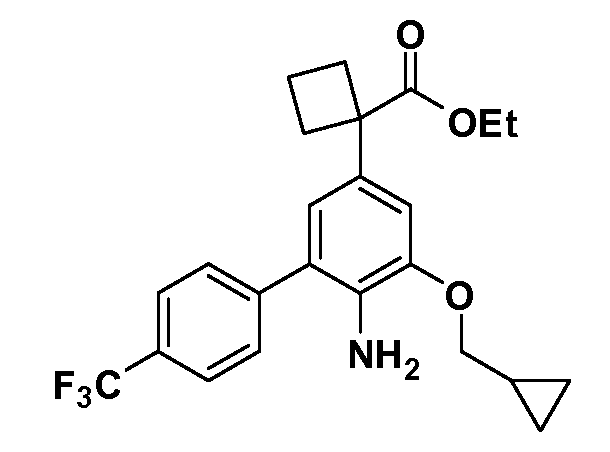
Смесь 1-(4-амино-3-бром-5-(циклопропилметокси)фенил)циклобутанэтилкарбоксилата (0,32 г, 0,86 ммоль), 4-трифторметилфенилбороновой кислоты (0,246 г, 1,3 ммоль), CsF (0,262 г, 1,7 ммоль) и Pd(PPh3)4 (0,1 г, 0,08 ммоль) в безводном 1,2-диметоксиэтане (10 мл) нагревали с обратным холодильником в течение 8 часов под аргоном. Реакционную смесь охлаждали до температуры окружающей среды и добавляли 25 мл EtOAc и 75 мл воды. Органическую фазу отделяли, высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении, получая желтое масло. Масло очищали хроматографией на силикагеле (гексан/EtOAc), получая 1-(6-амино-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)циклобутанэтилкарбоксилат (0,290 г) в форме желтого масла.
Стадия 5
1-(6-хлор-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)циклобутанэтилкарбоксилат
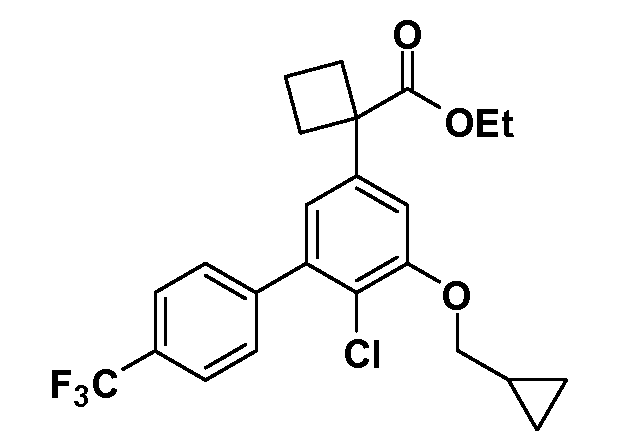
1-(6-Амино-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)циклобутанэтилкарбоксилат (0,280 г, 0,64 ммоль) растворяли в смеси MeCN/H2O/HCl 10 мл/10 мл/4 мл при 0°C. РастворNaNO2 (0,066 г, 0,96 ммоль) в воде (2 мл) добавляли по каплям при 0°C, и реакционную смесь перемешивали в течение 40 минут при той же самой температуре. Раствор CuCl (0,32 г, 3,2 ммоль) в воде (2 мл) добавляли по каплям при 0°C. Реакционную смесь нагревали до 70°C в течение 1 часа, и растворитель выпаривали при пониженном давлении. Реакционную смесь экстрагировали EtOAc (3×50 мл), и объединенные органические слои промывали водой (50 мл), затем солевым раствором (50 мл). Раствор высушивали надNa2SO4, фильтровали и концентрировали, получая сырое черное масло, которое очищали хроматографией на силикагеле (гексан/EtOAc), получая 1-(6-хлор-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)циклобутанэтилкарбоксилат (0,110 г) в форме желтого масла.
Стадия 6
1-(6-хлор-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)циклобутанкарбоновая кислота
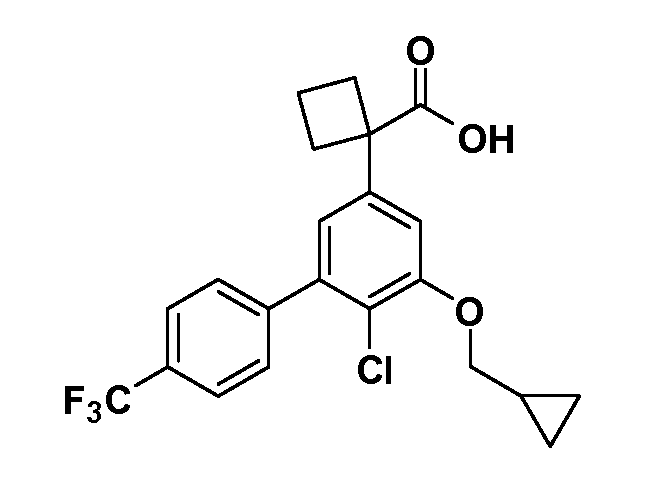
1-(6-Хлор-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)циклобутанэтилкарбоксилат (0,1 г) растворяли в смеси MeOH/THF/H2O (10 мл/10 мл/5 мл) и добавлялии LiOH (70 мг). Реакционную смесь перемешивали при температуре окружающей среды в течение 5 часов и концентрировали при пониженном давлении. Добавляли воду (10 мл) и реакционную смесь экстрагировали EtOAc (3×10 мл). Объединенные органические экстракты высушивали надMgSO4, фильтровали и упаривали при пониженном давлении. Очистка хроматографией на колонках с силикагелем (гексан/EtOAc 9:1) дала 1-(6-хлор-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)циклобутанкарбоновую кислоту (75 мг) в форме твердого вещества белого цвета.1H-ЯМР (500 МГц,CDCl3): 7,71 (д, 2H), 7,54 (д, 2H), 6,86 (с, 1H), 6,85 (с, 1H), 3,97 (д, 2H), 2,85 (м, 2H), 2,54 (м, 2H), 2,13 (м, 1H), 1,92 (м, 1H), 1,35 (т, 1H), 0,47 (м, 2H), 0,41 (м, 2H).
Пример 2495: 1-(6-хлор-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)циклопентанкарбоновая кислота
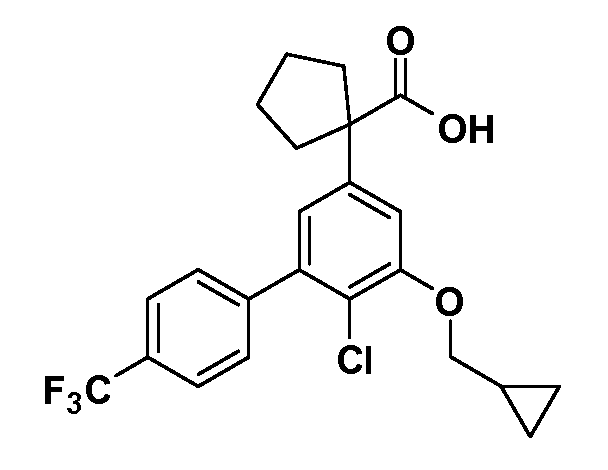
Стадия 1
1-(3-(циклопропилметокси)-4-нитрофенил)циклопентанэтилкарбоксилат
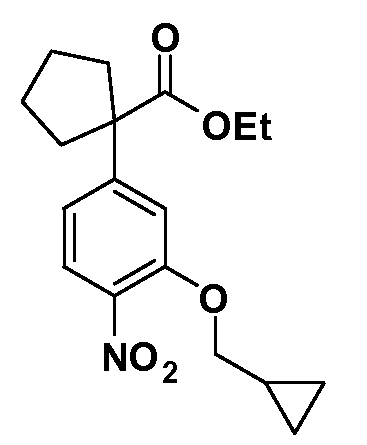
2-(3-(Циклопропилметокси)-4-нитрофенил)этилацетат (0,5 г) растворяли в 10 мл безводного DMF и добавляли при 0°C NaH (60 вес.% в масле, 0,13 г, ммоль). Реакционную смесь перемешивали в течение 0,5 ч при 25°C и 1,4-дибромбутан (0,24 г, ммоль) добавляли по каплям при 0°C. Реакционную смесь перемешивали при 0°C в течение 1 ч, и добавляли насыщенный раствор (10 мл)NH4Cl. Реакционную смесь экстрагировали EtOAc (3×20 мл), и объединенные органические фазы промывали водой (3×20 мл) и солевым раствором (20 мл) и высушивали надMgSO4, фильтровали и концентрировали при пониженном давлении, получая 1-(3-(циклопропилметокси)-4-нитрофенил)циклопентанэтилкарбоксилат (380 мг) в форме бесцветного масла.
Стадия 2
1-(4-амино-3-(циклопропилметокси)фенил)циклопентанэтилкарбоксилат
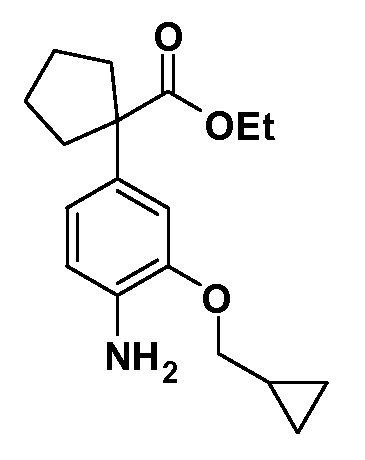
К перемешиваемому раствору 1-(3-(циклопропилметокси)-4-нитрофенил)циклопентанэтилкарбоксилата (10 г) в сухом MeOH (100 мл) добавляли Pd(ОН)2 (2 г), и смесь восстанавливали в атмосфереH2 в течение 6 часов при температуре окружающей среды. Смесь фильтровали через слой Целита™, промывая MeOH. Объединенные фильтраты концентрировали при пониженном давлении, получая 1-(4-амино-3-(циклопропилметокси)фенил)циклопентанэтилкарбоксилат (7,5 г) в форме вязкой жидкости.
Стадия 3
1-(4-амино-3-бром-5-(циклопропилметокси)фенил)циклопентанэтилкарбоксилат
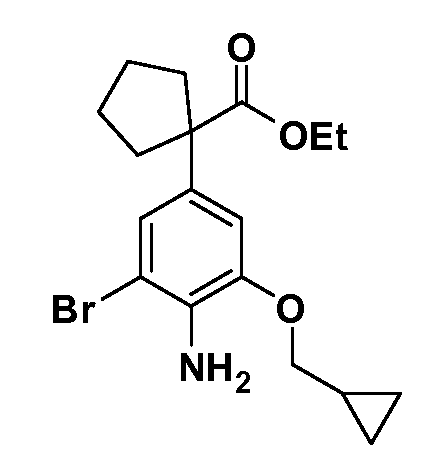
К перемешиваемому раствору 1-(4-амино-3-(циклопропилметокси)фенил)циклопентанэтилкарбоксилата (1,2 г, 4,0 ммоль) в сухомCCl4 (60 мл) добавляли при 0°C NBS (0,427 г, 3,2 ммоль). Реакционную смесь перемешивали в течение 3 при температуре окружающей среды, чтобы закончить реакцию. Реакционную смесь разбавляли водой, экстрагировали DCM (2×50 мл), объединенные органические экстракты высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении. Сырую реакционную смесь очищали хроматографией на колонках, получая 1-(4-амино-3-бром-5-(циклопропилметокси)фенил)циклопентанэтилкарбоксилат (920 мг) в форме твердого вещества желтого цвета.
Стадия 4
1-(6-амино-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)циклопентанэтилкарбоксилат
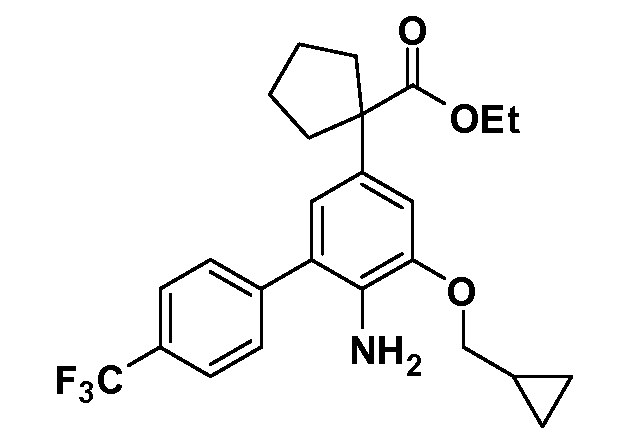
Смесь 1-(4-амино-3-бром-5-(циклопропилметокси)фенил)циклопентанэтилкарбоксилат (5,1 г, 14 ммоль), 4-трифторметилфенилбороновой кислоты (3,36 г, 17 ммоль), CsF (0,28 г, 1,84 ммоль) и Pd(PPh3)4 (0,410 г, 0,4 ммоль) в безводном 1,2-диметоксиэтане (75 мл) нагревали с обратным холодильником в течение 8 часов под аргоном. Реакционную смесь охлаждали и добавляли 75 мл EtOAc и 75 мл воды. Органическую фазу отделяли, высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении, получая желтое масло. Масло очищали хроматографией на силикагеле (гексан/EtOAc), получая 1-(6-амино-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)циклопентанэтилкарбоксилат (4,6 г) в форме желтого масла.
Стадия 5
1-(6-хлор-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)циклопентанэтилкарбоксилат
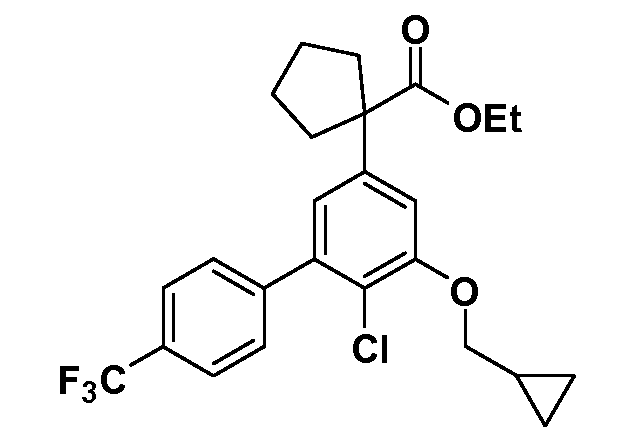
1-(6-Амино-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)циклопентанэтилкарбоксилат (1 г, 2,2 ммоль) растворяли в смеси MeCN/H2O/HCl 30 мл/30 мл/2 мл при 0°C. РастворNaNO2 (0,200 г, 2,9 ммоль) в воде (10 мл) добавляли по каплям при 0°C, и реакционную смесь перемешивали в течение 40 минут при той же самой температуре. Раствор CuCl (1,1 г, 11,1 ммоль) в воде (10 мл) добавляли по каплям при 0°C. Реакционную смесь нагревали до 90°C в течение 2,0 часов, и растворитель выпаривали. Реакционную смесь экстрагировали EtOAc (3×50 мл), и объединенные органические слои промывали водой (50 мл), затем солевым раствором (50 мл). Раствор высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении, получая сырое черное масло. Масло очищали хроматографией на силикагеле (гексан/EtOAc), получая 1-(6-хлор-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)циклопентанэтилкарбоксилат в форме желтого масла (1,1 г).
Стадия 6
1-(6-хлор-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)циклопентанкарбоновая кислота
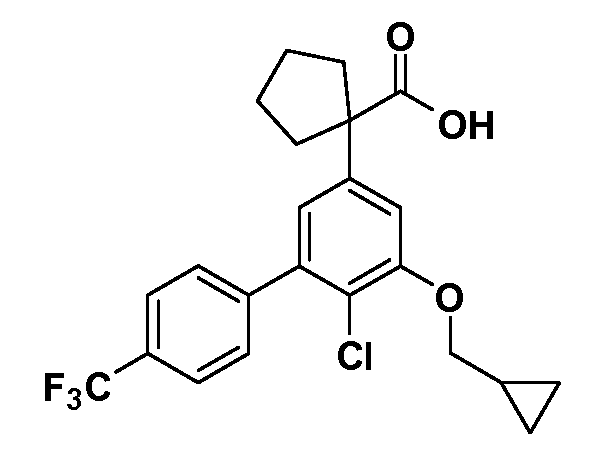
1-(6-Хлор-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)циклопентанэтилкарбоксилат (80 мг) растворяли в 10 мл MeOH/THF/H2O (10 мл/10 мл/5 мл) и добавляли LiOH (57 мг). Реакционную смесь перемешивали при температуре окружающей среды в течение 5 часов и концентрировали при пониженном давлении. Добавляли воду (10 мл), и реакционную смесь экстрагировали EtOAc (3×10 мл). Объединенные органические фазы высушивали надMgSO4, фильтровали и концентрировали при пониженном давлении. Очистка хроматографией на колонках с силикагелем (гексан/EtOAc 9:1) дала 1-(6-хлор-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)циклопентанкарбоновую кислоту (45 мг) в форме твердого вещества белого цвета.1H-ЯМР (500 МГц,CDCl3): 7,68 (д, 2H), 7,55 (д, 2H), 6,99 (с, 1H), 6,97 (с, 1H), 3,97 (д, 2H), 2,64 (м, 2H), 1,95 (м, 2H), 1,77 (м, 4H), 1,21 (м, 1H), 0,45 (м, 2H), 0,18 (м, 2H).
Пример 2419: 2-(6-хлор-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилпропановая кислота
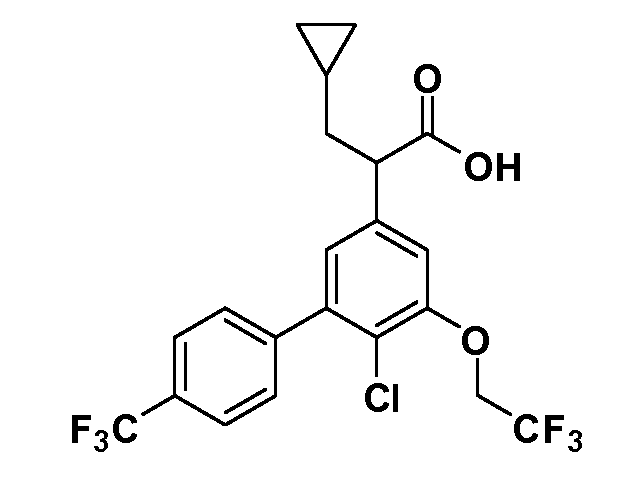
Стадия 1
3-циклопропил-2-(4-нитро-3-(2,2,2-трифторэтокси)фенил)этилпропаноат
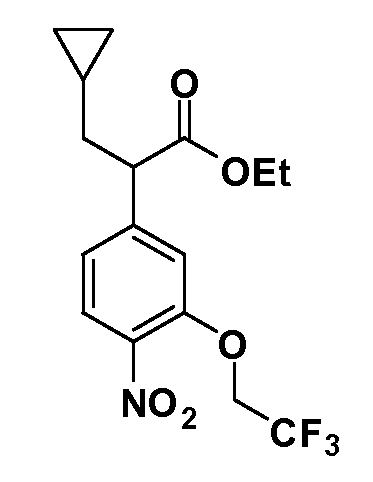
2-(4-Нитро-3-(2,2,2-трифторэтокси)фенил)этилацетат (2 г, 6,5 ммоль) растворяли в безводном DMF (50 мл), добавляли при 0°C NaH (60 вес.% в масле, 0,171 г, 7,1 ммоль). Реакционную смесь перемешивали в течение 0,5 ч при 25°C, и циклопропилметилбромид (0,967 г, 7,16 ммоль) добавляли по каплям при 0°C. Реакционную смесь перемешивали при 0°C в течение 1 ч и добавляли насыщенный раствор (10 мл)NH4Cl. Реакционную смесь экстрагировали EtOAc (3×20 мл), и объединенные органические фазы промывали водой (3×20 мл) и солевым раствором (20 мл), высушивали надMgSO4, фильтровали и концентрировали при пониженном давлении, получая 3-циклопропил-2-(4-нитро-3-(2,2,2-трифторэтокси)фенил)этилпропаноат (1,05 г) в форме бесцветного масла.
Стадия 2
2-(4-амино-3-(2,2,2-трифторэтокси)фенил)-3-циклопропилэтилпропаноат
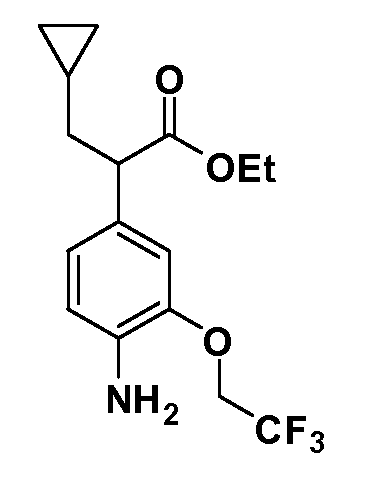
К перемешиваемому раствору 3-циклопропил-2-(4-нитро-3-(2,2,2-трифторэтокси)фенил)этилпропаноата (1,0 г) в сухом MeOH (100 мл) добавляли Pd(ОН)2 (500 мг), и смесь восстанавливали в атмосфереH2 в течение 6 часов при температуре окружающей среды. Смесь фильтровали через слой Целита™, промывая MeOH. Объединенные фильтраты концентрировали при пониженном давлении, получая 2-(4-амино-3-(2,2,2-трифторэтокси)фенил)-3-циклопропилэтилпропаноат (0,9 г) в форме вязкой жидкости.
Стадия 3
2-(4-амино-3-бром-5-(2,2,2-трифторэтокси)фенил)-3-циклопропилэтилпропаноат
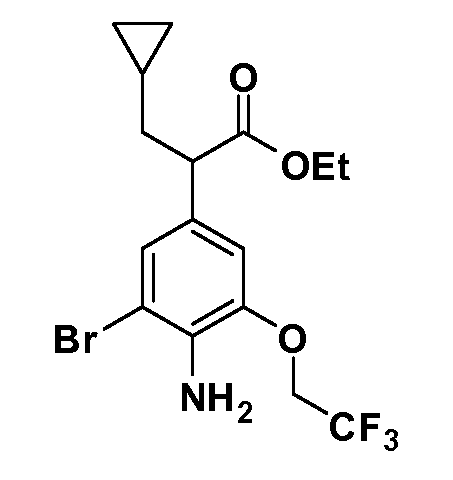
К перемешиваемому раствору 2-(4-амино-3-(2,2,2-трифторэтокси)фенил)-3-циклопропилэтилпропаноата (0,9 г, 2,7 ммоль) в сухомCHCl3 (50 мл) добавляли при 0°C NBS (0,412 г, 2,3 ммоль). Реакционную смесь перемешивали в течение 3 ч при температуре окружающей среды, чтобы закончить реакцию. Реакционную смесь разбавляли водой, экстрагировали DCM (2×50 мл), объединенные органические растворители высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении. Сырую реакционную смесь очищали хроматографией на колонках, получая 2-(4-амино-3-бром-5-(2,2,2-трифторэтокси)фенил)-3-циклопропилэтилпропаноат (1,02 г) в форме твердого вещества желтого цвета.
Стадия 4
2-(6-амино-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилэтилпропаноат
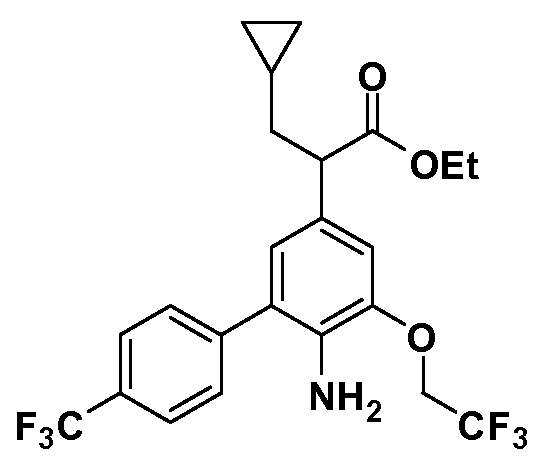
Смесь 2-(4-амино-3-бром-5-(2,2,2-трифторэтокси)фенил)-3-циклопропилэтилпропаноата (1,1, 3,3 ммоль), 4-трифторметилфенилбороновой кислоты (1,26 г, 6,7 ммоль), CsF (1,26 г, 8,3 ммоль) и Pd(PPh3)4 (0,38 г, 0,33 ммоль) в безводном 1,2-диметоксиэтане (50 мл) нагревали с обратным холодильником в течение 8 часов под аргоном. Реакционную смесь охлаждали и добавляли 50 мл EtOAc и 50 мл воды. Органическую фазу отделяли, высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении, получая желтое масло. Масло очищали хроматографией на силикагеле (гексан/EtOAc), получая 2-(6-амино-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилэтилпропаноат (0,85 г, 82%-ый выход) в форме твердого вещества белого цвета.
Стадия 5
2-(6-хлор-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилэтилпропаноат
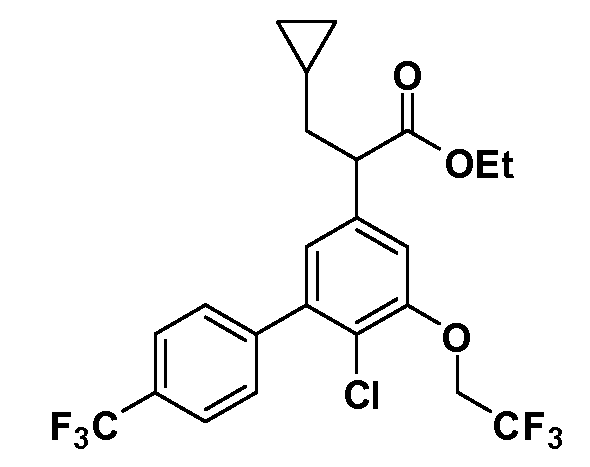
2-(6-Амино-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилэтилпропаноат (0,85 г, 1,78 ммоль) растворяли в смеси MeCN/H2O/HCl 15 мл/15 мл/2 мл при 0°C. РастворNaNO2 (0,185 г, 2,68 ммоль) в воде (2 мл) добавляли по каплям при 0°C, и реакционную смесь перемешивали в течение 40 минут при той же самой температуре. Раствор CuCl (1,8 г, 17,8 ммоль) в воде (10 мл) добавляли по каплям при 0°C. Реакционную смесь нагревали до 90°C в течение 2 часов. Реакционную смесь экстрагировали EtOAc (3×50 мл), и объединенные органические слои промывали водой (50 мл), затем солевым раствором (50 мл). Раствор высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении, получая масло. Масло очищали хроматографией на силикагеле (гексан/EtOAc), получая 2-(6-хлор-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилэтилпропаноат (0,528 г) в форме желтого масла.
Стадия 6
2-(6-хлор-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилпропановая кислота
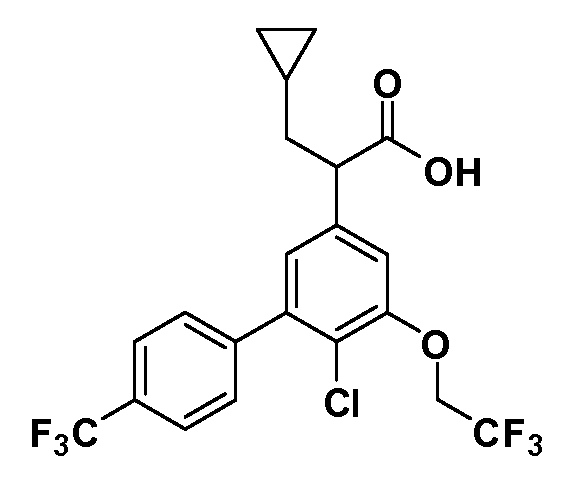
2-(6-Хлор-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-3-циклопропилэтилпропаноат (500 мг, 1,01 ммоль) растворяли в 20 мл MeOH/THF/H2O (10 мл/10 мл/5 мл) и добавляли LiOH (57 мг). Реакционную смесь перемешивали при температуре окружающей среды в течение 5 часов и концентрировали при пониженном давлении. Добавляли воду (10 мл), и реакционную смесь экстрагировали EtOAc (3×10 мл). Объединенные органические фазы высушивали надMgSO4, фильтровали и концентрировали при пониженном давлении. Очистка хроматографией на колонках с силикагелем (гексан/EtOAc 9:1) дала 2-(6-хлор-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-циклопропилпропановую кислоту (250 мг) в форме твердого вещества белого цвета.1H-ЯМР (500 МГц,CDCl3): 7,72 (д, 2H), 7,54 (д, 2H), 7,02 (д, 2H), 4,44 (кв., 2H), 3,72 (т, 1H), 1,92 (м, 1H), 1,79 (м, 1H), 1,08 (м, 1H), 0,66 (м, 1H), 0,44 (м, 2H), 0,16 (м, 2H).
Пример 2422: 1-(6-хлор-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклобутанэтилкарбоксилат
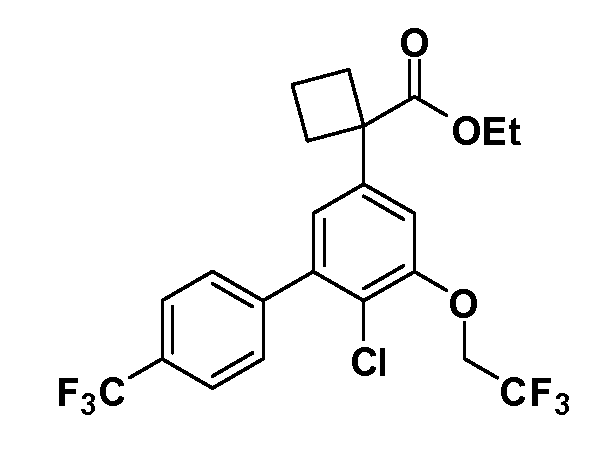
Стадия 1
1-(4-нитро-3-(2,2,2-трифторэтокси)фенил)циклобутанэтилкарбоксилат
2-(4-Нитро-3-(2,2,2-трифторэтокси)фенил)этилацетат (3 г, 9,7 ммоль) растворяли в безводном DMF (50 мл), при 0°C добавляли NaH (60 вес.% в масле, 0,514 г, 10,7 ммоль). Реакционную смесь перемешивали в течение 0,5 часов при 25°C, и 1,3-дибромпропан (1,03 мл, 9,7 ммоль) добавляли по каплям при 0°C. Реакционную смесь перемешивали при 0°C в течение 1 ч и добавляли насыщенный раствор (10 мл)NH4Cl. Реакционную смесь экстрагировали EtOAc (3×20 мл), и объединенные органические фазы промывали водой (3×20 мл) и солевым раствором (20 мл), высушивали надMgSO4, фильтровали и концентрировали при пониженном давлении, получая 1-(4-нитро-3-(2,2,2-трифторэтокси)фенил)циклобутанэтилкарбоксилат (900 мг) в форме бесцветного масла.
Стадия 2
1-(4-амино-3-(2,2,2-трифторэтокси)фенил)циклобутанэтилкарбоксилат
К перемешиваемому раствору 1-(4-нитро-3-(2,2,2-трифторэтокси)фенил)циклобутанэтилкарбоксилата (900 мг) в сухом MeOH (50 мл) добавляли Pd(ОН)2 (400 мг), и смесь восстанавливали в атмосфереH2 в течение 6 часов при температуре окружающей среды. Смесь фильтровали через слой Целита™, промывая MeOH, объединенные фильтраты концентрировали при пониженном давлении, получая 1-(4-амино-3-(2,2,2-трифторэтокси)фенил)циклобутанэтилкарбоксилат (800 мг) в форме вязкой жидкости.
Стадия 3
1-(4-амино-3-бром-5-(2,2,2-трифторэтокси)фенил)циклобутанэтилкарбоксилат
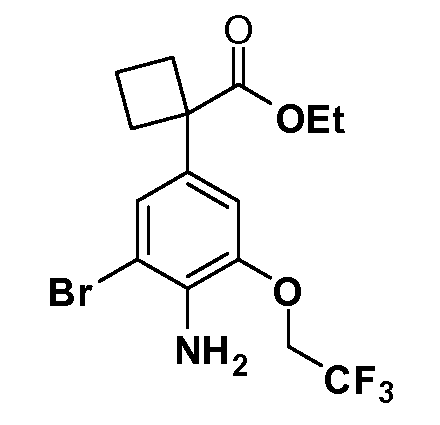
К перемешиваемому раствору 1-(4-амино-3-(2,2,2-трифторэтокси)фенил)циклобутанэтилкарбоксилата (2,4 г, 8,3 ммоль) в сухомCHCl3 (50 мл) добавляли при 0°C NBS (1,4 г, 7,8 ммоль). Реакционную смесь перемешивали в течение 3 ч при температуре окружающей среды до завершения реакции. Реакционную смесь разбавляли водой, экстрагировали DCM (2×50 мл), объединенные органические растворители высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении. Сырую реакционную смесь очищали хроматографией на колонках, получая 1-(4-амино-3-бром-5-(2,2,2-трифторэтокси)фенил)циклобутанэтилкарбоксилат (1,5 г) в форме твердого вещества желтого цвета.
Стадия 4
1-(6-амино-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклобутанэтилкарбоксилат
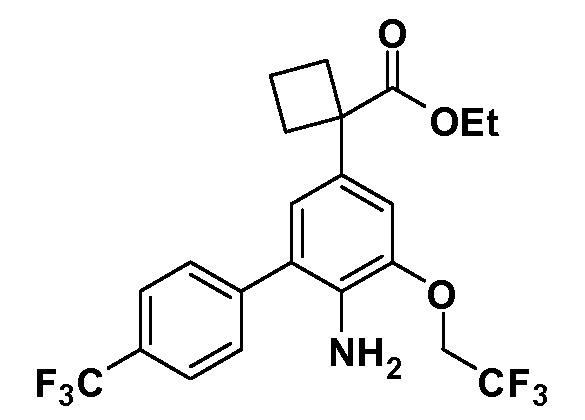
Смесь 1-(4-амино-3-бром-5-(2,2,2-трифторэтокси)фенил)циклобутанэтилкарбоксилата (0,32 г, 0,86 ммоль), 4-трифторметилфенилбороновой кислоты (0,246 г, 1,3 ммоль), CsF (0,262 г, 1,7 ммоль) и Pd(PPh3)4 (0,1 г, 0,08 ммоль) в безводном 1,2-диметоксиэтане (10 мл) нагревали с обратным холодильником в течение 8 часов под аргоном. Реакционную смесь охлаждали и добавляли 25 мл EtOAc и 75 мл воды. Органическую фазу отделяли, высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении, получая желтое масло. Масло очищали хроматографией на силикагеле (гексан/EtOAc), получая 1-(6-амино-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклобутанэтилкарбоксилат (0,290 г) в форме желтого масла.
Стадия 5
1-(6-хлор-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклобутанэтилкарбоксилат
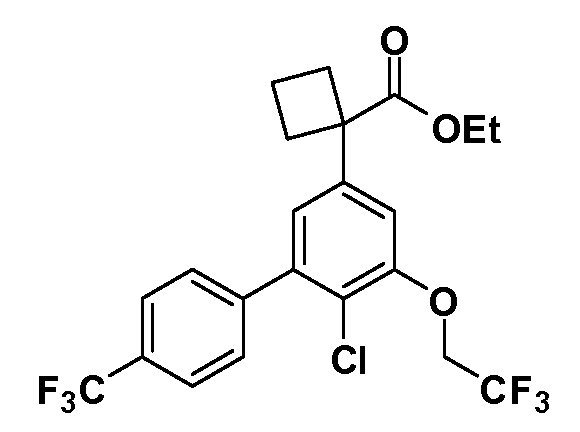
1-(6-Амино-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклобутанэтилкарбоксилат (0,280 г, 0,64 ммоль) растворяли в смеси MeCN/H2O/HCl 10 мл/10 мл/4 мл при 0°C. РастворNaNO2 (0,066 г, 0,96 ммоль) в воде (2 мл) добавляли по каплям при 0°C, и реакционную смесь перемешивали в течение 40 минут при той же самой температуре. Раствор CuCl (0,32 г, 3,2 ммоль) в воде (2 мл) добавляли по каплям при 0°C. Реакционную смесь нагревали до 70°C в течение 1 часа, и растворитель выпаривали. Реакционную смесь экстрагировали EtOAc (3×50 мл), и объединенные органические слои промывали водой (50 мл), затем солевым раствором (50 мл). Раствор высушивали надNa2SO4, фильтровали и концентрировали, получая масло. Масло очищали хроматографией на силикагеле (гексан/EtOAc), получая 1-(6-хлор-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклобутанэтилкарбоксилат в форме желтого масла (0,110 г).
Стадия 6
1-(6-хлор-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклобутанкарбоновая кислота
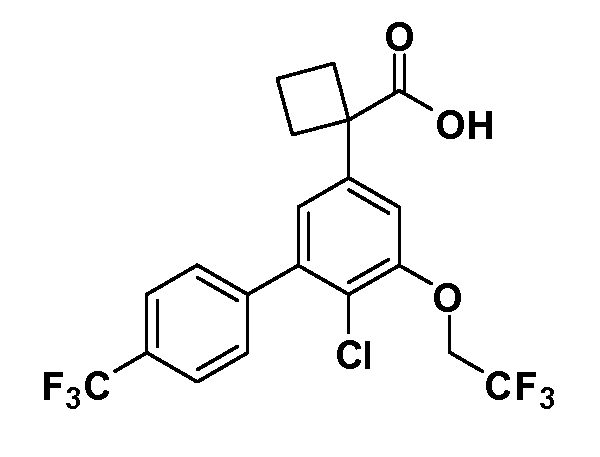
1-(6-Хлор-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклобутанэтилкарбоксилат (0,1 г) растворяли в MeOH/THF/H2O (10 мл/10 мл/5 мл) и добавляли LiOH (70 мг). Реакционную смесь перемешивали при температуре окружающей среды в течение 5 часов и концентрировали при пониженном давлении. Добавляли воду (10 мл), и реакционную смесь экстрагировали EtOAc (3×10 мл). Объединенные органические фазы высушивали надMgSO4, фильтровали и упаривали при пониженном давлении. Очистка хроматографией на колонках с силикагелем (гексан/EtOAc 9:1) дала 1-(6-хлор-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклобутанкарбоновую кислоту (75 мг) продукта в форме твердого вещества белого цвета.1H-ЯМР (500 МГц,CDCl3): 7,74 (д, 2H), 7,53 (д, 2H), 6,99 (с, 1H), 6,97 (с, 1H), 4,43 (кв., 2H), 2,88 (м, 2H), 2,54 (м, 2H), 2,15 (м, 1H), 1,93 (м, 1H).
Пример 2423: 1-(6-хлор-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклопентанкарбоновая кислота
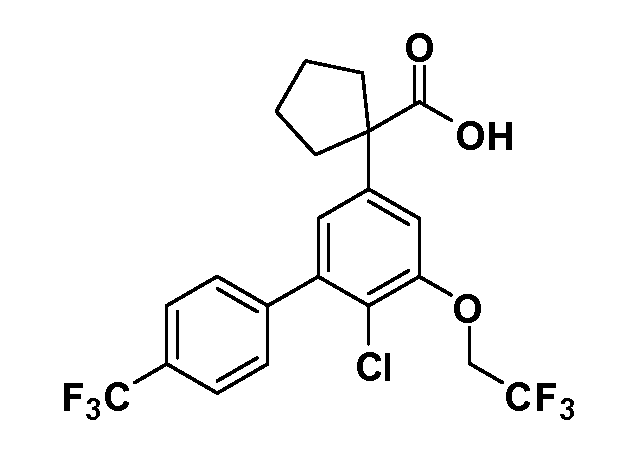
Стадия 1
1-(4-нитро-3-(2,2,2-трифторэтокси)фенил)циклопентанэтилкарбоксилат
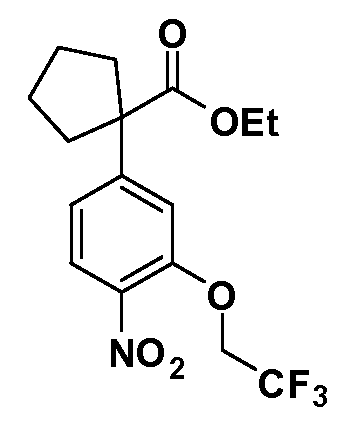
2-(4-Нитро-3-(2,2,2-трифторэтокси)фенил)этилацетат (0,5 г, ммоль) растворяли в 10 мл безводного DMF и добавляли при 0°C NaH (60 вес.% в масле, 0,13 г, ммоль). Реакционную смесь перемешивали в течение 0,5 ч при 25°C, и 1,4-дибромбутан (0,24 г, ммоль) добавляли по каплям при 0°C. Реакционную смесь перемешивали при 0°C в течение 1 ч и добавляли насыщенный раствор (10 мл)NH4Cl. Реакционную смесь экстрагировали EtOAc (3×20 мл), и объединенные органические фазы промывали водой (3×20 мл) и солевым раствором (20 мл), высушивали надMgSO4, фильтровали и концентрировали при пониженном давлении, получая 1-(4-нитро-3-(2,2,2-трифторэтокси)фенил)циклопентанэтилкарбоксилат (380 мг) в форме бесцветного масла.
Стадия 2
1-(4-амино-3-(2,2,2-трифторэтокси)фенил)циклопентанэтилкарбоксилат
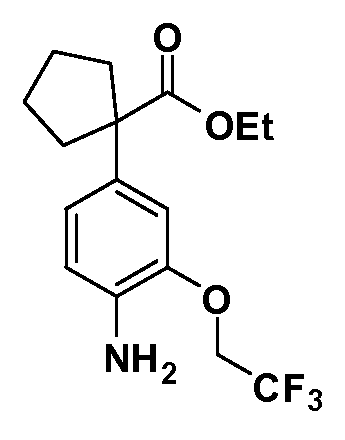
К перемешиваемому раствору 1-(4-нитро-3-(2,2,2-трифторэтокси)фенил)циклопентанэтилкарбоксилата (10 г) в сухом MeOH (100 мл) добавляли Pd(ОН)2 (2 г) и восстанавливали в атмосфереH2 в течение 6 часов при температуре окружающей среды. Смесь фильтровали через слой Целита™, промывая MeOH. Объединенные фильтраты концентрировали при пониженном давлении, получая 1-(4-амино-3-(2,2,2-трифторэтокси)фенил)циклопентанэтилкарбоксилат (7,5 г) в форме вязкой жидкости.
Стадия 3
1-(4-амино-3-бром-5-(2,2,2-трифторэтокси)фенил)циклопентанэтилкарбоксилат
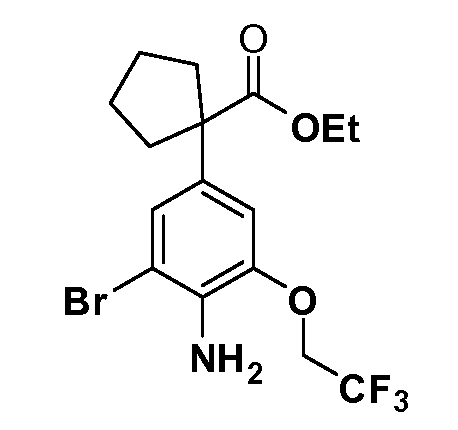
К перемешиваемому раствору 1-(4-амино-3-(2,2,2-трифторэтокси)фенил)циклопентанэтилкарбоксилата (1,2 г, 4,0 ммоль) в сухомCCl4 (60 мл) добавляли при 0°C NBS (0,427 г, 3,2 ммоль). Реакционную смесь перемешивали в течение 3 часов при температуре окружающей среды. Реакционную смесь разбавляли водой, экстрагировали DCM (2×50 мл), объединенные органические растворители высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении. Сырую реакционную смесь очищали хроматографией на колонках, получая 1-(4-амино-3-бром-5-(2,2,2-трифторэтокси)фенил)циклопентанэтилкарбоксилат (920 мг) в форме твердого вещества желтого цвета.
Стадия 4
1-(6-амино-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклопентанэтилкарбоксилат
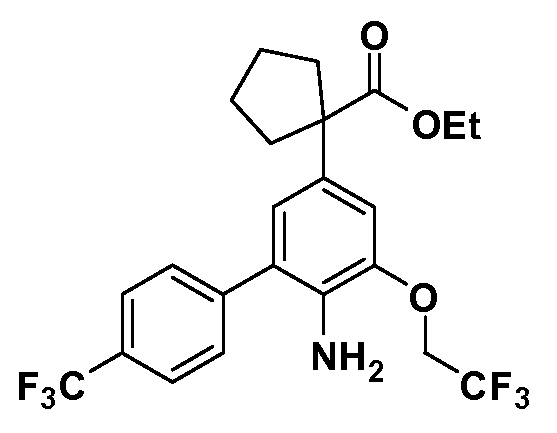
Смесь 1-(4-амино-3-бром-5-(2,2,2-трифторэтокси)фенил)циклопентанэтилкарбоксилата (5,1 г, 14 ммоль), 4-трифторметилфенилбороновой кислоты (3,36 г, 17 ммоль), CsF (0,28 г, 1,84 ммоль) и Pd(PPh3)4 (0,410 г, 0,4 ммоль) в безводном 1,2-диметоксиэтане (75 мл) нагревали с обратным холодильником в течение 8 часов под аргоном. Реакционную смесь охлаждали и добавляли 75 мл EtOAc и 75 мл воды. Органическую фазу отделяли, высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении до желтого масла. Масло очищали хроматографией на силикагеле (гексан/EtOAc), получая 1-(6-амино-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклопентанэтилкарбоксилат (4,6 г) в форме желтого масла.
Стадия 5
1-(6-хлор-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклопентанэтилкарбоксилат
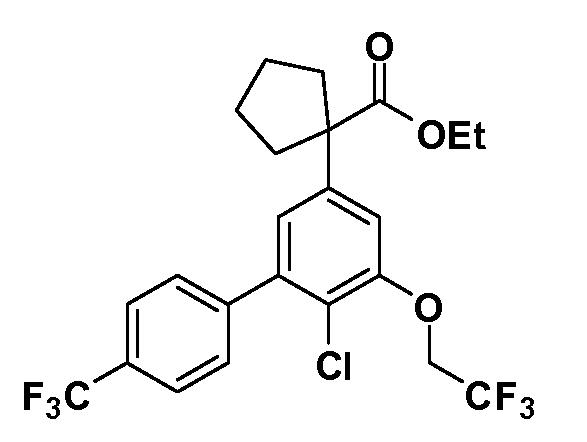
1-(6-Амино-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклопентанэтилкарбоксилат (1 г, 2,2 ммоль) растворяли в смеси MeCN/H2O/HCl 30 мл/30 мл/2 мл при 0°C. РастворNaNO2 (0,200 г, 2,9 ммоль) в воде (10 мл) добавляли по каплям при 0°C, и реакционную смесь перемешивали в течение 40 минут при той же самой температуре. Раствор CuCl (1,1 г, 11,1 ммоль) в воде (10 мл) добавляли по каплям при 0°C. Реакционную смесь нагревали до 90°C в течение 2,0 часов, и растворитель выпаривали. Реакционную смесь экстрагировали EtOAc (3×50 мл), и объединенные органические слои промывали водой (50 мл), затем солевым раствором (50 мл). Раствор высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении, получая масло. Масло очищали хроматографией на силикагеле (гексан/EtOAc), получая 1-(6-хлор-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклопентанэтилкарбоксилат (1,1 г) в форме желтого масла.
Стадия 6
1-(6-хлор-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклопентанкарбоновая кислота
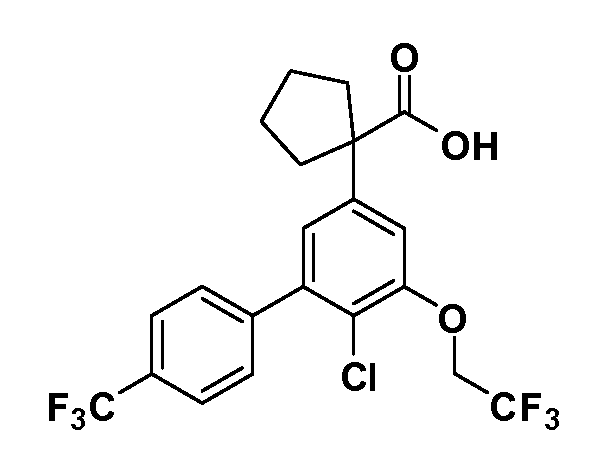
1-(6-Хлор-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклопентанэтилкарбоксилат (80 мг) растворяли в 10 мл MeOH/THF/H2O (10 мл/10 мл/5 мл) и добавляли LiOH (57 мг). Реакционную смесь перемешивали при температуре окружающей среды в течение 5 часов и концентрировали при пониженном давлении. Добавляли воду (10 мл), и реакционную смесь экстрагировали EtOAc (3×10 мл). Объединенные органические фазы высушивали надMgSO4, фильтровали и концентрировали при пониженном давлении. Очистка хроматографией на колонках с силикагелем (гексан/EtOAc 9:1) дала 1-(6-хлор-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)циклопентанкарбоновую кислоту (45 мг) в форме твердого вещества белого цвета.1H-ЯМР (500 МГц,CDCl3): 7,74 (д, 2H), 7,55 (д, 2H), 7,08 (с, 1H), 4,44 (кв., 2H), 2,66 (м, 2H), 1,98 (м, 2H), 1,78 (м, 4H).
Пример 2418: 2-(6-хлор-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-4-метилпентановая кислота
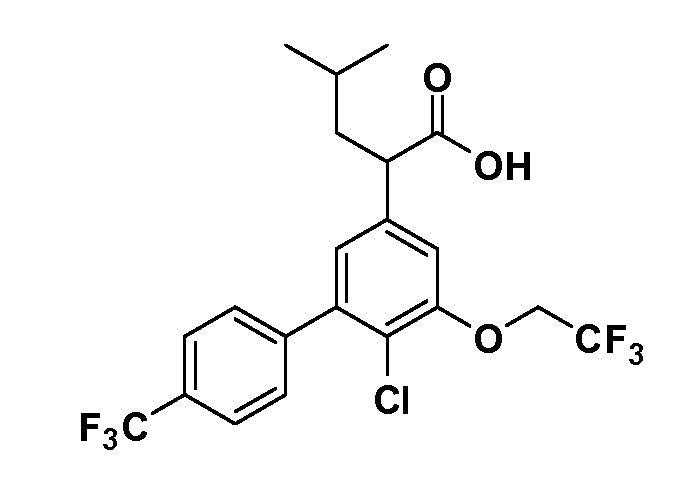
Стадия 1
4-метил-2-(4-нитро-3-(2,2,2-трифторэтокси)фенил)этилпентаноат
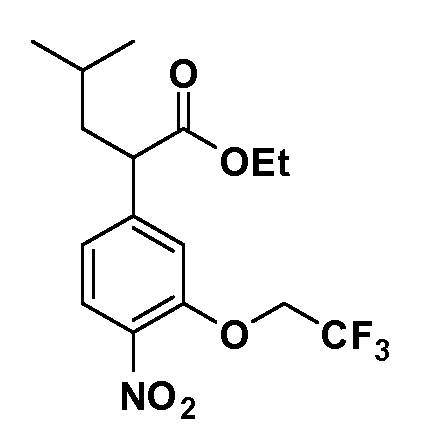
2-(4-Нитро-3-(2,2,2-трифторэтокси)фенил)этилацетат (4 г, 16,2 ммоль) растворяли в безводном DMF (50 мл) и добавляли при 0°C NaH (60 вес.% в масле, 0,846 г, 21,1 ммоль). Реакционную смесь перемешивали в течение 0,5 ч при 25°C, и изобутилбромид (2,12 мл, 19,5 ммоль) добавляли по каплям при 0°C. Реакционную смесь перемешивали при 0°C в течение 1 ч и добавляли насыщенный растворNH4Cl. Реакционную смесь экстрагировали EtOAc (3×20 мл), и объединенные органические фазы промывали водой (3×20 мл) и солевым раствором (20 мл), высушивали надMgSO4, фильтровали и концентрировали при пониженном давлении, получая 4-метил-2-(4-нитро-3-(2,2,2-трифторэтокси)фенил)этилпентаноат (1,5 г) в форме бесцветного масла.
Стадия 2
2-(4-амино-3-(2,2,2-трифторэтокси)фенил)-4-метилэтилпентаноат
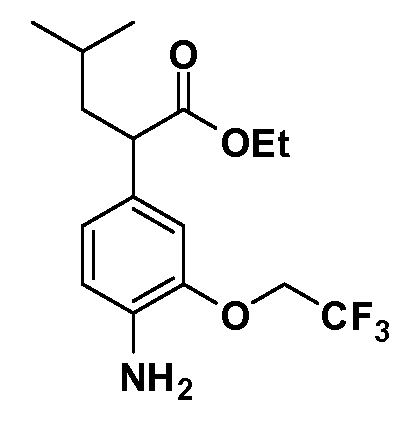
К перемешиваемому раствору 4-метил-2-(4-нитро-3-(2,2,2-трифторэтокси)фенил)этилпентаноата (1,5 г) в сухом MeOH (100 мл) добавляли Pd(ОН)2 (500 мг), и смесь восстанавливали в атмосфереH2 в течение 6 часов при температуре окружающей среды. Смесь фильтровали через слой Целита™, промывая MeOH. Объединенные фильтраты концентрировали при пониженном давлении, получая 2-(4-амино-3-(2,2,2-трифторэтокси)фенил)-4-метилэтилпентаноат (1,2 г) в форме вязкой жидкости.
Стадия 3
2-(4-амино-3-бром-5-(2,2,2-трифторэтокси)фенил)-4-метилэтилпентаноат
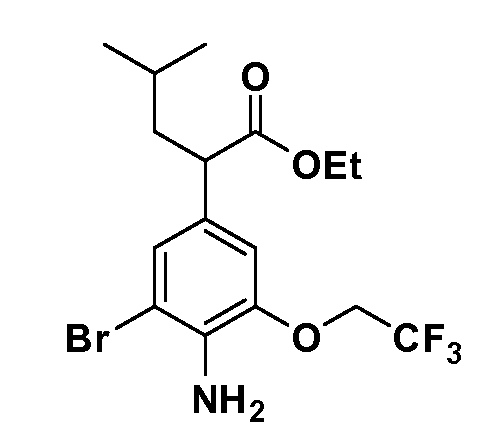
К перемешиваемому раствору 2-(4-амино-3-(2,2,2-трифторэтокси)фенил)-4-метилэтилпентаноата (0,750 г, 2,2 ммоль) в сухомCHCl3 (100 мл) при 0°C добавляли NBS (0,320 г, 1,8 ммоль). Реакционную смесь перемешивали в течение 3 ч при температуре окружающей среды. Реакционную смесь разбавляли водой, экстрагировали DCM (2×50 мл), объединенные органические растворители высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении. Сырую реакционную смесь очищали хроматографией на колонках, получая 2-(4-амино-3-бром-5-(2,2,2-трифторэтокси)фенил)-4-метилэтилпентаноат (700 мг) в форме твердого вещества желтого цвета.
Стадия 4
2-(6-амино-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноат
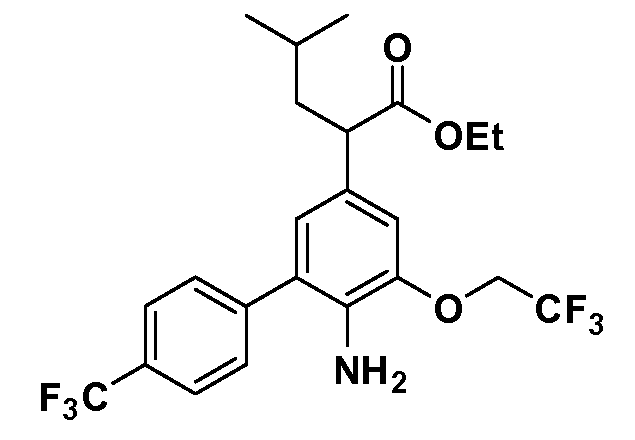
Смесь 2-(4-амино-3-бром-5-(2,2,2-трифторэтокси)фенил)-4-метилэтилпентаноата (0,70 г, 1,6 ммоль), 4-трифторметилфенилбороновой кислоты (0,642 г, 3,39 ммоль), CsF (0,641 г, 4,2 ммоль) и Pd(PPh3)4 (0,196 г, 0,16 ммоль) в безводном 1,2-диметоксиэтане (40 мл) нагревали с обратным холодильником в течение 8 часов под аргоном. Реакционную смесь охлаждали и добавляли 35 мл EtOAc и 35 мл воды. Органическую фазу отделяли, высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении до желтого масла. Масло очищали хроматографией на силикагеле (гексан/EtOAc), получая 2-(6-амино-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноат (650 мг) в форме бесцветной жидкости.
Стадия 5
2-(6-хлор-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноат
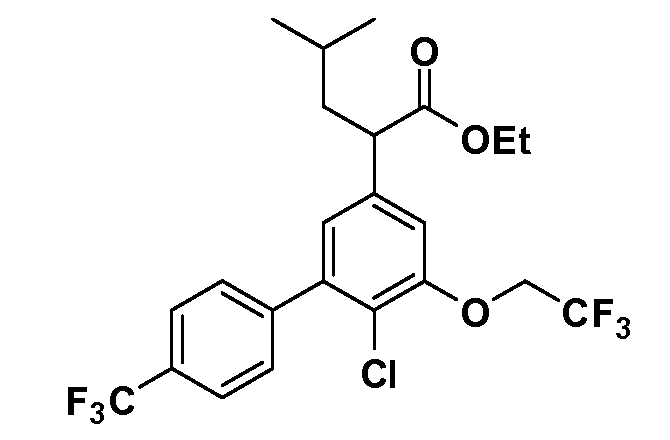
2-(6-Амино-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноат (640 мг, 1,3 ммоль) растворяли в смеси MeCN/H2O/HCl 15 мл/15 мл/1 мл при 0°C. РастворNaNO2 (0,138 г, 2,0 ммоль) в воде (2 мл) добавляли по каплям при 0°C, и реакционную смесь перемешивали в течение 40 минут при той же самой температуре. Раствор CuCl (1,32 г, 13,4 ммоль) в воде (5 мл) добавляли по каплям при 0°C. Реакционную смесь нагревали до 80°C в течение 2 часов, и смесь концентрировали при пониженном давлении. Реакционную смесь экстрагировали EtOAc (3×50 мл), и объединенные органические слои промывали водой (50 мл), затем солевым раствором (50 мл). Раствор высушивали надNa2SO4, фильтровали и концентрировали, получая сырое черное масло, которое очищали хроматографией на силикагеле (гексан/EtOAc), получая 2-(6-хлор-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноат (380 мг) в форме твердого вещества желтого цвета.
Стадия 6
2-(6-хлор-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-4-метилпентановая кислота
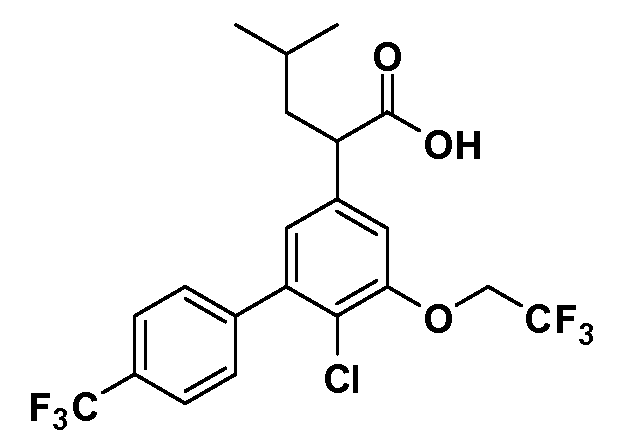
2-(6-Хлор-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноат (320 мг, 0,647 ммоль) растворяли в смеси MeOH/THF/H2O (10 мл/10 мл/5 мл), добавляли LiOH (163 мг, 3,88 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 5 часов и затем концентрировали при пониженном давлении. Добавляли воду (10 мл) и реакционную смесь экстрагировали EtOAc (3×10 мл). Объединенные органические фазы высушивали надMgSO4, фильтровали и упаривали при пониженном давлении. Очистку завершали перекристаллизацией в смеси гексан/простой эфир, получая 2-(6-хлор-5-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-3-ил)-4-метилпентановую кислоту (220 мг) в форме твердого вещества белого цвета.1H-ЯМР (500 МГц,CDCl3): 7,74 (д, 2H), 7,55 (д, 2H), 7,01 (с, 2H), 4,44 (кв., 2H), 3,68 (т, 1H), 1,98 (м, 2H), 1,61 (м, 1H), 1,54 (м, 1H), 0,95 (д, 6H).
Пример 1277: 2-(5-хлор-4'-метил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилпропановая кислота
Стадия 1
2-(3-хлор-4-гидроксифенил)этилацетат
К перемешиваемому раствору 2-(4-гидроксифенил)этилацетата (25 г, 138 ммоль) в 375 мл DCM в течение 30 минут при 0°C медленно добавляли сульфурилхлорид (9,48 мл 118 ммоль). Простой диэтиловый эфир (19,6 мл) медленно добавляли к реакционной смеси при 0°C, и перемешивание продолжали в течение 30 минут при 0°C. Реакционную смесь медленно нагревали до 15°C в течение 1 ч. После завершения реакции смесь лили на измельченный лед и экстрагировали DCM (x2). Объединенные органические слои промывали 10%-ным растворомNaHCO3, затем водой. Органический слой высушивали надNa2SO4, фильтровали и упаривали под вакуумом, получая 2-(3-хлор-4-гидроксифенил)этилацетат (15 г) в форме густого масла.
Стадия 2
2-(3-бром-5-хлор-4-гидроксифенил)этилацетат
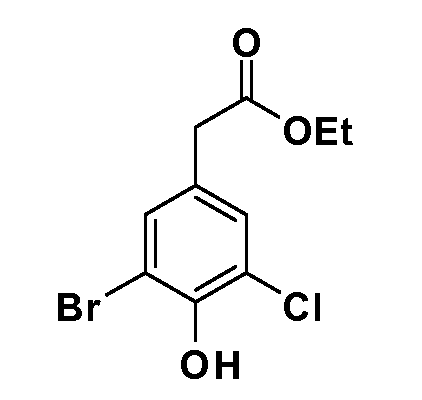
К перемешиваемому раствору 2-(3-хлор-4-гидроксифенил)этилацетата (15 г, 69 ммоль) вCCl4 (270 мл) медленно добавляли бром (11,1 г, 69 ммоль) (растворенный в 140 млCCl4) при -10°C в течение 30 мин. Реакционную смесь перемешивали в течение еще 1 часа при -10°C. После завершения реакции смесь лили на измельченный лед и экстрагировали DCM (x2). Объединенные органические слои промывали насыщенным растворомNa2S2O3, водой, высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении. Сырое соединение очищали перекристаллизацией, используя гексан, получая 2-(3-бром-5-хлор-4-гидроксифенил)этилацетат (7 г, 7 г рекуперируемых исходных материалов) в форме твердого вещества белого цвета.
Стадия 3
2-(3-бром-5-хлор-4-(2,2,2-трифторэтокси)фенил)этилацетат
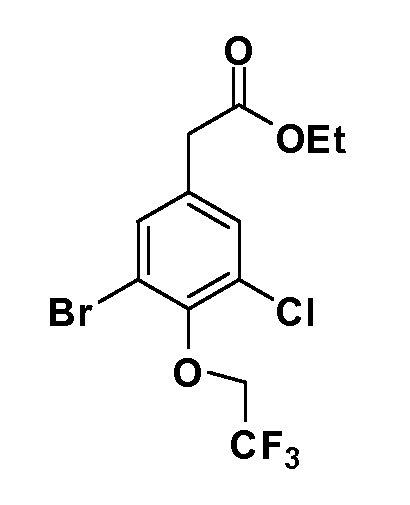
К перемешиваемому раствору 2-(3-бром-5-хлор-4-гидроксифенил)этилацетата(6,5 г, 22 ммоль) в DMF (100 мл) добавлялиK2CO3 (7,67 г, 55,6 ммоль). Трифторэтилйодид (13,16 мл, 133 ммоль) добавляли по каплям к реакционной смеси при температуре окружающей среды. Смесь затем нагревали при 60°C в течение 4 ч. После завершения реакции смесь лили в воду и экстрагировали этилацетатом (2×100 мл). Объединенные органические слои промывали водой, высушивали надNa2SO4 и концентрировали при пониженном давлении. Сырое соединение очищали хроматографией на колонках, получая 2-(3-бром-5-хлор-4-(2,2,2-трифторэтокси)фенил)этилацетат (6,5 г) в форме твердого вещества белого цвета.
Стадия 4
2-(3-бром-5-хлор-4-(2,2,2-трифторэтокси)фенил)-3-циклопропилэтилпропаноат
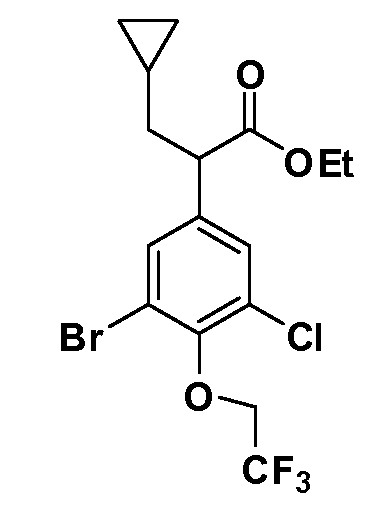
К суспензии NaH (0,327 г, 60% в парафиновом масле, 8,1 ммоль) в DMF (100 мл) при 0°C за 15 минут в атмосфере азота медленно добавляли смесь 2-(3-бром-5-хлор-4-(2,2,2-трифторэтокси)фенил)этилацетата(3,0 г, 6,8 ммоль) и циклопропилметилбромида (0,718 мл, 7,5 ммоль), растворенных в DMF (20 мл). Реакционную смесь перемешивали при 0°C в течение 15 минут, после чего смесь лили на измельченный лед и экстрагировали этилацетатом (2×50 мл). Объединенные органические слои промывали водой, солевым раствором, высушивали надNa2SO4 и упаривали. Остаток очищали флэш-хроматографией на колонке, получая 2-(3-бром-5-хлор-4-(2,2,2-трифторэтокси)фенил)-3-циклопропилэтилпропаноат (2,35 г) в форме густого сиропа.
Стадия 5
2-(5-хлор-4'-метил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилэтилпропаноат
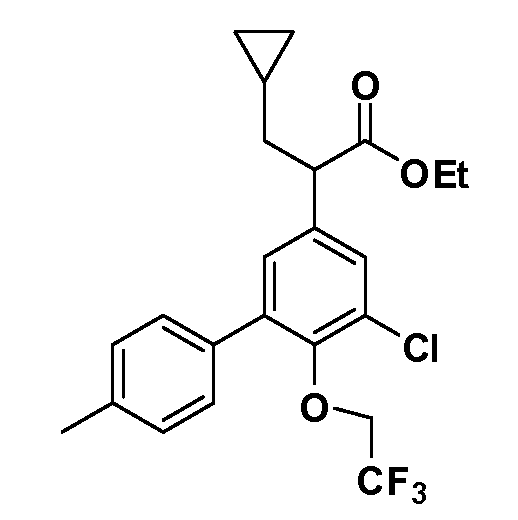
Смесь 2-(3-бром-5-хлор-4-(2,2,2-трифторэтокси)фенил)-3-циклопропилэтилпропаноата (500 мг, 1,15 ммоль), 4-метилфенилбороновой кислоты (0,237 г, 1,74 ммоль), тетракис(трифенилфосфин)палладия (0,134 г, 0,116 ммоль), фторида цезия (0,354 г, 2,23 ммоль) в DME (30 мл) перемешивали в течение ночи при 100°C. После завершения реакции осадок удаляли фильтрацией. Фильтрат разбавляли водой и экстрагировали этилацетатом (2×100 мл). Объединенные органические слои промывали водой, солевым раствором, высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении. Сырой материал очищали хроматографией на колонках, получая 2-(5-хлор-4'-метил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилэтилпропаноат (375 мг) в форме густого масла.
Стадия 7
2-(5-хлор-4'-метил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилпропановая кислота
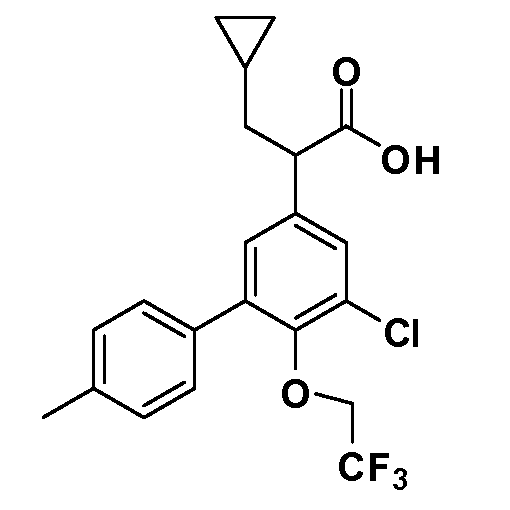
Смесь 2-(5-хлор-4'-метил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилэтилпропаноата (370 мг, 0,84 ммоль) и моногидрата гидроксида лития (282 мг, 6,7 ммоль) в смеси растворителей MeOH/THF/вода (10 мл/10 мл/10/ мл) перемешивали в течение 3 ч при температуре окружающей среды. После завершения реакции летучие компоненты удаляли при пониженном давлении. Остаток разбавляли водой, подкисляли 5% раствором HCl и экстрагировали этилацетатом (2×25 мл). Объединенные органические слои промывали водой, высушивали с помощью Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке, получая 2-(5-хлор-4'-метил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилпропановую кислоту (200 мг) в форме твердого вещества белого цвета.1H ЯМР(CDCl3): 7,21-7,42 (м, 6H), 3,87 (кв., 2H), 3,65 (т, 1H), 2,39 (с, 3H), 1,93 (м, 1H), 1,88 (м, 1H), 0,66 (м, 1H), 0,42 (м, 2H), 0,12 (м, 1H), 0,1 (м, 1H).
Пример 1289: 2-(5-хлор-4'-этил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилпропановая кислота
Стадия 1
2-(5-хлор-4'-этил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилэтилпропаноат
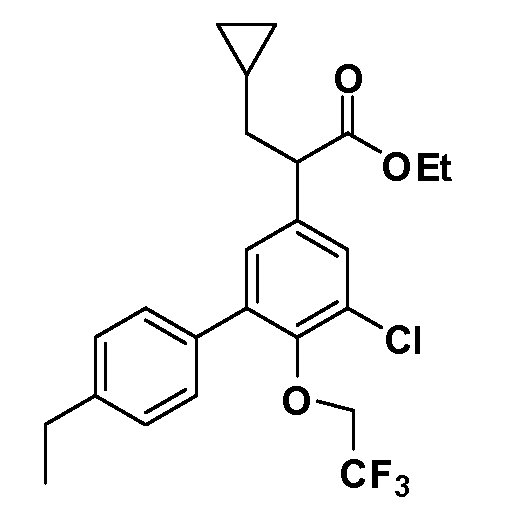
Смесь 2-(3-бром-5-хлор-4-(2,2,2-трифторэтокси)фенил)-3-циклопропилэтилпропаноата (500 мг, 1,15 ммоль), 4-этилфенилбороновой кислоты (225 мг, 1,74 ммоль), тетракис(трифенилфосфин)палладия (0,134 г, 0,116 ммоль), фторид цезия (0,354 г, 2,23 ммоль) в DME (30 мл) перемешивали в течение ночи при 100°C. После завершения реакции осадок удаляли фильтрацией. Фильтрат разбавляли водой и экстрагировали этилацетатом (2×100 мл). Объединенные органические слои промывали водой, солевым раствором, высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении. Сырой материал очищали хроматографией на колонках, получая 2-(5-хлор-4'-этил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилэтилпропаноат (400 мг) в форме густого масла.
Стадия 2
2-(5-хлор-4'-этил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилпропановая кислота
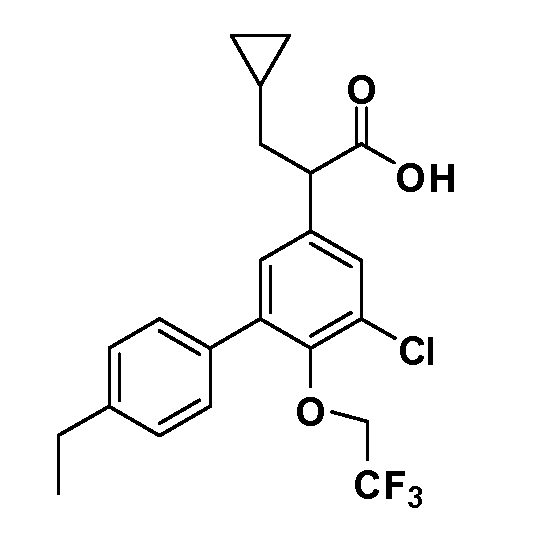
Смесь 2-(5-хлор-4'-этил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилэтилпропаноата (400 мг, 0,88 ммоль) и моногидрата гидроксида лития (222 мг, 5,2 ммоль) в смеси растворителей MeOH/THF/вода (10 мл/10 мл/10 мл) перемешивали в течение 3 ч при температуре окружающей среды. После завершения реакции летучие компоненты удаляли при пониженном давлении. Остаток разбавляли водой, подкисляли 5% раствором HCl и экстрагировали этилацетатом (2×25 мл). Объединенные органические слои промывали водой, высушивали с использованием Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке, получая 2-(5-хлор-4'-этил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилпропановую кислоту (200 мг) в форме твердого вещества белого цвета.1H ЯМР(CDCl3): 7,42 (д, 2H), 7,38 (с, 1H), 7,22 (д, 2H), 7,20 (с, 1H), 3,85 (кв., 2H), 3,66 (т, 1H), 2,73 (кв., 2H), 1,93 (м, 1H), 1,88 (м, 1H), 1,29 (т, 3H), 0,66 (м, 1H), 0,42 (м, 2H), 0,12 (м, 1H), 0,05 (м, 1H).
Пример 1313: 2-(5-хлор-4'-(метилтио)-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилпропановая кислота
Стадия 1
2-(5-хлор-4'-(метилтио)-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилэтилпропаноат
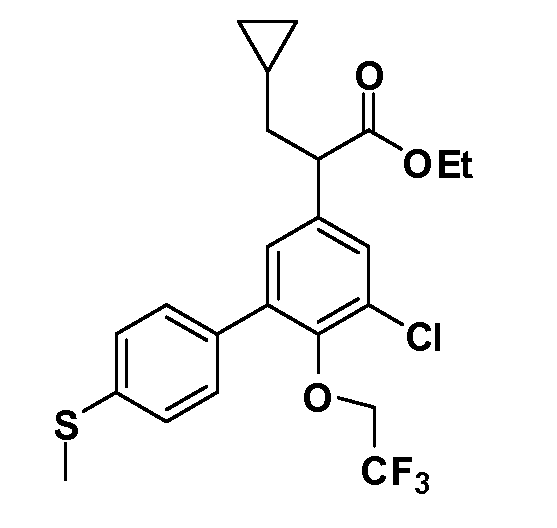
Смесь 2-(3-бром-5-хлор-4-(2,2,2-трифторэтокси)фенил)-3-циклопропилэтилпропаноата (500 мг, 1,15 ммоль), 4-тиометилфенилбороновой кислоты (293 мг, 1,7 ммоль), тетракис(трифенилфосфин)палладия (0,134 г, 0,116 ммоль), фторида цезия (0,354 г, 2,23 ммоль) в DME (30 мл) перемешивали в течение ночи при 100°C. После завершения реакции осадок удаляли фильтрацией. Фильтрат разбавляли водой и экстрагировали этилацетатом (2×100 мл). Объединенные органические слои промывали водой, солевым раствором, высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении. Сырой материал очищали хроматографией на колонках, получая 2-(5-хлор-4'-(метилтио)-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилэтилпропаноат (360 мг) в форме густого масла.
Стадия 2
2-(5-хлор-4'-(метилтио)-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилпропановая кислота
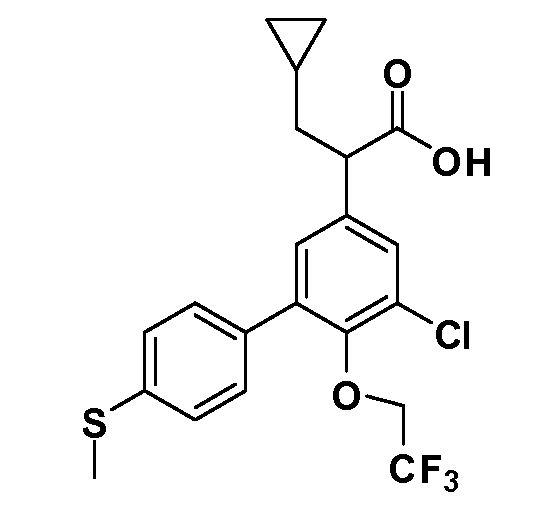
Смесь 2-(5-хлор-4'-(метилтио)-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилэтилпропаноата (350 мг, 0,74 ммоль) и моногидрата гидроксида лития (186 мг, 4,44 ммоль) в смеси растворителей MeOH/THF/вода (10 мл/10 мл/10 мл) перемешивали в течение 3 ч при температуре окружающей среды. После завершения реакции летучие компоненты удаляли при пониженном давлении. Остаток разбавляли водой, подкисляли 5% раствором HCl и экстрагировали этилацетатом (2×25 мл). Объединенные органические слои промывали водой, высушивали с использованием Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке, получая 2-(5-хлор-4'-(метилтио)-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилпропановую кислоту (310 мг) в форме твердого вещества белого цвета.1H ЯМР(CDCl3): 7,46 (д, 2H), 7,38 (с, 1H), 7,32 (д, 2H), 7,22 (с, 1H), 3,93 (кв., 2H), 3,68 (т, 1H), 2,56 (с, 3H), 1,93 (м, 1H), 1,78 (м, 1H), 1,29 (т, 3H), 0,65 (м, 1H), 0,42 (м, 2H), 0,12 (м, 1H), 0,05 (м, 1H).
Пример 1325: 2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметокси)бифенил-3-ил)-3-циклопропилпропановая кислота
Стадия 1
2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметокси)бифенил-3-ил)-3-циклопропилэтилпропаноат
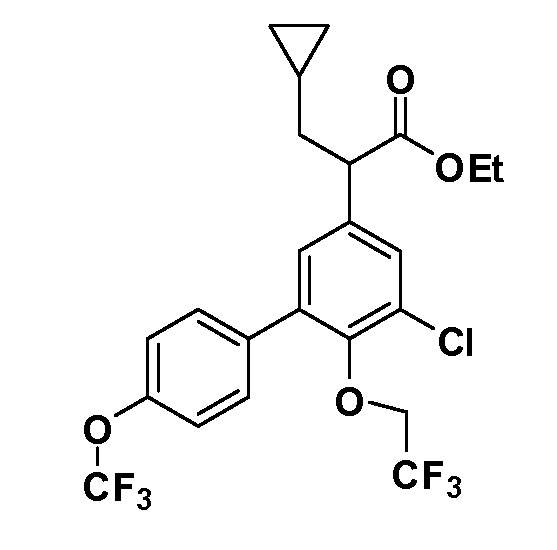
Смесь 2-(3-бром-5-хлор-4-(2,2,2-трифторэтокси)фенил)-3-циклопропилэтилпропаноата (500 мг, 1,15 ммоль), 4-трифторметоксифенилбороновой кислоты (310 мг, 1,65 ммоль), тетракис(трифенилфосфин)палладия (0,134 г, 0,116 ммоль), фторида цезия (0,354 г, 2,23 ммоль) в DME (30 мл) перемешивали в течение ночи при 100°C. После завершения реакции осадок удаляли фильтрацией. Фильтрат разбавляли водой и экстрагировали этилацетатом (2×100 мл). Объединенные органические слои промывали водой, солевым раствором, высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении. Сырой материал очищали хроматографией на колонках, получая 2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметокси)бифенил-3-ил)-3-циклопропилэтилпропаноат (260 мг) в форме густого масла.
Стадия 2
2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметокси)бифенил-3-ил)-3-циклопропилпропановая кислота
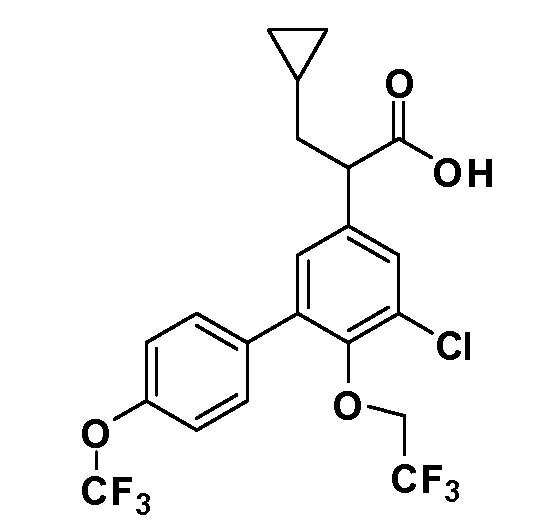
Смесь 2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметокси)бифенил-3-ил)-3-циклопропилэтилпропаноата (260 мг, 0,50 ммоль) и моногидрата гидроксида лития (186 мг, 4,44 ммоль) в смеси растворителей MeOH/THF/вода (10 мл/10 мл/10 мл) перемешивали в течение 3 ч при температуре окружающей среды. После завершения реакции летучие компоненты удаляли при пониженном давлении. Остаток разбавляли водой, подкисляли 5% раствором HCl и экстрагировали этилацетатом (2×25 мл). Объединенные органические слои промывали водой, высушивали с использованием Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке, получая 2-(5-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметокси)бифенил-3-ил)-3-циклопропилпропановую кислоту (180 мг) в форме твердого вещества белого цвета.1H ЯМР(CDCl3): 7,56 (д, 2H), 7,40 (с, 1H), 7,25 (м, 3H), 3,98 (кв., 2H), 3,68 (т, 1H), 2,56 (с, 3H), 1,913 (м, 1H), 1,76 (м, 1H), 1,29 (т, 3H), 0,62 (м, 1H), 0,41 (м, 2H), 0,12 (м, 1H), 0,05 (м, 1H).
Пример 1301: 2-(5-хлор-4'-изопропил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилпропановая кислота
Стадия 1
2-(5-хлор-4'-изопропил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилэтилпропаноат
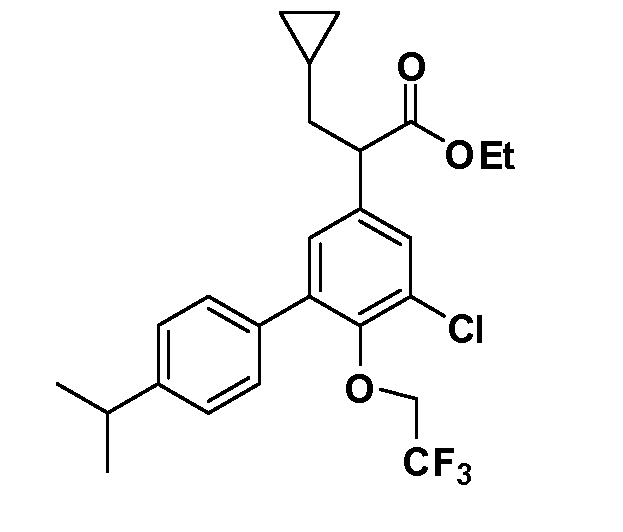
Смесь 2-(3-бром-5-хлор-4-(2,2,2-трифторэтокси)фенил)-3-циклопропилэтилпропаноата (500 мг, 1,15 ммоль), 4-изопропилфенилбороновой кислоты (225 мг, 1,74 ммоль), тетракис(трифенилфосфин)палладия (0,134 г, 0,116 ммоль), фторида цезия (0,354 г, 2,23 ммоль) в DME (30 мл) перемешивали в течение ночи при 100°C. После завершения реакции осадок удаляли фильтрацией. Фильтрат разбавляли водой и экстрагировали этилацетатом (2×100 мл). Объединенные органические слои промывали водой, солевым раствором, высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении. Сырой материал очищали хроматографией на колонках, получая 2-(5-хлор-4'-изопропил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилэтилпропаноат (400 мг) в форме густого масла.
Стадия 2
2-(5-хлор-4'-изопропил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилпропановая кислота
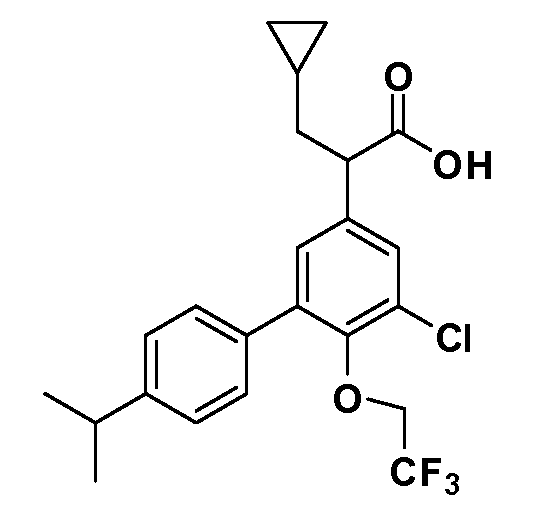
Смесь 2-(5-хлор-4'-изопропил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилэтилпропаноата (400 мг, 0,85 ммоль) и моногидрата гидроксида лития (215 мг, 5,1 ммоль) в смеси растворителей MeOH/THF/вода (10 мл/10 мл/10 мл) перемешивали в течение 3 ч при температуре окружающей среды. После завершения реакции летучие компоненты удаляли при пониженном давлении. Остаток разбавляли водой, подкисляли 5% раствором HCl и экстрагировали этилацетатом (2×25 мл). Объединенные органические слои промывали водой, высушивали с использованием Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке, получая 2-(5-хлор-4'-изопропил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилпропановую кислоту (180 мг) в форме твердого вещества белого цвета.1H ЯМР(CDCl3): 7,44 (д, 2H), 7,38 (с, 1H), 7,31 (д, 2H), 7,21 (с, 1H), 3,86 (кв., 2H), 3,67 (т, 1H), 2,98 (м, 1H), 1,93 (м, 1H), 1,78 (м, 1H), 1,28 (д, 6H), 0,66 (м, 1H), 0,43 (м, 2H), 0,12 (м, 1H), 0,05 (м, 1H).
Пример 1280: 1-(5-хлор-4'-метил-6-(2,2,2-трифторэтокси)бифенил-3-ил)циклобутанкарбоновая кислота
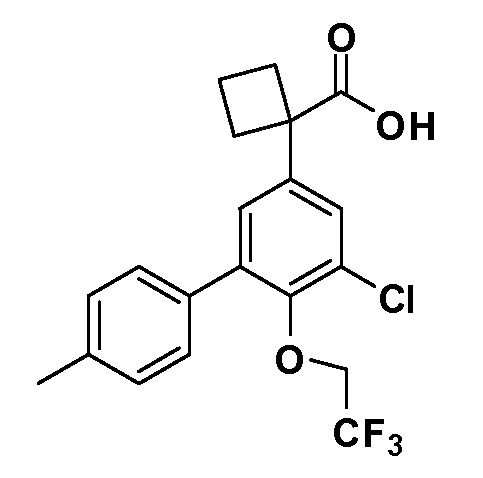
Стадия 1
1-(3-бром-5-хлор-4-(2,2,2-трифторэтокси)фенил)циклобутанэтилкарбоксилат
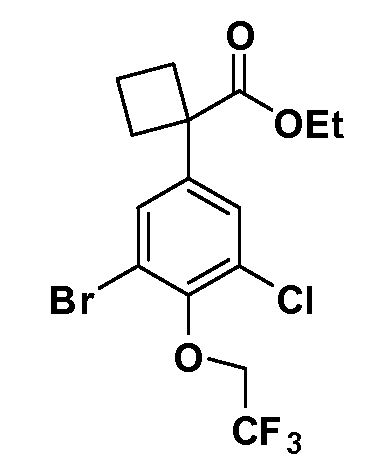
К суспензии NaH (0,65 г, 60% в парафиновом масле) в DMF (100 мл) при 0°C за 15 минут в атмосфере азота медленно добавляли смесь 2-(3-бром-5-хлор-4-(2,2,2-трифторэтокси)фенил)этилацетата(3,0 г, 6,8 ммоль) и 1,3-дибромпропана (1,61 г, 8,0 ммоль), растворенных в DMF (20 мл). Реакционную смесь перемешивали при 0°C в течение 15 минут, после чего реакционную смесь лили на измельченный лед и экстрагировали этилацетатом (2×50 мл). Объединенные органические слои промывали водой, солевым раствором, высушивали надNa2SO4 и концентрировалив вакууме. Остаток очищали флэш-хроматографией на колонке, получая 1-(3-бром-5-хлор-4-(2,2,2-трифторэтокси)фенил)циклобутанэтилкарбоксилат (2,12 г) в форме густого сиропа.
Стадия 2
1-(5-хлор-4'-метил-6-(2,2,2-трифторэтокси)бифенил-3-ил)циклобутанэтилкарбоксилат
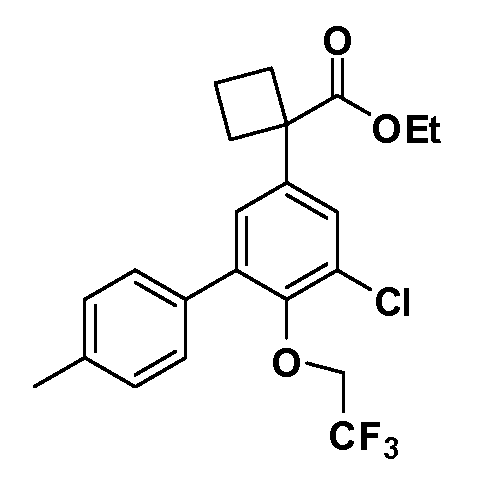
Смесь 1-(3-бром-5-хлор-4-(2,2,2-трифторэтокси)фенил)циклобутанэтилкарбоксилата (500 мг, 1,2 ммоль), 4-метилфенилбороновой кислоты (0,237 г, 1,68 ммоль), тетракис(трифенилфосфин)палладия (0,134 г, 0,116 ммоль), фторида цезия (0,354 г, 2,23 ммоль) в DME (30 мл) перемешивали в течение ночи при 100°C. После завершения реакции осадок удаляли фильтрацией. Фильтрат разбавляли водой и экстрагировали этилацетатом (2×100 мл). Объединенные органические слои промывали водой, солевым раствором, высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении. Сырой материал очищали хроматографией на колонках, получая 1-(5-хлор-4'-метил-6-(2,2,2-трифторэтокси)бифенил-3-ил)циклобутанэтилкарбоксилат (325 мг) в форме густого масла.
Стадия 3
1-(5-хлор-4'-метил-6-(2,2,2-трифторэтокси)бифенил-3-ил)циклобутанкарбоновая кислота
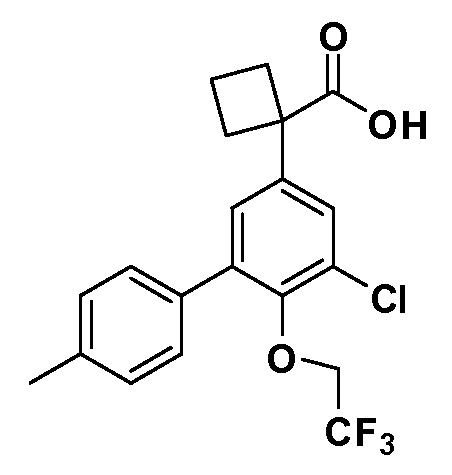
Смесь 1-(5-хлор-4'-метил-6-(2,2,2-трифторэтокси)бифенил-3-ил)циклобутанэтилкарбоксилата (300 мг, 0,70 ммоль) и моногидрата гидроксида лития (280 мг, 11,6 ммоль) в смеси растворителей MeOH/THF/вода (10 мл/10 мл/10 мл) перемешивали в течение 3 ч при температуре окружающей среды. После завершения реакции летучие компоненты удаляли при пониженном давлении. Остаток разбавляли водой, подкисляли 5% раствором HCl и экстрагировали этилацетатом (2×25 мл). Объединенные органические слои промывали водой, высушивали с использованием Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке, получая 1-(5-хлор-4'-метил-6-(2,2,2-трифторэтокси)бифенил-3-ил)циклобутанкарбоновую кислоту (185 мг, 66%) в форме твердого вещества белого цвета.1H ЯМР(CDCl3): 7,42 (м, 2H), 7,32 (с, 1H), 7,23 (д, 2H), 7,18 (с, 1H), 3,87 (кв., 2H), 2,85 (м, 2H), 2,54 (м, 2H), 2,39 (с, 3H), 2,12 (м, 1H), 1,83 (м, 1H).
Стадия 4
1-(5-хлор-4'-этил-6-(2,2,2-трифторэтокси)бифенил-3-ил)циклобутанэтилкарбоксилат
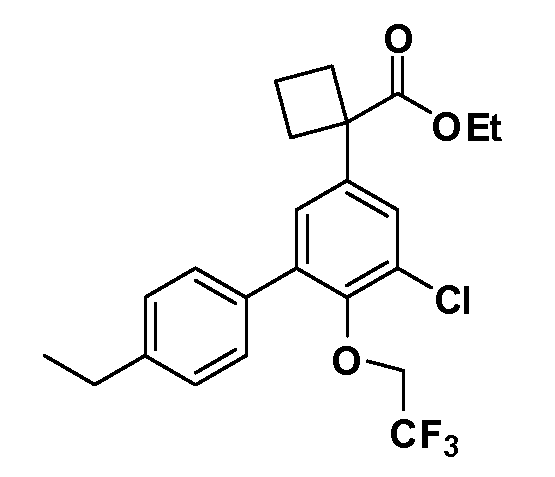
Смесь 2-(3-бром-5-хлор-4-(2,2,2-трифторэтокси)фенил)этилацетата (500 мг, 1,2 ммоль), 4-этилфенилбороновой кислоты (225 мг, 1,74 ммоль), тетракис(трифенилфосфин)палладия (0,134 г, 0,116 ммоль), фторида цезия (0,354 г, 2,23 ммоль) в DME (30 мл) перемешивали в течение ночи при 100°C. После завершения реакции осадок удаляли фильтрацией. Фильтрат разбавляли водой и экстрагировали этилацетатом (2×100 мл). Объединенные органические слои промывали водой, солевым раствором, высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении. Сырой материал очищали хроматографией на колонках, получая 1-(5-хлор-4'-этил-6-(2,2,2-трифторэтокси)бифенил-3-ил)циклобутанэтилкарбоксилат (360 мг) в форме густого масла.
Стадия 5
1-(5-хлор-4'-этил-6-(2,2,2-трифторэтокси)бифенил-3-ил)циклобутанкарбоновая кислота
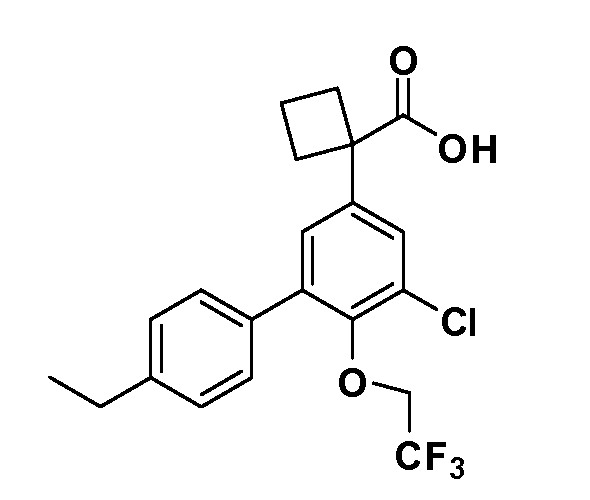
Смесь 1-(5-хлор-4'-этил-6-(2,2,2-трифторэтокси)бифенил-3-ил)циклобутанэтилкарбоксилата (350 мг, 0,84 ммоль) и моногидрата гидроксида лития (222 мг, 9,2 ммоль) в смеси растворителей MeOH/THF/вода (10 мл/10 мл/10 мл) перемешивали в течение 3 ч при температуре окружающей среды. После завершения реакции летучие компоненты удаляли при пониженном давлении. Остаток разбавляли водой, подкисляли 5% раствором HCl и экстрагировали этилацетатом (2×25 мл). Объединенные органические слои промывали водой, высушивали с использованием Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке, получая1-(5-хлор-4'-этил-6-(2,2,2-трифторэтокси)бифенил-3-ил)циклобутанкарбоновую кислоту (260 мг) в форме твердого вещества белого цвета.1H ЯМР (CDCl3, 500 МГц): 7,42 (д, 2H), 7,38 (с, 1H), 7,22 (д, 2H), 7,20 (с, 1H), 3,85 (кв., 2H), 2,82 (м, 2H), 2,71 (кв., 2H), 2,52 (м, 2H), 2,15 (м, 1H), 1,91 (м, 1H), 1,27 (т, 3H).
Пример 1316: 1-(5-хлор-4'-(метилтио)-6-(2,2,2-трифторэтокси)бифенил-3-ил)циклобутанкарбоновая кислота
Стадия 1
1-(5-хлор-4'-(метилтио)-6-(2,2,2-трифторэтокси)бифенил-3-ил)циклобутанэтилкарбоксилат
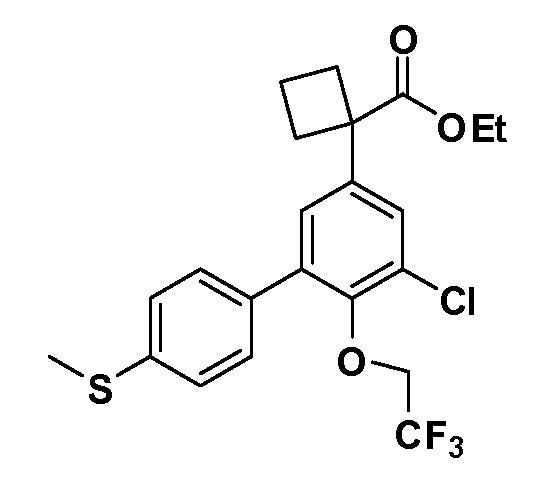
Смесь 2-(3-бром-5-хлор-4-(2,2,2-трифторэтокси)фенил)этилацетата (500 мг, 1,2 ммоль), 4-тиометилфенилбороновой кислоты (293 мг, 1,7 ммоль), тетракис(трифенилфосфин)палладия (0,134 г, 0,116 ммоль), фторида цезия (0,354 г, 2,23 ммоль) в DME (30 мл) перемешивали в течение ночи при 100°C. После завершения реакции осадок удаляли фильтрацией. Фильтрат разбавляли водой и экстрагировали этилацетатом (2×100 мл). Объединенные органические слои промывали водой, солевым раствором, высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении. Сырой материал очищали хроматографией на колонках, получая 1-(5-хлор-4'-(метилтио)-6-(2,2,2-трифторэтокси)бифенил-3-ил)циклобутанэтилкарбоксилат (342 мг) в форме густого масла.
Стадия 2
1-(5-хлор-4'-(метилтио)-6-(2,2,2-трифторэтокси)бифенил-3-ил)циклобутанкарбоновая кислота
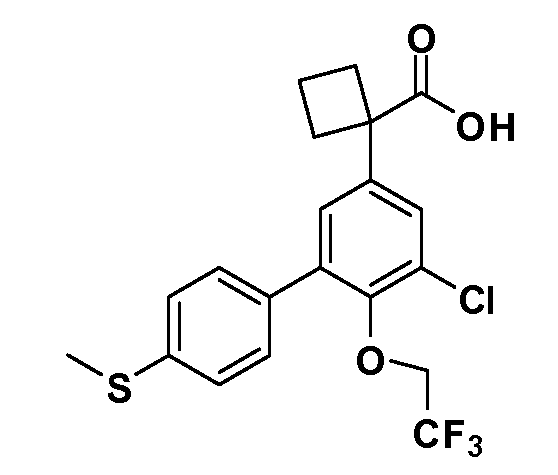
Смесь 1-(5-хлор-4'-(метилтио)-6-(2,2,2-трифторэтокси)бифенил-3-ил)циклобутанэтилкарбоксилата (325 мг, 0,70 ммоль) и моногидрата гидроксида лития (186 мг, 4,44 ммоль) в смеси растворителей MeOH/THF/вода (10 мл/10 мл/10 мл) перемешивали в течение 3 ч при температуре окружающей среды. После завершения реакции летучие компоненты удаляли при пониженном давлении. Остаток разбавляли водой, подкисляли 5% раствором HCl и экстрагировали этилацетатом (2×25 мл). Объединенные органические слои промывали водой, высушивали с использованием Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке, получая 1-(5-хлор-4'-(метилтио)-6-(2,2,2-трифторэтокси)бифенил-3-ил)циклобутанкарбоновую кислоту (265 мг) в форме твердого вещества белого цвета.1H ЯМР(CDCl3): 7,46 (д, 2H), 7,38 (с, 1H), 7,32 (д, 2H), 7,19 (с, 1H), 3,93 (кв., 2H), 2,83 (м, 2H), 2,53 (с, 3H), 2,32 (м, 2H), 2,13 (м, 1H), 1,93 (м, 1H).
Пример 1304: 1-(5-хлор-4'-изопропил-6-(2,2,2-трифторэтокси)бифенил-3-ил)циклобутанкарбоновая кислота
Стадия 1
1-(5-хлор-4'-изопропил-6-(2,2,2-трифторэтокси)бифенил-3-ил)циклобутанэтилкарбоксилат
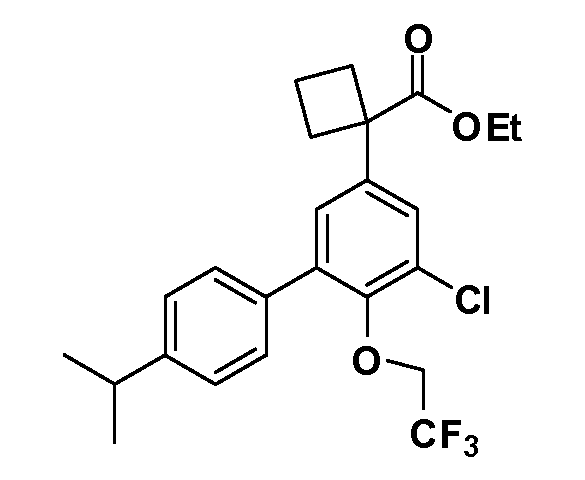
Смесь 2-(3-бром-5-хлор-4-(2,2,2-трифторэтокси)фенил)этилацетата (500 мг, 1,2 ммоль), 4-изопропилфенилбороновой кислоты (245 мг, 1,68 ммоль), тетракис(трифенилфосфин)палладия (0,134 г, 0,116 ммоль), фторида цезия (0,354 г, 2,23 ммоль) в DME (30 мл) перемешивали в течение ночи при 100°C. После завершения реакции осадок удаляли фильтрацией. Фильтрат разбавляли водой и экстрагировали этилацетатом (2×100 мл). Объединенные органические слои промывали водой, солевым раствором, высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении. Сырой материал очищали хроматографией на колонках, получая 1-(5-хлор-4'-изопропил-6-(2,2,2-трифторэтокси)бифенил-3-ил)циклобутанэтилкарбоксилат (425 мг) в форме густого масла.
Стадия 2
1-(5-хлор-4'-изопропил-6-(2,2,2-трифторэтокси)бифенил-3-ил)циклобутанкарбоновая кислота
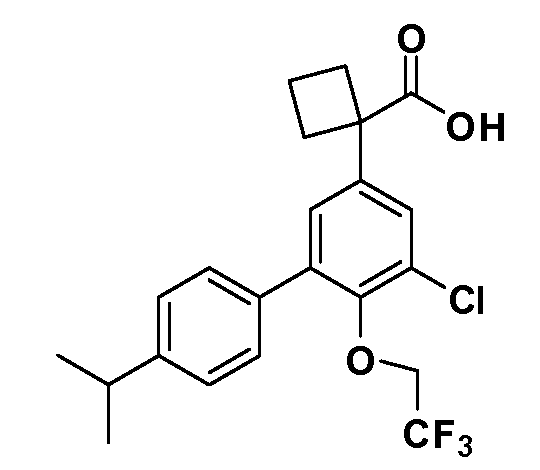
Смесь 1-(5-хлор-4'-изопропил-6-(2,2,2-трифторэтокси)бифенил-3-ил)циклобутанэтилкарбоксилата (400 мг, 0,88 ммоль) и моногидрата гидроксида лития (215 мг, 5,1 ммоль) в смеси растворителей MeOH/THF/вода (10 мл/10 мл/10 мл) перемешивали в течение 3 ч при температуре окружающей среды. После завершения реакции летучие компоненты удаляли при пониженном давлении. Остаток разбавляли водой, подкисляли 5% раствором HCl и экстрагировали этилацетатом (2×25 мл). Объединенные органические слои промывали водой, высушивали с использованием Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке, получая 1-(5-хлор-4'-изопропил-6-(2,2,2-трифторэтокси)бифенил-3-ил)циклобутанкарбоновую кислоту (289 мг) в форме твердого вещества белого цвета.1H ЯМР(CDCl3): 7,44 (д, 2H), 7,38 (с, 1H), 7,31 (д, 2H), 7,21 (с, 1H), 3,86 (кв., 2H), 2,99 (м, 1H), 2,86 (м, 2H), 2,52 (м, 2H), 2,13 (м, 1H), 1,92 (м, 1H), 1,28 (д, 6H).
Пример 1833: 2-(2-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-4-ил)-3-циклопропилпропановая кислота
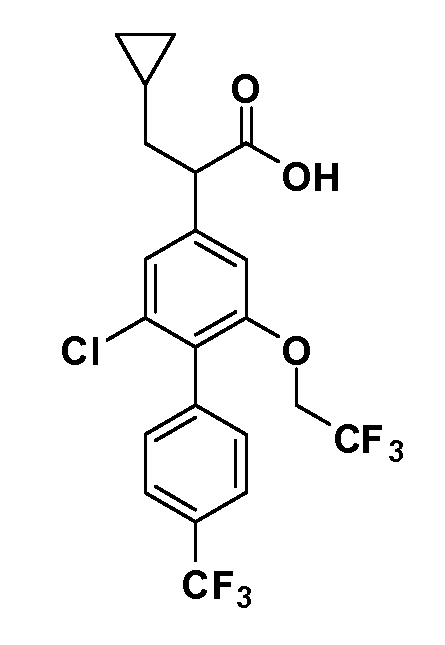
Стадия 1
2-(4-амино-3-хлор-5-(2,2,2-трифторэтокси)фенил)-3-циклопропилэтилпропаноат
К перемешиваемому раствору 2-(4-амино-3-(2,2,2-трифторэтокси)фенил)-3-циклопропилэтилпропаноата (1,2 г, 4,0 ммоль) в сухомCCl4 (60 мл) при 0°C добавляли NCS (0,427 г, 3,2 ммоль). Реакционную смесь перемешивали в течение 3 часов при температуре окружающей среды, чтобы закончить реакцию. Реакционную смесь разбавляли водой, экстрагировали DCM (2×50 мл), объединенные органические растворители высушивали надNa2SO4, фильтровали и концентрировалив вакууме. Сырую реакционную смесь очищали хроматографией на колонках, получая 2-(4-амино-3-хлор-5-(2,2,2-трифторэтокси)фенил)-3-циклопропилэтилпропаноат (0,920 г) в форме твердого вещества желтого цвета.
Стадия 2
2-(3-хлор-4-йод-5-(2,2,2-трифторэтокси)фенил)-3-циклопропилэтилпропаноат
2-(4-Амино-3-хлор-5-(2,2,2-трифторэтокси)фенил)-3-циклопропилэтилпропаноат (0,9 г, 2,6 ммоль) растворяли в смеси AcCN/H2O/HCl (96%) 25 мл/25 мл/1 мл при 0°C. РастворNaNO2 (0,277 г, 4,02 ммоль) в воде (2 мл) добавляли по каплям при 0°C, и реакционную смесь перемешивали в течение 40 минут при той же самой температуре. Раствор KI (4,5 г, 26,8 ммоль) в воде (10 мл) добавляли по каплям при 0°C. Реакционную смесь нагревали до 70°C в течение 1 часа. Реакционную смесь экстрагировали EtOAc (3×50 мл), и объединенные органические слои промывали 10%-ным тиосульфатом натрия (2×50 мл), водой (100 мл), затем солевым раствором (100 мл). Раствор высушивали надNa2SO4, фильтровали и концентрировали, получая сырое черное масло, которое очищали хроматографией на колонках с силикагелем (гексан/EtOAc, 95:5), получая 2-(3-хлор-4-йод-5-(2,2,2-трифторэтокси)фенил)-3-циклопропилэтилпропаноат (1,1 г, 90,9%) в форме желтого масла.
Стадия 3
2-(2-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-4-ил)-3-циклопропилэтилпропаноат
Смесь 2-(3-хлор-4-йод-5-(2,2,2-трифторэтокси)фенил)-3-циклопропилэтилпропаноата (1,1 г, 2,4 ммоль), 4-трифторметилфенилбороновой кислоты (0,928 г, 4,9 ммоль), CsF (0,926 г, 6,1 ммоль) и Pd(PPh3)4 (0,283 г, 0,245 ммоль) в безводном 1,2-диметоксиэтане (50 мл) нагревали с обратным холодильником в течение 8 часов под аргоном. Реакционную смесь охлаждали и добавляли 40 мл EtOAc и 40 мл воды. Органическую фазу отделяли, высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении, получая желтое масло. Масло очищали хроматографией на колонках с силикагелем (гексан/EtOAc, 95:5), получая 2-(2-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-4-ил)-3-циклопропилэтилпропаноат (0,650 г) в форме желтого масла.
Стадия 4
2-(2-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-4-ил)-3-циклопропилпропановая кислота
2-(2-Хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-4-ил)-3-циклопропилэтилпропаноат (0,65 г, 1,31 ммоль) растворяли в 25 мл смеси MeOH/THF/H2O (10:10:5, об./об.), добавляли LiOH (0,252 г, 10,5 ммоль). Реакционную смесь перемешивали в течение 5 часов при температуре окружающей среды и концентрировали при пониженном давлении. Добавляли воду (10 мл), и реакционную смесь экстрагировали EtOAc (3×10 мл). Объединенные органические фазы высушивали надNa2SO4, фильтровали и упаривали при пониженном давлении. Очистка хроматографией на колонках с силикагелем (DCM/MeOH, 95:5) дала 2-(2-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-4-ил)-3-циклопропилпропановую кислоту (0,585 г) в форме твердого вещества белого цвета.1H ЯМР (500 МГц,CDCl3/TMS): δ 7,71 (д, 2H), 7,39 (д, 2H), 7,22 (с, 1H), 6,91 (с, 1H), 4,23 (кв., 2H), 3,72 (т, 1H), 1,93 (м, 1H), 1,82 (м, 1H), 0,81 (м, 1H), 0,52 (м, 2H), 0,15 (м, 2H).
Пример 1836: 1-(2-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-4-ил)циклобутанкарбоновая кислота
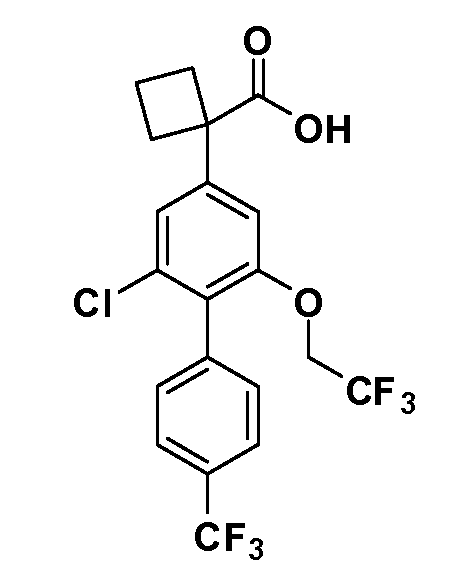
Стадия 1
1-(4-амино-3-хлор-5-(2,2,2-трифторэтокси)фенил)циклобутанэтилкарбоксилат
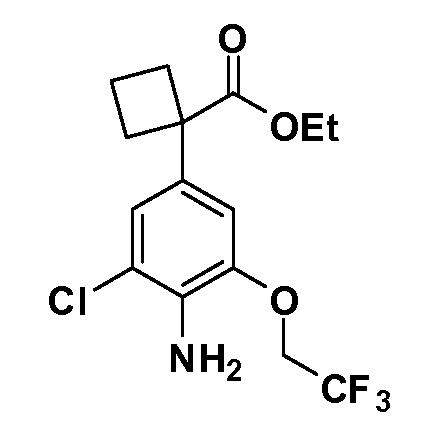
К перемешиваемому раствору 1-(4-амино-3-(2,2,2-трифторэтокси)фенил)циклобутанэтилкарбоксилата (2,0 г, 6,3 ммоль) в сухомCHCl3 (30 мл) при 0°C добавляли NCS (0,842 г, 6,3 ммоль). Реакционную смесь перемешивали в течение 3 ч при температуре окружающей среды, чтобы закончить реакцию. Реакционную смесь разбавляли водой, экстрагировали DCM (2×100 мл), объединенные органические растворители высушивали надNa2SO4, фильтровали и концентрировалив вакууме. Сырую реакционную смесь очищали флэш-хроматографией на колонке, получая 1-(4-амино-3-хлор-5-(2,2,2-трифторэтокси)фенил)циклобутанэтилкарбоксилат (0,4 г) в форме густого сиропа.
Стадия 2
1-(3-хлор-4-йод-5-(2,2,2-трифторэтокси)фенил)циклобутанэтилкарбоксилат
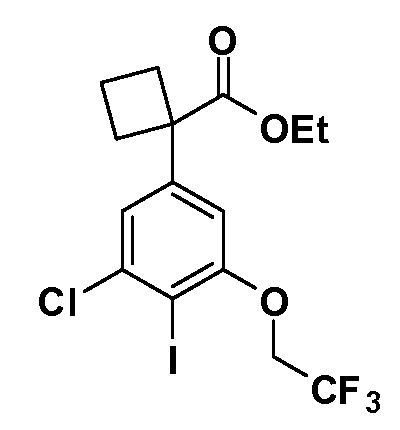
1-(4-амино-3-хлор-5-(2,2,2-трифторэтокси)фенил)циклобутанэтилкарбоксилат (0,45 г, 1,27 ммоль) растворяли в смеси AcCN/H2O/HCl (96%) 15 мл/10 мл/3,1 мл при 0°C. РастворNaNO2 (0,132 г, 1,91 ммоль) в воде (1 мл) добавляли по каплям при 0°C, и реакционную смесь перемешивали в течение 40 минут при той же самой температуре. Раствор KI (2,11 г, 12,7 ммоль) в воде (10 мл) добавляли по каплям при 0°C. Реакционную смесь нагревали до 80°C в течение 1 часа. Реакционную смесь экстрагировали EtOAc (3×50 мл), и объединенные органические слои промывали 10%-ным тиосульфатом натрия (2×50 мл), водой (100 мл), затем солевым раствором (100 мл). Раствор высушивали надNa2SO4, фильтровали и концентрировали, получая сырое черное масло, которое очищали хроматографией на колонках с силикагелем (гексан/EtOAc, 95:5), получая 1-(3-хлор-4-йод-5-(2,2,2-трифторэтокси)фенил)циклобутанэтилкарбоксилат (0,350 г) в форме желтого масла.
Стадия 3
1-(2-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-4-ил)циклобутанэтилкарбоксилат
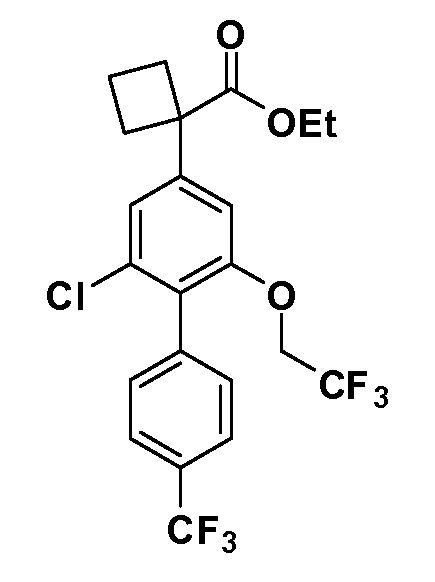
Смесь 1-(3-хлор-4-йод-5-(2,2,2-трифторэтокси)фенил)циклобутанэтилкарбоксилата (0,35, 7,35 ммоль), 4-трифторметилфенилбороновой кислоты (0,277 г, 1,47 ммоль), CsF (0,277 г, 1,83 ммоль) и Pd(PPh3)4 (0,084 г, 0,36 ммоль) в безводном 1,2-диметоксиэтане (20 мл) нагревали с обратным холодильником в течение 8 часов под аргоном. Реакционную смесь охлаждали и добавляли 20 мл EtOAc и 20 мл воды. Органическую фазу отделяли, высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении до желтого масла. Масло очищали хроматографией на колонках с силикагелем (гексан/EtOAc, 95:5), получая 1-(2-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-4-ил)циклобутанэтилкарбоксилат (0,182 г) в форме бесцветного масла.
Стадия 4
1-(2-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-4-ил)циклобутанкарбоновая кислота
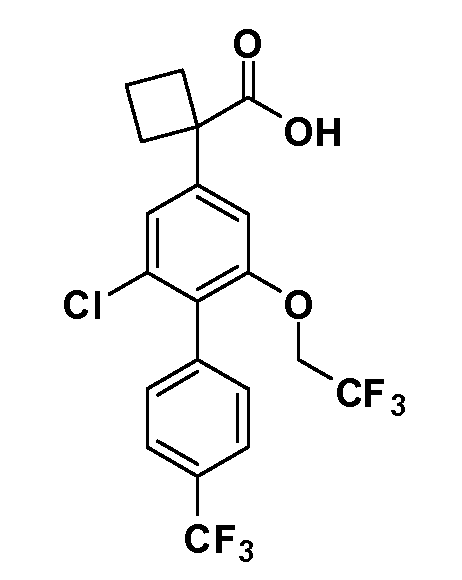
1-(2-Хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-4-ил)циклобутанэтилкарбоксилат (0,2 г, 0,41 ммоль) растворяли в 25 мл смеси MeOH/THF/H2O (10:10:5, об./об.), добавляли LiOH (0,10 г, 4,1 ммоль). Реакционную смесь перемешивали в течение 5 часов при температуре окружающей среды и концентрировали при пониженном давлении. Добавляли воду (10 мл), и реакционную смесь экстрагировали EtOAc (3×10 мл). Объединенные органические фазы высушивали надNa2SO4, фильтровали и упаривали при пониженном давлении. Очистка хроматографией на колонках с силикагелем (DCM/MeOH, 95:5) дала 1-(2-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-4-ил)циклобутанкарбоновую кислоту (0,06 г) в форме твердого вещества белого цвета.1H ЯМР (500 МГц,CDCl3/TMS): δ 7,72 (д, 2H), 7,41 (д, 2H), 7,19 (с, 1H), 6,79 (с, 1H), 4,23 (кв., 2H), 3,92 (м, 2H), 2,58 (м, 2H), 2,19 (м, 1H), 1,97 (м, 1H).
Пример 1837: 1-(2-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-4-ил)циклопентанэтилкарбоксилат
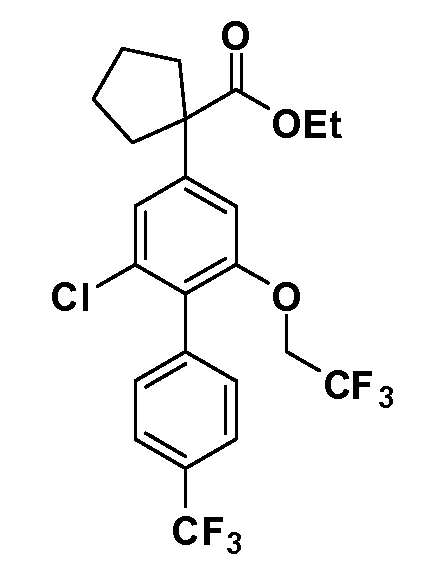
Стадия 1
1-(4-амино-3-хлор-5-(2,2,2-трифторэтокси)фенил)циклопентанэтилкарбоксилат
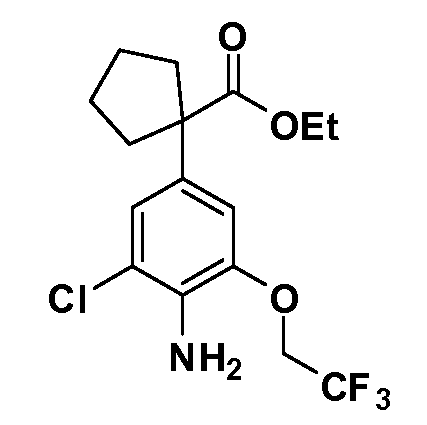
К перемешиваемому раствору 1-(4-амино-3-(2,2,2-трифторэтокси)фенил)циклопентанэтилкарбоксилата (1,2 г, 3,6 ммоль) в сухомCHCl3 (60 мл) при 0°C добавляли NCS (0,411 г, 3,08 ммоль). Реакционную смесь перемешивали в течение 3 ч при температуре окружающей среды, чтобы закончить реакцию. Реакционную смесь разбавляли водой, экстрагировали DCM (2×100 мл), объединенные органические растворители высушивали надNa2SO4, фильтровали и концентрировалив вакууме. Сырую реакционную смесь очищали флэш-хроматографией на колонке, получая 1-(4-амино-3-хлор-5-(2,2,2-трифторэтокси)фенил)циклопентанэтилкарбоксилат (0,860 г) в форме густого сиропа.
Стадия 2
1-(3-хлор-4-йод-5-(2,2,2-трифторэтокси)фенил)циклопентанэтилкарбоксилат
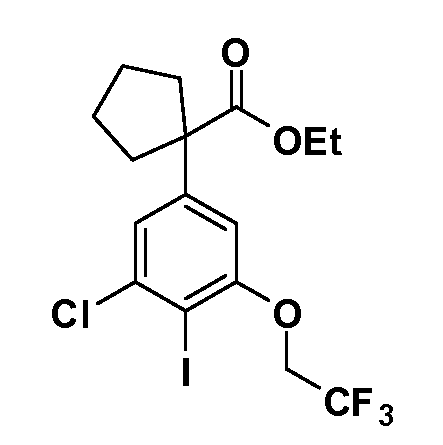
1-(4-амино-3-хлор-5-(2,2,2-трифторэтокси)фенил)циклопентанэтилкарбоксилат (0,86 г, 2,3 ммоль) растворяли в смеси AcCN/H2O/HCl (96%) 10 мл/8 мл/2,1 мл при 0°C. РастворNaNO2 (0,243 г, 3,5 ммоль) в воде (1 мл) добавляли по каплям при 0°C, и реакционную смесь перемешивали в течение 40 минут при той же самой температуре. Раствор KI (3,9 г, 23,5 ммоль) в воде (10 мл) добавляли по каплям при 0°C. Реакционную смесь нагревали до 80°C в течение 1 часа. Реакционную смесь экстрагировали EtOAc (3×50 мл), и объединенные органические слои промывали 10%-ным тиосульфатом натрия (2×50 мл), водой (100 мл), затем солевым раствором (100 мл). Раствор высушивали надNa2SO4, фильтровали и концентрировали, получая сырое черное масло, которое очищали хроматографией на колонках с силикагелем (гексан/EtOAc, 95:5), получая 1-(3-хлор-4-йод-5-(2,2,2-трифторэтокси)фенил)циклопентанэтилкарбоксилат (0,580 г) в форме светло-желтого масла.
Стадия 3
1-(2-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-4-ил)циклопентанэтилкарбоксилат
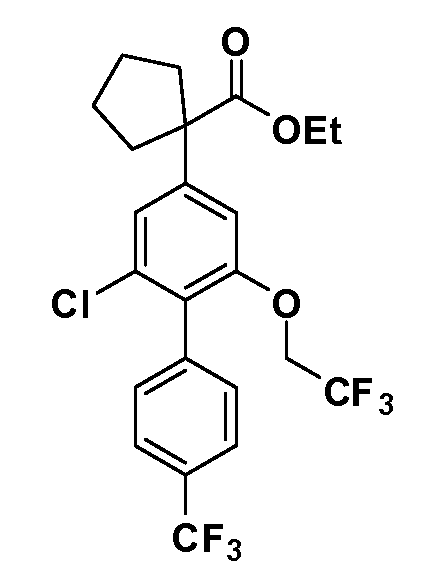
Смесь 1-(3-хлор-4-йод-5-(2,2,2-трифторэтокси)фенил)циклопентанэтилкарбоксилата (0,58, 1,2 ммоль), 4-трифторметилфенилбороновой кислоты (0,56 г, 2,4 ммоль), CsF (0,46 г, 3,0 ммоль) и Pd(PPh3)4 (0,14 г, 0,12 ммоль) в безводном 1,2-диметоксиэтане (20 мл) нагревали с обратным холодильником в течение 8 часов под аргоном. Реакционную смесь охлаждали и добавляли 25 мл EtOAc и 25 мл воды. Органическую фазу отделяли, высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении до желтого масла. Масло очищали хроматографией на колонках с силикагелем (гексан/EtOAc, 95:5), получая 1-(2-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-4-ил)циклопентанэтилкарбоксилат (0,480 г) в форме бесцветного масла.
Стадия 4
1-(2-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-4-ил)циклопентанкарбоновая кислота
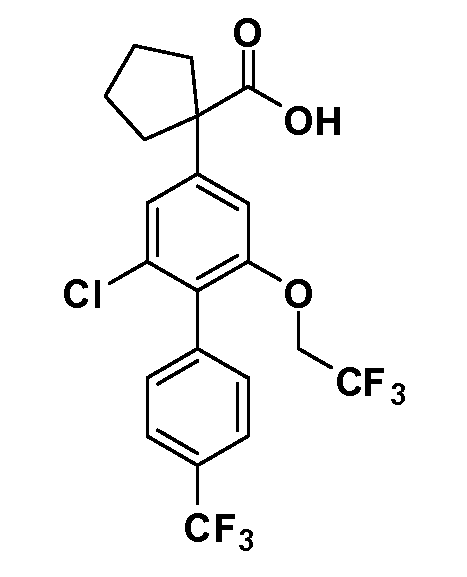
1-(2-Хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-4-ил)циклопентанэтилкарбоксилат (0,32 г, 0,64 ммоль) растворяли в 25 мл MeOH/THF/H2O (10:10:5, об./об.), добавляли LiOH (0,163 г, 3,88 ммоль). Реакционную смесь перемешивали в течение 5 часов при температуре окружающей среды и концентрировали при пониженном давлении. Добавляли воду (10 мл), и реакционную смесь экстрагировали EtOAc (3×10 мл). Объединенные органические фазы высушивали надNa2SO4, фильтровали и упаривали при пониженном давлении. Очистка хроматографией на колонках с силикагелем (DCM/MeOH, 95:5) дала 1-(2-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-4-ил)циклопентанкарбоновую кислоту (0,220 г, 73%) в форме твердого вещества белого цвета.1H ЯМР (500 МГц, CDCl3): δ 7,69 (д, 2H), 7,41 (д, 2H), 7,26 (с, 1H), 6,92 (с, 1H), 4,22 (кв., 2H), 3,71 (м, 2H), 1,98 (м, 2H), 1,81 (м, 4H).
Пример 1832: 2-(2-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-4-ил)-4-метилпентановая кислота
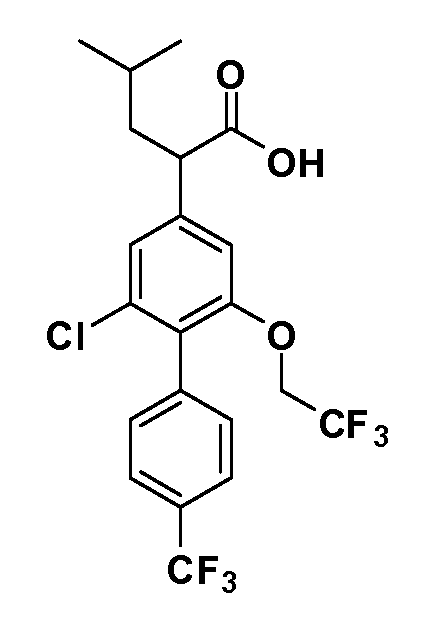
Стадия 1
2-(4-амино-3-хлор-5-(2,2,2-трифторэтокси)фенил)-4-метилэтилпентаноат
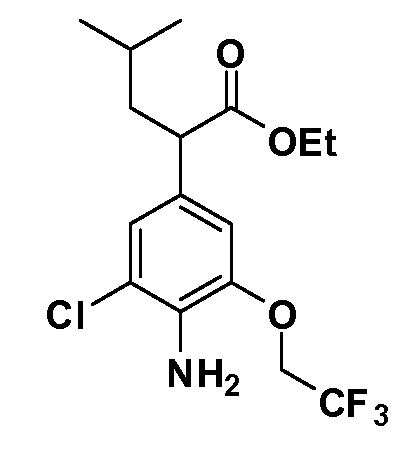
К перемешиваемому раствору 2-(4-амино-3-(2,2,2-трифторэтокси)фенил)-4-метилэтилпентаноата (0,25 г, 0,75 ммоль) в сухомCHCl3 (20 мл) при 0°C добавляли NCS (0,08 г, 0,6 ммоль). Реакционную смесь перемешивали в течение 3 часов при температуре окружающей среды, чтобы закончить реакцию. Реакционную смесь разбавляли водой, экстрагировали DCM (2×100 мл), объединенные органические растворители высушивали надNa2SO4, фильтровали и концентрировалив вакууме. Сырую реакционную смесь очищали флэш-хроматографией на колонке, получая 2-(4-амино-3-хлор-5-(2,2,2-трифторэтокси)фенил)-4-метилэтилпентаноат (0,15 г) в форме густого сиропа.
Стадия 2
2-(3-хлор-4-йод-5-(2,2,2-трифторэтокси)фенил)-4-метилэтилпентаноат
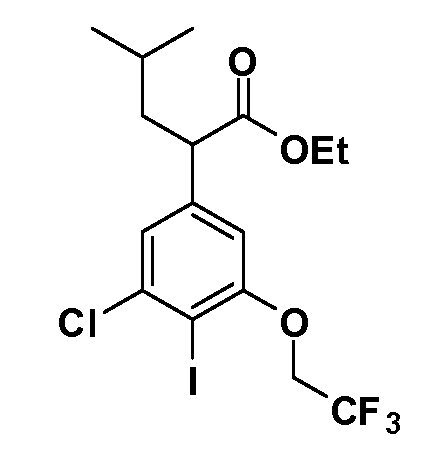
2-(4-амино-3-хлор-5-(2,2,2-трифторэтокси)фенил)-4-метилэтилпентаноат (0,7 г, 1,9 ммоль) растворяли в смеси AcCN/H2O/HCl (96%) 20 мл/20 мл/1,3 мл при 0°C. РастворNaNO2 (0,197 г, 2,8 ммоль) в воде (2 мл) добавляли по каплям при 0°C, и реакционную смесь перемешивали в течение 40 минут при той же самой температуре. Раствор KI (3,16 г, 19,0 ммоль) в воде (10 мл) добавляли по каплям при 0°C. Реакционную смесь нагревали до 80°C в течение 1 часа. Реакционную смесь экстрагировали EtOAc (3×100 мл), и объединенные органические слои промывали 10%-ным тиосульфатом натрия (2×50 мл), водой (100 мл), затем солевым раствором (100 мл). Раствор высушивали надNa2SO4, фильтровали и концентрировали, получая сырое черное масло, которое очищали хроматографией на колонках с силикагелем (гексан/EtOAc, 95:5), получая 2-(3-хлор-4-йод-5-(2,2,2-трифторэтокси)фенил)-4-метилэтилпентаноат (0,35 г) в форме светло-желтого масла.
Стадия 3
2-(2-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-4-ил)-4-метилэтилпентаноат
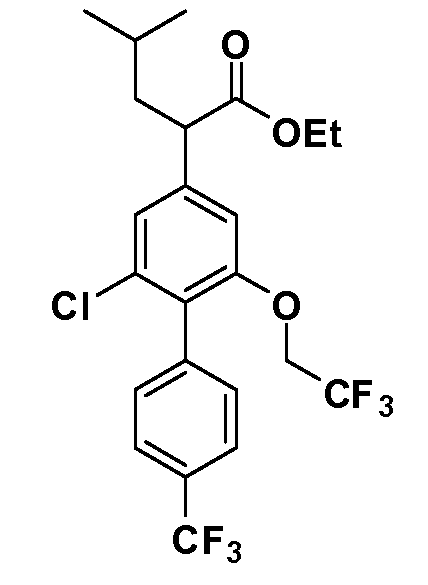
Смесь 2-(3-хлор-4-йод-5-(2,2,2-трифторэтокси)фенил)-4-метилэтилпентаноата (0,5, 1,04 ммоль), 4-трифторметилфенилбороновой кислоты (0,96 г, 2,09 ммоль), CsF (0,395 г, 2,6 ммоль) и Pd(PPh3)4 (0,121 г, 0,104 ммоль) в безводном 1,2-диметоксиэтане (50 мл) нагревали с обратным холодильником в течение 8 часов под аргоном. Реакционную смесь охлаждали и добавляли 25 мл EtOAc и 25 мл воды. Органическую фазу отделяли, высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении до желтого масла. Масло очищали хроматографией на колонках с силикагелем (гексан/EtOAc, 95:5), получая 2-(2-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-4-ил)-4-метилэтилпентаноат (0,265 г,) в форме бесцветного масла.
Стадия 4
2-(2-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-4-ил)-4-метилпентановая кислота
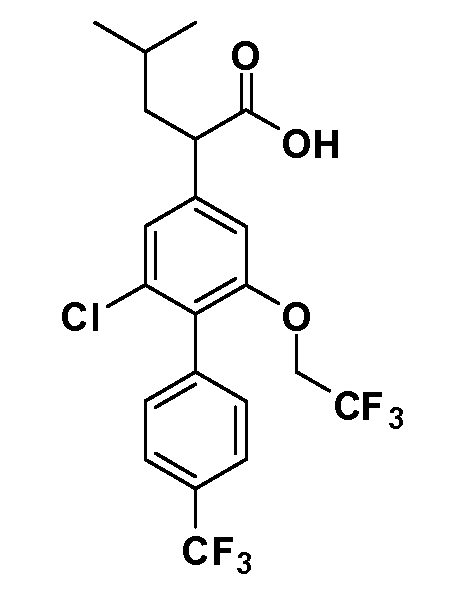
2-(2-Хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-4-ил)-4-метилэтилпентаноат (0,35 г, 0,733 ммоль) растворяли в 25 мл MeOH/THF/H2O (10:10:5, об./об.), добавляли LiOH (0,176 г, 7,33 ммоль). Реакционную смесь перемешивали в течение 5 часов при температуре окружающей среды и концентрировали при пониженном давлении. Добавляли воду (10 мл), и реакционную смесь экстрагировали EtOAc (3×10 мл). Объединенные органические фазы высушивали надNa2SO4, фильтровали и упаривали при пониженном давлении. Очистка хроматографией на колонках с силикагелем (DCM/MeOH, 95:5) дала 2-(2-хлор-6-(2,2,2-трифторэтокси)-4'-(трифторметил)бифенил-4-ил)-4-метилпентановую кислоту (0,085 г) в форме твердого вещества белого цвета.1H ЯМР (500 МГц, CDCl3): δ 7,69 (д, 2H), 7,41 (д, 2H), 7,20 (с, 1H), 6,86 (с, 1H), 4,23 (кв., 2H), 3,71 (т, 1H), 2,01 (м, 1H), 1,73 (м, 1H), 1,58 (м, 1H), 0,98 (д, 6H).
Пример 1908: 1-(2-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-4-ил)циклобутанкарбоновая кислота
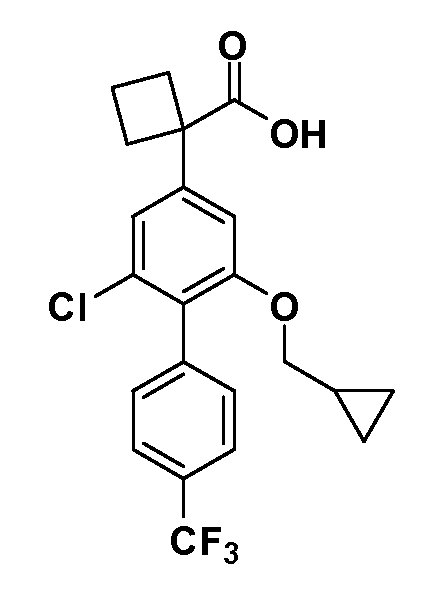
Стадия 1
2-(циклопропилметокси)-4-фтор-1-нитробензол
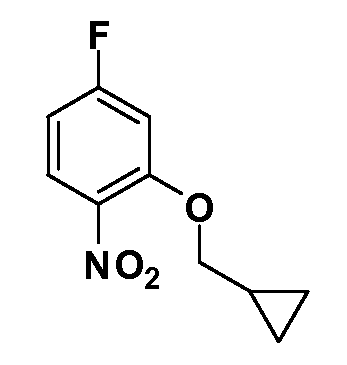
К перемешиваемой суспензии NaH (60% в минеральном масле, 8,37 г) в 200 мл THF за 15 минут при 0°C под азотом добавляли циклопропилметанол (15 г, 207 ммоль). Реакционной смеси давали нагреться до температуры окружающей среды и перемешивали в течение 1 ч. Раствор 2,4-дифтор-1-нитробензол (30 г, 187 ммоль) в 200 мл THF добавляли по каплям при 0°C. Реакционную смесь перемешивали при 0°C в течение 2 ч и затем вливали в воду со льдом. Реакционную смесь экстрагировали этилацетатом (3×100 мл). Объединенные органические слои высушивали надMgSO4 и концентрировали при пониженном давлении, получая 22,0 г продукта в форме оранжевого масла (86%).
Стадия 2
2-(3-(циклопропилметокси)-4-нитрофенил)диэтилмалонат
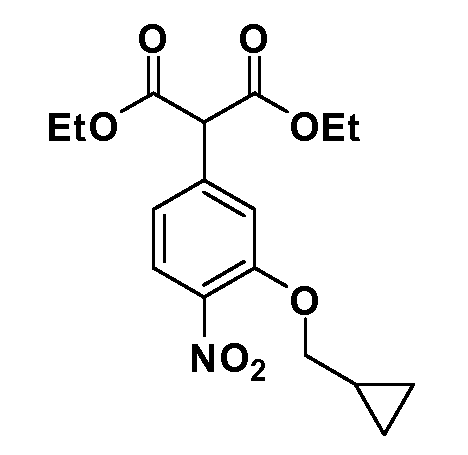
Диэтилмалонат (9,8 г, 1,1 экв.) добавляли за 15 минут при 0°C под азотом к перемешиваемой суспензии гидрида натрия (60% в минеральном масле, 2,09 г) в DMF (88 мл). Реакционной смеси давали нагреться до температуры окружающей среды и перемешивали в течение 1 ч. Раствор 2-циклопропилметокси-4-фтор-1-нитробензол (10 г, 1 экв.) в DMF (88 мл) добавляли по каплям при 0°C, и реакционную смесь нагревали до 100°C в течение 3 часов. Реакционной смеси давали охладиться до температуры окружающей среды, вливали в воду со льдом и экстрагировали EtOAc (3×100 мл). Объединенные органические фазы промывали водой (3×100 мл), солевым раствором (100 мл) и высушивали (MgSO4). Выпаривание растворителя при пониженном давлении дало 10,0 г сырого продукта, который очищали хроматографией на силикагеле (гексан/EtOAc), дало 7,0 г желаемого продукта (42%)
1H-ЯМР (CDCl3, 200 МГц): 0,4 (м, 2H), 0,71 (м, 2H), 1,3 (м, 1H), 1,3 (т, 6H), 3,96 (д, 2H), 4,25 (кв., 4H), 4,5 (с, 1H), 7,02 (д, 1H), 7,18 (с, 1H), 7,81 (д, 2H).
Стадия 3
2-(3-(циклопропилметокси)-4-нитрофенил)этилацетат
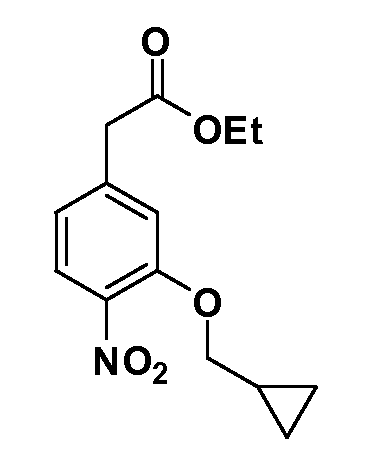
i) 2-(3-(Циклопропилметокси)-4-нитрофенил)диэтилмалонат (10 г) растворяли в 100 мл этанола и охлаждали до 0°C, к реакционной смеси приблизительно за 15 минут медленно добавляли раствор (4 экв.) NaOH. Реакционную смесь мягко нагревали до 60°C в течение 5 часов. Развитие реакции проверяли анализом TLC. После полного преобразования исходного материала растворитель выпаривали при пониженном давлении, остаток, растворенный вH2O, подкисляли с использованием 6н. HCl до рН 2. Твердый материал собирали фильтрацией, промывали водой, высушивали при пониженном давлении, получая 6,5 г (90%) 2-(3-(циклопропилметокси)-4-нитрофенил)уксусной кислоты в форме твердого вещества желтого цвета.
1H-ЯМР (CDCl3, 200 МГц): 0,36 (м, 2H), 0,58 (м, 2H), 1,28 (м, 1H), 3,71 (с, 2H), 4,01 (д, 2H), 7,02 (д, 1H), 7,23 (с, 1H), 7,81 (д, 1H).
ii) 2-(3-(Циклопропилметокси)-4-нитрофенил)уксусную кислоту (6,5 г) забирали в этанольный раствор HCl (50 мл, 25%) и нагревали с обратным холодильником в течение 4 часов, и проверяли TLC. Реакционную смесь концентрировалив вакууме досуха и растворяли в этилацетате. Смесь промывали растворомNaHCO3, высушивали надNaSO4 и концентрировалив вакууме, получая сырое твердое вещество желтого цвета, которое очищали перекристаллизацией, получая желаемый продукт (4,2 г).
1H-ЯМР (CDCl3, 200 МГц): 0,36 (м, 2H), 0,58 (м, 2H), 1,12 (т, 3H), 1,28 (м, 1H), 3,71 (с, 2H), 4,01 (д, 2H), 4,21 (кв., 2H), 7,02 (д, 1H), 7,23 (с, 1H), 7,81 (д, 1H).
Стадия 4
2-(4-амино-3-(циклопропилметокси)фенил)этилацетат
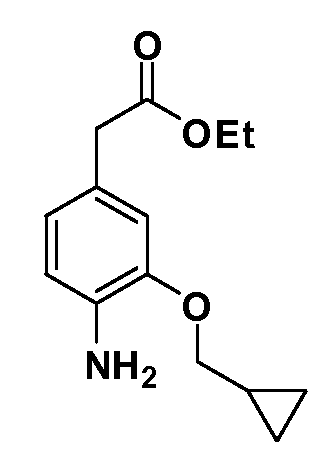
К перемешиваемому раствору 2-(3-(циклопропилметокси)-4-нитрофенил)этилацетата (10 г) в сухом MeOH (100 мл) добавляли Pd(ОН)2 (2 г). Смесь гидрировали в атмосфереH2 в течение 6 часов при температуре окружающей среды. Реакционную смесь фильтровали через слой Целита™, промывая MeOH. Объединенные фильтраты концентрировали при пониженном давлении, получая 7,5 г желаемого продукта в форме масла.
1H-ЯМР (CDCl3, 200 МГц): 0,38 (м, 2H), 0,61 (м, 2H), 1,23 (м, 1H), 1,23 (т, 3H), 3,51 (с, 2H), 3,80 (д, 2H), 4,16 (кв., 2H), 6,72 (м, 3H).
Стадия 5
2-(4-амино-3-хлор-5-(циклопропилметокси)фенил)этилацетат
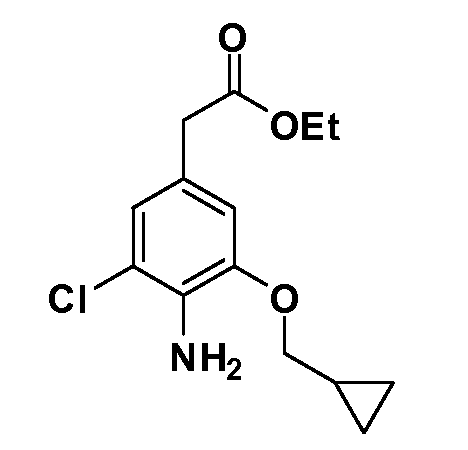
К перемешиваемому раствору 2-(4-амино-3-(циклопропилметокси)фенил)этилацетата (1,2 г, 4,0 ммоль) в сухомCCl4 (60 мл) при 0°C добавляли NCS (0,427 г, 3,2 ммоль). Реакционную смесь перемешивали в течение 3 часов при температуре окружающей среды, чтобы закончить реакцию. Реакционную смесь разбавляли водой, экстрагировали DCM (2×50 мл), объединенные органические растворители высушивали надNa2SO4, фильтровали и концентрировалив вакууме. Сырую реакционную смесь очищали хроматографией на колонках, получая 2-(4-амино-3-хлор-5-(циклопропилметокси)фенил)этилацетат (920 мг) в форме твердого вещества желтого цвета.
Стадия 6
2-(3-хлор-5-(циклопропилметокси)-4-йодфенил)этилацетат
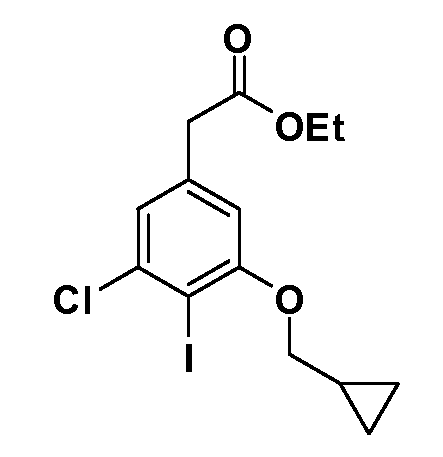
2-(4-Амино-3-хлор-5-(циклопропилметокси)фенил)этилацетат (2,5 г, 10,0 ммоль) растворяли в смеси AcCN/H2O/HCl (96%) 50 мл/50 мл/25 мл при 0°C. РастворNaNO2 (3,2 г, 1,16 экв.) в воде (40 мл) добавляли по каплям при 0°C, и реакционную смесь перемешивали в течение 40 минут при той же самой температуре. Раствор KI (30 г, 30,1 ммоль) в воде (80 мл) добавляли по каплям при 0°C. Реакционную смесь нагревали до 50°C в течение 2,5 часов, и растворитель выпаривали. Реакционную смесь экстрагировали EtOAc (3×50 мл), и объединенные органические слои промывали 10%-ным тиосульфатом натрия (2×50 мл), водой (300 мл), затем солевым раствором (300 мл). Раствор высушивали надNa2SO4, фильтровали и концентрировалив вакууме, получая сырое черное масло, которое очищали хроматографией на силикагеле (гексан/EtOAc), получая 2-(3-хлор-5-(циклопропилметокси)-4-йодфенил)этилацетат (1,2 г).
Стадия 7
2-(2-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-4-ил)этилацетат
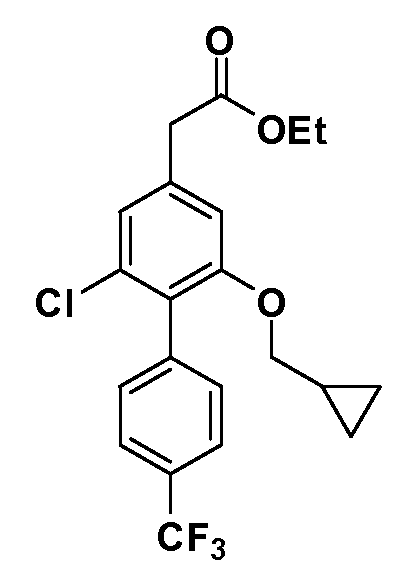
Смесь 2-(3-хлор-5-(циклопропилметокси)-4-йодфенил)этилацетата (5,1 г, 12,9 ммоль), 4-трифторметилфенилбороновой кислоты (3,66 г, 19 ммоль), CsF (3,9 г, 25,8 ммоль) и Pd(PPh3)4 (1,5 г, 1,3 ммоль) в безводном 1,2-диметоксиэтане (100 мл) нагревали с обратным холодильником в течение 8 часов под аргоном. Реакционную смесь охлаждали и добавляли 75 мл EtOAc и 75 мл воды. Органическую фазу отделяли, высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении до желтого масла. Масло очищали хроматографией на колонках с силикагелем (гексан/EtOAc), получая 2-(2-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-4-ил)этилацетат (3,2 г) в форме желтого масла.
Стадия 8
1-(2-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-4-ил)циклобутанкарбоновая кислота
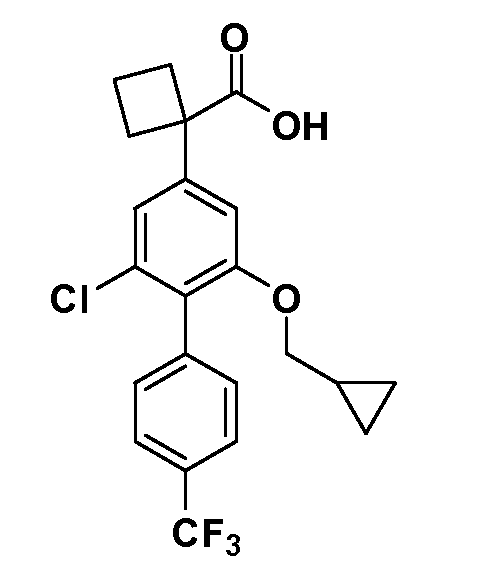
2-(2-Хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-4-ил)этилацетат (0,5 г, 1,2 ммоль) растворяли в 10 мл безводного DMF, при 0°C добавляли NaH (60 вес.% в масле, 0,058 г, 2,4 ммоль). Реакционную смесь перемешивали в течение 0,5 ч при 25°C, и 1,3-дибромпропан (1,5 мл) добавляли по каплям при 0°C. Реакционную смесь перемешивали при 0°C в течение 1 ч и добавляли насыщенный раствор (10 мл)NH4Cl. Реакционную смесь экстрагировали EtOAc (3×20 мл), и объединенные органические фазы промывали водой (3×20 мл) и солевым раствором (20 мл) и высушивали надMgSO4, фильтровали и концентрировали при пониженном давлении, получая (320 мг) бесцветного масла. Масло растворяли в 10 мл смеси EtOH/H2O (9:1, об./об.) и добавляли 0,163 г LiOH. Реакционную смесь нагревали с обратным холодильником в течение 5 часов и концентрировали при пониженном давлении. Добавляли воду (10 мл), и реакционную смесь экстрагировали EtOAc (3×10 мл). Объединенные органические фазы высушивали надMgSO4, фильтровали и концентрировали при пониженном давлении. Очистка хроматографией на колонках с силикагелем (гексан/EtOAc 9:1) дала 1-(2-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-4-ил)циклобутанкарбоновую кислоту (0,210 г) в форме твердого вещества белого цвета.1H ЯМР (300 МГц,CDCl3): δ 7,68 (д, 2H), 7,41 (д, 2H), 7,06 (с, 1H), 6,78 (с, 1H), 3,78 (д, 2H), 2,86 (м, 2H), 2,58 (м, 2H), 2,16 (м, 1H), 1,95 (м, 1H), 1,03 (м, 1H), 0,46 (м, 2H), 0,18 (м, 2H).
Пример 1909: 1-(2-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-4-ил)циклопентанкарбоновая кислота
1-(2-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-4-ил)циклопентанкарбоновая кислота
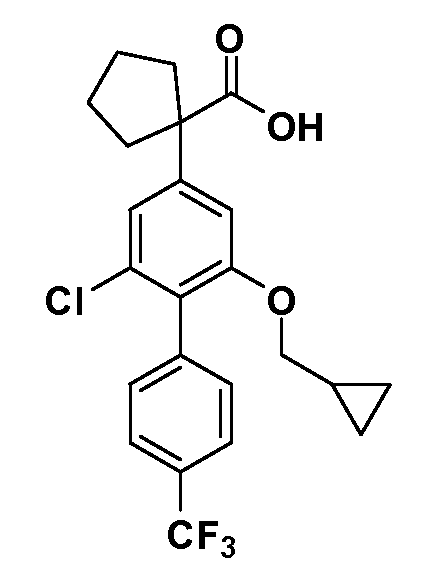
2-(2-Хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-4-ил)этилацетат (0,5 г,) растворяли в 10 мл безводного DMF и при 0°C добавляли NaH (60 вес.% в масле, 0,058 г, 2,4 ммоль). Реакционную смесь перемешивали в течение 0,5 ч при 25°C, и 1,4-дибромбутан (0,24 г) добавляли по каплям при 0°C. Реакционную смесь перемешивали при 0°C в течение 1 ч и добавляли насыщенный раствор (10 мл)NH4Cl. Реакционную смесь экстрагировали EtOAc (3×20 мл), и объединенные органические фазы промывали водой (3×20 мл) и солевым раствором (20 мл) и высушивали надMgSO4, фильтровали и концентрировали при пониженном давлении, получая (320 мг, 0,64 ммоль) бесцветного масла. Масло растворяли в 10 мл EtOH/H2O (9:1, об./об.) и добавляли LiOH (0,163 г, 3,88 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 5 часов и концентрировали при пониженном давлении. Добавляли воду (10 мл), и реакционную смесь экстрагировали EtOAc (3×10 мл). Объединенные органические фазы высушивали надMgSO4, фильтровали и концентрировали при пониженном давлении. Очисткой хроматографией на колонках с силикагелем (гексан/EtOAc 9:1) получали 1-(2-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-4-ил)циклопентанкарбоновую кислоту (220 мг) в форме твердого вещества белого цвета.1H ЯМР (500 МГц,CDCl3): δ 7,68 (д, 2H), 7,41 (д, 2H), 7,16 (с, 1H), 6,91 (с, 1H), 3,78 (д, 2H), 2,66 (м, 2H), 1,97 (м, 2H), 1,79 (м, 4H), 1,03 (м, 1H), 0,46 (д, 2H), 0,18 (д, 2H).
Пример 2418: 2-(6-хлор-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4-метилпентановая кислота
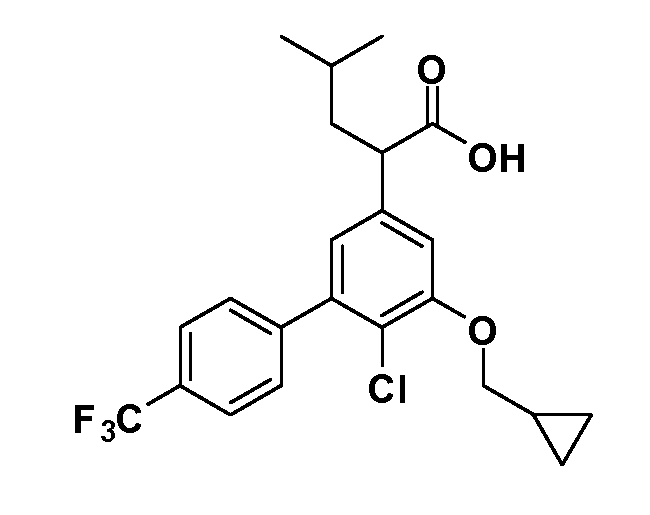
Стадия 1
2-(3-(циклопропилметокси)-4-нитрофенил)-4-метилэтилпентаноат
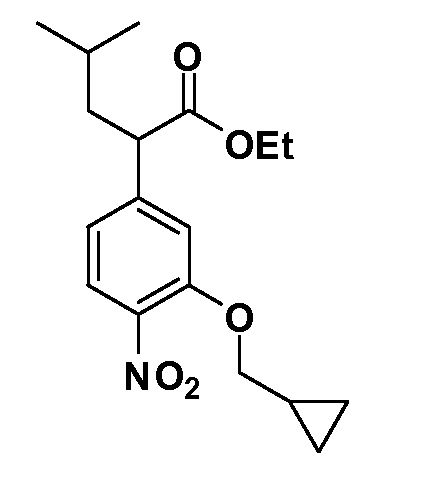
2-(3-(Циклопропилметокси)-4-нитрофенил)этилацетат (2,2 г, 7,8 ммоль) растворяли в 20 мл безводного DMF и добавляли при 0°C NaH (60 вес.% в масле, 0,189 г, 7,8 ммоль). Реакционную смесь перемешивали в течение 0,5 ч при 25°C, и изобутил бромид (1,08 г, 7,8 ммоль) добавляли по каплям при 0°C. Реакционную смесь перемешивали при 0°C в течение 1 ч и добавляли насыщенный раствор (10 мл)NH4Cl. Реакционную смесь экстрагировали EtOAc (3×20 мл), и объединенные органические фазы промывали водой (3×20 мл) и солевым раствором (20 мл) и высушивали надMgSO4, фильтровали и концентрировали при пониженном давлении, получая 2-(3-(циклопропилметокси)-4-нитрофенил)-4-метилэтилпентаноат (2,06 г) в форме бесцветного масла.
Стадия 2
2-(4-амино-3-(циклопропилметокси)фенил)-4-метилэтилпентаноат
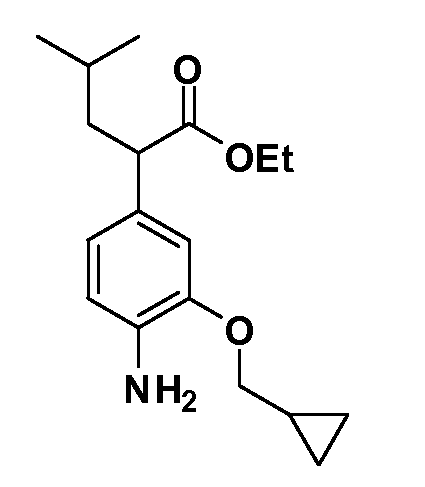
К перемешиваемому раствору 2-(3-(циклопропилметокси)-4-нитрофенил)-4-метилэтилпентаноата (2,0 г, 5,9 ммоль) в сухом MeOH (50 мл) добавляли Pd(ОН)2 (1,1 г). Смесь восстанавливали в атмосфереH2 в течение 6 часов при температуре окружающей среды. Реакционную смесь фильтровали через слой Целита™, промывая MeOH. Объединенные фильтраты концентрировали при пониженном давлении, получая 2-(4-амино-3-(циклопропилметокси)фенил)-4-метилэтилпентаноат (1,69 г) в форме вязкой жидкости.
Стадия 3
2-(4-амино-3-бром-5-(циклопропилметокси)фенил)-4-метилэтилпентаноат
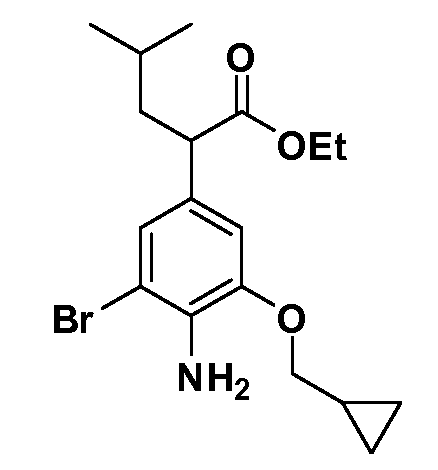
К перемешиваемому раствору 2-(4-амино-3-(циклопропилметокси)фенил)-4-метилэтилпентаноата (1,65 г, 5,4 ммоль) в сухомCCl4 (60 мл) при 0°C добавляли NBS (0,96 г, 5,4 ммоль). Реакционную смесь перемешивали в течение 3 ч при температуре окружающей среды, чтобы закончить реакцию. Реакционную смесь разбавляли водой, экстрагировали DCM (2×50 мл), объединенные органические растворители высушивали надNa2SO4, фильтровали и концентрировалив вакууме. Сырую реакционную смесь очищали хроматографией на колонках, получая 2-(4-амино-3-бром-5-(циклопропилметокси)фенил)-4-метилэтилпентаноат (1,5 г) в форме твердого вещества желтого цвета.
Стадия 4
2-(6-амино-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноат
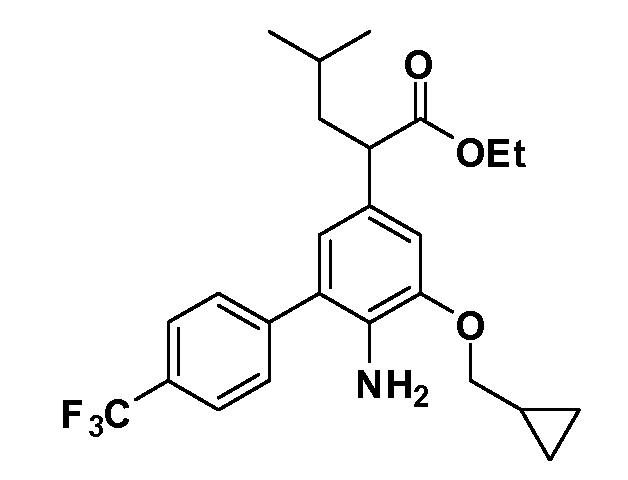
Смесь 2-(4-амино-3-бром-5-(циклопропилметокси)фенил)-4-метилэтилпентаноата (1,5 г, 3,9 ммоль), 4-трифторметилфенилбороновой кислоты (1,1 г, 5,8 ммоль), CsF (1,47 г, 7,8 ммоль) и Pd(PPh3)4 (0,45 г, 0,39 ммоль) в безводном 1,2-диметоксиэтане (75 мл) нагревали с обратным холодильником в течение 8 часов под аргоном. Реакционную смесь охлаждали и добавляли 75 мл EtOAc и 75 мл воды. Органическую фазу отделяли, высушивали надNa2SO4, фильтровали и концентрировали при пониженном давлении до желтого масла. Масло очищали хроматографией на силикагеле (гексан/EtOAc), получая 2-(6-амино-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноат (1,2 г) в форме желтого масла.
Стадия 5
2-(6-хлор-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноат
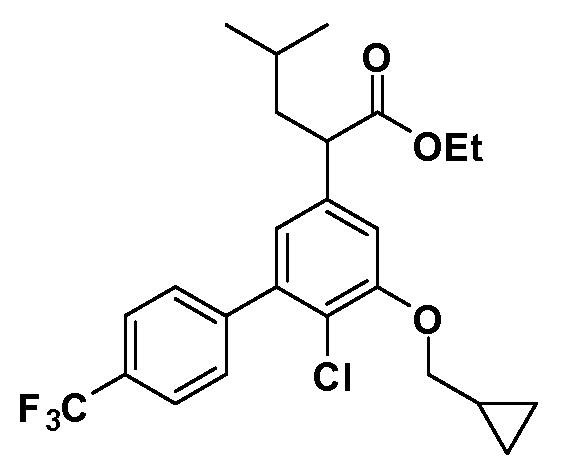
2-(6-Амино-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноат (0,2 г, 0,44 ммоль) растворяли в смеси AcCN/H2O/HCl 10 мл/10 мл/1 мл при 0°C. РастворNaNO2 (0,039 г, 0,53 ммоль) в воде (1 мл) добавляли по каплям при 0°C, и реакционную смесь перемешивали в течение 40 минут при той же самой температуре. Раствор CuCl (0,22 г, 2,2 ммоль) в воде (5 мл) добавляли по каплям при 0°C. Реакционную смесь нагревали до 40°C в течение 2,0 часов, и растворитель выпаривали. Реакционную смесь экстрагировали EtOAc (3×50 мл), и объединенные органические слои промывали водой (30 мл), затем солевым раствором (20 мл). Раствор высушивали надNa2SO4, фильтровали и концентрировалив вакууме, получая сырое черное масло, которое очищали хроматографией на силикагеле (гексан/EtOAc), получая 2-(6-хлор-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноат (0,12 г) в форме густого масла.
Стадия 6
2-(6-хлор-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4-метилпентановая кислота
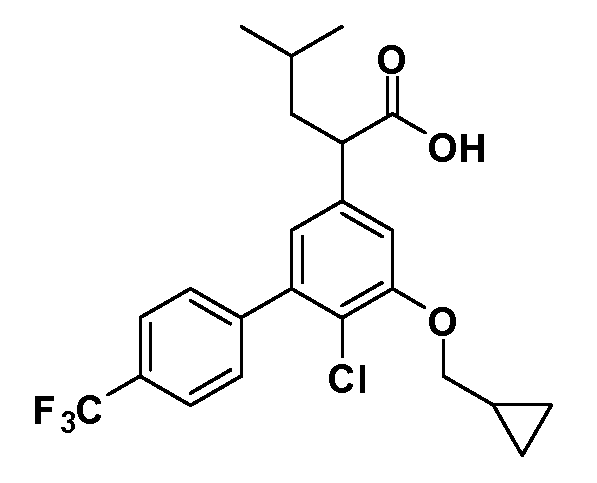
2-(6-Хлор-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноат (120 мг, 0,255 ммоль) растворяли в 10 мл смеси MeOH/THF/H2O (10 мл/10 мл/5 мл) и добавляли LiOH (30 мг, 1,2 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 5 часов и концентрировали при пониженном давлении. Добавляли воду (10 мл), и реакционную смесь экстрагировали EtOAc (3×10 мл). Объединенные органические фазы высушивали надMgSO4, фильтровали и упаривали при пониженном давлении. Очистка хроматографией на колонках с силикагелем (DCM:MeOH 9:1) дала 2-(6-хлор-5-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4-метилпентановую кислоту (89 мг) в форме твердого вещества белого цвета.1H-ЯМР (500 МГц,CDCl3): 7,68 (д, 2H), 7,55 (д, 2H), 6,92 (с, 1H), 6,85 (с, 1H), 3,96 (д, 2H), 3,64 (т, 1H), 1,98 (м, 1H), 1,68 (м, 1H), 1,55 (м, 1H), 1,32 (м, 1H), 0,91 (д, 6H), 0,64 (м, 2H), 0,42 (м, 2H).
Пример 3205: 2-(5-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4-метоксибутановая кислота
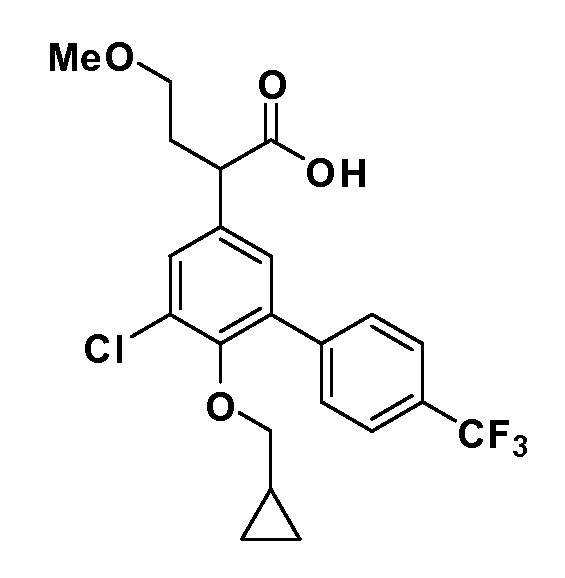
Стадия 1
2-(3-бром-5-хлор-4-(циклопропилметокси)фенил)этилацетат
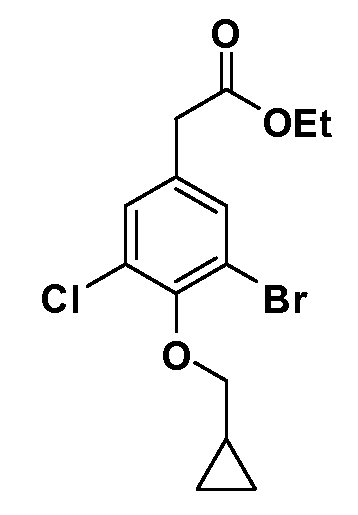
К перемешиваемому раствору 2-(3-бром-5-хлор-4-гидроксифенил)этилацетата (12 г, 40,816 ммоль) в ДМСО (80 мл) при температуре окружающей среды под инертной атмосферой добавляли K2CO3 (14,08 г, 102,020 ммоль) и циклопропилметилбромид (5 мл, 4,880 ммоль). Реакционную смесь перемешивали при температуре 80°C в течение 14 часов. После исчерпания исходного материала (по результатам TLC) реакционную смесь охлаждали до температуры окружающей среды и гасили водой, и экстрагировали EtOAc (3×100 мл). Объединенные органические слои промывали водой (3×75 мл), солевым раствором и высушивали надNa2SO4. После фильтрации и концентрации при пониженном давлении сырой материал очищали хроматографией на колонках, получая 2-(3-бром-5-хлор-4-(циклопропилметокси)фенил)этилацетат (10 г) в форме твердого вещества желтого цвета.
Стадия 2
2-(3-бром-5-хлор-4-(циклопропилметокси)фенил)-4-метоксиэтилбутаноат
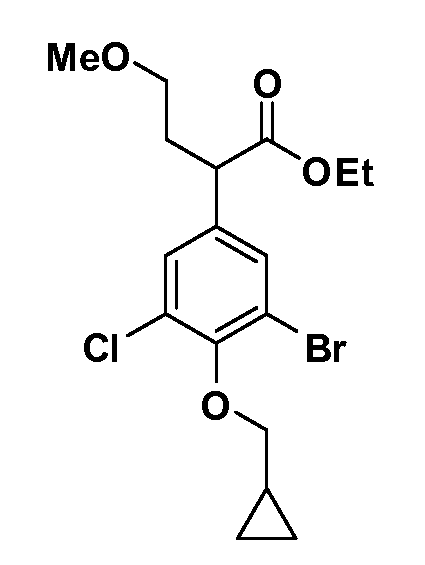
К перемешиваемому раствору NaH (0,3 г, 12,5 ммоль) в DMF (10 мл) при 0°C добавляли 2-(3-бром-5-хлор-4-(циклопропилметокси)фенил)этилацетат (2,0 г, 5,70 ммоль). Реакционную смесь перемешивали при 0°C в течение 30 мин. К реакционной смеси добавляли 2-бромэтилметиловый эфир (0,87 г, 6,25 ммоль) и перемешивали при 0°C в течение 30 мин. После исчерпания исходного материала (по результатам TLC) реакционную смесь разбавляли водой (20 мл), подкисляли с помощью 1 н. HCl (pH=5) и экстрагировали EtOAc (3×50 мл). Объединенные органические слои промывали водой (3×25 мл), солевым раствором и высушивали над безводнымNa2SO4. После фильтрации и концентрации при пониженном давлении сырой материал очищали хроматографией на колонках, получая 2-(3-бром-5-хлор-4-(циклопропилметокси)фенил)-4-метоксиэтилбутаноат (560 мг) в форме твердого вещества грязно-белого цвета.
Стадия 3
2-(5-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4-метоксиэтилбутаноат
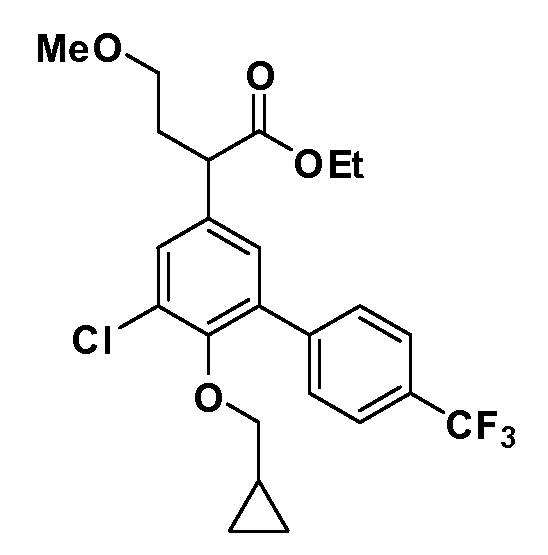
К перемешиваемому раствору 2-(3-бром-5-хлор-4-(циклопропилметокси)фенил)-4-метоксиэтилбутаноата (2,3 г, 5,660 ммоль) в смеси DMF (50 мл) и воды (5 мл) при температуре окружающей среды в атмосфереN2 добавляли Cs2CO3 (6,4 г, 19,815 ммоль), Pd(TPP)4 (1,3 г, 1,120 ммоль) и 4-(трифторметил)фенилбороновую кислоту (1,29 г, 6,780 ммоль), и полученную смесь перемешивали при 80°C в течение 14 часов. После исчерпания исходного материала (по результатам TLC) отфильтровывали катализатор, и слой целита промывали EtOAc и экстрагировали EtOAc (3×100 мл). Объединенные органические слои промывали водой (3×50 мл), солевым раствором и высушивали над безводнымNa2SO4. После фильтрации и концентрации при пониженном давлении сырой материал очищали хроматографией на колонках, получая 2-(5-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4-метоксиэтилбутаноат (1,2 г) в форме твердого вещества грязно-белого цвета.
Стадия 4
2-(5-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4-метоксибутановая кислота
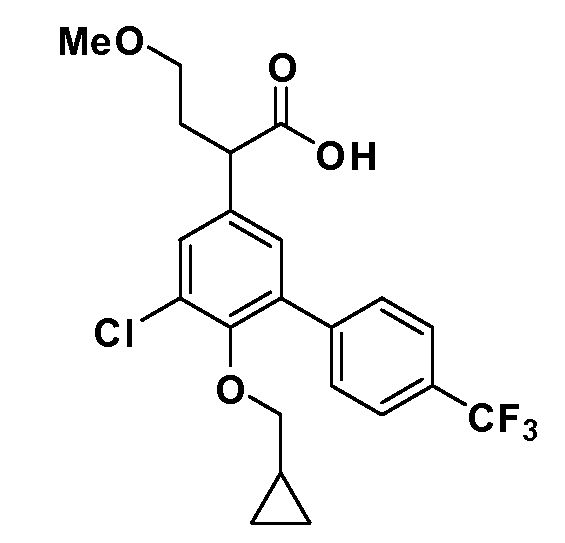
К перемешиваемому раствору 2-(5-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4-метоксиэтилбутаноата (0,3 г, 0,638 ммоль) в смеси THF (10 мл), метанола (10 мл) и воды (5 мл) при температуре окружающей среды добавляли LiOH(H2O (53 мг, 12,030 ммоль), и смесь перемешивали при температуре окружающей среды в течение 2 часов. После полного расхода исходного материала, по результатам TLC, реакционную смесь разбавляли водой (10 мл) и подкисляли с использованием 1 н. HCl при 0°C. Водный слой экстрагировали EtOAc (2×20 мл); объединенные органические экстракты промывали водой (20 мл), солевым раствором (30 мл), высушивали над безводным Na2SO4 и концентрировали в вакууме. Сырой материал очищали хроматографией на колонках, получая 2-(5-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4-метоксибутановую кислоту (100 мг) в форме твердого вещества грязно-белого цвета.1H ЯМР (500 МГц)(CDCl3): δ м.д. 7,68 (м, 4H), 7,40 (с, 1H), 7,20 (с, 1H), 3,80 (т, 1H), 3,41 (д, 2H), 3,25 (м, 5H), 2,39 (м, 1H), 1,99 (м, 1H), 0,95 (м, 1H), 0,4 (д, 2H), 0,0 (м, 2H).
Пример 3206: 2-(3-(бензо[d]тиазол-6-ил)-5-хлор-4-(циклопропилметокси)фенил)-4-метилпентановая кислота
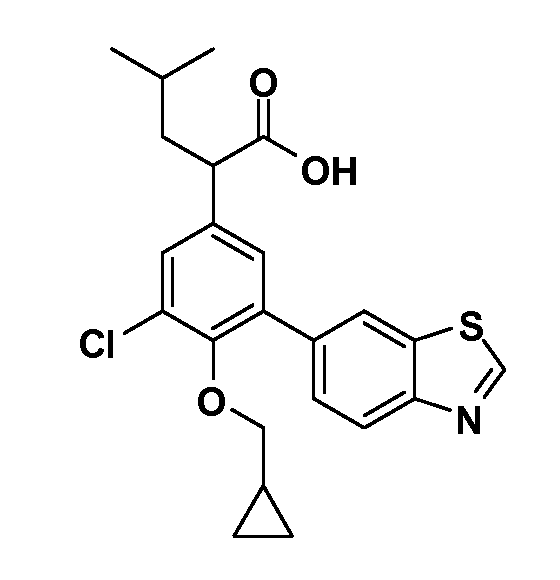
Стадия 1
2-(3-бром-5-хлор-4-(циклопропилметокси)фенил)-4-метилэтилпентаноат
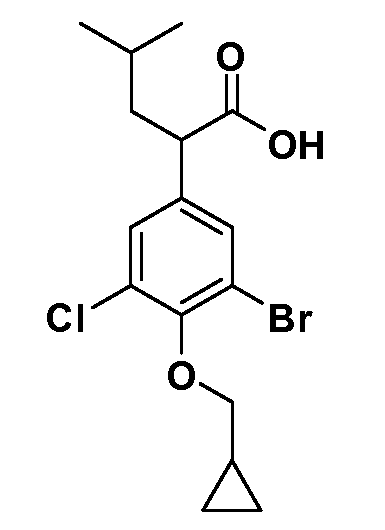
К перемешиваемому раствору NaH (0,76 г, 15,82 ммоль) в DMF (50 мл) при 0°C добавляли 2-(3-бром-5-хлор-4-гидроксифенил)-4-метилпентановую кислоту (5,0 г, 14,4 ммоль). Реакционную смесь перемешивали при 0°C в течение 30 мин. К реакционной смеси добавляли изобутилбромид (2,93 г, 21,57 ммоль) и перемешивали при 0°C в течение 1 ч. После исчерпания исходного материала (по результатам TLC) разбавляли водой (40 мл), подкисляли с использованием 1 н. HCl (pH=5) и экстрагировали EtOAc (3×100 мл). Объединенные органические слои промывали водой (3×50 мл), солевым раствором и высушивали над безводнымNa2SO4. После фильтрации и концентрации при пониженном давлении сырой материал очищали хроматографией на колонках, получая 2-(3-бром-5-хлор-4-(циклопропилметокси)фенил)-4-метилэтилпентаноат (5,0 г) в форме жидкости.
Стадия 2
2-(3-(бензо[d]тиазол-6-ил)-5-хлор-4-(циклопропилметокси)фенил)-4-метилэтилпентаноат
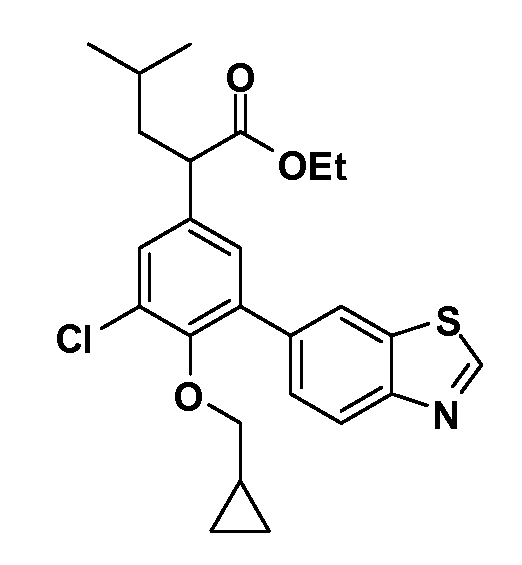
К перемешиваемому раствору 2-(3-бром-5-хлор-4-(циклопропилметокси)фенил)-4-метилэтилпентаноата (0,5 г, 1,239 ммоль) в смеси DMF (10 мл) и воды (5 мл) при температуре окружающей среды в атмосфереN2 добавляли Cs2CO3 (1,4 г, 4,325 ммоль), Pd(TPP)4 (286 мг, 2,475 ммоль) и 6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]тиазол (355 мг, 1,363 ммоль), и полученную смесь перемешивали при 80°C в течение 14 часов. После исчерпания исходного материала (по результатам TLC) твердые частицы удалялифильтрацией через слой Целита™, промывая EtOAc (3×100 мл). Объединенные органические слои промывали водой (3×50 мл), солевым раствором и высушивали над безводнымNa2SO4, фильтровали и концентрировали при пониженном давлении. Сырой материал очищали хроматографией на колонках, получая 2-(3-(бензо[d]тиазол-6-ил)-5-хлор-4-(циклопропилметокси)фенил)-4-метилэтилпентаноат (100 мг) в форме твердого вещества грязно-белого цвета.
Стадия 3
2-(3-(бензо[d]тиазол-6-ил)-5-хлор-4-(циклопропилметокси)фенил)-4-метилпентановая кислота
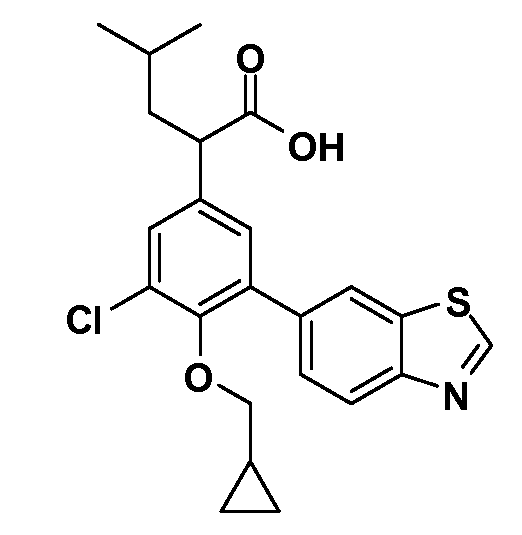
К перемешиваемому раствору 2-(3-(бензо[d]тиазол-6-ил)-5-хлор-4-(циклопропилметокси)фенил)-4-метилэтилпентаноата (0,1 г, 0,218 ммоль) в смеси THF (10 мл), метанола (10 мл) и воды (5 мл) при температуре окружающей среды добавляли LiOH·H2O (45 мг, 1,090 ммоль), и смесь перемешивали при температуре окружающей среды в течение 2 часов. После полного расхода исходного материала по результатам проверки TLC реакционную смесь разбавляли водой (10 мл) и подкисляли с использованием 1 н. HCl при 0°C. Водный слой экстрагировали EtOAc (2×20 мл); объединенные органические экстракты промывали водой (10 мл), солевым раствором (20 мл), высушивали над безводнымNa2SO4, фильтровали и концентрировалив вакууме. Сырой материал очищали хроматографией на колонках, получая 2-(3-(бензо[d]тиазол-6-ил)-5-хлор-4-(циклопропилметокси)фенил)-4-метилпентановую кислоту (39 мг) в форме твердого вещества грязно-белого цвета.1H ЯМР (500 МГц)(CDCl3): δ (м.д.) 9,05 (с, 1H), 8,2 (м, 2H), 7,73 (м, 1H), 7,40 (с, 1H), 7,30 (с, 1H), 3,63 (т, 1H), 3,40 (д, 2H), 1,99 (м, 1H), 1,65 (м, 1H), 1,55 (м, 1H), 0,93 (м, 7H), 0,38 (д, 2H), -0,5 (д, 2H).
Пример 514: 2-(3-(бензо[c][1,2,5]оксадиазол-5-ил)-5-хлор-4-(циклопропилметокси)фенил)-4-метилпентановая кислота
Стадия 1
2-(3-(бензо[c][1,2,5]оксадиазол-5-ил)-5-хлор-4-(циклопропилметокси)фенил)-4-метилэтилпентаноат
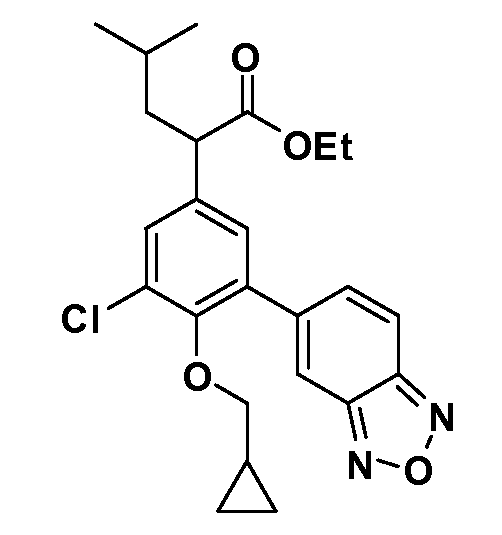
К перемешиваемому раствору 2-(3-бром-5-хлор-4-(циклопропилметокси)фенил)-4-метилэтилпентаноата (0,5 г, 1,240 ммоль) в смеси DMF (20 мл) и воды (5 мл) при температуре окружающей среды в атмосфереN2 добавляли Cs2CO3 (1,4 г, 4,342 ммоль), Pd(TPP)4 (286 мг, 2,480 ммоль) и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[c][1,2,5]оксадиазол (355 мг, 1,364 ммоль), и полученную смесь перемешивали при 80°C в течение 14 часов. После исчерпания исходного материала (по результатам TLC) твердые частицы удалялифильтрацией через слой Целита™, промывая EtOAc (3×100 мл). Объединенные органические слои промывали водой (3×50 мл), солевым раствором и высушивали над безводнымNa2SO4, фильтровали и концентрировали при пониженном давлении. Сырой материал очищали хроматографией на колонках, получая 2-(3-(бензо[c][1,2,5]оксадиазол-5-ил)-5-хлор-4-(циклопропилметокси)фенил)-4-метилэтилпентаноат (250 мг) в форме твердого вещества грязно-белого цвета.
2-(3-(бензо[c][1,2,5]оксадиазол-5-ил)-5-хлор-4-(циклопропилметокси)фенил)-4-метилпентановая кислота
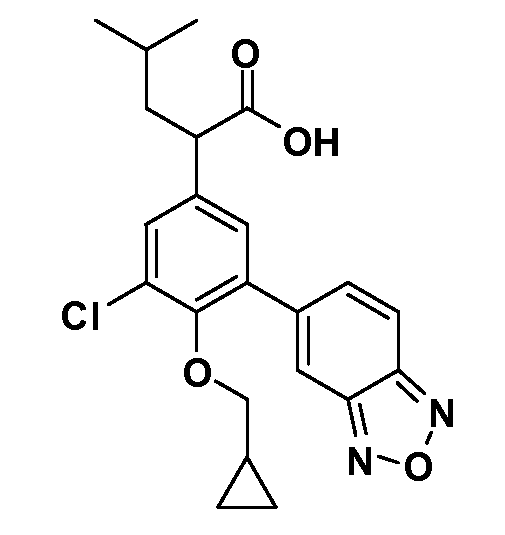
К перемешиваемому раствору 2-(3-(бензо[c][1,2,5]оксадиазол-5-ил)-5-хлор-4-(циклопропилметокси)фенил)-4-метилэтилпентаноата (0,25 г, 0,565 ммоль) в смеси THF (10 мл), метанола (10 мл) и воды (5 мл) при температуре окружающей среды добавляли LiOH·H2O (118,7 мг, 2,828 ммоль), и смесь перемешивали при температуре окружающей среды в течение 2 часов. После полного расхода исходного материала по результатам проверки TLC реакционную смесь разбавляли водой (10 мл) и подкисляли с использованием 1 н. HCl при 0°C. Водный слой экстрагировали EtOAc (2×20 мл); объединенные органические экстракты промывали водой (10 мл), солевым раствором (20 мл), высушивали над безводнымNa2SO4, фильтровали и концентрировалив вакууме. Сырой материал очищали хроматографией на колонках, получая 2-(3-(бензо[c][1,2,5]оксадиазол-5-ил)-5-хлор-4-(циклопропилметокси)фенил)-4-метилпентановую кислоту (152 мг) в форме твердого вещества грязно-белого цвета.1H ЯМР (500 МГц)(CDCl3): δ (м.д.) 7,92 (с, 1H), 7,85 (м, 1H), 7,72 (м, 1H), 7,46 (с, 1H), 7,25 (с, 1H), 3,65 (т, 1H), 3,48 (д, 2H), 1,95 (м, 1H), 1,65 (м, 1H), 1,55 (м, 1H), 1,22 (м, 1H), 0,93 (д, 6H), 0,39 (д, 2H), 0,0 (м, 2H).
Пример 524: 2-(3-(бензо[c][1,2,5]тиадиазол-5-ил)-5-хлор-4-(циклопропилметокси)фенил)-4-метилпентановая кислота
Стадия 1
2-(3-(бензо[c][1,2,5]тиадиазол-5-ил)-5-хлор-4-(циклопропилметокси)фенил)-4-метилэтилпентаноат
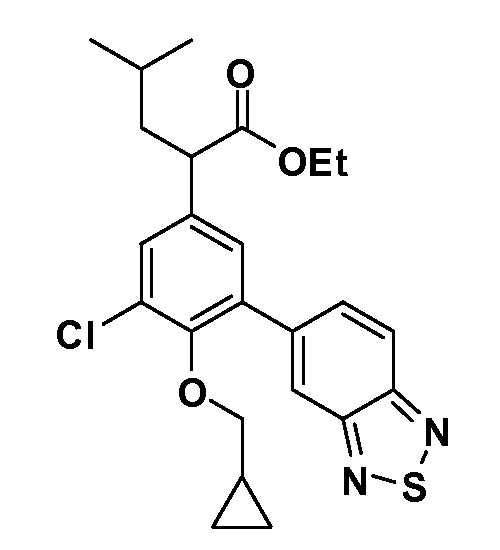
К перемешиваемому раствору 2-(3-бром-5-хлор-4-(циклопропилметокси)фенил)-4-метилэтилпентаноата (0,5 г, 1,239 ммоль) в смеси DMF (10 мл) и воды (5 мл) при температуре окружающей среды в атмосфереN2 добавляли Cs2CO3 (1,4 г, 4,325 ммоль), Pd(TPP)4 (286 мг, 2,475 ммоль) и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[c][1,2,5]тиадиазол (355 мг, 1,363 ммоль), и полученную смесь перемешивали при 80°C в течение 14 часов. После исчерпания исходного материала (по результатам TLC), твердые частицы удалялифильтрацией через слой Целита™, промывая EtOAc (3×100 мл). Объединенные органические слои промывали водой (3×50 мл), солевым раствором и высушивали над безводнымNa2SO4, фильтровали и концентрировали при пониженном давлении. Сырой материал очищали хроматографией на колонках, получая 2-(3-(бензо[c][1,2,5]тиадиазол-5-ил)-5-хлор-4-(циклопропилметокси)фенил)-4-метилэтилпентаноат (222 мг) в форме твердого вещества грязно-белого цвета.
Стадия 2
2-(3-(бензо[c][1,2,5]тиадиазол-5-ил)-5-хлор-4-(циклопропилметокси)фенил)-4-метилпентановая кислота
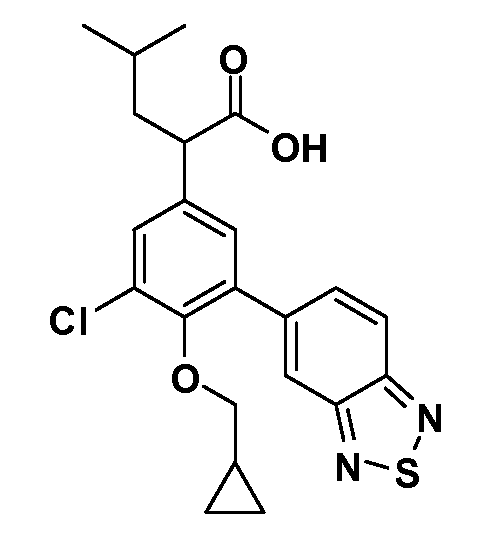
К перемешиваемому раствору 2-(3-(бензо[c][1,2,5]тиадиазол-5-ил)-5-хлор-4-(циклопропилметокси)фенил)-4-метилэтилпентаноата (0,22 г, 0,479 ммоль) в смеси THF (5 мл), метанола (5 мл) и воды (2 мл) при температуре окружающей среды добавляли LiOH·H2O (60,3 мг, 1,438 ммоль), и смесь перемешивали при температуре окружающей среды в течение 2 часов. После полного расхода исходного материала по результатам проверки TLC, реакционную смесь разбавляли водой (10 мл) и подкисляли с использованием 1 н. HCl при 0°C. Водный слой экстрагировали EtOAc (2×20 мл); объединенные органические экстракты промывали водой (10 мл), солевым раствором (20 мл), высушивали над безводнымNa2SO4 и концентрировалив вакууме. Сырой материал очищали хроматографией на колонках, получая 2-(3-(бензо[c][1,2,5]тиадиазол-5-ил)-5-хлор-4-(циклопропилметокси)фенил)-4-метилпентановую кислоту (105 мг, 50,0%) в форме твердого вещества грязно-белого цвета.1H ЯМР (500 МГц)(CDCl3): δ (м.д.) 8,18 (с, 1H), 8,03 (д, 1H), 7,96 (д, 1H), 7,42 (с, 1H), 7,18 (с, 1H), 3,68 (т, 1H), 3,43 (д, 2H), 2,00 (м, 1H), 1,70 (м, 1H), 1,58 (м, 1H), 0,98 (д, 6H), 0,88 (м, 1H), 0,38 (д, 2H), 0,0 (м, 2H).
Пример 3207: 2-(6-(циклопропилметокси)-5-(N,N-диметилсульфамоил)-4'-(трифторметил)бифенил-3-ил)-4-метилпентановая кислота
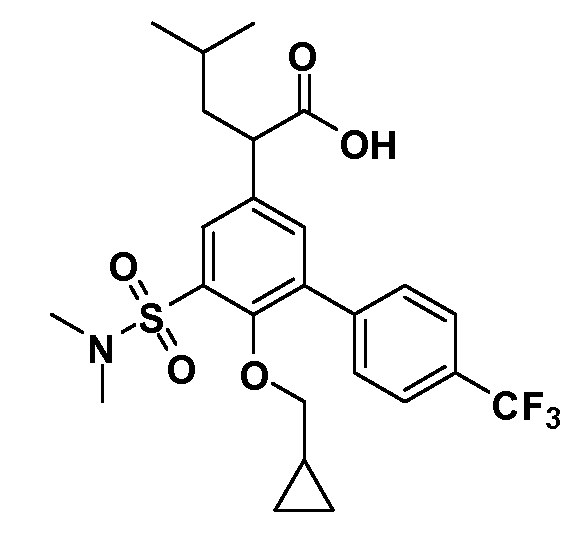
Стадия 1
2-(3-бром-5-(хлорсульфонил)-4-гидроксифенил)-4-метилэтилпентаноат
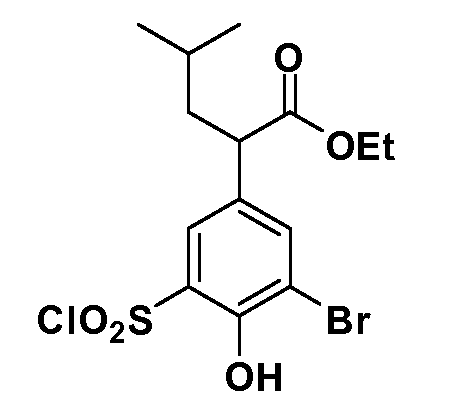
К перемешиваемому 2-(3-бром-4-гидроксифенил)-4-метилэтилпентаноату (1,0 г, 3,174 ммоль) в DCM (15 мл) добавляли хлорсульфоновую кислоту (2 мл, 28,571 ммоль). Реакционную смесь перемешивали в течение 14 часов при 80°C в атмосфереN2. После исчерпания исходного материала (по результатам TLC) реакционную смесь гасили растворомNaHCO3 и экстрагировали DCM (3×100 мл). Объединенные органические слои промывали водой (3×75 мл), солевым раствором и высушивали надNa2SO4, фильтровали и концентрировалив вакууме, получая 2-(3-бром-5-(хлорсульфонил)-4-гидроксифенил)-4-метилэтилпентаноат (0,5 г) в форме жидкости.
Стадия 2
2-(3-бром-5-(N,N-диметилсульфамоил)-4-гидроксифенил)-4-метилэтилпентаноат
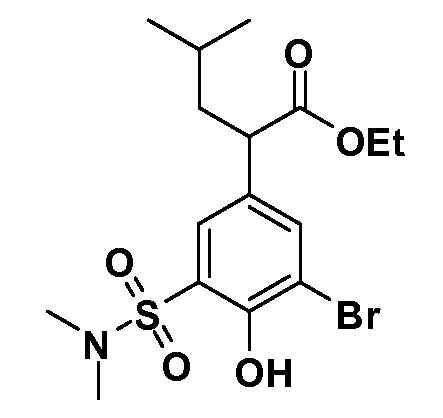
К перемешиваемому раствору 2-(3-бром-5-(хлорсульфонил)-4-гидроксифенил)-4-метилэтилпентаноата (0,73 г, 1,765 ммоль) в THF (20 мл) при температуре окружающей среды под инертной атмосферой добавляли раствор N,N-диметиламина (5,2 мл, 10,592 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 14 часов. После исчерпания исходного материала (по результатам TLC) реакционную смесь гасили водой и экстрагировали EtOAc (3×100 мл). Объединенные органические слои промывали водой (3×75 мл), солевым раствором и высушивали над Na2SO4. После фильтрации и концентрации при пониженном давлении сырой материал очищали хроматографией на колонках, получая 2-(3-бром-5-(N,N-диметилсульфамоил)-4-гидроксифенил)-4-метилэтилпентаноат (0,6 г) в форме светло-желтой жидкости.
Стадия 3
2-(3-бром-4-(циклопропилметокси)-5-(N,N-диметилсульфамоил)фенил)-4-метилэтилпентаноат
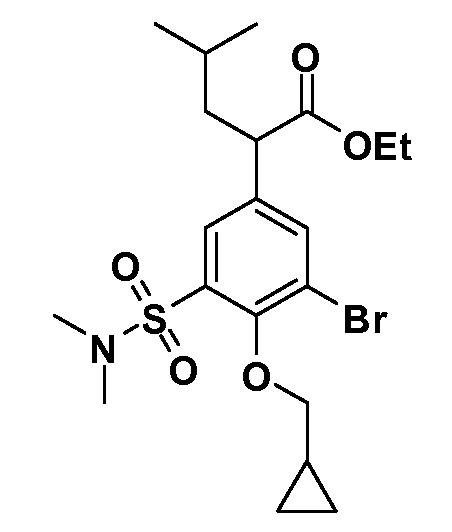
К перемешиваемому раствору 2-(3-бром-5-(N,N-диметилсульфамоил)-4-гидроксифенил)-4-метилэтилпентаноата (0,75 г, 1,77 ммоль) в ДМСО (25 мл) при температуре окружающей среды под инертной атмосферой добавляли K2CO3 (367 мг, 2,106 ммоль) и циклопропилметилбромид (0,2 мл, 2,13 ммоль). Реакционную смесь перемешивали при температуре 80°C в течение 14 часов. После исчерпания исходного материала (по результатам TLC) реакционную смесь охлаждали до температуры окружающей среды и гасили водой и экстрагировали EtOAc (3×100 мл). Объединенные органические слои промывали водой (3×75 мл), солевым раствором и высушивали надNa2SO4. После фильтрации и упаривания сырой материал очищали хроматографией на колонках, получая 2-(3-бром-4-(циклопропилметокси)-5-(N,N-диметилсульфамоил)фенил)-4-метилэтилпентаноат (350 мг) в форме жидкости.
Стадия 4
2-(6-(циклопропилметокси)-5-(N,N-диметилсульфамоил)-4'-(трифторметил)бифенил-3-ил)-4-метилпентановая кислота
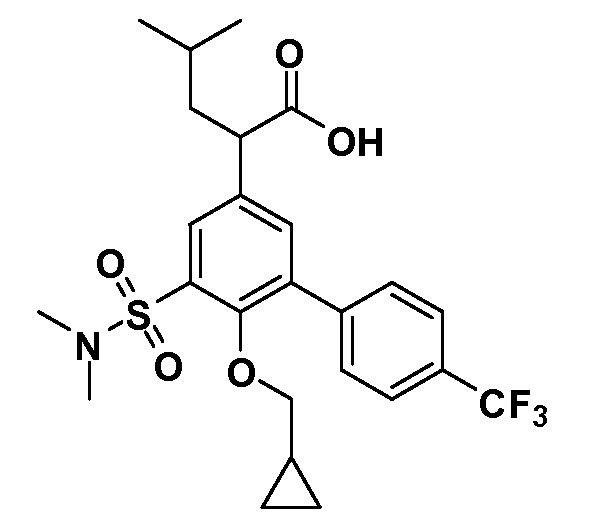
К перемешиваемому раствору 2-(3-бром-4-(циклопропилметокси)-5-(N,N-диметилсульфамоил)фенил)-4-метилпентаноата (0,5 г, 1,049 ммоль) в смеси DMF (10 мл) и воды (5 мл) при температуре окружающей среды в атмосфереN2 добавляли Cs2CO3 (1,19 г, 3,670 ммоль), Pd(TPP)4 (243 мг, 0,209 ммоль) и 4-(трифторметил)фенилборнат (220 мг, 1,150 ммоль), и полученную смесь перемешивали при 80°C в течение 14 часов. После исчерпания исходного материала (по результатам TLC) отфильтровывали катализатор, и слой целита промывали EtOAc и экстрагировали EtOAc (3×100 мл). Объединенные органические слои промывали водой (3×50 мл), солевым раствором и высушивали над безводнымNa2SO4. После фильтрации и концентрациив вакууме сырой материал очищали хроматографией на колонках, получая 2-(6-(циклопропилметокси)-5-(N,N-диметилсульфамоил)-4'-(трифторметил)бифенил-3-ил)-4-метилпентановую кислоту (100 мг) в форме твердого вещества грязно-белого цвета.1H ЯМР (500 МГц)(CDCl3): δ (м.д.) 7,83 (с, 1H), 7,72 (м, 4H), 7,51 (с, 1H), 3,73 (м, 1H), 3,38 (д, 2H), 2,95 (с, 3H), 2,87 (с, 3H), 2,01 (м, 1H), 1,65 (м, 1H), 1,51 (м, 1H), 0,91 (м, 7H), 0,40 (д, 2H), 0,00 (м, 2H).
Стадия 5
2-(6-(циклопропилметокси)-5-йод-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноат
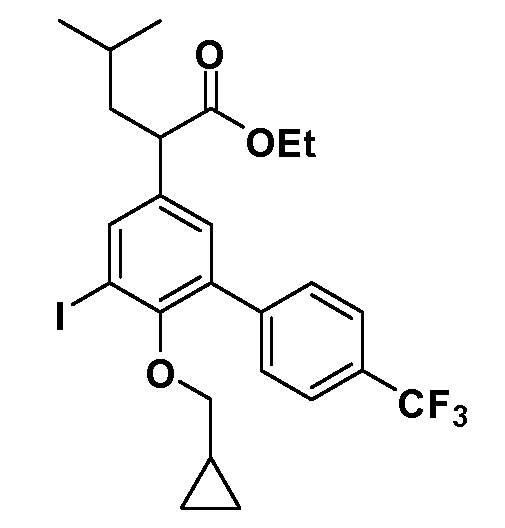
К перемешиваемому раствору 2-(5-амино-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноата (1,0 г, 2,227 ммоль) в смеси HCl:H2O (0,81 мл, 6,681 ммоль) добавлялиNaNO2 (0,180 г, 2,672 ммоль). После перемешивания в течение 1 часа при 0°C добавляли при 0°C под инертной атмосферой KI (3,69 г, 22,271 ммоль). Реакционную смесь перемешивали при температуре 100°C в течение 2 часов. После исчерпания исходного материала (по результатам TLC) реакционную смесь охлаждали до температуры окружающей среды и экстрагировали EtOAc (3×100 мл). Объединенные органические слои промывали водой (3×75 мл), солевым раствором и высушивали надNa2SO4. После фильтрации и концентрациив вакууме сырой материал очищали хроматографией на колонках, получая 2-(6-(циклопропилметокси)-5-йод-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноат (0,93 г) в форме твердого вещества.
Пример 3210: 2-(5-циано-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4-метилпентановая кислота
Стадия 1
2-(5-циано-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноат
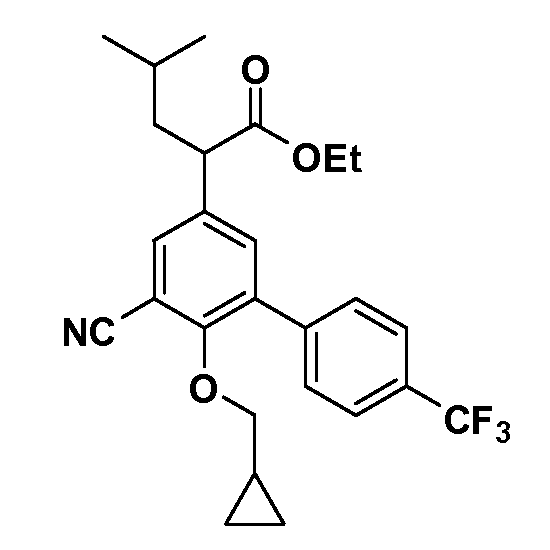
К перемешиваемому раствору 2-(6-(циклопропилметокси)-5-йод-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноата (0,25 г, 0,447 ммоль) в NMP (10 мл) при температуре окружающей среды под инертной атмосферой добавляли CuCN (50 мг, 0,536 ммоль). Реакционную смесь перемешивали при температуре 200°C в течение 2 часов. После исчерпания исходного материала (по результатам TLC) реакционную смесь охлаждали до температуры окружающей среды и экстрагировали EtOAc (3×20 мл). Объединенные органические слои промывали водой (3×15 мл), солевым раствором и высушивали надNa2SO4. После фильтрации и упаривания сырой материал очищали хроматографией на колонках, получая 2-(5-циано-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноат (0,125 г) в форме твердого вещества.
Стадия 2
2-(5-циано-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4-метилпентановая кислота
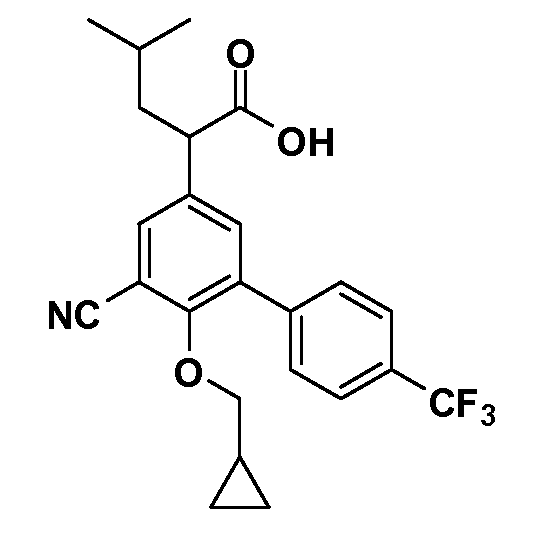
К перемешиваемому раствору 2-(5-циано-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноата (0,125 г, 0,272 ммоль) в смеси THF (5 мл), метанола (5 мл) и воды (2 мл) при температуре окружающей среды добавляли LiOH·H2O (34 мг, 0,816 ммоль), и смесь перемешивали при температуре окружающей среды в течение 2 часов. После полного расхода исходного материала по результатам проверки TLC, реакционную смесь разбавляли водой (10 мл) и подкисляли с использованием 1 н. HCl при 0°C. Водный слой экстрагировали EtOAc (2×20 мл); объединенные органические экстракты промывали водой (10 мл), солевым раствором (20 мл), высушивали над безводнымNa2SO4 и концентрировали при пониженном давлении. Сырой материал очищали хроматографией на колонках, получая 2-(5-циано-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4-метилпентановую кислоту (50 мг) в форме твердого вещества грязно-белого цвета.1H ЯМР (500 МГц)(CDCl3): δ (м.д.) 7,70 (м, 4H), 7,61 (с, 1H), 7,51 (с, 1H), 3,71 (т, 1H), 3,55 (м, 2H), 2,00 (м, 1H), 1,67 (м, 1H), 1,51 (м, 1H), 1,02 (м, 1H), 0,91 (д, 6H), 0,45 (м, 2H), 0,05 (м, 2H).
Пример 3208: 2-(6-(циклопропилметокси)-5-(метилтио)-4'-(трифторметил)бифенил-3-ил)-4-метилпентановая кислота
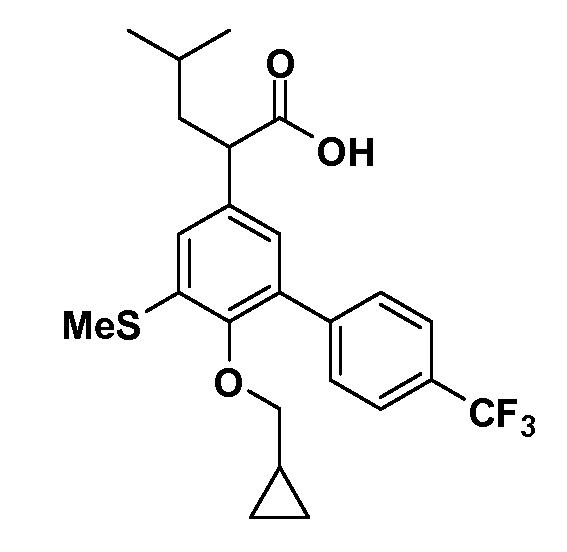
Стадия 1
2-(6-(циклопропилметокси)-5-(метилтио)-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноат
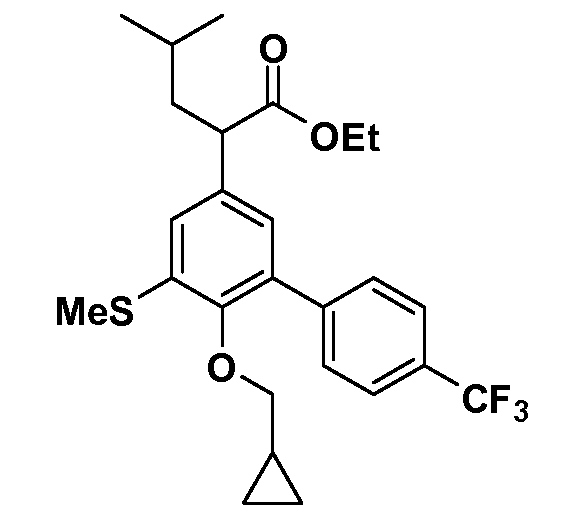
К перемешиваемому раствору 2-(5-амино-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноата (1,0 г, 2,604 ммоль) в смеси HCl:H2O (0,86 мл, 10,4 ммоль) и THF (10 мл) добавлялиNaNO2 (0,215 г, 3,92 ммоль). После перемешивания в течение 1 часа при 0°C добавляли NaSMe (368 мг, 0,260 ммоль) при 0°C под инертной атмосферой. Реакционную смесь перемешивали при температуре окружающей среды в течение 14 часов. После полного расхода исходного материала (TLC) реакционную смесь экстрагировали EtOAc (3×100 мл). Объединенные органические слои промывали водой (3×75 мл), солевым раствором и высушивали надNa2SO4. После фильтрации и концентрации в вакууме сырой материал очищали хроматографией на колонках, получая 2-(6-(циклопропилметокси)-5-(метилтио)-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноат (0,93 г) в форме твердого вещества.
Стадия 2
2-(6-(циклопропилметокси)-5-(метилтио)-4'-(трифторметил)бифенил-3-ил)-4-метилпентановая кислота
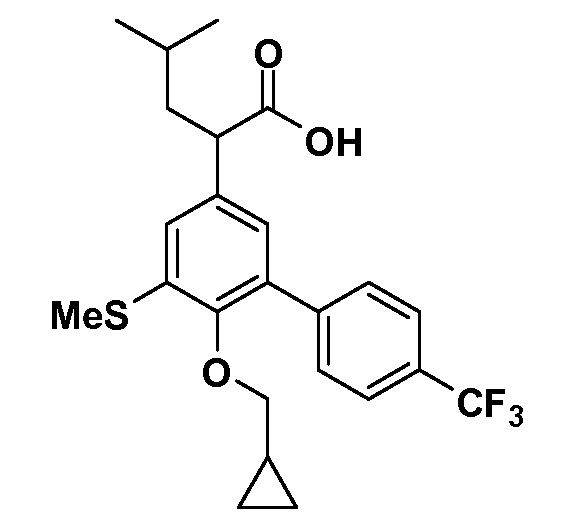
К перемешиваемому раствору 2-(6-(циклопропилметокси)-5-(метилтио)-4'-(трифторметил)бифенил-3-ил)-4-метилэтилпентаноата (80 мг, 0,166 ммоль) в смеси THF (10 мл), метанола (10 мл) и воды (5 мл) при температуре окружающей среды добавляли LiOH(H2O (20 мг, 0,832 ммоль), и смесь перемешивали при температуре окружающей среды в течение 2 часов. После полного расхода исходного материала по результатам проверки TLC, реакционную смесь разбавляли водой (10 мл) и подкисляли с использованием 1 н. HCl при 0°C. Водный слой экстрагировали EtOAc (2×20 мл); объединенные органические экстракты промывали водой (10 мл), солевым раствором (20 мл), высушивали над безводным Na2SO4, фильтровали и концентрировали в вакууме. Сырой материал очищали хроматографией на колонках, получая 2-(6-(циклопропилметокси)-5-(метилтио)-4'-(трифторметил)бифенил-3-ил)-4-метилпентановую кислоту (38 мг) в форме твердого вещества грязно-белого цвета.1H ЯМР (500 МГц)(CDCl3): δ (м.д.) 7,75 (д, 2H), 7,65 (д, 2H), 7,31 (с, 1H), 7,23 (с, 1H), 3,65 (т, 1H), 3,60 (д, 2H), 2,82 (с, 3H), 1,98 (м, 1H), 1,65 (м, 1H), 1,5 (м, 1H), 1,22 (м, 1H), 0,9 (д, 6H), 0,38 (д, 2H), 0,01 (д, 2H).
Пример 3209: 2-(5-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-3-метилбутановая кислота
Стадия 1
2-(3-бром-5-хлор-4-(циклопропилметокси)фенил)-3-метилэтилбутаноат
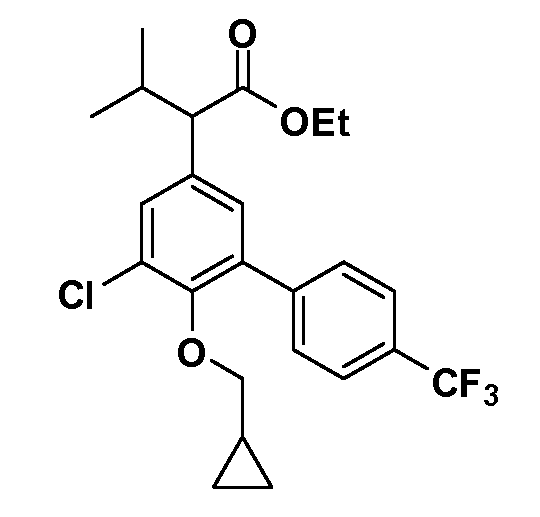
К перемешиваемому раствору NaH (40 мг, 0,830 ммоль) в DMF (5 мл) добавляли 2-(5-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)этилацетат (300 мг, 0,728 ммоль) и перемешивали при 0°C в течение 1 ч. К реакционной смеси при 0°C добавляли изопропилбромид (0,08 мл, 0,880 ммоль) и продолжали перемешивать при 0°C в течение 30 мин. После полного расхода исходного материала (TLC) реакционную смесь разбавляли водой (20 мл), подкисляли с помощью 1 н. HCl (pH=5) и экстрагировали EtOAc (3×30 мл). Объединенные органические слои промывали водой (3×15 мл), солевым раствором и высушивали над безводнымNa2SO4. После фильтрации и концентрации при пониженном давлении сырой материал очищали хроматографией на колонках, получая 2-(3-бром-5-хлор-4-(циклопропилметокси)фенил)-3-метилэтилбутаноат (120 мг) в форме жидкости.
Стадия 2
2-(5-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-3-метилбутановая кислота
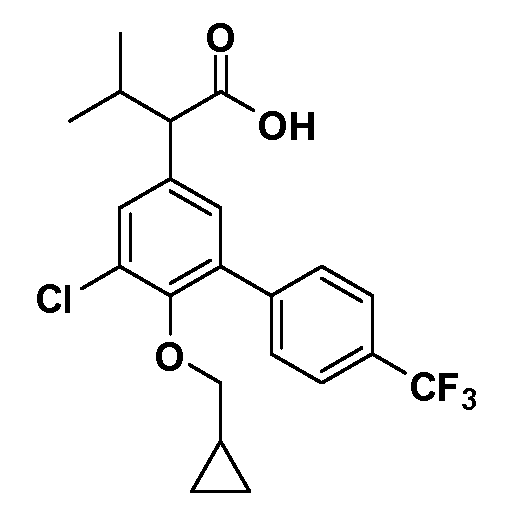
К перемешиваемому раствору 2-(3-бром-5-хлор-4-(циклопропилметокси)фенил)-3-метилэтилбутаноата (0,12 г, 0,260 ммоль) в смеси THF (5 мл), метанола (5 мл) и воды (2 мл) при температуре окружающей среды добавляли LiOH·H2O (75 мг, 1,320 ммоль), и смесь перемешивали при температуре окружающей среды в течение 2 часов. После полного расхода исходного материала, по результатам проверки TLC, реакционную смесь разбавляли водой (10 мл) и подкисляли с использованием 1 н. HCl при 0°C. Водный слой экстрагировали EtOAc (2×20 мл); объединенные органические экстракты промывали водой (10 мл), солевым раствором (20 мл), высушивали над безводным Na2SO4 и концентрировали в вакууме. Сырой материал очищали хроматографией на колонках, получая 2-(5-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-3-метилэтилбутаноат (100 мг) в форме твердого вещества грязно-белого цвета.1H ЯМР (500 МГц)(CDCl3): δ (м.д.) 7,66 (м, 4H), 7,41 (с, 1H), 7,20 (с, 1H), 3,41 (д, 2H), 3,15 (д, 1H), 2,3 (м, 1H), 1,12 (д, 3H), 0,97 (м, 1H), 0,72 (д, 3H), 0,40 (д, 2H), 0,00 (д, 2H).
Пример 482: 2-(5-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4,4,4-трифторбутановая кислота
Стадия 1
2-(5-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4,4,4-трифторэтилбутаноат
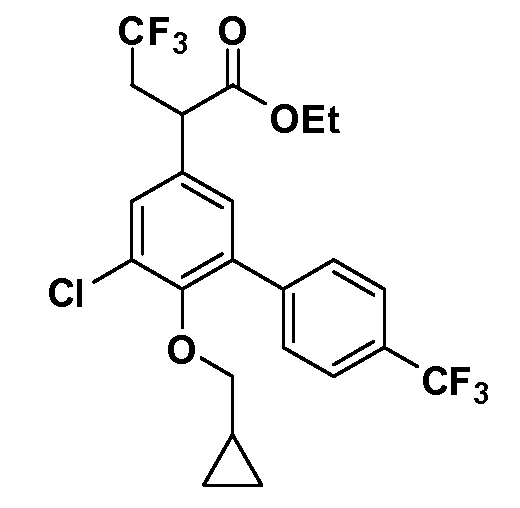
К перемешиваемому раствору NaH (64 мг, 0,13 ммоль) в DMF (15 мл) при 0°C добавляли 2-(5-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)этилацетат (500 мг, 0,12 ммоль) и 1,1,1-трифтор-2-йодэтан (0,304 мл, 0,15 ммоль). Реакционную смесь перемешивали при 0°C в течение 30 мин. После исчерпания исходного материала (по результатам TLC) разбавляли водой (20 мл), подкисляли с использованием 1 н. HCl (pH=5) и экстрагировали EtOAc (3×30 мл). Объединенные органические слои промывали водой (3×15 мл), солевым раствором и высушивали над безводнымNa2SO4. После фильтрации и упаривания сырой материал очищали хроматографией на колонках, получая 2-(5-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4,4,4-трифторэтилбутаноат (300 мг) в форме жидкости.
Стадия 2
2-(5-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4,4,4-трифторбутановая кислота
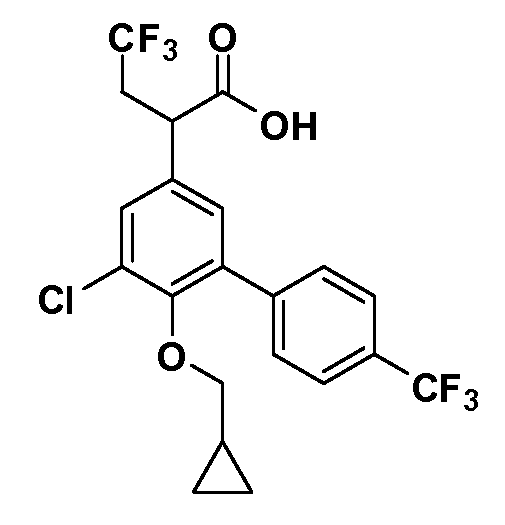
К перемешиваемому раствору 2-(5-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4,4,4-трифторэтилбутаноата (0,1 г, 0,404 ммоль) в смеси THF (10 мл), метанола (10 мл) и воды (5 мл) при температуре окружающей среды добавляли LiOH·H2O (85 мг, 2,024 ммоль), и смесь перемешивали при температуре окружающей среды в течение 2 часов. После полного расхода исходного материала по результатам проверки TLC, реакционную смесь разбавляли водой (10 мл) и подкисляли с использованием 1 н. HCl при 0°C. Водный слой экстрагировали EtOAc (2×20 мл), объединенные органические экстракты промывали водой (10 мл), солевым раствором (20 мл), высушивали над безводным Na2SO4 и упаривали под вакуумом. Сырой материал очищали хроматографией на колонках, получая 2-(5-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4,4,4-трифторбутановую кислоту (38 мг) в форме липкого сиропа.1H ЯМР (500 МГц)(CDCl3): δ (м.д.) 7,71 (м, 4H), 7,39 (с, 1H), 7,19 (с, 1H), 3,92 (м, 1H), 3,41 (д, 2H), 3,08 (м, 1H), 2,54 (м, 1H), 0,96 (м, 1H), 0,40 (д, 2H), 0,00 (м, 2H).
Следующие примеры могут также быть осуществлены с использованием процедур, аналогичных описанным выше, с заменой соответствующих реагентов на известные специалисту в данной области техники.
Пример 3211: 2-(5-хлор-6-(циклопропилметокси)бифенил-3-ил)-4-метилпентановая кислота
Пример 3212: 2-(5-хлор-6-(2-метоксиэтокси)-4'-(трифторметил)бифенил-3-ил)-4-метилпентановая кислота
Пример 3213: 2-(5-хлор-6-(циклопропилметокси)-3'-(трифторметил)бифенил-3-ил)-4-метилпентановая кислота
Пример 3214: 2-(5-бром-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-4-метилпентановая кислота
Пример 3215: 2-(5-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-3-метилпентановая кислота
Пример 3216: 2-(5-хлор-6-(циклопропилметокси)-4'-(трифторметил)бифенил-3-ил)-3-фенилпропановая кислота
Пример 3217: 2-(3-(бензо[d]тиазол-5-ил)-5-хлор-4-(циклопропилметокси)фенил)-4-метилпентановая кислота
Следующие примеры могут также быть осуществлены с использованием процедур, аналогичных описанным выше, с заменой соответствующих реагентов на известные специалисту в данной области техники.
Примеры 464, 474, 480, 481, 483, 485, 488, 489, 494, 504, 1292, 1334, 2490, 2708, 3211, 3212, 3213, 3214, 3215, 3216 и 3217
Экспериментальная фармакология
Измерение Aβ in vitro
Пептид Aβ протеолитически получали из большего интегрального мембранного амилоидного белка-предшественника (АРР). Продукция Aβ происходит в результате протеолитических расщеплений по его N- и C-концам в пределах β-АРР активностями β- и γ-секретазы, соответственно. Трансфицированные клетки, суперэкспрессирующие β-АРР или его эквиваленты, продуцирующие пептид Aβ, могут использоваться для мониторинга эффектов синтетических соединений на продукцию Aβ.
Для анализа эффектов соединений на концентрации различных продуктов расщепления γ-секретазной активности, пептидов Aβ, доступны различные способы, известные специалисту. Примеры таких способов, но не ограничиваясь ими, включают масс-спектрометрическую идентификацию, как описано Wang et al., 1996, J. Biol. Chem. 271:31894-31902, или детекцию с использованием специфических антител, например, методом ELISA.
Примеры таких тестов для измерения продукции Aβобщего, Aβ40 и Aβ42 методом ELISA включают, но не ограничены ими, описанные Vassar et al., 1999, Science 286:735-741. Подходящие наборы, содержащие необходимые антитела и реактивы для такого анализа, доступны, например, но не ограничиваясь ими, от Genetics Company, Wako, Covance и Innogenetics. Эти наборы по существу используются согласно рекомендациям изготовителей, подобно тесту, который описан Citron et al., (1997) Nature Medicine 3:67-72, и оригинальному тесту, описанному Seubert et al., (1992) Nature 359:325-327.
Скрининг осуществляли, используя линию клеток почки эмбриона человека HEK-293, суперэкспрессирующую трансген амилоидного белка-предшественника (АРР), выращиваемую в среде Pro-293a CDM (BioWhittaker). Клетки выращивали до приблизительно 70-80% слияния после добавления тестируемых соединений. Среды для выращивания отсасывали или удаляли, клетки промывали и заменяли 100 мкл соединения, соответственно разбавленного в бессывороточной среде. Планшеты затем инкубировали в течение 16-18 часов при 37°C.
Образцы кондиционированной среды удаляли для анализа/количественной оценки различных уровней пептида Aβ дифференциальным методом ELISA, как описано в сопутствующих инструкциях к наборам. Те исследованные соединения, которые не демонстрируют никакой явной токсичности или неспецифических ингибирующих свойств, исследовали далее в отношении их Aβ-ингибирующих эффектов, и они составляют базу для исследований в области лекарственной химии и для изучения эффекта соединений в различных экспериментальных условиях и конфигурациях.
Таблица 14 показывает репрезентативные данные in vitro (HEK 293) EC50 для соединений по изобретению, где:
А показывает, что соединение имеетEC50 для понижения Aβ42<1 мкМ;
B показывает, что соединение имеетEC50 для понижения Aβ42>1 мкМ, но <5 мкМ;
C показывает, что соединение имеетEC50 для понижения Aβ42>5 мкМ.
Таблица 15 показывает индивидуальные значенияEC50 для репрезентативных соединений по изобретению.
Экспериментальные процедуры для Aбета1→42/1→x ELISA на основе первичной культуры коры крысы
Первичные неокортикальные культуры крыс получали рассечением неокортексов от 10-12 эмбрионов E17, отобранных от беременных крыс SD (Sprague Dawley) (Charles River Laboratories). После иссечения комбинированный объем гистологического препарата неокортекса дополняли до 5 мл средой для иссечения (DM; 1xHBSS (Invitrogen Corp., кат.№ 14185-052)/10 мМ HEPES (Invitrogen Corp., кат.№ 15630-080)/1 мМ пирувата натрия (Invitrogen Corp., кат.№ 11360-070)), дополненной 100 мкл трипсина (0,25%; Invitrogen Corp., кат.№ 15090-046) и 100 мкл дезоксирибонуклеазы I (сток-раствор 0,1% в DM, Roche Diagnostics Corp., кат.№ 0104159), и подвергали расщеплению путем инкубации при 37°C в течение 10 минут. Расщепленную ткань промывали один раз в среде для чашек Петри (PM; NeuroBasal (Invitrogen Corp., кат.№ 21103-049)/10% конской сыворотки (Sigma-Aldrich Co., кат.№ H1138)/0,5 мМ L-глутамина (Invitrogen Corp., кат.№ 25030-081)), затем повторно суспендировали в новом объеме 10 мл РМ для растирания. Растирание состоит из 18 циклов с 5-мл серологической пипеткой, сопровождаемых 18 циклами с полированной пламенем стеклянной пипеткой Пастера. Объем увеличивали до 50 мл с использованием РМ, содержимое затем пропускали через 70-мкм клеточное сито (BD Biosciences, кат.№ 352350) и переносили непосредственно во влажную ванну со льдом. Плотность клеток определяли количественно, используя гемацитометр, и разбавляли для обеспечения высевания в количестве 50000 клеток/лунка/100 мкл в предварительно покрытые PDL планшеты с 96 лунками (Corning, Inc., кат.№ 3665). Клетки инкубировали в течение 4-5 часов при 37°C/5%CO2, после чего весь объем заменяли питательной средой (FM; NeuroBasal/2% B-27 бессывороточной добавки (Invitrogen Corp., кат.№ 17504-044)/0,5 мМ L-глутамина/1% пенициллина-стрептомицина (Invitrogen Corp., кат.№ 15140-122)). Культуры подвергают двум обменам на 50% свежего FM после 3 дней in vitro (DIV3) и еще раз в DIV7.
Человеческие иммобилизованные антитела, распознающие С-концевой сайтAбета1→42, и крысиные иммобилизованные антитела, распознающие N-концевой сайтAбета1→x, разбавленные 1:300 в 0,05M карбонатно-бикарбонатном буфере (Sigma-Aldrich Co., C-3041), использовали, чтобы покрыть (100 мкл/лунка) плоскодонные F96 MicroWell™ (поверхность MaxiSorp™) планшеты (Nalge Nunc International, кат.№ 439454), и инкубировали в течение ночи при 4°C для возможного использования в тесте ELISA. Соединения для скрининга солюбилизировали в диметилсульфоксиде (ДМСО, Sigma-Aldrich Co., кат.№ 15493-8) и затем разбавляли в ДМСО в восьмиточечном формате доза-ответ. В планшетах с 96 лунками осуществляли разведения соединения доза-ответ (1000x желаемая конечная концентрация) в количестве 2 мкл/лунка, в двойном экземпляре (до 3 соединений/планшет), получая дочерний планшет. Кроме того, ДМСО и трет-бутиловый эфир N-[N-(3,5-дифторфенацетил)-L-аланил]-S-фенилглицина (DAPT), ингибитор гамма-секретазы (GSI), включали в качестве растворителя и позитивных контролей, соответственно. С помощью автоматической жидкостной пипетки соединение на дочернем планшете разбавляли 1:500 нагретым FM, и два культуральных планшета DIV8 выравнивали до 60 мкл/лунка и немедленно покрывали 60 мкл/лунка 2x разбавленным дочерним планшетом. Планшеты возвращали в термостат для инкубации при 37°C/5%CO2в течение 24 часов.
Каждый покрытый иммобилизованным антителом планшет ELISA подвергали промывке 4×250 мкл/лунка фосфатно-буферным солевым раствором с 0,05% Tween®-20 SigmaUltra (PBS-T; Fluka, кат.№ 79383/Sigma-Aldrich Co., кат.№ P7949). Планшеты ELISA затем покрывали 120 мкл/лунка PBS-T, дополненной 1%-ным разбавляющим/блокирующим раствором бычьего сывороточного альбумина (BSA; Kirkegaard & Perry Laboratories (KPL), Inc., кат.№ 50-61-01), и инкубировали при температуре окружающей среды на орбитальном встряхивателе минимум 2 часа.
Сток-растворы пептидаAбета1→42 и пептидаAбета1→40 крысы (American Peptide Co., кат.№ 62-0-84/62-0-86A) в ДМСО последовательно разбавляли 1:2 в FM, получая диапазон конечной концентрации 0-500 пг/мл, для высевания на соответствующие планшеты ELISA для определения соответствующей стандартной кривой, на основании которой могут быть вычислены концентрации специфических или полных пептидов Aбета в присутствии специфической концентрации лекарственного средства. Кондиционированную среду от двойных культуральных планшетов собирали и объединяли в один промежуточный 96-луночный круглодонный планшет, который инкубировали на влажном льду. Культуральные планшеты промывали один раз 120 мкл/лунка FM и немедленно пополняли 100 мкл/лунка FM, после чего возвращали в термостат на 10 минут. Жизнеспособность клеток оценивали, добавляя 20 мкл/лунка нагретого CellTiter 96® Aqueous One Solution (MTS/PES; Promega Corp., кат.№ G3581), и планшеты возвращали в термостат на 30-90 минут. Поглощение света планшетов при 492 нм считывали на спектрофотометре, и на основании этого вычисляли отношение поглощения обработанных соединением клеток к поглощению обработанных растворителем (ДМСО) контрольных клеток. Вычисление соответствующих значенийEC50 осуществляли согласно построению нелинейной кривой, используя программное обеспечение GraphPad Prism®.
Для каждого планшета ELISA создают соответствующий промежуточный планшет, содержащий 120 мкл/лунка титрованных растворов пептидаAбета1→42 или пептидаAбета1→40крысы, в двойном экземпляре, и планшет, содержащий 110-115 мкл/лунка собранной кондиционированной среды, половина которого предназначена дляELISA Aбета1→42, а другая половина - дляELISA Aбета1→х. Планшеты ELISA подвергают второй серии промывок 4×250 мкл/лунка PBS-T, после чего немедленно покрывают соответствующим промежуточным планшетом. Планшеты ELISA инкубируют на орбитальном встряхивателе в течение 16-18 часов при 4°C.
Раствор для детекции антител получают, разбавляя бета-амилоид 17-24 (4G8) биотинилированное моноклональное антитело (Covance, Inc, кат.№ SIG-39240-200) 1:1500 в PBS-T, дополненном 0,67% BSA. Планшеты ELISA подвергают промывке 4×250 мкл/лунка PBS-T и покрывают 100 мкл/лунка 4G8 разбавленным раствором для детекции антител. ПланшетыELISA Aбета1→42 инкубируют на орбитальном встряхивателе при температуре окружающей среды в течение 90 минут, планшеты ELISA Aбета1→x - в течение 60 минут.
Для того чтобы конъюгировать биотинилированное моноклональное 4G8 антитело, после промывки 4×250 мкл/лунка PBS-T, планшеты ELISA подвергают одночасовой инкубации в количестве 100 мкл/лунка с разбавлением 1:15000 конъюгата стрептавидин-HRP (Jackson ImmunoResearch Laboratories, Inc, кат.№ 016-030-0840) на орбитальном встряхивателе при температуре окружающей среды.
После последней промывки 4×250 мкл/лунка PBS-T планшеты ELISA покрывают 100 мкл/лунка раствором субстрата пероксидазы для микролунок SureBlue 3,3',5,5'-тетраметилбензидина (TMB) (Kirkegaard & Perry Laboratories, Inc., кат.№ 52-00-02), защищают от света и инкубируют в течение 20-45 минут при температуре окружающей среды. В момент достижения желаемого уровня проявления, добавляют 100 мкл/лунка стоп-раствора TMB (Kirkegaard & Perry Laboratories, Inc., кат.№ 50-85-05), и планшет интенсивно встряхивают для подготовки к считыванию на спектрофотометре. Субстрат для микролунок SureBlue TMB проявляет глубокий синий цвет в присутствии меченного пероксидазой конъюгата и становится желтым при остановке путем подкисления, позволяя осуществить считывание поглощения планшета при 450 нм. На основании расчета стандартной кривой, кривые доза-ответ соединения, нормализованные к выполнению DAPT, выстраивают как % ДМСО, используя программное обеспечение GraphPad Prism®, и вычисляют соответствующие значенияEC50.
Измерение Aβ 42 in vivo
Соединения по изобретению могут использоваться для лечения AD у млекопитающего, такого как человек, или, альтернативно, на апробированной модели животных, такой как мышь, крыса или морская свинка. У млекопитающего может не быть диагностирована AD, или оно может не иметь генетической предрасположенности к AD, но может быть трансгенным, таким, в котором суперпродуцируется и возможно откладывается Aβ, подобно тому, как это происходит у человека. Дополнительно, нетрансгенные животные могут также использоваться для определения биохимической эффективности соединения с помощью подходящего теста.
Соединения могут вводиться в любой стандартной форме с использованием любого стандартного метода. Например, но не ограничиваясь этим, соединения могут быть в форме жидкости, таблеток или капсул, которые принимают перорально или вводят инъекцией. Соединения могут вводиться в любой дозе, которая является достаточной, чтобы значительно снизить, например, уровниAβобщего или более конкретноAβ42 в плазме крови, спинномозговой жидкости (CSF) или мозге.
Чтобы определить, уменьшило ли острое введение соединения уровниAβ42 in vivo, могут использоваться двух-трехмесячные трансгенные мыши Tg2576, экспрессирующиеAPP695, содержащий "шведский" вариант, или любая другая соответствующая апробированная трансгенная модель. Эти трансгенные мыши демонстрируют спонтанное прогрессивное накопление β-амилоида (Aβ) в мозге, в конечном счете, приводящее к амилоидным бляшкам в основании гиппокампа, гиппокампе и коре. Животные этого возраста имеют высокие уровни Aβ в мозге, но не имеют обнаружимых отложений Aβ. Мышей, обработанных соединением, исследуют и сравнивают с необработанными или обработанными носителем, и уровни растворимого Aβ42 и общего Aβ в мозге количественно определяют стандартными методиками, например, используя ELISA. Лечения могут быть острыми или подострыми, и периоды лечения могут варьировать от нескольких часов до нескольких дней или дольше и могут быть отрегулированы на основании биохимических результатов, как только динамика начала эффекта может быть установлена.
Показан типичный протокол измерения уровней Aβ или Aβ42 образцов in vivo, но он является только одним из многих вариантов, которые могут быть использованы для детекции уровней Aβ. Например, аликвоты соединений могут быть растворены в ДМСО (объем, равный 1/10 конечного объема состава), центрифугированы в вортексе и далее разбавлены (1:10) с использованием 10% (вес./об.) раствора гидроксипропил β циклодекстрина (HBC, Aldrich, Ref N° 33,260-7) в PBS, после чего их обрабатывают ультразвуком в течение 20 секунд.
Соединения могут вводиться в форме единственной пероральной дозы, которую вводят за три-четыре часа до умерщвления и последующего анализа, или, альтернативно, могут вводиться курсом в течение нескольких дней, и животных умерщвляют спустя три-четыре часа после введения последней дозы.
Мыши Tg2576 могут быть анестезированы смесью кетамин/ксилазин (80/16 мг/кг внутрибрюшинно). Когда достигнут глубокий уровень анестезии, голову мышей фиксируют в стереотаксической рамке. Кожу задней поверхности шеи отводят, и мышцы задней поверхности удаляют, чтобы обнажить мостомозжечковую цистерну. CSF собирают из мостомозжечковой цистерны с использованием микропипетки на 10 мл, следя за тем, чтобы не загрязнить CSF кровью. CSF немедленно разбавляют 1:10 в 1%-ном 3-[3-холамидопропил)диметил-аммонио]-1-пропан сульфонате (CHAPS) [вес на объем в фосфатном буферном солевом растворе (вес./об. в PBS)], содержащем ингибиторы протеазы (PI) (полный, коктейль ингибитора мини-протеазы в таблетках, Roche), быстро замораживают в жидком азоте и сохраняют при -80°C до использования в биохимическом анализе.
Кровь собирают через кардиальную пункцию, используя иглу калибра 25, соединенную со шприцем на 1 мл, и распределяют в пробирки microtainer на 0,6 мл, содержащие этилендиаминтетрауксусную кислоту (EDTA). Кровь центрифугируют немедленно при 4°C в течение 5 минут при 1500×g. Полученную плазму разделяют на аликвоты в пробирки на 0,5 мл для микроцентрифуги, аликвоты быстро замораживают в жидком азоте и сохраняют при -80°C.
Мозг удаляют после удаления черепа и промывают PBS. Мозжечок/ствол удаляют, замораживают и сохраняют для анализа воздействия лекарственного средства; оставшуюся часть мозга разделяют на четыре части. Заднюю правую четверть, которая содержит кору и гиппокамп, взвешивают, замораживают в жидком азоте и сохраняют при -80°C до анализа ELISA. Оставшуюся мозговую ткань замораживают в жидком азоте и сохраняют при -80°C.
Для анализа общего Aβ или Aβ40 мозговую ткань гомогенизируют в объеме 24 мл/г в холодном 1%-ном CHAPS, содержащем ингибиторы протеазы, и полученные гомогенаты центрифугируют в течение 1 часа при 100000×g при 4°C. Супернатант удаляют и переносят в новую пробирку и далее разбавляют до 240 мл/г в CHAPS с ингибиторами протеазы.
Для анализаAβ42 мозговую ткань гомогенизируют в объеме 50 мл/г в холодном 1%-ном CHAPS, содержащем PI. Гомогенаты центрифугируют в течение 1 часа при 100000×g при 4°C. Супернатант удаляют и переносят в новую пробирку и далее разбавляют до конечного объема 66,7 мл/г в 1%-ном CHAPS с ингибиторами протеазы.
Для определения количества человеческого Aβ42 в растворимой фракции гомогенатов мозга могут использоваться коммерчески доступные наборы Enzyme-Linked-Immunosorbent-Assay (ELISA), (h Amyloid Aβ42 ELISA high sensitive, The Genetics Company, Цюрих, Швейцария, является только одним из многих примеров). ELISA осуществляют согласно протоколу изготовителя. Кратко, стандарт (разбавление синтетического Aβ1-42) и образцы получали в полипропиленовом планшете с 96 лунками без протеин-связывающей способности (Greiner bio-one, Frickenhausen, Германия). Стандартное разбавление с конечными концентрациями 1000, 500, 250, 125, 62,5, 31,3 и 15,6 пг/мл и образцы получали в типовом разбавителе, поставляемом с набором ELISA, до конечного объема 60 мкл. Образцы, стандарты и контроли (50 мкл) добавляли к полистирольному планшету с покрытием анти-Aβ (иммобилизованное антитело селективно распознает С-конец антигена) в дополнение к селективному конъюгату анти-Aβ-антитела (биотинилированное антитело для обнаружения) и инкубировали в течение ночи при 4°C, чтобы обеспечить формирование комплекса антитело-амилоид-антитело. На следующий день добавляли конъюгат стрептавидин-пероксидаза и 30 минут спустя добавляли смесь TMB/пероксид, приводя к преобразованию субстрата в цветной продукт. Эту реакцию останавливали добавлением серной кислоты (1M), и интенсивность цвета измеряли посредством фотометрии с ELISA-ридером с фильтром 450 нм. Количественный анализ содержания Aβ в образцах проводили, сравнивая поглощение со стандартной кривой, полученной с синтетическим Aβ1-42.
Подобный анализ, с незначительной модификацией, может быть выполнен с CSF (разбавленной 1:10 (для конечного разбавления загрузки 1:100)) в 1%-ном CHAPS, содержащем PI, и образцами плазмы (разбавленной 1:15 в 0,1% CHAPS [вес./об. в PBS]).
Некоторые соединения раскрытия могут понизить Aβ42>15%, в некоторых случаях некоторые соединения могут понизить Aβ42>25%, и в других случаях некоторые соединения могут понизить Aβ42>40% относительно основных уровней.
Исследования in vivo (крысы)
Для исследований использовали самцов крыс Sprague Dawley от Harlan, 230-350 г. Крысам натощак пероральным скармливанием вводили носитель (15% Solutol HS 15, 10% EtOH, 75% воды) или соединение, в объеме 10 мл/кг. Для исследований PK в фиксированные моменты времени после введения крыс умерщвляли избыткомCO2. Терминальную кровь собирали через кардиальную пункцию, смешивали в пробирках с EDTA, немедленно центрифугировали (3 минуты при 11000 об/мин при 4°C) и подвергали шоковой заморозке для получения коллекции плазмы. Часть фронтальной коры собирали и подвергали шоковой заморозке для определения уровня соединения. Для исследований снижения A-бета, в определенный момент времени после введения (Cmax, если это ≥3 часов) крыс умерщвляли, как в исследованиях PK, и плазму собирали, как описано выше. Мозжечок удаляли и сохраняли для определения уровня соединения, и оставшуюся часть мозга разделяли на 4 квадранта, подвергали шоковой заморозке и сохраняли для исследования уровней пептида A-бета.
Solutol HS 15 был получен от Mutchler Inc.
Практикам также известно, что подобные способы могут также быть применены к другим видам, таким как мыши (включая трансгенные штаммы, такие как Tg2576), морская свинка, собака и обезьяна.
Анализ снижения Aβin vivo
Соединения по изобретению могут использоваться для лечения AD у млекопитающего, такого как человек, или, альтернативно, на апробированной модели животных, такой как мышь, крыса или морская свинка. У млекопитающего может не быть диагностирована AD, или оно может не иметь генетической предрасположенности к AD, но может быть трансгенным, таким, в котором суперпродуцируется и возможно откладывается Aβ, подобно тому, как это происходит у человека. Альтернативно нетрансгенные животные могут также использоваться для определения биохимической эффективности соединения, то есть эффект на биомаркер Aβ, с помощью подходящего теста.
Соединения могут вводиться в любой стандартной форме, с использованием любого стандартного метода. Например, но не ограничиваясь этим, соединения могут быть в форме жидкости, таблеток или капсул, которые принимают перорально или вводят инъекцией. Соединения могут вводиться в любой дозе, которая является достаточной, чтобы значительно снизить, например, уровниAβобщего или более специфичноAβ42 в плазме крови, спинномозговой жидкости (CSF) или мозге.
Чтобы определить, уменьшило ли острое введение соединения уровниAβ42 in vivo, использовались двух-трехмесячные нетрансгенные крысы Sprague-Dawley. Крыс, обработанных соединением, исследовали и сравнивали с необработанными или обработанными носителем, и уровни растворимогоAβ42 иAβобщего в мозге количественно определяли стандартными методиками, например, используя иммунологический анализ, такой как ELISA. Лечения могут быть острыми или подострыми, и периоды лечения могут варьировать от нескольких часов до нескольких дней или дольше и могут быть отрегулированы на основании биохимических результатов, как только динамика начала эффекта может быть установлена.
Показан типичный протокол измерения уровней Aβ или Aβ42 образцов in vivo, но он является только одним из многих вариантов, которые могут быть использованы для детекции уровней Aβ.
Соединения могут вводиться в форме единственной пероральной дозы, которую вводят за три-четыре часа до умерщвления и последующего анализа, или, альтернативно, могут вводиться курсом в течение нескольких дней, и животных умерщвляют спустя три-четыре часа после введения последней дозы.
Для анализа общего Aβ или Aβ42 мозговую ткань гомогенизировали в десяти объемах ледяной смеси 0,4% DEA/50 мМ NaCl, содержащей ингибиторы протеазы, например, на 0,1 г мозга добавляли 1 мл буфера гомогенизации. Гомогенизацию осуществляют либо обработкой ультразвуком в течение 30 секунд при мощности 3-4 Вт, либо с использованием политронного гомогенизатора на скорости три четверти в течение 10-15 секунд. Гомогенаты (1,2 мл) переносят в предварительно охлажденные пробирки для центрифугирования (поликарбонатные пробирки Beckman 343778), помещают в ротор Beckman TLA120.2. Гомогенаты центрифугируют в течение 1 часа при 100000 об/мин (355040×g) при 4°C. Полученные супернатанты переносят в новые типовые пробирки и помещают на лед (осадок после центрифугирования отбрасывают).
Образцы затем концентрируют и очищают на колонках Waters 60 мг HLB Oasis согласно описанным способам (Lanz and Schachter (2006) J. Neurosci Methods. 157(1):71-81; Lanz and Schachter (2008). J. Neurosci Methods. 169(1):16-22). Кратко, используя вакуумный трубопровод (Waters # WAT200607), колонки соединяют и кондиционируют с помощью 1 мл метанола при объемной скорости потока 1 мл/мин. Затем колонки уравновешивают с помощью 1 мл воды. Образцы загружают (800 мл) на индивидуальные колонки (Aβ присоединится к смоле колонке). Колонки последовательно промывают 1 мл 5%-го метанола, затем 1 мл 30%-го метанола. После последней промывки экстракты из адсорбента собирают в пробирки 13×100 мм, пропуская 800 мкл раствора (90% метанол/2% гидроксида аммония) через колонки со скоростью 1 мл/мин. Образцы переносят в несиликоновые пробирки на 1,5 мл, высушивают в концентраторе speed-vac при средней температуре в течение по крайней мере 2 часов или до сухости.
Высушенные образцы либо сохраняют при -80°C, либо используют немедленно, повторно суспендируя осадки после центрифугирования в 80 мкл бессывороточной среды Ultra-Culture (Lonza), дополненной ингибиторами протеазы, путем центрифугирования в вортексе в течение 10 секунд. Шестьдесят микролитров каждого образца переносят на планшет для иммунологического анализа, предварительно покрытый аффинно очищенным поликлональным антителом кролика, специфичным дляAβ42 (x-42). Шестьдесят микролитров свежей, соответствующим образом дополненной ультракультуры добавляют к оставшемуся образцу, и 60 микролитров переносят на предварительно покрытый и блокированный BSA планшет для иммунологического анализа, покрытый аффинно-очищенным поликлональным антителом кролика, специфичным для общего Aβ грызунов (1-x). Дополнительные эталоны Aβ грызуна/Aβ42 грызуна также добавляют к планшетам с конечными концентрациями 1000, 500, 250, 125, 62,5, 31,3 и 15,6 пг/мл. Образцы инкубируют в течение ночи при 4°C, чтобы обеспечить формирование комплекса антитело-амилоид-антитело. На следующий день планшеты промывают 3-4 раза с помощью 150 микролитров фосфатного буферного солевого раствора, содержащего 0,05% Tween 20. После удаления последней порции промывочного раствора добавляют 100 мл моноклонального антитела 4G8, конъюгированного с биотином (Covance), разбавленного 1:1000 в PBS-T, содержащей 0,67% BSA, и планшеты инкубируют при температуре окружающей среды в течение 1-2 часов. Планшеты снова промывают 3-4 раза PBS-T и добавляют 100 мл конъюгата стрептавидин-пероксидаза, разбавленного 1:10000 из стока 0,5 мг/мл в PBS-T, содержащем 0,67% BSA, и планшеты инкубируют в течение по меньшей мере 30 минут. После последней серии промывок в PBS-T добавляют смесь TMB/пероксид, что приводит к преобразованию субстрата в цветной продукт. Эту реакцию останавливают добавлением серной кислоты (1M), и интенсивность цвета измеряют посредством фотометрии со считывателем микропланшетов с фильтром 450 нм. Количественный анализ содержания Aβ образцов получают, сравнивая поглощение со стандартной кривой, полученной с синтетическим Aβ. Это является одним примером из множества возможных измеряемых результатов для иммунологического анализа, который мог бы дать подобные результаты.
Фигура 1 демонстрирует желаемый эффект в отношении Aβ после введения примера 1301 (2-(5-хлор-4'-изопропил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилпропановая кислота) мышам C57BL/6, при введении одной дозы 30 мг/кг в составе Solutol HS 15:этанол:вода (15:10:75) (измерение Aβ в момент времени 3 часа).
Фармакокинетический анализ
Получение пробы
Образцы плазмы и стандарты получали для анализа путем обработки 3x объема ацетонитрила, содержащего 500 нг/мл внутреннего стандарта (выбранная арилпропионовая кислота). Обычно 150 мл ацетонитрила с внутренним стандартом добавляли к 50 мл плазмы. Ацетонитрил добавляли сначала в каждую лунку 96-луночного фильтровального планшета для осаждения белка Phenomenex Strata Impact с последующим добавлением образца плазмы или стандарта. Фильтровальный планшет оставляли для отстаивания в течение по меньшей мере 15 минут при температуре окружающей среды, после чего использовали вакуум для фильтрации образцов в чистый планшет с 96 лунками.
Если наблюдали или были предсказаны концентрации образца более 1000 нг/мл, образцы плазмы разбавляли с чистой плазмой в 10-150 раз в зависимости от ожидаемой концентрации и верхнего предела количественной оценки аналитического способа.
Образцы фронтальной коры или мозжечка гомогенизировали, затем обрабатывали подобным образом. К каждому образцу мозга добавляли 4X объема буфера PBS (рН 7,4) вместе с 15X объема ацетонитрила (содержащего внутренний стандарт) в пластмассовой пробирке на 2 мл с навинчивающейся пробкой. Пробирки затем наполняли на одну треть гранулами диоксида циркония/диоксида кремния диаметром 1 мм (Biospec) и помещали в Mini Bead Beater на 3 минуты. Образцы осматривали, и если оставались какие-нибудь видимые части мозга, их возвращали в Bead Beater еще на 2-3 минут взбалтывания. Полученная суспензия предположительно представляла собой 5-кратное разведение, обработанное 3X объемами ацетонитрила (с внутренним стандартом). Стандарты калибровки получали в 5-кратном разбавленном чистом мозговом гомогенате и осаждали 3X объемами ацетонитрила сразу после добавления подходящего раствора активного вещества (см. ниже). Все мозговые стандарты и образцы отстаивали в течение по меньшей мере 15 минут, после чего их пропускали через фильтровальный планшет для осаждения белка Phenomenex Strata Impact в чистый планшет с 96 лунками.
Растворы активного вещества для калибровочных стандартов плазмы и мозга получали в концентрациях 0,02, 0,1, 0,2, 1, 2, 10, 20, 100 и 200 мкг/мл в смеси 50:50 ацетонитрил/вода. Стандарты калибровки получали, беря 190 мл чистого матрикса (плазменный или мозговой гомогенат) и добавляя 10 мл раствора активного вещества, получая конечные концентрации 1, 5, 10, 50, 100, 500, 1000, 5000 и 10000 нг/мл.
Анализ LC-MS/MS
Осажденные плазменные и мозговые образцы анализировали с помощью LC-MS/MS с использованием системы LC Shimadzu, состоящей из двух насосов LC-10AD и автоматической пипетки SIL-HTc, связанной с масс-спектрометром Applied Biosystems MDS/Sciex API 3200 QTRAP.
Для хроматографического разделения использовали колонку Phenomenex Luna C-18 3 мкМ (2×20 мм) с мобильной фазой градиента на основе ацетонитрила. Компоненты обеих мобильных фаз были следующими:
Мобильная фаза A: вода 0,05% (об./об.) муравьиной кислоты и 0,05% (об./об.) 5н. гидроксида аммония.
Мобильная фаза B: 95:5 ацетонитрил/вода 0,05% (об./об.) муравьиной кислоты и 0,05% (об./об.) 5н. гидроксида аммония.
Градиент для каждого анализа оптимизировали для определенного соединения, но обычно разгон начинали с концентрацией мобильной фазы B от 0% до 40%, затем до 100% мобильной фазы B за 1-2 минуты, затем поддерживали на этом уровне в течение 2-3 минут перед возвращением к начальным условиям в течение 4 минут для повторного уравновешивания.
Масс-спектрометр API 3200 QTRAP использовали в способе MRM с отрицательной ионизацией электрораспылением. Переходы MRM и настройки масс-спектрометра оптимизировали для каждого соединения.
Стандартные кривые выстраивали с помощью квадратичной или линейной регрессии с утяжелением 1/x*x. Стандарты калибровки получали 1-10000 нг/мл, но самые высокие (и иногда самый низкий) стандарты были часто неприемлемы для количественной оценки, и только стандарты с приемлемой точностью обратного расчета были включены в калибровочную кривую. Идеально, только стандарты с +/-15% номинальной концентрации были включены в выстраиваемую калибровочную кривую, но иногда большие отклонения принимали после тщательного рассмотрения. Концентрации образца ниже диапазона количественной оценки обозначены как “BQL”. Концентрации выше кривой обычно вторично использовали с большим разбавлением образца.
Протоколы глюкуронидирования
Реакции глюкуронидирования микросом проводили, используя растворы UGT Reaction Mix (A и B) от BD Biosciences и согласно протоколам изготовителя. 10 мкМ тестируемого продукта или контрольного соединения инкубировали с 0,5 мг/мл человеческих или крысиных микросом печени. Образцы отбирали в моменты времени 0 и 60 минут, и ацетонитрил добавляли, чтобы завершить реакции. Образцы анализировали LC/MS, контролируя потерю родительского соединения и появление глюкуронида. Для каждого соединения проводили контрольные реакции, заменяя раствор глюкуроновой кислоты водой, чтобы контролировать потерю родительского соединения вследствие разложения или непредвиденных микросомальных реакций.
Эксперименты с гепатоцитами проводили, используя сохраненные замораживанием человеческие гепатоциты (единственный донор), полученные от Celsis/In Vitro Technologies. Клетки размораживали и рассчитывали согласно протоколам изготовителя, используя способ исключения рипанового синего, чтобы получить индекс живых клеток. Тестируемый продукт и контрольное соединение инкубировали в концентрации 5 мкМ в буфере KHB (Celsis/In Vitro Technologies), содержащем 1 миллион клеток на мл. Образцы собирали в моменты времени 0, 60 и 120 минут. Реакции завершали добавлением ацетонитрила. Образцы анализировали LC/MS, контролируя потерю родительского соединения и появление глюкуронида.
Фармакология
Соединения по изобретению представляют собой модуляторы гамма-секретазы (GSM), то есть соединения, действие которых заключается в изменении относительных уровней пептидов Aβ, продуцируемых γ-секретазой. В некоторых случаях соединения изменяют относительные уровни пептидов Aβ, продуцируемых γ-секретазой, значительно не изменяя общий уровень продуцированных пептидов Aβ. Некоторые соединения по изобретению модулируют активность γ-секретазы в отношении протеолитического процессинга АРР и при этом понижают продукциюAβ42 как in vitro в клетках, так и in vivo у животных. В некоторых случаях этот эффект наблюдается при концентрациях, которые не снижают значительно жизнеспособность клеток in vitro, и в дозах, которые хорошо переносятся in vivo. Некоторые соединения по изобретению понижают секрециюAβ42 в тестовых системах нативных нейронных и клеточных конструкций со значениямиEC50 ниже 1 микромоль (соединения класса А, таблица 14), в то время как другие имеют значенияEC50 от 1 до 5 микромоль (соединения класса B, таблица 14), и другие имеют значенияEC50 больше 5 микромоль (соединения класса C). Некоторые соединения по изобретению, по-видимому, не препятствуют в значительной степени родственной γ-секретазе активности процессинга Notch. Соединения, которые препятствуют в значительной степени родственной γ-секретазе активности процессинга Notch, были связаны с токсическими побочными эффектами. Некоторые соединения по изобретению имеют благоприятные фармакокинетические (PK) свойства у животных. Таким образом, некоторые из соединений являются биодоступными перорально, проникают в мозг и имеют благоприятные параметры PK, включая период полужизни и клиренс, позволяющие их фармацевтическое применение на человеке. В свою очередь, некоторые соединения по изобретению значительно снижают продукциюAβ42 в мозге нетрансгенных и трансгенных животных после перорального введения единственной дозы и множества доз без явных побочных эффектов. Для некоторых соединений по изобретению единственные пероральные дозы <30 миллиграмм/килограмм эффективны в отношении снижения продукцииAβ42 в мозге крыс (например, Sprague-Dawley) и мышей дикого типа (например, C57BL/6). Некоторые соединения по изобретению, которые понижаютAβ42 в дозах <30 миллиграмм/килограмм, по-видимому, хорошо переносятся и не демонстрируют видимой или клинической химической токсичности после подострого 14-дневного введения в дозах >30 миллиграмм/килограмм/сутки. Некоторые соединения по изобретению имеют благоприятные свойства абсорбции-распределения-метаболизма и экскреции (ADME). Кроме того, некоторые соединения по изобретению не имеют тенденции к значительной биоаккумуляции в тканях, особенно в мозге. Соединения Формул I-IX, в которых А =CO2H, показывают благоприятные профили относительно формирование метаболитов ацилглюкуронида (А =CO2Glu). Способность метаболитов ацилглюкуронида вызывать токсичность была описана особенно для нестероидных противовоспалительных лекарственных средств (NSAID), содержащих группы карбоновой кислоты (Ebner et al. Drug Metabolism and Disposition 1999, 27(10), 1143-49). Некоторые такие NSAID были удалены с рынка вследствие идиосинкратической токсичности для человека, и было сделано предположение, что идиосинкратическая токсичность NSAID связана с относительной нагрузкой и относительной реакционной способностью метаболитов ацилглюкуронида. Поэтому соединения карбоновой кислоты, которые менее склонны к образованию ацилглюкуронида, как ожидают, будут менее токсичными. Как измерено с использованием апробированных тестовых систем in vitro, некоторые желаемые соединения по изобретению менее склонны к ацилглюкуронидированию, чем соединения NSAID, которые остаются на рынке как считающиеся безопасными (например, флурбипрофен).
Дозировка и введение
Настоящее раскрытие включает фармацевтическую композицию для лечения пациента, имеющего неврологическое нарушение, содержащую терапевтически эффективное количество соединения Формул I-IX, его производного или фармацевтически приемлемой соли и фармацевтически приемлемый эксципиент, носитель или разбавитель.
Фармацевтические композиции могут вводиться в различных лекарственных формах, включая, но не ограничиваясь ими, твердые лекарственные формы или в жидкой лекарственной форме, пероральной лекарственной форме, парентеральной лекарственной форме, внутриносовой лекарственной форме, суппозитории, таблетке для рассасывания, пастилке, щечной, лекарственной форме контролируемого высвобождения, лекарственной форме импульсного высвобождения, лекарственной форме немедленного высвобождения, внутривенном растворе, суспензии или их комбинациях. Доза может быть пероральной лекарственной формой, которая является лекарственной формой контролируемого высвобождения. Пероральная лекарственная форма может быть таблеткой или каплетой. Соединения могут вводиться, например, пероральным или парентеральным путями, включая внутривенное, внутримышечное, внутрибрюшинное, подкожное, чрескожное, через дыхательные пути (аэрозоль), ректальное, влагалищное и топическое (включая щечное и подъязычное) введение. В одном варианте осуществления соединения или фармацевтические композиции, включающие соединения, доставляют к желаемому участку, такому как мозг, непрерывной инъекцией через шунт.
В другом варианте осуществления соединение может вводиться парентеральным, например, внутривенным (в/в) введением. Составы для введения обычно включают раствор соединения Формул I-IX, растворенного в фармацевтически приемлемом носителе. Среди приемлемых носителей и растворителей, которые могут использоваться, можно назвать воду и раствор Рингера, изотонический хлорид натрия. Кроме того, стерильные нелетучие масла могут традиционно использоваться как растворитель или суспендирующая среда. С этой целью может использоваться любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, могут аналогично использоваться в получении форм для инъекций. Эти растворы являются стерильными и обычно не содержат нежелательных веществ. Эти составы могут стерилизоваться обычными известными методиками стерилизации. Составы могут содержать фармацевтически приемлемые вспомогательные вещества, необходимые для придания соответствия физиологическим условиям, такие как регуляторы рН и буферизующие средства, агенты, регулирующие токсичность, например, ацетат натрия, хлорид натрия, хлорид калия, хлорид кальция, лактат натрия и т.п. Концентрация соединения Формул I-IX в этих составах может широко варьировать, и ее выбирают, прежде всего, на основании объема жидкости, вязкости, массы тела и т.п., в соответствии с конкретным выбранным способом введения и потребностями пациента. Для в/в введения состав может представлять собой стерильный препарат для инъекций, такой как стерильная водная или масляная суспензия для инъекций. Эта суспензия может быть составлена согласно известному уровню техники с использованием подходящих диспергирующих или смачивающих веществ и суспендирующих агентов. Стерильный препарат для инъекций может также быть стерильным раствором или суспензией для инъекций в нетоксичном парентерально-приемлемом разбавителе или растворителе, таком как раствор 1,3-бутандиола.
В одном варианте осуществления соединение Формул I-IX может вводиться в центральную нервную систему пациента, например, в спинномозговую жидкость пациента. Составы для введения обычно включают раствор соединения Формул I-IX, растворенного в фармацевтически приемлемом носителе. В некоторых аспектах, соединение Формул I-IX вводят внутриоболочечно, например, в желудочек мозга, поясничную область или мостомозжечковую цистерну. В другом аспекте соединение Формул I-IX вводят внутриглазным путем для обеспечения, таким образом, контакта с клетками ганглиев сетчатки.
Фармацевтически приемлемые составы могут быть легко суспендированы в водных носителях и введены через обычные иглы шприца или с использованием насосов для вливаний. До введения составы могут стерилизоваться, предпочтительно гамма-облучением или путем стерилизации электронным лучом.
В одном варианте осуществления фармацевтическую композицию, содержащую соединение Формул I-IX, вводят пациенту внутриоболочечно. В рамках изобретения термин "внутриоболочечное введение" включает доставку фармацевтической композиции, содержащей соединение Формул I-IX, непосредственно в спинномозговую жидкость пациента, методиками, включающими боковую церебровентрикулярную инъекцию через трепанационное отверстие или цистернальную или поясничную пункцию и т.п. (описанные в Lazorthes et al. Advances in Drug Delivery Systems and Applications in Neurosurgery, 143-192 и Omaya et al., Cancer Drug Delivery, 1:169-179, содержание которых включено в настоящее описание путем ссылки). Термин "поясничная область" включает область между третьим и четвертым поясничным (нижняя часть спины) позвонками. Термин "мостомозжечковая цистерна" включает область окончания черепа и начала спинного мозга позади головы. Термин "желудочек мозга" включает полости в мозге, которые являются неразрывными с центральным каналом спинного мозга. Введение соединения Формул I-IX в любой из указанных участков может быть осуществлено прямой инъекцией фармацевтической композиции, содержащей соединение Формул I-IX, или при помощи насосов для вливаний. Для инъекции фармацевтические композиции могут быть составлены в жидких растворах, предпочтительно в физиологически совместимых буферах, таких как раствор Хэнкса или раствор Рингера. Кроме того, фармацевтические композиции могут быть составлены в твердой форме и повторно растворены или суспендированы непосредственно перед использованием. Лиофилизированные формы также включены в рамки изобретения. Инъекция может быть осуществлена, например, в форме болюсного вливания или непрерывной инфузии (например, с использованием насосов для вливаний) фармацевтической композиции.
В одном варианте осуществления фармацевтическую композицию, содержащую соединение Формул I-IX, вводят боковой церебровентрикулярной инъекцией в мозг пациента. Инъекция может быть осуществлена, например, через трепанационное отверстие, сделанное в черепе пациента. В другом варианте осуществления инкапсулированное терапевтическое средство вводят через хирургически вставленный шунт в желудочек мозга пациента. Например, инъекция может быть осуществлена в самые крупные боковые желудочки, однако также может быть сделана инъекция в третий и четвертый желудочки, имеющие меньшие размеры.
В еще одном варианте осуществления фармацевтическую композицию вводят инъекцией в мостомозжечковую цистерну или в поясничную область пациента.
Для перорального введения соединения обычно находятся в стандартных лекарственных формах в виде таблетки, пилюли, драже, таблетки для рассасывания или капсулы; в форме порошка или гранул; или в форме водного раствора, суспензии, жидкости, гелей, сиропа, кашицы и т.д., подходящих для проглатывания пациентом. Таблетки для перорального использования могут включать активные ингредиенты, смешанные с фармацевтически приемлемыми эксципиентами, такими как инертные разбавители, дезинтеграторы, связующие, лубриканты, подсластители, ароматизаторы, красители и консерванты. Подходящие инертные разбавители включают карбонат натрия и кальция, фосфат натрия и кальция и лактозу, в то время как кукурузный крахмал и альгиновая кислота являются подходящими дезинтеграторами. Связующие могут включать крахмал и желатин, в то время как лубрикант, если он присутствует, обычно является стеаратом магния, стеариновой кислотой или тальком. Если желаемо, таблетки могут быть покрыты такими материалами, как глицерил моностеарат или глицерил дистеарат, для задержки абсорбции в желудочно-кишечном тракте.
Фармацевтические препараты для перорального использования могут быть получены путем комбинации соединения Формул I-IX с твердым эксципиентом, в случае необходимости размалывания полученной смеси и обработкой смеси гранул, после добавления подходящих дополнительных соединений, если желаемо, с получением сердцевин драже или таблетки. Подходящими твердыми эксципиентами, в дополнение к указанным выше, являются углеводные или белковые наполнители, которые включают, но не ограничены ими, сахара, включая лактозу, сахарозу, маннит или сорбит; крахмал из кукурузы, пшеницы, риса, картофеля или других растений; целлюлозу, такую как метилцеллюлоза, гидроксипропилметилцеллюлоза или натрий карбоксиметилцеллюлоза; и смолы, включая гуммиарабик и трагакант; а также белки, такие как желатин и коллаген. Если желаемо, могут быть добавлены дезинтеграторы или солюбилизаторы, такие как поперечно-сшитый поливинилпирролидон, агар-агар, альгиновая кислота или ее соль, такая как альгинат натрия.
Капсулы для перорального использования включают твердые желатиновые капсулы, в которых активный ингредиент смешан с твердым разбавителем, и мягкие желатиновые капсулы, в которых активные ингредиенты смешаны с водой или маслом, таким как арахисовое масло, жидкий парафин или оливковое масло.
Сердцевины драже получают с подходящими покрытиями. С этой целью могут использоваться концентрированные растворы сахаров, которые могут в случае необходимости содержать гуммиарабик, тальк, поливинилпирролидон, карбопол гель, полиэтиленгликоль и/или диоксид титана, растворы лака и подходящие органические растворители или смеси растворителей. Красители или пигменты могут быть добавлены к таблеткам или покрытиям драже для идентификации или охарактеризовывания различных комбинаций активных доз соединения.
Для введения через слизистые оболочки (например, щечного, ректального, носового, глазного и т.д.) в составе используют смачивающие реагенты, адаптированные к барьеру, который необходимо преодолеть. Такие смачивающие реагенты являются общеизвестными в данной области техники.
Составы для ректального введения могут быть представлены в форме суппозитория с подходящей основой, включающей, например, масло какао или салицилат. Составы, подходящие для влагалищного введения, могут быть представлены в форме пессариев, тампонов, кремов, гелей, паст, составов в виде пены или спрея, содержащих, в дополнение к активному ингредиенту, носители, такие, которые известны в данной области техники как подходящие. Для внутримышечного, внутрибрюшинного, подкожного и внутривенного использования соединения обычно представлены в стерильных водных растворах или суспензиях, буферизованных для соответствующего рН и изотоничности. Подходящие водные носители включают раствор Рингера и изотонический хлорид натрия. Водные суспензии могут включать суспендирующие агенты, такие как производные целлюлозы, альгинат натрия, поливинилпирролидон и трагакант, и смачивающее вещество, такое как лецитин. Подходящие консерванты для водных суспензий включают этил- и н-пропил-п-гидроксибензоат.
Суппозитории для ректального введения лекарственного средства могут быть получены путем смешивания лекарственного средства с подходящим нераздражающим эксципиентом, который является твердым при обычных температурах, но жидким при температурах прямой кишки и поэтому плавится в прямой кишке, высвобождая лекарственное средство. Такими материалами являются масло какао и полиэтиленгликоли.
Соединения могут быть доставлены чрескожно, топическим путем, составлены в виде аппликатора в форме карандаша, растворов, суспензий, эмульсий, гелей, кремов, мазей, паст, желе, лекарственных форм в вязком носителе, порошков или аэрозолей.
Соединения могут также быть представлены как водные или липосомные составы. Водные суспензии могут содержать соединение Формул I-IX в смеси с эксципиентами, подходящими для получения водных суспензий. Такие эксципиенты включают суспендирующий агент, такой как натрий карбоксиметилцеллюлоза, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагакант и гуммиарабик, и диспергаторы или смачивающие вещества, такие как природный фосфатид (например, лецитин), продукт конденсации алкиленоксида с жирной кислотой (например, стеарат полиоксиэтилена), продукт конденсации этиленоксида с длинноцепочечным алифатическим спиртом (например, гептадекаэтилен оксицетанол), продукт конденсации этиленоксида с неполным эфиром многоатомного спирта, полученным из жирной кислоты и гексита (например, полиоксиэтилен сорбит моноолеат) или продукт конденсации этиленоксида с неполным эфиром многоатомного спирта, полученным из жирной кислоты и ангидрида гексита (например, полиоксиэтилен сорбитан моноолеат). Водная суспензия может также содержать один или более консервантов, таких как этил- или н-пропил-п-гидроксибензоат, один или более красителей, один или более ароматизаторов и один или более подсластителей, таких как сахароза, аспартам или сахарин. Составы могут быть отрегулированы в отношении осмолярности.
Масляные суспензии можно составлять, суспендируя соединение Формул I-IX в растительном масле, таком как арахисовое масло, оливковое масло, кунжутное масло или кокосовое масло, или в минеральном масле, таком как жидкий парафин; или в их смеси. Масляные суспензии могут содержать загуститель, такой как пчелиный воск, твердый парафин или цетиловый спирт. Для того чтобы получить приемлемый пероральный препарат, можно добавлять подсластители, такие как глицерин, сорбит или сахароза. Эти составы могут быть законсервированы добавлением антиоксиданта, такого как аскорбиновая кислота. В отношении примера масляного носителя для инъекций см. Minto, J. Pharmacol. Exp. Ther. 281:93-102, 1997. Фармацевтические составы могут также быть в форме эмульсий типа "масло в воде". Масляная фаза может представлять собой растительное масло или минеральное масло, описанные выше, или их смесь. Подходящие эмульгаторы включают природные смолы, такие как гуммиарабик и трагакант, природные фосфатиды, такие как лецитин сои, сложные эфиры или неполные эфиры многоатомного спирта, полученные из жирных кислот и ангидридов гексита, такие как сорбитан моноолеат, и продукты конденсации этих неполных эфиров многоатомного спирта с этиленоксидом, такие как полиоксиэтилен сорбитан моноолеат. Эмульсия может также содержать подсластители и ароматизаторы, как в составе сиропов и эликсиров. Такие составы могут также содержать смягчающее средство, консервант или краситель.
В дополнение к составам, описанным выше, соединения могут также быть составлены в форме препаратов депо. Такие составы длительного действия могут вводиться имплантацией или чрескожной доставкой (например, подкожной или внутримышечной), внутримышечной инъекцией или с помощью трансдермального пластыря. Таким образом, например, соединения могут быть составлены с подходящими полимерными или гидрофобными материалами (например, в форме эмульсии в приемлемом масле) или ионообменными смолами, или как умеренно растворимые производные, например, как умеренно растворимая соль.
Фармацевтические композиции также могут включать подходящие твердые или гелеобразные носители или эксципиенты. Примеры таких носителей или эксципиентов включают, но не ограничены ими, карбонат кальция, фосфат кальция, различные сахара, крахмалы, производные целлюлозы, желатин и полимеры, такие как полиэтиленгликоли.
Для введения ингаляцией соединения обычно доставляют в форме аэрозольного спрея в герметичных упаковках или распылителях, с использованием подходящего пропеллента, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа. В случае герметичного аэрозоля единица дозировки может быть определена с помощью клапана, выдающего отмеренное количество. Могут быть составлены капсулы и картриджи из, например, желатина для использования в ингаляторе или инсуффляторе, содержащие порошковую смесь соединения и подходящей основы порошка, такой как лактоза или крахмал.
Обычно подходящая доза находится в диапазоне от 0,01 до 100 мг на кг массы тела реципиента в сутки, предпочтительно в диапазоне от 0,2 до 10 мг на кг массы тела в сутки. Желаемую дозу предпочтительно принимают один раз в сутки, но ее можно вводить в виде двух, трех, четырех, пяти, шести или больше поддоз, вводимых через подходящие интервалы в течение дня.
Соединения могут вводиться как единственный активный агент или в комбинации с другим известным терапевтическим средством, пригодным в лечении неврологических нарушений. В любом случае лечащий врач может подобрать способ лечения, который будет являться профилактическим или терапевтическим, приспосабливая количество и рассчитывая введение лекарственного средства на основе наблюдений за одним или более симптомами (например, моторной или когнитивной функцией, измеряемыми стандартными клиническими оценками или исследованиями) подвергаемого лечению нарушения.
Детали относительно методик получения состава и введения подробно описаны в научной и патентной литературе, см., например, последний выпуск Remington's Pharmaceutical Sciences, Maack Publishing Co, Easton Pa. После составления фармацевтической композиции в приемлемом носителе, она может быть помещена в подходящий контейнер и маркирована для лечения обозначенного состояния. Для введения соединений Формул I-IX такая маркировка может включать, например, инструкции относительно количества, частоты и способа введения.
Реферат
Изобретение относится к новым соединениям Формулы III или к его фармацевтически приемлемым солям, в которой: Rи Rнезависимо выбраны из группы, состоящей из: (a) H, (b) (C-C)алкила, (c) C-Cалкила, прерванного одной или более групп -O-, (d) (C-C)алкил-(C-C)циклоалкила и (e) (CH)Q, где n=1-2 и где Q обозначает ароматическую кольцевую систему, имеющую от 5 до 6 кольцевых атомов C, и причем Q может быть независимо замещен группами числом до 3, выбранными из галогена, при условии, что Rи Rодновременно не обозначают H, причем каждый алкил Rи Rможет быть независимо замещен одной или более групп, выбранных из группы, состоящей из галогена, гидрокси, циано, CFили C-Cалкила, или Rи Rвместе с углеродом, к которому они присоединены, образуют 3-7-членное циклоалкильное или 6-членное гетероциклоалкильное кольцо, включающее один атом кислорода и которое в случае необходимости несет C-Cалкильный заместитель, или Rи Rвместе с углеродом, к которому они присоединены, образуют 3-7-членное циклоалкильное кольцо, замещенное Rи R, причем Rи Rвместе с углеродом или углеродами, к которому (которым) они присоединены, образуют 3-7-членное циклоалкильное кольцо; Rобозначает C-Cалкил; каждый Rнезависимо обозначает C-Cалкил; Y обозначает -O-; Rвыбран из группы, состоящей из: (a) (C-C)алкил-(C-C)циклоалкила, (b) трифторэтила, и (c) трифторпропила; Z обозначает фенил или бициклическую кольцевую систему, имеющую 9 кольцевых атомов, независимо выбранных из C, N, O и S, при условии, что не больше чем 3 кольцевых атома в любом единственном кольце отличаются от C, причем указанная кольцевая система может нести до 3 заместителей, независимо выбранных из группы, состоящей из R, CFи SR; и Rвыбран из группы, состоящей из NO, NH, F, Cl, Br
Формула
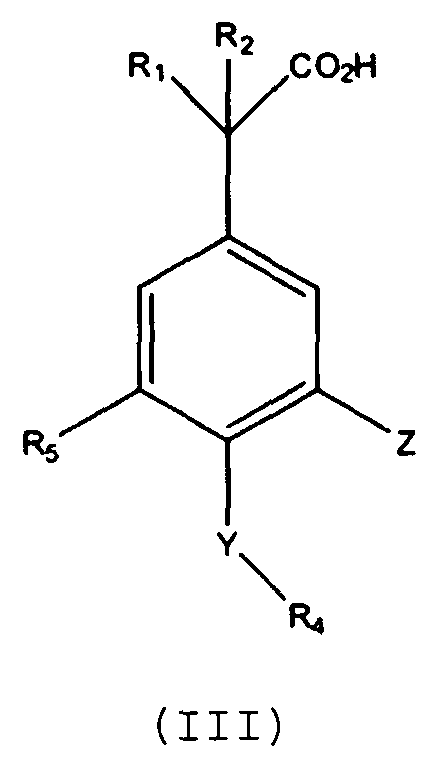
или его фармацевтически приемлемая соль,
в которой:
R1 и R2 независимо выбраны из группы, состоящей из: (a) H, (b) (C2-C6)алкила, (c) C1-C6 алкила, прерванного одной или более групп -O-, (d) (C0-C3)алкил-(C3-C7)циклоалкила и (e) (CH2)nQ, где n=1-2 и где Q обозначает ароматическую кольцевую систему, имеющую от 5 до 6 кольцевых атомов C, и причем Q может быть независимо замещен группами числом до 3, выбранными из галогена, при условии, что R1 и R2 одновременно не обозначают H,
причем каждый алкил R1 и R2 может быть независимо замещен одной или более групп, выбранных из группы, состоящей из галогена, гидрокси, циано, CF3 или C1-C4 алкила, или
R1 и R2 вместе с углеродом, к которому они присоединены, образуют 3-7-членное циклоалкильное или 6-членное гетероциклоалкильное кольцо, включающее один атом кислорода и которое в случае необходимости несет C1-C4 алкильный заместитель,
или
R1 и R2 вместе с углеродом, к которому они присоединены, образуют 3-7-членное циклоалкильное кольцо, замещенное R20 и R21, причем R20 и R21 вместе с углеродом или углеродами, к которому (которым) они присоединены, образуют 3-7-членное циклоалкильное кольцо;
R6 обозначает C1-C6 алкил;
каждый R7 независимо обозначает C1-C6 алкил;
Y обозначает -O-;
R4 выбран из группы, состоящей из:
(a) (C0-C3)алкил-(C3-C7)циклоалкила,
(b) трифторэтила, и
(c) трифторпропила;
Z обозначает фенил или бициклическую кольцевую систему, имеющую 9 кольцевых атомов, независимо выбранных из C, N, O и S, при условии, что не больше чем 3 кольцевых атома в любом единственном кольце отличаются от C, причем указанная кольцевая система может нести до 3 заместителей, независимо выбранных из группы, состоящей из R6, CF3 и SR6; и
R5 выбран из группы, состоящей из NO2, NH2, F, Cl, Br, CN, SR6, S(O)2N(R7)2 и (C1-C4)алкила, причем каждый алкил может быть независимо замещен одним или более галогенами или CF3.
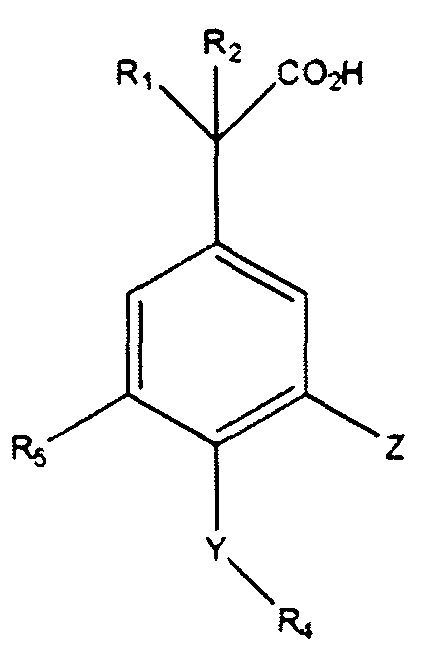
или его фармацевтически приемлемая соль.
R1 и R2 вместе с углеродом, к которому они присоединены, образуют 3-7-членное циклоалкильное или 6-членное гетероциклоалкильное кольцо, включающее один атом кислорода, и которое в случае необходимости несет C1-C4 алкильный заместитель, или
R1 и R2 вместе с углеродом, к которому они присоединены, образуют 3-7-членное циклоалкильное кольцо, замещенное R20 и R21, причем R20 и R21 вместе с углеродом или углеродами, к которому (которым) они присоединены, образуют 3-7-членное циклоалкильное кольцо;
Z обозначает фенильное кольцо, которое может нести до 3 заместителей, независимо выбранных из группы, состоящей из R6, CF3 и SR6; и
R5 выбран из группы, состоящей из F, Cl и Br.
2-(5-хлор-6-(2,2,2-трифторэтокси)-4′-(трифторметил)бифенил-3-ил)-3-циклобутилпропановая кислота;
2-(5-хлор-6-(2,2,2-трифторэтокси)-4′-(трифторметил)бифенил-3-ил)-2-циклопентилуксусная кислота;
2-(5-хлор-6-(2,2,2-трифторэтокси)-4′-(трифторметил)бифенил-3-ил)-3-циклопропилпропановая кислота;
2-(5-хлор-6-(2,2,2-трифторэтокси)-4′-(трифторметил)бифенил-3-ил)-4-метилпентановая кислота;
4-метил-2-(6-(2,2,2-трифторэтокси)-4′,5-бис(трифторметил)бифенил-3-ил)пентановая кислота;
3-циклопропил-2-(6-(2,2,2-трифторэтокси)-4′,5-бис(трифторметил)бифенил-3-ил)пропановая кислота;
2-(5-хлор-4′-(метилтио)-6-(2,2,2-трифторэтокси)бифенил-3-ил)-2-циклопентилуксусная кислота;
2-(5-хлор-4′-(метилтио)-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклобутилпропановая кислота;
2-(5-хлор-4′-(метилтио)-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилпропановая кислота;
2-(5-хлор-4′-(метилтио)-6-(2,2,2-трифторэтокси)бифенил-3-ил)-4-метилпентановая кислота;
2-(5-хлор-4′-изопропил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-2-циклопентилуксусная кислота;
2-(5-хлор-4′-изопропил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклобутилпропановая кислота;
2-(5-хлор-4′-изопропил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-3-циклопропилпропановая кислота;
2-(5-хлор-4′-изопропил-6-(2,2,2-трифторэтокси)бифенил-3-ил)-4-метилпентановая кислота;
2-(3-(бензо[с][1,2,5]оксадиазол-5-ил)-4-(2,2,2-трифторэтокси)-5-(трифторметил)фенил)-4-метилпентановая кислота;
2-(3-(бензо[с][1,2,5]оксадиазол-5-ил)-4-(2,2,2-трифторэтокси)-5-(трифторметил)фенил)-3-циклопропилпропановая кислота;
2-(3-(бензо[с][1,2,5]тиадиазол-5-ил)-4-(2,2,2-трифторэтокси)-5-(трифторметил)фенил)-3-циклопропилпропановая кислота; и
2-(3-(бензо[с][1,2,5]тиадиазол-5-ил)-4-(2,2,2-трифторэтокси)-5-(трифторметил)фенил)-4-метилпентановая кислота;
или его фармацевтически приемлемая соль.

Комментарии