Люциферазы - RU2192467C2
Код документа: RU2192467C2
Чертежи





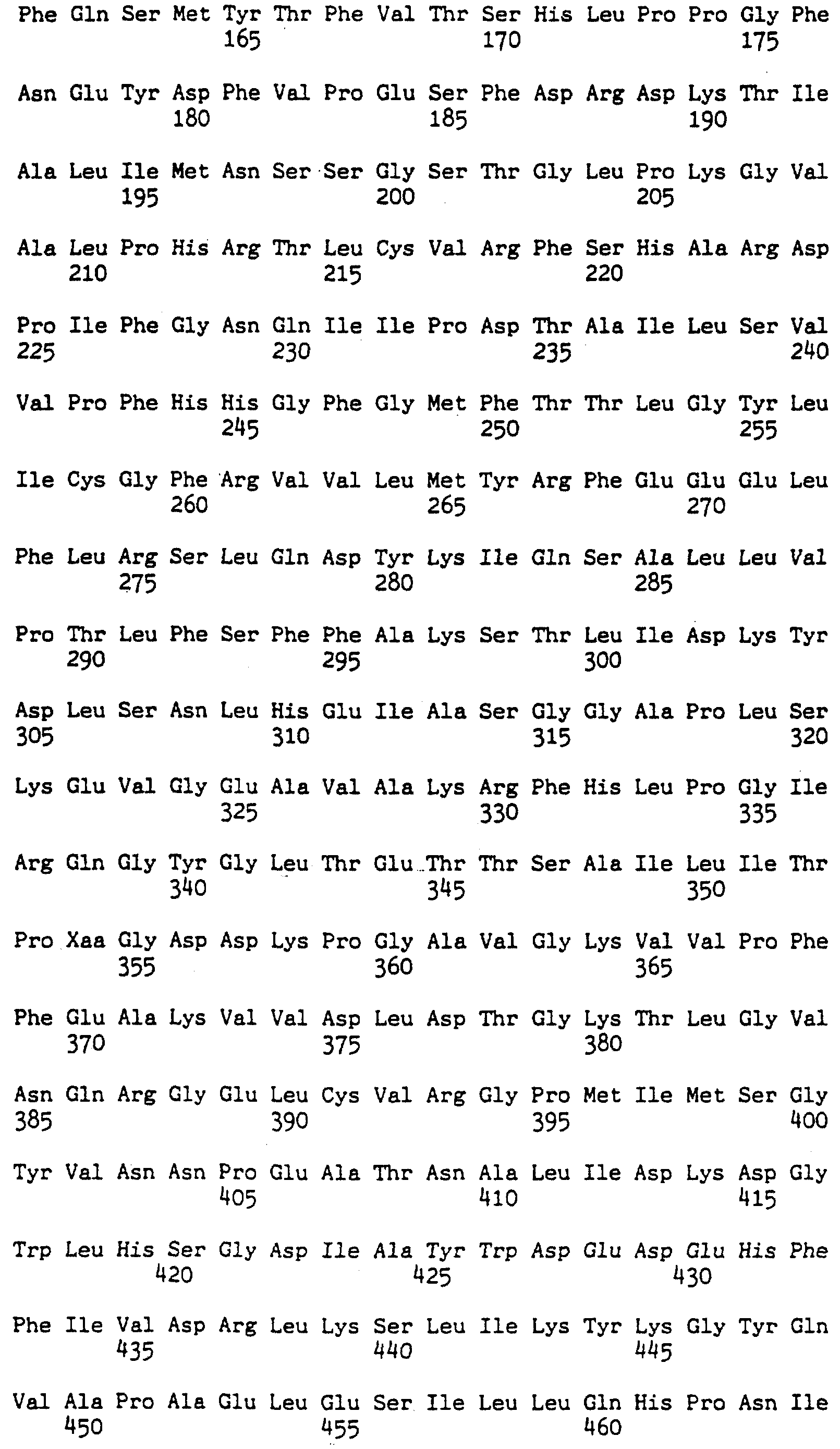






Описание
Изобретение относится к новым протеинам, обладающим люциферазной активностью, и к ДНК и векторам, кодирующим их экспрессию. В частности, настоящее изобретение предлагает люциферазы, отличающиеся термостабильностью при температурах выше 30oС.
Люцифераза светляков катализирует окисление люциферина в присутствии АТР, Мg2+ и молекулярного кислорода, в результате чего возникает свет. Эта реакция имеет квантовый выход примерно 0,88 /см. De Luca and McElroy /1978/ и Seliger and McElroy /1960//, и эта способность испускать свет привела к ее использованию в люминометрических анализах, когда необходимо измерить уровни АТР.
Люциферазы получают непосредственно из тел таких насекомых, как светляки или личинки светляков, или за счет экспрессии из микроорганизмов, включая рекомбинантные ДНК конструкции, кодирующие этот энзим. Четырьмя основными видами светляков, из которых можно получить энзим, или выделить, кодирующую его ДНК, являются японские GEHJI и HEIKE светляки Luciola crucita и Luciola lateralis, Восточно-европейские светляки Luciola mingrelica и Северно-американские светляки /Photinus pyralis/. Личинки светляка Lampyris noctiluca являются еще одним источником, причем их люциферазная аминокислотная последовательность обладает 84%, гомологией с последовательностью люциферазы Photinus pyralis.
Термостабильность дикого типа и рекомбинантного типа люцифераз такова, что они теряют свою активность очень быстро, если попадают в условия с температурой выше, чем около 30oС, особенно выше 35oС. Такая нестабильность приводит к дефициту энзима при использовании или хранении его при столь высоких комнатных температурах, или если необходимо увеличить скорость реакции за счет повышения температуры. Известно, что люцифераза Японских светляков может быть стабилизирована против термоинактивации за счет осуществления мутации ее в положении 217, за счет замены треонинового остатка на изолейциновый остаток /Kajiyama and Nakano /1993/, Biochemistry 32 р. 13795-13799/. Таким образом повышаются термостабильность, рН-стабильность и специфическая активность. О термостабильности люцифераз Photinus pyralis и Luciola mingrelia до сих пор нет сообщений.
В настоящем изобретении предложены новые люциферазы, обладающие повышенной термостабильностью по сравнению с люциферазами дикого типа, за счет замены глутаматного остатка, присутствующего в последовательности, сохраняющейся в каждой из Photinus pyralis, Luciola mingrelia, Luciola lateralis и Luciola cruciata альтернативными аминокислотами, в частности лизином или аргинином. Этот глутамат находится в положении 354 в люциферазе Photinus pyralis на третьей аминокислоте консервативной аминокислотной последовательности TPEGDDKPGA, встречающейся в люциферазах как этого, так и других видов.
Таким образом, в первом аспекте настоящего изобретения предложен протеин, имеющий более 60% гомологии аминокислотной последовательности с последовательностями Photinus pyralis, Luciola mingrelia, Luciola cruciata или Luciola lateralis, отличающийся тем, что аминокислотный остаток, соответствующий остатку 354 люциферазы Photinus pyralis и остатку 356 люцифераз Luciola mingrelia, Luciola cruciata и Luciola lateralis представляет аминокислоту, отличную от глутамата.
Эта аминокислота может быть как нативной аминокислотой, так может быть так называемой, необычной аминокислотой, например модифицированной нативной аминокислотой или ее аналогом. Под термином аналоги аминокислот, отличные от глутамата, следует понимать соединения, которые обладают эквивалентным действием на протеин, что и аминокислота, аналогом которой они являются. Типичными необычными аминокислотами являются те, которые перечислены в US and European Patent Manual and The Rules and Practice in Patent Case: описания заявок, содержащих нуклеотидные и/или аминокислотные последовательности: модифицированные и необычные аминокислоты.
Предпочтительно, чтобы протеин характеризовался тем, что содержал бы аминокислотную последовательность XGDDYPGA, где Х представляет аминокислоту, отличную от глутамата. Более предпочтительно, чтобы протеин содержал аминокислотную последовательность ТРXGDDKPGA и предпочтительно для термостабильности, чтобы Х был любой аминокислотой, отличной от аспарагиновой кислоты, пролина или глицина; еще более предпочтительно, чтобы он был представлен триптофаном, валином, лейцином, изолейцином или аспарагином, но более всего предпочтительно, чтобы он был представлен лизином или аргинином, или аналогом любой из них.
Следует учитывать, что некоторые виды насекомых могут иметь люциферазы с одной или двумя аминокислотами, отличающимися в этом консервативном участке TPXGDDKPA, но все активные протеины, соответствующие таким люциферазам, которые изменены до такой степени, что аминокислота в положении 3 в последовательности не представляют глутамат, также входят в объем настоящего изобретения.
В предпочтительных вариантах настоящего изобретения протеин изобретения также содержит аминокислоту в положении, соответствующем аминокислоте 217 люцифераз Luciola светляков, или в положении 215 Photinus pyralis, замененные на гидрофобную аминокислоту, предпочтительно на изолейцин, лейцин или валин, как указано в ЕР 0524448 А. Было обнаружено, что такие изменения приводят к повышению термостабильности больше, нежели только изменение одной 354: таким образом два изменения оказывают действия, которые практически не зависят друг от друга, и которые можно использовать совместно.
Во втором аспекте настоящего изобретения предложена ДНК, кодирующая протеин изобретения, а в третьем аспекте предложен вектор, в частности плазмида, содержащая luc ген /ген, кодирующий люциферазу/ в форме, способной к экспрессии протеина настоящего изобретения. Такими формами являются те, в которых вектор включает ДНК последовательности, способные контролировать экспрессию протеина настоящего изобретения таким образом, что если он введен в клетку микроорганизма хозяина, этот протеин может легко экспрессироваться как это нужно, с добавлением в случае необходимости соответствующих индукторов.
luc гены Photinus pyralis, Luciola mingrelia, Luciola cruciata и Luciola lateralis хорошо известны и выделены стандартными методами молекулярной биологии. luc ген Photinus pyralis коммерчески доступен от Promega, как плазмида pGEM. Так, стандартные методики служат источниками для получения исходных материалов для получения ДНК настоящего изобретения и включают: /i/ использование геномной ДНК светляков, встречающихся в природе, и амплификацию полученного из них luc гена, например, за счет PCR, /ii/ pGEM и /iii/ pGLf37 плазмиду Kajiyama and Nakano. Другие гены, кодирующие, например, протеины, обладающие люциферазной активностью, т.е. активностью окисления люциферина с эмиссией света, также могут служить подходящими источниками в качестве исходных материалов для получения ДНК, и в конце-концов за счет генной экспрессии, протеина настоящего изобретения.
Подходящими векторами для использования при работе с ДНК дикого типа или другого luc гена для получения ДНК настоящего изобретения могут быть любые векторы, в которых может содержаться ДНК, где осуществляется замена встречающегося нативно глутамата на альтернативную аминокислоту. Для химически индуцированного мутагенеза, например, с использованием таких агентов, как гидроксиламин, это не является особо критичным, и многие подходящие векторы, известные специалистам в этой области, позволяют с легкостью манипулировать геном как до, так и после процесса мутагенеза.
Может оказаться предпочтительным специфически мутировать luc ген по глутамату, и в этом случае необходим сайт-направленный мутагенез. Такие операции легче всего осуществлять в векторах, и они должны быть хорошо знакомы специалистам.
Для экспрессии luс генов дикого или известного типа и генов настоящего изобретения подходящие векторы включают рКК223-3, рDR540 /доступны от Boehringer Mannheim/ и рТ7-7; причем первые два содержат tас промотор под контролем лактозного репрессора, что позволяет индуцировать экспрессию за счет присутствия изопропилтиогалактозида /IPTG/. рТ7-7 обеспечивает контроль за счет Т7-РНК полимеразного промотора и таким образом обеспечивает базу для очень высокого уровня генной экспрессии в клетках E.coli, содержащих Т7 RHK-полимеразу. Обнаружено, что экспрессия этих векторов наивысшая, если luc гены встроены в рТ7-7 вектор.
Экспрессия люциферазы из luc гена, встроенного в рКК223-3, и рDR540, приводит к экспрессии дикого типа N-терминальной последовательности люциферазы, тогда как экспрессия из luc гена, встроенного в рТ7-7, приводит к синтезу протеина слияния с дополнительными Н-терминальными аминокислотами M-A-B-I-Q. Рибосомный связывающий сайт и стартовый кодон luc гена в каждом из векторов, в которых присутствует 1uс ген /например, конструкции pPW204, pPW116 и рРW304/ представлены в таблице примеров.
В третьем аспекте в настоящем изобретении предложены клетки, способные к экспрессии протеинов настоящего изобретения; способы получения таких протеинов с использованием этих клеток и тестовые наборы, содержащие протеины настоящего изобретения. Предложены также легкие способы, в которых АТР измеряют, используя реагенты люциферин/люциферазы, как это хорошо известно специалистам, отличающиеся тем, что люцифераза является протеином настоящего изобретения. Препараты люциферазы настоящего изобретения относительно более термостабильны при 30-70oС, особенно при 37-60oС и особенно при 40-50oС по сравнению с люциферазами дикого типа и рекомбинантными люциферазами дикого типа.
Любая клетка, способная экспрессировать гетерологический протеин, используя ДНК последовательности в своей ДНК, или в таких векторах, как плазмиды, содержащиеся в клетке, может быть использована для экспрессии протеинов настоящего изобретения. Обычно такими клетками могут быть дрожжевые и бактериальные клетки, такие как клетки Saccharomyces cerevisiae и Escherichia coli, но для специалистов очевидны и многие другие организмы-хозяева для целей экспрессии протеина. Предпочтительны клетки насекомых, так как в качестве протеина выступает протеин насекомого. Этот протеин может быть экспрессирован в виде протеина со структурой, сходной со структурой нативной и известной рекомбинантной люциферазы, или может быть экспрессирован в виде слияния или конъюгата таких протеинов с другими аминокислотами, пептидами, протеинами или другими химическими веществами, например с указанной ранее последовательностью M-A-R-I-Q.
Специалистам следует учитывать, что некоторые хозяева могут иметь предпочтения к конкретному кодону, например бактерии, в некоторых случаях используют не такой кодон как дрожжи, и поэтому ДНК, введенная в такого хозяина, должна быть с выгодой изменена для обеспечения вырожденного кодона для данной аминокислоты, что обеспечит более благоприятную экспрессию в этом хозяине. Естественно, что такие вырожденные ДНК также включены в объем ДНК настоящего изобретения.
E. coli BL21/DEЗ/ является одним из подходящих хозяев и содержит Т7 РНК полимеразу, стабильно интегрированную в ее хромосому под контролем индуцируемого lacUV5 промотора, и таким образом совместима с конструкцией, полученной из рТ7-7. Штаммы E.coli подобно BL21 не содержат lon протеазы и протеазы ompT внешней мембранной. Их отсутствие может помочь стабилизировать экспрессию и накопление чужеродных протеинов в E.coli.
Анализы неочищенных экстрактов E.coli ВL21/ДЕЗ/, содержащих каждую из трех экспрессирующих конструкций, описанных ранее, показывает, то наивысшие уровни экспрессии люциферазы получены для клеток, содержащих конструкцию pPW304.
Мутантные протеины настоящего изобретения отличаются и другими преимуществами, помимо термостабильности. Было обнаружено, что мутация аминокислоты в положении 354 Photinus /356 Luciola обеспечивают изменение длины волны испускаемого света при окислении люциферина в зависимости от аминокислоты или аналога, которыми замещен глутамат. Таким образом, в настоящем изобретении предложены люциферазы для использования в качестве меток специфических связывающих агентов, и репортерных генов, которые обеспечивают идентификацию в виде специфической длины волны света, когда окисление люциферазы происходит с использованием их протеинов; это свойство позволяет использовать такие мутации, как глицин, пролин и аспартат. Другим преимуществом протеинов настоящего изобретения, определяемым их повышенной термостабильностью, является способность получать их при высоких температурах, например при 37oС или выше, что соответственно повышает выход, как будет проиллюстрировано далее.
Далее протеины, ДНК, векторы и клетки настоящего изобретения будут проиллюстрированы со ссылками на следующие нелимитирующие примеры, чертежи, таблицу и описания последовательностей. Другие протеины, конъюгаты протеинов, ДНК, векторы и клетки, а также способы анализов и тестовые наборы, их содержащие, будут очевидны специалистам в свете вышеизложенного.
Описание черитежей
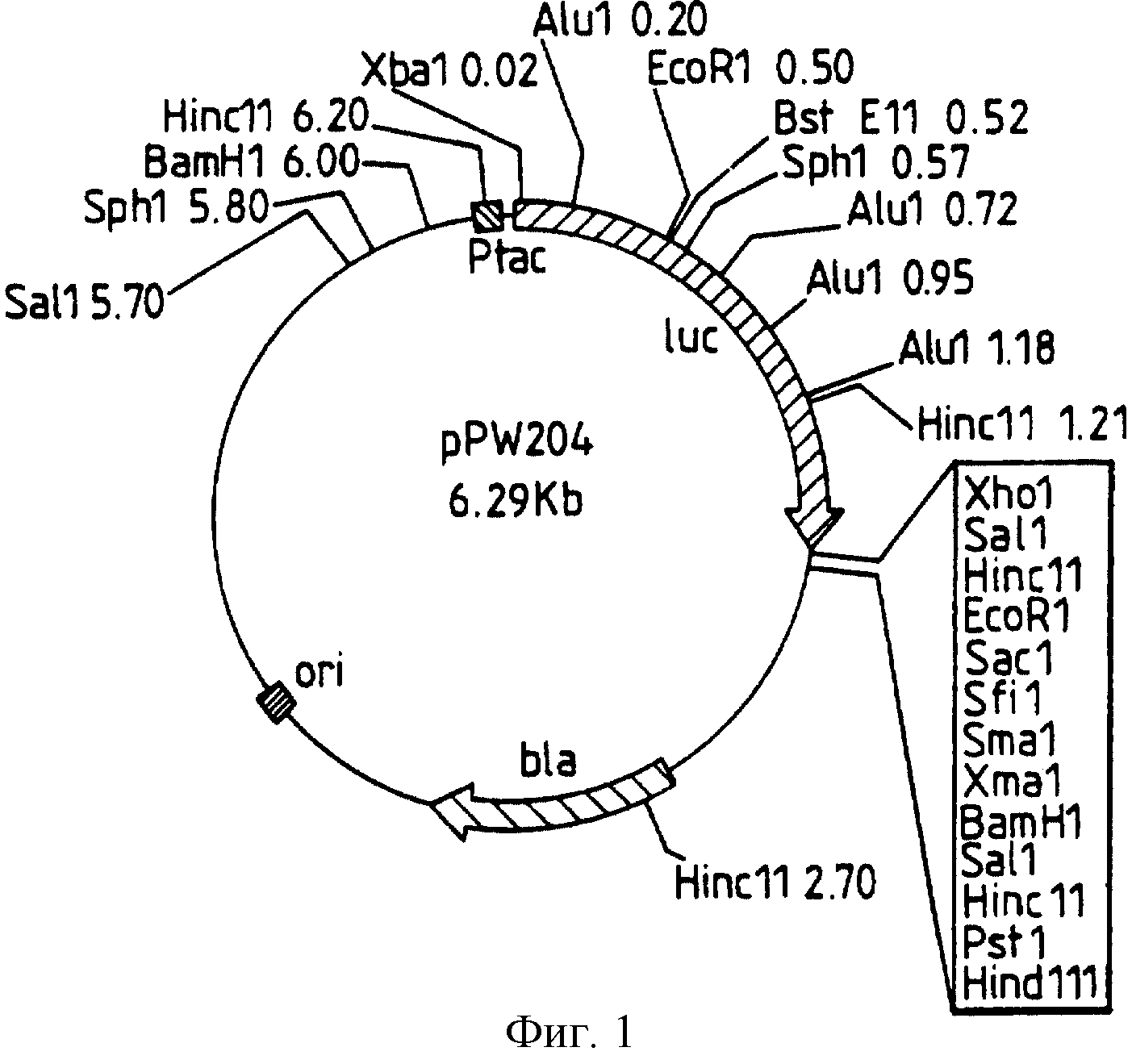
Фиг. 1:
представляет рестрикционную карту плазмиды pPW204, полученной из рКК223-3 за счет встраивания luc
гена, как раскрыто в следующих далее примерах.
Фиг. 2: представляет рестрикционную карту плазмиды pPW116, полученной из рDR540, за счет встраивания luс гена, как раскрыто в следующих далее примерах.
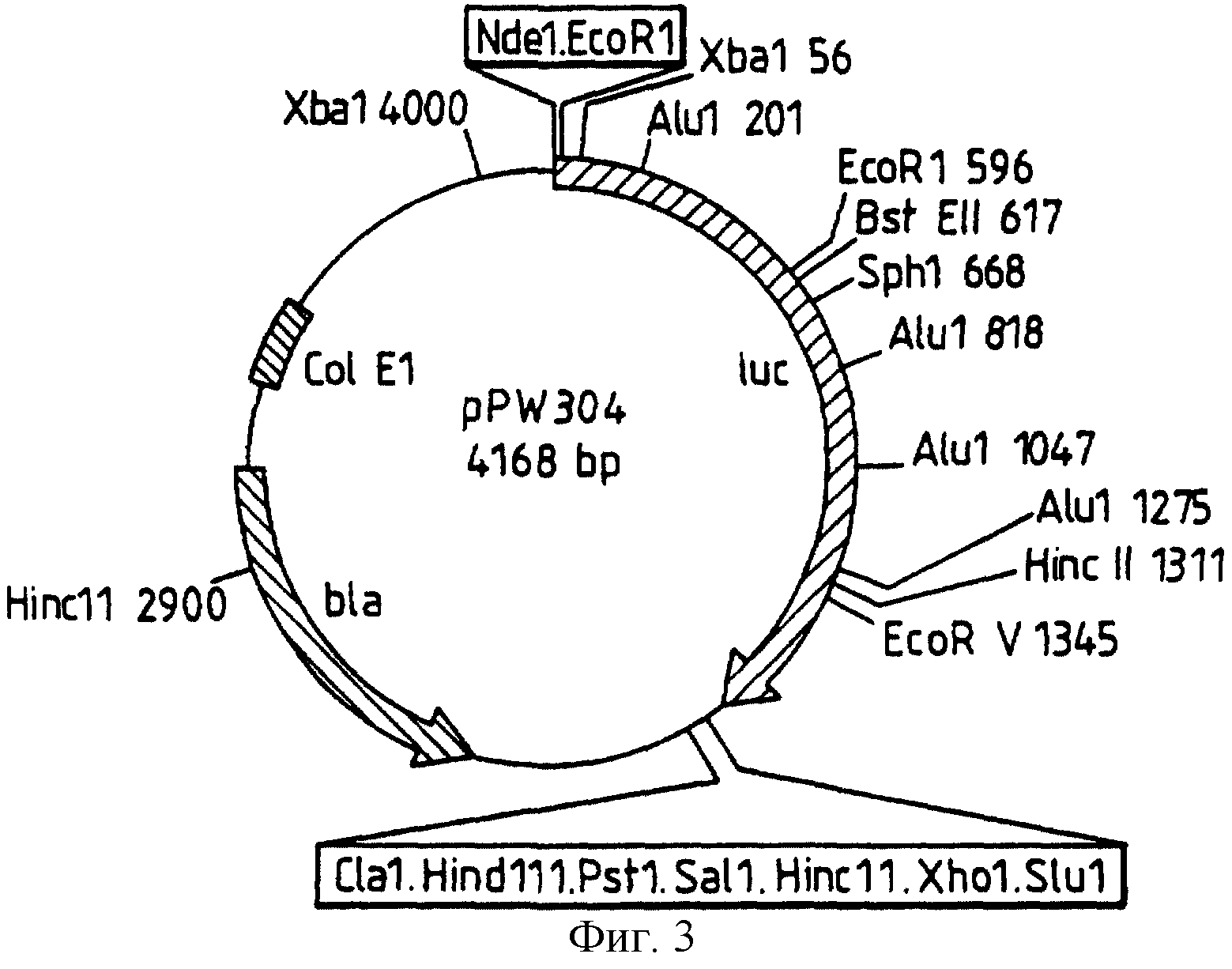
Фиг. 3: представляет рестрикционную карту плазмиды рРW304, полученной из рТ7-7 за счет встраивания luс гена, как раскрыто в следующих далее примерах.
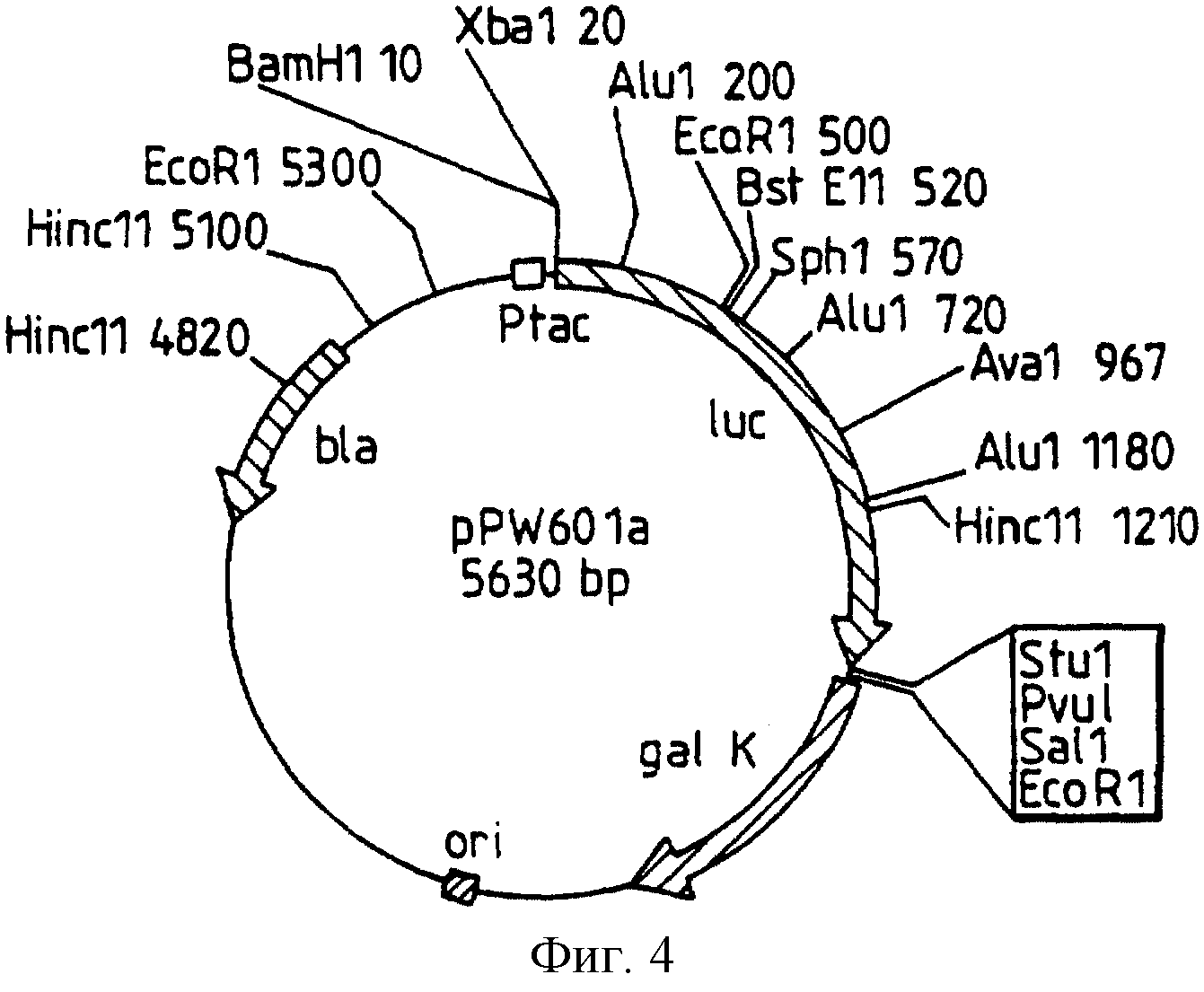
Фиг.4: представляет рестрикционную карту плазмиды pPW601a, полученной из pDR540 и ВаmН1/Ssт1 фрагмента из pGEM-luc, с удаленным Xhо сайтом.
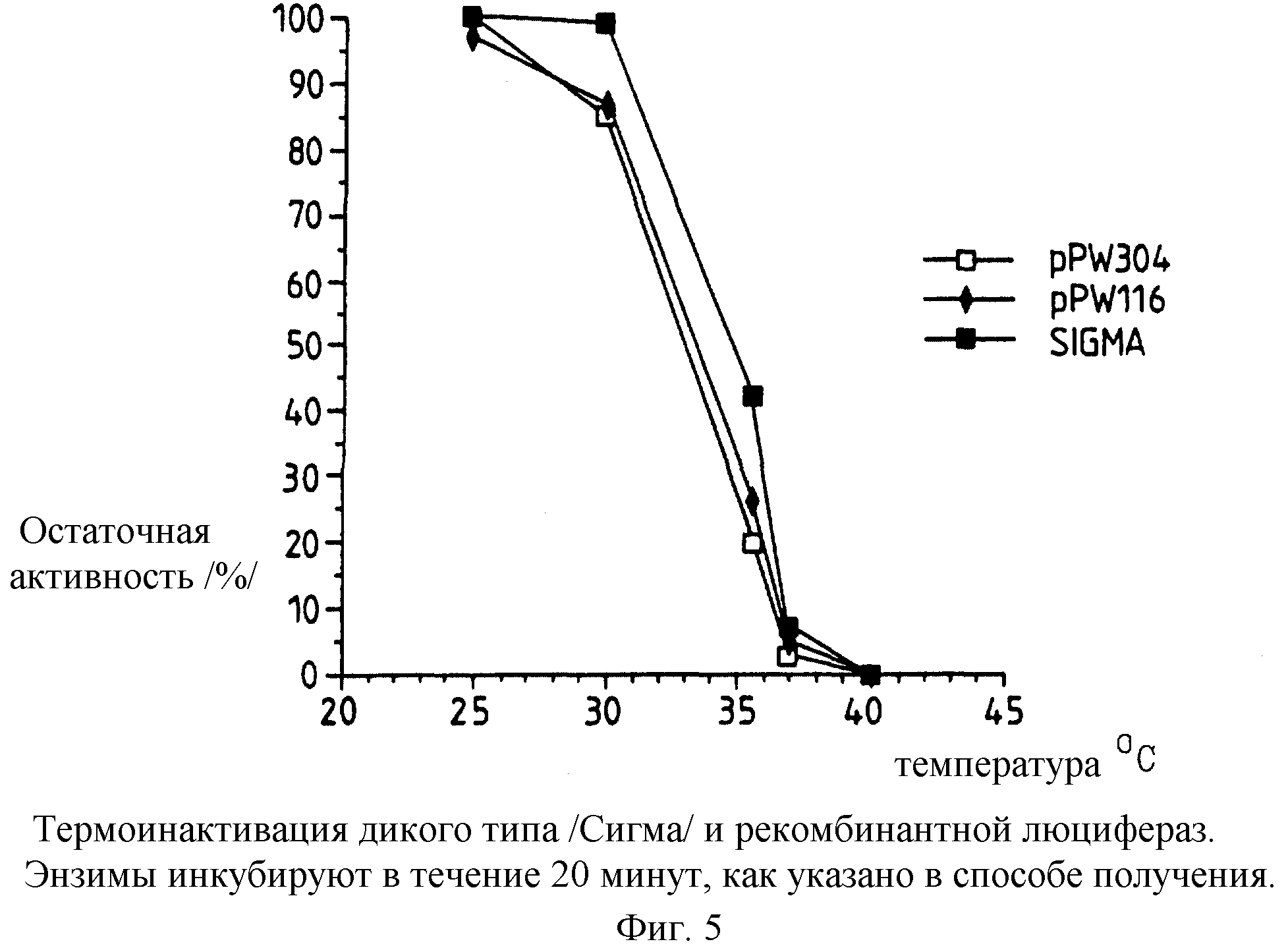
Фиг. 5: представляет график термоинактивации рекомбинантной люциферазы и люциферазы дикого типа Photinus /Sigma/, инкубируемых при заданной температуре в течение 20 минут, как раскрыто в следующих далее примерах.
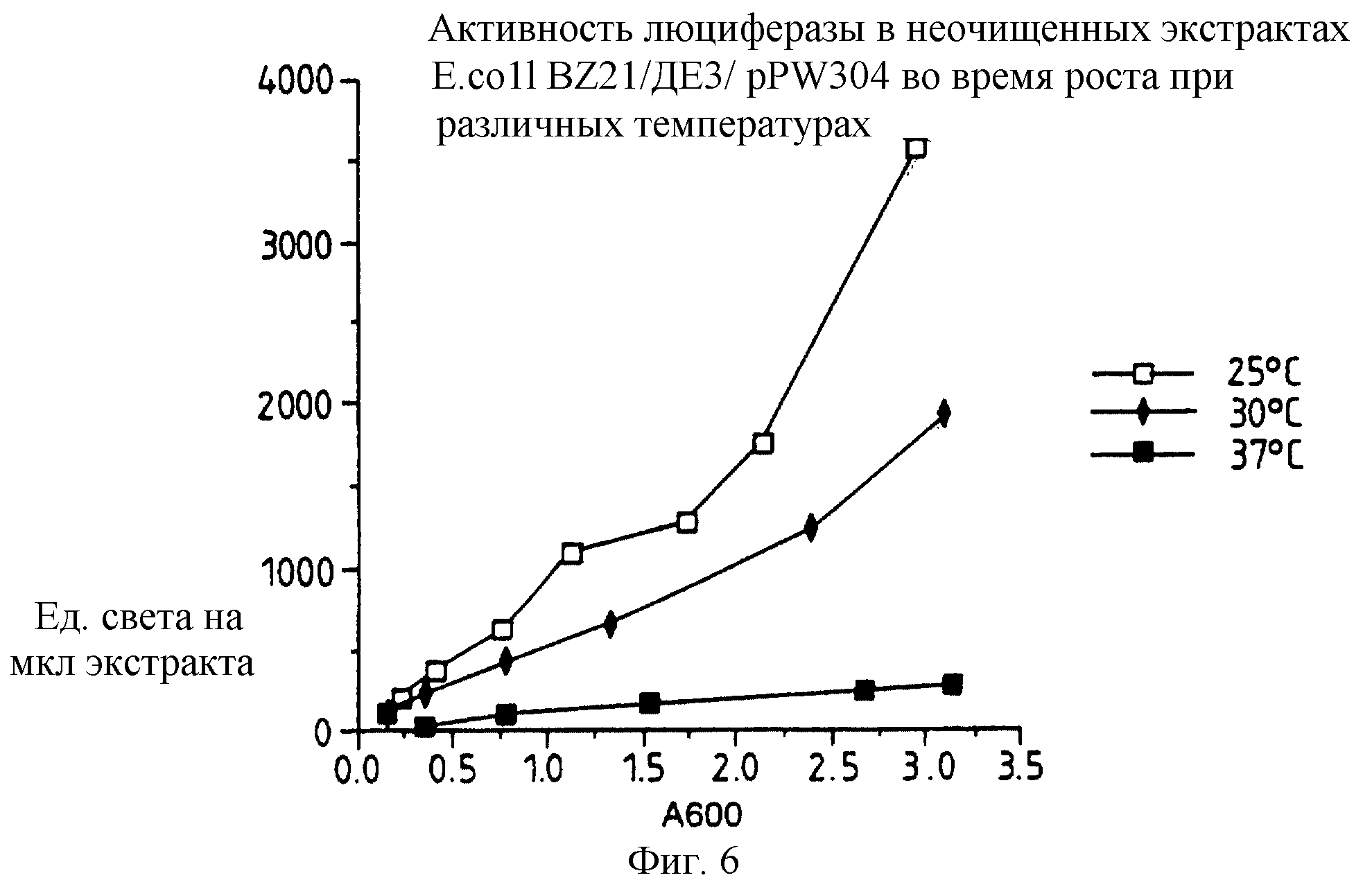
Фиг. 6: представляет график активности люциферазы в неочищенных экстрактах E.coli BL21/DЕЗ/pPW304 во время роста при различных температурах.
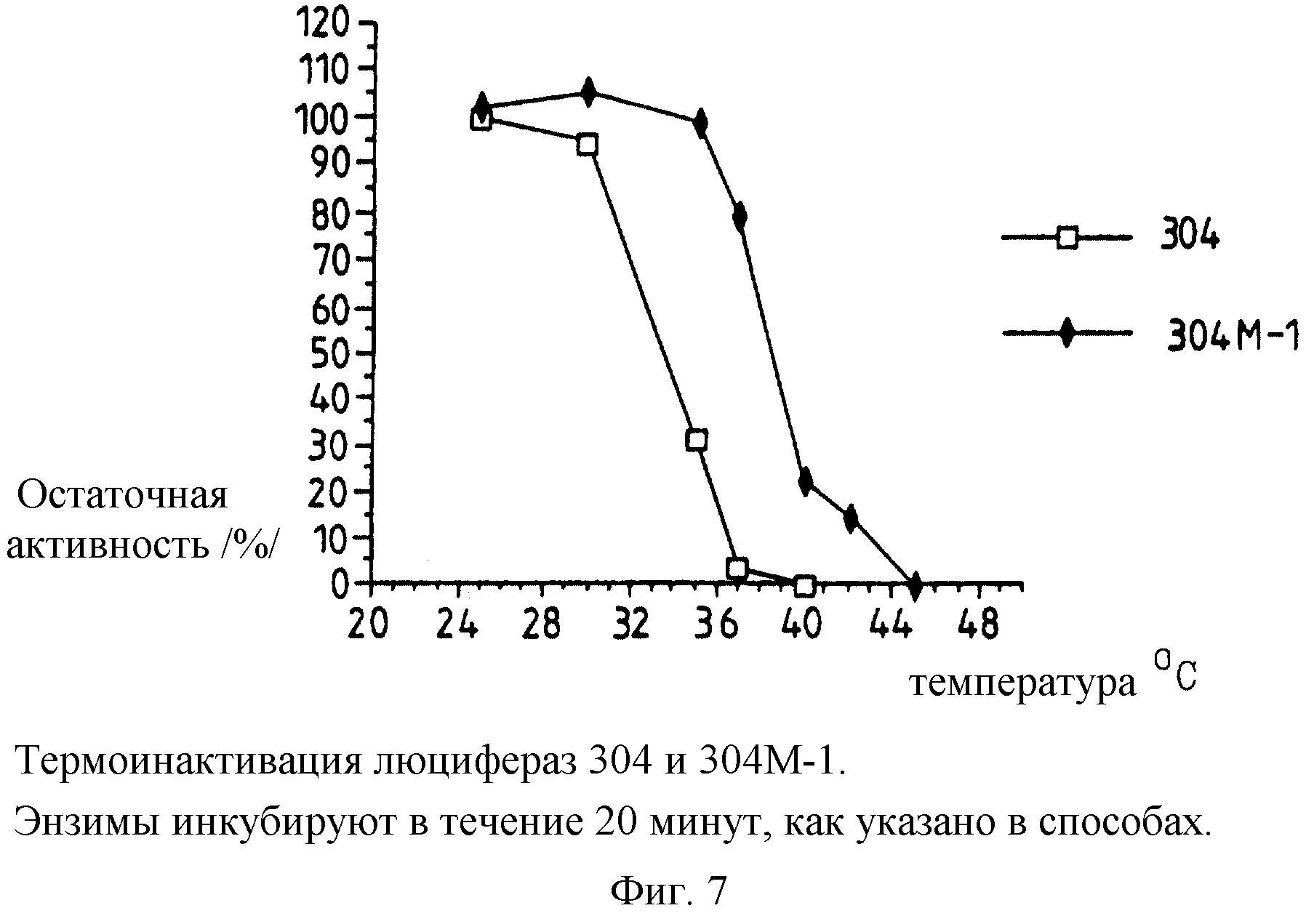
Фиг. 7: представляет график термоинактивации активности люцифераз, полученных из pPW304 и pPW304M-l /плазмида настоящего изобретения, закодированная так, что лизин замещает глутамат 354/.
Фиг. 8: представляет график зависящей от времени инактивации дикого типа /Sigma/ и pPW304 и pPW304M-1 рекомбинантной люцифераз при 37oС.
Фиг.9: представляет рестрикционную карту рТ7-7 по Tabor.
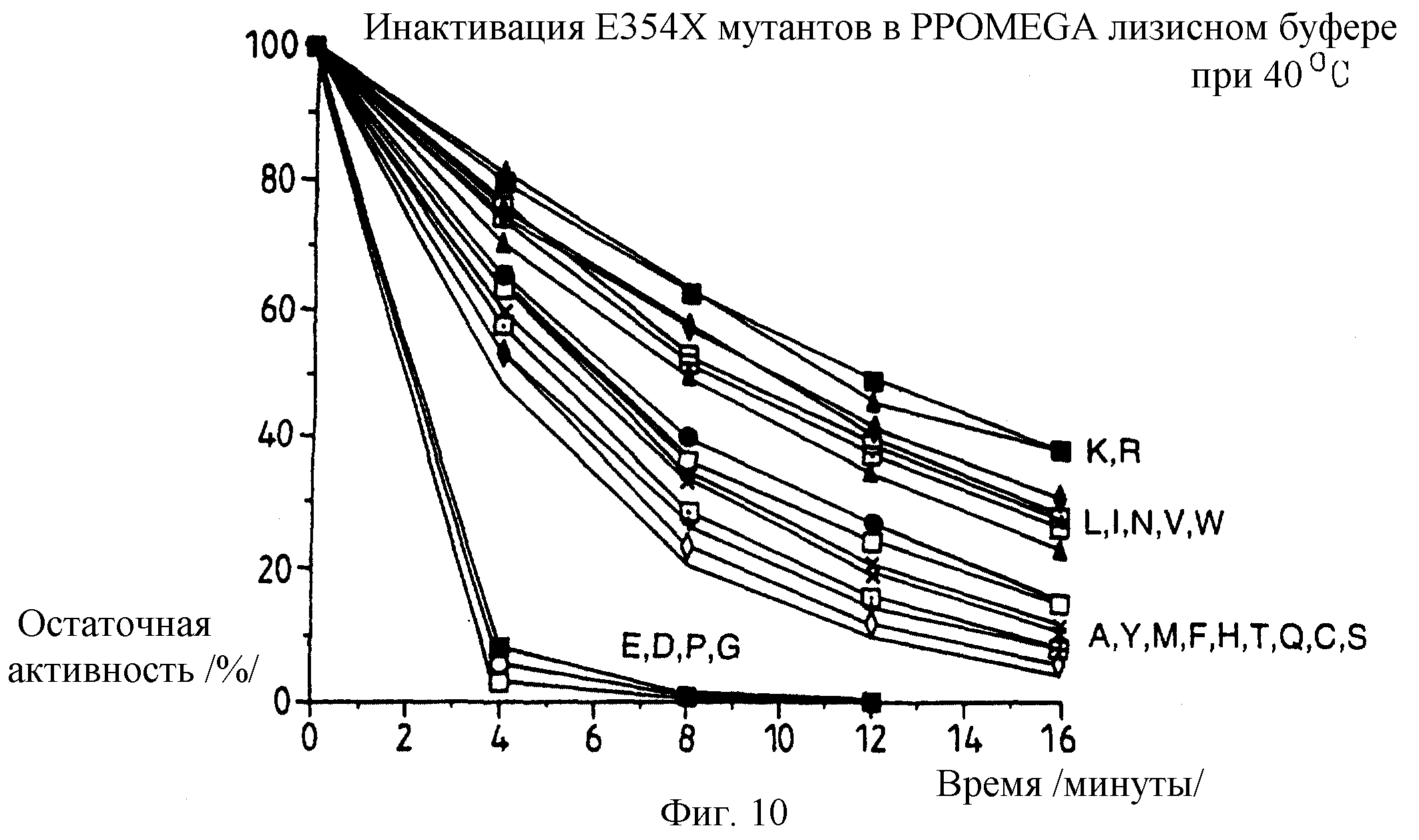
Фиг. 10: представляет график, иллюстрирующий термоинактивацию в лизисном буфере /Prоmega/ при 40oС активности неочищенных клеточных экстрактов E.coli, экспрессирующей люциферазу настоящего изобретения, экспрессирующую люциферазы с замещениями аланином, валином, лейцином, изолейцином, тирозином, фенилаланином, триптофаном, глютамином, гистидином, аспарагином, метионином, аргинином, лизином, серином, треонином и цистеином соответственно глутамата дикого типа в положении 354.
Фиг. 11: представляет график, иллюстрирующий термоинактивацию активности очищенной дважды мутантной люциферазы, содержащей Е354К лизина и А215L лейцин замены при 47oС в фосфатном буфере по сравнению с одномутантными А215L и Е354К.
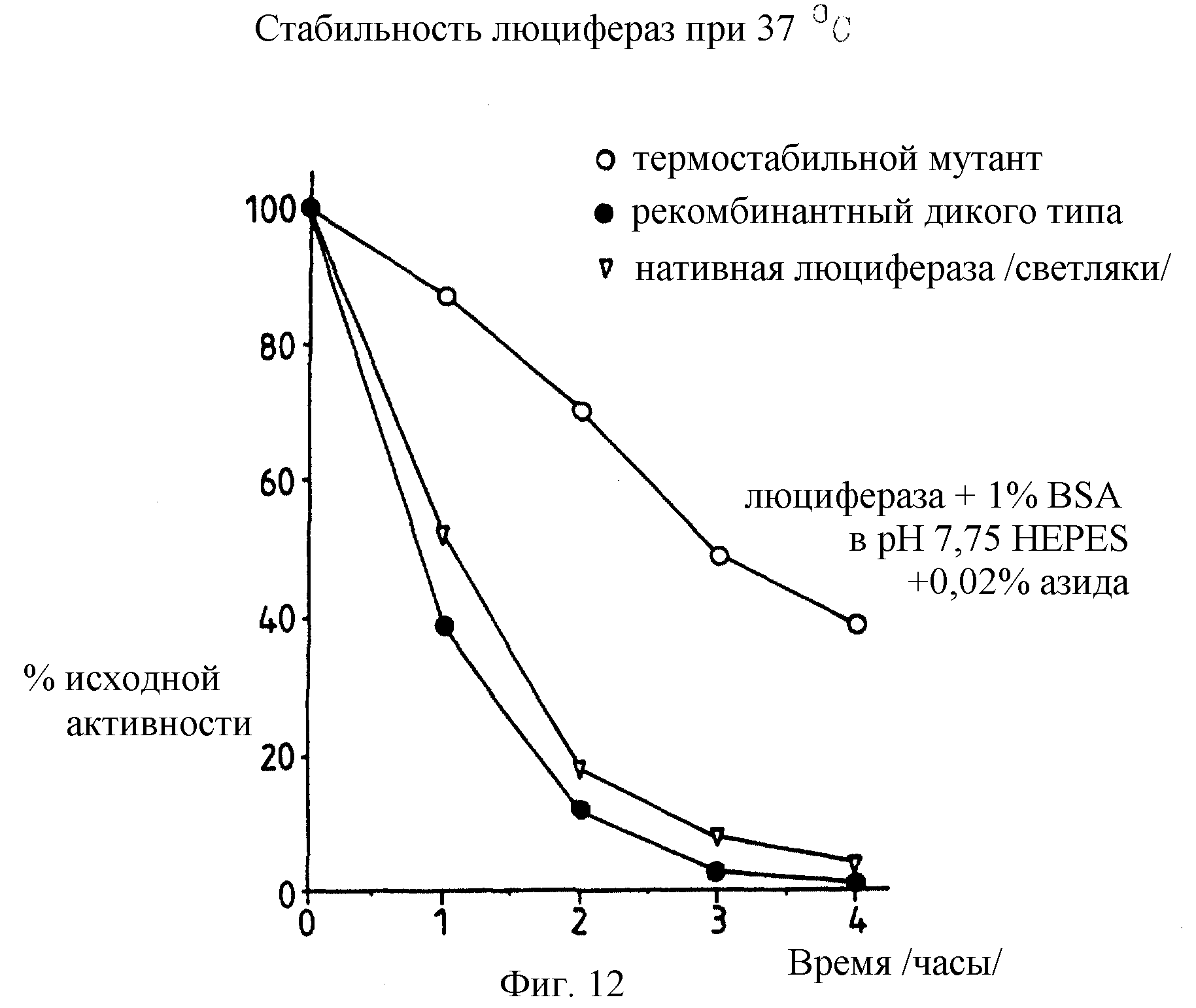
Фиг. 12: представляет график /в %/ исходной активности мутантной Е354К лизин; рекомбинантной дикого типа и нативной /светляковой/ люцифераз, остающейся при 37oС и рН7 в зависимости от времени. Буфер 7,75 НЕРЕS с 0,02% азида.
Фиг.13: представляет график экспрессии люциферазы при 37oС для рекомбинантного дикого типа, Е354К однократного и E354K+A215L двойного мутантов при повышении оптической активности, как меры плотности клеток культуры в зависимости от активности люциферазы.
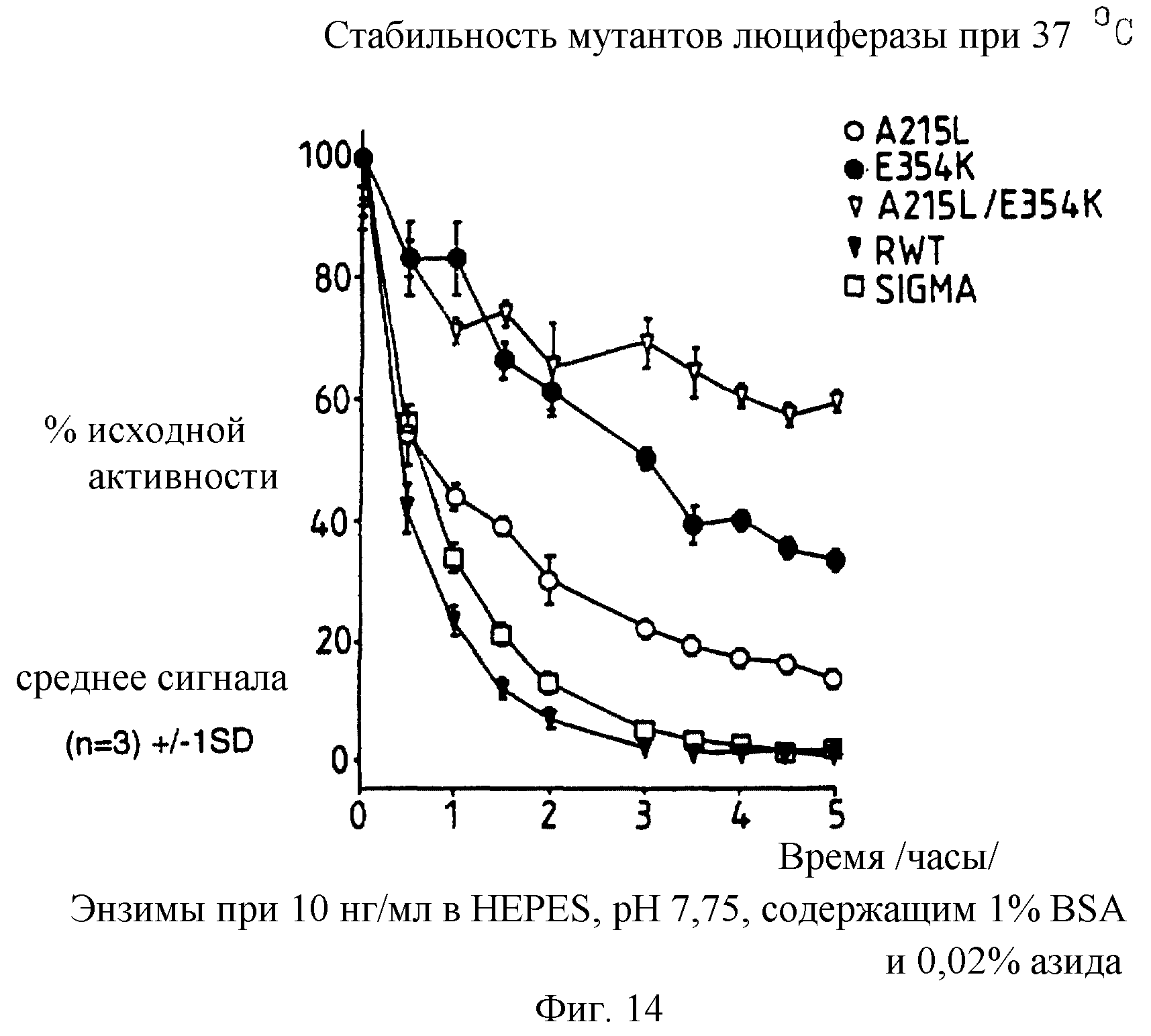
Фиг. 14: представляет график /%/ исходной активности в зависимости от времени 10 нг/мл каждого из А215L и Е354К однократного, А215L+Е354К двукратного мутантов, рекомбинантной дикого типа /Sigma/ люцифераз после 5 часов в HEPES, рН 7,75, содержащем 1% ВSА и 0,02% азида при 37oС.
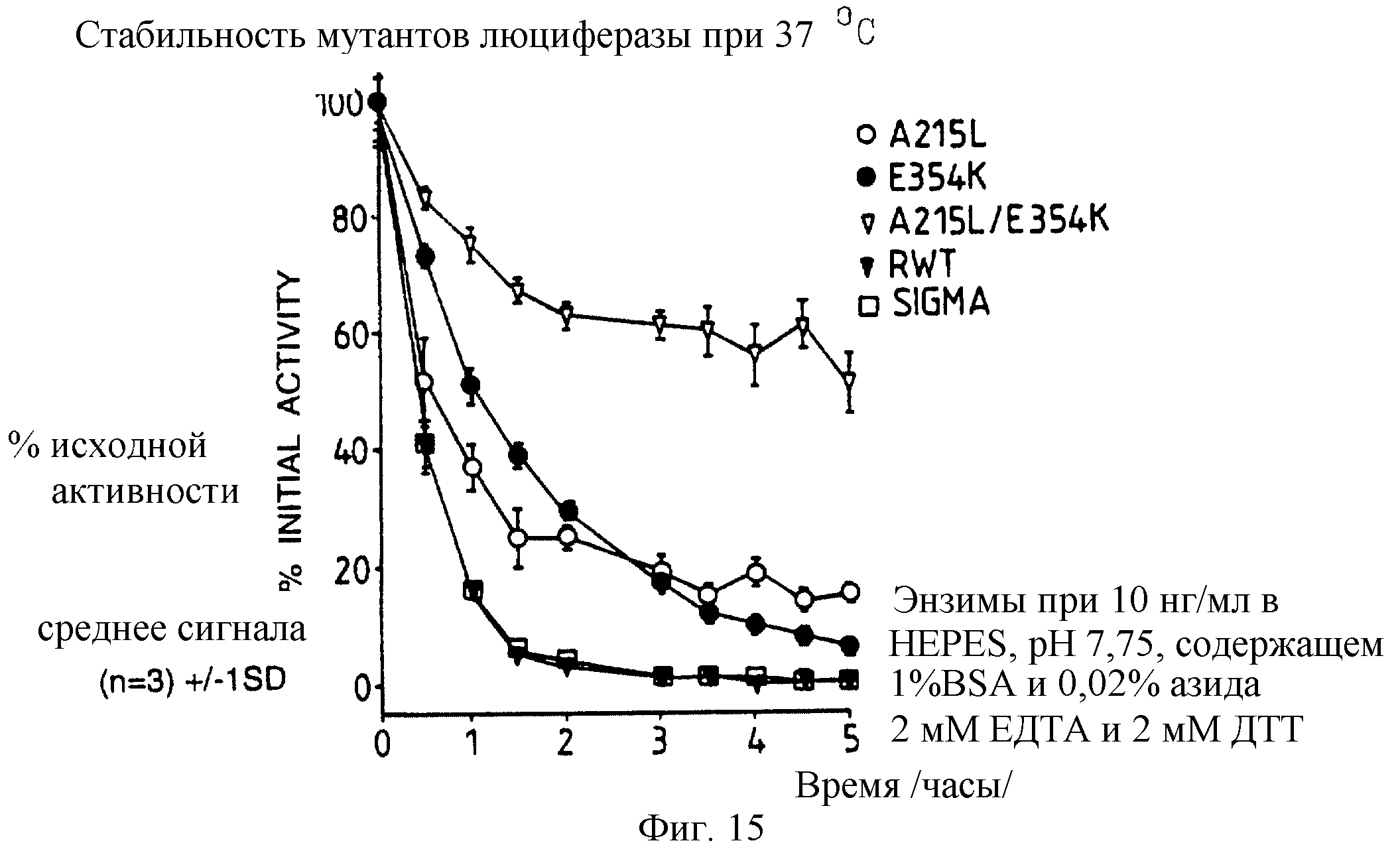
Фиг. 15: представляет график /%/ исходной активности в зависимости от времени, 10 нг/мл каждого из A215L и Е354К однократного и А215L+Е354К двукратного мутанта, рекомбинантной и дикого типа /Sigma/ люциферазы после 5 часов в HEPES рН 7,75, содержащем 1% ВSА, 0,02% азида, 2 мМ ЕДТА и 2 мМ ДТТ при 37oС.
Описание последовательностей:
Описание последовательностей, представленное в конце описания, описывает
последовательности ДНК и аминокислот следующим образом.
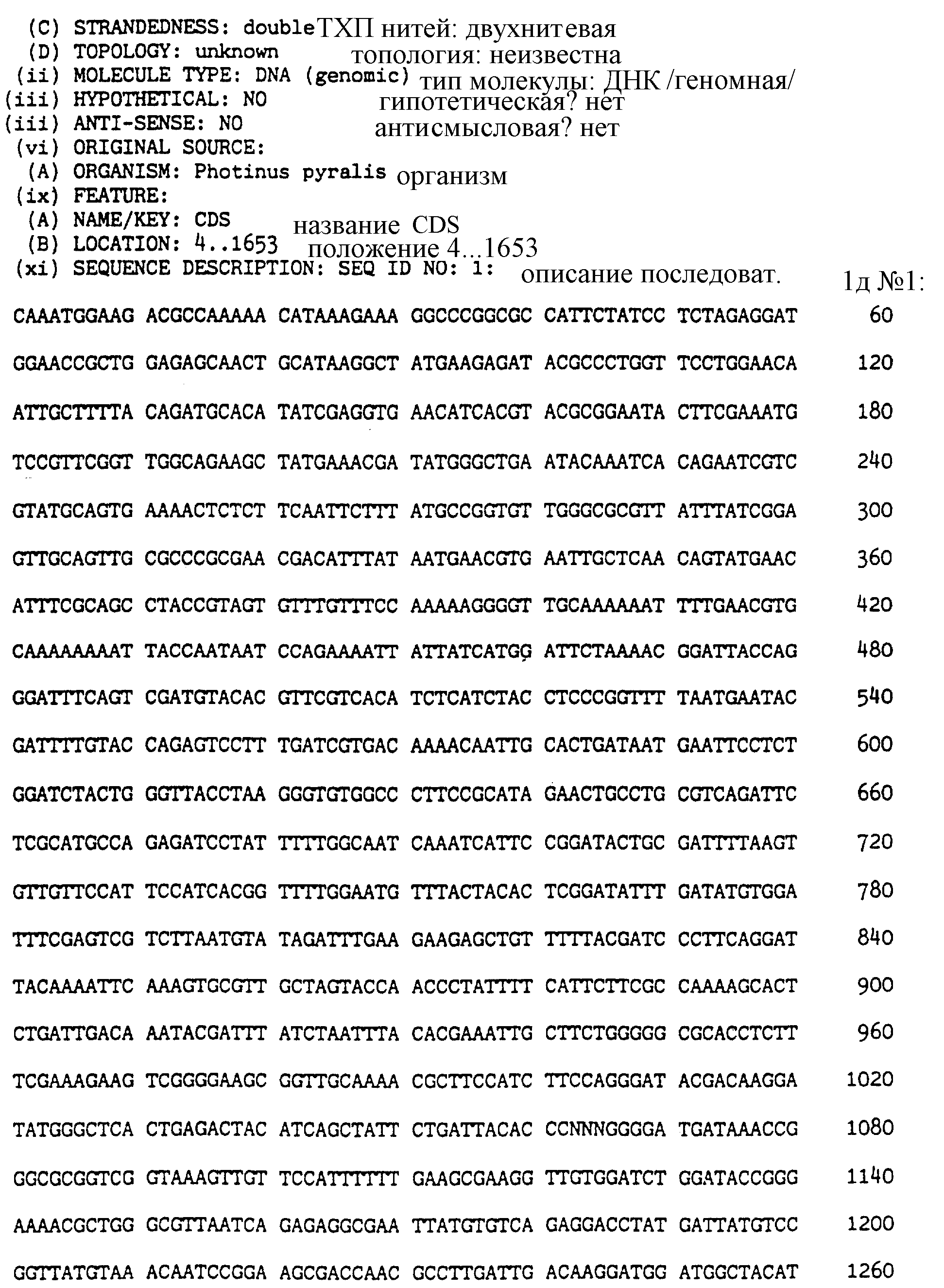
Последовательность ID 1: представляет ДНК последовательность, кодирующую люциферазу настоящего изобретения, в которой кодон дикого типа Photinus pyralis в положениях 1063 и 1065 подвергся мутациям; для лизина основание 1063 в результате мутации представлено А.
Последовательность ID 2: представляет аминокислотную последовательность протеина настоящего изобретения, в котором глутамат аминокислоты в положении 354 Photinus pyralis был заменен на другую аминокислоту.
Последовательность ID 3: представляет последовательность олигонуклеотида, использованного для SDМ мутации рРW601 для получения лизина вместо глутамата в положении 354 в пример 2.
Последовательность ID 4: представляет последовательность олигонуклеотида, использованную для SDM мутации в pPW601 для получения лейцина в положении 215 в примере 5.
Последовательность ID 5: представляет аминокислотную последовательность протеина настоящего изобретения, в котором аминокислота в положении 354 /глутамата/ Photinus pyralis дикого типа была заменена на любую другую аминокислоту, и аминокислота в положении 215 была заменена на лейцин.
ПРИМЕРЫ
Пример 1: Получение плазмид, содержащих ДНК настоящего изобретения.
Плазмиды рКК223-3 и pDRR540 получают от Boehringer Mannheim; pDR540 доступна также от Pharmacia.
Плазмиду рТ7-7 /см. Current brotocols in Molecular Biology Vol. 11, Section 16, 2.1/ получают от Stan Tabor, Dept. of Biol. Chem. Harvard Medical School, Boston, Mass, 02115 и /как видно на фиг.8/ она содержит Т7 РНК полимеразный промотор ⌀ 10 и сайт начала трансляции для Т7 гена 10 протеина /Т7 bp 22857 до 22972/, встроенные между Pvull и Clal сайтами рТ7-5. Уникальные рестрикционные сайты для создания протеинов слияния /после заполнения 5' концов/ представляют рамку О: EcoRI, Рамку 1: NосI, SmaI, ClaI; Рамку 2: BamHI, SalI, HindIII.
Сайт SacI исходного полилинкера удаляют за счет делении и вводят дополнительный XbaI сайт в обратном направлении от стартового кодона.
Люциферазу светляков /полученную из кристаллической суспензии. Кат. L9009/ коэнзим А и АТР получают от Sigma.
Сигма Кемикал Ко. Калиевую соль люциферина жуков получают от Promega. Клеточные экстракты приготавливают в соответствии с указаниями технического бюллетеня Promega 101. Аликвоты культур E.coli подвергают лизису в лизисном реагенте клеточных культур /25 мМ Tris-фосфата, рН 7,8, 2 мМ ДТТ, 2 мМ ЕДТА, 10% глицерина, 1% Triton Х-100, 2,5 мг/мл ВSА, 1,25 мкг/мл лизоцима/ в течение 10 минут при комнатной температуре, а затем хранят на льду до анализа.
Люциферазную активность клеточных линий анализируют, измеряют биолюминесценцию колоний, перенося их на найлоновые фильтры /Hybond N., Amersham/, а затем смачивая эти фильтры 0, 5 мМ растворы люциферина в 100 мМ натрийцитратном буфере рН 5,0 /Wood and De Luka. //1987/ Anal. Biochem. 16l p. 501-507/. Анализ люциферазы ин витро осуществляют при 25oС, используя 125 мкл аналитического буфера /20 мМ Tricine, 1 мМ MgSO4, 0,1 мМ ЕДТА, 33,3 мМ ДТТ, 0,27 мМ коэнзима А, 0,47 мМ люциферина, 0,53 мМ АТР и от 1 до 2 мкл образца/. Окончательное значение рН аналитической смеси составляет 7,8, и излучение измеряют с помощью люминометра BioOrbit 1250.
Для получения неспецифических химический мутаций ДНК плазмиды, содержащие luc гены, обрабатывают по способу Kironde et al. /1989/ Biochem. J. 259 p. 421-426, используя 0,8 М гидроксиламин, 1 мМ ЕДТА в 0,1 мM фосфате натрия рН 6,0, в течение 2 часов при 65oС. Мутагенизированные плазмиды обессоливают на колонке G60 DNA grade Nick /Pharmacia/, с последующей трансформацией в E.coli BL21 /ДЕЗ/.
Исследования термоинактивации осуществляют, инокулируя неочищенные клеточные экстракты, обладающие люциферазной активностью, при различных температурах в течение 20 минут, и измеряя остаточные активности. В исследованиях с очищенной люциферазой, полученной от Sigma, энзим разбавляют в Promega лизисном буфере перед инактивацией. Для исследования зависимости от времени пробирки Эппендорфа, содержащие 50 мкл неочищенного клеточного экстракта или Sigma люциферазы в лизисном буфере, инкубируют при 37oС. Пробирки вынимают в различные моменты времени и хранят на льду до анализа. Остаточную активность выражают в процентах от исходной активности.
Относительные уровни экспрессии люциферазы для каждой из конструкций рРW204, pPW116 и рРW304 составляют 0,1:0,5:1,0 из E.coli ВL21 /DЕЗ/. Клетки выращивают в LВ при 37oС до оптической плотности ОД 600 с 0,3, затем индуцируют IPTG и культивирование продолжают в течение 4 часов, после чего приготавливают неочищенный экстракт и измеряют люциферазную активность.
Таблица: Рибосомные связывающие сайты /подчеркнуты/ и стартовые кодоны в конструкциях экспрессии, использованные в примере 1.
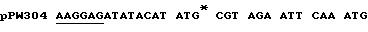

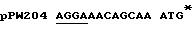
Сайт-направленный мутагенез, необходимый для превращения глутамата в альтернативную аминокислоту, осуществляют, используя следующую схему.
Так как мутация глутамата в лизин находится в уникальном Aval рестрикционном сайте и таким образом его разрушает, имеется возможность использовать один нуклеотид в качестве мутагенного и селекционного олигонуклеотида.
Схема
сайт-направленного мутагенеза:
Выбранную плазмиду денатурируют и отжигают с селекционно/мутагенным нуклеотидом для
лизина:

Трансформацию в клетки, здесь E.coli BMH 71-18 mut S клетки, осуществляют, используя Bio-Rad Gene Pulser, модель 2-89. Получают собранные клетки и очищенный смешанный плазмидный пул, содержащий мутированную и исходную плазмиды, и осуществляют вторичный рестрикционный перевар А за счет Аvа1 перед трансформацией клеток E.coli JM109. Эти клетки высевают на селективную среду /LB агар + 50 мкг/мл ампициллин/ и клоны скринируют, очищают их плазмидную ДНК и анализируя потерю Aval рестрикционного сайта. Плазмидную ДНК выделяют в каждом случае, используя способ щелочного лизиса Birnboim and Doly /1979/ Nucleic Acid Research 7, р. 1513. Точные схемы соответствовали описанным в TransformerRTM Site-Directed Mutagenesis Kit /вариант 2/, продаваемом Clontech Laboratories Inc. /US/ каталожный К1600-1.
Рестрикционная карта для рРМ/601а, варианта рРW/116, полученного от Pharmacia pDR540, и BamHI/SstI фрагмента из pGEM-luc с разрушенным сайтом Xho, представлена на фиг.4. Сайт-направленный мутагенез осуществляют, как указано ранее, и в инструкциях Clontech для превращения дикого типа Photinus luc гена, встроенного в них, в последовательность, представленную как последовательность IД 1, где 1063-1065 представляют ААG, с экспрессированным протеином аминокислотной последовательности, модифицированной в положении 354, как представлено в последовательности IД 2, в лизин.
Пример 2: Термостабильность люцифераз.
Термостабильность различных люцифераз, экспрессированных немодифицированным и модифицированными /т.е. настоящего изобретения/ luc генами в векторах в E.coli, полученных, как указано ранее, определяют, и полученные результаты представлены на фиг.5-8.
Сравнение
t1/2 /полужизнь/ активности 50 мкг/мл люциферазы при 43,5oС в 50 мм калийфосфатного буфера рН 7,8, 1 мМ ЕДТА, 0,2% /вес/объем/ ВSА, 1 мМ ДТТ
и 10% сульфат аммония, демонстрирует
50% остаточную активность, которую достигают за следующие промежутки времени:
Люцифераза дикого типа /Sigma/ t1/2 достигают примерно за 1,5
минуты
pPW601
/354=глутамат/ t1/2 достигают примерно за 5 минут
рРW/601аК /354=лизин/: t1/2 достигают примерно за 30 минут.
Таким образом, из указанных чертежей очевидно следует, что замена глутамата 354 лизином увеличивает термостабильность люциферазы по крайней мере вплоть до 43,5oС.
Пример 3. Термостабильность люциферазы.
Определяют термостабильность ряда люцифераз, экспрессированных SDM модифицированными 1uс генами, соответствующими другому положению 354 мутаций настоящего изобретения в векторах в E.coli, полученных способами, аналогичными описанным в примере 1, и полученные результаты графически представлены на фиг.10.
Проводят сравнение t1/2 при 40oС в лизисном
буфере /Promega/, полученные результаты для t1/2 в минутах составляют:
pPW601aK /354=лизин/ достигает t1/2 примерно за 13 минут
рРW/601аR
/"=аргинин/ " " " 13
минут
pPW/601aL /"=лейцин/ " " " 10 минут
pPW601aI /"=изолейцин/ " " " 10 минут
рРW/601аN /"=аспарагин/ " " " 10 минут
рРW/601аV /"=валин/ " "
" 9 минут
pPW601АW /"=триптофан/ " " " 8 минут
рPW601аА /354=аланин/ " " " 6,5 минут
рРW601aY /"=тирозин/ " " " 6,5 минут
рРW601аМ /354=метионин/ " " " 5,5 минут
pPW60laF
/"=фенилаланин/ " " " 5 минут
pPW60laH /"=гистидин/ " " " 5 минут
pPW601aT /"=треонин/ " " " 4,5 минут
pPW601aQ /"=глутамин/ " " " 4,5 минут
рРW/601аС
/"=цистеин/ достигает t1/2 примерно за 4 минуты
рРW/601aS /"=серин/ " " " 3,5 минуты
pPW601aE /"=глутаминовая кислота/ " " " 1 минуту
рРW601аД
/"=аспарагиновая
кислота/ " " " 1 минуту
рРW/601аР /"=пролин/ " " " 1 минуту
pPW601aG /"=глицин/ " " " менее чем за 1 минуту
Пример 4: Стабильность люцифераз при 37oС и комнатной
температуре.
Люциферазы pPW601K лизиновой мутации /86 нг/мл/, рекомбинантные дикого типа /550 нг/мл/ и нативного типа /Sigma/ /62,5 нг/мл/ инкубируют в течение 4 часов при 37oС в 1% ВSА, рН 7,75 НЕРЕS буфере с 0,02% азидом в качестве консерванта. Для измерения остаточной активности 1 нг люциферазы добавляют к D-люцифериновому субстрату и записывают акты люминесценции в минуту.
Полученные результаты представлены далее в единицах остаточной активности после инкубирования в течение 2 часов при 37oС и спустя 10 дней при комнатной температуре.
Спустя 2 часа при 37oС:
Е354К мутантная люцифераза 70% остаточной активности
Рекомбинантная дикого типа
люцифераза 12% "
"
Нативная люцифераза /Sigma/ 18% " "
Спустя 10 дней при комнатной температуре
Е354К мутантная люцифераза 85% остаточной активности
Рекомбинантная дикого типа
люцифераза 59% " "
Нативная люцифераза /Sigma/ 71% " "
Пример 5: Получение и стабильность 354K:215L двойного мутанта.
Двойной мутант 354 лизин: 215 лейцин
рРW601а Photinus pyralis люциферазы получают, беря pPW601aE354K примера 1 и осуществляя его мутацию, используя олигонуклеотид с последовательностью IД 4

При температуре 43,5oС в фосфатном буфере происходит менее 5% потери активности более чем за 32 минуты, тогда как при 47oС t1/2 составляет примерно 38 минут. При 50oС двойной мутант сохраняет 15% активности после 16 минут инкубирования. Результаты этого теста на инактивацию представлены графически на фиг.12.
Пример 6: Очистка люцифераз.
E.coli JM109 клетки, экспрессирующие рекомбинантные дикого типа или мутантные люциферазы, выращивают при 30oС в бульоне Лурье /LВ=Luria Broth/, содержащем 50 мкг/мл ампициллина и индуцируют за счет IPTG /1 мМ/ во время ранней логарифмической фазы. Клетки собирают в средней стационарной фазе и снова суспендируют в 50 мМ Tris-HC1 рН 8,0, содержащем 50 мМ КС1, 1 мМ дитиотреитола, 1,2 мМ фенилметилсульфонилфторида /РМSF/ и 1 мМ ЕДТА /Буфер А/. Клетки разрушают в МSЕ 150 ультразвуковом дизинтеграторе /амплитуда 14 мкм/, и полученный клеточный лизат центрифугируют при 3000 g в течение 30 минут. Надосадочную жидкость неочищенного экстракта фракционируют за счет сульфата аммония, причем оказывается, что фракции, осаждавшиеся при концентрациях от 35% до 55% насыщения, содержат люциферазную активность, и их растворяют в буфере А.
Полученный экстракт обессоливают на колонке Pharmacia PD10, уравновешенной 50 мМ Tris-HCl рН 8,0, содержащем 0,5 мМ DТТ /буфер В/ и обессоленный экстракт вводят в Pharmacia Mono Q анионо-обменную колонку и элюируют линейным градиентом от 0 до 500 мМ NaCl буфера В при скорости потока 4 мл/мин на фракции по 2 мл. Фракцию с пиковой люциферазной активностью собирают и диализуют против 25 мМ натрийфосфатного буфера, рН 7,5, содержащего 0,5 мМ ДТТ и 12% /объем/объем/ глицерина для длительного хранения.
Пример 7: Термоинактивация очищенных люцифераз.
Пробирки Эппендорфа, содержащие экстракты/без клеток/ люциферазы, получают по способу примера 6. Очищенные препараты люциферазы /50 мкг/мл/ инкубируют в буфере термостабильности, содержащем 50 мМ калийфосфатного буфера рН 7,8, содержащего 10% насыщенного сульфата аммония, 1 мМ дитиотреитола и 0,2% альбумина бычьей сыворотки /ВSА/. В определенные моменты времени пробирку удаляют и охлаждают в бане со смесью лед/вода перед анализом, причем определенную остаточную активность рассчитывают как процент от исходной активности.
Кривые Аррениуса для очищенных рекомбинантной дикого типа и термостабильной люцифераз строят, измеряя срок полужизни для инактивации в буфере термостабильности в интервале температур от 42oС до 50oС. Затем откладывают натуральный логарифм t1/2 в минутах от 1/К. Для эквивалентной скорости инактивации Е354К мутация повышает термостабильность на 2oС при температурах в этом интервале по сравнению с повышением 5oС для A215L мутации, и 6oС для двойного мутанта E354K+A215L; причем последний демонстрирует аддитивный характер двойной мутации.
Пример 8: Повышение экспрессии мутантной люциферазы по сравнению с дикого типа рекомбинантной люциферазой в Е.соli.
Экспрессию люциферазы в E.coli JM109 клетках фиксируют во время роста в жидкой культуре при 37oС. Оказывается, что клетки, экспрессирующие термостабильные мутанты, более активно накапливают люциферазу во время роста, нежели клетки, экспрессирующие рекомбинантный дикого типа энзим. На фиг.13 этот эффект представлен графически, где люциферазная активность отложена с повышающейся оптической плотностью на 600 нм для культур рекомбинантного дикого типа, E354K+A215L двойного мутанта и Е354К. Можно видеть, что повышение термостабильности одиночного и двойного мутантов позволяет увеличить производство люциферазы при температуре культуры 37oС.
Пример 9: Влияние буфера на стабильность мутантной люциферазы при 37oС.
По 10 нг/мл растворы каждой из A215L, Е354К, E354K+A215L рекомбинантной дикого типа и Sigma люцифераз приготавливают в HEPES рН 7,75 буфере с 1% ВSА и 0,02% азида, и их термостабильность при 37oС сравнивают с термостабильностью тех же составов с добавлением 2 мМ ЕДТА и 2 мМ МДТТ. Полученные результаты представлены графически на фиг.14 и 15, демонстрируя, что относительные стабильности А215L и Е354К меняются в зависимости от буфера при 37oС.
Пример 10: Влияние замены аминокислот на длину волны испускаемого света при окислении D-люциферина
Определяют длину волны испускаемого света при
окислении D-люциферина различными
люциферазами изобретения, представленными в примере 3, и оказывается, что она зависит от аминокислотной мутации. Длина волны испускаемого света меняется на 5 нм
между рекомбинантной дикого типа
/Е354/ и Е354К, и на около 15 нм между Е354К и Е354J.
Дикого типа рекомбинантные E.coli организмы характеризуются желто-зеленой люминесценцией в
присутствии D-люциферина. Свет,
испускаемый соответствующими мутантными E.coli в присутствии D-люциферина, оказывается следующим:
E354G желто-зеленый
E354N желто-зеленый
Е354А желтый
Е354N
оранжево-красный
Е354М оранжево-красный
E354F желто-зеленый
Е354L желтый
Е354Y желто-зеленый
E354S желто-зеленый
Е354С желто-зеленый
Е354К желтый
E354Q желто-зеленый
E354W желто-зеленый
Е354Т желто-зеленый
Е354Р оранжевый
E354R желто-оранжевый
Е354Н
желто-зеленый
Е354N
желтый
E354J красный
Описание последовательностей приведено в конце описания.
Реферат
Изобретение относится к области биохимии и генетической инженерии и может быть использовано в люминометрических анализах для измерения уровней АТФ. Путем замены остатка глутаминовой кислоты в консервативной области 354-361 аминокислотной последовательности люциферазы Photinus pyralis или в соответствующей области фермента, обладающего более чем 60%-ной гомологией последовательности с люциферазой Photinus pyralis, любым другим аминокислотным остатком, кроме глицина, пролина и аспартата, получены белки с люциферазной активностью и повышенной по сравнению с природным ферментом термостабильностью. Предпочтительными являются модифицированные формы люцифераз, дополнительно содержащие в положении, соответствующем 215 аминокислотному остатку последовательности люциферазы Photinus pyralis, остаток гидрофобной аминокислоты. Предложены последовательности ДНК, которые при экспрессии в хозяйской клетке обеспечивают получение указанных модифицированных форм люцифераз, пригодных для использования при температурах выше 30oС. 2 с. и 13 з.п. ф-лы, 15 ил., 1 табл.

Комментарии