Композиции штаммов bacillus и способы их применения в отношении жвачных животных - RU2783525C2
Код документа: RU2783525C2
Чертежи





























































































Описание
ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка истребует приоритет предварительной патентной заявки США № 62/341,332, поданной 25 мая 2016, которая полностью включена в настоящее описание посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[0002] Настоящее изобретение относится к композициям и способам, использующим штаммы Bacillus. В одном варианте осуществления настоящее изобретение относится к штаммам Bacillus, композициям и способам борьбы с ростом микроорганизмов, например, в корме или кормовых растениях. В ещё одном варианте осуществления настоящее изобретение относится к штаммам Bacillus, композициям и способам улучшения продуктивности животного; и, более конкретно, относится к пробиотику, содержащему микроорганизмы на основе штаммов Bacillus, для улучшения продуктивности жвачных животных.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
[0003] Организмы рода Clostridium являются грамположительными, анаэробными, эндоспорообразующими бактериями. Clostridium являются нормальными обитателями почвы и кишечного тракта животных, включая молочных коров и телят. Многие их виды встречаются повсеместно на молочных фермах и обычно обнаруживаются в сенаже, кукурузном силосе, соломе, навозе, молозиве и подстилке для крупного рогатого скота. Рост клостридий ограничен в ферментированных кормах за счет снижения рН до менее чем 5,0, но указанные организмы могут выживать в течение длительного периода даже в хорошо ферментированных кормах.
[0004] Известно более 100 видов Clostridium, некоторые из которых, как известно, вызывают кишечную болезнь, в то время как другие являются непатогенными с широким спектром ферментативных функций и промышленным применением. Виды, про которые известно, что они вызывают кишечную болезнь у животных, включают C. perfringens, C. septicum, C. sordelli и C. botulinum. Примеры заболеваний, вызываемых этими организмами, включают некротический энтерит, геморрагический синдром кишечника (ГСК), злокачественные отеки, соматические заболевания и ботулизм.
[0005] Заболевания, вызванные C. perfringens, являются серьёзной причиной экономических потерь для животноводства. В производстве молочных продуктов ГСК является одной из основных причин смерти, связанных с пищеварительным трактом, и, по сообщениям, ответственен как минимум за 2% смертей молочных животных, что установлено в ходе опроса, проведённого в 2000 году в США (Baker 2002). Позднее стали считать, что заболеваемость ГСК возрастает, но дополнительные оценки заболеваемости недоступны, поскольку отмечается выраженная сезонность заболевания, симптомы, имитирующие общие пищеварительные заболевания жвачных животных, и значительная доля пораженного крупного рогатого скота не представлена для вскрытия.
[0006] Впервые о ГСК было сообщено в 1991 году в результате наблюдения у пяти высокопродуктивных коров голштинской породы одного молочного завода в Айдахо (Sockett, 2004). Симптомы включали точечное гематомы под слизистой оболочкой, каждая из которых поражала 10-20 см тощей кишки. У одной из пяти коров была вскрытая гематома с кровотечением в просвет тонкой кишки. Общие симптомы ГСК включают внезапное снижение молочной продуктивности, боли в животе из-за закупорки кишечника и анемию (Anderson, 2002). Клиническими признаками заболевания являются снижение потребления корма, депрессия, снижение выработки молока, обезвоживание, вздутие живота и сгустки крови в кале (Dennison и др., 2002). Смерть наступает в течение 48 часов с момента начала закупорки пробкой из сгустка крови.
[0007] Хотя известно, что Aspergillus fumigatus и Clostridium perfringens участвуют в этиологии ГСК (Ceci и др., 2006; Dennison и др., 2005), этот синдром лучше описывать как полимикробный и многофакторный по своей природе. Увеличение потребления высокоэнергетической диеты, по-видимому, является наиболее вероятным общим путём для всех описанных факторов риска (Berghaus и др., 2005).
[0008] В дополнение к видам Clostridium, вызывающим кишечную болезнь, другие виды Clostridium, выделенные из жидкости рубца и фекальных образцов молочных коров, являются видами, которые, как известно, продуцируют высокие уровни ацетона, бутанола, 1,3-пропандиола и масляной кислоты в качестве конечных продуктов своего метаболизма. Известно, что эти метаболические конечные продукты ингибируют функцию рубца и желудочно-кишечных бактерий, и могут влиять на рубец и его пищеварительную функцию и снижать её эффективность. Если эти организмы присутствуют в силосе, они могут снизить питательную ценность корма.
[0009] Из-за спорадической, острой этиологии кишечных клостридиальных инфекций терапевтическое лечение, как известно, не является высокоэффективным. Таким образом, профилактические стратегии, такие как использование пробиотиков для контроля пролиферации клостридий в желудочно-кишечном тракте, являются предпочтительным направлением контроля заболеваний. Нетоксикогенные клостридиальные проблемы также можно контролировать с помощью пробиотиков. В соответствии с одним аспектом настоящего изобретения авторы настоящего изобретения провели поиск эффективного пробиотика, способного ингибировать широкий спектр патогенных и непатогенных видов клостридий. На протяжении веков бактерии Bacillus конкурировали с клостридиями в почвенной экосистеме. В ходе этого процесса определенные штаммы рода Bacillus выработали эффективные механизмы для ингибирования некоторых видов клостридий. В соответствии с одним из аспектов настоящего изобретения авторы настоящего изобретения выделили и идентифицировали несколько штаммов Bacillus, способных ингибировать широкий спектр клостридий, которые влияют на продуктивность жвачных животных. Преобладающими бактериоцинами, продуцируемыми бациллами, являются разнообразные функционально и структурно разнообразные пептиды. Они часто являются гидрофобными и циклическими с необычными аминокислотами и устойчивы к пептидазам и протеазам. Они могут быть синтезированы рибосомально или нерибосомально с помощью мультиферментных комплексов, часто с последующими посттрансляционными модификациями. Штаммы Bacillus часто продуцируют нерибосомально синтезированные липопептиды, где жирные кислоты присоединены к маленьким циклическим пептидам. Эти нерибосомально синтезированные пептиды являются структурно разнообразными (Luo и др., 2015a), так как они собраны из гетерогенной группы предшественников, но их синтез с помощью механизма с несколькими несущими тиоматрицами сохраняется (Luo и др., 2015b).
[0010] Силос является важным источником клостридиальных организмов в системах производства жвачных животных. Силос и корма могут поддерживать рост различных микроорганизмов, вызывающих порчу, таких как клостридии, бациллы, дрожжи и плесень, которые способствуют ухудшению питательной ценности. Из-за множества переменных, которые препятствуют созданию идеальных условий для сохранения силоса, молочнокислые бактерии часто используются в качестве инокулянтов для силоса, чтобы обеспечить правильное брожение и оптимальное сохранение силоса. Молочнокислые бактерии быстро растут в анаэробных условиях и становятся доминирующими микроорганизмами, присутствующими в корме, и снижают рН путем производства молочной кислоты. Хотя колиформы и плесень подавляются снижением pH до уровня ниже 5, контролировать клостридию спомощью низкого уровня pH сложнее, поскольку они могут выживать даже при pH ниже 5,0. Поэтому традиционные инокулянты молочнокислых бактерий не обладают высокой эффективностью в борьбе с клостридиями в силосе.
[0011] Борьба с клостридийными организмами в силосе важна для предотвращения вредного воздействия этих бактерий на качество силоса и продуктивность жвачных животных. Активность клостридий в силосе нежелательна из-за снижения потребления, наблюдаемого у крупного рогатого скота, когда присутствует активность клостридий, и из-за пониженного питательного качества силоса, возникающего в результате ферментации клостридий. Ферментация молочной кислоты в масляную кислоту с помощью клостридий, продуцирующих бутират, приводит к примерно 50%-ной потере сухого вещества и 18%-ной потере полной энергии кормов для силоса (McDonald и др., 1991). Кроме того, организмы клостридий, вызывающие порчу, оказывают вредное воздействие на здоровье крупного рогатого скота, о чем свидетельствует более высокая частота ацидоза при скармливании силоса крупному рогатому скоту (Seglar, 2003).
[0012] Хотя бациллы считаются организмами, вызывающими порчу силоса, известно, что некоторые представители рода Bacillus продуцируют антимикробные соединения, способные контролировать рост и выживание клостридий (Hong и др., 2005). Наличие бактерий Bacillus может привести к ускорению порчи силоса после воздействия кислорода, но редко влияет на ферментацию урожая в анаэробных условиях получения силоса (Muck, 2010). Следовательно, бактерии Bacillus могут быть использованы во время силосования для контроля роста организмов клостридий, вызывающих порчу. Штаммы Bacillus, идентифицированные в одном из вариантов осуществления настоящего изобретения, продуцируют множество соединений, обладающих ингибирующей активностью в отношении широкого круга клостридий.
[0013] Штаммы Bacillus влияют на общую экологию рубца и кишечного тракта, подавляя клостридий, которые производят непищевые конечные продукты, такие как ацетон и бутанол, которые могут отрицательно влиять на функцию рубца. Активность штаммов Bacillus снижает не только уровни, но и общее разнообразие C. perfringens и нетоксичных клостридий.
[0014] Иммуномодулирующая активность, приписываемая штаммам Bacillus, используемым в качестве пробиотиков, является одним из множества способов, с помощью которых они способствуют общему здоровью и благополучию (обзор Hong и др., 2005). Сообщалось, что споры Bacillus проходят в бляшки Пейера и лимфатические узлы брыжейки после перорального введения и подвергаются фагоцитозу макрофагами в исследованиях in vitro (Due и др., 2003, 2004). Пероральное введение B. subtilis индуцировало продукцию цитокина, интерферона-X, мононуклеарными клетками крови (Kosaka и др., 1998), что указывает на то, что Bacillus вызывают системный эффект, а также локальный эффект на кишечном уровне. Кроме того, после их введения цыплятам-бройлерам наблюдалось увеличение экспрессии РНК-мессенджера толл-подобного рецептора (TLR)-2 и TLR-4 в кишечной тонкой кишке и подвздошной кишке, а также членов нижестоящего сигнального пути TLR, MyD88, TRAF6 и NF-κВ (Раджпут и др., 2017).
[0015] Штаммы Bacillus обладают рядом активностей, которые делают их эффективными в качестве микробов пробиотика, включая продуцирование внеклеточных ферментов, противомикробных препаратов и иммуномодулирующих молекул. Кроме того, Bacillus образуют эндоспоры, которые делают их стабильными в корме и других компонентах корма. Эти споры являются термостабильными и, таким образом, выдерживают обычные процессы гранулирования корма. Споры устойчивы к сушке, а минеральные соли делают их стабильными в премиксах витаминов и микроэлементов.
[0016] Как данные in vitro, так и испытания in vivo указывают на эффективность этих штаммов Bacillus в подавлении клостридий, таких как C. perfringens, тем самым уменьшая бремя болезней при коммерческих операциях по производству молочных продуктов. Эти же испытания продемонстрировали эффективность штаммов Bacillus для ингибирования нетоксикогенных клостридий, способных продуцировать ингибирующие метаболиты. Эти штаммы в настоящее время доступны в качестве пробиотиков для улучшения молочной продуктивности и снижения заболеваний органов пищеварения у крупного рогатого скота.
КРАТКОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
[0017] Авторы настоящего изобретения разработали микробную композицию пробиотика, содержащую изолированный штамм Bacillus, для использования при снижении количества Clostridium в пищеварительной системе жвачных животных, употребивших эффективное количество указанной микробной композиции пробиотика, где указанный изолированный штамм Bacillus выбран из группы, состоящей из: Bacillus subtilis 1104, Bacillus subtilis 1781, Bacillus subtilis 747, Bacillus subtilis 1541, Bacillus subtilis 1999 и Bacillus subtilis 2018.
[0018] В одном аспекте настоящего изобретения микробная композиция пробиотика может ингибировать клостридию, выбранную из группы, состоящей из: Clostridium perfringens, Clostridium bifermentans, Clostridium beijerinckii, Clostridium butyricum, Clostridium tertium, и Clostridium sordellii.
[0019] В одном аспекте настоящего изобретения, когда указанной Clostridium является Clostridium bifermentans, указанный изолированный штамм Bacillus может ингибировать продукцию 1,3-пропандиола в пищеварительной системе жвачных животных, употребивших эффективное количество указанной микробной композиции пробиотика.
[0020] В одном аспекте настоящего изобретения, когда указанной Clostridium является Clostridium beijernckii, указанный изолированный штамм Bacillus может ингибировать продукцию бутанола в пищеварительной системе жвачных животных, употребивших эффективное количество указанной микробной композиции пробиотика.
[0021] В одном аспекте настоящего изобретения, когда указанной Clostridium является Clostridium beijerinckii, указанный изолированный штамм Bacillus может ингибировать продукцию ацетона в пищеварительной системе жвачных животных, употребивших эффективное количество указанной микробной композиции пробиотика.
[0022] В одном аспекте настоящего изобретения, когда указанной Clostridium является Clostridium butyricum, указанный изолированный штамм Bacillus может ингибировать продукцию бутирата в пищеварительной системе жвачных животных, употребивших эффективное количество указанной микробной композиции пробиотика.
[0023] В одном аспекте настоящего изобретения, когда указанной Clostridium является Clostridium perfringens, указанный изолированный штамм Bacillus может уменьшать возникновение расстройства пищеварения, такого как геморрагический синдром кишечника, у жвачных, употребивших эффективное количество указанной микробной композиции пробиотика.
[0024] В одном аспекте настоящего изобретения, микробная композиция пробиотика может дополнительно содержать криопротектор, размещённый вокруг изолированного штамма Bacillus, и при этом указанный изолированный штамм Bacillus представляет собой биологически чистый порошкообразный лиофилизированный штамм.
[0025] В одном аспекте настоящего изобретения, микробная композиция пробиотика может представлять собой биологически чистый порошкообразный лиофилизированный штамм Bacillus, который содержит споры Bacillus.
[0026] В одном аспекте настоящего изобретения, микробная композиция пробиотика может дополнительно содержать носитель.
[0027] В одном аспекте настоящего изобретения, эффективное количество микробной композиции пробиотика, потребляемой жвачным животным в сутки, может включать концентрацию изолированного штамма Bacillus от примерно 2×108 КОЕ/жвачное животное до примерно 2×1010 КОЕ/жвачное животное.
[0028] В одном аспекте настоящего изобретения, эффективное количество микробной композиции пробиотика, потребляемой жвачным животным в сутки, может включать концентрацию изолированного штамма Bacillus примерно 2×109 КОЕ/жвачное животное.
[0029] В другом аспекте настоящего изобретения предложен способ улучшения продуктивности жвачных животных, включающий этапы введения в пищеварительную систему одного или нескольких жвачных животных эффективного количества микробной композиции пробиотика по п.1 и предоставления при по меньшей мере одного эффекта, выбранного из: (1) ингибирования патогена, выбранного из по меньшей мере одного из Clostridium perfringens, Clostridium bifermentans, Clostridium beijerinckii, Clostridium butyricum, Clostridium tertium и Clostridium sordellii у одного или нескольких жвачных животных; (2) снижение уровня смертности одного или нескольких жвачных животных; (3) повышение эффективности кормления одного или нескольких жвачных животных; (4) снижение частоты возникновения геморрагического синдрома кишечника у одного или нескольких жвачных животных; (5) улучшение ферментации рубца у одного или нескольких жвачных животных; (6) улучшение выработки молока у одного или нескольких жвачных животных; и (7) модулирование иммунных ответов воспалительных цитокинов в системных и кишечных иммунных клетках у одного или нескольких жвачных животных.
[0030] В другом аспекте настоящего изобретения способ введения микробной композиции пробиотика может обеспечить эффект уменьшения разнообразия штаммов Clostridium perfringens у одного или нескольких жвачных животных.
[0031] В другом аспекте настоящего изобретения способ введения микробной композиции пробиотика может обеспечить эффект уменьшения разнообразия нетоксикогенных штаммов клоcтридий у одного или нескольких жвачных животных.
[0032] В другом аспекте настоящего изобретения способ введения микробной композиции пробиотика может обеспечить эффект увеличения выработки молока с поправкой на средние энергетические затраты у одного или нескольких жвачных животных, когда одно или несколько жвачных животных являются молочными коровами.
[0033] В другом аспекте настоящего изобретения способ введения микробной композиции пробиотика может обеспечить эффект снижения смертности, связанной с пищеварительной системой, одного или нескольких жвачных животных в течение периода введения микробной композиции пробиотика.
[0034] В другом аспекте настоящего изобретения способ введения микробной композиции пробиотика может включать добавление микробной композиции пробиотика в корм для жвачных животных.
[0035] В другом аспекте настоящего изобретения авторы изобретения разработали криопротектор, размещённый вокруг порошкообразного лиофилизированного изолированного штамма спор Bacillus, выбранного по меньшей мере из одного из: Bacillus subtilis 1104, Bacillus subtilis 1781, Bacillus subtilis 747, Bacillus subtilis 1541, Bacillus subtilis 1999 и Bacillus subtilis 2018; и носитель, при этом указанная композиция может ингибировать по меньшей мере один патоген, выбранный из: Clostridium perfringens, Clostridium bifermentans, Clostridium beijerinckii и Clostridium butyricum в системе пищеварения жвачного животного, употребившего эффективное количество указанной микробной композиции пробиотика, и где эффективное количество указанной микробной композиции пробиотика может содержать концентрацию изолированного штамма Bacillus от примерно 2×108 КОЕ/жвачных животных/сутки до примерно 2×1010 КОЕ/жвачных животных/сутки.
[0036] В другом аспекте настоящего изобретения авторы настоящего изобретения разработали композицию для снижения количества клостридий, содержащую эффективное количество биологически чистой культуры штамма Bacillus, выбранного из группы, состоящей из Bacillus 1104, Bacillus 1781, Bacillus 747, Bacillus 1541, Bacillus 1999 и Bacillus 2018.
[0037] В другом аспекте настоящего изобретения ингибированная клостридия выбрана из группы, состоящей из Clostridium perfringens, Clostridium bifermentans, Clostridium beijerinckii, and Clostridium butyricum, Clostridium tertium и Clostridium sordellii.
[0038] В другом аспекте настоящего изобретения указанная композиция, также содержащая криопротектор, размещённый вокруг изолированного штамма Bacillus, и указанный изолированный штамм Bacillus, представляет собой порошкообразный лиофилизированный штамм.
[0039] В другом аспекте настоящего изобретения указанная композиция включает биологически чистый порошкообразный лиофилизированный штамм Bacillus в форме спор Bacillus.
[0040] В другом аспекте настоящего изобретения указанную композицию можно использовать в качестве микробного препарата пробиотика для борьбы с клостридиями в пищеварительной системе жвачных животных, употребивших эффективное количество указанного микробного препарата прямого кормления.
[0041] В другом аспекте настоящего изобретения эффективное количество микробной композиции пробиотика, употребляемой жвачным животным в сутки, представляет собой концентрацию изолированного штамма Bacillus от примерно 2×108 КОЕ / жвачное животное до примерно 2×1010 КОЕ / жвачное животное.
[0042] В другом аспекте настоящего изобретения эффективное количество микробной композиции пробиотика, употребляемой жвачным животным в сутки, представляет собой концентрацию выделенного штамма Bacillus, составляющую приблизительно 2×109 КОЕ / жвачное животное.
[0043] В другом аспекте настоящего изобретения композицию можно использовать в качестве микробиологического средства для контроля за силосом для ингибирования роста клостридий в массе силоса, содержащем эффективное количество указанной композиции, смешанной с массой корма, из которого получают указанный силос.
[0044] В другом аспекте настоящего изобретения биологически чистая культура штамма Bacillus ингибирует рост патогенного микроорганизма, выбранного из группы, состоящей из E. coli, Clostridium perfringens, Clostridium bifermentans, Clostridium beijerinckii, Clostridium butyricum, Clostridium tertium, Clostridium sordellii, кишечных палочек, дрожжей и плесени.
[0045] В другом аспекте настоящего изобретения биологически чистая культура штамма Bacillus увеличивает концентрацию молочной кислоты и уксусной кислоты в силосе.
[0046] В другом аспекте настоящего изобретения биологически чистая культура штамма Bacillus уменьшает порчу силоса.
[0047] В другом аспекте настоящего изобретения предложен способ уменьшения роста патогенных микроорганизмов в силосе, включающий смешивание массы корма с эффективным количеством композиции для уменьшения роста патогенного микроорганизма.
[0048] В другом аспекте настоящего изобретения штамм Bacillus выбран из группы, состоящей из Bacillus 1104, Bacillus 1781, Bacillus 747, Bacillus 1541, Bacillus 1999 и Bacillus 2018 для использования в микробнойкомпозиции пробиотика для контроля количества Clostridium в пищеварительной системе жвачных животных.
[0049] В другом аспекте настоящего изобретения штамм Bacillus выбран из группы, состоящей из Bacillus 1104, Bacillus 1781, Bacillus 747, Bacillus 1541, Bacillus 1999 и Bacillus 2018 для использования в производстве микробной композиции пробиотика для контроля Clostridium в пищеварительной системе жвачных животных.
[0050] В другом аспекте настоящего изобретения штамм Bacillus выбран из группы, состоящей из Bacillus 1104, Bacillus 1781, Bacillus 747, Bacillus 1541, Bacillus 1999, and Bacillus 2018 для использования в микробиологическом контроле силоса для подавления роста Clostridium в силосе.
[0051] В другом аспекте настоящего изобретения штамм Bacillus выбран из группы, состоящей из Bacillus 1104, Bacillus 1781, Bacillus 747, Bacillus 1541, Bacillus 1999 и Bacillus 2018 для использования в производстве силоса для контроля микробов для подавления роста Clostridium в силосе.
[0052] Другие объекты, особенности и преимущества настоящего изобретения станут очевидными после рассмотрения описания, формулы изобретения и чертежей.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
[0053] Фигура 1 представляет собой круговую диаграмму, показывающую пропорции Clostridium perfringens и нетоксичных клостридий, выделенных из образцов корма в соответствии с одним вариантом осуществления настоящего изобретения, в соответствии с Примером 1;
[0054] Фигура 2 представляет собой круговую диаграмму, показывающую основные нетоксичные клостридии, идентифицированные в образцах корма (n = 345) в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 1;
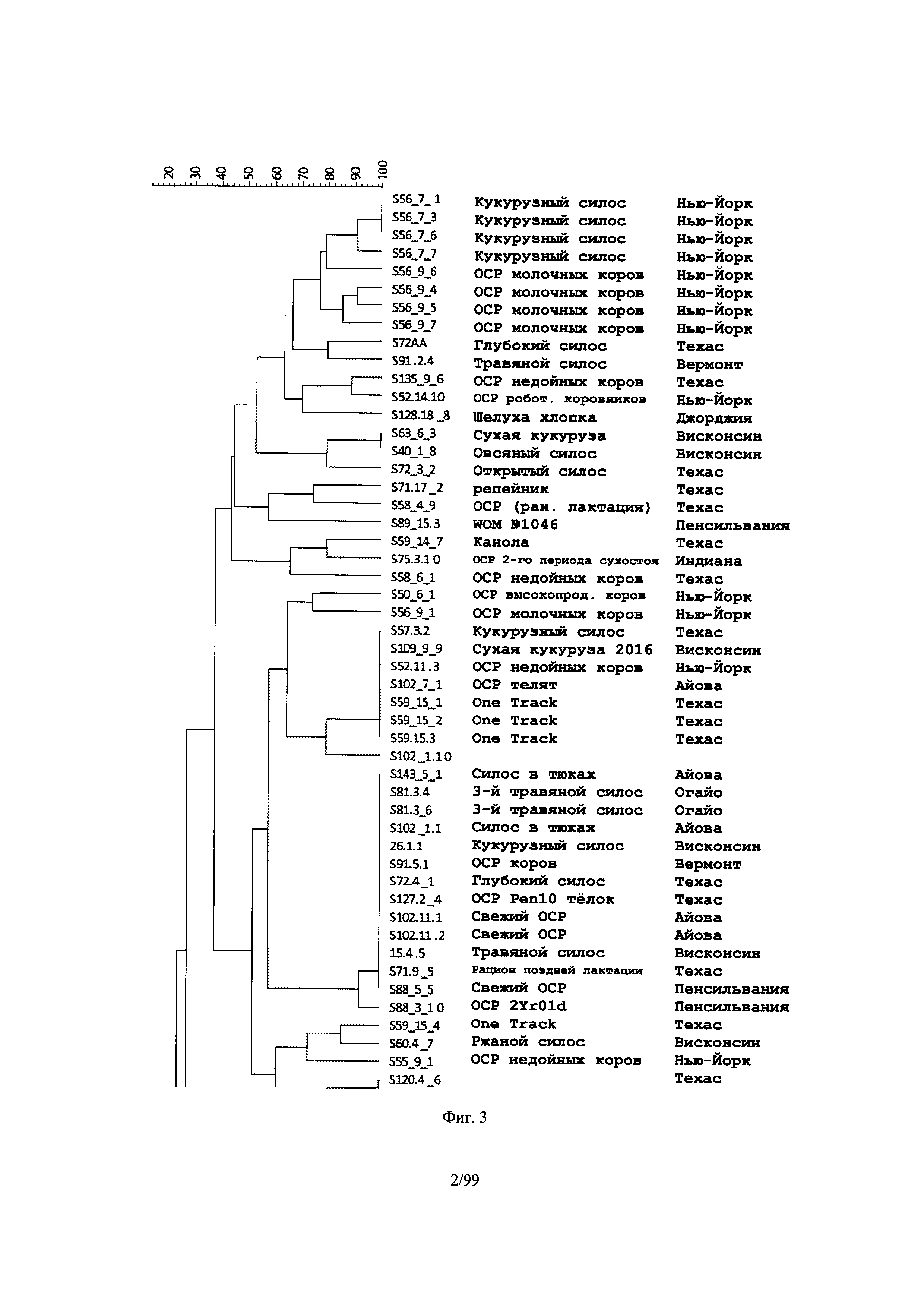
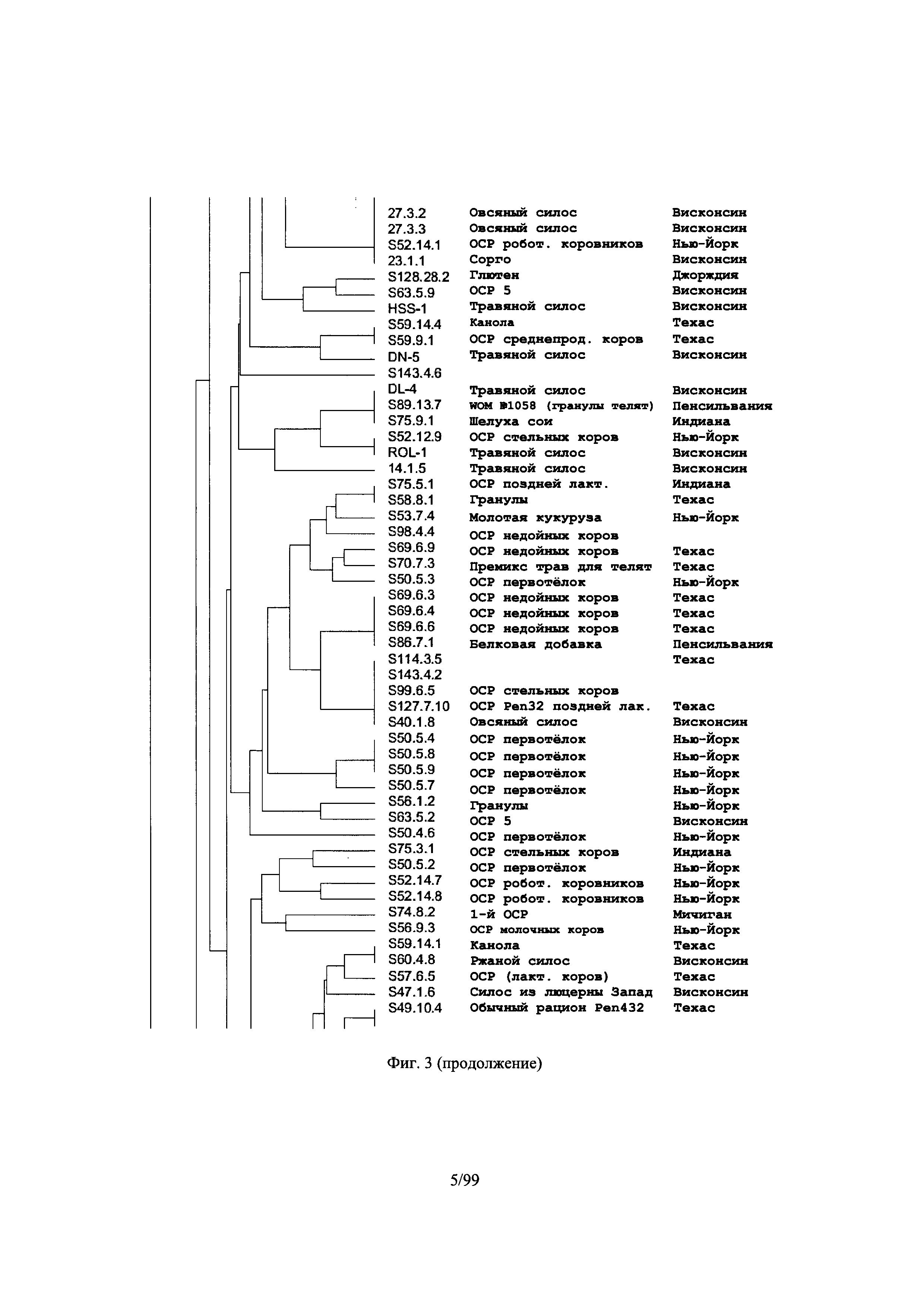
[0055] Фиг.3 представляет собой дендрограмму, отображающую различия между изолятами клостридий в корме на основе генетических отпечатков, полученных с помощью ПЦР RAPD (со случайной амплификацией полиморфной ДНК) в соответствии с одним вариантом осуществления настоящего изобретения, в соответствии с Примером 1;
[0056] Фигура 4 представляет собой линейный график, показывающий измерения рН в зависимости от времени для шести обработок мини-силосными инокулянтами в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 2;
[0057] Фигура 5 представляет собой линейный график, показывающий изменение количества Bacillus с течением времени для шести обработок инокулянтом мини-силосом в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 2;
[0058] Фигура 6 представляет собой линейный график, показывающий изменение популяции молочнокислых бактерий (МКБ) с течением времени для шести обработок мини-силосными инокулянтами в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 2;
[0059] Фигура 7 представляет собой линейный график, показывающий изменение популяции дрожжей с течением времени для шести обработок мини-силосными инокулянтами в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 2;
[0060] Фигура 8 представляет собой линейный график, показывающий изменение популяции плесени с течением времени для шести обработок силосным инокулянтом в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 2;
[0061] Фигура 9 представляет собой линейный график, показывающий изменение популяции клостридий с течением времени для шести обработок силосным инокулянтом в соответствии с одним вариантом воплощения настоящего изобретения в соответствии с Примером 2;
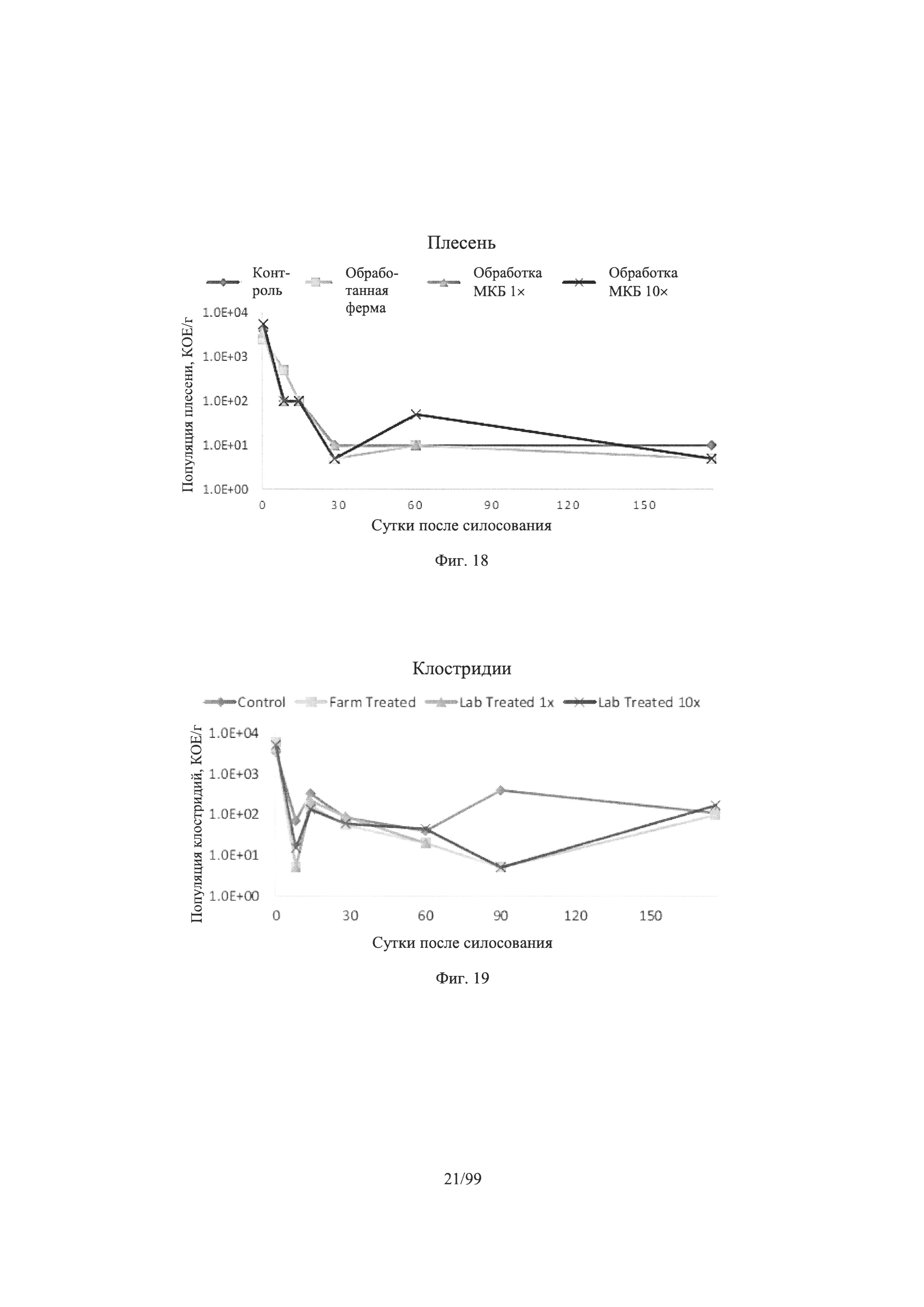
[0062] Фигура 10 представляет собой линейный график, показывающий изменение концентрации молочной кислоты с течением времени для шести обработок силосным инокулянтом на основе выборки в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 2;
[0063] Фигура 11 представляет собой линейный график, показывающий изменение концентрации уксусной кислоты с течением времени для шести обработок силосным инокулянтом на основе выборки в соответствии с одним вариантом осуществления настоящего изобретения согласно Примеру 2;
[0064] Фигура 12 представляет собой линейный график, показывающий измерения рН с течением времени для четырех обработок силосным инокулянтом на основе выборки в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 3;
[0065] Фигура 13 представляет собой линейный график, показывающий изменение популяции кишечной палочки с течением времени для четырех обработок силосным инокулянтом на основе выборки в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 3;
[0066] Фигура 14 представляет собой линейный график, показывающий изменение популяции кишечной палочки с течением времени для четырех обработок силосным инокулянтом на основе выборки в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 3;
[0067] Фигура 15 представляет собой линейный график, показывающий изменение популяции Bacillus с течением времени для четырех обработок силосным инокулянтом на основе выборки в соответствии с одним вариантом осуществления настоящего изобретения согласно Примеру 3.;
[0068] Фигура 16 представляет собой линейный график, показывающий изменение популяции молочнокислых бактерий (МКБ) с течением времени для четырех обработок силосным инокулянтом на основе выборки в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 3;
[0069] Фигура 17 представляет собой линейный график, показывающий изменение популяции дрожжей с течением времени для четырех обработок силосным инокулянтом на основе выборки в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 3;
[0070] Фигура 18 представляет собой линейный график, показывающий изменение популяции плесени с течением времени для четырех обработок силосным инокулянтом на основе выборки в соответствии с одним вариантом воплощения настоящего изобретения согласно Примеру 3;
[0071] Фигура 19 представляет собой линейный график, показывающий изменение популяции клостридий с течением времени для четырех обработок силосным инокулянтом на основе выборки в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 3;
[0072] Фигура 20 представляет собой линейный график, показывающий уровень молочной кислоты в течении времени для четырех обработок силосным инокулянтом на основе выборки в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 3;
[0073] Фигура 21 представляет собой линейный график, показывающий изменение уровня уксусной кислоты в течении времени для четырех обработок силосным инокулянтом на основе выборки в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 3;
[0074] Фигура 22 представляет собой линейный график, показывающий измерения pFI во времени в сравнении с применением на ферме силосного инокулянта, содержащего Bacillus, и необработанного контроля в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 4;
[0075] Фигура 23 представляет собой линейный график, показывающий количество кишечной палочки (КОЕ / г) с течением времени, при сравнении внутрихозяйственного применения силосного инокулянта, содержащего Bacillus, и необработанного контроля в соответствии с одним вариантом осуществления настоящего изобретения согласно Примеру 4;
[0076] Фигура 24 представляет собой линейный график, показывающий количество кишечной палочки (КОЕ / г) с течением времени, при сравнении внутрихозяйственного применения силосного инокулянта, содержащего Bacillus, и необработанного контроля в соответствии с одним вариантом осуществления настоящего изобретения согласно Примеру 4;
[0077] Фигура 25 представляет собой линейный график, показывающий количество Bacillus (КОЕ / г) в течение времени, при сравнении применения на ферме инокулянта, содержащего Bacillus, и необработанного контроля в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 4;
[0078] Фигура 26 представляет собой линейный график, показывающий количество молочнокислых бактерий (МКБ) (КОЕ/г) с течением времени, при сравнении применения на ферме силосного инокулянта, содержащего Bacillus, и необработанного контроля в соответствии с одним вариантом осуществления настоящего изобретения согласно к Примеру 4;
[0079] Фигура 27 представляет собой линейный график, показывающий количество дрожжей (КОЕ/г) с течением времени, при сравнении применения на ферме силосного инокулянта, содержащего Bacillus, и необработанного контроля в соответствии с одним вариантом осуществления настоящего изобретения согласно Примеру 4;
[0080] Фигура 28 представляет собой линейный график, показывающий количество плесени (КОЕ/г) с течением времени, при сравнении применение на ферме инокулянта, содержащего Bacillus, и необработанного контроля в соответствии с одним вариантом осуществления настоящего изобретения согласно Примеру 4;
[0081] Фигура 29 представляет собой линейный график, показывающий количество клостридий (КОЕ/г) с течением времени, при сравнении сравнивая применения на ферме силосного инокулянта, содержащего Bacillus, и необработанного контроля в соответствии с одним вариантом осуществления настоящего изобретения согласно Примеру 4;
[0082] Фигура 30 представляет собой линейный график, показывающий концентрацию молочной кислоты с течением времени, при сравнении применения на ферме силосного инокулянта, содержащего Bacillus, и необработанного контроля в соответствии с одним вариантом осуществления настоящего изобретения согласно Примеру 4;
[0083] Фигура 31 представляет собой линейный график, показывающий концентрацию уксусной кислоты во времени, при сравнении применения на ферме инокулянта, содержащего Bacillus, и необработанного контроля в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 4;
[0084] Фигура 32 представляет собой диаграмму, показывающую результаты подсчёта всех клостридий (без дифференциации Clostridium sp.) по отдельным образцам фекалий коров и телят в Висконсине в соответствии с одним вариантом осуществления настоящего изобретения согласно Примеру 5;
[0085] Фигура 33 представляет собой диаграмму, показывающую результаты подсчёта всех клостридий (без дифференциации Clostridium sp.) по отдельным образцам фекалий телят для каждой фермы, отобранных в Висконсине в соответствии с одним вариантом осуществления настоящего изобретения, в соответствии с Примером 5;
[0086] Фигура 34 представляет собой диаграмму, показывающую результаты подсчета всех клостридий (без дифференциации Clostridium sp.) по отдельным образцам фекалий коров для каждой фермы, отобранных в Висконсина в соответствии с одним вариантом осуществления настоящего изобретения, в соответствии с Примером 5;
[0087] Фигура 35 представляет собой диаграмму, показывающую подсчитанное количество C. perfringens в образце фекалий из образцов фекалий, собранных в Висконсине. Количество C. perfringens оценивали путем умножения общего количества клостридий в каждом образце на процент, который был подтвержден как C. perfringens, в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 5;
[0088] Фигура 36 представляет собой диаграмму, показывающую подсчитанное количество C. perfringens в индивидуальном образце фекалий телят из Висконсина. Подсчет C. perfringens оценивали путем умножения количества клостридий в каждом образце на процент, который был подтвержден как C. perfringens. Результаты представлены для каждой фермы в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 5;
[0089] Фигура 37 представляет собой диаграмму, показывающую подсчитанное количество C. perfringens в индивидуальном образце фекалий коровы, собранном в Висконсине. Подсчет C. perfringens оценивали путем умножения количества клостридий в каждом образце на процент, который был подтвержден как C. perfringens. Результаты представлены для каждой фермы в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 5;
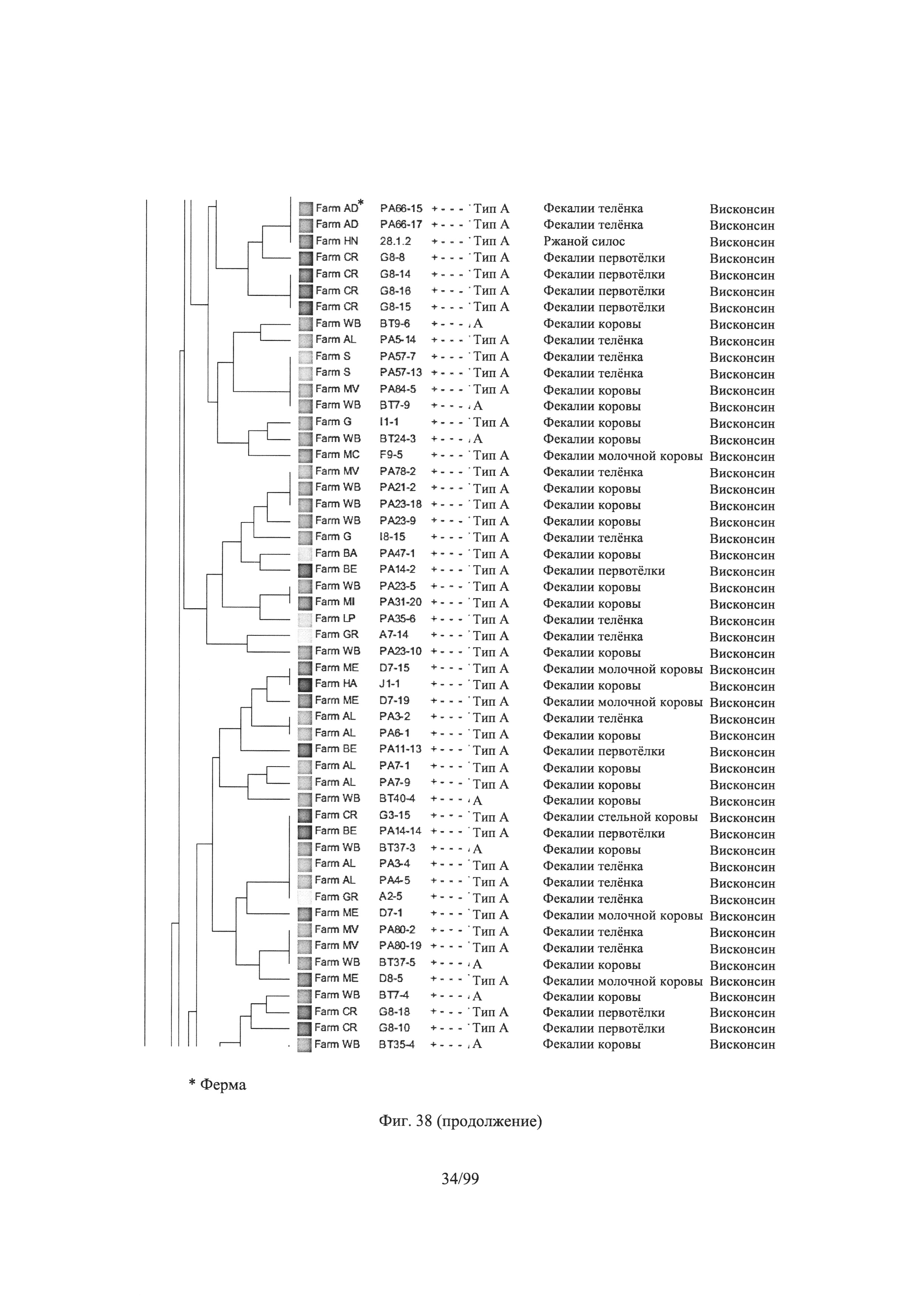
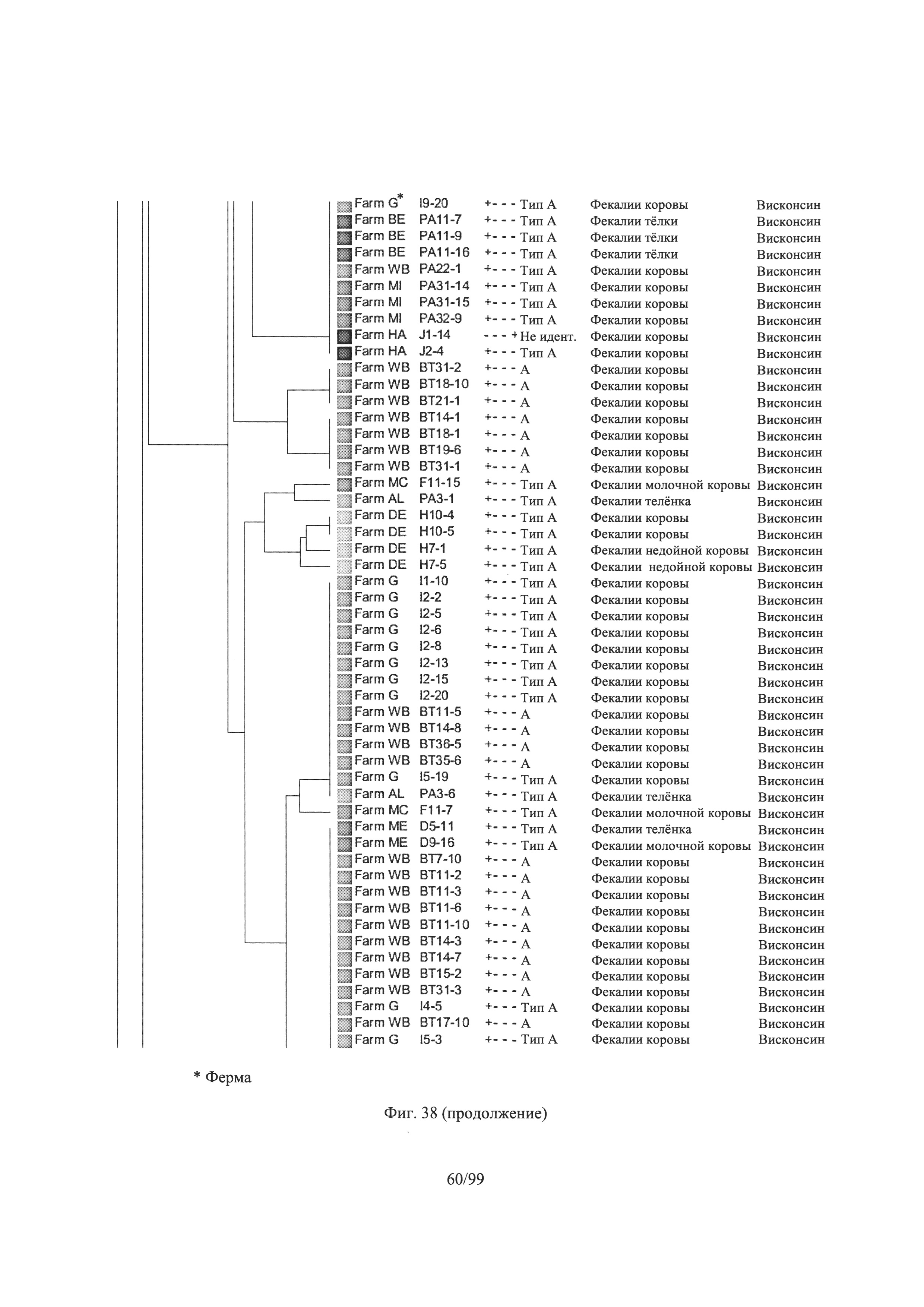
[0090] Фигура 38 представляет собой дендрограмму, показывающую Clostridium perfringens (n = 1,522), выделенных в Висконсине, с отсечением кластера при сходстве 75%, где информация о каждом изоляте (n = 1,252) приведена справа: ферма, идентификационный номер, результаты в отношении токсинов Альфа, Бета, Эпсилон и Йота. Тип токсина, источник и состояние; и репрезентативные данные были отобраны на основе кластеров дендрограмм для скрининга в анализах ингибирования бактериоцина в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 5;
[0091] На Фигуре 39 представлена дендрограмма нетоксичных клостридий (n = 183), демонстрирующая сходство между последовательностями 16S ДНК из каждого изолята из Висконсина; причем информация о каждом изоляте приведена слева направо, включая: ферму, идентификационный номер или идентификация типа штамма, идентификацию, источник изолята в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 5;
[0092] Фигура 40 представляет собой круговую диаграмму, показывающую основные нетоксичные виды клостридий (n = 183) по сравнению со всеми другими нетоксикогенными типами в соответствии с одним вариантом осуществления настоящего изобретения согласно Примеру 5;
[0093] Фигура 41 представляет собой диаграмму, показывающую результаты подсчета всех клостридий (без дифференциации Clostridium sp.) по отдельному образцу фекалий для коров и телят в Техасе в соответствии с одним вариантом осуществления настоящего изобретения согласно Примеру 6;
[0094] Фигура 42 представляет собой диаграмму, показывающую результаты подсчета общих клостридий (без дифференциации Clostridium sp.) по отдельным образцам фекалий телят для каждой фермы, отобранных в Техасе в соответствии с одним вариантом осуществления настоящего изобретения, в соответствии с Примером 6;
[0095] На Фигуре 43 представлена диаграмма, показывающая результаты подсчета общих клостридий (без дифференциации Clostridium sp.) по отдельным пробам фекалий коров для каждой фермы, отобранных в Техасе в соответствии с одним вариантом осуществления настоящего изобретения, в соответствии с Примером. 6;
[0096] Фигура 44 представляет собой диаграмму, показывающую подсчитанное количество C. perfringens в образце фекалий среди образцов фекалий, собранных в Техасе, где число C. perfringens было оценено путём умножения общего количества клостридий в каждом образце на процент, который был подтвержден как C. perfringens, в соответствии с одним вариантом осуществления настоящего изобретения, в соответствии с Примером 6;
[0097] Фигура 45 представляет собой диаграмму, показывающую вычисленные данные по C. perfringens на ферму, по индивидуальным образцам фекалий телят из Техаса, где подсчет C. perfringens оценивали путем умножения подсчета клостридий в каждой пробе на процент, который был подтвержден как C. perfringens в в соответствии с одним вариантом осуществления настоящего изобретения, в соответствии с Примером 6;
[0098] Фигура 46 представляет собой диаграмму, показывающую вычисленные данные по C. perfringens на ферму, по индивидуальному образцу фекалий коровы, собранных в Техасе, где подсчет C. perfringens оценивали путём умножения подсчета клостридий в каждом образце на процент, который был подтвержден как C. perfringens в соответствии с одним вариантом осуществления настоящего изобретения, в соответствии с Примером 6;
[0099] Фигура 47 представляет собой круговую диаграмму, показывающую основные виды нетоксикогенных клостридий (n = 215), выделенные из образцов Техаса, по сравнению со всеми другими нетоксикогенными типами в соответствии с одним вариантом осуществления настоящего изобретения согласно Примеру 6;
[0100] На Фигуре 48 представлена диаграмма, показывающая результаты подсчета всех клостридий (без дифференциации Clostridium sp.) по отдельным пробам фекалий коров и телят из района Верхнего Среднего Запада в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 7;
[0101] Фигура 49 представляет собой диаграмму, показывающую результаты подсчета общих клостридий (без дифференциации Clostridium sp.) по отдельным пробам фекалий телят для каждой фермы, отобранных в районе Верхнего Среднего Запада, в соответствии с одним вариантом осуществления настоящего изобретения согласно Примеру 7;
[0102] Фигура 50 представляет собой диаграмму, показывающую результаты подсчета общих клостридий (без дифференциации Clostridium sp.) по отдельным пробам фекалий коров для каждой фермы, отобранных в районе Верхнего Среднего Запада, в соответствии с одним вариантом осуществления настоящего изобретения согласно Примеру 7;
[0103] Фигура 51 представляет собой диаграмму, показывающую подсчитанное количество C. perfringens в образце фекалий среди образцов фекалий, собранных в районе Верхнего Среднего Запада, где число C. perfringens было оценено путем умножения общего количества клостридий в каждом образце на процент, который был подтвержден как C. perfringens, в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 7;
[0104] Фигура 52 представляет собой диаграмму, показывающую подсчитанное количество C. perfringens для каждой фермы по отдельному образцу фекалий телят из района Верхнего Среднего Запада, где подсчет C. perfringens оценивали путем умножения количества клостридий в каждом образце на процент, который был подтвержден как C. perfringens, в соответствии с одним вариантом осуществления настоящего изобретения, в соответствии с Примером 7;
[0105] Фигура 53 представляет собой диаграмму, показывающую подсчитанное количество C. perfringens для каждой фермы по отдельному образцу фекалий коров, собранному в районе Верхнего Среднего Запада, где число C. perfringens оценивали путём умножения количества клостридий в каждом образце на процент, который был подтвержден как C. perfringens в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 7;
[0106] Фигура 54 представляет собой круговую диаграмму, показывающую круговую диаграмму нетоксичных клостридий (n = 218), показывающую два основных типа идентификации (группу C. bifermentans и группу C. beijerinckii) по сравнению со всеми другими нетоксикогенными типами, выделенными из района Верхнего Среднего Запада в соответствии с одним вариантом осуществления настоящего изобретения согласно Примеру 7;
[0107] Фигура 55 представляет собой диаграмму, показывающую результаты подсчёта всех клостридий (без дифференциации Clostridium sp.) по отдельным образцам фекалий коров и телят из района Великих озер в соответствии с одним вариантом осуществления настоящего изобретения согласно Примеру 7;
[0108] Фигура 56 представляет собой диаграмму, показывающую результаты подсчёта всех клостридий (без дифференциации Clostridium sp.) по отдельным образцам фекалий телят для каждой фермы, полученным из района Великих озер в соответствии с одним вариантом осуществления настоящего изобретения согласно Примеру 8;
[0109] Фигура 57 представляет собой диаграмму, показывающую результаты подсчёта всех клостридий (без дифференциации Clostridium sp.) по отдельным образцам фекалий коров из каждой фермы, отобранных из района Великих озер в соответствии с одним вариантом осуществления настоящего изобретения согласно Примеру 8;
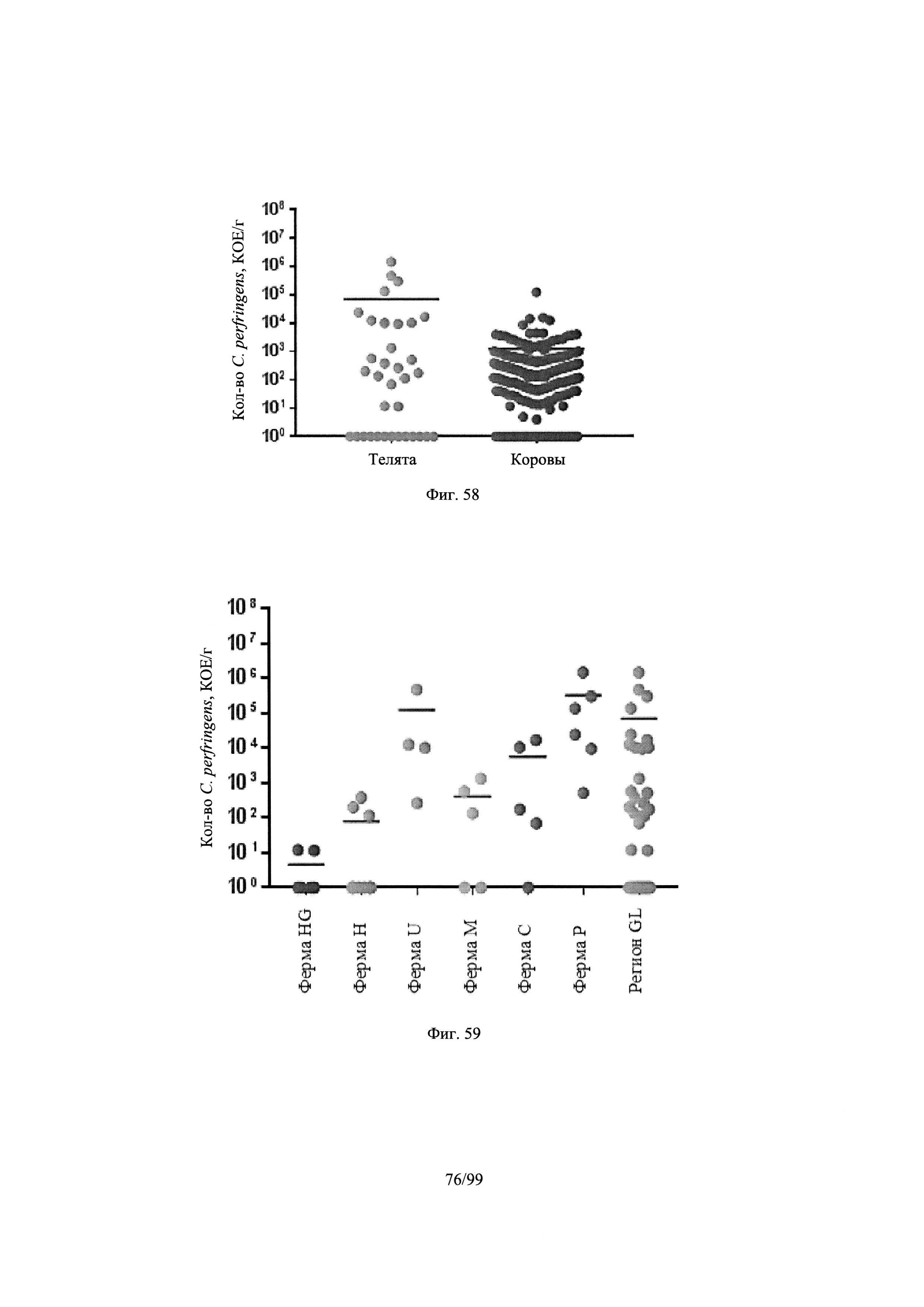
[0110] Фигура 58 представляет собой диаграмму, показывающую результаты подсчёта количества C. perfringens в фекальном образцее из фекальных образцов, собранных в районе Великих озер, где подсчёт C. perfringens оценивали путём умножения общего количества клостридий в каждой пробе на процент, который был подтвержден как C. perfringens в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 8;
[0111] Фигура 59 представляет собой диаграмму, показывающую результаты подсчёта количества C. perfringens для каждой фермы по индивидуальному обазцу фекалий из района Великих озер, где подсчёт C. perfringens оценивали путём умножения числа клостридий в каждой пробе на процент, который был подтвержден как C. perfringens в соответствии с одним вариантом осуществления настоящего изобретения, в соответствии с Примером 8;
[0112] Фигура 60 представляет собой диаграмму, показывающую результаты подсчёта количества C. perfringens для каждой фермы по отдельным образцам фекалий коров, собранным в районе Великих озер. Количество C. perfringens оценивали путём умножения количества клостридий в каждом образце на процент, который был подтвержден как C. perfringens в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 8;
[0113] Фигура 61 представляет собой круговую диаграмму, показывающую нетоксикогенные клостридий (n = 190), включая основной тип идентификации (группа C. bifermentans) по сравнению со всеми другими нетоксикогенными типами, выделенными из района Великих озер в соответствии с одним вариант осуществления настоящего изобретения в соответствии с Примером 8;
[0114] Фигура 62 представляет собой диаграмму, показывающую результаты подсчёта всех клостридий (без дифференциации Clostridium sp.) по отдельному образцу фекалий коров и телят из северо-восточного региона в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 9;
[0115] Фигура 63 представляет собой диаграмму, показывающую результаты подсчёта всех клостридий (без дифференциации Clostridium sp.) по отдельным образцам фекалий телят для каждой фермы, отобранных в северо-восточном регионе в соответствии с одним вариантом осуществления настоящего изобретения, в соответствии с Примером 9;
[0116] Фигура 64 представляет собой диаграмму, показывающую результаты подсчёта всех клостридий (без дифференциации Clostridium sp.) по отдельным образцам фекалий коров для каждой фермы, отобранных в северо-восточном регионе в соответствии с одним вариантом осуществления настоящего изобретения, в соответствии с Примером 9;
[0117] Фигура 65 представляет собой диаграмму, показывающую результаты подсчёта количества C. perfringens по образцу фекалий из образцов фекалий, собранных в северо-восточном регионе, где число C. perfringens было оценено путём умножения общего количества клостридий в каждом образце на процент, который был подтвержден как C. perfringens, в соответствии с одним вариантом осуществления настоящего изобретения, в соответствии с Примером 9;
[0118] Фигура 66 представляет собой диаграмму, показывающую результаты подсчёта количества C. perfringens для каждой фермы по отдельному образцу фекалий телят в северо-восточном регионе, где число C. perfringens было оценено путём умножения количества клостридий в каждом образце на процент, который был подтвержден как C. perfringens, в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 9;
[0119] Фигура 67 представляет собой диаграмму, показывающую результаты подсчёта количества C. perfringens для каждой фермы по отдельному образцу фекалий коровы, собранному в северо-восточном регионе, где число C. perfringens было оценено путём умножения количества клостридий в каждом образце на процент, который был подтвержден как C. perfringens, в соответствии с одним вариантом осуществления настоящего изобретения, в соответствии с примером 9;
[0120] Фигура 68 представляет собой круговую диаграмму, показывающую нетоксикогенные клостридий (n = 181), включая два основных типа идентификации (группу C. bifermentans и группу C. beijerinckii) по сравнению со всеми другими нетоксикогенными типами, выделенными в северо-восточном регионе, в соответствии с одним вариантом осуществления настоящего изобретения согласно Примеру 9;
[0121] Фиг. 69 представляет собой диаграмму, показывающую результаты подсчёта всех клостридий (без дифференциации Clostridium sp.) по отдельному образцу фекалий коров и телят из среднеатлантического региона в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 10;
[0122] Фигура 70 представляет собой диаграмму, показывающую результаты подсчёта всех клостридий (без дифференциации Clostridium sp.) по отдельным образцам фекалий телят для каждой фермы, отобранным в районе центральной Атлантики в соответствии с одним вариантом осуществления настоящего изобретения, в соответствии с Примером 10;
[0123] Фигура 71 представляет собой диаграмму, показывающую результаты подсчёта всех клостридий (без дифференциации Clostridium sp.) по отдельным образцам фекалий коров для каждой фермы, отобранным в районе центральной Атлантики в соответствии с одним вариантом осуществления настоящего изобретения, в соответствии с Примером 10;
[0124] Фигура 72 представляет собой диаграмму, показывающую результаты подсчёта количества C. perfringens в образце фекалий среди образцов фекалий, собранных в районе центральной Атлантики, где количество C. perfringens было оценено путём умножения общего количества клостридий в каждом образце на процент, который был подтвержден как C. perfringens, в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 10;
[0125] Фигура 73 представляет собой диаграмму, показывающую результаты подсчёта количества C. perfringens для каждой фермы по индивидуальной пробе фекалий из Центральной Атлантики, где подсчёт C. perfringens оценивали путём умножения числа клостридий в каждой пробе на процент, который был подтвержден как C. perfringens, в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 10;
[0126] Фигура 74 представляет собой диаграмму, показывающую результаты подсчёта количества C. perfringens для каждой фермы по отдельному образцу фекалий коровы, отобранному из района центральной Атлантики, где число C. perfringens было оценено путём умножения количества клостридий в каждом образце на процент, который был подтвержден как C. perfringens, в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 10;
[0127] Фигура 75 представляет собой круговую диаграмму, показывающую нетоксикогенные клостридии (n = 151), включая основной тип идентификации, группу C. bifermentans, по сравнению со всеми другими нетоксикогенными типами, выделенными из среднеатлантического региона в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 10;
[0128] Фиг. 76 представляет собой диаграмму, показывающую результаты подсчёта всех клостридий (без дифференциации Clostridium sp.) по отдельному образцу фекалий коров и телят из области коридора I-29, в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 11;
[0129] Фигура 77 представляет собой диаграмму, показывающую результаты подсчёта всех клостридий (без дифференциации Clostridium sp.) по отдельным образцам фекалий телят для каждой фермы, отобранным в области коридора I-29, в соответствии с одним вариантом осуществления настоящего изобретения, в соответствии с Примером 11;
[0130] Фигура 78 представляет собой диаграмму, показывающую результаты подсчёта всех клостридий (без дифференциации Clostridium sp.) по отдельным образцам фекалий коров для каждой фермы, отобранным в области коридора I-29 в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 11;
[0131] Фиг. 79 представляет собой диаграмму, показывающую результаты подсчёта C. perfringens в фекальном образце из фекальных образцов, собранных в области коридора I-29, где количество C. perfringens оценивали путём умножения общего количества клостридий в каждой пробе на процент, который был подтверждён как C. perfringens, в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 11;
[0132] Фигура 80 представляет собой диаграмму, показывающую результаты подсчёта количества C. perfringens для каждого отдельного образца фекалий теленка из области коридора I-29, где количество C. perfringens оценивали путём умножения количества клостридий в каждом образце на процент, который был подтверждён как C. perfringens в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 11;
[0133] Фигура 81 представляет собой диаграмму, показывающую результаты подсчёта количества C. perfringens для каждой фермы по отдельному образцу фекалий коровы, собранному в области коридора I-29, где количество C. perfringens оценивали путём умножения количества клостридий в каждом образце на процент, который был подтверждён как C. perfringens, в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 11;
[0134] Фигура 82 представляет собой круговую диаграмму, показывающую нетоксичные клостридии (n = 399), включая два основных типа идентификации (группу C. bifermentans и группу C. beijerinckii) по сравнению со всеми другими нетоксикогенными типами, выделенными из области коридора I-29, в соответствии с одним вариантом осуществления настоящего изобретения, в соответствии с Примером 11;
[0135] Фигура 83 представляет собой диаграмму, показывающую результаты подсчёта всех клостридий в отдельных образцах фекалий для всех временных точек, включая точки Примера 6, где моменты времени, которые значительно отличаются от образцов перед обработкой, отмечены звездочками в столбцах средних погрешностей, в соответствии с одним вариантом осуществления настоящего изобретения, в соответствии с Примером 12;
[0136] Фигура 84 представляет собой диаграмму, показывающую результаты подсчёта количества Clostridium perfringens в отдельных образцах фекалий для всех временных точек, включая точки из Примера 6, в соответствии с одним вариантом осуществления настоящего изобретения, в соответствии с Примером 12;
[0137] На Фигуре 85 представлена гистограмма, показывающая изменения пропорций нетоксичных видов Clostridium с течением времени на ферме ALJ в Техасе в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 12;
[0138] Фигура 86 представляет собой диаграмму, показывающую результаты подсчёта всех клостридий в отдельном образце фекалий для всех точек отбора образцов для Висконсинской фермы E в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 13;
[0139] Фигура 87 представляет собой диаграмму, показывающую результаты подсчёта количества Clostridium perfringens в отдельном образце фекалий с течением времени для Висконсинской фермы E в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 13;
[0140] Фигура 88 представляет собой график, показывающий пропорции нетоксичных видов Clostridium с течением времени для Висконсинской фермы E в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 13;
[0141] Фигура 89 представляет собой диаграмму, показывающую результаты подсчёта общих клостридий в ферме BS в отдельном образце фекалий для всех временных точек, включая точки Примера 6, в то время как временные точки, которые значительно отличаются от образцов перед обработкой, отмечены звездочками в столбцах средних погрешностей в соответствии с одним вариантом осуществления настоящего изобретения, в соответствии с Примером 14;
[0142] Фигура 90 представляет собой диаграмму, показывающую рассчитанные количества Clostridium perfringens для фермы BS по отдельным образцам фекалий для всех временных точек, в том числе для точек Примера 6, в соответствии с одним вариантом осуществления настоящего изобретения, в соответствии с Примером 14.;
[0143] Фигура 91 представляет собой график, показывающий пропорции нетоксичных видов Clostridium из образцов перед обработкой по сравнению с образцами, обработанными в течение 107 дней, из фермы BS в Техасе в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 14;
[0144] Фиг. 92 представляет собой график, показывающий кратное изменение экспрессии гена воспалительного цитокина (MIP-2 и TNF-α), вызванного штаммом Bacillus 747 с EPS и без него, в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 15;
[0145] Фиг. 93 представляет собой график, показывающий кратное изменение экспрессии гена воспалительного цитокина (MIP-2 и TNF-α), вызванного штаммом Bacillus 1781 с EPS и без него, в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 15;
[0146] Фиг. 94 представляет собой график, показывающий кратное изменение экспрессии гена воспалительного цитокина (MIP-2 и TNF-α), вызванную штаммом Bacillus 1104 с EPS и без него, в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 15;
[0147] Фиг. 95 представляет собой график, показывающий кратное изменение экспрессии гена воспалительного цитокина (MIP-2 и TNF-α), вызванную штаммом Bacillus 1541 с EPS и без него, в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 15;
[0148] Фиг. 96 представляет собой график, показывающий кратное изменение экспрессии гена воспалительного цитокина (MIP-2 и TNF-α), вызванную штаммом Bacillus 2018 с EPS и без него, в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 15;
[0149] Фиг. 97 представляет собой график, показывающий кратное изменение экспрессии гена воспалительного цитокина (MIP-2 и TNF-α), вызванную штаммами Bacillus 747 и 1781 с EPS и без него, в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 15;
[0150] Фиг. 98 представляет собой график, показывающий концентрации гаптоглобина в плазме телят через 14 дней после начала лечения заменителем молока в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 16.;
[0151] Фигура 99 представляет собой диаграмму, показывающую результаты подсчёта всех клостридий на ферме WB в Висконсине по индивидуальным образцам фекалий для всех временных точек, включая точки Примера 5, где моменты времени, которые значительно отличаются от образцов перед обработкой, отмечены звездочками в столбцах средних погрешностей в соответствии с одним вариантом осуществления настоящего изобретения согласно Примеру 18;
[0152] Фигура 100 представляет собой диаграмму, показывающую результаты подсчёта всех клостридий на ферме WB в Висконсине по отдельному образцу фекалий для всех временных точек, включая точки Примера 5 в соответствии с одним вариантом осуществления настоящего изобретения, в соответствии с Примером 18; и
[0153] Фигура 101 представляет собой диаграмму, показывающую пропорции нетоксичных видов Clostridium стечением времени на ферме WB в Висконсине в соответствии с одним вариантом осуществления настоящего изобретения в соответствии с Примером 18.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
[0154] Если не указано иное, все технические и научные термины, используемые в данном документе, имеют то же значение, которое обычно понимают специалисты в области техники, к которой относится настоящее изобретение.
[0155] Настоящее изобретение не ограничено способами, описанными в Примерах, и материалами, раскрытыми в данной заявке, и любые способы и материалы, подобные или эквивалентные тем, которые описаны в данной заявке, могут использоваться при практическом применении или тестировании вариантов осуществления настоящего изобретения. Числовые диапазоны включают в себя числа, определяющие указанный диапазон.
[0156] Отмечается, что использованные в описании и прилагаемой формуле изобретения формы единственного числа включают в себя формы множественного числа, если из контекста явно не следует иное.
[0157] Числовые диапазоны в этом описании являются приблизительными и, таким образом, могут включать значения вне диапазона, если не указано иное. Числовые диапазоны включают в себя все значения, включая нижнее и верхнее значения, с шагом в одну единицу, при условии, что между любым более низким значением и любым более высоким значением имеется разделение по меньшей мере на две единицы. Для диапазонов, содержащих значения, которые меньше единицы, или содержащие дробные числа больше единицы (например, 1,1, 1,5 и т.д.), одна единица считается равной 0,0001, 0,001, 0,01 или 0,1, в зависимости от ситуации. Для диапазонов, содержащих однозначные числа менее десяти (например, от 1 до 5), одна единица обычно считается равной 0,1. В настоящем описании присутствуют единственные примеры того, что конкретно заявлено, и все возможные комбинации числовых значений между наименьшим значением и перечисленным наивысшим значением должны рассматриваться как явно указанные в этом описании. В настоящем описании представлены, среди прочего, числовые диапазоны для относительных количеств компонентов в смеси и различных диапазонов температур и других параметров, указанных в способах.
[0158] Используемый в настоящем описании термин «введение» означает действие по введению штамма или композиции в окружающую среду.
[0159] Используемый в настоящем описании термин «животное» включает млекопитающих, амфибий, птиц, рептилий, свиней, коров, крупный рогатый скот, коз, лошадей, овец, домашнюю птицу и других животных, содержащихся или выращиваемых на ферма или ранчо, овец, крупных рогатых баранов, буйволов, антилоп, волов, ослов, мулов, оленей, лосей, карибу, водяных буйволов, верблюдов, лам, альпак, кроликов, мышей, крыс, морских свинок, хомяков, хорьков, собак, кошек и других домашних животных, приматов, обезьян, человекообразных обезьян и горилл, человека, но не ограничивается ими. В некоторых вариантах осуществления указанными животными являются жвачные животные, включая крупный рогатый скот, овец, коз и т.д., но не ограничиваются ими.
[0160] Используемый в настоящем описании термин «продуктивность животных» может определяться кормовой эффективностью и/или увеличением веса животного и/или коэффициентом конверсии корма и/или усвояемостью питательного вещества в корме (например, переваримостью аминокислот) и/или усваиваемой энергией или метаболизируемой энергией в корме и/или удерживании азота и/или способностью животных избегать негативных последствий некротического энтерита и/или иммунного ответа субъекта.
[0161] Под «по меньшей мере одним штаммом» подразумевается один штамм, а также смеси штаммов, включающие по меньшей мере два штамма бактерий. Под «смесью по меньшей мере двух штаммов» понимают смесь двух, трёх, четырёх, пяти, шести или даже более штаммов. В некоторых вариантах осуществления смеси штаммов пропорции могут варьироваться от 1% до 99%. Когда смесь содержит более двух штаммов, штаммы могут присутствовать в смеси в практически равных пропорциях или в разных пропорциях.
[0162] Используемый в настоящем описании термин «биологически чистый штамм» относится к штамму, не содержащему других бактериальных штаммов в количествах, достаточных для того, чтобы препятствовать репликации штамма или быть обнаруживаемыми с помощью обычных бактериологических методов. Термин «изолированный», использующийся в связи с организмами и культурами, описанными в настоящей заявке, включает в себя не только биологически чистый штамм, но также любую культуру организмов, которая выращивается или поддерживается иначе, чем в природе.
[0163] В настоящем описании Clostridium perfringens (ранее известный как C. welchii или Bacillus welchii) представляет собой грамположительную, палочковидную, анаэробную спорообразующую патогенную бактерию рода Clostridium.
[0164] Используемый в настоящем описании термин «контактирующий» относится к непрямому или прямому применению штаммов, микробов для контроля силоса («МКС») или композиции, раскрытой в данном документе, к продукту, включающему корм, но не ограничивающимся им. Примеры способов применения, которые могут быть использованы, включают обработку продукта с помощью материала, содержащего бактериальный штамм, МКС или композицию, непосредственное нанесение путём смешивания бактериального штамма, МКС или композиции с продуктом, распыление бактериального штамма, МКС или композиции на поверхность продукта или погружение продукта в препарат бактериального штамма, МКС или композицию, но не ограничиваются ими.
[0165] Используемый в настоящем описании термин «комбикорм» относится к коммерческому корму в форме муки, гранулы, орехов, кекса или крошки. Комбикорма могут быть смешаны из различных сырьевых материалов и добавок. Эти смеси смешивают в соответствии с конкретными требованиями целевого животного.
[0166] В одном варианте осуществления «эффективное количество» относится к количеству МКС, уменьшающему рост клостридий в корме, включая силос и корм, но не ограничиваются ими.
[0167] В другом варианте осуществления «эффективное количество» означает количество пробиотика для улучшения продуктивности животного. Улучшение производительности может быть измерено, как указано в настоящем описании, или другими способами, известными в данной области техники. Эффективное количество можно вводить животному, предоставляя неограниченный доступ к корму, содержащему пробиотик и экзогенные ферменты. Пробиотик и экзогенные ферменты также можно вводить в одной или нескольких дозах.
[0168] Используемый в настоящем описании термин «перевариваемость энергии» означает общую энергию потребленного корма минус общую энергию фекалий или общую энергию потребленного корма минус полную энергию оставшегося содержимого желудка в указанном сегменте желудочно-кишечного тракта животного, например, в подвздошной кишке. Метаболизируемая энергия, используемая в настоящем описании, относится к измеренной метаболизируемой энергии и означает валовую энергию потребляемого корма минус валовая энергия, содержащаяся в кале, моче и газообразных продуктах пищеварения. Перевариваемость энергии и метаболизируемая энергия могут быть измерены как разница между потреблением валовой энергии и валовой энергией, выделяемой с калом или содержимым желудка, присутствующей в указанном сегменте желудочно-кишечного тракта, с использованием тех же методов для измерения перевариваемости питательных веществ, с соответствующими поправками на экскрецию азота для расчёта метаболической энергии корма.
[0169] Используемый в настоящем описании термин «корм» используется как синоним термина «кормовой продукт».
[0170] Используемый в настоящем описании термин « кормовой продукт » может содержать кормовые материалы, включающие маис или кукурузу, пшеницу, ячмень, тритикале, рожь, рис, тапиоку, сорго и/или любые побочные продукты, а также компоненты, богатые белком, такие как сердцевина сои, рапсовый шрот, каноловый шрот, хлопковый шрот, подсолнечный шрот, побочные продукты животного происхождения и их смеси. Более предпочтительно, корм может содержать животные жиры и/или растительные масла. Корм может также содержать дополнительные минералы, такие как, например, кальций, и/или дополнительные витамины.
[0171] Используемый в настоящем описании термин «эффективность кормления» относится к количеству прибавки в весе у животного, которое происходит, когда животное получает неограниченное питание или определённое количество пищи в течение периода времени.
[0172] Используемый в настоящем описании термин «коэффициент конверсии корма» относится к соотношению количества корма, скармливаемого животному, увеличивающему массу животного, к указанному количеству скармливаемого корма.
[0173] Под «более низким коэффициентом конверсии корма» или «улучшенным коэффициентом конверсии корма» подразумевается, что использование пробиотика или композиции в корме приводит к уменьшению количества корма, необходимого для кормления животного, чтобы увеличить вес животное в пересчёте на указанное количество по сравнению с количеством корма, необходимого для увеличения веса животного по сравнению с таким же количеством корма, когда он не содержит указанный пробиотик или композицию.
[0174] Используемый в настоящем описании термин «корм» относится к любому корму, который предоставляется животному (а не тому корму, который животное должно добывать самостоятельно). Корм включает в себя растения, которые были срезаны. Термин «корм» включает сено, солому, силос, комбикорма и гранулы, масла и смешанные рационы, а также проросшие зерна и бобовые.
[0175] Используемый в настоящем описании термин «улучшенная продуктивность животных» означает повышенную эффективность корма, и/или увеличенный прирост массы, и/или пониженный коэффициент конверсии корма, и/или улучшенную усвояемость питательных веществ или энергии в корме и/или улучшенное усвоение азота и/или улучшенную способность избегать негативных эффектов некротического энтерита и/или улучшенный иммунный ответ у субъекта, являющегося результатом бактериального штамма, пробиотика, МКС или композиции, раскрытой в настоящем изобретении, по сравнению с субъектом, не получавшим указанный бактериальный штамм, пробиотик, МКС или композицию.
[0176] Используемый в настоящем описании термин «иммунный ответ» означает один из множества способов, которыми бактериальные штаммы, МКС, пробиотики или композиции, раскрытые в данном изобретении, модулируют иммунную систему животных, включая повышенную выработку антител, активацию клеточного иммунитета, регуляцию провоспалительных цитокинов и усиленную передачу сигналов, толл-подобными рецепторами. Следует понимать, что иммуностимуляция желудочно-кишечного тракта бактериальными штаммами, МКС, пробиотиками или композициями, раскрытыми в данном изобретении, может быть полезной для защиты хозяина от заболевания, и что иммуносупрессия желудочно-кишечного тракта может быть выгодной для хозяина, потому что меньше питательных веществ и энергии используются для поддержки иммунной функции.
[0177] Используемый в настоящем описании термин «домашний скот» относится к любому животноводческому животноводству. В одном варианте осуществления домашний скот представляет собой одного или нескольких жвачных животных, таких как крупный рогатый скот (например, коровы или быки, включая телят), животных с однокамерным желудком, таких как домашняя птица (включая бройлеров, цыплят и индеек), свиней (включая поросят), птиц, водных животных, такие как рыбы, агастральные рыбы, гастральные рыбы, пресноводные рыбы, такие как лосось, треска, форель и карп, например карп кои, морские рыбы, такие как морской окунь, и ракообразные, такие как креветки, мидии и морские гребешки, лошади (включая скаковых лошадей), овцы (включая ягнят).
[0178] Используемый в настоящем описании термин «микроб» используется взаимозаменяемо с термином «микроорганизмом».
[0179] Используемый в настоящем описании термин «усвоение азота» означает способность субъекта удерживать азот из рациона в виде массы тела. Отрицательный азотный баланс возникает, когда экскреция азота превышает ежедневное потребление, и часто наблюдается, когда уменьшается масса мышц. Положительный баланс азота часто связан с ростом мышц, особенно у растущих животных. Усвоение азота может быть измерено как разница между потреблением азота и выделением азота посредством общего сбора экскрементов и мочи в течение определённого периода времени. Следует понимать, что выделяемый азот включает непереваренный белок из корма, эндогенные белковые выделения, микробный белок и азот мочи.
[0180] Используемый в настоящем описании термин «перевариваемость питательных веществ» означает фракцию питательного вещества, которая исчезает из желудочно-кишечного тракта или определенного сегмента желудочно-кишечного тракта, например, тонкой кишки. Перевариваемость питательных веществ может быть измерена как разница между тем, что вводится субъекту, и тем, что выводится с фекалиями субъекта, или между тем, что вводится субъекту, и тем, что остается в содержимом желудка в указанном сегменте желудочно-кишечного тракта, например подвздошной кишке. Перевариваемость питательных веществ может быть измерена как разность между потреблением питательного вещества и выделением питательного вещества посредством полного сбора экскрементов в течение определённого периода времени; или с использованием инертного маркера, который не абсорбируется животным и позволяет исследователю рассчитать количество питательного вещества, которое исчезло во всем желудочно-кишечном тракте или сегменте желудочно-кишечного тракта. Таким инертным маркером может быть диоксид титана, оксид хрома или нерастворимая в кислоте зола. Перевариваемость может быть выражена в процентах от питательного вещества в корме или в единицах массы усваиваемого питательного вещества на единицу массы питательного вещества в корме.
[0181] Используемый в настоящем описании термин «уменьшение роста микроорганизмов» включает уменьшение роста микроорганизмов на процент или диапазон процентов, по меньшей мере, более 1%, но не ограничивается этим.
[0182] Используемый в настоящем описании термин «силос» относится к ферментированному корму с высоким содержанием влаги, которым можно кормить крупный рогатый скот, овец и других жвачных животных или использовать в качестве биотопливного сырья для анаэробных варочных котлов. Он ферментируется и сохраняется в процессе, называемом силосованием или вызреванием, и обычно производится из травяных культур, включая кукурузу, сорго или другие злаки, с использованием всего зеленого растения (а не только зерна). Силос может быть получен из многих полевых культур, и могут использоваться специальные термины в зависимости от типа (овсянка для овса, сенаж для люцерны - но см. ниже различия британского использования термина сенаж).
[0183] Используемый в настоящем описании термин «вариант» имеет по меньшей мере 80% идентичность генетических последовательностей с раскрытыми в настоящем описании штаммами с использованием анализа методом полимеразной цепной реакции случайной амплифицированной полиморфной ДНК (RAPD-PCR). Степень идентичности генетических последовательностей может варьироваться. В некоторых вариантах осуществления вариант имеет генетическую последовательность по меньшей мере на 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичную последовательности раскрытым в настоящем описании штаммами с использованием анализа RAPD-PCR. Шесть праймеров, которые могут использоваться для анализа RAPD-PCR, включают следующие: Праймер 1 (5'-GGTGCGGGAA-3') (SEQ ID No. 1), Праймер 2 (5'- GTTTCGCTCC-3') (SEQ ID No. 2), Праймер 3 (5'-GTAGACCCGT-3') (SEQ ID No. 3), Праймер 4 (5'-AAGAGCCCGT-3') (SEQ ID No. 4), Праймер 5 (5'- AACGCGCAAC-3') (SEQ ID No. 5), Праймер 6 (5'-CCCGTCAGCA-3') (SEQ ID No. 6). Анализ RAPD может быть выполнен с использованием аналитических бусин RAPD Ready-to-Go™ (Amersham Biosciences, Швеция), которые разработаны как предварительно смешанные, предварительно дозированные реакционные компоненты для проведения анализа RAPD.
[0184] Используемый в настоящем описании термин «жизнеспособный микроорганизм» относится к микроорганизму, который метаболически активен или обладает способностью к адаптации.
[0185] В одном варианте осуществления настоящее изобретение относится к бактериальным штаммам, МКС, композициям и способам контроля роста клостридий в кормах. В другом варианте осуществления настоящее изобретение относится к бактериальным штаммам, МКС, композициям и способам контроля роста клостридий в силосе.
[0186] В одном варианте осуществления настоящее изобретение относится к бактериальным штаммам, пробиотикам, композициям и способам улучшения продуктивности животного. Определенные штаммы Bacillus и их комбинации и композиции могут быть использованы для повышения показателей продуктивности животного.
I. Микробы
[0187] В одном варианте осуществления настоящее изобретение относится к одному или нескольким бактериальным штаммам. В ещё одном варианте осуществления настоящее изобретение относится к композициям, включающим или состоящим из одного или нескольких бактериальных штаммов или состоящим по существу из из одного или нескольких бактериальных штаммов. В одном варианте осуществления композиция может представлять собой гетерогенную смесь, гомогенную смесь, порошок, лиофилизированный порошок или любую их комбинацию.
A. Микробиологический контроль силоса
[0188] Микробы для контроля силоса (МКС) представляют собой микроорганизмы, которые уменьшают порчу субстрата, включая корм, силос и кормовой продукт, но не ограничиваются ими. В одном варианте осуществления МКС содержат жизнеспособный микроорганизм. В другом варианте осуществления МКС содержат жизнеспособную бактерию.
[0189] В одном варианте осуществления МКС может быть спорообразующей бактерией, и, следовательно, термин МКС может состоять из спор, например бактериальных спор, или содержать их. Следовательно, в одном варианте осуществления термин «жизнеспособный микроорганизм» в контексте настоящего описания может включать микробные споры, такие как эндоспоры.
[0190] В другом варианте осуществления настоящее изобретение относится к композициям, которые не состоят из микробных спор, например эндоспор, или не содержат их.
[0191] В одном варианте осуществления МКС представляет собой комбинацию, включающую два или более бактериальных штамма.
[0192] В одном варианте осуществления бактерия или бактерии являются или являются изолированными. В другом воплощении МКС представляет собой биологически чистую культуру бактерии. В еще одном варианте осуществления МКС представляет собой композицию, которая содержит по меньшей мере два бактериальных штамма, которые не содержат других микроорганизмов. В еще одном варианте осуществления МКС представляет собой композицию, которая содержит по меньшей мере два бактериальных штамма, которые не содержат других микроорганизмов, обнаруженных в природной среде.
[0193] В одном варианте осуществления МКС может быть жизнеспособным или нежизнеспособным микроорганизмом, который используется в изолированной или полуизолированной форме. МКС может использоваться в комбинации с ростовой средой, в которой он был культивирован, или без неё.
[0194] В одном варианте осуществления МКС способны продуцировать колониеобразующие единицы при выращивании на соответствующей среде. Соответствующая среда может содержать корм или компонент корма или состоять из них.
[0195] В одном варианте осуществления МКС не способны продуцировать колониеобразующие единицы при выращивании на подходящей среде. Независимо от того, способны ли МКС или неспособны продуцировать колониеобразующие единицы при выращивании на соответствующей среде, клетки могут все ещё оставаться метаболически активными, например, даже если они не способны к делению.
[0196] В одном варианте осуществления МКС можно вводить в виде нежизнеспособных клеток. В одном воплощении МКС могут быть введены в виде жизнеспособного микроорганизма.
[0197] В одном варианте осуществления МКС могут быть выбраны из следующих видов Bacillus: Bacillus subtilis, Bacillus cereus, Bacillus licheniformis, Bacillus amyloliquefaciens, Bacillus pumilus. В одном варианте осуществления МКС может представлять собой штамм Bacillus.
[0198] В одном варианте осуществления МКС может представлять собой Bacillus subtilis. В одном варианте осуществления МКС может быть выбран из группы, состоящей из: Bacillus subtilis 1104.
[0199] В ещё одном варианте осуществления МКС может представлять собой Bacillus subtilis. В ещё одном варианте осуществления МКС может представлять собой Bacillus subtilis 1781. В ещё одном варианте осуществления МКС может представлять собой Bacillus subtilis 747.
[0200] В другом варианте осуществления МКС представляет собой МКС из нескольких штаммом, включающих Bacillus subtilis 747, 1104, 1541, 1781, 1999 и 2018.
a. Композиция МКС
[0201] В одном варианте осуществления композиция МКС содержит инокулянт из 50% каждого из штаммов Bacillus 1104 и 1781.
[0202] В другом варианте осуществления МКС представляет собой МКС из нескольких штаммов и содержит штаммы Bacillus subtilis 1104 и 1781, и штаммы МКБ. Композиция штаммов МКБ содержит 30% Lp115 (Lactobacillus plantarum), 30% Pj300 (Pediococcus acidilactici), 30% P751 (P. pentosaceus), и 10% Enterococcus faecium.
[0203] В другом варианте осуществления целевые нормы внесения инокулянта на грамм силоса варьируют для Bacillus от приблизительно 5 000 КОЕ/г до приблизительно 5 000 000 КОЕ/г. Ингибитор ЛАБ может применяться при 150 000 КОЕ/г.
b. Дозирование
[0204] В одном варианте осуществления МКС и композиции, раскрытые в данном документе, могут быть предназначены для одноразового применения. В одном варианте осуществления МКС и композиции, раскрытые в данном документе, могут быть смешаны с субстратом, таким как силос или корм, для предотвращения порчи, вызываемой клостридиями.
[0205] Оптимальное количество композиции (и каждого содержащегося в ней компонента) для использования в комбинации может зависеть от продукта, подлежащего обработке, и/или от способа контакта продукта с композицией и/или предполагаемого использования композиции. Количество МКС должно быть достаточным для того, чтобы быть эффективным и оставаться достаточно эффективным для уменьшения порчи субстрата.
B. Пробиотки
[0206] Пробиотики - это микроорганизмы, которые улучшают продуктивность животного. В одном варианте указанный пробиотик содержит жизнеспособный микроорганизм. В другом варианте осуществления указанный пробиотик содержит жизнеспособную бактерию.
[0207] В одном варианте осуществления пробиотик может быть спорообразующей бактерией, и, следовательно, пробиотик может состоять из спор, например, бактериальных спор, или содержать их. Следовательно, в одном варианте осуществления термин «жизнеспособный микроорганизм», как он использован в настоящем описании, может включать микробные споры, такие как эндоспоры или конидии.
[0208] В другом варианте осуществления настоящее изобретение относится к композициям, которые не состоят из микробных спор, например, эндоспор, или не содержат их.
[0209] В одном варианте осуществления пробиотик представляет собой комбинацию, включающую два или более бактериальных штамма.
[0210] В одном варианте осуществления бактерия или бактерии являются изолированными. В другом варианте осуществления пробиотик представляет собой биологически чистую культуру бактерии. В ещё одном варианте осуществления пробиотик представляет собой композицию, которая содержит по меньшей мере два бактериальных штамма, которые не содержат других микроорганизмов. В ещё одном варианте осуществления пробиотик представляет собой композицию, которая содержит по меньшей мере два бактериальных штамма, которые не содержат других микроорганизмов, обнаруженных в природной среде.
[0211] В одном варианте осуществления пробиотик может представлять собой жизнеспособный или нежизнеспособный микроорганизм, который используется в изолированной или полуизолированной форме. Пробиотик может использоваться в комбинации с питательной средой, в которой он был культивирован, или без неё.
[0212] В одном варианте осуществления пробиотик способен продуцировать колониеобразующие единицы при выращивании на подходящей среде. Соответствующая среда может содержать корм или компонент корма или состоять из них.
[0213] В одном варианте осуществления пробиотик неспособен продуцировать колониеобразующие единицы при выращивании на подходящей среде. Независимо от того, способен ли пробиотик или неспособен продуцировать колониеобразующие единицы при выращивании на соответствующей среде, клетки могут все ещё оставаться метаболически активными (например, даже если они не способны делиться).
[0214] В одном варианте осуществления пробиотик может вводиться в виде нежизнеспособных клеток.
[0215] В одном варианте осуществления пробиотик может представлять собой Bacillus subtilis. В одном варианте осуществления пробиотик может быть выбран из группы, состоящей из: Bacillus subtilis 747, 1104, 1541, 1781, 1999, 2018.
[0216] В одном варианте осуществления пробиотик представляет собой пробиотик состоящий из нескольких штаммов, содержащий Bacillus subtilis 747, 1104, 1541, 1781, 1999, 2018.
a. Получение композиции пробиотика
[0217] В одном варианте осуществления один или несколько носителей или других ингредиентов могут быть добавлены к пробиотику. Пробиотик может быть представлен в различных физических формах, например, в виде подкормки, в виде водорастворимого концентрата для использования в качестве жидкого средства или для добавления в заменитель молока, желатиновую капсулу или гели.
[0218] В одном варианте осуществления формы в виде подкормки, высушенный сублимацией продукт ферментации добавляют к носителю, такому как сыворотка, мальтодекстрин, сахароза, декстроза, известняк (карбонат кальция), рисовая шелуха, дрожжевая культура, высушенный крахмал и/или алюмосиликат натрия.
[0219] В одном варианте осуществления в виде водорастворимого концентрата для жидкой лекарственной формы для перорального введения или добавки для заменителя молока, лиофилизированный продукт ферментации добавляют к водорастворимому носителю, такому как сыворотка, мальтодекстрин, сахароза, декстроза, высушенный крахмал, алюмосиликат натрия, и добавляют жидкость для образования жидкой лекарственной формы для перорального введения, а добавку добавляют в молоко или заменитель молока.
[0220] В одном варианте осуществления в форме желатиновой капсулы, лиофилизированный продукт ферментации добавляют к носителю, такому как сыворотка, мальтодекстрин, сахар, известняк (карбонат кальция), рисовая шелуха, высушенный крахмал дрожжевой культуры и/или алюмиосиликата натрия.
[0221] В одном варианте осуществления бактерии и носитель заключены в разлагаемую желатиновую капсулу. В одном варианте осуществления в форме геля, лиофилизированный продукт ферментации добавляют к носителю, такому как растительное масло, сахароза, диоксид кремния, полисорбат 80, пропиленгликоль, бутилированный гидроксианизол, лимонная кислота, этоксихин и / или искусственный краситель, чтобы сформировать гель.
[0222] Пробиотик или пробиотики могут быть необязательно смешаны с сухим составом добавок, включая субстраты для роста, ферменты, сахара, углеводы, экстракты и стимулирующие рост микро-ингредиенты, но не ограничиваются ими. Сахара могут включать следующие сахара: лактоза, мальтоза, декстроза, мальто-декстрин, глюкоза, фруктоза, манноза, тагатоза, сорбоза, рафиноза и галактоза. Уровень сахара варьируется в диапазоне 50 до 95%, как по отдельности, так и в комбинации. Экстракты могут включать дрожжи или сухие растворы для ферментации дрожжей в диапазоне 5-50%. Субстраты для роста могут включать триптиказу в диапазоне 5-25%; лактат натрия в диапазоне 5-30%; а также Твин 80 в диапазоне 1-5%. Углеводы могут включать маннит, сорбит, адонит и арабит. Уровень углеводов варьируется в диапазоне от 5-50% по отдельности или в комбинации. Микро-ингредиенты могут включать следующие вещества: карбонат кальция в диапазоне от 0,5 до 5,0%; хлорид кальция в диапазоне 0,5-5,0%; дикалийфосфат в диапазоне от 0,5 до 5,0%; фосфат кальция в пределах 0,5-5,0%; протеинат марганца в диапазоне 0,25-1,00%; и марганец в диапазоне 0,25-1,0%.
[0223] Для приготовления пробиотиков, описанных в настоящем документе, культура(ы) и носитель(и) (если используется) могут быть добавлены в ленточный или лопастной смеситель и перемешаны в течение примерно 15 минут, хотя время может быть увеличено или уменьшено. Компоненты смешиваются так, что получается однородная смесь культур и носителей. Конечный продукт предпочтительно представляет собой сухой сыпучий порошок. Затем пробиотики или композицию, содержащую их, можно добавлять в корм для животных или кормовой премикс, добавлять в воду животного или вводить другими способами, известными в данной области (предпочтительно одновременно с ферментами согласно настоящему изобретению). Корм для животного может быть дополнен одним или несколькими пробиотиками, описанными в настоящей заявке, или композицией, описанной в настоящей заявке.
[0224] В одном варианте осуществления пробиотики и композиции, раскрытые в настоящей заявке, могут быть в форме концентрата. Обычно эти концентраты содержат существенно более высокую концентрацию пробиотика.
[0225] Порошки, гранулы и жидкие композиции в форме концентратов могут быть разбавлены водой или ресуспендированы в воде или других подходящих разбавителях, например, подходящей питательной среде, такой как молоко или минеральные или растительные масла, для получения композиций, готовых к применению.
[0226] Пробиотик и композиции, раскрытые в настоящей заявке, в форме концентратов, могут быть получены в соответствии со способами, известными в данной области техники.
b. Дозирование
[0227] В одном варианте осуществления пробиотики и композиции, раскрытые в данном документе, обеспечивают содержание жизнеспособных клеток (колониеобразующих единиц, КОЕ) в диапазоне, выбранном от примерно 108 КОЕ/на голову/сутки до примерно 5×109 КОЕ/на голову/сутки.
[0228] В одном варианте осуществления пробиотика в форме концентрата может иметь содержание жизнеспособных клеток в диапазоне по меньшей мере от 109 КОЕ/г до примерно 1012 КОЕ/г или по меньшей мере от 1011 КОЕ/г до примерно 1012 КОЕ/г.
[0229] В одном варианте осуществления композиция пробиотика и/или кормовой добавки, раскрытая в данном документе, может быть предназначена для однократного введения дозы или может быть предназначена для ежедневного кормления. Оптимальное количество композиции (и каждого содержащегося в ней компонента) для использования в комбинации будет зависеть от продукта, подлежащего обработке, и/или от способа контакта продукта с композицией и/или её предполагаемого использования. Количество пробиотика, используемого в композициях, должно быть достаточным для того, чтобы быть эффективным и оставаться достаточно эффективным в улучшении эффективности кормовых продуктов для животных, содержащих указанную композицию. Этот промежуток времени в отношении эффективности должен составлять, по меньшей мере, время использования продукта (например, композиции кормовой добавки или корма, содержащего её).
C. Депонирование в соответствии с Будапештским договором
[0230] Штаммы Bacillus 747, 1104, 1541, 1781 и 2018 были депонированы 24 мая 2016 года в Коллекции культур сельскохозяйственной исследовательской службы (NRRL), 1815 North University Street, Peoria, Иллинойс, 61604, и им были присвоены регистрационные номера NRRL B-67257 для штамма 747, NRRL B-67258 для штамма 1104, NRRL B-67260 для штамма 1541, NRRL B-67259 для штамма 1781 и NRRL B-67261 для штамма 2018. Штамм 1999 был депонирован 15 сентября 2016 года и получил регистрационный номер NRRL B-67318. Все депозиты были сделаны в соответствии с положениями Будапештского договора о международном признании депонирования микроорганизмов для целей патентной процедуры.
D. Способы культивирования штаммов.
[0231] Штаммы Bacillus могут быть получены путём ферментации бактериальных штаммов. Ферментация может быть начата путём масштабирования посевной культуры. Это включает многократный и асептический перенос культуры во всё больший и больший объём в качестве инокулята для ферментации, которую проводят в больших ферментерах из нержавеющей стали в среде, содержащей белки, углеводы и минералы, необходимые для оптимального роста. Примером такой среды, не ограничивающей рамки настоящего изобретения, является Tyticase Soy Broth (TSB). После добавления инокулята в сосуд для ферментации регулируют температуру и перемешивание для обеспечения максимального роста. Как только культура достигает максимальной плотности популяции, её собирают путём отделения клеток от ферментационной среды. Обычно это делают центрифугированием.
[0232] Затем можно определить количество культуры. Колониеобразующая единица (КОЕ) - это количество жизнеспособных клеток в образце, полученное в результате стандартных методов микробиологического посева. Термин происходит из того факта, что отдельная клетка при посеве на соответствующую среду будет расти и становиться жизнеспособной колонией в агаровой среде. Поскольку из нескольких клеток может образовываться одна видимая колония, термин «колониеобразующая единица» является более полезной единицей измерения, чем число клеток.
[0233] В одном варианте осуществления штаммы Bacillus, раскрытые в данном документе, могут быть ферментированы в диапазоне от 5×108 КОЕ/мл до около 5×1011 КОЕ/мл.
[0234] По меньшей мере в одном варианте осуществления используется уровень 2×109 КОЕ/мл. Бактерии собирают центрифугированием, а супернатант удаляют. Супернатант можно использовать в описанных в настоящей заявке способах. По меньшей мере в некоторых вариантах осуществления бактерии являются гранулированными. По меньшей мере в некоторых вариантах осуществления бактерии являются лиофилизированными. По меньшей мере в некоторых вариантах осуществления бактерии смешивают с носителем. Тем не менее, нет необходимости лиофилизовать Bacillus перед их использованием. Штаммы также можно использовать с консервантами или без них, а также в концентрированной, неконцентрированной или разбавленной форме.
[0235] В одном варианте осуществления настоящее изобретение относится к биологически чистой культуре, включающей, состоящей из по существу из одного или нескольких штаммов Bacillus, раскрытых в настоящем документе, или содержащей их в концентрации от примерно 5×102 КОЕ/мл до примерно 5×109 КОЕ/мл.
[0236] В одном варианте осуществления настоящее изобретение относится к культуре, включающей, состоящей из по существу из одного или нескольких штаммов Bacillus, раскрытых в данном документе, или содержащей их в концентрации, выбранной из группы, состоящей из 5×1011 КОЕ/мл, 5×1012 КОЕ/мл и 5×1013 КОЕ/мл.
[0237] В одном варианте осуществления настоящее изобретение относится к культуре, включающей, состоящей из по существу из одного или нескольких штаммов Bacillus, раскрытых в данном документе, или содержащей их в концентрации от 5×1010 КОЕ/мл до 1012 КОЕ/мл или от 5×1011 КОЕ/мл до 1012 КОЕ/мл.
II. Композиции
[0238] В одном варианте осуществления настоящее изобретение относится к композиции, содержащей один или несколько штаммов Bacillus, раскрытых в данном документе. В ещё одном варианте осуществления настоящее изобретение относится к композиции, содержащей один или несколько МКС. В ещё одном варианте осуществления настоящее изобретение относится к композиции, содержащей один или несколько пробиотиков.
[0239] В одном варианте осуществления настоящее изобретение относится к композиции, содержащей один или несколько штаммов Bacillus, выбранных из группы, состоящей из Bacillus subtilis 781 и Bacillus subtilis 747, где указанная композиция не содержит других микробных организмов.
[0240] В одном варианте осуществления настоящее изобретение относится к композиции, содержащей один или несколько штаммов Bacillus, выбранных из группы, состоящей из Bacillus subtilis 747, 1781, 1104, 1541, 1999 и 2018, где указанные штаммы Bacillus являются биологически чистыми до получения композиции.
[0241] В одном варианте осуществления настоящее изобретение относится к композиции, содержащей (а) один или несколько штаммов Bacillus, выбранных из группы, состоящей из Bacillus subtilis 1781 и Bacillus subtilis 747; (б) носитель и (в) консервант. В другом варианте осуществления один или несколько штаммов Bacillus имеют концентрацию, по меньшей мере, 109 КОЕ/мл.
[0242] В другом варианте осуществления настоящее изобретение относится к композиции, содержащей (а) один или несколько штаммов Bacillus, выбранных из группы, состоящей из Bacillus subtilis 1781, Bacillus subtilis 747 и (б) корма. В ещё одном варианте осуществления настоящее изобретение относится к корму, содержащему (а) один или несколько штаммов Bacillus, выбранных из группы, состоящей из Bacillus subtilis 1104, 1781 и 2018, (б) силос или корм, где указанный корм имеет более низкую концентрацию клостридий по сравнению с кормом без указанных штаммов Bacillus.
III. Корм / кормовой продукт
[0243] В одном варианте осуществления штаммы, МКС, пробиотики и композиции, раскрытые в данном документе, могут использоваться в качестве корма или при приготовлении корма. В одном варианте осуществления указанным кормом является кормовой продукт. В другом варианте осуществления указанным кормом является силос.
[0244] Фураж, который был выращен в то время, когда он ещё был зеленым и питательным, может быть сохранён с помощью естественного процесса «заквашивания». Молочная кислота образуется, когда сахара в кормовых растениях ферментируются бактериями в герметичном контейнере («бункере») без воздуха. Корм, сохраняемый таким образом, известен как «силосный корм» или «силос» и будет храниться до трёх лет без ухудшения его качества. Силос очень благоприятен для скота и может быть скормлен в любое время.
[0245] Указанный корм может быть в форме раствора или в виде твёрдого вещества, в зависимости от использования и/или способа применения и/или способа введения. При использовании в качестве корма или при приготовлении корма, такого как функциональный корм, композиция согласно настоящему изобретению может использоваться в сочетании с одним или несколькими из следующего: приемлемого для питания носителя, приемлемого для питания разбавителя, приемлемого для питания наполнителя, диетически приемлемого адъюванта, пищевого активного ингредиента.
[0246] В одном варианте осуществления штаммы, МКС, пробиотики и композиции, раскрытые в данном документе, смешивают с компонентом корма для образования кормового продукта. В одном варианте осуществления указанный корм может представлять собой корм или его премикс, комбикорм или его премикс. В одном варианте осуществления штаммы, МКС, пробиотики и композиции, раскрытые в данном документе, могут быть смешаны с комбикормом, компонентом комбикорма или с премиксом комбикорма или с кормом, кормовым компонентом или премиксом корма.
[0247] В ещё одном варианте осуществления штаммы, МКС, пробиотики и композиции, раскрытые в данном документе, могут быть смешаны с силосом, прессованными и гранулированными кормами, маслами и смешанными рационами, а также проросшими зернами и бобовыми. Корм может быть получен из одного или нескольких растений, выбранных из следующего: рапса, ячменя (канола), кукурузы (маиса), проса, овса, сорго, сои, пшеницы и бобовых.
[0248] Любой раскрытый в настоящей заявке кормовой продукт может содержать один или несколько кормовых материалов, выбранных из группы, включающей а) злаки, такие как мелкие зерна (например, пшеница, ячмень, рожь, овес и их комбинации) и/или крупные зерна, такие как маис или сорго; b) побочные продукты из зерновых, такие как кукурузная глютеновая мука, влажный жмых (особенно влажный жмых на кукурузной основе), высушенное зерно дистилляторов (DDG) (особенно дистилляторы из высушенного зерна (cDDG)), растворимые вещества дистилляторов из высушенного зерна (DDGS) (в частности, на основе кукурузы на основе дистиллированных сухих растворимых зерен (cDDGS)), пшеничные отруби, средние пшеничные шорты, пшеничные шорты, рисовые отруби, рисовая шелуха, овсяная шелуха, ядро пальмы и мякоть цитрусовых; в) белок, полученный из таких источников, как соя, подсолнечник, арахис, люпин, горох, фасоль, хлопок, канола, рыбная мука, сухой белок плазмы, мясокостная мука, картофельный белок, сыворотка, копра, кунжут; г) масла и жиры, полученные из растительных и животных источников; д) минералы и витамины.
[0249] Корм может содержать по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30% или по меньшей мере 50% по массе кукурузной и соевой муки или кукурузной и жирной сои, или пшеничной муки или подсолнечной муки.
[0250] Корм может содержать от около 0 до около 40% кукурузы DDGS. Если корм содержит какое-либо количество кукурузы DDGS, он может содержать от около 5 до около 40% кукурузы DDGS. Для домашней птицы, если присутствует кукуруза DDGS, кормовой материал в среднем может содержать от 7 до 15% кукурузы DDGS. Для свиней, если присутствует кукуруза DDGS, корм может содержать в среднем от 5 до 40% кукурузыё DDGS.
[0251] Корм может содержать кукурузу только виде зерна, и в этом случае корм может содержать от около 35% до около 80% кукурузы.
[0252] В одном варианте осуществления корм может представлять собой одно или несколько из следующего: комбикорм и премикс, включая пеллеты, орехи или жмых (для крупного рогатого скота); растения или растительный остаток: кукуруза, соя, сорго, овес, ячмень, копра, мякина, отходы сахарной свеклы; корм из рыбы; мясокостная мука; меласса; масляный жмых и прессованный жмых; олигосахариды; консервированные кормовые растения: силос; морские водоросли; семена и зерна, как целые, так и приготовленные дроблением, измельчением и т. д.; проросшие зерна и бобовые; дрожжевой экстракт.
[0253] В одном варианте осуществления бактериальный штамм, МКС, пробиотик или композицию, раскрытые в данном документе, смешивают с продуктом (например, кормом). В другом варианте осуществления бактериальный штамм, МКС, пробиотик или композиция могут быть включены в эмульсию или исходные ингредиенты корма. Для некоторых применений важно, чтобы композиция была доступна на поверхности продукта, на который воздействуют или который обрабатывают. Это позволяет композиции придавать одну или несколько из следующих благоприятных характеристик: повышение производительности.
[0254] В одном варианте осуществления бактериальный штамм, МКС, пробиотик или композиция, раскрытые в данном документе, могут быть применены для вкрапления, нанесения покрытия и/или пропитки продукта (например, корма или сырых ингредиентов корма).
[0255] В одном варианте осуществления бактериальный штамм, МКС, пробиотик или композиция, раскрытые в данном документе, могут быть добавлены в подходящих концентрациях, таких как, например, концентрации в конечном продукте питания, которые предлагают суточную дозу приблизительно от 2×105 КОЕ до около 2×1011 КОЕ, соответственно от около 2×106 до около 1×1010 или от около 3,75×107 КОЕ до около 1×1010 КОЕ.
[0256] В ещё одном варианте осуществления бактериальный штамм, МКС, пробиотик или композиция будут термостабильными для термической обработки до примерно 70°С, примерно до 85°С или примерно до 95°C. Термическая обработка может выполняться в течение примерно 1 минуты, примерно до 5 минут; примерно до 10 минут, примерно до 30 минут, примерно до 60 минут. Термин «термически стабильный» означает, что, по меньшей мере около 75% бактериального штамма или МКС, которые присутствовали/активны в добавке перед нагреванием до указанной температуры, всё еще присутствуют/активны после того, как она остынет до комнатной температуры. В одном варианте осуществления, по меньшей мере около 80% бактериального штамма или МКС, которые присутствовали и активны в добавке перед нагреванием до указанной температуры, все ещё присутствуют и активны после того, как она остынет до комнатной температуры.
[0257] В одном варианте осуществления бактериальный штамм, МКС, пробиотик или композиция, раскрытые в данном документе, гомогенизируют для получения порошка.
IV. Формы
[0258] В одном варианте осуществления бактериальный штамм, МКС, пробиотик или композиция и другие компоненты и/или корм, содержащий их, могут быть использованы в любой подходящей форме. Штамм бактерий, МКС, пробиотик или композиция, раскрытые в данном документе, могут быть использованы в форме твёрдых или жидких препаратов или их альтернатив. Примеры твёрдых препаратов включают порошки, пасты, болюсы, капсулы, пеллеты, таблетки, пудра и гранулы, которые могут быть смачиваемыми, высушенными распылением или лиофилизированными. Примеры жидких препаратов включают водные, органические или водно-органические растворы, суспензии и эмульсии, но не ограничиваются ими.
[0259] В некоторых применениях бактериальный штамм, МКС, пробиотик или композиция, раскрытые в данном описании, могут быть смешаны с кормом или введены в питьевую воду. В одном воплощении диапазон дозировки для включения в воду составляет от примерно 1×108 КОЕ/животное/сутки до примерно 1×1010 КОЕ/животное/сутки и более предпочтительно примерно 1×109 КОЕ/животное/сутки.
[0260] Подходящие примеры форм включают одно или несколько из следующего: порошки, пасты, болюсы, гранулы, таблетки, пилюли, капсулы, растворов или суспензий, которые могут содержать ароматизаторы или красители, для немедленного, замедленного, модифицированного, длительного, импульсного или контролируемого высвобождения.
[0261] Например, если бактериальный штамм, МКС, пробиотик или композиция, раскрытые в данном документе, используются в твёрдом виде, например, в форме таблеток, они также могут содержать один или несколько из следующего: эксципиенты, такие как микрокристаллическая целлюлоза, лактоза, цитрат натрия, карбонат кальция, двухосновный фосфат кальция и глицин; дезинтегранты, такие как крахмал (предпочтительно кукурузный, картофельный или крахмал из тапиоки), гликолят крахмала натрия, кроскармеллоза натрия и некоторые сложные силикаты; гранулирующие связующие, такие как поливинилпирролидон, гидроксипропилметилцеллюлоза (ГПМЦ), гидроксипропилцеллюлоза (ГПЦ), сахароза, желатин и камедь; могут быть включены лубриканты, такие как стеарат магния, стеариновая кислота, глицерилбегенат и тальк.
[0262] Примеры приемлемых для питания носителей для использования при приготовлении форм включают, например, воду, растворы солей, спирт, силикон, воски, вазелин, растительные масла, полиэтиленгликоли, пропиленгликоль, липосомы, сахара, желатин, лактозу, амилозу, стеарат магния, тальк, поверхностно-активные вещества, кремниевую кислоту, вязкий парафин, парфюмерное масло, моноглицериды и диглицериды жирных кислот, сложные эфиры петроэфирных жирных кислот, гидроксиметилцеллюлоза, поливинилпирролидон и подобные им вещества.
[0263] В одном варианте осуществления наполнители для форм включают лактозу, крахмал, целлюлозу, молочный сахар или полиэтиленгликоли с высокой молекулярной массой.
[0264] Для получения водных суспензий и/или эликсиров бактериальный штамм, МКС, пробиотик или композиция, раскрытые в данном документе, могут комбинироваться с различными подсластителями или ароматизаторами, красящими веществами или красителями, с эмульгирующими и/или суспендирующими агентами и с разбавителями, такими как вода, пропиленгликоль и глицерин, и их комбинациями.
[0265] В одном варианте осуществления негигроскопичная сыворотка может использоваться в качестве носителя для бактериального штамма, МКС, пробиотика или композиции, раскрытой в данном документе (в частности, бактериальных пробиотиков), и является хорошей средой для инициирования роста. Штамм бактерий, МКС, пробиотик или композиция, раскрытые в данном документе, содержащие пасты, может быть приготовлены на основе растительного масла и инертных гелеобразующих ингредиентов.
[0266] В одном варианте осуществления продукты грибов могут быть использованы вместе с побочным продуктами зерна в качестве носителей.
[0267] Сухой порошок или гранулы могут быть получены с использованием средств, известных специалистам в данной области техники, такими как устройство для нанесения покрытий с верхним распылением в псевдоожиженном слое, нижний распылитель Вюрстера или грануляция в барабане (например, гранулирование с высокой степенью прозрачности), экструзия, покрытие на сковороде или в смесителе микроэлементов.
[0268] В другом варианте осуществления бактериальные штаммы, МКС, пробиотики или композиции, раскрытые в данном документе, могут быть покрыты оболочкой, например инкапсулированы. В некоторых вариантах осуществления, таких, когда бактериальный штамм способен продуцировать эндоспоры, бактериальные штаммы, МКС, пробиотики или композиции, раскрытые в данном документе, могут быть предоставлены без какого-либо покрытия.
V. Способы обработки корма с помощью пробиотика
[0269] В одном варианте осуществления настоящее изобретение относится к способам уменьшения порчи корма, включающим смешивание МКС или композиции, раскрытой в настоящей заявке, с кормом в эффективном количестве для уменьшения порчи силоса по сравнению с кормом, не смешанным с указанными МКС или указанной композицией. В одном варианте осуществления указанный корм представляет собой силос или кормовой продукт.
[0270] В одном варианте осуществления порча корма уменьшается на процент, выбранный из группы, состоящей из: по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 15 %, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60% по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% и по меньшей мере 99% по сравнению с кормом, не обработанным МКС или композицией.
[0271] В одном варианте осуществления порча корма уменьшается на величину в диапазоне с 2 до 5%, или с 5 до 10%, или с 10 до 15%, или с 15 до 20%, или с 20 до 25%, или с 25 до 30%, или от 30 до 35%, или от 35 до 40%, или от 40 до 45%, или от 45 до 50%, или от 50 до 55%, или от 55 до 60%, или от 60 до 65%, или от 65 до 70%, или от 70 до 75%, или от 75 до 80%, или от 80 до 85%, или от 85 до 90%, или от 90 до 95%, или от 95 до 99 % по сравнению с кормом, не обработанным МКС или композицией.
[0272] В другом варианте осуществления настоящее изобретение относится к способам борьбы с ростом микроорганизмов в корме, включающим смешивание МКС или композиции, раскрытой в данном документе, с кормом в эффективном количестве для контроля роста микроорганизмов в корме.
[0273] В другом варианте осуществления настоящее изобретение относится к способам снижения роста клостридий в корме, включающим смешивание МКС или композиции, раскрытой в настоящей заявке, с кормом в эффективном количестве для контроля роста клостридий в корме.
[0274] В другом варианте осуществления настоящее изобретение относится к способам снижения роста клостридий в корме, включающим: (а) смешивание МКС или композиции, раскрытой в настоящей заявке, в жидкости; (б) смешивание указанной жидкости с кормом; и (с) размещение указанного корма в запечатанном контейнере.
[0275] В другом варианте осуществления настоящее изобретение относится к способам снижения роста клостридий в корме, включающим: (а) смешивание МКС или композиции, раскрытой в настоящей заявке, в сухом виде с кормом; и (б) размещение указанного корма в запечатанном контейнере.
[0276] В другом варианте осуществления настоящее изобретение относится к способам снижения роста клостридий в корме, включающим: (а) распыление МКС или композиции, раскрытой в настоящей заявке, на корм; и (б) размещение указанного корма в запечатанном контейнере.
[0277] В одном варианте осуществления настоящее изобретение относится к способам получения силоса, включающим: (а) смешивание МКС или композиции, раскрытой в настоящей заявке, в жидкости; (б) смешивание указанной жидкости с кормом; (в) размещение указанного корма в запечатанном контейнере в течение подходящего периода времени; и (d) получение силоса из указанного контейнера.
[0278] В другом варианте осуществления настоящее изобретение относится к способам производства силоса, включающим: (а) смешивание МКС или композиции, раскрытой в настоящей заявке, в сухой форме с кормом; (б) размещение указанного корма в герметичном контейнере; и (c) получение или сбор силоса из указанного контейнера.
[0279] В другом варианте осуществления настоящее изобретение относится к способам производства силоса, включающим: (а) распыление МКС или композиции, раскрытой в настоящей заявке, на корм; (б) размещение указанного корма в герметичном контейнере; и (c) получение или сбор силоса из указанного контейнера.
[0280] В одном варианте осуществления МКС или композицию смешивают или распыляют в процентном содержании корма, выбранном из группы, состоящей из: 5-10%, 10-20%, 20-30%, 30-40%, 40-50%, 50-60%, 60-70%, 70-80%, 80-90%, 90-95%, 95-99% и 100% указанного корма.
[0281] В одном варианте осуществления МКС или композицию смешивают или распыляют с по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 15%, по меньшей мере, 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35% , по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85% , по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 99% и 100% указанного корма.
[0282] В одном варианте осуществления герметичный контейнер представляет собой силосную башню. В другом варианте герметичный контейнер представляет собой пластиковый пакет.
[0283] В одном варианте силос имеет более низкую концентрацию патогенных микроорганизмов, таких как клостридии, по сравнению с силосом, полученным из корма, не обработанного штаммами Bacillus.
[0284] В одном варианте осуществления рост клостридий уменьшается на процент, выбранный из группы, состоящей из: по меньшей мере 2%, по меньшей мере 3%, по меньшей мере 4%, по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 15 %, не менее 20%, не менее 25%, не менее 30%, не менее 35%, не менее 40%, не менее 45%, не менее 50%, не менее 55%, не менее 60% не менее 65 %, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере по меньшей мере 95% и по меньшей мере 99% по сравнению с кормом, не обработанным МКС или композицией.
[0285] В одном варианте осуществления рост клостридий снижается с 2 до 5%, или с 5 до 10%, или с 10 до 15%, или с 15 до 20%, или с 20 до 25%, или с 25 до 30%, или от 30 до 35%, или от 35 до 40%, или от 40 до 45%, или от 45 до 50%, или от 50 до 55%, или от 55 до 60%, или от 60 до 65 %, или от 65 до 70%, или от 70 до 75%, или от 75 до 80%, или от 80 до 85%, или от 85 до 90%, или от 90 до 95%, или от 95 до 99% по сравнению с кормом, не обработанным МКС или композицией.
[0286] В одном варианте осуществления указанной клостридией является Clostridium tetani, Clostridium botulinum, Clostridium perfringens, Clostridium acetobutylicum, Clostridium difficile, Clostridium novyi
[0287] В одном варианте осуществления указанной клостридией является Clostridium perfringens.
[0288] В другом варианте осуществления настоящее изобретение относится к способам увеличения срока годности или хранения корма, включающим смешивание МКС или композиции с кормом в эффективном количестве для увеличения срока годности или продолжительности хранения корма по сравнению с кормом, не смешанным с МКС или композиция.
[0289] В одном варианте осуществления МКС содержит один или несколько штаммов Bacillus. В одном варианте осуществления штаммы Bacillus имеют концентрацию, выбранную из группы, состоящей из: 5000 КОЕ/г, 10 000 КОЕ/г, 15 000 КОЕ/г, 20 000 КОЕ/г, 25 000 КОЕ/г, 30 000 КОЕ/г, 35 000 КОЕ/г, 40 000 КОЕ/г, 45 000 КОЕ/г, 50 000 КОЕ/г, 55 000 КОЕ/г, 60 000 КОЕ/г, 65 000 КОЕ/г, 70 000 КОЕ/г, 75 000 КОЕ/г, 80 000 КОЕ/г, 85 000 КОЕ/г, 90 000 КОЕ/г, 95 000 КОЕ/г и 100 000 КОЕ/г. В одном варианте осуществления МКС представляет собой композицию Bacillus amyloliquefaciens 1104 и Bacillus subtilis 1781.
[0290] В еще одном варианте осуществления штаммы Bacillus имеют концентрацию, выбранную из группы, состоящей из: от 5 000 КОЕ/г до 10,000 КОЕ/г.
[0291] В еще одном варианте осуществления штаммы Bacillus имеют концентрацию, выбранную из группы, состоящей из: от 10,000 КОЕ/г до 75,000 КОЕ/г.
[0292] В еще одном варианте осуществления штаммы Bacillus имеют концентрацию, выбранную из группы, состоящей из: 103 КОЕ/г, 104 КОЕ/г, 105 КОЕ/г, 106 КОЕ/г, 107 КОЕ/г, 108 КОЕ/г, 109 КОЕ/г и 1010 КОЕ/г.
[0293] В другом варианте осуществления указанная композиция дополнительно содержит консервант.
[0294] В одном варианте осуществления МКС представляет собой композицию молочнокислых бактерий и бактерий Bacillus. В одном варианте осуществления КОЕ молочнокислых бактерий в 2 раза превосходит КОЕ штаммов Bacillus в указанной композиции. В ещё одном варианте осуществления КОЕ молочнокислых бактерий в 3 раза превышает КОЕ штаммов Bacillus в указанной композиции.
[0295] В одном варианте осуществления концентрация молочнокислых бактерий выбрана из группы, состоящей из 50 000 КОЕ/г, 75 000 КОЕ/г, 100 000 КОЕ/г, 125 000 КОЕ/г, 150 000 КОЕ/г, 200 000 КОЕ/г, 250 000 КОЕ/г, 275 000 КОЕ/г, 300 000 КОЕ/г, 325 000 КОЕ/г, 350 000 КОЕ/г, 375 000 КОЕ/г и 400 000 КОЕ/г.
[0296] В ещё одном варианте концентрацию штамма Bacillus выбирают из группы, состоящей из: 25 000 КОЕ/г, 50 000 КОЕ/г, 75 000 КОЕ/г, 100 000 КОЕ/г, 125 000 КОЕ/г, 150 000 КОЕ/г и 200 000 КОЕ/г.
[0297] В ещё одном варианте осуществления МКС представляет собой композицию, содержащую Bacillus amyloliquefaciens 1104 и Bacillus subtilis 1781 и один или несколько из следующих штаммов: Enterococcus faecium, Lactobacillus plantarum LP 115, Pediococcus acidilactici PJ300 и Pediococcus pentosaceus P75. В одном варианте осуществления концентрация штаммов Bacillus в композиции составляет от примерно 25 000 КОЕ/г до примерно 75 000 КОЕ/г. В другом варианте осуществления концентрация молочнокислых бактерий составляет от примерно 75 000 КОЕ/г до примерно 225 000 КОЕ/г.
VI. Способы введения пробиотиков животным
[0298] В одном варианте осуществления настоящее изобретение относится к способам повышения показателей продуктивности животного. В другом варианте осуществления настоящее изобретение относится к способам увеличения показателей производительности жвачных животных.
[0299] В ещё одном варианте осуществления настоящее изобретение относится к способу, включающему введение животному композиции, содержащей пробиотик. В ещё одном варианте осуществления настоящее изобретение относится к способу, включающему введение животному эффективного количества композиции, содержащей пробиотики, для повышения продуктивности животного. Это эффективное количество можно вводить животному в одной или нескольких дозах.
[0300] В другом варианте осуществления настоящее изобретение относится к способу, включающему введение животному эффективного количества композиции, содержащей пробиотики, для увеличения среднесуточного потребления корма.
[0301] В другом варианте осуществления настоящее изобретение относится к способу, включающему введение животному эффективного количества композиции, содержащей пробиотики, для увеличения среднесуточного прироста веса.
[0302] В другом варианте осуществления настоящее изобретение относится к способу, включающему введение животному эффективного количества композиции, содержащей пробиотики, для увеличения общего прироста веса.
[0303] В другом варианте осуществления настоящее изобретение относится к способу, включающему введение животному эффективного количества композиции, содержащей пробиотики, для увеличения конверсии корма, которое может быть измерено либо по соотношению кормом : прирост, либо прирост : корм.
[0304] В другом варианте осуществления настоящее изобретение относится к способу, включающему введение животному эффективного количества композиции, содержащей пробиотики, для повышения эффективности кормления.
[0305] В другом варианте осуществления настоящее изобретение относится к способу, включающему введение животному эффективного количества композиции, содержащей пробиотики и экзогенные кормовые ферменты, для снижения смертности.
[0306] В другом варианте осуществления настоящее изобретение относится к способу, включающему введение животному эффективного количества композиции, содержащей пробиотики, для снижения фактических производственных затрат.
[0307] В ещё одном варианте осуществления указанный пробиотик представляет собой Bacillus subtilis 1104 или штамм, имеющий все идентифицирующие признаки Bacillus subtilis 1104. В ещё одном варианте осуществления указанный пробиотик представляет собой Bacillus subtilis 1781 или штамм, имеющий все идентифицирующие признаки Bacillus subtilis 1781. В ещё одном варианте осуществления указанный пробиотик представляет собой Bacillus subtilis 747 или штамм, имеющий все идентифицирующие признаки Bacillus subtilis 747. В ещё одном варианте осуществления указанный пробиотик представляет собой Bacillus subtilis 1541 или штамм, имеющий все идентифицирующие признаки Bacillus subtilis 1541. В ещё одном варианте осуществления указанный пробиотик представляет собой Bacillus subtilis 1999 или штамм, имеющий все идентифицирующие признаки Bacillus subtilis 1999. В ещё одном варианте осуществления указанный пробиотик представляет собой Bacillus subtilis 2018 или штамм, имеющий все идентифицирующие признаки Bacillus Subtilis 2018.
[0308] В ещё одном варианте осуществления указанный пробиотик представляет собой мульти-штамм, включающий Bacillus subtilis 747 и Bacillus subtilis 1781.
[0309] В некоторых вариантах осуществления один или несколько штаммов Bacillus добавляют в корм для животных из расчёта по меньшей мере 1×109 КОЕ/животное/сутки. В некоторых вариантах осуществления один или несколько штаммов Bacillus скармливают в количестве от 1×109 КОЕ/г корма до 1×1010 КОЕ/г корма.
[0310] Пробиотик, предоставленный в настоящем документе, может быть введён, например, в виде штаммсодержащего культурального раствора, штаммсодержащего супернатанта или бактериального продукта культурального раствора.
[0311] Введение пробиотика или композиции, раскрытой в данном документе, животному может повысить продуктивность указанного животного. В одном варианте осуществления введение пробиотика, предоставленного в настоящем документе, животному может увеличить среднесуточное потребление корма (ADFI), среднесуточный прирост (ADG) или эффективность кормления (прирост:кормление; G:F) (вместе взятые, «показатели эффективности»). Одна или несколько из этих метрик производительности могут быть улучшены.
[0312] Композиция, содержащая пробиотики, может быть введена животному одним из множества способов. Например, композицию можно вводить в твёрдой форме в виде ветеринарного фармацевтического препарата, можно распределять в эксципиенте, предпочтительно в воде, и непосредственно скармливать животному, можно физически смешивать с кормовым материалом в сухой форме, или указанная композиция может быть сформирована в виде раствора, а затем распылена на кормовой материал. Считается, что способ введения композиций, раскрытых в данном документе, животному известен специалисту в данной области техники.
[0313] При использовании в сочетании с кормом, указанным кормом для жвачных животных может быть зерно или сено, силос или трава или их комбинации. В число таких кормовых материалов входят кукуруза, сушеное зерно, люцерна, любые кормовые ингредиенты и побочные продукты пищевой или кормовой промышленности, а также побочные продукты биотоплива и его смеси и их смеси. Для моногастрических диет кормовой материал может включать кукурузу, соевую муку, побочные продукты, такие как сухие зерна дистилляторов с растворимыми веществами (DDGS), и витаминно-минеральные добавки. Также могут быть использованы другие кормовые материалы. Введение возможно в любое время с кормом или без него. Однако бактерию предпочтительно вводить с кормом или непосредственно перед кормом.
[0314] Таким образом, по меньшей мере в некоторых вариантах осуществления эффективное количество композиции, содержащей пробиотики, вводят животному путём дополнения корма, предназначенного для животного. Используемый в настоящем описании термин «дополнение» относится к действию включения эффективного количества бактерий, представленных в настоящем описании, непосредственно в корм, предназначенный для животного. Таким образом, животное при кормлении поглощает бактерии, представленные в настоящем описании. В одном варианте осуществления настоящее изобретение относится к штаммам Bacillus. В одном варианте осуществления штамм Bacillus представляет собой Bacillus subtilis 1104. В ещё одном варианте осуществления штамм Bacillus представляет собой Bacillus subtilis 1781. В ещё одном варианте осуществления штамм Bacillus представляет собой Bacillus subtilis 747. В ещё одном варианте осуществления штамм Bacillus представляет собой Bacillus subtilis 1541. В ещё одном варианте варианте осуществления штамм Bacillus представляет собой Bacillus subtilis 2018.
[0315] В одном варианте осуществления настоящее изобретение относится к композиции, содержащей два или более следующих штаммов Bacillus: Bacillus subtilis 1104, Bacillus subtilis 1781, Bacillus subtilis 747, Bacillus subtilis 1541, Bacillus subtilis 1999 и Bacillus subtilis 2018.
[0316] В ещё одном варианте осуществления настоящее изобретение относится к композиции, содержащей Bacillus subtilis 747 и один или несколько из следующих штаммов Bacillus: Bacillus subtilis 1104, Bacillus subtilis 1781, Bacillus subtilis 1541, Bacillus subtilis 1999 и Bacillus subtilis 2018.
[0317] В ещё одном варианте осуществления настоящее изобретение относится к композиции, содержащей Bacillus subtilis 1781 и один или несколько из следующих штаммов Bacillus: Bacillus subtilis 1104, Bacillus subtilis 747, Bacillus subtilis 1541, Bacillus subtilis 1999 и Bacillus subtilis 2018.
[0318] В ещё одном варианте осуществления настоящее изобретение относится к композиции, содержащей Bacillus subtilis 747 и Bacillus subtilis 1781.
[0319] В ещё одном варианте осуществления настоящее изобретение относится к композиции, содержащей один или несколько штаммов Bacillus, выбранных из группы, состоящей из: Bacillus subtilis 1104, Bacillus subtilis 1781, и Bacillus subtilis 747, Bacillus subtilis 1541, Bacillus subtilis 1999, Bacillus subtilis 2018 и консервант.
[0320] В ещё одном варианте осуществления настоящее изобретение относится к композиции, содержащей один или несколько штаммов Bacillus, выбранных из группы, состоящей из: Bacillus subtilis 1104, Bacillus subtilis 1781, и Bacillus subtilis 747, Bacillus subtilis 1541, Bacillus subtilis 1999, Bacillus subtilis 2018 и Lactobacillus plantarum.
[0321] В другом варианте осуществления настоящее изобретение относится к штаммам Bacillus, композициям и способам контроля или уменьшения порчи корма, включая корм и силос, но не ограничиваясь ими.
[0322] В другом варианте осуществления настоящее изобретение относится к штаммам Bacillus, композициям и способам борьбы или снижения роста микроорганизмов. В другом варианте осуществления раскрыты композиции и способы для контроля или уменьшения роста микроорганизмов в корме, включая силос и/или корм, но не ограничиваясь ими.
[0323] В ещё одном варианте осуществления штаммы Bacillus, композиции и способы раскрыты для контроля или уменьшения роста клостридий. В ещё одном варианте осуществления раскрыты штаммы Bacillus, композиции и способы для контроля или уменьшения роста клостридий в кормах, включая, силос и/или корм, но не ограничиваясь ими.
[0324] В одном варианте осуществления настоящее изобретение относится к композиции, содержащей один или несколько микробов, контролирующих порчу корма. В другом варианте осуществления настоящее изобретение относится к композиции, содержащей один или несколько микробов, контролирующих порчу корма, и один или несколько дополнительных компонентов.
[0325] В другом варианте осуществления настоящее изобретение относится к штаммам Bacillus, композициям и способам улучшения продуктивности животного. В другом варианте осуществления настоящее изобретение относится к одному или нескольким микробам для непосредственного кормления для улучшения продуктивности животного.
[0326] В другом варианте осуществления настоящее изобретение относится к способу увеличения срока годности силоса или корма, включающему: смешивание эффективного количества по меньшей мере одного штамма Bacillus с силосом для увеличения срока годности силоса или корма. В ещё одном варианте осуществления настоящее изобретение относится к способу увеличения срока годности силоса или корма, включающему: смешивание композиции, содержащей, по меньшей мере, один микроб, контролирующий порчу, с силосом для увеличения срока годности силоса или корма. В ещё одном варианте осуществления настоящее изобретение относится к способу увеличения срока годности силоса или корма, включающему: смешивание композиции, содержащей, по меньшей мере, два микроба для контроля порчи, с силосом для увеличения срока годности силоса или корма.
[0327] В ещё одном варианте осуществления настоящее изобретение относится к способу борьбы с ростом микроорганизма в силосе или корме, включающему смешивание эффективного количества по меньшей мере одного штамма Bacillus с силосом или кормом. В одном варианте осуществления штамм Bacillus смешивают с силосом во время силосования.
[0328] В ещё одном варианте осуществления настоящее изобретение относится к способу борьбы с ростом микроорганизма в силосе или корме, включающему: смешивание композиции, содержащей по меньшей мере один микроб, контролирующий порчу, с силосом или кормом для контроля роста микроорганизма в силосе или фураж. В ещё одном варианте осуществления настоящее изобретение относится к способу борьбы с ростом микроорганизма в силосе или корме, включающему: смешивание композиции, содержащей, по меньшей мере, два микроба, контролирующих порчу, с силосом или кормом.
[0329] В ещё одном варианте осуществления настоящее изобретение относится к способу улучшения продуктивности животного, включающему введение одного или нескольких штаммов Bacillus, одного или нескольких микробов прямого кормления или композиции животному для улучшения продуктивности указанного животного по сравнению с животным, которое не получало указанный штамм Bacillus, указанный микроб прямого кормления или указанную композицию.
[0330] В одном варианте осуществления настоящее изобретение относится к способу борьбы или лечения или предотвращения роста патогена у животного, включающему введение животному одного или нескольких штаммов Bacillus, одного или нескольких микробов прямого кормления или композиции для контроля, лечения или предотвращения роста патогена по сравнению с животным, которого не кормили указанным штаммом Bacillus, указанным микробом прямого кормления или указанной композицией. В одном варианте осуществления патоген представляет собой Clostridium perjringens.
[0331] В ещё одном варианте осуществления настоящее изобретение относится к корму для животного, содержащему один или несколько штаммов Bacillus, один или несколько пробиотиков или одну или несколько композиций.
ОПИСАНИЕ ПРИМЕРОВ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
[0332] Пример 1. Отбор штаммов Bacillus для ингибирования Clostridium perfringens и нетоксичных клостридий, выделенных из образцов корма.
[0333] Введение: Процесс силосования является средством сохранения питательной ценности влажной культуры путём стимулирования анаэробной ферментации сахаров, присутствующих в культуре, и превращения их в молочную кислоту и другие полезные кислотные соединения, которые сохраняют материал (Muck, 2010). Влажная культура может поддерживать рост различных микроорганизмов, вызывающих порчу, таких как Clostridia, бациллы, дрожжи и плесень, которые способствуют ухудшению питательной ценности, особенно когда анаэробные условия не поддерживаются или когда молочной кислоты, конечного продукта анаэробной ферментации, не хватает для достаточного снижения pH (Driehuis и Oude Elferink, 2000). Таким образом, процесс силосования позволяет осуществлять длительное хранение кормового материала для скота жвачных животных, когда свежий корм недоступен.
[0334] Из-за множества переменных, которые препятствуют идеальным условиям для сохранения силоса, молочнокислые бактерии часто используют в качестве инокулянтов для силоса, чтобы способствовать правильной ферментации и оптимальному сохранению силоса. Молочнокислые бактерии быстро растут в анаэробных условиях и становятся доминирующими микроорганизмами, присутствующими в урожае, и снижают рН путём производства молочной кислоты, конечного продукта их ферментации. Количество энтеробактерий и бацилл контролируют путём понижения pH до уровня ниже 5, тогда как клостридии труднее ингибировать, так как некоторые из них могут расти при более низком pH (Driehuis, 2013). Поэтому более низкий pH может быть необходим для сохранения урожая и предотвращения роста микроорганизмов клостридий, вызывающих порчу, когда условия менее оптимальны для ферментации молочнокислых бактерий, например, в условиях высокой влажности (Driehuis и Oude Elferink, 2000). Эти клостридии, вызывающие порчу, имеют тенденцию оказывать негативное влияние на качество силоса после того, как молочнокислые бактерии перестали расти.
[0335] Контроль организмов клостридий в силосе важен для предотвращения вредного воздействия этих бактерий на качество силоса. Как правило, организмы клостридий, вызывающие порчу, подразделяются на три группы, включая протеолитические клостридии, которые ферментируют аминокислоты и продуцируют аммиак, амины и диоксид углерода, группу Clostridium butyricim, которая ферментирует углеводы, и группу C. tyrobutyricum, которая ферментирует сахара и молочную кислоту, при этом две последние группы производят масляную кислоту, уксусную кислоту, водород и диоксид углерода в качестве конечных продуктов (Muck, 2010). Активность клостридий в силосе нежелательна из-за снижения потребления, наблюдаемого у крупного рогатого скота, когда присутствует клостридиальная активность, и из-за пониженного питательного качества силоса, возникающего в результате клостридиальной ферментации. Ферментация молочной кислоты в масляную кислоту с помощью клостридий, продуцирующих бутират, приводит к примерно 50%-ной потере сухого вещества и 18%-ной потере полной энергии в кормах для силоса (McDonald и др., 1991). Кроме того, организмы клостридий, вызывающие порчу, оказывают вредное воздействие на здоровье крупного рогатого скота, о чём свидетельствует более высокая частота ацидоза при скармливании такого силоса крупному рогатому скоту (Seglar, 2003).
[0336] Ферментация клостридий в силосе контролируют с использованием молочнокислых бактерий в качестве силосных инокулянтов для поддержания сохранности урожая и обеспечения сбора урожая и его силосования в условиях низкой влажности. Однако управление внутрихозяйственными условиями, такими как погода, которые могут повлиять на содержание влаги в урожае во время сбора урожая, не всегда практично или возможно, и часто силосование происходит при неоптимальных условиях. Хотя бациллы считаются организмами, вызывающими порчу силоса, известно, что представители рода Bacillus продуцируют антимикробные соединения, способные ингибировать конкурирующие бактерии в окружающей среде, и демонстрируют эффективность в борьбе с ростом клостридий. Бациллы обычно приводят к ускорению порчи силоса после воздействия кислорода, но редко влияют на ферментацию урожая в анаэробных условиях силосной башни (Muck, 2010). Следовательно, существует необходимость в штаммах Bacillus, которые можно добавлять во время силосования, чтобы контролировать рост микроорганизмов клостридий, вызывающих порчу, в силосе, собранном в условиях высокой влажности.
[0337] Материалы и методы: образцы корма собирали из 111 различных молочных заводов. Образцы разбавляли в соотношении 1:10 стерильным пептоном, подвергали тепловому шоку в течение 10 минут при 50°C, подсчитывали в стерильном пептоне и высевали на агар с триптозосульфитциклосерином (TSC) с D-циклосерином (400 мг/л) для отбора клостридий. Чашки с агаром инкубировали при 37°C анаэробно в течение 24 часов для роста клостридий. Если они присутствовали, изолированные сульфитредуцирующие колонии отбирали в среду для клостридий Reinforced Clostridia Medium (RCM) (Oxoid, CM0149) и инкубировали анаэробно в течение 24 часов при 37°C. После 24 часов инкубации культуры переносили (10%) в бульон с сердечно-мозговым экстрактом (BHI) (BD, 211059) и инкубировали анаэробно в течение 24 часов при 37°С.
[0338] Выделение ДНК из культур проводили в 96-луночных блоках, содержащих 500 мкл предполагаемой культуры клостридий на лунку. Клетки собирали центрифугированием при 4700 об/мин в течение 10 минут и супернатант отбрасывали. Клетки ресуспендировали в 500 мкл 50 мМ ЭДТА-2Na (рН = 8,0). Аликвоты 300 мкл суспендированных клеток переносили в новый 96-луночный блок и объединяли с 20 мкл лизоцима из раствора куриного яичного белка (Sigma, L6876) (100 мг/мл в 50 мМ ЭДТА) для лизиса бактериальных клеток. 96-луночный блок инкубировали в течение 1 часа при 37°С для лизиса бактериальных клеток. После инкубации добавляли 220 мкл буфера для лизиса (6 М гуанидина, 20% Тритон-Х 100, 10 мМ Трис-HCL, рН 7,5), перемешивали, затем инкубировали при комнатной температуре в течение 15 минут. После инкубации в каждую лунку добавляли 20 мкл протеиназы К (NEB, 800 Ед/мл), перемешивали и инкубировали при 55°С в течение 30 минут для разложения белков. Затем клеточный лизат переносили в 96-луночный планшет для связывания (Promega, A2278) и центрифугировали при 4700 об/мин в течение 5 минут. Фильтрат отбрасывали, выполняли три промывки связующих колонок центрифугированием 750 мкл промывочного раствора для колонки (Promega, A1318) при 4700 об/мин в течение 1 минуты и 30 секунд и фильтрат отбрасывали в конце каждой промывки. Планшет для связывания центрифугировали в течение дополнительных 10 минут при 4700 об/мин для удаления остаточного этанола. Затем под связывающую пластину помещали чистый элюирующий планшет и ДНК элюировали 200 мкл воды, свободной от нуклеаз, (Promega, PI 195), предварительно нагретой до 55°C.
[0339] ДНК подвергали скринингу на наличие генов токсинов (α, β, ε и ι), специфичных для C. perfringens, с использованием полимеразной цепной реакции (ПЦР). Амплификацию генов токсинов проводили с использованием мультиплексной ПЦР, содержащей четыре набора праймеров (Yoo и др., 1997) (Таблица 1). Смесь ПЦР содержала 2,5 мкл 10Х ПЦР-буфера, 2 мкл 50 мМ MgCl2, 0,5 пМ каждого праймера, 0,1 мкл Taq ДНК-полимеразы Invitrogen™ Platinum™, 2,5 мкл ДНК и стерильную воду для достижения 25 мкл общего реакционного объема. Смесь выдерживали 5 минут при 94°С, затем осуществляли 30 циклов при 94°С в течение 1 минуты, 55°С в течение 1 минуты, 72°С в течение 1 минуты с окончательным удлинением в течение 3 минут при 72°С. Продукты ПЦР наблюдали с использованием анализатора фрагментов (Advanced Analytics), чтобы определить, была ли осуществлена амплификация.
[0340] Таблица 1. Праймеры, используемые для амплификации генов токсинов C. perfringens из собранных изолятов клостридий, для генерирования профилей RAPD позитивных изолятов C. perfringens и амплификации гена 16S рРНК из представителей нетоксикогенных клостридий для секвенирования ДНК.
[0341] Уникальные штамм-специфические генетические отпечатки были получены с использованием анализа методом случайной амплификации полиморфной ДНК (RAPD) для определения разнообразия среди силосных изолятов клостридий. ПЦР содержала 5 мкл ДНК, 2,5 мкл RAPD-праймера 2 (10 пМ; Таблица 4) и 17,5 мкл стерильной воды, которая была добавлена к бусам Ready-To-Go RAPD (Life Sciences, 27-9500-01). Указанную смесь выдерживали 5 минут при 95°С, затем осуществляли 45 циклов при 95°С в течение 1 минуты, 36°С в течение 1 минуты, 72°С в течение 2 минут и проводили окончательное удлинение в течение 5 минут при 72°С. Продукты ПЦР наблюдали на анализаторе фрагментов (Advanced Analytics) для определения характера амплификации и импортировали в BioNumerics, программное обеспечение для биоинформатического анализа. Паттерны RAPD сравнивали с помощью метода корреляционного анализа Дайса на основе полос, чтобы определить сходство паттернов RAPD.
[0342] Для идентификации нетоксичных изолятов Clostridium была проведена реакция ПЦР на образцах фуража для амплификации 16S-области рДНК с использованием праймеров 27F-YM и 1492R-Y (Таблица 1). Смесь для ПЦР содержала 5 мкл 10X буфера для ПЦР, 2 мкл 50 мМ MgCCl2, 1 мкл 50 мМ dNTP, 0,4 мМ каждого праймера (Таблица 3), 0,2 мкл Taq ДНК-полимеразы Invitrogen™ Platinum™, 5 мкл ДНК и добавляли стерильную воду для достижения общего объёма 50 мкл реакционной смеси. Смесь выдерживали 4 минуты при 95°С, затем осуществляли 35 циклов при 95°С в течение 30 секунд, 50°С в течение 30 секунд, 72°С в течение 2 минут с окончательным удлинением в течение 7 минут при 72°С. Была проведена проверка качества амплификации, и продукт ПЦР был отправлен в MWG operon (http://www.operon.com/) для получения последовательностей генов 16S. Последовательности сравнивали с известными типизированными бактериальными штаммами, полученными из электронной электронной базы данных EZbiocloud (http://www.ezbiocloud.net/). На основании сравнений этих последовательностей изолятам была приписана бактериальная идентификация.
[0343] Антимикробный скрининг проводили на изолятах C. perfringens и нетоксичных изолятах клостридий, полученных из образцов корма, для определения эффективности антимикробного бактериоцина, продуцируемого идентифицированными авторами штаммами Bacillus 747, 1104, 1541, 1781 и 2018. Штамм 1999 был протестирован против нетоксикогенных изолятов клостридий. Бактериоцин собирали путём выращивания каждого штамма при 32°C во встряхиваемом инкубаторе при 150 об/мин в течение 24 часов в бульоне с сердечно-мозговым экстрактом (BHI). После инкубации осуществляли 1%-ный перенос 24-часовой культуры на свежий бульон BHI. Затем инкубировали Bacillus в течение 36-48 часов в инкубаторе со встряхиванием при 32°C при 150 об/мин. Затем культуру центрифугировали при 14000×g в течение 20 минут, затем супернатант отфильтровали через фильтр 0,2 мкм для удаления любых остаточных клеток.
[0344] Анализ мутности бактериоцина проводили путём выращивания штаммов клостридий, выделенных из образцов силоса в среде Reinforced Clostridial Medium (RCM) в течение 24 часов, анаэробно, при 37°C. Ночную культуру (1%) переносили в стерильную RCM и сразу использовали в анализе. Четыре копии каждого изолята клостридий помещали в стерильный 48-луночный реакционный планшет. Каждый изолят клостридий тестировали следующим образом: 600 мкл инокулированной культуры клостридий (положительный контроль), 600 мкл RCM + 70 мкл бактериоцина из Bacillus 2018, 600 мкл RCM + 70 мкл бактериоцина из Bacillus 1104, 600 мкл RCM + 70 мкл бактериоцина из Bacillus 1541, 600 мкл RCM + 70 мкл бактериоцина из Bacillus 1781, 600 мкл RCM + 70 мкл бактериоцина из Bacillus 747 и 670 мкл RCM (отрицательный контроль). Планшеты инкубировали анаэробно при 37°С в течение 24 часов, затем считывали с использованием спектрофотометра BioTek Epoch Microplate с показаниями, полученными при длине волны 600 нм. Перед считыванием к положительному контролю добавляли 70 мкл стерильной воды для обеспечения равных объёмов в каждой лунке. Показания оптической плотности из отрицательных контролей вычитали из всех данных оптической плотности и процент ингибирования рассчитывали для каждой обработки бактериоцином относительно положительного контроля.
[0345] Результаты: Результаты подсчета клостридий, полученные из 1169 протестированных образцов кормов из 111 различных мест, показали, что средний уровень КОЕ/г клостридий во всех образцах составлял 4,2 E+03 КОЕ/г. Индивидуальные образцы находились в диапазоне от <10 до 4,1 E+06 КОЕ/г (Таблица 2).
[0346] В общей сложности 3958 предполагаемых изолятов клостридий были протестированы в отношении указанных генов токсинов C. perfringens. Испытанные изоляты собирали из образцов силоса, собранных в более 100 различных сельскохозяйственных районах. Из 3958 изолятов, прошедших скрининг, 756 изолятов (19,1%) дали положительный результат по крайней мере на один из генов токсинов (Фиг. 1). Из 756 изолятов, положительных в отношении генов токсинов 635 (84%) были идентифицированы как тип А (только токсин α), однако β, ε и ι токсины были также обнаружены в изолятах силоса клостридий.
[0347] Генетические RAPD-отпечатки продемонстрировали разнообразие среди 590 кормовых изолятов, которые успешно амплифицировались. Эти изоляты были получены из 70 образцов из различных ферм и образовали 133 кластера на основе сходства 75% в соответствии с методом корреляции Дайса. Самый большой кластер был из 40 изолятов (9,7%) (Фиг. 3).
[0348] Было обнаружено, что из 3958 собранных изолятов 3202 изолята (80,9%) являются нетоксикогенными клостридиями. Репрезентативные данные секвенирования (n = 345) из нетоксикогенных клостридий показали две доминирующие группы клостридий: группа C. bifermentans (Paraclostridium bifermentans и P. benzoelyticum) и группа C. beijerinckii (C. diolis, C. beijerinckii, C. chromiireducens, C. saccharoperbutylacetonicum, C. puniceum и C. saccharobutylicum). Виды C. beijerinckii являются известными продуцентами ацетона и бутанола. Виды C. bifermentans являются редкими оппортунистическими патогенами, которые могут продуцировать 1,3-пропандиол. Эти два основных типа идентификации группы нетоксикогенных клостридий составляли 44% нетоксикогенных изолятов (Фиг. 2).
[0349] Репрезентативные данные (n = 196) из дендрограммы RAPD каждой отдельной фермы были отобраны для выявления разнообразия популяции C. perfringens и подвергнуты анализу ингибирования. Объединённые данные по отдельным местам составлены из 41 различных мест (Таблица 3). Антимикробное тестирование с использованием анализа мутности бактериоцина показало хорошее ингибирование большинства кормовых изолятов C. perfringens с использованием бактериоцина, полученного из штаммов 747, 1104, 1541, 1781 и 2018. Бактериоцин по меньшей мере из одного из штаммов 747, 1104, 1541, 1781 и 2018 был способен на более 60% ингибирование роста 126 (64,3%) из 196 протестированных изолятов. По крайней мере один бактериоциновый штамм был способен ингибировать рост 97 (49,5%) из 196 протестированных изолятов более чем на 79%. Штамм 747 обладал наибольшим общим уровнем ингибирования среди всех протестированных силосных изолятов C. perfringens - 54,9%.
[0350] Изоляты нетоксикогенных клостридий (n = 14), собранные из двух разных молочных заводов в Техасе, также подвергли анализу на ингибирование. Изученные изоляты состояли из группы C. bifermentans, группы C. butyricum, C. beijerinckii, группы C. ghonii, Clostridium tertium и C. sordellii (Таблица 4). Бактериоцин из по меньшей мере одного из штаммов 747, 1104, 1541, 1781, 1999 и 2018 был способен более чем на 60% ингибировать рост 11 (78,6%) из 14 протестированных изолятов. По крайней мере один штамм бактериоцина был способен ингибировать рост 9 (64,3%) из 14 протестированных изолятов более чем на 79%. Штамм 747 обладал наибольшим общим уровнем ингибирования среди всех протестированных нетоксичных изолятов силоса клостридий - 77,2%.
[0351] Таблица 2. Количество образцов и результаты среднего количества клостридий по местоположению
[0352] Таблица 3. Процент ингибирования каждого силосного изолята C. perjringens, протестированного с бактериоцином, полученным из изолятов Bacillus.
[0353] Таблица 4. Процент ингибирования нетоксичных изолятов клостридий, собранных из техасских образцов кормов, бактериоцином, собранным из изолятов Bacillus.
[0354] Вывод: образцы корма (1169) были отобраны из 111 различных мест и проверены на уровни клостридий. Эти уровни варьировались от <10 до 4,1E+06 КОЕ/г, со средним значением 4,2E+03 КОЕ/г для всех образцов. Все места, за исключением одного участка, где был взят только один образец, имели детектируемые уровни клостридий.
[0355] Из 3958 предполагаемых изолятов клостридий, собранных из 100 различных мест, 756 дали положительный результат по крайней мере на один ген токсина C. perfringens. Большинство (84%) этих положительных изолятов были идентифицированы как тип А. Генетический анализ с помощью RAPD ПЦР 590 из этих токсикогенных изолятов клостридий показал разнообразную популяцию, состоящую из 133 кластеров. По большей части изоляты, по-видимому, не группировались в зависимости от местоположения, за исключением нескольких более мелких кластеров. Было 38 изолятов, которые не сгруппировались с другими изолятами.
[0356] Типичные изоляты (345) из нетоксичных изолятов (3202) идентифицировали секвенированием гена 16S рРНК. Преобладали группа C. beijerinckii (23%) и группа C. bifermentans (21%). Другие идентифицированные нетоксичные виды включают группу C. tertium, группу C. butyricum, C. sordellii, C. perfringens, виды Terri spar obacter, группу C. sardiniense и Romboutsia lituserburensis.
[0357] Антимикробный скрининг против как токсикогенных, так и нетоксикогенных клостридий показал их ингибирование штаммами Bacillus, идентифицированными авторами настоящего изобретения. Один или несколько штаммов Bacillus 747, 1104, 1541, 1781 и 2018 ингибировали 126 из 196 изолятов C. perfringens. Для нетоксичных изолятов, 11 из 14 ингибировались одним или несколькими штаммами Bacillus 747, 1104, 1541, 1781, 1999 и 2018.
[0358] ПРИМЕР 2: Влияние комбинации штаммов Bacillus на силосование люцерны в мини-силосохранилищах
[0359] Введение. Ферментацию клостридий в силосе контролируют с использованием молочнокислых бактерий в качестве инокулянтов для силоса, чтобы поддержать сохранение урожая и обеспечить сбор и накопление урожая в условиях низкой влажности. Однако управление внутрихозяйственными условиями, такими как погода, которые могут повлиять на содержание влаги в урожае во время сбора урожая, не всегда практично или возможно, и часто силосование происходит при неоптимальных условиях. Хотя бациллы считаются организмами, вызывающими порчу силоса, известно, что представители рода Bacillus продуцируют антимикробные соединения, способные ингибировать конкурирующие бактерии в окружающей среде, и продемонстрировали эффективность в борьбе с ростом клостридий. Цель этого исследования состояла в том, чтобы определить эффективность штаммов Bacillus в соответствии с этим вариантом осуществления настоящего изобретения для контроля роста организмов клостридий, вызывающих порчу, в люцерне, помещённой в мини-силосохранилище.
[0360] Материалы и методы. Два штамма Bacillus в соответствии с этим вариантом осуществления настоящего изобретения, Bacillus 1104 и 1781, были объединены в равных пропорциях в качестве инокулянта для силоса и добавлены к корму для проверки действия инокулянт для силоса на основе Bacillus на физические и химические свойства кормового материала, а также его способность подавлять вторичную ферментацию, связанную с ростом клостридий.
[0361] Свежесрезанную завяленную люцерну обрабатывали следующими силосными инокулянтами:
[0362] 1) Контроль без силосного инокулянта;
[0363] 2) Инокулянт с низкой дозой Bacillus;
[0364] 3) Инокулянт с высокой дозой Bacillus
[0365] 4) Инокулянт молочнокислых бактерий (МКБ)
[0366] 5) Инокулянт с мега-дозой Bacillus + Инокулянт МКБ
[0367] 6) Инокулянт с очень высокой дозой Bacillus + Инокулянт МКБ
[0368] Инокулянт Bacillus содержал 50% штаммов 1104 и 1781. Инокулянт МКБ содержал 30% Lpl 15 (Lactobacillus plantarum), 30% PJ300 (Pediococcus acidilactici), 30% P751 (P. pentosaceus) и 10% Enterococcus faecium. Целевые нормы внесения инокулянта на грамм силоса были следующими: низкая доза Bacillus при 5 000 КОЕ/г, высокая доза Bacillus при 50 000 КОЕ/г, МКБ при 150 000 КОЕ/г, высокая доза Bacillus + МКБ в комбинации соответствующих скоростей обработки Bacillus и МКБ, мега-доза Bacillus + МКБ при 5 000 000 КОЕ/г Bacillus и соответствующей норме МКБ (Таблица 5).
[0369] Таблица 5. Дозы инокулянта в шести обработках, применённых к кормовому материалу люцерны
[0370] Каждую обработку осуществляли с 1000 г кормового материала и упаковывали в стеклянные банки объемом 8 унций с герметичными крышками с плотностью 39 фунтов/фут3. Банки хранили при комнатной температуре и проводили подсчёты в дни 7, 30, 78, 90 и 182 для представляющих интерес бактерий и микробов (Bacillus, МКБ, E. coli и кишечные палочки (колиформы), клостридии, дрожжи и плесень). Необработанный образец (контроль) тестировали в день 0 на pH и наличие исходных фоновых бактерий. В каждый момент времени показания pH также записывали для каждого обработанного образца и анализировали на наличие и концентрацию летучих жирных кислот (ЛЖК) на основе выборки. Были оценены следующие ЛЖК: молочная кислота, уксусная кислота, масляная кислота, изомасляная кислота, пропионовая кислота, валериановая кислота и изовалериановая кислота. Окончательные результаты ЛЖК были представлены как среднее значение двух значений.
[0371] Результаты и обсуждение. Уровни pH для всех шести обработок снизились с 5,70 в день 0 до 4,19-4,33 в день 30 (Фиг. 4). Начиная с 30-го дня и до 182-го дня значения pH для всех обработок оставались в основном стабильными, тогда как контроль поддерживал самый высокий уровень pH в течение этого времени по сравнению с образцами, обработанными инокулянтом. Эти данные свидетельствуют о том, что добавление Bacillus в применяемые силосные инокулянты может помочь быстро снизить pH, запуская процесс ферментации раньше, и может помочь поддерживать более стабильный pH в течение стабильной фазы (или фазы хранения) процесса силосования. Более низкий уровень рН может помочь подавить бактерии, вызывающие порчу, улучшить усвояемость корма, уменьшить протеолитические ферменты, ингибировать анаэробные бактерии, изменить конечные продукты ферментации и увеличить гидролиз гемицеллюлозы.
[0372] Популяция E. coli в контроле и других пяти обработках снизились с 43 КОЕ/г в день 0 до 10 КОЕ/г в день 78 (Таблица 6). Начиная с 78-го дня и до 182-го, уровни E. coli для контроля и всех обработок оставались неизменными на уровне 10 КОЕ/г. Количество колиформ поддерживалось на уровне 10 КОЕ/г как для контрольного образца, так и для других четырёх обработанных образцов с 78-го по 18-й день. Добавление Bacillus в применяемые инокулянты для силоса не приводило к увеличению уровней E. coli или колиформ в течение времени в процессе силосования.
[0373] Таблица 6. Изменение популяции E. coli или колиформ с течением времени в зависимости от обработки
[0374] Как и ожидалось, обработка без добавления Bacillus (контроль и МКБ) приводило к наименьшему количеству Bacillus за период измерений по сравнению с обработками с добавлением Bacillus (Фиг. 5). Как правило, уровни Bacillus в контроле и при обработке МКБ были ниже, чем в остальных пяти обработках во все моменты времени. Обработка мега-дозой Bacillus + МКБ имело самый высокий уровень роста Bacillus в течение всего теста по сравнению со всеми другими методами обработки. К концу теста все образцы, обработанные инокулянтом, имели более высокие уровни Bacillus, обнаруженные в них, чем в контроле, что указывает на то, что штаммы Bacillus, присутствующие в инокулянте для силоса, оставались стабильными и практически не погибали в течение всего процесса силосования. Популяции МКБ уменьшались на 2-3 порядка после 60 дней после силосования для всех обработок, что указывает на нормальную бактериальную ферментацию молочной кислоты для сохранения корма (Фиг. 6).
[0375] Для всех обработок и контроля количество дрожжей уменьшилось с 0 по 30 день (Фиг. 7). После 30-го дня все обработки, за исключением обработки высокой дозой Bacillus + МКБ на 78-й день, имели постоянное количество дрожжей 10 КОЕ/г и оставались при этой концентрации в течение оставшейся части эксперимента, за исключением контроля. Контроль имел самый высокий уровень роста дрожжей среди обработок, изученных к концу теста в день 180. Эти данные указывают на то, что добавление Bacillus не оказывало отрицательного влияния на способность инокулянта молочнокислых бактерий ингибировать рост организмов дрожжей, вызывающих порчу, в процессе хранения силоса.
[0376] Количество плесени снизилось с 0 дня до 30 день для всех обработок и контроля (Фиг.8). После 30-го дня у всех обработок было одинаковое количество плесени 10 КОЕ/г в течение оставшихся протестированных временных точек, тогда как контрольная обработка имела количество плесени 10 КОЕ/г с 30-го дня до 90-го дня и затем увеличилась до 3,5 КОЕ/г до последнего посева в день 182. Эти данные показывают, что добавление Bacillus не оказывало отрицательного влияния на способность инокулянта молочнокислых бактерий уменьшать и контролировать рост организма, вызывающего порчу плесени.
[0377] Все обработки инокулянтом, за исключением высокой дозы Bacillus + МКБ, имели сходные или более низкие уровни клостридий к концу эксперимента по сравнению с контролем (Фиг. 9). Обработка низкой дозой Bacillus приводила к самым низким уровням клостридий в течение последних двух временных периодов, протестированных для всех обработок. Эти данные указывают на то, что Bacillus сами по себе и/или в сочетании с МКБ контролирюет рост клостридий и вторичную ферментацию более эффективно, чем при отсутствии обработки.
[0378] Концентрация молочной кислоты увеличивалась при всех обработках с 0 дня до 78 день, а затем уменьшалась с 78 дня до 90 дня (Фигура 10). Контроль постоянно показывал более низкие уровни молочной кислоты в каждый момент времени по сравнению с образцами, обработанными микробными инокулянтами. Самые высокие уровни молочной кислоты наблюдались при обработке высокой дозой Bacillus + МКБ по сравнению со всеми другими обработками для каждого протестированного момента времени. Концентрации уксусной кислоты увеличились во всех пробах после обработки с 0 дня до 78 дня, а затем снизились с 78 дня до 90 дня (Фиг. 11). Для каждого протестированного момента времени обработка высокой дозой Bacillus + МКБ имела самую высокую концентрацию уксусной кислоты по сравнению со всеми другими обработками. Обработка МКБ имела самую низкую концентрацию уксусной кислоты для всех временных точек, за исключением 30-го дня, в который обработка мегадозой было немного ниже. Концентрации масляной кислоты, изомасляной кислоты, пропионовой кислоты, валериановой кислоты и изовалериановой кислоты не были обнаружены ни в одном из обработанных образцов ни в один из измеренных моментов времени.
[0379] Выводы: рН существенно упал в течение первых 30 дней с начальной точки рН 5,7. С этого момента показания рН были стабильными в этом диапазоне до конца испытания. Все образцы, обработанные инокулянтом Bacillus для силоса, имели более низкий рН по сравнению с контролем. Количество молочнокислых бактерий увеличивалось в течение первых нескольких дней после силосования, а затем в целом уменьшалось в ходе экспериментов, в то время как уровни Bacillus для всех обработанных образцов были выше, чем у контролей. Количество дрожжей и плесени резко снизилось в течение первых 30 дней после силосования, а затем выровнялось до конца испытания. В обработанных образцах показатели были в десять раз ниже, чем в контроле. В обработанных образцах, за исключением обработки высокой дозой Bacillus + МБ, клостридии имели несколько более низкие уровни к концу испытания.
[0380] Эти данные указывают на то, что на сохранение силоса не оказывает негативного влияния добавление этих штаммов Bacillus в качестве инокулянта для силоса. Фактически Bacillus сами по себе и/или в сочетании с МКБ контролируют рост клостридий и вторичную ферментацию, а также рост дрожжей и плесени, более эффективно, чем при отсутствии обработки.
[0381] ПРИМЕР 3: Влияние комбинации штаммов Bacillus в качестве инокулянтов силоса на силос люцерны на ферме и в мини-силосохранилищах
[0382] Введение. Ферментацию клостридий в силосе контролируют с использованием молочнокислых бактерий в качестве инокулянтов для силоса, что способствует сохранению урожая и обеспечению сбора урожая и силосования в условиях низкой влажности. Однако управление внутрихозяйственными условиями, такими как погода, которые могут повлиять на содержание влаги в урожае во время сбора урожая, не всегда практично или возможно, и часто силосование происходит при неоптимальных условиях.
Хотя бациллы считаются организмами, вызывающими порчу силоса, известно, что представители рода Bacillus продуцируют антимикробные соединения, способные ингибировать конкурирующие бактерии в окружающей среде, и продемонстрировали эффективность в борьбе с ростом клостридий. Цель этого исследования состояла в том, чтобы определить эффективность штаммов Bacillus в соответствии с данным вариантом осуществления настоящего изобретения для контроля роста микроорганизмов клостридий, вызывающих порчу, в люцерне, силосованной на ферме и в мини-силосохранилищах.
[0383] Материалы и методы. Два штамма Bacillus в соответствии с данным вариантом осуществления настоящего изобретения, Bacillus 1104 и 1781, были объединены в равных пропорциях в качестве инокулянта для силоса и добавлены к корму для проверки действия инокулянт силоса на основе Bacillus на физико-химические свойства кормового материала, а также его способность подавлять вторичную ферментацию, связанную с ростом клостридий.
[0384] В исследовании использовался силос люцерны второго покоса и обработки, включающие контроль, обработку инокулянтом силоса, выполненную на ферме, обработку инокулянтом силоса, выполненную в однократной дозе в лаборатории, и обработку инокулянтом силоса, выполненную в десятикратной дозе в лаборатории. Обработка инокулянтом как на ферме, так и в лаборатории включала 12,5% штаммов (1104 и 1781), 7% En. faecium, 22,5% каждого из LP 115 (L. plantarum), Pj300 (P. acidilactici) и P751 (P. pentosaceus).
[0385] Целевая норма внесения инокулянта для обработки инокулянта на ферме и в лаборатории составляла 200 000 КОЕ/г культуры, состоящей из 150 000 КОЕ молочнокислых бактерий (МКБ) и 50 000 КОЕ Bacillus. Десятикратная доза включала 2 000 000 КОЕ/г культуры, состоящей из 1 500 000 КОЕ МКБ и 500 000 Bacillus. Лабораторные обработки инокулянтом осуществляли на 1000 г кормового материала, и все обработанные материалы были упакованы в стеклянные банки объемом 8 унций с герметичными крышками с плотностью 39 фунтов/фут3. Банки хранили при комнатной температуре и проводили подсчеты в дни 8, 14, 28, 60, 90 и 176 дней в отношении представляющих интерес бактерий (Bacillus, МКБ, E. coli и колиформы, клостридии, дрожжи и плесень).
[0386] Исходные фоновые бактерии и pН регистрировали для всех обработок в день 0. В каждый момент времени для каждого обработанного образца получали показания pH и анализировали на наличие и концентрацию ЛЖК на основе выборки. Летучие жирные кислоты, включая молочную кислоту, уксусную кислоту, масляную кислоту, изомасляную кислоту, пропионовую кислоту, валериановую кислоту и изовалериановую кислоту, обрабатывали в двух экземплярах и измеряли. Окончательные результаты ЛЖК были представлены как средние значения двух измерений.
[0387] Результаты и обсуждение: рН снижался для всех обработок в начальном измерении после проведения обработки и сохранялся в течение всего исследования (Фиг. 12). Наблюдаемое снижение pH свидетельствует об активной ферментации кормового материала и о том, что добавление штаммов Bacillus в инокулянт для силоса не оказывает негативного влияния на длительную сохранность силоса.
[0388] За исключением десятикратной дозы инокулянта для силоса, количество E. coli в образцах, обработанных инокулянтом, первоначально снижалось с более высокой скоростью по сравнению с контролем (Фиг. 13). После 30-го дня у всех обработанных образцов поддерживался низкий уровень кишечной палочки (10 КОЕ/г) в течение оставшейся части экспериментального периода. Аналогичное снижение уровня колиформ наблюдалось для образцов, обработанных инокулянтом, в течение первых 30 дней тестирования (Фиг. 14). Эти данные указывают на то, что указанная обработка контролирует рост организмов, вызывающих порчу, в течение процесса ферментации.
[0389] В ходе настоящего исследования общее количество Bacillus варьировалось от 6,7×103 до 4,7×105 КОЕ/г, причем самые высокие показатели Bacillus наблюдались при обработке силоса десятикратной дозой инокулянта. После того, как уровень Bacillus был установлен в обработанных образцах после 60-го дня, уровни Bacillus не сильно колебались в течение оставшейся части испытания. Это показывает, что Bacillus стабильны в образцах корма и сохраняют активность в широком диапазоне условий (Фиг. 15). Показатели МКБ первоначально увеличивались до 30-го дня, а затем постепенно снижались в течение оставшейся части тестового периода (Фиг. 16).
[0390] В течение первых 30 дней испытания популяция дрожжей во всех обработанных образцах и контроле уменьшалась и поддерживалась на низком уровне (10 КОЕ/г) в течение указанного экспериментального периода (Фиг. 17). Показатели уровня плесени реагировали одинаково для всех обработанных образцов в течение испытательного периода (Фиг. 18). Эти данные указывают на то, что процесс ферментации контролировал рост дрожжей и плесени, вызывающих порчу силоса и что практическое применение силосного инокулянта на ферме приводило к тем же результатам, что и при применении инокулянта в экспериментальных условиях в лаборатории.
[0391] Количество клостридий снижалось в первые семь дней испытания для всех видов обработки (Фиг. 19). Все препараты с силосным инокулянтом имели сходные или более низкие показатели клостридий по сравнению с контрольным образцом, в который не вводили бактериальный инокулянт. Эти данные указывают на то, что добавление силосных инокулянтов в корм позволяет контролировать рост клостридий и вторичную ферментацию более эффективно, чем при отсутствии обработки.
[0392] Более высокие концентрации молочной кислоты наблюдались во всех обработанных образцах на день 14 и день 90 по сравнению с другими днями отбора проб (Фиг. 20). Десятикратная доза инокулянта силоса имела самые высокие уровни молочной кислоты по сравнению с другими видами обработки, что указывает на то, что такая обработка привела к хорошему сохранению корму. Аналогичная тенденция наблюдалась для концентраций уксусной кислоты, в которых уровни уксусной кислоты увеличились в 1-3 раза с 0-го дня до 90-го (Фиг. 21). Как 10-кратная доза силосного инокулянта, вводимая в лаборатории, так и силосный инокулянт, вводимый на ферме, имели более высокие концентрации уксусной кислоты, присутствующие в конце испытательного периода, по сравнению с необработанным контролем, что указывает на то, что эти обработки обеспечивали более стабильный процесс ферментации для сохранение силоса.
[0393] Выводы: рН снижался во всех обработанных образцах при начальном измерении после проведения обработки и сохранялся в течение всего исследования. Количество E. coli и колиформ в образцах для обработки инокулянтом снижалось с большей скоростью по сравнению с контролем, за исключением 10-кратной дозы инокулянта силоса. Обработанные образцы имели немного более низкие уровни присутствия плесени по сравнению с необработанными контролями.
[0394] Эти данные указывают на то, что на сохранение силоса не оказывает негативного влияния добавление этих штаммов Bacillus к инокулянту для силоса. Фактически, Bacillus в сочетании с МКБ улучшали уменьшение колиформ и предотвращали рост плесени, более эффективно, чем когда обработка не проводилось. рH снижался во всех обработанных образцах при начальном измерении после проведения обработки и поддерживался наодном уровне в течение всего исследования (Фиг. 12). Наблюдаемое снижение pH свидетельствует об активной ферментации кормового материала и о том, что добавление штаммов Bacillus в инокулянт для силоса не оказывает негативного влияния на длительную сохранность силоса.
[0395] Пример 4. Применение на ферме инокулянта, содержащего штаммы Bacillus, в качестве средства биологического контроля клостридий в силосе.
[0396] Введение. Ферментацию клостридий в силосе контролируют с использованием молочнокислых бактерий в качестве инокулянтов для силоса, что способствует сохранению урожая и обеспечению сбора урожая и силосования в условиях низкой влажности. Однако управление внутрихозяйственными условиями, такими как погода, которые могут повлиять на содержание влаги в урожае во время сбора урожая, не всегда практично или возможно, и часто силосование происходит при неоптимальных условиях. Хотя бациллы считаются организмами, вызывающими порчу силоса, известно, что представители рода Bacillus продуцируют антимикробные соединения, способные ингибировать конкурирующие бактерии в окружающей среде, и они продемонстрировали эффективность в борьбе с ростом клостридий. Цель этого исследования состояла в том, чтобы определить эффективность штаммов Bacillus в соответствии с данным вариантом осуществления настоящего изобретения для контроля роста микроорганизмов клостридий, вызывающих порчу, в люцерне, силосованной на ферме и в мини-силосохранилищах.
[0397] Материалы и методы: было исследовано использование силосного инокулянта, содержащего штаммы Bacillus, для борьбы с микроорганизмами клостридий, вызывающими порчу, в консервированном корме, чтобы задокументировать эффективность инокулянта при его применении на ферме. В указанном исследовании использовали завяленную люцерну второго покоса, а образцы состояли из необработанного контроля и силосного инокулянта, добавленного к корму на ферме при резке. Инокулянт для силоса содержал 12,5% Bacillus 1104 и 12,5% Bacillus 1781, 7% Enterococcus faecium, 22,5% каждого из LP 115 (Lactobacillus plantarum), PJ 300 (Pediococcus acidilactici) и P 751 (P. pentosaceus). Целевая норма внесения силосного инокулянта составляла 200 000 КОЕ/грамм, состоящего из 150 000 КОЕ молочнокислых бактерий (МКБ) и 50 000 КОЕ Bacillus. Каждую обработку осуществляли добавлением к 1000 г кормового материала и упаковывали в стеклянные банки объёмом 8 унций с герметичными крышками с плотностью 39 фунтов/фут3. Банки хранили при комнатной температуре и проводили подсчеты в дни 0, 7, 14, 28, 58, 91 и 175 дней для представляющих интерес бактерий (Bacillus, МКБ, E. coli и колиформы, клостридии, дрожжи и плесень). Как обработанные, так и необработанные образцы были протестированы в день 0 на pH и исходные фоновые бактерии, присутствующие в образцах. В каждый момент времени показания pH также записывались для каждого образца и анализировались на наличие и концентрацию ЛЖК, включая молочную кислоту, уксусную кислоту, масляную кислоту, изомасляную кислоту, пропионовую кислоту, валериановую кислоту и изовалериановую кислоту на основе выборки. Результаты по ЛЖК были представлены как среднее значение двух измерений.
[0398] Результаты и обсуждение: во время процесса силосования pH образцов корма после обеих обработок уменьшался с 0 дня до 14 дня (Фиг. 22). Этот пониженный уровень pH сохранялся в течение указанного экспериментального периода. Эти данные свидетельствуют о том, что добавление Bacillus в применяемые силосные инокулянты может помочь быстро снизить pH, запуская процесс ферментации раньше, и может помочь поддерживать более стабильный pH в течение стабильной фазы (или фазы хранения) процесса силосования. Более низкий рН может помочь ингибировать бактерии, вызывающие порчу, улучшить перевариваемость корма, уменьшить протеолитические ферменты, ингибировать анаэробные бактерии, изменить конечные продукты ферментации и увеличить гидролиз гемицеллюлозы.
[0399] Популяции E. coli и колиформ уменьшались с 0 дня до 14 дня в образцах после обеих обработок (Фиг. 23; Фиг. 24). После 14-го дня количество E. coli и колиформ оставалось в необнаружимых пределах для остальных измерений. Уровень E. coli и колиформ был ниже в образце, подвергнутом бактериальной обработке на 7-й день, по сравнению с необработанным контрольным образцом, что указывает на то, что бактериальная обработка более эффективно контролировала эти организмы, вызывающие порчу, чем в необработанном образце.
[0400] Организмы Bacillus присутствовали в качестве фонового подсчета для обоих обработанных образцов при первоначальном измерении в день 0 (Фиг. 25). К концу испытания количество Bacillus было выше, когда корм обрабатывали бактериальным силосным инокулянтом, по сравнению с днем 0. Кроме того, введение Bacillus, представленного в бактериальном инокулянте, не приводило к значительным различиям количества Bacillus в течение указанного экспериментального периода по сравнению с необработанным контролем, что указывает на то, что Bacillus, введенный в инокулянт, не перерастает и не действует как организм, вызывающий порчу. Показатели МКБ были сходными между необработанным контролем и образцами с введённым бактериальным силосным инокулянтом (Фиг. 26).
[0401] Количество дрожжей и плесени уменьшилось примерно на 5 порядков в течение первых 7 дней после силосования и оставалось низким (<1,0E+02 КОЕ/г) для обоих обработанных образцов в течение оставшейся части экспериментального периода (Фиг. 27 и 28), что указывает на эффективный процесс ферментации для сохранения корма.
[0402] Количество клостридий в образцах, обработанных инокулянтом, было таким же или ниже, чем в контроле для всего испытания (Фиг. 29). Эти данные указывают на то, что добавление силосных инокулянтов в корм позволяет контролировать рост клостридий и вторичную ферментацию более эффективно, чем при отсутствии обработки.
[0403] Уровни молочной и уксусной кислот были одинаковыми в двух обработанных образцах в течение всего курса исследования (Фиг. 30; Фиг. 31). Некоторое отклонение наблюдалось в уровнях этих ЛЖК на 90-й день, но аналогичные значения снова наблюдались в двух обработанных образцах в последний момент времени отбора проб.
[0404] Заключение: рН снижался для всех обработанных образцов при начальном измерении после обработки и сохранялся на одном уровне в течение всего исследования. Количество E. coli и колиформ в образцах, обработанных инокулянтом, снижалось с большей скоростью по сравнению с контролем. Обработанные образцы имели немного более низкие уровни присутствия плесени по сравнению с необработанными контролями. Показатели клостридий для образцов, обработанных инокулянтом, были такими же или ниже, чем в контроле для всего испытания. Эти данные указывают на то, что добавление силосных инокулянтов в корм позволяет контролировать рост клостридий и вторичную ферментацию более эффективно, чем при отсутствии лечения.
[0405] Эти данные указывают на то, что на сохранность силоса не оказывает негативного влияния добавление этих штаммов Bacillus к инокулянту для силоса. Фактически, Bacillus в сочетании с МКБ улучшали уменьшение количества колиформ и предотвращал рост плесени более эффективно, чем когда обработка не проводилась. Рост клостридий и вторичная ферментация контролировались более эффективно, чем при отсутствии обработки.
[0406] Пример 5. Отбор штаммов Bacillus для ингибирования Clostridium perfringens и нетоксикогенных клостридий, выделенных из образцов фекалий жвачных животных (Висконсин)
[0407] Введение: Clostridium - это род грамположительных, спорообразующих бактерий, которые являются общими резидентами желудочно-кишечного тракта. Ряд видов Clostridium был связан с кишечными заболеваниями у жвачных, включая геморрагический синдром кишечника (ГСК), заболевание, часто коррелирующее с повышенным уровнем C. perfringens типа A (Dennison и др., 2005). В то время как большинство кишечных заболеваний, вызванных клостридиями, являются острыми и спорадически возникают в стадах, в целом прогноз плохой, и первым признаком заболевания может быть смерть. Основываясь на недавних результатах, проблемы с подострыми кишечными заболеваниями, вызываемыми клостридиями, могут быть более распространенными проблемами, чем острые проблемы. Из-за низкого показателя успешности лечения острых заболеваний акцент необходимо делать на профилактических мерах.
[0408] Целью данного исследования было охарактеризовать распределение и разнообразие клостридий у жвачных животных и обеспечить ингибирование этих изолятов с использованием новых штаммов Bacillus в качестве способа контроля популяций клостридий.
[0409] Материалы и методы. Образцы фекалий (228) от коров, телок и телят, собранные на 24 фермах в Висконсине, разбавляли стерильным пептоном 1:10, подвергали тепловому шоку в течение 30 минут при 60°C, подсчитывали в стерильном пептоне и высевали в чашки с агаром, содержащим триптозо-сульфитный циклосерин (TSC) с D-циклосерином (400 мг/л) для отбора видов клостридий. Чашки с агаром инкубировали при 37°С анаэробно в течение 24 часов. Если изолированные сульфитредуцирующие колонии присутствовали, подсчитывали общее количество клостридий (КОЕ/г) и репрезентативные изоляты отбирали в среду Reinforced Clostridia Medium (RCM) (Oxoid, CM0149) и инкубировали анаэробно в течение 24 часов при 37°C. Через 24 часа инкубации культуры (10%) переносили в бульон с сердечномозговым экстрактом (BHI) (BD, 211059) и инкубировали анаэробно в течение 24 часов при 37°C.
[0410] Экстракцию ДНК проводили в 96-луночных блоках, содержащих 500 мкл предполагаемой культуры клостридий на лунку. Клетки собирали центрифугированием при 4700 об/мин в течение 10 минут, супернатант удаляли. Клетки ресуспендировали в 500 мкл 50 мМ ЭДТА-2Na (рН = 8,0). Аликвоты 300 мкл суспендированных клеток переносили в новый 96-луночный блок и объединяли с 20 мкл лизоцима из раствора куриного яичного белка (Sigma, L6876) (100 мг/мл в 50 мМ ЭДТА) для лизиса бактериальных клеток. 96-луночный блок инкубировали в течение 1 часа при 37°С для лизиса бактериальных клеток. После инкубации добавляли 220 мкл буфера для лизиса (6 М гуанидина, 20% Тритон-Х 100, 10 мМ Трис-HCL, рН 7,5), перемешивали, затем инкубировали при комнатной температуре в течение 15 минут. После инкубации в каждую лунку добавляли 20 мкл протеиназы К (NEB, 800 Ед/мл), перемешивали и инкубировали при 55°С в течение 30 минут для разложения белков. Затем клеточный лизат переносили в 96-луночный планшет для связывания (Promega, A2278) и центрифугировали при 4700 об/мин в течение 5 минут. Фильтрат отбрасывали, выполняли три промывки связывающих колонок пластины центрифугированием 750 мкл промывочного раствора для колонки (Promega, A1318) при 4700 об/мин в течение 1 минуты и 30 секунд, отбрасывая фиьтрат в конце каждого вращения. Планшет для связывания центрифугировали в течение дополнительных 10 минут при 4700 об/мин для удаления любого остаточного этанола. Затем под связывающую пластину помещали чистый элюирующий планшет и ДНК элюировали 200 мкл предварительно нагретой (55°С) воды, свободной от нуклеаз (Promega, P1195).
[0411] ДНК подвергали скринингу на наличие генов токсинов (α, β, ε и ι), специфичных для C. perfringens, с использованием полимеразной цепной реакции (ПЦР). Амплификацию генов токсинов проводили с использованием мультиплексной ПЦР, содержащей четыре набора праймеров (Yoo и др., 1997) (Таблица 1). Смесь ПЦР содержала 2,5 мкл 10×ПЦР-буфера, 2 мкл 50 мМ MgCl2, 0,5 мкМ каждого праймера (Таблица 1), 0,1 мкл Taq ДНК-полимеразы Invitrogen™ Platinum™, 2,5 мкл ДНК, стерильную воду добавляли до достижения 25 мкл общего реакционного объёма. Смесь выдерживали 5 минут при 94°С, затем осуществляли 30 циклов при 94°C в течение 1 минуты, 55°C в течение 1 минуты, 72°C в течение 1 минуты с окончательным удлинением в течении 3 минут при 72°C. Продукты ПЦР наблюдали с использованием анализатора фрагментов (Advanced Analytics), чтобы определить, прошла ли амплификация. Если наблюдался один или несколько генов токсинов, то для каждого изолята проводили идентификацию типа токсина на основе их профиля гена токсина (Songer, 1996). Соотношение токсин-положительных C. perfringens изолятов клостридий по отношению к общему количеству изолятов клостридий использовали для получения расчётного количества C. perfringens, основаного на общем количестве клостридий.
[0412] Уникальные штамм-специфические генетические отпечатки были получены с использованием анализа методом случайной амплификации полиморфной ДНК (RAPD) на отобранных изолятах для определения степени разнообразия фекальных изолятов C. perfringens. ПЦР содержала 5 мкл ДНК, 2,5 мкл RAPD-праймера 2 (10 пМ) (Таблица 1) и 17,5 мкл стерильной воды, которую добавляли в готовую аналитическую бусину RAPD (Life Sciences, 27-9500- 01). Смесь выдерживали 5 минут при 95°С, затем осуществляли 45 циклов при 95°С в течение 1 минуты, 36°С в течение 1 минуты, 72°С в течение 2 минут с окончательным удлинением 5 минут при 72°С. Продукты ПЦР наблюдали на анализаторе фрагментов (Advanced Analytics) для определения характера амплификации и импортировали для анализа в BioNumerics, программное обеспечение для биоинформатики. Паттерны RAPD сравнивали с помощью метода корреляционного анализа Дайса на основе полос, чтобы определить сходство между паттернами RAPD как способ мониторинга различий между изолятами.
[0413] Антимикробный скрининг проводили на изолятах C. perfringens, полученных из образцов жвачных животных, для определения эффективности антимикробного бактериоцина, продуцируемого идентифицированными авторами штаммами Bacillus 747, 1104, 1541, 1781 и 2018. Бактериоцин собирали путём выращивания каждого штамма при 32°C в инкубаторе со встряхиванием при 150 об/мин в течение 24 часов в бульоне с сердечномозговым экстрактом (BHI). После инкубации проводили перенос 1% 24-часовой культуры в свежий бульон BHI. Затем Bacillus инкубировали в течение 36-48 часов в инкубаторе со встряхиванием при 32°C при 150 об/мин. Затем культуру центрифугировали при 14000×g в течение 20 минут, затем супернатант фильтровали через фильтр 0,2 мкм для удаления любых оставшихся клеток.
[0414] Анализ мутности бактериоцина проводили путём выращивания штаммов C. perfringens, выделенных из образцов фекалий жвачных животных, в среде RCM в течение 24 часов, анаэробно, при 37°C. Ночную культуру (1%) переносили в стерильную среду RCM и сразу использовали в анализе. Каждый изолят C. perfringens помещали в по меньшей мере шесть лунок стерильного 48-луночного реакционного планшета, добавляли 600 мкл инокулированной культуры (положительный контроль), 600 мкл инокулированного RCM + 70 мкл бактериоцина (747, 1104, 1541, 1781 и 2018) и 670 мкл RCM (неинокулированный, отрицательный контроль). Планшеты инкубировали анаэробно при 37°С в течение 24 часов, затем считывали с использованием спектрофотометра BioTek Epoch Microplate, показания снимали на длине волны 600 нм. Показания оптической плотности из отрицательных контролей вычитали из всех показаний OD, и процент ингибирования рассчитывали, используя положительный контроль и каждую обработку бактериоцином.
[0415] Для идентификации клостридий, у которых не было по меньшей мере одного гена токсина, специфичного для C. perfringens, была проведена реакция ПЦР ДНК изолята для амплификации 16S-области рДНК с использованием праймеров 27F-YM и 1492R-Y (Таблица 1). Это было сделано на 20% изолятов, которые не содержали генов токсинов, специфичных для C. perfringens. Смесь для ПЦР содержала 5 мкл 10-кратного ПЦР-буфера, 2 мкл 50 мМ MgCl2, 1 мкл 50 мМ dNTP, 0,4 мМ каждого праймера (Таблица 1), 0,2 мкл Taq ДНК-полимеразы Invitrogen™ Platinum™, 5 мкл ДНК и стерильную воду добавляли до достижения общего реакционного объема 50 мкл. Смесь выдерживали 4 минуты при 95°С, затем осуществляли 35 циклов при 95°С в течение 30 секунд, 50°С в течение 30 секунд, 72°С в течение 2 минут с окончательным удлинением в течение 7 минут при 72°С. Была проведена проверка качества амплификации, и продукт ПЦР был отправлен в Genewiz (https://www.genewiz.com) для получения последовательностей для генов 16S. Последовательности сравнивали с известными типизированными бактериальными штаммами, полученными из электронной электронной базы данных EZbiocloud (http://www.ezbiocloud.net/). На основании сравнений этих последовательностей изолятам была присвоена бактериальная идентификация.
[0416] Анализ мутности бактериоцина проводили путём выращивания нетоксикогенных, не принадлежащих к С. perfringens штаммов клостридий, выделенных из фекалий жвачных животных, и образцов корма в среде RCM в течение 24 часов, анаэробно, при 37°С. Ночную культуру (1%) переносили в стерильную среду RCM и сразу использовали в анализе. Для каждого изолята C. perfringens использовали не менее шести лунок в стерильном реакционном планшете на 48 лунок, 600 мкл инокулированной культуры (положительный контроль), 600 мкл инокулированной RCM + 70 мкл бактериоцина (747, 1104, 1541, 1781, 1999 и 2018) и 670 мкл RCM (без инокуляции, отрицательный контроль). Планшеты инкубировали анаэробно при 37°С в течение 24 часов, затем считывали с использованием спектрофотометра BioTek Epoch Microplate, показания снимали на длине волны 600 нм. Показания оптической плотности из отрицательных контролей вычитали из всех показаний OD, и процент ингибирования рассчитывали, используя положительный контроль и каждую обработку бактериоцином.
[0417] Результаты: 228 образцов фекалий были собраны в 24 молочных фермах Висконсина, из которых было выделено 2914 предполагаемых штаммов клостридий в качестве представителей клостридиального разнообразия в молочных продуктах штата Висконсин (Таблица 7).
[0418] Результаты подсчёта клостридий показали, что средний уровень клостридий КОЕ/г во всех образцах фекалий теленка составлял 1 240 000 КОЕ/г при отдельных образцах фекалий в диапазоне от <10 до 28 900 000 КОЕ/г. В то время как средний уровень клостридий КОЕ/г во всех образцах фекалий коровы составлял 59 200 КОЕ/г, в отдельных образцах фекалий от 10 до 6 700 000 КОЕ/г (Фиг. 32). Как оказалось, уровни клостридий варьируют в образцах у телят (Фиг. 33) и коров (Фиг. 34).
[0419] Результаты подсчета C. perfringens показали, что средний уровень C. perfringens в КОЕ/г для всех образцов телят составляет 495 000 КОЕ/г для отдельных образцов в диапазоне от <10 до 14 500 000 КОЕ/г. В то время как средний уровень C. perfringens в КОЕ/г во всех образцах фекалий коровы составлял 36 200 КОЕ/г, а в отдельных образцах - от <10 до 3 690 000 КОЕ/г (Фиг. 35). Как оказалось, уровни клостридий варьируют в образцах у телят (Фиг. 36) и коров (Фиг. 37).
[0420] Показан анализ результатов мультиплексной ПЦР с токсином, в которых изоляты содержали гены токсинов, специфичные для C. perfringens. В общей сложности 1737 предполагаемых изолятов клостридий из образцов фекалий коровы были протестированы на указанные гены токсинов C. perfringens. Из 1737 скринированных изолятов клостридий у коровы 1219 изолятов (70,2%) дали положительный результат по крайней мере на один из генов токсинов. Из 1219 изолятов, положительных по гену токсинов, 1203 (98,5%) были идентифицированы как Тип A (только токсин α), однако токсины β, ε и ι также были обнаружены изолятах клостридий из коровьих фекалий. В общей сложности 1177 предполагаемых изолятов клостридий из образцов телят были проверены на указанные гены токсинов C. perfringens. Из 1177 скринированных изолятов клостридий теленка 482 (41,0%) дали положительный результат по крайней мере на 1 ген токсина. Из 482 токсин-положительных изолятов гена 438 (90,9%) были идентифицированы как тип А (только токсин α), однако токсины β, ε и ι были также обнаружены в изолятах клостридий фекалий телят.
[0421] В генетических RAPD отпечатках было выявлено разнообразие среди 1522 изолятов, которые были успешно амплифицированы. Изученные изоляты собирали из фекалий теленка, коровы и корма и не группировали строго в зависимости от типа пробы или фермы. Изоляты сформировали 170 кластеров на основе 75% сходства в соответствии с методом корреляции по кости. Самый большой кластер состоял из 148 изолятов (9,7%) и состоял из изолятов из 11 различных ферм, все кроме двух изолятов были C. perfringens типа A (рис. 38).
[0422] Представители дендрограммы RAPD были отобраны для определения разнообразия популяции C. perfringens из этого региона и подвергнуты анализу ингибирования. Антимикробное тестирование с использованием анализа мутности бактериоцина показало хорошее ингибирование большинства изолятов C. perfringens фекалий жвачных животных с использованием бактериоцина, полученных из 747, 1104, 1541, 1781 и 2018. Бактериоцин по меньшей мере из одного из штаммов 747, 1104, 1541, 1781, и 2018 был способен ингибировать более чем на 60% рост 244 из 271 протестированных изолятов, что в целом составило 93,4% ингибирования популяции C. perfringens на основе дендрограммы (Таблица 8).
[0423] Было обнаружено, что из 2 914 выделенных изолятов 1 207 изолятов (41%) были нетоксикогенными клостридиями. Данные секвенирования (n = 183) нетоксикогенных клостридий показали три доминирующие группы клостридий (Фиг. 39). Группа Clostridium bifermentans (Paraclostridium bifermentans и P. benzoelyticum), группа Clostridium butyricum и группа Clostridium beijerinckii (C. diolis, C. beijerinckii, C. chromiireducens, C. saccharoperbutylacetonicum, C. puniceum и C. saccharobutylicum), три основные группы нетоксикогенных клостридий составлили 47,5% нетоксикогенных изолятов (Фиг. 40).
[0424] Шесть изолятов с известными идентификациями по 16S из Висконсина были отобраны для антимикробного тестирования с использованием анализа мутности бактериоцина. Результаты показали хорошее ингибирование большинства нетоксикогенных изолятов, протестированных с использованием бактериоцина, полученных из штаммов 747, 1104, 1541, 1781, 1999 и 2018. Бактериоцины по крайней мере из одного из штаммов 747, 1104, 1541, 1781, 1999 и 2018 были способны ингибировать > 60% рост 6 из 6 протестированных изолятов (Таблица 9).
[0425] Обсуждение: образцы фекалий были использованы в качестве наиболее легкодоступного типа образцов для оценки уровня и получения изолятов клостридий и C. perfringens в пищеварительной системе жвачных животных. Из 228 образцов фекалий, собранных в Висконсине, все, кроме двух, содержали обнаруживаемые уровни клостридий. Результаты исследования показали, что клостридии присутствует почти во всех пробах фекалий в разных количествах. Большинство изолятов (59%), собранных из образцов жвачных, содержали ген токсина, специфичный для C. perfringens. C. perfringens была обнаружена в 92% образцов фекалий коровы и в 77% образцов фекалий теленка. Высокое присутствие клостридий и C perfringens указывает на риск возникновения подострой кишечной проблемы, связанной с клостридиями, у большинства жвачных в Висконсине. Изоляты C. perfringens были разнообразны в соответствии с генетическими отпечатками RAPD, но не были специфичными по типу образца или ферме. Разнообразные представители C. perfringens в основном ингибировались (> 60%) по меньшей мере одним бактериоцином из следующих штаммов 747, 1104, 1541, 1781 или 2018. Из 271 протестированных изолятов 244 изолята ингибировались более чем на 60% в отношении по меньшей мере одного из штаммов, показывая 93,4% ингибирование по отношению к общей популяции C. perfringens на основе представления кластеров на дендрограмме RAPD. Это указывает на то, что штаммы Bacillus 747, 1104, 1541, 1781 и 2018 могут ингибировать широкий спектр разнообразных изолятов C. perfringens. Штаммы Bacillus не ограничиваются конкретным штаммом(ами) клостридий, подобно вакцине, в которой могут отсутствовать большие группы популяций клостридий на основе генетического разнообразия, наблюдаемого в дендрограмме RAPD. Секвенирование ДНК нетоксикогенных клостридий выявило три основных группы видов Clostridium: группа C. bifermentans, которая, как известно, продуцирует 1,3-пропандиол (Leja и др., 2014; Myszka и др., 2012), группа C. beijerinckii, которая, как известно, продуцирует бутанол и ацетон (Hou и др., 2017), и C. butyricum (Weng и др., 2015) - производитель бутирата. Производство конечных продуктов метаболизма этих видов может оказывать влияние на рубец, снижая такие показатели производительности, как производство молока у молочной коровы. Все протестированные нетоксикогенные клостридии ингибировались (> 60%) бактериоцином по меньшей мере из одного из следующих штаммов 747, 1104, 1541, 1781, 1999 или 2018. Ингибирование нетоксикогенных клостридий также может быть потенциальным способом действия, который штаммы Bacillus используют для увеличения параметров свой производительности. Высокий уровень ингибирования изолятов клостридий in vitro указывает на потенциальный способ действия штаммов Bacillus 747, 1104, 1541, 1781, 1999 и 2018.
[0426] Штаммы Bacillus оказывают профилактическое действие на популяции клостридий, которые могут не только повышать эффективность рубца, приводя к увеличению молочной продуктивности, но и предотвращать острые уровни C. perfringens, уменьшая количество случаев смерти из-за проблем пищеварительной системы. Высокая распространенность клостридий и C. perfringens в собранных пробах фекалий свидетельствует о возможностях повышения эффективности у многих жвачных в Висконсине. В этом примере показано разнообразие изолятов клостридий из фекалий жвачных животных и образцов кормов, собранных в Висконсине. Протестированные штаммы Bacillus 747, 1104, 1541, 1781, 1999 и 2018, могут ингибировать большую часть разнообразия клостридий, наблюдаемого в Висконсине. Продукт в соответствии с этим вариантом осуществления настоящего изобретения может ингибировать как токсикогенные, так и нетоксикогенные клостридии, выделенные из жвачных животных в Висконсине, что указывает на эффект по повышению эффективности рубца при скармливании молочным коровам в качестве пробиотика.
[0427] Таблица 7. Фекальные пробы, 228, были собраны в молочных заводах Висконсина, разделённых по ферме (24) и возрасту (корова или теленок), в которых были подсчитаны клостридии, протестированы на C. perfringens, изоляты были генотипированы и протестированы на ингибирование.
[0428] Таблица 8: Результаты анализа бактериоцина, показывающие каждый протестированный изолят и источник этого изолята, выделенного из образцов фекалий в Висконсине. Ингибирование рассчитывали на основе процента роста для каждой обработанной лунки по сравнению с положительным контролем.
[0429] Таблица 9: Результаты анализа бактериоцина, отображающие каждый протестированный изолят из Висконсина. Ингибирование рассчитывали на основе процента роста для каждой лунки обработки по сравнению с положительным контролем.
[0430] Пример 6. Отбор штаммов Bacillus для ингибирования Clostridium perfringens и нетоксикогенных клостридий, выделенных из образцов фекалий жвачных животных (Техас)
[0431] Введение: Clostridium - это род грамположительных спорообразующих бактерий, которые являются частыми обитателями желудочно-кишечного тракта. Ряд видов Clostridium связывают с кишечными заболеваниями у жвачных, включая геморрагический синдром кишечника (ГСК), заболевание, часто коррелирующее с повышенным уровнем Clostridium perfringens типа А. В то время как большинство кишечных заболеваний, вызванных клостридиями, являются острыми и встречаются спорадически в стадах, в общем, прогноз является плохим и первым признаком болезни может быть смерть. Основываясь на недавних результатах, проблемы с подострой кишечной клостридией могут быть более распространенной проблемой, чем острые проблемы. Из-за низкого показателя успешности лечения острых заболеваний акцент должен быть сделан на профилактических мерах.
[0432] Цель этого исследования состояла в том, чтобы охарактеризовать распределение и разнообразие клостридий у жвачных животных и обеспечить ингибирование этих изолятов с использованием новых штаммов Bacillus в качестве метода контроля популяций клостридий.
[0433] Задачи заключались в определении уровня клостридий и C. perfringens в фекалиях коров и образцах корма, в определении генотипа нетоксикогенной популяции клостридий, в определении генотипа C. perfringens и в проверкке репрезентативных изолятов на чувствительность к идентифицированным авторами штаммам Bacillus 747, 1104, 1541, 1781 и 2018. Цель этого исследования состояла в том, чтобы охарактеризовать распределение и разнообразие клостридий у жвачных и обеспечить мнгибирование указанных изолятов с использованием новых штаммов Bacillus в качестве метода контроля популяций клостридий.
[0434] Материалы и методы. Образцы фекалий (827) от коров, телок и телят, собранные на 12 фермах в Техасе, разбавляли стерильным пептоном 1:10, подвергали тепловому шоку в течение 30 минут при 60°C, подсчитывали в стерильном пептоне и высевали на чашки с агаром с триптозо-сульфитным циклосерином (TSC) и с D-циклосерином (400 мг/л) для отбора видов клостридий. Чашки с агаром инкубировали при 37°С анаэробно в течение 24 часов. Если изолированные сульфитредуцирующие колонии присутствовали, их подсчитывали по общему количеству клостридий (КОЕ/г) и репрезентативные изоляты отбирали в среду Reinforced clostridia Medium (RCM) (Oxoid, CM0149) и инкубировали анаэробно в течение 24 часов при 37°C. После инкубации в течение 24 часов культуры (10%) переносили в бульон с сердечномозговым экстрактом (BHI) (BD, 211059) и инкубировали анаэробно в течение 24 часов при 37°C.
[0435] Экстракцию ДНК проводили в 96-луночных блоках, содержащих 500 мкл предполагаемой культуры клостридий на лунку. Клетки собирали центрифугированием при 4700 об/мин в течение 10 минут, супернатант удаляли. Клетки ресуспендировали в 500 мкл 50 мМ ЭДТА-2Na (рН = 8,0). Аликвоты 300 мкл суспендированных клеток переносили в новый 96-луночный блок и объединяли с 20 мкл лизоцима из раствора куриного яичного белка (Sigma, L6876) (100 мг/мл в 50 мМ ЭДТА) для лизиса бактериальных клеток. 96-луночный блок инкубировали в течение 1 часа при 37°С для лизиса бактериальных клеток. После инкубации добавляли 220 мкл буфера для лизиса (6 М гуанидин, 20% Тритон-Х 100, 10 мМ Трис-HCL, рН 7,5), перемешивали, затем инкубировали при комнатной температуре в течение 15 минут. После инкубации в каждую лунку добавляли 20 мкл протеиназы К (NEB, 800 Ед/мл), перемешивали и инкубировали при 55°С в течение 30 минут для разложения белков. Затем клеточный лизат переносили в 96-луночный планшет для связывания (Promega, A2278) и центрифугировали при 4700 об/мин в течение 5 минут. Фильтрат отбрасывали, выполняли три промывки колонок связывающей пластины центрифугированием 750 мкл промывочного раствора для колонки (Promega, A1318) при 4700 об/мин в течение 1 минуты и 30 секунд, отбрасывая фильтрат в конце каждой промывки. Планшет для связывания центрифугировали в течение дополнительных 10 минут при 4700 об/мин для удаления остаточного этанола. Затем под связывающую пластину помещали чистый элюирующий планшет и ДНК элюировали 200 мкл предварительно нагретой (55°С) воды, свободной от нуклеаз (Promega, P1195).
[0436] ДНК подвергали скринингу на наличие генов токсинов (α, β, ε и ι), специфичных для C. perfiingens с использованием полимеразной цепной реакции (ПЦР). Амплификацию генов токсинов проводили с использованием мультиплексной ПЦР, содержащей четыре набора праймеров (Yoo и др., 1997) (Таблица 1.) Смесь ПЦР содержала 2,5 мкл 10Х ПЦР-буфера, 2 мкл 50 мМ MgCl2, 0,5 пМ каждого праймера (таблица 1), 0,1 МКЛ Taq ДНК-полимеразы Invitrogen™ Platinum™, 2,5 мкл ДНК, стерильную воду добавляли до достижения 25 мкл общего реакционного объёма. Смесь выдерживали 5 минут при 94°С, затем осуществляли 30 циклов при 94°С в течение 1 минуты, 55°С в течение 1 минуты, 72°С в течение 1 минуты с окончательным удлинением в течение 3 минут при 72°С. Продукты ПЦР наблюдали с использованием анализатора фрагментов (Advanced Analytics), чтобы определить, была ли достигнута амплификация. Если был обнаружен один или несколько генов токсина, то для каждого изолята проводили идентификацию типа токсина на основе профиля гена токсина (Songer, 1996). Соотношение токсин-положительных C. perfiingens к общему количеству изолятов клостридий использовали для расчёта оценочного количества C. perfringens на основе общего количества клостридий.
[0437] Уникальные штамм-специфические генетические отпечатки получали с использованием анализа методом случайной амплификации полиморфной ДНК (RAPD) на отобранных изолятах для определения видового разнообразия среди фекальных изолятов C. perfiingens. ПЦР содержала 5 мкл ДНК, 2,5 мкл RAPD-праймера 2 (10 пМ) (Таблица 1) и 17,5 мкл стерильной воды, которую добавляли в готовуюю аналитическую бусину RAPD (Life Sciences, 27-9500-01). Смесь выдероживали 5 минут при 95°С, затем осуществляли 45 циклов при 95°С в течение 1 минуты, 36°С в течение 1 минуты, 72°С в течение 2 минут с окончательным удлинением в течение 5 минут при 72°С. Продукты ПЦР наблюдали на анализаторе фрагментов (Advanced Analytics) для определения характера амплификации и импортировали для анализа в BioNumerics, программное обеспечение для биоинформатики. Паттерены RAPD сравнивали с помощью метода корреляционного анализа Дайса на основе полос, чтобы определить сходство паттернов RAPD как способа мониторинга различий между изолятами.
[0438] Антимикробный скрининг проводили на изолятах C. perfringens, полученных из образцов жвачных животных, для определения эффективности противомикробного бактериоцина, продуцируемого идентифицированными авторами штаммами Bacillus 747, 1104, 1541, 1781 и 2018. Бактериоцин собирали путём выращивания каждого штамма при 32°C в инкубаторе со встряхиванием при 150 об/мин в течение 24 часов в бульоне с сердечномозговым экстрактом (BHI). После инкубации проводили перенос 1% 24-часовой культуры в свежий бульон BHI. Затем Bacillus инкубировали в течение 36-48 часов в инкубаторе со встряхиванием при 32°C при 150 об/мин. Затем культуру центрифугировали при 14000×g в течение 20 минут, затем супернатант отфильтровывали через фильтр 0,2 мкм для удаления остаточных клеток.
[0439] Анализ мутности бактериоцина проводили путем выращивания штаммов C. perfiingens, выделенных из образцов фекалий жвачных животных, в среде RCM в течение 24 часов, анаэробно, при 37°C. Ночную культуру (1%) переносили в стерильную RCM и сразу использовали в анализе. Каждыйо изолят C. perfringens помещали в по меньшей мере шесть лунок стерильного 48-луночного реакционного планшета, добавляли 600 мкл инокулированной культуры (положительный контроль), 600 мкл инокулированного RCM + 70 мкл бактериоцина (747, 1104, 1541, 1781 и 2018) и 670 мкл RCM (неинокулированный, отрицательный контроль). Планшеты инкубировали анаэробно при 37°С в течение 24 часов, затем считывали с использованием спектрофотометра BioTek Epoch Microplate, показания снимали на длине волны 600 нм. Показания оптической плотности из отрицательных контролей вычитали из всех показаний OD и рассчитывали процент ингибирования, используя положительный контроль и каждую обработку бактериоцином.
[0440] Для идентификации видов клостридий, у которых не было по меньшей мере одного гена токсина, специфичного для C. perfiingens, проводили реакцию ПЦР с ДНК изолятов для амплификации 16S-области рДНК с использованием праймеров 27F-YM и 1492R-Y (Таблица 1). Это было сделано для 20% изолятов, которые не содержали гены токсинов, специфичныео для C. perfiingens. Смесь для ПЦР содержала 5 мкл 10-кратного ПЦР-буфера, 2 мкл 50 мМ MgCl2, 1 мкл 50 мМ dNTP, 0,4 мкл каждого праймера (Таблица 1), 0,2 мкл Taq ДНК-полимеразы Invitrogen™ Platinum™, 5 мкл ДНК, стерильную воду добавляли до достижения 50 мкл общего реакционного объёма. Смесь выдерживали 4 минуты при 95°С, затем осуществляли 35 циклов при 95°С в течение 30 секунд, 50°С в течение 30 секунд, 72°С. в течение 2 минут с окончательным удлинением в течение 7 минут при 72°C. Была проведена проверка качества амплификации, и продукт ПЦР был отправлен в Genewiz (https://www.genewiz.com) для получения последовательностей генов 16S. Последовательности сравнивали с известными типизированными бактериальными штаммами, полученными из электронной онлайн базы данных EZbiocloud (http://www.ezbiocloud.net/). На основании сравнений этих последовательностей изолятам присваивали бактериальную идентификацию.
[0441] Анализ мутности бактериоцина проводили путём выращивания нетоксичных штаммов клостридий, выделенных из фекалий жвачных животных и образцов корма в RCM в течение 24 часов, анаэробно, при 37°С. Ночную культуру (1%) переносили в стерильную RCM и сразу использовали в анализе. Каждый изолят C. perfringens помещали в не менее шести лунок в стерильном реакционном планшете на 48 лунок, добавляли 600 мкл инокулированной культуре (положительный контроль), 600 мкл инокулированной RCM + 70 мкл бактериоцина (747, 1104, 1541, 1781, 1999 и 2018) и 670 мкл RCM (без инокуляции, отрицательный контроль). Планшеты инкубировали анаэробно при 37°С в течение 24 часов, затем считывали с использованием спектрофотометра BioTek Epoch Microplate, показания снимали на длине волны 600 нм. Показания оптической плотности из отрицательных контролей вычитали из всех показаний OD, и процент ингибирования рассчитывали, используя положительный контроль и каждую обработку бактериоцином.
[0442] Результаты: 827 проб фекалий были собраны в 12 техасских фермах, из которых было выделено 7046 предполагаемых штаммов клостридий в качестве представителей клостридиального разнообразия в Техасе (Таблица 10).
[0443] Результаты подсчёта клостридий показали, что средний уровень клостридий КОЕ/г во всех образцах фекалий телят составлял 1 110 000 КОЕ/г с отдельными образцами фекалий в диапазоне от 10 до 17 300 000 КОЕ/г. В то время как средний уровень клостридий КОЕ/г во всех образцах фекалий коров составлял 59 700 КОЕ/г с отдельными образцами фекалий в диапазоне от <10 до 35 500 000 КОЕ/г (Фиг. 41). Как представляется уровни клостридий варьируют в образцах как у телят (Фиг. 42), так и у коров (Фиг. 43).
[0444] Результаты подсчёта C. perfringens показали, что средний уровень C. perfringens в КОЕ/г для всех образцов телят составляет 353 000 КОЕ/г, для отдельных образцов - от <10 до 4 020 000 КОЕ/г. В то время как средний уровень C. perfringens в КОЕ/г во всех образцах фекалий коров составлял 56 100 КОЕ/г с отдельными образцами в диапазоне от <10 до 35 500 000 КОЕ/г (Фиг. 44). Как представляется уровни клостридий варьируют в образцах как у телят (Фиг. 45), так и у коров (Фиг. 46).
[0445] Анализ результатов мультиплексной ПЦР токсинов показал какие изоляты содержали гены токсинов, специфичные для C. perfringens. В общей сложности 7046 предполагаемых изолятов клостридий из образцов фекалий были протестированы на указанные гены токсинов C. perfringens. Из 7046 скринированных изолятов клостридий 3697 изолятов (52,5%) дали положительный результат по крайней мере на один из генов токсинов. Из 3697 положительных по гену токсина изолятов 3588 (97%) были идентифицированы как тип А (только α токсин), однако β, ε и ι токсины были также обнаружены в фекальных изолятах клостридий.
[0446] Генетические отпечатки паттерны RAPD продемонстрировали разнообразие среди 3460 изолятов, которые были успешно амплифицированы. Изученные изоляты собирали из фекалий теленка, фекалий коровы и корма и не группировались строго в зависимости от типа пробы или фермы. Изоляты сформировали 513 кластеров на основе 75% сходства в соответствии с методом корреляции по Дайсу.
[0447] Представители из дендрограммы RAPD были отобраны для определения разнообразия популяции C. perfringens из этого региона и подвергнуты анализу на ингибирование. Антимикробное тестирование с использованием анализа мутности бактериоцина показало хорошее ингибирование большинства выделенных фекальных изолятов C. perfringens с использованием бактериоцина, полученного из 747, 1104, 1541, 1781 и 2018. Бактериоцин по меньшей мере из одного из штаммов 747, 1104, 1541, 1781, и 2018 был способен ингибировать рост более чем на 60% 877 из 983 протестированных изолятов, что в целом составило 92,7% ингибирования популяции C. perfringens на основе дендрограммы (Таблица 11).
[0448] Было обнаружено, что из 7046 собранных изолятов 3349 изолятов (47,5%) были нетоксикогенными клостридиями. Секвенирование репрезентативных образцов (n = 215) нетоксикогенных клостридий показало две доминирующие группы клостридий. Группа Clostridium bifermentans (Paraclostridium bifermentans и P. benzoelyticum) и группа Clostridium beijerinckii (C. diolis, C. beijerinckii, C. chromiireducens, C. saccharoperbutylacetonicum, C. puniceum и C. saccharobutylicum), две основные группы нетоксикогенных клостридий составляли 52,1% нетоксикогенных изолятов (Фиг. 47).
[0449] Нетоксикогенные изоляты (n = 105) известной идентификациями по 16S из Техаса были отобраны для антимикробного тестирования с использованием анализа мутности бактериоцина. Изоляты были отобраны, чтобы охватить всё разнообразие репрезентативных нетоксикогенных изолятов. Результаты показали хорошее ингибирование большинства нетоксикогенных изолятов, протестированных с использованием бактериоцина, полученного из 747, 1104, 1541, 1781, 1999 и 2018. Бактериоцин по крайней мере из одного из штаммов 747, 1104, 1541, 1781, 1999 и 2018 был способен ингибировать рост на > 60% для 71 из 105 протестированных изолятов (Таблица 12).
[0450] Обсуждение: образцы фекалий использовали в качестве наиболее легкодоступного типа образцов для оценки уровня клостридий и C. perfiingens в пищеварительной системе жвачных животных и получения их изолятов. Из 827 образцов фекалий, собранных по всему Техасу, все, кроме одного, содержали детектируемый уровень клостридий. Результаты исследования показали, что клостридии присутствуют почти во всех пробах фекалий с разными уровнями. Большая часть изолятов (52,5%), собранных из образцов жвачных животных, содержала ген токсина, специфичный для C. perfringens. C. perfringens были обнаружены в 86% образцов фекалий коров и в 60% образцов фекалий телят. Высокий уровень присутствия клостридий и C. perfringens указывает на риск возникновения подострой кишечной проблемы, вызванной клостридиями, у большинства жвачных животных по всему Техасу. Изоляты C. perfringens были разнообразными в соответствии с генетическими отпечатками RAPD, но не были специфичными по типу образца или фермы. Разнообразные представители C. perfringens в основном ингибировались (> 60%) по меньшей мере одним бактериоцином из следующих штаммов 747, 1104, 1541, 1781 или 2018. Из 983 протестированных изолятов 877 изолятов ингибировались более чем на 60% по меньшей мере одним из штаммов, демонстрируя ингибирование 92,7% популяции C. perfiingens на основе представления данных из кластеров на дендрограмме RAPD. Это указывает на то, что штаммы Bacillus 747, 1104, 1541, 1781 и 2018 могут ингибировать широкий спектр разнообразных изолятов C. perfiingens. Штаммы Bacillus не ограничиваются конкретным штаммом(ами) клостридий, подобно вакцине, в которой могут отсутствовать большие группы популяций клостридий на основе генетического разнообразия, наблюдаемого в дендрограмме RAPD. Секвенирование ДНК нетоксикогенных клостридий выявило две основные характеристичные группы видов Clostridium: группа C. bifermentans, которая, как известно, производит 1,3-пропандиол (Leja и др., 2014; Myszka и др., 2012) и группа C. beijerinckii, которая, как известно, продуцирует бутанол и ацетон (Hou и др., 2017). Производство конечных продуктов метаболизма этих видов может оказывать влияние на рубец, снижая такие показатели производительности, как производство молока у молочной коровы. Протестированные нетоксикогенные клостридии в основном ингибировались (71/105) более чем на 60% бактериоцином по крайней мере из одного из следующих штаммов 747, 1104, 1541, 1781, 1999 или 2018. Ингибирование нетоксикогенных клостридий может также быть потенциальным механизмом действия, который штаммы Bacillus используют для увеличения параметров производительности. Высокий уровень ингибирования изолятов клостридий in vitro указывает на потенциальный способ действия штаммов Bacillus 747, 1104, 1541, 1781, 1999 и 2018.
[0451] Штаммы Bacillus оказывают профилактическое действие на популяции клостридий, которые могут не только повышать эффективность рубца, приводя к увеличению молочной продуктивности, но и предотвращать острые уровни C. perfringens, снижая риск смерти от проблем с пищеварением. Высокая распространенность клостридий и C. perfiingens в собранных пробах фекалий свидетельствует о возможности повышения эффективности у многих жвачных животных по всему Техасу. В этом примере показано разнообразие изолятов клостридий из фекалий жвачных животных и образцов кормов, собранных в Техасе. Протестированные штаммы Bacillus 747, 1104, 1541, 1781, 1999 и 2018 могут ингибировать большую часть разнообразия клостридий, наблюдаемого в Техасе. Указанный продукт в соответствии с этим вариантом осуществления настоящего изобретения может ингибировать как токсикогенные, так и нетоксикогенные клостридии, выделенные из жвачных животных в Техасе, что указывает на его пользу в повышении эффективности рубца при скармливании молочным коровам в качестве пробиотика.
[0452] Таблица 10. 827 образцов фекалий были собраны в техасских фермах, разделенных по ферме (12) и возрасту (корова или теленок), в которых были подсчитаны клостридии, которые были протестированы на C. perfiingens, изоляты были генотипированы и протестированы на ингибирование.
[0453] Таблица 11: Результаты анализа с использованием бактериоцина, показывающие каждый протестированный изолят и источник этого изолята, выделенного из техасских фекальных образцов. Ингибирование рассчитывали на основе процента роста для каждой обработанной лунки по сравнению с положительным контролем.
[0454] Таблица 12: Результаты анализа с использоваием бактериоцина, отображающие каждый изолят, протестированный из Техаса. Ингибирование рассчитывали на основе процента роста для каждой обработанной лунки по сравнению с положительным контролем.
[0455] Пример 7. Отбор штаммов Bacillus для ингибирования Clostridium perfringens и нетоксигенных Clostridia, выделенных из образцов фекалий жвачных (Верхний Средний Запад).
[0456] Введение: Clostridium - это род грамположительных, спорообразующих бактерий, которые являются обычными обитателями желудочно-кишечного тракта. Ряд видов Clostridium связывают с кишечными заболеваниями у жвачных животных, включая геморрагический синдром кишечника (ГСК), заболевание, часто коррелирующее с повышенным уровнем Clostridium perfringens типа А. В то время как большинство кишечных заболеваний, вызванных клостридиями, являются острыми и возникают спорадически в стадах, в общем, прогноз плохой, и первым признаком болезни может быть смерть. Основываясь на недавних результатах, проблемы с подострой кишечной клостридией могут быть более распространенной проблемой, чем острые проблемы. Из-за низкого показателя успешности лечения острых заболеваний необходимо делать акцент на профилактических мерах.
[0457] Целью данного исследования было охарактеризовать распределение и разнообразие клостридий у жвачных животных и обеспечить ингибирование этих изолятов с использованием новых штаммов Bacillus в качестве метода контроля популяций клостридий.
[0458] Материалы и методы: образцы фекалий (248) от коров, телок и телят, собранных на 4 фермах в районе Верхнего Среднего Запада, разбавляли стерильным пептоном 1:10, подвергали тепловому шоку в течение 30 минут при 60°C, подсчитывали в стерильном пептоне и высевали на агаре с триптозосульфит-циклосеринос (TSC) с D-циклосерином (400 мг/л) для отбора и определения видов клостридий. Чашки с агаром инкубировали при 37°С анаэробно в течение 24 часов. Если присутствовали изолированные сульфитредуцирующие колонии, их подсчитывали как общее количество клостридий (КОЕ/г) и репрезентативные изоляты отбирали в среду Reinforced Сlostridia Medium (RCM) (Oxoid, CM0149) и инкубировали анаэробно в течение 24 часов при 37°C. Через 24 часа инкубации культуры (10%) переносили в бульон с сердечномозговым экстрактом (BHI) (BD, 211059) и инкубировали анаэробно в течение 24 часов при 37°С.
[0459] Экстракцию ДНК проводили в 96-луночных блоках, содержащих 500 мкл предполагаемой культуры клостридий на лунку. Клетки собирали центрифугированием при 4700 об/мин в течение 10 минут, супернатант удаляли. Клетки ресуспендировали в 500 мкл 50 мМ ЭДТА-2Na (рН = 8,0). Аликвоты 300 мкл суспендированных клеток переносили в новый 96-луночный блок и объединяли с 20 мкл лизоцима из раствора куриного яичного белка (Sigma, L6876) (100 мг/мл в 50 мМ ЭДТА) для лизиса бактериальных клеток. 96-луночный блок инкубировали в течение 1 часа при 37°С для лизиса бактериальных клеток. После инкубации добавляли 220 мкл буфера для лизиса (6 М гуанидина, 20% Тритон-Х 100, 10 мМ Трис-HCL, рН 7,5), перемешивали, затем инкубировали при комнатной температуре в течение 15 минут. После инкубации в каждую лунку добавляли 20 мкл протеиназы К (NEB, 800 Ед/мл), перемешивали и инкубировали при 55°С в течение 30 минут для разложения белков. Затем клеточный лизат переносили в 96-луночный планшет для связывания (Promega, A2278) и центрифугировали при 4700 об/мин в течение 5 минут. Фильтрат отбрасывали, выполняли три промывки колонок связывающей пластины центрифугированием 750 мкл промывочного раствора для колонки (Promega, A1318) при 4700 об/мин в течение 1 минуты и 30 секунд, отбрасывая фильтрат в конце каждого отжима. Планшет для связывания центрифугировали в течение дополнительных 10 минут при 4700 об/мин для удаления остаточного этанола. Затем под связывающую пластину помещали чистый элюирующий планшет и ДНК элюировали 200 мкл предварительно нагретой (55°С) воды, свободной от нуклеаз (Promega, PI 195).
[0460] ДНК подвергали скринингу на наличие генов токсина (α, β, ε и ι), специфичных для C. perfringens, с использованием полимеразной цепной реакции (ПЦР). Амплификацию генов токсинов проводили с использованием мультиплексной ПЦР, содержащей четыре набора праймеров (Yoo и др., 1997) (Таблица 1.) Смесь для ПЦР содержала 2,5 мкл 10-кратного ПЦР-буфера, 2 мкл 50 мМ MgCl2, 0,5 мМ каждого праймера (Таблица 1), 0,1 мкл Taq ДНК-полимеразы Invitrogen™ Platinum , 2,5 мкл ДНК, добавляли стерильную воду до достижения 25 мкл общего реакционного объёма. Смесь выдерживали 5 минут при 94°С, затем осуществляли 30 циклов при 94°С в течение 1 минуты, 55°С в течение 1 минуты, 72°С в течение 1 минуты с окончательным удлинением 3 минуты при 72°С. Для определения того, была ли достигнута амплификация, наблюдали продукты ПЦР с использованием анализатора фрагментов (Advanced Analytics). Если был обнаружен один или несколько генов токсинов, их идентифицировали и приписывали соответствующий тип токсина каждому изоляту на основании их профиля гена токсина (Songer, 1996). Соотношение токсин-положительных C. perfringens к общему количеству изолятов клостридий использовали для расчёта предполагаемого количества C. perfringens на основе общего количества клостридий.
[0461] Уникальные штамм-специфические генетические отпечатки получали с использованием анализа методом случайной амплификации полиморфной ДНК (RAPD) на отдельных изолятах для определения разнообразия среди фекальных изолятов C. perfringens. ПЦР содержала 5 мкл ДНК, 2,5 мкл RAPD-праймера 2 (10 пМ) (Таблица 1) и 17,5 мкл стерильной воды, которую добавляли в готовую аналитическую бусину RAPD (Life Sciences, 27-9500- 01). Смесь выдерживали 5 минут при 95°С, затем осуществляли 45 циклов при 95°С в течение 1 минуты, 36°С в течение 1 минуты, 72°С в течение 2 минут с окончательным удлинением 5 минут при 72°С. Продукты ПЦР наблюдали на анализаторе фрагментов (Advanced Analytics) для определения характера амплификации и импортировали для анализа в BioNumerics, программное обеспечение для биоинформатики. Паттерны RAPD сравнивали с помощью метода корреляционного анализа Дайса на основе полос, чтобы определить сходство между паттернами RAPD как способ мониторинга различий между изолятами.
[0462] Антимикробный скрининг проводили на изолятах C. perfringens, полученных из образцов жвачных животных, для определения эффективности противомикробного бактериоцина, продуцируемого идентифицированными авторами штаммами Bacillus 747, 1104, 1541, 1781 и 2018. Бактериоцин собирали пут`м выращивания каждого штамма при 32°C в инкубаторе со встряхиванием при 150 об/мин в течение 24 часов в бульоне c сердечномозговым экстрактом (BHI). После инкубации осуществляли перенос 1% 24-часовой культуры в свежий бульон BHI. Затем Bacillus инкубировали в течение 36-48 часов в инкубаторе со встряхиванием при 32°C при 150 об/мин. Затем культуру центрифугировали при 14000×g в течение 20 минут, затем супернатант отфильтровывали через фильтр 0,2 мкм для удаления остаточных клеток.
[0463] Анализ мутности бактериоцина проводили путём выращивания штаммов C. perfringens, выделенных из образцов фекалий жвачных животных, в RCM в течение 24 часов, анаэробно, при 37°C. Ночную культуру (1%) переносили в стерильную RCM и сразу использовали в анализе. Каждый изолят C. perfringens помещали в по меньшей мере шесть лунок в стерильный 48-луночный реакционный планшет, 600 мкл инокулированной культуры (положительный контроль), добавляли 600 мкл инокулированного RCM + 70 мкл бактериоцина (747, 1104, 1541, 1781 и 2018) и 670 мкл RCM (неинокулированный, отрицательный контроль). Планшеты инкубировали анаэробно при 37°С в течение 24 часов, затем считывали с использованием спектрофотометра BioTek Epoch Microplate, показания снимали на длине волны 600 нм. Показания оптической плотности из отрицательных контролей вычитали из всех показаний OD, и процент ингибирования рассчитывали, используя положительный контроль и данные каждой обработки бактериоцином.
[0464] Для идентификации клостридий, у которых не было по меньшей мере одного гена токсина, специфичного для C. perfringens, проводили реакцию ПЦР ДНК изолятов для амплификации 16S-области рДНК с использованием праймеров 27F-YM и 1492R-Y (Таблица 1). Это было сделано для 20% изолятов, которые не содержали гены токсинов, специфичных для C. perfringens. Смесь для ПЦР содержала 5 мкл 10-кратного ПЦР-буфера, 2 мкл 50 мМ MgCl2, 1 мкл 50 мМ dNTP, 0,4 мМ каждого праймера (Таблица 1), 0,2 мкл Taq ДНК-полимеразы Invitrogen™ Platinum™, 5 мкл ДНК и стерильную воду добавляли до достижения 50 мкл общего реакционного объёма. Смесь выдерживали 4 минуты при 95°С, затем осуществляли 35 циклов при 95°С в течение 30 секунд, 50°С в течение 30 секунд, 72°С в течение 2 минут с окончательным удлинением в течение 7 минут при 72°С. Была проведена проверка качества амплификации, и продукт ПЦР был отправлен в Genewiz (https://www.genewiz.com) для получения последовательностей генов 16S. Последовательности сравнивали с известными типизированными бактериальными штаммами, полученными из электронной онлайн базы данных EZbiocloud (http://www.ezbiocloud.net/). На основании сравнений этих последовательностей изолятам приписывали бактериальную идентификацию.
[0465] Результаты: 248 образцов фекалий были собраны из 4 региональных ферм Верхнего Среднего Запада (Миннесота и Южная Дакота), из которых было выделено 2419 предполагаемых штаммов клостридий в качестве представителей клостридиального разнообразия в регионе Верхнего Среднего Запада (Таблица 13).
[0466] Результаты подсчета клостридий показали, что средний уровень клостридий КОЕ/г во всех образцах телят составляет 505 000 КОЕ/г с отдельными образцами фекалий в диапазоне от 15 до 1 160 000 КОЕ/г. В то время как средний уровень клостридий КОЕ/г во всех образцах фекалий коров составлял 8 480 КОЕ/г, а в отдельных образцах фекалий - от 5 до 785 000 КОЕ/г (Рисунок 48). Как оказалось, образцы, варьируют по уровням клостридий как у телят (Фиг. 49), так и коров (Фиг. 50).
[0467] Результаты подсчета C. perfringens показали, что средний уровень C. perfringens в КОЕ/г для всех образцов телят составляет 81 800 КОЕ/г, для отдельных образцов - от <10 до 1 160 000 КОЕ/г. В то время как средний уровень C. perfringens в КОЕ/г во всех образцах фекалий коров составлял 5 490 КОЕ/г в отдельных образцах в диапазоне от <10 до 314 000 КОЕ/г (Фиг. 51). Как оказалось, образцы, варьируют по уровням клостридий как у телят (Фиг. 52), так и у коров (Фиг. 53).
[0468] Анализ результатов мультиплексной ПЦР токсинов выявил изоляты, которые содержали гены токсинов, специфичные для C. perfringens. В общей сложности 2419 предполагаемых изолятов клостридий из образцов фекалий были протестированы на указанные гены токсинов C. perfringens. Из 2419 скринированных изолятов клостридий 629 изолятов (26,0%) дали положительный результат по крайней мере на 1 ген токсина. Из 629 токсин-положительных изолятов 583 (92,7%) были идентифицированы как тип А (только токсин α), однако токсины β, ε и ι также были обнаружены в фекальных изолятах клостридий.
[0469] Генетические паттерны отпечатков RAPD показали разнообразие среди 551 изолятов, которые были успешно амплифицированы. Испытанные изоляты собирали из фекалий теленка, коровы и корма и не группировались строго в зависимости от типа образца или фермы. Изоляты сформировали 106 кластеров на основе 75% сходства в соответствии с методом корреляции по Дайсу. Самый большой кластер состоял из 37 изолятов, что составило 6,7% от общей дендрограммы.
[0470] Представители дендрограммы RAPD были отобраны для определения разнообразия популяции C. perfringens из этого региона и подвергнуты анализу ингибирования. Антимикробное тестирование с использованием анализа мутности бактериоцина показало хорошее ингибирование большинства выделенных фекальных изолятов C. perfringens с использованием бактериоцина, полученного из штаммов 747, 1104, 1541, 1781 и 2018. Бактериоцин по меньшей мере из одного из штаммов 747, 1104, 1541, 1781 и 2018 был способен на > 60% ингибировать рост 123 протестированных изолятов из 135, что в целом составило 95,2% ингибирования популяции C. perfringens на основе дендрограммы (Таблица 14).
[0471] Было обнаружено, что из 2419 выделенных изолятов 1790 изолятов (74,0%) были нетоксигенными клостридиями. Данные секвенирования (n = 218) нетоксигенных клостридий показали две доминирующие группы клостридий: группу Clostridium bifermentons (Paraclostridium bifermentans и P. benzoelyticum) и группу Clostridium beijerinckii (C. diolis, C. beijerinckii, C. chromiireducens, C. saccharoperbutylacetonicum, C. puniceum и C. saccharobutylicum), указанные две основные группы нетоксигенной группы клостридий составляли 50,5% нетоксичных изолятов (Фиг. 54).
[0472] Обсуждение: образцы фекалий использовали в качестве наиболее легкодоступного типа образцов для оценки уровня клостридий C. perfringens в пищеварительной системе жвачных животных и получения их изолятов. Из 248 образцов фекалий, собранных по всему Среднему Западу, все образцы имели детектируемые уровни клостридий. Многие собранные изоляты (629 изолятов) из образцов жвачных животных содержали гены токсинов, специфичных для C. perfringens. C. perfringens были обнаружены в 74% образцов фекалий коров и в 50% образцов фекалий телят. Высокое присутствие клостридий и C. perfringens указывает на риск возникновения подострой кишечного заболевания, вызванного клостридиями, у большинства жвачных животных в Верхнем Среднем Западе. Изоляты C. perfringens были разнообразны в соответствии с генетическими отпечатками RAPD, но не были специфичными для типа образца или фермы. Разнообразные представители C. perfringens в основном ингибировались (> 60%) по меньшей мере одним бактериоцином из следующих штаммов 747, 1104, 1541, 1781 или 2018. Из 135 протестированных изолятов 123 изолята ингибировались более чем на 60% бактериоцином из по меньшей мере одного из штаммов, что представляет собой ингибирование 95,2% общей популяции C. perfringens на основе данных из кластеров на дендрограмме RAPD. Это указывает на то, что штаммы Bacillus 747, 1104, 1541, 1781 и 2018 могут ингибировать широкий спектр разнообразия изолятов C. perfringens. Штаммы Bacillus не ограничиваются ингибированием конкретного штамма(ов) клостридий, на подобии вакцины, в которой могут отсутствовать большие группы популяций клостридий на основе генетического разнообразия, наблюдаемого в дендрограмме RAPD. Секвенирование ДНК нетоксикогенных клостридий выявило две основные группы видов Clostridium: группа C. bifermentons, которая, как известно, производит 1,3-пропандиол (Leja и др., 2014; Myszka и др., 2012), и группа C. beijerinckii, которая, как известно, продуцирует бутанол и ацетон (Hou et al., 2017). Производство конечных продуктов метаболизма этих видов может оказывать влияние на рубец, снижая такие показатели производительности, как производство молока у молочной коровы. Высокий уровень ингибирования изолятов клостридий in vitro указывает на потенциальный механизм действия штаммов Bacillus 747, 1104, 1541, 1781 и 2018.
[0473] Штаммы Bacillus оказывают профилактическое действие на популяции клостридий, которые могут не только повышать эффективность рубца, приводя к увеличению молочной продуктивности, но и предотвращать острые уровни C. perfringens, снижая риск смерти от заболеваний связанных с пищеварением. Высокая распространенность клостридий и C. perfringens в собранных фекальных пробах свидетельствует о возможностях повышения эффективности у многих жвачных животных на Верхнем Среднем Западе. В этом примере показано разнообразие изолятов клостридий из фекалий жвачных животных и образцов кормов, собранных на Верхнем Среднем Западе. Протестированные штаммы Bacillus, 747, 1104, 1541, 1781 и 2018, могут ингибировать большую часть разнообразия клостридий, наблюдаемого на Верхнем Среднем Западе. Продукт в соответствии с этим вариантом осуществления настоящего изобретения может ингибировать токсикогенные клостридии, выделенные от жвачных животных на Верхнем Среднем Западе, что указывает на повышение эффективности рубца при их скармливании молочным коровам в виде пробиотика.
[0474] Таблица 13. Образцы фекалий, 248, были собраны из региональных молочных регионов Верхнего Среднего Запада, разделенных по ферме (4) и возрасту (корова или теленок), в которых были подсчитаны клостридии, и которые были протестированы на C. perfringens, изоляты генотипировали и протестировали на ингибирование.
[0475] Таблица 14: Результаты анализа бактериоцина, показывающие каждый протестированный изолят и источник этого изолята, выделенного из региональных фекальных или кормовых проб Верхнего Среднего Запада. Ингибирование рассчитывали на основе процента роста для каждой лунки после обработки по сравнению с положительным контролем.
[0476] Пример 8. Отбор штаммов Bacillus для ингибирования Clostridium perfringens и нетоксигенных клостридий, выделенных из образцов фекалий жвачных животных (Великие озера).
[0477] Введение: Clostridium - это род грамположительных спорообразующих бактерий, которые являются частыми обитателями желудочно-кишечного тракта. Ряд видов Clostridium связывают с кишечными заболеваниями у жвачных животных, включая геморрагический синдром кишечника (ГСК), заболевание, часто коррелирующее с повышенным уровнем Clostridium perfringens типа А. В то время как большинство кишечных заболеваний, вызванных клостридиями, являются острыми и встречаются спорадически в стадах, в общем, прогноз плохой, и первым признаком болезни может быть смерть. Основываясь на недавних результатах, проблемы с подострой кишечной клостридией могут быть более распространенной проблемой, чем острые проблемы. Из-за низкого показателя успешности лечения острых заболеваний акцент необходимо делать на профилактических мерах.
[0478] Целью данного исследования было охарактеризовать распределение и разнообразие клостридий у жвачных животных и обеспечить ингибирование этих изолятов с использованием новых штаммов Bacillus в качестве метода контроля популяций клостридий.
[0479] Материалы и методы: Образцы фекалий (265) от коров, нетелей и телят, собранные с 6 ферм в районе Великих озер, разбавляли стерильным пептоном 1:10, подвергали тепловому шоку в течение 30 минут при 60°C, подсчитывали в стерильном пептоне и высевали на агар с триптоз-сульфит-циклосерином (TSC) с D-циклосерином (400 мг/л) для отбора видов клостридий. Чашки с агаром инкубировали при 37°С анаэробно в течение 24 часов. Если присутствовали изолированные сульфитредуцирующие колонии, подсчитывали их как общее количество клостридий (КОЕ/г) и репрезентативные изоляты отбирали в среду с Reinforced clostridia Medium (RCM) (Oxoid, CM0149) и инкубировали анаэробно в течение 24 часов при 37°C. Через 24 часа инкубации культуры (10%) переносили в бульон с сердечномозговым экстрактом (BHI) (BD, 211059) и инкубировали анаэробно в течение 24 часов при 37°С.
[0480] Экстракцию ДНК проводили в 96-луночных блоках, содержащих 500 мкл предполагаемой культуры клостридий на лунку. Клетки собирали центрифугированием при 4700 об/мин в течение 10 минут, супернатант удаляли. Клетки ресуспендировали в 500 мкл 50 мМ ЭДТА-2Na (рН = 8,0). Аликвоты 300 мкл суспендированных клеток переносили в новый 96-луночный блок и объединяли с 20 мкл лизоцима из раствора куриного яичного белка (Sigma, L6876) (100 мг/мл в 50 мМ ЭДТА) для лизиса бактериальных клеток. 96-луночный блок инкубировали в течение 1 часа при 37°С для лизиса бактериальных клеток. После инкубации добавляли 220 мкл буфера для лизиса (6 М гуанидина, 20% Тритон-Х 100, 10 мМ Трис-HCL, рН 7,5), перемешивали, затем инкубировали при комнатной температуре в течение 15 минут. После инкубации в каждую лунку добавляли 20 мкл протеиназы К (NEB, 800 Ед/мл), перемешивали и инкубировали при 55°С в течение 30 минут для разложения белков. Затем клеточный лизат переносили в 96-луночный планшет для связывания (Promega, A2278) и центрифугировали при 4700 об/мин в течение 5 минут. Фильтрат отбрасывали, осуществляли три промывки колонок связывающей пластины центрифугированием 750 мкл промывочного раствора для колонки (Promega, A1318) при 4700 об/мин в течение 1 минуты и 30 секунд, отбрасывая фильтрат в конце каждого отжима. Планшет для связывания центрифугировали в течение дополнительных 10 минут при 4700 об/мин для удаления остаточного этанола. Затем под связывающую пластину помещали чистый элюирующий планшет и ДНК элюировали 200 мкл предварительно нагретой (55°С) воды, свободной от нуклеаз (Promega, PI 195).
[0481] ДНК подвергали скринингу на наличие генов токсинов (α, β, ε и ι), специфичных для C. perfringens, с использованием полимеразной цепной реакции (ПЦР). Амплификацию генов токсинов проводили с использованием мультиплексной ПЦР, содержащей четыре набора праймеров (Yoo и др., 1997) (Таблица 1.) Смесь для ПЦР содержала 2,5 мкл 10-кратного ПЦР-буфера, 2 мкл 50 мМ MgCl2, 0,5 мМ каждого праймера (Таблица 1), 0,1 мкл Taq ДНК-полимеразы Invitrogen™ Platinum™, 2,5 мкл ДНК, добавляли стерильную воду до достижения 25 мкл общего реакционного объёма. Смесь выдерживали 5 минут при 94°С, затем 30 циклов при 94°С в течение 1 минуты, 55°С в течение 1 минуты, 72°С в течение 1 минуты с окончательным удлинением в течение 3 минут при 72°С. Для определения того, была ли достигнута амплификация, продукты ПЦР наблюдали с использованием анализатора фрагментов (Advanced Analytics). Если обнаруживали один или несколько генов токсина, осуществляли идентификацию типа токсина в каждом изоляте на основании их профиля гена токсинов (Songer, 1996). Соотношение токсин-положительных C. perfringens к общему количеству изолятов клостридий использовали для расчёта предполагаемого количества C. perfringens на основе общего количества клостридий.
[0482] Уникальные штамм-специфические генетические отпечатки получали с использованием анализа методом случайной амплификации полиморфной ДНК (RAPD) на отдельных изолятах для определения разнообразия среди фекальных изолятов C. perfringens. ПЦР содержала 5 мкл ДНК, 2,5 мкл RAPD-праймера 2 (10 пМ) (Таблица 1) и 17,5 мкл стерильной воды, которую добавляли в готовую аналитическую бусину RAPD (Life Sciences, 27-9500- 01). Смесь выдерживали 5 минут при 95°С, затем осуществляли 45 циклов при 95°С в течение 1 минуты, 36°С в течение 1 минуты, 72°С в течение 2 минут с окончательным удлинением в течение 5 минут при 72°С. Продукты ПЦР наблюдали на анализаторе фрагментов (Advanced Analytics) для определения характера амплификации и импортировали для анализа в программное обеспечение для биоинформатики BioNumerics. Паттерены RAPD сравнивали с помощью метода корреляционного анализа полос по Дайсу, чтобы определить сходство паттернов RAPD, как способа мониторинга различий между изолятами.
[0483] Антимикробный скрининг проводили на изолятах C. perfringens, полученных из образцов жвачных животных, для определения эффективности противомикробного бактериоцина, продуцируемого идентифицированными изобретателями штаммами Bacillus 747, 1104, 1541, 1781 и 2018. Бактериоцин получали путём выращивания каждого штамма при 32°C в инкубаторе со встряхиванием при 150 об/мин в течение 24 часов в бульоне с сердечномозговым экстрактом (BHI). После инкубации выполняли перенос 1% 24-часовой культуры в свежий бульон BHI. Затем Bacillus инкубировали в течение 36-48 часов в инкубаторе со встряхиванием при 32°C при 150 об/мин. Затем культуру центрифугировали при 14000×g в течение 20 минут, затем супернатант фильтровали через фильтр 0,2 мкм для удаления остаточных клеток.
[0484] Анализ мутности бактериоцина проводили путём выращивания штаммов C. perfringens, выделенных из образцов фекалий жвачных животных, в RCM в течение 24 часов, анаэробно, при 37°C. Ночную культуру (1%) переносили в стерильную RCM и сразу использовали в анализе. Каждый изолят C. perfringens помещали в по меньшей мере шесть лунок стерильного 48-луночного реакционного планшета, добавляли 600 мкл инокулированной культуры (положительный контроль), 600 мкл инокулированного RCM + 70 мкл бактериоцина (747, 1104, 1541, 1781 и 2018) и 670 RCM (неинокулированный, отрицательный контроль). Планшеты инкубировали анаэробно при 37°С в течение 24 часов, затем считывали с использованием спектрофотометра BioTek Epoch Microplate, результаты снимали на длине волны 600 нм. Показания оптической плотности из отрицательных контролей вычитали из всех показаний OD, и процент ингибирования рассчитывали, используя положительный контроль и каждую обработку бактериоцином.
[0485] Для идентификации клостридий, у которых не было по меньшей мере одного гена токсина, специфичного для C. perfringens, с ДНК изолята проводили реакцию ПЦР для амплификации 16S-области рДНК с использованием праймеров 27F-YM и 1492R-Y (Таблица 1). Это было сделано на 20% изолятов, которые не содержали гены токсинов, специфичных для C. perfringens. Смесь для ПЦР содержала 5 мкл 10Х ПЦР-буфера, 2 мкл 50 мМ MgCl2, 1 мкл 50 мМ dNTP, 0,4 пМ каждого праймера (Таблица 1), 0,2 мкл Taq ДНК-полимеразы Invitrogen™ Platinum™, 5 мкл ДНК и стерильную воду добавляли до достижения 50 мкл общего реакционного объёма. Смесь выдерживали 4 минуты при 95°С, затем осуществляли 35 циклов при 95°С в течение 30 секунд, 50°С в течение 30 секунд, 72°С в течение 2 минут с окончательным удлинением в течение 7 минут при 72°С. Проводили проверку качества амплификации, и продукт ПЦР отправляли в Genewiz (https://www.genewiz.com) для получения последовательностей для генов 16S. Последовательности сравнивали с известными типизированными бактериальными штаммами, полученными из электронной онлайн базы данных EZbiocloud (http://www.ezbiocloud.net/). На основании сравнений этих последовательностей изолятам присваивали бактериальную идентификацию.
[0486] Результаты: 265 образцов фекалий были взяты из 6 региональных ферм Великих озер (Мичиган, Индиана, Огайо, Нью-Йорк), из которых было выделено 2715 предполагаемых изолятов клостридий в качестве представителей клостридиального разнообразия в районе Великих озер (Таблица 15).
[0487] Результаты подсчёта клостридий показали, что средний уровень клостридий КОЕ/г во всех образцах фекалий телят составлял 180 000 КОЕ/г с отдельными образцами фекалий в диапазоне от 50 до 2910 000 КОЕ/г. В то время как средний уровень клостридий КОЕ/г во всех образцах фекалий коров составлял 69 800 КОЕ/г с отдельными образцами фекалий в диапазоне от 10 до 125 000 КОЕ/г (Фиг. 55). Как выяснилось уровни клостридий варьируют как у телят (Фиг. 56), так и у коров (Фиг. 57).
[0488] Результаты подсчёта C. perfringens показали, что средний уровень C. perfringens КОЕ/г для всех образцов телят составляет 1620 КОЕ/г с отдельными образцами в диапазоне от <10 до 1 450 000 КОЕ/г. В то время как средний уровень C. perfringens в КОЕ/г во всех образцах фекалий коров составлял 1250 КОЕ/г с отдельными образцами в диапазоне от <10 до 125 000 КОЕ/г (Фиг. 58). Как выяснилось уровни клостридий варьируют как у телят (Фиг. 59), так и коров (Фиг. 60).
[0489] Анализ результатов мультиплексной ПЦР в отношении токсинов показал которые из изолятов содержали гены токсинов, специфичных для C. perfringens. В общей сложности 2715 предполагаемых изолятов клостридий из образцов фекалий были протестированы на указанные гены токсинов C. perfringens. Из 2715 скринированных изолятов клостридий 1456 изолятов (53,6%) дали положительный результат по крайней мере на 1 ген токсина. Из 1456 изолятов, положительных по гену токсина, 1427 (98%) были идентифицированы как тип А (только токсин α), однако токсины β, ε и ι также были обнаружены в фекальных изолятах клостридий.
[0490] Генетические паттерны отпечатков RAPD продемонстрировали разнообразие среди 1276 изолятов, которые были успешно амплифицированы. Испытанные изоляты собирали из фекалий телят, коров и корма и не группировались строго в зависимости от типа пробы или фермы. Изоляты сформировали 162 кластера на основе 75% сходства в соответствии с методом корреляции по Дайсу. Самый большой кластер состоял из 102 изолятов (8,0%) и состоял из изолятов всех шести ферм.
[0491] Данные дендрограмм RAPD отбрабатывали для определения разнообразия популяции C. perfringens из этого региона и подвергали анализу ингибирования. Антимикробное тестирование с использованием анализа мутности бактериоцина показало хорошее ингибирование большинства выделенных фекальных изолятов C. perfringens с использованием бактериоцинов, полученных из штаммов 747, 1104, 1541, 1781 и 2018. Бактериоцин по меньшей мере из одного из штаммов 747, 1104, 1541, 1781 и 2018 был способен на > 60% ингибировать рост 221 из 254 протестированных изолятов, что в целом составило 89,0% ингибирования популяции C. perfringens на основе дендрограммы (Таблица 16).
[0492] Было обнаружено, что из 2715 выделенных изолятов, 1259 изолятов (46%) являлись нетоксигенными клостридиями. Данные секвенирования (n = 190) нетоксигенных клостридий показали одну группу доминирующих клостридий, группу Clostridium bifermentons (Paraclostridium bifermentons и P. benzoelyticum). Clostridium bifermentons составляли 50,0% нетоксикогенных изолятов (Фиг. 61).
[0493] Обсуждение: образцы фекалий использовали в качестве наиболее легкодоступного типа образцов для оценки уровня и получения изолятов клостридий и C. perfringens в пищеварительной системе жвачных животных. Из 265 образцов кала, собранных по всему району Великих озер, все образцы имели одетектируемые уровни клостридий. Большая часть изолятов (53,6%), собранных из образцов жвачных животных, содержала ген токсина, специфичного для C. perfringens. C. perfringens был обнаружен в 86% образцов фекалий коров и в 63% образцов фекалий телят. Высокий уровень клостридий и C. perfringens указывает на риск возникновения подострого заболевания, связанного с кишечной клостридией, у большинства жвачных животных в районе Великих озер. Изоляты C. perfringens были разнообразными в соответствии с генетическими отпечатками RAPD, но не были специфичными для типа образца или фермы. Разнообразные представители C. perfringens в основном (> 60%) ингибировались по меньшей мере одним бактериоцином из следующих штаммов 747, 1104, 1541, 1781 или 2018. Из 254 протестированных изолятов 221 изолят был ингибирован более чем на 60% по меньшей мере одним из штаммов, что представляет собой ингибирование 89,0% от общей популяции C. perfringens на основе данных для кластеров на дендрограмме RAPD. Это указывает на то, что штаммы Bacillus 747, 1104, 1541, 1781 и 2018 могут ингибировать широкий спектр разнообразия изолятов C. perfringens. Штаммы Bacillus не ограничиваются конкретным штаммом(ами) клостридий, наподобие вакцины, в которой могут отсутствовать большие группы популяций клостридий на основе генетического разнообразия, наблюдаемого в дендрограмме RAPD. Секвенирование ДНК нетоксикогенных клостридий выявило один из основных видов Clostridium, Clostridium bifermentons. Высокой уровень ингибирования в отношении изолятов клостридий in vitro указывает на потенциальный механизм действия штаммов Bacillus 747, 1104, 1541, 1781 и 2018.
[0494] Штаммы Bacillus оказывают профилактическое действие на популяции клостридий, которые могут не только повышать эффективность рубца, приводя к увеличению молочной продуктивности, но и предотвращать острые уровни C. perfringens, снижая риск смерти от проблем, связанных с пищеварением. Высокая распространенности клостридий и C. perfringens в собранных фекальных пробах свидетельствует о возможности повышения эффективности у многих жвачных животных в районе Великих озер. В этом примере показано разнообразие изолятов клостридий из фекалий жвачных животных и образцов кормов, собранных в районе Великих озер. Протестированные штаммы Bacillus 747, 1104, 1541, 1781 и 2018 были способны ингибировать большую часть разнообразия клостридий, наблюдаемого в районе Великих озер. Продукт в соответствии с этим вариантом осуществления настоящего изобретения был способен ингибировать токсикогенные клостридии, выделенные от жвачных животных в районе Великих озер, что указывает на повышение эффективности рубца при скармливании молочным коровам в виде пробиотика.
[0495] Таблица 15. Образцы фекалий (265) были собраны в региональных молочных заводах Великих озер и разделены по ферме (6) и возрасту (корова или теленок), было подсчитано количество клостридий в образцах, образцы протестированы на C. perfringens, изоляты генотипированы и протестированы на ингибировани.
[0496] Таблица 16. Результаты анализа бактериоцина, показывающие каждый протестированный изолят и источник этого изолята, выделенного из региональных фекальных образцов Великих озер. Ингибирование рассчитывали на основе процента роста для каждой лунки обработки по сравнению с положительным контролем.
[0497] Пример 9: Отбор штаммов Bacillus для ингибирования Clostridium perfringens и нетоксикогенных клостридий, выделенных из образцов фекалий жвачных (Северо-восток).
Введение: Clostridium - это род грамположительных спорообразующих бактерий, которые являются частыми обитателями желудочно-кишечного тракта. Ряд видов Clostridium связывают с кишечными заболеваниями у жвачных животных, включая геморрагический синдром кишечника (ГСК), заболевание, часто коррелирующее с повышенным уровнем Clostridium perfringens типа А. В то время как большинство кишечных заболеваний, вызванных клостридиями, являются острыми и встречаются спорадически в стадах, в общем, прогноз плохой, и первым признаком болезни может быть смерть. Основываясь на недавних результатах, проблемы с подострой кишечной клостридией могут быть более распространенной проблемой, чем острые проблемы. Из-за низкого показателя успешности лечения острых заболеваний необходимо делать акцент на профилактических мерах.
[0499] Целью данного исследования было охарактеризовать распределение и разнообразие клостридий у жвачных животных и обеспечить ингибирование этих изолятов с использованием новых штаммов Bacillus в качестве метода контроля популяций клостридий.
[0500] Материалы и методы. Образцы фекалий (339) от коров, нетелей и телят, собранные на 9 фермах в Северо-восточном регионе, разбавляли стерильным пептоном 1:10, подвергали тепловому шоку в течение 30 минут при 60°C, пересчитывали в стерильном пептоне и высевали на агар с триптоз-сульфит-циклосерином (TSC) с D-циклосерином (400 мг/л) для отбора видом клостридий. Чашки с агаром инкубировали при 37°С анаэробно в течение 24 часов. Если присутствовали изолированные сульфитредуцирующие колонии, подсчитывали их как общее количество клостридий (КОЕ/г) и репрезентативные изоляты отбирали в среду Reinforced Clostridia Medium (RCM) (Oxoid, CM0149) и инкубировали анаэробно в течение 24 часов при 37°C. Через 24 часа инкубации культуры (10%) переносили в бульон с сердеченомозговым экстрактом (BHI) (BD, 211059) и инкубировали анаэробно в течение 24 часов при 37°С.
[0501] Экстракцию ДНК проводили в 96-луночных блоках, содержащих 500 мкл предполагаемой культуры клостридий на лунку. Клетки собирали центрифугированием при 4700 об/мин в течение 10 минут, супернатант удаляли. Клетки ресуспендировали в 500 мкл 50 мМ ЭДТА-2Na (рН = 8,0). Аликвоты 300 мкл суспендированных клеток переносили в новый 96-луночный блок и объединяли с 20 мкл лизоцима из раствора куриного яичного белка (Sigma, L6876) (100 мг/мл в 50 мМ ЭДТА) для лизиса бактериальных клеток. 96-луночный блок инкубировали в течение 1 часа при 37 С для лизиса бактериальных клеток. После инкубации добавляли 220 мкл буфера для лизиса (6 М гуанидина, 20% Тритон-Х 100, 10 мМ Трис-HCL, рН 7,5), перемешивали, затем инкубировали при комнатной температуре в течение 15 минут. После инкубации в каждую лунку добавляли 20 мкл протеиназы К (NEB, 800 Ед/мл), перемешивали и инкубировали при 55°С в течение 30 минут для разложения белков. Затем клеточный лизат переносили в 96-луночный планшет для связывания (Promega, A2278) и центрифугировали при 4700 об/мин в течение 5 минут. Фильтрат отбрасывали, выполняли три промывки колонок связывающей пластины центрифугированием 750 мкл промывочного раствора для колонки (Promega, A1318) при 4700 об/мин в течение 1 минуты и 30 секунд, отбрасывая фильтрат в конце каждого отжима. Планшет для связывания центрифугировали в течение дополнительных 10 минут при 4700 об/мин для удаления остаточного этанола. Затем под связывающую пластину помещали чистый элюирующий планшет и ДНК элюировали 200 мкл предварительно нагретой (55°С) водой, свободной от нуклеаз (Promega, PI 195).
[0502] ДНК подвергали скринингу на наличие генов токсинов (α, β, ε и ι), специфичных для C. perfringens, с использованием полимеразной цепной реакции (ПЦР). Амплификацию генов токсинов проводили с использованием мультиплексной ПЦР, содержащей четыре набора праймеров (Yoo и др., 1997) (Таблица 1). Смесь для ПЦР содержала 2,5 мкл 10-кратного ПЦР-буфера, 2 мкл 50 мМ MgCl2, 0,5 мМ каждого праймера (Таблца 1), 0,1 мкл Taq ДНК-полимеразы Invitrogen™ Platinum™, 2,5 мкл ДНК, добавляли стерильную воду до достижения 25 мкл общего реакционного объема. Смесь выдерживали 5 минут при 94°С, затем осуществляли 30 циклов при 94°С в течение 1 минуты, 55°С в течение 1 минуты, 72°С в течение 1 минуты с окончательным удлинением в течение 3 минут при 72°С. Для определения того, была ли достигнута амплификация, наблюдали продукты ПЦР с использованием анализатора фрагментов (Advanced Analytics). Если был обнаружен один или несколько генов токсинов, проводили идентификацию типа токсина в отношении каждого изолята на основании их профиля гена токсина (Songer, 1996). Соотношение положительных в отношении токсинов C. perfringens к общему количеству изолятов клостридий использовали для расчёта предполагаемого количества C. perfringens на основе общего количества клостридий.
[0503] Уникальные штамм-специфические генетические отпечатки получали с использованием анализа случайной амплификации полиморфной ДНК (RAPD) на отдельных изолятах для определения разнообразия фекальных изолятов C. perfringens. ПЦР содержала 5 мкл ДНК, 2,5 мкл RAPD-праймера 2 (10 пМ) (Таблица 1) и 17,5 мкл стерильной воды, которую добавляли в готовую аналитическую бусину RAPD (Life Sciences, 27-9500- 01). Смесь выдерживали 5 минут при 95°С, затем осуществляли 45 циклов при 95°С в течение 1 минуты, 36°С в течение 1 минуты, 72°С в течение 2 минут с окончательным удлинением в течение 5 минут при 72°С. Продукты ПЦР наблюдали на анализаторе фрагментов (Advanced Analytics) для определения характера амплификации и импортировали для анализа в BioNumerics, программное обеспечение для биоинформатики. Паттерны RAPD сравнивали с помощью метода корреляционного анализа по Дайсу на основе полос, чтобы определить сходство между паттернами RAPD, как способа мониторинга различий между изолятами.
[0504] Антимикробный скрининг проводили на изолятах C perfringens, полученных из образцов жвачных животных, для определения эффективности противомикробного бактериоцина, продуцируемого идентифицированными авторами штаммами Bacillus 747, 1104, 1541, 1781 и 2018. Бактериоцин собирали путём выращивания каждого штамма при 32°C в инкубаторе со встряхиванием при 150 об/мин в течение 24 часов в бульоне с сердечномозговым экстрактом (BHI). После инкубации выполняли перенос 1% 24-часовой культуры в свежий бульон BHI. Затем Bacillus инкубировали в течение 36-48 часов в инкубаторе со встряхиванием при 32°C при 150 об/мин. Затем культуру центрифугировали при 14000×g в течение 20 минут, затем супернатант отфильтровали через фильтр 0,2 мкм для удаления остаточных клеток.
[0505] Анализ мутности бактериоцина проводили путём выращивания штаммов C. perfringens, выделенных из образцов фекалий жвачных животных, в RCM в течение 24 часов, анаэробно, при 37°C. Ночную культуру (1%) переносили в стерильную RCM и сразу использовали в анализе. Каждый изолят C. perfringens помещали в по меньшей мере шесть лунок стерильного 48-луночного реакционного планшета, добавляли 600 мкл инокулированной культуры (положительный контроль), 600 мкл инокулированного RCM + 70 мкл бактериоцина (747, 1104, 1541, 1781 и 2018) и 670 мкл RCM (неинокулированный, отрицательный контроль). Планшеты инкубировали анаэробно при 37°С в течение 24 часов, затем считывали с использованием спектрофотометра BioTek Epoch Microplate, считывание проводили на длине волны 600 нм. Показания оптической плотности из отрицательных контролей вычитали из всех показаний OD, и процент ингибирования рассчитывали, используя данные положительного контроля и каждой обработки бактериоцином.
[0506] Для дентификации клостридий, у которых не было по меньшей мере одного гена токсина, специфичного для C. perfringens, проводили реакцию ПЦР ДНК изолята для амплификации 16S-области рДНК с использованием праймеров 27F-YM и 1492R-Y (Таблица 1). Это было сделано на 20% изолятов, которые не содержали гены токсинов, специфичные для C. perfringens. Смесь для ПЦР содержала 5 мкл 10Х ПЦР-буфера, 2 мкл 50 мМ MgCl2, 1 мкл 50 мМ dNTP, 0,4 пМ каждого праймера (Таблица 1), 0,2 мкл ДНК-полимеразы Taq Invitrogen ™ Platinum ™, 5 мкл ДНК и стерильную воду добавляли до достижения 50 мкл общего реакционного объёма. Смесь выдерживали 4 минуты при 95°С, затем осуществляли 35 циклов при 95°С в течение 30 секунд, 50°С в течение 30 секунд, 72°С в течение 2 минут с окончательным удлинением в течение 7 минут при 72°С. Проводили проверку качества амплификации, и продукт ПЦР отправляли в Genewiz (https://www.genewiz.com) для получения последовательностей для генов 16S. Последовательности сравнивали с известными типизированными бактериальными штаммами, полученными из электронной онлайн базы данных EZbiocloud (http://www.ezbiocloud.net/). На основании сравнений этих последовательностей изолятам присваивали бактериальную идентификацию.
[0507] Результаты: 339 образцов фекалий были собраны из 9 северо-восточных региональных ферм (Мэн, Вермонт и Нью-Йорк), из которых было выделено 3252 предполагаемых изолятов клостридий в качестве представителей клостридиального разнообразия в северо-восточном регионе (Таблица 17).
[0508] Результаты подсчета клостридий показали, что средний уровень клостридий КОЕ/г во всех образцах телят составляет 466 000 КОЕ/г с отдельными образцами фекалий в диапазоне от 25 до 1 250 000 КОЕ/г. В то время как средний уровень клостридий КОЕ/г во всех образцах фекалий коров составлял 18 200 КОЕ/г с отдельными образцами фекалий в диапазоне от 5 до 3 540 000 КОЕ/г (Фиг. 62). Как оказалось, уровни клостридий варьируют как у телят (Фиг. 63), так и у коров (Фиг. 64).
[0509] Результаты подсчета C. perfringens показали, что средний уровень C. perfringens в КОЕ/г для всех образцов телят составляет 311 000 КОЕ/г с отдельными образцами в диапазоне от <10 до 3 540 000 КОЕ/г. В то время как средний уровень C. perfringens в КОЕ/г во всех образцах фекалий коров составлял 16 700 КОЕ/г с отдельными образцами в диапазоне от <10 до 3 540 000 КОЕ/г (Фиг. 65). Как оказалось, уровни клостридий варьируют как у телят (Фиг. 66), так и у коров (Фиг. 67).
[0510] Анализ результатов мультиплексной ПЦР в отношении токсинов показал, которые изоляты содержали гены токсинов, специфичные для C. perfringens. В общей сложности 3252 предполагаемых изолята клостридий из образцов фекалий были протестированы на указанные гены токсинов C. perfringens. Из 3 252 скринированных изолятов клостридий 1795 изолятов (55,2%) дали положительный результат по крайней мере на 1 ген токсина. Из 1795 изолятов, положительных по гену токсина, 1687 (94%) были идентифицированы как тип A (только токсин α), однако токсины β, ε и ι также были обнаружены в фекальных изолятах клостридий.
[0511] Генетические паттерны отпечатков RAPD показали разнообразие среди 1619 изолятов, которые были успешно амплифицированы. Испытанные изоляты собирали из фекалий телят, коров и из корма и не группировались строго в зависимости от типа пробы или фермы. Изоляты сформировали 361 кластер на основе 75% сходства в соответствии с методом корреляции по Дайсу. Самый большой кластер состоял из 82 изолятов (5,1%) и состоял из изолятов нескольких ферм.
[0512] Данные дендрограммы RAPD собирали для получения разнообразия популяции C. perfringens из этого региона и подвергали анализу ингибирования. Антимикробное тестирование с использованием анализа мутности бактериоцина показало хорошее ингибирование большинства выделенных фекальных изолятов C. perfringens с использованием бактериоцина, полученных из 747, 1104, 1541, 1781 и 2018. Бактериоцин по меньшей мере из одного из штаммов 747, 1104, 1541, 1781 и 2018 был способен на > 60% ингибировать рост 342 из 412 протестированных изолятов, что в целом составило 84,6% ингибирования популяции C. perfringens на основе дендрограммы (Таблица 18).
[0513] Было обнаружено, что из 3252 выделенных изолятов 1457 изолятов (44,8%) были нетоксикогенными клостридиями. Данные секвенирования (n = 181) нетоксикогенных клостридий продемонстрировали две доминирующие группы клостридий: группу Clostridium bifermentans (Paraclostridium bifermentans и P. benzoelyticum) и группу Clostridium beijerinckii (C. diolis, C. beijerinckii, C. chromiireducens, C. saccharoperbutylacetonicum, C. puniceum и C. saccharobutylicum), две основные группы нетоксикогенной группы клостридий составляли 53,6% нетоксикогенных изолятов (Фиг. 68).
[0514] Обсуждение: образцы фекалий использовали в качестве наиболее легкодоступного типа образцов для оценки уровня и получения изолятов клостридий и C. perfringens в пищеварительной системе жвачных животных. Из 339 образцов фекалий, собранных по всему северо-восточному региону, все образцы имели детектируемые уровни клостридий. Большинство собранных изолятов (55,2%) образцов жвачных, содержали ген токсина, специфичный для C. perfringens. C. perfringens был обнаружен в 90% образцов фекалий коровы и в 70% образцов фекалий телят. Большое количество клостридий и C. perfringens указывает на риск возникновения подострой проблемы, связанной с кишечной клостридией, у большинства жвачных животных в северо-восточном регионе. Изоляты C. perfringens были разнообразны в соответствии с генетическими отпечатками RAPD, но не были специфичными для типа образца или фермы. Разнообразные представители C. perfringens в основном ингибировались (> 60%) по меньшей мере одним бактериоцином из следующих штаммов 747, 1104, 1541, 1781 или 2018. Из 412 протестированных изолятов 342 изолята ингибировались более чем на 60% по меньшей мере один из штаммов, что даёт ингибирование 84,6% от общей популяции C. perfringens на основе данных кластеров на дендрограмме RAPD. Это указывает на то, что штаммы Bacillus 747, 1104, 1541, 1781 и 2018 могут ингибировать широкий спектр разнообразия изолятов C. perfringens. Штаммы Bacillus не ограничиваются конкретным штаммом(ами) клостридий, на подобии вакцины, в которой могут отсутствовать большие группы популяций клостридий на основе генетического разнообразия, наблюдаемого в дендрограмме RAPD. Секвенирование ДНК нетоксикогенных клостридий выявило две основные характеристики видов Clostridium: группу C. bifermentans, которая, как известно, производит 1,3-пропандиол (Leja и др., 2014; Myszka и др., 2012) и группу C. beijerinckii, которая, как известно, производит бутанол и ацетон (Hou и др., 2017). Продукция конечных продуктов метаболизма этих видов может оказывать влияние на рубец, снижая такие показатели производительности, как производство молока у молочной коровы. Высокий уровень ингибирования в отношении изолятов C. perfringens in vitro указывает на потенциальный механизм действия штаммов Bacillus 747, 1104, 1541, 1781 и 2018.
[0515] Штаммы Bacillus оказывают профилактическое действие на популяции клостридий, которые могут не только повышать эффективность рубца, приводя к увеличению молочной продуктивности, но и предотвращать острые уровни C. perfringens, снижая риск смерти от проблем, связанных с пищеварением. Высокая распространенность клостридий и C. perfringens в собранных пробах фекалий свидетельствует о возможностях повышения эффективности у многих жвачных животных в северо-восточном регионе. В этом примере показано разнообразие изолятов клостридий из фекалий жвачных животных и образцов кормов, собранных в северо-восточном регионе. Протестированные штаммы Bacillus 747, 1104, 1541, 1781 и 2018 могут ингибировать большую часть разнообразия клостридий, наблюдаемого в северо-восточном регионе. Продукт в соответствии с этим вариантом осуществления настоящего изобретения может ингибировать токсикогенные клостридии, выделенные от жвачных животных на северо-востоке, что указывает на повышение эффективности рубца при скармливании молочным коровам в качестве пробиотика.
[0516] Таблица 17. Фекальные пробы (339) собирали из северо-восточных региональных молочных хозяйств, разделенных по ферме (9) и возрасту (корова или теленок), подсчитывали количество клостридий, тестировали на C. perfringens, изоляты генотипировали и тестировали на ингибирование.
[0517] Таблица 18: Результаты анализа бактериоцина, показывающие каждый протестированный изолят и источник этого изолята, выделенного из северо-восточных региональных образцов фекалий. Ингибирование рассчитывали на основе процента роста для каждой обработанной лунки по сравнению с положительным контролем.
[0518] Пример 10. Отбор штаммов Bacillus для ингибирования Clostridium perfringens и нетоксикогенных Clostridia, выделенных из образцов фекалий жвачных животных (Среднеатлантические штаты).
[0519] Введение: Clostridium - это род грамположительных, спорообразующих бактерий, которые являются частыми обитателями желудочно-кишечного тракта. Ряд видов Clostridium связывают с кишечными заболеваниями у жвачных, включая геморрагический синдром кишечника (ГСК), заболевание, часто коррелирующее с повышенным уровнем Clostridium perfringens типа А. В то время как большинство кишечных заболеваний, вызываемых клостридиями, являются острыми и встречаются спорадически в стадах, в общем, прогноз плохой, и первым признаком болезни может быть смерть. Основываясь на недавних результатах, проблемы с подострой кишечной клостридией могут быть более распространенной проблемой, чем острые проблемы. Из-за низкого показателя успешности лечения острых заболеваний необходимо делать акцент на профилактических мерах.
[0520] Цель этого исследования состояла в том, чтобы охарактеризовать распределение и разнообразие клостридий у жвачных животных и обеспечить ингибирование этих изолятов с использованием новых штаммов Bacillus в качестве метода контроля популяций клостридий.
[0521] Материалы и методы. Образцы фекалий (186) от коров, нетелей и телят, собранные на 6 фермах в Среднеатлантическом регионе, разводили стерильным пептоном 1:10, подвергали тепловому шоку в течение 30 минут при 60°C, подсчитывали в стерильном пептон и высевали на агар с триптозосульфит-циклосерином (TSC) с D-циклосерином (400 мг/л) для отбора видов клостридий. Чашки с агаром инкубировали при 37°С анаэробно в течение 24 часов. Если присутствовали изолированные сульфитредуцирующие колонии, их подсчитывали как общее количество клостридий (КОЕ/г) и репрезентативные изоляты отбирали в среду Reinforced Сlostridia Medium (RCM) (Oxoid, CM0149) и инкубировали анаэробно в течение 24 часов при 37°C. Через 24 часа инкубации культуры (10%) переносили в бульон с сердечномозговым экстрактов (BHI) (BD, 211059) и инкубировали анаэробно в течение 24 часов при 37°С.
[0522] Экстракцию ДНК проводили в 96-луночных блоках, содержащих 500 мкл предполагаемой культуры клостридий на лунку. Клетки собирали центрифугированием при 4700 об/мин в течение 10 минут, супернатант удаляли. Клетки ресуспендировали в 500 мкл 50 мМ ЭДТА-2Na (рН = 8,0). Аликвоты 300 мкл суспендированных клеток переносили в новый 96-луночный блок и объединяли с 20 мкл лизоцима из раствора куриного яичного белка (Sigma, L6876) (100 мг/мл в 50 мМ ЭДТА) для лизиса бактериальных клеток. 96-луночный блок инкубировали в течение 1 часа при 37°С для лизиса бактериальных клеток. После инкубации добавляли 220 мкл буфера для лизиса (6 М гуанидина, 20% Тритон-Х 100, 10 мМ Трис-HCL, рН 7,5), перемешивали, затем инкубировали при комнатной температуре в течение 15 минут. После инкубации в каждую лунку добавляли 20 мкл протеиназы К (NEB, 800 Ед/мл), перемешивали и инкубировали при 55°С в течение 30 минут для разложения белков. Затем клеточный лизат переносили в 96-луночный планшет для связывания (Promega, A2278) и центрифугировали при 4700 об/мин в течение 5 минут. Фильтрат отбрасывали, выполняли три промывки колонок связывающей пластины центрифугированием 750 мкл промывочного раствора для колонки (Promega, A1318) при 4700 об/мин в течение 1 минуты и 30 секунд, отбрасывая фильтрат в конце каждого отжима. Планшет для связывания центрифугировали в течение дополнительных 10 минут при 4700 об/мин для удаления остаточного этанола. Затем под связывающую пластину помещали чистый элюирующий планшет и ДНК элюировали 200 мкл предварительно нагретой (55°С) водой, свободной от нуклеаз (Promega, PI 195).
[0523] ДНК подвергали скринингу на наличие генов токсина (α, β, ε и ι), специфичных для C. perfringens, с использованием полимеразной цепной реакции (ПЦР). Амплификацию генов токсинов проводили с использованием мультиплексной ПЦР, содержащей четыре набора праймеров (Yoo и др., 1997) (Таблица 1.) Смесь ПЦР содержала 2,5 мкл 10Х ПЦР-буфера, 2 мкл 50 мМ MgCl2, 0,5 пМ каждого праймера (Таблица 1), 0,1 мкл Taq ДНК-полимеразы Invitrogen™ Platinum™, 2,5 мкл ДНК, стерильную воду добавляли до достижения 25 мкл общего реакционного объёма. Смесь выдерживали 5 минут при 94°С, затем осуществляли 30 циклов при 94°С в течение 1 минуты, 55°С в течение 1 минуты, 72°С в течение 1 минуты с окончательным удлинением в течение 3 минут при 72°С. Продукты ПЦР наблюдали с использованием анализатора фрагментов (Advanced Analytics), чтобы определить, была ли достигнута амплификация. Если был обнаружен один или несколько генов токсинов, то для каждого изолята проводили идентификацию типа токсина на основе их профиля гена токсина (Songer, 1996). Соотношение положительных по генам токсинов C. perfringens к общему количеству изолятов клостридий использовали для расчёта оценочного количества C. perfringens на основе общего количества клостридий.
[0524] Уникальные штамм-специфические генетические отпечатки получали с использованием анализа методом случайной амплификации полиморфной ДНК (RAPD) на отдельных изолятах для определения разнообразия среди фекальных изолятов C. perfringens. ПЦР содержала 5 мкл ДНК, 2,5 мкл RAPD-праймера 2 (10 пМ) (Таблица 1) и 17,5 мкл стерильной воды, которую добавляли в готовую аналитическую бусину RAPD (Life Sciences, 27-9500-01). Смесь выдерживали 5 минут при 95°С, затем осуществляли 45 циклов при 95°С в течение 1 минуты, 36°С в течение 1 минуты, 72°С в течение 2 минут с окончательным удлинением в течение 5 минут при 72°С. Продукты ПЦР наблюдали на анализаторе фрагментов (Advanced Analytics) для определения характера амплификации и импортировали для анализа в BioNumerics, программное обеспечение для биоинформатики. Паттерены RAPD сравнивали с помощью метода корреляционного анализа по Дайсу, основанного на исследовании полос, чтобы определить сходство паттернов RAPD как способа мониторинга различий между изолятами.
[0525] Антимикробный скрининг проводили на изолятах C. perfringens, полученных из образцов жвачных животных, для определения эффективности противомикробного бактериоцина, продуцируемого идентифицированными авторами штаммами Bacillus 747, 1104, 1541, 1781 и 2018. Бактериоцин собирали путём выращивания каждого штамма при 32°C в инкубаторе со встряхиванием при 150 об/мин в течение 24 часов в бульоне с сердечномозговым экстрактом (BHI). После инкубации выполняли перенос 1% 24-часовой культуры в свежий бульон BHI. Затем Bacillus инкубировали в течение 36-48 часов в инкубаторе со встряхиванием при 32°C при 150 об/мин. Затем культуру центрифугировали при 14000×g в течение 20 минут, затем супернатант отфильтровывали через фильтр 0,2 мкм для удаления остаточных клеток.
[0526] Анализ мутности бактериоцина проводили путём выращивания штаммов C. perfringens, выделенных из образцов фекалий жвачных животных, в RCM в течение 24 часов, анаэробно, при 37°C. Ночную культуру (1%) переносили в стерильную RCM и сразу использовали в анализе. Каждый изолят С. perfringens помещали в по меньшей мере шесть лунок в стерильный 48-луночный реакционный планшет, добавляли 600 мкл инокулированной культуры (положительный контроль), 600 мкл инокулированного RCM + 70 мкл бактериоцина (747, 1104, 1541, 1781 и 2018) и 670 мкл RCM (без инокуляции, отрицательный контроль). Планшеты инкубировали анаэробно при 37°С в течение 24 часов, затем считывали с использованием спектрофотометра BioTek Epoch Microplate, показания снимали при длине волны 600 нм. Показания оптической плотности из отрицательных контролей вычитали из всех показаний OD, и процент ингибирования рассчитывали, используя положительный контроль и каждую обработку бактериоцином.
[0527] Для идентификации клостридий, у которых не было по меньшей мере одного гена токсина, специфичного для C. perfringens, проводили реакцию ПЦР на ДНК изолята для амплификации 16S-области рДНК с использованием праймеров 27F-YM и 1492R-Y (Таблица 1), Это было сделано на 20% изолятов, которые не содержали гены токсинов, специфичные для C. perfringens. Смесь для ПЦР содержала 5 мкл 10Х ПЦР-буфера, 2 мкл 50 мМ MgCl2, 1 мкл 50 мМ dNTP, 0,4 пМ каждого праймера (Таблица 1), 0,2 мкл Taq ДНК-полимеразы Invitrogen™ Platinum™, 5 мкл ДНК и стерильную воду добавляли до достижения 50 мкл общего реакционного объёма. Смесь выдерживали 4 минуты при 95°С, затем осуществляли 35 циклов при 95°С в течение 30 секунд, 50°С в течение 30 секунд, 72°С в течение 2 минут с окончательным удлинением в 7 минут при 72°С. Проводили проверку качества амплификации, и продукт ПЦР отправляли в Genewiz (https://www.genewiz.com) для получения последовательностей генов 16S. Последовательности сравнивали с известными типизированными бактериальными штаммами, полученными из электронной онлайн базы данных EZbiocloud (http://www.ezbiocloud.net/). На основании сравнений этих последовательностей изолятам приписывали бактериальную идентификацию.
[0528] Результаты: 186 образцов фекалий были собраны в 6 молочных фермах Среднеатлантического региона (Пенсильвания и Вирджиния), из которых было выделено 2026 предполагаемых изолятов клостридий в качестве представителей клостридиального разнообразия в молочных фермах Среднеатлантического региона (Таблица 19).
[0529] Результаты подсчета клостридий показали, что средний уровень клостридий КОЕ/г во всех образцах телят составляет 58 500 КОЕ/г c отдельными образцами фекалий в диапазоне от 35 до 615 000 КОЕ/г. В то время как средний уровень клостридий КОЕ/г во всех образцах фекалий коров составлял 2570 КОЕ/г, с отдельными образцами фекалий - от 20 до 147 000 КОЕ/г (Фиг. 69). Как оказалось, уровни клостридий варьируют как у телят (Фиг. 70), так и у коров (Фиг. 71).
[0530] Результаты подсчета C. perfringens показали, что средний уровень C. perfringens в КОЕ/г для всех образцов телят составляет 1100 КОЕ/г с отдельными образцами в диапазоне от <10 до 5640 КОЕ/г. В то время как средний уровень C. perfringens в КОЕ/г во всех образцах фекалий коров составлял 1430 КОЕ/г с отдельными образцами в диапазоне от <10 до 87 900 КОЕ/г (Фиг. 72). Как оказалось, уровни клостридий варьируют как у телят (Фиг. 73), так и у коров (Фиг. 74).
[0531] Анализ результатов мультиплексной ПЦР в отношении токсинов показал, коакие изоляты содержали гены токсинов, специфичные для C. perfringens. В общей сложности 2026 предполагаемых изолятов клостридий из образцов фекалий в среднеатлантическом регионе протестировали на указанные гены токсинов C. perfringens. Из 2026 скринированных изолятов клостридий 649 изолятов (32%) дали положительный результат по крайней мере на 1 ген токсина. Из 649 токсин-положительных изолятов 630 (97,1%) были идентифицированы как тип А (только токсин α), однако в изолятах клостридий также были обнаружены токсины β, ε и ι.
[0532] Генетические паттерны отпечатков RAPD показали разнообразие среди 582 изолятов, которые были успешно амплифицированы. Испытанные изоляты собирали из фекалий теленка, коров и из корма и не группировались строго в зависимости от типа пробы или фермы. Изоляты сформировали 85 кластеров на основе 75% сходства в соответствии с методом корреляции по Дайсу. Самый большой кластер состоял из 55 изолятов (9,5%) и имел индекс разветвленности Шеннона 4,07.
[0533] Данные дендрограммы RAPD собирали для определения разнообразия популяции C. perfringens из этого региона и подвергали анализу на ингибирование. Антимикробное тестирование с использованием анализа мутности бактериоцина показало хорошее ингибирование большинства выделенных фекальных изолятов C. perfringens с использованием бактериоцинов, полученных из 747, 1104, 1541, 1781 и 2018. Бактериоцин по меньшей мере из одного из штаммов 747, 1104, 1541, 1781, и 2018 был способен ингибировать на > 60% рост 103 протестированных изолятов из 129, что в целом составило 85,9% ингибирования популяции C. perfringens на основе дендрограммы (Таблица 20).
[0534] Было обнаружено, что из собранных 2026 изолятов 1377 изолятов (68%) были нетоксикогенными клостридиями. Данные секвенирования (n = 151) нетоксикогенных клостридий показали одну доминирующую группу клостридий, группу Clostridium bifermentans (Paraclostridium bifermentans и P. benzoelyticum). Clostridium bifermentans составляли 51,5% нетоксикогенных изолятов (Фиг. 75).
[0535] Обсуждение: образцы фекалий использовали в качестве наиболее легкодоступного типа образцов для оценки уровня и получения изолятов клостридий и C. perfringens в пищеварительной системе жвачных животных. Из 186 образцов фекалий, собранных по всему Среднеатлантическому региону, все образцы имели детектируемые уровни клостридий. Многие собранные изоляты (649 изолятов) из образцов жвачных животных содержали гены токсинов, специфичных для C. perfringens. C. perfringens был обнаружен в 72% образцов фекалий коров и в 50% образцов фекалий телят. Высокий уровень клостридий и C. perfringens указывает на риск возникновения подострых кишечных заболеваний, вызванных клостридиями, у большинства жвачных животных во всём Среднеатлантическом регионе. Изоляты C. perfringens были разнообразными в соответствии с генетическими отпечатками RAPD, но не были специфичными для типа образца или фермы. Разнообразные представители C. perfringens в основном ингибировались (> 60%) по меньшей мере одним бактериоцином из следующих штаммов 747, 1104, 1541, 1781 или 2018. Из 129 протестированных изолятов 103 изолята ингибировались более чем на 60% по меньшей мере одним из штаммов, что представляет собой ингибирование 85,9% от общей популяции C. perfringens на основе представления, полученного из анализа кластеров на дендрограмме RAPD. Это указывает на то, что штаммы Bacillus 747, 1104, 1541, 1781 и 2018 могут ингибировать широкий спектр разнообразия изолятов C. perfringens. Штаммы Bacillus не ограничиваются конкретным штаммом(ами) клостридий, наподобии вакцины, в которой могут отсутствовать большие группы популяций клостридий на основе генетического разнообразия, наблюдаемого в дендрограмме RAPD. Секвенирование ДНК нетоксикогенных клостридий выявило одну главную группу видов Clostridium: группу C. bifermentans, которая, как известно, продуцирует 1,3-пропандиол (Leja и др., 2014; Myszka идр., 2012). Высокий уровень ингибирования изолятов C. perfringensin vitro указывает на потенциальный механизм действия штаммов Bacillus 747, 1104, 1541, 1781 и 2018.
[0536] Штаммы Bacillus оказывают профилактическое действие на популяции клостридий, которые могут не только повышать эффективность рубца, приводя к увеличению молочной продуктивности, но и предотвращать острые уровни C. perfringens, снижая риск смерти от проблем, связанных с пищеварением. Высокий уровень распространенности клостридий и C. perfringens в собранных пробах фекалий свидетельствует о возможностях повышения эффективности у многих жвачных животных во всем Среднеатлантическом регионе. В этом примере показано разнообразие изолятов клостридий из фекалий жвачных животных и образцов кормов, собранных в Среднеатлантическом регионе. Протестированные штаммы Bacillus 747, 1104, 1541, 1781 и 2018 были способны ингибировать большую часть разнообразия клостридий, наблюдаемого в. Продукт в соответствии с этим вариантом осуществления настоящего изобретения был способен ингибировать токсикогенные клостридии, выделенные от жвачных животных в Среднеатлантическом регионе, что указывает на преимущество в повышении эффективности рубца при скармливании молочным коровам в качестве пробиотика.
[0537] Таблица 19. Образцы фекалий (186) собирали из молочных ферм Среднеатлантического региона, разделенных по ферме (6) и возрасту (корова или теленок), в них подсчитывали уровень клостридий, тестировали на C. perfringens, изоляты были генотипировали и тестировали на ингибирование.
[0538] Таблица 20. Результаты анализа бактериоцина, показывающие каждый протестированный изолят и источник этого изолята, выделенного из фекальных образцов в Среднеатлантическом регионе. Ингибирование рассчитывали на основе процента роста для каждой лунки после обработки по сравнению с положительным контролем.
[0539] Пример 11. Отбор штаммов Bacillus для ингибирования Clostridium perfringens и нетоксикогенных клостридий, выделенных из образцов фекалий жвачных животных (коридор межштатной магистрали I-29)
[0540] Введение: Clostridium - это род грамположительных, спорообразующих бактерий, которые являются обычными резидентами желудочно-кишечного тракта. Ряд видов Clostridium связывают с кишечными заболеваниями у жвачных животных, включая геморрагический синдром кишечника (ГСК), заболевание, часто коррелирующее с повышенным уровнем Clostridium perfringens типа А. В то время как большинство кишечных заболеваний, вызванных клостридиями, являются острыми и встречаются спорадически в стадах, в общем, прогноз плохой, и первым признаком болезни может быть смерть. Основываясь на недавних результатах, проблемы с подострой кишечной клостридией могут быть более распространенной проблемой, чем острые проблемы. Из-за низкого показателя успешности лечения острых заболеваний необходимо делать акцент на профилактических мерах.
[0541] Цель этого исследования состояла в том, чтобы охарактеризовать распределение и разнообразие клостридий у жвачных животных и обеспечить ингибирование этих изолятов с использованием новых штаммов Bacillus в качестве метода контроля популяций клостридий.
[0542] Материалы и методы. Образцы фекалий (411) от коров, нетелей и телят, собранные на 8 фермах в коридоре I-29, разбавляли стерильным пептоном 1:10, подвергали тепловому шоку в течение 30 минут при 60°C, подсчитывали в стерильном пептоне и высевали на агар с триптозо-сульфит-циклосерином (TSC) с D-циклосерином (400 мг/л) для отбора видов клостридий. Чашки с агаром инкубировали при 37°С анаэробно в течение 24 часов. Если изолированные сульфитредуцирующие колонии присутствовали, их подсчитывали как общее количество клостридий (КОЕ/г) и репрезентативные изоляты отбирали в среду Reinforced Clostridia Medium (RCM) (Oxoid, CM0149) и инкубировали анаэробно в течение 24 часов при 37°C. Через 24 часа инкубации культуры (10%) переносили в бульон с сердечномозговым экстрактом (BHI) (BD, 211059) и инкубировали анаэробно в течение 24 часов при 37°С.
[0543] Экстракцию ДНК проводили в 96-луночных блоках, содержащих 500 мкл предполагаемой культуры клостридий на лунку. Клетки собирали центрифугированием при 4700 об/мин в течение 10 минут, супернатант удаляли. Клетки ресуспендировали в 500 мкл 50 мМ ЭДТА-2Na (рН = 8,0). Аликвоты 300 мкл суспендированных клеток переносили в новый 96-луночный блок и объединяли с 20 мкл лизоцима из раствора куриного яичного белка (Sigma, L6876) (100 мг/мл в 50 мМ ЭДТА) для лизиса бактериальных клеток. 96-луночный блок инкубировали в течение 1 часа при 37°С для лизиса бактериальных клеток. После инкубации добавляли 220 мкл буфера для лизиса (6 М гуанидина, 20% Тритон-Х 100, 10 мМ Трис-HCL, рН 7,5), перемешивали, затем инкубировали при комнатной температуре в течение 15 минут. После инкубации в каждую лунку добавляли 20 мкл протеиназы К (NEB, 800 Ед/мл), перемешивали и инкубировали при 55°С в течение 30 минут для разложения белков. Затем клеточный лизат переносили в 96-луночный планшет для связывания (Promega, A2278) и центрифугировали при 4700 об/мин в течение 5 минут. Фильтрат отбрасывали, три промывки колонок связывающей пластины выполняли центрифугированием 750 мкл промывочного раствора для колонки (Promega, A1318) при 4700 об/мин в течение 1 минуты и 30 секунд, отбрасывая фильтрат в конце каждого отжима. Планшет для связывания центрифугировали в течение дополнительных 10 минут при 4700 об/мин для удаления остаточного этанола. Затем под связывающую пластину помещали чистый элюирующий планшет и ДНК элюировали 200 мкл предварительно нагретой (55°С) водой, свободной от нуклеаз (Promega, PI 195).
[0544] Проводили скрининг ДНК на гены токсинов (α, β, ε и ι), специфичные для C. perfringens, с помощью полимеразной цепной реакции (ПЦР). Амплификацию генов токсинов проводили с использованием мультиплексной ПЦР, содержащей четыре набора праймеров (Yoo и др., 1997) (Таблица 1.) Смесь ПЦР содержала 2,5 мкл 10Х ПЦР-буфера, 2 мкл 50 мМ MgCl2, 0,5 пМ каждого праймера (Таблица 1), 0,1 мкл Taq ДНК-полимеразы Invitrogen™ Platinum™, 2,5 мкл ДНК, стерильную воду добавляли до достижения 25 мкл общего реакционного объёма. Смесь выдерживали 5 минут при 94°С, затем осуществляли 30 циклов при 94°С в течение 1 минуты, 55°С в течение 1 минуты, 72°С в течение 1 минуты с окончательным удлинением в течение 3 минут при 72°С. Продукты ПЦР наблюдали с использованием анализатора фрагментов (Advanced Analytics), чтобы определить, была ли достигнута амплификация. Если был обнаружен один или несколько генов токсина, то каждому изоляту приписывали идентификацию типа токсина на основе их профиля гена токсина (Songer, 1996). Соотношение положительных по генам токсинов C. perfringens к общему количеству изолятов клостридий использовали для расчта оценочного количества C. perfringens на основе общего количества клостридий.
[0545] Уникальные штамм-специфические генетические отпечатки получали с использованием анализа методом случайной амплификации полиморфной ДНК (RAPD) на отдельных изолятах для определения разнообразия фекальных изолятов C. perfringens. ПЦР содержала 5 мкл ДНК, 2,5 мкл RAPD-праймера 2 (10 пМ) (Таблица 1) и 17,5 мкл стерильной воды, которую добавляли в готовую аналитическую бусину RAPD (Life Sciences, 27-9500-01). Смесь выдерживали 5 минут при 95°С, затем осуществляли 45 циклов при 95°С в течение 1 минуты, 36°С в течение 1 минуты, 72°С в течение 2 минут с окончательным удлинением в течние 5 минут при 72°С. Продукты ПЦР наблюдали на анализаторе фрагментов (Advanced Analytics) для определения характера амплификации и импортировали для анализа в BioNumerics, программное обеспечение для биоинформатики. Паттерны RAPD сравнивали с помощью метода корреляционного анализа по Дайсу на основе полос, чтобы определить сходство между паттернами RAPD, как способа мониторинга различий между изолятами.
[0546] Антимикробный скрининг проводили на изолятах C. perfringens, полученных из образцов жвачных животных, для оценки эффективности противомикробного бактериоцина, продуцируемого идентифицированными авторами штаммами Bacillus 747, 1104, 1541, 1781 и 2018. Бактериоцин собирали путём выращивания каждого штамма при 32°C в инкубаторе со встряхиванием при 150 об/мин в течение 24 часов в бульоне с сердечномозговым экстрактом (BHI). После инкубации выполняли перенос 1% 24-часовой культуры в свежий бульон BHI. Затем Bacillus инкубировали в течение 36-48 часов в инкубаторе со встряхиванием при 32°C при 150 об/мин. Затем культуру центрифугировали при 14000 × g в течение 20 минут, затем супернатант фильтровали через фильтр 0,2 мкм для удаления любых остаточных клеток.
[0547] Анализ мутности бактериоцина проводили путём выращивания штаммов C. perfringens, выделенных из образцов фекалий жвачных животных, в RCM в течение 24 часов, анаэробно, при 37°C. Ночную культуру (1%) переносили в стерильную RCM и сразу использовали в анализе. Каждый изолят С. perfringens помещали в по меньшей мере шесть лунок стерильного 48-луночного реакционного планшета, добавляли 600 мкл инокулированной культуры (положительный контроль), 600 мкл инокулированного RCM + 70 мкл бактериоцина (747, 1104, 1541, 1781 и 2018) и 670 мкл RCM (неинокулированный, отрицательный контроль). Планшеты инкубировали анаэробно при 37°С в течение 24 часов, затем считывали с использованием спектрофотометра BioTek Epoch Microplate, показания снимали на длине волны 600 нм. Показания оптической плотности из отрицательных контролей вычитали из всех показаний OD, и процент ингибирования рассчитывали, используя положительный контроль и каждую обработку бактериоцином.
[0548] Для выявления клостридий, у которых не было по меньшей мере одного гена токсина, специфичного для C. perfringens, проводили реакцию ПЦР с ДНК изолята для амплификации 16S-области рДНК с использованием праймеров 27F-YM и 1492R-Y (Таблица 1). Это было сделано на 20% изолятов, которые не содержали гены токсина, специфичного к C. perfringens. Смесь для ПЦР содержала 5 мкл 10Х ПЦР-буфера, 2 мкл 50 мМ MgCl2, 1 мкл 50 мМ dNTP, 0,4 пМ каждого праймера (Таблица 1), 0,2 мкл Taq ДНК-полимеразы Invitrogen™ Platinum™, 5 мкл ДНК и стерильную воду добавляли до достижения 50 мкл общего реакционного объёма. Смесь выдерживали 4 минуты при 95°С, затем осуществляли 35 циклов при 95°С в течение 30 секунд, 50°С в течение 30 секунд, 72°С в течение 2 минут с окончательным удлинением в течение 7 минут при 72°С. Проводили проверку качества амплификации, и продукт ПЦР отправляли в Genewiz (https://www.genewiz.com) для получения последовательностей для генов 16S. Последовательности сравнивали с известными типизированными бактериальными штаммами, полученными из электронной онлайн базы данных EZbiocloud (http://www.ezbiocloud.net/). На основании сравнений этих последовательностей изолятам приписывали бактериальную идентификацию.
[0549] Результаты: образцы фекалий, 411, собирали в восьми региональных фермерских хозяйствах I-29 (Миннесота, Южная Дакота и Айова), из которых был выделен 3471 предполагаемый изолят клостридий в качестве представителей клостридиального разнообразия в коридоре I-29 (Таблица 21).
[0550] Результаты подсчёта клостридий показали, что средний уровень клостридий в КОЕ/г во всех образцах фекалий телят составлял 270 000 КОЕ/г с отдельными образцами фекалий в диапазоне от <10 до 7 020 000 КОЕ/г. В то время как средний уровень клостридий в КОЕ/г во всех образцах фекалий коров составлял 38 100 КОЕ/г, с отдельными образцами фекалий от 5 до 6 970 000 КОЕ/г (Фиг. 76). Как оказалось, уровни клостридий варьируют как у телят (Фиг. 77), так и коров (Фиг. 78).
[0551] Результаты подсчёта C. perfringens показали, что средний уровень C. perfringens в КОЕ/г для всех образцов телят составляет 54 800 КОЕ/г с отдельными образцами в диапазоне от <10 до 764 000 КОЕ/г. В то время как средний уровень C. perfringens в КОЕ / г во всех образцах фекалий коров составлял 35 400 КОЕ/г, а в отдельных образцах - от <10 до 6 970 000 КОЕ/г (Фиг. 79). Как оказалось, уровни клостридий варьируют как у телят (Фиг. 80),так и у коров (Фиг. 81).
[0552] Показан анализ результатов мультиплексной ПЦР в отношении токсинов, в которых изоляты содержали гены токсинов, специфичных для C. perfringens. В общей сложности 3471 предполагаемый изолят клостридий из образцов фекалий был протестирован на указанные гены токсинов C. perfringens. Из 3471 изолята клостридий, прошедшего скрининг, 1549 изолятов (44,2%) дали положительный результат по крайней мере на 1 ген токсина. Из 1549 изолятов, положительных по гену токсина, 1,534 (99%) были идентифицированы как тип А (только токсин α), однако (токсины β, ε и ι также были обнаружены в изолятах клостридий).
[0553] Генетические паттерны отпечатков RAPD продемонстрировали разнообразие среди 1547 изолятов, которые были успешно амплифицированы. Испытанные изоляты собирали из фекалий теленка, коровы и изкорма и не группировали строго в зависимости от типа пробы или фермы. Изоляты сформировали 72 кластера на основе 75% сходства в соответствии с методом корреляции по Дайсу. Самый большой кластер состоял из 776 изолятов, что составило 50,2% от общей дендрограммы.
[0554] Данные дендрограммы RAPD отбирали для определения разнообразия популяции C. perfringens из этого региона и подвергали анализу ингибирования. Антимикробное тестирование с использованием анализа мутности бактериоцина показало хорошее ингибирование большинства выделенных фекальных изолятов C. perfringens с использованием бактериоцинов, полученных из 747, 1104, 1541, 1781 и 2018. Бактериоцины по меньшей мере из одного из штаммов 747, 1104, 1541, 1781 и 2018 были способны на > 60% ингибировать рост 138 из 156 протестированных изолятов, что в целом составило 92,0% ингибирования популяции C. perfringens на основе дендрограммы (Таблица 22).
[0555] Было обнаружено, что из 3443 выделенных изолятов 1922 изолята (55,8%) были нетоксикогенными клостридиями. Данные секвенирования (n = 399) нетоксикогенных клостридий демонстрировали две доминирующие группы клостридий: группу Clostridium bifermentans (Paraclostridium bifermentans и P. benzoelyticum) и группу Clostridium beijerinckii (Clostridium diolis, Clostridium beijerinckii, Clostridium chromiireducens, Clostridium saccharoperbittylacetonicum, Clostridium puniceum и Clostridium saccharobutylicum), две указанные основные группы нетоксикогенной группы клостридий составили 61,7% нетоксикогенных изолятов (Фиг. 82).
[0556] Обсуждение: образцы фекалий использовали в качестве наиболее легкодоступного типа образцов для оценки уровня и получения изолятов клостридий и C. perfringens в пищеварительной системе жвачных животных. Из 411 образцов фекалий, собранных по всему коридору I-29, все образцы имели детектируемые уровни клостридий. Многие собранные изоляты (1549 изолятов) из образцов жвачных животных содержали гены токсинов, специфичных для C. perfringens. C. perfringens был обнаружен в 76% образцов фекалий коров и в 50% образцов фекалий телят. Высокий уровень присутствия клостридий и C. perfringens указывает на риск возникновения подострой кишечной проблемы, связанной с клостридиями, у большинства жвачных животных в коридоре I-29. Изоляты C. perfringens были разнообразными в соответствии с генетическими отпечатками RAPD, но не были специфичными для типа образца или фермы. Разнообразные представители C. perfringens в основном ингибировались (> 60%) по меньшей мере одним бактериоцином из следующих штаммов 747, 1104, 1541, 1781 или 2018. Из 156 протестированных изолятов 138 изолятов ингибировались более чем на 60% по меньшей мере одним из штаммов, что представляет собой ингибирование 92,0% популяции C. perfringens на основе представления из кластеров на дендрограмме RAPD. Это указывает на то, что штаммы Bacillus 747, 1104, 1541, 1781 и 2018 могут ингибировать широкий спектр разнообразия изолятов C. perfringens. Штаммы Bacillus не ограничиваются конкретным штаммом(ами) клостридий, наподобие вакцины, в которой могут отсутствовать большие группы популяций клостридий на основе генетического разнообразия, наблюдаемого в дендрограмме RAPD. Секвенирование ДНК нетоксикогенных клостридий выявило две основные группы видов Clostridium: группу C. bifermentans, которая, как известно, производит 1,3-пропандиол (Leja и др., 2014; Myszka и др., 2012) и группу C. beijerinckii, которая, как известно, производит бутанол и ацетон (Hou и др., 2017). Продукция конечных продуктов метаболизма этих видов может оказывать влияние на рубец, снижая такие показатели производительности, как производство молока у молочной коровы.
[0557] Штаммы Bacillus оказывают профилактическое действие на популяции клостридий, которые могут не только повышать эффективность рубца, приводя к увеличению молочной продуктивности, но и предотвращать острые уровни C. perfringens, уменьшая количество случаев смерти, вызванной проблемами с пищеварением. Высокая распространенность клостридий и C. perfringens в собранных пробах фекалий свидетельствует о возможностях улучшения эффективности у многих жвачных в коридоре I-29. В этом примере показано разнообразие изолятов клостридий из фекалий жвачных животных и образцов кормов, собранных из коридора I-29. Протестированные штаммы Bacillus, 747, 1104, 1541, 1781 и 2018 могут ингибировать большую часть разнообразия клостридий, наблюдаемого в коридоре I-29. Продукт в соответствии с этим вариантом осуществления настоящего изобретения может ингибировать токсикогенную клостридию, выделенную от жвачных животных в коридоре I-29, что указывает на преимущество в эффективности рубца при скармливании молочным коровам в качестве пробиотика.
[0558] Таблица 21. Фекальные образцы 411 были собраны из молочных ферм региона коридора I-29, разделённых по ферме (8) и возрасту (корова или теленок), в них подсчитан уровень клостридий, образцы протестированы на C. perfringens, изоляты генотипированы и протестированы на ингибирование.
[0559] Таблица 22. Результаты анализа бактериоцина, показывающие каждый тестируемый изолят и источник этого изолята, выделенного из образцов фекалий или кормов региона коридора I-29. Ингибирование рассчитывали на основе процента роста для каждой лунки после обработки по сравнению с положительным контролем.
[0560] ПРИМЕР 12: Влияние комбинации штаммов Bacillus на популяции клостридий у молочных коров на ферме ALJ в Техасе
[0561] Введение. Синдром геморрагического кишечника (ГСК) впервые был описан в 1991 году и наблюдался у пяти коров голштинской породы высокой продуктивности из одной молочной фермы в Айдахо (Sockett, 2004). Симптомы включали подслизистые гематомы с точечным источником, каждая из которых поражала 10-20 см тонкой кишки. У одной из пяти коров была рваная гематома с кровотечением в просвет тонкой кишки. Хотя, как известно, Aspergillus fumigatus и Clostridium perfringens, как известно, участвуют в этиологии ГСК, этот синдром лучше описываать как полимикробный и многофакторный по своей природе. Повышенное потребление высокоэффективной энергетической диеты представляется наиболее вероятным общим путём для всех описанных факторов риска (Berghaus и др., 2005).
[0562] ГСК характеризуется внезапным снижением молочной продуктивности, болями в животе из-за обструкции кишечника и анемии (Anderson, 2002). Клиническими признаками заболевания являются снижение потребления корма, депрессия, снижение выработки молока, обезвоживание, вздутие живота и сгустки крови в фекалиях. Смерть наступает в течение 48 часов с момента начала закупорки пробкой из сгустка крови. Из-за спорадической, острой этиологии известно лишь несколько случаев излечения.
[0563] В дополнение к изолятам Clostridium нескольких видов, вызывающих кишечную болезнь, другие виды Clostridium продуцируют высокие уровни ацетона, бутанола, 1,3-пропандиола и масляной кислоты в качестве конечных продуктов их метаболизма. Если такие конечные метаболические продукты образуются в рубце, они могут влиять на функцию рубца и снижать его эффективность.
[0564] Штаммы Bacillus, выбранные авторами изобретения для ингибирования патогенов, продуцируют множество соединений, обладающих ингибирующей активностью в отношении других микробов, с множеством штаммов, содержащих более десяти оперонов, продуцирующих противогрибковые и антибактериальные соединения. Множество бактериоцинов продуцируются in vitro непосредственно в месте действия штаммов Bacillus, поэтому устойчивая смесь бактериоцинов присутствует в дозах, меньших, чем это было бы необходимо, если бы выделенные бактериоцины добавляли непосредственно в корм.
[0565] Цель этого исследования состояла в том, чтобы измерить уровни и разнообразие клостридий у молочных коров на ферме ALJ, обработанных продуктом в соответствии с этим вариантом осуществления настоящего изобретения (называемых в настоящем описании «обработанными») в течение более 110 дней.
[0566] Материалы и методы. Молочное стадо в Техасе (ферма ALJ) было выбрано для изучения влияния продукта Bacillus, в соответствии с этим вариантом осуществления настоящего изобретения, на уровни клостридий и их разнообразие. Стадо состояло из 2900 дойных коров, размещённых в сараях в саудовском стиле с засыпанным песком полом.
[0567] Продукт в соответствии с данным вариантом осуществления настоящего изобретения, представлял собой комбинированный продукт из двух штаммов Bacillus в равных пропорциях, Bacillus 747 и Bacillus 1781, включенных в общий смешанный рацион (ОСР) в дозе 2 миллиарда КОЕ на голову в сутки.
[0568] Образцы фекалий получали у 90 коров в два периода времени до лечения и у 63 коров через 110 суток после обработки.
[0569] Образцы фекалий коров разбавляли 1:10 стерильным пептоном, подвергали тепловому шоку в течение 30 минут при 60°C, подсчитывали в стерильном пептоне и высевали на агар с триптозо-сульфитным циклосерином (TSC) с D-циклосерином (400 мг/л) для выбора клостридиальных видов. Чашки с агаром инкубировали при 37°С анаэробно в течение 24 часов. Если присутствовали сульфитредуцирующие колонии, изолированные колонии подсчитывали как общее количество клостридий (КОЕ/г) и репрезентативные изоляты отбирали в среду Reinforced Clostridia Medium (RCM) (Oxoid, CM0149) и инкубировали анаэробно в течение 24 часов при 37°C. Через 24 часа инкубации культуры (10%) переносили в бульон с сердечномозговым экстрактом (BHI) (BD, 211059) и инкубировали анаэробно в течение 24 часов при 37°C.
[0570] Экстракцию ДНК проводили в 96-луночных блоках, содержащих 500 мкл предполагаемой культуры клостридий на лунку. Клетки собирали центрифугированием при 4700 об/мин в течение 10 минут, супернатант удаляли. Клетки ресуспендировали в 500 мкл 50 мМ ЭДТА-2Na (рН = 8,0). Аликвоты 300 мкл суспендированных клеток переносили в новый 96-луночный блок и объединяли с 20 мкл лизоцима из раствора куриного яичного белка (Sigma, L6876) (100 мг/мл в 50 мМ ЭДТА) для лизиса бактериальных клеток. 96-луночный блок инкубировали в течение 1 часа при 37°С для лизиса бактериальных клеток. После инкубации добавляли 220 мкл буфера для лизиса (6 М гуанидина, 20% Тритон-Х 100, 10 мМ Трис-HCL, рН 7,5), перемешивали, затем инкубировали при комнатной температуре в течение 15 минут. После инкубации в каждую лунку добавляли 20 мкл протеиназы К (NEB, 800 Ед/мл), перемешивали и инкубировали при 55°С в течение 30 минут для разложения белков. Затем клеточный лизат переносили в 96-луночный планшет для связывания (Promega, A2278) и центрифугировали при 4700 об/мин в течение 5 минут. Фильтрат отбрасывали, выполняли три промывки колонок связывающей пластины центрифугированием 750 мкл промывочного раствора для колонки (Promega, A1318) при 4700 об/мин в течение 1 минуты и 30 секунд, отбрасывая фильтрат в конце каждого отжима. Планшет для связывания центрифугировали в течение дополнительных 10 минут при 4700 об/мин для удаления остаточного этанола. Затем под связывающую пластину помещали чистый элюирующий планшет и ДНК элюировали 200 мкл предварительно нагретой (55°С) водой, свободной от нуклеаз (Promega, PI 195).
[0571] ДНК подвергали скринингу на наличие генов токсинов (α, β, εи ι), специфичных для C. perfringens, с использованием полимеразной цепной реакции (ПЦР).
Амплификацию генов токсинов проводили с использованием мультиплексной ПЦР, содержащей четыре набора праймеров (Yoo и др., 1997) (Таблица 1.) Смесь ПЦР содержала 2,5 мкл 10Х ПЦР-буфера, 2 мкл 50 мМ MgCl2, 0,5 пМ каждого праймера (Таблица 1), 0,1 мкл Taq ДНК-полимеразы Invitrogen™ Platinum™, 2,5 мкл ДНК, стерильную воду добавляли до достижения 25 мкл общего реакционного объёма. Смесь выдерживали 5 минут при 94°С, затем осуществляли 30 циклов при 94°С в течение 1 минуты, 55°С в течение 1 минуты, 72°С в течение 1 минуты с окончательным удлинением в течение 3 минут при 72°С. Продукты ПЦР наблюдали с использованием анализатора фрагментов (Advanced Analytics), чтобы определить, была ли достигнута амплификация. Если был обнаружен один или несколько генов токсина, то для каждого изолята проводили идентификацию типа токсина на основе профиля гена токсина (Songer, 1996). Соотношение положительных по токсинам C. perfringens к общему количеству изолятов клостридий использовали для расчёта оценочного количества C. perfringens на основе общего количества клостридий.
[0572] Уникальные штамм-специфические генетические отпечатки получали с использованием анализа методом случайной амплификации полиморфной ДНК (RAPD) на отдельных изолятах для определения разнообразия среди фекальных изолятов C. perfringens. ПЦР содержала 5 мкл ДНК, 2,5 мкл RAPD-праймера 2 (10 пМ) (Таблица 1) и 17,5 мкл стерильной воды, которую добавляли в готовую аналитическую бусину RAPD (Life Sciences, 27-9500-01). Смесь выдерживали 5 минут при 95°С, затем осуществляли 45 циклов при 95°С в течение 1 минуты, 36°С в течение 1 минуты, 72°С в течение 2 минут с окончательным удлинением в течение 5 минут при 72°С. Продукты ПЦР наблюдали на анализаторе фрагментов (Advanced Analytics) для определения характера амплификации и импортировали для анализа в BioNumerics, программное обеспечение для биоинформатики. Паттерны RAPD сравнивали с помощью метода корреляционного анализа по Дайсу на основе полос, чтобы определить сходство паттернов RAPD как способа мониторинга различий между изолятами. Отсечение кластеров производили при сходстве 75%.
[0573] Для выявления клостридий, у которых не было по меньшей мере одного гена токсина, специфичного для C. perfringens, проводили реакцию ПЦР ДНК изолята для амплификации 16S-области рДНК с использованием праймеров 27F-YM и 1492R-Y (Таблица 1). Это было сделано на 20% изолятов, которые не содержали гены токсинов, специфичных для C. perfringens. Смесь для ПЦР содержала 5 мкл 10X буфера для ПЦР, 2 мкл 50 мМ МgCl2, 1 мкл 50 мМ dNTP, 0,4 пМ каждого праймера (Таблица 1), 0,2 мкл Taq ДНК-полимеразы Invitrogen™ Platinum™, 5 мкл ДНК и стерильную воду добавляли до достижения 50 мкл общего реакционного объёма. Смесь выдерживали 4 минуты при 95°С, затем осуществляли 35 циклов при 95°С в течение 30 секунд, 50°С в течение 30 секунд, 72°С в течение 2 минут с окончательным удлинением в течение 7 минут при 72°С. Проводили проверку качества амплификации, и продукт ПЦР отправляли в Genewiz (https://www.genewiz.com) для получения последовательностей для генов 16S. Последовательности сравнивали со штаммами известного типа, полученными из электронной онлайн базы данных EZbiocloud (http://www.ezbiocloud.net/). На основании сравнений этих последовательностей изолятам приписывали бактериальную идентификацию.
[0574] Результаты: общее количество клостридий на ферме ALJ (Фиг. 83) существенно не отличалось от данных, полученных во время обследования в Техасе (Пример 6). За 110 дней применения препарата общее количество клостридий значительно уменьшилось. Хотя не было никакого снижения при обработке C. perfringens смесью Bacillus (Фиг. 84), было меньше различий в штаммах C. perfringens, выделенных во время обработки, как показано по индексу Шеннона-Винера RAPD-паттернов C. perfringens (Таблица 23). Разнообразие нетоксикогенных клостридий также уменьшилось во время лечения, и преобладающие изоляты группы C. beijerincki были вытеснены изолятами группы C. tertium во время лечения (Фиг. 85 и Таблица 24).
[0575] Обсуждение: смесь штаммов Bacillus вызывала снижение общего количества клостридий и уменьшала разнообразие штаммов C. perfringens у коров. Продукт Bacillus также уменьшал разнообразие нетоксикогенных клостридиальных видов и вызывал вытеснение штаммов группы C. beijerinckii группой C. tertium. Эти данные демонстрируют, что продукт вызывает снижение количества клостридий и уменьшение разнообразия изолятов C. perfringens, а также разнообразия и типов видов Clostridium. Снижение доли группы C. beijerinckii, которая, как известно, вырабатывает большие количества бутанола и ацетона, скорее всего улучшит ферментацию рубца и улучшит эффективность кормления, а также продуктивность молока у молочных коров.
[0576] Таблица 23. Разнообразие RAPD-отпечатков изолятов Clostridium perfringens с течением времени.
[0577] Таблица 24. Разнообразие нетоксикогенных видов Clostridium и изменение пропорций двух наиболее преобладающих групп с течением времени.
[0578] Пример 13: Влияние комбинации штаммов Bacillus на популяции клостридий у молочных коров на ферме Е в Висконсине.
[0579] Введение. Синдром геморрагического кишечника (ГСК) впервые был описан в 1991 году и наблюдался у пяти коров голштинской породы высокой продуктивности из одной молочной фермы в Айдахо (Sockett, 2004). Симптомы включали подслизистые гематомы с точечным источником, каждая из которых поражала 10-20 см тонкой кишки. У одной из пяти коров была рваная гематома с кровотечением в просвет тонкой кишки. Хотя, как известно, Aspergillus fumigatus и Clostridium perfringens, как известно, участвуют в этиологии ГСК, этот синдром лучше описывать как полимикробный и многофакторный по своей природе. Повышенное потребление высокоэффективной энергетической диеты представляется наиболее вероятным общим путём для всех описанных факторов риска (Berghaus и др., 2005).
[0580] ГСК характеризуется внезапным снижением молочной продуктивности, болями в животе из-за закупорки кишечника и анемии (Anderson, 2002). Клиническими признаками заболевания являются снижение потребления корма, депрессия, снижение выработки молока, обезвоживание, вздутие живота и сгустки крови в фекалиях. Смерть наступает в течение 48 часов с момента начала закупорки пробкой из сгустка крови. Из-за спорадической, острой этиологии известно лишь несколько случаев излечения.
[0581] В дополнение к изолятам Clostridium нескольких видов, вызывающих кишечную болезнь, другие виды Clostridium проводят большие количества ацетона, бутанола, 1,3-пропандиола и масляной кислоты в качестве конечных продуктов их метаболизма. Если они образуются в рубце, эти конечные метаболические продукты могут влиять на функцию рубца и снижать его эффективность.
[0582] Штаммы Bacillus, отобранные авторами настоящего изобретения для ингибирования патогенов, продуцируют множество соединений, обладающих ингибирующей активностью в отношении других микробов, с множеством штаммов, содержащих более десяти оперонов, продуцирующих противогрибковые и антибактериальные соединения. Множественные бактериоцины продуцируются in vitro непосредственно в месте действия штаммов Bacillus, поэтому устойчивая смесь бактериоцинов присутствует в дозах, меньших, чем это было бы необходимо, если бы изолированные бактериоцины добавлялись непосредственно в корм.
[0583] Цель этого исследования состояла в том, чтобы измерить уровни и разнообразие клостридий у молочных коров на ферме E в Висконсине, обработанных указанным продуктом, в соответствии с этим вариантом осуществления настоящего изобретения (называемых в настоящем документе «обработанными») в течение 220 суток.
[0584] Материалы и методы. Молочное стадо в Висконсине (Ферма E) было выбрано для изучения влияния продукта Bacillus в соответствии с этим вариантом осуществления настоящего изобретения на уровень и разнообразие клостридий. Стадо состояло из 650 дойных коров, размещенных в свободном стойле, и коровы лежат на песке.
[0585] Продукт в соответствии с данным вариантом осуществления настоящего изобретения представлял собой комбинированный продукт из трех штаммов Bacillus: Bacillus 747 (50%), Bacillus 1781 (45%) и Bacillus 1541 (5%), включённых в общий смешанный рацион (ОСР) в дозе около 2 миллиардов КОЕ на голову в сутки.
[0586] Образцы фекалий получали у коров до лечения и во время него. Даты получения образцов и количество тестируемых животных указаны в Таблице 25.
[0587] Образцы фекалий коров разбавляли 1:10 стерильным пептоном, подвергали тепловому шоку в течение 30 минут при 60°C, подсчитывали в стерильном пептоне и высевали на агар с триптозо-сульфитным циклосерином (TSC) с D-циклосерином (400 мг/л) для отбора видов клостридий. Чашки с агаром инкубировали при 37°С анаэробно в течение 24 часов. Если присутствовали изолированные сульфитредуцирующие колонии, их подсчитывали как общее количество клостридий (КОЕ/г) и репрезентативные изоляты отбирали в Reinforced Clostridia Medium (RCM) (Oxoid, CM0149) и инкубировали анаэробно в течение 24 часов при 37°C. Через 24 часа инкубации культуры (10%) переносили в бульон сердечномозговым экстрактом (BHI) (BD, 211059) и инкубировали анаэробно в течение 24 часов при 37°C.
[0588] Экстракцию ДНК проводили в 96-луночных блоках, содержащих 500 мкл предполагаемой культуры клостридий на лунку. Клетки собирали центрифугированием при 4700 об/мин в течение 10 минут, супернатант удаляли. Клетки ресуспендировали в 500 мкл 50 мМ ЭДТА-2Na (рН = 8,0). Аликвоты 300 мкл суспендированных клеток переносили в новый 96-луночный блок и объединяли с 20 мкл лизоцима из раствора куриного яичного белка (Sigma, L6876) (100 мг/мл в 50 мМ ЭДТА) для лизиса бактериальных клеток. 96-луночный блок инкубировали в течение 1 часа при 37°С для лизиса бактериальных клеток. После инкубации добавляли 220 мкл буфера для лизиса (6 М гуанидин, 20% Тритон-Х 100, 10 мМ Трис-HCL, рН 7,5), перемешивали, затем инкубировали при комнатной температуре в течение 15 минут. После инкубации в каждую лунку добавляли 20 мкл протеиназы К (NEB, 800 Ед/мл), перемешивали и инкубировали при 55°С в течение 30 минут для разложения белков. Затем клеточный лизат переносили в 96-луночный планшет для связывания (Promega, A2278) и центрифугировали при 4700 об/мин в течение 5 минут. Фильтрат отбрасывали, выполняли три промывки колонок связывающей пластины центрифугированием 750 мкл промывочного раствора для колонки (Promega, A1318) при 4700 об/мин в течение 1 минуты и 30 секунд, отбрасывая фильтрат в конце каждого отжима. Планшет для связывания центрифугировали в течение дополнительных 10 минут при 4700 об/мин для удаления остаточного этанола. Затем под связывающую пластину помещали чистый элюирующий планшет и ДНК элюировали 200 мкл предварительно нагретой (55°С) водой, свободной от нуклеаз (Promega, PI 195).
[0589] ДНК подвергали скринингу на наличие генов токсинов (α, β, ε и ι), специфичных для C. perfringens, с использованием полимеразной цепной реакции (ПЦР). Амплификацию генов токсинов проводили с использованием мультиплексной ПЦР, содержащей четыре набора праймеров (Yoo и др., 1997) (Таблица 1.) Смесь ПЦР содержала 2,5 мкл 10Х ПЦР-буфера, 2 мкл 50 мМ MgCl2, 0,5 пМ каждого праймера (Таблица 1), 0,1 мкл Taq ДНК-полимеразы Invitrogen™ Platinum™, 2,5 мл ДНК, стерильную воду добавляли до достижения 25 мкл общего реакционного объёма. Смесь выдерживали 5 минут при 94°С, затем осуществляли 30 циклов при 94°С в течение 1 минуты, 55°С в течение 1 минуты, 72°С в течение 1 минуты с окончательным удлинением в течение 3 минут при 72°С. Продукты ПЦР наблюдали с использованием анализатора фрагментов (Advanced Analytics), чтобы определить, была ли достигнута амплификация. Если был обнаружен один или несколько генов токсина, то для каждого изолята проводили идентификацию типа токсина на основе их профиля генов токсинов (Songer, 1996). Соотношение положительных C. perfringens к общему количеству изолятов клостридий использовали для расчёта оценочного количества C. perfringens на основе общего количества клостридий.
[0590] Уникальные штамм-специфические генетические отпечатки получали с использованием анализа методом случайной амплификации полиморфной ДНК (RAPD) на отобранных изолятах для определения разнообразия C. perfringens среди фекальных изолятов. ПЦР содержала 5 мкл ДНК, 2,5 мкл RAPD-праймера 2 (10 пМ) (Таблица 1) и 17,5 мкл стерильной воды, которую добавляли в готовую аналитическую бусину RAPD (Life Sciences, 27-9500-01). Смесь выдерживали 5 минут при 95°С, затем осуществляли 45 циклов при 95°С в течение 1 минуты, 36°С в течение 1 минуты, 72°С в течение 2 минут с окончательным удлинением в течение 5 минут при 72°С. Продукты ПЦР наблюдали на анализаторе фрагментов (Advanced Analytics) для определения характера амплификации и импортировали для анализа в BioNumerics, программное обеспечение для биоинформатики. Паттерны RAPD сравнивали с помощью метода корреляционного анализа по Дайсу на основе полос, чтобы определить сходство паттернов RAPD как способа мониторинга различий между изолятами. Отсекание кластера выполняли при 75% сходстве.
[0591] Для выявления клостридий, у которых не было по меньшей мере одного гена токсина, специфичного для C. perfringens, проводили реакцию ПЦР ДНК изолята для амплификации 16S-области рДНК с использованием праймеров 27F-YM и 1492R-Y (Таблица 1). Это делали на 20% изолятов, которые не содержали гены токсинов, специфичных для C. perfringens. Смесь для ПЦР содержала 5 мкл 10Х ПЦР-буфера, 2 мкл 50 мМ MgCl2, 1 мкл 50 мМ dNTP, 0,4 пМ каждого праймера (Таблица 1), 0,2 мкл Taq ДНК-полимеразы Invitrogen™ Platinum™, 5 мкл ДНК и стерильную воду добавляли до достижения 50 мкл общего реакционного объёма. Смесь выдерживали 4 минуты при 95°С, затем осуществляли 35 циклов при 95°С в течение 30 секунд, 50°С в течение 30 секунд, 72°С в течение 2 минут с окончательным удлинением в течение 7 минут при 72°С. Проводили проверку качества амплификации и продукт ПЦР отправляли в Genewiz (https://www.genewiz.com) для получения последовательностей для генов 16S. Последовательности сравнивали со штаммами известного типа, полученными из электронной онлайн базы данных EZbiocloud (http://www.ezbiocloud.net/). На основании сравнений этих последовательностей изолятам присваивали бактериальную идентификацию.
[0592] Результаты: Общее количество клостридий на ферме E (Фиг. 86) незначительно отличалось от данных, полученных во время обследования в Висконсине (Пример 5). Хотя не было никакого снижения уровня клостридий (Фиг. 86) или C. perfringens (Фиг. 87) во время обработки смесью Bacillus, было меньшее разнообразие штаммов C. perfringens, выделенных во время обработки, как было показано по данным индекса Шеннона-Винера по паттернам RAPD для C. perfringens (Таблица 26). Разнообразие нетоксигенных клостридий также уменьшилось во время обработки и преобладающие изоляты группы C. beijerincki были полностью вытеснены изолятами группы C. bifermentans во время обработки (Фиг. 88 и Таблица 27).
[0593] Обсуждение. Смесь штаммов Bacillus, отобранных для ингибирования C. perfringens, уменьшала разнообразие штаммов C. perfringens у коров. Указанный продукт Bacillus также уменьшал разнообразие нетоксикогенных видов клостридий и вызвал вытеснение штаммов группы C. beijerinckii штаммами группы C. bifermentans и другими. Эти данные демонстрируют, что даже когда количество клостридий находится в пределах нормы для региона и не снижается под действием указанного продукта, всё равно наблюдается уменьшение разнообразия изолятов C. perfringens, а также разнообразия и типов присутствующих видов Clostridium. Группа C. beijerinckii была преобладающей на 96% до обработки, но не обнаруживалась через 220 дней после обработки. Снижение доли группы C. beijerinckii, которая, как известно, вырабатывает большие количества бутанола и ацетона, скорее всего улучшает ферментацию рубца и улучшает эффективность кормления, а также молочную продуктивность у молочных коров.
[0594] Таблица 25: Количество образцов фекалий, собранных в каждой точке отбора проб на ферме E в Висконсине.
[0595] Таблица 26. Разнообразие RAPD-отпечатков изолятов Clostridium perfringens с течением времени на ферме E в Висконсине.
[0596] Таблица 27. Разнообразие нетоксикогенных видов Clostridium и изменение пропорций двух наиболее преобладающих групп с течением времени.
[0597] Пример 14: Влияние комбинации штаммов Bacillus на популяции клостридий у молочных коров на ферме BS-TX в Техасе
[0598] Введение. Синдром геморрагического кишечника (ГСК) впервые был описан в 1991 году и наблюдался у пяти коров голштинской породы высокой продуктивности из одной молочной фермы в Айдахо (Sockett, 2004). Симптомы включали подслизистые гематомы с точечным источником, каждая из которых поражала 10-20 см тонкой кишки. У одной из пяти коров была рваная гематома с кровотечением в просвет тонкой кишки. Хотя, как известно, Aspergillus fumigatus и Clostridium perfringens, как известно, участвуют в этиологии ГСК, этот синдром лучше описываать как полимикробный и многофакторный по своей природе. Повышенное потребление высокоэффективной энергетической диеты представляется наиболее вероятным общим путём для всех описанных факторов риска (Berghaus и др., 2005).
[0599] ГСК характеризуется внезапным снижением молочной продуктивности, болями в животе из-за обструкции кишечника и анемии (Anderson, 2002). Клиническими признаками заболевания являются снижение потребления корма, депрессия, снижение выработки молока, обезвоживание, вздутие живота и сгустки крови в фекалиях. Смерть наступает в течение 48 часов с момента начала закупорки пробкой из сгустка крови. Из-за спорадической, острой этиологии известно лишь несколько случаев излечения.
[0600] В дополнение к изолятам Clostridium нескольких видов, вызывающих кишечное заболевание, другие виды Clostridium продуцируют большие количества ацетона, бутанола, 1,3-пропандиола и масляной кислоты в качестве конечных продуктов их метаболизма. Если эти конечные метаболические продукты образуются в рубце, они могут влиять на функцию рубца и снижать его эффективность.
[0601] Штаммы Bacillus, отобранные авторами настоящего изобретения для ингибирования патогенов, продуцируют множество соединений, обладающих ингибирующей активностью в отношении других микробов, со множнством штаммов, содержащих более десяти оперонов, продуцирующих противогрибковые и антибактериальные соединения. Множественные бактериоцины продуцируются in vitro непосредственно в месте действия штаммов Bacillus, поэтому устойчивая смесь бактериоцинов присутствует в дозах меньших, чем это было бы необходимо, если бы изолированные бактериоцины добавлялись непосредственно в корм.
[0602] Целью данного исследования было измерение молочной продуктивности, а также уровней и разнообразия клостридий у молочных коров на ферме B-TX, обработанных указанным продуктом, в соответствии с этим вариантом осуществления настоящего изобретения (называемых в настоящем документе «обработанными», более 107 суток.
[0603] Материалы и методы. Молочное стадо в Техасе (Farm BS) было выбрано для изучения влияния продукта Bacillus в соответствии с этим вариантом осуществления настоящего изобретения на производство молочной продуктивности и уровней клостридий и их разнообразие. Стадо состояло из 5500 дойных коров, помещенных в искусственно проветриваемые стойла, где коровы лежат на песке.
[0604] Указанный продукт в соответствии с данным вариантом осуществления настоящего изобретения представлял собой комбинированный продукт из двух штаммов Bacillus в равных пропорциях: Bacillus 747 и Bacillus 1781, включённый в общий смешанный рацион (ОСР) в дозе около 2 миллиардов КОЕ на голову в сутки.
[0605] Среднюю выработку молока с поправкой на энергию (ECM) рассчитывали за 4 месяца до кормления молочных коров бациллами. Указанную выработку ECM рассчитывали в течение 4 месяцев после включения продукта в корм. ECM - это расчёт для стандартизации объёма молока, производимого на основе общей энергии, с учетом выработки жидкого молока (фунтов), молочного жира (фунтов) и молочного белка (фунтов). Указанный расчёт корректирует фактический молочный жир (фунты) до стандартизированных 3,5 процентов, а фактический молочный белок (фунты) - до стандартизированных 3,2 процента. Этот расчёт позволяет производителям сравнивать объёмы производства молока на стандартизированной основе.
[0606] Указанная формула для ECM:
[0607] ECM = (0.327 x фунты молока) +(12.95 x фунты жира) + (7.65 x фунты белка)
[0608] Образцы фекалий получали от 60 коров до обработки и от 60 коров после 107 суток обработки.
[0609] Образцы фекалий коров разбавляли 1:10 стерильным пептоном, подвергали тепловому шоку в течение 30 минут при 60°C, подсчитывали в стерильном пептоне и высевали на агаре с триптозо-сульфитным циклосерином (TSC) с D-циклосерином (400 мг/л) для отбора видов клостридий. Чашки с агаром инкубировали при 37°С анаэробно в течение 24 часов. Если присутствовали изолированные сульфитредуцирующие колонии, их подсчитывали как общее количество клостридий (КОЕ/г) и репрезентативные изоляты отбирали в среду Reinforced Clostridia Medium (RCM) (Oxoid, CM0149) и инкубировали анаэробно в течение 24 часов при 37°C. Через 24 часа инкубации культуры (10%) переносили в бульон с сердечномозговым эктрактом (BНI) (BD, 211059) и инкубировали анаэробно в течение 24 часов при 37°C.
[0610] Экстракцию ДНК проводили в 96-луночных блоках, содержащих 500 мкл предполагаемой культуры клостридий на лунку. Клетки собирали центрифугированием при 4700 об/мин в течение 10 минут, супернатант удаляли. Клетки ресуспендировали в 500 мкл 50 мМ ЭДТА-2Na (pН = 8,0). Аликвоты 300 мкл суспендированных клеток переносили в новый 96-луночный блок и объединяли с 20 мкл лизоцима из раствора куриного яичного белка (Sigma, L6876) (100 мг/мл в 50 мМ ЭДТА) для лизиса бактериальных клеток. 96-луночный блок инкубировали в течение 1 часа при 37°С для лизиса бактериальных клеток. После инкубации добавляли 220 мкл буфера для лизиса (6 М гуанидина, 20% Тритон-Х 100, 10 мМ Трис-HCL, рН 7,5), перемешивали, затем инкубировали при комнатной температуре в течение 15 минут. После инкубации в каждую лунку добавляли 20 мкл протеиназы К (NEB, 800 Ед/мл), перемешивали и инкубировали при 55°С в течение 30 минут для разложения белков. Затем клеточный лизат переносили в 96-луночный планшет для связывания (Promega, A2278) и центрифугировали при 4700 об/мин в течение 5 минут. Фильтрат отбрасывали, выполняли три промывки колонок связывающей пластины центрифугированием 750 мкл промывочного раствора для колонки (Promega, A1318) при 4700 об/мин в течение 1 минуты и 30 секунд, отбрасывая фильтрат в конце каждого отжима. Планшет для связывания центрифугировали в течение дополнительных 10 минут при 4700 об/мин для удаления остаточного этанола. Затем под связывающую пластину помещали чистый элюирующий планшет и ДНК элюировали 200 мкл предварительно нагретой (55°С) воды, свободной от нуклеаз (Promega, PI 195).
[0611] ДНК подвергали скринингу на наличие генов токсинов (α, β, ε и ι), специфичных для C. perfringens, с использованием полимеразной цепной реакции (ПЦР). Амплификацию генов токсинов проводили с использованием мультиплексной ПЦР, содержащей четыре набора праймеров (Yoo и др., 1997) (Таблица 1). Смесь ПЦР содержала 2,5 мкл 10Х ПЦР-буфера, 2 мкл 50 мМ MgCl2, 0,5 пМ каждого праймера (Таблица 1), 0,1 мкл Taq ДНК-полимеразы Invitrogen™ Platinum™, 2,5 мкл ДНК, стерильную воду добавляли до достижения 25 мкл для общего реакционного объёма. Смесь выдерживали 5 минут при 94°С, затем осуществляли 30 циклов при 94°С в течение 1 минуты, 55°С в течение 1 минуты, 72°С в течение 1 минуты с окончательным удлинением в течение 3 минут при 72°С. Продукты ПЦР наблюдали с использованием анализатора фрагментов (Advanced Analytics), чтобы определить, была ли достигнута амплификация. Если был обнаружен один или несколько генов токсинов, то для каждого изолята проводили идентификацию типа токсина на основе их профиля гена токсина (Songer, 1996). Соотношение положительным C. perfringens к общему количеству изолятов клостридий использовали для расчёта оценочного количества C. perfringens на основе общего количества клостридий.
[0612] Уникальные штамм-специфические генетические отпечатки получали с использованием анализа методом случайной амплификации полиморфной ДНК (RAPD) на отдельных изолятах для определения разнообразия C. perfringens среди фекальных изолятов. ПЦР содержала 5 мкл ДНК, 2,5 мкл RAPD-праймера 2 (10 пМ) (Таблица 1) и 17,5 мкл стерильной воды, которую добавляли в готовую аналитическую бусину RAPD (Life Sciences, 27-9500-01). Смесь выдерживали 5 минут при 95°С, затем осуществляли 45 циклов при 95°С в течение 1 минуты, 36°С в течение 1 минуты, 72°С в течение 2 минут с окончательным удлинением в течение 5 минут при 72°С. Продукты ПЦР наблюдали на анализаторе фрагментов (Advanced Analytics) для определения характера амплификации и импортировали для анализа в BioNumerics, программное обеспечение для биоинформатики. Паттерны RAPD сравнивали с помощью метода корреляционного анализа по Дайсу на основе полос, чтобы определить сходство паттернов RAPD как способа мониторинга различий между изолятами. Отсекание кластера осуществляли при 75% сходстве.
[0613] Для идентификации клостридий, которые не имели по меньшей мере одного гена токсина, специфичного для C. perfringens, проводили реакцию ПЦР ДНК изолятов для амплификации 16S-области рДНК с использованием праймеров 27F-YM и 1492R-Y (Таблица 1). Это было сделано на 20% изолятов, которые не содержали гены токсинов, специфичных для C. perfringens. Смесь для ПЦР содержала 5 мкл 10Х ПЦР-буфера, 2 мкл 50 мМ MgCl2, 1 мкл 50 мМ dNTP, 0,4 пМ каждого праймера (Таблица 1), 0,2 мкл ДНК-полимеразы Taq Invitrogen™ Platinum™, 5 мкл ДНК и стерильную воду добавляли до достижения 50 мкл общего реакционного объёма. Смесь выдерживали 4 минуты при 95°С, затем осуществляли 35 циклов при 95°С в течение 30 секунд, 50°С в течение 30 секунд, 72°С в течение 2 минут с окончательным удлинением в течение 7 минут при 72°С. Проводили проверку качества амплификации, и продукт ПЦР отправляли в Genewiz (https://www.genewiz.com) для получения последовательностей для генов 16S. Последовательности сравнивали со штаммами известного типа, полученными из электронной онлайн базы данных EZbiocloud (http://www.ezbiocloud.net/). На основании сравнений этих последовательностей изолятам присваивали бактериальную идентификацию.
[0614] Результаты: производство молока увеличилось в течение указанного периода обработки на ферме BS, поскольку ECM увеличился на 0,6 фунта в сутки.
[0615] Средние значения общего количества клостридий на ферме BS (Фиг. 89) были значительно выше (P> 0,05), чем те, которые были определены во время обследования в Техасе (Пример 6). Во время обработки смесью Bacillus не наблюдалось изменений в общем количестве клостридий или C. perfringens (Фиг. 90), однако было меньшее разнообразие штаммов C. perfringens, выделенных во время обработки, на что указывает индекс Шеннона-Винера для RAPD-паттерном C. perfringens (Таблица 28). Изоляты группы C. beijerincki были вытеснены изолятами группы C. bifermentans во время обработбки (Фиг. 91 и Таблица 29).
[0616] Обсуждение: Производство молока улучшилось в течение периода обработки, кроме того, смесь штаммов Bacillus в соответствии с этим вариантом осуществления настоящего изобретения уменьшила разнообразие штаммов C. perfringens у коров. Продукт Bacillus также уменьшил разнообразие нетоксикогенных клостридиальных видов и вызвал вытеснение штаммов группы C. beijerinckii штаммами C. bifermentans. Эти данные показывают, что даже если штаммы Bacillus не сильно снижают количество клостридий, указанный продукт оказывает влияние на разнообразие изолятов C. perfringens и виды Clostridium. Снижение доли группы C. beijerinckii, которая, как известно, продуцирует большие количества бутанола и ацетона, наиболее вероятно, улучшило ферментацию в рубце и эффективность кормления, тем самым увеличивая молочную продуктивность, измеренную у этих молочных коров.
[0617] Таблица 28. Разнообразие отпечатков RAPD изолятов Clostridium perfringens с течением времени у коров фермы BS в Техасе.
[0618] Таблица 29. Разнообразие нетоксикогенных видов Clostridium и изменение пропорций двух наиболее преобладающих групп с течением времени на ферме BS в Техасе.
[0619] Пример 15: Ответ экспрессии иммунных генов Bacillus на стимуляцию LPS в эпителиальной клеточной линии кишечника
[0620] Введение: исследование скрининга культуры клеток in vitro проводили для определения влияния штаммов Bacillus и комбинации штаммов на реакцию экспрессии гена воспалительного цитокина в линии кишечных эпителиальных клеток. Штаммы Bacillus подвергали скринингу на линии эпителиальных клеток кишечника крысы LEC-6 на модели стимуляции LPS, чтобы определить влияние каждого штамма и комбинации Bacillus на реакцию экспрессии гена воспалительного цитокина со стимуляцией LPS и без неё. Штаммы и комбинации Bacillus, протестированные в модели, включали:
[0621] Штамм Bacillus 747
[0622] Штамм Bacillus 1781
[0623] Штамм Bacillus 1104
[0624] Штамм Bacillus 1541
[0625] Штамм Bacillus 2018
[0626] Штамм Bacillus 747+1781
[0627] Материалы и методы. Приготовление клеточной культуры. В этом исследовании использовали линию кишечных эпителиальных клеток IEC6 крысы (ATCC); клетки размножали в инкубаторе при 37°С при 5% СО2 до 18-го пассажа в колбах для тканевой культуры до 80% конфлюентности в среде полного роста CCM (DMEM: модифицированная по Дульбекко среда Игла, содержащая 4 мМ L-глютамина и 4,5 г/л глюкозы; 1,5 г/л бикарбоната натрия; 0,1 ед/мл бычьего инсулина, 90%; 10% FBS: фетальная бычья сыворотка) с 1% антибиотиком (пенициллин, 10 ед/мл; стрептомицин, 10 мг/мл). Среду для выращивания удаляли из колб, а затем клетки дважды промывали нагретым фосфатно-солевым буфером Дульбекко (DPBS). Трипсин, нагретый до 37°С, добавляли до покрытия клеточного монослоя в колбе и инкубировали при 37°С до тех пор, пока клетки не отделились от поверхности колбы. Среду для роста CCM немедленно добавляли к трипсинизированным клеткам, тщательно перемешивали пипеткой и переносили в коническую пробирку объёмом 15 мл. Клетки осаждали центрифугированием при 1500 об/мин в течение 10 минут. После удаления супернатанта клетки ресуспендировали в 2-3 мл среды для роста CCM и определяли концентрацию и жизнеспособность клеток путём разведения части суспензии клеток в трипановом голубом и подсчёта на гемоцитометре. Клетки разбавляли до 3×105 клеток/мл, 1 мл этой клеточной суспензии добавляли в каждую лунку 24-луночного планшета и инкубировали в течение ночи в инкубаторе при 37°C при 5% CO2 для того, чтобы клетки прилипли к дну лунок и образовали монослой. На следующий день из каждой лунки удаляли питательную среду, монослои клеток дважды промывали DPBS, и обработки назначенные лунки обрабатывали.
[0628] Обработки клеточной культуры: обработку проводили в лунках 24-х луночного планшета. Для этой стадии анализа, когда проводилась обработка, использовали среду CCM, не содержащую антибиотики. Раствор LPS 30 нг/мл готовили в среде CCM без антибиотиков, и 500 мкл этого раствора вводили в каждую лунку, обработанную LPS, в результате чего в каждую подходящую лунку вводили 15 нг. Штаммы Bacillus выращивали в течение ночи в триптической сое и разводили в DPBS так, чтобы 250 мкл каждой соответствующей обработки вводили в каждую лунку для доставки 1×105 КОЕ/лунка. Общий объём 1 мл вводили в каждую лунку с добавлением среды DPBS или CCM, при необходимости, чтобы довести каждую лунку до равного объёма 1 мл. Конкретные объёмы, вводимые в лунки, не стимулированные LPS, Bacillus и Bacillus + LPS, показаны в Таблице 30.
[0629] После обработки определенных лунок планшет инкубировали в течение 1 часа при 37°С и 5% СО2. После одного часа инкубации среду удаляли из лунок и клетки дважды промывали тёплым DPBS. Сразу после второй промывки DPBS в каждую лунку добавляли 400 мкл тризола и оставляли инкубироваться при комнатной температуре в течение 5 минут. Тризол удаляли из каждой лунки, помещали в микроцентрифужную пробирку объёмом 1,5 мл, помеченную указанным способом обработки, и немедленно замораживали в жидком азоте. Пробирки хранили при -80°С для последующей экстракции РНК и анализа экспрессии генов кПЦР.
[0630] Выделение РНК и синтез кДНК. Замороженные пробирки с тризолом вынимали из морозильного хранилища и оставляли оттаивать на льду. РНК экстрагировали с использованием набора DirectZol RNA MiniPrep (Zymo Research, Ирвин, Калифорния) в соответствии с инструкциями производителя. Концентрацию РНК проверяли на флуорометре Qubit (ThermoFisher Scientific, Inc.) и регистрировали для документирования выделение РНК из каждой лунки экспериментальной матрицы клеточных культур. Набор для обратной транскрипции QuantiNova (Qiagen, Germantown, MD) использовали для получения кДНК в соответствии с инструкциями производителя.
[0631] Количественная ПЦР в реальном времени. кПЦР осуществляли в системе ПЦР в реальном времени Applied Biosystems StepOne Plus (Applied Biosystems, Foster City, CA) с использованием Taq полимеразы Platinum и праймеров, перечисленных в Таблице 31. β-Актин использовали в качестве конститутивного гена, и значения ΔCt определяли для обработки каждой лунки путём вычитания количества циклов ПЦР, имеющих отношение к целевому гену из циклов ПЦР конститутивного гена. Изменение кратности экспрессии гена также рассчитывали с использованием метода ΔΔCt для расчёта кратного изменения экспрессии гена после каждой из обработок LPS и Bacillus относительно нестимулированных клеток.
[0632] Результаты: Все протестированные штаммы Bacillus вызывали некоторую воспалительную реакцию при воздействии на эпителиальную клеточную линию кишечника, о чем свидетельствует увеличение кратного изменения экспрессии генов воспалительных цитокинов, MIP-2 и TNF-α (Фиг. 92-96). Из пяти протестированных штаммов Bacillus, штамм Bacillus 747 (Фиг. 92) продемонстрировал существенно более низкое кратное увеличение экспрессии генов воспалительных цитокинов, чем другие. В сочетании с LPS три штамма Bacillus (Bacillus 1781, Bacillus 1104 и Bacillus 2018; Фиг. 93, 94 и 96, соответственно) снижали экспрессию гена воспалительного цитокина по сравнению с одним воспалительным заражением LPS, указывая на то, что эти штаммы Bacillus обладают способностью улучшать ответы на воспалительный процесс в желудочно-кишечной ткани. Комбинация Bacillus 747 и Bacillus 1781, вводимая в эпителиальную клеточную линию IEC-6, приводила к кратному изменению экспрессии генов, аналогично штамму Bacillus 747, вводимому отдельно, и проявляла умеренную склонность к уменьшению воспалительного ответа, индуцированного LPS, подобно Bacillus 1781 (Фиг. 97).
[0633] Обсуждение: Эти данные иллюстрируют иммуномодулирующий потенциал штаммов Bacillus в модели воспалительного заражения, имитирущей эффекты грамотрицательной бактериальной патогенной инфекции. Кроме того, отдельные штаммы Bacillus вызывают различные иммуномодулирующие воспалительные эффекты, что позволяет предположить, что штаммы Bacillus могут выполнять определенные функции (воспалительные или противовоспалительные) для удовлетворения потребностей здоровья хозяина.
[0634] Таблица 30. Последовательности праймеров, использованные в исследовании дрожжевых продуктов клеточной культуры.
[0635] Таблица 31. Объёмы, вводимые в каждую лунку в зависимости от назначения обработки.
[0636] Пример 16: Введение пробиотика, содержащего штаммы Bacillus и Lactobacillus, в заменители молока для телят
[0637] Введение: показатели до отъёма и после, а также состояние здоровья молочных телят при кормлении пробиотиками с добавлением в заменители молока.
[0638] Материалы и методы: В исследование было включено в общей сложности 100 молочных тёлочек голштинской породы (39,2 ± 0,65 кг массы тела) для оценки эффекта двух различных микробных комбинаций, вводимых в виде пробиотиков, добавленных к заменитель молока для телят. 56-дневное исследование включало 42-дневную часть перед отъёмом, в которой телятам вводили заменитель молока 20/20 (20% жира / 20% белка) и 14-дневный период после отъёма, в котором у телят была полностью сухая диета. Цельный молочный белок, заменитель молока, не содержащий лекарств, скармливали из расчёта 0,28 кг на 2 л воды 2 раза в сутки с 1-х по 35-е сутки и l раз в сутки с 36-х суток до объёма на 42-е сутки. Питательный состав заменителя молока и сухого корма, использованных в исследовании, суммирован в Таблице 32. Телятам случайным образом назначали одну из четырёх обработок (25 телят/обработка), которые добавляли в суточную смесь заменителя молока для телят, вводимую индивидуально для каждого теленка при испытании:
[0639] 1) Контроль - 20/20 заменитель молока
[0640] 2) Антибиотик - Контроль дополнен неомицином и окситетрациклином из расчёта 22 мг/кг массы тела в течение 14 дней
[0641] 3) Bacillus 747 - Контроль дополнен 5 г премикса пробиотика, содержащего штамм Bacillus 747 (1×109 КОЕ/голова/сутки) на одно кормление, в течение 42 дней
[0642] 4) Bacillus 747 + 1781 - контроль с добавлением 5 г премикса пробиотика, содержащего штаммы Bacillus 747 + 1781 (всего 109 КОЕ/голова/сутки общего КОЕ с каждым из штаммов Bacillus, составляющим 50% от общего количества), кормление в течение 42 дней.
[0643] Массу телят регистрировали на 14, 28, 42 и 56 сутки исследования и рассчитывали среднесуточный прирост (ССП). Высоту бедра измеряли и записывали для каждого теленка в 1-е сутки и 56-е сутки исследования. Потребление всего корма регистрировали ежедневно и суммировали каждые две недели в процессе обработки. Оценки фекалий проводили у телят ежедневно и суммировали еженедельно в течение первых четырёх недель исследования с использованием шкалы 1-4, определенной как l = нормальная, 2 = рыхлая, 3 = очень рыхлая, но без водянистых выделений, и 4 = очень водянистая. Записи, касающиеся здоровья, включая обработку, количество дней обработки, стоимость обработки и смертность, записывали на протяжении всего исследования.
[0644] Образец крови по 10 мл отбирали в пробирки с ЭДТА от каждого теленка через 14 дней после первоначального введения смеси для обработки. Образец объёмом 0,5 мл удаляли из образца объёмом 10 мл и помещали в пробирки RNA Protect (Qiagen, Inc., Valencia, CA). Плазму крови отбирали из оставшегося образца цельной крови и анализировали на белок острой фазы, гаптоглобин. Гаптоглобин анализировали с помощью набора ELISA согласно инструкциям производителя (MyBioSource, Сан-Диего, Калифорния). Кровь из пробирок RNA Protect использовали для извлечения РНК из клеток крови и проводили анализ экспрессии генов различных иммунных цитокинов между четырьмя обработками. Вкратце, экстракцию РНК проводили на образце крови, хранящемся в пробирках RNA Protect, с использованием набора для крови животных RNEasy Protect в соответствии с инструкциями производителя (Qiagen, Inc.). Набор для обратной транскрипции QuantiNova (Qiagen, Germantown, MD) использовали для приготовления кДНК в соответствии с инструкциями производителя. Количественную ПЦР в реальном времени (ОТ-кПЦР) выполняли на системе ПЦР Applied Biosystems StepOne Plus в реальном времени (Applied Biosystems, Foster City, CA) с использованием Taq полимеразы Platinum и праймеров, перечисленных в Таблице 33. Глицеральдегид-3-фосфатдегидрогеназу (GAPDH) использовали в качестве конститутивного гена, и значения ΔCt определяли для каждой обработки лунки путём вычитания количества циклов ПЦР, связанных с целевым геном, из циклов ПЦР, связанных с конститутивным геном.
[0645] Данные о росте и здоровье теленка анализировали с использованием процедуры PROC MIXED SAS, и при необходимости применяли анализ повторных измерений. Данные об острой фазе белков сыворотки и данные экспрессии генов цитокинов анализировали с использованием процедуры General Linear Model с использованием IMP. Метод наименьших квадратов использовали для дифференциации эффектов лечения с использованием теста Стьюдента. Начальную массу тела (НМТ) использовали в качестве ковариации для данных НМТ, ССП и потребления сухого вещества (ПСВ), когда они были значительными. Начальную высоту бёдер использовали в качестве ковариации для 56-х суток роста бедра и увеличения высоты бедра.
[0646] Результаты: телята, получавшие лечение антибиотиками (TRT2) и Bacillus 747 (TRT3), имели большую (P = 0,05) массу тела на 56-е сутки исследования и имели тенденцию (P <0,10) к увеличению ССП и общего увеличения массы тела по сравнению с телятами, получавшими контрольный (TRT1) заменитель молока, тогда как телята, которым вводили Bacillus 747 + 1781 (TRT4), имели промежуточные значения между контролем и другими обработками (Таблица 34). Потребление заменителя молока и корма для телят было одинаковым во всех обработках (Таблица 35 и Таблица 36), и не наблюдалось различий в сывороточных белках, показателях фекалий, днях очищения желудочно-кишечного тракта или стоимости обработки (Таблица 37).
[0647] Концентрации гаптоглобина в плазме были одинаковыми во всех четырёх обработках (Фиг. 98). Экспрессия генов реакционноспособного кислородного соединения, iNOS, была выше (P <0,05) в клетках крови телят, которых подвергали обработке Bacillus 747 + 1781, по сравнению со всеми остальными (Таблица 38). Кроме того, экспрессия гена воспалительного цитокина, IL-6, была выше (P <0,05) у телят, получавших обработку антибиотиком, по сравнению с телятами из контроля, телятами, обработанными Bacillus 747, а телята, получавшие контрольный заменитель молока и заменитель с добавкой Bacillus 747 + 1781, имели более высокую (P <0,05) экспрессию гена хемокина, CCL8, по сравнению с телятами, получавшими антибиотик или Bacillus 747. Различия в экспрессии гена цитокинов, наблюдаемые в этом исследовании, указывают на то, что Bacillus 747, вводимый отдельно, приводит к получению менее воспалительной среды по сравнению с комбинацией Bacillus 747 + 1781, о чем свидетельствует большая экспрессия генов iNOS и CCL8, наблюдаемая у телят, которых кормили Bacillus 747 + 1781.
[0648] Обсуждение: Телята, получавшие заменитель молока с добавкой Bacillus, имели такой же рост и здоровье, как и телята, которых кормили заменителями молока, содержащими антибиотики, неомицин сульфат: окситетрациклин, в течение 14 дней, что указывает на то, что Bacillus, вводимый телятам, потенциально может быть использован в качестве альтернативы введению антибиотика для укрепления здоровья и эффективного роста. Кроме того, это исследование показывает, что определенные штаммы Bacillus по отдельности или в комбинации вызывают различную иммуномодулирующую активность, стимулируя либо воспалительную, либо спокойную иммунологическую среду у молодого теленка, что может привести к расхождению в развитии и функции иммунной системы.
[0649] Таблица 32. Состав питательных веществ заменителя базального молока (ЗМ) и базальной закваски для теленка (ЗТ).
1 КДК = кислотно-детергентная клетчатка; НДК = нейтрально-детергентная клетчатка;
ОБ = общий белок; ОКППВ = общее количество перевариваемых питательных веществ; УНК = углеводы не из клетчатки
[0650] Таблица 33. Последовательности праймеров быка для анализа экспрессии иммунных генов с использованием ОТ-кПЦР.
[0651] Таблица 34. Параметры роста телят, измеренные в процессе исследования с 1 по 56 сутки.
1TRT1 = Контроль; TRT2 = Антибиотик; TRT3 = Bacillus 747; ТRT4 = Bacillus 747+1781.
2Начальная масса тела, используемая в качестве независимой переменной для данных о массе тела и среднем дневном приросте.
3Начальная высота бедра, используемая в качестве независимой переменной для данных об измерении высоты бедра на 56-е сутки and приросте высоты бедра.
a,b,cСредние значения в одном ряду с разными верхними индексами различаются (P = 0,05).
x,y,zСредние значения в одном ряду с разными верхними индексами различаются (P < 0,10).
[0652] Таблица 35. Потребление заменителей молока (ЗМ) у телят, измеренное с 1 по 42 сутки исследования.
1TRT1 = Контроль; TRT2 = Антибиотик; TRT3 = Bacillus 747; ТRT4 = Bacillus 747+1781.
[0653] Таблица 36. Стартовый корм, потребление сухого вещества и эффективность кормления телят, измеренная с 1 по 56 сутки исследования.
1TRT1 = Контроль; TRT2 = Антибиотик; TRT3 = Bacillus 747; ТRT4 = Bacillus 747+1781.
[0654] Таблица 37. Белок сыворотки и показатели здоровья телят с 1 по 56 сутки исследования.
1TRT1 = Контроль; TRT2 = Антибиотик; TRT3 = Bacillus 747; ТRT4 = Bacillus 747+1781.
2Значение оценки фекалий от 1 до 4, с 1 = нормальное значение до 4 = водянистое.
3Сутки очистки кишечника = любые сутки с оценкой фекалий >3.
[0655] Таблица 38. Экспрессия иммунных генов телят через 14 дней после проведения обработок заменителем молока.
1TRT1 = Контроль; TRT2 = Антибиотик; TRT3 = Bacillus 747; ТRT4 = Bacillus 747+1781.
2Note: ΔCt показывает количество циклов ПЦР и обратно пропорциональна экспрессии гена; большее значение ΔCt = меньшая экспрессия гена.
a,b,cСредние значения в одном ряду с разными верхними индексами различаются (P < 0,05).
[0656] ПРИМЕР 17: Влияние комбинации штаммов Bacillus на производство молока в стаде молочных коров на пяти стадах в Висконсине.
[0657] Введение. Синдром геморрагического кишечника (ГСК) впервые был зарегистрирован в 1991 году и наблюдался у пяти коров голштинской породы высокой продуктивности из одного молочного завода в Айдахо (Sockett, 2004). Симптомы включали гематомы подслизистого слоя с точечным источником, каждая из которых поражала 10-20 см тонкой кишки. У одной из пяти коров была рваная гематома с кровотечением в просвет тонкой кишки. Хотя известно, что Aspergillus fumigatus и Clostridium perfringens участвуют в этиологии ГСК, этот синдром лучше описать как полимикробный и многофакторный по своей природе. Повышенное потребление высокоэффективной энергетической диеты представляется наиболее вероятным общим путём для всех описанных факторов риска (Berghaus и др., 2005).
[0658] ГСК характеризуется внезапным снижением молочной продуктивности, болями в животе из-за обструкции кишечника и анемии (Anderson, 2002). Клиническими признаками заболевания являются снижение потребления корма, депрессия, снижение выработки молока, обезвоживание, вздутие живота и сгустки крови в фекалиях. Смерть наступает в течение 48 часов с момента начала закупорки пробкой из сгустка крови. Из-за спорадической, острой этиологии известно лишь несколько случаев излечения.
[0659] В дополнение к изолятам Clostridium нескольких видов, вызывающих кишечную болезнь, другие виды Clostridium продуцируют большие количества ацетона, бутанола, 1,3-пропандиола и масляной кислоты в качестве конечных продуктов их метаболизма. Если эти конечные метаболические продукты образуются в рубце, они могут влиять на функцию рубца и снижать его эффективность.
[0660] Штаммы Bacillus, выбранные авторами изобретения для ингибирования патогенов, продуцируют множество соединений, обладающих ингибирующей активностью в отношении других микробов, со множеством штаммов, содержащих более десяти оперонов, продуцирующих противогрибковые и антибактериальные соединения. Множественные бактериоцины продуцируются in vitro непосредственно в месте действия штаммов Bacillus, поэтому устойчивая смесь бактериоцинов присутствует в дозах, меньших, чем необходимо, если бы изолированные бактериоцины добавлялись непосредственно в корм.
[0661] Целью данного исследования было измерение молочной продуктивности у молочных коров на пяти фермах в Висконсине, обработанных продуктом, в соответствии с этим вариантом осуществления настоящего изобретения.
[0662] Материалы и методы. Пять молочных ферм штата Висконсин были отобраны для изучения влияния Bacillus, в соответствии с этим вариантом осуществления настоящего изобретения, на продукцию молока с энергетической коррекцией (ЕСМ). ECM - это расчёт для стандартизации объёма молока, производимого на основе общей энергии, с учетом выработки жидкого молока (фунты), молочного жира (фунты) и молочного белка (фунты). Расчёт корректирует фактический молочный жир (фунты) до стандартизированных 3,5 процента, а фактический молочный белок (фунты) - до стандартизированных 3,2 процента. Этот расчёт позволяет производителям сравнивать объёмы производства молока на стандартизированной основе.
[0663] Указанная формула для ECM:
[0664] ECM = (0,327 x молоко в фунтах) +(12,95 x жир в фунтах) + (7,65 x белок в фунтах).
[0665] Размеры стада в исследовании варьировались от 185 до 940 голов. Фермы, выбранные для этого исследования, считаются типичными молочными фермами штата Висконсин. У пяти отобранных стад не было никаких серьезных изменений в управлении в течение времени измерения.
[0666] Продукт в соответствии с данным вариантом осуществления настоящего изобретения представлял собой комбинированный продукт из трех штаммов Bacillus: Bacillus 1104 (50%), Bacillus 1781 (45%) и Bacillus 1541 (5%), включённых в общий смешанный рацион (ОСР) в дозе 2 миллиарда КОЕ на голову в сутки.
[0667] Средняя выработка ЕСМ была рассчитана за 4 месяца до кормления бациллами молочных коров. Bacillus включали в рацион кормления молочных коров на ежедневной основе (период обработки Bacillus). Производство ECM рассчитывали за 4 месяца после включения Bacillus в корм.
[0668] Результаты: Данные в стаде (Таблица 39) варьировались от увеличения на 0,4 фунта ECM в день (номер стада № 2) до 2,8 фунта ECM в день (номер стада № 5). Среднее увеличение ECM для всех 5 стад составляло 1,82 фунта в день.
[0669] Обсуждение. Смесь штаммов Bacillus в соответствии с данным вариантом осуществления настоящего изобретения, выбранная для ингибирования клостридий, последовательно улучшала молочную продуктивность, измеренную с помощью ECM, на нескольких фермах различных размеров в Висконсине.
[0670] Таблица 39. Улучшение продукции молока с поправкой на энергию (ECM) при использовании продукта Bacillus из пяти стад в Висконсине.
[0671] ПРИМЕР 18: Влияние комбинации штаммов Bacillus на здоровье стада, молочную продуктивность и популяции клостридий молочных коров на ферме WB в Висконсине
[0672] Введение. Синдром геморрагического кишечника (ГСК) впервые был описан в 1991 году и наблюдался у пяти коров голштинской породы высокой продуктивности из одного молочного завода в Айдахо (Sockett, 2004). Симптомы включали гематомы подслизистого слоя с точечным источником, каждая из которых поражала 10-20 см тонкой кишки. У одной из пяти коров была рваная гематома с кровотечением в просвет тонкой кишки. Хотя известно, что Aspergillus fumigatus и Clostridium perfringens участвуют в этиологии ГСК, этот синдром лучше описывать как полимикробный и многофакторный по своей природе. Повышенное потребление высокоэффективной энергетической диеты представляется наиболее вероятным общим путём для всех описанных факторов риска (Berghaus и др., 2005).
[0673] ГСК характеризуется внезапным снижением молочной продуктивности, болями в животе из-за обструкции кишечника и анемии (Anderson, 2002). Клиническими признаками заболевания являются снижение потребления корма, депрессия, снижение выработки молока, обезвоживание, вздутие живота и сгустки крови в фекалиях. Смерть наступает в течение 48 часов с момента начала закупорки пробкой сгустка крови. Из-за спорадической, острой этиологии известно лишь несколько случаев излечения.
[0674] В дополнение к изолятам Clostridium нескольких видов, вызывающих кишечные заболевания, другие виды Clostridium продуцируют большие количества ацетона, бутанола, 1,3-пропандиола и масляной кислоты в качестве конечных продуктов их метаболизма. Если эти конечные метаболические продукты образуются в рубце, они могут влиять на функцию рубца и снижать его эффективность.
[0675] Штаммы Bacillus, выбранные авторами изобретения для ингибирования патогенных микроорганизмов, продуцируют множество соединений с ингибирующей активностью в отношении других микробов, причем множество штаммов содержат более десяти оперонов, продуцирующих противогрибковые и антибактериальные соединения. Множественные бактериоцины продуцируются in vitro непосредственно в месте действия штаммов Bacillus, поэтому устойчивая смесь бактериоцинов присутствует в дозах, меньших, чем необходимо, если бы изолированные бактериоцины добавляли непосредственно в корм.
[0676] Цель этого исследования состояла в том, чтобы измерить здоровье стада, молочную продуктивность, уровни клостридий и разнообразие у молочных коров на ферме WB, обработанных продуктом в соответствии с этим вариантом осуществления настоящего изобретения, (называемых в настоящем описании «обработанным» в течение более 86 суток. Лечение было прекращено на 98 сутки, а затем возобновлено на второй период.
[0677] Материалы и методы. Молочное стадо в Висконсине (ферма WB) было выбрано для изучения влияния продукта Bacillus, в соответствии с этим вариантом осуществления настоящего изобретения, на здоровье стада и производство молока. Стадо состояло из 900 дойных коров, размещенных в свободном стойле, где коровы лежат на песке. Стадо доят 3 раза в сутки и надой в среднем по стаду составляет около 30000 фунтов на корову в год.
[0678] Продукт, в соответствии с данным вариантом осуществления настоящего изобретения, представлял собой комбинированный продукт из трёх штаммов Bacillus в равных пропорциях: Bacillus 747, Bacillus 1781 и Bacillus 2018, включённых в общий смешанный рацион (ОСР) в дозе 2 миллиарда КОЕ на голову в сутки.
[0679] Здоровье стада определяли путём измерения смертности коров, вызванной проблемами с пищеварением.
[0680] Производство молока на ферме отслеживали с использованием энергетически скорректированного производства молока (ECM). ECM - это расчёт для стандартизации объёма молока, производимого на основе общей энергии, с учетом выработки жидкого молока (фунты), молочного жира (фунты) и молочного белка (фунты). Расчёт корректирует фактический молочный жир (фунты) до стандартизированных 3,5 процента, а фактический молочный белок (фунты) - до стандартизированных 3,2 процента. Этот расчёт позволяет производителям сравнивать объёмы производства молока на стандартизированной основе.
[0681] Указана формула для ECM:
[0682] ECM = (0,327 x молоко в фунтах) + (12,95 x жир в фунтах) + (7,65 x белок в фунтах).
[0683] Образцы фекалий получали от коров до обработки, во время обработки и после неё. Даты и количество образцов животных указаны в Таблице 1.
[0684] Образцы фекалий коров разбавляли 1:10 стерильным пептоном, подвергали тепловому шоку в течение 30 минут при 60°C, подсчитывали в стерильном пептоне и высевали на агар с триптозо-сульфитным циклосерином (TSC) с D-циклосерином (400 мг/л) для отбора клостридиальных видов. Чашки с агаром инкубировали при 37°С анаэробно в течение 24 часов. Если присутствовали изолированные сульфитредуцирующие колонии, их подсчитывали как общее количество клостридий (КОЕ/г) и репрезентативные изоляты отбирали в среду Reinforced Clostridia Medium (RCM) (Oxoid, CM0149) и инкубировали анаэробно в течение 24 часов при 37°C. Через 24 часа инкубации культуры (10%) переносили в бульон с сердечно-мозговым экстрактом (BHI) (BD, 211059) и инкубировали анаэробно в течение 24 часов при 37°C.
[0685] Экстракцию ДНК проводили в 96-луночных блоках, содержащих 500 мкл предполагаемой культуры клостридий на лунку. Клетки собирали центрифугированием при 4700 об/мин в течение 10 минут, супернатант удаляли. Клетки ресуспендировали в 500 мкл 50 мМ ЭДТА-2Na (рН = 8,0). Аликвоты 300 мкл суспендированных клеток переносили в новый 96-луночный блок и объединяли с 20 мкл лизоцима из раствора куриного яичного белка (Sigma, L6876) (100 мг/мл в 50 мМ ЭДТА) для лизиса бактериальных клеток. 96-луночный блок инкубировали в течение 1 часа при 37°С для лизиса бактериальных клеток. После инкубации добавляли 220 мкл буфера для лизиса (6 М гуанидина, 20% Тритон-Х 100, 10 мМ Трис-HCL, рН 7,5), перемешивали, затем инкубировали при комнатной температуре в течение 15 минут. После инкубации в каждую лунку добавляли 20 мкл протеиназы К (NEB, 800 Ед/мл), перемешивали и инкубировали при 55°С в течение 30 минут для разложения белков. Затем клеточный лизат переносили в 96-луночный планшет для связывания (Promega, A2278) и центрифугировали при 4700 об/мин в течение 5 минут. Фультрат отбрасывали, осуществляли три промывки колонок связывающей пластины центрифугированием 750 мкл промывочного раствора для колонки (Promega, A1318) при 4700 об/мин в течение 1 минуты и 30 секунд, отбрасывая фильтрат в конце каждого отжима. Планшет для связывания центрифугировали в течение дополнительных 10 минут при 4700 об/мин для удаления остаточного этанола. Затем под связывающую пластину помещали чистый элюирующий планшет и ДНК элюировали 200 мкл предварительно нагретой (55°С) водой, свободной от нуклеаз (Promega, PI 195).
[0686] ДНК подвергали скринингу на наличие генов токсинов (α, β, ε и ι), специфичных для C. perfringens, с использованием полимеразной цепной реакции (ПЦР). Амплификацию генов токсинов проводили с использованием мультиплексной ПЦР, содержащей четыре набора праймеров (Yoo и др., 1997) (Таблица 1). Смесь ПЦР содержала 2,5 мкл 10Х ПЦР-буфера, 2 мкл 50 мМ MgCl2, 0,5 пМ каждого праймера (Таблица 1), 0,1 мкл Taq ДНК-полимеразы Invitrogen™ Platinum™, 2,5 мкл ДНК, стерильную воду добавляли до достижения 25 мкл общего реакционного объёма. Смесь выдерживали 5 минут при 94°С, затем осуществляли 30 циклов при 94°С в течение 1 минуты, 55°С в течение 1 минуты, 72°С в течение 1 минуты с окончательным удлинением в течение 3 минут при 72°С. Продукты ПЦР наблюдали с использованием анализатора фрагментов (Advanced Analytics), чтобы определить, была ли достигнута амплификация. Если был обнаружен один или несколько генов токсинов, то для каждого изолята проводили идентификацию типа токсина на основе их профиля гена токсина (Songer, 1996). Соотношение положительных C. perfringens к общему количеству изолятов клостридий использовали для расчёта оценочного количества C. perfringens на основе общего количества клостридий.
[0687] Уникальные штамм-специфические генетические отпечатки получали с использованием анализа методом случайной амплификации полиморфной ДНК (RAPD) на отобранных изолятах для определения разнообразия среди фекальных изолятов C. perfringens. ПЦР содержала 5 мкл ДНК, 2,5 мкл RAPD-праймера 2 (10 пМ) (Таблица 1) и 17,5 мкл стерильной воды, которую добавляли в готовую аналитическую бусину RAPD (Life Sciences, 27-9500-01). Смесь выдерживали 5 минут при 95°С, затем осуществляли 45 циклов при 95°С в течение 1 минуты, 36°С в течение 1 минуты, 72°С в течение 2 минут с окончательным удлинением в течение 5 минут при 72°С. Продукты ПЦР наблюдали на анализаторе фрагментов (Advanced Analytics) для определения характера амплификации и импортировали для анализа в BioNumerics, программное обеспечение для биоинформатики. Паттерны RAPD сравнивали с помощью метода корреляционного анализа по Дайсу на основе полос, чтобы определить сходство паттернов RAPD как способа мониторинга различий между изолятами. Отсечение кластера осуществляли при 75% сходстве.
[0688] Для выявления клостридий, у которых не было по меньшей мере одного гена токсина, специфичного для C. perfringens, на изолятах ДНК проводили реакцию ПЦР для амплификации 16S-области рДНК с использованием праймеров 27F-YM и 1492R-Y (Таблица 1). Это было сделано на 20% изолятов, которые не содержали генов токсинов, специфичных для C. perfringens. Смесь для ПЦР содержала 5 мкл 10-кратного ПЦР-буфера, 2 мкл 50 мМ MgCl2, 1 мкл 50 мМ dNTP, 0,4 пМ каждого праймера (Таблица 1), 0,2 мкл Taq ДНК-полимеразы Invitrogen™ Platinum™, 5 мкл ДНК и стерильную воду добавляли до достижения 50 мкл общего реакционного объёма. Смесь выдерживали 4 минуты при 95°С, затем осуществляли 35 циклов при 95°С в течение 30 секунд, 50°С в течение 30 секунд, 72°С в течение 2 минут с окончательным удлинением в течение 7 минут при 72°С. Была проведена проверк качества амплификации, и продукт ПЦР был отправлен в Genewiz (https://www.genewiz.com) для получения последовательностей генов 16S. Последовательности сравнивали со штаммами известного типа, полученными из электронной онлайн базы данных EZbiocloud (http://www.ezbiocloud.net/). На основании сравнений этих последовательностей изолятам присваивали бактериальную идентификацию.
[0689] Результаты: в стаде было зафиксировало 5 смертей коров из-за проблем с пищеварением в период перед обработкой. Продукт Bacillus в соответствии с этим вариантом осуществления настоящего изобретения включали в рацион корма для молочных коров ежедневно, начиная с 4-16-2016, и добавление продолжали до 9-1-2016. В течение этого периода обработки бациллами № 1 в стаде была зарегистрирована одна смерть коровы из-за проблем с пищеварением. Bacillus удаляли из корма на период после обработки с 9-2-2016 по 12-8-2016. За этот период на ферме было зарегистрировано 6 смертей коров из-за проблем с пищеварением. Период обработки Bacillus № 2 начался 12-9-2016, и на ферме не было зарегистрировано смертей коров из-за проблем с пищеварением до 5-1-2017 (Таблица 41).
[0690] Результаты показывают, что ECM увеличился на 3,9 фунта/день, а молочный жир увеличился на 0,3% в течение периода обработки Bacillus (Таблица 42).
[0691] Среднюю температуру регистрировали в периоды времени в 2015 году и сравнивали с теми же периодами времени в 2016 году. Это было сделано для того, чтобы обеспечить положительный отклик производства молока, зарегистрированный во время периода обработки Bacillus, а не просто из-за более низкой средней температуры. В период обработки Bacillus в 2016 году температура была в среднем жарче на +2,6°F в июне и на +2,7°F в июле (Таблица 43).
[0692] Общее количество клостридий на ферме WB (Фиг. 99) существенно не отличалось от данных, полученных во время исследования в Висконсине (Пример 5). В течение первых 16 дней приёма препарата общее количество клостридий значительно снижалось, а затем либо не отличалось (30-е и 86-е сутки), либо было выше (58-е сутки) по сравнению с периодом перед обработкой. Подсчеты количества клостридий для образцов, взятых через 98 дней после отмены продукта, были значительно выше, чем до добавления продукта. Хотя не было никакого снижения C. perfringens в любое время во время или после обработки смесью Bacillus (Фиг. 100), было меньше различий в штаммах C. perfringens, выделенных во время обработки, и это количество поддерживалось после обработки, как показано по индексу Шеннона-Винера паттернов RAPDдля C. perfringens (Таблица 44). Разнообразие нетоксикогенных клостридий также снижалось во время обработки и преобладающие изоляты группы C. beijerinckii были вытеснены изолятами группы C. bifermentans во время оброаботки (Фиг. 101 и Таблица 45). Когда обработка была прекращена, штаммы группы C. beijerinckii снова стали преобладающими нетоксикогенными клостридиями.
[0693] Обсуждение. Смесь штаммов Bacillus в соответствии с данным вариантом осуществления настоящего изобретения, выбранная для ингибирования клостридий, уменьшала количество смертей коров из-за проблем с пищеварением, таких как ГСК. Количество смертей из-за проблем с пищеварением снова увеличилось, когда обработка продуктом была прекращена. Производство молока, измеряемое как ECM и молочный жир, также улучшилось. Это увеличение производства произошло, даже несмотря на то, что в течение периода обработки было больше потенциального теплового стресса. Смесь штаммов Bacillus в соответствии с этим вариантом осуществления настоящего изобретения, выбранная для ингибирования C. perfringens, изначально вызывала снижение общего количества клостридий и уменьшала разнообразие штаммов C. perfringens у коров. Также наблюдалось уменьшение разнообразия нетоксикогенных клостридиальных видов, и продукт вызвал вытеснение штаммов группы C. beijerinckii группой C. bifermentans. Соотношение группы C. beijerinckii снова возросло, когда обработка была прекращена. Эти данные демонстрируют, что продукт в соответствии с вариантом осуществления настоящего изобретения, улучшает здоровье стада и производство молока путём снижения уровней и разнообразия изолятов C. perfringens, а также разнообразия и типов присутствующих видов Clostridium. Снижение доли группы C. beijerinckii, которая, как известно, обеспечивает высокий уровень продукции бутанола и ацетона, вероятно, улучшает ферментацию рубца и повышает эффективность кормления, что приводит к увеличению производства молока у молочных коров.
[0694] Таблица 41. Число смертей коров из-за проблем с пищеварением на ферме WB в Висконсине.
[0695] Таблица 42. Уровни производства ECM отслеживали в течение периода перед обработкой (с 1 апреля 2015 г. по 1 августа 2015 г.) и в течение периода обработки Bacillus (с 1 апреля 2016 г. по 1 августа 2016 г.) на ферме WB в Висконсине.
[0696] Таблица 43. Записи метеостанции - температура в градусах Фаренгейта (F) на ферме WB в Висконсине.
[0697] Таблица 44. Разнообразие RAPD-отпечатков изолятов Clostridium perfringens с течением времени на ферме WB в Висконсине.
[0698] Таблица 45. Разнообразие нетоксикогенных видов Clostridium и изменение пропорций двух преобладающих групп с течением времени на ферме WB в Висконсине.
[0699] Другие варианты осуществления и применения изобретения будут очевидны для специалистов в данной области после изучения настоящего описания и практики применения настоящего изобретения, раскрытого в данном документе. Все ссылки, цитируемые в данном документе по любой причине, включая все ссылки на журналы, а также патенты и патентные заявки США и иностранных патенты и патентные заявки, специально и полностью включены в настоящий документ посредством ссылки. Следует понимать, что настоящее изобретение не ограничивается конкретными реагентами, составами, условиями реакции и т.д., проиллюстрированными и описанными в настоящем документе, но охватывает такие их модифицированные формы, которые не выходят за рамки следующей формулы изобретения.
Библиографические ссылки
Berghaus, R.D., McCluskey, В J., and Callan, RJ. (2005). Risk factors associated with hemorrhagic bowel syndrome in dairy cattle. J. Am. Vet. Med. Assoc. 226, 1700-1706.
Ceci, L., Paradies, P., Sasanelli, M., De Caprariis, D., Guarda, F., Capucchio, M. t., and Carelli, G. (2006). Haemorrhagic Bowel Syndrome in Dairy Cattle: Possible Role of Clostridium perfringens Type A in the Disease Complex. J. Vet. Med. Ser. A 55, 518-523.
Dennison, A.C., VanMetre, D C., Callan, R.J., Dinsmore, P., Mason, G.L., and Ellis, R.P. (2002). Hemorrhagic bowel syndrome in dairy cattle: 22 cases (1997-2000). J. Am. Vet. Med. Assoc. 227, 686-689.
Dennison, A.C., Van Metre, D.C., Morley, P.S., Callan, R.J., Plampin, E.C., and Ellis, R.P. (2005). Comparison of the odds of isolation, genotypes, and in vivo production of major toxins by Clostridium perfringens obtained from the gastrointestinal tract of dairy cows with hemorrhagic bowel syndrome or left-displaced abomasum. J. Am. Vet. Med. Assoc. 227, 132-138.
Due, L.H., Hong, H.A., Fairweather, N., Ricca, E., and Cutting, S.M. (2003). Bacterial spores as vaccine vehicles. Infect. Immun. 77, 2810-2818.
Due, L.H., Hong, H.A., Uyen, N.Q., and Cutting, S.M. (2004). Intracellular fate and immunogenicity of B. subtilis spores. Vaccine 22, 1873-1885.
Hong, H.A., Due, L.H., and Cutting, S.M. (2005). The use of bacterial spore formers as probiotics. FEMS Microbiol. Rev. 29, 813-835.
Hou, X., From, N., Angelidaki, I., Huijgen, W.J.J., and Bjerre, A.-B. (2017). Butanol fermentation of the brown seaweed Laminaria digitata by Clostridium beijerinckii DSM-6422. Bioresour. Technol. 238, 16-21.
Kosaka, T., Maeda, T., Nakada, Y., Yukawa, M., and Tanaka, S. (1998). Effect of Bacillus subtilis spore administration on activation of macrophages and natural killer cells in mice. Vet. Microbiol. 60, 215-225.
Leja, К., Samul, D., Drozdzynska, A., Myszka, K., Juzwa, W., Pawlicka, J., and Czaczyk, K. (2014). Hypothetical glycerol pathways of newly isolated strains capable of 1,3-propanediol production. ActaBiochim. Pol. 61, 759-763.
Luo, C., Liu, X., Zhou, H., Wang, X., and Chen, Z. (2015a). Nonribosomal peptide synthase gene clusters for lipopeptide biosynthesis in Bacillus subtilis 916 and their phenotypic functions. Appl. Environ. Microbiol. 81, 422-431.
Luo, C., Liu, X., Zhou, X., Guo, J., Truong, J., Wang, X., Zhou, H., Li, X., and Chen, Z. (2015b). Unusual biosynthesis and structure of locillomycins from Bacillus subtilis 916. Appl. Environ. Microbiol. 81, 6601-6609.
McDonald, P., Henderson, A.R., and Heron, S.J.E. (1991). The biochemistry of silage (Chalcombe Publications).
Muck, R.E. (2010). Silage microbiology and its control through additives. Rev. Bras. Zootec. 39, 183-191.
Myszka, K., Leja, K., Olejnik-Schmidt, A.K., and Czaczyk, K. (2012). Isolation process of industrially useful Clostridium bifermentans from natural samples. J.
Biosci. Bioeng. 113, 631-633.
Rajput, I.R., Ying, H., Yajing, S., Arain, M.A., Weifen, L., Ping, L., Bloch, D.M., and Wenhua, L. (2017). Saccharomyces boulardii and Bacillus subtilis B10 modulate TLRs and cytokines expression patterns in jejunum and ileum of broilers. PLOS ONE 12, e0173917.
Seglar, B. (2003). Fermentation analysis and silage quality testing.
Sockett, D.C. (2004). Hemorrhagic bowel syndrome. In Proceedings of the 2 Mid-Atlantic Nutrition Conference, (College Park, MD), pp. 139-145.
Songer, J.G. (1996). Clostridial enteric diseases of domestic animals. Clin. Microbiol. Rev. 9, 216-234.
Weng, H., Endo, K., Li, J., Kito, N., and Iwai, N. (2015). Induction of Peroxisomes by Butyrate-Producing Probiotics. PLoS ONE 10.
Yoo, H.S., Lee, S.U., Park, K.Y., and Park, Y.H. (1997). Molecular typing and epidemiological survey of prevalence of Clostridium perfringens types by multiplex PCR. J. Clin. Microbiol. 55, 228-232.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ЧЁРЧ ЭНД ДВАЙТ КО., ИНК.
<120> КОМПОЗИЦИИ ШТАММОВ BACILLUS И СПОСОБЫ ИХ ПРИМЕНЕНИЯ
В ОТНОШЕНИИ ЖВАЧНЫХ ЖИВОТНЫХ
<130> 2994.016
<150> 62/341332
<151> 2016-05-25
<160> 34
<210> 1
<211> 10
<212> DNA
<213> Artificial Sequence
<400> 1
GGTGCGGGAA 10
<210> 2
<211> 10
<212> DNA
<213> Artificial Sequence
<400> 2
GTTTCGCTCC 10
<210> 3
<211> 10
<212> DNA
<213> Artificial Sequence
<400> 3
GTAGACCCGT 10
<210> 4
<211> 10
<212> DNA
<213> Artificial Sequence
<400> 4
AAGAGCCCGT 10
<210> 5
<211> 10
<212> DNA
<213> Artificial Sequence
<400> 5
AACGCGCAAC 10
<210> 6
<211> 10
<212> DNA
<213> Artificial Sequence
<400> 6
CCCGTCAGCA 10
<210> 7
<211> 24
<212> DNA
<213> Artificial Sequence
<400> 7
GTTGATAGCG CAGGACATGT TAAG 24
<210> 8
<211> 24
<212> DNA
<213> Artificial Sequence
<400> 8
CATGTAGTCA TCTGTTCCAG CATC 24
<210> 9
<211> 24
<212> DNA
<213> Artificial Sequence
<400> 9
ACTATACAGA CAGATCATTC AACC 24
<210> 10
<211> 24
<212> DNA
<213> Artificial Sequence
<400> 10
TTAGGAGCAG TTAGAACTAC AGAC 24
<210> 11
<211> 24
<212> DNA
<213> Artificial Sequence
<400> 11
ACTGCAACTA CTACTCATAC TGTG 24
<210> 12
<211> 24
<212> DNA
<213> Artificial Sequence
<400> 12
CTGGTGCCTT AATAGAAAGA CTCC 24
<210> 13
<211> 24
<212> DNA
<213> Artificial Sequence
<400> 13
GCGATGAAAA GCCTACACCA CTAC 24
<210> 14
<211> 24
<212> DNA
<213> Artificial Sequence
<400> 14
GGTATATCCT CCACGCATAT AGTC 24
<210> 15
<211> 10
<212> DNA
<213> Artificial Sequence
<400> 15
GTTTCGCTCC 10
<210> 16
<211> 20
<212> DNA
<213> Artificial Sequence
<400> 16
AGAGTTTGAT YMTGGCTCAG 20
<210> 17
<211> 16
<212> DNA
<213> Artificial Sequence
<400> 17
TACCTTGTTA YGACTT 16
<210> 18
<211> 20
<212> DNA
<213> Artificial Sequence
<400> 18
TGACGAGGCC CAGAGCAAGA 20
<210> 19
<211> 20
<212> DNA
<213> Artificial Sequence
<400> 19
ATGGGCACAG TGTGGGTGAC 20
<210> 20
<211> 20
<212> DNA
<213> Artificial Sequence
<400> 20
CCCCTTGGTT CAGAGGATCG 20
<210> 21
<211> 20
<212> DNA
<213> Artificial Sequence
<400> 21
CCCCTTGGTT CAGAGGATCG 20
<210> 22
<211> 18
<212> DNA
<213> Artificial Sequence
<400> 22
GGCCCGAGGC AACACAT 18
<210> 23
<211> 20
<212> DNA
<213> Artificial Sequence
<400> 23
GGGCCATGGA ACTGATGAGA 20
<210> 24
<211> 24
<212> DNA
<213> Artificial Sequence
<400> 24
GGCAGACTCA CAGGCTTCAA TATC 24
<210> 25
<211> 23
<212> DNA
<213> Artificial Sequence
<400> 25
GGCGTGAACC ACGAGAAGTA TAA 23
<210> 26
<211> 22
<212> DNA
<213> Artificial Sequence
<400> 26
ACTTCGAGGC AAAGGGAGAT AC 22
<210> 27
<211> 21
<212> DNA
<213> Artificial Sequence
<400> 27
TCCTGAAACC CACTCCCAAC A 21
<210> 28
<211> 22
<212> DNA
<213> Artificial Sequence
<400> 28
GGCTACGGAA CTGGACATCA AC 22
<210> 29
<211> 22
<212> DNA
<213> Artificial Sequence
<400> 29
ATGACTTCTG CTTTCCCTAC CC 22
<210> 30
<211> 22
<212> DNA
<213> Artificial Sequence
<400> 30
CACGTTTCCT CTCCTAAGAA GC 22
<210> 31
<211> 22
<212> DNA
<213> Artificial Sequence
<400> 31
CCAGATGCAA TTAACTCCCA AG 22
<210> 32
<211> 21
<212> DNA
<213> Artificial Sequence
<400> 32
AAGCAGAAGT GGGTCCAGAC T 21
<210> 33
<211> 24
<212> DNA
<213> Artificial Sequence
<400> 33
TCCACGGACT GTGGTACATG AAGA 24
<210> 34
<211> 24
<212> DNA
<213> Artificial Sequence
<400> 34
TCAGAGTTTC CTGCAGTGGG TCAA 24
<---
Реферат
Изобретение относится к композициям, содержащим штаммы Bacillus, и их применению. Предложена композиция для снижения уровня Clostridium в жвачных животных, содержащая эффективное количество биологически чистой культуры штамма Bacillus, выбранного из группы, состоящей из штамма Bacillus subtilis 1104, депонированного в коллекции NRRL с регистрационным номером NRRL В67258, штамма Bacillus subtilis 1781, депонированного в коллекции NRRL с регистрационным номером NRRL В67259, штамма Bacillus subtilis 747, депонированного в коллекции NRRL с регистрационным номером NRRL В67257, штамма Bacillus subtilis 1541, депонированного в коллекции NRRL с регистрационным номером NRRL В67260, и штамма Bacillus subtilis 2018, депонированного в коллекции NRRL с регистрационным номером NRRL В67261. Также предложена композиция для применения в качестве микробного препарата, контролирующего качество силоса, для ингибирования роста клостридий в массе силоса, содержащая эффективное количество штаммов. Также предложены способы с использованием указанных композиций и применения указанных штаммов. Изобретение обеспечивает эффективное подавление клостридий, таких как C. Рerfringens, и нетоксикогенных клостридий. 8 н. и 12 з.п. ф-лы, 101 ил., 44 табл., 18 пр.

Комментарии