Способ проведения реакции глицерина с образованием органических солей - RU2617420C2
Код документа: RU2617420C2
Описание
Область техники, к которой относится изобретение
Настоящее изобретение в целом относится к способу проведения реакции глицерина в высококонцентрированных жидких водных растворах гидроксидов металлов.
Уровень техники
Глицерин (глицерин по номенклатуре IUPAC (Международный союз теоретической и прикладной химии)) является тривиальным названием и общепринятым названием пропан-1,2,3-триола. Глицерин можно получить путем химической переработки нефти через промежуточные продукты, аллилхлорид и эпихлоргидрин, или он образуется химически в качестве побочного продукта омыления натуральных жиров и масел при синтезе мыл. В настоящее время большие количества глицерина получают в качестве побочного продукта при производстве биодизельного топлива. Его получают в основном при переэтерификации растительных масел метанолом. Одна молекула жира (триацилглицерид) вступает в реакцию с тремя молекулами метанола и образуется одна молекула глицерина и три молекулы метилового эфира жирной кислоты (МЭЖК).
В зависимости от методики переэтерификации образуется 100 кг глицерина в пересчете на 1 тонну биодизельного топлива. До настоящего времени для этого глицерина существовало очень незначительное количество путей промышленного применения. Традиционные области применения глицерина в косметической, пищевой промышленности, промышленности безалкогольных напитков и фармацевтической промышленности в значительной степени исчерпаны.
Вследствие этого, избыточные количества глицерина, полученного при производстве биодизельного топлива, частично сбрасывают в сточные воды или сжигают с целью получения энергии.
Альтернативными вариантами применения являются, например, производство биогаза, химическое превращение в топливо и смазывающие вещества или использование в качестве кормовой добавки.
Вследствие его хорошей химической реакционной способности глицерин также является подходящим сырьем для производства химических реагентов, которые в ином случае получают из нефти. Проводится испытание новых методик производства с использованием глицерина, например эпихлоргидрина или пропиленгликоля, и многочисленные научно-исследовательские проекты направлены на поиск новых областей применения глицерина в качестве сырья.
Однако существует немного полностью разработанных технологий регенерации неочищенного глицерина.
В US 7829740 B2 описан способ получения лактата из глицерина путем введения глицерина в гидротермальную реакцию в щелочной среде.
Задача настоящего изобретения
Задачей настоящего изобретения является превращение глицерина и предпочтительно глицерина, полученного при производстве биодизельного топлива, в коммерчески ценный продукт.
Эта задача решена способом, соответствующим пункту 1 формулы изобретения.
Общее описание изобретения
В частности, эта задача решена способом проведения реакции глицерина, в котором глицерин вводят в реакцию при температурах выше 150°C в жидком водном растворе гидроксида Me, где концентрация гидроксида Me выше концентрации в насыщенном растворе при комнатной температуре, где Me выбран из группы, включающей щелочные металлы и щелочноземельные металлы и их смеси, и указанная реакция приводит к получению по меньшей мере одной соли, выбранной из группы, включающей формиат, ацетат, пропионат, оксалат, лактат, бутират, валерат, цитрат, адипат, сукцинат, малат и карбонат и их смеси, и газообразного водорода (H2) или метана (CH4) и их смесей.
Поэтому способ проводят в высококонцентрированном водном растворе гидроксида Me при температурах в области жидкого состояния системы, в диапазоне от температуры плавления до температуры кипения, предпочтительно близких к температуре кипения, где концентрация гидроксида Me выше концентрации в насыщенном растворе при комнатной температуре.
Способ предпочтительно проводят при давлении, равном от 800 до 1500 гПа, предпочтительно от 950 до 1050 гПа и особенно предпочтительно при атмосферном давлении.
В качестве гидроксида Me предпочтительно использовать NaOH или KOH, или их смеси.
В предпочтительном варианте осуществления концентрация гидроксида Me равна более 54 мас. %, предпочтительно более 60 мас. %, особенно предпочтительно более 70 мас. % и еще более предпочтительно более 80 мас. %, и наиболее предпочтительно более 85 мас. %.
Реакцию предпочтительно проводят при температуре выше 150°C, особенно предпочтительно выше 160°C и еще более предпочтительно выше 180°C, и наиболее предпочтительно выше 200°C.
В отличие от способа, описанного в патенте US 7829740 B2, способ, предлагаемый в настоящем изобретении, можно проводить без использования высокого давления, поскольку температура кипения высококонцентрированного раствора гидроксида Me сильно повышена и значительно превышает 100°C. Кроме того, полученную соль по меньшей мере частично выделяют прямо на стадии проведения реакции и не проводят дополнительные стадии выделения. Поэтому способ проводят значительно более простым и безопасным образом, чем способ, описанный в патенте US 7829740 B2. Использование высокой концентрации гидроксида позволяет проводить способ при высоких температурах без использования высокого давления, поскольку температура кипения высококонцентрированного водного раствора гидроксида Me значительно выше, чем температура кипения воды.
Реакцию предпочтительно проводят при температурах, равных температуре кипения раствора гидроксида, причем температура кипения повышается с увеличением концентрации раствора гидроксида. Для предотвращения удаления воды из реакционного сосуда предпочтительно используют обратный холодильник. Пары, образующиеся в ходе реакции, могут конденсироваться на охлаждающих поверхностях и поступать обратно в реакционную смесь. В качестве охлаждающего средства в обратном холодильнике используют, например, проточную воду.
В контексте настоящего изобретения "температуры, равные температуре кипения" следует понимать, как означающие температуру, которая отличается от температуры кипения раствора гидроксида Me не более чем на 15°C, предпочтительно не более чем на 10°C, особенно предпочтительно не более чем на 7,5°C, и наиболее предпочтительно не более чем на 5°C.
Например, если температура кипения раствора гидроксида натрия равна 150°C, то в контексте настоящего изобретения температурный диапазон следует понимать, как означающий диапазон от 135 до 165°C. Кроме того, добавление глицерина приводит к смещению температуры кипения не поддающимся прогнозированию образом, поскольку двухкомпонентная система гидроксид Me-H2O превращается во многокомпонентную систему вследствие наличия продуктов реакции, образующихся при добавлении глицерина.
В предпочтительном варианте осуществления способ проводят с использованием NaOH при концентрации, находящейся в диапазоне 60-80%, при температурах ниже 180°C. При этих температурах в основном образуется лактат.
Неожиданно было установлено, что при этих условиях выход лактата, составляющий более 97%, является намного более высоким, чем при использовании условий, находящихся за пределами этого диапазона. Эксперименты, проведенные в контексте настоящего изобретения, показали, что, например, при концентрации NaOH, равной 83%, и температуре, равной 222°C, образуется лишь 10,5% лактата, тогда как при 67% NaOH/175°C содержание лактата в конечном продукте составляет примерно 98%.
Во втором предпочтительном варианте осуществления способ проводят при температурах, находящихся в диапазоне 220-260°C, предпочтительно при 235°C, и в основном получают ацетат, пропионат или оксалат, а также их смеси. При использовании атмосферного давления и концентрации NaOH, равной более 85%, предпочтительно концентрации NaOH, равной более 93%, и температур выше 220°C, предпочтительно выше 260°C, в основном получают ацетат или пропионат, а также их смеси.
Неожиданно установлено, что при этих температурах в основном получают ацетат, пропионат и оксалат, и не получают лактат. Лактат получают при более низких температурах. Эксперименты, проведенные в контексте настоящего изобретения, показали, что, например, при 235°C образуется 35 мас. % ацетата, 30 мас. % пропионата и 25 мас. % оксалата и при температурах, равных 260°C, образуется 52 мас. % ацетата, 42 мас. % пропионата.
В другом предпочтительном варианте осуществления водный раствор гидроксида Me выдерживают при непрерывном перемешивании при температурах, близких к температуре кипения, и глицерин дозируют в раствор гидроксида Me.
Предпочтительно, если перед дозированием в раствор гидроксида Me глицерин предварительно нагревают.
Особенно предпочтительно, если в качестве гидроксида Me используют NaOH.
Предпочтительно, если глицерин образуется при производстве биодизельного топлива.
Способ может являться непрерывным или даже периодическим способом.
В предпочтительном варианте осуществления воду, образующуюся при превращении глицерина, полностью или частично удаляют.
Подробное описание изобретения на основании примеров
Дополнительные подробности и преимущества настоящего изобретения можно понять из приведенного ниже подробного описания возможных вариантов осуществления настоящего изобретения на основании примеров.
Превращение глицерина с использованием высококонцентрированных водных растворов NaOH, обладающих концентрацией NaOH, находящейся в диапазоне ≥53 мас. %, исследовали при температурах, близких к температурам кипения растворов NaOH. В качестве глицерина предпочтительно использовать глицерин, образующийся при производстве биодизельного топлива. Однако для упрощения процедуры в экспериментах использовали чистый глицерин, а также глицерин, содержание воды в котором являлось таким же, как в неочищенном глицерине, образующемся при производстве биодизельного топлива.
В проводимых экспериментах способ включал следующие стадии:
- твердые гранулы NaOH смешивали с H2O в разных соотношениях и кипятили с обратным холодильником;
- максимальная рабочая температура определяется температурой кипения смеси NaOH - H2O при атмосферном давлении и для концентраций NaOH > 50 мас. % она зависит от концентрации и находится в температурном диапазоне примерно от 140 до более 300°C;
- глицерин дозировали под поверхность перемешиваемого раствора NaOH, вследствие чего происходила быстрая экзотермическая реакция. В периодических способах глицерин, воду и NaOH смешивали и затем нагревали;
- единственными газообразными продуктами реакции являлись H2 и CH4, причем содержание H2 составляло более 90 об. %;
- продуктами реакции являлись сода (Na2CO3) и органические соли натрия, выбранные из группы, включающей формиат, ацетат, пропионат, оксалат, лактат, бутират, валерат, цитрат, адипат, сукцинат и малат;
- селективность реакции можно регулировать так, чтобы предпочтительно образовывались конкретные соли.
Сравнительный пример
Периодический способ, проводимый при атмосферном давлении и концентрации NaOH, равной менее 54% (лабораторный масштаб)
Насыщенный раствор, содержащий осадок, готовили при комнатной температуре (23°C) путем добавления примерно 200 г NaOH примерно к 150 мл H2O. Насыщенный раствор, номинально содержащий 47 мас. % H2O/53 мас. % NaOH (согласно приведенной в литературе фазовой диаграмме), сливали с осадка в многогорлую стеклянную колбу. Добавляли чистый глицерин (2 мл, 99,6%) и смесь при перемешивании медленно нагревали. Перед нагреванием сначала откачивали воздушную прослойку над смесью и затем смесь продували азотом. Образующийся газ направляли через Y-образный запорный клапан, затем через расположенную сверху трубку для охлаждения газа в газометр.
Температуру реакционной смеси измеряли с помощью погруженной термопары. Выделение газа начиналось при 144°C, что должно быть связано с достижением температуры кипения (литературные данные: 147°C), поскольку с помощью присоединенного газометра не установлено увеличение объема. Температуру понижали до равной немного ниже температуры кипения и поддерживали в течение более 1 ч. С помощью лупы можно было наблюдать отдельные пузырьки газа, но было невозможно определить являются ли они пузырьками газа, образующегося при реакции вещества, или пузырьками водяного пара.
Анализ реакционной смеси с помощью ионной хроматографии показал отсутствие продуктов реакции. Провести анализ газа было невозможно, поскольку его количество было слишком мало.
Пример 1
Периодический способ, проводимый при атмосферном давлении (опытная установка)
При перемешивании в реактор помещали твердый NaOH (25 кг), воду (5 кг) и глицерин (3,3 кг) при отношении количеств, составляющем 75% NaOH/15% H2O/10% глицерина, и перемешивали при комнатной температуре в атмосфере инертного газа (N2). Только часть NaOH (не более примерно 5 кг в пересчете на чистую воду) растворялась при комнатной температуре и образовывалась вязкая суспензия. Эту неоднородную смесь медленно нагревали со скоростью, равной 2°C/мин, в результате чего растворялось все большее количество NaOH. При продолжении растворения NaOH температура кипения смеси повышалась. Следили за тем, чтобы смесь не начала кипеть.
Однородную жидкую смешанную фазу получали только примерно при 185°C. Перед этим примерно при 160°C наблюдали образование первых пузырьков газа (H2), что указывало на начало необходимой реакции. С постепенным повышением температуры образование газа усиливалось. Температуру непрерывно повышали до 218°C. Эта температура являлась максимальной температурой системы при нормальном давлении, поскольку смесь бурно кипела.
Реакционную смесь выдерживали в течение еще 4 ч при умеренном кипении при 215°C. Полученный газ направляли через выпускную трубку и охлаждали вместе с паром с помощью обратного холодильника.
Состав газа непрерывно анализировали с помощью термокондуктометрической ячейки и количество водорода достигло максимального значения, составляющего 100 об. %.
По мере протекания реакции количество твердой дисперсной фазы в жидкой реакционной смеси увеличивалось. Образец этой суспензии отсасывали для последующего анализа.
Анализ органических солей натрия проводили с помощью капиллярного электрофореза. Результаты представлены в приведенной ниже таблице. Из 3,3 кг исходного глицерина получали 4,1 кг органических солей; массовый выход составлял более 100%. Поэтому в таблице представлен только баланс углерода, т.е. отношение количества углерода, содержащегося в продуктах (С-солей), к полному количеству углерода в исходном глицерине (С-глицерина).
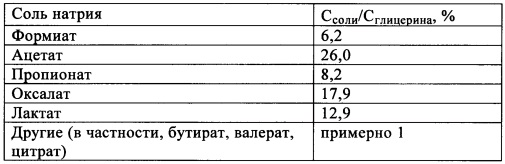
В заключение следует отметить, что более 70 мас. % исходного углерода повторно найдено в продуктах, органических солях Na, в основном в ацетате и оксалате. Оставшийся исходный углерод неорганически связан в виде Na2CO3. Содержанием углерода во фракции метана пренебрегали и не учитывали при расчетах.
Поэтому превращение глицерина можно считать почти полным.
Пример 2
Полунепрерывный способ или способ с периодической загрузкой, проводимый при атмосферном давлении (лабораторный масштаб)
Пример 2a): с использованием менее 50 мас. % NaOH
В стеклянной колбе NaOH (15,04 г) смешивали с водой (34,34 г) и после продувания азотом смесь нагревали на песчаной бане до температуры кипения. Смесь, номинально содержащую 30,45% Na, выдерживали при температуре кипения (температура, измеренная с помощью погруженной термопары: 119°C), образующийся водяной пар конденсировался в обратном холодильнике, и вода стекала обратно в раствор.
С помощью капилляра под поверхность кипящей смеси вводили безводный чистый глицерин (0,5 мл). Эту процедуру повторяли через 2 мин и повторно через 10 мин, используя количество, равное 1 мл. Реакционную смесь выдерживали при температуре кипения в течение 105 мин.
Было невозможно обнаружить признаки какой-либо реакции, проявляющиеся, например, в виде пенообразования, помутнения и т.п.
После охлаждения всю реакционную смесь анализировали с помощью ионной хроматографии. Не обнаружено никакого продукта реакции.
Пример 2b) с использованием более 54 мас. % NaOH
Твердые гранулы NaOH (87,5 г) и дистиллированную воду (14,6 г) (соответствует NaOH (85,7 мас. %) и H2O (14,3 мас. %)) отвешивали в многогорлую колбу. Колбу продували с помощью N2 и затем смесь при перемешивании кипятили с обратным холодильником до полного растворения NaOH (примерно при 220°C). Выходное отверстие обратного холодильника было присоединено к газометру.
Затем температуру медленно повышали до максимально возможной температуры проведения реакции при атмосферном давлении, т.е. до рассчитанной температуры кипения смеси, равной 230°C (получена путем экстраполяции на основе литературных данных), в действительности измеренной равной 243°C (различие, вероятно, обусловлено изменением концентрации, происходящим вследствие наличия фракции воды, которая циркулирует в кипящей системе). Температуру измеряли с помощью термопары, погруженной в реакционную смесь.
После установления температуры, равной температуре кипения, под поверхность перемешиваемого раствора NaOH на глубине примерно 1 см через калиброванный шприц объемом 2 мл и с использованием герметизированного капилляра, изготовленного из нержавеющей стали, расположенного на горле стеклянной колбы, быстро добавляли предварительно немного нагретый чистый (99,6%, примерно 35°C) глицерин (0,7 г).
При добавлении глицерина сразу происходило образование газа. Примерно каждые 10 мин через мембрану с помощью газонепроницаемого шприца отбирали образец газа и его сразу анализировали с помощью газовой хроматографии. Результаты были следующими: примерно 96 об. % H2 и 4 об. % CH4.
Примерно через 1 ч повторно добавляли глицерин (1,31 г) и отбирали образцы газа, в которых содержалось примерно 98 об. % H2 и 2 об. % CH4.
При добавлении глицерина сразу наблюдали образование белого твердого вещества. При перемешивании оно оставалось в виде суспензии и в ходе проведения эксперимента вязкость реакционной смеси увеличивалась (перемешивание становилось более затруднительным).
Затем содержимое колбы анализировали для определения содержания карбоната и органических веществ. Обнаружены Na2CO3, формиат Na, ацетат Na, пропионат Na и оксалат Na, однако вследствие особенностей методики не все вещества можно было обнаружить. Отдельные вещества не выделяли и не проводили количественный анализ.
Пример 3
Полунепрерывный способ или способ с периодической загрузкой, проводимый при атмосферном давлении (опытная установка)
В реакторе с перемешивающим устройством воду (20 кг) предварительно нагревали примерно до 70°C таким образом, что практически не образовывался водяной пар. Через загрузочный сосуд порциями добавляли NaOH и перемешивали таким образом, что повышающаяся температура раствора вследствие сильного разогрева раствора оставалась намного ниже температуры кипения раствора и не происходило удаление паров воды через загрузочный сосуд. Образующиеся незначительные количества водяного пара конденсировались в обратном холодильнике и поглощались с помощью NaOH в загрузочным сосуде, последний герметизировали пластмассовой крышкой. После последующего перемешивания и проводимого порциями добавления NaOH до обеспечения полного количества, равного 100 кг, температуру смеси постоянно повышали путем внешнего нагревания реактора до полного растворения NaOH. Температура жидкости, измеренная с помощью нескольких погруженных термопар, находилась в диапазоне от 180 до 190°C (литературное значение для 83,3 мас. % NaOH=185°C). Загрузочный сосуд закрывали, затем содержимое реактора нагревали с обратным холодильником до температуры кипения и затем выдерживали при этой температуре или при температуре не более чем на 5°C ниже этой температуры.
После продувания азотом чистый глицерин (99,6%) предварительно нагревали до 70°C в питающем сосуде и затем добавляли через круглое сопло под поверхность перемешиваемой реакционной смеси на глубине примерно 25 см.
В нескольких сериях экспериментов, проводимых по аналогичным методикам, концентрацию NaOH меняли в диапазоне от 68 до 93 мас. %, температуру проведения реакции меняли в диапазоне от 175 до 270°C и скорость загрузки глицерина меняли в диапазоне от 0,5 до 25 кг/ч.
Непосредственно после добавления начиналось образование газа, в котором увеличивалось содержание H2. Объемы и составы газов определяли с помощью встроенного оборудования или анализировали с помощью газометра и специального детектора теплопроводности.
Измерены разные скорости образования газа и это указывало на последовательность множества вторичных реакций с образованием разных продуктов.
После проведения реакции в течение примерно от 30 до 90 мин всегда обеспечивалась максимальная концентрация водорода, которая всегда составляла не менее 97 об. % и даже достигала 100%. Для проведения более точного анализа из потока газа с помощью контейнера для отбора образцов отбирали дополнительные образцы газа. С помощью газовой хроматографии в них обнаружены лишь незначительные фракции метана и следовые количества дополнительных органических веществ, находящиеся в диапазоне част./млн.
За тем, что происходило внутри реактора с перемешивающим устройством, можно было наблюдать визуально через смотровое стекло, при этом в дополнение к образованию газа также можно было наблюдать образование твердого продукта реакции. Он всплывал на всей площади поверхности вследствие выходящих из круглого сопла пузырьков газа и образовывался рыхлый слой пены, который становился все более плотным и превращался в густой осадок.
После завершения добавления глицерина температуру поддерживали в течение по меньшей мере 2 ч и наблюдали последующую реакцию с образованием газа. После того как образование газа практически завершалось (менее 1 л/мин), реактор продували азотом, открывали и плавающий продукт полностью снимали.
Последующий анализ, проводимый с помощью капиллярного электрофореза, ионной хроматографии, ИКФС (инфракрасная Фурье-спектроскопия), ПРГГ (порошковая рентгенография), ОНУ (общее содержание неорганического углерода), ООУ (общее содержание органического углерода), ТГА (термогравиметрический анализ), показал наличие смеси органических солей натрия (карбоксилаты натрия), каждая из которых содержалась в разных количествах в зависимости от условий проведения реакции. Обнаружены следующие соли натрия: формиат, ацетат, пропионат, оксалат, н-бутират, изобутират, н-валерат, изовалерат, лактат, цитрат, сукцинат, адипат и малат, а также некоторые другие вещества, которые невозможно точно классифицировать с помощью соответствующих методик детектирования. Кроме того, в образцах обнаружена неорганическая соль, Na2CO3, и ее содержание определяли путем титрования кислотой.
Аналогичным образом отбирали образцы из жидкого расплава, находящегося под плавающим твердым веществом. Они содержали такие же органические соли, но обладали другим количественным составом.
Затем оставшийся расплав выливали и оставляли затвердевать. При этом на разных стадиях охлаждения при разных температурах кристаллизовались разные твердые фазы, обладающие разным составом.
В приведенной ниже таблице представлены количества каждой соли Na в полном количестве смеси, т.е. включая количества, определенные в оставшемся расплаве, а также выход, выраженный, как отношение количества углерода, содержащегося в продуктах (С-солей), к полному количеству углерода в исходном глицерине (С-глицерина).
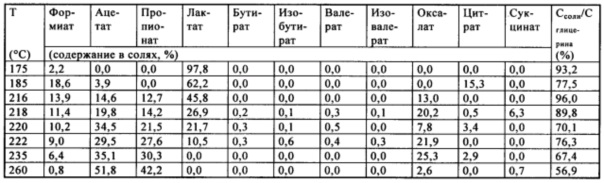
Очевидно, что при изменении температуры меняется содержание соли, например:
- содержание ацетата увеличивается от 0 до примерно 52 мас. % в диапазоне температур 175-260°C;
- содержание лактата уменьшается примерно от 98 до 0 мас. % в диапазоне температур 175-260°C;
- максимальное содержание формиата, равное примерно 19%, наблюдается в диапазоне от 180 до 200°C.
Таким образом, температуру проведения реакции можно использовать в качестве параметра для регулирования селективности, в зависимости от того, какую соль предпочтительно получить.
Кроме того, для селективного получения можно использовать данные о разном распределении количеств солей в твердом веществе и в расплаве.
Кроме того, разные соли можно получить селективно и с высокой чистотой путем регулируемой (фракционной) кристаллизации оставшегося расплава.
Выходы органических солей натрия (последний столбец) уменьшаются с увеличением температуры. В то же время выходы карбоната Na увеличиваются. В последнем столбце количество углерода, которого не хватает до 100%, в основном дополнено углеродом, содержащемся в карбонате Na.
Пример 4
По аналогии с примером 3 в реактор помещали воду (20 кг) и твердый NaOH (60 кг), что соответствовало концентрации NaOH, равной 75 мас. %. При этой концентрации температура области жидкой фазы составляла примерно 124°C (между температурой плавления, равной 71°C, и температурой кипения, равной 195°C).
Температуру повышали до 180°C, т.е. она была на 15°C ниже температуры кипения.
После продувания азотом чистый глицерин (99,6%), предварительно нагретый до 80°C, добавляли при скорости, равной 14 кг/ч, всего 32,5 кг.
Реакцию проводили в течение примерно 1¼ ч при постоянной температуре, равной 180°C, затем, несмотря на установленное на регуляторе значение, истинная температура реакционной смеси начинала медленно снижаться. Это можно объяснить тем, что происходило медленное разбавление реакционной смеси вследствие образования воды в ходе реакции (например, C3H8O3+NaOH→CH3CH(OH)COONa+H2O+H2), при постоянной температуре исходная концентрация реакционной смеси смещается в область концентрации, при которой происходит кипение системы, и затем при дополнительном разбавлении температура кипения системы (= теоретическая максимальная температура) снижается.
Дальнейшее снижение температуры реакционной смеси предотвращали путем регулируемого удаления конденсированной воды (примерно 16 г/мин) из фазы водяного пара. В течение оставшегося времени проведения реакции систему выдерживали в неизменном состоянии при температуре ее кипения, равной 173°C, что в соответствии с литературными данными соответствовало нормальной концентрации NaOH, равной примерно 66-67 мас. %.
Последующая процедура и наблюдения соответствовали описанным в примере 3, где в данном случае наблюдали существенно более продолжительное протекание вторичной реакции, т.е. даже через 8 ч образование газа, обладающего полным объемом, равным примерно 9000 л, и содержанием водорода, составляющим 99,8%, еще не окончательно завершалось.
Плавающий твердый продукт содержал лактат, оксалат, формиат и ацетат в соотношении 51:25:12:1.
Оставшаяся смесь не содержала оксалат, а только лактат, формиат и ацетат в соотношении 54:11:1.
В приведенной ниже таблице представлен полный выход в пересчете на количество исходного глицерина:

Эксперимент, вероятно, закончился до того, как реакция полностью завершилась, поскольку в реакцию вступило всего только примерно 80% глицерина.
Можно предположить, что более низкая степень превращения по сравнению с другими экспериментами обеспечивалась, во-первых, вследствие высокой скорости загрузки и, во-вторых, также тем, что превращение в ходе загрузки не происходило при максимально возможной температуре системы (= температура кипения), и, следовательно, происходило при более низкой скорости реакции.
Реферат
Изобретение относится к способу получения по меньшей мере одной соли, выбранной из группы, включающей формиат, ацетат, пропионат, оксалат, лактат, бутират, валерат, цитрат, адипат, сукцинат, малат и карбонат и их смеси, путем проведения реакции глицерина, в котором глицерин вводят в реакцию при температурах выше 150°С в жидком водном растворе гидроксида Me, где концентрация гидроксида Me выше концентрации в насыщенном растворе при комнатной температуре, где Me выбран из группы, включающей щелочные металлы и щелочноземельные металлы и их смеси, и указанная реакция приводит к получению по меньшей мере одной соли, выбранной из группы, включающей формиат, ацетат, пропионат, оксалат, лактат, бутират, валерат, цитрат, адипат, сукцинат, малат и карбонат и их смеси, и газообразного водорода (Н) или метана (СН) и их смесей. Способ позволяет глицерин, особенно глицерин, полученный при производстве биодизеля, превратить в коммерчески ценный продукт. Продукты – различные соли, можно получить селективно и с высокой чистотой. 14 з.п. ф-лы, 4 пр., 2 табл.

Комментарии