Индукция толерантности к антигенам через слизистую - RU2420569C2
Код документа: RU2420569C2
Чертежи









Описание
Настоящее изобретение относится к индукции толерантности к антигенам через слизистую оболочку, предпочтительно, посредством оральной доставки антигена в комбинации с микроорганизмом, вырабатывающим иммуномодулирующее соединение. В более специфичном воплощении изобретение относится к индукции антигенспецифических регуляторных T-клеток, вырабатывающих Foxp3+ и/или IL-10 и/или TGF-β, которые способны подавлять нежелательный иммунный ответ на антиген, что достигается посредством оральной доставки указанного антигена в комбинации с микроорганизмом, секретирующим иммуносупрессорный цитокин.
Область техники, к которой относится изобретение
Задача иммунной системы заключается в том, чтобы четко разделять свое и чужое. Иммунная система слизистой, представленная на протяжении дыхательного, желудочно-кишечного тракта и мочеполовых путей, несет дополнительную нагрузку, постоянно сосуществуя с огромным количеством бактерий и безвредных антигенов, например, поступающих с пищей, вдыхаемых с воздухом, а также с симбиотической бактериальной флорой. Отличительная особенность иммунной системы слизистой заключается в том, что, эффективно противодействуя патогенам, она способна сохранять толерантность к безвредным антигенам. Системное введение антигенов при инъекции или травме приводит к локальной инфильтрации воспалительных клеток и выработке специфических иммуноглобулинов. В отличие от этого, поступление антигенов через поверхность слизистых оболочек, например, желудочно-кишечного тракта и мочеполовых путей, вызывает активное подавление иммунного ответа на те же антигены при их системном введении в организм. Специфическая индукция таких регламентированных (управляемых) реакций посредством введения антигена в желудочно-кишечный тракт известна как оральная толерантность. Оральное введение антигена может привести к блокированию иммунного ответа на системном уровне, что представляет собой впечатляющую альтернативу иммуносупрессорным медицинским вмешательствам (например, применению стероидов), для которых характерны нежелательные побочные эффекты. Настоящее изобретение, в частности, лежит в сфере низкодозовой толерантности, достигаемой при повторных контактах с низкими дозами антигена. Индукция толерантности через слизистую была предложена как стратегия лечения аутоиммунных, аллергических и воспалительных заболеваний.
Уровень техники
Хотя оральная толерантность была впервые описана еще в 1911 году, исследователи не занимались изучением ее механизмов до конца 1970-х годов (Mayer and Shao, 2004a). В отношении механизмов развития оральной толерантности были предложены различные варианты: от уничтожения антигенспецифических T-клеток до иммунной девиации, анергии и супрессии регуляторными T-клетками (Tregs) (Mucida et al., 2005). Большинство исследователей согласны с тем, что существуют два разных пути к достижению оральной толерантности: высокодозовую толерантность, основанную на анергии и/или уничтожении, получают после одноразового введения высокой дозы антигена, а низкодозовую толерантность, опосредованную активной супрессией иммунных реакций T-клетками типа CD4+, включая регуляторные T-клетки, вырабатывающие Foxp3+, IL-10 и/или TGF-β, получают при повторных контактах с низкими дозами антигена. Было продемонстрировано то важное обстоятельство, что регуляторные T-клетки, индуцированные толерантностью через слизистую, опосредуют неспецифическую супрессию, то есть процесс, посредством которого регуляторные клетки, специфичные для одного белка, подавляют ответ ближайших эффекторных клеток на другой белок. Неспецифическая супрессия представляет собой важное свойство супрессии, индуцированной антигеном, которое перевешивает роль феномена рассеивания эпитопа, поскольку совокупность антигенов, индуцирующих органоспецифический аутоиммунитет, практически неизвестна. Рассеивание эпитопа представляет собой осложнение аутоиммунных и аллергических заболеваний, которое проявляется в том, что первоначальный иммунный ответ со временем расширяется и включает ответные реакции на другие антигены.
Роль дендритических клеток (DC) в индукции оральной толерантности была продемонстрирована в исследованиях, показавших усиление такой толерантности после экспансии DC, управляемой Flt3L (Viney et al. 1998) и опосредованной RANK-L активацией DC in vivo (Williamson et al., 2002). В частности, толерантность могут опосредовать незрелые дендритические клетки, предположительно, за счет индукции регуляторных T-клеток. Кроме того, IL-10 может модулировать функцию незрелых дендритических клеток и подавлять их конечную дифференциацию, увеличивая местное присутствие толеризующих дендритических клеток, вовлеченных в индукцию регуляторных T-клеток (De Smedt et al. 1997).
Индукция толерантности через слизистую проходила оценку на многочисленных экспериментальных моделях аллергии и аутоиммунных заболеваний, но клинические данные, полученные в исследованиях на человеке, в целом неутешительны. Для достижения оральной толерантности предпринималось множество попыток доставки антигенов как в комбинации с иммуномодулирующими соединениями, так и без них, но в большинстве случаев эффект оказался незначительным. В любом случае полученные результаты недостаточны для перенесения таких способов на человека. Основной проблемой во всех экспериментах подобного рода было то, что индукция T-клеток типа CD4+и последующая выработка антигенспецифических регуляторных T-клеток не сопровождалась активной супрессией. А истинная и активная супрессия иммунного ответа на антигены у человека может быть достигнута только при этом условии.
Нацеленная и более эффективная доставка молекул для терапевтических и профилактических применений представляет собой приоритетную задачу фармацевтической индустрии. Эффективные стратегии помогут добиться снижения необходимой дозы, повысить безопасность и эффективность, если нам удастся сфокусировать молекулы на желательных точках действия. Способы доставки лекарственных средств и вакцин через слизистую открывают много логистических и биологических преимуществ перед инъекционным способом. Оральная доставка лекарственных средств особенно впечатляет с точки зрения простоты их введения. Однако разрушение в желудочно-кишечном тракте и низкий уровень всасывания обычно сводят к минимуму преимущества этого способа доставки для пептидов и протеинов, делая его неэффективным. Проверку в исследованиях проходили также альтернативные способы введения лекарственных средств через слизистую, например, назальный, ректальный, пульмонарный и глазной. Доставка белковых и пептидных вакцинных антигенов через слизистую, как правило, довольно слабо стимулирует иммунные реакции и может индуцировать иммунологическую толерантность.
Была выдвинута гипотеза о том, что доставка IL-4, TGF-β, IL-10 (Slavin et al., 2001) и антител против IL-12 через слизистую усиливает толерантность, а интерлейкин-10 (IL-10) играет критическую роль в развитии низкодозовой толерантности (Slavin et al., 2001; Mauer et al., 2003). Было показано, что лечение мышей низкими оральными дозами основного миелинового белка (MBP) при одновременном оральном введении IL-10 снижает тяжесть и частоту экспериментального аутоиммунного энцефаломиелита, но лечебный эффект оказался невысоким и явно недостаточным для эффективного применения на человеке. В этих экспериментах количество орального IL-10 было довольно высоко (от 1 мкг до 10 мкг), хотя по цифровым показателям можно предположить, что введение более высоких доз будет эффективнее. Хотя in vitro наблюдался супрессорный эффект IL-10 (доза 0,1 мкг) в отношении пролиферации, а также секреции IL-12 и IFN-γ, применительно к проявлениям заболевания не выявлено никакого лечебного эффекта от одновременного введения 0,1 мкг IL-10 и MBP. Такие же эксперименты на мышах проводили с оральным введением IL-10 в комбинации с низкими оральными дозами миелинового гликопротеина олигодендроцитов (MOG), а результаты этих экспериментов показали снижение частоты и тяжести рецидивов в мышиной модели с индукцией MOG. Но и в этих экспериментах лечебный эффект был невысоким даже при большом количестве орального IL-10, хотя по цифровым данным можно предположить, что введение более высоких доз было бы более эффективным. В обеих сериях экспериментов вообще не наблюдалась или наблюдалась, по меньшей мере, недостаточно активная супрессия иммунного ответа при длительной стимуляции иммунной толерантности, чтобы можно было рассчитывать на эффективное применение такого лечения у человека. В частности, для того чтобы декларировать реальный лечебный эффект, достаточный для переноса на человека, необходимо наблюдать индукцию антигенспецифических T-клеток типа CD4+, в конечном итоге приводящую к выработке регуляторных T-клеток. Только такой механизм будет способен активно подавлять иммунный ответ у человека. Ни в одном из вышеупомянутых примеров индукции T-клеток CD4+ не наблюдалось.
Общепризнано, что микрофлора играет определенную роль в индукции оральной толерантности (Moreau and Corthier, 1988; Gaboriau-Routhiau et al., 2003). Группой исследователей Di Giacinto et al. (2005) высказано предположение о том, что пробиотики могут индуцировать IL-10 и зависимые от IL-10 регуляторные клетки, несущие TGF-β. Однако далеко не ясно, каким образом этот эффект приводится в действие, поскольку простого присутствия микроорганизмов в кишечнике явно недостаточно (Rask et al., 2005). Кроме того, хотя пробиотики могут улучшать симптомы аллергии и астмы, результаты не всегда бывают однозначными, а одного использования пробиотиков недостаточно для того, чтобы индуцировать надежную реакцию оральной толерантности. Предпринималось несколько попыток доставки низкодозовых антигенов с молочнокислыми бактериями для предупреждения аллергического иммунного ответа (Daniel et al., 2006), в результате которых были получены сниженный аллергенспецифический секреторный ответ IgE и повышенный аллергенспецифический секреторный ответ IgA. Хотя у мышей удается достичь желательного сдвига иммунного баланса от ответа типа T-хелперов 2 к типу T-хелперов 1, значительного улучшения при доставке свободных аллергенов не происходит. В целом этот подход по исключительной (изолированной) доставке аллергенов будет недостаточен для достижения таких же результатов на человеке. Это объясняется тем фактом, что подобные стратегии требуют весьма длительного периода интермиттирующего лечения, наряду с тем, что индукция регуляторных T-клеток не достигается или по меньшей мере недостаточна для того, чтобы привести регуляторный компартмент в такое состояние, которое сопровождается истинным, активным и длительным эффектом иммунной толерантности. В другом примере оральное введение рекомбинантных лактобацилл, экспрессирующих антигены миелина, приводило к уменьшению проявлений экспериментального аутоиммунного энцефаломиелита в мышиной модели (Maassen et al., 2003). Однако лечебный эффект было расценен как низкий и недостаточный для переноса на человека. В частности, для того чтобы декларировать реальный лечебный эффект, достаточный для переноса на человека, необходимо наблюдать индукцию антигенспецифических T-клеток типа CD4+, в конечном итоге приводящую к выработке регуляторных T-клеток. Только такой механизм будет способен активно подавлять иммунный ответ у человека. Ни в одном из вышеупомянутых примеров индукция T-клеток CD4+ не была исследована.
Таким образом, в данной области остается нерешенной проблема эффективной индукции толерантности к антигенам.
Сущность изобретения
Авторы изобретения неожиданно обнаружили, что доставка антигена на слизистую в сочетании с одновременной доставкой микроорганизма, вырабатывающего иммуномодулирующее соединение, может индуцировать через слизистую стабильную реакцию толерантности, предпочтительно, если такой антиген экспрессируется микроорганизмом, и предпочтительно, если доставка на слизистую происходит оральным способом. Авторы выяснили, что доставка на слизистую такой комбинации обеспечивает значительно лучшую супрессию антигенспецифического иммунного ответа по сравнению с доставкой на слизистую только микроорганизма, экспрессирующего антиген. Еще более удивительно, что иммуносупрессия, получаемая посредством настоящего изобретения, значительно более эффективна по сравнению с оральной доставкой свободных иммуномодулирующих соединений, хотя бы и в комбинации с оральной доставкой антигенов.
Авторы изобретения показали, что можно индуцировать оральную толерантность намного эффективнее, чем монотерапией L. lactis, продуцирующим только антиген или только IL-10, или лечение антигеном в комбинации с оральной доставкой свободного IL-10. То есть благодаря настоящему изобретению активация антигенспецифических регуляторных T-клеток in vivo решительно усиливается. Эти клетки передают доминирующую толерантность иммунокомпетентным реципиентам и опосредуют равномерную низкоиммуногенную (неспецифическую) супрессию. Эффективность изобретения была продемонстрирована на мышиных моделях аутоиммунных и аллергических заболеваний, а также в контексте иммунной инактивации лекарственных средств.
Подробное описание изобретения
В настоящем документе, раскрывающем изобретение, приводятся ссылки на различные публикации, патенты и опубликованные патентные спецификации в виде идентифицирующего цитирования. Сведения, раскрытые в этих публикациях, патентах и опубликованных патентных спецификациях, включены сюда в качестве ссылок, с тем, чтобы более полно описать в настоящей заявке уровень техники в той области знаний, к которой относится настоящее изобретение.
A. Общие методики
Практика настоящего изобретения будет использовать, если специально не указано иное, общепринятые методики органической химии, фармакологии, молекулярной биологии (включая рекомбинантные методики), клеточной биологии, биохимии и иммунологии, находящиеся в пределах компетенции обычных специалистов. Такие методики полностью разъяснены в литературе, например, в книгах "Molecular Cloning: A Laboratory Manual" Second Edition (Sambrook et al., 1989); "Oligonucleotide Synthesis" (M. J. Gait, ed., 1984); "Animal Cell Culture" (R. I. Freshney, ed., 1987); в серии "Methods in Enzymology" (Academic Press, Inc.); "Handbook of Experimental Immunology" (D. M. Weir & C. C. Blackwell, eds.); "Gene Transfer Vectors for Mammalian Cells" (J. M. Miller & M. P. Calos, eds., 1987); "Current Protocols in Molecular Biology" (F. M. Ausubel et al., eds., 1987, а также в периодических изданиях); "Polymerase Chain Reaction" (Mullis et al., eds., 1994); "Current Protocols in Immunology" (J. E. Coligan et al., eds., 1991).
B. Определения
При использовании в этом документе некоторые термины могут иметь следующее определенное смысловое значение. При использовании в спецификации и пунктах формулы изобретения грамматические формы единственного числа подразумевают ссылки на множественное число, если из контекста явно не следует иное. Например, термин "клетка" включает множество (популяцию) клеток, в том числе смеси разных клеток. Точно также применение "соединения" для лечения больных или изготовления лекарственных средств в приведенном здесь описании предполагает применение в этих целях одного и более соединений, предлагаемых настоящим изобретением, если из контекста явно не следует иное.
При использовании здесь термин "содержит (включает)" означает, что композиции и способы включают перечисленные элементы, но не исключают другие. Конструкция "состоит главным образом из" или "включает главным образом" при использовании для определения композиций и способов означает исключение из указанной комбинации других элементов, имеющих какое-либо принципиальное значение. Так, в композиции, состоящей главным образом из элементов, указанных в тексте, не исключается присутствие следовых примесей и загрязнений, связанных со способом выделения и очистки, а также фармацевтически приемлемых носителей, например, фосфатного забуференного солевого раствора, консервантов и тому подобных компонентов.
Конструкция "состоит из" означает исключение более чем следовых примесей других ингредиентов, а также существенных этапов способа применительно к композициям, предлагаемым настоящим изобретением.
Варианты реализации, определенные каждым из этих переходных терминов, не выходят за рамки настоящего изобретения.
Первый аспект изобретения связан со способом индуцирования иммунной толерантности к антигену, включающим в себя доставку на слизистую оболочку указанного антигена в комбинации с доставкой на слизистую оболочку микроорганизма, продуцирующего иммуномодулирующее соединение.
В предпочтительном воплощении настоящее изобретение относится к применению микроорганизма, продуцирующего иммуномодулирующее соединение, в комбинации с антигеном при изготовлении лекарственного средства, предназначенного для введения на слизистую оболочку с целью индуцирования иммунной толерантности.
Предпочтительно, чтобы указанная иммунная толерантность была индуцирована у животного. Таким животным может быть млекопитающее, предпочтительно выбранное из группы, которая включает в себя мышей, крыс, свиней, коров, овец, лошадей и человека. Предпочтительно, чтобы указанным млекопитающим был человек.
Предпочтительно, чтобы указанной иммунной толерантностью была толерантность, индуцированная через слизистую.
Термин слизистая здесь означает любую слизистую оболочку, например, оральную (полости рта) слизистую, ректальную (прямой кишки) слизистую, уретральную (мочеиспускательного канала) слизистую, вагинальную (влагалища) слизистую, слизистую глаз, буккальную (щеки) слизистую, пульмонарную (легких) слизистую и назальную (полости носа) слизистую. Термин доставка на слизистую означает здесь доставку на слизистую оболочку. Оральные способы доставки на слизистую включают в себя буккальную, сублингвальную и десневую доставку. В соответствии с этим, настоящее изобретение относится к способу, в котором доставку на слизистую выбирают из группы, включающей ректальную доставку, буккальную доставку, пульмонарную доставку, доставку в глаза, назальную доставку, вагинальную доставку и оральную доставку. Предпочтительным способом указанной доставки на слизистую является оральная доставка, а предпочтительным вариантом указанной толерантности - оральная толерантность.
Термин толерантность через слизистую при использовании здесь означает подавление специфической иммунной реактивности на антиген у животного (включая человека) после того как указанное животное контактировало с указанным антигеном, поступающим в организм через слизистую. Предпочтительно, чтобы указанная толерантность через слизистую представляла собой системную толерантность. Последующий контакт с антигеном может быть любым контактом, известным компетентному специалисту, например, контактом при парентеральной инъекции, при доставке на слизистую или при эндогенной выработке, например, в случае аутоантигенов. Термин оральная толерантность означает подавление специфической иммунной реактивности на антиген у животного (включая человека), после того как указанное животное контактировало с указанным антигеном через оральный путь поступления антигена в организм. Низкодозовая оральная толерантность означает оральную толерантность, индуцированную низкими дозами антигенов и характеризующуюся активной иммунной супрессией, опосредованной регуляторными T-клетками, чувствительными к циклофосфамиду, которые могут передавать толерантность хозяевам, еще не подвергавшимся воздействию антигена. Высокодозовая оральная толерантность означает оральную толерантность, индуцированную высокими дозами антигенов, которая нечувствительна к циклофосфамиду и приводит к индукции пониженной реактивности T-клеток через анергию и/или уничтожение антигенспецифических T-клеток. Различие в чувствительности к циклофосфамиду можно использовать для различения низкодозовой и высокодозовой толерантности (Strobel et al., 1983). Предпочтительным вариантом указанной оральной толерантности является низкодозовая оральная толерантность, как это описано в ссылке Mayer and Shao (2004b).
Таким образом, настоящее изобретение относится к описанному выше способу применения, в котором указанная индукция иммунной толерантности повышает начальный уровень толерантности (до индукции) по меньшей мере в 1,5 раза, предпочтительнее, в 2 раза, еще предпочтительнее, в 3 раза и более. Иначе говоря, указанный антиген переносится по меньшей мере в 1,5, 2 или 3 и более раза спокойнее по сравнению с состоянием организма перед указанной индукцией. Индукцию иммунной толерантности можно измерять количественно способами, известными в данной области. Предпочтительно проводить измерение указанной индукции иммунной толерантности, оценивая модуляцию уровня цитокинов у указанного животного. Модуляция как таковая может представлять собой повышение уровня цитокинов, например, по меньшей мере в 1,5, 2 или 3 и более раз по сравнению с их уровнем до указанной индукции. В альтернативном варианте указанная модуляция может представлять собой снижение уровня определенного цитокина, например, по меньшей мере в 1,5, 2 или 3 и более раз по сравнению с его уровнем до указанной индукции. Цитокины можно выбирать из всех подходящих цитокинов, предпочтительно, из группы, включающей IL-2, IL-4, IL-6, IL-10, IL-12, TNF-α, IFN-γ, IFN-α, MCP-1, TGFβ, RANK-L и Flt3L.
В качестве антигена может выступать любой антиген, известный специалисту, компетентному в данной области. Здесь термин антиген в предпочтительном воплощении означает любое вещество, которое при попадании в организм животного провоцирует иммунный ответ, причем указанный иммунный ответ может представлять собой ответ, опосредованный T-клетками и/или B-клетками. Иммунные реакции, опосредованные T-клетками, охватывают реакции типа Th1 и/или Th2. Антигеном может быть любой антиген, включая, но не ограничиваясь ими, аллергены (в том числе пищевые аллергены), аллоантигены, собственные антигены (аутоантигены), а также антигенные молекулы лекарственных средств, вызывающие иммунный ответ. В предпочтительном воплощении указанный антиген участвует в индукции заболеваний, связанных с иммунным ответом. В более предпочтительном воплощении указанный антиген участвует в индукции аллергической астмы, рассеянного склероза, сахарного диабета I типа, аутоиммунного увеита, аутоиммунного тиреоидита, аутоиммунной миастении gravis, ревматоидного артрита, пищевой аллергии, целиакии или болезни "трансплантат против хозяина".
Здесь понятие "заболевание, связанное с иммунным ответом" означает заболевание, обусловленное нежелательным иммунным ответом организма на антиген, причем указанный антиген может быть или гетерологичным антигеном, или аутоантигеном. Заболевания, связанные с иммунным ответом, включают в себя, но не ограничиваются ими, аллергические реакции, в том числе пищевую аллергию, целиакию, аллергическую астму, аутоиммунный увеит, аутоиммунный тиреоидит, аутоиммунную миастению gravis, ревматоидный артрит, сахарный диабет I типа и рассеянный склероз. Заболевания, связанные с иммунным ответом, также включают нежелательные иммунные реакции, например, болезнь "трансплантат против хозяина" и иммунную инактивацию лекарственных средств, например, выработку антител против фактора VIII неэндогенного происхождения. В предпочтительном воплощении заболевание выбирают из группы, включающей в себя аллергическую астму, пищевую аллергию, целиакию, сахарный диабет I типа и иммунную инактивацию лекарственных средств. Таким образом, надо принять во внимание, что заболевания, связанные с иммунным ответом, включают, но не ограничиваются ими, аллергические реакции, в том числе пищевую аллергию, целиакию, аллергическую астму, аутоиммунный увеит, аутоиммунный тиреоидит, аутоиммунную миастению gravis, ревматоидный артрит, сахарный диабет I типа и рассеянный склероз. Заболевания, связанные с иммунным ответом, также связаны с нежелательными иммунными реакциями, например, болезнь "трансплантат против хозяина" и иммунная инактивация лекарственных средств, например, выработка антител против фактора VIII неэндогенного происхождения. В предпочтительном воплощении заболевание выбирают из группы, включающей в себя аллергическую астму, пищевую аллергию, целиакию, болезнь "трансплантат против хозяина", сахарный диабет I типа и иммунную инактивацию лекарственных средств.
В дальнейших вариантах реализации изобретения указанный антиген доставляется в организм хозяина микроорганизмом, экспрессирующим этот антиген. В предпочтительном варианте антиген доставляется микроорганизмом, секретирующим антиген, или микроорганизмом, демонстрирующим (проявляющим) антиген. Таким образом, изобретение относится к описанному здесь способу, в котором указанный антиген демонстрируется (проявляется) на поверхности указанного микроорганизма, экспрессирующего антиген, или микроорганизма, в котором указанный антиген экспрессируется. Иммуномодулирующее соединение и антиген могут доставляться либо одним и тем же микроорганизмом, либо разными микроорганизмами.
Учитывая сказанное выше, надо принимать во внимание, что настоящее изобретение относится к описанному здесь способу или применению, причем указанный способ или указанное применение носят лечебный и/или профилактический характер.
Термин соединение означает любое химическое или биологическое соединение (комплекс), включая простые и сложные органические или неорганические молекулы, пептиды, пептидомиметики, протеины, комплексы протеинов, антитела, углеводы, нуклеиновые кислоты и их производные. Иммуномодулирующее соединение является соединением, которое модифицирует функцию иммунной системы. При использовании здесь под иммуномодулирующим соединением подразумевается соединение, индуцирующее толерантность. Индукцию толерантности можно получить (как неограничивающий пример) прямым путем за счет индукции регуляторных T-клеток, например, Treg, Tr1 или Th3, или за счет сдвига баланса Th1/Th2 в сторону Th1, либо непрямым путем за счет активации незрелых дендритических клеток до состояния толеризующих дендритических клеток и/или подавления иммунного ответа Th2, включая экспрессию "костимулирующих" факторов на зрелых дендритических клетках. Иммуномодулирующие и иммуносупрессорные соединения известны компетентным специалистам и включают, но не ограничиваются ими, бактериальные метаболиты, например, спергуалин, метаболиты грибов и стрептомицетов, например, такролимус или циклоспорин, иммуносупрессорные цитокины, например, IL-4, IL-10, IFNα, TGFβ (как селективный адъювант для регуляторных T-клеток), Flt3L, TSLP и Rank-L (как селективные толерогенные индукторы DC), антитела и/или антагонисты, например, против CD40L, против CD25, против CD20, против IgE, против CD3, а также белки, пептиды или гибридные (химерные) белки, например, CTL-4 Ig или гибридный агонистический белок CTLA-4.
Таким образом, иммуномодулирующим соединением может быть любое иммуномодулирующее соединение, известное компетентному специалисту. В предпочтительном варианте указанное иммуномодулирующее соединение является иммуносупрессорным соединением, а еще предпочтительнее, если указанное соединение является иммуносупрессорным цитокином или антителом. Предпочтительно, чтобы указанный иммуносупрессорный цитокин представлял собой усиливающий толерантность цитокин или антитело. Иммуносупрессорные цитокины известны компетентным специалистам и включают, но не ограничиваются ими, IL-4, IL-10, IFN-α и TGFβ, как селективный адъювант для регуляторных T-клеток, а также Flt3L, TSLP и Rank-L, как селективные толерогенные индукторы DC. Предпочтительно, чтобы указанный иммуносупрессорный цитокин был выбран из группы, включающей IL-4, IL-10, IFN-α и TGFβ. Компетентный специалист поймет, что настоящее изобретение также относится к функциональным гомологам указанных веществ. Понятие функциональный гомолог означает молекулу, обладающую по существу той же или сходной функцией, по меньшей мере, в отношении целевого назначения, но имеющую другую структуру. Наиболее предпочтительным из указанных иммуносупрессорных цитокинов, усиливающих толерантность, является IL-10 или его функциональный гомолог. Предпочтительно, чтобы указанное иммуносупрессорное антитело было выбрано из группы, включающей антитела против IL-2, антитела против IL12, антитела против IL6 и антитела против IFN-γ.
Термин доставка здесь означает любой способ доставки, известный компетентному специалисту, и включает, но не ограничиваются ими, фармацевтические композиции с подлежащим доставке соединением, покрытые или не покрытые оболочкой, капсулы, липосомы, масляные тельца, полимерные частицы, содержащие или несущие подлежащее доставке соединение, микроорганизмы, секретирующие, демонстрирующие или аккумулирующие подлежащее доставке соединение, по выбору, в присутствии соединений, способных усиливать доставку на слизистую и/или поглощение слизистой.
Описанные здесь соединения или композиции можно вводить в чистой форме, а также в комбинации с другими ингредиентами и с фармацевтически приемлемыми нетоксичными наполнителями или носителями. Оральные композиции обычно будут включать инертный разбавляющий носитель или съедобный носитель. В качестве составной части в композицию могут быть включены фармацевтически совместимые связующие агенты и/или вспомогательные материалы (адъюванты). Таблетки, пилюли, капсулы, пастилки и т.п. могут содержать любые из нижеперечисленных ингредиентов или соединений сходной природы: связующее вещество, например, микрокристаллическую целлюлозу, трагакантовую камедь или желатин, наполнитель, например, крахмал или лактозу, диспергирующий агент, например, альгиновую кислоту, примогель или кукурузный крахмал, скользящее вещество, например, стеарат магния, глидант (вещество, способствующее скольжению), например коллоидную двуокись кремния, подслащивающее вещество, например, сахарозу или сахарин, вкусовое/ароматизирующее вещество, например, перечную мяту, метилсалицилат или апельсиновую приправу. Если стандартная дозовая форма представляет собой капсулу, то она в дополнение к материалам вышеуказанного типа может содержать жидкий носитель, например, жирное масло. В дополнение к этому стандартные дозовые формы могут содержать разнообразные другие материалы, модифицирующие физическую форму дозового стандарта, например, покрытие сахаром, шеллаком или кишечными агентами. Кроме того, сироп может в дополнение к активным соединениям содержать сахарозу, как подслащивающее вещество, а также определенные консерванты, красители, вкусовые и ароматические добавки. Надо принимать во внимание, что вид и характер фармацевтически приемлемого носителя диктуются количеством активного ингредиента, с которым этот носитель будет скомбинирован, путем введения композиции и другими хорошо известными переменными. Носитель (носители) должен быть "приемлемым" в смысле совместимости с другими ингредиентами композиции, а также безвредным для реципиента.
Альтернативные препараты для введения включают стерильные водные и неводные растворы, суспензии и эмульсии. Примерами неводных растворителей являются диметилсульфоксид, спирты, пропиленгликоль, полиэтиленгликоль, растительные масла, например, оливковое масло, и инъецируемые органические эфиры, например, этилолеат. Водные носители включают смеси спиртов с водой, забуференные среды и солевые растворы. Внутривенные наполнители (среды) включают жидкие и питательные пополняющие добавки, электролитные пополняющие добавки, например, на основе раствора Рингера с декстрозой, и т.п. Консерванты и другие добавки могут также представлять собой, например, противомикробные средства, антиоксиданты, хелатообразующие агенты, инертные газы и т.п. Для предлагаемых изобретением способов доставки подходят разные жидкие составы, включая солевые растворы, спирты, DMSO (диметилсульфоксид) и водные растворы других веществ.
Предпочтительно, чтобы указанный иммуносупрессорный цитокин экспрессировался в небольших количествах, например, 0,1 мкг и менее в расчете на дозу бактерий, вводимых в условиях экспериментов на мышах, причем такие количества могут быть перенесены и в условия заболеваний человека. Авторы демонстрируют, что изобретение способно индуцировать оральную толерантность намного эффективнее, чем монотерапия микроорганизмом, продуцирующим только антиген или только IL-10, например, L. lactis, или лечение антигеном в комбинации с оральной доставкой свободного IL-10. То есть, благодаря настоящему изобретению, активация антигенспецифических регуляторных T-клеток in vivo решительно усиливается. Эти клетки передают доминирующую толерантность иммунокомпетентным реципиентам и опосредуют равномерную низкоиммуногенную (неспецифическую) супрессию. Эффективность изобретения была продемонстрирована на мышиных моделях аутоиммунных и аллергических заболеваний, а также в контексте иммунной инактивации лекарственных средств.
Термины "лечение", "очистка" и т.п. здесь означают уменьшение интенсивности или элиминацию развитого психического заболевания или состояния после установления диагноза или облегчение характерных симптомов такого заболевания/состояния. Здесь эти термины также охватывают (в зависимости от состояния больного) предупреждение вспышки заболевания/состояния, либо симптомов, связанных с этим заболеванием/состоянием, либо симптомов, связанных с указанным заболеванием/состоянием, еще до развития его клинической картины. Такое предупреждение или ослабление симптомов до развития клинической картины заболевания/состояния относится к введению соединения или композиции, предлагаемых изобретением, больному, который во время введения указанного соединения или композиции еще не страдает указанным заболеванием/состоянием. "Предупреждение" также охватывает профилактику повторных атак или рецидивов указанного заболевания/состояния или связанных с ним симптомов, например, после периода улучшения (ремиссии). Должно быть понятно, что психические заболевания/состояния могут сопровождаться соматическими жалобами. В этом смысле термин "лечение" также включает профилактику соматического заболевания/состояния или его облегчение, или элиминацию развитого соматического заболевания/состояния после установления диагноза, или облегчение характерных симптомов таких заболеваний/состояний.
Здесь термин "лекарственное средство" также охватывает термины "лекарство", "лекарственное средство", "лекарственное питье" или другие термины, используемые в медицине для обозначения препаратов с лечебным или профилактическим эффектом.
Надо принять во внимание, что соединения, предлагаемые изобретением, то есть антиген и иммуномодулирующая молекула, доставляются или экспрессируются в терапевтически эффективном количестве. Здесь термин "терапевтически эффективное количество" относится к такому количеству соединения или композиции, предлагаемых изобретением, которое обеспечит желательный лечебный или профилактический эффект или ответную реакцию организма при введении в соответствии с рекомендованной схемой лечения. Предпочтительно, чтобы соединения или композиции предоставлялись в виде стандартных дозовых форм, например, таблеток, капсул или мерных доз аэрозоля, с тем расчетом, чтобы субъект, например, больной, мог получать унифицированную дозу.
Терминологическая конструкция "в комбинации с" здесь означает, что в определенный момент антиген и иммуномодулирующее соединение присутствуют на слизистой оболочке одновременно. Это не означает, что антиген и иммуномодулирующее соединение всегда должны присутствовать на слизистой одновременно. Таким образом, способ охватывает как одновременное введение антигена и микроорганизма, вырабатывающего иммуномодулирующее соединение, так и их последовательное введение или их введение в любой комбинации.
В дальнейшем варианте реализации изобретения указанный антиген доставляется одновременно или последовательно с указанным микроорганизмом, секретирующим иммуномодулирующее соединение.
В предпочтительном варианте реализации изобретения антиген и микроорганизм, вырабатывающий иммуномодулирующее соединение, вводятся одновременно. В этом случае антиген и микроорганизм, вырабатывающий иммуномодулирующее соединение, могут содержаться в одной и той же фармацевтической композиции или в разных фармацевтических композициях, которые вводят на слизистую одновременно. В предпочтительном варианте реализации изобретения осуществляется доставка микроорганизма, вырабатывающего как антиген, так и иммуномодулирующее соединение.
Если антиген и микроорганизм, экспрессирующий иммуномодулирующее соединение, или композиция, содержащая оба элемента, вводятся одновременно, то соединения и активные ингредиенты могут быть представлены в единой фармацевтической композиции или лекарственной форме.
В альтернативном варианте соединения или активные ингредиенты вводятся в разных фармацевтических композициях или лекарственных формах для одновременного или раздельного применения. Изобретение также относится к фармацевтическим композициям, включающим в свой состав как антиген, так и микроорганизм, экспрессирующий иммуномодулирующую молекулу, а также к способам применения таких фармацевтических композиций.
В случае последовательного введения первым может вводиться либо антиген, либо микроорганизм, вырабатывающий иммуномодулирующее соединение. Предпочтительно, чтобы при последовательном введении антигена и микроорганизма, вырабатывающего иммуномодулирующее соединение, промежуток времени между их введением не превышал трех часов, еще предпочтительнее двух часов и наиболее предпочтительно одного часа.
Активные ингредиенты можно вводить от 1 до 6 раз в день, чтобы в достаточной степени проявлялась желательная активность их комбинации. Такие ежедневные дозы можно давать реципиенту в виде одной дозы один раз в день либо в виде двух и более меньших доз в одно и то же или в разное время дня, чтобы в сумме они давали заданную суточную дозу. Предпочтительно, чтобы активный ингредиент вводился один или два раза в день. Предполагается, чтобы оба активных ингредиента вводились в одно и то же время или с минимальным интервалом по времени. В альтернативном варианте одно соединение можно принимать утром, а другое позже (днем). По другому сценарию один из ингредиентов можно принимать два раза в день, а другой - один раз в день, причем либо в одно и то же время, что и первый (двухразовый), либо в другое время. Предпочтительно, чтобы оба ингредиента принимались вместе, в одно и то же время и вводились в виде смеси. В одном из вариантов реализации изобретения второй ингредиент вводят одновременно с указанным первым ингредиентом, раздельно или последовательно.
Во всех аспектах изобретения ежедневную поддерживающую дозу можно давать больному в течение желательного по клиническим соображениям периода, например, от одного дня до нескольких лет (вплоть до пожизненного применения у млекопитающих) или, например, в течение 2, 3, 5 дней, 1 или 2 недели, 1 месяца и/или, например, 5 лет, 1 года, 6 месяцев, 1 месяца, 1 недели, 3 или 5 дней. Типичным вариантом является введение поддерживающей суточной дозы приблизительно от 3 до 5 дней или приблизительно от 1 недели до 1 года. Другими составляющими жидких лекарственных композиций могут быть консерванты, неорганические соли, кислоты, основания, буферы, питательные вещества, витамины или другие фармацевтические вещества.
Микроорганизм, секретирующий иммуномодулирующее соединение, и/или антиген можно доставлять в дозе от по меньшей мере 104колониеобразующих единиц (КОЕ) до 1012 КОЕ в день, предпочтительнее от 106 КОЕ до 1012 КОЕ в день, наиболее предпочтительно от 109 КОЕ до 1012 КОЕ в день. В соответствии со способом, описанным в ссылке Steidler et al. (Science 2000), например, 109 КОЕ секретируют по меньшей мере от 1 нг до 100 нг иммуномодулирующего соединения. Посредством метода ELISA, известного компетентным специалистам, 109 КОЕ секретируют по меньшей мере от 1 нг до 100 нг антигена. Компетентный специалист может рассчитать диапазон секреции иммуномодулирующего соединения и/или антигена для любой другой дозы КОЕ.
Антиген можно доставлять в дозе, индуцирующей низкодозовый ответ. Предпочтительно, чтобы указанный антиген доставлялся в дозе по меньшей мере от 10 фг до 100 мкг в день, предпочтительнее от 1 пг до 100 мкг в день, наиболее предпочтительно от 1 нг до 100 мкг в день.
Иммуномодулирующее соединение, предлагаемое изобретением, может доставляться в дозе по меньшей мере от 10 фг до 100 мкг в день, предпочтительнее от 1 пг до 100 мкг в день, наиболее предпочтительно от 1 нг до 100 мкг в день.
Предпочтительно, чтобы соединения или композиции предоставлялись в виде стандартных дозовых форм, например, таблеток, растворов, капсул или мерных доз аэрозоля с тем расчетом, чтобы субъект, например больной, мог получать унифицированную дозу.
В зависимости от способа введения, например, орального или любого из описанных выше, компетентный специалист сможет определить или рассчитать фактическую дозу для введения больному. Компетентный специалист сумеет провести корректировку доз в зависимости от конкретного больного, микроорганизма, вектора и т.д.
Соединения, предлагаемые настоящим изобретением, также могут иметь форму фармакологически приемлемой соли, гидрата, сольвата или метаболита. Фармакологически приемлемые соли включают основные соли неорганических и органических кислот, включая, но не ограничиваясь ими, соляную кислоту, бромистоводородную кислоту, серную кислоту, фосфорную кислоту, азотную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, п-толуолсульфоновую кислоту, нафталинсульфоновую кислоту, яблочную кислоту, уксусную кислоту, щавелевую кислоту, винную кислоту, лимонную кислоту, молочную кислоту, фумаровую кислоту, янтарную кислоту, малеиновую кислоту, салициловую кислоту, бензойную кислоту, фенилуксусную кислоту, миндальную кислоту и т.д. Если соединения, предлагаемые изобретением, включают кислотообразующую функцию, например, карбоксильную группу, то подходящие пары катионов хорошо известны компетентному специалисту и включают щелочные, щелочноземельные, аммониевые, четвертичные аммониевые катионы и т.п.
Микроорганизмом может быть любой микроорганизм, пригодный для доставки на слизистую, включая бактерии, дрожжи и грибы. Предпочтительно, чтобы указанный микроорганизм был непатогенным микроорганизмом, а еще предпочтительнее, чтобы указанный микроорганизм был пробиотическим микроорганизмом. Пробиотические микроорганизмы известны компетентному специалисту. Пробиотические микроорганизмы включают, но не ограничиваются ими, бактерии, например разные виды лактобацилл, разные виды лактококков, разные виды бифидобактерий, а также дрожжи, например, Saccharomyces cerevisiae (подвиды boulardii). Предпочтительно, чтобы указанная бактерия была молочнокислой бактерией, еще предпочтительнее, чтобы указанная молочнокислая бактерия была выбрана из группы, состоящий из Lactobacillus, Leuconostoc, Pediococcus, Lactococcus, Streptococcus, Aerococcus, Carnobacterium, Enterococcus, Oenococcus, Teragenococcus, Vagococcus и Weisella. В одном из дальнейших предпочтительных вариантов реализации изобретения указанный микроорганизм представляет собой Lactococcus lactis. В другом предпочтительном варианте реализации изобретения указанный микроорганизм представляет собой Saccharomyces cerevisiae.
В предпочтительном варианте реализации изобретения иммуносупрессорный цитокин комбинируется с антагонистическими антителами против иммуноиндуцирующих цитокинов, такими как антитела против IL-2, антитела против IL-12 и/или антитела против IFNγ, а также с костимулирующими молекулами, такими как антитела против CD40L и антитела против CD3. В альтернативном варианте могут доставляться соединения, стимулирующие выработку иммуносупрессорных цитокинов, таких как субъединица токсина B холеры, а также молекулы, стимулирующие функцию регуляторных T-клеток, например, агонисты ICOS и CTLA-4. Как описано выше, предпочтительно, чтобы указанный микроорганизм был непатогенным микроорганизмом, а еще предпочтительнее, чтобы он был пробиотическим микроорганизмом. Пробиотические микроорганизмы известны компетентному специалисту и включают, но не ограничиваются ими, бактерии, например, разные виды лактобацилл, разные виды лактококков, разные виды бифидобактерий, а также дрожжи, например, Saccharomyces cerevisiae (подвиды boulardii). В одном из предпочтительных вариантов реализации изобретения указанный микроорганизм представляет собой Lactococcus lactis. В другом предпочтительном варианте реализации изобретения указанный микроорганизм представляет собой Saccharomyces cerevisiae. Наиболее предпочтительно, чтобы указанный пробиотический микроорганизм являлся молочнокислой бактерией, поскольку в научной литературе описана доставка молочнокислыми бактериями на слизистую гетерологичных белков (то есть белков, не являющихся протеинами молочнокислых бактерий), включая как оральную, так и вагинальную доставку (Steidler and Rottiers, 2006; Liu et al., 2006), а это обстоятельство делает молочнокислые бактерии особенно удобными для доставки как антигенов, так и иммуносупрессорных соединений.
Другим аспектом изобретения является применение микроорганизма, продуцирующего иммуномодулирующее соединение, в комбинации с антигеном при изготовлении лекарственного средства, предназначенного для лечения заболеваний, связанных с иммунным ответом. Предпочтительно, чтобы указанное иммуномодулирующее соединение было иммуносупрессорным цитокином. Предпочтительно, чтобы указанный антиген доставлялся микроорганизмом, секретирующим этот антиген. Иммуномодулирующее соединение и антиген могут доставляться либо одним и тем же микроорганизмом, либо разными микроорганизмами. Предпочтительно, чтобы указанный иммуносупрессорный цитокин являлся иммуносупрессорным цитокином, усиливающим толерантность. Иммуносупрессорные цитокины, усиливающие толерантность, известны компетентному специалисту и включают, но не ограничиваются ими, IL-4, IL-10, IFNα и TGFβ, Flt3L и Rank-L. Предпочтительно, чтобы указанный иммуносупрессорный цитокин был выбран из группы, состоящей из IL-4, IL-10, IFNα и Flt3L. Наиболее предпочтительным из указанных иммуносупрессорных цитокинов является IL-10 или его функциональный гомолог. В одном из предпочтительных вариантов реализации изобретения иммуносупрессорный цитокин комбинируется с антагонистическими антителами против иммуноиндуцирующих цитокинов, такими как антитела против IL-2, антитела против IL-12 и/или антитела против IFNγ, а также с костимулирующими молекулами, такими как антитела против CD40L и антитела против CD3. Предпочтительно, чтобы указанный иммуносупрессорный цитокин экспрессировался в небольших количествах, например, 0,1 мкг и менее в расчете на условия экспериментов на мышах, причем такие количества могут быть перенесены в условия заболеваний человека.
Надо принимать во внимание, что соединения и композиции, предлагаемые изобретением, можно использовать как нутрицевтики, функциональные или медицинские пищевые продукты или как добавки к указанным нутрицевтикам, функциональным или медицинским пищевым продуктам. Другой вариант реализации изобретения предлагает пищевой продукт или напиток, предпочтительно, пригодный для употребления человеком, который включает нутрицевтик и вкусовой/ароматизирующий агент, причем нутрицевтик включает экстракт из сельскохозяйственного продукта.
Нутрицевтики в виде жидкого экстракта или сухой композиции съедобны и могут непосредственно употребляться в пищу людьми, но предпочтительно, чтобы люди получали их в виде пищевых или питательных добавок, например, в виде таблеток типа тех, что продаются в магазинах диетических продуктов, или в виде ингредиентов съедобных сухих продуктов, более предпочтительно, готовых к употреблению пищевых продуктов, например, сухих завтраков (корнфлексов), хлеба, тофу, булочек, мороженого, кексов, картофельных чипсов, крендельков, сыра и т.д., а также в виде жидкостей для питья, например таких напитков, как молоко, содовая вода, спортивные напитки и фруктовые соки. Так, в одном из вариантов реализации изобретения предлагается способ повышения питательной ценности пищевого продукта или напитка посредством перемешивания этого пищевого продукта или напитка с нутрицевтиком, вводимым в таком количестве, которое эффективно повышает питательную ценность пищевого продукта или напитка.
Еще один вариант реализации изобретения предлагает способ увеличения питательной ценности пищевого продукта или напитка, заключающийся в перемешивании пищевого продукта или напитка с нутрицевтиком для получения питательно обогащенного пищевого продукта или напитка, причем нутрицевтик вводится в смесь в достаточном количестве для эффективного увеличения питательной ценности пищевого продукта или напитка, причем указанный нутрицевтик включает в свой состав экстракт сельскохозяйственной культуры, содержащий антигены, относящиеся к настоящему изобретению, а питательно обогащенный пищевой продукт или напиток может дополнительно содержать вкусовую приправу. Предпочтительные вкусовые приправы включают подсластители, например, сахар, кукурузный сироп, фруктозу, декстрозу, мальтодекстрозу, цикламаты, сахарин, фенилаланин, ксилит, сорбит, мальтит и травяные подсластители, например, посконник крапиволистный.
Описанные здесь нутрицевтики предназначены для употребления человеком, поэтому процессы для их получения предпочтительно проводятся в соответствии с принципами надлежащей производственной практики (GMP) и любыми применимыми правительственными постановлениями, регламентирующими такие процессы. Особенно предпочтительные процессы связаны с применением растворителей исключительно природного происхождения. Описанные здесь нутрицевтики преимущественно содержат относительно высокий уровень веществ, поддерживающих и укрепляющих здоровье. Для усиления оздоровительных эффектов нутрицевтиков их можно смешивать друг с другом.
В отличие от нутрицевтиков так называемые "медицинские пищевые продукты" не предназначены для широкого потребления всем населением и не поступают в розничные магазины и супермаркеты. Медицинские пищевые продукты - это не такие продукты, которые включаются в общеоздоровительную диету для снижения риска заболеваний, например, как продукты с низким содержанием жиров или продукты с низким содержанием натрия, или продукты для снижения веса. Врач предписывает больному медицинский продукт, если у этого больного имеется потребность в конкретном питательном веществе для борьбы с каким-либо заболеванием или патологическим состоянием, причем этот больной находится под постоянным наблюдением врача. На этикетке продукта должно быть четко указано, что он предназначен для применения при конкретном заболевании или патологическом состоянии. Типовым примером медицинского пищевого продукта является разнообразный по содержанию питательных веществ медицинский пищевой продукт, который по своему составу предназначен для нацеленной поддержки определенными питательными веществами больных с хроническими воспалительными состояниями. Активными компонентами такого продукта могут быть, например, одно или более описанных здесь соединений. Функциональные пищевые продукты могут охватывать такие продукты, которые включаются в общеоздоровительную диету для снижения риска заболеваний, например, продукты с низким содержанием жиров или продукты с низким содержанием натрия, или продукты для снижения веса. Поэтому настоящее изобретение рассматривает применение пищевого продукта или напитка, содержащего нутрицевтик, соответствующий этому изобретению.
Настоящее изобретение также относится к применению микроорганизма, продуцирующего иммуномодулирующее соединение, в комбинации с антигеном при изготовлении лекарственного средства, медицинского пищевого продукта или нутрицевтика, предназначенного для индукции иммунной толерантности или для лечения заболевания, связанного с иммунным ответом. В предпочтительном воплощении настоящее изобретение относится к применению композиции в изготовлении и/или производстве лекарственного средства, медицинского пищевого продукта или нутрицевтика для лечения, профилактики и/или облегчения заболевания или расстройства, связанного с иммунным ответом, причем указанная композиция включает по меньшей мере микроорганизм, секретирующий иммуномодулирующее соединение, и антиген.
В дальнейшем аспекте настоящее изобретение относится к применению по меньшей мере микроорганизма, секретирующего иммуномодулирующее соединение, и антигена для лечения, профилактики и/или облегчения заболевания или расстройства, связанного с иммунным ответом. Следовательно, настоящее изобретение также относится к способу лечения заболевания, связанного с иммунным ответом, у животного, которое нуждается в таком лечении, причем указанный способ включает доставку на слизистую антигена в комбинации с доставкой на слизистую микроорганизма, секретирующего иммуномодулирующее соединение.
В дальнейшем варианте реализации изобретение относится к композиции, которая включает микроорганизм, секретирующий иммуномодулирующее соединение в комбинации с антигеном. Предпочтительно, чтобы указанная композиция была фармацевтической композицией. Предпочтительно, чтобы указанный антиген был аллергеном, аллоантигеном, собственным антигеном или аутоантигеном. Еще предпочтительнее, чтобы указанный антиген участвовал в индукции аллергической астмы, рассеянного склероза, сахарного диабета I типа, аутоиммунного увеита, аутоиммунного тиреоидита, аутоиммунной миастении gravis, ревматоидного артрита, пищевой аллергии или целиакии. В одном из предпочтительных вариантов реализации изобретения указанный антиген представляет собой терапевтический антиген, предпочтительно, антитело против CD3. Предпочтительно, чтобы антиген, рассматриваемый в изобретении, доставлялся микроорганизмом, экспрессирующим этот антиген. В этом случае антиген может проявляться на поверхности упомянутого микроорганизма, экспрессирующего антиген, либо может секретироваться указанным микроорганизмом. Предпочтительно, чтобы указанная композиция входила в состав спрея, капсулы, аэрозоля, пастилок, болюса, таблеток, саше, жидкости, суспензии, эмульсии или лепешек, предпочтительно, в дозированной лекарственной форме, например, таблетки, капсулы или в аэрозольном дозаторе. Предпочтительно, чтобы иммуномодулирующее соединение в составе композиции, предлагаемой изобретением, представляло собой иммуносупрессорное соединение или антитело. В одном из предпочтительных вариантов реализации изобретения указанное иммуносупрессорное соединение представляет собой цитокин, усиливающий толерантность, или антитело, усиливающее толерантность, причем наиболее предпочтительно, чтобы выбор такого соединения производился из группы, состоящей из IL-4, IL-10, IFN-α, Flt3L, TGFβ и RANK-L. В другом предпочтительном варианте реализации изобретения указанное иммуносупрессорное соединение представляет собой иммуносупрессорное антитело и выбирается из группы, состоящий из антитело против IL-2, антитела против IL12 и антитела против IFN-γ. Еще в одном предпочтительном варианте реализации изобретения микроорганизм в составе композиции, секретирующий иммуномодулирующее соединение, представляет собой пробиотический микроорганизм. В другом предпочтительном варианте реализации изобретения микроорганизм в составе композиции, предлагаемой изобретением, который секретирует иммуномодулирующее соединение, представляет собой бактериальную или дрожжевую клетку, и предпочтительно, чтобы указанная бактерия была молочнокислой бактерией, выбираемой из группы, которая состоит из Lactobacillus, Leuconostoc, Pediococcus, Lactococcus, Streptococcus, Aerococcus, Carnobacterium, Enterococcus, Oenococcus, Teragenococcus, Vagococcus, и Weisella, причем наиболее предпочтительно, чтобы указанный Lactococcus относился к виду Lactococcus lactis. Предпочтительно, чтобы указанные дрожжи относились к виду Saccharomyces cerevisiae. Предпочтительно, чтобы указанный антиген и указанное иммуномодулирующее соединение в составе композиции, предлагаемой изобретением, экспрессировались одним и тем же микроорганизмом. Предпочтительно, чтобы композиция, предлагаемая изобретением, дополнительно включала адъювант, фармацевтически приемлемый носитель и/или наполнитель. Предпочтительно, чтобы композиция, предлагаемая изобретением, дополнительно включала соединение, стимулирующее выработку иммуносупрессорных цитокинов, а указанное соединение, стимулирующее выработку иммуносупрессорных цитокинов, представляло собой субъединицу токсина B холеры. Предпочтительно, чтобы в композиции, предлагаемой изобретением, микроорганизм, секретирующий указанный антиген и/или указанное иммуномодулирующее соединение, был представлен в дозе, по меньшей мере, от 10 фемтограммов до 100 мг.
В конечном варианте реализации настоящее изобретение относится к лекарственному средству, нутрицевтику или медицинскому пищевому продукту, применяемому для лечения, профилактики и/или облегчения заболевания или расстройства, связанного с иммунным ответом, причем указанное лекарственное средство, нутрицевтик или медицинский пищевой продукт включает, по меньшей мере, антиген в комбинации с микроорганизмом, секретирующим иммуномодулирующее соединение.
Компетентный специалист поймет, что предпочтительные варианты реализации изобретения допускают многочисленные изменения и модификации, причем такие изменения и модификации могут быть осуществлены без отклонений от духа изобретения. В этой связи авторы рассчитывают на то, что прилагаемые пункты формулы изобретения охватывают все эквивалентные вариации, соответствующие истинному духу изобретения и попадающие в сферу его применения.
В дополнение к этому следует отметить, что все термины, используемые при описании соединений, которые относятся к настоящему изобретению, имеют смысловое значение, хорошо известное в данной области знаний.
Краткое описание фигур
Фиг. 1. Пролиферативный иммунный ответ в подколенных и паховых лимфатических узлах (PLN/ILN) после орального кормления мышей Balb/c GM L.lactis или белком овальбумином (OVA). OVA-специфический пролиферативный ответ измеряли через 11 дней после подкожной провокации (в 0-й день), которую проводили мышам с OVA в полном адъюванте Фрейнда. Мыши получали смешанную суспензию в дни от -46 до -42, от -39 до -35, от -32 до -28, от -25 до -21, от -18 до -14, от -11 до -7, от -4 до -1. LL-pT: смешанная бактериальная суспензия LL-pT1NX (векторный контроль) и LL-pT1NX; LL-OVA: смешанная бактериальная суспензия штамма L. lactis, секретирующего овальбумин и LL-pT1NX; LL-OVA+LL-mIL10: смешанная бактериальная суспензия LL-OVA и штамма L. lactis, секретирующего мышиный интерлейкин-10. Мыши в группе положительного контроля 1 получали 20 мг OVA в день -7. Мыши в группе положительного контроля 2 получали 1 мкг OVA в те же дни, что и кормление L. lactis. Результаты представлены средними показателями инкорпорирования [3H]-тимидина (число импульсов в минуту [cpm]±SD) для трех идентичных копий культур объединенных клеток в группах из 4 мышей.
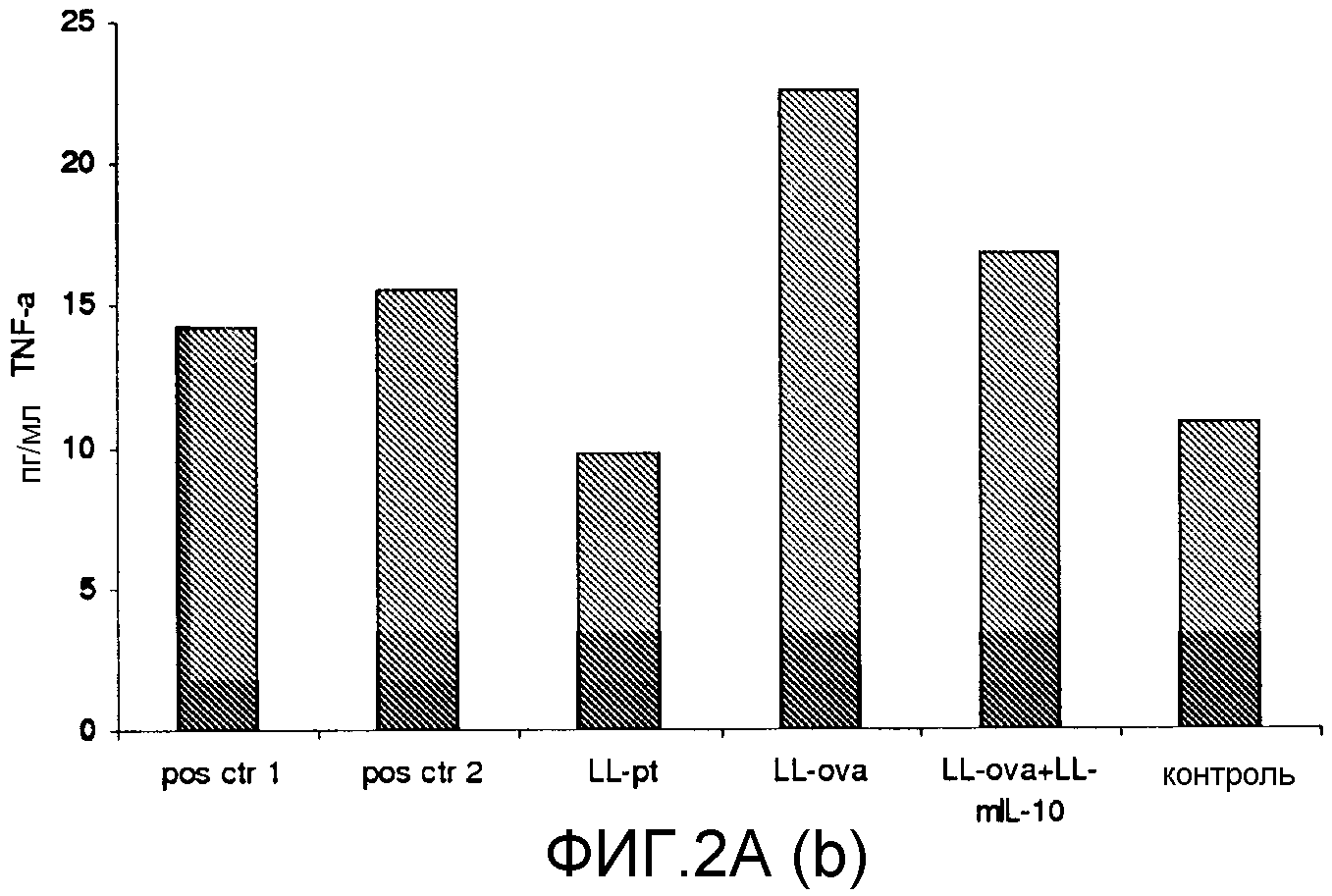
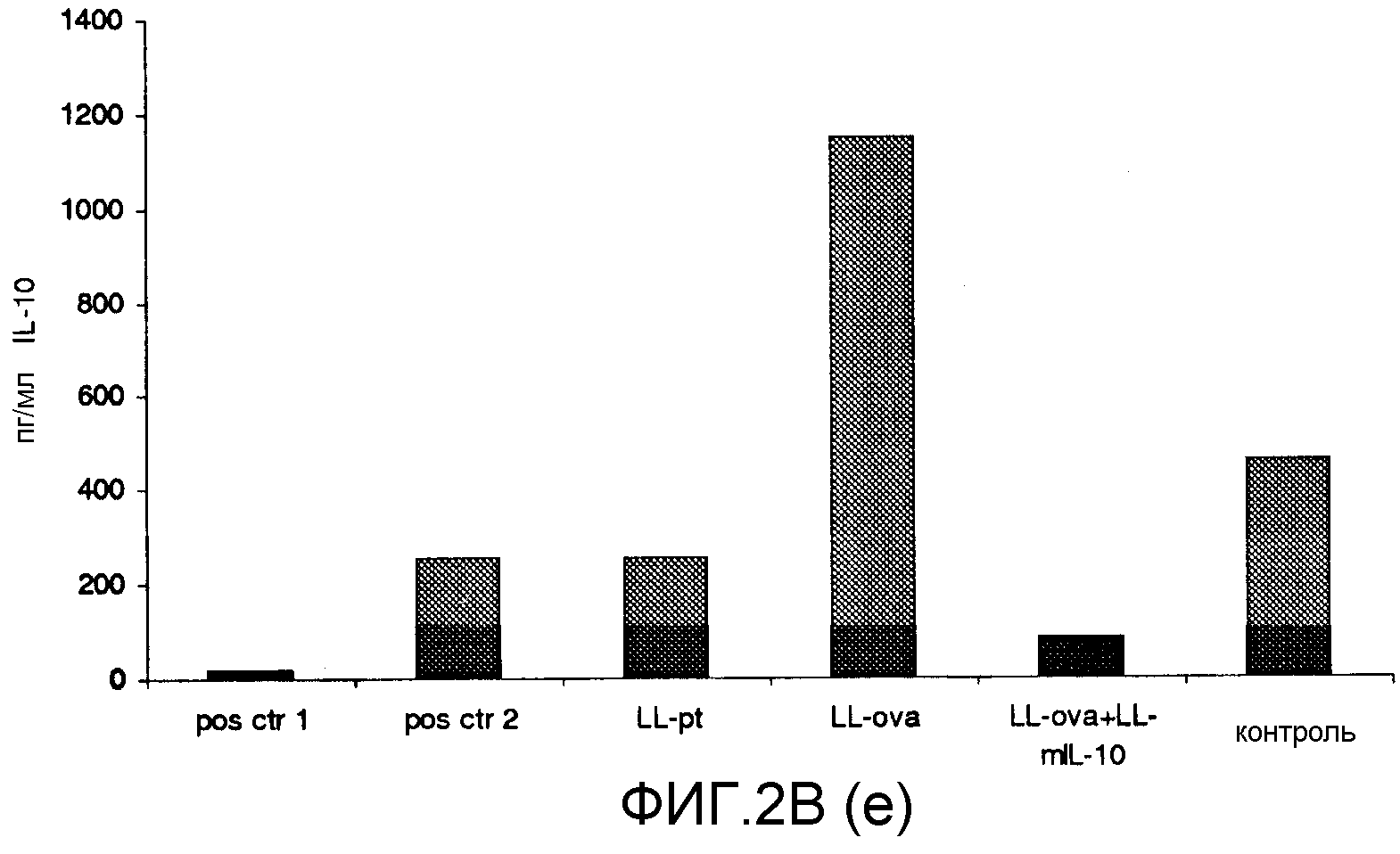
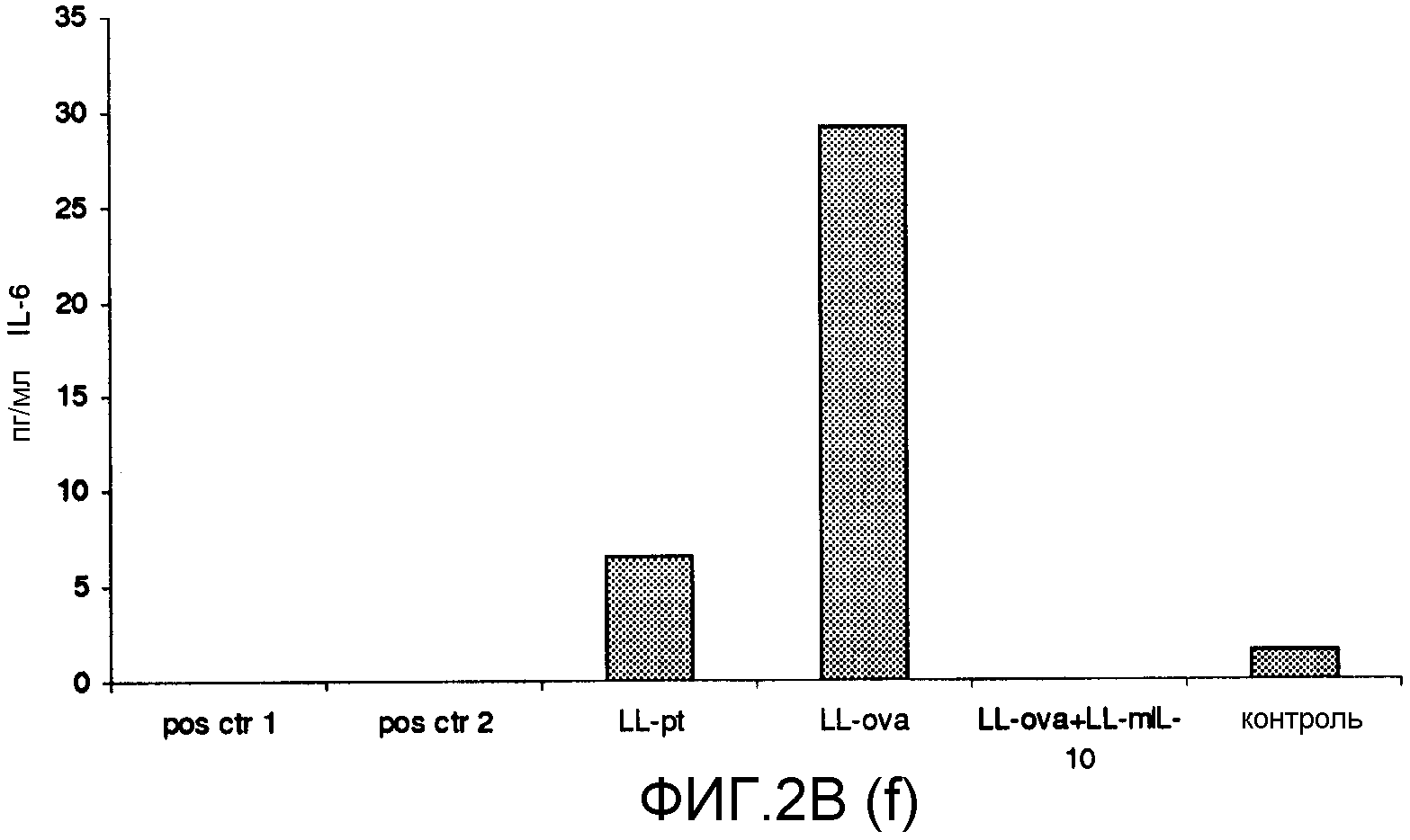
Фиг. 2. Ответ цитокинов в MLN и PLN/ILN после орального кормления мышей Balb/c GM L.lactis или OVA. Оценивали секрецию IL12p70 (a), TNF-α (b), IFN-γ (c), MCP-1 (d), IL-10 (e) и IL-6 (f) у контрольных мышей и мышей, кормленных GM L. lactis или OVA. Супернатанты культур клеток из MLN (A) и из PLN/ILN (B) после рестимуляции 300 мкг/мл OVA in vitro тестировали на присутствие цитокинов при помощи CBA (BD Bioscience) с использованием набора мышиного воспаления. Результаты представлены показателями выработки цитокина объединенными клетками в группах из 4 мышей.
Фиг. 3. OVA-специфический пролиферативный ответ T-клеток типа CD4+ в PLN/ILN после орального кормления мышей Balb/c GM L. lactis или OVA. OVA-специфический пролиферативный ответ измеряли через 11 дней после подкожной провокации (в 0-й день), которую проводили мышам с OVA в полном адъюванте Фрейнда. Мыши получали смешанную суспензию L. lactis в дни от -46 до -42, от -39 до -35, от -32 до -28, от -25 до -21, от -18 до -14, от -11 до -7, от -4 до -1. LL-pT: смешанная бактериальная суспензия LL-pT1NX (векторный контроль) и LL-pT1NX; LL-OVA: смешанная бактериальная суспензия штамма L. lactis, секретирующего овальбумин и LL-pT1NX; LL-OVA+LL-mIL10: смешанная бактериальная суспензия LL-OVA и штамма L. lactis, секретирующего мышиный интерлейкин-10. Мыши в группе положительного контроля 1 получали 20 мг OVA в день -7. Мыши в группе положительного контроля 2 получали 1 мкг OVA в те же дни, что и кормление L. lactis. Результаты представлены средними показателями инкорпорирования [3H]-тимидина (число импульсов в минуту [cpm]±SD) для трех идентичных копий культур объединенных клеток в группах из 4 мышей.
ПРИМЕРЫ
Пример A: Индукция толерантности к овальбумину после орального введения L. lactis, секретирующего указанный овальбумин в комбинации с IL-10, доставляемым in situ.
Материалы и методы, использованные в примерах
Бактерии и плазмиды
Во всем этом исследовании был использован штамм L. lactis MG1363. Бактерии были культивированы в среде GM17, т.е. M17 (Difco Laboratories, Детройт, штат Мичиган) с добавкой 0,5% глюкозы. Маточные суспензии всех штаммов хранили при температуре -20°C в 50% глицерине в среде GM17. Для внутрижелудочных инокуляций маточные суспензии разводили в 500 раз в свежей среде GM17 и инкубировали при 30°C. Плотность бактериального насыщения в разведенных суспензиях 2×109 колониеобразующих единиц (КОЕ) на мл достигалась через 16 часов. В этом исследовании были использованы смешанные бактериальные суспензии. Поэтому бактерии, подлежавшие перемешиванию, собирали центрифугированием, а осадки обеих бактериальных культур концентрировали в 10 раз в среде BM9 (Schotte, et al., 2000). Для лечения каждая мышь получала 100 мкл этой суспензии через внутрижелудочный катетер.
Последовательность мРНК, кодирующая овальбумин Gallus gallus, была получена из хранилища информации Genbank (номер доступа AY223553). Тотальную РНК выделяли из матки кур, а кДНК синтезировали, используя 2 мкг тотальной РНК, 2мкМ олиго-dT-праймеры (Promega Corporation Benelux, Лейден, Нидерланды), 0,01 мМ DTT (Sigma-Aldrich, Звейндрехт, Нидерланды), 0,5 мМ dNTP (Invitrogen, Мерелбеке, Бельгия), 20 единиц Rnasin (Promega Incorporation Benelux) и 100 единиц обратной транскриптазы суперскрипта II (Invitrogen) в объеме 25 мкл. Фрагмент кДНК OVA был амплифицирован при помощи полимеразной цепной реакции (ПЦР) в следующих условиях: 94°C в течение 2 минут с последующими 30 циклами при 94°C в течение 45 секунд, 62°C в течение 30 секунд и 72°C в течение 90 секунд, а также с применением следующих прямого и обратного праймеров
5'-GGCTCCATCGGTGCAGCAAGCATGGAATT-3' и
5'-ACTAGTTAAGGGGAAACACATCTGCCAAAGAAGAGAA-3'.
Амплифицированный фрагмент был сплавлен с сигналом секреции Usp45 вектора pT1NX, устойчивого к эритромицину, ниже лактококкового промотора P1. Штаммы MG1363, трансформированные плазмидами, несущими кДНК OVA и IL-10, были обозначены как L. lactis, секретирующие OVA (LL-OVA) и LL-IL10. В качестве контроля использовали L. lactis-pT1NX, то есть штамм MG1363, содержащий пустой вектор pT1NX и обозначенный (LL-pT1NX).
Животные
Самки мышей линии Balb/c семинедельного возраста были получены от Charles River Laboratories (Италия). Их разместили в условиях SPF, кормили стандартным лабораторным кормом и обеспечили питьевой (водопроводной) водой без ограничений. Разрешение на проведение исследования на животных было получено от комиссии по этике отдела молекулярных и биомедицинских исследований Гентского университета.
Индукция и оценка оральной толерантности
Мыши получали смешанную суспензию в дни от -46 до -42, от -39 до -35, от -32 до -28, от -25 до -21, от -18 до -14, от -11 до -7, от -4 до -1. LL-pT: смешанная бактериальная суспензия LL-pT1NX (векторный контроль) и LL-pT1NX; LL-OVA: смешанная бактериальная суспензия штамма L. lactis, секретирующего овальбумин и LL-pT1NX; LL-OVA+LL-mIL10: смешанная бактериальная суспензия LL-OVA и штамма L. lactis, секретирующего мышиный интерлейкин-10. В исследование были включены два положительных контроля оральной толерантности. Мыши в группе положительного контроля 1 получали 20 мг овальбумина в 100 мкл среды BM9 в день -7. Мыши в группе положительного контроля 2 получали 1 мкг овальбумина в 100 мкл среды BM9 в тот же день, что и кормление L. lactis. Мыши получали кормление через внутрижелудочный катетер. Контрольные мыши не получали орального лечения. В 0-й день мышей иммунизировали подкожно 100 мкг OVA, эмульгированного в соотношении 1:1 в полном адъюванте Фрейнда, содержавшем 100 мкг M. tuberculosis H37 RA (Difco). Через одиннадцать дней после иммунизации у животных собирали мезентериальные лимфоузлы (MLN), а также подколенные и паховые лимфоузлы (PLN/ILN), после чего оценивали клетки на OVA-специфическую пролиферацию и выработку цитокинов.
OVA-специфическая пролиферация in vitro
Была приготовлена единая клеточная суспензия дренирующих подколенных и паховых лимфоузлов. Клетки были посчитаны и ресуспендированы на уровне 2×105 клеток в 200 мкл среды RPMI-1640, содержащей 10% фетальной телячьей сыворотки (FCS), 10 единиц/мл пенициллина, 10 мкг/мл стрептомицина, 2 мМ L-глютамакса, 0,4 мМ пирувата натрия (полная среда RPMI) или в чистом виде или с добавкой 11, 33, 100 или 300 мкг/мл OVA. Клетки были культивированы в течение 90 часов в 96-луночных планшетах для тканевых культур с U-образным дном (Becton Dickinson) при 37°C в увлажненном инкубаторе с 5% CO2. Пролиферацию оценивали при добавлении [3H]-тимидина (1 мкКи на лунку) на последние 18 часов культивирования. ДНК-связанную радиоактивность собирали на фильтрующих матах из стекловолокна (Perkin Elmer), а включение тимидина измеряли сцинтилляционным счетчиком (Perkin Elmer).
OVA-специфическая пролиферация очищенных T-клеток CD4 in vitro
T-клетки CD4+ были очищены из цельноклеточных препаратов PLN/ILN с применением набора для выделения T-клеток CD4+(Miltenyi Biotec). T-клетки CD4+, взятые в количестве 2×105 были культивированы в 200 мкл полной среды RPMI с обработанными митомицином C спленоцитами, загруженными OVA, которые действовали как антигенпредставляющие клетки, в соотношении (T-клетки CD4+/APC) 1/3, 1/1, 1/0,3, 1/0,1 и 1/0. Клетки культивировали 90 часов в 96-луночных планшетах для тканевых культур с U-образным дном (Becton Dickinson) при 37°C в увлажненном инкубаторе с 5% C02. Пролиферацию оценивали при добавлении [3H]-тимидина (1 мкКи на лунку) на последние 18 часов культивирования. ДНК-связанную радиоактивность собирали на фильтрующих матах из стекловолокна (Perkin Elmer), а включение тимидина измеряли сцинтилляционным счетчиком (Perkin Elmer).
Измерение OVA-специфической выработки цитокинов
Были приготовлены клетки из мезентериальных лимфоузлов (MLN), а также из дренирующих подколенных и паховых лимфоузлов, которые ресуспендировали в количестве 2×106 клеток/мл, а их аликвотные пробы объемом по 100 мкл культивировали в 96-луночных планшетах для тканевых культур с U-образным дном в течение 72 часов с 300 мкг/мл OVA. Супернатанты хранили при -20°C вплоть до количественного определения уровня цитокинов в цитометрической бисерной матрице с применением набора мышиного воспаления (BD Bioscience).
Пример A1: LL-IL10 значительно усиливает способность LL-Ova индуцировать толерантность. Для того чтобы исследовать индукцию оральной толерантности, мышей орально кормили GM L. lactis [LL-pt: смешанная бактериальная суспензия LL-pT1NX [все] (=векторный контроль) и LL-pT1NX; LL-OVA: смешанная бактериальная суспензия L. lactis, секретирующего OVA [везде курсивом], и LL-pT1NX; LL-OVA+LL-mIL10: смешанная бактериальная суспензия L.lactis, секретирующего OVA, и L.lactis, секретирующего мышиный IL-10] 6 раз в течение 5 дней подряд (в дни от -46 до -42, от -39 до -35, от -32 до -28, от -25 до -21, от -18 до -14, от -11 до -7 и от -4 до -1) или давали им разовую дозу 20 мг OVA в день -7 [положительный контроль 1], или давали им частые дозы 1 мкг OVA в те же дни, что и кормление L. lactis [положительный контроль 2]. Контрольные мыши не получали орального лечения. В 0-й день мышей иммунизировали подкожно OVA в полном адъюванте Фрейнда, а OVA-специфическую пролиферацию клеток PLN/ILN оценивали на 11-й день. Добавление LL-IL-10 значительно усиливало индукцию толерантности к OVA, поскольку OVA-специфический пролиферативный ответ клеток PLN/ILN (фиг. 1) был значительно снижен в группе LL-OVA [все]+LL-mIL-10 по сравнению с контролем и группой LL-ova.
Пример A2: LL-IL10 потенцирует оральную толерантность в сочетании со сниженной выработкой провоспалительных цитокинов в ответ на Ova
Для того чтобы исследовать оральную толерантность, мышей кормили орально GM L. lactis или OVA, как описано выше (пример 1), а несколько позже иммунизировали подкожно OVA в полном адъюванте Фрейнда. Через одиннадцать дней после иммунизации проводили количественную оценку выработки цитокинов в ответ на OVA в MLN и PLN/ILN в цитометрической бисерной матрице с применением набора мышиного воспаления. В MLN выработка провоспалительных цитокинов, IL-12, TNF-α, IFN-γ и IL-6 не была обнаружена или носила явно ограниченный характер в группе LL-ova+LL-mIL-10 по сравнению с группой LL-ova, в которой наблюдалась усиленная выработка этих провоспалительных цитокинов (фиг. 2A). В PLN выработка провоспалительных цитокинов, TNF-α, IFN-γ, MCP-1 и IL-6 носила строго ограниченный характер в группе LL-ova+LLmIL-10 по сравнению с группой LL-ova, причем в этой группе уровень TNF-α, MCP-1 и IL-6 был ниже по сравнению с контрольной группой (фиг. 2B).
Пример A3: LL-IL10 усиливает оральную толерантность через T-клетки CD4+.
Для того чтобы оценить, опосредована ли индукция оральной толерантности T-клетками CD4+ [везде], исследовали OVA-специфический пролиферативный ответ T-клеток CD4 в MLN и PLN/ILN. С этой целью мышей орально кормили GM L. lactis или OVA в указанные выше дни (см. пример 1). Мышей подкожно иммунизировали OVA в полном адъюванте Фрейнда в 0-й и 11-й дни. Затем T-клетки CD4 выделяли из MLN и PLN/ILN, после чего культивировали их в присутствии спленоцитов, обработанных митомицином C и нагруженных OVA. OVA-специфический ответ T-клеток CD4 в группе LL-ova+LL-mIL-10 был выражен значительно меньше по сравнению с группами LL-ova и контроля (фиг. 3).
Пример B: Индукция толерантности к факторам свертывания крови VIII и IX после орального введения L. lactis, секретирующего указанные факторы, в комбинации с IL-10, доставляемым in situ.
Введение
Некоторые терапевтические (рекомбинантные) белки, например, интерфероны, факторы VIII/IX и антитела (Remicade®), принято вводить в высоких дозах на протяжении длительного периода лечения. Однако их применение связано с таким осложнением как развитие специфического по отношению к этим белкам иммунного ответа, например, выработки антител. Такие антитела (Abs), также называемые ингибиторами, снижают лечебный эффект терапевтических белков. Примеры включают образование ингибиторов к факторам VIII/IX при гемофилии, к эритропоэтину (Epo) у больных, проходящих лечение по поводу хронической почечной недостаточности, и к бета-интерферону у больных, проходящих лечение по поводу рассеянного склероза. Здесь авторы демонстрируют, что оральная доставка фактора VIII (и фактора IX) в комбинации с L. lactis, вырабатывающим IL-10, подавляет образование ингибитора к указанным факторам через индукцию антигенспецифических регуляторных T-клеток CD4+.
Материалы и методы, использованные в примерах
Бактерии и плазмиды
Во всем этом исследовании был использован штамм L. lactis MG1363. Бактерии были культивированы в среде GM17, т.е. M17 (Difco Laboratories, Детройт, штат Мичиган) с добавкой 0,5% глюкозы. Запас исходных суспензий всех штаммов хранили при -20°C в 50% глицерине в среде GM17. Для внутрижелудочных инокуляций маточные суспензии разводили в 200 раз в свежей среде GM17 и инкубировали при 30°C. Плотность бактериального насыщения в разведенных суспензиях 2×109 колониеобразующих единиц (КОЕ) на мл достигалась через 16 часов. На всем протяжении этого исследования были использованы смешанные бактериальные суспензии. Поэтому бактерии, подлежавшие перемешиванию, собирали центрифугированием, а осадки обеих бактериальных культур концентрировали в 10 раз в среде BM9 (Schotte, Steidler et al. 2000). Для лечения каждая мышь получала 100 мкл этой суспензии через внутрижелудочный катетер.
Комплементарную ДНК FVIII и FIX человека или фрагменты кДНК, представляющие специфические по FVIII и FIX эпитопы T-клеток CD4+, амплифицировали в слитом состоянии с сигналом секреции Usp45 устойчивого к эритромицину вектора pT1NX, причем этот сигнал секреции был расположен ниже лактококкового промотора P1.
Штаммы MG1363, трансформированные плазмидами, несущими мышиный IL-10, FVIII (и/или фрагмент эпитопа), FIX (и/или фрагмент эпитопа), были обозначены как L. lactis, секретирующий IL10, LL-IL10, LL-FVIII, LL-FIX. В качестве контроля использовали LL-pT1NX, то есть штамм MG1363, содержащий пустой вектор pT1NX и обозначенный LL-pT1NX.
Количественное определение FVIII и FIX
FVIII или FIX из LL-FVIII и LL-IX, соответственно, определяли методом иммуносорбентного анализа с ферментной меткой (ELISA), специфического по FVIII и FIX человека, который был описан ранее (Chuah et al., 2003). Рекомбинантные белки также анализировали методом вестерн-блоттинга и аналитическими методиками COATests и aPTT, описанными в литературе (Chuah et al., 2003; Van den Driessche et al., 1999). NH2-конец этого белка определяли автоматическим расщеплением по Эдману. Поскольку FVIII и FIX обычно экспрессируются в печени, где они подвергаются большим посттрансляционным модификациям, факторы свертывания, которые выработаны L. lactis, сконструированными методами генной инженерии, могут быть биологически неактивными. Однако такие посттрансляционные различия, по-видимому, не отражаются на способности этих рекомбинантных белков, продуцированных L. lactis, индуцировать иммунную толерантность. Действительно, большинство ингибиторов, которые к настоящему времени подробно охарактеризованы, типично распознают аминокислотные остатки (Villard et al., 2003) скорее, чем гликозилированные компоненты.
Животные
В лаборатории разводили мышей с гемофилией A или B, полученных выбиванием мышиных генов FVIII или FIX, соответственно, при использовании гомологичной рекомбинации в клетках ES, как это описано в ссылках Bi et al., (1995) и Wang et al., (1997). При провокации очищенным рекомбинантным антигеном FVIII или FIX в присутствии CFA такие мыши реципиенты генерируют нейтрализующие антитела (Mingozzi et al., 2003). Статус ингибитора можно отслеживать по времени, применяя анализы Bethesda или специфические ELISA для антител против FVIII/против FIX. У мышей-реципиентов, контактировавших с FVIII или FIX (+CFA), ингибиторы, как правило, развиваются через 2-3 недели после антигенной провокации.
Условия эксперимента
Мыши 4-6-недельного возраста получали LL-FVIII, LL-FIX или LL-pT1NX, или посторонний антиген LL-OVA (оба фактора, упомянутые последними, служили отрицательным контролем) как в комбинации с LL-IL10 или белком IL-10 (1 или 10 мкг), так и без них. В качестве положительного контроля для индукции толерантности авторы инъекционно вводили мышам аденоассоциированные вирусные векторы (AAV), экспрессирующие FIX, начиная от специфического промотора гепатоцитов. У животных-реципиентов развивалась специфическая иммунная толерантность к FIX, которая предупреждала индукцию антител против FIX при последующей провокации FIX+CFA.
В целях профилактики мышам с гемофилией A или B орально (через желудочный катетер) вводили LL-FVIII, LL-FIX в чистом виде или в комбинации с LL-IL10 либо IL-10. Впоследствии этим мышам реципиентам делали провокацию очищенным рекомбинантным антигеном FVIII или FIX в присутствии CFA (Mingozzi et al., 2003). Контрольные животные контактировали с LL-pT1NX и LL-OVA. Плазму собирали посредством ретроорбитального извлечения крови. Развитие антител, направленных против FVIII или FIX, оценивали аналитическими методами Bethesda (Kasper et al., 1975) или посредством модифицированного специфического варианта ELISA для антител против FVIII или против FIX (Van den Driessche et al., 1999) с различными интервалами по времени.
В целях терапии мышей с гемофилией A или B сначала иммунизировали FVIII или FIX, как это описано в ссылке (Mingozzi et al., 2003). Статус ингибитора отслеживали по времени, применяя методы анализа Bethesda или специфические варианты ELISA для антител против FVIII/ против FIX. Мышей с низкими или высокими титрами ингибитора впоследствии лечили LL-FVIII, LL-FIX в чистом виде или в комбинации с LL-IL10 либо IL-10, применяя разные интервалы по времени и разные дозы и проводя исследование титра ингибитора во временной динамике. Специфичность положительной иммунной толерантности оценивали, делая провокации мышам, которые получали LL-FVIII, LL-FIX в чистом виде или в комбинации с LL-IL10 и посторонним антигеном (столбнячный анатоксин или Ova). В группе положительного контроля мыши получали орально очищенный FVIII или FIX.
Клеточные культуры, пролиферация и анализ цитокинов
Единые суспензии клеток селезенки и лимфатических узлов готовили, пропуская клетки через сетчатый клеточный фильтр с размером ячеек 70 мкм (Becton/Dickinson Labware). Эритроциты удаляли из суспензий клеток селезенки, проводя инкубацию с буфером для лизиса эритроцитов.
Для анализа пролиферации общей популяции спленоцитов 2×105 клеток культивировали в 96-луночных планшетах с U-образным дном в общем объеме 200 мкл полной среды (либо отдельно взятой, либо с добавлением очищенного FVIII или FIX, а также с добавкой или без добавки нейтрализующих моноклональных антител против IL-10 или против TGF-β. FVIII и FIX добавляли в концентрации от 1 до 100 мкг/мл. Нейтрализующие антитела добавляли в концентрации 1, 0,1 и 0,01 мкг/мл. Для анализа пролиферации популяций T-клеток CD4+ и T-клеток CD4+CD25- 0,2×105 T-клеток CD4+ или T-клеток CD4+CD25-культивировали в 96-луночных планшетах с U-образным дном и с добавлением 1×105 облученных клеток CD4-, действующих как антигенпредставляющие клетки, а также FVIII или FIX (0 или 100 мкг/мл) в общем объеме 200 мкл полной среды с нейтрализующими антителами или без них. После 72-часовой выдержки при 37°C в увлажненном инкубаторе с 5% CO2 проводили оценку пролиферации, добавляя 1 мкКи [3H]-тимидина на ячейку. ДНК-связанную радиоактивность собирали через 16-18 часов на фильтрующих матах из стекловолокна (Perkin Elmer, Бостон, штат Массачусетс), а включение тимидина измеряли сцинтилляционным счетчиком (Perkin Elmer).
Для измерения цитокинов супернатанты клеточных культур, использованных в различных анализах пролиферации, собирали через 24, 48 и 72 часа культивирования и замораживали при -20°C вплоть до проведения анализа на цитокины. Выработку цитокинов определяли количественно в цитометрической бисерной матрице с применением набора мышиного воспаления (BD Biosciences, Маунтин-Вью, штат Калифорния, США).
Анализ регуляторной активности T-клеток in vivo
Для тестирования на активную супрессию образования антител у мышей спленоциты, очищенные в бисерной матрице T-клетки CD4+, CD4+CD25- или CD4+CD25+, выделенные в разных экспериментальных группах, получавших L. Lactis, адоптивно переносили мышам линии C3H/HeJ, не подвергавшимся до этого никаким воздействиям. В качестве контроля были использованы мыши, не получавшие лечения. Количество перенесенных клеток составляло 107 для всех клеток селезенки, субпопуляции истощенных клеток селезенки или позитивно отобранных T-клеток CD4+, T-клеток CD4+CD25- и T-клеток CD4+CD25+. Мышам-реципиентам (n=4-5 на экспериментальную когорту) делали подкожную инъекцию 5 мкг FIX человека в cFA через 36 часов после адоптивного переноса. Титры антител IgG против FIX человека в плазме измеряли через 2,5 недели после иммунизации.
Пример B1: LL-IL10 значительно усиливает способность LL-FVIII и LL-IX индуцировать толерантность у мышей с гемофилией A или B.
Для того чтобы исследовать индукцию оральной толерантности, мышей орально кормили так, как это описано выше (см. условия эксперимента). Добавление LL-IL-10 значительно усиливало индукцию толерантности к FVIII и FIX, поскольку факторспецифический пролиферативный ответ спленоцитов значительно снижался в группе LL-FVIII/FIX+LL-mIL-10 по сравнению с группами контроля и LL-FVIII/IX.
Пример B2: LL-IL10 потенцирует оральную толерантность в сочетании со снижением специфических титров антител к FVIII и FIX, IFN-γ и большей выработкой IL10 и TGF-β в ответ на указанные факторы. Для того чтобы исследовать индукцию оральной толерантности, мышей орально кормили так, как описано выше (см. условия эксперимента). Количественную оценку специфических антител к FVIII и FIX, а также выработку цитокинов в ответ на указанные факторы в селезенке и лимфатических узлах проводили так, как описано выше. Образование ингибитора, выработка провоспалительного цитокина и IFN-γ были резко ограничены, а уровень иммуносупрессорных цитокинов IL-10 и TGF-β значительно повышен в группе LL-FVIII/FIX+LL-mIL-10 по сравнению с контролем и группой LL-FVIII/IX.
Пример B3: LL-IL10 усиливает оральную толерантность через T-клетки CD4+.
Для того чтобы оценить, опосредуют ли T-клетки CD4+ индукцию оральной толерантности, исследовали факторспецифический пролиферативный ответ T-клеток CD4+ в спленоцитах и лимфатических узлах. С этой целью мышей кормили орально, как это описано выше (см. условия эксперимента), а факторспецифическую пролиферацию T-клеток CD4+ определяли так, как это описано в разделе Клеточные культуры, пролиферация и анализ цитокинов. Факторспецифический ответ T-клеток CD4 в группе LL-FVIII/FIX+LL-mIL-10 был выражен значительно меньше по сравнению с контролем и группой LL-FVIII/IX.
Пример B4: IL-10 менее эффективен, чем LL-IL10 в потенцировании оральной толерантности
Для того чтобы оценить, насколько эффективна комбинация LL-IL10 по сравнению с IL-10, мышей кормили, как описано выше (см. условия эксперимента). Факторспецифический пролиферативный ответ T-клеток CD4 исследовали в спленоцитах и лимфатических узлах. Факторспецифический ответ T-клеток CD4 в группе LL-FVIII/FIX+LL-mIL-10 был выражен значительно меньше по сравнению с группой LL-FVIII/IX+IL-10.
Пример B5: Индуцированные антигеном регуляторные T-клетки после комбинированной терапии LL-FVIII/FIX-LL-IL10 могут переносить защиту от образования ингибитора in vivo
Для того чтобы протестировать активную супрессию образования антител у мышей, получавших лечение по протоколу оральной толерантности, авторы адоптивно переносили спленоциты от групп, получавших разное лечение, как это описано выше (Анализ регуляторной активности T-клеток in vivo). По сравнению с группами контроля и LL-FVIII/IX образование анти-фактора IgG было значительно снижено в группе LL-FVIII/FIX+LL-mIL-10, что указывает на активацию регуляторных T-клеток CD4+ в нашем протоколе комбинированной оральной толерантности.
Пример C: Индукция толерантности к аллергену Der p 1 после орального введения L. lactis, секретирующего указанный аллерген в комбинации с IL-10, доставляемым in situ.
Введение
Аллергическая астма является хроническим воспалительным заболеванием дыхательных путей. Оно характеризуется обратимой блокадой (непроходимостью) дыхательных путей, повышенным уровнем в сыворотке аллергенспецифического иммуноглобулина E, гиперсекрецией слизи и гиперчувствительностью дыхательных путей (AHR) к бронхоспазмогенным стимулам. Симптомы этой болезни ухудшаются при контакте с аллергенами, к которым больной был сенсибилизирован (например, с пыльцой деревьев, трав и сорняков, пылью и домашними пылевыми клещами, плесенью, шерстью животных). Ключевую роль в инициации, прогрессировании и персистенции заболевания играют T-хелперные лимфоциты 2 типа (Th2). Современные данные позволяют предположить, что регуляторные T-клетки в норме подавляют ответ Th2 на аллергены. Однако супрессия этой субпопуляции у лиц с аллергией понижена. Здесь мы демонстрируем, что оральная доставка аллергена в комбинации с L. lactis, вырабатывающим IL-10, подавляет реакции астматического типа через индукцию антигенспецифических регуляторных T-клеток CD4+.
Материалы и методы, использованные в примерах
Две мышиные модели аллергической астмы, имитирующей заболевание человека, представляет собой модель аллергена Ova и гуманизированную модель SCID.
Модель аллергена Ova
Мыши, сенсибилизированные OVA, получают ингаляционную провокацию аэрозолем с OVA, что приводит к эозинофильному воспалению дыхательных путей, зависимому от цитокина Th2, к гиперчувствительности бронхов и к выработке IgE, т.е. к тем проявлениям, которые очень характерны для аллергической астмы человека (Brusselle, 1994, Clin Exp Allergy 24:73; Kips et al. 1996, Am J Respir Crit Care Med 153:535; Brusselle et al. 1995, Am J Respir Cell Mol Biol 12:254).
Бактерии
Во всем этом исследовании был использован штамм L. lactis MG1363. Бактерии были культивированы в среде GM17, т.е. M17 (Difco Laboratories, Детройт, штат Мичиган) с добавкой 0,5% глюкозы. Запас исходных суспензий всех штаммов хранили при -20°C в 50% глицерине в среде GM17. Для внутрижелудочных инокуляций маточные суспензии разводили в 200 раз в свежей среде GM17 и инкубировали при 30°C. Плотность бактериального насыщения в разведенных суспензиях 2×109 колониеобразующих единиц (КОЕ) на мл достигалась через 16 часов. Бактерии собирали центрифугированием и 10-кратно концентрировали в среде BM9. Для лечения каждая мышь ежедневно получала 100 мкл этой суспензии через внутрижелудочный катетер.
Плазмиды
Последовательность мРНК, кодирующая овальбумин Gallus gallus, была получена из хранилища информации Genbank (номер доступа AY223553). Тотальную РНК выделяли из матки кур, а кДНК синтезировали, используя 2 мкг тотальной РНК, 2 мкМ олиго-dT-праймеры (Promega Corporation Benelux, Лейден, Нидерланды), 0,01 мМ DTT (Sigma-Aldrich, Звейндрехт, Нидерланды), 0,5 мМ dNTP (Invitrogen, Мерелбеке, Бельгия), 20 единиц Rnasin (Promega Incorporation Benelux) и 100 единиц обратной транскриптазы суперскрипта II (Invitrogen) в объеме 25 мкл. Фрагмент кДНК OVA был амплифицирован при помощи полимеразной цепной реакции (ПЦР) в следующих условиях: 94°C в течение 2 минут с последующими 30 циклами при 94°C в течение 45 секунд, 62°C в течение 30 секунд и 72°C в течение 90 секунд, а также с применением следующих прямого и обратного праймеров:
5'-GGCTCCATCGGTGCAGCAAGCATGGAATT-3' и
5'-ACTAGTTAAGGGGAAAC-ACATCTGCCAAAGAAGAGAA-3'.
Амплифицированный фрагмент был сплавлен с сигналом секреции Usp45 вектора pT1NX, устойчивого к эритромицину, ниже лактококкового промотора P1.
Штаммы MG1363, трансформированные плазмидами, несущими мышиный IL-10 и кДНК OVA, были обозначены LL-IL10 и LL-OVA. В качестве контроля использовали LL-pT1NX, то есть штамм MG1363, содержащий пустой вектор pT1NX и обозначенный LL-pT1NX.
Количественное определение OVA
OVA из LL-OVA определяли методом иммуносорбентного анализа с ферментной меткой (ELISA) собственной разработки. Выработку рекомбинантных белков также оценивали методом вестерн-блоттинга.
Модель аллергена OVA
Мыши
Мыши линии BALB/c (в возрасте от 6 до 8 недель) были приобретены в Charles River Laboratories (Калько, Италия). Мышей содержали в специальных условиях при отсутствии патогенных микроорганизмов.
Иммунизация мышей
Мышей иммунизировали интраперитонеально 2 мкг OVA (сорта V; Sigma-Aldrich) в 2 мг гидроокиси алюминия (alum). Эту иммунизацию повторяли с 10-дневным интервалом (0-й и 10-й дни). Контрольным мышам вместо раствора OVA/alum делали инъекцию физиологического раствора. Через семь дней после иммунизации сенсибилизированным мышам в течение 10 минут делали аэрозольную ингаляцию 3% раствором OVA в PBS. Ингаляцию OVA проводили 3 дня подряд (18-й, 19-й и 20-й дни). Контрольным мышам делали ингаляцию чистым PBS в тех же условиях, что и животным из экспериментальной группы.
Индукция оральной толерантности
Мыши получали или только LL-OVA, или LL-OVA в комбинации с IL-10 (1 или 10 мкг), либо LL-IL10, только LL-IL10, только IL-10 (1 или 10 мкг), LL-pT1NX или воду (контроль без кормления). В профилактическом варианте мышей кормили по двум разным режимам перед первой интраперитонеальной иммунизацией. Режимы кормления 1 и 2 состояли, соответственно, из 4 и 6 циклов ежедневного введения в течение 5 дней, перемежающегося с 2-дневными периодами, когда животные не получали корма (с испытуемыми веществами). Для положительного контроля индукции оральной толерантности мышей кормили OVA в дозах 1 мг (низкая доза) или 30 мг (высокая доза) через день с 10-го по 2-й день перед первой иммунизацией (в общей сложности 5 кормлений) через внутрижелудочный катетер, чтобы уменьшить бронхиальную эозинофилию и гиперчувствительность дыхательных путей, причем кормление высокой дозой оказалось эффективнее, чем кормление низкой дозой.
В терапевтическом варианте эксперимента мышей ежедневно кормили теми же штаммами L. lactis, что и в профилактическом варианте, с той разницей, что целевое кормление начинали с момента первой иммунизации и продолжали в течение 8 дней после иммунизации.
Для положительного контроля индукции оральной толерантности мышей кормили 30 мг OVA.
Измерение гиперчувствительности дыхательных путей (AHR)
Через 24 часа после заключительной ингаляции (21-й день) проводили оценку гиперчувствительности дыхательных путей методом индуцированной метахолином блокады дыхательных путей. Мышам в течение 2,5 минут давали дышать распыленным физиологическим раствором (Otsuka Pharmaceutical), а затем давали им через ингаляцию нарастающие дозы распыленного метахолина (от 1 до 30 мг/мл). Этих мышей помещали в плетизмограф для измерений всего тела на 2,5 минуты после распыления, а измерение расширенной паузы (Penh) проводили при помощи системы Biosystem XA WBP (Buxco Electronics). Показатель "Penh" отражает блокаду легочных дыхательных путей и рассчитывается по формуле: Penh=((Te-Tr)/(Tr×PEF/PIF)), где Penh = расширенная пауза (безразмерная), Te = время выдоха (в секундах), Tr = время релаксации (в секундах), PEF = максимальная скорость выдоха (в миллиметрах в секунду), а PIF = максимальная скорость вдоха (в миллиметрах в секунду). Показатель Penh измеряют и усредняют приблизительно каждые 5 секунд, а по кумулятивным величинам вычисляют средний показатель Penh для каждой точки времени. Гиперчувствительность дыхательных путей выражают как PC200Mch (200% провокационная концентрация метахолина), которая представляет собой удвоенную исходную величину Penh.
Анализ промывной бронхоальвеолярной жидкости (BALF)
После измерения гиперчувствительности дыхательных путей были взяты образцы промывной бронхоальвеолярной жидкости. Мышей анестезировали интраперитонеальной инъекцией 100 мг/кг кетамина и 10 мг/кг ксилазина, после чего легкие четыре раза промывали 0,5 мл физиологического раствора. Промывную жидкость центрифугировали, а полученный клеточный осадок ресуспендировали в 1 мл физиологического раствора с 1% BSA. Подсчет общего количества клеток проводили при помощи гемоцитометра. Цитоспиновые образцы готовили, центрифугируя суспензии на скорости 300 оборотов в минуту в течение 5 минут. Для того чтобы четко отличить эозинофилы от нейтрофилов, использовали три разных красителя: Diff-Quick, May-Grunwald-Giemsa и Hansel (эозин). По меньшей мере 300 лейкоцитов дифференцировали под световым микроскопом на основе стандартных морфологических критериев. Уровень IL-13, IL-4 и IL-5 в BALF определяли анализом в цитометрической бисерной матрице (BD Biosciences, Маунтин-Вью, штат Калифорния, США), основываясь на инструкциях производителя.
Измерение общего сывороточного IgE и OVA-специфического Ig
Образцы крови получали в 21-й день (из ретроорбитального синуса под анестезией). После полной коагуляции образцов проводили центрифугирование, собирали сыворотку и хранили ее при -80°C до момента использования в анализах. Общий IgE анализировали методом ELISA с использованием парных Abs (BD Pharmingen) в соответствии в инструкциями производителя. Чтобы измерить OVA-специфические IgE, IgG1 и IgG2a в сыворотке, планшеты для микротитров (Maxisorp, Nunc, VWR International, Хаасроде, Бельгия) покрывали 2 мкг/мл OVA. Затем лунки блокировали 0,1% казеином в PBS, после чего планшеты инкубировали с образцами мышиной сыворотки, разбавленными от 1:10 до 1:20480 в PBS, содержащем 0,1% казеина и 0,05% твин-20 (PBS-CT), с козьим противомышиным IgG2a-HRP [Southern Biotechnology Associates (SBA), Imtec ITK Diagnostics, Антверпен, Бельгия, разведение 1:5000], козьим противомышиным IgG1-HRP или козьим противомышиным IgE-HRP (SBA, разведение 1:5000). После отмывания в каждую лунку добавляли субстрат [субстратный реактив 3,3',5,5' тетраметилбензидин (TMB), Pharmingen, Becton Dickinson, Эрембодегем, Бельгия]. Наконец, реакции останавливали, добавляя в лунки 1M H2SO4. Спектральную поглощательную способность считывали на длине волны 450 нм. Балльные оценки ELISA выражали как титры, противоположные самому высокому разведению, которое при OD450 было все еще выше, чем расчетная величина отсечения. Величину отсечения рассчитывали как средний показатель OD450 по пяти неиммунизированным мышам, увеличенный на три стандартных отклонения.
Гистологическое исследование ткани легких
После получения образцов бронхоальвеолярной промывной жидкости легкие заполняли физиологическим раствором и резецировали из мышей. Легкие фиксировали нейтрализованным забуференным формалином и заливали парафином. Срезы толщиной 3 мкм окрашивали H&E или Шифф-иодной кислотой (PAS). Интенсивность гистологических изменений в легких оценивали по четырехбалльной шкале (0 = отсутствие воспаления; 1 = слабое/легкое воспаление; 2 = умеренное воспаление и 3= тяжелое воспаление) в зависимости от распределения и интенсивности следующих признаков: 1) сброс эпителия или ундуляция ядер в клетках бронхиального эпителия, 2) увеличение количества бокаловидных эпителиальных клеток, 3) инфильтрация воспалительных клеток из сосудов в слизистую и подслизистую области бронхов и перибронхиальную интерстициальную ткань и 4) гипертрофия и утолщение слоя гладкомышечных клеток.
Применение РТ-ПЦР для анализа экспрессии гена цитокина и хемокина в легких
Легкие извлекали после их заполнения физиологическим раствором, а тотальную РНК экстрагировали набором ISOGEN (Nippon Gene) в соответствии с инструкциями производителя. Затем проводили обратную транскрипцию тотальной РНК с праймером олиго(dT)15 (Promega) и обратной транскриптазой суперскрипта II РНазы H (Invitrogen Life Technologies) при 42°C в течение 2 часов. Для того чтобы убедиться в том, что каждый образец содержит одинаковое количество кДНК, прежде всего в образцах определяли концентрацию кДНК β-актина с использованием специфических для β-актина праймеров. Эти образцы амплифицировали в соответствующем числе циклов с тем расчетом, чтобы количество продукта ПЦР не выходило за линейную часть кривой амплификации. Продукты ПЦР подвергали электрофоретической разгонке в 2% агарозном геле и визуализировали, окрашивая бромидом этидия. Уровни IL-13, эотаксина, IL-10, IFN-γ и TGF-β определяли со следующими специфическими наборами праймеров.
Смысловой праймер для β-актина 5'-ACGACATGGAGAAGATCTGG-3' и
антисмысловой праймер 5'-TCGTAGATGGGCACAGTGTG-3'.
Смысловой праймер для IL-13 5'-TCTTGCTTGCCTTGGTGGTCTCGC-3' и
антисмысловой праймер 5'-GATGGCATTGCAATTGGAGATGTTG-3'.
Смысловой праймер для эотаксина 5'-GGGCAGTAACTTCCATCTGTCTCC-3' и
антисмысловой праймер 5'-CACTTCTTCTTGGGGTCAGC-3'.
Смысловой праймер для IL-10 5'-TACCTGGTAGGAGTGATGCC-3' и
антисмысловой праймер 5'-GCATAGAAGCATACATGATG-3'.
Смысловой праймер для IFN-γ 5'-CATAGATGTGGAAGAAAAGA-3' и
антисмысловой праймер 5'- TTGCTGAAGAAGGTAGTAAT-3'.
Смысловой праймер для TGF-β 5'-CTTTAGGAAGGACCTGGGTT-3' и
антисмысловой праймер 5'-CAGGAGCGCACAATCATGTT-3'.
Клеточные культуры, пролиферация и анализ цитокинов
Через день после заключительной ингаляции (21-й день) единые суспензии клеток селезенки и лимфатических узлов средостения готовили, пропуская клетки через сетчатый клеточный фильтр с размером ячеек 70 мкм (Becton/Dickinson Labware). Эритроциты удаляли из суспензий клеток селезенки, проводя инкубацию с буфером для лизиса эритроцитов. T-клетки CD4+ и T-клетки CD4+CD25- накапливали, используя набор для выделения T-клеток CD4+(Miltenyi Biotec, Германия) или набор для выделения регуляторных T-клеток CD4+CD25+(Miltenyi Biotec, Германия), соответственно, а также колонки MACS (midiMACS; Miltenyi Biotec).
Для анализа пролиферации общей популяции спленоцитов и популяции LN 2×105 клеток культивировали в 96-луночных планшетах с U-образным дном в общем объеме 200 мкл полной среды, либо отдельно взятой, либо с добавлением очищенного OVA, а также с добавкой или без добавки нейтрализующих моноклональных антител против IL-10 или против TGF-β. OVA добавляли в диапазоне концентраций от 1 до 100 мкг/мл. Нейтрализующие антитела добавляли в концентрации 1, 0,1 и 0,01 мкг/мл. Для анализа пролиферации популяций T-клеток CD4+ и T-клеток CD4+CD25-2×105 T-клеток CD4+ и T-клеток CD4+CD25- культивировали в 96-луночных планшетах с U-образным дном вместе с обработанными митомицином спленоцитами которые загружали с 1 мг/мл OVA на 16 часов (они действовали как антигенпредставляющие клетки) в соотношении T-клетки CD4+ или T-клетки CD4+CD25-/APC 1/1, 1/0,3, 1/0,1, 1/0,03, 1/0 в общем объеме 200 мкл полной среды с добавкой или без добавки нейтрализующих антител. После 72-часовой выдержки при 37°C в увлажненном инкубаторе с 5% CO2 проводили оценку пролиферации, добавляя 1 мкКи [3H]-тимидина на ячейку. ДНК-связанную радиоактивность собирали через 18 часов на фильтрующих матах из стекловолокна (Perkin Elmer, Бостон, США), а включение тимидина измеряли сцинтилляционным счетчиком (Perkin Elmer).
Для измерения цитокинов супернатанты клеточных культур, использованных в различных анализах пролиферации, собирали через 24, 48 и 72 часа культивирования и замораживали при -80°C вплоть до проведения анализа на цитокины. Выработку цитокинов определяли количественно в цитометрической бисерной матрице с применением набора мышиного воспаления (BD Biosciences, Маунтин-Вью, штат Калифорния, США).
Анализ регуляторной активности T-клеток in vivo
Через день после заключительной ингаляции (21-й день) селезенки экспериментальных мышей переваривали с 0,1% коллагеназой (Sigma-Aldrich) при 37°C в течение 20 минут. В некоторых экспериментах единые клеточные суспензии цельных клеток селезенки готовили и культивировали с Con A (2 мкг/мл, Sigma-Aldrich) в течение 48 часов. Клетки собирали и 107 клеток адоптивно переносили внутривенным способом мышам линии BALB/c, не подвергавшимся до этого никаким воздействиям. Для отрицательного отбора клетки CD4+, CD8+, CD11c+, CD19+ или CD11b+ извлекали из всей совокупности клеток селезенки, используя магнитный бисер (MACS; Miltenyi Biotec) с биотинилированными противомышиными антителами (mAb) CD4, CD8, CD11c, CD19 и CD11b (BD Pharmingen) в соответствии с инструкциями производителя. Эффективность извлечения исследовали проточной цитометрией (>99%). Клетки CD4+, CD4+CD25- очищали, используя набор для выделения T-клеток CD4+ и набор для выделения регуляторных T-клеток в соответствии с инструкциями производителей. Чистоту положительно отобранных клеток проверяли методом проточной цитометрии. В экспериментах с переносом клеток клетки из хвостовых вен переносили мышам линии BALB/c непосредственно перед их первой иммунизацией или сразу же после второй иммунизации OVA/alum. Количество перенесенных клеток составляло 107 для всех клеток селезенки, субпопуляции истощенных клеток селезенки или позитивно отобранных клеток CD4+и CD4+CD25-.
Гуманизированная модель SCID (hu-SCID) (описанная в ссылках Duez et al., 2000; Hammad et al., 2000)
В этой модели можно изучать аллергический иммунный ответ на аллерген Der p 1 клещей домашней пыли. У таких hu-SCID мышей, воссозданных интраперитонеальным введением PBMC от больных с аллергией на HDM и впоследствии подвергнутых контакту с аэрозолями HDM, вырабатывается IgE человека, развиваются инфильтраты в легких, состоящие из активированных T-клеток и DC, и демонстрируется AHR в ответ на бронхоконстрикторные агенты (Pestel et al. 1994, J Immunol, 153:3804; Duez et al., Am J Respir Crit Care Med, vol. 161, pp. 200-206, 2000).
Бактерии
Во всем этом исследовании был использован штамм L. lactis MG1363. Бактерии были культивированы в среде GM17, т.е. M17 (Difco Laboratories, Детройт, штат Мичиган), с добавкой 0,5% глюкозы. Запас исходных суспензий всех штаммов хранили при -20°C в 50% глицерине в среде GM17. Для внутрижелудочных инокуляций маточные суспензии разводили в 200 раз в свежей среде GM17 и инкубировали при 30°C. Плотность бактериального насыщения в разведенных суспензиях 2×109 колониеобразующих единиц (КОЕ) на мл достигалась через 16 часов. Бактерии собирали центрифугированием и 10-кратно концентрировали в среде BM9. Для лечения каждая мышь ежедневно получала 100 мкл этой суспензии через внутрижелудочный катетер.
Плазмиды
Одним из главных аллергенов клещей Dermatophagoides pteronyssinus (Dpt) считается Der p 1, глобулярный гликопротеин, состоящий из 222 аминокислотных остатков. Последовательность ДНК с оптимальным использованием кодона L. lactis, кодирующая белок Der p 1, была синтезирована, амплифицирована и слита с сигналом секреции Usp45 устойчивого к эритромицину вектора pT1NX (ниже лактококкового промотора P1). Штаммы MG1363, трансформированные плазмидами, несущими кДНК мышиных IL-10, Der p 1, Der p 1 aa52-71 и Der p 1 aa117-133, были обозначены LL-IL10, LL-Derp1, LL-Derp1aa52-71 и LL-Derplaa117-133. В качестве контроля был использован штамм LL-pT1NX, который представляет собой MG1363, содержащий пустой вектор pT1NX.
Количественное определение Der p 1
Der p 1 из LL-Derp1 определяли методом специфического по отношению к Der p 1 иммуносорбентного анализа с ферментной меткой (ELISA) собственной разработки. Выработку рекомбинантных белков также оценивали методом вестерн-блоттинга.
Больные
Кровь собирали от доноров, чувствительных или нечувствительных к домашним пылевым клещам. У больных с аллергией были представлены обычные признаки сенсибилизации к домашним пылевым клещам. Инъекционные кожные пробы на аллерген Dermatophagoides pteronyssinus (Dpt) (Stallergenes, Fresnes, Франция) (диаметр ≥10 мм) были положительными, и у всех больных в сыворотке были обнаружены специфические антитела IgE. Концентрации тотального IgE превышали 150 МЕ/мл (150-1600 МЕ/мл). Здоровые доноры проходили обследование в качестве отрицательного контроля (уровень тотального IgE менее 150 МЕ/мл и отрицательные результаты инъекционной кожной пробы на распространенные аллергены, вдыхаемые с воздухом).
Приготовление мононуклеарных клеток из периферической крови человека
Плазма с обилием тромбоцитов была получена после центрифугирования (120×g, 15 минут) и отброшена. После этого клетки крови разводили в среде RPMI 1640 (Life Technologies, Пейзли, Шотландия) и разделяли на слои в градиенте Ficoll (Pharmacia, Упсала, Швеция). После центрифугирования (400×g, 30 минут) мононуклеарные клетки периферической крови (PBMC) собирали на границе раздела и троекратно отмывали в стерильной среде RPMI перед переносом.
Мыши
Мышей линии C.B.-17 SCID (в возрасте 6-8 недель) содержали в изоляторах со стерилизованной подстилкой и в специальных условиях для животных. Колонию SCID регулярно проверяли методом ELISA на отсутствие мышиного сывороточного иммуноглобулина.
Перенос мононуклеарных клеток периферической крови мышам SCID: Мыши PBMC hu-SCID
На момент переноса клеток возраст мышей SCID составлял от 6 до 8 недель. Мыши были воссозданы посредством интраперитонеальной инъекции 10×106 мононуклеарных клеток от больных аллергией или от здоровых доноров в 400 мкл среды RPMI через иглу 23 калибра. В тот же день они получили интраперитонеально 2 единицы индексной реактивности [IR] Dpt. Через четыре дня после воссоздания клеток мышей SCID подвергали ежедневному контакту с аллергенными аэрозолями, содержавшими 100 единиц IR Dpt (100 единиц IR примерно соответствуют 200 мкг белка, содержащегося в экстракте Dpt), в течение 4 дней подряд (с 0-го по 4-й день). Контрольная группа животных не контактировала с Dpt. За один день до измерения реактивности дыхательных путей (35-й и 60-й день), мышей hu-SCID подвергали контакту еще с одним аэрозольным раствором, содержащим 100 единиц IR Dpt.
Условия эксперимента
Мыши получали L. lactis, сконструированный для экспрессии Der p 1 или постороннего антигена OVA (в качестве отрицательного контроля) в комбинации или без комбинирования с белком LL-IL10 или IL-10 (1 или 10 мкг).
Генетически сконструированные бактерии L. lactis вводили орально мышам SCID при помощи желудочного катетера, используя разные интервалы лечения и начиная введение доз через день после воссоздания PBMC. Индукцию оральной толерантности оценивали, измеряя содержание сывороточных антител человека IgE, анализируя инфильтрацию легких, измеряя AHR и анализируя клеточные популяции, а также выработку цитокинов в BALF. Кроме того, индукцию толерантности оценивали, анализируя ответ пролиферативных T-клеток, направленный против Der p 1.
Оценка реактивности дыхательных путей (AHR)
Реактивность дыхательных путей (выраженную как провокационная доза карбохолина, обусловливающая увеличение резистентности легких на 50%) измеряли в 35-й или 60-й день, как это описано в ссылке Duez et al. 2000.
Измерения IgE человека
Через несколько дней после трансплантации клеток человека у мышей извлекали кровь из ретроорбитального синуса под эфирным наркозом. Общий IgE человека исследовали иммунорадиометрическим методом с двойной системой различных мышиных антител (mAb), специфичных по отношению к ε-цепи (Immunotech International, Люмини, Франция). В повторных тестах было использовано по меньшей мере 20 мкл сыворотки. Чувствительность методики позволяла выявлять 0,1 МЕ/мл (0,24 нг/мл).
Определение специфических антител IgE против аллергена Dpt проводили методом ELISA. Вкратце, пластмассовые пробирки (Maxisorb Startube, Нунк, Дания) покрывали на ночь аллергеном Dpt в 0,1 M карбонатном/бикарбонатном буфере (pH 9,6) при 4°C и насыщали 1% BSA в 0,1 M PBS (pH 7,4) в течение 2 часов при комнатной температуре. После отмывания пробирки инкубировали 2 часа при комнатной температуре и в течение ночи при 4°C с сывороткой мышей Hu-SCID, разведенной в PBS, содержащем BSA (1%) и твин (0,01%). После экстенсивного отмывания добавляли антитела IgE против человека с меткой HRP. После отмывания в каждую лунку добавляли субстрат [субстратный реактив 3,3',5,5' тетраметилбензидин (TMB), Pharmingen, Becton Dickinson, Эрамбодегем, Бельгия]. Наконец, реакции останавливали, добавляя в лунки 1M H2SO4. Спектральную поглощательную способность считывали на длине волны 450 нм.
Гистологическое исследование легких.
Легкие иссекали на 35-й день, фиксировали в параформальдегиде и заливали парафином. Парафиновые срезы ткани окрашивали для выявления клеток CD45+ человека, после чего клетки человека в срезах мышиных легких подсчитывали по гистологической методике, описанной в ссылке Duez et al. 2000.
Анализ промывной бронхоальвеолярной жидкости (BALF)
Анализ BALF проводили так, как это описано в модели аллергена OVA.
Клеточные культуры, пролиферация и анализ цитокинов:
Единые суспензии клеток селезенки готовили, пропуская клетки через сетчатый клеточный фильтр с размером ячеек 70 мкм (Becton/Dickinson Labware). Эритроциты удаляли из суспензий клеток селезенки, проводя инкубацию с буфером для лизиса эритроцитов. T-клетки CD4+ и T-клетки CD4+CD25- накапливали, используя набор для выделения T-клеток CD4+(Miltenyi Biotec, Германия) или набор для выделения регуляторных T-клеток CD4+CD25+(Miltenyi Biotec, Германия), соответственно, а также колонки MACS (midiMACS; Miltenyi Biotec).
Для анализа пролиферации общей популяции спленоцитов 2×105 клеток культивировали в 96-луночных планшетах с U-образным дном в общем объеме 200 мкл полной среды, либо отдельно взятой, либо с добавлением очищенного Der p 1, а также с добавкой или без добавки нейтрализующих моноклональных антител против IL-10 или против TGF-β. Der p 1 добавляли в диапазоне концентраций от 1 до 100 мкг/мл. Нейтрализующие антитела добавляли в концентрации 1, 0,1 и 0,01 мкг/мл. Для анализа пролиферации популяций T-клеток человека CD4+ и T-клеток человека CD4+CD25-2×105 T-клеток CD4+ и T-клеток CD4+CD25- культивировали в 96-луночных планшетах с U-образным дном вместе с обработанными митомицином PBMC человека, которые загружали с 1 мг/мл Der p 1 на 16 часов (они действовали как антигенпредставляющие клетки) в соотношении T-клетки CD4+ или T-клетки CD4+CD25-/APC 1/1, 1/0,3, 1/0,1, 1/0,03, 1/0 в общем объеме 200 мкл полной среды с добавкой или без добавки нейтрализующих антител. После 72-часовой выдержки при 37°C в увлажненном инкубаторе с 5% C02 проводили оценку пролиферации, добавляя 1 мкКи [3H]-тимидина на ячейку. ДНК-связанную радиоактивность собирали через 18 часов на фильтрующих матах из стекловолокна (Perkin Elmer, Бостон, штат Массачусетс), а включение тимидина измеряли сцинтилляционным счетчиком (Perkin Elmer).
Для измерения цитокинов супернатанты клеточных культур, использованных в различных анализах пролиферации, собирали через 24, 48 и 72 часа культивирования и замораживали при -80°C вплоть до проведения анализа на цитокины. Выработку цитокинов определяли количественно в цитометрической бисерной матрице с применением набора воспаления человека (BD Biosciences, Маунтин-Вью, штат Калифорния, США).
Пример C1: LL-IL10 значительно усиливает способность LL-OVA и LL-Der p 1 индуцировать толерантность в OVA- и huSCID мышиной модели астмы, соответственно.
Для того чтобы исследовать индукцию оральной толерантности, мышей орально кормили так, как описано выше (см. условия эксперимента). Добавление LL-IL-10 значительно усиливало индукцию толерантности к OVA/Derp1, поскольку аллергенспецифический пролиферативный ответ спленоцитов значительно снижался в группе LL-OVA/Derp1+LL-mIL-10 по сравнению с группами контроля и LL-OVA/Derp1.
Пример C2: LL-IL10 потенцирует оральную толерантность в сочетании со снижением, эозинофильной инфильтрации, уровня IgE в сыворотке и сниженной выработкой цитокинов IL-13, IL-4 и IL-5 в ответ на указанный аллерген.
Для того чтобы исследовать индукцию оральной толерантности, мышей орально кормили так, как описано выше (см. условия эксперимента). Определение AHR, эозинофильной инфильтрации BALF, титр IgE, а также выработку цитокинов в ответ на указанный фактор проводили так, как описано выше. AHR, эозинофильная инфильтрация BALF, титр IgE были явно снижены, а уровень IL-13, IL-4 и IL-5 значительно снижен в группе LL-OVA/Derp1+LL-mIL-10 по сравнению с группами контроля и LL-OVA/Derp1.
Пример C3: LL-IL10 усиливает оральную толерантность через T-клетки CD4+.
Для того чтобы оценить, опосредуют ли T-клетки CD4 индукцию оральной толерантности, исследовали аллергенспецифический пролиферативный ответ T-клеток CD4 в спленоцитах и лимфатических узлах. С этой целью мышей кормили орально, как это описано выше (см. условия эксперимента), а аллергенспецифическую пролиферацию T-клеток CD4+ определяли так, как это описано в разделе Клеточные культуры, пролиферация и анализ цитокинов. Аллергенспецифический ответ T-клеток CD4 в группе LL-OVA/Derp1+LL-mIL-10 был выражен значительно меньше по сравнению с группами контроля и LL-OVA/Derp1.
Пример C4: IL-10 менее эффективен, чем LL-IL10 в потенцировании оральной толерантности
Для того чтобы оценить, насколько эффективна комбинация LL-IL10 по сравнению с IL-10, мышей кормили, как описано выше (см. условия эксперимента). Аллергенспецифический пролиферативный ответ T-клеток CD4 исследовали в спленоцитах и лимфатических узлах. Аллергенспецифический ответ T-клеток CD4 в группе LL-OVA/Derp1+LL-mIL-10 был выражен значительно меньше по сравнению с группой LL-OVA/Derp1+IL-10.
Пример C5: Индуцированные антигеном регуляторные T-клетки после комбинированной терапии LL-OVA-LL-IL10 могут переносить защиту от астмоподобного ответа in vivo
Для того чтобы протестировать активную супрессию астмоподобного ответа у мышей, получавших лечение по протоколу оральной толерантности, мы адоптивно переносили спленоциты от групп, получавших разное лечение, как это описано выше (Анализ регуляторной активности T-клеток in vivo). По сравнению с группами контроля и LL-OVA астмоподобные реакции были значительно снижены в группе LL-OVA+LL-mIL-10, что указывает на активацию регуляторных T-клеток CD4+ в нашем протоколе комбинированной оральной толерантности.
Пример D: Индукция толерантности к альфа-глиадину после орального введения L. lactis, секретирующих указанный аллерген, в комбинации с IL-10, доставляемым in situ
Введение
Целиакия, также известная как брюшное спру или глютензависимая энтеропатия, является хроническим воспалительным заболеванием, которое развивается в результате иммунного ответа на специфические пищевые злаки, содержащие глютен. Целиакия представляет собой сложное полигенное заболевание, в значительной степени связанное с генами, которые кодируют варианты лейкоцитарных антигенов человека HLA-DQ2 или HLA-DQ8. Одним из наиболее важных аспектов патогенеза целиакии является активация иммунного ответа T-хелперов 1. Это явление наблюдается, когда антигенпредставляющие клетки, которые экспрессируют молекулы HLA-DQ2/DQ8, представляют токсические глютеновые пептиды T-клеткам CD4(+). Оба класса глютеновых белков, глиадины и глютенины, содержат пептиды, которые связывают DQ2 и DQ8. Общепризнано, что такая иммунная реакция как выработка IFN-γ в глютенспецифических T-клетках, является пусковым фактором деструкции слизистой в тонком кишечнике у больных целиакией. Следовательно, активация вредного иммунного ответа T-клеток в кишечнике у больных целиакией является ключевым моментом в инициации и прогрессировании этого заболевания.
Здесь авторы демонстрируют, что оральная доставка глиадиновых пептидов в комбинации с L. lactis, вырабатывающим IL-10, подавляет глиадин-специфический иммунный ответ через индукцию антигенспецифических регуляторных T-клеток.
Материалы и методы, использованные в примерах
Бактерии
Во всем этом исследовании был использован штамм L. lactis MG1363. Бактерии были культивированы в среде GM17, т.е. M17 (Difco Laboratories, Детройт, штат Мичиган) с добавкой 0,5% глюкозы. Запас исходных суспензий всех штаммов хранили при -20°C в 50% глицерине в среде GM17. Для внутрижелудочных инокуляций маточные суспензии разводили в 200 раз в свежей среде GM17 и инкубировали при 30°C. Они достигали плотности насыщения 2×109 колониеобразующих единиц (КОЕ) на мл в течение 16 часов. Бактерии собирали центрифугированием и 10-кратно концентрировали в среде BM9. Для лечения каждая мышь ежедневно получала 100 мкл этой суспензии через внутрижелудочный катетер.
Плазмиды
Последовательность ДНК с оптимальным использованием кодона L. lactis, кодирующая белок альфа-глиадин (на основе последовательности Triticum aestivum, AJ133612), HLA-DQ8 (соответствие остаткам 203-220, последовательность UniProtKB/TrEMBL QYPSGQGSFQPSQQNPQA, вход Q9M4L6) и деамидированная форма HLA-DQ8 (соответствие остаткам 203-220, последовательность UniProtKB/TrEMBL QYPSGEGSFQPSQENPQA, вход Q9M4L6) для глиадиновых пептидов была синтезирована, амплифицирована и слита с сигналом секреции Usp45 устойчивого к эритромицину вектора pT1NX ниже лактококкового промотора P1.
Штаммы MG1363, трансформированные плазмидами, несущими мышиный IL-10, альфа-глиадин, HLA-DQ8 и деамидированный HLA-DQ8, были обозначены LL-IL10, LL-HLA/DQ8, LL-HLA/DQ8d. В качестве контроля использовали LL-pT1NX, то есть штамм MG1363, содержащий пустой вектор pT1NX.
Количественное определение HLA-DQ8 и DQ8d
HLA-DQ8 и HLA-DQ8d из LL-HLA/DQ8 и LL-HLA/DQ8d определяли по методике ELISA собственной разработки. Выработку рекомбинантных белков также оценивали методом вестерн-блоттинга.
Мыши
Трансгенные мыши HLA-DQ8 (Senger et al. 2003) содержались в специфических условиях (отсутствие патогенов, безглютеновая диета) и были использованы для экспериментов в возрасте 8-14 недель. Мышей иммунизировали инъекцией в подушечку лапки 50 мкг неочищенного глютена (Sigma-Aldrich) в 50 мкл CFA (Difco; BD).
Индукция оральной толерантности
Для экспериментов по толеризации мышам до и после их иммунизации вводили с разными интервалами и в разных дозах LL-HLA/DQ8, LL-HLA/DQ8d в чистом виде или в комбинации с IL-10 (1 или 10 мкг), либо LL-IL10, LL-IL10 в чистом виде, IL-10 в чистом виде (1 или 10 мкг), LL-pT1NX или воду (контроль без кормления). В группе положительного контроля индукции оральной толерантности мышей кормили дозами 50 мг пшеничного глиадина или рекомбинантного альфа-глиадина, растворенного в воде, из маточного раствора в дни -7, -6, -5, -4 перед иммунизацией (0-й день).
Измерение глиадин-специфического Ig
Неочищенный глиадин (Sigma-Aldrich) ресуспендировали в метаноле (10 мг/мл), а затем разводили в абсолютном этаноле до концентрации 1 мкг/мл. Сто микролитров раствора глиадина в этаноле (1 мкг/мл) вносили в каждую лунку планшета Immulon 2 (Fisher Scientific International Inc.), а затем высушивали под вытяжным колпаком. После этого планшеты блокировали 4% BSA/PBS в течение 2 часов при 37°C. Планшет отмывали 1×PBS, 0,05% твин-20. Образцы сыворотки разводили в 0,1% BSA/PBS в соотношении 1:200, 1:400 и 1:800, после чего их инкубировали в течение 1 часа при 37°C. Антителами для выявления служили биотинилированные противомышиные IgA крысы (Accurate Chemical & Scientific Corp.) и биотинилированные противомышиные IgG (Jackson ImmunoResearch Laboratories Inc). Ферментным конъюгатом был стрептавидин-HRP, а субстратом - TMB.
Клеточные культуры, пролиферация и анализ цитокинов
Единые суспензии клеток селезенки и лимфатических узлов средостения готовили, пропуская клетки через сетчатый клеточный фильтр с размером ячеек 70 мкм (Becton/Dickinson Labware). Эритроциты удаляли из суспензий клеток селезенки, проводя инкубацию с буфером для лизиса эритроцитов. T-клетки CD4+ и T-клетки CD4+CD25- накапливали, используя набор для выделения T-клеток CD4+(Miltenyi Biotec, Germany) или набор для выделения регуляторных T-клеток CD4+CD25+(Miltenyi Biotec, Germany), соответственно, а также колонки MACS (midiMACS; Miltenyi Biotec).
Для анализа пролиферации общей популяции спленоцитов и популяции LN 2×105 клеток культивировали в 96-луночных планшетах с U-образным дном в общем объеме 200 мкл полной среды, либо отдельно взятой, либо с добавлением неочищенного глиадина или синтетического HLA-DQ8/DQ8d, а также с добавкой или без добавки нейтрализующих моноклональных антител против IL-10 или против TGF-β. Антигены добавляли в диапазоне концентраций от 1 до 100 мкг/мл. Нейтрализующие антитела добавляли в концентрации 1, 0,1 и 0,01 мкг/мл. Для анализа пролиферации популяций T-клеток CD4+ и T-клеток CD4+CD25-2×105 T-клеток CD4+ и T-клеток CD4+CD25-культивировали в 96-луночных планшетах с U-образным дном вместе с обработанными митомицином спленоцитами, которые загружали с 1 мг/мл неочищенного глиадина или синтетического HLA-DQ8/DQ8d на 16 часов (они действовали как антигенпредставляющие клетки) в соотношении T-клетки CD4+ или T-клетки CD4+CD25-/APC 1/1, 1/0,3, 1/0,1, 1/0,03, 1/0 в общем объеме 200 мкл полной среды с добавкой или без добавки нейтрализующих антител. После 72-часовой выдержки при 37°C в увлажненном инкубаторе с 5% CO2 проводили оценку пролиферации, добавляя 1 мкКи [3H]-тимидина на ячейку. ДНК-связанную радиоактивность собирали через 18 часов на фильтрующих матах из стекловолокна (Perkin Elmer, Бостон, США), а включение тимидина измеряли сцинтилляционным счетчиком (Perkin Elmer).
Для измерения цитокинов супернатанты клеточных культур, использованных в различных анализах пролиферации, собирали через 24, 48 и 72 часа культивирования и замораживали при -80°C вплоть до проведения анализа на цитокины. Выработку цитокинов определяли количественно в цитометрической бисерной матрице с применением набора мышиного воспаления (BD Biosciences, Маунтин-Вью, штат Калифорния, США).
Пример D1: LL-IL10 значительно усиливает способность LL-HLA/DQ8d индуцировать толерантность
Для того чтобы исследовать индукцию оральной толерантности, мышей орально кормили так, как описано выше (см. Индукция оральной толерантности). Добавление LL-IL-10 значительно усиливало индукцию толерантности к HLA-DQ8d, поскольку HLA-DQ8d-специфический пролиферативный ответ спленоцитов значительно снижался в группе LL-HLA/DQ8d+LL-mIL-10 по сравнению с группами контроля и LL-HLA/DQ8d.
Пример D2: LL-IL10 потенцирует оральную толерантность в сочетании со сниженной выработкой IFN-γ в ответ на указанный аллерген.
Для того чтобы исследовать индукцию оральной толерантности, мышей орально кормили так, как описано выше (см. Индукция оральной толерантности). Выработку цитокинов в ответ на HLA-DQ8d оценивали количественно, как это описано выше (Клеточные культуры, пролиферация и анализ цитокинов). В спленоцитах и лимфатических узлах выработка провоспалительного цитокина IFN-γ была строго ограничена в группе LL-HLA/DQ8d+LL-mIL-10 по сравнению с группами контроля и LL-HLA/DQ8d.
Пример D3: LL-IL10 усиливает оральную толерантность через T-клетки CD4+.
Для того чтобы оценить, опосредуют ли T-клетки индукцию оральной толерантности, исследовали DQ8-специфический пролиферативный ответ T-клеток CD4 в спленоцитах и лимфатических узлах. С этой целью мышей кормили орально, как это описано выше (см. Индукция оральной толерантности), а DQ8-специфическую пролиферацию T-клеток CD4+ определяли так, как это описано в разделе Клеточные культуры, пролиферация и анализ цитокинов. DQ8-специфический ответ T-клеток CD4 в группе LL-HLA/DQ8d+LL-mIL-10 был выражен значительно меньше по сравнению с группами контроля и LL-HLA/DQ8d.
Пример D4: IL-10 менее эффективен, чем LL-IL10 в потенцировании оральной толерантности
Для того чтобы оценить, насколько эффективна комбинация LL-IL10 по сравнению с IL-10, мышей кормили, как описано выше (см. Индукция оральной толерантности). DQ8-специфический пролиферативный ответ T-клеток CD4 исследовали в спленоцитах и лимфатических узлах. DQ8-специфический ответ T-клеток CD4 в группе LL-HLA/DQ8d+LL-mIL-10 был выражен значительно меньше по сравнению с группой LL-HLA/DQ8d+IL-10.
Пример E: Индукция толерантности к пищевому аллергену BLG после орального введения L. lactis, секретирующих указанный аллерген, в комбинации с IL-10, доставляемым in situ
Введение
Пищевая аллергия является заболеванием, поражающим приблизительно от 2% до 5% населения. У человека повышение титра антител IgE, а также наличие антигенспецифических T-лимфоцитов, продуцирующих IL-4, позволяет предположить механизм, скошенный в сторону Th2.
Здесь мы демонстрируем, что оральная доставка пищевого аллергена в комбинации с L. lactis, вырабатывающим IL-10, подавляет аллергенспецифический иммунный ответ через индукцию антигенспецифических регуляторных T-клеток CD4+.
Материалы и методы, использованные в примерах
Бактерии и плазмиды
Во всем этом исследовании был использован штамм L. lactis MG1363. Бактерии были культивированы в среде GM17, т.е. M17 (Difco Laboratories, Детройт, штат Мичиган) с добавкой 0,5% глюкозы. Запас исходных суспензий всех штаммов хранили при -20°C в 50% глицерине в среде GM17. Для внутрижелудочных инокуляций маточные суспензии разводили в 200 раз в свежей среде GM17 и инкубировали при 30°C. Они достигали плотности насыщения 2×109 колониеобразующих единиц (КОЕ) на мл в течение 16 часов. Бактерии собирали центрифугированием и 10-кратно концентрировали в среде BM9. Для лечения каждая мышь ежедневно получала 100 мкл этой суспензии через внутрижелудочный катетер. кДНК бета-лактоглобулина крупного рогатого скота была амплифицирована и сплавлена с сигналом секреции Usp45 вектора pT1NX, устойчивого к эритромицину, ниже лактококкового промотора P1. Штаммы MG1363, трансформированные плазмидами, несущими мышиный IL-10 или BLG, были обозначены LL-IL10 и LL-BLG. В качестве контроля использовали LL-pT1NX, то есть штамм MG1363, содержащий пустой вектор pT1NX.
Количественное определение β-бактоглобулина (BLG) крупного рогатого скота
BLG из LL-BLG определяли специфичным для BLG методом иммуносорбентного анализа с ферментной меткой (ELISA) собственной разработки и вестерн-блоттингом.
Условия эксперимента
Для изучения защитного эффекта L. lactis была использована мышиная модель пищевой аллергии, представляющая собой мышиную модель индуцированного пищей иммунного ответа типа IgE, как это описано в ссылке Frossard et al. (J Allergy Clin Immunol 113:958-964, 2004). Мыши получали LL-BLG или посторонний антиген (OVA) в качестве отрицательного контроля либо в комбинации с LL-IL10 или рекомбинантным IL-10 (1 или 10 мкг), либо без них. Для положительного контроля индукции толерантности мыши получали высокую дозу BLG в питьевой воде, что служило профилактикой анафилаксии у мышей при последующей оральной провокации BLG.
В профилактическом варианте эксперимента мышам при помощи желудочного катетера орально вводили генетически сконструированные бактерии L. lactis, вырабатывающие BLG, с разными интервалами и в разных дозах. Впоследствии этим мышам реципиентам делали оральную провокацию очищенным антигеном BLG в присутствии токсина холеры. Контрольные животные контактировали с генетически сконструированными L. lactis и контрольным вектором, не экспрессирующим BLG (но вместо него экспрессирующим OVA). Индукцию толерантности оценивали, анализируя анафилаксию после внутрижелудочной антигенной провокации, измеряя титры BLG-специфического IgG1, IgG2a и IgE в сыворотке и фекалиях, определяя количество клеток, секретирующих антитела, в селезенке и PP, анализируя пролиферацию T-клеток и выработку цитокинов в MLN, PP и селезенке.
Для того чтобы оценить, усиливается ли индукция иммунной толерантности к BLG за счет IL-10, мышам вводили LL-BLG вместе с LL-IL10.
Оральная сенсибилизация к BLG.
Самок мышей линии C3H/HeOuJ (Charles River) в возрасте от 4 до 5 недель иммунизировали в 0-й, 7-й, 14-й и 21-й дни внутрижелудочным введением 20 мг BLG (Sigma) и 10 мкг CTX, приобретенного в List Biological Laboratories, в 0,2 моль/л NaHCO3. Группа положительного контроля (толеризованные мыши) получала 0,8 мг/мл BLG с питьевой водой без ограничений в течение 4 недель. Общее количество полученного животными белка (22,4 mg) соответствовало общему количеству BLG, полученного сенсибилизированными мышами. Авторы демонстрируют, что процедура толеризации также длительно активирует периферическую иммунную систему не только в слизистой оболочке, причем группа толеризованных мышей дважды получала интраперитонеальные инъекции 80 мкг BLG, адсорбированного в 1 мг квасцов, в 28-й и 42-й дни.
Антигенная провокация
В 28-й день эксперимента всем мышам делали провокацию, вводя внутрижелудочно 100 мг BLG в 0,4 мл 0,2 молярного NaHCO3. Анафилаксию наблюдали и оценивали по степеням, используя балльную шкалу (от 0 = отсутствием реакции до 3 = тяжелая реакция или смерть), которая подробно описана в ссылке (Frosssard et al., 2001). Внутреннюю температуру тела измеряли инфракрасным термометром в области уха непосредственно перед провокацией и через 30 минут после нее. Животных умерщвляли, через пункцию сердца собирали у них кровь в пробирки с ЭДТА и получали из этой крови плазму для измерения гистамина коммерческим набором ELISA (Immunotech, Марсель, Франция).
Клеточные культуры, пролиферация и анализ цитокинов
Единые клеточные суспензии селезенки, брыжеечных лимфоузлов и PP готовили, как это описано в ссылке Frossard et al. (2004). T-клетки CD4+ и T-клетки CD4+CD25- накапливали, используя набор для выделения T-клеток CD4+(Miltenyi Biotec, Германия) или набор для выделения регуляторных T-клеток CD4+CD25+(Miltenyi Biotec, Германия), соответственно, а также колонки MACS (midiMACS; Miltenyi Biotec). Для анализа пролиферации общей популяции спленоцитов и популяции LN 2×105 клеток культивировали в 96-луночных планшетах с U-образным дном в общем объеме 200 мкл полной среды, либо отдельно взятой, либо с добавлением очищенного BLG, а также с добавкой или без добавки нейтрализующих моноклональных антител против IL-10 или против TGF-β. BLG добавляли в диапазоне концентраций от 1 до 100 мкг/мл. Нейтрализующие антитела добавляли в концентрации 1, 0,1 и 0,01 мкг/мл. Для анализа пролиферации популяций T-клеток CD4+ и T-клеток CD4+CD25-2×105 T-клеток CD4+ и T-клеток CD4+CD25- культивировали в 96-луночных планшетах с U-образным дном вместе с обработанными митомицином спленоцитами, которые загружали с 1 мг/мл BLG на 16 часов (они действовали как антигенпредставляющие клетки) в соотношении T-клетки CD4+ или T-клетки CD4+CD25-/APC 1/1, 1/0,3, 1/0,1, 1/0,03, 1/0 в общем объеме 200 мкл полной среды с добавкой или без добавки нейтрализующих антител. После 72-часовой выдержки при 37°C в увлажненном инкубаторе с 5% CO2 проводили оценку пролиферации, добавляя 1 мкКи [3H]-тимидина на ячейку. ДНК-связанную радиоактивность собирали через 18 часов на фильтрующих матах из стекловолокна (Perkin Elmer, Бостон, США), а включение тимидина измеряли сцинтилляционным счетчиком (Perkin Elmer).
Для измерения цитокинов супернатанты клеточных культур, использованных в различных анализах пролиферации, собирали через 24, 48 и 72 часа культивирования и замораживали при -80°C вплоть до проведения анализа на цитокины. Выработку цитокинов определяли количественно в цитометрической бисерной матрице с применением набора мышиного воспаления (BD Biosciences, Маунтин-Вью, штат Калифорния, США).
Анализ регуляторной активности T-клеток in vivo
Для тестирования на активную супрессию образования антител у мышей спленоциты, очищенные в бисерной матрице T-клетки CD4+, CD4+CD25- или CD4+CD25+, выделенные в разных экспериментальных группах, получавших L. Lactis, адоптивно переносили мышам линии C3H/HeOuJ, не подвергавшимся до этого никаким воздействиям. В качестве контроля были использованы мыши, не получавшие лечения. Количество перенесенных клеток составляло 107 для всех клеток селезенки, субпопуляции истощенных клеток селезенки или позитивно отобранных T-клеток CD4+, T-клеток CD4+CD25- и T-клеток CD4+CD25+. Если вовлечены клетки Tregs, то последующая провокация с антигеном BLG у этих мышей должна предупреждать индукцию гуморальных иммунных реакций против BLG и анафилаксию.
Иммуносорбентный анализ с ферментной меткой на BLG-специфичную сыворотку и антитела в фекалиях.
Сыворотки получали из крови, взятой из хвостов животных в 0-й, 7-й, 14-й, 21-й и 28-й дни. Образцы фекалий получали в те же дни и ресуспендировали их в PBS плюс 1% FCS (Life technologies) с добавкой пепстатина 1:1000 (Fluka) в дозе 0,1 мг/мл. Эти образцы механически дезагрегировали и перемешивали вихревым движением в течение 2 минут, после чего дважды центрифугировали их при 4°C в течение 20 минут на скорости 14000 оборотов в минуту.
Анализ образцов сыворотки и фекалий на уровень BLG-специфичных антител IgE, IgG1, IgG2a и/или IgA проводили по методике, адаптированной из ссылки Adel-Patient et al. (2000, J. Immunol Methods). Вкратце, планшеты для микротитров MaxiSorp (Nunc) на 18 часов при комнатной температуре покрывали стрептавидином (Fluka) в дозе 250 нг на лунку с последующим добавлением 300 мкл раствора поливинилпирролидона K25 (Fluka) на ночь. Один микрограмм биотинилированного BLG инкубировали 3 часа, после чего добавляли разведенную сыворотку (1:6666 и 1:2222 на IgG1, 1:666 и 1:222 на IgG2a, 1:66 и 1:22 на IgE) или фекалии (1:3, 1:10 и 1:33) в PBS с 10% лошадиной сыворотки при дублировании проб и в присутствии меченных пероксидазой антител: 0,5 мкг/мл козьего противомышиного IgA, крысиного противомышиного IgG1 или противомышиного IgG2a (Southern Biotechnologies) на 2 часа. Для измерения IgE добавляли моноклональные противомышиные антитела IgE крысы (клон R35-72, BD Pharmingen) с последующим добавлением соединенных с пероксидазой противокрысиных антител (Caltag). Оптическую плотность измеряли на длине волны 490 нм. Результаты выражали в произвольных единицах, причем в качестве эталонной сыворотки использовали объединенную сыворотку от мышей, иммунизированных BLG и квасцами.
Измерение выработки антигенспецифических антител посредством ELISPOT.
Пейеровы бляшки механически иссекали из кишечника и инкубировали 30 минут в среде HBSS с добавкой 5 ммоль ЭДТА (Life Technologies). Подобным образом, пейеровы бляшки и брыжеечные лимфоузлы осторожно измельчали и фильтровали через нейлоновый фильтр с размером пор 70 мкм. Клетки селезенки предварительно инкубировали 5 минут в Tris-забуференном NH4Cl для удаления эритроцитов. Лимфобласты выделяли в градиенте перколла 60%/66% (Amersham).
Для измерения BLG-специфичных антител IgG1, IgG2a и IgA планшеты ELISPOT (Millipore) покрывали стрептавидином на ночь при 37°C, а затем добавляли 1 мкг биотинилированного BLG на 3 часа. Лимфобласты, выделенные в градиенте перколла 60%/66%, ресуспендировали в двух разных концентрациях, 1 и 2×106 в среде Дульбекко, модифицированной по способу Искова с добавкой пенициллина, стрептомицина, L-глютамина, гентамицина, полимиксина B и 5% FCS в течение 24 часов при 37°C, после чего их инкубировали в течение ночи при 4°C с антителами против IgA, против IgG1 и против IgG2a (Southern Biotechnology). Аминоэтилкарбазол в дозе 100 микролитров на лунку добавляли на 10 минут, после чего проводили автоматический подсчет пятен при помощи компьютерной программы KS ELISPOT, версия 4.2.1 (Zeiss), а результат подсчета выражали как количество клеткообразующих единиц на 106 клеток (КОЕ).
Пример E1: LL-IL10 значительно усиливает способность LL-BLG индуцировать толерантность в мышиной модели пищевой аллергии.
Для того чтобы исследовать индукцию оральной толерантности, мышей орально кормили так, как описано выше (см. условия эксперимента). Добавление LL-IL-10 значительно усиливало индукцию толерантности к BLG, поскольку аллергенспецифический пролиферативный ответ спленоцитов значительно снижался в группе LL-BLG+LL-mIL-10 по сравнению с группами контроля и LL-BLG.
Пример E2: LL-IL10 потенцирует оральную толерантность в сочетании со сниженной реакцией BLG-специфических антител и сниженной выработкой цитокина IL-4 в ответ на указанный аллерген. Для того чтобы исследовать индукцию оральной толерантности, мышей орально кормили так, как описано выше (см. условия эксперимента). Реакцию BLG-специфических антител и выработку цитокинов в ответ на указанный фактор определяли так, как это описано выше. Уровень BLG-специфических антител и IL-4 был значительно снижен в группе LL-BLG+LL-mIL-10 по сравнению с группами контроля и LL-BLG.
Пример E3: LL-IL10 усиливает оральную толерантность через T-клетки CD4+.
Для того чтобы оценить, опосредуют ли T-клетки CD4+ индукцию оральной толерантности, исследовали аллергенспецифический пролиферативный ответ T-клеток CD4+ в спленоцитах и лимфатических узлах. С этой целью мышей кормили орально, как это описано выше (см. условия эксперимента), а аллергенспецифическую пролиферацию T-клеток CD4+ определяли так, как это описано в разделе Клеточные культуры, пролиферация и анализ цитокинов. Аллергенспецифический ответ T-клеток CD4 в группе LL-BLG+LL-mIL-10 был выражен значительно меньше по сравнению с группами контроля и LL-BLG.
Пример E4: IL-10 менее эффективен, чем LL-IL10 в потенцировании оральной толерантности
Для того чтобы оценить, насколько эффективна комбинация LL-IL10 по сравнению с IL-10, мышей кормили, как описано выше (см. условия эксперимента). Аллергенспецифический пролиферативный ответ T-клеток CD4 исследовали в спленоцитах и лимфатических узлах. Аллергенспецифический ответ T-клеток CD4 в группе LL-BLG+LL-mIL-10 был выражен значительно меньше по сравнению с группой LL-BLG+IL-10.
Пример E5: Индуцированные антигеном регуляторные T-клетки после комбинированной терапии LL-BLG-LL-IL10 могут переносить защиту от ответа аллергического типа in vivo
Для того чтобы протестировать активную супрессию ответа аллергического типа у мышей, получавших лечение по протоколу оральной толерантности, авторы адоптивно переносили спленоциты от групп, получавших разное лечение, как это описано выше (Анализ регуляторной активности T-клеток in vivo). По сравнению с группами контроля и LL-BLG реакции аллергического типа были значительно снижены в группе LL-BLG+LL-mIL-10, что указывает на активацию регуляторных T-клеток CD4+ в нашем протоколе комбинированной оральной толерантности.
Пример F: Индукция толерантности к инсулину после орального введения L. lactis, секретирующих указанный аллерген в комбинации с IL-10, доставляемым in situ.
Введение
Аутоиммунитет характеризуется спонтанным воспалительным повреждением тканей и нарушением физиологической функции в результате ослабления толерантности к собственному антигену. Он связан с частичной гиперактивностью иммунной системы, характеризующейся избытком T-хелперных (Th) клеток. На такие предрасполагающие факторы, как гены подверженности и факторы окружающей среды, повлиять довольно трудно, поэтому современные усилия по разработке иммунотерапии сфокусированы на восстановлении функционального баланса между патогенными эффекторными клетками и иммунорегуляторными T-клетками, то есть на ослаблении/истощении первых и усилении/накоплении вторых. Основной причиной сахарного диабета 1 типа (T1D) является аутоиммунная деструкция бета-клеток панкреатических островков. Эта деструкция связана с клеточным и гуморальным иммунным ответом на некоторые аутоантигены бета-клеток, причем оба варианта иммунного ответа могут предшествовать клинической манифестации заболевания.
Здесь авторы демонстрируют, что оральная доставка аутоантигена в комбинации с L. lactis, вырабатывающим IL-10, подавляет специфический по отношению к диабету иммунный ответ через индукцию антигенспецифических регуляторных T-клеток.
Материалы и методы, использованные в примерах
Бактерии и плазмиды
Во всем этом исследовании был использован штамм L. lactis MG1363. Бактерии были культивированы в среде GM17, т.е. M17 (Difco Laboratories, Детройт, штат Мичиган) с добавкой 0,5% глюкозы. Запас исходных суспензий всех штаммов хранили при -20°C в 50% глицерине в среде GM17. Для внутрижелудочных инокуляций маточные суспензии разводили в 200 раз в свежей среде GM17 и инкубировали при 30°C. Они достигали плотности насыщения 2×109 колониеобразующих единиц (КОЕ) на мл через 16 часов. Бактерии собирали центрифугированием и 10-кратно концентрировали в среде BM9. Для лечения каждая мышь ежедневно получала 100 мкл этой суспензии через внутрижелудочный катетер. Последовательность ДНК с оптимальным использованием кодона L. lactis, кодирующего пептид проинсулина II человека B24-C36 (hpllp), свиной инсулин и иммунодоминантный пептид InsB9-23 (пептид B9-23 по существу одинаков для многих биологических видов, включая человека, крысу и мышь), была синтезирована, амплифицирована и слита с сигналом секреции Usp45 устойчивого к эритромицину вектора pT1NX ниже лактококкового промотора P1.
Штаммы MG1363, трансформированные плазмидами, несущими мышиный IL-10, hpllp, инсулин, InsB9-23, были обозначены LL-IL10, LL-hpllp, LL-insulin, LL-InsB9-23. В качестве контроля использовали LL-pT1NX, то есть штамм MG1363, содержащий пустой вектор pT1NX. Экспрессию этих белков определяли антигенспецифическим методом ELISA и вестерн-блоттингом.
Мыши
Самки и самцы мышей с диабетом без ожирения (NOD), а также мыши с NOD и тяжелым комбинированным иммунодефицитом (SCID) (первоисточник - линия Balb/c) были приобретены в Jackson laboratory. Мыши Balb/c дикого типа (WT) были приобретены в Charles River, Италия. Мышей содержали в центральном виварии в специальных условиях при отсутствии патогенных микроорганизмов. Содержание и использование мышей соответствовали ведомственным нормативам.
Условия эксперимента
В профилактическом варианте эксперимента LL-hpllp, LL-insulin, LL-InsB9-23 вводили орально мышам NOD, начиная с 21-дневного возраста (отнятие от материнской груди), либо в чистом виде, либо наряду с LL-IL10 или рекомбинантным мышиным IL-10 (1-10 мкг) с использованием оптимального режима кормления или до 100-дневного возраста (когда у большинства мышей развивался диабет). В дополнение к этому в качестве отрицательного контроля мышам орально вводили LL-pT1NX. В группе положительного контроля (толеризация) мышей NOD трехнедельного возраста лечили оральным введением 0,8 мг инсулина человека 3 раза в неделю на протяжении 2 или 4 недель. Развитие диабета определяли посредством непрерывного мониторинга уровня глюкозы в моче (три раза в неделю), а при выявлении гликозурии - мониторинга уровня глюкозы в крови. Образцы ткани поджелудочной железы собирали на 12-23 неделе, а также в конце эксперимента (35 недель), а серийные срезы материала окрашивали гематоксилином/эозином для балльной оценки инфильтрации поджелудочной железы мононуклеарными клетками или иммуногистохимическим методом для анализа инфильтрации T-клетками.
В терапевтическом варианте эксперимента LL-hpllp, LL-insulin, LL-InsB9-23 вводили орально в чистом виде либо наряду с LL-IL10 или рекомбинантным мышиным IL-10 диабетическим самкам мышей NOD, демонстрировавшим стабильную гликозурию и гипергликемию (12-23 недели). В дополнение к этому в качестве отрицательного контроля мышам орально вводили LL-pT1NX. В группе положительного контроля (толеризация) диабетических мышей NOD лечили так, как это описано в ссылке Bresson et al. 2006. Полную ремиссию определяли как исчезновение гликозурии и возврат к нормальной гликемии.
Точный механизм индукции толерантности анализировали in vitro, in vivo после повторной провокации у мышей NOD с использованием специфических аутоантигенов, а также посредством адоптивного переноса T-клеток мышам NOD-SCID.
Выявление диабета:
Мониторинг глюкозы: Уровень глюкозы в моче определяли индикатором Diastix (Miles) и подтверждали измерением глюкозы в крови системой мониторинга OneTouch Ultra (LifeScan Inc.). Диабет определяли как наличие в двух последовательных анализах уровня глюкозы в крови выше 250 мг/дл.
Инсулит: Мышей умерщвляли асфиксией CO2, а поджелудочную железу фиксировали в 10% формалине в течение ночи, заливали парафином, а серийные срезы толщиной 5 мкм окрашивали гематоксилином и эозином. Балльную оценку инсулита (средняя±стандартное отклонение) определяли посредством микроскопического ранжирования по степени клеточной инфильтрации в 10-15 островках на мышь следующим образом: 0 = отсутствие видимых признаков инфильтрации островков, 1 = околоостровковая инфильтрация, 2 = инфильтрация <50%, 3 = инфильтрация >50%.
Иммуногистохимия
Для выявления инсулина, а также экспрессии CD4 и CD8 в бета-клетках поджелудочной железы к замороженным срезам ткани были приложены первичные антитела (морской свинки против свиного инсулина от компании Dako [разведение 1:300], против CD4 RM4.5 и против CD8a IHC от компании BD Biosciences [разведение 1:50], как это описано в ссылке Christen et al., 2004.
Анализ пролиферации in vitro
Были приготовлены единые клеточные суспензии селезенки, брыжеечных лимфоузлов (MLN) и PLN. Для анализа пролиферации общей популяции спленоцитов 2×105 клеток культивировали в 96-луночных планшетах с U-образным дном в общем объеме 200 мкл полной среды, либо отдельно взятой, либо с добавлением ступенчатых концентраций (1-100 мкг/мл) очищенного инсулина человека или пептидов, специфичных для T-клеток CD4 (InsB9-23, H-2d или g ограниченных) или для T-клеток CD8 (InsB15-23, Kd ограниченных), а также с добавкой или без добавки нейтрализующих моноклональных антител против IL-10 или против TGF-β. Нейтрализующие антитела добавляли в концентрации 1, 0,1 и 0,01 мкг/мл. Для анализа пролиферации совокупных популяций T-клеток CD3+, T-клеток CD8+, T-клеток CD4+ и T-клеток CD4+CD25- 0,2×105 T-клеток культивировали в 96-луночных планшетах с U-образным дном и с добавлением 1×105 облученных спленоцитов от мышей WT Balb/c, нагруженных инсулином или GAD65, или пептидами, специфичными для T-клеток CD4+или CD8+, действующих как антигенпредставляющие клетки, в общем объеме 200 мкл полной среды с нейтрализующими антителами или без них. После 72-часовой выдержки при 37°C в увлажненном инкубаторе с 5% CO2 проводили оценку пролиферации, добавляя 1 мкКи на ячейку [3H]-тимидина. ДНК-связанную радиоактивность собирали через 16-18 часов на фильтрующих матах из стекловолокна (Perkin Elmer, Бостон, США), а включение тимидина измеряли сцинтилляционным счетчиком (Perkin Elmer). T-клетки выделяли из PLN или селезенки посредством отрицательного отбора сепарацией через магнитный бисер с применением набора для выделения CD3+, CD4+ или CD8+ (MACS; Milteny Biotec, Оберн, штат Калифорния). T-клетки CD4+ использовали в общей массе или дополнительно разделяли на CD25+ и CD25- в MACS, применяя набор для выделения CD25+ (Milteny Biotec). Чистоту клеточных популяций (>90%) определяли проточным цитометрическим анализом.
Для измерения цитокинов супернатанты клеточных культур, использованных в различных анализах пролиферации (антигенспецифической стимуляции), которые были описаны выше, собирали через 72 часа культивирования и замораживали при -80°C вплоть до проведения анализа на цитокины. Выработку цитокинов определяли количественно в цитометрической бисерной матрице с применением набора мышиного воспаления (BD Biosciences, Маунтин-Вью, штат Калифорния, США). Очищенные T-клетки CD3+, CD4+ или CD8+ культивировали и неспецифично стимулировали in vitro смесью антител против CD3/против CD28 (1 мкг/мл каждого) в течение 24 часов или оставляли без стимуляции для контроля. Супернатанты собирали и анализировали на выработку IL-10, IL-4, IL-5 и IFNγ, применяя гибкий набор цитометрической бисерной матрицы BD™ в биоанализаторе BD FACSArray и компьютерную программу FCAP (BD Biosciences). Эксперименты ELISA с захватом использовали для определения TGF-β1 с применением набора Quantikine (R&D Systems).
Анализ ингибирования пролиферации T-клеток in vitro
2×104 очищенных совокупных T-клеток селезенки CD4+CD25-, выделенных от самок мышей NOD с недавним диабетом (в возрасте 8-12 недель), были сокультивированы с различными количествами популяций T-клеток CD8+, T-клеток CD4+и T-клеток CD4+CD25-, выделенных из селезенки, MLN или PLN в различных экспериментальных группах в присутствии 2×104 истощенных T-клеток, облученных и нагруженных инсулином или пептидами спленоцитов от мышей WT Balb/c. После 72-часовой выдержки при 37°C в увлажненном инкубаторе с 5% CO2 проводили оценку пролиферации, добавляя 1 мкКи на ячейку [3H]-тимидина. ДНК-связанную радиоактивность собирали через 16-18 часов на фильтрующих матах из стекловолокна (Perkin Elmer, Бостон, США), а включение тимидина измеряли сцинтилляционным счетчиком (Perkin Elmer).
Анализ цитотоксичности in vitro
В качестве лимфобластных целей были использованы Con A-активированные спленоциты от мышей BALB/c. В общей сложности 106 целевых клеток были мечены 100 мкКи51Cr (Amersham International, Бакингемшир, Великобритания) в течение 90 минут при 37°C, троекратно отмыты, а затем инкубированы с 1 мкг/мл пептида (InsB15-23 или постороннего пептида) при 37°C в течение 1 часа. Затем целевые клетки отмывали два раза и высевали из расчета 104 клеток на лунку. В каждую лунку добавляли T-клетки CD8+, выделенные из селезенки, MLN и PLN в трех экземплярах с разным соотношением эффектора и цели (E:T). Планшеты центрифугировали со скоростью 500 оборотов в минуту в течение 2 минут и инкубировали при 37°C в течение 4 часов. После инкубации проводили сбор супернатантов для определения эмиссии51Cr [% лизиса = 100×(cpm в опыте - спонтанное cpm)/(общее cpm - спонтанное cpm)]. Для непрямого анализа цитолиза T-клетки CD8+ инкубировали с 5 мкг/мл антитела против CD3 (клон 145-2C11, Pharmingen) инкубацией с эффекторами.
Адоптивный перенос диабета
Мышам NOD-SCID в возрасте 8-10 недель делали внутривенные инъекции в дозе 2×107 спленоцитов или внутрибрюшинные инъекции в дозе 5×106 спленоцитов, выделенных от диабетических самок мышей NOD (6 недель, 12 недель и 18 недель) в комбинации или без комбинирования со ступенчатым количеством бисерно очищенных T-клеток CD3+, T-клеток CD8+, T-клеток CD4+, T-клеток CD4+CD25- или CD4+CD25+, выделенных в разных экспериментальных группах, получавших L. Lactis. В качестве контроля были использованы мыши, не получавшие лечения. Развитие диабета определяли непрерывным мониторингом уровня глюкозы в крови (три раза в неделю).
Пример F1: LL-IL10 значительно усиливает способность LL-hpllp, LL-insulin, LL-InsB9-23 индуцировать толерантность у мышей с диабетом без ожирения.
Для того чтобы исследовать индукцию оральной толерантности, мышей орально кормили так, как это описано выше (см. условия эксперимента). Добавление LL-IL10 значительно усиливало индукцию толерантности к аутоантигену, поскольку аутоантиген-специфический пролиферативный ответ спленоцитов значительно снижался в группе LL-hpllp/insulin/InsB9-23+LL-mIL-10 по сравнению с группами контроля и LL-hpllp/insulin/InsB9-23.
Пример F2: LL-IL10 потенцирует оральную толерантность в сочетании с ослаблением инсулита, снижением степени деструкции бета-клеток и усилением выработки IL-10 спленоцитами.
Для того чтобы исследовать индукцию оральной толерантности, мышей орально кормили так, как описано выше (см. условия эксперимента). Наличие инсулита, степень деструкции бета-клеток и выработку цитокинов в ответ на указанный аутоантиген определяли так, как описано выше. Гистологический анализ показал значительное снижение явлений инсулита и степени деструкции бета-клеток, а также усиленную выработку IL-10 в группе LL-hpllp/insulin/InsB9-23+LL-mIL-10 по сравнению с группами контроля и LL-hpllp/insulin/InsB9-23.
Пример F3: LL-IL10 усиливает оральную толерантность через T-клетки CD4+.
Для того чтобы оценить, опосредуют ли T-клетки индукцию оральной толерантности, исследовали аутоантиген-специфический пролиферативный ответ T-клеток CD4 в спленоцитах и лимфатических узлах. С этой целью мышей кормили орально, как это описано выше (см. условия эксперимента), а аутоантиген-специфическую пролиферацию T-клеток CD4+ определяли так, как это описано в разделе Анализ пролиферации in vitro. Аутоантиген-специфический ответ T-клеток CD4 в группе LL-hpllp/insulin/InsB9-23+LL-mIL-10 был выражен значительно меньше по сравнению с группами контроля и LL-hpllp/insulin/InsB9-23.
Пример F4: IL-10 менее эффективен, чем LL-IL10 в потенцировании оральной толерантности
Для того чтобы оценить, насколько эффективна комбинация LL-IL10 по сравнению с IL-10, мышей кормили, как описано выше (см. условия эксперимента). Аутоантиген-специфический пролиферативный ответ T-клеток CD4 исследовали в спленоцитах и лимфатических узлах. Аутоантиген-специфический ответ T-клеток CD4 в группе LL-hpllp/insulin/InsB9-23+LL-mIL-10 был выражен значительно меньше по сравнению с группами контроля и LL-hpllp/insulin/InsB9-23+IL-10.
Пример F5: Аутоагрессивные реакции CD8+ у мышей NOD подавляются после комбинированной терапии LL-InsB15-23-LL-IL10.
Для того чтобы исследовать, индуцирует ли авторский комбинированный подход супрессорные T-клетки CD4+, способные модулировать диабет неспецифическими супрессорными механизмами, авторы анализировали влияние на аутоагрессивные T-клетки CD8+. Процентная доля и/или активность антигенспецифических аутоагрессивных клеток CD8+ после комбинированной терапии заметно снижалась.
Пример F6: Индуцированные антигеном регуляторные T-клетки после комбинированной терапии LL-InsB5-23-LL-IL10 могут переносить защиту от ответа аллергического типа in vivo
Для того чтобы протестировать активную супрессию ответа диабетического типа у мышей, получавших лечение по протоколу оральной толерантности, авторы адоптивно переносили спленоциты от групп, получавших разное лечение, как это описано выше (Адоптивный перенос диабета). По сравнению с группами контроля и LL-InsB9-23 реакции диабетического типа были значительно снижены в группе LL-InsB9-23+LL-mIL-10, что указывает на активацию регуляторных T-клеток CD4+ в нашем протоколе комбинированной оральной толерантности.
ССЫЛКИ







Реферат
Изобретение раскрывает индукцию толерантности к антигенам посредством доставки на слизистую оболочку, предпочтительно, оральной доставки антигена в комбинации с микроорганизмом, вырабатывающим иммуномодулирующее соединение. Изобретение осуществляют путем использования микроорганизма, экспрессирующего иммуномодулирующее соединение, в комбинации с антигеном в виде лекарственного средства, медицинского пищевого продукта или нутрицевтика для индукции иммунотолерантности или лечения заболевания, связанного с иммунным ответом. В частности, изобретение раскрывает индукцию регуляторных Т-клеток, вырабатывающих Fоxр3+ и/или IL-10, и/или TGF-β, которые способны подавлять нежелательные иммунные ответы на антиген, посредством оральной доставки указанного антигена в комбинации с микроорганизмом, секретирующим иммуносупрессорный цитокин. Описан способ индукции у животного иммунотолерантности к антигену и способ лечения заболевания, связанного с иммунным ответом путем доставки на слизистую оболочку антигена в комбинации с микроорганизмом, экспрессирующим иммуномодулирующее соединение. Описано также лекарственное средство, нутрицевтик или медицинский пищевой продукт для лечения, профилактики и/или облегчения заболевания, связанного с иммунным ответом. Использование изобретения повышает эффективность иммуносупрессии. 6 н. и 19 з.п. ф-лы, 12 ил.

Комментарии