Медицинское применение ингибитора гистоновой дезацетилазы и способ оценки его противоопухолевого действия - RU2298414C2
Код документа: RU2298414C2
Чертежи
Описание
Техническая область
Настоящее изобретение относится к терапевтическому средству для лечения рака предстательной железы, терапевтическому средству для лечения злокачественной лимфомы (кроме T-клеточной лимфомы) и к способу оценки противоопухолевого действия ингибитора гистоновой дезацетилазы.
Предпосылки изобретения
В последние годы «индивидуальная медицина» представляет собой улучшенное распознавание, при котором рассматривают индивидуальные различия между пациентами, и считается необходимым поиск маркера для того, чтобы отличать злокачественную опухоль, против которой эффективно некоторое фармацевтическое средство, от злокачественной опухоли, против которой данное фармацевтическое средство неэффективно. Предпринята попытка в этическом и медицинском смысле улучшить эффективность затрат на лечение медикаментами путем введения фармацевтического средства пациентам после заблаговременного подтверждения вероятности проявления его действия, с улучшением таким образом эффективности и отменой токсичности фармацевтического средства, и со снижением бессмысленного применения фармацевтического средства. Для лечения злокачественных опухолей требовалась разработка способа предсказания эффективности противораковых средств, поскольку он может являться значимым средством для объединения фундаментальных исследований и клинических применений.
Кроме того, в отношении вещества или соединения, в общем указанного как проявляющее противоопухолевую активность, отмечалось, что, когда сообщение основывалось исключительно на результатах, полученных in vitro, такие результаты непосредственно не приводят к предсказанию результатов in vivo. Иными словами, проблемой является то, что вещество, проявляющее противоопухолевую активность in vitro, не обязательно проявляет противоопухолевую активность in vivo, и затруднено непосредственное применение вещества, проявляющего противоопухолевую активность in vitro, в качестве противоракового средства.
Например, вещество, представленное формулой (II),
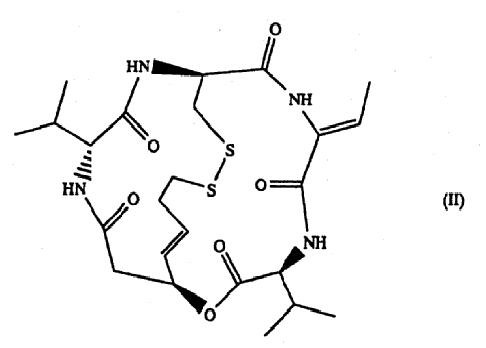
как сообщается, обладает мощной противоопухолевой активностью, реализуемой путем селективного ингибирования гистоновой дезацетилазы (данное вещество, как также сообщается, вызывает высокую степень ацетилирования гистона в клетке, обработанной данным соединением, и в результате индуцирует активность в плане транскрипционного контроля различных генов, активность в плане ингибирования активности клеточного цикла и активность в плане ингибирования апоптоза (JP-B-7-64872, H. Nakajima et al, Exp. Cell Res. 241, 126-133 (1998))). Однако ни в одном сообщении не был установлен фактор, способствующий предсказанию противоопухолевого действия данного соединения, и по имеющейся ситуации многие проблемы еще подлежат решению, например, могут ли переноситься результаты, полученные in vitro, непосредственно на ситуацию in vivo, обладает ли данное соединение практическим действием in vivo в отношении любой опухоли, и тому подобное.
Гистоновая дезацетилаза представляет собой металлосодержащий дезацетилирующий фермент, где Zn координирован в активном центре (M.S. Finnin et al, Nature, 401, 188-193 (1999)). Данный фермент, как считается, изменяет сродство к ДНК различных ацетилированных гистонов. Это приводит непосредственно к такому биологическому феномену как изменения в структуре хроматина. Минимальной единицей структуры хроматина является нуклеосома, где 146 п.н. ДНК закручена 1, 8 раза против часовой стрелки вокруг гистонового октамера (H2A, H2B, H3 и H4, по 2 молекулы каждого, коровый гистон). Коровый гистон стабилизирует структуру нуклеосом, поскольку положительный заряд с N-конца каждого белка-гистона взаимодействует с ДНК. Ацетилирование гистона контролируется балансом между реакцией ацетилирования, в которой участвует гистонацетилтрансфераза, и реакцией дезацетилирования, в которой участвует гистоновая дезацетилаза. Ацетилирование гистона происходит в эволюционно высококонсервативном остатке лизина на N-конце белка-гистона, за счет чего, как считается, белок корового гистона теряет заряд на N-конце, ослабляется взаимодействие с ДНК, и структура нуклеосомы становится нестабильной. В соответствии с этим дезацетилирование гистона, как считается, способствует обратному, а именно приводит к стабилизации структуры нуклеосомы. Однако пока остается много неясных аспектов, например, в какой степени ацетилирование изменяет структуру хроматина, и как оно относится к вторично индуцируемому транскрипционному контролю, и тому подобное.
Описание изобретения
Целью настоящего изобретения является предоставление нового терапевтического средства для лечения рака предстательной железы и терапевтического средства для лечения злокачественной лимфомы. Другой целью настоящего изобретения является предоставление способа оценки и предсказания противоопухолевого действия ингибитора гистоновой дезацетилазы.
Авторы настоящего изобретения провели интенсивные исследования в попытках решить указанные выше проблемы и обнаружить терапевтическое средство для лечения рака предстательной железы и терапевтическое средство для лечения злокачественной лимфомы, которые обеспечили подтверждение противоопухолевого действия in vivo. Более того, авторы настоящего изобретения обнаружили, что противоопухолевое действие ингибитора гистоновой дезацетилазы изменяется в зависимости от вида опухоли, и что данная вариация наблюдается в сочетании с изменениями в состоянии экспрессии конкретного гена или белка, и, основываясь на таком наблюдении, разработали способ оценки противоопухолевого действия ингибитора гистоновой дезацетилазы, результатом чего являлось завершение настоящего изобретения. В соответствии с этим настоящее изобретение относится к следующему.
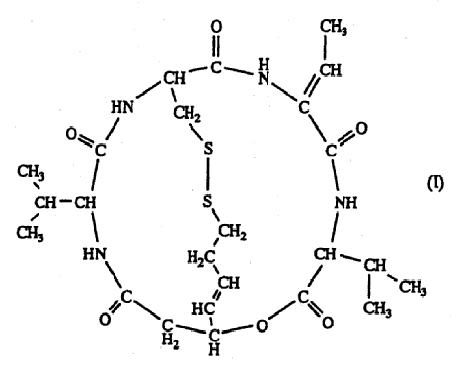
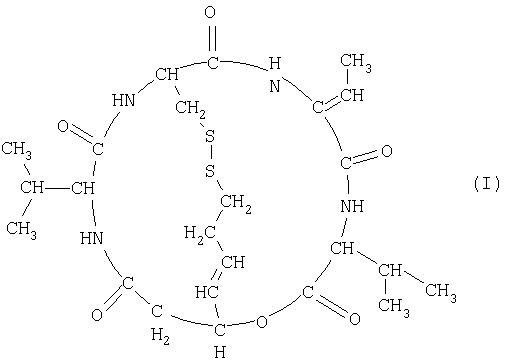
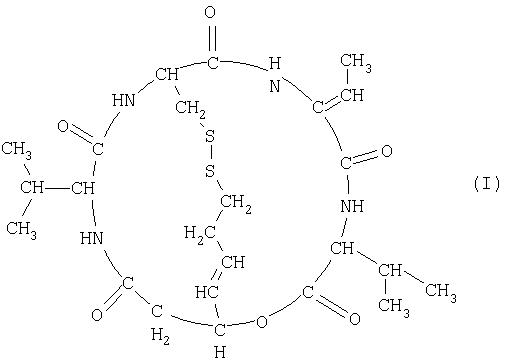
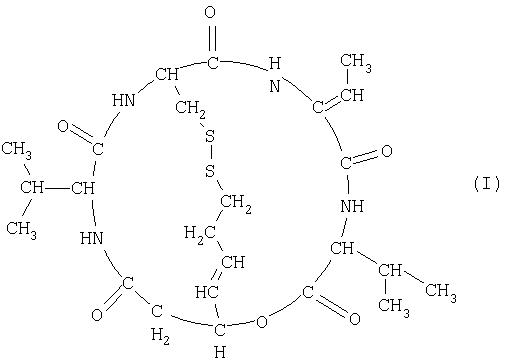
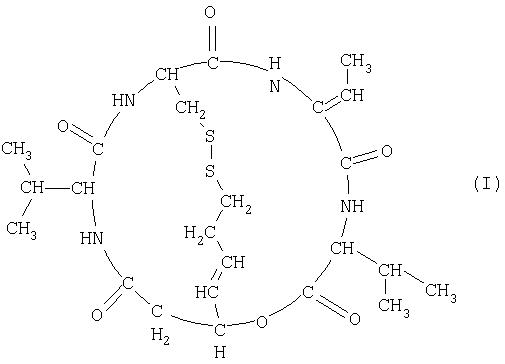
(1) Средство для лечения рака предстательной железы или средство для лечения злокачественной лимфомы, отличной от Т-клеточной лимфомы, которое содержит в качестве активного ингредиента соединение, представленное формулой (I) (здесь и далее также обозначается как FK228; SEQ ID; No 5),
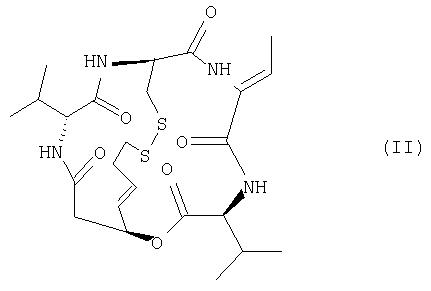
в частности, соединение, представленное формулой (II) (здесь и далее также обозначенное как FR901228),

или его соль.
(2) Средство для лечения рака предстательной железы или средство для лечения злокачественной лимфомы, отличной от Т-клеточной лимфомы, по указанному выше (1), которое обладает противоопухолевым действием in vivo.
(3) Фармацевтическая композиция для лечения рака предстательной железы или фармацевтическая композиция для лечения злокачественной лимфомы, отличной от Т-клеточной лимфомы, которая содержит FK228, в частности, формулы FR901228, и фармацевтически приемлемый носитель.
(4) Фармацевтическая композиция для лечения рака предстательной железы или фармацевтическая композиция для лечения злокачественной лимфомы, отличной от Т-клеточной лимфомы, по указанному выше (3), которое обладает противоопухолевым действием in vivo.
(5) Способ лечения рака предстательной железы или злокачественной лимфомы, отличной от Т-клеточной лимфомы, который охватывает введение эффективного количества FK228, в частности, формулы FR901228.
(6) Применение FK228, в частности, формулы FR901228, для продукции средства для лечения рака предстательной железы или средства для лечения злокачественной лимфомы, отличной от T-клеточной лимфомы.
(7) Применение указанного выше (6), где средство для лечения рака предстательной железы или средство для лечения злокачественной лимфомы, отличной от T-клеточной лимфомы, обладает противоопухолевым действием in vivo.
(8) Коммерческая упаковка, содержащая фармацевтическую композицию для лечения рака предстательной железы по указанному выше (3) и письменный материал, в котором указано, что фармацевтическая композиция может или должна применяться для лечения рака предстательной железы.
(9) Коммерческая упаковка, содержащая фармацевтическую композицию для лечения злокачественной лимфомы, отличной от Т-клеточной лимфомы, по указанному выше (3), и письменные материалы, утверждающие, что фармацевтическая композиция может или должна применяться для лечения злокачественной лимфомы, отличной от Т-клеточной лимфомы.
(10) Способ оценки противоопухолевой активности ингибитора гистоновой дезацетилазы, который охватывает по меньшей мере стадию лечения тестируемой клетки ингибирования гистоновой дезацетилазы и стадию измерения изменения экспрессии конкретного гена (или конкретного белка) в тестируемой клетке до и после обработки указанным ингибитором и сравнения обоих экспрессированных количеств.
(11) Способ оценки противоопухолевого действия ингибитора гистоновой дезацетилазы по указанному выше (10), где конкретный ген представляет собой ген p21 и/или ген c-myc.
(12) Способ оценки противоопухолевого действия ингибитора гистоновой дезацетилазы по указанному выше (10), где конкретный белок представляет собой ген p21 и/или ген c-myc.
(13) Способ оценки противоопухолевого действия по любому из указанных выше (10)-(12), где ингибитор гистоновой дезацетилазы является соединением, представленным формулой FK228, в частности, FR901228, или его солью.
(14) Способ скрининга ингибитора гистоновой дезацетилазы, обладающего специфичной в отношении определенной области противоопухолевой активностью, который охватывает применение способа оценки противоопухолевого действия любого из указанных выше (10)-(13).
(15) Способ получения гена, способного стать индикатором для предсказания эффективности FK228, который охватывает по меньшей мере,
(1) стадию обработки FK228 чувствительной к FK228 опухолевой клетки и резистентной к FK228 опухолевой клетки,
(2) стадию выбора генов, которые характеризуются повышенной или сниженной экспрессией на указанной выше стадии (1), и
(3) стадию выбора из генов, выбранных на указанной выше стадии (2),
(i) гена, который характеризуется повышенной экспрессией вследствие обработки FK228, более высоким уровнем экспрессии в чувствительной к FK228 опухолевой клетке и более низким уровнем экспрессии в резистентной к FK228 опухолевой клетке,
(ii) гена, который характеризуется повышенной экспрессией вследствие обработки FK228, более низким уровнем экспрессии в чувствительной к FK228 опухолевой клетке и более высоким уровнем экспрессии в резистентной к FK228 опухолевой клетке,
(iii) гена, который характеризуется сниженной экспрессией вследствие обработки FK228, более высоким уровнем экспрессии в чувствительной к FK228 опухолевой клетке и более низким уровнем экспрессии в резистентной к FK228 опухолевой клетке,
(iv) гена, который характеризуется сниженной экспрессией вследствие обработки FK228, более низким уровнем экспрессии в чувствительной к FK228 опухолевой клетке и более высоким уровнем экспрессии в резистентной к FK228 опухолевой клетке.
Краткое описание фигур
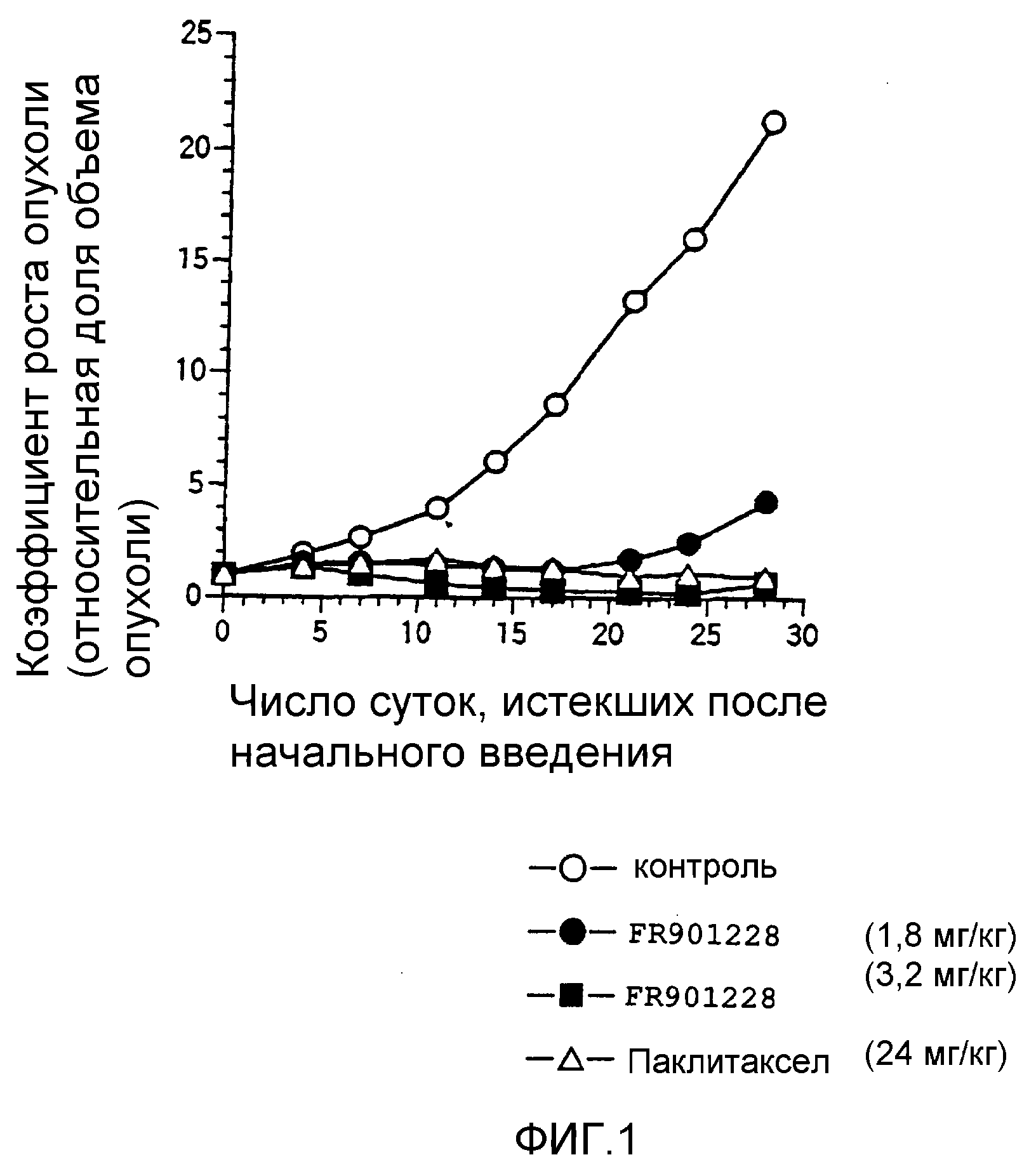
Фиг.1 представляет собой график, на котором показано противоопухолевое действие FR901228 на рак предстательной железы человека, где по вертикальной оси показана скорость роста опухоли, по поперечной оси показано число суток, истекших с момента начального введения, и скорость роста опухоли выражена в виде относительной доли объема опухоли после 0 суток по отношению к объему опухоли на 0 сутки, который принят за 1.
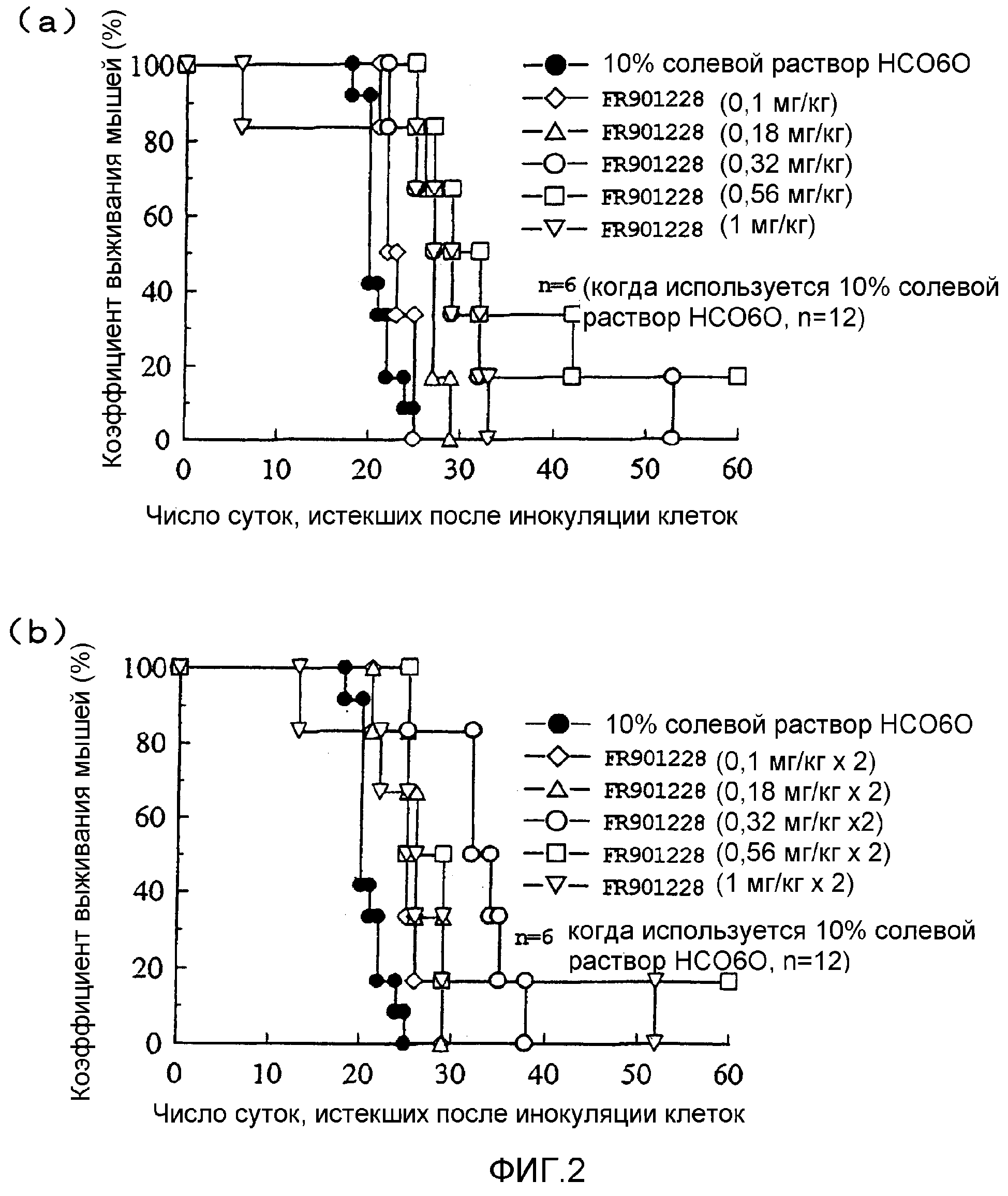
Фиг.2 охватывает графики, на которых показано противоопухолевое действие FR901228 на лимфому человека, где по вертикальной оси показана доля выживших мышей, а по поперечной оси показано число суток, истекших после имплантации опухолевых клеток.
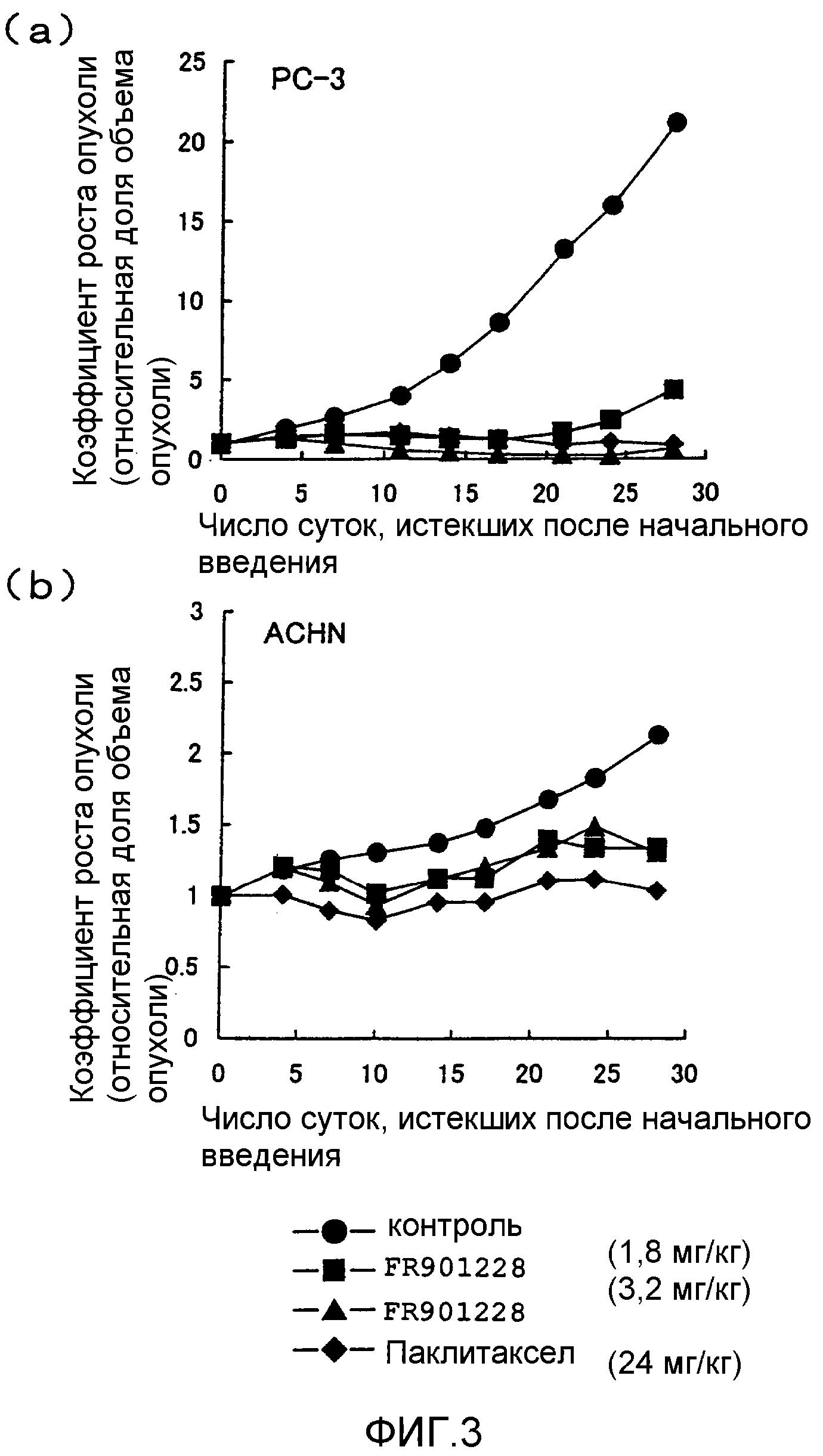
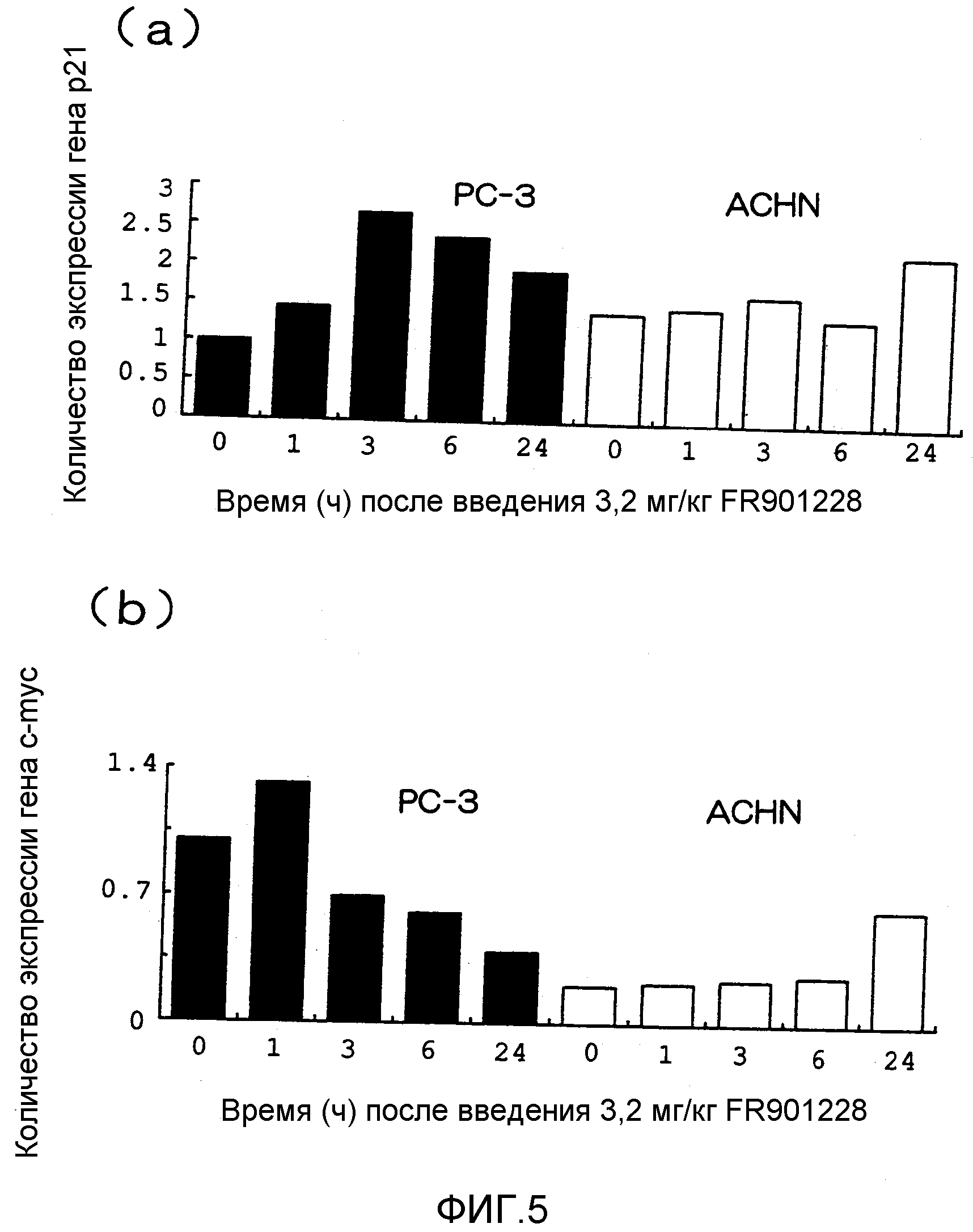
Фиг.3 охватывает графики, на которых показано противоопухолевое действие FR901228 на рак предстательной железы человека ((a); PC-3) и рак почек ((b); ACHN), где по вертикальной оси показана скорость роста опухоли, по поперечной оси показано число суток, истекших с момента начального введения, и скорость роста опухоли выражена в виде относительной доли объема опухоли после 0 суток по отношению к объему опухоли на 0 сутки, который принят за 1.
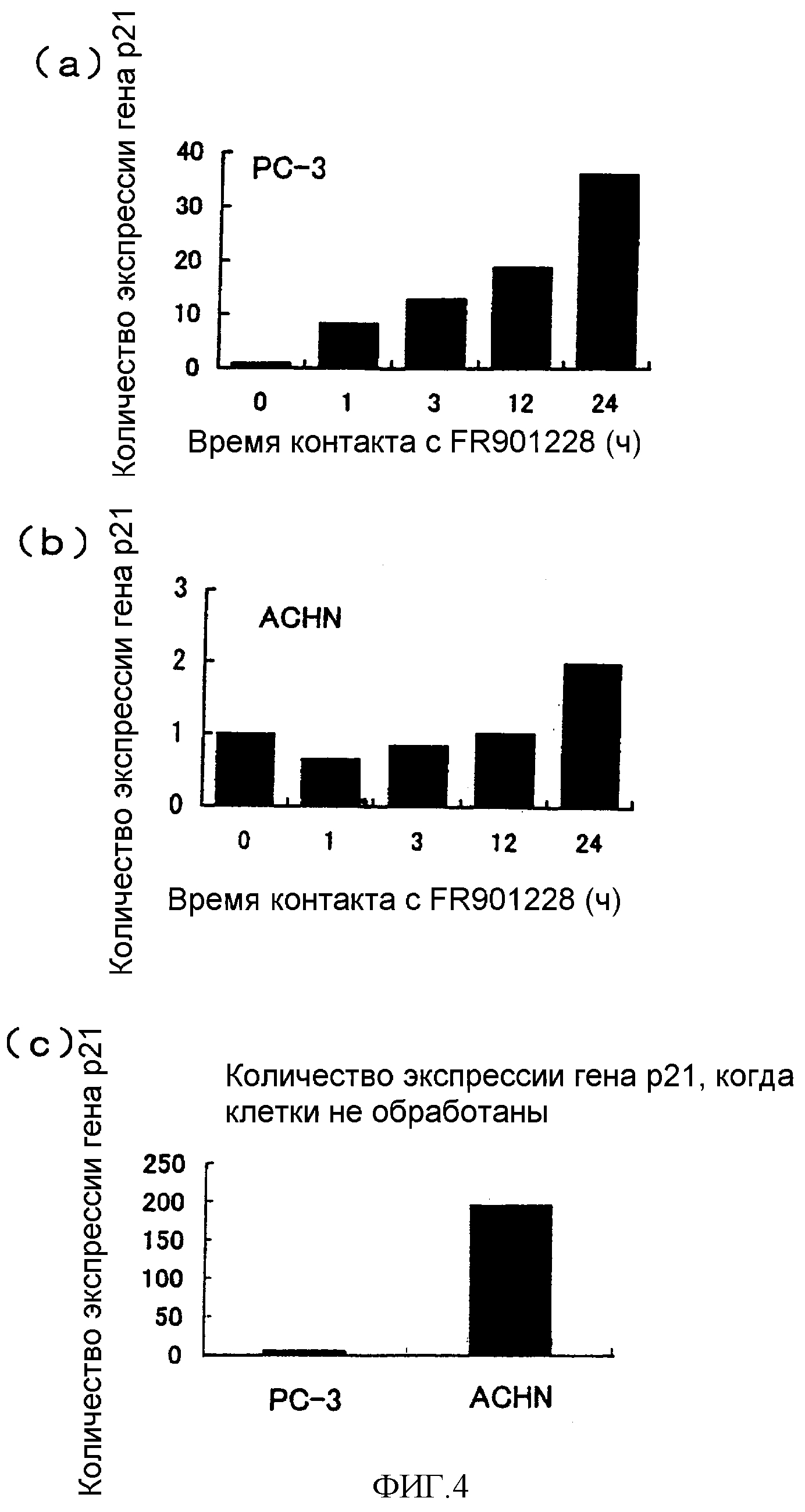
Фиг.4 охватывает графики, на которых показано действие FR901228 на экспрессию гена p21 in vitro (клетка PC-3, клетка ACHN).
(a),(b). По вертикальной оси показана относительная величина экспрессии гена p21, а по поперечной оси показано время контакта (ч) с FR901228.
(c). По вертикальной оси показана относительная величина экспрессии гена p21.
Фиг.5 охватывает графики, на которых показано действие FR901228 на экспрессию гена p21 и экспрессию гена c-myc in vivo (клетки PC-3, клетки ACHN), где по вертикальной оси показана относительная величина экспрессии гена p21 или c-myc, а по поперечной оси показано число суток, истекших после введения FR901228.
Подробное описание изобретения
Терапевтическое средство для лечения рака предстательной железы и терапевтическое средство для лечения злокачественной лимфомы согласно настоящему изобретению содержат в качестве активного ингредиента соединение (FK228), представленное формулой (I), или его соль. Из соединений формулы (I) предпочтительным является соединение (FR901228), представленное формулой (II), которое является стереоизомером. Данные соединения обладают сильной ингибиторной активностью в отношении гистоновой дезацетилазы (Nakajima, H. et al; ibid. (1998)), и FR901228 особенно предпочтительно входит в состав терапевтического средства для лечения рака предстательной железы и терапевтического средства для лечения злокачественной лимфомы согласно изобретению, поскольку оно обладает более сильной ингибиторной активностью в отношении гистоновой дезацетилазы.
В настоящем описании простое указание на FK228 означает группу соединений независимо от стереоизомерии, включая соединения, представленные формулой (II), кроме тех случаев, где определено иначе.
FK228 и его соль являются известными и доступными веществами. Например, FR901228, которое является одним из стереоизомеров FK228, может быть получено путем культивирования штамма, способного продуцировать FR901228 и принадлежащего к роду Chromobacterium, в аэробных условиях, и получения данного вещества из культурального бульона. В качестве штамма, способного продуцировать FR901228 и принадлежащего к роду Chromobacterium, например, может быть упомянут Chromobacterium violaceum WB968 (FERM BP-1968). Более конкретно, FR901228 может быть получен из FR901228-продуцирующего штамма по способу, описанному в JP-B-7-64872 (соответствует патенту США № 4977138). FR901228 предпочтительно получают из штамма, способного продуцировать FR901228 и принадлежащего к роду Chromobacterium, поскольку его проще получить. Однако предпочтительными также являются синтетический или полусинтетический FR901228, поскольку для их получения не требуются стадии очистки или требуется их малое количество. Сходным образом FK228, отличный от FR901228, может также быть получен полусинтетическим или полностью синтетическим путем по общепринятому известному способу. Более конкретно, он может быть получен способом, о котором сообщают Khan W. Li, et al (J. Am. Chem. Soc., vol. 118, 7237-7238 (1996)).
Соль FK228 является биологически приемлемой, в основном нетоксичной солью, и ее примеры охватывают соли с неорганическим основанием (например, соли щелочных металлов, такие как соль натрия, соль калия, и т.д., соли щелочно-земельных металлов, таких как соль кальция, соль магния, и т.д., и соль аммония), соли с органическим основанием (например, соли органических аминов, таких как триэтиламиновая соль, соль диизопропилэтиламина, соль пиридина, соль пиколина, соль этаноламина, соль триэтаноламина, соль дициклогексиламина, соль N,N'-дибензилэтилендиамина и т.д.), неорганические аддитивные соли (например, гидрохлорид, гидробромид, гидросульфат, фосфат и т.д.), аддитивные соли карбоновых кислот, сульфоновых кислот (например, формиат, ацетат, трифторацетат, малеат, тартрат, фумарат, метансульфонат, бензолсульфонат, толуолсульфонат и т.д.), соли с основными или кислыми аминокислотами (например, аргинин, аспарагиновая кислота, глутаминовая кислота и т.д.), соли с основными и кислыми аддитивными солями.
FK228 может иметь стереоизомер (например, FR901228), такой как оптический изомер или геометрический изомер, основанный на асимметричном атоме углерода или двойной связи, и все изомеры и их смесь находятся в объеме настоящего изобретения.
Сольватные соединения FK228, FR901228 и их соли (например, соединения включения (например, гидрат, и т.д.)) также могут входить в объем настоящего изобретения.
Согласно настоящему изобретению, in vivo и in vitro в основном имеют то же значение, что и обычно. Т.е. «in vivo» относится к состоянию, где целевая биологическая функция или реакция экспрессируется в живом организме, а «in vitro» относится к экспрессии такой функции или реакции в пробирке для тестирования (система тканевой культуры, система культуры клеток, бесклеточная система и т.д.).
Опухоль, являющаяся мишенью согласно изобретению, представляет собой опухоль, на которую оказывает противоопухолевое действие FK228, являющийся ингибитором гистоновой дезацетилазы, и ее примеры охватывают рак предстательной железы и злокачественную лимфому, где особенно примечательным является эффект in vivo. Злокачественная лимфома, на которую оказывает противоопухолевое действие терапевтическое средство для лечения злокачественной лимфомы согласно настоящему изобретению, предпочтительно является отличной от T-клеточной лимфомы, например, представляет собой В-клеточную лимфому, гистиоцитарную лимфому и тому подобное. В настоящем изобретении показано отличное противоопухолевое действие in vivo, особенно против данных опухолей.
Терапевтическое средство для лечения рака предстательной железы и терапевтическое средство для лечения злокачественной лимфомы согласно изобретению может использоваться в качестве фармацевтического препарата в виде твердого вещества, полутвердого вещества или жидкости, содержащей FK228 или его соль в качестве активного ингредиента в смеси с органическим или неорганическим носителем или наполнителем, подходящим для перорального или парентерального применения. Активный ингредиент может примешиваться к общепринятому нетоксичному фармацевтически приемлемому носителю, например, для получения порошка, таблетки, пилюли, капсулы, суппозитория, жидкости, эмульсии, суспензии, аэрозоля, спрея и другой формы, подходящей для применения. Там, где необходимо, может также использоваться добавка, стабилизатор, загуститель и тому подобное. Данные носители и наполнители могут использоваться, если необходимо, после стерилизационной обработки или могут стерилизоваться после составления в препарат. FK228 или его соль могут содержаться в количестве, достаточном для обеспечения противоопухолевого действия, в терапевтическом средстве для лечения рака предстательной железы и в терапевтическом средстве для лечения злокачественной лимфомы.
При использовании фармацевтического средства для человека его предпочтительно применяют путем внутривенного, внутримышечного и перорального введения. При том, что терапевтически эффективная доза FK228 или его соли, которые являются активными ингредиентами, варьирует в зависимости от возраста и состояния конкретных пациентов, подлежащих лечению, и вида злокачественной опухоли и вида злокачественной лимфомы, она в основном составляет 0,1-100 мг, предпочтительно 1-50 мг, более предпочтительно, 5-30 мг в сутки в количестве FK228 на площадь поверхности тела человека (м2) в случае внутривенного введения для лечения опухоли.
Настоящее изобретение также относится к способу оценки противоопухолевого действия ингибитора гистоновой дезацетилазы. С помощью данного способа может быть обнаружен ингибитор гистоновой дезацетилазы, который способен оказывать противоопухолевое действие на целевую опухолевую клетку, без действительного введения данного ингибитора в человеческий организм.
Под «ингибитором гистоновой дезацетилазы» подразумевается соединение, которое связывается с активным участком гистоновой дезацетилазы, конкурентно с субстратом, или соединение, которое связывается с участком, отличным от активного участка гистоновой дезацетилазы, и обладает действием по изменению ферментативной активности гистоновой дезацетилазы, и он охватывает соединение, уже известное как ингибитор гистоновой дезацетилазы, применение которого известно, все соединения (синтетические или природные), о которых сообщалось, что они имеют ингибиторную активность в отношении гистоновой дезацетилазы, и все соединения, о которых сообщат в будущем. Конкретно могут быть упомянуты указанное выше FK228, его соль и его производное (например, ацетилированное FK228, форма тиола, где восстановлена связь S-S, и т.д.). Кроме того, соединениями, об ингибиторной активности в отношении гистоновой дезацетилазы которых сообщалось, являются трихостатин A, бутират натрия, субероиланилидгидроксамовая кислота (SAHA), MS-275, циклический пептид, содержащий гидроксамовую кислоту, апицидин, трапоксин и тому подобное.
Способ оценки противоопухолевого действия ингибитора гистоновой дезацетилазы согласно изобретению охватывает по меньшей мере (i) стадию обработки тестируемой клетки ингибитором гистоновой дезацетилазы и (ii) стадию измерения изменения экспрессии конкретного гена и/или белка в тестируемой клетке до и после обработки указанным ингибитором, и сравнения обоих экспрессированных количеств. Каждая стадия подробно объясняется далее.
(i) Стадия обработки тестируемых клеток ингибитором гистоновой дезацетилазы
На данной стадии тестируемую клетку культивируют в растворе, содержащем ингибитор гистоновой дезацетилазы.
Хотя тестируемая клетка, подлежащая использованию согласно изобретению, особо не ограничена, лишь бы только она содержала гистоновую дезацетилазу, однако оценка противоопухолевого действия ингибитора гистоновой дезацетилазы, особенно местной опухолевой специфичности ингибитора, является одной из проблем настоящего изобретения, поэтому предпочтительно, чтобы используемая тестируемая клетка происходила из опухоли, действие на которую следует оценивать. Например, когда подлежит оценке действие на рак предстательной железы, используют клетку PC-3, которая представляет собой культивируемую клетку рака предстательной железы человека, и так далее, а когда подлежит оценке действие на рак почки, используют клетку ACHN, которая представляет собой культивируемую клетку рака почек человека, и так далее. Различные культивируемые клетки рака человека, подлежащие использованию в качестве тестируемых клеток, включая данные раковые клетки, коммерчески доступны или доступны из различных клеточных банков, и тому подобное. Для оценки долгосрочного эффекта лечения или эффективности для конкретных пациентов, а именно индивидуальной медицины, возможно культивирование раковой клетки, которая может быть получена из опухоли пациента, и применение данной раковой клетки в качестве тестируемой клетки.
Ингибитор гистоновой дезацетилазы, подлежащий использованию на данной стадии, соответствует указанному выше.
Условия обработки тестируемой клетки и ингибитор гистоновой дезацетилазы свободны от каких-либо конкретных ограничений, при условии, что действие ингибитора гистоновой дезацетилазы может оказываться полностью, и при подходящей установке по таким факторам, как вид тестируемой клетки, подлежащей использованию, и вид тестируемого ингибитора гистоновой дезацетилазы, и тому подобное.
Растворитель для получения раствора ингибитора гистоновой дезацетилазы конкретно не ограничен, при условии, что он способен растворять ингибитор гистоновой дезацетилазы, и он не проявляет токсичности в отношении тестируемой клетки. В общем, концентрированный раствор получают с этанолом, PEG400, 10%-ным раствором HCO-60, диметилсульфоксидом и тому подобным, смешанным растворителем из них и тому подобным, и разводят до требуемой концентрации культуральной средой, физиологическим буфером и тому подобным, и применяют. Концентрация ингибитора гистоновой дезацетилазы в данном растворе в основном составляет 0, 001-1000 нМ, предпочтительно 0,01-100 нМ, более предпочтительно - 0,1-10 нМ, а в некоторых случаях раствор серийно разводят, и серию серийных разведений получают и применяют.
В способе оценки согласно изобретению число тестируемых клеток, подлежащих инокуляции, может подходящим образом повышаться или снижаться, в зависимости от времени обработки ингибитором гистоновой дезацетилазы и тому подобного. Оно в основном составляет примерно 1×103-1×106 клеток, предпочтительно, примерно 1×104-1×105 клеток на 1 мл культуральной среды.
Время обработки (время культивирования) тестовой клетки ингибитором гистоновой дезацетилазы подходящим образом устанавливается в соответствии с видом и концентрацией тестируемых клеток и с ингибитором и другими условиями культивирования, и варьирует, в зависимости от объекта оценки, однако оно в основном составляет 1-100 ч, предпочтительно 1-72 ч. Когда требуется подтверждение поддерживаемого в течение длительного времени противоопухолевого действия, устанавливают сравнительно большее время обработки. Тестируемую клетку в основном обрабатывают (культивируют) при 37°C в присутствии 5% CO2+ 95% O2.
(ii) Стадия измерения изменений в экспрессии конкретного гена и/или конкретного белка в тестируемой клетке до и после обработки указанным ингибитором и сравнения обоих количеств экспрессии
Данную стадию можно проводить любым способом, при помощи которого можно наблюдать количество экспрессии конкретного гена и/или конкретного белка в тестируемой клетке. Например, могут быть указаны процедуры, описанные далее.
(1) Ген, в частности, мРНК, или белок экстрагируют из тестируемой клетки до обработки ингибитором гистоновой дезацетилазы.
(2) Как подробно описано в указанной выше стадии (i) обработки тестируемой клетки ингибитором гистоновой дезацетилазы, после обработки тестируемой клетки ингибитором гистоновой дезацетилазы и культивирования в течение некоторого периода времени ген, в частности мРНК, или белок экстрагируют из обработанной клетки тем же способом, как указано выше (1).
(3) С использованием вещества, обладающего специфичной аффинностью в отношении конкретного гена (или конкретного белка) детектируют конкретный ген (или конкретный белок). Здесь конкретный ген (или конкретный белок) означает тот, который характеризуется изменением количества его экспрессии до и после обработки ингибитором гистоновой дезацетилазы и характеризуется корреляцией между изменением количества экспрессии и противоопухолевым действием ингибитора гистоновой дезацетилазы. Конкретно, может указываться ген (белок) p21 и ген (белок) c-myc. Ген p21 представляет собой ген, регулирующий клеточный цикл, участвующий в подавления прогресса клеточного цикла, и известно, что его продукт ингибирует активность комплекса циклин/циклинзависимая киназа, блокируя таким образом прогресс клеточного цикла. Ген c-myc кодирует внутриядерный белок, и его генная экспрессия заметно изменяется по ходу роста клетки, развития клетки и злокачественного перерождения. Соответственно, участие данного генного продукта в клеточном росте привлекает внимание.
Для конкретного гена (или конкретного белка), подлежащего измерению согласно настоящему изобретению, может быть достаточно применения одного вида измерения, но когда необходимо выявить противоопухолевое действие более подробно, предпочтительно одновременное измерение двух или более видов конкретных генов (или конкретных белков).
Вещество, обладающее специфичным сродством к конкретному гену или конкретному белку, свободно от какого-либо конкретного ограничения до тех пор, пока оно обладает той чувствительностью, которая обеспечивает детекцию экспрессии в тестируемых клетках. Здесь под «специфичным сродством» подразумевается свойство гибридизоваться или связываться исключительно с целевым геном или белком. Как вещество для детекции конкретного гена может быть указано вещество, полностью комплементарное целому указанному гену или его части, или вещество, содержащее одно или несколько несовпадений, в степени, удовлетворяющей указанному выше качеству. Конкретные примеры включают в себя олиго- или полинуклеотид, содержащий частично или полностью последовательность оснований гена и последовательности, комплементарные им, и тому подобное, и подходящее вещество выбирают, в зависимости от формы детектируемого гена. Происхождение данного вещества конкретно не ограничено, если только оно обладает специфичным сродством к гену, и оно может быть синтезировано или образовано путем отщепления необходимой части от гена и очистки этой части общепринятым способом. Данное вещество может быть мечено флуоресцентным веществом, ферментом, радиоизотопом и тому подобным. В качестве вещества, подлежащего использованию для детекции конкретного белка, например, может указываться антитело, обладающее конкретным сродством в отношении белка или его фрагмента. Его специфичное сродство означает способность к специфичному распознаванию белка в реакции антиген-антитело и связыванию с ним. Антитело и его фрагмент особо не ограничены, если только они могут конкретно связываться с белком, и могут быть поликлональным антителом, моноклональным антителом и их функциональными фрагментами. Данные антитела и их функциональные фрагменты могут продуцироваться по способу, обычно применяемому в данной области. Такие антитела и их фрагменты могут быть мечены флуоресцентным веществом, ферментом, радиоизотопом и тому подобным.
Экстракция гена, в частности, мРНК, а также экстракция белка из тестируемой клетки может проводиться способом, в основном используемым в связанной области, или подходящей комбинацией таких способов. При экстракции мРНК ее экспрессию оценивают способом, обычно используемым в данной области, таким как нозерн-блот, RT-PCR и тому подобное, с использованием вещества, обладающего специфичным сродством в отношении указанного выше конкретного гена. С другой стороны, когда белок экстрагируют, его экспрессию оценивают способом, обычно используемым в данной области, таким как иммуноблоттинг, вестерн-блоттинг и тому подобное, с использованием вещества (антитела, его фрагмента и т.д.), обладающего специфичным сродством в отношении указанного выше конкретного белка.
Таким образом, изменения в экспрессии конкретного гена (или конкретного белка) в тестируемой клетке до и после обработки ингибитором гистоновой дезацетилазы измеряют и сравнивают для определения того, проявляет ли тестируемый ингибитор гистоновой дезацетилазы эффективную противоопухолевую активность в тестируемой клетке. Когда в качестве индикатора используют ген (или белок) p21 и обработка ингибитором гистоновой дезацетилазы повышает количество экспрессии, определяют противоопухолевое действие ингибитора на происходящей из опухоли тестируемой клетке. Когда в качестве индикатора используют ген (или белок) c-myc и обработка ингибитором гистоновой дезацетилазы снижает количество экспрессии, определяют противоопухолевое действие ингибитора на происходящей из опухоли тестируемой клетке. Когда в качестве тестируемой клетки используют опухолевую клетку, полученную от пациента в клинике, достижимо предсказание противоопухолевого действия, отражающего индивидуальную специфичность пациента.
Способ скрининга ингибитора гистоновой дезацетилазы, согласно изобретению, обладающего противоопухолевой активностью в отношении конкретного участка (вида) опухоли, может быть предоставлен путем использования указанного выше способа оценки противоопухолевого действия ингибитора гистоновой дезацетилазы. Специфичность в отношении участков опухоли для каждого ингибитора может определяться путем использования тестируемой клетки, происходящей из целевой опухоли, обработки ингибитором гистоновой дезацетилазы, действие которого оценивают, и определения наличия или другого проявления противоопухолевого действия указанным выше способом.
Более того, настоящее изобретение относится к способу получения гена, который послужит индикатором эффективности действия FK228. Путем анализа экспрессии гена (группы), осуществляемого таким способом, может быть получена информация о том, может ли FK228 применяться для лечения, воздействует ли FK228 на целевую злокачественную опухоль и тому подобное, что может внести вклад в «индивидуальную медицину».
Данный способ конкретно осуществляется следующим образом.
(1) Стадия обработки FK228 чувствительной к FK228 опухолевой клетки и резистентной к FK228 опухолевой клетки
Чувствительная в отношении FK228 опухолевая клетка означает здесь тип опухолевой клетки, чей рост подавляется FK228. Как пример может быть указана клетка рака предстательной железы PC-3, что показано в описанных ниже примерах. Кроме того, одной из чувствительных к FK228 опухолевых клеток является SC-6, которая представляет собой клетку рака желудка. С другой стороны, резистентной к FK228 опухолевой клеткой является тип опухолевой клетки, чей рост не может подавляться FK228, и в ее отношении FK228 не может оказывать противоопухолевого действия. Как пример может указываться клетка рака почки ACHN, что показано описанными ниже примерами. Кроме того, одной из резистентных к FK228 опухолевых клеток является А498, которая представляет собой клетку рака почки.
Обработка данных опухолевых клеток FK228 проводится тем же способом, что на указанной выше «Стадии обработки тестируемой клетки ингибитором гистоновой дезацетилазы».
(2) Стадия выбора генов, которые характеризуются повышенной или сниженной экспрессией при обработке на указанной выше стадии (1)
Данная стадия отбора генов может осуществляться с использованием способов, приведенных в настоящем описании, и способов, обычно используемых в данной области. Способ с применением генного чипа предпочтительно используют в свете преимущества возможности одновременного анализа большого количества экспрессируемых генов.
(3) Стадия выбора из генов, отобранных выше на стадии (2),
(i) гена, который характеризуется повышенной экспрессией вследствие обработки FK228, большей экспрессией в чувствительной к FK228 опухолевой клетке и меньшей экспрессией в резистентной к FK228 опухолевой клетке,
(ii) гена, который характеризуется повышенной экспрессией вследствие обработки FK228, меньшей экспрессией в чувствительной к FK228 опухолевой клетке и большей экспрессией в резистентной к FK228 опухолевой клетке,
(iii) гена, который характеризуется сниженной экспрессией вследствие обработки FK228, большей экспрессией в чувствительной к FK228 опухолевой клетке и меньшей экспрессией в резистентной к FK228 опухолевой клетке, или
(iv) гена, который характеризуется сниженной экспрессией вследствие обработки FK228, меньшей экспрессией в чувствительной к FK228 опухолевой клетке и большей экспрессией в резистентной к FK228 опухолевой клетке.
Иными словами, данная стадия подразумевает селекцию генов, которые показывают некоторые изменения в экспрессии (увеличение или снижение) вследствие обработки FK228 и характеризуются различным состоянием экспрессии, в зависимости от того, чувствительны они к FK228 или нет. Анализ состояния экспрессии гена (группы) может представлять собой подходящее средство для предсказания эффективности FK228 без введения FK228.
Способ обнаружения повышения или снижения генной экспрессии может осуществляться в соответствии со способами, обычно используемыми в данной области, и проводится с использованием способов, описанных также в настоящем описании. Способ с применением генного чипа предпочтительно используют в свете преимущества возможности одновременного анализа большого количества экспрессируемых генов.
Примеры
Настоящее изобретение конкретно и подробно объясняется далее путем ссылки на примеры, которые, как подразумевается, не являются ограничивающими.
Пример 1
(1) Получение фармацевтического средства
Взвешивали необходимое количество FR901228, и добавляли растворитель (10% HCO-60/солевой раствор). Смесь обрабатывали ультразвуком, чтобы обеспечить растворение. Вещество положительного контроля паклитаксел перед тестированием растворяли в растворе Cremophor EL/этанол (1:1) до концентрации 24 мг/мл, и сохраняли в холодильнике. При использовании его разводили 9-кратным количеством физиологического солевого раствора до концентрации 2,4 мг/мл (компоненты раствора: 5% Cremophor EL - 5% этанол - 90% солевой раствор).
(2) Тестируемое животное
Для противоопухолевого тестирования фармацевтического средства приобретали мышей BALB/cANnNCrj-nu/nu (самцы в возрасте 6 недель) от Charles River Japan, и после акклиматизации не менее чем в течение одной недели использовали для тестирования. Мышей содержали в условиях SPF и обеспечивали свободный доступ к воде и корму.
(3) Тестируемая опухоль
Культивируемую клеточную линию рака предстательной железы (PC-3: доступна от Japanese Foundation for Cancer Research, Cancer Chemotherapy Center, Fundamental Research) имплантировали подкожно в количестве 2-3×107 клеток на голую мышь. Выросшую сулидную опухоль субкультивировали не менее чем в 3 генерациях и использовали для тестирования.
(4) Экспериментальная имплантация и группировка
Сулидную опухоль, субкультивируемую в голой мыши, иплантировали подкожно в правую часть спины мыши в виде фрагмента опухолевой ткани размером примерно 3 мм. После имплантации опухоли, когда объем опухоли (1/2×более длинный диаметр × более короткий диаметр2) достигал 100-300 мм3, мышей группировали по 6 мышей на группу для уравнивания размера опухоли.
(5) Введение
Введение начинали на сутки группировки (сутки 0). FR901228 вводили внутривенно группе введения FR901228 3 раза каждые 4 суток (q4d×3) (3,2 и 1,8 мг/кг). Паклитаксел (24 мг/кг) вводили внутривенно в течение 5 суток подряд (qd×5) группе введения вещества положительного контроля паклитаксела. Контрольной группе вводили только растворитель (10% HCO-60/солевой раствор) (q4d×3). Количество жидкости для каждого введения рассчитывали (0,1 мл/10 г массы тела), основываясь на массе тела, измеренной в день введения. Следует отметить, что 3,2 мг/кг/сутки (q4d×3) FR901228 и 24 мг/кг/сутки (qd×5) паклитаксела представляли собой их максимально переносимые дозы (MTD).
(6) Измерение размера опухоли и массы тела
Размер опухоли (более длинный диаметр, более короткий диаметр) и массу тела измеряли два раза в неделю, начиная с суток 0.
(7) Оценка противоопухолевого действия
Уровень опухолевого роста оценивали на основе коэффициента опухолевого роста (относительный объем опухоли). Коэффициент подавления опухоли выражали в относительной доле объема опухоли после суток 0, считая объем опухоли на сутки 0 за 1. Противоопухолевое действие определяли на 14 сутки (сутки 14) с начала введения фармацевтического средства. Когда доля коэффициента опухолевого роста в группе введения фармацевтического средства по отношению к таковому для контрольной группы (введение растворителя), (T/C%), составляла не более 50%, и в U-тесте Манна-Уитни обнаруживали значимое различие (P<0,01), фармацевтическое средство определяли как эффективное.
Результаты показаны на фиг.1. FR901228 характеризовался противоопухолевым действием in vivo в отношении рака предстательной железы человека.
Пример 2
(1) Получение фармацевтического средства
Взвешивали необходимое количество FR901228, и добавляли растворитель (10% HCO-60/солевой раствор). Смесь обрабатывали ультразвуком, чтобы обеспечить растворение.
(2) Тестируемое животное
Для противоопухолевого тестирования фармацевтического средства приобретали мышей Fox Chase C.B-17/Icr-SCID.Jcl (самцы в возрасте 6 недель) от CLEA JAPAN INC., и после акклиматизации не менее чем в течение одной недели использовали для тестирования. Мышей содержали в условиях SPF и обеспечивали свободный доступ к воде и корму.
(3) Тестируемая опухоль
Культивируемая клеточная линия лимфомы человека (U937: получена от д-ра Minowada, Hayashibara Biochemical Laboratories, Inc.) культивировалась в RPMI (содержащей 10% FCS) и субкультивировалась in vitro.
(4) Экспериментальная имплантация и группировка
Циклофосфамид (Shionogi & Co., Ltd., 150 мг/кг) вводили мышам внутрибрюшинно. Лимфому (1×107 клеток), субкультивируемую in vitro, имплантировали внутрибрюшинно на следующие сутки. После имплантации опухоли мышей группировали по 6 мышей на группу (в контрольной группе 12) с выравниванием по массе тела.
(5) Введение
Введение начинали со дня группировки (сутки 0). FR901228 вводили внутрибрюшинно группе введения FR901228 один или два раза в неделю (0,1-1,0 мг/кг). Контрольной группе вводили только растворитель (10% HCO-60/солевой раствор).
(6) Оценка
В качестве противоопухолевого действия подсчитывали число дней выживания мышей.
Результаты показаны на фиг.2. На фиг.2(a) показаны результаты введения FR901228 один раз в неделю, а на фиг.2(b) показаны результаты введения FR901228 два раза в неделю. FR901228 характеризовался противоопухолевым действием in vivo в отношении лимфомы человека.
Пример 3
(1) Получение фармацевтического средства
Взвешивали необходимое количество FR901228, и добавляли растворитель (10% HCO-60/солевой раствор). Смесь обрабатывали ультразвуком, чтобы обеспечить растворение. Вещество положительного контроля паклитаксел перед тестированием растворяли в растворе Cremophor EL/этанол (1:1) до концентрации 24 мг/мл, и сохраняли в холодильнике. При использовании его разводили 9-кратным количеством физиологического солевого раствора до концентрации 2,4 мг/мл (компоненты раствора: 5% Cremophor EL - 5% этанол - 90% солевой раствор).
(2) Тестируемое животное
Для противоопухолевого тестирования фармацевтического средства приобретали мышей BALB/cANnNCrj-nu/nu (самцы в возрасте 6 недель) от Charles River Japan, и после акклиматизации не менее чем в течение одной недели использовали для тестирования. Мышей содержали в условиях SPF и обеспечивали свободный доступ к воде и корму.
(3) Тестируемая опухоль
Культивируемую клеточную линию рака почки 1 (ACHN: доступна от ATCC) и культивируемую клеточную линию рака предстательной железы 1 (PC-3: доступна от ATCC) имплантировали подкожно в количестве 2-3×107 клеток в голую мышь. Выросшую сулидную опухоль субкультивировали не менее чем в 3 генерациях и использовали для тестирования.
(4) Экспериментальная имплантация и группировка
Сулидную опухоль, субкультивируемую в голой мыши, иплантировали подкожно в правую часть спины мыши в виде фрагмента опухолевой ткани размером примерно 3 мм. После имплантации опухоли, когда объем опухоли (1/2×более длинный диаметр × более короткий диаметр2) достигал 100-300 мм3, мышей группировали по 6 мышей на группу для уравнивания размера опухоли.
(5) Введение
Введение начинали на сутки группировки (сутки 0). FR901228 вводили внутривенно группе введения FR901228 3 раза каждые 4 суток (q4d×3) (3,2 и 1,8 мг/кг). Паклитаксел (24 мг/кг) вводили внутривенно в течение 5 суток подряд (qd×5) группе введения вещества положительного контроля паклитаксела. Контрольной группе вводили только растворитель (10% HCO-60/солевой раствор) (q4d×3). Количество жидкости для каждого введения рассчитывали (0,1 мл/10 г массы тела), основываясь на массе тела, измеренной в день введения. Следует отметить, что 3,2 мг/кг/сутки (q4d×3) FR901228 и 24 мг/кг/сутки (qd×5) паклитаксела представляли собой их MTD.
(6) Измерение размера опухоли и массы тела
Размер опухоли (более длинный диаметр, более короткий диаметр) и массу тела измеряли два раза в неделю, начиная с суток 0.
(7) Оценка противоопухолевого действия
Уровень опухолевого роста оценивали на основе коэффициента опухолевого роста (относительный объем опухоли). Коэффициент подавления опухоли выражали в относительной доле объема опухоли после суток 0, считая объем опухоли на сутки 0 за 1. Противоопухолевое действие определяли на 14 сутки (сутки 14) с начала введения фармацевтического средства. Когда доля коэффициента опухолевого роста в группе введения фармацевтического средства по отношению к таковому для контрольной группы (введение растворителя), (T/C%), составляла не более 50%, и в U-тесте Манна-Уитни обнаруживали значимое различие (P<0,01), фармацевтическое средство определяли как эффективное.
Результаты показаны на фиг.3. FR901228 характеризовался мощным противоопухолевым действием в отношении PC-3 в дозе 3,2 мг/кг (фиг.3(a)), но не проявлял противоопухолевого действия в отношении ACHN (фиг.3(b)).
Пример 4
(1) Получение фармацевтического средства
Необходимое количество FR901228 взвешивали и растворяли в растворителе (99,5% этанол) до концентрации 1 мг/мл. Затем раствор разбавляли культуральной средой.
(2) Тестируемая опухоль
Культивируемую клетку злокачественной опухоли человека (PC-3 и ACHN) культивировали в DMEM (содержащей 10% FCS).
(3) Культура и экстракция РНК
Клетки инокулировали в количестве 2×106 клеток на культуральную чашку и культивировали в присутствии FR901228 (5 нг/мл) в течение заданного времени. После культивирования РНК экстрагировали с реагентом TRIZOL (GIBCO BRL) по инструкции для применения.
(4) PCR в реальном времени
РНК подвергали обратной транскрипции с использованием реагента для обратной транскрипции Taq-man (PE Biosystem) по инструкции для применения. После этого ген p21 амплифицировали с использованием специальной смеси с SYBR зеленым для PCR (PE Biosystem) и праймеров 5'-GGC AGA CCA GCA TGA CAC ATT-3' (выше p21)(SEQ ID; No 1), 5'-GGA TTA GGG CTT CCT CTT GGA G-3' (SEQ ID; No 2) по инструкции для применения, и детектировали детектором последовательностей ABI 7700 PRISM (PE Biosystem). Количество экспрессии гена p21 рассчитывали из стандартной кривой, делили на количество экспрессии гена β-актина, которое использовали в качестве внутреннего стандарта, и выражали в виде стандартизованного относительного количества экспрессии.
Результаты показаны на фиг.4. Путем контакта с FR901228 in vitro PC-3 (фиг.4(a)) с течением времени проявили повышенную экспрессию гена p21. ACHN, наоборот, не показали повышенной экспрессии гена p21 (фиг.4(b)). В необработанных клетках ген p21 показал незначительную экспрессию в PC-3, но характеризовался экспрессией в ACHN (фиг.4(c)).
Пример 5
Клетки рака предстательной железы человека PC-3 или клетки рака почки ACHN подкожно имплантировали голой мыши и, когда размер опухоли достигал 100-300 мг, внутривенно вводили FR901228 (3,2 мг/кг). Опухоль с течением времени удаляли, и после экстракции РНК количество экспрессии гена p21 и гена c-myc определяли путем PCR реального времени тем же образом, что и в примере 4. Ген c-myc амплифицировали с использованием специальной смеси с SYBR зеленым для PCR (PE Biosystem) и праймеров 5'-GAC AGA TCA GCA ACA ACC GAA A-3' (выше человеческого c-myc)(SEQ ID; No 3), 5'-TTG TGT GTT CGC CTC TTG ACA T-3' (ниже человеческого c-myc)(SEQ ID; No 4) по инструкции для применения, и детектировали детектором последовательностей ABI 7700 PRISM (PE Biosystem).
Результаты показаны на фиг.5. PC-3 характеризовались повышенной экспрессией гена p21 in vivo с пиком через 3 ч после введения FR901228 (фиг.5(a)). ACHN, наоборот, не характеризовался повышенной экспрессией гена p21 (фиг.5(a)). Хотя ген c-myc показал сниженную экспрессию в PC-3, он характеризовался повышенной экспрессией в ACHN (фиг.(b)).
Пример 6: Анализ генной экспрессии (in vitro) в опухолевой клетке под действием FK228 с использованием генного чипа
Действие FK228 на генную экспрессию in vitro в опухолевой клетке человека анализировали с использованием генного чипа.
<Материалы. Процедура>
(1) Материалы для тестирования
фармацевтическое средство FK228 (FR901228)
концентрация при использовании: 50 нг/мл
способ получения: раствор 10 мг/мл получали с этанолом заранее и серийно разводили культуральной средой с получением раствора с концентрацией 50 нг/мл.
дозированная форма: раствор (полученный при использовании)
Использованные клетки: рак предстательной железы человека (PC-3), лимфома человека (U937), рак почки человека (ACHN)
Культуральная среда: DMEM (для PC-3, ACHN), RPMI1640 (для U937)
Обе получены от Nikken Biomedical Laboratory, кроме того, содержат FCS (Moregate) и пенициллин-стрептомицин (ICN Biomedicals Inc.).
Экстракция РНК: набор RNeasy Mini Kit (50) (Qiagen)
вода, не содержащая РНКазу, ДНКазу (Life Technologies)
Синтез ДНК: система Superscript Choice System (Life Technologies)
Ethachinmate (Nippon gene)
Праймер T7-(dT)24 (Amersham Pharmacia)
Синтез кРНК: набор для мечения РНК-транскриптов BioArray (Amersham Pharmacia)
фрагментация кРНК: основание Trizma (SIGMA)
ледяная уксусная кислота (SIGMA)
ацетат магния (SIGMA)
ацетат калия (SIGMA)
Гибридизация: набор для контроля за гибридизацией у эукариот (Eukaryotic Hybridization Control Kit (Amersham Pharmacia))
0,5 M раствор EDTA (SIGMA)
Натриевая соль MES (SIGMA)
Моногидрат свободной кислоты MES (SIGMA)
ДНК спермы сельди (Promega)
Раствор ацетилированного бычьего сывороточного альбумина (Life Technologies)
Окрашивание: Фикоэритрин-стрептавидин (Molecular Probes)
IgG козы, степень очистки реагента (SIGMA)
Антитело против стрептавидина (козы), биотинилированное (Vector Lab)
Используемый чип: поле HuGeneFL (Amersham Pharmacia)
(2) Получение клеток и экстракция ДНК
Опухолевые клетки человека (PC-3, U937, ACHN), которые достигали сомкнутого слоя во флаконах F75, подвергали обработке трипсином с образованием суспензий отдельных клеток, которые инокулировали на пять флаконов F75 и культивировали в течение 24 ч. Культуральную среду отбирали, и добавляли свежую культуральную среду (18 мл) и 10-кратную концентрацию (50 нг/мл) раствора FR901228 (2 мл). Смесь культивировали в инкубаторе с CO2 при 37°C в течение заданного времени (0, 1, 3, 12 и 24 ч). По окончании культивирования культуральную среду отбрасывали, и выделяли общую РНК по протоколу к набору RNeasy Mini Kit (50) (Qiagen). РНК подвергали количественному анализу и подтверждали его путем электрофореза.
(3) Синтез кРНК
По руководству к GeneChip, глава 2 - глава 4, и руководствам к набору RNeasy Mini Kit и к набору для мечения РНК-транскриптов РНК очищали, синтезировали кДНК, синтезировали кРНК и фрагментировали кРНК.
(4) Гибридизация, отмывка-окрашивание, сканирование
Гибридизацию, отмывку-окрашивание и сканирование проводили по руководству к GeneChip, глава 5 - глава 7.
(5) Анализ
Анализировали с использованием GeneSpring (программное обеспечение для данных микрополей: производство Silicon Genetics).
<Результаты>
Клетки рака предстательной железы человека PC-3 и клетки лимфомы человека U937, которые представляют собой чувствительные к FK228 опухолевые клетки, и клетки рака почки человека ACHN, которые представляют собой резистентные к FK228 опухолевые клетки, контактировали in vitro с FK228 в течение некоторого времени, после чего экстрагировали РНК, и оценивали 7070 генов, детектируемых с использованием GeneChip, на предмет генов, характеризующихся изменением в экспрессии вследствие воздействия FK228. Такие гены анализировали по следующим процедурам.
Анализ 1: Выбор гена, который характеризуется изменением экспрессии вследствие ингибирования гистоновой дезацетилазы.
Для ограничения гена, который характеризуется изменением экспрессии вследствие воздействия FK228, выбирали ген, проявляющий линейное изменение экспрессии (условие анализа GeneSpring: ген, который характеризуется изменением экспрессии в 0,5 раз или более, или в 0,5 раз или менее в любое время).
Анализ 2: Выбор гена, относящегося к эффективности
При контакте с FK228 в течение 72 ч эффект подавления роста в отношении PC-3, U937 и ACHN по значению IC50 составлял 3,17, 3,20 и 4,25 нг/мл, соответственно, что показывало по существу одинаковую степень эффекта подавления роста в отношении данных опухолевых клеток. Из данных результатов предполагали, что гены, относящиеся к подавлению роста, обычно характеризуются изменением экспрессии в любой клетке. Было обнаружено 105 генов, которые обычно характеризовались повышенной экспрессией в данных трех видах опухолевых клеток человека, и 100 генов, которые обычно характеризовались сниженной экспрессией в данных трех видах опухолевых клеток человека.
Пример 7: Анализ генной экспрессии (in vivo) под воздействием FK228 в опухолевой клетке с использованием генного чипа
Действие FK228 на генную экспрессию in vivo в опухолевой клетке человека анализировали с использованием генного чипа.
<Материалы. Процедура>
(1) Материалы для тестирования
Фармацевтическое средство FK228 (FR901228)
доза: 10 мг/кг
вводимая доза: 10 мл/кг
растворитель: 10% HCO-60/солевой раствор
дозированная форма: раствор (полученный при использовании)
Опухолевая клетка: клетка рака предстательной железы человека PC-3 (опухолевый фрагмент 3 мм×3 мм×3 мм/участок имплантации в мышь п.к.)
клетки рака желудка человека SC-6; получены из Central Institute for Experimental Animals (опухолевый фрагмент 3 мм×3 мм×3 мм/участок имплантации в мышь п.к.)
клетки рака почки человека ACHN (опухолевый фрагмент 3 мм×3 мм×3 мм/участок имплантации в мышь п.к.)
клетки рака почки человека A498; получены от ATCC (опухолевый фрагмент 3 мм×3 мм×3 мм/участок имплантации в мышь п.к.)
Субкультивируемое животное: самцы BALB c/nu/nu
Экстракция РНК: набор RNeasy Mini Kit (50) (Qiagen)
вода, свободная от РНКаз, ДНКаз (Life Technologies)
Синтез ДНК: система Superscript Choice System (Life Technologies)
Ethachinmate (Nippon gene)
Праймер T7-(dT)24 (Amersham Pharmacia)
Синтез кРНК: набор для мечения РНК-транскриптов BioArray (Amersham Pharmacia)
Фрагментация кРНК: основание Trizma (SIGMA)
Ледяная уксусная кислота (SIGMA)
Ацетат магния (SIGMA)
Ацетат калия (SIGMA)
Гибридизация: набор для контроля за гибридизацией у эукариот (Amersham Pharmacia)
0,5 M раствор EDTA (SIGMA)
Натриевая соль MES (SIGMA)
Моногидрат свободной кислоты MES (SIGMA)
ДНК спермы сельди (Promega)
Раствор ацетилированного бычьего сывороточного альбумина (Life Technologies)
Используемый чип: поле HuGeneFL (Amersham Pharmacia)
(2) Получение клеток и экстракция РНК
Квадратный фрагмент опухоли размером 3 мм (PC-3, SC-6, ACHN, A498) подкожно имплантировали голой мыши, и, когда опухоль достигала примерно 100 мг (более длинный диаметр 9 мм, более короткий диаметр 8 мм), вводили внутривенно FR901228 (10 мг/кг). Через 0, 0,5, 1, 2 и 4 ч после введения FR901228 опухоль удаляли, и экстрагировали общую РНК по протоколу к набору RNeasy Mini Kit (50) (Qiagen). РНК подвергали количественному анализу и подтверждали его путем электрофореза.
(3) Синтез кРНК
По руководству к GeneChip, глава 2 - глава 4, и руководствам к набору RNeasy Mini Kit и к набору для мечения РНК-транскриптов РНК очищали, синтезировали кДНК, синтезировали кРНК и фрагментировали кРНК.
(4) Гибридизация, отмывка-окрашивание, сканирование
Гибридизацию, отмывку-окрашивание и сканирование проводили по руководству к GeneChip, глава 5 - глава 7.
(5) Анализ
Анализировали с использованием GeneSpring (программное обеспечение для данных микрополей: производство Silicon Genetics).
<Результаты>
FR901228 (10 мг/кг) внутривенно вводили мышам, несущим рак предстательной железы человека PC-3, рак желудка человека SC-6, рак почек человека ACHN и рак почек человека A498, и опухоль удаляли с течением времени (0, 0,5, 1, 2 и 4 ч). Затем РНК экстрагировали, и оценивали 7070 генов, детектируемых с использованием GeneChip, на предмет генов, характеризующихся изменением в экспрессии вследствие воздействия FR901228.
Коэффициент подавления роста опухоли рака предстательной железы человека PC-3, рака желудка человека SC-6, рака почек человека ACHN и рака почек человека A498 путем введения FR901228 (3,2 мг/кг), составлял 98%, 84%, 20% и 29%, соответственно. Таким образом, определяли PC-3 и SC-6 как чувствительные к FK228 опухоли, а ACHN и A498 были определены как резистентные к FK228 опухоли.
Пример 8: Способ генной экспрессии в чувствительной к FK228 опухоли и резистентной к FK228 опухоли
Корреляцию между состоянием генной экспрессии и эффективностью FK228 оценивали в опухоли, которая, как подтверждали в примере 7, была чувствительной или резистентной. Непосредственное внимание было уделено генам (105 генов), которые характеризовались повышенной экспрессией за счет обработки FK228, и генам (100 генов), которые при этом характеризовались сниженной экспрессией, что продемонстрировано в тесте in vitro в примере 6, и исследовали корреляцию между поведением данных генов и эффективностью. Более того, искали ген, который характеризовался повышенной экспрессией в чувствительной опухоли и пониженной экспрессией в резистентной опухоли, ген, который характеризовался пониженной экспрессией в чувствительной опухоли и повышенной экспрессией в резистентной опухоли. В результате из 105 генов, которые характеризовались повышенной экспрессией in vitro за счет обработки FR901228, 6 генов, как было обнаружено, характеризовались высокой экспрессией в чувствительной опухоли и низкой экспрессией в резистентной опухоли, и 4 гена, как было обнаружено, характеризовались низкой экспрессией в чувствительной опухоли и высокой экспрессией в резистентной опухоли (таблица 1). Кроме того, из 100 генов, которые характеризовались пониженной экспрессией in vitro за счет обработки FR901228, 4 гена, как было обнаружено, характеризовались высокой экспрессией в чувствительной опухоли и низкой экспрессией в резистентной опухоли, и 9 генов, как было обнаружено, характеризовались низкой экспрессией в чувствительной опухоли и высокой экспрессией в резистентной опухоли (таблица 2).
Данные гены проявляют корреляцию с эффективностью FK228 и корреляцию с чувствительностью или резистентностью к FK228, таким образом указывая на возможность применения данных генов в качестве маркеров для предсказания эффективности.
Промышленная применимость
Терапевтическое средство для лечения рака предстательной железы и терапевтическое средство для лечения злокачественной лимфомы согласно настоящему изобретению, содержащее в качестве активного ингредиента FK228 (в частности, FR901228) или его соль, которое обладает активностью в плане ингибирования гистоновой дезацетилазы, обладают выраженным противоопухолевым действием не только in vitro, но также in vivo. Поэтому их можно использовать в клинике, в частности, подходящим образом для лечения злокачественных опухолей. С использованием способа оценки или способа скрининга согласно настоящему изобретению, может, кроме того, быть обнаружен ингибитор гистоновой дезацетилазы, способный оказывать противоопухолевое действие, специфичное в отношении целевой опухолевой клетки, без действительного введения данного ингибитора в человеческое тело.
Текст, свободный от списка последовательностей
SEQ ID; No 1: олигонуклеотид, сконструированный так, что он действует как праймер для PCR мРНК p21.
SEQ ID; No 2: олигонуклеотид, сконструированный так, что он действует как праймер для PCR мРНК p21.
SEQ ID; No 3: олигонуклеотид, сконструированный так, что он действует как праймер для PCR мРНК c-myc.
SEQ ID; No 4: олигонуклеотид, сконструированный так, что он действует как праймер для PCR мРНК c-myc.
SEQ ID; No 5: Xaa представляет собой аминокислоту, представленную формулой NH2C(CHCH3)COOH.
Карбоксильная группа соединения формулы COOHCH2CH(CHCHC2 H4SH)OH связывается с аминогруппой Val, которая является первой аминокислотой, гидроксильная группа связывается с карбоксильной группой Val, которая является четвертой аминокислотой, а SH-группа связана дисульфидным мостиком с SH-группой Cys, которая является второй аминокислотой.
Данная заявка основана на патентной заявке № 2001-250846, поданной в Японии, содержание которой включено сюда в качестве ссылки.
Реферат
Изобретение относится к медицине, а именно к лекарственному средству для лечения рака предстательной железы, содержащему соединение формулы (I) или его фармацевтически приемлемую соль, к фармацевтической композиции, содержащей указанное соединение, к способу лечения рака предстательной железы, предполагающему введение такого соединения и к применению данного соединения для лечения рака предстательной железы.
Технические результат - расширение арсенала лекарственных средств для лечения рака предстательной железы. 4 н. и 3 з.п., 2 табл., 5 ил.
Формула


Комментарии