Способ получения штамма бактериофага, специфических штаммов бактериофагов и их применение - RU2573934C2
Код документа: RU2573934C2
Чертежи





Описание
Данное изобретение относится к способу получения штамма бактериофага, специфического к выбранному штамму бактерий, штаммам бактериофагов, полученных таким образом, и применению бактериофагов в получении препарата для предупреждения и борьбы с инфекциями сельскохозяйственных животных, в частности домашней птицы, вызванными патогенными штаммами бактерий, чувствительных к этим бактериофагам.
Целью настоящего изобретения является обеспечение технологии производства противомикробного препарата, подходящего для применения в качестве кормовой добавки для домашней птицы и свиней, который в то же время был бы специфическим к патогенным штаммам Salmonella spp, которые являются причиной возникновения сальмонеллеза, в частности, у людей. Данный препарат должен соответствовать строгим требованиям безопасности для кормовых добавок. Запрет на применение антибиотиков в корме для животных, действующий в странах Европейского Союза с 1 января 2006 года, создал огромный спрос на кормовые добавки, не содержащие антибиотики, но имеющие противомикробный эффект.
Целью настоящего изобретения является обеспечение препарата, который смог бы заменить применяемые в настоящее время антибиотики.
Неожиданно такой препарат был успешно получен в настоящем изобретении.
Данное изобретение относится к способу получения штамма бактериофага, специфического к выбранному штамму бактерий, отличающемуся тем, что
a) получают коллекцию штаммов бактериофагов, содержащую штамм бактериофага, специфический к выбранному штамму бактерий,
b) осуществляют культивирование выбранного штамма бактерий на стерильной культуральной среде,
с) образцы культуры наносят на специальный многолуночный измерительный планшет, затем суспензию испытываемого штамма бактериофага добавляют в различных концентрациях и инкубируют при 37°C в течение по меньшей мере 4 часов,
d) к культуре добавляют резазурин и продолжают инкубацию в темноте при 37°С в течение по меньшей мере 3 часов,
e) контролируют цвет или флуоресценцию культуры, а также штамм бактериофага, находящийся в культуре, которая сохраняет синий цвет или не демонстрирует существенного увеличения флуоресценции по сравнению с контрольным образцом, идентифицируют как штамм бактериофага, специфический к выбранному штамму бактерий; при этом стерильный образец, который обработали с такой же инкубацией, используют в качестве контрольного образца,
f) размножают идентифицированный штамм бактериофага, специфический к выбранному штамму бактерий.
Предпочтительно, чтобы выбранный бактериальный штамм являлся штаммом S. enterica серовара Enteritidis.
Раскрытый способ подходит для легкого и быстрого скрининга больших коллекций бактериофагов и позволяет легко определить титр (литическую концентрацию) тестируемых фагов, что обязательно при промышленных применениях.
Другой целью настоящего изобретения является применение бактериофагов в производстве препарата для предупреждения и борьбы с инфекциями сельскохозяйственных животных, в частности домашней птицы, вызванными патогенными штаммами бактерий, чувствительных к этим бактериофагам. Полученный препарат предназначен для введения находящимся в опасности животным с пищей или водой с интервалами от одного до семи дней.
Предпочтительно, чтобы полученный препарат обеспечивал по меньшей мере 200-кратное снижение уровня инфекции через неделю после прекращения применения.
Предпочтительно, чтобы инфекция, с которой нужно бороться, представляла собой инфекцию домашней птицы, вызванную патогенными штаммами Salmonella sp., тогда как для того, чтобы получить препарат, используют штамм бактериофага, выбранный из группы, включающей те штаммы, которые раскрыты в данной заявке, депонированные 7 июня 2011 года в Польской Коллекции Микроорганизмов (Polish Collection of Microorganisms) под следующими депозитными номерами: PCM F/00069 (штамм 8 sent 1748), PCM F/00070 (штамм 8 sent 65) и PCM F/00071 (штамм 3 sent 1).
Другой целью настоящего изобретения является штамм бактериофага, подходящий для предупреждения или борьбы с инфекциями, вызванными патогенными штаммами Salmonella sp., выбранный из группы, включающей PCM F/00069 (штамм 8 sent 1748), PCM F/00070 (штамм 8 sent 65) и PCM F/00071 (штамм 3 sent 1).
Препарат согласно настоящему изобретению основан на природных компонентах экосистемы и не имеет неблагоприятного влияния на организмы помимо конкретных патогенных бактерий. В то время как коммерчески доступные заменители антибиотиков имеют в своей основе вещества, которые, как, например, органические кислоты, неспецифически модулируют бактериальную флору, предупреждая до некоторой степени рост нежелательных микроорганизмов, препарат согласно настоящему изобретению гарантирует, что избирательно подавляются только патогенные штаммы Salmonella spp. Неожиданно также оказалось, что препарат согласно настоящему изобретению не удерживается в организме человека или животного, если не присутствует Salmonella spp. В конкретной реализации препарат подходит для применения в животноводстве, в частности для борьбы с инфекцией Salmonella у домашней птицы.
Штаммы бактериофага, раскрытые в данной заявке, идентифицировали способом согласно настоящему изобретению. Неожиданно они показывают широкую специфичность с участием лизиса по меньшей мере четырех конкретных серотипов Salmonella и сохраняют стабильность в условиях хранения в охлажденном состоянии в течение по меньшей мере 3 месяцев. Кроме того, они могут быть успешно размножены в промышленном масштабе без потери активности и они не являются специфическими к пробиотическим бактериям Lactobacillus.
Для того чтобы пояснить настоящее изобретение, его проиллюстрировали прилагаемыми фигурами, которые представляют
фигуру 1: профили рестрикции для выбранных бактериофагов;
фигуру 2: графики контролируемых параметров проведенных экспериментов;
фигуру 3: образец изображения планшетов ELISA непосредственно после добавления реакционной смеси и через три часа инкубации, при этом оптическая плотность OD600 используемой суспензии штамма АТСС 13076 S. enterica серовара Enteritidis в количестве 0,05; 0,1; 0,25; 0,5; 1,0 и 2,0; соответственно, соответствует плотности клеток - 8 х 105, 1,05 х 106, 7,0 х 106, 3,5 х 107, 1,4 х 108 и 3,8 х 108;
фигуру 4: результаты термостабильности выбранных бактериофагов, выполненные в течение трех месяцев в трех различных температурных условиях;
фигуру 5: результаты испытания препарата с бактериофагом на цитотоксичность способом с нейтральным красным; при этом препарат, содержащий стерильную смесь бактериофагов, добавляли в течение 24 ч к культуре мышиных фибробластов 3T3 и оценивали жизнеспособность клеток с применением теста поглощения нейтрального красного;
фигуру 6: обнаружение бацилл Salmonella в проведенном эксперименте;
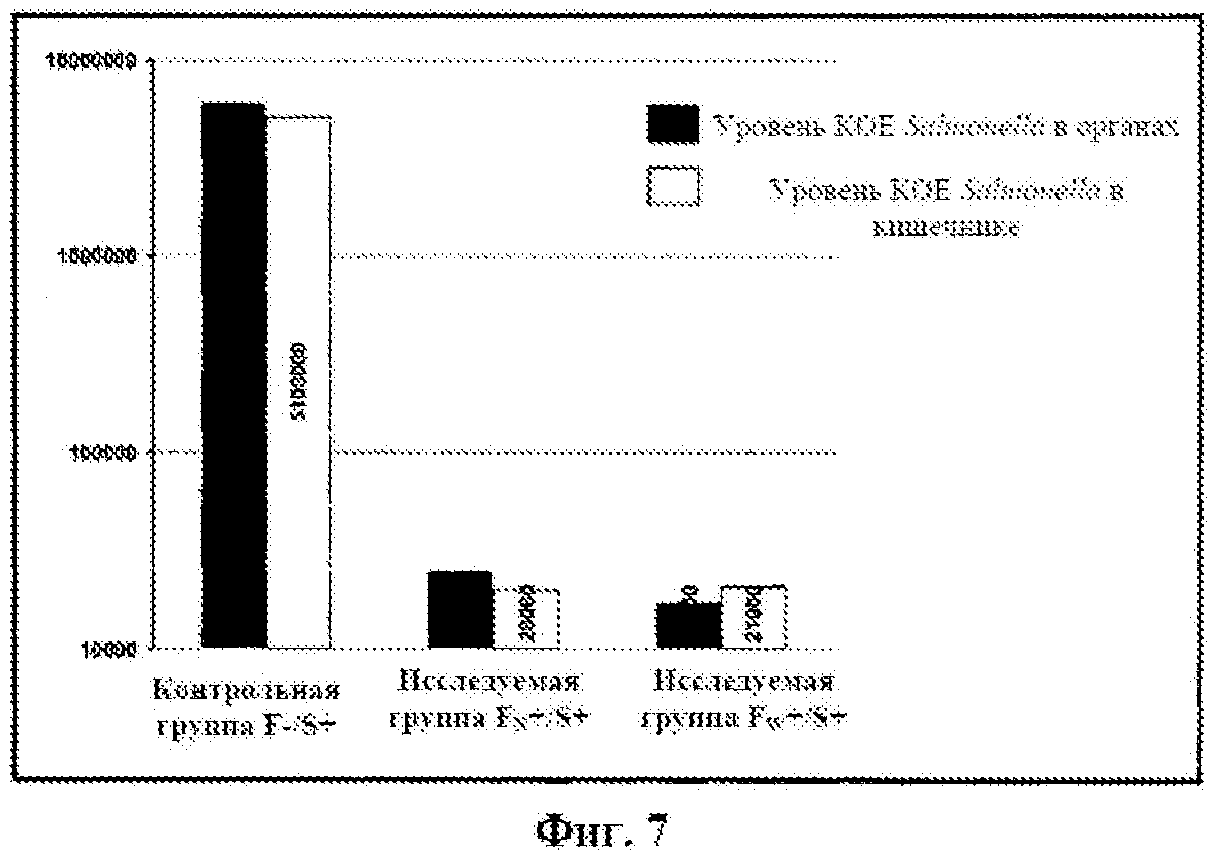
фигуру 7: уровень КОЕ Salmonella во внутренних органах и кишечнике 21-дневных цыплят.
Приведенное в данном документе описание дополнено следующими примерами, которые служат для лучшей иллюстрации сущности настоящего изобретения. Однако эти примеры не следует отождествлять с полным объемом настоящего изобретения.
Пример 1. Выделение и описание бактериофагов
Создание банка штаммов (сероваров) Salmonella, наиболее часто выделяемых у людей и сельскохозяйственных животных
Набор из 108 штаммов Salmonella ssp., включающий наиболее часто выделяемые серовары, собрали для потребностей проекта (таблица 1). Эти штаммы применяли для определения специфичности очищенных бактериофагов. Коллекция включает как эталонные штаммы, доступны в общественных хранилищах, так и изоляты, полученные благодаря сотрудничеству с компанией VETLAB (Брудзев, Польша) и Государственной санитарной инспекцией.

Выделение бактериофагов из образцов окружающей среды, демонстрирующих активность по отношению к выбранным сероварам эталонных штаммов Salmonella ssp.
Бактериофаги выделяли из образцов, предоставленных станциями водоочистки из Лодзи, Польша и Тушина, Польша. Исследования подтверждали, что образцы, собранные на стадии отделения песков (песчаная камера), которая представляет собой один из способов очистки сточных вод, являются богатейшим источником вирусов. Кроме того, бактериофаги также получали из куриных фекалий, предоставленных частным фермером и компанией VETLAB, специализирующейся на анализе бактериального загрязнения ферм. Выделение фагов выполняли с применением эталонных штаммов Salmonella enterica, включая серовары Typhimurium, Enteritidis и Typhi, а также нескольких природных штаммов. На настоящий момент подробно описаны несколько выбранных фагов (таблица 2).

Все фаги, предназначенные для дальнейших исследований, очищали с применением способа отбора для того, чтобы получить одиночные пятна на чашках LB (Луриа-Бертани). Эта процедура требует по меньшей мере пятикратного применения процесса отбора.
Первоначально специфичность вирусов, выделенных с применением чашечного способа, установили путем определения литической способности выделенных бактериофагов по отношению к 17 выбранным штаммам S. enterica, включая 7 различных выбранных сероваров, 9 штаммов сероваров Enteritidis, выделенных из человека и сельскохозяйственных животных, а также штаммы-хозяева анализируемых бактериофагов (таблица 3). Для того чтобы подтвердить результаты, определение специфичности выделенных бактериофагов повторяли три раза.


Полученные фаги, размноженные в штамме-хозяине, концентрировали с помощью PEG8000. Подготовленные таким образом образцы подвергли процессу выделения геномной ДНК исследуемых бактериофагов. В данной процедуре применяли цирконовые сферы диаметром 0,1 мм. Также применяли экстракцию органическими растворителями и коммерческие системы для выделения геномной ДНК. Полученную ДНК использовали в (1) рестрикционном анализе (три независимых эксперимента с использованием фермента EcoRI), образующем разные профили рестрикции для различных бактериофагов, которые представляют собой начальную генную характеристику фагов (фиг. 1).
Более подробную генетическую характеристику получали путем секвенирования геномов бактериофагов из данной коллекции, созданной авторами настоящего изобретения, выполненного с применением методов секвенирования нового поколения по субдоговору с компанией Macrogen. Анализ результатов этого секвенирования выполнен данной исследовательской группой. Установлено, что полученные до настоящего времени последовательности геномной ДНК демонстрируют высокую гомологию по отношению к бактериофагу из хорошо изученного семейства Т5 и представляют собой литические бактериофаги.
Пример 2. Получение препарата
Определение и оптимизация условий процесса размножения бактериофага в культуре Salmonella ssp. в лабораторном масштабе
Оптимизацию выполняли с применением штамма ATCC 13076 Salmonella enterica серовара Enteritidis. Учитываемые параметры были следующими: объем инокулята бактериальной культуры и бактериофагов, время процесса чистого культивирования и инкубации инфицированной культуры, температура культуры, уровень аэрации, рН среды и условия, необходимые для индукции литического цикла.
Оптимальный объем инокулята бактериальной культуры определяли как составляющий 2 x 109 КОЕ на 0,5 л культуральной среды. Оптимизированный процесс культивирования выполняли до достижения уровня оптической плотности OD600=0,5, который достигли через 3 часа инкубации. Температура 37°C оказалась оптимальной для бактериального роста. Оптимального уровня аэрации достигли путем встряхивания при 220 об/мин в шейкере New Brunswick. Оптимальный рост культуры наблюдали на среде LB при pH=7,0. Процесс оптимизации показал, что добавление 10% суспензии с бактериофагом, демонстрирующей титр 109 (50 мл на 500 мл культуры), является наиболее выгодным количеством инокулята. Также анализ показал, что оптимальная исходная пропорция частиц бактериофага и бактериальных клеток составляет 25:1. Кроме того, исследования оптимизации выявили, что выделенные бактериофаги проявляли литическую природу, и, следовательно, индукция литического цикла не требуется.
Процесс извлечения бактериофага из культуры осуществляли ультрацентрифугированием в ультрацентрифуге типа Beckman L-80. Бактериальные культуры, инфицированные бактериофагами после надлежащего процесса инкубации (см. выше), первоначально центрифугировали в течение 30 мин (3700 g). После этого надосадочную жидкость переносили в пробирки для ультрацентрифугирования типа Beckman и ультрацентрифугировали в течение 2 часов (200000 g). Эта процедура позволила провести одновременную очистку и концентрирование препарата с фагом.
Оптимизация культивирования эталонного штамма Salmonella spp в 10-литровом объеме
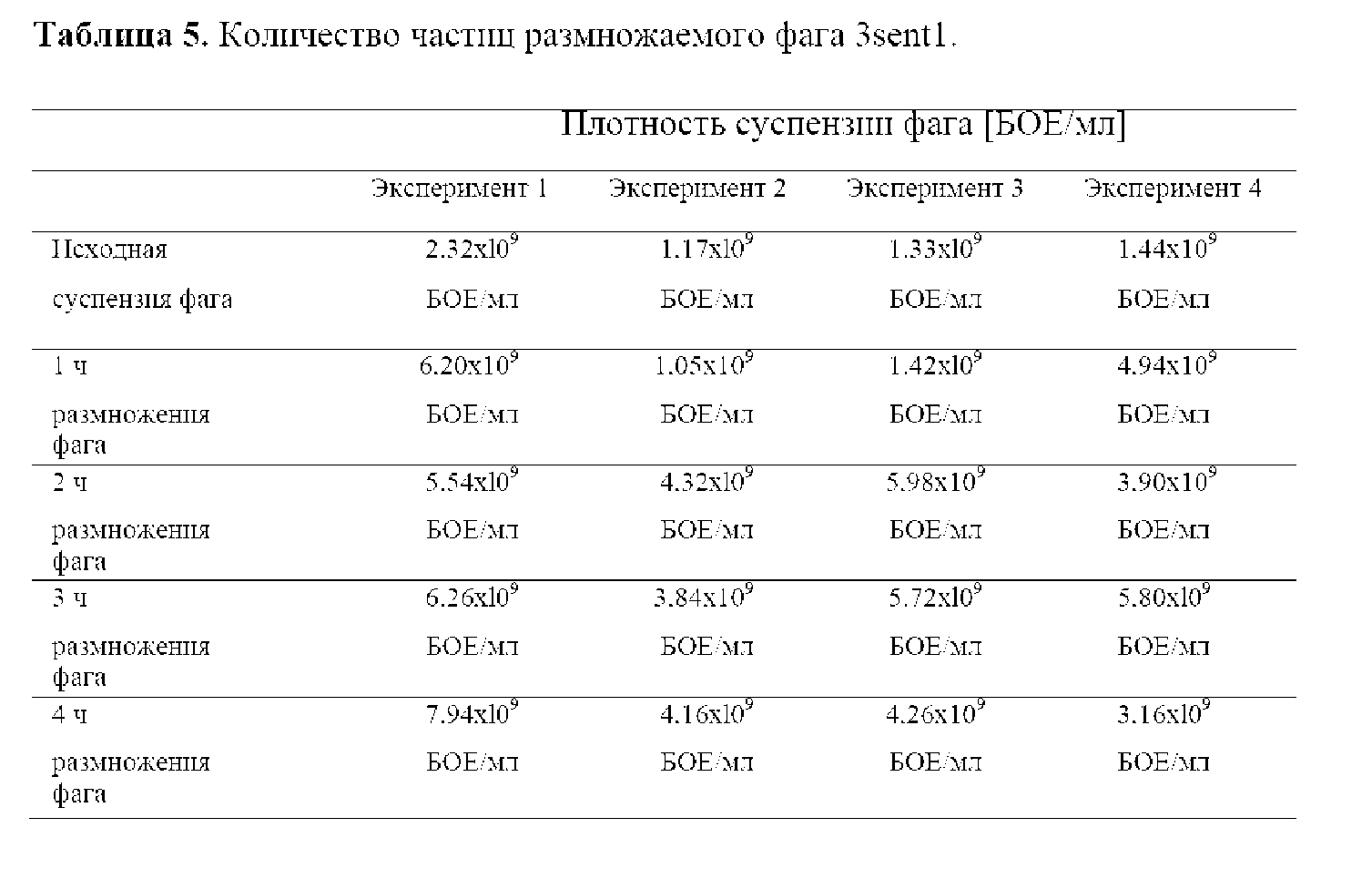
На следующем этапе оптимизации разработали способ размножения бактериофага в 10-литровом биореакторе (8-литров рабочего объема). С этой целью 8 литров среды LB готовили и автоклавировали (в течение 20 мин при 120°С) в биореакторе. Перед инокуляцией 200 мл штамма Salmonella Enteritidis 65 среду аэрировали до 90% - 100% и нагревали до 37°С. Инокулят представлял собой 16-часовую бактериальную культуру, демонстрирующую оптическую плотность приблизительно OD600=5,0 (4,5-5*109 КОЕ/мл). После инокуляции среды брали образец для того, чтобы измерить оптическую плотность (OD600) исходной культуры Salmonella Enteritidis 65. Контролировали ключевые параметры культивирования и конечный титр размножаемых бактериофагов (таблица 4 и 5). Культивирование осуществляли в биореакторе с постоянной аэрацией 1,3 л/мин (объем воздуха, доставляемый в среду в течение 1 минуты) и перемешиванием при 50 об/мин. Через 40 минут процесса интенсивность перемешивания увеличивали с 50 до 100 об/мин. В процессе культивирования брали образцы каждые 30 минут для определения оптической плотности культуры (OD600). Когда достигли значения оптической плотности бактериальной культуры (OD600) 0,48-0,55, суспензию с бактериофагом 3sent1 подходящего титра добавляли в культуру в следующих объемах:
• 800 мл в случае эксперимента 1,
• 700 мл в случае эксперимента 2, а также
• 200 мл в случае эксперимента 3 и 4.
С этого момента времени культивирование осуществляли в течение 4 часов при постоянной аэрации и перемешивании (см. выше). Изменения оптической плотности и кинетики размножения фага контролировали путем отбора образцов каждый час. Во время процесса контролировали параметры культивирования, включая рН, рО2 (уровень аэрации, указанный в %), температуру среды и соответствующий уровень перемешивания. Каждый контролируемый параметр записывали с применением программного обеспечения, предназначенного для документирования хода процесса культивирования (фигура 2), за исключением эксперимента 1 из-за технических проблем, испытанных при инициализации программного обеспечения. В ходе проведенных экспериментов было отмечено прогрессирующее уменьшение уровня растворенного кислорода в среде (увеличение потребления кислорода бактериальными клетками из-за их роста в культуре), а также небольшие колебания рН в диапазоне 7,2-6,7.
Независимо от используемого объема суспензии с фагом (от 200 до 800 мл с титром 1,3-2,3 х 109 БОЕ/мл) был достигнут высокий титр размножаемого бактериофага, около 109 БОЕ/мл.

Через 4 часа процесса размножения бактериофага все содержимое биореактора центрифугировали в течение 30 минут при 4°С со скоростью 4500 об/мин. Поскольку применяемые технические параметры недостаточно эффективны для тщательного отделения биомассы от среды; на следующем этапе надосадочную жидкость, содержащую фаговые частицы, микрофильтровали дважды с применением системы фильтрации в поперечном потоке с мембранными кассетами для отделения оставшейся биомассы и стерилизации полученного препарата с фагом.
ВЫВОДЫ: Проведенные биотехнологические процессы позволяли авторам описать исходные ограничения для способа размножения фаговых частиц с помощью культуры штамма Salmonella spp. в объеме 10-литрового биореактора.
• Объем среды - 8 литров;
• Объем инокулята Salmonella Enteritidis 65 (OD600=5; 4,5-5 x 109 КОЕ/мл) - 200 мл;
• Объем суспензии с фагом (титр 109 БОЕ/мл) - 200 мл;
• Время процесса размножения фаговых частиц - 3 часа;
• Параметры центрифугирования - 30 минут при 4°C со скоростью 4500 об/мин;
• Двукратная микрофильтрация (мембрана с размером пор 0,22 мкм);
• Процедура титрования полученного препарата с фагом.
Разработка технологии получения и очистки препарата
Стадии процесса получения препарата с бактериофагом
1. Культивирование в биореакторе
Процесс размножения частиц бактериофага является первой стадией производственной линии. Он реализуется путем инокуляции бактериальной культуры Salmonella в биореакторе (условия описаны выше) суспензией частиц бактериофага. В процессе культивирования фаговые частицы размножали в бактериальных клетках, что приводит к клеточному лизису. Каждый из трех бактериофагов должен размножаться в отдельной культуре. До настоящего времени в данном исследовании использовали классический 10-литровый биореактор (8 литров рабочего объема). Для того, чтобы осуществить этот тип культивирования, используют ранее подготовленные компоненты, включая (1) бактериальный инокулят и (2) суспензию с бактериофагом, которую добавляли после достижения подходящей оптической плотности (OD600) бактериальной культуры. После добавления суспензии с фагом осуществляли культивирование от 3 до 4 часов, и процесс дает возможность получать высокий титр размножаемого бактериофага на уровне около 109 БОЕ/мл. После того, как процедура размножения закончена, культуру переносят в стерильных условиях на следующую стадию производственного процесса с помощью перистальтического насоса. В будущем планируется применять на производственной линии 100-литровые биореакторы или одноразовые усовершенствованные биореакторы-мешки (до 15 литров), которые в последнее время успешно заменяют классические биореакторы.
2. Удаление биомассы
Поскольку полный лизис бактериальной культуры во время инкубационного процесса в биореакторе невозможен, требуется последующая стадия отделения биомассы от фаг-содержащей культуральной жидкости. Таким образом, на первой стадии культуру переносят в центрифугу, и затем дважды выполняли процесс микрофильтрации с использованием системы фильтрации в поперечном потоке, содержащей мембрану с размером пор 0,22 мкм. Эта процедура позволяет получать стерильную суспензию с бактериофагом с очень небольшим снижением титра фаговых частиц. После того, как процесс фильтрации закончен, суспензию переносят в стерильных условиях на следующую стадию производственного процесса с помощью перистальтического насоса. В будущем планируется расширение этой стадии производственной линии за счет приобретения дополнительных систем фильтрации. Это позволит обработать биологический материал, полученный из культуры отдельного биореактора, без необходимости очистки и стерилизации фильтрационного оборудования, используемого на этой стадии.
3. Концентрирование продукта (факультативно)
В зависимости от спроса на продукт суспензия с бактериофагом может быть концентрирована в 10 раз, что позволяет увеличить количество фаговых частиц в заданном объеме. Таким образом, используют систему фильтрации в поперечном потоке с мембраной ультрафильтрации с размером пор на 30 или 50 кДа (в зависимости от фага). Этот процесс позволяет 7,5-кратное концентрирование частиц бактериофага.
4. Удаление потенциального загрязнения эндотоксином
Для того чтобы устранить эндотоксин, оставшийся после лизиса бактериальных клеток, вызванного бактериофагами во время биотехнологического процесса, планируется применение специальных адсорбционных колонок. Эти колонки будут содержать смолу, подходящую для удаления эндотоксина, с размером и емкостью в зависимости от объема фаг-содержащего препарата.
5. Получение продукта в жидкой фазе
На этой стадии получали смесь различных суспензий с бактериофагом, полученных в процедурах, описанных выше. Смесь должна содержать все бактериофаги с очень сходным значением титра. Бактериофаги, выбранные для препарата, демонстрируют способность к лизису широкого спектра бактериальных штаммов Salmonella spp. из имеющейся коллекции. Затем препарат разделяли на порции в строго стерильных условиях. Кроме того, во время этого процесса конечную суспензию снова подвергали стерилизации с помощью одноразовых микрофильтров (0,22 мкм).
6. Микрокапсулирование (факультативно)
В зависимости от того, требуется ли продукт в жидкой или твердой форме, планируют осуществление технологии микрокапсулирования для того, чтобы заключить частицы бактериофага в альгинатные капсулы. Цель этой стадии заключается в создании легко рассасывающихся капсул, которые безопасно проходят через пищеварительную систему и постепенно высвобождают заключенные частицы бактериофага в целевом месте без раздражения всего организма.
Пример 3. Исследование эффективности и безопасности препарата
Исследование in vitro
Разработка и оптимизация высокоэффективного и автоматизированного колориметрического способа измерения активности препарата с бактериофагом
Имеющийся в продаже реагент alamarBlue® использовали для разработки анализа, пригодного для измерения литической активности бактериофага. AlamarBlue® представляет собой индикаторный краситель, который позволяет быструю и точную количественную оценку пролиферации и цитотоксичности на основе цветной реакции. Удобный в работе реагент выгодно использует феномен реакции окисления-восстановления (REDOX), и во время данного процесса резазурин меняет свой цвет с синего (нефлуоресцентного) на красный (флуоресцентный) в результате окисления, которое является следствием клеточной метаболической активности. Изменение цвета видно невооруженным глазом. Оно также может быть измерено спектрофотометрически или флуорометрически. Из-за отсутствия у него клеточной токсичности, аlamarBlue® особенно ценен при наблюдении дифференцировки бактериальных клеток в микробных культурах. Этот тест скорректировали для применения на 96-луночном планшете для ELISA и разработали две методики измерения. Первая из них предназначена для оценки литической активности бактериофагов. Во время теста использовали так называемую свежую рабочую смесь (приготовленную непосредственно перед нанесением на планшет для ELISA), которая включала alamarBlue® и 20% стерильный раствор Tween™80 (3 части аlamarBlue® и 1 часть 20% стерильного раствора Tween™80), и добавляли в лунки, содержащие суспензию с исследуемым штаммом Salmonella соответствующей плотности, а также в лунки, заполненные одновременно клеточной суспензией Salmonella соответствующей плотности и суспензией исследуемого бактериофага требуемого титра. Процедура дает возможность визуального определения литической активности фаговых частиц по отношению к исследуемым штаммам Salmonella. Синий цвет реакционной смеси аlamarBlue®+20% стерильный раствор Tween™80 (3 части аlamarBlue® и 1 часть 20% стерильного раствора Tween™80) указывает на отсутствие роста исследуемого штамма Salmonella и высокий литический эффект соответствующей концентрации бактериофага. Изменение цвета реакционной смеси аlamarBlue®+20% стерильный раствор Tween™80 (3 части аlamarBlue® и 1 часть 20% стерильного раствора Tween™80) с синего на красный, вызванное окислением, связанным с метаболической активностью, указывает на рост клеток Salmonella и отсутствие или низкий литический эффект соответствующей концентрации бактериофага по отношению к исследуемому штамму Salmonella.
Подробный экспериментальный протокол, дающий возможность количественной оценки литической активности бактериофагов, а также графический материал, представляющий результаты выбранного эксперимента, проведенного для бактериофага 3sent1 в отношении штамма АТСС 13076 Salmonella enterica серовара Enteritidis (фигура 3), представлены ниже.
1. Добавляли 100 мкл суспензии культуры Salmonella spp. соответствующей оптической плотности (OD600), связанной с соответствующим количеством колониеобразующих единиц (КОЕ/1 мл)1, в каждую лунку первого ряда в колонки с 1 по 12. Более подробно, суспензия оптической плотности 0,05; 0,1; 0,25; 0,5; 1,0 и 2,0 в лунки 1 и 7, 2 и 8, 3 и 9, 4 и 10, 5 и 11, а также 6 и 12 планшета соответственно.
2. Добавляли 100 мкл суспензии с фагом в концентрации 6,5 х 109 БОЕ (бляшкообразующих единиц) в каждую лунку первого ряда в колонки с 1 по 6. Объемное соотношение бактериальной суспензии к суспензии с фагом составляет 1:1.
3. Аналогичным образом добавляли 75 мкл суспензии культуры Salmonella spp. соответствующей оптической плотности и 125 мкл суспензии с фагом в лунки второго ряда. Объемное соотношение бактериальной суспензии к суспензии с фагом составляет 1:1,5.
4. Аналогичным образом добавляли 50 мкл суспензии культуры Salmonella spp. соответствующей оптической плотности и 150 мкл суспензии с фагом в лунки третьего ряда. Объемное соотношение бактериальной суспензии к суспензии с фагом составляет 1:3.
5. Готовили контроли; добавляли стерильную среду LB вместо суспензии с фагом в каждую лунку первого, второго и третьего рядов в колонки с 7 по 12 (контроль роста штамма Salmonella заданной плотности). Кроме того, добавляли суспензию с фагом в каждую лунку 6-го, 7-го и 8-го рядов в колонку 3 (контроль загрязнения суспензии с фагом) и добавляли среду LB в каждую лунку 7-го и 8-го рядов в колонку 7 (контроль загрязнения среды, применяемой для разбавления культуры в исследуемом и контрольном наборах).
6. Накрывали планшет для ELISA стерильными крышками и инкубировали в течение 4 ч при 37°С. После стадии инкубации добавляли 50 мкл реакционной смеси2 аlamarBlue®+20% стерильный Tween™80 в каждую лунку планшета. В связи с чувствительностью реакционной смеси к свету защищали планшет алюминиевой фольгой. Продолжали инкубацию в течение следующих 3 ч при 37°С. Выполняли визуальное наблюдение каждые 30 минут.
1 Соотношение между оптической плотностью OD600 и значением КОЕ должны быть определены экспериментально в нескольких независимых подходах.
2 Смесь должна быть получена непосредственно перед внесением в лунки на планшете для ELISA (3 части аlamarBlue® и 1 часть 20% стерильного раствора Tween™80).
Модифицированный протокол можно применить в качестве полезного инструмента для оценки защитного эффекта бактериофагов против роста Salmonella Enteritidis. Изменение цвета реакционной смеси аlamarBlue® с синего на красный, которое вызвано окислением, связанным с метаболической активностью, указывает на рост клеток Salmonella. Синий цвет реакционной смеси аlamarBlue®+20% стерильный раствор Tween 80 указывает на защитный эффект суспензии с фагом, предотвращающий рост клеток Salmonella. Подробный протокол:
1. Добавляли 20 мл среды LB в коническую плоскодонную колбу Эрленмейера на 100 мл и автоклавировали.
2. Инокулировали 20 мл стерильной жидкой среды LB со штаммом S. Enteritidis и инкубировали культуру в течение ночи при 37°С со встряхиванием (об/мин=150). Суспензия должна храниться в холодильнике при 4°С не дольше 1 недели и рассматриваться в качестве инокулята для текущих культур.
3. Инокулировали 20 мл стерильной жидкой среды LB (в колбы Эрленмейера на 100 мл) с 20 мкл штамма S. Enteritidis и инкубировали культуру в течение 1 ч при 37°С со встряхиванием (об/мин=150).
4. Делали соответствующие разведения суспензии в LB. Разведения должны содержать 2000, 200 и 20 бактериальных клеток в 1 мл. Применяли для экспериментов с суспензией с фагом, демонстрирующей защитный эффект.
5. Смешивали 100 мкл соответствующего разведения бактериальных клеток S. Enteritidis со 100 мкл суспензии бактериофага и добавляли смеси в последовательные лунки 96-луночного титровального планшета.
6. Готовили контроли, соответствующие разведения суспензии с S. Enteritidis, которые будут служить в качестве контроля бактериального роста, а также суспензию с бактериофагом и чистую среду LB в качестве контролей микробного загрязнения.
7. Накрывали титровальный планшет крышкой и инкубировали в течение 4 ч при 37°С.
8. Накрывали титровальный планшет крышкой и защищали алюминиевой фольгой от доступа света, затем продолжали инкубацию в течение следующих 4 ч при 37°С. Выполняли считывание через 4 ч инкубационного процесса.
Исследование термостабильности бактериофагов
Анализ термостабильности хранения бактериофагов выполняли в течение 3 месяцев при трех различных температурах: -20°С,+4°С и при комнатной температуре. Стабильность измеряли путем определения титра фага с помощью чашечного подсчета в начале эксперимента, через месяц и через три месяца хранения при указанных выше температурах. Бактериофаги суспендировали в среде LB после размножения и очистки от бактериальных клеток. Результаты показывали, что некоторые из бактериофагов существующей коллекции, а именно 3sent1, 8sent65 и 8sent1748 (фиг. 4), сохраняли свой титр в порядке величин в течение трех месяцев хранения при температуре -20°С или 4°С, в отличие от других фагов, например lst1 или 2styp5 (фиг. 4), что является важным с точки зрения стойкости.
Исследование безопасности препарата с бактериофагом
Определение уровня эндотоксина
Определение концентрации эндотоксина (LPS), основного компонента клеточной стенки грамотрицательных бактерий, выполняли с использованием LAL-теста (лизат амебоцитов Limulus). LAL-тесты доступны в виде готовых к применению наборов для колориметрического измерения уровня и активности LPS:
1. Набор производства Genscript (ToxinSensor LAL Endotoxin Assay Kit).
2. Набор производства LONZA (QCL-1000 Endpoint chromogenic LAL Assay).
В этих тестах LAL-реагент взаимодействует с эндотоксином в анализируемых образцах, приводя к получению продукта реакции, который способен реагировать с хромогенным субстратом, таким образом возможно спектрофотометрическое измерение. Интенсивность окрашивания прямо пропорциональна концентрации эндотоксина.
Фаг-содержащие образцы брали на различных стадиях технологического процесса (оценка эффективности ультрацентрифугирования - образцы А1-А2, и концентрации фаговых частиц с использованием мембран с различным размером пор 100 кДа - образцы B1-B5 и 50 кДа - образцы С1-С7) и анализировали на уровень эндотоксина. Полученные результаты указывали на присутствие большого количества LPS в образцах, взятых после стадии концентрирования фаговых частиц (таблица 6).

Анализ цитотоксичности
Исследование выполняли с помощью анализа поглощения нейтрального красного. Тест проводили в 96-луночных планшетах с использованием клеточной линии 3Т3. Клетки 3T3 представляют собой полученные от мыши нетрансформированные фибробласты, обычно используемые для анализа токсичности in vitro. Анализ выполняли на препарате, содержащем смесь трех различных фагов в 4-серийных разведениях. Измерения проводили в двух экземплярах и в 5 независимых повторах. Полученные значения оптической плотности использовали для расчета % жизнеспособности клеток путем сравнения оптической плотности анализируемого образца с оптической плотностью контрольного образца (т.е. клеток, инкубированных в культуральной среде) (фигура 5).
Тест цитотоксичности с использованием клеточной линии 3T3:
1. Помещали 10000 фибробластов 3T3, суспендированных в стандартной культуральной среде, в каждую лунку 96-луночного планшета и инкубировали в течение 24 часов в инкубаторе (37°С, 5% CО2).
2. Удаляли культуральную среду и добавляли препарат с бактериофагом, разведенный в культуральной среде. Продолжали инкубацию в течение следующих 24 часов (37°С; 5% CО2).
3. После инкубации удаляли среду, содержащую препарат с фагом, промывали монослой фибробластов в PBS и инкубировали с раствором нейтрального красного в PBS в течение 3 часов (37°С, 5% CО2).
4. Удаляли раствор нейтрального красного, промывали PBS и индуцировали лизис клеток. Измеряли количество поглощенного красителя колориметрическим способом.
Полученные результаты указывали на отсутствие цитотоксической активности препарата с бактериофагом даже в высоких концентрациях. Следовательно, не ожидается появление острой цитотоксичности после использования данного препарата in vivo в концентрации фага по меньшей мере до 108 частиц.
Исследование іn vivo
Определение эффективности и безопасности прототипного препарата с бактериофагом, примененного против сальмонеллеза у куриных бройлеров.
Исследование выполняли в сотрудничестве с Варминско-Мазурским университетом, а также VETLAB.
Цель: оценить возможность использования бактериофагов в защите против сальмонеллезных инфекций у цыплят-бройлеров.
Штамм 65/S/10 Salmonella enterica серовара Enteritidis, предоставленный VETLAB, использовали для инфицирования бройлеров, тогда как для подготовки средства с бактериофагом использовали три бактериофага: 3sent1, 8sent65 и 8sent1748, выделенных из двух штаммов Salmonella enterica (таблица 3) и демонстрирующих широкий спектр специфичности против различных сероваров Salmonella, а также против исследуемых штаммов Enteritidis. Исходя из специфичности использованных бактериофагов можно предположить специфичность полного препарата (таблица 7). Препарат с бактериофагом получали следующим образом, каждый из трех бактериофагов подвергали оптимизированной процедуре размножения, а затем полученные суспензии с фагом смешивали таким образом, что значения их титров в конечном продукте были сходными. Готовили две смеси с различными концентрациями фагов, высокая концентрация с содержанием 2,0 х 108 БОЕ/мл и низкая концентрация с содержанием 2,0 х 106 БОЕ/мл. После этого смеси разделяли на порции и стерилизовали с использованием микрофильтрации. Анализ микробного загрязнения не показал присутствия бактерий в используемом препарате с бактериофагом.



Процедура эксперимента
Сто пятьдесят петухов Ross 308, случайным образом разделенных на 5 равных изолированных групп (отдельные комнаты - загоны), использовали для исследования. Цыплят кормили стандартным сбалансированным комбикормом, произведенным Agrocentrum Кольно, Польша, и содержащимся в условиях, соответствующих рекомендации производителя биологического материала. Четырехдневных цыплят из загонов 1, 2 и 3 инфицировали бациллами Salmonella Enteritidis в дозе 1x105 КОЕ на животное (таблица 8). Цыплят из загонов 4 и 5 не инфицировали бациллами Salmonella. Препарат с бактериофагом вводили цыплятам, помещенным в загоны 1 (низкая концентрация 2,0 х 106 БОЕ/мл, отмечен как FN), 2 и 5 (высокая концентрация 2,0 х 108 БОЕ/мл, отмечен как FW). Препарат вводили петухам раз в день в течение первых 14 дней их жизни. Средство с бактериофагом не вводили цыплятам из загонов 4 и 5. Время выращивания составило 21 день, и в течение этого периода умерли только пять птиц из разных загонов (таблица 8). Поскольку обнаруженная смертность была минимальной и не зависела от заданной группы цыплят, то смертность не могла быть результатом введения препарата с фагом.

Обнаружение бацилл Salmonella
Образцы для обнаружения бацилл Salmonella собирали согласно схеме, описанной ниже (фигура 6):
• исследование фекалий в течение 21 дня эксперимента,
• исследование подстилки - собирали мазки с подошв на 3й, 15й и 21й день жизни птиц,
• исследование печени, селезенки и кишечника 21-дневных бройлеров,
• исследование пустых загонов до размещения птенцов - мазки собирали со стен, кормушек, поилок и пола (контроль),
• исследование однодневных птенцов - внутренних органов, кишечника и мекония (контроль).
Обнаружение присутствия бацилл Salmonella в анализируемых образцах выполняли в аккредитованной лаборатории - VETLAB (Брудзев, Польша). В 2008 году эта лаборатория получила разрешение руководителя Ветеринарной службы (№GIWhig-5120-23/08) на проведение обнаружения бацилл Salmonella с помощью бактериологического качественного способа.
Бациллы Salmonella не обнаруживали в анализируемых образцах внутренних органов и кишечника однодневных птенцов, мекония, а также мазков из загонов до размещения птенцов. Отсутствие бацилл Salmonella или различный уровень их обнаружения в случае анализа фекалий за 21 день эксперимента, а также анализа мазков с подошв на 3й, 15й и 21й день жизни (таблица 9) и анализа внутренних органов 21-дневных бройлеров (фигура 7) зависел от исследуемого загона. Таким образом, как и ожидалось, бациллы Salmonella не обнаруживали у цыплят из загонов 4 и 5. В случае птиц из загона 3, которых инфицировали бациллами Salmonella и не обрабатывали препаратом с бактериофагом, бациллы обнаруживали, начиная с шестого дня жизни. В то же время в случае цыплят из загонов 1 и 2, которых инфицировали бациллами Salmonella и лечили средством с фагом, ингибирование размножения бактерий было отчетливо видно до тех пор, пока введение препарата с фагом не было прекращено. Что важно, количество бацилл, обнаруженных во внутренних органах и кишечнике 21-дневных птиц, было очень низким относительно цыплят, которых не лечили препаратом с фагом. Таким образом, бактериофаги предотвращали размножение бактерий и, следовательно, появление бактерий в фекалиях птиц, инфицированных в ходе эксперимента. Соответственно, можно отметить, что бактериофаги уменьшали в 200 раз уровень инфекции даже через неделю после прекращения обработки фагом.

"-" означает, что бациллы Salmonella не обнаружены
"+" означает, что бациллы Salmonella обнаружены, но было трудно определить их титр
Обнаружение наличия бактериофагов
Образцы, анализируемые на присутствие бактериофага, собирали из фекалий в течение 21 дня эксперимента и из мазков из всех загонов до размещения птенцов, до инфицирования, а также через день и через неделю после прекращения обработки фагом. Бактериофаги во внутренних органах не обнаруживали. Отмечено, что отсутствие бактериофагов или различный уровень их обнаружения в фекалиях птиц (таблица 10) и при анализе мазков с подошв (таблица 11) зависит от заданного загона анализируемых цыплят. То есть, бактериофаги обнаруживали в фекалиях цыплят из загонов 1, 2 и 5, которым вводили средство с фагом. Однако их количество уменьшилось после прекращения обработки, и особенно в случае с птицами из загонов 2 и 5, где применяли высокую концентрацию фага, бактериофаги больше не обнаруживали. Следует добавить, что значительно меньшее количество бактериофагов обнаруживали в фекалиях из загона 5 в сравнении с фекалиями из загона 2, что может быть результатом невозможности размножения фага в связи с отсутствием бацилл Salmonella.


Выводы на основании исследования эффекта препарата с бактериофагом на бройлеров
На основании проведенных тестов можно заключить, что препарат является безопасным и эффективным.
1. Данный препарат является безопасным для домашней птицы.
2. Бактериофаги проходят через желудочно-кишечный тракт и проникают в фекалии и подстилку.
3. Бактериофаги не попадают во внутренние органы птиц.
4. Бактериофаги исчезают после прекращения введения данного препарата.
5. Бактериофаги предупреждают появление бактерий в фекалиях экспериментально инфицированных птиц.
6. Бактериофаги снижают в 200 раз уровень инфекции через неделю после прекращения лечения фагом.
Реферат
Группа изобретений относится к способу определения штамма бактериофага, вариантам штамма бактериофага и их применению. Способ предусматривает получение коллекции штаммов бактериофагов, культивирование штамма Salmonella spp на стерильной культуральной среде, нанесение образцов культур на планшет, добавление суспензии испытываемого штамма бактериофага в концентрации 6,5 х 10БОЕ при соотношении бактериальной суспензии к суспензии с фагом 1:1, 1:1,5 или 1:3 и инкубирование при 37°C в течение 4 ч. К образцам культуры добавляют резазурин и инкубируют в темноте при 37°C в течение 3 ч. Контролируют цвет или флуоресценцию культуры. Штамм бактериофага, содержащийся в культуре, сохраняющей синий цвет или не демонстрирующей существенного увеличения флуоресценции по сравнению с контролем, идентифицируют как штамм бактериофага, специфический к выбранному патогену. Предложены также штамм бактериофага РСМ F/00069, штамм бактериофага PCM F/00070 и штамм бактериофага PCM F/00071 и их применение для получения препарата. Группа изобретений обеспечивает эффективный скрининг бактериофагов, а также уменьшение уровня инфекции в 200 раз через неделю после прекращения обработки препаратом на основе бактериофага. 5 н. и 3 з.п. ф-лы, 7 ил., 11 табл., 3 пр.
Формула
a) получают коллекцию штаммов бактериофагов, выбранных из группы, состоящей из PCM F/00069 (штамм 8 sent 1748), PCM F/00070 (штамм 8 sent 65) и PCM F/00071 (штамм 3 sent 1),
b) осуществляют культивирование патогенного штамма Salmonella spp. на стерильной культуральной среде,
c) образцы культуры наносят на многолуночный измерительный планшет, затем добавляют суспензию испытываемого штамма бактериофага в концентрации 6,5 х 109 БОЕ и при объемном соотношении бактериальной суспензии к суспензии с фагом 1:1, 1:1,5 или 1:3 и инкубируют при 37°C в течение по меньшей мере 4 часов,
d) к образцам культуры добавляют резазурин и продолжают инкубацию в темноте при около 37°C в течение 3 часов,
e) контролируют цвет или флуоресценцию культуры, а также штамм бактериофага, содержащийся в культуре, которая сохраняет синий цвет или не демонстрирует существенного увеличения флуоресценции по сравнению с контрольным образцом, идентифицируют как штамм бактериофага, специфический к выбранному штамму бактерий;
f) размножают идентифицированный штамм бактериофага, специфический к выбранному штамму бактерий.

Комментарии