Бактерия для применения в качестве пробиотика, употребляемого с пищей и в медицине - RU2645466C2
Код документа: RU2645466C2
Чертежи











Описание
Настоящее изобретение относится к бактериальному виду Roseburia hominis и его различным, связанным с питанием и терапевтическим применениям.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Кишечник человека, который хотя первоначально в утробе матери является стерильным, подвергается воздействию широкого ряда материнских микробов и микробов окружающей среды сразу же после рождения. Последующие события колонизаций и сукцессий в пищеварительном тракте остаются динамическими на протяжении первых лет жизни, после чего микробиота становится созревшей и относительно стабильной (1). Микробиота пищеварительного тракта человека содержит более 500 различных филотипов, по существу относящихся к двум основным типам бактерий: Bacteroidetes и Firmicutes (2). Успешные симбиотические отношения, являющиеся результатом бактериальной колонизации пищеварительного тракта человека, привели к широкому ряду метаболических, структурных, защитных и других полезных функций. Увеличенные метаболические активности колонизированного пищеварительного тракта обеспечивают то, что компоненты пищи, неперевариваемые в других обстоятельствах, расщепляются с высвобождением побочных продуктов, обеспечивающих важный источник питательных веществ для хозяина. Также иммунологическая значимость микробиоты пищеварительного тракта широко известна и проиллюстрирована на безмикробных животных, имеющих ослабленную иммунную систему, которая становится функционально восстановленной после введения бактерий-комменсалов (3-5).
В резком отличии от продукции секреторных кишечных IgA, на которую оказывает непосредственное влияние микробная колонизация (6, 7), для развития и дифференциации T-клеток, как представляется, требуется колонизация специфических микроорганизмов-комменсалов. Виды Clostridium, в особенности спорообразующие сегментные нитчатые бактерии (SFB), по-видимому, являются основным стимулятором созревания кишечных Th1, Th17 и регуляторных T-клеток (8, 9). Однако недавние исследования показали теперь, что другие бактерии пищеварительного тракта, включая бактерии измененной флоры Шедлера, могут индуцировать de novo образование регуляторных T-клеток, в то время как моноколонизация Bacteroides fragilis может корректировать Th1/Th2 дисбаланс у безмикробных мышей посредством активации развития регуляторных Т-клеток (5, 10).
Настоящее изобретение пытается установить другие бактерии-резиденты пищеварительного тракта, которые могут модулировать метаболическую активность в пищеварительном тракте и/или играть роль в процессах иммунорегуляции.
ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение сосредоточено на активности вида бактерий Roseburia hominis, члене типа Firmicutes. Проведенные заявителем исследования показали, что этот бактериальный вид играет важную роль в иммунорегуляции и метаболической активности в пищеварительном тракте, а также оказывает воздействие на гены, имеющие отношение к аппетиту и чувству сытости. Роли генов бактерий, участвующих в колонизации пищеварительного тракта мыши и адаптации к нему, а также гены хозяев, ответственные за колонизацию этой бактерией, описываются подробнее ниже.
Аспекты настоящего изобретения, вместе с предпочтительными вариантами осуществления, изложены в сопроводительной формуле изобретения.
Первый аспект настоящего изобретения относится к бактериальному виду Roseburia hominis для применения для регуляции иммунной системы субъекта.
Другой аспект настоящего изобретения относится к бактериальному виду Roseburia hominis для применения для лечения нарушения, выбираемого из воспалительного расстройства, иммунного нарушения и кишечного расстройства.
Другой аспект настоящего изобретения относится к бактериальному виду Roseburia hominis для применения для способствования здоровому состоянию пищеварительного тракта с помощью восстановления иммунного гомеостаза.
Другой аспект настоящего изобретения относится к бактериальному виду Roseburia hominis для применения для улучшения микробиоты кишечника у субъекта.
Другой аспект настоящего изобретения относится к бактериальному виду Roseburia hominis для применения для регуляции врожденной иммунной системы субъекта.
Другой аспект настоящего изобретения относится к бактериальному виду Roseburia hominis для применения для регуляции адаптивной иммунной системы субъекта.
Другой аспект настоящего изобретения относится к бактериальному виду Roseburia hominis для применения для стимуляции регуляторных T-клеток и иммунологической толерантности у субъекта.
Другой аспект настоящего изобретения относится к бактериальному виду Roseburia hominis для применения для регуляции аппетита у субъекта.
Другой аспект настоящего изобретения относится к применению бактериального вида Roseburia hominis для приготовления лекарственного средства для регуляции иммунной системы субъекта.
Другой аспект настоящего изобретения относится к применению бактериального вида Roseburia hominis для приготовления пищевой добавки или лекарственного средства для лечения нарушения, выбираемого из воспалительного расстройства, иммунного нарушения и кишечного расстройства, у субъекта.
Другой аспект настоящего изобретения относится к применению бактериального вида Roseburia hominis для приготовления пищевой добавки или лекарственного средства для улучшения микробиоты кишечника у субъекта.
Другой аспект настоящего изобретения относится к применению бактериального вида Roseburia hominis для приготовления пищевой добавки или лекарственного средства для регуляции врожденной иммунной системы субъекта.
Другой аспект настоящего изобретения относится к применению бактериального вида Roseburia hominis для приготовления пищевой добавки или лекарственного средства для регуляции адаптивной иммунной системы субъекта.
Другой аспект настоящего изобретения относится к применению бактериального вида Roseburia hominis для приготовления пищевой добавки или лекарственного средства для регуляции аппетита у субъекта.
Другой аспект настоящего изобретения относится к способу лечения нарушения, выбираемого из воспалительного расстройства, иммунного нарушения и кишечного расстройства, у субъекта, включающему введение субъекту алиментарно или фармацевтически эффективного количества бактериального вида Roseburia hominis.
Другой аспект настоящего изобретения относится к способу улучшения микробиоты кишечника у субъекта, включающему введение субъекту композиции, включающей бактериальный вид Roseburia hominis.
Другой аспект настоящего изобретения относится к способу регуляции врожденной иммунной системы субъекта, включающему введение субъекту композиции, включающей бактериальный вид Roseburia hominis.
Другой аспект настоящего изобретения относится к способу регуляции адаптивной иммунной системы субъекта, включающему введение субъекту композиции, включающей бактериальный вид Roseburia hominis.
Другой аспект настоящего изобретения относится к способу регуляции аппетита у субъекта, включающему введение субъекту композиции, включающей бактериальный вид Roseburia hominis.
Другой аспект настоящего изобретения относится к бактериальному виду Roseburia hominis для применения в медицине.
Другой аспект настоящего изобретения относится к фармацевтической композиции, включающей бактериальный вид Roseburia hominis и фармацевтически приемлемый наполнитель, носитель или разбавитель.
Другой аспект настоящего изобретения относится к пищевой добавке, включающей бактериальный вид Roseburia hominis и алиментарно приемлемый наполнитель, носитель или разбавитель.
Другой аспект настоящего изобретения относится к пробиотической композиции, включающей бактериальный вид Roseburia hominis.
Другой аспект настоящего изобретения относится к кормовому материалу, продукту питания, пищевой добавке, добавке к рациону или добавке к пищевому продукту, включающему(ей) бактериальный вид Roseburia hominis.
Другой аспект настоящего изобретения относится к способу производства фармацевтической композиции в соответствии с настоящим изобретением, включающему смешивание бактериального вида Roseburia hominis с фармацевтически приемлемым наполнителем, носителем или разбавителем.
Другой аспект настоящего изобретения относится к способу производства пищевой добавки в соответствии с настоящим изобретением, включающему смешивание бактериального вида Roseburia hominis с алиментарно приемлемым наполнителем, носителем или разбавителем.
Другой аспект настоящего изобретения относится к бактериальному виду Roseburia hominis для применения для сохранения иммунного гомеостаза у субъекта.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Как отмечено выше, один аспект настоящего изобретения относится к Roseburia hominis для применения для одного или более из:
• лечения иммунного нарушения;
• лечения кишечного расстройства;
• улучшения микробиоты кишечника;
• регуляции врожденной иммунной системы субъекта;
• регуляции адаптивной иммунной системы субъекта;
• стимуляции регуляторных T-клеток и иммунологической толерантности;
• регуляции аппетита у субъекта;
• способствования здоровому состоянию пищеварительного тракта у субъекта; и/или
• сохранения иммунного гомеостаза у субъекта.
Roseburia hominis
Roseburia hominis, недавно описанный анаэроб-комменсал пищеварительного тракта филогенетического кластера XIVa внутри типа Firmicutes, относится к основной группе бактерий в пищеварительном тракте человека, а также является основным продуцентом бутирата (11). Заявитель настоящего изобретения установил полную геномную последовательность и дал комментарий к этой бактерии. В ходе дальнейших исследований изучали транскриптомные ответные реакции и бактерии, и хозяина на безмикробных мышах, моноколонизированных R. hominis. Здесь описываются роли генов бактерий, участвующих в колонизации пищеварительного тракта мыши и адаптации к нему, а также гены хозяев, ответственные за колонизацию этой бактерии.
Проведенные заявителем эксперименты показали, что активность Roseburia hominis является в высокой степени специфической. Исследования показали, что важные части геномов видов Roseburia очень отличаются, что означает отличную функциональность. В самом деле, эксперименты показали, что бактерии из кластера XIVa Clostridium, в том числе виды бактерий Roseburia intestinalis, Roseburia hominis и Eubacterium rectaie (все из которых являются продуцентами бутирата), как ни удивительно, вызывают очень различные и отличные эффекты на клетки пищеварительного тракта.
В одном предпочтительном варианте осуществления бактериальным видом является штамм, депонированный по условиям Будапештского соглашения в Национальные коллекции промышленных, пищевых и морских бактерий (NCIMB) в NCIMB Ltd, Ferguson Building, Craibstone Estate, Bucksburn, Aberdeen, Великобритания, AB21 9YA, 21 октября 2004 от имени Rowett Research Institute of Nutrition and Health, University of Aberdeen, Greenburn Road, Aberdeen, AB21 9SB, Шотландия, Великобритания, под идентификационным номером NCIMB 14029T Roseburia hominis A2-183T (DSM = 16839T).
Предпочтительно бактериальным видом является Roseburia hominis, описанный в Duncan, S.H., Aminov, R.I., Scott, K.P., Louis, P., Stanton, T.B., & Flint, H.J. (2006) Int. J. Syst. Evol. Microbiol. 56: 2437-2441.
В одном предпочтительном варианте осуществления бактериальный вид находится в форме популяции живых бактерий, популяции лиофилизированных бактерий, препарата нежизнеспособных бактерий или их клеточных компонентов. Предпочтительно, когда бактериальный вид находится в форме препарата нежизнеспособных бактерий, его выбирают из убитых с помощью нагревания бактерий, подвергнутых облучению бактерий и лизированных бактерий.
В одном предпочтительном варианте осуществления бактериальный вид находится в форме живых бактерий или их клеточных компонентов.
В одном предпочтительном варианте осуществления бактериальный вид находится в изолированной форме. Используемый здесь термин «изолированный» означает изолированный от своего природного окружения.
В одном предпочтительном варианте осуществления бактериальный вид находится в биологически чистой форме. Используемый здесь термин «биологически чистый» относится к лабораторной культуре, которая по существу не содержит другие виды организмов. Предпочтительно бактериальный вид находится в форме культуры одного вида организма.
Настоящим изобретением также охватывается применение мутантов вида или штаммов бактерий, описываемых здесь. Используемый здесь термин «мутант» включает производные штаммов бактерий, имеющие полинуклеотидные последовательности, гомологичные на по крайней мере 93%, предпочтительно на по крайней мере 96%, более предпочтительно на 98% полинуклеотидной последовательности ссылочного штамма, а в остальном - включающие мутации в других последовательностях в бактериальном геноме. Мутанты можно получить с помощью методов генетической инженерии, подразумевающие изменение генетического материала штаммов настоящего изобретения или подразумевающие рекомбинацию генетического материала штаммов настоящего изобретения с другими молекулами. Типично для получения таких мутантных штаммов квалифицированный в данной области специалист может использовать стандартные методы мутагенеза, такие как ультрафиолетовое облучение или подвергание воздействию мутагенных химических продуктов.
Используемый здесь термин «мутации» включает природные или индуцированные мутации, включающие по крайней мере точечные мутации, включающие делеции, вставки, трансверсии и другие модификации, известные квалифицированным в данной области техники специалистам, в том числе генетическую модификацию, введенную в исходную нуклеотидную или аминокислотную последовательность при сохранении составляющей по крайней мере 50% гомологии с исходной последовательностью. Предпочтительно, когда последовательность, включающая мутацию или мутации, гомологична на по крайней мере 60%, более предпочтительно на по крайней мере 75%, еще более предпочтительно на 85% исходной последовательности. Как здесь используется, «гомологию» последовательности можно определить, используя стандартные методы, известные квалифицированным в данной области техники специалистам. Например, гомологию можно определить, используя диалоговую программу «BLAST», в которой используется алгоритм для вычисления гомологии, общедоступную на сайте http://www.ncbi. nlm.nih.gov/BLAST/.
Настоящим изобретением также охватывается применение гомологов вида или штаммов бактерий, описываемых здесь. Используемый здесь термин «гомолог» относится к штамму бактерий, имеющему нуклеотидную последовательность со степенью идентичности или гомологии с нуклеотидной последовательностью исходного штамма бактерий (ниже называемую «гомологичной последовательностью(ями)»). Здесь термин «гомологичный» означает объект с некоей гомологией с рассматриваемой нуклеотидной последовательностью. Здесь термин «гомология» может быть приравнен к «идентичности».
В контексте настоящего изобретения гомологичная последовательность, как считается, включает нуклеотидную последовательность, которая может быть идентична на по крайней мере 50, 60, 70, 75, 80, 85 или 90%, предпочтительно идентична на по крайней мере 95%, 97%, 98% или 99% нуклеотидной последовательности исходного штамма бактерий (рассматриваемой последовательности).
Сравнения для определения гомологии можно выполнить на глаз, или обычнее - с помощью легкодоступных программ для сравнения последовательностей. С помощью этих имеющихся в продаже компьютерных программ можно рассчитать % гомологии между двумя или более последовательностями.
% гомологии можно рассчитать на протяжении соприкасающихся последовательностей, т.е. одну последовательность совмещают с другой последовательностью, и каждую аминокислоту в одной последовательности непосредственно сравнивают с соответствующей аминокислотой в другой последовательности, один остаток за раз. Это называется совмещением «без внесения пропусков». Типично такие совмещения без внесения пропусков выполняют только на протяжении относительно короткого числа остатков.
Хотя это очень простой и логичный способ, в нем не учитывается, что, например, в идентичной в других отношениях паре последовательностей одна вставка или делеция будет вызывать сбивание совмещения последующих аминокислотных остатков, таким образом, потенциально приводя к большому уменьшению % гомологии при выполнении общего совмещения.
Следовательно, для расчета максимального % гомологии, во-первых, необходимо создание оптимального совмещения, учитывая штрафы за внесение пропусков. Подходящей компьютерной программой для выполнения такого совмещения является Vector NTI (Invitrogen Corp.). Примеры программного обеспечения, с помощью которого можно выполнить сравнения последовательностей, включают, но без ограничения, пакет программ BLAST (смотрите Ausubel et al. 1999 Short Protocols in Molecular Biology, 4th Ed - Chapter 18), BLAST 2 (смотрите FEMS Microbiol Lett 1999 174(2): 247-50; FEMS Microbiol Lett 1999 177(1): 187-8), FASTA (Altschul et al. 1990 J. Mol. Biol. 403-410) и AlignX, например. По крайней мере BLAST, BLAST 2 и FASTA имеются в распоряжении для исследования в автономном режиме и режиме онлайн (смотрите Ausubel et al 1999, страницы 7-58 - 7-60).
Предпочтительно, степень идентичности в отношении нуклеотидной последовательности определяют на протяжении по крайней мере 20 следующих друг за другом нуклеотидов, предпочтительно на протяжении по крайней мере 30 следующих друг за другом нуклеотидов, предпочтительно на протяжении по крайней мере 40 следующих друг за другом нуклеотидов, предпочтительно на протяжении по крайней мере 50 следующих друг за другом нуклеотидов, предпочтительно на протяжении по крайней мере 60 следующих друг за другом нуклеотидов, предпочтительно на протяжении по крайней мере 100 следующих друг за другом нуклеотидов. Предпочтительно степень идентичности в отношении нуклеотидной последовательности можно определить на протяжении всей последовательности.
Традиционная идентификация бактерий на основе фенотипических характеристик является, как правило, не настолько точной, как идентификация на основе генотипических методов. Сравнение последовательности гена 16S рРНК бактерии возникло в качестве предпочтительного генетического метода и создает возможность для идентификации новых штаммов посредством сравнения последовательностей с известными бактериальными последовательностями ДНК, используя BLAST (http://blast.ncbi.nlm.nih.gov/Blast.cgi). Последовательность гена 16S рРНК является универсальной у бактерий, а значит, взаимосвязи можно определить между множеством различных бактерий. В общем, сравнение последовательности 16S рРНК позволяет дифференцировать организмы на уровне рода по всем основным типам бактерий, в дополнение к тому, что оно позволяет классифицировать штаммы на множестве уровней, в том числе на уровне вида и подвида. Последовательность гена 16S рРНК была определена для большого числа штаммов. GenBank - самый большой банк данных, касающихся нуклеотидных последовательностей, содержит свыше 20 миллионов депонированных последовательностей, из которых свыше 90000 являются последовательностями генов 16S рРНК. Это значит, что существует множество ранее депонированных последовательностей, с которыми можно сравнить последовательность неизвестного штамма.
Используемый здесь термин «идентичность по 16S рРНК» относится к проценту идентичности с известным бактериальным штаммом. В одном предпочтительном варианте осуществления штамм бактерий идентичен по 16S рРНК на по крайней мере 99,5% со штаммом, депонированным под вышеуказанным идентификационным номером.
Настоящим изобретением также охватываются мутантные штаммы, которые можно получить из вышеотмеченного депонированного штамма, и штаммы, демонстрирующие ДНК-ДНК гомологию, составляющую по крайней мере 70%, и/или идентичность по 16S рРНК, составляющую по крайней мере 99,5%, со штаммом, который был депонирован под вышеуказанным идентификационным номером.
В контексте настоящего изобретения термин «гомология между ДНК-ДНК» относится к тому, насколько близкородственными друг к другу являются две или более отдельных цепей ДНК на основе их нуклеотидной последовательности. Типично это определяют в виде % их идентичности. В одном предпочтительном варианте осуществления штамм бактерий характеризуется ДНК-ДНК гомологией, составляющей по крайней мере 70%, со штаммом, который был депонирован под вышеуказанным идентификационным номером.
В одном очень предпочтительном варианте осуществления штамм бактерий характеризуется ДНК-ДНК гомологией, составляющей по крайней мере 70%, и идентичностью по 16S рРНК, составляющей по крайней мере 99,5%, со штаммом, который был депонирован под вышеуказанным идентификационным номером.
Терапевтические применения
Другой аспект настоящего изобретения относится к бактериальному виду R. hominis для применения в медицине.
Конкретнее, бактериальный вид Roseburia hominis предназначен для применения для лечения нарушения, выбираемого из воспалительного расстройства, иммунного нарушения и кишечного расстройства, у субъекта.
Используемый здесь термин «лекарственное средство» охватывает лекарственные средства для применения и для людей, и для животных в медицине и ветеринарии. Кроме того, термин «лекарственное средство», как здесь используется, означает любое вещество, которое обеспечивает терапевтический и/или благотворный эффект. Термин «лекарственное средство», как здесь используется, необязательно ограничивается веществами, для которых требуется разрешение продажи на рынке страны, а могут включать вещества, которые могут использоваться в косметических средствах, БАД, продуктах питания (в том числе пище и напитках, например), культурах пробиотиков, пищевых добавках и лекарственных средствах природного происхождения. Кроме того, термин «лекарственное средство», как здесь используется, охватывает продукт, предназначенный для включения в корм для животных, например, корм для домашнего скота и/или корм для любимых домашних животных.
В одном предпочтительном варианте осуществления настоящего изобретения нарушение выбирают из синдрома раздраженного кишечника (IBS), колита, воспалительного расстройства кишечника (IBD), в том числе болезни Крона и неспецифического язвенного колита, воспаления созданного хирургическим путем тонкокишечного резервуара, функциональной диспепсии, функционального запора, функциональной диареи (в том числе связанной с приемом антибиотиком диареи, диареи путешественников и диареи у детей), функциональной боли в животе, функционального вздутия, болевого синдрома в эпигастральной области, постпрандиального дистресс-синдрома, гастроэзофагеальной рефлюксной болезни (GERD), аутоиммунных заболеваний, таких как сахарный диабет, артрит, рассеянный склероз и псориаз, аллергий, атопических заболеваний, например, атопического дерматита, некротизирующего энтероколита, других инфекционных заболеваний и их комбинаций.
В одном особенно предпочтительном варианте осуществления нарушением является воспалительное расстройство. Предпочтительно экспрессия провоспалительных генов является уменьшенной у субъекта-хозяина. Дополнительные подробности в отношении этих исследований представлены ниже.
Более предпочтительно, воспалительным нарушением является колит, даже более предпочтительно - болезнь Крона, неспецифический язвенный колит или воспаление созданного хирургическим путем тонкокишечного резервуара.
В одном особенно предпочтительном варианте осуществления кишечным расстройством является IBS. Остается выяснить точную патофизиологию IBS. В недавних исследованиях отмечены воспаление слизистой оболочки и изменения в микробиоте кишечника у пациентов с IBS и корреляция заболевания с кишечными инфекциями.
В одном особенно предпочтительном варианте осуществления кишечным расстройством является IBD. Предпочтительно экспрессия барьерных генов является увеличенной у субъекта-хозяина. Дополнительные подробности в отношении этих исследований представлены ниже.
В одном особенно предпочтительном варианте осуществления кишечным расстройством является болезнь Крона.
В одном особенно предпочтительном варианте осуществления нарушением является иммунное нарушение. Предпочтительно иммунное нарушение выбирают из неспецифического язвенного колита, воспаления созданного хирургическим путем тонкокишечного резервуара, других аутоиммунных заболеваний, включающих ревматоидный артрит, псориаз, рассеянный склероз, аллергий, в том числе глютеновой болезни, атопического дерматита и ринита.
В одном варианте осуществления бактериальный вид Roseburia hominis предназначен для регуляции иммунной системы субъекта. Известно, что иммунорегуляция с помощью бактериальных видов является в высокой степени видоспецифической (8). В частности, иммунорегулирующее действие бактерий кластеров XIVa и VI является очень сложным и зависит от продукции бутирата (41).
В одном предпочтительном варианте осуществления подвергается модуляции врожденная иммунная система субъекта.
В другом предпочтительном варианте осуществления адаптивная иммунная система подвергается модуляции в направлении иммунорегуляции (а не активации иммунной системы, следовательно, уменьшения воспаления).
Другой аспект настоящего изобретения относится к бактериальному виду Roseburia hominis для улучшения микробиоты кишечника у субъекта.
Микробиота кишечника относится к микроорганизмам, которые живут в пищеварительном тракте животных-хозяев. Эти микроорганизмы выполняют широкий ряд метаболических, структурных, защитных и других полезных функций. Как здесь используется, «улучшение микробиоты кишечника» относится к увеличению количества и/или типа микроорганизмов, присутствующих в кишечнике хозяина, и/или увеличению активности указанных микроорганизмов в плане их метаболических, структурных, защитных и других полезных функций.
Предпочтительно Roseburia hominis колонизирует ободочную кишку и/или подвздошную кишку, более предпочтительно - ободочную кишку.
В одном предпочтительном варианте осуществления Roseburia hominis регулирует экспрессию по крайней мере одного гена, имеющего отношение к мобилизации или хемотаксису.
Более предпочтительно, Roseburia hominis увеличивает экспрессию по крайней мере одного гена, имеющего отношение к мобилизации или хемотаксису. Еще предпочтительнее, ген, имеющий отношение к мобилизации или хемотаксису, выбирают из MobA и MobL.
В другом предпочтительном варианте осуществления Roseburia hominis регулирует экспрессию по крайней мере одного гена, выбираемого из FlaA1, FlaA2, Fla3 и FlaB.
Специфические сывороточные антитела против белков типа FLA присутствуют при воспалительном заболевании кишечника. Таким образом, в одном предпочтительном варианте осуществления, Roseburia hominis предназначен для применения для лечения воспалительного заболевания кишечника.
В другом предпочтительном варианте осуществления Roseburia hominis регулирует экспрессию одного или более из следующего: ацетил-КоA-ацетилтрансферазы, 3-гидроксиацил-КоА-дегидрогеназы, бутирил-КоА-дегидрогеназы, бета-субъединицы окислительно-восстановительного флавопротеина и альфа-субъединицы окислительно-восстановительного флавопротеина.
Другой аспект настоящего изобретения относится к бактериальному виду Roseburia hominis для регуляции врожденной иммунной системы субъекта.
Используемый здесь термин «врожденная иммунная система», также известный как неспецифическая иммунная система, включает клетки и механизмы, которые обеспечивают хозяину незамедлительную защиту от инфицирования другими организмами неспецифическим образом. Это означает, что клетки врожденной системы распознают патогены и отвечают на них генетически, но в отличие от адаптивной иммунной системы она не обеспечивает хозяину длительный или протективный иммунитет.
Используемый здесь термин «регуляция врожденной иммунной системы» означает индуцирование активности врожденной иммунной системы и/или увеличение уровня активности относительно исходного уровня активности, так что она содействует иммунному гомеостазу.
Уменьшение функционирования врожденной иммунной системы или ее дисрегуляция, вследствие или утраты эпителиального барьера, пептидов врожденной иммунной системы, таких как дефенсины, хемокины и цитокины, или дефектной передачи сигналов с участием TLR, связано с повышенным риском развития воспалительных заболеваний в нескольких органах организма, включая пищеварительный тракт. Такие заболевания включают воспалительное заболевание кишечника. Таким образом, в одном особо предпочтительном варианте осуществления Roseburia hominis предназначен для применения для лечения воспалительного заболевания кишечника.
В одном предпочтительном варианте осуществления Roseburia hominis регулирует экспрессию по крайней мере одного гена, выбираемого из Tlr5, Tlr1, Vnn1, Defb37, Pla2g, Muc16, Itln, Sprr1a, Cldn4, Pmp22, Crb3, Magi3, Marveld3, Mpp7, Defcr20, Pcgf2, Ltbp4, Igsf8 и Tcfe2a. Многие из этих генов являются генами, имеющими отношение к кишечному барьеру, и противомикробными веществами и, следовательно, функционируют для уменьшения инвазивной способности кишечных патогенов, а также уменьшения числа жизнеспособных патогенов.
Другой аспект настоящего изобретения относится к бактериальному виду Roseburia hominis для регуляции адаптивной иммунной системы субъекта.
Используемый здесь термин «адаптивная иммунная система», иначе известный как «специфическая иммунная система», относится к высокоспециализированным системным клеткам и процессам, которые устраняют или предотвращают рост патогенов. Адаптивный иммунный ответ дает иммунной системе позвоночного возможность распознавать и вспоминать конкретные патогены (для формирования иммунитета), и поднимать в более сильные атаки каждый раз при встрече с патогеном.
Используемый здесь термин «регуляция адаптивной иммунной системы» означает индуцирование активности адаптивной иммунной системы и/или стимулирование механизмов иммунного гомеостаза посредством увеличения уровня активности относительно исходного уровня активности. Предпочтительно адаптивная иммунная система подвергается модуляции в направлении иммунорегуляции (а не активации иммунной системы, следовательно, уменьшения воспаления).
Дефекты и нарушения, связанные с адаптивной иммунной системой, в особенности, связанные с функционированием T-клеток, связаны со многими воспалительными и аутоиммунными заболеваниями. T-клеточные реакции, связанные с Th1, Th2 и Th17, связаны с атопическими, воспалительными и аутоиммунными заболеваниями. Терапии, которые улучшают или увеличивают популяции регуляторных T-клеток, важны для борьбы с заболеваниями, запускаемыми чрезмерными T-клеточными реакциями, связанными с Th1, Th2 и Th17.
В одном предпочтительном варианте осуществления Roseburia hominis активирует по крайней мере один ген, имеющий отношение к иммунному ответу, в ободочной кишке или подвздошной кишке.
В одном предпочтительном варианте осуществления Roseburia hominis регулирует адаптивную иммунную систему посредством модуляции экспрессии генов, связанных с регуляцией T-клеток, более предпочтительно в ободочной кишке. Более предпочтительно Roseburia hominis индуцирует регуляторные Т-клетки. Увеличение количеств регуляторных Т-клеток будет противодействовать эффектам других эффекторных T-клеток, таких как Th1, Th17 и Th2, которые запускают воспаление, аутоиммунитет и аллергические/атопические заболевания. Поэтому это свойство R. hominis можно использовать для устранения многих заболеваний, в случае которых утрачен баланс между эффекторными Т-клетками и регуляторными T-клетками, например, болезни Крона и неспецифического язвенного колита.
В одном особенно предпочтительном варианте осуществления Roseburia hominis увеличивает экспрессию по крайней мере одного гена, выбираемого из Ly6g6c и Ly6g6e, в восходящей части ободочной кишки. Уменьшение Ly6g6c и Iy6g6e увеличивает риск инфицирования и пищеварительного тракта, и дыхательных путей и связано с такими заболеваниями, как нейтропения. Таким образом, в одном предпочтительном варианте осуществления Roseburia hominis предназначен для применения для лечения нейтропении.
Другой аспект настоящего изобретения относится к бактериальному виду Roseburia hominis для применения для сохранения иммунного гомеостаза у субъекта. Как здесь используется, «сохранение иммунного гомеостаза» относится к саморегуляции иммунной системы организма для сохранения оральной толерантности или стабильности иммунной системы в ответ на изменение условий. Оральная толерантность относится к нормальным иммунным реакциям на пищу и бактерии-комменсалы в здоровом пищеварительном тракте. Они утрачиваются при глютеновой болезни и воспалительных заболеваниях кишечника, таких как болезнь Крона и неспецифический язвенный колит. Таким образом, в одном особенно предпочтительном варианте осуществления Roseburia hominis предназначен для применения для лечения глютеновой болезни и воспалительных заболеваний кишечника, таких как болезнь Крона и неспецифический язвенный колит.
Другой аспект настоящего изобретения относится к бактериальному виду Roseburia hominis для применения для регуляции аппетита у субъекта.
Как здесь используется, «регуляция аппетита» относится к способности к модуляции (т.е. увеличению или уменьшению) желания хозяина поесть. Предпочтительно Roseburia hominis проявляет стимулирующее действие на аппетит хозяина посредством уменьшения экспрессии генов, связанных с подавлением аппетита. Предпочтительно Roseburia hominis уменьшает экспрессию по крайней мере одного гена, выбираемого из Agt, Cartpt, Cck, Cxcl12 и Gcg. Более предпочтительно Roseburia hominis уменьшает экспрессию гормонов насыщения Cck и Gcg.
Бактериальный вид в соответствии с настоящим изобретением может также использоваться для профилактических применений. При профилактических применениях бактериальный вид или композиции в соответствии с настоящим изобретением вводят пациенту с конкретным заболеванием или с риском развития конкретного заболевания, в количестве, достаточном для по крайней мере частичного уменьшения риска развития заболевания. Устанавливается, что такое количество является «профилактически эффективной дозой». Точные количества зависят от ряда специфических для пациента факторов, таких как состояние здоровья и вес пациента.
Настоящее изобретение далее описано в виде следующих фигур, где:
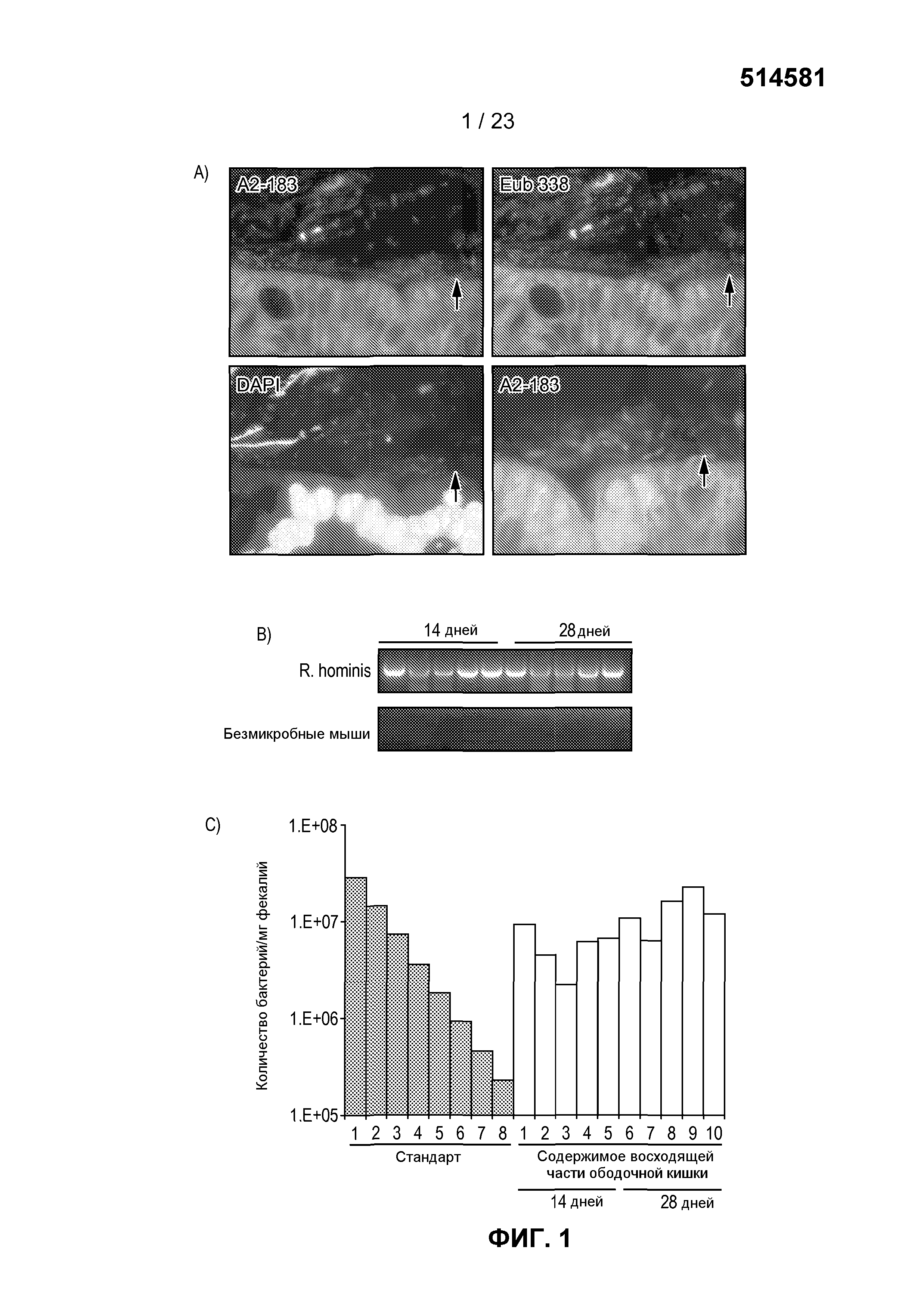
На фиг. 1 продемонстрировано большое количество и локализация R. hominis в восходящей части ободочной кишки. (A) Восходящая часть ободочной кишки мышки с колонизацией R. hominis, демонстрирующая тесную связь бактерий с эпителием хозяина с применением A2-183 FISH-зонд. Начальное увеличение x630. (B) ПЦР с использованием R. hominis-специфических праймеров показало сильный положительный сигнал по ДНК в фекалиях после колонизации, в то время как фекалии GF животных были негативными в отношении присутствия каких-либо бактерий. (C) Анализ с помощью ПЦР в режиме реального времени, демонстрирующий уровни колонизации R. hominis/мг фекалий.
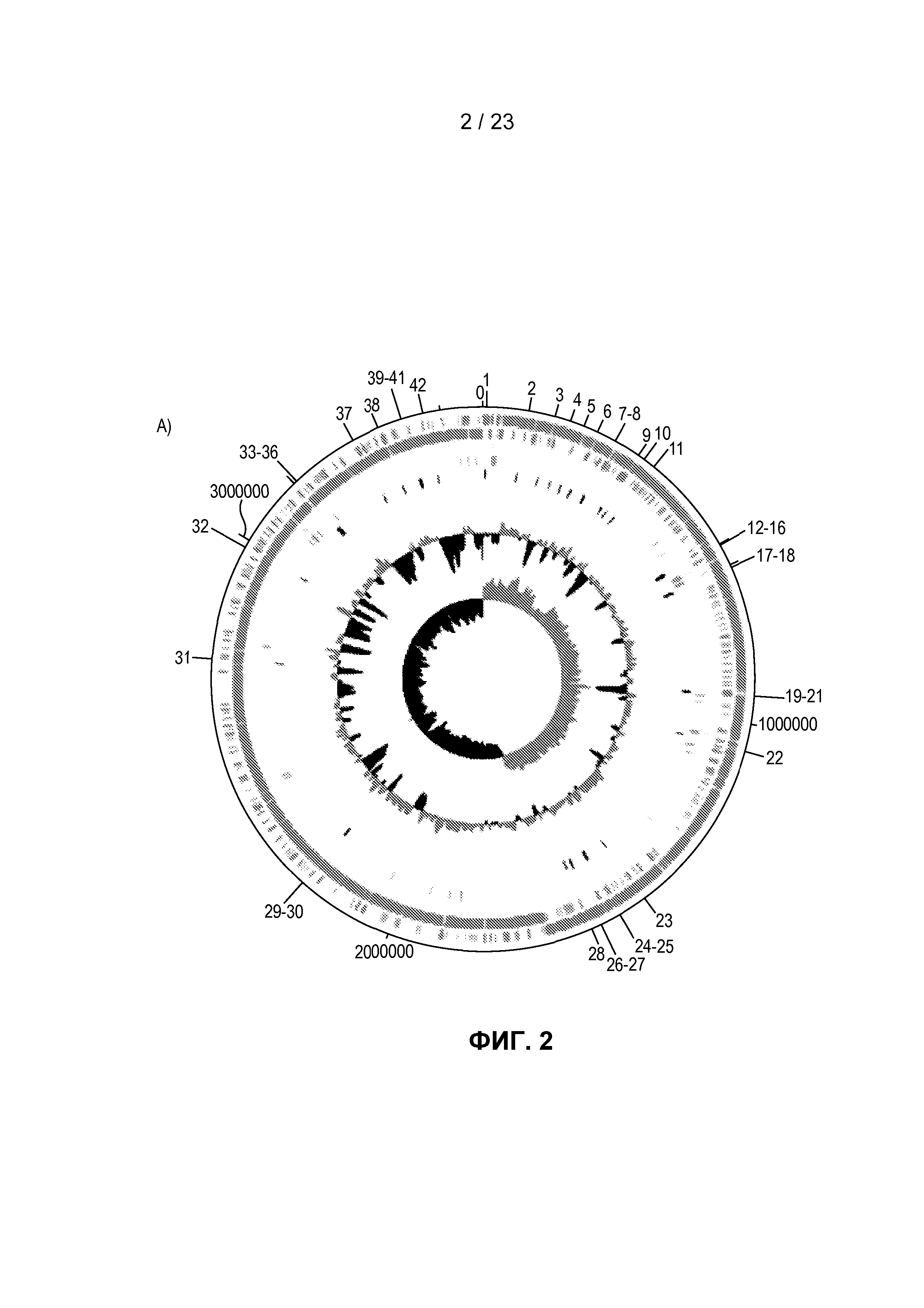
На фиг. 2 представлена последовательность генома R. hominis и комментарий к ней. (A) Карта циркулярного генома R. hominis с локализацией экспериментов с использованием ПЦР, указанной в участках, заданных праймерами. Тракты на геномной карте, начиная с внешнего тракта 0, представляют собой: тракт 0 - (голубой) Эксперименты с использованием ПЦР в режиме реального времени, указанные с помощью засечек с числовыми значениями; тракт 1 - (светло-голубой) прямая кодирующая последовательность; тракт 2 - (светло-голубой) обратная кодирующая последовательность; тракт 3 - (голубой) рРНК; тракт 4 - (зеленый) тРНК; тракт 5 - (красный) ДНК-маркирующие участки, намеченные с помощью ПЦР в режиме реального времени; диаграмма 1 - содержание GC; диаграмма 2 - систематические ошибки оценки GC. (B) Функциональный комментарий к геному R. hominis.
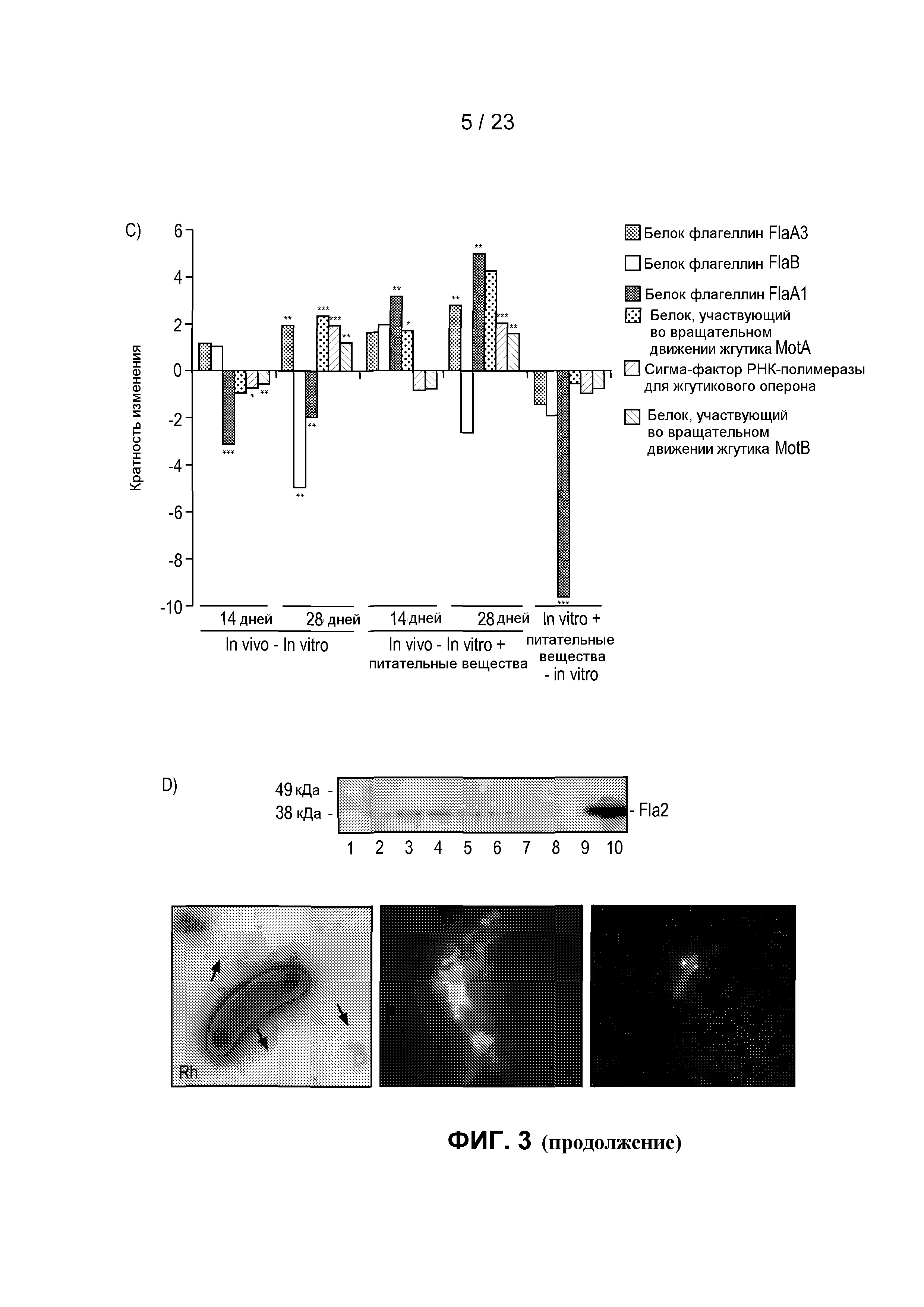
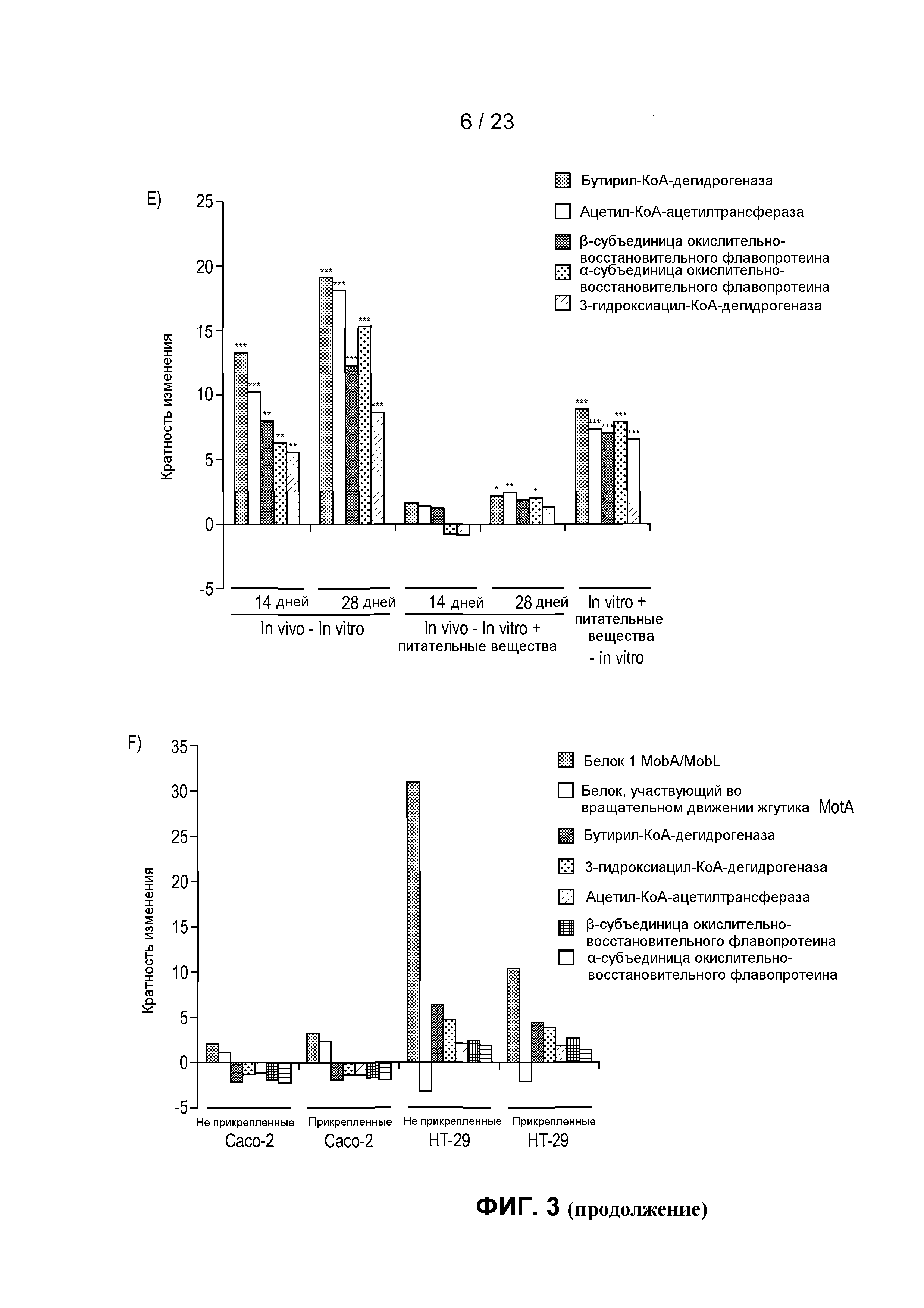
На фиг. 3 показаны транскрипты, дифференциально экспрессированные в R. hominis после колонизации и адаптации к пищеварительному тракту мыши. (A) Бактериальную РНК выделяли из содержимого слепой кишки мыши, метили или dCTP-Cy3, или dCTP-Cy5 во время синтеза кДНК и подвергали гибридизации с предметными стеклами - биологическими микрочипами, включая смену красителей. Данные считались значимыми, когда кратность изменения >2 и P<0,05. 50 диффенциально экспрессируемых генов (in vivo против in vitro) было обнаружено с помощью анализа с использованием биологического микрочипа. (B) Оценка с помощью ПЦР в режиме реального времени генов, вовлеченных в конъюгационный/мобилизационный перенос. (C) Оценка с помощью ПЦР в режиме реального времени генов, вовлеченных в подвижность и хемотаксис. (D) Вестерн-блоттинг содержимого восходящей части кишки, подвергнутого иммуноокрашиванию аффинно-очищенным антителом против Fla2 в день 14 (дорожка 1: маркеры, дорожки 2-6: содержимое пищеварительного тракта от животных 1-5, дорожки 7-8: пустые, дорожки 9-10: биомасса R. hominis (положительный контроль)). Фотография R. hominis, демонстрирующая жгутик (черная стрела) и (E) Оценка с помощью ПЦР в режиме реального времени генов, вовлеченных в метаболизм бутирата. (F) Анализ с помощью ПЦР в режиме реального времени транскриптов R. hominis во время in vitro подвергания воздействию эпителиальных клеток кишечника человека. Результаты ПЦР в режиме реального времени представляют средние значения трех повторов, *P<0,05, **P<0,01, ***P<0,001.
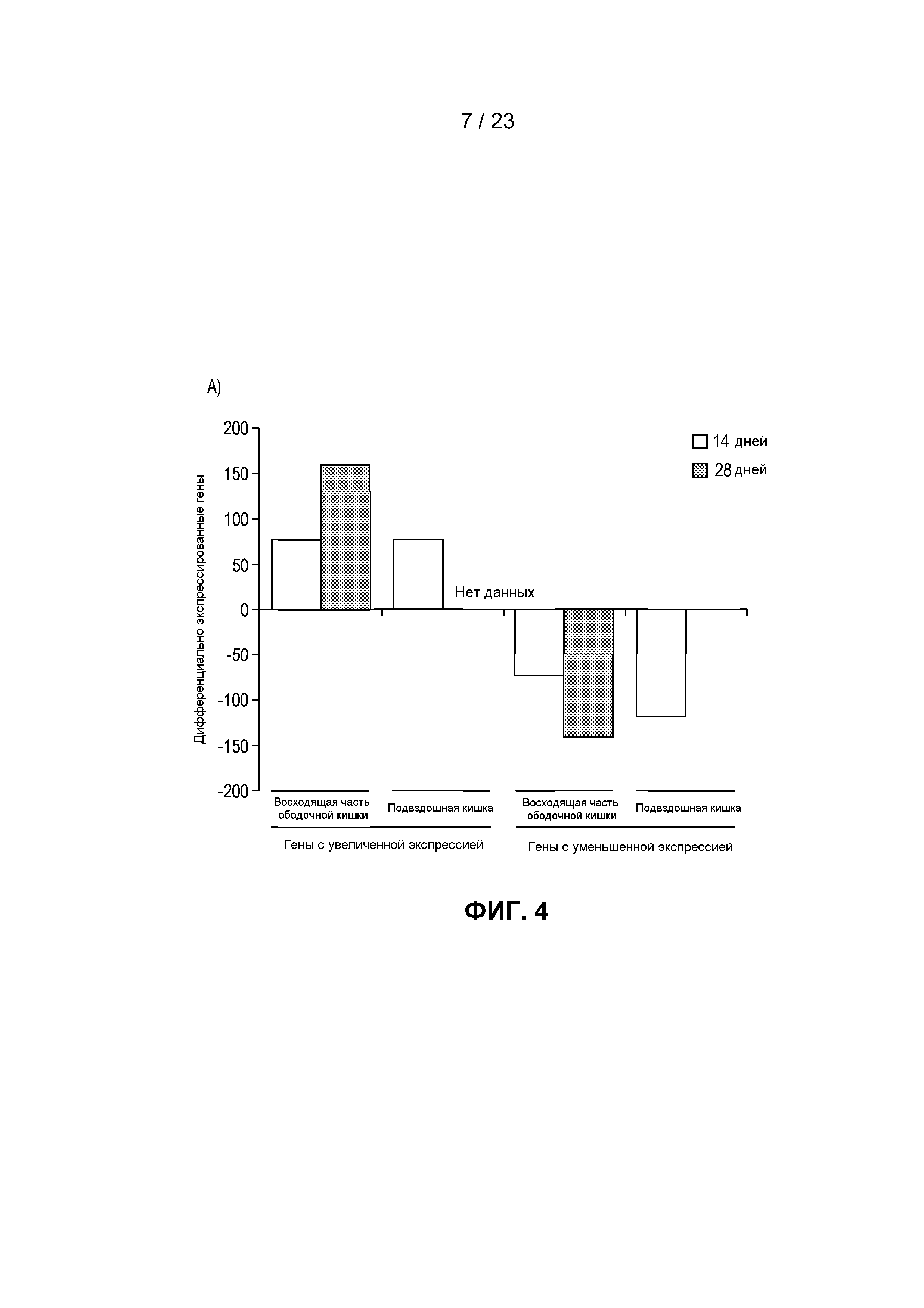
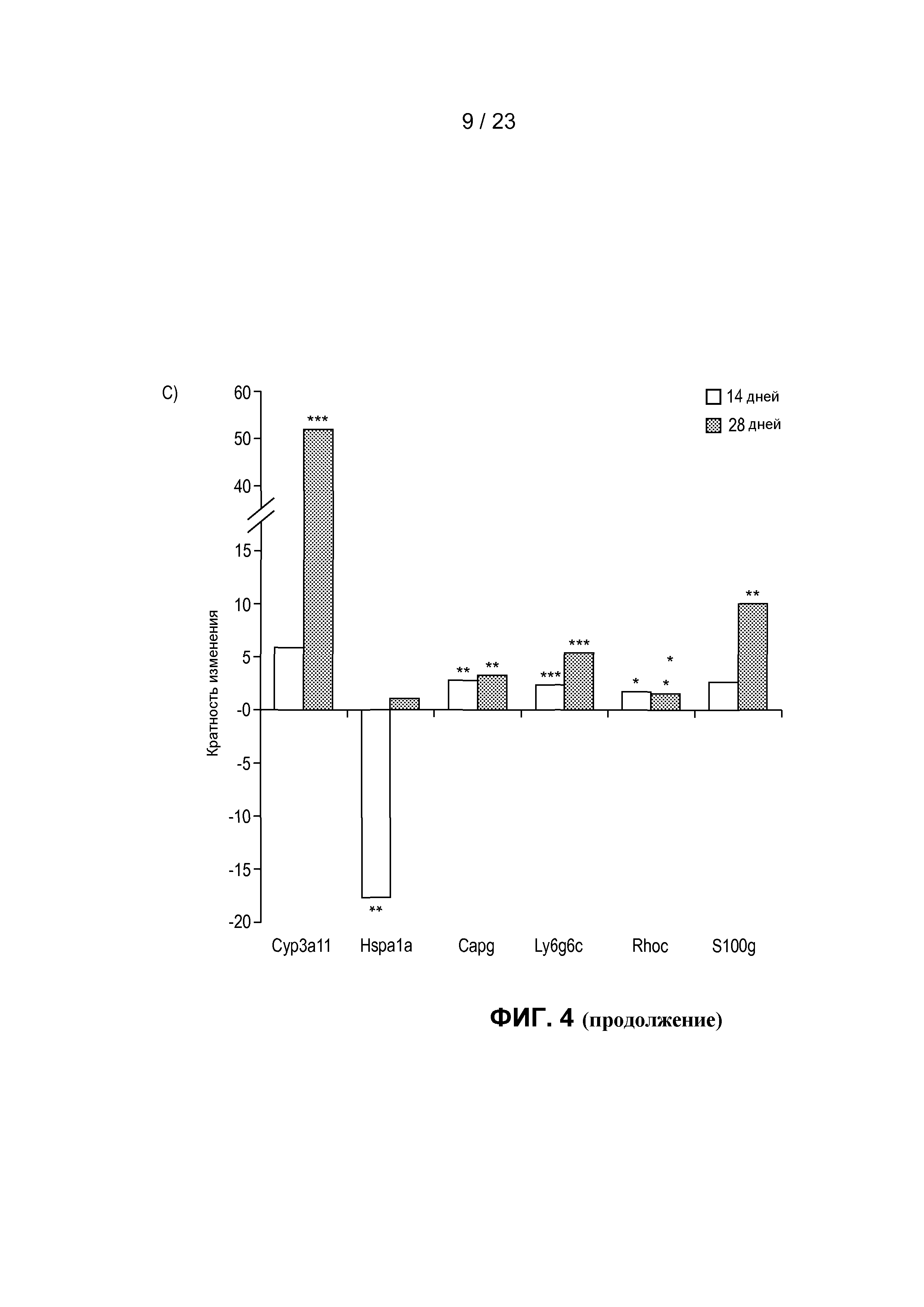
На фиг. 4 показаны транскрипты, дифференциально экспрессированные в пищеварительном тракте мыши после моноассоциации с R. hominis. (A) Анализ с использованием биологического микрочипа Affymetrix дифференциально экспрессированных генов R. hominis-колонизированных мышей по сравнению с GF. Гистограммы представляют собой количество генов с более высокой и более низкой экспрессией через 14 и 28 дней. (B) Карта интенсивностей, созданная на основе дифференциально экспрессируемых генов с функциональной значимостью - между GF мышами и R. hominis-колонизированными мышами в день 14 и 28. Вертикальные ряды представляют собой отдельные чипы, а строки - конкретные гены, представляющие интерес. Z-показатель описывает меру различия, в среднеквадратических отклонениях, от среднего значения. Относительное значение для каждого гена представлено с помощью интенсивности цвета, при этом зеленый цвет указывает на более высокую экспрессию, а красный цвет отображает более низкую экспрессию. (C) Оценка с помощью ПЦР в режиме реального времени генов, которые, как установлено, являются значимо различными между R. hominis-колонизированными мышами и GF мышами. Результаты ПЦР в режиме реального времени представляют средние значения трех повторов: *P<0,05, **P<0,01, ***P<0,001.
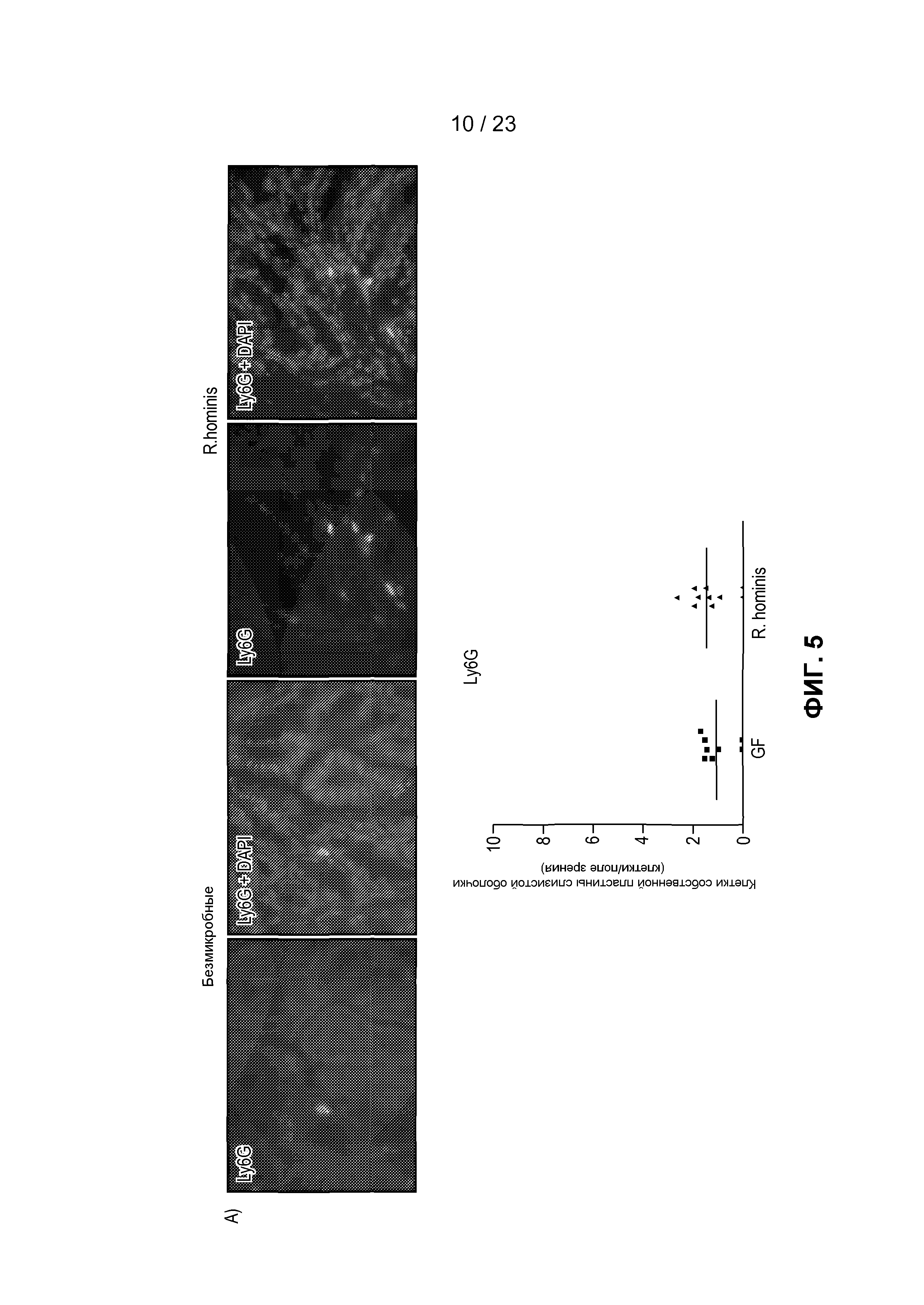
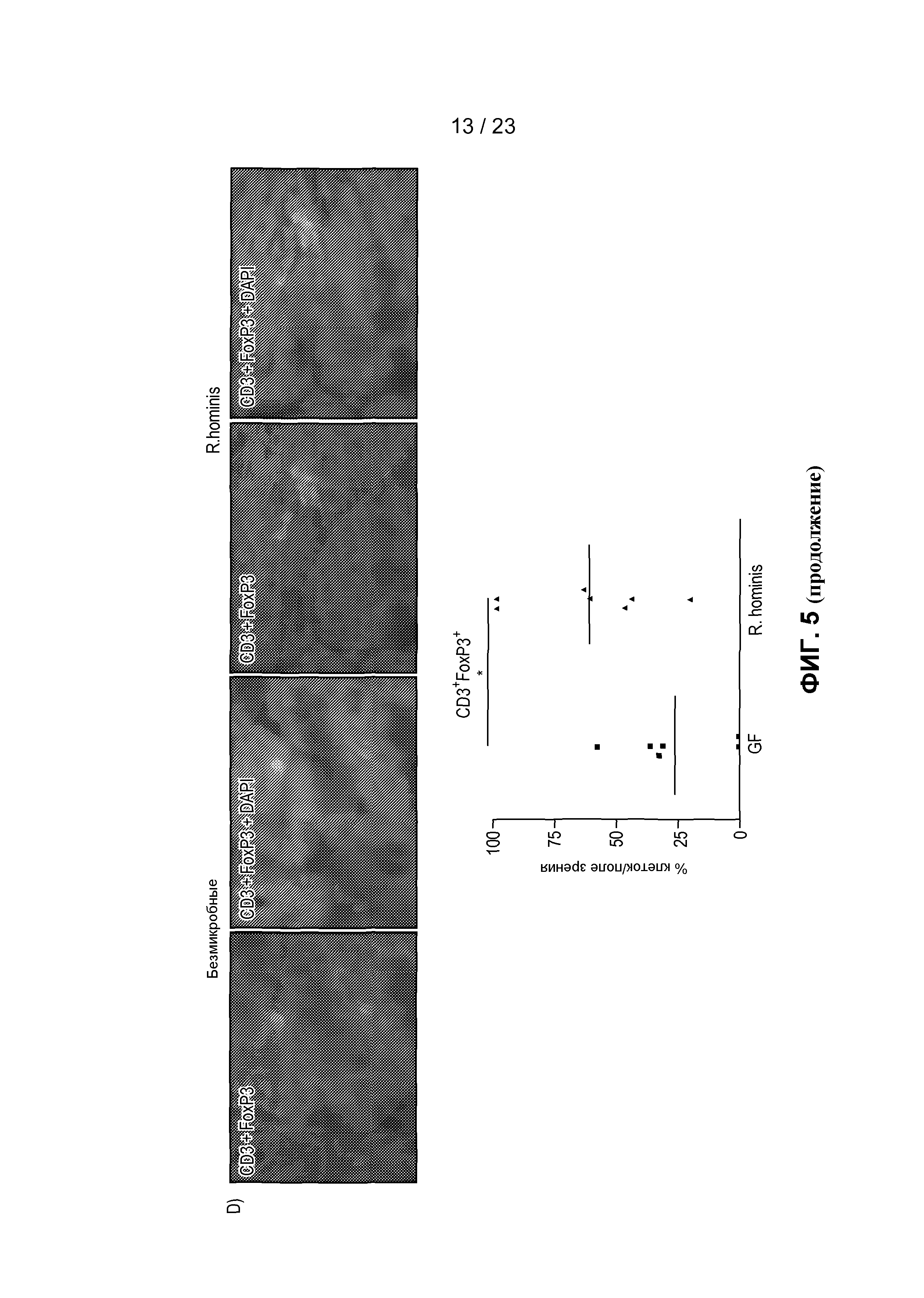
На фиг. 5 продемонстрирована экспрессия и локализация T-клеточных маркеров в ободочной кишке. Иммунофлуоресценция и анализ клеток собственной пластины слизистой оболочки, помеченных антителами против Ly6G (A), CD3 (B) и CD11b (C), в собственной пластине слизистой оболочки GF мышей и подвергнутых воздействию R. hominis мышей - *P<0,05.
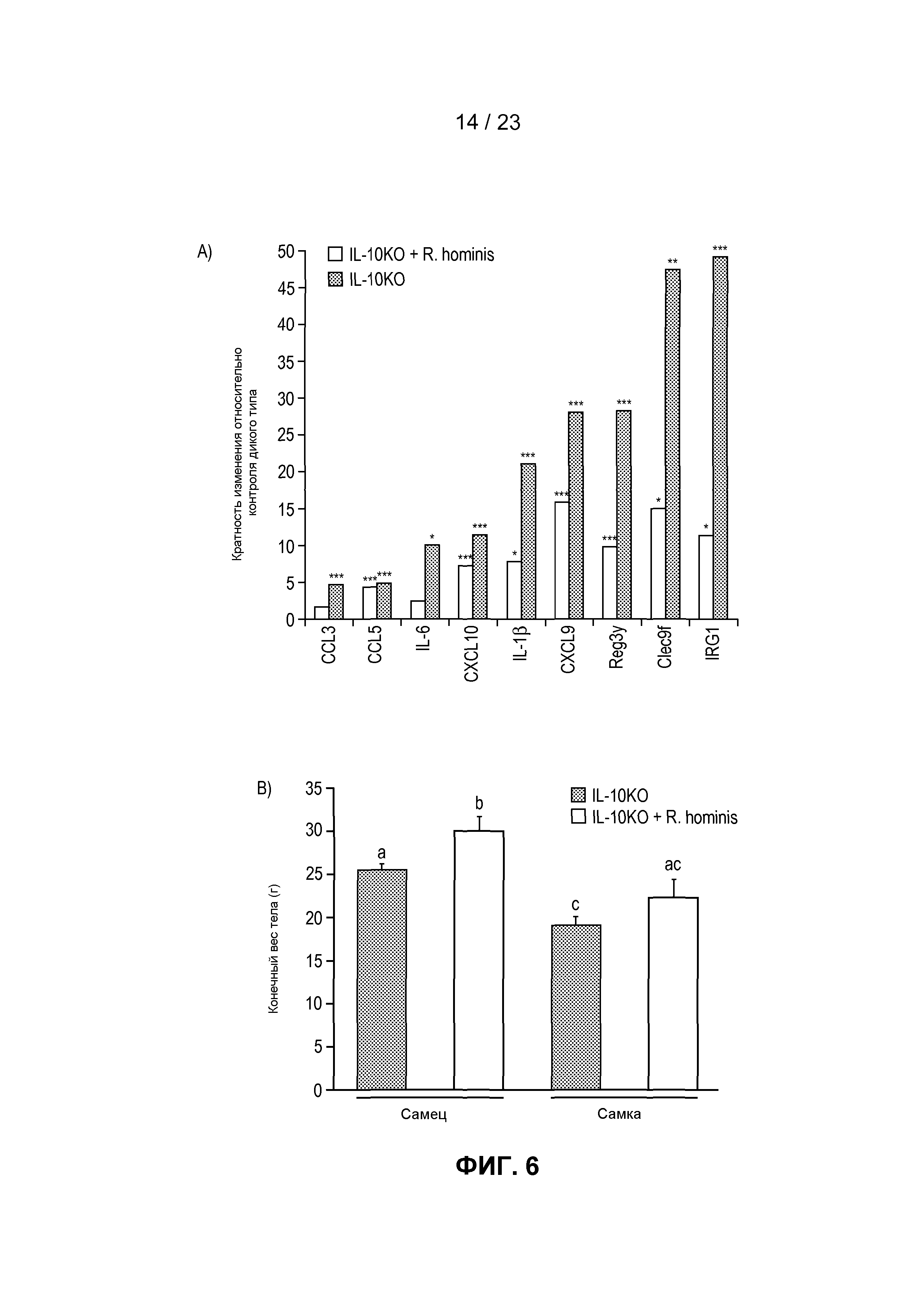
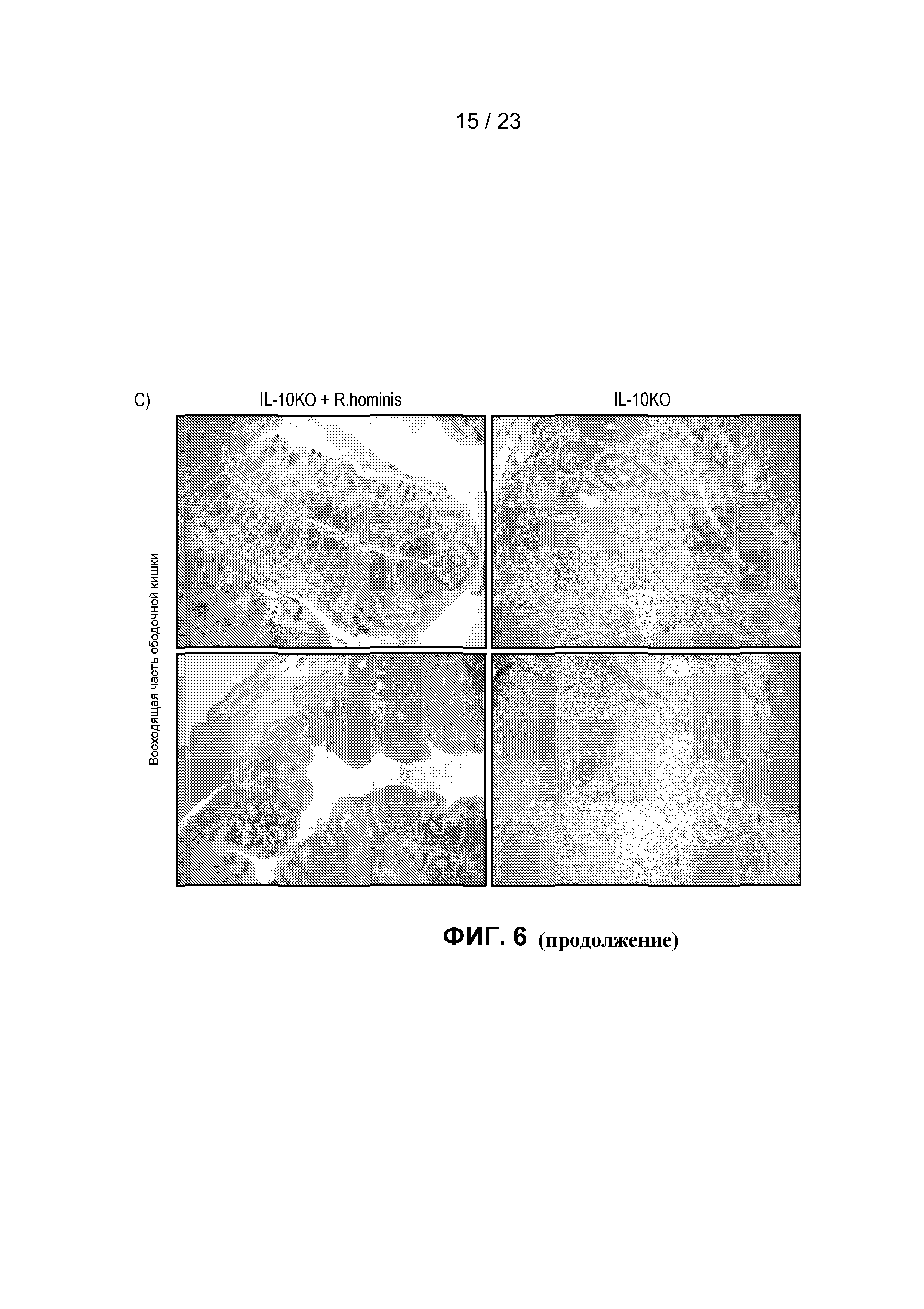
На фиг. 6 продемонстрированы противовоспалительные действия R. hominis в экспериментальной модели колита. IL-10KO мышам вводили дозы трижды в неделю в течение 14 недель. (A) У не подвергнутых воздействию мышей IL-10KO отмечалось сильное увеличение экспрессии всех генов по сравнению с мышами дикого типа, при этом дифференциальная экспрессия генов была ниже у подвергнутых воздействию R. hominis животных. Результаты ПЦР в режиме реального времени представляют средние значения трех повторов: *P<0,05, **P<0,01, ***P<0,001. (B) Веса тел, не подвергнутых воздействию животных IL-10KO и подвергнутых воздействию R. hominis животных IL-10KO в конце исследования. (C) Восходящая часть ободочной кишки (с окрашиванием гематоксилином/эозином) животных IL-10KO и подвергнутых воздействию R. hominis животных IL-10KO. Начальное увеличение × 100.
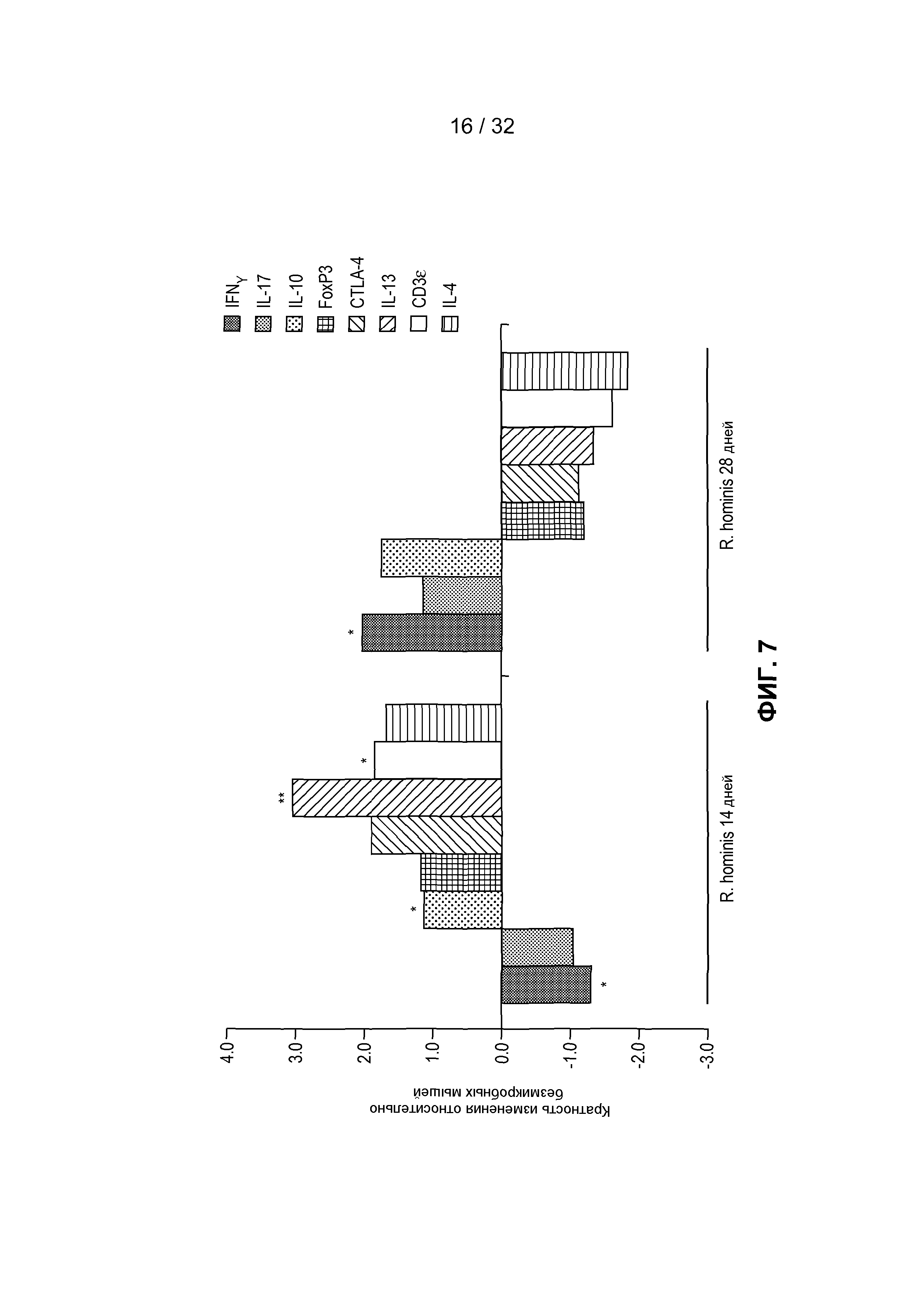
На фиг. 7 представлен анализ с помощью ПЦР в режиме реального времени уровней мРНК для IL-10, IL-17 и IFN-γ. ПЦР в режиме реального времени была выполнена на ткани восходящей части ободочной кишки для измерения T-клеточных маркеров. Результаты ПЦР в режиме реального времени представляют средние значения трех повторов: *P<0,05, **P<0,01.
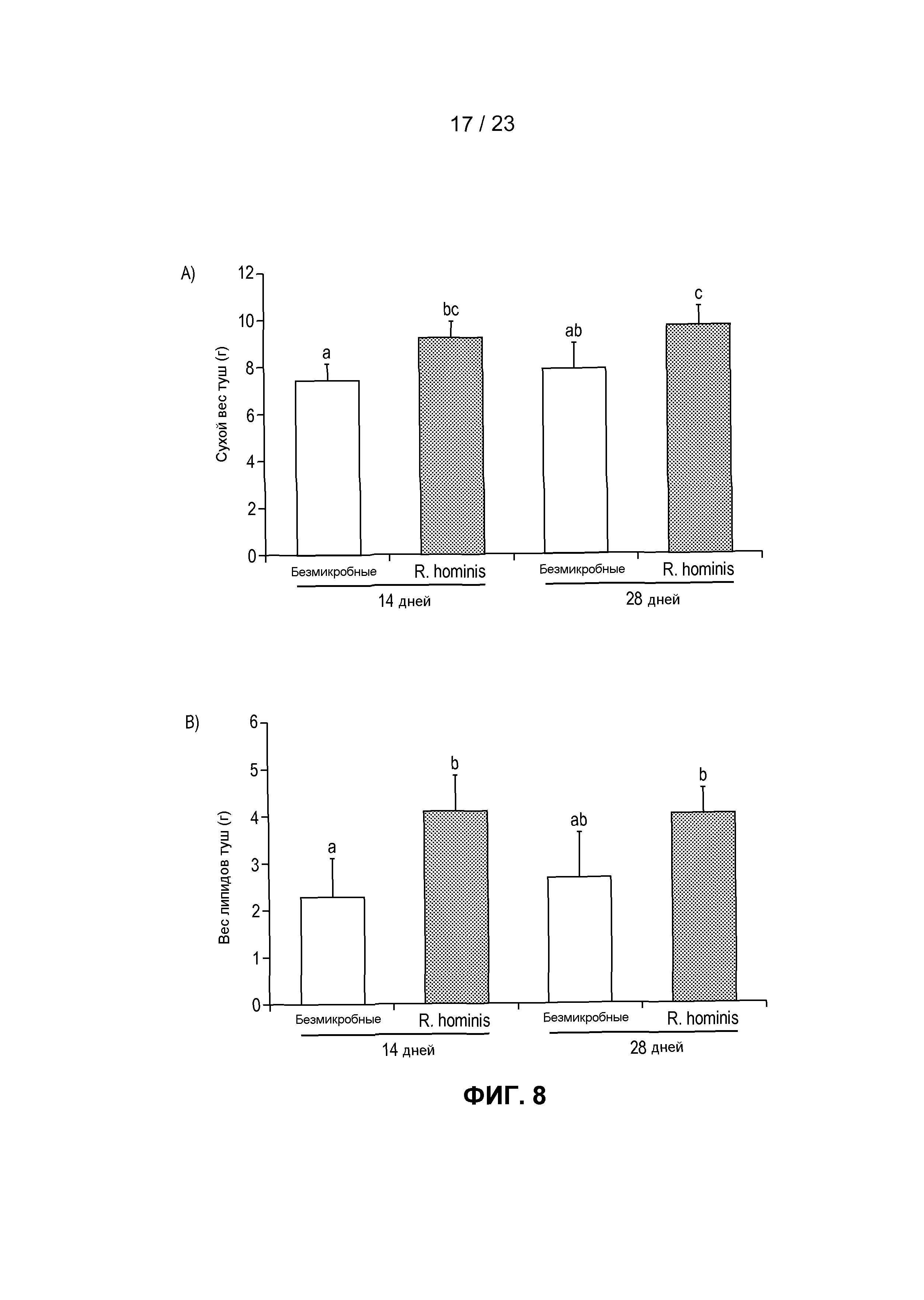
На фиг. 8 продемонстрированы эффекты моноассоциации GF мышей с R. hominis на весовой состав тела. Был выполнен анализ сухого веса тела и липидный анализ туш. (A) Сухой вес туш мышей, моноассоциированных с R. hominis, был значительно больше такового GF животных. (B) Дальнейший анализ липидов туш показал, что общее ожирение было также значительно больше у животных, подвергнутых воздействию R. hominis, через 14 дней.
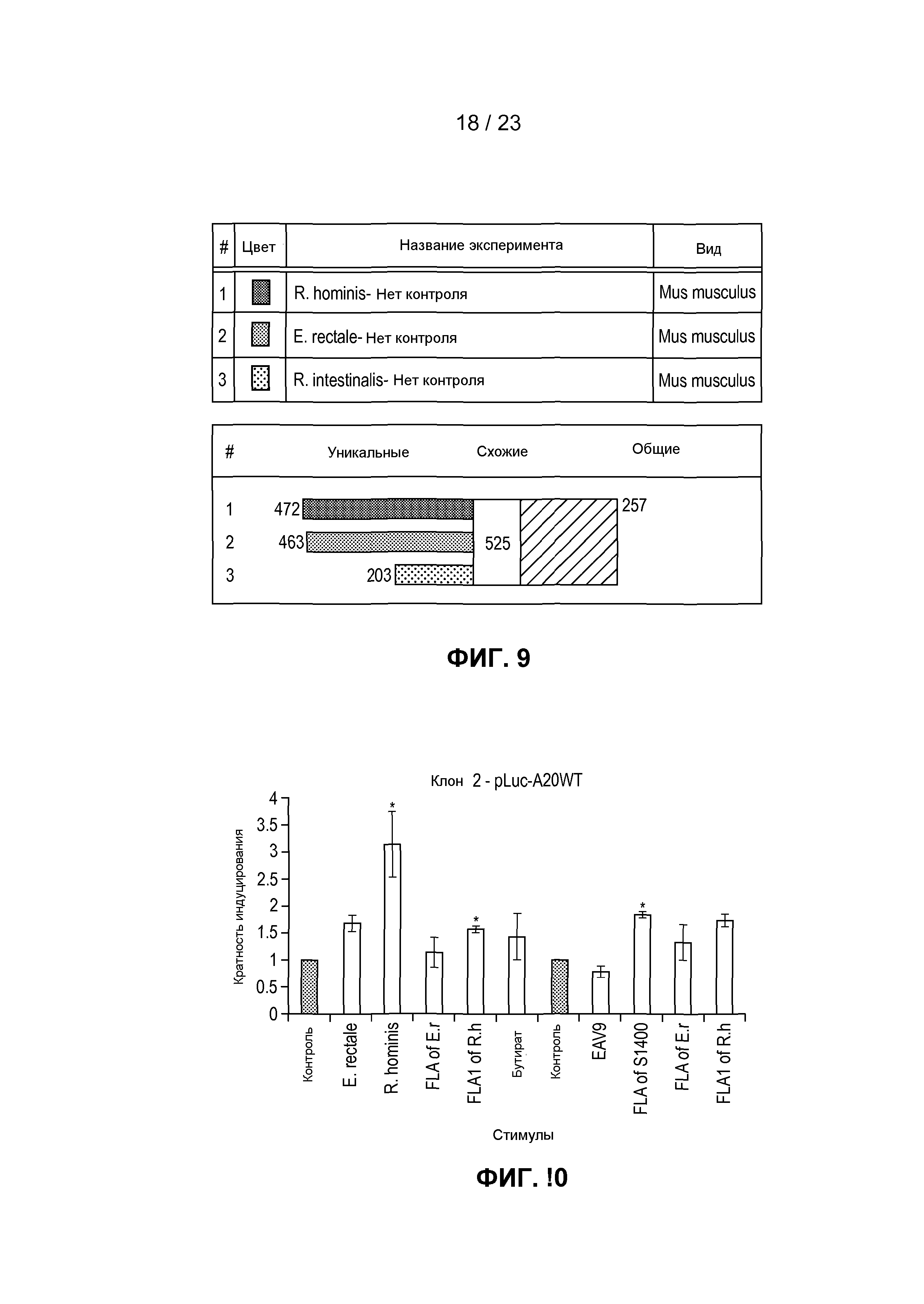
На фиг. 9 продемонстрировано сравнение данных, касающихся экспрессии генов трех штаммов бактерий из кластера XIVa (Firmicutes), а именно Roseburia hominis, E. rectale и Roseburia intestinalis.
На фиг. 10 продемонстрировано, что Roseburia hominis индуцирует A20, негативный регулятор передачи сигналов с участием NF-κB с сильной противовоспалительной активностью, тогда как другие бактериальные штаммы не оказывают эффекта. Составляющая флагеллина Roseburia hominis (FLA1 R. hominis) также индуцирует A20 в отличие от Eubacterium rectale- родственной бактерии. Конкретнее, на фиг. 10 представлена кратность индуцирования A20 E. rectale, R. hominis, FLA E. rectale, FLA1 R. hominis, EAV9, FLA SV1400 относительно контролей.
На фиг. 11 представлено распределение по категориям подсистем для R. hominis A2-183, определенное с помощью RAST, с представлением функциональных подсистем и количества генов в каждой подкатегории.
На фиг. 12 представлено распределение по категориям подсистем для R. inulinivorans DSM 16841 A2-183, определенное с помощью RAST, с представлением функциональных подсистем и количества генов в каждой подкатегории.
На фиг. 13 представлено распределение по категориям подсистем для R. intestinalis L1-82, определенное с помощью RAST, с представлением функциональных подсистем и количества генов в каждой подкатегории.
На фиг. 14 представлено распределение по категориям подсистем для R. intestinalis M50/1, определенное с помощью RAST, с представлением функциональных подсистем и количества генов в каждой подкатегории.
На фиг. 15 представлено распределение по категориям подсистем для Eubacterium rectale ATCC 33656, определенное с помощью RAST, с представлением функциональных подсистем и количества генов в каждой подкатегории.
R. hominis предпочтительно колонизирует ободочную кишку.
Здоровым взрослым безмикробным (GF) мышам C3H/HeN вводили с помощью трех кормлений через желудочный зонд R. hominis в последовательные дни. Успешной колонизации достигали, используя среду для инокуляции, содержащую 3% аскорбиновой кислоты и 2% цистеина, для защиты бактерии от воздействия кислорода. Анализ ткани пищеварительного тракта с помощью флуоресцентной in situ гибридизации (FISH) показал, что R. hominis колонизировали и подвздошную кишку, и ободочную кишку, но был обнаружен в гораздо больших количествах в ободочной кишке. Было также обнаружено, что бактерии тесно связаны со слизистой оболочной ободочной кишки (фиг. 1A). Колонизацию далее оценивали и количественно определяли с помощью ПЦР, используя R. hominis-специфические праймеры с использованием количеств, приближенно равных 1× 1010 бактерий/г фекалий (фиг. 1B и 1C). Фекалии GF животных в соответствии с исследованиями были негативными в отношении присутствия каких-либо бактерий.
В геноме R. hominis обнаруживаются уникальные гены, способствующие взаимодействиям с хозяином.
Была установлена полная геномная последовательность R. hominis A2-183 (фиг. 2A, которая представлена одной хромосомой размером 3592125 п.о. (фиг. 2B). Комментарий к геному, сделанный в автоматическом и ручном режиме с использованием платформы RAST, показал присутствие четырех рибосомных оперонов, 66 РНК и 3273 предсказанных белков. Самая большая группа генов относилась к подсистемной категории - Углеводы (271 генов), кодирующих белки, участвующие в метаболизме углеводов, за которой следовали категории Метаболизм белков (197) и Аминокислоты и производные (175) (фиг. 2B). Другие важные функциональные категории включали Подвижность и хемотаксис (49) и Покой и споруляция (12). Сравнительный геномный анализ показал, что самым близкородственным по показателю геномной структуры и функции среди полных бактериальных геномов является Eubacterium rectale (12), который не является неожиданным, принимая во внимание близкую таксономическую связь с этими организмами (11, 13). Сравнительная реконструкция этих двух геномов с использованием 1095 генов показала, что они отличаются на приблизительно 25% генов. В частности, эти различия охватывали гены, кодирующие важные функции для взаимодействия с хозяином. Например, имеющие отношение к подвижности и хемотаксису гены, кодирующие белки сборки фимбрилл типа IV PilB и PilC, присутствовали в E. rectale, но отсутствовали в R. hominis, тогда как стержневой белок базального тельца жгутика FlgC, белок комплекса крючок-базальное тельце жгутика FliE, белок флагеллин FlaB и белок-переключатель для изменения направления вращения жгутика FliG были присущи только R. hominis. Два бактериальных генома также отличались 42 генами углеводов, что служит отражением их отличных потребностей в питательных веществах.
R. hominis реагирует на среду пищеварительного тракта увеличением экспрессии генов, имеющих отношение к мобилизации и хемотаксису.
Для определения генов, дифференциально экспрессируемых R. hominis в ответ на ассоциацию с хозяином и пищу, был сконструирован микрочип с использованием 6000 фрагментов, созданных с помощью ПЦР из библиотеки для секвенирования с небольшим размером вставок. Последующая оценка с помощью ПЦР в режиме реального времени была выполнена на 42 дифференциально экспрессируемых генах, которые образуют кластеры в специфических районах генома R. hominis, как продемонстрировано на фиг. 2B. Для проведения различий между эффектами среды пищеварительного тракта и компонентами пищи бактериальную ДНК выделяли из четырех различных экспериментальных условий: (i) in vivo - из слепой кишки моноассоциированных мышей; (ii) in vitro - из бактерий, выращенных в средах для культивирования; (iii) in vitro - из бактерий, выращенных в присутствии компонентов пищи; и (iv) - из бактерий, подвергнутых инкубации на поверхности непрерывного слоя клеток Caco-2 и HT-29.
Пятьдесят дифференциально экспрессируемых генов было идентифицировано (in vivo против in vitro) (фиг. 3A). Самым неожиданным обнаружением было очень большое увеличение экспрессии in vivo генов, вовлеченных в конъюгационный/мобилизационный перенос, генов вроде mobA и mobL (фиг. 3B). Присутствие таких генов при исследованиях транскрипции было неожиданным, поскольку поддающиеся определению гены не были отнесены к Фагам, профагам, перемещающимся элементам и плазмидам при определении элементов категорий подсистем. Это различие в обнаружении и отнесении генов, вероятно, обусловлено очевидными ограничениями комментария к подсистемным категориям. Стимулирующий эффект питательных веществ был намного менее выраженным, что наводит на мысль о том, что сама по себе среда пищеварительного тракта является основным индуктором генов, вовлеченных в горизонтальный перенос генов.
Другие индуцируемые средой пищеварительного тракта подсистемы включали Перенос через мембрану, в том числе перенос магния, и Подвижность и хемотаксис, в том числе множество метил-акцептирующих белков хемотаксиса и гены жгутикового оперона (фиг. 3C). R. hominis обладает множеством генов флагеллинов flaA1, flaA2, flaA3 и flaB, и примечательно, что рост в среде пищеварительного тракта мыши активировал экспрессию флагеллинов в этой бактерии, как видно при Вестерн-блоттинге бактерий, выделенных из in vivo колонизированных мышей, используя специфические в отношении флагеллинов R. hominis антитела (фиг. 3D). Это находится в соответствии с прежними сообщениями, указывающими на то, что только некоторые субпопуляции Firmicutes образуют жгутик in vivo (14).
Неудивительно, что питательные вещества оказывали наибольшее влияние на экспрессию генов катаболических путей метаболизма в R. hominis в среде пищеварительного тракта (фиг. 3E). Вовлеченные в это гены включали ацетил-КоA-ацетилтрансферазу, 3-гидроксиацил-КоА-дегидрогеназу, бутирил-КоА-дегидрогеназу и фосфоенолпируваткарбоксикиназу [ATP]. Хотя регуляция этих генов запускалась в основном с помощью питательных веществ, в более поздней точке отбора образца было также очевидно воздействие хозяина. Неожиданно среда хозяина уменьшала экспрессию некоторых генов, участвующих в метаболизме происходящих от хозяина веществ, таких как глюкуронат, который распространен среди углеводных цепей протеогликанов слизистой оболочки.
Для дальнейшего исследования эффектов адаптации к хозяину на транскриптом R. hominis была выполнена in vitro стимуляция эпителиальных клеток кишечника человека (Caco-2 и HT-29). Она показала, что белок 1 mobA/mobL вовлеченного в конъюгационный/мобилизационный перенос гена, индукция которого наблюдалась в результате адаптации к пищеварительному тракту мыши, также увеличен в обеих линиях клеток (фиг. 3F). В соответствии с in vivo данными, экспрессия гена флагеллина MotA была увеличена в клетках Caco-2. Гены, вовлеченные в метаболизм бутирата, продемонстрировали различия между двумя линиями клеток, с уменьшением экспрессии, отмечаемым в клетках Caco-2, и увеличением экспрессии, отмечаемым в клетках HT-29.
R. hominis оказывает воздействие на T-клеточные пути в основном в ободочной кишке.
Колонизация GF мышей R. hominis коррелировала с увеличенной экспрессией генов в пищеварительном тракте, которая была наибольшей в ободочной кишке (фиг. 4A). Дифференциальная экспрессия была наиболее выраженной через 28 дней после колонизации, при этом экспрессия 159 генов была увеличенной, а экспрессия 143 генов была уменьшенной. Количество дифференциально экспрессируемых генов в подвздошной кишке через 14 дней было подобно таковому в восходящей части ободочной кишки, при этом экспрессия 79 была увеличенной, а экспрессия 119 генов была уменьшенной. Дифференциальная экспрессия в подвздошной кишке была очень низкой через 28 дней, в соответствии с уменьшенными уровнями колонизации. Транскриптомный ответ отличался в эти два момента времени, что продемонстрировано по отчетливому расхождению значимых транскриптов с помощью анализа карты интенсивностей (фиг. 4B). Положительная оценка с помощью ПЦР в режиме реального времени данных Affymetrix представлена на фиг. 4C.
Большинство путей, на которые оказывалось воздействие через 14 дней, в подвздошной кишке и восходящей части ободочной кишки группировалось в категории: Дифференциация клеток, Регуляция клеточного цикла и Ремоделирование ткани. Важно, что иммунный ответ был основной группой путей, индуцированных через 28 дней в восходящей части ободочной кишки. 36 путей, на которые оказывалось значительное воздействие, в этой категории были в основном вовлечены в функционирование T-клеток и включали путь передачи сигналов с участием IL-10, путь с участием ICOS в Т-клетках-хелперах и регуляцию функционирования T-клеток с помощью CTLA-4. Гены, вовлеченные в эти пути, продемонстрировали как увеличение экспрессии, так и уменьшение экспрессии, поэтому, несмотря на то, что на эти пути оказывало значительное влияние присутствие R. hominis, требуется дальнейшее изучение определенных совокупных функциональных эффектов на дифференциацию T-клеток. Однако увеличенная экспрессия IL-10, CD3ε и IL-13 и измененная экспрессия IFN-γ были подтверждены с помощью ПЦР в режиме реального времени (фиг. 7), что наводит на мысль о том, что колонизация R. hominis может помогать путям дифференциации регуляторных Т-клеток и Th2. Был применен анализ генных онтологий (GO) для получения дополнительной информации о функциональной классификации дифференциально регулируемых генов. Регуляция GO-процесса для «полимеризации актина» (GO:0030041) (Arpc3, Capg, Cdc42ep5 и Rhoc) была увеличенной через 28 дней в ободочной кишке R. hominis-колонизированных мышей (фиг. 8). Полимеризация актина в иммунном синапсе необходима для активации T-клеток и эффекторной функции. Индукция гена была далее подтверждена с помощью ПЦР в режиме реального времени (фиг. 4C). В целом, эти данные указывают на то, что R. hominis активно воздействует на адаптивный иммунный ответ в ободочной кишке в результате положительного влияния на регуляцию T-клеток.
Связанной с этими результатами была индукция членов семейства Ly6 в восходящей части ободочной кишки. В частности, экспрессия GPI-заякоренного продукта гена Ly6g6c была увеличенной в 25 раз, а экспрессия родственного гена Ly6g6e была увеличенной в 2 раза через 28 дней. Большинство гемопоэтических клеток, в том числе нейтрофилы и плазмацитоидные дендритные клетки, экспрессируют один или более членов семейства Ly6. Кроме того, была предположена возможная роль Ly6 в активации, дифференциации и созревании Т-клеток (15).
Иммуноцитохимический анализ подтвердил увеличенное присутствие Ly6G+, CD11b+ и CD3+ клеток у R. hominis-колонизированных мышей (фиг. 5). В соответствии с данными, показывающими, что в T-клеточных путях в основном преобладали реакции регуляторных T-клеток, было статистически значимое увеличение дважды позитивных CD3+FoxP3+T-клеток в ободочной кишке R. hominis-зараженных мышей. Очевидно, что колонизация R. hominis в виде единственного бактериального вида вызывала значительное увеличение популяции CD3+FoxP3+ клеток, в особенности в ободочной кишке этих мышей.
R. hominis модулирует гены, вовлеченные во врожденный иммунный ответ, и в подвздошной кишке, и в ободочной кишке и ослабляет колит у мышей IL10KO.
Гены, вовлеченные во врожденный иммунитет и функционирование кишечного барьера, были значительно индуцированы в результате присутствия R. hominis в восходящей части ободочной кишки. Регуляция GO-процесса «врожденный иммунный ответ» (GO:0045087) была увеличенной, и этот процесс включал TLR-связанные гены Tlr5, 77r7 и Vnn1. Увеличение экспрессии Tlr5 было интересным, в особенности принимая во внимание соответствующую индукцию жгутиковых генов и присутствие белка флагеллина в R. hominis во время колонизации пищеварительного тракта, и может подразумевать роль этого врожденного пути передачи сигналов в опосредовании других врожденных и адаптивных иммунных ответов. Связь между передачей сигналов с участием TLR5 и CD4+ T-клеточными реакциями недавно была продемонстрирована для жгутиковых патогенов (16). Также была показана роль TLR2 в способствовании колонизации Bacteroides fragilis, размножении регуляторных Т-клеток и иммунном гомеостазе (17).
Другие гены врожденной иммунной системы, на которые оказывал воздействие R. hominis в ободочной кишке, включали гены противомикробных пептидов Defb37, Pla2g3, Muc16 и Itln и вовлеченные в функционирование кишечного барьера гены Sprr1a, Cldn4, Pmp22, Crb3 и Magi3. Гены врожденной иммунной системы, демонстрирующие увеличение экспрессии в подвздошной кишке в ответ на R. hominis, включали Defcr20, Pcgf2, Ltbp4, Igsf8 и Tcfe2a. Примечательно, что Pcgf2 осуществляет негативную регуляцию экспрессии различных цитокинов, хемокинов и рецепторов хемокинов и может играть важную роль в контролировании воспалительных реакций в тканях пищеварительного тракта в ответ на эту бактерию-комменсал. Примечательно, что авторы настоящего изобретения установили негативную регуляцию пути с участием NF-κВ (GO:0043124) с помощью R. hominis, который, подобно B. thetaiotaomicron (19), может вносить вклад в иммунный гомеостаз в результате регуляции с понижением этого каскада воспалительных реакций.
Модель на мышах с выключенным геном IL-10 была использована для проверки терапевтической эффективности R. hominis, благодаря контролированию путей воспаления, а также положительным эффектам на индуцирование регуляторных Т-клеток у мышей, подвергнутых моноассоциации. Мышам вводили дозы (~50 мкл, 1010CFU) трижды в неделю после отлучения от матери в возрасте 20 дней в течение периода времени, составляющего 14 недель. Анализ экспрессии генов для набора провоспалительных биомаркеров показал, что у не подвергнутых воздействию мышей IL-10KO отмечалось сильное увеличение экспрессии всех исследованных генов по сравнению с мышами дикого типа, при этом индукция генов находилась в диапазоне от 4 до 49 раз (фиг. 6A). Индукция провоспалительных генов была значительно меньше у подвергнутых воздействию R. hominis мышей по сравнению с не подвергнутыми воздействию мышами, что указывает на сильное терапевтическое действие при пероральном введении R. hominis. Веса тел подвергнутых воздействию R. hominis мышей были также больше в конце исследования, чем у не подвергнутых воздействию мышей, и этот эффект был статистически значимым у самцов (фиг. 6B). Наконец, гистологический анализ показал наличие сильного воспаления в восходящей части ободочной кишки не подвергнутых воздействию мышей IL-10KO, в то время как подвергнутые воздействию R. hominis животные имели слизистую оболочку ободочной кишки, выглядящую относительно нормальной.
Колонизация R. hominis оказывает воздействие на гены насыщения и состав тела.
Были также очевидны значительные воздействия R. hominis на метаболизм у мышей, подвергнутых моноассоциации. Регуляции всех GO-процессов «негативная регуляция реакции на пищу» (GO:0032096), «негативная регуляция аппетита» (GO:032099) и «регуляция секреции катехоламинов» (GO:0050433) была уменьшенной в восходящей части ободочной кишки после колонизации R. hominis. Эти данные позволяют сделать вывод, что R. hominis проявляет стимулирующий эффект на аппетит у хозяина. Генами, вовлеченными в эти процессы, были Agt, Cartpt, Cck и Cxcl12, при этом кратности изменений находились в диапазоне 2-12 раз. Cck, в частности, играет основную роль в усвоении пищи и насыщении в качестве супрессанта голода. Gcg также продемонстрировал снижение экспрессии в этом месте пищеварительного тракта.
Для установления того, имели ли изменения экспрессии этих генов физиологичную значимость в отношении поглощения пищи и состава тела, были выполнены анализы сухого веса туши и состава. Примечательно, сухой вес туш мышей, подвергнутых моноассоциации с R. hominis, был значительно больше такового GF животных, и различия были наиболее заметными через 14 дней. Дальнейший анализ липидов туш показал, что общее ожирение было также значительно больше у животных, подвергнутых воздействию R. hominis, через 14 дней. Эти данные находятся в соответствии с недавними данными, показывающими роль Firmicutes в получении энергии благодаря ферментации пищи, но также служат подкреплением идеи, что бактерии пищеварительного тракта могут в действительности модулировать нервную регуляцию пищеварительной системы и регулирующие аппетит гормоны.
Обсуждение
Длительная коэволюция мутуализма с участием хозяина и микробов, вероятно, привела к отбору функционально важных видов бактерий в пищеварительном тракте, большая часть из которых не очень представлена в других экосистемах. В настоящее время существует ограниченная информация в отношении вклада отдельных членов микробного сообщества в функционировании кишечника, в частности, в отношении развития иммунной системы в слизистой оболочке.
Недавняя работа с использованием модели обратимой колонизации на основе E. coli (HA 107) показала, что для иммунологического вызова эффектов на IgA требуются живые бактерии в количествах, приблизительно равных 108 CFU на грамм содержимого (20). Недавно были исследованы специфические функции SFB и Bacteroides fragilis в пищеварительном тракте мыши для определения их индивидуальных вкладов в биологию T-клеток, и было установлено, что обе эти бактерии являются сильными индукторами регуляторных T-клеток и Th17-клеток (5, 8, 9). Ранее сообщалось об эффектах отдельных членов кластера XIVa Firmicutes, хотя их присутствие в ASF, который также оказывает влияние на дифференциацию T-клеток, не отмечалось (10).
Заявитель продемонстрировал здесь первую успешную моноассоциацию пищеварительного тракта безмикробной мыши с анаэробной бактерией, R. hominis, которая является членом типа Firmicutes. Чрезмерная чувствительность бактерий вроде Roseburia к кислороду требует строго анаэробных способов культивирования, что делает затруднительным проведение функциональной характеристики. Заявитель установил стабильную моноассоциацию R. hominis с безмикробными мышами и представил полную прокомментированную геномную последовательность для раскрытия ее метаболической организации, физиологии и симбиотических свойств. Было установлено, что транскрипционные ответные реакции R. hominis после колонизации могут быть связаны как со средой пищеварительного тракта хозяина, так и с пищей. Стимулируемые хозяином эффекты доминировали в ответной реакции R. hominis после моноассоциации. Они включали подсистемы: перенос генов, перенос через мембрану, хемотаксис и подвижность. Сильное увеличение экспрессии генов, вовлеченных в мобилизацию/перенос, подкрепляет представление, что среда пищеварительного тракта очень способствует горизонтальному обмену генов между членами микробиоты пищеварительного тракта. Таким образом, эта среда может ускорить распространение генов, важных для выживания, колонизации и функционирования бактерий внутри кишечной экосистемы.
Роль подвижности и жгутикового аппарата в колонизации хозяина достаточно разъяснена для патогенных бактерий, но намного меньше известно о роли жгутиковых белков у бактерий-комменсалов. In vivo эксперименты выявили стимулирующий эффект кишечной среды хозяина на экспрессию генов флагеллинов. Сигналы от флагеллинов воспринимают рецепторы TLR5 хозяина (24), и флагеллиновые структуры многих патогенов вызывают сильные провоспалительные реакции (24). Передача сигналов через TLR5 в ответ на постоянно живущие комменсалы со жгутиками может быть важна для гомеостаза, поскольку устранение TLR5 приводит к самопроизвольному колиту у мышей (25). Поэтому увеличенная экспрессия флагеллина R. hominis in vivo представляет потенциальный интерес. Другая работа показала, что мутантные по флагеллину E. coli обладают преимуществами в плане колонизации по сравнению со штаммами со жгутиками дикого типа, возможно, в результате отсутствия передачи сигналов вследствие врожденного распознавания TLR5 (26, 27). Заявитель установил, что в случае некоторых Firmicutes увеличение экспрессии флагеллина является природной реакцией на колонизацию пищеварительного тракта. Белок флагелллин R. hominis остается экспрессируемым in vivo и корррелирует с длительной колонизацией, отсутствием явного воспаления и ростом T-клеток с регуляторным фенотипом. Следовательно, флагеллиновые структуры комменсалов благодаря TLR5 могут помочь в регулировании ответов в виде иммунотолерантности. Дополнительные данные, основанные на TLR5KO и мутантах по флагеллину R. hominis, в дальнейшем прояснят важность флагеллинов комменсалов в отношении иммунного гомеостаза, но отмечаемый протективный эффект R. hominis у IL-10 KO мышей служит подтверждением этой гипотезы, хотя другие компоненты передачи сигналов, такие как бутират, могут также вносить вклад в иммунорегуляцию.
Была установлена очевидная роль R. hominis в стимуляции функции кишечного барьера и врожденного иммунитета в ободочной кишке мыши. Плотные соединения, щелевидные соединения и адгезионные контакты функционируют для ограничения перемещения бактерий в субэпителиальный слой (28). И болезнь Крона, и неспецифический язвенный колит характеризуются уменьшением функционирования барьера и целостности плотных соединений. Примечательно, что дисбиоз микробиоты пищеварительного тракта при IBD связан с уменьшением Firmicutes (1, 29). Данные наблюдений, что R. hominis активно увеличивает экспрессию барьерных генов, говорят о том, что их уменьшение у пациентов с IBD может быть функционально значимым. Активация комплексов плотных соединений не является прерогативой только R. hominis; другие комменсалы, такие как Bacteroides thetaiotaomicron и Lactobacillus acidophilus, также усиливают функционирование барьера в виде слизистой оболочки (18, 30), что означает противообические возможности при использовании этих бактерий при IBD у человека.
Эффекты R. hominis на иммунную систему пищеварительного тракта были интригующими. Самые сильные эффекты отмечались в восходящей части ободочной кишки, и отмечалась регуляция с сильным повышением таких генов, как Ly6g6c, а также путей, вовлеченных в регуляцию и дифференциацию T-клеток и полимеризацию актина в иммунном синапсе, которые, как установлено, вовлечены в активацию T-клеток и эффекторные функции. Хотя экспрессия генов регуляторных Т-клеток в ответ на колонизацию R. hominis не была очень сильной, пути с участием Т-клеток, на которые оказывалось наибольшее воздействие, включали те, которые связаны с IL-10, ICOS и CTLA-4, все из которых вовлечены в поддержку дифференциации в регуляторные Т-клетки. Важно отметить, что заявитель смог установить значительные увеличения CD3+FoxP3+ клеток в ободочной кишке этих мышей. Эти данные дополняют недавние данные по другим видам Clostridium, которые стимулируют дифференциацию в регуляторные T-клетки. Очевидно, что R. hominis может стимулировать рост Т-клеток в слизистой оболочке и оказывать воздействие на дифференциацию в регуляторные Т-клетки.
Интересно отметить сильные иммунные эффекты в ободочной кишке по сравнению с подвздошной кишкой, в особенности через 28 дней после моноколонизации R. hominis. Данные транскриптомного анализа в день 14 говорят о том, что некоторое премирование иммунной системы могло начаться в подвздошной кишке в этот момент времени. Таким образом, эффекты на различные субпопуляции T-клеток в восходящей части ободочной кишки через 28 дней могут служить отражением распространения и хоуминга клеток из подвздошной кишки в кишечный лимфатический узел в ободочной кишке.
Интересным дополнительным биологическим эффектом колонизации R. hominis была регуляция генов, влияющих на ответные реакции на пищу и контролирование аппетита. В частности, гормоны насыщения Cck и Gcg были значительно уменьшены. Эффекты Cck на поглощение пищи опосредуются вагусным афферентным путем. Он является основным нервным путем, по которому информация о проглоченных питательных веществах достигает центральной нервной системы для оказания влияния как на функционирование пищеварительного тракта, так и на пищевое поведение. Cck воздействует на вагусную систему с уменьшением экспрессии молекул, которые стимулируют аппетит и прием пищи, и с увеличением экспрессии молекул, которые сдерживают прием пищи и уменьшают аппетит (Npy2r и Cartpt - оба с двукратным уменьшением экспрессии в настоящем исследовании). До сих пор не сообщалось о связи между Cck, Gcg и бактериями-комменсалами, однако и жирные кислоты, и белки являются сильными индукторами Cck и Gcg (31). R. hominis продуцирует короткоцепочечные жирные кислоты, такие как бутират, с алифатическими хвостами из менее чем шести атомов углерода; в соответствии с сообщениями эта метаболическая активность уменьшает стимулирующий эффект на Cck в плазме, отмечаемый в случае более длинноцепочечных жирных кислот (32). Примечательно, что анализ веса туш показал, что и вес тела, и содержание липидов действительно значительно увеличивается с помощью R. hominis, в соответствии с увеличениями веса тела, отмечаемыми при конвенционализации безмикробных мышей (33). Является ли это прямым эффектом уменьшения гормонов насыщения, отмечаемым в настоящем исследовании, остается вопросом, поскольку об участии Cck и Gcg ранее не сообщалось. Однако важно подтвердить, что ранее была установлена связь между колонизацией микробиоты и получением энергии из пищи, отчасти благодаря высвобождению SCFA (34). Принимая во внимание то, что R. hominis является основным продуцентом бутирата, этот механизм, вероятно, также вносит вклад в метаболическую эффективность, отмечаемую после воздействия R. hominis.
В заключение, моноассоциация мышиного пищеварительного тракта с R. hominis индуцировала сильные двунаправленные явления экспрессии генов в соответствии с изменениями в переносе через мембрану, хемотаксисе и подвижности этой адаптированной к пищеварительному тракту бактерии и сопутствующей активацией врожденной и адаптивной иммунной системы хозяина. Эта метаболически активная бактерия также продемонстрировала важные эффекты на гены, имеющие отношение к аппетиту и чувству сытости, которые коррелировали с увеличением прироста веса тела у колонизированных мышей.
Композиции
Другой аспект настоящего изобретения относится к композиции, включающей вид бактерий, описанный выше, и фармацевтически приемлемый наполнитель, носитель или разбавитель. Подходящие наполнители, разбавители, носители описаны ниже.
Композицией может быть любая композиция, но предпочтительно она является композицией, которую вводят перорально, энтерально или ректально. Например, композицией может быть съедобная композиция. «Съедобный» означает материал, который санкционирован для потребления людьми или животными.
Другой аспект настоящего изобретения относится к пробиотической композиции, включающей бактериальный вид, описанный выше.
Используемый здесь термин «пробиотик» означает препараты клеток микроорганизмов или компоненты клеток микроорганизмов, обладающие благотворным эффектом на состояние здоровья или благополучие хозяина. (Salminen S, Ouwehand A. Benno Y. et al "Probiotics: how should they be defined" Trends Food Sci. Technol. 1999: 10107-10).
Предпочтительно, когда пробиотическая композиция является перорально вводимой композицией метаболически активных, т.е. живых и/или лиофилизированных, или нежизнеспособных, убитых с помощью нагревания бактерий, подвергнутых облучению, или лизированных бактерий-пробиотиков. Пробиотическая композиция может содержать другие ингредиенты. Пробиотическую композицию по настоящему изобретению можно вводить перорально, т.е. в форме таблетки, капсулы или порошка. Инкапсулированные продукты являются предпочтительными в случае R. hominis, поскольку он является анаэробом. Другие ингредиенты (такие как витамин C, например) могут быть включены в качестве поглотителей кислорода. Вещества-пребиотики, такие как эти, увеличивают колонизацию и выживание in vivo. Альтернативно, пробиотическую композицию по настоящему изобретению можно вводить перорально в виде продукта питания или пищевого продукта, такого как полученный на основе сбраживания молока или сыворотки молочный продукт, или в виде фармацевтического продукта.
Подходящая суточная доза бактерий-пробиотиков составляет от приблизительно 1×103 до приблизительно 1×1011 колониеобразующих единиц (CFU), более предпочтительно - от приблизительно 1×107 до приблизительно 1×1010 CFU, более предпочтительно - от приблизительно 1×106 до приблизительно 1×1010 CFU.
В одном предпочтительном варианте осуществления композиция содержит бактериальный вид и/или его клеточные компоненты, в качестве активных ингредиентов, в количестве от приблизительно 1×106 до приблизительно 1×1011 CFU/г относительно веса композиции, предпочтительно от приблизительно 1×108 до приблизительно 1×1010 CFU/г. Дозой может быть доза, равная 1 г, 3 г, 5 г и 10 г.
Типично пробиотик необязательно объединен с по крайней мере одним подходящим соединением-пребиотиком. Пребиотиком является обычно неперевариваемый углевод, такой как олиго- или полисахарид, или сахароспирт, который не расщепляется или не абсорбируется в верхних отделах пищеварительного тракта. Известные пребиотики включают имеющиеся в продаже продукты, такие как инулин и трансгалактоолигосахариды.
Предпочтительно, когда композиция по настоящему изобретению включает пребиотик в количестве от приблизительно 1 до 30% в весовом отношении, по отношению к общему весу композиции, предпочтительно от 5 до 20% в весовом отношении. Предпочтительные углеводы выбирают из: фруктоолигосахаридов (или FOS), короткоцепочечных фруктоолигосахаридов, инулина, изомальтоолигосахаридов, пектинов, ксилоолигосахаридов (или XOS), хитозан-олигосахаридов (или COS), бета-глюканов, аравийской камеди, модифицированных и устойчивых крахмалов, полидекстрозы, D-тагатозы, волокон акации, рожкового дерева, овса и волокон цитрусовых. Особенно предпочтительными пребиотиками являются короткоцепочечные фруктоолигосахариды (для простоты указанные ниже как FOSs-c.c); указанные FOSs-c.c. представляют собой неперевариваемые углеводы, обычно получаемые при переработке сахарной свеклы и включающие молекулу сахарозы, с которой связаны три молекулы глюкозы.
Кормовые материалы/продукты
Дальнейший аспект настоящего изобретения относится к продуктам питания, пищевым добавкам, БАД, молочным смесям для питания, напиткам и лекарственным средствам, содержащим бактериальный вид, определенный выше, и их применениям.
В одном предпочтительном варианте осуществления композиция включает, кроме того, по крайней мере один другой вид подходящей для пищевых продуктов бактерии, причем подходящую для пищевых продуктов бактерию предпочтительно выбирают из группы, состоящей из лактобактерий, бифидобактерий, пропионибактерий или их смесей.
Один аспект настоящего изобретения относится к продукту питания, включающему вид бактерий, определенный выше. Термин «продукт питания», как предполагается, охватывает все потребляемые продукты, которые могут быть твердыми, застудневевшими или жидкими. Подходящие продукты питания могут включать, например, функциональные продукты питания, пищевые смеси, корм для любимых домашних животных, корм для домашнего скота, диетические продукты, кормовые материалы и т.п. В одном предпочтительном варианте осуществления продуктом питания является диетический продукт.
Используемый здесь термин «функциональный продукт питания» означает пищевой продукт, который способен обеспечить не только питательный эффект, но также способен обеспечить дополнительный благотворный эффект на потребителя. Соответственно, функциональными пищевыми продуктами являются обычные продукты питания, которые содержат включенные в них компоненты или ингредиенты (такие как те, которые здесь описаны), которые придают продукту питания специфическую функцию - например, терапевтическое или физиологическое преимущество - отличную от исключительно питательного действия.
Примеры конкретных продуктов питания, которые применимы для настоящего изобретения, включают продукты на основе молока, готовые десерты, порошки для восстановления влагосодержания с помощью, например, молока или воды, шоколадно-молочные напитки, солодовые напитки, готовые блюда, быстро приготовляемые блюда или напитки для людей или пищевые смеси, представляющие собой полный или частичный рацион, предназначенные для любимых домашних животных или домашнего скота.
В одном предпочтительном варианте осуществления композицией в соответствии с настоящим изобретением является продукт питания, предназначенный для людей, любимых домашних животных или домашнего скота. Композиция может предназначаться для животных, выбираемых из группы, состоящей из собак, кошек, свиней, крупного рогатого скота, лошадей, коз, овец или домашней птицы. В предпочтительном варианте осуществления композицией является продукт питания, предназначенный для взрослых особей, в частности взрослых людей.
В настоящем изобретении «продукт на основе молока» означает любой жидкий или полутвердый продукт на основе молока или сыворотки с различным содержанием жира. Продуктом на основе молока может быть, например, коровье молоко, козье молоко, овечье молоко, снятое молоко, цельное молоко, молоко, рекомбинированное из порошкового молока и сыворотки без какой-либо переработки, или переработанный продукт, такой как йогурт, простокваша, творог, кислое, свернувшееся молоко, кислое, свернувшееся цельное молоко, кефир и другие молочнокислые продукты. Другая важная группа включает молочные напитки, такие как напитки из молочной сыворотки, сквашенное молоко, сгущенное молоко, молоко для грудных детей или детей; молоко с вкусовыми добавками, мороженное; содержащий молоко пищевой продукт, такой как конфеты.
Один аспект настоящего изобретения относится к кормовому материалу или корму для животных, включающему вид бактерий, определенный выше.
Композиции настоящего изобретения могут представлять собой добавки к продукту питания, также называемые здесь пищевыми добавками или добавками к пищевому продукту, или могут добавляться к ним. Таким образом, другой аспект настоящего изобретения относится к пищевой добавке или добавке к пищевому продукту, включающей один или более бактериальных штаммов в соответствии с настоящим изобретением.
Вид бактерий и пробиотические композиции в соответствии с настоящим изобретением могут также использоваться при кормлении животных (например, при кормлении свиней), особенно в период после раннего отлучения от матери и в период доращивания и откорма. Пробиотики, как полагают, усиливают функционирование иммунной системы, ослабляют и предупреждают инфекционные заболевания, выгодно изменяют состав микробиоты и усиливают рост и улучшают характеристики животных, например, благодаря увеличенной эффективности трансформации корма.
Разбавители, наполнители и носители
Как отмечено выше, настоящее изобретение также относится к композициям, более предпочтительно - фармацевтическим композициям или пищевым добавкам, включающим вид бактерий, определенный выше, и их применению. Бактериальный вид, как правило, вводят в смеси с фармацевтически или алиментарно приемлемым носителем, наполнителем или разбавителем, в частности, для лечения людей. Фармацевтические композиции могут предназначаться для применения для людей или животных в медицине и ветеринарии.
Примеры таких наполнителей, подходящих для различных форм фармацевтических композиций, описываемых здесь, можно найти в "Handbook of Pharmaceutical Excipients, 2nd Edition, (1994), Edited by A Wade and PJ Weller.
Приемлемые для терапевтического применения носители или разбавители хорошо известны в фармацевтической области и описаны, например, в Remington's Pharmaceutical Sciences, Mack Publishing Co. (A.R. Gennaro edit. 1985).
Примеры подходящих носителей включают лактозу, крахмал, глюкозу, метилцеллюлозу, стеарат магния, маннит, сорбит и т.п. Примеры подходящих разбавителей включают этанол, глицерин и воду.
Выбор фармацевтического носителя, наполнителя или разбавителя можно сделать, принимая во внимание намеченный путь введения и стандартную фармацевтическую практику. Фармацевтические композиции могут включать в качестве носителя, наполнителя или разбавителя, или помимо него, любое подходящее связующее вещество(а), смазывающее вещество(а), суспендирующий агент(ы), вещество(а) для покрытия, солюбилизатор(ы).
Примеры подходящих связующих веществ включают крахмал, желатин, природные сахара, такие как глюкоза, безводная лактоза, сыпучая лактоза, бета-лактоза, сахаристые вещества из кукурузы, природные и синтетические камеди, такие как аравийская камедь, трагакант или альгинат натрия, карбоксиметилцеллюлозу и полиэтиленгликоль.
Примеры подходящих смазывающих веществ включают олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и т.п.
Консерванты, стабилизаторы, красители и даже корригенты могут быть предусмотрены в фармацевтической композиции. Примеры консервантов включают бензоат натрия, сорбиновую кислоту и эфиры пара-гидроксибензойной кислоты. Могут также использоваться антиоксиданты и суспендирующие агенты.
Алиментарно приемлемые носители, наполнители и разбавители включают те, которые являются подходящими для потребления человеком или животным, и которые используются как стандарт в пищевой промышленности. Типичные алиментарно приемлемые носители, наполнители и разбавители хорошо известны квалифицированному в данной области техники специалисту.
Введение
Композиции по настоящему изобретению можно адаптировать для перорального, ректального, вагинального, парентерального, внутримышечного, внутрибрюшинного, внутриартериального, подоболочечного, внутрибронхиального, подкожного, внутрикожного, внутривенного, назального, трансбуккального или подъязычного путей введения. Предпочтительно, когда композиции по настоящему изобретению адаптированы для перорального, ректального, вагинального, парентерального, назального, трансбуккального или подъязычного путей введения.
В случае перорального введения под конкретным применением понимают прессованные таблетки, пилюли, таблетки, желатиновые капсулы, капли и капсулы.
Другие формы введения включают растворы или эмульсии, которые можно вводить внутривенно, внутриартериально, подоболочечно, подкожно, внутрикожно, внутрибрюшинно или внутримышечно, и которые готовят из стерильных или стерилизуемых растворов. Фармацевтические композиции по настоящему изобретению могут также быть в форме суппозиториев, вагинальных суппозиториев, суспензий, эмульсий, лосьонов, мазей, кремов, гелей, аэрозолей, растворов или присыпок.
Альтернативный способ чрескожного введения осуществляют, используя трансдермальный пластырь. Например, активный ингредиент может быть включен в крем, состоящий из водной эмульсии полиэтиленгликолей или жидкого парафина. Штамм бактерий может также быть включен в мазь, состоящую из основы в виде белого воска или белого мягкого парафина вместе с такими стабилизаторами и консервантами, которые могут потребоваться.
Композиции могут быть приготовлены в стандартной лекарственной форме, т.е. в форме дискретных частей, содержащих стандартную дозу, или их множество, или субъединицу стандартной дозы.
Доза
Специалист со средним уровнем квалификации в данной области техники может без труда определить соответствующую дозу одной из композиций настоящего изобретения для введения субъекту без чрезмерного экспериментирования. Типично врач определит фактическую дозу, которая будет наиболее подходящей для отдельного пациента, и она будет зависеть от ряда факторов, включающих активность конкретного используемого бактериального штамма, метаболической стабильности и продолжительности действия этого штамма, возраста, веса тела, общего состояния здоровья, пола, рациона, способа и времени введения, скорости экскреции, комбинации лекарственных средств, тяжести конкретного состояния и подвергания индивидуума терапии. Раскрытые здесь дозы являются примерами среднего случая. Конечно, могут быть отдельные случаи, когда диапазоны более высоких или более низких доз являются преимущественными, и они находятся в пределах объема этого изобретения.
Обычная эффективная суточная доза для людей или животных составляет от приблизительно 1×103 до приблизительно 1×1011, более предпочтительно от приблизительно 1×107 до приблизительно 1×1011, даже более предпочтительно от приблизительно 1×106 до приблизительно 1×1010 CFU.
Комбинации
В особенно предпочтительном варианте осуществления композиции по настоящему изобретению вводят в комбинации с одним или более других активных агентов. В таких случаях композиции по настоящему изобретению могут вводиться друг за другом, одновременно или последовательно с одним или более другими активными агентами.
Настоящее изобретение далее описано в виде следующих неограничивающих примеров.
ПРИМЕРЫ
Материалы и методы
Условия выращивания бактерий
R. hominis A2-183T (=DSM 16839T=NCIMB 14029T) выращивали в анаэробных условиях на синтетической среде YCFA или среде сложного состава M2GSC. Засев культуры осуществляли из замороженного штока в пробирки Хангейта и осуществляли инкубацию в течение ночи при 37°C. Затем бактерии выращивали на чашках с агаром в M2GSC в течение 48 ч в анаэробном рабочем устройстве MACS-MG-1000 (Don Whitley Scientific) при 80% N2, 10% CО2 и 10% H2 при 37°C. Исследовали эффект муцина посредством добавления 0,5% (в отношении веса к объему) муцина из свиного желудка типа III (Sigma-Aldrich) в среду YCFA.
Для колонизации безмикробных мышей R. hominis выращивали в среде YCFA в течение ночи при 37°C. Культуру подвергали центрифугированию, и осадок ресуспендировали в 1 мл среды YCFA, дополненной 2% цистеина (в отношении веса к объему, Sigma-Aldrich) и 3% аскорбиновой кислоты (в отношении веса к объему, Sigma-Aldrich).
Эксперименты на животных
Эксперименты на безмикробных животных проводили в гнотобиологическом изоляторе для разведения грызунов INRA в Jouy-en-Josas (платформе ANAXE, Institut Micalis, INRA, Jouy-en-Josas, Франция). Все эксперименты на животных были разрешены местной комиссией по этике. Восемнадцать безмикробных самцов мышей C3H/HeN распределяли по группам, включающим контрольную группу (N=8) и группу, подвергаемую воздействию (N=10), и содержали по отдельности в пластиковых изоляторах. Мышей кормили вволю стерильным коммерческим кормом (R03-40; UAR). В день 0 животным в группе, подвергаемой воздействию, вводили с помощью кормления через желудочный зонд 100 мкл культуры R. hominis, в то время как контрольным животным вводили 100 мкл среды YCFA. В день 14 и 28 умерщвляли четырех контрольных животных и пять животных, подвергнутых воздействию R. hominis. Эксперименты на мышах C57/BL6 IL-10KO проводили в Rowett Institute of Nutrition and Health (Aberdeen, Шотландия, Великобритания). Через 14 дней от начала эксперимента исследовали мышей дикого типа (N=8), IL-10KO (N=12) и IL-10KO + R. hominis (N=11). Вкратце, R. hominis вводили 3 раза в неделю в дозе, составляющей 109 cfu/день. Подвздошную кишку, восходящую часть ободочной кишки и нисходящую часть ободочной кишки делили на четыре равные части и переносили в RNAIater (Ambion), нейтральный забуференный формалин (Sigma-Aldrich) или жидкий азот. Всю слепую кишку и поперечную ободочную кишки переносили в RNAIater. Гистопатологию также определяли у мышей IL-10KO.
Эксперименты с использованием культуры тканей
Поставка всех реагентов для культивирования клеток, кроме особо оговоренных случаев, осуществлялась Sigma-Aldrich. 2x105 клеток Caco-2 или HT29 в 1,5 мл среды DMEM (с высоким содержанием глюкозы, HEPES), дополненной инактивированной с помощью нагревания фетальной телячьей сывороткой (Gibco), пенициллином, стрептомицином, амфотерицином B и L-глютамином, засевали в верхние отсеки шестилуночных планшетов со вставками-трансвеллами (Corning). Нижние отсеки содержали 3,0 мл той же среды. Клетки инкубировали при 37°C в атмосфере 5% CО2 до 3 дней после достижения конфлюэнтности, промывали раствором Хенкса для удаления антибиотиков и FCS и переводили в DMEM, дополненную L-глютамином, селенитом натрия и трансферрином, на 24 ч без антибиотиков. Вставки-трансвеллы затем переносили в анаэробный бокс для культивирования внутри анаэробного рабочего устройства при 37°C. Верхний отсек от каждой вставки заполняли анаэробной средой для клеток DMEM, в то время как нижний отсек заполняли насыщенной кислородом средой DMEM.
Культуру R. hominis A2-183 собирали в экспоненциальной фазе посредством центрифугирования при 3500× g в течение 5 мин. Осадок промывали и ресуспендировали в 0,8 мл анаэробной среды DMEM. Сто микролитров бактериальной суспензии (108CFU/мл) добавляли в экспериментальные лунки. В контрольные лунки вносили то же количество среды без бактериальных клеток. Дополнительный контроль включал бактериальные клетки, подвергнутые инкубации без клеток Caco-2 или HT29.
Бактериальные и эукариотические клетки собирали после инкубации в течение 2 ч и 4 ч. И не прикрепленные, и прикрепленные бактерии аспирировали и хранили в RNAIater. Жизнеспособность клеток R. hominis проверяли посредством высева на чашки с YCFA. Клетки Caco-2 или клетки HT-29 собирали из лунок и также хранили в RNAIater.
Конструирование библиотеки R. hominis
Хромосомную ДНК R. hominis для конструирования библиотеки небольшого размера и пиросеквенирования выделяли, используя набор для выделения микробной ДНК UltraClean™ (Mo Bio Laboratories Inc), а высокомолекулярную ДНК для библиотек в фосмидах выделяли, используя набор для очистки геномной ДНК Wizard (Promega). Целостность ДНК проверяли с помощью гель-электрофореза.
ДНК подвергали механической деградации в результате гидродинамического сдвига, используя набор Nebulizer (Invitrogen), и фракционировали с помощью гель-электрофореза. Фрагменты ДНК желаемого размера вырезали из геля и очищали, используя систему для очистки из ПЦР-смеси и агарозного геля Wizard® (Promega). Концевую репарацию осуществляли с помощью набора для концевой репарации DNA Terminator® (Lucigen). Фрагменты размером 1,5-3,5 т.п.о. клонировали, используя набор CloneSmart® LCAmp (Lucigen), и библиотеку рекомбинантных ДНК размером 4-8 т.п.о. конструировали, используя вектор pJA2Z®-OCr (Lucigen). Библиотеки в фосмиде конструировали, используя набор для создания библиотеки в фосмиде CopyControl™ (Epicentre Biotechnologies). Колонии отбирали, используя автоматическое устройство для захвата колоний (BioRobotics BioPick, Genomic Solutions), и архивировали в 384-луночных титрационных микропланшетах, содержащих 70 мкл среды 2xLB, дополненной 10% глицерина и соответствующим антибиотиком. Клетки выращивали в течение ночи при 37°C со встряхиванием и хранили при -80°C.
Секвенирование, компоновка и комментарий
Матрицы для секвенирования библиотек небольшого размера создавали с помощью ПЦР, используя один мкл биомассы клона и праймеры SL1 и SR2, окружающие сайт для клонирования pSMART-LCAmp. Продукты ПЦР очищали, используя фильтровальные пластины для очистки продуктов ПЦР Multiscreen (Millipore). Рекомбинантную ДНК из клонов pJAZZ®-OC выделяли, используя систему для очистки плазмидной ДНК Wizard® SV 96 Plasmid DNA Purification System (Promega). Фосмидную ДНК выделяли, используя набор для очистки ДНК FosmidMAX™(Epicentre). Концевые считывания фрагментов ДНК из библиотек R. hominis WGS с различными размерами вставок получали, используя ДНК-секвенаторы CEQ8000 (Beckman Coulter) и ABI 3770 (Applied Biosystems). Геномную ДНК R. hominis также секвенировали, используя секвенаторы 454 GS20 (454 Life Sciences) и 454 FLX (Roche). Компоновку данных секвенирования по Сенгеру и 454 осуществляли с использованием версии 3 MIRA (http://cheyreux.org/proiects mira.html; (35)). Цепочку процессов для комментариев RAST (http://rast.nmpdr.org;(36)) использовали для комментария в автоматическом и ручном режиме и для сравнительных геномных анализов. Снабженная комментариями геномная последовательность R. hominis A2-183 была передана в GenBank под идентификационным номером CP003040.
Анализы с использованием биологических микрочипов
Бактериальный микрочип
Бактериальную РНК выделяли из содержимого слепой кишки мыши, используя мининабор RNeasy, и подвергали дальнейшей обработке с использованием набора MICROBEnrich™ (Ambion), набора для обогащения бактериальной мРНК MICROBExpress™ (Ambion) и набора для амплификации РНК бактерий MessageAmp™ II (Applied Biosystems). Осуществляли мечение РНК или dCTP-Cy3, или dCTP-Cy5 во время синтеза кДНК (с использованием набора для мечения кДНК во время синтеза первой цепи; Amersham). Меченые продукты очищали, используя набор для очистки CyScribe GFX (Amersham). Продукты ПЦР, амплифицированные из 6000 клонов в библиотеке RA8, располагали в определенном порядке в двух повторах на покрытых аминосиланом предметных стеклах (Corning), используя MicroGrid II TAS (BioRobotics). Амплифицированные фрагменты генов «домашнего хозяйства» rpoD и gyrA беспорядочно распределяли по чипу в качестве контролей. Гибридизацию микрочипа выполняли в устройстве для гибридизации GeneTAC (Genomic Solutions). Осуществляли смену мечения красителем для второй гибридизации, и РНК отдельной отчистки также метили и подвергали дважды гибридизации для обеспечения воспроизводимости и получения статистически значимых результатов. Всего четыре предметных стекла были подвергнуты гибридизации для каждого сравнения, для всего 12 гибридизующихся пятен на каждый амплифицированный клон. Флуоресценцию измеряли с использованием двух каналов, используя GeneTAC LS IV (Genomic Solutions), с использованием программного обеспечения GeneTac Integrator версии 3.0.1. Интенсивности пятен были подвергнуты логарифмическому преобразованию, и Loess-нормализация была применена для исключения различий в эффективностях мечения и гибридизации зондов. Одновыборочные t-критерии были использованы в отношении значений коэффициентов перед логарифмом для проверки дифференциальной экспрессии. Данные считались значимыми, когда кратность изменения >2 и P<0,05.
Анализ с использованием мышиного микрочипа
Ткань подвздошной кишки и восходящей части ободочной кишки извлекали из RNAIater и лизировали в Тризоле (Invitrogen). РНК выделяли, используя стандартные стадии с использованием хлороформа/изопропанола. Тотальную РНК далее очищали, используя набор Rneasy (Qiagen), включая стадию расщепления ДНКазой I, не содержащей РНКазу (Qiagen). Целостность РНК определяли, используя биоанализатор Agilent 2100 (Agilent Technologies). Тотальную РНК превращали в меченную биотином кРНК, используя набор для мечения мишени за один цикл (Affymetrix). Гибридизацию с генным чипом, включающим маркеры генома мыши, (Affymetrix) в устройстве GeneChip Fluidics Station 450 (Affymetrix) выполняли в Institute of Medical Sciences Microarray Core Facility (University of Aberdeen, Великобритания). Чипы сканировали с использованием сканнера Affymetrix GeneChip Scanner 3000 (Affymetrix). Анализ качества изображения выполняли, используя программное обеспечение для манипулирования генными чипами (GCOS) (Affymetrix). Дальнейший анализ данных выполняли с использованием широкодоступных пакетов программ R (http://www.r-proiect.org) и Bioconductor (http://www.bioconductor.org). Модерируемый критерий Фишера, предусматриваемый пакетом LIMMA Bioconductor, использовали для проверки дифференциальной экспрессии. Данные считались значимыми, когда P<0,05, используя способ обнаружения ложноположительных результатов Бенжамини и Хочберга. Статистический анализ выполняли отдельно для каждого из двух моментов времени. Все дифференциально экспрессируемые гены (P<0,05) вводили в аналитическое программное обеспечение MetaCore (GeneGo, St Joseph, MI) для создания карт путей. Анализ получения дополнительной информации об интегрируемых путях выполняли, используя основанные на знаниях канонические пути и эндогенные метаболические пути. Ранжирование соответствующих интегрированных путей был основан на p-значениях, рассчитанных, используя гипергеометрическое распределение. P-значения представляли собой вероятность того, что конкретное число генов из списка ввода будет случайно соответствовать определенному числу генов на карте, учитывая количество генов в эксперименте в сравнении с количеством генов на карте внутри полной совокупности всех генов на картах.
Основанную на генной онтологии (GO) интерпретацию данных выполняли, используя DAVID (http://david.abcc.ncifcrf.gov)-расширенную версию исходной веб-доступной программы (37). Значимо различные транскрипты (P<0,05) относили к GO категории «Биологический процесс» для обнаружения картин экспрессии генов, значительно обогащенных в отношении конкретных GO терминов.
Данные, полученные с использованием микрочипов, передали в Сборник данных об экспрессии генов Национального центра биотехнологической информации (NCBI) (идентификационный номер GSE25544:http://www.ncbi.nlm.nih.gov/geo).
Анализ с помощью ПЦР в режиме реального времени
Специфические в отношении бактерий праймеры для ПЦР были разработаны, используя средство в диалоговом режиме Primer3Plus (38) и приобретены у Sigma-Aldrich. Анализ с помощью ПЦР в режиме реального времени был выполнен, используя систему 7500 Fast Real-Time PCR System (Applied Biosystems) с использованием смеси Power SYBR Green PCR Master Mix (Applied Biosystems). ПЦР выполняли, как указано далее: один цикл при 95°C в течение 10 мин, с последующими 40 циклами при 95°C в течение 15 сек и при 60°C в течение 1 мин, заканчивающимися стадией диссоциации. Анализ всех образцов выполняли в трех повторах. GyrA использовали в качестве контрольного гена для нормализации вследствие его низкой степени вариации между образцами.
Для анализа экспрессии генов хозяина 2 г тотальной эукариотической РНК, выделенной из подвздошной кишки и восходящей части ободочной кишки, превращали в результате обратной транскрипции в кДНК, используя набор High Capacity cDNA Reverse Transcription Kit (Applied Biosystems) с использованием неспецифических праймеров. Анализ с помощью ПЦР в режиме реального времени был выполнен, используя систему 7500 Fast Real-Time PCR System (Applied Biosystems) с использованием набора QuantiFast SYBR Green PCR Kit (Qiagen) и анализов QuantiTect Primer Assays (Qiagen). Условиями выполнения циклов ПЦР были следующие условия: один цикл при 95°C в течение 5 мин, с последующими 40 циклами при 95°C в течение 10 сек и при 60°C в течение 30 сек, заканчивающимися стадией диссоциации. Анализ всех образцов выполняли в трех повторах. Hprt был выбран в качестве контрольного гена для нормализации из-за его низкой степени вариации между образцами. Все данные, полученные в результате ПЦР в режиме реального времени, анализировали по логарифмической шкале с основанием 2 с использованием проверки по критерию Стьюдента, допускающим неодинаковые дисперсии с уровнем значимости (границей отсечки) P<0,05. Различия были подвергнуты обратному преобразованию для расчета кратностей изменений.
Вестерн-блоттинг
Иммуноочищенные кроличьи поликлональные антитела против Roseburia hominis Fla2 были продуцированы, как описано в Duck et al (39). Вкратце, новозеландских белых кроликов иммунизировали синтетическим пептидом в полном адъюванте Фрейнда и подвергали бустер-иммунизации несколько раз. Для R. hominis использовали пептид 261-275 (C-AQYNDDAKSVLEILK-COOH) и пептид 58-71 (C-GLNKASRNSQDGIS-CONH2) fla2. После иммунизации антитела подвергали очистке на иммуноаффинной колонке, приготовленной посредством соединения пептидов с 1 мл гранул Сефарозы.
Для Вестерн-блоттинга содержимое восходящей части ободочной кишки суспендировали в буфере Лэмли, содержащем 8 M мочевину. Биомассу R. hominis (положительный контроль) разбавляли в том же буфере. Тридцать мкл каждого образца вносили в лунки 4-12% геля в Bis-Tris NuPAGE® Novex® (Invitrogen) и подвергали электрофорезу, с последующей дополнительной обработкой, используя хемилюминесцентную систему для иммунодетекции WesternBreeze (Invitrogen). Антитело против Fla2 разбавляли 1:1000 в разбавителе для антитела и инкубировали в течение ночи при 4°C, а затем в течение 1 ч при комнатной температуре с конъюгированным с щелочной фосфатазой антикроличьим антителом. Детектирование осуществляли, используя систему формирования и обработки изображений Fuji LAS3000.
Сухой вес тела и липидных анализ туш
Нутрированную тушу мыши взвешивали, лиофилизировали до постоянного веса, а затем размалывали для анализа. Содержание липидов определяли посредством экстракции (1:100 в отношении веса к объему) смесью хлороформ/метанол (2:1 в весовом отношении), как ранее описано (40).
Анализ с использованием FISH (флуоресцентной гибридизации in-situ)
Анализ с использованием FISH выполняли на срезах тканей пищеварительного тракта, используя зонд для всех бактерий Eub338 и вновь разработанный, специфический в отношении R. hominis A2-183 зонд.
Ткани, фиксированные в нейтральном забуференном формалине, заливали Technovit 8100 (Heraeus Kulzer). Делали срезы толщиной два микрона, используя колесный микротом (Leica/Reichert Autocut). Три среза в 100 мкм, 200 мкм и 300 мкм в ткани располагали на каждом предметном стекле, что приводило к девяти срезам на каждое животное.
Предметные стекла обезвоживали с помощью последовательной инкубации в 50% (в объемном отношении), 80% и 96% этаноле и сушили при комнатной температуре. Используемыми для FISH зондами для 16S рРНК были зонд для всех бактерий Eub338 (GCTGCCTCCCGTAGGAGT; Cy3) и вновь разработанный, специфический в отношении R. hominis A2-183 зонд (GTACATTACATACTCTGTCAGTG; FITC), который прошел всесторонние испытания в отношении специфичности на фоне панели кишечных бактериальных изолятов. Десять микролитров зонда (30 нг/мкл) в 100 мкл буфера для гибридизации применяли к обезвоженному образцу и инкубировали при специфической для зонда температуре. Предметные стекла промывали в буфере для промывки при 50°C в течение 30 мин, макали в холодную как лед воду для удаления остаточного буфера для промывки и сушили в потоке сжатого воздуха. Контрастирующее окрашивание выполняли с использованием 4',6-диамидино-2-фенилиндола (DAPI; Vector Laboratories Inc), и предметные стекла заливали заливочной средой для флуоресценции Vectashield (Vector Laboratories Inc) для предотвращения выцветания. Визуализацию бактерий осуществляли, используя флуоресцентный микроскоп Leica DM RBE (Leitz GMBH), и их фотографировали с использованием фотоаппарата Penguin 600CL (Pixera) и программного обеспечения Viewfinder 3.0 (Studio Lite). Изображения с большим увеличением (x63) извлекали, используя систему Apochromatics (Leica).
Иммунофлуоресценция
Иммунолокализацию T-клеточных маркеров исследовали на последовательных криосрезах (8 мкм). Срезы фиксировали или в предварительно охлажденном метаноле в течение 30 мин при -20°C (Ly6G FITC, CD3 FITC, CD11b FITC - все в разведении 1:50 (BD Biosciences)) или, в случае FoxP3 с двойном меткой (1:500, Abeam) с использованием CD3 FITC (1:100, BD Biosciences), фиксировали в 1% параформальдегиде (PFA) в течение 2 мин при комнатной температуре, а затем в течение 3 мин в 0,01% Triton X в PBS. Все срезы блокировали с использованием 10% BSA (Sigma), содержащего 10% соответствующих сывороток до иммунизации в PBS (pH 7,4). Фиксированные в метаноле ткани инкубировали с первыми антителами в течение 1 ч при комнатной температуре. Фиксированные в PFA срезы инкубировали с антителами в течение ночи при 4°C. FoxP3 визуализировали, используя меченные Alexa козьи антикроличьи антитела 594 (1:1000, Molecular Probes). Срезы метили контрастной меткой DAPI и заливали Vectashield (Vector Laboratories). Для определения количества позитивных клеток минимум пять полей зрения из каждого мышиного среза исследовали, используя программное обеспечение для обработки изображений и настройки микроскопа, описанные выше.
Гистология
Образцы тканей фиксировали в течение трех часов в фиксаторе Карноя (60% (в объемном отношении) этанола, 30% (в объемном отношении) хлороформа и 10% (в объемном отношении) ледяной уксусной кислоты) при комнатной температуре при постоянном перемешивании. Образцы переносили в 70% этанол и хранили при комнатной температуре до ориентирования для изготовления поперечных срезов и заливки смолой холодного отверждения, используя Technovit 8100 (Heraeus Kulzer) в соответствии с инструкциями производителя. Залитую ткань монтировали на Histobloc, используя Technovit 3040 (Heraeus Kulzer). Делали четырехмикронные срезы, используя колесный микротом (Leica Autocut), оснащенный стеклянным ножом (TAAB Laboratories Equipment Ltd.). Тканевые срезы окрашивали, используя стандартные способы с использованием гематоксилина/эозина, и исследовали с использованием микроскопа Zeiss Axioskop, оснащенного объективами × 10 и × 20. Изображения получали, используя фотоаппарат Qlmaging и программное обеспечение Image Pro Plus.
Сравнение геномов родственных Roseburia видов и штаммов
Заявитель установил полную геномную последовательность R. hominis A2-183, которая представлена одной хромосомой размером 3592125 п.о. Комментарий к геному, сделанный в автоматическом и ручном режиме с использованием платформы RAST, показал присутствие четырех рибосомных оперонов, 66 РНК и 3273 предсказанных белков. Распределения по категориям подсистем для R. hominis A2-183, R. inulinivorans DSM 16841, R. intestinalis L1-82, R. intestinalis M50/1 и Eubacterium rectale ATCC 33656 продемонстрированы на фиг. 11-15, соответственно.
Эта информация демонстрирует различия в количестве генов (представленном в скобках) в каждой функциональной подсистеме. Эти гены очень важны в опосредовании реакции хозяина на каждую отдельную бактерию. Важно, что эти гены как по количеству, так и по функции, отличаются между различными штаммами. Результаты суммированы ниже:
R. hominis A2-183
Клеточная стенка и капсула (57)
Перенос через мембрану (24)
Подвижность и хемотаксис (49)
Регуляция и передача сигналов в клетке (16)
Покой и споруляция (12)
Углеводы (271)
E. rectale ATCC 33656
Клеточная стенка и капсула (41)
Перенос через мембрану (13)
Подвижность и хемотаксис (16)
Регуляция и передача сигналов в клетке (9)
Покой и споруляция (6)
Углеводы (172)
R. intestinalis L1-82
Клеточная стенка и капсула (35)
Перенос через мембрану (36)
Подвижность и хемотаксис (15)
Регуляция и передача сигналов в клетке (10)
Покой и споруляция (17)
R. intestinalis M50/1
Клеточная стенка и капсула (28)
Перенос через мембрану (37)
Подвижность и хемотаксис (17)
Регуляция и передача сигналов в клетке (10)
Покой и споруляция (17)
Углеводы (201)
R. inulinovorans DSM 16841
Клеточная стенка и капсула (69)
Перенос через мембрану (26)
Подвижность и хемотаксис (14)
Регуляция и передача сигналов в клетке (9)
Покой и споруляция (17)
Углеводы (160)
Процент идентичности последовательностей >3000 генов, обнаруженных в контиге 1, подчеркивает различия между геномами бактерии R. hominis и бактерий E. rectale, R. intestinalis и R. inulinivorans.
Были осуществлены сравнения между геномами различных видов Roseburia и родственного вида Eubacterium rectale, с наибольшим родством к R. hominis.
R. hominis ссылочный геном 585394.12
E. rectale геном ATCC336556 515619.3
R. intestinaiis L1-82166486.4
R. intestinaiis M50/1166486.5
R. inulinovorans DSM16841 622312.3
Процент идентичности вероятных генов между различными геномами Roseburia находится в диапазоне от 0% до приблизительно 90% идентичности последовательностей. Многие гены являются гипотетическими и варьируют между штаммами. В геноме R. hominis присутствует большое количество генов, которые отсутствуют в геномах других видов Roseburia.
Roseburia hominis содержит 924 генов, которые не обнаруживаются в геномах других видов Roseburia (составляющая 0% идентичность), что означает, что почти 25% его генома присущи только R. hominis. Также низкая степень гомологии между другими генами (<10-70%) указывает на то, что функции многих других генов, вероятно, также отличаются.
Эта информация обеспечивает убедительные данные, что эти бактерии очень отличаются, что касается генома и функций, и не могут быть сгруппированы, кроме как по их филогенетическому родству, которое, как правило, основывается на консервативном гене 16S рРНК, который является консервативной частью прокариотической ДНК, обнаруживаемой у всех бактерий. Последовательности генов 16S рРНК используются для филогенетических и таксономических исследований бактерий (общий генетический маркер).
Функция, что касается ответной реакции хозяина и иммунитета, является специфической для бактериального штамма.
На фиг. 9 продемонстрировано сравнение данных, касающихся экспрессии генов трех штаммов бактерий из кластера XIVa (Firmicutes), а именно Roseburia hominis, E. rectale и Roseburia intestinalis. Данные означают количество уникальных генов, экспрессируемых филогенетически родственными бактериальными штаммами после подвергания воздействию эпителиальных клеток человека. Экспрессию генов определяли, используя микрочипы Affymetrix, содержащие 56000 генов человека. Эта разница служит отражением различий в их соответствующих геномах. [Эти эксперименты схожи с экспериментами, описанными в другом месте в этом описании, с использованием мышиных микрочипов, но в них использовались специфические для человека микрочипы. Микрочип GeneChip® Human Genome U133 Plus 2.0 Array представляет собой первый и охватывающий в наибольшей степени весь геном человека экспрессионный биочип. Микрочип Affymetrix GeneChip® Human Genome U133 Plus 2.0 Array (HG-U133 Plus 2.0) включает 1300000 деталей - уникальных олигонуклеотидов, охватывающих свыше 47000 транскриптов и вариантов, которые, в свою очередь, представляют приблизительно 39000 из самых охарактеризованных генов человека. Линии клеток, использованные для оценки ответов сигнальной системы, индуцируемых различными бактериями-комменсалами, включают клетки Caco-2 и клетки HT-29 линий клеток ободочной кишки человека и бактерии, включающие R. hominis, E. rectale и R. intestinalis, в случаях сравнения с Salmonella enteritidis - кишечным патогеном.
Функциональные различия бактерий кластера XIVa - сравнение между R. hominis и E. rectale
На фиг. 10 продемонстрировано, что Roseburia hominis индуцирует A20 - негативный регулятор передачи сигналов с участием NF-κB с сильной противовоспалительной активностью, тогда как другие бактериальные штаммы не оказывают эффекта. Составляющая флагеллина Roseburia hominis также индуцирует A20 в отличие от Eubacterium rectale - родственной бактерии.
Поставка всех реагентов для культивирования клеток, кроме особо оговоренных случаев, осуществлялась Sigma-Aldrich. Линии клеток Caco-2 (ECACC каталожный № 860102002) и HT29 (ATCC), подвергнутые культивированию в модифицированной Дульбекко среде Игла (DMEM), дополненной 10% фетальной телячьей сывороткой (FBS) (Gibco, Великобритания), 200 мМ L-глютамином и 1% антибиотиков/антимикотиков, засевали в шестилуночный планшет со вставками-трансвеллами (Corning). Клетки инкубировали при 37°C в атмосфере 5% CО2 до 3 дней после достижения конфлюэнтности, промывали раствором Хенкса для удаления антибиотиков и FCS и переводили в DMEM, дополненную L-глютамином, селенитом натрия и трансферрином, на 24 ч без антибиотиков. Вставки-трансвеллы затем переносили в анаэробный бокс для культивирования внутри анаэробного рабочего устройства при 37°C. Верхний отсек от каждой вставки заполняли анаэробной средой для клеток DMEM, в то время как нижний отсек заполняли насыщенной кислородом средой DMEM.
Roseburia hominis A2-183 и E. rectale ATCC336556 в стандартных средах для культивирования YCFA и M2 и Salmonella enteric серовар enteritidis, подвергнутый культивированию в LB бульоне, собирали в экспоненциальной фазе посредством центрифугирования при 3500× g в течение 5 мин. Осадок промывали и ресуспендировали в анаэробной среде DMEM. Сто микролитров бактериальной суспензии (108CFU/мл) добавляли в экспериментальные лунки. В контрольные лунки вносили то же количество среды без бактериальных клеток. Дополнительный контроль включал бактериальные клетки, подвергнутые инкубации без клеток Caco-2 или HT29.
Бактериальные и эукариотические клетки собирали после инкубации в течение 2 ч и 4 ч. И не прикрепленные, и прикрепленные бактерии аспирировали и хранили в RNAIater. Клетки Caco-2 или клетки HT-29 собирали из лунок и также хранили в RNAIater.
Анализ люциферазы для определения экспрессии гена люциферазы A20
Реагент для трансфекции Fugene® (Roche, Великобритания) использовали для трансфекции клеток HT29 плазмидами, содержащими ген люциферазы-репортера под контролем промотора A20 pLuc-A20 и pLuc-A20Δ NF-κB (с 3 мутациями нуклеотидов в районе промотора A20) и ген GFP-репортера под контролем промотора A20 pCAGGS-GFP\A20 и pLuc-GL2\NF-κB. Через 48 ч клетки стимулировали живыми бактериями R. hominis, E. rectale и S. enteritidis и рекомбинантными флагеллинами; S. enteritidis и R. hominis (Fla 1) (100 нг/мл) в течение 9, 12 и 24 ч. Рекомбинантный флагеллин создавали, используя полноразмерные последовательности, клонированные в соответствующие векторы и экспрессированные в E. coli JM109, BL21 и Rosetta. Активности люцифераз (светляков - f-Luc и Renilla - r-Luc) определяли, используя систему для анализа люциферазы Dual-Glo® (Promega, Великобритания) и считывающее устройство Envision 2102 Multilabel Reader. Относительные активности люциферазы-репортера получали посредством нормализации к контролю Renilla.
Квалифицированным в данной области техники специалистам будут очевидны различные модификации и вариации описанных аспектов настоящего изобретения, не выходящие за пределы объема и сущности настоящего изобретения. Хотя настоящее изобретение было описано в связи с конкретными предпочтительными вариантами осуществления, следует понимать, что заявленное изобретение не должно неоправданно ограничиваться такими конкретными вариантами осуществления. Действительно, различные модификации описанных способов реализации настоящего изобретения, которые будут очевидны квалифицированным в соответствующих областях специалистам, как предполагается, находятся в пределах объема следующей формулы изобретения.
СПИСОК ЛИТЕРАТУРЫ
1. Spor, A., Koren, O., & Ley, R. (2011) Unravelling the effects of the environment and host genotype on the gut microbiome. Nat. Rev. Microbiol. 9: 279-290.
2. Eckburg, P.B., Bik, E.M., Bernstein, C.N., Purdom, E., Dethlefsen, L, Sargent, M., Gill, S.R., Nelson, K.E., & Relman, D.A. (2005) Diversity of the human intestinal microbial flora. Science 308: 1635-1638.
3. Macpherson, A.J., Hunziker, L, McCoy, K., & Lamarre, A. (2001) IgA responses in the intestinal mucosa against pathogenic and non-pathogenic microorganisms. Microbes. Infect. 3: 1021-1035.
4. Macpherson, A.J., Martinic, M.M., & Harris, N. (2002) The functions of mucosal T cells in containing the indigenous commensal flora of the intestine. Cell Mol. Life Sci. 59: 2088-2096.
5. Mazmanian, S.K., Liu, C.H., Tzianabos, A.O., & Kasper, D.L. (2005) An immunomodulatory molecule of symbiotic bacteria directs maturation of the host immune system. Cell 122: 107-118.
6. Chung, H. & Kasper, D.L. (2010) Microbiota-stimulated immune mechanisms to maintain gut homeostasis. Curr. Opin. Immunol. 22: 455-460.
7. Macpherson, A.J. (2006) IgA adaptation to the presence of commensal bacteria in the intestine. Curr. Top. Microbiol. Immunol. 308: 117-136.
8. Gaboriau-Routhiau, V., Rakotobe, S., Lecuyer, E., Mulder, I., Lan, A., Bridonneau, C, Rochet, V., Pisi, A., De, P.M., Brandi, G. et al. (2009) The key role of segmented filamentous bacteria in the coordinated maturation of gut helper T cell responses. Immunity. 31: 677-689.
9. Ivanov, I.I., Atarashi, K., Manel, N., Brodie, E.L, Shima, T., Karaoz, U., Wei, D., Goldfarb, K.C, Santee, C.A., Lynch, S.V. et al. (2009) Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell 139: 485-498.
10. Geuking, M.B., Cahenzli, J., Lawson, M.A., Ng, D.C, Slack, E., Hapfelmeier, S., McCoy, K.D., & Macpherson, A.J. (2011) Intestinal Bacterial Colonization Induces Mutualistic Regulatory T Cell Responses. Immunity.
11. Duncan, S.H., Aminov, R.I., Scott, K.P., Louis, P., Stanton, T.B., & Flint, H.J. (2006) Proposal of Roseburia faecis sp. nov., Roseburia hominis sp. nov. and Roseburia inulinivorans sp. nov., based on isolates from human faeces. Int. J. Syst. Evol. Microbiol. 56: 2437-2441.
12. Mahowald, M.A., Rey, F.E., Seedorf, H., Tumbaugh, P.J., Fulton, R.S., Wollam, A., Shah, N., Wang, C, Magrini, V., Wilson, R.K. et al. (2009) Characterizing a model human gut microbiota composed of members of its two dominant bacterial phyla. Proc. Natl. Acad. Sci. U.S.A 106: 5859-5864.
13. Aminov, R.I., Walker, A.W., Duncan, S.H., Harmsen, H.J., Welling, G.W., & Flint, H.J. (2006) Molecular diversity, cultivation, and improved detection by fluorescent in situ hybridization of a dominant group of human gut bacteria related to Roseburia spp. or Eubacterium rectale. Appl. Environ. Microbiol. 72: 6371-6376.
14. Turnbaugh, P.J., Backhed, F., Fulton, L, & Gordon, J.I. (2008) Diet-induced obesity is linked to marked but reversible alterations in the mouse distal gut microbiome. Cell Host. Microbe 3: 213-223.
15. Mallya, M., Campbell, R.D., & Aguado, B. (2006) Characterization of the five novel Ly-6 superfamily members encoded in the MHC, and detection of cells expressing their potential ligands. Protein Sci. 15: 2244-2256.
16. Letran, S.E., Lee, S.J., Atif, S.M., Flores-Langarica, A., Uematsu, S., Akira, S., Cunningham, A.F., & McSorley, S.J. (2011) TLR5-deficient mice lack basal inflammatory and metabolic defects but exhibit impaired CD4 T cell responses to a flagellated pathogen. J Immunol. 186: 5406-5412.
17. Round, J.L, Lee, S.M., Li, J., Tran, G., Jabri, B., Chatila, T.A., & Mazmanian, S.K. (2011) The Toll-like receptor 2 pathway establishes colonization by a commensal of the human microbiota. Science 332: 974-977.
18. Hooper, L.V., Wong, M.H., Thelin, A., Hansson, L, Falk, P.G., & Gordon, J.I. (2001) Molecular analysis of commensal host-microbial relationships in the intestine. Science 291: 881-884.
19. Kelly, D., Campbell, J.I., King, T.P., Grant, G., Jansson, E.A., Courts, A.G., Pettersson, S., & Conway, S. (2004) Commensal anaerobic gut bacteria attenuate inflammation by regulating nuclear-cytoplasmic shuttling of PPAR-gamma and RelA. Nat. Immunol. 5: 104-112.
20. Hapfelmeier, S., Lawson, M.A., Slack, E., Kirundi, J.K., Stoel, M., Heikenwalder, M., Cahenzli, J., Velykoredko, Y., Balmer, M.L, Endt, K. et al. (2010) Reversible microbial colonization of germ-free mice reveals the dynamics of IgA immune responses. Science 328: 1705-1709.
21. Elkins, C.A., Moser, S.A., & Savage, D.C. (2001) Genes encoding bile salt hydrolases and conjugated bile salt transporters in Lactobacillus johnsonii 100-100 and other Lactobacillus species. Microbiology 147: 3403-3412.
22. Louis, P., McCrae, S.I., Charrier, C, & Flint, H.J. (2007) Organization of butyrate synthetic genes in human colonic bacteria: phylogenetic conservation and horizontal gene transfer. FEMS Microbiol. Lett. 269: 240-247.
23. Peterson, G., Kumar, A., Gart, E., & Narayanan, S. (2011) Catecholamines increase conjugative gene transfer between enteric bacteria. Microb. Pathog.
24. Hayashi, F., Smith, K.D., Ozinsky, A., Hawn, T.R., Yi, E.C., Goodlett, D.R., Eng, J. K., Akira, S., Underhill, D. M., & Aderem, A. (2001) The innate immune response to bacterial flagellin is mediated by Toll-like receptor 5. Nature 410: 1099-1103.
25. Vijay-Kumar, M., Sanders, C.J., Taylor, R.T., Kumar, A., Aitken, J.D., Sitaraman, S.V., Neish, A.S., Uematsu, S., Akira, S., Williams, I.R. et al. (2007) Deletion of TLR5 results in spontaneous colitis in mice. J Clin. Invest 117: 3909-3921.
26. De, P.M., Gaboriau-Routhiau, V., Rainteau, D., Rakotobe, S., Taddei, F., & Cerf-Bensussan, N. (2011) Trade-off between bile resistance and nutritional competence drives Escherichia coli diversification in the mouse gut. PLoS Genet. 7: e1002107.
27. Giraud, A., Arous, S., De, P.M., Gaboriau-Routhiau, V., Bambou, J.C., Rakotobe, S., Lindner, A.B., Taddei, F., & Cerf-Bensussan, N. (2008) Dissecting the genetic components of adaptation of Escherichia coli to the mouse gut. PLoS Genet. 4: e2.
28. Werth, M., Walentin, K., Aue, A., Schonheit, J., Wuebken, A., Pode-Shakked, N., Vilianovitch, L, Erdmann, B., Dekel, B., Bader, M. et al. (2010) The transcription factor grainyhead-like 2 regulates the molecular composition of the epithelial apical junctional complex. Development 137: 3835-3845.
29. Qin, J., Li, R., Raes, J., Arumugam, M., Burgdorf, K.S., Manichanh, C, Nielsen, T., Pons, N., Levenez, F., Yamada, T. et al. (2010) A human gut microbial gene catalogue established by metagenomic sequencing. Nature 464: 59-65.
30. Ukena, S.N., Singh, A., Dringenberg, U., Engelhardt, R., Seidler, U., Hansen, W., Bleich, A., Bruder, D., Franzke, A., Rogler, G. ef al. (2007) Probiotic Escherichia coli Nissle 1917 inhibits leaky gut by enhancing mucosal integrity. PLoS. One. 2: e1308.
31. Geraedts, M.C., Troost, F.J., Tinnemans, R., Soderholm, J.D., Brummer, R.J., & Saris, W.H. (2010) Release of satiety hormones in response to specific dietary proteins is different between human and murine small intestinal mucosa. Ann. Nutr. Metab 56: 308-313.
32. McLaughlin, J., Grazia, L.M., Jones, M.N., D'Amato, M., Dockray, G.J., & Thompson, D.G. (1999) Fatty acid chain length determines cholecystokinin secretion and effect on human gastric motility. Gastroenterology 116: 46-53.
33. Turnbaugh, P.J., Ley, R.E., Mahowald, M.A., Magrini, V., Mardis, E.R., & Gordon, J.I. (2006) An obesity-associated gut microbiome with increased capacity for energy harvest. Nature 444: 1027-1031.
34. Tremaroli, V., Kovatcheva-Datchary, P., & Backhed, F. (2010) A role for the gut 'microbiota in energy harvesting? Gut 59: 1589-1590.
35. Chevreux, B., Wetter, T., & Suhai, S. (1999) Genome sequence assembly using trace signals and additional sequence information. Computer Science and Biology: Proceedings of the German Conference on Bioinformatics (GCB) 99: 45-56.
36. Aziz, R.K., Bartels, D., Best, A.A., DeJongh, M., Disz, T., Edwards, R.A., Formsma, K., Gerdes, S., Glass, E.M., Kubal, M. et al. (2008) The RAST Server: rapid annotations using subsystems technology. BMC Genomics 9: 75.
37. Dennis, G., Jr., Sherman, B.T., Hosack, D.A., Yang, J., Gao, W., Lane, H.C., & Lempicki, R.A. (2003) DAVID: Database for Annotation, Visualization, and Integrated Discovery. Genome Biol. 4: 3.
38. Untergasser, A., Nijveen, H., Rao, X., Bisseling, T., Geurts, R., & Leunissen, J.A. (2007) Primer3Plus, an enhanced web interface to Primer3. Nucleic Acids Res. 35: W71-W74.
39. Duck, L.W., Walter, M.R., Novak, J., Kelly, D., Tomasi, M., Cong, Y., & Elson, C.O. (2007) Isolation of flagellated bacteria implicated in Crohn's disease. Inflamm. Bowel. Dis. 13: 1191-1201.
40. Olivera, L, Canul, R.R., Pereira-Pacheco, F., Cockburn, J., Soldani, F., McKenzie, N.H., Duncan, M., Olvera-Novoa, M.A., & Grant, G. (2003) Nutritional and physiological responses of young growing rats to diets containing raw cowpea seed meal, protein isolate (globulins), or starch. J Agric. Food Chem. 51: 319-325.
41. Sokol H., et al, PNAS, October 28, 2008, Vol 105, No 43, 16731-16736.
Реферат
Изобретения касаются способа регуляции иммунной системы субъекта, включающего введение субъекту композиции, включающей бактериальный вид Roseburia hominis; способа лечения нарушения у субъекта, включающего введение субъекту композиции, включающей Roseburia hominis; фармацевтической композиции, включающей Roseburia hominis, и способа производства такой композиции. Композиция, используемая для регуляции иммунной системы млекопитающего и/или лечения нарушения у млекопитающего, включает Roseburia hominis в количестве от около 1×10до около 1×10колониеобразующих единиц/г относительно веса композиции или суточная доза Roseburia hominis является от около 1×10до около 1×10колониеобразующих единиц. Изобретения позволяют модулировать метаболическую активность в пищеварительном тракте и могут быть использованы в процессах иммунорегуляции. 4 н. и 2 з.п. ф-лы, 15 ил.
Формула
Документы, цитированные в отчёте о поиске
Пробиотический пищевой продукт с длительным сроком хранения

Комментарии