Устройство для анализов и способ выполнения биологических анализов - RU2527686C2
Код документа: RU2527686C2
Чертежи


Описание
Изобретение относится к технологии анализа в индустрии биологических наук и, в частности, к мультиплексированию, применяемому в диагностике, геномных исследованиях и молекулярной биологии. В изобретении используются технологии и процессы техники микрообработки, а также технологии полупроводников.
Анализы в области биологии позволяют детектировать целевую молекулу в биологическом образце. Как правило, детектирование целевых молекул осуществляется с использованием твердых поверхностей (например, микроматриц или дна лунок) или структур наноносителя или микроносителя, которые функционализируют с детектирующими молекулами (лигандами), предназначенными для связывания специфических мишеней.
Одной из задач технологии биологических анализов является ускорение массопереноса, имеющего место в течение анализа. Проблема массопереноса еще более осложнена в мультиплексных анализах, в которых ведется одновременный поиск многочисленных целевых молекул в единичном биологическом образце, так как относительный удельный вес в каждой пробе меньше, чем в единичном анализе.
Были описаны различные приспособления для преодоления ограничений массопереноса, такие как, например, выполнение мультиплексных анализов в микроканалах, тем самым снижая диффузионную длину между мишенями и пробами. Например, Дж.К.-К. Нг и др. (2007), Anal. Chem Acta 582, стр. 295-303 описывают микрожидкостное устройство, содержащее микрошарики, которые должны функционализировать с олигонуклеотидами посредством связывания биотин-стрептоавидин. Микроструйное устройство состоит из основного отделения с различными участками и с перегородкой для задержки микрошариков в структуре монослоя. Различные наборы микрошариков последовательно вводятся, с разделением нефункционализирующими спейсерными шариками. Как видно на фиг.5а документа микрошарики формируют большие группы с неопределенными границами из-за смешения частиц с частицами из спейсерного набора. Так как у шариков нет характеристик, по которым они отличаются друг от друга, таких как, например, размер, форма или код, границы различных наборов неизвестны и становятся явными только после анализа путем детектирования присутствия в образце аналита. Вследствие этого приспособление, описанное Дж.К.-К. Нг и др., не подходит для мультиплексных анализов, так как невозможно достоверно определить присутствие или отсутствие определенных мишеней в образце. Например, в отсутствие некоторых аналитов в образце, которые соответствуют последовательным наборам, не будет записан никакой сигнал во всей области микроканала.
Таким образом, будет сложно установить, скольким наборам в действительности соответствует эта область (таким образом, не будет индикации того, сколько аналитов в действительности отсутствуют). Также будет сложно или даже невозможно установить идентичность более поздних аналитов, которые реагируют с последовательными наборами, так как местонахождение последовательности этих наборов не может быть достоверно установлено.
В заявках EP 1712282A2, WO 00/061198A1 и WO 04/025560AI описываются приспособления, имеющие элементы микроносителя, помещенные внутрь микроканалов так, что их перемещение ограничено микроканалом. Анализы выполняются посредством протекания жидкостей. Этот тип приспособления эффективен для массопереноса, так как диффузионные расстояния малы и перемещение образца относительно микроносителя приводит целевые молекулы близко к рецепторным молекулам. Этот тип приспособлений также снижает стоимость посредством снижения количества требуемых реагентов.
Однако в заявках EP 1712282A2 и WO 00/061198Al порядок микроносителей в микроканале очень важен, так как он определяет идентичность микроносителей. В заявке WO 2004025560A1 микроносители закодированы так, что их порядок в микроканале не так критичен, как в заявке EP 1712282A2. Тем не менее открытие заявки WO 2004025560A1 описывает только конфигурации, в которых микроносители определенно ориентированы друг за другом для того, чтобы удовлетворять требованиям предложенного декодирующего механизма, для которого требуется специфическое расположение кодов микроносителей, чтобы сделать возможной их идентификацию.
В заявках EP 1712282A2, WO 00/061198A1 и WO 04/025560A1 описываются приспособления, которые нелегко подготовить на практике потому, что для них требуется высококонтролируемое введение микроносителей в ограниченное пространство как для контроля их порядка, так и для их выравнивания в целях декодирования. Для достижения таких конфигураций требуются специализированные методы и специфические установочные параметры, включающие в себя микроскопию, микроманипулирование (использование контролируемых на микроскопическом уровне сил) и/или технологии микрообработки.
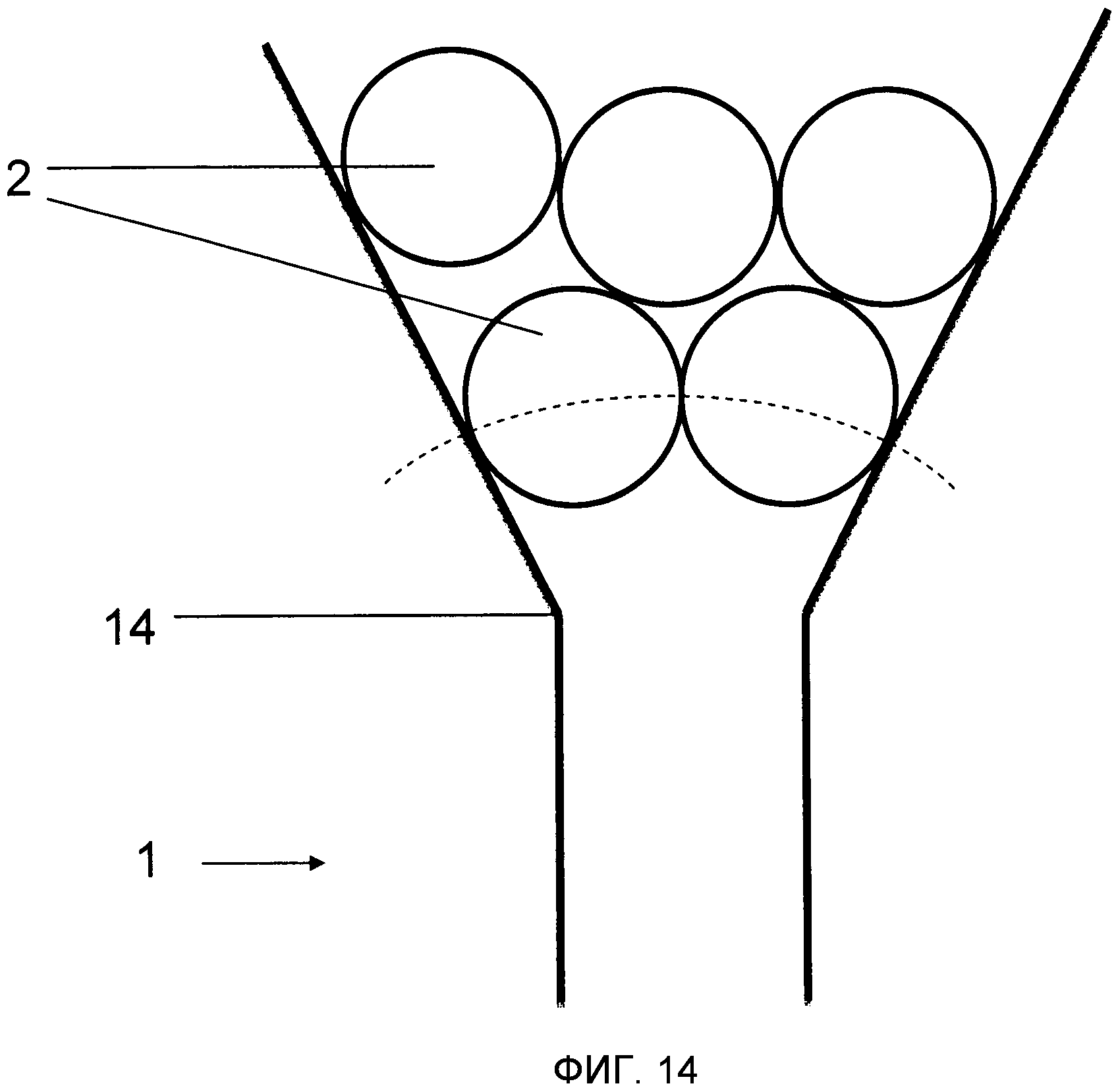
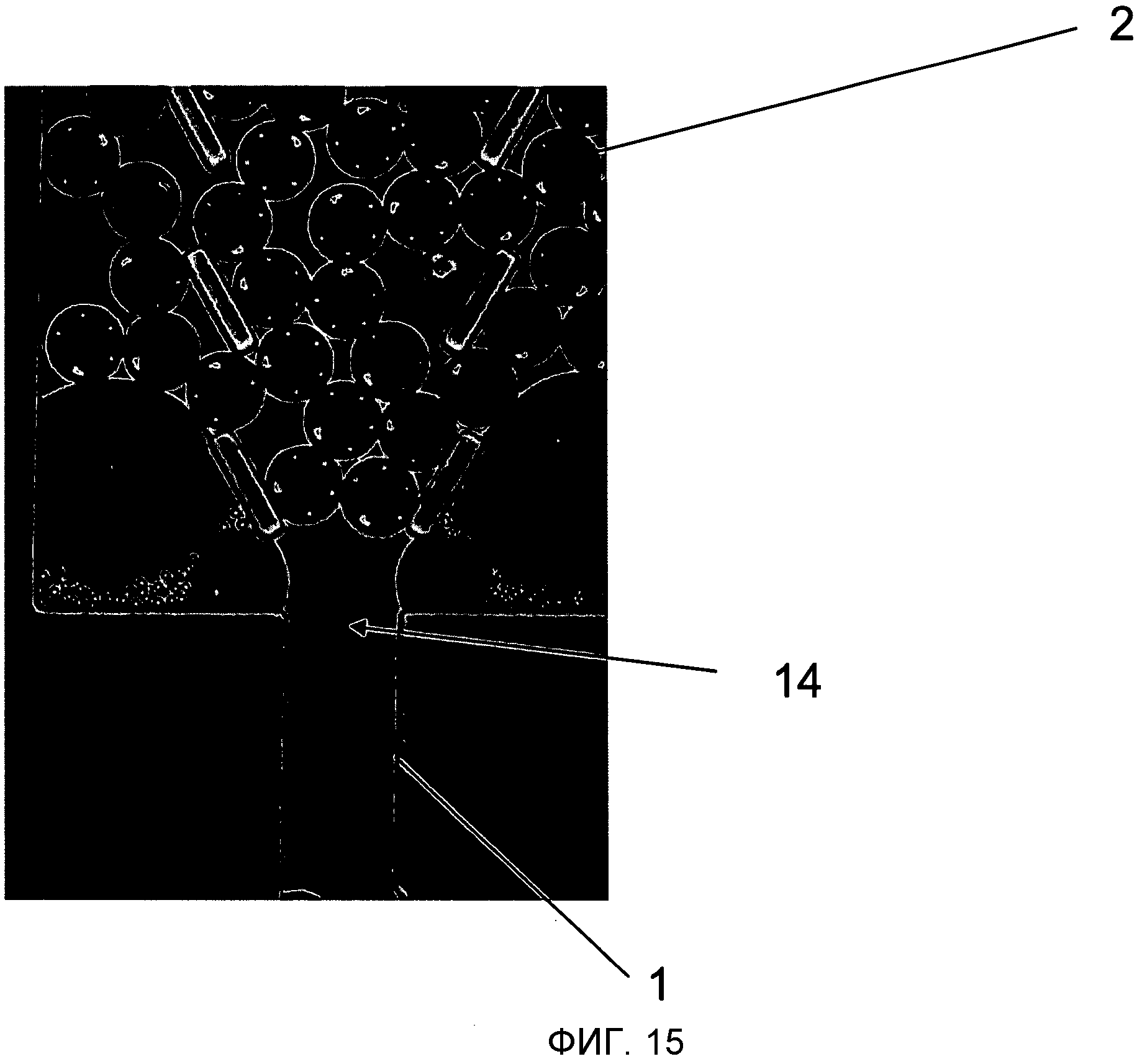
В действительности нужно, чтобы микроносители вводились в микроканал посредством некоторого процесса, который включает в себя или сложное микроманипулирование индивидуальными микроносителями, такое как, например, описанное в заявке WO 0061198Al, или, когда не нужен контроль за точной позицией каждого микроносителя, некоторые виды вороночного механизма, которые направляют микроносители из основной массы в маленький микроканал, такой как, например, описанный в заявке WO 04/025560A1. Вороночный механизм на практике проще создавать, но он чувствителен к засорению образованием зависаний на входе в микроканал 1 (Фигуры 14 и 15). В продолжение вороночного подхода в заявке WO 04/025560A1 предполагается производство стержней для анализа многослойным подходом, где шарики помещаются на нижнюю пластину, имеющую выемку. Впоследствии верхняя пластина располагается сверху и прикрепляется к нижней пластине.
Практическим следствием сложности этапа приготовления приспособлений, описанных в предшествующем уровне техники, является то, что он снижает возможность использования для производства гибкой конфигурации для исследовательского использования лаборантом. Например, было бы крайне затруднительно позволить приготовление изготовляемой по специальным техническим требованиям конфигурации лаборанту, который хотел бы использовать собственные методики нанесения покрытия на микроносители (например, для тестирования биологических проб, находящихся в развитии) и тогда вводить их в приспособление для проведения биологических анализов.
Вследствие этого в данной области существует необходимость в устройствах для анализа и способах, которые улучшают массоперенос в биологических мультиплексных анализах, основанных на микроносителях, и упрощают общую процедуру приготовления приспособлений, осуществления биологического анализа и выполнения снятия необходимых показаний.
Таким образом, основной задачей изобретения является обеспечение устройства и способа, которые позволяют осуществить улучшенный массоперенос и упрощение процедуры подготовки и проведения биологических мультиплексных анализов, в частности, устройство и способ для мультиплексных анализов.
Настоящее изобретение обеспечивает микроканал в качестве реакционного пространства, содержащего одновременно несколько наборов закодированных микроносителей (например, микрочастицы, имеющие лиганды, прикрепленные к их поверхности) таких, что форма и размер микроносителей относительно сечения микроканала позволяют иметь по всей длине микроканала по меньшей мере два любых микроносителя, расположенных бок о бок без соприкосновения друг с другом и без соприкосновения с периметром микроканала при движении в продольном направлении канала, например при наполнении. Предпочтительно, чтобы можно было наблюдать за микроносителями внутри микроканала. Оборудование также включает в себя некоторые средства для ограничения продольного движения вышеупомянутых микроносителей в вышеупомянутом микроканале, в то время как жидкость все еще может протекать. Биологические образцы, типично содержащие одну или более целевых молекул, перемещаются через ограниченные или иммобилизованные микроносители так, что микроносители не следуют за потоком биологического образца. Движение образца относительно микроносителей приводит к близости целевых молекул с рецепторными молекулами, при этом увеличивая возможность связывания и поэтому уменьшая инкубационный период, необходимый для совершения массопереноса. Для того чтобы отличить различные наборы независимо от выполнения анализа и независимо от их расположения, микроносители закодированы так, что код указывает их функцию.
Важный аспект изобретения заключается в сравнительной форме и размере микроносителей по отношению к поперечному сечению микроканала, для того чтобы облегчить подготовку оборудования. В существующем методе, описанном в заявках EP 1712282A2, WO 00/061198Al и WO 04/025560A1, требуется точный контроль окружения микроносителей в микрожидкостном канале, который не просто выполнить, так как манипулирование объектами такого малого размера (например, в пределах микрона) не тривиально и требует специализированных способов и специфических установок, включая микроскопию, микроманипулирование (использование контролируемых на микроскопическом уровне сил) и/или технологии микрообработки.
В настоящем изобретении у микроносителей гораздо большая степень свободы перемещения внутри микроканала. Форма и размер микроносителей в изобретении такие, что, по меньшей мере, два микроносителя могут быть размещены бок о бок без соприкосновения друг с другом и без соприкосновения с периметром микроканала по всей длине микроканала, служащего в качестве реакционного пространства, и особенно на входе в него. Это означает, что микроносители, которые будут передвигаться в продольном направлении микроканала с разной скоростью будут способны пропускать друг друга до того места, где их продольное передвижение ограничено. Эта особенность является ключом к облегчению конструкции оборудования, которая особенно важна при подготовке оборудования в исследовательской обстановке непосредственно перед выполнением анализа, что позволяет гибкость приготовления смесей наборов микроносителей. Использование микроканала, который гораздо более широк по сравнению с размерами микроносителей, имеет эффект уменьшения вероятности образования нависаний на входе в микроканал, что может засорять вход. Это дополнительно позволяет использование для загрузки микроканала расширенного впускного отверстия вместо узкой воронки. Второе преимущество заключается в уменьшении возможности блокирования больших участков микроносителей, если есть препятствия внутри микроканала. В качестве препятствий могут быть нежелательные элементы, такие как, например, осколки (пыль) или воздушные пузыри в микроканале, или встроенные детали, которые обязательно необходимы для облегчения микрообработки микроструйного канала, например, опоры для обеспечения должной устойчивости микроканалов при использовании мягких полимеров, таких как, например, ПДМС.
Изобретение в дальнейшем обеспечивает способ проведения анализа, основанного на микроносителях и пригодного для мультиплексирования, содержащего этапы:
а) обеспечение оборудования для анализа, содержащего микроканал в качестве реакционного пространства и обеспечение по меньшей мере двух наборов закодированных микроносителей, при этом код микроносителей является указывающим на функцию и при этом форма и размер вышеупомянутых микроносителей по отношению к поперечному сечению микроканала позволяет иметь по всей длине микроканала по меньшей мере два любых микроносителя, расположенных бок о бок без соприкосновения друг с другом и без соприкосновения с периметром микроканала;
b) по меньшей мере, частичное наполнение вышеупомянутого микроканала, по меньшей мере, двумя вышеупомянутыми закодированными микроносителями;
c) ограничение перемещения вышеупомянутых микроносителей в продольном направлении вышеупомянутого микроканала, в то время как текучая среда все еще может протекать;
d) протекание образца, потенциально содержащего одну или более целевых молекул через вышеупомянутый микроканал, содержащий вышеупомянутые микроносители
e) идентификация наборов микроносителей и
f) детектирование реакции между лигандом и целевой молекулой и соотношение присутствия или отсутствия реакции с идентичностью специфического набора для вывода о присутствии или отсутствии целевой молекулы в образце.
В традиционных решениях, таких как, например, использование многочисленных лунок, массоперенос улучшен за счет стандартных технологий перемешивания, в соответствии с которыми образец и элементы микроносителя беспорядочно перемешиваются. В микромасштабе, где потоки - ламинарные, эта технология только минимально повышает относительное перемещение микроносителей по отношению к образцу, что является ключевым элементом для достижения эффективного массопереноса. Настоящее изобретение разъединяет перемещения образца и микроносителей. Более того, удлиненное реакционное пространство приспособления и лимитированный объем вокруг микроносителей гарантируют то, что образец проходит близко к максимальному количеству микроносителей. Полученное преимущество анализа и способа, раскрытого в данном документе, заключается в ускорении массопереноса посредством уменьшения степени использования диффузии для контакта представляющих интерес молекул с потенциальными рецепторами. Другие преимущества включают в себя простоту механизма, который основывается на свойствах микроканалов и геометрическом расположении для улучшения массопереноса. Приспособление также позволяет гибкие жидкостные манипуляции с минимумом требований для оперирования микроносителями, например, если необходимы дополнительные этапы для выполнения комплексных анализов. Если желательно перемещение жидкости вперед и назад, то необходима небольшая адаптация приспособления, например, если скорость жидкости не может достоверно контролироваться или если образец разбавлен, то может быть, таким образом, необходимо его пропускание в течение нескольких раз в контакте с микроносителями для гарантирования точного захвата представляющих интерес молекул.
Открытие пригодно для мультиплексных анализов, так как оно позволяет соединение различных функций с различными наборами микроносителей и их одновременное использование в анализе, в то время как все еще существует возможность распознавать различные реакции при условии, что реакция генерирует сигнал о том, что бок о бок локализовалось на носителе. Это осуществлено посредством работы с закодированными микроносителями, которые опознаваемы и вследствие этого определяют функцию, которую они несут.
Кроме того, микрожидкостное приспособление уменьшает количество образца, необходимое для проведения биологического анализа. Это также облегчает проведение любых необходимых дополнительных этапов анализа, позволяя пропускать дополнительные реагенты или моющие растворы через микроканал без выполнения каких-либо специфических манипуляций на микроносителях.
Изобретение также в целом упрощает манипуляции, необходимые для получения результатов анализа, по сравнению с традиционными основанными на микроносителях подходами, где микроносители должны быть собраны из реакционного пространства и внесены в считывающее устройство. Более того, при тех условиях, когда микроканал, по меньшей мере, частично прозрачный, за микроносителями можно наблюдать непосредственно внутри микроканала с помощью оптических средств для определения наборов и проведения считывания биологических показаний. Эта конфигурация также дает возможность получения кинетической информации посредством наблюдения за микроносителями, если реакция имеет место.
Кроме того, изобретение также упрощает подготовку устройства для анализа посредством облегчения манипулирования и уменьшения уровня экспертизы, необходимого для введения микроносителей в микроканал, таким образом, позволяя использование пользовательских конфигураций, которые подготовлены непосредственно перед выполнением анализа (например, в исследовательских условиях).
Изобретение главным образом может использоваться в индустрии биологических наук и, в частности, в диагностике, геномных исследованиях и молекулярной биологии.
Изобретение будет лучше понято и объекты, отличные от вышеизложенных, станут наглядными при рассмотрении дальнейшего подробного описания таковых. Такое описание ссылается на чертежи, на которых:
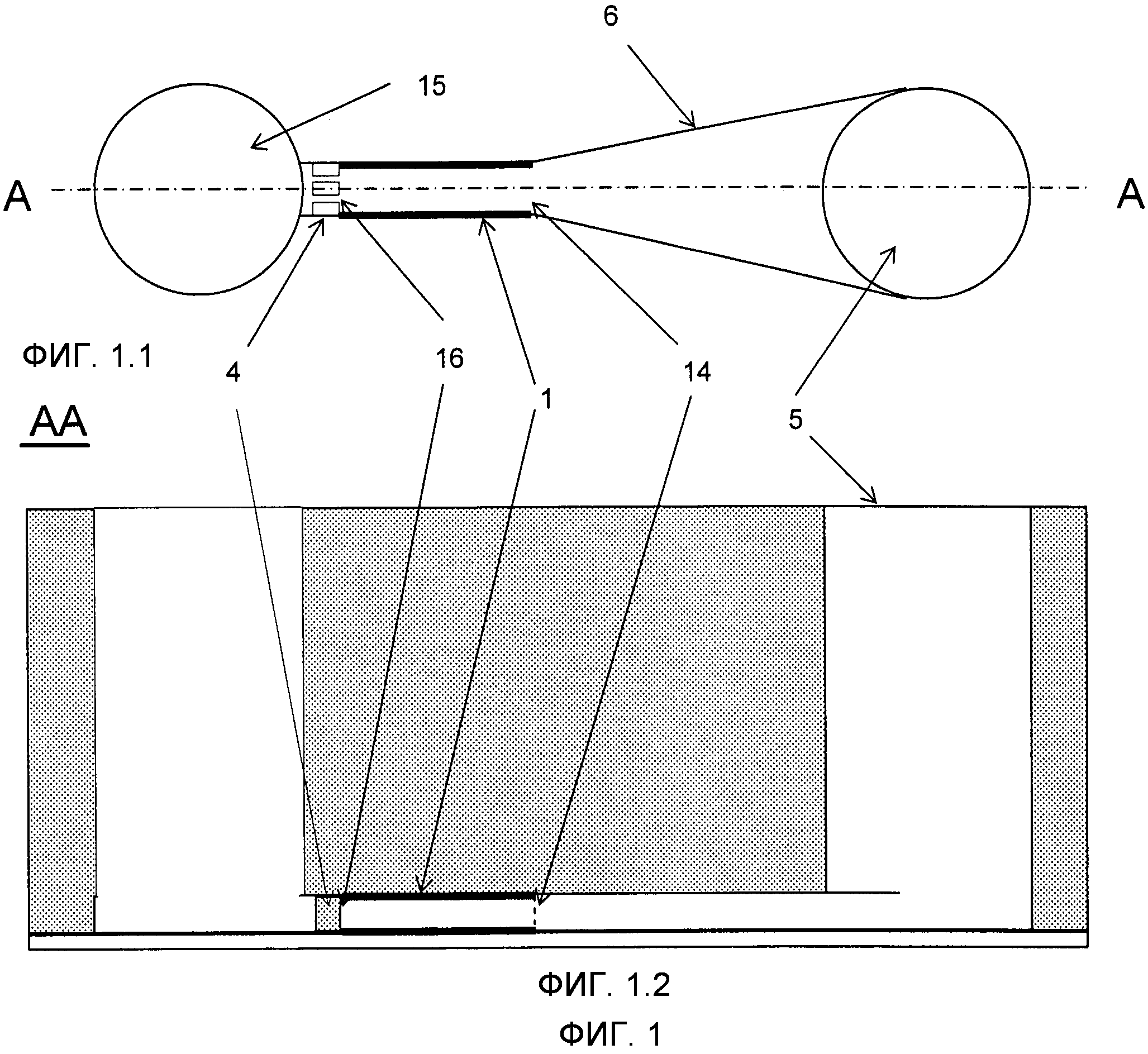
Фиг.1 представляет примерный вариант выполнения микроканала 1 в качестве реакционного пространства (изображен с выделением жирным цветом) с его входом 14, который соединяется с расширенным краем 6 и с впускным отверстием 5, его выход 16, который соединяется с задерживающим средством 4 (в форме фильтрующей конструкции) и со стоком 15. На Фиг.1.1 изображен вид сверху, тогда как на Фиг.1.2 показан вид поперечного сечения по линии A-A Фиг.1.1.
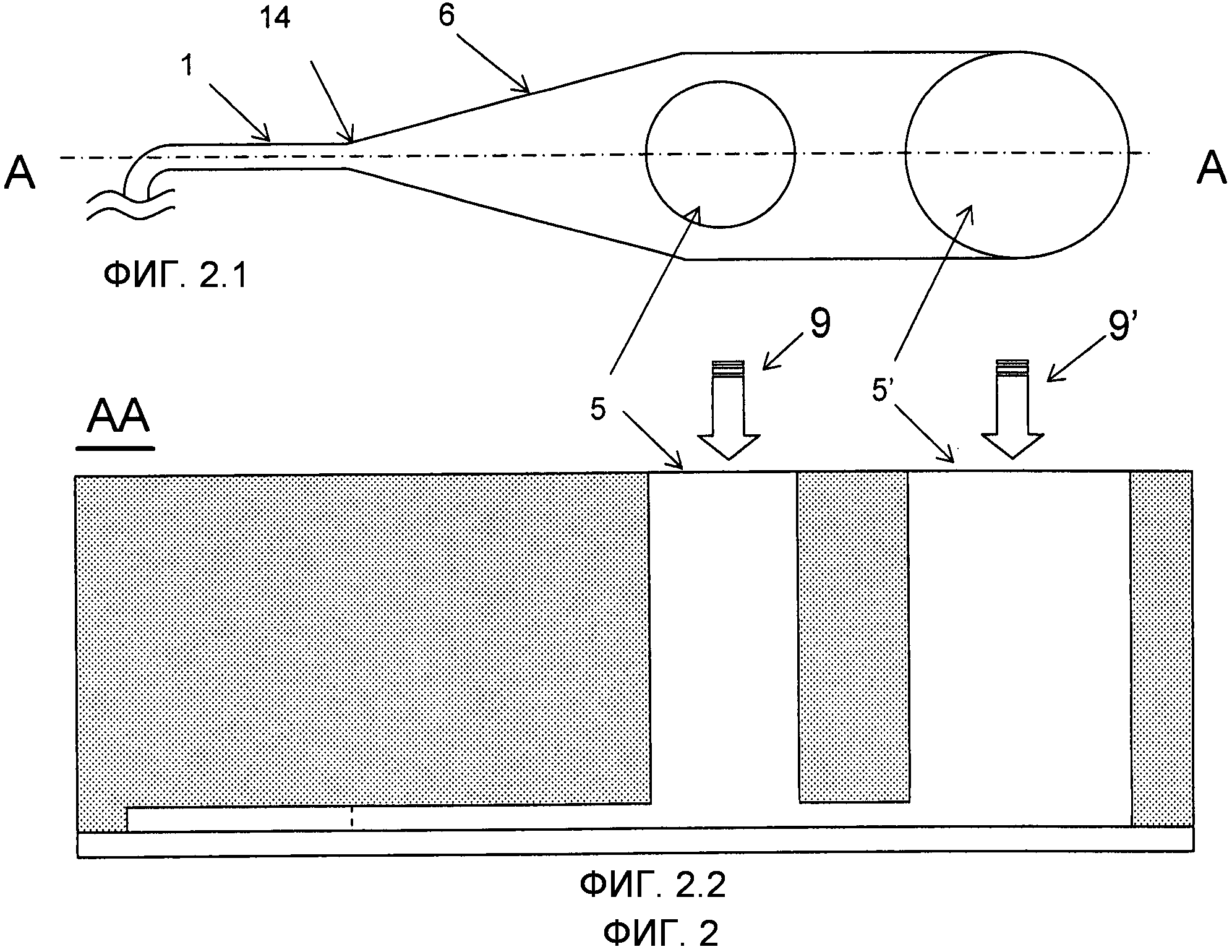
На Фиг.2 изображен вариант выполнения микроканала 1, имеющего вход 14 с увеличенным краем 6 и двумя впускными отверстиями 5 и 5'. На Фиг.2.1 изображен вид сверху микроканала 1 с расширенной частью 6 и двумя впускными отверстиями 5 и 5', тогда как на Фиг.2.2 показан вид поперечного сечения по линии A-A Фиг.2.1.
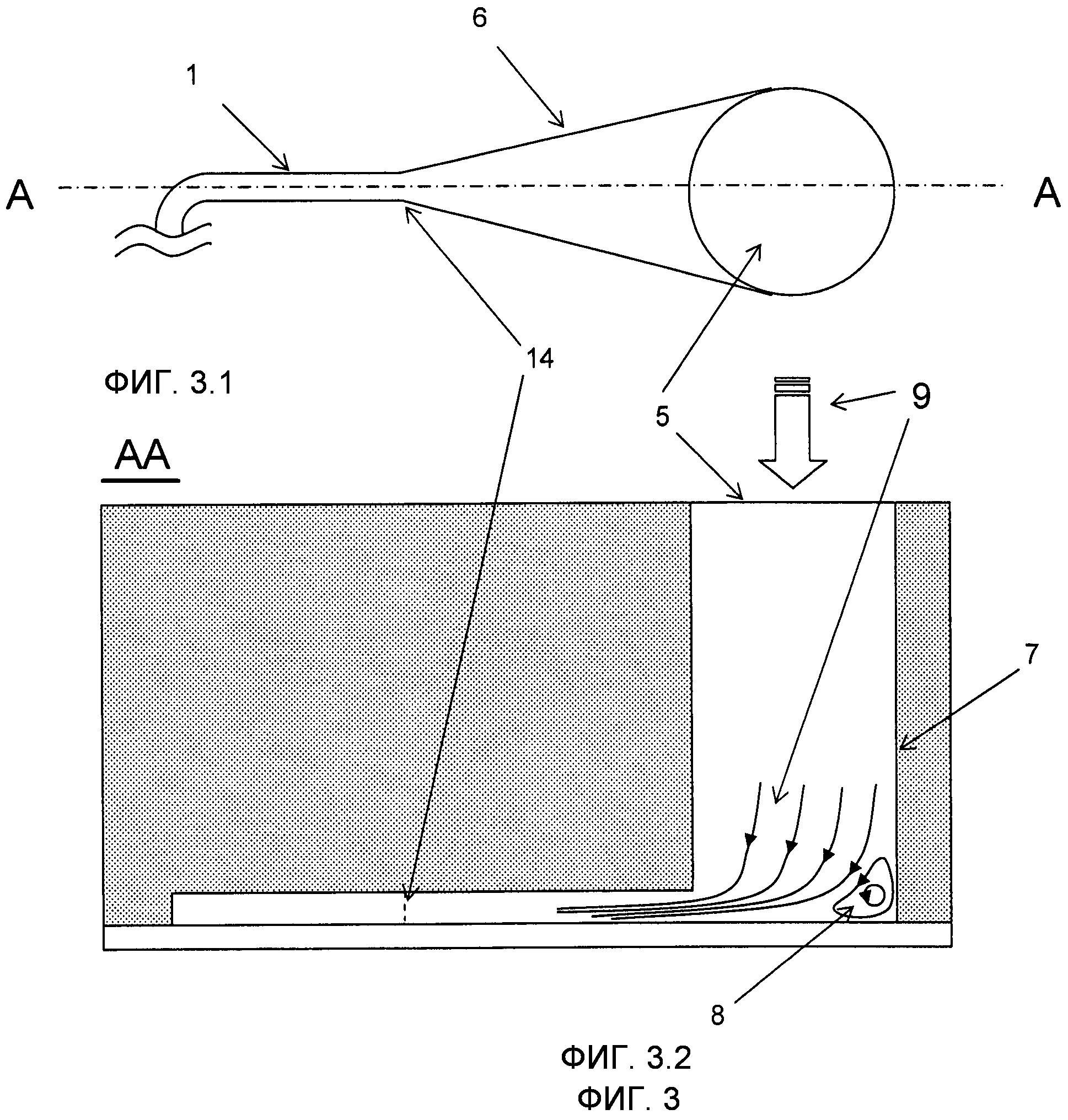
На Фиг.3 изображен вариант выполнения микроканала 1, имеющего вход 14 с увеличенным краем 6 и одним впускным отверстием 5 также показаны ламинарные потоки и ламинарный завихритель 8 в резервуаре 7. На Фиг.3.1 показан вид сверху микроканала 1 и его расширенной части 6 в одном из концов микроканала 1. На Фиг.3.2 изображен вид поперечного сечения по линии A-A Фиг.3.1 и показывает впускное отверстие 5 и резервуар 7, который имеет доступ к микроканалу 1 так же, как и к потоку 9, формируемому завихрителем 8.
На Фиг.4 показан вариант осуществления, где микроносители 2 имеют форму диска (то есть форму в виде пластинки с округлой передней поверхностью) и находятся в микроканале 1 с прямоугольным поперечным сечением. Микроканал 1 имеет боковые стенки 101, основание 102 и покрытие 103. Поперечное сечение микроканала 1 такое, что микроносители 2 формируют структуру монослоя и их вращательные перемещения ограничены. На Фиг.4.1 показан вид сверху, тогда как на Фиг.4.2 показан вид поперечного сечения по линии A-A Фиг.4.1. На Фиг.4.3 показано трехмерное изображение. В проиллюстрированном случае структура монослоя не находится строго в плоскости (вертикальное положение микроносителей 2 может незначительно отличаться как показано на Фигуре 4.2), но микроносители 2 не могут быть на вершине друг друга. Различные дополнительные примеры микроносителей 2 иллюстрируют различные наборы.
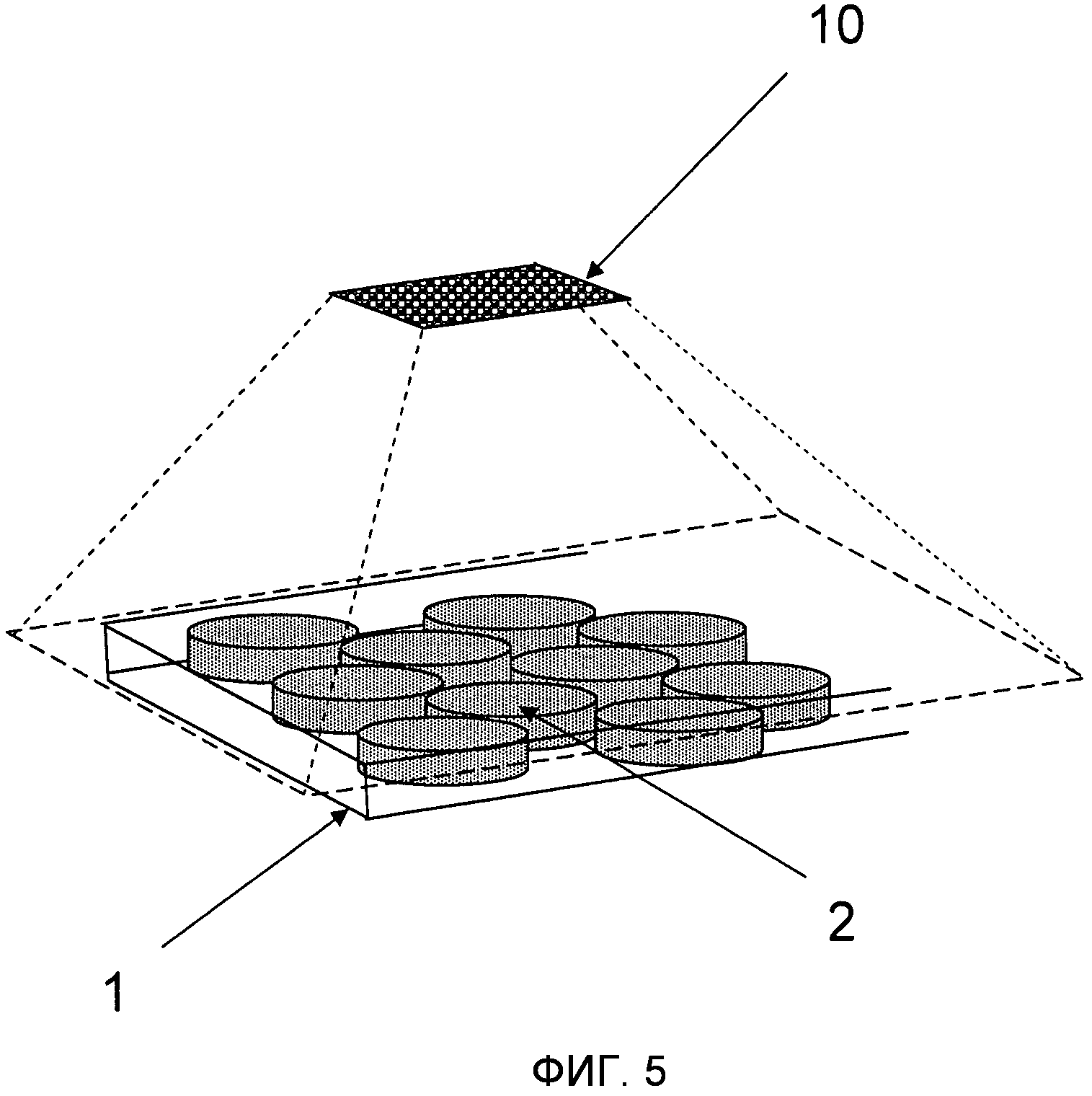
На Фиг.5 проиллюстрировано использование сенсора (10) регулярного типа, например, ПЗС или КМОП фотодетектор, для записи широкой области изображений структуры монослоя микроносителей 2 внутри микроструйного канала 1.
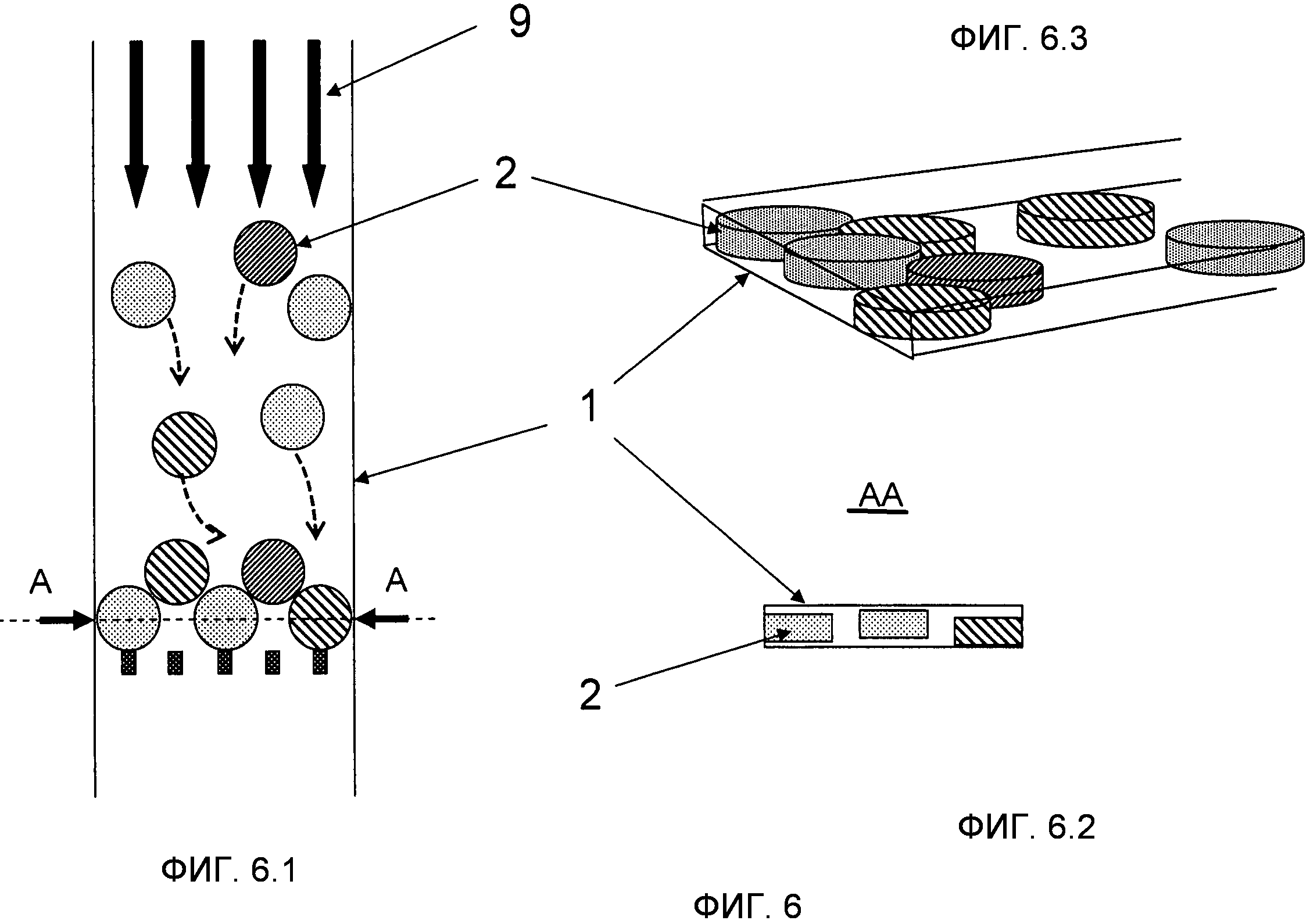
На Фиг.6 показан вариант осуществления, где микроносители 2 имеют форму диска и находятся в микроканале 1 с прямоугольным сечением. Это иллюстрирует то, как микроносители могут иметь относительно свободное движение (в двумерной плоскости в этом примере) до того, как они достигнут точки, где их продольное перемещение ограничено. Это позволяет им пропускать друг друга и снижать риск блокирования большого количества микроносителей в случае наличия препятствия. На Фиг.6.1 показан вид сверху, тогда как на фиг.6.2 показан вид сечения по линии A-A Фиг.6.1. На Фиг.6.3 показано трехмерное изображение.
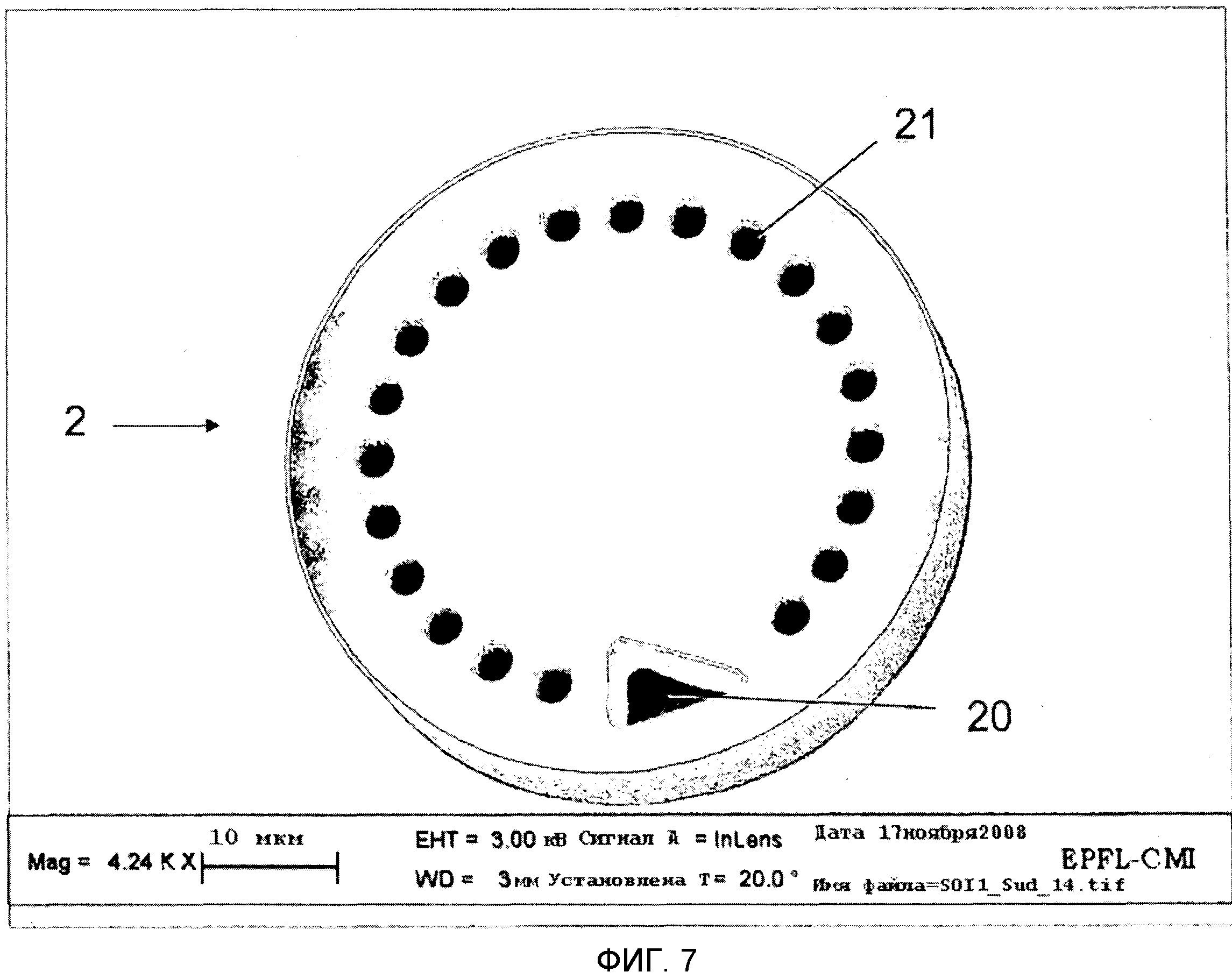
На Фиг.7 показан вариант выполнения микроносителя 2, имеющего форму диска, и код в форме схемы поперечных отверстий 21 через микроноситель 2. Микроноситель 2 имеет треугольную ориентационную метку 20, которая используется для определения того, что микроноситель 2 перевернут вверх дном и также служит в качестве точки отсчета кодируемой схемы. Микроноситель 2 имеет кодирующие элементы по периметру, таким образом, оставляя значительный участок поверхности, около центра микроносителя 2, для специализированного равномерного и плоского участка, пригодного для снятия биологических показаний.
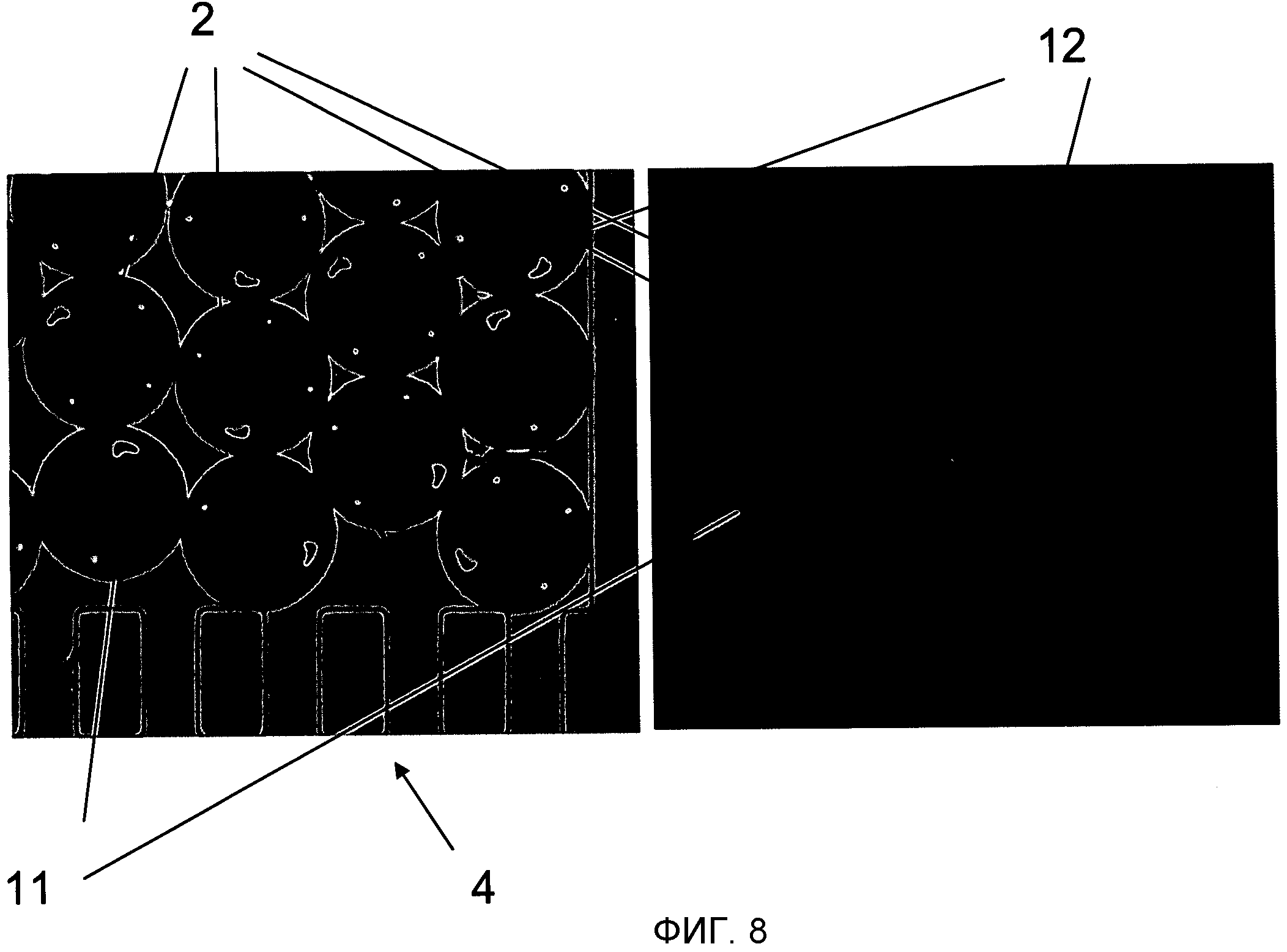
На Фиг.8 показано два изображения, полученных ПЗС камерой и иллюстрирующих снятие биологических показаний микроносителя 2 в простом мультиплексном анализе. Два набора микроносителей 2 были введены в микроканал: первый набор микроносителей 11 (кодированные одним отверстием), функционализирующие с ДНК пробой Pl (5' - CAA CCC CAG CTA ATA TTA TT - 3') и второй набор микроносителей 12 (кодированные двумя отверстиями), функционализирующие с другой ДНК пробой P2 (5' - TGG GTA AGT TAG GGC GATGG - 3'). После этого раствор, содержащий флуоресцентно меченную ДНК мишень Tl (5' Cy5 - AAT AAT ATT AGC TGG GGT TG - 3'), комплементарную пробе Pl, был пропущен и только микроносители 11, функционализирующие с ДНК пробой Pl, реагировали (видно различие между яркой областью (белый свет) на Фиг.8.1 и флуоресцентный свет в Фиг.8.2).
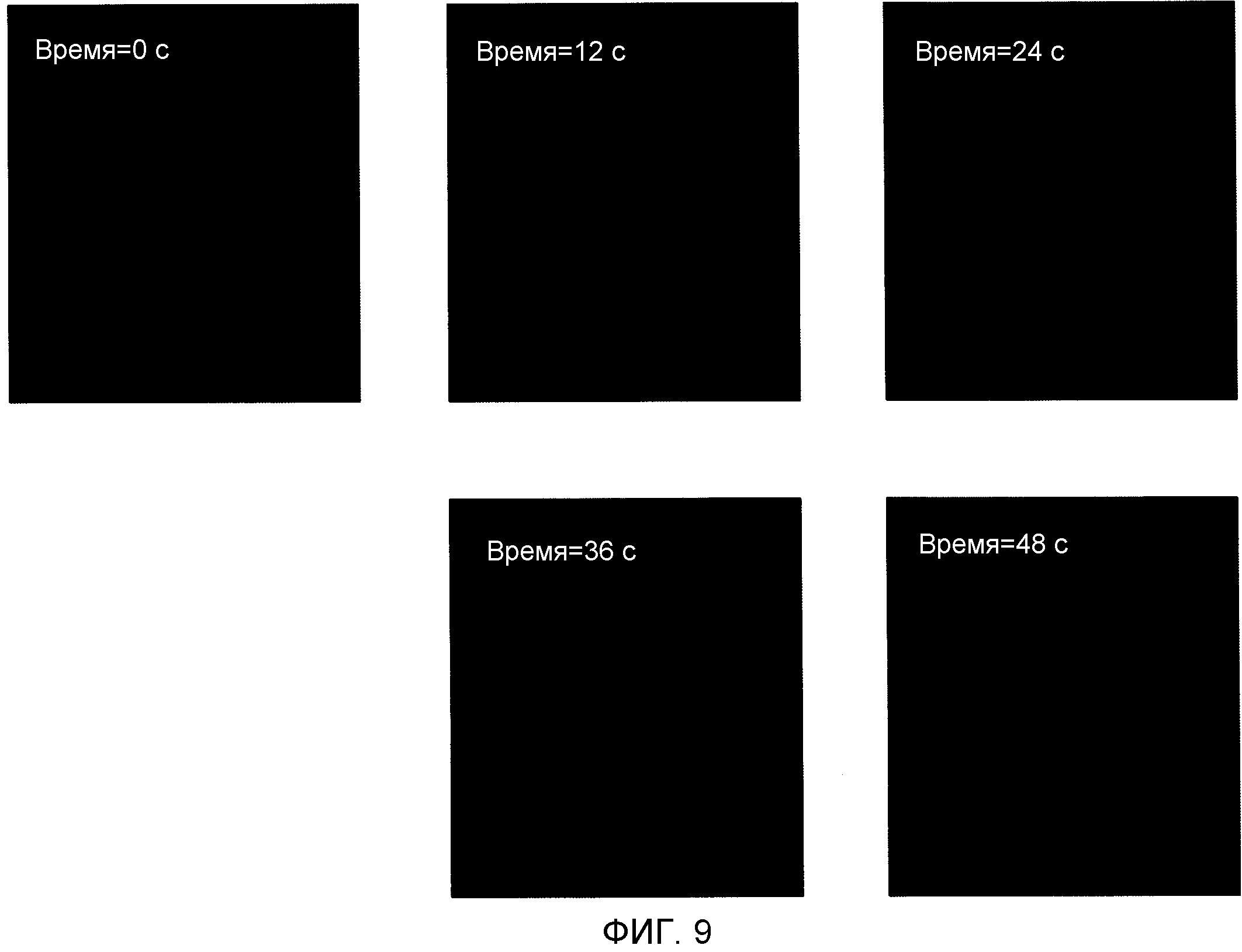
На Фиг.9 проиллюстрировано, как может быть выполнено снятие биологических показаний, когда анализы должны обеспечивать информацию о кинетике реакции. На этой фигуре также показано, что устройство очень эффективно относительно массопереноса, так как возможно детектировать реакции гибридизации в течение нескольких секунд (выполнено при концентрации мишеней 200 нмоль). Это изображение было получено ПЗС камерой при флуоресцентном свете.
На Фиг.10 показан вариант осуществления, где маркированные микроносители 2, имеющие форму диска (как это описано выше для Фиг.7), находятся внутри микроканала 1 с прямоугольным поперечным сечением. Поперечное сечение микроканала 1 такое, что микроносители 2 формируют структуру монослоя (они не могут быть на вершине друг друга), и их вращательное перемещение ограничено так, что они располагаются главным образом ровно внутри микроканала.
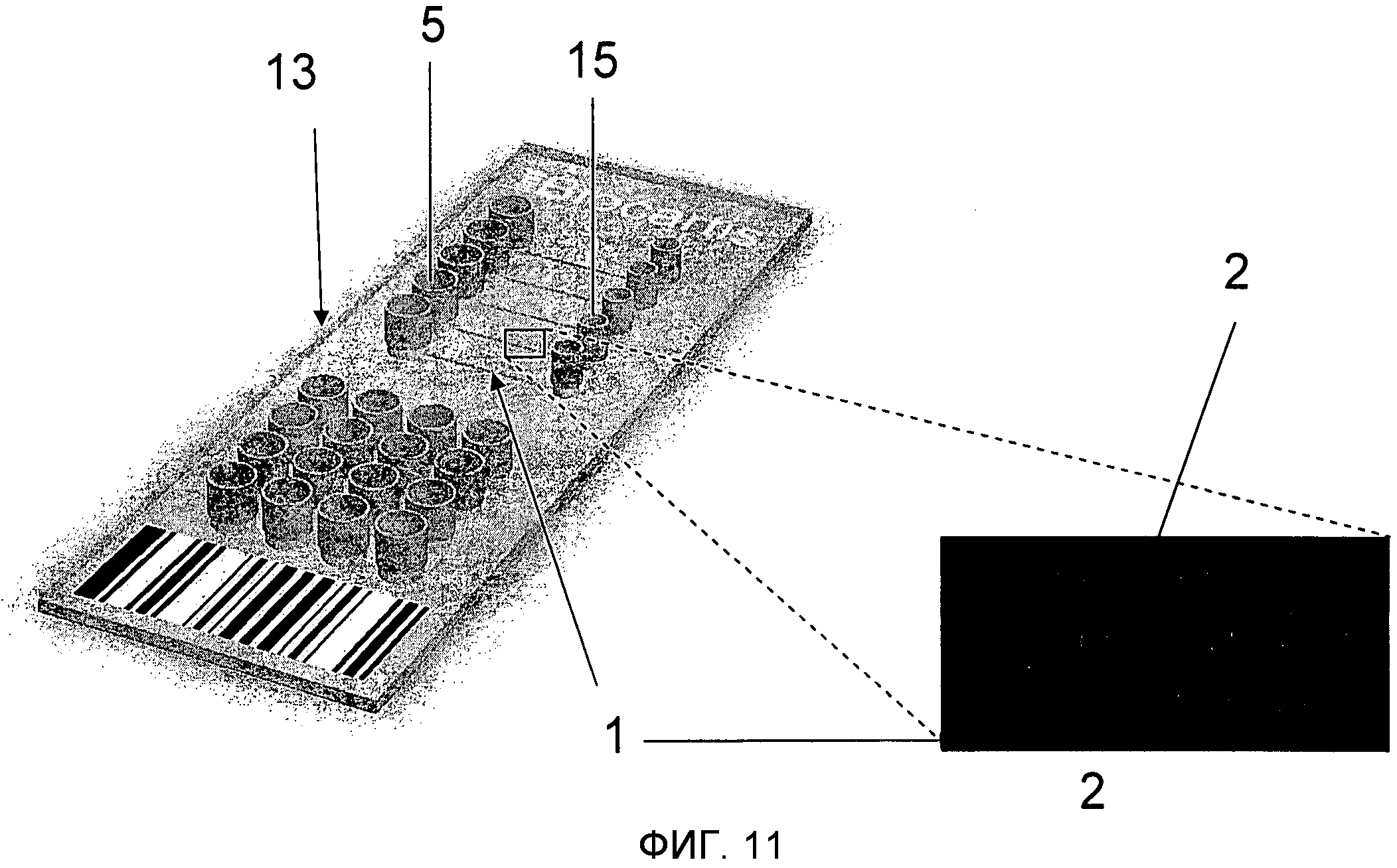
На Фиг.11 проиллюстрирована микрохема 13 для мультиплексирования. Указанная микросхема содержит несколько микроканалов 1, содержащих несколько наборов функционализирующих микроносителей 2. Микроканалы 1 соединяются с впускным отверстием 5 и стоком 15. Микроносители 2 имеют форму диска и закодированы (как это описано выше для Фиг.10).
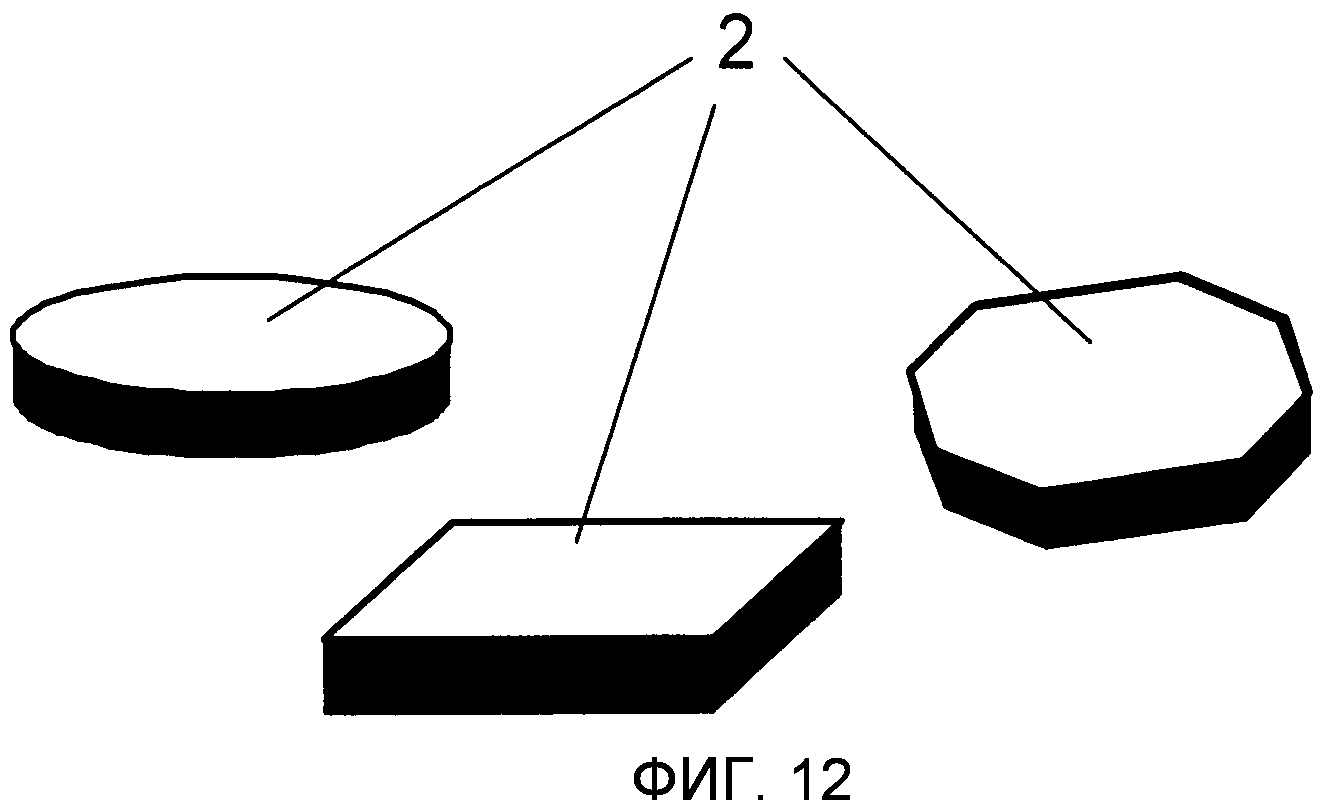
На Фиг.12 проиллюстрированы различные примеры микрочастиц в форме пластины. Передняя поверхность имеет форму диска (слева), квадрата (середина) или шестиугольника (справа).
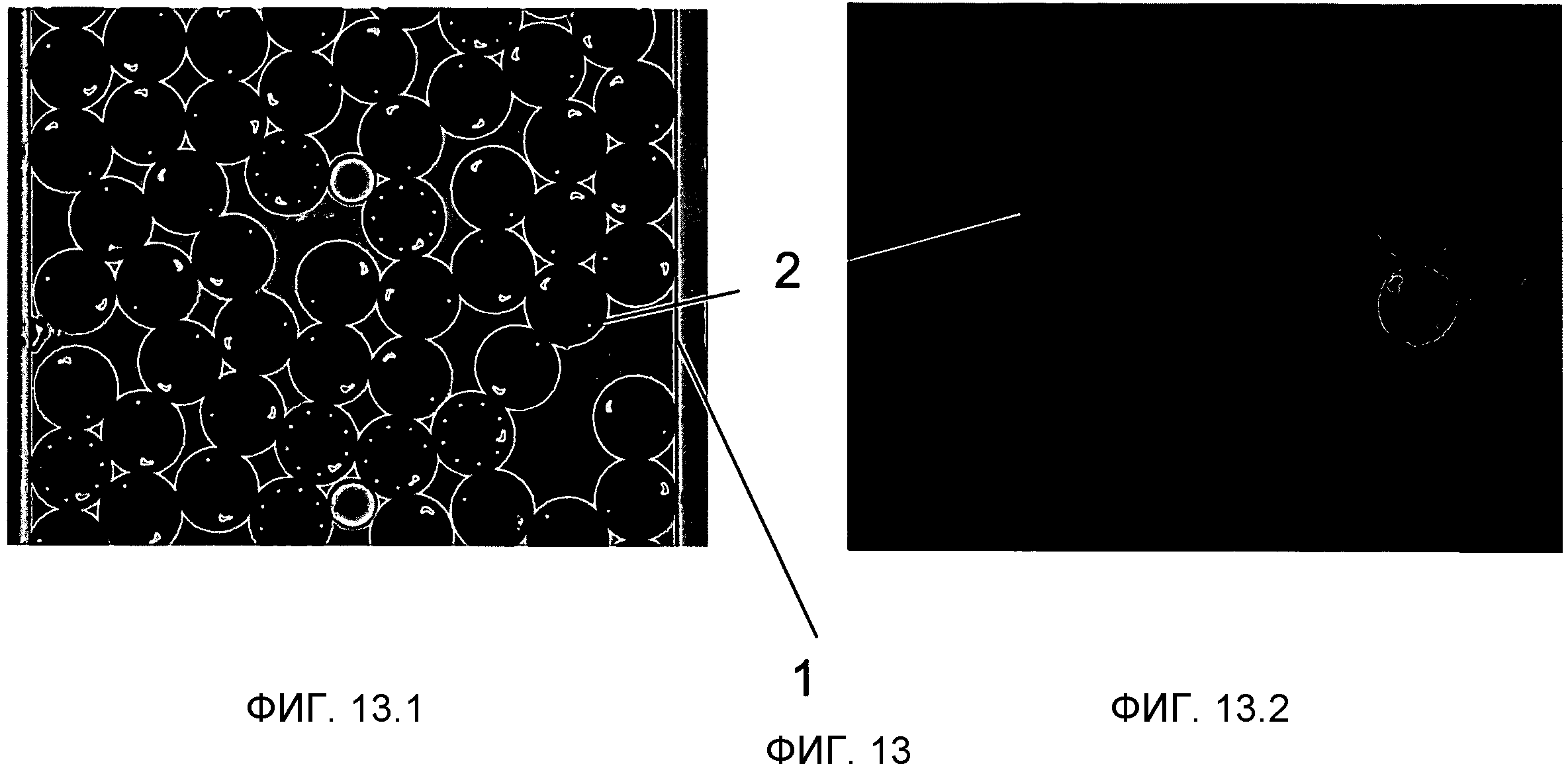
На Фиг.13 показан вариант осуществления, где микроносители 2 имеют форму диска и закодированы комбинацией поперечных отверстий 21 и Г-образной ориентационной меткой 20. На Фиг.13.1 показана яркая область (белый свет) изображения микроносителей. На Фиг.13.2 показано флуоресцентное изображение, которое демонстрирует микроносители, которые прореагировали после протекания образца 9. Оба изображения были получены после протекания образца 9.
На Фиг.14 показано, как могут формироваться зависания в воронке, которая направляет микроносители 2 в узкий микроканал 1 и тем самым засоряет вход 14 микроканала 1.
На Фиг.15 показано изображение зависания микроносителей 2, сформированной в ворончатой конструкции, что засоряет вход микроканала 1.
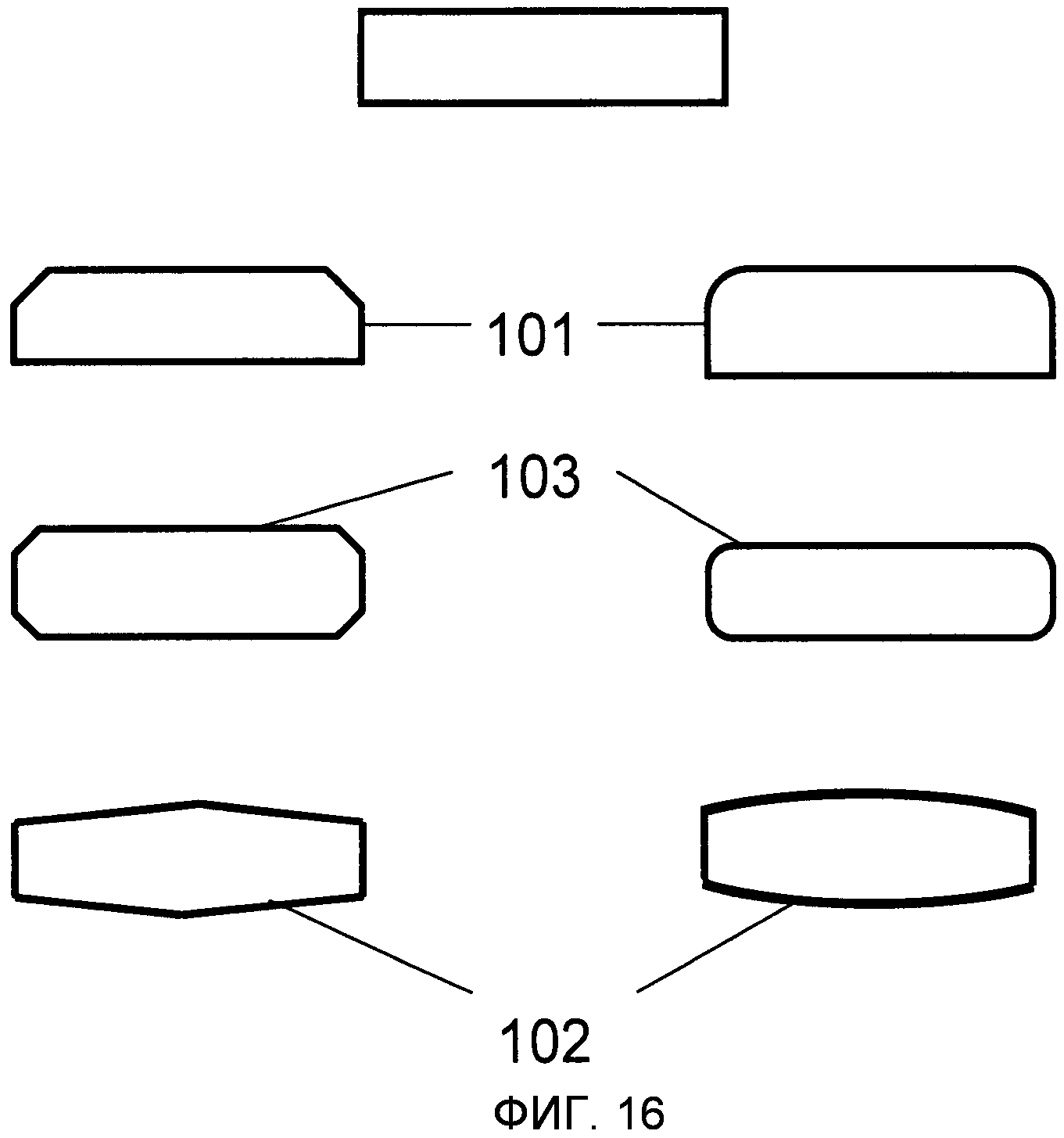
На Фиг.16 изображены различные нелимитирующие примеры форм, являющихся прямоугольными или “близкими к прямоугольным”. Они иллюстрируют предпочитаемые поперечные сечения микроканалов 1 или микроносителей 2, когда они в форме пластины.
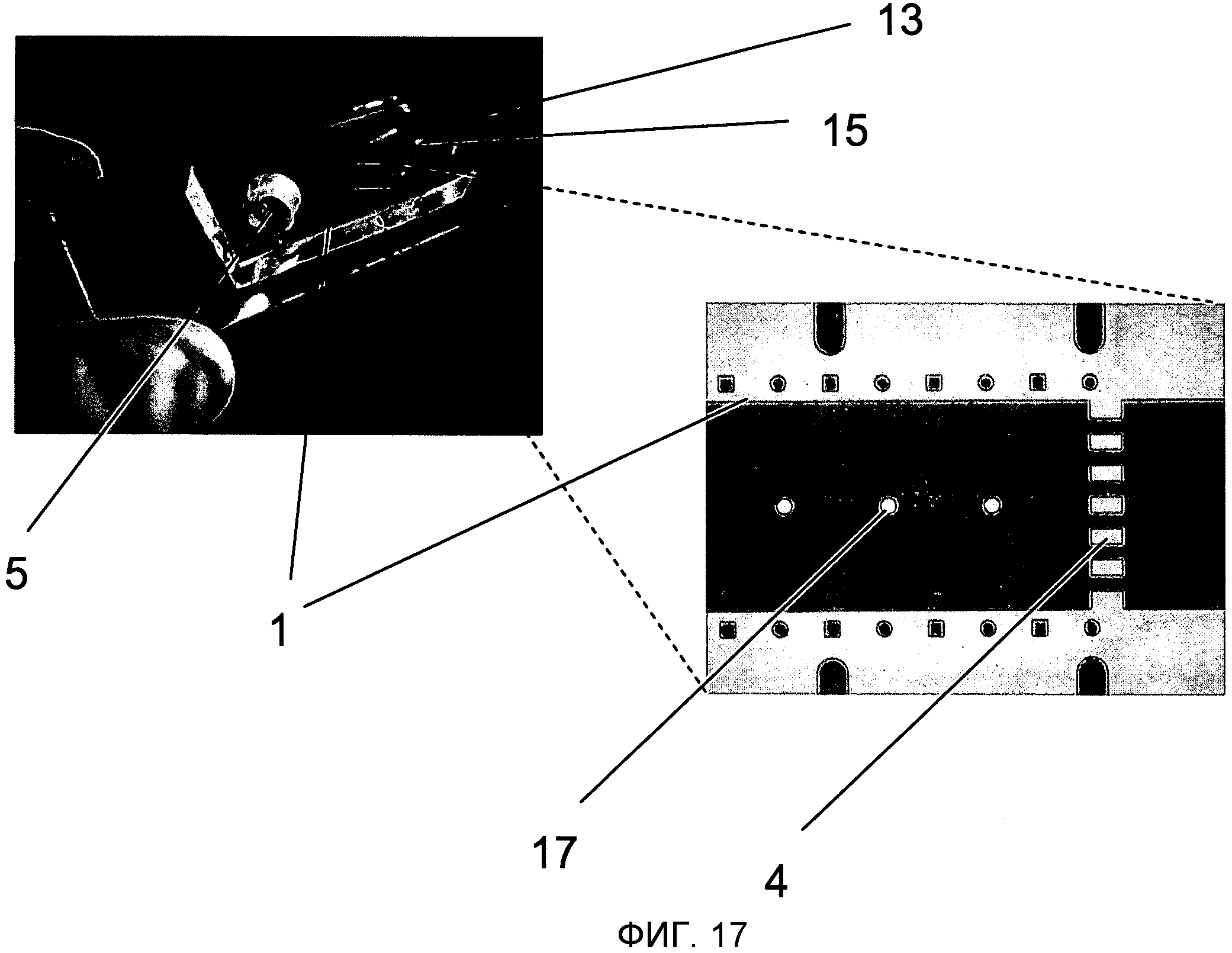
На Фиг.17 показано два изображения примерного варианта осуществления. Микросхема 13, изготовленная с использованием технологии формования ПДМС и соединенная с предметным стеклом микроскопа (как описано в Fundamentals and Applications of Microfluidics by Nam-Trung Nguyen and Steve Wereley [Основы и приложения микрогидродинамики], ISBN: 9781580533430, глава 3), содержит микроканал 1, который соединяется с впускным отверстием 5 и, с другой стороны, со стоком 15. Задерживающее устройство 4, состоящее из фильтрующей конструкции, сделанной из прямоугольных опор, встроено в выход из микроканала 1. Кроме того, цилиндрические опоры 17 встроены в микроканал 1 для стабилизации высоты микроканала (то есть для избежания его сжатия) при применении давления ниже атмосферного.
На Фиг.18 показано изображение пластины, содержащей кремниевые микрочастицы, которые еще не высвобождены. Микрочастицы имеют дископодобную форму и закодированы комбинацией поперечных отверстий 21. Микрочастицы имеют диаметр 50 микрон и включают в себя Г-образную ориентационную метку 20.
Способы выполнения изобретения
В рамках настоящего изобретения используются следующие определения:
'Мультиплексирование' относится к совмещенному выполнению ряда анализов, как правило, на большое количество соединений и молекул, с возможностью различать результаты каждого анализа индивидуально. Эти анализы могут, например, быть биологической и/или химической природы и, как правило, включают в себя некоторые целевые молекулы, которые должны быть обнаружены, и некоторые фиксирующие молекулы, которые должны служить в качестве агентов для детектирования тех целевых молекул. Упомянутые фиксирующие молекулы, как правило, присоединены в качестве лигандов на субстрате носителя. На количество совмещенных анализов, проводимых в мультиплексных анализах, обычно ссылаются как на “уровень” мультиплексирования, и он может изменяться в пределах от незначительных (2 или 3) до нескольких сотен или тысяч для высших уровней мультиплексирования. Последние обычно гибридизационные анализы на нуклеиновые кислоты, как правило, проводятся на сегодняшний день на микроматрицах, но они могут быть выполнены с помощью устройства, раскрытого в настоящем документе.
'Одиночный анализ' относится к проведению одиночного анализа, в котором только одна целевая молекула определяется детектированием одной фиксирующей молекулой.
'Реакционное пространство' относится к пространству, где имеет место биологическая и химическая реакция между целевой молекулой и фиксирующей молекулой или лигандом.
'Микроканал' или 'микрожидкостной канал' относится к закрытому каналу, то есть вытянутому проходу для жидкостей, с поперечным сечением микроскопического размера, то есть с наибольшим размером (поперечного сечения), как правило, от 1 до 500 микрометров, предпочтительно от 10 до 500 микрометров, более предпочтительно от 20 до 300 микрометров, еще более предпочтительно от 30 до 300 микрометров. Микроканал имеет продольное направление, которое необязательно является прямой линией и которое соответствует направлению, в котором направлена жидкость внутри микроканала, то есть по существу по направлению, соответствующему направлению добавления векторов скорости жидкости, проходящей в микроканале, при ламинарном режиме потока. Микроканал имеет с одного конца вход 14 и с другого конца выход 16, которые являются отверстиями микроканала, которые, например, позволяют жидкостям соответственно проникать в микроканал и покидать микроканал. Сечение микроканала обычно постоянно по большей части длины, но это сечение может варьироваться и может, как правило, увеличиваться по крайней мере рядом с входом 14 или рядом с выходом 16, для того чтобы соединить их с впускным отверстием 5, и со стоком 15, с одним или более микроканалов или с другим микрожидкостным компонентом (таким как, например, клапанный механизм). Микроканал может продолжаться так, что граница, образованная продольным направлением, имеет любую форму и длину и может продолжаться в пространстве (то есть линия, образованная продолжением в продольном направлении, не лежит в плоскости).
При ссылке на 'сечение' подразумевается перпендикулярное продольной оси сечение.
Термин “периметр” относится к внутреннему периметру микроканала или окружности сечения.
'Функционализирующий' относится к частице или микрочастице, имеющей один или более, но предпочтительно один, лиганд, прикрепленный к их поверхности, который может служить в качестве фиксирующей или рецепторной молекулы для данной целевой молекулы (аналита). Термин 'молекула' должен пониматься в широком смысле и может включать в себя некоторые молекулы, частицы или клетки. Например, целевая 'молекула' может быть вирусной частицей и/или фиксирующая 'молекула' (лиганд) может быть группой антиген-связывающих фрагментов. В другом примере целевая 'молекула' может быть нуклеиновой кислотой, такой как, например, ДНК, РНК или фрагмент одноцепочечной ДНК, а фиксирующая 'молекула' - другой нуклеиновой кислотой, такой как, например, ДНК, РНК или фрагмент одноцепочечной ДНК, разработанной для гибридизации с первой нуклеиновой кислотой. Может быть, также необходимо несколько различных фиксирующих молекул для специфического фиксирования одной целевой молекулы. В рамках настоящего изобретения упомянутые примеры будут относиться к категориям 'фиксирующая молекула' или 'целевая молекула', соответственно. Лиганды и целевые молекулы могут быть натуральными, синтетическими или полусинтетическими.
Термин 'функция' относится к способности связывать и/или реагировать с данной целевой молекулой и, следовательно, относится к наличию специфического лиганда.
Термин 'лиганд', 'фиксирующая молекула' и 'рецепторная молекула' используются в данном документе синонимично. То же самое относится к терминам 'целевая молекула' и 'аналит', несмотря на то, что аналит может содержать несколько целевых молекул.
'Микрочастицы' относится к любому типу частиц микроскопического размере, как правило, с наибольшим и размером от 100 нм до 300 мкм, предпочтительно от 1 мкм до 200 мкм.
'Микроносители' в используемом в настоящем документе значении являются микрочастицами, которые функционализируют для исследования и/или взаимодействия с аналитом в образце. Термин 'функционализирующий микроноситель' используется в настоящем документе синонимично. При описании аспектов, которые не привязаны к их функции, такие как, например, геометрические аспекты или аспекты микротехнологии, 'Микроносители' и 'Микрочастицы' могут рассматриваться в настоящем документе эквивалентно.
'Набор' или 'набор микроносителей' относится к одному или более микроносителей с одинаковой функционализацией. Набор может быть только одним или более чем одним микроносителем. Микроносители одного набора могут нести более одной фиксирующей молекулы для того, чтобы фиксировать две или более целевые молекулы, но это все равно считается носителем с одной функцией. Два различных микроносителя, которые отличимы друг от друга, могут иметь одинаковую функционализацию.
Термин 'снятие биологических показаний' относится к детектированию того, связался или прореагировал лиганд, присоединенный к микроносителю, с целевым аналитом. Снятие биологических показаний может также обеспечивать количественной информацией, которая указывает на количество целевого аналита, который прореагировал.
'Код' в используемом в настоящем документе является атрибутом или характеристикой микрочастицы или микроносителя, которые различимы при наблюдении или считывании и которые используются для идентифицирования микрочастиц или микроносителя или для объединения микрочастиц микроносителя в специфическую совокупность (например, совокупность микроносителей, имеющих заданную функцию). Код на микроносителя может быть определен независимо от его расположения и независимо от выполнения анализа, то есть не требует присутствия целевого аналита, который должен быть выявлен. Как правило, код характеризуется оптическим или магнитным откликом микрочастиц или микронасителя при наблюдении. Этот отклик должен быть определен для микрочастицы или микроносителя как целый (например, цвет микроносителя) или должен быть пространственно модулирован в или на микрочастице или микроносителе с результатом в виде характерной схемы (например, штрихкод, полученный посредством модуляции цвета микроносителя). Примеры кодов включают в себя, но не лимитированы цветом, формой, размером, маркированными или с неправильными выемками на поверхности образцами, конфигурацией отверстий, голографическими структурами, магнитными характеристиками, химической композицией, модификацией светопередачи или характеристиками отражения, точечной квантовой эмиссией или отличительными детектируемыми инородными объектами (например, олигонуклеотидами и другими полимерами), прикрепленными к поверхности.
Термины 'закодированные микроносители' и 'закодированные микрочастицы' относятся здесь, соответственно, к микроносителям и к микрочастицам, которые имеют код. Микроносители настоящего изобретения индивидуально закодированы, то есть каждый микроноситель несет свой собственный код, даже если несколько микроносителей (как правило, микроносители одного набора) могут нести код с одним и тем же значением (то есть микроносители не различимы на основании только их кода). Различные наборы закодированных микроносителей настоящего изобретения могут быть различимы и/или идентифицированы независимо от расположения микроносителей в микроканале и независимо от выполнения анализа.
Расположенные 'бок о бок' или стоящие 'бок о бок' в используемом в настоящем документе значении относится к геометрическому свойству, которое соотносит геометрию двух или более частиц с геометрией микроканала. Об одной или более микрочастиц говорят, что они расположены 'бок о бок' в установленном положении в микроканале, когда они (i) находятся в такой конфигурации, что две или более микрочастиц помещаются внутри микроканала, и (ii) пересекают сечение в этом установленном положении, и (iii) их защищенные поверхности в продольном направлении (в этом установленном положении) не перекрываются и ограничены поверхностью сечения (в этом установленном положении). В общем, в микроканале, который не имеет постоянного поперечного сечения по всей своей длине, возможно, что одна или более микрочастиц могут быть расположены 'бок о бок' в некоторых положениях, но не в других положениях (несмотря на то, что это основное правило не применяется к микроканалу 1 настоящего изобретения, в котором требуется возможность расположения бок о бок по всей его длине). В зависимости от геометрии микрочастиц возможно, что две или более микрочастиц могут стоять бок о бок в установленном положении в микроканале, только когда они в определенных ориентациях. При положении бок о бок микрочастицы могут контактировать друг с другом или иметь расстояние между ними.
“Форма пластины” относится здесь к особой форме микрочастицы, где высота заметно меньше (например по меньшей мере в два раза), чем как ширина, так и длина, и тому, что микрочастица имеет две главным образом параллельные и главным образом плоские поверхности (передние поверхности) на вершине и дне (Фиг.12). “Дископодобная” форма относится к форме в виде пластины с круглой передней поверхностью.
Микроканал
Микроканал 1 настоящего изобретения предпочтительно не изогнут, то есть продольное направление продолжается по прямой линии, но может также иметь извилистый контур, то есть продольное направление продолжается с образованием линии с параллельными траекториями, соединенными дугами, для лимитирования занимаемой площади. Микроканал 1 предпочтительно в основном планарный, но может также распространяться трехмерно.
Длина микрожидкостного канала 1 может варьироваться в зависимости от его поперечного сечения и желаемого контура, обычно для того, чтобы уместить в него микрожидкостной микроноситель 13, который он обычно содержит. Типично, она будет изменяться в пределах от 1 мм до 500 см, предпочтительно от 5 мм до 200 см. Например, микроканал 1 с извилистым контуром и имеющий маленькое поперечное сечение (например, менее 100 микрон), может достигать относительно большой длины, такой как, например, сотни сантиметров в относительно малой занимаемой площади (несколько квадратных сантиметров). Например, в одном в квадратном сантиметре возможно уместить извилистый микроканал длиной 100 см, который имеет сечение 50 мкм (предполагая, что половина поверхности занята микроканалом 1 и другая половина свободна). В наиболее предпочтительном варианте выполнения микроканал 1 главным образом прямой и имеет длину от 2 мм до 10 мм, ширину от 200 микрон до 600 мм и высоту от 10 микрон до 20 микрон.
Микроканал 1 изобретения имеет вход 14 и выход 16, которые позволяют жидкостям 9 соответственно проникать в микроканал 1 и выходить из него. Вход 14 также используется для введения микроносителей 2 внутрь микроканала 1 и типично бывает соединен с резервуаром впускного отверстия 5, предпочтительно через расширенный край 6. Микроканал 1 изобретения предпочтительно заканчивается в задерживающем средстве 4, как это описано ниже, и типично продолжен другим микрожидкостным каналом (не служащим рекционным объемом), который ведет жидкости 9 в сток 15.
Микроканал 1 предпочтительно имеет сечение, которое прямоугольное или близко к прямоугольному (Фиг.16), трапециевидное или в форме параллелограмма. Микроканал типично имеет две боковые стенки 101, основание 102 и покрывающую поверхность 103. Боковые стенки предпочтительно, но не обязательно, прямые и расположены под углом 90 градусов к основанию (нижняя поверхность) и покрывающей поверхности (верхняя поверхность), соответственно. Боковые стенки могут быть выпуклыми или вогнутыми или могут соединяться с основанием или покрывающей поверхностью под непрямым углом, например 45 градусов или 60 градусов. Типично, высота микроканала заметно меньше (например по меньшей мере в два раза), чем его ширина. В другом варианте осуществления основание 102 и/или покрывающая поверхность 103 слегка изогнуты или имеют выемки или неровности, например для облегчения потока жидкостей 9.
Микроканал 1 настоящего изобретения, который служит в качестве реакционного объема 1, разработан так, что может содержать по меньшей мере 2 набора микроносителей 2 так, что два микроносителя могут располаться бок о бок без соприкосновения друг с другом и без соприкосновения с периметром по всей его длине, особенно на входе 14. В одном из вариантов выполнения микроканала по меньшей мере одно измерение поперечного сечения канала больше суммы наибольшего расширения и наибольшей проецированной площади двух микроносителей 2. Например, микроканал 1 с прямоугольным или близким к прямоугольному сечением и микроносители 2 в форме пластины, вышеупомянутое измерение может быть шириной микроканала 1, которое больше, чем сумма ширины любых двух микроносителей 2. Таким образом, микроканал 1 может иметь ширину такую, что две микрочастицы могут быть расположены бок о бок без подавления перемещений микрочастиц в продольном направлении микроканала 1, например, в течение наполнения. Более предпочтительна ширина такая, что микрочастицы могут пропускать друг друга без соприкосновения с периметром микроканала 1, что из-за трения может приводить к блокированию. В предпочтительном варианте осуществления поперечное сечение микроканала 1 предпочтительно постоянное или главным образом постоянное по всей длине микроканала 1. В другом варианте осуществления микроканал 1 соединен с расширенным краем 6, где поперечное сечение расширяется, типично на входе 14, для облегчения ввода микроносителей. В предпочтительном варианте осуществления расширенный край 6 на входе 14 прямоугольного или главным образом прямоугольного микроканала сделан увеличением расстояния от боковых стенок 101 до продольной оси, в то время как высота микроканала (то есть расстояние между основанием и покрывающей поверхностью) предпочтительно остается главным образом постоянной.
В предпочтительном варианте осуществления микроканал 1 сделан из или содержит кремний, SU-8 (фототвердеющий мтериал эпоксидной смолы), полиимид (ПИ), полидиметилксилан (ПДМС), силикон или другие термопластические эластомеры (ТПЭ), полиметилметакрилат (ПММА), Тефлон (ПТФЭ), термопластические эластомеры (ТПЭ), Victrex PEEK™, Поликарбонат, Поливинилхлорид (ПВХ), полипропилен (ПП), полиэтилен (PE), полистирол (ПС), Фторированный Этилен-Пропилен (ФЭП, циклического олефина (со)полимер (ЦОП или ЦОС) или другие термопластические полимеры, кварц, стекло или покрываемые металлы, такие как, например, никель, серебро или золото, наиболее предпочтительные из прозрачных полимеров. Наиболее предпочтительно микроканал выполнен из циклического олефина (со)полимера.
Предпочтительно по меньшей мере одна из сторон микроканала 1 прозрачна. Таким образом, можно легко наблюдать за микрочастицами посредством соответствующего устройства для оптического контроля, например, микроскопа. Это позволяет проводить незатруднительную идентификацию наборов микроносителей 2, которые маркированы с помощью оптических технологий, когда они помещены внутрь микроканала 1, и позволяет снятие биологических показаний посредством общепринятых технологий, основанных на оптическом ответе, используемом для определения в данной области. Подходящими материалами для обеспечения прозрачности являются, например, SU-8, ПДМС или силикон.
Микроканал 1 может быть изготовлен с использованием общепринятой фотолитографии, и/или штамповкой, и/или технологиями формования, которые широко описаны в литературе (например, в Fundamentals of microfabrication by Marc J. Madou, [Основы микроформования] ISBN: 0849308267, 9780849308260, Fundamentals and Applications of Microfluidics by Nam-Trung Nguyen and Steve Wereley [Основы и приложения микрогидродинамики], ISBN: 9781580533430, глава 3). Например, микроканал 1 может быть изготовлен травлением канала в субстрате известными способами и затем его уплотнением или нанесением слоя, например, произведенного из стекла, или вторым каналом, который тоже травился в субстрате. Для производства микрочастиц могут быть также использованы технологии микрообработки, например, для производства кремниевых микрочастиц в виде пластины, как это описано в патенте EP 1276555B1.
В рамках того, что рассмотрено, потоки - ламинарные. Для того чтобы обеспечить то, что представляющие интерес целевые молекулы в образцах проходили в близости от максимума микроносителей 2, микроканал 1 должен быть спроектирован так, чтобы микроносители 2 оставляли наименьший участок вокруг себя, через который образец 9 протекает. Расход жидкости будет, например, лимитирован оставшимся свободным участком вокруг микроносителей, длиной микроканала, силами, которые перемещают жидкости (например, используемое давление) и жидкостными свойствами образца (вязкостью, размером молекул носителя образца и так далее).
Микроносители и наборы микроносителей
Микроканал 1 содержит в себе одновременно по меньшей мере два набора микроносителей 2, но может также содержать три, четыре, пять, десять, или сотни, или более наборов микроносителей. При высоких уровнях мультиплексирования (например, гибридизационные анализы нуклеиновых кислот) микроканал может содержать сотни или тысячи наборов. Это, например, достижимо в длинных и широких микроканалах, связанных с маленькими микроносителями 2.
Размеры, форма и материал, как и различие между микрочастицами и микроносителями, описаны в формуле изобретения.
Микрочастицы или микроносители 2 настоящего изобретения могут быть изготовлены или содержать любые материалы, повседневно используемые в высокопроизводительной технологии экранирования и диагностике. Нелимитирующие примеры таких материалов включают в себя латекс, полистирол, поперечно-связанные декстраны, полиметилстирол, поликарбонат, полипропилен, целлюлозу, полиакриламид, полидиметилакриламид, фторированный этиленпропилен, а также материалы, широкоиспользуемые в микрообработке и микроизмельчении, такие как, например, оксид кремния, кремний, ПММА (полиметилметакрилат), золото, серебро, алюминий, сталь и другие металлы или фототвердеющие материалы на основе эпоксидной смолы, как SU-8. Микрочастицы могут иметь любые формы и размеры. Предпочтительно микрочастицы 2 выполнены из кремния.
Микроносители 2 настоящего изобретения закодированы таким образом, что их функция может быть определена считыванием кода.
Микрочастицы и микроносители 2 предпочтительно имеют сферическую форму или форму пластины, что означает, что их высота значительно меньше (например, по меньшей мере в два раза), чем их ширина и длина вместе, и что у них параллельные или главным образом параллельные плоские поверхности (передние поверхности) и наверху и в нижней части.
Таким образом, при введении микроносителей 2 в форме пластины в микроканал 1 с прямоугольным или близким к прямоугольному сечению, как это описано выше, они располагаются плоско на любую из их передних поверхностей и они могут легко быть детектированы с помощью оптического устройства. Фиг.13 показывает характерный вариант выполнения микроносителей 2 в форме пластины. Главная поверхность может иметь любую форму, нелимитирующими примерами являются квадрат, прямоугольник, круг, треугольник или шестиугольник (Фиг.12, справа).
В предпочтительном варианте осуществления микроносители 2 имеют дископодобную форму с передней поверхностью в виде круга и закодированы соответствующими образцу поперечными отверстиями 21, которые также предпочтительно включают в себя асимметрично ориентированную отметку 20, такую как, например, треугольник и Г-образный знак. Сочетание кода и формы позволяет незатруднительную идентификацию посредством технологий декодирования изображения.
В другом варианте осуществления микроносители 2 имеют магнитные свойства, которые, например, пригодны для иммобилизации их внутри микроканала.
Микроносители 2 каждого набора, как правило, функционализируют идентично. Микроносители 2 могут иметь различные размеры и формы по отношению друг к другу. Микроносители 2 маркированы так, что различные наборы различимы друг от друга по меньшей мере по одному атрибуту или характеристике, которые поддаются наблюдению, то есть по коду. Несмотря на то, что микроносители 2 индивидуально закодированы, микроносители 2 установленного набора предпочтительно имеют одинаковый код. При использовании маркированных микроносителей 2 в них может более вероятно быть введена случайная последовательность, чем при контролируемом методе.
Микроносители 2 служат в качестве средств обеспечения химических и биологических анализов. При этой возможности, микроносители 2 могут содержать один или более лигандов, прикрепленных к их поверхности, и могут контактировать с их целевыми аналитами для определения присутствия или отсутствия определенных представляющих интерес аналитов, или они также могут служить в качестве средств обеспечения реакций комбинаторной химии, совершенных на прикрепленном лиганде. В предпочтительном варианте осуществления каждый микроноситель имеет один лиганд, прикрепленный к его поверхности. Надо уточнить, что термин 'один лиганд' в используемом в данном документе значении не означает количественно одну молекулу, а означает один тип лиганда. Большой спектр химических и биологических функциональных средств может быть присоединен в качестве лигандов к микрочастицам настоящего изобретения, включая антитела и другие белки, как и нуклеиновые кислоты, такие как, например, ДНК, РНК или фрагменты одноцепочечной ДНК или аптамеры, предназначенные для связывания представляющих интерес молекул. Эти функциональные средства включают в себя все функциональные средства, которые повседневно используются в технологии высокопроизводительного экранирования и диагностики. Кроме того, микроносители 2 могут функционализировать различными способами, чтобы позволить связывание исходного реагента. Примеры целевых аналитов для лигандов, присоединенных к микроносителям 2, включают в себя антигены, антитела, рецепторы, гаптены, ферменты, белки, пептиды, нуклеиновые кислоты, лекарства, гормоны, патогены, токсины, клетки и другие представляющие интерес химикаты или молекулы.
Средства для ограничения продольного перемещения микроносителей
Настоящее изобретение обеспечивает средства для повышения скорости потока относительно скорости микроносителей 2 для того, чтобы увеличить возможность контакта между представляющими интерес молекулами 3 в жидкости 9 и рецепторов 8, присоединенных к микроносителям 2. По этой причине важно ограничивать перемещение микроносителей 2 в направлении потока, который направлен продольно, в то время как будет возможность прохождения жидкостей 9. Присутствие средств ограничения обеспечивает главным образом статическую конфигурацию проведения анализа и снятие показаний в том же месте, с возможностью снятия кинетических показаний вдобавок к убыстрению массопередачи. Может иметь место перпендикулярное потоку движение микроносителей, и может даже иметь положительное воздействие на скорость массопередачи, если движение микроносителей 2 достаточно быстрое, из-за повышения эффективного размера площади охвата (это форма перемешивания, которое может быть достигнуто, например, посредством постукивания, вибрации или обработки ультразвуком).
Ограничение продольного перемещения микроносителей может быть осуществлено несколькими путями. Например, может быть использовано по меньшей мере одно задерживающее средство 4 в конце реакционного объема 1, которое позволяет жидкостям 9 проходить, но блокирует прохождение микроносителей 2. Нелимитирующие примеры упомянутых задерживающих устройств включают в себя сетку, проволоку, сетчатый фильтр, проволочную конструкцию, одну или более опор, уменьшение сечения микроканала, электростатические силы, в частности, одну или более микрочастиц, удерживаемых электростатическими силами, диэлектрофоретическими силами, магнитную частицу и т.д. Также в качестве задерживающих средств 4 могут быть использованы решения, основанные на частичном сжатии деформируемых микроканалов 1 (то есть сокращающие геометрию микроканала, например, в случае микроканалов, изготовленных из мягких полимеров, таких как, например, ПДМС или парафин). Задерживающие средства 4 могут быть закрепленными или съемными. Съемные задерживающие средства, например магнитные частицы, позволяют незатруднительное удаление микрочастиц 2 в направлении потока 9 для замены микрочастиц или анализа микрочастиц. Закрепленные задерживающие средства 4, такие как, например, сетка, могут быть удалены с помощью лазера для удаления микрочастиц 2, например, для их анализа.
Альтернативно или дополнительно микроносители 2 могут иметь магнитные свойства, микроносители 2 могут быть иммобилизованы посредством магнитного поля. Поэтому присутствие задерживающих средства 4 может не быть необходимо. В альтернативном варианте осуществления микроносители 2 иммобилизованы посредством диэлектрофоретических сил. Благодаря ограниченному перемещению микроносителей в оборудовании также облегчены этапы очистки, промывка добавленных реагентов, а также и снятие биологических показаний, которые предпочтительно осуществлять в статическом режиме.
Конструкция микроканалов относительно микроносителей
В соответствии с настоящим изобретением микроканал 1 имеет поперечное сечение, которое позволяет по меньшей мере двум микроносителям располагаться бок о бок по всей длине микроканала 1, в особенности на входе 14, без соприкосновения друг с другом и с периметром. Необходимо иметь в виду, что строго говоря, микроканал настоящего изобретения, который служит в качестве реакционного пространства 1, заканчивается любым задерживающем средством, которое может быть встроено в микроканал (например, фильтр или сетчатая структура или уменьшение сечения, и так далее). Это означает, что любой микрожидкостной участок, который содержит задерживающее средство 4, не рассматривается частью микроканала 1 изобретения и, следовательно, необязателен для того, чтобы позволить бок о бок расположение двух или более микроносителей 2. Для наглядности, когда микроканал продолжается после задерживающего средства 4, эта часть рассматривается как другой микроканал (не служащий в качестве реакционного пространства), присоединенный к микроканалу 1 изобретения (который служит в качестве реакционного пространства), например, чтобы позволить жидкостям уходить через сток (см. Фиг. 1).
Тот факт, что сечение микроканала 1 и форма микроносителей 2 позволяют по меньшей мере двум микроносителям быть расположенными бок о бок без соприкосновения друг с другом или периметром, не означает, что они не должны соприкасаться друг с другом или с периметром. Это означает только, что относительная геометрия микроканала 1 и микроносителей 2 не вынуждает соприкасаться друг с другом или периметром, когда они расположенны бок о бок, несмотря на то, что они могут соприкасаться при свободном передвижении внутри микроканала 1 или когда они зафиксированы после ограничения их продольного перемещения.
Способность быть расположенными бок о бок без соприкосновения друг с другом и периметром микроканала 1 означает, что микроносители 2 могут пропускать друг друга, если они движутся с различными скоростями в продольном направлении микроканала 1, без трения со стороны стенок микроканала 1 или со стороны друг друга. Эта конфигурация уменьшает шансы засорения входа 14 в микроканал 1, так как гораздо более сложно формировать зависания, когда два носителя 2 могут быть расположены бок о бок на входе 14 и заметно более сложно в предпочтительном варианте осуществления, когда более чем двум микроносителям позволено располагаться бок о бок в микроканале 1. Также то, что один из них зафиксирован препятствием, позволяет микроносителям пропускать друг друга. Препятствиями могут быть осколки, присутствующие в микроканале 1, например, когда способ выполняется в условиях исследовательской лаборатории (как противоположность производственному оборудованию) непосредственно перед проведением анализа. Препятствия могут также быть элементами конструкции, такими как опоры, которые встроены в микрожидкостной канал 1 для облегчения производства микроканала 1 или для обеспечения жесткости, например, в случае создания микроканалов с использованием мягких полимеров, таких как, например, ПДМС. Скрепление устройства, содержащего микрожидкостной канал 1, также помогает при введении микроносителей 2. При использовании более тяжелых микрочастиц, таких как, например, кремниевые микрочастицы, скрепление более эффективно, когда оно проведено при низких частотах, типично ниже 5 герц.
В более предпочтительном варианте осуществления более чем два микроносителя 2 могут быть расположены бок о бок в микроканале 1 для того, чтобы уменьшить чувствительность к препятствиям (например, каналам) или дугообразным образованиям, обычно от 3 до 50 микроносителей, более предпочтительно от 3 до 12.
В предпочтительном варианте осуществления микроносители 2 имеют форму, которая минимализирует поверхностный контакт между ними, когда они в микроканале 1, для снижения трения. В основном предпочтительны формы с изогнутыми поверхностями, такими как, например, сферы или дископодобные формы, по сравнению с гранеными поверхностями (такими как, например, кубическая или полиугольная формы).
В предпочтительном варианте осуществления микроносители 2 имеют дископодобную форму, которая обеспечивает дополнительное преимущество незатруднительного распознавания на изображении. Другие формы, представляющие изогнутые поверхности, которые могут контактировать с другими микроносителями 2, также могут рассматриваться, такие как, например, микроносители 2 в форме пластины с передней поверхностью в виде овала, эллипсоида или близкой к круглой формой.
Структура монослоя
В более предпочтительном варианте осуществления форма микроносителей 2 и сечение микроканала 1 выбраны так, что микроносители 2 формируют структуру монослоя и оставляют открытым минимальный участок вокруг для протекания образца 9. ”Структура монослоя”, в используемом в этом документе значении, относится к пространственной конфигурации, в которой существует точка, из которой можно наблюдать за всеми микроносителями 2 по прямой линии без заслонения или преграждения друг другу любой другой части, которая важна для их идентификации (то есть для определения кода). В случае если микроканал 1 расположен горизонтально (то есть с продольным направлением, которое простирается главным образом горизонтально), это преобразуется в невозможность микроносителей 2 помещаться друг напротив друга или перекрываться при нахождении внутри микроканала 1. При условии, что микроканал 1 прозрачен по меньшей мере с одной стороны, структура монослоя намного более предпочтительна, так как она будет облегчать снятие биологических показаний и идентификацию микроносителей простым оптическим средством непосредственно внутри реакционного пространства 1.
В сочетании с тем фактом, что может быть по меньшей мере два микроносителя 2 бок о бок, как предусмотрено изобретением, эта конфигурация формирует квазидвумерное монослойное расположение, несмотря на минимизацию участка вокруг микроканалов для протекания образца 9 (см., например, Фиг.4). Как проиллюстрировано на Фиг. 4.2, это не обязательно влечет за собой строгое выравнивание микроносителей 2 в одной плоскости. Предпочтительно позволено более чем двум микроносителям 2 быть расположенными бок о бок, как правило, от 3 (трех) до 50 (пятидесяти) микроносителей 2, более предпочтительно от 3 (трех) до 12 (двенадцати). В этой структуре будет использоваться больше жидкости (пробной жидкости) 9, чем при строгом выравнивании микроносителей 2 один за другим, как видно в предшествующем уровне техники, но она будет гораздо легче в подготовке.
Сечение микроканала предпочтительно постоянно в области, где происходит реакция на микроносителях 2, для содействия равномерности условий течения.
Ориентация и идентификация микроносителей
При работе с закодироваными микроносителями 2 в сочетании с монослойным расположением более выгодно выбирать форму микроносителей 2, форму и материал микроканала 1 и декодирующий механизм так, чтобы коды могли быть прочитаны без необходимости активного манипулирования структурой микроносителей 2 и/или их ориентацией подходящим образом при наблюдении их непосредственно в микроканале 1. Это может быть достигнуто, например, использованием кодирующих механизмов, которые не требуют особенной ориентации или расположения, таких как, например, размер или цвет всего микроносителя 2, который может быть, например, сферическим (таким образом, не требуется какая-либо особенная ориентация).
Альтернативно форма микроносителей может быть такой, что их вращение пассивно ограничено, то есть ограничено без требования каких-либо внешних сил, отличных от проистекающих из геометрических ограничений сил, при расположении внутри микроканала 1, так что какой-либо код соответственно представлен устройству наблюдения/обнаружения.
Примерный вариант осуществления этой концепции заключается в разработке микроносителей 2 в форме пластины, имеющей код на одной или обеих поверхностях, и внесение их внутрь микроканала 1 с прямоугольным или близким к прямоугольному сечением, у которого по меньшей мере основание 102 или покрывающая поверхность 103 предпочтительно выполнены из прозрачного материала (см. Фиг. 8). Высота микроканала 1 предпочтительно меньше, чем высота двух микроносителей, при этом имеется эффект того, что микроносители не могут помещаться на вершине друг друга. Таким образом, микроносители формируют структуру монослоя и могут просто находиться в беспорядке, но всегда необходима представленность одной из плоских поверхностей одному устройству обнаружения, которые размещены для наблюдения за поверхностью микроканала 1 (как на Фиг.5). Это дополнительное ограничение формы микроносителей 2 фактически не становится причиной их более сложной загрузки при ее осуществлении через вертикальное впускное отверстие 5 с жидкостью 9, всасываемой в микроканал 1 (как изображено на Фиг.2 и 3), благодаря использованию микроканала 1, который относительно широк в сравнении с размером микроносителя 2, как предусмотрено изобретением. Примерный вариант выполнения такого микроканала 1 можно увидеть на Фиг. с 4 по 6.
Если какой-либо код представлен на поверхности микроносителя 2, то он легко поддается наблюдению на всех микроносителях, у которых устройству представлена правильная поверхность (статистически половина из них). Кроме того, если код представлен или видим с двух сторон, то все микроносители 2 могут быть декодированы без необходимости каких-либо дальнейших манипуляций для их ориентации.
Предпочтительный вариант осуществления этой концепции заключается в использовании кодов, которые располагаются поперек микроносителей 2 так, что код может быть прочитан и интерпретирован с обеих сторон. Необходимо иметь ввиду, что если кодирующая схема - фигурная (в отличие от нелокализованной характеристики всей поверхности, такой как цвет, размер и т.д.), то может быть нужно ее сочетание с меткой, которая показывает ориентацию (то есть метка с ассиметрией такой как, например, Г-образная метка или треугольник). На Фиг 7 показано изображение примерного варианта осуществления такого кода, произведенного посредством поперечных отверстий 21 на микроносителе в форме пластины (дискообразный микроноситель на Фиг.7). Упомянутая кодирующая схема дополнительно позволяет идентифицировать микроносители независимо от выполнения анализа и независимо от их расположения внутри микроканала.
Так как ориентация и расположение микроносителей 2 в плоскости не контролируется, то предпочтительным способом детектирования и декодирования упомянутых пластинообразных микроносителей 2 является фиксация изображения или нескольких изображений реакционного пространства 1, используя регулярный тип сенсора (например, ПЗС или КМОП фотосенсорную матрицу) такой как, например, проиллюстрированный на Фиг.5, или быстро сканирующую систему, которая создает изображение и затем выполняет аналитическую операцию над изображением для того, чтобы детектировать расположение микроносителя 2 и интерпретировать его код. Эта аналитическая операция, как правило, включает в себя алгоритм распознавания формы, такой как, например, алгоритм Хафа для детектирования расположения микроносителей 2 и “виртуального вращения” микроносителя 2 для того, чтобы интерпретировать их код независимо от их ориентации. Аналитическая операция над изображением также, как правило, может снижать или устранять эффект присутствия осколков или воздушных пузырей в реакционном пространстве 1. Одна “картинка”, снятая ПЗС (или КМОП) камерой с микроскопом, может быть использована для детектирования и декодирования таких микроносителей 2 и эта же камера может также быть использована для считывания флуоресцентного сигнала для снятия биологических показаний (как показано на Фиг.8).
Введение микроносителей в микроканал
Микроканал 1 настоящего изобретения имеет вход 14, который позволяет введение микроносителей 2 внутрь микроканала 1. Классический способ введения микрочастиц 2 в микроканал 1 заключается в получении их суспензии в буферном растворе, который заливается через впускное отверстие 5, соединенное с входом 14, в микроканал 1.
Микроканал 1 предпочтительно после входа 14 имеет расширенный участок 6, связанный с одним или более вертикальных резервуаров 7, которые служат в качестве впускного отверстия 5 для введения микрочастиц 2 в микроканал 1 (см. Фиг.2, 3). Расширенный участок 6 формирует воронку, что позволяет направление микроносителей 2 и жидкостей 9 из впускного отверстия 5 в микроканал 1. Как разъяснено выше, микроканал 1 настоящего изобретения имеет такое сечение по отношению к форме микроносителей 2, которое позволяет расположение бок о бок по меньшей мере двух микроносителей 2 в микроканале 1 по всей его длине, особенно на входе 14, тем самым снижая возможность засорения входа 14 формированием зависаний.
Распространенной проблемой, с которой сталкиваются при введении микрочастиц 2 в суспензии в микроканалы 1, является то, что, когда поток 9 останавливается (например, при смене одного раствора на другой), оставшиеся микрочастицы 3 имеют склонность к оседанию на дно резервуара 7, возможно, в областях, где они не могут быть захвачены пластинчатым завихрителями 8 (см. Фиг. 3). Это создает сложность их перемещения контролируемым способом и увеличивает опасность того, что различные наборы микроносителей будут смешаны, что не имеет никаких последствий, если микроносители 2 индивидуально закодированы, но будет проблематичным, если микроносители 2 каждого набора должны быть введены контролируемым способом в микроканал 1, как это требуется существующей технологией. Как правило, предоставляется время для полного осаждения микрочастиц 2 и расположения на дне впускного отверстия 5. Затем они перемещаются в микроканал 1 при комбинированных воздействиях засасывания буферного раствора и гравитационных сил, действующих на микрочастицы посредством наклона устройства. Этот способ особенно эффективен для тяжелых микрочастиц 2, таких как, например, кремниевые микрочастицы. Взбалтывание и перемешивание могут дополнительно содействовать процессу.
Для того чтобы преодолеть проблему микрочастиц 2, которые оседают в местах, откуда они не могут быть удалены, в варианте осуществления изобретения помимо резервуара 7 представлен второй резервуар 7', используемый в качестве впускного отверстия 5' для промывающего потока 9'. Посредством этого может быть достигнут постоянный (или микроимпульсный) промывающий поток 9', протекающий через микроканал 1 во время введения микрочастиц 2 для предотвращения их осаждения в дальнейшем (см. Фиг. 2). Когда микрочастицы тяжелые, как, например, выполненные из кремния, обычно это не требуется, так как силы тяжести, действующие на микрочастицы 2 при наклоне устройства, достаточны для их перемещения в требуемом направлении.
Также обосновано пропускать чистую жидкость 9 (то есть без микрочастиц в суспензии) во впускное отверстие 5 микроносителей после введения микрочастиц для того, чтобы обеспечить то, что никаких частиц не осталось в резервуаре 7 или расширяющемся пространстве 6 микроканала 1. Это также может быть в сочетании с оптической проверкой расширяющегося пространства 6 микроканала 1 для дополнительного повышения надежности процедуры.
Способ
Второй аспект настоящего изобретения обеспечивает способ проведения мультиплексного анализа на основании микроносителей, состоящий из этапов, которые:
a) обеспечивают анализирующее устройство, содержащее микроканал 1 в качестве реакционного пространства и обеспечивают по меньшей мере два набора закодированных носителей 2, где код упомянутых носителей 2 является указывающим на их функцию и где форма и размер упомянутых микроносителей относительно сечения упомянутого микроканала 1 позволяет иметь по всей длине упомянутого микроканала 1 по меньшей мере два каких-либо из упомянутых микроносителей 2, расположенных бок о бок;
b) по меньшей мере частично наполняют упомянутый микроканал 1 с по меньшей мере двумя упомянутыми закодированными микроносителями 2;
c) ограничивают передвижения упомянутых микроносителей 2 в продольном направлении упомянутого микроканала 1 наряду с тем, что жидкости 9 все еще могут протекать;
d) пропускают образец потенциально содержащего одну или более целевых молекул 3 через упомянутый микроканал 1, содержащий упомянутые микроносители 2;
e) идентифицируют наборы микроносители 2 и
f) детектируют реакцию между лигандом и целевой молекулой, то есть совершают снятие биологических показаний и соотносят присутствие или отсутствие реакции с идентичностью специфического набора для вывода о присутствии или отсутствии целевой молекулы 3 в образце. Это, как правило, соотносится с идентификацией микроносителей 2.
Микроканал 1, микроносители 2 и ограничивающее средство 4 предпочтительно такие, как описано выше. Следовательно, специалист в данной области должен понимать, что этапы от (a) до (c) способа выполнения мультиплексных анализов, изложенных в настоящем документе в качестве второго аспекта изобретения, фактически формируют устройство для мультиплексного анализа первого аспекта изобретения. Описания каждого из этих двух аспектов изобретения, следовательно, могут быть понятны в контексте другого аспекта.
Для мультиплексирования микроканал 1 предпочтительно загружен различными наборами микроносителей 2, при этом каждый набор имеет различную функционализацию. Все наборы присутствуют в реакционном пространстве до того, как протекают образцы и они одновременно подвергаются анализу. Так как используется более одного функционализирующего микроносителя и положение микроносителей не должно контролироваться, то различные наборы микроносителей 2 должны быть отличимы друг от друга, то есть должен быть метод для того, чтобы определить функцию микроносителей 2, когда они в реакционном пространстве 1, независимо от их расположения внутри микроканала 1. Это осуществлено посредством использования закодированных микроносителей 2, в которых код является указывающим на функцию. Примеры кодов кратко изложены выше. Для мультиплексных технологий также важно то, что микроносители могут быть различимы и/или идентифицируемы даже в отсутствии сигнала, произведенного аналитом, то есть независимо от выполнения анализа (то есть технология не должна основываться на присутствии аналита для выявления того, какому набору принадлежит микроноситель), так как есть варианты осуществления, в которых наборы не должны выявляться в случае отсутствия соответствующей мишени, то визуальный качественный контроль затруднителен и также значительно лимитировано количество различных наборов, которые могут быть использованы (то есть уровень мультиплексирования,) потому что в таком случае нужно основываться на способах, где реакция должна быть отличаема для каждого набора (в случае снятия флуоресцентных показаний это, как правило, осуществляется при помощи использования различных флуорофоров, но уровень мультиплексирования в таком случае лимитирован их спектральными характеристиками и на практике, это сводится к типичному максимуму 5 или 6 различных наборов микроносителей, которые могут быть использованы совместно). Это может быть достигнуто посредством использования физических кодирующих технологий. Например, микроносители могут быть индивидуально закодированы или иначе произведены с атрибутом, который различим при наблюдении, как, например, код или атрибут, указывающий на функцию.
В предпочтительном варианте осуществления примеров кодов, кратко изложенных выше в описании первого аспекта, микроносители 2 способа имеют дископодобную форму, и даже более предпочтительно они имеют код, содержащий поперечные отверстия 21, предпочтительно также включая в себя ориентационную отметку 20. Соответственно микроканал 1 имеет предпочтительно плоскую форму с прямоугольным сечением, и микроносители 2 упорядочены в монослой внутри микроканала 1 (как на Фиг.6).
Этап (b) можно успешно выполнить пропусканием жидкости 9, содержащей микроносители 2 в суспензии, через впускное отверстие 5, которое соединяет вход 14 микрожидкостного канала 1, предпочтительно через расширенное пространство 6. Как объяснено выше, практическое выполнение этого этапа облегчено тем фактом, что сечение микроканала 1 такое, что по меньшей мере два микроносителя могут быть расположенными рядом в микрожидкостном канале по всей его длине. Этап (b) может также сопровождаться покрытием анализирующего устройства, содержащего микроканал. Этому будет содействовать тот факт, что микроносители могут пропускать друг друга, как это допускается геометрией устройства в случае блокирования микроносителя препятствием.
Для этапа (b) предпочтительно позволить более чем точно двум микроносителям быть расположенными бок о бок без соприкосновения со стенками микроканала. Как правило, возможность расположения от 3 (трех) до 50 (пятидесяти) микроносителей бок о бок облегчает подготовку приспособления, так как это позволяет уменьшить опасность засорения входа в микроканал и также противодействует препятствиям или осколкам, которые могут быть в микроканале.
Этап (c) выполняется посредством использования ограничительного средства, как кратко изложено в описании ограничительного средства выше. Перемещение микроносителей 2 в продольном направлении сдерживается, или они иммобилизованы внутри микроканала 1, в то время как все еще существует возможность протекания жидкости.
На этапе (d) образец, возможно содержащий молекулу(ы), представляющую интерес, проводится через микроканал 1 и, таким образом, входит в близкий контакт с микроносителями 2. Это может быть осуществлено использованием некоторых технологий, включающих в себя давление, электрический потенциал (электроосмотический поток), капиллярное действие, силу тяжести или центробежную силу. В предпочтительном варианте осуществления микроканал 1 соединен одним концом с одним или более впускных отверстий 5 (как разъяснено выше) и другим концом с одним или более стоков, что позволяет перемещать жидкости посредством применения разности давлений между одним или более впускных отверстий и/или одним или более стоков, таким образом, создавая давление управляющее потоком (ДУП). Положительное давление и/или отрицательное давление (отсасывание) могут применяться к одному или более впускных отверстий и стоков посредством использования перекачивающих или пневматических механизмов. Таким образом, в одном из вариантов осуществления жидкости 9 перемещаются посредством применения позитивного давления на впускном отверстии, соединенном с микроканалом, и/или отрицательным давлением (отсасыванием) на стоке, соединенном с микроканалом. Жидкости 9 могут проводиться непрерывным методом или методом остановки потока (то есть последовательность перемещающихся жидкостей 9 и неподвижных жидкостей 9 в микроканале).
Скорость, при которой образец должен протекать, и соответственно время, за которое представляющая интерес молекула проходит близко от микроносителя 2, могут быть оптимизированы на основании скорости диффузии целевой молекулы 3 и концентрации микроносителей 2, покрытых рецепторами 10 к целевой молекуле 3.
Так как продольное перемещение микроносителей 2 ограничено реакционным пространством, то незатруднительно выполнять дополнительные этапы анализа, если это требуется. Это может быть легко осуществлено посредством пропускания различных жидкостей 9 последовательно или одновременно, например, для выполнения промывки или добавления новых реагентов, без необходимости каких-либо специфических манипуляций с микроносителями 2.
В одном варианте осуществления образец 9 пропускается туда и обратно в микроканале 1. Предпочтительно это перемещение оптимизировано для того, чтобы оно совпадало с расстоянием соответствующим среднему расстоянию между двумя микроносителями 2, имеющими лиганды 10 на одинаковую целевую молекулу 3. Вариант осуществления, в котором образец 9 перемещается туда и обратно, может быть успешно выполнен посредством использования задерживающего средства 4, основанного на силах, действующих на микрочастицы 2 (таких как, например, магнитные силы), или посредством использования “активируемого” задерживающего средства 4 рядом с входом 14 микроканала 1 (такого как, например, сокращение части микроканала 1) для того, чтобы позволить проникновение микрочастиц 2 перед активацией задерживающего средства 4.
В дополнительном варианте осуществления образец 9 рециркулирует через весь микроканал 1 посредством обеспечения жидкостного соединения стока с впускным отверстием и средством воздействия на жидкости, таким как, например, перистальтический насос.
Рециркуляция или движение туда и обратно образца 9 полезны в ситуациях, когда трудно контролировать скорость образца 9 и/или в случае сильно разбавленных образцов 9.
Этап (e) идентификации может быть выполнен перед, во время или после протекания образца (этап d). Он также может быть выполнен одновременно или после детектирования реакции (этап f), в особенности, когда микроносители 2 опознаются независимо от проведения анализа, например, совмещением способов, которые используются для обеих целей, например, использованием схожих оптических способов, таких как, например, получение изображения и анализ для идентификации двух наборов и детектирования реакций. Эта идентификация достигается посредством использования закодированных микроносителей 2, как это уже описано выше в нескольких местах. Несмотря на то, что их расположение в микроканале 1 не контролируется, различные наборы микроносителей 2 настоящего изобретения могут быть идентифицированы и/или распознаны, когда они находятся внутри микроканала 1 на основании свойственных характеристик, которые не должны выявляться присутствием целевых молекул, то есть независимо от проведения анализа и независимо от их расположения в микроканале 1, например, посредством кода в форме отверстий или посредством формы микроносителей.
Этап (f) детектирования может быть выполнен во время протекания образца (этап d) для того, чтобы получить кинетическую информацию о развитии реакции, когда анализ продолжается, или после этапа (d) для снятия показаний в конечной точке. Также возможно проводить идентификацию различных наборов перед протеканием образца (этап d). Этап детектирования может, например, включать в себя исследование микроносителей (например, оптическое детектирование) или опознавание микроносителей (например, магнитнитная детекция) как по отдельности, так и одновременно, например, посредством широкой области технологий наблюдения. Микроносители 2 способа, раскрытого здесь, предпочтительно являются описанными выше микроносителями 2.
В дополнение к проведению анализа осуществляется снятие биологических показаний для определения того, какие микроносители прореагировали и, если требуется, до какой степени (смотри этап f). В предпочтительном варианте осуществления микроканал 1 разработан так, чтобы позволять наблюдение за микроносителями 2 непосредственно внутри микроканала 1 посредством предоставления возможности исследуемым сигналам проходить по меньшей мере через одну сторону или участок, содержащий микроносители 2. В гораздо более предпочтительном варианте осуществления микроканал 1 прозрачен по меньшей мере с одной стороны и участке для того, чтобы позволить оптическое наблюдение. Альтернативно или добавочно, микроканал 1 может также быть проницаем для магнитных полей электромагнитной радиации и позволяет магнитное или электомагнитное опознавание микроносителей для идентифицирования различных наборов и/или проведения снятия биологических показаний (например, используя магнитные метки).
В предпочтительном варианте осуществления микроносители 2 имеют структуру монослоя и микроканал 1 прозрачен по меньшей мере с одной стороны, что позволяет простое непосредственное оптическое наблюдение за всеми микроносителями 2 по отдельности. Если микроносители не в структуре монослоя, то более сложные конфокальные оптические технологии могут быть использованы при условии, что микроносители (полу)прозрачные.
Снятие биологических показаний, как правило, выполняется посредством генерирования различимого сигнала, предпочтительно оптически различимого сигнала, когда происходит связывание, например, люминометрическим откликом, или магнитным откликом, или другим типом электромагнитного излучения, как правило, с использованием дополнительных меченых молекул. Реакция может быть зарегистрирована колориметрическим, химолюминометрическим, точечным квантовым испусканием и/или флюорометрическим откликом. Снятие биологических показаний может также давать количественную информацию (то есть информацию о количестве аналита, присутствующего в образце) измерением интенсивности сигнала, генерированного реакцией. Если в реакционном пространстве используется несколько наборов микроносителей, то необходимо, чтобы генерирующий сигнал локализировался на микроносителе и не выделялся в основную часть раствора. Как правило, реакция выявляется посредством использования комплементарной молекулы, которая присоединяется к комплексу, сформированному лигандом и целевой молекулой (если последняя присутствует в образце). Альтернативно, возможно наличие комплекса, содержащего флуорофор и гаситель люминесценции, присоединенные к поверхности микроносителя. Снятие биологических показаний может также включать в себя технологии детекции без использования меток, известные в данной области, например, поверхностный плазмонный резонанс (ППР) или электрические методы (например, изменение электропроводности).
Как проиллюстрировано на Фиг.5, предпочтительный метод заключается в подготовке приспособления, где микроносители 2 в монослойной структуре и ориентации относительно сенсора, предпочтительно оптического сенсора, для наблюдения за микроносителями 2 непосредственно в области, где происходит реакция, то есть внутри реакционного пространства 1, предпочтительно без перемещения микроносителей 2. Сенсор может быть широкообластным сенсором, который контролирует/распознает многочисленные микроносители 2 за один раз (например, ПЗС или КМОП фотосенсорный анализ, связанный с необходимым оптическим средством, таким как, например, линзы и объективы для формирования приспособления, сходного с микроскопом) или узкообластным сенсором (например, фотодиодом, фотоумножителем, или контрольным сканером, или магнитным сенсором), который контролирует/распознает один микроноситель 2 за один раз. Для оптических сенсоров, микроканал должен быть прозрачен, по меньшей мере, со стороны, на которой наблюдаются микроносители. Предпочтительно для “фиксации” изображения или ряда изображений микроносителей 2 внутри реакционного пространства и выявления реакций обработкой изображений используется широкообластной сенсор. Эта технология может быть совмещена с детектированием кодов для идентификации наборов микроносителей, при условии, что кодирующий механизм основан на оптическом контрасте, который может быть детектирован схожими оптическими приборами (например, посредством использования декодирующего механизма, основанного на поперечных отверстиях). Узкообластные сенсоры могут также быть использованы, но необходимо их перемещение для того, чтобы они были пройдены всеми микроносителями 2, и генерировался сигнал, который может быть проанализирован для выявления реакций. Так как расположение микроносителей в микроканале относительно свободное внутри микроканала, узкообластные сенсоры могут быть использованы некоторым образом, где они создают изображение сканированием реакционного пространства 1. Альтернативно могут быть использованы некоторые узкообластные сенсоры для наблюдения за несколькими участками микроканала 1 одновременно. Также возможно объединять использование широкообластного сенсора для идентификации микроносителей 2 с узкообластным сенсором для детектирования реакции.
В вариантах осуществления, где микроносители 2 наблюдаются непосредственно в реакционном пространстве 1, нет необходимости удалять задерживающее устройство 4 и нет необходимости выпускания микроносителей 2 в целях детектирования; однако микроканал 1 предпочтительно прозрачен по меньшей мере с одной стороны и/или по меньшей мере на одном участке имеется возможность оптического наблюдения за микроносителями 2. Этот вариант осуществления также позволяет считывание кинетики реакции. На самом деле возможно наблюдать биологические сигналы при проведении анализа и, следовательно, получать своевременную информацию о реакционной кинетике (см. Фиг. 9). В качестве альтернативы оптическим сенсорам возможно использование других сенсоров, таких как, например, магнитные сенсоры или спектрометрические сенсоры, если анализ разработан для изменения магнитной характеристики или выделения спектра микроносителей 2, когда происходит реакция. Это может быть достигнуто, например, посредством использования “магнитных меток” присоединенных к комплементарным антителам в такой же форме, как при флуоресцентных метках.
Другой вариант заключается в выпускании или перемещении в конце анализа микроносителей 2 через другой участок микроканала 1 (участок для наблюдения или окно) и считывание биологических сигналов по мере их прохождения, подобно тому, как это делается в флуоресцентно-активированном разделении клеток (ФАРК) или, альтернативно, возвращение микроносителей 2 через впускной резервуар и помещение их в другое устройство для наблюдения, например на предметное стекло, установленное на флуоресцентном микроскопе. Этот способ позволяет только снятие биологических показаний в конечной точке, но не дает возможность снятия кинетических показаний. Здесь опять может быть использован широкообластной сенсор (такой как, например, ПЗС или КМОП фотосенсорный анализ) или узкообластной сенсор (такой как, например, фотодиод). Это также может быть совмещено с детектированием кода для идентификации наборов микроносителей 2. Для указанной цели необходимо устранить ограничение продольного перемещения, как это описано выше, например, посредством удаления задерживающего устройства 4 или устранением магнитного поля.
На этапе (f) наблюдение за снятием биологических показаний взаимосвязано с идентичностью микроносителя 2, которая наблюдалась на этапе (е). Эта взаимосвязь двух наблюдений (то есть наблюдение за идентичностью и наблюднение за биологическим сигналом) может, например, быть осуществлена как объединением двух измерений в одном (то есть использование одинакового сигнала или одинакового оптического изображения) или посредством расположения микроносителей для взаимосвязи двух измерений (то есть посредством использования двух сигналов или оптических изображений, которые соответствуют одинаковому пространственному расположению, где присутствует микроноситель 2). Статичное расположение микроносителей 2 облегчает это соотношение, так как два измерения могут быть разделены во времени, например когда идентификационный этап (e) выполняется перед пропусканием образца (этап d). В предпочтительном варианте осуществления идентификационный этап (e) выполняется главным образом одновременно со снятием биологических показаний этапа (f) для того, чтобы обеспечить, чтобы какое-либо неумышленное передвижение микроносителей 2 не препятствовало соотношению индивидуальности микроносителей 2 с их биологическим сигналом. Это может быть достигнуто, например, посредством получения двух изображений ПЗС или КМОП камерой одновременно или в течение очень короткого периода времени после или во время протекания образца (этап d). Первое изображение, как правило, изображение в яркой области, используется для идентифицирования микроносителей 2, тогда как второе изображение, как правило, флуоресцентное изображение, используется для выполнения снятия биологических показаний. Альтернативно идентификация и снятие биологических показаний могут быть основаны на единственном измерении (например, одинаковом изображении). Последнее применимо к вариантам осуществления, где микроносители 2 высвобождаются в участок для наблюдения и наблюдаются по мере их прохождения.
Микросхема
В другом аспекте изобретение обеспечивает микросхему 13 для мультиплексирования. Упомянутая микросхема 13 содержит анализирующее устройство, описанное в первом аспекте изобретения. Примерная микросхема 13 показана на Фиг.11. Упомянутая микросхема 13 может, например, быть использована для диагностических целей. В гораздо более предпочтительном варианте осуществления можно наблюдать за микроносителями 2 без необходимости высвобождать микроносители 2 из микроканала 1.
Пример 1
Приспособление, имеющее в своем составе микроканал, соединенный с впускным резервуаром и выпускным резервуаром, и содержащее опоры (см. Фиг. 17), было изготовлено с использованием технологии формовки ПДМС и соединено с предметным стеклом 5 (как это описано в Fundamentals and Applications of Microfluidics by Nam-Trung Nguyen and Steve Wereley [Основы и применения микрогидродинамики], ISBN: 9781580533430, глава 3).
Были изготовлены кремниевые микроносители в форме диска со структурой поперечных отверстий по периметру (для использования в качестве кода). Это было сделано в условиях чистого помещения с использованием основанных на пластине технологий микрообработки, которые позволяют произвести несколько миллионов микроносителей с диаметром 50 микрометров и толщиной 10 микрометров. Протекает процесс, составленный из следующих этапов:
1) Обеспечивают КНИ (кремний на изоляторе) пластины (10.16 см в диаметре, толщина пластины подложки интегральной микросхемы 380 мкм, толщина BOX 1 мкм, слой устройства 10 мкм).
2) Намечают форму микроносителей и их код (см. Фиг. 18) посредством использования традиционных технологий фотолитографии (покрытие, полученное методом центрифугирования светочувствительного защитного слоя, УФ-освещением через фильтр, расширением, травлением кремния всего слоя устройства и конечное снятие защиты).
3) Готовят отслаивание микроносителей посредством стравления BOX слоя пластины.
4) Образуют покрытие оксидным слоем толщиной приблизительно 110 нм ПОГФ (плазмохимическое осаждение из газовой фазы) на верх микроносителей. Этот слой необходим для обеспечения соответствующего флуоресцентного сигнала на кремниевых частицах (Bras, M., et al., Optimisation of a silicon/silicon dioxide substrate for a fluorescence DNA microarray.[Оптимизация субстрата кремний/диоксид кремния для флуоресценции ДНК микроматричного анализа] Biosensors & bioelectronics, 2004. 20(4): стр. 797-806; Voile, J.N., et al., Enhanced sensitivity detection of protein immobilization by fluorescent interference on oxidized silicon [Повышенная чувствительность детектирования иммобилизации белков посредством флуоресцентной интерференции на окисленном кремнии]. Biosensors and Bioelectronics, 2003. 19(5): стр. 457-464).
5) Освобождают микроносители с субстрата посредством погружения пластинок в раствор жидкости, такой как, например, ацетон, при обработке ультразвуком.
Эта процедура была повторена для производства двух наборов микроносителей с несколькими различными кодами.
Приблизительно 300,000 микроносителей каждого кода были далее функционализированы на поверхности с первичными аминами реакцией с 10% по объему (3-аминопропил)триэтоксисиланом в 1 мл ацетона при комнатной температуре в течение одного часа с взбалтыванием. Микроносители были гранулированы и ресуспендированы в 1 мл 10 ммоль борном буфере, 150 ммоль хлорида натрия, содержащего 0,1% Tween-20 при pH 8,2(BBST). Аминогруппы группы на поверхности микроносителей были активированы добавлением 800 мкл 10% по объему глутарового альдегида в BBST. Микрочастицы перемешивались в растворе при комнатной температуре в течение одного часа. После этапа активации микроносители промывались 1 мл BBST 3 раза.
После этого 2 набора микроносителей были покрыты биологическими пробами P1 (5' - CAA CCC CAG CTA ATA TTA TT - 3') и P2 (5' - TGG GTAAGT TAG GGC GAT GG - 3'), соответственно, посредством добавления раствора 500 нмоль аминомодифицированного (5' - или 3') олигонуклеотида (P1 или P2) в BBST. Микроносители далее перемешивались в растворе при комнатной температуре в течение 1 часа. После этапов промывки, как описано выше, с BBST непрореагировавшие функциональные группы были блокированы посредством реакции с 35 нмоль глицина в BBST при комнатной температуре в течение 15 мин. Микроносители промывались BBST дважды и после этого хранились в том же буфере.
Мастер-микс суспензия двух наборов микроносителей была приготовлена посредством тщательного перемешивания 10 мкл суспензии микроносителей каждого набора, приготовленых ранее. Смесь двух наборов функционализированных микроносителей была далее загружена в микроканал раскапыванием мастер-микс суспензии во впускное отверстие и применения отрицательного давления в стоке для засасывания мастер-микс суспензии микроносителей в микроканал. ПДМС микроканал был предварительно наполнен этанолом для усиления гидрофильности.
Пробный раствор мишеней T1 (5' Cy 5 - AAT AAT ATT AGC TGG GGT TG - 3'), комплементарных P1, был приготовлен посредством предоставления раствора 200 нмоль олигонуклеотидов T1, меченных флуорофором Cy5 на 5'-конце в 5 x SSPE (содержащем 125 ммоль фосфатного буфера, 745 ммоль NaCl, 5 ммоль EDTA при pH 7.4).
После удаления всего избыточного раствора из впускного резервуара, этот пробный раствор был добавлен во впускной резервуар и пропускался через канал при комнатной температуре в течение 5 минут. После промывания целевой последовательностью T1 избыточный раствор был удален из впускного резервуара и микроносители промывались пропусканием 2 × SSC (15 ммоль цитрата натрия, 150 ммоль NaCl, pH 7) при комнатной температуре в течение 1 минуты. Наблюдали за флуоресцентным сигналом двух наборов микроносителей через стеклянный слой на флуоресцентном микроскопе (Zeiss Axiovert 135) с набором фильтров Cy 5. На Фиг. 8 показаны результаты эксперимента, зарегистрированного охлажденной CCD камерой (камера Hamamatsu ORCA C4742-80-12AG).
Несмотря на то, что здесь показаны и описаны предпочтительные в настоящее время варианты осуществления изобретения, необходимо отчетливо понимать, что изобретение не лимитировано для этой цели, но может быть иным способом по-разному реализовано и выполнено в рамках следующей формулы изобретения.
Реферат
Группа изобретений относится к области медицины и может быть использована для мультиплексного анализа. Анализирующее устройство содержит реакционное пространство, два набора индивидуально закодированных микроносителей (2), причем каждый микроноситель является функционализирующим, а каждый микроноситель одного из по меньшей мере двух наборов имеет одинаковую функционализацию, в котором реакционное пространство является микроканалом. При этом микроносители (2) имеют форму относительно сечения микроканала (1), которая позволяет иметь по всей длине микроканала (1) два каких-либо микроносителя (2), расположенных бок о бок без соприкосновения друг с другом и без соприкосновения с периметром микроканала (1). При этом устройство содержит средство (4) для ограничения перемещения микроносителей (2) в продольном направлении микроканала (1), наряду с тем, что жидкости все еще могут протекать, а код микроносителей является указывающим на его функционализацию. Группа изобретений относится также к способу приведения мультиплексного анализа и микросхеме для мультиплексных анализов. Группа изобретений обеспечивает ускорение массопереноса, уменьшение количества образцов, упрощает подготовку и выполнение анализа и облегчает снятие показаний биологических реакций. 3 н. и 14 з.п. ф-лы,18 ил., 1 пр.
Формула
реакционное пространство является микроканалом (1);
при этом микроносители (2) имеют форму относительно сечения микроканала (1), которая позволяет иметь по всей длине микроканала (1), по меньшей мере, два каких-либо микроносителя (2), расположенных бок о бок без соприкосновения друг с другом и без соприкосновения с периметром микроканала (1), так что микроносители, которые будут передвигаться в продольном направлении микроканала с разной скоростью, будут способны пропускать друг друга до того места, где их продольное передвижение ограничено, при этом одна или более микрочастиц (i) находятся в такой конфигурации, что две или более микрочастиц помещаются внутри микроканала и (ii) пересекают сечение в этом установленном положении, и (iii) их проецируемые поверхности в продольном направлении, в этом установленном положении, не перекрываются и ограничены поверхностью сечения в этом установленном положении;
при этом устройство содержит средство (4) для ограничения перемещения микроносителей (2) в продольном направлении микроканала (1), наряду с тем, что жидкости все еще могут протекать; а
код микроносителей является указывающим на его функционализацию.
a) обеспечивают анализирующее устройство в соответствии с любым из предшествующих пунктов;
b) по меньшей мере, частично наполняют микроканал (1), по меньшей мере, двумя наборами закодированных микроносителей (2);
c) ограничивают перемещение микроносителей (2) в продольном направлении микроканала (1), тогда как все еще оставляют возможность протекания жидкостей;
d) пропускают образец (9) через микроканал (1), содержащий микроносители (2);
e) идентифицируют наборы микроносителей (2); и
f) проводят снятие биологических показаний в соответствии с идентичностью микроносителей (2).

Комментарии