Трипептидилпептидазы, способные воздействовать на связи с участием пролина, и их применения - RU2741080C2
Код документа: RU2741080C2
Чертежи




























Описание
Область изобретения
Настоящее изобретение касается толерантных к пролину трипептидилпептидаз для применения в получении гидролизатов и в продуктах питания, содержащих указанные трипептидилпептидазы, способные воздействовать на связи с участием пролина, или гидролизаты.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Протеазы (синонимичные пептидазам) представляют собой ферменты, способные к расщеплению пептидных связей между аминокислотами в субстратных пептидах, олигопептидах и/или белках.
Протеазы сгруппированы в 7 семейств на основе механизма их каталитической реакции и аминокислотного остатка, вовлеченного в активный центр для катализа. Сериновые протеазы, протеазы аспарагиновой кислоты, цистеиновые протеазы и металлопротеазы представляют собой 4 основных семейства, в то время как треониновые протеазы, протеазы глутаминовой кислоты и не сгруппированные протеазы составляют остальные 3 семейства.
Субстратную специфичность протеазы обычно определяют в единицах преимущественного расщепления связей между конкретными аминокислотными остатками в субстрате. Как правило, положения аминокислот в субстратном пептиде определяются относительно местоположения расщепляемой связи (т. е. положения, в котором протеаза расщепляет):
NH2 -……P3-P2-P1*P1ʹ-P2ʹ-P3ʹ……-COOH
Проиллюстрированная с использованием гипотетического пептида выше расщепляемая связь обозначена звездочкой (*), в то время как аминокислотные остатки представлены буквой ʹРʹ, причем остатки с N-конца по отношению к расщепляемой связи начинаются с Р1 и возрастают по номеру при продвижении от расщепляемой связи к N-концу. Аминокислотные остатки с C-конца по отношению к расщепляемой связи начинаются с P1ʹ и возрастают по номеру при продвижении к C-концевому остатку.
Протеазы также можно в целом разделить на две широкие группы на основании их субстратной специфичности. Первая группа представляет собой такие эндопротеазы, которые яваляются протеолитическими пептидазами, способными к расщеплению внутренних пептидных связей пептидного или белкового субстрата и проявляющие тенденцию к активности в удалении от N-конца или С-конца. Примеры эндопротеаз включают трипсин, химотрипсин и пепсин. В противоположность этому, вторая группа протеаз представляет собой экзопептидазы, которые расщепляют пептидные связи между аминокислотными остатками, расположенными по направлению к С или N-концу белкового или пептидного субстрата.
Определенные ферменты группы экзопептидаз могут обладать трипептидилпептидазной активностью. Следовательно, такие ферменты способны к отщеплению фрагментов из 3 аминокислот (трипептиды) с незамещенного N-конца субстратных пептидов, олигопептидов и/или белков. Известно, что трипептидилпептидазы отщепляют трипептидные последовательности с N-конца субстрата, за исключением пептидных связей с пролином в положении P1 и/или P1'. В качестве альтернативы трипептидилпептидазы могут быть пролин-специфическими и способными к расщеплению только субстратов, имеющих остаток пролина с N-конца от расщепляемой связи (т. е. в положении Р1).
Как экзопептидазы, так и эндопротеазы имеют множество применений как в пищевой промышленности, так и в промышленности кормов, а также в получении гидролизатов.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В широком аспекте настоящее изобретение предлагает способ получения гидролизата, предусматривающий: (a) смешивание по меньшей мере одного белка или его части с:
(A) по меньшей мере одной эндопротеазой и
трипептидилпептидазой, содержащей одну или несколько аминокислотных последовательностей, выбранных из группы, состоящей из последовательностей под SEQ ID No. 29, SEQ ID No. 1, SEQ ID No. 2, SEQ ID No. 3, SEQ ID No. 4, SEQ ID No. 5, SEQ ID No.6, SEQ ID No. 7, SEQ ID No. 8, SEQ ID No. 9, SEQ ID No. 10, SEQ ID No. 11, SEQ ID No. 12, SEQ ID No. 13, SEQ ID No. 14, SEQ ID No. 15, SEQ ID No. 16, SEQ ID No. 17, SEQ ID No. 18, SEQ ID No. 19, SEQ ID No. 20, SEQ ID No. 21, SEQ ID No. 22, SEQ ID No. 23, SEQ ID No. 24, SEQ ID No. 25, SEQ ID No. 26, SEQ ID No. 27, SEQ ID No. 28, SEQ ID No. 30, SEQ ID No. 31, SEQ ID No. 32, SEQ ID No. 33, SEQ ID No. 34, SEQ ID No. 35, SEQ ID No. 36, SEQ ID No. 37, SEQ ID No. 38, SEQ ID No. 39, SEQ ID No. 40, SEQ ID No. 41, SEQ ID No. 42, SEQ ID No. 43, SEQ ID No. 44, SEQ ID No. 45, SEQ ID No. 46, SEQ ID No. 47, SEQ ID No. 48, SEQ ID No. 49, SEQ ID No. 50, SEQ ID No. 51, SEQ ID No. 52, SEQ ID No. 53, SEQ ID No. 54, SEQ ID No. 55, SEQ ID No. 98, SEQ ID No. 99 или их функционального фрагмента или аминокислотной последовательности, которая по меньшей мере на 70% идентична им; или трипептидилпептидазой, экспрессируемой с одной или нескольких из нуклеотидных последовательностей, выбранных из группы, состоящей из: SEQ ID No. 56, SEQ ID No. 57, SEQ ID No. 58, SEQ ID No. 59, SEQ ID No. 60, SEQ ID No. 61, SEQ ID No. 62, SEQ ID No. 63, SEQ ID No. 64, SEQ ID No. 65, SEQ ID No. 66, SEQ ID No. 67, SEQ ID No. 68, SEQ ID No. 69, SEQ ID No. 70, SEQ ID No. 71, SEQ ID No. 72, SEQ ID No. 73, SEQ ID No. 74, SEQ ID No. 75, SEQ ID No. 76, SEQ ID No. 77, SEQ ID No. 78, SEQ ID No. 79, SEQ ID No. 80, SEQ ID No. 81, SEQ ID No. 82, SEQ ID No. 83, SEQ ID No. 84, SEQ ID No. 85, SEQ ID No. 86, SEQ ID No. 87, SEQ ID No. 88, SEQ ID No. 89, SEQ ID No. 90, SEQ ID No. 91, SEQ ID No. 92, SEQ ID No. 93, SEQ ID No. 94, SEQ ID No. 95, SEQ ID No. 98, SEQ ID No. 99 или нуклеотидной последовательности, которая по меньшей мере на 70% идентична им, или которая отличается от данных нуклеотидных последовательностей по вырожденности генетического кода, или которая гибридизируется в условиях средней или высокой жесткости.
В соответствии с первым аспектом настоящего изобретения предложен способ получения гидролизата, предусматривающий:
(a) смешивание по меньшей мере одного белка или его части с:
(A) по меньшей мере одной эндопротеазой и
(B) (aʹ) по меньшей мере одной толерантной к пролину трипептидилпептидазой или ферментатом, содержащим толерантную к пролину трипептидилпептидазу, преимущественно обладающую экзопептидазной активностью, где указанная трипептидилпептидаза, способная воздействовать на связи с участием пролина, способна к отщеплению трипептидов с N-конца пептидов, имеющих:
пролин в P1 и
аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1;или
(bʹ) по меньшей мере одной толерантной к пролину трипептидилпептидазой, обладающей экзопептидазной активностью, где указанная толерантная к пролину трипептидилпептидаза способна к отщеплению трипептидов с N-конца пептидов, имеющих:
пролин в P1ʹ и
аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1ʹ; и
(b) извлечение гидролизата.
Во втором аспекте предложен способ получения гидролизата, предусматривающий:
(a) смешивание по меньшей мере одного белка или его части, выбранных из группы, состоящей из растительного белка, белка молока или яичного белка, с:
(i) по меньшей мере одной эндопептидазой;
(ii) по меньшей мере одной экзо-трипептидилпептидазой семейства S53 и
(iii) одной или несколькими аминопептидазами, и
(b) извлечение гидролизата.
В третьем аспекте предложено применение (i) по меньшей мере одной эндопептидазы; (ii) по меньшей мере одной экзо-трипептидилпептидазы семейства S53 и (iii) одной или нескольких аминопептидаз в получении гидролизата по меньшей мере из одного белка или его части, выбранных из группы, состоящей из растительного белка, белка молока или яичного белка, для снижения иммуногенности у субъекта, имеющего склонность к иммунной реакции на необработанный гидролизат, или для уменьшения горечи гидролизата.
В четвертом аспекте предложена выделенная нуклеиновая кислота, содержащая:
(a) нуклеотидную последовательность, представленную в данном документе под SEQ ID No. 56, SEQ ID No. 57, SEQ ID No. 58, SEQ ID No. 59, SEQ ID No. 60, SEQ ID No. 61, SEQ ID No. 62, SEQ ID No. 63, SEQ ID No. 64, SEQ ID No. 65, SEQ ID No. 66, SEQ ID No. 67, SEQ ID No. 68, SEQ ID No. 69, SEQ ID No. 70, SEQ ID No. 71, SEQ ID No. 72, SEQ ID No. 73, SEQ ID No. 74, SEQ ID No. 75, SEQ ID No. 76, SEQ ID No. 77, SEQ ID No. 78, SEQ ID No. 79, SEQ ID No. 80, SEQ ID No. 81, SEQ ID No. 82, SEQ ID No. 83, SEQ ID No. 84, SEQ ID No. 85, SEQ ID No. 86, SEQ ID No. 87, SEQ ID No. 88, SEQ ID No. 89, SEQ ID No. 90, SEQ ID No. 91, SEQ ID No. 92, SEQ ID No. 93, SEQ ID No. 94, SEQ ID No. 95, SEQ ID No. 98 или SEQ ID No. 99;
(b) нуклеотидную последовательность, которая по меньшей мере на приблизительно 70% идентична последовательности под SEQ ID No. 56, SEQ ID No. 57, SEQ ID No. 58, SEQ ID No. 59, SEQ ID No. 60, SEQ ID No. 61, SEQ ID No. 62, SEQ ID No. 63, SEQ ID No. 64, SEQ ID No. 65, SEQ ID No. 66, SEQ ID No. 67, SEQ ID No. 68, SEQ ID No. 69, SEQ ID No. 70, SEQ ID No. 71, SEQ ID No. 72, SEQ ID No. 73, SEQ ID No. 74, SEQ ID No. 75, SEQ ID No. 76, SEQ ID No. 77, SEQ ID No. 78, SEQ ID No. 79, SEQ ID No. 80, SEQ ID No. 81, SEQ ID No. 82, SEQ ID No. 83, SEQ ID No. 84, SEQ ID No. 85, SEQ ID No. 86, SEQ ID No. 87, SEQ ID No. 88, SEQ ID No. 89, SEQ ID No. 90, SEQ ID No. 91, SEQ ID No. 92, SEQ ID No. 93, SEQ ID No. 94, SEQ ID No. 95, SEQ ID No. 98 или SEQ ID No. 99; или
(c) последовательность, которая гибридизируется с последовательностью под SEQ ID No. 56, SEQ ID No. 57, SEQ ID No. 58, SEQ ID No. 59, SEQ ID No. 60, SEQ ID No. 61, SEQ ID No. 62, SEQ ID No. 63, SEQ ID No. 64, SEQ ID No. 65, SEQ ID No. 66, SEQ ID No. 67, SEQ ID No. 68, SEQ ID No. 69, SEQ ID No. 70, SEQ ID No. 71, SEQ ID No. 72, SEQ ID No. 73, SEQ ID No. 74, SEQ ID No. 75, SEQ ID No. 76, SEQ ID No. 77, SEQ ID No. 78, SEQ ID No. 79, SEQ ID No. 80, SEQ ID No. 81, SEQ ID No. 82, SEQ ID No. 83, SEQ ID No. 84, SEQ ID No. 85, SEQ ID No. 86, SEQ ID No. 87, SEQ ID No. 88, SEQ ID No. 89, SEQ ID No. 90, SEQ ID No. 91, SEQ ID No. 92, SEQ ID No. 93, SEQ ID No. 94, SEQ ID No. 95, SEQ ID No. 98 или SEQ ID No. 99 в условиях средней или высокой жесткости; или
(c) нуклеотидную последовательность, которая отличается от последовательности под SEQ ID No. 56, SEQ ID No. 57, SEQ ID No. 58, SEQ ID No. 59, SEQ ID No. 60, SEQ ID No. 61, SEQ ID No. 62, SEQ ID No. 63, SEQ ID No. 64, SEQ ID No. 65, SEQ ID No. 66, SEQ ID No. 67, SEQ ID No. 68, SEQ ID No. 69, SEQ ID No. 70, SEQ ID No. 71, SEQ ID No. 72, SEQ ID No. 73, SEQ ID No. 74, SEQ ID No. 75, SEQ ID No. 76, SEQ ID No. 77, SEQ ID No. 78, SEQ ID No. 79, SEQ ID No. 80, SEQ ID No. 81, SEQ ID No. 82, SEQ ID No. 83, SEQ ID No. 84, SEQ ID No. 85, SEQ ID No. 86, SEQ ID No. 87, SEQ ID No. 88, SEQ ID No. 89, SEQ ID No. 90, SEQ ID No. 91, SEQ ID No. 92, SEQ ID No. 93, SEQ ID No. 94, SEQ ID No. 95, SEQ ID No. 98 или SEQ ID No. 99 из-за вырожденности генетического кода.
В пятом аспекте предложен вектор (например, плазмида), содержащий нуклеиновую кислоту по настоящему изобретению (соответственно, выделенную нуклеиновую кислоту по второму аспекту).
В соответствии с шестым аспектом настоящего изобретения предложена клетка-хозяин, содержащая последовательность нуклеиновой кислоты или вектор в соответствии с настоящим изобретением.
В соответствии с седьмым аспектом настоящего изобретения предложен способ экспрессии трипептидилпептидазы, способной воздействовать на связи с участием пролина, преимущественно обладающей экзопептидазной активностью, где указанная трипептидилпептидаза, способная воздействовать на связи с участием пролина, способна к отщеплению трипептидов с N-конца пептидов, имеющих сайты расщепления консенсусной последовательности:
(i) пролин в P1 и
аминокислота, выбранная из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1; или
(ii) пролин в P1ʹ и
аминокислотa, выбраннaя из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1ʹ,
при этом указанный способ предусматривает:
(a) трансформацию клетки-хозяина нуклеиновой кислотой или вектором, содержащими нуклеотидную последовательность, кодирующую трипептидилпептидазу, способную воздействовать на связи с участием пролина;
(b) экспрессию последовательности нуклеиновой кислоты или вектора из стадии (a) и
(c) получение трипептидилпептидазы, способной воздействовать на связи с участием пролина, или ферментата, содержащего указанную трипептидилпептидазу, способную воздействовать на связи с участием пролина, и необязательно выделение, и/или очистку, и/или упаковывание.
В восьмом аспекте предложено применение по меньшей мере одной эндопротеазы и по меньшей мере одной трипептидилпептидазы, способной воздействовать на связи с участием пролина, или ферментата, содержащего трипептидилпептидазу, способную воздействовать на связи с участием пролина, где указанная трипептидилпептидаза, способная воздействовать на связи с участием пролина, преимущественно обладает экзопептидазной активностью и способна к отщеплению трипептидов с N-конца пептидов, имеющих:
(i) пролин в P1 и
аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1; или
(ii) пролин в P1ʹ и
аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1ʹ;
или которые являются получаемыми посредством любого из способов по настоящему изобретению при получении гидролизата для снижения иммуногенности у субъекта, имеющего склонность к иммунной реакции на необработанный гидролизат, или для уменьшения горечи гидролизата.
В девятом аспекте предложен гидролизат, содержащий по меньшей мере одну эндопротеазу и трипептидилпептидазу, способную воздействовать на связи с участием пролина, преимущественно обладающую экзопептидазной активностью, где указанная трипептидилпептидаза, способная воздействовать на связи с участием пролина, способна к отщеплению трипептидов с N-конца пептидов, имеющих:
(i) пролин в P1 и
аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1; или
(ii) пролин в P1ʹ и
аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1ʹ;
или получаемую посредством какого-либо из способов по настоящему изобретению.
В соответствии с десятым аспектом предложена композиция, содержащая по меньшей мере одну трипептидилпептидазу, способную воздействовать на связи с участием пролина, преимущественно обладающую экзопептидазной активностью, где указанная трипептидилпептидаза, способная воздействовать на связи с участием пролина, способна к отщеплению трипептидов с N-конца пептидов, имеющих:
(i) пролин в P1 и
аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1; или
(ii) пролин в P1ʹ и
аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1ʹ;
или получаемую посредством какого-либо из способов по настоящему изобретению; и один или несколько ингредиентов, выбранных из группы, состоящей из: полиолов, таких как глицерин и/или сорбит; сахаров, таких как глюкоза, фруктоза, сахароза, мальтоза, лактоза и трегалоза; солей, таких как NaCl, KCl, CaCl2, Na2SO4, или других солей для применения в пищевой промышленности; консерванта, например, бензоата натрия и/или сорбата калия; или их комбинаций.
В одиннадцатом аспекте предложен способ получения кормового продукта или пищевого продукта, предусматривающий приведение в контакт кормового компонента или пищевого компонента с гидролизатом или композицией по настоящему изобретению.
В двенадцатом аспекте предложена композиция пищевой добавки или композиция кормовой добавки, содержащая по меньшей мере одну трипептидилпептидазу, способную воздействовать на связи с участием пролина, где указанная трипептидилпептидаза, способная воздействовать на связи с участием пролина, преимущественно обладает экзопептидазной активностью и способна к отщеплению трипептидов с N-конца пептидов, имеющих:
(i) пролин в P1 и
аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1; или
(ii) пролин в P1ʹ и
аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1ʹ;
или получаемую посредством какого-либо из способов по настоящему изобретению, или гидролизат по настоящему изобретению;
необязательно дополнительно содержащая один или несколько ингредиентов, выбранных из группы, состоящей из: полиолов, таких как глицерин и/или сорбит; сахаров, таких как глюкоза, фруктоза, сахароза, мальтоза, лактоза и трегалоза; солей, таких как NaCl, KCl, CaCl2, Na2SO4, или других солей для применения в пищевой промышленности; консерванта, например, бензоата натрия и/или сорбата калия; или их комбинаций.
В тринадцатом аспекте предложена композиция пищевой добавки или кормовой добавки, содержащая гидролизат в соответствии с настоящим изобретением.
В четырнадцатом аспекте предложен пищевой продукт или кормовой продукт, содержащий: по меньшей мере одну трипептидилпептидазу, способную воздействовать на связи с участием пролина, содержащую аминокислотную последовательность, выбранную из последовательностей под SEQ ID No. 1, SEQ ID No. 2, SEQ ID No. 3, SEQ ID No. 4, SEQ ID No. 5, SEQ ID No.6, SEQ ID No. 7, SEQ ID No. 8, SEQ ID No. 9, SEQ ID No. 10, SEQ ID No. 11, SEQ ID No. 12, SEQ ID No. 13, SEQ ID No. 14, SEQ ID No. 15, SEQ ID No. 16, SEQ ID No. 17, SEQ ID No. 18, SEQ ID No. 19, SEQ ID No. 20, SEQ ID No. 21, SEQ ID No. 22, SEQ ID No. 23, SEQ ID No. 24, SEQ ID No. 25, SEQ ID No. 26, SEQ ID No. 27, SEQ ID No. 28, SEQ ID No. 29, SEQ ID No. 30, SEQ ID No. 31, SEQ ID No. 32, SEQ ID No. 33, SEQ ID No. 34, SEQ ID No. 35, SEQ ID No. 36, SEQ ID No. 37, SEQ ID No. 38, SEQ ID No. 39, SEQ ID No. 40, SEQ ID No. 41, SEQ ID No. 42, SEQ ID No. 43, SEQ ID No. 44, SEQ ID No. 45, SEQ ID No. 46, SEQ ID No. 47, SEQ ID No. 48, SEQ ID No. 49, SEQ ID No. 50, SEQ ID No. 51, SEQ ID No. 52, SEQ ID No. 53, SEQ ID No. 54, SEQ ID No. 55, SEQ ID No. 98, SEQ ID No. 99, или их функционального фрагмента или аминокислотной последовательности, которая по меньшей мере на 70% идентична им, или получаемую посредством способа по настоящему изобретению; или гидролизат по настоящему изобретению и необязательно по меньшей мере один пищевой или кормовой ингредиент.
В пятнадцатом аспекте предложен набор, содержащий по меньшей мере одну трипептидилпептидазу, способную воздействовать на связи с участием пролина, где указанная трипептидилпептидаза, способная воздействовать на связи с участием пролина, преимущественно обладает экзопептидазной активностью и способна к отщеплению трипептидов с N-конца пептидов, имеющих:
(i) пролин в P1 и
аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1; или
(ii) пролин в P1ʹ и
аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1ʹ;
или получаемую посредством какого-либо из способов по настоящему изобретению; по меньшей мере одну эндопротеазу и инструкции для их совместного введения.
В шестнадцатом аспекте предложен набор, содержащий:
(i) по меньшей мере одну эндопептидазу;
(ii) по меньшей мере одну экзо-трипептидилпептидазу семейства S53 и
(iii) одну или несколько аминопептидаз и инструкции для их совместного введения.
В семнадцатом аспекте настоящее изобретение предлагает продукт, не являющийся пищевым продуктом, содержащий гидролизат по настоящему изобретению, где продукт, не являющийся пищевым продуктом, представляет собой косметическое средство, лосьон или очищающее средство для применения на коже человека.
В восемнадцатом аспекте настоящее изобретение предлагает гидролизат, обогащенный:
(a) трипептидом, имеющим пролин на своем N-конце; или
(b) трипептидом, имеющим пролин на своем N-конце и на своем C-конце.
В любом из вариантов осуществления, описанных в данном документе, гидролизаты, полученные посредством способов гидролиза белка, описанных в данном документе, могут быть удалены или отфильтрованы ультрафильтрацией или любым подходящим мембранным разделением, известным в данной области.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Варианты осуществления настоящего изобретения будут описаны исключительно в качестве примера со ссылкой на сопровождающие графические материалы, в которых:
на фигуре 1 показана плазмидная карта вектора экспрессии pTTT-pyrG-TRI083.
На фигуре 2 показан профиль pH для трипептидилпептидазы, способной воздействовать на связи с участием пролина.
На фигуре 3 показан график, демонстрирующий активность трипептидилпептидазы, способной воздействовать на связи с участием пролина, при различных температурах.
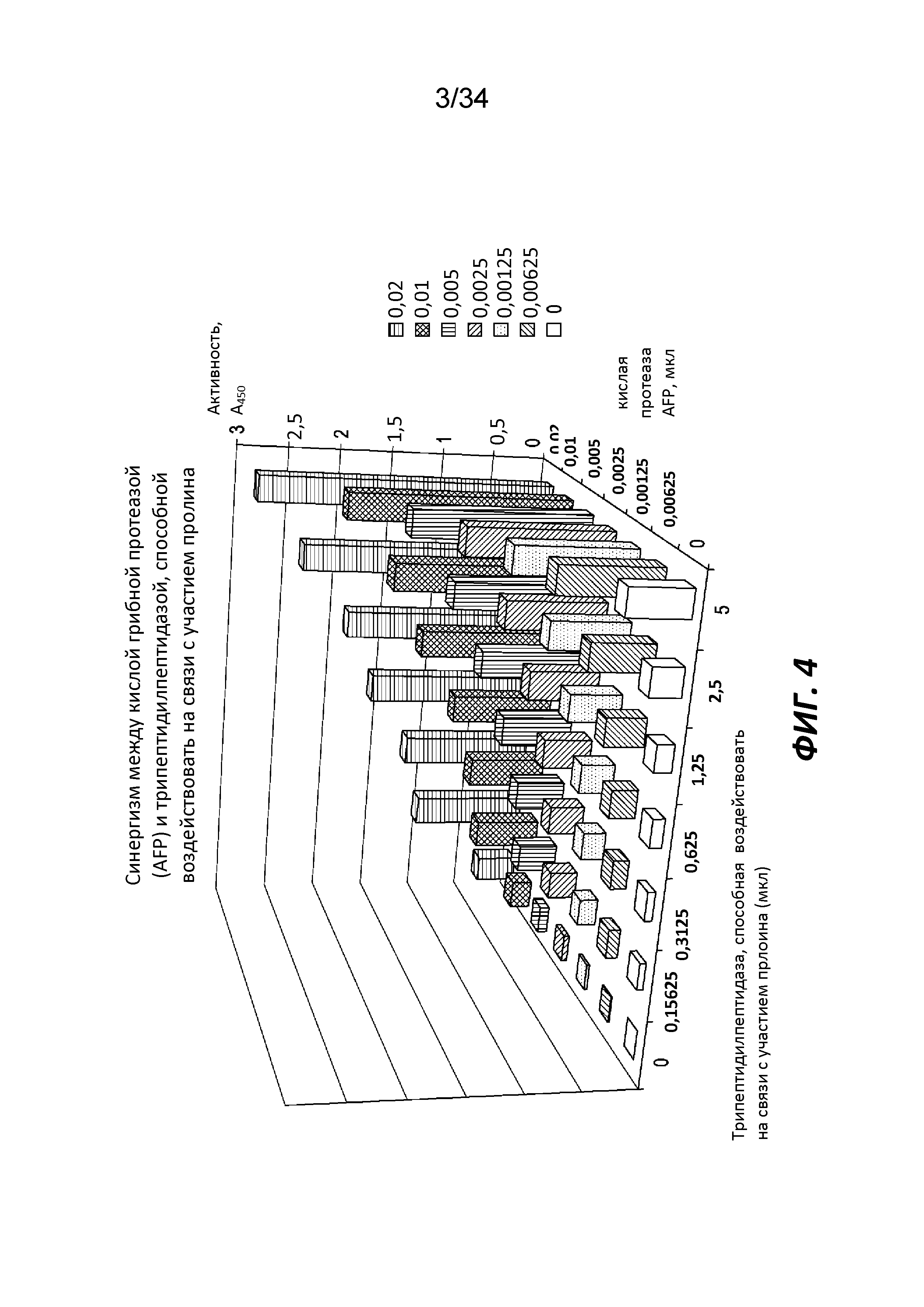
На фигуре 4 показана ферментативная активность при использовании AFP Alphalase® (в данном документе упоминается как AFP) (кислая протеаза) в комбинации с трипептидилпептидазой, способной воздействовать на связи с участием пролина, при различных дозировках каждого из ферментов.
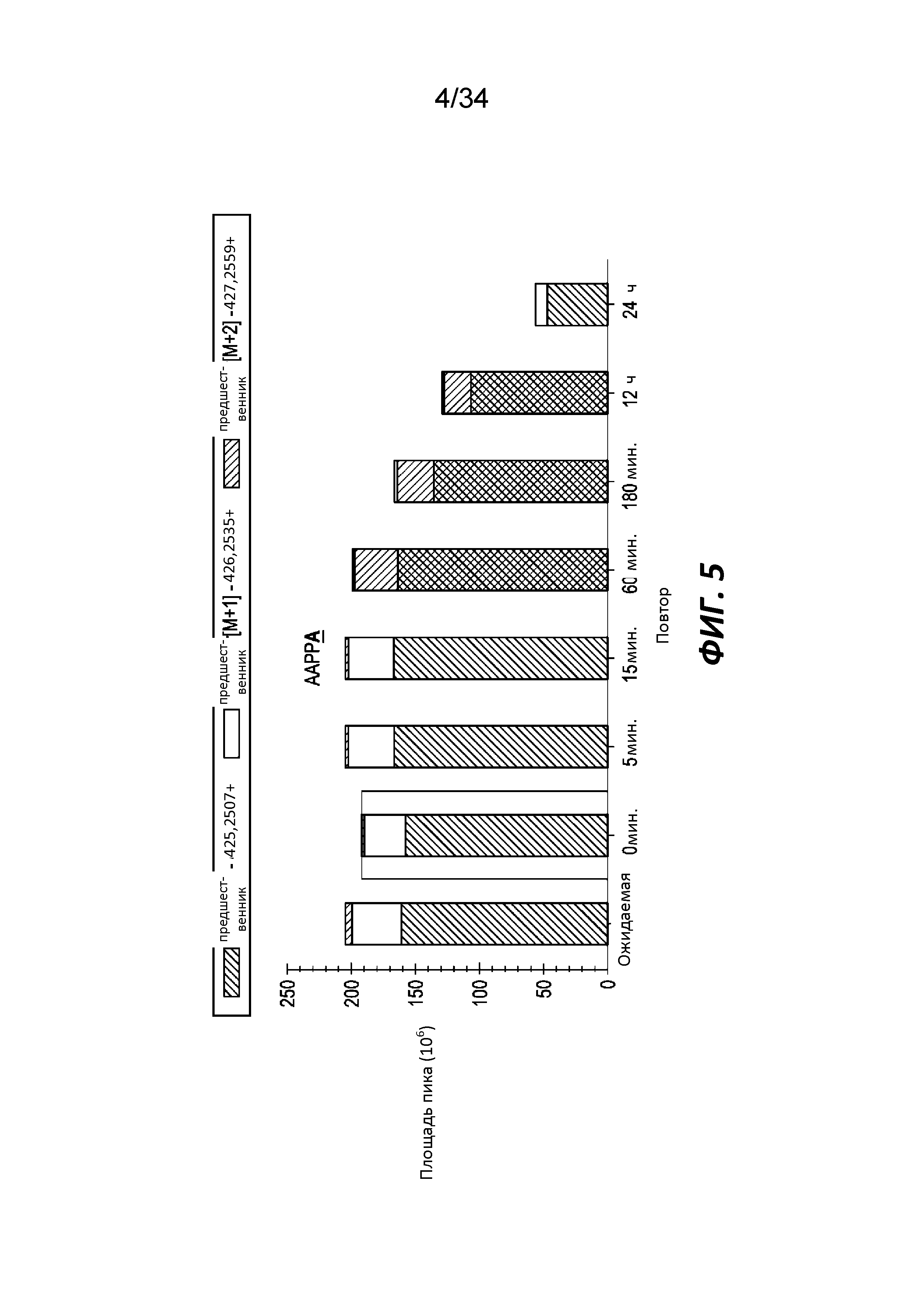
На фигуре 5 показана способность трипептидилпептидазы, способной воздействовать на связи с участием пролина, к расщеплению субстрата AAPPA в течение определенного времени.
На фигуре 6 показано получение продукта расщепления AAP из субстрата AAPPA в течение определенного времени.
На фигуре 7 показана плазмидная карта вектора экспрессии pTTT-pyrG13-TRI071. Эндогенную сигнальную последовательность заменяли сигнальной последовательностью секреции из кислой грибной протеазы (AFP) Trichoderma reesei и интроном из гена гликоамилазы Trichoderma reesei (TrGA1) (см. нижнюю часть фигуры 7).
На фигуре 8 показандозозависимый ответ AFP Alphalase® на гидролиз белка кукурузно-соевого корма. Пунктирная линия представляет собой контроль, в котором использовали только пепсин и панкреатин.
На фигуре 9 показана зависимость DH от ферментной композиции в образце корма.
На фигуре 10 показан эффект обработки корма при использовании AFP Alphalase® и трипептидилпептидазы, способной воздействовать на связи с участием пролина, в различных условиях. Сплошные полосы представляют обработку при 40°C в течение 100 мин. Незакрашенные полосы представляют обработку при 40°C в течение 200 мин.
На фигуре 11 показан эффект коммерческих протеаз по сравнению с трипептидилпептидазой, способной воздействовать на связи с участием пролина, в отношении % подвздошно-кишечной усвояемости N (азота).
На фигуре 12 показан эффект коммерческих протеаз по сравнению с трипептидилпептидазой, способной воздействовать на связи с участием пролина, в отношении подвздошно-кишечной усвояемости энергии (MДж/кг).
На фигуре 13 показано повышение сериновых эквивалентов гидролиза 15 вес. % WPI при использовании эндопептидазы и различных комбинаций эндопептидазы/экзопептидазы (эндопептидаза (Endo): Alphalase® FP2, PepN: 197 нкатH-Ala-pNA/мл в маточном растворе; трипептидилпептидазы, способной воздействовать на связи с участием пролина (TRI083), 4375 нкатH-Ala-Ala-Ala-pNA/мл).
На фигуре 14 показано повышение сериновых эквивалентов гидролиза 15 вес. % WPI при использовании эндопептидазы и трипептидилпептидазы (эндопептидаза (Endo): Alphalase® FP2, трипептидилпептидазы, способной воздействовать на связи с участием пролина (TRI071=3PP_Fo), 4375 нкатH-Ala-Ala-Ala-pNA/мл).
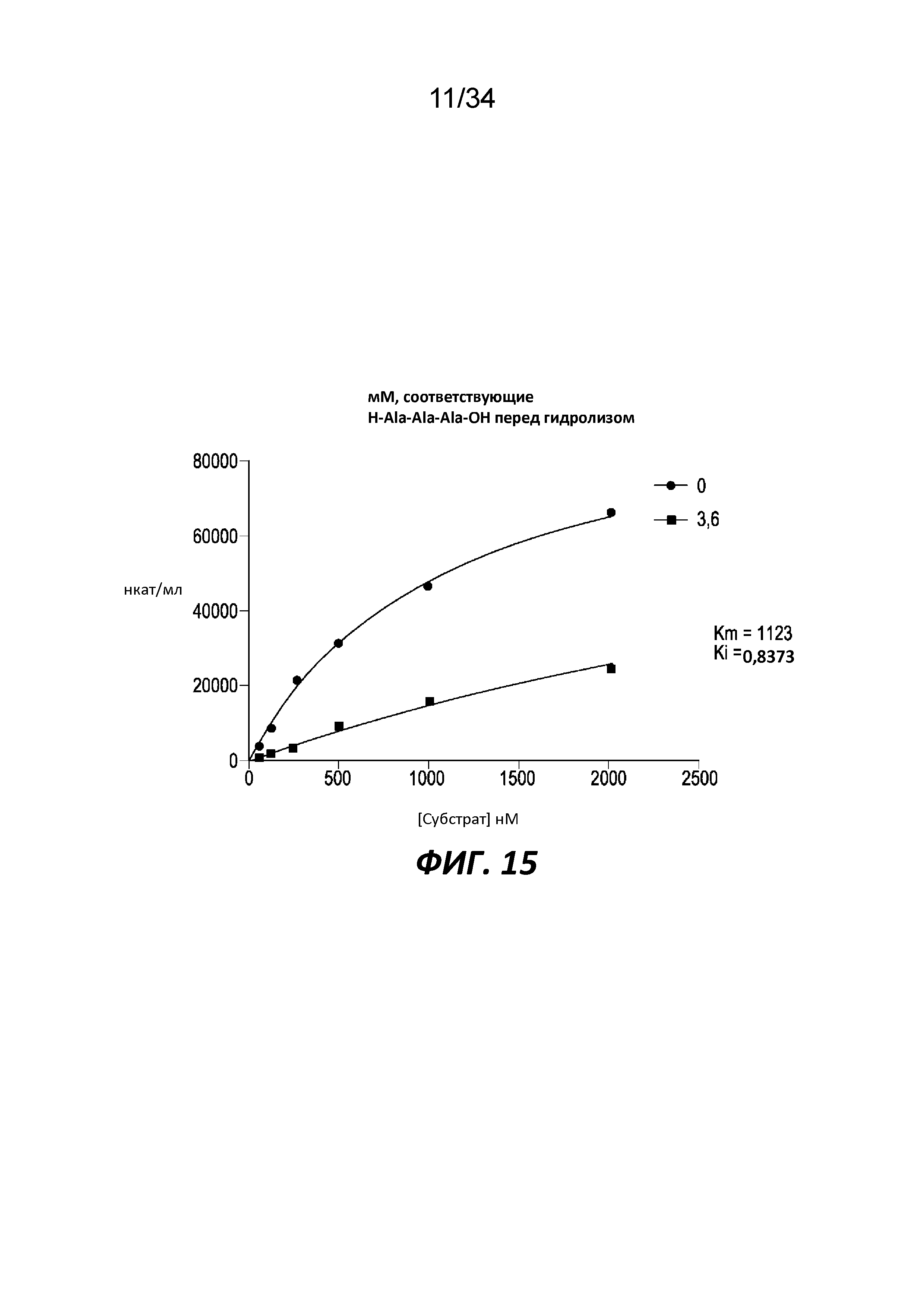
На фигуре 15 показаны графики Михаэлиса-Ментена для трипептидилпептидазы, способной воздействовать на связи с участием пролина, из T. reesei, проанализированной с использованием H-Ala-Ala-Ala-pNA в ходе проведения анализа с использованием или без использования предварительно гидролизированного H-Ala-Ala-Ala-OH. Добавленный предварительно гидролизированный ингибитор содержит Ala-Ala-Ala, Ala-Ala и Ala. Концентрация приведена в виде концентрации H-Ala-Ala-Ala-OH перед гидролизом.
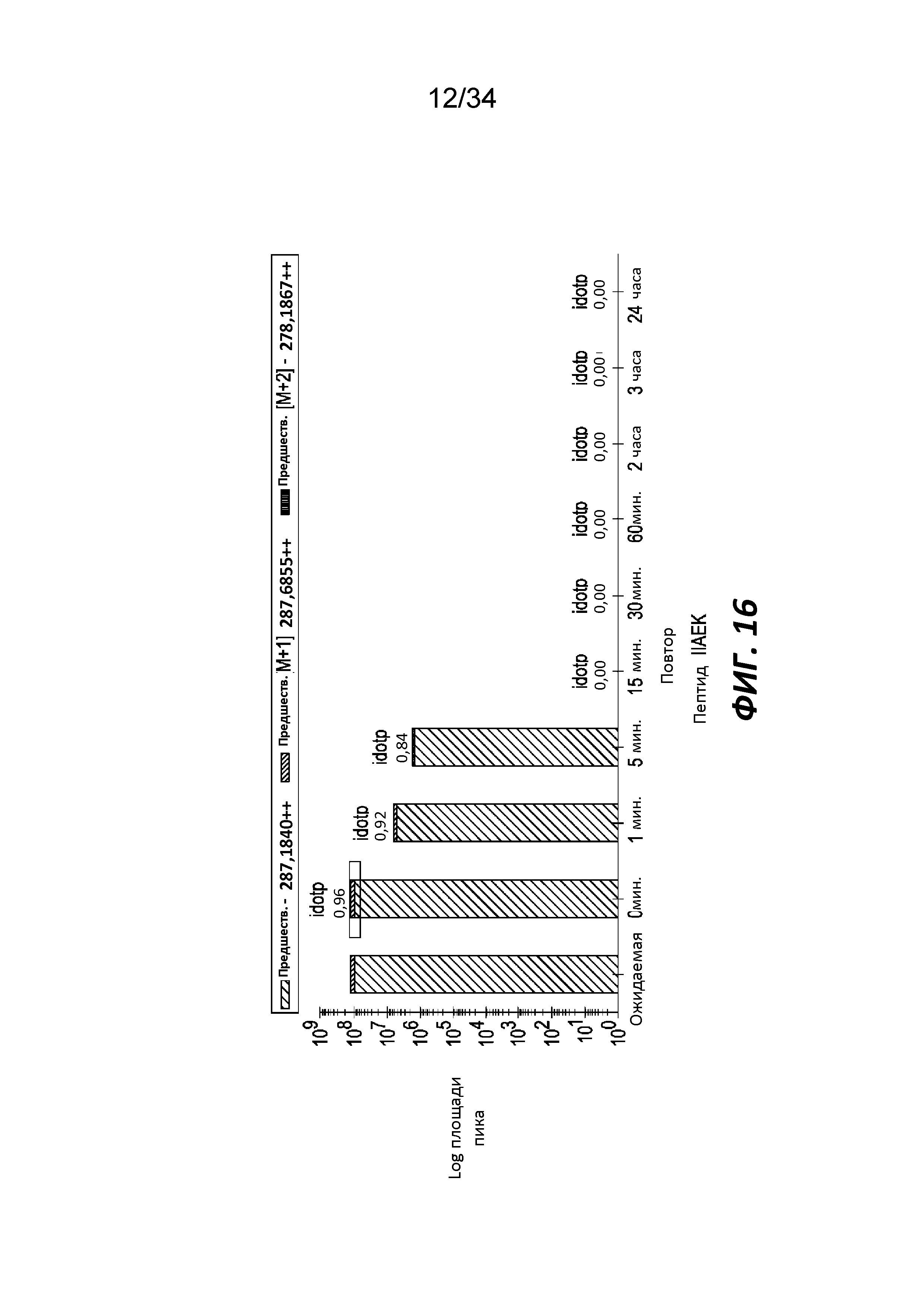
На фигуре 16 показано расщепление фрагмента β-лактоглобулина (пептида IIAEK) трипептидилпептидазой, способной воздействовать на связи с участием пролина, измеренное с помощью жидкостной хроматографии-масс-спектрометрии (LC-MS).
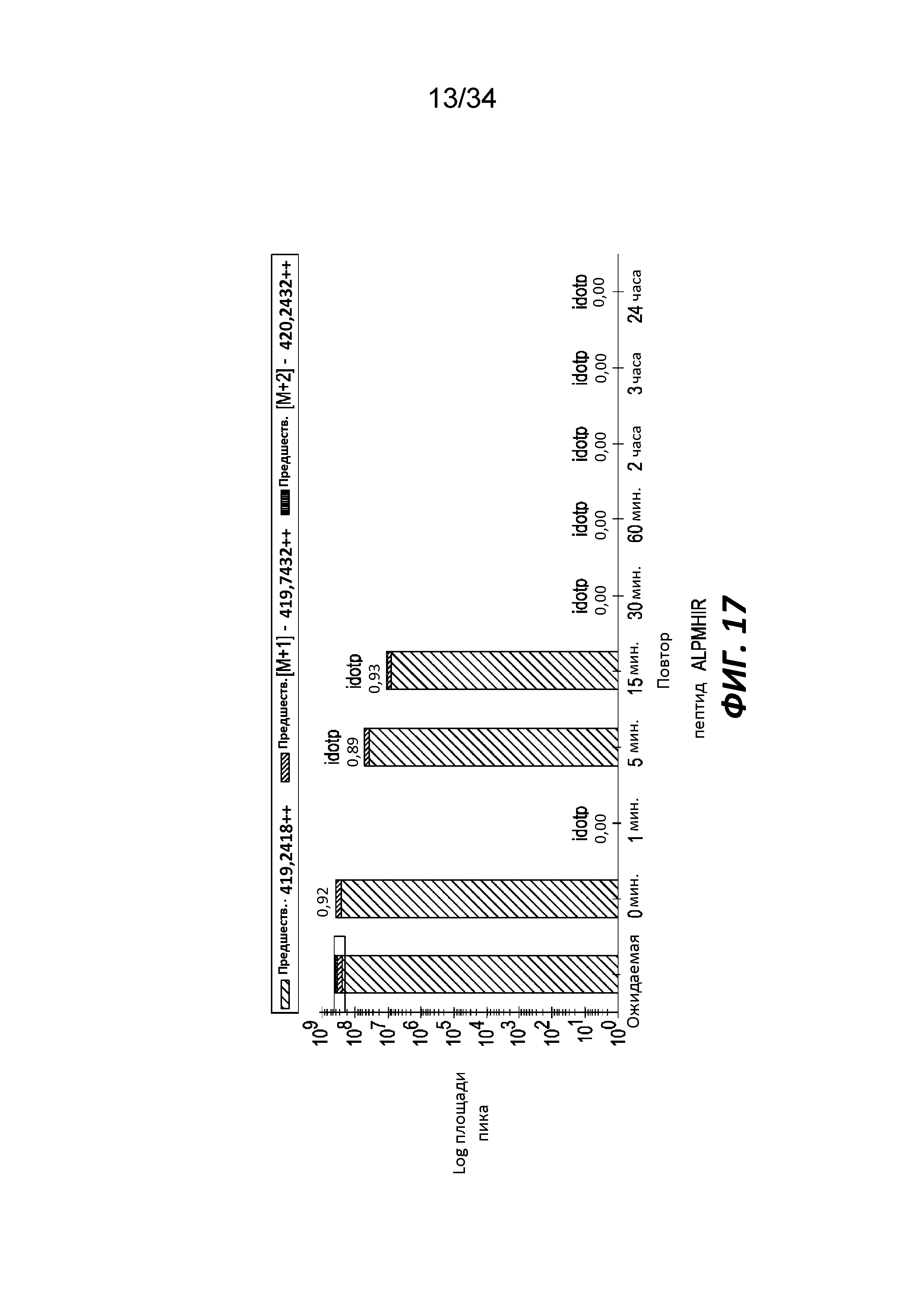
На фигуре 17 показано расщепление фрагмента β-лактоглобулина (пептида ALPMHIR) трипептидилпептидазой, способной воздействовать на связи с участием пролина, измеренное с помощью LC-MS.
На фигуре 18 показано расщепление фрагмента β-лактоглобулина (пептида WENGECAQK) трипептидилпептидазой, способной воздействовать на связи с участием пролина, измеренное с помощью LC-MS.
На фигуре 19 показано расщепление фрагмента β-лактоглобулина (пептида VYVEELKPTPEGDLEILLQK) трипептидилпептидазой, способной воздействовать на связи с участием пролина, измеренное с помощью LC-MS.
На фигуре 20 показано дополнительное расщепление продукта расщепления трипептидилпептидазой, способной воздействовать на связи с участием пролина, бета-лактоглобулина, EELKPTPEGDLEILLQK, трипептидилпептидазой, способной воздействовать на связи с участием пролина, измеренное с помощью LC-MS.
На фигуре 21 показано расщепление фрагмента β-лактоглобулина (пептида VAGTWYSLAMAASDISLLDAQSAPLR) трипептидилпептидазой, способной воздействовать на связи с участием пролина, измеренное с помощью LC-MS.
На фигуре 22 показано расщепление триптического фрагмента β-казеина (GPFPIIV) трипептидилпептидазой, способной воздействовать на связи с участием пролина, измеренное с помощью LC-MS.
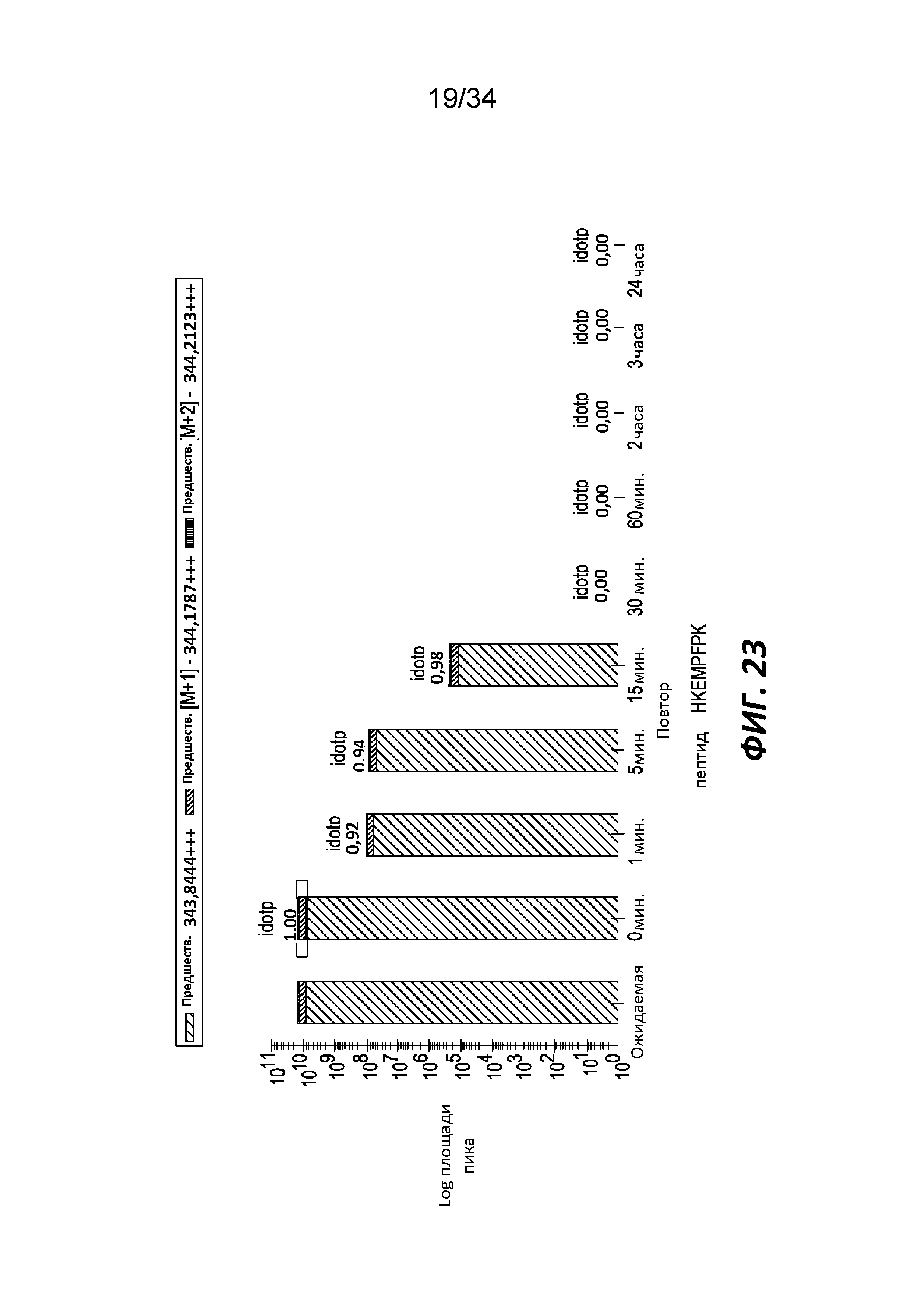
На фигуре 23 показано расщепление триптического фрагмента β-казеина (HKEMPFPK) трипептидилпептидазой, способной воздействовать на связи с участием пролина, измеренное с помощью LC-MS.
На фигуре 24 показано расщепление пептида брадикинина трипептидилпептидазой, способной воздействовать на связи с участием пролина.
На фигуре 25 показано выравнивание ряда аминокислотных последовательностей трипептидилпептидазы, способной воздействовать на связи с участием пролина. Показаны мотивы xEANLD, yʹTzxʹG и QNFSV (в рамке).
На фигуре 26 показан эффект pH в отношении активности TRI045 (трипептидилпептидазы c препропоследовательностью под SEQ ID No. 98 и зрелого белка под SEQ ID No. 99) с использованием AAF-pNA в качестве субстрата (значения представлены в виде среднего для одного теста с 0,8 мкл TRI045 (n=2).
На фигуре 27 показана плазмидная карта вектора экспрессии pTTT-pyrG13-TRI045.
На фигуре 28 показан профиль pH для трипептидилпептидазы TRI045.
ПОДРОБНОЕ ОПИСАНИЕ
Существенным результатом настоящего изобретения является то, что трипептидилпептидаза может обладать экзопептидазной активностью в отношении субстрата, имеющего пролин в P1 и/или P1', а также любую другую аминокислоту в P1 и/или P1'. Это является неожиданным, поскольку трипептидилпептидазы, которые описаны в уровне техники, обычно ингибируются, когда пролин находится в Р1, или являются активными, когда пролин находится в Р1, но неактивными, когда аминокислота, отличная от пролина, присутствует в положении Р1 в субстрате, при этом в данном документе она иногда называется пролин-специфической трипептидилпептидазой.
Авторы настоящего изобретения впервые показали, что трипептидилпептидаза, способная воздействовать на связи с участием пролина, по настоящему изобретению является очень выгодной для применения в получении гидролизатов и дает преимущества субъектам, получающим гидролизат, или продукт питания, и/или корм, содержащие гидролизат, и/или композицию пищевой или кормовой добавки, содержащую трипептидилпептидазу, способную воздействовать на связи с участием пролина (необязательно в комбинации по меньшей мере с одной эндопротеазой).
В качестве альтернативны или дополнительно, гидролизат, полученный с использованием эндопротеазы и трипептидилпептидазы, также может иметь уменьшенную горечь по сравнению с необработанным гидролизатом.
Преимущественно трипептидилпептидаза, способная воздействовать на связи с участием пролина, предназначенная для использования в настоящем изобретении, способна воздействовать на широкий спектр пептидных и/или белковых субстратов, и вследствие наличия такой широкой субстратной специфичности затрудняется ингибирование расщепления субстратов, обогащенных определенными аминокислотами (например, пролином, и/или лизином, и/или аргинином, и/или глицином). Следовательно, применение такой трипептидилпептидазы, способной воздействовать на связи с участием пролина, может эффективно и/или быстро разрушать белковые субстраты (например, присутствующие в субстрате для получения гидролизата).
На основе этих выводов предложен способ получения гидролизата, предусматривающий:
(a) смешивание по меньшей мере одного белка или его части с:
(A) по меньшей мере одной эндопротеазой и
(B) (aʹ) по меньшей мере одной трипептидилпептидазой, способной воздействовать на связи с участием пролина, или ферментатом, содержащим трипептидилпептидазу, способную воздействовать на связи с участием пролина, преимущественно обладающую экзопептидазной активностью, где указанная трипептидилпептидаза, способная воздействовать на связи с участием пролина, способна к отщеплению трипептидов с N-конца пептидов, имеющих:
пролин в P1 и
аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1;или
(bʹ) по меньшей мере одной трипептидилпептидазой, способной воздействовать на связи с участием пролина, обладающей экзопептидазной активностью, где указанная трипептидилпептидаза, способная воздействовать на связи с участием пролина, способна к отщеплению трипептидов с N-конца пептидов, имеющих:
пролин в P1ʹ и
аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1ʹ; и
(b) извлечение гидролизата.
Соответственно, данный способ может предусматривать дополнительную стадию смешивания гидролизата, извлеченного на стадии (b), по меньшей мере с одним пищевым или кормовым ингредиентом.
Соответственно, стадию (A) и стадию (B) способа получения гидролизата можно осуществлять одновременно (например, в одно и то же время).
Соответственно, белок или его часть можно смешивать с эндопротеазой перед добавлением трипептидилпептидазы, способной воздействовать на связи с участием пролина. Соответственно, белок или его часть можно смешивать с эндопротеазой перед добавлением трипептидилпептидазы, способной воздействовать на связи с участием пролина, и одной или несколькими дополнительной(дополнительными) протеазой(протеазами), как указано в данном документе.
Во втором аспекте также предложен способ получения гидролизата, предусматривающий:
(a) смешивание по меньшей мере одного белка или его части, выбранных из группы, состоящей из растительного белка, белка молока или яичного белка, с:
(i) по меньшей мере одной эндопептидазой;
(ii) по меньшей мере одной экзо-трипептидилпептидазой семейства S53 и
(iii) одной или несколькими аминопептидазами, и
(b) извлечение гидролизата.
Соответственно, (i), (ii) и/или (iii) можно смешивать с белком или его частью одновременно.
В качестве альтернативы порядок осуществления смешивания на стадии (a) может представлять собой определенный порядок, а именно, (i) осуществляют перед (ii) и/или (iii).
В другом аспекте также предложено использование (i) по меньшей мере одной эндопептидазы; (ii) по меньшей мере одной экзо-трипептидилпептидазы семейства S53 и (iii) одной или нескольких аминопептидаз в получении гидролизата из по меньшей мере одного белка или его части, выбранных из группы, состоящей из: растительного белка, белка молока или яичного белка, для снижения иммуногенности у субъекта, имеющего склонность к иммунной реакции на необработанный гидролизат, или для уменьшения горечи гидролизата.
В любом из вариантов осуществления, описанных в данном документе, ультрафильтрацию или мембранное разделение можно использовать для улучшения описанных в данном документе способов гидролиза белка. Это может увеличить получение коротких пептидов со значительно сниженной аллергенностью.
В одном варианте осуществления по меньшей мере один белок для использования в способах и/или применениях по настоящему изобретению можно выбрать из группы, состоящей из: растительного белка, где предпочтительно белок представляет собой один или несколько из глиадина, иммуногенного фрагмента глиадина, белка зерновых, глютена, соевого белка.
В другом варианте осуществления по меньшей мере один белок для использования в способах и/или применениях по настоящему изобретению можно выбрать из группы, состоящей из белка молока, где предпочтительно белок представляет собой один или несколько из казеина, например, бета-казеин; лактоглобулина, например, бета-лактоглобулин; или белка сыворотки молока.
Соответственно, по меньшей мере один белок для использования в способах и/или применениях по настоящему изобретению может представлять собой яичный белок.
Используемый в данном документе термин ʺэкзо-трипептидилпептидаза семейства S53ʺ относится к протеазе, преимущественно обладающей экзопептидазной активностью, а также способностью отщеплять трипептиды с N-конца белкового и/или пептидного субстрата. Семейство пептидаз S53 широко охватывает класс сериновых протеаз. Хотя семейство S53 включает как эндопротеазы, так и экзопептидазы, в данном документе предполагается, что это определение относится только к тем трипептидилпептидазам, которые обладают преимущественно экзопептидазной активностью.
ʺЭкзо-трипептидилпептидаза семейства S53ʺ обладает активностью по меньшей мере в 50 нкат в ʺэкзопептидазном анализе широкой специфичностиʺ (EBSA), изложенном в данном документе. Соответственно, ʺэкзо-трипептидилпептидаза семейства S53ʺ в соответствии с настоящим изобретением обладает активностью в приблизительно 50-2000 нкат на мг белка в анализе активности EBSA, изложенном в данном документе.
Комбинация эндопротеазы, экзо-трипептидилпептидазы семейства S53 и аминопептидазы может называться в данном документе ʺтройной ферментной композициейʺ. Выражение ʺтройная ферментная композицияʺ относится к комбинации по меньшей мере: эндопротеазы, экзо-трипептидилпептидазы семейства S53 и аминопептидазы. Иными словами, выражение ʺтройная ферментная композицияʺ может также включать одну или несколько дополнительных ферментативных активностей и/или дополнительных составляющих компонентов.
В одном варианте осуществления экзо-трипептидилпептидаза семейства S53 может представлять собой трипептидилпептидазу, способной воздействовать на связи с участием пролина.
Используемый в данном документе термин ʺаминопептидазаʺ означает экзопептидазу, которая способна к отщеплению отдельных аминокислот с N-конца белкового и/или пептидного субстрата.
Аминопептидазу может быть получена (например, можно получить) из Lactobacillus.
Соответственно, аминопептидазу можно получать из Lactobacillus helveticus. Более подходящим образом аминопептидазу можно получать из Lactobacillus helveticus ATCC 12046.
Аминопептидаза для использования в комбинации с эндопротеазой и экзо-трипептидилпептидазой в соответствии с настоящим изобретением может представлять собой аминопептидазу N (например, PepN) (ЕС 3.4.11.2).
В одном варианте осуществления аминопептидаза, используемая в комбинации с эндопротеазой и экзо-трипептидилпептидазой семейства S53, может содержать последовательность, представленную под:
MAVKRFYKTFHPEHYDLRINVNRKNKTINGTSTITGDVIENPVFINQKFM
TIDSVKVDGKNVDFDVIEKDEAIKIKTGVTGKAVIEIAYSAPLTDTMMGI
YPSYYELEGKKKQIIGTQFETTFARQAFPCVDEPEAKATFSLALKWDEQD
GEVALANMPEVEVDKDGYHHFEETVRMSSYLVAFAFGELQSKTTHTKDGV
LIGVYATKAHKPKELDFALDIAKRAIEFYEEFYQTKYPLPQSLQLALPDF
SAGAMENWGLVTYREAYLLLDPDNTSLEMKKLVATVITHELAHQWFGDLV
TMKWWDNLWLNESFANMMEYLSVDGLEPDWHIWEMFQTSEAASALNRDAT
DGVQPIQMEINDPADIDSVFDGAIVYAKGSRMLVMVRSLLGDDALRKGLK
YYFDHHKFGNATGDDLWDALSTATDLDIGKIMHSWLKQPGYPVVNAFVAE
DGHLKLTQKQFFIGEGEDKGRQWQIPLNANFDAPKIMSDKEIDLGNYKVL
REEAGHPLRLNVGNNSHFIVEYDKTLLDDILSDVNELDPIDKLQLLQDLR
LLAEGKQISYASIVPLLVKFADSKSSLVINALYTTAAKLRQFVEPESNEE
KNLKKLYDLLSKDQVARLGWEVKPGESDEDVQIRPYELSASLYAENADSI
KAAHQIFTENEDNLEALNADIRPYVLINEVKNFGNAELVDKLIKEYQRTA
DPSYKVDLRSAVTSTKDLAAIKAIVGDFENADVVKPQDLCDWYRGLLANH
YGQQAAWDWIREDWDWLDKTVGGDMEFAKFITVTAGVFHTPERLKEFKEF
FEPKINVPLLSREIKMDVKVIESKVNLIEAEKDAVNDAVAKAID
Используемый в данном документе термин ʺсмешиваниеʺ означает смешивание одного или нескольких ингредиентов и/или ферментов, где один или несколько ингредиентов или ферментов добавляют в любом порядке и в любой комбинации. Соответственно, смешивание может относиться к смешиванию одного или нескольких ингредиентов и/или ферментов одновременно или последовательно.
В одном варианте осуществления один или несколько ингредиентов и/или ферментов можно смешивать последовательно.
Предпочтительно один или несколько ингредиентов и/или ферментов можно смешивать одновременно.
Используемый в данном документе термин ʺизвлечение гидролизатаʺ означает выделение гидролизата. В некоторых вариантах осуществления термин может включать отделение гидролизованного вещества от негидролизованных белковых и/или пептидных субстратов. В других вариантах осуществления это может дополнительно или альтернативно включать отделение гидролизованного вещества от трипептидилпептидазы, способной воздействовать на связи с участием пролина, и/или эндопротеазы, или тройной ферментной композиции по настоящему изобретению, используемых для получения указанного гидролизата. В одном варианте осуществления гидролизат может содержать гидролизованное вещество с чистотой по меньшей мере 80%, более предпочтительно по меньшей мере 90%, еще более предпочтительно по меньшей мере 95%. Предпочтительно гидролизат может содержать гидролизованное вещество с чистотой по меньшей мере приблизительно 99%.
В одном варианте осуществления трипептидилпептидазу, способную воздействовать на связи с участием пролина, или тройную ферментную композицию для использования в способах и/или применениях настоящего изобретения можно инкубировать с субстратом (например, с белковым и/или пептидным субстратом) при температуре по меньшей мере приблизительно 40°C. Иными словами, способ по настоящему изобретению можно осуществлять при температуре по меньшей мере приблизительно 40°С.
Соответственно, трипептидилпептидазу, способную воздействовать на связи с участием пролина, или тройную ферментную композицию можно инкубировать с субстратом при температуре по меньшей мере приблизительно 45°C, более предпочтительно по меньшей мере приблизительно 50°C.
Предпочтительно трипептидилпептидазу, способную воздействовать на связи с участием пролина, или тройную ферментную композицию можно инкубировать с субстратом при температуре по меньшей мере приблизительно 55°C.
В другом варианте осуществления трипептидилпептидазу, способную воздействовать на связи с участием пролина, или тройную ферментную композицию для использования в способах и/или применениях настоящего изобретения можно инкубировать с субстратом (например, с белковым и/или пептидным субстратом) при температуре от приблизительно 40°C до приблизительно 70°C. Иными словами, способ по настоящему изобретению можно осуществлять при температуре от приблизительно 40°C до приблизительно 70°C.
Соответственно, трипептидилпептидазу, способную воздействовать на связи с участием пролина, или тройную ферментную композицию можно инкубировать с субстратом при температуре от приблизительно 40°C до приблизительно 60°C; еще более предпочтительно при температуре от приблизительно 45°C до приблизительно 65°C.
Предпочтительно трипептидилпептидазу, способную воздействовать на связи с участием пролина, или тройную ферментную композицию можно инкубировать с субстратом при температуре от приблизительно 50°C до приблизительно 60°C.
Соответственно, трипептидилпептидаза, способная воздействовать на связи с участием пролина, для использования в способах и/или применениях, или содержащаяся в любом из продуктов по настоящему изобретению, может быть способна к отщеплению трипептидов с N-конца пептидов, имеющих пролин в P1 и аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1.
В качестве альтернативы или дополнительно трипептидилпептидаза, способная воздействовать на связи с участием пролина, для использования в способах и/или применениях, или содержащаяся в любом из продуктов по настоящему изобретению, может быть способна к отщеплению трипептидов с N-конца пептидов, имеющих пролин в P1ʹ и аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1ʹ.
Используемый в данном документе термин ʺтрипептидилпептидаза, способная воздействовать на связи с участием пролинаʺ относится к экзопептидазе, которая способна к отщеплению трипептидов с N-конца пептидного, олигопептидного и/или белкового субстрата. ʺТрипептидилпептидаза, способная воздействовать на связи с участием пролинаʺ также упоминаемая в данном документе как 3PP, способна расщеплять пептидные связи там, где пролин находится в положении P1, а также расщеплять пептидные связи там, где аминокислота, отличная от пролина, находится в P1, и/или способна расщеплять пептидные связи там, где пролин находится в положении P1ʹ, а также расщеплять пептидные связи там, где аминокислота, отличная от пролина, находится в P1ʹ.
В одном варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, и/или экзо-трипептидилпептидаза семейства S53 не является эндопротеазой.
В другом варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, и/или экзо-трипептидилпептидаза семейства S53 не является ферментом, который отщепляет тетрапептиды с N-конца субстрата.
В дополнительном варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, и/или экзо-трипептидилпептидаза семейства S53 не является ферментом, который отщепляет дипептиды с N-конца субстрата.
В еще одном дополнительном варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, и/или экзо-трипептидилпептидаза семейства S53 не является ферментом, который отщепляет отдельные аминокислоты с N-конца субстрата.
В одном варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, может быть способна к расщеплению пептидных связей там, где пролин находится в положении P1, а также к расщеплению пептидных связей там, где аминокислота, отличная от пролина, находится в P1.
В другом варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, может быть способна к расщеплению пептидных связей там, где пролин находится в положении P1ʹ, а также к расщеплению пептидных связей там, где аминокислота, отличная от пролина, находится в P1ʹ.
Соответственно, трипептидилпептидаза, способная воздействовать на связи с участием пролина, также может быть способна к расщеплению пептидных связей там, где пролин, присутствующий в положении P1 и/или P1ʹ, присутствует в своей цис- или транс-конфигурации.
Соответственно, ʺаминокислота, отличная от пролинаʺ может представлять собой аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот.
В другом варианте осуществления ʺаминокислота, отличная от пролинаʺ может представлять собой аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина или валина.
Соответственно, в таких вариантах осуществления синтетические аминокислоты могут исключаться.
Предпочтительно трипептидилпептидаза, способная воздействовать на связи с участием пролина, может быть способна к расщеплению пептидных связей там, где пролин присутствует в положении P1 и P1ʹ.
Неожиданно то, что трипептидилпептидаза способна воздействовать на субстрат, имеющий пролин в положении P1 и/или P1ʹ. Еще более удивительно то, что помимо этой активности трипептидилпептидаза может также проявлять активность, когда аминокислота, отличная от пролина, присутствует в положении Р1 и/или P1ʹ.
Помимо активности в отношении любого из различных субстратов, что описано выше, трипептидилпептидаза, способная воздействовать на связи с участием пролина, для использования в настоящем изобретении дополнительно может воздействовать на связи с участием пролина в одном или нескольких положениях, выбранных из группы, состоящей из: P2, P2ʹ, P3 и P3ʹ.
Соответственно, трипептидилпептидаза, способная воздействовать на связи с участием пролина, в дополнение к активностям, описанным выше, может воздействовать на связи с участием пролина в положении P2, P2ʹ, P3 и P3ʹ.
Это является преимущественным, поскольку позволяет эффективно расщеплять пептидные и/или белковые субстраты, имеющие участки с пролином, и позволяет расщеплять широкий спектр пептидных и/или белковых субстратов.
Предпочтительно трипептидилпептидаза, способная воздействовать на связи с участием пролина, может обладать высокой активностью в отношении пептидов и/или белков, имеющих один или несколько из лизина, аргинина или глицина в положении Р1. Не вдаваясь в теорию, пептидные и/или белковые субстраты, содержащие эти аминокислоты в положении Р1, могут трудно поддаваться расщеплению многими трипептидилпептидазами и/или протеазами в целом, и при обнаружении таких остатков расщепление пептидного и/или белкового субстрата с помощью трипептидилпептидазы и/или протеазы может прекращаться или замедляться. Преимущественно с использованием трипептидилпептидазы, способной воздействовать на связи с участием пролина, по настоящему изобретению можно эффективно расщеплять белковые и/или пептидные субстраты, содержащие лизин, аргинин и/или глицин в P1.
Соответственно, трипептидилпептидаза, способная воздействовать на связи с участием пролина, может иметь предпочтительную активность в отношении пептидов и/или белков, имеющих лизин в положении Р1. Преимущественно это позволяет эффективно расщеплять субстраты с высоким содержанием лизина, такие как белок сыворотки молока.
В одном варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, или экзо-трипептидилпептидаза семейства S53 может содержать каталитическую триаду из аминокислот серина, аспартата и гистидина.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, или экзо-трипептидилпептидаза семейства S53 для использования в настоящем изобретении может быть термостабильной трипептидилпептидазой, способной воздействовать на связи с участием пролина, или экзо-трипептидилпептидазой семейства S53.
Термин ʺтермостабильныйʺ означает, что фермент сохраняет свою активность при нагревании до температур в приблизительно 60°C. Соответственно, ʺтермостабильныйʺ может означать, что фермент сохраняет свою активность при нагревании до приблизительно 65°C, более предпочтительно приблизительно 70°C.
Преимущественно термостабильная трипептидилпептидаза, способная воздействовать на связи с участием пролина, или экзо-трипептидилпептидаза семейства S53 в меньшей степени подвержена денатурации и/или будет сохранять свою активность в течение более длительного периода времени, например, в животном, по сравнению с вариантом, не являющимися термостабильными.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, или экзо-трипептидилпептидаза семейства S53 может обладать активностью в диапазоне от приблизительно pH 2 до приблизительно pH 7. Соответственно, трипептидилпептидаза, способная воздействовать на связи с участием пролина, или экзо-трипептидилпептидаза семейства S53 может обладать активностью в диапазоне от приблизительно pH 4 до приблизительно pH 7, более предпочтительно в диапазоне от приблизительно pH 4,5 до приблизительно pH 6,5.
Соответственно, способ по настоящему изобретению, в частности, стадию гидролиза, можно осуществлять при pH от 2 до приблизительно 7.
В одном варианте осуществления способ по настоящему изобретению, в частности, стадию гидролиза, можно осуществлять при pH от приблизительно 4 до приблизительно 7, например, от 4,5 до 6,5.
Использование трипептидилпептидазы, способной воздействовать на связи с участием пролина, или экзо-трипептидилпептидазы семейства S53, проявляющей активность в диапазоне pH от приблизительно pH 4 до приблизительно pH 7, является преимущественным, поскольку это позволяет использовать трипептидилпептидазу, способную воздействовать на связи с участием пролина, или экзо-трипептидилпептидазу семейства S53 с еще одной эндопротеазой, обладающей активностью в данном диапазоне pH.
При использовании трипептидилпептидазы, способной воздействовать на связи с участием пролина, или экзо-трипептидилпептидазы семейства S53, проявляющей активность в диапазоне pH от приблизительно pH 4 до приблизительно pH 7, подходящим может быть использование в комбинации с нейтральной или щелочной эндопротеазой.
Преимущественно, это означает, что изменение рН реакционной среды, содержащей белковый и/или пептидный субстрат для получения гидролизата, между обработками ферментами не является необходимым. Иными словами, это позволяет одновременно вводить трипептидилпептидазу, способную воздействовать на связи с участием пролина, и эндопротеазу или составляющие компоненты тройной ферментной композиции в реакцию, что может сделать способ получения гидролизата более быстрым, и/или более эффективным, и/или более рентабельным. Кроме того, это позволяет проводить более эффективную реакцию, поскольку при более низких значениях рН субстрат может выпадать в осадок в растворе и, следовательно, не расщепляться.
В настоящем изобретении можно использовать любую подходящую щелочную эндопротеазу. Соответственно, щелочная эндопротеаза может представлять собой одну или несколько, выбранных из группы, состоящей из трипсина, химотрипсина или субтилизина.
В другом варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, или экзо-трипептидилпептидаза семейства S53 может проявлять активность при кислом значении pH (предпочтительно трипептидилпептидаза, способная воздействовать на связи с участием пролина, может проявлять оптимальную активность при кислом значении pH). Трипептидилпептидаза, способная воздействовать на связи с участием пролина, или экзо-трипептидилпептидаза семейства S53 может проявлять активность при pH менее приблизительно pH 6, более предпочтительно менее приблизительно pH 5. Предпочтительно трипептидилпептидаза, способная воздействовать на связи с участием пролина, может проявлять активность при pH от приблизительно 2,5 до приблизительно pH 4,0, более предпочтительно от приблизительно 3,0 до приблизительно 3,3.
Соответственно, способ по настоящему изобретению, в частности, стадию гидролиза, можно осуществлять при pH от 2 до приблизительно 4, например, от 3 до 3,3. В одном варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, или экзо-трипептидилпептидаза семейства S53 может проявлять активность при pH около 2,5.
Трипептидилпептидазу, способную воздействовать на связи с участием пролина, или экзо-трипептидилпептидазу семейства S53, обладающую активностью при кислом значении pH, можно использовать в комбинации с кислой эндопротеазой, при этом преимущественно не требуется изменять pH реакционной среды, содержащей белковый и/или пептидный субстрат для получения гидролизата, между обработками ферментами. Иными словами, это позволяет одновременно вводить трипептидилпептидазу, способную воздействовать на связи с участием пролина, и эндопротеазу или составляющие компоненты тройной ферментной композиции в реакцию, что может сделать способ получения гидролизата более быстрым, и/или более эффективным, и/или более рентабельным.
По меньшей мере одну эндопротеазу можно использовать в комбинации с трипептидилпептидазой, способной воздействовать на связи с участием пролина, или экзо-трипептидилпептидазой семейства S53 для любого из применений в данном документе. Например, по меньшей мере одна эндопротеаза может содержаться в композиции, и/или композиции пищевой добавки, и/или в продукте, не являющемся пищевым продуктом, по настоящему изобретению.
Используемый в данном документе термин ʺэндопротеазаʺ является синонимичным термину ʺэндопептидазаʺ и относится к ферменту, который представляет собой протеолитическую пептидазу, способную расщеплять внутренние пептидные связи пептидного или белкового субстрата (например, расположенные по направлению к C- или N-концу пептидного или белкового субстрата). Такие эндопротеазы могут быть определены как такие, которые проявляют тенденцию к активности в удалении от N-конца или С-конца.
В одном варианте осуществления эндопротеаза может представлять собой одну или несколько, выбранных из группы, состоящей из: сериновой протеазы, протеазы аспарагиновой кислоты, цистеиновой протеазы, металлопротеазы, треониновой протеазы, протеазы глутаминовой кислоты и протеазы, выбранной из семейства несгруппированных протеаз.
В одном варианте осуществления эндопротеаза может представлять собой одну или несколько из эндопротеаз, выбранных из группы, состоящей из: кислой грибной протеазы, субтилизина, химотрипсина, трипсина и пепсина, или из группы коммерческих протеазных продуктов - Alphalase® AFP, Alphalase® FP2, Alphalase® NP, FoodPro® Alkaline Protease, FoodPro® PXT, FoodPro® PBR, FoodPro® 30L, FoodPro® PHT или FoodPro® 51FP.
В одном варианте осуществления эндопротеаза может представлять собой кислую эндопротеазу. Соответственно, эндопротеаза может представлять собой кислую грибную протеазу.
Преимущественно использованием эндопротеазы в комбинации с трипептидилпептидазой, способной воздействовать на связи с участием пролина, или экзо-трипептидилпептидазой семейства S53 может повысить эффективность расщепления субстрата. Не вдаваясь в теорию, полагают, что эндопротеаза способна расщеплять пептидный и/или белковый субстрат в нескольких участках в удалении от C- или N-конца, давая тем самым больше N-концов для использования в качестве субстрата для трипептидилпептидазы, способной воздействовать на связи с участием пролина, тем самым выгодно повышая эффективность реакции, и/или сокращая время реакции, и/или более эффективно удаляя антигены (и тем самым снижая иммуногенность).
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, или экзо-трипептидилпептидаза семейства S53 для использования в соответствии с настоящим изобретением может представлять собой трипептидилпептидазу, способную воздействовать на связи с участием пролина, ʺв продукте питанияʺ.
Используемый в данном документе термин ʺв продукте питанияʺ или ʺв кормеʺ означает, что фермент (например, трипептидилпептидаза, способная воздействовать на связи с участием пролина, и/или эндопротеаза, и/или экзо-трипептидилпептидаза семейства S53, и/или тройная ферментная композиция) является функциональным, предпочтительно преимущественно функциональным, более предпочтительно функциональным исключительно в желудочно-кишечном тракте (GIT) субъекта. Иными словами, используемый в данном документе термин ʺв пищевом продуктеʺ означает, что фермент, по сути, неактивен (или является неактивным) в композиции, и/или в композиции пищевой добавки, и/или в композиции кормовой добавки, и/или в пищевом продукте, и/или в кормовом продукте до употребления композиции, и/или композиции пищевой добавки, и/или композиции кормовой добавки, и/или пищевого продукта, и/или кормового продукта субъектом.
Термин ʺпреимущественно функциональныйʺ означает, что фермент главным образом проявляет действие в отношении своего субстрата сразу после того, как поступает в GIT. Иными словами, до поступления в GIT уровень ферментативной активности, определяемой как количество расщепления пептидных и/или белковых субстратов до трипептидов, составляет менее приблизительно 20%, предпочтительно менее приблизительно 10%, предпочтительно менее приблизительно 5% от уровня активности фермента после его поступления в GIT.
Используемый в данном документе термин ʺисключительно функциональныйʺ означает, что фермент является неактивным до поступления в GIT и активируется при поступлении в GIT.
Используемый в данном документе термин ʺнеактивныйʺ означает, что фермент не является активным. Это может означать, что активность фермента каким-либо образом ингибируется, или что фермент находится в среде, в которой он неактивен, или что фермент вводят в его субстрат непосредственно перед скармливанием животному так, что времени для его активирования недостаточно. ʺНеактивностьʺ фермента может быть в любом случае обратимой, как только он поступает в GIT субъекта.
Таким образом, соответственно, трипептидилпептидазу, способную воздействовать на связи с участием пролина (необязательно, в комбинации с эндопротеазой), и/или экзо-трипептидилпептидазу семейства S53, и/или тройную ферментную композицию можно смешать по меньшей мере с одним белком или его частью непосредственно перед употреблением этого субъектом.
Используемый в данном документе термин ʺпо сути, неактивныйʺ означает, что фермент имеет низкую активность по сравнению с его активностью сразу после того, как он поступает в GIT. Например, по сути, неактивный может означать, что фермент в композиции кормовой добавки, и/или в композиции пищевой добавки, и/или в композиции кормовой добавки, и/или в пищевом продукте, и/или кормовом продукте имеет менее 10% своей активности по сравнению с его активностью в GIT.
Поддержания фермента ʺв продукте питанияʺ в неактивном или, по сути, неактивном состоянии в композиции, и/или в композиции пищевой добавки, и/или в композиции кормовой добавки, и/или в пищевом продукте, и/или кормовом продукте можно достичь при помощи ряда способов, известных специалисту в данной области.
Исключительно в качестве примера, сохранение содержания воды (вес. %) в композиции, и/или в композиции пищевой добавки, и/или в композиции кормовой добавки, и/или в пищевом продукте, и/или в кормовом продукте менее чем 15%, предпочтительно менее чем 10%, является достаточным для того, чтобы гарантировать, что фермент в продукте питания является неактивным или, по сути, неактивным в композиции, и/или в композиции пищевой добавки, и/или в композиции кормовой добавки, и/или в пищевом продукте, и/или кормовом продукте.
В одном варианте осуществления композиция, и/или композиция пищевой добавки, и/или композиция кормовой добавки, и/или пищевой продукт, и/или кормовой продукт после смешивания с ферментом в продукте питания находится (поддерживается и/или хранится) в сухом состоянии или, по сути, в сухом состоянии.
Используемый в данном документе термин ʺсухое состояниеʺ означает, что трипептидилпептидаза, способная воздействовать на связи с участием пролина (необязательно в комбинации с эндопротеазой), и/или композиция, и/или композиция пищевой добавки, и/или композиция кормовой добавки, и/или пищевой продукт, и/или кормовой продукт не содержит или содержит очень низкое количество воды. Иными словами, используемый в данном документе термин ʺсухое состояниеʺ может означать, что трипептидилпептидаза, способная воздействовать на связи с участием пролина (необязательно в комбинации с эндопротеазой), и/или экзо-трипептидилпептидаза семейства S53, и/или тройная ферментная композиция, и/или композиция, и/или композиция пищевой добавки и/или композиция кормовой добавки, и/или пищевой продукт, и/или кормовой продукт содержит менее 5%, предпочтительно менее 1%, абсолютной влажности (вес. %).
В одном варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, и/или эндопротеаза, и/или экзо-трипептидилпептидаза семейства S53, и/или тройная ферментная композиция для использования в способах, и/или применениях, и/или продуктах по настоящему изобретению может быть в сухом или, по сути, в сухом состоянии.
В другом варианте осуществления трипептидилпептидазу, способную воздействовать на связи с участием пролина, для использования в любом из способов, и/или применений, и/или продуктов по настоящему изобретению можно смешивать с композицией, содержащей по меньшей мере один белок или по меньшей мере часть белка, где композиция на основе трипептидилпептидазы, способной воздействовать на связи с участием пролина, или их комбинаций, и/или экзо-трипептидилпептидазы семейства S53, и/или тройная ферментная композиция находятся в сухом или, по сути, в сухом состоянии при смешивании. Соответственно, можно дополнительно примешивать эндопротеазу.
Термин ʺсухое или, по сути, сухое состояниеʺ при использовании в данном документе означает, что композиция на основе трипептидилпептидазы, способной воздействовать на связи с участием пролина, эндопротеазы или их комбинации содержит очень низкое количество воды. Иными словами, используемый в данном документе термин ʺпо сути, сухое состояниеʺ может означать, что композиция на основе трипептидилпептидазы, способная воздействовать на связи с участием пролина, эндопротеазы или их комбинаций, и/или экзо-трипептидилпептидазы семейства S53, и/или тройная ферментная композиция содержит менее 15%, предпочтительно менее 10% абсолютной влажности (вес. %).
В одном варианте осуществления композиция на основе трипептидилпептидазы, способной воздействовать на связи с участием пролина, эндопротеазы или их комбинации, и/или экзо-трипептидилпептидазы семейства S53, и/или тройная ферментная композиция может быть высушена до, во время или после (предпочтительно до) использования в способах и/или применениях по настоящему изобретению.
В другом варианте осуществления композиция на основе трипептидилпептидазы, способной воздействовать на связи с участием пролина, эндопротеазы или их комбинации, и/или экзо-трипептидилпептидазы семейства S53, и/или тройная ферментная композиция до или после использования в способах и/или применениях по настоящему изобретению содержит менее 15 вес. % влажности.
В другом варианте осуществления композиция на основе трипептидилпептидазы, способной воздействовать на связи с участием пролина, эндопротеазы или их комбинации, и/или экзо-трипептидилпептидазы семейства S53, и/или тройная ферментная композиция до или после использования в способах и/или применениях по настоящему изобретению содержит менее 10 вес. % влажности; более предпочтительно менее 5 вес. % влажности и еще более предпочтительно менее 1 вес. % влажности.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина (например, трипептидилпептидаза, способная воздействовать на связи с участием пролина, ʺв продукте питанияʺ), эндопротеаза или их комбинации могут поддерживаться в неактивном или, по сути, неактивном состоянии в композиции, и/или в композиции пищевой добавки, и/или в композиции кормовой добавки, и/или в пищевом продукте, и/или в кормовом продукте путем физического предотвращения взаимодействия фермента с его субстратом. Например, трипептидилпептидаза, способная воздействовать на связи с участием пролина (например, трипептидилпептидаза, способная воздействовать на связи с участием пролина, ʺв продукте питанияʺ), эндопротеаза или их комбинации, и/или экзо-трипептидилпептидаза семейства S53, и/или тройная ферментная композиция может быть инкапсулирована до ее использования в способах, и/или в применениях, в композиции, и/или в композиции пищевой добавки, и/или в композиции кормовой добавки, и/или в пищевом продукте, и/или в кормовом продукте по настоящему изобретению.
Если физически предотвращается взаимодействие трипептидилпептидазы, способной воздействовать на связи с участием пролина (например, трипептидилпептидазы, способной воздействовать на связи с участием пролина, ʺв продукте питанияʺ), эндопротеазы или их комбинации, и/или экзо-трипептидилпептидазы семейства S53, и/или тройной ферментной композиции с ее субстратом в композиции, и/или в композиции пищевой добавки, и/или в композиции кормовой добавки, и/или в пищевом продукте, и/или кормовом продукте, тогда как только в GIT удаляется физический барьер, это позволяет трипептидилпептидазе, способной воздействовать на связи с участием пролина (например, трипептидилпептидазе, способной воздействовать на связи с участием пролина, ʺв продукте питанияʺ), эндопротеазе или их комбинациям, и/или экзо-трипептидилпептидазе семейства S53, и/или тройной ферментной композиции взаимодействовать с ее субстратом.
Исключительно в качестве примера, капсула может удаляться при прохождении инкапсулированной трипептидилпептидазы, способной воздействовать на связи с участием пролина (трипептидилпептидазы, способной воздействовать на связи с участием пролина, ʺв продукте питанияʺ), эндопротеазы или их комбинаций, и/или экзо-трипептидилпептидазы семейства S53, и/или тройной ферментной композиции через мышечный желудок, преджелудок или желудок субъекта. Мышечный желудок, преджелудок или желудок субъекта характеризуется очень низким (кислым) значением pH (например, pH 2-4). Эту кислотность можно использовать для активации инкапсулированных ферментов.
В одном варианте осуществления фермент может быть инкапсулирован с помощью полимера, такого как, например, хитин или хитозаны, желатин, гуммиарабик или воск. Исключительно в качестве примера полимер может представлять собой желатин или гуммиарабик, как изложено в Xue et al Food Funct. 2013, 25 апреля; 6 февраля (epub); 4 (4) 610-7. В качестве альтернативы, полимер может представлять собой гидрогель на основе хитозана, как изложено в Zhang et al Biomacromolecules 2011,12,2894-2901.
В одном варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина (например, трипептидилпептидаза, способная воздействовать на связи с участием пролина, ʺв продукте питанияʺ), эндопротеаза или их комбинаци, и/или экзо-трипептидилпептидаза семейства S53, и/или тройная ферментная композиция могут активироваться в результате употребления фермента субъектом.
Используемый в данном документе термин ʺнеактивныйʺ может означать, что ферменту презентируется его субстрат непосредственно перед употреблением фермента субъектом, в результате чего этого времени недостаточно для активации перед его поступлением в GIT субъекта.
В некоторых вариантах осуществления инактивация фермента представляет собой постоянную деактивацию, например, путем тепловой, химической или pH-денатурации. Поэтому в таких вариантах осуществления ʺнеактивныйʺ может быть постоянно неактивным, например, в том числе в GIT субъекта.
Ферменты по настоящему изобретению, включая комбинации 3PP и эндопротеазы, также применимы в способе превращения крахмала, особенно в способе осахаривания и ферментации желатинизированного, сырого и/или зернистого крахмала, который подвергся разжижению. Целевым конечным продуктом (часто называемым продуктом ʺконечной ферментацииʺ или ʺEOFʺ) может быть любой продукт, который можно получить путем ферментативного превращения крахмального субстрата. Например, целевым продуктом может быть сироп, богатый глюкозой и мальтозой, который можно использовать в других способах, таких как получение кукурузного сиропа с высоким содержанием фруктозы (HFCS), или который можно превращать в ряд других полезных продуктов, таких как промежуточные соединения аскорбиновой кислоты (например, глюконат, 2-кето-L-гулоновая кислота, 5-кето-глюконат и 2,5-дикетоглюконат); 1,3-пропандиол; аминокислоты (например, тирозин, серин, лизин, глутаминовая кислота, глицин, фенилаланин и триптофан); органические кислоты (например, лактат, пируват, сукцинат, цитрат, изоцитрат, глюконат, итаконат и оксалоацетат); антибиотики; противомикробные средства; ферменты; витамины; гормоны; этанол, бутанол и другие спирты; глюконо-дельта-лактон; натрия эриторбат; омега-3 жирная кислота; изопрен и другие биохимические вещества и биологические материалы. Специалист в данной области осведомлен о различных условиях ферментации, которые можно использовать в получении этих продуктов EOF.
Специалистам в данной области хорошо известны доступные способы, которые можно использовать для получения крахмальных субстратов для превращения. Полезные субстраты крахмала можно получить из клубней, корней, стеблей, бобовых, злаков или цельного зерна. В частности, зернистый крахмал можно получить из кукурузы, початков, пшеницы, ячменя, ржи, тритикале, сорго, саго, пшена, кассавы, тапиоки, сорго, риса, гороха, фасоли, бананов или картофеля. Крахмальный субстрат может представлять собой сырой крахмал из измельченного цельного зерна, который содержит некрахмальные фракции, например, остатки зародыша и волокна.
Разжижение обычно включает желатинизацию крахмала одновременно с добавлением или после добавления α-амилазы, хотя необязательно можно добавлять дополнительные ферменты, вызывающие разжижение. В некоторых случаях разжижение крахмала осуществляют при температуре желатинизации или ниже, что, как правило, требует ферментов аналогичных классов с разными критериями эффективности. Разжиженный крахмал можно осахаривать в сироп с более низкой степенью полимеризации (DP) с использованием α-амилаз, необязательно в присутствии других ферментов. Точный состав продуктов осахаривания зависит от комбинации используемых ферментов, а также от типа перерабатываемого зернистого крахмала.
Ферменты по настоящему изобретению можно добавлять во время разжижения и/или осахаривания в виде выделенного ферментного раствора, высушенного или гранулированного фермента, осветленного бульона, ультрафильтратного концентрата или цельноклеточного бульона, необязательно в виде части смеси. Ферменты по настоящему изобретению можно также добавлять в виде культивируемого клеточного материала, продуцируемого клетками-хозяевами, экспрессирующими ферменты. Ферменты по настоящему изобретению могут также секретироваться клеткой-хозяином в реакционной среде в ходе cпособа ферментации или одновременного способа осахаривания и ферментации (SSF), так что фермент вводится в реакцию непрерывно (см. ниже). Клетка-хозяин, продуцирующая и секретирующая ферменты по настоящему изобретению, может также экспрессировать дополнительный фермент, такой как глюкоамилаза и/или α-амилаза. Клетка-хозяин может быть сконструирована для экспрессии широкого спектра различных сахаролитических ферментов.
Растворимый гидролизат крахмала, полученный посредством обработки амилазой, можно превращать в сироп с высоким содержанием фруктозы, такой как кукурузный сироп с высоким содержанием фруктозы (HFCS). Это превращение может быть достигнуто с использованием глюкозоизомеразы, в частности, глюкозоизомеразы, иммобилизованной на твердом носителе.
Растворимый гидролизат крахмала, в частности, богатый глюкозой сироп, можно ферментировать путем приведения в контакт гидролизата крахмала с ферментирующим организмом. Этанологенные микроорганизмы включают дрожжи, такие как Saccharomyces cerevisiae, и бактерии, например, Zymomonas mobilis, экспрессирующие алкогольдегидрогеназу и пируватдекарбоксилазу. Коммерческие источники дрожжей включают ETHANOL REDÒ (LeSaffre); THERMOSACCÒ (Lallemand); RED STARÒ (Red Star); FERMIOLÒ (DSM Specialties) и SUPERSTARTÒ (Alltech). Микроорганизмы, которые продуцируют другие EOF (такие как упомянутые выше), также известны в данной области. Как упоминалось выше, способы осахаривания и ферментации могут быть осуществлены в виде SSF-способа, в котором ферментирующий организм экспрессирует ферменты по настоящему изобретению, необязательно с одним или несколькими дополнительными ферментами, такими как глюкоамилаза и/или α-амилаза. Ферментация может включать последующие обогащение, очистку и извлечение EOF.
ГИДРОЛИЗАТЫ
Настоящее изобретение также предлагает гидролизат, получаемый (например, полученный) посредством способа по настоящему изобретению.
Соответственно, такой гидролизат может быть обогащен трипептидами. Соответственно, гидролизат может быть обогащен одним или несколькими трипептидами, имеющими пролин на своем N-конце, и/или трипептидами, имеющими пролин на своем N-конце и С-конце.
Предпочтительно такой гидролизат может быть обогащен одним или несколькими трипептидами, имеющими пролин на своем N-конце и пролин на своем С-конце.
В качестве альтернативы или дополнительно гидролизат может содержать трипептидилпептидазу, способную воздействовать на связи с участием пролина (необязательно в комбинации с эндопротеазой), и/или экзо-трипептидилпептидазу семейства S53, и/или тройную ферментную композицию, описанную в данном документе, как, например, любую из аминокислотных последовательностей, описанных в данном документе, или трипептидилпептидазу, способную воздействовать на связи с участием пролина, получаемую (например, полученную) посредством любого из способов данного документа.
Используемый в данном документе термин ʺгидролизатʺ имеет свое обычное значение в данной области и означает продукт, полученный в результате обработки белка или его части трипептидилпептидазой, способной воздействовать на связи с участием пролина, и эндопротеазой. Степень протеолитического расщепления белка или его части может варьироваться от минимальной (например, отщепление одиночной пептидной связи от одного белка) до обширной в зависимости, например, от условий обработки, таких как продолжительность обработки, температура, концентрация белка и чистота, концентрация и активность трипептидилпептидазы, способной воздействовать на связи с участием пролина, и эндопротеазы.
Таким образом, ʺгидролизатʺ обычно включает смесь коротких пептидов, получаемых путем расщепления пептидного и/или белкового субстрата по меньшей мере одной протеазой (предпочтительно трипептидилпептидазой, способной воздействовать на связи с участием пролина). Соответственно, такой гидролизат может быть существенно обогащен трипептидами и необязательно также отдельными аминокислотами и/или дипептидами.
Преимущественно обогащение трипептидами, дипептидами и/или отдельными аминокислотами может привести к более эффективному поглощению гидролизата животным и/или человеком.
Гидролизаты с высоким содержанием трипептидов, а также дипептидов, являются преимущественными в пищевом отношении, поскольку кишечная абсорбция ди- и трипептидов происходит через рецепторы PepT1, которые функционируют независимо от поглощения свободных аминокислот (Gilbert et al. 2008, J ANIM SCI, 86:2135-2155).
Используемый в данном документе термин ʺпо сути, обогащенный трипептидамиʺ означает, что из общей концентрации пептидов, измеренной посредством любого способа, известного в данной области (например, посредством жидкостной хроматографии-масс-спектрометрии (LC-MS)), по меньшей мере приблизительно 20% (предпочтительно по меньшей мере приблизительно 30%) из этих пептидов составляют трипептиды. Предпочтительно по меньшей мере приблизительно 40% из этих пептидов представляют собой трипептиды, более предпочтительно по меньшей мере приблизительно 50%.
В одном варианте осуществления используемый в данном документе термин ʺпо сути, обогащенный трипептидамиʺ означает, что из общей концентрации пептидов, измеренной посредством любого способа, известного в данной области (например, посредством жидкостной хроматографии-масс-спектрометрии (LC-MS)), по меньшей мере приблизительно 70% из этих пептидов составляют трипептиды.
Преимущественно ультрафильтрацию можно использовать в способе гидролиза белка. Ферментативные мембранные реакторы имеют по меньшей мере одну ультрафильтрационную мембрану, соединенную с реактором гидролиза. Таким образом, ультрафильтрацию можно использовать в ходе гидролиза для удаления пептидов, ингибирующих фермент, и/или для получения пептидных фракций с молекулярными массами, определяемыми по отсечению по молекулярной массе мембраны. Это является полезным для получения коротких пептидов со значительно сниженной аллергенностью. Ферментативные мембранные реакторы могут также способствовать более интенсивному превращению белкового субстрата в требуемые пептиды и повторному использованию протеолитических ферментов. Примеры использования ферментативного мембранного реактора приведены в Eisele et al. (2013), European Food Research and Technology 236, 483-490 и Cheison SC, Wang Z, Xu SY (2007) J Agric Food Chem 55, 3896-3904.
В одном варианте осуществления гидролизат может содержать менее приблизительно 20%, предпочтительно менее приблизительно 10% полноразмерного исходного субстрата (например, по меньшей мере одного белка). Предпочтительно гидролизат может содержать менее приблизительно 5%, более предпочтительно менее приблизительно 1% полноразмерного исходного субстрата (например, по меньшей мере одного белка).
В некоторых вариантах осуществления гидролизат может не содержать или, по сути, не содержать полноразмерный исходный субстрат.
Используемый в данном документе термин ʺпо сути, не содержитʺ в данном контексте может означать менее приблизительно 0,5%, предпочтительно менее приблизительно 0,1% полноразмерного исходного субстрата.
В тех случаях, когда эндопротеаза, экзо-трипептидилпептидаза семейства S53 и аминопептидаза были использованы в получении гидролизата, считается, что такой гидролизат будет обогащен отдельными аминокислотами, дипептидами и трипептидами.
В одном варианте осуществления отдельные аминокислоты, дипептиды и трипептиды, присутствующие в таком гидролизате, можно количественно определить по показателю молярности каждого заявленного. В одном варианте осуществления молярное соотношение отдельных аминокислот, дипептидов и трипептидов в гидролизате может составлять по меньшей мере приблизительно 20% отдельных аминокислот и по меньшей мере приблизительно 10% дипептидов и по меньшей мере приблизительно 10% трипептидов.
В другом варианте осуществления молярное отношение отдельных аминокислот, дипептидов и трипептидов в гидролизате может составлять по меньшей мере приблизительно 10% отдельных аминокислот и по меньшей мере приблизительно 20% дипептидов и по меньшей мере приблизительно 20% трипептидов.
Гидролизат, получаемый в соответствии со способами по настоящему изобретению, или для использования в любом из заявленных в данном документе применений, может характеризоваться пониженной иммуногенностью по отношению к субъекту, имеющему склонность к возникновению иммунного ответа по меньшей мере на один белок или его часть, которые образуют субстрат для расщепления для получения гидролизата.
Гидролизат по настоящему изобретению получают путем смешивания по меньшей мере одного белка или его части с эндопротеазой и трипептидилпептидазой, способной воздействовать на связи с участием пролина.
Белок или его часть, используемые в качестве субстрата в получении гидролизата, могут представлять собой белок животного происхождения или растительный белок (например, белок из овощей).
Соответственно, белок или его часть могут представлять собой один или несколько белков, выбранных из группы, состоящей из: глиадина, бета-казеина, бета-лактоглобулина или иммуногенного фрагмента глиадина, бета-казеина, бета-лактоглобулина, глицинина, бета-конглицинина, круциферина, напина, коллагена, белка сыворотки молока, белка рыбы, белка мяса, яичного белка, соевого белка, гордеина и белка зерновых.
В одном варианте осуществления белок или его часть предпочтительно представляют собой растительный белок, белок молока, яичный белок или их комбинацию.
В одном варианте осуществления, белок или его часть предпочтительно представляют собой растительный белок, где предпочтительно белок представляет собой один или несколько из глиадина, иммуногенного фрагмента глиадина, белка зерновых, глютена, соевого белка.
В одном варианте осуществления, белок или его часть предпочтительно представляют собой белок молока, где предпочтительно белок представляет собой один или несколько из казеина, например, бета-казеин; лактоглобулина, например, бета-лактоглобулин; или белка сыворотки молока.
В одном варианте осуществления белок или его часть предпочтительно представляют собой яичный белок.
Белок или его часть могут содержаться в кукурузе, соевой муке, сухой барде с растворимыми веществами кукурузы (DDGS), пшенице, белках пшеницы (включая глютен), побочных продуктах переработки пшеницы, пшеничных отрубях, побочных продуктах переработки кукурузы, включая кукурузную глютеновую муку, в ячмене, овсе, ржи, тритикале, необезжиренной сое, измельченном материале побочных продуктов животного происхождения, растворимом в спирте белке (предпочтительно зеине (например, зеине кукурузы) и/или кафирине (например, из сорго)), белке из семян масличных растений (предпочтительно из белков семян сои, белков семян подсолнечника, белков рапса, белков семян канолы или их комбинаций) или их комбинации.
В одном варианте осуществления белок или его часть могут представлять собой белковую муку. В одном варианте осуществления это может быть белковая мука из рыбы или белковая мука из животного (например, из такого как млекопитающее, отличное от человека).
В некоторых вариантах осуществления белок или его часть для использования в соответствии с настоящим изобретением может представлять собой побочный продукт животного происхождения.
Такие побочные продукты могут включать в себя ткани, полученные в ходе получения и переработки продуктов животного происхождения, которые не используются в получении продуктов питания для человека и обрабатываются в виде массы белковой муки, используемой в кормах для животных и кормах для домашних животных. В одном варианте осуществления белковые побочные продукты переработки животного происхождения могут представлять собой мясо-костную муку, мясную муку, кровяную муку, муку из побочных продуктов переработки птицы, муку из сельскохозяйственной птицы, перьевую муку и рыбную муку.
В другом варианте осуществления белок или его часть для использования в настоящем изобретении может представлять собой микробный белок. Микробные белки, как, например, дрожжевые экстракты, как правило, получают путем извлечения содержимого клеток из микробных культур; их можно использовать в качестве пищевых добавок или ароматизаторов, или в качестве питательных веществ для микробных культуральных сред.
В других вариантах осуществления белок или его часть для использования в настоящем изобретении может представлять собой белок беспозвоночных, предпочтительно белок насекомого.
Насекомые/беспозвоночные обладают огромным биологическим разнообразием и представляют собой большую биомассу (95% животного мира), и таким образом представляют собой альтернативные источники белка.
В одном варианте осуществления белок или его часть могут представлять собой один или несколько, выбранных из группы, состоящей из: белка пшеницы, частей белка пшеницы, белка молока и частей белка молока.
Белок пшеницы или его часть можно получать из пшеницы, продуктов пшеницы (например, пшеничной муки), отходов переработки пшеницы и/или пшеничных отрубей. Соответственно, белок пшеницы может представлять собой один или несколько белков, выбранных из группы, состоящей из: глиадина, частей глиадина, глютена и частей глютена.
Белок молока или его часть могут представлять собой белок молока. Соответственно, белок молока может представлять собой один или нескольков белков, выбранных из группы, состоящей из: бета-казеина, бета-лактоглобулина и белка сыворотки молока.
Выражение ʺего частьʺ по отношению к белку или его части, используемой для получения гидролизата, может означать иммуногенный фрагмент белка. "Иммуногенным фрагментом" является любая часть, которая способна вызывать иммунный ответ у чувствительного индивидуума. "Иммуногенный фрагмент" или "его часть" представляет собой участок полноразмерного белка, содержащий или состоящий по меньшей мере из 10 аминокислот, предпочтительно по меньшей мере из 20 аминокислот, более предпочтительно по меньшей мере из 30 аминокислот.
В некоторых вариантах осуществления размер иммуногенного фрагмента или его части может составлять по меньшей мере приблизительно 50 аминокислот; более предпочтительно по меньшей мере приблизительно 100 аминокислот и еще более предпочтительно по меньшей мере приблизительно 200 аминокислот.
Используемый в данном документе термин ʺбелок молокаʺ охватывает любой встречающийся в природе белок в нормальном секрете молочной железы млекопитающего женского пола в послеродовом периоде или продукты, полученные из него, такие как его фракции или компоненты, полученные из него или из них. Молоко может быть от любого вида млекопитающих, включая без ограничения корову, козу, овцу, буйвола, яка, верблюда, ламу, альпаку и человека. Предпочтительными являются белки молока от тех млекопитающих, чье молоко коммерчески или широко предпочтительно используется в различных культурах и странах. Следует отметить, что используемый в данном документе термин ʺбелок молокаʺ охватывает как единственное, так и множественное число слова ʺбелокʺ, таким образом, термин ʺбелок молокаʺ может относиться к отдельному белку или к любой смеси одного или нескольких белков, если не указано иное.
Термин ʺбелок сыворотки молокаʺ охватывает любой белок, обнаруженный в любом количестве в ʺсыворотке молокаʺ; жидком побочном продукте сыроварения, который отделяется от творога. Сыворотка молока, полученная в результате производства многих видов сыра, чрезвычайно бедна мицеллярными белками молока, такими как казеины, но относительно богата растворимыми белками, такими как альфа-лактальбумин и бета-лактоглобулин. Как и в случае вышеописанного ʺбелка молокаʺ, используемый в данном документе термин ʺбелок сыворотки молокаʺ охватывает как единственное, так и множественное число слова ʺбелокʺ, таким образом, термин ʺбелок сыворотки молокаʺ также может означать отдельный белок или любую смесь из одного или нескольких белков сыворотки молока, если не указано иное. Специалисту в данной области должно быть понятно, что белки сыворотки молока фактически являются подклассом белков молока, и, таким образом, термин ʺбелок молокаʺ может включать один или несколько белков сыворотки молока, если не указано иное. Композиции на основе сыворотки могут включать, например, молоко, сливки и сырную сыворотку. Можно использовать сыворотку, полученную из сыра любого типа. Белок сыворотки молока можно получать посредством любого из способов, таким как фильтрация, диализ, выпаривание и обратный осмос сырной сыворотки, или посредством любого другого способа, который дает в результате белки, обычно описываемые как ʺбелки сыворотки молокаʺ.
В предпочтительном варианте осуществления гидролизат, получаемый (например, полученный) посредством способа по настоящему изобретению, может представлять собой гидролизат белка молока, гидролизат белка пшеницы (например, гидролизат глиадина и/или глютена), гидролизат соевого белка или их комбинации.
Таким образом, предложено использование по меньшей мере одной эндопротеазы и по меньшей мере одной трипептидилпептидазы, способной воздействовать на связи с участием пролина, или ферментата, содержащего трипептидилпептидазу, способную воздействовать на связи с участием пролина, где указанная трипептидилпептидаза, способная воздействовать на связи с участием пролина, преимущественно обладает экзопептидазной активностью и способна к отщеплению трипептидов с N-конца пептидов, имеющих:
(i) пролин в P1 и
аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1; или
(ii) пролин в P1ʹ и
аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1ʹ;
или получаемую посредством любого из способов по настоящему изобретению; в получении гидролизата для снижения иммуногенности у субъекта, имеющего склонность к иммунной реакции на необработанный гидролизат.
Соответственно, трипептидилпептидаза, способная воздействовать на связи с участием пролина, может быть способна к отщеплению трипептидов с N-конца пептидов, имеющих: пролин в P1ʹ и аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1ʹ; и пролин в P1ʹ и
аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1ʹ.
Используемое в данном документе выражение ʺсниженная иммуногенностьʺ относится к любому снижению, уменьшению или ослаблению поддающегося измерению иммунного ответа. Измерение такого ответа можно оценить in vitro или in vivo. Например, ответ можно измерить прямо или опосредованно в биологическом образце, содержащем ткань, клетки или жидкость или им подобные, или любую их комбинацию от индивидуума, или его можно оценить у индивидуума прямо или опосредованно. Хотя в различных вариантах осуществления, предусмотренных в данном документе, любое математическое уменьшение (или снижение) такого ответа, независимо от того, измерено ли оно in vitro или in vivo, будет достаточным, предпочтительно, чтобы уменьшение было более существенным. Разумеется, специалист в данной области поймет, что биологические данные, такие как измерение иммунного ответа, подвержены потенциально большим изменениям в пределах индивидуума и от индивидуума к индивидууму. Например, если ответ относится к ʺчувствительномуʺ индивидууму, то иммунный ответ предпочтительно значительно снижен (например, по меньшей мере приблизительно на 50%, 60% или 70%, или даже приблизительно на 80% или более). Более предпочтительно, чтобы у такого чувствительного индивидуума с описанными в данном документе белковыми гидролизатами наблюдались лишь небольшие или минимальные различия по сравнению со степенью иммунологического ответа у индивидуума, который не чувствителен к одному или нескольким белкам или их частям. Это особенно предпочтительно, когда иммунный ответ считается неблагоприятным, например, аллергический ответ. В таких случаях снижение иммунного ответа (или его степени) у чувствительного индивидуума может составлять по меньшей мере от приблизительно 85% до приблизительно 90%, более предпочтительно от приблизительно 90% до приблизительно 95% или даже больше. В некоторых случаях ответу чувствительного индивидуума на описанные в данном документе белковые гидролизаты существенно статистически не отличается от ответа индивидуума, который не является чувствительным. В других случаях может иметь место многократное снижение иммунологического ответа, чем при использовании негидролизованного белка у ʺчувствительногоʺ индивидуума. Например, может иметь место приблизительно 10-кратное - 100-кратное или даже 1000-кратное снижение ответа. Более предпочтительно приблизительно 1000-кратное - 10000-кратное снижение или даже 100000-кратное или больше снижение показателя иммунного ответа индивидуума, употребляющего композиции белкового гидролизата или подвергнутого их воздействию, раскрываемых в данном документе, по сравнению с ответом этого индивидуума на немодифицированные белки.
Используемое в данном документе выражение ʺчувствительныйʺ индивидуум представляет собой индивидуума, который имеет склонность к возникновения иммунного ответа или реакции на белок в негидролизованной форме. Такой иммунный ответ или реакция в качестве прямого или опосредованного результата употребления или воздействия, например, одного или нескольких белков или их частей, является показателем иммуногенности этих белков. Такие белки практически не будут демонстрировать иммуногенность у индивидуума, который не имеет склонности к такому иммунному ответу на белок, такой индивидуум иногда упоминается в данном документе как ʺневосприимчивыйʺ или ʺнечувствительныйʺ к одному или нескольким белкам или их частям. Предпочтительно такой индивидуум не будет проявлять значительный иммунный ответ (иммунологический ответ) на воздействие белком или на потребление белка.
Чувствительные индивидуумы, имеющие реакцию на белки пшеницы (в частности, на глютен и/или глиадин), могут проявлять симптомы целиакии (например, спру-целиакии). Симптомы включают боль и дискомфорт в пищеварительном тракте, хронические запоры и диарею, отсутствие прибавки в весе (у детей), анемию и усталость, но они могут отсутствовать, причем были описаны симптомы в других системах органов. Недостаток витаминов часто отмечается у лиц с целиакией из-за ограниченной способности тонкого кишечника надлежащим образом усваивать питательные вещества из пищи. Не вдаваясь в теорию, считают, что воздействие глиадина, который модифицируется тканевым ферментом трансглутаминазой, данный глиадин приводит к перекрестной реакции иммунной системы с тканью кишечника, вызывая воспалительную реакцию у пораженного индивидуума.
Чувствительные индивидуумы, имеющие реакцию на белки молока, могут иметь симптомы аллергии на молоко, которые вызваны неблагоприятной иммунной реакцией на один или несколько белков или их иммуногенные фрагменты в молоке. Нарушение может быть либо антитело-опосредованным, либо неопосредованное антителом. Антитело-опосредованные аллергии на молоко, как правило, быстро наступают и могут приводить к проявлению желудочно-кишечных, дерматологических и/или респираторных симптомов у индивидуума. Такие симптомы могут дополнительно проявляться в виде кожной сыпи, крапивницы, рвоты и желудочных расстройств, таких как диарея, ринит, боли в желудке, хрипы или анафилактические реакции. Обычно полагают, что нарушения, которые не опосредованы антителами, опосредованы Т-лимфоцитами и не вызываются антителами. Симптомы этой формы обычно являются желудочно-кишечными и кожными.
Другие чувствительные индивидуумы могут реагировать на сою, что приводит к ряду симптомов, наиболее серьезным из которых является анафилаксия.
Гидролизаты, и/или продукт питания, и/или корм, содержащие такие гидролизаты или композиции по настоящему изобретению, могут быть особенно подходящими для введения субъекту, страдающему целиакией, аллергией на белок молока и/или аллергией на соевый белок.
Преимущественно эндопротеаза в комбинации с трипептидилпептидазой, способной воздействовать на связи с участием пролина, способна расщеплять белковые субстраты, ассоциированные с инициированием иммунного ответа у чувствительных индивидуумов, страдающих от такого заболевания, как аллергия на белок молока и/или аллергия на соевый белок.
Следовательно, в одном варианте осуществления предложена композиция пищевой добавки или кормовой добавки, содержащая гидролизат, полученный в соответствии со способами и/или применениями по настоящему изобретению.
В другом аспекте по настоящему изобретению также предложено использованием по меньшей мере одной эндопротеазы и по меньшей мере одной трипептидилпептидазы, способной воздействовать на связи с участием пролина, или ферментата, содержащего трипептидилпептидазу, способную воздействовать на связи с участием пролина, где указанная трипептидилпептидаза, способная воздействовать на связи с участием пролина, преимущественно обладает экзопептидазной активностью и способна к отщеплению трипептидов с N-конца пептидов, имеющих:
(i) пролин в P1 и
аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1; или
(ii) пролин в P1ʹ и
аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1ʹ;
или получаемую посредством любого из способов по настоящему изобретению; в получении гидролизата для уменьшения горечи гидролизата.
Когда белковый субстрат или его часть для получения гидролизата богаты гидрофобными L-аминокислотами, то белковый гидролизат может иметь горький вкус. Не вдаваясь в теорию, полагают, что горечь пептида зависит от длины пептида и средней гидрофобности остатков L-аминокислот в его составе.
ʺУменьшенную горечьʺ гидролизата можно объективно измерить с использованием группы дегустирующих индивидуумов, которых просят оценить горечь гидролизата. Индекс горечи можно использовать для оценки горечи гидролизата. Например, можно использовать индекс горечи, который устанавливает оценку вещества по сравнению с хинином, которому присваивается эталонный индекс 1, в качестве альтернативы можно использовать индекс горечи по шкале от 0 (не горький) до 10 (горький). Соответственно, любую дегустацию гидролизатов можно проводить с использованием соответствующих контролей, таких как слепое тестирование. Дополнительно или в качестве альтернативы расщепление известных горьких пептидов можно контролировать с помощью LC-MS или других подходящих методик, известных в данной области.
Эндопротеазу и трипептидилпептидазу, способную воздействовать на связи с участием пролина, можно использовать для расщепления горьких пептидов.
Преимущественно этого можно достичь благодаря способности воздействовать на связи с участием широкого спектра аминокислот в положениях P1, P2, P3, P1', P2' и/или P3' с помощью трипептидилпептидазы, способной воздействовать на связи с участием пролина.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может быть способна к расщеплению пептида, имеющего последовательность GPFPIIV, VIPVPQK и/или GPFPVI. GPFPVI известен как очень горький пептид (Matoba et al (1970), Agric. Biol. Chem. 34, 321).
Неожиданно, но трипептидилпептидаза, способная воздействовать на связи с участием пролина, может быть способна к расщеплению пептидов, имеющих пролин в положении P1 и/или P1ʹ, облегчая тем самым расщепление таких горьких пептидов.
В одном варианте осуществления гидролизаты со уменьшенной горечью можно использовать в приготовлении пищи или пищевых продуктов.
В одном варианте осуществления гидролизат может содержать трипептидилпептидазу, способную воздействовать на связи с участием пролина, содержащую одну или несколько аминокислотных последовательностей, выбранных из последовательностей под:
SEQ ID No. 29, SEQ ID No. 1, SEQ ID No. 2, SEQ ID No. 3, SEQ ID No. 4, SEQ ID No. 5, SEQ ID No.6, SEQ ID No. 7, SEQ ID No. 8, SEQ ID No. 9, SEQ ID No. 10, SEQ ID No. 11, SEQ ID No. 12, SEQ ID No. 13, SEQ ID No. 14, SEQ ID No. 15, SEQ ID No. 16, SEQ ID No. 17, SEQ ID No. 18, SEQ ID No. 19, SEQ ID No. 20, SEQ ID No. 21, SEQ ID No. 22, SEQ ID No. 23, SEQ ID No. 24, SEQ ID No. 25, SEQ ID No. 26, SEQ ID No. 27, SEQ ID No. 28, SEQ ID No. 30, SEQ ID No. 31, SEQ ID No. 32, SEQ ID No. 33, SEQ ID No. 34, SEQ ID No. 35, SEQ ID No. 36, SEQ ID No. 37, SEQ ID No. 38, SEQ ID No. 39, SEQ ID No. 40, SEQ ID No. 41, SEQ ID No. 42, SEQ ID No. 43, SEQ ID No. 44, SEQ ID No. 45, SEQ ID No. 46, SEQ ID No. 47, SEQ ID No. 48, SEQ ID No. 49, SEQ ID No. 50, SEQ ID No. 51, SEQ ID No. 52, SEQ ID No. 53, SEQ ID No. 54, SEQ ID No. 55, SEQ ID No. 98, SEQ ID No. 99, или их функционального фрагмента или аминокислотной последовательности, которая по меньшей мере на 70% идентична им.
Соответственно, трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из последовательностей под SEQ ID No. 1, SEQ ID No. 2, SEQ ID No. 3, SEQ ID No. 4, SEQ ID No. 5, SEQ ID No.6, SEQ ID No. 7, SEQ ID No. 8, SEQ ID No. 9, SEQ ID No. 10, SEQ ID No. 11, SEQ ID No. 12, SEQ ID No. 13, SEQ ID No. 14, SEQ ID No. 15, SEQ ID No. 16, SEQ ID No. 17, SEQ ID No. 18, SEQ ID No. 19, SEQ ID No. 20, SEQ ID No. 21, SEQ ID No. 22, SEQ ID No. 23, SEQ ID No. 24, SEQ ID No. 25, SEQ ID No. 26, SEQ ID No. 27, SEQ ID No. 28, или их функционального фрагмента или аминокислотной последовательности, которая по меньшей мере на 70% идентична им.
Соответственно, трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из последовательностей под SEQ ID No. 29, SEQ ID No. 30, SEQ ID No. 31, SEQ ID No. 32, SEQ ID No. 33, SEQ ID No. 34, SEQ ID No. 35, SEQ ID No. 36, SEQ ID No. 37, SEQ ID No. 38, SEQ ID No. 39, SEQ ID No. 40, SEQ ID No. 41, SEQ ID No. 42, SEQ ID No. 43, SEQ ID No. 44, SEQ ID No. 45, SEQ ID No. 46, SEQ ID No. 47, SEQ ID No. 48, SEQ ID No. 49, SEQ ID No. 50, SEQ ID No. 51, SEQ ID No. 52, SEQ ID No. 53, SEQ ID No. 54, SEQ ID No. 55, SEQ ID No. 98, SEQ ID No. 99, или их функционального фрагмента или аминокислотной последовательности, которая по меньшей мере на 70% идентична им.
НАБОРЫ
В одном аспекте предложен набор, содержащий по меньшей мере одну трипептидилпептидазу, способную воздействовать на связи с участием пролина, где указанная трипептидилпептидаза, способная воздействовать на связи с участием пролина, преимущественно обладает экзопептидазной активностью и способна к отщеплению трипептидов с N-конца пептидов, имеющих:
(i) пролин в P1 и
аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1; или
(ii) пролин в P1ʹ и
аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1ʹ;
или получаемую посредством какого-либо из способов по настоящему изобретению; по меньшей мере одну эндопротеазу и инструкции для их совместного введения.
Соответственно, трипептидилпептидаза, способная воздействовать на связи с участием пролина, может быть способна к отщеплению трипептидов с N-конца пептидов, имеющих:
(i) (A) пролин в P1 и
(B) аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1ʹ; и
(ii) (aʹ) пролин в P1ʹ и
(bʹ) аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1ʹ.
Более предпочтительно трипептидилпептидаза, способная воздействовать на связи с участием пролина, может быть способна к отщеплению трипептидов с N-конца пептидов, имеющих пролин в положении P1 и в положении P1ʹ.
Настоящее изобретение также предлагает набор, содержащий: (i) по меньшей мере одну эндопептидазу;
(ii) по меньшей мере одну экзо-трипептидилпептидазу семейства S53 и (iii) одну или несколько аминопептидаз и инструкции для их совместного введения.
Эндопротеаза может быть размещена отдельно от трипептидилпептидазы, способной воздействовать на связи с участием пролина, или два фермента могут быть смешаны.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, и/или эндопротеаза могут быть составлены посредством любого способа, описываемого в данном документе или известного специалисту в данной области.
Используемое в данном документе выражение ʺсовместное введениеʺ означает введение одного или нескольких ингредиентов и/или фермента по отдельности (например, последовательно) или совместно (например, одновременно).
АКТИВНОСТЬ И АНАЛИЗЫ
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, для использования в настоящем изобретении преимущественно обладает экзопептидазной активностью.
Используемый в данном документе термин ʺэкзопептидазнаяʺ активность означает, что трипептидилпептидаза, способная воздействовать на связи с участием пролина, способна к отщеплению трипептидов с N-конца субстрата, такого как белковый и/или пептидный субстрат.
Используемый в данном документе термин ʺпреимущественно обладает экзопептидазной активностьюʺ означает, что трипептидилпептидаза не обладает или, по сути, не обладает эндопротеазной активностью.
ʺПо сути, не обладает эндопротеазной активностьюʺ означает, что трипептидилпептидаза, способная воздействовать на связи с участием пролина, или экзопептидаза семейства S53 обладает менее приблизительно 100 ЕД эндопротеазной активности в ʺЭндопротеазном анализеʺ, изложенном в данном документе, по сравнению с 1000 нкат экзопептидазной активности в ʺЭкзопептидазном анализе широкой специфичности (EBSA)ʺ, изложенном в данном документе. Соответственно, ʺпо сути не обладает эндопротеазной активностьюʺ означает, что трипептидилпептидаза, способная воздействовать на связи с участием пролина, обладает менее приблизительно 100 ЕД эндопротеазной активности в ʺЭндопротеазном анализеʺ, изложенном в данном документе, по сравнению с 1000 нкат экзопептидазной активности в ʺЭкзопептидазном анализе широкой специфичностиʺ, изложенном в данном документе.
Предпочтительно трипептидилпептидаза, способная воздействовать на связи с участием пролина, или экзопептидаза семейства S53 может обладать менее приблизительно 10 ЕД эндопротеазной активности в ʺЭндопротеазном анализеʺ, изложенном в данном документе, по сравнению с 1000 нкат экзопептидазной активности в ʺЭкзопептидазном анализе широкой специфичностиʺ, изложенном в данном документе, более предпочтительно менее чем приблизительно 1 ЕД эндопротеазной активности в ʺЭндопротеазном анализеʺ, изложенном в данном документе, по сравнению с 1000 нкат экзопептидазной активности в ʺЭкзопептидазном анализе широкой специфичностиʺ, изложенном в данном документе. Еще более предпочтительно трипептидилпептидаза, способная воздействовать на связи с участием пролина, или экзо-трипептидилпептидаза может обладать менее приблизительно 0,1 ЕД эндопротеазной активности в ʺЭндопротеазном анализеʺ, изложенном в данном документе, по сравнению с 1000 нкат экзопептидазной активности в ʺЭкзопептидазном анализе широкой специфичностиʺ, изложенном в данном документе.
ʺЭНДОПРОТЕАЗНЫЙ АНАЛИЗʺ
Анализ эндопротеазной активности с азоказеином
Использовали модифицированный вариант эндопротеазного анализа, описанного в Iversen и Jørgensen, 1995 (Biotechnology Techniques 9, 573-576). Образец фермента объемом 50 мкл добавляли к 250 мкл азоказеина (0,25% вес./об.; от Sigma) в 4-кратно разбавленном буфере McIlvaine, pH 5, и инкубировали в течение 15 мин. при 40°C со встряхиванием (800 об./мин.). Реакцию останавливают добавлением 50 мкл 2 М трихлоруксусной кислоты (ТСА) (от Sigma Aldrich, Дания) и центрифугируют в течение 5 мин. при 20000 g. К 195 мкл.образца надосадочной жидкости добавляют 65 мкл 1 M NaOH и измеряют оптическую плотность при 450 нм. Одну единицу эндопротеазной активности определяют как количество, которое дает повышение оптической плотности на 0,1 за 15 мин. при 40°C при 450 нм.
ʺЭКЗОПЕПТИДАЗНЫЙ АНАЛИЗʺ
Существуют две части анализа:
часть 1 - ʺэкзопептидазный анализ широкой специфичностиʺ (EBSA)
10 мкл раствора хромогенного пептида (10 мM H-Ala-Ala-Ala-pNA, растворенного в диметилсульфоксиде (DMSO); MW=387,82; Bachem, Швейцария) добавляют к 130 мкл Na-ацетата (20 мM, доводят до pH 4,0 уксусной кислотой) в микротитровальном планшете и нагревают в течение 5 минут при 40°C. Добавляют 10 мкл соответствующим образом разбавленного фермента и измеряют оптическую плотность на MTP-ридере (Versa max, Molecular Devices, Дания) при 405 нм. Один катал протеолитической активности определяли как количество фермента, необходимое для выделения 1 моля п-нитроанилина в секунду.
Часть 2 (i) -анализ пролина в положении P1
(a) растворяют субстрат H-Arg-Gly-Pro-Phe-Pro-Ile-Ile-Val (MW=897,12; от Schafer-N, Копенгаген, в разбавленном в 10 раз буфере McIlvain, pH=4,5 при концентрации 1 мг/мл;
(b) инкубируют 1000 мкл раствора субстрата с раствором 10 мкг трипептидилпептидазы, способной воздействовать на связи с участием пролина, при 40°C;
(c) отбирают образцы 100 мкл в семи моментах времени (0, 30, 60, 120, 720 и 900 мин.), разбавляют их с помощью 50 мкл 5% TFA, инактивируют нагреванием (10 мин при 80°C) и хранят при -20°C до анализа LC-MS;
(d) проводят анализ LC-MC/MS с использованием системы капиллярной HPLC Agilent 1100 Series (Agilent Technologies, Санта-Клара, CA), сопряженной с гибридным масс-спектрометром LTQ Orbitrap Classic (Thermo Scientific, Бремен, Германия);
(e) загружают образцы в 50 мм колонку Fortis ™ C18 с внутренним диаметром 2,1 мм и практическим размером 1,7 мкм;
(f) проводят разделение при скорости потока 200 мкл/мин. с использованием 14-минутного градиента 2-28% растворителя B (H2O/CH3CN/ HCOOH (50/950/0,65 об./об/об.)) в источнике IonMAX - прибор LTQ Orbitrap Classic эксплуатировали в режиме MS/MS, зависящем от данных;
(g) измеряют массы пептидов с помощью Orbitrap (получают MS-спектры с разрешением 60000 при соотношении масса/заряд (m/z) 400), отбирают 2 наиболее интенсивных пептидных m/z и подвергают фрагментации с использованием CID в линейной ионной ловушке (LTQ). Включают динамическое исключение с размером списка исключения 500 масс, продолжительностью 40 с и шириной исключения масс ±10 ppm по отношению к массам в списке;
(h) используют программу с открытым исходным кодом Skyline 1.4.0.4421 (доступную от MacCoss Lab Software, университет Вашингтона, Отдел геномных исследований, 3720 15th Ave NE Seattle, Вашингтон, США) для доступа к файлам RAW и извлечения интенсивности MS1 для построения хроматограмм. Устанавливают изотопный фильтр для импорта предшественника в количестве до трех (M, M+1 и M+2) с разрешением 60000 и используют наиболее интенсивное состояние заряда;
(i) пептидные последовательности субстрата и продуктов расщепления вводят в Skyline и интенсивности рассчитывают в каждом образце (0, 30, 60, 120, 720 и 900 мин гидролиза);
(j) одну единицу активности определяют как количество фермента, которое в данном анализе гидролизует 50% субстрата в течение 720 мин c высвобождением Arg-Gly-Pro.
Part 2 (ii) -анализ пролина в положении P1ʹ
(a) растворяют пептид H-Ala-Ala-Phe-Pro-Ala-NH2 (MW=474,5; от Schafer-N, Копенгаген) в разбавленном в 10 раз буфере McIlvain, pH=4,5 при концентрации 0,1 мг/мл;
(b) инкубируют 1000 мкл раствора субстрата с раствором 10 мкг трипептидилпептидазы, способной воздействовать на связи с участием пролина, при 40°C;
(c) отбирают образцы 100 мкл в семи моментах времени (0, 30, 60, 120, 720 и 900 мин.), разбавляют их с помощью 50 мкл 5% TFA, инактивируют нагреванием (10 мин при 80°C) и хранят при -20°C до анализа LC-MS;
(d) проводят анализ LC-MC/MS с использованием системы капиллярной HPLC Agilent 1100 Series (Agilent Technologies, Санта-Клара, CA), сопряженной с гибридным масс-спектрометром LTQ Orbitrap Classic (Thermo Scientific, Бремен, Германия);
(e) загружают образцы в 50 мм колонку Fortis ™ C18 с внутренним диаметром 2,1 мм и практическим размером 1,7 мкм;
(f) проводят разделение при скорости потока 200 мкл/мин. с использованием 14-минутного градиента 2-28% растворителя B (H2O/CH3CN/ HCOOH (50/950/0,65 об./об/об.)) в источнике IonMAX - прибор LTQ Orbitrap Classic эксплуатировали в режиме MS/MS, зависящем от данных;
(g) измеряют массы пептидов с помощью Orbitrap (получают MS-спектры с разрешением 60000 при соотношении масса/заряд (m/z) 400), отбирают 2 наиболее интенсивных пептидных m/z и подвергают фрагментации с использованием CID в линейной ионной ловушке (LTQ). Включают динамическое исключение с размером списка исключения 500 масс, продолжительностью 40 с и шириной исключения масс ±10 ppm по отношению к массам в списке;
(h) используют программу с открытым исходным кодом Skyline 1.4.0.4421 (доступную от MacCoss Lab Software, университет Вашингтона, Отдел геномных исследований, 3720 15th Ave NE Seattle, Вашингтон, США) для доступа к файлам RAW и извлечения интенсивности MS1 для построения хроматограмм. Устанавливают изотопный фильтр для импорта предшественника в количестве до трех (M, M+1 и M+2) с разрешением 60000 и используют наиболее интенсивное состояние заряда;
(i) пептидные последовательности субстрата, а также продукты расщепления вводят в Skyline и интенсивности рассчитывают в каждом образце;
(j) одну единицу активности определяют как количество фермента, которое в данном анализе гидролизует 50% субстрата в течение 720 мин с высвобождением Ala-Ala-Phe.
В одном варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, в соответствии с настоящим изобретением обладает активностью по меньшей мере в 50 нкат в части 1 для активности, изложенной в данном документе, и по меньшей мере 100 ЕД активности в части 2(i) или части 2(ii) анализа, изложенного в данном документе, на мг белка.
В одном варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, в соответствии с настоящим изобретением обладает активностью по меньшей мере в приблизительно 50-2000 нкат в части 1 для активности, изложенной в данном документе, и приблизительно 1-500 единиц активности в части 2(i) или части 2(ii) анализа, изложенного в данном документе, на мг белка. Обратите внимание, что измерение белка описано в примере 2.
ʺАНАЛИЗ АКТИВНОСТИ ОТНОСИТЕЛЬНО ПРОЛИНА В ПОЛОЖЕНИЯХ P1 И P1ʹʺ
Соответственно, трипептидилпептидаза для использования в настоящем изобретении может быть способной к расщеплению субстратов, имеющих пролин в положении P1 и P1ʹ. Это можно оценить с использованием анализа, изложенного ниже.
В данном анализе трипептидилпептидазу исследуют на способность гидролизовать синтетический субстрат AAPPA с использованием LC-MS и количественной оценки без метки.
(a) растворяют пептид H-AAPPA-NH2 (MW=424,3, от Schafer-N, Копенгаген) в 20 мM буфере MES, pH=4,0 (1 мг/мл);
(b) инкубируют 1000 мкл раствора H-AAPPA-NH2 с 200 мкл раствора трипептидилпептидазы, способной воздействовать на связи с участием пролина (40 мкг/мл) (субстрат/фермент 100:0,8) при комнатной температуре;
(c) отбирают образцы 100 мкл в семи моментах времени (0, 5, 15, 60, 180, 720 и 1440 мин.), разбавляют их с помощью 50 мкл 5% TFA, инактивируют нагреванием (10 мин при 80°C) и хранят при -20°C до анализа LC-MS;
(d) проводят анализ Nano LC-MS/MS с использованием системы Easy LC (Thermo Scientific, Оденсе, Дания), сопряженной с гибридным масс-спектрометром LTQ Orbitrap Classic (Thermo Scientific, Бремен, Германия);
(e) загружают образцы на специально изготовленную 2 см предколонку (внутр. д. 100 мкм, внешн. д. 375 мкм, заполненную Reprosil C18, частицы обращенной фазы 5 мкм (Dr. Maisch GmbH, Ammerbuch-Entringen, Германия)), соединенную с 10 см аналитической колонкой (внутр. д. 75 мкм, внешн. д. 375 мкм, заполнена Reprosil C18, частицы обращенной фазы 3 мкм (Dr. Maisch GmbH, Ammerbuch-Entringen, Германия)) со стальной иглой;
(f) проводят разделение при скорости потока 300 нл/мин. с использованием 10-минутного градиента 0-34% растворителя B (H2O/CH3CN/TFE/HCOOH (100/800//100/1 об./об./об./об.)) в наноэлектрораспылительном источнике ионов (Thermo Scientific, Оденсе, Дания) -эксплуатируют прибор LTQ Orbitrap Classic в режиме MS/MS, зависящем от данных;
(g) измеряют массы пептидов с помощью Orbitrap (получают MS-спектры с разрешением 60000 при соотношении масса/заряд (m/z) 400), отбирают 2 наиболее интенсивных пептидных m/z и подвергают фрагментации с использованием CID в линейной ионной ловушке (LTQ); Включают динамическое исключение с размером списка исключения 500 масс, продолжительностью 40 с и шириной исключения масс ±10 ppm по отношению к массам в списке;
(h) используют программу с открытым исходным кодом Skyline 1.4.0.4421 (доступную от MacCoss Lab Software, университет Вашингтона, Отдел геномных исследований, 3720 15th Ave NE Seattle, Вашингтон, США) для доступа к файлам RAW, из которых программа может использовать интенсивности MS1 для построения хроматограмм. Устанавливают изотопный фильтр для импорта предшественника в количестве до трех (M, M+1 и M+2) с разрешением 60000 и используют наиболее интенсивное состояние заряда;
(i) пептидные последовательности субстрата, а также продукты расщепления вводят в Skyline и интенсивности рассчитывают в каждом образце;
(j) одну единицу активности определяют как количество фермента, которое в данном анализе гидролизует 50% субстрата в течение 24 ч с высвобождением AАP.
В одном варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, в соответствии с настоящим изобретением обладает активностью по меньшей мере в 50 нкат в части 1 для активности, изложенной в данном документе, и по меньшей мере 100 ЕД активности в части 2(i) или части 2(ii) анализа, изложенного в данном документе, на мг белка.
В одном варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, в соответствии с настоящим изобретением обладает активностью по меньшей мере в приблизительно 50-2000 нкат в части 1 для активности, изложенной в данном документе, и приблизительно 1-500 единиц активности в части 2(i) или части 2(ii) анализа, изложенного в данном документе, на мг белка (концентрацию белка рассчитывали как в примере 2).
В одном варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, для использования в настоящем изобретении может обладать по меньшей мере 10 ЕД активности в ʺАнализе активности относительно пролина в положениях P1 и P1ʹʺ, изложенном в данном документе, на мг белка.
В одном варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, в соответствии с настоящим изобретением обладает активностью от приблизительно 1 ЕД до 500 ЕД активности в ʺАнализе активности относительно пролина в положениях P1 и P1ʹʺ, изложенном в данном документе, на мг белка.
В дополнение к вышеизложенному, трипептидилпептидаза, способная воздействовать на связи с участием пролина, может также обладать активностью в соответствии с частью 1 ʺАнализа экзопептидазной активностиʺ, изложенного выше.
В одном варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, для использования в настоящем изобретении может обладать по меньшей мере 10 ЕД активности в ʺАнализе активности относительно пролина в положениях P1 и P1ʹʺ, изложенном в данном документе, и по меньшей мере 50 нкатал в части 1 ʺАнализа экзопептидазной активностиʺ, изложенного в данном документе, на мг белка.
В другом варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, в соответствии с настоящим изобретением обладает активностью от приблизительно 1 ЕД до 500 ЕД активности в ʺАнализе активности относительно пролина в положениях P1 и P1ʹʺ, изложенном в данном документе, и от приблизительно 50 ЕД до 2000 ЕД нкатал в части 1 ʺАнализа экзопептидазной активностиʺ, изложенного в данном документе, на мг белка.
АМИНОКИСЛОТНЫЕ И НУКЛЕОТИДНЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ
Трипептидилпептидазу, способную воздействовать на связи с участием пролина, для использования в соответствии с настоящим изобретением можно получать (например, получить) из любого источника, если она обладает описанной в данном документе активностью.
В одном варианте осуществления трипептидилпептидазу, способную воздействовать на связи с участием пролина, для использования в соответствии с настоящим изобретением можно получать (например, получить) из Trichoderma.
Предпочтительно из Trichoderma reesei, более предпочтительно из Trichoderma reesei QM6A.
Предпочтительно из Trichoderma virens, более предпочтительно из Trichoderma virens Gv29-8.
Предпочтительно из Trichoderma atroviride. Более предпочтительно Trichoderma atroviride IMI 206040.
В одном варианте осуществления трипептидилпептидазу, способную воздействовать на связи с участием пролина, для использования в соответствии с настоящим изобретением можно получать (например, получить) из Aspergillus.
Предпочтительно из Aspergillus fumigatus, более предпочтительно Aspergillus fumigatus CAE17675.
Предпочтительно из Aspergillus kawachii, более предпочтительно из Aspergillus kawachii IFO 4308.
Предпочтительно из Aspergillus nidulans, более предпочтительно из Aspergillus nidulans FGSC A4.
Предпочтительно из Aspergillus oryzae, более предпочтительно из Aspergillus oryzae RIB40.
Предпочтительно из Aspergillus ruber, более предпочтительно из Aspergillus ruber CBS135680.
Предпочтительно из Aspergillus terreus, более предпочтительно из Aspergillus terreus NIH2624.
В одном варианте осуществления трипептидилпептидазу, способную воздействовать на связи с участием пролина, для использования в соответствии с настоящим изобретением можно получать (например, получить) из Bipolaris, предпочтительно из Bipolaris maydis, более предпочтительно из Bipolaris maydis C5.
В одном варианте осуществления трипептидилпептидазу, способную воздействовать на связи с участием пролина, для использования в соответствии с настоящим изобретением можно получать (например, получить) из Togninia, предпочтительно из Togninia minima, более предпочтительно из Togninia minima UCRPA7.
В одном варианте осуществления трипептидилпептидазу, способную воздействовать на связи с участием пролина, для использования в соответствии с настоящим изобретением можно получать (например, получить) из Talaromyces, предпочтительно из Talaromyces stipitatus, более предпочтительно из Talaromyces stipitatus ATCC 10500.
В одном варианте осуществления трипептидилпептидазу, способную воздействовать на связи с участием пролина, для использования в соответствии с настоящим изобретением можно получать (например, получить) из Arthroderma, предпочтительно из Arthroderma benhamiae, более предпочтительно из Arthroderma benhamiae CBS 112371.
В одном варианте осуществления трипептидилпептидазу, способную воздействовать на связи с участием пролина, для использования в соответствии с настоящим изобретением можно получать (например, получить) из Magnaporthe, предпочтительно из Magnaporthe oryzae, более предпочтительно из Magnaporthe oryzae 70-1.
В другом варианте осуществления трипептидилпептидазу, способную воздействовать на связи с участием пролина, для использования в соответствии с настоящим изобретением можно получать (например, получить) из Fusarium.
Предпочтительно из Fusarium oxysporum, более предпочтительно из Fusarium oxysporum f. sp. cubense штамма 4.
Предпочтительно из Fusarium graminearum, более предпочтительно из Fusarium graminearum PH-1.
В дополнительном варианте осуществления трипептидилпептидазу, способную воздействовать на связи с участием пролина, для использования в соответствии с настоящим изобретением можно получать (например, получить) из Phaeosphaeria, предпочтительно из Phaeosphaeria nodorum, более предпочтительно из Phaeosphaeria nodorum SN15.
В еще одном дополнительном варианте осуществления трипептидилпептидазу, способную воздействовать на связи с участием пролина, для использования в соответствии с настоящим изобретением можно получать (например, получить) из Agaricus, предпочтительно из Agaricus bisporus, более предпочтительно из Agaricus bisporus вара burnettii JB137-S8.
В еще одном дополнительном варианте осуществления трипептидилпептидазу, способную воздействовать на связи с участием пролина, для использования в соответствии с настоящим изобретением можно получать (например, получить) из Acremonium, предпочтительно из Acremonium alcalophilum.
В еще одном дополнительном варианте осуществления трипептидилпептидазу, способную воздействовать на связи с участием пролина, для использования в соответствии с настоящим изобретением можно получать (например, получить) из Sodiomyces, предпочтительно из Sodiomyces alkalinus.
В одном варианте осуществления трипептидилпептидазу, способную воздействовать на связи с участием пролина, для использования в соответствии с настоящим изобретением можно получать (например, получить) из Penicillium.
Предпочтительно, трипептидилпептидазу, способную воздействовать на связи с участием пролина, можно получать из Penicillium digitatum, более предпочтительно из Penicillium digitatum Pd1.
Предпочтительно, трипептидилпептидазу, способную воздействовать на связи с участием пролина, можно получать из Penicillium oxalicum, более предпочтительно из Penicillium oxalicum 114-2.
Предпочтительно, трипептидилпептидазу, способную воздействовать на связи с участием пролина, можно получать из Penicillium roqueforti, более предпочтительно из Penicillium roqueforti FM164.
Предпочтительно трипептидилпептидазу, способную воздействовать на связи с участием пролина, можно получать из Penicillium rubens, более предпочтительно из Penicillium rubens Wisconsin54-1255.
В другом варианте осуществления трипептидилпептидазу, способную воздействовать на связи с участием пролина, для использования в соответствии с настоящим изобретением можно получать (например, получить) из Neosartorya.
Предпочтительно, трипептидилпептидазу, способную воздействовать на связи с участием пролина, можно получать из Neosartoryafischeri, более предпочтительно из Neosartoryafischeri NRRL181.
В одном варианте осуществления трипептидилпептидазу (например, трипептидилпептидазу, способную воздействовать на связи с участием пролина) для использования в соответствии с настоящим изобретением не получают из (например, не получают) из Aspergillus niger.
По меньшей мере одна трипептидилпептидаза, способная воздействовать на связи с участием пролина, может:
(a) содержать аминокислотную последовательность под SEQ ID No. 29, SEQ ID No. 1, SEQ ID No. 2, SEQ ID No. 3, SEQ ID No. 4, SEQ ID No. 5, SEQ ID No.6, SEQ ID No. 7, SEQ ID No. 8, SEQ ID No. 9, SEQ ID No. 10, SEQ ID No. 11, SEQ ID No. 12, SEQ ID No. 13, SEQ ID No. 14, SEQ ID No. 15, SEQ ID No. 16, SEQ ID No. 17, SEQ ID No. 18, SEQ ID No. 19, SEQ ID No. 20, SEQ ID No. 21, SEQ ID No. 22, SEQ ID No. 23, SEQ ID No. 24, SEQ ID No. 25, SEQ ID No. 26, SEQ ID No. 27, SEQ ID No. 28, SEQ ID No. 30, SEQ ID No. 31, SEQ ID No. 32, SEQ ID No. 33, SEQ ID No. 34, SEQ ID No. 35, SEQ ID No. 36, SEQ ID No. 37, SEQ ID No. 38, SEQ ID No. 39, SEQ ID No. 40, SEQ ID No. 41, SEQ ID No. 42, SEQ ID No. 43, SEQ ID No. 44, SEQ ID No. 45, SEQ ID No. 46, SEQ ID No. 47, SEQ ID No. 48, SEQ ID No. 49, SEQ ID No. 50, SEQ ID No. 51, SEQ ID No. 52, SEQ ID No. 53, SEQ ID No. 54, SEQ ID No. 55, SEQ ID No. 98, SEQ ID No. 99, или ее функциональный фрагмент;
(b) содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 29, SEQ ID No. 1, SEQ ID No. 2, SEQ ID No. 3, SEQ ID No. 4, SEQ ID No. 5, SEQ ID No.6, SEQ ID No. 7, SEQ ID No. 8, SEQ ID No. 9, SEQ ID No. 10, SEQ ID No. 11, SEQ ID No. 12, SEQ ID No. 13, SEQ ID No. 14, SEQ ID No. 15, SEQ ID No. 16, SEQ ID No. 17, SEQ ID No. 18, SEQ ID No. 19, SEQ ID No. 20, SEQ ID No. 21, SEQ ID No. 22, SEQ ID No. 23, SEQ ID No. 24, SEQ ID No. 25, SEQ ID No. 26, SEQ ID No. 27, SEQ ID No. 28, SEQ ID No. 30, SEQ ID No. 31, SEQ ID No. 32, SEQ ID No. 33, SEQ ID No. 34, SEQ ID No. 35, SEQ ID No. 36, SEQ ID No. 37, SEQ ID No. 38, SEQ ID No. 39, SEQ ID No. 40, SEQ ID No. 41, SEQ ID No. 42, SEQ ID No. 43, SEQ ID No. 44, SEQ ID No. 45, SEQ ID No. 46, SEQ ID No. 47, SEQ ID No. 48, SEQ ID No. 49, SEQ ID No. 50, SEQ ID No. 51, SEQ ID No. 52, SEQ ID No. 53, SEQ ID No. 54, SEQ ID No. 55, SEQ ID No. 98, SEQ ID No. 99, или ее функциональный фрагмент;
(c) кодироваться нуклеотидной последовательностью, содержащей последовательность SEQ ID No. 56, SEQ ID No. 57, SEQ ID No. 58, SEQ ID No. 59, SEQ ID No. 60, SEQ ID No. 61, SEQ ID No. 62, SEQ ID No. 63, SEQ ID No. 64, SEQ ID No. 65, SEQ ID No. 66, SEQ ID No. 67, SEQ ID No. 68, SEQ ID No. 69, SEQ ID No. 70, SEQ ID No. 71, SEQ ID No. 72, SEQ ID No. 73, SEQ ID No. 74, SEQ ID No. 75, SEQ ID No. 76, SEQ ID No. 77, SEQ ID No. 78, SEQ ID No. 79, SEQ ID No. 80, SEQ ID No. 81, SEQ ID No. 82, SEQ ID No. 83, SEQ ID No. 84, SEQ ID No. 85, SEQ ID No. 86, SEQ ID No. 87, SEQ ID No. 88, SEQ ID No. 89, SEQ ID No. 90, SEQ ID No. 91, SEQ ID No. 92, SEQ ID No. 93, SEQ ID No. 94, SEQ ID No. 95, SEQ ID No. 96 или SEQ ID No. 97;
(d) кодироваться нуклеотидной последовательностью, которая по меньшей мере на приблизительно 70% идентична последовательности под SEQ ID No. 56, SEQ ID No. 57, SEQ ID No. 58, SEQ ID No. 59, SEQ ID No. 60, SEQ ID No. 61, SEQ ID No. 62, SEQ ID No. 63, SEQ ID No. 64, SEQ ID No. 65, SEQ ID No. 66, SEQ ID No. 67, SEQ ID No. 68, SEQ ID No. 69, SEQ ID No. 70, SEQ ID No. 71, SEQ ID No. 72, SEQ ID No. 73, SEQ ID No. 74, SEQ ID No. 75, SEQ ID No. 76, SEQ ID No. 77, SEQ ID No. 78, SEQ ID No. 79, SEQ ID No. 80, SEQ ID No. 81, SEQ ID No. 82, SEQ ID No. 83, SEQ ID No. 84, SEQ ID No. 85, SEQ ID No. 86, SEQ ID No. 87, SEQ ID No. 88, SEQ ID No. 89, SEQ ID No. 90, SEQ ID No. 91, SEQ ID No. 92, SEQ ID No. 93, SEQ ID No. 94, SEQ ID No. 95, SEQ ID No. 96 или SEQ ID No. 97;
(e) кодироваться нуклеотидной последовательностью, которая гибридизируется с последовательностью под SEQ ID No. 56, SEQ ID No. 57, SEQ ID No. 58, SEQ ID No. 59, SEQ ID No. 60, SEQ ID No. 61, SEQ ID No. 62, SEQ ID No. 63, SEQ ID No. 64, SEQ ID No. 65, SEQ ID No. 66, SEQ ID No. 67, SEQ ID No. 68, SEQ ID No. 69, SEQ ID No. 70, SEQ ID No. 71, SEQ ID No. 72, SEQ ID No. 73, SEQ ID No. 74, SEQ ID No. 75, SEQ ID No. 76, SEQ ID No. 77, SEQ ID No. 78, SEQ ID No. 79, SEQ ID No. 80, SEQ ID No. 81, SEQ ID No. 82, SEQ ID No. 83, SEQ ID No. 84, SEQ ID No. 85, SEQ ID No. 86, SEQ ID No. 87, SEQ ID No. 88, SEQ ID No. 89, SEQ ID No. 90, SEQ ID No. 91, SEQ ID No. 92, SEQ ID No. 93, SEQ ID No. 94, SEQ ID No. 95, SEQ ID No. 96 или SEQ ID No. 97 в условиях средней жесткости; или
(f) кодироваться нуклеотидной последовательностью, которая отличается от последовательности под SEQ ID No. 56, SEQ ID No. 57, SEQ ID No. 58, SEQ ID No. 59, SEQ ID No. 60, SEQ ID No. 61, SEQ ID No. 62, SEQ ID No. 63, SEQ ID No. 64, SEQ ID No. 65, SEQ ID No. 66, SEQ ID No. 67, SEQ ID No. 68, SEQ ID No. 69, SEQ ID No. 70, SEQ ID No. 71, SEQ ID No. 72, SEQ ID No. 73, SEQ ID No. 74, SEQ ID No. 75, SEQ ID No. 76, SEQ ID No. 77, SEQ ID No. 78, SEQ ID No. 79, SEQ ID No. 80, SEQ ID No. 81, SEQ ID No. 82, SEQ ID No. 83, SEQ ID No. 84, SEQ ID No. 85, SEQ ID No. 86, SEQ ID No. 87, SEQ ID No. 88, SEQ ID No. 89, SEQ ID No. 90, SEQ ID No. 91, SEQ ID No. 92, SEQ ID No. 93, SEQ ID No. 94, SEQ ID No. 95, SEQ ID No. 96 или SEQ ID No. 97 из-за вырожденности генетического кода.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может экспрессироваться в виде полипептидной последовательности, которая подвергается дальнейшей посттранскрипционной и/или посттрансляционной модификации.
В одном варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность под SEQ ID No. 1, SEQ ID No. 2, SEQ ID No. 3, SEQ ID No. 4, SEQ ID No. 5, SEQ ID No.6, SEQ ID No. 7, SEQ ID No. 8, SEQ ID No. 9, SEQ ID No. 10, SEQ ID No. 11, SEQ ID No. 12, SEQ ID No. 13, SEQ ID No. 14, SEQ ID No. 15, SEQ ID No. 16, SEQ ID No. 17, SEQ ID No. 18, SEQ ID No. 19, SEQ ID No. 20, SEQ ID No. 21, SEQ ID No. 22, SEQ ID No. 23, SEQ ID No. 24, SEQ ID No. 25, SEQ ID No. 26, SEQ ID No. 27, SEQ ID No. 28, SEQ ID No. 98, или ее функциональный фрагмент.
В другом варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, содержит аминокислотную последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 1, SEQ ID No. 2, SEQ ID No. 3, SEQ ID No. 4, SEQ ID No. 5, SEQ ID No.6, SEQ ID No. 7, SEQ ID No. 8, SEQ ID No. 9, SEQ ID No. 10, SEQ ID No. 11, SEQ ID No. 12, SEQ ID No. 13, SEQ ID No. 14, SEQ ID No. 15, SEQ ID No. 16, SEQ ID No. 17, SEQ ID No. 18, SEQ ID No. 19, SEQ ID No. 20, SEQ ID No. 21, SEQ ID No. 22, SEQ ID No. 23, SEQ ID No. 24, SEQ ID No. 25, SEQ ID No. 26, SEQ ID No. 27, SEQ ID No. 28, SEQ ID No. 98, или ее функциональный фрагмент.
В одном варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность под SEQ ID No. 1, SEQ ID No. 2, SEQ ID No. 3, SEQ ID No. 4, SEQ ID No. 5, SEQ ID No.6, SEQ ID No. 7, SEQ ID No. 8, SEQ ID No. 9, SEQ ID No. 10, SEQ ID No. 11, SEQ ID No. 12, SEQ ID No. 13, SEQ ID No. 14, SEQ ID No. 15, SEQ ID No. 16, SEQ ID No. 17, SEQ ID No. 18, SEQ ID No. 98, или ее функциональный фрагмент.
В другом варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, содержит аминокислотную последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 1, SEQ ID No. 2, SEQ ID No. 3, SEQ ID No. 4, SEQ ID No. 5, SEQ ID No.6, SEQ ID No. 7, SEQ ID No. 8, SEQ ID No. 9, SEQ ID No. 10, SEQ ID No. 11, SEQ ID No. 12, SEQ ID No. 13, SEQ ID No. 14, SEQ ID No. 15, SEQ ID No. 16, SEQ ID No. 17, SEQ ID No. 18, SEQ ID No. 98, или ее функциональный фрагмент.
В другом варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, может представлять собой ʺзрелуюʺ трипептидилпептидазу, способную воздействовать на связи с участием пролина, которая подверглась посттранскрипционной и/или посттрансляционной модификации (например, посттрансляционному расщеплению). Соответственно, такая модификация может приводить к активации фермента.
Соответственно, трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность под SEQ ID No. 29, SEQ ID No. 30, SEQ ID No. 31, SEQ ID No. 32, SEQ ID No. 33, SEQ ID No. 34, SEQ ID No. 35, SEQ ID No. 36, SEQ ID No. 37, SEQ ID No. 38, SEQ ID No. 39, SEQ ID No. 40, SEQ ID No. 41, SEQ ID No. 42, SEQ ID No. 43, SEQ ID No. 44, SEQ ID No. 45, SEQ ID No. 46, SEQ ID No. 47, SEQ ID No. 48, SEQ ID No. 49, SEQ ID No. 50, SEQ ID No. 51, SEQ ID No. 52, SEQ ID No. 53, SEQ ID No. 54, SEQ ID No. 55, SEQ ID No. 99, или ее функциональный фрагмент.
В другом варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, содержит аминокислотную последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 29, SEQ ID No. 30, SEQ ID No. 31, SEQ ID No. 32, SEQ ID No. 33, SEQ ID No. 34, SEQ ID No. 35, SEQ ID No. 36, SEQ ID No. 37, SEQ ID No. 38, SEQ ID No. 39, SEQ ID No. 40, SEQ ID No. 41, SEQ ID No. 42, SEQ ID No. 43, SEQ ID No. 44, SEQ ID No. 45, SEQ ID No. 46, SEQ ID No. 47, SEQ ID No. 48, SEQ ID No. 49, SEQ ID No. 50, SEQ ID No. 51, SEQ ID No. 52, SEQ ID No. 53, SEQ ID No. 54, SEQ ID No. 55, SEQ ID No. 99, или ее функциональный фрагмент.
В еще одном дополнительном варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность под SEQ ID No. 29, SEQ ID No. 30, SEQ ID No. 31, SEQ ID No. 32, SEQ ID No. 33, SEQ ID No. 34, SEQ ID No. 35, SEQ ID No. 36, SEQ ID No. 37, SEQ ID No. 38, SEQ ID No. 39, SEQ ID No. 40, SEQ ID No. 41, SEQ ID No. 42, SEQ ID No. 43, SEQ ID No. 44, SEQ ID No. 45, SEQ ID No. 99, или ее функциональный фрагмент.
В другом варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, содержит аминокислотную последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 29, SEQ ID No. 30, SEQ ID No. 31, SEQ ID No. 32, SEQ ID No. 33, SEQ ID No. 34, SEQ ID No. 35, SEQ ID No. 36, SEQ ID No. 37, SEQ ID No. 38, SEQ ID No. 39, SEQ ID No. 40, SEQ ID No. 41, SEQ ID No. 42, SEQ ID No. 43, SEQ ID No. 44, SEQ ID No. 45, SEQ ID No. 99, или ее функциональный фрагмент.
Выражение ʺфункциональный фрагментʺ представляет собой часть аминокислотной последовательности, которая сохраняет ее пептидазную ферментативную активность. Следовательно, функциональный фрагмент трипептидилпептидазы, способной воздействовать на связи с участием пролина, представляет собой часть трипептидилпептидазы, способной воздействовать на связи с участием пролина, преимущественно обладающую экзопептидазной активностью, где указанная трипептидилпептидаза, способная воздействовать на связи с участием пролина, способна к отщеплению трипептидов с N-конца пептидов, имеющих
(i) (A) пролин в P1 и
(B) аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1; и/или
(ii) (aʹ) пролин в P1ʹ и
(bʹ) аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1ʹ. В качестве альтернативы или дополнительно функциональный фрагмент трипептидилпептидазы, способной воздействовать на связи с участием пролина, представляет собой часть трипептидилпептидазы, способной воздействовать на связи с участием пролина, преимущественно обладающую экзопептидазной активностью и способную отщеплять трипептиды с N-конца пептидов, имеющих пролин в P1 и P1ʹ.
ʺЧастьʺ представляет собой любую часть, которая по-прежнему обладает активностью, определяемой выше; предпочтительно часть может иметь по меньшей мере 50 аминокислот в длину, более предпочтительно по меньшей мере 100. В других вариантах осуществления часть может иметь приблизительно 150 или приблизительно 200 аминокислот в длину.
В одном варианте осуществления функциональный фрагмент может представлять собой часть трипептидилпептидазы, способной воздействовать на связи с участием пролина, после посттранскрипционной и/или посттрансляционной модификации (например, расщепления). Соответственно, функциональный фрагмент может содержать последовательность, представленную под: SEQ ID No. 29, SEQ ID No. 30, SEQ ID No. 31, SEQ ID No. 32, SEQ ID No. 33, SEQ ID No. 34, SEQ ID No. 35, SEQ ID No. 36, SEQ ID No. 37, SEQ ID No. 38, SEQ ID No. 39, SEQ ID No. 40, SEQ ID No. 41, SEQ ID No. 42, SEQ ID No. 43, SEQ ID No. 44, SEQ ID No. 45, SEQ ID No. 46, SEQ ID No. 47, SEQ ID No. 48, SEQ ID No. 49, SEQ ID No. 50, SEQ ID No. 51, SEQ ID No. 52, SEQ ID No. 53, SEQ ID No. 54, SEQ ID No. 55 или SEQ ID No. 99.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 1, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 1, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 2, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 2, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 3, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 3, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 4, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 4, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 5, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 5, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 6, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 6, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 7, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 7, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 8, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 8, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 9, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 9, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 10, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 10, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 11, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 11, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 12, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 12, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 13, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 13, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 14, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 14, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 15, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 15, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 16, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 16, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 17, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 17, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 18, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 18, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 19, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 19, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 20, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 20, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 21, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 21, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 22, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 22, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 23, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 23, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 24, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 24, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 25, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 25, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 26, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 26, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 27, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 27, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 28, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 28, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 29, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 29, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 30, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 30, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 31, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 31, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 32, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 32, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотную последовательность, выбранную из SEQ ID No. 33, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 33, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 34, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 34, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 35, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 35, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 36, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 36, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 37, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 37, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 38, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 38, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 39, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 39, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 40, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 40, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 41, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 41, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 42, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 42, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 43, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 43, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 44, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 44, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 45, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 45, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 46, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 46, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 47, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 47, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 48, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 48, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 49, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 49, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 50, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 50, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 51, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 51, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 52, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 52, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 53, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 53, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 54, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 54, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 55, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 55, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 98, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 98, или ее функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из SEQ ID No. 99, или их функциональный фрагмент.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID No. 99, или ее функциональный фрагмент.
Соответственно, трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 80% идентична последовательности под SEQ ID No. 29, SEQ ID No. 1, SEQ ID No. 2, SEQ ID No. 3, SEQ ID No. 4, SEQ ID No. 5, SEQ ID No.6, SEQ ID No. 7, SEQ ID No. 8, SEQ ID No. 9, SEQ ID No. 10, SEQ ID No. 11, SEQ ID No. 12, SEQ ID No. 13, SEQ ID No. 14, SEQ ID No. 15, SEQ ID No. 16, SEQ ID No. 17, SEQ ID No. 18, SEQ ID No. 19, SEQ ID No. 20, SEQ ID No. 21, SEQ ID No. 22, SEQ ID No. 23, SEQ ID No. 24, SEQ ID No. 25, SEQ ID No. 26, SEQ ID No. 27, SEQ ID No. 28, SEQ ID No. 30, SEQ ID No. 31, SEQ ID No. 32, SEQ ID No. 33, SEQ ID No. 34, SEQ ID No. 35, SEQ ID No. 36, SEQ ID No. 37, SEQ ID No. 38, SEQ ID No. 39, SEQ ID No. 40, SEQ ID No. 41, SEQ ID No. 42, SEQ ID No. 43, SEQ ID No. 44, SEQ ID No. 45, SEQ ID No. 46, SEQ ID No. 47, SEQ ID No. 48, SEQ ID No. 49, SEQ ID No. 50, SEQ ID No. 51, SEQ ID No. 52, SEQ ID No. 53, SEQ ID No. 54, SEQ ID No. 55, SEQ ID No. 98, SEQ ID No. 99, или ее функциональный фрагмент.
Соответственно, трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 85% идентична последовательности под SEQ ID No. 29, SEQ ID No. 1, SEQ ID No. 2, SEQ ID No. 3, SEQ ID No. 4, SEQ ID No. 5, SEQ ID No.6, SEQ ID No. 7, SEQ ID No. 8, SEQ ID No. 9, SEQ ID No. 10, SEQ ID No. 11, SEQ ID No. 12, SEQ ID No. 13, SEQ ID No. 14, SEQ ID No. 15, SEQ ID No. 16, SEQ ID No. 17, SEQ ID No. 18, SEQ ID No. 19, SEQ ID No. 20, SEQ ID No. 21, SEQ ID No. 22, SEQ ID No. 23, SEQ ID No. 24, SEQ ID No. 25, SEQ ID No. 26, SEQ ID No. 27, SEQ ID No. 28, SEQ ID No. 30, SEQ ID No. 31, SEQ ID No. 32, SEQ ID No. 33, SEQ ID No. 34, SEQ ID No. 35, SEQ ID No. 36, SEQ ID No. 37, SEQ ID No. 38, SEQ ID No. 39, SEQ ID No. 40, SEQ ID No. 41, SEQ ID No. 42, SEQ ID No. 43, SEQ ID No. 44, SEQ ID No. 45, SEQ ID No. 46, SEQ ID No. 47, SEQ ID No. 48, SEQ ID No. 49, SEQ ID No. 50, SEQ ID No. 51, SEQ ID No. 52, SEQ ID No. 53, SEQ ID No. 54, SEQ ID No. 55, SEQ ID No. 98, SEQ ID No. 99, или ее функциональный фрагмент.
Соответственно, трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 90% идентична последовательности под SEQ ID No. 29, SEQ ID No. 1, SEQ ID No. 2, SEQ ID No. 3, SEQ ID No. 4, SEQ ID No. 5, SEQ ID No.6, SEQ ID No. 7, SEQ ID No. 8, SEQ ID No. 9, SEQ ID No. 10, SEQ ID No. 11, SEQ ID No. 12, SEQ ID No. 13, SEQ ID No. 14, SEQ ID No. 15, SEQ ID No. 16, SEQ ID No. 17, SEQ ID No. 18, SEQ ID No. 19, SEQ ID No. 20, SEQ ID No. 21, SEQ ID No. 22, SEQ ID No. 23, SEQ ID No. 24, SEQ ID No. 25, SEQ ID No. 26, SEQ ID No. 27, SEQ ID No. 28, SEQ ID No. 30, SEQ ID No. 31, SEQ ID No. 32, SEQ ID No. 33, SEQ ID No. 34, SEQ ID No. 35, SEQ ID No. 36, SEQ ID No. 37, SEQ ID No. 38, SEQ ID No. 39, SEQ ID No. 40, SEQ ID No. 41, SEQ ID No. 42, SEQ ID No. 43, SEQ ID No. 44, SEQ ID No. 45, SEQ ID No. 46, SEQ ID No. 47, SEQ ID No. 48, SEQ ID No. 49, SEQ ID No. 50, SEQ ID No. 51, SEQ ID No. 52, SEQ ID No. 53, SEQ ID No. 54, SEQ ID No. 55, SEQ ID No. 98, SEQ ID No. 99, или ее функциональный фрагмент.
Соответственно, трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 95% идентична последовательности под SEQ ID No. 29, SEQ ID No. 1, SEQ ID No. 2, SEQ ID No. 3, SEQ ID No. 4, SEQ ID No. 5, SEQ ID No.6, SEQ ID No. 7, SEQ ID No. 8, SEQ ID No. 9, SEQ ID No. 10, SEQ ID No. 11, SEQ ID No. 12, SEQ ID No. 13, SEQ ID No. 14, SEQ ID No. 15, SEQ ID No. 16, SEQ ID No. 17, SEQ ID No. 18, SEQ ID No. 19, SEQ ID No. 20, SEQ ID No. 21, SEQ ID No. 22, SEQ ID No. 23, SEQ ID No. 24, SEQ ID No. 25, SEQ ID No. 26, SEQ ID No. 27, SEQ ID No. 28, SEQ ID No. 30, SEQ ID No. 31, SEQ ID No. 32, SEQ ID No. 33, SEQ ID No. 34, SEQ ID No. 35, SEQ ID No. 36, SEQ ID No. 37, SEQ ID No. 38, SEQ ID No. 39, SEQ ID No. 40, SEQ ID No. 41, SEQ ID No. 42, SEQ ID No. 43, SEQ ID No. 44, SEQ ID No. 45, SEQ ID No. 46, SEQ ID No. 47, SEQ ID No. 48, SEQ ID No. 49, SEQ ID No. 50, SEQ ID No. 51, SEQ ID No. 52, SEQ ID No. 53, SEQ ID No. 54, SEQ ID No. 55, SEQ ID No. 98, SEQ ID No. 99, или ее функциональный фрагмент.
Соответственно, трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 97% идентична последовательности под SEQ ID No. 29, SEQ ID No. 1, SEQ ID No. 2, SEQ ID No. 3, SEQ ID No. 4, SEQ ID No. 5, SEQ ID No.6, SEQ ID No. 7, SEQ ID No. 8, SEQ ID No. 9, SEQ ID No. 10, SEQ ID No. 11, SEQ ID No. 12, SEQ ID No. 13, SEQ ID No. 14, SEQ ID No. 15, SEQ ID No. 16, SEQ ID No. 17, SEQ ID No. 18, SEQ ID No. 19, SEQ ID No. 20, SEQ ID No. 21, SEQ ID No. 22, SEQ ID No. 23, SEQ ID No. 24, SEQ ID No. 25, SEQ ID No. 26, SEQ ID No. 27, SEQ ID No. 28, SEQ ID No. 30, SEQ ID No. 31, SEQ ID No. 32, SEQ ID No. 33, SEQ ID No. 34, SEQ ID No. 35, SEQ ID No. 36, SEQ ID No. 37, SEQ ID No. 38, SEQ ID No. 39, SEQ ID No. 40, SEQ ID No. 41, SEQ ID No. 42, SEQ ID No. 43, SEQ ID No. 44, SEQ ID No. 45, SEQ ID No. 46, SEQ ID No. 47, SEQ ID No. 48, SEQ ID No. 49, SEQ ID No. 50, SEQ ID No. 51, SEQ ID No. 52, SEQ ID No. 53, SEQ ID No. 54, SEQ ID No. 55, SEQ ID No. 98, SEQ ID No. 99, или ее функциональный фрагмент.
Соответственно, трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, которая по меньшей мере на 99% идентична последовательности под SEQ ID No. 29, SEQ ID No. 1, SEQ ID No. 2, SEQ ID No. 3, SEQ ID No. 4, SEQ ID No. 5, SEQ ID No.6, SEQ ID No. 7, SEQ ID No. 8, SEQ ID No. 9, SEQ ID No. 10, SEQ ID No. 11, SEQ ID No. 12, SEQ ID No. 13, SEQ ID No. 14, SEQ ID No. 15, SEQ ID No. 16, SEQ ID No. 17, SEQ ID No. 18, SEQ ID No. 19, SEQ ID No. 20, SEQ ID No. 21, SEQ ID No. 22, SEQ ID No. 23, SEQ ID No. 24, SEQ ID No. 25, SEQ ID No. 26, SEQ ID No. 27, SEQ ID No. 28, SEQ ID No. 30, SEQ ID No. 31, SEQ ID No. 32, SEQ ID No. 33, SEQ ID No. 34, SEQ ID No. 35, SEQ ID No. 36, SEQ ID No. 37, SEQ ID No. 38, SEQ ID No. 39, SEQ ID No. 40, SEQ ID No. 41, SEQ ID No. 42, SEQ ID No. 43, SEQ ID No. 44, SEQ ID No. 45, SEQ ID No. 46, SEQ ID No. 47, SEQ ID No. 48, SEQ ID No. 49, SEQ ID No. 50, SEQ ID No. 51, SEQ ID No. 52, SEQ ID No. 53, SEQ ID No. 54, SEQ ID No. 55, SEQ ID No. 98, SEQ ID No. 99, или ее функциональный фрагмент.
В одном варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, выбранную из еще одной группы, состоящей из: SEQ ID No. 29, SEQ ID No. 1, SEQ ID No. 2, SEQ ID No. 3, SEQ ID No. 4, SEQ ID No. 5, SEQ ID No.6, SEQ ID No. 7, SEQ ID No. 8, SEQ ID No. 9, SEQ ID No. 10, SEQ ID No. 11, SEQ ID No. 12, SEQ ID No. 13, SEQ ID No. 14, SEQ ID No. 15, SEQ ID No. 16, SEQ ID No. 17, SEQ ID No. 18, SEQ ID No. 19, SEQ ID No. 20, SEQ ID No. 21, SEQ ID No. 22, SEQ ID No. 23, SEQ ID No. 24, SEQ ID No. 25, SEQ ID No. 26, SEQ ID No. 27, SEQ ID No. 28, SEQ ID No. 30, SEQ ID No. 31, SEQ ID No. 32, SEQ ID No. 33, SEQ ID No. 34, SEQ ID No. 35, SEQ ID No. 36, SEQ ID No. 37, SEQ ID No. 38, SEQ ID No. 39, SEQ ID No. 40, SEQ ID No. 41, SEQ ID No. 42, SEQ ID No. 43, SEQ ID No. 44, SEQ ID No. 45, SEQ ID No. 46, SEQ ID No. 47, SEQ ID No. 48, SEQ ID No. 49, SEQ ID No. 50, SEQ ID No. 51, SEQ ID No. 52, SEQ ID No. 53, SEQ ID No. 54, SEQ ID No. 55, SEQ ID No. 98 и SEQ ID No. 99.
При использовании в качестве пищевой добавки трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, выбранную из еще одной группы, состоящей из: SEQ ID No. 1, SEQ ID No. 2, SEQ ID No. 3, SEQ ID No. 29 и SEQ ID No. 30, или последовательность, которая по меньшей мере на 70% идентична им; более предпочтительно последовательность, которая по меньшей мере на 80% идентична им или по меньшей мере на 90% идентична им.
В некоторых вариантах осуществления может быть подходящим то, что трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID No. 3, SEQ ID No. 4, SEQ ID No. 30 и SEQ ID No. 31, или последовательность, которая по меньшей мере на 70% идентична им. Предпочтительно последовательность, которая по меньшей мере на 80% идентична им или по меньшей мере на 90% идентична им.
Преимущественно эти конкретные аминокислотные последовательности могут быть особенно пригодными для расщепления пептидных и/или белковых субстратов, обогащенных лизином, аргинином и/или глицином. В частности, когда в положении Р1 присутствуют лизин, аргинин и/или глицин.
При использовании в качестве кормовой добавки, соответственно, трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать аминокислотную последовательность, выбранную из еще одной группы, состоящей из: SEQ ID No. 1, SEQ ID No. 2, SEQ ID No. 5, SEQ ID No. 6, SEQ ID No. 7, SEQ ID No. 29, SEQ ID No. 32, SEQ ID No. 33, SEQ ID No. 34, SEQ ID No. 98 и SEQ ID No. 99, или последовательность, которая по меньшей мере на 70% идентична им. Предпочтительно последовательность, которая по меньшей мере на 80% идентична им или по меньшей мере на 90% идентична им.
Соответственно, трипептидилпептидаза, способная воздействовать на связи с участием пролина, может иметь последовательность под SEQ ID No. 1, SEQ ID No. 2 или SEQ ID No. 29.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать один или несколько мотивов последовательности, выбранных из группы, состоящей из: xEANLD, yʹTzxʹG и QNFSV.
Соответственно, трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать xEANLD.
x может представлять собой одну или несколько аминокислот, выбранных из группы, состоящей из: G, T, S и V.
В другом варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать yʹTzxʹG.
yʹ может представлять собой одну или несколько аминокислот, выбранных из группы, состоящей из: I, L и V.
z может представлять собой одну или несколько аминокислот, выбранных из группы, состоящей из: S и T.
хʹ может представлять собой одну или несколько аминокислот, выбранных из группы, состоящей из: I и V.
В другом варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать мотив последовательности QNFSV.
В дополнительном варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать мотивы последовательности xEANLD и yʹTzxʹG или xEANLD и QNFSV.
В еще одном варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать мотивы последовательности yʹTzxʹG и QNFSV.
Соответственно, трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать мотивы последовательности xEANLD, yʹTzxʹG и QNFSV.
Один или несколько из данных мотивов присутствуют в трипептидилпептидазах, способных воздействовать на связи с участием пролина, для использования в настоящем изобретении. На фигуре 25 указано расположение этих мотивов.
В одном варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, может кодироваться нуклеотидной последовательностью, представленной под SEQ ID No. 56, SEQ ID No. 57, SEQ ID No. 58, SEQ ID No. 59, SEQ ID No. 60, SEQ ID No. 61, SEQ ID No. 62, SEQ ID No. 63, SEQ ID No. 64, SEQ ID No. 65, SEQ ID No. 66, SEQ ID No. 67, SEQ ID No. 68, SEQ ID No. 69, SEQ ID No. 70, SEQ ID No. 71, SEQ ID No. 72, SEQ ID No. 73, SEQ ID No. 74, SEQ ID No. 75, SEQ ID No. 76, SEQ ID No. 77, SEQ ID No. 78, SEQ ID No. 79, SEQ ID No. 80, SEQ ID No. 96, SEQ ID No. 97, или нуклеотидной последовательностью, которая по меньшей мере на 70% идентична им. Предпочтительно последовательностью, которая по меньшей мере на 80% идентична им или по меньшей мере на 90% идентична им.
Предпочтительно трипептидилпептидаза, способная воздействовать на связи с участием пролина, может кодироваться нуклеотидной последовательностью, которая по меньшей мере на 95% идентична последовательности под SEQ ID No. 56, SEQ ID No. 57, SEQ ID No. 58, SEQ ID No. 59, SEQ ID No. 60, SEQ ID No. 61, SEQ ID No. 62, SEQ ID No. 63, SEQ ID No. 64, SEQ ID No. 65, SEQ ID No. 66, SEQ ID No. 67, SEQ ID No. 68, SEQ ID No. 69, SEQ ID No. 70, SEQ ID No. 71, SEQ ID No. 72, SEQ ID No. 73, SEQ ID No. 74, SEQ ID No. 75, SEQ ID No. 76, SEQ ID No. 77, SEQ ID No. 78, SEQ ID No. 79 или SEQ ID No. 80, более предпочтительно по меньшей мере на 99% идентична последовательности под SEQ ID No. 56, SEQ ID No. 57, SEQ ID No. 58, SEQ ID No. 59, SEQ ID No. 60, SEQ ID No. 61, SEQ ID No. 62, SEQ ID No. 63, SEQ ID No. 64, SEQ ID No. 65, SEQ ID No. 66, SEQ ID No. 67, SEQ ID No. 68, SEQ ID No. 69, SEQ ID No. 70, SEQ ID No. 71, SEQ ID No. 72, SEQ ID No. 73, SEQ ID No. 74, SEQ ID No. 75, SEQ ID No. 76, SEQ ID No. 77, SEQ ID No. 78, SEQ ID No. 79, SEQ ID No. 80, SEQ ID No. 96 или SEQ ID No. 97.
В другом варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, может кодироваться нуклеотидной последовательностью, которая гибридизируется с последовательностью под SEQ ID No. 56, SEQ ID No. 57, SEQ ID No. 58, SEQ ID No. 59, SEQ ID No. 60, SEQ ID No. 61, SEQ ID No. 62, SEQ ID No. 63, SEQ ID No. 64, SEQ ID No. 65, SEQ ID No. 66, SEQ ID No. 67, SEQ ID No. 68, SEQ ID No. 69, SEQ ID No. 70, SEQ ID No. 71, SEQ ID No. 72, SEQ ID No. 73, SEQ ID No. 74, SEQ ID No. 75, SEQ ID No. 76, SEQ ID No. 77, SEQ ID No. 78, SEQ ID No. 79, SEQ ID No. 80, SEQ ID No. 96 или SEQ ID No. 97 в условиях средней жесткости. Предпочтительно нуклеотидной последовательностью, которая гибридизируется с последовательностью под SEQ ID No. 56, SEQ ID No. 57, SEQ ID No. 58, SEQ ID No. 59, SEQ ID No. 60, SEQ ID No. 61, SEQ ID No. 62, SEQ ID No. 63, SEQ ID No. 64, SEQ ID No. 65, SEQ ID No. 66, SEQ ID No. 67, SEQ ID No. 68, SEQ ID No. 69, SEQ ID No. 70, SEQ ID No. 71, SEQ ID No. 72, SEQ ID No. 73, SEQ ID No. 74, SEQ ID No. 75, SEQ ID No. 76, SEQ ID No. 77, SEQ ID No. 78, SEQ ID No. 79, SEQ ID No. 80, SEQ ID No. 96 или SEQ ID No. 97 в условиях высокой жесткости.
В дополнительном варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, может кодироваться нуклеотидной последовательностью, которая отличается от последовательности под SEQ ID No. 56, SEQ ID No. 57, SEQ ID No. 58, SEQ ID No. 59, SEQ ID No. 60, SEQ ID No. 61, SEQ ID No. 62, SEQ ID No. 63, SEQ ID No. 64, SEQ ID No. 65, SEQ ID No. 66, SEQ ID No. 67, SEQ ID No. 68, SEQ ID No. 69, SEQ ID No. 70, SEQ ID No. 71, SEQ ID No. 72, SEQ ID No. 73, SEQ ID No. 74, SEQ ID No. 75, SEQ ID No. 76, SEQ ID No. 77, SEQ ID No. 78, SEQ ID No. 79, SEQ ID No. 80, SEQ ID No. 96 или SEQ ID No. 97 из-за вырожденности генетического кода.
Настоящее изобретение также предлагает выделенную нуклеиновую кислоту, содержащую:
(a) нуклеотидную последовательность, представленную в данном документе под SEQ ID No. 56, SEQ ID No. 57, SEQ ID No. 58, SEQ ID No. 59, SEQ ID No. 60, SEQ ID No. 61, SEQ ID No. 62, SEQ ID No. 63, SEQ ID No. 64, SEQ ID No. 65, SEQ ID No. 66, SEQ ID No. 67, SEQ ID No. 68, SEQ ID No. 69, SEQ ID No. 70, SEQ ID No. 71, SEQ ID No. 72, SEQ ID No. 73, SEQ ID No. 74, SEQ ID No. 75, SEQ ID No. 76, SEQ ID No. 77, SEQ ID No. 78, SEQ ID No. 79, SEQ ID No. 80, SEQ ID No. 81, SEQ ID No. 82, SEQ ID No. 83, SEQ ID No. 84, SEQ ID No. 85, SEQ ID No. 86, SEQ ID No. 87, SEQ ID No. 88, SEQ ID No. 89, SEQ ID No. 90, SEQ ID No. 91, SEQ ID No. 92, SEQ ID No. 93, SEQ ID No. 94, SEQ ID No. 95, SEQ ID No. 96 или SEQ ID No. 97;
(b) нуклеотидную последовательность, которая по меньшей мере на приблизительно 70% идентична последовательности под SEQ ID No. 56, SEQ ID No. 57, SEQ ID No. 58, SEQ ID No. 59, SEQ ID No. 60, SEQ ID No. 61, SEQ ID No. 62, SEQ ID No. 63, SEQ ID No. 64, SEQ ID No. 65, SEQ ID No. 66, SEQ ID No. 67, SEQ ID No. 68, SEQ ID No. 69, SEQ ID No. 70, SEQ ID No. 71, SEQ ID No. 72, SEQ ID No. 73, SEQ ID No. 74, SEQ ID No. 75, SEQ ID No. 76, SEQ ID No. 77, SEQ ID No. 78, SEQ ID No. 79, SEQ ID No. 80, SEQ ID No. 81, SEQ ID No. 82, SEQ ID No. 83, SEQ ID No. 84, SEQ ID No. 85, SEQ ID No. 86, SEQ ID No. 87, SEQ ID No. 88, SEQ ID No. 89, SEQ ID No. 90, SEQ ID No. 91, SEQ ID No. 92, SEQ ID No. 93, SEQ ID No. 94, SEQ ID No. 95, SEQ ID No. 96 или SEQ ID No. 97; или
(c) последовательность, которая гибридизируется с последовательностью под SEQ ID No. 56, SEQ ID No. 57, SEQ ID No. 58, SEQ ID No. 59, SEQ ID No. 60, SEQ ID No. 61, SEQ ID No. 62, SEQ ID No. 63, SEQ ID No. 64, SEQ ID No. 65, SEQ ID No. 66, SEQ ID No. 67, SEQ ID No. 68, SEQ ID No. 69, SEQ ID No. 70, SEQ ID No. 71, SEQ ID No. 72, SEQ ID No. 73, SEQ ID No. 74, SEQ ID No. 75, SEQ ID No. 76, SEQ ID No. 77, SEQ ID No. 78, SEQ ID No. 79, SEQ ID No. 80, SEQ ID No. 81, SEQ ID No. 82, SEQ ID No. 83, SEQ ID No. 84, SEQ ID No. 85, SEQ ID No. 86, SEQ ID No. 87, SEQ ID No. 88, SEQ ID No. 89, SEQ ID No. 90, SEQ ID No. 91, SEQ ID No. 92, SEQ ID No. 93, SEQ ID No. 94, SEQ ID No. 95, SEQ ID No. 96 или SEQ ID No. 97 в условиях средней или высокой жесткости; или
(d) нуклеотидную последовательность, которая отличается от последовательности под SEQ ID No. 56, SEQ ID No. 57, SEQ ID No. 58, SEQ ID No. 59, SEQ ID No. 60, SEQ ID No. 61, SEQ ID No. 62, SEQ ID No. 63, SEQ ID No. 64, SEQ ID No. 65, SEQ ID No. 66, SEQ ID No. 67, SEQ ID No. 68, SEQ ID No. 69, SEQ ID No. 70, SEQ ID No. 71, SEQ ID No. 72, SEQ ID No. 73, SEQ ID No. 74, SEQ ID No. 75, SEQ ID No. 76, SEQ ID No. 77, SEQ ID No. 78, SEQ ID No. 79, SEQ ID No. 80, SEQ ID No. 81, SEQ ID No. 82, SEQ ID No. 83, SEQ ID No. 84, SEQ ID No. 85, SEQ ID No. 86, SEQ ID No. 87, SEQ ID No. 88, SEQ ID No. 89, SEQ ID No. 90, SEQ ID No. 91, SEQ ID No. 92, SEQ ID No. 93, SEQ ID No. 94, SEQ ID No. 95, SEQ ID No. 96 или SEQ ID No. 97 из-за вырожденности генетического кода.
Предпочтительно нуклеотидная последовательность может представлять собой нуклеотидную последовательность, которая по меньшей мере на приблизительно 80% идентична последовательности под SEQ ID No. 56, SEQ ID No. 57, SEQ ID No. 58, SEQ ID No. 59, SEQ ID No. 60, SEQ ID No. 61, SEQ ID No. 62, SEQ ID No. 63, SEQ ID No. 64, SEQ ID No. 65, SEQ ID No. 66, SEQ ID No. 67, SEQ ID No. 68, SEQ ID No. 69, SEQ ID No. 70, SEQ ID No. 71, SEQ ID No. 72, SEQ ID No. 73, SEQ ID No. 74, SEQ ID No. 75, SEQ ID No. 76, SEQ ID No. 77, SEQ ID No. 78, SEQ ID No. 79, SEQ ID No. 80, SEQ ID No. 81, SEQ ID No. 82, SEQ ID No. 83, SEQ ID No. 84, SEQ ID No. 85, SEQ ID No. 86, SEQ ID No. 87, SEQ ID No. 88, SEQ ID No. 89, SEQ ID No. 90, SEQ ID No. 91, SEQ ID No. 92, SEQ ID No. 93, SEQ ID No. 94, SEQ ID No. 95, SEQ ID No. 96 или SEQ ID No. 97, более предпочтительно по меньшей мере на приблизительно 90% идентична последовательности под SEQ ID No. 56, SEQ ID No. 57, SEQ ID No. 58, SEQ ID No. 59, SEQ ID No. 60, SEQ ID No. 61, SEQ ID No. 62, SEQ ID No. 63, SEQ ID No. 64, SEQ ID No. 65, SEQ ID No. 66, SEQ ID No. 67, SEQ ID No. 68, SEQ ID No. 69, SEQ ID No. 70, SEQ ID No. 71, SEQ ID No. 72, SEQ ID No. 73, SEQ ID No. 74, SEQ ID No. 75, SEQ ID No. 76, SEQ ID No. 77, SEQ ID No. 78, SEQ ID No. 79, SEQ ID No. 80, SEQ ID No. 81, SEQ ID No. 82, SEQ ID No. 83, SEQ ID No. 84, SEQ ID No. 85, SEQ ID No. 86, SEQ ID No. 87, SEQ ID No. 88, SEQ ID No. 89, SEQ ID No. 90, SEQ ID No. 91, SEQ ID No. 92, SEQ ID No. 93, SEQ ID No. 94, SEQ ID No. 95, SEQ ID No. 96 или SEQ ID No. 97.
Нуклеотидная последовательность может представлять собой нуклеотидную последовательность, которая по меньшей мере на приблизительно 95% идентична, более предпочтительно по меньшей мере на приблизительно 99% идентична последовательности под SEQ ID No. 56, SEQ ID No. 57, SEQ ID No. 58, SEQ ID No. 59, SEQ ID No. 60, SEQ ID No. 61, SEQ ID No. 62, SEQ ID No. 63, SEQ ID No. 64, SEQ ID No. 65, SEQ ID No. 66, SEQ ID No. 67, SEQ ID No. 68, SEQ ID No. 69, SEQ ID No. 70, SEQ ID No. 71, SEQ ID No. 72, SEQ ID No. 73, SEQ ID No. 74, SEQ ID No. 75, SEQ ID No. 76, SEQ ID No. 77, SEQ ID No. 78, SEQ ID No. 79, SEQ ID No. 80, SEQ ID No. 81, SEQ ID No. 82, SEQ ID No. 83, SEQ ID No. 84, SEQ ID No. 85, SEQ ID No. 86, SEQ ID No. 87, SEQ ID No. 88, SEQ ID No. 89, SEQ ID No. 90, SEQ ID No. 91, SEQ ID No. 92, SEQ ID No. 93, SEQ ID No. 94, SEQ ID No. 95, SEQ ID No. 96 или SEQ ID No. 97.
В одном варианте осуществления выделенная нуклеиновая кислота может содержать нуклеотидную последовательность, которая гибридизируется с последовательностью под SEQ ID No. 56, SEQ ID No. 57, SEQ ID No. 58, SEQ ID No. 59, SEQ ID No. 60, SEQ ID No. 61, SEQ ID No. 62, SEQ ID No. 63, SEQ ID No. 64, SEQ ID No. 65, SEQ ID No. 66, SEQ ID No. 67, SEQ ID No. 68, SEQ ID No. 69, SEQ ID No. 70, SEQ ID No. 71, SEQ ID No. 72, SEQ ID No. 73, SEQ ID No. 74, SEQ ID No. 75, SEQ ID No. 76, SEQ ID No. 77, SEQ ID No. 78, SEQ ID No. 79, SEQ ID No. 80, SEQ ID No. 81, SEQ ID No. 82, SEQ ID No. 83, SEQ ID No. 84, SEQ ID No. 85, SEQ ID No. 86, SEQ ID No. 87, SEQ ID No. 88, SEQ ID No. 89, SEQ ID No. 90, SEQ ID No. 91, SEQ ID No. 92, SEQ ID No. 93, SEQ ID No. 94, SEQ ID No. 95, SEQ ID No. 96 или SEQ ID No. 97 в условиях высокой жесткости.
В одном варианте осуществления выделенная нуклеотидная последовательность, содержащая нуклеотидную последовательность, представленную под SEQ ID No. 56, SEQ ID No. 57, SEQ ID No. 58, SEQ ID No. 59, SEQ ID No. 60, SEQ ID No. 61, SEQ ID No. 62, SEQ ID No. 63, SEQ ID No. 64, SEQ ID No. 65, SEQ ID No. 66, SEQ ID No. 67, SEQ ID No. 68, SEQ ID No. 69, SEQ ID No. 70, SEQ ID No. 71, SEQ ID No. 72, SEQ ID No. 73, SEQ ID No. 74, SEQ ID No. 75, SEQ ID No. 76, SEQ ID No. 77, SEQ ID No. 78, SEQ ID No. 79, SEQ ID No. 80, SEQ ID No. 81, SEQ ID No. 82, SEQ ID No. 83, SEQ ID No. 84, SEQ ID No. 85, SEQ ID No. 86, SEQ ID No. 87, SEQ ID No. 88, SEQ ID No. 89, SEQ ID No. 90, SEQ ID No. 91, SEQ ID No. 92, SEQ ID No. 93, SEQ ID No. 94, SEQ ID No. 95, SEQ ID No. 96 или SEQ ID No. 97, может представлять собой последовательность ДНК, кДНК, синтетической ДНК и/или РНК.
Предпочтительно последовательность представляет собой последовательность ДНК, более предпочтительно последовательность кДНК, кодирующую трипептидилпептидазу, способную воздействовать на связи с участием пролина, по настоящему изобретению.
Соответственно, настоящее изобретение также предлагает выделенную нуклеиновую кислоту, содержащую:
(a) нуклеотидную последовательность, представленную в данном документе под SEQ ID No. 56;
(b) нуклеотидную последовательность, которая по меньшей мере на приблизительно 70% идентична последовательности под SEQ ID No. 56; или
(c) последовательность, которая гибридизируется с последовательностью под SEQ ID No. 56 в условиях средней жесткости; или
(c) нуклеотидную последовательность, которая отличается от последовательности под SEQ ID No. 56 из-за вырожденности генетического кода.
Предпочтительно нуклеотидная последовательность может представлять собой нуклеотидную последовательность, которая по меньшей мере на приблизительно 80% идентична последовательности под SEQ ID No. 56, более предпочтительно по меньшей мере на приблизительно 90% идентична последовательности под SEQ ID No. 56.
Нуклеотидная последовательность может представлять собой нуклеотидную последовательность, которая по меньшей мере на приблизительно 95% идентична, более предпочтительно по меньшей мере на приблизительно 99% идентична последовательности под SEQ ID No. 56.
В одном варианте осуществления выделенная нуклеиновая кислота может содержать нуклеотидную последовательность, которая гибридизируется с последовательностью под SEQ ID No. 56 в условиях высокой жесткости.
Соответственно, выделенная нуклеиновая кислота может содержаться в векторе (например, в плазмиде).
Настоящее изобретение также предлагает клетку-хозяина, содержащую выделенную последовательность нуклеиновой кислоты или вектор в соответствии с настоящим изобретением.
Соответственно, клетка-хозяин может представлять собой клетку-хозяина Trichoderma, предпочтительно клетку-хозяина Trichoderma reesei.
В одном аспекте предпочтительно аминокислотная и/или нуклеотидная последовательность для использования в настоящем изобретении находится в выделенной форме. Термин ʺвыделенныйʺ обозначает, что последовательность по меньшей мере, по сути, не содержит по меньшей мере еще один компонент, с которым данная последовательность естественным образом связана в природе и встречается в природе. Аминокислотная и/или нуклеотидная последовательность для использования в настоящем изобретении может быть предложена в форме, которая, по сути, не содержит один или несколько контаминантов, с которыми вещество может быть каким-либо образом связанным. Таким образом, например, они могут, по сути, не содержать одну или несколько потенциально контаминирующих молекул полипептидов и/или нуклеиновых кислот.
В одном аспекте предпочтительно аминокислотная и/или нуклеотидная последовательность для использования в настоящем изобретении находится в очищенной форме. Термин ʺочищенныйʺ обозначает, что приведенный компонент присутствует в большом количестве. При необходимости компонент является преобладающим компонентом, присутствующим в композиции. Предпочтительно он присутствует в количестве, составляющим по меньшей мере приблизительно 90%, или по меньшей мере приблизительно 95%, или по меньшей мере приблизительно 98%, при этом указанное количество определяют на основе соотношения сухой вес/сухой вес по отношению к общей рассматриваемой композиции.
ФЕРМЕНТЫ
В одном варианте осуществления трипептидилпептидазу или экзо-трипептидилпептидазу семейства S53 для использования в соответствии с настоящим изобретением можно выбрать из любой из последовательностей, кодирующих фермент, выбранных ниже.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 1, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 1. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 2, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 2. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 3, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 3. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 4, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 4. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 5, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 5. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 6, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 6. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 7, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 7. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 8, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 8. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 9, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 9. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 10, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 10. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 11, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 11. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 12, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 12. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 13, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 13. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 14, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 14. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 15, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 15. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 16, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 16. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 17, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 17. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 18, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 18. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 19, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 19. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 20, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 20. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 21, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 21. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 22, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 22. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 23, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 23. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 24, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 24. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 25, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 25. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 26, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 26. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 27, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 27. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 28, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 28. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 29, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 29. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 30, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 30. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 31, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 31. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 32, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 32. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 33, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 33. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 34, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 34. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 35, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 35. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 36, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 36. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 37, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 37. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 38, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 38. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 39, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 39. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 40, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 40. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 41, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 41. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 42, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 42. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 43, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 43. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 44, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 44. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 45, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 45. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 46, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 46. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 47, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 47. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 48, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 48. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 49, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 49. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 50, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 50. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 51, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 51. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 52, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 52. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 53, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 53. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 54, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 54. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 55, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 55. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 98, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 98. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, содержащую SEQ ID No. 99, ее функциональный фрагмент или последовательность, которая по меньшей мере на 70% идентична последовательности под SEQ ID No. 99. Соответственно, последовательность фермента может быть по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 56, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 57, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 58, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 59, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 60, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 61, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 62, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 63, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 64, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 65, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 66, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 67, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 68, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 69, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 70, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 71, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 72, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 73, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 74, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 75, или последовательностью, которая по меньшей мере на 70% идентична ей.
Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 76, или последовательностью, которая по меньшей мере на 70% идентична ей.
Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 77, или последовательностью, которая по меньшей мере на 70% идентична ей.
Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 78, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 79, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 80, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 81, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 82, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 83, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 84, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 85, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 86, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 87, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 88, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 89, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 90, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 91, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 92, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 93, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 94, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 95, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 96, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
В одном варианте осуществления фермент для использования в настоящем изобретении может представлять собой трипептидилпептидазу, кодируемую нуклеотидной последовательностью, содержащей последовательность, представленную под SEQ ID No. 97, или последовательностью, которая по меньшей мере на 70% идентична ей. Соответственно, последовательностью, которая по меньшей мере на 80% или 85% идентична ей. Предпочтительно по меньшей мере на 90% или 95% идентична ей. Более предпочтительно по меньшей мере на 97% или 99% идентична ей.
НУКЛЕОТИДНАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ
Объем настоящего изобретения также охватывает нуклеотидные последовательности, кодирующие белки с конкретными свойствами, которые определены в данном документе.
Термин ʺнуклеотидная последовательностьʺ, используемый в данном документе, относится к олигонуклеотидной последовательности или полинуклеотидной последовательности, и их варианту, гомологам, фрагментам и производным (таким, как их части). Нуклеотидная последовательность может быть геномного, или синтетического, или рекомбинантного происхождения, которая может быть двунитевой или однонитевой в зависимости от того, представляет она смысловую или антисмысловую нить.
Термин "нуклеотидная последовательность" применительно к настоящему изобретению включает геномную ДНК, кДНК, синтетическую ДНК и РНК. Предпочтительно данный термин обозначает ДНК, более предпочтительно кодирующую последовательность кДНК для целей настоящего изобретения.
В предпочтительном варианте осуществления нуклеотидная последовательность, применительно к объему настоящего изобретения и охваченная per se объемом настоящего изобретения, не содержит нативной нуклеотидной последовательности в соответствии с настоящим изобретением в ее естественной окружающей среде, и в случае, если она соединена со своей(своими) естественным образом связанной(связанными) последовательностью(последовательностями), которая(которые) также находится(находятся) в своей естественной окружающей среде. Для простоты ссылки мы будем называть этот предпочтительный вариант осуществления "нуклеотидной последовательностью, не являющейся нативной". В этом отношении выражение "нативная нуклеотидная последовательность" означает полную нуклеотидную последовательность, которая находится в своей естественной окружающей среде, и когда она функционально присоединена ко всему промотору, с которым она естественно связана, причем промотор также находится в своей естественной окружающей среде. Однако аминокислотная последовательность, охватываемая объемом настоящего изобретения, может быть выделена и/или очищена после экспрессии нуклеотидной последовательности в ее нативном организме. Предпочтительно, однако, чтобы аминокислотная последовательность, охваченная объемом настоящего изобретения, могла быть экспрессирована нуклеотидной последовательностью в ее нативном организме, но в котором нуклеотидная последовательность не контролируется промотором, с которым она естественно связана внутри этого организма.
Как правило, нуклеотидную последовательность, охваченную объемом настоящего изобретения, получают с помощью методик рекомбинатной ДНК (т. е. рекомбинатной ДНК). Однако в альтернативном варианте осуществления настоящего изобретения нуклеотидная последовательность может быть синтезирована полностью или частично при помощи химических способов, хорошо известных в данной области (см. Caruthers MH et al., (1980) Nuc Acids Res Symp Ser 215-23 и Horn T et al., (1980) Nuc Acids ResSymp Ser 225-232).
ПОЛУЧЕНИЕ НУКЛЕОТИДНОЙ ПОСЛЕДОВАТЕЛЬНОСТИ
Нуклеотидную последовательность, кодирующую или белок, который имеет конкретные свойства, определенные в данном документе, или белок, который подходит для модификации, можно идентифицировать, и/или выделить, и/или очистить из любой клетки или организма, продуцирующих указанный белок. В данной области хорошо известны различные способы идентификации, и/или выделения, и/или очистки нуклеотидных последовательностей. В качестве примера, можно использовать методики амплификации с помощью ПЦР для получения большего количества последовательностей сразу после того, как идентифицировали, и/или выделили, и/или очистили подходящую последовательность.
В качестве дополнительного примера, можно сконструировать библиотеку геномной ДНК и/или кДНК с помощью хромосомной ДНК или матричной РНК из организма, продуцирующего фермент. Если аминокислотная последовательность фермента известна, тогда можно синтезировать меченые олигонуклеотидные зонды и использовать для идентификации клонов, кодирующих ферменты, из геномной библиотеки, полученной из организма. В качестве альтернативы меченый олигонуклеотидный зонд, содержащий последовательности, гомологичные другому известному гену фермента, можно использовать для идентификации клонов, кодирующих ферменты. В последнем случае используют условия гибридизации и промывки пониженной жесткости.
В качестве альтернативы клоны, кодирующие ферменты, можно идентифицировать с помощью вставки фрагментов геномной ДНК в вектор экспрессии, такой как плазмида, трансформирования бактерий, отрицательных по ферменту, с использованием полученной библиотекой геномной ДНК, а затем помещения трансформированных бактерий на чашки с агаром, содержащие субстрат для фермента (т. е. Мальтозу), предоставляя таким образом клонам возможность экспрессировать фермент, который подлежит идентификации.
В еще одном альтернативном варианте нуклеотидную последовательность, кодирующую фермент, можно получить синтетически с помощью общепризнанных стандартных способов, например, фосфорамидитного способа, описанного Beucage S.L. et al., (1981) Tetrahedron Letters 22, p 1859-1869, или способа, описанного Matthes et al., (1984) EMBO J. 3, p 801-805. В фосфорамидитном способе олигонуклеотиды синтезируют, например, в автоматическом ДНК-синтезаторе, очищают, отжигают, лигируют и клонируют в соответствующих векторах.
Нуклеотидная последовательность может быть смешанного геномного и синтетического происхождения, смешанного синтетического и кДНК происхождения или смешанного геномного и кДНК происхождения, полученная с помощью лигирования фрагментов синтетического, геномного или кДНК происхождения (при необходимости) в соответствии со стандартными способами. Каждый лигированный фрагмент соответствует различным частям полной нуклеотидной последовательности. Последовательность ДНК может также быть получена посредством полимеразной цепной реакции (ПЦР) с использованием специфических праймеров, например, как описано в патенте US 4683202 или в Saiki R K et al., (Science (1988) 239, pp 487-491).
АМИНОКИСЛОТНЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ
Объем настоящего изобретения также охватывает аминокислотные последовательности ферментов c конкретными свойствами, которые определены в данном документе.
Используемый в данном документе термин ʺаминокислотная последовательностьʺ является синонимом термина ʺполипептидʺ и/или термина ʺбелокʺ. В некоторых случаях термин ʺаминокислотная последовательностьʺ является синонимом термина ʺпептидʺ. В некоторых случаях термин ʺаминокислотная последовательностьʺ является синонимом термина ʺферментʺ.
Аминокислотная последовательность может быть получены/выделена из подходящего источника, или может быть создана синтетическим путем, или может быть получена с использованием методик рекомбинантной ДНК.
Белок, охватываемый настоящим изобретением, можно применять совместно с другими белками, в частности, ферментами. Таким образом, настоящее изобретение также распространяется на комбинацию белков, при этом комбинация содержит белок/фермент по настоящему изобретению и другой белок/фермент, который может быть другим белком/ферментом в соответствии с настоящим изобретением. Этот аспект обсуждается в разделе ниже.
Предпочтительно аминокислотная последовательность, относящаяся к объему настоящего изобретения и охватываемая per se объемом настоящего изобретения, является ненативным ферментом. В этом отношении выражение "нативный фермент" обозначает целый фермент, который находится в своей естественной среде и в случае если он экспрессировался своей нативной нуклеотидной последовательностью.
ВЫДЕЛЕННЫЙ
В одном аспекте предпочтительно аминокислотная последовательность, или нуклеиновая кислота, или фермент в соответствии с настоящим изобретением находится в выделенной форме. Термин ʺвыделенныйʺ означает, что последовательность, или фермент, или нуклеиновая кислота по меньшей мере, по сути, не содержит по меньшей мере еще один компонент, с которым последовательность, фермент или нуклеиновая кислота естественным образом связана в природе и встречается в природе. Последовательность, фермент или нуклеиновая кислота по настоящему изобретению может быть представлена в форме, которая, по сути, не содержит один или несколько контаминантов, с которыми вещество может каким-либо образом связано. Таким образом, например, они могут, по сути, не содержать одну или несколько потенциально контаминирующих молекул полипептидов и/или нуклеиновых кислот.
ОЧИЩЕННЫЕ
В одном аспекте предпочтительно последовательность, фермент или нуклеиновая кислота в соответствии с настоящим изобретением находится в очищенной форме. Термин ʺочищенныйʺ означает, что указанный компонент присутствует в большом количестве. При необходимости компонент является преобладающим компонентом, присутствующим в композиции. Предпочтительно он присутствует в количестве по меньшей мере приблизительно 80%, при этом указанное количество определяют на основе соотношения сухой вес/сухой вес по отношению к общей рассматриваемой композиции. Соответственно, он может присутствовать в количестве по меньшей мере приблизительно 90%, или по меньшей мере приблизительно 95%, или по меньшей мере приблизительно 98%, при этом указанное количество определяют на основе соотношения сухой вес/сухой вес по отношению к общей рассматриваемой композиции.
ИДЕНТИЧНОСТЬ ПОСЛЕДОВАТЕЛЬНОСТИ ИЛИ ГОМОЛОГИЯ ПОСЛЕДОВАТЕЛЬНОСТИ
Настоящее изобретение также охватывает использование последовательностей, имеющих степень идентичности последовательности или степень гомологии последовательности с аминокислотной(аминокислотными) последовательностью(полследовательностями) полипептида с конкретными свойствами, определенными в данном документе, или с любой нуклеотидной последовательностью, кодирующей такой полипептид (далее в данном документе обозначаемой(обозначаемых) как ʺгомологичная(гомологичные) последовательность(последовательности)ʺ). В данном документе термин ʺгомологʺ означает объект, имеющий определенную гомологию с рассматриваемыми аминокислотными последовательностями и рассматриваемыми нуклеотидными последовательностями. В данном документе термин ʺгомологияʺ может быть приравнен к ʺидентичностиʺ.
Гомологичная аминокислотная последовательность и/или нуклеотидная последовательность должны обеспечивать и/или кодировать полипептид, который сохраняет функциональную активность и/или усиливает активность фермента.
В контексте настоящего изобретения гомологичной последовательностью считается последовательность, которая включает аминокислотную или нуклеотидную последовательность, которая может быть по меньшей мере на 75, 85 или 90% идентичной, предпочтительно по меньшей мере на 95 или 98% идентичной рассматриваемой последовательности. Как правило, например, гомологи будут содержать те же самые активные сайты и т. д., что и рассматриваемая аминокислотная последовательность. Хотя гомологию также можно рассматривать исходя из сходства (т. е. аминокислотных остатков, имеющих сходные химические свойства/функции), в контексте настоящего изобретения предпочтительно выражать гомологию исходя из идентичности последовательности.
В одном варианте осуществления гомологичной последовательностью считается последовательность, которая включает аминокислотную или нуклеотидную последовательность, имеющую одно или несколько добавлений, делеций и/или замен по сравнению с рассматриваемой последовательностью.
В одном варианте осуществления настоящее изобретение касается белка, аминокислотная последовательность которого представлена в данном документе, или белка, полученного из этого (родительского) белка путем замены, делеции или добавления одной или нескольких аминокислот, как, например, 2, 3, 4, 5, 6, 7, 8, 9 аминокислот, или большего количества аминокислот, как, например, 10 или более 10 аминокислот в аминокислотной последовательности родительского белка, и обладающего активностью родительского белка.
Соответственно, степень идентичности в отношении аминокислотной последовательности определяют по меньшей мере по 20 смежным аминокислотам, предпочтительно по меньшей мере по 30 смежным аминокислотам, предпочтительно по меньшей мере по 40 смежным аминокислотам, предпочтительно по меньшей мере по 50 смежным аминокислотам, предпочтительно по меньшей мере по 60 смежным аминокислотам, предпочтительно по меньшей мере по 100 смежным аминокислотам, предпочтительно по меньшей мере по 200 смежным аминокислотам.
В одном варианте осуществления настоящее изобретение касается последовательности нуклеиновых кислот (или гена), кодирующей белок, аминокислотная последовательность которого представлена в данном документе, или кодирующей белок, полученный из этого (родительского) белка путем замены, делеции или добавления одной или нескольких аминокислот, как, например, 2, 3, 4, 5, 6, 7, 8, 9 аминокислот, или большего количества аминокислот, как, например, 10 или более 10 аминокислот в аминокислотной последовательности родительского белка, и обладающий активностью родительского белка.
В контексте настоящего изобретения гомологичной последовательностью считается последовательность, которая включает нуклеотидную последовательность, которая может быть по меньшей мере на 75, 85 или 90% идентичной, предпочтительно по меньшей мере на 95 или 98% идентичной нуклеотидной последовательности, кодирующей пептид по настоящему изобретению (последовательность субъекта). Как правило, гомологи будут содержать те же самые последовательности, которые кодируют активные сайты и т. д., что и рассматриваемая последовательность. Хотя гомологию также можно рассматривать исходя из сходства (т. е. аминокислотных остатков, имеющих сходные химические свойства/функции), в контексте настоящего изобретения предпочтительно выражать гомологию исходя из идентичности последовательности.
Сравнения гомологии можно проводить на глаз или, что более принято, при помощи общедоступных программ сравнения последовательностей. Эти коммерчески доступные компьютерные программы могут вычислять % гомологии между двумя или более последовательностями.
% гомологии можно рассчитать для непрерывных последовательностей, т. е. одну последовательность выравнивают с другой последовательностью и каждую аминокислоту в одной последовательности непосредственно сравнивают с соответствующей аминокислотой в другой последовательности, один остаток за один заход. Это называется выравнивание "без введения гэпов". Как правило, такое выравнивание без введения гэпов проводят только с относительно небольшим количеством остатков.
Хотя этот способ является очень простым и унифицированным способом, он не может учесть, например, что идентичная в иных случаях пара последовательностей, с одной вставкой или делецией, приведет к тому, что следующие аминокислотные остатки выйдут за пределы выравнивания, таким образом, потенциально приводя к большому снижению % гомологии при выполнении масштабного выравнивания. Поэтому большинство способов сравнения последовательностей разработаны для проведения оптимальных выравниваний, которые учитывают возможные вставки и делеции без чрезмерного штрафования общего балла гомологии. Это достигается путем введения ʺгэповʺ при выравнивании последовательностей в попытке максимально увеличить локальную гомологию.
Однако эти более сложные способы устанавливают ʺштрафы за введения гэпаʺ на каждый гэп, который имеет место в выравнивании, так что на такое же количество идентичных аминокислот выравнивание последовательности с наименьшим количеством гэпов, по возможности - отражая большое родство между двумя сравниваемыми последовательностями - достигнет более высокого балла, чем со многими гэпами. Как правило, используют ʺцену делеции в последующих итерацияхʺ, что требует относительно высокой цены за введение гэпа и меньшего штрафа за каждый последующий остаток в гэпе. Это является наиболее часто используемой системой подсчета гэпов. Высокие штрафы за введение гэпа, соответственно, дают оптимизированные выравнивания с меньшим количеством гэпов. Большинство программ для выравнивания позволяют модифицировать штрафы за введение гэпов. Однако предпочтительно использовать значения по умолчанию при использовании такого программного обеспечения для сравнения последовательностей.
Расчет максимального % гомологии или % идентичности, таким образом, сперва требует получения оптимального выравнивания, принимая во внимание штрафы за введение гэпов. Подходящей компьютерной программой для проведения такого выравнивания является Vector NTI (Invitrogen Corp.). Примеры программного обеспечения, которое может выполнять сравнения последовательностей, включают без ограничения например пакет BLAST (см. Ausubel et al 1999 Short Protocols in Molecular Biology, 4th Ed - Chapter 18), BLAST 2 (см. FEMS Microbiol Lett 1999 174(2): 247-50; FEMS Microbiol Lett 1999 177(1): 187-8 и tatiana@ncbi.nlm.nih.gov), FASTA (Altschul et al 1990 J. Mol. Biol. 403-410) и AlignX. По меньшей мере BLAST, BLAST 2 и FASTA доступны для автономного и поиска в Интернете (см. Ausubel et al 1999, cтраницы от 7-58 до 7-60), такого как, например, в поисковом инструменте GenomeQuest (www.genomequest.com).
Хотя окончательный % гомологии может быть измерен исходя из идентичности, сам способ выравнивания, как правило, не основан на принципе парного сравнения "все или ничего". Вместо этого обычно применяют масштабированную матрицу подсчета сходства, которая присваивает баллы каждому парному сравнению на основе химического сходства или эволюционного расстояния. Примером такой широко используемой матрицы является матрица BLOSUM62 - матрица по умолчанию для пакета программ BLAST. Программы Vector NTI обычно используют либо общедоступные значения по умолчанию, либо таблицу сравнения пользовательских символов, если они предоставлены (см. руководство пользователя для дополнительной информации). Для некоторых приложений предпочтительно использовать значения по умолчанию для пакета Vector NTI.
В качестве альтернативы процент гомологии можно рассчитать с помощью средства множественного выравнивания в Vector NTI (Invitrogen Corp.) на основе алгоритма, аналогичного CLUSTAL (Higgins DG & Sharp PM (1988), Gene 73(1), 237-244).
Как только программа производит оптимальное выравнивание, можно подсчитать % гомологии, предпочтительно % идентичности последовательности. Программное обеспечение, как правило, делает это в качестве части сравнения последовательностей и выдает числовой результат.
Если при определении идентичности последовательности необходимо использовать штрафы за введение гэпов, то предпочтительно использовать следующие параметры для парного выравнивания:
В одном варианте осуществления CLUSTAL можно использовать с установленными штрафом за введение гэпа и за продление гэпа, как определено ранее.
Соответственно, степень идентичности в отношении нуклеотидной последовательности определяют по меньшей мере по 20 смежным нуклеотидам, предпочтительно по меньшей мере по 30 смежным нуклеотидам, предпочтительно по меньшей мере по 40 смежным нуклеотидам, предпочтительно по меньшей мере по 50 смежным нуклеотидам, предпочтительно по меньшей мере по 60 смежным нуклеотидам, предпочтительно по меньшей мере по 100 смежным нуклеотидам.
Соответственно, степень идентичности в отношении нуклеотидной последовательности определяют по меньшей мере по 100 смежным нуклеотидам, предпочтительно по меньшей мере по 200 смежным нуклеотидам, предпочтительно по меньшей мере по 300 смежным нуклеотидам, предпочтительно по меньшей мере по 400 смежным нуклеотидам, предпочтительно по меньшей мере по 500 смежным нуклеотидам, предпочтительно по меньшей мере по 600 смежным нуклеотидам, предпочтительно по меньшей мере по 700 смежным нуклеотидам, предпочтительно по меньшей мере по 800 смежным нуклеотидам.
Соответственно, степень идентичности в отношении нуклеотидной последовательности может быть определена по полной последовательности.
Соответственно, степень идентичности в отношении белковой (аминокислотной) последовательности определяют по меньшей мере по 100 смежным аминокислотам, предпочтительно по меньшей мере по 200 смежным аминокислотам, предпочтительно по меньшей мере по 300 смежным аминокислотам.
Соответственно, степень идентичности в отношении аминокислотной или белковой последовательности может быть определена по полной последовательности, изложенной в данном документе.
В контексте настоящего изобретения термин ʺзапрашиваемая последовательностьʺ означает гомологичную последовательность или чужеродную последовательность, которую выравнивают с рассматриваемой последовательностью, чтобы увидеть, входит ли она в объем настоящего изобретения. Соответственно, такая запрашиваемая последовательность может быть, например, последовательностью предшествующего уровня техники или последовательностью третьей стороны.
В одном предпочтительном варианте осуществления последовательности выравнивают с помощью программы глобального выравнивания и идентичность последовательности рассчитывают путем идентификации числа точных совпадений, выявленных программой, деленного на длину рассматриваемой последовательности.
В одном варианте осуществления степень идентичности последовательностей между запрашиваемой последовательностью и рассматриваемой последовательностью определяют с помощью 1) выравнивания двух последовательностей с помощью любой подходящей программы для выравнивания с использованием оценочной матрицы, используемой по умолчанию, и штрафа за введение гэпа, используемого по умолчанию, 2) идентификации количества точных совпадений, где точное совпадение является таким, при котором программа для выравнивания идентифицировала идентичные аминокислоту или нуклеотид в двух выровненных последовательностях в указанном положении при выравнивании, и 3) деления количества точных совпадений на длину рассматриваемой последовательности.
В еще одном дополнительном предпочтительном варианте осуществления программу для глобального выравнивания выбирают из группы, состоящей из CLUSTAL и BLAST (предпочтительно BLAST), и идентичность последовательности рассчитывают путем идентификации числа точных совпадений, выявленных программой, деленного на длину рассматриваемой последовательности.
Последовательности могут также иметь делеции, вставки или замены аминокислотных остатков, которые производят молчащую замену и приводят к функционально эквивалентному веществу. Запланированные аминокислотные замены могут быть сделаны на основе сходства полярности, заряда, растворимости, гидрофобности, гидрофильности и/или амфипатической природы остатков, при условии, что вторичная связывающая активность вещества сохраняется. Например, отрицательно заряженные аминокислоты включают аспарагиновую кислоту и глутаминовую кислоту; положительно заряженные аминокислоты включают лизин и аргинин; и аминокислоты с незаряженными группами полярной головки, имеющие сходные значения гидрофильности, включают лейцин, изолейцин, валин, глицин, аланин, аспарагин, глутамин, серин, треонин, фенилаланин и тирозин.
Консервативные замены могут быть проведены, например, согласно нижеприведенной таблице. Аминокислоты в одном и том же блоке второй колонки и предпочтительно в том же ряду в третьей колонке могут быть заменены одна на другую.
Настоящее изобретение также охватывает гомологичную замену (в данном документе оба термина замена и замещение используют для обозначения обмена существующего аминокислотного остатка на альтернативный остаток), которая может иметь место, т. е. замену подобного на подобное, такую как основную на основную, кислотную на кислотную, полярную на полярную и т. д. Негомологичная замена также может иметь место, т. е. с остатка одного класса на другой или в качестве альтернативы включающая введение аминокислот не природного происхождения, таких как орнитин (далее в данном документе обозначается как Z), диаминомасляная кислота-орнитин (далее в данном документе обозначается как B), норлейцин-орнитин (далее в данном документе обозначаемый как O), пириилаланин, тиенилаланин, нафталиналанин и фенилглицин.
Замены, которые также могут быть проведены посредством синтетических аминокислот (например, не природного происхождения), включают: альфа* и альфа-дизамещенные* аминокислоты, N-алкиламинокислоты*, молочную кислоту*, галоген-производные природных аминокислот, такие как трифтортирозин*, p-Cl-фенилаланин*, p-Br-фенилаланин*, p-I-фенилаланин*, L-аллил-глицин*, ß-аланин*, L-α-аминомасляная кислота*, L-γ-аминомасляная кислота*, L-α-аминоизомасляная кислота*, L-ε-аминокапроновая кислота#, 7-аминогептановая кислота*, L-метионинсульфон#*, L-норлейцин*, L-норвалин*, p-нитро-L-фенилаланин*, L-гидроксипролин#, L-тиопролин*, метиловые производные фенилаланина (Phe), такие как 4-метил-Phe*, пентаметил-Phe*, L-Phe (4-амино)#, L-Tyr (метил)*, L-Phe (4-изопропил)*, L-Tic (1,2,3,4-тетрагидроизохинолин-3-карбоновая кислота)*, L-диаминопропионовая кислота# и L-Phe (4-бензил)*. Примечание * использовали с целью обсуждения приведенного ранее (относительно гомологичной и негомологичной замены) для указания гидрофобной природы производного, при этом # использовали для указания гидрофильной природы производного, #* указывает алифатические характеристики.
Вариантные аминокислотные последовательности могут включать подходящие спейсерные группы, которые могут быть вставлены между любыми двумя аминокислотными остатками последовательности, включая алкильные группы, такие как метильные, этильные или пропильные группы, в дополнение к аминокислотным спейсерам, таким как остатки глицина или β-аланина. Дополнительная форма варианта включает наличие одного или нескольких аминокислотных остатков в пептоидной форме и будет хорошо понятна специалисту в данной области. Чтобы избежать сомнений, ʺпептоидную формуʺ используют для обозначения вариантных аминокислотных остатков, где α-углеродная группа заместителя уходит на атом азота остатка, а не на α-углерод. Способы получения пептидов в пептоидной форме известны в данной области, например, в Simon RJ et al., PNAS (1992) 89(20), 9367-9371 и Horwell DC, Trends Biotechnol. (1995) 13(4), 132-134.
Нуклеотидные последовательности для использования в настоящем изобретении могут включать в себя синтетические или модифицированные нуклеотиды. Ряд различных типов модификации олигонуклеотидов известен в данной области. Они включает метилфосфонатные и фосфоротиоатные остовы и/или добавление акридиновых или полилизиновых цепей к 3'- и/или 5'-концам молекулы. Для целей настоящего изобретения следует понимать, что нуклеотидные последовательности, описанные в данном документе, могут быть модифицированы любым способом, доступным в данной области. Такие модификации можно проводить для усиления активности in vivo или времени существования нуклеотидных последовательностей по настоящему изобретению.
Настоящее изобретение также охватывает применение нуклеотидных последовательностей, которые комплементарны последовательностям, предсталвенным в данном документе, или любому производному, фрагменту или его производному. Если последовательность комплементарна ее фрагменту, то тогда такая последовательность может быть использована в качестве зонда для идентификации сходных кодирующих последовательностей в других организмах и т. д.
Полинуклеотиды, которые не являются на 100% гомологичными последовательностям по настоящему изобретению, но входят в объем данного изобретения, могут быть получены посредством ряда способов. Другие варианты последовательностей, описанные в данном документе, могут быть получены, например, путем зондирования библиотек ДНК, полученных от ряда особей, например, особей из разных популяций. Также можно получить другие гомологи и такие гомологи и их фрагменты в целом будут способны избирательно гибридизироваться с последовательностями, представленными в последовательностях, приведенных в данном документе. Такие последовательности могут быть получены путем зондирования библиотек кДНК, полученных из библиотек геномной ДНК от других видов животных, и путем зондирования таких библиотек зондами, содержащими всю или часть любой из последовательностей в прилагаемых перечнях последовательностей в условиях от средней до высокой жесткости. Сходные факторы применимы к получению видовых гомологов и аллельных вариантов полипептидов или нуклеотидных последовательностей по настоящему изобретению.
Варианты и штаммы/виды гомологов могут также быть получены с использованием ПЦР с вырожденными праймерами, в которой будут использовать праймеры, сконструированные для целевых последовательностей, в пределах вариантов и гомологов, кодирующих консервативные аминокислотные последовательности в пределах последовательностей по настоящему изобретению. Консервативные последовательности могут быть предсказаны, например, путем выравнивания аминокислотных последовательностей из нескольких вариантов/гомологов. Выравнивания последовательностей могут быть выполнены с использованием компьютерного программного обеспечения, известного в данной области. Например, широко используют программу GCG Wisconsin PileUp.
Праймеры, используемые в ПЦР с вырожденными праймерами, будут содержать одно или несколько вырожденных положений, и будут использоваться в условиях более низкой жесткости, чем используемые для клонирования последовательностей с одиночными праймерами последовательностей против известных последовательностей.
В качестве альтернативы такие полинуклеотиды могут быть получены сайт-направленным мутагенезом охарактеризованных последовательностей. Это может быть полезным тогда, когда, например, требуются изменения в последовательности молчащего кодона для оптимизации предпочтений по кодонам для определенной клетки-хозяина, в которой экспрессируется полинуклеотидная последовательность. Могут быть необходимы другие изменения для того, чтобы ввести сайты узнавания для рестрикционных ферментов или изменить свойство или функцию полипептидов, кодируемых полинуклеотидами.
Полинуклеотиды (нуклеотидные последовательности) по настоящему изобретению могут быть использованы для получения праймера, например, ПЦР-праймера, праймера для реакции альтернативной амплификации, зонда, например, меченного обнаруживаемой при помощи обычных средств меткой, используя радиоактивные и нерадиоактивные метки, или полинуклеотиды могут быть клонированы в векторы. Такие праймеры, зонды и другие фрагменты будут иметь по меньшей мере 15, предпочтительно по меньшей мере 20, например, по меньшей мере 25, 30 или 40 нуклеотидов в длину, и они также охватываются термином полинуклеотиды по настоящему изобретению, используемым в данном документе.
Полинуклеотиды, такие, как ДНК-полинуклеотиды и зонды согласно настоящему изобретению, могут быть получены рекомбинантным, синтетическим или любым способом, доступным специалисту в данной области. Они также могут быть клонированы с помощью стандартных способов.
В целом, праймеры будут получать синтетическим способом, включая постадийное получение требуемой последовательности нуклеиновых кислот, один нуклеотид за один заход. Методики выполнения этого с применением автоматизированных методик являют общедоступными в данной области.
Более длинные полинуклеотиды обычно будут получать с использованием рекомбинантных способов, например, используя ПЦР (полимеразную цепную реакцию) клонирующие методики. Праймеры могут быть сконструированы для содержания подходящих сайтов распознавания для рестрикционных ферментов так, что амплифицированная ДНК может быть клонирована в подходящем клонирующем векторе.
ГИБРИДИЗАЦИЯ
Настоящее изобретение также охватывает последовательности, которые комплементарны последовательностям нуклеиновых кислот по настоящему изобретению, или последовательностям, которые способны гибридизироваться либо с последовательностями по настоящему изобретению, либо с последовательностями, которые комплементарны им.
Термин "гибридизация", используемый в данном документе, включает "процесс, при котором нить нуклеиновой кислоты присоединяется к комплементарной нити путем спаривания оснований", а также процесс амплификации, которая осуществляется в методиках полимеразной цепной реакции (ПЦР).
Настоящее изобретение также охватывает использование нуклеотидных последовательностей, которые способны гибридизироваться с последовательностями, которые комплементарны последовательностям, представленным в данном документе, или любому производному, фрагменту или его производному.
Термин ʺвариантʺ также охватывает последовательности, которые комплементарны последовательностям, которые способны гибридизироваться с нуклеотидными последовательностями, представленными в данном документе.
Предпочтительно термин ʺвариантʺ охватывает последовательности, которые комплементарны последовательностям, которые способны гибридизироваться в условиях средней жесткости (например, 50°C и 0,2xSSC {1xSSC=0,15 M NaCl, 0,015 M Na3цитрат pH 7,0}) с нуклеотидными последовательностями, представленными в данном документе.
Более предпочтительно термин ʺвариантʺ охватывает последовательности, которые комплементарны последовательностям, которые способны гибридизироваться в условиях высокой жесткости (например, 65°C и 0,1xSSC {1xSSC=0,15 M NaCl, 0,015 M Na3цитрат pH 7,0}) с нуклеотидными последовательностями, представленными в данном документе.
Настоящее изобретение также относится к нуклеотидным последовательностям, которые могут гибридизироваться с нуклеотидными последовательностями по настоящему изобретению (включая комплементарные последовательности последовательностей, представленных в данном документе).
Настоящее изобретение также относится к нуклеотидным последовательностям, которые комплементарны последовательностям, которые могут гибридизироваться с нуклеотидными последовательностями по настоящему изобретению (включая комплементарные последовательности последовательностей, представленных в данном документе).
Также входящими в объем настоящего изобретения являются полинуклеотидные последовательности, которые способны гибридизироваться с нуклеотидными последовательностями, представленными в данном документе, при условиях от средней до максимальной жесткости.
В предпочтительном аспекте настоящее изобретение охватывает нуклеотидные последовательности, которые могут гибридизироваться с нуклеотидной последовательностью по настоящему изобретению или комплементарной ей последовательностью в условиях средней жесткости (например, 50°C и 0,2xSSC {1xSSC=0,15 M NaCl, 0,015 M Na3цитрат pH 7,0}).
В более предпочтительном аспекте настоящее изобретение охватывает нуклеотидные последовательности, которые могут гибридизироваться с нуклеотидной последовательностью по настоящему изобретению или комплементарной ей последовательностью в условиях высокой жесткости (например, 65°C и 0,1xSSC {1xSSC=0,15 M NaCl, 0,015 M Na3цитрат pH 7,0}).
Предпочтительно гибридизацию анализируют во всех изложенных в данном документе последовательностях.
МОЛЕКУЛЯРНАЯ ЭВОЛЮЦИЯ
В качестве неограничивающего примера возможно проводить различные сайт-направленные или случайные мутации в нуклеотидной последовательности, либо in vivo, либо in vitro, и в последующем провести скрининг в отношении улучшенной функциональности кодируемого полипептида при помощи различных способов.
Также мутации или природные варианты полинуклеотидной последовательности можно рекомбинировать либо с диким типом, либо другими мутациями, либо природными вариантами для получения новых вариантов. Такие новые варианты также могут быть подвергнуты скринингу в отношении улучшенной функциональности кодируемого полипептида. Получения новых предпочтительных вариантов можно достичь различными способами, общепринятыми в данной области, например, посредством мутагенеза с пределом погрешности (WO 92/18645), олигонуклеотид-опосредованным случайным мутагенезом (US 5723323), перестановкой в ДНК (US 5605793), экзо-опосредованной сборкой гена WO00/58517. Использование этих и аналогичных случайно-направленных способов молекулярной эволюции обеспечивает идентификацию и отбор вариантов фермента по настоящему изобретению, которые имеют предпочтительные характеристики, без какой-либо предварительной информации о структуре или функции белка, и обеспечивает получение непрогнозируемых, но полезных мутаций или вариантов. Существуют многочисленные примеры применения молекулярной эволюции в данной области для оптимизации или изменения активности фермента, такие примеры включают без ограничения одно или несколько из следующих: оптимизированная экспрессия и/или активность в клетке-хозяине или in vitro, повышенная ферментативная активность, измененная субстратная специфичность и/или специфичность к продукту, увеличенная или уменьшенная ферментативная или структурная стабильность, измененная ферментативная активность/специфичность в предпочтительных условиях окружающей среды, например, температура, pH, субстрат.
САЙТ-НАПРАВЛЕННЫЙ МУТАГЕНЕЗ
Сразу после выделения нуклеотидной последовательности, кодирующей белок, или идентификации предполагаемой нуклеотидной последовательности, кодирующей белок, может быть необходимым осуществить мутацию последовательности с целью получения белка по настоящему изобретению.
Мутации могут быть введены с использованием синтетических олигонуклеотидов. Эти олигонуклеотиды содержат нуклеотидные последовательности, фланкирующие сайты необходимых мутаций.
Подходящий способ раскрыт в Morinaga et al., (Biotechnology (1984) 2, p646-649). Другой способ введения мутаций в кодирующие фермент нуклеотидные последовательности описан в Nelson и Long (Analytical Biochemistry (1989), 180, p 147-151).
РЕКОМБИНАНТ
В одном аспекте последовательностью для использования в настоящем изобретении является рекомбинантная последовательность - т. е. последовательность, которую получили с помощью методик рекомбинантной ДНК.
Специалист в данной области владеет навыками этих методик рекомбинантной ДНК. Такие методы объясняются в литературе, например, J. Sambrook, E. F. Fritsch, и T. Maniatis, 1989, Molecular Cloning: A Laboratory Manual, Second Edition, Books 1-3, Cold Spring Harbor Laboratory Press.
СИНТЕТИЧЕСКИЙ
В одном аспекте последовательностью для использования в настоящем изобретении является синтетическая последовательность - т. е. последовательность, которую получили с помощью химического или ферментативного синтеза in vitro. Это включает без ограничения последовательности, полученные при оптимальном использовании кодонов в организмах-хозяевах, таких как метилотрофные дрожжи Pichia и Hansenula.
Белки и/или пептиды для использования в настоящем изобретении также могут быть синтетического происхождения.
ЭКСПРЕССИЯ ФЕРМЕНТОВ
Настоящее изобретение предлагает способ экспрессии трипептидилпептидазы, способной воздействовать на связи с участием пролина, преимущественно обладающей экзопептидазной активностью, при этом указанная трипептидилпептидаза, способная воздействовать на связи с участием пролина, способна к отщеплению трипептидов с N-конца пептидов, имеющих сайты расщепления консенсусной последовательности:
(i) пролин в P1 и
аминокислотa, выбраннaя из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1; или
(ii) пролин в P1ʹ и
аминокислотa, выбраннaя из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1ʹ,
при этом указанный способ предусматривает:
(a) трансформацию клетки-хозяина нуклеиновой кислотой или вектором, содержащими нуклеотидную последовательность, кодирующую трипептидилпептидазу, способную воздействовать на связи с участием пролина;
(b) экспрессию последовательности нуклеиновой кислоты или вектора из стадии (a) и
(c) получение трипептидилпептидазы, способной воздействовать на связи с участием пролина, или ферментата, содержащего указанную трипептидилпептидазу, способную воздействовать на связи с участием пролина.
Соответственно, способ может дополнительно предусматривать выделение, и/или очистку, и/или упаковывание трипептидилпептидазы, способной воздействовать на связи с участием пролина.
Нуклеиновая кислота может представлять собой любую нуклеиновую кислоту, кодирующую трипептидилпептидазу, способную воздействовать на связи с участием пролина, обладающую активностью, подробно описанную в данном документе. Соответственно, нуклеиновая кислота может представлять собой любую из нуклеиновых кислот, подробно описанных в данном документе. Соответственно, нуклеиновая кислота может представлять собой выделенную нуклеиновую кислоту по настоящему изобретению.
Используемый в данном документе термин ʺферментатʺ относится к смеси составляющих компонентов, присутствующих после (например, в завершении) культивирования клетки-хозяина, которая включает в себя трипептидилпептидазу (например, трипептидилпептидазу, способную воздействовать на связи с участием пролина) и/или экзо-трипептидилпептидазу семейства S53. Ферментат может содержать как трипептидилпептидазу в соответствии с настоящим изобретением, так и другие компоненты, такие как твердые частицы, твердые вещества, субстраты, не использованные в ходе культивирования, дебрис, культуральную среду, клеточные отходы и т. д. В одном аспекте бактериальные клетки (и предпочтительно споры) удаляют из ферментата и/или инактивируют с получением бесклеточного ферментата.
Нуклеотидная последовательность для использования в настоящем изобретении может быть включена в рекомбинантный реплицируемый вектор. Вектор можно использовать для репликации и экспрессии нуклеотидной последовательности в форме белка/фермента в совместимой клетке-хозяине и/или из совместимой клетки-хозяина.
Экспрессией можно управлять, используя контрольные последовательности, например, регуляторные последовательности
Белок, продуцируемый рекомбинантной клеткой-хозяином посредством экспрессии нуклеотидной последовательности, может секретироваться или может содержаться внутри клетки в зависимости от используемых последовательности и/или вектора. Кодирующие последовательности могут быть сконструированы с сигнальными последовательностями, которые направляют секрецию веществ кодирующих последовательностей в конкретную прокариотическую или эукариотическую клеточную мембрану.
Термин "вектор экспрессии" означает конструкцию, способную к экспрессии in vivo или in vitro.
В одном варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, и/или эндопротеаза для использования в настоящем изобретении может кодироваться с помощью вектора. Иными словами, вектор может содержать нуклеотидную последовательность, кодирующую трипептидилпептидазу, способную воздействовать на связи с участием пролина.
Предпочтительно вектор экспрессии встроен в геном подходящего организма-хозяина. Термин "встроен" предпочтительно охватывает стабильное встраивание в геном.
Нуклеотидная последовательность по настоящему изобретению может присутствовать в векторе, в котором нуклеотидная последовательность функционально связана с регуляторными последовательностями, способными обеспечивать экспрессию нуклеотидной последовательности посредством подходящего организма-хозяина.
Векторы для использования в настоящем изобретении могут быть трансформированы в подходящую клетку-хозяина, как описано ниже, для обеспечения экспрессии полипептида по настоящему изобретению.
Выбор вектора, например, плазмиды, космиды или фагового вектора, часто зависит от клетки-хозяина, в которую он должен быть введен
Векторы для использования в настоящем изобретении могут содержать один или несколько селектируемых маркерных генов, таких как ген, который придает устойчивость к антибиотику, например, ампициллину, канамицину, хлорамфениколу или тетрациклину. В качестве альтернативы отбор можно осуществлять путем ко-трансформации (как описано в WO91/17243).
Векторы могут быть использованы in vitro, например, для получения РНК или для трансфекции, трансформации, трансдукции или заражения клетки-хозяина.
Таким образом, в дополнительном варианте осуществления настоящее изобретение предлагает способ получения нуклеотидных последовательностей по настоящему изобретению путем введения нуклеотидной последовательности по настоящему изобретению в реплицируемый вектор, введения вектора в совместимую клетку-хозяина и выращивания клетки-хозяина в условиях, которые приводят к репликации вектора.
Вектор может дополнительно содержать нуклеотидную последовательность, обеспечивающую репликацию вектора в интересующей клетке-хозяине. Примерами таких последовательностей являются точки начала репликации плазмид pUC19, pACYC177, pUB110, pE194, pAMB1 и pIJ702.
Нуклеотидная последовательность и/или вектор, кодирующие трипептидилпептидазу, способную воздействовать на связи с участием пролина, и/или эндопротеазу, могут быть оптимизированы по кодонам для экспрессии в конкретном организме-хозяине.
Нуклеотидная последовательность и/или вектор, кодирующие трипептидилпептидазу, способную воздействовать на связи с участием пролина, и/или эндопротеазу, могут быть оптимизированы по кодонам для экспрессии в прокариотической или эукариотической клетке. Соответственно, нуклеотидная последовательность и/или вектор, кодирующие трипептидилпептидазу, способную воздействовать на связи с участием пролина, и/или эндопротеазу, могут быть оптимизированы по кодонам для экспрессии в организме-хозяине гриба (например, Trichoderma, предпочтительно Trichoderma reesei).
Оптимизация кодонов относится к способу модификации последовательности нуклеиновой кислоты для повышения экспрессии в представляющей интерес клетке-хозяине путем замещения по меньшей мере одного кодона (например, по меньшей мере более 1, 2, 3, 4, 5, 10, 15, 20, 25, 50, 60, 70, 80 или 100 кодонов) нативной последовательности кодонами, которые более часто используются в генах клетки-хозяина, при сохранении нативной аминокислотной последовательности. Различные виды проявляют специфическое смещение для определенных кодонов конкретной аминокислоты. Смещение кодонов (различия в использовании кодонов между организмами) часто коррелирует с эффективностью трансляции информационной РНК (мРНК), которая, как полагают, зависит, помимо прочего, от свойств кодонов, которые транслируются, и наличия конкретных молекул транспортной РНК (тРНК). Преобладание выбранных тРНК в клетке, как правило, является отражением кодонов, наиболее часто используемых в синтезе пептидов.
Соответственно, гены могут быть адаптированы для оптимальной экспрессии генов в данном организме на основе оптимизации кодонов. Нуклеотидную последовательность и/или вектор, который подвергся этой адаптации, можно отнести, таким образом, к ʺоптимизированным по кодонамʺ нуклеотидной последовательности и/или вектору.
Таблицы использования кодонов легко доступны, например, в "Базе данных использования кодов", и эти таблицы можно адаптировать посредством различных способов. См. Nakamura, Y., et al. "Codon usage tabulated from the international DNA sequence databases: status for the year 2000" Nucl. Acids Res. 28:292 (2000). Компьютерные алгоритмы для оптимизации кодонов определенной последовательности для экспрессии в конкретной клетке-хозяине также доступны, такие как Gene Forge (Aptagen; Джейкобас, Пенсильвания). В некоторых вариантах осуществления один или несколько кодонов (например, 1, 2, 3, 4, 5, 10, 15, 20, 25, 50 или больше, или все кодоны) в последовательности, кодирующей трипептидилпептидазу, способную воздействовать на связи с участием пролина, и/или эндопротеазу для использования в настоящем изобретении, соответствуют наиболее часто используемому кодону для конкретной аминокислоты.
В одном варианте осуществления нуклеотидная последовательность, кодирующая трипептидилпептидазу, способную воздействовать на связи с участием пролина, может представлять собой нуклеотидную последовательность, которая была оптимизирована по кодонам для экспрессии в Trichoderma reesei.
В одном варианте осуществления оптимизированная по кодонам последовательность может содержать нуклеотидную последовательность, представленную под SEQ ID No. 81, SEQ ID No. 82, SEQ ID No. 83, SEQ ID No. 84, SEQ ID No. 85, SEQ ID No. 86, SEQ ID No. 87, SEQ ID No. 88, SEQ ID No. 89, SEQ ID No. 90, SEQ ID No. 91, SEQ ID No. 92, SEQ ID No. 93, SEQ ID No. 94, SEQ ID No. 95, SEQ ID No. 97, или нуклеотидную последовательность, которая по меньшей мере на 70% идентична ми. Предпочтительно последовательность, которая по меньшей мере на 80% идентична им или по меньшей мере на 90% идентичная им.
Предпочтительно оптимизированная по кодонам последовательность может содержать нуклеотидную последовательность, которая меньшей мере на 95% идентична последовательности под SEQ ID No. 81, SEQ ID No. 82, SEQ ID No. 83, SEQ ID No. 84, SEQ ID No. 85, SEQ ID No. 86, SEQ ID No. 87, SEQ ID No. 88, SEQ ID No. 89, SEQ ID No. 90, SEQ ID No. 91, SEQ ID No. 92, SEQ ID No. 93, SEQ ID No. 94, SEQ ID No. 95, болеe предпочтительно по меньшей мере на 99% идентична SEQ ID No. 81, SEQ ID No. 82, SEQ ID No. 83, SEQ ID No. 84, SEQ ID No. 85, SEQ ID No. 86, SEQ ID No. 87, SEQ ID No. 88, SEQ ID No. 89, SEQ ID No. 90, SEQ ID No. 91, SEQ ID No. 92, SEQ ID No. 93, SEQ ID No. 94, SEQ ID No. 95 или SEQ ID No. 97.
В одном варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, может кодироваться нуклеотидной последовательностью, которая гибридизируется с последовательностью под SEQ ID No. 81, SEQ ID No. 82, SEQ ID No. 83, SEQ ID No. 84, SEQ ID No. 85, SEQ ID No. 86, SEQ ID No. 87, SEQ ID No. 88, SEQ ID No. 89, SEQ ID No. 90, SEQ ID No. 91, SEQ ID No. 92, SEQ ID No. 93, SEQ ID No. 94, SEQ ID No. 95, SEQ ID No. 97 в условиях средней жесткости. Предпочтительно нуклеотидной последовательностью, которая гибридизируется с последовательностью под SEQ ID No. 81, SEQ ID No. 82, SEQ ID No. 83, SEQ ID No. 84, SEQ ID No. 85, SEQ ID No. 86, SEQ ID No. 87, SEQ ID No. 88, SEQ ID No. 89, SEQ ID No. 90, SEQ ID No. 91, SEQ ID No. 92, SEQ ID No. 93, SEQ ID No. 94, SEQ ID No. 95 или SEQ ID No. 97 в условиях высокой жесткости.
В дополнительном варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, может кодироваться нуклеотидной последовательностью, которая отличается от последовательности под SEQ ID No. 81, SEQ ID No. 82, SEQ ID No. 83, SEQ ID No. 84, SEQ ID No. 85, SEQ ID No. 86, SEQ ID No. 87, SEQ ID No. 88, SEQ ID No. 89, SEQ ID No. 90, SEQ ID No. 91, SEQ ID No. 92, SEQ ID No. 93, SEQ ID No. 94, SEQ ID No. 95 или SEQ ID No. 97 из-за вырожденности генетического кода.
Также предложен вектор (например, плазмида), содержащий одну или несколько последовательностей, выбранных из группы, состоящей из: SEQ ID No. 81, SEQ ID No. 82, SEQ ID No. 83, SEQ ID No. 84, SEQ ID No. 85, SEQ ID No. 86, SEQ ID No. 87, SEQ ID No. 88, SEQ ID No. 89, SEQ ID No. 90, SEQ ID No. 91, SEQ ID No. 92, SEQ ID No. 93, SEQ ID No. 94, SEQ ID No. 95 или SEQ ID No. 97.
РЕГУЛЯТОРНЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ
В некоторых применениях нуклеотидная последовательность для использования в настоящем изобретении функционально связана с регуляторной последовательностью, которая способна обеспечивать экспрессию нуклеотидной последовательности, как, например, выбранной клеткой-хозяином. В качестве примера настоящее изобретение охватывает вектор, содержащий нуклеотидную последовательность по настоящему изобретению, функционально связанную с такой регуляторной последовательностью, т. е. вектор представляет собой вектор экспрессии.
Термин "функционально связанный" относится к наложению, при котором описанные компоненты находятся во взаимосвязи, позволяющей им функционировать в присущей им манере. Регуляторная последовательность, "функционально связанная" с кодирующей последовательностью, лигируется таким образом, что экспрессия кодирующей последовательности достигается при условии, сопоставимом с контролирующими последовательностями.
Термин "регуляторные последовательности" включает промоторы и усилители и другие регуляторные сигналы экспрессии.
Термин "промотор" используется в нормальном смысле данной области, например, сайт связывания РНК-полимеразы.
Усиленная экспрессия нуклеотидной последовательности, кодирующей фермент по настоящему изобретению, также может быть достигнута путем подбора гетерологичных регуляторных участков, например, промоторной, лидерной последовательности секреции и терминаторных участков.
Предпочтительно нуклеотидная последовательность по настоящему изобретению является функционально связанной по меньшей мере с промотором.
Другие промоторы могут быть пригодны даже для управления экспрессией полипептида по настоящему изобретению.
Примеры подходящих промоторов для управления транскрипцией нуклеотидной последовательности в бактериальном, грибном или дрожжевом хозяине хорошо известны в данной области.
Промотор может дополнительно включать в себя признаки для обеспечения или увеличения экспрессии в подходящем хозяине. Например, эти признаки могут представлять собой консервативные участки, такие как бокс Прибнова или TATA-бокс.
КОНСТРУКЦИИ
Термин "конструкция" - который является синонимом таких терминов, как "конъюгат", "кассета" и "гибрид" - включает нуклеотидную последовательность для использования в соответствии с настоящим изобретением, прямо или опосредованно связанную с промотором.
Примером непрямого присоединения является подходящая спейсерная группа, как, например, интронная последовательность, такая как Sh1-интрон или ADH-интрон, являющаяся промежуточным звеном между промотором и нуклеотидной последовательностью по настоящему изобретению. То же справедливо применительно к настоящему изобретению для термина "слитый", который включает прямое или непрямое присоединение. В некоторых случаях термины не охватывают естественную комбинацию нуклеотидной последовательности, кодирующей белок, обычно ассоциируемый с промотором гена дикого типа, и когда они оба находятся в своей естественной окружающей среде.
Конструкция даже может содержать или экспрессировать маркер, который дает возможность отбора генетической конструкции.
Для некоторых применений предпочтительно, что конструкция по настоящему изобретению содержала по меньшей мере нуклеотидную последовательность по настоящему изобретению, функционально связанную с промотором.
КЛЕТКИ-ХОЗЯЕВА
Термин ʺклетка-хозяинʺ применительно к настоящему изобретению включает любую клетку, которая содержит либо нуклеотидную последовательность, либо вектор экспрессии, описываемые выше, и которую используют в рекомбинантном получении белка, обладающего конкретными свойствами, определяемыми в данном документе.
Таким образом, дополнительный вариант осуществления настоящего изобретения предлагает клетки-хозяева, трансформированные или трансфицированные нуклеотидной последовательностью, которая экспрессирует белок по настоящему изобретению. Клетки выбирают так, чтобы они были совместимы с указанным вектором, и они могут быть, например, прокариотическими (например, бактериальными), клетками грибов, дрожжевыми или растительными клетками.
Примерами подходящих бактериальных организмов-хозяев являются грамположительные или грамотрицательные виды бактерий.
В зависимости от природы нуклеотидной последовательности, кодирующей полипептид по настоящему изобретению, и/или необходимости в дальнейшем процессинге экспрессированного белка, предпочтительными могут быть эукариотические хозяева, такие как дрожжи или другие грибы. В целом, дрожжевые клетки предпочтительнее клеток грибов, потому что на них легче воздействовать. Однако некоторые белки либо плохо секретируются из дрожжевой клетки, либо в некоторых случаях не процессируются надлежащим образом (например, гипергликозилирование в дрожжах). В таких случаях следует выбирать другие организмы-хозяева грибы.
Применение подходящих клеток-хозяев, таких как дрожжи, хозяева-грибы и растительные клетки-хозяева, может обеспечивать посттрансляционные модификации (например, миристоилирование, гликозилирование, усечение, липидирование и фосфорилирование тирозина, серина или треонина), которые могут потребоваться для обеспечения оптимальной биологической активности продуктам рекомбинантной экспрессии по настоящему изобретению.
Клетка-хозяин может представлять собой штамм, дефектный по протеазе, или штамм протеаза-минус. Это может быть, например, дефектный по протеазе штамм Aspergillus oryzae JaL 125, имеющий делецию гена щелочной протеазы с названием ʺalpʺ. Этот штамм описан в WO97/35956.
ОРГАНИЗМ
Термин "организм" применительно к настоящему изобретению включает любой организм, который может содержать нуклеотидную последовательность, кодирующую полипептид по настоящему изобретению, и/или продукты, полученные из него, и/или где промотор может обеспечивать экспрессию нуклеотидной последовательности в соответствии с настоящим изобретением, если присутствует в организме.
Подходящие организмы могут включать прокариота, гриб, дрожжи или растение.
Термин "трансгенный организм" применительно к настоящему изобретению включает любой организм, который содержит нуклеотидную последовательность, кодирующую полипептид по настоящему изобретению, и/или продукты, полученные из него, и/или где промотор может обеспечивать экспрессию нуклеотидной последовательности в соответствии с настоящим изобретением в организме. Предпочтительно нуклеотидная последовательность включена в геном организма.
Термин "трансгенный организм" не охватывает нативные нуклеотиды, кодирующие последовательности в их естественной окружающей среде, когда они находятся под контролем их нативного промотора, который также находится в своей естественной окружающей среде.
Поэтому трансгенный организм по настоящему изобретению включает в себя организм, содержащий любую из или комбинации из нуклеотидной последовательности, кодирующей полипептид в соответствии с настоящим изобретением, конструкций в соответствии с настоящим изобретением, векторов в соответствии с настоящим изобретением, плазмид в соответствии с настоящим изобретением, клеток в соответствии с настоящим изобретением, тканей в соответствии с настоящим изобретением или их продуктов.
Например, трансгенный организм может также содержать нуклеотидную последовательность, кодирующую полипептид по настоящему изобретению под контролем гетерологичного промотора.
ТРАНСФОРМАЦИЯ КЛЕТКИ/ОРГАНИЗМА-ХОЗЯИНА
Как указано выше, организм-хозяин может представлять собой прокариотический или эукариотический организм. Примеры подходящих прокариотических хозяев включают E. coli и Bacillus subtilis.
Руководство по трансформации прокариотических клеток хорошо задокументировано в данной области, например, см. Sambrook et al (Molecular Cloning: A Laboratory Manual, 2nd edition, 1989, Cold Spring Harbor Laboratory Press). Если используется прокариотический хозяин, то нуклеотидную последовательность может быть необходимо соответствующим образом модифицировать перед трансформацией, как, например, путем удаления интронов.
Клетки нитчатых грибов можно трансформировать с использованием различных способов, известных в данной области, такими, как процесс, включающий образование протопластов и трансформацию протопластов с последующим восстановлением стенки клетки известным путем. Применение Aspergillus в качестве микроорганизма-хозяина описано в EP 0238023.
Другим организмом-хозяином может быть растение. Обзор общих методик, используемых для трансформации растений, можно найти в статьях Potrykus (Annu Rev Plant Physiol Plant Mol Biol [1991] 42:205-225) и Christou (Agro-Food-Industry Hi-Tech March/April 1994 17-27). Дополнительную информация о трансформации растений можно найти в публикации EP-A-0449375.
Общая информация о трансформации грибов, дрожжей и растений представлена в следующих разделах.
ТРАНСФОРМИРОВАННЫЙ ГРИБ
Организм-хозяин может представлять собой гриб - такой как плесень. Примеры таких подходящих хозяев включают любого представителя, принадлежащего к роду Thermomyces, Acremonium, Aspergillus, Penicillium, Mucor, Neurospora, Trichoderma и т. п.
В одном варианте осуществления организм-хозяин может представлять собой нитчатый гриб.
Трансформация нитчатых грибов обсуждается в US-A-5741665, в котором утверждается, что стандартные методики трансформации нитчатых грибов и культивирования грибов хорошо известны в данной области. Обширный обзор методик применительно к N. crassa находится, например, в Davis и de Serres, Methods Enzymol (1971) 17A: 79-143.
Дополнительные рекомендации, которые можно использовать в трансформации нитчатых грибов, рассмотрены в US-A-5674707.
Кроме того, экспрессия генов в нитчатых грибах изложена в Punt et al. (2002) Trends Biotechnol 2002 May;20(5):200-6, Archer & Peberdy Crit Rev Biotechnol (1997) 17(4):273-306.
Настоящее изобретение охватывает получение трансгенных нитчатых грибов в соответствии с настоящим изобретением, полученных с использованием этих стандартных методик.
Предпочтительно организм-хозяин представляет собой организм-хозяин Trichoderma, например, организм-хозяин Trichoderma reesei.
В другом варианте осуществления организм-хозяин может быть из рода Aspergillus, как, например, Aspergillus niger.
Трансгенный Aspergillus в соответствии с настоящим изобретением также можно получить, следуя, например, рекомендациям Turner G. 1994 (Vectors for genetic manipulation. In: Martinelli, S.D., Kinghorn J.R. (Editors) Aspergillus: 50 years on. Progress in industrial microbiology vol 29. Elsevier Amsterdam 1994. pp. 641-666).
ТРАНСФОРМИРОВАННЫЕ ДРОЖЖИ
В другом варианте осуществления трансгенным организмом могут быть дрожжи.
Обзор принципов экспрессии гетерологичных генов у дрожжей представлен, например, в Methods Mol Biol (1995), 49:341-54, и Curr Opin Biotechnol (1997) Oct;8(5):554-60.
В этом отношении дрожжи - такие как вид Saccharomyces cerevisiae или Pichia pastoris (см.FEMS Microbiol Rev (2000 24(1):45-66),можно использовать как носитель для экспрессии гетерологичных генов.
Обзор принципов экспрессии гетерологичных генов в Saccharomyces cerevisiae и секреции генных продуктов приведен E Hinchcliffe E Kenny (1993, "Yeast as a vehicle for the expression of heterologous genes", Yeasts, Vol 5, Anthony H Rose и J Stuart Harrison, eds, 2nd edition, Academic Press Ltd.).
Для трансформации дрожжей были разработаны несколько протоколов трансформации. Например, трансгенный Saccharomyces в соответствии с настоящим изобретением можно получить, следуя рекомендациям Hinnen et al., (1978, Proceedings of the National Academy of Sciences of the USA75, 1929); Beggs, J D (1978, Nature, London, 275, 104); и Ito, H et al (1983, J Bacteriology 153, 163-168).
Трансформированные дрожжевые клетки можно подвергать отбору, используя различные селективные маркеры, такие, как ауксотрофные маркеры, доминантные маркеры устойчивости к антибиотикам.
КУЛЬТИВИРОВАНИЕ И ПОЛУЧЕНИЕ
Клетки-хозяева, трансформированные нуклеотидной последовательностью по настоящему изобретению, можно культивировать в условиях, которые способствуют продуцированию кодируемого полипептида и облегчают извлечение полипептида из клеток и/или культуральной среды.
Средой, используемой для культивирования клеток, может быть любая обычная среда, подходящая для выращивания обсуждаемой клетки-хозяина и получения экспрессии полипептида.
Белок, полученный посредством рекомбинантной клетки, может быть представлен на поверхности клетки.
Этот белок может секретироваться из клеток-хозяев и может быть легко извлечен из культуральной среды с использованием хорошо известных процедур.
СЕКРЕЦИЯ
Часто желательно, чтобы белок секретировался из экспрессирующего хозяина в культуральную среду, откуда белок можно легче извлечь. Согласно настоящему изобретению лидерную последовательность секреции можно отбирать на основе желаемого экспрессирующего хозяина. Гибридные сигнальные последовательности также могут быть использованы в контексте данного изобретения.
Типичными примерами лидерных последовательностей для гетерологичной секреции являются те, которые происходят из гена амилоглюкозидазы гриба (AG) (glaA - оба варианта из 18 и 24 аминокислот, например, из Aspergillus), гена a-фактора (дрожжи, например, Saccharomyces,Kluyveromyces и Hansenula) или гена α-амилазы (Bacillus).
В качестве примера, секрецию гетерологичных белков в E. coli рассматривают в Methods Enzymol (1990) 182:132-43.
ПОСТТРАНСКРИПЦИОННЫЕ И ПОСТТРАНСЛЯЦИОННЫЕ МОДИФИКАЦИИ
Соответственно, трипептидилпептидаза, способная воздействовать на связи с участием пролина, и/или эндопротеаза для использования в настоящем изобретении может кодироваться с помощью любой из нуклеотидных последовательностей, изложенных в данном документе.
В зависимости от использованной клетки-хозяина могут быть выполнены посттранскрипционные и/или посттрансляционные модификации. Предполагается, что ферменты (например, трипептидилпептидаза, способная воздействовать на связи с участием пролина, и/или эндопротеаза) для использования в настоящих способах и/или применениях охватывают ферменты (например, трипептидилпептидазу, способную воздействовать на связи с участием пролина, и/или эндопротеазу), которые подверглись посттранскрипционной и/или посттрансляционной модификации.
Одним неограничивающим примером посттранскрипционных и/или посттрансляционных модификаций является ʺобрезаниеʺ или ʺрасщеплениеʺ полипептида (например, трипептидилпептидазы, способной воздействовать на связи с участием пролина, и/или эндопротеазы).
В некоторых вариантах осуществления полипептид (например, трипептидилпептидазу по настоящему изобретению, например, трипептидилпептидазу, способную воздействовать на связи с участием пролина, и/или эндопротеазу) можно обрезать или расщеплять. Это может приводить к превращению трипептидилпептидазы, способной воздействовать на связи с участием пролина, и/или эндопротеазы из неактивного или, по сути, неактивного состояния в активное состояние (т. е. способное осуществлять описанную в данном документе активность).
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может представлять собой пропептид, который подвергается дальнейшей посттрансляционной модификации в зрелый пептид, т. е. в полипептид, который обладает активностью трипептидилпептидазы, способной воздействовать на связи с участием пролина.
Исключительно в качестве примера, SEQ ID No. 1 представляет собой то же, что и SEQ ID No. 29 за исключением того, что SEQ ID No. 1 подвергли посттрансляционной и/или посттранскрипционной модификации с удалением некоторых аминокислот, более конкретно 197 аминокислот с N-конца. Поэтому полипептид, показанный в данном документе под SEQ ID No. 1, может рассматриваться в некоторых случаях (т. e. в некоторых клетках-хозяевах) как пропептид - который дополнительно процессируется в зрелый пептид (SEQ ID No. 29) посредством посттрансляционной и/или посттранскрипционной модификации. Точные модификации, например, сайт(сайты) расщепления, в отношении посттрансляционной и/или посттранскрипционной модификации могут незначительно отличаться в зависимости от видов-хозяев. У некоторых видов-хозяев посттрансляционная и/или посттранскрипционная модификация отсутствует, поэтому пропептид в этом случае эквивалентен зрелому пептиду (т. е. полипептиду, который обладает трипептидилпептидазной активностью по настоящему изобретению). Не вдаваясь в теорию, сайт(сайты) расщепления может быть(могут быть) сдвинут(сдвинуты) на несколько остатков (например, 1, 2 или 3 остатка) в любом направлении относительно участка расщепления, показанного посредством ссылки на SEQ ID No. 29, по сравнению с SEQ ID No.1. Иными словами, вместо расщепления, например, в положении 197 (R), расщепление может иметь место, например, в положении 196-A, 195-A, 194-A, 198Q, 199E, 200P. Дополнительно или в качестве альтернативы расщепление может привести к удалению приблизительно 197 аминокислот, в некоторых вариантах осуществления расщепление может привести к удалению от 194 до 200 остатков.
Другие примеры посттранскрипционных и/или посттрансляционных модификаций включают без ограничения миристоилирование, гликозилирование, усечение, липидизацию и фосфорилирование тирозина, серина или треонина. Квалифицированному специалисту будет понятно, что тип посттранскрипционных и/или посттрансляционных модификаций, которые могут происходить с белком (например, с трипептидилпептидазой, способной воздействовать на связи с участием пролина, и/или эндопротеазой), может зависеть от организма-хозяина, в котором экспрессируется белок (например, трипептидилпептидаза, способная воздействовать на связи с участием пролина, и/или эндопротеаза).
ОБНАРУЖЕНИЕ
В данной области известны различные протоколы для обнаружения и измерения экспрессии аминокислотной последовательности. Примеры включают твердофазный иммуноферментный анализ (ELISA), радиоиммунологический анализ (RIA) и активированную флуоресценцией сортировку клеток (FACS).
Широкий набор методик мечения и конъюгации известен специалистам в данной области и может быть использован в различных количественных анализах нуклеиновых и аминокислот.
Ряд компаний, таких как Pharmacia Biotech (Пискатавей, Нью Джерси), Promega (Мэдисон, Висконсин) и US Biochemical Corp (Кливленд, Огайо) поставляют коммерческие наборы и протоколы для этих процедур.
Подходящие молекулы-репортеры или метки включают такие радионуклиды, ферменты, флуоресцентные, хемолюминисцентные или хромогенные агенты, а такжесубстраты, кофакторы, ингибиторы, магнитные частицы и им подобные. Патенты, в которых изложено использованием таких меток, включают US-A-3,817,837; US-A-3,850,752; US-A-3,939,350; US-A-3,996,345; US-A-4,277,437; US-A-4,275,149 и US-A-4,366,241.
Также, рекомбинантные иммуноглобулины могут быть получены, как показано в US-A-4816567.
БЕЛКИ CЛИЯНИЯ
Аминокислотная последовательность для использования в соответствии с настоящим изобретением может быть получена в виде белка слияния, например, для облегчения экстрагирования и очистки. Примеры партнеров по белку слияния включают глутатион-S-трансферазу (GST), 6xHis, GAL4 (домены связывания ДНК и/или активации транскрипции) и (β-галактозидазу). Также может быть удобно включить сайт протеолитического расщепления между партнером по белку слияния и представляющей интерес белковой последовательностью, чтобы обеспечить возможность удаления последовательности белка слияния.
Предпочтительно белок слияния не будет препятствовать активности белковой последовательности.
Системы экспрессии для генов слияния в E. coli были рассмотрены в Curr Opin Biotechnol (1995) 6(5):501-6.
В другом варианте осуществления настоящего изобретения аминокислотная последовательность может быть лигирована с гетерологичной последовательностью для кодирования белка слияния. Например, для скрининга библиотек пептидов в отношении средств, способных влиять на активность вещества, может быть полезно кодировать химерное вещество, экспрессирующее гетерологичный эпитоп, который распознается коммерчески доступным антителом.
ОБЩИЕ ТЕХНИЧЕСКИЕ ПРИЕМЫ МЕТОДОЛОГИИ РЕКОМБИНАНТНОЙ ДНК
В настоящем изобретении используют, если не указано иное, традиционные методики химии, молекулярной биологии, микробиологии, рекомбинантной ДНК и иммунологии, навыками которых владеет специалист в данной области. Такие методики объясняются в литературе. См., например, J. Sambrook, E. F. Fritsch, и T. Maniatis, 1989, Molecular Cloning: A Laboratory Manual, Second Edition, Books 1-3, Cold Spring Harbor Laboratory Press; Ausubel, F. M. et al. (1995 и периодические дополнения; Current Protocols in Molecular Biology, ch. 9, 13, и 16, John Wiley & Sons, New York, N.Y.); B. Roe, J. Crabtree, и A. Kahn, 1996, DNA Isolation и Sequencing: Essential Techniques, John Wiley & Sons; M. J. Gait (Editor), 1984, Oligonucleotide Synthesis: A Practical Approach, Irl Press; и, D. M. J. Lilley и J. E. Dahlberg, 1992, Methods of Enzymology: DNA Structure Part A: Synthesis и Physical Analysis of DNA Methods in Enzymology, Academic Press.
ДОЗИРОВКИ
Трипептидилпептидазу, способную воздействовать на связи с участием пролина, и/или эндопротеазу и/или экзо-трипептидилпептидазу семейства S53 для использования в способах и/или применениях по настоящему изобретению можно добавлять в любом подходящем количестве.
В одном варианте осуществления трипептидилпептидазу, способную воздействовать на связи с участием пролина, и/или экзо-трипептидилпептидазу семейства S53 можно добавлять в количестве от приблизительно 5 мг до 3 г фермента на кг белкового субстрата и/или композиции пищевой и/или кормовой добавки.
При получении гидролизата, соответственно, трипептидилпептидазу, способную воздействовать на связи с участием пролина, и/или экзо-трипептидилпептидазу семейства S53 можно добавлять в количестве от 5 мг до 3 г фермента на кг белкового субстрата.
В одном варианте осуществления, соответственно, трипептидилпептидазу, способную воздействовать на связи с участием пролина, и/или экзо-трипептидилпептидазу семейства S53 можно добавлять в количестве от 25 мг до 1000 мг фермента на кг белкового субстрата.
В одном варианте осуществления трипептидилпептидазу, способную воздействовать на связи с участием пролина, можно добавлять в количестве приблизительно 0.01 мг -100 мг; 0.5 мг -100 мг; 1 мг -50 мг; 5 мг -100 мг; 5 мг - 20 мг, 10 мг-100 мг; 0.05 мг - 50 мг; или 0.10 мг -10 мг фермента на кг композиции кормовой добавки.
В определенных вариантах осуществления трипептидилпептидазу, способную воздействовать на связи с участием пролина, можно добавлять в количестве от приблизительно 0,01 г до 1000 г фермента на кг композиции кормовой добавки, в таком количестве как от 0,1 г до 500 г, таком как от 0,5 г до 700 г, например, в количестве приблизительно 0.01 г - 200 г, 0.01 г -100 г; 0.5 г -100 г; 1 г - 50 г; 5 г -100 г; 5 г - 20 г, 5 г - 15 г, 10 г -100 г; 0.05 г - 50 г; или 0.10 г -10 г фермента на кг композиции кормовой добавки.
В одном предпочтительном варианте осуществления трипептидилпептидазу, способную воздействовать на связи с участием пролина, можно добавлять в количестве от приблизительно 5 до 20 мг фермента на кг композиции кормовой добавки.
Точное количество будет зависеть от конкретного типа используемой композиции и от удельной активности протеазы на мг белка.
В другом варианте осуществления трипептидилпептидазу, способную воздействовать на связи с участием пролина, и/или экзо-трипептидилпептидазу семейства S53 можно добавлять в количестве от приблизительно 1 мг до приблизительно 1 кг фермента на кг продукта питания, и/или корма, и/или кормового продукта, и/или премикса. Соответственно, трипептидилпептидазу, способную воздействовать на связи с участием пролина, и/или экзо-трипептидилпептидазу семейства S53 можно дозировать от приблизительно 1 мг до приблизительно 250 г на кг продукта питания, и/или корма, и/или кормового продукта, и/или премикса. Предпочтительно от приблизительно 1 мг до приблизительно 100 г (более предпочтительно от приблизительно 1 мг до приблизительно 1 г) на кг продукта питания, и/или корма, и/или кормового продукта, и/или премикса.
Эндопротеазу можно добавлять в количестве от приблизительно 50 до приблизительно 3000 мг фермента на кг белкового субстрата, например, 0,05-3 г фермента на метрическую тонну (MT) белкового субстрата.
Предпочтительно, эндопротеазу можно добавлять в количестве менее приблизительно 4,0 г фермента на МТ белкового субстрата.
В другом варианте осуществления эндопротеазу можно добавлять в количестве от приблизительно 0,5 г до приблизительно 5,0 г фермента на МТ белкового субстрата. Предпочтительно, эндопротеазу можно добавлять в количестве от приблизительно 0,5 г до приблизительно 3,0 г фермента на МТ белкового субстрата. Более предпочтительно эндопротеазу можно дозировать в количестве от приблизительно 1,0 г до приблизительно 2,0 г фермента на МТ белкового субстрата.
В одном варианте осуществления аминопептидазу можно добавлять в количестве от приблизительно 0,5 мг до приблизительно 2 г фермента на кг белкового субстрата, и/или композиции пищевой и/или кормовой добавки. Предпочтительно, аминопептидазу можно добавлять в количестве от приблизительно 1 мг до приблизительно 2 г фермента на кг белкового субстрата, и/или композиции пищевой и/или кормовой добавки. Более предпочтительно в количестве от приблизительно 5 мг до приблизительно 1,5 г фермента на кг белкового субстрата, и/или композиции пищевой и/или кормовой добавки.
При получении гидролизата аминопептидазу можно добавлять в количестве от приблизительно 0,5 мг до приблизительно 2 г фермента на кг белкового субстрата. Предпочтительно аминопептидазу можно добавлять в количестве от приблизительно 1 мг до приблизительно 2 г фермента на кг белкового субстрата. Более предпочтительно в количестве от приблизительно 5 мг до приблизительно 1,5 г фермента на кг белкового субстрата.
В одном варианте осуществления аминопептидазу можно добавлять в количестве от приблизительно 5 мг до приблизительно 500 мг фермента на кг белкового субстрата. Предпочтительно аминопептидазу можно добавлять в количестве от приблизительно 50 мг до приблизительно 500 мг фермента на кг белкового субстрата. Предпочтительно аминопептидазу можно добавлять в количестве от приблизительно 100 мг до приблизительно 450 мг фермента на кг белкового субстрата.
СУБЪЕКТ
Термин ʺсубъектʺ можно использовать по отношению к ʺживотномуʺ или ʺчеловекуʺ.
Соответственно, субъектом может быть ʺчувствительный индивидуумʺ, имеющий склонность к иммунной реакции на необработанный гидролизат, содержащий один или несколько конкретных белков или их части. Например, субъект может быть чувствительным индивидуумом, имеющим аллергию на глютен (например, глиадин), аллергию на белок молока и/или аллергию на соевый белок.
Используемый в данном документе термин ʺживотноеʺ означает животное, которому должны вводить или вводили композицию кормовой добавки в соответствии с настоящим изобретением или кормовой продукт, содержащий указанную композицию кормовой добавки в соответствии с настоящим изобретением.
Предпочтительно животное представляет собой млекопитающее, жвачное животное, животное с однокамерным желудком, рыбу или ракообразное, включая, например, сельскохозяйственное животное или одомашненное животное (например, домашнего питомца).
В одном варианте осуществления ʺживотноеʺ представляет собой сельскохозяйственное животное.
Используемый в данном документе термин ʺсельскохозяйственное животноеʺ относится к любому фермерскому животному. Предпочтительно, сельскохозяйственное животное представляет собой одно или несколько животных из коров или быков (включая телят), свиней (включая поросят, свиней, поросят на доращивании, свиноматок), сельскохозяйственной птицы (включая бройлеров, цыплят, несушек и индеек), птицы, рыбы (включая пресноводных рыб, таких как лосось, треска, форель и карп, например карп кои, и морскую рыбу, такую как морской окунь), ракообразных (таких как креветки, мидии и гребешки), лошадей (включая скаковых лошадей), овец (включая ягнят).
В другом варианте осуществления ʺживотноеʺ представляет собой одомашненное животное, или домашнего питомца, или животное, содержащееся в среде зоопарка.
Используемый в данном документе термин ʺодомашненное животное, или домашний питомец, или животное, содержащееся в среде зоопаркаʺ относится к любому соответствующему животному, включая псовых (например, собак), кошачьих (например, кошек), грызунов (например, морских свинок, крыс, мышей), птиц, рыб (включая пресноводных рыб и морских рыб) и лошадей.
В одном варианте осуществления животное представляет собой животное с однокамерным желудком. В предпочтительном варианте осуществления животное с однокамерным желудком может представлять собой сельскохозяйственную птицу или свинью (или их комбинацию).
В другом варианте осуществления животное представляет собой жвачное животное.
Термин животное не предназначен для обозначения человека.
КОМПОЗИЦИИ
Настоящее изобретение предлагает общую композицию, содержащую по меньшей мере одну трипептидилпептидазу, способную воздействовать на связи с участием пролина, преимущественно обладающую экзопептидазной активностью, где указанная трипептидилпептидаза, способная воздействовать на связи с участием пролина, способна к отщеплению трипептидов с N-конца пептидов, имеющих:
(i) пролин в P1 и
аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1; или
(ii) пролин в P1ʹ и
аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1ʹ.
В одном варианте осуществления предложена композиция пищевой добавки, содержащая по меньшей мере одну трипептидилпептидазу, способную воздействовать на связи с участием пролина, где указанная трипептидилпептидаза, способная воздействовать на связи с участием пролина, преимущественно обладает экзопептидазной активностью и способна к отщеплению трипептидов с N-конца пептидов, имеющих:
(i) пролин в P1 и
аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1; или
(ii) пролин в P1ʹ и
аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1ʹ.
Также предложена композиция кормовой добавки, содержащая по меньшей мере одну трипептидилпептидазу, способную воздействовать на связи с участием пролина, где указанная трипептидилпептидаза, способная воздействовать на связи с участием пролина, преимущественно обладает экзопептидазной активностью и способна к отщеплению трипептидов с N-конца пептидов, имеющих:
(i) пролин в P1 и
аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1; или
(ii) пролин в P1ʹ и
аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот, в P1ʹ.
В качестве альтернативы или дополнительно композиция и/или композиция пищевой добавки и/или композиция кормовой добавки может содержать трипептидилпептидазу, способную воздействовать на связи с участием пролина, получаемую посредством любого из способов по настоящему изобретению.
В другом варианте осуществления предложена композиция, и/или композиция пищевой добавки, или композиция кормовой добавки, содержащая гидролизат по настоящему изобретению. Предпочтительно такая композиция пищевой и/или кормовой добавки может дополнительно содержать трипептидилпептидазу, способную воздействовать на связи с участием пролина (необязательно в комбинации с эндопротеазой).
Ферменты по настоящему изобретению, такие как трипептидилпептидаза, способная воздействовать на связи с участием пролина, для использования в способах и/или применениях по настоящему изобретению, и/или экзо-трипептидилпептидаза, и/или композиция, и/или композиция пищевой добавки и/или кормовой добавки могут быть составлены посредством любого подходящего способа, известным в данной области техники.
В некоторых вариантах осуществления дополнительные ингредиенты можно смешивать с трипептидилпептидазой (например, трипептидилпептидазой, способной воздействовать на связи с участием пролина), как, например, соли, такие как Na2SO4, мальтодекстрин, известняк (карбонат кальция), циклодекстрин, пшеница или компонент пшеницы, крахмал, тальк, PVA, полиолы, такие как сорбит и глицерин, бензоат, сорбиат, сахара, такие как сахароза и глюкоза, пропиленгликоль, 1,3-пропандиол, парабены, хлорид натрия, цитрат, ацетат, ацетат натрия, фосфат, кальций, метабисульфит, формиат или их смеси.
В предпочтительном варианте осуществления композиция пищевой добавки или композиция кормовой добавки в соответствии с настоящим изобретением содержит трипептидилпептидазу (например, трипептидилпептидазу, способную воздействовать на связи с участием пролина) в соответствии с настоящим изобретением или ферментат в соответствии с настоящим изобретением, и дополнительно содержит один или несколько ингредиентов, выбранных из группы, состоящей из: соли, полиола, включая сорбит и глицерин, пшеницы или компонента пшеницы, ацетата натрия, тригидрата ацетата натрия, сорбата калия, талька, PVA, бензоата, сорбиата, 1,3-пропандиола, глюкозы, парабенов, хлорида натрия, цитрата, метабисульфита, формиата или их комбинации.
В одном варианте осуществления соль можно выбирать из группы, состоящей из: Na2SO4, NaH2PO4, Na2HPO4, Na3PO4, (NH4)H2PO4, K2HPO4, KH2PO4, K2SO4, KHSO4, ZnSO4, MgSO4, CuSO4, Mg(NO3)2, (NH4)2SO4, бората натрия, ацетата магния, цитрата натрия или их комбинаций.
Типичные жидкие составы ферментов для применения в пищевой промышленности могут включать следующие компоненты (% в вес/вес): представляющий интерес фермент 0,2-30%, предпочтительно 2-20%.
Стабильность ферментного состава можно также повысить путем использования солей, таких как NaCl, KCl, CaCl2, Na2SO4 или других солей для применения в пищевой промышленности в концентрациях от приблизительно 0,1% до приблизительно 20% (предпочтительно от приблизительно 0,1% до приблизительно 5%). Не вдаваясь в теорию, полагают, что высокие концентрации солей могут, кроме того, быть способом достижения микробной стабильности либо сами по себе, либо в комбинации с дополнительными ингредиентами. Механизм действия может быть связан с более низкой активностью воды или специфическим взаимодействием между определенным ферментом и солью. Поэтому в некоторых вариантах осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, может быть смешана по меньшей мере с одной солью.
Подходящим консервантом может быть бензоат натрия и/или сорбат калия. Эти консерванты можно обычно использовать в комбинированной концентрации, составляющей приблизительно 0,1-1%, предпочтительно приблизительно 0,2-0,5%. Бензоат натрия наиболее эффективен при рН <5,5, и сорбат натрия при рН <6.
Подходящим сахаром является сорбит.
Подходящей солью является сульфат натрия.
В одном варианте осуществления один или несколько ингредиентов (например, используемых для состава композиции, и/или композиции пищевой добавки, и/или композиции кормовой добавки) можно выбирать из группы, состоящей из: полиолов, таких как глицерин и/или сорбит; сахаров, таких как глюкоза, фруктоза, сахароза, мальтоза, лактоза и трегалоза; солей, таких как NaCl, KCl, CaCl2, Na2SO4, или других солей для применения в пищевой промышленности; консерванта, например, бензоата натрия и/или сорбата калия; или их комбинаций.
Соответственно, один или несколько ингредиентов (например, используемых для состава композиции, и/или композиции пищевой добавки, и/или композиции кормовой добавки) можно выбирать из группы, состоящей из пшеничного носителя, сорбита и сульфата натрия.
Соответственно, трипептидилпептидазу, способную воздействовать на связи с участием пролина, и/или экзо-трипептидилпептидазу семейства S53, и/или композицию, и/или композицию пищевой добавки и/или кормовой добавки можно смешивать с носителем на основе пшеницы.
Соответственно, трипептидилпептидазу, способную воздействовать на связи с участием пролина, и/или экзо-трипептидилпептидазу семейства S53, и/или композицию, и/или композицию пищевой добавки и/или кормовой добавки можно смешивать с сорбитом.
Соответственно, трипептидилпептидазу, способную воздействовать на связи с участием пролина, и/или экзо-трипептидилпептидазу семейства S53 и/или композицию, и/или композицию пищевой добавки и/или кормовой добавки можно смешивать с сульфатом натрия.
В предпочтительном варианте осуществления композиция, и/или композиция пищевой добавки и/или кормовой добавки может дополнительно содержать любую эндопротеазу, подробно описанную в данном документе.
ФОРМЫ
Композицию кормовой добавки по настоящему изобретению и другие компоненты и/или кормовой продукт, содержащий их, можно использовать в любой подходящей форме.
Композицию кормовой добавки по настоящему изобретению можно использовать в форме твердых или жидких препаратов или их альтернативных вариантов. Примеры твердых препаратов включают порошки, пасты, болюсы, капсулы, драже, таблетки, присыпки и гранулы, которые могут быть смачиваемыми, высушенными распылительной сушкой или лиофилизированными. Примеры жидких препаратов включают без ограничения водные, органические или водно-органические растворы, суспензии и эмульсии.
В некоторых применениях композицию кормовой добавки по настоящему изобретению можно смешивать с кормом или вводить в питьевую воду.
Подходящие примеры форм включают одно или несколько из порошков, паст, болюсов, гранул, таблеток, пилюль, гранул, капсул, суппозиториев, растворов или суспензий, которые могут содержать вкусовые или красящие вещества, для применений с немедленным, отсроченным, модифицированным, длительным, прерывистым или контролируемым высвобождением.
В качестве примера, если композиция по настоящему изобретению используется в твердой, например, гранулированной форме, она также может содержать один или несколько из наполнителей, таких как микрокристаллическая целлюлоза, лактоза, цитрат натрия, карбонат кальция, гидроортофосфат кальция и глицин; разрыхлителей, таких как крахмал (предпочтительно кукурузный, картофельный или тапиоковый крахмал), крахмал гликолят натрия, кроскармеллоза натрия и определенные комплексные силикаты; связующих для гранулирования, таких как поливинилпирролидон, гидроксипропилметилцеллюлоза (HPMC), гидроксипропилцеллюлоза (HPC), сахароза, желатин и гуммиарабик; смазывающих веществ, таких как стеарат магния, стеариновая кислота, глицерилбегенат и тальк, которые могут быть включены.
Примеры приемлемых в пищевом отношении носителей для применения в получении форм включают, к примеру, воду, солевые растворы, спирт, силикон, воска, вазелиновое масло, растительные масла, полиэтиленгликоли, пропиленгликоль, липосомы, сахара, желатин, лактозу, амилозу, стеарат магния, тальк, поверхностно-активные вещества, кремниевую кислоту, вязкий парафин, парфюмерное масло, моноглицериды и диглицериды жирных кислот, сложные эфиры нефтяных жирных кислот, гидроксиметиллцеллюлозу, поливинилпирролидон и т. п.
Предпочтительные наполнители для форм включают лактозу, крахмал, целлюлозу, молочный сахар или полиэтиленгликоли с высоким молекулярным весом.
Для водных суспензий и/или эликсиров композицию по настоящему изобретению можно комбинировать с различными подсластителями или вкусовыми веществами, красящим веществом или красителями, с эмульгирующими и/или суспендирующими средствами и с разбавителями, такими как вода, пропиленгликоль и глицерин, а также их комбинациями.
КОМБИНАЦИЯ С ДРУГИМИ КОМПОНЕНТАМИ
Трипептидилпептидазу, способную воздействовать на связи с участием пролина, и эндопротеазу и/или экзо-трипептидилпептидазу семейства S53, и/или трехферментную композицию, и/или композицию, и/или композицию пищевой и/или кормовой добавки, и/или гидролизат по настоящему изобретению можно использовать в комбинации с другими компонентами.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, и эндопротеаза, и/или экзо-трипептидилпептидаза семейства S53, и/или трехферментная композиция, и/или композиция, и/или композиция пищевой и/или кормовой добавки, и/или гидролизат по настоящему изобретению и другой компонент, который является подходящим для употребления животными и способен обеспечивать медицинскую или физиологическую пользу потребителю.
В одном варианте осуществления ʺдругой компонентʺ может представлять собой один или несколько ферментов.
Подходящими дополнительными ферментами для использования в настоящем изобретении могут быть один или несколько ферментов, выбранных из группы, состоящей из эндоглюканаз (E.C. 3.2.1.4); целлобиогидролаз (E.C. 3.2.1.91), β-глюкозидаз (E.C. 3.2.1.21), целлюлаз (E.C. 3.2.1.74), лихеназ (E.C. 3.1.1.73), липаз (E.C. 3.1.1.3), липид-ацилтрансфераз (в целом классифицированных как E.C. 2.3.1.x), фосфолипаз (E.C. 3.1.1.4, E.C. 3.1.1.32 или E.C. 3.1.1.5), фитаз (например, 6-фитазы (E.C. 3.1.3.26) или 3-фитазы (E.C. 3.1.3.8), альфа-амилаз (E.C. 3.2.1.1), ксиланаз (E.C. 3.2.1.8, E.C. 3.2.1.32, E.C. 3.2.1.37, E.C. 3.1.1.72, E.C. 3.1.1.73), глюкоамилаз (E.C. 3.2.1.3), протеаз (например, субтилизина (E.C. 3.4.21.62) или бациллолизина (E.C. 3.4.24.28), или щелочной сериновой протеазы (E.C. 3.4.21.x), или кератиназы (E.C. 3.4.x.x)), и/или маннаназ (например, β-маннаназы (E.C. 3.2.1.78)).
Соответственно, другим компонентом может быть фитаза (например, 6-фитаза (E.C. 3.1.3.26) или 3-фитаза (E.C. 3.1.3.8)).
В одном варианте осуществления (в частности для применений в кормах) другим компонентом может быть один или несколько ферментов, выбранных из группы, состоящей из ксиланаз (E.C. 3.2.1.8, E.C. 3.2.1.32, E.C. 3.2.1.37, E.C. 3.1.1.72, E.C. 3.1.1.73), амилазы (в том числе α-амилазы (E.C. 3.2.1.1), G4-образующей амилазы (E.C. 3.2.1.60), β-амилазы (E.C. 3.2.1.2) и γ-амилазы (E.C. 3.2.1.3); и/или протеазы (например, субтилизина (E.C. 3.4.21.62), или бациллолизина (E.C. 3.4.24.28), или щелочной сериновой протеазы (E.C. 3.4.21.x), или кератиназы (E.C. 3.4.x.x)).
В одном варианте осуществления (особенно для применений в кормах) другим компонентом может быть комбинация амилазы (например, α-амилазы (E.C. 3.2.1.1)) и протеазы (например, субтилизина (E.C. 3.4.21.62)).
В одном варианте осуществления (в частности, для применений в кормах) другим компонентом может быть β-глюканаза, например, эндо-1,3(4)-β-глюканаза (E.C. 3.2.1.6).
В одном варианте осуществления (особенно для применений в кормах) другим компонентом может быть маннаназа (например, β-маннаназа (E.C. 3.2.1.78)).
В одном варианте осуществления (особенно для применений в кормах) другим компонентом может быть липаза (E.C. 3.1.1.3), липид-ацилтрансфераза (в целом классифицированная как E.C. 2.3.1.x), или фосфолипаза (E.C. 3.1.1.4, E.C. 3.1.1.32 или E.C. 3.1.1.5), предпочтительно липаза (E.C. 3.1.1.3).
В одном варианте осуществления (особенно для применений в кормах) другим компонентом может быть протеаза (например, субтилизин (E.C. 3.4.21.62), или бациллолизин (E.C. 3.4.24.28), или щелочная сериновая протеаза (E.C. 3.4.21.x), или кератиназа (E.C. 3.4.x.x)).
В другом варианте осуществления дополнительная протеаза может быть другим компонентом для комбинирования с трипептидилпептидазой, способной воздействовать на связи с участием пролина (необязательно в комбинации с эндопротеазой), и/или для комбинирования с эндопротеазой в комбинации с экзо-трипептидилпептидазой семейства S53 и аминопептидазой. Предпочтительно дополнительную протеазу можно выбирать из группы, состоящей из аминопептидазы и карбоксипептидазы.
Используемый в данном документе термин ʺкарбоксипептидазаʺ имеет свое обычное значение в данной области и относится к экзопептидазе, которая способна к отщеплению n аминокислот с С-конца пептидного и/или белкового субстрата. В одном варианте осуществления n может составлять по меньшей мере 1, предпочтительно n может составлять по меньшей мере 2. В других вариантах осуществления n может составлять по меньшей мере 3, предпочтительно по меньшей мере 4.
В других вариантах осуществления трипептидилпептидазу, способную воздействовать на связи с участием пролина (необязательно в комбинации с эндопротеазой), и/или трехферментную композицию можно использовать с одной или несколькими дополнительными экзопептидазами.
В одном варианте осуществления трипептидилпептидазу, способную воздействовать на связи с участием пролина (необязательно в комбинации с эндопротеазой), и/или трехферментную композицию не комбинируют с пролин-специфической экзопептидазой.
В особенно предпочтительном варианте осуществления трипептидилпептидазу, способную воздействовать на связи с участием пролина, и/или трехферментную композицию можно не комбинировать с ферментом, имеющим следующую полипептидную последовательность:
MRTAAASLTLAATCLFELASALMPRAPLIPAMKAKVALPSGNATFEQYIDHNNPGLG
TFPQRYWYNPEFWAGPGSPVLLFTPGESDAADYDGFLTNKTIVGRFAEEIGGAVILLE
HRYWGASSPYPELTTETLQYLTLEQSIADLVHFAKTVNLPFDEIHSSNADNAPWVMT
GGSYSGALAAWTASIAPGTFWAYHASSAPVQAIYDFWQYFVPVVEGMPKNCSKDL
NRVVEYIDHVYESGDIERQQEIKEMFGLGALKHFDDFAAAITNGPWLWQDMNFVSG
YSRFYKFCDAVENVTPGAKSVPGPEGVGLEKALQGYASWFNSTYLPGSCAEYKYW
TDKDAVDCYDSYETNSPIYTDKAVNNTSNKQWTWFLCNEPLFYWQDGAPKDEST
IVSRIVSAEYWQRQCHAYFPEVNGYTFGSANGKTAEDVNKWTKGWDLTNTTRLIW
ANGQFDPWRDASVSSKTRPGGPLQSTEQAPVHVIPGGFHCSDQWLVYGEANAGVQ
KVIDEEVAQIKAWVAEYPKYRKP
В одном варианте осуществления дополнительным компонентом может быть стабилизатор, или эмульгатор, или связующее вещество, или носитель, или наполнитель, или разбавитель, или разрыхлитель.
Используемый в данном документе термин ʺстабилизаторʺ определяется как ингредиент или комбинация ингредиентов, которые препятствуют изменению продукта (например, кормового продукта) в течение некоторого периода времени.
Используемый в данном документе термин ʺэмульгаторʺ относится к ингредиенту (например, ингредиенту корма), который предупреждает разделение эмульсий. Эмульсии представляют собой два несмешиваемых вещества, причем одно, присутствующее в форме капель, содержится внутри другого. Эмульсии могут представлять собой масло-в-воде, где капельной или дисперсной фазой является масло, а непрерывной фазой является вода; или воду-в-масле, где вода становится дисперсной фазой, а непрерывной фазой является масло. Пены, которые представляют собой газ-в-жидкости, и суспензии, которые представляют собой твердое вещество-в-жидкости, также можно стабилизировать с помощью использования эмульгаторов.
Используемый в данном документе термин ʺсвязующееʺ относится к ингредиенту (например, ингредиенту корма), который связывает продукт в единое целое посредством физического или химического воздействия. Во время "желатинированияʺ, к примеру, абсорбируется вода, обеспечивая эффект связывания. Однако связующие могут абсорбировать другие жидкости, такие как масла, удерживая их внутри продукта. В контексте настоящего изобретения связующие будут, как правило, использоваться в твердых продуктах или в продуктах с низким содержанием влаги, к примеру, в выпекаемых продуктах: мучных изделиях, пончиках, хлебе и других. Примеры связующих для гранулирования включают одно или несколько из: поливинилпирролидона, гидроксипропилметилцеллюлозы (HPMC), гидроксипропилцеллюлозы (HPC), сахарозы, мальтозы, желатина и гуммиарабика.
"Носители" означают материалы, подходящие для введения фермента, и включают любой подобный материал, известный в данной области, к примеру, любую жидкость, гель, растворитель, жидкий разбавитель, солюбилизатор или подобный, который является нетоксичным, и который не взаимодействует с какими-либо компонентами композиции с повреждением.
Настоящее изобретение предлагает способ получения композиции (например, композиции кормовой добавки), включающий смешивание кормовой добавки по настоящему изобретению (и предпочтительно кукурузы или продукта переработки кукурузы) по меньшей мере с одним физиологически приемлемым носителем, выбранным по меньшей мере из одного из мальтодекстрина, известняка (карбоната кальция), циклодекстрина, пшеницы или компонента пшеницы, сахарозы, крахмала, Na2SO4, талька, PVA, сорбита, бензоата, сорбиата, глицерина, сахарозы, пропиленгликоля, 1,3-пропандиола, глюкозы, парабенов, хлорида натрия, цитрата, ацетата, фосфата, кальция, метабисульфата, формиата и их смесей.
Примеры ʺнаполнителейʺ включают одно или несколько из микрокристаллической целлюлозы или других целлюлоз, лактозы, цитрата натрия, карбоната кальция, гидроортофосфата кальция, глицина, крахмала, молочного сахара и полиэтиленгликолей с высоким молекулярным весом.
Примеры ʺразрыхлителейʺ включают одно или несколько из крахмала (предпочтительно кукурузного, картофельного или тапиокового крахмала), крахмалгликолята натрия, кроскармеллозы натрия и определенных комплексных силикатов.
Примеры ʺразбавителейʺ включают одно или несколько из воды, этанола, пропиленгликоля, глицерина и их комбинаций.
Другие компоненты можно использовать одновременно (например, когда их смешивают вместе, или даже когда их доставляют с помощью различных путей) или последовательно (например, их можно доставлять с помощью различных путей) в композиции пищевой добавки, или композиции кормовой добавки, или в гидролизате по настоящему изобретению.
В одном варианте осуществления предпочтительно композиция кормовой добавки, или кормовой ингредиент, или корм, или кормовой продукт, или премикс в соответствии с настоящим изобретением не содержит хром или органический хром.
В одном варианте осуществления предпочтительно композиция кормовой добавки, или кормовой ингредиент, или корм, или кормовой продукт, или премикс в соответствии с настоящим изобретением не содержит сорбиновую кислоту.
УПАКОВКА
В одном варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, и эндопротеаза, и/или экзо-трипептидилпептидаза семейства S53, и/или трехферментная композиция, и/или композиция, и/или композиция пищевой и/или кормовой добавки, и/или гидролизат, и/или пищевой продукт, и/или кормовой продукт в соответствии с настоящим изобретением являются упакованными.
В одном предпочтительном варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, и эндопротеаза, и/или экзо-трипептидилпептидаза семейства S53, и/или трехферментная композиция, и/или композиция, и/или композиция пищевой и/или кормовой добавки, и/или гидролизат, и/или пищевой продукт, и/или кормовой продукт являются упакованными в мешок, такой как бумажный мешок.
В альтернативном варианте осуществления трипептидилпептидаза, способная воздействовать на связи с участием пролина, и эндопротеаза, и/или экзо-трипептидилпептидаза семейства S53, и/или трехферментная композиция, и/или композиция, и/или композиция пищевой и/или кормовой добавки, и/или гидролизат, и/или пищевой продукт, и/или кормовой продукт может быть герметично упакованным в контейнер. Можно использовать любой подходящий контейнер.
ПИЩЕВОЙ ПРОДУКТ
Термин ʺпищевой продуктʺ используется в данном документе в качестве синонима ʺпищиʺ.
В данном документе термин ʺпищевой продуктʺ используется для обозначения пищи для людей.
Пища может находиться в форме раствора или в твердом виде в зависимости от использования, и/или способа применения, и/или способа введения.
В случае применения в качестве - или в получении - пищи, такой как функциональный пищевой продукт, гидролизат, и/или композицию, и/или композицию пищевой добавки по настоящему изобретению можно использовать в сочетании с одним или несколькими из приемлемого в пищевом отношении носителя, приемлемого в пищевом отношении разбавителя, приемлемого в пищевом отношении наполнителя, приемлемого в пищевом отношении вспомогательного вещества, активного в пищевом отношении ингредиента.
В одном варианте осуществления настоящее изобретение предлагает пищевой продукт, содержащий гидролизат в соответствии с настоящим изобретением. Пищевой продукт может дополнительно содержать трипептидилпептидазу, способную воздействовать на связи с участием пролина (такую как получаемая посредством любого из способов в данном документе), необязательно в комбинации с эндопротеазой.
Необязательно пищевой продукт может дополнительно содержать по меньшей мере один пищевой ингредиент.
Соответственно, пищевой продукт может содержать по меньшей мере одну трипептидилпептидазу, способную воздействовать на связи с участием пролина, содержащую аминокислотную последовательность, выбранную из последовательностей под:
SEQ ID No. 29, SEQ ID No. 1, SEQ ID No. 2, SEQ ID No. 3, SEQ ID No. 4, SEQ ID No. 5, SEQ ID No.6, SEQ ID No. 7, SEQ ID No. 8, SEQ ID No. 9, SEQ ID No. 10, SEQ ID No. 11, SEQ ID No. 12, SEQ ID No. 13, SEQ ID No. 14, SEQ ID No. 15, SEQ ID No. 16, SEQ ID No. 17, SEQ ID No. 18, SEQ ID No. 19, SEQ ID No. 20, SEQ ID No. 21, SEQ ID No. 22, SEQ ID No. 23, SEQ ID No. 24, SEQ ID No. 25, SEQ ID No. 26, SEQ ID No. 27, SEQ ID No. 28, SEQ ID No. 30, SEQ ID No. 31, SEQ ID No. 32, SEQ ID No. 33, SEQ ID No. 34, SEQ ID No. 35, SEQ ID No. 36, SEQ ID No. 37, SEQ ID No. 38, SEQ ID No. 39, SEQ ID No. 40, SEQ ID No. 41, SEQ ID No. 42, SEQ ID No. 43, SEQ ID No. 44, SEQ ID No. 45, SEQ ID No. 46, SEQ ID No. 47, SEQ ID No. 48, SEQ ID No. 49, SEQ ID No. 50, SEQ ID No. 51, SEQ ID No. 52, SEQ ID No. 53, SEQ ID No. 54, SEQ ID No. 55, SEQ ID No. 98, SEQ ID No. 99, или их функционального фрагмента или аминокислотной последовательности, которая по меньшей мере на 70% идентична им.
Соответственно, трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из последовательностей под SEQ ID No. 1, SEQ ID No. 2, SEQ ID No. 3, SEQ ID No. 4, SEQ ID No. 5, SEQ ID No.6, SEQ ID No. 7, SEQ ID No. 8, SEQ ID No. 9, SEQ ID No. 10, SEQ ID No. 11, SEQ ID No. 12, SEQ ID No. 13, SEQ ID No. 14, SEQ ID No. 15, SEQ ID No. 16, SEQ ID No. 17, SEQ ID No. 18, SEQ ID No. 19, SEQ ID No. 20, SEQ ID No. 21, SEQ ID No. 22, SEQ ID No. 23, SEQ ID No. 24, SEQ ID No. 25, SEQ ID No. 26, SEQ ID No. 27, SEQ ID No. 28, или их функционального фрагмента или аминокислотной последовательности, которая по меньшей мере на 70% идентична им.
Соответственно, трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из последовательностей под SEQ ID No. 29, SEQ ID No. 30, SEQ ID No. 31, SEQ ID No. 32, SEQ ID No. 33, SEQ ID No. 34, SEQ ID No. 35, SEQ ID No. 36, SEQ ID No. 37, SEQ ID No. 38, SEQ ID No. 39, SEQ ID No. 40, SEQ ID No. 41, SEQ ID No. 42, SEQ ID No. 43, SEQ ID No. 44, SEQ ID No. 45, SEQ ID No. 46, SEQ ID No. 47, SEQ ID No. 48, SEQ ID No. 49, SEQ ID No. 50, SEQ ID No. 51, SEQ ID No. 52, SEQ ID No. 53, SEQ ID No. 54, SEQ ID No. 55, SEQ ID No. 98, SEQ ID No. 99, или их функционального фрагмента или аминокислотной последовательности, которая по меньшей мере на 70% идентична им.
Настоящее изобретение также касается способа получения пищевого продукта, предусматривающего приведение в контакт пищевого компонента с гидролизатом по настоящему изобретению или с композицией и/или композицией пищевой добавки по настоящему изобретению.
Когда пищевой компонент приводят в контакт с композицией и/или композицией пищевой добавки, соответственно, пищевой компонент может также контактировать с эндопротеазой.
Композицию по настоящему изобретению можно использовать для получения продуктов питания, таких как одно или несколько из джемов, мармеладов, желе, молочных продуктов (таких как молоко или сыр), мясных продуктов, продуктов из cельскохозяйственной птицы, рыбных продуктов и хлебобулочных продуктов.
В одном варианте осуществления композицию по настоящему изобретению можно использовать для получения богатых белком отходов. Используемый в данном документе термин ʺбогатые белком отходыʺ может включать субстраты, представляющие собой побочные продукты переработки растений и животных, например, переработки соевых бобов, побочные продукты с объектов по переработке (например, отходы со скотобойни и/или объектов по переработке рыбы).
В качестве примера, композицию по настоящему изобретению можно использовать в качестве ингредиентов безалкогольных напитков, фруктового сока или напитка, содержащего белок сыворотки молока, целебных чаев, какао-напитков, молочных напитков и напитков с молочно-кислыми бактериями, кисломолочного продукта и питьевого йогурта, сыра, мороженого, щербетов и десертов, кондитерских изделий, бисквитных тортов и смесей для тортов, закусочных пищевых продуктов, сухих завтраков, лапши быстрого приготовления и лапши из чашки, супов быстрого приготовления и супов из чашки, сбалансированных пищевых продуктов и напитков, подсластителей, закусочных батончиков с улучшенной текстурой, батончиков с пищевыми волокнами, твердых фруктовых начинок для выпечки, защитной глазури, шоколадной начинки для хлебобулочных изделий, ароматизированной начинки для чизкейка, фруктовой начинки для торта, сахарной глазури для тортов и пончиков, теплостойкой начинки для хлебобулочных изделий, кремов для начинки хлебобулочных изделий быстрого приготовления, начинки для печенья, готовой начинки для хлебобулочных изделий, начинки с уменьшенной калорийностью, питательного напитка для взрослых, подкисленного соевого/сокового напитка, стерильного/автоклавированного шоколадного напитка, смесей для батончиков, порошков для напитков, обогащенного кальцием соевого/простого и шоколадного молока, обогащенного кальцием кофейного напитка, порошковых коктейлей (например, коктейлей с добавлением белка, или лечебных коктейлей, или спортивных коктейлей, или коктейлей для пожилых лиц), продукта спортивного питания, функционального пищевого продукта, детского питания, питания для пожилых, питания для лиц, нуждающихся в медицинской помощи, добавок для насыщения.
Композицию в соответствии с настоящим изобретением можно дополнительно использовать в качестве ингредиента в продуктах питания, таких как американский сырный соус, ингибитор комкования для тертого и измельченного сыра, соус для чипсов, сливочного сыра, обезжиренная сметана для взбитого украшения на верхней поверхности изделия в виде сухой смеси, замороженные/оттаявшие молочные взбитые сливки, замороженное/оттаявшее стабильное взбитое украшение на поверхности изделия, низкожирный и легкий натуральный сыр чеддер, низкожирный швейцарский йогурт, насыщенные воздухом замороженные десерты и сувенирные батончики, прессованное мороженое, прессованное мороженое с безвредной этикеткой, улучшенными экономическими показателями и изысканным вкусом, низкожирное мороженое: мягкое мороженое, соус для барбекю, сырный соус для обмакивания, заправка для творога, сухая смесь для соуса Альфредо, смешанный сырный соус, сухая смесь для томатного соуса и других.
Для определенных аспектов предпочтительно пищевой продукт представляет собой напиток.
Предпочтительно пищевым продуктом может быть хлебобулочный продукт - такой как хлеб, датское печенье, бисквиты или печенье.
Настоящее изобретение также предусматривает способ получения пищевого продукта или пищевого ингредиента, при этом способ предусматривает смешивание 5-KGA, полученного посредством способа по настоящему изобретению, или композиции в соответствии с настоящим изобретением с другим пищевым ингредиентом. Способ получения или пищевой ингредиент также является другим аспектом настоящего изобретения.
Пищевой продукт в соответствии с настоящим изобретением может представлять собой молочный продукт, продукт на основе белка сыворотки молока, хлебобулочный продукт, продукт ферментации, функциональный пищевой продукт, продукт детского питания, напиток, коктейль, упаковку, продукт спортивного питания, функциональный пищевой продукт, продукт детского питания, продукт питания для лиц пожилого возраста или продукт питания для лиц, нуждающихся в медицинской помощи.
Соответственно, молочный продукт может представлять собой продукт на основе молока. Такие продукты на основе молока могут содержать один или несколько белков молока или их фрагментов.
Предпочтительно молочный продукт (например, продукт на основе молока) может быть детской смесью.
Соответственно, хлебобулочный продукт может быть хлебным продуктом.
Соответственно, продукт ферментации может быть продуктом ферментации сои.
Соответственно, упаковка может быть упаковкой для напитка (предпочтительно упаковкой для пива) или молочного продукта.
ПИЩЕВОГО ИНГРЕДИЕНТ
Композицию и/или композицию пищевой добавки по настоящему изобретению можно использовать в качестве пищевого ингредиента.
Используемый в данном документе термин ʺпищевой ингредиентʺ включает состав, который представляет собой или может добавляться к функциональным продуктам питания или пищевым продуктам в качестве биологически активной добавки и/или добавки пищевых волокон. Используемый в данном документе термин пищевой ингредиент также относится к составам, которые можно использовать при низких уровнях в широком спектре продуктов, которые требуют гелеобразования, текстурирования, стабилизации, суспендирования, пленкообразования и структурирования, сохранения сочности, улучшения вкуса, улучшения пептидного состава, улучшения питательных компонентов без придания вязкости.
Пищевой ингредиент может находиться в форме раствора или в твердом виде в зависимости от применения, и/или способа применения, и/или способа введения.
ПИЩЕВЫЕ ДОБАВКИ
Гидролизат, и/или композиция, и/или композиция пищевой добавки по настоящему изобретению может представлять собой - или может добавляться в - пищевые добавки.
ФУНКЦИОНАЛЬНЫЕ ПРОДУКТЫ ПИТАНИЯ
Композиция по настоящему изобретению может представлять собой - или может добавляться в - функциональные продукты питания.
Используемый в данном документе термин ʺфункциональный продукт питанияʺ означает пищевой продукт, который способен обеспечивать не только питательный эффект и/или вкусовое удовольствие, но также способен предоставлять потребителю дополнительный благоприятный эффект.
Соответственно, функциональные продукты питания представляют собой обычные пищевые продукты с включенными в них компонентами или ингредиентами (такие как описываемые в данном документе), которые придают пищевому продукту определенную функциональную - например, медицинскую или физиологическую пользу - иную, нежели исключительно питательный эффект.
Хотя не существует юридического определения функционального продукта питания, большинство сторон, проявляющих интерес в данной области, соглашается с тем, что они представляют собой пищевые продукты, продаваемые как оказывающие определенные виды воздействия на здоровье.
Некоторые функциональные продукты питания представляют собой нутрицевтики. В данном документе термин ʺнутрицевтикʺ означает пищевой продукт, который способен обеспечивать не только питательный эффект и/или вкусовое удовольствие, но также способен предоставлять терапевтический (или другой благоприятный) эффект потребителю. Нутрицевтики преодолевают традиционные разграничения между пищевыми продуктами и медициной.
Опросы показывают, что потребители уделяют больше внимания функциональным продуктам питания, применяемым при болезнях сердца. Профилактика рака представляет собой другой аспект питания, который в значительной степени интересует потребителей, но интересно, что это представляет собой область, в которой, как считают потребители, можно осуществлять минимальный контроль. В действительности, по данным Всемирной организации здравоохранения по меньшей мере 35% случаев рака связаны с рационом. Кроме того, жалобы, связанные с остеопорозом, состоянием кишечника и ожирением, также являются ключевыми факторами, которые могут побудить к приобретению функциональных продуктов питания и стимулировать развитие рынка.
КОРМ
Композиция кормовой добавки по настоящему изобретению может использоваться в качестве - или в получении - кормового продукта.
В одном варианте осуществления настоящее изобретение предлагает кормовой продукт, содержащий гидролизат в соответствии с настоящим изобретением. Кормовой продукт может дополнительно содержать трипептидилпептидазу, способную воздействовать на связи с участием пролина (такую как получаемая посредством любого из способов в данном документе), необязательно в комбинации с эндопротеазой.
Необязательно кормовой продукт может дополнительно содержать по меньшей мере один кормовой ингредиент.
Соответственно, кормовой продукт может содержать по меньшей мере одну трипептидилпептидазу, способную воздействовать на связи с участием пролина, содержащую аминокислотную последовательность, выбранную из последовательностей под:
SEQ ID No. 29, SEQ ID No. 1, SEQ ID No. 2, SEQ ID No. 3, SEQ ID No. 4, SEQ ID No. 5, SEQ ID No.6, SEQ ID No. 7, SEQ ID No. 8, SEQ ID No. 9, SEQ ID No. 10, SEQ ID No. 11, SEQ ID No. 12, SEQ ID No. 13, SEQ ID No. 14, SEQ ID No. 15, SEQ ID No. 16, SEQ ID No. 17, SEQ ID No. 18, SEQ ID No. 19, SEQ ID No. 20, SEQ ID No. 21, SEQ ID No. 22, SEQ ID No. 23, SEQ ID No. 24, SEQ ID No. 25, SEQ ID No. 26, SEQ ID No. 27, SEQ ID No. 28, SEQ ID No. 30, SEQ ID No. 31, SEQ ID No. 32, SEQ ID No. 33, SEQ ID No. 34, SEQ ID No. 35, SEQ ID No. 36, SEQ ID No. 37, SEQ ID No. 38, SEQ ID No. 39, SEQ ID No. 40, SEQ ID No. 41, SEQ ID No. 42, SEQ ID No. 43, SEQ ID No. 44, SEQ ID No. 45, SEQ ID No. 46, SEQ ID No. 47, SEQ ID No. 48, SEQ ID No. 49, SEQ ID No. 50, SEQ ID No. 51, SEQ ID No. 52, SEQ ID No. 53, SEQ ID No. 54, SEQ ID No. 55, SEQ ID No. 98, SEQ ID No. 99, или их функционального фрагмента или аминокислотной последовательности, которая по меньшей мере на 70% идентична им.
Соответственно, трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из последовательностей под SEQ ID No. 1, SEQ ID No. 2, SEQ ID No. 3, SEQ ID No. 4, SEQ ID No. 5, SEQ ID No.6, SEQ ID No. 7, SEQ ID No. 8, SEQ ID No. 9, SEQ ID No. 10, SEQ ID No. 11, SEQ ID No. 12, SEQ ID No. 13, SEQ ID No. 14, SEQ ID No. 15, SEQ ID No. 16, SEQ ID No. 17, SEQ ID No. 18, SEQ ID No. 19, SEQ ID No. 20, SEQ ID No. 21, SEQ ID No. 22, SEQ ID No. 23, SEQ ID No. 24, SEQ ID No. 25, SEQ ID No. 26, SEQ ID No. 27, SEQ ID No. 28, или их функционального фрагмента или аминокислотной последовательности, которая по меньшей мере на 70% идентична им.
Соответственно, трипептидилпептидаза, способная воздействовать на связи с участием пролина, может содержать одну или несколько аминокислотных последовательностей, выбранных из последовательностей под SEQ ID No. 29, SEQ ID No. 30, SEQ ID No. 31, SEQ ID No. 32, SEQ ID No. 33, SEQ ID No. 34, SEQ ID No. 35, SEQ ID No. 36, SEQ ID No. 37, SEQ ID No. 38, SEQ ID No. 39, SEQ ID No. 40, SEQ ID No. 41, SEQ ID No. 42, SEQ ID No. 43, SEQ ID No. 44, SEQ ID No. 45, SEQ ID No. 46, SEQ ID No. 47, SEQ ID No. 48, SEQ ID No. 49, SEQ ID No. 50, SEQ ID No. 51, SEQ ID No. 52, SEQ ID No. 53, SEQ ID No. 54, SEQ ID No. 55, SEQ ID No. 98, SEQ ID No. 99, или их функционального фрагмента или аминокислотной последовательности, которая по меньшей мере на 70% идентична им.
Настоящее изобретение также касается способа получения кормового продукта, предусматривающего приведение в контакт кормового компонента с гидролизатом по настоящему изобретению или с композицией и/или композицией кормовой добавки по настоящему изобретению.
Когда кормовой компонент приводят в контакт с композицией и/или композицией кормовой добавки, соответственно, кормовой компонент может также контактировать с эндопротеазой.
Термин ʺкормʺ используется в данном документе в качестве синонима ʺкормового продуктаʺ.
Корм может находиться в форме раствора или в твердом виде в зависимости от использования, и/или способа применения, и/или способа введения.
В случае применения в качестве - или при получении - корма, такого как функциональный кормовой продукт, композицию по настоящему изобретению можно использовать в сочетании с одним или несколькими из приемлемого в пищевом отношении носителя, приемлемого в пищевом отношении разбавителя, приемлемого в пищевом отношении наполнителя, приемлемого в пищевом отношении вспомогательного вещества, активного в пищевом отношении ингредиента.
В предпочтительном варианте осуществления композицию кормовой добавки по настоящему изобретению смешивают с кормовым компонентом с образованием кормового продукта.
Используемый в данном документе термин ʺкормовой компонентʺ означает весь кормовой продукт или его часть. Часть кормового продукта может означать одну составляющую кормового продукта или более чем одну составляющую кормового продукта, например, 2, или 3, или 4. В одном варианте осуществления термин ʺкормовой компонентʺ охватывает премикс или составляющие компоненты премикса.
В одном варианте осуществления композицию кормовой добавки, содержащую трипептидилпептидазу, способную воздействовать на связи с участием пролина, и один или несколько ингредиентов, выбранных из группы, состоящей из: полиолов, таких как глицерин и/или сорбит; сахаров, таких как глюкоза, фруктоза, сахароза, мальтоза, лактоза и трегалоза; солей, таких как NaCl, KCl, CaCl2, Na2SO4, или других солей для применения в пищевой промышленности; консерванта, например, бензоата натрия и/или сорбата калия; или их комбинаций (необязательно в комбинации с эндопротеазой), можно смешивать по меньшей мере с одним белком или его частью, который представляет собой белок животного происхождения или растительный белок (например, выбранный из одного или нескольких из глиадина, бета-казеина, бета-лактоглобулина или иммуногенного фрагмента глиадина, бета-казеина, бета-лактоглобулина, глицинина, бета-конглицинина, круциферина, напина, коллагена, белка сыворотки молока, белка рыбы, белка мяса, яичного белка, соевого белка гордеина или белка зерновых), предпочтительно содержащийся в кукурузе, соевой муке, сухой барде с растворимыми веществами кукурузы (DDGS), пшенице, белках пшеницы, включая глютен, побочных продуктах переработки пшеницы, пшеничных отрубях, побочных продуктах переработки кукурузы, включая кукурузную глютеновую муку, в ячмене, овсе, ржи, тритикале, необезжиренной сое, измельченном материале побочных продуктов переработки животного происхождения, растворимом в спирте белке (предпочтительно из белков семян сои, белков семян подсолнечника, белков cемян рапса, белков семян канолы (семян рапса) или их комбинаций) или их комбинацию
Предпочтительно корм может представлять собой кормовое вещество или его премикс, комбикорм или его премикс. В одном варианте осуществления композицию кормовой добавки в соответствии с настоящим изобретением, можно смешивать с комбикормом, компонентом комбикорма, или премиксом комбикорма, или кормовым веществом, компонентом кормового вещества или премиксом кормового вещества.
Термин кормовое вещество, используемый в данном документе, означает любую пищу, которая задается животному (в отличие пищи, которую животное добывает самостоятельно). Кормовое вещество охватывает растения, которые были срезаны.
Термин кормовое вещество включает сено, солому, силос, прессованные и гранулированные корма, масла и смешанные рационы, а также проросшие зерновые и бобовые.
Кормовое вещество можно получить из одного или нескольких из растений, выбранных из: люцерны (люцерны посевной), ячменя, ледвенца рогатого, представителей рода капусты, капусты огородной сорта Chau moellier, кормовой капусты, семени рапса (канолы), репы (брюквы), турнепса, клевера, гибридного клевера, красного клевера, подземного клевера, белого клевера, травы, травы райграса французского высокого, овсяницы, бермудской травы, костра, трехзубки, видов мятлика (из смешанных в природе пастбищных трав), ежи сборной, райграса многолетнего, тимофеевки луговой, кукурузы (маиса), проса, овса, сорго, соевых бобов, деревьев (всходов подстриженных деревьев для сена из деревьев), пшеницы и бобовых.
Термин ʺкомбикормʺ означает промышленный корм в форме муки, гранулы, орешков, жмыха или крошки. Комбикорма можно смешивать с различным сырьем и добавками. Эти смеси составляют в соответствии с конкретными требованиями целевого животного.
Комбикорма могут быть полными кормами, которые обеспечивают все суточно необходимые питательные вещества, концентратами, которые обеспечивают часть рациона (белковую, энергетическую), или добавками, которые обеспечивают только дополнительные микронутриенты, такие как минералы и витамины
Основными ингредиентами, используемыми в комбикорме, являются кормовые зерновые, которые включают кукурузу, пшеницу, рожь, маис, соевые бобы, сорго, овес и ячмень.
Соответственно, премиксом, как обозначается в данном документе, может быть композиция, состоящая из микроингредиентов, таких как витамины, минералы, химические консерванты, антибиотики, продукты ферментации и другие необходимые ингредиенты. Премиксами обычно являются композиции, подходящие для смешивания в промышленных рационах.
Любой кормовой продукт по настоящему изобретению может содержать один или несколько кормовых материалов, выбранных из группы, включающей: a) злаки, такие как мелкие зерновые (например, пшеницу, ячмень, рожь, овес и их комбинации) и/или крупные зерновые, такие как маис или сорго; b) побочные продукты переработки растений, такие как сухая барда с растворимыми веществами кукурузы (DDGS), пшеничные отруби, пшеничная крупка, мелкие пшеничные отруби, рисовые отруби, рисовая шелуха, овсяная шелуха, ядро кокосового ореха, цитрусовый жом, кукурузные волокна, мука из жмыха зародышей кукурузы, кукурузные отруби, кормовой продукт хомини, кукурузный глютеновый кормовой продукт, глютеновая мука, мелкие пшеничные отруби, пшеничная крупка или их комбинации; c) белок, полученный из таких источников, как соя, подсолнечник, арахис, люпин, горох, конские бобы, хлопчатник, канола (семя рапса), рыбная мука, сухой белок плазмы крови, мясо-костная мука, картофельный белок, молочная сыворотка, копра, кунжут; d) масла и жиры, полученные из растительных и животных источников; e) минералы и витамины.
Кормовой продукт по настоящему изобретению, может содержать по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50% или по меньшей мере 60% по весу кукурузной и соевой муки или кукурузы и необезжиренной сои, или пшеничной муки, или кормовой муки из жмыха семян подсолнечника.
Дополнительно или в качестве альтернативы кормовой продукт по настоящему изобретению, может содержать по меньшей мере один кормовой материал с высоким содержанием клетчатки и/или по меньшей мере один продукт переработки по меньшей мере одного кормового материала c высоким содержанием клетчатки для получения кормового продукта с высоким содержанием клетчатки. Примеры кормовых материалов с высоеим содержанием клетчатки включают: пшеницу, ячмень, рожь, овес, отходы переработки растений (например, зерновых), такие как сухая барда с растворимыми веществами кукурузы (DDGS), пшеничные отруби, пшеничная крупка, мелкие пшеничные отруби, рисовые отруби, рисовая шелуха, овсяная шелуха, ядро кокосового ореха, цитрусовый жом, кукурузное волокно, мука из зародышей кукурузы, кукурузные отруби, кормовой продукт хомини, кукурузный глютеновый кормовой продукт, глютеновая мука, мелкие пшеничные отруби, пшеничная крупка или их комбинации. Некоторые источники белка также можно рассматривать как источники с высоким содержанием клетчатки: белок, полученный из источников, таких как подсолнечник, люпин, конские бобы и хлопчатник.
В настоящем изобретении корм может быть одним или несколькими из следующего: комбикорм и премикс, включая гранулы, орешки или (крупный рогатый скот) жмых; сельскохозяйственная культура или остатки сельскохозяйственных культур: кукуруза, соевые бобы, сорго, овес, ячмень, кукурузная солома с початками, копра, солома, мякина, отходы сахарной свеклы; рыбная мука; свежесрезанная трава и другие кормовые растения; мясо-костная мука; меласса; масличный жмых и прессованный жмых; олигосахариды; консервированные кормовые растения: сено и силос; водоросли; семена и зерна, цельные или подготовленные дроблением, измельчением и т. д.; проросшие зерновые и бобовые; экстракт дрожжей.
Термин ʺкормʺ в настоящем изобретении также охватывает в некоторых вариантах осуществления корм для домашних питомцев. Корм для домашних питомцев представляет собой растительный материал или материал животного происхождения, предназначенный для потребления домашними питомцами, такой как корм для собак или корм для кошек. Корм для домашних питомцев, такой как корм для собак и кошек, может быть либо в сухой форме, такой как гранулированный корм для собак, либо во влажный консервированной форме. Корм для кошек может содержать аминокислоту таурин.
Термин ʺкормʺ в настоящем изобретении также охватывает в некоторых вариантах осуществления корм для рыб. Корм для рыб в норме содержит макронутриенты, микроэлементы и витамины, необходимые для поддержания здоровыми рыб, содержащихся в неволе. Корм для рыб может находиться в форме хлопьевидной частицы, гранулы или таблетки. Гранулированные формы, некоторые из которых быстро тонут в воде, часто используют для более крупных видов рыбы или видов, питающихся на дне. Некоторые корма для рыб также содержат добавки, такие как бета-каротин или половые гормоны для искусственного усиления окраски декоративных рыб.
Термин ʺкормʺ в настоящем изобретении также охватывает в некоторых вариантах осуществления корм для птиц. Корм для птиц включает пищу, которую используют как в кормушках для птиц, так и для кормления птиц домашних питомцев. Как правило, корм для птиц содержит разные семена, но также может включать нутряное сало (говяжий или бараний жир).
Используемый в данном документе термин "приведение в контакт" относится к опосредованному или непосредственному применению композиции по настоящему изобретению по отношению к продукту (например, корму). Примеры способов применения, которые можно использовать, включают без ограничения обработку продукта в материале, содержащем композицию кормовой добавки, непосредственное воздействие путем смешивания композиции кормовой добавки с продуктом, нанесение распылением композиции кормовой добавки на поверхность продукта или погружение продукта в препарат на основе композиции кормовой добавки.
В одном варианте осуществления композицию кормовой добавки по настоящему изобретению предпочтительно смешивают с продуктом (например, кормовым продуктом). В качестве альтернативы композицию кормовой добавки можно включать в эмульсию или сырьевые ингредиенты кормового продукта.
Для некоторых применений является важным, что композицию делают доступной около поверхности продукта или на поверхности продукта, подлежащего воздействию/обработке. Это позволяет придать композиции одну или несколько из следующих благоприятных характеристик: биофизическую характеристику выбранную из группы, состоящей из одного или нескольких из следующих показателей: продуктивность животного, показатели роста животного, коэффициент превращения корма (FCR), способность к усвоению сырья (например, усвояемость питательных веществ, включая усвояемость крахмала, жира, белка, волокон), усвояемость азота (например, подвздошно-кишечная усвояемость азота) и усваиваемая энергия (например, подвздошно-кишечно усвояемая энергия), отложение азота, выход туши, скорость роста, прирост веса тела, вес тела, масса, эффективность корма, процентное содержание жира в организме, распределение жира в организме, рост, размер яйца, вес яйца, масса яйца, скорость яйценоскости, прирост постного мяса, % костной золы, мг костной золы, % шпига, выход молока, % жира молока, параметры репродуктивности, такие как размер помета, выживаемость помета, % выводимости, и воздействие на окружающую среду, например, продукция навоза и/или выделение азота.
Композиции кормовой добавки по настоящему изобретению можно наносить на промежуточный слой, покрывать и/или пропитывать продукт (например, кормовой продукт или сырьевые ингредиенты кормового продукта) контролируемым количеством фермента (ферментов).
Предпочтительно композиция кормовой добавки по настоящему изобретению будет термостабильной в отношении термической обработки до приблизительно 70°C; до приблизительно 85°C или до приблизительно 95°C. Термическую обработку можно проводить в течение до приблизительно 1 минуты; до приблизительно 5 минут; до приблизительно 10 минут; до приблизительно 30 минут; до приблизительно 60 минут. Термин термостабильный означает, что по меньшей мере приблизительно 75% ферментных компонентов, которые присутствовали/были активными в добавке перед нагреванием до определенной температуры, по-прежнему присутствуют/являются активными после ее охлаждения до комнатной температуры. Предпочтительно по меньшей мере приблизительно 80% ферментных компонентов, которые присутствовали и были активными в добавке перед нагреванием до определенной температуры, по-прежнему присутствуют и являются активными после ее охлаждения до комнатной температуры.
В особенно предпочтительном варианте осуществления композицию кормовой добавки гомогенизируют с получением порошка.
В альтернативном предпочтительном варианте осуществления композицию кормовой добавки составляют в виде гранул, как описано в WO2007/044968 (названных гранулами TPT).
В другом предпочтительном варианте осуществления, когда композицию кормовой добавки составляют в гранулы, гранулы содержат гидратированную барьерную соль, покрывающую белковую сердевину. Преимуществом такого солевого покрытия является улучшенная термоустойчивость, улучшенная стабильность при хранении и защита от других кормовых добавок, неблагоприятно воздействующих каким-либо образом на фермент.
Предпочтительно соль, используемая для солевого покрытия, имеет активность воды более 0,25 или постоянную влажность более 60% при 20°C.
Предпочтительно солевое покрытие содержит Na2SO4.
Способ получения композиции кормовой добавки может также предусматривать дополнительную стадию гранулирования порошка. Порошок можно смешивать с другими компонентами, известными в данной области. Порошок или смесь, содержащую порошок, можно продавить через форму и полученные нити разрезать на подходящие гранулы переменной длины.
Необязательно стадия гранулирования может включать в себя обработку паром или стадию кондиционирования перед образованием гранул. Смесь, содержащую порошок, можно поместить в кондиционер, например, смеситель со впрыском пара. Смесь нагревают в кондиционере до определенной температуры, такой как 60-100°С, как правило, температуры составляют 70°С, 80°С, 85°С, 90°С или 95°С. Время пребывания можно варьировать от секунд до минут и даже часов. Например, 5 секунд, 10 секунд, 15 секунд, 30 секунд, 1 минута, 2 минуты, 5 минут, 10 минут, 15 минут, 30 минут и 1 час.
Будет понятно, что композиция кормовой добавки по настоящему изобретению является подходящей для добавления в любой соответствующий кормовой материал.
Используемый в данном документе термин кормовой материал означает основной кормовой материал, потребляемый животным. Далее будет понятно, что он может содержать, например, по меньшей мере одно или несколько необработанных зерновых, и/или обработанный растительный материал, и/или материал животного происхождения, такой как соевая мука или костная мука.
Используемый в данном документе термин ʺкормовой продуктʺ относится к кормовому материалу, к которому добавляли одну или несколько композиций кормовой добавки.
Специалисту будет понятно, что разные животные нуждаются в разных кормовых продуктах, и даже одному и тому же животному могут требоваться различные кормовые продукты в зависимости от цели, ради которой выращивают животное.
Предпочтительно кормовой продукт может содержать кормовые материалы, содержащие маис или кукурузу, пшеницу, ячмень, тритикале, рожь, рис, тапиоку, сорго и/или любые продукты переработки, а также богатые белком компоненты, такие как соевая мука, мука из рапсового семени, мука канолы, мука из семян хлопчатника, мука из семян подсолнечника, мука из продуктов переработки животных, и их смеси. Более предпочтительно кормовой продукт может содержать животные жиры и/или растительные масла.
Необязательно кормовой продукт может также содержать дополнительные минералы, такие как, например, кальций и/или дополнительные витамины.
Предпочтительно кормовой продукт представляет собой смесь кукурузной и соевой муки.
Кормовой продукт, как правило, получают в кормодробилках, в которых сырье сначала измельчают до подходящего размера частиц, а затем смешивают с соответствующими добавками. Затем кормовой продукт можно получить в виде кашицы или гранул; последние, как правило, предполагают способ, с помощью которого температуру поднимают до заданного уровня, а затем корм пропускают через форму для получения гранул конкретного размера. Гранулам дают остыть. Впоследствии можно добавлять жидкие добавки, такие как жир и фермент. Получение кормового продукта также может включать дополнительную стадию, которая до гранулирования включает экструзию или разбухание - в частности, с помощью подходящих методик, которые могут включать по меньшей мере использованием пара.
Кормовой продукт может быть кормовым продуктом для животного с однокамерным желудком, такого как cельскохозяйственная птица (например, бройлер, несушка, племенные бройлеры, индейка, утка, гуси, водоплавающая птица), свинья (все возрастные категории), домашние питомцы (например, собаки, кошки) или рыба, предпочтительно кормовой продукт предназначен для домашней птицы.
Исключительно в качестве примера, в кормовом продукте для цыплят, например, цыплят-бройлеров, может содержаться один или несколько ингредиентов, указанных далее в таблице, например, в %, приведенных далее в таблице.
Исключительно в качестве примера, описание рациона для цыплят, таких как цыплята-бройлеры, может быть таким, как представлено далее в таблице:
Исключительно в качестве примера, кормовой продукт для кур-несушек может содержать один или несколько ингредиентов, указанных далее в таблице, например, в %, приведенных далее в таблице:
Исключительно в качестве примера, описание рациона для кур-несушек может быть таким, как представлено далее в таблице.
Исключительно в качестве примера, кормовой продукт для индеек может содержать один или несколько ингредиентов, указанных далее в таблице, например, в %, приведенных далее в таблице:
Исключительно в качестве примера, описание рациона для индеек может быть таким, как представлено далее в таблице.
Исключительно в качестве примера, кормовой продукт для поросят может содержать один или несколько ингредиентов, указанных далее в таблице, например, в %, приведенных далее в таблице:
Исключительно в качестве примера, описание рациона для поросят может быть таким, как представлено далее в таблице:
Исключительно в качестве примера, кормовой продукт для молодняка/свиней на завершающей стадии откорма может содержать один или несколько ингредиентов, указанных далее в таблице, например, в %, приведенных далее в таблице:
Исключительно в качестве примера, описание рациона для молодняка/свиней на откорме может быть таким, как представлено далее в таблице:
ПИЩЕВОЙ/КОРМОВОЙ ПРОДУКТ НА ОСНОВЕ МЯСА
Трипептидилпептидазу, способную воздействовать на связи с участием пролина, и эндопротеазу, и/или композицию, и/или пищевую/кормовую композицию, и/или гидролизат можно использовать для получения пищевого/кормового продукта на основе мяса.
ʺПищевой продукт на основе мясаʺ и ʺкормовой продукт на основе мясаʺ в соответствии с настоящим изобретением представляет собой любой продукт на основе мяса.
Пищевой продукт на основе мяса подходит для употребления человеком и/или животным в качестве продукта питания и/или корма. В одном варианте осуществления по настоящему изобретению пищевой продукт на основе мяса представляет собой кормовой продукт для кормления животных, такой как, например, пищевой продукт для домашних питомцев. В другом варианте осуществления по настоящему изобретению пищевой продукт на основе мяса представляет собой пищевой продукт для человека.
Пищевой/кормовой продукт на основе мяса может содержать мясные ингредиенты, не являющиеся мясом, такие как, например, вода, соль, мука, белок молока, растительный белок, крахмал, гидролизованный белок, фосфат, кислота, специи, красители и/или текстурирующие средства.
Пищевой/кормовой продукт на основе мяса в соответствии с настоящим изобретением предпочтительно содержит 5-90% (вес/вес) мяса. В некоторых вариантах осуществления пищевой продукт на основе мяса может содержать по меньшей мере 30% (вес/вес) мяса, например, по меньшей мере 50%, по меньшей мере 60% или по меньшей мере 70% мяса.
В некоторых вариантах осуществления пищевой/кормовой продукт на основе мяса представляет собой мясо, прошедшее тепловую обработку, такое как, например, ветчина, филейная часть, свиная лопатка, бекон и/или свиная грудинка.
Пищевой/кормовой продукт на основе мяса может быть одним или несколькими из следующих:
сухие или полусухие колбасные изделия - такие как ферментированные продукты, сухого посола и ферментированные заквасочными культурами, например, сухие колбасы, салями, пепперони и сухая ветчина;
эмульгированные мясные продукты (например, для холодного или горячего потребления), такие как мортаделла, сосиска, мясной рулет и паштет;
рыба и морепродукты, такие как креветки, лосось, рыбные продукты с измененным составом, замороженная рыба в упаковке;
мышечная ткань свежего мяса, такая как целая маринованная мышечная ткань мяса, например, филейная часть, окорок, маринованное мясо;
молотое и/или реструктурированное свежее мясо - или мясо с измененным составом, например, обогащенное отверждаемым гелем или связующим средством вырезанное мясо, например, сырые, не подвергнутые тепловой обработке порционные куски мяса для отбивной, стейки, мясо для жаркого, свежие колбасы, говяжьи рубленые бифштексы, мясные шарики, пельмени;
продукты из сельскохозяйственной птицы - такие как грудка цыпленка или индейки, или сельскохозяйственная птица с измененным составом, например, куриные наггетсы и/или куриные колбасы;
Стерилизованные продукты - стерилизованные в автоклаве мясные продукты, например, ветчина для пикника, мясной рулет, эмульгированные продукты.
В одном варианте осуществления настоящего изобретения пищевой/кормовой продукт на основе мяса представляет собой переработанный мясной продукт, такой как, например, колбаса, болонская колбаса, мясной хлеб, измельченный мясной продукт, рубленое мясо, бекон, варено-копченая свиная колбаса, салями или паштет.
Переработанным мясным продуктом может быть, например, эмульгированный мясной продукт, полученный из эмульсии на основе мяса, такой как, например, мортаделла, болонская колбаса, пепперони, ливерная колбаса, куриная колбаса, копченая сосиска, сосиска, мясной рулет, мясной паштет.
Эмульсию на основе мяса можно подвергнуть тепловой обработке, стерилизовать или выпекать, например, в форме для выпечки или после наполнения оболочки из, например, пластика, коллагена, целлюлозы или натуральной оболочки. Переработанным мясным продуктом может быть также реструктурированный мясной продукт, такой как, например, реструктурированная ветчина. Мясной продукт по настоящему изобретению можно подвергать стадиям обработки, таким как, например, соление, т. е. сухой посол; консервирование, например, консервирование солевым раствором; сушка; копчение; ферментация; тепловая обработка; консервирование в герметичной таре; стерилизация; нарезка и/или измельчение.
В другом варианте осуществления пищевой/кормовой продукт может быть эмульгированным мясным продуктом.
МЯСО
Используемый в данном документе термин ʺмясоʺ означает любой вид ткани, полученный из любого вида животного.
Используемый в данном документе термин ʺмясоʺ может представлять собой ткань, содержащую мышечные волокна, полученные от животного. Мясо может представлять собой мышцу животного, например, целую мышцу животного или части, вырезанные из мышцы животного.
В другом варианте осуществления мясо может содержать внутренние органы животного, такие как, например, сердце, печень, почка, селезенка, тимус и мозг.
Термин мясо охватывает мясо, которое измельчается, рубится или разрезается на мелкие кусочки любым другим подходящим способом, известным в данной области.
Мясо может быть получено из любого вида животного, например, из коровы, свиньи, барана, овцы, козы, курицы, индейки, страуса, фазана, оленя, лося, северного оленя, буйвола, бизона, антилопы, верблюда, кенгуру; любого вида рыбы, например, из шпрот, трески, пикши, тунца, морского угря, лосося, сельди, сардины, скумбрии, ставриды, сайры, сельди-круглобрюшки, минтая, камбалы, анчоуса, сардинки, путассу, тихоокеанской путассу, форели, сома, окуня, мойвы, марлина, красного окуня, тресочки Эсмарка и/или хека; любого вида моллюсков, например, двустворчатого моллюска, мидии, гребешка, сердцевидки, береговой улитки, улитки, устрицы, креветки, омара, лангустина, краба, рака, каракатицы, кальмара и/или осьминога.
В одном варианте осуществления мясо представляет собой говядину, свинину, курятину, баранину и/или индюшатину.
БИОФИЗИЧЕСКАЯ ХАРАКТЕРИСТИКА
Кормление животного трипептидилпептидазой (необязательно, в комбинации с эндопротеазой) и/или кормовым продуктом, и/или композицией кормовой добавки, и/или композицией по настоящему изобретению может улучшить биофизическую характеристику выкармливаемого таким образом животного.
Соответственно, способ и/или применение могут дополнительно предусматривать введение животному по меньшей мере одного кормового компонента, по меньшей мере одного минерала, по меньшей мере одного витамина или их комбинаций.
В качестве альтернативы или дополнительно способ и/или применение могут дополнительно предусматривать введение животному по меньшей мере одной эндопротеазы.
Используемое в данном документе выражение ʺбиофизическая характеристикаʺ означает любое биофизическое свойство животного, которое улучшает его здоровье, и/или продуктивность, и/или выход продукции.
В качестве примера, биофизическая характеристика может представлять собой одну или несколько, выбранных из группы, состоящей из одного или нескольких из следующих показателей: продуктивность животного, показатели роста животного, коэффициент превращения корма (FCR), способность к усвоению сырья (например, усвояемость питательных веществ, включая усвояемость крахмала, жира, белка, волокон), усвояемость азота (например, подвздошно-кишечная усвояемость азота) и усваиваемая энергия (например, подвздошно-кишечно усваиваемая энергия), отложение азота, выход туши, скорость роста, прирост веса тела, вес тела, масса, эффективность корма, процентное содержание жира в организме, распределение жира в организме, рост, размер яйца, вес яйца, масса яйца, скорость яйценоскости, прирост постного мяса, % костной золы, мг костной золы, % шпига, выход молока, % жира молока, параметры репродуктивности, такие как размер помета, выживаемость помета, % выводимости, и воздействие на окружающую среду, например, продукция навоза и/или выделение азота.
Соответственно, биофизическая характеристика может представлять собой одну или несколько, выбранных из группы, состоящей из: коэффициента превращения корма, усвояемости азота (например, подвздошно-кишечной усвояемости азота) и усвояемой энергии (например, подвздошно-кишечно усвояемой энергии).
В предпочтительном варианте осуществления биофизическая характеристика может представлять собой способность переваривать белок.
В одном варианте осуществления биофизическая характеристика животного означает продуктивность животного.
Соответственно, введение животному композиции кормовой добавки, и/или корма, и/или кормового продукта, и/или кормового ингредиента, и/или премикса по настоящему изобретению не может, по сути, повысить заболеваемость некротическим энтеритом у животного по сравнению с животным, которым не скармливают композицию кормовой добавки, и/или корм, и/или кормовой продукт, и/или кормовой ингредиент, и/или премикс по настоящему изобретению.
Используемый в данном документе термин ʺпо сути, повышает заболеваемость некротическим энтеритомʺ означает, что заболеваемость не повышается более чем приблизительно на 20%, предпочтительно не повышается более чем приблизительно на 10%. Предпочтительно это означает, что заболеваемость некротическим энтеритом не повышается более чем приблизительно на 5%, более предпочтительно более чем приблизительно на 1%.
ПРОДУКТИВНОСТЬ
Используемое в данном документе выражение ʺпродуктивность животногоʺ может определяться эффективностью корма, и/или приростом массы тела животного, и/или коэффициентом превращения, и/или усвояемостью питательных веществ в корме (например, усвояемостью аминокислот), и/или усвояемой энергией, или обменной энергией в корме, и/или удержанием азота.
Предпочтительно ʺпродуктивность животногоʺ определяется эффективностью корма, и/или приростом веса тела животного, и/или коэффициентом превращения корма.
Под ʺулучшенной продуктивностью животногоʺ подразумевают, что имеет место повышенная эффективность корма, и/или повышенный прирост веса тела, и/или сниженный коэффициент превращения корма, и/или улучшенная усвояемость питательных веществ или энергии корма, и/или улучшенное удержание азота у субъекта в результате использования гидролизата по настоящему изобретению или композиции (например, композиции пищевой или кормовой добавки) по настоящему изобретению в корме по сравнению со скармливанием животному корма, не содержащего гидролизат или композицию, полученную в соответствии с настоящим изобретением.
Предпочтительно под ʺулучшенной продуктивностью животногоʺ подразумевается, что имеет место повышенная эффективность корма, и/или повышенный прирост веса тела, и/или сниженный коэффициент превращения корма.
Используемый в данном документе термин ʺэффективность кормаʺ относится к величине прироста веса тела у животного, которая возникает, когда животное кормится ad libitum или поедает определенное количество пищи в течение определенного периода времени.
Под ʺповышенной эффективностью кормаʺ подразумевается, что использованием гидролизата по настоящему изобретению или композиции (например, композиции пищевой или кормовой добавки) в соответствии с настоящим изобретением в корме приводит к повышенному приросту веса тела на единицу потребления корма по сравнению с животным, которому не скармливали гидролизат или композицию, полученную в соответствии с настоящим изобретением.
КОЭФФИЦИЕНТ ПРЕВРАЩЕНИЯ КОРМА (FCR)
Используемый в данном документе термин ʺкоэффициент превращения кормаʺ означает количество корма, cкармливаемого животному для увеличения веса животного на определенну величину.
Улучшенный коэффициент превращения корма означает более низкий коэффициент кормоотдачи.
Под ʺболее низким коэффициентом превращения кормаʺ или ʺулучшенным коэффициентом превращения кормаʺ подразумевается, что использованием гидролизата по настоящему изобретению или композиции (например, композиции пищевой или кормовой добавки) в корме приводит к меньшему количеству корма, которое требуется для скармливания животному, чтобы повысить вес животного на определенную величину, по сравнению с количеством корма, необходимого для повышения веса животного на ту же величину без использования указанного гидролизата или композиции, полученной в соответствии с настоящим изобретением.
УСВОЯЕМОСТЬ ПИТАТЕЛЬНЫХ ВЕЩЕСТВ
Термин "усвояемость питательных веществ", используемый в данном документе, означает долю питательных веществ, которая исчезает из желудочно-кишечного тракта или определенного участка желудочно-кишечного тракта, например, тонкого кишечника. Усвояемость питательных веществ можно измерить как разницу между тем, что вводят субъекту, и тем, что выходит с фекалиями субъекта, или между тем, что вводят субъекту, и тем, что остается в содержимом определенного участка желудочно-кишечного тракта, например, в подвздошной кишке.
Усвояемость питательных веществ, используемую в данном документе, можно измерить по разнице между поглощением нутриентом и выделенным нутриентом с помощью полного сбора экскрементов в течение определенного периода времени; или с использованием инертного маркера, который не абсорбируется животным и позволяет исследователю рассчитывать количество питательного вещества, которое исчезло во всем желудочно-кишечном тракте или в участке желудочно-кишечного тракта. Такой инертный маркер может представлять собой диоксид титана, оксид хрома или нерастворимую в кислоте золу. Усвояемость можно выразить в виде процентного содержания нутриента в корме, или в виде единиц массы усваиваемого питательного вещества на единицы массы питательного вещества в корме.
Усвояемость питательных веществ, используемая в данном документе, охватывает усвояемость крахмала, усвояемость жиров, усвояемость белка и усвояемость аминокислот.
Соответственно, использование трипептидилпептидазы, способной воздействовать на связи с участием пролина, в соответствии со способами, и/или применениями, или любыми аспектами настоящего изобретения (необязательно в комбинации по меньшей мере с одной эндопротеазой) повышает усвояемость белка и/или аминокислот у животного, которому скармливают композицию кормовой добавки, и/или кормовой ингредиент, и/или корм, и/или кормовой продукт, и/или премикс, и/или гидролизат по настоящему изобретению.
Выражение усвояемость энергии, используемое в данном документе, означает валовую энергию потребляемого корма за вычетом валовой энергии фекалий, или валовую энергию потребляемого корма за вычетом валовой энергии оставшегося содержимого в определенном участке желудочно-кишечного тракта животного, например, в подвздошной кишке. Выражение обменная энергия, используемое в данном документе, относится к кажущейся обменной энергии и означает валовую энергию потребляемого корма за вычетом валовой энергии, содержащейся в фекалиях, моче и газообразных продуктах пищеварения. Усвояемость энергии и обменную энергию можно измерить как разницу между потреблением валовой энергии и валовой энергией, выделенной с фекалиями или содержимым, присутствующим в определенном участке желудочно-кишечного тракта, с использованием тех же способов, что и для измерения усвояемости нутриентов, с соответствующими поправками на выведение азота для расчета обменной энергии корма.
УДЕРЖАНИЕ АЗОТА
Выражение удержание азота, используемое в данном документе, означает способность субъекта удерживать азот из рациона, что обуславливает прирост массы тела. Отрицательный баланс азота встречается тогда, когда выведение азота превышает суточное потребление, и часто наблюдается при потере мышечной массы. Положительный баланс азота часто ассоциируется с ростом мышц, особенно у растущих животных.
Удержание азота можно измерить как разницу между потреблением азота и выделенным азотом посредством полного сбора экскрементов и мочи в течение определенного периода времени. Понятно, что выделяемый азот включает непереваренный белок корма, эндогенные белковые выделения, микробный белок и азот мочи.
ВЫХОД ТУШИ И ВЫХОД МЯСА
Используемый в данном документе термин выход туши означает величину туши, пропорционально живому весу тела после процесса убоя с коммерческой или экспериментальной целью. Термин туша означает тело животного, которое забито c пищевой целью, с удалением головы, внутренностей, части конечностей и перьев или кожи. Используемый в данном документе термин выход мяса означает количество съедобного мяса в пропорции к живому весу тела или количество определенного мяса, вырезанного в пропорции к живой массе тела.
ПРИРОСТ ВЕСА ТЕЛА
Настоящее изобретение дополнительно предлагает способ повышения прироста веса тела у субъекта, например, у сельскохозяйственной птицы или свиньи, предусматривающий скармливание указанному субъекту кормового продукта, содержащего композицию кормовой добавки в соответствии с настоящим изобретением.
ʺПовышенный прирост веса телаʺ касается животного, имеющего повышенный вес тела при скармливании корма, содержащего гидролизат по настоящему изобретению или композицию (например, композицию пищевой или кормовой добавки) в соответствии с настоящим изобретением, по сравнению с животным, получающим корм, не содержащий гидролизат или композицию, полученную в соответствии с настоящим изобретением.
ПРОДУКТЫ, НЕ ЯВЛЯЮЩИЕСЯ ПИЩЕВЫМИ ПРОДУКТАМИ
Настоящее изобретение предлагает продукт, не являющийся пищевым продуктом, содержащий гидролизат по настоящему изобретению.
Получаемый гидролизат (например, полученный) можно использовать в получении продукта для местного применения, такого как лосьон, крем, мазь, скраб, очищающее средство и им подобные. Соответственно, в данном документе рассматриваются такие продукты, которые содержат описанные в данном документе гидролизованные белковые композиции. Такие продукты применимы, например, для терапевтических целей, например, для обеспечения смягчения сухой кожи, облегчения зуда, устранения дискомфорта и им подобного.
Эти продукты предпочтительно содержат в дополнение к гидролизованному белковому компоненту липид, воск, масло, эмульсию вода в масле, эмульсию масло в воде или им подобное в качестве основы. Как правило, они могут дополнительно содержать один или несколько ароматизирующих компонентов, а также другие ингредиенты, такие как поверхностно-активные вещества или эмульгаторы.
Также предложены косметические продукты и другие вспомогательные средства для поддержания внешнего вида или вспомогательные средства для поддержания красоты, содержащие описанные в данном документе гидролизаты белка молока или сыворотки молока.
В одном варианте осуществления косметический продукт можно наносить на лицо, щеки, губы или глаза человека. В другом варианте осуществления продукт можно использовать в отношении любой части тела, чтобы улучшить внешний вид кожи или, например, уменьшить появление морщин, родинок, веснушек, рубцов, пятен и им подобных.
ПРЕИМУЩЕСТВА
Авторы настоящего изобретения впервые показали, что трипептидилпептидаза, способная воздействовать на связи с участием пролина, по настоящему изобретению является очень выгодной для применения в получении гидролизатов и дает преимущества субъектам, получающим гидролизат, или продукт питания, и/или корм, содержащие гидролизат, и/или композицию пищевой или кормовой добавки, содержащую трипептидилпептидазу, способную воздействовать на связи с участием пролина (необязательно в комбинации по меньшей мере с одной эндопротеазой).
В качестве альтернативны или дополнительно, гидролизат, полученный с использованием эндопротеазы и трипептидилпептидазы, также может иметь уменьшенную горечь по сравнению с необработанным гидролизатом.
Преимущественно трипептидилпептидаза, способная воздействовать на связи с участием пролина, предназначенная для использования в настоящем изобретении, способна воздействовать на широкий спектр пептидных и/или белковых субстратов, и вследствие наличия такой широкой субстратной специфичности затрудняется ингибирование расщепления субстратов, обогащенных определенными аминокислотами (например, пролином, и/или лизином, и/или аргинином, и/или глицином). Следовательно, применение такой трипептидилпептидазы, способной воздействовать на связи с участием пролина, может эффективно и/или быстро разрушать белковые субстраты (например, присутствующие в субстрате для получения гидролизата).
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, может обладать предпочтительной активностью в отношении пептидов и/или белков, имеющих одно или несколько из лизина, аргинина или глицина в положении Р1. Не вдаваясь в теорию, пептидные и/или белковые субстраты, содержащие эти аминокислоты в положении Р1, могут быть трудно расщепляемыми для многих трипептидилпептидаз и/или протеаз в целом, и при обнаружении таких остатков расщепление пептидного и/или белкового субстрата с помощью трипептидилпептидазы и/или протеазы может прекращаться или замедляться. Преимущественно с использованием трипептидилпептидазы, способной воздействовать на связи с участием пролина, по настоящему изобретению можно эффективно расщеплять белковые и/или пептидные субстраты, содержащие лизин, аргинин и/или глицин в P1, без существенного замедления реакции расщепления.
Настоящее изобретение также предлагает трипептидилпептидазу, способную воздействовать на связи с участием пролина, в дополнение к активностям, описанным выше, которая может воздействовать на связи с участием пролина в положении P2, P2ʹ, P3 и P3ʹ. Это является преимущественным, поскольку позволяет эффективно расщеплять пептидные и/или белковые субстраты, имеющие участки с пролином, и позволяет расщеплять широкий спектр пептидных и/или белковых субстратов.
Преимущественно трипептидилпептидаза, способная воздействовать на связи с участием пролина, может обладать предпочтительной активностью в отношении пептидов и/или белков, имеющих лизин в положении Р1, что позволяет эффективно расщеплять субстраты с высоким содержанием лизина, такие как белок сыворотки молока.
Настоящее изобретение также предлагает термостабильные трипептидилпептидазы, способные воздействовать на связи с участием пролина, которые в меньшей степени склонны к денатурированию и/или будут таким образом сохранять активность в течение более длительного периода времени по сравнению с вариантом, не являющимся термостабильным.
Преимущественно трипептидилпептидаза, способная воздействовать на связи с участием пролина, может обладать активностью в пределах показателя pH, составляющего приблизительно pH 7, и поэтому ее можно использовать со щелочной эндопротеазой. Это означает, что изменение рН реакционной среды, содержащей белковый и/или пептидный субстрат для получения гидролизата, между обработками ферментами не является необходимым. Иными словами, это позволяет одновременно вводить трипептидилпептидазу, способную воздействовать на связи с участием пролина, и эндопротеазу в реакцию, что может сделать способ получения гидролизата более быстрым, и/или более эффективным, и/или более рентабельным. Кроме того, это позволяет проводить более эффективную реакцию, поскольку при более низких значениях рН субстрат может выпадать в осадок в растворе и, следовательно, не расщепляться.
Трипептидилпептидазу, обладающую активностью при кислом pH, можно использовать в комбинации с кислой эндопротеазой, при этом преимущественно не требуется изменять pH реакционной среды, содержащей белковый и/или пептидный субстрат для получения гидролизата, между обработками ферментами. Иными словами, это позволяет одновременно вводить трипептидилпептидазу, способную воздействовать на связи с участием пролина, и эндопротеазу в реакцию, что может сделать способ получения гидролизата более быстрым, и/или более эффективным, и/или более рентабельным.
Преимущественно эндопротеаза в комбинации с трипептидилпептидазой, способной воздействовать на связи с участием пролина, способна расщеплять белковые субстраты, ассоциированные с инициированием иммунного ответа у чувствительных индивидуумов, страдающих от такого заболевания, как аллергия на белок молока и/или аллергия на соевый белок.
Преимущественно применение эндопротеазы в комбинации с трипептидилпептидазой, способной воздействовать на связи с участием пролина, может повысить эффективность расщепления субстрата. Не вдаваясь в теорию, полагают, что эндопротеаза способна расщеплять пептидный и/или белковый субстрат в нескольких участках в удалении от C- или N-конца, давая тем самым больше N-концов для использования в качестве субстрата для трипептидилпептидазы, способной воздействовать на связи с участием пролина, тем самым выгодно повышая эффективность реакции и/или сокращая время реакции.
Многие современные способы кормления включают введение животным щелочной протеазы, активной при высоком показателе рН (например, рН 8). По этой причине щелочные протеазы активны только в нижней (например, дистальной) части желудочно-кишечного тракта животного, где среда желудочно-кишечного тракта становится более щелочной, например, в дистальной части тонкого кишечника и в толстой кишке и слепой кишке. Не вдаваясь в теорию, полагают, что продуцирование олигопептидов в дистальной части желудочно-кишечного тракта увеличивает популяции микробов, использующих олигопептиды, которые, в свою очередь, могут вызывать проблемы в виде заболеваний кишечника и/или уменьшать количество питательных веществ, доступных для поглощения животным. Кроме того, в дистальной части желудочно-кишечного тракта (т. е. в нижней части) слизистая оболочка менее защищена, чем в верхних отделах (например, мышечный желудок, преджелудок или желудок), и таким образом она легче повреждается, что приводит к воспалению. Преимущественно применение трипептидилпептидазы, способной воздействовать на связи с участием пролина, обладающей активностью при кислом значении pH, устраняет эту проблему, поскольку она способна расщеплять ее субстрат в верхнем отделе желудочно-кишечного тракта, существенно тем самым не увеличивая популяции микробов и/или увеличивая количество питательных веществ (например, аминокислот/пептидов), доступных для поглощения животным, и/или уменьшая воспаление.
Преимущественно применение эндопротеазы в комбинации с трипептидилпептидазой, способной воздействовать на связи с участием пролина, может повысить эффективность расщепления субстрата. Не вдаваясь в теорию, полагают, что эндопротеаза способна расщеплять пептидный и/или белковый субстрат в нескольких участках в удалении от C- или N-конца, давая тем самым больше N-концов для использования в качестве субстрата для трипептидилпептидазы, способной воздействовать на связи с участием пролина, тем самым выгодно повышая эффективность реакции и/или сокращая время реакции.
Применение кислой эндопротеазы и трипептидилпептидазы, способной воздействовать на связи с участием пролина, обладающей активностью при кислом значении pH, является очень выгодным, поскольку эти два фермента могут взаимодействовать для переваривания пептидного и/или белкового субстрата в верхнем отделе желудочно-кишечного тракта (например, в мышечном желудке, преджелудке или желудке) животного, и могут быть активными в комбинации с другими эндогенными протеазами (например, с пепсином, трипсином или химотрипсином), присутствующими у животного.
Преимущественно скармливание животному трипептидилпептидазы, способной воздействовать на связи с участием пролина, приводит к увеличению прироста массы тела, и/или снижению коэффициента превращения корма, и/или повышенной усвояемости азота (например, подвздошно-кишечной усвояемости азота), и/или повышенному усвоению энергии (например, подвздошно-кишечному усвоению энергии).
Применение эндопротеазы, экзо-трипептидилпептидазы семейства S53 (например, такой как трипептидилпептидаза, способная воздействовать на связи с участием пролина) и аминопептидазы, необязательно в комбинации с одним или несколькими дополнительными компонентами, имеет множество преимуществ:
• это позволяет эффективно получать отдельные аминокислоты, и/или дипептиды, и/или трипептиды, которые могут эффективно поглощаться субъектом (например, из-за наличия лучшего осмотического потенциала для поглощения);
• белковый и/или пептидный субстрат может более эффективно и/или более быстро перевариваться;
• сниженное ингибирование в конечной точке (т. e. ингибирование собственными продуктами реакции) трипептидилпептидазы, способной воздействовать на связи с участием пролина, особенно при использовании in vitro, например, при получении гидролизата путем переваривания трипептидов до отдельных аминокислот и/или дипептидов; и/или
• синергетическая и/или аддитивная активность в отношении субстратов, содержащих высокие уровни пролина, лизина, аргинина и/или глицина.
ДОПОЛНИТЕЛЬНЫЕ ОПРЕДЕЛЕНИЯ
Если не определено иное, все технические и научные термины, используемые в данном документе, имеют то же самое значение, которое обычно понимает специалист в данной области, к которой принадлежит настоящее раскрытие. Singleton, et al., DICTIONARY OF MICROBIOLOGY AND MOLECULAR BIOLOGY, 20 ED., John Wiley and Sons, New York (1994), и Hale & Marham, THE HARPER COLLINS DICTIONARY OF BIOLOGY, Harper Perennial, NY (1991) предоставляют для специалиста общий словарь для многих терминов, используемых в данном раскрытии.
Настоящее раскрытие не ограничено иллюстративными способами и материалами, раскрытыми в данном документе, и любые способы и материалы, подобные или эквивалентные описанным в данном документе можно использовать при практическом осуществлении или при испытании вариантов осуществления по настоящему раскрытию. Область числовых значений включает числа, определяющие диапазон. Если не указано иное, любые последовательности нуклеиновых кислот пишутся слева направо в направлении от 5' к 3'; аминокислотные последовательности пишут слева направо в направлении от аминогруппы до карбоксигруппы, соответственно.
Заглавия, представленные в данном документе, не являются ограничениями различных аспектов или вариантов осуществления настоящего раскрытия, которые могут присутствовать, исходя из описания в целом. Соответственно, термины, определяемые непосредственно ниже, более полно определены на основе описания в целом.
Аминокислоты упоминаются в данном документе с использованием названия аминокислоты, трехбуквенной аббревиатуры или однобуквенной аббревиатуры.
Используемый в данном документе термин ʺбелок" включает белки, полипептиды и пептиды.
Используемый в данном документе термин ʺаминокислотная последовательностьʺ является синонимом термина ʺполипептидʺ и/или термина ʺбелокʺ. В некоторых случаях термин ʺаминокислотная последовательностьʺ является синонимом термина ʺпептидʺ. В некоторых случаях термин ʺаминокислотная последовательностьʺ является синонимом термина ʺферментʺ.
Термины "белок" и "полипептид" используются в данном документе взаимозаменяемо. В настоящем раскрытии и формуле изобретения могут использоваться традиционные однобуквенный и трехбуквенный коды для аминокислотных остатков. 3-буквенный код для аминокислот определен в согласии с IUPACIUB объединенным комитетом по биохимической номенклатуре (Joint Commission on Biochemical Nomenclature (JCBN)). Также понятно, что полипептид может быть закодирован несколькими нуклеотидными последовательностями из-за вырожденности генетического кода.
Другие определения терминов могут появляться по всему описанию. Перед более подробным описанием иллюстративных вариантов осуществления, необходимо понять, что настоящее раскрытие не ограничено конкретными описанными вариантами осуществления, поскольку таковые могут, конечно, изменяться. Также необходимо понимать, что терминология, используемая в данном документе, приведена только с целью описания конкретных вариантов осуществления, и не предполагает ограничительный характер, поскольку объем настоящего раскрытия будет ограничиваться только прилагаемой формулой изобретения.
В случае, если представлен диапазон значений, необходимо понимать, что каждое промежуточное значение, до десятой единицы измерения нижнего предела, если только в контексте явно не предписано иное, между верхними и нижними пределами этого диапазона также является определенным образом раскрытым. Каждый меньший диапазон между любым указанным значением или промежуточным значением в указанном диапазоне и любым другим указанным или промежуточным значением в этом указанном диапазоне охвачен настоящим раскрытием. Верхние и нижние пределы этих меньших диапазонов независимо могут быть включенными или исключенными из диапазона, и каждый диапазон, в котором один, ни один из них или оба предела включены в меньшие диапазоны, также охвачен настоящим раскрытием, при условии любого специальным образом исключенного предела в указанном диапазоне. В случае, если указанный диапазон включает один или оба из пределов, диапазоны, исключающие один или оба из диапазонов, включивших пределы, также включены в настоящее раскрытие.
Необходимо отметить, что используемые в данном документе и в прилагаемой формуле изобретения формы единственного числа включают формы множественного числа, если контекст четко не определяет иное. Так, например, упоминание ʺтрипептидилпептидазы, способной воздействовать на связи с участием пролинаʺ, ʺэндопротеазыʺ, ʺэкзо-трипептидилпептидазы семейства S53ʺ, ʺаминопептидазыʺ или "фермента" включает в себя множество таких кандидатных средств, а упоминание ʺкормаʺ, ʺкормового продуктаʺ, ʺпремиксаʺ или ʺкомпозиции кормовой добавкиʺ включает в себя упоминание одного или нескольких кормов, кормовых продуктов, премиксов и их эквивалентов, известных специалисту в данной области, и так далее.
Публикации, обсуждаемые в данном документе, представлены только для их раскрытия до даты подачи настоящей заявки. В данном документе ничего не следует истолковывать в виде признания того, что такие публикации относятся к предшествующему уровню техники формулы изобретения, прилагаемой к данному документу.
Настоящее изобретение будет описано, исключительно в качестве примера, со ссылкой на следующие фигуры и примеры.
ПРИМЕРЫ
ПРИМЕР 1
Клонирование и экспрессия трипептидилпептидаз, способных воздействовать на связи с участием пролина, в Trichoderma reesei
Синтетические гены, кодирующие трипептидилпептидазы, способные воздействовать на связи с участием пролина, конструировали с использованием кодонов, предпочтительных для экспрессии в Trichoderma reesei, за исключением TRI079 (SEQ ID No. 57) и TRI083 (SEQ ID No. 56), которые конструировали в виде геномных последовательностей. Предсказанные сигнальные последовательности секреции (SignalP 4.0: Discriminating signal peptides from transmembrane regions. Thomas Nordahl Petersen, Søren Brunak, Gunnar von Heijne & Henrik Nielsen. Nature Methods, 8:785-786, 2011) заменяли (за исключением TRI079 и TRI083) сигнальной последовательностью секреции из кислой грибковой протеазы (AFP) Trichoderma reesei и интроном из гена глюкоамилазы (TrGA1) Trichoderma reesei (см. нижнюю панель фигуры 7).
Синтетические гены вводили в целевой вектор pTTT-pyrG13 (как описано в US8592194 B2, принципы которого включены в данный документ посредством ссылки) с использованием смеси ферментов LR ClonaseTM (Life Technologies), получая в результате конструкцию на основе векторов экспрессии pTTT-pyrG13 для трипептидилпептидаз, способных воздействовать на связи с участием пролина, согласно данному документу. Векторы экспрессии, кодирующие SEQ ID No. 1, 2 и 29, показаны на фигуре 1, а кодирующие SEQ ID No. 12 и 39 показаны на фигуре 7. Векторы экспрессии, кодирующие SEQ ID No. 96 или 97 (TRI045), показаны на фигуре 2. 5-10 мкг векторов экспрессии отдельно трансформировали в подходящий штамм Trichoderma reesei с помощью PEG-опосредованной трансформации протопластов в сущности, как описано в (US8592194 B2). Прорастающие споры собирали центрифугированием, промывали и обрабатывали с помощью 45 мг/мл раствора лизирующего фермента (Trichodermaharzianum, Sigma L1412) для лизиса клеточных стенок грибков. Дальнейшее получение протопластов осуществляли с помощью стандартного способа, описанного Penttilä et al. (Gene 61(1987) 155-164).
Споры собирали с использованием раствора с 0,85% NaCl, 0,015% Tween 80. Суспензии спор использовали для инокуляции жидких культур.
Культуры выращивали в течение 7 дней при 28°С и 80% относительной влажности со встряхиванием при 180 об./мин. Надосадочные жидкости культур собирали путем вакуумной фильтрации и использовали для измерения экспрессии и эффективности фермента.
ПРИМЕР 2
Очистка и определение характеристик
A. Очистка трипептидилпептидазы, способной воздействовать на связи с участием пролина
Обессоливание образцов осуществляли на колонке PD10 (GE Life Sciences, США), уравновешенной с помощью 20 мМ Na-ацетата, pH 4,5 (буфер A). Для ионообменной хроматографии на Source S15 HR25/5 (GE Life Sciences, США) колонку уравновешивали буфером A. Обессоленный образец (7 мл) наносили на колонку со скоростью потока 6 мл/мин. и колонку промывали буфером A. Связанные белки элюировали линейным градиентом 0-0,35 M NaCl в 20 мM Na-ацетате, pH 4,5 (35 мин.). В течение всего прогона собирали фракции по 10 мл. Собранные образцы анализировали в отношении трипептидил-аминопептидазной активности, как описано ниже. Концентрацию белка рассчитывали на основе измерения оптической плотности при 280 нм и теоретического значения оптической плотности белка, вычисленного с использованием инструмента ExPASy ProtParam (http://web.expasy.org/cgi-bin/protparam/protparam).
B. Определение активности трипептидилпептидазы, способной воздействовать на связи с участием пролина, и эндопептидазы
Хромогенный пептид H-Ala-Ala-Ala-pNA (MW=387.82; Bachem, Швейцария) использовали для определения активности трипептидилпептидазы, способной воздействовать на связи с участием пролина, в образцах, полученных, как описано выше. Анализ проводили следующим образом: 10 мкл раствора хромогенного пептида (10 мM, растворен в диметилсульфоксиде; DMSO) добавляли к 130 мкл Na-ацетата (20 мM, доведен до pH 4,0 уксусной кислотой) в микротитровальном планшете и нагревали в течение 5 минут при 40°C. Добавляли 10 мкл соответствующим образом разбавленного фермента и измеряли оптическую плотность на MTP-ридере (Versa max, Molecular Devices, Дания) при 405 нм. Один катал протеолитической активности определяли как количество фермента, необходимое для выделения 1 моля п-нитроанилина в секунду.
Анализ с азоказеином на эндопротеазную активность.
Использовали модифицированный вариант эндопротеазного анализа, описанного Iversen и Jørgensen, 1995. Образец фермента объемом 50 мкл добавляли к 250 мкл азоказеина (0,25% вес./об.; от Sigma) в 4-кратно разбавленном буфере McIlvaine, pH 5, и инкубировали в течение 15 мин. при 40°C со встряхиванием (800 об./мин.). Реакцию останавливали добавлением 50 мкл 2 M TCA и центрифугировали в течение 5 мин. при 20000 g. К 195 мкл образца надосадочной жидкости добавляли 65 мкл 1 M NaOH и измеряли оптическую плотность при 450 нм. Одну единицу эндопротеазной активности определяли как количество, которое дает повышение оптической плотности на 0,1 за 15 мин при 40°C.
Было обнаружено, что образцы трипептидилпептидазы, способной воздействовать на связи с участием пролина, полученные как описано в примере 1, практически не обладают побочной эндопептидазной активностью. После очистки, как описано в примере 2А, никакой побочной эндопептидазной активности по сути не было обнаружено.
C. Профиль pH
Вышеописанный анализ трипептидилпептидазы, способной воздействовать на связи с участием пролина, с субстратом H-Ala-Ala-Ala-pNA с модификацией в виде применения буферов, представляющих собой 20 мM Na-глициновый (pH 2,0, 2,5, 3,0, 3,5 и 4,0) или 20 мM Na-ацетатный буфер (pH 4,0, 4,5 и 5,5), использовали для определения профиля pH трипептидилпептидазы, способной воздействовать на связи с участием пролина, TRI083 (фигура 2) и TRI045 (фигура 24). Оптимальный рН для TRI083 и TRI045, как наблюдали, составлял 4,0.
D. Температурный профиль
Вышеописанный анализ трипептидилпептидазы, способной воздействовать на связи с участием пролина, использовали при значениях температуры 25, 50, 55, 60, 65, 70, 75, 80 и 85°C. Обнаружили, что оптимальная температура для трипептидилпептидазы, способной воздействовать на связи с участием пролина, TRI083 составляет 50°C, тогда как при 70°C и более высоких значениях температуры активность не обнаруживали (фигура 3).
Гидролиз белка с применением трипептидилпептидазы, способной воздействовать на связи с участием пролина, в комбинации с эндопротеазой (AFP Alphalase®)
Ферменты: AFP Alphalase® итрипептидилпептидаза, способная воздействовать на связи с участием пролина, TRI083, экспрессированные, как описано в примере 1.
Буфер для анализа: 50 мM NaOAc, pH 4,0, 3% диметилгемоглобин (Sigma Aldrich), 37°C, 1 ч. инкубации (100 мкл реакционной смеси на лунку MTP).
Реагент для остановки/окрашивания: 0,05% тринитробензолсульфоновая кислота в 125 мM Na-борате, pH 8,6 (200 мкл на лунку).
Планшет считывали при 450 нм с использованием микропланшетного ридера Versa max (Molecular Devices) после приблизительно 20 мин. инкубации с реагентом для остановки/окрашивания. Результаты анализа (фигура 4) демонстрируют синергетический эффект при применении эндопротеазы (Alphalase® AFP) в комбинации с трипептидилпептидазой, способной воздействовать на связи с участием пролина.
Гидролиз белка сыворотки молока (WPI) с использованием трипептидилпептидазы, способной воздействовать на связи с участием пролина, в комбинации с эндопептидазой
Для гидролиза белка сыворотки молока использовали Lacprodan-9224 (Arla Food Ingredients, Дания). 20 вес. % суспензию WPI получали в дистиллированной H2O и доводили до pH 4,0 уксусной кислотой (Sigma-Aldrich, Дания). Для предотвращения роста микроорганизмов добавляли 0,0285 вес. % NaN3. Суспензию WPI в объеме 200 мкл переносили в каждую из 96 лунок микротитровального планшета (MTP; VWR, Дания). Затем в каждую лунку добавляли 5 мкл каждой из последовательно разбавленных пептидаз, Alphalase® FP2 и трипептидилпептидазы, способной воздействовать на связи с участием пролина (3PP=TRI083; активность в добавляемом маточном растворе составляла 0-8750 нкат H-Ala-Ala-Ala-pNA/мл), с получением дозировок, показанных в таблице 1. MTP герметично закрывали и помещали в инкубатор/шейкер iEMS (Thermo Scientific, Дания) при 40°C. После 24 ч. инкубации и встряхивания при 400 об./мин. гидролиз останавливали путем добавления 20 мкл 2 М трихлоруксусной кислоты (TCA; Sigma-Aldrich, Дания). В качестве эталона использовали 20 вес. % суспензию WPI без добавок, которую обрабатывали так же, как в случае гидролиза WPI. Негидролизованный осажденный WPI удаляли путем фильтрования (0,22 мкм). В отфильтрованном гидролизате WPI проводили дериватизацию с o-фтальальдегидом (OPA) в соответствии с Nielsen et al. (2001) с небольшими модификациями. Образец объемом 25 мкл переносили в лунку, а затем добавляли 175 мкл OPA-реагента, растворенного в фосфатном буфере с pH 11. Измеренные значения оптической плотности при 340 нм на MTP-ридере (Molecular Devices, Дания) преобразовывали в значения относительной степени гидролиза (DH) в процентах.
В качестве эталона (100% DH) служила 20 вес. % суспензия WPI, гидролизованного в 6 М HCl (Sigma-Aldrich, Дания) при 100°C в течение 24 ч.
Как показано в таблице 1, комбинация трипептидилпептидазы, способной воздействовать на связи с участием пролина, и эндопептидазы Alphalase® FP2 обеспечивала наилучшую степень гидролиза. Дополнение эндопептидазы трипептидилпептидазой, способной воздействовать на связи с участием пролина, приводило в целом к более высокой DH, чем без добавления TRI083 (SEQ ID No. 1, SEQ ID No. 2 или SEQ ID No. 29). Например, добавление 5 мкл TRI083 с 2188 нкат/мл к 0,6% Alphalase® FP2 приводило к повышению степени гидролиза на 25,0%, тогда как дополнение 1,2 вес. % Alphalase® FP2 с помощью 5 мкл TRI083 с 8375 нкат/мл приводило к повышению DH на 21,4%.
Таблица 1. Степень гидролиза 20 вес. % WPI, гидролизованного эндопептидазой в комбинации с трипептидилпептидазой, способной воздействовать на связи с участием пролина (3PP)
Гидролиз 33-мерного пептида глиадина
Трипептидилпептидазу, способную воздействовать на связи с участием пролина, исследовали на способность гидролизовать синтетический субстрат из альфа-глиадина (альфа-2-глиадина) с использованием LC-MS и количественной оценки без метки. Было обнаружено, что она расщепляет субстрат на трипептиды, не смотря на высокое содержание пролина в субстрате.
Схема эксперимента
33-мерный пептид глиадина (альфа-2-глиадина) (aa 56-88) H-LQLQPFPQPQLPYPQPQLPYPQPQLPYPQPQPF-OH (Zedira GmbH; D-64293 Дармштадт, Германия) C190H273N43O47 (MW=3911,46) (1 мг/мл; 0,26 мM) инкубировали при 24°С в присутствии трипептидилпептидазы, способной воздействовать на связи с участием пролина, (0,01 мг/мл TRI083) в общем объеме 1000 мкл буфера (pH=4,5) (соотношение субстрат/фермент 100:1, вес/вес). Ферментативную реакцию в аликвотных пробах (100 мкл) останавливали с помощью 20 мкл 5% трифторуксусной кислоты (TFA) через 0, 1, 3, 5, 10, 15 и 30 минут соответственно. Затем образцы переносили в новые флаконы и анализировали на масс-спектрометре LTQ Orbitrap.
Сбор данных, количественная оценка без метки и анализ данных MS/MS
Анализы Nano LC-MS/MS проводили с использованием системы Easy LC (Thermo Scientific, Оденсе, Дания), сопряженной с гибридным масс-спектрометром LTQ Orbitrap Classic (Thermo Scientific, Бремен, Германия). Образцы загружали на специально изготовленную 2 см предколонку (внутр. д. 100 мкм, внеш. д. 375 мкм, заполнена Reprosil C18, частицы обращенной фазы 5 мкм (Dr. Maisch GmbH, Ammerbuch-Entringen, Германия)), соединенную с 10 см аналитической колонкой (внутр. д. 75 мкм., внешн. д. 375 мкм, заполнена Reprosil C18, частицы обращенной фазы 3 мкм (Dr. Maisch GmbH, Ammerbuch-Entringen, Германия)) со стальной иглой. Разделение проводили при скорости потока 300 нл/мин. с использованием 10-минутного градиента 0-34% растворителя B (H2O/CH3CN/TFE/HCOOH (100/800//100/1 об./об./об./об)) в наноэлектрораспылительном источнике ионов (Thermo Scientific, Оденсе, Дания). Прибор LTQ Orbitrap Classic эксплуатировали в режиме MS/MS, зависящем от данных. Массы пептидов измеряли с помощью Orbitrap (MS-спектры получали с разрешением 60000 при соотношении масса/заряд (m/z) 400) и 2 наиболее интенсивных пептидных m/z отбирали и подвергали фрагментации с использованием CID в линейной ионной ловушке (LTQ). Динамическое исключение включали с размером списка исключения 500 масс, продолжительностью 40 с и шириной исключения масс ±10 ppm по отношению к массам в списке.
Доступ к файлам RAW получали с использованием программы с открытым исходным кодом Skyline 1.4.0.4421 (доступной от MacCoss Lab Software, университет Вашингтона, Отдел геномных исследований, 3720 15th Ave NE Seattle, Вашингтон, США), которая может использовать интенсивности MS1 для построения хроматограмм. Изотопный фильтр для импорта предшественника устанавливали в количестве до трех (M, M+1 и M+2) с разрешением 60000 и использовали наиболее интенсивное состояние заряда. Пептидные последовательности двух субстратов, а также продуктов их расщепления вводили в Skyline и интенсивности рассчитывали в каждом образце.
Данные LC-MS/MS аннотировали вручную с использованием GPMAW для расчета теоретических значений фрагментации.
Тройную заряженную массу интактного пептида альфа-2-глиадина выделяли и следили в течение некоторого времени. Интактный пептид не обнаруживался через 3 мин. и очень быстро гидролизовался (таблица 2). Полный гидролиз 33-мерного пептида альфа-2-глиадина даст следующие трипептиды: LQL´ QPF´ PQP´ QLP´ YPQ´ PQL´ PYP´ QPQ´ LPY´ PQP´ QPF. Было обнаружено, что промежуточный продукт YPQPQLPYPQPQLPYPQPQPF, полученный в результате отщепления четырех трипептидов LQL, QPF, PQP и QLP от субстрата альфа-2-глиадина, накапливается, а затем снижается (таблица 2).
Таблица 2. Относительные интенсивности MS-пиков альфа-2-глиадина и полученных пептидов

Было обнаружено накопление большинства ожидаемых трипептидов. Подчеркнутые трипептиды обнаруживали и подтверждали на основании их фрагментации MS/MS: LQL´ QPF´ PQP´ QLP´ YPQ´ PQL´ PYP´ QPQ´ LPY´ PQP´ QPF, тогда как трипептиды QPF обнаруживали только на основании их массы.
Наконец было обнаружено, что трипептидилпептидаза, способная воздействовать на связи с участием пролина, расщепляет субстрат альфа-2-глиадин последовательно на трипептиды, не смотря на высокое содержание пролина. Во время гидролиза пролин присутствовал в положениях P3,P2,P1,P1ʹ,P2´и P3´ соответственно.
Это противоречит ранее обнаруженному факту, что трипептидилпептидаза не расщепляет пролин в положениях P1 или P1´ (US7972808B2, US5821104, Reichard et al. 2006, Applied and Environmental Microbiology 72, 1739-1748).
Расщепление пептида AAPPA
Трипептидилпептидазу, способную воздействоватьна связи с участием пролина, исследовали на способность гидролизовать синтетический субстрат AAPPA с использованием LC-MS и количественной оценки без метки. Пептид H-AAPPA-NH2 (MW=424.49, от Schafer-N, Копенгаген) растворяли в 20 мM буфере MES, pH=4,0 (1 мг/мл). 1000 мкл раствора H-AAPPA-NH2 инкубировали с 200 мкл раствора трипептидилпептидазы, способной воздействовать на связи с участием пролина, (TRI083) (40 мкг/мл) (субстрат/фермент 100:0,8) при комнатной температуре. В семь моментов времени (0, 5, 15, 60, 180, 720 и 1440 мин) отбирали образцы по 100 мкл, разбавляли их с помощью 50 мкл 5% TFA, инактивировали нагреванием (10 мин при 80°C) и хранили при -20°C до анализа LC-MS.
Анализ Nano LC-MS/MS проводили с использованием системы Easy LC (Thermo Scientific, Оденсе, Дания), сопряженной с гибридным масс-спектрометром LTQ Orbitrap Classic (Thermo Scientific, Бремен, Германия). Образцы загружали на специально изготовленную 2 см предколонку (внутр. д. 100 мкм., внешн. д. 375 мкм, заполнена Reprosil C18, частицы обращенной фазы 5 мкм (Dr. Maisch GmbH, Ammerbuch-Entringen, Германия)), соединенную с 10 см аналитической колонкой (внутр. д. 75 мкм, внешн. д. 375 мкм, заполнена Reprosil C18, частицы обращенной фазы 3 мкм (Dr. Maisch GmbH, Ammerbuch-Entringen, Германия)) со стальной иглой. Разделение проводили при скорости потока 300 нл/мин. с использованием 10-минутного градиента 0-34% растворителя B (H2O/CH3CN/TFE/HCOOH (100/800//100/1 об./об./об./об)) в наноэлектрораспылительном источнике ионов (Thermo Scientific, Оденс, Дания). Прибор LTQ Orbitrap Classic эксплуатировали в режиме MS/MS, зависящем от данных. Массы пептидов измеряли с помощью Orbitrap (MS-спектры получали с разрешением 60000 при соотношении масса/заряд (m/z) 400) и 2 наиболее интенсивных пептидных m/z отбирали и подвергали фрагментации с использованием CID в линейной ионной ловушке (LTQ). Динамическое исключение включали с размером списка исключения 500 масс, продолжительностью 40 с и шириной исключения масс ±10 ppm по отношению к массам в списке.
Доступ к файлам RAW получали с использованием программы с открытым исходным кодом Skyline 1.4.0.4421, которая может использовать интенсивности MS1 для построения хроматограмм. Изотопный фильтр для импорта предшественника устанавливали в количестве до трех (M, M+1 и M+2) с разрешением 60000 и использовали наиболее интенсивное состояние заряда. Пептидные последовательности субстрата, а также продукта расщепления вводили в Skyline и интенсивности рассчитывали в каждом образце.
Анализ показал, что трипептидилпептидаза, способная воздействовать на связи с участием пролина, способна в течении некоторого времени разрушать пептид AAPPA (фигура 5) и обеспечивать образование продукта AAP (фигура 6), что указывает на то, что пептидная связь PP в AAPPA гидролизуется трипептидилпептидазой, способной воздействовать на связи с участием пролина.
Применение трипептидилпептидазы, способной воздействовать на связи с участием пролина, для снижения аллергенности β-лактоглобулина
Эксперимент проводили с использованием набора ʺELISA для исследования белка молока (β-лактоглобулина)ʺ, поставляемого MIoBS (Morianga Institute of Biological Sciences, Inc., Йокогама, Япония. № по каталогу 171LG).
Снижение потенциальной аллергенности исследовали путем обработки раствора β-лактоглобулина трипептидилпептидазой, способной воздействовать на связи с участием пролина, эндопротеазой и комбинацией трипептидилпептидазы, способной воздействовать на связи с участием пролина, и эндопротеазы.
Буфер: 50 мM ацетат, pH 4,5.
Раствор β-лактоглобулина: 100 мкг/мл в буфере.
Ферменты: трипептидилпептидаза, способная воздействовать на связи с участием пролина, TRI083 (40000 нкат/мл в буфере) и AFP Alphalase® (100 SAPU/мл в буфере)
Раствор β-лактоглобулина (1000 мкл) помещали в пробирку Эппендорф и нагревали до 40°С. Добавляли 20 мкл буфера и 50 мкл трипептидилпептидазы, способной воздействовать на связи с участием пролина (t=0), и раствор перемешивали путем прокачивания пипеткой. Непосредственно после добавления фермента аликвоту 50 мкл переносили в 950 мкл ледяного раствора для экстракции образца (поставляется в наборе). Последующие аликвоты отбирали и обрабатывали таким же образом через 1 ч., 3 ч., 6 ч. и 24 ч. Все образцы хранили на льду до дальнейшего анализа. Эксперимент повторяли с использованием 20 мкл AFP Alphalase®+50 мкл буфера; 20 мкл AFP Alphalase®+50 мкл трипептидилпептидазы, способной воздействовать на связи с участием пролина, или 70 мкл буфера (без фермента). Все образцы анализировали с использованием протокола, поставляемого в наборе (включая инкубирование всех образцов в растворе для экстракции при комнатной температуре в течение 24 ч. в качестве начальной стадии процедуры).
С использованием набора ELISA для исследования белка молока (β-лактоглобулина) было обнаружено, что трипептидилпептидаза, способная воздействовать на связи с участием пролина, в комбинации с эндопротеазой способна снижать ответ в анализе и, следовательно, потенциальную аллергенность в значительно большей степени, чем AFP Alphalase® в отдельности. Трипептидилпептидаза, способная воздействовать на связи с участием пролина, в отдельности оказывает только незначительное влияние на ответ в анализе.
ПРИМЕР 3
Материалы и способы
1. Обработка кукурузно-соевого корма ферментами
Кормовую муку просеивали до размера частиц менее 212 мкм и суспендировали в воде с образованием 10 вес. % суспензии и доводили pH до рН 3,5. Затем 138 мкл 10% суспензии добавляли в каждую лунку 96-луночного МТР-планшета с использованием дозирующих по 0,5 мл инструментов Agilent с автоматизированным модулем Biomeck NX. Использовали наконечники с широким отверстием. Затем добавляли 20 мкл ферментного раствора, содержащего протеазы, подлежащие тестированию, в 20 мМ ацетате с pH 3,5, после чего добавляли 10 мкл (1,14 ЕД/мкл) пепсина, растворенного в воде. Планшет инкубировали при 40°С в течение 45 минут в инкубаторе/шейкере iEMS при 1150 об./мин. Затем добавляли 34 мкл панкреатина в концентрации 1,126 мг/мл в 1 М бикарбонате натрия и планшет инкубировали при 40°С в течение 60 минут в iEMS при 1150 об./мин. После этого планшет центрифугировали при 5°С, 4000 об./мин. в течение 15 мин., 10 мкл надосадочной жидкости переносили в новые планшеты (планшет Сorning № 3641, несвязывающий), содержащие в каждой лунке 190 мкл воды для обеспечения 20х разведения. Полученные планшеты (планшеты с исходными образцами) хранили в морозильной камере при -20oC.
2. Измерения степени гидролиза
Способ анализа степени гидролиза (DH) растворимого белка основан на реакции первичных аминогрупп с o-фтальальдегидом (анализ OPA). Ссылка: P.M. Nielsen, D. Petersen и C. Dambmann. Improved Method for Determining Food Protein Degree of Hydrolysis. Journal of Food Science. 66 (2001) 642-646.
Для анализа OPA проводили следующую процедуру. 10-25 мкл образца корма, обработанного ферментом из планшета с исходными образцами, переносили в новый планшет, затем в данный планшет добавляли 175 мкл реагента OPA, содержащего борат натрия, додецилсульфат и дитиотреитол. Окончательные измерения оптической плотности при 340 нм проводили сразу через 2 мин. и 5 секунд перемешивания.
Влияние AFP Alphalase® (кислой протеазы) на кукурузно-соевый корм в присутствии пепсина и панкреатина Исследования in vitro
Композиция кукурузно-соевого корма представлена в таблице ниже (дополнительная информация: Interactions of phytate and myo-inositol phosphate esters (IP1-5) including IP5 isomers with dietary protein and iron and inhibition of pepsin. S. Yu, A. Cowieson, C. Gilbert, P. Plumstead and S. Dalsgaard J. Anim. Sci. 90 (2012) 1824-1832.)
Кукурузно-соевый корм обрабатывали с помощью AFP Alphalase® (NSP24, доступна от подразделения Genencor, Food Enzymes) (в данном документе упоминается как ʺAFPʺ) в различных концентрациях (450, 1000 и 1500 ppm по отношению к кукурузно-соевому корму) в присутствии пепсина и панкреатина (фигура 8). Результаты представлены ниже; уровень улучшения DH кукурузно-соевого корма составляет 4,5, 6,3 и 9,0% соответственно.
ПРИМЕР 4
Влияние трипептидилпептидазы, способной воздействовать на связи с участием пролина, на кукурузно-соевый корм в присутствии пепсина и панкреатина, а также в присутствии и в отсутствие Alphalase® AFP Исследования in vitro
В данных исследованиях AFP Alphalase® и трипептидилпептидазу, способную воздействовать на связи с участием пролина, использовали только в дозировках 1000 и 450 ppm соответственно. Результаты представлены в таблице 3. В контрольном эксперименте использовали только пепсин и панкреатин. Улучшение гидролиза представляет собой соотношение между обработкой и контролем.
Таблица 3. Влияние трипептидилпептидазы, способной воздействовать на связи с участием пролина, и AFP Alphalase® на гидролиз кукурузно-соевого корма
Как можно увидеть из таблицы 3, трипептидилпептидаза, способная воздействовать на связи с участием пролина, сама по себе не обеспечивает достаточного преимущества в отношении гидролиза кукурузно-соевого белка. Эффективность AFP Alphalase® аналогична результатам, представленным в примере 3. Однако комбинация трипептидилпептидазы, способной воздействовать на связи с участием пролина, и AFP Alphalase® дает максимальные результаты и может быть связана с синергетическим действием эндо- и экзопротеаз.
ПРИМЕР 5
Подтверждение дозозависимого ответа трипептидилпептидазы, способной воздействовать на связи с участием пролина, в комбинации с эндопротеазами на гидролиз кукурузно-соевого корма в отсутствие пепсина и панкреатина
Цель работы состояла в идентификации первопричины, обеспечивающей эффективность ферментов, и достоверном контроле возможной аддитивной или синергетической эффективности эндо- и экзопротеаз. Ввиду этого эксперименты проводили в отсутствие пепсина и панкреатина, и результаты обобщены на фигуре 9.
Как можно увидеть из фигуры 9, степень гидролиза при использовании трипептидилпептидазы, способной воздействовать на связи с участием пролина, с эндопротеазами является очень выраженной. Очевидно, что это явление синергетическое, поскольку дозозависимый ответ зависит от уровня трипептидилпептидазы, способной воздействовать на связи с участием пролина, и природы эндопротеазы. В случае AFP Alphalase® эффект гораздо более выражен.
ПРИМЕР 6
Подтверждение дозозависимого ответа трипептидилпептидазы, способной воздействовать на связи с участием пролина, в комбинации с различными дозировками эндопротеаз AFP Alphalase® на гидролиз кукурузно-соевого корма в присутствии пепсина и панкреатина
Для оценки уровня синергизма между AFP Alphalase® и трипептидилпептидазы, способной воздействовать на связи с участием пролина, проводили эксперимент с различными дозировками ферментов и в присутствии пепсина и панкреатина.
Как можно увидеть из фигуры 10, уровень степени гидролиза не зависит от концентрации трипептидилпептидазы, способной воздействовать на связи с участием пролина, и AFP Alphalase® в композиции. Вероятно, для обоих ферментов концентрации 1000 ppm и 2000 ppm соответствуют уровню насыщения. Однако степень гидролиза резко возрастает при увеличении времени обработки со 100 мин. до 200 мин.
ПРИМЕР 7
Анализ 20 трипептидилпептидаз на их стабильность при низком pH при pH 2,5, 40oC, 60 мин.
В качестве требований для использования ферментов в корме для животных с однокамерным желудком ферменты должны быть активными при более низком pH. Ввиду этого было протестировано ряд трипептидилпептидаз в реакции с синтетическим субстратом AAF (H-Ala-Ala-Phe-pNA. BACHEM, L-1095), при pH 2,5.
Трипептидный субстрат AAF получали в концентрации 2,5 мг/мл в DMSO. Трипептидилпептидазы использовали в виде бульона. Реакционную смесь, содержащую 2,5 мкл фермента и 90 мкл буфера на основе глицина, уксусной кислоты, Tris (каждый компонент буфера в концентрации 50 мМ, рН 2,5), получали в 96-луночных инкубационных планшетах.
Инкубационный планшет перемешивали и инкубировали при 40°C в течение 60 мин. Затем в каждую лунку добавляли 50 мкл 0,2 M Mes-NaOH pH 6,0, перемешивали при 600 об./мин. в течение 2 мин. После этого 5 мкл инкубационной смеси переносили в 96-луночный планшет для анализа, уже заполненный 85 мкл 0,1 М уксуснокислого буфера, рН 4,0 и 5 мкл раствора субстрата AAF с концентрацией 2,5 мг/мл.
Реакционную смесь перемешивали при 600 об./мин. в течение 2 мин. и осуществляли считывание непосредственно в микропланшетном ридере (Molecular Devices, Дания) при 410 нм при 30°C каждые 30 секунд в течение 15 мин.
Для измерения исходной ферментативной активности проводили аналогичную процедуру, за исключением стадии инкубации фермента при 40°C в течение 60 мин.
Результаты измерения исходной и конечной активности со значениями выхода по активности представлены в таблице 4.
Таблица 4. Исходная, конечная активность и выход по ней для трипептидилпептидаз
Из таблицы 4 можно увидеть, что 11 из 20 образцов трипептидилпептидаз значительно стабильны при рН 2,5 и 40°C в течение 60 мин., так как сохранялось более 70% активности. Необходимо учитывать, что последние четыре образца представляют собой одну и ту же молекулу (TRI071) и 2 образца являются отрицательными контролями. Из этих результатов можно сделать вывод, что трипептидилпептидазы, способные воздействовать на связи с участием пролина, являются стабильными при низком рН.
Выводы
В этой работе было продемонстрировано синергизм сериновой экзопептидазы - трипептидилпептидазы, способной воздействовать на связи с участием пролина, с сериновой эндопротеазой FoodPro® 30L, а также протеазой аспарагиновой кислоты AFP Alphalase® при гидролизе корма на основе кукурузы и сои в условиях, имитирующих пищеварительную систему, характерную для однокамерного желудка. Было также показано, что многие трипептидилпептидазы являются стабильными при низком рН и могут рассматриваться для применений в кормах.
ПРИМЕР 8
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, в корме для животных
В общей сложности 288 однодневных самцов цыплят-бройлеров Ross 308 приобретали в коммерческом инкубаторе. В начале исследования по 8 птиц случайным образом распределяли в клеточные батареи блоками согласно соответствующим видам обработки. Для эксперимента отбирали только здоровых птиц, и ни одну из птиц не заменяли в течение всего исследования. Исследование включало следующие виды обработки (таблица 5).
Таблица 5. План эксперимента
Вес птиц регистрировали в начале исследования (d0), на 14-й день и в конце исследования (d21). Клетка представляла собой экспериментальную установку. Рационы обеспечивали в виде кормовой смеси и составляли с учетом соответствия требованиям стандартов NRC или их перевыполнения, за исключением Ca и AvP (таблица 5). Все корма смешивали с использованием мешалки Davis S-20, при этом мешалку промывали перед каждой обработкой для предотвращения перекрестного загрязнения между рационами. Образцы собирали из каждого рациона для обработки в начале, средине и конце каждой партии и перемалывали вместе для анализа активности ферментов в корме.
Всем птицам скармливали рацион на основе кукурузы и сои до 14-го дня; при этом с 14-го дня им скармливали рацион для обработки. Фитазу добавляли во все рационы для обработки. При смене корма кормушки доставали из клеток, снова взвешивали, опорожняли и повторно заполняли соответствующим рационом для обработки. В последний день исследования (d21) корм и птиц взвешивали для определения величины потребления корма (FI) и прироста массы тела (BWG) в течение периода эксперимента. Секции птичника ежедневно проверяли в отношении смертности. Когда птицу отбраковывали или находили мертвой, то записывали дату и вес (кг) на время выведения. Для определения возможной причины смерти проводили грубое вскрытие всех мертвых или отбракованных птиц. Определяли коэффициент превращения корма (FCR) с поправкой на смертность.
В d21 всех птиц в клетке подвергали эвтаназии путем внутрисердечной инъекции пентобарбитона натрия и содержимое нижнего отдела подвздошной кишки выжимали с осторожным промыванием дистиллированной водой. Содержимое от птиц в клетке объединяли c получением восьми образцов на рацион для обработки. Образцы содержимого замораживали непосредственно после сбора, лиофилизировали и обрабатывали. Образцы рационов и содержимого анализировали в отношении маркера, азота (N) и валовой энергии, чтобы рассчитать коэффициенты усвояемости.
Таблица 6. Составы рационов
Статистический анализ
Данные анализировали с помощью ANOVA и проводили разделение средних, чтобы проверить различия между разными ферментами и дозировками ферментов. Клетку использовали в качестве экспериментальной установки.
Результаты
Таблица 7. Результаты продуктивности и усвояемости
Каждое значение представляет собой среднее из 9 повторов (8 птиц на повтор).
ab Средние значения в столбце, не разделяющем общий индекс, отличаются (P < 0,05).
Дополнение трипептидилпептидазы, способной воздействовать на связи с участием пролина, приводило к значимому снижению FCR по сравнению с отрицательным контролем и коммерческой протеазой B и численному снижению по сравнению с коммерческой протеазой A.
Дополнение трипептидилпептидазы, способной воздействовать на связи с участием пролина, значимо повышало BWG по сравнению с NC, причем этого не наблюдали ни с коммерческой протеазой A, ни с коммерческой протеазой B.
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, значимо повышала % подвздошно-кишечной усвояемости N по сравнению с контролем и коммерческой протеазой A (фигура 11). Трипептидилпептидаза, способная воздействовать на связи с участием пролина, также значимо повышала усвояемую энергию до уровня, значимо большего, чем у отрицательного контроля, и численно большего, чем у двух коммерческих протеаз (фигура 12).
Выводы
В заключение, дополнение трипептидилпептидазы, способной воздействовать на связи с участием пролина, приводило к значительно лучшей продуктивности птицы, чем NC и коммерческая протеаза B, в отношении FCR и BWG. Наблюдалось численное увеличение BWG и снижение FCR при дополнении трипептидилпептидазы, способной воздействовать на связи с участием пролина, по сравнению с коммерческой протеазой A.
Улучшения в отношении продуктивности птиц обусловлены улучшенной усвояемостью энергии и белка (N) по сравнению с коммерческими протеазами.
ПРИМЕР 9
Определение активностей трипептидилпептидазы, способной воздействовать на связи с участием пролина, аминопептидазы и эндопептидазы
Для трипептидилпептидазы, способной воздействовать на связи с участием пролина, использовали хромогенный пептид H-Ala-Ala-Ala-pNA. Анализ проводили следующим образом: 27,5 мкл соответствующим образом разбавленного фермента добавляли к 200 мкл буфера McIlvaine (20 мМ, рН 4,0). После инкубации при 50°С в течение 5 мин. к реакционной смеси добавляли 12,5 мкл раствора хромогенного пептида (5 мг/мл, растворенного в диметилсульфоксиде (DMSO); Sigma-Aldrich, Дания). Реакцию останавливали путем добавления 50 мкл 0,5 М трихлоруксусной кислоты (TCA; Sigma-Aldrich, Дания). После центрифугирования (15000 x g, 5 мин.) 240 мкл раствора переносили в микротитровальный планшет (MTP; Kisker-biotech, Германия) и измеряли оптическую плотность на MTP-ридере (Molecular Devices, Дания) при 405 нм. Один катал протеолитической активности определяли как количество фермента, необходимое для выделения 1 моля п-нитроанилина в секунду.
Аминопептидазную активность измеряли, как описано в Stressler, Eisele et al. 2013.
Эндопептидазную побочную активность измеряли с помощью азоказеина, как описано в примере 2.
ПРИМЕР 10
Гидролиз белка сыворотки молока с использованием эндопептидазы в комбинации с трипептидилпептидазой, способной воздействовать на связи с участием пролина, и неспецифической аминопептидазой
Рекомбинантно экспрессированную в E. coli и очищенную с His-меткой неспецифическую аминопептидазу (PepN) из Lactobacillus helveticus ATCC 12046 использовали для гидролиза изолята белка сыворотки молока (WPI) (Stressler, Eisele et al. 2013). Применяемая PepN характеризовалась биохимическими параметрами, такими как pH-оптимум, температурный диапазон и специфичность последовательности, сопоставимыми с другими PepN из научной литературы (таблица 8), и поэтому является репрезентативной для неспецифических аминопептидаз из про- и эукариотических видов.
Таблица 8. Биохимические параметры и специфичность последовательностей неспецифических аминопептидаз (PepN) различного происхождения
Применяемая PepN в гидролизе WPI не обладала побочной эндопептидазной и X-пролил-дипептидильной (PepX) активностью, которую анализировали либо с помощью анализа с азоказеином, либо с H-Ala-Pro-pNA в качестве субстрата для PepX соответственно.
Для гидролиза белка сыворотки молока использовали Lacprodan-9224 (Arla Food Ingredients, Дания), 15 вес. % суспензию WPI получали в дистиллированной H2Od и доводили до pH 4,5 уксусной кислотой (Sigma-Aldrich, Дания). Для предотвращения роста микроорганизмов добавляли 0,0285 вес. % NaN3. Перед гидролизом посредством экзопептидаз добавляли 1% (вес/весиспользованного WPI) FP2 Alphalase® для инициации гидролиза WPI, чтобы получить субстраты для экзопептидаз (трипептидилпептидазы и неспецифической аминопептидазы). Суспензию WPI в объеме 200 мкл переносили в каждую из 96 лунок микротитровального планшета (MTP; VWR, Дания). Затем в каждую лунку добавляли 5 мкл последовательно разведенной PepN (0-1572 нкатH-Ala-pNA/мл) и трипептидилпептидазы, способной воздействовать на связи с участием пролина (0-70000 нкатH-Ala-Ala-Ala-pNA/мл). Затем MTP герметично закрывали и помещали в инкубатор (инкубатор/шейкер HT iEMS, Thermo scientific, Дания), который инкубировали при 40°C. После 24 ч. инкубации при 400 об./мин.. реакции гидролиза останавливали путем добавления 20 мкл 2 М трихлоруксусной кислоты (TCA; Sigma-aldrich, Дания), за исключением эталона (0 ч.), при этом TCA добавляли перед добавлением эндо- и экзопептидаз. Негидролизованный осажденный WPI удаляли путем фильтрования (0,22 мкм; фильтровальный планшет Corning 3504, Corning incorporated, США). Отфильтрованный гидролизат WPI использовали для дериватизации с o-фтальальдегидом (OPA) (Nielsen, Petersen et al. 2001). OPA-дериватизацию проводили в соответствии с Nielsen et al., (2001) с небольшими модификациями. Образец объемом 25 мкл переносили в лунку и добавляли 175 мкл OPA-реагента, содержащего додекагидрат тринатрийфосфата. Измеренные значения оптической плотности при 340 нм на MTP-ридере (VersaMax, Molecular Devices, Дания) необязательно преобразовывали в значения относительной степени гидролиза (DH) в процентах, тогда как 15 вес.% суспензию WPI получали в 6 M HCl (Sigma-Aldrich, Дания) и выдерживали при 100°C в течение 24 ч. Кислотный гидролизат 15 вес.% WPI служил в качестве эталона (100% DH) для расчета степени гидролиза.
На фигуре 13 показано увеличение свободных альфа-аминогрупп, выраженных в виде сериновых эквивалентов (SE), в течение 24 ч. при использовании комбинаций различных эндо- и экзопептидаз. Наименьшее повышение SE определяли с добавлением только эндопептидаз, за которым шла комбинация эндопептидазы и трипептидилпептидазы, способной воздействовать на связи с участием пролина (TRI083), которая обеспечивает высвобождение трипептидов с N-конца пептидов. В связи с тем, что трипептидилпептидаза, способная воздействовать на связи с участием пролина TRI083, ингибируется продуктом, представляющим собой высвобождаемые ею трипептиды, увеличение SE не является очень высоким. Дополнение эндопептидазы рекомбинантно экспрессированной и очищенной с His-меткой неспецифической аминопептидазой (PepN) из Lactobacillus helveticus ATCC12046 приводило к значительному повышению SE вследствие высвобождения свободных аминокислот (фигура 13). Комбинированное применение эндопептидазы, TRI083 и PepN приводило к значительно высшему высвобождению свободных альфа-аминогрупп по сравнению с добавлением эндопептидазы и TRI083, а также эндопептидазы и PepN на 43,5% (фигура 13).
Краткое изложение дополнительного эффекта эндопептидазы, трипептидилпептидазы, способной воздействовать на связи с участием пролина, и неспецифической аминопептидазы (PepN) показано в таблице 9.
Таблица 9.Краткое изложение дополнительного эффекта эндопептидазы в комбинации с трипептидилпептидазой, способной воздействовать на связи с участием пролина (TRI083), и неспецифической аминопептидазой (PepN) при гидролизе 15% WPI через 24 ч.
ПРИМЕР 11
Гидролиз казеина с использованием эндопептидазы в комбинации с трипептидилпептидазой, способной воздействовать на связи с участием пролина (TRI083), и неспецифической аминопептидазой (PepN)
Гидролиз 5 вес. % раствора казеината натрия проводили по той же схеме, как описано для гидролиза белка сыворотки молока в примере 2, за исключением того, что использовали 5 вес.% казеинат натрия (Arla Foods, Дания). Как показано в таблице 10, независимо от используемой активности PepN или TRI083, определенные сериновые эквиваленты (SE) могут быть увеличены либо путем добавления TRI083 к эндопептидазе, либо путем добавления PepN к эндопептидазе.
Кроме того, синергетический эффект наблюдали при высоких дозировках PepN и TRI083 (таблица 11). Увеличение активности PepN вдвое, с 786 до 1572 нкат/мл, приводило к относительно небольшому увеличению сериновых эквивалентов на 10 мМ, тогда как применение TRI083 с 17500 нкат/мл увеличивало SE на 18 мМ. Применение TRI083 и PepN при 17500 и 1572 нкат/мл приводило к увеличению SE на 97 мМ. Это соответствует 21% увеличению значения SE по сравнению с суммой отдельных добавок TRI083 и PepN к эндопептидазе.
Таблица 10.Дозозависимый ответ гидролиза 5 вес.% казеината натрия с помощью эндопептидазы в комбинации с TRI083 и PepN с разными значениями активности через 24 ч. гидролиза, который количественно определяли по сериновым эквивалентам (SE).
ПРИМЕР 12
Гидролиз казеина с использованием эндопептидазы в комбинации с трипептидилпептидазой, способной воздействовать на связи с участием пролина, и частично инактивированным Flavourzyme 500
Гидролиз казеината натрия проводили, как описано в примере 10, за исключением того, что вместо очищенного PepN применяли частично инактивированный Flavourzyme 500 (FZ500; Sigma-Aldrich, Дания). Для инактивации эндопептидаз FZ 500 подвергали тепловой обработке (55°C, 24 ч.). Активность эндопептидаз значительно снижалась (96% инактивировано, остаточная активность 4%). После тепловой обработки FZ 500 определяли приблизительно 97% остаточной активности PepN.
Таблица 11.Дозозависимый ответ гидролиза 5 вес.% казеината натрия с помощью эндопептидазы в комбинации с трипептидилпептидазой, способной воздействовать на связи с участием пролина (TRI083), и частично инактивированным FZ 500 через 24 ч. гидролиза, который количественно определяли по сериновых эквивалентах (SE).
Как показано в таблице 11, добавление TRI083 либо к эндопептидазе, либо к эндопептидазе, которые дополняли несколькими экзопептидазами (Flavourzyme 500 (FZ500, Sigma-Aldrich, Дания)), приводило в обоих случаях к увеличению значений сериновых эквивалентов, указывая, что степень гидролиза гидролизата, полученного с помощью комплексной смеси экзопептидаз, таких как FZ500, можно повысить путем применения трипептидилпептидазы (например, трипептидилпептидазы, способной воздействовать на связи с участием пролина).
ПРИМЕР 13
Гидролиз белка сыворотки молока (WPI) с использованием эндопептидазы в комбинации с гомологами трипептидилпептидазы, способной воздействовать на связи с участием пролина
Для гидролиза WPI использовали Lacprodan-9224 (Arla Food Ingredients, Дания), 15 вес.% суспензию WPI получали в дистиллированной H2Od и доводили до pH 4,5 уксусной кислотой (Sigma-Aldrich, Дания). Для предотвращения роста микроорганизмов добавляли 0,0285 вес. % NaN3. Затем добавляли 1 вес. % Alphalase® FP2 и суспензию WPI в объеме 200 мкл переносили в каждую из 96 лунок микротитровального планшета (MTP; VWR, Дания). После этого в определенные лунки MTP добавляли 5 мкл каждого гомолога трипептидилпептидазы, способной воздействовать на связи с участием пролина, имеющего либо 0, либо 4375 нкатH-Ala-Ala-Ala-pNA/мл. Затем MTP герметично закрывали и помещали в инкубатор при 40°C (инкубатор/шейкер HT iEMS, Thermo Scientific, Дания).
После 24 ч. инкубации и встряхивания при 400 об./мин. реакции гидролиза останавливали путем добавления 20 мкл 2 М трихлоруксусной кислоты (TCA; Sigma-Aldrich, Дания), за исключением эталона (0 ч.), к которому TCA добавляли перед добавлением эндо- и экзопептидаз. Негидролизованный осажденный WPI удаляли путем фильтрования (0,22 мкм; фильтровальный планшет Corning 3504, Corning Incorporated, США). Отфильтрованный гидролизат WPI использовали для дериватизации с o-фтальальдегидом (OPA) (Nielsen, Petersen et al. 2001). OPA-дериватизацию проводили в соответствии с Nielsen et al., (2001) с небольшими модификациями. Образец объемом 25 мкл переносили в лунку, а затем добавляли 175 мкл OPA-реагента, растворенного в додекагидрате тринатрийфосфата. Измеренные значения оптической плотности при 340 нм на MTP-ридере (VersaMax, Molecular Devices, Дания) преобразовывали в сериновые эквиваленты с использованием калибровочной кривой для серина (0-2 мM).
Трипептидилпептидаза, способная воздействовать на связи с участием пролина TRI071 (SEQ ID No. 12 или SEQ ID No. 39), значимо повышала измеренные сериновые эквиваленты в течение некоторого времени по сравнению с эталоном (эндопептидазой). Относительное повышение SE составляло приблизительно 64% для TRI071 через 7 ч. гидролиза соответственно (фигура 14).
ПРИМЕР 14
Ингибирование продуктом реакции трипептидилпептидазы, способной воздействовать на связи с участием пролина (TRI083), с нативным трипептидом (H-Ala-Ala-Ala-OH)
Эксперименты по ингибированию проводили с TRI083 и Ala-Ala-Ala-pNA (0-2000 нМ) в качестве субстрата в анализе, описанном в примере 8. Анализ проводили без ингибитора, с использованием 3,6 мМ трипептида (H-Ala-Ala-Ala-OH; Bachem, Дания), 18 мM дипептида (H-Ala-Ala-OH; Bachem, Швейцария) или 18 мM аланина (Sigma-Aldrich, Дания). Подбор кривой и анализ ингибирования проводили путем обработки H-Ala-Ala-Ala-OH, H-Ala-Ala-OH и аланина как конкурентных ингибиторов с использованием GraphPad Prism версии 6.02 для Windows, программное обеспечение от GraphPad, Ла-Холья, Калифорния, США, www.graphpad.com.
В случае трипептида H-Ala-Ala-Ala-OH было обнаружено сильное ингибирование с Ki, составляющей 0,34 мM, тогда как дипептид H-Ala-Ala-OH проявлял лишь очень слабое ингибирование с Ki, составляющей 40 мM. Алалин вовсе не проявлял ингибирования.
ПРИМЕР 15
Сниженное ингибирование продуктом реакции трипептидилпептидазы, способной воздействовать на связи с участием пролина (TRI083), с нативным трипептидом (H-Ala-Ala-Ala-OH), предварительно гидролизованным с помощью неспецифической аминопептидазы (PepN)
Эксперименты по ингибированию проводили по схеме, описанной в примере 14. Кроме того, 1 мг/мл H-Ala-Ala-Ala-OH (Bachem, Швейцария) подвергали гидролизу с помощью неспецифической аминопептидазы (PepN) в течение 24 ч. при 40°C в 12,5-кратно разбавленном буфере McIlvaine (рН 4,0). Для этого 1,2 мг/мл H-Ala-Ala-Ala-OH растворяли в 8 мл 10-кратно разбавленного буфера McIlvaine (рН 4,0) и заполняли до 10 мл очищенной PepN (1572 нкат/мл [pH 6,5]). Через 24 ч. гидролиза гидролиз PepN останавливали путем инактивации нагреванием PepN (90°С, 10 мин.). Степень предварительного гидролиза H-Ala-Ala-Ala-OH определяли с помощью газовой хроматографии (Husek, 1991; FEBS-Letters 280, 354-356). Было измерено приблизительно 0,18 мг/мл аланина, что соответствует приблизительно 54% гидролиза первоначально внесенного H-Ala-Ala-Ala-OH.
Затем TRI083 анализировали в отношении ингибирования продуктом реакции без ингибитора, с 1 мг/мл H-Ala-Ala-Ala-OH, а также с предварительно гидролизованным с помощью PepN H-Ala-Ala-Ala-OH (1 мг/мл).
Как показано на фигуре 15, было обнаружено, что предварительно гидролизованный H-Ala-Ala-Ala-OH имеет Ki, составляющую 0,8 мМ. Это хорошо согласуется с ранее определенной для H-Ala-Ala-Ala-OH Ki, составляющей 0,34 мM, поскольку немного больше половины H-Ala-Ala-Ala-OH было предварительно гидролизовано до H-Ala-Ala-OH и аланина. Это указывает на то, что неспецифическая аминопептидаза может снижать ингибирование продуктом реакции трипептидилпептидазы, способной воздействовать на связи с участием пролина, путем расщепления трипептидов на дипептиды и свободные аминокислоты.
ПРИМЕР 16
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, в снижении иммуногенности пептидовβ-лактоглобулина при аллергии на коровье молоко (CMA)
Описание процедуры гидролиза
β-Лактоглобулин (1 мг/мл) в 10 мM Tris-HCl, pH 8,0, подвергали гидролизу при 25°C в течение 24 ч. с помощью трипсина (10 мкг/мл). Спустя 24 ч. трипсин инактивировали нагреванием до 80°С в течение 15 мин.
Используемый β-лактоглобулин имеет аминокислотную последовательность:
>sp|P02754|LACB_BOVIN Бета-лактоглобулин OS=Bos taurus GN=LGB PE=1 SV=3
MKCLLLALALTCGAQALIVTQTMKGLDIQKVAGTWYSLAMAASDISLLDAQSAPLRVYVE ELKPTPEGDLEILLQKWENGECAQKKIIAEKTKIPAVFKIDALNENKVLVLDTDYKKYLL FCMENSAEPEQSLACQCLVRTPEVDDEALEKFDKALKALPMHIRLSFNPTQLEEQCHI
Триптический гидролизат β-лактоглобулина (1 мг/мл) в 10 мМ TRIS HCL с pH 4,0 разводили в пять раз в 20 мМ буфере MES с pH 4,0. Гидролиз инициировали путем добавления 100 мкл раствора трипептидилпептидазы, способной воздействовать на связи с участием пролина, TRI083 (80 мкг/мл) в 20 мМ буфере MES, рН 4,0, к 1 мл 5-кратно разведенного раствора β-лактоглобулина (200 мкг/мл) и инкубировали при RT.
Протеолиз с помощью трипептидилпептидазы, способной воздействовать на связи с участием пролина, останавливали через 1, 5, 15, 30, 60, 120 и 180 мин., а также через 24 ч. путем добавления 5% TFA (50 мкл) к 100 мкл раствора β-лактоглобулина. Трипептидилпептидазу, способную воздействовать на связи с участием пролина, инактивировали нагреванием при 80°C в течение 10 минут. Раствор хранили при -20°С до дальнейшего анализа LC-MS/MS.
Анализы Nano LC-MS/MS проводили с использованием системы Easy LC (Thermo Scientific, Оденсе, Дания), сопряженной с гибридным масс-спектрометром LTQ Orbitrap Classic (Thermo Scientific, Бремен, Германия). Образцы загружали на специально изготовленную 2 см предколонку (внутр. д. 100 мкм, внеш. д. 375 мкм, заполнена Reprosil C18, частицы обращенной фазы 5 мкм (Dr. Maisch GmbH, Ammerbuch-Entringen, Германия)), соединенную с 10 см аналитической колонкой (внутр. д. 75 мкм., внешн. д. 375 мкм, заполнена Reprosil C18, частицы обращенной фазы 3 мкм (Dr. Maisch GmbH, Ammerbuch-Entringen, Германия)) со стальной иглой. Разделение проводили при скорости потока 300 нл/мин. с использованием 10-минутного градиента 0-34% растворителя B (H2O/CH3CN/TFE/HCOOH (100/800//100/1 об./об./об./об.)) в наноэлектрораспылительном источнике ионов (Thermo Scientific, Оденсе, Дания). Прибор LTQ Orbitrap Classic эксплуатировали в режиме MS/MS, зависящем от данных. Массы пептидов измеряли с помощью Orbitrap (MS-спектры получали с разрешением 60000 при соотношении масса/заряд (m/z) 400) и 2 наиболее интенсивных пептидных m/z отбирали и подвергали фрагментации с использованием CID в линейной ионной ловушке (LTQ). Динамическое исключение включали с размером списка исключения 500 масс, продолжительностью 40 с и шириной исключения масс ±10 ppm по отношению к массам в списке.
Доступ к файлам RAW получали с использованием программы с открытым исходным кодом Skyline 1.4.0.4421, которая может использовать интенсивности MS1 для построения хроматограмм. Изотопный фильтр для импорта предшественника устанавливали в количестве до трех (M, M+1 и M+2) с разрешением 60000 и использовали наиболее интенсивное состояние заряда. Пептидные последовательности субстрата, а также продукта расщепления вводили в Skyline и интенсивности рассчитывали в каждом образце.
Результаты
Обработанный трипсином β-лактоглобулин эффективно гидролизовался трипептидилпептидазой, способной воздействовать на связи с участием пролина, как показано на фигурах 16-21. Следует отметить, что трипептидилпептидаза, способная воздействовать на связи с участием пролина, обладала очень широкой субстратной специфичностью и могла расщеплять пептиды, имеющие пролин в P1 (фигура 17) и глицин в P1 (фигура 21).
ПРИМЕР 17
Гидролиз бета-казеина с помощью трипептидилпептидазы, способной воздействовать на связи с участием пролина
Сначала β-казеин подвергали гидролизу с помощью трипсина перед тем, как подвергнуть расщеплению с помощью трипептидилпептидазы, способной воздействовать на связи с участием пролина. β-Казеин (1 мг/мл) в 10 мM Tris-HCl, pH=8,0, подвергали гидролизу при RT в течение 24 ч. с помощью трипсина (10 мкг/мл), а затем инактивировали нагреванием до 80°C в течение 15 минут.
Триптический гидролизат β-казеина (1 мг/мл) в 10 мМ TRIS HCL с pH 4,0 разводили в пять раз в 20 мМ буфере MES с pH 4,0. Гидролиз инициировали путем добавления 100 мкл раствора трипептидилпептидазы, способной воздействовать на связи с участием пролина, TRI083 (80 мкг/мл) в 20 мМ буфере MES, рН 4,0, к 1 мл 5-кратно разведенного раствора β-казеина (200 мкг/мл) и инкубировали при RT.
Протеолиз с помощью трипептидилпептидазы, способной воздействовать на связи с участием пролина, останавливали через 1, 5, 15, 30, 60, 120 и 180 мин., а также через 24 ч. путем добавления 5% TFA (50 мкл) к 100 мкл раствора β-казеина. Трипептидилпептидазу, способную воздействовать на связи с участием пролина, инактивировали нагреванием при 80°C в течение 10 минут. Раствор хранили при -20°С до проведения дальнейшего анализа LC-MS/MS, как описано в примере 16.
Используемый бета-казеин имел следующую аминокислотную последовательность:
>sp|P02666|CASB_BOVIN Бета-казеин OS=Bos taurus GN=CSN2 PE=1 SV=2 MKVLILACLVALALARELEELNVPGEIVESLSSSEESITRINKKIEKFQSEEQQQTEDEL QDKIHPFAQTQSLVYPFPGPIPNSLPQNIPPLTQTPVVVPPFLQPEVMGVSKVKEAMAPK HKEMPFPKYPVEPFTESQSLTLTDVENLHLPLPLLQSWMHQPHQPLPPTVMFPPQSVLSL SQSKVLPVPQKAVPYPQRDMPIQAFLLYQEPVLGPVRGPFPIIV
Результаты
Пептид GPFPIIV, полученный в результате триптического расщепления β-казеина, был очень гидрофобным и имел очень горький вкус. На фигуре 22 показано, что трипептидилпептидаза, способная воздействовать на связи с участием пролина, способна эффективно расщеплять этот пептид с пролином в положении P1ʹ и в положении P2. На фигуре 23 показано, что пептид HKEMPFPK также эффективно расщепляется трипептидилпептидазой, способной воздействовать на связи с участием пролина.
ПРИМЕР 18
Разрушение пептида брадикинина с помощью трипептидилпептидазы, способной воздействовать на связи с участием пролина
Брадикинин (RPPGFSPFR; MW 1660,21; B2259 от Sigma Aldrich) растворяли в концентрации 1 мг/мл в 20 мМ буфере McIlvaine (рН 4,5). К раствору пептида добавляли трипептидилпептидазу, способную воздействовать на связи с участием пролина, TRI083 (10 мкг). Гидролиз останавливали через 1, 3, 5, 15, 30 и 60 мин., а также через 20 ч. путем добавления 5% TFA (50 мкл) к 100 мкл раствора. Трипептидилпептидазу, способную воздействовать на связи с участием пролина, инактивировали нагреванием при 80°C в течение 10 минут. Раствор хранили при -20°С до проведения дальнейшего анализа LC-MS/MS, как описано в примере 16.
Результаты
Трипептидилпептидаза, способная воздействовать на связи с участием пролина, эффективно расщепляет пептид брадикинин, имеющий аминокислотную последовательность RPPGFSPFR (см. фигуру 24). Это демонстрирует то, что трипептидилпептидаза, способная воздействовать на связи с участием пролина, способна разрушать субстраты, имеющие пролин в положениях P1 и P2, что очень удивительно для трипептидилпептидаз.
ПРИМЕР 19
Гидролиз субстрата AAXF-NH2 с помощью трипептидилпептидазы, способной воздействовать на связи с участием пролина TRI079
Описание процедуры гидролиза и анализа LC-MS
Субстрат AAXF-NH2 из библиотеки(синтезирован Schaefer, Копенгаген), где X представляет собой все аминокислоты, за исключением Cys и Met, солюбилизировали в 20 мM буфере McIlvaine, pH 4,5 (1 мг в 1 мл). Раствор пептида подвергали гидролизу при 25°C в течение 1 ч. или 2 ч. с помощью 10 мкл TRI079 (SEQ ID NO: 57) в концентрации 1 мг/мл, полученной как описано в примере 1. Затем гидролиз останавливали путем добавления 5% TFA (50 мкл) к 50 мкл раствора пептида. Раствор хранили при -20°С до дальнейшего анализа LC-MS/MS.
Анализы Nano LC-MS/MS проводили с использованием системы Easy LC (Thermo Scientific, Оденсе, Дания), сопряженной с гибридным масс-спектрометром LTQ Orbitrap Classic (Thermo Scientific, Бремен, Германия). Образцы загружали на специально изготовленную 2 см предколонку (внутр. д. 100 мкм, внеш. д. 375 мкм, заполнена Reprosil C18, частицы обращенной фазы 5 мкм (Dr. Maisch GmbH, Ammerbuch-Entringen, Германия)), соединенную с 10 см аналитической колонкой (внутр. д. 75 мкм., внешн. д. 375 мкм, заполнена Reprosil C18, частицы обращенной фазы 3 мкм (Dr. Maisch GmbH, Ammerbuch-Entringen, Германия)) со стальной иглой. Разделение проводили при скорости потока 300 нл/мин с использованием 10-минутного градиента 0-34% растворителя B (H2O/CH3CN/TFE/HCOOH (100/800//100/1 об./об./об./об)) в наноэлектрораспылительном источнике ионов (Thermo Scientific, Оденсе, Дания). Прибор LTQ Orbitrap Classic эксплуатировали в режиме MS/MS, зависящем от данных. Массы пептидов измеряли с помощью Orbitrap (MS-спектры получали с разрешением 60000 при соотношении масса/заряд (m/z) 400) и 2 наиболее интенсивных пептидных m/z отбирали и подвергали фрагментации с использованием CID в линейной ионной ловушке (LTQ). Динамическое исключение включали с размером списка исключения 500 масс, продолжительностью 40 с и шириной исключения масс ±10 ppm по отношению к массам в списке.
Доступ к файлам RAW получали с использованием программы с открытым исходным кодом Skyline 1.4.0.4421, которая может использовать интенсивности MS1 для построения хроматограмм. Изотопный фильтр для импорта предшественника устанавливали в количестве до трех (M, M+1 и M+2) с разрешением 60000 и использовали наиболее интенсивное состояние заряда. Пептидные последовательности субстрата, а также продукта расщепления вводили в Skyline и интенсивности рассчитывали в каждом образце.
Результаты
Анализ LC-MS показал, что TRI079 может расщеплять все пептиды AAXF-NH2 на трипептиды независимо от того, какая аминокислота находится в P1. При наличии пролина в Р1 наблюдали увеличение количества продукта расщепления ААР со временем, что указывает на то, что TRI079 способна воздействовать на связи с участием пролина в положении P1.
ПРИМЕР 20
Гидролиз белка сыворотки молока (WPI) с использованием трипептидилпептидазы, способной воздействовать на связи с участием пролина TRI079, в комбинации с эндопептидазами и неспецифической аминопептидазой PepN
Для гидролиза WPI использовали Lacprodan-9224 (Arla Food Ingredients, Дания), 15 вес. % суспензию WPI получали в дистиллированной H2Od и доводили до pH 6 гидроксидом натрия. Для предотвращения роста микроорганизмов добавляли 0,0285 вес. % NaN3. Затем добавляли 0,5% (вес/вес относительно белкового субстрата) щелочную протеазу Food Pro® и 0,5% (вес/вес относительно белкового субстрата) Food Pro® PNL и суспензию WPI в объеме 200 мкл переносили в каждую из 96 лунок микротитровального планшета (MTP; VWR, Дания). После этого в определенные лунки MTP добавляли 5 мкл трипептидилпептидазы, способной воздействовать на связи с участием пролина TRI079,имеющей либо 0 нкат/мл, либо 2188 нкат/мл, и 5 мкл PepN (описана в примере 10), имеющей 0, 197 или 393 нкат/мл. Затем MTP герметично закрывали и помещали в инкубатор при 50°C (инкубатор/шейкер HT iEMS, Thermo Scientific, Дания).
После 24 ч. инкубации и встряхивания при 400 об./мин. гидролиз останавливали путем добавления 20 мкл 2 М трихлоруксусной кислоты (TCA; Sigma-Aldrich, Дания), за исключением эталона (0 ч.), к которому TCA добавляли перед добавлением эндо- и экзопептидаз. Негидролизованный осажденный WPI удаляли путем фильтрования (0,22 мкм; фильтровальный планшет Corning 3504, Corning Incorporated, США). Отфильтрованный гидролизат WPI использовали для дериватизации с o-фтальальдегидом (OPA) (Nielsen, Petersen et al. 2001). OPA-дериватизацию проводили в соответствии с Nielsen et al. (2001) с небольшими модификациями. Образец объемом 25 мкл переносили в лунку, а затем добавляли 175 мкл OPA-реагента, растворенного в додекагидрате тринатрийфосфата. Измеренные значения оптической плотности при 340 нм на MTP-ридере (VersaMax, Molecular Devices, Дания) преобразовывали в сериновые эквиваленты с использованием калибровочной кривой для серина (0-2 мM).
Как показано в таблице 12, трипептидиламинопептидаза TRI079 (SEQ ID No. 57), а также PepN сильно повышали измеренную степень гидролиза по сравнению с эталоном только с эндопептидазами. Дополнительное повышение степени гидролиза получали при комбинировании TRI079 и PepN.
Таблица 12. Анализ DH (в %) гидролизата WPI, полученного за 24 ч. при 50°C, pH 6,0, с помощью комбинации TRI079 и PepN
ПРИМЕР 21
Гидролиз субстрата AAFPA-NH2 с помощью трипептидилпептидазы, способной воздействовать на связи с участием пролина TRI079
Описание процедуры гидролиза и анализа LC-MS
Субстрат AAFPA-NH2(синтезирован Schaefer, Копенгаген) солюбилизировали в 20 мM буфере McIlvaine, pH 4,5 (1 мг в 1 мл) и подвергали гидролизу при 25°C не более 8 ч. с помощью TRI079 (10 мкл раствора TRI079 в концентрации 1 мг/мл), полученной, как описано в примере 1. Затем гидролиз останавливали путем добавления 5% TFA (50 мкл) к 50 мкл раствора пептида. Раствор хранили при -20°С до дальнейшего анализа LC-MS/MS.
Анализы Nano LC-MS/MS проводили с использованием системы Easy LC (Thermo Scientific, Оденсе, Дания), сопряженной с гибридным масс-спектрометром LTQ Orbitrap Classic (Thermo Scientific, Бремен, Германия). Образцы загружали на специально изготовленную 2 см предколонку (внутр. д. 100 мкм, внеш. д. 375 мкм, заполнена Reprosil C18, частицы обращенной фазы 5 мкм (Dr. Maisch GmbH, Ammerbuch-Entringen, Германия)), соединенную с 10 см аналитической колонкой (внутр. д. 75 мкм., внешн. д. 375 мкм, заполнена Reprosil C18, частицы обращенной фазы 3 мкм (Dr. Maisch GmbH, Ammerbuch-Entringen, Германия)) со стальной иглой. Разделение проводили при скорости потока 300 нл/мин. с использованием 10-минутного градиента 0-34% растворителя B (H2O/CH3CN/TFE/HCOOH (100/800//100/1 об./об./об./об.)) в наноэлектрораспылительном источнике ионов (Thermo Scientific, Оденсе, Дания). Прибор LTQ Orbitrap Classic эксплуатировали в режиме MS/MS, зависящем от данных. Массы пептидов измеряли с помощью Orbitrap (MS-спектры получали с разрешением 60000 при соотношении масса/заряд (m/z) 400) и 2 наиболее интенсивных пептидных m/z отбирали и подвергали фрагментации с использованием CID в линейной ионной ловушке (LTQ). Динамическое исключение включали с размером списка исключения 500 масс, продолжительностью 40 с и шириной исключения масс ±10 ppm по отношению к массам в списке.
Доступ к файлам RAW получали с использованием программы с открытым исходным кодом Skyline 1.4.0.4421, которая может использовать интенсивности MS1 для построения хроматограмм. Изотопный фильтр для импорта предшественника устанавливали в количестве до трех (M, M+1 и M+2) с разрешением 60000 и использовали наиболее интенсивное состояние заряда. Пептидные последовательности субстрата, а также продукта расщепления вводили в Skyline и интенсивности рассчитывали в каждом образце.
Результаты
Анализ LC-MS показал снижение количества AAFPA-NH2 и накопление AAF со временем, указывая на то, что TRI079 способна гидролизовать AAFPA-NH2 и способна воздействовать на связи с участием пролина в положении P1´.
ПРИМЕР 22
Стабильность трипептидилпептидазы TRI045 (SEQ ID No. 99) в присутствии пепсина
Материалы и способы
Раствор пепсина: В данном примере использовали свиной пепсин от Sigma (P7000, 674 Sigma ед./мг, www.sigma.com) и получали в воде MilliQ в концентрации 10000 Sigma ед./мл.
Смесь для предварительной инкубации содержала 2,5 мкл образца TRI045, 95 мкл буфера GAT (50 мМ глицина, 50 мМ уксусной кислоты, 50 мМ Tris, рН 3,5), 5 мкл пепсина в воде milliQ (10000 Sigma ед./мл) (конечная концентрация, пепсиновые единицы: 500 Sigma ед./мл реакционной смеси) в 96-луночном MTP Corning с половинным объемом лунок. В случае контроля смесь для предварительной инкубации содержала 5 мкл воды вместо 5 мкл пепсина. Смесь инкубировали при 40°C в течение 60 мин., а затем хранили на льду. Для анализа остаточной активности анализируемая смесь содержала 5 мкл смеси для предварительной инкубации, 85 мкл 0,1 M уксусной кислоты-ацетата натрия (pH 4,0), 5 мкл H-Ala-Ala-Phe-pNA (2,5 мг/мл) от BACHEM.com (L-1095.0250). Считывание при 410 нм проводили на микропланшетном ридере каждые 0,5 мин. при 30oC. N=2.
Результаты
В условиях анализа и предварительной инкубации при 40°C в течение 60 мин. было обнаружено, что остаточная активность составляет выше 90% для TRI045 в присутствии предварительно инкубированной смеси с 500 пепсиновых ед./мл.
ПРИМЕР 23
TRI045 (SEQ ID No. 99) в качестве кормового фермента для стимуляции гидролиза белков корма
У животных протеазы продуцируются и секретируются в пищеварительном тракте для переваривания корма. Эти протеазы включают эндопротеазы - пепсин, трипсин и химотрипсин, и экзопептидазы - карбоксипептидаза А и В и т. д. Однако у животных не продуцируются аминопептидазы в качестве пищеварительных ферментов или по меньшей мере продуцируются в незначительном количестве. Как показано в данном примере, добавление трипептидилпептидазы TRI045 (седолизин) в корм на основе кукурузы и сои способствует расщеплению белка в системе in vitro. В данном примере показано, что TRI045 обладает высокой активностью при рН 4-6,5.
Материалы и способы
Трипептидный субстрат H-Ala-Ala-Phe-pNA (AAF-pNA от BACHEM.com, L-1095.0250) для седолизина получали в концентрации 2,5 мг/мл в DMSO. Реакционную смесь получали путем смешивания 8,5 мкл AAF-pNA, 7 мкл DMSO, 32 мкл воды и 50 мкл буфера с рН 4,14-6,57 и 0,8 мкл или 1,5 мкл TRI045. Реакцию инициировали при 30°C путем добавления фермента TRI045. Начальную скорость реакции регистрировали с использованием микропланшетного ридера с интервалом каждые 0,5 мин. при 410 нм в 96-луночном планшете.
Результаты
В таблице 13 показано, что TRI045 имеет оптимальную активность при рН около 5,0, но все еще имеет активность около 50% при рН около 4 и рН 6,5, что идеально подходит для переваривания корма в желудке. На фигуре 22 дополнительно показано, что конечная степень реактивности, достигаемая при рН 5, рН 5,5 и рН 6, очень сходна. Высокий оптимум рН идеально подходит для корма для животных, поскольку в таком случае панкреатин успеет образовать больше олигопептидных субстратов для TRI045.
Таблица 13. Влияние pH на активность TRI045 с использованием H-Ala-Ala-Phe-pNA в качестве субстрата (значения представляют собой среднее от одного теста с 0,8 мкл TRI045 (n=2) и одного теста с дозой TRI045 1,5 мкл (n=1).
ПРИМЕР 24
Влияние TRI045 (SEQ ID No. 99), а также пепсина и панкреатина на гидролиз субстрата из кукурузно-соевого корма
Реакционная система in vitro содержала 140 мкл 10% (вес./об.) суспензии кукурузно-соевого корма (14 мг кукурузно-соевого корма), 10 мкл TRI045 в 50 мM MES-NaOH, pH 6,0, 10 мкл свиного пепсина (1,14 ЕД/мкл в воде). Реакционную смесь инкубировали со встряхиванием при 40°C в течение 45 мин., а затем добавляли 34 мкл свиного панкреатина (0,4636 мг/мл в 1 М Na-бикарбонате) и дополнительно инкубировали в течение дополнительных 60 мин. После инкубации 96-луночный планшет центрифугировали и надосадочные жидкости использовали для анализа остаточной активности TRI045 и для анализов OPA и BCA (см. ниже).
Измерения степени гидролиза растворимого белка основаны на реакции первичных аминогрупп с o-фтальальдегидом (анализ OPA). Ссылка: P.M. Nielsen, D. Petersen и C. Dambmann. Improved Method for Determining Food Protein Degree of Hydrolysis. Journal of Food Science. 66 (2001) 642-646.
Для анализа OPA выполняли следующую процедуру. 10-25 мкл образца корма, обработанного ферментом из планшета с исходными образцами, переносили в новый планшет, затем в данный планшет добавляли 175 мкл реагента OPA, содержащего борат натрия, додецилсульфат и дитиотреитол. Окончательные измерения оптической плотности при 340 нм проводили сразу через 2 мин. и 5 секунд перемешивания.
Для количественного определения концентраций белка в каждом образце протеазы использовали набор реагентов для анализа белков с помощью BCA Pierce (Thermo Scientific, номер по каталогу 23228). Образец TRI045 не очищали перед количественной оценкой. Набор для анализа белков с помощью BCA Pierce представляет собой совместимый с детергентами состав на основе бицинхониновой кислоты (BCA) для колориметрического выявления и количественной оценки общего содержания белков. В этом способе сочетается хорошо известное восстановление Cu2+ до Cu1+ с помощью белка в щелочной среде с высокочувствительным и селективным колориметрическим выявлением катиона меди (Cu+1) с использованием специального реагента, содержащего бицинхониновую кислоту. В данном анализе продукт реакции, окрашенный в пурпурный цвет, образуется путем хелатирования двух молекул BCA с одним ионом меди. Этот водорастворимый комплекс характеризуется значительным поглощением при 562 нм, которое является почти линейным при увеличении концентрации белка в широком рабочем диапазоне (20-2000 мкг/мл). Макромолекулярная структура белка, количество пептидных связей и присутствие четырех конкретных аминокислот - цистеина, цистина, триптофана и тирозина, как сообщалось, отвечают за окрашивание с BCA.
Для определений с помощью OPA (общее количество высвобожденных аминогрупп) и BCA (общее содержание белка в растворимой фракции) надосадочные жидкости разбавляли в 20 раз и использовали 10 мкл.
В системе, содержащей TRI045 в концентрации 1000 ppm, в присутствии свиного пепсина и панкреатина, высвобождение свободных аминогрупп из кукурузно-соевого корма (как мера гидролиза белка (значение OPA)) повышалось на 9% и растворимость белка повышалась на 5%.
Для того, чтобы проверить стабильность TRI045 в описанных выше условиях анализа in vitro (инкубация в присутствии пепсина при рН 3 в течение 45 мин. при 40oC, а затем в присутствии панкреатина в течение 60 мин. при 40oC), затем оценивали остаточную активность TRI045. Реакционная смесь содержала 50 мкл 0,1 М буфера HAC-NaAC (рН 5,0), 10 мкл надосадочной жидкости и 5 мкл AAF-pNA (5 мг/мл в DMSO). Скорость реакции отслеживали при 410 нм и 30°C каждые 30 секунд с использованием микропланшетного ридера. В качестве контроля использовали коммерческую протеазу в той же концентрации 1000 ppm.
Вывод для примеров 22-24
Скорость реакции для контроля (только пепсин и панкреатин) составляла 4,3 mOD/мин., для коммерческойпротеазы - 11,0 mOD/мин. и для TRI045-19,3 mOD/мин. После вычитания контроля (4,3 mOD/мин.) остаточная активность TRI045 в отношении субстрата AAF-pNA была в 2,2 раза выше, чем для коммерческой протеазы. Эти результаты указывают на то, что TRI045 является стабильной к действию пепсина и панкреатина при 40°C в течение по меньшей мере 100 минут.
В заключение, в данном примере продемонстрировано, что TRI045 является стабильной к действию пепсина и панкреатина при инкубации в течение 105 мин. при 40°C в присутствии кукурузно-соевого корма в диапазоне pH 3-7. Она также обладала дополнительным эффектом в виде повышения солюбилизации белка и гидролиза белка в присутствии пепсина и панкреатина при использовании кукурузно-соевого корма в качестве субстрата в условиях, имитирующих пищеварительную систему, характерную для однокамерного желудка (BEDFORD, M.R., & CLASSEN, H.L. (1993) ʺAn in vitro assay for prediction of broiler intestinal viscosity and growth when fed rye-based diets in the presence of exogenous enzymesʺ. Poultry Science, 72: 137-143)., т. е. реакцию проводили при 40°C при рН 3,0-3,3 в присутствии пепсина в течение 45 мин., а затем pH повышали до рН 6,5-7,0 и добавляли панкреатин с дополнительной инкубацией в течение 60 мин.
Литература
Nakadai, T., et al. (1973). "Purification and properties of leucine amino-peptidase I from Aspergillus oryzae." Agricultural and Biological Chemistry 37(4): 757-765.
Nielsen, P. M., et al. (2001). "Improved method for determining food protein degree of hydrolysis." Journal of Food Science 66(5): 642-646.
Stressler, T., et al. (2013). "Characterization of the Recombinant Exopeptidases PepX and PepN from Lactobacillus helveticus ATCC 12046 Important for Food Protein Hydrolysis." PLoS ONE 8(7) e70055.
Wang, F., et al. (2012). "Biochemical and conformational characterization of a leucine amino-peptidase from Geobacillus thermodenitrificans NG80-2." World Journal of Microbiology and Biotechnology 28(11): 3227-3237.
Различные модификации и варианты описанных способов и совокупность принципов настоящего изобретения будут очевидны специалистам в данной области техники без отступления от объема и сущности настоящего изобретения. Хотя настоящее изобретение было описано с привязкой к конкретными предпочтительными вариантами осуществления, следует понимать, что заявляемое изобретение не должно чрезмерно ограничиваться такими конкретными вариантами осуществления. Действительно, различные модификации описанных способов осуществления настоящего изобретения, которые являются очевидными для специалистов в области биохимии и биотехнологии или в смежных областях, как предполагается, находятся в пределах объема следующей формулы изобретения.
Реферат
Изобретение относится к области биотехнологии. Описан способ получения гидролизата. Заявленный способ включает стадию смешивания белка или его части с эндопротеазой и толерантной к пролину трипептидилпептидазой, обладающей экзопептидазной активностью, где указанная толерантная к пролину трипептидилпептидаза способна к отщеплению трипептидов с N-конца пептидов, имеющих пролин в P1' или аминокислоту, выбранную из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, серина, треонина, триптофана, тирозина, валина или синтетических аминокислот в положении P1'. Изобретение расширяет арсенал средств для получения гидролизата. 14 з.п. ф-лы, 28 ил., 13 табл., 24 пр.
Формула
Документы, цитированные в отчёте о поиске
Гидролизат казеина и способ его получения

Комментарии