Способ культивирования одиночной в-клетки - RU2709531C2
Код документа: RU2709531C2
Описание
В данном документе сообщается о способе получения аминокислотной последовательности по меньшей мере вариабельных доменов моноклонального антитела, секретируемого одиночной В-клеткой, которая была получена из популяции В-клеток экспериментального животного путем размещения одиночных клеток и совместного культивирования с фидерными клетками в присутствии фидерной смеси.
Уровень техники
Для получения клеток, секретирующих моноклональные антитела, широко используется гибридомная технология, разработанная Келером и Мильштейном. Но в гибридомной технологии только часть В-клеток, полученных от иммунизированного экспериментального животного, можно подвергнуть слиянию и размножению. Источником В-клеток, как правило, является орган иммунизированного экспериментального животного, такой как селезенка.
Zubler и соавт. в 1984 году начали разработку другого подхода к получению клеток, секретирующих моноклональные антитела (см., например, Eur. J. Immunol. 14 (1984) 357-63, J. Exp. Med. 160 (1984) 1170-1183). В этом подходе из крови иммунизированного экспериментального животного получали В-клетки и совместно культивировали с мышиными фидерными клетками EL-4 В5 в присутствии цитокин-содержащей фидерной смеси. С этой методикой через 10-12 дней совместного культивирования можно получить до 50 нг/мл антитела.
Weitkamp, J-H., et al. (J. Immunol. Meth. 275 (2003) 223-237) сообщают о создании рекомбинантных человеческих моноклональных антител к ротавирусу из отдельных антиген-специфических В-клеток, выбранных с помощью люминесцентных вирусподобных частиц. В патенте США 2006/0051348 сообщается о способе получения множества выделенных антител к множеству родственных антигенов. В патентах WO 2008/144763 и WO 2008/045140 сообщается, соответственно, об антителах к IL-6 и об их применении и способе культивирования для получения клональной популяции антиген-специфических В-клеток. В патенте США 2007/0269868 сообщается о способе культивирования для получения клональной популяции антиген-специфических В-клеток. Masri et al. (в Mol. Immunol. 44 (2007) 2101-2106) сообщают о клонировании и экспрессии в E. coli функционального Fab-фрагмента, полученного из одиночного человеческого лимфоцита против токсина сибирской язвы. В патенте WO 2007/031550 сообщается о способе получения иммуноглобулиновых библиотек.
Сущность изобретения
В данном документе сообщается о способе выделения В-клетки из популяции В-клеток, которая обладает особыми свойствами. Во-первых, уже через четыре недели после первой иммунизации экспериментального животного можно выделить индуцированные клетки, продуцирующие антитела, и определить специфичность связывания антител. Во-вторых, можно увеличить количество и/или качество (например, способность к продукции/секреции антитела) клеток, продуцирующих антитела, любым из следующих этапов: i) этапом предварительной инкубации, и/или ii) этапом центрифугирования, и/или iii) этапом пэннинга («просеивания» анализируемого содержимого через сорбент или субстрат с иммобилизованным лигандом). В-третьих, фидерную смесь, используемую для совместного культивирования В-клеток и фидерных клеток, можно улучшить путем добавления IL-21, или IL-6, или SAC, или BAFF.
Таким образом, в данном документе в качестве аспекта сообщается о способе выбора В-клетки, содержащем следующие этапы:
а) возможно, мечение В-клеток из популяции В-клеток,
б) индивидуальное культивирование каждой В-клетки из популяции В-клеток, которые были размещены в виде одиночных клеток, совместно с фидерными клетками,
в) выбор В-клеточного клона, пролиферирующего и секретирующего антитело на этапе б).
В данном документе в качестве аспекта сообщается о способе получения В-клеточного клона, включающем следующие этапы:
а) получение В-клеток от экспериментального животного,
б) мечение В-клеток,
в) размещение меченых В-клеток в виде одиночных клеток,
г) индивидуальное культивирование размещенных одиночных В-клеток совместно с фидерными клетками,
д) выбор В-клеточного клона, пролиферирующего и секретирующего антитело на этапе г), и тем самым получение В-клеточного клона.
В данном документе в качестве другого аспекта сообщается о способе получения антитела, специфически связывающегося с антигеном-мишенью, включающем следующие этапы:
а) возможно, мечение В-клеток из популяции В-клеток по меньшей мере одной флуоресцентной меткой,
б) культивирование каждой В-клетки из популяции В-клеток, которые были размещены в виде одиночных клеток в отдельных контейнерах, в присутствии фидерных клеток и фидерной смеси, для получения одиночных В-клеточных клонов и культуральных супернатантов,
в) выбор В-клеточного клона, продуцирующего антитело, специфически связывающееся с антигеном-мишенью,
г) культивирование клетки, которая содержит нуклеиновую кислоту, которая кодирует антитело, специфически связывающееся с антигеном-мишенью, которое продуцируется В-клеточным клоном, выбранным в этапе в), или его гуманизированный вариант, и выделение этого антитела из клетки или культурального супернатанта и тем самым получение антитела.
В одном воплощении способ включает один или более чем один из следующих этапов:
после этапа в): в1) определение нуклеиновокислотной последовательности, кодирующей вариабельный домен легкой цепи и вариабельный домен тяжелой цепи антитела путем ПЦР с обратной транскрипцией,
после этапа в1): в2) трансфекция клетки нуклеиновой кислоты, содержащей нуклеиновокислотную последовательность, кодирующую вариабельный домен легкой цепи и вариабельный домен тяжелой цепи антитела.
В этом документе также в качестве аспекта сообщается о способе получения антитела, включающем следующие этапы:
а) получение популяции (зрелых) В-клеток (полученных из крови экспериментального животного),
б) мечение клеток из популяции В-клеток по меньшей мере одной флуоресцентной меткой (в одном воплощении от одной до трех или двумя-тремя флуоресцентными метками),
в) размещение одиночных клеток из меченой популяции В-клеток в отдельных контейнерах (в одном воплощении контейнер является лункой в многолуночном планшете),
г) культивирование размещенных отдельных В-клеток в присутствии фидерных клеток и фидерной смеси (в одном воплощении фидерными клетками являются клетки EL-4 В5, в одном воплощении фидерной смесью является природный TSN, в одном воплощении фидерной смесью является синтетическая фидерная смесь),
д) определение специфичности связывания антител, секретируемых в культивационную среду отдельных В-клеток,
е) определение аминокислотной последовательности вариабельных доменов легкой и тяжелой цепей специфически связывающих антител путем ПЦР с обратной транскрипцией и путем секвенирования, и тем самым получение нуклеиновой кислоты, кодирующей вариабельные домены легкой и тяжелой цепей моноклонального антитела,
ж) введение нуклеиновой кислоты, кодирующей вариабельные домены легкой и тяжелой цепей моноклонального антитела, в экспрессионную кассету для экспрессии антитела,
з) введение нуклеиновой кислоты в клетку,
и) культивирование клетки и выделение антитела из клетки или клеточного культурального супернатанта и тем самым получение антитела.
В одном воплощении всех аспектов, о которых сообщается в данном документе, способ включает этап инкубации популяции В-клеток в среде для совместного культивирования перед размещением клеток по отдельности. В одном воплощении инкубация осуществляется при температуре примерно 37°C. В одном воплощении инкубация осуществляется от 0,5 до двух часов. В конкретном воплощении инкубация осуществляется в течение примерно одного часа. В одном воплощении инкубация осуществляется при температуре примерно 37°C в течение примерно одного часа.
В одном воплощении всех аспектов, о которых сообщается в данном документе, способ включает этап центрифугирования размещенных по отдельности В-клеток перед совместным культивированием. В одном воплощении центрифугирование осуществляется в течение от примерно 1 минуты до примерно 30 минут. В конкретном воплощении центрифугирование осуществляется в течение примерно 5 минут. В одном воплощении является центрифугирование осуществляется со скоростью от примерно 100 g до примерно 1000 g. В конкретном воплощении центрифугирование осуществляется со скоростью примерно 300 g. В одном воплощении центрифугирование осуществляется в течение примерно 5 минут со скоростью примерно 300 g.
В одном воплощении всех аспектов, о которых сообщается в данном документе, способ включает непосредственно перед этапом мечения следующий этап: пэннинг В-клеток с иммобилизованным антигеном.
В одном воплощении всех аспектов, о которых сообщается в данном документе, популяцию В-клетки получают из крови животного с помощью центрифугирования в градиенте плотности.
В одном воплощении всех аспектов, о которых сообщается в данном документе, популяцию В-клеток получают из крови экспериментального животного через 4 дня после иммунизации. В другом воплощении популяцию В-клеток получают из крови экспериментального животного через период от 4 дней до минимум 9 дней после иммунизации. В еще воплощении популяцию В-клеток получают из крови экспериментального животного через 4-9 дней после иммунизации.
В одном воплощении всех аспектов, о которых сообщается в данном документе, популяцию В-клеток выделяют путем центрифугирования в градиенте плотности.
В одном воплощении всех аспектов, о которых сообщается в данном документе, В-клетки являются зрелыми В-клетками.
В одном воплощении всех аспектов, о которых сообщается в данном документе, мечение осуществляется одной-тремя флуоресцентными метками. В конкретном воплощении мечение осуществляется двумя или тремя флуоресцентными метками.
В одном воплощении всех аспектов, о которых сообщается в данном документе, мечение В-клеток приводит к мечению от 0,1% до 2,5% клеток от общей В-клеточной популяции.
В одном воплощении всех аспектов, о которых сообщается в данном документе, В-клетки представляют собой В-клетки мыши, или В-клетки хомяка, или В-клетки кролика.
В одном воплощении всех аспектов, о которых сообщается в данном документе, клетки размещают по отдельности в лунках многолуночного планшета.
В одном воплощении всех аспектов, о которых сообщается в данном документе, фидерные клетки являются мышиными клетками EL-4 В5.
В одном воплощении всех аспектов, о которых сообщается в данном документе, антитело является моноклональным антителом.
В одном воплощении всех аспектов, о которых сообщается в данном документе, осуществляется мечение IgG+CD19+-B-клеток, IgG+CD38+-B-клеток, IgG+CD268+-B-клеток, IgG-CD138+-В-клеток, CD27+CD138+-В-клеток или CD3-CD27+-В-клеток.
В одном воплощении всех аспектов, о которых сообщается в данном документе, В-клетки имеют мышиное происхождение, и осуществляется мечение IgG+CD19+-B-клеток и/или IgG-CD138+-В-клеток.
В одном воплощении всех аспектов, о которых сообщается в данном документе, В-клетки получены от хомяка, и осуществляется мечение IgG+IgM--B-клеток.
В одном воплощении всех аспектов, о которых сообщается в данном документе, В-клетки получены от кролика, и осуществляется мечение IgG+-B-клеток, и/или CD138+-В-клеток, или CD138+IgG+-B-клеток, и/или IgC+IgM--В-клеток.
В одном воплощении всех аспектов, о которых сообщается в данном документе, совместное культивирование осуществляют в среде RPMI 1640 с добавлением 10% (объем/объем) FCS, 1% (вес/объем) 200 мМ раствора глутамина, которая содержит пенициллин и стрептомицин, 2% (объем/объем) 100 мМ раствора пирувата натрия и 1% (объем/объем) 1 М HEPES-буфера (2-(4-(2-гидроксиэтил)-1-пиперазин)этансульфокислота). В другом воплощении совместное культивирование осуществляют в среде, которая дополнительно содержит 0,05 мМ бета-меркаптоэтанол.
В одном воплощении всех аспектов, о которых сообщается в данном документе, совместное культивирование осуществляют с фидерными клетками и фидерной смесью. В одном воплощении фидерной смесью является супернатант природных культивированных тимоцитов (TSN) или синтетическая фидерная смесь.
В одном конкретном воплощении фидерная смесь представляет собой синтетическую фидерную смесь. В одном воплощении синтетическая фидерная смесь включает интерлейкин-1 бета и фактор некроза опухоли альфа. В одном воплощении синтетическая фидерная смесь включает интерлейкин-2 (IL-2) и/или интерлейкин-10 (IL-10). В одном воплощении синтетическая фидерная смесь также содержит клетки золотистого стафилококка штамма Cowan (SAC, Staphylococcus aureus Cowan). В одном воплощении синтетическая фидерная смесь включает интерлейкин-21 (IL-21). В одном воплощении синтетическая фидерная смесь включает В-клеточный фактор активации из семейства фактора некроза опухоли (BAFF, B-cell activation factor of the tumor necrosis factor family). В одном воплощении синтетическая фидерная смесь включает интерлейкин-6 (IL-6). В одном воплощении синтетическая фидерная смесь включает интерлейкин-4 (IL-4).
В одном воплощении совместное культивирование осуществляют в присутствии супернатанта культивированных тимоцитов в качестве фидерной смеси. В конкретном воплощении супернатант культивированных тимоцитов получают из тимоцитов тимуса молодого животного.
В одном воплощении способ получения В-клеточного клона также включает этап
е) определения аминокислотной последовательности вариабельного домена легкой и тяжелой цепей антитела, произведенного выбранным В-клеточным клоном этапа д), с помощью ПЦР с обратной транскрипцией и секвенирования, и тем самым получения аминокислотной последовательности вариабельного домена моноклонального антитела.
В одном воплощении экспериментальное животное выбрано среди мыши, хомяка и кролика.
Подробное описание изобретения
Способ, о котором сообщается в данном документе, позволяет быстро охарактеризовать специфичность связывания моноклональных антител, полученных от отдельных В-клеточных клонов, т.е. в течение четырех недель после первой иммунизации экспериментального животного можно выделить индуцированные клетки, продуцирующие антитела, и определить специфичность связывания антител, продуцированных ими, в результате чего можно выполнить по меньшей мере 4 различных эксперимента из-за большого количества/концентрации антитела в супернатанте с совместным культивированием В-клеток.
Иммунизация:
Часто животные (не человек), такие как мыши, кролики, хомяки и крысы, используются в качестве животной модели для оценки терапии на основе антител. Поэтому часто требуется предоставить антитела с перекрестной реактивностью, связывающиеся с нечеловеческим животным антигеном, а также с человеческим антигеном. Способ, о котором сообщается в данном документе, может быть использован для предоставления антител с перекрестной реактивностью. В способе, о котором сообщается в данном документе, могут быть использованы В-клетки, полученные, например, от мыши, хомяка и кролика. В одном воплощении мышь является NMRI-мышью или BALB/c-мышью. В другом воплощении хомяк выбран среди армянского хомяка (Cricetulus migratorius), китайского хомяка (Cricetulus griseus) и сирийского хомяка (Mesocricetulus auratus). В конкретном воплощении хомяк является армянским хомяком. В одном воплощении кролик выбран среди белого новозеландского (NZW) кролика, кролика Zimmermann (ZIKA), кролика мутантной линии Alicia, кролика мутантной линии Basilea, трансгенного кролика с локусом иммуноглобулина человека, нокаутного кролика rbIgM и результатов их скрещивания.
В одном воплощении экспериментальные животные, например, мыши, хомяки и кролики, выбранные для иммунизации, имеют возраст не старше 12 недель.
Источник и выделение В-клеток:
Кровь экспериментальных животных обеспечивает высокое разнообразие В-клеток, продуцирующих антитела. Полученные из нее В-клетки секретируют антитела, которые практически не имеют идентичных или перекрывающихся аминокислотных последовательностей в CDR и, таким образом, демонстрируют большое разнообразие.
В одном воплощении В-клетки экспериментального животного, например, из крови, получают через период от 4 дней после иммунизации до по меньшей мере 9 дней после иммунизации или самого последнего бустирования. Этот промежуток времени обеспечивает высокую гибкость в способе, о котором сообщается в данном документе. Вполне вероятно, что в этот промежуток времени В-клетки, обеспечивающие наиболее аффинные антитела, мигрируют из селезенки в кровь (см., например, Paus, D., et al., JEM 203 (2006) 1081-1091; Smith, K.G.S., et al., The EMBO J. 16 (1997) 2996-3006; Wrammert, J., et al., Nature 453 (2008) 667-672).
В-клетки из крови экспериментального животного могут быть получены любым способом, известным специалистам в данной области. Например, могут быть использованы центрифугирование в градиенте плотности (DGC, density gradient centrifugation) или лизис эритроцитов (лизис). Центрифугирование в градиенте плотности по сравнению с гипотоническим лизисом обеспечивает более высокий общий выход, т.е. число В-клеточных клонов. Кроме того, из клеток, полученных путем центрифугирования в градиенте плотности, большее количество клеток делится и растет на этапе совместного культивирования. Кроме того, концентрация секретированного антитела выше по сравнению с клетками, полученными с помощью других способов. Таким образом, в одном воплощении предоставление популяции В-клеток осуществляется путем центрифугирования в градиенте плотности.
Таблица 1: Число IgG-продуцирующих лунок/клеточных клонов, когда клетки получают путем центрифугирования в градиенте плотности (DGC) или гипотонического лизиса эритроцитов.

Этапы выбора перед совместным культивированием:
В-клетки, продуцирующие антитела, которые специфически связываются с антигеном, могут быть получены из мононуклеарных клеток периферической крови (МНПК). Таким образом, в одном воплощении всех способов, о которых сообщается в данном документе, В-клеточную популяцию получают из мононуклеарных клеток периферической крови (МНПК).
Термин «специфически связывается» и его грамматические эквиваленты означают, что антитело связывается с его мишенью с константой диссоциации (Kd) 10-7 М или менее, в одном воплощении от 10-8 М до 10-13 М, в другом воплощении от 10-9 М до 10-13 М. Этот термин также используется для указания, что антитело не связывается специфически с другими присутствующими биомолекулами, т.е. он связывается с другими биомолекулами с константой диссоциации (Kd) 10-6 М или более, в одном воплощении от 10-6 М до 1 М.
В одном воплощении всех способов, о которых сообщается в данном документе, МНПК обеднены макрофагами. Это выгодно, как указано ниже, например, в одном воплощении для В-клеток кроличьего происхождения для этапа совместного культивирования.
Макрофаги могут быть удалены из МНПК за счет адгезии к поверхности клеточного культурального планшета (см. этап предварительной инкубации).
В одном воплощении способа, о котором сообщается в данном документе, клетки получают из иммунизированных белком животных и обедняют их макрофагами перед мечением.
Было установлено, что инкубирование популяции В-клеток в среде для совместного культивирования перед размещением клеток по отдельности увеличивает общее число клеток, секретирующих антитела, полученных после размещения клеток по отдельности по сравнению с клетками, размещенными по отдельности непосредственно после выделения и дополнительного обогащения популяции В-клеток из крови экспериментального животного (например, кролика, см. таблицы 2а и 2b). В частности, инкубация осуществляется при температуре примерно 37°C в течение примерно одного часа в среде EL-4 В5, например, с использованием клеточного культурального инкубатора.
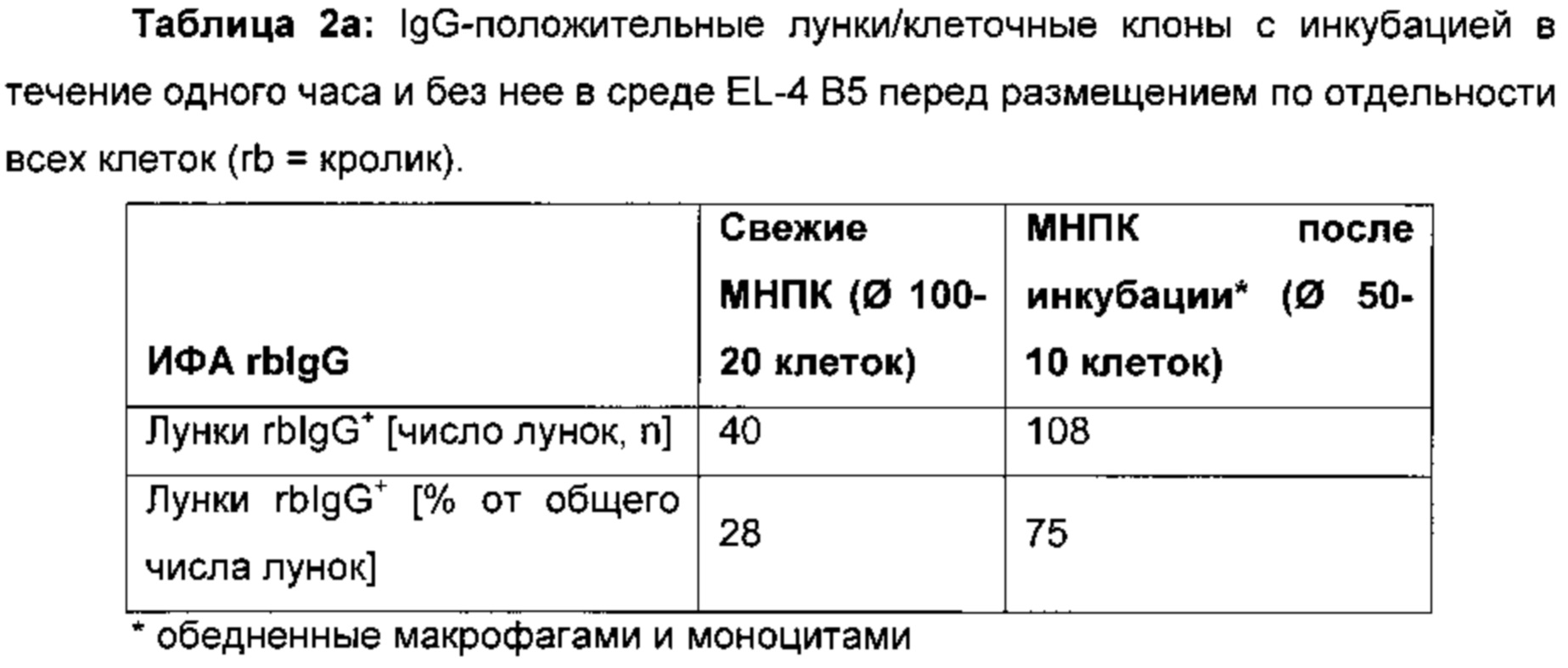
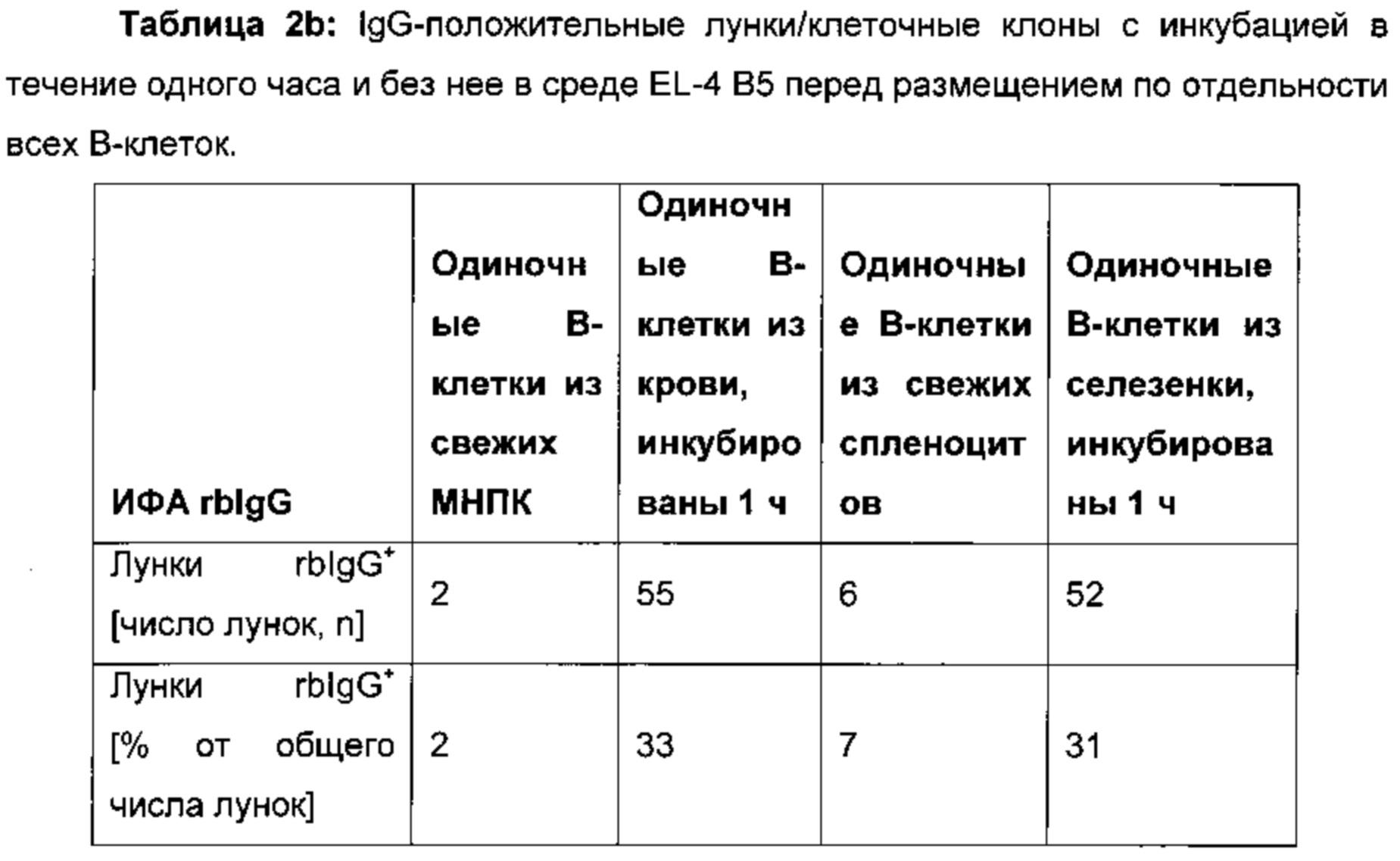
В одном воплощении способов, о которых сообщается в данном документе, клетки получают от иммунизированного белком животного и обедняют их макрофагами.
Число клеток, не продуцирующих антитело, связывающее антиген, или, аналогично, число клеток, продуцирующих антитело, связывающее антиген, можно уменьшить или увеличить, соответственно, с помощью подхода пэннинга. При этом присутствующий связывающий партнер прикреплен к поверхности, и число клеток, связывающихся с ним, селективно увеличено в клеточной популяции в случае, когда связанные клетки подвергаются дальнейшей обработке, или уменьшено в клеточной популяции в случае, когда клетки, остающиеся в растворе, подвергаются дальнейшей обработке.

Способ, о котором сообщается в данном документе, включает в одном воплощении перед размещением клеток по отдельности этап выбора, на котором В-клетки, продуцирующие специфические и/или не реагирующие перекрестно антитела, выбирают на основе маркеров клеточной поверхности и флуоресцентно-активированной сортировки/селекции клеток. В одном воплощении сортируют/обогащают/отбирают зрелые В-клетки. Для выбора В-клеток у различных экспериментальных видов животных могут быть использованы различные маркеры клеточной поверхности. Было установлено, что многие из доступных маркеров клеточной поверхности не обеспечивают подходящего мечения ни по отдельности, ни в комбинации.
При мечении нецелевых клеточных популяций и неспецифически связывающих лимфоцитов можно выборочно удалять эти клетки. На этом этапе удаления (обеднения) может быть достигнуто только неполного удаление. Хотя удаление является не количественным, оно обеспечивает преимущество при последующем флуоресцентном мечении оставшихся клеток, так как число мешающих клеток может быть снижено или даже сведено к минимуму. При размещении по отдельности зрелых В-клеток (В-клеток памяти, аффинно зрелых лимфобластов и плазматических клеток) путем флуоресцентно-активированной сортировки клеток с помощью мечения, как указано ниже, может быть получено большее количество IgG+-лунок/клеточных клонов на этапе совместного культивирования.
Термин «мечение» обозначает наличие или отсутствие поверхностного маркера, который может быть определен путем добавления специфически связывающегося и меченого антитела против поверхностного маркера. Таким образом, наличие поверхностного маркера определяется, например, в случае флуоресцентной метки при возникновении флуоресценции, в то время как отсутствие поверхностного маркера определяется отсутствием флуоресценции после инкубации с соответствующим специфически связывающимся и меченым антителом против поверхностного маркера.
С помощью различных поверхностных маркеров могут быть помечены различные клеточные популяции, например CD3+-клетки (Т-клетки), CD19+-клетки (В-клетки), IgM+-клетки (зрелые наивные В-клетки), IgG+-клетки (зрелые В-клетки), CD38+-клетки (например, лимфобласты) и IgG+CD38+-клетки (преплазматические клетки).
Как сообщалось в данном документе, было разработано иммунофлуоресцентное мечение для отбора зрелых IgG+-В-клеток, таких как В-клетки памяти, лимфобласты и плазматические клетки. Для отбора или обогащения В-клетками клетки метят либо одной, либо двумя, либо тремя метками. Также необходимо такое мечение, которое дает примерно от 0,1% до 2,5% меченых клеток от общей популяции клеток. В одном воплощении В-клетки размещают в виде одиночных клеток, выбранных путем мечения поверхностных молекул, присутствующих у 0,1%-2,5% В-клеток в популяции, в другом воплощении у 0,3%-1,5% В-клеток в популяции, в еще одном воплощении у 0,5%-1% В-клеток в популяции.
Из IgG+-В-клеток в популяции МНПК 0,5%-1% могут быть дважды помечены как IgG+CD19+-клетки, IgG+CD38+-клетки и IgG+CD268+-клетки. Таким образом, в одном воплощении всех способов, о которых сообщается в данном документе, IgG+CD19+-В-клетки, IgG+CD38+-В-клетки или IgG+CD268+-B-клетки размещают в виде одиночных клеток.
Из IgG--B-клеток в популяции МНПК 0,5%-1% могут быть дважды помечены как IgG-CD138+-клетки. Таким образом, в одном воплощении всех способов, о которых сообщается в данном документе, IgG-CD138+-В-клетки размещают в виде одиночных клеток.
Мечение CD27+CD138+-клеток или CD3-CD27+-клеток приводит примерно к 1,5% клеток клеточной популяции, которые должны быть помечены, соответственно. Таким образом, в одном воплощении всех способов, о которых сообщается в данном документе, CD27+CD138+-В-клетки или CD3-CD27+-В-клетки размещают в виде одиночных клеток.
Из IgG+-В-клеток хомяка в популяции МНПК 0,6%±0,1 могут быть дважды помечены как IgG+IgM--В-клетки хомяка. Таким образом, в одном воплощении всех способов, о которых сообщается в данном документе, IgG+IgM--B-клетки хомяка размещают в виде одиночных клеток.
В одном воплощении в виде одиночных клеток размещают IgG-CD138+-B-клетки из В-клеток, полученных от иммунизированного животного. В одном воплощении всех способов, о которых сообщается в данном документе, в виде одиночных клеток размещают IgG+CD19+-В-клетки из В-клеток, полученных от неиммунизированного животного. В другом воплощении всех способов, о которых сообщается в данном документе, в виде одиночных клеток размещают IgG+IgM--B-клетки из В-клеток, полученных от неиммунизированного или иммунизированного животного. В одном воплощении всех способов, о которых сообщается в данном документе, в виде одиночных клеток размещают IgG+CD19+-B-клетки мыши. Этот этап выбора приводит к повышению или даже к максимальному выходу IgG+-лунок в последующем этапе совместного культивирования. В другом воплощении всех способов, о которых сообщается в данном документе, в виде одиночных клеток размещают IgG-CD138+-В-клетки мыши. При этом выбирают клетки, во-первых, продуцирующие наибольшее число В-клеточных клонов, и, во-вторых, с наибольшей концентрацией IgG (см. таблицу 5). В другом воплощении всех способов, о которых сообщается в данном документе, в виде одиночных клеток размещают IgG+CD19+-В-клетки мыши и IgG-CD138+-B-клетки мыши. В одном конкретном воплощении способ имеет условие, что, если клетки получены от кролика, осуществляют мечение не IgG+-В-клеток и/или не CD138+-В-клеток.
IgG+-В-клетки мыши могут быть помечены с помощью антитела 227, распознающего IgG мыши (Ab 227), IgG+-В-клетки хомяка могут быть помечены с помощью антитела 213, распознающего IgG хомяка (АВ 213) и/или антитела 225, распознающего IgG кролика (АВ 225), а В-клетки кролика могут быть помечены с помощью анти- антитела 184, распознающего IgG (см. таблицу 4).


Следует отметить, что не все коммерчески доступные антитела могут быть использованы для мечения из-за их низкой или не существующей специфичности.
Мышиные В-клетки могут быть помечены с помощью анти-IgG-антитела 227, В-клетки хомяка могут быть помечены с помощью анти-IgG-антитела 213.
Мышиные IgG+CD19+-B-клетки могут быть помечены с помощью антитела 227 и антитела 218,
мышиные IgG+IgM--В-клетки могут быть помечены с помощью антитела 227 и антитела 219,
IgG+IgM--В-клетки хомяка могут быть помечены с помощью антитела 213 и антитела 224,
IgG+-В-клетки кролика могут быть помечены с помощью антитела 184,
IgG+IgM--В-клетки кролика могут быть помечены с помощью антитела 184, антитела 254 и SA 263,
IgG+CD138+-B-клетки кролика могут быть помечены с помощью антитела 259 и антитела 256.
Мышиные В-клетки могут быть помечены с помощью анти-CD27-антитела 235 или 236 (АВ 235, АВ 236), анти-CD38-антитела 192 (АВ 192), анти-CD138-антитела 233 (АВ 233) и анти-CD268-антитела 246 (АВ 246).


В одном воплощении способы включают этап обеднения В-клеточной популяции макрофагами и обогащение В-клеточной популяции В-клетками, секретирующими антитело, специфически связывающееся с антигеном-мишенью.
Размещение клеток по отдельности:
Способ, о котором сообщается в данном документе, включает этап размещения В-клеток из В-клеточной популяции в виде одиночных клеток. В одном воплощении всех способов, о которых сообщается в данном документе, клетки размещают по отдельности с помощью флуоресцентно-активированной сортировки клеток (FACS). Мечение, необходимое для размещения одиночных клеток с помощью FACS, может осуществляться так, как сообщалось в предыдущем разделе.
В одном воплощении всех способов, о которых сообщается в данном документе, специфически меченые В-клетки размещают в виде одиночных клеток. В еще одном воплощении всех способов, о которых сообщается в данном документе, мечение является мечением маркеров клеточной поверхности флуоресцентно мечеными антителами. В другом воплощении способы, о которых сообщается в данном документе, предусматривают моноклональные антитела. В одном воплощении всех способов, о которых сообщается в данном документе, в виде одиночных клеток размещают зрелые В-клетки.
Кроме того, было обнаружено, что дополнительный этап центрифугирования после размещения одиночных клеток и перед совместным культивированием обеспечивает увеличение числа клеток, секретирующих антитело, и увеличивает количество секретируемого IgG (например, экспериментальное животное с локусом иммуноглобулина человека, см. таблицу 6).
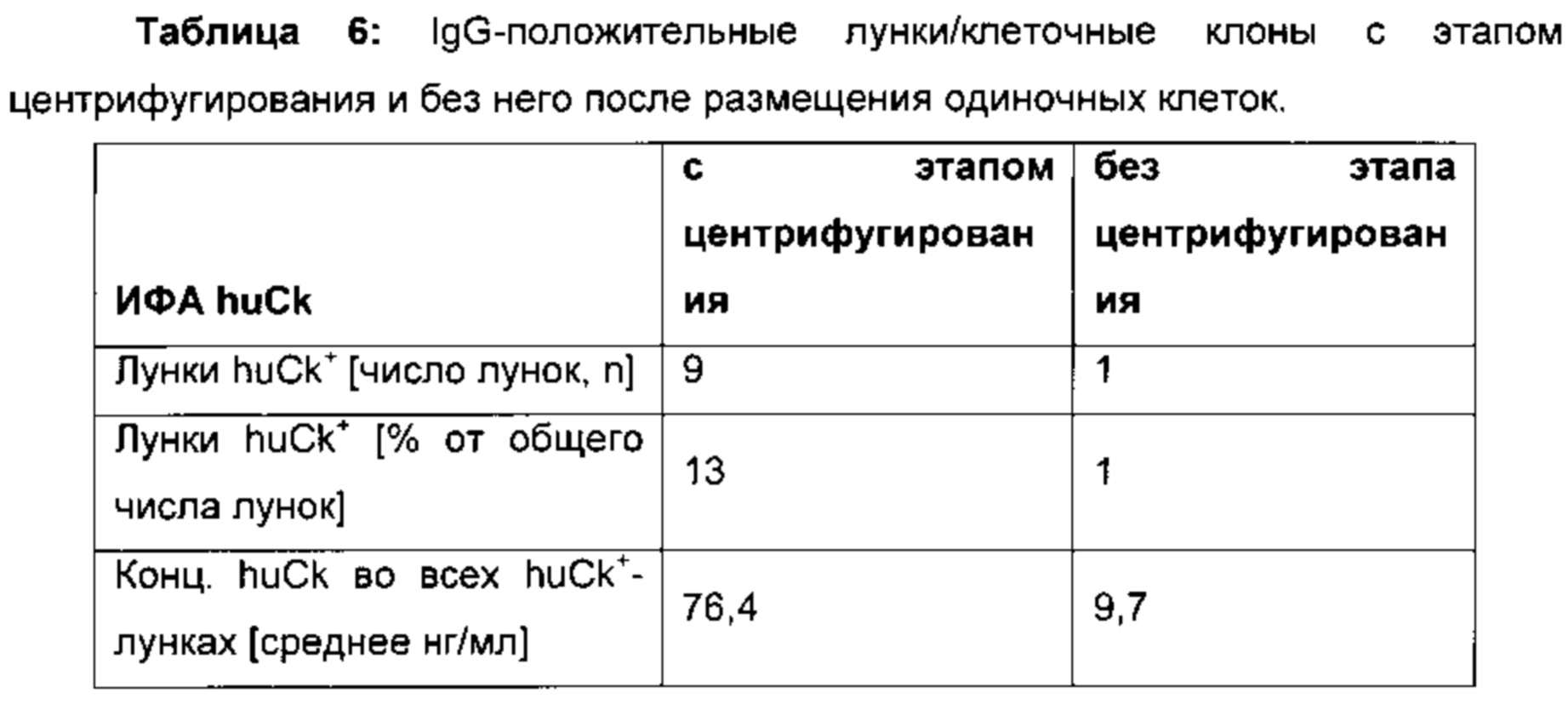
В одном воплощении всех способов, о которых сообщается в данном документе, способ включает этап центрифугирования размещенных по отдельности клеток перед совместным культивированием. В одном конкретном воплощении центрифугирование осуществляют в течение 5 минут со скоростью 300 g.
Совместное культивирование:
Этапу совместного культивирования с фидерными клетками могут предшествовать ряд дополнительных этапов, а также следовать за ним.
В одном воплощении всех способов, о которых сообщается в данном документе, размещенные по отдельности В-клетки культивируют совместно с фидерными клетками в присутствии фидерной смеси. В конкретном воплощении В-клетки культивируют совместно с мышиными фидерными клетками EL-4 В5. С помощью подходящего иммунофлуоресцентного мечения, такого как описано выше, может быть достигнуто увеличение выхода на этапе совместного культивирования (число IgG+-лунок/клеточных клонов, а также концентрация IgG), а также обогащение зрелыми IgC-B-клетками или выделение зрелых IgG+-В-клеток из МНПК.
Путем размещения по отдельности IgG+CD19+- и/или IgG+CD38+-B-клеток из свежевыделенных МНПК можно получить наибольшее число IgG+-лунок/клеточных клонов. Путем размещения по отдельности IgG+CD19+-, IgG+CD38+- и/или IgG-CD138+-В-клеток после обеднения макрофагами или KLH-специфическими клетками (гемоцианин лимфы улитки) могут быть получены хорошие результаты. Путем размещения по отдельности IgG+CD19+-, IgG+CD38+- и/или IgG-CD138+-B-клеток после обеднения антиген-специфическими В-клетками могут быть получены улучшенные результаты. Таким образом, в одном воплощении всех способов, о которых сообщается в данном документе, в виде одиночных клеток размещают IgG+CD19+-, IgG+CD38+- и/или IgG-CD138+-В-клетки.
Было обнаружено, что размещение клеток по отдельности на основании мечения, которое описано выше, приводит к наибольшей доле IgG+-лунок/клеточных клонов и к лункам/клеточным клонам с высокой концентрацией IgG в супернатанте. Таким образом, в одном воплощении всех способов, о которых сообщается в данном документе, в виде одиночных клеток размещают мышиные IgG+CD19+- и/или IgG-CD138+-B-клетки. В одном воплощении всех способов, о которых сообщается в данном документе, в виде одиночных клеток размещают IgG+IgM--клетки хомяка. В одном воплощении всех способов, о которых сообщается в данном документе, в виде одиночных клеток размещают IgG+-, и/или IgG+CD138+-, и/или CD138+-, и/или IgG+IgM--В-клетки кролика.
Таблица 7: Выход при совместном культивировании в зависимости от иммунофлуоресцентного мечения.

Для мышиных В-клеток путем размещения IgG+CD19+-клеток по отдельности после каждого этапа обогащения (обогащ.) и/или обеднения (обедн.) может быть получено наибольшее число IgG+-лунок/клеточных клонов после совместного культивирования. Кроме того, путем размещения IgG-CD138+-клеток по отдельности могут быть получены лунки/клеточные клоны с наивысшей концентрацией IgG в супернатанте. Размещение IgG-CD138+-клеток по отдельности может быть использовано для В-клеток от иммунизированных животных. Сохранение одиночных IgG+CD19+-клеток может быть использовано для В-клеток от неиммунизированных животных. Размещение по отдельности IgG+IgM--клеток может быть использовано для В-клеток хомяка от иммунизированных и неиммунизированных животных. Размещение по отдельности IgG+-, и/или IgG+CD138+-, и/или CD138+-, и/или IgG+IgM--В-клеток может быть использовано для В-клеток кролика.
Иммунофлуоресцентное мечение, используемое для В-клеток, полученных из крови экспериментальных животных, также может быть использовано для мечения В-клеток, полученных из селезенки и других иммунных органов экспериментального животного, такого как мышь, хомяк и кролик. Для мышиных В-клеток доля IgG+-В-клеток селезенки составила примерно 0,8% по сравнению с 0,4% для IgG+CD19+-клеток. Для В-клеток хомяка соответствующие значения составили 1,9% и 0,5% IgG+IgM--клеток. Для В-клеток, полученных из крови кролика, после обеднения макрофагами было обнаружено 0,2% IgG+-клеток. После обеднения макрофагами пейеровы бляшки от кролика показали 0,4% IgG+-клеток, а селезенка показала 0,3% IgG+-клеток.
С помощью способов, о которых сообщается в данном документе, примерно через семь (7) дней, т.е. через 5, 6, 7 или 8 дней, особенно через 7 или 8 дней, после совместного культивирования могут быть получены концентрации антител от примерно 30 нг/мл до 15 мкг/мл или более (среднее значение примерно 500 нг/мл). С таким полученным количеством антитела можно выполнить большое число различных анализов для того, чтобы охарактеризовать антитело более подробно, например, в отношении специфичности связывания. С улучшением характеризации антитела на этом раннем этапе скрининга/отбора можно сократить число выделений необходимых нуклеиновых кислот и сиквенсных реакций, которые должны быть выполнены. Кроме того, В-клеточный клон предоставляет большое количество мРНК, кодирующей моноклональные вариабельные области легкой и тяжелой цепей, позволяя использовать вырожденный ПЦР-праймер, и устраняет необходимость в высоко специфическом праймере. Также снижается необходимое число циклов ПЦР. Таким образом, в одном воплощении ПЦР с обратной транскрипцией проводят с вырожденным ПЦР-праймером для вариабельных доменов легкой и тяжелой цепей.
В одном воплощении всех способов, о которых сообщается в данном документе, фидерная смесь является культуральным супернатантом тимоцитов. В конкретном воплощении культуральный супернатант тимоцитов получают из тимоцитов тимуса соответствующего молодого животного. Особенно подходит для применения тимус молодых животных по сравнению с выделением тимоцитов из крови взрослых животных. Термин «молодое животное» означает животное до половой зрелости. Молодой хомяк, например, имеет возраст менее 6 недель, особенно менее 4 недель. Молодая мышь, например, имеет возраст менее 8 недель, особенно менее 5 недель.
Из-за происхождения фидерной смеси, которая получена из супернатанта культивируемых тимоцитов (TSN, thymocyte cultivation supernatant), от партии к партии происходят значительные изменения. Для того чтобы преодолеть эту изменчивость, была разработана синтетическая фидерная смесь, состоящая из синтетических компонентов. Фидерная смесь, состоящая из 1L-1β (интерлейкина-1 бета), TNF (фактора некроза опухоли альфа), ИЛ-2 (интерлейкина-2) и IL-10 (интерлейкина-10), известна из Tucci, A., et al., J. Immunol. 148 (1992) 2778-2784.
В данном документе сообщается о синтетической фидерной смеси для совместного культивирования размещенных по отдельности В-клеток и фидерных клеток. Также в данном документе сообщается о В-клеточных видоспецифических добавках к синтетической фидерной смеси для увеличения количества антитела, секретируемого соответствующим В-клеточным клоном. Одновременно высоко продуцирующие клетки содержат больше мРНК, которая в свою очередь способствует обратной транскрипции и секвенированию кодирующей нуклеиновой кислоты, например, с набором резервных неспецифических праймеров.
Путем добавления SAC (клеток золотистого стафилококка штамма Cowan, была использована отдельная серия SAC) может быть увеличено число В-клеток, секретирующих антитело, и средняя концентрация IgG в супернатанте после совместного культивирования. Было обнаружено, что при добавлении SAC при совместном культивировании диапазон концентраций может быть определен как сниженный, а повышенные концентрации SAC уменьшали количество секретируемого антитела.
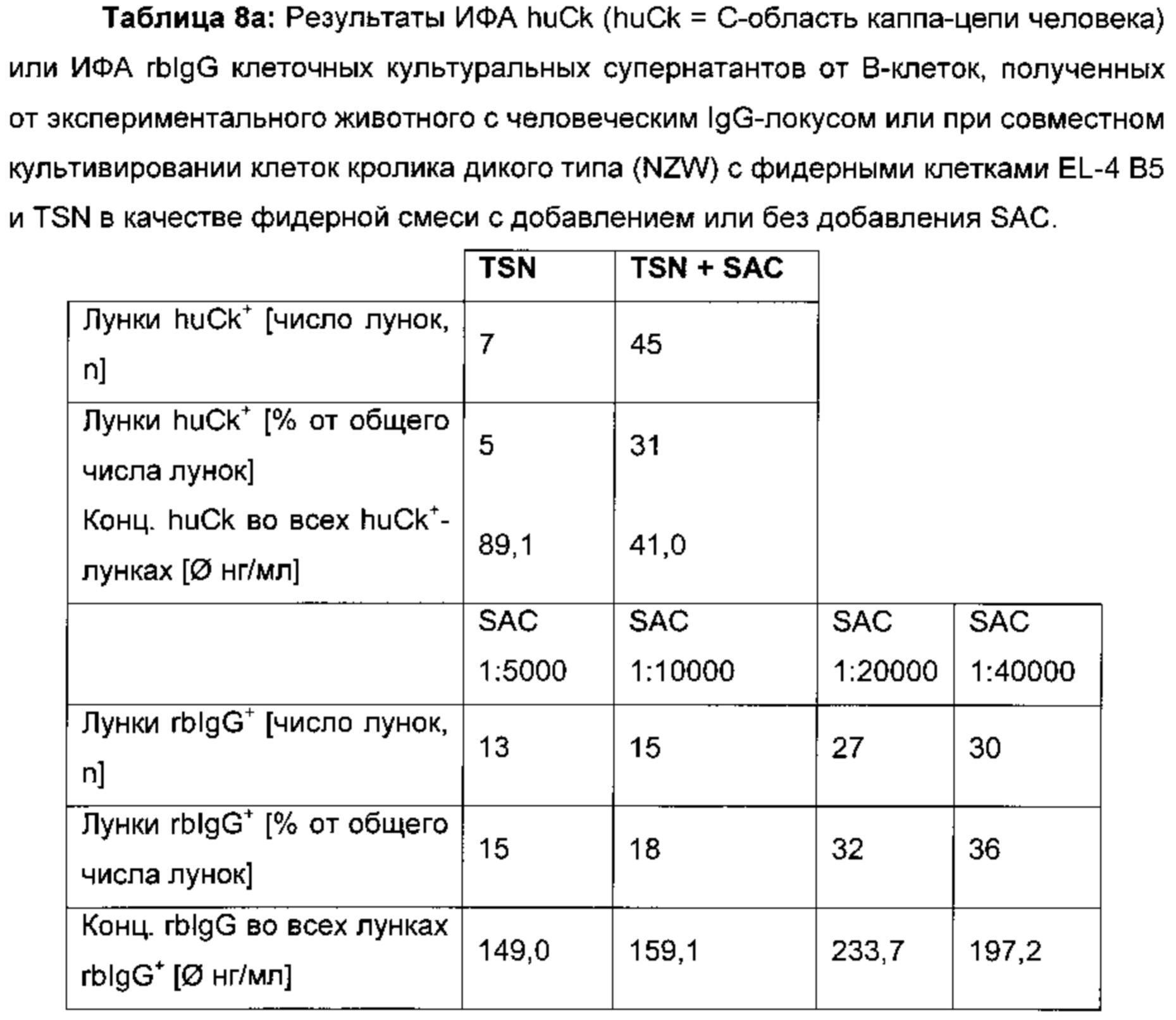
Видно, что отношение SAC от 1:20000 до 1:150000 предусматривает увеличение числа IgG+-лунок/клеточных клонов, в результате чего соотношение от 1:50000 до 1:100000 показывает самые высокие цифры. В одном воплощении количество SAC, добавленного в культивационную среду, определяют путем применения серии разведений и определения того разбавления, при котором добавленный SAC обеспечивает наибольшее число IgG+-лунок/клеточных клонов.
Было отмечено, что при добавлении SAC в фидерную смесь совместное выращивание В-клеток неожиданно изменялась таким образом, что только размещенные по отдельности В-клетки имели преимущества в росте, в то время как В-клеточный рост подавлялся при использовании смеси для совместного культивирования МНПК (например, В-клеток и эндогенных Т-клетки).

Другие данные, полученные с различными фидерными смесями, представлены в следующих таблицах 9 и 10.
В одном воплощении всех способов, о которых сообщается в данном изобретении, синтетическая фидерная смесь для совместного культивирования В-клеток содержит IL-1β, TNF-α, IL-2, IL-10 и IL-21 (интерлейкин-21). В одном воплощении всех способов, о которых сообщается в данном изобретении, синтетическая фидерная смесь для совместного культивирования В-клеток включает IL-1β, TNF-α, IL-2, IL-10 и SAC. В одном конкретном воплощении IL-13, TNF-α, IL-2, IL-10 и IL-21 являются рекомбинантными мышиным IL-1β, мышиным TNF-α, мышиным IL-2, мышиным IL-10 и мышиным IL-21.
В одном воплощении всех способов, о которых сообщается в данном изобретении, синтетическая фидерная смесь для совместного культивирования В-клеток мыши включает IL-1β, IL-2, IL-10, TNF-α и BAFF. В одном конкретном воплощении BAFF добавляют в концентрации 5 нг/мл.
В одном воплощении всех способов, о которых сообщается в данном изобретении, синтетическая фидерная смесь для совместного культивирования В-клеток хомяка включает IL-1β, IL-2, IL-10, TNF-α, IL-6 и SAC. В одном конкретном воплощении IL-6 добавляют в концентрации 10 нг/мл. В одном конкретном воплощении SAC добавляют в соотношении 1:75000.


Совместное культивирование фидерных клеток и мышиных В-клеток без IL-2, без IL-10, а также без IL-2 и IL-10, приводит к увеличению выхода IgG+-лунок, хотя концентрация IgG снижается. Без TNF-α концентрация IgG также уменьшается. Без IL-1β IgG в супернатанте не найден.
Совместное культивирование В-клеток хомяка без IL-2 или без IL-10, соответственно, дает IgG+-лунки с обнаруживаемой концентрацией IgG. В противоположность этому при совместном культивировании без IL-2 и IL-10 В-клеточный рост может быть практически не обнаружен. В отсутствие TNF-α или IL-1β может быть не определена секреция IgG.
В присутствии фидерных клеток EL-4 В5 для совместного культивирования В-клеток мыши, хомяка и кролика необходимы по меньшей мере IL-1β и TNF-α. IL-2 и IL-10 могут быть опущены при совместном культивировании мышиных клеток. В-клетки хомяка можно культивировать в отсутствие либо IL-2, либо IL-10. В-клетки кролика можно культивировать в отсутствие IL-2 или IL-10 или IL-6.
Для В-клеток мыши и хомяка добавление IL-4 в фидерную смесь увеличивает количество IgG+-лунок/клеточных клонов, а также концентрацию IgG в супернатанте. Таким образом, в одном воплощении всех способов, о которых сообщается в данном изобретении, фидерная смесь для совместного культивирования В-клеток мыши или хомяка включает IL-4.
Добавление IL-6 в фидерную смесь для совместного культивирования В-клеток мыши или В-клеток хомяка приводит к увеличению числа IgG+-лунок/клеточных клонов, а также к повышению концентрации IgG в супернатанте, соответственно. Таким образом, в одном воплощении всех способов, о которых сообщается в данном изобретении, фидерная смесь для совместного культивирования В-клеток мыши или В-клеток хомяка включает IL-6. В одном конкретном воплощении IL-6 добавляют в концентрации 50 нг/мл. В одном конкретном воплощении IL-6 добавляют в концентрации 10 нг/мл, если требуется высокая концентрация IgG. В одном конкретном воплощении добавление IL-6 проводят через три дня совместного культивирования выбранных В-клеток и клеток EL-4 В5.
Один аспект, о котором сообщается в данном изобретении, представляет собой синтетическую фидерную смесь для совместного культивирования В-клеток и фидерных клеток, которая содержит IL-1β, TNF-α, IL-10, а также один или более чем один из выбранных среди IL-21, SAC, BAFF, IL-2, IL-4 и IL-6.
Один аспект, о котором сообщается в данном изобретении, представляет собой синтетическую фидерную смесь для совместного культивирования В-клеток и фидерных клеток, которая содержит IL-1β, TNF-α, IL-2, IL-10 и SAC.
Один аспект, о котором сообщается в данном изобретении, представляет собой синтетическую фидерную смесь для совместного культивирования В-клеток мыши и фидерных клеток, которая содержит IL-1β, TNF-α и возможно содержит IL-21, и/или SAC, и/или BAFF, и/или IL-6.
Один аспект, о котором сообщается в данном изобретении, представляет собой синтетическую фидерную смесь для совместного культивирования В-клеток мыши и фидерных клеток, которая содержит IL-1β, IL-2, IL-10, TNF-α и BAFF.
Один аспект, о котором сообщается в данном изобретении, представляет собой синтетическую фидерную смесь для совместного культивирования В-клеток мыши или хомяка и фидерных клеток, которая содержит IL-1β, TNF-α, IL-2, IL-10 и IL-6.
Один аспект, о котором сообщается в данном изобретении, представляет собой синтетическую фидерную смесь для совместного культивирования В-клеток хомяка и фидерных клеток, которая содержит IL-1β, TNF-α, IL-2 или IL-10 и возможно содержит IL-21, и/или SAC, и/или BAFF.
Один аспект, о котором сообщается в данном изобретении, представляет собой синтетическую фидерную смесь для совместного культивирования В-клеток хомяка и фидерных клеток, которая содержит IL-1β, IL-2, IL-10, TNF-α, IL-6 и SAC.
Один аспект, о котором сообщается в данном изобретении, представляет собой синтетическую фидерную смесь для совместного культивирования В-клеток кролика и фидерных клеток, которая содержит IL-1β, TNF-α, IL-10 и IL-6.
Один аспект, о котором сообщается в данном изобретении, представляет собой синтетическую фидерную смесь для совместного культивирования В-клеток кролика и фидерных клеток, которая содержит IL-1β, TNF-α, IL-10, IL-6 или IL-2 и SAC.
В одном конкретном воплощении IL-1β, TNF-α, IL-2, IL-10 и IL-21 являются рекомбинантными мышиным IL-1β, мышиным TNF-α, мышиным IL-2, мышиным IL-10 и мышиным IL-21.
В одном конкретном воплощении BAFF добавляют в концентрации 5 нг/мл.
В одном конкретном воплощении IL-6 добавляют в концентрации 10 нг/мл.
В одном конкретном воплощении SAC добавляют в соотношении 1:75000.
В одном конкретном воплощении фидерные клетки являются мышиными клетками EL-4 В5.
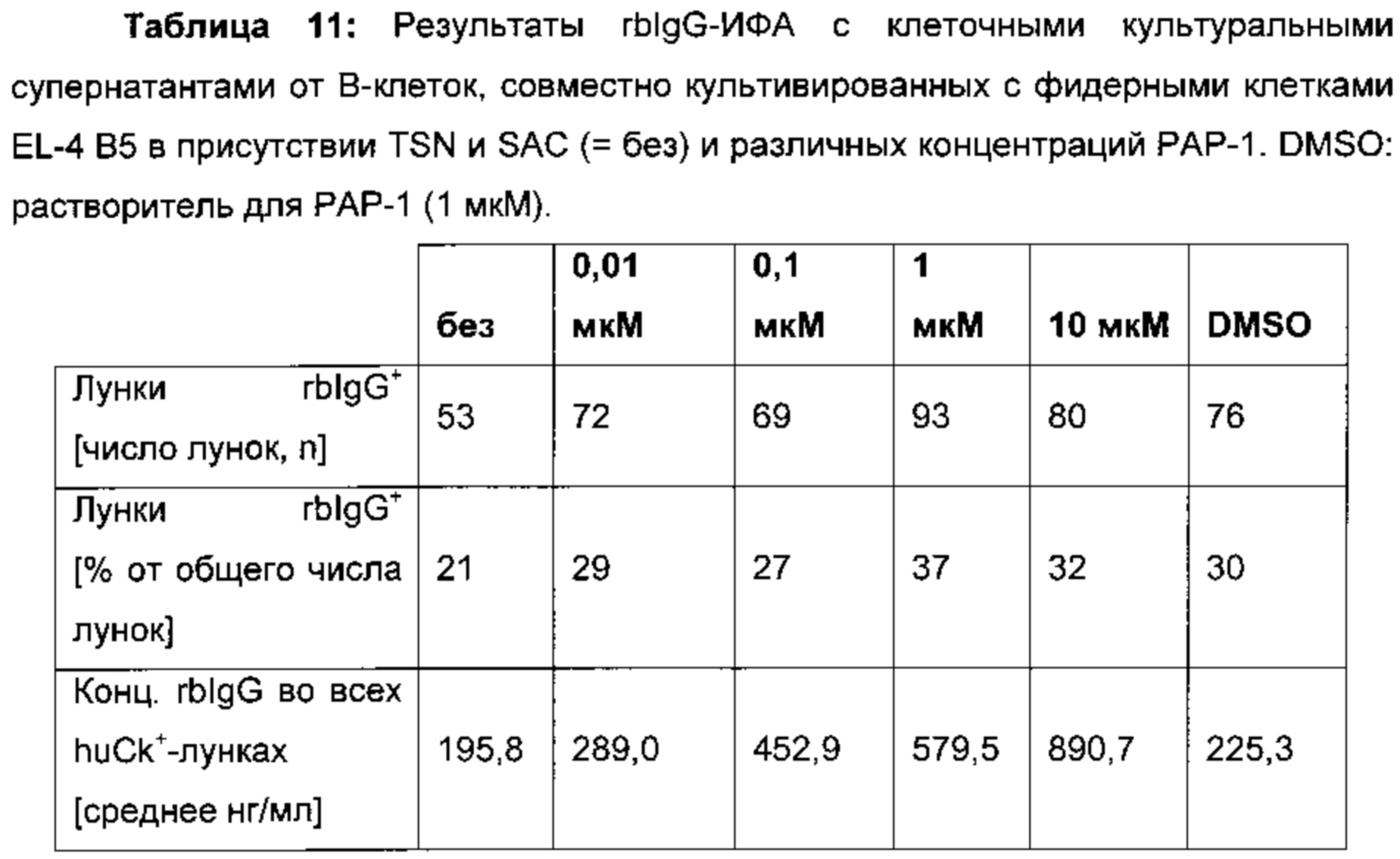
Добавление ингибитора определенной калиевого канала (=РАР-1,5-(4-феноксибутокси)псорален) неожиданно увеличивает секрецию rbIgG В-клетками в зависимости от концентрации, не уменьшая число В-клеточных клонов. Обычно цитокин, который индуцирует производительность rbIgG, может коррелировать с уменьшением общего числа В-клеточных клонов. Этого не было в случае с РАР-1.
С концентрацией TSN 7,5% может быть получена самая высокая концентрация IgG в супернатанте.

С числом фидерных клеток 30000 на лунку в 96-луночном планшете может быть получено наибольшее число IgG+-лунок в сочетании с концентрацией IgG в супернатанте. В одном воплощении всех способов, о которых сообщается в данном изобретении, число фидерных клеток на каждую размещенную по отдельности В-клетку составляет примерно 30000.

Совместное культивирование в одном воплощении всех способов, о которых сообщается в данном изобретении, осуществляется в полистироловом многолуночном планшете с лунками с круглым дном. Рабочий объем лунок в одном воплощении всех способов, о которых сообщается в данном изобретении, составляет от 50 мкл до 250 мкл. В одном конкретном воплощении лунки по меньшей мере частично покрыты неволокнистым субстратом, изготовленным из смеси полимерной пластической смолы и амфипатических молекул, причем амфипатическая молекула содержит гидрофильную группировку и гидрофобную область, в которой гидрофобные области закреплены в субстрате, а гидрофильные группировки выставлены на субстрате. В одном конкретном воплощении амфипатические молекулы выбраны среди этоксилированных алкиламинов, полиэтиленимина, октилдекамина или их смесей (см., например, ЕР 1860181).
Характеризация совместно культивируемых клеток:
Для (качественного и количественного) определения секретируемого IgG после совместного культивирования, как правило, могут быть использованы все способы, известные специалистам в данной области, такие как ИФА. В одном воплощении всех способов, о которых сообщается в данном изобретении, используется ИФА. В одном конкретном воплощении для определения IgG, секретированного мышиными В-клетками, используется ИФА с анти-IgG-антителом АВ 216 (антитело захвата) и АВ 215 (меченое антитело). В одном конкретном воплощении для определения IgG, секретированного В-клетками хомяка, используется ИФА с моноклональными антителами АВ 220 (антитело захвата) и АВ 213 (меченое антитело).
В зависимости от результатов характеризации может быть получен, т.е. выбран, В-клеточный клон. Термин «клон» означает популяцию делящихся и секретирующих антитело В-клеток, полученных/происходящих из одной В-клетки. Таким образом, В-клеточный клон продуцирует моноклональное антитело.
Выделение мРНК, клонирование и секвенирование:
Из В-клеток может быть выделена общая мРНК и транскрибирована в кДНК. С помощью специфических праймеров может быть амплифицирована нуклеиновая кислота, кодирующая родственные VH- и VL-области. С помощью секвенирования полученной нуклеиновой кислоты было подтверждено, что полученные антитела в большинстве случаев (71-95%) представляют собой моноклональные антитела. Из секвенирования отдельных В-клеток также видно, что почти не получены одинаковые последовательности. Таким образом, способ обеспечивает высокое разнообразие антител, связывающихся с одним и тем же антигеном.
Праймеры, используемые для амплификации VH-кодирующей нуклеиновой кислоты, могут быть использованы для кДНК, полученной из клеток NMRI-мыши, армянского хомяка, BALB/c-мыши, а также сирийского хомяка и кролика.
В одном воплощении всех способов, о которых сообщается в данном изобретении, аминокислотная последовательность получена из амплифицированной VH-кодирующей нуклеиновой кислоты, и точные начальную и конечную точки определяют путем локализации аминокислотных последовательностей с EVQL/QVQL по VSS (VH-область) и с DIVM/DIQM до KLEIK (VL-область).
Термин «антитело» обозначает белок, состоящий из одной или более чем одной полипептидной цепи, по существу кодируемой генами иммуноглобулинов. Распознанные гены иммуноглобулинов включают гены различных константных областей, а также множество генов вариабельных областей иммуноглобулинов. Иммуноглобулины могут существовать в различных форматах, в том числе, например, Fv, Fab и F(ab)2, а также в виде одноцепочечных антител (scFv), димерных антител, в одновалентной, двухвалентной, трехвалентной или четырехвалентной формах, а также в биспецифической, триспецифической или тетраспецифической формах (например, Huston, J.S., et al., Proc. Natl. Acad. Sci. USA 85 (1988) 5879-5883; Bird, R.E., et al., Science 242 (1988) 423-426; в целом, Hood et al., Immunology, Benjamin N.Y., 2nd edition (1984); и Hunkapiller, T. and Hood, L, Nature 323 (1986) 15-16).
Также в данном изобретении сообщается о способе получения антитела, включающем следующие этапы:
а) получение популяции (зрелых) В-клеток (полученных из крови экспериментального животного),
б) мечение клеток из популяции В-клеток по меньшей мере одной флуоресцентной меткой (в одном воплощении от одной-тремя или двумя-тремя флуоресцентными метками),
в) размещение одиночных клеток из меченой популяции В-клеток в отдельных контейнерах (в одном воплощении контейнер является лункой в многолуночном планшете),
г) культивирование размещенных по отдельности В-клеток в присутствии фидерных клеток и фидерной смеси (в одном воплощении фидерными клетками являются клетки EL-4 В5, в одном воплощении фидерной смесью является природный TSN, в одном воплощении фидерной смесью является синтетическая фидерная смесь),
д) определение специфичности связывания антител, секретируемых в культивационную среду отдельных В-клеток,
е) определение аминокислотной последовательности вариабельных доменов легкой и тяжелой цепей специфически связывающих антител путем ПЦР с обратной транскрипцией и путем нуклеотидного секвенирования, и тем самым получение нуклеиновой кислоты, кодирующей вариабельные домены легкой и тяжелой цепей моноклонального антитела,
ж) введение нуклеиновой кислоты, кодирующей вариабельные домены легкой и тяжелой цепей моноклонального антитела, в экспрессионную кассету для экспрессии антитела,
з) введение нуклеиновой кислоты в клетку,
и) культивирование клетки и выделение антитела из клетки или культурального клеточного супернатанта и тем самым получение антитела.
Понятие «экспрессионная кассета» относится к конструкции, которая содержит необходимые регуляторные элементы, такие как промотор и сайт полиаденилирования, для экспрессии по меньшей мере нуклеиновой кислоты, содержащейся в клетке.
Термин «экспериментальное животное» означает отличное от человека млекопитающее. В одном воплощении экспериментальное животное выбрано среди крысы, мыши, хомяка, кролика, приматов, овцы, собаки, коровы, курицы, амфибий и рептилий.
Следующие примеры приведены для облегчения понимания данного изобретения, истинные масштабы которого изложены в формуле изобретения. Понятно, что в изложенных процедурах могут быть сделаны изменения без отхода от сущности изобретения.
Примеры
Пример 1
Среды и буферы:
Блокирующий буфер для ИФА включает 1×PBS и 1% BSA.
Буфер для сорбции в ИФА включает 4,29 г Na2CO3*10H2O и 2,93 г NaHCO3 с добавлением воды до конечного объема 1 л, рН 9,6 корректируют с помощью 2 N HCl.
Этаноловый раствор для выделения РНК состоит из 70% этанола и 80% этанола.
FACS-буфер для иммунофлуоресцентного окрашивания включает 1×PBS и 0,1% BSA.
IMDM-буфер для ИФА включает 1×PBS, 5% IMDM и 0,5% BSA.
Инкубационный буфер 1 для ИФА включает 1×PBS, 0,5% CroteinC.
Инкубационный буфер 2 для ИФА включает 1×PBS, 0,5% CroteinC и 0,02% Tween 20.
Инкубационный буфер 3 для ИФА включает 1×PBS, 0,1% BSA.
Инкубационный буфер 4 для ИФА включает 1×PBS, 0,5% BSA, 0,05%
Tween, PBS (10х), 0,01 М KH2PO4, 0,1 М Na2HPO4, 1,37 М NaCl, 0,027 М KCl, рН 7,0.
ПЦР-буфер содержит 500 мМ KCl, 15 мМ MgCl2, 100 мМ Tris/HCl, рН 9,0.
Промывочный буфер 1 для ИФА включает 1×PBS, 0,05% Tween 20.
Промывочный буфер 2 для ИФА включает 1×PBS, 0,1% Tween 20.
Промывочный буфер 3 для ИФА состоит из воды, 0,9% NaCl, 0,05% Tween 20.
Среда EL-4 В5 содержит RPMI 1640, 10% FCS, 1% смесь глутамина/пенициллина/стрептомицина, 2% 100 мМ пирувата натрия, 1% 1 М HEPES-буфера.
Пример 2
Уход за животными и иммунизация
Экспериментальных животных содержали в соответствии с немецким законом о защите животных (TierSCHG), а также в соответствии с соответствующими европейскими директивами.
Мышей и хомяков получали в возрасте от 6 до 8 недель и иммунизировали в возрасте до 12 недель. Антиген вначале вводили вместе с полным адъювантом Фрейда (CFA, complete Freud’s adjuvant). Дальнейшие введения проводили с неполным адъювантом Фрейда (IFA, incomplete Freud’s adjuvant). Антиген-содержащую эмульсию вводили подкожно, при этом эмульсия содержала от 50 до 100 мкг антигена в зависимости от веса полученного экспериментального животного.
Для иммунизации использовали кроликов NZW (Charles River Laboratories International, Inc). Антиген растворяли в K3PO4-буфере с рН 7,0 до концентрации 1 мг/мл и смешивали (1:1) с полным адъювантом Фрейда (CFA) до получения стабильной эмульсии. Кролики получали внутрикожную (i.d.) инъекцию 2 мл эмульсии, после чего следовала вторая внутримышечная (i.m.) и третья подкожная (s.c.) инъекции, каждая по 1 мл, с интервалом в одну неделю. Четвертую i.m. инъекцию 1 мл проводили через две недели, а затем еще две s.c. инъекции по 1 мл с интервалом в четыре недели.
Во время иммунизации определяли титр антитела в сыворотке с помощью антиген-специфического анализа. При титре антитела с IC50 1:10000 у иммунизированного животного извлекали кровь или селезенку. Для реактивации антигенспецифических В-клеток экспериментальному животному за три дня до изъятия крови или селезенки внутривенно вводили от 30 мкг до 50 мкг антигена.
Пример 3
Изъятие органов, крови и макрофагов
Кровь от мышей и хомяков получали путем пункции ретробульбарной вены. Кровь у кроликов получали путем пункции вены уха или, при больших объемах, артерии уха. Цельную кровь (10 мл) собирали у кроликов через 4-6 дней после третьей, четвертой, пятой и шестой иммунизации и использовали для сортировки одиночных клеток с помощью FACS.
Макрофаги выделяли из полученной крови путем присоединения к пластику для клеточных культур. С помощью этого способа от каждой мыши и хомяка может быть получено примерно 3×105 макрофагов.
Если требовалось большее количество макрофагов мыши или хомяка, выделяли перитонеальные макрофаги. Для этого животные должны быть в возрасте не менее 3 месяцев. Для удаления перитонеальных макрофагов животных умерщвляли и в брюшную полость сразу же вводили 5 мл среды EL-4 В5 с температурой 37°C. После разминания живота животного в течение 5 минут извлекали раствор, содержащий клетки.
Пример 4
Культивирование клеток EL-4 В5
Замороженные клетки EL-4 В5 быстро размораживали на водяной бане при температуре 37°C и разводили 10 мл среды EL-4 В5. После центрифугирования при 300 g в течение 10 минут супернатант удаляли, а осадок ресуспендировали в среде. После еще одного этапа центрифугирования супернатант снова удаляли и осадок ресуспендировали в 1 мл среды.
Клетки EL-4 В5 высевали с плотностью клеток 3×104 клеток/мл в колбы для культивирования объемом 175 м2. Плотность клеток определяли каждый второй день и доводили ее до 3×104 клеток/мл. Клетки имели время удвоения примерно 12 часов и должны были быть культивированы при плотности клеток ниже 5×105 клеток/мл, потому что при более высокой плотности клеток стимулирующие свойства клеток теряются.
Когда общее число клеток составляло примерно 1,5×109 клеток, среду удаляли путем центрифугирования. После этого клетки облучали 50 Гр (5000 рад). После определения числа жизнеспособных клеток путем окрашивания трипановым синим клетки в количестве от 5×106 до 1×107 аликвотировали и замораживали при -80°C.
Для совместного культивирования клетки размораживали и дважды промывали средой EL-4 В5. Для определения числа жизнеспособных клеток клеточную суспензию разводили 1:10 раствором трипанового синего 0,4% (вес/объем), 10 мкл смеси переносили в счетную камеру Нойбауэра и подсчитывали число клеток.
Пример 5
Центрифугирование в градиенте плотности
Выделение мононуклеарных клеток периферической крови (МНПК) осуществляли путем разделения по градиенту плотности с помощью Lympholyte® в соответствии с инструкцией А от изготовителя (Lympholyte®-mammal, cedarlane).
Отобранную кровь разводили 2:1 фосфатным буферным раствором (PBS). В сосуд для центрифугирования помещали такой же объем среды для разделения по плотности, и разведенную кровь осторожно добавляли по стенке сосуда. Сосуд центрифугировали в течение 20 минут при 800 g без торможения. Лимфоциты получали из белого промежуточного слоя. К извлеченным клеткам добавляли 10 мл PBS и центрифугировали при 800 g в течение 10 минут. Супернатант удаляли, а осадок ресуспендировали, промывали, центрифугировали. Конечный осадок ресуспендировали в PBS.
Пример 6
Гипотонический лизис эритроцитов
Для разрушения эритроцитов путем гипотонического лизиса раствор хлорида аммония (BD Lyse™) разводили 1:10 водой и добавляли в соотношении 1:16 к цельной крови. Для лизиса эритроцитов смесь инкубировали в течение 15 минут в темноте. Для отделения клеточного мусора от неповрежденных клеток раствор центрифугировали в течение 10 минут при 800 g. Супернатант удаляли, осадок ресуспендировали в PBS, снова промывали, центрифугировали и осадок ресуспендировали в PBS.
Пример 7
Получение клеток из внутренних органов экспериментального животного
Для получения клеток селезенки и тимуса соответствующий орган рассекали в чашке Петри и переносили клетки в PBS. Для удаления оставшейся ткани клеточную суспензию фильтровали через фильтр с размером пор 100 мкм. Для получения лимфоцитов из клеток селезенки использовали центрифугирование в градиенте плотности. Для клеток тимуса дополнительный этап обогащения не требовался.
Пример 8
Обеднение макрофагами
Для обеднения макрофагами и моноцитами путем неспецифической адгезии использовали стерильные 6-луночные планшеты (стандарт для клеточного культивирования). Лунки либо покрывали KLH (key hole limpet haemocyanine, гемоцианин лимфы улитки), либо стрептавидином и контрольными пептидами. Каждую лунку заполняли средой в объеме от 3 мл до максимум 4 мл, вносили до 6×106 мононуклеарных клеток периферической крови от иммунизированного кролика и оставляли для связывания на период от 60 до 90 минут при 37°C в инкубаторе. После этого супернатант, содержащий лимфоциты, переносили в сосуд для центрифугирования и центрифугировали при 800 g в течение 10 минут. Осадок ресуспендировали в PBS.
50% клеток в супернатанте использовали для этапа пэннинга; оставшиеся 50% клеток подвергали прямому иммунофлуоресцентному мечению и сортировке одиночных клеток.
Пример 9
Удаление KLH-специфических В-клеток
Четыре миллилитра раствора, содержащего гемоцианин лимфы улитки (KLH), инкубировали с буфером для сорбции в концентрации 2 мкг/мл в лунках многолуночного планшета в течение ночи при комнатной температуре. Перед этапом обеднения супернатант удаляли и лунки дважды промывали PBS. После этого клетки крови подводили до клеточной плотности 2×106 клеток/мл и вносили в каждую лунку многолуночного планшета по 3 мл. Затем многолуночный планшет инкубировали в течение 60-90 минут при 37°C. Супернатант переносили в сосуд для центрифугирования, лунки дважды промывали PBS и супернатанты объединяли в сосуде для центрифугирования. Клетки осаждали центрифугированием при 800 g в течение 10 минут и осадок ресуспендировали в PBS.
Пример 10
Обогащение антиген-специфическими В-клетками
Соответствующий антиген разводили буфером для сорбции до конечной концентрации 2 мкг/мл. 3 мл этого раствора добавляли в лунку 6-луночного планшета и инкубировали в течение ночи при комнатной температуре. Перед использованием супернатант удаляли, а лунки дважды промывали PBS. Раствор В-клеток доводили до концентрации 2×106 клеток/мл и 3 мл вносили в каждую лунку 6-луночного планшета. Планшет инкубировали в течение 60-90 минут при 37°C. Супернатант удаляли и лунки промывали PBS два-четыре раза. Для выделения антиген-специфических В-клеток 1 мл раствора трипсина/EDTA добавляли в лунки многолуночного планшета и инкубировали в течение 10-15 минут при 37°C. Инкубацию останавливали путем добавления среды и супернатант переносили в сосуд для центрифугирования. Лунки дважды промывали PBS и супернатанты объединяли с другими супернатантами. Клетки осаждали центрифугированием в течение 10 минут при 800 g. Осадок ресуспендировали в PBS.
Пример 11
Совместное культивирование В-клеток и клеток EL-4 В5
а) Совместное культивирование проводили в 96-луночных планшетах с круглым дном. Готовили основной раствор, содержащий клетки EL-4 В5 (1,6×106 клеток/15,2 мл) и цитокины в среде EL-4 В5. 200 мкл основного раствора добавляли в каждую лунку многолуночного планшета. В каждую лунку вносили одиночную В-клетку при помощи флуоресцентно-активированной сортировки клеток. После добавления В-клеток планшет центрифугировали в течение 5 минут при 300 g. Планшет инкубировали в течение семи дней при температуре 37°C.
б) Одиночные сортированные В-клетки культивировали в 96-луночных планшетах в 210 мкл/лунку среды EL-4 В5 с клетками Pansorbin (1:20000) (Calbiochem (Merck), Дармштадт, Германия), с 5% супернатантном кроличьих тимоцитов и гамма-облученными мышиными клетками тимомы EL-4-B5 (2×104/лунка) в течение 7 дней при 37°C в атмосфере 5% CO2 в инкубаторе. В-клеточные культуральные супернатанты удаляли для скрининга и сразу собирали клетки для клонирования гена вариабельной области или замораживали при -80°C в 100 мкл буфера RLT (Qiagen, Хилден, Германия).
Пример 12
Культивирование Т-клеток
Т-клетки выделяли из тимуса 3-4-недельных мышей и хомяков или 4-5-недельных кроликов, соответственно. Клетки центрифугировали и сразу культивировали или замораживали в аликвотах по 3×107 клеток. Тимоциты высевали с минимальной плотностью 5×105 клеток/мл среды EL-4 В5 в культуральных сосудах объемом 175 см2 и инкубировали в течение 48 часов при 37°C.
Пример 13
Культивирование макрофагов
Макрофаги выделяли из брюшной полости мышей и хомяков, соответственно, в возрасте не менее трех месяцев. Перитонеальные макрофаги мышей или хомяков или мононуклеарные клетки крови кроликов культивировали в среде EL-4 В5 с плотностью клеток не менее 1×105 клеток/мл в культуральных сосудах объемом 175 см2 в течение 1,5 часов при 37°C. Затем среду удаляли и неприкрепленные клетки отделяли от прикрепленных макрофагов путем промывания теплой средой EL-4 В5, а затем культивирования в течение 48 часов в 35 мл среды.
Пример 14
Совместное культивирование Т-клеток и макрофагов
Т-клетки и макрофаги культивировали в течение 48 часов в отдельных сосудах. Перед объединением обеих популяции клеток Т-клетки центрифугировали в течение 10 минут при 800 g. Супернатант удаляли, а клеточный осадок ресуспендировали в 10 мл среды. Т-клетки доводили до минимальной плотности 5×105 клеток/мл и добавляли 10 пг форбол-12-миристат-13-ацетата (РМА) и 5 нг или 50 нг фитогемагглютинина М (РНА-М) на каждый мл среды. Культивационную среду отделяли от макрофагов и в сосуды, содержащие макрофаги, добавляли Т-клеточную суспензию. Через 36 часов совместного культивирования культивационную среду удаляли и называли ее раствором TSN. Для удаления оставшихся клеток раствор TSN фильтровали через фильтр с размером пор 0,22 мкм. Раствор TSN замораживали при -80°C в аликвотах по 4 мл.
Пример 15
Иммунофлуоресцентное окрашивание
В зависимости от числа клеток, которые подвергали окрашиванию, клетки использовали в 100 мкл среды (менее 106 клеток) или 200 мкл среды (более 106клеток), соответственно. Флуоресцентно меченое антитело разводили 5% сывороткой экспериментального животного и FACS-буфером до конечного объема 100 мкл или 200 мкл, соответственно. Реакционную смесь инкубировали во вращающемся штативе в течение 40 минут при 4°C в темноте. После инкубации клетки дважды промывали при 300 g в течение 5 минут. Осадок ресуспендировали в 400 мкл PBS и фильтровали через фильтр с размером пор 70 мкм. Отфильтрованный раствор переносили в FACS-сосуд и непосредственно перед FACS-экспериментом мертвые клетки окрашивали путем добавления йодида пропидия (6,25 мкг/мл). Если меченое антитело было мечено биотином, то антитело обнаруживали на втором этапе меченым стрептавидином Alexa Flour(R) 647 (антитело 197).
Пример 16
Количественная оценка IgG
96-луночный планшет, в котором проводили совместное культивирование, центрифугировали через семь дней совместного культивирования при 300 g в течение 5 минут. 150 мкл супернатанта удаляли и разводили PBS в соотношении 2:1 во втором 96-луночном планшете.
ИФА проводили, как описано в примере 17.
Антитело использовали в концентрации 50 нг/мл. Если OD составляла или превышала 1, после инкубации в течение 5 минут анализировали серию разведений от 0,8 до 108 нг/мл IgG.
Пример 17
Обнаружение антиген-специфического IgG
Антитела, вырабатываемые размещенными по отдельности и совместно культивированными В-клетками или В-клетками, полученными от иммунизированного экспериментального животного, могут быть охарактеризованы в отношении специфического связывания с антигеном. ИФА проводили при комнатной температуре и ИФА-раствор инкубировали между отдельными этапами на качалке со скоростью 20 g. На первом этапе антиген связывался с лунками 96-луночного планшета. Если антиген был белком, его разводили в буфере для сорбции и вносили непосредственно в планшет. Пептидные антигены связывали через пару специфического связывания биотин/стрептавидин. Лунки многолуночного планшета могут быть уже покрыты растворимым CroteinC (CRC) изготовителем. Если нет, то лунки инкубировали после иммобилизации антигена с 200 мкл блокирующего буфера. После инкубации с 100 мкл раствора антигена на лунку (предварительно сорбированного многолуночного планшета) или 200 мкл блокирующего буфера, соответственно, несвязанный антиген или блокирующий буфер удаляли промыванием промывочным буфером. Разведенные В-клеточные супернатанты вносили в объеме 100 мкл на лунку и инкубировали. После инкубации лунки промывали. Затем вносили антитело для обнаружения в объеме 100 мкл на лунку. Антитело может быть либо конъюгированным с пероксидазой хрена, либо меченым биотином. Антитело для обнаружения определяли с помощью конъюгата стрептавидин-пероксидаза хрена. После инкубации многолуночный планшет промывали, а затем вносили по 50 мкл на лунку раствора субстрата, содержащего 3,3',5,5'-тетраметилбензидин (ТМВ), и инкубировали в течение периода, приведенного в таблице X. Ферментативную реакцию останавливали путем добавления 50 мкл серной кислоты и определяли оптическую плотность при 450 нм и 680 нм с помощью фотометра (Rainbow Thermo ELISA Reader) и программного обеспечения Xread plus.
Пример 18
Выделение рибонуклеиновой кислоты (РНК)
Клетки, из которых нужно было выделить РНК, сначала осаждали путем центрифугирования. Клеточный осадок лизировали путем добавления 100 мкл буфера RLT с 10 мкл/мл бета-меркаптоэтанола. Клетки ресуспендировали путем многократного пипетирования. Раствор переносили в лунку многолуночного планшета. Планшет быстро встряхивали при 200 g и замораживали при -20°C.
Выделение РНК проводили с помощью набора RNeasy® (Qiagen, Хилден, Германия) в соответствии с инструкцией изготовителя.
Пример 19
Полимеразная цепная реакция с обратной транскрипцией
Обратную транскрипцию проводили в объеме 20 мкл. Для каждой реакции выполняли контроль с обратной транскриптазой и без нее. На одну реакцию предварительно смешивали 1 мкл дНТФ (каждый по 10 мМ), 0,4 мкл олиго(dT)12-18 (0,2 мкг) и 0,6 мкл случайных гексамеров (0,03 мкг) и добавляли до 8,5 мкл РНК в H2O. Реакционную смесь инкубировали в течение 5 минут при температуре 65°C и сразу после этого переносили на лед. Затем предварительно смешивали 2 мкл RT-буфера (10х), 4 мкл MgCl2 (25 мМ), 2 мкл DTT (0,1 М) и 1 мкл РНКазы Out™ (40 единиц) и добавляли к ледяной реакционной смеси. После инкубации в течение 2 минут при комнатной температуре добавляли 0,5 мкл обратной транскриптазы Superscript™ II (25 единиц). Реакционную смесь инкубировали в течение 10 минут при комнатной температуре.
Трансляцию проводили в течение 50 минут при 42°C. После трансляции обратную транскриптазу инактивировали путем инкубации в течение 15 минут при 70°C. кДНК хранили при температуре -20°C.
Пример 20
Полимеразная цепная реакция
Полимеразную цепную реакцию проводили с помощью набора Taq PCR Core Kit (Qiagen, Хилден, Германия) в соответствии с инструкцией изготовителя. ПЦР проводили в объеме 20 мкл. Образцы переносили в Mastercyler® при температуре 95°C.
Пример 21
Секвенирование
Все последовательности определяли с помощью SequiServe (Ватерстеттен, Германия).
Пример 22
Пэннинг на антиген
а) Покрытие планшетов
Биотин/стрептавидин: стерильные покрытые стрептавидином 6-луночные планшеты (степень клеточного культивирования) инкубировали с биотинилированным антигеном в концентрации 0,5-2 мкг/мл в PBS при комнатной температуре в течение 1 часа. Планшеты промывали стерильным PBS три раза перед применением.
Ковалентно связанный белок: Клеточные культуральные 6-луночные планшеты покрывали 2 мкг/мл белка в карбонатном буфере (0,1 М бикарбонат натрия, 34 мМ гидрокарбонат натрия, рН 9,55) в течение ночи при 4°C. Планшеты промывали стерильным PBS три раза перед применением.
б) Пэннинг В-клеток на пептиды
В 6-луночные клеточные культуральные планшеты, покрытые соответствующим антигеном, высевали до 6×106 клеток в 4 мл среды и оставляли b для связывания на 1 час при 37°C в инкубаторе. Неприкрепленные клетки удаляли путем тщательного промывания лунок 1×PBS 1-2 раза. Оставшиеся прикрепленные клетки отделяли путем обработки трипсином в течение 10 минут при 37°C в инкубаторе, а затем дважды промывали средой. Клетки сохраняли на льду до иммунофлуоресцентного окрашивания.
Реферат
Группа изобретений относится к биотехнологии, а именно к способу получения В-клеток, секретирующих антиген-специфические антитела. Для получения B-клеток проводят следующие этапы: получение B-клеток из крови кролика; мечение IgG+-B-клеток и/или CD138+-B-клеток; инкубацию B-клеток при температуре 37°C в течение одного часа в среде для совместного культивирования перед размещением меченых B-клеток в виде одиночных клеток с последующим совместным культивированием с фидерными клетками в среде для совместного культивирования; выбор B-клетки, пролиферирующей на этом этапе; получение B-клетки. Способ также может включать этап центрифугирования размещенных по отдельности В-клеток перед совместным культивированием. Фидерными клетками являются мышиные клетки EL-4 B5, а фидерная смесь содержит интерлейкин-1-бета, фактор некроза опухоли альфа, клетки золотистого стафилококка штамма Cowan, BAFF, интерлейкин-2, и/или интерлейкин-10, и/или интерлейкин-6, и/или интерлейкин-4. Для получения антител берут популяцию зрелых B-клеток, полученную из крови кролика; проводят мечение IgG+-B-клеток и/или CD138+-B-клеток по меньшей мере одной флуоресцентной меткой; инкубируют B-клетки при температуре 37°C в течение одного часа в среде для совместного культивирования перед размещением одиночных клеток из популяции меченых B-клеток в отдельные контейнеры; культивируют размещенные по отдельности B-клетки в присутствии фидерных клеток и фидерной смеси; определяют специфичность связывания антител и аминокислотную последовательность вариабельных доменов легкой и тяжелой цепей специфически связывающихся антител путем ПЦР с обратной транскрипцией; вводят нуклеиновую кислоту, кодирующую вариабельные домены легкой и тяжелой цепей моноклонального антитела для экспрессии антитела; вводят нуклеиновую кислоту в клетку; культивируют клетку и выделяют антитело из клетки или клеточного супернатанта. Группа изобретений позволяет быстро охарактеризовать специфичность связывания моноклональных антител, полученных из отдельных В-клеточных клонов, полученных из крови кролика. 2 н. и 5 з.п. ф-лы, 13 табл., 22 пр.

Комментарии