Аналитический способ для количественной оценки жизнеспособных бактерий, содержащихся в композициях для терапии для восстановления микробиоты (mrt) - RU2714841C1
Код документа: RU2714841C1
Чертежи

Описание
Перекрестная ссылка на родственные заявки
По этой заявке по 35 U.S.C. 119 испрашивается приоритет Предварительной заявки США серийный No. 62/336184, поданной 13 мая 2016 г., полное содержание которой приведено в настоящем описании в качестве ссылки.
Область
Настоящее описание относится к способам анализа композиций для лечения пациентов.
Уровень техники
Широкое множество композиций и способов разработано для лечения заболеваний и/или состояний пищеварительного тракта. Из известных композиций и способов, каждый имеет конкретные преимущества и недостатки. Существует постоянная необходимость предоставления альтернативных композиций и способов для лечения заболеваний и/или состояний пищеварительного тракта.
Краткое изложение сущности изобретения
Иллюстративный способ количественной оценки жизнеспособных бактериальных микроорганизмов в лекарственной субстанции для терапии для восстановления микробиоты (MRT) может включать получение тестового образца лекарственной субстанции для MRT из лекарственной субстанции для MRT и получение контрольного тестового образца из контрольного образца. Тестовый образец лекарственной субстанции для MRT и контрольный тестовый образец можно обрабатывать моноазидом пропидия (PMA) и затем переносить аликвоты в множество индивидуальных лунок тестового планшета. Тестовый планшет можно подвергать воздействию света в пределах 10 минут. Можно выделять образцы ДНК из тестового образца лекарственной субстанции для MRT в каждой из множества индивидуальных лунок и контрольного тестового образца в каждой из множества индивидуальных лунок. Образцы ДНК из тестового образца лекарственной субстанции для MRT в каждой из множества индивидуальных лунок и контрольного тестового образца в каждой из множества индивидуальных лунок можно разводить водой качества для молекулярной биологии. Смесь для количественной полимеразной цепной реакции (qПЦР) можно добавлять в множество лунок второго тестового планшета, и затем разведенные образцы ДНК из тестового образца лекарственной субстанции для MRT в каждой из множества индивидуальных лунок и контрольного тестового образца в каждой из множества индивидуальных лунок тестового планшета можно добавлять в множество лунок второго тестового планшета. Затем второй тестовый планшет можно центрифугировать. Второй тестовый планшет можно помещать в систему для детекции qПЦР и запускать протокол термоциклера. Затем можно рассчитывать общее количество колониеобразующих единиц (КОЕ) на миллилитр (мл) (КОЕ/мл) для каждого тестового образца в множестве индивидуальных лунок второго тестового планшета.
В некоторых вариантах осуществления, лекарственную субстанцию для терапии для восстановления микробиоты (MRT) можно получать из образца фекалий человека для доставки посредством клизмы или гастроназальной трубки. Способ получения лекарственной субстанции для MRT может включать сбор образца свежих фекалий от донора-человека, добавление некоторого количества солевого раствора к образцу свежих фекалий, добавление полиэтиленгликоля к образцу свежих фекалий в концентрации приблизительно 30-90 г/л (или приблизительно 10-90 г/л), смешивание вместе образца свежих фекалий, солевого раствора и полиэтиленгликоля для получения смешанной композиции, и фильтрацию смешанной композиции, и сбор фильтрата, где фильтрат определяет лекарственную субстанцию для MRT.
В некоторых вариантах осуществления, лекарственную субстанцию для терапии для восстановления микробиоты (MRT) можно получать из образца фекалий человека для пероральной доставки. Способ получения лекарственной субстанции для MRT может включать сбор образца фекалий человека, очистку образца фекалий человека для получения очищенного образца, стабилизацию очищенного образца для получения стабилизированного образца, перевод стабилизированного образца в твердое состояние и добавление одной или нескольких добавок и/или наполнителей к твердому веществу для получения композиции для лечения, где композиция для лечения определяет лекарственную субстанцию для MRT.
Вышеописанная сущность некоторых вариантов осуществления не предназначена для описания каждого описанного варианта осуществления или каждого воплощения по настоящему описанию. Приведенные ниже фигуры и подробное описание более конкретно иллюстрируют эти варианты осуществления.
Краткое описание чертежей
Описание можно более полно понять, принимая во внимание приведенное ниже подробное описание различных вариантов осуществления описания в связи с сопровождающими чертежами, на которых:
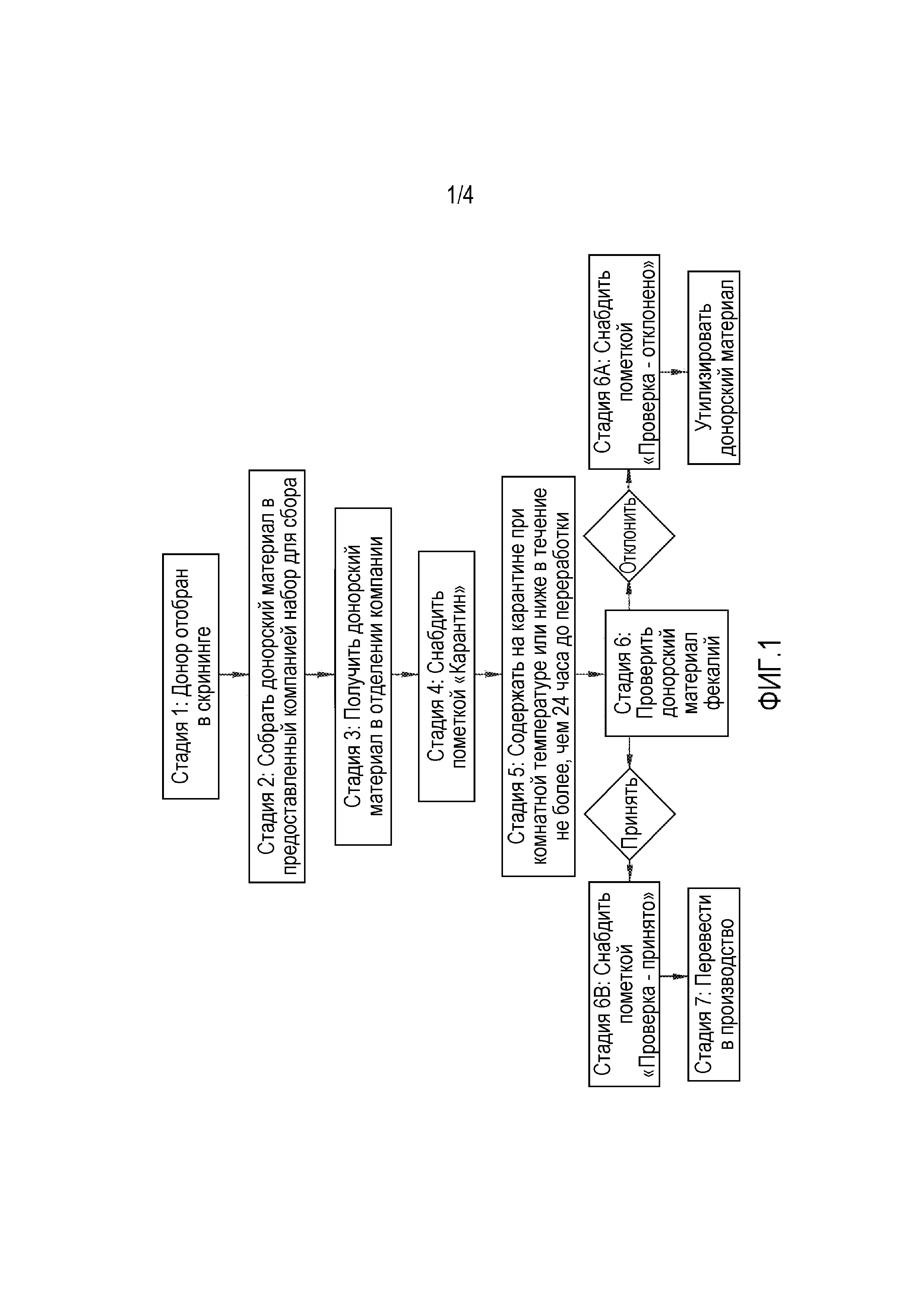
ФИГ. 1 представляет собой блок-схему, изображающую общий способ изготовления стандартизованной композиции FMT; и,
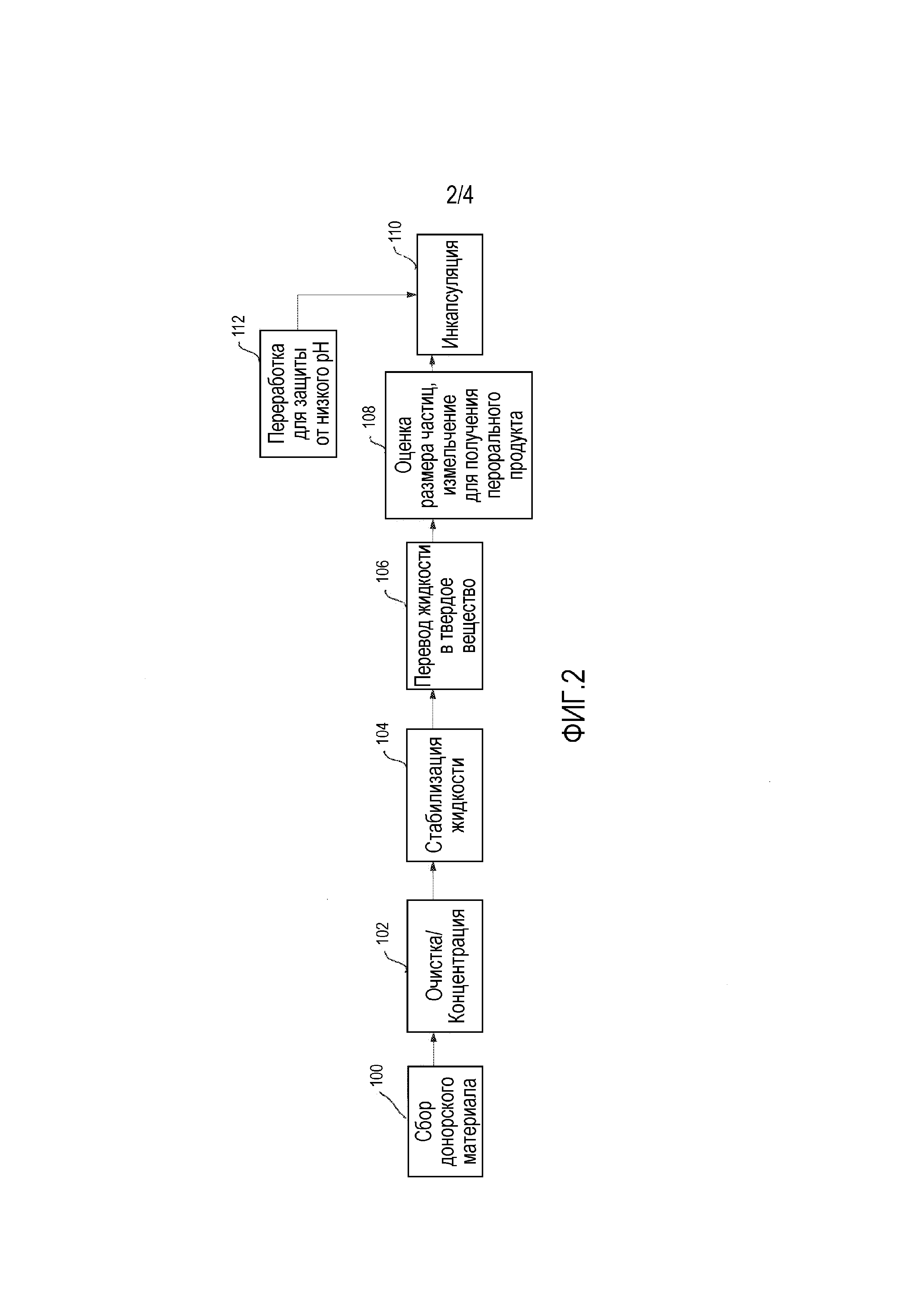
ФИГ. 2 представляет собой блок-схему, изображающую дополнительные стадии репрезентативного производственного процесса.
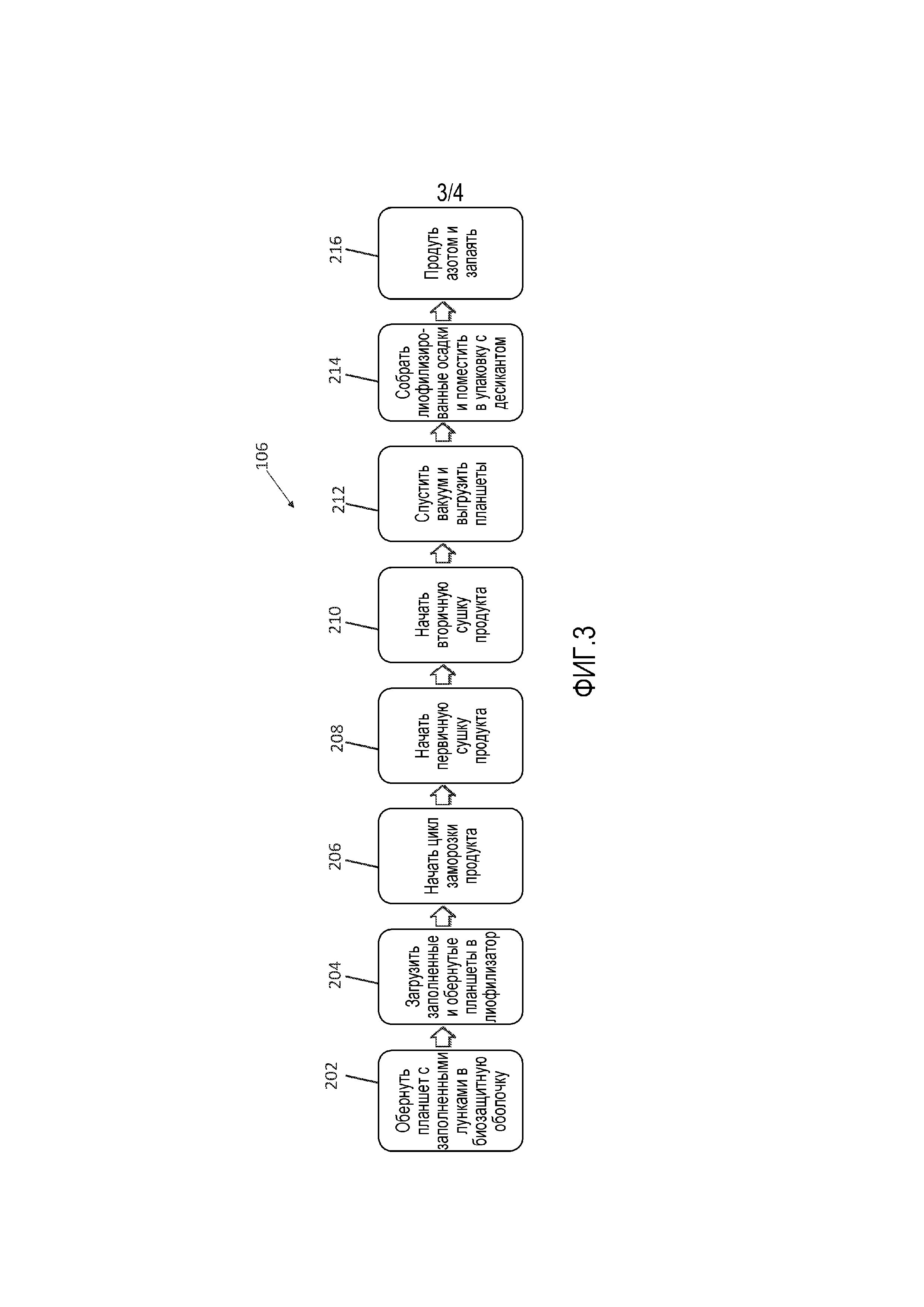
ФИГ. 3. представляет собой блок-схему, изображающую дополнительные стадии репрезентативного производственного процесса.
ФИГ. 4 представляет собой блок-схему, изображающую иллюстративный аналитический способ.
В то время как это описание подходит для различных модификаций и альтернативных форм, его специфические особенности показаны в качестве примера на чертежах и описаны подробно. Следует понимать, однако, что не существует намерения ограничивать это описание конкретными описанными вариантами осуществления. Напротив, существует намерение охватить все модификации, эквиваленты и альтернативы, попадающие в содержание и объем изобретения.
Подробное описание
Для следующих определенных терминов, следует применять эти определения, если другое определение не дано в формуле изобретения или в другом месте этого описания.
Все числовые значения в настоящем описании допускают модификацию посредством термина «приблизительно», вне зависимости от того, указано это явно или нет. Термин «приблизительно» в общем относится к диапазону чисел, который специалист в данной области считает эквивалентным указанному значению (т.е., имеющим такую же функцию или дающим такой же результат). Во многих случаях, термины «приблизительно» могут включать числа, округленные до ближайшей значащей цифры.
Ссылка на числовые диапазоны посредством конечных точек включает все числа в пределах этого диапазона (например, 1-5 включает 1, 1,5, 2, 2,75, 3, 3,80, 4 и 5).
Как используют в этом описании и прилагаемой формуле изобретения, неконкретизированные и конкретизированные формы единственного числа включают объекты ссылки множественного числа, если контекст явно не требует иного. Как используют в этом описании и прилагаемой формуле изобретения, термин «или», как правило, используют в его смысле, включающем «и/или», если контекст явно не требует иного.
Следует отметить, что ссылка в описании на «вариант осуществления», «некоторые варианты осуществления», «другие варианты осуществления» и т.д., показывает, что описанный вариант осуществления может включать один или несколько конкретных признаков, структур и/или характеристик. Однако, такие ссылки не обязательно означают, что все варианты осуществления включают конкретные признаки, структуры и/или характеристики. Кроме того, когда конкретные признаки, структуры и/или характеристики описаны в связи с одним вариантом осуществления, следует понимать, что такие признаки, структуры и/или характеристики можно также использовать в связи с другими вариантами осуществления, вне зависимости от того, описано это явно или нет, если явно не указано обратное.
Следующее подробное описание следует читать со ссылкой на чертежи, в которых сходные элементы на различных чертежах пронумерованы одинаково. Чертежи, которые необязательно соответствуют масштабу, описывают иллюстративные варианты осуществления и не предназначены для ограничения объема описания.
«Млекопитающее», в рамках изобретения, относится к любому члену класса Mammalia, включая, без ограничения, человека и не относящихся к человеку приматов, таких как шимпанзе, и другие виды человекообразных и не человекообразных обезьян; сельскохозяйственных животных, таких как крупный рогатый скот, овцы, свиньи, козы и лошади; домашних млекопитающих, таких как собаки и кошки; лабораторных животных, включая грызунов, таких как мыши, крысы и морские свинки, и т.п. Термин не обозначает конкретный возраст или пол. Таким образом, взрослые и новорожденные субъекты, так же как эмбрионы, мужского или женского пола, включены в объем этого термина.
Термин «криокосервация», в рамках изобретения, относится к способу охлаждения и хранения биологических клеток, тканей или органов при очень низких температурах для поддержания их жизнеспособности. В качестве неограничивающего примера, криокосервация может представлять собой технологию охлаждения и хранения клеток при температуре ниже точки замерзания (например, 196 K (-77°C)), что обеспечивает высокую частоту выживаемости клеток после размораживания.
Термин «криопротектор», в рамках изобретения, относится к веществу, которое используют для защиты биологических клеток или тканей от эффектов замораживания.
В рамках изобретения, термин «микробиота» может относиться к микробиому человека, микробиоте человека или микробиоте кишечника человека. Микробиом человека (или микробиота человека) представляет собой совокупность микроорганизмов, находящихся на поверхности и в глубоких слоях кожи, в слюне и слизистой оболочке полости рта, в конъюнктиве и в желудочно-кишечном, мочеполовом или вагинальном трактах человека. Микробиом человека состоит из бактерий, грибов и архей. Некоторые из этих организмов выполняют задачи, полезные для человека-хозяина, но функция большинства организмов, составляющих микробиом человека, неизвестна. В нормальных условиях, эти микроорганизмы не вызывают заболевания у человека-хозяина, но вместо этого участвуют в поддержании здоровья. Таким образом, эту популяцию организмов часто обозначают как «нормальная флора».
Популяцию микроорганизмов, живущих в желудочно-кишечном тракте человека, обычно обозначают как «кишечную флору» или «кишечную микробиоту». Микрофлора кишечника человека включает широкое разнообразие микроорганизмов, способствующих пищеварению, синтезу витаминов и образованию ферментов, не продуцируемых организмом человека.
Фраза «терапия для восстановления микробиоты», в рамках изобретения, относится к композиции, которая может включать, но без ограничения, материал фекалий человека, содержащий жизнеспособную кишечную флору, от пациента или донора, разбавитель и криопротектор. Дополнительные композиции включают эквивалентные лиофилизированные и разведенные фекалии или композицию «синтетических» фекалий. Материал фекалий человека подвергают скринингу на присутствие патогенных микроорганизмов перед использованием в терапии для восстановления микробиоты. Материал фекалий человека подвергают скринингу на присутствие видов Clostridium, включая C. difficile, норовируса, аденовируса, кишечных патогенов, антигенов видов Giardia, видов Cryptosporidia и других патогенов, включая кислотоустойчивые бактерии, энтерококки, включая, но без ограничения, устойчивые к ванкомицину энтерококки (VRE), устойчивого к метициллину Staphylococcus aureus (MSRA), так же как яиц или организмов каких-либо паразитов, или спорообразующих паразитов, включая, но без ограничения, Isospora, Clyslospora и Cryptospora.
Способ фекальной бактериотерапии может включать введение образца фекалий здорового донора или донора, имеющего одну или несколько желательных характеристик, в желудочно-кишечный тракт пациента для восстановления популяции здоровой или желательной кишечной микробиоты. В конкретных примерах, перед введением образца фекалий, кишечную флору пациента можно разрушать с использованием антибиотиков, так что здоровая или желательная кишечная микробиота, при введении пациенту, может легко заселять желудочно-кишечный тракт.
Материал фекалий человека, необязательно, фильтруют перед его использованием в терапии для восстановления микробиоты.
Настоящее описание относится к способам количественной оценки жизнеспособных бактерий в терапии для восстановления микробиоты (MRT). MRT можно использовать для лечения инфекций Clostridium difficile (CDI). CDI представляет собой общераспространенную внутрибольничную инфекцию и часто ассоциирована с тяжелой заболеваемостью и смертностью, особенно у пожилых пациентов. В то время как лечение CDI является одним примером использования композиций для MRT, описанных в настоящем описании, оно не является ограничивающим. Предусматривают другие заболевания и/или состояния. Некоторые из медицинских состояний, на которые можно желательным образом влиять посредством лечения с использованием композиций для MRT, могут включать сердечно-сосудистое заболевание и/или заболевание периферических сосудов, аллергию, ожирение, гипогликемию, констипацию, брюшные афты (например, глютенчувствительную целиакию), злокачественную опухоль желудочно-кишечного тракта (например, злокачественная опухоль желудочно-кишечного тракта представляет собой по меньшей мере одну из рака желудка, рака пищевода, рака ободочной кишки, рака желчного пузыря, рака печени, рака поджелудочной железы, колоректального рака, рака анального канала и стромальной опухоли желудочно-кишечного тракта), миоклоническую дистонию, сакроилеит, спондилоартропатию, спондилоартрит, проксимальную миотоническую миопатию; аутоиммунный нефритический синдром, аутизм, диарею путешественников, избыточный бактериальный рост в тонком кишечнике, хронический панкреатит, недостаточность поджелудочной железы, синдром хронической усталости, доброкачественный миалгический энцефаломиелит, синдром хронической усталости и иммунной дисфункции, болезнь Паркинсона (PD), боковой амиотрофический склероз (ALS), рассеянный склероз (MS), дегенеративные неврологические заболевания, большой эпилептический припадок или малый эпилептический припадок, болезнь Штейнерта, хронический инфекционный мононуклеоз, эпидемический миалгический энцефаломиелит, идиопатическую тромбоцитопеническую пурпуру (ITP), острую или хроническую аллергическую реакцию, ожирение, анорексию, синдром раздраженного кишечника (IBS или спастическую толстую кишку) болезнь Крона, болезнь раздраженного кишечника (IBD), колит, язвенный колит или колит Крона, хронический инфекционный мононуклеоз, эпидемический миалгический энцефаломиелит, острую или хроническую крапивницу, волчанку, ревматоидный артрит (RA) или ювенильный идиопатический артрит (JIA), предиабетический синдром, фибромиалгию (FM), диабет типа I или типа II, острую или хроническую бессонницу, мигрени, печеночную энцефалопатию и синдром дефицита внимания и гиперактивности (ADHD).
В случае человека, настоящее описание относится к способам лечения хронических нарушений, ассоциированных с присутствием аномальной кишечной микрофлоры. Такие нарушения включают, но без ограничения, состояния в следующих категориях: нарушения желудочно-кишечного тракта, включая синдром раздраженной кишки или спастическую толстую кишку, функциональные расстройства кишечника (FBD), включая FBD с преобладанием констипации, FBD с преобладанием боли, FBD верхнего отдела желудка, неязвенная диспепсия (NUD), гастроэзофагеальный рефлюкс, воспалительное заболевание кишечника, включая болезнь Крона, язвенный колит, неуточненный колит, коллагенозный колит, микроскопический колит, хроническая инфекция Clostridium difficile, псевдомембранозный колит, слизистый колит, ассоциированный с антибиотиками колит, идиопатическая или простая констипация, дивертикулез, энтеропатия при СПИД, избыточный бактериальный рост в тонком кишечнике, целиакия, полипоз coli, полипы толстой кишки, хронический идиопатический псевдообструктивный синдром; хронические инфекции кишечника специфическими патогенами, включая бактерии, вирусы, грибы и простейшие; вирусные желудочно-кишечные нарушения, включая вирусный гастроэнтерит, вирусный гастроэнтерит Норфолк, ротавирусный гастроэнтерит, связанный со СПИД гастроэнтерит; нарушения печени, такие как первичный биллиарный цирроз, печеночная энцефалопатия, первичный склерозирующий холангит, жировая инфильтрация печени или криптогенный цирроз; ревматические нарушения, такие как ревматоидный артрит, неревматоидный артрит, не положительный по ревматоидному фактору артрит, анкилозирующий спондилит, болезнь Лайма и синдром Рейтера; иммуноопосредованные нарушения, такие как гломерулонефрит, гемолитико-уремический синдром, ювенильный сахарный диабет, криоглобулинемия смешанного типа, полиартериит, семейная средиземноморская лихорадка, амилоидоз, склеродермия, системная красная волчанка и синдром Бехчета; аутоиммунные нарушения, включая системную волчанку, идиопатическую тромбоцитопеническую пурпуру, синдром Шегрена, гемолитико-уремический синдром или склеродермию; неврологические синдромы, такие как синдром хронической усталости, мигрень, рассеянный склероз, боковой амиотрофический склероз, миастения, синдром Гийена-Барре, болезнь Паркинсона, болезнь Альцгеймера, хроническая воспалительная демиелинизирующая полинейропатия и другие дегенеративные нарушения; психические расстройства, включая хроническую депрессию, шизофрению, психотические расстройства, маниакально-депрессивное заболевание; регрессивные расстройства, включая синдром Аспергера, синдром Ретта, синдром дефицита внимания и гиперактивности (ADHD), и cиндром дефицита внимания (ADD); регрессивное расстройство, аутизм; синдром внезапной смерти младенцев (SIDS), нервная анорексия; кожные заболевания, такие как хроническая крапивница, акне, герпетиформный дерматит и васкулитные нарушения; и сердечно-сосудистые и/или сосудистые нарушения и заболевания.
В мировом масштабе, увеличение распространения устойчивых к лекарственным средствам организмов создает для медицинских работников множество проблем, которые могут представлять риск для общественного здравоохранения. Инфекции устойчивыми к лекарственным средствам организмами (например, инфекция устойчивым к ванкомицину Enterococcus (VRE)) и Clostridium difficile, разделяют сходные факторы риска. VRE является внутрибольничным патогеном, что может вызывать осложнения у подвергнутых трансплантации пациентов и пациентов с нарушениями иммунитета. Носители VRE могут также подвергаться увеличенному риску инфекции из-за VRE, а также могут являться потенциальным источником передачи VRE другим. Распространение VRE с фекалиями увеличивается при воздействии противомикробных средств и уменьшается при нормализации кишечной микробиоты при прекращении введения противомикробных средств. Соответственно, нормализация кишечной микробиоты может являться полезной не только для лечения инфекций Clostridium difficile (включая хронические инфекции), эти способы лечения могут также являться полезными для лечения инфекций устойчивыми к лекарственным средствам организмами (например, VRE и/или другими устойчивыми к лекарственным средствам организмами, включая описанные в настоящем описании).
В некоторых случаях, композиции для терапии для восстановления микробиоты (и/или композиции для фекальной бактериотерапии), описанные в настоящем описании, можно использовать для лечения пациентов с инфекциями устойчивыми к лекарственным средствам организмами и/или организмами с множественной устойчивостью к лекарственным средствам (MDRO). Устойчивые к лекарственным средствам организмы могут являться устойчивыми к противомикробным средствам (например, антибиотикам, противовирусным средствам, противогрибковым средствам, противопаразитарным средствам, другим лекарственным средствам, их комбинациям и т.п.) и могут включать устойчивые к лекарственным средствам микроорганизмы, такие как бактерии, вирусы, грибы, паразиты и т.д. Инфекции, которые можно лечить посредством композиций для терапии для восстановления микробиоты, описанных в настоящем описании, могут присутствовать в пищеварительном тракте или в других системах пациента.
Композиции для терапии для восстановления микробиоты можно использовать для лечения инфекций множеством устойчивых к лекарственным средствам организмов, таких как устойчивые к ванкомицину энтерококки (VRE), устойчивый к метициллину Staphylococcus aureus (MRSA), продуцирующие β-лактамазу расширенного спектра действия грамотрицательные бактерии, Klebsiella pneumoniae, продуцирующие карбапенемазу грамотрицательные бактерии, грамотрицательные палочковидные бактерии с множественной устойчивостью к лекарственным средствам (например, такие как виды Enterobacter, E.coli, Klebsiella pneumoniae, Acinetobacter baumannii и Pseudomonas aeruginosa), устойчивые к лекарственным средствам виды Enterobacter, возбудители туберкулеза с множественной устойчивостью к лекарственным средствам (например, Mycobacterium tuberculosis), устойчивые к лекарственным средствам стафилококки, устойчивые к лекарственным средствам энтерококки, устойчивые к лекарственным средствам гонококки, устойчивые к лекарственным средствам стрептококки(например, включая Streptococcus pneumoniae), устойчивая к лекарственным средствам Salmonella, устойчивые к лекарственным средствам грамотрицательные бактерии, устойчивая к лекарственным средствам Candida, устойчивый к лекарственным средствам HIV, устойчивый к лекарственным средствам вирус гриппа, устойчивый к лекарственным средствам цитомегаловирус, устойчивый к лекарственным средствам вирус простого герпеса, устойчивая к лекарственным средствам малярия, устойчивый к лекарственным средствам Plasmodium vivax, устойчивый к лекарственным средствам Plasmodium falciparum, устойчивая к лекарственным средствам Toxoplasma gondii, и т.п., и/или другие устойчивые к лекарственным средствам организмы. Они являются только примерами.
Лечение инфекций устойчивыми к лекарственным средствам организмами с использованием композиций для терапии для восстановления микробиоты, описанных в настоящем описании, может включать лечение пациентов без предшествующей инфекции устойчивым к лекарственному средству организмом в анамнезе, лечение пациентов с одной предшествующей инфекцией устойчивым к лекарственному средству организмом, лечение пациентов с двумя или более (например, двумя, тремя, четырьмя, пятью, шестью или более) предшествующими инфекциями устойчивым к лекарственному средству организмом и т.д. В некоторых случаях, композиции для терапии для восстановления микробиоты можно использовать для лечения пациента с тремя предшествующими инфекциями устойчивым к лекарственному средству организмом. В других случаях, композиции для терапии для восстановления микробиоты можно использовать для лечения пациента с двумя предшествующими инфекциями устойчивым к лекарственному средству организмом, если предшествующие инфекции привели к госпитализации, если предшествующие или текущие инфекции требуют лечения токсичными лекарственными средствами, или если предшествующие инфекции все были вызваны одним и тем же организмом.
В некоторых случаях, композиции для MRT можно вводить пациенту с использованием клизмы или другого пригодного способа. Однако, может являться желательным пероральное введение композиции для MRT. Для получения композиции для MRT в форме, пригодной для перорального введения, можно осуществлять ряд стадий. Как правило, эти стадии могут включать сбор образца фекалий, переработку образца фекалий, лиофилизацию или «сублимационную сушку» переработанного образца фекалий, добавление одной или нескольких добавок и/или наполнителей, и составление пероральной формы композиции для MRT из лиофилизированного материала и добавок (например, таблетки, капсулы, жидкого препарата или т.п).
После получения композиции для MRT для введения пациенту, может являться желательной количественная оценка жизнеспособных бактериальных микроорганизмов в продукте лекарственного средства. Например, активным ингредиентом в композиции для MRT считают жизнеспособных бактериальных микроорганизмов, присутствующих в суспензии и/или лиофилизированном продукте. Для выпуска продукта на основании спецификаций качества, необходимо определять «активность» этого продукта («активность» определена в 21 CFR 600.3(s) как «специфическая способность или мощность продукта, как показано по соответствующим лабораторным тестам или по адекватно контролируемым клиническим данным, полученным посредством введения продукта способом, предназначенным для достижения данного результата»). Предусматривают, что количественную полимеразную цепную реакцию с детекцией в реальном времени (qПЦР) можно использовать для количественной оценки жизнеспособных бактериальных микроорганизмов, как более подробно обсуждают ниже.
Фигура 1 представляет собой блок-схему, изображающую пример части процесса производства для MRT. Это является только примером. Другие примеры скрининга доноров, получения образцов фекалий человека и переработки образцов фекалий в продукт для MRT, описаны в принадлежащей тому же правообладателю Публикации патента США 2014/0363398, содержание которой приведено в настоящем описании в качестве ссылки. Более конкретно, на фигуре 1 схематически изображен способ сбора и проверки образца фекалий донора. В качестве первой стадии способа сбора/проверки, проводят скрининг потенциальных доноров фекалий. После того, как донор отобран в скрининге, стадия два может включать сбор фекалий донора с использованием набора для сбора фекалий человека, как определено в настоящем описании, либо в домашних условиях, либо в отделении для сбора. Набор может включать, но без ограничения, чистый контейнер с крышкой для фекалий человека, большой закрываемый/герметично запечатываемый пакет, форму для заполнения при донации и инструкцию для сбора фекалий человека. Время и дату сбора, вместе с идентификацией донора и способом транспортировки, можно регистрировать, чтобы отслеживать время от сбора до переработки и условия транспортировки. В качестве неограничивающего примера, контейнер для сбора может включать индикатор минимальной и максимальной температуры, воздействию которой подвергается образец. В качестве другого неограничивающего примера, одну или несколько чувствительных к температуре наклеек, которые меняют цвет при температурах ниже 4°C и при температурах выше, чем приблизительно комнатная температура (приблизительно 22-29°C), можно прикреплять к контейнеру.
Стадия три может включать транспортировку образца в отделение для переработки. Следует понимать, что если образец собирают в отделении для переработки, транспортировка образца не является необходимой. В некоторых случаях, может являться желательным сбор образца в отделении для переработки, чтобы более ясно установить цепь ответственности и обеспечения сохранности образца. При получении первой донации фекалий для любого индивидуума, для каждого донора разрабатывают профиль. Последующие образцы фекалий можно подвергать тестированию фекалий человека, которое используют для установления совпадений и подтверждения идентичности донора с донацией. На основании собранных ранее образцов, получают профиль фекалий человека для донора, и его можно сохранять или расширять на протяжении повторных донаций. Любой новый образец можно сравнивать с этим профилем для подтверждения того, что это тот же самый донор. Дифференцировку для подтверждения идентичности донора можно проводить на основании представленности видов Bacterioides в фекалиях человека. В неограничивающем примере, основной набор образцов фекалий, используемый для получения профиля, собирают в отделении для переработки для обеспечения идентичности донора в образцах для профиля. В другом неограничивающем примере, основной набор образцов фекалий, используемый для получения профиля, собирают в местоположениях, отличных от отделения для переработки, с использованием протоколов обеспечения идентичности донора, соответствующих ситуации или местоположению.
Стадия четыре способа может включать снабжение донорского материала пометкой «карантин» и содержание донорского материала на карантине при комнатной температуре или ниже в течение не более, чем в диапазоне от 24 часов до пяти суток до переработки. Донорский материал можно отклонять в ситуациях, когда индикатор температуры был активирован, или когда время между донацией и получением превышает 24 часа. Кроме того, когда это применимо, результаты тестирования фекалий человека должны совпадать с профилем донора. Если при тестировании фекалии человека не совпадают с профилем донора, донорский материал, собранный в эти сутки, отклоняют, и донора дисквалифицируют.
В одном способе по описанию, образец фекалий человека перерабатывают в пределах приблизительно 24 часов после сбора. В другом способе по описанию, время сбора регистрируют на время прибытия образца фекалий в отделение для переработки. Стадия шесть может включать проверку донорского материала фекалий. Визуальную проверку можно проводить после прибытия образца фекалий в отделении для переработки. В случае, когда образец фекалий человека является слишком мягким, несформированным, имеет недостаточную массу (например, менее приблизительно 50 г), или по любой другой причине, включая, но без ограничения, свидетельства, указывающие на плохое качество образца или сомнения относительно общего состояния здоровья донора, образец можно отклонять, снабжать пометкой «проверка - отклонено», и отбрасывать донорский материал. Кроме того, ответы на вопросы в форме для сбора фекалий человека должен проверять квалифицированный специалист. Конкретные ответы в форме для сбора могут требовать отклонения с некоторым избытком. Если образец принят, его можно снабжать пометкой «проверка - принято» и переводить в производственный процесс.
Фигура 2 представляет собой блок-схему, изображающую часть общего иллюстративного способа получения образца фекалий для MRT в форме пероральной дозы. Предусматривают, что промежуточный продукт в способе получения образца фекалий для MRT в форме пероральной дозы может являться пригодным для MRT посредством клизмы или гастроназальной трубки. Образец фекалий можно сначала собирать и подвергать скринингу 100, например, в способе, описанном применительно к Фигуре 1. После того, как образец принят, образец можно очищать и концентрировать 102. Образец можно очищать с использованием центрифугирования, фильтрации на мембране или их комбинации для удаления материала фекалий, превышающего определенный размер частиц. Предусматривают, что поскольку большинство представляющих интерес бактерий лежит в диапазоне от 0,3 микрон (мкм) до 30 мкм, образец можно перерабатывать для удаления частиц более 50-70 мкм. Образец можно перерабатывать для получения 75%-90% концентрации бактерий. Это может обеспечивать увеличенную гибкость соотношения состава наполнителей к бактериям для дальнейшей переработки.
Образец можно подвергать мембранной фильтрации посредством ряда различных способов, включая, но без ограничения, использование фильтровальных мешков, работающих под давлением фильтров и/или вакуумных фильтров. В некоторых случаях, образец можно фильтровать множество раз с использованием более мелкой фильтрующей мембраны при каждой последующей фильтрации. В некоторых случаях, солевой раствор можно добавлять в качестве разбавителя в соотношении 1:3 (фекалии к солевому раствору), хотя это и не обязательно. В других случаях, смесь солевого раствора и криопротектора (например, полиэтиленгликоля (PEG) 3350) можно использовать в качестве разбавителя. Концентрация PEG в разбавителе может составлять около приблизительно 30-90 г/литр (или приблизительно 10-90 г/литр). Концентрация PEG в разбавителе может также составлять между приблизительно 25-75 г/литр. В одном примере, соотношение смеси солевой раствор/PEG к образцу фекалий составляет 2:1, или 2 мл смеси солевой раствор/PEG на 1 грамм фекалий человека. В качестве неограничивающего примера, приблизительно 100 мл смеси солевой раствор/PEG можно использовать для 50 г фекалий человека. В то время как солевой раствор/PEG может являться пригодным в качестве разбавителя (и/или криопротектора), он не является ограничивающим. Другие криопротекторы также можно использовать. Например, декстрозу, бетаин, глицин, сахарозу, поливиниловый спирт, плюроник F-l27, маннит, tween 80, этиленгликоль, l,3-пропандиол, гидроксипропилцеллюлозу, глицерин, смесь PEG/глицерин, пропиленгликоль или их комбинации можно использовать в качестве криопротекторов. Эти материалы можно использовать отдельно или в комбинации с растворителем, таким как солевой раствор.
В одном примере, образец можно помещать в 500 мкм фильтровальный мешок, с разбавителем или без него, и перемешивать с использованием, например, встряхивателя Stomacher при 230 об./мин в течение приблизительно 2 минут для получения фильтрата, имеющего размер частиц приблизительно 500 мкм или менее. Затем этот фильтрат можно помещать в фильтровальный мешок, имеющий размер пор менее 500 мкм, например, 280 мкм. Образец можно снова перемешивать с использованием, например, встряхивателя Stomacher при 230 об./мин с разбавителем или без него, в течение приблизительно 4 минут для получения фильтрата, имеющего размер частиц приблизительно 280 мкм или менее. Этот фильтрат моно помещать в другой фильтровальный мешок, имеющий размер пор менее, например, 280 мкм, например, но без ограничения, 60 мкм. Образец можно снова перемешивать с использованием, например, встряхивателя Stomacher при 230 об./мин с разбавителем или без него в течение приблизительно 4 минут для получения фильтрата, имеющего размер частиц приблизительно 50-70 мкм или менее.
В другом примере, образец можно помещать в 500 мкм фильтровальный мешок, с разбавителем или без него, и перемешивать с использованием, например, встряхивателя Stomacher для получения фильтрата, имеющего размер частиц приблизительно 500 мкм или менее. Затем этот фильтрат можно перерабатывать с использованием работающего под давлением фильтра, имеющего размер пор приблизительно 160 мкм, и перерабатывать полученный фильтрат с использованием работающего под давлением фильтра, имеющего размер пор приблизительно 60 мкм. В некоторых случаях, может являться необходимым перерабатывать образец второй раз с использованием фильтровального мешка, имеющего размер пор между 160 мкм и 500 мкм перед использованием работающего под давлением фильтра.
В другом примере, образец можно помещать в 500 мкм фильтровальный мешок, с разбавителем или без него, и перемешивать с использованием, например, встряхивателя Stomacher для получения фильтрата, имеющего размер частиц приблизительно 500 мкм или менее. Затем этот фильтрат можно перерабатывать с использованием вакуумного фильтра, имеющего размер пор приблизительно 160 мкм, и перерабатывать полученный фильтрат с использованием вакуумного фильтра, имеющего размер пор приблизительно 60 мкм. В некоторых случаях, может являться необходимым перерабатывать образец второй раз с использованием фильтровального мешка, имеющего размер пор между 160 мкм и 500 мкм перед использованием вакуумного фильтра.
После переработки образца, чтобы он имел размер частиц приблизительно 60 мкм или менее, образец можно затем промывать и дополнительно концентрировать с использованием центрифуги. В некоторых случаях, пробирки для центрифугирования могут иметь объем в диапазоне 50-500 мл или более. Фильтрованной суспензией заполняют приблизительно 20-80% объема пробирки для центрифугирования. В одном примере, образцы можно центрифугировать при 1100-3600 оборотов в минуту (об./мин) в течение циклов по 10-15 минут. В другом примере, образцы можно центрифугировать с такой скоростью, что центробежная сила лежит в диапазоне приблизительно 8000-12000 g (например, приблизительно 10000 g) в течение 15-45 минут или 20-30 минут. Центрифугу можно разгонять или постепенно ускорять до скорости, необходимой для получения центробежной силы в диапазоне приблизительно 8000-12000 g (например, приблизительно 10000 g). Кроме того, предусматривают, что центрифугу можно также медленно останавливать или замедлять, когда процесс центрифугирования окончен. В некоторых случаях, может являться желательным замедлять центрифугу настолько медленно, насколько возможно, чтобы возврат к атмосферному давлению являлся медленным, чтобы защитить клетки бактерий от потенциального взрыва. Супернатант удаляют, и оставшийся в пробирке материал представляет собой очищенную промежуточную композицию для MRT. Это может приводить к получению продукта, концентрированного до приблизительно 60%. В некоторых случаях, процесс центрифугирования может представлять собой 2-уровневый процесс. Например, продукт можно сначала подвергать «предварительному центрифугированию» (например, при 300 g в течение 2-5 минут) для удаления волокнистого материала фекалий и затем можно подвергать более длительному центрифугированию для концентрирования продукта. Кроме того, предусматривают, что объемы вплоть до 300 мл можно центрифугировать без падения в результате значения концентрации. Полученная композиция для MRT представляет собой бактериальную суспензию, имеющую размер частиц 70 мкм или менее и концентрацию бактерий порядка приблизительно 1×1010 КОЕ/г. Полученная композиция для MRT может также являться стабильной в течение 3 недель в условиях охлаждения. Эта полученная композиция для MRT может являться пригодной для доставки пациенту посредством клизмы или гастроназальной трубки. Дополнительная переработка может являться необходимой для перевода жидкой композиции для MRT в твердое вещество, пригодное для пероральной доставки.
В некоторых вариантах осуществления, только центрифугирование можно использовать множество раз для очистки и концентрирования. Однако, размер частиц бактериальной суспензии может еще оставаться в диапазоне (например, более чем 60 мкм), который засоряет наконечники пипеток. Однако, в некоторых случаях, можно использовать широкие наконечники пипеток. Будет ли это успешным или нет, зависит от входящего материала фекалий, который является изменчивым. Кроме того, предусматривают, что можно использовать систему сепараторов и отстойников, если размер партии лежал в диапазоне нескольких десятков литров или более. Однако, это может не являться необходимым, если исходный продукт подвергали предварительной переработке.
В некоторых вариантах осуществления, может являться желательной стабилизация переработанного образца в суспензии 104 в условиях охлаждения в течение периода времени в диапазоне от одной до двух недель. В некоторых случаях, удаление материала фекалий и замена на носители или наполнители, которые являются растворимыми в водном растворе, может позволять суспендирование бактерий в жидкости и дальнейшую переработку без опасений относительно стабильности. Учитываемые факторы для этих растворов наполнителя могут представлять собой pH, концентрацию, и изотоничность или изоосмоляльность. Наполнители можно выбирать на основании составов белка и моноклональных антител и их предположительной роли в стабилизации биологических веществ. Некоторые примеры наполнителей, которые можно использовать для обеспечения стабилизации жидкости 104 из образца, могут включать, но без ограничения: соль (NaCl), сахарозу, трегалозу, моногидрохлорид L-аргинина и/или PEG 3350.
Предусматривают, что сходные наполнители можно также использовать для защиты бактерий в ходе мембранной фильтрации. Например, в Farber and Sharpe in Applied and Environmental Microbiology, Aug 1984, P. 441-443 указано, что выделение бактерий улучшается в присутствии дебриса некоторых пищевых продуктов (моркови, сыра, персиков, тунца) -pH может являться важным - pH 5,88-6,40 моркови, pH 4,75-5,02 для сыра, pH 5,9-6,2 для тунца, pH 3,3-4,05 для персиков. Присутствие сахаров, углеводов или белков может являться важным, свойства этих пищевых продуктов, которые покрывают бактерии, поддерживают рост бактерий (пребиотическая активность) или поддерживают клеточную стенку бактерий во время фильтрации, могут являться важными.
От времени получения стандартизованного продукта до времени введения пациенту, стандартизованный продукт необходимо поддерживать жизнеспособным. Это может включать использование способа хранения в замороженном состоянии и криопротектора для поддержания жизнеспособности. Например, полиэтиленгликоль (PEG) можно использовать в качестве эффективного криопротектора для продуктов для MRT. Время хранения, способ размораживания, способ транспортировки и манипуляции с размороженным продуктом также представляют собой факторы, влияющие на жизнеспособность, и определены в настоящем описании. В одном варианте осуществления, криопротектор полиэтиленгликоль (PEG) можно смешивать с образцом фекалий человека и изотоническим солевым раствором во время переработки. PEG можно добавлять в концентрации от приблизительно 0,1 г/мл до приблизительно 70 г/мл, или от приблизительно 2 г/мл до приблизительно 68 г/мл, или от приблизительно 4 г/мл до приблизительно 65 г/мл, или от приблизительно 5 г/мл до приблизительно 60 г/мл. Используемый PEG может иметь среднюю молекулярную массу от приблизительно 600 до приблизительно 20000. В некоторых вариантах осуществления, PEG имеет среднюю молекулярную массу от приблизительно 2000 до приблизительно 4000, например, приблизительно 3350, как представлено в составе PEG 3350. Можно использовать другие криопротекторы, такие как декстроза, бетаин, глицин, сахароза, поливиниловый спирт, плюроник F-127, маннит, tween 80, этиленгликоль, 1,3-пропандиол, гидроксипропилцеллюлоза, глицерин, PEG.
Пригодные носители можно менять в зависимости от желательной формы и способа введения композиции. Например, они могут включать разбавители или расширители, такие как наполнители, связующие средства, увлажняющие средства, дезинтегрирующие средства, поверхностно-активные средства, средства, способствующее скольжению, смазывающие средства и т.п. Как правило, носитель может представлять собой твердое вещество (включая порошок), жидкость или их комбинации. Каждый носитель, предпочтительно, является «приемлемым» в том смысле, что он является совместимым с другими ингредиентами в композиции и не является вредным для субъекта. Носитель может являться биологически приемлемым и инертным (например, он позволяет композиции поддерживать жизнеспособность биологического материала до доставки в подходящий участок).
Пероральные композиции могут включать инертный разбавитель или съедобный носитель. Для цели перорального терапевтического введения, активное соединение можно объединять с наполнителями и использовать в форме таблеток, лепешек или капсул, например, желатиновых капсул. Пероральные композиции можно также получать посредством объединения композиции по настоящему описанию с пищевым продуктом. В одном варианте осуществления, пищевой продукт, используемый для введения, является замороженным, например, мороженое. Фармацевтически совместимые связующие средства и/или вспомогательные материалы можно включать в качестве части композиции. Таблетки, пилюли, капсулы, лепешки и т.п. могут содержать любой из следующих ингредиентов или соединений сходной природы: связующее, такое как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; наполнитель, такой как крахмал или лактоза, дезинтегрирующее средство, такое как альгиновая кислота, примогель или кукурузный крахмал; смазывающее средство, такое как стеарат магния или Sterotes; средство, способствующее скольжению, такое как коллоидный диоксид кремния; a подсластитель, такой как сахароза или сахарин; или ароматизатор, такой как перечная мята, метилсалицилат, апельсиновый ароматизатор или другие пригодные ароматизаторы. Они приведены только с целью примера и не являются ограничивающими.
После того, как образец очищен и стабилизирован в водной суспензии (например, в вышеописанной композиции для MRT), которая в этой точке может являться пригодной для доставки посредством гастроназальной трубки или клизмы, образец можно далее перерабатывать, чтобы он являлся пригодным для пероральной доставки, например, в форме таблеток, лепешек или капсул. Например, водный раствор можно переводить в твердое вещество 106. Список способов переработки бактерий можно обнаружить в Martin et al., Innovative Food Science and Emerging Technologies, 27 (2015) 15-25.
В некоторых случаях, лиофилизацию или сублимационную сушку можно использовать для перевода образца из жидкости в твердое вещество. Образец можно снабжать криопротектором, таким как, но без ограничения, PEG, обезжиренное молоко, активированный уголь, аскорбиновая кислота или их комбинация, для защиты бактерий от эффектов замораживания. Образец можно также снабжать лиопротектором, таким как, но без ограничения, сахароза, инозитол, трегалоза, глицерин или их комбинация. В некоторых случаях, образец можно также снабжать обогатительный материал, который может обеспечивать кислое забуферивание. Альтернативно или дополнительно, обогатительный материал может также поддерживать бактерии более активными, что может облегчать аналитическое тестирование. Некоторые примеры обогатительных материалов могут включать, но без ограничения, обезжиренное молоко, активированный уголь, желатин, аскорбиновую кислоту, среды GI или их комбинации. Альтернативно или дополнительно, поглотитель кислорода можно добавлять в образец до и/или после лиофилизации. Без намерения быть связанными с теорией, считают, что поглотитель кислорода может улучшать стабильность и/или жизнеспособность образца. Предусматривают, что пробирки для лиофилизации могут включать вставку, которую можно использовать для извлечения лиофилизированного осадка из пробирки для лиофилизации после сублимационной сушки. Ширина пробирки для лиофилизации может быть меньше, чем ширина оболочки капсулы для перорального лечения. Это может позволять вытеснение массива осадков непосредственно в оболочки капсул. Предусматривают, что это может уменьшать или исключать необходимость оценки размера частиц состава или их дополнительное измельчение 108 для улучшения свойств текучести в капсуле. Дозу можно также определять по размеру осадка. В некоторых случаях, осадок, полученный в процессе лиофилизации, может включать приблизительно 4,5×108 колониеобразующих единиц (КОЕ) (CDC). Капсула размера 0 может вмещать три осадка. Таким образом, капсула может включать приблизительно 6,7×109 КОЕ (CDC). Восемь капсул, принимаемых дважды в сутки, могут являться необходимыми для получения эквивалента одной дозы клизмы. Кроме того, может не являться необходимым тестирование гомогенности партии осадков, которые смешивают перед заполнением капсулы. В некоторых случаях, трамбовка может обеспечивать большую концентрацию или большее количество осадков внутри каждой капсулы. Например, трамбовка осадков внутри капсулы может обеспечивать приблизительно в 2-4 раза (например, приблизительно в 2,5 раз) большее количество осадков в каждой капсуле (например, без трамбовки каждая капсула может вмещать 2-4 или приблизительно 3 осадка, в то время как с трамбовкой каждая капсула может вмещать приблизительно 7-10 или приблизительно 8 осадков). Это может способствовать уменьшению количества капсул, которое может быть необходимо принимать пациенту, чтобы достичь желательной дозы.
Иллюстративный способ лиофилизации (например, перевод жидкости в твердое вещество) 106 описан применительно к фигуре 3. Композицию для MRT или очищенное промежуточное соединение можно смешивать в соотношении 1:1 с раствором наполнителя для лиофилизации. Раствор наполнителя для лиофилизации может содержать 2,3% PEG 3350, 1% глицерина, 10% трегалозы и 10% сахарозы. Однако, можно использовать другие наполнители для лиофилизации. Перед добавлением раствора наполнителя к очищенному промежуточному соединению, раствор наполнителя для лиофилизации (без глицерина) фильтруют через фильтр 0,2 мкм. Глицерин автоклавируют при 121°C в течение минимум 15 минут и добавляют асептически. После смешивания наполнителей для лиофилизации и очищенного промежуточного соединения (суспензия для лиофилизации), одну аликвоту двести микролитров (200 мкл) суспензии для лиофилизации помещают в каждую лунку 96-луночного планшета и лиофилизируют.
Для проведения лиофилизации, после заполнения, 96-луночный планшет можно заворачивать в стерильную биозащитную оболочку, как показано на стадии 202. Предусмотрены также другие размеры планшетов. После заворачивания всех планшетов, их можно немедленно транспортировать и загружать в лиофилизатор, как показано на стадии 204. Лиофилизатор можно закрывать и начинать цикл лиофилизации. Продукт замораживают посредством снижения температуры содержания продукта до диапазона приблизительно от -40°C до -45°C, как показано на стадии 206. После замораживаия продукта, первичную сушку (сублимацию) осуществляют посредством воздействия вакуума и повышения температуры содержания вплоть до 0°C, как показано на стадии 208. Начинают стадию вторичной сушки для дальнейшего уменьшения влажности и доведения продукта до температуры окружающей среды (приблизительно 25°C), как показано на стадии 210. Вакуум спускают в конце стадии вторичной сушки, и продукт извлекают из лиофилизатора, как показано на стадии 212. Продукт можно помещать внутрь анаэробной камеры для сбора лиофилизированных аликвот. Лиофилизированные аликвоты могут находиться в форме осадка, и их переносят в упаковку с десикантом, как показано на стадии 214. Заполненные упаковки можно продувать газообразным азотом и запаивать, как показано на стадии 216.
В некоторых случаях, может являться желательным, чтобы лиофилизированные осадки имели температуру стеклования (Tg) более 30°C. Это может приводить к получению конечного продукта, который является стабильным при комнатной температуре. Температуру стеклования можно использовать также в качестве инструмента для скринига продукта, полученного в процессе лиофилизации, и/или для подтверждения стабильности конечного продукта.
В других случаях, может являться желательным консервировать образец посредством выпаривания при сушке во вспененном состоянии. Предусматривают, что традиционные наполнители и оборудование можно использовать для этого способа. Более высокие концентрации наполнителя и оптимальные параметры процесса для получения пены в ходе переработки могут приводить к получению составов с низкой влажностью. Чем ниже влажность, тем выше вероятность стабильности при комнатной температуре. Со ссылкой снова на фигуру 2, после сушки образца 106, образец можно дополнительно перерабатывать для достижения желательного размера частиц и/или измельчать 108 для подготовки образца для получения перорального продукта.
В других вариантах осуществления жидкий образец можно, необязательно, микроинкапсулировать посредством липидов для защиты от желчи, альгинатов и/или полимеров. После микроинкапсуляции образца, образец можно дополнительно перерабатывать для достижения желательного размера частиц и/или измельчать 108 для подготовки образца для получения перорального продукта. После переработки образца до желательного размера частиц и/или измельчения 108 для подготовки образца для получения перорального продукта, образец можно инкапсулировать 110, как более подробно описано ниже. Предусматривают что способ инкапсуляции может обеспечивать защиту от низкого pH 112. Например, способ инкапсуляции может предотвращать или в основном предотвращать оболочки капсул, таблетки и/или лепешки от разрушения в кислом окружении желудка, так что композиция для MRT высвобождается в желательном участке кишечного тракта. Предусматривают, что покрытая кишечнорастворимой оболочкой капсула может являться необходимой для обеспечения защиты в желудке и наличия дезинтеграции капсулы в тонком и толстом кишечнике. В некоторых случаях, капсулы можно подвергать дражерованию с использованием кишечнорастворимой оболочки. Материалы кишечнорастворимой оболочки могут включать жирные кислоты, воски, шеллак, пластик и растительные волокна. Дражерование капсул гидроксипропилметилцеллюлозой (HPMC), или называемой также гипромеллозой, может защищать при низком pH, а также способствовать защите от влажности. Некоторые пригодные капсулы могут включать DRcapsTM и VcapsTM,доступные из Capsugel®. Подобным образом, AR caps, имеющие состав 60% HPMC и 40% HPMCP (фталат гипромеллозы), могут иметь такие же свойства. Типы капсул, которые не являются желатиновыми, могут содержать меньше воды (желатиновые капсулы обычно содержат 10-12% воды, в отличие от других полимерных капсул, имеющих 3-4% или менее воды). Покрытие капсулы слоем полимеров, которые являются нерастворимыми в окружении низкого pH, может являться необходимым, как более подробно обсуждают ниже. В других случаях, капсулы можно комплектовать, так что 2 или более капсул используют для размещения образца. Например, образец можно помещать в капсулу, и затем помещать капсулу в другую, более крупную, капсулу.
После получения лиофилизированного промежуточного соединения, его можно извлекать из упаковки и заполнять капсулы. Можно также отбирать образцы лиофилизированного промежуточного соединения и измерять общую жизнеспособность посредством способа PMA-qПЦР. Инкапсуляцию можно проводить в продуваемом азотом участке при температуре окружающей среды для минимизации подвергания лиофилизированного промежуточного соединения воздействию кислорода. Лиофилизированные промежуточные соединения инкапсулируют в капсулу из гипромеллозы. Множество лиофилизированных промежуточных соединений можно загружать в капсулу из гипромеллозы, в зависимости от размера капсулы (например, размеры 1, 0 или 00).
Затем капсулу можно покрывать дополнительным слоем. В некоторых случаях, капсулы можно покрывать дополнительным слоем гипромеллозы. В других случаях, материал покрывающего слоя может представлять собой анионный сополимер на основе метакриловой кислоты и метилметакрилат, такой как, но без ограничения, Eudragit® L100. В других случаях, материал покрывающего слоя может представлять собой фталат гипромеллозы или ацетат-сукцинат гипромеллозы. Они являются только примерами. Материал покрывающего слоя может представлять собой любой материал, который является устойчивым к окружению низкого pH (например, в желудке) и деградирует в окружении высокого pH (например, в кишечном тракте). На каждую капсулу наносят слой согласованной толщины, так что эффективность дезинтеграции соответствует допустимому пределу. Капсулы хранят в условиях охлаждения, при 5±3°C в продуваемом азотом большом пластиковом контейнере или в упаковке с десикантом. Инкапсулированный и покрытый дополнительным слоем продукт лекарственного средства можно упаковывать с десикантом и запаивать. В некоторых случаях, инкапсулированный и покрытый дополнительным слоем продукт лекарственного средства можно упаковывать в количествах для индивидуального дозирования в металлизированную полиэфирную пленку с полиэтиленовым покрытием. Это может минимизировать воздействие на продукт лекарственного средства кислорода и/или влажности, которые могут вызывать деградацию продукта. Металлизированная полиэфирная пленка с полиэтиленовым покрытием может иметь a скорость проницаемости водяных паров 0,02 г/100 дюймов2 (0,02 г/254 см2) и скорость проницаемости кислорода 0,0402/мл/100 дюймов2 (0,0402 мл/254 см2) за 24 часа. Пакеты из пленки с покрытием можно предоставлять пациенту в безопасном для детей контейнере, чтобы соответствовать требованиям безопасной для детей упаковки клинических поставок. Безопасный для детей контейнер может представлять собой зеленый фармацевтический флакон 40 драхм (2,5 унции) (148 мл) с крышкой с функцией защиты от детей. Флакон может быть изготовлен из прозрачного, светоустойчивого полипропилена. Крышка с функцией защиты от детей из полиэтилена низкой плотности (LDPE) помогает предотвращать несанкционированный доступ посредством того, сто пользователь должен нажать и повернуть крышку, чтобы открыть контейнер.
Как описано выше, может являться желательной количественная оценка жизнеспособных бактериальных микроорганизмов в продукте лекарственного средства для доставки посредством гастроназальной трубки, клизмы и/или капсулы, или таблетки. Способ на молекулярной основе, такой как анализы с использованием PMA (моноазида пропидия) - qПЦР (количественной полимеразной цепной реакции), можно использовать для количественной оценки жизнеспособных бактерий. Только количественной ПЦР может быть недостаточно для определения количества жизнеспособных бактерий в образце, поскольку амплифицируется ДНК как из живых, так и из мертвых клеток. С использованием обработки PMA в комбинации с qПЦР, можно определять количество жизнеспособных бактериальных клеток в образце. Кратко, анализ PMA-qПЦР представляет собой способ из двух частей. Сначала, образцы обрабатывают фотореактивным связывающим ДНК красителем, называемым моноазидом пропидия (PMA). После фотоактивации, PMA интеркалирует между основаниями ДНК и делает ее неспособной к амплификации ПЦР. Из-за химической структуры PMA, он не может проникать через мембраны бактериальных клеток. Таким образом, ДНК в жизнеспособных клетках (с интактной клеточной мембраной) защищена от PMA, в то время как ДНК из мертвых клеток (с поврежденной клеточной мембраной) связывается с PMA и неспособна к амплификации ПЦР (Fittipaldi M., Nocker A., Codony F. 2012. Progress in understanding preferential detection of live cells using viability dyes in combination with DNA amplification. J Microbiol Methods. 91(2): 276-89.). Во второй части этого способа используют количественную ПЦР (qПЦР). Количественная ПЦР представляет собой независимый от культивирования анализ, позволяющий определение количества организмов в образце на основании количества детектированных копий гена. Праймеры можно разрабатывать или выбирать для амплификации конкретной области конкретного гена.
Предусматривают, что для анализа продукта для терапии для восстановления микробиоты, праймеры можно выбирать и/или разрабатывать для амплификации области V3 гена 16s рРНК gene. Эта область выбрана, поскольку она представляет собой гипервариабельную область, фланкированную высоко консервативными последовательностями и имеет подходящую длину последовательности для PMA-qПЦР. В некоторых случаях, праймер может представлять собой разработанный на заказ JE 341F (прямой смысловой праймер), и/или можно использовать V3-R1 (стандартный обратный антисмысловой праймер), как показано в таблице 1 ниже. Они являются только примерами.
Таблица 1. Последовательности праймеров
Другие праймеры можно выбирать и/или разрабатывать для амплификации области V3 гена 16s рРНК. Кроме того, предусматривают, что другие праймеры можно выбирать и/или разрабатывать для амплификации других областей и/или генов, как желательно. Эти праймеры (JE 341F и/или V3-R1) могут иметь частоту перекрывания 95,55% для всех прокариот (программа Ribosomal Project Probe Match Program (RDP)). Это означает, что они способны амплифицировать область V3 гена 16s рРНК для 95,55% из всех прокариот. Таким образом, «общее» количество, или 100% бактерий в образце может не быть детектировано для каждого переработанного образца.
Фигура 4 представляет собой блок-схему, изображающую иллюстративный способ 300 для определения количества жизнеспособных микроорганизмов в лекарственной субстанции для MRT с использованием PMATM-qПЦР. Предусматривают, что способ может являться одинаковым для лекарственной субстанции для MRT, подготовленной для доставки посредством клистирной трубки или посредством клизмы, или гастроназальной трубки. Лекарственную субстанцию для MRT можно получать и подготавливать 302. В некоторых случаях, минимум 200 микролитров (мкл) лекарственной субстанции для MRT может потребоваться для проведения анализа. Предусматривают, что лекарственную субстанцию для MRT можно хранить при -80 (-10/+20)°C до проведения анализа. Однако, охлаждение может не является необходимым для всех образцов. Для подготовки лекарственной субстанции для MRT для тестирования, лекарственную субстанцию для MRT можно разводить с кратностью 100. Например, 9,9 миллилитров (мл) солевого раствора (0,9%) можно добавлять к 100 мкл лекарственной субстанции для MRT. Разведенную лекарственную субстанцию для MRT, которую можно смешивать таким же образом, как положительный контроль, можно помещать в пробирку для центрифугирования. В некоторых случаях, приблизительно 500 мкл разведенной лекарственной субстанции для MRT (далее в настоящем описании обозначено как «тестовый образец») можно помещать в 1,5 мл пробирку для микроцентрифугирования. Один или множество тестов можно проводить с использованием лекарственной субстанции для MRT, когда доступен дополнительный объем. Одну или множество лекарственных субстанций для MRT можно подготавливать в уникальных, отдельных пробирках для микроцентрифугирования для переработки.
Контрольные образцы также можно подготавливать 304. Предусматривают, что как положительный контроль, так и отрицательный контроль, можно использовать для целей сравнения. Положительный контроль может состоять из эталонного стандарта продукта (PRS), который может включать лекарственную субстанцию для MRT, сохраняемую для тестирования качества. В некоторых случаях, положительные контрольные образцы и отрицательные контрольные образцы можно хранить при -80 (-10/+20)°C. Контрольные образцы можно извлекать из морозильника и размораживать при комнатной температуре в течение приблизительно 15-30 минут, хотя предусмотрены другие периоды времени, менее 15 минут или более 30 минут. Положительный контрольный образец моно разводить с кратностью пять солевым раствором (0,9%). Отрицательный контроль можно не разводить солевым раствором, хотя кратность разведения в солевом растворе ниже или выше пяти можно использовать. Например, 400 мкл солевого раствора можно добавлять к 100 мкл положительного контроля. В некоторых вариантах осуществления, солевой раствор можно помещать в 1,5 мл пробирку для микроцентрифугирования, и добавлять положительный контроль в пробирку для микроцентрифугирования. Это является только примером. Предусматривают, что положительный контроль можно помещать в 1,5 мл пробирку для микроцентрифугирования, и затем добавлять солевой раствор в пробирку для микроцентрифугирования. Пробирку для микроцентрифугирования можно кратко вращать или встряхивать (либо вручную, либо механически) для смешивания солевого раствора и положительного контроля.
После перемешивания тестовых образцов и контрольных образцов, тестовые образцы и контрольные образцы можно обрабатывать PMA, как показано в 306. 1,25 мкл 20 миллимолярного (мМ) исходного раствора PMA можно добавлять к аликвотам по 500 мкл тестовых образцов, положительных контрольных образцов и отрицательных контрольных образцов. Для получения 20 мМ исходного раствора красителя PMA, 1 миллиграмм (мг) красителя PMA можно растворять в 98 мкл стерильного раствора. Исходный раствор PMA может являться стабильным при -20°C в течение приблизительно 6 месяцев. Может являться желательным хранить исходный раствор PMA в устойчивом к УФ контейнеру, или иным образом защищать исходный раствор PMA от света. Исходный раствор PMA можно кратко центрифугировать перед использованием для сбора раствора на дне флакона, хотя это не является обязательным.
Каждую из пробирок для микроцентрифугирования можно переворачивать пять раз для смешивания исходного раствора PMA с образцами. Это является только примером. Пробирки для микроцентрифугирования можно переворачивать любое желательное количество раз или перемешивать другим способом, таким как, но без ограничения, вращение. В ходе процедуры перемешивания, может являться желательным минимизировать воздействие света на краситель PMA. Тестовые образцы и контрольные образцы можно инкубировать в темноте в течение приблизительно 6 минут±1 минута. Каждый из тестовых образцов и контрольных образцов можно переворачивать два раза приблизительно через 2 минуты в ходе периода инкубации и через 4 минуты в ходе периода инкубации.
После завершения периода инкубации, по 100 мкл из каждого тестового и контрольного образца можно добавлять в три индивидуальные лунки, всего по 300 мкл на образец, в закрытый крышкой 96-луночный планшет с V-образным дном, который можно помечать уникальной меткой для сохранения возможности отслеживания образцов. Множество образцов можно включать в 96-луночные планшеты в индивидуальные, уникальные лунки. Предусматривают, что планшеты другой формы, и/или другого размера (например, с менее, чем или более, чем 96 лунками) также можно использовать. Затем крышку можно снимать с планшета, и помещать планшет в свет светоизлучающего диода (LED) всего на 10 минут±1 минуту. В некоторых случаях, свет LED может представлять собой рабочее освещение LED 1720 люмен. Однако, можно использовать другие режимы света LED. Верх планшета можно располагать приблизительно в 2,5 сантиметрах (см) ±0,5 см от поверхности источника света. После приблизительно 5 минут воздействия света±0,5 минут, планшет можно убирать из-под источника света. Образцы можно перемешивать посредством пипетирования вверх и вниз пять раз с использованием многоканальной пипетки. Предусматривают, что образцы можно перемешивать с использованием других способов или посредством пипетирования вверх и вниз любое количество раз (например, менее, чем или более, чем пять). Может являться желательным устанавливать объем пипетки приблизительно на 70 мкл для уменьшения или исключения образования пузырей. Планшет можно помещать обратно под свет и подвергать воздействию света в течение следующих 5 минут±0,5 минут.
После подвергания тестовых образцов и контрольных образцов воздействию света LED, можно начинать выделение ДНК, как показано в 308. Тестовые и контрольные образцы можно центрифугировать в 96-луночном планшете при 2100 g в течение приблизительно 5 минут±1 минута. Количество об./мин, необходимое для достижения желательного ускорения, может зависеть от радиуса центрифуги. После центрифугирования, супернатант можно осторожно удалять с использованием многоканальной пипетки, чтобы избегать затрагивания осадка на дне пробирки для центрифугирования. Каждый из осадков затем можно ресуспендировать в 100 мкл фосфатно-солевого буфера (PBS). Каждый из осадков можно смешивать с буфером PBS посредством пипетирования вверх и вниз пять раз с использованием многоканальной пипетки. Предусматривают, что образцы можно перемешивать с использованием других способов или посредством пипетирования вверх и вниз любое количество раз (например, менее, чем или более, чем пять). Ресуспендированные тестовые и контрольные образцы можно центрифугировать при 2100 g в течение приблизительно 5 минут±1 минута. После центрифугирования, супернатант можно осторожно удалять с использованием многоканальной пипетки, чтобы избегать затрагивания осадка на дне пробирки для центрифугирования. Каждый из осадков затем можно ресуспендировать в 50 мкл реагента для подготовки образцов PrepMan® Ultra, доступного из Thermo Fisher Scientific. Каждый из осадков можно смешивать с реагентом для подготовки образцов PrepMan® Ultra посредством пипетирования вверх и вниз двенадцать раз с использованием многоканальной пипетки. Предусматривают, что образцы можно перемешивать с использованием других способов или посредством пипетирования вверх и вниз любое количество раз (например, менее, чем или более, чем двенадцать). Тестовые образцы и контрольные образцы (смешанные с реагентом для подготовки образцов PrepMan® Ultra) можно затем переносить из 96-луночного планшета с V-образным дном во второй 96-луночный планшет высокого профиля с полуюбкой для ПЦР.
Планшет, содержащий тестовые образцы и контрольные образцы, можно помещать в морозильник на -80°C приблизительно на 5-30 минут. Планшет можно извлекать и помещать в термальный циклер (также известный как термоциклер, устройство для ПЦР или амплификатор ДНК). Термоциклер можно программировать для выполнения программы или протокола, которые нагревают образцы при 95°C в течение 3 минут±0,5 минут и затем охлаждают до 4°C в течение 30 секунд±10 секунд. После тепловых циклов, образцы можно переносить в 96-луночный планшет с V-образным дном и центрифугировать при 2100 g в течение приблизительно 5 минут±1 минута. После центрифугирования, приблизительно 30 мкл супернатанта можно осторожно отбирать с использованием многоканальной пипетки, чтобы избегать затрагивания осадка на дне планшета. Затем 30 мкл супернатанта можно помещать в чистый 96-луночный планшет. Эти аликвоты 30 мкл представляют собой образцы ДНК (как тестовые образцы, так и контрольные образцы), которые можно анализировать. Предусматривают, что в этой точке, супернатант можно хранить в морозильнике при приблизительно -20 °C. Затем образцы ДНК можно разводить с кратностью 50 в ультрачистой воде. Если образцы ДНК ранее были заморожены, их следует разморозить перед разведением. В одном варианте осуществления, 196 мкл воды квалификации для молекулярной биологии можно помещать в каждую лунку стерильного 96-луночного планшета. Планшет для ПЦР с V-образным дном или сходный можно использовать для содержания образцов. По 4 мкл из каждого из образцов ДНК по 30 мкл можно добавлять в 196 мкл воды квалификации для молекулярной биологии, всего до 200 мкл в каждой лунке.
После разведения, образцы ДНК можно подготавливать для реакции qПЦР, как показано в 310. Стандарт для qПЦР, такой как дегидратированная ДНК G-Block, регидратированная в буфере Трис-ЭДТА (TE) в разведении 1:10 или эквивалентный, можно подготавливать и анализировать вместе с тестовыми образцами для MRT (например, неизвестными) для получения стандартной кривой. Стандартная кривая может позволять определение количества копий гена для каждого неизвестного образца. Предусматривают, что стандартные разведения могут составлять 10-5, 10-6, 10-7, 10-8 и 10-9.
Реакционную смесь для qПЦР можно предоставлять в каждой индивидуальной лунке/пробирке планшета для ПЦР в дополнение к матрице (например, стандартным разведениям, положительному контролю, отрицательному контролю или тестовому образцу для MRT). Следует отметить, что только одну отдельную матрицу помещают в каждую индивидуальную лунку. Реакционная смесь для qПЦР может включать реагенты и объемы (на пробирку), перечисленные в таблице 2 ниже.
Таблица 2. Готовая реакционная смесь для qПЦР (на лунку)
Для получения готовой реакционной смеси для qПЦР, умножают количество лунок для qПЦР, необходимых для проведения qПЦР, на каждый из объемов, перечисленных в таблице 2, и добавляют эти объемы в 1,5 мл пробирку для микроцентрифугирования. В некоторых случаях, может являться желательным добавлять дополнительное количество каждого реагента, например, приблизительно дополнительно 5%, чтобы позволять возможные потери при переносе. Например, если необходимо использовать 50 лунок, необходимо 500 мкл готовой реакционной смеси SsoAdvanced™ Universal Inhibitor-Tolerant SYBR® Green Supermix (например, 50 лунок умножают на 10 мкл на лунку). Чтобы позволять возможные потери при переносе, можно добавлять 25 мкл (например, приблизительно 5%), всего до 525 мкл. Предусматривают, что менее, чем 5% или более, чем 5% можно добавлять к необходимым объемам, чтобы позволять возможные потери при переносе, как желательно. Реагенты, показанные в таблице 2, можно добавлять в пробирку для центрифугирования в следующем порядке: H2O квалификации для молекулярной биологии, праймер 1, праймер 2, SsoAdvanced™ Universal Inhibitor-Tolerant SYBR® Green Supermix. Кратко встряхивают для перемешивания. Предусматривают, что содержимое пробирки для центрифугирования можно перемешивать вручную или механически, как желательно.
15 мкл готовой реакционной смеси для qПЦР можно добавлять в каждую лунку 96-луночного планшета для qПЦР, который используют для процедуры qПЦР. Предусматривают, что можно использовать любое количество лунок, в зависимости от количества тестовых образцов для MRT, контрольных образцов и/или стандартных разведений, подлежащих тестированию. Например, можно использовать все 96 лунок или менее, чем 96 лунок. Готовую реакционную смесь для qПЦР следует добавлять только в то количество лунок, которое будет включать тестовый образец, контрольный образец и/или стандартное разведение. В некоторых случаях, по меньшей мере 3 лунки могут включать образцы для контроля без матрицы (NTC). Эти образцы могут не включать каких-либо колониеобразующих единиц (КОЕ). 5 мкл воды квалификации для молекулярной биологии можно добавлять в лунки для образцов, обозначенных как NTC. После добавления воды квалификации для молекулярной биологии, лунки с образцами NTC можно накрывать для предотвращения или минимизации загрязнения. 5 мкл серий стандартного разведения, положительного контроля, отрицательного контроля и/или тестовых образцов можно добавлять в обозначенные лунки. В некоторых случаях, можно предоставлять шаблон для иллюстрации, где тестовые образцы (неизвестные), положительный контроль, отрицательный контроль, NTC и стандарты следует помещать в планшет для qПЦР. После добавления матриц в готовую реакционную смесь для qПЦР, планшет можно герметично закрывать. В некоторых случаях, пленка для герметизации может представлять собой пленку Bio-Rad Microseal® «B», хотя это не является обязательным. Планшет для qПЦР можно затем центрифугировать в течение приблизительно одной минуты при приблизительно 2100 об./мин, чтобы убедиться, что каждая из реакционных смесей для qПЦР находится на дне пробирки. Количество об./мин может меняться в зависимости от размера используемой центрифуги.
После центрифугирования, планшет для qПЦР можно помещать в систему для детекции qПЦР. В некоторых случаях, система для детекции может представлять собой систему для детекции ПЦР в реальном времени BIO-RAD CFX96 Touch™ Deep Well, хотя можно использовать также другие системы для детекции в реальном времени. Систему для детекции qПЦР можно запрограммировать для выполнения следующего протокола термоциклера, описанного в таблице 3 ниже.
Таблица 3. Параметры термоциклера
Стадии 2 и 3 можно повторять 39 раз, всего до 40 циклов денатурации/гибридизации. В ходе стадии гибридизации, можно регистрировать интенсивность флуоресценции или интенсивность проявления адгезии красителя PMA к подвергнутой воздействию бактериальной ДНК. После завершения qПЦР, общее количество КОЕ/мл для каждого тестового образца для MRT можно определять, как показано в 312, с использованием следующего уравнения:

где фон образца, который можно определять с использованием известного соотношения живых/мертвых организмов, таких как E. coli, или эталонного стандарта продукта, представляет собой среднее фоновое количество копий гена до трансформации КОЕ, тестовый образец представляет собой выходное значение количества копий гена из системы детекции на основании стандартной кривой, фактор разведения составляет 5,0×105, и среднее количество копий гена 16s на КОЕ составляет 5. КОЕ/мл для образца можно рассчитывать посредством компьютерной программы, или оператор может рассчитывать вручную. Предусматривают, что множество тестовых образцов можно отбирать для каждой донации и/или продукта для MRT. КОЕ/мл для каждого из этих образцов можно усреднять для определения среднего количества КОЕ/мл для донации и/или продукта MRT.
Для обеспечения точных результатов, может являться желательным подтверждение определенных критериев приемлемости для пригодности системы, как показано в 314. Например, может являться необходимым соответствие следующим критериям, или результаты могут быть признаны недействительными:
Соотношение среднего необработанного количества копий гена для положительного контроля к среднему необработанному количеству копий гена для отрицательного контроля должно составлять > 1500:1.
Средний пороговый цикл для отрицательного контроля (Cq) должен находиться в пределах +/- 5 Cq от среднего значения CqдляNTC.
КОЕ/мл для положительного контроля должно составлять +/- 1 log от известной концентрации КОЕ/мл, как определено по рассеву на среды с агаром
Стандартная кривая для qПЦР должна иметь величину r2 > 0,97.
Стандартная кривая для qПЦР должна иметь величину E в диапазоне 100±15%.
Среднее значение Cq для NTC должно составлять > 31,00. Среднее значение Cq для NTC должно составлять > 2 значений Cq от любого среднего значения Cq для неизвестного образца, чтобы поддерживать количественную оценку неизвестного образца.
В некоторых случаях, проведение qПЦР можно повторять, в то время как в других случаях, весь способ 300 может быть необходимо повторить.
Следует понимать, что это описание является, во многих отношениях, только иллюстративным. Можно вносить изменения в детали, в частности, в вопросах формы, размера и аранжировки стадий, без отклонения от объема описания. Объем изобретения, разумеется, определен в формулировках, в которых выражена прилагаемая формула изобретения.
Реферат
Изобретение относится к области биотехнологии и молекулярной биологии. Предложен способ количественной оценки жизнеспособных бактерий в лекарственной субстанции для терапии для восстановления микробиоты (MRT), на основе количественной полимеразной цепной реакции (qПЦР). Изобретение можно использовать для количественной оценки жизнеспособных бактерий в медицине. 14 з.п. ф-лы, 4 ил., 3 табл.
Формула


Комментарии