Гетероциклические ингибиторы гликоген-синтазы киназы gsk-3 - RU2294931C2
Код документа: RU2294931C2
Описание
Область изобретения
Настоящее изобретение относится к ингибиторам ферментов и, более конкретно, к гетероциклическим ингибиторам гликоген-синтазы киназы 3β, GSK-3.
Основания изобретения
Болезнь Альцгеймера (AD) представляет собой нейродегенеративный процесс, характеризующийся расстройствами сознания, связанными с прогрессирующим ухудшением холинергической функции и нейропатологическими поражениями, такими как старческие бляшки, образованные фибриллярным β-амилоидом, и нейрофибриллярные сплетения, пучки спаренных спиральных волокон.
Вообще говоря, AD ограничена группой старше 60 лет или более и является наиболее распространенной причиной слабоумия у старшей группы населения. Сегодня AD поражено 23 миллиона человек во всем мире. Поскольку долгожительство возрастает, существует оценка, что к 2050 году число случаев AD может возрасти более чем втрое [Amaduci, L.; Fratiglioni, L., "Epidemiology of AD: Impact on the treatment", in Alzheimer Disease: Therapeutic Strategies, E.Giacobini and R.Becker, Eds., Birhäuser, EEUU, 1994, p.8].
В мозгу больных AD наблюдаются два основных гистологических нарушения, связанных с потерей нейронов: нейрофибриллярные сплетения и старческие бляшки на внутриклеточном и внеклеточном уровнях, соответственно ["Alzheimer Disease: From molecular biology to therapy", E.Giacobini and R.Becker, Eds., Birhäuser, EEUU, 1996].
Нейрофибриллярные сплетения представляют собой структуры, образованные спаренными спиральными волокнами (PHFs). Они состоят, главным образом, из протеина, ассоциированного с микротрубочками (MAP) тау в аномальном гиперфосфорилированном состоянии [Grundke-Iqbal, I.; Iqbal, K.; Tung, Y.C.; Quinlan, M.; Wisniewski, H.M.; Binder, L.I., "Abnormal phosphorylation of the microtubule-associated protein tau in Alzheimer cytoskeletal pathology", Proc. Natl. Acad. Sci. USA, 1986, 83, 4913-4917; Grundke-Iqbal, I.; Iqbal, K.; Quinlan, M.; Tung, Y.C.; Zaidi, M.S.; Wisniewski, H.M., "Microtubule-associated protein tau. A component of the Alzheimer paired helical filaments", J. Biol. Chem., 1986, 261, 6084-6089; Greenberg, S.G.; Davies, P.; Schein, J.D.; Binder, L.L., "Hydrofluoric acid-treated tau PHF proteins display the same biochemical properties as normal tau", J. Biol. Chem., 1992, 267, 564-569]. Такое отклоняющееся от нормы фосфорилирование тау, определяемое действиями различных протеинкиназ и фосфатаз, по-видимому, согласуется с его способностью связывать и стабилизировать микротрубочки, и это может вносить вклад в патологию AD [Moreno, F.J.; Medina, M.; Perez, M.; Montejo de Garcini, E.; Avila, J., "Glycogen sintase kinase 3 phosphorylation of different residues in the presence of different factors: Analysis of tau protein", FEBS Lett., 1995, 372, 65-68]. Таким образом, блокада такой стадии гиперфосфорилирования может быть основной мишенью, в которой можно прервать патогенный каскад. Селективные ингибиторы тау киназ могут оказаться новыми эффективными лекарствами для лечения AD.
Поиск ингибиторов тау киназ является очень интересной областью. Тау может быть фосфорилировано несколькими пролиннаправленными протеинкиназами (PDKs) и не-PDKs. Однако при AD точная роль каждой из этих киназ в аномальном гиперфосфорилировании тау еще не понята, и на сегодня не найден способ регулирования активности этих киназ. Нет сомнения в том, что гликогенсинтаза киназа (GSK-3β) является in vivo тау-киназой в мозге [Lovestone, S.; Hartley, C.L.; Pearce, J.; Anderton, B.H., "Phosphorylation of tau by glycogen syntase-3 in intact mammalian cells: the effect on the organization and stability of microtubules", Neuroscience, 1996, 73, 1145-1157; Wagner, U.; Utton, M.; Gallo, J.M.; Miller, C.C., "Cellular phosphorylation of tau by GSK-3β influences tau binding to microtubules and microtubule organisation", J. Cell. Sci., 1996, 109, 1537-1543; Ledesma, M.; Moreno, F.J.; Perez, M.M.; Avila, J., "Binding of apolipoprotein E3 to tau protein: effects on tau glycation, tau phosphorylation and tau-microtubule binding, in vitro", Alzheimer Res., 1996, 2, 85-88]. Эти заключения открыли возможность для использования ингибиторов GSK-3β в качестве терапевтических агентов при лечении AD. На данный момент известно только несколько соединений с таким свойством ингибирования ферментов. Литий ведет себя как специфичный ингибитор семейства GSK-3β in vitro и в интактных клетках [Muñoz-Montaño, J.R.; Moreno, F.J.; Avila, J.; Diaz-Nido, J., "Lithium inhibits Alzheimer's disease-like tau protein phosphorylation in neurons", FEBS Lett., 1997, 411, 183-188].
Наконец, обнаружено, что инсулин инактивирует GSK-3β, и показано, что при активации данного фермента развивается инсулинонезависимый сахарный диабет. Таким образом, ингибиторы GSK-3β должны стать новым лекарством для инсулинонезависимого сахарного диабета.
Заявители обнаружили новое семейство малых синтетических гетероциклических молекул с GSK-3β ингибирующими свойствами при микромолярных концентрациях.
Описание изобретения
Изобретение направлено на соединения, представленные общей формулой I:
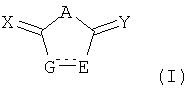
где:
A представляет -C(R1)2-, -O-, или -NR1-;
E представляет -NR1- или -CR1R2-, и заместитель R2 отсутствует, если

G представляет -S-, -NR1- или -CR1R2-, и заместитель R2 отсутствует, если


R1 и R2 независимо выбирают из водорода, алкила, циклоалкила, галогеноалкила, арила, (Z)n-арила, гетероарила, -OR3, -C(O)R3, -C(O)OR3, -(Z)n-C(O)OR3 и -S(O)t, или, как указано, R2 может быть таким, что затем E и G образуют конденсированную арильную группу;
Z независимо выбирают из -C(R3 )(R4)-, -C(O)-, -О-, -C(=NR3)-, -S(O)t-, -N(R3)-;
n имеет значения ноль, один или два;
t имеет значения ноль, один или два;
R3 и R4 независимо выбирают из водорода, алкила, арила и гетероцикла; и
X и Y независимо выбирают из =O, =S, =N(R3) и =C(R1 )(R2).
Подробное описание изобретения
Следующие термины, которые использованы в данном описании и прилагаемой формуле изобретения, имеют, если не указано иное, указанные значения:
"Алкил" относится к углеводородным радикалам с прямой или разветвленной цепью, состоящим из атомов углерода и водорода, не содержащим ненасыщенности, имеющим от одного до восьми атомов углерода, которые присоединены к остальной молекуле одинарной связью, например, к метилу, этилу, н-пропилу, изопропилу, н-бутилу, трет-бутилу, н-пентилу, и т.д. Алкильные радикалы могут быть, необязательно, замещены одним или несколькими заместителями, независимо выбранными из группы, состоящей из галогена, гидрокси, алкокси, карбокси, циано, карбонила, ацила, алкоксикарбонила, амино, нитро, меркапто и алкилтио.
"Алкокси" относится к радикалу формулы -ORa, где Ra представляет алкильный радикал, как он определен выше, например к метокси, этокси, пропокси и т.д.
"Алкоксикарбонил" относится к радикалу формулы -C(O)ORa, где Ra представляет алкильный радикал, как он определен выше, например к метоксикарбонилу, этоксикарбонилу, пропоксикарбонилу и т.д.
"Алкилтио" относится к радикалу формулы -SRa, где Ra представляет алкильный радикал, как он определен выше, например к метилтио, этилтио, пропилтио и т.д.
"Амино" относится к радикалу формулы -NH2.
"Арил" относится к фенильному или нафтильному радикалу, предпочтительно к фенильному радикалу. Арильный радикал может быть, необязательно, замещен одним или несколькими заместителями, выбранными из группы, состоящей из гидрокси, меркапто, галогена, алкила, фенила, алкокси, галогеноалкила, нитро, циано, диалкиламино, аминоалкила, ацила и алкоксикарбонила, как они определены здесь.
"Аралкил" относится к арильной группе, присоединенной к алкильной группе. Предпочтительные примеры включают бензил и фенетил.
"Ацил" относится к радикалу формул -C(O)-Rc и -C(O)-Rd, где Rc представляет алкильный радикал, как он определен выше, а Rd представляет арильный радикал, как он определен выше, например к ацетилу, пропионилу, бензоилу и т.п.
"Ароилалкил" относится к алкильной группе, замещенной -C(O)-Rd. Предпочтительные примеры включают бензоилметил.
"Карбокси" относится к радикалу формулы -С(О)ОН.
"Циано" относится к радикалу формулы -CN.
"Циклоалкил" относится к стабильному 3-10-членному моноциклическому или бициклическому радикалу, который является насыщенным или частично насыщенным и который состоит только из атомов углерода и водорода. Если иное не указано особо в описании, подразумевается, что термин "циклоалкил", включает циклоалкильные радикалы, которые, необязательно, замещены одним или несколькими заместителями, независимо выбранными из группы, состоящей из алкила, галогена, гидрокси, амино, циано, нитро, алкокси, карбокси и алкоксикарбонила.
"Конденсированный арил" относится к арильной группе, в особенности, к фенильной или герероарильной группе, конденсированной с пятичленным кольцом.
"Галогено" относится к бромо, хлоро, йодо или фторо.
"Галогеноалкил" относится к алкильному радикалу, как он определен выше, который замещен одним или несколькими группами галогена, как они определены выше, например к трифторметилу, трихлорметилу, 2,2, 2-трифторэтилу, 1-фторметил-2-фторэтилу и т.п.
"Гетероцикл" относится к гетероциклическому радикалу. Гетероцикл относится к стабильному 3-15-членному кольцу, которое состоит из атомов углерода и из 1-5 гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, предпочтительно, к 4-8-членному кольцу с одним или несколькими гетероатомами, более предпочтительно, к 5-6-членному кольцу с одним или несколькими гетероатомами. Для целей данного изобретения гетероцикл может быть моноциклической, бициклической или трициклической кольцевой системой, которая может включать конденсированные кольцевые системы; атом азота, углерода или серы в гетероциклическом радикале может быть, необязательно, окисленным, атом азота может быть, необязательно, кватернизированным; гетероциклический радикал может быть частично или полностью насыщенным или ароматическим. Примеры таких гетероциклов включают, но не ограничиваются этим, азепины, бензимидазол, бензотиазол, фуран, изотиазол, имидазол, индол, пиперидин, пиперазин, пурин, хинолоин, тиадиазол, тетрагидрофуран. Гетероцикл может быть, необязательно, замещен R3 или R4, как они определены выше в кратком описании изобретения.
"Гетероарил" относится к ароматическому гетероциклу.
"Меркапто" относится к радикалу формулы -SH.
"Нитро" относится к радикалу формулы -NO2.
Изобретение, в частности, направлено на ферментативную активность соединений общей формулы I в отношении киназ.
А предпочтительно выбирают из -C(R1)2- и -NR1-.
Предпочтительно R1 выбирают из водорода, алкила, циклоалкила, арила (необязательно замещенного группой, выбранной из алкила, галогена и алкокси), -С(R3)(R4)-арила (причем арильная часть необязательно замещена группой, выбранной из алкила, галогена и алкокси), -OR3, -C(O)OR3 и -С(R3)(R4)-C(O)OR3, и R3 и R4 независимо выбирают из водорода и алкила.
Число групп n предпочтительно равно нулю или единице, и n может быть выбрано в соответствии с известной химией возможных группировок.
X и Y предпочтительно представляют кислород или серу, по меньшей мере один из X и Y представляет кислород.
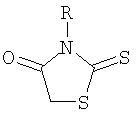
Особо предпочтительным классом соединений являются соединения формулы (II):

где Ra и Rb независимо выбирают из водорода, алкила, циклоалкила, галогеноалкила, арила, (Z)n-арила, гетероарила, -OR3, -C(O)R3, -C(O)OR3, -(Z)n-C(O)OR3, и -S(O)t, и Z, n, t, R3, R4, X и Y таковы, как они определены выше.
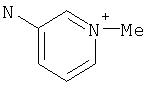
В формуле (II) X и Y предпочтительно выбирают из кислорода, серы и -NR3-, где R3 представляет гетероцикл, в частности, 6-членный гетероцикл, имеющий один гетероатом, который представляет собой азот, являющийся, необязательно, ароматическим и, необязательно, окисленным или квартернизированным. Более предпочтительно и X, и Y представляют собой кислород.
Предпочтительно Ra и Rb независимо выбирают из водорода, алкила, циклоалкила, арила (необязательно замещенного группой, выбранной из алкила, галогена и алкокси), -С(R3)(R4)-арила (причем арильная часть необязательно замещена группой, выбранной из алкила, галогена и алкокси), -OR3, -C(O)OR3 и -С(R3)(R4)-C(O)OR3, и R3 и R4 независимо выбирают из водорода, алкила и гетероциклов.
Более предпочтительно Ra и Rb независимо выбирают из алкила, арила (необязательно замещенного группой, выбранной из алкила, галогена и алкокси), -СН2-арила (причем арильная часть необязательно замещена группой, выбранной из алкила, галогена и алкокси) и -СН2-C(O)OR3, и R3 представляет водород или алкил.
Еще более предпочтительно Ra и Rb независимо выбирают из метила, этила, пропила, бензила, фенила (необязательно замещенного группой, выбранной из метила, фторо, хлоро, бромо и метокси) и -СН2-C(O)-O-этила.
Наиболее предпочтительные соединения формулы (II) перечислены ниже в таблице 1.
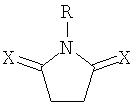
Другим предпочтительным классом соединений по изобретению являются соединения формулы (III):
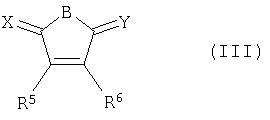
в которой:
B представляет -NR7- или C(R7)(R8)- (где R7 и R8 независимо выбирают из водорода, алкила, арила, -CH2-W-арила и -W-CO2H, и W представляет простую связь, CH2 или CO);
R5 и R6 независимо выбирают из водорода, алкила, арила и -CH2-арила; и
X и Y независимо выбирают из =O и =S.
В формуле (III) B предпочтительно представляет -NR7-, где R7 выбирают из водорода, алкила и -CH2-арила, в особенности из водорода, метила или бензила.
R5 и R6 предпочтительно представляют водород.
X и Y предпочтительно представляют кислород.
Наиболее предпочтительные соединения формулы (III) перечислены ниже в таблице 2.
Примеры дополнительных классов соединений формулы I включают те соединения, в которых:
a) A представляет -CH2-; E представляет -CR1R2-, предпочтительно -CH2-; G представляет -CR1R2-, предпочтительно -CH2-;
b) A представляет -CH2-; E представляет -CR1-, предпочтительно -CH-; G представляет -CR1-, предпочтительно -CH-; и

c) A представляет -O-; E представляет -CR1-, предпочтительно -CH-; G представляет -CR1-, предпочтительно -CH-; и -- представляет вторую связь между G и E;
d) A представляет -NR1-, где R1, предпочтительно, представляет водород, алкил или аралкил; E представляет -CR1-, предпочтительно -CH-; G представляет -CR1-, предпочтительно -CH-; и

е) A представляет -NR1 -, где R1, предпочтительно, представляет водород или аралкил; E представляет -CR1R2-, предпочтительно -CH2-; G представляет -CR1R2-, предпочтительно -CH2-;
f) A представляет -NR1-, где R1, предпочтительно, представляет водород или аралкил; E представляет -CR1-; G представляет -CR1-;

g) A представляет -NR1-, где R1, предпочтительно, представляет водород, алкил, карбоксиалкил, ароилалкил или аралкил; Е представляет -S; G представляет C(R1)2 -, предпочтительно, -СН2-;
h) A представляет -NR1-, где R1, предпочтительно, представляет арил; Е представляет -NR1-, где R1, предпочтительно, представляет водород или алкил; G представляет -NR1-, где R1, предпочтительно, представляет водород или алкил.
В данных классах соединений X и Y, предпочтительно, оба представляют О, хотя для класса g) X может представлять О, а Y может быть S. Когда E вместе с G образуют конденсированную фенильную группу, получающиеся соединения являются производными фталимида.
Синтез соединений по изобретению
Соединения по изобретению могут быть синтезированы по доступным методикам.
Для предпочтительных соединений формулы (II) общая методика описана в [Martinez, A.; Castro, A.; Cardelus, I.; Llenas, J.; Palacios, J.M., Bioorg. Med. Chem., 1997, 5, 1275-1283].
Конкретно, соединения общей формулы (II), собранные в таблице 1, готовили, следуя процедуре синтеза, представленной на схеме 1, и используя способность N-алкил-S-[N'-хлоркарбамоил)амино]изотиокарбамоилхлоридов реагировать с различными алкилизоцианатами. Хлорирование изотиоцианатов осуществляли добавлением эквимолярного количества хлора к гексановому раствору упомянутого изотиоцианата при -15°С. Реакция образовавшегося иминохлоралкилсульфенилхлорида с алкил- или арилизоцианатом в атмосфере инертного газа и последующий гидролиз дают тиадиазолидиндионы, описанные в таблице 1.

Схема 1
Типичные соединения по настоящему изобретению селективно ингибируют GSK-3β, не ингибируя другие протеинкиназы, такие как PKA, PKC, CK-2 и Cdk2, что позволяет избежать широко распространенные побочные эффекты. GSK-3β участвует в этиопатогенезе AD и является ответственной за аномальное гиперфосфорилирование тау протеина. Раскрытые здесь селективные ингибиторы могут быть полезными терапевтическими агентами при лечении нейродегенеративных заболеваний, связанных с патологией тау протеина, в особенности при AD, что составляет часть данного изобретения. Ингибирующее действие этих соединений против GSK-3β ведет к разработке лекарств, способных остановить образование нейрофибриллярных сплетений, один из характерных признаков, присутствующих в данном нейродегенеративном процессе.
Данные соединения могут быть полезными при лечении других патологий, в которые вовлечена GSK-3β, таких как инсулиннезависимый сахарный диабет.
Дополнительно, данные соединения могут быть использованы при лечении гиперпролиферативных заболеваний, таких как дисплазии и метаплазии различных тканей, псориаз, артериосклероз, рестеноз и рак, благодаря ингибированию клеточного цикла, которое составляет часть данного изобретения.
Соответственно, настоящее изобретение далее предлагает фармацевтические композиции, включающие соединения по данному изобретению вместе с фармацевтически приемлемым носителем или разбавителем. Подходящие дозировочные формы и мощности доз могут быть разработаны и подобраны в соответствии с обычной практикой.
Примеры
Пример 1. Ингибирование ферментов соединениями по изобретению
Ингибирование GSK-3β: Активность GSK-3β определяли, инкубируя смесь фермента GSK-3β (Sigma), источника фосфата и субстрата GSK-3β в присутствии и в отсутствие соответствующего испытуемого соединения и определяя GSK-3β активность такой смеси.
Конкретно, активность GSK-3β определяли инкубацией фермента при 37°С в течение 20 минут в конечном объеме 12 мкл буфера (50 мМ трис, рН = 7,5, 1 мМ EDTA, 1 мМ EGTA, 1 мМ DTT, 10 мМ MgCl2), дополненного 15 мкМ (конечная концентрация) синтетического пептида GS 1 [Woodget, J.R. "Use of peptides for affinity purification of protein-serine kinases", Anal. Biochem., 1989, 180, 237-241] в качестве субстрата, 15 мкМ АТФ, 0,2 мкСi [γ_32p]АТФ и различными концентрациями испытуемого соединения. Реакцию гасили введением аликвоты реакционной смеси на фосфоцеллюлозные р81 листы. Эти листы трижды промывают 1% фосфорной кислотой и определяют радиоактивность, связанную с GS1 пептидом в жидкостном сцинтилляционном счетчике.
Соединения, показанные в таблице 1, являются представленными соединениями по изобретению, обладающими GSK-3 ингибирующей активностью. Данные ИК50 (концентрация при которой достигают 50% подавления фермента) сведены в таблице 3 ниже.
Ингибирование GSK-3: Эксперименты по ингибированию были проведены также при различных концентрациях АТФ (до 50 мкМ), и во всех случаях были получены такие же значения ИК50. Следовательно, можно предполагать, что тиадиазолиндионы не конкурируют с АТФ в связывании c GSK-3.
Первые четыре соединения были испытаны на ингибирование других ферментов.
Ингибирование протеинкиназы A (PKA): Потенциальное ингибирование данного фермента оценивали путем определения фосфорилирования эстатмина протеинкиназой А (PKA). Эстатмин очищали, следуя методике, описанной Belmont and Mitchinson (Belmont, L.D.; Mitchinson, T.J., "Identification of a protein that interact with tubulin dimers and increase the catastrophe rate of microtubule", Cell, 1996, 84, 623-631).
Конкретно, использовали очищенную PKA (Sigma, каталитическая субъединица из бычьего сердца (p. 2645)) и 10-15 мкг субстрата (эстатмин) в 25 мкл общего объема буферного раствора, содержащего 20 мкМ (γ-32p) АТФ. Протеин cAMP киназы (100 нг/реакцию) готовили в 50 мкл 25 мМ HEPES, pH 7,4, 20 мМ MgCl2, 2 мМ EGTA, 2 мМ дитиотреитола, 0,5 мМ Na3VO4. После того как происходила реакция, добавляли гасящий буфер, реакционную смесь кипятили при 100оС в течение 5 минут, и фосфорилированный протеин характеризовали гель-электрофорезом, определяли количественно авторадиографией.
В этих условиях ни одно из испытанных соединений не проявило какого-либо ингибирования PKA.
Ингибирование протеинкиназы С (PKC): Потенциальное ингибирование данного фермента оценивали путем определения фосфорилирования пептида PANKTPPKSPGEPAK (Woodgett, J.R., "Use of peptides for affinity purification of protein-serine kinases", Anal. Biochem., 1989, 180, 237-241) протеинкиназой С (PKC), используя фосфатидилсерин в качестве стимулирующего агента. Использованная методика была такой же, как описанная выше для GSK-3.
Конкретно, использовали очищенную PKC из мозга крыс, следуя методике, описанной Walsh (Walsh, M.P.; Valentine, K.A.; Nagi, P.K.; Corruthers, C.A.; Hollenberg, M.D., Biochem. J., 1984, 224, 117-127) и 1-10 мМ субстрата в общем объеме 25 мкл адекватного буферного раствора, содержащего 10 мкМ (γ-32p) АТФ.
В этих условиях ни одно из испытанных соединений не проявило какого-либо ингибирования PKC.
Ингибирование казеинкиназы 2 (CK-2): Фосфорилирующую активность данного фермента против эстатмина измеряли, используя очищенную CK-2 из бычьего мозга, следуя методике, описанной Alcazar (Alcazar, A.; Marin, E.; Lopez-Fando, J.; Salina, M., "An improved purification procedure and properties of casein kinase II from brain", Neurochem. Res., 1988, 13, 829-836), с 3,6 мкМ субстрата в общем объеме 25 мкл адекватного буферного раствора, содержащего 20 мкМ (γ-32p) АТФ. Опыты с CK-2 проводили, используя в качестве субстрата эстатмин (см. определение PKA) в 50 мл HEPES, pH 7, 4, 20 мМ MgCl2, 2 мМ EGTA, 2 мМ дитиотретиола, 0,5 мМ Na3VO4. После того как происходила реакция, следовали той же методике, описанной для PKA.
В этих условиях ни одно из испытанных соединений не проявило какого-либо ингибирования CK-2.
Ингибирование циклинзависимой протеинкиназы 2 (Cdc2): Фосфорилирующую активность данного фермента против гистона Н1 измеряли, используя Сdc2 (Calbiochem), следуя методике, описанной Kobayashi (Kobayashi, H.; Stewart, E.; Poon, R.Y.; Hunt, T., "Cyclin A and cyclin B dissociate from p34cdc2 with half-times of 4 and 15 h, respectively, regardless of the phase of cell cycle", J. Biol. Chem., 1994, 269, 29153-29160), с 1 мкг/мкл субстрата в общем объеме 25 мкл адекватного буферного раствора, содержащего 20 мкМ (γ-32p) АТФ. Опыты с Cdc2 проводили c гистоном Н1 в качестве субстрата (см. определение PKA) в 50 мкл буфера pH 7,5, 50 мМ трис-HCl, 10 мМ MgCl2, 1 мМ DTT, 1 мМ EGTA, 100 мкМ АТФ, 0,01% BRIJ-35. После того как происходила реакция, следовали той же методике, описанной для PKA.
В этих условиях ни одно из испытанных соединений не проявило какого-либо ингибирования Cdc2.
Пример 2. Анализ роста аксонов после обработки лекарственным соединением
Клетки выдерживали в среде Дульбеко (DEMEM) с 10% фетальной бычьей сыворотки, глютамином (2 мМ) и антибиотиками. Для анализа потенциального ингибирования GSK-3 in vivo использовали культуры нейробластом мыши N2 A (Garcia-Perez, J.; Avila, J.; Diaz-Nido, J., "Lithium induces morphological differentiation of mouse neuroblastoma", J. Neurol. Res., 1999, 57, 261-270). К этим культурам клеток добавляли испытуемые соединения. Данная клеточная линия имеет особенность экспрессировать определенный вид нейронного фенотипа (удлиненные нейриты) после добавления хлорида лития (10 мМ), известного ингибитора GSK-3. После 2-3 суток культивирования проверяли влияние испытуемых соединений, перечисленных в таблице 1. Были обнаружены удлиненные нейриты в такой же степени, как и при добавлении лития. Данный факт подтверждает ингибирование GSK-3 in vivo соединениями по изобретению.
Пример 3. Блокада клеточного цикла
Параллельно исследовали потенциальное взаимодействие данных соединений с клеточным циклом на клетках N2A. Культуру клеток выдерживали в среде Дульбеко (DEMEM) с 10% фетальной бычьей сыворотки, глутамином (2 мМ) и антибиотиками.
Первые четыре соединения общей формулы I, приведенные в таблице 3, были испытаны в описанных условиях и показали способность ингибировать клеточный цикл при концентрации в интервале от 100 нМ до 1 мкМ. Клеточная блокада начинала проявляться при концентрации между 100 и 200 нМ и была полностью эффективной при 1 мкМ.
Испытанные соединения нетоксичны в стационарной культуре фибробластов MRC-5 после 10 суток непрерывного воздействия ингибиторов.
Пример 4. Ингибирование GSK-3 дополнительными соединениями
Данные по ингибированию GSK-3
Ингибиторы GSK-3: Для соединений, принадлежащих к семейству D, были проведены также эксперименты по ингибированию GSK-3 при различных концентрациях АТФ (до 50 мкМ), и во всех случаях были получены такие же значения ИК50. Следовательно, можно предполагать, что эти соединения не конкурируют с АТФ за связывание c GSK-3.
Пример 5. Блокада клеточного цикла
ИК50 для некоторых соединений, определенные на культурах клеток N2A, собраны в таблице 5 ниже.

"ОПРЕДЕЛЕНИЕ ЦИТОТОКСИЧНОСТИ ЛДГ (LDH)"
Целью эксперимента было определение наличия цитотоксических эффектов в клетках человеческой нейробластомы SH-SY5Y экстракта из морских водорослей или синтетических соединений формулы (II), в частности, путем количественной оценки активности лактатдегидрогеназы ЛДГ (LDH).
Лактатдегидрогеназа (ЛДГ) является стабильным цитоплазматическим ферментом, присутствующим во всех клетках. При разрушении клеточной мембраны он быстро высвобождается в супернатант культуральной среды. Активность ЛДГ определяют ферментативным тестом: на первом этапе NAD* восстанавливается до NADH/H4" путем ЛДГ катализируемой конверсии лактата в пируват. На втором этапе катализатор (диафораза) переносит Н/Н+ от NADH/H* на тетразолиевую соль INT, которая восстанавливается до формазана. Таким образом, количество образующегося красителя в ходе эксперимента пропорционально числу лизировавших клеток. Соль формазана является водорастворимой и имеет широкую полосу абсорбции с максимумом примерно около 500 нм, тогда как тетразолиевая соль INT не демонстрирует существенной абсорбции при данной длине волны.
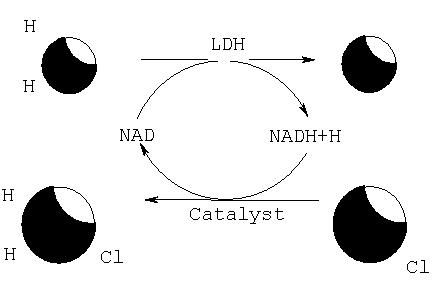
Реагенты:
минимальная эссенциальная среда Игла (MEM), ref: 31095-029 (Gibco)
питательная смесь HAM'S F12, ref: 21765-029 (Gibco)
несущественные аминокислоты, ref: 11140-035 (Gibco)
Пенициллин-стрептомицин, ref: 15140-122 (Gibco)
L-глютамин, ref: 2S030-024 (Gibco)
фетальная телячья сыворотка (FBS), ref: DE14-801F (INNOGENETICS Bio/Whittaker Europe)
Тритон Х-100, ref:1086031000 (WWR International)
Набор для определения цитотоксичности, ref: 1644793 (Roche)
Капельный мультидиспенсер 384 (Thermo Lab Systems)
Цифровой сканирующий планшет-ридер ELISA (ASYS HITECH GmbH)
Исходные растворы:
- Раствор синтетических соединений сохраняют при 4°С или -20°С.
- Набор реагентов Kit 1 (смесь диафораза/NAD*) хранится при -20°С. После восстановления до 1 мл дистиллированной водой хранится при 4°С и сохраняет стабильность в течение нескольких недель.
- Набор реагентов Kit 2 (иодотетразолий хлорид, INT, и лактат натрия) хранят при -20°С. После размораживания хранится при 4°С и сохраняет стабильность в течение нескольких недель.
- Культуральная среда (Hams F12):МЕМ (1:1), 10% FBS, несущественные аминокислоты Ix, L-глутамин Ix и Пенициллин-стрептомицин Ix) хранят при 4°С.
- Тритон Х-100 1% в Krebs-Hepes хранят при комнатной температуре.
МЕТОДИКА:
За два или три дня до начала эксперимента, клетки человеческой нейробластомы SH-SY5Y засевают в 96-луночный микропланшет для культивирования по 104 клеток/лунку.
Среду удаляют и клетки инкубируют с различными испытуемыми образцами соединений при различных концентрациях в течение 24 ч. Синтезированные соединения испытывают при конечной концентрации 10-5, 10-6 и 5×10-8 М, в зависимости от активности, в свежей культуральной среде.
После 24 часов среду удаляют и лизируют клетки, прикрепившиеся ко дну лунки добавлением 50 мкл Krebs-Hepes, Тритон Х-100 1%, в течение 5 минут при комнатной температуре. Для количественной оценки активности лактатдегидрогеназы ЛДГ (LDH) лизат инкубируют в течение 30 минут с 50 мкл реакционной смеси (1:45) набора для определения цитотоксичности, при 15-25°С в защищенном от света месте. ЛДГ (LDH) измеряют по абсорбции 492 нм при стандартной длине волны 620 нм (стандартные длины волн должны превышать 600 нм).
Результаты цитотоксичности, полученные для ряда соединений формулы (II), показали их высокую эффективность.
СВЕДЕНИЯ, КАСАЮЩИЕСЯ ВОЗМОЖНОСТИ ПРИМЕНЕНИЯ ПРИ РАЗЛИЧНЫХ ЗАБОЛЕВАНИЯХ:
БОЛЕЗНЬ АЛЬЦГЕЙМЕРА:
Одним из признаков данного заболевания является конкретный тип дегенерации нейронов, в котором тау белок, ассоциированный с микротрубочками аномально гиперфосфорилируется, вызывая разрыв сети микротрубочек.
Широко известным является тот факт, что GSK-3 бета является одним из ферментов непосредственно вовлеченных в аномальное гиперфосфорилирование тау. Смотри, например, следующие материалы:
- "Tau is phosphorytated by GSK-3 at several sites found in Alzheimer disease и its biological activity markedly inhibited only after it is prephosphorylated by A-kinase" Febs Lett. 1998, 436, 28-34.
См. реферат.
- "Inhibition of tau phosphorylation: a new therapeutic strategy for the treatment of Alzheimer's disease and other neurodegenerative disorders".
Exp. Opin. Ther. Patents.
2000 10(10).
См. стр.2, правая колонка.
- "Inhibition of cyclin-dependent kinases, GSK˜3b and CK1 by hymenialdisine, a marine sponge constituent".
Chem. Biol. 2000751-63.
См. "Введение".
- "Decreased nuclear B-catenin, tau hyperphosphorylation and neurodegeneration in GSK-ЗВ conditional transgenic mice".
EMBO 2001 20(1-2)27-39.
См. реферат.
- "Alzheimer's disease - like phosphorylation of the microtubule-associated protein tau by glycogen synthase kinase-3 in transfected mammalian cells".
Curr. Biol. 19944(12) 1077-1086.
См. "Обоснование".
- "Expression, purification and crystallization of human tail-protein kinase l/glycogen synthase kinase-3 beta".
Acta Crystallogr D 2000 56 1464-1465.
См. "Введение".
ДИАБЕТ
При диабете наблюдаются повышенные уровни GSK-3 бета, и таким образом утверждается, что использование ингибиторов GSK-3 является разумным подходом к лечению диабета. Так, например, в "Potential Role of Glycogen Synthase Kinase-3 in Skeletal Muscle Insulin Resistance of Type 2 Diabetes", Diabetes 2000 49 263-271, указывается, что диабет ассоциирован с повышенной активностью GSK-3 (см. реферат и стр.795, последний параграф - 796, начало левого столбца). Действительно, при описании полезности ингибиторов GSK-3 утверждается, что "такие соединения могут применяться при заболеваниях, связанных с повышенной активностью GSK-3, таких как диабет и неродегенеративные заболевания" (стр.798, правый столбец, второй параграф "Обсуждение").
Согласно "Purification of GSK-3 by Affinity Chromatography on Immobilized Axin", Protein Expr. Purif. 2000 20(3) 394-404, GSK-3 непосредственно вовлечена в механизм таких заболеваний, как диабет. На стр.402, левый столбец, указано что "вовлечение GSK-3 в механизмы различных заболеваний, таких как рак, болезнь Альцгеймера, ВИЧ индуцированная нейротоксичность или диабет свидетельствует о настоятельной необходимости активного поиска и отбора ингибиторов GSK-3". В "Selective small molecule inhibitors of glycogen synthase kinase-3 modulate glycogen metabolism и gene transcription", Chem. Biol. 2000 7(10) 793-803, указано, что разработка ингибиторов GSK-3 "может быть полезна при использовании в терапии состояний, связанных с повышенной активностью GSK-3, таких как инсулиннезависимый диабет" (см. стр.793, "Выводы"; стр.794, последние строки; стр.798, второй параграф "обсуждения"; стр. 800, последние строки).
ГИПЕРПРОФИЛЕРАТИВНЫЕ ЗАБОЛЕВАНИЯ: РАК, ДИСПЛАЗИИ И МЕТАПЛАЗИИ ТКАНЕЙ, ПСОРИАЗ, АРТЕРИОСКЛЕРОЗ, РЕСТЕНОЗ:
Известно, что GSK-3 вовлечена в механизм множества физиологических процессов, включая регуляцию клеточного цикла; так, известно, что GSK-3 вовлечена в общий механизм гиперпрофилеративных заболеваний, хотя наиболее изученным, наиболее распространенным и тяжелым является рак. Тем не менее, взаимосвязь между гиперпрофилерацией и GSK-3 до сих пор до конца не ясна.
Так, например в "Indirubins Inhibit Glycogen Synthase Kinase-3 beta and CDK5/P25, Two Protein Kinases Involved in Abnormal Tau Phosphorylation in Alzheimer's Disease", J. Biol. Chem. 2001 276(1) 251-260, постулируется взаимосвязь между ингибиторами GSK-3 и противоопухолевыми свойствами, хотя механизм и их роль до конца не ясна. Индирубин известен своими противоопухолевыми свойствами, и является сильным ингибитором GSK-3 (см. стр.251, левая колонка). Такая же корреляция наблюдается в отношении других противоопухолевых соединений (см. стр.257, правая колонка). Это может быть связано с тем, что GSK-3 "вовлечена в механизм множества физиологических процессов, включая регуляцию клеточного цикла" (см. стр.252, левая колонка). В "Purification of GSK-3 by Affinity Chromatography on Immobilized Axin", Protein Expr. Purif. 2000 20(3) 394-404, подтверждается, что GSK-3 вовлечена в механизм рака (см. Реферат); действительно, указывается, что "вовлечение GSK-3 в механизм различных заболеваний, таких как рак, [...] свидетельствует о настоятельной необходимости активного поиска и отбора ингибиторов GSK-3" (стр.402, левая колонка).
ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ
Настоящее изобретение касается также фармкомпозиций, включающих соединение по данному изобретению, вместе с фармацевтически приемлемым носителем, наполнителем или разбавителем для введения пациенту.
Примеры фармкомпозиций включают любые твердые (таблетки, пилюли, капсулы, гранулы и проч.) или жидкие формы (растворы, суспензии или эмульсии) составы для перорального, местного или парентерального введения.
Предпочтительна форма для орального введения. Подходящими формами для орального применения являются таблетки и капсулы, содержащие обычные носители, такие как связывающие агенты, например сироп, камедь акации, желатин, сорбит, трагакант или поливинилпирролидон; наполнители, например лактоза, сахар, кукурузный крахмал, фосфат кальция, сорбит или глицин; смазывающие агенты для таблетирования, например стеарат магния; дезинтегрирующие средства, например крахмал, поливинилпирролидон, крахмал натрийгликолят или микрокристаллическая целлюлоза; или фармацевтически приемлемые смачивающие агенты, такие как натрий лаурилсульфат.
Твердые формы для орального введения могут быть получены обычными способами смешения, заполнения или таблетирования. Процедуры повторного смешения могут быть использованы для распределения активного ингредиента по всему объему композиции при использовании больших количеств наполнителей. Методики являются обычными в данной области. Так, например таблетки могут быть получены влажным или сухим гранулированием и необязательно покрыты, в частности, энтеросолюбильным покрытием.
Фармкомпозиции могут предназначаться для парентерального введения, например, в виде стерильных растворов, суспензий или лиофилизованных продуктов в виде соответствующей стандартной дозы. Могут использоваться подходящие наполнители, буферирующие агенты или ПАВ.
Введение соединений и составов по изобретению может осуществляться любым приемлемым для данной формы способом, таким как внутривенное вливание, оральное, интраперитонеальное и внутривенное введение. Оральное введение наиболее предпочтительно, поскольку наиболее удобно для пациента ввиду хронического характера заболеваний, при которых показано их введение.
Обычно, эффективное количество вводимого соединения зависит от его относительной эффективности, тяжести и характера заболевания, которое лечат, а также от веса пациента. Однако обычно соединения вводят однократно или до 4 раз в день в стандартной дозе от 0.1 до 1000 мг/кг/день.
Соединения и составы по изобретению могут использоваться с другими лекарствами в комплексной терапии. Другое лекарство может быть введено в ту же или иную композицию, или вводиться отдельно, как одновременно, так и в разное время.
Общая схема синтеза 1,2,4-тиадиазолидин-3, 5-дионов:
Хлор медленно барботируют через раствор арил или алкил изотиоцианата в сухом гексане (25 мл), в атмосфере азота, при от -15°С до -10°С. Хлор получали добавлением 35% HCl к KMnO4. Температуру реакции тщательно контролировали в ходе добавления. На этом этапе образуется N-арил или N-алкил-S-хлороизотиокарбамоилхлорид. Затем, добавляют алкил изоцианат. Смесь перемешивают при комнатной температуре от 8 до 10 ч, после чего полученный продукт очищают фильтрацией с отсасыванием и перекристаллизацией либо колоночной хроматографией на силикагеле с использованием подходящего элюента. В ряде случаев возможно получение 5-оксо-1,2,4-тиадиазолидин-3-тиона в качестве побочного продукта.
Синтез и физико-химические данные конкретных соединений изобретения:
4-Бензил-2-метил-1,2,4-тиадиазолидин-З,5-дион.
Реагенты: Бензил изотиоцианат (0,86 мл, 6,5 ммоль), 35% HCl (3,1 мл), KMnO4 (0,5 г), метилизоцианат (0,38 мл, 6,5 ммоль). Условия: комн. темп., 8 ч. Выделение (1): фильтрование реакционной смеси. Очистка: перекристаллизация из гексана. Выход: 0,75 г (35%) в виде белого твердого вещества; темп. пл. 60-61°С.1H-NMR (CDCl3): 3,2 (s, 3H, СН3); 4,8 (s, 2H, CH2-Bn) ; 7,31-7,45 (m, 5H, arom.).13 C-NMR (CDCl3): 31,4 (СН3); 46,0 (CH2-Bn) 128,2; 128,6; 128,8; 135,1 (С arom.); 155,2 (3-С=O); 165,6 (5-С=O). Анализ. (C10H10N2SO2) C, H, N, S.
4-(Этоксикарбонилметил)-2-метил-1,2,4-тиадиазолидин-3,5-дион
Реагенты: Этил изотиоцианатоацетат (0,8 мл, 6,5 ммоль), 35% HCl (3,1 мл), KMnO4 (0,5 г), метилизоцианат (0,38 мл, 6,5 ммоль). Условия: комн. темп., 8 ч. Выделение: фильтрование реакционной смеси. Очистка: перекристаллизация из гексана. Выход 0,28 г (20%) в виде белого твердого вещества; темп. пл. 67-69°С.1H-NMR (CDCl3): 1,3 (t, 3H СН2CO2 СН2 CH3, J=7,1 Гц); 3,2 (s, 3H, СН3); 4, 2 (с, 2H, СН2CO2CH2СН3, J=7,1 Гц); 4,4 (s, 2H, CH2CO2СН2СН3).13C-NMR (CDCl3): 14,0 (СН2CO2СН2CH3); 31,5 (СН3); 42,7 (CH2CO2СН2 СН3) ; 62,1 (CH2СО2CH2 СН3) ; 152,6 (3-С=O); 166,4 (5-С=O); 166,4 (CO2). Анализ. (C7H10N2SO3) C, H, N, S.
(4-метоксифенил)-2-метил-1,2, 4-тиадиазолидин-3,5-дион.
Реагенты: 4-Метоксифенилизотиоцианат (0,89 мл, 6.5 ммоль), 35% HCl (3,1 мл), KMnO4 (0,5 г), метилизоцианат (0,38 мл, 6,5 ммоль). Условия: комн. темп., 8 ч. Выделение: фильтрование реакционной смеси. Очистка: перекристаллизация из СН2Cl2/гексана. Выход: 0,44 г (30%) в виде белого твердого вещества; темп. пл. 140-144°С.1H-NMR (CDCl3): 3,31 (s, 3H, СН3); 3,80 (s, 3H, р-СН3О-Ph); 7,02-7,32 (m, 4H, arom.).13C-NMR (CDCl3): 31,7 (СН3 ); 55,5 (p-CH3O-Ph); 114,7; 125,3; 128,5; 159,9 (С arom.); 152,9 (3-C=O); 165,5 (5-C=O). Анализ. (C10H10N2SO3) С, Н, N, S.
4-(4-метилфенил)-2-метил-1,2,4-тиадиазолидин-3,5-дион.
Реагенты: 4-метилфенилизотиоцианат (0,88 мл, 6,5 ммоль), 35% HCl (3,1 мл), KMnO4 (0,5 г), метилизоцианат (0,38 мл, 6, 5 ммоль). Условия: комн. темп., 6 ч. Выделение: фильтрование реакционной смеси. Очистка: перекристаллизация из СН2Cl2 /гексана. Выход: 0,29 г (21%) в виде белого твердого вещества; темп. пл. 182-184°С.1H-NMR (CDCl3): 2,4 (s, 3 час, р-СН3-Ph); 3,25 (s, 3H, СН3 ); 7, 20-7,34 (m, 4H, arom.).13C-NMR (CDCl3): 21,1 (р-СН3-Ph); 31,7 (СН3); 126,7; 130,0; 130,3; 139,3 (С arom.); 152,9 (3-С=O); 165,3 (5-С=O). Анализ. (C10H10N2SO2) С, Н, N, S.
4-(Этоксикарбонилметил)-2-(этоксикарбонилметил)-1,2,4-тиадиазолидин-3,5-дион.
Реагенты: Этилизотиоцианатоацетат (0,8 мл, 6.5 ммоль), 35% HCl (3,1 мл), KMnO4 (0,5 г), этилизоцианатоацетат (0,73 мл, 6,5 ммоль). Условия: комн. темп., 9 ч. Выделение: выпаривание растворителя. Очистка: колоночной хроматографией на силикагеле с использованием элюента AcOEt/гексана (1:3). Выход: 0.90 г (48%) в виде белого твердого вещества; темп. пл. 72-74°С.1H-NMR (CDCl3): 1,25 (t, 3H, СН2CO2СН2CH3, J=7,1 Гц); 1,26 (t, 3H, СН2CO2СН2CH3, J=7,1 Гц); 4.18 (с, 2Н, СН2CO2CH2СН3 , J=7,1 Гц); 4,20 (с, 2Н, (CH2CO2CH2CH3, J=7,1); 4,3 (s, 2Н, CH2CO2CH2СН3); 4,4 (s, 2Н, CH2CO2CH2СН3).13C-NMR (CDCl3): 14,0 (CH2CO2CH2СН3); 14,0 (CH2CO2CH2СН3); 42,7 (CH2CO2CH2СН3); 45,6 (CH2CO2CH2СН3); 62,1 (CH2CO2CH2СН3); 62,1 (CH2CO2CH2СН3); 153,0 (3-С=O); 165,7 (5-С=O); 166,1 (CH2CO2CH2СН3); 166,8 (CH2CO2CH2СН3). Анализ. (C10H14N2SO6) C, H, N, S.
4-(4-Бромфенил)-2-метил-1,2,4-тиадиазолидин-3,5-дион.
Реагенты: 4-Бромфенилизотиоцианат (1,4 г, 6,5 ммоль), 35% HCl (3,1 мл), KMnO4 (0,5 г), метилизоцианат (0,38 мл, 6,5 ммоль). Условия: комн. темп., 9 ч. Выделение: фильтрование реакционной смеси. Очистка: перекристаллизация из гексана/СН2Cl2; выход 0,32 г (20%) в виде белого твердого вещества; темп. пл. 182-184°С.1H-NMR (CDCl3): 3,25 (s, 3H, СН3); 7,25-7,61 (2d, 4H, arom., J=8,6 Гц).13C-NMR (CDCl3): 31,6 (СН3); 123, 0; 128,6; 131,6; 132,5 (С arom.); 153,4 (3-C=O); 165,7 (5-С=O). Анализ. (C9H7N2SO2Br) С, Н, N, S.
Реферат
Изобретение относится к применению соединений, представленных общей формулой (II):

где: Ra и Rb независимо выбирают из водорода, алкила, циклоалкила, арила (необязательно замещенного группой, выбранной из алкила, галогена и алкокси), (Z)n -арила (необязательно замещенного группой, выбранной из алкила, галогена и алкокси), -(Z)n-C(O)OR3, Z независимо выбирают из -C(R3)(R4)-, R3 и R4 независимо выбирают из водорода, алкила, арила и 6-членного цикла с атомом азота в качестве гетероатома; n имеет значения ноль, один или два; Х и Y независимо выбирают из =O, =S, =N(R3); в качестве активного ингредиента для получения фармацевтической композиции, предназначенной для лечения заболеваний, в которые вовлечена гликоген-синтаза киназа 3-бета (GSK-3). Изобретение относится к соединениям, представленным общей формулой II, где Ra выбирают из СН2Ph, CH2CO2Et, 4-OMePh, 4-MePh, 4-BrPh; Rb выбирают из Me и CH2CO2 Et, Х и Y представляют собой =O. Также изобретение относится к фармацевтической композиции, обладающей GSK-3 ингибирующей активностью, содержащей в качестве активного ингредиента соединение общей формулы (II). Технический результат - гетероциклические ингибиторы гликоген-синтазы киназы 3β, GSK-3. 3 н. и 14 з.п. ф-лы, 5 табл.
Формула











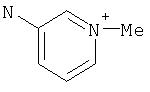


Комментарии