Способы стимуляции биогенного продуцирования метана в углеводородсодержащих пластах - RU2488636C2
Код документа: RU2488636C2
Чертежи












Описание
Перекрестная ссылка на родственную заявку
По настоящей заявке испрашивается приоритет согласно предварительной заявке США № 61/052624, поданной 12 мая 2008 года, которая включена в настоящее описание посредством ссылки во всей своей полноте.
Уровень техники
Настоящее изобретение в основном относится к молекулярной характеристике автохтонных метан-продуцирующих микроорганизмов и их определенных сообществ из углеводородсодержащих пластов, таких как угольные пласты; и более конкретно, к анализам геномных данных окружающей среды из таких микроорганизмов и применению таких данных и микроорганизмов для увеличения степени конверсии и извлечения метана с использованием стимуляторов, идентифицированных путем определения присутствия ферментов в метаболических путях, участвующих в конверсии углеводорода в метан.
Метан угольных пластов (CBM) является источником природного газа, образующегося либо биологически, либо термогенно в угольных месторождениях. Биогенное продуцирование CBM является результатом микробного метаболизма и разложения угля с последующим обменом электронами между многочисленными микробными популяциями. Термогенное продуцирование CBM является результатом термического крекинга осадочного органического вещества или нефти, происходящего позже при углефикации, когда температуры поднимаются выше уровней, при которых могут существовать метан-продуцирующие микроорганизмы. В угольных пластах давление вышележащих горных пород и окружающей воды вынуждает CBM связываться с поверхностью угля и абсорбироваться в твердую матрицу угля в виде свободного газа в микропорах и зонах кливажа (расщепление угольной породы сетью трещин на тонкие пластины и т.д.), в виде растворенного в воде газа, в виде адсорбированного газа, удерживаемого силами молекулярного притяжения на поверхности мацералов (органических составляющих, которые образуют угольную массу), микропор и зон кливажа в угле, и в виде газа, абсорбированного внутри молекулярной структуры угля.
Уголь представляет собой осадочную породу c различными степенями проницаемости, причем метан находится преимущественно в зонах кливажа. Эти трещины в угле действуют в качестве основных каналов, обеспечивающих возможность течения CBM. Для извлечения CBM в угольном пласте бурят скважину со стальной обсадной колонной, которая дает возможность снизить давление благодаря выходу скважины на поверхность или откачивать небольшое количество воды из угольного пласта (обезвоживание). CBM имеет очень низкую растворимость в воде и легко выделяется при снижении давления, что дает возможность откачивать его из скважины отдельно от воды. Затем CBM поступает в компрессорную станцию и в трубопроводы для природного газа.
CBM составляет значительную часть природного газа, добываемого в США, обеспечивая, по оценкам, приблизительно 10% поставок природного газа, или примерно 1,8 триллиона кубических футов (TCF) (50 миллиардов кубических метров). Международные ресурсы обеспечивают огромные возможности добычи CBM в будущем. К наиболее продуктивным областям относится бассейн Сан-Хуан (San Juan), расположенный в Колорадо и Нью-Мексико. При наличии таких огромных месторождений CBM минимальные улучшения степени извлечения CBM могут, таким образом, привести к значительному увеличению добычи из скважины, и в соответствии с этим разрабатываются различные способы для улучшения степени извлечения CBM из угольных пластов.
Чисто физические воздействия могут включать оптимизацию способов бурения и разрыва пласта. Другие способы усовершенствования включают воздействие внешних факторов непосредственно на угольные пласты. Они включают, например, нагнетание газов, таких как азот (см., например, Shimizu, S., Akiyama, M., Naganuma, T., Fujioka, M., Nako M. и Ishijima, Y. 2007. Molecular characterization of microbial communities in deep coal seam groundwater of northern Japan. Geobiology, 5(4): 423-433; патент США 4883122) и CO2 (см., например, патент США 5402847); и закачивание горячих текучих сред, таких как вода или пар (см., например, патент США 5072990). Различные способы предназначены для увеличения проницаемости угольных пластов либо физическими (см., например, патент США 5014788), либо химическими (см., например, патент США 5865248) методами.
Впоследствии разрабатывались усовершенствованные способы стимуляции биогенного продуцирования метана в существующих скважинах. В патенте США 5424195 раскрыто использование консорции микроорганизмов, культивируемых in situ или на содержащем уголь субстрате, для биологического превращения угля в метан. В PCT/GB2006/004443 (WO2007/060473) представлены способы получения и применения культуры подземных микроорганизмов. В PCT/US2006/039352 (WO2008/041990) раскрыты способы и системы для стимуляции биогенного продуцирования путем нагнетания закачиваемой текучей среды, которая способствует анаэробному биологическому разложению нежидких углеводородов в пласте автохтонными микроорганизмами. В PCT/US2007/080161 (WO2008/042888) раскрыты способы, включающие нагревание in situ пласта с нежидкими углеводородами для обеспечения биогенного продуцирования метана. В патенте США 7426960 раскрыты способы стимуляции биогенного продуцирования метаболита с повышенным содержанием водорода, включающие закачивание воды в выработку для распределения в ней консорции микроорганизмов. В патенте США 6543535 раскрыты способы стимуляции активности микробных сообществ в углеводородсодержащем подземном пласте для превращения углеводородов в метан с использованием информации, полученной в результате анализа компонентов пласта и характеризации микроорганизмов в консорциях. Хотя в патенте США 6543535 предусмотрено сравнение выделенных микроорганизмов с известными микроорганизмами, для установления филогенетической идентичности таким известным организмам, в нем не раскрыта идентификация или использование специфических генов, кодирующих ферменты, которые участвуют в биотрансформации угля в метан, из метанобразующих бактерий в пределах сообществ, или использование анализа активности ферментов для выявления новых стимуляторов. В публикации патентной заявки США № 2008/0289816 раскрыты способы введения микроорганизмов в углеродсодержащий материал в анаэробной среде и увеличения биогенного продуцирования углеводородов, включающие использование модифицированных пластовых вод. В публикации патентной заявки США № 2008/0299635 раскрыты способы стимуляции продуцирования метана из углеродного материала с метаногенной консорцией. В публикации патентной заявки США № 2009/0023612 раскрыты способы увеличения биогенного продуцирования горючего газа из углеродного материала, предусматривающие использование анаэробного сообщества, включающего виды Pseudomonas. В публикации патентной заявки США № 2009/0023611 раскрыты изолированные микробные сообщества для биогенного продуцирования метана из сложных углеводородов, включающие виды Thermotoga. В публикации патентной заявки США № 2008/0286855 раскрыт способ увеличения продуцирования материалов с повышенным содержанием водорода, включающий введение сообщества, содержащего выделенную культуру Thermacetogeniumphaeum. В патенте США № 7416879 раскрыты способы стимуляции биологической активностиThermacetogenium phaeumв геологическом пласте, включающие введение в пласт модификатора. В публикации патентной заявки США № 2008/0182318 раскрыты выделенные микробные сообщества для биогенного продуцирования метана, содержащие виды Desulfuromonas. В публикации патентной заявки США № 2007/0295505 раскрыты способы стимуляции биогенного продуцирования продукта метаболизма с повышенным содержанием водорода в геологическом пласте, который включает углеродный материал, включающие обеспечение фосфорного соединения для присутствующих в них микроорганизмов. В публикации патентной заявки США № 2007/0261843 раскрыты способы стимуляции биогенного продуцирования продукта метаболизма с повышенным содержанием водорода в геологическом пласте, который включает углеродный материал, включающие обеспечение доступности соединений водорода и фосфора для присутствующих в них микроорганизмов. В PCT/US2006/031723 (WO2007/022122) раскрыты системы для усиления биогенного продуцирования метана, включающие модифицирующую CBM воду и другие содержащие микроорганизмы среды, уменьшающие конкуренцию за восстановление сульфатов и увеличивающие концентрацию органических веществ.
Биогенное продуцирование метана является результатом многочисленных возможных ферментативных путей метаболизма, которые последовательно разрушают комплексные макромолекулярные полициклические органические вещества, образующиеся из лигнина. Например, лигнинолитические ферменты могут включать пероксидазы (марганецпероксидаза, лигнинпероксидазы и т.д.), фенолоксидазы (лакказы), гидролазы, эстеразы и оксидазы (см., например, Fakoussa, R.M. и Hofrichter, M. 1999. Biotechnology and Microbiology of Coal Degradation. Appl. Microbiol. Biotechnol. 52:25-40). Когда происходит первичная фрагментация, в реакцию начинают вступать ферменты, участвующие в деметилировании и раскрытии кольца, окислении ароматических и алифатических фрагментов и последующих метаболических путях ферментации и метаногенеза. Считается, что микроорганизмы, обитающие в углеводородсодержащих пластах, включая метан-продуцирующие бактерии, являются облигатными анаэробами.
В данной области остается потребность в эффективной стимуляции биогенного продуцирования в углеводородсодержащих пластах, таких как угольные, и в повышении производительности по CBM существующих скважин. Настоящее изобретение предлагает способы не только для идентификации и применения микроорганизмов, обитающих в окружающей среде пласта, но и для идентификации точно приспособленных воздействий (таких как стимуляторы, которые могут быть введены в окружающую среду для усиления биогенного продуцирования метана) после установления присутствия специфических генных продуктов, принимающих участие в путях метаболизма, приводящих к образованию метана.
Сущность изобретения
Настоящее изобретение предоставляет методы и способы идентификации и применения стимуляторов и ферментов для биогенного продуцирования метана в углеводородсодержащих пластах. Способы по настоящему изобретению включают использование информации о нуклеиновых кислотах, полученной от многочисленных микроорганизмов, идентифицированных в углеводородсодержащем пласте, для идентификации генных продуктов, которые представляют собой ферменты, присутствующие в микроорганизмах, которые могут функционировать в различных путях метаболизма, начиная от источника углеводорода и приводя к образованию метана. См., например, фиг.1.
В первом аспекте изобретение предоставляет способы идентификации стимулятора, который увеличивает биогенное продуцирование метана в углеводородсодержащем пласте, включающие: (а) получение последовательности нуклеиновой кислоты из одного или нескольких микроорганизмов, выделенных из среды углеводородсодержащего пласта; (b) определение присутствия одного или нескольких генных продуктов указанной последовательности нуклеиновой кислоты, где генный продукт является ферментом метаболического пути, вовлеченного в конверсию углеводорода в метан; и (с) идентификацию субстрата, реактанта или кофактора указанного фермента, который увеличивает продуцирование метана, будучи доступным для одного или нескольких микроорганизмов в указанном углеводородсодержащем пласте.
В одном варианте осуществления один или несколько микроорганизмов из углеводородсодержащего пласта улучшают путем отбора по способности к росту на угле в качестве единственном источнике углерода.
В еще одном варианте осуществления указанная выше стадия (с) включает тестирование in vitro одного или нескольких субстратов, реактантов или кофакторов при более чем одной концентрации для мониторинга и оптимизации продуцирования метана в системе культур, включающей по меньшей мере один микроорганизм, выделенный из указанного углеводородсодержащего пласта, где дополнительно для указанной системы культур уголь является единственным источником углерода.
В одном предпочтительном варианте осуществления по меньшей мере один микроорганизм представляет собой бактериальный вид или архебактериальный вид, способный преобразовывать углеводород в продукт, выбранный из группы, состоящей из водорода, диоксида углерода, ацетата, формиата, метанола, метиламина и метаногенного субстрата; вид разлагающих углеводороды бактерий, вид метаногенных бактерий или метаногенный архебактериальный вид. В еще одном предпочтительном варианте осуществления такой микроорганизм представляет собой вид бактерий, выбранных из группы родов, состоящей из Pseudomonas, Arcobacter, Desulfuromonas, Pelobacter, Desulfovibrio, Spirochaeta, Erysipelothrix, Thauera, Clostridium, Acholeplasma, Magnetospirillum и Sulfurospirillum; или вид архебактерий, выбранных из группы, состоящей из Methanolobus, Methanocalculus и членов типа Crenarcheaota.
В альтернативном варианте осуществления стадию (с) выполняют с использованием определенного микробного сообщества, которое объединяет культуру единичного штамма микроорганизма из углеводородсодержащего пласта по меньшей мере с одной другой определенной культурой еще одного единичного штамма микроорганизма так, что члены указанного определенного микробного сообщества проявляют синергическое действие в продуцировании метана; и, дополнительно, где для указанной системы культур уголь является единственным источником углерода. Предпочтительное определенное микробное сообщество включает по меньшей мере два вида микроорганизмов, выбранных из группы родов, состоящей из Pseudomonas, Arcobacter, Desulfuromonas, Pelobacter, Desulfovibrio, Spirochaeta, Erysipelothrix, Thauera, Clostridium, Acholeplasma, Magnetospirillum, Sulfurospirillum; Methanolobus, Methanocalculus и членов типа Crenarcheaota.
В различных вариантах осуществления углеводородсодержащий пласт выбирают из группы, состоящей из угля, торфа, бурого угля, битуминозного сланца, нефтеносного пласта, традиционных тяжелых нефтяных остатков, вязкой нефти, нефтеносных песков и битуминозных песков. В предпочтительном варианте осуществления пласт представляет собой уголь в угольном пласте или угольной залежи.
В различных вариантах осуществления фермент, вовлеченный в конверсию углеводорода в метан, выбирают из группы, состоящей из пероксидаз, фенолоксидаз, алкогольоксидаз, лакказ, гидролаз, гликозилгидролаз, эстераз, этераз, оксидаз, нитрогеназ, целлюлаз, амилаз, глюканаз, пулланаз, редуктаз, дисмутаз, оксигеназ, монооксигеназ, диоксигеназ, каталаз, гидрогеназ и карбоксилаз. В предпочтительном варианте осуществления фермент выбирают из группы, состоящей из оксигеназ, монооксигеназ и диоксигеназ.
В различных вариантах осуществления субстрат, реактант или кофактор выбирают из группы, состоящей из серосодержащего соединения, азотсодержащего соединения, фосфорсодержащего соединения, микроэлемента, электроноакцептора, электронодонора, галогена, металла, спирта, органической кислоты, алкана, алкена, алкина, ароматического соединения, амина, простого эфира, альдегида, кетона, тиола, ацетата, ароматического углеводорода и газа. В предпочтительном варианте осуществления реактантом является кислород.
Во втором аспекте изобретение предоставляет способы увеличения биогенного продуцирования метана в углеводородсодержащем пласте, где указанный способ включает введение в углеводородсодержащий пласт стимулятора, идентифицированного любым из описанных выше способов согласно первому аспекту.
В одном варианте осуществления способ предусматривает введение кислорода в указанный углеводородсодержащий пласт. В предпочтительном варианте осуществления углеводородсодержащий пласт представляет собой уголь.
В третьем аспекте изобретение предоставляет способы увеличения биогенного продуцирования метана в углеводородсодержащем пласте, где указанный способ включает модуляцию фермента, выбранного из группы, состоящей из пероксидаз, фенолоксидаз, алкогольоксидаз, лакказ, гидролаз, гликозилгидролаз, эстераз, этераз, оксидаз, нитрогеназ, целлюлаз, амилаз, глюканаз, пулланаз, редуктаз, дисмутаз, оксигеназ, монооксигеназ, диоксигеназ, каталаз, гидрогеназ и карбоксилаз.
В альтернативных вариантах осуществления фермент присутствует в существующем в углеводородсодержащем пласте микроорганизме, или его вводят в углеводородсодержащий пласт. В последнем варианте осуществления фермент вводят в указанный углеводородсодержащий пласт внесением микроорганизма, экспрессирующего указанный фермент. В одном варианте осуществления вводимый микроорганизм, экспрессирующий указанный фермент, представляет собой рекомбинантный микроорганизм, полученный путем модифицирования микроорганизма, выделенного из указанного углеводородсодержащего пласта. В еще одном варианте осуществления микроорганизм, экспрессирующий указанный фермент, представляет собой искусственный микроорганизм.
В четвертом аспекте изобретение предоставляет способы идентификации определенного микробного сообщества для конверсии угля в метан, включающий: (а) получение последовательности нуклеиновой кислоты из одного или нескольких микроорганизмов, выделенных из среды угля; (b) определение присутствия одного или нескольких генных продуктов указанной последовательности нуклеиновой кислоты, где указанный генный продукт является ферментом метаболического пути, вовлеченного в конверсию угля в метан; (с) получение культуры единичного штамма указанного одного или нескольких микроорганизмов из указанной среды угля, где единичный штамм микроорганизма содержит указанные один или несколько генных продуктов; и (d) объединение указанного культивированного единичного штамма микроорганизма по меньшей мере с одной другой определенной культурой еще одного единичного штамма микроорганизма, для создания определенного микробного сообщества; где члены указанного определенного микробного сообщества проявляют синергическое действие в продуцировании метана.
В одном варианте осуществления создают определенное микробное сообщество для конверсии угля в метан, идентифицированное описанными выше способами согласно изобретению.
В еще одном варианте осуществления способ дополнительно включает (е) обеспечение указанному определенному микробному сообществу, которое увеличивает продуцирование метана, доступа к субстрату, реактанту или кофактору.
В предпочтительных вариантах осуществления определенное микробное сообщество включает по меньшей мере два вида микроорганизмов, выбранных из группы родов, состоящей из Pseudomonas, Arcobacter, Desulfuromonas, Pelobacter, Desulfovibrio, Spirochaeta, Erysipelothrix, Thauera, Clostridium, Acholeplasma, Magnetospirillum, Sulfurospirillum; Methanolobus, Methanocalculus и членов типа Crenarcheaota.
В пятом аспекте изобретение предоставляет способы увеличения биогенного продуцирования метана из угля путем введения в угольный пласт определенного микробного сообщества, идентифицированного описанными в данном описании способами согласно изобретению.
В предпочтительном варианте осуществления такие способы включают введение определенного микробного сообщества, идентифицированного, как указано выше, в угольный пласт вместе с указанным субстратом, реактантом или кофактором.
Краткое описание чертежей
Фиг.1 иллюстрирует многообразие потенциальных ферментативных путей метаболизма при конверсии угля в метан.
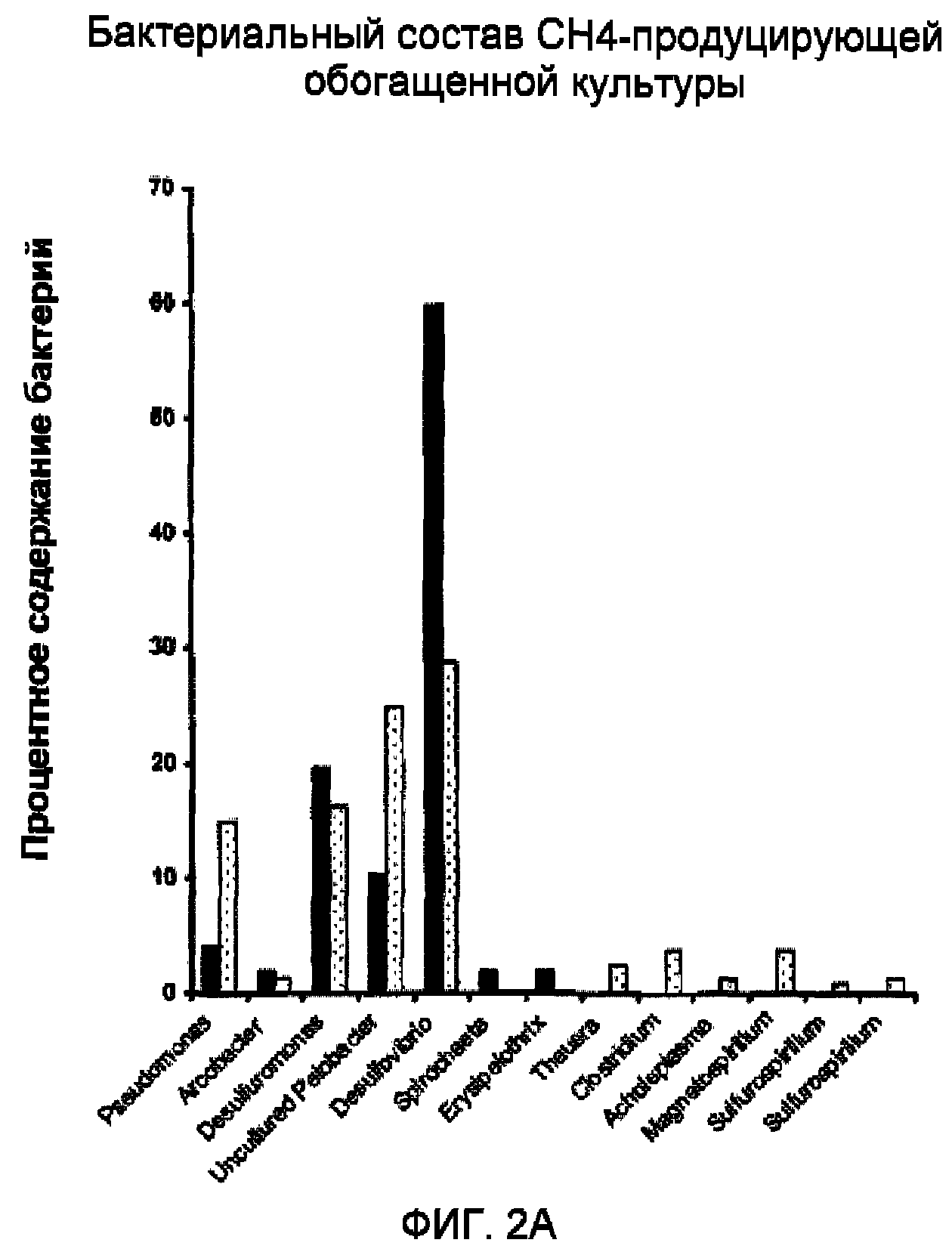
Фиг.2A и 2B иллюстрируют бактериальный и архебактериальный таксономический состав репрезентативной метан-продуцирующей обогащенной культуры после 10 и 30 дней культивирования.
Фиг.3 иллюстрирует бактериальное разнообразие в конкретном образце пластовых вод по данным анализа генных последовательностей из метагенома с использованием белка RecA.
Фиг.4 иллюстрирует и приводит сравнение профиля оксигеназ в конкретных образцах пластовых вод, метан-продуцирующей обогащенной культуры и двух индивидуальных штаммах, для которых было проведено секвенирование геномов.
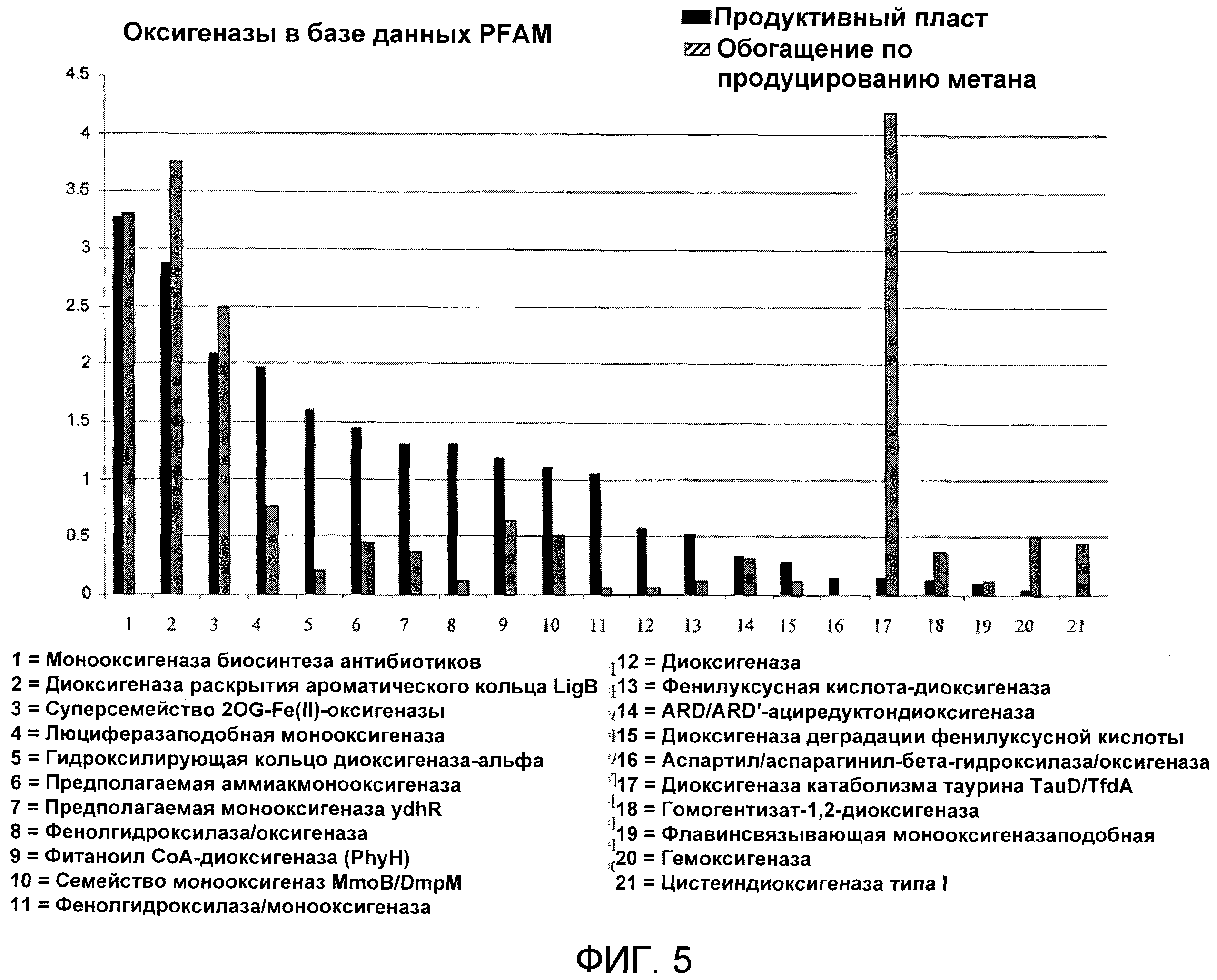
Фиг.5 иллюстрирует и приводит сравнение профиля оксигеназ в конкретном продуктивном пласте и образцах метан-продуцирующей обогащенной культуры.
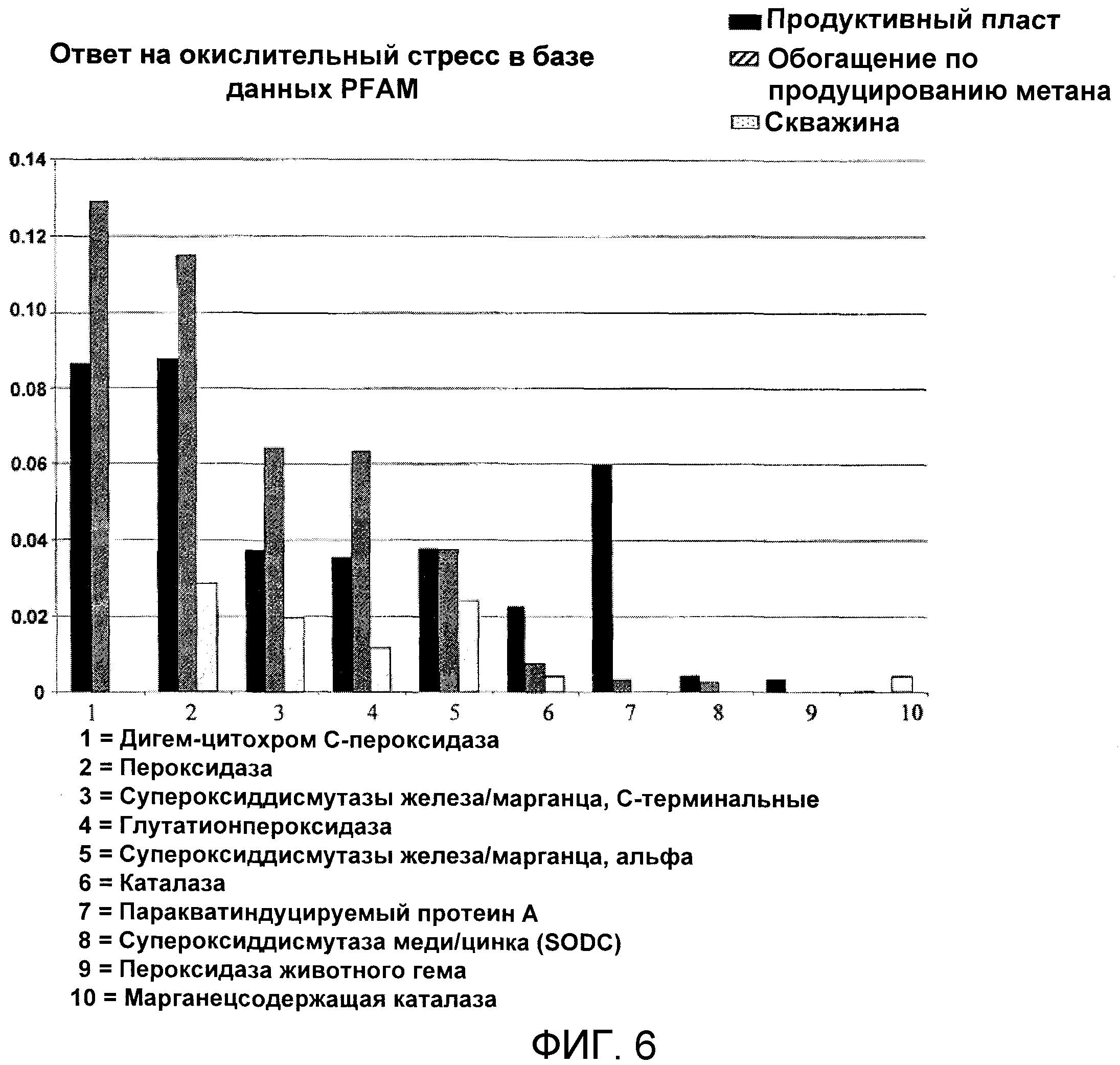
Фиг.6 иллюстрирует и приводит сравнение профиля ответов ферментов на окислительный стресс в конкретном продуктивном пласте, метан-продуцирующей обогащенной культуре и образцах из скважины.
Фиг.7 иллюстрирует и приводит сравнение профиля ферментов метаногенеза в конкретном продуктивном пласте, метан-продуцирующей обогащенной культуре и образцах из скважины.
Фиг.8 иллюстрирует и приводит сравнение профиля эстераз в конкретном продуктивном пласте, метан-продуцирующей обогащенной культуре и образцах из скважины.
Фиг.9 иллюстрирует и приводит сравнение профиля сахаролитических ферментов в конкретном продуктивном пласте, метан-продуцирующей обогащенной культуре и образцах из скважины.
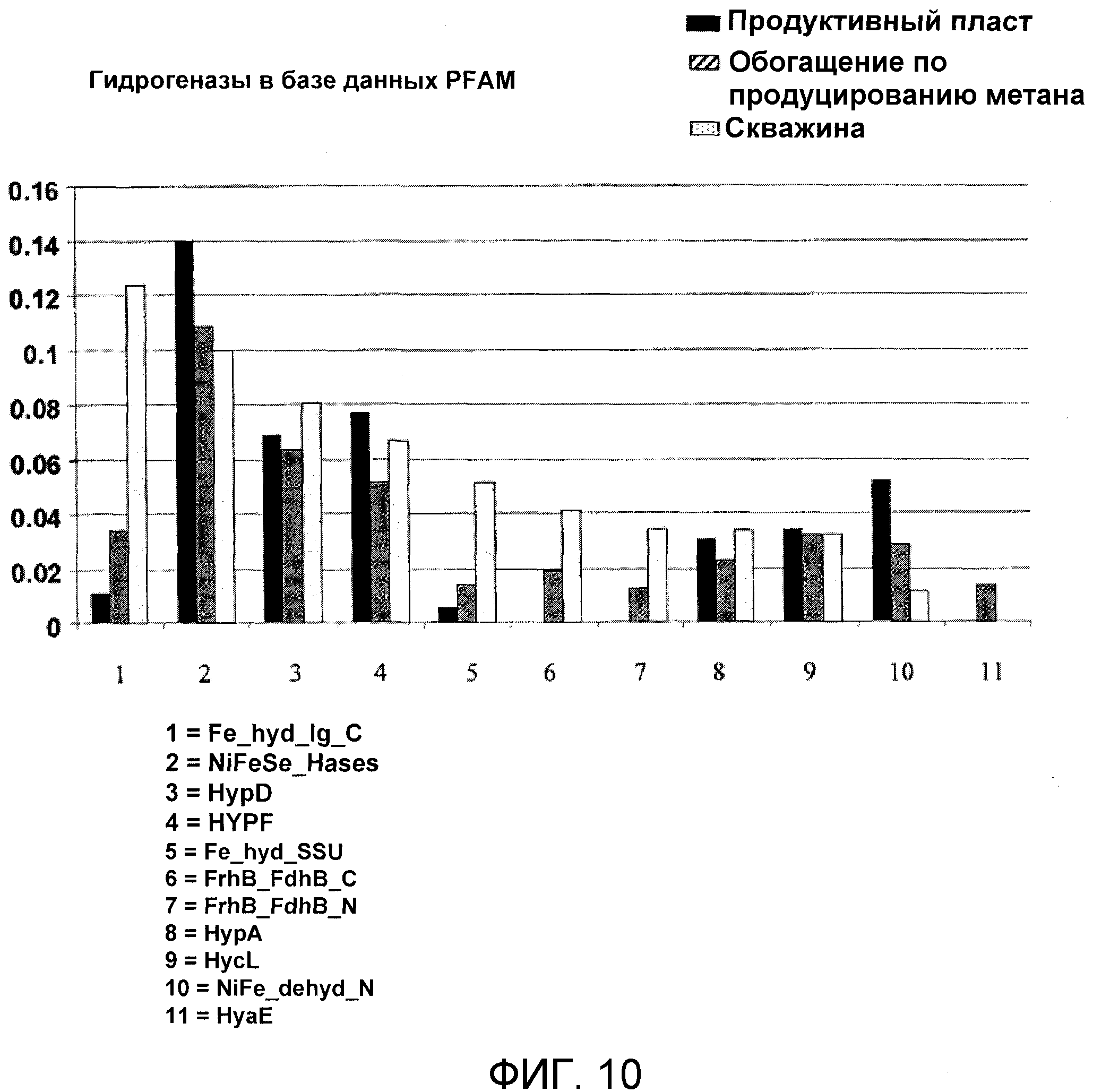
Фиг.10 иллюстрирует и приводит сравнение профиля гидрогеназ в конкретном продуктивном пласте, метан-продуцирующей обогащенной культуре и образцах из скважины.
Фиг.11 иллюстрирует и приводит сравнение профиля азотфиксирующих белков в конкретном продуктивном пласте, метан-продуцирующей обогащенной культуре и образцах из скважины.
Фиг.12 иллюстрирует и приводит сравнение профиля денитрифицирующих белков в конкретном продуктивном пласте, метан-продуцирующей обогащенной культуре и образцах из скважины.
Фиг.13 иллюстрирует увеличение продуцирования метана определенным микробным сообществом после стимуляции различными электроноакцепторами и кислородом.
Фиг.14 иллюстрирует увеличение продуцирования метана определенным микробным сообществом после стимуляции водородом и ацетатом.
Фиг.15 иллюстрирует увеличение продуцирования метана определенным микробным сообществом после стимуляции глицерином или триметиламином.
Фиг.16 иллюстрирует способ введения внешнего фактора, такого как фермент или стимулятор, в угольный пласт путем повторного закачивания пластовых вод для увеличения продуцирования метана.
Подробное описание изобретения
Настоящее изобретение предоставляет новые методы и способы стимуляции биогенного продуцирования метана в углеводородсодержащем пласте, таком как угольные пласты и скважины для добычи метана из угольных пластов, с использованием культивированных микроорганизмов, выделенных из пласта. Геномную информацию, полученную для резидентных микробных популяций, обитающих в углеводородсодержащем пласте, используют для идентификации и стимуляции ферментов, вовлеченных в различные пути метаболизма, реализуемые при конверсии углеводорода в метан, которые присутствуют в одном или нескольких микроорганизмах в пласте или вводятся в пласт, предпочтительно, вместе с идентифицированным стимулятором.
Способы согласно настоящему изобретению предоставляют постадийный подход к идентификации стимуляторов и/или определенных микробных сообществ (DMA), пригодных для увеличения биогенного продуцирования метана. Приведенные в настоящем описании примеры демонстрируют поэтапный подход в успешной идентификации стимуляторов для увеличения продуцирования метана. Коротко, в приведенных в настоящем описании примерах образцы пластовых вод отбирали из скважины для добычи метана из угольных пластов в газоносном бассейне Сан-Хуан (San Juan), где ранее проведенные исследования указали на возраст 70 миллионов лет в условиях изоляции от поверхности и отсутствия свидетельств событий подповерхностного перемешивания. Вода может быть отобрана из устья скважины, разделительного резервуара (барабанный сепаратор) или резервуара-хранилища, поскольку эти образцы воды являются наиболее легкодоступными материалами. Образцы воды, содержащие живые микроорганизмы, затем визуально исследовали с помощью световой микроскопии, и микроорганизмы культивировали с использованием пластовых вод в качестве минеральной основы. Культуры микроорганизмов обогащали (накапливали) в отношении содержания метан-продуцирующих микробов, используя уголь в качестве единственного источника углерода. В качестве стимуляторов микробного дыхания испытывали различные комбинации электроноакцепторов, таких как нитрат, сульфат или фосфат железа. Обогащенные микробные культуры затем подвергали скринингу на продуцирование метана с использованием газовой хроматографии. Состав культивированного сообщества микроорганизмов анализировали с использованием филогенетических маркеров для идентификации доминирующих групп микроорганизмов, и несколько видов микроорганизмов независимо культивировали в чистые культуры (деконволюция) для изучения их ферментных профилей, метаболизма и способности разлагать уголь. Сообщество может быть воспроизведено и составлено для оптимизированного продуцирования метана из угля (воссоздание), с образованием целенаправленно спроектированной сложной микробной экосистемы или определенного микробного сообщества (DMA).
Возможности способов согласно настоящему изобретению можно продемонстрировать путем идентификации кислорода в качестве стимулятора, увеличивающего биогенное продуцирование метана из угля. В результате идентификации присутствия большого числа оксигеназ, монооксигеназ и диоксигеназ при проведении геномных анализов образцов, кислород был идентифицирован как стимулятор. Идентификация этих ферментов была неожиданной из-за анаэробной среды, из которой были выделены микроорганизмы. Бактериальные диоксигеназы ароматических углеводородов представляют собой многокомпонентные ферментные системы, которые вводят дикислородный фрагмент в ароматическое ядро с образованием ареновых цис-диолов, в случае окисления бензола толуолдиоксигеназой до цис-1,2-дигидрокси-3,5-циклогексадиена (цис-диол из бензола) (Gibson, D.T., Cardini, G.E., Maseles, F.C., Kallio, R.E. Incorporation of oxygen-18 into benzene by Pseudomonas putida. Biochemistry. 1970. 9: 1631-1635). Другие типы оксигеназ, выявленных в геномном анализе, в обогащенной метан-продуцирующей культуре и в изолированном штамме Pseudomonas, связаны с пирокатехин-2,3-диоксигеназой. Пирокатехиндиоксигеназы представляют собой металлопротеиновые ферменты, которые осуществляют окислительное расщепление пирокатехинов. Этот класс ферментов присоединяет молекулярный кислород к субстрату. Пирокатехиндиоксигеназы принадлежат к классу оксидоредуктаз и обладают несколькими различными характеристиками субстратной специфичности, включая пирокатехин-1,2-диоксигеназу (EC 1.13.11.1), пирокатехин-2,3-диоксигеназу (EC 1.13.11.2) и протокатехат-3,4-диоксигеназу (EC 1.13.11.3). Активный центр пирокатехиндиоксигеназ наиболее часто содержит железо, но известны также марганецсодержащие формы. В реакциях, катализируемых оксигеназами, выделяется энергия, которая может быть использована для роста микроорганизмов, и в результате такого роста будут продуцироваться другие метаболиты, которые могут быть ассимилированы другими видами.
Кислород может быть релевантным газом в подземных горизонтах, поскольку было описано, что аэробные штаммы процветают в предполагаемо анаэробных средах, таких как залежи нефти (Nazina et al. The phylogenetic diversity of aerobic organotrophic bacteria from the Dagang high temperature oil field. 2007. Microbiology, 74: 343-351)). Однако в этих способах не описан механизм или принцип действия, и возможности регулировать или контролировать лежащие в их основе биологические процессы и сообщества микроорганизмов, реагирующие на такие стимулы, без такого знания ограничены.
Источники микроорганизмов и их характеристика
Как используется в данном описании, термин «углеводородсодержащий пласт» относится к любому источнику углеводородов, из которого может быть получен метан, включающему, но не ограничивающемуся ими, уголь, торф, бурый уголь, битуминозный сланец, нефтеносный пласт, традиционные тяжелые нефтяные остатки, вязкую нефть, нефтеносные пески и битуминозные пески. В обсуждаемых в данном описании различных вариантах осуществления углеводородсодержащий пласт или даже среда, окружающая углеводородсодержащий пласт, могут включать, но, не ограничиваясь ими, битуминозный сланец, уголь, угольный пласт, угольные отвалы, побочные продукты перегонки угля, бурый уголь, торф, нефтеносные пласты, битуминозные пески, загрязненную углеводородами почву, нефтяной шлам, буровой шлам и подобные, и могут также включать такие условия состояния или даже окружения в дополнение к битуминозному сланцу, углю, угольному пласту, угольным отвалам, побочным продуктам перегонки угля, бурому углю, торфу, нефтеносным пластам, битуминозным пескам, загрязненной углеводородами почве, нефтяному шламу, буровому шламу и подобным. В некоторых вариантах осуществления настоящее изобретение может предусматривать in situ (здесь: в природных условиях) углеводородсодержащий пласт, иногда называемый in situ средой, окружающей углеводородсодержащий пласт, или in situ средой продуцирования метана. Варианты осуществления могут включать ex situ (здесь: в искусственных условиях) углеводородсодержащий пласт, иногда называемый ex situ средой, окружающей углеводородсодержащий пласт, или ex situ средой продуцирования метана. Понятие “in situ” может иметь отношение к пласту или окружающей среде, в которых углеводородсодержащие источники могут находиться в их исходных местоположениях, например, in situ окружающие средымогут включать подземное месторождение. Понятие “ex situ” может относиться к пластам или условиям окружающей среды, в которых углеводородсодержащий пласт был извлечен из его исходного местоположения и необязательно может также находиться в биореакторе, ex situ реакторе, шахте, наземных конструкциях и подобных ситуациях. В качестве неограничивающего примера, биореактор может иметь отношение к любому устройству или системе, поддерживающим биологически активную среду.
При использовании угля в качестве примера углеводородсодержащего пласта, существуют многочисленные источники автохтонных микроорганизмов, которые могут играть определенную роль в конверсии углеводорода в метан, и которые могут быть проанализированы. Уголь представляет собой сложное органическое вещество, состоящее из нескольких групп мацералов, или основных типов органического вещества, которые накапливаются в различных типах условий осадконакопления, таких как торфяные болота или травяные болота. Состав мацерала и, тем самым, состав угля, изменяется в горизонтальном и вертикальном направлениях в пределах индивидуальных угольных пластов. После того, как микроорганизмы идентифицированы как содержащие фермент метаболического пути, участвующий в стадии конверсии, различные определенные микробные сообщества или стимуляторы, идентифицированные способами согласно настоящему изобретению, могут более эффективно воздействовать на конкретные группы мацералов, и поэтому каждый угольный пласт может быть уникальным в том отношении, какие типы микроорганизмов и стимуляторов являются наиболее эффективными для in situ биоконверсии угля.
Существуют многочисленные распространенные в природе микроорганизмы, ассоциированные с углем и другими осадочными породами с высоким содержанием органических веществ в подземных условиях. Со временем такие виды микроорганизмов могут стать очень эффективными в метаболизме органического вещества в подземных условиях вследствие естественного отбора. Относительно быстрая адаптация бактерий к условиям местной окружающей среды позволяет предположить, что микроорганизмы, собранные из месторождений или индивидуальных угольных пластов, могут быть генетически уникальными. После сбора проб эти микроорганизмы могут быть выращены в лабораторных культурах, как описано в данном описании, для оценки и определения факторов, увеличивающих и/или ограничивающих конверсию угля в метан. В некоторых случаях, ключевое питательное вещество или микроэлемент могут отсутствовать, и прибавление этого лимитирующего фактора может значительно увеличить продуцирование метана. Когда бактерии лишены доступа к питательным веществам, происходят физиологические изменения, и если состояние голодания продолжается, то все метаболические системы перестают функционировать, и бактерии испытывают остановку метаболизма. Когда условия окружающей среды изменяются, бактерии могут восстанавливаться и снова образовывать жизнеспособную популяцию. Таким образом, возможно, что некоторые бактерии в осадочных породах с высоким содержанием органических веществ достигли состояния остановки метаболизма, и требуется только добавление питательных веществ для активации популяции согласно настоящему изобретению. Путем специального анализа ферментов, присутствующих в таких популяциях, можно определить способы стимуляции путей метаболизма, задействованных в конверсии угля в метан, осуществляемых одним или несколькими членами этих микробных популяций.
Анаэробные бактерии из подземных горизонтов могут быть собраны несколькими разными способами, включающими: (1) добывание или отбирание образцов пластовых вод, (2) бурового шлама, (3) образцов породы со стенок скважины, (4) образцов цельного керна, и (5) образцов спрессованного цельного керна. Образцы спрессованного керна могут обеспечивать наилучшую возможность отбора жизнеспособных микробных популяций, но авторы настоящего изобретения обнаружили, что отбор микробных популяций из пластовых вод обеспечивает получение репрезентативного образца присутствующих микробных популяций. Метан-продуцирующие бактерии являются облигатными анаэробами, но могут оставаться жизнеспособными в присутствии кислорода в течение до 24 часов путем образования многоклеточных скоплений. Кроме того, бескислородные/восстановительные условия микроокружения в кислородсодержащей системе потенциально могут увеличивать срок жизнеспособности анаэробных бактерий. В некоторых случаях, буровой шлам, собранный и помещенный в анаэробные герметизированные контейнеры, будет содержать микроорганизмы, способные конвертировать уголь в метан, в течение нескольких часов, приводя, таким образом, к ошибочным результатам определения содержания газов.
Авторы настоящего изобретения оптимизировали способы отбора проб в полевых условиях для обеспечения оптимального извлечения анаэробных популяций присутствующих в них микроорганизмов. Настоящее изобретение предусматривает отбор проб микробных популяций в анаэробных условиях способами, ранее описанными в заявке PCT № PCT/US2008/057919 (WO2008/116187), и культивирование автохтонных микроорганизмов, обитающих в среде углеводородсодержащего пласта, такой как пластовые воды или скважины для добычи метана угольных пластов.
Предложенные настоящим изобретением способы также обеспечивают возможность генетических изменений микроорганизмов. Благодаря идентификации ферментативных функций в резидентных микроорганизмах и стимуляторах, которые могут быть использованы для увеличения продуцирования метана, авторы настоящего изобретения могут использовать эту информацию для генетического инжиниринга микроорганизмов для сообщения им способностей, которые могут быть связаны со стимулированием и увеличением продуцирования метана. Селекция микроорганизмов описанными в данном описании способами повышает способность эффективно метаболизировать уголь и другие субстраты с высоким содержанием органических веществ. После проведения ферментативных анализов таких обогащенных культур, можно оптимизировать целевые стимуляторы и/или генетически модифицированные бактерии. Различные возможности усиления продуцирования метана из скважин включают введение в пласт идентифицированных стимуляторов, идентифицированных микроорганизмов, определенных сообществ организмов, генетически модифицированных организмов или любых их комбинаций.
В соответствии со способами согласно настоящему изобретению, автохтонные микроорганизмы идентифицируют и затем стимулируют для превращения углеводородов в метан. Микроорганизмы, присутствующие в пласте в природных условиях, являются предпочтительными, поскольку известно, что они способны выживать и активно размножаться в условиях окружающей пласт среды, и должны обеспечивать ферментные компоненты различных путей метаболизма, начиная от гидролиза углеводородов и до метаногенеза. Однако настоящее изобретение не ограничено использованием автохтонных микроорганизмов. При анализе ферментных профилей автохтонных микроорганизмов может быть желательным объединить такую информацию с информацией, касающейся экзогенных микроорганизмов. Эта информация может быть получена из известных микроорганизмов, предпочтительно таких, которые пригодны для выращивания в подземном пласте, и которые, аналогичным образом, обладают подобным потенциалом ферментативных процессов.
Термин «определенное микробное сообщество» или «DMA», как использовано в данном описании, относится к культуре более чем одного микроорганизма, в которой различные штаммы целенаправленно комбинируют или подбирают для оптимизации преобразования углеводорода в метан. Микроорганизмы сообщества являются «определенными» в том смысле, что в любой момент времени можно определить членов популяции путем использования генетических способов, таких как таксономия по гену 16S, как описано в данном описании. DMA необязательно остаются неизменными во времени, но могут эволюционировать как постоянно изменчивые культуры для оптимизации гидролиза углеводородов и продуцирования метана. Оптимально, DMA готовят для получения микроорганизмов, обладающих профилями сильного ферментативного действия в метаболических путях преобразования углеводородов в метан. DMA могут состоять из 2 или более микроорганизмов в любых комбинациях для получения бактериальных или архебактериальных видов, способных конвертировать углеводород в любые промежуточные соединения, приводящие к образованию метана, и/или любых метаногенных видов. Например, в DMA могут присутствовать 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или более организмов. Члены DMA проявляют синергическое действие в продуцировании метана между собой или вместе с микроорганизмами, присутствующими в углеводородсодержащем пласте.
Термин «микроорганизм» предполагает включение бактерий и архебактериальных организмов, а также связанных с ними грибов, дрожжей и плесневых грибов. Следует понимать, что бактерии и архебактерии являются типичными представителями микроорганизмов вообще, которые могут разлагать углеводороды и превращать образующиеся продукты в метан. Разграничительные линии между классами микроорганизмов не всегда являются четкими, особенно между бактериями и грибами. Поэтому предпочтительно использовать термин «микроорганизмы» для включения всех микроорганизмов, которые могут преобразовывать углеводороды в метан, независимо от обычно используемых классификаций. Однако из таких микроорганизмов предпочтительными являются такие, которые обычно классифицируются как бактерии и архебактерии. Если в описываемых способах используются экзогенные бактерии и архебактерии, то также могут быть использованы другие микроорганизмы, такие как грибы, дрожжи, плесневые грибы и подобные.
Термин «анаэробный микроорганизм», как использовано в данном описании, относится к микроорганизмам, которые могут жить и расти в атмосфере, содержащей меньшее количество свободного кислорода, чем тропосферный воздух (т.е. примерно менее чем 18% моль. свободного кислорода). Анаэробные микроорганизмы включают организмы, которые могут функционировать в атмосфере с концентрацией свободного кислорода менее чем около 10% мол., или менее чем около 5% мол., или менее чем около 2% мол., или менее чем около 0,5% мол.
Термин «факультативные анаэробы», как использовано в данном описании, имеет отношение к микроорганизмам, которые могут обеспечивать протекание процессов метаболизма или расти в средах либо с высокими, либо с низкими концентрациями свободного кислорода.
Конверсия углеводородов в метан требует активного участия метан-продуцирующих бактерий. Термин «метан-продуцирующая бактерия», как использовано в данном описании, относится к облигатным и факультативным анаэробным микроорганизмам, которые продуцируют метан в результате метаболического процесса. Присутствие метан-продуцирующих бактерий в образцах указывает на высокую вероятность in situ образования метана. Метан-продуцирующие бактерии обычно классифицируют на четыре основных группы микроорганизмов: Methanobacteriales, Methanomicrobacteria и родственные, Methanopyrales и Methanococcales. Как считается, все метан-продуцирующие микроорганизмы используют для синтеза метана элементы одних и тех же биохимических превращений. Метаногенез осуществляется в результате ряда химических реакций, катализируемых металлсодержащими ферментами. Одним из путей метаболизма является восстановление CO2 до CH4 путем последовательного введения атомов водорода по одному (CO2-восстановительный метаногенез). Еще одним путем является ферментация ацетата и соединений, содержащих один атом углерода (иных, нежели метан), в метан (ферментация ацетата или ацетокластический метаногенез). Последней стадией всех известных метаболических путей метаногенеза является восстановление метильной группы до метана с использованием фермента, известного как метилредуктаза. Поскольку присутствие метилредуктазы представляет собой общую особенность всех метан-продуцирующих бактерий; оно является отличительным признаком метан-продуцирующих микроорганизмов. Предпочтительным способом идентификации присутствия метан-продуцирующих бактерий является прямое тестирование гена метан-продуцирующей бактерии, необходимого для продуцирования фермента метилредуктазы. Альтернативно, присутствие метан-продуцирующих бактерий может быть определено путем сравнения выделенной рибосомальной 16S rДНК с библиотекой архебактериальных 16S rДНК с использованием методов, известных специалисту в данной области (как правило, называемых таксономией по гену 16S).
Классы метан-продуцирующих бактерий включают, наряду с другими, Methanobacteriales, Methanomicrobacteria, Methanopyrales, Methanococcales и Methanosaeta (например, Methanosaeta thermophila). Конкретные примеры метан-продуцирующих бактерий включают Methanobacter thermoautotorophicus и Methanobacter wolfeii. Метан-продуцирующие бактерии могут также продуцировать метан путем метаболической конверсии спиртов (например, метанола), аминов (например, метиламинов), тиолов (например, метилмеркаптана), и/или сульфидов (например, диметилсульфида). Примеры таких метан-продуцирующих бактерий включают метан-продуцирующие бактерии из родов Methanosarcina (например, Methanosarcina barkeri, Methanosarcina thermophila, Methanosarcina siciliae, Methanosarcina acidovorans, Methanosarcina mazeii, Methanosarcina frisius); Methanolobus (например, Methanolobus bombavensis, Methanolobus tindarius, Methanolobus vulcani, Methanolobus taylorii, Methanolobus oregonensis); Methanohalophilus (например, Methanohalophilus mahii, Methanohalophilus euhalobius); Methanococcoides (например, Methanococcoides methylutens, Methanococcoides burtonii); и/или Methanosalsus (например, Methanosalsus zhilinaeae). Они могут также представлять собой метан-продуцирующие бактерии из рода Methanosphaera (например, Methanosphaera stadtmanae и Methanosphaera cuniculi, которые, как было продемонстрировано, метаболизируют метанол в метан). Дополнительно, они могут представлять собой метан-продуцирующие бактерии из рода Methanomethylovorans (например, Methanomethylovorans hollandica, которые, как было показано, метаболизирует метанол, диметилсульфид, метилмеркаптан, монометиламин, диметиламин и триметиламин в метан).
Как описано в данном описании, отличительным признаком настоящего изобретения является то, что микробные сообщества, полученные из разнообразных образцов окружающей среды, подлежат исследованию с использованием геномных средств, как указано выше; кроме того, микробные популяции могут быть культивированы и необязательно выделены и/или обогащены в лаборатории с использованием способов согласно изобретению. С применением таких подходов на геномном уровне и путем специфической характеристики ферментных профилей микроорганизмов, участвующих в конверсии углеводородов в метан, можно достичь фундаментального понимания метаболизма микробных сообществ и, более конкретно, метаногенного разложения угля в пластовых водах и угольных пластах. В таком случае будет возможно выяснить экологическую нишу каждой популяции и, в конечном счете, разработать стимуляторы и/или DMA, которые дадут возможность достичь увеличения биологического продуцирования метана.
В соответствии со способами согласно настоящему изобретению микроорганизмы, обитающие в среде углеводородсодержащего пласта (автохтонные микроорганизмы), и/или ферменты, присутствующие в таких микроорганизмах, идентифицируют и затем стимулируют или модулируют с целью превращения углеводородов в метан. Микроорганизмы, обитающие в природных условиях в пласте, являются предпочтительными, потому что известно, что они способны выживать и активно размножаться в среде пласта. Однако настоящее изобретение не ограничено использованием автохтонных микроорганизмов. Могут быть идентифицированы экзогенные микроорганизмы, пригодные для выращивания в подземном пласте, или могут быть идентифицированы ферменты из них, и такие микроорганизмы или ферменты вводят в пласт известными способами введения до, во время или после реализации способа согласно настоящему изобретению. Например, если пласт содержит только два микроорганизма из желательного трехкомпонентного сообщества, или только две из трех желательных ферментных функций для ферментативного пути метаболизма углеводорода в метан, то в пласт могут быть введены отсутствующие микроорганизмы, фермент или стимулятор для таких микроорганизмов или фермента. Микроорганизм, автохтонный или экзогенный, может также представлять собой рекомбинантно модифицированные или искусственные организмы.
Анализы метагенома и нуклеиновых кислот
В настоящем изобретении представлен новый подход и потенциально общий принцип увеличения продуцирования метана. Он включает описание геномов и метагеномов, наиболее фундаментальных биологических объектов в природе. Путем характеристики генома сообщества в целом, известного также как метагеном, в местах образования метана, можно достичь фундаментального понимания продуцирования метана микроорганизмами, включая используемые субстраты и образующиеся промежуточные соединения и продукты. Кроме того, могут быть выявлены взаимодействия и синергические эффекты между разными популяциями вследствие переноса электронов, которые, в конечном счете, приводят к каскадному переносу энергии в направлении к метану. Данные культивирования в комбинации с геномными результатами позволяют предположить, что микробные популяции и, вследствие этого, образование газа в подземных условиях могут быть стимулированы внешними воздействиями, состоящими во введении дополнительных субстратов, реактантов или факторов роста, и/или в засеве определенными микроорганизмами, которые приводят к увеличению продуцирования метана. Способы согласно настоящему изобретению и получаемые при их использовании результаты являются первым исследованием в области подземной микробиологии, интегрирующим метагеномику, культивирование микроорганизмов и геномный анализ выделенных штаммов. Результаты демонстрируют, что для разработки комплексного понимания экосистемы необходимо учитывать взаимозависимость этих дисциплин.
Термин «метагеном» или «метагеномика», как использовано в данном описании, относится к генетическому материалу и анализу этого генетического материала, полученному из проб окружающей среды, представляющему профиль всех микроорганизмов, присутствующих в образце. Метагеномика также называется в данной области «геномикой сообщества» или «геномикой окружающей среды». Как правило, метагеномика включает секвенирование нуклеиновой кислоты и анализ общей ДНК популяции организмов, выделенной из окружающей среды, например, коллективной ДНК, выделенной из всех микроорганизмов в образце без необходимости культивирования штаммов самих индивидуальных членов микробной популяции.
В общем, сначала выделяют ДНК из сообщества микроорганизмов в целом, т.е. метагеном, и затем амплифицируют с использованием ген-специфических праймеров (обычно, универсальных праймеров для гена 16S) и технологии полимеразной цепной реакции (ПЦР). Затем фрагменты очищают с использованием ряда методик и затем лигируют к молекулярным носителям (например, плазмидную ДНК) и трансформируют в бактерии (обычно, E. coli) как часть процесса клонирования с получением большого количества изолированных фрагментов ДНК. Культуры индивидуальных бактериальных колоний используют для выделения индивидуальных клонов (рекомбинантная плазмидная ДНК), и затем эти клоны секвенируют с использованием мишень-специфических праймеров. Полученные ДНК-последовательности затем сравнивают с ДНК-последовательностями известных штаммов по молекулярно-генетическим базам данных. В большинстве случаев, можно предположить идентичность микроорганизмов, если наблюдаются близкие совпадения с известными микроорганизмами, обладающими известными физиологическими и экологическими характеристиками.
Обычно, ДНК выделяют любыми известными в данной области способами из полученной из окружающей среды ДНК и затем разрезают на фрагменты, которые используют для составления библиотеки клона ДНК. Библиотеки клонов могут быть либо библиотеками с малыми или средними по размеру вставками (с размером вставки 2-15 т.о.), либо библиотеками с большой вставкой бактериальной искусственной хромосомы (BAC) или фосмиды (размер вставки до 150 т.о.), которые могут быть секвенированы в случайном порядке или целенаправленно.
Дальнейшие анализы метагенома включают культуро-независимый анализ 16S рРНК для определения филогенетического разнообразия (называемый 16S-таксономией), и дополнительный анализ последовательности для идентификации представляющих интерес генов в метагеноме. При секвенировании в случайном порядке клоны выбирают случайно и секвенируют с конца, и полученные последовательности собирают в большие по размеру непрерывно перекрывающиеся фрагменты («контиги») путем выравнивания перекрывающихся последовательностей. Полученные данные представляют собой контиги разной длины, а также более короткие не собранные воедино фрагменты. Наличие полностью секвенированных «эталонных» геномов может облегчить процесс сборки для близкородственных геномов. В случае их отсутствия, контиги могут быть отнесены к разным «ячейкам» на основании содержания в них G+C (гуанин+цитозин), использования кодонов, области охвата последовательности, присутствия коротких n-меров (частей нуклеотидов) и других параметров, что позволяет разделить их на группы, которые можно рассматривать в качестве «видов». Кодирующие последовательности (CDS, гены) затем прогнозируют по этим данным последовательностей различными способами. Часто в подходе случайного секвенирования идентифицированные гены не могут быть отнесены к конкретным видам микроорганизмов (т.е. таксономическая или филогенетическая привязка отсутствует), но, тем не менее, они представляют способности всего микробного сообщества и могут отображать характеристики окружающей их среды. При «целенаправленном» секвенировании клоны сначала подвергают скринингу на присутствие желательного гена (например, методом ПЦР-амплификации) или генной функции (путем функционального анализа). Секвенирование клонов-мишеней с большими вставками целиком дает возможность выделять полные опероны, например, такие, которые кодируют метаболические пути.
Общим подходом является использование в качестве мишени фосмид, несущих филогенетически информативные гены, такие как 16S рРНК. В этом способе, известном как «филогенетическая фиксация», в случае детектирования гена 16S рРНК, фосмидная вставка секвенируется целиком, что позволяет отнести геномную ДНК-последовательность к определенному филотипу. Такой подход помогает соотнести филогенез (рРНК) с предполагаемыми функциональными генами (предсказанными по фланкирующим последовательностям вставки). Фосмиды, несущие процесс-специфические или биомаркерные гены (например, для процессов, которые могут быть значительными в рассматриваемой среде, таких как окисление метана или денитрификация), могут также быть мишенями для секвенирования с целью получения дополнительной информации о путях метаболизма для этих процессов. Благодаря объединению случайного и целенаправленного подходов, представляющие интерес гены (например, гены 16S рРНК от неизвестных филотипов) или новые гены, идентифицированные на этапе случайного секвенирования, могут быть использованы для скрининга и нацеливания на другие клоны для секвенирования, или для идентификации связующих клонов и расширения охвата генома.
В одном конкретном сравнительном анализе гены, идентифицированные в метагеноме и/или представленных в нем микроорганизмах, можно сравнить с известными семействами белков для определения присутствия генных продуктов, кодирующих ферменты в метаболических путях, задействованных в конверсии углеводорода в метан. Например, база данных Pfam представляет собой большую коллекцию семейств белков, каждое из которых представлено множеством выравненных последовательностей и скрытых марковских моделей (HMM). Белки обычно состоят из одного или нескольких функциональных участков, обычно называемых доменами. Разные комбинации доменов обеспечивают многообразие белков в природе. Поэтому идентификация доменов, которые присутствуют в белках, может прояснить их функцию. См. The Pfam protein families database: R.D. Finn, J. Tate, J. Mistry, P.C. Coggill, J.S. Sammut, H.R. Hotz, G. Ceric, K. Forslund, S.R. Eddy, E.L. Sonnhammer и A. Bateman, Nucleic Acids Research, (2008), Database Issue 36: D281-D288. Путем сравнения геномной информации с базой данных Pfam, предложенные тут способы обеспечивают получение профиля ферментативных функций, присутствующих в метагеноме, индивидуальных штаммах микроорганизмов, DMA или любых их комбинациях.
Идентификация стимуляторов
Термин «стимулятор», как используется в данном описании, относится к любому фактору, который может быть использован для увеличения или стимуляции биогенного продуцирования метана в углеводородсодержащем пласте. Предпочтительно, стимулятор представляет собой субстрат, реактант или кофактор для фермента, который участвует в метаболическом пути, задействованном в конверсии углеводорода в метан. В определенных случаях стимулятор добавляют для модулирования фермента (увеличения, уменьшения или модулирования любым путем), присутствующего в обитающем в углеводородсодержащем пласте микроорганизме. В определенных случаях стимулятор может представлять собой сам фермент, микроорганизм (например, микроорганизм, экспрессирующий фермент или еще один белок, модулирующий соответствующий фермент или такой микроорганизм, полученный рекомбинантными или синтетическими методами), или определенное микробное сообщество. В любом случае, назначение стимулятора заключается в усилении имеющегося продуцирования путем повышения уровня активности или роста микроорганизма, или в увеличении, снижении или любом модулировании ферментативной активности фермента, участвующего в пути метаболизма, задействованном в конверсии углеводорода в метан, чтобы оптимизировать конечное продуцирование метана из углеводородсодержащего пласта.
Стимуляторы могут обеспечивать усиление действия, замену, или добавление любого фермента, не являющегося оптимально представленным или функциональным в углеводородсодержащей среде. Цель заключается в оптимизации и/или завершении пути метаболизма углеводорода в метан. В общем, это требует предоставления ферментов или микроорганизмов, экспрессирующих ферменты, которые способны конвертировать углеводород в продукт, такой как водород, диоксид углерода, ацетат, формиат, метанол, метиламин или любой другой метаногенный субстрат, и метаногенных ферментов. Общие категории ферментов включают ферменты, способные осуществлять гидролиз низкосортного угля, деполимеризацию угля, анаэробное или аэробное разложение полиароматических углеводородов, гомоацетогенез и метаногенез (включая гидрогенотрофный или CO2-восстановительный и ацетокластический), и любые их комбинации для достижения конверсии углеводорода в метан. Ферменты, обеспечивающие такие функции, могут включать, например, пероксидазы, фенолоксидазы, алкогольоксидазы, лакказы, гидролазы, гликозилгидролазы, эстеразы, этеразы, оксидазы, нитрогеназы, целлюлазы, амилазы, глюканазы, пулланазы, редуктазы, дисмутазы, оксигеназы, монооксигеназы, диоксигеназы, каталазы, гидрогеназы и карбоксилазы.
Примеры стимуляторов включают лиофилизированные микроорганизмы, такие как метан-продуцирующие бактерии, синтрофы, ферментативный и/или гидролитический микроорганизм; или стимулятор, субстрат, реактант или кофактор может иметь химическую природу, включая такие соединения, как азот, фосфор, калий, витамины, металлические микроэлементы, дрожжевой экстракт, серосодержащее соединение, азотсодержащее соединение, фосфорсодержащее соединение, микроэлемент, электроноакцептор, электронодонор, галоген, металл, спирт, органическая кислота, алкан, алкен, алкин, ароматическое соединение, амин, простой эфир, альдегид, кетон, тиол, ацетат, ароматический углеводород и газ.
После идентификации фермента способом согласно настоящему изобретению могут быть идентифицированы соответствующие субстрат, реактант или кофактор для этого фермента.
Конкретные стимуляторы включают, например, дрожжевой экстракт, NH4Cl, NaNO3, K2HPO4, кофермент M, PO4, витаминную смесь без фосфата, металлические микроэлементы, O2, H2, фосфористые соединения, молочную кислоту, минеральные почвенные структурообразователи (такие как хлоридные, аммониевые, фосфатные, натриевые, калиевые, магниевые и кальциевые), металлсодержащие добавки (такие как Mn, Fe, Co, Zn, Cu, Ni, Se, W или Mo), витаминные добавки (такие как пиридоксим, тиамин, рибофлавин, кальций, пантотенат, липоевая кислота, парааминобензойная кислота, никотиновая кислота, витамин B12, биотин, фолиевая кислота и меркаптогептансульфоновая кислота, пируват, алифатические спирты, метанол, этанол, 2-пропанол, 2,3-бутандиол, ваниллат, глицин, цистеин, формиат, этаноламин и 3,4,5-триметоксибензоат, водосодержащие добавки, формиат, ацетат, лактат, пируват, NaCl, целлюлоза, раствор минеральных веществ, коричная кислота, бензойная кислота, 1,2-динитроглицерин (DNG), аласан (биоэмульгатор), композиция удобрения, хитин, хитозан, хлорат, перхлорат и любые их комбинации.
Введение стимуляторов для увеличения продуцирования метана
Способы и методы согласно настоящему изобретению могут быть легко использованы в полевых условиях и для увеличения in situ или ex situ образования метана из любого углеводородсодержащего пласта, такого как уголь. Существует несколько способов или комбинация методов введения, известных в данной области, которые могут быть использованы in situ. Стимуляторы, DMA или микроорганизмы, идентифицированные способами согласно настоящему изобретению, могут быть введены непосредственно в трещины в пласте. Должны учитываться такие факторы, как ориентация разломов, in situнаправление распространения напряжений в настоящий момент, геометрия продуктивного пласта (угля и/или сланца) и локальное строение. Например, в угольных пластах существует две основные сети трещин (называемые зонами кливажа), называемые системами главного кливажа и второстепенного кливажа. Зоны главного кливажа часто являются более протяженными в горизонтальном направлении и проницаемыми, в то время как зоны второстепенного кливажа (которые примыкают к зонам главного кливажа), являются менее протяженными и проницаемыми. При стимуляции скважин для добычи метана угольных пластов искусственно создаваемые трещины пересекаются с первичными зонами главного кливажа, обеспечивая улучшенный доступ к продуктивному пласту. Однако в тех случаях, когда существующее в данный момент in situнаправление распространения напряжений перпендикулярно зонам главного кливажа, давление напряжения сдавливает зоны главного кливажа, тем самым уменьшая проницаемость, но, в то же время, in situ давление увеличивает проницаемость системы второстепенного кливажа. В таких условиях, искусственно созданные трещины перпендикулярны к направлению второстепенного кливажа, обеспечивая лучший доступ к природной системе трещин продуктивного пласта. Геометрия нагнетающей и продуктивной скважин и использование или неиспользование горизонтальных шурфов для доступа к продуктивному пласту, зависят преимущественно от местных геологических и гидрологических условий.
Целью стимуляции выхода метана угольных пластов методом гидроразрыва, как в обычных нефтяных и газовых скважинах, является создание искусственной сети трещин, которая соединяется с природной сетью трещин продуктивного пласта. Стимуляторы, DMA или микроорганизмы, идентифицированные способами согласно настоящему изобретению, могут быть введены в природные и искусственно сформированные трещины под давлением для нагнетания смеси в природные трещины вглубь продуктивного пласта для увеличения скоростей биоконверсии и эффективности. При стимуляции продуктивных пластов путем гидроразрыва песчаный агент для расклинивания трещин и различные химические вещества могут быть закачаны в пласт под высоким давлением через буровую установку.
Стимуляторы, DMA или микроорганизмы могут быть введены под давлением в продуктивный пласт одновременно со стимулированием методом гидроразрыва и/или после образования трещин гидроразрыва. Как предполагается, основная часть in situ деятельности микроорганизмов будет происходить после стимуляции методом гидроразрыва и удаления текучих сред для закачивания скважины, когда будут восстановлены анаэробные условия подземной среды. Однако при одновременном in situмикробной стимуляции и возбуждении гидроразрывом, предпочтительным является использование текучих сред для стимуляции в бескислородных или малокислородных условиях, чтобы поддерживать анаэробные условия в продуктивном пласте, или оно может быть без труда реализовано после стимуляции. Нагнетание аэробных бактерий при одновременной стимуляции будет приводить к быстрому расходованию кислорода и возврату к анаэробным условиям.
В некоторых случаях, вместе с текучими средами для гидроразрыва пласта могут быть использованы текучие среды для предварительной обработки, которые модифицируют уголь, углистый сланец или сланец с высоким содержанием органических веществ для биоконверсии. Однако предпочтительным способом стимуляции in situбиоконверсии органического вещества является нагнетание стимуляторов, DMA или микроорганизмов под давлением и в анаэробных условиях после стимуляции гидроразрывом и последующей промывки скважины.
Стимуляторы, DMA или микроорганизмы, идентифицированные способами согласно настоящему изобретению, могут быть введены путем повторного закачивания пластовых вод под землю, как изображено на фиг.16. Коротко, метан и пластовые воды выкачивают из обсадной трубы 1 скважины в разделительный резервуар 2 (известный также как барабанный газоотделитель) для удаления газа из воды. Пластовые воды хранят в резервуаре-хранилище 3, из которого они могут быть направлены в накопительную станцию или поданы для повторной закачки под землю. Затем стимуляторы, DMA или микроорганизмы могут быть добавлены в подготовительный резервуар 4 и смешаны с извлеченными пластовыми водами. Затем компрессор 5 или напорная система могут быть использованы для закачки стимуляторов, DMA или микроорганизмов в пластовых водах под землю.
Растворенный in situ кислород, присутствующий в пластовых водах, может не быть доступным для микроорганизмов в угольных пластах и, тем самым, становится ограничивающим фактором для повышения продуцирования метана. Введение стимуляторов, DMA или микроорганизмов, или подача газов, жидкостей, гелей или твердых веществ могут создавать среду, пригодную для увеличения продуцирования метана, включая штаммы, способные к аэробному разложению углеводородов, связанных с кислородом. Например, в примере варианта осуществления посевной материал, состоящий из подходящих автохтонных штаммов, таких как Pseudomonas, в количестве 107 клеток на мл, может быть смешан с гелем, состоящим из органических субстратов, таких как глицерин, которые могут быть использованы в качестве питательных веществ, стимулирующих рост путем ферментации и секреции метаболитов, включая водород, который может быть использован метан-продуцирующими бактериями. После ассимиляции геля, он будет медленно выделять оптимальные количества кислорода, который, в свою очередь, будет использоваться штаммами, способными к аэробному разложению углеводородов. Такие добавки и создаваемый в результате метаболизм будут стимулировать перенос электронов, способствующий увеличению продуцирования метана и выхода, по сравнению с контрольными скважинами в этом же пласте, которые не подвергались воздействию. Это особенно предпочтительно для штаммов, обладающих способностью к росту в аэробных или анаэробных условиях, и которые могут адаптировать свой метаболизм для разложения углеводородов. В отдельном варианте осуществления пластовые воды с высокой концентрацией растворенного кислорода нагнетают в скважину с целью подачи некоторого количества кислорода, необходимого для катализируемых оксигеназой реакций. Кислород может быть растворен в пластовых водах путем аэрации с помощью механических систем, таких как турбинные мешалки или другие механизмы. Альтернативно, для подачи кислорода в анаэробную среду может быть использован промежуточный механизм. Например, для стимуляции выделения кислорода ферментами хлоратредуктазой и хлоритдисмутазой, присутствие которых было определено при проведении анализов метагенома, в качестве электроноакцептора может быть использован хлорат.
В альтернативном варианте осуществления способ, основанный на использовании частиц, может быть применен для распределения стимуляторов, DMA или микроорганизмов (в совокупности, средства воздействия) во время проведения гидроразрыва. Цель заключается в использовании таких средств воздействия для обеспечения устойчивого увеличения продуцирования метана. Усовершенствованная система подачи нагнетает средства глубоко в трещины скважины и обеспечивает распределение с замедленным во времени высвобождением. Например, средство воздействия для скважины может быть приготовлено либо в виде покрытия с пролонгированным высвобождением на зернах песка, используемого в процессе гидроразрыва, либо в виде твердых частиц, которые медленно растворяются со временем; предусматривается, что они будут иметь приблизительно такой же размер, как зерна песка, используемого в процессе гидроразрыва, и могут быть смешаны вместе перед добавлением в раствор гуаровой смолы, известный как проппант. В любом варианте осуществления, после нагнетания проппанта и частиц в скважину под давлением, зерна песка с покрытием или твердые частицы, смешанные с песком, нагнетают под давлением в трещины скважины, поддерживая их в открытом состоянии для облегчения выхода газа или нефти. Поскольку средства воздействия приготовлены в расчете на долговременное высвобождение, подобно некоторым фармацевтическим препаратам, соединения и/или микробы будут медленно растворяться и диффундировать в окружающие пластовые воды и зоны кливажа в угле (или в тонкие трещины скальной породы в случае нефти), где предположительно обитают прикрепленные бактерии. Таким образом, растворяющиеся средства непрерывно стимулируют биогенную конверсию угля в метан. Композиции могут быть составлены таким образом, чтобы обеспечить высвобождение средства воздействия на протяжении периода времени в несколько часов, дней, недель или месяцев, с целью оптимизации процесса стимуляции выделения метана. Покрытия или частицы могут быть приготовлены в условиях отсутствия кислорода для поддержания жизнеспособности строго анаэробных микроорганизмов, или они могут также содержать газы, которые стимулируют продуцирование метана.
Приведенные ниже примеры предназначены для иллюстрации изобретения, но не его ограничения.
Пример 1
Отбор проб и накопление метан-продуцирующих микроорганизмов из скважин для добычи метана угольных пластов
Пластовые воды в объеме 200 л отбирали из резервуара-хранилища и в объеме 20 л из отстойника на скважине для добычи метана угольных пластов, расположенной в месторождении Сан-Хуан, Колорадо, США. Затем образцы воды фильтровали через серию стерильных сит с размерами отверстий от 1 мм до 45 мкм для удаления крупных частиц угля и нефтепродуктов, поступающих вместе с пластовыми водами. Затем часть образца переносили в стерильную бутылку емкостью 1 л, и через ее содержимое барботировали азот (N2) с использованием переносного резервуара и стеклянной пипетки. Затем бутылки герметично закупоривали пробками из бутилкаучука и использовали для инокуляции.
Среда состояла из минеральной основы и сырого угля в качестве источника углерода, дозированных в пробирки Хангейта с 5 мл культуры и 0,5 г угля в качестве единственного источника углерода.
Состав среды для накопления метан-продуцирующих бактерий и чистых культур:
На 1 л стерильной пластовой воды:
коммерческий (из коллекции ATCC) раствор витамина и микроэлемента по 10 мл каждого.
Стерилизовали при давлении 1 атм (101,32 кПа) в течение 15-30 минут и затем добавляли из маточного раствора:
дрожжевой экстракт до конечной концентрации 0,05%
Na2S×9H2O до конечной концентрации 3 мМ
цистеин-HCl до конечной концентрации 3 мМ.
Стерилизовали при давлении 1 атм (101,32 кПа) в течение 15-30 минут и затем добавляли из маточного раствора:
надлежащий источник углерода и энергии для метаногенеза:
газовая смесь CO2:H2/20:80 до давления 2 атм (202,64 кПа).
В некоторых культурах для стимуляции анаэробного дыхания и роста была использована смесь электроноакцепторов, состоящая из нитрата натрия (10 мМ), сульфата натрия (10 мМ) и фосфата железа (10 мМ). Среду готовили анаэробно путем дозирования всех компонентов в анаэробной камере с атмосферой из 5% H2, 5% CO2, и остальное N2. Другие культуры включали использование автоклавированного угля. Для приготовления сред не использовали восстановительные реагенты, такие как сульфид натрия или цистеин. Образцы инокулировали непосредственно в полевых условиях путем отбора в анаэробных условиях 1 мл из бутылок для образцов емкостью 1 л с помощью шприца и иглы, которые предварительно трижды продували азотом. Инокулированные пробирки инкубировали при температуре 30°C и направляли в лабораторию. После нескольких недель выращивания образцы обследовали на наличие роста с использованием микроскопа, и продуцирование метана измеряли с помощью газовой хроматографии. Улучшенные образцы отбирали по их способности расти на угле в качестве единственного источника углерода и по уровню продуцирования ими метана. Наивысшая концентрация метана была определена у культур, где электроноакцепторы отсутствовали. После шести последовательных пересевов первичного обогащенного образца, продуцирование метана становилось, по наблюдениям, воспроизводимым и масштабируемым, устойчиво давая содержание 3% в паровоздушном пространстве. Сообщество, выбранное для продолжения характеризации, переносили затем во флаконы для сыворотки, и продуцирование метана происходило стабильно на уровне около 3% в паровоздушном пространстве в течение от 10 до 30 дней при температуре 30°C.
Пример 2
Характеристика сообщества микроорганизмов из скважины для добычи метана угольных пластов и накопление метан-продуцирующих микроорганизмов
Общую ДНК сообщества экстрагировали из образцов пластовых вод способами, оптимизированными для эффективного отделения нуклеиновых кислот от угля, присутствующего в пластовых водах и обогащенных образцах. Геномные библиотеки были составлены из образца воды из резервуара-хранилища с использованием различных способов для оценки потенциальных систематических ошибок и для эффективного охвата всех популяций микроорганизмов, включая бактерии, архебактерии и эукариоты. Предшествующие геномные анализы на образцах из резервуара-хранилища выявили относительно низкую степень сложности по сравнению с такими окружающими средами, как почвы или вода морской поверхности. Примечательной особенностью было отсутствие эукариотических клеток. В геномных данных наблюдались две доминирующих клеточных линии, соответствующих Proteobacteria, Arcobacter и Chrysiogenes, геномы которых могут быть повторно собраны из ДНК сообщества. Их метаболизм может быть ассоциирован с разложением нефтепродуктов и других углеводородов и с дыханием в присутствии арсенитов.
Получение ДНК
Воду, пропущенную через сито с размером отверстий менее 45 мкм, затем фильтровали с помощью серии соединенных последовательно мембран с размерами пор 3, 0,8 и 0,1 мкм. Мембраны извлекали из фильтровального аппарата, замораживали с буфером Tris-EDTA при температуре -20°C и направляли в лабораторию. ДНК экстрагировали из мембран следующим образом.
Фильтры промывали в течение 45 минут при комнатной температуре на вращающемся колесе в избыточном объеме лизисного буфера (50 мМ NaCl, 50 мМ Tris с pH 8,0, 50 мМ EDTA, 5% SDS, 4% поливинилпирролидона, 1% полиэтиленгликоля (8000), 0,5 M глюкозы, 200 мМ бета-меркаптоэтанола, 10 мМ спермидина, 10 мМ аскорбиновой кислоты, 20 мкг/мл бис-бензамида и 100 мкг/мл дрожжевой тРНК). С каждого образца собирали супернатанты, и клетки разрушали добавлением к каждому образцу пяти шариков из нержавеющей стали диаметром 1/8 дюйма (3,175 мм) и одного с диаметром 3/8 дюйма (9,525 мм), а также 1 г стеклянных бусин размером 0,5 мм, и встряхиванием образцов в течение 4 минут при 1500 тактов в минуту в аппарате Geno/Grinder 2000. К каждому образцу добавляли хлорид натрия до концентрации 0,8M, образец однократно экстрагировали смесью «фенол-хлороформ», один раз хлороформом, и осаждали их изопропанола.
В качестве альтернативы фильтрации, сначала из пластовых вод выделяли осадок путем центрифугирования при скорости 10000 об/мин в течение 30 минут при температуре 4°C, супернатант удаляли в свежий контейнер, осадок клеток/обломков суспендировали в лизисном буфере, и ДНК очищали таким же образом, как описано выше. Остаточный биологический материал извлекали из надосадочной жидкости добавлением полиэтиленгликоля 8000 до концентрации 10%, инкубированием при температуре 4°C в течение ночи и затем центрифугированием при скорости 10000 об/мин в течение 30 минут при температуре 4°C, суспендированием осадка в лизисном буфере и повторением описанной выше методики очистки. Полученную в результате очищенную ДНК растворяли в малом объеме 10 мМ Tris с pH 8,0, 1 мМ EDTA, и анализировали методами спектроскопии и гель-электрофореза.
Составление геномной библиотеки
Геномную библиотеку составляли путем разрезания метагеномной ДНК из пула описанных выше микроорганизмов на фрагменты со средним размером 1-8 т.о. с помощью устройства GeneMachines HydroShear для геномных растворов, оборудованного стандартным блоком для создания сдвиговых нагрузок. ДНК сортировали по размеру на агарозных гелях, присоединяли к держателям для ДНК и лигировали в клонирующий вектор E.coli со средним числом копий с использованием стандартных процедур, известных в данной области. Продукт лигирования трансформировали в E. coli методом электропорации, отбирали случайные клоны, выращивали в 1 мл культурах и экстрагировали плазмидную ДНК. Каждый клон секвенировали двунаправленно по методу Сангера.
Анализы последовательности
Таксономическое разнообразие пластовых вод (резервуар-хранилище) анализировали сравнением 16S генных последовательностей либо непосредственно из метагенома (последовательности из библиотеки окружающей среды), либо путем амплификации 16S генной последовательности из образцов ДНК, использованных для составления библиотеки метагенома. Эти анализы показали, что сообщество состояло из архебактерий и бактерий, но эукариотические клетки не присутствовали.
Результаты анализов индивидуальных метагеномов затем подвергали конвейерной обработке с помощью специализированной системы биоинформационного аннотирования, которая сначала идентифицировала все открытые рамки считывания (ORF) размером более 50 аминокислот. Для отнесения предполагаемых функций к каждой ORF, их сначала анализировали на принадлежность к семействам PFAM, TIGRFAM и SUPERFAM по имеющимся на данный момент коллекциям множественных выравниваний последовательностей и скрытых марковских моделей для соответствующих семейств белков с помощью прикладной программы HMMER. Дополнительно, программу BLASTp использовали для сравнения белков, идентифицированных в метагеноме, с безизбыточной базой данных белков при базе данных GenBank. Затем проводили поиск по аннотациям, полученным при такой конвейерной обработке, и сравнение метагенома из резервуара-хранилища, метан-продуцирующих обогащенных культур и выделенных штаммов. Анализы выявили большое число генов, которые нуждаются в кислороде, таких как диоксигеназы (нитропропан, фитаноил-CoA, толуат, бифенил-2,3-диол и дитерпеноид) и монооксигеназы (P450, алкан-, аммиак- и 2,4-дихлор-). Наряду с ферментами, нуждающимися в кислороде, было найдено также значительное число ферментов, обеспечивающих защиту от кислорода, таких как каталазы, супероксиддисмутаза, рубредоксин и тиоредоксин.
Метан-продуцирующие обогащенные культуры анализировали таксономически с использованием 16S генных последовательностей для доменов Bacteria (бактерии) и Archaea (архебактерии), последний из которых содержит метан-продуцирующие бактерии. Сообщество анализировали после 10 и 30 дней инкубации путем амплификации этого фрагмента сообщества, создания библиотеки 16S фрагментов путем клонирования их в вектор, его трансформации в E. coli и секвенирования клонированных фрагментов, как описано выше. Эти последовательности затем сравнивали с опубликованными базами данных для определения ближайших культивируемых родственных культур. Как показано на фиг.2A, в бактериальном разнообразии доминировали организмы, относящиеся к Pseudomonas, Desulfuromonas, Pelobacter, Desulfovibrio, после 10 дней, и Spirochaeta, Erysipelothrix, Thauera, Clostridium, Acholeplasma и Magnetospirillumбыли менее распространенными через 10 или 30 дней. Как показано на фиг.2B, в архебактериальной популяции доминировала метан-продуцирующая бактерияMethanolobusна день 10, и на 30-й день Methanocalculus,и появлялся неохарактеризованный Crenarcheaota. Фиг.3 иллюстрирует бактериальное разнообразие в конкретном образце пластовых вод при проведении анализа по генным последовательностям RecA из метагенома.
Образцы из устья скважины - представители бактериальной 16S таксономии
Dictyoglomus
Planctomycetaceae
Rubrobacteraceae
Thermodesulfovibrio
Clostridiales
Bacteroidales
Thermacetogenium
Thermotoga
Thermosediminibacter
Deltaproteobacteria
Syntrophomonas
Bacteroidetes
Bacteroidales
Termodesulfovibrio
Magnetobacterium
Sporomusa
Deferribacteraceae
Thermotoga
Clostridiales
Sulfurospirillum
Proteiniphilum
Coprothermobacter
Anaerosinus
Azospira
Ceillonellaceae
Nitrospiracaea
Thermoanaerobacterium
Ruminococcaceae
Clostridia
Therminocola
Peptococcaceae
Clostridiales
Proteobacteria
Ralstonia
Ruminococcaceae
Bactersidales
Propionibacteriaceae
Niastella
Serratia
Thermodesulfovibrio
Niastella
Chryseobacterium
Smithella
Gammaproteobacteria
Magnetobacterium
Proteiniphilum
Spirochaetaceae
Представители архебактериальной 16S таксономии - метаногенез
Thermoprotei
Methanothrix
Methanofollis
Methanobacterium
Methanomicrobiales
Methanocorpusculum
Desulfurococcales
Выделение штамма
Функциональное обогащение и пробы окружающей среды были использованы для выделения индивидуальных штаммов путем компартментализированного культивирования микроорганизмов окружающей среды (EMCC, как описано в PCT/US2008/057919, WO2008/116187), или стандартными способами, такими как встряхивание на агаре. Способ EMCC осуществляли путем инкапсулирования суспензии клеток в гелевых микрокапельках (GMD) и инкубации в аэробных условиях при температуре 30°C. Клетки образовывали колонии, которые сортировали на стерильной среде для субкультивирования. Полученные клеточные культуры затем анализировали по 16S для идентификации уникальных штаммов. Последний способ заключался в использовании плавленого агара, на который наносили суспензию клеток из серии разведений. Пробирки затем закупоривали, и газовую среду над образцом заменяли N2:CO2 или H2:O2, и инкубировали до начала образования колоний клеток, которые отбирали и субкультивировали. Выбранные выделенные штаммы затем культивировали в анаэробных условиях, причем некоторые из них были способны расти либо в аэробных, либо в анаэробных условиях.
Для выделения индивидуальных штаммов из метан-продуцирующей обогащенной культуры, 100 мкл образца разводили и инокулировали в пробирки Хангейта с агаром и углем для образования колоний и обеспечения возможности выделения конкретных линий. Дополнительно, обогащенную культуру инкапсулировали и инкубировали в аэробных условиях для образования микроколоний, которые высеивали на 96-луночные планшеты высокоскоростного устройства для сортировки клеток. Такие методики выделения привели к получению штаммов, которые затем были идентифицированы с помощью 16S генных последовательностей (как показано в фиг.2A и 2B). Из этой исходной метан-продуцирующей обогащенной культуры выращивали индивидуальные штаммы Pseudomonas, Desulfuromonas, Pelobacter, Desulfovibrio, Thauera, Acholeplasma и Methanocalculus pumilus. Индивидуальные штаммы затем могут быть восстановлены в сообщества в функционально обогащенной культуре, как определенные микробные сообщества. Некоторые выделенные штаммы также использовали для секвенирования генома с целью идентификации генов и путей метаболизма, задействованных в разложении угля. Например, штамм Pseudomonas содержал оксигеназы, принимающие участие в разложении некоторых полициклических ароматических углеводородов (PAH), такие как 3-фенилпропаноатдиоксигеназа, алкансульфонатмонооксигеназа и пирокатехин-2,3-диоксигеназа, наряду с другими.
Выделенные клеточные культуры - 16S таксономия
Культивирование толерантных к кислороду штаммов микроорганизмов из пластовых вод
Инокуляция анаэробно отобранных пластовых вод в аэробные среды приводила к росту различных клеточных линий, способных ассимилировать экзогенные источники углерода, такие как дрожжевой экстракт, но при этом способных расти на пластовых водах и сыром угле в качестве единственного источника углерода. Это позволяет предположить, что в среде существуют клетки с генетическим и физиологическим потенциалом аэробного разложения углеводородов. Такие штаммы включают генетически неоднородные члены группы Pseudomonas, такие как Pseudomonas sp., Pseudomonas 3CB6, Pseudomonas sp. SCT, Pseudomonas sp.G-R2A7 и другие, такие как Hvphomonas polymorpha, Staphylococcus haemolyticus, некультивируемая бактерия, некультивируемая денитрифицирующая бактерия (Thalassospira, Pannonibacter phragmatis (Achromobacter), Azoarcus (Betaproteobacteria), Tistrella mohilis, и некультивируемая бактерия (Thaurea).Многие из них могут расти в присутствии угля в качестве единственного источника углерода и продуцировать значительные количества биомассы.
Участки локализации метана угольных пластов и связанные с ними пластовые воды считаются бескислородными, и современные парадигмы указывают, что доминирующий метаболизм, по-видимому, связан с ферментацией и анаэробным дыханием нитратных, сульфатных и других концевых электроноакцепторов, но не с кислородом. Однако метагеномные анализы пластовых вод показали, что микроорганизмы могут быть пригодны для культивирования с использованием пластовых вод в качестве минеральной основы и угля в качестве единственного источника углерода, и различных комбинаций электроноакцепторов, включая кислород, нитрат, сульфат или фосфат железа, для стимуляции дыхания микроорганизмов. Как показано на фиг.4, широкий спектр монооксигеназ и диоксигеназ был обнаружен в образцах пластовых вод, обогащенных метан-продуцирующих культур, а также в выделенных штаммах Pseudomonas и Thallasospira.
Идентификация ферментных семейств
Метагеномные данные, полученные для образцов продуктивного пласта и обогащенных метан-продуцирующих культур, позволили идентифицировать несколько классов ферментов, которые могут быть использованы для воздействия с целью увеличения продуцирования метана в углеводородсодержащих пластах. В приведенной ниже таблице 1 представлены данные Pfams для идентифицированных ферментных семейств, которые функционируют на различных ферментативных стадиях конверсии углеводорода в уголь. Фиг.5-12 дополнительно иллюстрируют разнообразие ферментов, идентифицированных в ряде Pfams.
Пример 3
Стимулирование продуцирования метана
Наличие определенного микробного сообщества, продуцирующего метан из угля in vitro, а также набора штаммов, способных осуществлять аэробное разложение угля, привело к проведению лабораторных экспериментов, в которых тестировали влияние различных стимуляторов на продуцирование метана. Фиг.13 показывает результаты стимуляции системы культур с различными количествами кислорода (2%, 4% и 10% O2) и электроноакцепторными сульфатом (при концентрациях 0,1 мМ, 1 мМ и 10 мМ) и нитратом (при концентрациях 0,1 мМ, 1 мМ и 10 мМ).
Наибольшее увеличение продуцирования метана наблюдали в ответ на кратковременные импульсные подачи кислорода, что позволяет предположить, что лимитирующим фактором продуцирования метана из угля может быть перенос электронов, создаваемый при аэробном разложении углеводородов. Это разложение стимулируется добавлением кислорода в качестве реактанта для ферментов классов оксигеназ, присутствующих в некоторых штаммах, входящих в DMA. Однако когда кислород вводят в количествах выше оптимальных уровней, он подавляет метаногенез, возможно, вследствие замены CO2 как концевого электроноакцептора и/или окисления чувствительных к кислороду ферментов либо в метан-продуцирующих бактериях, либо в других анаэробных группах микроорганизмов.
Приведенная ниже таблица 2 представляет список предполагаемых оксигеназ и соответствующих организмов-хозяев, идентифицированных методом 16S геномных анализов.
На фиг.4 приведено сравнение профиля монооксигеназ и диоксигеназ, обнаруженных при проведении 16S геномных анализов микроорганизмов пластовых вод, обогащенной метан-продуцирующей культуры, а также выделенных штаммов Pseudomonas и Thallasospira.
Добавление кислорода к DMA может привести к увеличению продуцирования метана только в тех случаях, когда это не оказывает влияния на строго анаэробных членов. Толерантность анаэробных бактерий и метаногенных архебактерий к кислороду была недавно описана (Boga, H.I. и Brune, A. 2003. Hydrogen-dependent oxygen reduction by homoacetogenic bacteria isolated from termite guts, Appl. Environ. Microbiol., 69: 779-786), и могут быть проведены испытания толерантности по отношению к кислороду чистой культуры, содержащей DMA.
Фиг.14 показывает увеличение продуцирования метана после стимуляции h2 и ацетатом в культурах, выращенных с использованием угля в качестве единственного источника углерода.
Фиг.15 демонстрирует увеличение продуцирования метана после стимуляции триметиламином в культурах, выращенных с использованием угля в качестве единственного источника углерода.
Все публикации и патентные заявки, приведенные в настоящем описании, включены в настоящее описание посредством ссылки в такой степени, как если бы каждая отдельная публикация и патентная заявка была конкретно и индивидуально указана, как включенная в качестве ссылки.
Реферат
Изобретение относится к области биотехнологии и может быть использовано для повышения биогенного продуцирования метана. Способ включает: (a) получение последовательности нуклеиновой кислоты от одного или более микроорганизмов, выделенных из среды углеводородсодержащего пласта; (b) определение присутствия одного или более генных продуктов указанной последовательности нуклеиновой кислоты, где указанный генный продукт представляет собой фермент на пути метаболизма, вовлеченного в преобразование углеводорода в метан, выбранный из группы, состоящей из пероксидаз, фенолоксидаз, алкогольоксидаз, лакказ, гидролаз, гликозилгидролаз, эстераз, этераз, оксидаз, нитрогеназ, целлюлаз, амилаз, глюканаз, пуллуланаз, редуктаз, дисмутаз, оксигеназ, монооксигеназ, диоксигеназ, каталаз, гидрогеназ, карбоксилаз и метилредуктаз; или фермент, вовлеченный в гомоацетогенез, метаногенез, ацетокластический метаногенез или CO-восстановительный метаногенез; и (c) идентификацию субстрата, реактанта или кофактора указанного фермента, который повышает продуцирование метана, будучи доступным одному или более микроорганизмам в указанном углеводородсодержащем пласте, и (d) идентификация тем самым стимулятора, который повышает биогенное продуцирование метана в углеводородсодержащем пласте по сравнению с продуцированием метана в углеводородсодержащем пласте в отсутствие стимулятора. Изобретение позволяет эффективно стимулировать биогенное продуцирование метана в углеводородсодержащих пластах. 4 н. и 11 з.п. ф-лы, 16 ил., 3 табл., 3 пр.
Формула
(a) получение последовательности нуклеиновой кислоты от одного или более микроорганизмов, выделенных из среды углеводородсодержащего пласта;
(b) определение присутствия одного или более генных продуктов указанной последовательности нуклеиновой кислоты, где указанный генный продукт представляет собой фермент на пути метаболизма, вовлеченного в преобразование углеводорода в метан, выбранный из группы, состоящей из пероксидаз, фенолоксидаз, алкогольоксидаз, лакказ, гидролаз, гликозилгидролаз, эстераз, этераз, оксидаз, нитрогеназ, целлюлаз, амилаз, глюканаз, пуллуланаз, редуктаз, дисмутаз, оксигеназ, монооксигеназ, диоксигеназ, каталаз, гидрогеназ, карбоксилаз и метилредуктаз; или фермент, вовлеченный в гомоацетогенез, метаногенез, ацетокластический метаногенез или CO2-восстановительный метаногенез; и
(c) идентификацию субстрата, реактанта или кофактора указанного фермента, который повышает продуцирование метана, будучи доступным одному или более микроорганизмам в указанном углеводородсодержащем пласте, и
(d) идентификация тем самым стимулятора, который повышает биогенное продуцирование метана в углеводородсодержащем пласте по сравнению с продуцированном метана в углеводородсодержащем пласте в отсутствии стимулятора.
(i) тестирование in vitro одного или более субстратов, реактантов или кофакторов при более чем одной концентрации для мониторинга и оптимизации продуцирования метана в системе культур, включающей по меньшей мере один микроорганизм, выделенный из указанного углеводородсодержащего пласта, где дополнительно для указанной системы культур уголь является единственным источником углерода; или
(ii) тестирование in vitro одного или более субстратов, реактантов или кофакторов при более чем одной концентрации для мониторинга и оптимизации продуцирования метана в системе культур, включающей определенное микробное сообщество; где указанное определенное микробное сообщество сочетает культуру единичного штамма микроорганизма из углеводородсодержащего пласта по меньшей мере с одной другой определенной культурой еще одного единичного штамма микроорганизма, таким образом, что члены указанного определенного микробного сообщества проявляют синергическое действие в продуцировании метана; и где дополнительно для указанной системы культур уголь является единственным источником углерода.
(d) получение культуры единичного штамма указанного одного или более микроорганизмов из указанной угольного пласта или скважины для добычи метана из угольных пластов, в которой единичный штамм микроорганизма содержит указанный один или более генных продуктов; и
(e) объединение указанного культивированного единичного штамма микроорганизма по меньшей мере с одной другой определенной культурой еще одного единичного штамма микроорганизма для получения определенного микробного сообщества; где члены указанного определенного микробного сообщества проявляют синергическое действие в продуцировании метана.

Комментарии