Способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, и набор для его осуществления - RU2630648C2
Код документа: RU2630648C2
Описание
Группа изобретений относится к медицине, более конкретно к лабораторной диагностике, и может быть использована для диагностики заболеваний, сопровождающихся повышенной гибелью клеток.
В крови человека имеются нуклеиновые кислоты (НК), не связанные с клетками и свободно циркулирующие в кровотоке. Эти НК появляются в результате гибели (распада) клеток, связанной с непрерывной заменой старых клеток на новые во всех органах. В плазме здорового человека концентрация свободно циркулирующей ДНК (сцДНК) около 6 нг/мл. Некоторые заболевания сопровождаются повышенной гибелью клеток, и, как следствие, повышенной концентрацией сцДНК в плазме больных. Примерами таких заболеваний являются, прежде всего, онкологические заболевания, а также некоторые заболевания печени, в частности гепатоз [Зайратьянц О.В. и др. «Патологическая анатомия», Гл. 1, Повреждение и гибель клеток и тканей. 2012, 960 стр.].
Рост злокачественной опухоли зачастую сопровождается повышенной гибелью клеток. Опухолевые клетки гибнут преимущественно путем некроза, в меньшей степени путем апоптоза; продукты клеточного распада попадают в кровеносные сосуды. Поэтому у большинства онкологических больных концентрация сцДНК в плазме крови повышена по сравнению с таковой у здоровых индивидуумов. Доказано, что сцДНК онкологических больных произошла из опухолевых клеток [Huang Z.H. et al. Quantitative analysis of plasma circulating DNA at diagnosis and during follow-up of breast cancer patients. Cancer Lett. 2006, 243: 64-70] и, более того, эта сцДНК при определенных условиях может индуцировать онкогенную трансформацию здоровых клеток [Garcia-Olmo D.C. et al. Cell-free nucleic acids circulating in the plasma of colorectal cancer patients induce the oncogenic transformation of susceptible cultured cells. Cancer Res. 2010, 70: 560-567].
Энергетический метаболизм раковых клеток отличается от метаболизма здоровых клеток. В раковых клетках наблюдается увеличение анаэробного гликолиза, также как число копий митохондиальной ДНК (мтДНК) изменяется при различных формах рака (8). Увеличенное число копий мтДНК было найдено при раке предстательной железы и яичников, эндометриальном раке, карциноме щитовидной железы, некоторых формах лейкемии, карциноме толстого кишечника, раке головного мозга, шеи и других формах рака. И наоборот, уменьшенное число копий мтДНК было найдено при раке желудка, карциноме печени, раке молочной железы и других формах рака. Многие факторы, такие как возраст, оксидативный стресс, тканевая специфичность и степень развития опухоли влияют на количество копий мтДНК [Meng S. et al. Mitochondrial DNA copy number alteration in human cancers. NAJ Med Sci. 2013, 6(1): 22-25. DOI: 10.7156/najms.2013.0601022].
Известны способ диагностики онкологических заболеваний и набор для его осуществления от компании Mitomics Inc. [www.mitomicsinc.com], основанные на анализе структуры мтДНК, ее мутаций, в том числе делеций. Наиболее разработанным тестом у компании Mitomics Inc. является тест на рак предстательной железы (Prostate Core Mitomics TEST, PCMT). Чувствительность теста составляет 85%, специфичность 92%. Недостатки метода: инвазивность, для анализа используется материал биопсии предстательной железы, а это болезненная процедура. Для получения указанных параметров чувствительности и специфичности требуются неоднократные биопсии. Компания продолжает работать над применением метода для диагностики других форм рака.
В литературе много работ по анализу содержания тотальной сцДНК, отдельных генов, мтДНК в плазме и сыворотке крови [Mehra N. et al. Circulating mitochondrial nucleic acids have prognostic value for survival in patients with advanced prostate cancer. Clin Cancer Res. 2007, 13:421-426; Xia P. et al. (2009) Simultaneous quantitative assessment of circulating cell-free mitochondrial and nuclear DNA by multiplex real-time PCR. Gen. Mol. Biology, 32, 1, 20-24; http://core-genomics.blogspot.ru/2014/12/extracting-cell-free-dna-from-plasma.html; PLoS One. (2014) Mar 3; 9(3): e87838. doi: 10.1371/joumal.pone.0087838. eCollection 2014]. В работе Xia P. et al. анализировали геномную и мтДНК у здоровых доноров. Главным недостатком вышеуказанной и аналогичных работ является выделение ДНК из плазмы крови. С тех пор как появились биохимические методы выделения нуклеиновых кислот, исследователям известно, что при выделении происходит потеря части ДНК и изменение соотношения генов. В компании Core Genomics сравнили киты разных фирм и определили, что потери составляют до 40% [http://core-genomics.blogspot.ru/2014/12/extracting-cell-free-dna-from-plasma.html]. Предпринимаются попытки оценивать содержание сцДНК у пациентов без предварительной амплификации [PLoS One. (2014) Mar 3; 9(3): е87838. doi: 10.1371/journal.pone.0087838. eCollection 2014]. Но невозможно диагностировать заболевания только по количеству ДНК или определенного гена, так как концентрация ДНК в плазме крови у здоровых пациентов по данным этой работы варьирует в пределах 1.6 - 23.7 нг/мл, а у больных в пределах 5.1-183 нг/мл.
Задачей настоящей группы изобретений является создание способа диагностики заболеваний, сопровождающихся повышенной гибелью клеток, и набора для его осуществления, на основании количественного анализа свободно циркулирующих нуклеиновых кислот в плазме крови без их предварительного выделения.
Задача решена созданием способа диагностики заболевания, сопровождающегося повышенной гибелью клеток, включающего:
а) получение образца плазмы крови у человека;
б) изотермическую амплификацию нуклеиновых кислот плазмы крови;
в) очистку нуклеиновых кислот из реакционной смеси, полученной по пункту б)
г) проведение количественного анализа нуклеиновых кислот методом полимеразной цепной реакции в режиме реального времени и определение коэффициента К в пробах:
К=C1 или
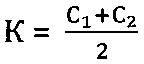
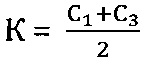

где

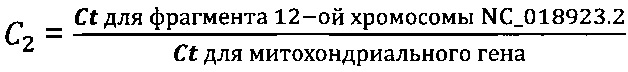

Ct - величина порогового цикла полимеразной цепной реакции;
д) сравнение коэффициента К с референсным значением;
е) диагностику заболевания, сопровождающегося повышенной гибелью клеток, при значении коэффициента К менее референсного значения.
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что изотермическая амплификация нуклеиновых кислот плазмы крови проводится без предварительного выделения нуклеиновых кислот из плазмы крови.
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что изотермическая амплификация нуклеиновых кислот плазмы крови проводится в одной пробирке с плазмой крови.
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что нуклеиновые кислоты плазмы крови включают геномную ДНК, митохондриальную ДНК, информационную РНК, транспортные РНК, микроРНК, нуклеиновые кислоты экзосом.
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что заболеванием, сопровождающимся повышенной гибелью клеток, является онкологическое заболевание.
В частном случае выполнения способ диагностики онкологического заболевания характеризуется тем, что онкологическое заболевание выбрано из группы, включающей рак молочной железы, рак толстого кишечника, рак поджелудочной железы, рак тимуса, рак предстательной железы, рак яичников, глиома мозга.
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что заболеванием, сопровождающимся повышенной гибелью клеток, является гепатоз.
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что референсное значение определяется как среднее значение коэффициента К, полученное при массовом обследовании здорового населения.
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что заболеванием, сопровождающимся повышенной гибелью клеток, является рак молочной железы, а референсное значение равно 2.
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что заболеванием, сопровождающимся повышенной гибелью клеток, является гепатоз, а референсное значение равно 2.
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что фермент гликолиза выбран из группы, включающей гексокиназу, фосфоглюкозо изомеразу, фосфофруктокиназу, фруктобифосфатальдолазу, триозофосфат изомеразу, глицеральдегидфосфат дегидрогеназу, фосфоглицерат киназу, фосфоглицератмутазу, энолазу и пируваткиназу.
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что фрагмент митохондриальной ДНК выбран из группы митохондриальных генов, включающей ген транспортной РНК, ген 12S рРНК, ген 16S рРНК, ген субъединицы NADH-дегидрогеназы, ген субъединицы цитохромоксидазы, ген субъединицы АТФ-синтазы и ген цитохром С редуктазы.
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что изотермическая амплификация нуклеиновых кислот плазмы крови проводится с использованием ДНК полимеразы phi29.
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что изотермическую амплификацию нуклеиновых кислот плазмы крови проводят с использованием белка, связывающегося с однонитевой ДНК, трегалозы, случайных праймеров, детергента, дезоксинуклеозидтрифосфатов, хлористого магния.
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что случайные праймеры представляют собой Random-7 thio.
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что изотермическую амплификацию нуклеиновых кислот плазмы крови останавливают путем добавления в реакционную смесь этилендиаминтетраацетата.
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что после остановки изотермической амплификации нуклеиновых кислот плазмы крови проводят выделение ДНК.
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что выделение ДНК осуществляют следующим образом: добавляют в реакционную смесь протеиназу К, инкубируют реакционную смесь в течение 15 минут при температуре 55°С, обрабатывают реакционную смесь реагентом DNAzol® BD, осаждают ДНК изопропанолом и промывают ДНК этанолом.
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что выделенную ДНК растворяют в ТЕ буфере и определяют ее концентрацию.
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, по п. 1, характеризующийся тем, что ген, кодирующий фермент гликолиза, представляет собой ген, кодирующий пируваткиназу.
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что Ct для гена пируваткиназы определяют с использованием пары олигонуклеотидных праймеров и олигонуклеотидного зонда для детекции, при этом один олигонуклеотидный праймер имеет последовательность, гомологичную по меньшей мере на 90% последовательности SEQ ID NO: 1, второй олигонуклеотидный праймер имеет последовательность, гомологичную по меньшей мере на 90% последовательности SEQ ID NO: 2, олигонуклеотидный зонд для детекции имеет последовательность, гомологичную по меньшей мере на 90% последовательности SEQ ID NO: 3.
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что Ct для гена пируваткиназы определяют с использованием пары олигонуклеотидных праймеров и олигонуклеотидного зонда для детекции, при этом один олигонуклеотидный праймер имеет последовательность SEQ ID NO: 1, второй олигонуклеотидный праймер имеет последовательность SEQ ID NO: 2, олигонуклеотидный зонд для детекции имеет последовательность SEQ ID NO: 3.
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что Ct для фрагмента 12-ой хромосомы NC_018923.2 определяют с использованием пары олигонуклеотидных праймеров и олигонуклеотидного зонда для детекции, при этом один олигонуклеотидный праймер имеет последовательность, гомологичную по меньшей мере на 90% последовательности SEQ ID NO: 4, второй олигонуклеотидный праймер имеет последовательность, гомологичную по меньшей мере на 90% последовательности SEQ ID NO: 5, олигонуклеотидный зонд для детекции имеет последовательность, гомологичную по меньшей мере на 90% последовательности SEQ ID NO: 6.
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что Ct для фрагмента 12-ой хромосомы NC_018923.2 определяют с использованием пары олигонуклеотидных праймеров и олигонуклеотидного зонда для детекции, при этом один олигонуклеотидный праймер имеет последовательность SEQ ID NO: 4, второй олигонуклеотидный праймер имеет последовательность SEQ ID NO: 5, олигонуклеотидный зонд для детекции имеет последовательность SEQ ID NO: 6.
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что Ct для гена M6PRBP определяют с использованием пары олигонуклеотидных праймеров и олигонуклеотидного зонда для детекции, при этом один олигонуклеотидный праймер имеет последовательность, гомологичную по меньшей мере на 90% последовательности SEQ ID NO: 7, второй олигонуклеотидный праймер имеет последовательность, гомологичную по меньшей мере на 90% последовательности SEQ ID NO: 8, олигонуклеотидный зонд для детекции имеет последовательность, гомологичную по меньшей мере на 90% последовательности SEQ ID NO: 9.
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что Ct для гена M6PRBP определяют с использованием пары олигонуклеотидных праймеров и олигонуклеотидного зонда для детекции, при этом один олигонуклеотидный праймер имеет последовательность SEQ ID NO: 7, второй олигонуклеотидный праймер имеет последовательность SEQ ID NO: 8, олигонуклеотидный зонд для детекции имеет последовательность SEQ ID NO: 9.
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что митохондриальный ген представляет собой ген COX1.
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что Ct для гена COX1 определяют с использованием пары олигонуклеотидных праймеров и олигонуклеотидного зонда для детекции, при этом один олигонуклеотидный праймер имеет последовательность, гомологичную по меньшей мере на 90% последовательности SEQ ID NO: 10, второй олигонуклеотидный праймер имеет последовательность, гомологичную по меньшей мере на 90% последовательности SEQ ID NO: 11, олигонуклеотидный зонд для детекции имеет последовательность, гомологичную по меньшей мере на 90% последовательности SEQ ID NO: 12.
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что Ct для гена COX1 определяют с использованием пары олигонуклеотидных праймеров и олигонуклеотидного зонда для детекции, при этом один олигонуклеотидный праймер имеет последовательность SEQ ID NO: 10, второй олигонуклеотидный праймер имеет последовательность SEQ ID NO: 11, олигонуклеотидный зонд для детекции имеет последовательность SEQ ID NO: 12.
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что олигонуклеотидный зонд для детекции на 5'-конце содержит флуоресцентный краситель, на 3'-конце содержит гаситель флуоресценции.
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что флуоресцентный краситель выбран из группы: JOE, FAM, R6G, ROX, Cy5, Cy5.5, HEX.
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что гаситель флуоресценции выбран из группы: BHQ1, BHQ2, BHQ3, RTQ.
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что

В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что

В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что
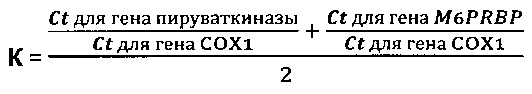
В частном случае выполнения способ диагностики заболевания, сопровождающегося повышенной гибелью клеток, характеризуется тем, что

Задача решена созданием набора реагентов для осуществления вышеописанного способа диагностики заболевания, сопровождающегося повышенной гибелью клеток, включающего по меньшей мере пару олигонуклеотидных праймеров и олигонуклеотидный зонд для детекции для определения Ct для гена, кодирующего фермент гликолиза, и пару олигонуклеотидных праймеров и олигонуклеотидный зонд для детекции для определения Ct для митохондриального гена.
В частном случае выполнения набор реагентов по изобретению характеризуется тем, что ген, кодирующий фермент гликолиза, представляет собой ген, кодирующий пируваткиназу, а пара олигонуклеотидных праймеров и олигонуклеотидный зонд для детекции для определения Ct для гена, кодирующего пируваткиназу имеют последовательности, гомологичные по меньшей мере на 90% последовательностям SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NO: 3, соответственно.
В частном случае выполнения набор реагентов по изобретению характеризуется тем, что ген, кодирующий фермент гликолиза, представляет собой ген, кодирующий пируваткиназу, а пара олигонуклеотидных праймеров и олигонуклеотидный зонд для детекции для определения Ct для гена, кодирующего пируваткиназу имеют последовательности SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NO: 3, соответственно.
В частном случае выполнения набор реагентов по изобретению характеризуется тем, что митохондриальный ген представляет собой ген COX1, а пара олигонуклеотидных праймеров и олигонуклеотидный зонд для детекции для определения Ct для гена COX1 имеют последовательности, гомологичные по меньшей мере на 90% последовательностям SEQ ID NO: 10, SEQ ID NO: 11 и SEQ ID NO: 12, соответственно.
В частном случае выполнения набор реагентов по изобретению характеризуется тем, что митохондриальный ген представляет собой ген COX1, а пара олигонуклеотидных праймеров и олигонуклеотидный зонд для детекции для определения Ct для гена COX1 имеют последовательности SEQ ID NO: 10, SEQ ID NO: 11 и SEQ ID NO: 12, соответственно.
В частном случае выполнения набор реагентов по изобретению характеризуется тем, что дополнительно содержит пару олигонуклеотидных праймеров и олигонуклеотидный зонд для детекции для определения Ct для фрагмента 12-ой хромосомы NC_018923.2.
В частном случае выполнения набор реагентов по изобретению характеризуется тем, что пара олигонуклеотидных праймеров и олигонуклеотидный зонд для детекции для определения Ct для фрагмента 12-ой хромосомы NC_018923.2 имеют последовательности, гомологичные по меньшей мере на 90% последовательностям SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6, соответственно.
В частном случае выполнения набор реагентов по изобретению характеризуется тем, что пара олигонуклеотидных праймеров и олигонуклеотидный зонд для детекции для определения Ct для фрагмента 12-ой хромосомы NC_018923.2 имеют последовательности SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6, соответственно.
В частном случае выполнения набор реагентов по изобретению характеризуется тем, что дополнительно содержит пару олигонуклеотидных праймеров и олигонуклеотидный зонд для детекции для определения Ct для гена M6PRBP.
В частном случае выполнения набор реагентов по изобретению характеризуется тем, что пара олигонуклеотидных праймеров и олигонуклеотидный зонд для детекции для определения Ct для гена M6PRBP имеют последовательности, гомологичные по меньшей мере на 90% последовательностям SEQ ID NO: 7, SEQ ID NO: 8 и SEQ ID NO: 9, соответственно.
В частном случае выполнения набор реагентов по изобретению характеризуется тем, что пара олигонуклеотидных праймеров и олигонуклеотидный зонд для детекции для определения Ct для гена M6PRBP имеют последовательности SEQ ID NO: 7, SEQ ID NO: 8 и SEQ ID NO: 9, соответственно.
В частном случае выполнения набор реагентов по изобретению характеризуется тем, что дополнительно содержит пару олигонуклеотидных праймеров и олигонуклеотидный зонд для детекции для определения Ct для фрагмента 12-ой хромосомы (43119006-43120809) и пару олигонуклеотидных праймеров и олигонуклеотидный зонд для детекции для определения Ct для гена M6PRBP.
В частном случае выполнения набор реагентов по изобретению характеризуется тем, что дополнительно содержит реагенты для изотермической амплификации.
В частном случае выполнения набор реагентов по изобретению характеризуется тем, что реагенты для изотермической амплификации включают ДНК полимеразу phi29, белок, связывающийся с однонитевой ДНК, трегалозу, случайные праймеры, детергент, дезоксинуклеозидтрифосфаты, хлористый магний.
В частном случае выполнения набор реагентов по изобретению характеризуется тем, что дополнительно содержит реагенты для полимеразной цепной реакции в режиме реального времени.
В частном случае выполнения набор реагентов по изобретению характеризуется тем, что реагенты для полимеразной цепной реакции в режиме реального времени включают термостабильную ДНК-полимеразу, буферный раствор для полимеразной цепной реакции, дезоксинуклеозидтрифосфаты.
Способ и набор по изобретению обеспечивают достижение технического результата - диагностику заболевания, сопровождающегося повышенной гибелью клеток; диагностика при этом малоинвазивная, обладает высокой чувствительностью на любых стадиях заболевания, в том числе на ранних стадиях, при которых клинические симптомы отсутствуют. Кроме того, способ и набор по изобретению могут быть использованы:
- при дифференциальной диагностике доброкачественных и злокачественных опухолей, в том числе и на ранних стадиях, при которых еще нет клинических симптомов;
- для контроля качества проводимого лечения заболеваний, при которых происходит повышенная гибель клеток (мониторинг эффективности лечения);
- при проведении клинических испытаний новых лекарственных препаратов;
- для первичного скрининга пациентов на наличие заболеваний, сопровождающихся повышенной гибелью клеток в организме и появлении нуклеиновых кислот в плазме крови человека.
В настоящей заявке использованы следующие термины и определения.
Нуклеиновые кислоты (НК) - к ним относится ДНК (дезоксирибонуклеиновая кислота), РНК (рибонуклеиновая кислота), иРНК (информационная РНК, матричная РНК, мРНК), миРНК (микро РНК), тРНК (транспортная РНК), полинуклеотиды из органелл клетки: ядра, митохондрии, цитоплазмы клеток, экзосом, плазмы крови или олигонуклеотиды синтезированные in vitro. Данный термин может означать как один вид НК, так и смесь различных видов НК, при этом в зависимости от контекста специалисту в данной области техники ясен смысл данного термина.
Гликолиз - метаболический путь, в котором глюкоза превращается до пирувата с помощью десяти ферментов: гексокиназа, фосфоглюкозо изомераза, фосфофруктокиназа, фруктобифосфатальдолаза, триозофосфат изомераза, глицеральдегидфосфат дегидрогеназа, фосфоглицерат киназа, фосфоглицератмутаза, энолаза и пируваткиназа.
Коэффициент К - соотношение Ct или среднее из соотношений Ct между фрагментами геномной ДНК и фрагментом митохондриальной ДНК, определяется следующим образом:
К=С1 или
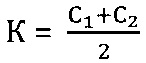


где
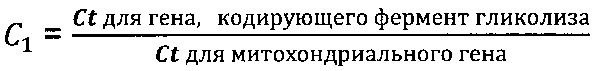

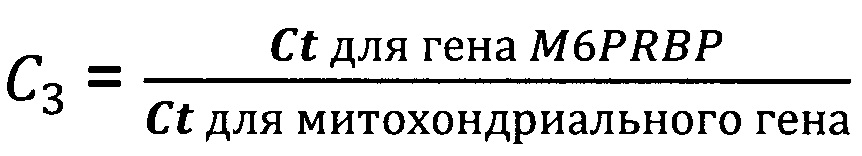
Фрагмент 12-й хромосомы - chr12 (43119006-43120809), NC_018923.2 (GenBank NCBI), SEQ ID NO: 13.
Автором настоящего изобретения экспериментально установлено, что у больных с заболеваниями, сопровождающимися повышенной гибелью клеток, коэффициент К<2.0. У здоровых доноров крови коэффициент К ≥ 2.0. В настоящее время исключений из данной закономерности пока не обнаружено. Поэтому автором настоящего изобретения данный коэффициент был назван «коэффициентом здоровья» (Кз).
Ct - аналитический сигнал, пороговый цикл, при котором величина цикла амплификации, на котором флуоресценция от расщепления олигонуклеотидного зонда для детекции превысила значение фоновой флуоресценции.
Референсное значение лабораторного показателя, в данном случае коэффициента К - среднее значение лабораторного показателя, в данном случае коэффициента К, полученное при массовом обследовании здорового населения.
Набор реагентов для осуществления способа - набор реагентов может представлять собой как «полный набор», так и «неполный набор». «Полный набор» представляет собой полный набор реагентов, необходимый для осуществления стадий способа по изобретению: получения образца плазмы крови у человека, изотермической амплификации нуклеиновых кислот плазмы крови, очистки нуклеиновых кислот из реакционной смеси, проведения количественного анализа нуклеиновых кислот методом полимеразной цепной реакции в режиме реального времени. Реагенты, необходимые для осуществления каждой из стадий способа, известны специалисту в данной области техники. Реагенты для изотермической амплификации включают ДНК полимеразу phi29, белок, связывающийся с однонитевой ДНК, трегалозу, случайные праймеры, детергент, дезоксинуклеозидтрифосфаты, хлористый магний. Реагенты для полимеразной цепной реакции в режиме реального времени включают олигонуклеотидные праймеры, олигонуклеотидные зонды для детекции, термостабильную ДНК-полимеразу, буферный раствор для полимеразной цепной реакции, дезоксинуклеозидтрифосфаты. Термостабильная ДНК-полимераза может представлять собой Taq-, Tth-, Tub-, Bst-, Vent-, Pfu-полимеразу или другую известную из уровня техники термостабильную ДНК-полимеразу. Например, может быть использована SynTaq ДНК-полимераза с ингибирующими активность фермента антителами. «Неполный набор» представляет собой набор реагентов, не включающий по меньшей мере один ингредиент полного набора, но включающий по меньшей мере две пары подходящих олигонуклеотидных праймеров и два подходящих олигонуклеотидных зонда для детекции.
Случайный праймер - олигонуклеотидный праймер (затравка), нуклеотидная последовательность которого выбрана случайно; используется для амплификации фрагментов нуклеиновых кислот с неизвестной последовательностью нуклеотидов. Могут использоваться следующие синонимы: рассеянный праймер, рэндом(ный) праймер [от англ. random primer], неспецифический праймер. Случайные праймеры могут быть модифицированными, например могут быть использованы случайные праймеры длиной 7 нуклеотидов, с 3'-S-S модификацией Random-7 thio Syntol (Синтол).
Автор настоящего изобретения назвал способ диагностики заболевания, сопровождающегося повышенной гибелью клеток: «АРНА» (Analysis Ratio Nucleic Acid, анализ соотношения нуклеиновых кислот).
Способ по изобретению состоит из шести последовательных стадий: получение образца плазмы крови у человека; изотермическая амплификация нуклеиновых кислот плазмы крови; очистка нуклеиновых кислот из реакционной смеси, полученной на предыдущей стадии; проведение количественного анализа нуклеиновых кислот методом полимеразной цепной реакции в режиме реального времени и определение коэффициента К в пробах; сравнение коэффициента К с референсным значением; и собственно диагностика заболевания, сопровождающегося повышенной гибелью клеток, если значение коэффициента К составляет менее референсного значения.
Стадия 1. Получение образца (пробы) плазмы крови у человека. Для анализа используется плазма крови человека. Кровь может быть отобрана как из вены, так и из пальца: требуется всего несколько капель крови, которые отбираются в пробирку с консервантом (например, ЭДТА, с концентрацией 10 мМ, или гепарином). Для предотвращения распада клеток пробирка с кровью до центрифугирования хранится при 4°С, и плазма должна быть получена из крови не позднее одного часа. Центрифугирование клеток крови проводится при 1000 g в течение 10 минут. Аккуратно отбирается верхний слой, не касаясь интерфазы. Нарушение описанной процедуры приводит к распаду клеток крови в процессе выделения плазмы и ошибкам в анализе. До анализа плазма хранится в замороженном виде до 1 месяца при -20°С, до года при -80°С.
Стадия 2. Изотермическая амплификация нуклеиновых кислот плазмы крови. Данная амплификация осуществляется ДНК-полимеразой бактериофага phi29 без предварительного выделения нуклеиновых кислот из плазмы крови и происходит в одной пробирке, что является одним из существенных признаков изобретения. Принципиально важно, что для синтеза в пробирке берутся нуклеиновые кислоты, имеющиеся в плазме на момент отбора крови у пациента, без искажений, которые происходят при биохимических методах выделения нуклеиновых кислот. Известно, что при использовании ионообменных колонок фрагменты нуклеиновых кислот связываются по-разному в зависимости от G-C состава. Также искажения происходят на стадии осаждения нуклеиновых кислот, так как короткие фрагменты нуклеиновых кислот (15-100 нуклеотидов) осаждаются спиртами с меньшим выходом. Фрагменты нуклеиновых кислот от 7 нуклеотидов и больше выполняют функцию праймирования в реакции амплификации. Эти параметры становятся существенными при работе с малыми количествами нуклеиновых кислот, 1 нг и меньше.
Амплификация нуклеиновых кислот осуществляется ДНК-полимеразой phi29 (NEB, cat. № M0269L) в присутствии белка, связывающегося с однонитевой ДНК (NEB, SSB protein cat. № M0249S), трегалозы, случайных праймеров (представляющих собой модифицированные олигонуклеотиды длиной 7 нуклеотидов, с 3'-S-S модификацией Random-7 thio Syntol (Синтол)), устойчивых к экзонуклеазе, детергента (например, полиэтиленгликоль 8%, но можно использовать и другой подходящий детергент), дезоксинуклеозидтрифосфатов (дНТФ, dNTP), хлористого магния и нуклеиновых кислот плазмы крови человека (Таблица 1) и продолжается 16 часов при 30°С.

Для денатурации нуклеиновых кислот приготовленная смесь инкубируется 2 минуты при 95°С, затем пробирки переносятся в лед, добавляется ДНК-полимераза с белком SSB, и инкубация продолжается 16 часов при 30°С. В таблице 1 приведены оптимальные концентрации компонентов, которых достаточно для синтеза ДНК до 10 мкг. Увеличение концентрации фермента ДНК-полимеразы phi29, дНТФ и случайных праймеров способно увеличить выход ДНК, но синтезируемого количества ДНК достаточно для анализа и большего количества не требуется.
Стадия 3. Очистка нуклеиновых кислот из реакционной смеси. Третья стадия заключается в остановке синтеза и очистке ДНК. Для остановки синтеза добавляется ЭДТА до 10 мМ, протеиназа К до 100 мкг/мл для расщепления всех белков в реакционной смеси и производится инкубирование при 55°С в течение 15 минут.
Дальнейшая очистка производится двумя объемами реагента DNAzol® BD (MRC, cat. № DN129), осаждением 1,2 объемами изопропанола, дополнительной промывкой осадка 80% этанолом с последующим растворением в ТЕ буфере и определением концентрации ДНК. Концентрация ДНК определяется на флуориметре с флуоресцентной краской Hoechst или на спектрофотометре по оптической плотности при 260/280 нм.
Стадия 4. Проведение количественного анализа нуклеиновых кислот методом полимеразной цепной реакции (ПЦР) в режиме реального времени и определение коэффициента К в пробах. Для проведения количественного анализа нуклеиновых кислот методом ПЦР в режиме реального времени (кПЦР, qPCR, real-time PCR) используется ДНК, полученная на стадии 3. Количественный анализ методом ПЦР проводится согласно стандартному протоколу компании Синтол (Syntol, кат. № М-428). Детекция осуществляется с использованием зондов TaqMan, зонды подбираются в соответствии с рекомендациями компании Biosearch Technologies Inc. Состав реакционной смеси приведен в таблице 2, последовательности олигонуклеотидных праймеров и олигонуклеотидных зондов для детекции приведены в таблице 3. Специалисту понятно, что данный набор олигонуклеотидных праймеров и олигонуклеотидных зондов для детекции (количество и последовательности) является неограничивающим примером настоящей группы изобретений. Количество ДНК, равное 50 нг, является оптимальным для соотношений реагентов, указанных в таблице 2. Содержание ДНК, используемое в реакции, можно варьировать от нескольких нг до 0.5 мкг.


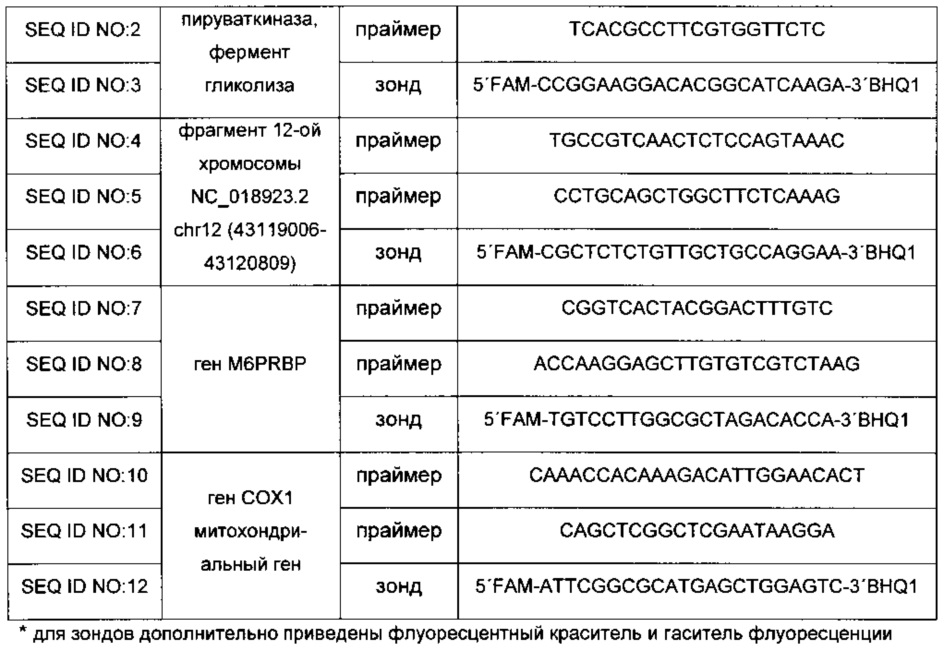
Схема кПЦР следующая:
95°С / 5 мин + (95°С /15 с + 62°С / 20 с + 72°С / 45 с) × 40 циклов.
На основании полученных значений Ct определяется коэффициент К в пробах:
К=С1 или
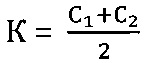


где


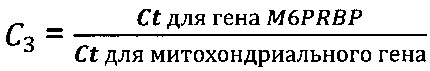
Стадии 5 и 6. Сравнение коэффициента К с референсным значением и диагностика заболевания, сопровождающегося повышенной гибелью клеток, при значении коэффициента К менее референсного значения.
Диагностика заболевания, сопровождающегося повышенной гибелью клеток - рака молочной железы.
Вышеописанным способом по изобретению были проанализированы образцы (пробы) плазмы крови, отобранные у здоровых доноров и больных раком молочной железы. Пробы были получены из Онкоцентра им. Блохина (г. Москва). Возраст женщин варьировался от 29 до 79 лет. Как видно из приведенных в таблице 4 данных, способ по изобретению и набор для его осуществления позволяют достоверно различать плазму здоровых доноров от плазмы больных раком молочной железы, независимо от стадии заболевания. Чувствительность метода достаточна для обнаружения заболевания и на 1-й стадии.
Коэффициент

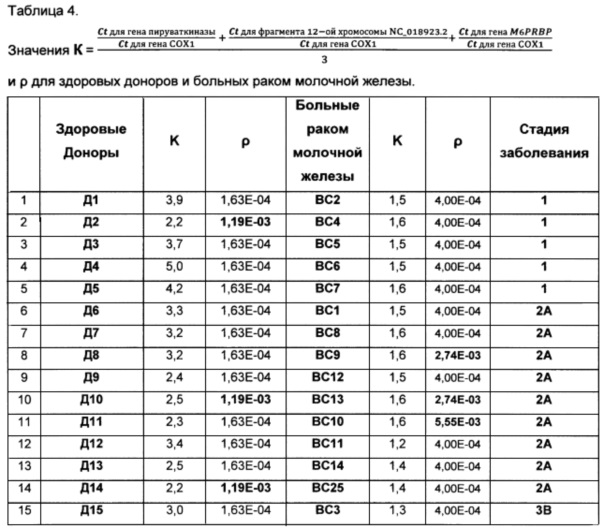

Для всех проб, приведенных в таблице 4, были определены также коэффициенты
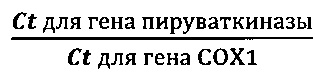


При этом, что примечательно, закономерность осталась прежней: у больных раком молочной железы коэффициенты К всегда составляли менее 2.0, у здоровых доноров крови коэффициенты К всегда составляли более 2.0 или были равны 2.0.
Таким образом, на основании полученных данных можно утверждать, что способ и набор по изобретению позволяют обнаруживать заболевание, сопровождающееся повышенной гибелью клеток - рак молочной железы, с чувствительностью >97% на всех стадиях развития болезни (0 ошибок при выборке 27 истинно положительных образцов).
Диагностика заболевания, сопровождающегося повышенной гибелью клеток - гепатоза, и мониторинг эффективности лечения.
Вышеописанным способом по изобретению был проанализирован образец (проба) плазмы крови, взятой из пальца у добровольца М-33, не имеющего клинических проявлений какого-либо заболевания. Неожиданно анализ крови добровольца показал
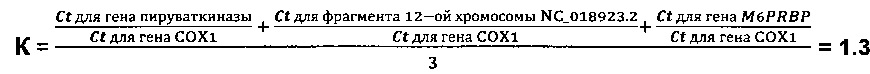
Два повторных анализа показали тот же результат. В одной из клиник врачи диагностировали гепатоз печени у данного добровольца и рекомендовали ему лечение. Спустя два месяца после начала лечения анализ крови показал эффективность лечения и возвращение коэффициента в норму (К=2.5) (см. таблицу 5).

Этот пример демонстрирует возможность применения способа и набора по изобретению для диагностики заболевания, сопровождающегося повышенной гибелью клеток - гепатоза, на начальных стадиях, при которых отсутствуют клинические проявления, а также для мониторинга эффективности лечения.
Перечень последовательностей
<110> ОБЩЕСТВО С ОГРАНИЧЕННОЙ ОТВЕТСТВЕННОСТЬЮ «БИОМАРКЕР-РУ»
<120> СПОСОБ ДИАГНОСТИКИ ЗАБОЛЕВАНИЯ, СОПРОВОЖДАЮЩЕГОСЯ ПОВЫШЕННОЙ ГИБЕЛЬЮ КЛЕТОК, И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ
<160> 12
<210> 1
<211> 18
<212> ДНК
<213> Homo Sapiens
<400> 1
gtcagggctg ctctgggt 18
<210> 2
<211> 19
<212> ДНК
<213> Homo Sapiens
<400> 2
tcacgccttc gtggttctc 19
<210> 3
<211> 22
<212> ДНК
<213> Homo Sapiens
<400> 3
ccggaaggac acggcatcaa ga 22
<210> 4
<211> 22
<212> ДНК
<213> Homo Sapiens
<400> 4
tgccgtcaac tctccagtaa ac 22
<210> 5
<211> 21
<212> ДНК
<213> Homo Sapiens
<400> 5
cctgcagctg gcttctcaaa g 21
<210> 6
<211> 22
<212> ДНК
<213> Homo Sapiens
<400> 6
cgctctctgt tgctgccagg aa 22
<210> 7
<211> 20
<212> ДНК
<213> Homo Sapiens
<400> 7
cggtcactac ggactttgtc 20
<210> 8
<211> 24
<212> ДНК
<213> Homo Sapiens
<400> 8
accaaggagc ttgtgtcgtc taag 24
<210> 9
<211> 21
<212> ДНК
<213> Homo Sapiens
<400> 9
tgtccttggc gctagacacc a 21
<210> 10
<211> 25
<212> ДНК
<213> Homo Sapiens
<400> 10
caaaccacaa agacattgga acact 25
<210> 11
<211> 20
<212> ДНК
<213> Homo Sapiens
<400> 11
cagctcggct cgaataagga 20
<210> 12
<211> 22
<212> ДНК
<213> Homo Sapiens
<400> 12
attcggcgca tgagctggag tc 22
<210> 13
<211> 1804
<212> ДНК
<213> Homo Sapiens
<400> 13
aatgaaatga atgacaaagt cccctaaaat aactatcagg gtctcctccc tccacagtgg 60
aggagcccct ctctgtctca tgcttctctg acatggtctg cacatgctgc tggttgggtg 120
tgaagttagt atcctaggca gaagagtgaa ttgacaactt tatatgtttt caagttgttt 180
aaagtataaa ccactttagc gatggatctt ggaatggttg aaattgtggt ttgtgaaata 240
agcacttaat ttaagattgg aaatacccac aggaataact gagcctataa aatatgaaaa 300
ttcacatcaa cctgtaatga taaacatata tgaagtacac aacctgtaaa gataagagta 360
tatcacatca acctgtaatg ataaaagtat atgaagtaca caaaagcatg acttgagttt 420
acaagacttg tccagagagc acagaaaatc acgtgctact gggtaattca gacaaatagc 480
tttggcttgc ccttaattac ctaaacaatt caggactgag ctgggccatt tttaactgaa 540
tataattagg gtggttccct ttggttgtgt ggacctgggt atataatatg ttgtatttca 600
attcctataa tttacaggca tatgagcagg ctaaatattg taaagcagga tatggttcct 660
ggaggatgcc agcatccacc cactaattga cctgctaaga accagcagca acatgctctc 720
cagttgtggt ctggaggctg aattacaata aatacccaca tgagtgtctt atttagattt 780
gtccgattaa aaaaactcat gtacaaagct gatgagacct atgttagttg caggttaata 840
cttgctgatt tcttgccgtc aactctccag taaacaagaa cgaaggcatg gccaggcgct 900
ctctgttgct gccaggaagg gaggctttga gaagccagct gcagggcagg ggcatggcca 960
ggagcattgg tcttggagcc agataatttg ggttgcactc tttgtttgga tacttctctt 1020
cctttgaccc ttcgtcactt atggaagcta gaccacagtt ttctcatctg caaaatagag 1080
gcaatgatgt ggttctcaca gatggttgtg agatacaagg cggcaaggtt tgagactgct 1140
ccttataatt aagtcgttgg catagaggaa aagactggtg tttgcaatcc ctttactagg 1200
cagcatcttg gtgggaattc tgagaaagga cccagtgagc ctatggccag tctcctccaa 1260
cttgggatgg tgtctagatt ccaaacaaag agccagtggg cagcagaaaa gcaaagcact 1320
ggtttctgac tgaggggcca ttgggccccc cgtgggagac agatctttaa taatgttttt 1380
aatgacagtt cctttccaat gtgggggaag tctgtactga gagaaactcg atgcctctgg 1440
cctcgggcgg cagaattacc atgtatcttt taatctcaag gaataaggag ctttagttca 1500
caacaaccct gtgcatcttg tctaggcctc ctgctacact gtgttcaggt aatcacatca 1560
aatggagaaa tcagatagtt tctggctgat tcaaaatgtc ctggctgaga ggcagaggag 1620
atgtcaacag agatttcagg ctcatggaaa aacgctcagg tccagcttca tctgcttgtt 1680
ccattctaat cagagaggtc ctctgtgggt cgtaagacaa gaaactaggg gtttaaaggt 1740
ccctcaggaa ccagggacca aaatctggat ctgaggagca aaatgcttaa acaagctctg tctg 1804
Реферат
Настоящее изобретение относится к биохимии, в частности к способу диагностики заболеваний, сопровождающихся повышенной гибелью клеток, и набору для его осуществления. Для осуществления указанного способа получают образец плазмы крови у человека, затем проводят изотермическую амплификацию нуклеиновых кислот плазмы крови. Далее осуществляют очистку нуклеиновых кислот из реакционной смеси и проводят количественный анализ нуклеиновых кислот методом полимеразной цепной реакции в режиме реального времени. Определяют коэффициент К в пробах. Далее сравнивают коэффициент К с референсным значением и диагностируют заболевание, сопровождающееся повышенной гибелью клеток, при значении коэффициента К менее референсного значения. Настоящее изобретение позволяет проводить малоинвазивную диагностику заболеваний, сопровождающихся повышенной гибелью клеток, с высокой чувствительностью, на любых стадиях заболевания, в том числе на ранних стадиях, при которых клинические симптомы отсутствуют. 2 н. и 50 з.п. ф-лы, 5 табл., 1 пр.
Формула
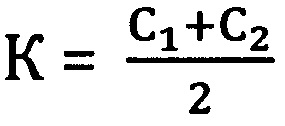

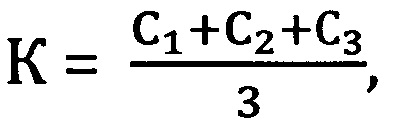

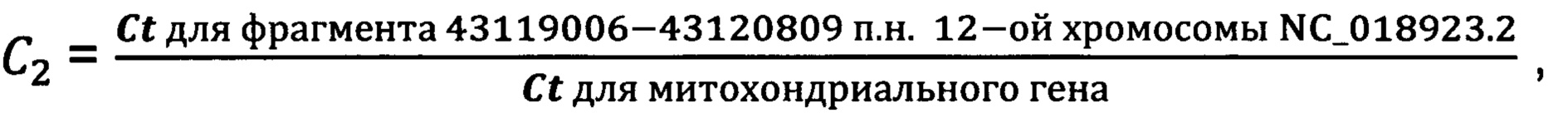





Документы, цитированные в отчёте о поиске
Способ амплификации и детекции нуклеотидных последовательностей в реакционной смеси и используемый в нем набор

Комментарии