Способ и система для клеточного анализа с помощью массовой цитометрии - RU2636352C2
Код документа: RU2636352C2
Чертежи
Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящее изобретение относится к устройству и способам для анализа клетки с помощью массовой цитометрии.
ВВЕДЕНИЕ
[0002] Одна область цитобиологических исследований включает в себя опрос клеточных образцов путем идентификации биологических свойств, указывающих на функции клетки, клеточные процессы или отклик благодаря некоторым реакциям. Некоторые из этих свойств могут наблюдаться с помощью традиционных основанных на клетке методик визуализации, таких как микроскопия для визуализации внешнего вида структурных особенностей клетки или визуализация маркеров в иммуноцитохимии и иммуногистохимии, использующая люминесцентное или радиоактивное обнаружение.
[0003] Альтернативно методика для анализа одиночной клетки с использованием массовой цитометрии может быть применена к клеткам, маркированным сопряженными с металлом антителами и металлоинтеркаляторами, и вводящимся индивидуально в источник ионов индуктивно сопряженной плазмы (ICP), где клетки выпариваются, измельчаются и ионизируются для одновременного элементного анализа. Как следствие большого количества различимых элементарных маркеров и одновременного обнаружения и количественного определения массовым цитометром, клеточные свойства, определяемые этой комплексной методикой, могут использоваться для того, чтобы расширить область клеточного анализа по сравнению с возможностями традиционных основанных на клетке методик отображения или визуализации.
[0004] Однако основанные на клетке методики отображения/визуализации и методики массовой цитометрии требуют отдельных и выделенных наборов образцов клеток для их анализа. Таким образом, комбинирование результатов различных основанных на дискретных образцах независимых методик анализа клеток для увеличения размера информации о клетке может быть подвержено неустранимой неопределенности.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0005] Принимая во внимание вышеизложенное и в соответствии с настоящим изобретением заявители установили, что многомерный анализ группы клеток может быть выполнен с помощью комбинации методик путем использования того факта, что каждая технология выполняет свой опрос на основе различных процессов. Группа клеток может быть первоначально подготовлена в соответствии с условиями, требуемыми каждой методикой, так, чтобы каждый процесс мог быть дополнительно применен к той же самой группе клеток в соответствии с каждым интересующим свойством без существенной интерференции условий, накладываемых каждым процессом. Последовательность для процессов опроса может быть выбрана в таком порядке, который стремится сохранять условия для каждой последующей методики, и может заканчиваться опросом, выполняемым детектором массовой цитометрии для окончательного исследования. Процесс лазерно-абляционной массовой цитометрии может конфигурироваться так, чтобы иметь своей целью только подходящие клетки, которые были ранее идентифицированы как имеющие интересующие свойства. Прямая корреляция между результатами массово-цитометрического анализа для каждой подходящей клетки и соответствующими интересующими свойствами может быть установлена для одной и той же группы клеток.
[0006] Другим аспектом настоящего изобретения является способ для анализа клеток с помощью массовой цитометрии. Этот способ включает в себя обеспечение группы клеток, маркированных более чем одним отличным элементарным маркером, и выбор подходящей клетки в группе клеток путем идентификации локализации подходящей клетки, имеющей интересующее свойство. Локализация подходящей клетки в соответствии с ее положением внутри группы клеток записывается так, что когда по меньшей мере один лазерный импульс направляется на подходящую клетку в записанной локализации, генерируется дискретный шлейф для каждого из по меньшей мере одного лазерного импульса. Каждый дискретный шлейф включает в себя более одного различных элементарных маркеров. Этот способ дополнительно включает в себя введение каждого дискретного шлейфа в индуктивно сопряженную плазму и генерирование групп элементарных ионов, соответствующих каждому из более чем одного различных элементарных маркеров, которые могут быть одновременно обнаружены с помощью массовой цитометрии для каждого дискретного шлейфа. Обнаруженные элементарные ионы коррелируются с интересующим свойством.
[0007] Еще одним аспектом настоящего изобретения является система анализа клеток с использованием элементарных маркеров. Эта система имеет по меньшей мере одно опрашивающее устройство, выполненное с возможностью идентификации локализации подходящей клетки, и хранилище данных, отформатированное так, чтобы записывать локализацию подходящей клетки. Система лазерной абляции соединяется с хранилищем данных, причем система лазерной абляции выполнена с возможностью направлять по меньшей мере один лазерный импульс на локализацию подходящей клетки. Система дополнительно включает в себя массовый цитометр, соединенный с системой лазерной абляции, причем массовый цитометр выполнен с возможностью обнаружения элементарного маркера, связанного с подходящей клеткой.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0008] Специалисту в данной области техники будет понятно, что описанные ниже чертежи предназначены для целей иллюстрации. Эти чертежи не предназначены для того, чтобы каким-либо образом ограничивать область охвата настоящего изобретения. В сопроводительных чертежах, где одинаковые ссылочные позиции указывают на одинаковые части:
Фиг. 1 представляет собой графическое представление системы и процесса согласно одному варианту осуществления настоящего изобретения;
Фиг. 1А представляет собой схематическую диаграмму системы, проиллюстрированной на Фиг. 1;
Фиг. 2 представляет собой примерную матрицу, содержащую многомерную клеточную информацию в соответствии с настоящим изобретением;
Фиг. 3 представляет собой увеличенный вид основы в соответствии с вариантом осуществления, изображенным на Фиг. 1; и
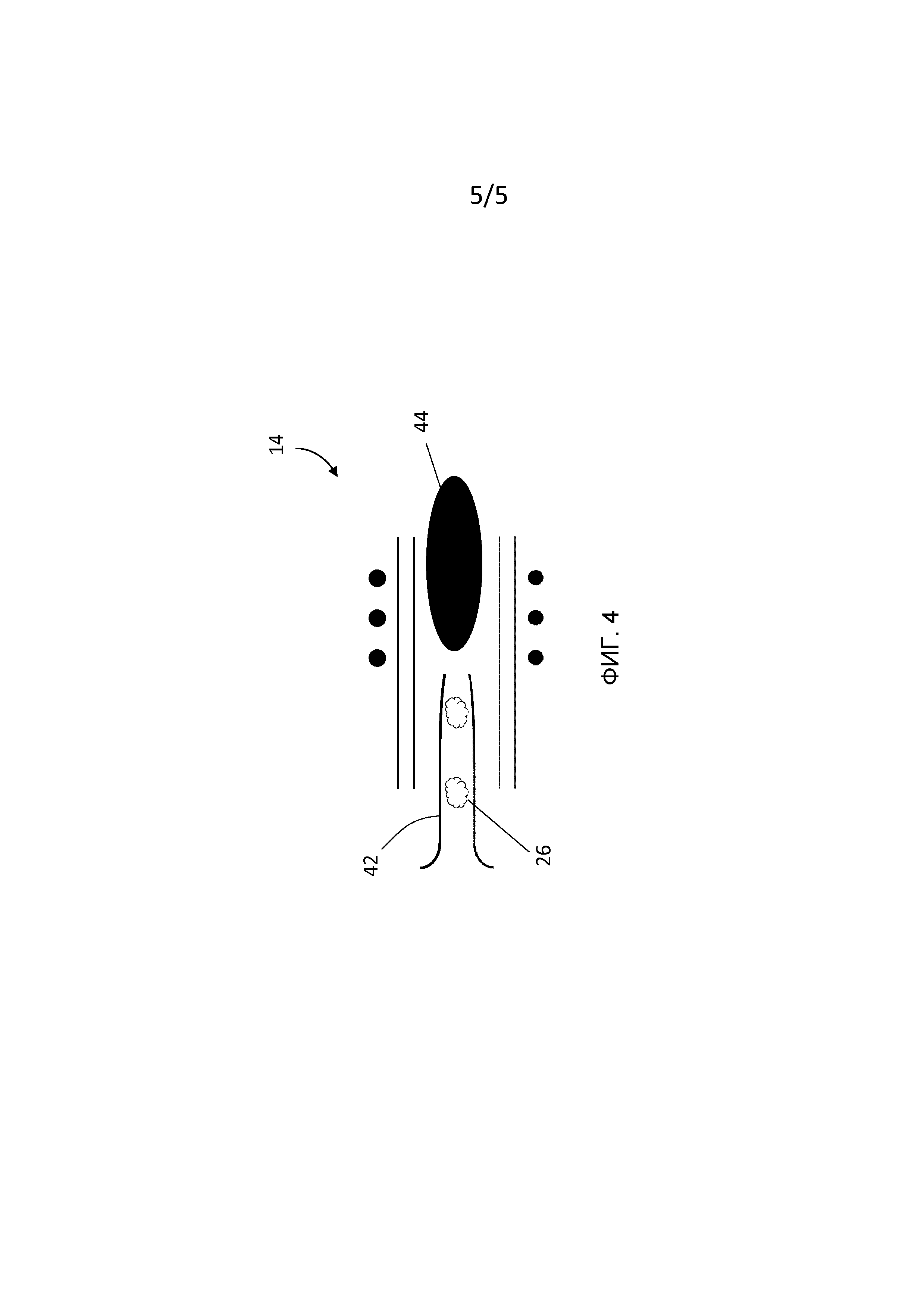
Фиг. 4 представляет собой схематическое изображение одного варианта осуществления источника ионов ICP в соответствии с настоящим изобретением.
ОПИСАНИЕ РАЗЛИЧНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
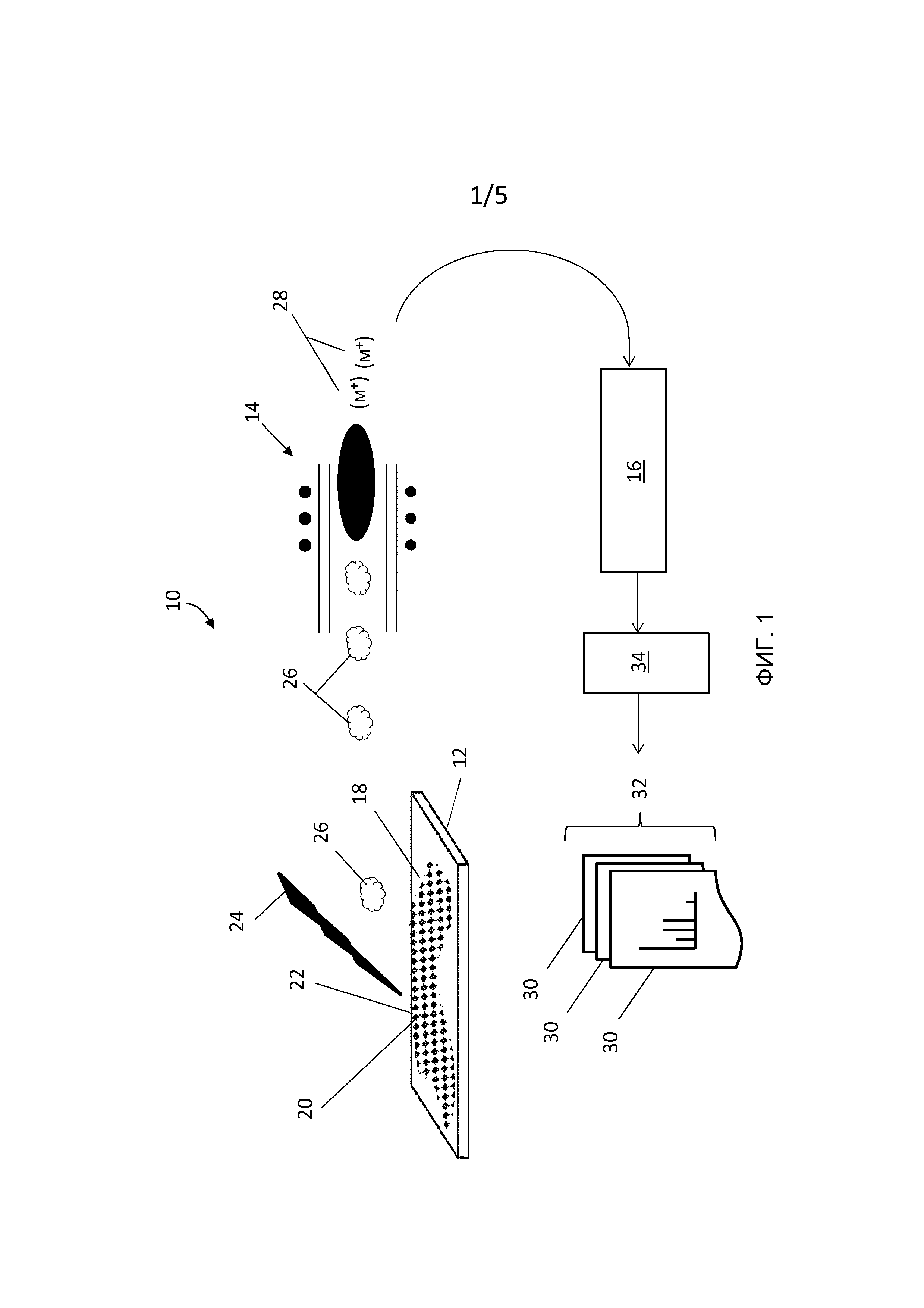
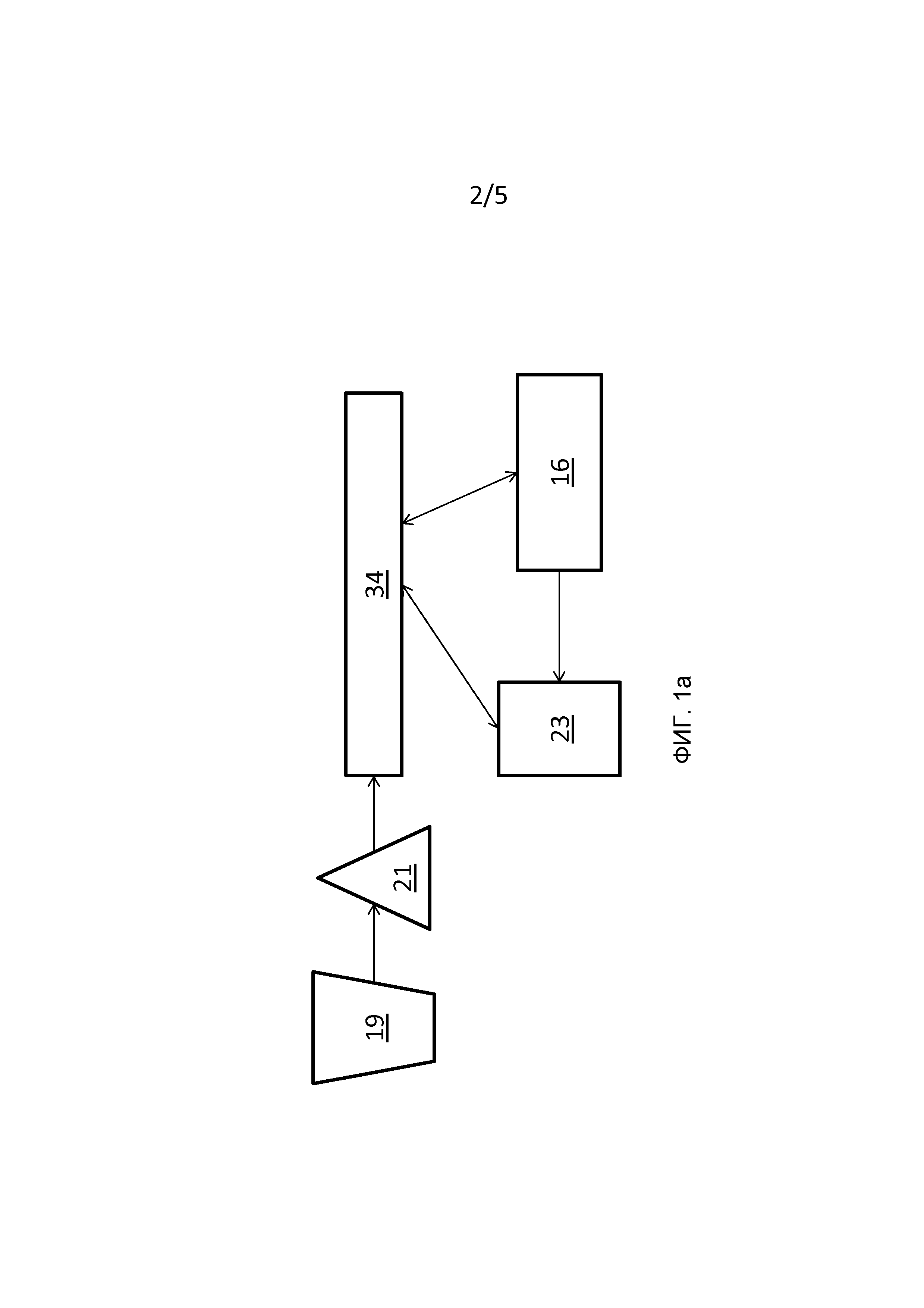
[0009] Следует понимать, что использование элементов в единственном числе, используемое в настоящем документе в отношении различных элементов, включают в себя также варианты «один или более» или «по меньшей мере один», если контекст ясно не указывает иное. На Фиг. 1 показано графическое представление системы анализа клеток, в целом обозначенной ссылочной цифрой 10. Система 10 анализа клеток включает в себя основу 12, соединенную с источником 14 ионов индуктивно сопряженной плазмы (ICP) массового цитометра 16. В целом источник 14 ионов индуктивно сопряженной плазмы можно рассматривать как интегральный компонент массового цитометра 16, однако для ясности источник 14 ионов индуктивно сопряженной плазмы представлен отдельно от массового цитометра 16. Основа 12, например стеклянное предметное стекло, обеспечивает поверхность, которая может быть выполнена с возможностью удерживать группу клеток 18, из которой подходящие клетки 20 могут быть идентифицированы или были идентифицированы опрашивающим устройством 19 как имеющие интересующие свойства, для последующего анализа с помощью массового цитометра 16. Система 10 клеточного анализа дополнительно включает в себя систему 23 лазерной абляции для обеспечения по меньшей мере одного лазерного импульса 24, направленного на подходящую клетку 20 в ее локализации 22 в пределах группы клеток 18. Массовый цитометр 16 может включать в себя систему 34 управления для того, чтобы управлять системой лазерной абляции, а также для генерирования соответствующих данных 30 элементарного маркера. Схема этой системы проиллюстрирована на Фиг. 1A.
[0010] Обычно в массовой цитометрии для одновременного многопараметрического анализа в пределах одиночной клетки группа клеток 18 может быть маркирована более чем одним отличающимися элементарными маркерами Tn. Отличающийся элементарный маркер Tn может быть обычно выбран из группы, включающей в себя переходные металлы, как описано в одновременно поданной американской патентной заявке №12/513011, опубликованной как US 2010/0144056, принадлежащей цессионариям настоящего изобретения. Для удобства обозначение «n» в Tn может быть переменным для того, чтобы обозначить различные переходные элементы или изотопы металлов. В различных вариантах осуществления, например, группа клеток 18 может быть маркирована более чем одним родственным реагентом, как например, в случае различных типов элементарно-сопряженных антител, где каждый тип антитела маркируется одним или более отличающимся элементарным маркером Tn. Отличающийся металлический или элементарный маркер Tn, сопряженный с каждым типом антитела, может быть изотопом любого одного или комбинации из, например, следующих металлов: Gd, Nd, Tb, Eu, Gd, Dy, Ho, Sm, Er, Yb. Каждый тип элементарно-сопряженных антител может быть уникально различимым по его отличающемуся элементарному маркеру Tn. Как хорошо известно, клетки в группе клеток 20, которые имеют сродство к сопряженному с металлом антителу, могут быть маркированными более чем одним элементарным маркером Tn. Таким образом, после элементного анализа массовым цитометром 16 элементная сигнатура клетки представлена различными элементарными маркерами Tn, связанными с антителами.
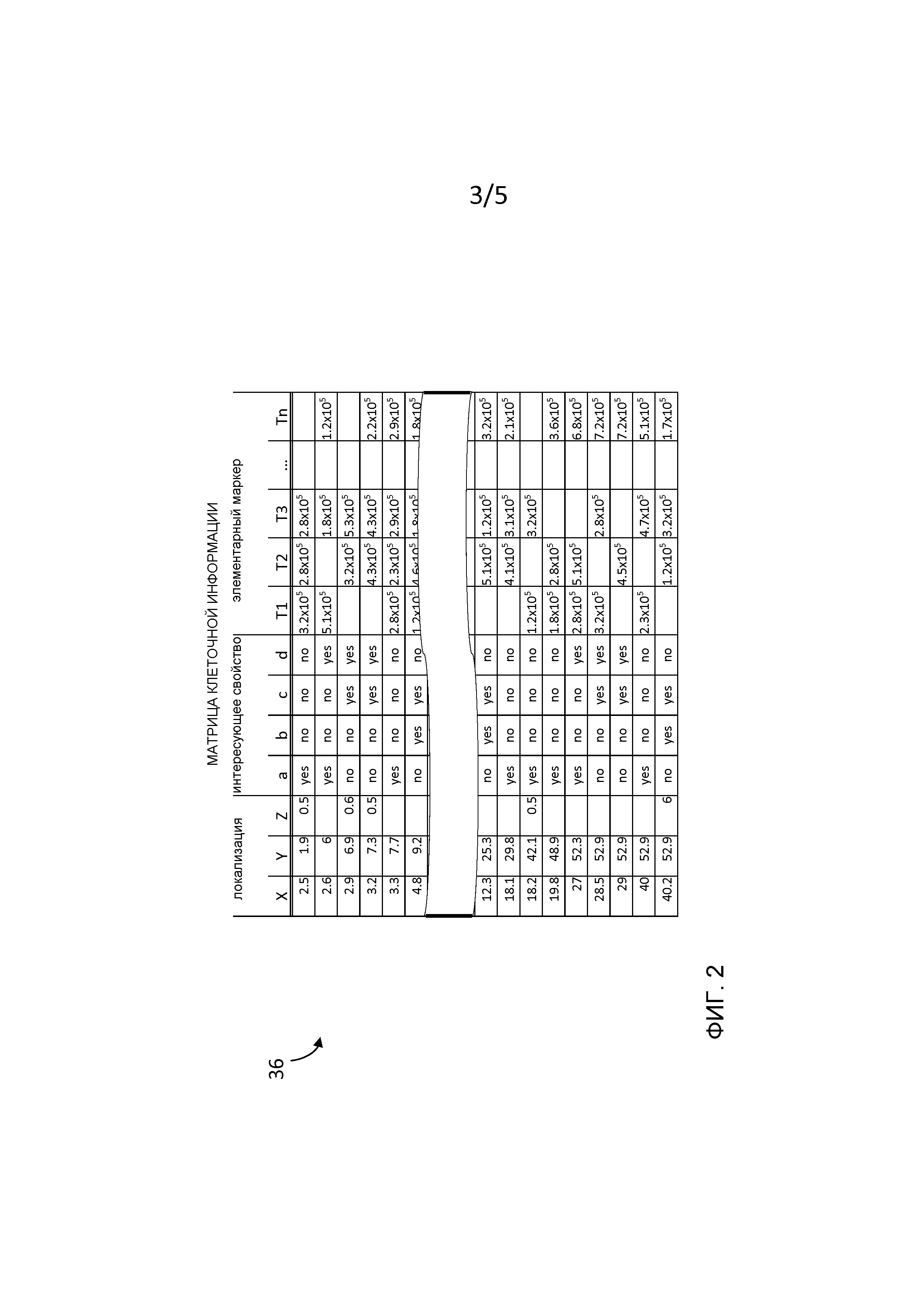
[0011] Как было отмечено выше, заявители настоящего изобретения установили, что процесс опроса для обнаружения различных интересующих свойств может быть скомбинирован в многомерный клеточный анализ для той же самой группы клеток 18 при условии, что a) вначале группа клеток проявляет или может быть подготовлена так, чтобы она проявляла интересующее свойство в соответствии с каждым процессом опроса; b) последовательность анализа может быть выбрана так, чтобы обеспечить целостность каждого интересующего свойства для последовательного процесса опроса; и c) результаты каждого анализа могут быть взаимно коррелированы. Поскольку маркированные клетки, содержащие элементарный маркер (маркеры), испаряются во время ионизации с помощью источника 14 ионов индуктивно сопряженной плазмы, процесс массово-цитометрического обнаружения может быть основой окончательного опрашивающего устройства многомерного клеточного анализа. Соответственно, маркированная группа клеток 18 для идентификации подходящих клеток 20, имеющих свойства, кажущиеся интересными, может подвергаться начальным процессам опроса, которые отличаются от процессов опроса, связанных с больше чем одним отличающимся элементарным маркером Tn. В различных вариантах осуществления, например, интересующее свойство может быть определением жизнеспособности для идентификации подходящей клетки 20, которая может быть либо живой, либо мертвой, а другое интересующее свойство может быть основано на физической форме или физической особенности, свойственной живой или мертвой подходящей клетке. Дополнительное интересующее свойство, зависимое или независимое от любого из вышеупомянутых интересующих свойств, может, например, соответствовать другим люминесцентным свойствам, связанным с условиями методик иммунного окрашивания для идентификации подходящих клеток с определенными интересующими белками. Таким образом, предполагается, что каждое интересующее свойство может быть представлено его конкретной физической локализацией (локализациями) в пределах тех же самых или других подходящих клеток 20. Хотя описанный процесс первоначального опроса обычно соответствует оптическим или флуоресцентным микроскопам, были рассмотрены и другие основанные на клетке типы отображающих/визуализирующих опрашивающих устройств 19, такие как использующие электронные или конфокальные микроскопы, и они также могут быть применены независимо или в комбинации. Таким образом, для процесса рассечения подходящей клетки первоначальный опрос может быть выполнен по меньшей мере одним опрашивающим устройством 19, выполненным с возможностью идентифицировать подходящую клетку с соответствующими интересующими свойствами. Как только подходящие клетки 20 были идентифицированы, локализация подходящих клеток 20, которая может определяться ее координатами относительно их положения внутри группы клеток 18, может быть записана для каждого интересующего свойства независимо или в их комбинации. Как проиллюстрировано на Фиг. 2, информация в хранилище 21 данных относительно локализации 22 подходящей клетки и соответствующих интересующих свойств может быть закодирована в формате, который может быть доступным для системы 34 управления, и может быть сделана частью матрицы, содержащей многомерную клеточную информацию 36.
[0012] После этого, имея доступ к информации в хранилище 21 данных, для каждой записанной локализации 22 система 34 управления может направить по меньшей мере один лазерный импульс 24 на соответствующую подходящую клетку 20 так, чтобы часть материала клетки в форме дискретного шлейфа 26 могла быть удалена. Как правило, каждый лазерный импульс может произвести дискретный шлейф 26, так что серия лазерных импульсов может произвести серию соответствующих дискретных шлейфов 26. Следовательно, материал, удаленный из подходящей клетки 20 для каждого дискретного шлейфа 26, может содержать более одного отличающегося элементарного маркера Tn. При массово-цитометрическом анализе обнаружение более чем одного отличающегося элементарного маркера Tn из подходящей клетки 20 может представлять наличие связанного родственного реагента и может быть коррелировано с интересующим свойством для подходящей клетки 20, как проиллюстрировано на Фиг.2.
[0013] При поддержании пространственного разделения каждого последовательного шлейфа 26, каждый шлейф 26 может быть перенесен и введен в источник 14 ионов индуктивно сопряженной плазмы как дискретная и независимая сущность. По мере того, как каждый дискретный шлейф 26 проходит в источник 14 ионов индуктивно сопряженной плазмы, каждый элементарный маркер Tn может быть ионизирован в соответствующие элементарные ионы, количественно связанные с каждым элементарным маркером Tn. Поскольку может быть больше одного различимого элементарного маркера Tn в подходящей клетке 20, источник 14 ионов индуктивно сопряженной плазмы может генерировать различные группы элементарных ионов для каждого элементарного маркера Tn. Следовательно, для каждого дискретного шлейфа 26 источник 14 ионов индуктивно сопряженной плазмы может генерировать группы элементарных ионов 28, представляемые обычно как (M+) на Фиг. 1. Каждая из групп элементарных ионов 28 может быть обнаружена массовым цитометром 16 в соответствии с отношением массы ионов к их заряду (m/z). В соответствии с настоящим изобретением массовый цитометр 16 может обнаруживать каждый тип элементарных ионов одновременно и, при использовании преимущества быстрого времени передачи ионов для минимизации перекрытия, массовый цитометр 16 может различать группы элементарных ионов, происходящие из последовательных импульсов лазеров. Данные 30 элементарного маркера, показанные на Фиг. 1 как последовательность одиночных файлов данных в общем наборе 32 данных, представляют данные, полученные от одновременного обнаружения групп элементарных ионов 28 для последовательности каждого шлейфа 26. Следовательно, система 10 клеточного анализа может обнаруживать и идентифицировать каждый из более одного отличающихся элементарных маркеров Tn одновременно для каждого лазерного импульса 24 и генерировать данные 30 элементарного маркера, которые могут быть записаны для интересующего свойства подходящей клетки.
[0014] В то время как обычно одиночный лазерный импульс 24 может полностью испарить подходящую клетку 20 и сгенерировать шлейф, содержащий больше одного отличающихся элементарных маркеров Tn, может быть некоторый случай подходящих клеток 20, требующих серии лазерных импульсов 24 для проникновения в клетку или через смежную поверхность для того, чтобы достичь максимальной интенсивности более чем одного отличающихся элементарных маркеров Tn. Кроме того, клеточное профилирование может быть достигнуто с помощью подходящей конфигурации лазера, способной доставлять энергию с высокой временной и пространственной точностью. Последовательность лазерных импульсов 24 может использоваться для того, чтобы проанализировать элементарный маркер Tn, содержавшийся внутри подходящей клетки 20. Например, во время анализа, по мере того, как каждый лазерный импульс 24 удаляет последовательные слои маркированной подходящей клетки 20, группы элементарных ионов 28, соответствующие более чем одному отличающемуся элементарному маркеру Tn, могут быть одновременно обнаружены массовым цитометром 16. Каждая из обнаруженных групп элементарных ионов 28 может представлять материал, удаленный в каждом слое подходящей клетки 20. Как отмечено выше, некоторые из дискретных шлейфов 26 могут совсем не содержать металлических элементов или элементарных маркеров, или некоторые из дискретных шлейфов 26 могут включать в себя последовательность металлических элементов различных концентраций. Таким образом, для каждого одновременного измерения, выполняемого массовым цитометром 16, данные 30 в наборе 32 могут содержать качественную и количественную информацию, основанную на наличии и в некоторых случаях на отсутствии одного или более элементарных маркеров Tn. Каждые из полученных данных 30 могут обеспечить часть информации о поперечном сечении или профиле толщины маркированной подходящей клетки 20.
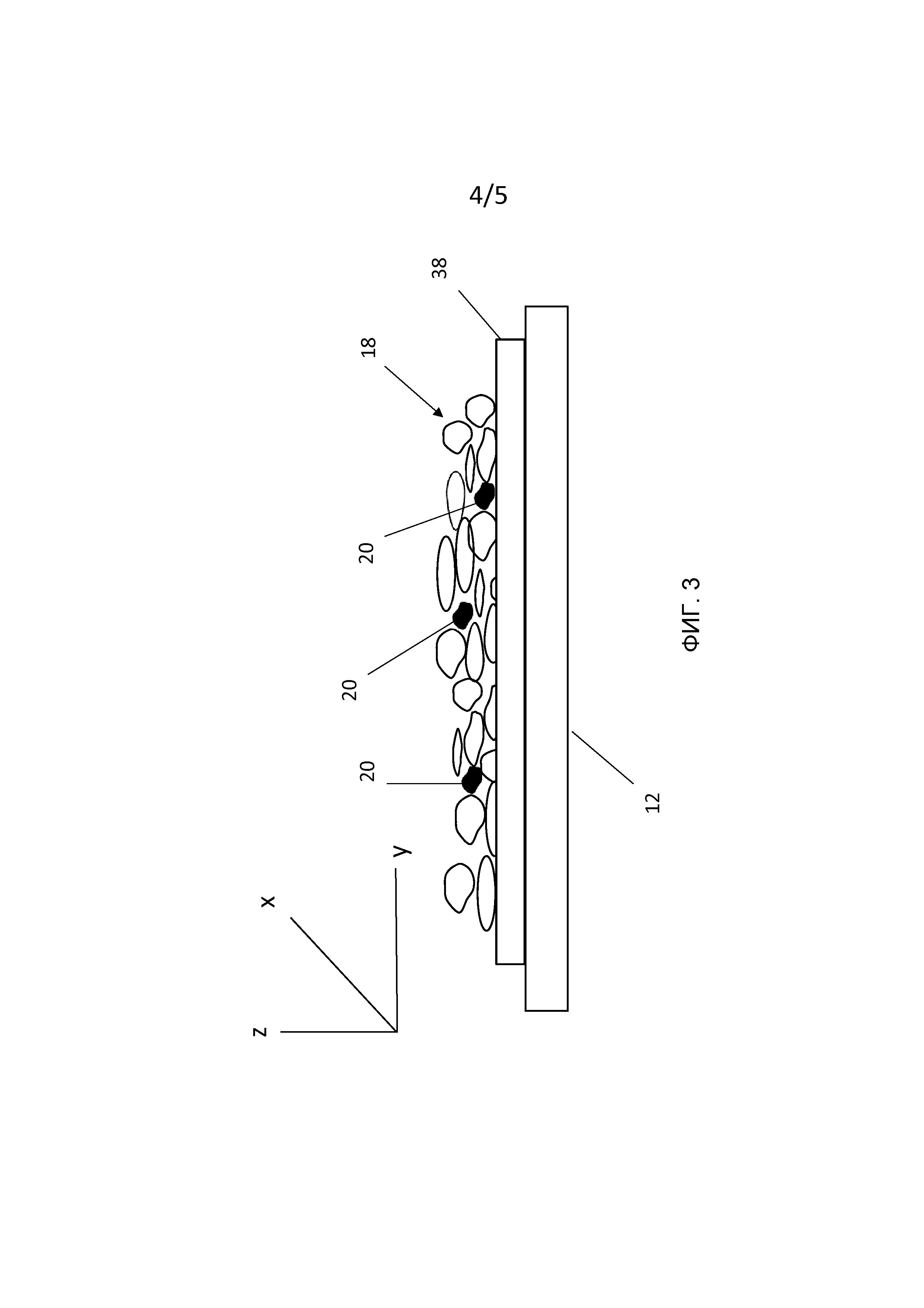
[0015] Кроме того, могут быть случаи, когда, например, толщина группы клеток 18 больше, чем средний диаметр клетки, как, например, в случае перекрывающихся слоев клеток в присутствии носителя клеток или в случае толстых срезов ткани или нерассеченного целостного гистологического препарата, как показано на Фиг. 3. Следовательно, локализация одной или более идентифицированной подходящей клетки 20 или части подходящей клетки 20 может находиться внутри на некотором расстоянии от верхней или от нижней поверхности группы клеток 18. В различных вариантах осуществления, например, находящаяся внутри подходящая клетка или клетки 20 могут быть идентифицированы с помощью флуоресцентной микроскопии, используя методику конфокального микроскопа для обеспечения структурных изображений локализованной клетки. Другие методики для выбора подходящих клеток 20, которые могут быть основаны на идентификации их интересующего свойства, могут включать в себя, например, фосфоресценцию, отражение и поглощение. Следовательно, локализация или локальные детали находящейся внутри подходящей клетки или клеток 20 могут быть определены с помощью, например, декартовой системы координат в трехмерном пространстве (Χ, Υ, Ζ), где значение для оси Z на Фиг. 3 обозначает глубину в направлении толщины группы клеток 18. Трехмерные координаты могут быть записаны (как проиллюстрировано на Фиг. 2) и использованы для того, чтобы представить и идентифицировать локализацию подходящей клетки 20 относительно ее положения внутри группы клеток 18. В этом случае, когда локализация 22 подходящей клетки 20 подвергается методике анализа элементарного маркера Tn в соответствии с настоящим изобретением, координата Z глубины может рассматриваться как интересующее свойство и может использоваться для того, чтобы определить, например, ожидаемое количество лазерных импульсов 24, которое может потребоваться для того, чтобы достичь находящейся внутри подходящей клетки 20. Последовательность дискретных шлейфов 26, сгенерированная последовательностью лазерных импульсов 24, может не содержать элементарных маркеров Tn до тех пор, пока по меньшей мере один лазерный импульс 24 не достигнет находящейся внутри подходящей клетки 20 с координатой Z. С другой стороны, фактическое количество лазерных импульсов, произведенных для достижения подходящей клетки 20 и генерирования шлейфов, содержащих элементарный маркер Tn, и обнаружения группы элементарных ионов 28, может быть скоррелировано с записанной глубиной Z как способ перекрестной калибровки двух взаимоисключающих методик на основе клетки.
[0016] В то время как настоящее изобретение описывается в связи с различными вариантами осуществления, оно не ограничивается такими вариантами осуществления. Напротив, настоящее изобретение охватывает различные альтернативы, модификации и эквиваленты, как будет понятно специалистам в данной области техники. Например, заявители настоящего изобретения установили, что одновременно с меткой, сопряженной с элементарным маркером Tn, группа клеток 18 может быть первоначально подготовлена так, чтобы она проявляла интересующее свойство, поддающееся обнаружению процессом отображения/визуализации для идентификации подходящей клетки 20, как это известно в данной области техники. По существу группа клеток 18 может быть подготовлена с маркированными флуорофорами белками и/или эндогенной экспрессией флуоресцеинов в дополнение к маркировке сопряженными с элементарным маркером Tn родственными реагентами. Дополнительно к этому сопряженное с элементарным маркером Tn антитело может быть подготовлено с люминесцентной характеристикой так, чтобы обеспечить двойные свойства, определяемые более чем одной взаимоисключающими аналитическими методиками на основе клетки. В различных вариантах осуществления, например, белок CD34 может быть маркирован элементарными изотопами 148Nd в дополнение к флуоресцентным белкам для маркирования в биологическом образце, подозреваемом на наличие определенной функции. С флуоресцентной микроскопией, биологический образец может быть первоначально исследован, и подходящие клетки, экспрессирующие белок CD34, могут быть идентифицированы и изолированы на предметном стекле. Локализация изолированных подходящих клеток, экспрессирующих белок CD34, может быть выбрана в качестве мишени для элементарного обнаружения с помощью массовой цитометрии в соответствии с настоящим изобретением. В этом примере обнаруженная группа элементарных ионов 28 может быть коррелирована с обнаружением флуоресцеинов в качестве способа обеспечения количественной оценки или для целей подтверждения.
[0017] В различных вариантах осуществления информация, записанная для подходящей клетки 20, включая, но не ограничиваясь ее локализацией 22, может иметь различные форматы хранилища данных и может быть доступна для системы 34 управления с использованием различных протоколов. Например, визуальное представление группы клеток 18, такое как флуоресцентное эмиссионное изображение, может использоваться для того, чтобы идентифицировать и представить каждую подходящую клетку 20. В этом случае интерфейс между хранилищем 21 данных и системой 34 управления может быть системой оптического обнаружения с подходящим программным обеспечением визуального распознавания. Это программное обеспечение может быть выполнено с возможностью определения локализации подходящей клетки 20 из эмиссионного изображения для того, чтобы впоследствии направить по меньшей мере один лазерный импульс 24 на локализацию подходящей клетки 20. Альтернативно записанная информация может быть представлена и получена с помощью различных оптических машиночитаемых интерфейсов, таких как те, которые воплощены в считывателях/сканерах штриховых кодов (одномерных или двухмерных), или с помощью других интерфейсов, которые используют радиочастотную идентификацию (RFID), или их вариации и комбинации. Кроме того, локализация подходящей клетки 20 наряду с ее интересующим свойством обычно может быть записана как запись алфавитно-цифровых данных, доступная системе 34 управления, или данные могут быть вручную введены непосредственно в органы управления системы лазерной абляции или системы массовой цитометрии. Независимо от интерфейсного формата, в котором передается информация подходящей клетки, конфигурация системы лазерной абляции может быть разработана так, чтобы записанная информация могла обеспечить координаты локализации для того, чтобы направить по меньшей мере один лазерный импульс 24 на локализацию 22 подходящей клетки 20.
[0018] В различных вариантах осуществления, в то время как основа 12 была описана как предметное стекло микроскопа, которое обычно удовлетворяет существенным требованиями для приложений микроскопии, заявители рассмотрели изготовление основы 12 из другого материала, такого, например, как один из или комбинация нержавеющей стали, кварца, керамики, политетрафторэтилена (PTFE) и полиэфирэфиркетона (PEEK). Альтернативно, обращаясь к Фиг. 3, основа 12 может быть основанием или структурой, которая может быть отделена от предметного стекла 38, удерживающего группу клеток 18. Например, в оптической микроскопии группа клеток 18, маркированных более чем одним отличающимся элементарным маркером Tn, может быть помещена на предметное стекло 38 и освещена снизу (для типичной микроскопии в проходящем свете) или освещена сверху через линзу объектива (для типичной флуоресцентной микроскопии). Изображение, захваченное оптикой микроскопа, может использоваться для идентификации подходящей клетки 20 в соответствии с интересующим свойством, таким как, например, физическая форма или присутствие флуоресцентного зонда (зондов). Локализация идентифицированной подходящей клетки 20 наряду с ее интересующим свойством может быть записана для того, чтобы представить информацию, относящуюся к клеточному анализу биологического образца. Обычно процесс идентификации может повторяться по мере необходимости так, чтобы более одной подходящей клетки 20 могло быть найдено в группе клеток 18. Как только подходящая клетка 20 или подходящие клетки 20 были идентифицированы, предметное стекло 38 и его содержимое может быть перенесено на основу 12 для его поддержки. Информация относительно локализации каждой подходящей клетки 20, выраженная декартовыми координатами, представленными, например, в двухмерном или в трехмерном пространстве внутри группы клеток 18, может быть использована для того, чтобы направить по меньшей мере один лазерный импульс 24 на подходящую клетку 20 для генерирования дискретного шлейфа 26 для каждого из по меньшей мере одного лазерного импульса 24.
[0019] Заявители настоящего изобретения установили, что для того, чтобы каждые данные 30 элементарного маркера соответствовали каждому из по меньшей мере одного лазерного импульса 24, должно поддерживаться пространственное разделение каждого последовательного шлейфа 26 и соответствующих ионов во время их перемещения вдоль пути между основой и источником 14 ионов индуктивно сопряженной плазмы и между источником ионов 14 и детектором ионов массового цитометра 16. Например, твердотельный лазер, обычно используемый для лазерной абляции, такой как фемтосекундный импульсный лазер, может быть настроен на работу с частотой импульсов от 10 до 100 Гц. В этом диапазоне частот шлейф 26 может генерироваться каждые 10-100 мс. Рассматривая нижний предел, система 10 была бы обязана иметь максимальное время задержки порядка 10 мс. В соответствии с различными вариантами осуществления настоящего изобретения массовый цитометр 16 может быть охарактеризован как «проточное» аналитическое устройство, включающее в себя линейный ионный путь с электростатическими линзами и детектором ионов, способным к параллельному обнаружению элементарных ионов. В этой конфигурации может быть достигнуто время задержки порядка 10 мс, так, чтобы группы элементарных ионов (М+) могли ускориться и пройти через массовый цитометр 16 для одновременного обнаружения. Следовательно, может быть реализована вероятность того, что детектор ионов сможет отдельно обнаруживать каждую из групп элементарных ионов 28.
[0020] Для того, чтобы поддержать соответствующую пространственную различительную способность после массового цитометра 16, конфигурация пути между локализацией лазерной абляции на основе 12 и входом в плазму может быть выбрана так, чтобы максимизировать разделение шлейфов 26 при минимизации турбулентности потока. В нижнем пределе время задержки порядка 10 мс для поддержания разделения каждого шлейфа 26 перед ионизацией может быть достигнуто при пути, имеющем минимальное расстояние перемещения шлейфа и соответствующее средство ускорения этого перемещения. Обычно источник 14 ионов индуктивно сопряженной плазмы использует инжекторную трубку 42, как обозначено на Фиг. 4, и поток несущего газа (не показан) может быть применен подходящим образом для того, чтобы направить каждый дискретный шлейф 26 в плазму 44. Соответственно, инжекторная трубка 42 может быть выполнена с возможностью обеспечения ламинарной или почти ламинарной геометрии потока, имеющей значение числа Рейнольдса, например, ниже 2000 для получения шлейфа 26 и для того, чтобы несущий газ тек со шлейфом 26 так, чтобы турбулентность могла быть минимизирована. Таким образом, в различных вариантах осуществления комбинированное время задержки, соответствующее полному пути между основой 12 и источником ионов 14 и между источником ионов 14 и детектором ионов массового цитометра 16, может составлять от 20 мс до 200 мс.
[0021] Кроме того, в различных вариантах осуществления основа 12 может быть позиционирована относительно источника 14 ионов индуктивно сопряженной плазмы так, что время прохождения для каждого шлейфа 26 может быть минимизировано. Например, источник 14 ионов индуктивно сопряженной плазмы может быть структурирован так, чтобы охватывать основу 12 для обеспечения близко расположенного источника ионов индуктивно сопряженной плазмы лазерной абляции. Источник ионов индуктивно сопряженной плазмы лазерной абляции может конфигурироваться с интегрированным замкнутым пространством, имеющим оптический вход для лазерных импульсов 24, несущий газ для захвата и транспортировки шлейфа и источник ионов индуктивно сопряженной плазмы для генерирования групп элементарных ионов 28. Поток несущего газа может конфигурироваться так, чтобы уносить каждый дискретный шлейф 26 с локализации 22 абляции и передавать каждый шлейф 26 непосредственно в плазму 44.
[0022] В то время как в различных вариантах осуществления термин «группа клеток» относится обычно к клеткам, содержащимся в тонко нарезанных образцах биологической ткани или в нерассеченных целостных образцах ткани, настоящее изобретение может быть равной степени применено к клеткам, обычно находящимся в клеточных культурах. В различных вариантах осуществления группа клеток 18 может быть смесью подгрупп клеток, где каждая подгруппа может происходить из различных источников или различных биологических сущностей. В этом случае происхождение клетки может быть охарактеризовано одним из интересующих свойств. Например, рассмотрим образцы, взятые от более чем одной биологической сущности, где каждый образец соответствует подгруппе клеток, которая может быть различимо промаркирована более чем одним отличающимся элементарным маркером Tn. Каждая из подгрупп клеток может быть скомбинирована в ту же самую группу клеток 18 так, чтобы клетки из каждого образца могли коллективно экспрессировать их различимо промаркированное сопряженное с элементом антитело в пределах той же самой группы клеток 20. Комбинированная группа клеток 18 может быть опрошена, и подходящие клетки 20 могут быть идентифицированы и выбраны на основе некоторого интересующего свойства без знания о происхождении подходящей клетки. При элементном анализе в соответствии с настоящим изобретением элементарные маркеры Tn могут быть обнаружены и соответствующие подходящие клетки 20 могут быть идентифицированы как относящиеся к конкретной биологической сущности. Соответственно соотношение между интересующим свойством и обнаруженными элементарными ионами 24 может быть скоррелировано для того, чтобы определить интересующее свойство, указывающее на эту подгруппу клеток и потенциально на происхождение клетки. В целом преимущество настоящего изобретения может быть применено к группам клеток, включающих в себя неразрушенные клетки, где неразрушенные подходящие клетки могут быть идентифицированы и затем проанализированы на их элементарные маркеры с помощью массовой цитометрии.
[0023] В то время как были описаны усилия для создания условий поддержания пространственного разделения каждого шлейфа 26 и соответствующих групп элементарных ионов 28 во время всего клеточного анализа, заявители настоящего изобретения установили, что некоторое пространственное распределение или перекрытие может присутствовать. Соответственно, заявители рассмотрели усредняющий подход, применяемый к двум или более из полученных элементарных данных 30 без существенной потери информации, генерируемой из каждого лазерного импульса 24. Альтернативно комплексный подход комбинирования каждых из полученных элементарных данных 30 в набор 32 может быть достаточным для представления массово-цитометрической части информации многомерного клеточного анализа. В различных вариантах осуществления алгоритм анализа данных, такой как БПФ, может использоваться для развертки интегрированного набора данных 32. Различные формы алгоритмов могут использоваться в аналитической системе 10 или могут быть применены уже после сбора информации общеизвестным образом.
[0024] Кроме того, система 34 управления может быть выполнена с возможностью служить многофункциональным целям в соответствии с настоящим изобретением. Хотя система 34 управления была описана в связи с управлением системой лазерной абляции, а также для генерирования соответствующих данных 30 элементарного маркера, система 34 управления, обычно функционирующая под логическим управлением, может обеспечить различные уровни автоматизации или выполнять последовательность управляемых с использованием обратной связи действий для того, чтобы обеспечить автоматизацию аналитической системы 10. В различных вариантах осуществления, например, система 34 управления может быть основанной на процессоре системой, соединенной с автоматизированной системой обработки образцов для выполнения опроса и идентификации, записи информации и обеспечения доступа к ней, направления лазерных импульсов, осуществления процесса массово-цитометрического обнаружения и корреляции данных автономно или с вмешательством пользователя.
Реферат
Группа изобретений относится к области биохимии. Предложены способ и система для клеточного анализа. Способ включает обеспечение группы маркированных клеток, выбор имеющей интересующее свойство клетки в группе, запись локализации клетки, направление лазерного импульса на клетку и генерирование дискретного шлейфа, введение дискретного шлейфа в индуктивно сопряженную плазму и генерирование групп соответствующих маркеру элементарных ионов, обнаружение каждой из групп элементарных ионов одновременно для каждого дискретного шлейфа с помощью массовой цитометрии и корреляцию обнаруженных элементарных ионов с интересующим свойством. Система включает опрашивающее устройство для идентификации локализации подходящей клетки, хранилище данных для записи локализации клетки, систему лазерной абляции для направления лазерного импульса на локализацию клетки и массовый цитометр для обнаружения связанного с подходящей клеткой маркера. Изобретения обеспечивают расширение области клеточного анализа по сравнению с возможностями традиционных основанных на клетке методик отображения или визуализации. 2 н. и 13 з.п. ф-лы, 5 ил.

Комментарии