Искусственные ткани печени, матриксы искусственных тканей и способы их изготовления - RU2625016C2
Код документа: RU2625016C2
Чертежи

































Описание
Перекрестные ссылки на родственные заявки
Данная заявка претендует на приоритет и является частично продолжающейся заявкой США сериальный №13/841430 от 15 марта 2013 г., которая включена здесь ссылкой во всей полноте.
Предпосылки создания изобретения
Система здравоохранения сталкивается со множеством актуальных проблем. К июню 2012 г. в Организации Распределения Донорских Органов США (United Network for Organ Sharing (UNOS)) были зарегистрированы 114636 пациентов, нуждающихся в трансплантации органов. Согласно данным UNOS, между январем и мартом 2012 г. были проведены только 6838 трансплантаций. Каждый год в UNOS обращаются больше пациентов, чем выполняется трансплантаций, что приводит к увеличению очереди из пациентов, ожидающих пересадки органов.
Кроме того, затраты на исследование и разработку новых фармацевтических препаратов составляют приблизительно $1,8 миллиарда. См. статью: Paul, et al. (2010) How to improve R&D productivity: the pharmaceutical industry's grand challenge. Nature Reviews Drug Discovery 9(3): 203-214. Создание лекарства включает изобретение и/или разработку препарата. Процесс разработки лекарства включает по меньшей мере следующие стадии: идентификация предполагаемых соединений, синтез, характеризация, поиск и анализ терапевтической эффективности. Несмотря на прогресс в технологии и исследовании биологических систем, разработка лекарства остается длительным, затратным и малоэффективным процессом с малой скоростью открытия новых терапевтических средств.
Сущность изобретения
Настоящее изобретение относится к области регенеративной медицины и инженерии тканей и/или органов. Более конкретно изобретение относится к искусственно создаваемым конструкциям печеночной ткани, матриксов искусственных тканей и способам их изготовления.
В одном аспекте изобретение предлагает искусственные трехмерные живые конструкции печеночной ткани, содержащие по меньшей мере один компартмент, определяющий плоскую структуру; причем компартмент содержит внутреннюю область, определенную границей, причем внутренняя область содержит паренхимальные клетки, а граница содержит непаренхимальные клетки; причем клетки объединены с образованием трехмерной живой конструкции печеночной ткани; при условии, что по меньшей мере один компонент такой конструкции получен методом биопринтинга и конструкция во время ее использования по существу не содержит ранее сформированного каркаса. В некоторых вариантах такая конструкция включает также компонент для экструзии, облегчающий биопринтинг клеток. В некоторых вариантах паренхимальные клетки получают из одного или более из следующих источников: печеночная ткань взрослых млекопитающих; печеночная ткань плода; ткань из линий или штаммов клеток печени, стволовые эмбриональные клетки (ESC); стволовые гепатоцитоподобные клетки, индуцированные мультипотентные стволовые клетки (iPSC); мультипотентные гепатоцитоподобные клетки; взрослые стволовые клетки/клетки-предшественники, полученные из печени; и стволовые клетки/клетки-предшественники из непеченочной ткани. В некоторых вариантах непаренхимальные клетки включают один или более типов клеток: васкулярные клетки, эндотелиальные клетки, фибробласты, мезенхимальные клетки, иммунные клетки, клетки Купфера, звездчатые клетки, билиарные эпителиальные клетки, билиарные эпителий-подобные клетки, синусоидальные эндотелиальные клетки, полученные из печени стволовые клетки/клетки-предшественники и полученные не из печени стволовые клетки/клетки-предшественники. В некоторых вариантах такая конструкция включает стволовые клетки/клетки-предшественники, которые получили один или более дифференцирующих сигналов. В других вариантах дифференциация включает один или более сигналов: биомеханические, из раствора и физические. В других вариантах стволовые клетки/клетки-предшественники были подвергнуты воздействию одного или более дифференцирующих сигналов до изготовления конструкции. В следующих вариантах стволовые клетки/клетки-предшественники были подвергнуты воздействию одного или более дифференцирующих сигналов во время изготовления конструкции. В еще одних вариантах стволовые клетки/клетки-предшественники были подвергнуты воздействию одного или более дифференцирующих сигналов после изготовления конструкции. В некоторых вариантах конструкция содержит один или более слоев. В некоторых вариантах конструкция является многослойной и по меньшей мере один слой композиционно или архитектурно отличается от других слоев при формировании структуры. В некоторых вариантах конструкция предназначения для применения в исследованиях in vitro. В некоторых вариантах конструкция предназначена для применения с одной или более целями, такими как обнаружение лекарства; тестирование лекарства; доклиническое исследование; тестирование токсичности; тестирование абсорбции, распределения, метаболизма и экскреции (ADME) лекарства; тестирование метаболизма лекарства и фармакокинетики (DMPK); моделирование болезни; моделирование инфекционного заболевания; моделирование болезни хозяина; изучение трехмерной биологии и клеточный скрининг. В некоторых вариантах конструкция предназначена для применения в клеточном скрининге, причем скрининг проводят по одному или более инфекционным заболеваниям: фиброз печени (например, цирроз), рак печени, жировое перерождение печени (например, жирная печень); по одному или более видам дефицита метаболизма, по одному или более видам дефицита белка. В других вариантах инфекционные заболевания включают вирусные инфекции или паразитарные инфекции (например, плазмодиевую инфекцию и т.п.). В следующих вариантах конструкция предназначена для применения в длительных исследованиях токсичности тканей, причем анализы проводят в течение времени от >3 суток и до 6 месяцев. В некоторых вариантах конструкция предназначена для улучшения одной или более функций печени у людей. В следующих вариантах конструкция предназначена для имплантации пациенту на месте раны, при заболевании или дегенерации. В еще одних вариантах конструкция предназначена для клинического применения в экстракорпоральных устройствах, предназначенных для улучшения или восстановления одной или более функций печени. В некоторых вариантах конструкцию применяют в неиннервированном виде.
В другом аспекте изобретение предлагает искусственные живые трехмерные конструкции печеночной ткани, содержащие один или более слоев, причем каждый слой содержит клетки печени одного или более типов, один или более слоев объединены в живую трехмерную конструкцию печеночной ткани, причем такие конструкции характеризуются тем, что они содержат по меньшей мере: по меньшей мере один слой, содержащий многие типы клеток; типы клеток, расположенных в пространстве относительно друг друга с образованием плоской структуры; и множество слоев, из которых по меньшей мере один слой композиционно или архитектурно отличается от другого слоя, образуя слоистую структуру. В некоторых вариантах по меньшей мере один компонент конструкции получен методом биопринтинга. В некоторых вариантах каждый слой искусственной печеночной ткани включает множество клеток в направлении осей X, Y и Z. В других вариантах каждый слой искусственной печеночной ткани имеет толщину по меньшей мере около 50 микрон в направлении осей X, Y и Z. В следующих вариантах конструкция также включает композицию для экструзии, которая способствует биопринтингу клеток. В некоторых вариантах к моменту использования конструкция по существу не содержит ранее сформированного каркаса. В некоторых вариантах печеночные клетки получают из одного или более следующих источников: ткань печени взрослых млекопитающих; ткань печени плода; стволовые эмбриональные клетки (ESC); полученные из ESC гепатоцитоподобные клетки, индуцированные мультипотентные стволовые клетки (iPSC); полученные из iPSC гепатоцитоподобные клетки; взрослые стволовые клетки/клетки-предшественники, полученные из печени; а также взрослые стволовые клетки/клетки-предшественники, полученные из ткани, отличной от ткани печени. В некоторых вариантах конструкция также включает один или более типов клеток: васкулярные клетки, эндотелиальные клетки, паренхимальные клетки, непаренхимальные клетки, фибробласты, мезенхимальные клетки, иммунные клетки, раковые клетки, клетки Купфера, звездчатые клетки, билиарные клетки, синусоидальные эндотелиальные клетки, полученные из печени стволовые клетки/клетки-предшественники и стволовые клетки/клетки-предшественники, полученные не из печени. В некоторых вариантах конструкция включает стволовые клетки/клетки-предшественники, которые получили один или более дифференцирующих сигналов. В других вариантах дифференциация включает один или более сигналов: биомеханические, растворение и физические сигналы. В других вариантах стволовые клетки/клетки-предшественники были подвергнуты воздействию одного или более дифференцирующих сигналов до изготовления конструкции. В следующих вариантах стволовые клетки/клетки-предшественники были подвергнуты воздействию одного или более дифференцирующих сигналов во время изготовления конструкции. В еще одних вариантах стволовые клетки/клетки-предшественники получили один или более дифференцирующих сигналов после изготовления конструкции. В некоторых вариантах конструкция предназначена для применения в исследованиях in vitro. В некоторых вариантах конструкция предназначена для применения с одной или более целями: открытие лекарства; тестирование лекарства; доклиническое исследование; тестирование токсичности; тестирование абсорбции, распределения, метаболизма и экскреции (ADME); тестирование метаболизма лекарства и фармакокинетики (DMPK); моделирование болезни; моделирование инфекционного заболевания; моделирование болезни хозяина; изучение трехмерной биологии и клеточного скрининга. В некоторых вариантах конструкция предназначена для клеточного скрининга, причем поиск проводят по одной или более инфекционным болезням: по фиброзу печени (например, циррозу), раку печени, жировому перерождению печени (например, жирной печени), одному или более видам дефицита метаболизма или одному или более видам белкового дефицита. В других вариантах инфекционные заболевания включают вирусные инфекции или паразитарные инфекции (например, плазмодиевую инфекцию и т.п.). В следующих вариантах конструкция предназначена для применения в длительных исследованиях токсичности тканей, причем анализы проводят в течение времени от >3 суток до 6 месяцев. В некоторых вариантах конструкция предназначена для улучшения одной или более функций печени у людей. В следующих вариантах конструкция предназначена для имплантации пациенту по месту раны, при заболевании или дегенерации. В еще одних вариантах конструкция предназначена для применения в клинической практике в экстракорпоральных устройствах, предназначенных для улучшения или восстановления одной или более функций печени. В некоторых вариантах конструкцию применяют неиннервированной.
В другом аспекте изобретение предлагает искусственные трехмерные живые конструкции печеночной ткани, включающие: множество слоев, и каждый слой включает цилиндрические тканевые биочернила, причем цилиндры биочернил располагаются соосно, по существу параллельно друг другу, биочернила включают паренхимальные клетки печени; и необязательно непаренхимальные клетки находятся внутри или между цилиндрами биочернил; и необязательно в пустотах между цилиндрами биочернил. В некоторых вариантах по меньшей мере один компонент конструкции получают биопринтингом. В некоторых вариантах конструкция включает также компонент для экструзии, который способствует биопринтингу клеток. В некоторых вариантах паренхимальные клетки получают из одного или более из следующих источников: ткань печени взрослых млекопитающих; ткань печени плода; стволовые эмбриональные клетки (ESC); полученные из ESC гепатоцитоподобные клетки, индуцированные мультипотентные стволовые клетки (iPSC); полученные из iPSC гепатоцитоподобные клетки; взрослые стволовые клетки/клетки-предшественники, полученные из печени; и взрослые стволовые клетки/клетки-предшественники из ткани, отличной от печени. В некоторых вариантах непаренхимальные клетки включают один или несколько видов клеток: васкулярные клетки, эндотелиальные клетки, фибробласты, мезенхимальные клетки, иммунные клетки, клетки Купфера, звездчатые клетки, билиарные эпителиальные клетки, билиарные эпителий-подобные клетки, синусоидальные эндотелиальные клетки, полученные из печени стволовые клетки/клетки-предшественники и стволовые клетки/клетки-предшественники, полученные не из печени. В некоторых вариантах конструкция включает множество слоев, из которых по меньшей мере один слой композиционно или архитектурно отличается от по меньшей мере одного из других слоев, формируя слоистую структуру. В некоторых вариантах по меньшей мере один компонент конструкции получен методом биопринтинга. В некоторых вариантах конструкцию применяют для улучшения одной или более функций печени у людей. В следующих вариантах конструкцию применяют для имплантации пациенту по месту раны, при заболевании или дегенерации. В еще одних вариантах конструкцию применяют в клинической практике в экстракорпоральных устройствах, предназначенных для улучшения или восстановления одной или более функций печени. В некоторых вариантах конструкцию используют неиннервированной.
В другом аспекте данное изобретение предлагает матриксы искусственных живых трехмерных конструкций печеночной ткани, причем каждая конструкция включает: один или более слоев, а каждый слой содержит один или более типов клеток печени, один или более слоев накладываются с образованием живой трехмерной конструкции печеночной ткани, причем каждая конструкция характеризуется тем, что имеет по меньшей мере: один слой, содержащий множество типов клеток, расположенных в пространстве относительно друг друга с образованием плоской структуры; и множество слоев, причем по меньшей мере один слой композиционно или архитектурно отличается по меньшей мере от одного другого слоя, формируя слоистую структуру. В некоторых вариантах по меньшей мере один компонент конструкции получен биопринтингом. В следующих вариантах конструкция также включает компонент для экструзии, который способствует биопринтингу клеток. В некоторых вариантах конструкция ко времени использования по существу не содержит ранее сформированного каркаса. В некоторых вариантах клетки печени получают из одного или более из следующих источников: ткань печени взрослых млекопитающих; эмбриональная печеночная ткань; стволовые эмбриональные клетки (ESC); полученные из ESC гепатоцитоподобные клетки, индуцированные мультипотентные стволовые клетки (iPSC); полученные из iPSC гепатоцитоподобные клетки; взрослые стволовые клетки/клетки-предшественники, полученные из печени; и взрослые стволовые клетки/клетки-предшественники, полученные из ткани, отличной от печеночной ткани. В некоторых вариантах конструкция включает стволовые клетки/клетки-предшественники, которые были подвергнуты воздействию одного или более дифференцирующих сигналов. В других вариантах дифференцирующие сигналы включают один или более сигналов: биомеханический, растворение и физические сигналы. В других вариантах стволовые клетки/клетки-предшественники были подвергнуты воздействию одного или более дифференцирующих сигналов до изготовления конструкции. В следующих вариантах стволовые клетки/клетки-предшественники были подвергнуты одному или более дифференцирующих сигналов во время изготовления конструкции. В еще одних вариантах стволовые клетки/клетки-предшественники получали один или более дифференцирующих сигналов после изготовления конструкции. В некоторых вариантах каждая конструкция включает также один или более из следующих типов клеток: васкулярные клетки, эндотелиальные клетки, паренхимальные клетки, непаренхимальные клетки, фибробласты, мезенхимальные клетки, иммунные клетки, раковые клетки, клетки Купфера, звездчатые клетки, билиарные клетки, синусоидальные эндотелиальные клетки, полученные из печени стволовые клетки/клетки-предшественники и стволовые клетки/клетки-предшественники, полученные не из печени. В некоторых вариантах матрикс предназначен для применения в анализах in vitro. В некоторых вариантах матрикс предназначен для применения с одной или более целями: обнаружение лекарства; тестирование лекарства; доклиническое исследование; тестирование токсичности; тестирование абсорбции, распределения, метаболизма и экскреции (ADME); тестирование метаболизма лекарства и фармакокинетики (DMPK); моделирование болезни; моделирование инфекционного заболевания; моделирование болезни хозяина; изучение трехмерной биологии и клеточный скрининг.В некоторых вариантах матрикс предназначен для применения в клеточном скрининге, причем поиск проводят по одной или более инфекционным болезням: фиброз печени (например, цирроз печени), рак печени, перерождение печени (например, жирная печень), один или более видов дефицита метаболизма или один или более видов белкового дефицита. В следующих вариантах инфекционные заболевания включают вирусные инфекции или паразитарные инфекции (например, плазмодиевые инфекции и т.п.). В следующих вариантах матрикс предназначен для применения в длительных исследованиях токсичности тканей, причем анализы проводят в течение времени от >3 суток до 6 месяцев.
В другом аспекте изобретение предлагает матриксы искусственных живых трехмерных тканевых конструкций, причем по меньшей мере одна из конструкций является конструкцией печеночной ткани и каждая конструкция печеночной ткани включает: один или более слоев, причем каждый слой содержит один или более типов клеток печени, один или более слоев накладываются с образованием живой трехмерной конструкции печеночной ткани, которая характеризуется тем, что имеет по меньшей мере: по меньшей мере один слой, содержащий множество типов клеток, и клетки разных типов расположены в пространстве относительно друг друга, формируя плоскую структуру; и в множестве слоев по меньшей мере один слой композиционно или архитектурно отличается от одного другого слоя, формируя слоистую структуру. В некоторых вариантах по меньшей мере один компонент каждой конструкции печеночной ткани получали биопринтингом. В следующих вариантах каждая конструкция печеночной ткани также включает компонент для экструзии, который способствует биопринтингу клеток. В некоторых вариантах конструкция к моменту использования по существу не содержит ранее сформированного каркаса. В некоторых вариантах печеночные клетки получают из одного или более следующих источников: ткань печени взрослых млекопитающих; ткань печени плода; стволовые эмбриональные клетки (ESC); полученные из ESC гепатоцитоподобные клетки, индуцированные мультипотентные стволовые клетки (iPSC); полученные из iPSC гепатоцитоподобные клетки; взрослые стволовые клетки/клетки-предшественники, полученные из печени; и взрослые стволовые клетки/клетки-предшественники, полученные из ткани, отличной от печени. В некоторых вариантах конструкция включает стволовые клетки/клетки-предшественники, которые были подвергнуты воздействию одного или более дифференцирующих сигналов. В других вариантах дифференцирующие сигналы включают один или более сигналов: биомеханический, растворение и физические сигналы. В других вариантах стволовые клетки/клетки-предшественники до изготовления конструкции были подвергнуты воздействию одного или более дифференцирующих сигналов. В следующих вариантах стволовые клетки/клетки-предшественники были подвергнуты воздействию одного или более дифференцирующих сигналов во время изготовления конструкции. В еще одних вариантах стволовые клетки/клетки-предшественники были подвергнуты воздействию одного или более дифференцирующих сигналов после изготовления конструкции. В некоторых вариантах каждая конструкция печеночной ткани также включает один или более типов клеток: васкулярные клетки, эндотелиальные клетки, паренхимальные клетки, непаренхимальные клетки, фибробласты, мезенхимальные клетки, иммунные клетки, раковые клетки, клетки Купфера, звездчатые клетки, билиарные клетки, синусоидальные эндотелиальные клетки; полученные из печени стволовые клетки/клетки-предшественники и стволовые клетки/клетки-предшественники, полученные не из печени. В некоторых вариантах матриксы предназначены для применения в анализах in vitro. В некоторых вариантах матриксы предназначены для применения с одной или более целями: взаимодействие ткань-ткань; обнаружение лекарства; тестирование лекарства; доклиническое исследование; тестирование токсичности; тестирование абсорбции, распределения, метаболизма и экскреции (ADME); тестирование метаболизма лекарства и фармакокинетики (DMPK); моделирование болезни; моделирование инфекционного заболевания; моделирование болезни хозяина; изучение трехмерной биологии и клеточный скрининг.В некоторых вариантах матриксы предназначены для клеточного скрининга, причем скрининг проводят по одной или более инфекционным болезням, фиброзу печени (например, циррозу печени), раку печени, жировому перерождению печени (например, жирная печень), одному или более видам дефицита метаболизма, одному или более видам белкового дефицита. В других вариантах инфекционные заболевания включают вирусные инфекции или паразитарные инфекции (например, плазмодиевую инфекцию и т.п.). В следующих вариантах конструкции предназначены для применений в длительных исследованиях токсичности тканей, причем анализы проводят в течение времени от >3 суток до 6 месяцев.
В другом аспекте изобретение предлагает способы изготовления живой трехмерной конструкции печеночной ткани, включающие: изготовление одного или более видов биочернил, содержащих непаренхимальные клетки; изготовление одного или более видов биочернил, содержащих паренхимальные клетки; нанесение биочернил на носитель и инкубирование нанесенных биочернил в течение от около 1 часа до около 30 суток с образованием живой трехмерной конструкции печеночной ткани, содержащей по меньшей мере один компартмент, содержащий внутреннюю область, содержащую паренхимальные клетки, ограниченные границей из непаренхимальных клеток. В некоторых вариантах непаренхимальные клетки включают один или более типов клеток: васкулярные клетки, эндотелиальные клетки, фибробласты, мезенхимальные клетки, иммунные клетки, раковые клетки, клетки Купфера, звездчатые клетки, билиарные эпителиальные клетки, билиарные эпителий-подобные клетки, синусоидальные эндотелиальные клетки; полученные из печени стволовые клетки/клетки-предшественники и стволовые клетки/клетки-предшественники, полученные не из печени. В некоторых вариантах паренхимальные клетки получают из одного или более следующих источников: ткань печени взрослых млекопитающих; ткань печени плода млекопитающих; стволовые эмбриональные клетки (ESC); полученные из ESC гепатоцитоподобные клетки, индуцированные мультипотентные стволовые клетки (iPSC); полученные из iPSC гепатоцитоподобные клетки; стволовые клетки/клетки-предшественники из печени взрослых; и стволовые клетки/клетки-предшественники из ткани взрослых, отличной от печени. В некоторых вариантах по меньшей мере один компонент конструкции получен биопринтингом. В следующих вариантах конструкция также включает компонент для экструзии, который способствует биопринтингу клеток. В некоторых вариантах конструкция к моменту использования по существу не содержит ранее сформированного каркаса. В некоторых вариантах конструкция является неиннервированной.
В другом аспекте изобретение предлагает способы получения искусственной живой трехмерной конструкции печеночной ткани, включающие: изготовление одного или более видов биочернил, содержащих клетки печени; нанесение одного или более биочернил на носитель и инкубирование одного или более биочернил в течение от около 1 час до около 30 суток; причем конструкция содержит один или более слоев, а каждый слой содержит один или несколько типов клеток, один или несколько слоев объединяются с образованием живой трехмерной конструкции печеночной ткани. В некоторых вариантах клетки печени получают из одного или более следующих источников: ткань печени взрослых млекопитающих; ткань печени плода млекопитаающих; стволовые эмбриональные клетки (ESC); полученные из ESC гепатоцитоподобные клетки, индуцированные мультипотентные стволовые клетки (iPSC); полученные из iPSC гепатоцитоподобные клетки; взрослые стволовые клетки/клетки-предшественники из печени и взрослые стволовые клетки/клетки-предшественники из ткани, отличной от ткани печени. В некоторых вариантах конструкция также включает один или несколько следующих типов клеток: васкулярные клетки, эндотелиальные клетки, паренхимальные клетки, непаренхимальные клетки, фибробласты, мезенхимальные клетки, иммунные клетки, раковые клетки, клетки Купфера, звездчатые клетки, билиарные клетки, синусоидальные эндотелиальные клетки; полученные из печени стволовые клетки/клетки-предшественники и стволовые клетки/клетки-предшественники, полученные не из печени. В некоторых вариантах конструкция характеризуется тем, что она имеет: по меньшей мере один слой, включающий множество типов клеток, типы клеток пространственно расположены относительно друг друга, формируя плоскую структуру; а также множество слоев и по меньшей мере один слой композиционно или архитектурно отличается по меньшей мере от одного из других слоев с образованием ламинарной структуры. В некоторых вариантах по меньшей мере один компонент конструкции получен биопринтингом. В следующих вариантах конструкция также включает компонент для экструзии, который способствует биопринтингу клеток. В некоторых вариантах конструкция в момент использования по существу не содержит ранее сформированного каркаса. В следующих вариантах конструкция является неинервированной.
В другом аспекте изобретение предлагает способы конструирования живой трехмерной конструкции печеночной ткани, включающие: изготовление одного или более объединенных многоклеточных агрегатов, включающих клетки печени млекопитающих; нанесение одного или более указанных объединенных многоклеточных агрегатов на носитель с образованием по меньшей мере: одного слоя, содержащего множество типов клеток, причем разные типы клеток расположены в пространстве относительно друг друга с образованием плоской структуры и в множестве слоев по меньшей мере один слой композиционно или архитектурно отличается по меньшей мере от одного другого слоя, формируя слоистую структуру; а также инкубирование одного или более указанных многоклеточных агрегатов на время от около 1 часа до 30 суток, с тем чтобы дать им объединиться и образовать живую трехмерную конструкции печеночной ткани. В некоторых вариантах клетки печени получают из одного или более следующих источников: ткань печени взрослых млекопитающих; ткань печени плода млекопитающих; стволовые эмбриональные клетки (ESC); полученные из ESC гепатоцитоподобные клетки, индуцированные мультипотентные стволовые клетки (iPSC); полученные из iPSC гепатоцитоподобные клетки; взрослые стволовые клетки/клетки-предшественники из печени; а также взрослые стволовые клетки/клетки-предшественники из ткани, отличной от ткани печени. В некоторых вариантах конструкция печеночной ткани также включает один или несколько следующих видов клеток: васкулярные клетки, эндотелиальные клетки, паренхимальные клетки, непаренхимальные клетки, фибробласты, мезенхимальные клетки, иммунные клетки, раковые клетки, клетки Купфера, звездчатые клетки, билиарные клетки, синусоидальные эндотелиальные клетки, полученные из печени стволовые клетки/клетки-предшественники и стволовые клетки/клетки-предшественники, полученные не из ткани печени. В некоторых вариантах по меньшей мере один компонент конструкции получен биопринтингом. В следующих вариантах конструкция также включает компонент для экструзии, который способствует биопринтингу клеток. В некоторых вариантах конструкция по существу не содержит ранее сформированного каркаса во время биопринтинга или во время использования. В некоторых вариантах конструкция является неиннервированной.
В другом аспекте изобретение предлагает способы изготовления живой трехмерной конструкции печеночной ткани, включающие инкубирование одного или более биочернил, содержащих непаренхимальные клетки, и одного или более биочернил, содержащих паренхимальные клетки, нанесенных на носитель, в течение от около 1 час до около 30 суток с образованием живой трехмерной конструкции печеночной ткани, причем такая конструкция содержит по меньшей мере один компартмент, содержащий внутреннюю область, содержащую паренхимальные клетки, ограниченные границей, содержащей непаренхимальные клетки.
В другом варианте данной изобретение предлагает искусственные, живые трехмерные конструкции печеночной ткани, включающие один или несколько слоев, причем по меньшей мере один слой содержит по меньшей мере два типа клеток, которые включают паренхимальные клетки печени и непаренхимальные клетки печени; по меньшей мере два типа клеток расположены в пространстве относительно друг друга, создавая плоскую структуру, причем плоская структура содержит по меньшей мере один компартмент с паренхимальными клетками печени и по меньшей мере один компартмент с непаренхимальными клетками печени, и один или более слоев объединяются с образованием живой трехмерной конструкции печеночной ткани, при условии, что живая трехмерная конструкция печеночной ткани остается по существу живой in vitro культурой в течение по меньшей мере 7 суток и характеризуется по меньшей мере двумя параметрами работы печени: синтезирует холестерин; накапливает липиды; накапливает гликоген; экспрессирует специфические для печени белки, включая два или несколько из следующих: альбумин, фибриноген, трансферрин, CYP450, альфа-1-антитрипсин, орнитин транскарбамилазу, гликогенсинтазу, Фактор VIII и Фактор IX, реагирует на модуляторы печени, включая один или более из следующих: гормоны, стимуляторы, токсичные соединения, лекарственные препараты, антитела, интерферирующие вещества PHКs, малые PHКs, блокированные нунлеиновые кислоты, вирусы, бактерии, паразиты и стимуляторы воспаления; реагирует на токсины печени, включая один или более из следующих: ацетаминофен, алкоголь, тровафлоксацин, метотрексат, диклофенак, троглитазон, вальпроевая кислота и амиодарон; выделяет транспортные белки, в том числе один или несколько из них: BSEP, ОАТР1В1, NTCP, PGP, BCRP, ОАТР1В3. АВСВ4, АТР8В1, Multi-Drug Resistance Transporter (MDR); сохраняет по меньшей мере некоторые полученные латентные звездчатые клетки и включает микроваскулярные структуры. В некоторых вариантах конструкция остается по существу живой in vitro культурой в течение по меньшей мере 14 суток. В некоторых вариантах конструкция остается по существу живой in vitro культурой в течение по меньшей мере 28 суток. В следующих вариантах конструкция остается по существу живой in vitro культурой в течение по меньшей мере 40 суток. В различных вариантах конструкция остается по существу живой in vitro культурой в течение по меньшей мере 7, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60 или более суток. В некоторых вариантах конструкцию получают полностью автоматически с помощью биопринтера. В некоторых вариантах по меньшей мере два типа клеток включают клетки, полученные из индуцированных мультипотентных стволовых клеток (iPSC). В других вариантах по меньшей мере два типа клеток включают миелоидные клетки, полученные из моноцитов или макрофагов. В различных вариантах характеризуется по меньшей мере тремя, четырьмя, пятью или шестью, семью, восемью или всеми параметрами печени.
Краткое описание чертежей
Новизна данного изобретения показана далее, в том числе в прилагаемой формуле. Параметры и преимущества настоящего изобретения станут более понятными благодаря подробному описанию в иллюстративных примерах, в которых использованы принципы изобретения, и в сопровождающих рисунках:
Фиг. 1 представляет неограничивающий пример, иллюстрирующий структуру ткани природной печени.
Фиг. 2 представляет неограничивающий пример созревания и биохимической характеризации биопринтированной конструкции печени, содержащей клетки HepaRG. Клетки HepaRG нанесли в середину контейнера и дали созревать в течение 96 час (А-С). Биопринтированные конструкции печени метаболически активно продуцируют альбумин (D) и холестерин (Е) за 96 час. После обработки дексаметазоном активность цитохрома Р450 (CYP3A4) более чем в 5 раз превысила активность необработанных контрольных образцов (F).
Фиг. 3 представляет неограничивающий пример биопринтированных структур в определенных геометрических вариантах (А, В), содержащих полученные из iPSC гепатоциты (С), которые синтезируют значительно большее количество альбумина (D) в расчете на миллион введенных клеток в искусственной биопринтированной конструкции, чем в контрольных 2D культурах.
Фиг. 4 представляет неограничивающий пример созревания биопринтированной конструкции печени (А), содержащей отдельные сфероиды непаренхимальных клеток (В). Биопринтированная конструкция оставалась слитной и стабильной после инкубирования в течение дополнительных 24 часов (С, D).
Фиг. 5 представляет неограничивающий пример растворения принтированного шаблона, который контролирует процесс биопринтинга печеночных клеток в пространстве и времени и приводит к образованию специфичных для пользователя участков определенной формы и размера по направлению осей х, у и z. Стрелками показаны компартменты, где принтированный шаблон растворился за 24 часа после биопринтинга, и участки, в которые можно ввести дополнительные клетки.
Фиг. 6 представляет макроскопическое изображение как неограничивающий пример искусственной печеночной ткани, в данном случае многослойной печеночной ткани, биопринтированной с использованием непрерывного механизма нанесения и биочернил, имеющих в составе разные типы клеток печени и водорастворимую экструзионную добавку (например, PF-127). Рисунок (А) показывает схематический вид одного функционального элемента, включающий плоскую структуру, изготовленную из биочернил, и отрицательное пространство; (В) мозаичные функциональные элементы, полученные биопринтингос с PF-127, содержащим 2×108 клеток; (С) показывает конструкцию через 20 минут после введения среды; и (D) показывает конструкцию через 16 часов после введения среды в структуру и растворения добавки для экструзии. Отмечается сохранение плоской структуры во времени.
Фиг. 7 представляет неограничивающую микрофотографию мозаичной конструкции с фиг. 6, показывающую "спицу" в мозаичной конструкции. Эта микрофотография демонстрирует окрашивание с помощью гематоксилина и эозина зафиксированной формалином и встроенной в парафин секции ткани из звездчатых клеток, эндотелиальных клеток и кожных фибробластов, биопринтированных путем непрерывного внедрения в многослойную мозаичную гексагональную структуру и затем культивации в течение 16 час.
Фиг. 8 представляет неограничивающий пример растворения совместно сформованного шаблона путем плавления отдельных компартментированных участков печеночных клеток (помечены стрелками). Через определенное время (В; Т=24 час) эти участки вплавляются в твердую биопринтированную ткань.
Фиг. 9 представляет неограничивающий пример совместно сформованного шаблона (4% желатина и 2% альгината), полученного методом биопринтинга с помощью шприцевого модуля Syringe Deposition Module (SDM) биопринтера MMX Bioprinter, формирующего конструкции (А), которые плавятся и созревают в тканях печени через 72 час после биопринтинга (В). В этом примере биопринтированная ткань четко видна благодаря окрашиванию красителем Н и Е (С), и она живая, как это следует из относительно малых количеств клеток, окрашенных с помощью TUNEL (D), по сравнению с пролиферирующими клетками (Е).
Фиг. 10 представляет неограничивающий пример совместно сформованного шаблона (А; 4% желатина и 2% альгината), полученного методом биопринтинга с непрерывным нанесением из модульного шприца (SDM), для продуцирования плавленной трехмерной конструкции печеночной ткани. Добавка эндотелиальных биочернил в середину структуры повышает сложность конструкции (В). Окрашивание с помощью красителей Е-Cadherin (С) и CD31 (D) показывает эпителиальные и эндотелиальные клетки, присутствующие во всех областях, в которые они были введены биопринтингом, через 144 час после этого. Окрашивание с помощью TUNEL демонстрирует ограниченную гибель клеток в центральной области искусственной печеночной ткани после 144 час инкубирования (Е).
Фиг. 11 представляет неограничивающий пример совместно сформованного шаблона, имеющего в составе гидрогель (4% желатина и 2% альгината) (А) или биочернила, имеющие в составе непаренхимальные клетки и экструзионную добавку на основе гидрогеля (В). Полученные образцы, совместно сформованные с биочернилами, содержали 150×106 клеток на мл гидрогеля компонента для экструзии. Добавка клеток HepG2 к совместно сформованной структуре и инкубирование в течение 24 ч приводят к плавленой биопринтированной структуре печени (С). Растворение компонента для экструзии протекает во времени в водной среде.
Фиг. 12 представляет неограничивающий пример плотной клеточной ткани печени, полученной непрерывным нанесением из модулей с двумя шприцами (SDM) на принтере NovoGen ММХ Bioprinter. Совместно сформованные образцы, содержащие 4% желатина и 2% альгината, были нанесены с помощью первого модуля SDM с последующим заполнением биопастой HepG2 из второго SDM.
Фиг. 13 представляет неограничивающий пример биопринтированной новой ткани со слоистой структурой. Основу из гидрогеля NovoGel™ и совместно сформованный ограниченный шаблон создали методом биопринтинга и затем нанесли первый слой, содержащий биочернила с эпителиальными клетками печени (HepG2 cells), на который был биопринтирован второй слой, имеющий в составе печеночные звездчатые клетки и эндотелиальные клетки. В этом примере слой «звездчатые клетки:ЕС» был отпринтован путем непрерывного отложения биочернил, содержащих гидрогель компонента для экструзии (А). Увеличенные изображения конструкции сразу после получения демонстрировали два различных слоя биочернил (В). Окрашивание с помощью гематоксилина и эозина секций конструкций, зафиксированных формалином и внедренных в парафин (С) после 48 час культивирования, показывает различную морфологию двух слоев и образование слоистой структуры. Положительные клетки CD31 ограничены верхним слоем конструкции, где была биопринтирована суспензия эндотелиальных клеток и печеночных звездчатых клеток (D), в то время как положительные клетки IGF-2-HepG2 были обнаружены только в нижнем слое (Е).
Фиг. 14 представляет неограничивающий пример структурирования клеток и формирования слоев в биопринтированных печеночных тканях. Окрашивание тканевых секций в парафине гематоксилином и эозином показывает непрерывную новую ткань (А), полученную биопринтингом популяций политипических клеток, содержащих васкулярные эндотелиальные клетки и печеночные звездчатые клетки. Окрашивание секций ткани антителами к CD31 обнаруживает присутствие центрально локализованных микрососудов ЕС-линий и внешний слой ЕС, положительных к CD31 (В).
Фиг. 15 представляет неограничивающий пример стимулирования биопринтированных тканей из печеночных звездчатых клеток с помощью TGF-β1. Инкубирование биопринтированных чешуек из печеночных звездчатых клеток при увеличении концентрации TGF-β1 (0, 1, 10, 50 нг/мл) приводит к большим наблюдаемым изменениям
биопринтированных тканей, т.к. повышение концентрации цитокинов ведет к усиленному формированию отростков ткани (A-D, 0-50 нг/мл). Трехцветное окрашивание секций ткани из биопринтированных тканей, содержащих печеночные звездчатые клетки, показывает увеличенное отложение коллагена, укрупнение конструкции и резкое уменьшение плотности клеток (Е-Н, 0-50 нг/мл).
Фиг. 16 представляет неограничивающий пример биопринтинга в многолуночных планшетах. Конструкции биопринтированной ткани получают в многолуночных планшетах (А) или в многолуночных вставках для культуры (В), которые необязательно вносят в соответствующий многолуночный планшет для длительного выдерживания и созревания. Здесь конструкции тканей были отпринтованы в 48-луночном полистирольном планшете (А) и на пористой мембране 6-луночной вставки с культурой клеток (В).
Фиг. 17 представляет неограничивающий пример биопринтированной печеночной трубчатой структуры, изготовленной и биопринтированной для экстракорпорального носителя. Цилиндры биочернил длиной 40 мм, содержащие 70% HepG2/25% HUVEC/5% Hepatic Stellate, были биопринтированы и кондиционированы. В центре структуры создан канал с помощью удаляемого биоинертного гидрогеля.
Фиг. 18 представляет ряд неограничивающих примеров плоской и слоистой структур, в том числе их комбинации, совместимые с описанными здесь способами конструирования, и показывает архитектурные или пространственные элементы реальной архитектуры тканей и их биологии. Примеры такой структуры включают архитектурно корректную ткань с сосудистой сетью (А), зональную ткань (В), а также дольчатую ткань (С), перфузированную/упорядоченную ткань (D), ткань с границей раздела твердое+жидкость/жидкость (Е), барьерную ткань (F) и слоистую ткань со слоистой структурой (G).
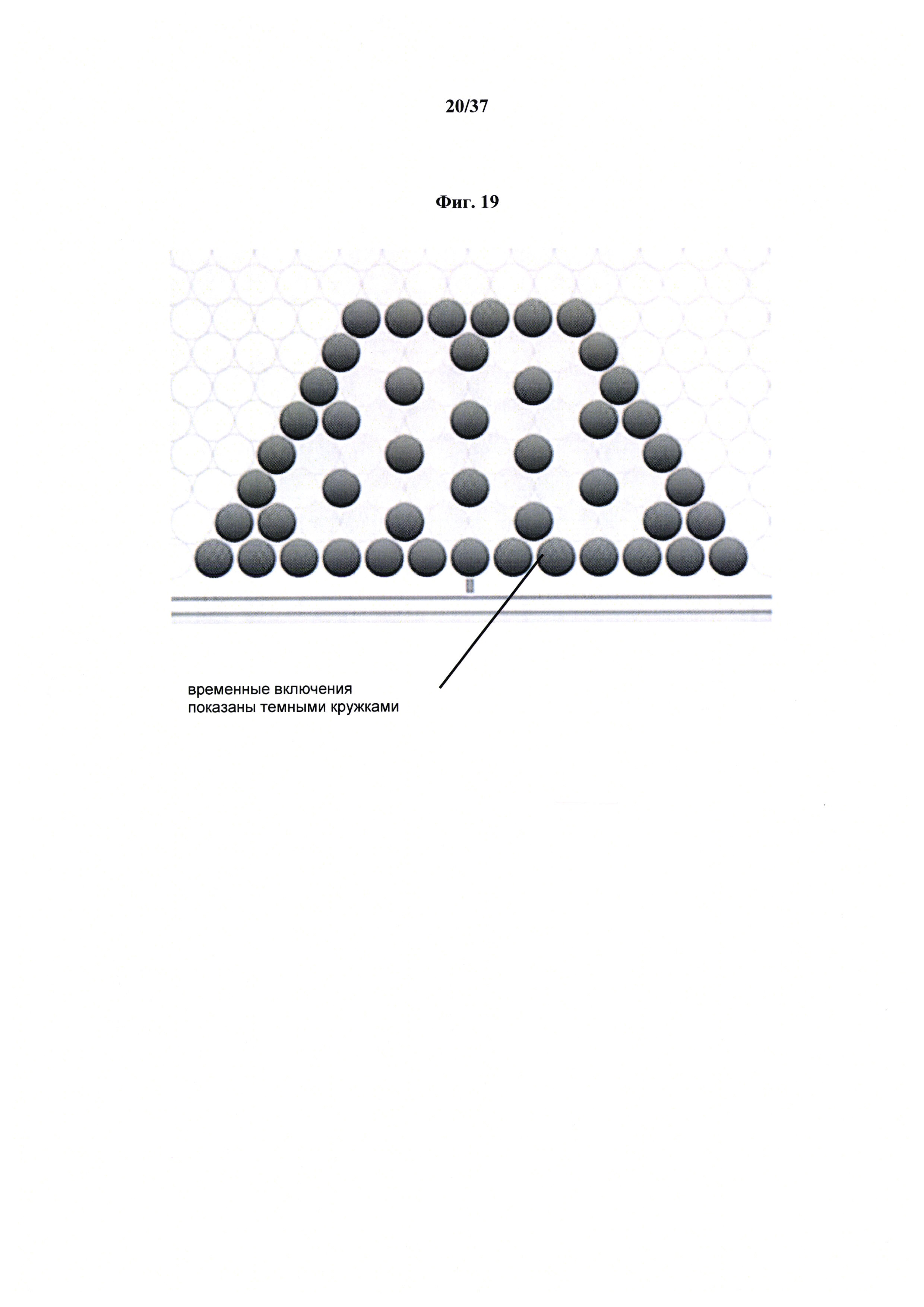
Фиг. 19 представляет неограничивающее схематическое представление экстракорпорального печеночного устройства, содержащего повторяющиеся трубчатые структуры с пустотами (временные включения показаны темными кружками) и регулярными интервалами, что приводит к перфузии в искусственную ткань печени и/или через нее.
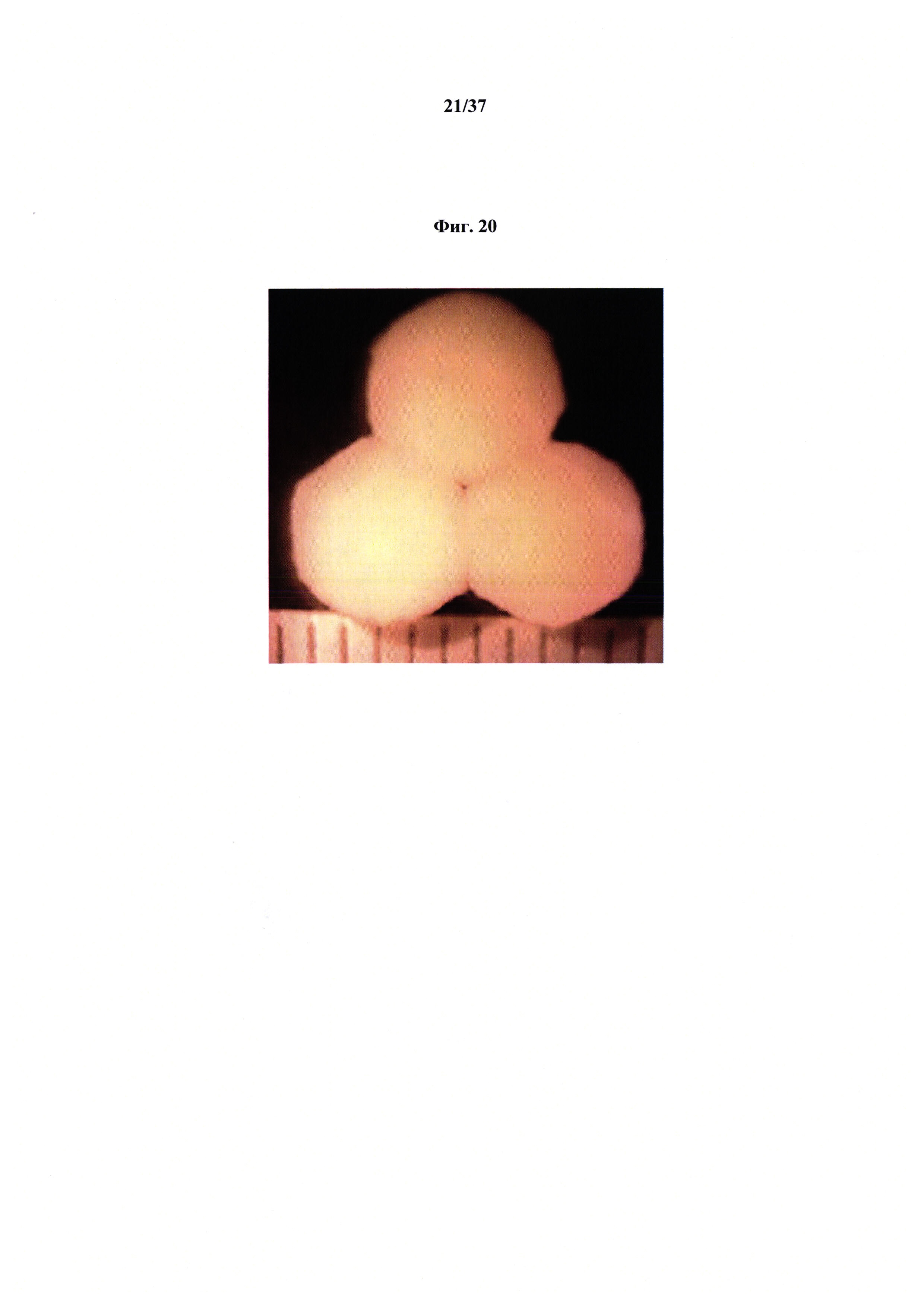
Фиг. 20 представляет неограничивающий пример биопринтированной печеночной ткани человека.
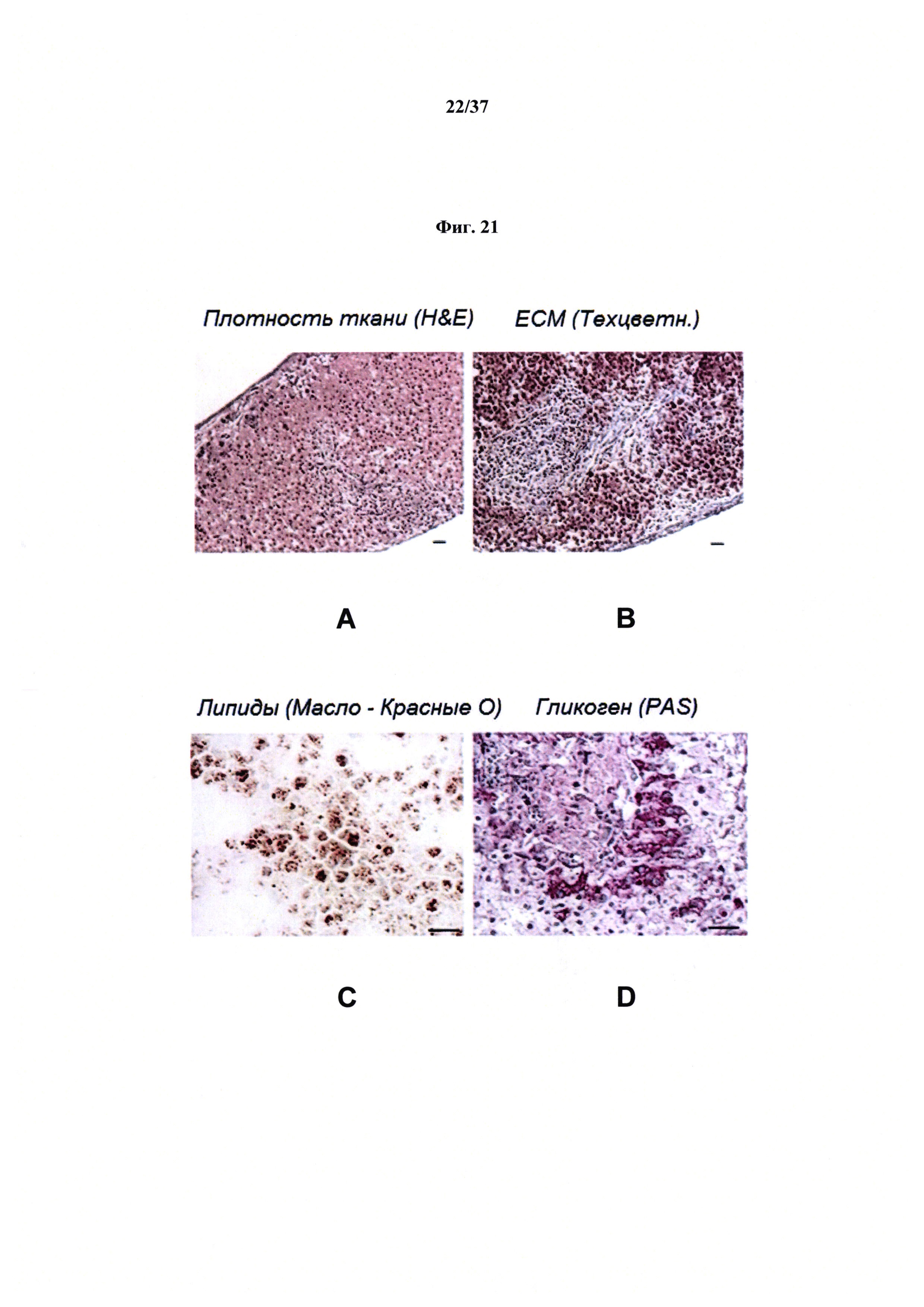
Фиг. 21 представляет ряд неограничивающих микрофотографий, демонстрирующих гистологические характеристики биопринтированной печеночной ткани человека; в этом случае микрофотографии показывают высокую плотность печеночной ткани (А), продуцирование ВКМ (В), липидов (С) и гликогена (D).
Фиг. 22 представляет ряд неограничивающих микрофотографий, демонстрирующих гистологические характеристики биопринтированной печеночной ткани человека; в этом случае микрофотографии показывают области гепатоцитов, окруженные непаренхимальной оболочкой, и видимую самоорганизацию дольчатой структуры, которая имитирует природную ткань печени.
Фиг. 23 представляет неограничивающий пример данных, демонстрирующих продуцирование альбумина (А) и холестерина (В) биопринтированной печеночной тканью человека.
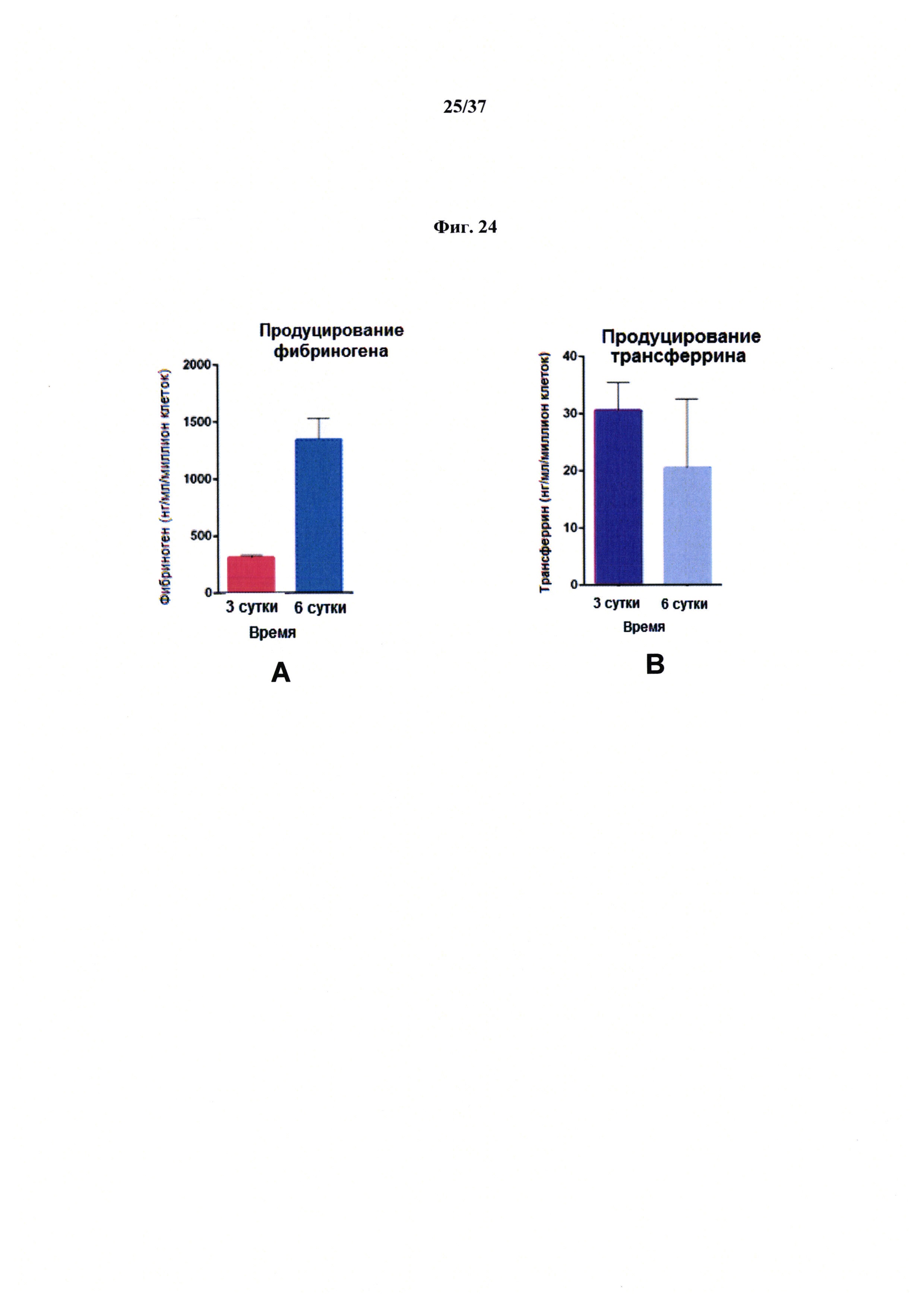
Фиг. 24 представляет неограничивающий пример, демонстрирующий продуцирование трансферрина (А) и фибриногена (В) биопринтированной печеночной тканью человека.
Фиг. 25 представляет неограничивающий пример, который демонстрирует относительное количество солей желчной кислоты, выделяющих белок мРНК, по сравнению с конститутивным геном РНК (18S-РНК) в биопринтированной печеночной ткани человека на десятые сутки после изготовления.
Фиг. 26 представляет неограничивающий пример, который демонстрирует постоянную индукцию активного фермента CYP3A4 при обработке рифампицином (А) в биопринтированной печеночной ткани, который ингибируется верапамилом (В).
Фиг. 27 представляет неограничивающий пример, который демонстрирует индукцию CYP3A4 в биопринтированной печеночной ткани при обработке диклофенаком с последующим разрушением ткани при повышенным дозах, определенных с помощью лактатдегидрогеназы (LDH).
Фиг. 28 представляет неограничивающий пример, который демонстрирует уменьшение продуцирования альбумина (А) и увеличение продуцирования LDH (В) при действии многократных доз тровафлоксацина по сравнению с левофлоксацином в биопринтированной печеночной ткани.
Фиг. 29 представляет неограничивающий пример, который демонстрирует уменьшение жизненной устойчивости по измеренному количеству АТФ (А), уменьшение продуцирования альбумина (В) и увеличение продуцирования LDH (С) при действии многократных доз метотрексата в биопринтированной печеночной ткани.
Фиг. 30 представляет собой неограничивающий пример, который демонстрирует ответ биопринтированной печеночной ткани на витамин D по результатам индукции CYP.
Фиг. 31 представляет собой неограничивающий пример, который демонстрирует ответ на стимулирование LPS по результатам образования IL-6 в биопринтированной печеночной ткани, содержащей клетки Купфера.
Фиг. 32 представляет собой неограничивающий пример, который демонстрирует зависящий от дозы ответ на стимулирование LPS (10 мкг/мл (А) и 100 мкг/мл (В)), как следует из образования цитокина (IL-10, IL-1b и TNF-α) в биопринтированной печеночной ткани, содержащей клетки Купфера.
Фиг. 33 представляет собой неограничивающий пример монослоя печеночных синусоидальных эндотелиальных клеток (HSECs) при около 90% слиянии.
Фиг. 34 представляет собой неограничивающий пример, который демонстрирует отклик HSEC на LPS по образованию IL-6 в двумерных культурах.
Фиг. 35 представляет собой неограничивающий пример плавленной трехмерной биопринтированной печеночной ткани, включающей HSECs в непаренхимальной фракции.
Фиг. 36 представляет собой неограничивающий пример микрофотографии (FITC; 5Х), на которой видно проникновение малых молекул через криосекционированную трехмерную биопринтированную ткань печени.
Подробное описание изобретения
Для многих пациентов с болезнями печени восстановление даже части печени путем введения здоровых клеток или ткани является решающим фактором для выживания и функционирования печени. Судя по базе данных 2011 UNOS, в США более 10000 пациентов ожидали трансплантата и более 50% этих пациентов реально получили трансплантированную печень. Намного больше пациентов смогли получить трансплантированную печень, чем это значилось в списке трансплантатов, который обычно оставляют для самых тяжелых пациентов. Кроме того, многие люди страдают от хронических дегенеративных заболеваний, для которых в настоящее время трансплантация не является парадигмой здравоохранения. Таким образом, живые функционирующие печеночной ткани очень ценились бы в клинической практике. Сейчас в США сегментированные или частичные трансплантаты получают по рутинной процедуре, причем один орган делят на 2-3 секции или доли и каждый кусочек трансплантируют пациенту из списка ожидания. Поскольку здоровая ткань печени обладает уникальной способностью к росту и аккомодации у пациента в соответствии с размером и участием в метаболизме, подход, основанный на использовании частично-массового трансплантата, клинически оправдан.
Кроме того, многие препараты исключают на поздних стадиях клинических испытаний или уже после их поступления в продажу из-за непредсказуемой токсичности, так что до 35% препаратов исключают на стадии III (Curr. Pharm. Des. 2005 11:3545). Непредсказуемая токсичность для печени составляет наибольшую часть таких неудач, и за ней следуют кардиотоксичность и нефротоксичность. Таким образом, для более точного прогноза поведения лекарства in vivo у людей необходимы улучшенные системы.
Необходимы материалы, инструменты и методики, которые существенно повышают число и качество инновационных, доступных по цене новых медицинских средств, которые не потребовали бы нерациональных трат на исследования и разработки (R&D). В связи с этим авторы данного изобретения предлагают искусственные конструкции печеночной ткани, матриксы и способы их изготовления, которые применяются в инженерии тканей и органов, в анализах in vitro, для обнаружения лекарств и в других областях.
Прежние модели печеночной ткани были направлены на создание искусственных конструкций печени путем осаждения клеток на трехмерный готовый материал, который был предварительно сформован таким образом, чтобы приспособиться к предполагаемому способу применения, либо для формирования многоклеточных сфероидов из клеток печени путем их беспорядочного слипания, причем образующийся сферический клеточный агрегат клеток не имеет никакой внутренней архитектуры. Клетки, осажденные на готовые материалы, представляли собой первичные клетки, линии клеток, искусственные клетки и/или стволовые клетки/клетки-предшественники. При использовании мультипотентных стволовых клеток или клеток-предшественников их либо подвергают дифференциации в двумерной монослойной культуре до осаждения на трехмерный готовый материал, либо их сначала осаждают на готовый материал и затем подвергают дифференциации in situ или in vitro с образованием нужной ткани. Традиционный подход трудоемок и малоэффективен с точки зрения получаемого количества клеток, времени, необходимого для конечной дифференциации клеток внутри конструкции, а также суммарной насыщенности клетками и архитектуры конечной трехмерной структуры.
Важно отметить, что прежние попытки и технологии не смогли генерировать определенные компартменты ткани со специфическим видом клеток, находящихся в определенных положениях внутри архитектуры, которые сохранялись бы в конструкции в течение дней или недель (до 40 суток). Прежние усилия и технологии также не смогли продемонстрировать структуры, похожие на природные, включая микроциркуляторную часть сосудистого русла и непроницаемые перегородки, которые определяют срок жизни ткани. Описанная в данном изобретении технология дает возможность тонко регулировать архитектуру и генерировать заданную структуру, которая напоминает натуральные ткани. Кроме того, предлагаемая технология позволяет конструировать ткани с высокой плотностью клеток, сохраняющих свою структуру, что продлевает полезную жизнь тканей.
В некоторых вариантах данного изобретения также предлагаются искусственные, живые трехмерные конструкции печеночной ткани, содержащие по меньше мере один компартмент, определяющий плоскую структуру, причем такой компартмент содержит внутреннюю область, определенную границей, причем внутренняя область содержит паренхимальные клетки, а граница содержит непаренхимальные клетки; клетки объединяются с образованием живой трехмерной конструкции печеночной ткани, при условии, что по меньшей мере один компонент конструкции получен биопринтингом и конструкция во время использования по существу не содержит ранее сформированного каркаса.
В некоторых вариантах изобретения также предлагаются искусственные, живые трехмерные конструкции печеночной ткани, содержащие: один или несколько слоев, причем каждый слой содержит один или несколько типов клеток печени, один или несколько слоев объединяются с образованием живой трехмерной конструкции печеночной ткани, и конструкция характеризуется тем, что имеет по меньшей мере одно из: по меньшей мере один слой, содержащий множество типов клеток, которые расположены в пространстве друг относительно друга, создавая плоскую структуру; и множество слоев, причем по меньшей мере один слой композиционно или архитектурно отличается от по меньшей мере одного другого слоя с образованием слоистой структуры.
В некоторых вариантах изобретения также предлагаются искусственные, живые трехмерные конструкции печеночной ткани, содержащие: множество слоев, причем каждый слой содержит цилиндрические биочернила, биочернила выровнены в осевом направлении по существу параллельно друг другу, биочернила включают паренхимальные клетки печени; и необязательно непаренхимальные клетки внутри или между цилиндрическими биочернилами; и необязательно пустоты между цилиндрическими биочернилами.
В некоторых вариантах изобретения также предлагаются матриксы искусственной живой трехмерной конструкции печеночной ткани, причем каждая конструкция содержит: один или несколько слоев, каждый слой содержит один или несколько типов клеток печени, один или несколько слоев объединяются с образованием живой трехмерной конструкции печеночной ткани, причем каждая конструкция характеризуется тем, что имеет по меньшей мере одно из: по меньшей мере один слой, содержащий множество типов клеток, причем типы клеток расположены в пространстве относительно друг друга с образованием плоской структуры; и множество слоев, причем по меньшей мере один слой композиционно или архитектурно отличается по меньшей мере от одного другого слоя, что создает слоистую структуру.
В некоторых вариантах изобретения также предлагаются матриксы искусственных живых трехмерных конструкций ткани, причем по меньшей мере одна из конструкций представляет собой конструкцию печеночной ткани, каждая конструкции печеночной ткани содержит: один или более слоев, каждый слой содержит один или более типов клеток печени, один или несколько слоев объединяются с образованием живой трехмерной конструкции печеночной ткани, причем конструкция печеночной ткани характеризуется тем, что имеет по меньшей мере одно из: по меньшей мере один слой, содержащий множество типов клеток, причем типы клеток расположены в пространстве относительно друг друга с образованием плоской структуры; и множество слоев, причем по меньшей мере один слой композиционно или архитектурно отличается по меньшей мере от одного другого слоя, что создает слоистую структуру.
В некоторых вариантах изобретения также предлагаются способы изготовления живой трехмерной конструкции печеночной ткани, включающие: изготовление одного или более биочернил, содержащих непаренхимальные клетки; изготовление одного или более видов биочернил, содержащих паренхимальные клетки; осаждение биочернил на носитель и инкубирование осажденных биочернил в течение от около 1 часа до около 30 суток с образованием живой трехмерной конструкции печеночной ткани, содержащей по меньшей мере один компартмент, содержащий внутреннюю область, содержащуюя паренхиальные клетки, ограниченные границей, содержащей непаренхимальные клетки.
В некоторых вариантах изобретения также предлагаются способы изготовления искусственной живой трехмерной конструкции печеночной ткани, включающие: изготовление одного или несколько видов биочернил, содержащих клетки печени; нанесение одного или несколько видов биочернил на носитель и инкубирование одного или более нанесенных биочернил в течение от около 1 часа до около 30 суток, причем такая конструкция включает один или более слоев, и каждый слой содержит один или более типов клеток, причем один или более слоев объединяются с образованием живой трехмерной конструкции печеночной ткани.
В некоторых вариантах изобретения также предлагаются способы конструирования живой трехмерной конструкции печеночной ткани, включающие: изготовление одного или более объединенных многоклеточных агрегатов, содержащих клетки печени млекопитающих; нанесение одного или более указанных многоклеточных агрегатов на носитель с образованием по меньшей мере одного из: по меньшей мере одного слоя, содержащего множество типов клеток, причем типы клеток располагаются в пространстве относительно друг друга с образованием плоской структуры; и множества слоев, причем по меньшей мере один слой композиционно или архитектурно отличается от по меньшей мере одного другого слоя с образованием слоистой структуры; и инкубирование указанного одного или более многоклеточных агрегатов в течение от около 1 часа до около 30 суток, чтобы дать им возможность объединиться и образовать живую трехмерную конструкцию печеночной ткани.
В некоторых вариантах изобретения также предлагаются способы изготовления живой трехмерной конструкции печеночной ткани, включающие инкубирование одного или более видов биочернил, содержащих непаренхимальные клетки, и одного или более видов биочернил, содержащих паренхимальные клетки, нанесенные на носитель, в течение от около 1 часа до около 30 суток с образованием живой трехмерной конструкции печеночной ткани, причем такая конструкция содержит по меньшей мере один компартмент, содержащий внутреннюю область, содержащую паренхимальные клетки, определенный границей, содержащей непаренхимальные клетки.
В некоторых вариантах данного изобретения также предлагаются искусственные живые трехмерные конструкции печеночной ткани, включающие один или более слоев, причем по меньшей мере один слой содержит по меньшей мере два типа клеток, включая паренхимальные и непаренхимальные клетки печени, по меньшей мере два типа клеток располагаются в пространстве относительно друг друга с образованием плоской структуры, причем плоская структура включает по меньшей мере один компартмент с паренхимальными клетками печени и по меньшей мере один компартмент с непаренхимальными клетками печени, один или более слоев объединяются с образованием живой трехмерной конструкции печеночной ткани, при условии, что живая трехмерная конструкция печеночной ткани остается по существу живой in vitro культурой в течение по меньшей мере 7 суток или по меньшей мере 14 суток и характеризуется по меньшей мере двумя следующими ахарактеристиками печени: синтезирует холестерин; накапливает липиды; накапливает гликоген; экспрессирует специфические к печени белки, включая два или более из следующих: альбумин, фибриноген, трансферрин, CYP450, альфа-1 антитрипсин, орнитин транскарбамилазу, гликогенсинтазу, Фактор VIII и Фактор IX; реагирует модуляторы печени, включая один или более из следующих: гормоны, стимуляторы, токсичные вещества, лекарства, антитела, интерферирующие РНК, малые РНК, блокированные нуклеиновые кислоты, вирусы, бактерии, паразиты и стимуляторы воспалительных процесов; реагирует на токсины печени, включая один или более из следующих: ацетаминофен, алкоголь, тровафлоксацин, метотрексат, диклофенак, троглитазон, вальпроевая кислота и амиодарон; выделяет транспортные белки, включая один или более из следующих: BSEP, ОАТР1В1, NTCP, PGP, BCRP, ОАТР1В3. АВСВ4, АТР8В1, Multi-Drug Resistance Transporter (MDR); сохраняет по меньшей мере некоторые полученные латентные звездчатые клетки и включает микроваскулярные структуры.
Определения
Если не указано иное, все использованные здесь технические и научные термины имеют общепринятое значение для обычных специалистов в данной области, для которых представляет интерес данное изобретение.
В данном описании и прилагаемой формуле артикли "a," "an" и "the" включают ссылки на множественное число, если контекст четко не имеет в виду иное. Так, например, ссылки на «нуклеиновую кислоту» включают одну или несколько нуклеиновых кислот и/или композиций типа описанных здесь, что станет очевидным для специалистов в данной области после ознакомления с описанием. Любая ссылка на «или» включает «и/или», если не заявлено иное.
Использованный здесь термин «матрикс» означает научный инструмент, включающий одновременное действие многих элементов, расположенных таким образом, что становится возможным проведение многих тестов на образце, одного или более тестов на многих образцах либо и то и другое.
Использованный здесь термин «исследование» означает процедуру тестирования или измерения активности вещества (например, химического реактива, молекулы, биохимического препарата, белка, гормона или лекарства и т.д.) в органическом или биологическом образце (например, в клеточном агрегате, ткани, органе, организме и т.п.).
Использованный здесь термин «биосовместимый» представляет ограниченный риск повреждения или отравления клеток. Как показано в описании и формуле, «биосовместимые многоклеточные контейнеры» и «биосовместимые мембраны» напоминают об ограниченном риске повреждения или отравления клеток млекопитающих, но такое определение не предполагает, что эти биосовместимые элементы могут быть имплантированы in vivo млекопитающему.
Использованный здесь термин «биочернила» означают жидкую, полутвердую или твердую композицию для применения в биопринтинге. В некоторых вариантах биочернила включают растворы клеток, агрегаты клеток, включающие клетки гели, многоклеточные тела или ткани. В некоторых вариантах биочернила кроме того содержат носитель. В некоторых вариантах биочернила кроме того содержат неклеточные материалы, которые обеспечивают особые биомеханические свойства, необходимые для биопринтинга. В некоторых вариантах биочернила включают компонент для экструзии.
Использованный здесь термин «биопринтинг» означает применение трехмерного точного нанесения клеток (например, растворов клеток, содержащих клетки гелей, клеточных суспензий, концентратов клеток, многоклеточных агрегатов, многоклеточных тел и т.п.) по методике, совместимой с автоматическим или полуавтоматическим, компьютеризированным трехмерным прототипирующим устройством (например, биопринтером).
Использованный здесь термин «объединяться», «объединенный» и «когезия» относится к способности клеток объединяться (слипаться) с другими клетками, которая позволяет связывать между собой клетки, агрегаты клеток, многоклеточные агрегаты, многоклеточные тела и/или их слои. Эти термины используют взаимозаменяемо с терминами «сливаться», «слитой» и «слияние».
Использованный здесь термин «цилиндрический» означает по существу форму цилиндра. В различных вариантах цилиндрические биочернила по существу имеют форму цилиндра и около на 99, 98, 97, 96, 95, 94, 93, 92, 91, 90, 85, 80, 75, 70, 65 или 60 процентов, включая промежуточные значения, имеют цилиндрическую форму. В других вариантах цилиндрические биочернила имеют форму цилиндра около на 99, 98, 97, 96, 95, 94, 93, 92, 91, 90, 85, 80, 75, 70, 65, 60, 55 и 50 процентов, включая промежуточные значения длины. В некоторых вариантах «цилиндрический» означает имеющий по существу форму цилиндра в момент изготовления.
Использованный здесь термин «слоистый» означает многослойную биопринтированную ткань, в которой два или несколько плоских слоя слеплены, что увеличивает общую толщину ткани в плоскости Z. В некоторых вариантах каждый плоский слой по существу близок другому по архитектуре и/или составу. В других вариантах каждый плоский слой по существу отличается по архитектуре и/или составу.
Использованный здесь термин «слой» означает ассоциацию клеток в плоскостях X и Y, которые являются многоклеточными по толщине. В некоторых вариантах описанные здесь искусственные печеночные ткани включают один слой. В других вариантах описанные здесь искусственные печеночные ткани включают много слоев. В разных вариантах слой образует соприкасающиеся, по существу соприкасающиеся или несоприкасающиеся пласты клеток. В некоторых вариантах каждый слой описанной здесь искусственной печеночной ткани включает множество клеток по осям X, Y и Z. В следующих вариантах каждый слой искусственной печеночной ткани имеет толщину по меньшей мере около 50 микрон по осям X, Y и Z.
Использованный здесь термин «многослойный» означает имеющий в составе два или несколько слоев ткани, причем каждый слой ткани включает один или несколько слоев по толщине. В некоторых вариантах слои ткани наносят по одному. В других вариантах много слоев наносят одновременно. Необязательно каждый слой имеет в составе клетки многих типов. Кроме того, клетки многих типов в каждом слое необязательно расположены относительно друг друга с пространственной архитектурой в плоскостях X-Y (т.е. в горизонтальных плоскостях). Кроме того, добавление слоев в плоскости Z (т.е. вертикальной плоскости) в некоторых случаях приводит к регулируемому пространственному расположению клеток в слоях относительно друг друга, так что пространственно определенная архитектура продолжается в плоскости Z.
Использованный здесь термин «мультипотентные клетки» относится к клеткам, которые способны подвергнуться дифференциации на клетки двух или несколькх типов.
Мультипотентные клетки включают, например, мезенхиальные стволовые/стромальные клетки, индуцированные мультипотентные стволовые клетки и эмбриональные стволовые клетки.
Использованный здесь термин «паренхимальные клетки» относится к гепатоцитам или гепатитоподобным клеткам; в то время как «непаренхимальные клетки» относятся к клеткам печени, которые не являются гепатоцитами или гепатитоподобными клетками.
Использованный здесь термин «плоский» означает слой многоклеточной биопринтированной ткани, в которой многие композиции биочернил и/или пустоты расположены в пространстве относительно друг друга в определенном порядке по существу в плоскости X-Y слоя ткани. См., например, фигуры 18А-Е. В различных вариантах плоский слой является фактически плоским около на 99, 98, 97, 96, 95, 94, 93, 92, 91, 90, 85, 80, 75, 70, 65 или 60 процентов, включая промежуточные значения, и пространственно выстроен в определенном порядке в плоскости X-Y слоя ткани.
Использованный здесь термин «каркас» относится к синтетическим каркасам, таким как полимерный каркас или пористые гидрогели, несинтетические каркасы типа предварительно сформированных слоев внеклеточной матрицы, слоев мертвых клеток и децеллюлизированных тканей, и любым другим типам ранее сформированных каркасов, которые интегрируются в физическую структуру искусственной ткани и/или органа и не могут быть удалены из ткани и/или органа без повреждения/разрушения указанных ткани и/или органа. В других вариантах каркасы из децеллюлиризованной ткани включают децеллюлиризованные природные ткани или децеллюлиризованные клеточные материалы, полученные из культивированных клеток любым способом; например, слоям клеток дают погибнуть или децеллюлиризуют, после чего остается ВКМ, который продуцируют живые клетки. Термин «бескаркасный» поэтому предполагает, что каркас не интегрирован в искусственную ткань к моменту использования и удаляется либо остается в качестве инертного компонента искусственной ткани. «Без каркаса» используют взаимозаменяемо с термином «без ранее сформированного каркаса».
Использованный здесь термин «субъект» означает любую особь, которая представляет собой человека, животное, любое млекопитающее или любое позвоночное. Термин взаимозаменяем с терминами «пациент», «реципиент» и «донор».
Использованный здесь термин «носитель» означает любую биосовместимую поверхность, на которую можно нанести биочернила.
Использованный здесь термин «ткань» означает агрегат из клеток. Примеры тканей включают, но не ограничиваются этим, соединительную ткань (например, ареолярную соединительную ткань, плотную соединительную ткань, эластичную ткань, ретикулярную соединительную ткань и жировую ткань), мускульную ткань (например, мускулы скелета, гладкую мускулатуру и сердечную мышцу), урогенитальную ткань, ткань желудочно-кишечного тракта, легочную ткань, костную ткань, нервную ткань и эпителиальную ткань (например, простой эпителий и многослойный эпителий), эндодермную ткань, мезодермную ткань и эктодермную ткань.
Тканевая инженерия
Тканевая инженерия находится на стыке различных дисциплин и объединяет принципы инженерии, направленные на разработку биологических заместителей, которые восстанавливают, сохраняют или улучшают функции ткани путем наращивания, восстановления или замены органа либо ткани. Базовый подход в классической тканевой инженерии заключается во внесении живых клеток в биосовместимую или иногда биоразлагаемую среду (например, в каркас) и затем культивировании этой конструкции в биореакторе для размножения начальной популяции клеток и их созревания с образованием целевой ткани в результате имплантации. При наличии соответствующего каркаса, который моделирует биологический внеклеточный матрикс (ВКМ), разрабатываемая ткань в некоторых случаях принимает форму и выполняет функцию требуемого органа после созревания in vitro и in vivo. Однако достижение достаточно высокой плотности клеток с архитектурой, подобной архитектуре природной ткани, актуально из-за ограниченной возможности регулировать распределение и пространственное расположение клеток в каркасе. Эти ограничения часто приводят к тканям или органам с плохими механическими свойствами и/или недостаточной функцией. Существуют также дополнительные проблемы, которые относятся к биоразложению каркаса, захвату остатков полимера и промышленного масштабирования производственных процессов. Были предприняты попытки решать проблемы без использования каркаса. Современные подходы без использования каркаса имеют некоторые ограничения.
Сложная плоская и/или слоистая структура, такая как многослойные структуры, в которых один или несколько слоев композиционно или архитектурно отличаются от других слоев или один или несколько слоев содержат клетки различных типов в пространственно определенных положениях относительно друг друга, часто требует определяемого с высоким разрешением размещения клеток разных типов в специфической архитектуре для получения на выходе воспроизводимой ткани, подобной природной.
Масштаб и структура ограничены диффузией и/или требованием о функциональных васкулярных сетях для доставки питательных веществ.
Жизнеспособность тканей в некоторых случаях снижается из-за удерживающих свойств материала, что лимитирует диффузию и ограничивает доступ клеток к питательным веществам.
В некоторых вариантах данного изобретения предлагаются искусственные ткани млекопитающих, искусственные печеночные ткани/конструкции, матриксы и способы их изготовления. Раскрытые здесь способы тканевой инженерии имеют следующие преимущества:
Они способны продуцировать клеткосодержащие ткани и/или органы.
Они моделируют окружающие условия для разработки, гомеостаза и/или патогенеза природных тканей путем воспроизведения межклеточных взаимодействий, подобных природным.
Они необязательно создают живые, трехмерные ткани и соединений тканей с широким набором сложной топологии и геометрии (например, многоклеточные структуры, сегменты, пласты, трубки, капсулы, фолликулы и т.п.).
Они совместимы с автоматическими или полуавтоматическими средствами производства и их можно масштабировать.
Биопринтинг обеспечивает улучшенные способы генерации маломасштабных аналогов ткани, в том числе применяемых в анализах in vitro (см. ниже).
Биопринтинг
В некоторых вариантах по меньшей мере один компонент искусственных печеночных тканей/конструкций и их матриксов получают биопринтингом. В других вариантах биопринтированные конструкции получают по технологии быстрого фототипирования, основанной на трехмерном автоматическом компьютеризированном нанесении клеток, в том числе растворов клеток, суспензий клеток, гелей и паст, содержащих клетки, концентратов клеток, многоклеточных тел (например, цилиндров, сфероидов, лент и т.п.) и необязательно связующего материала на поверхность биосовместимого носителя (например, имеющего в составе гидрогель и/или пористую мембрану) с помощью трехмерного устройства для доставки (например, биопринтера). В некоторых использованных здесь вариантах термин «искусственный» в отношении тканей и/или органа означает, что клетки, растворы клеток, суспензии клеток, гели и пасты, содержащие клетки, концентраты клеток, многоклеточные тела и их слои размещаются в виде трехмерных структур с помощью компьютеризованного устройства (например, биопринтера) согласно компьютерному коду. В других вариантах компьютерный код представляет собой, например, одну или несколько компьютерных программ, компьютерных приложений или компьютерных модулей. В следующих вариантах трехмерные структуры тканей формируются путем постпринтерного сплавления клеток или многоклеточных тел, которое в некоторых случаях напоминает явление самоорганизации в раннем морфогенезе.
Существует много способов сформировать трехмерную структуру из клеток, многоклеточных агрегатов и/или их слоев на биосовместимой поверхности в ручном режиме. Однако предпочтительнее для этой цели применять автоматизированый компьютеризированный прибор, такой как биопринтер. Преимущества формирования набора клеток или многоклеточных тел по этой технологии включают быстрое, точное и воспроизводимое размещение клеток или многоклеточных тел с образованием конструкций с плоской или предварительно заданной ориентацией клеток, многоклеточных агрегатов и/или их слоев различного состава. Преимущества также включают высокую плотность клеток при их минимальном повреждении. Паренхимальные клетки печени особенно чувствительны к повреждению из-за сдвиговых усилий и других биомеханических напряжений; таким образом, совместное применение биочернил и описанной здесь процедуры биопринтинга имеет существенное преимущество по сравнению с альтернативными технологиями, что проявляется в большой жизнестойкости паренхимальных клеток после биопринтинга, как показано на фиг. 9.
В некоторых вариантах способ биопринтинга является непрерывным и/или по существу непрерывным. Неограничивающий пример непрерывного биопринтинга - это распределение биочернил (т.е. клеток, клеток, объединенных с эксципиентом или компонентом для экструзии, или агрегатов клеток) из биопринтера через распределительную насадку (например, шприц, иглу, капиллярную трубку и т.п.), связанную с резервуаром биочернил. В следующих неограничивающих вариантах способ непрерывного биопринтинга включает распределение биочернил в повторяющемся режиме с использованием функциональных элементов. В различных вариантах повторяющийся функциональный элемент может иметь любую подходящую форму, включая, например, круги, квадраты, прямоугольники, треугольники, многоугольники и нерегулярные типы геометрии, что приводит к одному или нескольким слоям ткани с плоской структурой, образованной путем пространственного формирования различных биочернил и/или пустот. В следующих вариантах повторяющаяся картина биопринтированных функциональных элементов приводит к стопкам из многих смежных слоев с образованием искусственной ткани или органа со слоистой структурой. В различных вариантах рядом получают биопринтингом 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или более соседних слоев (например, в виде стопок) с образованием искусственной ткани или органа. В следующих вариантах один или несколько слоев ткани со слоистой структурой также имеют плоскую структуру.
В некоторых вариантах функциональный элемент состоит из многих слитых или слипшихся трубчатых структур, которые расположены в горизонтальном и вертикальном направлениях в виде прилегающих друг к другу структур печеночной ткани, содержащей пустоты или каналы с регулярными интервалами, что обеспечивает перфузию в искусственную ткань печени и/или через нее. См. фигуры 17 и 19.
В некоторых вариантах биопринтированный фукциональный элемент повторяется в виде мозаики. «Мозаичная картина» является плоскостью, заполненной фигурами без перекрываний и промежутков. На фиг. 6А показан пример фукционального элемента, которая необязательно повторяется с образованием мозаики, приведенной на фигурах 6В-D и 7. Преимущества непрерывного и/или мозаичного биопринтинга включают в качестве неограничивающего примера повышенную производительность по биопринтированной ткани. Другим неограничивающим преимуществом является тот факт, что отпадает необходимость встраивать биопринтируемые элементы в один ряд с предварительно нанесенными элементами биочернил. В некоторых вариантах непрерывный биопринтинг облегчает принтование увеличенных тканей из большого резервуара биочернил, необязательно с использованием шприцов. Непрерывный биопринтинг также обеспечивает удобный способ одновременного создания пространственно определенных границ, используя компонент для экструзии, гидрогель, полимер, биочернила или любые принтуемые материалы, которые могут сохранять свою форму после принтования; причем образованные границы необязательно заполняются путем биопринтинга одного или более видов биочернил, создавая в результате мозаичную ткань с пространственно определенной плоской структурой; см., например, варианты, проиллюстрированные на фигурах 3А, 5А, 5В, 6, 8 и 11.
В некоторых вариантах способы непрерывного биопринтинга включают оптимизацию и/или балансировку таких параметров, как высота печати, скорость работы насоса, скорость работы робота или их комбинации, независимо или относительно друг друга. В некоторых случаях скорость работы головки биопринтера при нанесении составляла 3 мм/с при глубине распределения 0,5 мм для первого слоя и более 0,4 мм для каждого последующего слоя. В некоторых вариантах глубина распределения равна приблизительно диаметру распределительной насадки. Без ограничения подходящее и/или оптимальное распределение не приводит к материалу, расплющенному на распределительной игле или прилипшему к ней. В различных вариантах распределительная насадка биопринтера имеет внутренний диаметр около 20, 50, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000 мкм или более, включая промежуточные значения. В различных вариантах резервуар биочернил имеет объем около 0,05, 0,1, 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100 кубических сантиметров или больше, включая промежуточные значения. Скорость работы насоса в некоторых случаях выбирают подходящей и/или оптимальной, когда остаточное давление в системе мало. В некоторых случаях предпочтительная скорость работы насоса зависит от соотношения площадей поперечного сечения резервуара и распределяющей иглы, причем чем больше это соотношение, тем меньше скорость работы насоса. В некоторых вариантах подходящая и/или оптимальная скорость печати позволяет создавать однородную линию, не влияя на механическую целостность материала.
Раскрытое здесь изобретение включает ведение бизнеса. В некоторых вариантах скорость и масштабирование раскрытых методик и способов используют для проектирования, строительства и работы промышленных и/или торговых предприятий, производящих искусственные печеночные ткани и/или органы для имплантации, или применяют в изготовлении клеточных инструментов для исследования и разработки, например, анализов in vitro. В следующих вариантах получают, хранят, распределяют, маркетируют, рекламируют и продают, например, искусственные печеночные ткани и/или органы и их матриксы (например, микроматриксы или чипы), клеточные матриксы (например, микроматриксы или микрочипы) и наборы для биологических анализов и быстрого поиска лекарств. В других вариантах получают искусственные печеночные ткани и/или органы и их матриксы и предлагают услугу проведения биологических анализов и/или поиска лекарств.
Искусственные ткани печени
Показанная на фиг. 1 природная ткань печени имеет в составе клетки различных типов с различной пространственной архитектурой. Каждая доля печени образует работающий функциональный элемент печени, который является около шестиугольным по форме. Паренхимальные клетки, или гепатоциты, в основном образуют доли вместе с различными непаренхимальными клетками (клетки желчных потоков, синусоидальные эндотелиальные клетки, звездчатые клетки и клетки Купфера) в соседних положениях, окружающих эту долю и расходящихся лучами между портальной веной и желчными протоками (по периферии доли) в направлении к центральной вене (в центре доли). Расположение непаренхимальных клеток и поток крови и желчи по синусоидам и желчным канальцам соответственно действуют совместно, образуя микроокружение гепатоцитов, и таким образом влияют на жизнедеятельность и функционирование этих клеток. Различные патологические состояния печени типа цирроза или фиброза ведут к утрате критических метаболических функций, т.к. микроокружение гепатоцитов разрывается и архитектура печени постепенно разрушается из-за перепроизводства внеклеточных матриц, воспаления и образования патогенных цитокинов и факторов роста.
Биопринтинг позволяет генерировать компартменты печеночных клеток из клеток различных видов в трех изменениях, создавая таким образом ключевые элементы архитектуры и функции природной ткани. Дольчатые ткани можно генерировать на основе представленных здесь примеров, в которых паренхимальные и непаренхимальные клетки расположены в пространстве относительно друг друга, создавая плоскую структуру в каждом полученном слое ткани. Можно добавить последующие слои, которые либо точно воспроизводят структуру первого слоя, либо придают ей дополнительные особенности, такие как пустоты или каналы, либо дополнительные биологические элементы типа клеток опухоли или другие биологические или биохимические компоненты, связанные с патогенными или восстановительными/регенеративными процессами. Помимо сказанного о дольчатых образованиях, сопровождающие диаграммы показывают, что биопринтингом можно генерировать специфические взаимные связи между тканями, включая, но не ограничиваясь этим: клетки васкулярные/паренхимальные; васкулярные/гепатоциты; гепатоциты; гепатоциты/желчный проток; фиброзная ткань/сосудистая сеть; фиброзная ткань/гепатоциты; гепатоциты/иммунные клетки; паренхимальные/непаренхимальные, печеночные синусоидалиные капилляры/кровь или заменитель крови. В следующих вариантах аналоги печеночной ткани включают: гепатоциты или гепатоцитоподобные клетки и необязательно эпителиальные клетки желчных протоков и необязательно клетки непаренхимального типа, в том числе, но не ограничиваясь этим: звездчатые клетки, эндотелиальные клетки, клетки Купфера, иммунные клетки или миофибробласты.
В некоторых вариантах данного изобретения также предлагаются искусственные печеночные ткани, содержащие нанесенные клетки млекопитающих и кроме того один или несколько слоев клеток млекопитающих, где по меньшей мере один компонент ткани получен методом биопринтинга. В некоторых вариантах один или несколько слоев ткани имеют плоскую структуру, причем клетки многих типов или биочернила и/или пустоты находятся в пространственно определенных положениях на плоскостях X-Y. В некоторых вариантах ткани являются многослойными, причем по меньшей мере один слой архитектурно или композиционно отличается от других слоев, что придает ткани характерную слоистую структуру. В других вариантах слои в плоскости Z имеют одинаковую толщину. В еще одних вариантах слои в плоскости Z имеют разную толщину. В следующих вариантах любой из слоев является однослойным по толщине. В некоторых вариантах ткани являются аналогами печени. В следующих вариантах аналоги печеночной ткани включают: гепатоциты или гепацитоподобные клетки и необязательно эпителиальные клетки желчных протоков и необязательно непаренхимальные клетки, включающие, не ограничиваясь этим: звездчатые клетки, эндотелиальные клетки, клетки Купфера, иммунные клетки или миофибробласты. В некоторых вариантах полученные конструкции печеночной ткани имеют толщину по меньшей мере около 50 микрон в плоскостях X, Y и Z.
В некоторых вариантах искусственные печеночные ткани/конструкции получают биопринтингом по описанной здесь методике. В следующих вариантах по меньшей мере один компонент искусственной печеночной ткани получен биопринтингом. В еще одних вариантах дополнительные компоненты ткани изготовлены биопринтингом. В некоторых вариантах ткани не содержат какого-либо ранее сформированного каркаса во время производства или во время применения, как здесь описано. В некоторых вариантах ткани по настоящему изобретению, изготовленные по методикам тканевой инженерии, включая биопринтинг, отличаются от тканей, созданных in vivo как части организма.
В некоторых вариантах искусственные печеночные ткани включают любой тип клеток млекопитающих. В различных других вариантах искусственные печеночные ткани включают 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или больше типов клеток. В некоторых вариантах клетки искусственной печеночной ткани «объединяются» или «прилипают» друг к другу. В следующих вариантах когезия или адгезия относятся к свойствам адгезии клетки с клеткой, которая связывает клетки, многоклеточные агрегаты и/или их слои.
В некоторых вариантах искусственные печеночные ткани/конструкции включают один или более слоев клеток. В других вариантах один или более слоев клеток имеют плоскую структуру. В еще одних вариантах многие слои искусственной ткани имеют плоскую структуру; причем плоские структуры либо варьируются между слоями, либо слои имеют одинаковую структуру. В других вариантах плоская структура (плоскости X-Y) в отдельных слоях вытянуты в плоскость Z во время изготовления, в результате чего в плоскости Z композитной ткани создается дополнительная структура. В некоторых вариантах один или несколько слоев внутри многослойной архитектуры также имеют плоскую структуру.
В некоторых вариантах слой клеток содержит один или несколько пластов. В различных вариантах пласт клеток имеет толщину около 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 мкм или более, включая промежуточные значения. В других вариантах пласт клеток имеет толщину около 3, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 125, 150, 175, 200, 225, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500 мкм или более, включая промежуточные значения. В некоторых вариантах слой ткани включает слитые агрегаты клеток. В следующих вариантах до слияния агрегаты клеток имеют в качестве неограничивающих примеров определенную форму и/или архитектуру - по существу сферическую, вытянутую, по существу цилиндрическую или ленточную форму. В различных вариантах слитые агрегаты клеток образуют слой толщиной около 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 125, 150, 175, 200, 225, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500 мкм или больше, включая промежуточные значения.
В некоторых вариантах один или несколько слоев включают любой тип клеток млекопитающих. В следующих вариантах каждый слой включает 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 типов клеток или больше. В некоторых вариантах искусственные печеночные ткани/конструкции включают один или более слоев эндотелиальных клеток на одной или более поверхностях. В других вариантах искусственные печеночной ткани/конструкции включают один или более слоев эпителиальных клеток на одной или более нескольких поверхностях.
В различных вариантах искусственные печеночные ткани имеют любой подходящий размер. В некоторых вариантах размер биопринтированной печеночной ткани изменяется во времени. В следующих вариантах искусственные печеночной ткани сокращаются или сжимаются после биопринтинга, например, из-за миграции клеток, гибели клеток, межклеточных взаимодействий, сжатия или других форм сокращения. В других вариантах искусственная ткань печени растет или расширяется после биопринтинга, например, в результате миграции клеток, роста клеток и пролиферации, образования внеклеточной матрицы или других образующих клетки компонентов природной ткани, созревания клеток/ткани или других видов расширения.
В некоторых вариантах физические размеры искусственных тканей печени ограничены емкостью по нутриентам, включая кислород, который диффундирует внутрь конструкции. В различных вариантах искусственные печеночные ткани/конструкции во время биопринтинга имеют размеры по меньшей мере около 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950 или 1000 мкм в их наименьшем размере. В других вариантах искусственные печеночной ткани во время биопринтинга имеют размеры по меньшей мере около 0,25, 0,5, 0,75, 1,0, 1,25, 1,5, 1,75, 2,0, 2,25, 2,5, 2,75, 3,0, 3,25, 3,5, 3,75, 4,0, 4,25, 4,5, 4,75 или 5,0 мм в наименьшем размере. В других вариантах искусственные печеночные ткани/конструкции во время биопринтинга имеют размеры от около 25 мкм до около 500 мкм в самом малом размере.
В различных вариантах искусственные печеночные ткани имеют любую подходящую форму. В некоторых вариантах форму выбирают для моделирования конкретной природной ткани или органа. В следующих вариантах форму выбирают для моделирования конкретной патологии, состояния или заболевания. В некоторых вариантах искусственные печеночные ткани имеют по существу плоскую структуру. В следующих вариантах плоские ткани имеют любую плоскую структуру, включая в качестве неограничивающих примеров квадрат, треугольник, многоугольник, круг, овал или нечеткую форму. В некоторых вариантах плоскую структуру генерируют в искусственной печеночной ткани, размещая специфические клеточные или биочернильные компоненты и/или пустоты в плоскостях X-Y относительно друг друга.
В некоторых вариантах искусственные печеночные ткани/конструкции хранят в защитной оболочке, фиксируя положение ткани в пространстве относительно защитной оболочки. В некоторых вариантах искусственные печеночные ткани заключают в биосовместимый материал, который является физическим носителем с одной или более сторон и ограничивает пространство, занимаемое искусственной тканью печени. В других вариантах искусственные печеночные ткани закрепляют на поверхности. В следующих вариантах искусственные печеночные ткани закрепляют на биосовместимой поверхности. В еще одних вариантах много тканей связывают путем закрепления на поверхности и располагают в пространстве с образованием матрикса, как здесь описано. В некоторых вариантах искусственные печеночные ткани подвергаются действию сдвигового усилия, вызванного жидким потоком, на одной или более сторонах. В следующих вариантах приложение сдвигового усилия служит для облегчения созревания и развития ткани и/или облегчает миграцию, дифференциацию, пролиферацию, нанесение внеклеточных матриц или транспорт белков или молекул в клетки или из них внутри ткани. В других вариантах искусственные печеночные ткани подвергаются непрерывной или периодической перфузии, рециркуляции или перемешиванию жидких нутриентов на одной или более поверхностях. В некоторых вариантах искусственные печеночные ткани и их матриксы помещают в многолуночный биореактор, что обеспечивает непрерывную или периодическую рециркуляцию жидкой культуральной среды в каждой конструкции.
Структура ткани
Природные ткани характеризуются присутствием пространственных и композиционных участков, управляемых клеточными или внеклеточными компонентами ткани (т.е. пустотами, внеклеточными матрицами, белковоподобным материалом и т.п.). Серьезной проблемой в стратегии тканевой инженерии является неспособность репродуцирования как геометрических, так биологических атрибутов природной ткани, когда для достижения трехмерности применяют синтетические каркасы. К настоящему моменту попытки создать слоистую или плоскую структуру, подобную природной печеночной ткани, внутри каркаса, способную также инкорпорировать клетки с плотностью, которая моделирует природную ткань, тормозились техническими ограничениями. Биопринтинг позволил преодолеть присущие проблемы (плоская/слоистая структура и плотность клеток) путем пространственно определенного нанесения биочернил, имеющих в составе клетки согласно примерам, приведенным на фигурах 18А-Е. В некоторых вариантах плоские структуры создаются из многих составов биочернил, тем самым два или более компонентов ткани (т.е. стромальный, эпителиальный, васкулярный, костный, хрящевой, паренхимальный, кортикальный, мозговой, папиллярный, дольчатый и т.п.) получают таким образом, который размещает каждый компонент ткани/популяцию клеток/состав биочернил в определенное положение относительно друг друга в плоскостях X, Y и/или Z. В некоторых вариантах плоская структура включает пустоты. В следующих вариантах пустоты внутри плоской структуры размещают потоки, моделирующие по меньшей мере один элемент телесных потоков, таких как кровь, лимфа, желчь, моча, секреты и т.п. В других вариантах пустоты необязательно содержат виды неслипшихся клеток или полученные из телесных потоков компоненты (например, клетки крови, клетки мозга, лимфатические клетки, иммунные клетки, раковые клетки, тромбоциты, белки и т.д.). В следующих вариантах неслипшиеся типы клеток из компонентов, полученных из телесных потоков, необязательно существуют как компонент непустотных пространств, который был введен в содержащие клетки компоненты плоской структурой до, во время или после изготовления. В некоторых вариантах неслипшиеся клеточные компоненты или полученные из телесных потоков компоненты переносят из пустот в пространство, содержащее клетки, в плоской структуре за счет межклеточных взаимодействий или отклика на факторы секретирования.
В некоторых вариантах жидкие потоки или перфузию необязательно инициируют через пустоты в структуре. В некоторых вариантах плоская структура способна генерировать границы раздела ткань-ткань или ткань-жидкость. В следующих вариантах ткани помещают в оптически прозрачные контейнеры, с тем чтобы наблюдать в реальном времени клетки на границах раздела, обусловленных структурой.
В некоторых вариантах ткани содержат много слоев, где по меньшей мере один слой архитектурно или композиционно отличается от других слоев в конструкции, что создает слоистую архитектуру в плоскости Z. Примеры слоистой архитектуры включают барьерные ткани, создающие эндотелиальный или эпителиальный барьер нижележащим слоям, как показано примерами на Фиг. 18F. В некоторых вариантах один или несколько слоев ткани включают васкулярные или микроваскулярные компоненты. В других вариантах включение васкулярных или микроваскулярных компонентов ведет к образованию микроваскулярных или псевдоваскулярных сетей внутри одного или более компонентов искусственной ткани. В некоторых вариантах один или несколько компонентов ткани со слоистой структурой получают биопринтингом. В некоторых вариантах одну или несколько тканей со слоистой структурой получают по соседству друг с другом, что создает границу раздела тканей.
В некоторых вариантах один или несколько слоев многослойной искусственной ткани со слоистой структурой включают также плоскую структуру, согласно неограничивающим примерам, приведенным на фиг. 18G. В некоторых вариантах такая же плоская структура продолжается в каждом слое, что приводит к трехмерной ткани с непрерывной архитектурой в плоскостях X, Y и Z. В некоторых вариантах состав или плоская структура одного или более слоев изменяется, в результате чего полученная трехмерная ткань имеет сложную архитектуру в плоскостях X, Y и Z.
На фиг. 18А в конкретном варианте искусственную ткань печени получают с помощью плоской структуры, и она представляет собой архитектурно-корректную ткань с сосудистой сетью. В этом варианте искусственную ткань печени получают с помощью первых биочернил, включающих паренхимальные клетки печени. Каждый слой паренхимальных клеток необязательно включает любой плоский профиль. В этом варианте искусственную печеночную ткань изготавливают с помощью вторых биочернил, включая сосудистые клетки типа эндотелиальных клеток, клеток гладкой маскулатуры и фибробластов, с образованием сосудистой сети. Необязательно эта архитектура может быть создана путем первого биопринтинга и формирования сосудистой сети, и затем на второй стадии получают печеночную ткань, окружающую эту сеть.
На фиг. 18В в конкретном варианте искусственную печеночную ткань получают в виде плоской структуры, представляющей зональное соединение ткани. Такой прием можно использовать, например, для воспроизведения трех специфических долей печени от перипортальной области до центродолевой области.
На фиг. 18С в конкретном варианте искусственную печеночную ткань изготавливают в виде плоской структуры, представляющей собой дольчатую ткань. В этом варианте искусственную печеночную ткань изготавливают с участием первых билчернил, включающих клетки печени, с образованием долей. Каждая геометрическая доля в своих границах необязательно включает пространственно определенную архитектуру. В этом варианте искусственную печеночную ткань изготавливают с помощью вторых биочернил, включающих стромальные/васкулярные клетки с образованием граничных областей вокруг долей.
На фиг. 18D в конкретном варианте искусственную ткань печени изготавливают в виде плоской структуры, представляющей перфузированную/матриксную ткань. В этом варианте первый компонент образует каналы, сосуды или трубки с просветами. В этом варианте второй компонент образует пятна ткани, которые необязательно имеют те же размер/форму или разные размер/форму и необязательно включают клетки одного типа или клетки многих типов и необязательно включают один или более пространственных участков, полученных путем направленного формирования в плоскостях X, Y и/или Z.
На фиг. 18Е в конкретном варианте искусственную печеночную ткань изготавливают в виде плоской структуры, представляющей собой границу раздела в ткани типа твердое тело+жидкость/жидкость. В этом варианте первые биочернила образуют внешнюю стенку люминальной структуры, вторые биочернила образуют там, где требуется, внутреннюю стенку люминальной структуры, а третий компонент необязательно представляет поток, содержащий клетки или другие биологически подобные компоненты.
На фиг. 18F в конкретном варианте искусственную печеночную ткань изготавливают в виде слоистой структуры, представляющей барьерную ткань. В этом варианте барьерный слой необязательно является эндотелиальным или эпителиальным и промежуточный слой образует стенку и/или поверхность люминальной ткани, которая становится похожей на пористое сито или мембрану.
На фиг. 18G в конкретном варианте изготавливают многослойную искусственную печеночную ткань таким образом, что каждый слой имеет плоскую структуру, а слои объединяют с образованием ткани слоистой структуры. В этом варианте плоская структура по осям X и Y продолжается в полученной ткани и по оси Z. Геометрические параметры необязательно включает соседние каналы или клеточные компартменты.
Клетки
В некоторых вариантах данное изобретение предлагает искусственные печеночные ткани (например, аналоги печени), содержащие один или более типов клеток млекопитающих. В других вариантах искусственной печеночной ткани включают гепатоциты или гератоцитоподобные клетки. В следующих вариантах подходящие гепатоциты или гепатоцитоподобные клетки включают, но не ограничиваются этим, первичные гепатоциты, линии клеток типа HepG2, специфические предшественники, такие как клетки HepaRG, или их комбинации. В следующих вариантах искусственные печеночные ткани включают клетки эпителия желчных протоков или клетки, подобные клеткам эпителия желчных протоков. В других вариантах искусственные печеночные ткани включают непаренхимальные клетки. В еще других вариантах подходящие непаренхимальные клетки включают, но не ограничиваются этим, васкулярные клетки, эндотелиальные клетки, фибробласты, миофибробласты, адипоциты, адипогенные клетки, мезенхимальные клетки, иммунные клетки, клетки Купфера, звездчатые клетки, билиарные эпителий-подобные клетки, синусоидальные эндотелиальные клетки, полученные из печени стволовые клетки/клетки-предшественники, стволовые клетки, полученные не из печени/клетки-предшественнии и их комбинации.
В некоторых вариантах любые клетки млекопитающих пригодны для инклюзии в искусственные печеночные ткани и их матриксы. В других вариантах по меньшей мере один компонент искусственной печеночной ткани содержит клетки адгезивного типа. В следующих вариантах клетки млекопитающих включают в качестве неограничивающих примеров: печеночные клетки, паренхимальные клетки, непаренхимальные клетки, клетки сократительных мышц (например, клетки гладкой мускулатуры и миобласты), клетки соединительной ткани (например, фибробласты), клетки костного мозга, эндотелиальные клетки, эпителиальные клетки, васкулярные клетки, клетки крови, лимфатические клетки, перициты, мезотелиальные клетки, стромальные клетки, недифференцированные клетки (например, эмбриональные клетки, стволовые клетки и клетки-предшественники), клетки эндодерма, клетки мезодерма, клетки эктодерма и их комбинации.
В некоторых вариантах искусственные печеночные ткани включают эндотелиальные клетки, такие как человеческие эндотелиальные клетки. В некоторых вариантах подходящие эндотелиальные клетки появляются из ткани, включая, в качестве неограничивающего примера: ткани печени, крови, кровеносных сосудов, лимфатических сосудов, ткани пищеварительного тракта, ткани мочеполового тракта, жировой ткани, ткани дыхательных путей, ткани репродуктивной системы, костной и пуповинной (пупочной)ткани.
В некоторых вариантах клетки являются взрослыми, дифференцированными клетками. В других вариантах «дифференцированные клетки» - это клетки фенотипа, специфического для ткани, согласующегося, например, с гепатоцитами или эндотелием во время выделения, в то время как специфический для ткани фенотип (или потенциал для раскрытия фенотипа) сохраняется от момента выделения до момента использования. В следующих вариантах клетки являются взрослыми, недифференцированными клетками, в дальнейших вариантах «недифференцированные клетки» - это клетки, которые не имеют или потеряли определенные специфические для ткани особенности. В некоторых вариантах недифференцированные клетки включают стволовые клетки. В других вариантах «стволовые клетки» - это клетки, которые обладают активностью и самообновляются. Стволовые клетки включают, но не ограничиваются этим: тотипотентные клетки, плюрипотентные клетки, мультипотентные клетки, олигопотентные клетки, унипотентные клетки и клетки-предшественники. В различных вариантах стволовые клетки - это эмбриональные стволовые клетки, взрослые стволовые клетки, амниотические стволовые клетки и введенные плюрипотентные стволовые клетки. В еще одних вариантах клетки представляют собой смесь взрослых дифференцированных клеток и взрослых недифференцированных клеток.
В некоторых вариантах искусственные печеночные ткани включают паренхимальные клетки, полученные из мультипотентных стволовых клеток/клеток-предшественников. В различных вариантах паренхимальные клетки получают из эмбриональной печеночной ткани млекопитающих; эмбриональных стволовых клеток (ESC); индуцированных плюрипотентных стволовых клеток (iPSC); взрослых стволовых клеток/клеток-предшественников, полученных из печени, и взрослых стволовых клеток/клеток-предшественников, полученных из ткани, отличной от печени. В некоторых вариантах искусственные печеночные ткани получают из мультипотентных клеток/клеток-предшественников, которые ранее были частично или полностью дифференцированы в эндодермальный или печеночный фенотип до использования для получения конструкций печеночной ткани.
В некоторых вариантах конструкции включают стволовые клетки/клетки-предшественники, которые были подвергнуты воздействию одного или более сигналов дифференциации. В других вариантах сигнал дифференциации включает один или несколько биомеханических сигналов, сигналов растворения (например, биохимический сигнал) и физических сигналов. При изготовлении искусственной печеночной ткани стволовые клетки/клетки-предшественники многократно получают один или несколько сигналов дифференциации. В некоторых вариантах стволовые клетки/клетки-предшественники получали один или несколько сигналов дифференциации до изготовления конструкции. В других вариантах стволовые клетки/клетки-предшественники получали один или несколько сигналов дифференциации во время изготовления конструкции. В еще одних вариантах стволовые клетки/клетки-предшественники получали один или несколько сигналов дифференциации после изготовления конструкции.
В различных вариантах типы клеток и/или источники клеток выбирают, располагают, обрабатывают или модулируют в соответствии с конкретной целью исследования или его объектом. В некоторых вариантах один или несколько конкретных типов клеток выбирают, располагают, обрабатывают или модулируют для содействия исследованию конкретного заболевания или состояния. В некоторых вариантах один или несколько конкретных типов клеток выбирают, располагают, обрабатывают или модулируют для содействия исследованию конкретного заболевания или состояния у конкретного пациента. В некоторых вариантах один или несколько конкретных типов клеток получают от двух или более различных доноров-людей. В некоторых вариантах один или несколько конкретных типов клеток получают от конкретного позвоночного животного. В других вариантах один или несколько конкретных типов клеток получают от конкретного млекопитающего. В еще одних вариантах один или несколько конкретных типов клеток получают от конкретного человека. В следующих вариантах один или несколько конкретных типов клеток получают от конкретного субъекта со специфическим фенотипом, связанным с заболеванием или функционированием ткани. В следующих вариантах специфические клетки субъекта выделяют из целевой ткани путем биопсии или отбора образца ткани. В еще одних вариантах специфические клетки субъекта используют для изготовления ткани сразу после выделения. В других вариантах со специфическими клетками манипулируют in vitro до изготовления трехмерных тканей; причем обработка включает один или несколько типов операций: расширение, дифференциация, прямая дифференциация, пролиферация, контактирование с белками или нуклеионовыми кислотами, инкорпорация генетических векторов, инкорпорация генетических или негенетических клеточных меток, дедифференциация (т.е. генерация индуцированных плюрипотентных стволовых клеток или их эквивалентов), криоконсервация. В некоторых вариантах специфические клетки субъекта выделяют из другой ткани, отличной от целевой. В некоторых вариантах специфические клетки субъекта требуют дифференциации в нужные типы клеток внутри целевой ткани. В других вариантах специфические клетки пациента, нуждающиеся в дифференциации, дифференцируют до, во время или после изготовления трехмерной структуры.
Способы культивирования клеток
Типы клеток, используемых в искусственной печеночной ткани по данному изобретению, культивируют любым способом, известным в данной области. Способы культивирования клеток и тканей хорошо известны и описаны, например, в работе Freshney, R., Culture of Animal Cells: A Manual of Basic Techniques, Wiley (1987), содержание которой включено здесь ссылками. Основная методика культивирования клеток млекопитающих, линии клеток и системы культивирования клеток, использованные в связи с настоящим изобретением, также описаны в работе Doyle, A., Griffiths, J.В., Newell, D.G., (ред.) Cell and Tissue Culture: Laboratory Procedures, Wiley (1998), содержание которой включено здесь ссылками.
Условия культурального роста клеток млекопитающих хорошо известны в данной области. Среды для клеточных культур в основном включают нутриенты и необязательно дополнительные элементы, такие как факторы роста, соли, минералы, витамины, обогащенную тромбоцитами плазму и т.п., которые необязательно выбирают согласно типу культивируемых клеток. В некоторых вариантах выбирают конкретные ингредиенты для ускорения роста клеток, дифференциации, выделения специфических белков и т.п. В целом стандартные среды роста включают среду Dulbecco's Modified Eagle Medium (DMEM) с 4 г/л и глюкозы и добавками 1-20% сыворотки крови коровьих эмбрионов (FBS), телячьей сыворотки или сыворотки человека, инсулина (4 микрограмм/мл), дексаметазона (1,0 микромоля), амфотерицина В (0,25 микрограмм/мл) и глютамакса Glutamax (1x) Williams Е с добавками инсулина (1 г/л), селенита натрия (0,0067 г/л), трансферрина (0,55 г/л), дексаметазона (1 микромоль), пенициллина (100 U/мл), стрептомицина (0,1 мг/мл), амфотерицина В (0,25 микрограмм/мл) и Glutamax (1x) или различных других сред, известных в данной области. Предпочтительно, чтобы клетки культивировались в стерильных условиях в атмосфере 1-21% О2 и предпочтительно 3-5% СО2 при температуре тела животного - источника клеток или близкой к ней. Например, человеческие клетки предпочтительно культивировать приблизительно при 37°С.
Клетки необязательно культивируют вместе с реагентами для клеточной дифференциации, с тем чтобы индуцировать дифференциацию клеток по нужной линии. Например, клетки необязательно культивируют вместе с факторами роста, цитокинами и т.п. В некоторых вариантах термин «фактор роста» относится к белку, полипептиду или комплексу полипептидов, включая цитокины, продуцируемые клетками, и влияют сами и/или вместе с другими соседними или удаленными клетками. Обычно факторы роста влияют на рост и/или дифференциацию специфических типов клеток либо эволюционно, либо в ответ на многие физиологические стимулы или стимулы от окружающей среды. Некоторые, но не все факторы роста представляют собой гормоны. Примерами факторов роста являются инсулин, инсулиноподобный фактор роста (IGF), фактор роста нервов (NGF), фактор роста васкулярного эндотелия (VEGF), факторы роста кератиноцитов (KGF), факторы роста фибробластов (FGFs), включая базовый фактор FGF (bFGF), факторы роста, полученные из лимфоцитов (PDGFs), включая PDGF-AA и PDGF-AB, фактор роста гепатоцитов (HGF), альфа-трансформирующий ростовой фактор α (TGF-α), трансформирующий ростовой фактор β (TGF-β), включая TGFβ1 и TGFβ3, фактор роста эпидермиса (EGF), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), гранулоцитарный колониестимулирующий фактор (G-CSF), интерлейкин-6 (IL-6), IL-8 и т.п. Факторы роста обсуждаются среди прочих в Molecular Cell Biology, Scientific American Books, Darnell et al., eds., 1986; Principles of Tissue Engineering, 2d ed., Lanza et al., eds., Academic Press, 2000. Специалистам будет очевидно, что любой и все полученные из культур факторы роста в описанных здесь средах входят в объем изобретения.
Биочернила и многоклеточные агрегаты
В некоторых вариантах данное изобретение предлагает трехмерные живые ткани, в том числе печеночные ткани/конструкции, их матриксы и способы, включающие использование биопринтированные клеток. В некоторых вариантах клетки получают биопринтингом путем осаждения или экструдирования биочернил из биопринтера. В некоторых вариантах «биочернила» включают жидкие, полутвердые или твердые композиции, содержащие множество клеток. В некоторых вариантах биочернила включают жидкие или полутвердые растворы клеток, суспензии клеток или концентраты клеток. В других вариантах раствор клеток, суспензия или концентрат включают жидкий или полутвердый (например, вязкий) носитель и множество клеток. В следующих вариантах носитель является подходящей средой для клеточных нутриентов, такой, как здесь описано. В некоторых вариантах биочернила включают множество клеток, которые необязательно слипаются с образованием многоклеточных агрегатов до биопринтинга. В следующих вариантах биочернила включают множество клеток и их биопринтируют с образованием специфической плоской и/или слоистой структуры; причем слипание индивидуальных клеток в биочернилах происходит до, во время и/или после биопринтинга. В некоторых вариантах биочернила получают следующим образом: 1) собирают множество клеток в фиксированном объеме; причем клеточный компонент(ы) представляет по меньшей мере около 30% и самое большее 100% от общего объема. В некоторых вариантах биочернила включают полутвердые или твердые многоклеточные агрегаты или многоклеточные тела. В следующих вариантах биочернила получают 1) смешением множества клеток или клеточных агрегатов с биосовместимой жидкостью в предварительно заданном соотношении с образованием биочернил, и 2) компактированием биочернил для получения биочернил нужной плотности и вязкости. В некоторых вариантах биочернила компактируют путем центрифугирования, тангенциальной поточной фильтрации («TFF») или их комбинации. В некоторых вариантах компактирование биочернил приводит к композиции, которую можно экструдировать, что позволяет формировать многоклеточные агрегаты или многоклеточные тела. В некоторых вариантах «способность к экструдированию» означает способность к формованию под действием внешнего усилия (например, под давлением) через сопло или отверстие (например, через одно или несколько отверстий или трубок). В некоторых вариантах биочернила компактируются в результате роста клеток до нужной плотности. Необходимую плотность клеток в биочернилах варьируют в зависимости от получаемой ткани или органа. В некоторых вариантах клетки биочернил связываются и/или прилипают. В некоторых вариантах «объединяться», «объединенный» и «когезия» относятся к свойству адгезии клетки к клетке, что связывает вместе клетки, многоклеточные агрегаты, многоклеточные тела и/или их слои. В других вариантах эти термины используют взаимозаменяемо с терминами «сливаться», «слитой» и «слияние». В некоторых вариантах биочернила кроме того включают носитель, среду культивирования клеток (или дополнения к ней), внеклеточную матрицу (или ее компоненты), компоненты для адгезии клеток, ингибиторы гибели клеток, антиапоптозные реагенты, антиоксиданты, соединения для экструзии и их комбинации.
В различных вариантах клетки могут быть любыми. В следующих разных вариантах клетки - это клетки позвоночных, млекопитающих, человека или их комбинации. В некоторых вариантах тип клеток, использованных в предлагаемом способе, зависит от типа получаемой конструкции или ткани. В некоторых вариантах биочернила включают один тип клеток (они также называются «однородными» или «монотипическими» биочернилами). В некоторых вариантах биочернила включают более одного типа клеток (они называются также «гетерогенными» или «политипическими» биочернилами).
Среды для культивирования клеток
Некоторых варианты включают среду для культивирования клеток. Среда для культивирования клеток может быть любой. В различных вариантах подходящая среда для культивирования клеток включает в качестве неограничивающих примеров Dulbecco's Phosphate Buffered Saline, Earle's Balanced Salts, Hanks' Balanced Salts, Tyrode's Salts, Alsever's Solution, Gey's Balanced Salt Solution, Kreb's-Henseleit Buffer Modified, Kreb's-Ringer Bicarbonate Buffer, Puck's Saline, Dulbecco's Modified Eagle's Medium, Dulbecco's Modified Eagle's Medium/Nutrient F-12 Ham, Nutrient Mixture F-10 Ham (Ham's F-10), Medium 199, Minimum Essential Medium Eagle, RPMI-1640 Medium, Ames' Media, BGJb Medium (Fitton-Jackson Modification), Click's Medium, CMRL-1066 Medium, Fischer's Medium, Glascow Minimum Essential Medium (GMEM), Iscove's Modified Dulbecco's Medium (IMDM), L-15 Medium (Leibovitz), McCoy's 5A Modified Medium, NCTC Medium, Swim's S-77 Medium, Waymouth Medium, William's Medium E, или их комбинации. В некоторых вариантах среду для культивирования клеток модифицируют или вводят добавки. В некоторых вариантах среда для культивирования клеток содержит также альбумин, селен, трансферрины, фетуины, сахара, аминокислоты, витамины, факторы роста, цитокины, гормоны, антибиотики, липиды, носители липидов, циклодекстрины, богатую лимфоцитами плазму или их комбинации.
Внеклеточная матрица
В некоторых вариантах биочернила также включают один или несколько компонентов внеклеточной матрицы или их производные. В некоторых вариантах «внеклеточная матрица» включает белки, которые продуцированы клетками и переносятся из клеток во внеклеточное пространство, где они служат носителем для удержания тканей вместе и придают прочность при растяжении и/или облегчают подачу сигналов клеткам. Примеры внеклеточной матрицы включают, но не ограничиваются этим: коллагены, фибронектин, ламинины, гиалуронаты, эластин и протеогликан. Например, в некоторых вариантах многоклеточные агрегаты содержат различные внеклеточные матриксные белки (ВКМ), например, желатин, фибриноген, фибрин, коллагены, фибронектин, ламинины, эластин и/или протеогликаны. Компоненты ВКМ или производные компонентов ВКМ необязательно добавляют в пасту из используемых клеток с образованием многоклеточного агрегата. Компоненты ВКМ или производные компонентов ВКМ, добавляемые в пасту из клеток, необязательно очищают от источника - человека или животного - или получают рекомбинантными способами, известными в данной области. Альтернативно в природе компоненты ВКМ или производные компонентов ВКМ, выделенные клетками в вытянутом клеточном теле или клетками, используемыми для изготовления вытянутого клеточного тела, необязательно подвергают генетической обработке любым способом, известным в данной области, для варьирования уровня экспрессии одного или более ВКМ компонентов или производных ВКМ компонентов и/или одной или более молекул клеточной адгезии либо молекул адгезии клеточных субстратов (например, селектинов, интегринов, иммуноглобулинов и адгезинов). В некоторых вариантах ВКМ компоненты или производные ВКМ компонентов промотируют когезию клеток в многоклеточных агрегатах. Например, желатин и/или фибрироген добавляют к пасте из клеток, которую используют для образования многоклеточных агрегатов. Фибриноген превращают в фибрин путем добавления тромбина.
В некоторых вариантах биочернила включают реагент, который стимулирует адгезию клеток.
В некоторых вариантах биочернила также включают ингибитор гибели клеток (например, некроза, апоптоза или аутофагоцитоза). В некоторых вариантах биочернила также включают антиапоптический реагент. Реагенты, ингибирующие гибель клеток, включают, но не ограничиваются этим, малые молекулы, антитела, белки, пептидные антитела или их комбинации. В некоторых вариантах реагент, ингибирующий гибель клеток, выбирают из следующих: анти-TNF реагенты, реагенты, ингибирующие активность интерлейкина, реагенты, ингибирующие активность интерферона, реагенты, ингибирующие активность GCSF (гранулоцитарный колониестимулирующий фактор), реагенты, ингибирующие активность воспалительного белка макрофагов, реагенты, ингибирующие активность GF-В (трансформирующий фактор роста В) (см., например, фигуры 15 и 16), реагенты, ингибирующие активность ММР (матричная металлопротеиназа), реагенты, ингибирующие активность каспазы, реагенты, ингибирующие активность сигнального каскада MAPK/JNK, реагенты, ингибирующие активность Src киназы, реагенты, ингибирующие активность JAK (Janus киназы) или их комбинаций. В некоторых вариантах биочернила включают антиоксидант. В некоторых вариантах биочернила включают переносчики кислорода или другие специфические для клеток нутриенты.
Добавки для экструзии
В некоторых вариантах биочернила также включают добавку для экструзии (т.е. вещество, которое улучшает экструзионные свойства биочернил). Примеры добавок для экструзии включают, но не ограничиваются ими: гели, гидрогели, пептидные гидрогели, гели на основе аминокислот, поверхностно-активные полиолы (например, Pluronic F-127 или PF-127), термореактивные полимеры, гиаулоронаты, альгинаты, компоненты внеклеточных матриц (и их производные), коллагены, желатин, другие биосовместимые природные или синтетические полимеры, нановолокна и самоорганизующиеся нановолокна. В некоторых вариантах добавки для экструзии удаляют после биопринтинга физическими, химическими или ферментативными способами.
Гели, иногда называемые желе, были определены по-разному. Например, Фармакопея Соединенных Штатов определяет гели как полутвердые системы, состоящие либо из суспензий, полученных из малых неорганических молекул, либо из больших органических молекул в жидкости. Гели включают однофазную или двухфазную системы. Однофазный гель состоит из органических макромолекул, распределенных равномерно в жидкости таким образом, что между диспергированными макромолекулами и жидкостью не образуется видимых поверхностей раздела. Некоторые однофазные гели получают из синтетических макромолекул (например, карбомера) или природных камедей (например, трагаканта). В некоторых вариантах однофазные гели обычно бывают водными, но их также получают из спиртов и масел. Двухфазные гели состоят из сетки малых дискретных частиц.
В некоторых случаях гели классифицируют как гидрофобные или гидрофильные. В некоторых вариантах гидрофобный гель состоит из жидкого парафина с полиэтиленом или жирными маслами, желированными с помощью коллоидного оксида кремния или мыла на основе алюминия или цинка. Напротив, основа гидрофобных гелей обычно состоит из воды, глицерина или пропиленгликоля, желированных с помощью подходящего желирующего реагента (например, трагаканта, крахмала, производных целлюлозы, карбоксивинилполимеров и силикатов магния-алюминия). В некоторых вариантах текучесть раскрытых здесь композиций или устройств является псевдопластичной, пластичной, тиксотропной или способной расширяться.
Подходящие гидрогели включают гели, полученные из коллагена, гиаулороната, гиаулоронана, фибрина, альгината, агарозы, хитозана и их комбинаций. В других вариантах подходящие гидрогели являются синтетическими полимерами. В следующих вариантах подходящие гидрогели включают гидрогели, полученные из полиакриловой кислоты и ее производных, полиэтиленоксида и его сополимеров, поливинилового спирта, полифосфазена и их комбинаций. В различных особенных вариантах связывающий материал выбирают из следующих материалов: гидрогель, NovoGel™, агароза, альгинат, желатин, Matrigel™, гиаулоронан, полоксамер, пептидный гидрогель, полиизопропил-н-полиакриламид, полиэтиленгликольдиакрилат (PEG-DA), гидроксиэтилметакрилат, полидиметилсилоксан, полимер молочной кислоты, кремний, шелк или их комбинации.
В некоторых вариантах вещество для экструзии на основе гидрогеля является термообратимым гелем (известным также как термореактивный гель или термогель). В некоторых вариантах подходящий термообратимый гидрогель не является жидким при комнатной температуре. В конкретных вариантах температура гелеобразования (Tgel) подходящего гидрогеля составляет около 10°С, 11°С, 12°С, 13°С, 14°С, 15°С, 16°С, 17°С, 18°С, 19°С, 20°С, 21°С, 22°С, 23°С, 24°С, 25°С, 26°С, 27°С, 28°С, 29°С, 30°С, 31°С, 32°С, 33°С, 34°С, 35°С, 36°С, 37°С, 38°С, 39°С, 40°С, включая промежуточные значения. В некоторых вариантах Tgel подходящего гидрогеля составляет от около 10°С до 40°С. В других вариантах Tgel подходящего гидрогеля составляет от около 20°С до около 30°С. В некоторых вариантах описанные здесь биочернила (например, содержащие гидрогель одного или более типов и другие добавки и т.п.) не являются жидкими при комнатной температуре. В некоторых вариантах подходящий термообратимый гидрогель не является жидким при температуре тела млекопитающего. В конкретных вариантах температура желирования (Tgel) подходящего гидрогеля составляет около 22°С, 23°С, 24°С, 25°С, 26°С, 27°С, 28°С, 29°С, 30°С, 31°С, 32°С, 33°С, 34°С, 35°С, 36°С, 37°С, 38°С, 39°С, 40°С, 41°С, 41°С, 43°С, 44°С, 45°С, 46°С, 47°С, 48°С, 49°С, 50°С, 51°С, 52°С, включая промежуточные значения. В определенных вариантах Tgel подходящего гидрогеля составляет от около 22°С до около 52°С. В следующих вариантах Tgel подходящего гидрогеля составляет от около 32°С до около 42°С. В некоторых вариантах описанные здесь биочернила (например, содержащие гидрогель одного или более типов и другие добавки и т.п.) не являются жидкими при температуре тела млекопитающих. В конкретных вариантах температура желирования (Tgel) описанных здесь биочернил составляет около 10°С, около 15°С, около 20°С, около 25°С, около 30°С, около 35°С, около 40°С, около 45°С, около 50°С, около 55°С, включая промежуточные значения. В конкретных вариантах Tgel описанных здесь биочернил составляет от около 10°С до около 15°С. В другом конкретном варианте Tgel описанных здесь биочернил составляет от около 15°С до около 20°С. В другом конкретном варианте Tgel описанных здесь биочернил составляет от около 20°С до около 25°С. В другом конкретном варианте Tgel описанных здесь биочернил составляет от около 25°С до около 30°С. В еще одном конкретном варианте Tgel описанных здесь биочернил составляет от около 30°С до около 35°С. В другом конкретном варианте Tgel описанных здесь биочернил составляет от около 35°С до около 40°С. В другом конкретном варианте Tgel описанных здесь биочернил составляет от около 40°С до около 45°С. В другом конкретном варианте Tgel описанных здесь биочернил составляет от около 45°С до около 50°С.
Полимеры полипропиленксид и полиэтиленксид образуют термообратимые гели, инкорпорированные в водные растворы. Эти полимеры способны изменять свое состояние от жидкого до состояния геля при температурах, которые поддерживают в аппарате биопринтинга. Фазовый переход от жидкости до геля зависит от концентрации полимера и ингредиентов в растворе.
Полоксамер 407 (Pluronic F-127 или PF-127 или Lutrol) представляет собой неионное поверхностноактивное вещество, имеющее в составе сополимеры полиэтиленоксида и полипропиленоксида. Другие полоксомеры включают 188 (F-68 grade), 237 (F-87 grade), 338 (F-108 grade). Водные растворы полоксамеров стабильны в присутствии кислот, щелочей и ионов металлов. Полоксамер PF-127 представляет собой промышленный трехблочный сополимер полиэтиленоксида и полипропиленоксида общей формулы Е106 Р70 Е106 со средней мольной массой 13000. Далее полимер необязательно очищают способами, которые способствуют усиленному желированию полимера. Он содержит приблизительно 70% этиленоксида, что объясняет его гидрофильность. Это один из ряда блок-сополимеров полоксамера ABA. Полоксамер PF-127 хорошо растворяется, мало токсичен и поэтому считается подходящим компонентом для экструзии.
В некоторых вариантах вязкость представленных здесь гидрогелей и биочернил определяют любыми известными способами. Например, в некоторых вариантах для измерения вязкости гидрогелей и биочернил используют вискозиметоры LVDV-II+CP Cone Plate Viscometer и Cone Spindle CPE-40. В других вариантах для определения вязкости гидрогелей и биочернил применяют вискозиметр Brookfield (шпиндель и колпачок). В некоторых вариантах приведенные здесь интервалы вязкости определяли при комнатной температуре. В других вариантах приведенные здесь интервалы вязкости определяли при температуре тела (например, при средней температуре тела здорового человека).
В следующих вариантах гидрогели и/или биочернила имеют вязкость от около 500 и 1000000 сантипуаз, от около 750 до 1000000 сантипуаз, от около 1000 до 1000000 сантипуаз; от около 1000 до 400000 сантипуаз; от около 2000 до 100000 сантипуаз; от около 3000 до 50000 сантипуаз; от около 4000 до 25000 сантипуаз; от около 5000 до 20000 сантипуаз или от около 6000 до 15000 сантипуаз.
В некоторых вариантах биочернила включают клетки и добавки для экструзии, пригодные для непрерывного биопринтинга. В конкретных вариантах биочернила имеют вязкость около 1500 мПа⋅с. В некоторых вариантах для непрерывного биопринтинга пригодна смесь Pluronic F-127 и клеточного материала. Такие биочернила получают растворением порошка Pluronic F-127 при непрерывном перемешивании в холодном (4°С) насыщенном солевом растворе с фосфатным буфером (PBS) в течение 48 час до 30% (масс/об). Pluronic F-127 также растворяется в воде в нужной концентрации. В некоторых вариантах клетки культивируют и размножают с помощью стандартных стерильных методик культивирования клеток. В следующих вариантах клетки формуют, например, в таблетки по 200 г и заново суспендируют в 30% растворе Pluronic F-127 и переносят в резервуар, прикрепленный к биопринтеру, где в некоторых вариантах ему дают затвердеть при температуре желирования от около 10 до около 25°С. Желировать биочернила до биопринтинга необязательно. Биочернила, включая биочернила, содержащие Pluronic F-127, необязательно готовят в виде жидкости.
В разных вариантах концентрация Pluronic F-127 может быть любой для обеспечения нужной вязкости и/или цитотоксичности. В некоторых вариантах подходящая концентрация Pluronic F-127 может удерживать его массу при сохранении формы во время биопринтинга. В некоторых вариантах концентрация Pluronic F-127 составляет около 10%, около 15%, около 20%, около 25%, около 30%, около 35%, около 40%, около 45% или около 50%. В некоторых вариантах, концентрация Pluronic F-127 составляет от около 30% до около 40% или от около 30% до около 35%.
В некоторых вариантах концентрация желатина в добавке для экструзии или эксципиенте составляет 6% и концентрация альгината 0,5%. В других вариантах концентрация желатина в компоненте для экструзии составляет 4% и концентрация альгината 2%.
В некоторых вариантах неклеточные компоненты биочернил (например, соединения для экструзии) удаляют еще до использования. В других вариантах неклеточные компоненты представляют собой, например, гидрогели, пептидные гидрогели, гели на основе аминокислот, поверхностно-активные полиолы, термореактивные полимеры, гиалуронаты, альгинаты, коллагены или другие биосовместимые природные или синтетические полимеры. В следующих вариантах неклеточные компоненты удаляют физическими, химическими или ферментативными методами. В некоторых вариантах во время использования часть неклеточных компонентов остается связанной с клеточными компонентами.
В некоторых вариантах клетки предварительно обрабатывают для усиления взаимодействия между ними. Например, клетки инкубируют внутри трубки центрифуги после центрифугирования для усиления взаимодействия клетка-клетка до формирования биочернил.
Примеры клеточных соотношений
В некоторых вариантах биочернила включают многоклеточные тела, которые содержат также непаренхимальные печеночные клетки (например, эндотелиальные клетки, печеночные звездчатые клетки, клетки Купфера). В других вариантах соотношение эндотелиальных клеток, печеночных звездчатых клеток и клеток Купфера может быть любым. В следующих вариантах соотношение эндотелиальных клеток, печеночных звездчатых клеток и клеток Купфера составляет от около 90:10:0 до около 10:90:0. В следующих вариантах соотношение эндотелиальных клеток, печеночных звездчатых клеток и клеток Купфера составляет 45:45:10.
В некоторых вариантах биочернила включают многоклеточные тела, содержащие гепатоциты (например, первичные гепатоциты, HepG2 или HepaRG) и клетки дополнительных типов в соотношении 100:0. В следующих вариантах соотношение гепатоцитов и клеток дополнительных непаренхимальных типов (например, эндотелиальных клеток) составляет 95:5. В еще одних вариантах соотношение гепатоцитов и клеток дополнительных непаренхимальных типов (например, эндотелиальных клеток, звездчатых клеток) составляет 50:50. В некоторых вариантах соотношение паренхимальных и непаренхимальных клеток (например, эндотелиальных клеток, звездчатых клеток, клеток Купфера) составляет 50:35:10:5.
Аутосортинг клеток
В некоторых вариантах многоклеточные агрегаты, используемые для формирования конструкции или ткани, включают клетки всех типов, которые следует включить в искусственную ткань (например, гепатоциты, эндотелиальные клетки, печеночные звездчатые клетки и клетки Купфера); в таком примере клетки каждого типа мигрируют в соответствующие положения (например, во время созревания) с образованием искусственной ткани, например, искусственной печеночной ткани. В некоторых вариантах многоклеточные агрегаты, используемые для образования структуры, включают меньше клеток всех типов, которые следует включить в искусственную ткань. В других вариантах клетки каждого типа равномерно распределены в многоклеточных агрегатах или участках и слоях ткани. В других вариантах клетки каждого типа локализуются в конкретных участках внутри многоклеточного агрегата или в слоях или участках ткани.
Например, в случае искусственной печеночной ткани, содержащей гепатоциты, эндотелиальные клетки, звездчатые клетки и клетки Купфера в нужном соотношении (например, 70:15:10:5), соседние биопринтированные объединенные элементы политипических биочернил сплавляются между собой. Во время созревания эндотелиальные клетки локализуются до некоторой степени как на периферии, так и в ядре конструкции и организуются в микроваскулярные структуры. В некоторых вариантах локализация клеток в конструкции моделирует слоистую структуру in vivo или ex vivo тканей млекопитающих.
Ранее сформированный каркас
В некоторых вариантах изобретение предлагает искусственные имплантируемые ткани и органы, которые не содержат или по существу не содержат ранее сформированного каркаса. В следующих вариантах «каркас» относится к синтетическим каркасам типа полимерных каркасов и пористых гидрогелей, несинтетическим каркасам типа ранее сформированных слоев внеклеточных матриц, слоев мертвых клеток и бесклеточных тканей, и любому другому типу ранее сформированного каркаса, который интегрирован в физическую структуру искусственной ткани и/или органа и не удаляется из ткани и/или органа. В еще одних вариантах каркасы включают бесклеточные природные ткани или бесклеточный клеточный материал, генерируемый клетками, культивированными любым способом, например, слои клеток, которым дают погибнуть или лишить клеток, оставляя ВКМ белки, которые они продуцируют при своей жизни.
В некоторых вариантах в искусственных тканях/конструкциях и их матриксах не используют ранее сформированные каркасы, например, для образования ткани, любого слоя ткани или формирования формы ткани. В качестве неограничивающего примера в искусственных печеночных тканях по настоящему изобретению во время изготовления или во время применения не используют ранее сформированные синтетические каркасы типа полимерных, предварительно образованных слоев внеклеточной матрицы или ранее сформированного каркаса любого другого типа. В некоторых вариантах искусственные печеночные ткани по существу не содержат ранее сформированных каркасов. В других вариантах клеточные компоненты тканей содержат детектируемое, но следовое или тривиальное количество каркаса, например, менее 2,0%, менее 1,0% или менее 0,5% от всей композиции. В еще одних вариантах следовое или тривиальное количество каркаса недостаточно для влияния на длительное поведение ткани или ее матрикса или на первичную биологическую функцию. В дополнительных вариантах компоненты каркаса удаляют после принтинга физическими, химическими или ферментативными способами, что приводит к искусственной ткани, не содержащей или по существу не содержащей каркасных компонентов.
В некоторых вариантах искусственные печеночные ткани, не содержащие или по существу не содержащие раскрытого здесь ранее сформированного каркаса, представляют резкий контраст с искусственными тканями, полученными другими способами тканевой инженерии, где сначала изготовляют материал каркаса и затем клетки осаждают на каркас, и в результате клетки пролиферируют, например, заполняя каркас и принимая его форму. В одном аспекте описанные здесь способы биопринтинга дают возможность получать жизнеспособные и используемые ткани, которые не содержат или по существу не содержат ранее сформированного каркаса. В другом аспекте клетки по данному изобретению в некоторых вариантах удерживают нужную трехмерную форму с помощью изолирующего материала. Изолирующий материал отличается от каркаса по меньшей мере тем, что изолирующий материал является временным и/или его легко удалить из клеток и/или ткани.
Матриксы
В некоторых вариантах изобретение предлагает матриксы искусственных тканей/конструкций. В некоторых вариантах «матрикс» - это научный инструмент, включающий ассоциат из многих элементов, пространственно расположенных таким образом, чтобы на образце можно было провести множество тестов, либо провести один или несколько тестов на множестве образцов, либо и то и другое. В некоторых вариантах матриксы адаптированы или совместимы со способами поиска и устройствами, включающими такие, которые связаны с умеренным или высокоэффективным скринингом. В других вариантах матрикс позволяет провести множество тестов одновременно. В следующих вариантах матрикс позволяет протестировать одновременно множество образцов. В некоторых вариантах матриксы представляют собой клеточные микроматриксы. В еще одних вариантах клеточный микроматрикс является лабораторным инструментом, который позволяет провести мультиплексное обследование живых клеток на поверхности твердого носителя. В других вариантах матриксы являются микроматриксами ткани. В следующих вариантах тканевые микроматриксы включают много отдельных тканей или образцов ткани, объединенных в матрикс, для проведения разнообразных биохимических, метаболических, молекулярных или гистологических анализов.
В некоторых вариантах каждая из искусственных тканей/конструкций содержится в лунке биосовместимого многолуночного контейнера (см., например, фиг. 16). В некоторых вариантах каждая ткань находится в лунке. В других вариантах каждая ткань биопринтирована в лунку. В других вариантах лунки являются покрытыми. В различных вариантах лунки покрывают одним или несколькими веществами из следующих: биосовместимый гидрогель, один или несколько белков, одно или несколько химических веществ, один или несколько пептидов, одно или несколько антител и один или несколько факторов роста, включая их комбинации. В некоторых вариантах лунки покрывают гелем NovoGel™. В других вариантах лунки покрыты агарозой. В некоторых вариантах каждая ткань находится на пористой биосовместимой мембране внутри лунки биосовместимого многолуночного контейнера. В некоторых вариантах каждая лунка многолуночного контейнера содержит две или несколько тканей.
В некоторых вариантах искусственные ткани/конструкции закрепляют на одной или более сторонах биосовместимой поверхности. Для того, чтобы закрепить ткань на биосовместимой поверхности, можно использовать разные способы. В различных вариантах можно закрепить ткань на биосовместимой поверхности, например, целиком по одной или нескольким сторонам, только по ребрам одной или более сторон или только в центре. В еще некоторых вариантах ткань можно закрепить на биосовместимой поверхности с помощью держателя или носителя, интегрированного в поверхность или связанного с поверхностью. В различных следующих вариантах ткань можно закрепить на биосовместимой поверхности с помощью одного или более зажимов или пластиковых наклеек, встроенных в поверхность или связанных с поверхностью. В некоторых вариантах ткань можно зафиксировать на биосовместимой поверхности путем самоприкрепления к пористой мембране. В некоторых вариантах искусственные ткани/конструкции удерживают в конфигурации матрикса путем фиксации на биосовместимой поверхности с одной или более сторон. В следующих вариантах ткань закрепляют на 1, 2, 3, 4 или более сторонах биосовместимой поверхности. В некоторых вариантах биосовместимая поверхность - это любая поверхность, которая не создает значительного риска повреждения или токсичности для ткани или организма, контактирующего с тканью. В следующих вариантах биосовместимая поверхность - это любая поверхность, которая подходит для традиционных способов культивирования ткани. Подходящие биосовместимые поверхности включают в качестве неограничивающих примеров обработанные пластики, мембраны, пористые мембраны, мембраны с покрытием, пластики с покрытием, металлы, металлы с покрытием, стекло, обработанное стекло и стекло с покрытием, причем подходящие покрытия включают гидрогели, компоненты ВКМ, химические вещества, белки и т.д., и покрытия или обработки стимулируют адгезию клеток и ткани на биосовместимой поверхности или препятствуют ей.
В некоторых вариантах закрепление искусственной ткани на биосовместимой поверхности с одной или более сторон облегчает воздействие на ткань сдвигового усилия, вызываемого потоком жидкости. В следующих вариантах искусственные ткани/конструкции подвергают действию сдвигового усилия, вызываемого потоком жидкости. В различных вариантах искусственные печеночные ткани подвергают действию сдвигового усилия на 1, 2, 3, 4 или более сторонах. В следующих вариантах на искусственных тканях/конструкциях происходит рециркуляция, перфузия или перемешивание жидких нутриентов, которые контактируют с тканью на одной или более поверхностях контакта.
В некоторых вариантах матриксы искусственных тканей, включая печеночные ткани/конструкции, содержат ассоциаты из двух или более элементов. В различных вариантах матриксы содержат ассоциаты из 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 125, 150, 175, 200, 225, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475 или 500 элементов, включая промежуточные значения. В следующих вариантах каждый элемент включает один или несколько многоклеточных агрегатов, тканей, органов или их комбинаций.
В некоторых вариантах матриксы искусственных тканей, включая печеночные ткани/конструкции, содержат много элементов, расположенных в пространстве предварительно определенным образом. В следующих вариантах матрикс означает любое подходящее пространственное расположение элементов. В различных вариантах способы расположения включают в качестве неограничивающих примеров двухмерную сетку, трехмерную сетку, одну или несколько линий, арок или кругов, ряды или колонки и т.п.В следующих вариантах способ выбирают по принципу совместимости со способами или устройствами рутинного или высокоэффективного биологического анализа или скрининга.
В различных вариантах типы клеток и/или источник клеток, используемые для получения одной или более тканей в матриксе, выбирают в соответствии с конкретной целью разработки или с объектом исследования. В следующих разных вариантах конкретные ткани в матриксе выбирают в соответствии с конкретной задачей разработки или объектом исследования. В некоторых вариантах один или несколько конкретных видов искусственных тканей печени включают в матрикс, с тем чтобы способствовать исследованию конкретного заболевания или состояния. В некоторых вариантах один или несколько конкретных видов искусственных тканей печени включают в матрикс для того, чтобы способствовать изучению конкретного заболевания или состояния конкретного пациента. В следующих вариантах один или несколько конкретных видов искусственных тканей печени в матриксе генерируют вместе с одним или несколькими типами клеток, полученных от двух или более разных человеческих доноров. В некоторых вариантах ткани в матриксе по существу одинаковы по типу клеток, источнику клеток, слоям клеток, соотношениям клеток, способам конструирования, размеру, форме и т.д. В других вариантах один или несколько видов тканей в матриксе уникальны по типу клеток, источникам клеток, слоям клеток, соотношениям клеток, способам конструирования, размеру, форме и т.д. В различных вариантах являются уникальными 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 125, 150, 175, 200, 225, 250, 275, 300 или более тканей в матриксе, включая промежуточные значения. В других разных вариантах уникальны 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100% тканей в матриксе, включая промежуточные значения.
В некоторых вариантах каждую ткань матрикса сохраняют независимо в культуре клеток. В следующих вариантах условия культивирования каждой ткани в матриксе таковы, что они изолированы от других тканей и не могут изменять среду или факторы растворения в среде. В других вариантах две или несколько отдельных тканей в матриксе заменяют факторы растворения. В следующих вариантах условия культивирования двух или более отдельных тканей в матриксе таковы, что они обменивают среду и факторы растворения в среде с другими тканями. В различных вариантах обменивают среду и/или факторы растворения 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 125, 150, 175, 200, 225, 250, 275, 300 или более тканей в матриксе, включая промежуточные значения. В других разных вариантах обменивают среду и/или факторы растворения 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100% тканей в матриксе, включая промежуточные значения.
Анализы in vitro
В некоторых вариантах раскрытые здесь искусственные печеночные ткани и их матриксы анализируют in vitro. В некоторых вариантах «анализ» - это процедура тестирования или определения присутствия вещества или его активности (например, химического вещества, молекулы, биохимического лекарства и т.п.) в органическом или биологическом образце (например, в агрегате клеток, ткани, органе, организме и т.п.). В следующих вариантах анализы включают качественные анализы и количественные анализы. В еще следующих вариантах количественным анализом определяют количество вещества в образце.
В различных вариантах искусственные печеночные ткани и матриксы используют, в качестве неограничивающих примеров, в следующих анализах: анализ изображения, определение секретируемых белков, экспрессия маркеров и получение белков. В различных следующих вариантах искусственные печеночные ткани и матриксы используют в анализах для определения или измерения одного или более параметров: молекулярное связывание (включая связывание радиоактивных лигандов), поглощение молекул, активность (например, ферментативня активность и активность рецептора и т.п.), экспрессия генов, экспрессия белка, агонизм рецептора, клеточные сигналы, апоптоз, чувствительность к химическим препаратам, трансфекция, миграция клеток, хемотаксис, жизнеспособность клеток, пролиферация клеток, безопасность, эффективность, метаболизм, токсичность, инфективность и возможность злоупотреблений.
В некоторых вариантах искусственные печеночные ткани и матриксы используют в иммуноанализах. В следующих вариантах иммуноанализы являются конкурентными или неконкурентными. Например, в конкурентном иммуноанализе антиген в образце конкурирует с меченым антигеном в связывании антител, и тогда измеряют количество меченого антигена, связанного с центром антител. В неконкурентном иммуноанализе (также известном как «сэндвич-анализ»), например, антиген в образце связывают с центром антител; затем меченые антитела связывают с антигеном и определяют количество меченых антител на центре.
В некоторых вариантах искусственные печеночные ткани и матриксы используют в анализах связанного с ферментом иммуносорбента (ELISA). В следующих вариантах анализ ELISA является биохимической методикой, используемой для детектирования присутствия антител или антигенов в образце. Например, в анализе ELISA используют по меньшей мере одно антитело со специфичностью к конкретному антигену. В следующем примере образец с неизвестным количеством антигенов иммобилизуют на твердом носителе (например, полистирольном микропланшете для микротитрации) либо неспецифически (путем адсорбции на поверхности), либо специфически (путем захвата другими антителами, специфическими к тому же антигену, в «сэндвич-анализе» ELISA). В еще одном примере после иммобилизации антигена добавляют детектируемое антитело с образованием комплекса с антигеном. Например, детектируемое антитело ковалентно связывают с ферментом или детектируют само антитело с помощью вторичных антител, которые связывают с ферментом путем биосоединения.
Например, в некоторых вариантах для скрининга лекарства или обнаружения лекарства используют матрикс, микроматрикс или клеточный чип, многоклеточные агрегаты или ткани. В следующих вариантах используют матрикс, микроматрикс или тканевый чип в качестве набора для скрининга лекарств или обнаружения лекарства. В некоторых вариантах каждая печеночная ткань/конструкция находится в лунке биосовместимого многолуночного контейнера, причем контейнер совместим с одним или несколькими автоматизированными методиками и/или устройствами скрининга лекарств. В следующих вариантах автоматизированные методики скрининга лекарств и/или устройства включают любые подходящие процедуры либо компьютеризированные или роботизированные устройства.
В следующих вариантах матриксы для скрининга лекарств или их обнаружения используют для исследования и разработки лекарств, потенциально применимых в любой области терапии. В еще следующих вариантах такие области терапии включают в качестве неограничивающих примеров: инфекционные заболевания, гематологию, онкологию, педиатрию, кардиологию, заболевания центральной нервной системы, неврологию, гастроэнтерологию, гепатологию, урологию, бесплодие, офтальмологию, нефрологию, ортопедию, обезболивание, психиатрию, пульмонологию, вакцины, лечение ран, физиологию, фармакологию, дерматологию, генотерапию, токсикологию и иммунологию.
В некоторых вариантах искусственную ткань печени и матриксы используют в клеточном скрининге. В следующих вариантах проводят клеточный скрининг для одного или более инфекционных заболеваний, таких как вирусная инфекция или паразитарная инфекция (например, плазмодиевая инфекция и т.п.). В следующих вариантах клеточный скрининг проводят в случае фиброза печени (например, цирроза). В некоторых вариантах клеточный скрининг проводят в случае рака печени. В других вариантах клеточный скрининг осуществляют по поводу жировой дистрофии печени (например, жирной печени) В следующих вариантах клеточный скрининг проводят в случае одного или более метаболических дефицитов. В других вариантах клеточный скрининг проводят в случае одного или более белковых дефицитов. В некоторых вариантах искусственные печеночные ткани и матриксы используют при изучении инициирования рака, его прогрессирования или метастазирования. В еще одних вариантах искусственные печеночные ткани и матриксы используют при изучении взаимодействия других типов клеток, таких как раковые клетки, патогенные клетки, иммунные клетки, клетки крови или стволовые клетки/клетки-предшественники, с тканью печени и клетками, содержащими ткань печени.
В некоторых вариантах конструкции или матриксы используют в анализе активности биологических объектов, в том числе антител, клеток млекопитающих, бактерий, биологически активных белков, гормонов и т.п. В некоторых вариантах конструкции или их матриксы используют для детектирования, количественной оценки и исследования иммунологической пробы с помощью клеток Купфера и звездчатых клеток, включая влияние грамотрицательных или грамположительных сигналов от клеток Купфера и звездчатых клеток на гепатоциты в оболочке клетки (например, ответ на липополисахариды (LPS)). В некоторых вариантах конструкции или их матриксы используют для получения гепатотрофических вирусов, включая HBV и HCV. В следующих вариантах конструкции или их матриксы используют как наполнитель для получения Plasmodium spp. (паразит) в экзоэритроцитарной форме. В еще других вариантах полученный из конструкции печени Plasmodium используют в сравнительных анализах in vitro для определения эффективной терапии экзоэритроцитарных форм паразита. В других вариантах конструкцию или ее матриксы используют в терапии против хозяина вируса Hepatitis С Virus (HCV) или Plasmodium, включая исследования антител против хозяина. В других вариантах конструкции печени или их матриксы используют в изучении инициирования рака, прогрессирования болезни или метастазирования. В некоторых вариантах конструкции печени или их матриксы используют при изучении взаимодействий клетка-клетка и клетка-ткань между клетками печени млекопитающих/тканью, содержащей конструкцию и один или несколько дополнительные типов клеток, включая, но не ограничиваясь этим: патоген-несущие клетки, живые патогенные клетки, клетки рака, иммунные клетки, клетки крови, стволовые клетки/клетки-предшественники или генетически обработанные клетки.
В некоторых вариантах матрикс содержит конструкции искусственной ткани печени и дополнительные конструкции ткани. В других вариантах конструкции печеночной ткани напрямую контактируют с дополнительной конструкцией ткани на одной или более поверхностях. В еще одних вариантах печеночную ткань связывают с одной или несколькими дополнительными конструкциями ткани или клетками с помощью прохода жидкости или всего резервуара жидкости. В еще одних вариантах жидкая среда, которая контактирует с конструкцией искусственной ткани печени, содержит живые клетки млекопитающих, такие как иммунные клетки, клетки крови или клетки опухоли. В других вариантах жидкая среда, которая контактирует с конструкцией искусственной ткани печени, содержит бактерии, вирусы, паразиты или другие патогены. В некоторых вариантах искусственную ткань печени и ее матриксы используют как наполнитель для продуцирования гепатотрофических вирусов в трехмерных структурных исследованиях методами рентгеновской дифракции или крио-ЕМ.
Экстракорпоральный носитель
В некоторых вариантах искусственная ткань печени содержит множество слоев, причем каждый слой включает цилиндрические биочернила, аксиально вытянутые по существу параллельно друг другу, причем биочернила содержат паренхимальные клетки печени и необязательно непаренхимальные клетки между цилиндрическими биочернилами и необязательно пустоты или каналы перфузии. В других вариантах искусственные печеночные ткани применяют в качестве экстракорпорального носителя для данного пациента. В следующих вариантах кровь пропускают над конструкцией или через нее для фильтрации крови и поддержания функции печени пациента.
На фиг. 17 в конкретном варианте показана биопринтированная структура печени в качестве экстракорпорального носителя. В этом варианте биопринтированная структура печени имеет в составе множество паренхимальных клеточных цилидров. Структура также включает непаренхимальные клетки и тела наполнителя для создания компартментов и/или каналов, через которые возможна перфузия или поток.
На фиг. 19 в конкретном варианте биопринтированную структуру печени применяют в качестве экстракорпорального устройства, содержащего повторяющиеся трубчатые структуры с пустотами (показаны темными кружками как временно занятые места) и регулярными интервалами, которые делают возможной перфузию через искусственную ткань печени.
Способы
В некоторых вариантах данное изобретение предлагает способы конструирования живой трехмерной конструкции печеночной ткани, включающие стадии биопринтинга биочернил, содержащих по меньшей мере один слой печеночных клеток в форме или на ней, и сплавления биочернил в живую трехмерную конструкцию печеночной ткани. В следующих вариантах конструкцию ткани используют in vitro.
В некоторых вариантах изобретение предлагает способы конструирования тканей, в том числе искусственной печеночной ткани, включающие: приготовление объединенного многоклеточного агрегата, содержащего либо паренхимальные, либо паренхимальные и непаренхимальные клетки; нанесение указанного объединенного многоклеточного агрегата на носитель и инкубирование указанного многоклеточного агрегата, с тем чтобы дать ему возможность сформировать искусственную печеночную ткань; причем указанное инкубирование длится от около 1 часа до около 30 суток. В некоторых вариантах этих способов используют биопринтинг. В следующих вариантах эти способы позволяют получить искусственные печеночные ткани, не содержащие или по существу не содержащие во времяиспользования никакого ранее сформированного каркаса.
В некоторых вариантах данное изобретение предлагает способы конструирования живых трехмерных тканей печени, включающие следующие стадии: изготовление одного или более объединенных многоклеточных агрегатов, содержащих клетки печени млекопитающих; размещение указанного одного или более многоклеточных агрегатов на носителе; нанесение слоя клеток млекопитающих первого типа на один или несколько внешних слоев, слоя клеток млекопитающих второго типа на одну или несколько внешних поверхностей; и инкубирование указанного одного или более многоклеточных агрегатов, с тем чтобы дать ему время сформировать искусственную печеночную ткань; причем указанное инкубирование длится в течение времени от около 1 часа до около 30 суток. В некоторых вариантах в способах используют биопринтинг. В следующих вариантах способы позволяют получить искусственные печеночные ткани, не содержащие или по существу не содержащие во время использования никакого ранее сформированного каркаса.
В некоторых вариантах данное изобретение предлагает способы конструирования живой трехмерной конструкции печеночной ткани, включающий следующие стадии: изготовление одного или более объединенных многоклеточных агрегатов, содержащих клетки млекопитающих; размещение указанного одного или более многоклеточных агрегатов на носителе с образованием по меньшей мере одного из: по меньшей мере одного слоя, содержащего множество типов клеток, причем эти клетки расположены в пространстве относительно друг друга с образованием плоской структуры; и/или многих слоев, причем по меньшей мере один слой композиционно или архитектурно отличается по меньшей мере от одного другого слоя с образованием слоистой структуры; и инкубирование указанного одного или более многоклеточных агрегатов, с тем чтобы получить живую трехмерную конструкцию печеночной ткани.
Изготовление слипшихся многоклеточных агрегатов
В некоторых вариантах предлагаемые способы включают изготовление объединенных многоклеточных агрегатов, содержащих один или более типов клеток млекопитающих, причем по меньшей мере один клеточный компонент представляет собой клетки печени. В некоторых вариантах способы включают изготовление объединенных многоклеточных агрегатов, содержащих паренхимальные клетки печени. В некоторых вариантах способы включают изготовление объединенных многоклеточных агрегатов, содержащих также непаренхимальные клетки. В некоторых вариантах способы включают изготовление объединенных многоклеточных агрегатов, содержащих также один или несколько типов клеток, выбранных из следующей группы: эндотелиальные клетки, звездчатые клетки, фибробласты, клетки Купфера, иммунные клетки, лимфоциты, раковые клетки, несущие вирус клетки, патогенные клетки, адипоциты, адипогенные клетки, клетки гладкой мускулатуры или стволовые клетки/клетки-предшественники.
Существуют различные способы изготовления многоклеточных агрегатов, параметры которых описаны здесь. В некоторых вариантах многоклеточный агрегат получают из пасты клеток, содержащей множество живых клеток, с требуемой плотностью клеток и вязкостью. В других вариантах клеточной пасте придают нужную форму и в результате созревания (например, инкубации) получают многоклеточное тело. В некоторых вариантах форму многоклеточного тела определяет форма шаблона или каркаса. В других вариантах шаблон или каркас изготавливают с помощью автоматического инструмента в заданной геометрии. В следующих вариантах шаблон или каркас состоят из биочернил и содержат клетки печени. В еще одних вариантах шаблон или каркас включают непаренхимальные клетки печени, а паста, используемая для наполнения каркаса и создания многоклеточного агрегата, содержит паренхимальные клетки. В некоторых вариантах многоклеточные агрегаты являются по существу цилиндрическими. В других вариантах многоклеточные агрегаты являются гексагональными, квадратными, кубическими, прямоугольными, полиэдрическими. В еще одних вариантах многоклеточные агрегаты формируют путем приготовления шаблона или каркаса в мозаичной картине повторяющейся геометрии и заполнения последовательно или одновременно шаблонов или каркасов клеточной пастой. В следующих вариантах клеточную пасту инкубируют в регулируемой окружающей среде, в результате чего клетки прилипают одна к другой с образованием вытянутого многоклеточного тела. В другом конкретном варианте многоклеточное тело получают формованием клеточной пасты, содержащей множество живых клеток, в устройстве, которое удерживает клеточную пасту в трехмерной форме. В следующих вариантах клеточную пасту инкубируют в регулируемой окружающей среде, в то время как ее удерживают в трехмерной форме в течение достаточного времени для получения тела, обладающего достаточной адгезией к носителю, с тем чтобы оставаться на плоской поверхности.
В различных вариантах клеточную пасту готовят следующим способом: 1) объединение клеток или клеточных агрегатов (одного или более типов) с биосовместимым гелем или жидкостью, такой как среда для культивирования клеток (например, в предварительно определенном соотношении) с образованием клеточной суспензии и 2) компактирование клеточной суспензии до клеточной пасты с желательной плотностью клеток и вязкостью. В разных вариантах компактирование проводят разыми способами, такими как концентрирование конкретной клеточной суспензии, полученной из клеточной культуры, до достижения желательной концентрации клеток (плотности), вязкости и совместимости, которая необходима для клеточной пасты. В конкретном варианте сравнительно разбавленную клеточную суспензию из клеточной культуры центрифугируют в течение определенного времени до достижения такой концентрации клеток в таблетке, которая позволяет формовать пасту в шаблоне. Фильтрование тангенциальным потоком («TFF») является другим способом концентрирования или компактирования клеток. В некоторых вариантах для придания необходимых экструзионных свойств в клеточную суспензию вводят добавки. Подходящие добавки включают в качестве неограничивающих примеров: поверхностно-активные полиолы, коллагены, гидрогели, пептидные гидрогели, гели на основе аминокислот, Matrigel™, нановолокна, самоорганизующиеся нановолокна, желатин, фибриноген и т.п.
В некоторых вариантах клеточную пасту получают смешением множества живых клеток с культуральной тканевой средой и компактированием живых клеток (например, центрифугированием). Необязательно включают один или несколько компонентов ВКМ (или производные компонентов ВКМ) путем повторного суспендирования клеточной таблетки в одном или более физиологически приемлемых буферах, содержащих компоненты ВКМ (или их производные)), и полученную клеточную суспензию центрифугируют повторно с образованием клеточной пасты.
В некоторых вариантах плотность клеток в клеточной пасте, необходимую для дальнейшей обработки, варьируют в зависимости от типа клеток. В следующих вариантах взаимодействия между клетками определяют свойства клеточной пасты, и для различных типов клеток будут наблюдаться разные соотношения между плотностью клеток и взаимодействием клетка-клетка. В еще одних вариантах предварительно обрабатывают клетки до формования клеточной пасты для усиления клеточных взаимодействий. Например, в некоторых случаях для усиления взаимодействий клетка-клетка до формования клеточной пасты клетки инкубируют в центрифужной пробирке после их центрифугирования. В некоторых вариантах клеточную пасту формуют одновременно с биопринтингом, причем слипание отдельных клеток с образованием биочернил происходит во время и после биопринтинга.
В разных вариантах для формования клеточной пасты используют много разных способов. Например, в конкретном варианте клеточную пасту формуют вручную или прессуют (например, после концентрирования/компактирования) для достижения нужной формы. В следующем примере клеточную пасту отбирают (например, отсасывают) с помощью инструмента, такого как микропипетка или шприц (например, капиллярная пипетка или стеклянный/пластиковый шприц), так что клеточная паста принимает форму внутренней поверхности инструмента. Форма поперечного сечения микропипетки (например, капиллярной пипетки) бывает круглой, квадратной, прямоугольной, треугольной или другой некруглой формы. В некоторых вариантах клеточную пасту формуют путем нанесения на предварительно выбранный шаблон, такой как пластиковый шаблон, металлический шаблон или гелевый шаблон. В некоторых вариантах для клеточную пасту формуют центробежным литьем или непрерывным литьем. В некоторых вариантах формование биочернил проводят одновременно или после биопринтинга. В следующих вариантах формование биочернил проводят методом биопринтинга совместным формованием с шаблоном; причем шаблон необязательно наносят путем биопринтинга, и шаблон включает один или несколько компонентов: биочернила, биочернила, содержащие также композицию для экструзии, гель, гидрогель, синтетический полимер, углеводы, белки или клетки млекопитающих или их комбинации. В еще одних вариантах один или несколько компонентов совместного формования с шаблоном удаляют после биопринтинга; причем способ удаления выбирают из следующих: физические способы, растворение в водной среде; химическая обработка; ферментативная обработка, модулирование температуры. В следующих вариантах совместного формования шаблон остается связанным с полученной тканью. В некоторых вариантах только клеточные компоненты совместного формования с шаблоном остаются связанными с полученной тканью после изготовления.
В некоторых вариантах многоклеточные агрегаты заданной формы также пригодны для изготовления описанных здесь искусственных печеночных тканей. Сферические многоклеточные агрегаты необязательно изготавливают многими способами, включая, но не ограничиваясь этим, клеточную самоорганизацию, использование форм и способы с висячей каплей. В следующих вариантах способ изготовления по существу сферических многоклеточных агрегатов включает следующие стадии: 1) предоставление клеточной пасты, содержащей множество предварительно отобранных клеток или клеточных агрегатов, с нужной плотностью клеток и вязкостью, 2) обработка клеточной пасты для придания ей цилиндрической формы, 3) разрезание цилиндров на равные фрагменты, 4) необязательно выдерживание фрагментов на ротационном шейкере в течение ночи для придания им округлой формы, и 5) необязательно созревание по существу сферического многоклеточных агрегатов в течение времени от 1 часа до 7 суток. В следующих вариантах многоклеточные агрегаты получают методом акустического фокусирования.
В некоторых вариантах частично слипшуюся и/или объединенную клеточную пасту используют для биопринтинга; причем когезия и формирование биочернил происходят в основном после принтинга. В других вариантах клеточную пасту формуют на первой стадии до биопринтинга. В следующих вариантах клеточную пасту переносят из первого формующего устройства (например, капиллярной пипетки) во второе формующее устройство (например, форму), что позволяет доставить клеткам нутриенты и/или кислород в то время, когда они сохраняются во втором формующем устройстве в течение дополнительного периода созревания. Одним из примеров подходящего формующего устройства, в котором клеткам доставляются нутриенты и кислород, является форма для получения множества многоклеточных агрегатов (например, по существу многоклеточных агрегатов). В следующем примере такая форма включает биосовместимый субстрат из материала, устойчивого к миграции и врастанию клеток в субстрат и устойчивого к адгезии клеток на субстрате. В различных вариантах субстрат изготавливают из тефтона (Teflon® PTFE), нержавеющей стали, геля NovoGel™, агарозы, полиэтиленгликоля, стекла, металла, пластика или гелей (например, из агарозы или других гидрогелей) и аналогичных материалов. В некоторых вариантах форму также выбирают таким образом, чтобы к клеточной пасте доставлялась тканевая культуральная среда (например, распределением культуральной среды для тканей по верху формы).
Таким образом, в вариантах с использованием второго формующего устройства частично объединенную и/или слипшуюся клеточную пасту переносят из первого формующего устройства (например, капиллярной пипетки) во второе формующее устройство (например, форму). В следующих вариантах частично объединенную и/или слипшуюся клеточную пасту переносят с помощью первого формующего устройства (например, капиллярной пипетки) в бороздки формы. В еще следующих вариантах после периода созревания, когда форму инкубируют вместе с клеточной пастой, сохраняющейся там в регулируемой окружающей среде, что позволяет клеткам в клеточной пасте слипаться и/или объединяться с другими клетками с образованием многоклеточных агрегатов, когезия клеток будет достаточно прочной, что позволяет извлечь полученный многоклеточный агрегат с помощью какого-либо инструмента (например, капиллярной пипетки). В еще следующих вариантах капиллярная пипетка предназначена для того, что быть частью печатающей головки биопринтера или аналогичного аппарата, который способен автоматически ввести многоклеточный агрегат в трехмерную конструкцию.
В некоторых вариантах форма и размер поперечного сечения многоклеточных агрегатов по существу соответствуют форме и размеру поперечного сечения первого формующего устройства и необязательно второго формующего устройства, используемого для получения многоклеточных агрегатов, и специалист в данной области сможет подобрать подходящие формующие устройства с нужными формами поперечных сечений, их площадью, диаметром и длиной для изготовления многоклеточных агрегатов с описанными выше формами и площадями поперечных сечений, диаметрами и длинами.
Размещение слипшихся многоклеточных агрегатов на носителе
Известны различные способы размещения многоклеточных агрегатов на носитель с образованием нужной трехмерной структуры. Например, в некоторых вариантах многоклеточные агрегаты вручную наносят так, чтобы они были в контакте друг с другом, наносят в точке экструзии из пипетки, сопла или иглы или позиционируют с помощью автоматического компьютеризированного устройства типа биопринтера.
В различных вариантах, как здесь описано, многоклеточные агрегаты имеют разнообразные формы и размеры. В некоторых вариантах многоклеточные агрегаты вытянуты таким образом, что получают несколько форм поперечного сечения, включая, но не ограничиваясь этим: круглое, овальное, квадратное, треугольное, многоугольное и нерегулярное поперечное сечение. В следующих вариантах многоклеточные агрегаты вытянуты и имеют форму цилиндра. В некоторых вариантах вытянутые многоклеточные агрегаты имеют близкие длину и/или диаметр. В других вариантах вытянутые многоклеточные агрегаты имеют отличающиеся длину и/или диаметр. В некоторых вариантах многоклеточные агрегаты являются по существу сферическими. В некоторых вариантах искусственные печеночные ткани включают по существу сферические многоклеточные агрегаты с близкими размерами. В других вариантах искусственные печеночные ткани включают по существу сферические многоклеточные агрегаты с различающимися размерами. В некоторых вариантах искусственные печеночные ткани разной формы и размера образуются путем объединения многоклеточных агрегатов разных форм и размеров.
В некоторых вариантах объединенные многоклеточные агрегаты наносят на носитель. В различных вариантах носитель представляет собой любую подходящую биосовместимую поверхность. В еще одних вариантах подходящая биосовместимая поверхность включает в качестве неограничивающих примеров полимерные материалы, пористые мембраны, пластик, стекло, металл, гидрогель и их комбинации. В некоторых вариантах носитель покрывают биосовместимым веществом, включая, в качестве неограничивающего примера, гидрогель, белок, химическое вещество, пептид, антитела, факторы роста или их комбинации. В одном варианте носитель покрывают гелем NovoGel™. В другом варианте носитель покрывают агарозой. В еще одном варианте объединенные многоклеточные агрегаты вносят в лунки биосовместимого многолуночного контейнера.
В некоторых вариантах по окончании размещения многоклеточных агрегатов наливают культуральную тканевую среду поверх конструкции. В следующих вариантах культуральную тканевую среду вводят в пространство между многоклеточными телами, поддерживая клетки в многоклеточных телах.
Нанесение слоя клеток первого типа и/или слоя клеток второго типа
Для нанесения одного или более слоев клеток на одну или несколько внешних поверхностей конструкции из объединенных клеток млекопитающих пригодны различные способы. Например, в некоторых вариантах нанесение слоя клеток включает покрытие одной или более поверхностей указанных многоклеточных агрегатов суспензией, пластом, монослоем или сплавленными агрегатами клеток. В нескольких вариантах покрывают 1, 2, 3, 4 или более поверхностей конструкций из объединенных клеток млекопитающих.
В некоторых вариантах нанесение слоя клеток включает биопринтинг дополнительного слоя сплавленных многоклеточных агрегатов. В других вариантах нанесение слоя клеток включает биопринтинг, распыление или струйное впрыскивание раствора, суспензии или жидкого концентрата клеток. В следующих вариантах подходящая суспензия клеток содержит от около 1×104 до около 1×106 клеток/мкл. В следующих вариантах подходящая суспензия клеток содержит от около 1×105 до около 1,5×105 клеток/мкл. В других вариантах нанесение слоя клеток включает распределение суспензии клеток непосредственно на одной или более поверхностях конструкции из объединенных клеток млекопитающих в виде рассеянных в пространстве капель. В еще одних вариантах нанесение слоя клеток включает распределение суспензии клеток непосредственно на одной или более поверхностях конструкции из объединенных клеток млекопитающих в виде спрея. В некоторых вариантах слои клеток наносят в течение любого подходящего периода времени во время конструирования. В некоторых вариантах один или несколько слоев клеток наносят на одну или несколько поверхностей конструкции из объединенных клеток млекопитающих сразу после биопринтинга (например, в течение 10 мин). В других вариантах один или несколько слоев наносят после биопринтинга (например, через 10 мин.). В еще одних вариантах один или несколько слоев наносят во время созревания конструкции.
В некоторых вариантах способы также включают стадию культивирования слоя клеток на носителе. В таких вариантах нанесение слоя клеток в некоторых случаях включает прямой контакт одной или более поверхностей конструкции искусственной ткани печени с клеточной культурой. В следующих вариантах конструкцию биопринтируют непосредственно на культивированный слой или монослой клеток. Пригоден любой тип слоя культивированных клеток на биосовместимом носителе. В некоторых вариантах многоклеточные агрегаты наносят биопринтингом на слой эндотелиальных клеток. В других вариантах многоклеточные агрегаты наносят биопринтингом на слой непаренхимальных клеток. В еще одних вариантах слой клеток слипается и/или объединяется с многоклеточными агрегатами биопринтированной конструкции. В некоторых вариантах наносят биопринтингом каждый слой многослойной конструкции. В следующих вариантах отдельные клетки включают различные формы биочернил, включая, но не ограничиваясь этим, следующие: объединенные агрегаты клеток, клеточную пасту, клеточную пасту в комбинации с компонентами для экструзии или другими добавками, монослои клеток и пластины клеток.
Совместно печатаемые формы для изготовления разделенных на компартменты тканей
В некоторых вариантах предлагаемые способы включают изготовление одного или более типов биочернил, содержащих непаренхимальные клетки; изготовление одного или более типов биочернил, содержащих паренхимальные клетки, такие как гепатоциты или гепацитоподобные клетки; нанесение биочернил на носитель и инкубирование нанесенных биочернил в течение периода времени от около 1 часа до около 30 суток с образованием живой трехмерной конструкции печеночной ткани, содержащей по меньшей мере один компартмент, который содержит внутреннюю область, содержащую паренхимальные клетки, ограниченные границей, содержащей непаренхимальные клетки.
В некоторых вариантах способы включают изготовление одного или более объединенных многоклеточных агрегатов, содержащих клетки печени млекопитающих; размещение одного или более объединенных многоклеточных агрегатов на носителе с образованием по меньшей мере одного слоя из клеток многих типов, причем клетки разных типов расположены в пространстве относительно друг друга с образованием плоской структуры; и множества слоев, из которых по меньшей мере один слой композиционно или архитектурно отличается по меньшей мере от одного другого слоя с образованием слоистой структуры; и инкубирование указанного одного или более многоклеточных агрегатов в течение от около 1 часа до около 30 суток для их слипания и формирования живой трехмерной конструкции печеночной ткани.
Со ссылкой на фиг. 2, конкретный вариант получен путем биопринтинга созревших конструкций печени, содержащих клетки HepaRG. Сначала контейнер с размерами 4 мм × 4 мм × 1 мм был напечатан с биочернилами, содержащими эндотелиальные клетки и печеночные звездчатые клетки. Затем клетки HepRG нанесли в среднюю часть контейнера. За этим последовало созревание в течение 96 час при 37°С. Наконец, через 20 час после принтинга наблюдали плавление биопринтированной конструкции. В этом варианте биопринтированные конструкции печени были активны в метаболизме, т.к. продуцировали альбумин и холестерин в течение 96 часов.
Показанный на фиг. 3 конкретный вариант конструкции печени получен методом биопринтинга с границами из непаренхимальных клеток и наполнителем из паренхимальных клеток.
Показанный на фиг. 4 конкретный вариант конструкции печени получен методом биопринтинга с границей, содержащей эндотелиальные и звездчатые печеночные клетки, наполнителем, содержащим первичные гепатоциты, и третьим композиционным компонентом, введенным в виде пространственно распределенных сфероидов из эндотелиальных и звездчатых печеночных клеток печени внутри наполнителя.
Показанный на фиг. 5 конкретный вариант конструкции печени получен методом биопринтинга совместным формованием материала, который не содержит клеток и растворим в водной среде (например, в растворе PF-127), оставляя только наполнители и образуя пустоты.
Показанный на фиг. 6 конкретный вариант конструкции печени получен методом биопринтинга с помощью методики непрерывного нанесения с использованием биочернил, имеющих в составе клетки печени различных типов, инкапсулированных в водорастворимый компонент для экструзии (например, PF-127) с образованием мозаичной картины функциональных элементов.
Показанный на фиг. 8 конкретный вариант разделенной на компартменты конструкции печени получен методом биопринтинга с совместно напечатанной формой, не содержащей клеток, используемых для формования многоклеточных агрегатов в шестигранники. В этом варианте во время использования неклеточный материал исчезает с образованием бескаркасной ткани.
Показанный на фиг. 10 конкретный вариант многокомпартментной конструкции печени получен методом биопринтинга с совместным формованием границы, наполненной клетками HepG2.
В показанном на фиг. 11 конкретном варианте совместной печатаемая форма, содержащая клетки, получается методом биопринтинга в качестве границы, в которой в качестве наполнителя использованы паренхимальные клетки, в данном случае клетки HepG2.
Показанный на фиг. 12 конкретный вариант разделенной на компартметы конструкции печени получен методом биопринтинга с использованием непаренхимальной границы и паренхимального наполнителя для обеспечения высокой, тканеподобной плотности.
Инкубирование многоклеточных агрегатов
В некоторых вариантах многоклеточные агрегаты инкубируют. В других вариантах при инкубировании многоклеточные агрегаты слипаются и/или объединяются с образованием ткани, например печеночной ткани. В некоторых вариантах многоклеточные агрегаты объединяются с образованием ткани в культуре клеток (например, в чашке Петри, в колбе с культурой клеток, биореакторе и т.п.). В следующих вариантах многоклеточные агрегаты объединяются с образованием ткани в условиях, облегчающих выращивание клеток, входящих в многоклеточные агрегаты. В одном варианте многоклеточные агрегаты инкубируют около при 37°С во влажной атмосфере, содержащей около 5% CO2, в среде клеточной культуры, содержащей факторы и/или ионы, промотирующие слипание и/или когезию (объединение). В других вариантах многоклеточные агрегаты сохраняют в атмосфере с содержанием от 0,1% до 21% О2.
Длительность инкубации в разных вариантах может быть любой. В некоторых вариантах инкубация длится около 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180 или более минут, включая промежуточные значения. В следующих вариантах инкубация длится около 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 36, 48 или более часов, включая промежуточные значения. В еще одних вариантах инкубация длится около 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более суток, включая промежуточные значения. На время, необходимое для слипания многоклеточных агрегатов с образованием ткани, влияют несколько факторов, такие как типы клеток, соотношения клеток разных типов, условия культивирования и присутствие добавок, таких как факторы роста, и не только.
Дополнительные стадии для повышения жизнеспособности искусственной ткани
В некоторых вариантах предлагаемый способ также включает стадии для повышения жизнеспособности искусственной ткани. В других вариантах эти стадии включают прямой контакт ткани с питательной средой через временный или полупостоянный каркас из связующего материала. В некоторых вариантах ткань ограничивает использование пористого или дырчатого материала. Прямой доступ по меньшей мере некоторых клеток искусственной ткани к нутриентам увеличивает жизнеспособность искусственной ткани.
В следующих вариантах дополнительные и необязательные стадии для повышения жизнеспособности искусственной ткани включают: 1) необязательно создание базового слоя ограничивающего материала до введения объединенных многоклеточных агрегатов; 2) необязательно формирование периметра ограничивающего материала; 3) биопринтинг клеток ткани с заданной структурой; и 4) распределение вытянутых тел (например, цилиндров, лент и т.п.) связующего материала, наслаивающихся на растущую ткань таким образом, что в связующем материале образуются зазоры типа решетки, сита или сетки.
В раскрытых здесь способах можно использовать различные связующие материалы. В некоторых вариантах примером связующих материалов являются гидрогели, обладающие одним или несколькими преимуществами: не прилипают, биосовместимы, способны к экструзии, биопринтингу, являются неклеточным материалом, достаточно прочны и не растворяются в водной среде. В некоторых вариантах подходящие гидрогели представляют собой природные полимеры. В одном варианте связующий материал имеет в составе гель NovoGel™. В других вариантах подходящие гидрогели включают гели, полученные из поверхностно-активных полиолов, такие как Pluronic F-127, коллаген, гиалуронат, фибрин, альгинат, агарозу, хитозан, желатин и их производные или комбинации. В других вариантах подходящие гидрогели - это синтетические полимеры. В следующих вариантах подходящие гидрогели включают гели, полученные из полиакриловых кислот и их производных, этиленполиоксида и его сополимеров, поливинилового спирта, полифосфазена и их комбинаций. В разных специфических вариантах связующий материал выбирают из следующих: гидрогель, гель NovoGel™, агароза, альгинат, желатин, Matrigel™, гиалуронан, полоксамер, пептидный гидрогель, поли-изопропил-н-полиакриламид, полиэтиленгликоль диакрилат (PEG-DA), гидроксиэтилметакрилат, полидиметилсилоксан, полиакриламид, полимеры молочной кислоты, кремний, шелк и их комбинации.
В некоторых вариантах зазоры распределены равномерно или по существу равномерно вокруг поверхности ткани. В других вариантах зазоры распределены неравномерно, причем клетки ткани неодинаково контактируют с нутриентами. В неравномерных вариантах различный доступ к нутриентам необязательно используют для воздействия на одно или несколько свойств ткани. Например, в некоторых случаях желательно иметь клетки на одной стороне биопринтированной ткани, которые пролиферируют быстрее, чем клетки на другой поверхности биопринтированной ткани. В некоторых вариантах контакт различных частей ткани с нутриентами варьируют в разные отрезки времени, с тем чтобы влиять на развитие ткани в нужном направлении.
В некоторых вариантах связующий материал удаляют в любой подходящий момент, в том числе, но не ограничиваясь этим, сразу после биопринтинга (например, в течение 10 минут), через некоторое время после биопринтинга (например, спустя 10 минут), до того как клетки по существу объединяются друг с другом, после того как клетки по существу объединяются друг с другом, до того как клетки продуцируют внеклеточную матрицу, после того как клетки спродуцировали внеклеточную матрицу, непосредственно перед использованием и т.п. В различных вариантах связующий материал удаляют любым подходящим способом. Например, в некоторых вариантах связующий материал удаляют оперативно, вытягивают из клеток, переваривают или растворяют.
В некоторых вариантах предлагаемые способы также включают стадию воздействия на искусственную ткань печени усилием растяжения, вызванного потоком жидкости, перемешиванием или конвективной рециркуляцией с одной или более сторон.
Биологические свойства
Описанные здесь ткани печени включали многоклеточную структуру, напоминающую ткани человека. Как и природная ткань печени, биопринтированные ткани печени включали клетки специфических типов (например, звездчатые печеночные клетки, гепатоциты, эндотелиальные клетки и т.п.), скапливающиеся в конкретных зонах, что приводило к структурированной многокомпартментной архитектуре.
В некоторых вариантах описанные здесь биопринтированные ткани печени включают важные черты природной печени, включая высокую плотность клеток и продуцирование ВКМ, липидов и гликогена. См. фиг. 21. В некоторых вариантах описанные здесь биопринтированные ткани печени имеют плотность клеток по меньшей мере 30%. В различных следующих вариантах описанные здесь биопринтированные ткани печени имеют плотность клеток по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80% или по меньшей мере 90%. В других вариантах описанные здесь биопринтированные ткани печени имеют плотность клеток около 30%, около 40%, около 50%, около 60%, около 70%, около 80% или около 90%.
В некоторых вариантах трехмерные биопринтированные ткани печени включают такие гистологические особенности, как плотные контакты, сохранение по меньшей мере некоторых неактивных печеночных звездчатых клеток и развитие микрокапиллярной структуры. В некоторых вариантах трехмерные биопринтированные ткани печени включают многокомпартментную структуру, которая хорошо сохраняется после начального изготовления. Например, в следующих вариантах биопринтированные ткани печени включают многокомпартментную структуру, которая сохраняется в течение по меньшей мере 7 суток, по меньшей мере 10 суток, по меньшей мере 20 суток, по меньшей мере 30 суток или по меньшей мере 40 суток. В следующих вариантах биопринтированные ткани печени включают многокомпартментную структуру, которая сохраняется в течение около 7 суток, около 10 суток, около 20 суток, около 30 суток или около 40 суток.
В некоторых вариантах после изготовления ткани можно идентифицировать области гепатоцитов, окруженных непаренхимальной «стромой». См. фиг. 2. Неожиданно биопринтированные ткани печени продемонстрировали кажущуюся самоорганизацию с образованием дольчатой структуры, близко напоминающей природную печень. Наблюдаемая архитектура поддерживает функции и жизнеспособность в течение 40 + суток, что позволяет проводить длительное тестирование, например, низкодозовых, неоднократных и хронических патологических состояний.
В некоторых вариантах специфические функции печени описанных здесь трехмерных биопринтированных печеночных тканей сохраняются в течение времени более 7, 10, 20, 30 или 40 суток. Например, в некоторых вариантах описанные здесь биопринтированные печеночные ткани демонстрируют непрерывное продуцирование альбумина вплоть до 6 недель (42 суток), что далеко за пределами времени жизни первичных гепатоцитов, опубликованного для традиционных двумерных методик. См. фиг. 23. Биопринтированные ткани печени также демонстрируют постоянное продуцирование других факторов гепатоцитов типа холестерина. См. фиг. 23.
В случае трехмерных биопринтированных тканей печени человека получают дополнительные метаболиты, которые нельзя получить при использовании двумерных методик, включая трансферрин и фибриноген. См. фиг. 24. В некоторых вариантах на трехмерных биопринтированных тканях печени человека также находят маркеры формирования желчных канальцев. См. фиг. 25.
В отличие от двумерных первичных гепатоцитов, которые утрачивают свои функции через несколько суток, в некоторых вариантах на описанных здесь трехмерных биопринтированных конструкциях ткани печени наблюдается сохраняющаяся индуцибельность активного фермента CYP3A4, причем индуцибельность ингибируется верапамилом. См. фиг. 26. В некоторых вариантах описанные здесь трехмерные биопринтированные ткани печени демонстрируют подобные природным реакции на известные ядовитые для печени вещества, включая диклофенак, тровафлоксацин и метокрексат. См. фиг. 27-29. В некоторых вариантах описанные здесь трехмерные биопринтированные ткани печени демонстрируют подобные природным реакции на физиологически релевантные молекулы, такие как витамин D. См. фиг. 30.
В некоторых вариантах описанные здесь трехмерные биопринтированные ткани печени структурированы с паренхимальными (гепатоциты) и непаренхимальными участками (эндотелиальные клетки (ЕС) и печеночными звездчатыми клетками (hSC)). В других вариантах в качестве альтернативы первичным гепатоцитам структурированные трехмерные ткани печени включают полученные из iPSC гепатоцитоподобные клетки (iPSC-HC) (такие как iCell Hepatocytes, Cellular Dynamics Inc.). Использование iPSC позволяет разрабатывать in vitro системы, специфические для пациента и/или заболевания и может представлять способы генерирования клеток, которые трудно изолировать или размножить.
Примеры
Следующие конкретные примеры следует понимать как только иллюстративные и никоим образом не ограничены приведенным описанием.
Пример 1 - Ткань печени, полученная методом биопринтинга путем непрерывного нанесения, и мозаичная структура функциональных элементов
Искусственную печеночную ткань изготовили путем биопринтинтинга на NovoGen ММХ Bioprinter™ (Organovo, Inc., San Diego, CA) по методике непрерывного нанесения.
Трехмерная структура ткани печени была сформирована на основе повторяющегося функционального элемента, в данном случае шестигранника. Биочернила имели в составе печеночные звездчатые клетки и эндотелиальные клетки, инкапсулированные в компонент для экструзии (поверхностно-активный полиол PF-127).
Приготовление 30% раствора PF-127
30% раствор PF-127 (масс/масс) приготовили с помощью PBS. Порошок PF-127 смешали с охлажденным PBS на магнитной мешалке при 4°С.Полное растворение требовало приблизительно 48 часов.
Приготовление клеток и биопринтинг
Суспензию клеток, содержащую 82% звездчатых клеток (SC), 18% эндотелиальных клеток аорты человека (НАЕС) и кожные фибробласты взрослого человека (HDFa), распределили по 15 мл пробиркам, с тем чтобы получить после центрифугирования три концентрации клеток: 50×106 клеток/мл, 100×106 клеток/мл и 200×106 клеток/мл. Каждую таблетку с клетками повторно суспендировали в 30% PF-127 и перенесли в 3 см3 резервуар с помощью биопринтера. С помощью 510 мкм распределительного наконечника инкапсулированные клетки были биопринтированы на PDMS базовую плату в один шестигранник (см. фиг. 6А) или шестигранную мозаичную конфигурацию (см. фиг. 6В). Каждая конструкция получила приблизительно 200 мкл среды и была инкубирована в течение 20 минут при комнатной температуре для оценки целостности конструкции.
Многослойный биопринтинг
В опытах с мозаичными шестигранниками до (4) последовательных слоев были биопринтированы в более сложную структуру с большим содержанием клеточного материала. После изготовления к каждой конструкции вначале добавили приблизительно 200 мкл полной среды для оценки целостности конструкции. Полученные конструкции инкубировали в течение 20 минут при комнатной температуре и затем погрузили в 20 мл полной среды.
Результаты
Спустя 18 часов культивирования в среде роста, содержащей 10% фетальной бычьей сыворотки (с растворенным PF127), клетки, содержавшиеся в биопринтированной структуре, слиплись друг с другом достаточно, чтобы сформировать целый сплошной пласт ткани, который сохранял первоначальную геометрическую форму (см. фиг. 6D). На фиг. 7 показан один сегмент мозаичной конструкции, окрашенный гематоксилин-эозиновым красителем Н&Е после фиксации в 10% нейтральном забуференном формалине. Было установлено, что клетки жизнеспособны, сохраняют целостность и первоначально отпринтованную структуру.
Пример 2 - Принудительное формирование слоев
Популяции клеток (гомогенные или гетерогенные) подготовили для биопринтинга в виде либо цилиндрических биочернил, либо суспензии клеток в Pluronic F-127 (Lutrol, BASF). Коротко говоря, для изготовления биочернил клетки были извлечены из стандартной упаковки с тканевой культурой с помощью рекомбинантного человеческого трипсина (75 мкг/мл, Roche) либо 0,05% трипсина (Invitrogen). После извлечения фермента клетки промыли, собрали, подсчитали и соединили в нужных соотношениях (т.е. 50:50 печеночных звездчатых клеток (hSC):эндотелиальных клеток (ЕС)) и осадили центрифугированием. Надосадочную жидкость затем слили с клеточного осадка и смесь клеток перенесли в стеклянный микрокапилляр нужного диаметра, обычно внутреннего диаметра 500 мкм или 250 мкм. Этот цилиндрический препарат клеток затем экструдировали в форму, изготовленную из не слипающегся с клетками гидрогеля, с каналами для созревания биочернил. Полученные цилиндры биочернил культивировали в полной клеточной культуральной среде в течение эмпирически определенного времени обычно от 2 до 24 часов.
Короче говоря, для приготовления суспензии клеток в гидрогеле клетки извлекли из сосуда со стандартной культурой клеток по любой описанной здесь методике с участием фермента. Выделенные клетки затем промыли содержащей среду сывороткой, собрали, подсчитали и отцентрифугировали с образованием плотного клеточного осадка. Затем надосадочную жидкость отделили от полученного клеточного осадка и клетки повторно суспендировали в холодном растворе PF-127 (4°С) с концентрацией от 50 до 200×106 клеток/мл (в интервале от 10 до 300×106 клеток/мл). Полученную клеточную суспензию извлекли шприцем, используя биопринтер NovoGen ММХ Bioprinter™ (Organovo, Inc., San Diego, CA).
Затем с помощью биопринтера изготовили конструкции ткани путем принудительного структурирования клеток наслаиванием или ориентированием. Биопринтинг трехмерных конструкций тканей выполнили с помощью цилиндрических биочернил, суспензий клеток в водорастворимых гелях или их комбинаций. Для того, чтобы обеспечить определенное структурирование или наслаивание клеток, в биочернила или в препарат клеточной суспензии вводили комбинации популяций клеток и затем биопринтировали таким образом, чтобы растворение геля, являющегося носителем для клеточного раствора, приводило к определенному наслаиванию клеток вокруг нанесенных биочернил (см. фиг. 13). Структурирование клеток, организацию или наслаивание проводили также путем использования и инкорпорирования определенных дискретных популяций клеток (например, hSC и ЕС), что приводило к предсказуемой и воспроизводимой организации клеток и клеточных структур в биопринтированных тканях (см. фиг. 14).
В некоторых экспериментах конечную клеточную организацию в новой биопринтированной ткани наблюдали после периода созревания или культивирования. Конструкции хранили в стандартном лабораторном инкубаторе (37°С, влажная атмосфера в камере с добавками 5% СО2) и через некоторое время исследовали.
Результаты
Структурирование клеток, наслаивание или их распределение достигаются путем биопринтинга. В результате биопринтинга с биочернилами, содержащими гетерогенные (т.е. политипические) популяции клеток, или объединения биочернил (гомогенных или гетерогенных популяций клеток) с высокоплотными клетка-гелевыми или клеточными суспензиями наблюдали различную организацию клеток. Созревание этих конструкций новых тканей в камере с влажной атмосферой (инкубаторе) привело к различному расположению, организации и/или сегрегации в этих новых биопринтированных тканиях.
Например, принтование системы EC:hSC-laden PF-127 поверх биопринтированных биочернил, содержащих клетки HepG2, приводит к образованию различных слоистых конструкций с разными популяциями клеток и дискретной морфологией ткани. В случае конструкций биочернил, содержащих hSC и ЕС, было установлено, что биопринтированные конструкции, которым давали созревать более 3 суток в полной среде, содержат разные слои ЕС на периферии и организованные сети микрососудов в ядре конструкции. Было показано, что биопринтированные конструкции, полученные с биочернилами, содержащими гомогенную (т.е. монотипическую) популяцию васкулярных клеток гладкой мускулатуры, на которые был биопринтирован высококонцентрированный раствор ЕС, содержат разные слои ЕС на периферии конструкции.
Пример 3 - Многолуночные планшеты
Подготовили популяции клеток (гомогенные или гетерогенные) для биопринтинга с использованием различных форматов биочернил, включая агрегаты цилиндрических биочернил, суспензии клеточных агрегатов или суспензии клеток/пасты, необязательно содержащих компоненты для экструзии агрегатов. Коротко говоря, для приготовления цилиндрических биочернил клетки были извлечены из пластиковой упаковки со стандартной культурой ткани с помощью либо рекомбинантного человеческого трипсина (Roche, 75 мкг/мл), либо 0,05% трипсина (Invitrogen). После извлечения фермента клетки промыли, собрали, подсчитали, соединили в нужных соотношениях (т.е. 50:50 печеночных звездчатых клеток (hSC):эндотелиальных клеток (ЕС)) и осадили центрифугированием. Надосадочную жидкость затем слили с клеточного осадка и клеточную смесь отобрали в стеклянный микрокапилляр нужного диаметра, обычно внутреннего диаметра 500 мкм или 250 мкм. Этот цилиндрический препарат клеток затем экструдировали в форму, изготовленную из гидрогеля, не слипающегося с клетками, с каналами для созревания биочернил. Полученные цилиндры биочернил культивировали в полной культуральной среде клеток в течение эмпирически определенного времени, обычно от 2 до 24 часов
Для приготовления суспензии клеток или пасты из клеточных агрегатов следовали описанным здесь методикам выращивания клеток и их выделения. В ходе генерирования клеточного осадка надосадочную жидкость отделяли от осадка и осадок переносили в обычный шприц. Этот шприц помещали на головку нанесения в биопринтере для прямого биопринтинга раствора с агрегатами клеток или пастой в многолуночные планшеты.
Реплицированные тканевые конструкции затем биопринтировали в лунках многолуночного планшета для тканевой культуры (например, 6- или 24-луночного) либо во вставке в многолуночный планшет с культурой ткани (Transwell, BD) и затем вносили в соответствующий многолуночный планшет. После биопринтинга конструкции созревали/выдерживали в подходящей среде в течение некоторого времени от 3 до 14 суток. После созревания конструкции собирали, фиксировали и обрабатывали для обычного гистологического и иммуногистохимического анализа.
Результаты
Биопринтированные ткани успешно получали в многолуночных планшетах с культурой или многолуночных вставках в планшеты, которые затем вносили в многолуночные планшеты. Такой подход позволяет генерировать реплицированные биопринтированные ткани, которые необязательно культивируют и обрабатывают для разработки идентичных или уникальных условий культивирования. Такой подход приводит к значительному повышению производительности процесса биопринтинга и изготовления образцов (см. фиг. 16).
Пример 4 - Стимулирование биопринтированных новых тканей
Приготовили цилиндрические биочернила, содержащие популяции гетерогенных (т.е. мультипотентных) клеток. Физиологически близкие популяции клеток (например, печеночные звездчатые клетки (hSC) и эндотелиальные клетки из аорты человека (ЕС)) объединили в заданных соотношениях для получения нужных биочернил. Клетки сохраняли и выращивали в стандартных лабораторных условиях и культивировали в среде, либо приобретенной от того же поставщика, что и клетки, либо среде, содержащей компоненты, обычно указанные в предшествующих печатных работах и применявшиеся в стандартной практике обращения с культурой этих конкретных типов клеток. Обработка клеток для приготовления была следующей: коротко говоря, клетки выделяли из пластикового контейнера со стандартной тканевой культурой, промывали не содержащим катионов фосфатно-солевым буферным раствором (PBS) и затем приводили в контакт с 0,1-0,05% трипсина (Invitrogen). Затем выделенные клетки промыли в среде, содержащей сыворотку, собрали, подсчитали, объединили в соответствующем соотношении для опыта по стимулированию и осадили центрифугированием. Удалили надосадочную жидкость и клеточный осадок отобрали в стеклянный микрокапилляр, который затем погрузили в полную среду на время приблизительно от 15 до 20 минут. Полученную структуру цилиндрических биочернил затем экструдировали в содержащую линейные каналы форму из гидрогеля, не прилипающего к клеткам, и выдержали в течение времени от 2 до 18 часов. Затем для получения биопринтированных конструкций ткани использовали цилиндрические биочернила, содержащие hSC:EC, и хранили и/или созревали их в камере с влажной атмосферой. Были приготовлены сегменты ткани с начальными размерами 1,25 мм × 8 мм × 0,25 мм (W×L×Н). Во время созревания после биопринтинга некоторые конструкции приводили в контакт с цитокином TGF-β1 для анализа специфического отклика ткани (см. фиг. 15).
Для конструкций ткани со слоем гомогенных (т.е. монотипических) клеток, ограниченным внешней поверхностью, готовили вторичные клетки соответствующего типа. Обычно васкулярные эндотелиальные клетки или малые эпителиальные клетки дыхательных путей (из стенки кровеносных сосудов и моделей ткани легких человека соответственно) готовили в высококонцентрированных суспензиях. Коротко говоря, клетки выделили, как описано выше, собрали, пересчитали и осадили центрифугированием. Надосадочную жидкость удалили, клеточный осадок заново суспендировали в малом объеме полной среды и получили высококонцентрированный клеточный осадок с концентрацией 1×105 клеток/мкл. Эту суспензию клеток затем хранили при 4°С до момента использования.
Биопринтированные новые ткани затем погружали в содержащую сыворотку полную среду культуры клеток и для созревания помещали в стандартную увлажняемую камеру с добавкой 5% СО2. Биопринтированные новые ткани культивировали и стимулировали соответствующим цитокином в течение заданного периода времени, фиксировали формалином, собирали и обрабатывали для стандартного гистологического и иммуногистохимического анализа. Биопринтированные ткани оценивали по таким параметрам как морфология ткани, организация клеток, получение внеклеточных матриц, пролиферация клеток, жизнеспособность клеток и целостность конструкции и не только.
Стимулирование цитокином проводили путем добавления цитокина непосредственно в культуральную среду и инкубирования биопринтированных тканей с добавкой белка для обеспечения прямого и длительного доступа клеток к соответствующему стимулирующему фактору. Эксперименты по реакции на дозу проводили с дозами обычно в интервале от 0,1 до 100 нг/мл в зависимости от величины ED50 экспериментального цитокина. В экспериментах со стимулированием цитокином в течение более 48 час среду заменяли и свежий цитокин добавляли через каждые 48 час.
Результаты
Биопринтированные новые ткани, содержащие физиологически близкие популяции клеток, были успешно стимулированы цитокинами, которые, как было показано раньше, проявляют клеточные реакции в двумерных in vitro системах. Было показано, что реакции, наблюдаемые в биопринтированных трехмерных конструкциях печени, зависят от дозы и уникальны для клеток в биопринтированных конструкциях (см., например, фиг. 15).
Пример 5 - Биопринтинг совместно сформованной микроструктуры функциональной ткани печени при непрерывном нанесении
Приготовление 30% PF-127
30% раствор PF-127 (масс/масс) приготовили с помощью PBS. Порошок PF-127 смешали с охлажденным PBS на магнитной мешалке при 4°С. Полное растворение потребовало приблизительно 48 часов.
Изготовление клеток и совместный биопринтинг формы и наполнителя
Три миллилитра раствора PF-127 перенесли в 3 см3 резервуар с помощью биопринтера и распределяющего наконечника 510 мкм; 30% раствор PF-127 был биопринтирован в 6-луночном планшете Transwell в виде одного шестигранника и подвергнут последовательному шестикратному наслаиванию.
Суспензию клеток, содержащую 7.8×107 печеночных клеток (HepG2), центрифугировали при 1000 г в течение 6 мин для формирования клеточной пасты. Пять микролитров клеточной пасты экструдировали через 510 мкм иглу для заполнения каждой из треугольных форм (см. фиг. 5А). Шестигранную форму инкубировали при комнатной температуре в течение 15 мин. Три миллилитра среды (DMEM с добавками 10% FBS и 1X пенициллина, стрептомицина и амфотерицина В) добавили в лунку, покрытую сверху мембранным планшетом Transwell, и затем инкубировали при 37°С и 5% СО2. Через 45 минут форма из PF-127 растворилась в среде, оставив целыми сформованные печеночные биочернила, с образованием плоской структуры клеток и пустот (фиг. 5В). Для удаления из среды оставшегося PF-127 Transwell перенесли в новую лунку, содержащую 3 мл среды, и инкубировали в течение двух часов. Это было повторено еще дважды для полной замены 9 мл среды за 6 час.
Спустя 6 часов Transwell перенесли в новую лунку без среды, и суспензию 2×106 клеток при соотношении 90% эндотелиальных клеток аорты человека и 10% печеночных звездчатых клеток распределили для заполнения пустот, образовавшихся при растворении формы из PF-127. Печеночные конструкции инкубировали в течение 15 минут при комнатной температуре. После 15 мин инкубирования добавили 4 мл среды, содержащей 85% среды из DMEM с добавками 10% FBS и 1X пенициллина, стрептомицина, амфотерицина В для нанесения печеночных и звездчатых клеток и 15% M199 с добавками 2% LSGS, 10% FBS, HEPES и 1X пенициллина, стрептомицина, амфотерицина В для нанесения эндотелиальных клеток аорты человека. Конструкцию инкубировали при 37°С и 5% СО2 в течение 48 часов с образованием смежной конструкции с плоской структурой, включающей дольчатое (треугольное) расположение печеночной паренхимы с проникновением ткани, содержащей эндотелиальные клетки.
Пример 6 - Биопринтинг и характеризация функциональной печеночной ткани
Культура клеток
Охлажденные для сохранности первичные гепатоциты человека (Life Technologies) очистили по методике производителя и инкубировали в среде для сохранения гепатоцитов (Hepatocyte Maintenance Media, Life Technologies) с добавкой 100 м.ед./мл пенициллина, 0,25 мкг/мл стрептомицина и 85 мкг/мл амфотерицина В (1XP/S/A) (Life Technologies). В компоненте непаренхимальных клеток биопринтированных тканей использовали следующие клетки: эндотелиальные клетки умбиликальной вены человека (HUVECs; Becton Dickenson) и печеночные звездчатые клетки (ScienCell) и выращивали их согласно инструкциям производителя. HUVECs вырастили в среде EGM-2 (Lonza) и печеночные звездчатые клетки в DMEM (Corning) с добавкой 10% FBS (Life Technologies), 100 м.ед./мл пенициллина, 0,25 мкг/мл стрептомицина и 85 мкг/мл амфотерицина В (1XP/S/A; Corning).
Химические вещества, используемые в индукционных анализах
Следующие реагенты приобрели у Sigma: рифампицин, диклофенак, верапамил, 5-(и 6)-карбокси-2',7'-дихлорфторесцеин диацетат и витамин D3.
Приготовление биочернил
Биочернила готовили по описанным здесь методикам. Содержащие клетки гидрогели NovoGel 2.0 (Organovo, Inc.) готовили согласно инструкциям производителя и инкорпорировали популяции непаренхимальных клеток до биопринтинга.
Биопринтинг
Все ткани были изготовлены непосредственно на мембранах стандартных луночных планшетов для клеточной культуры (Corning Transwell) с использованием стандартных способов биопринтинга Organovo и биопринтера NovoGen ММХ Bioprinter или их модификаций. Биопринтированные ткани печени включали оболочку из непаренхимальных клеток (печеночные звездчатые клетки, HUVEC) в Novogel 2.0. Оболочки определяли компартмент, содержащий внутреннюю область. Внутреннюю область компартментов заполнили клеточной пастой, содержащей первичные гепатоциты. Биопринтированные ткани печени также включали углубление, содержащее Novogel 1.0. На фиг. 20 показан конкретный пример биопринтированной ткани печени человека. Биопринтированные ткани печени хранили на этих мембранах в течение всех экспериментов. Среду в конструкциях заменяли ежедневно на 600 мкл смеси из 90% среды первичных гепатитов и 10% EGM-2 и инкубировали при 37°С во влажной атмосфере с добавкой 5%СО2. Отработанную среду собирали для анализа секретированных факторов, а ткани печени собирали для конечного анализа (например, экспрессии генов, гистологии, жизнеспособности ткани и т.п.
Детектирование секретированных белков
Отработанную среду собирали, хранили при -80°С и анализировали с помощью стандартного коммерческого аналитического набора ELISA на следующие метаболиты печени: альбумин (Bethyl Laboratories), фибриноген (GenWay Labs) и трансферрин (GenWay Labs). Биосинтез холестерина измеряли количественно методом флуорометрии (Cayman Biochemical). Активность лактатдегидрогеназы (LDH) определяли колориметрически с помощью стандартного коммерческого реактива (Abeam).
Выделение РНК и синтез кДНК для транскрипционного анализа
Объемную РНК экстрагировали из трехмерных конструкций печени с помощью Quick-RNA MiniPrep (Zymo) по инструкциям производителей. Количество РНК определяли спектрофотометрически (Beckman Coulter DU 640). В каждом отдельном синтезе кДНК по реакции SmartScribe вводили 2 мкг РНК, следуя инструкциям производителя (CloneTech). Пробу TaqMan (Life Technologies) и пары праймеров для CYP3A4, меченного красителем FAM и 18S, меченного красителем VIC использовали в составе смеси компонентов TaqMan Universal Master Mix UNG согласно руководству от производителя (Life Technologies). Амплифицированные транскрипты детектировали с помощью системы Step One Plus system (Life Technologies).
Гистологический анализ: парафинированные образцы печеночных тканей
Конструкции печени фиксировали in situ в 2% растворе параформальдегида (2% параформальдегида, 10 мМ хлорида кальция, 50 мМ сахарозы в PBS) в течение 24 час при комнатной температуре. Через 24 часа фиксирующий раствор удалили и заменили 70% этанолом. Конструкции с присоединенной мембраной Transwell загрузили в жидкий HistoGel (American MasterTech, Lodi, CA, catalog # EMHGECS) при 45°C в пластиковой форме для биопсии и дали затвердеть при комнатной температуре. Блоки гистогеля с включенными конструкциями печени затем обработали для парафинирования с помощью тканевого процессора. После инфильтрации парафина конструкции печени закрепили в парафиновые формы и сделали 5 мкм поперечные срезы с помощью вращающегося микротома (Jung Biocut 2035, Leica Microsystems, Buffalo Grove, IL). Для окрашивания гематоксилином и эозином слайды очистили от парафина в ксилоле, регидратировали 100%, 95%, 70% и 50% этанолом и промыли дистиллированной водой. Слайды вымочили в Gill's гематоксилине (Fisher Scientific, Pittsburgh, РА). После промывки дистиллированной водой слайды ненадолго вымочили в 0,2% об/об гидроксиде аммония. После промывки дистиллированной водой слайды вымочили в водном растворе эозина (American MasterTech). Слайды затем дегидратировали промывкой в градиентных растворах этанола, очистили ксилолом и закрепили с помощью смолистой закрепляющей среды (CytoSeal, Fisher Scientific).
Окрашивание образцов с помощью PAS (иодная кислота и основание Шиффа) проводили согласно инструкциям производителя (Abcam, Cambridge, MA).
Для иммуногистохимического анализа слайды депарафинизировали, регидратировали последовательным вымачиванием в 100, 95, 70 и 50% этаноле и окончательно промыли дистиллированной водой. Из регидратированных секций восстановили антигены при подогреве в 10 мМ цитрата натрия с рН 6,0 в стандартной микроволновой печке, нагревая раствор и слайды почти до кипения и затем медленно охлаждая в течение 30 мин. Затем слайды были заблокированы 10% козьей сывороткой и насыщенным Tris-буферном солевом растворе (TBS) в течение 1 час с последующим инкубированием с первичными антителами в течение суток при 4°С.Были использованы следующие антитела: кроличий анти-Е-кадгерин (Abcam; 1:50); анти-альбумин мыши (Sigma-Aldrich, St. Louis, МО; 1:200); анти-десмин кролика (Abeam; 1:200); анти-CD31 мыши (Abeam; 1:25). Затем секции промыли три раза в TBS с 0,1% Tween 20 и инкубировали с AlexaFluor 488- или AlexaFluor 568-сопряженными вторичными антителами (Life Technologies, Carlsbad, СА), разбавленными 1:200 в TBS. Затем секции трижды промыли в TBS с 0,1% Tween 20, промыли дистиллированной водой и закрепили с помощью содержащей DAPI закрепляющей среды (Vector Labs, Burlingame, СА).
Подготовка конструкций для криосекционирования
Конструкции печени один раз промыли фосфатно-солевыи буфером DPBS, погрузили в жидкость Tissue-Tek OCT compound (Sakura Finetek Europe B.V., Netherlands) и быстро заморозили. Замороженные блоки, содержащие конструкции печени, разрезали на слои по 5 мкм на криостате (Leica Cryocut 1800, Leica Microsystems). Срезанные слайды зафиксировали в жидком ацетоне при -20°С и высушили на воздухе в течение 20 мин при комнатной температуре. Для окрашивания с помощью Oil Red О слайды регидратировали в дистиллированной воде и вымочили в 60% изопропаноле в течение 2 минут. Слайды окрасили в 0,3% масс/об растворе Oil Red О (Sigma-Aldrich) в 60% изопропаноле в течение 15 минут при комнатной температуре и затем промыли 60% изопропанолом в течение 1 мин. Слайды недолго вымочили в Gill's гематоксилине для контр-окрашивания. Слайды промыли дистиллированной водой и закрепили с помощью водной среды (American MasterTech).
Микроскопия
Слайды, окрашенные с помощью красителей Н&Е, PAS и Oil Red О, фотографировали в микроскопе Zeiss Axioskop (Zeiss, Jena, Germany). Снимки получали с помощью камеры Insight 2 с программой Spot 5.0 (Diagnostic Instruments, Inc., Sterling Heights, MI). Флуоресцентно окрашенные слайды фотографировали в микроскопе Zeiss AxioImager и снимки получали с помощью камеры Zeiss ICM-1 с программой Zen Pro.
Приготовление фракций S9
Из трехмерных конструкций печени удалили среду, добавили к ним 400 мкл буферного фосфатно-солевого раствора (Corning), содержащего смесь ингибиторов IX протеазы (Sigma), и охладили до -80°С. Конструкции разморозили и гомогенизировали с помощью гомогенизатора TissuRuptor (Qiagen) со сменными насадками при 3000 об/мин в течение 90 сек, затем с паузой в 90 сек и последующей гомогенизацией при 3000 об/мин в течение 90 сек. Гомогенизированную надосадочную жидкость центрифугировали при 20000 g при 4°С в течение 20 мин. Надосадочную жидкость перенесли в чистую пробирку и затем количественно определили белок.
Количественное определение белка
Количественное определение белка проводили путем анализа Bradford (Sigma) с коровьим альбумином в качестве стандарта (Sigma).
Анализы CYP 3А4
Фракции S9 нормализовали по содержанию белка и использовали в анализах Luciferin-IPA (CYP ProGlo; Promega) по инструкции производителя, люминесценцию записывали на планшете (Polarstar, BMG).
Статистика
ANOVA и t-student статистический анализ проводили с помощью программы GraphPad Prism Software.
Результаты
Биопринтированные ткани печени включали многоклеточную структуру, напоминающую печень человека. Как и природная ткань печени, биопринтированные ткани печени включали специфические типы клеток (например, печеночные звездчатые клетки, гепатоциты, эндотелиальные клетки и т.п.), сконцентрированные в специфических зонах, что обеспечило структурированную компартментированную архитектуру.
Гистологическое исследование биопринтированных тканей печени показывает основные характерные особенности природной печени, включая высокую плотность клеток и продуцирование внеклеточных матриксных белков (ВКМ), липидов и гликогена. См. фиг. 21 (7 сутки после биопринтинга). Трехмерные биопринтованные ткани печени демонстрировали привлекательные гистологические особенности, в том числе плотные контакты (найденные путем визуализации E-Cadherin, Albumin, и DAPI), неактивные звездчатые клетки и микроциркуляторное русло (найденное путем визуализации Desmin, CD31, и DAPI). Трехмерные биопринтированные ткани печени демонстрировали компартаментную структуру, которая долго сохранялась после изготовления. На 21 сутки после изготовления идентифицировали области гепатоцитов, окруженные непаренхимальной «стромой». См. фиг. 22. Биопринтированные ткани печени неожиданно продемонстрировали очевидную самоорганизацию в дольчатую структуру, отчетливо имитирующую природную печень.
Указанная архитектура поддерживает функционирование и жизнеспособность в течение более 40 суток, что позволяет проводить длительное тестирование, например, при малых дозах, повторных контактах и хронических патологических состояниях. У трехмерной биопринтированной печеночной ткани (первичных гепатоцитов) специфические для печени функции сохраняются в течение более 40 суток. Биопринтированные печеночные ткани продемонстрировали непрерывное продуцирование альбумина в течение более 6 недель (42 суток), что выходит за рамки опубликованных ранее данных по первичным гепатоцитам в традиционных двумерных технологиях. См. фиг. 23. Биопринтированные ткани печени продемонстрировали также продуцирование других факторов гепатоцитов типа холестерина. См. фиг. 23.
Трехмерные биопринтированные ткани печени человека продуцировали дополнительные метаболиты, не наблюдавшиеся в существующих двумерных методиках, в том числе трансферрин и фибриноген. См. фиг. 24.
В трехмерных биопринтированных тканях печени человека также обнаруживаются маркеры образования желчных канальцев. Экспортирующий соли желчных кислот белок (BSEP) является мембранным белком, который локализован внутри канальцевых мембран гепатоцитов. Главная функция BSEP заключается в удалении неконъюгированных и конъюгированных желчных кислот и солей из гепатоцитов. Кроме того, экспрессия BSEP указывает на полярность природной ткани. Гистологическая визуализация BSEP (IHC окрашивание белка BSEP), альбумина и DAPI демонстрируют присутствие BSEP в клетках гепатоцитов, продуцирующих альбумин. На фиг. 25 показан расчет относительного количества BSEP mRNA по сравнению с базовым геном РНК (18s РНК) в двух биопринтированных тканях печени на 10 сутки после принтинга. Вычисленные концентрации BSEP согласуются с данными гистологии.
В отличие от двумерных первичных гепатоцитов, которые перестают функционировать через несколько суток, биопринтированные конструкции трехмерных тканей печени человека демонстрируют сохраняющуюся индуцибельность активного фермента CYP3A4 (который ингибируется верапамилом). См. фиг. 26.
Трехмерные биопринтированные ткани печени демонстрируют аналогичные природным реакции на известные ядовитые для печени вещества, включая диклофенак, тровафлоксин и метотрексат. Фиг. 27 показывает индукцию CYP3A4 при умеренных дозах диклофенака с последующим разрушением при повышенных дозах, как установлено с помощью лактатдегидрогеназы (LDH). Фиг. 28 показывает уменьшение альбумина и увеличение LDH в многодозовых опытах с тровафлоксацином по сравнению с левофлоксацином (n=3, 2 дозы на 4 суток). Видно, что эффекты тровафлоксацина ближе к клиническим значениям Cmax (~ 4 мкМ). Этот результат существенно отличается от данных для традиционных двумерных культур первичных гепатоцитов, где вообще не была замечена индукция LDH. На фиг. 29 показано снижение жизнеспособности (определенной с помощью ATP-Cell titer glo), снижение продуцирования альбумина и увеличение LDH, наблюдаемое в многодозовых экспериментах с метотрексатом (n=3, ежедневное дозирование в течение 7 суток).
Трехмерные биопринтированные ткани печени демонстрируют аналогичные природным реакции на физиологически релевантные молекулы, такие как витамин D. Витамин D важен для поддержания гомеостаза организма. Витамин D можно получать вместе с диетическим питанием либо его синтезируют клетки кожи. Печень перерабатывает витамин D в метаболиты, важные для формирования/сохранения костей, и в формы, которые выводятся почками. Витамин D также стимулирует экспрессию CYP3A4 в печени и может потенциально воздействовать на биодоступность лекарств. Был изучен транскрипционный профиль биопринтированных 3D тканей печени, обработанных 1,5, 10 мкМ витамина D. Определили относительную экспрессию транскриптов CYP3A4. Фиг. 30 показывает, что активность CYP3A4 повысилась в ~7 и 4 раз при обработке витамином D в количестве 5 и 10 мкМ соответственно.
Пример 7 - Биопринтинг функциональной ткани печени, инкорпорирующей клетки Купфера
Инкорпорирование клеток Купфера позволяет изучить иммунологический аспект Organovo 3D тканей печени. Клетки Купфера были инкорпорированы в биопринтированные конструкции печени в физиологически приемлемом количестве. Конструкции отвечают на LPS стимуляцию в зависимости от дозы (LPS: Е. coli 0127:В8; Sigma). См. фиг. 31. Клетки Купфера были биопринтированы в конструкции печени в физиологически приемлемом количестве (~12%). Реакции конструкции на LPS стимуляцию зависят от дозы. IL-10 и TNF-α являются антагонистическими цитокинами. Экспрессия IL-10 уменьшает экспрессию TNF-α. Этот эффект наблюдается в биопринтированных 3D тканях печени и наиболее выражен при дозе 100 мкг/мл LPS. См. фиг. 32.
Пример 8 - Биопринтинг функциональной ткани печени, инкорпорирующей синусоидальные эндотелиальные клетки печени
Инкорпорирование печеночных синусоидальных эндотелиальных клеток позволяет изучать иммунологические аспекты трехмерных биопринированных тканей печени. Печеночные синусоидальные эндотелиальные клетки (HSECs) представляют популяцию эндотелиальных клеток природной печени. На фиг. 33 показан двумерный монослой HSEC. Эти клетки имеют уникальные особенности, включая отклик клеток на иммунологические реакции. Монослои HSEC реагируют на LPS, продуцируя IL-6 в 2D культурах, показанных на фиг. 34. Наоборот, монослои HUVEC не продуцируют детектируемых количеств IL-6 при стимулировании с помощью LPS. При включении в способ биопринтинга монослои HSEC продуцируют плавленые 3D ткани печени. Фиг. 35 показывает трехмерную ткань печени, сплавленную с HSECs. При получении этой ткани печеночные синусоидальные эндотелиальные клетки были инкорпорированы в непаренхимальную фракцию для получения плавленых структур.
Пример 9 - Проникновение малых молекул
Для выяснения вопроса, могут ли малые молекулы проникать в трехмерные биопринтированные ткани печени, провели следующий опыт. В среду 3D тканей печени добавили 1 мкМ 5-(и -6)-карбокси-2',7'-дихлофторесцеин диацетата в течение 24 час. Конструкцию промыли 1 мл буфера HBSS и промывки отделили. Эту операцию повторили 3 раза. Добавили раствор ОСТ, конструкцию быстро заморозили и криосекционировали. Слайды толщиной 5 микрон наблюдали визуально с помощью флуоресцеин изотиоцианата (FITC) при оптическом возбуждении на длине волны 495 нм. На этой длине волны возбуждается флоресцеиновый компонент молекулы 5-(and-6)-карбокси-2',7'-дихлофторесцеин диацетата. Этот слайд имел размер приблизительно 150 микрон в конструкции, и на протяжении всего опыта следили за флуоресцентно-меченным соединением. Молекулярная масса 5-(и -6)-карбокси-2',7'-дихлофторесцеин диацетата равна 529.28. На фиг. 36 показано FITC изображение криосекционированной 3D ткани печени при 5Х, демонстрирующее проникновение малой молекулы.
Несмотря на то, что в данном описании показаны и описаны предпочтительные варианты настоящего изобретения, тем не менее специалисту в данной области будет очевидно, что такие варианты являются только примерами. Специалисты в данной области могут увидеть многие варианты, изменения и замещения, не отклоняясь от духа изобретения. Следует понимать, что варианты, альтернативные приведенным в данном изобретении, также приемлемы в практике данного изобретения.
Реферат
Изобретение относится к биотехнологии и трансплантологии. Описана искусственная живая трехмерная конструкция печеночной ткани. Конструкция содержит один или несколько слоев, в которой каждый слой содержит один или несколько типов печеночных клеток и один или несколько слоев объединены между собой с образованием живой трехмерной конструкции печеночной ткани. В некоторых вариантах такие конструкции характеризуются тем, что имеют по меньшей мере один слой, включающий клетки многих типов, клетки разных типов пространственно расположены друг относительно друга таким образом, что они образуют плоскую структуру; причем среди этих слоев по меньшей мере один слой композиционно и архитектурно отличается по меньшей мере от одного из других слоев с образованием плоской структуры. Также описаны матриксы и способы их изготовления. Данное изобретение также предлагает искусственную живую трехмерную конструкцию печеночной ткани для применения с целью улучшения одной или нескольких функций печени путем введения in vivo ткани или применения ткани в экстракорпоральном устройстве. Предложенное изобретение может быть использовано в медицине. 7 н. и 27 з.п. ф-лы, 37 ил., 9 пр.

Комментарии