Способ получения 2,6-ди-трет-бутил-п-бензохинона - RU2654477C2
Код документа: RU2654477C2
Чертежи


Описание
Изобретение относится к области нефтехимического синтеза, а именно к способу получения 2,6-ди-трет-бутил-п-бензохинона (I).

Хинон I известен как высокоактивный антиоксидант, применяется для изучения скорости выведения микрозагрязнителей из ливневых и сточных вод, как метаболит бутилгидрокситолуола [1. www.chembiotrade.ru/node/294]; в органических синтезах и как фармацевтический интермедиат [2. www.lookchem.com / 2-6-Di-tert-butyl-p-benzoquinone]; в качестве регулятора и стимулятора роста растений [3. www.chemicalbook.com / ChemicalProductPropertyENCB8247272].
Производство хинона I осуществляют путем взаимодействия 2,3-дихлор-5,6-дициано-1,4-бензохинона и 2,6-ди-трет-бутил-4-метоксифенола в метаноле в атмосфере азота в течение 12 часов [2]. Последующие стадии вакуумирования, кристаллизации из бензола, отмыва осадка метанольно-водным раствором, приводят к образованию хинона I.
Однако учитывая наличие отечественной сырьевой базы - производство 2,6-ди-трет-бутилфенола (Агидол-0) на ОАО «Стерлитамакский нефтехимический завод», перспективной является разработка технологии получения хинона I путем прямого окисления 2,6-ди-трет-бутилфенола (II).

Известны гомогенные способы окисления фенола II в хинон I в присутствии различных металлокомплексных катализаторов.
Так, при окислении фенола II трет-бутилгидроперекисью (ButOOH) в присутствии в качестве катализатора ди-(метилбензоата)кобальта образуется монохинон I с выходом 59% и 3,3',5,5'-тетра-трет-бутил-4,4'-дифенохинон (III) с выходом 31% при температуре 30°C [4. Horswill Е.С., Ingold K.U. The oxidation of phenols. I. The oxidation of 2,6-di-tert-butyl-4-methylphenol, 2,6-di-tert-butylphenol, and 2,6-di-methylphenol with peroxy radicals // Can. J. Chem. 1996. 44. №36. 263-268].

В работе [5. Pathak R., Rao G. Oxidation of 2,6-di-tert-butylphenol with polymer anchored molybdenyl and vanadyl complexes // J. Mol. Catal. A: Chem. 1998. 130. 215-220] описано окисление фенола II с помощью ButOOH в присутствии в качестве катализатора полимера, содержащего комплексы ванадия и молибдена в ацетонитриле. Преобладающими продуктами были хинон I с выходом 81% и дифенохинон III.
Окисление фенола II посредством ButOOH, катализируемое железо- или кобальт-фталлоцианинтетрасульфонатом, также описано в [6. Y. Cimen, Н. Turk Oxidation of 2,6-di-tert-butylphenol with tert-butyl hydroperoxide catalyzed by iron phthalocyanine tetrasulfonate in a methanol-water mixture // J. Mol. Catal. A: Chem. 2007. 265. 237-243; 7. H. Turk, Y. Cimen Oxidation of 2,6-di-tert-butylphenol with tert-butylhydroperoxide catalyzed by cobalt(II) phthalocyanine tetrasulfonate in a methanol-water mixture and formation of an unusual product 4,4'-dihydroxy-3,3',5,5'-tetra-tert-butylbiphenyl // J. Mol. Catal. A: Chem. 2005. 234. 19]. Однако основными продуктами реакции являются дифенохинон III и 4,4'-дигидрокси-3,3',5,5'-тетра-трет-бутилбифенил (IV).
В литературе имеется большое число работ, посвященных окислению фенола II молекулярным кислородом в присутствии соединений, содержащих металлы переменной валентности: соли Cu+2, Mn+2, Fe+3, Ni+2, Со+2, Со+3, Pd+2, V+4 [8. V.M. Kothary, J.J. Tazuma Selective autooxidation of some phenols using salcomines and metalphthalocyanines // J. Catal. 1976. №41. 180-189; 9. Пат. 4410736 США. Coupling phenols with diphenoquinones / Strom R.M. (1983); 10. Пат. 4487977 США. High yield process for preparing 3,3',5,5'-tetraalkyl-4,4'-biphenol / Walter K.M., Stephen J.F. (1984)], Cr+2, Mo+2, Zn+2, Pt+2, Pd+2 [11. Пат. 58140034 Япония. Получение 3,3',5,5'-тетра-трет-бутил-бисфенола / Утита Хироси, Сева денко К.К. (1984)]; основные оксиды MgO, СаО, La2O3, ZrO2, ZnO, легированные катионами Mn+2, Со+3, Fe+3, Cu+2 [12. Hideky K, Wasaru U., Yutaka М., Yoshihiko М. Жидкофазное окисление 2,6-диалкилфенолов молекулярным кислородом в присутствии твердых основных оксидов, легированных ионами металлов // J. Chem. Soc. Jap. 1990. №6. 649-654]; гетерополикислоты [13. А.с. 1155580 СССР. Способ получения дифенохинонов / Городецкая Т.А., Кожевников И.В., Матвеев К.И. // Б.И. 1985. №18. 378-383]. Основными продуктами реакции являются дифенохинон III (30-50%) и хинон I (50-70%).
В работе [15. М. Hassanein, М. Sakaran, S. Shendy Oxidation of 2,6-Di-tert-butylphenol by Dioxygen Catalyzed by Tetrasodium Phthalocyaninatocobalt(II) Tetrasulfonate in Aqueous Micellar Media // J. Iran. Chem. Soc. 7. №1. 2010. 128-133] описано образование хинона I путем окисления фенола II кислородом в присутствии кобальт(II)фталлоцианин тетрасульфоната натрия (CoPcTSNa) в водном мицеллярном растворе цетилтриметиламмоний бромида (CTABr). Окисление фенола II протекает с 90%-ной конверсией в течение 5 ч с образованием хинона I и дифенохинона III с селективностью образования 60% и 40% соответственно. Отмечается, что в аналогичных условиях в отсутствии CTABr конверсия фенола II составляет всего 20%, а селективность образования хинона I и дифенохинона III 30% и 70% соответственно.
В работе [16. G.T. Musie, М. Wei, В. Subramaniam, D.H. Busch Autoxidation of Substituted Phenols Catalyzed by Cobalt Schiff Base Complexes in Supercritical Carbon Dioxide // Inorg. Chem. 2001. 40. 3336-3341] сообщается о получении хинона I с выходом 97% автоокислением фенола II под действием саленового комплекса кобальта (II) CoII(salen) в присутствии суперкритического CO2 в растворителе метилимидазоле при 70°C под давлением 62 атм.
К недостаткам описанных способов получения хинона I, в которых используют металлокомплексные катализаторы, следует отнести дороговизну и токсичность используемых катализаторов, сложность выделения из реакционной смеси и загрязнение продукта соединениями переходных металлов.
В работе [17. Y. Lin, B. Li, Z. Feng, Y.A. Kim, M. Endo, D.S. Su Efficient Metal-Free Catalytic Reaction Pathway for Selective Oxidation of Substituted Phenols // ACS Catal. 2015. 5. 5921-5926] в качестве эффективного дешевого катализатора селективного окисления замещенных фенолов в соответствующие п-бензохиноны предлагается «луковичная форма» углерода OLC. Сообщается, что окисление фенола II (0,1 ммоль) с помощью ButOOH (0,36 ммоль) в присутствии 8 мг катализатора в 5 мл ТГФ при 80°C за 4 ч протекает с конверсией фенола II 99,7% и селективностью образования хинона I 92,5%.
Перечисленные выше катализаторы окисления фенола II в хинон I активируют в качестве окислителя либо органические пероксидные соединения, либо молекулярный кислород. Следует отметить недостатки использования данных окислителей: 1) органические пероксиды взрывоопасные, дорогостоящие, дают токсичные отходы; 2) окисление при использовании в качестве окислителя молекулярного кислорода воздуха протекает с преимущественным образованием дифенохинона III и низкими выходами по хинону I.
В этой связи более перспективными являются способы окисления фенола II в хинон I с использованием в качестве окислителя водных растворов пероксида водорода и катализаторов, активирующих данный окислитель. Кроме того, процессы, основанные на окислении водными растворами Н2О2, считаются менее опасными.
Так, в работе [18. Clure J. Ortho oxidation of 2,6-di-methyl-phenol with trifluoroperoxyacetic acid // J. Org. Chem. 1963. 28. №1. 69-71] описано превращение фенола II в хинон I с выходом 70% при использовании в качестве окислителя водных растворов пероксида водорода в присутствии в качестве катализатора трифторуксусной кислоты.
Ряд работ [19. W. Adam, W.A. Herrmann, J.H. Lin, C.R.

В работе [22. I.D. Ivanchikova, N.V. Maksimchuk, R.I. Maksimovskaya, G.M. Maksimov, O.A. Kholdeeva Highly Selective Oxidation of Alkylphenols to p-Benzoquinones with Aqueous Hydrogen Peroxide Catalyzed by Divanadium-Substituted Polyoxotungstates // ACS Catal. 2014. 4. 2706-2713] приводится пример окисления фенола II в хинон I 35%-ным водным раствором H2O2 в присутствии диванадий-полиоксованадата тетра-н-бутиламмония ТВА4Н[γ-PW10V2O40]. Реакцию осуществляют в 1 мл раствора ацетонитрила, содержащем 0,1 ммоль субстрата, 0,003 ммоль катализатора, 0,2 ммоль H2O2 при 40°C в течение 40 мин. Селективность образования хинона I составляет 90% при конверсии фенола II 98%.
Предлагается способ окисления фенола II 30%-ым раствором пероксида водорода в присутствии Ti-супероксида с добавлением уксусной кислоты при 50-60°C в инертной атмосфере в течение 3 ч [23. Пат. 6872857 США. Process for conversion of phenol to hydroquinone and quinones / Dewkar G.K., Thakur V.V. (2005)]. Выход хинона I составляет 65% при конверсии фенола II 70%.
Сообщается об окислении фенола II в соответствующий хинон I со 100%-ной селективностью водными растворами H2O2 в присутствии титансодержащего пористого кристаллического металлорганического полимера MIL-125 [24. I.D. Ivanchikova, Ji Sun Lee, N.V. Maksimchuk, A.N. Shmakov, Y.A. Chesalov, A.B. Aupov, Y.K. Hwang, C.H. Jun, J.S. Chang, O.A. Kholdeeva Highly Selective H2O2 - Based Oxidation of Alkylphenols to p-Benzoquinones Over MIL-125 Metal-Organic Frameworks // Eur. J. Inorg. Chem. 2014. 132-139]. Однако в статье не приводятся условия реакции и конверсия субстрата.
Окисление фенола II водным раствором пероксида водорода в присутствии микропористого кристаллического титаносиликата со структурой UTD-1 (размер пор

Окисление фенола II в хинон I предлагается осуществлять в присутствии титансодержащего мезопористого мезоструктурированного материала Ti-MCM-41 с использованием 10 ммоль субстрата, 100 мг катализатора, 10 г ацетона в качестве растворителя и 30 ммоль 35%-го раствора H2O2 при температуре 60°C в течение 2 ч [26. W.S. Ahn, D.H. Lee, J.H. Kim, G. Seo, R. Ryoo Post-synthetic preparations of titanium-containing mesopore molecular sieves // Appl. Catal. A: General. 1999. 181. 39-49]. Конверсия фенола II в указанных условиях составляет 15 мол. %, селективность образования хинона I достигает более 98% по субстрату и 51% по H2O2. Катализатор Ti-MCM-41 получают гидротермальным синтезом с использованием коллоидного кремнезема (Ludox AS-40, 40% водный раствор), тетраэтиламмоний гидроксида (ТЕАОН, 20% водный раствор) и цетилтриметиламмоний бромида (CTMABr) в качестве темплатов и тетрабутоксититана (ТВОТ) при 105°C продолжительностью 24 ч. Состав реакционной смеси: SiO2 : 0,02 TiO2 : 0,2 ТЕАОН : 0,25 CTMABr : 31 H2O. Полученный продукт отфильтровывают, отмывают дистиллированной водой, сушат при 50°C и прокаливают при 540°C/6 ч. Катализатор Ti-MCM-41 представляет собой пористый материл с гексагональной упаковкой мезопор с удельной поверхностью 1135 м2/г, средним диаметром пор

Предлагается способ окисления фенола II 30%-ными водными растворами H2O2 [27. Пат. 5855864 США. Catalytic applications of mesoporous metallosilicate molecular sieves and methods for their preparation / T.J. Pinnavaia, P.T. Tanev, W. Zhang, J. Wang, M. Chibwe (1999)] в присутствии титансодержащих мезоструктурированных мезопористых материалов со структурой МСМ-41 и HMS, осуществляемый в среде растворителя ацетона при мольных соотношениях субстрат : ацетон = 1:270 и 1:27, субстрат : окислитель = 1:1, 1:2 и 1:6 и весовых соотношениях катализатор : субстрат = 1:1 и 1:10 при температуре 62°C в течение 2 ч. В присутствии Ti-HMS селективность образования хинона I составляет 14-98% при конверсии фенола II 33-62%; в присутствии Ti-MCM-41 селективность образования хинона I составляет 16-42% при конверсии фенола II 34-46%. Катализаторы получают путем кислотного гидролиза спиртовой смеси Si(OEt)4 и Ti(OPri)4 с использованием в качестве темплата додециламина при синтезе Ti-HMS и цетилтриметиламмоний бромида при синтезе Ti-MCM-41.
В работе [28. W. Zhang, M. Froba, J. Wang, R.T. Tanev, J. Wong, T.J. Pinnavaia Mesoporous titanosilicate molecular sieves prepared at ambient temperature by electrostatic (S+I-, S+X-I+) and neutral (S°I°) assembly pathways: A Comparison of physical properties and catalytic activity for peroxide oxidations // J. Am. Chem. Soc. 1996. 118. 9164-9171] описано окисление фенола II в смесь хинона I и дифенохинона III в присутствии Ti-MCM-41 и Ti-HMS, полученных низкотемпературным синтезом. Окисление фенола II осуществляют с использованием 10 ммоль субстрата, 100 мг катализатора, 10 мл ацетона в качестве растворителя и 30 ммоль 30%-го раствора Н2О2 при температуре 62°C в течение 2 ч. Суммарная селективность образования хинонов I и III составляет 90-91% при конверсии фенола II 55% и 22-39% в присутствии Ti-HMS и Ti-MCM-41 соответственно. К сожалению, селективность образования отдельно для хинона I в статье не приводится. Катализаторы Ti-MCM-41 и Ti-HMS получают при комнатной температуре с использованием деионизированного коллоидного кремнезема или тетраэтоксисилана (Si(OEt)4), тетраизопропилтитана (Ti(OPri)4) и длинноцепочечных алкиламмонийных солей или алкиламинов в качестве темплата в этаноле.
Сообщается, что активность титаносиликатных катализаторов со структурой HMS в окислении объемных молекул, таких как фенол II, выше, чем титаносиликатов со структурой МСМ-41. Данный факт авторы объясняют наличием в Ti-HMS значительной текстурной пористости, тогда как Ti-MCM-41 обладает преимущественной структурной мезопористостью.
Описано [29. Yong Y., Sayari A. Synthesis and catalytic properties of organically modified Ti-HMS // Stud. Surf. Sci. Catal. 2002. 141. 189-196] окисление фенола II в присутствии модифицированных органическими лигандами мезоструктурированных титансодержащих катализаторов со структурой HMS (Ti-(CH3)HMS, Ti-(CH3)2HMS; Si/Ti=50, 76 и 100) 30%-ым водным раствором пероксида водорода при 60°C в течение 2 ч в ацетоне. Максимальный выход хинона I составил 93%.
Показано, что в жидкофазном окислении фенола II водными растворами пероксида водорода активны катализаторы, полученные постсинтезом путем пришивки предшественников Ti к поверхности мезоструктурированных мезопористых силикатных материалов со структурой МСМ-41, KIT-1, МСМ-48, HMS [26; 30. K.K. Kang, W.S. Ahn Physiochemical properties of transition metal-grafted MCM-48 prepared using metallocene precursors // J. Mol. Catal. A: Chemical. 2000. 159. 403-410]. Окисление фенола II осуществляют с использованием 10 ммоль субстрата, 100 мг катализатора, 10 г ацетона в качестве растворителя и 30 ммоль 35%-го раствора H2O2 при температуре 60°C в течение 2 ч. Селективность образования хинона I достигает более 98% при конверсии фенола II 13-38 мол. %. Нанесенные катализаторы получают [26] путем суспендирования прокаленных мезопористых материалов (МСМ-41, KIT-1, МСМ-48) в этанольном растворе, содержащем расчетное количество тетрабутоксититана при перемешивании в течение 1 ч. Кроме того, Ti-KIT-1 получают методом атомного нанесения, обрабатывая дегидратированный KIT-1 парами TiCl4 при 500°C в течение 2 ч [26]. Синтез Ti-KIT-1 и Ti-MCM-48 [30] с использованием дихлорида бис(циклопентадиенил)титана Cp2TiCl2 осуществляют в 10%-ном хлороформном растворе Cp2TiCl2 с добавлением триэтаноламина для активации силанольных групп при перемешивании в течение 3 ч. Полученные материалы отфильтровывают, трижды промывают осушенным этанолом, центрифугируют, сушат при 50-80°C и прокаливают при 550°C в течение 4-5 ч.
В работе [31. S.K. Mohapatra, F. Hussain, P. Selvam Titanium substituted hexagonal mesoporous aluminophosphates: Highly efficient and selective heterogeneous catalysts for the oxidation of phenols at room temperature // Catal. Commun. 2003. 4. 57-62] описано окисление фенола II в хинон I в присутствии нового титансодержащего мезопористого алюмофосфата Ti-НМА. Отмечается высокая активность данного катализатора в окислении замещенных фенолов при комнатной температуре по сравнению с Ti-HMS и Ti-MMS. Окисление фенола II осуществляли с использованием 50 мг катализатора Ti-HMA, 10 ммоль субстрата, при мольном соотношении фенол II/H2O2=0,5 в 10 мл уксусной кислоты в качестве растворителя при температуре 27°C в течение 12 ч. Селективность образования хинона I достигала 93% при конверсии фенола II 42 мол. %. Катализатор получают с использованием изопропоксида алюминия, изопропоксида титана, фосфорной кислоты, тетраметиламмоний гидроксида (ТМАОН) и цетилтриметиламмоний хлорида (СТАС) в изопоропиловом спирте, путем гидротермальной обработки геля состава Al2O3:Р2О5:0.08TiO2:СТАС:2.5ТМАОН:70Н2О ([Al+P]/Ti=50) при 100°C в течение 72 ч. Катализатор Ti-HMA представляет собой пористый материл с гексагональной упаковкой мезопор, удельной поверхностью 957 м2/г, объемом пор 0,52 см3/г, средним диаметром пор

Таким образом, можно заключить, что системы на основе титансодержащего катализатора и пероксида водорода в качестве окислителя являются наиболее эффективными для окисления фенола II в хинон I. К недостаткам описанных выше способов можно отнести: 1) сложность синтеза катализаторов с кристаллической или упорядоченной мезофазной структурой и их высокую стоимость из-за необходимости использования дорогостоящих темплатов; 2) низкую устойчивость титансодержащих материалов с упорядоченной пористой структурой по отношению к водным растворам пероксида водорода.
В качестве прототипа выбран способ окисления фенола II в хинон I водными растворами пероксида водорода H2O2 в присутствии аморфного титаносиликата, описанный в работе [32. P.T. Tanev, M. Chibwe, T.J. Pinnavaia Titanium-containing mesoporous molecular sieves for catalytic oxidation of aromatic compounds // Nature. 1994. 368. 321-323]. Катализатор - аморфный титаносиликат с удельной поверхностью 7 м2/г - получают смешением спиртовых растворов Ti(OPri)4 и Si(OEt)4 в мольном соотношении 1:100, с последующей сушкой и прокалкой при 650°C в течение 4 ч. Окисление фенола II осуществляют 35%-ным водным раствором H2O2 в ацетоне в качестве растворителя при начальной концентрации фенола II 0,5 моль/л, мольном соотношении фенол II : H2O2 = 1:5,8 и содержании катализатора 1 мас. % (в расчете на реакционную массу). Реакцию проводят при температуре 62°C в течение 2 ч. Селективность образования хинона I составляет 67% при конверсии фенола II 12 мол. %.
К недостаткам данного способа можно отнести: 1) низкую селективность образования хинона I; 2) низкий выход хинона I; 3) низкую активность катализатора в превращении фенола II в хинон I; 4) использование большого избытка Н2О2; 5) проведение реакции окисления при высоких температурах по отношению к используемому легколетучему растворителю (ацетон, т. кип. 56°C).
Задачей настоящего изобретения является разработка способа получения 2,6-ди-трет-бутил-п-бензохинона (I) окислением 2,6-ди-трет-бутилфенола (II) водным раствором H2O2 под действием аморфного титаносиликатного катализатора с более высоким выходом и селективностью.
Решение поставленной задачи достигается тем, что способ получения 2,6-ди-трет-бутил-п-бензохинона (I) осуществляют окислением 2,6-ди-трет-бутилфенола (II) водным раствором (35%) пероксида водорода Н2О2 под действием мезопористых аморфных титаносиликатов с мольным соотношением Si/Ti=20÷80, взятых в количестве 2,5÷10 мас. % в расчете на реакционную массу. Реакцию осуществляют в реакторе периодического действия при мольном соотношении фенол II : H2O2 = 1:2÷4 в среде ацетонитрила CH3CN при 25÷60°C в течение 0,5÷2 ч. Начальная концентрация фенола II в CH3CN составляет 0,1÷0,4 моль/л.
Катализатор - мезопористый аморфный титаносиликат (MATS) - синтезируют при помощи золь-гель метода без использования темплатов. Синтез катализатора проводят с использованием смеси олигоэтоксисилоксанов марки «Этилсиликат-40» (ЭТС-40; ТУ 2435-427-05763441-2004) и спиртовых растворов TiCl4 по методике, приведенной в патентах [33. Пат. 2420455 РФ. Способ получения мезопористых аморфных смешанных элементосиликатов / Веклов В.А., Кутепов Б.И., Талипова P.P., Григорьева Н.Г. Джемилев У.М., Дроздов В.А. (2009); 34. Пат. 2422361 РФ. Способ получения мезопористых элементосиликатов / Веклов В.А., Кутепов Б.И., Талипова P.P., Григорьева Н.Г., Джемилев У.М., Дроздов В.А. (2009)].
Проведение окисления фенола II пероксидом водорода в присутствии катализаторов MATS при указанных условиях позволяет синтезировать хинон I с селективностью 97-99% при практически полной конверсии фенола II.
Преимущества предлагаемого способа:
1. Высокий выход 2,6-ди-трет-бутил-п-бензохинона (I) - 97-99%.
2. Высокая селективность образования 2,6-ди-трет-бутил-п-бензохинона (I) - 97-99%.
3. Используется высокоактивный и селективный катализатор - мезопористый аморфный титаносиликат.
4. Простота и низкая стоимость синтеза катализатора без использования дорогостоящего темплата, который используется в больших количествах.
5. Пониженный расход H2O2.
6. В качестве растворителя используют ацетонитрил, имеющий более высокую температуру кипения, чем ацетон, относящийся к особо опасным легковоспламеняющимся жидкостям.
Предлагаемый способ окисления 2,6-ди-трет-бутилфенола (II) в 2,6-ди-трет-бутил-п-бензохинон (I) иллюстрируется следующими примерами.
Пример 1. Синтез мезопористого аморфного титаносиликата с мольным соотношением Si/Ti=20 (MATS-20)
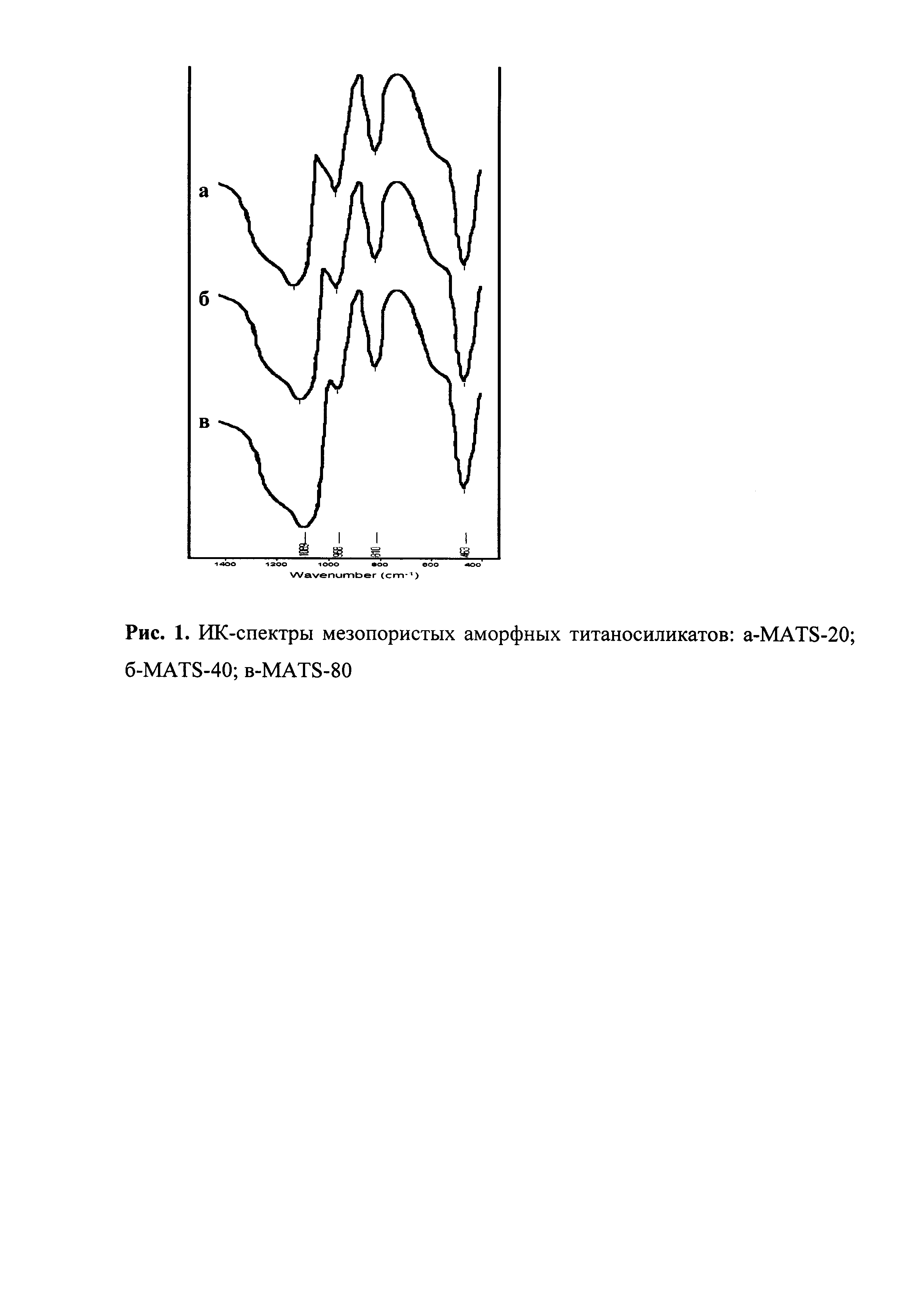
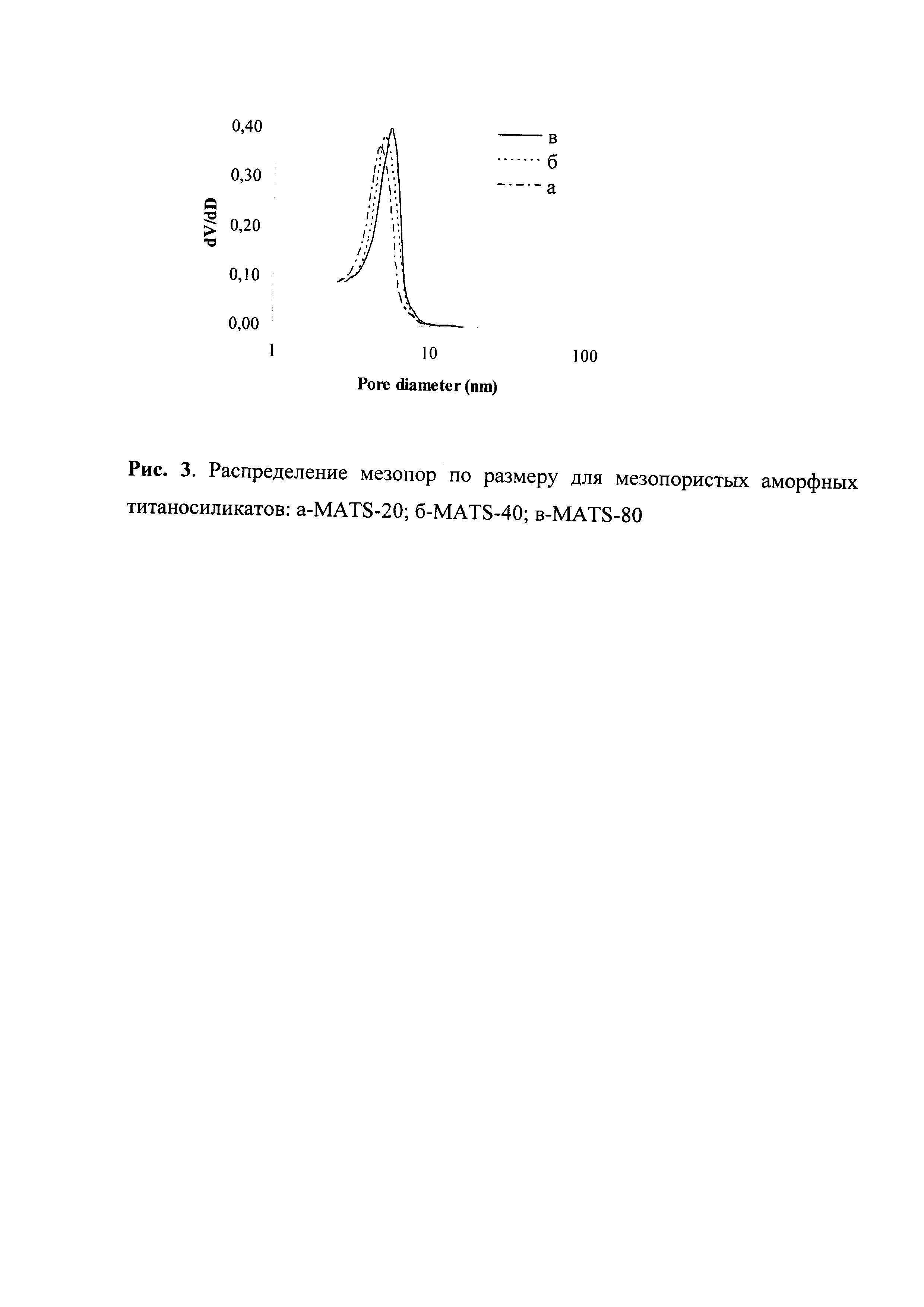
10 мл ЭТС-40 (70 ммоль SiO2) растворяют в 20 мл этилового спирта и 12 мл воды. Затем к полученному раствору ЭТС-40 при интенсивном перемешивании при комнатной температуре добавляют раствор 0,38 мл (3,50 ммоль) TiCl4 в 15 мл этилового спирта с образованием прозрачного геля. Выдерживают в термостате при 60°C в течение 24 ч, затем добавляют 1,2 мл 34%-ного аммиачного раствора (21 ммоль NH3) в 20 мл этилового спирта. Образовавшийся ксерогель сушат при 120°C в течение 8 ч и прокаливают при 550°C в течение 6 ч. Полученный титаносиликат MATS-20 имеет мольное соотношение Si/Ti=20, удельную поверхность 495 м2/г, объем мезопор 0,89 см3/г и средний диаметр пор 4,8 нм. В ИК-спектре присутствует полоса поглощения при ~960 см-1, свидетельствующая об образовании связи Ti-O-Si (рис. 1а). Изотерма адсорбции-десорбции азота (рис. 2а) имеет изотерму IV типа с петлей гистерезиса H1 и характерна для мезопористых материалов с узким распределением пор по размеру. На рис. 3а показано распределение пор по размеру. Спектр УФ-ДО (рис. 4а) имеет полосу поглощения с максимумом при 230 нм, которую относят к изолированному состоянию титана в искаженном тетраэдрическом координационном окружении.
Пример 2. Аналогично примеру 1, за исключением количества TiCl4, которое составляло 0,19 мл (1,75 ммоль). Полученный титаносиликат MATS-40 имеет мольное соотношение Si/Ti=40, удельную поверхность 505 м2/г, объем мезопор 0,92 см3/г и средний диаметр пор 4,9 нм. На рис. 1, 2, 3 и 4 представлены данные ИКС, адсорбции-десорбции азота, распределение пор и УФ-ДО, соответственно.
Пример 3. Аналогично примеру 1, за исключением количества TiCl4, которое составляло 0,10 мл (0,88 ммоль). Полученный титаносиликат MATS-80 имеет мольное соотношение Si/Ti=80, удельную поверхность 560 м2/г, объем мезопор 0,99 см3/г и средний диаметр пор 5,0 нм. На рис. 1, 2, 3 и 4 представлены данные ИКС, адсорбции-десорбции азота, распределение пор и УФ-ДО, соответственно.
Пример 4. Получение 2,6-ди-трет-бутил-п-бензохинона (I)
В стеклянный реактор с мешалкой, обратным холодильником и термометром загружают 5 мл ацетонитрила, 0,20 г (1,0 ммоль) фенола II, 0,45 г катализатора MATS-20, при перемешивании термостатируют до заданной температуры 40°C, после чего в реактор подают 0,39 мл 35%-го водного раствора H2O2 (4,0 ммоль Н2О2). Суспензию перемешивают при 40°C в течение 1 ч. Конверсия фенола II составляет 82 мол. %, селективность образования хинона 1-97 мол. %.
Пример 5. Аналогично примеру 4, за исключением катализатора - MATS-40 в количестве 0,11 г (2,5% на р.м.), температуры 60°C и продолжительности 0,5 ч. Конверсия фенола II составляет 36 мол. %, селективность образования хинона I - 99 мол. %.
Пример 6. Аналогично примеру 5, за исключением количества катализатора MATS-40 - 0,23 г (5% на р.м.). Конверсия фенола II составляет 55 мол. %, селективность образования хинона I - 99 мол. %.
Пример 7. Аналогично примеру 5, за исключением количества катализатора MATS-40 - 0,45 г (10% на р.м.). Конверсия фенола II составляет 64 мол. %, селективность образования хинона I - 99 мол. %.
Пример 8. Аналогично примеру 7, за исключением температуры 25°C и продолжительности 1 ч. Конверсия фенола II составляет 28 мол. %, селективность образования хинона I - 99 мол. %.
Пример 9. Аналогично примеру 8, за исключением количества катализатора - 0,43 г (10% на р.м.), температуры 40°C и количества окислителя - 0,19 мл 35%-го водного раствора H2O2 (2,0 ммоль H2O2). Конверсия фенола II составляет 50 мол. %, селективность образования хинона I - 99 мол. %.
Пример 10. Аналогично примеру 9, за исключением количества фенола II - 0,10 г (0,5 ммоль), количества катализатора - 0,42 г (10% на р.м.), количества окислителя - 0,19 мл 35%-го водного раствора H2O2 (2,0 ммоль H2O2) и продолжительности 0,5 ч. Конверсия фенола II составляет 42 мол. %, селективность образования хинона I - 99 мол. %.
Пример 11. Аналогично примеру 10, за исключением количества фенола II - 0,20 г (1,0 ммоль), количества катализатора - 0,45 г (10% на р.м.) и количества окислителя - 0,39 мл 35%-го водного раствора H2O2 (4,0 ммоль H2O2). Конверсия фенола II составляет 50 мол. %, селективность образования хинона I - 99 мол. %.
Пример 12. Аналогично примеру 4, за исключением катализатора MATS-40. Конверсия фенола II составляет 75 мол. %, селективность образования хинона I - 98 мол. %.
Пример 13. Аналогично примеру 11, за исключением продолжительности 2 ч. Конверсия фенола II составляет 100 мол. %, селективность образования хинона I - 97 мол. %.
Пример 14. Аналогично примеру 10, за исключением количества фенола II - 0,41 г (2,0 ммоль), количества катализатора - 0,51 г (10% на р.м.) и количества окислителя - 0,78 мл 35%-го водного раствора Н2О2 (8,0 ммоль Н2О2). Конверсия фенола II составляет 53 мол. %, селективность образования хинона I - 99 мол. %.
Пример 15. Аналогично примеру 4, за исключением катализатора MATS-80. Конверсия фенола II составляет 55 мол. %, селективность образования хинона I - 99 мол. %.

Реферат
Настоящее изобретение относится к способу получения 2,6-ди-трет-бутил-п-бензохинона (I), используемого в качестве высокоактивного антиоксиданта, регулятора и стимулятора роста растений, а также фармацевтического интермедиата. Способ заключается в окислении 2,6-ди-трет-бутилфенола (II) 35%-ным водным раствором пероксида водорода НОв присутствии титаносиликатного катализатора. При этом в качестве катализатора используют мезопористый аморфный титаносиликат с мольным соотношением Si/Ti=20÷80, взятый в количестве 2,5÷10 мас. % в расчете на реакционную массу, реакцию проводят при мольном соотношении фенол II : НО=1:2÷4, в среде ацетонитрила CHCN, при начальной концентрации фенола II в CHCN 0,1÷0,4 моль/л, температуре 25÷60°C и продолжительности 0,5÷2 ч. Предлагаемый способ позволяет получить I с селективностью и выходом 97÷99 мол. %. 4 ил., 1 табл., 15 пр.

Комментарии