Вакцины на основе солюбилизированных и комбинированных капсулярных полисахаридов - RU2528066C2
Код документа: RU2528066C2
Чертежи











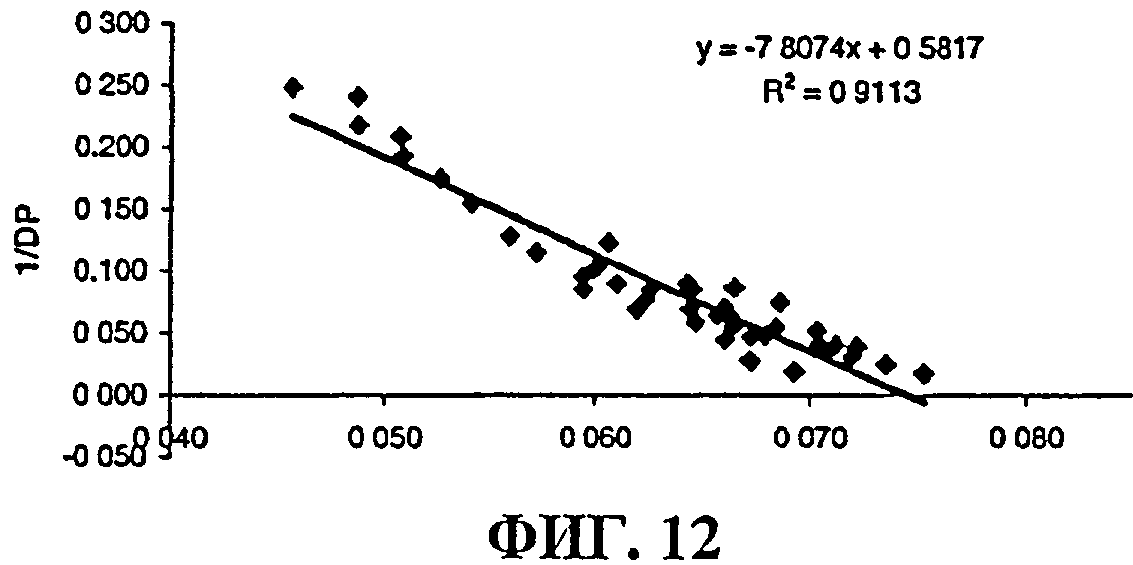







Описание
Техническая область
Настоящее изобретение относится к вакцинам, в частности против инфекции и болезни, вызванной менингококками.
Предпосылки к созданию настоящего изобретения
Neisseria meningitidis представляет собой грамотрицательный патоген, поражающий человека. Она колонизирует глотку, вызывая менингит и, изредка, септицемию при отсутствии менингита. Она является близкородственной по отношению к N.gonorrhoeae, хотя одним признаком, который четко дифференцирует менингококк, является наличие полисахаридной капсулы, которая имеется у всех патогенных менингококков.
На основе капсулярного полисахарида данного микроорганизма идентифицировано двенадцать серогрупп N.meningitidis (А, В, С, Н, I, К, L, 29Е, W135, X, Y и Z). Группа А представляет собой патоген, который наиболее часто является причиной болезни в Африке южнее Сахары. Серогруппы В и С ответственны за абсолютное большинство случаев в США и наиболее развитых странах. Серогруппы W135 и Y ответственны за остальные случаи в США и развитых странах.
Капсулярные полисахариды N. meningitidis обычно получают с помощью способа, включающего стадии осаждения полисахаридов (например, с использованием катионного детергента), выделение фракции этанолом, экстракцию холодным фенолом (для удаления белка) и ультрацентрифугирование (для удаления LPS) [например, ссылка 1].
Четырехвалентная вакцина из капсулярных полисахаридов серогрупп А, С, Y и W135 известна много лет [2, 3] и лицензирована для применения для людей. Несмотря на эффективность для подростков и взрослых людей она вызывает слабый иммунный ответ и короткую продолжительность защиты и не может использоваться для детей младшего возраста (например, 4]. Это происходит потому, что полисахариды представляют собой независимые от Т-клеток антигены, которые вызывают слабый иммунный ответ, который невозможно усилить. Полисахариды в указанной вакцине не конъюгированы и присутствуют в соотношении 1:1:1:1 [5]. MENCEVAX ACWY™ содержит 50 мкг каждого очищенного полисахарида после повторного растворения из его лиофилизированной формы.
Конъюгированные олигосахариды серогруппы С также разрешены для применения у людей (например, Menjugate™; ссылка 6]. Однако сохраняется необходимость улучшения конъюгированных вакцин против серогрупп A, W135 и Y и их производства.
Описание изобретения
Настоящее изобретение относится к способу очистки бактериального капсулярного полисахарида, включающему стадии (а) осаждения указанного полисахарида с последующей (b) солюбилизацией осажденного полисахарида с использованием этанола. Полисахарид можно использовать для изготовления вакцин, таких как конъюгированные вакцины, в частности против серогрупп A, W135 и Y N.meningitidis.
Осаждение и солюбилизация с использованием этанола
Специалистам известно много методик для осаждения растворимых полисахаридов. В предпочтительных способах используют один или более катионных детергентов. Детергенты предпочтительно имеют следующую общую формулу:

где: R1, R2 и R3 являются идентичными или различаются между собой и каждый обозначает алкил или арил; или R1 и R2 вместе с атомом азота, к которому они присоединены, образуют 5-6-членное насыщенное гетероциклическое кольцо, a R3 обозначает алкил или арил; или R1, R2 и R3 вместе с атомом азота, к которому они присоединены, образуют 5-6-членное гетероциклическое кольцо, ненасыщенное у атома азота,
R4 обозначает алкил или арил, и
X- обозначает анион.
Особенно предпочтительными детергентами для применения в данном способе являются соли тетрабутиламмония и цетилтриметиламмония (например, бромидные соли). Бромид цетилтриметиламмония («СТАВ») является особенно предпочтительным [8]. СТАВ известен также как бромид гексадецилтриметиламмония, бромид цетримония, Cetavlon и Centimide. Другие детергенты включают бромид гексадиметрина и соли миристилтриметиламмония.
Капсулярные полисахариды высвобождаются в среду во время культивирования. Соответственно, исходным материалом для осаждения обычно будет надосадочная жидкость после центрифугирования бактериальной культуры или концентрированная культура.
Стадия осаждения может быть избирательной по отношению к полисахаридам, но она обычно будет также вызывать соосаждение и других компонентов (например, белков, нуклеиновой кислоты и т.п.).
Осажденный полисахарид перед солюбилизацией можно собирать центрифугированием.
После осаждения полисахарид (обычно в форме комплекса с катионным детергентом) ресолюбилизируют. Предпочтительно использовать растворитель, который является относительно избирательным по отношению к полисахаридам, с целью свести к минимуму содержание примесей (например, белков, нуклеиновой кислоты и т.п.). Как было установлено, с этой точки зрения преимущества имеет этанол, и он является высокоизбирательным по отношению к СТАВ-полисахаридному комплексу. Можно использовать другие низшие спирты (например, метанол, пропан-1-ол, пропан-2-ол, бутан-1-ол, бутан-2-ол, 2-метилпропан-1-ол, 2-метилпропан-2-ол, диолы и т.п.)
Этанол предпочтительно добавляют к осажденному полисахариду до получения конечной концентрации этанола (на основе общего содержания этанола и воды) от 50% до 95% (например, около 55%, 60%, 65%, 70%, 75%, 80%, 85% или около 90%) и, предпочтительно, от 75% до 95%. Оптимальная конечная концентрация этанола может зависеть от серогруппы бактерии, из которой получают полисахарид.
Этанол можно добавлять к осажденному полисахариду в чистой форме или в разбавленной смешиваемым растворителем форме (например, водой). Предпочтительными смесями растворителей являются смеси этанол:вода с предпочтительными соотношениями приблизительно от 70:30 до 95:5 (например, 75:25, 80:20, 85:15, 90:10).
В противоположность способу, описанному в ссылке 9, в данном способе используется катионный детергент, а не анионный детергент. В отличие от способа, описанного в ссылке 10, полисахарид ресолюбилизируют с использованием этанола, а не катионного обмена с использованием солей кальция или магния. В отличие от способа, описанного в ссылке 11, осаждение не требует инертной пористой подложки. Помимо этого, в отличие от известных ранее способов, спирт используют скорее для ресолюбилизации полисахарида, чем для его осаждения.
Бактериальный капсулярный полисахарид обычно получают из Neisseria. Предпочтительно, его получают из N.meningitidis, включая серогруппы А, В, С, W135 и Y. Предпочтительными серогруппами являются A, W135 и Y.
Способ также подходит для получения капсулярного полисахарида из Haemophilus influenzae (особенно типа В или «Hib») и из Streptococcus pneumoniae (пневмококка).
Дальнейшая обработка солюбилизированного полисахарида
После ресолюбилизации полисахарид можно подвергать дальнейшей обработке для удаления примесей. Это особенно важно в тех ситуациях, когда даже минимальная контаминация является неприемлемой (например, для изготовления вакцин для человека). Обычно указанная обработка будет включать одну или более стадий фильтрации.
Можно использовать объемную фильтрацию. Это является особенно пригодным для очистки.
Можно использовать фильтрацию через активированный уголь. Это является пригодным для удаления пигментов и следовых количеств органических соединений. Данный процесс можно повторять до получения, например, ОП275нм<0,2.
Можно использовать фильтрацию по размеру или ультрафильтрацию.
После фильтрования для удаления примесей полисахарид можно осаждать для дальнейшего воздействия и/или обработки. Удобно осуществлять данный процесс с использованием обмена катионов (например, добавлением солей кальция или натрия).
Полисахарид можно химически модифицировать. Например, его можно модифицировать заменой одной или более гидроксильных групп на блокирующие группы. Это особенно пригодно для MenA [12]. Полисахариды из серогруппы В можно N-пропионилировать [13].
Полисахарид (необязательно модифицированный) обычно гидролизуют для получения олигосахаридов. Это предпочтительно осуществляют для получения конечной средней степени полимеризации (DP) в олигосахариде менее 30 (например, от 10 до 20, предпочтительно, приблизительно 10 для серогруппы А; от 15 до 25 для серогрупп W135 и Y, предпочтительно, приблизительно 15-20; и т.п.). Для использования в вакцинах олигосахариды предпочтительнее полисахаридов. DP удобно можно измерять использованием ионообменной хроматографии или колориметрических анализов [14].
Если проводят гидролиз, то гидролизат обычно разделяют по размерам с целью удаления коротких олигосахаридов. Этого можно добиваться различными путями, такими как ультрафильтрация с последующей ионообменной хроматографией. Олигосахариды со степенью полимеризации, менее или равной приблизительно 6, предпочтительно удаляют в случае серогруппы А, а те из них, которые имеют степень полимеризации менее приблизительно 4, предпочтительно удаляют в случае серогрупп W135 и Y.
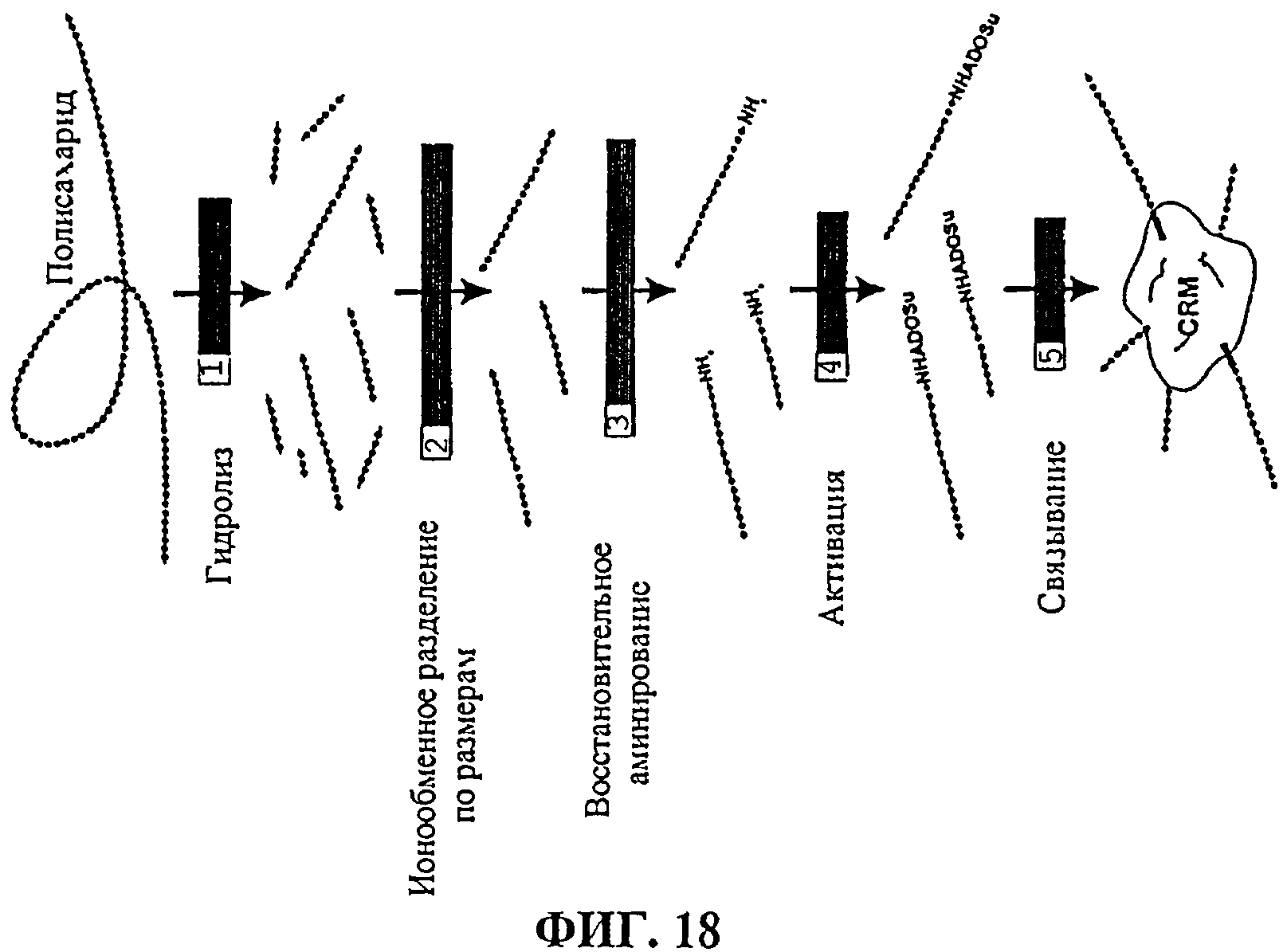
Для усиления иммуногенности полисахариды или олигосахариды по настоящему изобретению предпочтительно конъюгируют с носителем (фиг.18). Конъюгация с белками-носителями является особенно пригодной для педиатрических вакцин [например, ссылка 15] и представляет собой хорошо известную методику [например, обзор в ссылках от 16 до 24 и т.п.].
Предпочтительными белками-носителями являются бактериальные токсины или анатоксины, такие как дифтерийный или столбнячный анатоксины. Дифтерийный анатоксин CRM197 [25, 26, 27] является особенно предпочтительным. Другие подходящие белки-носители включают белок внешней оболочки N.meningitidis [28], синтетические пептиды [29, 30], белки теплового шока [31, 32], коклюшные белки [33, 34], цитокины [35], лимфокины [35], гормоны [35], факторы роста [35], искусственные белки, включающие множественные человеческие CD4+Т-клеточные эпитопы из различных полученных из патогенов антигенов [36, белок D из H.influenzae [37], токсин А или В из С.difficile [38] и т.п. Возможно использование смесей белков-носителей.
Конъюгаты с соотношением (масс./масс.) сахарид:белок от 0,5:1 (т.е. с избытком белка) до 5:1 (т.е. с избытком сахарида) являются предпочтительными, а конъюгаты с соотношением от 1:1,25 до 1:2,5 являются более предпочтительными.
Один белок-носитель может нести множество различных сахаридов [39]. Конъюгаты можно использовать в сочетании со свободным белком-носителем [40].
Можно использовать любую подходящую реакцию конъюгации с любым подходящим линкером, если это необходимо.
Сахарид обычно активируют или функционализируют перед конъюгацией. В активации могут участвовать, например, цианилирующие агенты, такие как CDAP (например, тетрафторборат 1-циан-4-диметиламинопиридиния [41, 42 и т.п.]). В других подходящих методиках используют карбодиимиды, гидразиды, активные сложные эфиры, норборан, п-нитробензойную кислоту, N-гидроксисукцинимид, S-NHS, EDC, TSTU; см. также введение в ссылке 22).
Связи посредством линкерной группы можно осуществить с помощью любой известной методики, например с помощью методик, описанных в ссылках 43 и 44. Один тип связи включает восстановительное аминирование полисахарида, связывание полученной аминогруппы с одним концом линкерной группы адипиновой кислоты, а затем связывание белка с другим концом линкерной группы адипиновой кислоты [20, 45, 46]. Другие линкеры включают В-пропионамидо [47], нитрофенилэтиламин [48], галогенацильные галогеноиды [49], гликозидные связи [50], 6-аминокапроновую кислоту [51], ADH [52], компоненты с С4-С12 [53] и т.п. В качестве альтернативы использованию линкера можно использовать прямую связь. Прямые связи с белком могут включать окисление полисахарида с последующим восстановительным аминированием с белком, как описано, например, в ссылках 54 и 55.
Способ, включающий введение аминогрупп в сахарид (например, путем замены концевых =O групп на -NH2) с последующей дериватизацией диэфиром адипиновой кислоты (например, N-гидроксисукцинимидного диэфира адипиновой кислоты) и взаимодействием с белком-носителем, является предпочтительным.
После конъюгации свободные и конъюгированные сахариды можно отделять друг от друга. Существует множество подходящих способов, включая гидрофобную хроматографию, тангенциальную ультрафильтрацию, диафильтрацию и т.п. [см. также ссылки 56 и 57 и т.п.].
Смеси и композиции, включающие сахариды
Олигосахариды, полисахариды и конъюгаты по настоящему изобретению можно смешивать с другими биологическими молекулами. Смеси сахаридов из более чем одной серогруппы N.meningitidis являются предпочтительными, например, композиции, включающие сахариды из серогрупп А+С, A+W135, A+Y, C+W135, C+Y, W135+Y, A+C+W135, A+C+Y, C+W135+Y, A+C+W135+Y и т.п. Предпочтительно, чтобы протективная эффективность отдельных сахаридных антигенов не устранялась после их объединения, хотя истинная иммуногенность (например, титры ELISA) может снижаться.
В случае когда используется сахарид из серогруппы С, он предпочтительно имеет от ~12 до ~22 повторяющихся единиц.
Сахариды из различных серогрупп N.meningitidis можно конъюгировать с одними и теми же или различными белками-носителями.
В случае когда смесь включает капсулярные сахариды из обеих серогрупп А и С, предпочтительно, чтобы соотношение (масс./масс.) сахарид MenА:сахарид MenС было более 1 (например, 2:1, 3:1, 4:1, 5:1, 10:1 или более). Неожиданно было установлено, что компонент MenА обладает улучшенной иммуногенностью, когда он имеется в избытке (масса/доза) по сравнению с компонентом МеnС.
В случае когда смесь включает капсулярные сахариды (например, олигосахариды) из серогруппы W135 и по меньшей мере из одной из серогрупп А, С и Y, неожиданно было установлено, что иммуногенность сахарида MenW135 выше, когда его вводят в комбинации с сахаридом (сахаридами) из другой серогруппы (серогрупп), чем когда его вводят в отдельности (в той же дозировке и т.п.) [сравн. со ссылкой 58]. Таким образом, способность антигена MenW135 вызывать иммунный ответ больше, чем иммунный ответ, вызываемый эквивалентным количеством того же самого антигена после введения без ассоциации с антигенами из других серогрупп. Указанная усиленная иммуногенность может быть установлена путем введения антигена MenW135 контрольным животным, а смеси - экспериментальным животным, и сравнения титров антител против указанных двух с использованием стандартных анализов, таких как бактерицидные титры, радиоиммунный анализ и анализы ELISA и т.п. Вакцины, включающие синергические комбинации сахаридов из серогруппы W135 и других серогрупп, имеют преимущества в иммунологическом смысле. Они позволяют усилить анти-№135 ответы и/или уменьшить дозы W135.
В случае когда смесь включает капсулярные сахариды из серогруппы Y и один или оба из серогрупп С и W135, предпочтительно, чтобы соотношение (масс./масс.) сахарид МеnY:сахарид MenW135 было более 1 (например, 2:1, 3:1, 4:1, 5:1, 10:1 или более), и/или соотношение (масс./масс.) сахарид МеnY:сахарид МеnС было менее 1 (например, 1:2, 1:3, 1:4, 1:5 или менее).
Предпочтительными соотношениями (масс./масс.) для сахаридов из серогрупп A:C:W135:Y являются: 1:1:1:1, 1:1:1:2, 2:1:1:1, 4:2:1:1, 8:4:2:1, 4:2:1:2, 8:4:1:2, 4:2:2:1, 2:2:1:1, 4:4:2:1, 2:2:1:2, 4:4:1:2 и 2:2:2:1.
Смеси могут также включать белки. Предпочтительно включать белки из серогруппы В N. meningitidis [например, ссылки с 59 по 64] или препараты OMV [например, ссылки с 65 по 68 и т.п.].
Можно включать также антигены, не имеющие отношения к менингококку и нейсерии, предпочтительно, такие, которые не уменьшают иммунный ответ против менингококковых компонентов. В ссылке 69, например, описаны комбинации олигосахаридов из серогрупп В и С N. meningitidis с сахаридом Hib. Предпочтительными являются антигены из пневмококка, вируса гепатита А, вируса гепатита В, В.pertussis, дифтерии, столбняка, Helicobacter pylori, полиомиелита и/или Н.influenzae. Особенно предпочтительные антигены, не имеющие отношения к нейсерии, включают:
- антигены из Helicobacter pylori, такие как СаgА [с 70 по 73], VacA [74, 75], NAP [76, 77, 78], НорХ [например, 79], HopY [например, 79] и/или уреазу,
- сахаридный антиген из Streptococcus pneumoniae [например, 80, 81, 82],
- антиген из вируса гепатита А, такой как инактивированный вирус [например, 83, 84],
- антиген из вируса гепатита В, такой как поверхностный и/или сердцевинный антигены [например, 84, 85], поверхностный антиген предпочтительно адсорбирован на фосфате алюминия [86],
- сахаридный антиген из Haemophilus influenzae В [например, 87], предпочтительно, неадсорбированный или адсорбированный на фосфате алюминия [88],
- антиген из вируса гепатита С [например, 89],
- антиген из N. gonorrhoeae [например, с 59 по 62],
- антиген из Chlamydia pneumoniae [например, ссылки с 90 по
96],
- антиген из Chlamydia trachomatis [например, 97],
- антиген из Porphyromonas gingivalis [например, 98],
- антиген (антигены) из вируса полиомиелита [например, 99, 100], такой как IPV,
- антиген (антигены) из вируса бешенства [например, 101], такой как лиофилизированный инактивированный вирус [например, 102, RabAvert™],
- антигены кори, эпидемического паротита и/или краснухи [например, главы 9, 10 и 11 ссылки 103],
- антиген (антигены) из вируса гриппа [например, глава 19 ссылки 103], такой как поверхностные белки гемагглютинин и/или нейраминидаза,
- антиген из Moraxella catarrhalis [например, 104],
- антиген из Streptococcus agalactiae (стрептококка группы В) [например, 105, 106],
- антиген из Streptococcus pyogenes (стрептококка группы А) [например, 106, 107, 108],
- антиген из Staphylococcus aureus [например, 109],
- антиген (антигены) из парамиксовируса, такого как респираторно-синцитиальный вирус (RSV [110, 111] и/или вирус парагриппа (PIV3 [112]),
- антиген из Bacillus anthracis [например, 113, 114, 115],
- антиген из вируса семейства flaviviridae (род flavivirus), такого как вирус желтой лихорадки, вирус японского энцефалита, четыре серотипа вирусов Денге, вирус клещевого энцефалита, вирус лихорадки западного Нила,
- пестивирусный антиген, такой как антиген из вируса классической лихорадки свиней, вирус вирусной диареи крупного рогатого скота и/или вирус пограничной болезни,
- парвовирусный антиген, например из парвовируса В19,
- столбнячный анатоксин [например, ссылка 116],
- коклюшный голотоксин (РТ) и нитевидный гемагглютинин (FHA) из В.pertussis, необязательно также в комбинации с пертактином и/или агглютиногенами 2 и 3 [например, ссылки 117 и 118],
- клеточный коклюшный антиген.
Смесь может включать один или более. из указанных дополнительных антигенов, которые могут быть подвергнуты детоксикации, когда это необходимо (например, детоксикация коклюшного токсина химическими и/или генетическими средствам).
В случае, когда в смесь включен дифтерийный антиген, предпочтительно также включать столбнячный антиген и коклюшные антигены. Подобно этому, когда в смесь включен столбнячный антиген, предпочтительно также включать дифтерийный и коклюшный антигены. Подобно этому, когда в смесь включен коклюшный антиген, предпочтительно также включать дифтерийный и столбнячный антигены.
Антигены в смеси обычно будут присутствовать в концентрации по меньшей мере 1 мкг/мл каждый. В общих чертах, концентрация любого данного антигена будет достаточной для того, чтобы вызвать иммунный ответ против данного антигена.
В качестве альтернативы использования белковых антигенов в смеси можно использовать нуклеиновую кислоту, кодирующую антиген. Белковые компоненты смеси, таким образом, можно заменять на нуклеиновую кислоту (предпочтительно, ДНК, например, в форме плазмиды), которая кодирует белок.
Поливалентные сахаридные вакцины
Настоящее изобретение относится также к вакцинам и иммуногенным композициям, включающим капсулярные сахариды по меньшей мере из двух (т.е. 2, 3 или 4) из серогрупп А, С, W135 и Y N.meningitidis, в которых указанные капсулярные сахариды конъюгированы с белком-носителем (белками-носителями) и/или представляют собой олигосахариды. В случае когда в вакцине имеются только два конъюгированных олигосахарида или полисахарида из серогрупп А, С, W135 и Y, они предпочтительно не из серогрупп А и С (сравн. со ссылками 6, 119 и 120). Предпочтительные композиции включают сахариды из серогрупп С и Y. Другие предпочтительные композиции включают сахариды из серогрупп С, W135 и Y.
Настоящее изобретение относится к иммуногенной композиции, включающей конъюгат олигосахарида серогруппы А и конъюгат олигосахарида серогруппы С и дополнительно включающей (i) адъювант - фосфат алюминия или гидроксид алюминия и (и) буфер. В случае когда композиция включает в качестве адъюванта фосфат алюминия, буфер предпочтительно представляет собой фосфатный буфер; в случае когда композиция включает в качестве адъюванта гидроксид алюминия, буфер предпочтительно представляет собой гистидиновый буфер.
В случае когда вакцина включает капсулярный сахарид из серогруппы А, то предпочтительно комбинировать сахарид серогруппы А с другим сахаридом (сахаридами) непосредственно перед применением, чтобы свести к минимуму его гидролиз (сравн. сахариды Hib). Удобно осуществить данный этап, если компонент серогруппы А находится в лиофилизированной форме, а компонент(ы) другой серогруппы находится (находятся) в жидкой форме и его используют для повторного растворения лиофилизированного компонента перед применением. Жидкий компонент предпочтительно включает в качестве адъюванта соль алюминия, в то время как лиофилизированный компонент серогруппы А может включать или может не включать в качестве адъюванта соль алюминия.
Таким образом, настоящее изобретение относится к набору, включающему: (а) капсулярный сахарид из серогруппы А N.meningitidis в лиофилизированной форме; и (b) капсулярный сахарид (сахариды) из одной или более (например, 1, 2, 3) серогрупп С, W135 и Y N.meningitidis в жидкой форме. Сахариды, предпочтительно, конъюгированы с белком-носителем (белками-носителями) и/или представляют собой олигосахариды. Набор может иметь форму двух флаконов.
Настоящее изобретение относится также к способу изготовления вакцинной композиции по настоящему изобретению, включающему смешивание лиофилизированного капсулярного сахарида из серогруппы А N.meningitidis с капсулярным сахаридом (сахаридами) из одной или более (например, 1, 2, 3) серогрупп С, W135 и Y, N.meningitidis, причем указанный один или более сахаридов находятся в жидкой форме.
Настоящее изобретение относится также к набору, включающему: (а) конъюгированный капсулярный олигосахарид из серогруппы А N.meningitidis в лиофилизированной форме; и (b) один или более дополнительных антигенов в жидкой форме. Дополнительный антиген может представлять собой или может не представлять собой конъюгированный капсулярный олигосахарид из серогруппы С N. meningitidis.
Иммуногенные композиции и вакцины
Полисахариды, олигосахариды и конъюгаты по настоящему изобретению являются особенно подходящими для включения в иммуногенные композиции и вакцины. Способ по настоящему изобретению может, следовательно, включать стадию изготовления из полисахарида, олигосахарида или конъюгата иммуногенной композиции или вакцины. Изобретение относится к композиции или вакцине, получаемой указанным путем.
Иммуногенные композиции и вакцины по настоящему изобретению, помимо менингококковых сахаридов, обычно будут включать «фармацевтически приемлемые носители», которые включают любой носитель, который сам по себе не вызывает выработки антител, вредных для индивидуума, которому вводят композицию. Подходящие носители обычно представляют собой большие, медленно метаболизируемые макромолекулы, такие как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимеризованные аминокислоты, аминокислотные сополимеры, трегалоза [121], липидные агрегаты (такие как масляные капельки или липосомы) и частицы неактивного вируса. Указанные носители хорошо известны специалистам. Вакцины могут также содержать разбавители, такие как вода, физиологический раствор, глицерин и т.п. Помимо этого, могут присутствовать вспомогательные вещества, такие как увлажняющие или эмульгирующие агенты, вещества, корригирующие рН, и т.п. Полное обсуждение фармацевтически приемлемых наполнителей можно найти в ссылке 122.
Иммуногенные композиции, используемые в качестве вакцин, включают иммунологически эффективное количество сахаридного антигена, а также любой другой из упомянутых выше компонентов, если это необходимо. Под «иммунологически эффективным количеством» подразумевается, что введение указанного количества индивидууму, как в виде однократной дозы, так и в виде части серии, является эффективным для лечения или профилактики.
Указанное количество варьирует в зависимости от состояния здоровья и физического состояния индивидуума, подвергаемого лечению, возраста, таксономической группы индивидуума, подвергаемого лечению (например, примат, не являющийся человеком, примат и т.п.), способности иммунной системы индивидуума синтезировать антитела, желательной степени защиты, состава вакцины, оценки лечащим врачом медицинской ситуации и других имеющих значение факторов. Ожидается, что количество будет заключаться в относительно обширных пределах, которые могут быть определены в ходе обычных испытаний. Схема введения может представлять собой однократную дозу или многократные дозы (например, схему, включающую бустер-дозы). Вакцину можно вводить в сочетании с другими иммунорегулирующими агентами.
Вакцина может включать адъювант. Предпочтительные адъюванты для усиления эффективности композиции включают, без ограничения: (1) алюминиевые соли (квасцы), такие как гидроксиды алюминия (включая оксигидроксиды), фосфаты алюминия (включая гидроксифосфаты), сульфат алюминия и т.п. [главы 8 и 9 в ссылке 123]; (2) эмульсионные композиции типа «масло-в-воде» (содержащие или не содержащие другие специфичные иммуностимулирующие агенты, такие как мурамиловые пептиды [мурамиловые пептиды включают N-ацетилмурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетилнормурамил-L-аланил-D-изоглутамин (nor-MDP), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-дипальмитоил-БП-глицеро-3-гидроксифосфорилокси)этиламин МТР-РЕ) и т.п.] или компоненты клеточной стенки бактерий), такие как, например, (a) MF59™ [глава 10 в ссылке 123; 124, 125], содержащий 5% Squalene, 0,5% Tween 80 и 0,5% Span 85 (необязательно содержащий МТР-РЕ), изготовленный в виде субмикронных частиц с использованием микрофлуидизирующего оборудования, (b) SAF, содержащий 10% Squalane, 0,4% Tween 80, 5% pluronic-блокированного полимера L121, и thr-MDP, микрофлуидизированный в субмикронную эмульсию или обработанный вихревым смешением для получения эмульсии с частицами большего размера, и (с) адъювантная система Ribi™ (RAS), (Ribi Immunochem, Hamilton, MT), содержащая 2% Squalene, 0,2% Tween 80 и один или более компонентов бактериальной клеточной стенки из группы, состоящей из монофосфориллипида A (MPL), димиколята трегалозы (TDM) и скелета клеточной стенки (CWS), предпочтительно, MPL+CWS (Detox™); (3) сапониновые адъюванты [глава 22 ссылки 123], такие как QS21 или Stimulon™ (Cambridge Bioscience, Worcester, MA), в простой форме или в форме выработанных из них частиц, таких как ISCOM (иммуностимулирующие комплексы; глава 23 ссылки 123), указанные ISCOM могут быть лишены дополнительного детергента, например, ссылка 126; (4) полный адъювант Фрейнда (CFA) и неполный адъювант Фрейнда (IFA); (5) цитокины, такие как интерлейкины (например, IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-12 [127] и т.п.), интерфероны (например, гамма-интерферон), колониестимулирующий фактор макрофагов (М-CSF), фактор некроза опухолей (TNF) и т.п.; (6) монофосфориллипид A (MPL) или 3-О-деацилированный MPL (3dMPL), например, ссылки 128 и 129, необязательно, при практическом отсутствии квасцов, если используется с пневмококковыми сахаридами, например, ссылка 130; (7) комбинации , например, с QS21 и/или эмульсиями типа «масло-в-воде», например, ссылки 131, 132 и 133; (8) олигонуклеотиды, включающие мотивы CpG (Roman et al., Nat. Med., 1997, 3, 849-854; Werner et al., PNAS USA, 1997, 94, 10833-10837; Davis et al., J. Immunol., 1998, 160, 870-876; Chu et al., J. Exp.Med., 1997, 186, 1623-1631; Lipford et al., Eur. J. Immunol., 1997, 27, 2340-2344; Moldoveanu et al., Vaccine, 1988, 16, 1216-1224, Krieg et al., Nature, 1995, 374, 546-549; Klinman et al., PNAS USA, 1996, 93, 2879-2883; Ballas et al., J. Immunol., 1996, 157, 1840-1845; Cowdery et al., J. Immunol., 1996, 156, 4570-4575; Halpern et al., Cell. Immunol., 1996, 167, 72-78; Yamamoto et al., Jpn. J. Cancer Res., 1988, 79, 866-873; Stacey et al., J. Immunol., 1996, 157, 2116-2122; Messina et al., J. Immunol., 1991, 147, 1759-1764; Yi et al., J. Immunol., 1996, 157, 4918-4925; Yi et al., J. Immunol., 1996, 157, 5394-5402; Yi et al., J. Immunol., 1998, 160, 4755-4761 и Yi et al., J. Immunol., 1998, 160, 5898-5906; международные патентные заявки WO 96/02555, WO 98/16247, WO 98/18810, WO 98/40100, WO 98/55495, WO 98/37919 и WO 98/52581), т.е. содержащие по меньшей мере один динуклеотид CG, в котором 5-метилцитозин, необязательно, используется вместо цитозина; (8) полиоксиэтиленовый эфир или полиоксиэтиленовый сложный эфир, например, ссылка 134; (9) сложный эфир полиоксиэтилена и сорбитана как поверхностно-активный агент в комбинации с октоксинолом [135] или полиоксиэтиленалкиловый эфир или сложный эфир, как поверхностно-активный агент в комбинации с по меньшей мере одним дополнительным неионным поверхностно-активным агентом, таким как октоксинол [136]; (10) сапонин и иммуностимулирующий олигонуклеотид (например, олигонуклеотид CpG) [137]; (11) иммуностимулятор и частицу соли металла, например, ссылка 138; (12) сапонин и эмульсию типа «масло-вводе», например, ссылка 139; (13) сапонин (например, QS21)+3dMPL+IL12 (необязательно,+стерол), например, ссылка 140; (14) термолабильный энтеротоксин E.coli ("LT") или его детоксифицированные мутанты, такие как мутанты К63 или R72 [например, глава 5 ссылки 141]; (15) холерный токсин («СТ») или его детоксифицированные мутанты [например, глава 5 ссылки 141]; (16) липосомы [главы 13 и 14 ссылки 123]; (17) хитозан [например, ссылка 142]; (18) двухцепочечная РНК; (19) микрочастицы (т.е. частицы диаметром от ~100 нм до -150 мкм, более предпочтительно, диаметром от ~200 нм до ~30 мкм, и, наиболее предпочтительно, диаметром от ~500 нм до -10 мкм), полученные из материалов, которые являются биоразлагаемыми и нетоксичными (например, поли(α-гидроксикислота), таких как поли(лактид-согликолид), полигидроксимасляная кислота, полиортоэфир, полиангидрид, поликапролактон и т.п.), необязательно обработанные таким образом, чтобы иметь отрицательный заряд на поверхности (например, с использованием SDS) или положительный заряд на поверхности (например, с использованием катионного детергента, такого как СТАВ); или (20) другие вещества, которые действуют как иммуностимулирующие агенты, для повышения эффективности композиции [например, глава 7 ссылки 123].
Соли алюминия (особенно фосфаты и/или гидроксиды алюминия) и MF59 являются предпочтительными для использования с сахаридными антигенами по настоящему изобретению. В случае когда используется фосфат алюминия, возможно адсорбировать один или более сахаридов на соли алюминия, но предпочтительно не адсорбировать сахариды на соли алюминия, и этому благоприятствует включение в раствор свободных фосфатных ионов (например, посредством использования фосфатного буфера). В случае когда используется гидроксид алюминия, предпочтительно адсорбировать сахариды на соли. Использование гидроксида алюминия в качестве адъюванта является особенно выгодным для сахарида из серогруппы А.
В композициях по настоящему изобретению возможно адсорбировать некоторые антигены на гидроксиде алюминия, но тогда они должны содержать другие антигены в ассоциации с фосфатом алюминия. Для четырехвалентных комбинаций серогрупп N.meningitidis, например, доступны следующие перестановки:
Для трехвалентных комбинаций серогрупп N. meningitidis доступны следующие перестановки:
После изготовления композиции по настоящему изобретению можно вводить непосредственно субъекту. Субъектами, подлежащими лечению, могут быть животные, в частности можно лечить людей.
Вакцины являются особенно пригодными для вакцинации детей и подростков. Их можно вводить системным путем и/или через слизистые оболочки.
Обычно иммуногенные композиции изготавливают в форме препаратов для инъекций, в виде жидких растворов или суспензий; также можно изготавливать твердые формы, подходящие для растворения или суспендирования в жидких носителях перед применением. Для усиления адъювантного эффекта препарат также можно эмульгировать или инкапсулировать в липосомы. Прямая доставка композиции обычно будет парентеральной (например, путем инъекции, подкожной, интраперитонеальной, внутривенной или внутримышечной, или путем доставки в интерстициальное пространство ткани). Композиции также можно вводить в участок повреждения. Другие способы введения включают оральное и внутрилегочное введение, суппозитории и трансдермальные или чрескожные аппликации (например, см. ссылку 14 3), иглы и гипоспреи. Схема введения может представлять собой однократную дозу или многократные дозы (например, схему, включающую бустер-дозы).
Вакцины по настоящему изобретению предпочтительно являются стерильными. Предпочтительно, они не содержат пирогенов. Предпочтительно, они содержат буфер, поддерживающий рН на уровне, например, от 6 до 8, обычно около 7. В случае когда вакцина включает соль гидроксида алюминия, предпочтительно использовать гистидиновый буфер [144].
Вакцины по настоящему изобретению могут включать детергент (например, Tween, такой как Tween 80) в малых количествах (например,<0,01%). Вакцины по настоящему изобретению могут включать сахарный спирт (например, маннит) или трегалозу, например, около 15 мг/мл, особенно, если им предстоит лиофильная сушка.
Оптимальные дозы отдельных антигенов можно оценить эмпирическим путем. Обычно, однако, сахаридные антигены по настоящему изобретению будут вводиться в дозе от 0,1 до 100 мкг каждого сахарида на одну дозу, при типичном объеме дозы 0,5 мл. Доза обычно содержит от 5 до 20 мкг сахарида на одну дозу. Указанные величины измеряют как сахарид.
Вакцины по настоящему изобретению могут быть профилактическими (т.е. для предупреждения инфекции) или терапевтическими (т.е. для лечения заболевания после инфекции), но обычно будут профилактическими.
Настоящее изобретение относится к способу получения иммунного ответа у пациента, включающему введение пациенту вакцины по настоящему изобретению. Иммунный ответ является предпочтительно защитным против менингококкового заболевания и может включать гуморальный иммунный ответ и/или клеточный иммунный ответ. Пациентом предпочтительно является ребенок.
Способ может вызывать бустерную реакцию у пациента, которому уже была сделана первая прививка от N. meningitidis.
Настоящее изобретение относится также к применению полисахарида, олигосахарида или конъюгата по настоящему изобретению для изготовления лекарственного средства для получения иммунного ответа у животного. Лекарственное средство предпочтительно представляет собой иммуногенную композицию (например, вакцину). Лекарственное средство предпочтительно предназначено для профилактики и/или лечения заболевания, вызванного Neisseria (например, менингита, септицемии, гонореи и т.п.), H.influenzae (например, среднего отита, бронхита, пневмонии, целлюлита, перикардита, менингита и т.п.) или пневмококком (например, менингита, сепсиса, пневмонии и т.п.). Таким образом, предпочтительной является профилактика и/или лечение бактериального менингита.
Вакцины можно испытывать на обычных экспериментальных животных (например, см. ссылку 145).
Настоящее изобретение также относится к способу солюбилизации осажденного бактериального капсулярного полисахарида, при котором в качестве растворителя используется этанол.
Определения
Термин «включающий» означает «имеющий в своем составе», а также «состоящий из», например композиция, «включающая» X, может состоять исключительно из X или может иметь в своем составе еще что-либо другое, например X+Y.
Термин «приблизительно» по отношению к численной величине х означает, например, х±10%.
Краткое описание рисунков
Фиг.1 показывает влияние изменяющихся соотношений этанол:вода на солюбилизацию полисахаридов.
Фиг.2-4 показывают титры IgG, полученные у мышей против олигосахаридных антигенов: фиг.2 показывает результаты использования олигосахарида серогруппы А; фиг.3 показывает результаты для серогруппы Y; и фиг.4 показывает результаты для серогруппы W135.
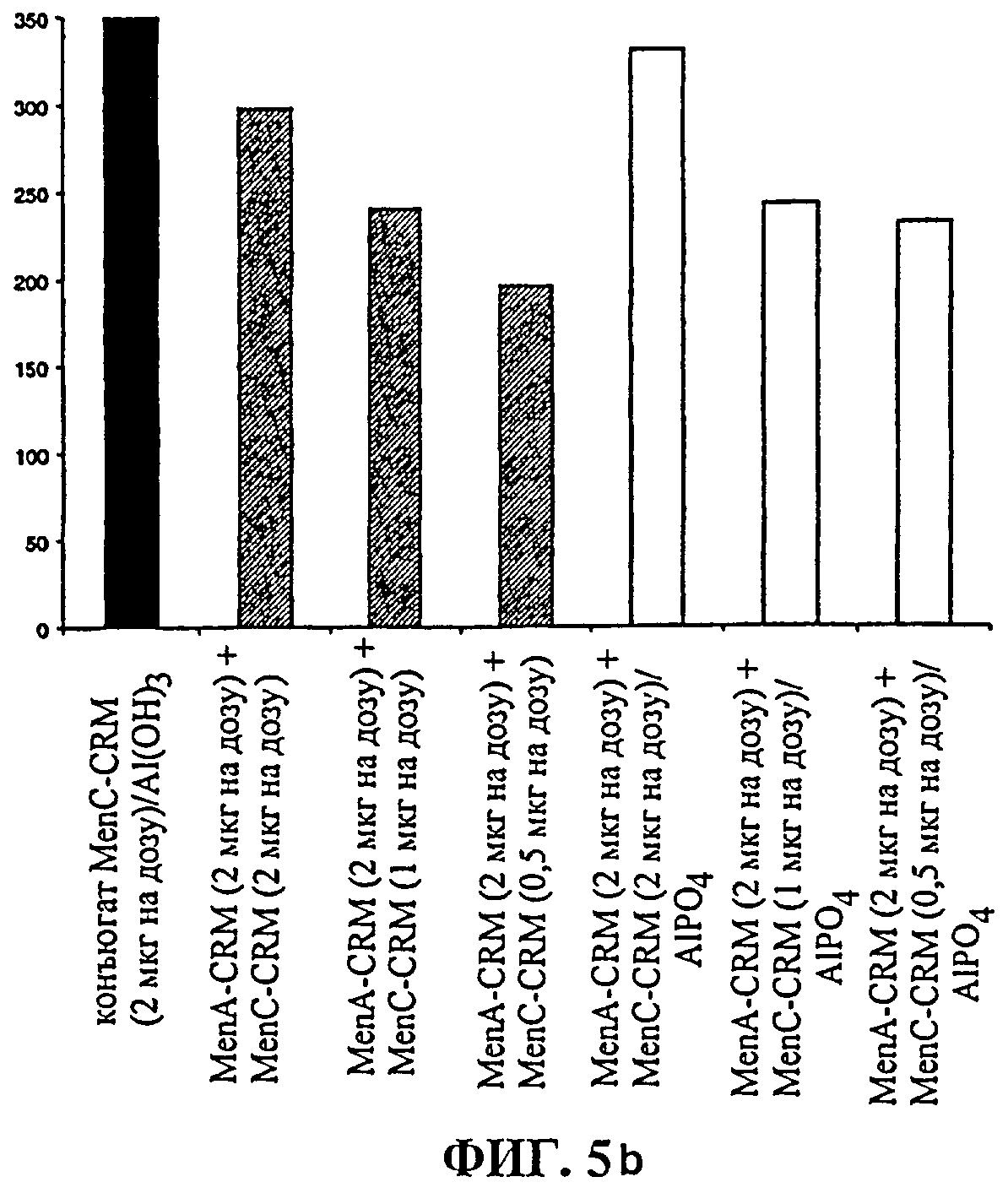
Фиг.5 показывает пост-II титры IgG, полученные у мышей для смеси олигосахаридных конъюгатов для серогрупп А и С: фиг.5а показывает ответы против серогруппы А, и фиг.5b показывает ответы против серогруппы С.
Фиг.6-8 показывают титры IgG, полученные у мышей для смеси олигосахаридных конъюгатов для серогрупп С, W135 и Y: фиг.6 показывает ответы против серогруппы W135; фиг.7 показывает ответы против серогруппы Y; и фиг.8 показывает ответы против серогруппы С.
Фиг.9-11 показывают пост-II титры IgG, полученные у мышей для смеси олигосахаридных конъюгатов для серогрупп А, С, W135 и Y: фиг.9 показывает ответы против серогруппы W135; фиг.10 показывает ответы против серогруппы Y; и фиг.11 показывает ответы против серогруппы А.
Фиг.12 представляет собой калибровочную кривую, полученную с использованием испытуемых образцов полисахарида MenА через различные промежутки времени гидролиза. Кривая показывает линейную зависимость обратной величины степени полимеризации от оптической вращательной способности.
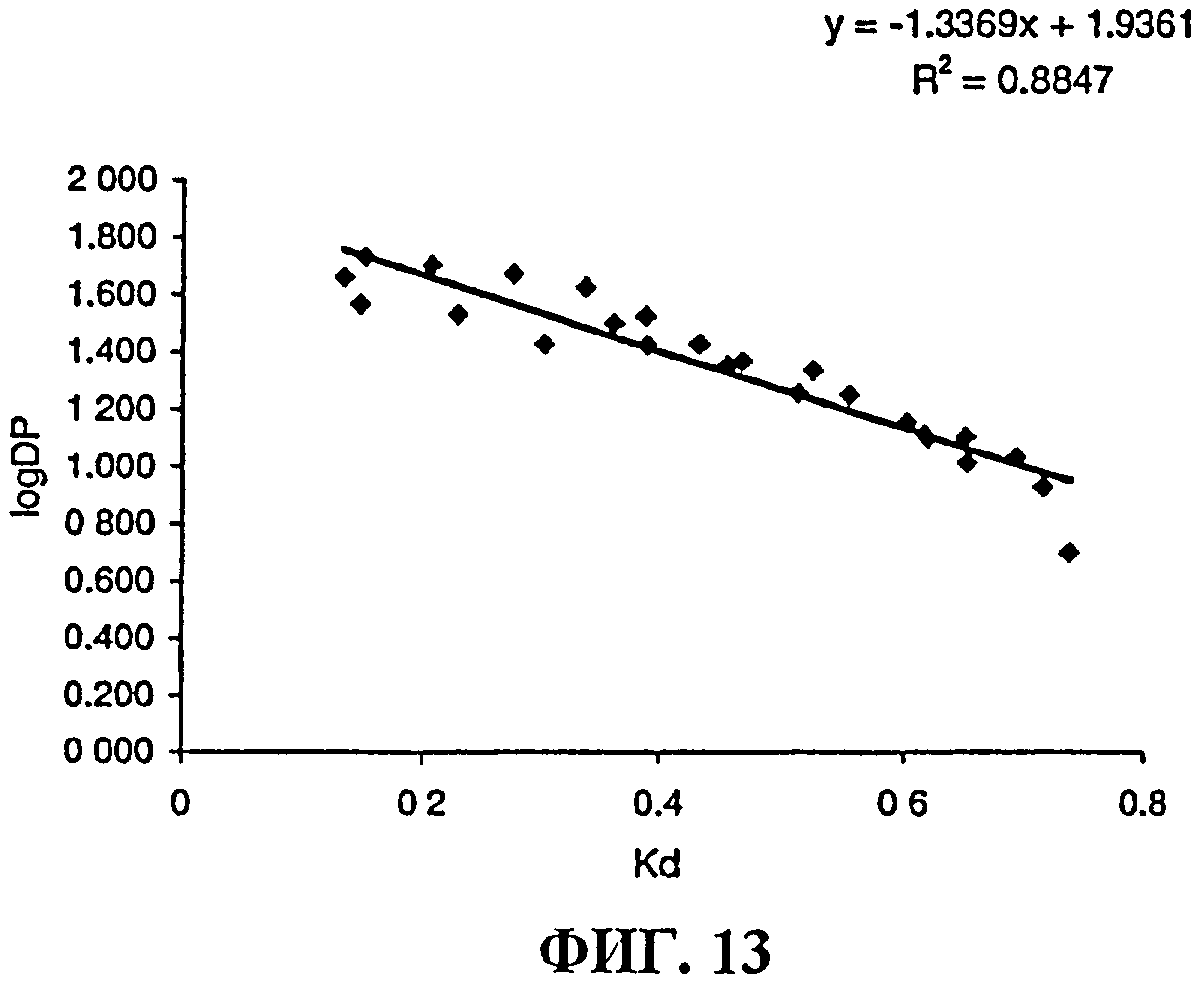
Фиг.13 представляет собой калибровочную кривую, полученную с использованием испытуемых образцов полисахарида MenY через различные промежутки времени гидролиза. Кривая показывает линейную зависимость log степени полимеризации от KD (коэффициента распределения).
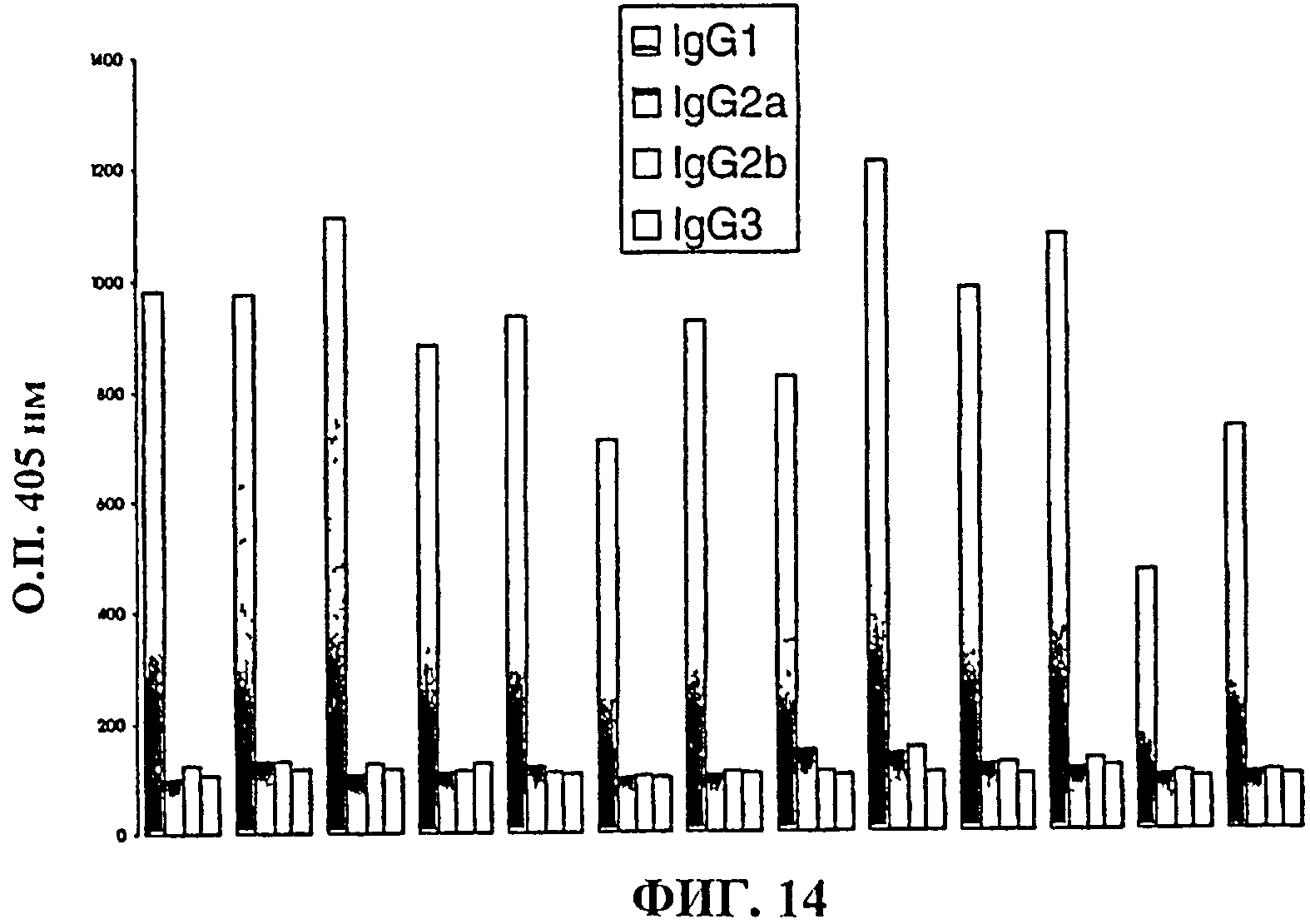
Фиг.14-16 показывают пост-II титры IgG, разделенные по подклассам IgG, полученные у мышей после иммунизации олигосахаридными конъюгатами для серогрупп (14) А; (15) С; (16) W135 и (17)Y.
Фиг.17 показывает пост-II титры IgG, разделенные по подклассам IgG, полученные у мышей после иммунизации четырехвалентной смесью олигосахаридных конъюгатов.
Фиг.18 иллюстрирует изготовление олигосахаридного конъюгата.
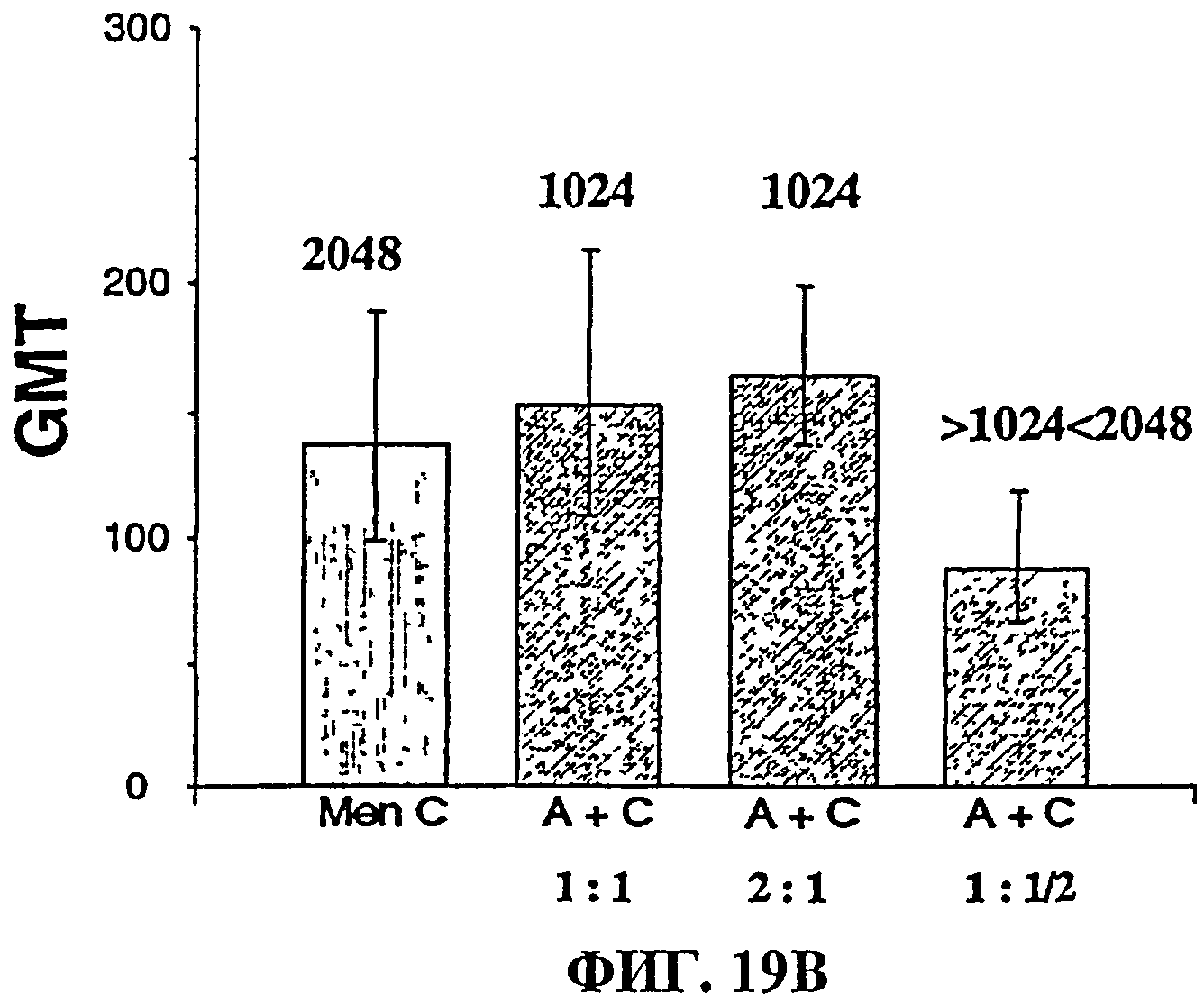
Фиг.19 показывает (А) анти-MenA и (В) анти-MenC GMT (±95% доверительные интервалы), полученные у морских свинок. Величины над столбиками представляют собой титры сывороточного бактериального анализа (SBA), т.е. обратные величины от величины разведения сыворотки, дающего 50% гибель бактерий.
Способы осуществления настоящего изобретения
А. Получение и очистка менингококковых полисахаридов
Менингококки серогрупп A, W135 и Y выращивали в 500 мл флаконах, содержавших 150 мл среды Franz А, в течение 12 часов при 35±1°С. Перемешивание производилось со скоростью 150 об/мин, с использованием 35 мм возвратно-поступательного шейкера. 85 мл среды затем инокулировали в 20-л ферментер, содержащий среду Watson.
Спустя 18,5 часов (W135 и Y) или 16,5 часов (А), когда ОП достигала 10, ферментацию прерывали добавлением 300 мл формалина, а затем, после 2 часов инкубации, ферментер охлаждали до 10°С. Надосадочную жидкость собирали центрифугированием с последующей фильтрацией (0,22 мкм) и ультрафильтрацией через мембрану 30 кДа.
Необработанный концентрированный полисахарид добавлением СТАВ в виде раствора 100 мг/мл воды. Добавленные объемы показаны в следующей таблице. Через 12 часов выдержки при комнатной температуре СТАВ комплексы собирали центрифугированием. СТАВ комплекс экстрагировали добавлением 95% раствора этанола при комнатной температуре в течение 16-20 ч при интенсивном перемешивании. Объем добавленного этанола показан в следующей таблице:
Полученные суспензии фильтровали через объемный фильтр CUNO 10 SP. Фильтрат рециркулировал через картридж CUNO zetacarbon™ до достижения ОП275нм<0,2. Фильтрат угля Z затем собирали и фильтровали через 0,22 мкм фильтр. В конечном итоге полисахарид осаждали из этанольной фазы добавлением 2М водного раствора СаСl2 (конечный раствор 10-12 мл/л EtOH). Очищенный полисахарид затем собирали центрифугированием, отмывали 95% этанолом и высушивали в условиях вакуума.
В других экспериментах конечную концентрацию этанола, использовавшегося для экстракции, изменяли (фиг.1). Для полисахарида серогруппы А наиболее эффективными были пределы от 80 до 95% этанола, при более низких процентных долях эффективность экстракции понижалась. Для серогруппы W135 хорошей экстракции добивались с использованием этанола в пределах от 75% до 90%, причем 95% концентрация была менее эффективной. Для серогруппы Y наилучших результатов добивались с использованием этанола в пределах от 75% до 85%, причем более высокие процентные доли (например, 90%, 95%) были менее эффективными. В целом, отмечено, что процентные доли этанола, которые были ниже, чем указанные в настоящем документе, имели тенденцию увеличивать совместную экстракцию примесей, таких как белки. Процентные доли этанола, приведенные в данном параграфе, выражены как конечная концентрация (этанол как процентная доля от общего объема этанол+вода) и основаны на содержании воды в пастах СТАВ-полисахарид, полученных центрифугированием, приблизительно 50% (т.е. 500 г Н2О на кг сырой пасты). Данную величину определили эмпирическим путем в небольших экспериментах с масштабным переходом.
В. Конъюгация полисахаридом серогруппы А
а) Гидролиз
Менингококковый полисахарид серогруппы А подвергали гидролизу в 50 мМ буфере ацетата натрия, рН 4,7, в течение приблизительно 3 ч при 73°С. Гидролиз контролировали с целью получения олигосахаридов со средней степенью полимеризации (DP) приблизительно 10, как определено по соотношению (масс./масс.) общего органического фосфора к сложному моноэфиру фосфорной кислоты.
Соотношение DP (общего органического фосфора) и (фосфора-сложного моноэфира) является обратно пропорциональным оптической вращательной способности (а), как показано на фиг.12. Эти взаимоотношения можно использовать для мониторинга степени гидролиза более удобным образом, чем с помощью прямого измерения количеств фосфора.
b) Разделение по размерам
На данной стадии удаляют короткие олигосахариды, полученные в ходе гидролиза. Полученный выше гидролизат подвергали ультрафильтрации через мембрану с отсекающей величиной 30 кДа (12 диафильтрационных объемов 5 мМ ацетатного буфера, рН 6,5). Удержанный материал, содержащий группу высокомолекулярных соединений, удаляли; прошедший через фильтр материал загружали на колонку Q-Sepharose Fast Flow, уравновешенную в ацетатном буфере 5 мМ, рН 6,5. Затем колонку промывали 5 колоночными объемами (CV) уравновешивающего буфера, затем 10 CV смеси 5 мМ ацетатный буфер/125 мМ NaCl, рН 6,5, с целью удаления олигосахаридов с DP<6. Отделенный по размеру олигосахарид затем элюировали 5 CV смеси 5 мМ ацетатный буфер/0,5 М NaCl, рН 6,5.
Популяция элюированного олигосахарида имела среднюю DP около 15.
c) Введение первичной аминогруппы в восстанавливающийся конец
Соль аммония (ацетат или хлорид) добавляли к раствору отделенного по размеру олигосахарида до конечной концентрации 49-300 г/л, затем добавляли цианоборгидрид натрия до конечной концентрации 12-73 г/л. После доводки рН до 6-7,3 смесь инкубировали при 37°С в течение 5 дней.
Аминоолигосахариды затем очищали тангенциальной проточной ультрафильтрацией с использованием мембраны с отсекающей величиной 1 кДа или 3 кДа и 13 диафильтрационных объемов 0,5 М NaCl, с последующими 7 диафильтрационными объемами 20 мМ NaCl. Раствор очищенных аминоолигосахаридов анализировали на содержание фосфора (одну химическую активность антигена) с помощью процедуры, описанной в ссылке 14 6, и на количество введенных аминогрупп, с помощью процедуры, описанной в ссылке 147.
Очищенные олигосахариды затем сушили с использованием роторного испарителя для удаления воды.
d) Дериватизация до активного сложного эфира
Высушенные аминоолигосахариды солюбилизировали в дистиллированной воде с концентрацией аминогрупп 40 мМ, затем добавляли 9 объемов ДМСО, с последующим добавлением триэтиламина до конечной концентрации 200 мМ. К полученному раствору добавляли N-гидроксисукцинимидный диэфир адипиновой кислоты до конечной концентрации 480 мМ.
Реакционную смесь поддерживали при комнатной температуре при перемешивании в течение 2 часов, затем активированный олигосахарид осаждали ацетоном (конечная концентрация 80% об./об.). Осадок собирали центрифугированием и несколько раз промывали ацетоном для удаления непрореагировавшего N-гидроксисукцинимидного диэфира адипиновой кислоты и побочных продуктов. В конце активированный олигосахарид высушивали в условиях вакуума.
Количество активных сложноэфирных групп, введенных в структуру олигосахарида, определяли колориметрическим способом, как описано в ссылке 148.
e) Конъюгирование с CRM197
Высушенный активированный олигосахарид добавляли к раствору 45 мг/мл CRM.197 в 0,01 М фосфатном буфере с рН 7,2 до соотношения активный сложный эфир/белок (моль/моль) 12:1. Реакционную смесь полдерживали при комнатной температуре при перемешивании в течение ночи. После данного периода времени конъюгат очищали гидрофобной хроматографией или тангенциальной проточной ультрафильтрацией. Очищенный конъюгат MenA-CRM197 фильтровали в стерильных условиях и хранили при температуре от -20°С до -60°С до изготовления вакцины.
Конъюгат анализировали: на содержание белка (анализ на белок microBCA Protein Assay), на содержание сахарида MenА (колориметрический анализ на фосфор), на содержание свободного сахарида, ВЭЖХ профиль (на колонке TSKgel G4000SW 7,5 мм ВД × 30 см) и SDS-PAGE. Характеристики типичных препаратов показаны в следующей таблице:
С. Конъюгация полисахаридов серогруппы W135
а) Гидролиз
Менингококковый полисахарид серогруппы W подвергали гидролизу в 50 мМ буфере ацетата натрия, рН 4,7, в течение приблизительно 3 ч при 80°С. В результате получали олигосахариды со средней DP приблизительно от 15 до 20, как определено по соотношению сиаловой кислоты (SA) к восстановленной концевой SA.
DP соотношение (общей SA) и (восстановленной концевой SA) относится к KD по результатам ВЭЖХ-SEC, как показано на фиг.13. Эти взаимоотношения можно использовать для мониторинга степени гидролиза более удобным образом, чем с помощью прямого измерения количества SA.
b) Разделение по размерам
Гидролизат подвергали ультрафильтрации через мембрану с отсекающей величиной 30 кДа (от 12 до 20 диафильтрационных объемов 5 мМ ацетатного буфера/15-30 мМ NaCl, рН 6,5). Удержанный материал, содержащий высокомолекулярные соединения, удаляли, в то время как прошедший через фильтр материал загружали на колонку Q-Sepharose Fast Flow, уравновешенную в смеси 5 мМ ацетатного буфера/15 мМ NaCl, рН 6,5. Затем колонку промывали 10 CV уравновешивающего буфера, с целью удаления олигосахаридов с DP ≤3-4 и элюировали 3 CV смеси 5 мМ ацетатный буфер/500 мМ NaCl, рН 6,5.
c) Введение первичной аминогруппы в восстанавливающийся конец
Хлорид или ацетат аммония добавляли к раствору отделенного по размеру олигосахарида до конечной концентрации 300 г/л, затем добавляли цианоборгидрид натрия до конечной концентрации 49 или 73 г/л. Смесь инкубировали при 50°С в течение 3 дней.
Аминоолигосахариды затем очищали тангенциальной проточной ультрафильтрацией, как описано для серогруппы А. Очищенный материал анализировали на содержание сиаловой кислоты (колориметрический способ, как описано в ссылке 149) и/или галактозы (ВЭЖХ) (химическая активность антигена MenW135). Очищенные олигосахариды затем сушили с использованием роторного испарителя для удаления воды.
d) Дериватизация до активного сложного эфира
Высушенные аминоолигосахариды дериватизировали, как описано для серогруппы А.
e) Конъюгирование с CRM197
Конъюгацию выполняли, как описано выше для серогруппы А, но для очистки конъюгата использовали диафильтрацию с мембраной 30 кДа (50 диафильтрационных объемов 10 мМ фосфатного буфера, рН 7,2). Очищенный конъюгат фильтровали в стерильных условиях и хранили при температуре от -20°С до -60°С до изготовления вакцины.
Конъюгат анализировали по тем же параметрам, которые описаны выше для серогруппы А. Содержание сахарида MenW анализировали колориметрическим определением сиаловой кислоты:
D. Конъюгация полисахаридов серогруппы Y
а) Гидролиз
Менингококковый полисахарид серогруппы Y подвергали гидролизу, как описано выше для серогруппы W135. В результате получали олигосахариды со средней DP приблизительно от 15 до 20, как определено по соотношению сиаловой кислоты (SA) к восстановленной концевой SA (измеренным косвенно, как описано в пункте С(а) выше).
b) Разделение по размерам, с) Введение аминогруппы, d) Дериватизация до активного сложного эфира и е) Конъюгирование
Данные стадии выполняли, как описано выше для серогруппы W135. Очищенный конъюгат фильтровали в стерильных условиях и хранили при температуре от -20°С до -60°С до изготовления вакцины.
Конъюгат анализировали так же, как описано выше для серогруппы W135:
Е. Иммуногенность отдельных конъюгатов
Замороженные массы конъюгатов оттаивали. Каждый из них разбавляли при перемешивании до конечной концентрации 20 мкг сахарида/мл, 5 мМ фосфата, 9 мг/мл NaCl, фосфата алюминия (до получения концентрации А13+0,6 мг/мл), рН 7,2. Смеси затем держали, без перемешивания, при 2-8°С в течение ночи и дополнительно разбавляли физиологическим раствором до концентрации 4 мкг сахарида/мл для иммунизации мышей.
Вторую серию изготавливали для каждой серогруппы тем же способом, но добавление фосфата алюминия заменяли тем же объемом воды.
Десяти мышам Balb/c для каждой группы иммунизации инъецировали п/к дважды 0,5 мл вакцины на 0 и 4 неделе. Забор крови осуществляли до иммунизации, за день до второй дозы и спустя 2 недели после второй дозы. Иммунизацию проводили (a) конъюгатной вакциной, содержащей или не содержащей квасцы (b) контролем - физиологическим раствором и (с) неконъюгированным полисахаридным контролем.
Специфичные антиполисахаридные антитела IgG определяли в сыворотке крови иммунизированных животных, главным образом, как описано в ссылке 150. Сыворотку от каждой мыши анализировали с двумя повторностями с помощью титрационной кривой и для каждой группы иммунизации рассчитывали величину GMT. Титры рассчитывали в мышиных единицах по ELISA (MEU) с использованием компьютерной программы "Titerun" (FDA). Специфичность антиполисахаридных титров определяли конкурентным ELISA с соответствующим полисахаридом в качестве конкурента.
Как показано на фиг.2, конъюгат MenА индуцировал высокие титры антител у животных. Как ожидалось, неконъюгированный полисахарид не обладал иммуногенностью. Конъюгатная композиция с фосфатом алюминия в качестве адъюванта индуцировала более высокий уровень антител по сравнению с титром, полученным для конъюгата в отдельности. Сходные результаты наблюдались для MenY (фиг.3) и MenW135 (фиг.4).
Подкласс IgG пост-II иммунных ответов измеряли для различных групп.Специфичные подклассы определяли с использованием того же способа ELISA, как для определения общего титра IgG в разделе Е, выше, но с использованием антител против щелочной фосфатазы мышей -IgGl, -IgG2a, -IgG2b или -IgG3 (Zymed) в качестве вторичных антител. Титры выражали как величины OF405нм, полученные через 30 минут проявки субстрата с использованием сыворотки, разведенной 1:3200, и они показаны на фиг.14 (MenА), 15 (MenW135) и 16 (MenY). Ответы наблюдаются, главным образом, в подклассе IgGl, который представляет собой подкласс, преимущественно индуцируемый у мышей Т-зависимыми антигенами. Поскольку полисахариды по своей природе являются Т-зависимыми антигенами, которые не способны индуцировать иммунологическую память, эти данные показывают, что конъюгация обладает желательным действием.
Сыворотки с пост-II также анализировали на предмет бактерицидной активности in vitro с помощью анализа для определения опосредованного комплементом лизиса бактерий. Сыворотки с пост-II инактивировали в течение 30 минут при 56°С перед использованием в анализе, а в качестве источника комплемента использовали 25% комплемент крольчат. Бактерицидный титр выражали как величину, обратную разведению сыворотки, получая 50% гибели бактерий следующих штаммов: MenА G8238, А1, F6124; MenW135 5554(ОАс+) и 242317(ОАс-); MenY 242975(ОАс-) и 240539(ОАс+).
Результаты для MenА включали:
Результаты для MenW135 включали:
Результаты для MenY включали:
F. Иммуногенностъ конъюгата МеnА в комбинации с конъюгатом
MenСКонцентрированную массу CRM-MenC (от Chiron Vaccines, Италия) смешивали с концентрированной массой CRM-MenA (полученной, как описано выше), разводили и смешивали перемешиванием. Изготавливали три различных препарата. Каждый содержал 20 мкг сахарида/мл для MenА, но включал различные количества конъюгата MenС: (д.) 20 мкг сахарида/мл; (и) 10 мкг сахарида/мл; (iii) 5 мкг сахарида/мл. Таким образом, соотношения MenА:MenС (масс./масс.) были следующими: (i) 1:1; (ix) 2:1; (iii) 4:1.
Каждый препарат также содержал 5 мМ фосфата натрия, 9 мг/мл NaCl, фосфат алюминия (до концентрации А13+0,6 мг/мл), рН 7,2. Каждую смесь затем держали, без перемешивания, при 2-8°С в течение ночи и дополнительно разбавляли 1:5 физиологическим раствором перед иммунизацией мышей.
Вторую серию вакцин изготавливали таким же способом, но добавление фосфата алюминия заменяли тем же объемом воды.
Для каждой из шести вакцин иммунизировали по десять мышей Balb/c, как описано выше. Контрольные группы получали физиологический раствор или только конъюгат MenА.
Антиполисахаридные антитела для MenА и MenС определяли, как описано выше.
Результаты, полученные для смеси конъюгатов MenА+MenС, ясно показывают, что соотношение (масс./масс.) компонентов А и С играет главную роль для иммуногенности MenА.1
Титр специфичных анти-MenApS, полученный для конъюгата MenА, был выше (с содержанием или без содержания квасцов в качестве адъюванта), чем для комбинации MenА+MenС в той же дозе (фиг.5а). В случае когда в комбинации используется меньшее количество конъюгата MenС, компонентом MenА конъюгата индуцируется более высокий титр анти-MenApS. В то же время, титр анти-MenС остается приемлемым (фиг.5b).
Проводились также эксперименты с морскими свинками. Изготавливали три различных препарата с использованием того же самого фосфата алюминия в качестве адъюванта, как ранее (аморфный гидроксифосфат, молярное соотношение PO4/AI от 0,84 до 0, 92, 0, 6 мг А13+/мл:
Данные препараты разбавляли 1:2 физиологическим раствором и использовали для иммунизации морских свинок. Пяти морским свинкам (линия Hartelley, самки, 450-500 граммов) для каждой группы иммунизации инъецировали п/к дважды по 0,5 мл вакцины на 0 и 28 дни. Забор крови осуществляли до первой иммунизации, а затем на 42 день. Сыворотки хранили при -70°С до анализа ELISA и анализа на бактерицидность сыворотки (против MenА штамма МК 83/94 или MenС штамма СИ). Результаты показаны на фиг.19.
G. Комбинированная вакцина для серогрупп С, W135 и Y
Конъюгаты полисахаридов из серогрупп С, W135 и Y смешивали, как описано выше, до получения конечной концентрации 20 мкг сахарида/мл для каждого конъюгата. Вакцина содержала конечную концентрацию 5 мМ фосфата натрия и 9 мг/мл NaCl, рН 7,2. После хранения в течение ночи смесь разбавляли до концентрации 4 мкг сахарида/мл для каждого конъюгата для иммунизации мышей.
Иммунизации и анализ проводили, как описано выше.
Результаты показывают, что иммуногенность конъюгата MenW135 усиливалась, если его вводили в комбинации с конъюгатами MenС и MenY, по сравнению с иммуногенностью, полученной для конъюгата MenW135 в отдельности (фиг.6). Иммуногенность MenY в комбинации была сравнима с иммуногенностью, полученной для отдельного конъюгата (фиг.7) и была сравнима также с иммуногенностью конъюгата MenС (фиг.8).
H. Комбинированная вакцина для серогрупп А, С, W135 и Y
Конъюгаты полисахаридов из серогрупп А, С, W135 и Y смешивали, как описано выше, до получения конечной концентрации 20 мкг сахарида/мл для конъюгатов серогрупп A, W135 и Y и 5 мкг сахарида/мл для конъюгата серогруппы С. Вакцина содержала конечную концентрацию 5 мМ фосфата натрия, 9 мг/мл NaCl, фосфата алюминия (до получения концентрации А13+0,6 мг/мл), рН 7,2. Смеси затем держали, без перемешивания, при 2-8°С в течение ночи и дополнительно разбавляли физиологическим раствором до концентрации 4 мкг сахарида/мл для конъюгатов A, W135 и Y и 1 мкг сахарида/мл для конъюгата С. Указанную разбавленную смесь использовали для иммунизации.
Иммунизации и анализ проводили, как описано выше, с контролями, включавшими отдельные конъюгаты, за исключением серогруппы С.
Фиг.9 показывает, что, как ранее, иммуногенность конъюгата MenW135 усиливалась, если его вводили в комбинации с конъюгатами MenА, MenС и MenY. Фиг.10 показывает, что иммуногенность конъюгата MenY практически не отличалась при его доставке в комбинации с конъюгатами MenА, MenС и MenW135. Фиг.11 показывает, что иммуногенность конъюгата MenА значительно снижалась в комбинации, даже если конъюгат MenС вводили в более низкой дозе (1/4). Данная антигенная конкуренция не наблюдалась в неконъюгированной четырехвалентной (ACWY) полисахаридной вакцине [5].
I. ЛиофилизированныЙ антиген серогруппы А
Капсулярный полисахарид серогруппы А N. meningitidis является особенно чувствительным к гидролизу. Конъюгаты капсулярного олигосахарида MenА, таким образом, изготавливали в лиофилизированной форме, готовой для повторного растворения перед введением. Изготавливали лиофилизированную форму с компонентами, которые дают следующий состав после восстановления с получением единичной дозы:
Данная композиция не содержит адъюванта. Для восстановления ее изготавливали два адъюванта:
После восстановления водой для инъекций стабильность сахаридного компонента была следующей:
По истечении той же временной шкалы в 4 недели величина рН была стабильной на уровне 7,2 как при 2-8°С, так и при 36-38°С, содержание белка было стабильным на уровне 24,5 мкг/мл, а содержание влаги было менее 2,5%.
После восстановления раствором фосфата алюминия в качестве адъюванта и хранении при 2-8°С стабильность была следующей:
J. Комбинированная вакцина для серогрупп А, С, W135 и Y (лиофилизированныЙ конъюгат серогруппы А)
Изготавливали трехвалентную смесь компонентов MenС, W135 и Y, адсорбированную на гидроксиде алюминия в качестве адъюванта (2 мг/мл) или смешанную с фосфатом алюминия в качестве адъюванта (аморфный гидроксифосфат, молярное соотношение PO4/AI от 0,84 до 0,92, 0,6 мг/мл А13+, в присутствии 10 мМ фосфатного буфера). Составы двух трехвалентных смесей были следующими:
Для гидроксидной смеси стабильность сахаридных компонентов была следующей:
По истечении той же временной шкалы в 4 недели величина рН была стабильной на уровне 7,15±0,05 как при 2-8°С, так и при 36-38°С.
Для фосфатной смеси стабильность сахаридных компонентов была
следующей:
По истечении той же временной шкалы в 4 недели величина рН
была стабильной на уровне 7,05±0,05 как при 2-8°С, так и при 36-38°С.
Трехвалентные жидкие композиции разбавляли и использовали 0,5 мл для восстановления лиофилизированного конъюгата MenА. Полученную трехвалентную смесь вводили десяти мышам Balb/c (самки в возрасте 6-8 недель) в каждой группе путем подкожной инъекции на 0 и 28 день. Смесь содержала по 2 мкг каждого сахаридного конъюгата на дозу, что составляет 1/5 от однократной человеческой дозы (SHD). Контроли представляли собой физиологический раствор или неконъюгированные гомологичные полисахариды. Забор крови осуществляли до иммунизации, а затем на 42 день, и сыворотки хранили при -70°С. IgG определяли, как описано выше.
Все использованные конъюгаты для животных были безопасными и иимуногенными. Пост-II GMT титры по результатам ELISA (с 95% доверительными интервалами) были следующими:
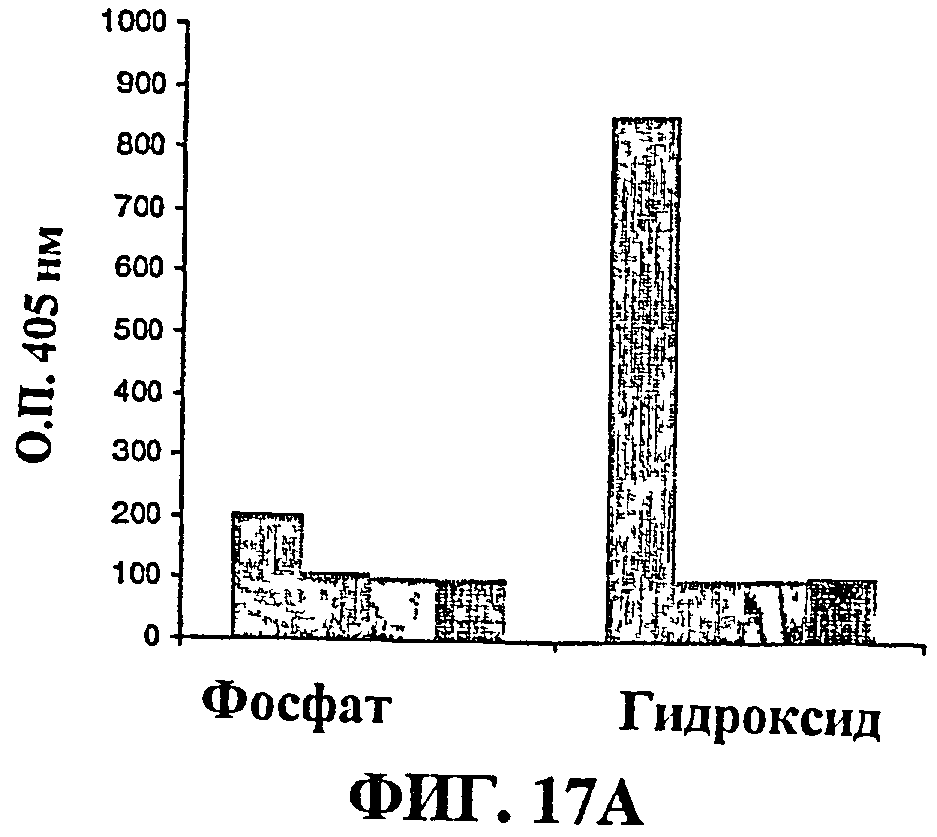
Фиг.17 показывает результаты анализа подкласса IgG для: (17А) MenА; 17(B) MenС; (17С) MenW135 и (17D) MenY. IgGl отчетливо является наиболее выраженным подклассом.
Мышей иммунизировали, как описано выше, но вакцинные композиции имели разные соотношения различных олигосахаридных конъюгатов. Дозы составляли 0,5, 1, 2 или 4 мкг на дозу и изменялись. Во всех экспериментах использовали лиофилизированный олигоконъюгат MenА.
Вторую серию экспериментов проводили с использованием дозы сахарида 2 мкг/мл для MenА и MenС; половину указанной дозы для MenY и четверть дозы для MenW135. Титры ELISA были следующими:
Следующая таблица показывает данные, относящиеся к конъюгатам MenА, MenW135 и MenY, подходящим для изготовления комбинированных композиций по настоящему изобретению:
Следует понимать, что настоящее изобретение было описано примером и что в нем можно производить изменения, оставаясь в пределах объема и идеи настоящего изобретения.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ (содержание которых целиком включено в настоящий документ в качестве ссылок)
[1] Frash (1990) pp.123-145 of Advances in Biotechnological Processes vol. 13 (eds. Mizrahi & Van Wezel).
[2] Armand et al. (1982) J. Biol. Stand. 10:335-339.
[3] Cadoz et al. (1985) Vaccine 3:340-342.
[4] MMWR (1997) 46(RR-5) 1-10.
[5] Baklaic et al. (1983) Infect. Immun. 42:599-604.
[6] Costantino et al. (1992) Vaccine 10:691-698.
[7] WO 02/00249.
[8] Inzana (1987) Infect. Immun. 55:1573-1579.
[9] WO 98/32873.
[10] US patent 4,753,796.
[11] European patent 0072513.
[12] UK patent application 0207117.3.
[13] Pon et al. (1997) J Exp Med 185:1929-1938.
[14] Ravenscroft et al. (1999) Vaccine 17:2802-2816.
[15] Ramsay et al. (2001) Lancet 357(9251):195-196.
[16] Lindberg (1999) Vaccine 17 Suppl 2:S28-36.
[17] Buttery & Moxon (2000) J R Coll Physicians Lond 34:163-168.
[18] Ahmad & Chapnick (1999) Infect Dis Clm North Am 13:113-133, vii.
[19] Goldblatt (1998) J. Med. Microbiol. 47:563-567.
[20] European patent 0477508.
[21] US patent 5,306,492.
[22] WO 98/42721.
[23] Dick et al. in Conjugate Vaccines (eds. Cruse et al.) Karger, Basel, 1989, Vol.10, pp.48-114.
[24] Hermanson Bioconjugate Techniques, Academic Press, San Diego (1996) ISBN: 0123423368.
[25] Anonymous (Jan 2002) Research Disclosure, 453077.
[26] Anderson (1983) Infect Immun 39(1):233-238.
[27] Anderson et al. (1985) J Clin Invest 76(l):52-59.
[28] EP-A-0372501.
[29] EP-A-0378881.
[30] EP-A-0427347.
[31] WO 93/17712.
[32] WO 94/03208.
[33] WO 98/58668.
[34] EP-A-0471177.
[35] WO 91/01146.
[36] Falugi et al. (2001) Eur J Immunol 31:3816-3824.
[37] WO 00/56360.
[38] WO 00/61761.
[39] WO 99/42130.
[40] WO 96/40242.
[41] Lees et al. (1996) Vaccine 14:190-198.
[42] WO 95/08348.
[43] US patent 4,882,317.
[44] US patent 4,695,624.
[45] Mol. Immunol., 1985, 22, 907-919.
[46] EP-A-0208375.
[47] WO 00/10599.
[48] Gever et al., Med. Microbiol. Immunol, 165: 171-288 (1979).
[49] US patent 4,057,685.
[50] US patents 4,673,574; 4,761,283; 4,808,700.
[51] US patent 4,459,286.
[52] US patent 4,965,338.
[53] US patent 4,663,160.
[54] US patent 4,761,283.
[55] US patent 4,356,170.
[56] Lei et al. (2000) Dev Biol (Basel) 103:259-264.
[57] WO 00/38711; US patent 6,146,902.
[58] McLeod Griffiss et al. (1981) Infect. Immun. 34:725-732.
[59] WO 99/24578.
[60] WO 99/36544.
[61] WO 99/57280.
[62] WO 00/22430.
[63] Tettelin et al. (2000) Science 287:1809-1815.
[64] Pizza et al. (2000) Science 287:1816-1820.
[65] WO 01/52885.
[66] Bjune et al. (1991) Lancet 338(8775):1093-1096.
[67] Fukasawa et al. (1999) Vaccine 17:2951-2958.
[68] Rosenqvist et al. (1998) Dev. Biol. Stand. 92:323-333.
[69] WO 96/14086.
[70] Covacci & Rappuoli (2000) J. Exp.Med. 19:587-592.
[71] WO 93/18150.
[72] Covacci et al. (1993) Proc. Natl. Acad. Sci. USA 90: 5791-5795.
[73] Tummuru et al. (1994) Infect. Immun. 61:1799-1809.
[74] Marchetti et al. (1998) Vaccine 16:33-37.
[75] Telford et al. (1994) J. Exp.Med. 179:1653-1658.
[76] Evans et al. (1995) Gene 153:123-127.
[77] WO 96/01272 & WO96/01273, especially SEQ ID N0:6.
[78] WO 97/25429.
[79] WO 98/04702.
[80] Watson (2000) Pediatr Infect Dis J 19:331-332.
[81] Rubin (2000) Pediatr Clin North Am 47:269-285, v.
[82] Jedrzejas (2001) Microbiol Mol Biol Rev 65:187-207.
[83] Bell (2000) Pediatr Infect Dis J 19:1187-1188.
[84] Iwarson (1995) APMIS 103:321-326.
[85] Gerlich et al. (1990) Vaccine 8 Suppl:S63-68 & 79-80.
[86] WO 93/24148.
[87] Costantino et al. (1999) Vaccine 17:1251-1263.
[88] WO 97/00697.
[89] Hsu et al. (1999) Clm Liver Dis 3:901-915.
[90] WO 02/02606.
[91] Kalman et al. (1999) Nature Genetics 21:385-389.
[92] Read et al. (2000) Nucleic Acids Res 28:1397-406.
[93] Shirai et al. (2000) J. Infect. Dis. 181(Suppl 3):S524-
S527.
[94] WO 99/27105.
[95] WO 00/27994.
[96] WO 00/37494.
[97] WO 99/28475.,
[98] Ross et al. (2001) Vaccine 19:4135-4142.
[99] Sutter et al. (2000) Pediatr Clin North Am 47:287-308.
[100] Zimmerman & Spann (1999) Am Fam Physician 59:113-118, 125-126.
[101] Dreesen (1997) Vaccine 15 Suppl:S2-6.
[102] MMWR Morb Mortal Nkly Rep 1998 Jan 16; 47(1):12, 19.
[103] Vaccines (1988) eds. Plotkin & Mortimer. ISBN 0-7216-1946-0.
[104] McMichael (2000) Vaccine 19 Suppl 1:S101-107.
[105] Schuchat (1999) Lancet 353(9146):51-6.
[106] WO 02/34771.
[107] Dale (1999) Infect Dis Clm North Am 13:227-43, vni.
[108] Ferretti et al. (2001) PNAS USA 98: 4658-4663.
[109] Kuroda et al. (2001) Lancet 357(9264): 1225-1240; see also pages 1218-1219.
[110] Anderson (2000) Vaccine 19 Suppl l:S59-65.
[111] Kahn (2000) Curr Opin Pediatr 12:257-262.
[112] Crowe (1995) Vaccine 13:415-421.
[113] J Toxicol Clm Toxicol (2001) 39:85-100.
[114] Demicheli et al. (1998) Vaccine 16:880-884.
[115] Stepanov et al. (1996) J Biotechnol 44:155-160.
[116] Wassilak & Orenstein, Chapter 4 of Vaccines (eds.
Plotkin & Mortimer), 1988.
[117] Gustafsson et al. (1996) N. Engl. J. Med. 334:349-355.
[118] Rappuoli et al. (1991) TIBTECH 9:232-238.
[119] WO 97/28273.
[120] Lieberman et al. (1996) JAMA 275:1499-1503.
[121] WO 00/56365.
[122] Gennaro (2000) Remington: The Science and Practice of Pharmacy. 20th ed ISBN: 0683306472.
[123] Vaccine Design... (1995) eds. Powell & Newman. ISBN: 030644867X. Plenum.
[124] WO 90/14837.
[125] US patent 6,299,884.
[126] WO 00/07621.
[127] WO 99/44636.
[128] GB-2220221.
[129] EP-A-0689454.
[130] WO 00/56358.
[131] JEP-A-0835318.
[132] EP-A-0735898.
[133] EP-A-0761231.
[134] WO 99/52549.
[135] WO 01/21207.
[136] WO 01/21152.
[137] WO 00/62800.
[138] WO 00/23105.
[139] WO 99/11241.
[140] WO 98/57659.
[141] Del Giudice et al. (1998) Molecular Aspects of Medicine, vol. 19, number 1.
[142] WO 99/27960.
[143] WO 98/20734.
[144] UK patent application 0118249.2.
[145] WO 01/30390.
[146] Chen et al. (1956) Anal. Chem. (1956) 28:1756-1758.
[147] Habeeb et al. (1966) Anal. Biochem. 14:328-336.
[148] Miron & Wilchek (1982) Anal. Biochem. 126:433-435.
[149] Svennerholm (1957) Biochem. Biophys. Acta 24:604-61.
[150] Carlone et al (1992) J.Clin. Microbiol. 30:154-159.
Реферат
Изобретение относится к биохимии и представляет собой набор для профилактики или лечения бактериального менингита, содержащий: (а) конъюгированный капсулярный сахарид, происходящий из N. meningitidis серогруппы А, в лиофилизированной форме; и (b) капсулярные сахариды, происходящие из N. meningitidis серогрупп С, W135 и Y, в жидкой форме, в котором соотношение (масс./масс.) сахарида серогруппы А и сахарида серогруппы С превышает 1. Изобретение позволяет получать эффективные вакцины на основе указанного набора. 2 н. и 27 з.п. ф-лы, 19 ил.
Формула
2 Набор по п.1, в котором один или более из сахаридов (b) конъюгированы с белком-носителем.

Комментарии