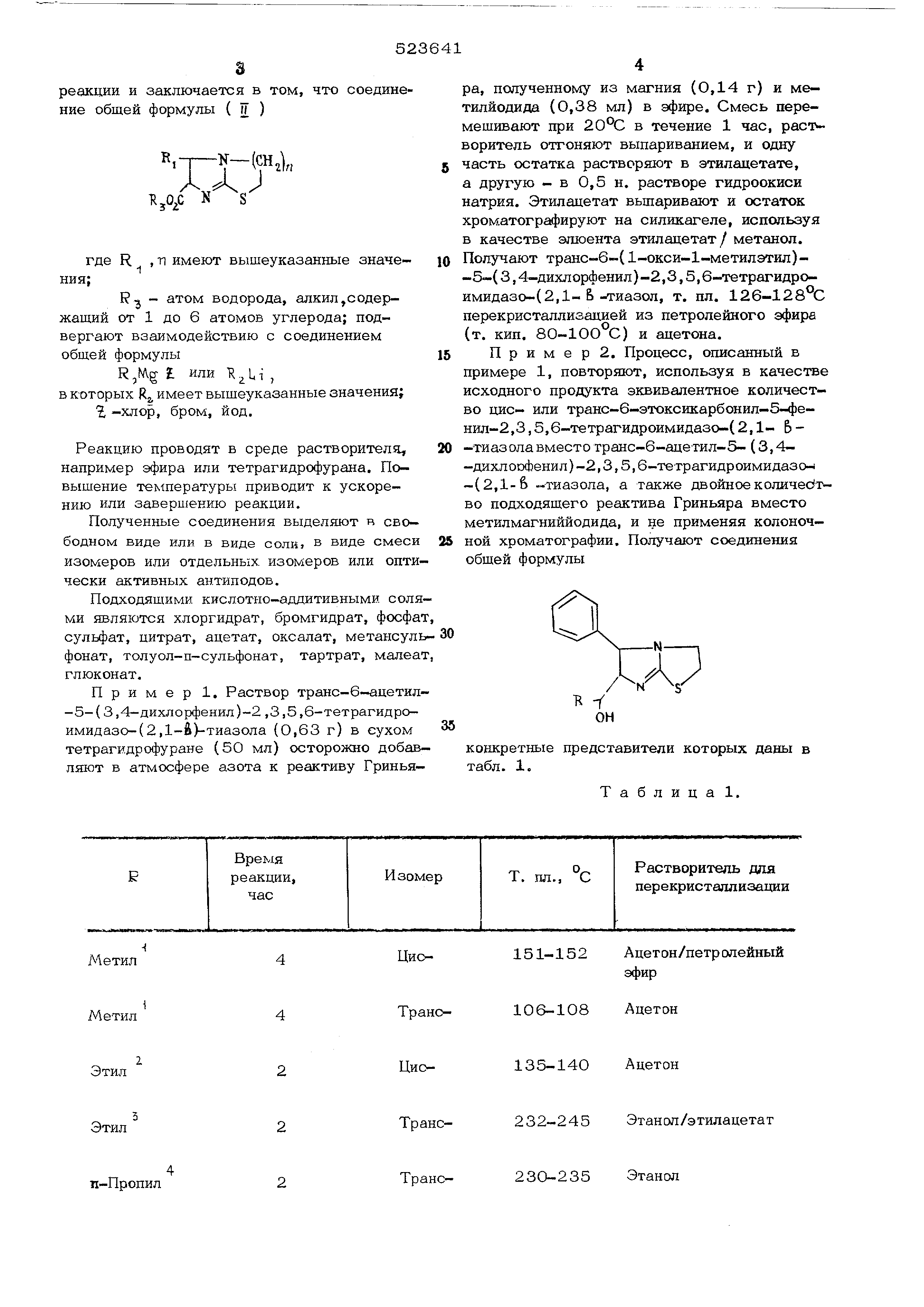
Винил
Бензил
Реакционную смесь нагревают с обратным холодильником в течение последних двух часов . рН доводят до 10 перед экстракцией эфиром.
Реактив Гриньяра готовят из магния и этилйодида.
Сырой продукт вначале кристаллизуют из ацетона и получают транс-6-( l-oкcи-н-пpoпил)-5-фeнил-2
,3,5, 6-тетрагидроимидазо-{2,1-)-тиааол, т.пл. 176 С. Маточный раствор обрабатывают
эфирным раствором НСЕ, и из осадка кристаллизуют хлоргидрат. Реактив Гри- ньяра готовят из магния и этилйодида.
Реактив Гриньяра готовят из магния и Нт-пропилбромида и нагревают с обратным холодильником
2 час. Из сырого продукта перекристаллизацией выделяют хлоргидрат.
Реактив Гриньяра готовят из магния и бензилбромида. Сырой продукт очищают хроматографией на силикагеле, элюируют этилацетатом.
Реактив Гриньяра готовят из магния и бензилбромида. Сырой продукт очищают хроматографией
на 1 мм пластине из силикагеля, помещенной в хлороформ/этиладетат (1:1). П р и м е р 3. Процесс, описанный в
примере 2, повторяют, используя в качеств исходного продукта эквивалентное количест
во 6-этоксикарбонилпроизводного, и получают соединения общей формулы t.
- конкретные представители которых приведены в табл. 2,
П р и м е р 4. Суспензшо комплекса из литийадетиленида и этилендиамина (1,84 г
в сухом диоксане (130мл) насыщают сухим ацетиленом. Транс-6-этоксикарбонил-5-
(3,4-дихлорфешш)-2,3,5,6- тетрагидроамидазо- (2,)-тивзоп (1,7 г) в сухом
диоксане (50 мл) добавляют быстро к насыщенному раствору, и смесь перемещивают
при 2О С в течение 2 час. Через смесь барботируют зот, отгоняя избыток ацетиле
на. Добавляют воду (1 мл), растворители oTTOHsnoT упариванием, одну часть остатка
растворяют в этиладетате, другую - в 2 н. НС1. Кислотный слой отделяют, подщелачивают
и экстрагируют этилацетатом. Остаток очищают хроматографией на колонне с сили.
кагелем, используя этиладетат как растворитель . получают транс-в-(1-этинил)-оксипроп-2-имил-5-
(3,4-дихлорфенил)-2,3,5, 6-тетрйгидроимидазо- (2,1- 6)-тиазол в виде
хлоргидрата с т. пл. более 3301 (из смеси этилацетат / этанол).
Транс140-144
Ацетон
184-187
Этанол
ТрансП р и м е р 5. Раствор 0,0-ди-п-толусил-
( D )-винной кислоты (7,6 г) в изопропаноле (100 мл) добавляют к раствору
рацемического транс-5-(3,4-дихлорфе НИЛ )-6-(1-окси-1метилэтил)-2,3,5,6-тетра
гидроимидазо-(2,)-тказола (6,2 г) в изопропаноле (1ОО мл). Смесь затравливают
и оставляют на ночь. Смесь отфильтровывают и осадок перекристаллизовывают
из этанола (50 мл), получают кислый тартрат (+) изомера с т. пл. 149 С. Эту соль
помещают в смесь этилацетата (100 мл) и раствора 0,5 н. гидроокиси натрия (80мл).
Этилацетатный слой отделяют, промывают водой, сущат, упаривают и получают хорощо
кристаллизующийся сироп. Обработкой последнего петролейным эфиром (т. кип.
40-60°С) получают (+)-транс-5-(3,4-дихдорфешш -6-( 1-окси-1-метилэтил)-2,3,
5,6-тетрагидроимидазо-(2,1-)- тиазол, т. пл. 135-136°С, ГоС + 155° (, в этилацетате).
Изопропанольный фильтрат, полученный при приготовлении соли, упаривают и получают
вязкий гель, который обработкой О,5н, гидроокисью натрия и экстракцией этилацетатом
превращают в (-) -основание, которое имеет вид сиропа. Перекристаллизацией из
эфира получают (-)-транс-5-(3,4-дихлорфенил )-6-( 1-окси-1-метилэтил)- 2,3,5,6-тетрагидроимидазо-
(2,1н6 )-тиазолс т. пл. 135°С, Ы25 (с 2, в этилацета )и
,
| - О
О
о
CO
CO
Ю iH
гЧ
t
.
t
CM
.со со
CO
со
со
g
0
я
ЕЮ
со
со
со со
со
см
к Е
и
о
о о
о
о
CD
тН
05 Ю
-
о.
со Ю
Xп:
см см
ои
с;
g Ф 2
о.
о.
со Пример 6. Смесь2-аминотиазолина(10,Ог), триэтипамина (25,0 мл) и этил-2,3-.дибро
-3-фенилпропионата в этилацетате (40 мл нагревают с обратным холодильником в атмосфере
азота в течение 20 час. Охлажден ную смесь фильтруют, и фильтрат хорошо
промывают водой, затем обрабатывают 1 н НС1, Кислый экстракт подщелачивают 2 н.
гидроокисью натрия и экстрагируют этилац татом. Этилацетат отгоняют выпариванием
и остаток хроматографируют на силикагеле , используя в качестве эпюента этилацетат
. Перекристаллизацией из ацетона получают цис-6-этоксикарбонил-5 енил-2,3,5,
6-тетрагиароимиаазо-(2,1- ) - тиазол, т. па. 99°С, и транс-6-этоксикарбонил-5-фенил-2
,3,5,6-тетрагидроимидазо-( 2,1-) -тиазол, органическую фазу перемешивают с
1 н. НС1 (1,5 л), охлаждают смесь ниже 10 С. Выпадает осадок, который отфильтрОБывают
, и перекристаллизацией из этанола получают цис-5-(3,4-дихлорфенил)- 6-втоксикарбонил-2
,3,5,6-. тетрагидроимидазо- ( 2,1-§)-тиазол гидрозшорид с т. пл. 226-230 С. Обработкой этой соли щелочью
получают свободное основание с т. пл. 125-130 С (перекристаллизовано из
адетонпетролеиного эфира, т. кип. 80-100 Маточный раствор, полученный после
выпадения в осадок цис изомера, отделяют, водную фазу охлаяэдают менее, чем на 10°
подщелачивают 4 н. гидроокисью натрия и экстрагируют дважды этилацетатом. Объединенные
экстракты выпаривают досуха, и остаток перекрксталлкзовывают из смеэфир (т. кип. 80си
ацетонпетролейный 1ОО С. Получают транс-5-(3,4-аихлорфенил ) -6-этоксикарбонил-2,3- 5,6 -тетра-
гидроимидазо-(2,1-S)-тиазол, т. пл, 65-68°С. Пример. Смесь этил-3-(3
трифторметилфенил) -2,3-дибромпропионата (8,0 г), 2-аминотиазолина (2,2 г) и триэтиламина
(4,0 г) в этилацетате нагревают с обратным холодильником в атмосфере азота в течение 7 час. Охлажденную
смесь фильтруют, фильтрат охлаждают до 10 С и добавляют 1 н. НС1 (40 мл).
Смесь перемешивают 15 мин, осадок отфильтровывают , обрабатывают щелочью и
получают цис-6-этоксикарбонил-5-(З- рифторметилфенил ) -2,3,5,6-тетраги дроимид азо-
(2,1-6)-тиазол, т. пл. 120-122°С (пер кристаллизован из петролейного эфира, т. кип. 80-100 С).
Подкисленный фильтрат охлаждают до 10 С, добавляют щелочь, и полученный тве
дый фильтрат перекристаллизовывают из петролейного эфира (т. кип. 80-100 С) с получением соответствующего транс-изоме111-113 С . с т. Ш1.
Прим е р 8. Раствор метил-2-бром-3- (4-диметиламинофенил)-акрилата(1,4 г),
триэтиламина (0,7 мл) и 2-аминотиазолина (0,5 г) в диоксане (50 мл) нагревают с
обратным холодильником в атмосфере азота 2 2 час. Охлажденную смесь выпаривают досуха,
одну часть остатка растворяют в воде, другую - в этилацетате, и этилацетатный экстракт
хроматографируют на силикагеле с использованием этилацетата в качестве элюента
, получают транс-5-(4-диметиламинофенил ) -6-метоксикарбонил-2,3,5,6-тетрагидроимидазо-
(2,1-)- тиазол в виде масла; HA-iP в CDCtg : 7,(2Н, d); 6,7 5 (2Н, d ); 4,8 d (IH, d ); 4,6 d
(IH, d ); 3,75(3H, S ); 2,8 (У (4H, m); 2,95 6 (6H, S ). Формула изобретения
Способ получения имидазогетероциклических соединений обшей формулы (1) -(CH,L
где -незамещенный фенил, нафтил, фурил, тиенил, пиридил или фенил, замещенный
1 или 2 заместителями, выбранными из группы, содержащей атом галогена, алкил
, галоидалкил, аякокси- или алкнлтио- группу, содержащую в алкильной части от 1
до 4 атомов углерода, диалкиламино- или ариламиногруппу, каждая из которых содержит
до 6 атомов углерода, нитрогруппу; R j -алкил, содержащий от 1 до 6 атомов
углерода, алкенил или алкинил, содержащий до 6 атомов углерода, фенилалкил,
содержащий до 8 атомов углерода; Т1 -целое число от 1 до 2; или их солей, отличающийся
тем, что соединение общей формулы ( (1 ) н.Д-(сн,„ RjOjC S
где имеют вышеуказанные значения, R - атом водорода, алкил, содержащий т 1 до 6 атомов углерода;
одвергают взаимодействию с соединением бщей формулы 1И Ri g- илиR2 Li,
в которых R имеет вышеуказанные знаения:
523641 1112
it-хлор, бром, йод;нием продуктов в свободном виде, или в вив
среде растворителя, например эфира,де соли, в виде смеси изомеров или отдельтетрагидрофурана
, с последующим выделе-ных изомеров, или оптических антиподов.







Комментарии