Способ получения имидазогетероциклических производных, их солей или их оптически-активных производных - SU520051A3
Код документа: SU520051A3
Описание
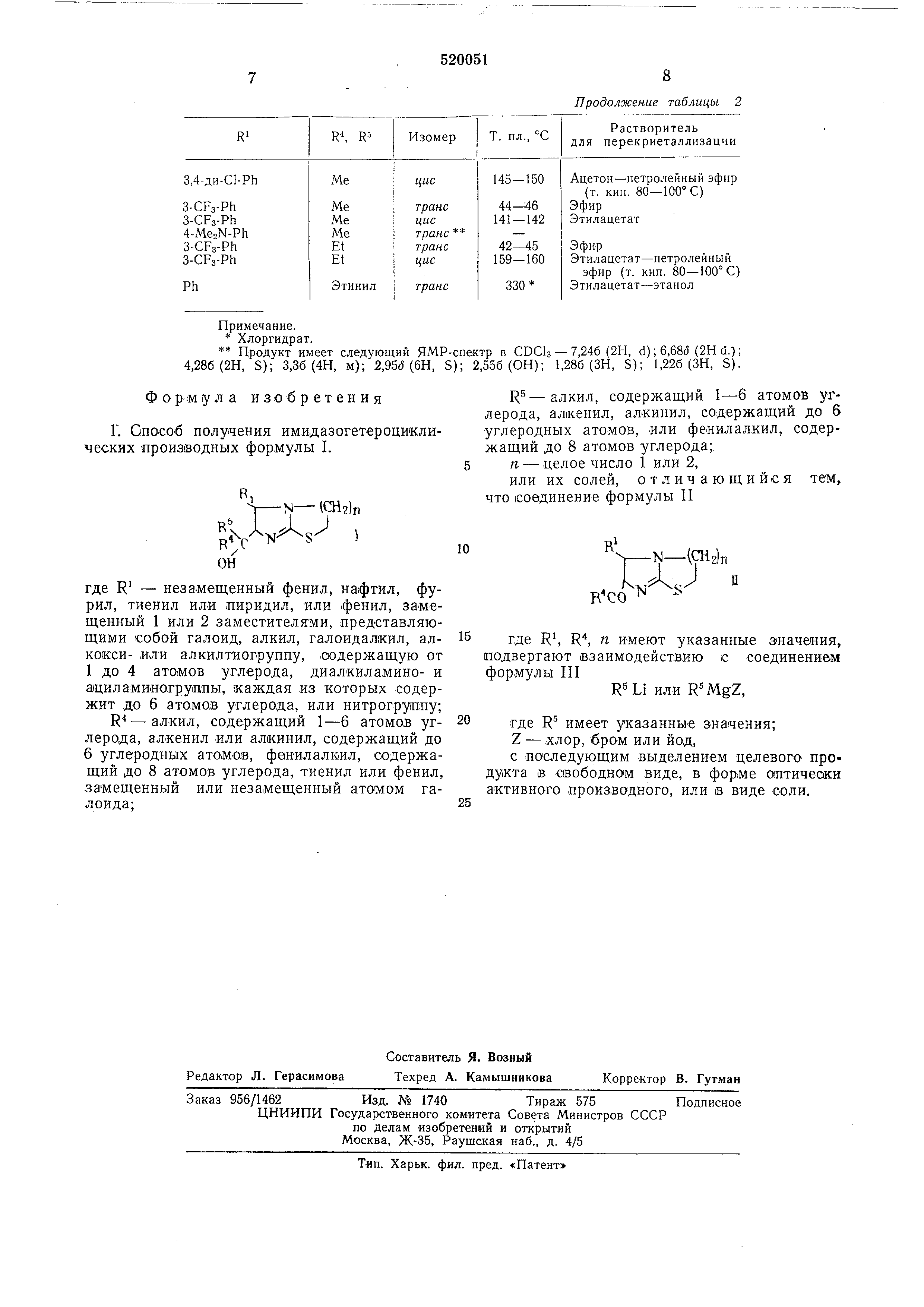
или , где R5 HiMeer указанное значение, Z - хлор, бром или йод, с выделением целевого продукта в свободком Виде, в форм.е оптически активного производиого , или IB виде соли. Обычно реакцию проводят в .растворителе, например эфире или тетрагидрофуране; ее МОЖНО ускорить, применяя нагревание. Соединения формулы I могут быть лолучены .в виде радемических смесей, либо в виде отдельных антиподов. В одной из групл предлагаемых соединений R - атом углерода, к -которому присоединены R и R находятся в транс-лоложении относительно друг друга. В качестве заместителей лри R, когда он ЯВляется фенильным радикалом, служит фтор, хлор, бром или метил , изопролил, трифторметил, метоксил, метилтио , диметиламико, ацетиламино или нитрорадикалы . К этой группе заместителей R относятся также 4-ДИметиламино-3-трифторметил , 3,4-дихлоргруп;пы или 4-бром. R обычно означает метил, этил, н-пропил, к-бутил, винил, бензил, фенил, хлорфенил или тиенил. R обычно означает метил, этил, н-пропил, винил или бензил. К Числу соединений, получаемых предлагаемым способом, относятся: транс-6- (1 -окси-1 -метил-га-бутил) -5-фенил 2 ,3,5,б-тетрагидроимидазо(2,1-Ь)тиазол; транс-6- (1 -этил-1 -окси-га-пропил) -5-фенил 2 ,3,5,6-тетрагидроимидазо(2,1-Ь)тиазол; транс-5-(3,4 - дихлорфенил) - 6-(1-этил-1окси-я-пропил ) - 2,3,5,6 - тетрагидроимидазо (2,1-6)тиазол; цыс-5-(3,4-дихлорфенил)-6-(1-этил-1-окси н-|Пропил )-2,3,5,6 - тетрагидроимидазо (2,-Ь) тиазол; г/ анс-6-(1-этинил-1-оксипроп - 2 - инил)-5 (3,4-дихлорфенил)-2,3,5,6-тетрагидроимидазо (2,1-Ь)тиазол. Подходящими кислотно-аддитивными солями получаемых илшдазогетероциклических производных по изобретению являются, например , хлоргидрат, бромгидрат, фосфат, сульфат или .цитрат. Исходные соединения формулы II могут быть получены реакцией соединения формулы IV R-СН-СН CDR, (.полученного из соответствующего ненасыщенного кетона), где Z - .хлор, бром или йод, с основанием, например триэтиламином (ИЛИ ацетатом натрия, в растворителе, например этилацетате, при этом получают соединение формулы V которое конденсируют с соединением формулы VI Л1р(СНг)л где п имеет вышеуказанное значение. РеаКцию можно вести в присутствии основания - триэтилавдина, ,в растворителе - этилацетате, ее можно ускорить или завершить нагреванием. Лучше реакцию вести В атмосфере азота. Сле1дующие примеры иллюстрируют изобретение . Пример 1. Раствор т/7анс-б-а:цетил-5 (3,4-дихлорфенил) -2,3,5,6-тетрагидроимидазо (2,2-&)тиазола (0,63 г) в сухОМ тетрагидрофуране (50 мл) осторожно добавляют в атмосфере азота к реактиву Гриньяра, полученного из магния (0,14 г) и метилиодида (0,38 мл) в эфире. Смесь перемешивают при 20° С в течение 1 час, растворитель отгоняют выпариванием и часть остатка растворяют в этилацетате , а другую в 0,5 н. NaOH. Этил ацетат упаривают и остаток хроматографируют на силикагеле, используя в качестве элюанта этилацетат - метанол. Получают транс-б-(окси-1-метилэтил ) - 5 - (3,4 - дихлорфенил) 2 ,3,5,6-тетрагидроимидазо (.2Л-&)тиазол; т. пл. 126- l28°C перекристаллизацией из петролейного эфира (т. кип. 80-100° С) и ацетона. Раствор дибромпроизводного (12,3 г), полученного бромированием г/7аяс-4-фенилбутЗ-он-2-она , 2-аминотиазолина (4,1 г) и триэтиламина (8,2 г) в этилацетате (50 мл) нагревают с обратным холодильником в течение 2 час. Смесь охлаждают, бромгидрат триэтиламина отфильтровывают, фильтрат упаривают досуха. Остаток растворяют .в .смеси эфир - 2,5 н. НС1 И водный слой подщелачивают раствором гидроокиси натрия (5 н.) и экстрагируют эфиром. Эфирный экстракт упаривают и остато.к перекристаллнзовывают из петролейного эфира (т. кип. 80-100°), получая г/ 7анс-6-ацетил-5-фенил-2,3,5,6-тетраГИдронмидазо (2,1-&)тиазол; т. пл. 83-89° С. Аналогичным образом, используя диб.роМпроизводное , полученное бромираванием транс - 4-(3,4 - дихлорфенил) - бут-З-ен-2-ОНа, вместо дибромпроизводного, -полученного бромированием т/ а«с-4-фенилбутаи-2-она, получают транс - 6-ацетил-5-(3,4 - дихлорфенил)2 ,3,5,6-тетрагидрО|Имидазо (2,1-6)тиазол в виде вязкого .масла. Продукт, полученный выше, пере,кристаллизовьшают из ацетона и получают транс6-а1цетил-5- (3,4-дихлорфенил) - 2,3,5,6 - тетраидроимидазо (2Л-6) тиазол; т. пл. 115-117° С.
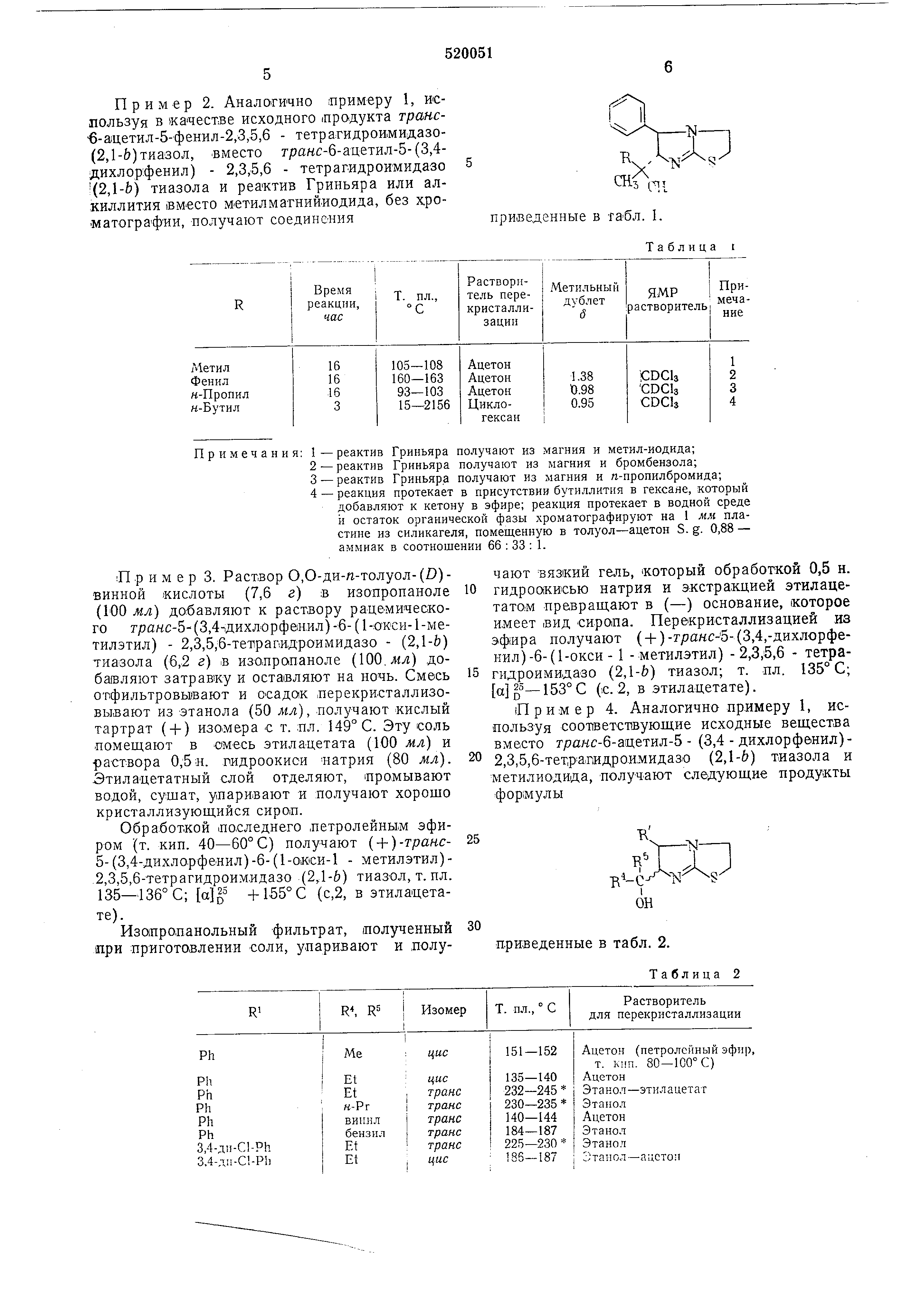
Пример 2. Аналогично примеру 1, используя в качестве исходного продукта транс6-ацетил-5-фенил-2 ,3,5,6 - тетрагидроимидазо (2,1-&)тиазол, -вместо тракс-6-ацетил-5-(3,4дихлор .фенил) - 2,3,5,6 - тетрагидроимидазо (2,1-Ь) тиазола и реактив Гриньяра или алкиллития iBM-ecTO метилматнийиодида, без х.роматографии , получают соединения
5 п приведенные в табл. I.
Таблица i


Реферат

Формула


Комментарии