Способ производных 5-нитроимидазола - SU365886A3
Код документа: SU365886A3
Описание
III
где Ri, Rg, Rs, Z и Y - имеют приведенные выше значения. Целевой продукт выделяют в свободном состоянии или в виде соли известными приемами.
Для превращения в простой эфир оксигрупп в качестве Ra берут преимущественно метильный , этильный, бутильный, аллильный или бензильный остаток. Алкильные остатки могут быть замещены в конце цепочки, окси-, алКОКСИ- , ацилокси- или тозилоксигруппами.
Для превращения в сложный эфир гидроксильных групп в качестве Rs используют алифатические и ароматические карбоновые кислоты , например уксусную, масляную, бензойную , коричную, метансульфоновую, л-толуолсульфоновую и бутансульфоновую кислоты.
В качестве N-замещепных аминогрупп берут преимущественно моноалкиламиногруппы и диалкиламиногруппы, причем каждая алкильная группа может содержать 1-5 атомов углерода.
Ra может представлять ацилированные и сульфонилированные аминогруппы, например ацетиламино-, пропиониламино-, бутириламиНО- , метансульфониламино-, бензолсульфониламино- и тол юлсульфониламиногруппы.
В качестве N-замещенных аминоалкоксигрупп используют преимущественно насыщенные и ненасыщенные свободные моноалкиламиноэтоксигруппы и диалкиламиноэтоксигруппы и превращенные в сложный эфир моно- (оксиалкил)-амипоэтоксигруппы и ди-(оксиалкил ) -аминоэтоксигруппы, моноциклоалкиламиноэтокси- и дпциклоалкйламиноэтокси-, гексаметилениминоэтокси-, октаметиЛёниминоэтокси- и декаметилениминоэтокси-, пирролиДННОЭТОКСИ- , пиперидиноэтокси-, пиперазииоэтокси- и морфолиноэтоксигруппы, причем алкильные II циклоалкильные остатки должны содержать 1-5 атомов углерода. Циклические основания могут замещаться алкильными группами, ОКСИ-, ацилоксигруппами, ацильными , оксиалкильнымИ или ацилоксиалкильными группами с соответственно 1-5 атомами углерода в алкильном и/или ацильном остатке и могут соединяться пряМыМи связями и/или с помощью алкиленовых групп.
Для получения солей аминогрупп можно применять, например, соляную, серную, фосфорную , молочную, уксусную, пропионовую, лимонную, бензойную, янтарную, гептаглюконовую кислоты и т. д. Образование соли может также происходить благодаря тому, что третичный амин с алкилгалогенидом, диалкилсульфатом или алкилсульфонатом переводят в четвертичную соль.
Способ осуществляют при комнатной или при повыщенной температуре в кислотной среде , преимущественно в ангидриде алифатической карбоновой кислоты с 1-6 атомами углерода или Б уксусной кислоте в присутствии концентрированной серной кислоты. Конденсацию можно также осуществлять в содержащем хлористый водород этаноле, в муравьиной , ортофосфорной и в пиперидинуксусной кислотах.
Цример 1. 405 мг (2,5 ммоль) 5-метокси1-инданона , 388 мг (2,5 ммоль) 5-нитро-1-метил-2-имидазолилальдегида и 350 мг обезвоженного ацетата натрия загружают в 2,5 мл ангидрида уксусной кислоты и выдерживают
в течение 1,5 час при температуре 70°С. Цосле охлал дения до температуры 5°С, отсасывания, промывания водой и настаивания в кииящем этаноле получают 235 мг (32% от теоретического ) 5-метокси-2- (5-нитро-1-метил-2-имидазолилметилен )-1-инданоиа с т. нл. 256-258°С. Найдено, %: С 60,44, Ц 4,22, N 13,94. Вычислено, %: С 60,19, Н 9,38, N 14,04. Пример 2. 81 мг (Q, ммоль 5-метокси-1инданона и 7Q мг (Q,b ммоль) 5-нитро-1-метил2-имидазолилальдегида кипятят в 2 мл 75%ного водного раствора этанола с 0,05 мл концентрированной соляной кислоты в течение 3 час. После охлаждения до температуры 20°С и обработки, как описано в примере 1, получают 10 мг (6,8% от теоретического) 5-метокси-2- (5-нитро-1 -метил-2 - имидазолилметилен) 1-инданона .
Пример 3. 81 мг (0,5 ммоль) 5-метокси1-инданона и 78 мг (0,5 ммоль) 5-нитро-1-меТ|ИЛ-2-имидазолилальдегида кипятят в течение 1 час Б 1 мл мура1вьи1ной кислоты. После Охлаждеиия до температуры 20°С и о-бработки , 1ка:к описано в примере 1, получают 15 мг (10% от теоретического) 5-метокси-2-(5-нитро - 1 - метил - 2 - имидазолилметилен) - 1 - и«данона .
Пример 4. 81 мг (О, ммоль) 5-метОКси-1индаиона и 78 мг (0,5 ммоль) 5-нитро-1-метил2-имиазолилальдегида загружают в 3,5 мл
бензола с 11 мл пиперидина и 9 мл уксусной кислоты и выдерживают в течение 2 дней при температуре 20°С, затем отсасывают и обрабатывают , как Описаню в .примере 1. Получают 7 мл (5% от теоретического) 5-метокси-2 (5-иитро-1 - метил-2- имидазолилметилен)-1инданона .
Пример 5. 388 мг (2,5 ммоль) 5-1НИтро-1метил-2-НМИдазолилальдегида и 350 мг обезвожениого ацетата натрия загружают в 2,5 мл
ангидрида уксусной кислоты в течение 90 мин лри температуре 100°С. Смесь охлаждают, отсасывают и промЫгвают 5 мл воды. После перекристаллизации получают 125 мл (19% от теоретического) 5-Н1Итро-1-метил-2-диацетоксиметилимидазолила с т. пл. 144-146°С.
81 Л1г (0,5 ммоль) 5-метокси-1-инданона и 128 мг (0,5 ммоль) 5-нитро-1-метил-2-диацетоксиметилимидазолила и 70 мг обезвоженного ацетата натрия замещают и обрабатывают
в 0,5 мл ангидрида уксусной кислоты, как описано в примере 1. Получают 240 мг (33% от теоретического) 5-метоксп-2-(5-питро-1-мети.п2-имидазолил мети лен)-1-инданона.
Пример 6. 330 мг индаиона подвергают химическому взаимодействию и обрабатывают , как описаио в примере 1. Получают 322 мг (48% от теоретического) 2-(5-питро-1-мет11Л2-имидазолилметилен )-1-индаиопа с т. пл. 250-254°С.
Найдеио, %: С 62,27; Н 4,39; N 15,80.
Вычислеио, %: С 62,44; Н 4,12; N 15,60.
Пример 7. 440 мг 5-этокси-1-ииданоиа, 388 мг 5-нитро-1-метил-2-имидазолилальдег11да и 350 мг обезвоженного ацетата натрия выдерживают в 2,5 мл ангидрида уксусной кислоты в течение 1,5 час при температуре 100°С. После охлаждения до температуры 5°С, отсасывания , промывания водой и размешивания с тетрагидрофураном получают 182 мг (23% от теоретического) 5-этокси-2-(5-нитро-1-лгетил-2-имидазолилметилен )-1-инданона с т. пл. 261-265°С.
Найдено, %: С 61,76; П 4,86; N 13,54.
Вычислено, %: С 61,33; П 4,83; N 13,41.
Пример 8. 510 мг 5-бутокс11-2-и11дано11а подвергают xi-гмическому взаимодейешию и обрабатьгвают, как о-писапо в примере 7. Получают 259 мг (30% от теоретического) 5-бутокси-2- (5-нитро-1-метил -2 - имидазолилметялен )-1-ипданоиа с т. пл. 243-246°С.
Пайдено, %: С 63,87; П 5,95; N 12,69.
Вычислеио, %: С 63,32; П 5,62; N 12,31.
Пример 9. 370 мг 5-окси-1-пиданона иол,вергают химическому взаимодействию, как описано в примере 7. Сырой продукт иерекристаллизовывают из диметилформамида. Получают 324 мг (40% от теоретического) 6-ацетокси-2- (5-нитро-1-метил-2- имидазолилметилен)1-индаиона с т. пл. 244-248°С.
Найдено, %: С 59,02; Н 4,20; N 13,04.
Вычислено, %: С 58,71; Н 4,01; N 12,84.
Пример 10. 370 мг 4-окси-1-ииданона иодвергают химическому взаимодействию, как описано в нpи.epe 7. Первичный иродукт настаивают с метанолом. Получают 540 мг (67% от теоретического) 4-ацетокси-2-(5-нитро-1-метил-2-им11дазолилметилеп )-1-инт,анона с т нл. 214-243°С.
Найдено, %: С 58JO; Н 3,95; N 13,03.
Вычислено, %; С 58,71; Н 4,01; N 12,84.
Пример 11. 480 мг 4,5-диметокси-1-инданона подвергают химическому взаимодействию и обрабатывают, как описано в примере 7. Получают 425 мг (52% от теоретического) 4,5-дидгетокси-2- (5-нитро-1-метнл-2 - имидазолилме тилей)-1-инданона с т. пл. 228-230°С.
Найдено, %: С 58,37; Н 4,42; N 12,71.
Вычислено, %: С 58,36; П 4,60; N 12,76.
Пример 12. 365 мг 6-метил-1-инданон подвергают химическому взаимодействию, как оиисаио в примере 7. Первичный иродукт иерекристаллизовывают из смеси ацетонитрила, улороформа и тетрагидрофурана (25:30: 10). Получают 133 мг (19% от теоретического) 6метил-2- (5-иитро-1-метил-2 - имидазолилметплен )-1-инданоиа с т. пл. 249-252°С.
Найдено, %: С 64,13; Н 4,68; N 14,90.
Вычислено, %: С 63,59; Н 4,63; X 14,83.
Пример 13. 455 мг 5-метокси-Ь-окси-1-инданоиа подвергают хпмическому взаимодействию , как описаио в примере 7. Первичный продукт настаивают с метанолом и перекристаллизовывают из диметилформамида. Получают 260 мг (30% от теоретического) 5-метокси-6ацетокси-2- (5-нитро-1-метил)- 2-и.мидазол11лметилеи-1-ииданона с т. пл. 248-252С.
Найдено, %: С 57,45; Н 4,17; N 11,78. Вычислено, %: С 57,14; П 4,24; N 11,76.
Пример 14. 415 г 6-хлор-1-ииданоиа подвергают химическому взаи.модс11ствию, как описаио в примере 7. Первичный продукт пастаивают с ацетоиитрилом. Получают 431 мг 57% от теоретического) 6-хлор-2-(5-иитро-1метил-2-имидазолилметилен ) - 1-инданона с т. пл. 258-259°С.
Найдено, %: С 54,76; Н 3,35; N 14,12. Вычпслено, %: С 55,36; Н 3,34; N 13,83. Пример 15. 370 ./1гг 7-окси-1-ипдаиоиа подвергают химическому взаимодействию, как описано в примере 7. Первичиый иродукт иерекристаллизовывают из смеси ацетонитрила и хлороформа (1 : 1). Получают 180 м.г (227о ol теоретического) 7-ацетокси-2-(5-иитро-1-метил-2-имидазолилметилеи )-1-ииданона с т. ил.
225229 С
Найдено, %: С 58,38; N4,19. Вычислено, %: С 58,94; Н 3,89. Пример 16. Исходя из 485 мг 7-ацетокси1-ииданоиа , как оиисано в примере 10, получают 80 мг (10% от теоретического) 7-ацетокси-2- (5-нитро-1-метил-2-имидазолил метилен)иидаиона .
Пример 17. Диалогично иримеру 7, исходя из 550 мг 5-(2-этоксиэтокси)-1-ппдаиона получают 100 мг (11% от теоретического) 5 (2-этоксиэтокси)-2-(5-нптро-1-метил-2 - имидазолилметилен )-1-ииданона с т. пл. 220- 222°С.
Нарщено, %: С 59,91; Н 5,50; N 11,56. Вычислено, %: С 60,49; Н 5,36; N 11,76. Пример 18. Аналогично примеру 7, исходя из 365 мг З-метил-1-ипданона, нолучают 100 мг (14% от теоретического) 3-метил-2-(5иитро-1-метил-2-имидазолилметплеи ) -1 - индаиоиа с т. пл. 215-216°С.
Найдено, %: 63,83; Н 4,62; N 14,94. Вычислеио, %: С 63,62; Н 4,63; N 14,83. Пример 19. 375 мг 6-окси-З-бензофуранона иодвергают химическому взаимодействию, как описано в примере 1. Первичиый продукт перекристаллизовывают из смеси метапола и хлороформа (1 : 1) и затем из диметилформа МИДа. Получают 270 мг (33% от теоретического ) 6-ацетокси-2-(5-нитро-1-метил - 2-импдазолилметилен )-3-бензофураноиа с т. пл 258- 259°С.
Пайдено, %: С 54,22; Н 3,40; N 12,78. Вычислеио, %: С 54,71; Н 3,37; X 12,76. Пример 20. 350 мг тиоиндоксила подвергают химическому взаимодействию, как описано в примере 7. Первичный продукт настаивают с диметилформамидом. Получают 132 мг (18% от теоретического) 2-(5-нитро-1-метил2-имит ,азолилметилен)-тиоиндоксила с т. пл. 283-288°С. Найдено, %: С 54,56; Н 3,47; N 14,30; S 11,50. Вычислено, %: С 54,36; Н 3,16; N 14,62; S 11,16. Пример 21. 365 мг 4-метнл-1-инданона подвергают химическому взаимодействию, как описано в примере 7. После настаивания в горячем диметилформамиде получают 213 мг (30% от теоретического) 4-метил-2-(5-питро-1метил-2-имидазолилметнлен )-1-инданона. Найдено, %: С 63,73; Н 4,80; N 14,58. Вычислено, %: С 63,59; Н 4,63; N 14,83. Пример 22. 435 мг 6-изоироиил-1-индаиона подвергают химическому взаимодействию и обрабатывают, как описано в примере 21. Получают 242 мг 6-изопропил-2-(5-нитро-1-метил2-имидазолилметилен )-1-индапопа (31% от теоретического) с т. пл. 243(250)-255°С. Найдено, %: С 65,50; Н 5,67; N 13,46. Вычислено, %: С 65,59; Н 5,51; N 13,50. Пример 23. 518 мг З-фепил-1-инданона, 388 мг 5-ннтро-1-метил-2-имидазолилальдегида в 350 мг обезвоженного ацетата натрия в 250 мл апгндрида уксусной кислоты выдерживают в течение 8 час при температуре 100°С. После охлаждения до температуры 5°С, отсасывания , промывания водой и перекристаллизации из диметилформамида получают 222 мг 3-фепил-2-(5-иитро-1-метил-2 - имидазолилметилен )-1-инданона (26% от теоретического) с т. нл. 184-186°С. Найдено, %: С 69,00; Н 4,74; N 12,01. Вычислено, %: С 69,75; Н 4,10; N 12,21. Пример 24. 370 мг 4-хроманона нодвергают химическому взаимодействию, как онисапо в примере 7. После обработки в горячем диметилформамиде и перекристаллизации из тетрагидрофурана получают 10 мг 3-(5-нитро1-метил-2-имидазолилметилен )-4 - хроманона (1,4% от теоретического) с т. пл. 215-218°С. Найдено, %: С 58,70; Н 4,00; N 14,48. Вычислено, %: С 58,94; Н 3,89; N 14,73. Пример 25. 410 мг 7-окси-4-хроманона замещают , как описано в примере 7. После добавления 5 мл воды смесь охлаждают до 5°С, осадок отсасывают и перекристаллизовывают из смеси ди метил форм амид/вода. Получают 78 мг 7-ацетокси-3-(5-нитро-1-метил-2-имидазолилметилен )-4-хроманона (9,2% от теоретического ) с т. пл. 202-203°С. Найдено, %: С 56,75; Н 3,89; N 12,31. Вычислено, %: С 55,65; Н 4,38; N 12,17. Пример 26. 388 мг (2,5 ммоль) 5-нитро-1метил-2-имидазолилальдегида и 440 мг (2,5 ммоль) 6-метокси-1-тетралопа нагревают в 2,55 мл уксусной кислоты и 0,055 мл 95%ной серной кислоты в течение 6 час до температуры 100°С. После охлаждения смесь подвергают взаимодействию с метанолом и отсасывают . Получают 154 мг 6-метокси-2-(5-нитро-1-метил-2-имидазолилметилеп )-1 - тетралоиа (20% от теоретического) с т. пл. 215°С. Найдеаю, %: С 61,45; Н 5,20; N 13,27. Вычислено, %: С 61,33; Н 4,83; N 13,41. Пример 27. мг (2,5 ммоль) 7-метокси4-тиахроманона подвергают химическому взаимодействию и обрабатывают, как оиисано в примере 26. Получают 70 мг 7-метокси-2-(5питро-1-метил-2 - имидазолилметилен) - 4-тиахроманона (8,5% от теоретического) с т. пл. 192(193) -198°С. Найдено, %: N 12,56; 59,34. Вычислено, %: N 12,69; S 9,68. Пример 28. 508 жг (2,5 ммоль) 6-ацетилам11НО-1-тетралопа замеш,ают, как описано в примере 26, причем нагревают только в течение 5 час, и, как указано в примере 26, обрабатывают . Получают 253 мг 6-ацетиламино2- (5-нитро-1-метил-2-имидазолилметилеи) - 1тетралона (30% от теоретического) с т. пл. 227-228°С. Найдено, %: С 59,91; Н 4,96; N 16,00. Вычислено, %: С 60,00; Н 4,74; N 16,46. Пример 29. 600 мг (2,5 ммоль) 6-метансульфонилокси-1-тетралопа подвергают химическому взаимодействию, как оиисано в примере 26, по нагревают в течение 7 час и обрабатывают как указано в примере 28. Получают 250 мг 6-метансульфонокси-2-(5-нитро-1метил-2-имидазолилметилен ) - 1 - тетралона (27% от теоретического) с т. нл. 183-185°С. Найдено, %: N 11,18; 58,78. Вычислено, %: .N 11,14; 5 8,50. Пример 30. 405 мг (2,5 Л1моль) 6-окси-1тетралона нодвергают химическому взаимодействию , как оиисано в нримере 26, но нагревают в течение 3 час и обрабатывают. Получают 105 мг 6-окси-2-(5-нитро-1-метил-2имндазолилметилен )- -тетралона (14% от теоретического ) с т. пл. 238-240°С. Найдено, %: С 60,19; Н 4,75; N 13,76. Вычислено, %: С 60,19; Н 4,38; N 14,04. Пример 31. 3Q5 мг (2,5 ммоль) 1-тетралона подвергают химическому взаимодействию, как описано в примере 26, но нагревание ведут в течение 2,5 час и обрабатывают. Получают 30 мг 2-(5-нитро-1-метил-2-нмидазолилметилен )- -тетралона (4,2% от теоретического ) ст. пл. 193-195°С. Найдено, %: С 63,59; Н 4,63; N 14,83. Вычислено, %: С 64,01; Н 4,97; -N 14,48. Нример 32. И г (78 ммоль) 5-нитро-1этилимидазолила нагревают с 11,7 г параформальдегида в 57 мл диметилсульфоксида в течение 48 час при температуре 110°С в закрытой трубке. После дистиллирования летучих составляющих при давлепии 1 мл рт. ст. и при температуре 100°С в ванне, остаток дважды перекристаллизовывают из бензола. Получают 5,1 г 5-нитро-1-этил-2-оксиметилимидазолила (38% от теоретического) с т. пл. 101-102°С. 3,42 г (20 ммоль) полученного выще соединения кипятят в ИЗ мл бензола с 15 г ацета«
та свинца (IV) в течение 8 час. Охлаждение, фильтрация, промывание нейтральной средой и высушивание бензольного раствора дают после выпаривания в вакууме 2,37 г 5-нитро-1этил-2-нмидазолилальдегнда (70% от теоретического ) в виде масла.
424 мг (2,5 лыюль) этого соединения подвергают химическому взаимодействию с 370 лгг (2,5 лыголь) 5-иитрокси-1-индаиоиа, как оппсаио в иримере 7. Первичиый иродукт настаивают в горячем этаноле. Получают 145 мг 5ацетоксп-2- (5-иитро-1-этил-2- имидазолилметнлен )-1-ин:инона (17% от теоретического) с т. пл. 225-227°С.
Найаеио, %: С 59,50; Н 4,30; N 12,38.
Вычислено, %: С 59,82; Н 4,43; N 12,32.
Пример 33. 3,66 г (20 .i/.woyzb) 5-нитро-1аллил-2-оксиметнл Мидазола подвергают взаимодействию с ацетатом свиица (IV) и обрабатывают , как оиисано в иримере 32. Получают 2,7 г 5-нитро-1-аллил-2-имидазолилальдегида (74% от теоретического) в виде масла.
443 мг (2,5 .i/лшль) получен ого выше соединения подвергают химическому взаимодействию с 370 лгг (2,5 моль} 5-окси-1-инданоиа, как описано в примере 7. Первичный иродукт перекристаллизовывают из этанола. Получают 18 7иг 5-ацетокси-2-(5-нитро-1-аллил-2-имидазолилметилеи )-1-ппдапоиа (2% по теоретическому ) ст. пл. 188-19 °С.
Пайдеио, %: С 61,62; Н 4,00; N 12,23.
Вычислеио, %: С 61,19; Н 4,28; N 11,89.
Пример 34. 4,8 г 5-нитро-1-(2-бензоилоксиэтил )-имидазола нагревают с 2,76 г параформальдегида в 16,8 л;л диметилсульфоксида в течение 48 час при температуре 110°С в закрытой трубке. Выпаривапие в вакууме и иерекристаллизация из бензола дают 2,77 г (52% от теоретического 5-нитро-2-оксиметил-1 (бензоилоксиэтпл)-имидазолила с т. ил. 136- 139°С.
5,84 г этого соединения обрабатывают ацетатом свинца (IV), как описано в прпмере 32.
Получают 3,95 г (68% от теоретического) 5-нитро-1- (2-бензонлоксиэтил) -2 - имидазолилальдегида с т. пл. 113-114°С.
772 мг этого соединения иодвергают химическому взаимодействию с 370 мг 5-окси-1-иидапона , как описано в примере 10, причем смесь нагревают ио крайней мере в теченне 4 час, и обрабатывают. Получают 306 .кг (27% от теоретического) 5-ацетокси-2- 5-питро-1-(2беизолилоксиэтил )-2-имидазолилметилеи) - 1ииданона с т. нл. 186,5-187,5°С.
Пайдено, %: С 62,75; Н 4,11; N 9,34.
Вычислеио, %: С 62,47; П 4,15; N 9,12.
Пример 35. 570 мг 7-хлор-4,6-диметокси-3бензофураиа подвергают взаимодействию и обрабатывают, как описано в иримере 10 (нагревание продолжают по крайней мере в течение 2,5 час до температуры 100°С). Получают 353 мг (39% от теоретического) 7-хлор4 ,6-диметокси-2-(5-нитро-1-метил - 2-имидазолилметилеи )-3-бензофурана с т. пл. выше 295°С.
Пайдено, %: N 11,32; С1 9,63.
Вычислено, %: N 11,49; С1 9,70.
Пример 36. 568 мг 4-бром-7-окси-1-инданона подвергают хпмпческому взанмодейстВИЮ , как описано в примере 2б. Перекристаллизация отстоеиного с водой продукта из ацетоиитрила дает 318 мг (32% от теоретического ) 4-бром-ацетокси-2-(5-нитро-1 - метил - 2имидазолил .метилен)-1-инданоиа с т. пл. 248- 25ГС.
Пай.деио, %: N 10,32; Вг 19,96.
Вычислеио, %: N 10,35; Вг 19,67.
Пример 37. 690 мг натрия, 4,44 г 5-окси-1ииданона и 7,5 г бро.мэтанола кииятят с небольшим колпчество.м йодида калия в 40 мл алкоголя в течеиие 48 час.
После выпаривания растворителя в вакууме смешивают остаток с 50 мл воды и 50 мл уксусной кислоты.
Полученный при этом оса.док отсасывают п перекрпсталтизовывают из уксусной кислоты. Получают 900 мг (16% от теоретического) 5 (2-оксиэтокси)-1-инданона с т. пл. 121(122) - 127°С.
480 мг 5-(2-окспэтокси)-1-инданона иодвергают химическому взаимодействию и обрабатывают , как описаио в иримере 26. Получают 145 мг (16% от теоретического) 5-2-ацетоксиэтокси )-2-(5-нитро-1-метил - ,aзoлилмeтилен )-1-инданона с т. пл. 212(215)-216°С.
Пайдено, %: С 57,33; Н 4,65; N 11,77.
Вычнслено, %; С 58,22; П 4,62; N 11,32.
Пример 38. 490 мг 5-хлор-4,6-диметил-3бензофурана подвергают химическому вазимодействию , как описано в примере 26. Перекристаллизация отстоеииого с водой продукта из тетрагидрофурапа дает 65 мг (8% от теоретического ) 5-хлор-4,5-диметил-2-(5-нитро-1метил-2-имидазолплметилен )-3 - бепзофурапа с т. пл. 265-217°С.
Пайдено, %: N 12,14; С1 10,61.
Вычислено, %: N 12,59; С1 10,63.
Пример 39. 455 мг тиоиндоксил-1,1-:1иоксида подвергают химическому взаимодействию , как описано в примере 7. Охлаждение смеси, ее отфильтровывание от ацетата натрия и смешивание фильтрата с водой дает осадок, который перекристаллизовывают из ацетонитрила . Получают 33 мг (4% от теоретического) 2-(5-нитро-1-метил-2-имилазолилметилен) -тиопндокснл-1 ,1-диоксида с т. пл. 288°С.
Пайдеио, %: N 12,83; S 9,75.
Вычислено, %: N 13,15; S 10,04.
Пример 40. 574 мг (2 ммоль} 2-(5-нитроI-мeтил-2-и пIдaзoлнлмeтилeи ) - тиоиндоксила иодвергают химическому взаимодействию в 50 мл уксусной кислоты с 0,5 мл 30%-ной перекиси водорода в 10 мл уксусной кислоты.
Через 16 час при иеремешивапип и при тe rпературе 20°С снова добавляют 0,5 мл 30%иой перекпси водорода.
Перемешивание продолжают в течеиие 8 час
при температуре 20°С, смесь отфт1льтровывают , фильтрат выпарпппют в вакууме и осадок
отстаивают с метаиолом. Получают 109 мг
11
(18% от теоретического) 2-(5-нитро-1-мет11л-2нм -щазолилметилен )-тиоинлокс11л-1-оксида с т. пл. 256°С.
Найдено, %: N 14,06; S 10,69.
Вычислено, %: N 13,85; S 10,56.
Пример 41. 638 мг (5- (2-диметиламииоэтокси )-1-индаио11а, гидрохлорида, подвергают химическому взаимодействию, как описано в примере 7. В реакционный раствор добавляют воду и экстрагируют хлороформом. Выпарениый экстракт хлороформа смешивают с метанолом и добавляют эфир. После фильтроваиия фильтрат выпаривают до сухого состояния и остаток растворяют в 25 мл 2N соляной кислоты . После промываиия кислотной фазы эфиром и уксусной кнслотой смесь иодщелачивают 2N натровым щелоком и экстрагируют хлороформом . Хлороформный экстракт вынаривают , остаток растирают с метанолом и эфиром . После отсасываиия получают 4,7 мг (0,5% от теоретического) 5-(2-диметиламиноэтокси ) -2- (5-нитро-1-метил-2- нмидазолилметилен )-1-ипданона с т. пл. 223-225°С.
Структуру проверяют путем спектрального анализа, который показывает иптенспвпые «пики при 356 (М) и 58 (+)
(СПз)2-.
Пример 42. 5.95 г (36,8 ммоль) 6-амино1-тетралоиа добавляют в 200 мл воды нрн температуре 80°С с 12 мл диметилсульфоната и одновременно 6,75 мл 50%-ного натронового щелока по каплям. После охлаждения смесь отсасывают и осадок растирают с эфиром. Эфирный фильтрат дает после выпаривания 3 г вещества, которое хроматографируют через столб кремииевой кислоты (150 г) с петролейным эфиром/уксусной кислотой. Вначале получают 473 мг 6-дпметиламипо-1-тетралона с т. пл. 66-67°С п после этого 1,21 г 6-метиламино-1-тетралона с т. пл. 93-94°С.
473 мг 6-диметиламино-1-тетралона замещают , как оиисано в примере 26. Получают 207 мг (25% от теоретического) 6-диметиламиио-2- (5-нитро-1-метил-2 - имидазолилл1етилен )-1-тетралопа с т. пл. 239(246)--249°С.
Найдено, %: С 62,50; Н 5,73; N 16,98.
Вычислено, %: С 62,57; Н 5,57; N 17,17.
Прнмер 43. 300 мг (2,5 ммоль) ацетофенона подвергают химическому взаимодействию , как описано в примере 7. После охлаждения добавляют фильтрат 5 мл воды. Отсасывание дает 53 мл (8% от теоретнческого) 2- (5-питро-1-метил-2-имидазолилметилеи) - ацетонопа с т. пл. 202°С.
Пример 44. 415 мг (2,5 ммоль} 5,6-диоксп-1-инданона обрабатывают, как оиисано в примере 26. Перекристаллизация из смеси диметилформамид/метанол дает 250 мг (33% от теоретического) 5,6-диокси-2- (5-нитро-1 -метил2-имидазолилметилен )-1-инданона с т. нл. выше 290°С.
Найдено, %: С 55,38; Н 4,05; N 13,77
Вычислено, %: С 55,81; Н 3,68; N 13,95.
Пример 45. 520 мг (2,5 ммоль) 4-фтор-7хлор-3-метил-1-ннданона обрабатывают, как
12
оиисано в иримере 7, причем одиако смесь выдерживают в течеиие 2,5 час ири температуре 100°С. После охлаждения добавляют метанол , кристаллы отсасывают, отстаивают в горячей воде и перекристаллизовывают из ацетонила .
Выход составляет 103 мг (12% от теоретического ) 4-фтор-7-хлор-3-метил-2-(5-нитро-1метнл-2-имидазолилметилеи )-1-ннданона с т.
пл. 225°С.
Найдено, %: С 58,86; Н 3,65; N 12,62; С1 10,30.
Вычнслено, %: С 53,67; Н 3,31; N 12,52; С1 10,56.
Нример 46. 2,07 г натрия растворяют в 120 мл этанола и затем 14,6 г (90 ммоль) 6-окси-1-тетралона , 22,5 г 2-бромэтанола н 0,4 г йодида калия добавляют к этому раствору. Через 48 час при кииячении в атмосфере азота раствор выпаривают в вакууме до сухого состояния, смешивают с 200 мл воды и экстрагируют эфиром уксусной кислоты. Растворы сложного эфира уксусной кислоты промывают 1 N соляной кислотой и водой, высушивают , фильтруют и выпаривают до сухого состояиия . Растирание осадка с эфиром дает 14,7 г (79% от теоретического) 6-(2-окснэтокси )-1-тетралона с т. пл. 89-91°С. Найдено, %: С 69,62; Н 7,00.
Вычислено, %: С 69,89; Н 6,85.
515 мг (2,5 ммоль} этого соединения подвергают химическому взаимодействию и обрабатывают , как описано в примере 26. Перекристаллизация из ди.метилформамида дает
215мг (22% от теоретического) 6-(2-ацетоксиэтокси ) -2- (5-нитро-1-метил-2- имидазолилметилен )-1-тетралона с т. пл. 168°С.
Найдено, %: С 59,68; Н 5,08; N 10,69. Вычислено, %: С 59,21; Н 4,97; N 10,97.
Пример 47. 438 мг (2,5 ммоль) 6-метиламиио-1-тетралоиа обрабатывают, как описано в примере 26. После охлаждення и добавления метанола получают кристаллпзат, который выделяют. Нз фильтрата получают через
16 час при температуре 4°С второй кристаллизат , который фильтруют в смеси бензола и ацетона (2:1) через 1 г кремнневого желе. Выиариванне в вакууме и перекристаллизация осадка из изопропанола дает 50 мг (6%
от теоретического) 6-метнламино-2-(5-нитро-1метил-2-нмидазолилметилен )-1-тетралона с т. пл. 235Т.
Найдено, %: N 17,89. Вычнслено, %: N 17,94.
Пример 48. 2 г (8,8 ммоль} 5-нитро-1-(2ацетоксиэтокси ) - 2 - имидазолилальдегида и 1,43 г (8,8 ммоль} 5-метокси-1-индапона выдерживают в 8,8 мл ангидрида уксусной кислоты с 1,23 г обезвоженного ацетата натрия в
течение 8 час при температуре 100°С. Охлаждение , отсасывание и отстаивание осадка в горячей воде дает 0,84 г (26% от теоретического ) 5-метокси-2- 5-нитро-1 - (2-ацетоксиэтокси) 2-имидазолил .метилен -1-инданона с т. пл.
190°С. Найдено, .%: С 57,84; Н 4,59; N 11,43. Вычислено, %: С 58,22; Н 4,62; N 11,32. Пример 49. 10 г (0,07 моль) диметиламиноэтилхлорида , гидрохлорида, и 2,8 г (0,07 моль) NaOH растворяют в 20 мл воды, экстрагируют с бензолом и бензольный раствор кинятят в течение 48 час при перемешивании над К2СОз. 1,2 г (0,052 моль) натрия растворяют в50лл этанола, затем добавляют 8,1 г (0,05 моль) 6-окси-1-тетралона. К реакционному раствору добавляют свежеполученный раствор диметиламиноэтилхлорида и небольшое количество йодида калия. В течение 20 час смесь перемешивают с обратным холодильником, затем отделяют от выпавшего хлористого натрия, раствор выпаривают, осадок смешивают с водой и экстрагируют эфиром уксусной кислоты. Органическую фазу высушивают над Na2SO-i и вынаривают. Маслянистый осадок растворяют в эфире и замешкают с эфирным НС1. Выпавший твердый продукт отсасывают и перекристаллизовывают из изопронанола. Выход составляет 7,4 г (55% от теоретического ) 6- (2-диметиламиноэтокси) -Ьтетралоиа гидрохлорида с т. нл. 173-174°С. Найдено, %: N 5,20; С1 13,19. Вычислено, 7о: N 5,19; С1 13,13. 673 мг (2,5 ммоль) 6-(2-диметиламиноэтокси )-1-тетралона, гидрохлорида, подвергают химическому взаимодействию, как описано в примере 26. Затем обрабатывают путем вливания в 10 мл воды и выпаривают реакционный раствор в вакууме до почти сухого состояния . Осадок растирают с метанол/эфиром и отсасывают. Выход составляет 280 мг (24% от теоретического) 6-(2-диметиламиноэтокси)2- (5-нитро-1-метнл-2-имидазолилметилен) - 1тетралона в виде сульфата с т. пл. 196(200) - 204°С. Найдено, %: N 11,49; S 7,05. Вычислено, %; N 11,96; S 6,85. Пример 50. 11,5 г (70 ммоль) диэтиламиноэтилхлорида , гидрохлорида, и 2,8 г (70 Л1моль) NaOH растворяют в 20 мл воды, экстрагируюг бензолом, и беизольный раствор высушивают при перемешивании в течение 48 час над карбонатом калия. 1,2 г (52 ммоль) натрия растворяют в 50 мл этанола, затем носледовательио добавляют 7,4 г (50 ммоль) 5нитрокси-1-инданона . К реакционному раствору добавляют полученный водный раствор диэтиламиноэтилхлорида и н.ебольи ое количество йодида калия. Смесь перемешивают в течение 24 час с обратным холодильником, затем реакционную смесь выпаривают в вакууме до сухого состояния, осадок номешают в воду и экстрагируют эфиром уксусной кислоты. Органическую фазу высушивают над сульфатом магния и выиаривают. Маслянистый осадок растворяют в эфире и замеш,ают эфирной соляной кислотой. Вьшавший твердый продукт отсасывают. Выход составляет 8,66 г 5-(2-диэтиламиноэтокси )-1-пнданона, гидрохлорида, (61% от теоретического) с т. пл. 173-175°С. 567 мг (2 ммоль) 5-(2-дпэтиламнноэтокси)1 -инданона, гидрохлорида, и 310 мг (2 ммоль) 5-11Итро-1-мегил-2-имидазолилальдеп1да перемешивают в 2,04 мл уксусной кислоты и 0,121 мл (2,2 ммоль) концентрированной серной кислоты в течение 6 час при температуре 100°С. Реакционную смесь выпаривают в вакууме почти до сухого состояния, осадок растирают с метанолом и отсасывают кристаллический твердый продукт. Вы.ход составляет 334 мг 5-(2-диэтиламиноэтокси )-2-(5-нитро-1-метил-2- имидазолилметилен )-1-ииданона, сульфата (35% от теоретического ) с т. ил. 194-196,5°С. Пример 51. 9,6 г (50 ммоль) 5-(2-оксиэ1окси )-1-11нданона и 9,5 г (50 ммоль) п-толуолсульфохлорида перемешивают в 100 мл пиридина в течение 1,5 час при комнатной температуре. Реакционный раствор выливают в 500 мл ледяио воды и отсасывают кристаллический твердый продукт. Выход составляет 12,2 г 5-(2-7г.-толуолсульфонилоксиэтокси )-1-инданона (70% от теоретического ) с т. пл. 94°С. 6,92 г (20 ммоль) 5-(2-к-толуолсульфонилоксиэтоксн )-1-инданона и 5,68 г (80 ммоль) пирролидииа кипятят в 200 мл этанола в течение 3 час. После выиаривания в вакууме до сухого состояния остаток иомещают в воду и добавляют 2 N NaOH и затем экстрагируют эфиром уксусной кислоты. Органическую фаЗУ высушивают над MgSO4 и выпаривают. Маслянистый осадок растворяют в эфире и замеш,ают эфирной соляной кислотой. Вьшавший твердый продукт отсасывают. Выход составляет 2,5 г 5-(2-пирролидинэтокси )-1-инданоиа, гидрохлорида (45% от теоретического). 2,5 г (8,9 1моль) 5-(2-пирролидинэтокси)-1инданона , гидрохлорида, и 1,38 г (8,9 ммоль) 5-нитро-1-метил-2-имидазолилальдегида замещают и обрабатывают, как описано в прпмере 10. Выход составляет 0,75 г 5-(2-пирролидиноэтокси )-2-(5-ннтро-1 -метил-2- имидазолилметилен )-1-инданона, сульфата (18% от теоретического ) с т. пл. 224-225°С. Пример 52. 1,38 г (4 ммоль) 5-(2-«-толуолсульфоннлокси )-этоксн-1-ппданона и 1,36 г (16 ммоль) пиперидина обрабатывают и подвергают химическому взаимо.чействию в 40 мл этаиола, как оиисано в примере 51. Выход составляет 0,96 г 5-(2-иинеридиноэтокси)-1-инданона , гидрохлорида (81% от теоретнческого) с т. пл. 188-190°С. 387 .иг (3 ммоль) 5-(2-ниперидиноэтокси)-1инданоиа , гидрохлорида, и 465 мг (3 ммоль) 5-нитро-1-метнл-2-имидазолилальдегида замешают и обрабатывают, как описано в примере 50. Выход составляет 340 мг 5-(2-пиперидиноэтокси )-2-(5-нитро-1-метил-2 - имидазолилме15
тилен)-1-инданона, сульфата (23% от теоретического ) с т. пл. 224-226°С.
Пример 53. 1,38 г (4 ммоль} 5-(2-/г-толуолсульфонилоксиэтокси )-1-инданона и 1,6 г (16 ммоль) 1-метилпиперидина подвергают химическому взаимодействию и обрабатывают в 40 мл этаиола, как описано в иримере 51.
Выход составляет 1,17 2 (4-метилиииеразино )-этокси -1-индаио11а, гидрохлорида (94% от теоретического) с т. пл. 234-236°С.
1,09 г (3,5 ммоль) (4-метилпиперазино)этокси -1-ииданона , гидрохлорида, и 0,543 г (3,5 ммоль) 5-иитро-1-метил-2-имидазолилальдегида замещают и обрабатывают, как описано в примере 50.
Выход составляет 0,55 г (4-метилпиперазина )-этокси -2-(5-нптро-1-метил - 2 - нмидазолилметилен )-1-инданона, сульфата (31% от теоретического) с т. пл. 206-209°С.
Пример 54. 5,44 г (37 ммоль) 5-амино-1инданоиа в 25 мл воды при температуре 80°С постепенно смешивают с 36 мл диметилсульфата и 15,5 г NaOH в 60 мл воды. После охлаждения реакционную смесь экстрагируют эфиром уксусной кислоты. Органическую фазу высушивают иад MgSO,( и выпаривают. После кристаллизации осадка из 50%-него водного метаиола получают 1,2 г 5-диметиламино-1инданоиа (19% от теоретического) с т. пл. 105-107°С.
438 мг (2,5 ммоль) 5-диметиламино-1-ииданона и 388 мг (2,5 ммоль) 5-нитро-1-метил-2имидазолилальдегида замещают, как описано в примере 7. Сырой продукт подвергают взаимодействию с метанолом. Получают 128 мг 5-диметиламино-2-(5-иитро-1-метил - 2 - импдазолилметилен )-1-инданона (16% от теоретического с т. пл. выше 290°С.
Пример 55. 19,27 г (93,5 млюль) 6-(2-оксиэтокси )-1-тетралона подвергают химическому взаимодействию и обрабатывают, как описано в примере 51, с 19,5 г (102,85 ммоль) л-толуолсульфохлорида.
Выход составляет 28,6 г 6- (2-/г-толуолсульфонилоксиэтокси )-1-тетралона (85% от теоретического с т. пл. 106-108°С).
3,6 г (10 ммоль) 6-(2-«-толуолсульфонилоксиэтокси )-1-тетралона и 3,48 г (40 млюль) морфолина замещают и обрабатывают, как описано Б примере 51.
Выход составляет 1,73 г 6-(2-морфолинэтокси )-1-тетралона, гидрохлорида (56% от теоретического ) с т. пл. 194-196°С.
1,87 г (в ммоль) 6-(2-морфолиноэтокси)-1тетралона , гидрохлорида и 0,93 г (6 ммоль) 5-нитро-1-метил-2-имидазолилальдегида перемешивают в 6,12 мл уксусной кислоты и 0,363 мл (6,6 ммоль) концентрированной серной кислоты в течение 6 час при температуре 100°С. После охлаждения замещают с метанолом и отсасывают. Получают 1,04 г 6-(2морфолииоэтокси ) -2-(5-иитро-1 -метил-2- имидазолилметилен )-1-тетралона, сульфата (34% от теоретического) с т. пл. 223-224°С.
Пример 56. 473 мг (2,5 ммоль) 5-ацетами16
но-1-инданона и 423 мг (2,5 Л1моль) 5-нитро-1этил-2-имидазолилальдегида подвергают химическому взаимодействию, как описано в примере 7. Сырой продукт подвергают реакцпи с метанолом. Получают 206 мг 5-ацетамино-2- (5-нитро-1 -этил-2-имидазолилметилен) -1 инданона (24% от теоретического) с т. пл. 268-269°С.
Пример 57. 1,8 г (10 .нмоль) 4-(2-оксиэтокси )-ацетофенона и 1,9 г (10 ммоль) /г-толуолсульфохлорида перемешивают в 20 мл пиридина в течение 2 час при комнатной температуре , выливают в 100 мл воды и твердый кристаллический продукт отсасывают.
Выход составляет 2,1 г 4-(2-«-толуолсуль (61
фонилоксиэтокси)-ацетофенона
ОТ теоретического ) с т. пл. 82-84°С.
1,67 г (5 ммоль) 4-(2-/г-толуолсульфонилоксиэтокси )-ацетофенона и 1,42 г (20 ммоль) пирролидина замещают и обрабатывают, как описано в иримере 51.
Выход составляет 0,7 г 4-(2-пирролидинэтокси )-ацетофенона, гидрохлорида (82% от теоретического) с т. пл. 128-130°С.
674 жг (2,5 ммоль) 4-(2-пирролидинэтокси)ацетофенона , гидрохлорида, и 338 мг (2,5 ммоль) 5-нитро-1-метил-2-имидазолилальдегида замещают и обрабатывают, как описано в примере 50.
Выход составляет 503 мг 4-(2-пирролидинэтокси )-2-(5-нитро-1-метпл-2- имидазолилметилен )-ацетофенона, сульфата (43% от теоретического ) ст. пл. 182-184°С.
Пример 58. 5 г (37 ммоль 4-аминоацетофенона в 25 мл воды при температуре 80°С постепенно смешивают с 12 мл диметильсульфата и 5,15 г NaOH в 20 мл воды. После охлаждения отсасывают осадок и перекриста лизовывают его из 70%-ного водного метанола. Получают 4,2 г 4-диметиламииоацетофенона (70% от теоретического) с т. пл. 102-103°С.
408 мг (2,5 ммоль) 4-диметиламиноацетофенона и 388 Л1г (2,5 ммоль) 5-нитро-1-метил2-имидазолилальдегида подвергают химическому взаимодействию и обрабатывают, как описано Б примере 26.
Выход составляет 250 мг 4-диметиламино2- (5-нитро-1-метил - 2 - имидазолилметилен)ацетофенона (33% от теоретического) с т. ил. 237-238°С.
Пример 59. 147 мг (1 ммоль) 5-амино-1индаиона и 228 мг {1,2 ммоль) «-толуолсульфохлорида кипятят в 2 мл пиридина в течение 1,5 час. После охлаждения реакционный раствор выливают в 10 мл воды и отсасывают кристаллический твердый продукт.
Затем 287 игг 5-я-толуолсульфониламиио-1инданона и 103 жг (0,67 ммоль) 5-иитро-1-метил-2-имидазолилальдегида подвергают химическому взаимодействию и обрабатывают, как описано в примере 7.
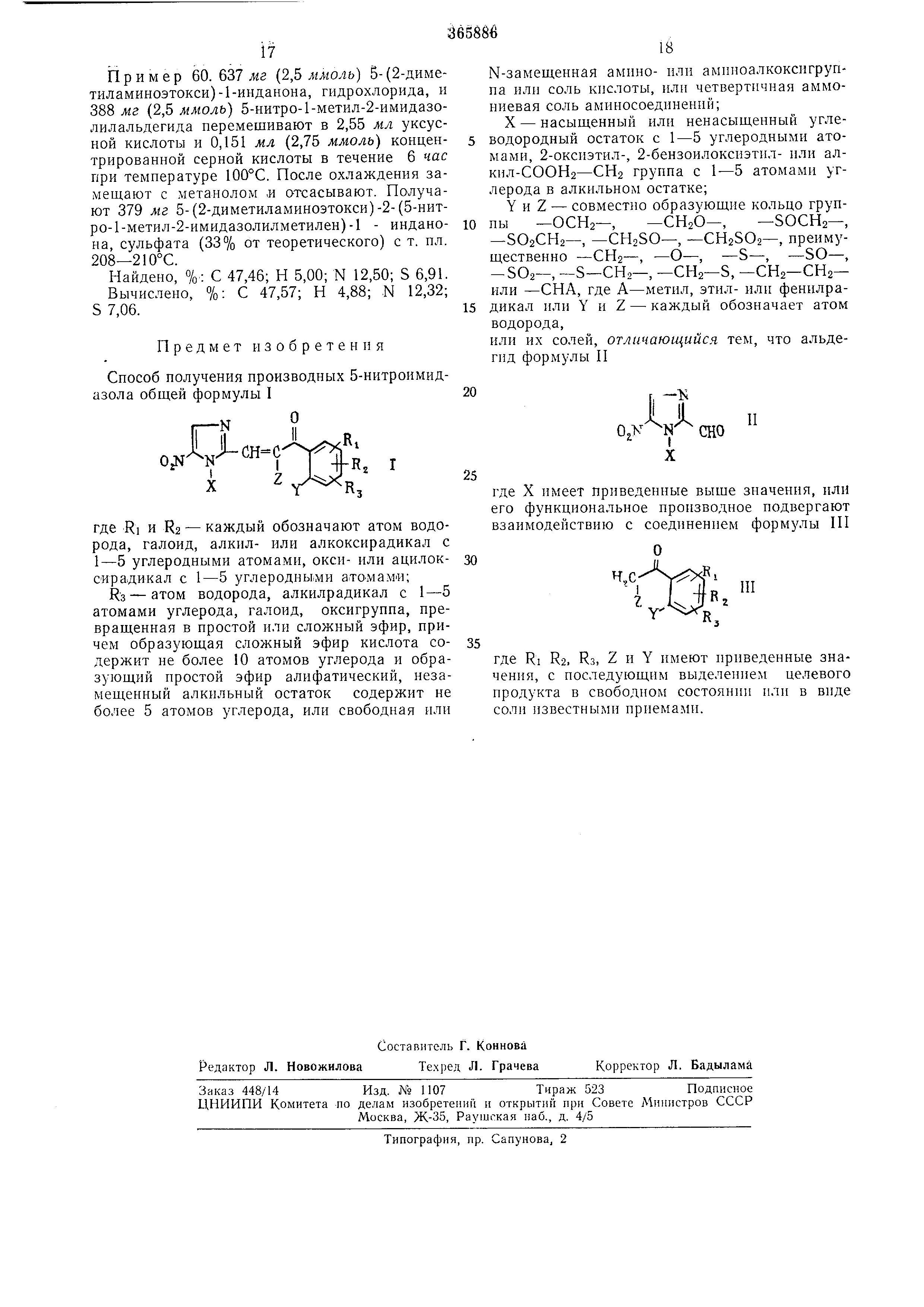
Выход составляет 220 мг 5-«-толуолсульфониламино-2- (5-нитро-1-метил - 2 - имидазолилметилеи )- -инданона (75% от теоретического) с т. пл. 274-275°С. Пример 60. 637 жг (2,5 ммоль) 5-(2-диметиламиноэтокси )-1-инданона, гидрохлорида, и 388 мг (2,5 ммоль) 5-нитро-1-метил-2-имидазолилальдегида иеремешивают в 2,55 мл уксусной кислоты и 0,151 мл (2,75 ммоль) концентрированиой серной кислоты в течение 6 час при температуре 100°С. После охлаждения замещают с метанолом ,и отсасывают. Получают 379 мг 5-(2-диметиламиноэтокси)-2-(5-нитро-1-метил-2-имидазолилметилен )-1 - инданона , сульфата (33% от теоретического) с т. пл. 208-210°С. Пайдено, «/о: С 47,46; Н 5,00; N 12,50; S 6,91. Вычислено, %: С 47,57; Н 4,88; N 12,32; S 7,06. Предмет изобретения Способ получения производных 5-нитроимидазола общей формулы I а сн где RI и R2 - каждый обозначают атом водорода , галоид, алкил- или алкоксирадикал с 1-5 углеродными атомами, окси- или ацилоксирадикал с 1-5 углеродны,ми аточмамИ; R3 - атом водорода, алкилрадикал с 1-5 атомами углерода, галоид, оксигруппа, превращенная в простой или сложный эфир, причем образующая сложный эфир кислота содержит не более 10 атомов углерода и образующий простой эфир алифатический, незамещенный алкильный остаток содержит не более 5 атомов углерода, или свободная или N-замещенная амино- или аминоалкоксигруппа или соль кислоты, илн четвертичная аммониевая соль аминосоедннений; X - насыщенный или ненасыщенный углеводородный остаток с 1-5 углеродными атомами , 2-ОКСИЭТИЛ-, 2-бензоилоксиэтил- или алкил-СООНа-СП2 группа с 1-5 атомами углерода в алкнльном остатке; Y и Z - совмест}1о образующие кольцо групны -ОСИг-, -CHsO-, -SOCH2-, -5О2СП2-, -СП25О-, -CH2SO2-, преимущественно -СН2-, -о-, -S-, -so-, -SO2-, -S-СН,-, -СП2-S, -СН2-СН2- или -СНА, где А-метил, этил- или фенилрадикал или Y и Z - каждый обозначает атом водорода, или их со.тей, отличающийся тем, что альдегид формулы II Л„л где X имеет приведенные выше значения, или его функциональное производное подвергают взаимодействию с соединением формулы III где RI R2, Rs, Z и Y имеют приведенные значения , с последующим выделением целевого продукта в свободном состоянии или в виде соли известными ириемами.








Реферат

Формула


Комментарии