Способ диагностики аллергических реакций - RU2536291C2
Код документа: RU2536291C2
Чертежи















Описание
РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет документа UUSN 61/120033, поданного 4 декабря 2008 года, который включен в настоящее описание в качестве ссылки в полном объеме.
ДЕКЛАРАЦИЯ ОТНОСИТЕЛЬНО ФИНАНСИРОВАНИЯ ИССЛЕДОВАНИЯ ФЕДЕРАЛЬНЫМ БЮДЖЕТОМ
Настоящее изобретение частично финансировалось правительством США, грант номер 5U19AI050864-07, выданный Национальным Институтом Здравоохранения. Правительство имеет определенные права на настоящее изобретение.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к способам обнаружения множественных цитокинов и взаимосвязанных поверхностно-экспрессируемых иммунофенотипических биомаркеров отдельно взятых клеток для создания иммунологических характеристик заболеваний.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Хорошо известно, что отдельные клетки, даже те, которые визуально идентичны, отличаются друг от друга множеством характеристик, таких как вариабельность экспрессии отдельного гена, концентрация особо важного метаболита или иона или характером ответа на приложенное раздражение. Живые клетки обладают очень низким количеством копий многих компонентов, включая дезоксирибонуклеиновую кислоту (ДНК) и важные регуляторные молекулы. Как случайные события, присущие биохимическому процессу экспрессии гена (собственный шум), так и изменения в других клеточных компонентах (внешний шум) вносят вклад по существу в общую изменчивость клеток. Типы клеток, мутации и изменения - все это вносит вклад в разнообразие клеток организма.
Однако при большинстве клинических или клеточных исследований проводится анализ клеток в большом объеме, с использованием сыворотки или культуральной среды для выращивания клеток. Эти исследования часто усредняют информацию о всей клеточной популяции и не дают подробной информации, которая является особо важной для оценки состояния биологической системы, например: 1) экспрессируются ли два или более гена совместно в одной и той же клетке или они экспрессируются в различных субпопуляциях клеток; 2) является ли небольшое увеличение экспрессии, измеренной в матрице, результатом небольшого, равномерного увеличения во всех клетках или большого увеличения в подмножестве клеток.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В системе нано- или суб-наноразмерных исследований, способы изобретения предоставляют количественные измерения как комбинации, так и распределения скоростей секреции для множества (например, 2, 4, 5, 6, 8, 10, 20) секретируемых продуктов, например, цитокинов, высвобождаемых одновременно из разных жизнеспособных клеток. Способы предоставляют ответы на множество вопросов в одной системе исследования, включая: "кто" (фенотип или линия дифференцировки подробно исследуемой клетки), "что" (идентификация секретируемого продукта, например, цитокин, антитело, хемокин или фактор роста), "как часто" (частота встречаемости респондеров в популяции клеток), и "как много" (величина секреции, например, уровень количества каждого секретируемого продукта). Способы могут использоваться для обнаружения характера любой секреторной клетки, например, иммунной клетки, такой как T-клетка или B-клетка, но также могут использоваться для других секреторных клеток, таких как клетки, которые секретируют гормоны или ферменты. Характер секреции отдельной жизнеспособной клетки соответствует ее фенотипу или линии дифференцировки (например, определяемому визуально или при анализе) для получения характера секреции клетки. Характер секреции дает ценную информацию для диагностики заболевания или мониторинга ответов при терапевтическом вмешательстве.
Например, изобретение относится к способу диагностики иммунологического заболевания у больного, например, инфекционного заболевания, аутоиммунного заболевания или аллергии. В некоторых вариантах осуществления, исследуют единичные клетки (или несколько клеток) для обнаружения характера иммунного ответа человека, например, аллергического ответа. Сгруппированные количественные (многомерные) наборы данных, полученные способами по изобретению, используются для распознавания ответов клеток различных доноров на различные стимулы. Способы, описанные в настоящей заявке, также можно использовать для клинического мониторинга вакцин, терапевтических биологических лекарственных препаратов, хронических инфекций, аутоиммунных заболеваний и т.д.
В одном из аспектов, отличительным признаком изобретения является способ определения иммунных характеристик больного, например, характеристик секретируемых цитокинов. Способ предусматривает наличие суспензии клеток (например, живых клеток) больного, нанесенной на пластичный планшет, содержащий по меньшей мере одну микролунку (причем каждая микролунка составляет менее 100×100×100 мкм3, например, 50×50×50 мкм3) в матрице микролунок, при этом по меньшей мере одна микролунка в матрице микролунок имеет субнанолитровый объем для единичной клетки. В одном из аспектов, клетками являются клетки цельной крови. В другом аспекте, клетками являются мононуклеарные клетки периферической крови (PBMC). Матрицу микролунок приводят в контакт с субстратом, при этом субстрат предварительно обрабатывают по меньшей мере одним средством для обнаружения (например, средством для обнаружения цитокина), и при этом средство для обнаружения связывается с секретируемым продуктом (например, цитокином) клетки. В одном из аспектов, в способе используют по меньшей мере два средства для обнаружения по меньшей мере три средства для обнаружения, или по меньшей мере четыре средства для обнаружения. Уровень средства для обнаружения на субстрате измеряют, при этом уровень соответствует количеству секретируемого продукта единичной клетки, определяя посредством этого иммунные характеристики. Необязательно, средство для обнаружения выявляет панель секретируемых продуктов T-клетки. В другом аспекте, средство для обнаружения выявляет панель секретируемых продуктов T-хелпера 2 (Th2).
В одном из аспектов, скорость секреции определяют для каждого секретируемого продукта. В другом аспекте, определяют фенотип клетки. Необязательно, секретируемые продукты соответствуют поверхностно-экспрессируемым маркерам на клетках, которые различают линии дифференцировки.
Способ определения характеристики отдельной жизнеспособной клетки осуществляют с использованием следующих стадий: получения суспензии клеток больного, нанесенной на пластичный планшет, содержащий по меньшей мере одну микролунку в матрице микролунок, при этом по меньшей мере одна микролунка в матрице микролунок содержит единичную клетку в субнанолитровом объеме; приведение в контакт матрицы микролунок с субстратом, при этом субстрат предварительно обрабатывают по меньшей мере одним средством для обнаружения, и при этом средство для обнаружения связывается с продуктом, секретируемым указанной клеткой для получения печатной микроматрицы; визуализации печатной матрицы для получения набора данных; фильтрования набора данных для идентификации локализаций на указанной матрице, состоящей из единичной клетки; и сравнение локализации с уровнями секретируемых продуктов, обнаруженными из локализаций единичных клеток, определяя посредством этого указанную иммунную характеристику отдельной жизнеспособной клетки. Необязательно, способ предусматривает идентификацию фенотипа или линии дифференцировки единственной клетки, а затем сравнение фенотипа или линии дифференцировки с уровнем секретируемых продуктов в точно установленной локализации.
В некоторых вариантах осуществления, характеристика представляет собой общий T-клеточный профиль, Th1-профиль, Th2-профиль, Th9-профиль, Th17-профиль или профиль другой секреторной клетки. Например, субстрат содержит соответствующие пары антител или множество антител для обнаружения интересующих цитокинов. Различные панели антител, используемые в качестве образцов, обнаруживающих пулы цитокинов, свидетельствуют об асимметричности ответа Th и специфичных ответов Th2 и Th1. Например, общая T-клеточная панель выявляет следующие цитокины IL-4/IL-10/IL-17/IFNγ. Увеличение одного или более цитокинов среди секретируемых продуктов подробно исследованной клетки свидетельствует о ее характеристике. Th2-панель содержит средства для обнаружения IL-4/IL-5/IL-9. Панель для обнаружения характеристик цитотоксического T-лимфоцита (CTL) или Th1 включает средства для обнаружения, которые выявляют IFNγ/MIP-1β/TNFα/перфорин/IL-2, где MIP и/или перфорин свидетельствуют об асимметричности в сторону CTL фенотипа, а IL-2 свидетельствуют об асимметричности в сторону Th1-фенотипа. Панель, содержащая средства для обнаружения, которые выявляют IFNγ/IL-10/IL-17/IL-22, подходит для оценки образцов слизистой оболочки, например, для определения иммунной характеристики клеток желудочно-кишечного тракта (в качестве средства для оценки заболевания/расстройства или предрасположенности к нему). Обнаружение изотипа антитела подходит для оценки аллергических реакций или предрасположенных к аллергии людей. Например, были разработаны панели средств для обнаружения для обнаружения следующих панелей антител (IgG1/IgA/IgE/IgG4 и IgG1/IgA/IgG3/IgM). Обнаружение увеличения изотипа антитела IgE свидетельствует об аллергической реакции к стимулирующему аллергену.
Характерный Th-пул содержит средства, которые выявляют интерлейкин-17 (IL-17), IL-10, IL-4, интерферон-γ (IFN-γ), IL-1b, IL-2, IL-6, IL-7, IL-8, IL-12, IL-21, IL-22, IL-23, макрофагальный воспалительный белок (MIP) 1b, MIP1a и/или Интерферон-индуцируемый белок (IP)-10. Характерный (Th2-пул) выявляет IL-4, IL-5, IL-13 и/или IL-9. В другом аспекте, клетки визуализируют на поверхностно-экспрессируемые маркеры (например, CD3, CD4, CD8, CD14, CD19, CD20, CD25, CD27, CD38, CD138, CD95, CD154, CD127). Эти маркеры согласуются с цитокиновыми характеристиками для каждой клетки, что отличает способы, описанные в настоящей заявке, от описанных ранее способов захвата.
В качестве альтернативы или в дополнение, в способе можно использовать средство для обнаружения идентифицирующего антитела, например, IgE, IgG1, IgG4, IgGA, IgG2, IgG3, IgM, IgA1 и/или IgA2. Предпочтительным средством для обнаружения цитокина является антитело, например, поликлональное или моноклональное антитело для цитокина. В качестве альтернативы, средством для обнаружения цитокина является аптамер.
В целом, используют любую биологическую ткань с цитокин-продуцирующими клетками. В некоторых вариантах осуществления, используют мононуклеарные клетки периферической крови (PBMC). При необходимости, клетки стимулируют перед помещением на пластичном планшете. Например, клетки стимулируют предполагаемым или известным аллергеном. В качестве альтернативы, клетки стимулируют пептидами, белками или исходными патогенами инфекционных агентов.
В некоторых вариантах осуществления, аллергеном является пищевой продукт. Например, пищевой продукт представляет собой молоко, яйцо, арахис, лесной орех, рыбу, моллюск, сою, пшеницу, яичные продукты, бобовые или морепродукты. В некоторых вариантах осуществления, аллергеном является лекарственный препарат, например, амоксициллин, пенициллин, сульфаниламидный препарат, барбитурат, противосудорожное средство, инсулин или йод. В некоторых вариантах осуществления, аллергеном является пыль, пыльца, перхоть домашних животных, латекс или хлор, или ядовитое вещество, связанное с укусом насекомого, например, укусом жала осы, огненного муравья или пчелы. В некоторых вариантах осуществления, аллергеном является биологическое терапевтическое средство, например, Г-КСФ (фильгастрим) и ГМ-КСФ (сарграмостим), EPO (эритропоэтин), РИТУКСАН® (ритуксимаб), ГЕРЦЕПТИН® (трастузумаб), гормон роста человека, БЕТАСЕРОН® (интерферон бета-1b), АВОНЕКС®, (интерферон-бета-1a или ЭНБРЕЛ® (этанерцепт).
В еще одном аспекте, отличительным признаком изобретения является способ оценки чувствительности к аллергену у больного. Способ предусматривает наличие суспензии клеток больного, нанесенной на пластичный планшет, содержащий по меньшей мере одну микролунку в матрице микролунок, при этом по меньшей мере одна микролунка в матрице микролунок имеет единичную клетку. Предпочтительно, клетки приводят в контакт с тестируемым аллергеном. Матрицу микролунок приводят в контакт с субстратом, при этом субстрат предварительно обрабатывают по меньшей мере одним средством для обнаружения, указывающим на чувствительность к аллергену. Вслед за этим, средство для обнаружения выявляют, например, измеряют уровень средства для обнаружения. Уровень средства для обнаружения коррелирует с уровнем секретируемого продукта, например, цитокина или антитела, оценивая посредством этого чувствительность аллергена. В одном из примеров, средство для обнаружения идентифицирует цитокин, например, увеличение уровня цитокина Th2, например, IL-4, по сравнению с уровнем цитокина Th1, IFNγ, свидетельствует о том, что больной страдает аллергией или существует риск развития аллергии к указанному аллергену. В еще одном примере, средство для обнаружения выявляет изотип антитела, причем увеличение изотипа IgE по сравнению с другими изотипами, такими как IgG (в частности, IgG4, IgM или IgA), свидетельствует об аллергической реакции на стимулирующий аллерген и аллергии или предрасположенности к ней больного, клетка которого была получена.
В другом аспекте, отличительным признаком изобретения является способ определения набора цитокиновых характеристик больного, служащего признаком аутоиммунного заболевания или инфекционного заболевания. Сначала получают суспензию клеток больного, нанесенную на пластичный планшет, содержащий по меньшей мере одну микролунку в матрице микролунок. В одном из аспектов по меньшей мере одна микролунка в матрице микролунок имеет единичную клетку. Затем матрицу микролунок приводят в контакт с субстратом. В одном из аспектов, субстрат предварительно обрабатывают по меньшей мере одним средством для обнаружения цитокина. В завершении, выявляют средство для обнаружения цитокина и определяют набор цитокиновых характеристик, служащий признаком аутоиммунного заболевания или инфекционного заболевания. Набор цитокиновых характеристик, являющийся эталоном и служащий признаком аутоиммунного заболевания или инфекционного заболевания, имеет повышение уровня IFNγ или IL-2 по сравнению с нормальным уровнем указанного IFNγ или IL-2.
Иллюстративные аутоиммунные заболевания включают артрит (включая ревматоидный артрит), рассеянный склероз, иммуно-опосредованный сахарный диабет или сахарный диабет 1 типа, воспалительное заболевание кишечника, системную красную волчанку, псориаз, склеродермию и аутоиммунные заболевания щитовидной железы. Примеры инфекционных заболеваний включают, например, африканский трипаносомоз, холеру, криптоспоридиоз, лихорадку денге, гепатит A, гепатит B, гепатит C, ВИЧ/СПИД, грипп, малярию, японский энцефалит, малярию, корь, менингит, онхоцеркоз ("речную слепоту"), пневмонию, ротавирус, шистосомоз, шигеллез, острый фарингит, туберкулез, брюшной тиф и желтую лихорадку.
Еще в одном аспекте, изобретение относится к набору, который включает субстрат, пластичный планшет, выполненный с возможностью приема субстрата и обеспечения водонепроницаемого уплотнения между пластичным планшетом и субстратом, и инструкции для использования адаптируемой подложки и субстрата для идентификации видов, которые могут ассоциировать. Набор предпочтительно имеет множество микролунок и выполнен с возможностью приема субстрата и обеспечения водонепроницаемого уплотнения между пластичным планшетом и субстратом. Набор предпочтительно включает инструкции для использования пластичного планшета и субстрата для идентификации видов, которые могут ассоциировать.
Как использовано в настоящем описании, термин "ассоциировать" относится к взаимодействиям, таким как связывание, адсорбция, ионное притяжение или некоторые другие типы взаимодействия между двумя видами. В некоторых примерах, виды, которые ассоциируют, предпочтительно связываются друг с другом с константой ассоциации, равной по меньшей мере приблизительно 109 M-1 или более. Виды, которые связываются друг с другом с такими константами ассоциации, предусматривают легкое распознавание между видами, которые ассоциируют, и видами, которые не ассоциируют.
В соответствии с некоторыми примерами, пластичный планшет используют в способах и наборах, описанных в настоящей заявке. Как использовано в настоящем описании, "пластичный планшет" относится к устройству, которое может изгибаться, смещаться или деформироваться по меньшей мере в одном измерении при помещении в контакт с субстратом. Например, в некоторых конфигурациях пластичный планшет может включать материал, например, эластомерный материал, который в случае, если пластичный планшет приводят в контакт с субстратом, между пластичным планшетом и субстратом может быть образовано по существу водонепроницаемое уплотнение для замедления или для предотвращения выхода или утечки любой текучей среды в пластичном планшете.
Пластичный планшет изготавливают с помощью мягкой литографии и реплицирующего формования, и он состоит из биологически совместимого материала, который является нетоксичным и газопроницаемым. Пластичный планшет или субстрат, или они оба, содержат один или более материалов, выбранных из группы, состоящей из стекла, пластмассы, полистирола, поликарбоната, поли(диметилсилоксана), нитроцеллюлозы, поли(винилиденфторида) и металла. Металлом является один или более из золота, палладиума, платины, серебра, стали или их сплавов и смесей. В некоторых вариантах осуществления, субстратом является стеклянный планшет, пластмассовый планшет или шарик, и пластичные планшеты содержат матрицу микролунок. Пластичный планшет вдавливают в субстрат для образования герметичного, но обратимого уплотнения с субстратом. Матрица микролунок включает блок лунок, где лунка имеет диаметр, равный приблизительно 50 мкм, и глубину, равную приблизительно 50 мкм, при этом лунки разделены приблизительно на 50 мкм, или лунка имеет диаметр, равный приблизительно 100 мкм, и глубину, равную приблизительно 100 мкм, при этом лунки разделены приблизительно на 100 мкм. Размеры лунок подбирают таким образом, чтобы удерживать приблизительно 1 нанолитр или менее текучей среды. Иллюстративные способы для получения пластичных планшетов более подробно описаны в патенте США № 6180239 и патенте США № 6776094, полное раскрытие каждого из которых включено в настоящее описании в качестве ссылки в полном объеме.
Точное количество лунок или камер в пластичном планшете может изменяться. В некоторых примерах, пластичный планшет включает единственную большую микролунку, где могут быть скринированы единичные виды. Например, пластичный планшет включает единственный тип клетки, катализатор или другие выбранные виды, подлежащие скринингу. В конфигурациях, где пластичный планшет выполнен в виде матрицы, количество отдельных микролунок может изменяться от приблизительно 1, 4, 8, 24, 48, 96, 384, 1024, 2048, 5096 или более или любого значения между данными иллюстративными значениями.
Гравировальный планшет включает множество лунок, при этом каждая из лунок имеет менее чем 100 микрометров в диаметре и содержит единичную клетку. Предпочтительно, количество клеток составляет менее чем 5 клеток. Гравировальный планшет имеет соответствующий газопроницаемый состав. Планшет имеет модуль упругости (Модуль Юнга) в диапазоне, составляющем 200-2000 килопаскаль (кПа). Композиция планшета предпочтительно представляет собой поли(диметилсилоксан). Лунки планшета содержат по меньшей мере одну клетку. Данная клетка является иммунной клеткой, продуцирующей антитела клеткой, клеткой гибридомы, T-клеткой или другой клеткой из крови или ткани. Функция или характер секреции клетки или клеток неизвестны. Необязательно, клетка продуцирует рекомбинантный секретируемый полипептид.
В еще одном аспекте, изобретение относится к испытательному устройству, содержащему пластичный планшет, содержащий по меньшей мере одну микролунку, которая образует матрицу микролунок, которая приводит в контакт субстрат с одним или более средствами обнаружения цитокина, описанными в настоящей заявке, способом, обеспечивающим водонепроницаемое уплотнение между пластичным планшетом и субстратом. Устройство помещает один вид, в большинстве случаев клетку по меньшей мере в одну лунку матрицы микролунок. Размеры микролунок пластичного планшета подбирают и располагают таким образом, чтобы удерживать приблизительно один нанолитр или меньше объема текучей среды.
Если не определено иное, все технические и научные термины, использованные в настоящем описании, имеют такое же смысловое значение, которое обычно подразумевается рядовыми специалистами в области, к которой относится настоящее изобретение. Несмотря на то что при практическом применении или тестировании настоящего изобретения могут быть использованы способы и материалы, аналогичные или эквивалентные тем, что описаны в настоящей заявке, ниже описаны подходящие способы и материалы. Все публикации, патентные заявки, патенты и другие ссылки, приведенные в настоящем описании, включены в качестве ссылки в полном объеме. В случае конфликта, настоящее описание, включая определения, будет иметь решающее значение. В дополнение, материалы, способы и примеры являются исключительно иллюстративными и не предназначены для ограничения.
Другие признаки и преимущества изобретения станут понятными из следующего подробного описания и формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
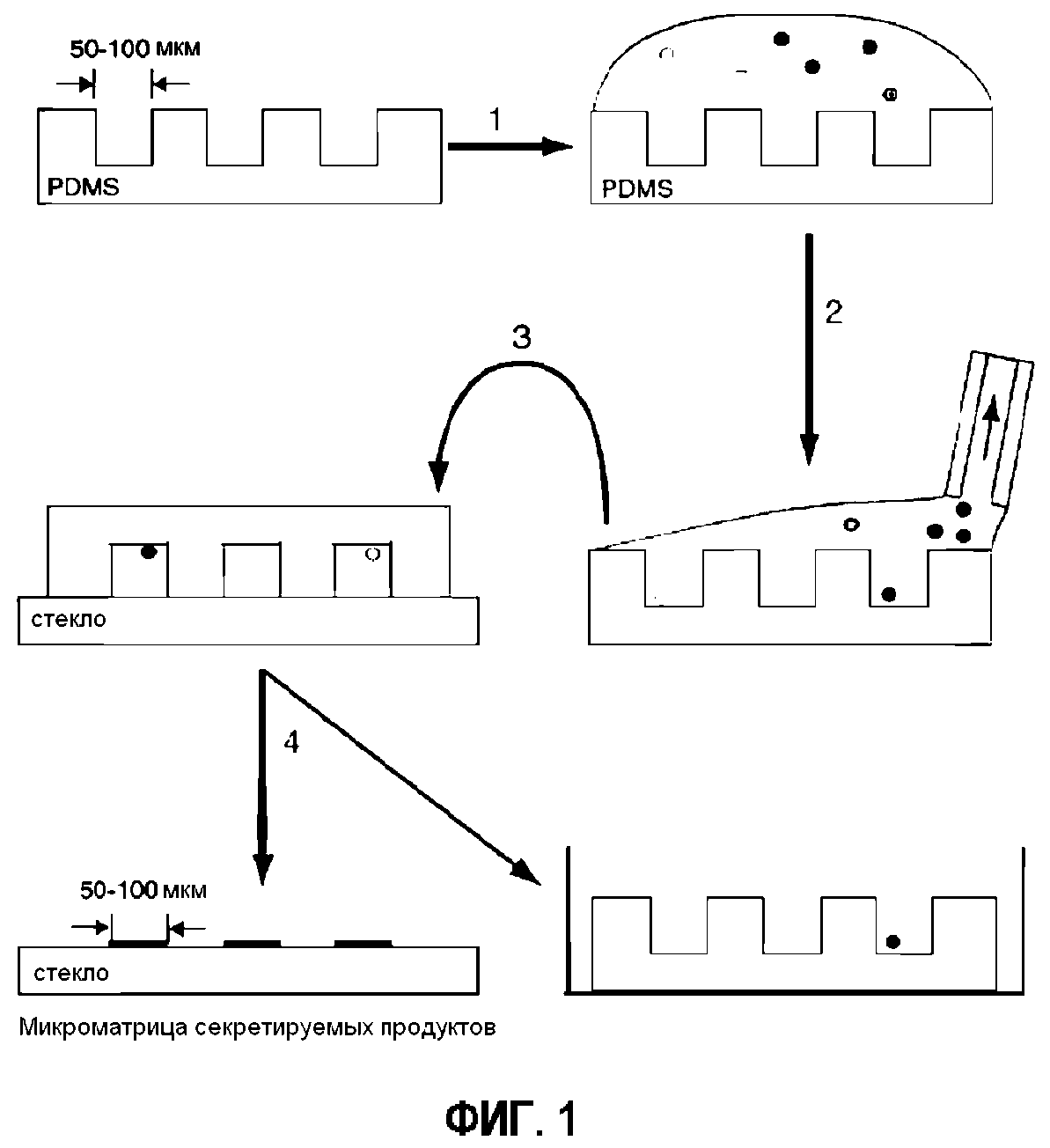
Фигура 1 представляет собой схематическое изображение процедуры микрогравирования. (1) Суспензию клеток наносят на матрицу микролунок, изготовленную с помощью мягкой литографии. (2) Клеткам предоставляют возможность осаждения в лунки, а затем избыточную среду удаляют с помощью аспирации. (3) Матрицу приводят в контакт с твердой подложкой, предварительно обработанной захватывающим антителом, слегка сдавливают и инкубируют в течение 1-2 ч. (4) Микролунки удаляют с твердой подложки и помещают обратно в среду. Стеклянный планшет обрабатывают идентифицирующими антителами.
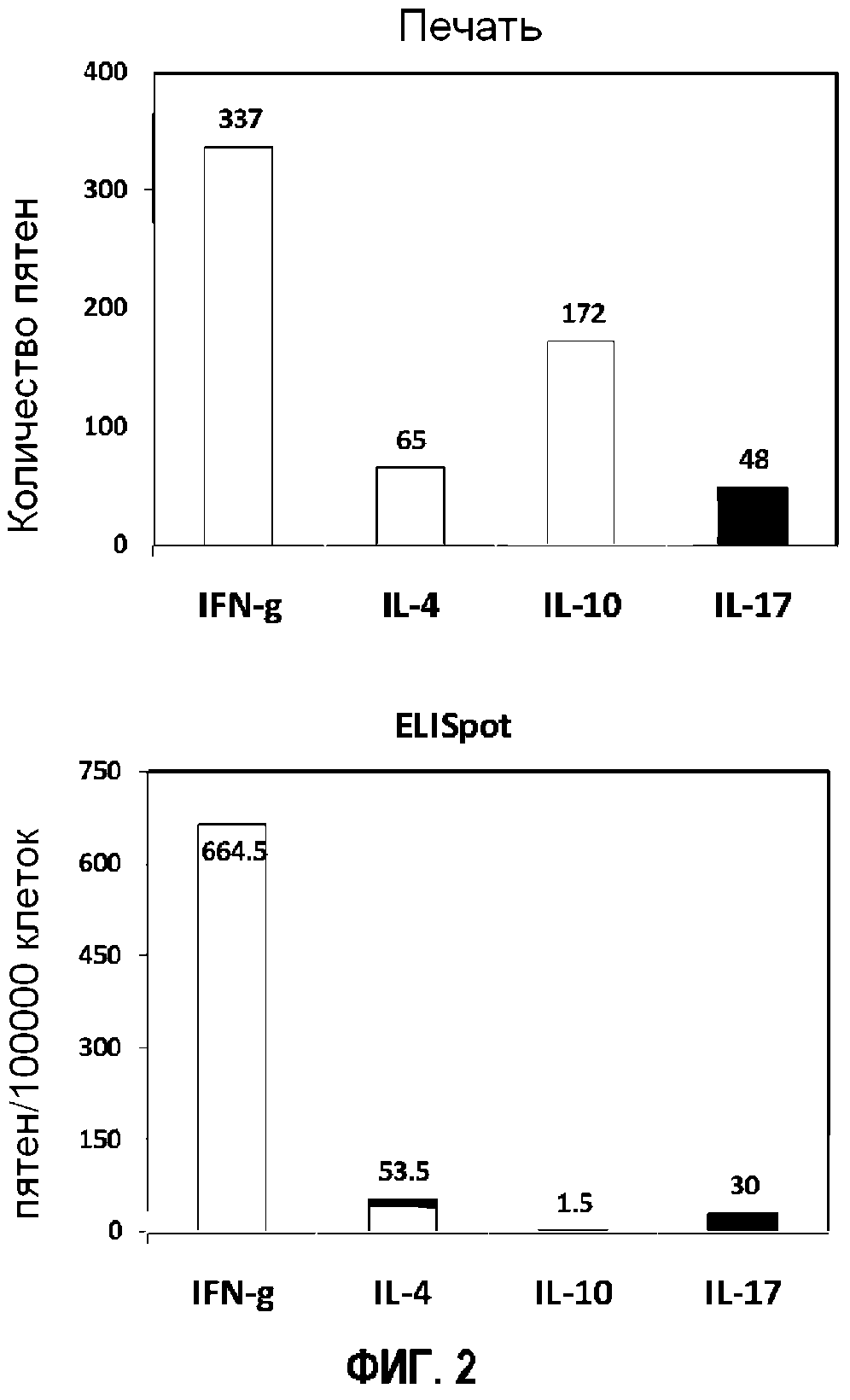
Фигура 2 представляет собой группу столбиковых диаграмм, демонстрирующих частоту встречаемости цитокин-секретирующих клеток, измеренную с помощью микрогравирования и иммуноферментного спот-анализа.
Фигура 3 представляет собой группу микрофотографий, иллюстрирующих квадриплексные наборы цитокиновых характеристик для CD4+ T-клеток, сформированные с помощью микрогравирования.
Фигура 4 представляет собой группу микрофотографий, показывающих квадриплексные наборы цитокиновых характеристик Th2 для CD4+ T-клеток, сформированных с помощью микрогравирования.
Фигура 5 представляет собой группу гистограмм, демонстрирующих квадриплексные цитокиновые исследования для PBMC человека, стимулированных (a) анти-CD3/анти-CD28, (b) фитогемагглютинином и (c) митогеном фитолакки. Данные показывают количество пятен, обнаруженных с помощью микрогравирования спустя 24 ч, 48 ч, и 72 ч стимулирования.
Фигура 6 показывает группу графиков, демонстрирующих количественное выражение секреции цитокинов отдельно взятых клеток. (A) Схематическое изображение конфигурации одной микролунки, содержащей единичную клетку, в процессе микрогравирования. (B) Графическое изображение рассчитанного количества анализируемого материала, накопленного в среде (o) и на поверхности стекла (•) в процессе микрогравирования, когда клетка секретирует с постоянной скоростью, составляющей 10 молекул/с. (C, D) Продуцирование IL-6 PBMC человека после стимулирования LPS в течение 3, 6 или 12 ч. (C) Гистограмма распределения скоростей секреции IL-6, измеренных с помощью микрогравирования после каждого стимулирования. (D) уровень мРНК IL-6, измеренный с помощью количественной ПЦР. (E) Гистограммы распределения скоростей секреции IL-6, измеренных с помощью микрогравирования, от двух доноров после стимулирования LPS, PHA и PWM. Значение n, показанное на (C) и (E), представляет собой нормированное общее количество клеток под каждой кривой.
Фигура 7 представляет собой пару графиков, демонстрирующих экспериментальный анализ измерений с использованием микрогравирования единственного анализируемого вещества. (A) Измерение IL-6, секретируемого отдельными PBMC человека. Клетки стимулировали на протяжении 48 ч. LPS (10 мкг/мл) и PWM (5 мкг/мл). Коробчатая диаграмма относительной интенсивности флуоресценции захваченного IL-6, как функции времени инкубирования. Минимальное количество событий, включенных в каждый короб, составляло 35. Сплошная линия была выстроена в соответствии с линейной регрессией средних значений. Статистические значения определяли с помощью двухстороннего критерия Стьюдента. (B) Измерение секреции антител из клеток HYB 099-01 гибридомы мышей (Анти-овальбумин, Statens Serum Institute). Секретируемый IgG захватывали с помощью смеси двух козлиных антимышиных IgG (от Zymed и Southern Biotech, по 50 мкг/мл каждого) и обнаруживали с помощью овальбумина Alexa 555 (Invitrogen, 2 мкг/мл). Количества живых клеток в микролунках определяли с помощью окрашивания Кальцеином фиолетовым AM (Invitrogen) после микрогравирования. Средние значения сигналов графически изображали как функцию чисел клеток, представленных в каждой лунке, для трех различных периодов инкубирования (15, 30, и 45 мин). Сплошные линии выстраивали с помощью линейной регрессии.
Фигура 8 представляет собой линейный график, который показывает рассчитанное количество захваченного анализируемого материала, как функцию скорости секреции и аффинности для захватывающих антител (KD). Сплошная линия представляет общее количество секретируемого анализируемого материала как функцию времени. θo представляет собой расчетную плотность центров связывания на стекле. Данные расчеты предполагают, что захватывающие антитела с низкой аффинностью (KD=10 нМ) могут преуменьшать скорости секреции приблизительно в два раза.
Фигура 9 представляет собой микроснимок стандартного контрольного планшета (A) и калибровочную кривую образца (B), использованную для вычисления скорости секреции клеток. Группу разведенных, флуоресцентно меченых идентифицирующих антител наносили в виде пятен на стекле (1 мкл/пятно) в указанных концентрациях, и среднюю интенсивность флуоресценции каждого пятна наносили на график для создания калибровочной кривой (сплошная линия).
Фигура 10 представляет собой микрофотографию и серию диаграмм, демонстрирующих квадриплексный анализ цитокинов из отдельно взятых клеток. PBMC человека стимулировали PMA/иономицином в течение 6 ч. (A) Характерные изображения отдельных клеток в микролунках сравнивали с микроснимками из соответствующей микроматрицы цитокинов (расположенных в рядах). Первая колонка показывает составные микроснимки микролунок (фазовый контраст) и клеток (Кальцеин AM). Оставшиеся четыре колонки представляют собой микроснимки, полученные из сравнения локализации на печатной микроматрице для каждого из четырех цитокинов (IL-17, синий; IFNγ, зеленый; IL-2, желтый; TNFα, красный). Оранжевые прямоугольники за пределами изображений указывают на позитивные пятна в каждом ряду (MFI > фон + 3σ). (B) Гистограммы скоростей секреции для каждого цитокина, упорядоченных в соответствии с комбинациями продуцированных цитокинов. Цвета присвоены в соответствии с (A). Вложенные ряды квадратов в каждой гистограмме показывают комбинацию цитокинов, продуцированных клетками, представленными на графике. Значения n на каждой гистограмме представляют собой нормированное общее количество цитокин-продуцирующих клеток на 100000 клеток. Гистограммы построили на данных из трех независимых экспериментов.
Фигура 11 представляет собой микрофотографию, показывающую характерные изображения редко встречающихся функциональных клеток в групповом обнаружении. Первая колонка показывает составные микроснимки микролунок (фазовый контраст) и клеток (Кальцеин AM). Оставшиеся четыре колонки представляют собой микроснимки, полученные из сравнения локализации на печатной микроматрице для каждого из четырех цитокинов (IL-17, синий; IFNγ, зеленый; IL-2, желтый; TNFα, красный). Оранжевый прямоугольник за пределами изображения обозначает позитивные пятна в каждом ряду (MFI > фон + 3 SD).
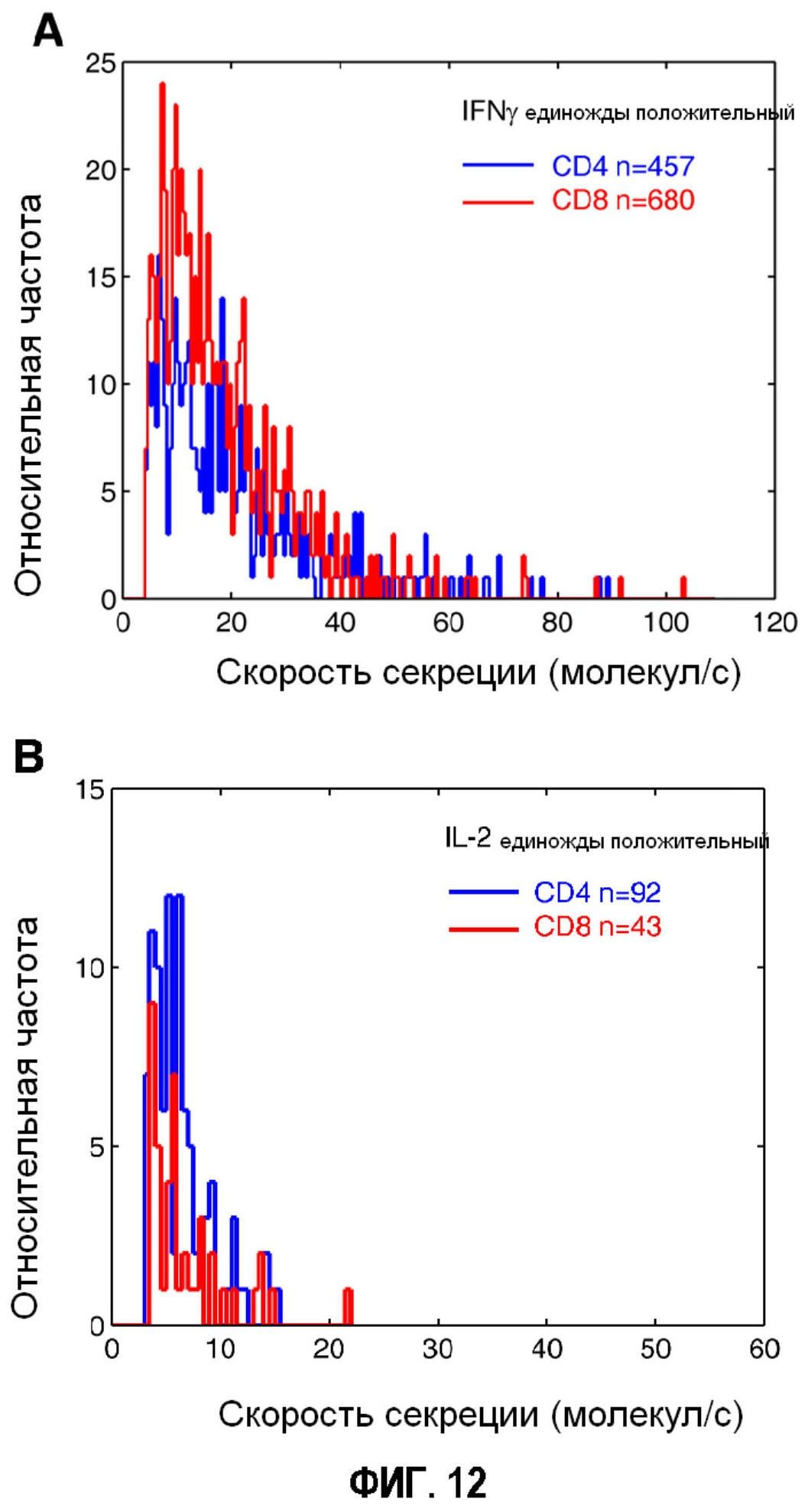
Фигура 12 представляет собой пару гистограмм, показывающих скорости секреции, измеренные для CD4 и CD8 T-клеток, продуцирующих (A) IFNγ или (B) IL-2. n представляет собой количество рядов клеток после микрогравирования, несущих обозначенные маркеры поверхности (p=0,055 для IFNγ, p=0,94 для IL-2).
Фигура 13 представляет собой группу графиков, демонстрирующих корреляцию совместно секретируемых цитокинов. (A) Двумерные графики рассеяния скоростей секреции для пары цитокинов из двойных продуцентов IFNγ/IL-2, IFNγ/TNFα и IL-2/TNFα. Цвет каждой оси показывает тип цитокина в данном измерении (IFNγ, зеленый; IL-2, желтый; TNFα, красный). Каждая точка изображает одну клетку, где значения x и y представляют собой скорости секреции для пары цитокинов; r представляет собой коэффициент корреляции, а р представляет собой вероятность отсутствия корреляции. (B) Двумерные графики каждой пары цитокинов для тройных продуцентов IFNγ/IL-2/TNFα. (C) Графики рассеяния скоростей для CD4 (синий) и CD8 (красный) IFNγ/IL-2 (верхняя панель) и IFNγ/TNFα (нижняя панель) T-клеток. Число n представляет собой общее количество пятен на графиках.
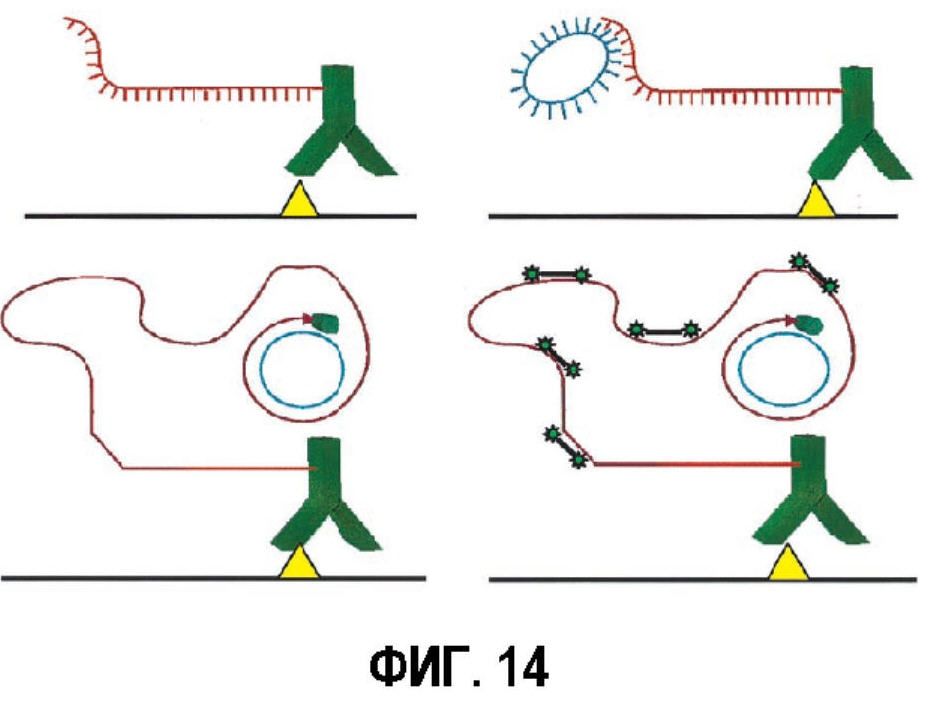
Фигура 14 представляет собой иллюстрацию механизма амплификации по типу катящегося кольца. Идентифицирующее антитело конъюгируют с олигонуклеотидом. Кольцо ДНК скрещивают с комплементарной последовательностью в олигонуклеотиде и амплифицируют посредством полимеразной цепной реакции (ПЦР). В заключение, амплифицированную последовательность ДНК метят in situ с помощью гибридизации с флуоресцетномечеными олигонуклеотидами.
Фигура 15 представляет собой иллюстрацию схемы обнаружения множественных цитокинов с использованием амплификации по типу катящегося кольца (RCA). Каждый тип идентифицирующего антитела связан с уникальной олигонуклеотидной последовательностью. Четыре кольца ДНК с комплементарной последовательностью праймеров используют для амплификации праймеров. Четыре репортерные последовательности метят различными флуорофорами для гибридизации длинных цепей ДНК.
Фигура 16 представляет собой изображение, показывающее схему последовательной маркировки на основании RCA для обнаружения множественных цитокинов. После процесса RCA, как показано выше, для обнаружения соответствующих последовательностей в систему добавляют первый набор репортерных последовательностей с флуоресцентной маркировкой. После сканирования планшеты обрабатывают либо ферментом для специфичного расщепления двойной нити ДНК или химическим реагентом для расщепления линкера между репортерной последовательностью и флуорофором. После данного процесса амплифицированные последовательности для первого пула цитокинов деактивируют. Затем к системе применяют второй пул репортерных последовательностей с флуорофором для обнаружения еще одного пула цитокинов. Весь процесс обнаружения может быть повторен несколько раз.
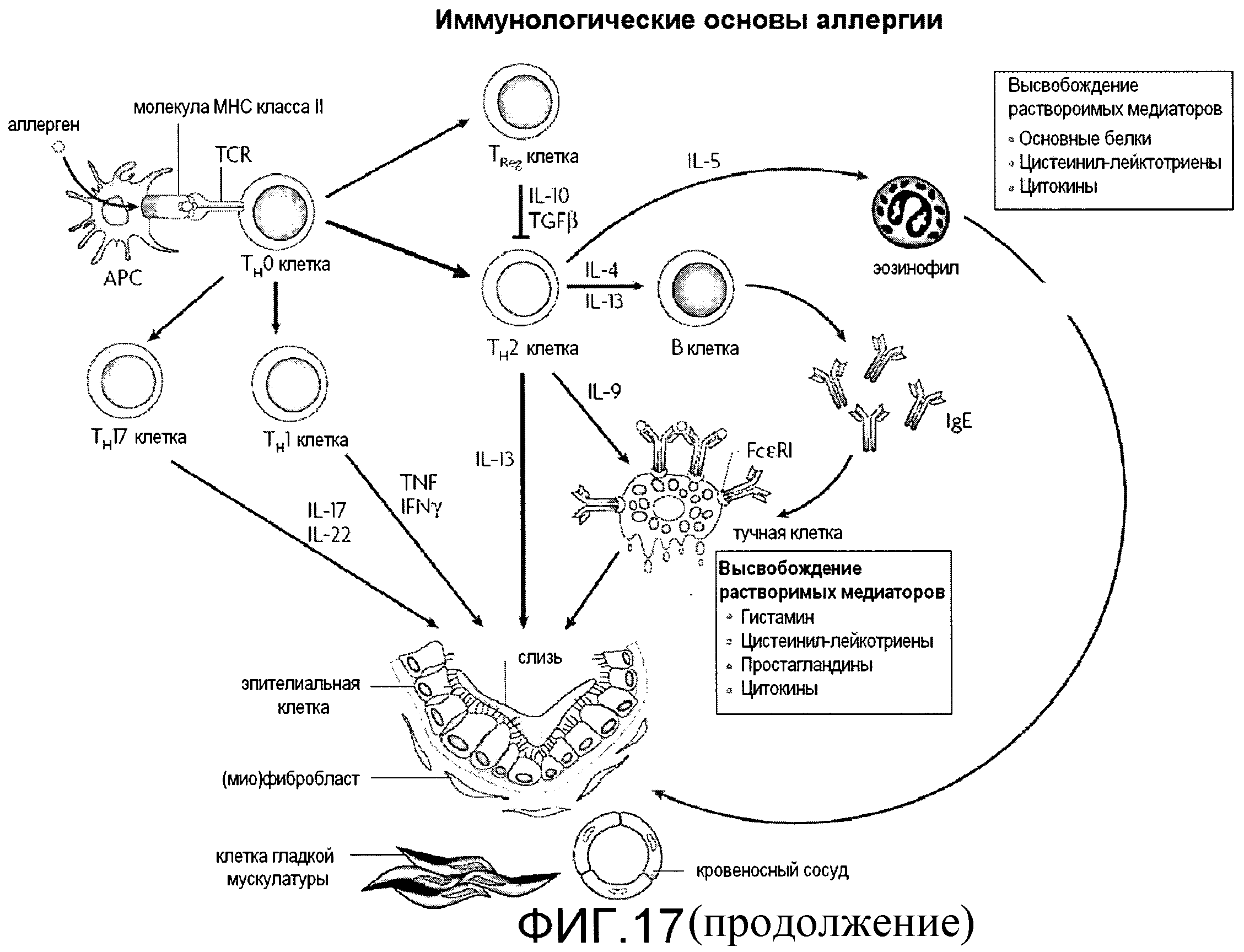
Фигура 17 представляет собой группу иллюстраций, иллюстрирующих проблему существующей в настоящее время аллергической пробы.
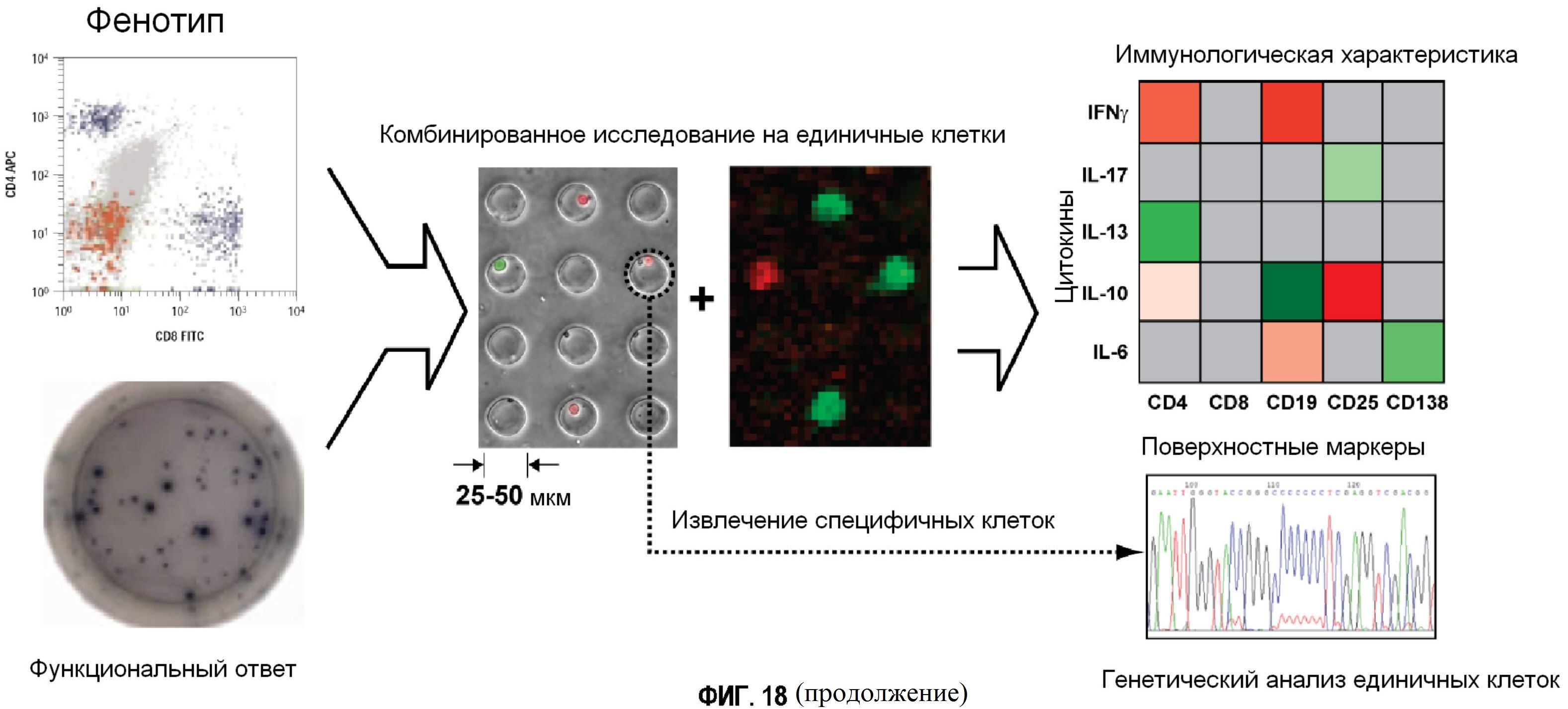
Фигура 18 представляет собой группу иллюстраций и графиков, демонстрирующих осуществление способа микрогравирования, описанного в настоящей заявке.
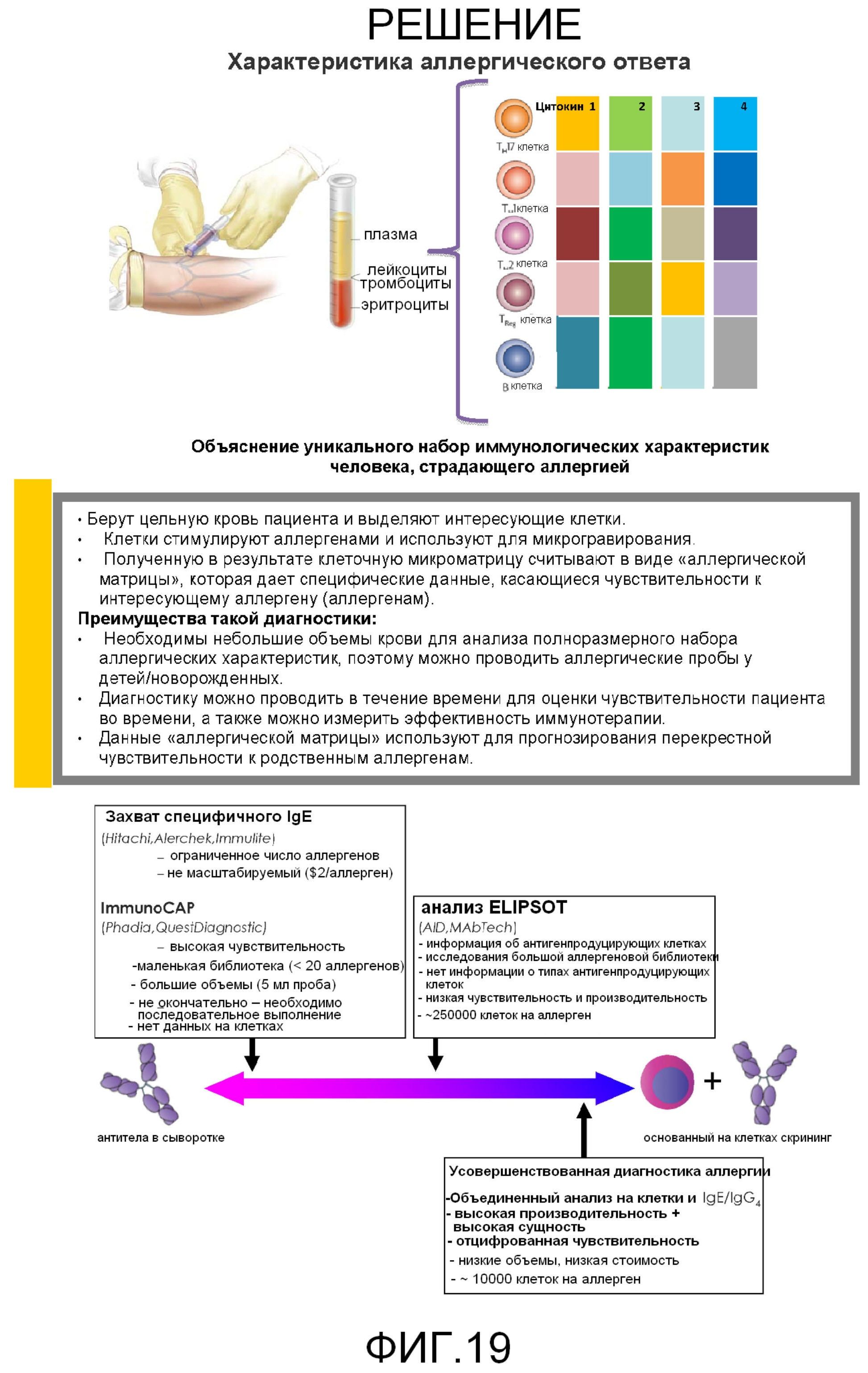
Фигура 19 представляет собой группу иллюстраций, составляющих характеристику аллергического ответа.
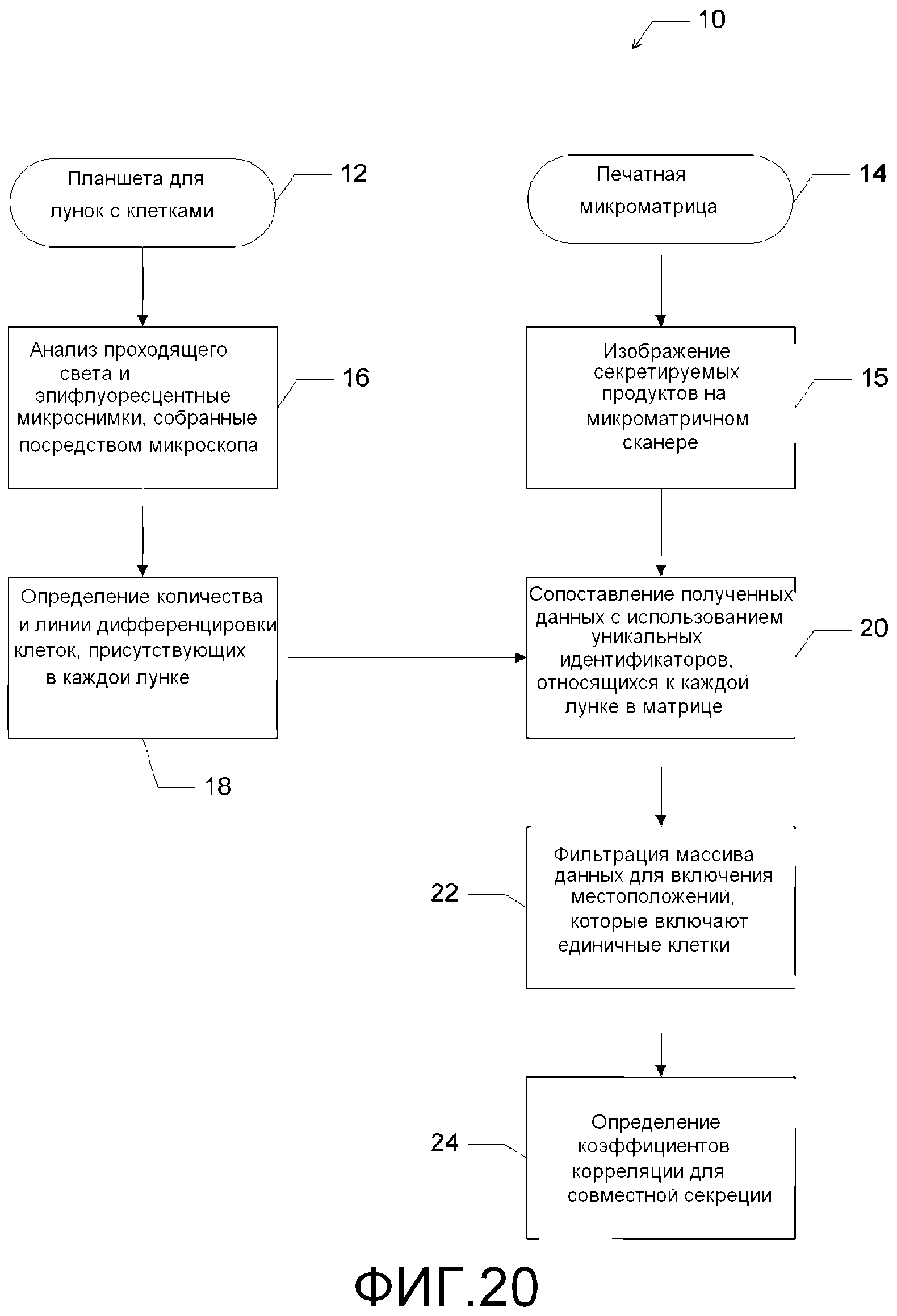
Фигура 20 представляет собой схематическое изображение, рисующее анализ микроматричных данных.
Фигура 21 представляет собой блок-схему, демонстрирующую составление иммунной характеристики на основании типа клетки, величины секреции и частоты встречаемости респондеров.
Рядовым специалистам в данной области, получающим пользу от данного раскрытия, должно быть понятно, что примеры, показанные на Фигурах, нарисованы необязательно в масштабе. Некоторыми признаки или компоненты могли быть увеличены, уменьшены или деформированы для облегчения лучшего понимания иллюстративных аспектов и примеров, раскрытых в настоящем описании. В дополнение, использование затемнения, рисунков, пунктиров и тому подобное на Фигурах не предназначено для предположения или обозначения какого-либо особого материала или ориентации, если иное не ясно из контекста.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение относится к способам мультиплексного захвата цитокинов. Изобретение также предусматривает сравнение цитокинов с поверхностно-экспрессируемыми маркерами на клетках, которые различают линии дифференцировки, и количественное определение скоростей секреции для повышения размерности данных. Области контакта идентифицируют с помощью дифференциальной маркировки.
Более конкретно, изобретение предоставляет измерение частоты встречаемости клеток-респондеров, сопровождающих поликлональные митогены/аллергены (например, митоген фитолакки (PWM) и фитогемагглютинин (PHA)), а также TCR-специфичную активацию (например, анти-CD3/CD28). Скорости секреции количественно определяют исходя из собранных данных. Такие дополнительные данные предусматривают возможность оценки как частоты встречаемости, так и величины (распределения) ответов. Такой дополнительный параметр важен для улучшения анализа цитокинового ответа. Как описано ниже, специфичный пример включает измерение секреции IL-6 (маркера раннего воспалительного ответа) PBMC у двух различных доноров после стимулирования PWM, PHA и т.д. Как описано ниже, частота встречаемости клеток-респондеров варьирует, но не совпадает с величиной ответов. Статистические проверки показывают, что распределения являются уникальными. Такие многомерные данные улучшают качество иммунного мониторинга заболеваний (например, аллергии, инфекционных, аутоиммунных и т.д.). Данные измерения осуществляют более чем для одного цитокина (по меньшей мере для четырех) на клетку.
Как описано ниже, поверхностно-экспрессируемые фенотипические маркеры (например, CD4 и CD8) сравнивают с отдельными измерениями, дополнительно усовершенствуя анализ данных для идентификации уникальных подмножеств с помощью визуализации цитометрии и соответствующего высвобождения цитокина. Скорости секреции для различных цитокинов привязывают к единичным клеткам. Способы, описанные в настоящей заявке, предусматривают сгруппированные количественные (многомерные) наборы данных, причем данные показывают, что такие измерения используют для распознавания ответов клеток от различных доноров на различные стимулы. Варианты применения изобретения включают аллергические пробы, клинический мониторинг вакцин, терапевтические биологические лекарственные препараты, непрерывные инфекции, аутоиммунные заболевания и т.д.
Изобретение относится к способам и композициям для тестирования чувствительности людей к одному или более аллергенам с помощью исследования уровней цитокинов, которые являются характеристикой аллергической реакции. Аллергия представляет собой один тип гиперчувствительности иммунной системы, причиной которой является контактирование с окружающими веществами, известными как аллергены. Аллергия представляет собой всемирное эпидемическое заболевание. Аллергический иммунный ответ требует сенсибилизации и развития специфичного иммунного ответа по отношению к аллергену. В процессе сенсибилизации к аллергену, активация аллерген-специфичных CD4+ Th2-клеток приводит к продуцированию цитокинов Th2 (таких как IL-4 и IL-13), которые являются ответственными за возникновение переключения класса на IgE в B-клетках, образование слизи и активацию эндотелиальных клеток для Th2-клеток и миграцию эозинофилов в ткани. IgE повышает чувствительность тучных клеток и базофилов посредством связывания с высокоаффинным рецептором для IgE (FcεRI), экспрессируемого на их поверхности. При перекрестном связывании комплексов IgE-FcεRI посредством аллергена тучные клетки и базофилы дегранулируют, высвобождают вазоактивные амины (в первую очередь гистамин), липидные медиаторы (простагландины и цистеиниловые лейкотриены), цитокины и хемокины, при этом все из них характерны для промежуточной фазы аллергической реакции. После фазы сенсибилизации в намеченном органе наблюдаются аллергическое воспаление и реакции на иммунизацию аллергеном, приводящие к развитию аллергического риноконъюктивита, экземы, астмы или системной анафилаксии (Larche, et al., 2006 Nat Rev Immunol, 6: 761-771; Romagnani, S. 2004 J Allergy Clin Immunol, 113: 395-400).
Цитокины Th2-типа, такие как интерлейкин-4 (IL-4), IL-5, IL-9 и IL-13, влияют на широкий диапазон явлений, связанных с хроническим аллергическим воспалением. IL-4 и IL-13 стимулируют продукцию IgE и молекул адгезии сосудистого эндотелия 1 типа, тогда как IL-5 и IL-9 связаны с развитием эозинофилов, а IL-4 и IL-9 способствуют развитию тучных клеток. IL-9 и IL-13 способствуют стимулированию гиперчувствительности дыхательных путей, тогда как IL-4, IL-9 и IL-13 также способствуют сверхвыделению слизи (Kay, AB 2001 N Engl J Med, 344: 109-113; Kay, AB 2001 N Engl J Med, 344: 30-37). Было обнаружено, что регуляторные T-клетки (TReg-клетки) представляют собой еще одно важнейшее подмножество CD4+ T-клеток с вовлечением в аллергические заболевания. Исследования на модели мышей дают значительное основание полагать, что TReg-клетки вовлечены в подавление аллергических ответов, и имеется новое свидетельство, что TReg клетки также управляют ответами Th2-клеток у людей через ингибиторные цитокины IL-10 и трансформирующий фактор роста-β (TGF-β), с атопией, обусловленной дисбалансом между Th2-клетками и TReg-клетками (Bacchetta, et al., 2007 J Allergy Clin Immunol, 120: 227-235; quiz 236-227; Larche, M. 2007 Chest, 132: 1007-1014). Регуляторные T-клетки могут участвовать в подавлении аллергических заболеваний за счет подавления IgE и индуцирования IgG4, тогда как продукция IgA усиливается за счет активации B-клеток посредством TLR7 и TLR9 (Meiler, F 2008 Allergy, 63: 1455-1463). Дисбаланс между Th1-клетками (продуцирующими IFN-γ) и Th2-клетками играет важную роль в лечении аллергии. Специфичная иммунотерапия связана с понижающим регулированием цитокинов, продуцируемых Th2-клетками, повышающим регулированием цитокинов, продуцируемых Th1-клетками и возбуждением регуляторных T-клеток. Данные изменения, в свою очередь, приводят к подавлению аллергического воспаления, увеличению цитокинов, которые управляют продукцией IgE (интерферон и интерлейкин-12), продуцированию "блокирующих" антител (IgG) и высвобождению цитокинов, вовлеченных в аллергенспецифическую гипочувствительность (IL-10 и TGF-β) (Kay, AB 2001 N Engl J Med, 344: 109-113). Еще один вновь установленный тип CD4+ T-клеток был назван Th17-клеткой, который связывают с нейтрофильным воспалением (Stockinger, B 2007 Immunol Cell Biol, 85: 83-84). IL-17A сверхэкспрессируется в дыхательных путях больных астмой совместно с наплывом нейтрофилов и это вызывает продуцирование хемоаттраканта нейтрофилов IL-8 (CXCL8) клетками гладкой мускулатуры дыхательных путей человека (Holgate, ST and Polosa, R 2008 Nat Rev Immunol, 8: 218-230). У здоровых и страдающих от аллергии людей имеются все аллергенспецифичные подмножества 3-Th1, Th2 и Treg в различных пропорциях (Akdis, M et al., 2004 J Exp Med, 199: 1567-1575). Соответственно, изменение доминирующего подмножества и баланса между Th1-, Th2- и Treg-клетками может приводить либо к развитию аллергии, либо к выздоровлению.
Микроматрицы и планшеты могут быть сконструированы с использованием способов, известных в данной области, включая способы, описанные в PCT/US2006/036282 (опубликованной как WO/2007/035633) и USSN 61/057371. Содержание обеих данных заявок включено в настоящее описание в качестве ссылки в полном объеме. Как использовано в настоящем описании, "пластичный планшет" относится к устройству, которое может изгибаться, смещаться или деформироваться по меньшей мере в одном измерении, при помещении в контакт с субстратом. Например, в некоторых конфигурациях пластичный планшет может включать материал, например, эластомерный материал, так что, когда пластичный планшет приводят в контакт с субстратом, между пластичным планшетом и субстратом может быть образовано по существу водонепроницаемое уплотнение для замедления или для предотвращения выхода или утечки любой текучей среды в пластичном планшете.
Способы, устройство и наборы, описанные в настоящей заявке, могут использовать пластичную матрицу микролунок или камер (например, меньше чем 100 микрон в диаметре или 50-100 микрон в диаметре), чтобы удерживать одну или несколько клеток в каждой микролунке. Матрицу приводит в физический контакт с субстратом таким образом, что микролунки становятся закрытыми контейнерами или испытательным устройством. Инкубирование данной системы предоставляет возможность продуцирования клетками продуктов, таких как антитела, цитокины и другие секретируемые продукты, которые затем иммобилизируют на субстрате в областях, находящихся в контакте с микролунками. Таким образом, получают микроматрицу клеточных продуктов из каждой микролунки. После инкубирования системы на протяжении подходящего периода времени, например, от 1, 5, 30, 40 или 50 минут до нескольких часов (1, 3, 6, 12, например, 24 часа или менее), матрицу микролунок удаляют с субстрата, при этом иммобилизированные клеточные продукты на субстрате, микроматрица или микрогравирование, могут быть скринированы с известным видом для определения того, связан или нет с известным видом иммобилизированный клеточный продукт (продукты).
Технологию мягкой литографии используют для микрогравирования плотной матрицы микролунок (0,1-1 нл каждая), содержащих отдельные клетки для печати соответствующей матрицы молекул, секретируемых каждой клеткой. Клетки остаются в культуре в микролунке после гравирования, а микроматрицы подробно исследуют способом, аналогичным коммерческим микроматрицам белков или антител, например, с помощью использования флуоресцентно меченых реагентов и сканеров для лазерной флуоресценции. Вследствие этого, данный способ предоставляет возможность быстрой идентификации тех клеток, которые демонстрируют требуемые свойства, такие как секреция антигенспецифичного антитела, и их последующего извлечения из отдельных лунок для клональной экспансии.
В целом, в способах и композициях по изобретению может быть использован любой способ, который специфично выявляет требующийся цитокин. В большинстве случаев, матрицы антител (поликлональных или моноклональных) с известными специфическими характеристиками используют для обнаружения присутствия цитокина.
В некоторых вариантах осуществления, тестируемой парой цитокиновых характеристик представляет собой Th1- или Th2-профиль. Например, для средства для обнаружения, которое выявляет Th-пул, цитокин может представлять собой, например, IL-17, IL-10, IL-4 и/или IFN-γ. Th2-пул содержит, например, IL-4, IL-5, IL-13 и/или IL-9. Третья характеристика определяет величину уровней антител IgE, IgG1, IgG4 и/или IgGA. Другие цитокины, которые могут быть исследованы, включают, например, IFN-гамма, TNF-альфа, IL-10, TGF-бета, ГМ-КСФ (который опосредует дифференциацию Th1 и Th2 клеток) и IL-17A. Цитокины, которые необязательно происходят из T-клеток, но которые могут также быть скринированы, включают, например, IL-2, IL-12, IL-18, IL-8, IL-15, IL-25 (IL-17E), IL-33, TGF-альфа, IL-35, IL-1бета, IL-6, IL-23, IL-22, IL-19, IL-17F, тимусный стромальный лимфопоэтин (TSLP), фактор, ингибирующий гликозилирование (GIF), MARC (Хемокин, связанный с Активацией Тучных Клеток) LTC4 и PGD2. Других хемокины, которые исследуют, включают CC-хемокины (например, моноцитарный хемоаттрактантный белок 1 типа (MCP-I или CCL2) и RANTES (хемокин, выделяемый T-клетками при активации) (CCL5)), CXC хемокины (например, IL-8), C-хемокины (например, XCLl (лимфотактин-α) и XCL2 (лимфотактин-β)), и CX3C-хемокины (например, фракталкин (или CX3CL1).
В целом, может быть исследован любой известный или предполагаемый аллерген. Обычные пищевые и лекарственные аллергены включают, например, молоко, яйцо, бобовые (включая арахис), лесной орех (грецкий орех, кешью и т.д.), рыбу, моллюсков, сою, пшеничные и молочные продукты, яичные продукты, морепродукты и моллюсков. Лекарственные аллергены включают, например, амоксициллин, пенициллин и сульфаниламидные препараты, барбитураты, противосудорожные средства, инсулин и йод. Другие обычные аллергены представляют собой, например, пыль, пыльцу, перхоть домашних животных, латекс, хлор, укусы насекомых (ужаленье осой, огненным муравьем и пчелой).
Анализ единичной клетки с использованием способов, описанных в настоящей заявке, дает уникальные преимущества для понимания биологического процесса и механизма заболевания. Формирование изображения в микроскопе и химическое разделение разъяснили уникальные биологические явления в единичных клетках, которые не могут быть обнаружены с помощью методик массового отбора проб (Sims, CE и Allbritton, NL 2007 Lab Chip, 7: 423-440). Один из примеров представляет собой уникальные схемы периодически повторяющегося увеличения и уменьшения концентрации Ca2+ с течением времени после стимулирования единичных клеток (Woods, et al., 1986 Nature, 319: 600-602). Это явление скрыто при изучении целой популяции клеток, вследствие различий тайминга и ответа отдельных клеток. Измерения единичной клетки также ценны для изучения популяций смешанных клеток.
При исследованиях течений заболеваний, анализ пробы, взятой непосредственно у организма модели или больного, осложняется за счет смеси нормальных клеток с пораженными болезнью клетками. Исследования единичных клеток опухолевых биопсий показали, что большинство клеток в опухоли могут быть нормальными. Среди патологических клеток, однако, существует значительная неоднородность (Fink, et al., 2006 Exp Toxicol Pathol, 57: Suppl 2, 25-29; Bodey, B 2002 Expert Opin Biol Ther, 2: 371-393). Таким образом, определение молекулярных характеристик большинства опухолей весьма ограничено анализом объединенных клеточных лизатов.
Обнаружение единичной клетки
На протяжении нескольких прошедших десятилетий был разработан ряд технологий для высокоэффективных исследований молекулярных комплексов отдельных клеток. ELISPot (иммуноферментный спот-анализ) представляет собой обычный способ обнаружения цитокин-продуцирующих клеток на уровне единичных клеток (Czerkinsky, et al., 1983 J Immunol Methods, 65: 109-121). При данной технологии клетки загружают и выращивают на мембране, которую функционализируют специфичными антителами. В процессе культивирования цитокины, полученные каждой клеткой, захватываются антителами вокруг клеток. После обнаружения другим антителом секретируемый продукт из отдельных клеток визуализируют. Этот способ дает как качественные результаты секретируемого белка, так и полуколичественные результаты частоты встречаемости клеток-респондеров. Недостатком данной технологии является то, что каждый раз может быть обнаружен только один или два типа секретируемого белка, при этом он не дает оценку множества схем секреции из каждой клетки. Также, специфичные клетки после экспериментов утрачиваются.
FACS (клеточный сортер с возбуждением флуоресценции) представляет собой тип проточной цитометрии. Каждую клетку окрашивают флуоресцентно мечеными антителами либо против маркеров клеточной поверхности, либо против внутриклеточных белков. С развитием новых технологий обнаружения, из каждой клетки может быть обнаружено одновременно до 19 параметров (17 флуоресцентных цветов и 2 физических параметра) (Perfetto, et al., 2004 Nat Rev Immunol, 4: 648-655), при этом стандартное применение, как правило, ограничено 6-8 цветами. FACS является наиболее обычной технологией, используемой в иммунологии для изучения популяций клеток. Он может анализировать несколько тысяч клеток в секунду. Однако тяжело собирать и культивировать единичные клетки после обнаружения, что делает невозможным изучение кинетики, которой следует одна клетка. Обычная чувствительность FACS составляет ~0,1% и требует достаточного окрашивания клеток-мишеней.
Еще одна группа высокоэффективных технологий ставит целью обнаружение редких циркулирующих в крови опухолевых клеток (CTC), например CTC-чип (Nagrath, et al., 2007 Nature, 450: 1235-1239), устройство микрофильтрации (Zheng, et al., 2007 J Chromatogr A 1162, 154-161), или метод ультрафильтрации (Talasaz, et al., 2006 ConfProc IEEE Eng Med Biol Soc, 1: 1838-1841). Некоторые представляют собой технологии, которые повышают эффективность системы обнаружения, как, например, система визуализации редких событий (REIS) (Kraeft, et al., 2004 Clin Cancer Res, 10: 3020-3028) и технология сканирования волоконно-оптической матрицы (FAST) (Krivacic, et al., 2004 Proc Natl Acad Sci USA, 101: 10501-10504). Преимуществом данных способов является возможность быстрого скрининга и выделения редких клеток. Однако ограничен тип захватываемых клеток и дополнительный анализ.
Лаборатория на чипе (LOC) является еще одним форматом для обнаружения единичной клетки. Многие системы основаны на микрообработке каналов и микроокружения. Различные типы LOC включают проточную цитометрию, электрофоретический анализ содержимого клеток, микроскопические анализы с индикаторами, клетки в качестве ферментеров небольшого объема, взаимодействие клеток с микроокружением и ПЦР единичной клетки (Sims, CE and Allbritton, NL 2007 Lab Chip, 7: 423-440).
Микрогравирование для изучения единичной клетки и его преимущества
Микрогравирование представляет собой разрабатываемую в настоящее время технологию быстрого, высокоэффективного, мультиплексного скрининга отдельных клеток. Данная технология используется для скрининга гибридом на продукцию моноклональных антител (Love, et al., 2006 Nat Biotechnol, 24: 703-707). Она была также адаптирована для тщательного мультиплексного исследования популяций мононуклеарных клеток периферической крови отдельных людей из пациентов, страдающих диабетом 1 типа, на секретируемые цитокины (IFN-гамма и IL-6), антигенспецифические антитела и линиеспецифические маркеры поверхности (Bradshaw, et al., 2008 Clin Immunol, 129: 10-18).
В соответствии с данной технологией матрицу микролунок впрессовывают в гибкий полимерный штамп из PDMS для выделения отдельных клеток (Фигура 1). Вслед за этим матрицу лунок прикладывают к стеклянному планшету, функционализированному захватывающими антителами против интересующих белков. После определенного периода инкубирования стеклянный планшет отделяют от штампа с микролунками и обрабатывают с использованием флуоресцентно меченых идентифицирующих антител. Штамп с клетками либо помещают обратно в среду для культивирования, либо окрашивают для маркеров клеточной поверхности. Интересующие клетки извлекают из лунок. В результате, данная технология адаптирует твердофазный иммуноферментный сэндвич-анализ (ELISA) для измерения секреции белка для уровня единичных клеток. Кроме предоставления информации, обычно получаемой с помощью ELISpot и FACS, данная технология также имеет возможность отслеживать единичные клетки.
Микрогравирование, применяемое для иммунологического исследования
Разнообразие клеток и многофункциональность клеток в иммунной системе делает технологию микрогравирования эффективной методикой для изучения единичных клеток иммунной системы. С помощью микрогравирования определяют следующую информацию из мононуклеарных клеток периферической крови (PBMC): 1) частоту встречаемости каждого типа клеток во всей популяции; 2) частоту встречаемости некоторых цитокин- или антителосекретирующих клеток во всей популяции; 3) набор цитокиновых характеристик и их динамическое изменение на уровне единичных клеток; 4) жизнеспособность интересующего клона после обнаружения; 5) функциональная сеть различных типов иммунных клеток в заболевании.
Приведенная выше информация может быть дополнительно использована при иммунологическом исследовании, клинической диагностике, разработке мониторинга заболевания и оценке лечения.
Усовершенствования микрогравирования
Изобретение обеспечивает повышенную чувствительность обнаружения. Одним из преимуществ микрогравирования по сравнению с ELISA, использующим общую клеточную культуру, является то, что клетки заключены в небольшом объеме (~0,1 нл/клетку), следствием чего является высокая локальная концентрация белков-мишеней. Способы, описанные в настоящей заявке, являются приблизительно в 10 раз более чувствительными, чем поверхностный захват секретируемых цитокинов (например, Миллипор). С другой стороны, непосредственная флуоресцентная маркировка для идентифицирующего антитела показывает более низкую чувствительность по сравнению с ELISA, где сигнал усиливается с помощью ферментной каталитической реакции. Чувствительность обнаружения является приблизительно в 10-100 раз более низкой, чем ELISA с использованием одних и тех же пар антител. Повышенная локальная концентрация секретируемого белка и пониженное усиление сигнала в микрогравировании делает общую чувствительность обнаружения не значительно более высокой, чем ELISA.
Изобретение будет дополнительно проиллюстрировано в следующих неограничивающих примерах.
Пример 1: Оптимизация Процесса Обнаружения цитокина
Был оптимизирован протокол обнаружения секретируемых цитокинов из матрицы микролунок, изготовленной с помощью мягкой литографии. Были исследованы различные планшеты, блокирующие буферы, и концентрация захватывающих антител.
Полилизин и эпоксиды представляют собой две общепринято используемые поверхности для планшетов в белковой микроматрице. Молоко и BSA представляют собой два общепринятых блокирующих буфера, используемых в вестерн-блоттинге и микроматрице. Градиент IL-4 захватывающего антитела наносили пятнами на поверхности стеклянных планшетов (либо поли-L, либо эпоксидная поверхность), 2 мкл/пятно. После инкубирования при комнатной температуре на протяжении 2 часов планшеты блокировали либо 1% BSA, либо 3% нежирным сухим молоком в PBS в течение 30 мин. В каждое пятно добавляли стандартный IL-4 (500 пк/мл) и инкубировали на протяжении 1 часа при 37°C. Вслед за этим, 1 мкг/мл IL-4 идентифицирующих антител, конъюгированных с Dylight 647, применяли в качестве идентифицирующего реагента. Для контроля (фона) добавляли не содержащий IL-4 стандарт. Градиент захватывающих антител исследовали с использованием четырех параметров в различных комбинациях. Поли-L планшеты, блокированные молоком и покрытые 10-25 мкг/мл захватывающими антителами, обеспечивали наилучшие результаты и дополнительно обеспечивали значительно лучшие результаты, чем первоначальный протокол (эпоксидный планшет, Блокирование BSA и 200 мкг/мл захватывающих антител). Оптимальную смесь использовали в следующих экспериментах.
Исследовали расширенное микрогравирование при четырехцветной идентификации, основанной на четырех лазерах в сканере GenePix. Были выбраны четыре T-клеточных цитокина IFN-γ, IL-4, IL-10 и IL-17. Идентифицирующие антитела по отдельности пометили четырьмя флуоресцентными метками: IL-17-Dylight 488 (синий), IFN-γ-Dylight 549 (зеленый), IL-10-Alexa Fluor 594 (желтый) и IL-4-Dylight 649 (красный). Отдельные цитокиновые стандарты выполняли с использованием отдельных пар антител и цитокиновый стандарт для исследования характеристики каждой пары антител. Стандартные кривые показывают, что чувствительность данных четырех цитокинов составляет 200 пк/мл. Мультиплексная стратегия состоит в том, чтобы покрыть стекло смесью всех четырех захватывающих антител и исследовать с помощью смеси идентифицирующих антител. Для изучения возможной перекрестной реакции между различными антителами и цитокинами для каждого единичного цитокина построили стандартные кривые с использованием смеси захватывающих антител и идентифицирующих антител. Результаты показывают, что при более высокой концентрации некоторые цитокиновые сигналы могут оказывать воздействие друг на друга. IL-10 имеет сильный сигнал на канале IFN-γ, когда его концентрация выше 16 нг/мл; IL-4 и IFN-γ имеют определенный сигнал на канале IL-10. На основании этих данных, эти четыре цвета могут быть четко различимы, если концентрация цитокина находится в диапазоне, составляющем 1-10 нг/мл.
Обнаружение множественных цитокинов из отдельно взятых клеток
Для того чтобы исследовать, обладает ли вышеуказанный способ чувствительностью для обнаружения множественных цитокинов, секретируемых клетками, PBMC стимулировали PHA на протяжении 24 часов и загружали в микролунки. Изображение нескольких пятен наблюдали после двухчасовой печати. Одноцветные пятна обнаружили на планшете, который показывает данные четыре цвета хорошо отличимы друг от друга. Также, имеются несколько двойных положительных или множество положительных пятен, которые демонстрируют, что функциональная характеристика каждой клетки отличается.
С целью сравнения микрогравирования и иммуноферментного спот-анализа, использовали такой же пул клеток и те же самые клоны антител для выявления частоты встречаемости цитокин-секретирующих клеток в обоих способах (Фигура 2). Общее количество лунок в одном штампе составляло приблизительно 80000, а эффективность загрузки составляла в нормальных условиях 50%. На основании данного расчета, частота встречаемости IFN-γ представляет собой одинаковую величину в этих двух способах. В сравнении трех других цитокинов с IFN-γ, относительная частота встречаемости IL-4 и IL-17 имеет такой же порядок, при этом микрогравирование показывает более высокую чувствительность, чем иммуноферментный спот-анализ.
Частота встречаемости IL-10 в данных двух способах не согласуется. Возможным объяснением является то, что антитела против IL-10, использованные в микрогравировании, не подходят для иммуноферментного спот-анализа. Однако иммуноферментный спот-анализ может выявлять только один параметр из каждой клетки и не может выдавать информацию о частоте встречаемости двойных положительных клеток. Прямое сравнение между иммуноферментным спот-анализом и микрогравированием показано в Таблице 1.
Таблица 1
Клетки, полученные обратно после микрогравирования, сохраняют свои фенотипы
Для определения, остаются ли все-таки первичные клетки живыми после печати и можно ли воспроизвести функциональные характеристики, выявленные с помощью микрогравирования, CD4+ T-клетки загружали в микролунки и измеряли секрецию IFN-γ и IL-17. Были обнаружены три типа сигналов: IFN-γ-положительный, IL-17-положительный и IFN-γ/IL17-двойной положительный. В процессе печати большинство лунок содержали 1-2 клетки, а некоторые из них содержали три клетки. После печати клетки в микролунках культивировали на протяжении еще двух дней, большинство клеток делилось, а некоторые из характерных клеток извлекали из лунок и культивировали в 96 лунках. После предоставления возможности клеточного роста проводили внутриклеточное окрашивание, и для выявления фенотипа использовали FACS.
Для обнаружения IL-17 и IFN-γ CD4+ T-клетки загружали в микролунки. Клетки с сигналом извлекали из лунок и культивировали в клонах. Некоторые из клеток сохраняли такие же фенотипы, которые были обнаружены при микрогравировании. Наблюдалась двойная отрицательная популяция. Может быть, данные клетки потеряли свою способность секреции цитокина в процессе культивирования или могла быть одна подобная клетка в первоначальных лунках, где загружали 2 или 3 клетки. Данные результаты демонстрируют: 1) за счет процесса оптимизации чувствительность обнаружения единственного цитокина составляет по меньшей мере 200 пг/мл с использованием прямой флуоресцентной маркировки; 2) при микрогравировании одновременно обнаруживаются четыре цитокина; 3) с использованием микрогравирования оценивают частоту встречаемости цитокин-секретирующих клеток и предоставляют более подробную информацию по сравнению с иммуноферментным спот-анализом; 4) после двух часов печати клетки были жизнеспособными и были получены из лунок обратно. Некоторые клетки все также сохраняют первоначальные фенотипы.
Пример 2: Мультиплексный Захват Цитокинов
Специализированное инжекционное формование для получения матриц микролунок.
Как описано выше, способы изобретения включают процесс инжекционного формования для получения тонких (1 мм) матриц нанолунок, сформованных в поли(диметилсилоксане), которые прикрепляют к стандартному стеклянному планшету. Данный стандартизированный процесс изготовления обеспечивает улучшенную воспроизводимость опытов и сбор данных.
Подтверждение антител для обнаружения цитокинов.
Ниже описано подтверждение соответствующих пар антител для обнаружения интересующих цитокинов. Простой бесклеточный анализ, описанный ниже, имитирует процесс микрогравирования, который используют для тестирования кандидата на пары антител. Данный гибкий анализ предусматривает идентификацию четырех различных панелей для обнаружения пулов цитокинов, которые свидетельствуют об асимметричности ответа Th и специфичных ответов Th2 и Th1 (IL-4/IL-10/IL-17/IFNγ; IL-4/IL-5/IL-9; IFNγ/MIP-lβ/TNFα/перфорин; IFNγ/IL-10/IL-17/IL-22). Были подтверждены идентифицирующие антитела для двух панелей антител (IgG1/IgA/IgE/IgG4; IgG1/IgA/IgG3/IgM).
Квадриплексное обнаружение цитокинов из отдельно взятых клеток.
Ниже описано квадриплексное обнаружение двух пулов цитокинов из отдельно взятых клеток. Фигура 3 представляет результаты исследования, которые свидетельствуют об асимметричности T-клеточного ответа (IFNγ/IL-4/IL-10/IL-17). В данном эксперименте PBMC стимулировали анти-CD3 и анти-CD28. CD4+ T-клетки отделяли посредством отрицательной селекции, окрашивали флуоресцентным маркером поверхности (αCD4-Alexa 647), и загружали на матрицу микролунок. Матрицу приводили в контакт со стеклянным планшетом, функционализированным захватывающими антителами для IL-4, IL-10, IL-17, и IFNγ. После 2 ч инкубирования матрицу удаляли и визуализировали. Планшет окрашивали и визуализировали на микроматричном сканере GenePix. чия привязывали к каждой лунке. Каждая лунка составляет 50 мкм × 50 мкм × 50 мкм. Фигура 4 показывает результаты исследования, которые свидетельствуют о широте Th2-ответа (IL-4/IL-5/IL-13/IL-9). В данном эксперименте PBMC стимулировали анти-CD3 и анти-CD28. CD4+ T-клетки отделяли посредством отрицательной селекции и загружали на матрицу микролунок. Матрицу приводили в контакт со стеклянным планшетом, функционализированным захватывающими антителами для IL-4, IL-5, IL-13, и IL-9. После 2 ч инкубирования матрицу удаляли и визуализировали. Планшет окрашивали и визуализировали на микроматричном сканере GenePix. В этот момент изображения связывают с каждой лункой. Каждая лунка составляет 50 мкм × 50 мкм × 50 мкм.
Особенно заслуживает внимания в данных исследованиях обнаружение IL-4 цитокина, который очень трудно обнаруживать с помощью традиционного иммуноферментного спот-анализа. Данные функциональные измерения также были связаны с автоматическим сбором изображений клеток в нанолунках. Таким образом, линии дифференцировки отдельных клеток согласуются с их характером секреции. Специализированный скрипт для анализа изображений был разработан для трансляции 1728×N каналов изображений, собранных в список клеток со связанными значениями шкалы серых тонов, обозначающими уровень экспрессии специфичных поверхностно экспрессируемых маркеров (например, CD4, CD8).
Наборы цитокиновых характеристик митоген-стимулированных клеток.
Для подтверждения мультиплексного исследование цитокинов, мононуклеарные клетки периферической крови (PBMC) от здоровых доноров стимулировали парой митогенов, которые, как известно, индуцируют цитокиновые ответы (митоген лаконоса и фитогемагглютинин, PHA) и поликлональным стимулом для T-клеток (анти-CD3/CD8). После определенного периода стимулирования оценивали количество пятен, обнаруженных на цитокиновых микроматрицах, сформированных с помощью микрогравирования (Фигура 5). Эти данные свидетельствовали о четких различиях между ответами, обнаруженными как функция стимулятора и периода воздействия. Сравнения общепризнанного иммуноферментного спот-анализа для данных условий активации также подтверждали данные.
Пример 3: Многомерные Наборы Цитокиновых Характеристик Единичной клетки
Цитокины, высвобождаемые лимфоцитами, представляют собой показатель клеточных функций и оказывают влияние на оценку иммунного ответа. Как описано ниже, посредством как численных моделирований, так и экспериментального подтверждения, микрогравирование это технология для улавливания секреции из отдельно взятых клеток предоставляет количественные измерения как частоты встречаемости, так и распределения скоростей секреции для до четырех цитокинов, высвобождаемых одновременно из отдельных жизнеспособных клеток. Данные многомерные измерения анализируют величину и интенсивности ответов клеток, подвергнутых воздействию стимулов, более подробно и с большей чувствительностью, чем функциональные исследования с единственным параметром. С использованием данного подхода показано, что средняя скорость секреции IFNγ увеличивается в лимфоцитах, продуцирующих одновременно два или три цитокина, но что другие цитокины (IL-2 и TNF-α) не демонстрируют подобного увеличения. Кроме того, скорости секреции IFNγ и IL-2 не коррелируют в клетках, продуцирующих оба цитокина, тогда как IL-2 и TNFα демонстрируют положительную корреляцию.
Четкие функциональные ответы, такие как секреция одного или более цитокинов или пролиферативный потенциал, различают уникальные подмножества лимфоцитов, которые могут быть связаны с качеством иммунного ответа (Pantaleo and Harari, 2006 Nat Rev Immunol, 6:417-423). Анализ гетерогенности среди подмножеств клеток требует аналитических способов, которые приводят к получению множества критериев широты и качества функций, демонстрируемых отдельными лимфоцитами (Seder, et al., 2008 Nat Rev Immunol, 8:247-258).
Существующие аналитические способы дают оценку частоты встречаемости, величины и количества цитокинов, продуцируемых отдельными клетками. ELISpot непосредственно измеряет секрецию для определения частоты встречаемости цитокин-продуцирующих клеток, но количественное определение едва заметных различий среди клеток в популяции является трудным. Интенсивности пятен могут свидетельствовать о скоростях секреции (Henn, et al., 2009 J Immunol, 183:3177-3187), но слабая чувствительность требует интегрирования сигналов на протяжении 12-48 ч для обнаружения большинства цитокинов (скорости <<100 молекул/с). Внутриклеточное окрашивание (ICS) для мультипараметрической цитометрии стало общепринятой альтернативой для оценки количества и величины цитокинов, экспрессируемых единичными клетками (Kannanganat, et al., 2007 J Virol, 81:8468-8476; Darrah, et al., 2007 Nat Med, 13:843-850). Средняя интенсивность флуоресценции (MFI) предоставляет относительный критерий количества белка, захваченного внутриклеточно, но данные значения трудны для сравнения между независимыми пробами. Кроме того, ICS измеряет продуцирующий потенциал клетки при препятствовании секреции и не может точно отразить количество цитокина, которое могло быть секретировано клеткой. Два модифицированных подхода для проточной цитометрии -«искусственные рецепторы» и микрошарики (Manz, et al., 1995 Proc Natl Acad Sci USA, 92:1921-1925; Powell и Weaver, 1990 Biotechnology (NY), 8:333-337) - обеспечивают возможность захвата секретируемых цитокинов вблизи внеклеточной поверхности клетки. Однако аналитические модели массовой транспортировки в данных двух процессах свидетельствуют о том, что скорость диффузии высвобождаемых цитокинов в основную массу среды ограничивает чувствительность данных измерений для слабо секретирующих клеток и может вызвать перекрестное загрязнение клеток (Frykman and Srienc, 1998 Biotechnol Bioeng, 59:214-226). Инкапсуляция клеток при холодных температурах в полимерных матрицах может также нарушать секрецию.
Длительные периоды, требующиеся для аккумулирования цитокинов или преодоления ограничений в чувствительности анализов, ограничивают изучение динамики высвобождения цитокинов отдельными первичными клетками. То, что описано в настоящей заявке, представляет собой новую одноклеточную аналитическую технологию, которая делает возможным проведение интегрированных, количественных измерений цитокинов, высвобождаемых из отдельных жизнеспособных клеток. Способ микрогравирования (Love, et al., 2006 Nat Biotechnol, 24:703-707) был модифицирован для определения скоростей секреции для множественных цитокинов одновременно из отдельно взятых клеток с чувствительностями, которые превышают существующие в настоящее время подходы на один или два порядка величины. Данные усиливают дифференциацию функциональных ответов у разных людей и раскрывают мелкие динамики секреции цитокинов в многофункциональных клетках.
Построение модели и численные моделирования
Для расчета концентрации анализируемого материала в микролунках, были сделаны следующие допущения: постоянная скорость секреции для заданного анализируемого вещества и что только анализируемые вещества специфично связываются с функционализированной стеклянной поверхностью:
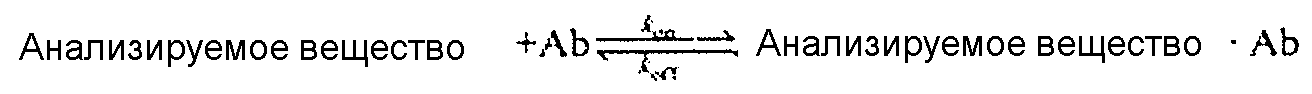
Изменяющаяся во времени диффузия анализируемого материала внутри микролунки составляла
где C представляет собой концентрацию анализируемого вещества в среде, D представляет собой коэффициент диффузии анализируемого вещества, а t представляет собой время инкубирования. Для решения частных дифференциальных уравнений, связанных с секрецией, диффузией и связыванием анализируемого материала со специфичным захватом Ab, использовали COMSOL Multiphysics 3.3 (COMSOL AB. Stockholm, Sweden). В Таблице 2 перечислены параметры системы, использованные при моделировании.
Выделение PBMC
Венозную кровь брали у здоровых контрольных пациентов в закрытые зелеными колпачками литиевые гепариновые пробирки (Кендалл) с Одобрения Внутреннего Экспертного Совета учреждения. PBMC отделяли с использованием центрифугирования в градиенте плотности на Ficoll-Paque PLUS (GE Healthcare). PBMC суспендировали при 106/мл в среде RPMI 1640 (Mediatech), дополненной 10% FBS, 2 мМ L-глютамина, 10 мМ HEPES, 100 ЕД пенициллина, 100 мг/мл стрептомицина, 0,1 мМ заменимых аминокислот и 1 мМ пирувата натрия.
Приготовление загруженных клетками микролунок для микрогравирования
Эксперименты проводили, как описано ранее, с некоторыми модификациями, как отмечено (Love, et al., 2006 Nat Biotechnol, 24:703-707; Bradshaw, et al., 2008 Clin Immunol, 129: 10-18). Кратко, матрицу микролунок изготавливали посредством инжектирования силиконового эластомера (полидиметилсилоксана, PDMS; Dow Corning) в изготовленную по заказу форму и отверждали при 80°C в течение 1 ч. Матрицы содержали 84672 микролунок (каждая 50×50×50 мкм3) (Ogunniyi, et al., 2009 Nat Protoc, 4:767-782). После обработки матрицы кислородной плазмой в течение 30 с (Harrick PDC-32G) на поверхности матрицы размещали клеточную суспензию (~2×105/мл) и обеспечивали клеткам возможность осаждения в лунках за счет силы тяжести с плотностью, составляющей ~1 клетка на лунку. После смывания средой избыточных клеток с поверхности матрицы, загруженное устройство затем помещали на стеклянный планшет, покрытый захватывающими антителами. Специфические подробности для каждого исследования описаны ниже.
Обнаружение IL-6 из PBMC
Поли-L-лизиновые планшеты готовили в соответствии с опубликованными протоколами и использовали для иммобилизации захватывающих антител. Античеловеческий IL-6 (40 мкг/мл, MAB206, R&D) и античеловеческий IgG (10 мкг/мл, 81-7100, Invitrogen) разбавляли в боратном буфере (Ogunniyi, et al., 2009 Nat Protoc, 4:767-782), наносили на планшеты на протяжении 1 ч при 25°C, промывали PBS и высушивали. Для стимулирования секреции IL-6 к PBMC по отдельности добавляли LPS (10 мкг/мл), PHA (5 мкг/мл) и PWM (5 мкг/мл) в 96-луночные планшеты с круглым дном и инкубировали при 37°C с 5% CO2 на протяжении необходимого периода времени. Перед загрузкой матриц микролунок, PBMC окрашивали Кальцеином фиолетовым AM (Invitrogen). Загруженные клетками матрицы затем визуализировали на автоматическом инвертированном эпифлуоресцентном микроскопе (Zeiss), оборудованном для визуализации живых клеток (регулирование температуры и CO2). Матрицы устанавливали на микроскопе покровным стеклом вверх (со средой, содержащей специфичные стимулы). Затем матрицу лунок осторожно промывали средой, содержащей следовое количество человеческой сыворотки (1:40000) (с целью отметить локализации всех микролунок с человеческим Ig) и немедленно наносили на стеклянный планшет, несущий захватывающие антитела. Соединенные матрицу и стеклянный планшет содержали вместе под легким сдавливанием в камере для гибридизации (Agilent TeClinologies, G2534A) и инкубировали при 37°C. Во время измерений, проводившихся по прошествии некоторого времени, половину клеток собирали для количественного определения мРНК в каждый момент времени. После печати для обнаружения использовали меченый Alexa Fluor 488 античеловеческий IL-6 (R&D) и меченый Alexa Fluor 700 античеловеческий IgG (Jackson ImmunoResearch). Для маркировки клеток после микрогравирования к матрице лунок добавляли 10 мкг/мл CD3-Alexa Fluor488, CDl lb-Alexa Fluor568, и CD14-Alexa Fluor 660. Спустя 30 мин при 4°C матрицу лунок промывали PBS и визуализировали (все антитела помечали сложными эфирами Alexa Fluor-NHS (Invitrogen), как указано).
ПЦР в режиме реального времени
РНК из PBMC очищали с использованием набора микропрепаратов исключительно для РНК (Stratagene). кДНК готовили с использованием набора Taqman, снабженного случайными гексамерами (Applied Biosystems). Праймеры IL-6 и зонд получали от Applied Biosystems и использовали в соответствии с рекомендованными методиками.
Мультиплексное обнаружение цитокинов
Парами антител, использованными для обнаружения множественных цитокинов, являлись: IFNγ (MABTECH), IL-17 (eBioscience), IL-2 (R&D) и TNFα (BD). Для захвата смесь захватывающих антител (10 мкг/мл каждого) наносили на стеклянные планшеты. PBMC стимулировали PMA (10 нг/мл) и иономицином (1 мкг/мл) на протяжении 6 ч, затем окрашивали Кальцеином фиолетовым AM и визуализировали в микролунках, как описано выше. Матрицу лунок промывали не содержащей сыворотку средой и немедленно наносили на стеклянный планшет, несущий захватывающие антитела. После печати для обнаружения использовали смесь антител - IL-17 (Alexa Fluor 488), IFNγ (Alexa Fluor 555), IL-2 (Alexa Fluor 594), TNFα (Alexa Fluor 700). Для маркировки клеток после микрогравирования на матрицу лунок добавляли 10 мкг/мл CD3 (Alexa Fluor 488), CD8 (Alexa Fluor 568) и CD4 (Alexa Fluor 660). Спустя 30 мин при 4°C матрицу лунок промывали PBS и визуализировали.
Анализ Данных
В процессе работы, со ссылкой на Фигуру 20, процесс 10 для анализа секретируемых продуктов включает показанные стадии. Процесс 10, однако, является всего лишь иллюстративным, а не ограничивающим. Процесс 10 может быть изменен, например, за счет наличия добавленных, удаленных или замененных стадий. Печатные микроматрицы цитокинов 14 могут быть визуализированы на микроматричном сканере 15 (например, GenePix 4200AL, MDS) и проанализированы с использованием прилагающегося программного обеспечения (например, GenePix 6,1). Проходящий свет и эпифлуоресцентные микроснимки, полученные через микроскоп, могут быть проанализированы 16 для определения количества и линий дифференцировки 18 клеток, присутствующих в каждой лунке 12. Данные, полученные как для матрицы клеток, так и для печатной микроматрицы, могут быть сопоставлены 20 (например, в MS Excel) с использованием уникальных идентификаторов, заданных для каждой лунки внутри матрицы. Набор данных может быть отфильтрован 22 с целью включения локализаций в матрице 12, которые содержат только единичные клетки, сопоставлен с секретируемыми белками на соответствующей микроматрице 14 для последующего анализа (например, в Excel или MATLAB (The Mathworks, Natick, MA)). Распределения скоростей можно сравнивать с использованием критерия Колмогорова-Смирнова, основанного на двойной выборке, а коэффициенты корреляции для совместной секреции могут быть рассчитаны с использованием ранговой корреляции Спирмана 24.
В процессе работы, со ссылкой на Фигуру 21, процесс 30 создания иммунной характеристики 38 с целью предоставления клинического диагноза 40 осуществляют за счет определения типа клетки 32, величины секреции 34 и частоты встречаемости респондеров 36, причем интеграция каждого набора данных приводит к получению иммунной характеристики, свидетельствующей о физиологическом состоянии реципиента, от которого была получена проанализированная клетка.
Количественное микрогравирование для оценки скоростей цитокиновой секреции
В микрогравировании используется матрица микроизготовленных лунок для временного ограничения жизнеспособных клеток в субнанолитровых объемах с минимальными нарушениями обычного состояния; одна внутренняя поверхность объема поддерживает антитело для захвата белка, секретируемого клеткой (Фигура 6A). После инкубирования (~1-2 ч), захватывающую поверхность удаляют, а затем подробно исследуют с помощью нанесения флуоресцентных антител (Bradshaw, et al., 2008 Clin Immunol, 129: 10-18). Для определения оптимальных условий, при которых микрогравирование обеспечило бы возможность количественных измерений секреции, использовали ряд дифференциальных уравнений и численных моделирований для создания модели массовой транспортировки для единичной клетки, ограниченной в отдельном объеме. Моделирования, показывающие три режима, описывают временное соотношение между количеством белка, захваченного на поверхности, и количеством белка в объеме (Фигура 6B). В промежуточном режиме (~ от 30 мин до >20 ч), количество белка, захваченного на поверхности, близко соответствует общему количеству белка, секретируемому клеткой.
Предполагая постоянное высвобождение анализируемого материала клеткой, модель предложила, что количество захваченного анализируемого вещества должно линейно увеличиваться либо со временем, либо с количеством клеток на лунку. Оба прогноза были экспериментально подтверждены с использованием PBMC человека и клеток гибридомы мышей (Фигура 7). Данные результаты предполагают, что колебания в MFI захваченного белка, измеренного для клеток в фиксированной временной точке, точно отражают колебания количеств секретируемого белка, а также, вследствие этого, средней скорости секреции (Фигура 8). Для преобразования MFI в скорость для данной клетки использовали стандартную ссылку, включающую известные количества флуоресцентных идентифицирующих антител, для перевода MFI в конечное количество захваченного анализируемого вещества; деление данного количества на время инкубирования дает усредненную скорость секреции из единичной клетки (Фигура 9). Вместе, модель и эти данные, демонстрируют, что микрогравирование предоставляет эффективную и количественную оценку общего количества белка, секретируемого за определенный период.
Количественное выражение частоты встречаемости и величины IL-6, высвобождаемого из PBMC
Для оценки чувствительности измерений авторов изобретения, измеряли как частоты встречаемости, так и скорости секреции IL-6, высвобождаемого из PBMC человека спустя три промежутка (3, 6, и 12 ч) стимулирования LPS. Измеренные ответы показали, что как частота встречаемости IL-6-секретирующих клеток, так и средняя скорость секреции на клетку монотонно увеличивались от 3 до 12 ч (особенно между 3 и 6 ч) (Фигура 6C). Экспрессия мРНК, кодирующей IL-6, однако, достигала пика в 6 ч (Фигура 6D); данное наблюдение подтверждает, что расчет времени транскрипции может не обязательно коррелировать с расчетом времени секреции белка. Большинство клеток, секретирующих IL-6, являлись CD11b+ (44,8%) и CD11b+CDH+ (26,9%), тогда как CD3+ являлась небольшой популяцией (4,7%). Распределение скоростей секреции среди данных клеток значительно не отличается, что предполагает, что все они обладают аналогичными секреторными возможностями.
Далее исследовали распределения скоростей секреции IL-6 для распознавания ответов между людьми после воздействия на их PBMC различными стимулами. Измерения показали, что ответы клеток одного и того же донора демонстрировали сильные колебания как по частоте встречаемости, так и по величине (скоростям) после различных стимулирований, и что данная комбинация ответов была уникальной для человека (Фигура 6E). Например, Доноры 1 и 2 демонстрировали аналогичные частоты встречаемости клеток-респондеров после стимулирования PHA, но распределения скоростей секреции совершенно различались (p < 0,001). Только два условия стимулирования для Донора 2 (LPS и PHA) привели к аналогичным распределениям скоростей (p=0,8622). Данные результаты предполагают, что различающаяся иммунная чувствительность с критериями как по частотам встречаемости, так и распределению скоростей, может быть более устойчивой к ошибкам, чем измерения с единственным параметром (частота встречаемости).
Одновременное обнаружение множественных цитокинов из отдельно взятых клеток
Аналитическая модель для микрогравирования предполагала, что множественные цитокины из одной и той же клетки могут быть независимо обнаружены, допуская достаточные специфические характеристики для каждой пары антител, использованных для захвата и обнаружения. Четыре коммерческих пары антител проверили на достоверность для обнаружения одновременно IL-17, IFNγ, IL-2 и TNFα, а затем измеряли широту ответов PBMC человека после стимулирования PMA/иономицином с помощью количественного микрогравирования. Живые клетки в матрице демонстрировали диапазон функциональных ответов, включающих один, два или три цитокина (Фигура 10A и Фигура 11). Проанализировали (Фигура 10B) скорости секреции для каждого цитокина для клеток, секретирующих комбинации цитокинов (мин 48 на 100000 клеток). Высвобождение IFNγ было наиболее динамичным (3,8-120 молекул/с), тогда как скорости для других цитокинов, как правило, были менее чем 20 молекул/с. Клетки IFNγ и IL-2+ включали как CD4, так и CD8 T-клетки: Несмотря на то что частоты встречаемости каждой линии дифференцировки различались, распределения их скоростей секреции были аналогичными (Фигура 12). Эти данные показывают, как ожидалось, что не имеется существенного отличия в секреторных возможностях CD4 и CD8 T-клеток.
Анализ многофункциональных клеток с помощью ICS показал, что клетки, продуцирующие два и три цитокина, экспрессируют большие количества цитокинов внутри клетки, чем единственные продуценты, когда секреция блокирована (Darrah, et al., 2007 Nat Med, 13:843-850). В экспериментах, распределение скоростей секреции для IFNγ также варьировало между единственными продуцентами и двойными/тройными продуцентами (Фигура 10B). Средняя скорость секреции IFNγ повышалась в 2,2 раза, когда клетки совместно секретировали IL-2 или IL-2/TNFα. Однако не было четкого различия в скоростях секреции для других цитокинов. Данные дополнительно проанализировали для определения, насколько скорости секреции у двойных и тройных продуцентов коррелировали для множественных цитокинов (Фигура 13A,B). Имелась положительная корреляция между скоростями секреции для IFNγ и TNFα для двойных продуцентов, и между IFNγ/TNFα и IL-2/TNFα для тройных продуцентов. В отличие от этого, скорости секреции для IFNγ и IL-2 не коррелировали либо для двойных, либо для тройных продуцентов. Данные результаты совпадают с предыдущими исследованиями совместной экспрессии цитокинов: гены для IL-2 и TNFα совместно регулируются общими факторами транскрипции (Decker, EL 2003 Nucleic Acids Research, 31:91 1-921), тогда как IFNγ и IL-2 регулируются независимо (Penix, et al., 1993 J Exp Med, 178: 1483-1496). Не было значительного различия в частотах встречаемости или корреляции скоростей между IFNγ+/IL-2+ CD4 и CD8 T-клетками, тогда как частота встречаемости IFNγ+/TNFα+ CD8 T-клеток была приблизительно в два раза выше, чем CD4 T-клеток (Фигура 13C). Данные результаты показывают, что микрогравирование выявляет едва различимые динамики секреции, демонстрируемые многофункциональными клетками, скрытые в ICS.
В настоящей заявке описан количественный способ с использованием микрогравирования для продуцирования многомерных наборов цитокиновых характеристик, высвобождаемых из отдельных жизнеспособных лимфоцитов. Технические преимущества данного подхода состоят в том, что: 1) он выдает количественный критерий секреторной функции, который подлежит сравнению между пробами, и 2) механизм массовой транспортировки усиливает чувствительность способа (Таблица 3) по сравнению с другими основанными на секреции исследованиями (Иммуноферментный спот-анализ, поверхностный захват) на порядок величины (Frykman, et al., Biotechnol Bioeng, 59:214-226). Данные характеристики минимизируют нарушения обычного состояния клеток перед процессом измерений и в течение его. Кроме того, оценка скоростей секреции для отдельных цитокинов, высвобождаемых из отдельно взятых клеток, повышает размерность анализов для многофункциональных клеток. Объединение цитометрии с визуализацией с данными измерениями имеет результатом комбинацию данных по единичной клетке, которые включает линия дифференцировки клеток, а также количество и скорости секретируемых цитокинов. Подобные данные улучшают дифференциацию гетерогенных подмножеств клеток, что является решающим для оценки реакций на вакцины и понимания патологии хронических заболеваний, особенно при определении параметров клинических проб, где количество доступных клеток может быть недостаточным для анализа с помощью независимых общепризнанных способов (например, новорожденные, тканевые биопсии).
Ограничение обнаружения определяли для специфичного флуорофора, использованного на каждом идентифицирующем антителе, и определили как три стандартных отклонения (SD) выше усредненного фона. Данные значения по меньшей мере в 10 раз ниже, чем ранее рассчитанные значения для исследования с искусственным рецептором, и в большинстве случаев ниже, чем значения для исследования с инкапсуляцией.
Пример 4: Применение Технологии Микрогравирования для Аллергической Пробы и Определения Аллергического Анамнеза
Определяют характеристики Цитокиновой секреции различных типов Th-клеток, а также частоты встречаемости различных B-клеток, секретирующих подтипы Ig. Информацию используют для диагностики чувствительности к аллергенам и мониторинга изменения иммунитета в процессе иммуннотерапии аллергии.
Разрабатывают три выявляющих чипа. Они включают: Th-пул: IL-17 (Th17), IL-10 (Treg), IL-4 (Th2) и IFN-g (Th1). Это характерные цитокины четырех подтипов CD4+T-клеток. Th2-пул: IL-4, IL-5, IL-13 и IL-9, четыре важных Th2-цитокина при аллергии. Набор антител: IgE, IgG1, IgG4 и IgA, четыре подтипа молекулы иммуноглобулина в аллергическом процессе.
Идентифицируют пары антител, подходящих для Th2-пула, и изучают их стандартные кривые и перекрестные реакции.
Для измерения секреции иммуноглобулинов стеклянные планшеты функционализируют аллергеном для захвата аллергенспецифичных антител. Четыре античеловеческих Ig изотипа антител (античеловеческий IgE, античеловеческий IgG1, античеловеческий IgG4 и античеловеческий IgA) используют в качестве идентифицирующих антител. Стандарты IgE, IgG1, IgG4 и IgA человека используют для исследования специфичности имеющихся в продаже античеловеческих Ig изотипов антител.
Чип с антителами имеет целью измерение четырех различных Ig изотипов в единственном исследовании. Однако невосприимчивость пептидов аллергена может быть утеряна или ослаблена при непосредственном нанесении аллергена на стеклянную поверхность. В качестве альтернативы, каждый тип античеловеческого Ig антитела используют в качестве захватывающего антитела на четырех различных планшетах. Аллерген флуоресцентно метят и используют в качестве идентифицирующего реагента.
Модель аллергии на арахис используют для изучения клеточной реакции при воздействии арахиса. Получают образцы крови больных, страдающих аллергией на арахис и больных, не страдающих аллергией на арахис. Из каждого образца крови выделяют PBMC и стимулируют таким же арахисовым экстрактом, который используют в клинической диагностике. Ответ PBMC исследуют с использованием Th, Th2 и Ab чипов. Для определения наилучшего условия стимулирования in vitro проводят исследование зависимости от времени, вместе с градиентом аллергена. Цитокиновые характерстики и частоты встречаемости аллергенспецифичных иммуноглобулинов больных, страдающих аллергией на арахис, статистически анализируют и сравнивают с характеристиками больного без аллергии на арахис. Значительные различия между данными двумя популяциями считаются диагнозом аллергии. Необязательно, исследуют цитокиновый характер и секрецию Ig на различных стадиях заболевания или в процессе лечения для изучения изменений иммунной системы в процессе развития аллергии и для изучения потенциального применения микрогравирования в клинических испытаниях.
Детализация технологии микрогравирования, разработанной в настоящем описании, предоставляет возможность высокоэффективного мультиплексного анализа единичных клеток, особенно в области иммунологического исследования. Отличительная черта единственных клеток позволяет лучше понять сеть иммунных клеток и динамически отслеживать изменения поведения клеток в процессе развития заболевания. Низкая стоимость материалов, стандартный процесс и короткое оперативное время данной технологии также предоставляют возможности для клинической диагностики. Помимо изучения аллергии, распространение данного способа может также быть использовано при аутоиммунных и инфекционных заболеваниях.
Других Варианты Осуществления
Повышение Чувствительности Обнаружения Цитокинов и Расширение Числа Цитокинов в Исследовании.
Для повышения чувствительности исследования используют амплификацию по типу катящегося кольца (RCA) (Schweitzer, et al., 2002 Nat Biotechnol, 20: 359-365) для обнаружения множественных цитокинов в исследовании. Преимуществом RCA является то, что она преобразует единственный сигнал от антитела в амплифицируемую молекулу ДНК (Фигура 14). Вместо маркировки идентифицирующих антител различными флуоресцентными цветами, идентифицирующие антитела метят различными праймерами (Фигура 15). Циклическая ДНК сконструирована из двух частей. Одна часть представляет собой консервированную последовательность, которая является одинаковой для всех циклических ДНК. Другая часть является комплементарной к специфичному праймеру, связанному с идентифицирующим антителом для каждого цитокина.
После применения идентифицирующего антитела, циклическую ДНК добавляют в систему и амплифицируют посредством определенных циклов, где праймеры, прикрепленные к идентифицирующим антителам, вытягиваются. В заключение реакционные реагенты удаляют и добавляют репортерные последовательности с флуорофорами.
Количество цитокинов, которые обнаруживаются при исследовании, также зависит от имеющихся в распоряжении флуоресцентных цветов и лазерного возбуждения и фильтров в инструменте. В настоящее время используют сканер GenePix, который имеет четыре лазера: 488 нм, 532 нм, 594 нм и 635 нм. Со стандартными фильтрами, из инструмента обнаруживают четыре цвета. Однако, с комбинацией других дополнительных фильтров, при использовании флуорофора, такого как Alexa Fluor 700, Alexa Fluor 750 или Qdot, могут быть добавлены два или три других цвета.
Однако для того, чтобы уменьшить наложение различных флуоресцентных спектров, ограничивают пространство для флуоресцентных цветов. С преимуществом более высокого разнообразия последовательностей ДНК, на основании RCA разрабатывают стратегию последовательной маркировки для расширения количества цитокинов. Как показано на Фигуре 16, после реакции RCA сигналы обнаруживаются группа за группой в зависимости от цвета, доступного при сканировании. Например, для обнаружения четырех цитокинов сперва добавляют четыре репортерных последовательности с различными цветами. После сканирования с планшета удаляют первую группу флуоресцентных молекул. Один способ состоит в том, чтобы разрезать участок ДНК из двойных нитей, который будет удалять обнаруживаемые последовательности из системы. Еще один способ состоит в том, чтобы использовать расщепляемый линкер между репортерной ДНК и флуорофором таким образом, чтобы после обнаружения флуорофор мог быть расщеплен (Ju, et al., 2006 Proc Natl Acad Sci USA, 103: 19635-19640). После промывания флуоресцентных молекул в системе на систему наносят вторую группу репортерных последовательностей для гибридизации еще одной группы последовательностей ДНК. По причине того, что первая группа флуорофоров была удалена, вторую группу репортерных последовательностей метят теми же самыми цветами.
Сперва RCA проводят при обнаружении единственного цитокина в системе микрогравирования. Используют циклическую ДНК и праймерную последовательность, как опубликовано Schweitzer с соавт. (Schweitzer et al., 2002 Nat Biotechnol, 20: 359-365).
Кольцо: 5'-CTC AGC TGT GTA ACA ACA TGA AGA TTG TAG GTC AGA ACT CAC CTG TTA GAA ACT GTG AAG ATC GCT TAT TAT GTC CTA TC-3'
Праймер: 5'-CAC AGC TGA GGA TAG GAC AT-3'
Репортерная последовательность: 5'-ATG TCC TAT CCT CAG CTG TG-3'
В процессе амплификации используют две температуры: 45°C и 37°C. Данную стадию амплификации объединяют и выполняют с помощью машины для промывания, так чтобы после печати автоматически выполнялись все стадии. Сначала используют один цитокин для оптимизации процесса (концентрация и время реакции) и определения чувствительности обнаружения.
Используя такую же цитокиновую модель, разработанную выше, для удаления флуорофора после обнаружения используют два способа: 1) для конъюгирования флуорофора с репортерной ДНК используют расщепляемый линкер. Одной альтернативой является фоторасщепляемый 2-нитробензиловый линкер, который может быть расщеплен с использованием лазерного излучения (355 нМ) за 10 сек (Seo, et al., 2005 Proc Natl Acad Sci USA, 102: 5926-5931). Еще одной альтернативой является линкер алкильной группы, который может быть удален за 30 секунд с помощью Pd катализатора (Ju, et al., 2006 Proc Natl Acad Sci USA, 103: 19635-19640; Bi, et al., 2006 J Am Chem Soc, 128: 2542-2543). 2) для расщепления двойной нити ДНК используют эндонуклеазу. Приоритет состоит в том, чтобы для расщепления участка репортерной связанной ДНК найти не специфичную к последовательности эндонуклеазу. Если эндонуклеазы нет в распоряжении или она слишком дорогая, используют ограниченно специфичную к последовательности эндонуклеазу. В данном случае, считается, что участок расщепления находится в составе праймера, циклической ДНК и репортерной ДНК. Эффективность удаления флуорофора оценивают во всех описанных выше способах и наилучшую стратегию используют на следующих стадиях.
Циклическая ДНК для обнаружения множественных цитокинов разрабатывают и применяют для обнаружения множественных цитокинов с использованием последовательной маркировки. Другие три группы праймера, циклической ДНК и репортера разрабатывают на основании первой группы последовательностей, показанных выше. Общей стратегией является изменение последовательностей праймера, репортера и участка циклической ДНК, которая является комплементарной к праймеру, в то же время сохраняя другую часть циклической ДНК неизменной (как показано на Фигуре 15). Четыре флуорофора конъюгируют с четырьмя репортерами, соответственно. Четыре праймера конъюгируют с четырьмя идентифицирующими антителами. На данной стадии используют те же группы флуорофоров и антител, которые были использованы при предварительном изучении. На стадии обнаружения четыре репортера добавляют в одно и то же время для измерения чувствительности обнаружения множественных цитокинов. Последовательную маркировку проверяют посредством добавления каждого репортера в разное время и удаления после сканирования. Целью является измерение максимального повторения обнаружений, которое может быть использовано в предложенной системе. В дополнение, разрабатывают другие четыре или восемь праймеров для расширения общего количества цитокинов до восьми иди двенадцати на исследование.
В некоторых вариантах осуществления, стадии, описанные выше, осуществляют в компьютерных программах с использованием стандартных методик программирования. Подобные программы разрабатывают для выполнения на программируемых компьютерах, каждый из которых включает электронный процессор, систему хранения данных (включая память и/или элементы хранения), по меньшей мере одно устройство ввода и по меньшей мере одно устройство вывода, такое как дисплей или принтер. В некоторых вариантах осуществления, для полученных данных применяют систему кодирования (например, для данных о связывании цитокинов), для выполнения функций, описанных в настоящей заявке, и для создания выходной информации (например, оценки аллергического статуса), которую применяют к одному или более устройствам вывода. Каждая подобная компьютерная программа может быть выполнена на процедурном или объектно-ориентированном языке высокого уровня, или языке ассемблера или машинном языке. Кроме того, язык может быть транслируемым или интерпретируемым языком. Каждая такая компьютерная программа может быть сохранена на носителе считываемых данных компьютера (например, CD ROM или магнитный диск), который при считывании компьютером может вызывать выполнение процессором компьютера анализа, описанного в настоящей заявке.
В процессе работы, со ссылкой на Фигуру 21, процесс 30 для вычисления иммунной характеристики (38) и предоставления клинического диагноза (40) включает определение типа клетки (32), определение величины секреции (34) и определение частоты встречаемости респондеров (36).
Таблица 4 показывает фенотипический характер Th1, Th2 и Th-17 клеточных типов.
Дополнительные варианты осуществления представлены в рамках формулы изобретения.
Реферат
Группа изобретений относится к способу обнаружения множественных цитокинов из отдельно взятых клеток и предназначено для создания набора иммунологических характеристик заболеваний. Для воплощения изобретения предусматривается наличие суспензии живых мононуклеарных клеток периферической крови индивида, нанесенной на пластичный планшет, который содержит по меньшей мере одну микролунку в матрице микролунок. При этом по меньшей мере одна микролунка в указанной матрице микролунок содержит одну клетку в объеме менее одного нанолитра. Матрицу микролунок приводят в контакт с субстратом, причем субстрат предварительно обрабатывают по меньшей мере двумя средствами для обнаружения и каждое средство для обнаружения связывается с секретированным цитокином указанной клетки. Измеряют уровень каждого указанного секретированного цитокина на указанном субстрате, при этом уровень соответствует количеству указанного секретированного цитокина указанной единичной клетки. Определяют скорость секреции каждого указанного секретированного цитокина из указанной клетки, определяя, таким образом, характеристики указанных секретированных цитокинов. Измеряют динамическое изменение указанных характеристик секретированных цитокинов. Использование группы изобретений обеспечивает создание иммунологических характеристик заболеваний. 2 н. и 39 з.п. ф-лы, 4 табл., 21 ил., 4 пр.
Формула
наличие суспензии живых мононуклеарных клеток периферической крови индивида, нанесенной на пластичный планшет, содержащий по меньшей мере одну микролунку в матрице микролунок, при этом по меньшей мере одна микролунка в указанной матрице микролунок содержит одну клетку в объеме менее одного нанолитра;
приведение матрицы микролунок в контакт с субстратом, при этом субстрат предварительно обрабатывают по меньшей мере двумя средствами для обнаружения и при этом каждое средство для обнаружения связывается с секретированным цитокином указанной клетки;
измерение уровня каждого указанного секретированного цитокина на указанном субстрате, при этом уровень соответствует количеству указанного секретированного цитокина указанной единичной клетки; и
определение скорости секреции каждого указанного секретированного цитокина из указанной клетки;
определение, таким образом, указанной характеристики секретированных цитокинов;
где способ дополнительно предусматривает измерение динамического изменения указанных характеристик секретированных цитокинов.
(a) осуществление первой стадии приведения в контакт в первую временную точку, где первая стадия приведения в контакт включает приведение в контакт планшета с первым субстратом;
где планшет содержит матрицу микролунок, где размер каждой микролунки позволяет удерживать объем менее одного нанолитра жидкости, где микролунки в матрице микролунок содержат живые T-клетки и продукты, секретированные T-клетками, и в среднем содержат не более одной T-клетки или несколько T-клеток на лунку;
где первый субстрат предварительно обрабатывают множеством первых средств для обнаружения, где указанное множество первых средств для обнаружения содержит первые средства для обнаружения, которые, соответственно, связываются с различными цитокинами, таким образом, цитокины, секретированные указанными T-клетками, которые присутствуют в указанных микролунках и являются партнерами связывания первого средства для обнаружения, связываются с первым средством для обнаружения в областях на первом субстрате, приведенным в контакт с содержимым микролунок, с получением первой печатной матрицы;
(b) после стадии (a) осуществление второй стадии приведения в контакт во вторую временную точку, где вторая стадия приведения в контакт включает приведение в контакт планшета со вторым субстратом,
где второй субстрат предварительно обрабатывают множеством вторых средств для обнаружения, где указанное множество вторых средств для обнаружения содержит вторые средства для обнаружения, которые идентичны указанным первым средствам для обнаружения, которые, соответственно, связываются с различными цитокинами, таким образом, цитокины, секретированные указанными T-клетками, которые присутствуют в указанных микролунках и являются партнерами связывания второго средства для обнаружения, связываются со вторым средством для обнаружения в областях на втором субстрате, приведенным в контакт с содержимым микролунок, с получением второй печатной матрицы;
(c) измерение уровней указанных различных цитокинов, связанных с первой печатной матрицей и уровней указанных различных цитокинов, связанных со второй печатной матрицей, и
(d) определение скорости секреции различных цитокинов, связанных с первой печатной матрицей и скорости секреции различных цитокинов, связанных со второй печатной матрицей, таким образом, определяя характеристики T-клеток.
и указанная стадия измерения дополнительно включает измерение уровней указанных различных цитокинов, связанных с каждой указанной дополнительной печатной матрицей, и определение скорости секреции различных цитокинов, связанных с каждой указанной дополнительной печатной матрицей.
и указанная стадия определения количества дополнительно включает измерение уровней указанных различных цитокинов, связанных с каждой указанной дополнительной печатной матрицей, и определение скоростей секреции различных цитокинов, связанных с каждой указанной дополнительной печатной матрицей.

Комментарии