Антитела против фактора роста эндотелия сосудов (vegf) - RU2514148C2
Код документа: RU2514148C2
Чертежи































Описание
Область, к которой относится изобретение
Данное изобретение в целом относится к выбранным полипептидным последовательностям и антителам против VEGF с целебными свойствами для применения в исследованиях, терапии и диагностике.
Предпосылки создания изобретения
Развитие сердечно-сосудистой системы является непременным требованием многих физиологических и патологических процессов. Для активного роста тканей, таких как эмбрионы и опухоли, требуется достаточное кровоснабжение. Эту потребность ткани удовлетворяют, продуцируя проангиогенные факторы, которые стимулируют образование новых кровеносных сосудов в процессе, называемом ангиогенезом. Образование сосудистых трубок является сложным, но упорядоченным (последовательным) биологическим событием, включающим все или многие из следующих стадий: а) эндотелиальные клетки (ЕС) образуются пролиферацией имеющихся ЕС или дифференцировкой клеток-предшественников; б) ЕС мигрируют и соединяются с образованием нитевидных структур; в) затем нити сосудов претерпевают тубулогенез с образованием сосудов с центральным просветом; г) имеющиеся нити или сосуды дают ростки, образуя вторичные сосуды; д) первоначальное сосудистое сплетение претерпевает дальнейшее ремоделирование и реструктурирование; и е) периэндотелиальные клетки рекрутируются, упаковываясь в эндотелиальные трубки, обеспечивающие сохранение и модуляторные функции сосудов; причем такие клетки включают перициты для небольших капилляров, клетки гладких мышц для сосудов большего размера и миокардиальные клетки в сердце. Hanahan, D, Science 277: 48-50 (1997); Hogan, В. L. & Kolodziej, P. A. Nature Reviews Genetics. 3: 513-23 (2002); Lubarsky, В & Krasnow, M. A. Cell. 112: 19-28 (2003).
Точно установлено, что ангиогенез играет роль в патогенезе различных расстройств. Эти расстройства включают солидные опухоли и метастазирование, атеросклероз, ретролентальную фиброплазию, гемангиомы, хроническое воспаление, внутриглазные неоваскулярные заболевания, такие как пролиферативные ретинопатии, например диабетическую ретинопатию, возрастную дегенерацию желтого пятна (AMD), неоваскулярную глаукому, иммунное отторжение трансплантированной ткани роговицы и других тканей, ревматоидный артрит и псориаз, Folkman et al., J, Biol. Chem., 267: 10931- 10934 (1992); Klagsbrun et al., Annu. Rev. Physiol. 53: 217-239 (1991); и Garner A., "Vascular diseases," В: Pathobiology of Ocular Disease. A Dynamic Approach, Garner A., Klintworth GK, eds., 2nd Edition (Marcel Dekker, NY, 1994), pp 1625-1710.
В процессе роста опухолей ангиогенез, по-видимому, отвечает за переход от гиперплазии к неоплазии и за доставку питательных веществ, необходимых для роста и метастазирования опухоли. Folkman et al., Nature 339: 58 (1989). Неоваскуляризация способствует предпочтительному росту и пролиферативной автономии опухолевых клеток по сравнению с нормальными клетками. Обычно опухоль начинается как единичная аберрантная клетка, которая может пролиферировать только до размера нескольких кубических миллиметров вследствие расстояния от доступного капиллярного ложа, и она может оставаться 'спящей' в отсутствие дальнейшего роста и диссеминации в течение продолжительного периода времени. Некоторые опухолевые клетки затем переключаются на ангиогенный фенотип ("ангиогенное переключение"), активируя эндотелиальные клетки, которые пролиферируют и созревают в новые капиллярные кровеносные сосуды. Эти вновь образовавшиеся кровеносные сосуды содействуют не только непрерывному росту первичной опухоли, но также дессименации (распространению) и повторной колонизации метастатических опухолевых клеток. Соответственно, наблюдается корреляция между плотностью микрососудов в опухолевых участках и продолжительностью жизни больных раком молочной железы, а также пациентов с некоторыми другими опухолями. Weidner., N. Engl. J. Med 324: 1-6 (1991); Horak et al. Lancet 340: 1120-1124 (1992); Macchiarini et al., Lancet 340: 145-146 (1992). Точные механизмы, которые контролируют ангиогенное переключение, не очень понятны, но полагают, что неоваскуляризация опухолевой массы является результатом "нетто-баланса" между множеством стимуляторов и ингибиторов ангиогенеза (Folkman, Nat Med 1(1): 27-31 (1995)).
Процесс развития сосудов тщательно регулируется. К настоящему времени показано, что значительное число молекул, главным образом, секретированных факторов, продуцируемых соседними клетками, регулируют дифференцировку, пролиферацию, миграцию и коалесценцию (соединение) ЕС клеток в нитеподобные (струноподобные) структуры. Например, определено, что сосудистый эндотелиальный фактор роста (VEGF) является ключевым фактором, принимающим участие в стимуляции ангиогенеза и индукции сосудистой проницаемости. Ferrara et al., Endocr. Rev. 18: 4-25(1997). Открытие того факта, что утрата даже одного VEGF аллеля приводит к эмбриональной летальности, указывает на незаменимую роль этого фактора в развитии и дифференцировке сосудистой системы. Показано, кроме того, что VEGF является важнейшим медиатором неоваскуляризации, связанной с опухолями и внутриглазными расстройствами. Ferrara et аl., Endocr. Rev, supra. мРНК VEGF сверхэкспрессируется (избыточно экспрессируется) большинством изученных человеческих опухолей. Berkman et al., J. Clin. Invest. 91: 153-159 (1993); Brown et al., Human Pathol 26: 86-91 (1995); Brown et al., Cancer Res. 53: 4727-4735 (1993); Mattern et al., Brit. J. Cancer 73: 931-934 (1996); Dvorak et al., Am. J. Pathol. 146: 1029-1039 (1995).
Также наблюдается высокая степень корреляции между уровнями концентрации VEGF в глазных жидкостях и наличием активной пролиферации кровеносных сосудов у пациентов с диабетом и другими типами связанной с ишемией ретинопатии. Aiello et al., N. Engl. J. Med. 331: 1480-1487 (1994). Помимо этого, исследования показали локализацию VEGF в хориоидальных неоваскулярных мембранах у пациентов, пораженных AMD. Lopez et al., Invest. Ophthalmol Vis. Sci. 37: 855-868 (1996).
Нейтрализующие антитела против VEGF подавляют рост различных человеческих опухолевых клеточных линий у "голых" мышей (Kim et al. Nature 362: 841-844 (1993); Warren et al., J. Clin. Invest. 95: 1789- 1797 (1995); Borgstrom et al., Cancer Res. 56: 4032-4039 (1996); Melnyk et al., Cancer Res. 56: 921-924 (1996)), а также ингибирует внутриглазной ангиогенез на моделях ишемии сетчатки. Adamis et al., Arch. Ophthalmol 114: 66-71 (1996). Следовательно, моноклональные антитела против VEGF или другие ингибиторы действия VEGF являются перспективными кандидатами для лечения опухолей и различных внутриглазных неоваскулярных заболеваний. Такие антитела описаны, например, в Европейской патентной заявке ЕР 817648, опубликованной 14 января 1998 года; и в Международных патентных заявках WO98/45331 и WO98/45332, обе опубликованы 15 октября 1998 года. Одно из антител против, бевацизумаб, одобрено FDA для применения в комбинации со схемой химиотерапии для лечения метастатического колоректального рака (CRC) и немелкоклеточного рака легкого (NSCLC). Бевацизумаб изучается во многих проводящихся клинических исследованиях для лечения различных признаков рака.
Известны также другие антитела против VEGF, антитела против Nrp1 и антитела против Nrp2, описанные, например, Liang el al., J Mol Biol 366, 815-829 (2007) и Liang et al., JBiol Chem 281, 951-961 (2006), Международная заявка РСТ WO2007/056470 и заявка РСТ No. PCT/US2007/069179, содержание этих патентных заявок вводится в данное описание ссылкой.
Сущность изобретения
Изобретение включает новые антитела против VEGF и их применение.
Изобретение включает ряд антител против VEGF. Например, охватывается антитело, которое связывается с VEGF, или его фрагмент, отличающееся тем, что антитело содержит шесть HVR (гипервариабельных областей), выбранных из:
(i) HVR-L1, содержащей аминокислотную последовательность X1X2RX3SL, причем HVR-L1 содержит 1, 2 или 3 замены в любой комбинации следующих положений: X1 обозначает G или А; Х2 обозначает V или I; и/или Х3 обозначает Т или R;
(ii) HVR-L2, содержащей аминокислотную последовательность DASSLA (SEQ ID NO:6);
(iii) HVR-L3, содержащей аминокислотную последовательность SYKSPL (SEQ ID NO:7);
(iv) HVR-H1, содержащей аминокислотную последовательность SISGSWIF (SEQ ID NO:1);
(v) HVR-H2, содержащей аминокислотную последовательность GAIWPFGGYTH (SEQ ID NO:2); и
(vi) HVR-Н3, содержащей аминокислотную последовательность RWGHSTSPWAMDY (SEQ ID NO:3).
В другом варианте изобретение включат антитело, которое связывается с VEGF, или его фрагмент, причем антитело содержит:
(1) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:1;
(2) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:2;
(3) HVR-Н3, содержащую аминокислотную последовательность SEQ ID NO:3;
(4) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:4;
(5) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:6; и
(6) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:7.
В другом варианте изобретение включат антитело, которое связывается с VEGF, или его фрагмент, причем антитело содержит:
(1) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:1;
(2) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:2;
(3) HVR-Н3, содержащую аминокислотную последовательность SEQ ID NO:3
(4) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:5;
(5) HVR- L2, содержащую аминокислотную последовательность SEQ ID NO:6; и
(6) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:7.
В другом варианте изобретение включает антитело, которое связывается с VEGF, или его фрагмент, причем вариабельный домен легкой цепи антитела содержит аминокислотную последовательность SEQ ID NO:44 или SEQ ID NO:45.
В другом варианте изобретение включает антитело, которое связывается с VEGF, или его фрагмент, причем антитело против VEGF имеет вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:43, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:44 или 45. Еще в одном варианте изобретения антитело против VEGF имеет вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:43, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:44. Еще в одном варианте изобретения антитело против VEGF имеет вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:43, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:45.
В некоторых вариантах изобретения любое из вышеуказанных антител представляет собой моноклональное антитело. В одном варианте изобретения антитело представляет собой фрагмент антитела, выбранный из фрагмента Fab, Fab'- SH, Fv, scFv (Fab')2. В одном варианте изобретения антитело является гуманизированным антителом. Еще в одном варианте изобретения по меньшей мере участок каркасной последовательности представляет собой человеческую консенсусную каркасную последовательность.
Также охватываются полинуклеотиды, кодирующие любое из вышеуказанных антител, а также векторы, содержащие полинуклеотиды, и клетки-хозяева, содержащие векторы по изобретению. В одном варианте изобретения клетка-хозяин представляет собой эукариотическую клетку. В другом варианте изобретения клетка-хозяин представляет собой клетку СНО. Также охватывается способ получения антитела против VEGF. Например, способ содержит культивирование клетки-хозяина в условиях, пригодных для экспрессии полинуклеотида, кодирующего антитело, и выделение антитела.
В одном аспекте охватывается способ детекции VEGF в биологическом образце, причем этот способ включает контактирование биологического образца с антителом по изобретению в условиях, допускающих связывание антитела с VEGF, и определение, действительно ли образовался комплекс между антителом и VEGF. В одном варианте изобретения способ включает детекцию комплекса VEGF-антитело против VEGF в биологическом образце, причем аминокислотная последовательность антитела против VEGF содержит вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:43, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:44 или 45. Еще в одном варианте изобретения способ включает детекцию комплекса VEGF - антитело против VEGF в биологическом образце, причем аминокислотная последовательность антитела против VEGF содержит вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:43, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:44. Еще в одном варианте изобретения способ включает детекцию комплекса VEGF-антитело против VEGF в биологическом образце, причем аминокислотная последовательность антитела против VEGF содержит вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:43, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:45. Еще в одном варианте изобретения антитело против VEGF имеет детектируемую метку.
Также охватываются фармацевтические композиции и способы лечения. Один аспект изобретения включает фармацевтическую композицию, содержащую антитело по изобретению и фармацевтически приемлемый носитель. Другой аспект изобретения включает способ лечения рака, например, этот способ заключается во введении индивидууму фармацевтической композиции, содержащей любое из вышеописанных антител. Раковые заболевания, которые можно лечить способами по изобретению, включают, но без ограничения, плоскоклеточный рак, мелкоклеточный рак легкого, немелкоклеточный рак легких, аденокарциному легких, плоскоклеточную карциному легких, рак брюшины, почечноклеточный рак, рак желудка, рак желудочно-кишечного тракта (ЖКТ), стромальные опухоли желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, колоректальный рак, карциному эндометрия или матки, рак почки, рак предстательной железы, рак вульвы, рак щитовидной железы, гепатокарциному и различные типы рака головы и шеи, меланому, поверхностную меланому, меланому типа злокачественного лентиго, акральные лентигинозные меланомы, нодулярные (узловые) меланомы, В-клеточную лимфому, хронический лимфоцитарный лейкоз (CLL); острый лимфобластный лейкоз (ALL); волосистоклеточный лейкоз; хронический миелобластный лейкоз; посттрансплантационное лимфопролиферативное расстройство (PTLD); аномальную васкулярную пролиферацию, обусловленную факоматозами, отек, связанный с опухолями мозга, или синдром Мейгса. В некоторых вариантах изобретения подлежащие лечению опухоль, рак или клеточное пролиферативное расстройство представляют собой рак толстой кишки, рак легкого, рак молочной железы или глиобластому. Еще в одном варианте изобретения подлежащим лечению субъектом является человек.
Помимо этого, изобретение включает иммуноконъюгаты, содержащие антитело, конъюгированное с агентом, таким как лекарство или цитотоксический агент.
Краткое описание Фигур
Фигура 1: Последовательности HVR петли тяжелой цепи и легкой цепи антител против VEGF. На фигурах показаны последовательности HVR тяжелой цепи, H1, H2 и Н3, и последовательности HVR легкой цепи, L1, L2 и L3. Используется следующая нумерация последовательностей: клон В20-4.1.1 (HVR-H1 имеет SEQ ID NO:1; HVR-H2 имеет SEQ ID NO:2; HVR-H3 имеет SEQ ID NO:3; HVR-L1 имеет SEQ ID NO:4; HVR-L2 имеет SEQ ID NO:6; HVR-L3 имеет SEQ ID NO:7); и клон В20- 4.1.1RR (HVR-H1 имеет SEQ ID NO:1; HVR-H2 имеет SEQ ID NO:2; HVR-H3 имеет SEQ ID NO:3; HVR-L1 имеет SEQ ID NO:5; HVR-L2 имеет SEQ ID NO:6; HVR-L3 имеет SEQ ID NO:7).
Нумерация положений аминокислот дается в соответствии с системой нумерации Kabat, как описано ниже.
Фигуры 2А и 2В: изображают типичные человеческие консенсусные каркасные последовательности акцептора для практического применения настоящего изобретения с идентификационными номерами последовательностей:
Консенсусные каркасные последовательности вариабельной области тяжелой цепи (VH)
человеческая консенсусная каркасная последовательность VH подгруппы I минус Kabat CDRs (SEQ ID NO:8),
человеческая консенсусная каркасная последовательность VH подгруппы I минус удлиненные гипервариабельные области (SEQ ID NO:9-11),
человеческая консенсусная каркасная последовательность VH подгруппы II минус Kabat CDRs (SEQ ID NO:12),
человеческая консенсусная каркасная последовательность VH подгруппы II минус удлиненные гипервариабельные области (SEQ ID NO:13-15),
человеческая консенсусная каркасная последовательность VH подгруппы III минус Kabat CDRs (SEQ ID NO:16),
человеческая консенсусная каркасная последовательность VH подгруппы III минус удлиненные гипервариабельные области (SEQ ID NO:17-19),
человеческая каркасная последовательность VH акцептора минус Kabat CDRs (SEQ ID NO:20),
человеческая каркасная последовательность VH акцептора минус удлиненные гипервариабельные области (SEQ ID NO:21-22),
человеческая 2 каркасная последовательность VH акцептора минус Kabat CDRs (SEQ ID NO:23),
человеческая 2 каркасная последовательность VH акцептора минус удлиненные гипервариабельные области (SEQ ID NO:24-26).
Нумерация положений аминокислот дается в соответствии с системой нумерации Kabat, как описано ниже.
Фигура 3: изображает типичные человеческие консенсусные каркасные последовательности акцептора для практического применения настоящего изобретения с идентификационными номерами последовательностей:
Консенсусные каркасные последовательности вариабельной области легкой цепи (VH)
человеческая консенсусная каркасная последовательность VL каппа подгруппы I (SEQ ID NO:27),
человеческая консенсусная каркасная последовательность VL каппа подгруппы II (SEQ ID NO:28),
человеческая консенсусная каркасная последовательность VL каппа подгруппы III (SEQ ID NO:27),
человеческая консенсусная каркасная последовательность VL каппа подгруппы IV (SEQ ID NO:27).
Фигура 4: изображает последовательности каркасной области тяжелой и легкой цепей huMAb4D5-8. Цифры в верхнем индексе/жирным шрифтом показывают положения аминокислот по Kabat.
Фигура 5: изображает модифицированные/вариантные последовательности каркасной области тяжелой и легкой цепей huMAb4D5-8. Цифры в верхнем индексе/жирным шрифтом показывают положения аминокислот по Kabat.
Фигура 6: Аминокислотные последовательности участков L1, L2 и L3 HVR легкой цепи для антител против VEGF B20-4.1.1 и B20-4.1.1RR.
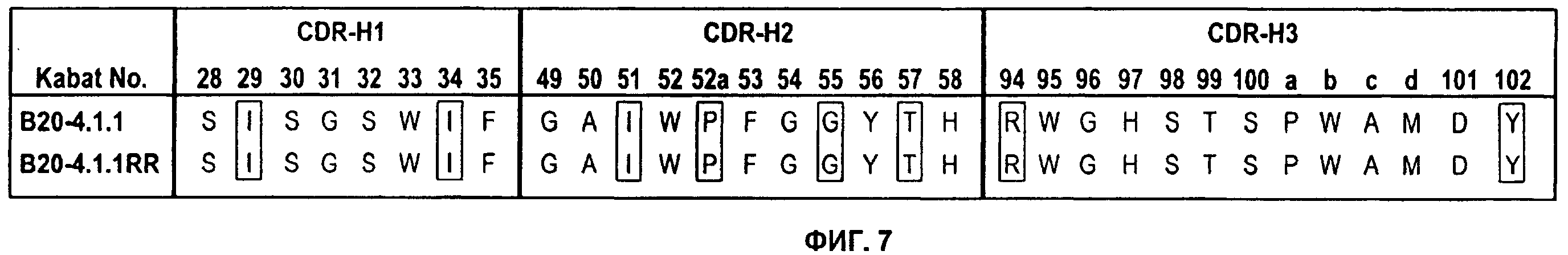
Фигура 7: Аминокислотные последовательности участков H1, H2 и Н3 HVR для антител против VEGF B20-4.1.1 и В20-4.1.1RR.
Фигура 8: изображает вариабельные области легкой цепи клонов антитела B20-4.1.1 (SEQ ID NO:44) и B20-4.1.1RR (SEQ ID NO:45).
Фигура 9: изображает вариабельные области тяжелой цепи клонов антитела B20-4.1.1 и B20-4.1.1 RR (SEQ ID NO:43).
Фигура 10: В таблице приводятся результаты кинетических измерений аффинности связывания В20 вариантов IgG с человеческим VEGF и мышиным VEGF. Человеческий или мышиный VEGF иммобилизуют до достижения примерно 60 относительных единиц.
Фигура 11: В таблице приводятся результаты кинетических измерений аффинности связывания В20 вариантов IgG с человеческим VEGF и мышиным VEGF. Человеческий или мышиный VEGF иммобилизуют до достижения примерно 1000 относительных единиц.
Фигура 12: Анализ включения тимидина на эндотелиальных клетках пупочной вены человека (HUVEC) показывает, что В20 варианты могут эффективно ингибировать пролиферацию клеток HUVEC.
Фигура 13: показывает воздействие B20-4.1.1 на индуцированную VEGF BRME пролиферацию.
Фигура 14: показывает воздействие B20-4.1.1 на рост опухоли у "голых" мышей с введенными в качестве ксенотрансплантата человеческими опухолевыми клетками (клетки А549), по измерению объема опухоли в течение периода лечения.
Фигура 15: показывает воздействие B20-4.1.1 на рост опухоли у "голых" мышей с введенными в качестве ксенотрансплантата человеческими опухолевыми клетками (клетки MDA-MB231), по измерению объема опухоли в течение периода лечения.
Фигура 16: показывает воздействие антитела авастина на индуцированную VEGF BRME пролиферацию. Ингибирования mVEGF не наблюдается при концентрации антитела авастина вплоть до 1500 нМ.
Подробное описание изобретения
Изобретение по данному описанию включает выделенные антитела, которые связываются с VEGF, и их применение. Изобретение также включает фармацевтические композиции, а также способы лечения.
Помимо этого, изобретение включает способы получения антител против VEGF и полинуклеотидов, кодирующих антитела против VEGF.
Общие методы
Методы и процедуры, представленные или цитируемые в данном описании, в целом понятны и применяются обычно специалистами в данной области техники с использованием традиционной методологии, например с использованием основной методологии, описанной в Sambrook et al., Molecular Cloning: A Laboratory Manual 3rd. edition (2001) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. Current Protocols in Molecular Biology (F. M. Ausubel, et al. eds., (2003)); серия Methods in Enzymology (Academic Press, Inc.): PCR 2: A Practical Approach (M. J. MacPherson, B. D. Hames and G. R. Taylor eds. (1995)), Harlow and Lane, eds. (1988) Antibodies, A Laboratory manual, and Animal cell culture (R. I. Freshney, ed. (1987)); Oligonucleotide Synthesis (M. J. Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J. E. Cellis, ed., 1998) Academic Press; Animal Cell Culture (R. I. Freshney), ed., 1987); Introduction to Cell and Tissue Culture (J. P. Mather and P. E. Roberts, 1998) Plenum Press; Cell and Tissue Culture: Laboratory Procedures (A. Doyle, J. B. Griffiths, and D. G. Newell, eds., 1993-8) J. Wiley and Sons; Handbook of Experimental Immunology (D. M. Weir and C. C. Blackwell, eds.); Gene Transfer Vectors for Mammalian Cells (J. M. Miller and M. P. Calos, eds., 1987); PCR: The Polymerase Chain Reaction, (Mullis et al., eds., 1994); Current Protocols in Immunology (J. E. Coligan et al., eds., 1991); Short Protocols in Molecular Biology (Wiley and Sons, 1999); Immunobiology (C. A. Janeway and P. Travers, 1997); Antibodies (P. Finch, 1997); Antibodies: A Practical Approach (D. Catty., ed., IRL Press, 1988-1989); Monoclonal Antibodies: A Practical Approach (P. Shepherd and C. Dean, eds., Oxford University Press, 2000); Using Antibodies: A Laboratory Manual (E. Harlow and D. Lane (Cold Spring Harbor Laboratory Press, 1999)); The Antibodies (M, Zanetti and J. D. Capra, eds., Harwood Academic Publishers, 1995); и Cancer: Principles and Practice of Oncology (V. T. DeVita et al., eds., J.B. Lippincott Company, 1993).
Определения
С целью интерпретации данного описания ниже приводятся определения и всякий раз, когда это уместно, термины, применяемые в единственном числе, включают множественное число и наоборот. В том случае, когда любое определение, представленное ниже, вступает в конфликт с любым документом, вводимым в данное описание в качестве ссылки, представленное ниже определение является господствующим.
Термин "антитело" применяется в широком смысле и конкретно охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела, полиспецифические антитела (например, биспецифические антитела) и фрагменты антител при условии, что они проявляют нужную биологическую активность,
Термин "моноклональное антитело" по данному описанию относится к антителу, полученному из популяции практически гомогенных антител, т.е. отдельные антитела, составляющие популяцию, являются идентичными за исключением возможных мутаций, например природных мутаций, которые могут присутствовать в минорных количествах. Таким образом, определение "моноклональное" указывает на характер антитела, не являющегося смесью отдельных антител. В некоторых вариантах изобретения такое моноклональное антитело обычно включает антитело, содержащее полипептидную последовательность, которая связывает мишень, причем связывающая мишень полипептидная последовательность получена способом, который включает отбор единственной связывающей мишень полипептидной последовательности из множества полипептидных последовательностей. Например, процесс отбора может представлять собой отбор уникального клона из множества клонов, такого как пул клонов гибридомных клеток, клонов фагов или клонов рекомбинантной ДНК. Следует понимать, что выбранную связывающую мишень последовательность можно дополнительно изменять, например, для повышения аффинности к мишени, для гуманизации последовательности, связывающей мишень, для повышения ее продуцирования в клеточной культуре, для снижения ее иммуногенности in vivo, для создания полиспецифического антитела и т.п. и что антитело, содержащее измененную последовательность, связывающую мишень, также является моноклональным антителом по данному изобретению. В отличие от препаратов поликлонального антитела, которые обычно включают различные антитела, специфические к различным детерминантам (эпитопам), каждое моноклональное антитело препарата моноклонального антитела специфично к единственной детерминанте на антигене. Помимо специфичности, препараты моноклинального антитела имеют то преимущество, что они обычно не имеют примесей других иммуноглобулинов.
Определение "моноклональный" указывает на свойство антитела, как полученного из практически гомогенной популяции антител, а не на то, что антитело должно быть получено каким-либо конкретным способом. Например, моноклональные антитела для применения в соответствии с настоящим изобретением можно получать различными методами, включая, например, метод гибридом (например, Kohler and Milstein, Nature, 256: 495-97 (1975); Hongo et al., Hybridoma, 14 (З): 253-260 (1995), Harlow et al., Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling et al., в: Monoclonal Antibodies and T-Cell Hybridomas 563-681 (Elsevier, N.Y., 1981)), методы рекомбинантной ДНК (см., например, патент США No. 4816567), методы фагового дисплея (см., например, Clackson el al., Nature, 352: 624-628 (1991); Marks et al., J. Mol. Biol. 222: 581-597 (1992); Sidhu et al., J. Mol. Biol. 338(2): 299- 310 (2004); Lee et al., J. Mol. Biol. 340(5): 1073-1093 (2004); Fellouse, Proc, Natl. Acad. Sci. USA 101(34): 12467-12472 (2004); и Lee et al., J. Immunol. Methods 284(1-2): 119-132 (2004), и методы получения человеческих или подобных человеческим антител в организме животных, которые содержат часть или все локусы человеческого иммуноглобулина или гены, кодирующие последовательности иммуноглобулина человека (см., например, Международные патентные заявки WO 1998/24893; WO 1996/34096; WO 1996/33735; WO 1991/10741; Jakobovits et al., Proc. Natl. Acad. Sci. USA 90: 2551 (1993); Jakobovits et al. Nature 362: 255-258 (1993); Bruggemann et al., Year in Immunol. 7: 33 (1993); патенты США No. 5545807; 5545806; 5569825; 5625126; 5633425; и 5661016; Marks et al., Bio/Technology 10: 779-783 (1992); Lonberg et al., Nature 368: 856-859 (1994); Morrison, Nature 368: 812-813 (1994); Fishwild et al. Nature Biotechnol 14: 845-851 (1996); Neuberger, Na.ture Biotechnol 14: 826 (1996); и Lonberg and Huszar, Intern. Rev. Immunol. 13: 65-93 (1995).
Моноклональные антитела по данному описанию конкретно включают "химерные" антитела, в которых участок тяжелой и/или легкой цепи идентичен или гомологичен соответствующим последовательностям антител, полученных от конкретного вида или относящихся к конкретному классу или подклассу антител, тогда как остаток цепи (цепей) идентичен или гомологичен соответствующим последовательностям антител, полученных от другого вида или относящихся к другому классу или подклассу антител, а также фрагменты таких антител при условии, что они проявляют заданную биологическую активность (см., например, патент США No. 4816567; и Morrison et al., Proc. Natl. Acad. Sci. USA 81: 6851-6855 (1984)). Химерные антитела включают приматизированные (Primatized®) антитела, в которых антигенсвязывающая область антитела образована из антитела, полученного, например, иммунизацией макаков представляющим интерес антигеном.
"Гуманизированными" формами антител нечеловеческого происхождения (например, мышиных антител) являются химерные антитела, которые содержат минимальную последовательность, образованную из нечеловеческого иммуноглобулина. В одном варианте изобретения гуманизированное антитело является человеческим иммуноглобулином (антитело реципиента), в котором остатки HVR реципиента заменены на остатки HVR вида, отличного от человека (антитело донора), такого как мышь, крыса, кролик или нечеловеческий примат, обладающим заданной специфичностью, аффинностью и/или способностью. В некоторых примерах остатки FR человеческого иммуноглобулина заменены на соответствующие остатки иммуноглобулина нечеловеческого происхождения. Помимо этого, гуманизированные антитела могут содержать остатки, отсутствующие в антителе реципиента или в антителе донора. Эти модификации можно осуществить для дальнейшего уточнения характеристик антитела. Как правило, гуманизированное антитело содержит практически все или по меньшей мере один, обычно два, вариабельных домена, в которых все или практически все гипервариабельные петли соответствуют гипервариабельным петлям иммуноглобулина нечеловеческого происхождения, а все или практически все FR представляют собой FR последовательности человеческого иммуноглобулина. Гуманизированное антитело, необязательно, также содержит по меньшей мере участок константной области иммуноглобулина (Fc), как правило, человеческого иммуноглобулина. Более подробно это описано, например, в Jones et al., Nature 321: 522-525 (1986); Riechmann et al., Nature 332: 323-329 (1988); и Presta, Curr. Op. Struct. Biol. 1: 593-596 (1992). См. также, например, Vaswani and Hamilton, Ann, Allergy, Asthma & Immunol. 1: 105-115 (1998); Harris, Biochem. Soc. Transactions 23: 1035-1038 (1995); Hurle and Gross, Curr. Op. Biotech. 5: 428-433 (1994); и патенты США No. 6982321 и 7087409.
"Человеческое антитело" представляет собой антитело, имеющее аминокислотную последовательность, которая соответствует последовательности антитела, продуцируемого (вырабатываемого) человеком, и/или получено любым из методов получения человеческих антител, раскрываемых в данном описании. Это определение человеческого антитела определенно исключает гуманизированное антитело, содержащее антигенсвязывающие остатки антитела нечеловеческого происхождения. Человеческие антитела можно продуцировать различными методами, известными в уровне техники, включая фаг-дисплейные библиотеки. Hoogenboom and Winter, J. Mol. Biol., 227: 381 (1991); Marks et al., J. Mol, Biol., 222: 581 (1991). Доступными методами получения человеческих моноклональных антител являются методы, описанные в Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p.77 (1985); Boerner et al., J, Immunol, 147(1): 86-95 (1991). См. также van Dijk and van de Winkel, Curr. Opin. Pharmacol, 5: 368-74 (2001). Человеческие антитела можно получать, вводя антиген трансгенному животному, которое модифицировано таким образом, чтобы продуцировать такие антитела в ответ на заражение антигеном, но эндогенные локусы которого заблокированы, например, иммунизированные XenoMice (см., например, патенты США No. 6075181 и 6150584, относящиеся к технологии XenoMouse™). См. также, например, Li et al., Proc. Natl. Acad. Sci. USA, 103: 3557-3562 (2006) о человеческих антителах, получаемых по методу гибридом на основе человеческих В-клеток.
"Зависимое от вида антитело" представляет собой антитело, обладающее повышенной аффинностью связывания с антигеном из млекопитающего первого вида, чем к гомологу этого антигена из млекопитающего второго вида. Обычно зависящее от вида ("видозависимое") антитело "специфически связывается" с человеческим антигеном (т.е. имеет величину аффинности связывания (Kd) не выше чем примерно 1×10-7 М, предпочтительно, не выше чем примерно 1×10-8 М и, наиболее предпочтительно, не выше чем примерно 1×10-9 М), но проявляет аффинность связывания с гомологом антигена из второго, отличного от человека, вида млекопитающего по меньшей мере примерно в 50 раз, или по меньшей мере примерно в 500 раз, или по меньшей мере примерно в 1000 раз слабее, чем его аффинность связывания с человеческим антигеном. "Видозависимое" антитело может относиться к любому из различных типов антител по определению выше, но, предпочтительно, является гуманизированным или человеческим антителом.
Выражения "мутант антитела" ("мутантное антитело") или "вариант антитела" по данному описанию относятся к варианту аминокислотной последовательности "видозависимого" антитела, в котором один или более аминокислотных остатков видозависимого антитела модифицированы. Последовательность таких мутантов обязательно имеет менее чем 100%-ную идентичность или сходство с видозависимым антителом. В одном варианте изобретения мутант антитела имеет аминокислотную последовательность, имеющую по меньшей мере 75%-ную идентичность или сходство с аминокислотной последовательностью вариабельного домена либо тяжелой, либо легкой цепи видозависимого антитела, в другом варианте по меньшей мере 80%, в другом варианте по меньшей мере 85%, в другом варианте по меньшей мере 90% и еще в одном варианте по меньшей мере 80%. Идентичность или сходство по отношению к последовательности определяется в данном описании как процентное содержание аминокислотных остатков в предполагаемой ("кандидатной") последовательности, которые идентичны (т.е. одинаковы) или сходны (т.е. аминокислотный остаток из той же группы в соответствии с обычными свойствами боковой цепи, см. ниже) с остатками "видозависимого" антитела, после выравнивания последовательностей и введения гэпов, если необходимо для достижения максимальной идентичности последовательностей, выраженной в процентах. Никакие N-концевые, C-концевые или внутренние удлинения, деления или инсерции в последовательности антитела вне вариабельного домена не должны быть созданы таким образом, чтобы влиять на идентичность или сходство последовательностей.
"Выделенное" антитело представляет собой антитело, которое идентифицировано и отделено и/или выделено от и/или из составляющих его естественного окружения. Загрязняющие компоненты (примеси) из его естественного окружения представляют собой материалы, которые могут помешать применению антитела для исследовательских, диагностических или терапевтических целей и могут включать ферменты, гормоны и другие белковые и небелковые растворенные вещества. В некоторых вариантах изобретения антитело очищено (1) до содержания антитела более чем 95% вес. по определению, например, методом Лоури, а в некоторых вариантах изобретения более чем 99% вес.; (2) до степени, достаточной для того, чтобы получить по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности, используя, например, секвенатор с вращающейся чашкой, или (3) до гомогенности методом SDS-PAGE в восстанавливающих или невосстанавливающих условиях, например, окрашивая Кумасси голубым или серебром. Выделенные антитела включают антитело in situ в рекомбинантных клетках, если отсутствует по меньшей мере один компонент из естественного окружения (среды). Обычно, однако, выделенное антитело получают, используя по меньшей мере одну стадию очистки.
"Нативные антитела" обычно представляют собой гетеротетрамерные гликопротеины с молекулярной массой около 150000 дальтон, состоящие из двух идентичных легких (L) цепей и двух идентичных тяжелых (Н) цепей. Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, хотя число дисульфидных связей в тяжелых цепях различных подтипов иммуноглобулинов варьируется. Каждая тяжелая и легкая цепь также содержит расположенные через регулярные промежутки внутрицепные дисульфидные мостики. Каждая тяжелая цепь имеет вариабельный домен на одном конце (VQ и константный домен на другом своем конце; константный домен легкой цепи выравнивается с первым константным доменом тяжелой цепи, а вариабельный домен легкой цепи выравнивается с вариабельным доменом тяжелой цепи. Полагают, что конкретные аминокислотные остатки образуют интерфейс (границу раздела) между вариабельными доменами легкой цепи и тяжелой цепи.
Выражение "вариабельная область" или "вариабельный домен" антитела относится к аминоконцевым доменам тяжелой или легкой цепи антитела. Вариабельный домен тяжелой цепи может обозначаться "VH", вариабельный домен легкой цепи может обозначаться "VL". Как правило, эти домены являются наиболее вариабельными (изменчивыми) участками антитела и содержат антигенсвязывающие сайты (сайты связывания антигена).
Термин "вариабельный" относится к тому факту, что некоторые участки вариабельных доменов сильно различаются в последовательностях различных антител и используются для связывания каждого конкретного антитела с его специфическим антигеном и специфичности каждого конкретного антитела к его специфическому антигену. Однако в вариабельных доменах антител вариабельность распределяется неравномерно. Она концентрируется в трех сегментах, называемых гипервариабельными областями (HVR), в вариабельных доменах как легкой, так и тяжелой цепи. Более высококонсервативные участки вариабельных доменов называются каркасными областями (FR). Каждый из вариабельных доменов нативной тяжелой и легкой цепей содержит четыре области FR, преимущественно имеющие конфигурацию бета-складок, связанных тремя HVR, которые образуют петли, связывающие бета-складчатые структуры, а в некоторых случаях образующие их часть. HVR в каждой цепи удерживаются вместе в тесной близости с помощью FR областей и, с HVR из другой цепи, содействуют образованию антигенсвязывающего сайта антител (см. Kabat et al. Sequences of Proteins of Immunological Interest, Fifth Edition, National Institute of Health, Bethesda, MD (1991)). Константные домены не участвуют непосредственно в связывании антитела с антигеном, но обнаруживают различные эффекторные функции, такие как участие антитела в антителозависимой клеточной токсичности.
"Легкие цепи" антител (иммуноглобулинов) позвоночных любого вида можно отнести к одному из двух четко различающихся типов, называемых каппа (κ) и лямбда (λ), в зависимости от аминокислотных последовательностей их константных доменов.
В зависимости от аминокислотных последовательностей константных доменов их тяжелых цепей антитела (иммуноглобулины) можно отнести к различным классам. Имеется пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них можно далее разделить на подклассы (изотипы), например IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелых цепей, которые соответствуют различным классам иммуноглобулинов, называются α, β, ε, γ и µ соответственно. Субъединичные структуры и трехмерные конфигурации различных классов иммуноглобулинов общеизвестны в уровне техники в целом, описаны, например, в Abbas et al., Cellular and Mol, Immunology, 4th ed. (W.B. Saunders, Co., 2000). Антитело может являться частью большей по размеру слитой молекулы, образованной ассоциацией антитела за счет ковалентной или нековалентной связи с одним или более других белков или пептидов.
Термины "полноразмерное антитело (антитело полной длины)", "интактное антитело" и "целое антитело" применяются в данном описании взаимозаменяемо по отношению к антителу в его практически интактной форме, не к фрагментам по определению ниже. Термины, в частности, относятся к антителу с тяжелыми цепями, которые содержат Fc область.
"Голое антитело" в настоящем изобретении обозначает антитело, которое не конъюгировано с цитотоксическим фрагментом или радиоактивной меткой.
"Фрагменты антитела" содержат участок интактного антитела, предпочтительно, включающий его антигенсвязывающую область. Примеры фрагментов антитела включают фрагменты Fab, Fab', F(ab')2 и Fv; диатела; линейные антитела; молекулы одноцепочечных антител; и полиспецифические (мультиспецифические) антитела, образованные из фрагментов антител.
Расщепление антител папаином дает два идентичных антигенсвязывающих фрагмента, называемых "Fab" фрагментами, каждый с единственным антигенсвязывающим сайтом, и оставшийся "Fc" фрагмент, название которого отражает его способность легко кристаллизоваться. Обработка пепсином дает фрагмент F(ab')2, который имеет два антигенсвязывающих сайта и еще способен перекрестно связываться с антигеном.
Фрагмент "Fv" обозначает наименьший фрагмент, который содержит полный антигенсвязывающий сайт. В одном варианте изобретения двухцепочечный Fv вид состоит из димера одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи, тесно связанных нековалентной связью. У вида с одноцепочечным Fv (scFv) один вариабельный домен тяжелой и легкой цепи может быть ковалентно связан с гибким пептидным линкером таким образом, что легкая и тяжелая цепи могут ассоциироваться в "димерную" структуру, аналогичную структуре двухцепочечного Fv вида. Именно в этой конфигурации три HVR каждого вариабельного домена взаимодействуют, определяя антигенсвязывающий сайт на поверхности димера VH-VL. Все вместе шесть областей HVR сообщают антителу антигенсвязывающую специфичность. Однако даже единственный вариабельный домен (или половина фрагмента Fv, содержащая только три области HVR, специфических к антигену) обладает способностью узнавать и связывать антиген, хотя с более низкой аффинностью, чем целый сайт связывания.
Фрагмент Fab содержит вариабельные домены тяжелой и легкой цепи, а также содержит константный домен легкой цепи и первый константный домен (СН1) тяжелой цепи. Фрагменты Fab' отличаются от фрагментов Fab добавлением нескольких остатков на карбокси-конце домена СН1 тяжелой цепи, включающих один или более цистеиновых остатков из шарнирной области антитела. Fab'- SH в данном описании обозначает фрагмент Fab', в котором цистеиновый(-е) остаток (остатки) константных доменов несет свободную тиольную группу. Фрагменты антитела F(ab')2 первоначально продуцируются как пары фрагментов Fab' с цистеиновыми остатками из шарнирной области между ними. Также известны другие химические связывающие группы.
"Одноцепочечные Fv" или "scFv" фрагменты антитела содержат VH и VL домены антитела, причем эти домены присутствуют в единственной полипептидной цепи. Обычно scFv полипептид дополнительно содержит полипептидный линкер между доменами VН и VL, который содействует образованию scFv структуры, требующейся для связывания антигена. Обзор по scFv, см., например, Pluckthun, в The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., (Springer- Verlag, New York, 1994), pp.269-315.
Термин "диатела" относится к фрагментам антител с двумя антигенсвязывающими сайтами, причем эти фрагменты содержат вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) в той же самой полипептидной цепи (VH-VL). Ввиду использования линкера, который слишком короток, чтобы два домена одной цепи могли соединиться друг с другом, домены вынуждены взаимодействовать с комплементарными доменами другой цепи и создают два антигенсвязывающих сайта. Диатела могут быть бивалентными или биспецифическими. Более подробно диатела описаны, например, в Европейской патентной заявке ЕР 404097; Международной патентной заявке WO 1993/01161; Hudson el al, Nat. Med. 9: 129-134 (2003); и Hollinger et al., Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993). Триатела (triabodies) и тетратела (tetrabodies) описаны также в Hudson et al., Nat. Med. 9: 129-134 (2003).
Термин "гипервариабельная область", "HVR" или "HV" по данному описанию относится к областям вариабельного домена антитела, являющимся гипервариабельными в последовательности и/или образующим структурно оформленные петли. Обычно антитела содержат шесть HVR; три в VH (H1, Н2, Н3) и три в VL (L1, L2, L3). В нативных антителах Н3 и L3 проявляют наибольшее разнообразие из шести HVR, и полагают, что в особенности Н3 играет уникальную роль, придавая тонкую специфичность антителам. См., например, Xu et al., Immunity 13: 37-45 (2000); Johnson and Wu, in Methods in Molecular Biology 248: 1-25 (Lo, ed., Human Press, Totowa, NJ, 2003). Действительно, природные антитела верблюдовых, состоящие только из тяжелой цепи, являются функциональными и устойчивыми в отсутствие легкой цепи. См., например, Hamers-Casterman el al. Nature 363: 446-448 (1993); Sheriff et al., Nature Struct. Biol. 3: 733-736(1996).
Ряд делинеаций (оконтуривание, очерчивание границ) HVR используется и охватывается в данном описании. Области, определяющие комплементарность, по Kabat (CDR) основаны на вариабельности последовательностей и являются общеупотребительными (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Напротив, Chothia обращает внимание на локализацию структурных петель (Chothia and Lesk, J. Mol Biol 196: 901-917 (1987)). AbM HVR представляют компромисс между HVR Kabat и структурными петлями Chothia и используются Оксфордской программой молекулярного моделирования AbM антител (Oxford Molecular's antibody AbM modeling software). "Контактные" HVR основаны на анализе имеющихся сложных кристаллических структур. Остатки из каждого из этих HVR отмечены ниже.
Области HVR могут включать "удлиненные HVR", например: 24-36 или 24-34 (L1), 46-56 или 50-56 (L2) и 89-97 или 89-96 (L3) в VL и 26-35 (H1), 50-65 или 49-65 (Н2) и 93-102, 94-102 или 95-102 (Н3) в VH. Остатки в вариабельных доменах нумеруются по Kabat et al., supra, для каждого из этих определений.
"Каркасные" или "FR" остатки представляют собой остатки вариабельных доменов, отличные от определяемых в данном описании остатков HVR.
Выражения "нумерация остатков вариабельного домена (дается) по Кабату (Kabat)" или "нумерация положений аминокислот (дается) по Kabat", и их варианты относятся к системе нумерации, используемой для вариабельных доменов тяжелой цепи или вариабельных доменов легкой цепи при составлении антител в Kabat et al., supra. При этой системе нумерации действительная линейная аминокислотная последовательность может содержать меньшее или дополнительное число аминокислот, соответствующее укорочению или инсерции в FR или HVR вариабельного домена. Например, вариабельный домен тяжелой цепи может включать инсерцию (вставку) единственной аминокислоты (остаток 52а по Kabat) после остатка 52 участка Н2 и инсерции остатков (например, 82а, 82b и 82с, и т.д. по Kabat) после остатка 82 FR. Нумерацию остатков по Kabat можно определить для данного антитела выравниванием в областях гомологии последовательности антитела с последовательностью со "стандартной" нумерацией Kabat.
Система нумерации Kabat обычно применяется по отношению к остатку в вариабельном домене (примерно, остатки 1-107 легкой цепи и остатки 1-113 тяжелой цепи) (например, Kabat el al., Sequences of Immunological Interest. 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). "Система нумерации EU" или "EU индекс" обычно применяется по отношению к остатку в константной области тяжелой цепи иммуноглобулина (например, EU индекс, сообщаемый в Kabat et al., supra). "EU индекс по Kabat" относится к нумерации остатков человеческого IgG1 EU антитела. Если в данном описании не указано иначе, ссылки на номера остатков в вариабельном домене антител означают нумерацию остатков по системе нумерации Kabat. Если в данном описании не указано иначе, ссылки на номера остатков в константном домене антител означают нумерацию остатков по системе нумерации EU (о EU нумерации см., например, предварительную патентную заявку США No. 60/640323, Фигуры).
Антитело с "созревшей (повышенной) аффинностью" представляет собой антитело с одним или более изменений в одной или более областей HVR, которые приводят к повышению аффинности антитела к антигену по сравнению с исходным ("родительским") антителом, которое не содержит этого (этих) изменения(-ий). В одном варианте изобретения антитело с "созревшей" аффинностью проявляет аффинность к антигену-мишени, выражаемую в наномолях или даже пикомолях. Антитело с "созревшей" аффинностью можно получать известными в уровне техники методами. Например, Marks el al., Bio/Technology 10: 779-783 (1992) описывает созревание аффинности с помощью шаффлинга ДНК доменов VH и VL. Случайный мутагенез HVR и/или каркасных остатков описан, например, Barbas et al., Proc Nat. Acad. Sci. USA 91: 3809-3813 (1994); Schier et al., Gene 169: 147-155 (1995); Yelton et al., J. Immunol. 155: 1994-2004 (1995); Jackson et al., J. Immunol. 154(7): 3310-9 (1995); и Hawkins et al., J. Mol. Biol. 226: 889-896 (1992).
"Блокирующее" антитело или антитело - "антагонист" представляет собой антитело, которое ингибирует или снижает биологическую активность антигена, который оно связывает. Некоторые блокирующие антитела или антитела-антагонисты в значительной степени или полностью ингибируют биологическую активность антигена.
"Антитело-агонист" по данному описанию представляет собой антитело, которое частично или полностью имитирует по меньшей мере одну из функциональных активностей представляющего интерес полипептида.
Антитела, "ингибирующие рост", представляют собой антитела, которые предупреждают или снижают пролиферацию клетки, экспрессирующей антиген, с которым связывается антитело.
"Эффекторные функции" антитела относятся к биологической активности, обусловленной областью Fc (областью Fc нативной последовательности или областью Fc варианта аминокислотной последовательности) антитела и меняются с изменением изотипа. Примеры эффекторных функций антитела включают: связывание белка C1q и комплемент-зависимую цитотоксичность (CDC); связывание Fc-рецептора; антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC); фагоцитоз; даун-регуляцию рецепторов клеточной поверхности (например, В-клеточного рецептора) и В-клеточную активацию.
Термин "Fc область" по данному описанию применяется для определения C-концевой области тяжелой цепи иммуноглобулина, включая Fc области нативной последовательности и Fc области вариантов (варианты Fc области). Хотя границы Fc области тяжелой цепи иммуноглобулина могут меняться, Fc область тяжелой цепи человеческого IgG обычно определяют как область от аминокислотного остатка в положении Cys226 или от Pro230 до его карбокси-конца. С-концевой остаток лизина (остаток 447 по EU системе нумерации) Fc области может быть удален, например, в процессе продуцирования или очистки антитела, или методом рекомбинантной ДНК можно создать нуклеиновую кислоту, кодирующую тяжелую цепь антитела. Соответственно, композиция интактных антител может содержать популяции антител, у которых удалены все остатки K447, популяции антител, у которых не удален ни один остаток K447, и популяции антител, содержащих смесь антител, содержащих и не содержащих остаток K447.
"Функциональная Fc область" обладает "эффекторной функцией" Fc области нативной последовательности. Типичные "эффекторные функции" включают связывание белка C1q; CDC; связывание Fc-рецептора; ADCC; фагоцитоз; даун-регуляцию рецепторов клеточной поверхности (например, В-клеточного рецептора, BCR) и т.д. Такие эффекторные функции обычно требуют, чтобы Fc область была связана со связывающим доменом (например, вариабельным доменом антитела), и могут оцениваться различными методами анализа, раскрываемыми, например, в определениях по данному описанию.
"Fc область нативной последовательности" содержит аминокислотную последовательность, идентичную аминокислотной последовательности природного Fc. Fc области нативной последовательности включают Fc область нативной последовательности человеческого IgG1 (не-А и А аллотипы); Fc область нативной последовательности человеческого IgG2; Fc область нативной последовательности человеческого IgG3; и Fc область нативной последовательности человеческого IgG4, а также их естественные (природные) варианты.
"Вариант Fc области" содержит аминокислотную последовательность, которая отличается от аминокислотной последовательности Fc области нативной последовательности по меньшей мере одной модификацией, предпочтительно одной или более аминокислотной заменой (заменами). Предпочтительно вариант Fc области (Fc область варианта) содержит по меньшей мере одну аминокислотную замену по сравнению с нативной последовательностью Fc области или с Fc областью исходного полипептида, например, содержит примерно от одной примерно до десяти аминокислотных замен и, предпочтительно, содержит примерно от одной примерно до пяти аминокислотных замен в нативной последовательности Fc области или в Fc области исходного полипептида. Вариант Fc области по данному описанию, предпочтительно, по меньшей мере примерно на 80% гомологичен Fc области нативной последовательности и/или Fc области исходного полипептида и, наиболее предпочтительно, гомологичен им по меньшей мере примерно на 90%, более предпочтительно, гомологичен им по меньшей мере примерно на 95%.
"Fc рецептор" или "FcR" описывает рецептор, который связывается с Fc областью антитела. В некоторых вариантах изобретения FcR представляет собой нативный человеческий FcR. В некоторых вариантах изобретения FcR обозначает рецептор, который связывает IgG антитело (гамма-рецептор) и включает рецепторы подклассов FcγRI, FcγRII и FcγRIII, включая аллельные варианты и альтернативно сплайсируемые формы этих рецепторов. FcγRII рецепторы включают FcγRIIA ("активирующий рецептор") и FcγRIIB ("ингибирующий рецептор"), которые имеют аналогичные аминокислотные последовательности, которые различаются главным образом своими цитоплазматическими доменами. Активирующий рецептор FcγRIIA содержит в своем цитоплазматическом домене иммунорецепторный активационный мотив на основе тирозина (ITAM). Ингибирующий рецептор FcγRIIB содержит в своем цитоплазматическом домене иммунорецепторный ингибиторный мотив на основе тирозина (ITIM). (См., например, Daeron, Annu. Rev. Immunol. 15: 203-234 (1997)). Обзор FcRs см., например, в Ravetch and Kinet, Annu. Rev. Immunol 9: 457-92 (1991); Capel et al., Immunomethods 4: 25-34 (1994); и de Haas et al., J. Lab. din. Med. 126: 330-41 (1995)). Термином "FcR" по данному описанию охватываются другие FcRs, которые должны быть идентифицированы в будущем.
Термин "Fc рецептор" или "FcR" включает также неонатальный рецептор, FcRn, который отвечает за перенос материнских антител класса IgG к плоду (Guyer et al., J. Immunol. 117: 587 (1976) и Kim et al., J. Immunol. 24: 249 (1994)) и регуляцию гомеостаза иммуноглобулинов. Известны методы количественного определения связывания с FcRn (см., например, Ghetie and Ward., Immunol. Today 18(12): 592-598 (1997); Ghetie et al., Nafure Biotechnology, 15(7): 637-640 (1997); Hinton et al., J. Biol Chem. 279(8): 6213-6216 (2004); Международная патентная заявка WO 2004/92219 (Hinton et al.).
Анализ связывания с человеческим FcRn in vivo и сывороточный период полужизни полипептидов с высокой аффинностью связывания с человеческим FcRn можно осуществить, например, на трансгенных мышах или на трансфецированных человеческих клеточных линиях, экспрессирующих человеческий FcRn, или на приматах, которым вводят полипептиды с вариантом Fc области. В Международной патентной заявке WO 2000/42072 (Presta) описаны варианты антител с повышенным или пониженным связыванием с FcRs. См. также, например. Shields et al., J. Biol. Chem. 9(2); 6591-6604 (2001).
Термин "человеческие эффекторные клетки" обозначает лейкоциты, которые экспрессируют один или более FcR и осуществляют эффекторные функции. В некоторых вариантах изобретения клетки экспрессируют по меньшей мере FcγRIII и осуществляют ADCC эффекторную(-ые) функцию(-и). Примеры человеческих лейкоцитов, которые опосредуют ADCC, включают мононуклеарные клетки периферической крови (РВМС), природные киллерные (NK) клетки, моноциты, цитотоксические Т-клетки и нейтрофилы. Эффекторные клетки можно выделять из естественного источника, например из крови.
Выражение "антителозависимая клеточно-опосредованная цитотоксичность" или "ADCC" относится к форме цитотоксичности, при которой секретированный Ig, связанный с Fc рецепторами (FcRs), присутствующими на некоторых цитотоксических клетках (например, NK клетках, нейтрофилах и макрофагах), способствует специфическому связыванию этих цитотоксических эффекторных клеток с несущей антиген клеткой-мишенью, а затем позволяет убивать эту клетку-мишень с помощью цитотоксинов. Первичные клетки для опосредования ADCC, NK клетки, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcyRI, FcγRII и FCγRIII. Данные по экспрессии FcR на гемопоэтических клетках приводятся в Таблице 3 на стр.464 статьи Ravetch and Kinet, Annu. Rev. Immunol 9: 457-92 (1991). Для оценки ADCC активности представляющей интерес молекулы можно провести in vitro ADCC анализ, такой как описанный в патентах США No. 5500362, или 5821337, или в патенте США No. 6737056 (Presta). Подходящие эффекторные клетки для таких анализов включают РВМС и NK клетки. Или же или помимо этого, ADCC активность представляющей интерес молекулы можно определить in vivo, например, на животной модели, такой как животная модель, раскрываемая в статье dynes el al., PNAS (USA) 95: 652-656 (1998).
Выражение "комплемент-зависимая цитотоксичность" или "CDC" относится к лизису клетки-мишени в присутствии комплемента. Активация комплемента по классическому пути инициируется связыванием первого компонента системы комплемента (C1q) с антителами (соответствующего подкласса), которые связываются со "своим" (по когнатному взаимодействию) антигеном. Для оценки активации комплемента можно провести CDC анализ, например, такой как анализ, описанный Gazzano-Santoro el al., J. Immunol. Methods 202: 163 (1996). Варианты полипептидов с измененными аминокислотными последовательностями Fc области (полипептиды с вариантом Fc области) и повышенная или пониженная способность связывания с C1q описаны, например, в патенте США No. 6194551 В1 и в Международной патентной заявке WO 1999/51642. См. также, например, Idusogie et al., J. Immunol. 164: 4178-4184 (2000).
Выражение "антитело, содержащее Fc область" относится к антителу, которое содержит Fc область. С-концевой остаток лизина (остаток 447 по EU системе нумерации) Fc области можно удалять, например, в процессе очистки антитела или получая методом рекомбинантной ДНК нуклеиновую кислоту, кодирующую антитело. Соответственно, композиция, содержащая антитело, антитело, имеющее Fc область по данному изобретению, может содержать антитело с K447, совсем не содержать K447 или содержать смесь антител, содержащих и не содержащих остаток K447.
"Аффинность связывания" обычно относится к эффективности совокупности нековалентных взаимодействий между единственным сайтом связывания молекулы (например, антитела) и ее партнером по связыванию (например, антигеном). Если не указано иначе, "аффинность связывания" по данному описанию относится в собственной аффинности связывания, которая отражает взаимодействие между членами связывающейся пары (например, антитела и антигена) в соотношении 1:1. Аффинность молекулы Х к ее партнеру Y обычно можно представить константой диссоциации (Kd). Аффинность можно количественно определять обычными методами из уровня техники, включая методы, представленные в данном описании. Низкоаффинные антитела обычно медленно связываются с антигеном и имеют тенденцию быстро диссоциировать, тогда как высокоаффинные антитела обычно быстрее связываются с антигеном и имеют тенденцию дольше оставаться в связанном состоянии. В уровне техники известны различные методы количественного определения аффинности, некоторые из них применяются в настоящем изобретении. Конкретные иллюстративные и типичные варианты количественного определения аффинности связывания описаны ниже.
В одном варианте изобретения "Kd" или "величину Kd" по данному изобретению определяют методом связывания с антигеном, меченным радиоактивной меткой (РИА, радиоиммуноанализ, RIA), анализ проводят с Fab вариантом представляющего интерес антитела и его антигеном, как описано ниже. Аффинность связывания Fab с антигеном в растворе определяют количественно, уравновешивая Fab с меченным (125I) антигеном в минимальной концентрации в присутствии серии образцов титруемого немеченого антигена, затем иммобилизуя связанный антиген на планшете с иммобилизованным на нем антителом против Fab (см., например, Chen et al., J. Mol. Biol. 293: 865-881(1999)). Чтобы выяснить условия анализа, на микротитрационных многолуночных планшетах Microtiter (Thermo Scientific) в течение ночи иммобилизуют раствором "захватывающего" антитела против Fab с концентрацией 5 мкг/мл (Cappel Labs) в 50 мМ растворе карбоната натрия (рН 9.6), а затем блокируют 2% (вес/об.) раствором альбумина бычьей сыворотки в PBS в течение двух-пяти часов при комнатной температуре (около 23°С). В планшете без адсорбента (Nunc #269620) 100 пМ или 26 пМ [125I]- антигена смешивают с серийными разведениями представляющего интерес Fab (например, в соответствии с анализом антитела против VEGF, Fab-12, в Presta et al., Cancer Res. 57: 4593-4599 (1997)). Затем представляющий интерес Fab инкубируют в течение ночи; однако инкубация может продолжаться дольше (например, около 65 часов), чтобы гарантировать достижение равновесия. Затем смеси переносят в планшет для захвата с целью инкубации при комнатной температуре (например, в течение одного часа). Затем раствор удаляют, а планшет отмывают восемь раз раствором c 0.1% Tween-20™ в PBS. Когда планшеты высохнут, прибавляют 150 мкл/лунка сцинтилляционной жидкости (MICROSCINT-20™, Packard) и определяют радиоактивность с помощью гамма-счетчика Topcount™ (Packard) в течение десяти минут. Концентрации каждого фрагмента Fab, при которых достигается связывание ≤20% от максимального связывания, выбирают для применения в анализах методом конкурентного связывания.
Согласно другому варианту изобретения, Kd или величину Kd определяют методами поверхностного плазменного резонанса, используя систему BIAcore®-2000 или BIAcore®-3000 (BIAcore, Inc., Piscataway, NJ) при 25°C с помощью биосенсорных чипов СМ5 с иммобилизованным антигеном, ~10 относительных единиц (RU). Коротко говоря, биосенсорные чипы с карбоксиметилированным декстраном (СМ5, BIAcore, Inc.) активируют гидрохлоридом N-этил-N'-(3-диметиламинопропил)- карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями производителя. Антиген разводят в 10 мМ растворе ацетата натрия, рН 4.8, до концентрации 5 мкг/мл (~0.2 мкМ) перед инжекцией при скорости потока 5 мкл/минута до достижения около 10 относительных единиц (RU) связанного белка. После инжекции антигена вводят 1 М раствор этаноламина (инжекция), чтобы блокировать непрореагировавшие группы. Для кинетических измерений двукратные серийные разведения Fab (от 0.78 нМ до 500 нМ) инъецируют в PBS с 0.05% Tween-20™ в качестве ПАВ (PBST) при 25°С при скорости потока около 25 мкл/мин. Константы ассоциации (kon) и константы диссоциации (koff) рассчитывают, используя простую модель Лэнгмюра для связывания в соотношении один-один (программа BIAcore® Evaluation Software версия 3.2), одновременно строя участки ассоциации и диссоциации на сенсограммах. Константу равновесной диссоциации (Kd) рассчитывают как соотношение kon/koff. См., например, Chen et al., J. Mol. Biol. 293: 865-881 (1999). Если константа ассоциации превышает 106 М-1 сек-1 в анализе методом поверхностного плазмонного резонанса, описанным выше, тогда константу ассоциации можно определять методом тушения флуоресценции, который позволяет измерять повышение или снижение интенсивности флуоресценции (возбуждение = 295 нм; излучение = 340 нм, полоса пропускания 16 нм) при 25°С раствора 20 нМ антитела против антигена (Fab форма) в PBS, рН 7.2, в присутствии увеличивающихся концентраций антигена, измеряемое на спектрометре, таком как спектрофотометр с остановкой потока (Aviv Instruments) или спектрофотометр серии 8000 SLM-Aminco™ (ThermoSpectronic) в кювете с перемешиванием.
Величину "on-rate," "константы ассоциации" или "kon" по данному описанию можно определять так же, как описано выше, используя систему BIAcore®-2000 или BIAcore®-3000 (BIAcore, Inc., Piscataway, NJ).
Выражение "практический сходный (аналогичный)" или "практически такой же" по данному описанию указывает на достаточно высокую степень сходства между двумя численными значениями (например, одно из них относится к антителу по изобретению, а другое - к эталонному антителу/антителу сравнения), так что специалист в данной области техники полагает, что разница между двумя значениями (величинами) имеет малую биологическую/статистическую значимость или не имеет никакой биологической/статистической значимости для биологической характеристики, измеряемой указанными значениями (например, значениями Kd). Разница между указанными двумя значениями составляет, например, менее примерно 50%, менее примерно 40%, менее примерно 30%, менее примерно 20% и/или менее примерно 10% от эталонного значения (величины)/значения (величины) сравнения.
Выражение "значительно пониженный" или "значительно (заметно) отличающийся" по данному описанию указывает на достаточно высокую степень различия между двумя численными значениями (величинами) (обычно одно из них относится к молекуле, а другое - к эталонной молекуле/молекуле сравнения), так что специалист в данной области техники полагает, что разница между двумя значениями (величинами) имеет статистическую значимость для биологической характеристики, измеряемой указанными значениями (например, значениями Kd). Разница между указанными двумя значениями составляет, например, более примерно 10%, более примерно 20%, более примерно 30%, более примерно 40% и/или более примерно 50% от величины эталонной молекулы/молекулы сравнения.
Выражение "акцепторная человеческая каркасная область" по данному описанию обозначает каркасную область, содержащую аминокислотную последовательность каркасной области VL или VH, образованную из каркасной области человеческого иммуноглобулина или консенсусной последовательности человеческой каркасной области. Акцепторная человеческая каркасная область, "образованная из" каркасной области человеческого иммуноглобулина или консенсусной последовательности человеческой каркасной области, может содержать такую же аминокислотную последовательность, как эти области, или может содержать ранее существовавшие (предсуществующие) изменения (замены) в аминокислотной последовательности. В некоторых вариантах изобретения число предсуществующих аминокислотных изменений (замен) составляет 10 или менее, 9 или менее, 8 или менее, 7 или менее, 6 или менее, 5 или менее, 4 или менее, 3 или менее или 2 или менее. Если предсуществующие аминокислотные замены (изменения) имеются в VH, предпочтительно, эти замены (изменения) происходят только в трех, двух или в одном положении 71Н, 73Н и 78Н; например, аминокислотные замены в этих положениях могут быть 71А, 73Т и/или 78А. В одном варианте изобретения последовательность акцепторной человеческой каркасной области VL идентична последовательности человеческой каркасной области VL или консенсусной последовательности человеческой каркасной области.
"Консенсусная последовательность человеческой каркасной области" обозначает каркасную область, которая представляет наиболее часто встречающиеся (обычные) аминокислотные остатки в селекции VL или VH каркасных последовательностей человеческого иммуноглобулина. Обычно селекцию VL или VH последовательностей человеческого иммуноглобулина осуществляют из подгруппы последовательностей вариабельного домена. Обычно подгруппа последовательностей представляет собой подгруппу по Rabat et al., supra. В одном варианте изобретения, для VL, подгруппа представляет собой подгруппу каппа I по Kabat et al., supra. В одном варианте изобретения, для VH, представляет собой подгруппу III по Kabat et al., supra.
"Консенсусная каркасная последовательность VH подгруппы III" включает консенсусную последовательность, полученную из аминокислотных последовательностей в вариабельной области тяжелой цепи подгруппы III по Kabat et al. В одном варианте изобретения консенсусная аминокислотная последовательность каркасной области VH подгруппы III содержит по меньшей мере участок каждой из нижеприведенных последовательностей или целую нижеприведенную последовательность:
EVQLVESGGGLVQPGGSLRLSCAAS (SEQ ID NO:31)-H1-
WVRQAPGKGLEWV (SEQ ID NO:32)-H2-
RFTISADTSKNTLYLQMNSLRAEDTAVYYC (SEQ ID NO:33)-H3-
WGQGTLVTVSS (SEQ ID NO:34). См. Фигуру 4.
"Консенсусная каркасная последовательность VL подгруппы I" включает консенсусную последовательность, полученную из аминокислотных последовательностей в вариабельной области легкой цепи каппа подгруппы I по Kabat et al. В одном варианте изобретения консенсусная аминокислотная последовательность каркасной области VL подгруппы I содержит по меньшей мере участок каждой из нижеприведенных последовательностей или целую нижеприведенную последовательность:
DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO:35)-L1-WYQQKPGKAPKLLIY
(SEQ ID NO:36)-L2-GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (SEQ ID NO:37)-L3-FGQGTKVEIK (SEQ ID NO:38). См. Фигуру 5.
Термин "набор кодонов" по данному описанию относится к набору различных последовательностей нуклеотидных триплетов, применяемому для кодирования заданных вариантов аминокислот. Набор олигонуклеотидов можно синтезировать, например, твердофазным синтезом, включая последовательности, которые представляют все возможные комбинации нуклеотидных триплетов, предоставляемых набором кодонов, и которые кодируют заданную группу аминокислот. Стандартной формой обозначения кодонов является обозначение по номенклатуре IUPAC-IUB, которое известно в уровне техники и представлено в данном описании. Обычно кодон изображают тремя заглавными буквами курсивом, например NNK, NNS, XYZ, DVK и т.п. "Неслучайный набор кодонов" по данному описанию относится к набору кодонов, который кодирует выбранные аминокислоты, которые соответствуют частично, предпочтительно, полностью, критериям для отбора (селекции) аминокислот по данному описанию. Синтез олигонуклеотидов с выбранной "вырожденностью" нуклеотидов в некоторых положениях общеизвестен в уровне техники, например метод TRIM (Knappek et al. (1999) J. Mol. Biol. 296: 57-86); Garrard & Henner (1993) Gene 128: 103). Такие наборы олигонуклеотидов, имеющих определенные наборы кодонов, можно синтезировать, используя продажные синтезаторы нуклеиновых кислот (ген-синтезаторы) (например, от фирмы Applied Biosystems, Foster City, CA), или их можно получать от производителя (например, от фирмы Life Technologies, Rockville, MD). Таким образом, набор синтезированных олигонуклеотидов, имеющих конкретный набор кодонов, обычно включает совокупность олигонуклеотидов с различными последовательностями, различия между ними определяются набором кодонов в полной последовательности. Олигонуклеотиды, применяемые по данному изобретению, имеют последовательности, которые способствуют гибридизации с нуклеотидной матрицей вариабельного домена, а также могут, но необязательно, включать сайты расщепления рестриктазами, применимые, например, в случае клонирования.
Выражение "линейные антитела" относится к антителам, описанным в Zapata et al. (1995 Protein Eng, 8(10): 1057-1062). Коротко говоря, эти антитела содержат пару тандемных Fd сегментов (VH-CH1-VH-CH1), которые, совместно с полипептидами комплементарной легкой цепи, образуют пару антигенсвязывающих областей. Линейные антитела могут быть биспецифическими или моноспецифическими.
Термин "библиотека" по данному описанию относится к совокупности последовательностей антител или фрагментов антител (например, полипептидов по изобретению), или нуклеиновых кислот, которые кодируют эти последовательности, причем последовательности различаются комбинацией различных аминокислот, введенных в эти последовательности методами по изобретению.
"Фаговый дисплей" представляет собой метод, с помощью которого различные полипептиды визуализируются в виде белков, слитых по меньшей мере с участком оболочечного белка на поверхности фага, например нитевидного фага, частиц, Применение фагового дисплея основано на том, что можно легко и эффективно провести сортировку больших библиотек случайных вариантов белков, отбирая последовательности, которые связываются с целевым антигеном с высокой аффинностью. Визуализация библиотек пептидов и белков на фаге использована для скрининга миллионов полипептидов на полипептиды со свойствами специфического связывания. Методы фагового дисплея с применением поливалентного фага применяют для визуализации малых случайных пептидов и малых белков путем слияния либо с геном III, либо с геном VIII нитевидного фага. Wells and Lowman (1992) Curr. Opin. Struct. Biol. 3: 355-362 и приведенные в этой статье ссылки. При "моновалентном" фаговом дисплее библиотеку белков или пептидов сливают с геном III или его участком и экспрессируют с низкими уровнями в присутствии белка, кодируемого дикого типа геном III, так что фаговые частицы визуализируют одну копию слитых белков или совсем не визуализируют слитые белки. Авидность понижена по сравнению с поливалентным фагом, так что сортинг проводится на основе собственной аффинности лиганда, и используются фагмидные векторы, которые упрощают манипуляции с ДНК. Lowman and Wells (1991) Methods: A companion to Methods in Enzymology 3: 205-216.
"Фагмида" представляет собой плазмидный вектор, имеющий репликацию бактериального происхождения, например Co1E1, и копию межгенной области бактериофага. Фагмиду можно использовать на любом известном бактериофаге, включая нитевидный бактериофаг и лямбдоидный бактериофаг. Плазмида обычно содержит также селективный маркер устойчивости к антибиотикам. Сегменты ДНК, клонированные в эти векторы, можно репродуцировать в виде плазмид. Если клетки, содержащие эти векторы предоставляются со всеми генами, необходимыми для продуцирования фаговых частиц, способ репликации плазмиды меняется на репликацию по механизму катящегося кольца, образуя копии одной нити плазмидной ДНК и упаковку фаговых частиц. Фагмида может образовывать инфекционные и неинфекционные фаговые частицы. Этот термин включает фагмиды, которые содержат ген белка оболочки фага, или его фрагмент, связанный с геном гетерологичного полипептида в виде генного слияния, так что гетерологичный полипептид визуализируется на поверхности фаговой частицы.
Термин "фаговый вектор" означает двухцепочечную репликативную форму бактериофага, содержащую гетерологичный ген и способную к репликации. Фаговый вектор имеет репликацию фагового происхождения, способствующую репликации фага и образованию фаговых частиц. Фаг, предпочтительно, является нитевидным бактериофагом, таким как М13, f1, fd, Pf3 фаг, или его производным, или лямбдоитным фагом, таким как лямбда, 21, phi80, phi81, 82, 424, 434 и т.д., или его производным.
Выражение "положение, доступное для растворителя" относится к положению аминокислотного остатка в вариабельных областях тяжелой и легкой цепей исходного антитела или его антигенсвязывающего фрагмента, которое определяется на основании структуры, совокупности структур и/или моделированной структуры антитела или антигенсвязывающего фрагмента, как потенциально доступных для доступа растворителя и/или контакта с молекулой, такой как специфический к антителу антиген. Эти положения обычно находятся в областях CDR и на внешней части белка. Положения (аминокислотных остатков) антитела или антигенсвязывающего фрагмента по данному описанию, доступные для растворителя, можно определить, используя ряд алгоритмов, известных в уровне техники. В одном варианте изобретения положения (аминокислотных остатков), доступные для растворителя, определяют, используя координаты из трехмерной модели антитела, предпочтительно, используя компьютерную программу, такую как программа InsightII (Accelrys, San Diego, CA). Положения (аминокислотных остатков), доступные для растворителя, можно также определить, используя алгоритмы, известные в уровне техники (например, Lee and Richards (1971) J. Mol. Biol. 55, 379 и Connolly (1983) J. Appl. Cryst. 16, 548). Определение положений (аминокислотных остатков), доступных для растворителя, используя программу, пригодную для моделирования белка, и сведений, полученных при изучении трехмерной информации антитела. Программа, которую можно использовать для этих целей, включает программу SYBYL Biopolymer Module (Tripos Associates). Обычно, если алгоритм (программа) требует от пользователя вводить параметр размера, "размер" зонда, который используется при расчете, представляет собой набор радиусом около 1.4 ангстрем или меньше. Кроме того, методы определения участков и области контакта, доступных для растворителя, с применением программы для персонального компьютера описаны Pacios (1994) Comput. Chem. 18(4); 377-386.
Выражение "ангиогенный фактор или агент" обозначает фактор роста, который стимулирует развитие кровеносных сосудов, например промотирует ангиогенез, рост эндотелиальных клеток, устойчивость кровеносных сосудов и/или васкулогенез и т.д. Например, ангиогенные факторы включают, но без ограничения, VEGF и членов семейства VEGF, P1GF, семейство PDGF, семейство факторов роста фибробластов (FGF), лиганды для TIE (ангиопоэтины), эфрины, дельтаподобный лиганд 4 (DLL4), Del- 1, факторы роста фибробластов: кислый (aFGF) и основной (bFGF), фоллистатин, гранулоцитарный колониестимулирующий фактор (G- CSF), фактор роста гепатоцитов (HGF)/рассеивающий фактор (SF), интерлейкин-8 (IL-8), лептин, мидкин, нейрофилины, плацентарный фактор роста, тромбоцитарный фактор роста эндотелиальных клеток (PD-ECGF), тромбоцитарный фактор роста, в особенности PDGF-ВВ или PDGFR-бета, плейотрофин (PTN), програнулин, пролиферин, трансформирующий фактор роста-альфа (TGF-альфа), трансформирующий фактор роста-бета (TGF-бета), фактор некроза опухолей-альфа (TNF-альфа) и т.д. Также они включают факторы, которые ускоряют заживление ран, такие как гормон роста, инсулиноподобный фактор роста-I (IGF-I), VIGF, эпидермальный фактор роста (EGF), CTGF и члены его семейства и TGF-альфа и TGF-бета. См., например, Klagsbrun and D'Amore (1991) Annu. Rev. Physiol. 53; 217-39; Streit and Detmar (2003) Oncogene 22: 3172-3179; Ferrara & Alitalo (1999) Nature Medicine 5(12): 1359-1364; Tonini et al. (2003) Oncogene 22: 6549-6556 (например, в Таблице 1 перечисляются известные ангиогенные факторы); и Sato (2003) Int. J. Clin. Oncol. 8: 200-206.
Термин "антиангиогенный агент" или "ингибитор ангиогенеза" относится к низкомолекулярному веществу, полинуклеотиду (включая, например, ингибирующую РНК (PHKi или siPHK)), полипептиду, выделенному белку, рекомбинантному белку, антителу или к их конъюгатам или слитым белкам, которые ингибируют ангиогенез, васкулогенез или нежелательную сосудистую проницаемость, либо прямо, либо косвенно. Следует понимать, что агент против ангиогенеза включает такие агенты, которые связывают и блокируют ангиогенную активность ангиогенного фактора или его рецептора. Например, агент против ангиогенеза представляет собой антитело или другой антагонист ангиогенного агента по описанию выше, например антитела к VEGF-A или к VEGF-A рецептору (например, KDR рецептору или Flt- 1 рецептору), ингибиторы антител к PDGFR, такие как гливек (Gleevec™) (иматиниба мезилат), молекулы низкомолекулярных веществ, которые блокируют передачу сигнала от VEGF рецептора (например, PTK787/ZK2284, SU6668, SUTENT®/SU11248 (сунитиниба малат), AMG706, или такие, которые описаны в Международной патентной заявке WO 2004/113304). Агенты против ангиогенеза включают также ингибиторы ангиогенеза, например ангиостатин, эндостатин и т.д. См., например, Klagsbrun and D'Amore (1991) Annu. Rev. Physiol. 53: 217-39; Streit and Detmar (2003) Oncogene 22: 3172-3179 (например, в Таблице 3 приводится антиангиогенная терапия при злокачественной меланоме); Ferrara & Alitalo (1999) Nature Medicine 5(12): 1359-1364; Tonini et al. (2003) Oncogene 22: 6549-6556 (например, в Таблице 2 приводятся известные антиангиогенные факторы); и Sato (2003) Int. J. Clin. Oncol. 8: 200-206 (например, в Таблице 1 приводятся антиангиогенные агенты, применяемые в клинических испытаниях).
Термин "VEGF" или "VEGF-A" по данному описанию относится к человеческому васкулярному эндотелиальному фактору роста, содержащему 165 аминокислот, и родственным человеческим васкулярным эндотелиальным факторам роста, содержащим 121-, 189- и 206 аминокислот, описанным Leung et al. (1989) Science 246: 1306, и Houck et al., (1991) Mol. Endocrm, 5: 1806, наряду с их естественными аллельными и процессированными формами. Термин "VEGF" относится также к факторам VEGF видов, отличных от человека, таких как мышь, крыса или примат. Иногда VEGF от конкретного вида показан терминами, такими как hVEGF для человеческого VEGF, mVEGF для мышиного VEGF и т.д. Термин "VEGF" используется также по отношению к усеченным формам полипептида, содержащего аминокислоты 8-109 или 1-109 из человеческого васкулярного эндотелиального фактора роста, содержащего 165 аминокислот. Ссылки на любые такие формы VEGF могут даваться в настоящей заявке, например, как "VEGF (8-109)", "VEGF (1-109)" или "VEGF165". Положения аминокислотных остатков для "усеченного" нативного VEGF нумеруются, как указано в нативной последовательности VEGF. Например, положение аминокислотного остатка 17 (метионин) в усеченном нативном VEGF, также положение 17 (метионин) в нативном VEGF. Усеченный нативный VEGF обладает аффинностью связывания с KDR и Flt- 1 рецепторами, сравнимой с аффинностью связывания с ними нативного VEGF.
Выражение "антитело против VEGF " обозначает антитело, которое связывается с VEGF с достаточной аффинностью и специфичностью. В одном варианте изобретения антитело против VEGF по изобретению представляет собой антитело В20-4.1.1. Еще в одном варианте изобретения антитело против VEGF по изобретению представляет собой антитело B20-4.1.1RR. Еще в одном варианте изобретения антитело против VEGF по изобретению можно применять в качестве терапевтического агента для нацеливания на заболевания или состояния и препятствования заболеваниям или состояниям, в которых задействована VEGF активность. Антитело против VEGF обычно не связывается ни с другими гомологами VEGF, такими как VEGF-B или VEGF-С, ни с другими факторами роста, такими как P1GF, PDGF или bFGF.
Антитело против VEGF "бевацизумаб (BV)," также известное как "rhuMAb VEGF" или "авастин®", представляет собой рекомбинантное гуманизированное моноклональное антитело против VEGF, полученное по методике Presta et al. (1997) Cancer Res. 57: 4593-4599. Оно содержит мутантные каркасные области человеческого IgG1 и антигенсвязывающие области, определяющие комплементарность мышиного моноклонального антитела против hVEGF A.4.6.1, которое блокирует связывание человеческого VEGF с его рецепторами. Около 93% аминокислотной последовательности бевацизумаба, включая большую часть каркасных областей, образовано из человеческого IgG1, и около 7% последовательности образовано из мышиного антитела А4.6.1. Бевацизумаб имеет молекулярную массу около 149000 дальтон и является гликозилированным.
Термин "полипептид вида В20" по данному описанию относится к полипептиду, включающему антитело, которое связывается с VEGF. Полипептиды вида В20 включают, но без ограничения, антитела, образованные из последовательности антитела В20 или антитела, происходящего из В20, описанного в опубликованной патентной заявке США No. 20060280747, опубликованной патентной заявке США No. 20070141065 и/или опубликованной патентной заявке США No. 20070020267, причем содержание этих патентных заявок вводится в данное описание в качестве ссылки. В одном варианте изобретения полипептид вида В20 представляет собой В20-4.1, описанный в опубликованной патентной заявке США No. 20060280747, опубликованной патентной заявке No. 20070141065 и/или опубликованной патентной заявке No. 20070020267.
Термин "В20-4.1.1" по данному описанию относится к антителу, которое связывается с VEGF, и представляет собой антитело, в котором HVR-H1 имеет последовательность SEQ ID NO:1; HVR-H2 имеет последовательность SEQ ID NO:2; HVR-H3 имеет последовательность SEQ ID NO:3; HVR-L1 имеет последовательность SEQ ID NO:4; HVR-L2 имеет последовательность SEQ ID NO:6; HVR-E3 имеет последовательность SEQ ID NO:7.
Термин "В20-4.1.1RR" по данному описанию относится к антителу, которое связывается с VEGF, и представляет собой антитело, в котором HVR-H1 имеет последовательность SEQ ID NO:1; HVR-H2 имеет последовательность SEQ ID NO:2; HVR-H3 имеет последовательность SEQ ID NO:3; HVR-L1 имеет последовательность SEQ ID NO:5; HVR-L2 имеет последовательность SEQ ID NO:6; HVR-L3 имеет последовательность SEQ ID NO:7.
Термин "G6-31" по данному описанию обозначает один из полипептидов вида G-6, описанных в опубликованной патентной заявке США No. 20060280747, опубликованной патентной заявке США No. 20070141065 и/или опубликованной патентной заявке США No. 20070020267. Другие полипептиды вида G-6, описанные в опубликованной патентной заявке США No. 20060280747, опубликованной патентной заявке США No. 20070141065 и/или опубликованной патентной заявке США No., включают, но без ограничения, G6-8 и G6-23.
Выражения "биологическая активность" и "биологически активный", по отношению к VEGF полипептиду, относятся к физическим/химическим свойствам и биологическим функциям, ассоциированным с VEGF.
Выражение "антагонист VEGF" относится к молекуле, способной нейтрализовать, блокировать, ингибировать, аннулировать, снижать активность VEGF или препятствовать активности VEGF, включая, но без ограничения, его связывание с одним или более VEGF рецепторов. Антагонисты VEGF включают, но без ограничения, антитела против VEGF и их антигенсвязывающие фрагменты, рецепторные молекулы и производные, которые специфически связываются с VEGF, тем самым блокируя его связывание с одним или более рецепторами, антитела против рецепторов VEGF и антагонисты рецепторов VEGF, такие как низкомолекулярные ингибиторы VEGFR тирозинкиназ. Термин "антагонист VEGF" по данному описанию конкретно включает молекулы, включая антитела, фрагменты антител, другие связывающие полипептиды и непептидные низкомолекулярные вещества, которые связываются с VEGF и способны нейтрализовать, блокировать, ингибировать, аннулировать, снижать активность VEGF или препятствовать активности VEGF. Таким образом, термин "активность VEGF" конкретно включает опосредуемую VEGF биологическую активность (по определению выше) VEGF. В одном варианте изобретения антагонист VEGF представляет собой антитело против VEGF В20-4.1.1. Еще в одном варианте изобретения антагонист VEGF представляет собой антитело против VEGF B20-4.1.1RR.
Термин "лечение" по данному описанию (и варианты, такие как "лечить") относится к клиническому вмешательству с целью изменить естественное течение заболевания индивидуума или состояния клетки, которые подвергаются лечению, и может проводиться либо с целью профилактики, либо в процессе клинической патологии. Ожидаемый эффект лечения включает предупреждение возникновения или рецидива заболевания, ослабление симптомов, уменьшение любых прямых или косвенных патологических последствий заболевания, предупреждение метастазов, уменьшение скорости прогрессирования заболевания, улучшение или временное улучшение болезненного состояния и ремиссию или более благоприятный прогноз. В некоторых вариантах изобретения антитела по изобретению применяют для задержки развития заболевания или расстройства или для замедления прогрессирования заболевания или расстройства.
"Продолжительное" введение относится к непрерывному введению агента (агентов), в отличие от экстренного (срочного, неотложного) введения, проводимому с целью поддержать первоначальный терапевтический эффект (активность) в течение длительного периода времени. "Периодическое" введение представляет собой лечение, которое не проводится последовательно без перерыва, но скорее является цикличным по характеру.
"Расстройство" обозначает состояние, для которого лечение является благотворным (например, млекопитающие, которые страдают аномальным ангиогенезом или нуждаются в профилактике аномального ангиогенеза (избыточный, несоответствующий или неконтролируемый ангиогенез) или аномальной сосудистой проницаемости). Этот термин включает хронические и острые расстройства или заболевания, включая патологические состояния, которые вызывают у млекопитающего предрасположенность к рассматриваемому заболеванию. Неограничивающие примеры расстройств, которые можно лечить по данному заболеванию, включают злокачественные и доброкачественные опухоли; злокачественные новообразования нелейкозного и лимфоидного происхождения; и, в частности, метастазирование опухоли (например, раковой).
Термины "клеточное пролиферативное расстройство" и "пролиферативное расстройство" относятся к расстройствам, которые ассоциируются с аномальной до некоторой степени клеточной пролиферацией. В одном варианте изобретения клеточное пролиферативное заболевание обозначает рак.
Термин "опухоль" по данному описанию относится к росту и пролиферации всех неопластических клеток, вне зависимости от того, являются они злокачественными или доброкачественными, и всех предраковых и раковых клеток и тканей. Термины "рак", "раковый", "клеточное пролиферативное расстройство", "пролиферативное расстройство" и "опухоль"не являются взаимно исключающими друг друга в данном описании.
Термины "рак" и "раковый" относятся к физиологическому состоянию и описывают физиологическое состояние млекопитающих, которое обычно характеризуется нерегулируемым ростом клеток. Примеры рака включают, но без ограничения, карциному, лимфому, бластому, саркому и лейкоз. Более конкретные примеры таких раковых заболеваний включают, но без ограничения, плоскоклеточный рак, рак легкого (включая мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого и плоскоклеточный рак легкого), рак брюшины, печеночноклеточный рак, рак желудка и кишечника (включая рак ЖКТ и стромальную опухоль ЖКТ), рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, колоректальный рак, карциному эндометрия и матки, карциному слюнной железы, рак почки, рак предстательной железы, рак вульвы, рак щитовидной железы, карциному печени и различные типы рака головы и шеи, меланому, поверхностную меланому, меланому типа злокачественного лентиго, акральные лентигинозные меланомы, нодулярные (узловые) меланомы, а также В-клеточную лимфому (включая низкодифференцированную/фолликулярную неходжкинскую лимфому (NHL); мелкоклеточную лимфоцитарную (SL) NHL; диффузную NHL с промежуточной дифференцировкой клеток; иммунобластную NHL высокой степени злокачественности; лимфобластную NHL высокой степени злокачественности; NHL из мелких клеток с нерасщепленными ядрами высокой степени злокачественности; генерализованную форму NHL; мантийноклеточную лимфому; лимфому, связанную со СПИДом; и макроглобулинемию Вальденстрома); хронический лимфоцитарный лейкоз (CLL); острый лимфобластный лейкоз (ALL); волосистоклеточный лейкоз; хронический миелобластный лейкоз и посттрансплантационное лимфопролиферативное расстройство (PTLD), а также аномальную васкулярную пролиферацию, обусловленную факоматозами (такую, которая связана с опухолями мозга), и синдром Мейгса.
Термины "индивидуум", "субъект" или "пациент" обозначают позвоночного. В некоторых вариантах изобретения позвоночное представляет собой млекопитающее. Млекопитающие включают, но без ограничения, сельскохозяйственных животных (таких как коровы), "спортивные" и домашние животные (такие как кошки, собаки и лошади), приматы, мыши и крысы. В некоторых вариантах изобретения млекопитающее обозначает человека.
Выражение (термин) "фармацевтическая лекарственная форма (состав)" относится к препарату, находящемуся в такой форме, которая способствует эффективной биологической активности активного ингредиента и которая не содержит дополнительных компонентов с неприемлемой токсичностью по отношению к субъекту, которому эта лекарственная форма (этот состав) должна вводиться. Такие препараты могут быть стерильными.
Понятие "стерильный" препарат является асептическим или не содержащим никаких живых микроорганизмов и их спор.
Выражение "эффективное количество" относится к количеству, эффективному в дозах и в течение периода времени, необходимых для достижения заданного терапевтического или профилактического результата.
"Терапевтически эффективное количество" вещества/молекулы по изобретению может меняться в зависимости от таких факторов, как стадия заболевания, возраст, пол и масса индивидуума и способность вещества/молекулы выявлять (вырабатывать) заданный ответ у индивидуума. Терапевтически эффективное количество охватывает количество, при котором терапевтически благоприятные эффекты превосходят токсические или вредные эффекты вещества/молекулы. Выражение "профилактически эффективное количество" относится к количеству, эффективному в дозах и в течение периода времени, необходимых для достижения заданного профилактического результата. Обычно, но необязательно, поскольку профилактическую дозу дают субъектам до заболевания или на его ранней стадии, профилактически эффективное количество должно быть меньше, чем терапевтически эффективное количество.
Введение "в комбинации (в сочетании) с" одним или более терапевтических агентов включает одновременное (конкурентное) и последовательное введение в любом порядке.
"Носители" по данному описанию включают фармацевтически приемлемые носители, эксципиенты или стабилизаторы, нетоксические по отношению к клетке или млекопитающему, которые с ними экспонируются, в применяемых дозах и концентрациях. Часто физиологически приемлемый носитель представляет собой водный рН забуференный раствор. Примеры физиологически приемлемых носителей включают буферные растворы, такие как фосфатный, нитратный буфер и буферные растворы других органических кислот; антиоксиданты, включающие аскорбиновую кислоту; низкомолекулярный (содержащий менее примерно 10 остатков) полипептид; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТА (EDTA); сахарные спирты, такие как маннит или сорбит; солеобразующие противоионы, такие как натрий; и/или неионные поверхностно-активные вещества, такие как Твин™, полиэтиленгликоль (ПЭГ, PEG) и плуроникс™.
"Липосома" представляет собой малую везикулу, состоящую из липидов различных типов, фосфолипидов и/или поверхностно-активного вещества, применимую для доставки лекарства (такого как VEGF полипептид или антитело к нему) млекопитающему. Составляющие липосомы обычно организованы в виде бислоя, аналогично организации биологических мембран.
Термин "противоопухолевая композиция" относится к композиции, применимой для лечения рака, содержащей по меньшей мере один активный терапевтический агент, например "противораковый агент". Примеры терапевтических агентов (противораковых агентов) включают, но без ограничения, химиотерапевтические агенты, ингибиторы роста, цитотоксические агенты, агенты, применяемые в лучевой терапии, агенты против ангиогенеза, апоптотические агенты, антитубулиновые агенты и другие агенты для лечения рака, такие как антитела против HER-2, антитела против CD20, антагонист рецептора эпидермального фактора роста (EGFR) (например, ингибитор тирозинкиназ), ингибитор HER1/EGFR (например, эрлотиниб (Тарцева™), ингибиторы тромбоцитарного фактора роста (например, Гливек™ (иматиниба мезилат)), ингибитор СОХ-2 (например, целекоксиб), интерфероны, цитокины, антагонисты (например, нейтрализующие антитела), которые связываются с одной из следующих мишеней: ErbB2, ErbB3, ErbB4, PDGFR-бета, BlyS, APRIL, BCMA или VEGF рецептор(ы), TRAIL/Apo2, и другие биоактивные и органические химические агенты и т.д. Изобретение также охватывает их комбинации.
Термин "цитотоксический агент" по данному описанию относится к веществу, которое ингибирует или предупреждает клеточную функцию и/или вызывает гибель или деструкцию клетки. Предполагается, что термин включает радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu), химиотерапевтические агенты (например, метотрексат, адриамицин, алкалоиды винка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин С, хлорамбуцил, даунорубицин или другие интеркалирующие агенты, ферменты и их фрагменты, такие как нуклеолитические ферменты, антибиотики и токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, включая их фрагменты и/или варианты, и различные противоопухолевые или противораковые агенты, раскрываемые далее. Другие цитотоксические агенты описаны ниже. Туморицидальный агент вызывает деструкцию опухолевых клеток.
Термин "токсин" обозначает любое вещество, способное оказывать вредное воздействие на рост или пролиферацию клетки.
"Химиотерапевтический агент" представляет собой химическое соединение, пригодное для лечения рака. Примеры химиотерапевтических агентов включают алкилирующие агенты, такие как тиотепа и циклофосфамид (питоксан, Cytoxan®); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метилмеламины, включая альтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилмеламин; ацетогенины (в особенности буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (дронабинол, маринол; бета-лапахон; лапахол; колхицины; бетулиновая кислота; камптотецин (включая синтетический аналог топотекан (Гикамтин, СРТ-11 (иринотекан, Камптостар®, ацетилкамптотецин, скополектин и 9-аминокамптотецин); бриостатин; каллистатин; СС-1065 (включая его синтетические аналоги адозелезин, карзелезин и бизелезин); подофиллотоксин; подофиллиновая кислота; тенипозид; криптофицины (в особенности криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги KW-2189 и СВ1-ТМ1); элеутеробин; панкратистатин; саркодиктин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлорэтамин, мехлорэтамина оксида гидрохлорид, мелфалан, новембихин, фенестрин, преднимустин, трофосфамид, урацил мустард; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимустин; антибиотики, такие как ендииновые антибиотики (такие как калихеамицин, в особенности калихеамицин гамма1I и калихеамицин омегаI1 (см., например, Nicolaou et al., Angew. Chem. Int. Ed. Engl., 33: 183-186 (1994)); CDP323 или пероральный игибитор альфа-4 интегрина; динемицин, включая динемицин А; эсперамицин; а также хромофор неокарциностатина и родственные хромопротеины, хромофоры на основе ендииновых антибиотиков), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин (включая Адриамицин®, морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролинодоксорубицин, инъекции липосом доксорубицин HCl (Доксиль®, доксорубицин липосомальный TLC D-99 (Миоцет®, пегилированный липосомальный доксорубицин (Келикс®) и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин С, микофенольная кислота, ногаламицин, оливомицины, пепломицин, порфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат, гемцитабин (Гемзар®), тегафур (Уфторал, Uftoral®), капецитабин (Кселода®), эпотилон и 5-фторурацил (5-FU); комбретастатин; аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азатидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; анти андрогены, такие как аминоглутетимид, митотан, трилостан; пополнитель фолиевой кислоты, такой как фолиниевая кислота; ацеглатон; альдофосфамидгликозид; аминолевулиновая кислота; енилурацил; амсакрин; бестрабуцил; бисантрен; эдатрексат; дефофамид; демеколцин; диазиквон; элфорнитин; эллиптиния ацетат; эпотилон; этоглюцид; нитрат галлия; гидроксимочевина; лентинан; лонидаинин; майтанзиноиды, такие как майтанзин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраерин; пентостатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2',2'-трихлортриэтиламин; трихотецины (в особенности Т-2 токсин, верракурин А, роридин А и ангуидин); уретан; виндезин (элдизин (ELDISINE®), FILDESIN®); дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ("Ara-С"); тиотепа; таксоид, например паклитаксел (Таксол, TAXOL ®), препарат из связанных с альбумином наночастиц паклитаксела (ABRAXANE™), и доцетаксел (Таксотер, TAXOTERE ®); хлорамбуцил; 6-тиогуанин; меркаптопурин; метотрексат; соединения платины, такие как цисплатин, оксиплатин, оксалиплатин (например, Элоксатин, ELOXATIN®) и карбоплатин; алкалоиды винка (барвинка малого), которые предупреждают образование микротрубочек при полимеризации тубулина, включающие винбластин (Велбан, VELBAN®), винкристин (Онковин, ONCOVIN®), виндезин (элдизин (ELDISINE®), FILDESIN®)) и винорелбин (Навелбин, NAVELBINE®); этопозид (VP-16); ифосфамид; митоксантрон; лейковорин (leucovorin); новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразз RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота, включая бексаротен (Таргретин, TARGRETIN); бифосфонаты, такие как клодронат (например, Бонефос, BONEFOS®, или OSTAC®), этидронат (Дидрокал, DIDROCAL®), NE-58095, золендроновая кислота/золендронат (Зомета, ZOMETA®), алендронат (Фозамакс, FOSAMAX), памидронат (Аредиа, AREDIA®), тилудронат (SKELID®) или ризедронат (Актонель, ACTONEL®); троксацитабин (1,3-диоксолановый аналог цитозинового нуклеозида); антисмысловые олигонуклеотиды, в особенности такие антисмысловые олигонуклеотиды, которые ингибируют экспрессию генов сигнальных путей, участвующих в аберрантной клеточной пролиферации, например, такие как PKC-альфа, Raf, H-Ras, и рецептор эпидермального фактора роста (EGF-R) (например, эрлотиниб (Тарцева, TARCEVA®); и VEGF-A, которые снижают клеточную пролиферацию; вакцины, такие как вакцина THERATOPE® и геннотерапевтические вакцины, например вакцина ALLOVECTIN®, вакцина LEUVECTIN® и вакцина VAXID®; ингибитор топоизомеразы 1 (например, луртотекан, LURTOTECAN®); rmRH (например, абареликс, ABARELIX®); BAY439006 (сорафениб; Bayer); SU-11248 (сунитиниб, SUTENT®, Pfizer); перифозин, ингибитор СОХ-2 (например, целекоксиб или эторикоксиб), ингибитор активности протеосом (например, PS341); бортезомиб (велкаде, VELCADE®); CCI-779; типифарниб (R11577); орафениб, АВТ510; ингибитор Bcl-2, такой как облимерсен натрий (GENASENSE®); пиксантрон; ингибиторы EGFR; ингибиторы тирозинкиназ; ингибиторы серин-треонинкиназ, такие как рапамицин (сиролимус, RAPAMUNE®); ингибиторы фарнезилтрансферазы, такие как лонафарниб (SCH 6636, SARASAR™); и фармацетически приемлемые соли, кислоты или производные любого из указанных выше соединений; а также комбинации двух или более указанных выше соединений, такие как CHOP, аббревиатура для комбинированной терапии с помощью циклофосфамида, доксорубицина, винкристина и преднизолона; и FOLFOX, сокращенное название схемы лечения оксалилплатиной (ELOXATIN™) в комбинации с 5-FU и лейковорином, и фармацетически приемлемые соли, кислоты или производные любого из указанных выше соединений; а также комбинации двух или более указанных выше соединений.
Химиотерапевтические агенты по данному описанию включают "антигормональные агенты", или "эндокринные терапевтические средства", которые регулируют, снижают, блокируют или ингибируют действие гормонов, стимулирующих рост раковой опухоли. Они могут сами по себе представлять собой гормоны, включая, но без ограничения: антиэстрогены и селективные эстроген-рецепторные модуляторы (SERM), включая, например, тамоксифен (в том числе NOLVADEX® тамоксифен), ралоксифен, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и фарестон (FARESTON)-торемифен; ингибиторы ароматазы, которые ингибируют фермент ароматазу, регулирующую продуцирование эстрогена в надпочечниках, например, такие как 4(5)-имидазолы, аминоглутетимид, MEGASE® мегестрола ацетат, аромазин (экземестан, AROMASIN®) форместан, фадрозол, RIVISOR® ворозол, FEMARA® летрозол и ARIMIDEX® анастрозол; и антиандрогены, такие как флутамид, нилутамид, бикалутамид, лейпролид и гозерелин; а также троксацитабин (1,3-диоксолановый аналог цитозинового нуклеозида); антисмысловые олигонуклеотиды, в особенности такие антисмысловые олигонуклеотиды, которые ингибируют экспрессию генов сигнальных путей, участвующих в аберрантной клеточной пролиферации, например, такие как PKC-альфа, Raf, H-Ras; рибозимы, такие как ингибитор экспрессии VEGF (например, ANGIOZYME® рибозим) и ингибитор экспрессии HER2; вакцины, такие как геннотерапевтические вакцины, например вакцина ALLOVECTIN®, вакцина LEUVECTIN® и вакцина VAXID®; PROLEUKIN® rIL-2; ингибитор топоизомеразы 1 LURTOTECAN® (луртотекан); ABARELIX® rmRH; Винорельбин и Эсперамицины (см. патент США No. 4675187), и фармацетически приемлемые соли, кислоты или производные любого из указанных выше соединений; а также комбинации двух или более указанных выше соединений.
"Агент, ингибирующий рост" ("ингибитор роста") по данному описанию относится к соединению или композиции, которое(ая) ингибирует рост клетки (такой как клетка, ингибирующая VEGF) in vitro или in vivo. Так, ингибитор роста может представлять собой агент, который значительно снижает процентное содержание клеток (таких как клетки, экспрессирующие VEGF) в S фазе. Примеры ингибиторов роста включают агенты, которые блокируют дальнейшее развитие клеточного цикла (не в S фазе), такие как агенты, которые индуцируют остановку клеточного цикла в G1 фазе или в М-фазе. Классические блокаторы М-фазы включают алкалоиды винка (винкристин и винбластин), таксаны и ингибиторы топоизомеразы II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Агенты, которые останавливают клеточный цикл в фазе G1, также распространяют свое действие на остановку клеточного цикла в S-фазе, например агенты, алкилирующие ДНК, такие как тамоксифен, преднизон, декарбазин, мехлорэтамин, цисплатин, метотрексат, 5-фторурацил и ara-С. Более подробные сведения можно найти в книге Mendelsohn and Israel, eds., The Molecular Basis of Cancer, Chapter 1, entitled "Cell cycle regulation, oncogenes, and antineoplastic drugs" by Murakami et al. (W.B. Saunders, Philadelphia, 1995), например, р. 13. Таксаны (паклитаксел и доцетаксел) представляют собой противораковые лекарства, оба получены из тисового дерева. Доцетаксел (TAXOTERE®, Rhone-Poulenc Rorer), полученный из европейского тиса, является полусинтетическим аналогом паклитаксела (TAXOL®, Bristol-Myers Squibb). Паклитаксел и доцетаксел стимулируют сборку микротрубочек из димеров тубулина и стабилизируют микротрубочки, предупреждая деполимеризацию, что приводит к ингибированию митоза в клетках.
"Патология" заболевания включает все явления, которые ставят под угрозу здоровье пациента. В случае рака патология включает, но без ограничения, аномальный или неконтролируемый рост клеток, метастазирование, препятствование нормальному функционированию соседних клеток, аномальные уровни высвобождения цитокинов или других продуктов секреции, подавление или обострение воспалительной или иммунологической реакции и т.д.
Термин "пролекарство", применяемый в данной заявке, относится к предшественнику или производному фармацевтически активного вещества, которое является менее цитотоксическим по отношению к опухолевым клеткам по сравнению с исходным лекарством и способно под действием фермента активироваться или превращаться в более активную исходную форму. См., например, Wilman (1986) "Prodrugs in Cancer Chemotherapy" Biochemical Society Transactions, 14, pp.375-382, 615thMeeting Belfast, и Stella et al. (1985) "Prodrugs: A Chemical Approach to Targeted Drug Delivery", Directed Drug Delivery, Borchardt et al., (ed.), pp.247-267, Humana Press. Пролекарства по данному изобретению включают, но без ограничения, фосфатсодержащие Пролекарства, тиофосфатсодержащие Пролекарства, сульфатсодержащие Пролекарства, пептидсодержащие Пролекарства, модифицированные Пролекарства, включающие D-аминокислоты, гликозилированные Пролекарства, β-лактам-содержащие Пролекарства, необязательно замещенные феноксиацетамид-содержащие Пролекарства или необязательно замещенные фенилацетамид-содержащие Пролекарства, 5-фторцитозин и другие 5-фторуридиновые Пролекарства, которые могут превращаться в более активную цитотоксическую свободную лекарственную форму. Примеры цитотоксических лекарств, которые можно дериватизировать в форму Пролекарства для применения в данном изобретении, включают, но без ограничения, описанные выше химиотерапевтические агенты.
"Низкомолекулярное соединение" ("малая молекула") по данному описанию имеет молекулярную массу ниже примерно 500 дальтон.
"Очищенный(ая)" означает, что молекула присутствует в образце, в котором она находится, в концентрации по меньшей мере 95% вес. или по меньшей мере 98% вес.
"Выделенная" нуклеотидная молекула (молекула нуклеиновой кислоты) обозначает молекулу нуклеиновой кислоты (нуклеотидную молекулу), которая отделена от молекулы по меньшей мере одной другой нуклеиновой кислоты, с которой она обычно ассоциирована, например, в естественной среде. Выделенная нуклеотидная молекула дополнительно включает нуклеотидную молекулу, содержащуюся в клетках, которые обычно экспрессируют нуклеотидную молекулу, но эта нуклеотидная молекула находится вне хромосомы или локализована на хромосоме в положении, отличном от ее естественной локализации на хромосоме.
Предполагается, что термин "вектор" по данному описанию относится к молекуле нуклеиновой кислоты, способной переносить другую нуклеиновую кислоту, с которой она связана. Одним из типов вектора является "плазмида", которая представляет собой кольцевую двухцепочечную молекулу ДНК, с которой могут быть лигированы дополнительные ДНК-сегменты. Другим типом вектора является фаговый вектор. Другим типом вектора является вирусный вектор, при этом дополнительные ДНК-сегменты могут быть лигированы в вирусный геном. Некоторые векторы способны к автономной репликации в клетке-хозяине, в которую они введены (например, бактериальные векторы, имеющие бактериальное происхождение репликации, и эписомные векторы млекопитающих). Другие векторы (например, не-эписомные векторы млекопитающих) можно интегрировать в геном клетки-хозяина при введении в клетку-хозяина, и при этом они реплицируются наряду с геномом хозяина. Кроме того, некоторые векторы способны направлять экспрессию гена, с которым они функционально связаны. Такие векторы в данном описании называются "рекомбинантными экспрессирующими (экспрессионными) векторами" или просто "экспрессирующими (экспрессионными) векторами". Обычно экспрессирующие векторы, применяемые в методах рекомбинантной ДНК, часто находятся в виде плазмид. В настоящем описании термины "плазмида" и "вектор" могут употребляться взаимозаменяемо, так как плазмида является самой общеупотребительной формой вектора.
Термины "полинуклеотид" или "нуклеиновая кислота", применяемые в данном описании взаимозаменяемо, относятся к полимерам нуклеотидов любой длины и включают ДНК и РНК. Нуклеотиды могут представлять собой дезоксирибонуклеотиды, рибонуклеотиды, модифицированные нуклеотиды или основания, и/или их аналоги, или любое вещество (субстрат), которое можно включить в полимер с помощью ДНК- или РНК-полимеразы или по реакции синтеза. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. В случае ее присутствия модификацию нуклеотидной структуры можно осуществлять до или после сборки полимера. Последовательность нуклеотидов может прерываться ненуклеотидными компонентами. Полинуклеотид может содержать модификацию(-и), осуществленную после синтеза, такую как конъюгация с меткой. Другие типы модификации включают, например, "кэпы", замену одного или более естественных нуклеотидов на аналог, межнуклеотидные модификации, например, такие как модификации за счет не имеющих заряда связей (например, метилфосфонаты, фосфотриэфиры, фосфоамидаты, карбаматы) и за счет имеющих заряд связей (например, фосфоротиоаты, фосфородитиоаты и т.д.), модификации, содержащие боковые цепи, например, такие как белки (например, нуклеазы, токсины, антитела, сигнальные пептиды, ply- L- лизин и т.д.), модификации с интеркалирующими веществами (низкомолекулярными веществами, взаимодействующими с ДНК) (например, акридин, псорален и т.д.), модификации, содержащие вещества, образующие хелаты (например, металлы, радиоактивные металлы, бор, металлы (соли тяжелых металлов)-окислители, и т.д.), модификации, содержащие алкилирующие агенты, модификации с модифицированными сцеплениями (например, нуклеиновые кислоты с аномерным альфа-С атомом и т.д.), а также немодифицированные формы полинуклеотидов. Кроме того, любая из гидроксильных групп, обычно имеющаяся в сахарах, может быть замещена, например, фосфонатными группами, фосфатными группами, защищена обычными защитными группами или активирована с целью образования дополнительных связей с другими нуклеотидами, или может быть конъюгирована с твердыми или полутвердыми подложками. 5' и 3' концевые группы ОН могут быть фосфорилированными или могут быть заменены аминогруппами или органическими кэпирующими группами, содержащими от 1 до 20 углеродных атомов. Полинуклеотиды могут также содержать аналоги сахаров рибозы или дезоксирибозы, которые обычно известны в уровне техники, включая, например, 2'-O-метил-, 2'-O- аллил-, 2'-фтор- или 2'-азидорибозу, карбоциклические аналоги сахаров, α-аномерные сахара, эпимерные сахара, такие как арабиноза, ксилозы или ликсозы, пиранозные сахара, фуранозные сахара, седогептулозы, ациклические аналоги и основные нуклеозидные аналоги, такие как метилрибозид. Одну или более фосфодиэфирных связей можно заместить альтернативными связывающими группами. Эти альтернативные связывающие группы включают, но без ограничения, варианты изобретения, в которых фосфатная группа заменена на P(O)S ("тиоат"), P(S)S ("дитиоат"), (O)NR2 ("амидат"), P(O)R, P(O)OR', CO или CH2 ("формацеталь"), где каждый заместитель R или R', независимо, обозначает Н или замещенный или незамещенный алкил (1-20 С), необязательно содержащий эфирную (-O-) связь, арил, алкенил, циклоалкил, циклоалкенил или аралкил. Необязательно все связи в полинуклеотиде должны быть идентичными. Описанное выше применимо ко всем полинуклеотидам по данному описанию, включая РНК и ДНК.
Термин "олигонуклеотид" по данному описанию обычно относится к коротким, как правило, одноцепочечным, как правило, синтетическим полинуклеотидам, которые обычно, но необязательно, имеют в длину менее, примерно, 200 нуклеотидов. Термины "олигонуклеотид" и "полинуклеотид" взаимно не исключают друг друга. Описанное выше для полинуклеотидов равно и целиком применимо к олигонуклеотидам.
Выражение "процент (%) идентичности аминокислотной последовательности" относительно эталонной полипептидной последовательности определяют как процентное содержание аминокислотных остатков в предполагаемой (кандидатной) последовательности, идентичных аминокислотным остаткам в эталонной последовательности, после выравнивания последовательностей и введения гэпов, если это необходимо для достижения максимальной идентичности последовательностей в процентах, и не рассматривая любые консервативные замены как часть идентичности последовательностей. Выравнивание с целью определения идентичности аминокислотных последовательностей можно осуществить различными способами, которые известны специалистам в данной области техники, например, используя общедоступную компьютерную программу, такую как BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области техники могут определить соответствующие параметры для выравнивания последовательностей, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Однако для целей данного описания значения идентичности аминокислотных последовательностей в % получают, используя компьютерную программу сравнения последовательностей ALIGN-2. Компьютерная программа сравнения последовательностей ALIGN-2 разработана Genentech, Inc., и исходная программа заявлена с руководством для пользователей в Бюро по охране авторского права США, Washington D.C., 20559, где она зарегистрирована под регистрационным номером No. TXU510087. Программа ALIGN-2 общедоступна от Genentech, Inc., South San Francisco, California, или ее можно скомпилировать, используя исходную программу. Программу ALIGN-2 следует компилировать для операционной системы UNIX, предпочтительно Digital UNIX V4.0D. Все параметры сравнения последовательностей задаются программой ALIGN-2 и не изменяются.
В тех случаях, когда программу ALIGN-2 используют для сравнения аминокислотных последовательностей, % идентичности аминокислотных последовательностей данной аминокислотной последовательности А с (по отношению к, с или против) данной аминокислотной последовательностью В (что можно иначе выразить как: данная аминокислотная последовательность А, которая имеет или содержит определенный % идентичности аминокислотной последовательности по отношению к, с или против данной аминокислотной последовательности В) рассчитывают следующим образом:
100 × доля Х/Y,
где X обозначает число аминокислотных остатков, оцениваемых как идентичные совпадения (пары) программой выравнивания последовательностей ALIGN-2 при использовании этой программы для выравнивания А и В, и где Y обозначает общее число аминокислотных остатков в B. Следует понимать, что если длина аминокислотной последовательности А не равна длине аминокислотной последовательности В, то % идентичности аминокислотной последовательности А к В не будет равен % идентичности аминокислотной последовательности В к А. Если специально не указано иначе, все значения идентичностей аминокислотных последовательностей в % по данному описанию получают, как описано в предыдущем абзаце с применением компьютерной программы ALIGN-2.
Выражение "контрольные последовательности" относится к ДНК-последовательностям, необходимым для экспрессии функционально связанной последовательности в конкретном организме-хозяине. Контрольные последовательности, применимые для прокариот, например, включают промотор, необязательно, последовательность оператора, сайт связывания рибосом. Известно, что эукариотические клетки используют промоторы, сигналы полиаденилирования и энхансеры.
Нуклеиновая кислота " функционально (операбельно) связана", когда она находится в функциональной связи с другой нуклеотидной последовательностью. Например, ДНК для препоследовательности или секреторной лидерной последовательности функционально связана с ДНК для полипептида, если она экспрессируется в виде пребелка, который участвует в секреции полипептида; промотор или энхансер функционально связан с кодирующей последовательностью, если он влияет на транскрипцию последовательности; или сайт связывания рибосом функционально связан с кодирующей последовательностью, если он расположен таким образом, чтобы способствовать трансляции. Как правило, "функционально связанный" означает, что связанные ДНК-последовательности являются непрерывными и, в случае секреторной лидерной последовательности, непрерывными в фазе считывания. Однако энхансеры необязательно являются непрерывными (соседними). Связывание осуществляют лигированием в соответствующих сайтах рестрикции. Если такие сайты отсутствуют, то в соответствии с обычной практикой используют синтетические олигонуклеотидные адаптеры или линкеры.
Выражения "клетка", "клеточная линия" ("линия клеток") и "клеточная культура" по данному описанию применяются взаимозаменяемо и все такие названия обозначают потомство. Так, выражения "трансформанты" и "трансформированные клетки" включают первичную подвергнутую воздействию клетку и образованные из нее культуры вне зависимости от числа переносов. Понятно также, что все потомство может не быть в точности идентичным по содержимому ДНК вследствие умышленных или неумышленных (случайных) мутаций. Изобретение включает мутантное потомство, имеющее такую же функцию или биологическую активность, как и функция или биологическая активность, обнаруженные в первоначально трансформированной клетке. Если предполагаются другие названия (указания), то это будет ясно из контекста.
Термин "конкурентно" применяется по отношению к введению двух или более терапевтических агентов, при котором по меньшей мере часть введения совпадает по времени. Соответственно, конкурентное введение включает схему введения, когда введение одного или более агентов продолжается после прекращения введения одного или более других агентов.
Выражение "рецидив рака" по данному описанию относится к возобновлению рака после лечения. В одном варианте изобретения рецидив рака включает (местный) рецидив рака в груди (в молочной железе), а также дистанционный (дистантный) рецидив, если рак рецидивирует вне груди (молочной железы).
Композиции по изобретению
Изобретение охватывает варианты выделенного антитела и полинуклеотидов. В одном варианте изобретения антитело против VEGF является очищенным.
Данное изобретение охватывает также композиции, включая фармацевтические композиции, содержащие антитело против VEGF; и полинуклеотиды, содержащие последовательности, кодирующие антитело против VEGF. Композиции по данному описанию содержат одно или более антител, которые связываются с VEGF, и/или один или более полинуклеотидов, содержащих последовательности, кодирующие одно или более антител, которые связываются с VEGF. Кроме того, эти композиции могут содержать подходящие носители, такие как фармацевтически приемлемые эксципиенты, включая буферы, общеизвестные в уровне техники.
В одном варианте изобретения антитела против VEGF по изобретению являются моноклональными. Еще в одном варианте изобретения антитела против VEGF по изобретению являются поликлональными. Также в объем изобретения входят фрагменты Fab, Fab', Fab'-SH и F(ab')2 антител против VEGF по данному описанию. Эти фрагменты антитела можно получать традиционным методом, таким как ферментативное расщепление, или их можно получать методами рекомбинантной ДНК. Такие фрагменты антител могут быть химерными или гуманизированными. Эти фрагменты применимы для целей диагностики и терапии, представленных ниже. В одном варианте изобретения антитело против VEGF представляет собой химерное, гуманизированное или человеческое антитело.
Моноклональные антитела получают из популяции практически гомогенных антител, т.е. индивидуальные антитела, составляющие популяцию, идентичны за исключением естественных мутаций, которые могут присутствовать в минорных количествах. Таким образом, определение "моноклональное" указывает на характеристику антитела, не являющегося смесью дискретных антител.
Типичные моноклональные антитела, полученные из фаговой библиотеки, приводятся в данном описании и описаны в Примере 1. Эти антитела обозначены как В20-4.1.1 и B20-4.1.1.RR. Последовательности вариабельных доменов тяжелой и легкой цепи антител В20-4.1.1 и В20-4.1.1.RR показаны на Фигурах 1 и 6-9.
Для скрининга на антитела, которые связываются с конкретным эпитопом на представляющем интерес антигене можно провести обычный анализ перекрестного блокирования, такой, который описан в Antibodies, A Laboratory manual. Cold Spring Harbor Laboratory, Ed Harlow and David Lane (1988). Или же можно провести эпитопное картирование, например, как описано в Champe et al. (1995) J. Biol. Chem. 270: 1388-1394, чтобы определить, действительно ли антитело связывается с представляющим интерес эпитопом. Другие типичные варианты антител против VEGF приводятся ниже.
Специфические варианты антител против VEGF по изобретению
В одном варианте изобретение включает антитело, содержащее:
(i) последовательность HVR-H1, содержащую последовательность SEQ ID NO:1;
(ii) последовательность HVR-H2, содержащую последовательность SEQ ID NO:2;
(iii) последовательность HVR-Н3, содержащую последовательность SEQ ID NO:3;
(iv) последовательность HVR-L1, содержащую последовательность SEQ ID NO:4;
(v) последовательность HVR-L2, содержащую последовательность SEQ ID NO:6; и
(vi) последовательность HVR-L3, содержащую последовательность SEQ ID NO:7.
В другом варианте изобретение включат антитело, содержащее:
(i) последовательность HVR-H1, содержащую последовательность SEQ ID NO:1;
(ii) последовательность HVR-H2, содержащую последовательность SEQ ID NO:2;
(iii) последовательность HVR-H3, содержащую последовательность SEQ ID NO:3
(iv) последовательность HVR-L1, содержащую последовательность SEQ ID NO:5;
(v) последовательность HVR-L2, содержащую последовательность SEQ ID NO:6; и
(vi) последовательность HVR-L3, содержащую последовательность SEQ ID NO:7.
Перечисляются аминокислотные последовательности SEQ ID NO:1-7 индивидуальных HVR (т.е. H1, H2 или Н3), показанные на Фигуре 1, нумерация дается по системе нумерации Kabat, см. данное описание.
В одном аспекте изобретение включает антитела, содержащие последовательности HVR тяжелой цепи, изображенные на Фигуре 1.
Некоторые варианты антител по изобретению содержат вариабельный домен легкой цепи гуманизированного антитела 4D5 (huMAb4D5-8) (Герцептин, HERCEPTIN®, Genentech, Inc., South San Francisco, CA, USA) (также описанного в патенте США No. 6407213 и Lee et al., J. Mol. Biol. (2004), 340(5): 1073-93), показанный ниже, в SEQ ID NO:39.
1Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Are Ala Ser Gln Asp Val Asn Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys107 (SEQ ID NO:39) (остатки HVR подчеркнуты).
В одном варианте изобретения последовательность вариабельного домена легкой цепи huMAb4D5-8 модифицирована в одном или двух положениях из положений 30, 66 и 91 (Asn, Arg и His, соответственно, показанные выше жирным шрифтом/курсивом). В одном варианте изобретения модифицированная последовательность huMAb4D5-8 содержит Ser в положении 30, Gly в положении 66 и/или Ser в положении 91. Соответственно, в одном варианте изобретения антитело по изобретению содержит вариабельный домен легкой цепи, содержащий изображенную ниже последовательность SEQ ID NO:40:
1Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gty Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Thr Thr Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys107 (SEQ ID NO:40) (остатки HVR подчеркнуты)
Жирным шрифтом/курсивом выделены остатки, являющиеся заменами по сравнению с huMAb4D5-8.
Антитела по изобретению могут содержать любую подходящую последовательность каркасной области вариабельного домена при условии практической сохранности активности связывания с VEGF. Например, в некоторых вариантах изобретения антитела по изобретению содержат консенсусную последовательность каркасной области тяжелой цепи подгруппы III человека. В одном варианте этих антител консенсусная последовательность каркасной области содержит замену в положении 71, 73 и/или 78. В некоторых вариантах этих антител положение 71 представляет собой А, 73 представляет собой Т и/или 78 представляет собой А. В одном варианте изобретения эти антитела содержат каркасные последовательности вариабельного домена тяжелой цепи huMAb4D5-8 (HERCEPTIN®, Genentech, Inc., South San Francisco, CA, USA) (также описаны в патентах США No. 6407213 & 5821337 и в Lee et al., J. Mol. Biol. (2004), 340(5): 1073-93). В одном варианте изобретения эти антитела дополнительно содержат консенсусную последовательность каркасной области легкой цепи κI человека. В одном варианте изобретения эти антитела содержат последовательности HVR легкой цепи huMAb4D5-8, описанного в патентах США No. 6407213 и 5821337). В одном варианте изобретения эти антитела содержат последовательности вариабельного домена легкой цепи huMAb4D5-8 (HERCEPTIN®, Genentech, Inc., South San Francisco, CA, USA) (также описаны в патентах США No. 6407213 и 5821337 и в Lee et al., J. Mol. Biol. (2004), 340(5): 1073-93).
В одном варианте изобретения антитело по изобретению содержит вариабельный домен тяжелой цепи, в котором каркасная последовательность содержит последовательности SEQ ID NOS:8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 и/или 26 (Фигуры 2а и 2b), a HVR H1, H2 и Н3 последовательности представляют собой SEQ ID NO:1, 2 и/или 3 соответственно. В одном варианте изобретения антитело по изобретению содержит вариабельный домен легкой цепи, в котором каркасная последовательность содержит последовательности SEQ ID NO:27, 28, 29 и/или 30 (Фигура 3), HVR L1 последовательность представляет собой SEQ ID NO:4 или 5, HVR L2 последовательность представляет собой SEQ ID NO:6 и HVR L3 последовательность представляет собой SEQ ID NO:7.
В одном варианте изобретения антитело по изобретению содержит вариабельный домен тяжелой цепи, содержащий последовательность SEQ ID NO:43. В одном варианте изобретения антитело по изобретению содержит вариабельный домен легкой цепи, содержащий последовательность SEQ ID NO:44 или 45. В одном варианте изобретения антитело по изобретению содержит вариабельный домен тяжелой цепи, содержащий последовательность SEQ ID NO:43, и вариабельный домен легкой цепи, содержащий последовательность SEQ ID NO:45. Еще в одном варианте изобретения антитело по изобретению содержит вариабельный домен тяжелой цепи, содержащий последовательность SEQ ID NO:44(?), и вариабельный домен легкой цепи, содержащий последовательность SEQ ID NO:45(?).
В одном аспекте изобретение включает антитело, которое конкурирует с каким-либо из вышеуказанных антител за связывание с VEGF. В одном аспекте изобретение включает антитело, которое связывается с тем же эпитопом на VEGF, что и любое из вышеуказанных антител.
Фрагменты антител
Настоящее изобретение охватывает фрагменты антител. Фрагменты антител можно получать обычным методом, таким как ферментативное расщепление, или методами рекомбинантной ДНК. В некоторых условиях предпочтительнее применять фрагменты антител, нежели целые антитела. Меньшие размеры фрагментов способствуют более быстрому клиренсу и могут иметь лучший доступ к солидным опухолям. Обзор некоторых фрагментов антител см. в Hudson et al. (2003) Nat. Med. 9: 129-134.
Для получения фрагментов антител разработаны различные методы. Обычно эти фрагменты получали протеолитическим расщеплением интактных антител (см., например, Morimoto et al., Journal of Biochemical and Biophysical Methods 24: 107-117 (1992); и Brennan et al., Science, 229: 81 (1985)). Однако эти фрагменты можно теперь получать непосредственно, используя рекомбинантные клетки-хозяева. Фрагменты антитела Fab, Fv и ScFv можно экспрессировать в и секретировать, используя Е.coli, что позволяет легко получать большие количества этих фрагментов. Фрагменты антитела можно выделять из любых фаговых библиотек, обсуждавшихся выше. Или же фрагменты Fab'-SH можно непосредственно выделять из Е.coli и объединять их химическим методом, получая фрагменты F(ab')2 (Carter el al., Bio/Technology 10: 163-167 (1992)). По другому методу фрагменты F(ab')2 можно непосредственно выделять из рекомбинантной клетки-хозяина. Фрагменты Fab и F(ab')2 с повышенным in vivo периодом полужизни, включающие остатки эпитопа связывания рецептора- "мусорщика", описаны в патенте США No. 5869046. Другие методы получения фрагментов антитела очевидны для опытных специалистов-практиков. В некоторых вариантах изобретения антитело представляет собой одноцепочечный Fv фрагмент (scFv). См. Международную патентную заявку WO 93/16185; Патенты США No. 5571894 и 5587458. Fv и scFv являются единственными фрагментами с интактными сайтами связывания, которые не содержат константных областей; поэтому они могут применяться для уменьшения неспецифического связывания при употреблении in vivo. Можно конструировать слитые белки scFv, чтобы получить слияние эффекторного белка либо по амино-, либо по карбокси-концу scFv. См. Antibody Engineering, ed. Borrebaeck, supra. Фрагмент антитела может быть также "линейным антителом", например, описанным в патенте США No. 5641870. Такие линейные антитела могут быть моноспецифическими или биспецифическими.
Гуманизированные антитела
Изобретение охватывает гуманизированные антитела. Различные методы гуманизации антител нечеловеческого происхождения известны в уровне техники. Например, гуманизированное антитело может иметь один или более аминокислотных остатков, которые введены в него из источника нечеловеческого происхождения. Эти нечеловеческие аминокислотные остатки часто называют "импортными" остатками, которые обычно взяты из "импортного" вариабельного домена. Практически гуманизацию можно осуществлять по методу Winter и сотр. (Jones et al. (1986) Nature 321: 522-525; Riechmann et al. (1988) Nature 332: 323-327; Verhoeyen et al. (1988) Science 239: 1534-1536), заменой последовательностей гипервариабельных областей на соответствующие последовательности человеческого антитела. Следовательно, такие "гуманизированные" антитела являются химерными антителами (патент США No. 4816567), в котором участок, значительно меньший, чем интактный вариабельный домен человеческой последовательности, заменен на соответствующую последовательность вида, отличного от человека. На практике гуманизированные антитела обычно являются человеческими антителами, в которых некоторые остатки гипервариабельной области и, возможно, некоторые FR остатки заменены на остатки из аналогичных сайтов антител грызунов.
Вариабельные домены как легкой, так и тяжелой цепи человеческой последовательности, которые выбирают для получения гуманизированных антител, могут быть важны для снижения антигенности. Согласно так называемому методу "best-fit" ("наилучшей подгонки", "максимального приближения") последовательность вариабельного домена антитела грызуна подвергают скринингу против целой библиотеки человеческих последовательностей вариабельного домена. Затем человеческую последовательность, ближайшую к последовательности грызуна, принимают как человеческую каркасную последовательность для гуманизированного антитела. См., например, Sims et al. (1993) J. Immunol. 151: 2296; Clothia et al. (1987) J. Mol. Biol. 196: 901. В других методах используют конкретную каркасную область, образованную из консенсусной последовательности всех человеческих антител конкретной подгруппы легкой или тяжелой цепей. Одну и ту же каркасную область можно использовать для нескольких различных гуманизированных антител. См., например. Carter et al. (1992) Proc. Natl. Acad. Sci. USA, 89: 4285; Presto et al. (1993) J. Immunol., 151: 2623.
Кроме того, обычно желательно, чтобы антитела были гуманизированы с сохранением высокой аффинности к антигену и других полезных биологических свойств. Для достижения этой цели согласно одному методу гуманизированные антитела получают, анализируя исходные последовательности и различные умозрительные (принципиальные) гуманизированные продукты с помощью трехмерных моделей исходной и гуманизированной последовательностей. Трехмерные модели иммуноглобулинов обычно имеются и знакомы специалистам в данной области техники. Имеются компьютерные программы, которые иллюстрируют и визуализируют возможные трехмерные конформационные структуры выбранных предполагаемых (кандидатных) иммуноглобулиновых последовательностей. Изучение результатов этой визуализации позволяет провести анализ возможной роли остатков в функционировании предполагаемой (кандидатной) иммуноглобулиновой последовательности, т.е. анализ остатков, которые влияют на способность предполагаемого иммуноглобулина связывать свой антиген. Таким образом можно выбрать остатки FR и объединить остатки из последовательностей реципиента и импортных последовательностей так, чтобы достичь заданной характеристики антитела, такой как повышенная аффинность к целевому антигену (целевым антигенам). Как правило, остатки гипервариабельной области и непосредственно и наиболее значительно влияют на связывание антигена.
Человеческие антитела
Человеческие антитела по изобретению можно конструировать, объединяя последовательность(и) вариабельного домена Fv клона, выбранную(ые) из библиотек фагового дисплея человеческих антител, с известными последовательностями человеческого константного домена, описанными выше. Или же человеческие моноклональные антитела по изобретению можно получать методом гибридом. Линии клеток человеческой миеломы и мышиной-человеческой гетеромиеломы для получения человеческих моноклональных антител описаны, например, в Kozbor, J. Immunol., 133: 3001 (1984); Brodeur et al. Monoclonal Antibody Production Techniques and Applications, pp.51-63 (Marcel Dekker, Inc., New York, 1987); и Boerner et al., J, Immunol., 147: 86 (1991).
В настоящее время можно получать трансгенных животных (например, мышей), которые способны после иммунизации продуцировать полный спектр человеческих антител, не продуцируя эндогенный иммуноглобулин. Например, было описано, что гомозиготная делеция гена соединяющей части (J-сегмента) тяжелой цепи (JH) у химерной мыши и мыши с мутантной зародышевой линией приводит к полному ингибированию продуцирования эндогенного антитела. Перенос набора генов зародышевой линии иммуноглобулина человека в таких мышей с мутантной зародышевой линией при заражении антигеном приводит к продуцированию человеческих антител. См., например, Jakobovits et al., Proc. Natl. Acad. Sci U.S.A. 90: 2551 (1993); Jakobovits et al., Nature, 362: 255 (1993); Bruggermann et al. Year in Immunol, 7: 33 (1993).
Для получения человеческих антител из нечеловеческих антител, например антител грызунов, при этом чтобы человеческое антитело имело аффинность и специфичность такие же, как у исходного нечеловеческого антитела, можно использовать шаффлинг генов. Согласно этому методу, который также называют "эпитопным импринтингом", вариабельную область либо тяжелой, либо легкой цепи фрагмента нечеловеческого антитела, полученного методами фагового дисплея по данному описанию, заменяют набором человеческих генов V домена, создавая популяцию химерных, содержащих нечеловеческую цепь/человеческую цепь, scFv или Fab. Отбор с помощью антигена приводит к выделению содержащих нечеловеческую цепь/человеческую цепь химерных scFv или Fab, в которых человеческая цепь восстанавливает сайт связывания с антигеном, нарушенный при удалении соответствующей нечеловеческой цепи в первичном фаг-дисплейном клоне, т.е. эпитоп управляет (впечатывает) выбором партнера человеческой цепи. Если процесс повторяют с целью замены остальной нечеловеческой цепи, получают человеческое антитело (см. Международную патентную заявку РСТ WO 93/06213, опубликованную 1 апреля 1993). В отличие от традиционной гуманизации антител нечеловеческого происхождения с применением CDR-прививки, этот метод дает полностью человеческие антитела, которые не содержат остатков FR или CDR нечеловеческого происхождения.
Биспецифические антитела
Биспецифические антитела представляют собой моноклональные антитела, обладающие специфичностью связывания, по меньшей мере, к двум антигенам. В некоторых вариантах изобретения биспецифические антитела представляют собой человеческие или гуманизированные антитела. В некоторых вариантах изобретения одна из специфичностей связывания представляет собой специфичность связывания с VEGF, а другая является специфичностью связывания с каким-либо другим антигеном. В некоторых вариантах изобретения биспецифические антитела могут связываться с двумя различными эпитопами VEGF. Биспецифические антитела могут также применяться, чтобы локализовать цитотоксические агенты в клетки, которые экспрессируют VEGF. Эти антитела имеют VEGF-связывающее плечо и плечо, которое связывает цитотоксический агент, например, такой как сапорин, антитело против интерферона-α, алкалоид винка, цепь А рицина, метотрексат или гаптен с радиоактивным изотопом. Биспецифические антитела можно получать в виде полноразмерных антител или в виде фрагментов антител (например, в виде F(ab')2 биспецифических антител).
Методы приготовления биспецифических антител известны в уровне техники. Обычно получение биспецифических антител методами рекомбинантной ДНК основано на коэкспрессии двух пар тяжелая цепь - легкая цепь иммуноглобулина, где две тяжелые цепи имеют различную специфичность (Milstein and Cuello, Nature, 305: 537 (1983)). Вследствие случайного набора тяжелой и легкой цепей иммуноглобулина эти гибридомы ("квадромы") продуцируют возможную смесь из 10 различных молекул антител, из которых только одна имеет корректную биспецифическую структуру. Очистка корректной молекулы, которую обычно проводят на стадиях аффинной хроматографии, является довольно трудоемкой и дает низкие выходы продукта. Аналогичные методики раскрываются в Международной патентной заявке WO 93/08829, опубликованной 13 мая 1993 года, и в Traunecker et al., EMBO J., 10: 3655 (1991).
По другому методу вариабельные домены антитела с заданными специфичностями связывания (сайтами связывания антиген-антитело) связываются (соединяются) с последовательностями константного домена иммуноглобулина. Например, происходит связывание с константным доменом тяжелой цепи иммуноглобулина, содержащим по меньшей мере часть шарнирной, СН2 и СН3 областей. В некоторых вариантах изобретения первая константная область тяжелой цепи (CH1), содержащая участок (сайт), необходимый для связывания легкой цепи, присутствует по меньшей мере в одном из слияний. ДНК, кодирующие слияния тяжелых цепей иммуноглобулина и, при желании, легкой цепи иммуноглобулина, вводят (инсерция) в отдельные векторы экспрессии и котрансфецируют в подходящий организм-хозяин. Это обеспечивает большую гибкость при корректировании взаимных соотношений трех полипептидных фрагментов в вариантах изобретения, когда неравные пропорции трех полипептидных цепей, используемых при конструировании, дают оптимальные выходы. Однако можно вводить кодирующие последовательности для двух или трех полипептидных цепей в одном векторе экспрессии, когда экспрессия по меньшей мере двух полипептидных цепей в равных пропорциях дает высокие выходы или когда пропорции (отношения) не имеют особого значения.
В одном варианте данного метода биспецифические антитела состоят из гибридной тяжелой цепи иммуноглобулина с первой специфичностью связывания на одном плече и гибридной парой тяжелая цепь-легкая цепь иммуноглобулина (обеспечивающей вторую специфичность связывания) на другом плече. Обнаружено, что такая асимметрическая структура способствует отделению заданного биспецифического соединения от нежелательных комбинаций иммуноглобулиновых цепей, так как присутствие легкой цепи иммуноглобулина только в одной половине биспецифической молекулы обеспечивает простой способ разделения. Этот метод раскрывается в Международной патентной заявке WO 94/04690. Более подробно получение биспецифических антител описано, например, в Suresh et al., Methods in Enzymology, 121: 210 (1986).
Согласно другому методу можно создать интерфейс (границу) между парой молекул антитела таким образом, чтобы обеспечивалось максимальное процентное содержание гетеродимеров, которые выделяются из рекомбинантной клеточной культуры. Интерфейс содержит по меньшей мере часть домена CH3 константной области антитела. По этому методу одну или более низкомолекулярных (малых) аминокислотных боковых цепей интерфейса первой молекулы антитела заменяют большими по размеру боковыми цепями (например, тирозин, триптофан). На интерфейсе второй молекулы антитела создают компенсирующие "полости" идентичного или сходного размера в большой боковой цепи (в больших боковых цепях), заменяя большие боковые цепи аминокислот меньшими по размеру (например, аланин или треонин). Это содействует повышению выхода гетеродимера по сравнению с другими нежелательными конечными продуктами, такими как гомодимеры.
Биспецифические антитела включают сшитые (перекрестно связанные) антитела или "гетероконъюгированные" ("гетероконъюгатные") антитела. Например, одно из антител в гетероконъюгате может быть связано с авидином, а другое - с биотином. Такие антитела были предложены, например, для нацеливания иммунных клеток на нежелательные клетки (патент США No. 4676980) и для лечения ВИЧ инфекции (Международные патентные заявки WO 91/00360, WO 92/00373 и Европейский патент ЕР 03089). Гетероконъюгатные антитела можно получать любым подходящим методом сшивания (перекрестного связывания). Подходящие сшивающие агенты общеизвестны в уровне техники и раскрываются в патенте США No. 4676980, равно как и ряд методов сшивания (перекрестного связывания).
Методы получения биспецифических антител из фрагментов антител также описаны в литературе. Например, биспецифические антитела можно получать путем связывания химическими связями. Brennan et al., Science, 229: 81 (1985) описывают метод, по которому интактные антитела расщепляют протеолитически, получая фрагменты F(ab')2. Эти фрагменты восстанавливают в присутствии арсенита натрия, образующего комплекс с дитиолом, для стабилизации вицинальных дитиолов и предупреждения образования внутримолекулярного дисульфида. Полученные фрагменты Fab' затем превращают в производные тионитробензоата (TNB). Затем одно из Fab'-TNB производных снова превращают в Fab'-тиол восстановлением меркаптоэтиламином и смешивают с эквимолекулярным количеством другого Fab'-TNB производного с образованием биспецифического антитела. Полученные биспецифические антитела можно применять в качестве агентов для селективной иммобилизации ферментов.
Последние достижения (в уровне техники) упростили непосредственное выделение фрагментов Fab'-SH fиз Е.coli, эти фрагменты можно связывать химической связью с образованием биспецифических антител. Shalaby et al., J. Exp. Med., 175: 217-225 (1992) описывают получение полностью гуманизированного биспецифического антитела F(ab')2. Каждый фрагмент Fab' по отдельности секретируют при использовании Е.coli и проводят непосредственное связывание химической связью in vitro с образованием биспецифического антитела. Образующееся при этом биспецифическое антитело способно связываться с клетками, сверхэкспрессирующими HER2 рецептор, и с нормальными человеческими Т-клетками, а также вызывать литическуто активность человеческих цитотоксических лимфоцитов против мишеней - человеческих опухолей молочной железы.
Различные методы получения и выделения фрагментов биспецифического антитела из рекомбинантной клеточной культуры также описаны. Например, биспецифические антитела можно получать, используя лейциновые застежки-"молнии". Kostelny et al., J. Immunol, 148(5): 1547-1553 (1992). Пептиды с лейциновыми застежками-"молниями" из белков Fos и Jun связывают с Fab' участками двух различных антител, используя слияние генов. Гомодимеры антитела восстанавливают в шарнирной области, получают мономеры, а затем снова окисляют с образование гетеродимеров. Этот метод можно также использовать для получения гомодимеров антител. Технология "диател" ("diabody"), описанная Hollinger et al., Proc, Natl. Acad. Sci. U.S.A. 90: 6444-6448 (1993), предоставляет альтернативный механизм получения биспецифического антитела из фрагментов. Фрагменты содержат вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) линкером, слишком коротким, чтобы содействовать образованию пары между двумя доменами одной и той же цепи. Соответственно, это заставляет домены VH и VL одного фрагмента образовывать пару с комплементарными доменами VL и VH другого фрагмента, тем самым образуя два антигенсвязывающих сайта. Сообщалось также о другой стратегии получения биспецифического антитела из фрагментов путем использования димеров одноцепочечных Fv (sFv). См. Gruber et al., J. Immunol, 152: 5368 (1994).
Рассматриваются антитела, имеющие более двух валентностей. Можно, например, получать триспецифические антитела. Tutt et al. J. Immunol. 147: 60 (1991).
Мультивалентные антитела
Мультивалентное (поливалентное) антитело может интернализоваться (и/или катаболизироваться) быстрее, чем бивалентное антитело, клеткой, экспрессирующей антиген, с которым связываются антитела. Антитела по настоящему изобретению могут быть мультивалентными антителами (иными, нежели IgM класса) с тремя или более антигенсвязывающими сайтами (например, тетравалентные антитела), которые можно легко продуцировать рекомбинантной экспрессией нуклеиновой кислоты, кодирующей полипептидные цепи антитела. Мультивалентное антитело может содержать димеризационный домен и три или более антигенсвязывающих сайтов. В некоторых вариантах изобретения димеризационный домен содержит (или состоит из) Fc область и шарнирную область (или состоит из Fc области и шарнирной области). При таком сценарии антитело содержит Fc область и три или более антигенсвязывающих сайтов на аминоконце относительно Fc области. В некоторых вариантах изобретения мультивалентное антитело содержит от (или состоит из) трех до восьми антигенсвязывающих сайтов. В одном таком варианте изобретения мультивалентное антитело содержит четыре антигенсвязывающих сайта (или состоит из четырех антигенсвязывающих сайтов). Мультивалентное антитело содержит по меньшей мере одну полипептидную цепь (например, две полипептидные цепи), причем полипептидная(ые) цепь(и) содержит (содержат) два или более вариабельных домена. Например, полипептидная(ые) цепь(и)может (могут) содержать VD1-(X1)n-VD2-(Х2)n-Fc, где VD1 обозначает первый вариабельный домен, VD2 обозначает второй вариабельный домен, Fc обозначает одну полипептиднуто цепь Fc области, X1 и Х2 обозначают аминокислоту или полипептид и n обозначает 0 или 1. Например, полипептидная(ые) цепь(и) может(могут) содержать: VH-CH1-гибкий линкер-VH-CH1-Fc область; или VH-CH1-VH-CH1-Fc область. Мультивалентное антитело по данному описанию может далее содержать по меньшей мере два (например, четыре) полипептида вариабельного домена тяжелой цепи. Мультивалентное антитело по данному описанию содержит, например, примерно, от двух до, примерно, восьми полипептидов вариабельного домена тяжелой цепи. Полипептиды вариабельного домена тяжелой цепи, рассматриваемые в данном описании, содержат вариабельный домен легкой цепи и, необязательно, дополнительно содержат CL домен.
Однодоменные антитела
В некоторых вариантах изобретения антитело по изобретению представляет собой однодоменное антитело. Однодоменное антитело представляет собой единичную полипептидную цепь, содержащую целый вариабельный домен тяжелой цепи антитела или его часть или целый вариабельный домен легкой цепи антитела или его часть. В некоторых вариантах изобретения однодоменное антитело представляет собой человеческое однодоменное антитело (Domantis, Inc., Waltham, MA; см., например, патент США No. 6248516 В1). В одном варианте изобретения однодоменное антитело состоит из целого вариабельного домена тяжелой цепи антитела или из его части.
Варианты антител
В некоторых вариантах изобретения рассматривае(ю)тся модификация(и) аминокислотных последовательностей антител по данному описанию. Например, может потребоваться повысить аффинность связывания и/или другие биологические свойства антитела. Варианты аминокислотной последовательности антитела можно получать, вводя соответствующие изменения в нуклеотидную последовательность, кодирующую антитело, или пептидным синтезом. Такие модификации включают, например, делеции остатков из аминокислотных последовательностей, и/или инсерции остатков в аминокислотные последовательности, и/или замены остатков в аминокислотных последовательностях антитела. Можно сделать любую комбинацию делеции, инсерции и замены, чтобы получить конечную конструкцию, при условии, что конечная конструкции обладает заданными свойствами. Изменения аминокислот можно вводить в аминокислотную последовательность антитела по изобретению во время составления этой последовательности.
Метод, применимый для идентификации некоторых остатков или областей антитела в местоположениях, предпочтительных для мутагенеза, называется "аланин-сканирующим мутагенезом", который описан Cunningham and Wells (1989) Science, 244: 1081-1085. По этому методу остаток или группу остатков-мишеней идентифицируют (например, заряженные остатки, такие как Arg, Asp, His, Lys и Gul) и заменяют нейтральной или отрицательно заряженной аминокислотой (например, аланином или полиаланином), чтобы повлиять на взаимодействие аминокислот с антигеном. Затем эти местоположения аминокислот, демонстрирующие функциональную селективность к заменам, уточняют, вводя дополнительные или другие варианты в сайты замен или для сайтов замен. Таким образом, хотя сайт для введения варианта аминокислотной последовательности предопределен, сама по себе природа мутации необязательно предопределена. Например, для анализа результата мутации в данном сайте в целевом кодоне или в целевой области проводят ala сканирование или случайный мутагенез и скрининг экспрессированных иммуноглобулинов на заданную активность.
Инсерции аминокислотных последовательностей включают амино- и/или карбоксил-концевые слияния длиной от одного остатка до полипептидов, содержащих сто или более остатков, а также инсерции одного или нескольких аминокислотных остатков внутри последовательности. Примеры концевых инсерций включают антитело с N-концевым метионильным остатком. Другие инсерционные варианты молекулы антитела включают слияние антитела по N- или с С-концу с ферментом (например, для ADEPT) или полипептидом, который повышает период полужизни антитела.
В некоторых вариантах изобретения антитело по изобретению изменяют таким образом, чтобы повысить или понизить степень гликозилирования антитела. Гликозилирование полипептидов обычно является либо N-связанным, либо О-связанным. N-связанное гликозилирование относится к связыванию углеводной частицы с боковой цепью аспарагинового остатка. Трипептидные последовательности, аспарагин-Х-серин и аспарагин-Х-треонин, в которых Х обозначает любую аминокислоту, кроме пролита, представляют собой распознаваемые последовательности для ферментативного связывания углеводного фрагмента с боковой цепью аспарагина. Таким образом, наличие этих трипептидных последовательностей в полипептиде создает потенциальный сайт гликозилирования. О-связанное гликозилирование относится к присоединению одного из сахаров, N-ацетилгалактозамина, галактозы или ксилозы, с гидроксиламинокислотой, чаще всего с серином или треонином, хотя можно также использовать 5-гидроксипролин или 5-гидроксилизин.
Добавление сайтов гликозилирования к антителу или делецию сайтов гликозилирования из антитела обычно осуществляют, изменяя аминокислотную последовательность таким образом, чтобы создать или удалить одну или более из вышеописанных последовательностей (для N-связанных сайтов гликозилирования). Изменение можно также осуществлять путем добавления, деления или замены одного или более остатков серина или треонина в последовательности оригинального антитела (для О-связанных сайтов гликозилирования).
Если антитело содержит область Fc, можно присоединять углевод к этой области. Нативные антитела, продуцируемые в клетках млекопитающих, обычно содержат разветвленный биантенный олигосахарид, который обычно соединен N-связью с остатком Asn297 домена СН2 области Fc. См., например, Wright et al. (1997) T1BTECH 15: 26-32. Олигосахарид может включать различные углеводы, например маннозу, N-ацетилглюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, связанную с GlcNAc в "стволе" биантенной олигосахаридной структуры. В некоторых вариантах изобретения можно создать модификации олигосахаридов в антителе по изобретению, чтобы получить варианты антитела с определенными улучшенными свойствами.
Например, изобретение включает варианты антител, имеющие углеводную структуру, в которой отсутствует фукоза, связанная (прямо или косвенно) с областью Fc. Такие варианты могут иметь улучшенную ADCC функцию. См., например, опубликованные патентные заявки США No. US 2003/0157108 (Presta, L.); US 2004/0093621 (Kyowa Hakko Kogyo Co., Ltd). Примеры публикаций, относящихся к "дефукозилированным" или "дефицитным по фукозе" вариантам антител, включают: опубликованную патентную заявку США US 2003/0157108; опубликованные Международные заявки WO 2000/61739; WO 2001/29246; опубликованные патентные заявки США No. US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; опубликованные Международные-заявки WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO 2005/053742; WO 2002/031140; Okazaki et al. J, Mol. Biol. 336: 1239-1249 (2004); Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004). Примеры линий клеток, способных продуцировать дефукозилированные антитела, включают Lee 13 СНО клетки, дефицитные по фукозилированию белка (Ripka et al. Arch. Biochem. Biophys. 249: 533-545 (1986); патентная заявка США US 2003/0157108 A1, Presta, L; и Международную патентная заявка WO 2004/056312 A1, Adams et al., в особенности Пример 11), и нокаутированные линии клеток, такие как клетки, нокаутированные по гену альфа-1,6-фукозилтрансферазы, FUT8, нокаутированные СНО клетки (см., например, Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004); Kanda, Y. et al., Biotechnol. Bioeng., 94(4): 680-688 (2006); и опубликованную Международную заявку WO 2003/085107).
Помимо этого, изобретение включает варианты антител с "бисекторными" (bisected, разрезанными пополам) олигосахаридами, например, такими, в которых биантенный олигосахарид, связанный с Fc областью антитела, разрезается пополам с помощью GlcNAc. Такие варианты антитела могут проявлять пониженную функцию фукозилирования и/или улучшенную ADCC функцию. Примеры таких вариантов антител описаны, например, в Международной патентной заявке WO 2003/011878 (Jean-Mairet et al.); патенте США No. 6602684 (Umana et al.); и в патентной заявке США US 2005/0123546 (Umana et al.). Также охватываются варианты антител по меньшей мере с одним остатком галактозы в олигосахариде, связанном с Fc областью. Такие варианты антител могут обладать повышенной CDC функцией. Такие варианты антител описаны, например, в Международных патентных заявках WO 1997/30087 (Patel et al.); WO 1998/58964 (Raju, S.); и WO 1999/22764 (Raju, S.).
В некоторых вариантах изобретения вариант антитела содержит Fc область с одной или более аминокислотных замен, которые дополнительно повышают ADCC, например, замены в положениях 298, 333 и/или 334 области Fc (Eu нумерация остатков). Такие замены могут осуществляться в комбинации с любым из вышеописанных вариантов.
В некоторых вариантах изобретение рассматривает вариант антитела, который обладает некоторыми, но не всеми, эффекторными функциями, что делает его желательным кандидатом для применения во многих случаях, когда важным является период полужизни антитела in vivo, в то время как некоторые эффекторные функции (такие как CDC (комплемент-зависимая цитотоксичность) и ADCC) являются необязательными или вредными. В некоторых вариантах изобретения определяют Fc активность антитела, чтобы гарантировать, что сохраняются только нужные свойства. Можно проводить in vitro и/или in vivo анализы цитотоксичности, чтобы подтвердить снижение/нормализацию (повышение) CDC и/или ADCC активности. Например, можно проводить анализы связывания Fc рецептора (FcR), чтобы убедиться, что отсутствует FcyR связывание антитела (следовательно, по-видимому, отсутствует ADCC активность), но сохраняется способность к FcRn связыванию. Первичные клетки для опосредования ADCC, NK клетки, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гемопоэтических клетках представлена в Таблице 3 на странице 464 в Ravetch and Kinet, Annu. Rev. Immunol. 9: 457-92 (1991). Неограничивающие примеры анализов in vitro пo оценке ADCC активности представляющей интерес молекулы описаны в патенте США No. 5500362 (см., например, Hellstrom, I., et al. Proc, Nat'l Acad. Sci. USA 83: 7059-7063 (1986)) и Hellstrom, I et al., Proc. Nat'l Acad. Sci. USA 82: 1499-1502 (1985); патенте США 5821337 (см. Bruggemann, M. et al., J. Exp. Med. 166: 1351-1361 (1987)). Или же можно использовать нерадиоактивные методы анализа (см., например, ACTI™ нерадиоактивный метод анализа цитотоксичности для проточной цитометрии (CellTechnology, Inc. Mountain View, CA); и CytoTox 96® нерадиоактивный метод анализа цитотоксичности (Promega, Madison, WI). Применимые для таких анализов эффекторные клетки включают мононуклеарные клетки периферической крови (РВМС) и естественные киллерные (NK) клетки. Или же, или помимо этого, ADCC активность представляющей интерес молекулы можно определять in vivo, например, на животной модели, такой, которая раскрывается в Clynes et al. Proc. Nat'l Acad. Sci. USA 95: 652-656(1998). Можно также проводить анализы связывания C1q для подтверждения того, что антитело неспособно связывать C1q и, следовательно, лишено CDC активности. Для оценки активации комплемента можно провести CDC анализ (см., например, Gazzano-Santoro et al., J. Immunol, Methods 202: 163 (1996); Cragg, M.S. et al., Blood 101: 1045-1052 (2003); и Cragg, M.S. и M.J. Glennie, Blood 103: 2738-2743 (2004)). Можно также провести определение FcRn связывания и in vivo определение клиренса/периода полужизни методами, известными в уровне техники (см., например, Petkova, S.B. el al., Int'l. Immunol. 18(12): 1759-1769 (2006)).
Изобретение также включает другие варианты антител, имеющие одну или более аминокислотных замен. Сайты, представляющие интерес для замещающего мутагенеза, включают гипервариабельные области, но также рассматриваются изменения в FR. Консервативные замены показаны в Таблице 1 под заголовком "предпочтительные замены." Более значительные изменения, озаглавленные "типичные замены", представлены в Таблице 1 или подробнее описаны ниже в ссылке на классы аминокислот. Аминокислотные замены можно вводить в антитело, представляющее интерес, а продукты подвергать скринингу, например, на заданную активность, такую как повышенное связывание с антигеном, пониженная иммуногенность, повышенная ADCC или CDC, и т.д.
Модификации биологических свойств антитела можно осуществлять, выбирая замены, которые влияют (а) на структуру полипептидного остова в области замены, например, в виде складчатой или спиральной конформации, (б) на заряд или гидрофобность молекулы в сайте- мишени, или (в) на объем боковой цепи. Аминокислоты можно разделить на группы в зависимости от сходства (подобия) свойств их боковых цепей (в A. L. Lehninger, in Biochemistry, second ed,, pp.73-75, Worth Publishers, New York (1975)):
(1) неполярные: Ala (A), Val (V), Leu (L), Ile (I), Pro (P), Phe (F), Trp (W), Met (M),
(2) незаряженные полярные: Gly (G), Ser (S), Thr (T), Cys (C), Tyr (Y), Asn (N), Gln(Q),
(3) кислые: Asp (D), Glu (E),
(4) основные: Lys (K), Arg (R), His(H).
Или же природные остатки можно разделить на группы с учетом общих свойств боковых цепей:
(1) гидрофобные: Норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислые: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, влияющие на ориентацию цепи: Gly, Pro;
(6) ароматические; Trp, Tyr, Phe.
Неконсервативные замены влекут за собой обмен одного из этих классов на другой класс. Такие замещающие остатки можно также вводить в сайты консервативных замен или в остальные (например, неконсервативные) сайты.
Один тип заместительного варианта (варианта с заменой) включает замещение одного или более остатков гипервариабельной области исходного антитела (например, гуманизированного или человеческого антитела). Обычно полученный(е) вариант(ы), выбираемый(е) для последующего исследования (разработки), проявляет(ют) модифицированные (например, улучшенные) биологические свойства по сравнению с исходным антителом, из которого они образованы. Типичный заместительный вариант (вариант с заменами) представляет собой антитело после созревания аффинности, которое удобнее всего получать, используя методы созревания аффинности на основе фагового дисплея. Коротко говоря, осуществляют мутацию в нескольких сайтах гипервариабельной области (например, в 6-7 сайтах), получая все возможные аминокислотные замены в каждом сайте. Образующиеся при этом антитела визуализируют в частицах нитевидных фагов в виде слияний по меньшей мере с частью белка оболочки фага (например, продукт гена III фага М13), упакованных внутри каждой частицы. Фаг-дисплейные варианты затем подвергают скринингу на биологическую активность (например, аффинность связывания). Для идентификации предполагаемых сайтов гипервариабельной области для модификации можно осуществить сканирующий мутагенез (например, аланин-сканирующий мутагенез), чтобы идентифицировать остатки в гипервариабельной области, которые вносят значительный вклад в связывание антигена. Или же, или помимо этого, может быть целесообразно проанализировать кристаллическую структуру комплекса антиген-антитело, чтобы идентифицировать точки контакта между антителом и антигеном. Такие контактные остатки и соседние остатки являются кандидатами на замену методами, известными в уровне техники, включая методы, усовершенствованные в данном описании. После создания таких вариантов проводят скрининг панели вариантов методами, известными в уровне техники, включая методы по данному описанию, и варианты с наилучшими свойствами в одном или более релевантных анализов могут быть выбраны для дальнейшей разработки.
Нуклеотидные молекулы, кодирующие варианты аминокислотной последовательности антитела, получают различными методами, известными в уровне техники. Эти методы включают, но без ограничения, выделение из природного источника (в случае природных вариантов аминокислотных последовательностей) или получение методом опосредуемого олигонуклеотидами (или сайт-направленного) мутагенеза, ПЦР-мутагенеза или кассетного мутагенеза ранее полученного варианта или не-вариантной версии антитела.
Может быть желательным ввести одну или более аминокислотных модификаций в Fc область антител по изобретению, при этом образуется вариант Fc области. Вариант Fc области может содержать человеческую последовательность Fc области (например, Fc область человеческого IgG1, IgG2, IgG3 или IgG4), включающую аминокислотную модификацию (например, замену) в одном или более положений аминокислот, в том числе модификацию цистеинового остатка шарнирной области.
В соответствии с этим описанием и указаниями в уровне техники рассматривается, что в некоторых вариантах изобретения антитело по изобретению может содержать одно или более изменений по сравнению с аналогичным антителом дикого типа, например, в Fc области. Тем не менее эти антитела сохраняют практически те же самые характеристики, необходимые для терапевтической полезности, по сравнению с их дикого типа аналогом. Например, полагают, что в Fc области можно сделать некоторые изменения, которые дадут измененные (либо повышенные, либо пониженные) C1q связывание и/или комплементзависимую цитотоксичность (CDC), например, как описано в Международной патентной заявке WO 99/51642. См. также Duncan & Winter, Nature 322: 738-40 (1988); патент США No. 5648260; патент США No. 5624821; и Международную патентную заявку WO 94/29351, где приводятся другие примеры вариантов Fc области. В Международных патентных заявках WO 00/42072 (Presta) и WO 2004/056312 (Lowman) описаны варианты антитела с повышенным и пониженным связыванием с FcRs. Содержание этих патентных публикаций вводится в данное описание в качестве ссылки. См. также Shields et al., J. Biol Chem. 9(2): 6591-6604 (2001). Антитела с повышенным периодом полужизни и повышенными параметрами связывания с Fc рецептором новорожденных (FcRn), который отвечает за перенос материнских IgGs плоду (Guyer et al., J. Immunol. 117: 587 (1976) и Kim et. al., J. Immunol. 24: 249 (1994)), описаны в опубликованной патентной заявке США US2005/0014934A1 (Hinton et al.). Эти антитела содержат Fc область с одной или более заменами, которые повышают характеристики связывания Fc области с FcRn. Варианты полипептидов с измененными последовательностями Fc области и повышенной или пониженной способностью C1q связывания описаны в патенте США Patent No. 6194551 В1, Международной патентной заявке WO 99/51642. Содержание этих патентных публикаций вводится в данное описание в качестве ссылки. См. также Idusogie et al., J. Immunol. 164: 4178-4184 (2000).
В другом аспекте изобретение включает антитела, содержащие модификации в интерфейсе Fc полипептидов, включающих Fc область, причем эти модификации облегчают и/или инициируют гетероизомеризацию. Эти модификации включают введение выступа в первый Fc полипептид и полости (впадины) во второй Fc полипептид, причем выступ позиционируется в полости таким образом, что инициируется образование комплекса первого и второго Fc полипептида. Методы получения антител с помощью таких модификаций известны в уровне техники, см., например, патент США No. 5731168.
В другом аспекте может потребоваться создать генно-инженерные антитела, содержащие цистеиновые остатки, например "тиоMAbs," в которых один или более остатков антитела заменен на цистеиновые остатки. В конкретных вариантах изобретения заменяемые остатки находятся в доступных сайтах антитела. Заменяя эти остатки на цистеин, тем самым в доступные сайты антитела помещают реактивные тиольные группы, которые можно использовать для конъюгации антитела с другими фрагментами, такими как лекарственные частицы или частицы линкер-лекарство, как представлено в данном описании далее. В некоторых вариантах изобретения какой-либо один или более из нижеприведенных остатков можно заменить на цистеин: V205 (нумерация Kabat) в легкой цепи; А118 (нумерация EU) тяжелой цепи; и S400 (нумерация EU) Fc области тяжелой цепи.
Производные антител
Антитела по настоящему изобретению можно далее модифицировать таким образом, чтобы они содержали дополнительные небелковые фрагменты, известные в уровне техники и легкодоступные. Предпочтительно, фрагментами, пригодными для дериватизации антитела, являются водорастворимые полимеры. Неограничивающие примеры водорастворимых полимеров включают, но без ограничения, полиэтиленгликоль (ПЭГ, PEG), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилена/малеинового ангидрида, полиаминокислоты (либо гомополимеры, либо случайные сополимеры) и декстран или поли-(н-винилпирролидон)полиэтиленгликоль, гомополимеры пропиленгликоля, сополимеры пропиленоксида/этиленоксида, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси. Преимуществом полиэтиленгликоля пропиональдегида в процессе получения может являться его устойчивость в воде. Полимер может иметь любую молекулярную массу и может быть разветвленным или неразветвленным. Число полимеров, связанных с антителом, может меняться, и если с антителом связывается более одного полимера, они могут представлять собой одинаковые или различные молекулы. В целом, число и/или тип полимеров, применяемых для дериватизации, можно определять, учитывая, но без ограничения, конкретные свойства или функции антитела, которое следует усовершенствовать, будет ли производное антитела применяться в терапии в определенных условиях и т.д.
Другой вариант изобретения включает конъюгаты антитела и небелковые фрагменты, которые можно селективно нагревать с помощью излучения. В одном варианте изобретения небелковый фрагмент представляет собой углеродную нанотрубку (Kam et al., Proc. Nat'l Acad. Sci. USA 102: 11600-11605 (2005)). Излучение может быть любой длины волны и включает, но без ограничения, длины волн, которые не повреждают обычные клетки, но которые нагревают небелковые частицы до температуры, при которой убиваются клетки, проксимальные к фрагменту антитело-небелковая частица.
Иммуноконъюгаты
Изобретение включает также иммуноконъюгаты (иначе называемые "конъюгаты антитело-лекарство" или "ADC"), содержащие антитело, конъюгированное с одним или более цитотоксических агентов, таких как химиотерапевтический агент, лекарство, ингибитор роста, токсин (например, белковый токсин, токсин с ферментативной активностью бактериального, грибкового, растительного или животного происхождения, или их фрагменты), или радиоактивный изотоп (т.е. радиоконъюгат).
Иммуноконъюгаты использовали для местной доставки цитотоксических агентов, т.е. лекарств, которые убивают или ингибируют рост или пролиферацию клеток при лечении рака (Lambert, J. (2005) Curr. Opinion in Pharmacology 5: 543-549; Wu et al. (2005) Nature Biotechnology 23(9); 1137-1146; Payne, G. (2003) i 3:207-212; Syrigos and Epenetos (1999) Anticancer Research 19: 605-614; Niculescu-Duvaz and Springer (1997) Adv. Drug Deliv. Rev. 26: 151-172; патент США No. 4975278). Иммуноконъюгаты содействуют целевой доставке частицы лекарства к опухоли и внутриклеточной аккумуляции в ней, тогда как системное введение неконъюгированных лекарств может привести к неприемлемым уровням токсичности в нормальных клетках, так же как в опухолевых клетках, которые требуется удалить (Baldwin et al., Lancet (Mar. 15, 1986) pp.603-05; Thorpe (1985) "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review," в Monoclonal Antibodies '84: Biological And Clinical Applications (A. Pinchera et al., eds) pp.475-506. Сообщалось, что для этой стратегии применимы как поликлональные, так и моноклональные антитела (Rowland et al., (1986) Cancer Immunol. Immunother. 21: 183-87). Лекарства, применимые в этих методах, включают дауномицин, доксорубицин, метотрексат и виндезин (Rowland et al., (1986) supra). Токсины, применяемые в конъюгатах антитело-токсин, включают бактериальные токсины, такие как дифтерийный токсин (дифтеротоксин), растительные токсины, такие как рицин, низкомолекулярные токсины, такие как гелданамицин (Mandler et al. (2000) J. Nat, Cancer Inst. 92(19): 1573-1581; Mandler et al. (2000) Bioorganic & Med. Chem. Letters 10: 1025-1028; Mandler et al. (2002) Bioconfugate Chem. 13: 786-791), майтанзиноиды (Европейский патент ЕР 1391213; Liu et al., (1996) Proc. Natl. Acad. Sci. USA 93: 8618-8623) и калихеамицин (Lode et al. (1998) Cancer Res. 58: 2928; Hinman et al. (1993) Cancer Res. 53: 3336-3342). Токсины могут проявлять свое токсическое действие по механизмам, включающим связывание тубулина, связывание ДНК или ингибирование топоизомераз. Некоторые цитотоксические лекарства имеют тенденцию инактивироваться или стать менее активными при конъюгации с большими антителами или лигандами для белковых рецепторов.
Зевалин® (ибритумомаб тиуксетан, Biogen/Idec представляет собой конъюгат антитело-радиоизотоп, состоящий из мышиного IgG1 каппа моноклонального антитела, специфического к CD20 антигену, находящемуся на поверхности нормальных и злокачественных В лимфоцитов, и радиоизотопа111In или90Y, связанный с помощью содержащего тиомочевинную группу линкера-хелатирующего агента ("хелатора") (Wiseman et al. (2000) Eur. Jour. Nucl. Med. 27(7): 766-77; Wiseman et al. (2002) Blood 99(12): 4336-42; Witziget al. (2002). J. din. Oncol. 20(10): 2453-63; Witzig et al. (2002) J. din. Oncol. 20(15): 3262-69). Хотя Зевалин обладает активностью против В- клеточной неходжкинской лимфомы (NHL), его применение у большинства пациентов вызывает тяжелую и продолжительную цитопению. Милотарг™ (гемтузумаб озогамицин, Wyeth Pharmaceuticals), конъюгат антитело-лекарство, состоящее из антитела huCD33, связанного с калихеамицином, был одобрен в 2000 году для лечения острого миелоидного лейкоза в виде инъекций (Drugs of the Future (2000) 25(7): 686; патенты США No. 4970198; 5079233; 5585089; 5606040; 5693762; 5739116; 5767285; 5773001). Начинается Фаза II испытаний кантузумаба мертанзина (Immunogen, Inc.), конъюгата антитело-лекарство, состоящего из антитела huC242, связанного через дисульфидный линкер SPP с молекулой майтанзиноида, DM1, для лечения раковых заболеваний, при которых экспрессируется CanAg, таких как рак толстой кишки, поджелудочной железы, желудка и другие типы рака. MLN-2704 (Millennium Pharm., BZL Biologies, Immunogen Inc.), конъюгат антитело-лекарство, состоящий из моноклонального антитела против простат-специфического мембранного антигена (ПСМА, PSMA), связанного с молекулой майтанзиноида, DM1, разрабатывается для возможного лечения рака предстательной железы. Ауристатины ауристатин Е (АЕ) и монометилауристатин (ММАЕ), синтетические аналоги доластатина, конъюгировали с химерными моноклональными антителами cBR96 (специфическими к антигену Lewis Y при карциномах) и сАС10 (специфическими к CD30 при злокачественных гематологических заболеваниях)) (Doronina et al. (2003) Nature Biotechnol. 21(7); 778-784) и находятся в стадии разработки для применения в терапии.
В некоторых вариантах изобретения иммуноконъюгат содержит антитело и химиотерапевтический агент или другой токсин. Химиотерапевтические агенты, применимые для создания иммуноконъюгатов, представлены в данном описании (например, см. выше). Ферментативно активные токсины и их фрагменты, которые можно использовать, включают А-цепь дифтерийного токсина, несвязывающие активные фрагменты дифтерийного токсина, А-цепь эндотоксина (из Pseudomonas aeruginosa), А-цепь рицина, А-цепь абрина, А-цепь модекцина, альфа-сарцин, белки тунга китайского (Aleurites fordii), белки dianthin, белки лаконоса американского (Phytolaca americana) (PAPI, PAPII и PAP-S), ингибитор момордика харантия (momordica charantia), курцин, кротин, ингибитор сапаонария оффициналис (sapaonaria officinalis), гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены. См., например, Международную патентную заявку WO 93/21232, опубликованную 28 октября 1993 года. Для получения конъюгированных с радиоактивными изотопами антител имеются различные радионуклиды. Примеры включают212Bi,131I,131In,90Y и186Re. Конъюгаты антитела и цитотоксического агента получают, применяя различные бифункциональные агенты для связывания белков, такие как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис- азидосоединения (такие как бис-(п-азидобензоил)гександиамин, производные бис-диазония (такие как бис-(п-диазонийбензоил)-этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат и "бис-активные фторсоединения (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин на основе рицина можно получать, как описано в Vitetta et al., Science, 238: 1098 (1987). Меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (МХ-DTPA) является типичным хелатирующим агентом для конъюгации радионуклида с антителом. См. Международную патентную заявку WO 94/11026.
Также в данном описании рассматриваются конъюгаты антитела с одним или более низкомолекулярных токсинов, таких как калихеамицин, майтанзиноиды, доластатины, ауростатины, трихотецины и СС1065 и производные этих токсинов, которые обладают активностью токсина.
Майтанзин и майтанзиноиды
В некоторых вариантах изобретения иммуноконъюгат содержит антитело (полноразмерное или фрагменты), конъюгированное с одной или более молекулами майтанзиноида.
Майтанзиноиды представляют собой митотические ингибиторы, которые ингибируют полимеризацию тубулина. Первоначально майтанзин был выделен из восточноафриканского кустарника Maytenus serrata (патент США No. 3896111). Позже было найдено, что некоторые микробы также продуцируют майтанзиноиды, такие как майтанзинол и сложные эфиры С-3 майтанзинола (патент США No. 4151042). Синтетический майтанзинол и его производные и аналоги раскрываются, например, в патентах США No. 4137230; 4248870; 4256746; 4260608; 4265814; 4294757; 4307016; 4308268; 4308269; 4309428; 4313946; 4315929; 4317821; 4322348; 4331598; 4361650; 4364866; 4424219; 4450254; 4362663 и 4371533.
Лекарственные агенты майтанзиноиды представляют собой заманчивые лекарственные агенты для применения в конъюгатах антител, потому что они: (i) относительно просто получаются ферментацией или химической модификацией, дериватизацией продуктов ферментации, (ii) способны к дериватизации функциональными группами, пригодными для конъюгации с антителами за счет несульфидных линкеров, (iii) устойчивы в плазме и (iv) эффективны по отношению к различным линиям опухолевых клеток.
Иммуноконъюгаты, содержащие майтанзиноиды, методы их получения и их применение в терапии раскрываются, например, в патентах США No. 5208020, 5416064 и Европейский патент ЕР 0425235 В1, раскрытие которых вводится в данное описании в качестве ссылки. Liu et al., Proc. Natl. Acad. Sci. USA 93: 8618-8623 (1996), описал иммуноконъюгаты, содержащие майтанзиноид, обозначенный DM1, связанный с моноклональным антителом С242, специфическим к колоректальному раку человека. Было обнаружено, что конъюгат проявляет высокую степень цитотоксичности по отношению к культивированным клеткам рака толстой кишки и противоопухолевую активность в in vivo анализе роста опухоли. Chari et al., Cancer Research 52: 127-131 (1992), описывают иммуноконъюгаты, в которых майтанзиноид был конъюгирован через дисульфидный линкер с мышиным антителом А7, связывающим антиген на линиях человеческих раковых клеток толстой кишки, или с другим мышиным моноклональным антителом ТА.1, которое связывает онкоген HER-2/neu. Цитотоксичность конъюгата ТА. 1-майтанзиноид проверяли in vitro на линии человеческих раковых клеток молочной железы SK-BR-3, которые экспрессируют 3×105 HER-2 поверхностных антигенов на клетку. Лекарственный конъюгат достигал степени цитотоксичности, аналогичной степени цитотоксичности свободного майтанзиноидного лекарства, которую можно было бы повысить, повышая число молекул майтанзиноида на молекулу антитела. В опытах на мышах конъюгат А7- майтанзиноид проявил низкую системную цитотоксичность.
Конъюгаты антитело-майтанзиноид получают путем связывания химической связью антитела с молекулой майтанзиноида без заметного снижения биологической активности ни антитела, ни майтанзиноида. См., например, патент США No. 5208020 (раскрытие которого вводится в данное описание в качестве ссылки). Показано, что в среднем 3-4 молекулы майтанзиноида, конъюгированные с молекулой антитела, эффективно повышают цитотоксичность по отношению к клеткам-мишеням, не оказывая негативного влияния на функцию или растворимость антитела, хотя предполагалось, что даже одна молекула токсина/антитело повышает цитотоксичность по сравнению с "голым" антителом. Майтанзиноиды хорошо известны в уровне техники, и их можно синтезировать известными методами или выделять из природных источников. Подходящие майтанзиноиды раскрываются, например, в патенте США No. 5208020 и в других патентах и непатентных публикациях, на которые даются вышеприведенные ссылки. Предпочтительными майтанзиноидами является майтанзин(ол) и его аналоги, модифицированные в ароматическом кольце или в других положениях молекулы майтанзинола, такие как различные сложные эфиры майтанзинола.
В уровне техники известно множество связывающих групп для получения конъюгатов антитело-майтанзиноид, включая, например, группы, описанные в патенте США No. 5208020 или в Европейском патенте ЕР 0425235 B1, Chari et al., Cancer Research 52: 127-131 (1992), и в патентной заявке США No. 10/960602, поданной 8 октября 2004 года, содержание которых вводится в данное описание ссылкой. Конъюгаты антитело-майтанзоид, содержащие линкерную составляющую SMCC, можно получать, как описано в патентной заявке США No. 10/960602, поданной 8 октября 2004 года. Связывающие (сшивающие) группы включают дисульфидные группы, тиоэфирные группы, группы, неустойчивые в кислой среде, фотолабильные группы или группы, неустойчивые к действию эстераз, раскрываемые в вышеуказанных патентах, причем предпочтительными являются дисульфидные и тиоэфирные группы. Другие связывающие группы описаны и проиллюстрированы в данном описании.
Конъюгаты антитела и майтанзиноида можно получать, используя ряд бифункциональных агентов, связывающих (сшивающих) белки, таких как N-сукцинимидил-3-(2-пиридилтио)пропионат (SPDP), сукцинимидил-4-(N- малеимидометил) циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат НС1), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис-(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)-этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат и бис-активные фторсоединения (такие как 1,5-дифтор-2,4-динитробензол). Особенно предпочтительные сшивающие агенты включают N-сукцинимидил-3-(2-пиридилтио)пропионат (SPDP) (Carlsson et al., Biochem. J. 173: 723-737 (1978)) и N-сукцинимидил-4-(2-пиридилтио)пентаноат (SPP) для образования дисульфидной связи.
Линкер может быть связан с майтанзиноидом в различных положениях в зависимости от типа связи. Например, сложноэфирную связь можно получать по реакции с гидроксильной группой обычными методами конденсации. Реакция может идти по гидроксильной группе в положении С-3, по гидроксиметильной группе в положении С-14 после модификации, по гидроксильной группе, введенной при модификации в положение С-15, и по гидроксильной группе в положении С-20. В предпочтительном варианте изобретения связь образуется в С-3 положении майтанзинола или аналога майтанзинола.
Ауристатины и доластатины
В некоторых вариантах изобретения иммуноконъюгаты содержат антитело, конъюгированное с доластатинами или пептидными аналогами и производными доластатинов, ауристатинами (патенты США No. 5635483; 5780588). Было показано, что доластатины и ауристатины препятствуют динамике микротрубочек, гидролизу GTP и делению ядер и клеток (Woyke et al. (2001) Antimicrob. Agents and Chemother. 45(12); 3580-3584) и проявляют противораковую (патент США No. 5663149) и противогрибковую активность (Pettit et al. (1998) Antimicrob. Agents Chemother. 42: 2961-2965). Молекула лекарства доластатина или ауристатина может связываться с антителом по N (амино)-концу или по С (карбоксильному)- концу пептидной молекулы лекарства (WO 02/088172).
Типичные варианты изобретения с ауристатином включают связанные с N-концом молекулы лекарства монометилауристатина DE и DF, раскрываемые в патентной заявке США Регистрационный No. 10/983340, поданной 5 ноября 2004 года, озаглавленной "Monomethylvaline Compounds Capable of Conjugation to Ligands," содержание которой во всей полноте вводится в данное описание в качестве ссылки.
Как правило, лекарства на основе пептидов можно получать, создавая пептидную связь между двумя или более аминокислотами и/или пептидными фрагментами. Такие пептидные связи можно получать, например, жидкофазным синтезом (см. Е. Schroder and K. Lubke, "The Peptides," volume 1, pp 76-136, 1965, Academic Press), который хорошо известен в химии пептидов. Лекарственные препараты ауристатин/доластатин можно получать методами, описанными в: патентах США 5635483; 5780588; Pettit et al. (1989) J. Am. Chem. Soc, 111: 5463-5465; Pettit et al. (1998) Anti-Cancer Drug Design 13: 243-277; Pettit, G.R., et al. Synthesis, 1996, 719-725; и Pettit et al. (1996) J. Chem. Soc. Perkin Trans. 15: 859-863. См. также Doronina (2003) Nat Biotechnol 21(7): 778-784; в патентной заявке США Регистрационный No. 10/983340, поданной 5 ноября 2004 года, озаглавленной "Monomethylvaline Compounds Capable of Conjugation to Ligands," содержание которой вводится в данное описание ссылкой во всей полноте (в заявке раскрываются, например, линкеры и методы получения монометилвалинов, таких как ММАЕ и MMAF, конъюгируемых с линкерами).
Калихеамицин
В других вариантах изобретения иммуноконъюгат содержит антитело, конъюгированное с одной или более молекулами калихеамицина. Антибиотик из семейства калихеамицина способен вызывать разрывы двухцепочечной ДНК в субпикомолярных концентрациях. О получении конъюгатов семейства калихеамицина см. патенты США No. 5712374, 5714586, 5739116, 5767285, 5770701, 5770710, 5773001, 5877296 (все принадлежат American Cyanamid Company). Структурные аналоги калихеамицина, которые можно использовать, включают, но без ограничения, γ1I, α2I, α3I, N-ацетил-γ1I, PSAG и θI1 (Hinman el al, Cancer Research 53: 3336-3342 (1993), Lode et al., Cancer Research 58: 2925-2928 (1998) и вышеуказанные патенты США, принадлежащие American Cyanamid). Другим противоопухолевым лекарством, с которым может конъюгироваться антитело, является QFA, который представляет собой антифолат. Как калихеамицин, так и QFA действуют в определенных сайтах внутри клетки и с трудом проходят через плазматическую мембрану. Поэтому поглощение клетками этих агентов с помощью опосредуемой антителом интернализации значительно повышает их цитотоксический эффект.
Другие цитотоксические агенты
Другие противоопухолевые агенты, которые могут конъюгироваться с антителами, включают BCNU, стрептозоицин, винкристин и 5-фторурацил, агенты из семейства, известного под общим названием LL-E33288 комплекс, описанные в патентах США No. 5053394, 5770710, а также эсперамицины (патент США No. 5877296).
Ферментативно активные токсины и их фрагменты, которые можно использовать, включают А цепь дифтерийного токсина, несвязывающие активные фрагменты дифтерийного токсина, А-цепь эндотоксина (из синегнойного бактериофага, Псевдомонас аэругиноза, Pseudomonas aeruginosa), А-цепь рицина. А-цепь абрина, А-цепь модекцина, альфа-сарцин, белки тунга китайского (Aleurites fordii), белки dianthin, белки лаконоса американского (Phytolaca americana) (PAPI, PAPII и PAP-S), ингибитор момордика харантия (momordica charantia), курцин, кротин, ингибитор сапаонария оффициналис (sapaonaria officinalis), гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены. См., например, Международную патентную заявку WO 93/21232, опубликованную 28 октября 1993 года.
Помимо этого, настоящее изобретение рассматривает иммуноконъюгат, образующийся между антителом и соединением с нуклеолитической активностью (например, рибонуклеазой или ДНК эндонуклеазой, такой как дезоксирибонуклеаза; ДНК-азой).
Для селективной деструкции опухоли антитело может содержать атом с высокой радиоактивностью. Имеется ряд радиоактивных радиоизотопов для получения радиоконъюгированных антител. Примеры включают At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu. Когда конъюгат применяют для детекции, он может содержать радиоактивный атом для сцинтиграфических исследований, например Тс-99 т или 1123, или спиновую метку для визуализации методом ядерного магнитного резонанса (ЯМР, NMR) (также известную как магниторезонансная томография, mri), такую как опять же йод-123, йод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Радиометки или другие метки можно включать в конъюгат известными способами. Например, пептид можно получать биосинтезом или химическим синтезом аминокислот, используя подходящие предшественники аминокислот, содержащие вместо водорода, например, фтор-19. Метки, такие как tc99m или I123, Re186, Re188 и In111, можно связывать через цистеиновый остаток в пептиде. Иттрий - 90 можно связывать через лизиновый остаток. Метод IODOGEN (Fraker et al. (1978) Biochem. Biophys. Res. Commun. 80: 49-57) можно применять для включения йода-123. В "Monoclonal Antibodies in Immunoscintigraphy" (Chatal, CRC Press 1989) подробно описаны другие методы.
Конъюгаты антитела и цитотоксический агент можно получать, используя различные бифункциональные агенты для связывания белков, такие как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис-(п-азидобензоил)гександиамин, производные бис-диазония (такие как бис-(п-диазонийбензоил)-этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат и бис-активные фторсоединения (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин на основе рицина можно получать, как описано в Vitetta et al., Science, 238: 1098 (1987). Меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (МХ-DTPA) является типичным хелатирующим агентом для конъюгации радионуклеотида с антителом. См. Международную патентную заявку WO 94/11026, Линкер может представлять собой "расщепляемый линкер", способствующий высвобождению цитотоксического лекарственного вещества в клетке. Например, можно использовать линкер, неустойчивый в кислой среде, линкер, чувствительный к действию пептидаз, фотолабильный линкер, диметильный линкер или дисульфидсодержащий линкер (Chari et al., Cancer Research 52: 127-131 (1992); патент США No. 5208020).
Соединения однозначно включают, но без ограничения, ADC, полученные с помощью кросслинкеров: BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC и сульфо-SMPB, и SVSB (сукцинимидил-(4-винилсульфон)бензоат), поставляемые промышленностью (например, от Pierce Biotechnology, Inc., Rockford, IL., U.S.A). См. страницы 467-498, 2003-2004 Applications Handbook and Catalog.
Приготовление конъюгатов лекарственных препаратов
В конъюгатах антитело-лекарство (ADC) антитело (АО) конъюгировано с одной или более молекулами (частицами) лекарственного вещества (D), например, около 1-20 молекул лекарственного конъюгируется с молекулой антитела, с помощью линкера (L). ADC Формулы I можно получать несколькими способами, применяя реакции из области органической химии, условия и реагенты, известные специалистам в данной области техники, включая: (1) реакцию нуклеофильной группы антитела с бивалентным линкерным реагентом с образованием Ab-L, связанных ковалентной связью, с последующей реакцией с молекулой лекарственного вещества D; и (2) реакцию нуклеофильной группы молекулы лекарственного вещества с бивалентным линкерным реагентом с образованием D-L, связанных ковалентной связью, с последующей реакцией с нуклеофильной группой антитела. Другие методы получения ADC представлены в данном описании.
Линкер может состоять из одного или более линкерных составляющих. Примеры линкерных составляющих включают 6-малеимидокапроил ("МС"), малеимидопропаноил ("МР"), валин-цитруллин ("val-cit"), аланин-фенилаланин ("ala-phe"), п-аминобензилоксикарбонил ("РАВ"), N-сукцинимидил 4-(2-пиридилтио) пентаноат ("SPP"), N-сукцинимидил 4-(N-малеимидометил)циклогексан-1 карбоксилат ("SMCC") и N-сукцинимидил (4-йодацетил) аминобензоат ("SIAB"). Другие линкерные составляющие известны в уровне техники и некоторые из них представлены в данном описании. См. также "Monomethylvaline Compounds Capable of Conjugation to Ligands," патентная заявка США Регистрационный No. 10/983340, поданная 5 ноября 2004 года, содержание которой ссылкой вводится в данное описание во всей полноте.
В некоторых вариантах изобретения линкер может содержать аминокислотные остатки. Типичные аминокислотные линкерные составляющие включают дипептид, трипептид, тетрапептид или пентапептид. Типичные дипептиды включают: валин-цитруллин (vc или val-cit), аланин-фенилаланин (af или ala-phe). Типичные трипептиды включают: глицин-валин-цитруллин (gly-val-cit) и глицин-глицин-глицин (gly-gly-gly). Аминокислотные остатки, которые составляют аминокислотную линкерную составляющую, включают природные аминокислотные остатки, а также минорные аминокислоты и неприродные аналоги аминокислот, таких как цитруллин. Аминокислотные линкерные составляющие можно создать и оптимизировать их селективность к ферментативному расщеплению конкретным ферментом, например ассоциированной с опухолью протеазой, катепсином В, С и D или плазмином.
Нуклеофильные группы в антителах включают, но без ограничения: (i) N-концевые аминогруппы; (ii) аминогруппы боковых цепей, например, лизина; (iii) тиольные группы боковых цепей, например, цистеина; и (iv) гидроксильную группу сахаров или аминогруппы, по которым антитело гликозилировано. Амино-, тиольные и гидроксильные группы являются нуклеофильными и способны реагировать с образованием ковалентных связей с электрофильными группами в молекулах линкеров и линкерных реагентов, включающих: (i) активные сложные эфиры, такие как NHS эфиры, HOBt эфиры, галогенформиаты и галогенагидриды кислот; (ii) алкил- и бензилгалогениды, такие как галогенацетамиды; (iii) альдегиды, кетоны, карбоксильная и малеимидная группы. Некоторые антитела содержат восстанавливаемые межцепные дисульфидные группы, т.е. цистеиновые мостики. Антитела можно сделать реакционно-способными в конъюгации с линкерными реагентами, восстанавливая их по реакции с восстановителем, таким как DTT (дитиотреитол). Теоретически при этом каждый цистеиновый мостик образует два реакционно-способных тиольных нуклеофила. Другие нуклеофильные группы можно вводить в антитела по реакции лизинов с 2-иминотиоланом (реагент Траута), при этом аминогруппа превращается в тиольную группу. Реакционно-способные тиольные группы можно ввести в антитело (или его фрагмент), вводя один, два, три, четыре или более цистеиновых остатков (например, получение мутантных антител, содержащих один или более не-нативных цистеиновых аминокислотных остатков).
Конъюгаты антитело-лекарство можно также получать модификацией антитела путем введения электрофильных фрагментов, которые могут реагировать с нуклеофильными заместителями в молекуле линкерного реагента или лекарственного вещества. Углеводные группы (сахара) в гликозилированных антителах можно окислять, например, периодатами с образованием альдегидо- или кетогрупп, которые могут реагировать с аминогруппой линкерных реагентов или молекул лекарственного вещества. Полученные иминогруппы шиффова основания могут образовывать устойчивую связь, или их можно восстановить, например, борогидридами с образованием устойчивых аминогрупп. В одном варианте изобретения реакцией углеводного фрагмента гликозилированного антитела либо с галактозоксидазой, либо с мета-периодатом натрия можно получать карбонильные (альдегидные или кето-) группы в белке, которые могут реагировать с соответствующими группами в лекарственном веществе (Hermanson, Bioconjugate Techniques). В другом варианте изобретения белки, содержащие N-концевой остаток серина или треонина, могут реагировать с мета-периодатом натрия, в результате на место первой аминокислоты встает альдегид (Geoghegan & Stroh, (1992) Bioconjugate Chem. 3: 138-146; патент США 5362852). Такие альдегиды могут реагировать с молекулой лекарственного вещества или нуклеофильной группой линкера.
Аналогично, нуклеофильные группы в молекуле лекарственного вещества включают, но без ограничения: амино-, тиольную, гидроксильную, гидразидную, оксимную, гидразиновую, тиосемикарбазоновую, гидразинкарбокси- и арилгидразидную группы, способные реагировать с образованием ковалентных связей с электрофильными группами в молекулах линкеров и линкерных реагентах, включая: (i) активные сложные эфиры, такие как NHS эфиры, HOBt эфиры, галогенформиаты и галогенагидриды кислот; (ii) алкил- и бензилгалогениды, такие как галогенацетамиды; (iii) альдегиды, кетоны, карбоксильная- и малеимидная группы.
Или же можно получать слитый белок, содержащий антитело и цитотоксический агент, например, методами рекомбинантной ДНК или пептидным синтезом. ДНК может содержать соответствующие области, кодирующие два участка конъюгата, либо прилежащие друг к другу (соседние), либо разделенные областью, кодирующей линкерный пептид, который не аннулирует заданные свойства конъюгата.
Еще в одном варианте изобретения антитело можно конъюгировать с "рецептором" (таким как стрептавидин) для утилизации в предварительном нацеливании на опухоли, при этом пациенту вводят конъюгат антитело-рецептор, а несвязавшийся конъюгат выводят из кровотока, используя очищающий (осветляющий) агент, а затем вводят "лиганд" (например, авидин), конъюгированный с цитотоксическим агентом (например, радионуклеотидом).
Некоторые методы получения антител
Некоторые методы гибридом
Моноклональные антитела по изобретению можно получать, используя метод гибридом, впервые описанный Kohler et al., Nature, 256: 495 (1975), позже описанный, например, Hongo et al., Hybridoma, 14 (3): 253-260 (1995), Harlow et al., Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling et al.+, in: Monoclonal Antibodies and T-Cell Hybridomas 563-681 (Elsevier, N.Y., 1981), и Ni, Xiandai Mianyixue, 26(4): 265-268 (2006) относительно гибридных человеческих клеток (человеческих гибридом). Другие методы включают методы, описанные, например, в патенте США No. 7189826, относящемся к получению моноклональных человеческих IgM-антител при использовании гибридомных линий. Применение человеческих гибридом (метод триом) описано Vollmers and Brandlein, Histology and Histopalhology, 20(3): 927-937 (2005) и Vollmers and Brandlein, Methods and Findings in Experimental and Clinical Pharmacology, 27(3): 185-91 (2005).
О различных методиках осуществления метода гибридом см., например, патентные заявки США US 2006/258841; US 2006/183887 (полностью человеческие антитела), US 2006/059575; US 2005/287149; US 2005/100546; US 2005/026229; и патенты США No. 7078492 и 7153507. Ниже представлен примерный протокол получения моноклональных антител методом гибридом. В одном варианте изобретения мышь или другое подходящее животное-хозяин, такое как хомяк, иммунизируют, выявляя лимфоциты, которые продуцируют или способны продуцировать антитела, специфически связывающиеся с белком, используемым для иммунизации. Антитела вырабатываются у животных с помощью нескольких (множественных) подкожных (sc) или интраперитонеальных (ip) инъекций полипептида, содержащего VEGF, или его фрагмента, и адъюванта, такого как монофосфориллипид А (MPL)/трегалоза-дикриномиколят (TDM) (Ribi Immunochem. Research, Inc., Hamilton, MT). Полипептид, содержащий VEGF, или его фрагмент можно получать хорошо известными в уровне техники методами, такими как методы рекомбинантной ДНК, некоторые из них подробнее описаны ниже. Сыворотку иммунизированных животных анализируют на антитела против VEGF и, необязательно, проводят бустер-иммунизацию. Лимфоциты животных, продуцирующие антитела против VEGF, выделяют. Или же лимфоциты можно иммунизировать in vitro.
Затем лимфоциты сливают с клетками миеломы, используя соответствующий гибридизующий агент, такой как полиэтиленгликоль, получают гибридому. См., например, Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986). Можно использовать миеломные клетки, которые эффективно гибридизуются, поддерживают стабильное продуцирование антитела на высоком уровне и чувствительны к среде, такой как среда HAT. Примеры миеломных клеток включают, но без ограничения, линии мышиных миеломных клеток, такие как линии клеток из мышиных опухолей МОРС-21 и МРС-11 от Salk Institute Cell Distribution Center, San Diego, California USA, и клетки SP-2 или X63-Ag8-653 из Американской коллекции типовых культур (American Type Culture Collection), Rockville, Maryland USA. Также описаны линии клеток гетеромиеломы мыши-человека для получения человеческих моноклональных антител (Kozbor, J. Immunol., 133: 3001 (1984); Brodeur et al. Monoclonal Antibody Production Techniques and Applications, pp.51-63 (Marcel Dekker, Inc., New York, 1987)).
Полученные таким образом гибридомы засевают в подходящей культуральной среде, например в среде, содержащей одно или более веществ, которые ингибируют рост или выживаемость негибридизованных родительских миеломных клеток. Например, если в родительских миеломных клетках не содержится фермент гипоксантин-гуанинфосфорибозилтрансфераза (ГГФТ, HGPRT или HPRT), культуральная среда для гибридом обычно включает гипоксантин, аминоптерин и тимидин (среда HAT), эти вещества предупреждают рост клеток, дефицитных по HGPRT. Предпочтительно, методы с культурами гибридомных клеток в бессывороточных средах применяют, чтобы уменьшить использование животной сыворотки, такой как фетальная бычья сыворотка, как описано, например, в Even et al., Trends in Biotechnology, 24(3), 105-108 (2006).
Олигопептиды, как инструмент для повышения продуктивности культур гибридомных клеток, описаны в Franek, Trends in Monoclonal Antibody Research, 111-122 (2005). Конкретно, стандартные культуральные среды обогащают некоторыми аминокислотами (аланином, серином, аспарагином, пролином) или фракциями белковых гидролизатов, а апоптоз можно в значительной степени подавить синтетическими олигопептидами, состоящими из трех-шести аминокислотных остатков. Пептиды присутствуют в миллимолярных или более высоких концентрациях.
Культуральную среду, в которой выращиваются гибридомные клетки, можно анализировать на продуцирование моноклональных антител, которые связываются с VEGF. Специфичность связывания моноклональных антител, продуцируемых гибридомными клетками, можно определять иммунопреципитапией или с помощью in vitro анализа связывания, такого как радиоиммуноанализ (РИА, RIA) или твердофазный иммуноферментный анализ (ELISA). Аффинность связывания моноклонального антитела можно определять, например, методом Скетчарда. См., например, Munson et al., Anal. Biochem., 107: 220 (1980).
После идентификации гибридомных клеток, которые продуцируют антитела с заданной специфичностью, аффинностью и/или активностью, клоны можно субклонировать методом предельных разведений и выращивать стандартными методами. См., например, Coding, supra. Подходящие культуральные среды для этой цели включают, например, среду D-MEM или RPMI-1640. Кроме того, гибридомные клетки можно выращивать in vivo в виде асцитных опухолей у животных. Моноклональные антитела, секретируемые субклонами, соответствующим образом отделяют от культуральной среды, асцитной жидкости или сыворотки традиционными методами очистки иммуноглобулинов, например, такими как хроматография на белок А-сефарозе, гидроксиапатите, электрофорез в геле или аффинная хроматография. Один способ отделения белков от гибридомных клеток описан в патентной заявке США 2005/176122 и в патенте США No. 6919436. Метод включает применение минимальных добавок солей, таких как лиотропные соли, в процессе связывания и, предпочтительно, малых количеств органических растворителей в процессе элюции.
Некоторые методы скрининга библиотек
Антитела по изобретению можно получать, используя комбинаторные библиотеки для скрининга антител с заданной активностью или активностями. Например, в уровне техники известны различные методы получения фаг-дисплейных библиотек на антитела, обладающие заданными характеристиками связывания. Такие методы в целом описаны Hoogenboom et al. в Methods in Molecular Biology 178: 1-37 (O'Brien et. al., ed., Human Press, Totowa, NJ, 2001). Например, в одном методе получения антител, представляющих интерес, используется фаговая библиотека антител, как описано Lee et al., J. Mol. Biol. (2004), 340(5); 1073-93.
В принципе клоны синтетических антител отбирают скринингом фаговых библиотек, содержащих фаг, который визуализирует различные фрагменты вариабельной области (Fv) антитела, слитые с белком оболочки фага. Такие фаговые библиотеки сортируют аффинной хроматографией против заданного антигена. Клоны, экспрессирующие Fv фрагменты, способные связываться с заданным антигеном, адсорбируют на антигене и таким образом отделяют от несвязывающихся клонов в библиотеке. Связывающиеся клоны затем элюируют с антигена, и их можно дополнительно обогащать, используя дополнительные циклы адсорбции (поглощения) антигеном/элюции. Любое из антител по изобретению можно получать с помощью скрининга подходящим антигеном, чтобы выбрать клон фага, представляющий интерес, с последующим конструированием клона полноразмерного антитела, используя Fv последовательности из представляющего интерес клона фага и подходящие последовательности константной области (Fc), описанные в Kabat et al. Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols. 1-3.
В некоторых вариантах изобретения антигенсвязывающий домен антитела образуется из двух вариабельных (V) областей, содержащих, примерно, 110 аминокислот, одна из которых легкой (VL), а другая из тяжелой (VH) цепей, обе они предоставляют три гипервариабельных петли (HVR) или области, определяющие комплементарность (CDR). Вариабельные домены можно визуализировать функционально на фаге либо в виде одноцепочечных Fv (scFv) фрагментов, в которых VH и VL ковалентно связаны коротким гибким пептидом, либо в виде фрагментов Fab, где каждая из них слита с константным доменом и взаимодействует с помощью нековалентной связи, как описано в Winter et al., Ann. Rev. Immunol, 12: 433-455 (1994). В данном описании клоны фага, кодирующие scFv, и клоны фага, кодирующие Fab, совместно называют "клоны фага Fv " или "Fv клоны."
Набор генов VH и VL можно по отдельности клонировать полимеразной цепной реакцией (ПЦР, PCR) и произвольно рекомбинировать в фаговых библиотеках, которые можно затем исследовать на антиген связывающие клоны, как описано Winter et al., Ann. Rev. Immunol., 12: 433-455 (1994). Библиотеки из иммунизированных источников включают антитела с высокой аффинностью к иммуногену, конструирование гибридом не является необходимым условием. Или же можно клонировать наивный набор, чтобы получить единственный источник человеческих антител к широкому ряду не-аутоантигенов, а также аутоантигенов без какой-либо иммунизации, как описано Griffiths et al., EMBO J, 12: 725-734 (1993). Наконец, наивные библиотеки можно также создавать синтетическим способом, клонируя неаранжированные V-генные сегменты с применением стволовых клеток и используя ПЦР-праймеры, содержащие случайную последовательность, чтобы кодировать высоковариабельные области CDR3 и осуществить реаранжировку in vitro, как описано Hoogenboom and Winter, J. Mol. Biol, 227: 381-388 (1992).
В некоторых вариантах изобретения нитевидный фаг используют для визуализации фрагментов антитела слиянием с минорным белком оболочки pIII. Фрагменты антитела можно визуализировать в виде одноцепочечных Fv фрагментов, в которых VH и VL домены связаны в одной и той же полипептидной цепи гибким полипептидным спейсером, например, как описано Marks et al., J. Mol. Biol, 111; 581-597 (1991), или в виде Fab фрагментов, в которых одна цепь связывается с pIII, а другая секретируется в периплазму бактериальной клетки-хозяина, где сборка Fab-структура белка оболочки визуализируется на поверхности фага, замещая некоторые оболочечные белки дикого типа, как описано, например, в Hoogenboom et al., Nucl. Acids Res., 19: 4133-4137 (1991).
Как правило, нуклеиновые кислоты генов, кодирующих фрагменты антител, получают при использовании иммунных клеток человека или животных. Если требуется библиотека с особым предпочтением к клонам антител против VEGF, субъекта иммунизируют с помощью VEGF, чтобы выработать антительный ответ, и клетки селезенки и/или В клетки, циркулирующие с кровотоком, отличные от лимфоцитов периферической крови (PBL), выделяют для создания библиотеки. В предпочтительном варианте изобретения библиотеку генных фрагментов антител, предпочтительно, содержащую клоны генов антител против VEGF, получают, вырабатывая антительный ответ против VEGF у трансгенных мышей, несущих ряд функциональных генов иммуноглобулинов человека (и не содержащих систему, продуцирующую функциональные эндогенные антитела), так что VEGF иммунизация вызывает продуцирование человеческих антител против VEGF в B клетках. Получение трансгенных мышей, вырабатывающих человеческие антитела, описано ниже.
Дополнительного обогащения анти-VEGF реактивной популяцией клеток можно достичь, используя подходящий метод скрининга, чтобы выделить В клетки, экспрессирующие VEGF-специфическое мембраносвязанное антитело, например, отделением клеток с помощью VEGF аффинной хроматографии или адсорбции клеток на меченном флуорохромом VEGF с последующим анализом на проточном цитометре (FACS).
Или же использование клеток селезенки и/или В клеток или других PBL неиммунизированного донора позволяет лучше представить возможный спектр антител, а также позволяет создать библиотеку антител с применением животного любого вида (человека и вида, отличного от человека), у которого VEGF не специфично к антигену. Для библиотек, включающих in vitro конструкцию гена антитела, у субъекта берут стволовые клетки для получения нуклеиновых кислот, кодирующих неаранжированные генные сегменты антител. Представляющие интерес иммунные клетки можно получать от животных различных видов, таких как человек, мышь, крыса, зайцеобразные, волчьи, псовые, кошачьи, свиные, крупный рогатый скот, лошадиные и птицы.
Нуклеиновые кислоты генных сегментов, кодирующих вариабельные области антител (включая VH и VL сегменты), выделяют из клеток, представляющих интерес, и амплифицируют. В случае библиотек реаранжированных генов VH и VL заданную ДНК можно получать, выделяя геномную ДНК или мРНК из лимфоцитов с последующей полимеразной цепной реакцией (ПЦР, PCR) с праймерами, соответствующими 5' и 3' концам реаранжированных VH и VL генов и описанными в Orlandi et al., Proc. Natl. Acad. Sci. (U.S.A), 86: 3833-3837 (1989), при этом получают набор различных V генов для экспрессии. V гены можно амплифицировать при использовании кДНК и геномной ДНК с обратными праймерами на 5' конце экзона, кодирующего зрелый V-домен, и прямыми праймерами в последовательности для J-сегмента, как описано в Orlandi et al. (1989) и в Ward et al., Nature, 341: 544-546 (1989). Однако для амплификации с помощью кДНК обратные праймеры могут также быть в экзоне лидерной последовательности, как описано Jones et al., Biotechnol, 9: 88-89 (1991), а прямые праймеры в (последовательности для) константной области, как описано у Sastry et al., Proc. Natl. Acad. Sci. (U.S.A), 86: 5728-5732 (1989). Для того чтобы максимально повысить комплементарность, в праймеры можно включать вырожденность, как описано у Orlandi et al. (1989) или Sastry el al (1989). В некоторых вариантах изобретения максимально повышают разнообразие библиотек, используя ПЦР праймеры, нацеленные на каждое семейство V-генов, чтобы амплифицировать все имеющиеся VH и VL комбинации, присутствующие в образце нуклеиновых кислот иммунных клеток, например, как описано в методе Marks et al., J. Mol. Biol., 222: 581-597 (1991) или как описано в методе Orum et al., Nucleic Acids Res., 21: 4491-4498 (1993). Для клонирования амплифицированной ДНК в экспрессирующие векторы маскированные сайты рестрикции можно ввести в ПЦР праймер в виде метки (тэга) на одном конце, как описано у Orlandi et al. (1989), или с помощью дополнительной ПЦР- амплификации с меченным тэгом праймером, как описано у Clackson et al., Nature, 352: 624-628 (1991).
Набор синтетическими методами реаранжированных V генов можно получать in vitro с помощью V генных сегментов. Было клонировано и секвенировано большинство человеческих VH-генных сегментов (описаны в Tomlinson et al., J. Mol. Biol., 227: 776-798 (1992)) и картировано (описаны в Matsuda et al., Nature Genet., 3: 88-94 (1993); эти клонированные сегменты (включая все основные конформации H1 и Н2 петли) можно использовать для создания разнообразных наборов VH генов с праймерами, кодирующими Н3 петли с разнообразием последовательностей и различной длины, как описано у Hoogenboom and Winter, J. Mol. Biol, Til: 381-388 (1992). Наборы VH также можно создавать со всем разнообразием последовательностей, сосредоточенным в длинной НЗ петле одной длины, как описано у Barbas et al., Proc. Natl. Acad. Sci. U.S.A. 89: 4457-4461 (1992). Были клонированы и секвенированы человеческие Vκ и Vλ сегменты (описано в Williams and Winter, Eur. J. Immunol., 23: 1456-1461 (1993)), и их можно использовать для создания набора синтетических легких цепей. Набор синтетических V генов с учетом протяженности VH и VL складок и длин L3 и Н3 кодирует антитела со значительным структурным разнообразием. После амплификации ДНК генов, кодирующих V-область, V-генные сегменты зародышевой линии можно реанжировать in vitro в соответствии с методами Hoogenboom and Winter, J. Mol Biol, 227: 381-388 (1992).
Наборы фрагментов антител можно конструировать, объединяя вместе наборы генов VH и VL различными методами. Каждый набор можно создавать в различных векторах, и векторы снова объединять in vitro, например, как описано у Hogrefe et al., Gene, 128: 119-126 (1993), или in vivo с помощью сочетанной инфекции, например, системы 1охР, описанной в Waterhouse et al., Nucl. Acids Res., 21: 2265-266 (1993). В методе in vivo рекомбинации двухцепочечный характер фрагментов Fab используется для того, чтобы преодолеть предел размера библиотеки, определяемый эффективностью трансформации в Е.coli. Наивные наборы (наборы наивных генов) для VH и VL клонируют по отдельности, один в фагмидный, а другой в фаговый вектор. Затем две библиотеки объединяют с помощью фаговой инфекции бактерий, содержащих фагмиды, так что каждая клетка содержит различные комбинации, а размер библиотек ограничивается числом присутствующих клеток (около 1012 клонов). Оба вектора содержат in vivo сигналы рекомбинации, так что VH и VL гены рекомбинируются в один репликон и совместно упаковываются в вирионы фагов. Эти колоссальные библиотеки предоставляют большие количества разнообразных антител с хорошей аффинностью (Kd-1около 10-8 М).
Или же наборы можно клонировать последовательно в один и тот же вектор, например, как описано у Barbas et al., Proc. Natl. Acad. Sci. U.S.A. 88: 7978-7982 (1991), или собирать вместе с помощью ПЦР, а затем клонировать, например, как описано Clackson et al., Nature, 352: 624-628 (1991). ПЦР-сборку можно также применять для связывания ДНК для VH и VL с ДНК, кодирующей гибкий пептидный спейсер, с образованием набора одноцепочечных Fv (scFv). Еще в одном методе "ПЦР-сборку в клетке" используют для связывания генов VH и VL внутри лимфоцитов с помощью ПЦР, а затем клонируют наборы связанных генов, как описано у Embleton et al., Nucl. Acids Res., 10: 3831-3837 (1992).
Антитела, продуцированные библиотеками наивных ДНК (либо природных, либо синтетических), могут иметь умеренную аффинность (Kd-1 около 106-107 М-1), но созревание аффинности можно также имитировать in vitro, создавая вторичные библиотеки и проводя их повторную селекцию, как описано у Winter et al. (1994), supra, Например, случайную мутацию можно вводить in vitro, используя ПЦР пониженной точности (допускающую ошибки) (описанную в Leung et al., Technique, 1: 11-15 (1989)) по методу Hawkins et al., J. Mol Biol, 226: 889-896 (1992) или по методу Gram et al., Proc. Natl. Acad Sci U.S.A., 89: 3576-3580 (1992). Помимо этого, созревание аффинности можно осуществлять случайной мутацией одного или более CDR, например, используя ПЦР праймеры, несущие случайные последовательности, перекрывающие целевые CDR, в выбранных индивидуальных Fv клонах и скринингом на клоны с повышенной аффинностью. В Международной патентной заявке WO 9607754 (опубликованной 14 марта 1996 года) описывается метод индукции мутагенеза в области, определяющей комплементарность (CDR), легкой цепи иммуноглобулина с целью создания библиотеки генов легкой цепи. Другим эффективным методом является рекомбинация VH или VL доменов, отобранных с помощью фагового дисплея с применением набора природных вариантов V домена, полученных от неиммунизированных доноров, и скрининг на повышенную аффинность в ходе нескольких циклов повторного шаффлинга цепей, как описано у Marks et al., Biotechnol, 10: 779-783 (1992). Этот метод позволяет получать антитела и фрагменты антител с аффинностью около 10-9 М или менее.
Скрининг библиотек можно осуществлять различными методами, известными в уровне техники. Например, для иммобилизации в лунках планшетов для адсорбции можно использовать VEGF, экспрессируемый на клетках-хозяевах, прикрепленных к адсорбционным планшетам, или используемый в сортинге клеток, или конъюгированный с биотином для захвата гранулами, покрытыми стрептавидином, или используемый в любом другом методе для пэннинга ("просеивания") фаг-дисплейных библиотек.
Образцы из фаговой библиотеки контактируют с иммобилизованным VEGF в условиях, подходящих для связывания по меньшей мере участка фаговых частиц с адсорбентом. Обычно выбирают условия, включая рН, ионную силу, температуру и т.п., имитирующие физиологические условия. Фаги, связанные с твердой фазой, отмывают, а затем элюируют кислотой, например, как описано в Barbas et al., Proc. Natl. Acad. Sci U.S.A, 88: 7978-7982 (1991), или щелочью, как описано в Marks et al., J. Mol Biol., 222: 581-597 (1991), или за счет конкуренции VEGFc антигеном, например, в методе, аналогичном методу конкуренции с антигеном Clackson et al., Nature, 352: 624-628 (1991). Фаги можно обогатить в 20-1000 раз в одном цикле селекции. Более того, обогащенные фаги можно выращивать в бактериальной культуре и проводить дополнительные циклы селекции.
Эффективность селекции зависит от многих факторов, включая кинетику диссоциации в процессе отмывки и то, могут ли несколько фрагментов антитела на одном фаге одновременно контактировать с антигеном. Антитела с быстрой скоростью диссоциации (и слабой аффинностью связывания) могут удерживаться, если используются кратковременные отмывки, фаговый диплей мультивалентных форм и высокая плотность покрытия антигена в твердой фазе. Высокая плотность не только стабилизирует фаг в процессе мультивалентных взаимодействий, но и способствует повторному связыванию диссоциированного фага. Селекцию антител с медленной скоростью диссоциации (и высокой аффинностью связывания) можно промотировать, используя длительные отмывки и моновалентный фаговый дисплей, как описано в Bass et al., Proteins, 8: 309-314 (1990) и в Международной патентной заявке WO 92/09690, и низкую плотность покрытия (иммобилизации) антигена, как описано в Marks et al., Biotechnol, 10: 779-783 (1992).
Можно выбирать между фаговыми антителами с различной аффинностью, даже с аффинностью, которая слабо различается, к VEGF. Однако случайные мутации выбранного антитела (например, осуществляемые в некоторых методах созревания аффинности), по-видимому, дает множество мутантов, большинство связывается с антигеном, а некоторые с повышенной аффинностью. При ограничении VEGF редкий высокоаффинный фаг мог бы конкурировать. Для сохранения всех высокоаффинных мутантов фаги можно инкубировать с избытком биотинилированного VEGF, но с биотинилированным VEGF в более низкомолярной концентрации, чем целевая константна аффинности по отношению к VEGF. Фаги с высокоаффинным связыванием могут затем захватываться покрытыми стрептавидином парамагнитными гранулами (бусами). Такой "равновесный процесс захвата" ("улавливания") способствует селекции антител в соответствии с их аффинностью связывания с чувствительностью, которая содействует выделению мутантных клонов с всего лишь в два раза более высокой аффинностью из большого избытка фагов с пониженной аффинностью. Условия, применяемые при отмывке фагов, связанных с твердой фазой, также можно изменять, чтобы провести селекцию в соответствии с кинетикой диссоциации.
Можно проводить отбор клонов антител против VEGF на основе активности. В некоторых вариантах изобретение включает антитела против VEGF, которые связываются с живыми клетками, в естественном состоянии экспрессирующими VEGF. В одном варианте изобретение включает антитела против VEGF, которые блокируют связывание между лигандом VEGF и VEGF, но не блокируют связывание между лигандом VEGF и вторым белком. Fv клоны, соответствующие таким антителам против VEGF, можно отбирать, используя (1) выделение клонов антител против VEGF из фаговой библиотеки, как описано выше, и, необязательно, амплификацию выделенной популяции фаговых клонов выращиванием популяции в соответствующем бактериальном хозяине; (2) отбор (селекцию) VEGF и второго белка, против которых желательна, соответственно, блокирующая и неблокирующая активность; (3) адсорбцию фаговых клонов антител против VEGF на иммобилизованном VEGF; (4) использование избытка второго белка для элюции любых ненужных клонов, которые узнают VEGF-связывающие детерминанты, перекрывающиеся или общие со связывающими детерминантами второго белка; и (5) элюцию клонов, остающихся адсорбированными после стадии (4). Необязательно, клоны с заданными блокирующими/неблокирующими свойствами можно далее обогащать в повторных процедурах селекции, представленных в данном описании один или более раз.
ДНК, кодирующую полученные с помощью гибридом моноклональные антитела или фаг-дисплейные Fv клоны по изобретению, легко выделять и секвенировать традиционными методами (например, используя олигонуклеотидные праймеры, созданные для конкретной амплификации целевых областей, кодирующих тяжелую и легкую цепь, с применением матрицы гибридомной или фаговой ДНК). После выделения ДНК можно поместить в экспрессирующие векторы, которые затем трансфецируют в клетки-хозяева, такие как клетки Е.coli, обезьяньи клетки COS, клетки яичника китайского хомяка (СНО) или миеломные клетки, которые иначе не продуцируют иммуноглобулиновый белок, чтобы осуществить синтез заданных моноклональных антител в рекомбинантных клетках-хозяевах. Обзорные статьи о рекомбинантной экспрессии ДНК, кодирующей антитело, в бактериях включают Skerra et al., Curr. Opinion in Immunol, 5: 256 (1993) и Pluckthun, Immunol. Revs, 130: 151 (1992).
ДНК, кодирующую Fv клоны по изобретению, можно связывать с известными ДНК-последовательностями, кодирующими константные области тяжелой цепи и/или легкой цепи (например, соответствующие ДНК-последовательности можно получить из Kabat el al, supra), чтобы получить клоны, кодирующие тяжелую и/или легкую цепи полной или неполной длины (частичные). Понятно, что для этой цели можно использовать константные области любого изотипа, включая константные области IgG, IgM, IgA, IgD и IgE, и что такие константные области можно получать от человека и животных любого вида. В определение "химерное" и "гибридное" антитело по данному описанию входит клон Fv, образованный с применением ДНК вариабельного домена животного одного вида (такого как человек), а затем слитый с ДНК константной области животного другого вида с образованием кодирующей(их) последовательности(ей) для "гибридной" полноразмерной тяжелой цепи и/или легкой цепи. В некоторых вариантах изобретения Fv клон, полученный с применением человеческой вариабельной ДНК, сливают с ДНК человеческой константной области с образованием кодирующей(их) последовательности(ей) для полноразмерной или частичной человеческой тяжелой и/или легкой цепей.
ДНК, кодирующую антитело против VEGF, получают при использовании гибридомы по изобретению, можно также модифицировать, например, заменой кодирующей последовательности на человеческие константные домены тяжелой и легкой цепей вместо гомологичных мышиных последовательностей гибридомного клона (например, как в методе Morrison et al., Proc. Natl. Acad. Sci. U.S.A. 81: 6851-6855 (1984)). ДНК, кодирующую антитело, полученное с помощью гибридомы или Fv клона, или его фрагмент, можно далее модифицировать, связывая ковалентной связью последовательность, кодирующую иммуноглобулин, с полной последовательностью или с частью последовательности, кодирующей неиммуноглобулиновый полипептид. Таким образом получают "химерные" или "гибридные" антитела, обладающие специфичностью связывания антител по изобретению, образованных с помощью Fv клона или гибридомного клона.
Векторы, клетки-хозяева и методы рекомбинантной ДНК
Антитела можно также получать, используя методы рекомбинантной ДНК. Для получения антитела против VEGF методами рекомбинантной ДНК нуклеиновую кислоту, кодирующую антитело, выделяют и встраивают в реплицируемый вектор для последующего клонирования (амплификации ДНК) или для экспрессии. ДНК, кодирующую антитело, можно легко выделять и секвенировать традиционными методами (например, используя олигонуклеотидные зонды, которые способны специфически связываться с генами, кодирующими тяжелые и легкие цепи антитела). Существует множество векторов. Компоненты (составляющие) Векторы обычно включают, но без ограничения, следующие компоненты (составляющие): сигнальную последовательность, ориджин репликации, один или более маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции.
Сигнальная последовательность
Антитело по изобретению можно продуцировать методом рекомбинантной ДНК не только непосредственно, но также в виде белка, слитого с гетерологичным полипептидом, который, предпочтительно, представляет собой сигнальную последовательность или другой полипептид, имеющий специфический сайт расщепления на N-конце зрелого белка или полипептида. Выбираемая предпочтительно гетерологичная сигнальная последовательность представляет собой последовательность, которая распознается и процессируется (например, расщепляется сигнальной пептидазой) в клетках-хозяевах. В случае прокариотических клеток, которые не распознают и не процессируют сигнальную последовательность нативного антитела, сигнальную последовательность заменяют сигнальной последовательностью прокариотического происхождения, выбранной, например, из группы, включающей лидерные последовательности щелочной фосфатазы, пенициллиназы, lpp или термоустойчивого энтеротоксина II. Для секреции в дрожжах нативнуто сигнальную последовательность можно заменить на лидерную последовательность дрожжевой инвертазы, лидерную последовательность α-фактора (включая лидерные последовательности α-фактора Saccharomyces и Kluiveromyces) или лидерную последовательность кислой фосфатазы, лидерную последовательность глюкоамилазы С.albicans или сигнальную последовательность, описанную в Международной патентной заявке WO 90/13646. Для экспрессии в клетках млекопитающих имеются сигнальные последовательности млекопитающих, а также секреторные лидерные последовательности вирусов, например сигнальная последовательность gD вируса простого герпеса.
Ориджин репликации
Как экспрессирующие, так и клонирующие векторы содержат нуклеотидную последовательность, способствующую репликации вектора в одной или более выбранных клетках-хозяевах. Обычно в клонирующих векторах эта последовательность является последовательностью, которая позволяет вектору реплицироваться независимо от хромосомной ДНК хозяина и включает ориджины репликации или автономно реплицирующиеся последовательности. Такие последовательности для различных бактерий, дрожжей и вирусов хорошо известны. Ориджин репликации с помощью плазмиды pBR322 применим для большинства грамотрицательных бактерий, Ориджин плазмиды 2µ применим для дрожжей, а различные вирусные ориджины репликации (SV40, полиомы, аденовируса, VSV или BPV) применимы для клонирующих векторов в клетках млекопитающих. Обычно ориджин репликации не требуется для работы с экспрессирующими векторами в клетках млекопитающих (ориджин SV40 обычно можно применять только потому, что он содержит ранний промотор).
Селективный ген
Экспрессирующие и клонирующие векторы могут содержать ген селекции, также называемый селективным маркером. Типичные гены селекции кодируют белки, которые (а) придают устойчивость к антибиотикам или другим токсинам, например ампициллину, неомицину, метотрексату или тетрациклину, (б) восполняют ауксотрофный дефицит или (в) поставляют важные питательные вещества, отсутствующие в комплексных средах, например ген, кодирующий D-аланинрацемазу для бактерий рода Bacilli.
В одном примере в схеме селекции используется лекарство для прекращения роста клетки-хозяина. Такие клетки, которые успешно трансформируются гетерологичным геном, продуцируют белок, придающий резистентность к лекарству, и, следовательно, выживаемость в схеме селекции. В примерах такой доминантной селекции используют лекарства неомицин, микофенольную кислоту и гигромицин.
Другими примерами подходящих селективных маркеров для клеток млекопитающих являются селективные маркеры, которые содействуют идентификации клеток, способных (компетентных) принимать нуклеиновую кислоту, кодирующую антитело, такие как DHFR, глутаминсинтетаза (GS), тимидинкиназа, металлотионеин-I и -II, предпочтительно гены металлотионеина приматов, аденозиндеаминаза, орнитиндекарбоксилаза и т.д.
Например, клетки, трансформированные геном DHFR, идентифицируют, культивируя трансформанты в культуральной среде, содержащей метотрексат (Mtx), конкурентный антагонист DHFR. В этих условиях ген DHFR амплифицируется наряду с любой другой котрансформированной нуклеиновой кислотой. Можно использовать линию клеток яичника китайского хомяка (СНО), дефицитную по активности эндогенной DHFR (например, АТСС CRL-9096).
Или же клетки, трансформированные геном GS, идентифицируют, культивируя трансформанты в культуральной среде, содержащей L-метионин-сульфоксимин (Msx), ингибитор GS. В этих условиях ген GS амплифицируется наряду с любой другой котрансформированной нуклеиновой кислотой. GS систему селекции/амплификации можно использовать в комбинации с DHFR системой селекции/амплификации, описанной выше.
Или же клетки-хозяева (в особенности дикого типа хозяева, которые содержат эндогенную DHFR), трансформированные или котрансформированные ДНК-последовательностями, кодирующими целевое антитело, геном DHFR дикого типа и другим селективным маркером, таким как аминогликозид 3'-фосфотрансфераза (АРН), можно отбирать, выращивая клетки в среде, содержащей агент для селекции селективного маркера, такой как аминогликозидный антибиотик, например канамицин, неомицин или G418. См. патент США No. 4965199.
Подходящим геном селекции для применения в дрожжах является trp1 ген, присутствующий в дрожжевой плазмиде YRp7 (Stinchcomb et al. Nature, 282: 39 (1979)). Ген trp1 предоставляет селективный маркер для мутантного штамма дрожжей, неспособных расти в триптофане, например, АТСС No. 44076 или РЕР4-1. Jones, Genetics, 85: 12 (1977). Тогда повреждение trp1 в геноме дрожжевой клетки- хозяине обеспечивает эффективные условия для детектирования трансформации при выращивании в отсутствие триптофана. Аналогично, штаммы дрожжей, дефицитные по Leu2 (ATCC 20622 или 38626), восполняются новыми плазмидами, несущими ген Leu2.
Далее, векторы, образованные из кольцевой плазмиды 1.6 мкм, pKD1, можно использовать для трансформации дрожжей Kluyveromyces. Или же, система экспрессии для получения рекомбинантного телячьего химозина в больших масштабах описана для K. lactis. Van den Berg, Bio/Technology, 8: 135 (1990). Также раскрываются устойчивые мультикопийные экспрессирующие векторы для секреции зрелого рекомбинантного человеческого сывороточного альбумина экспрессией промышленными штаммами Kluyveromyces. Fleer et al., Bid/Technology, 9: 968-975 (1991).
Промотор
Экспрессирующие и клонирующие векторы обычно содержат промотор, который узнается организмом-хозяином и функционально связан с нуклеиновой кислотой, кодирующей антитело. Промоторы, пригодные для применения с прокариотическими хозяевами, включают промотор phoA, промоторные системы β-лактамазы и лактозы, промотор щелочной фосфатазы, промоторную систему триптофана (trp) и гибридные промоторы, такие как tac промотор. Однако применимы и другие известные бактериальные промоторы. Промоторы для применения в бактериальных системах содержат также последовательность Шайна-Дальгарно (Shine-Dalgamo, S.D.), функционально связанную с ДНК, кодирующей антитело.
Промоторные системы известны для эукариот. Теоретически все эукариотические гены имеют область, богатую AT, локализованную, примерно, через 25-30 оснований в направлении 5' от сайта инициации транскрипции. Другая последовательность, находящаяся на расстоянии 70-80 оснований 5' от начала транскрипции многих генов, представляет собой область CNCAAT, где N может представлять собой любой нуклеотид. На 3' конце большинства эукариотических генов находится последовательность ААТААА, которая может являться сигналом для добавления polyA "хвоста" к 3' концу кодирующей последовательности. Все эти последовательности соответствующим образом вводятся в эукариотические экспрессирующие векторы.
Примеры соответствующих промоторных последовательностей для применения с дрожжами-хозяевами включают промоторы для 3-фосфоглицераткиназы или других гликолитических ферментов, таких как енолаза, глицеральдегид-3-фосфат дегидрогеназа, гексокиназа, пируватдекарбоксилаза, фосфофруктокиназа, глюкоза-6-фосфат-изомераза, 3-фосфоглицератмутаза, пируваткиназа, трифосфатизомераза, изомераза фосфоглюкозы и глюкокиназа.
Дополнительное преимущество других дрожжевых промоторов, которые являются индуцибельными промоторами, заключается в том, что транскрипция контролируется условиями выращивания, эти промоторы представляют собой промоторные области для алкогольдегидрогеназы 2, изоцитохрома С, кислой фосфатазы, деструктивных ферментов, ассоциированных с метаболизмом азота, металлотионеина, глицеральдегид-3-фосфат дегидрогеназы и ферментов, отвечающих за утилизацию мальтозы и галактозы. Подходящие векторы и промоторы для применения в экспрессии в клетках дрожжей более подробно описаны в Европейском патенте ЕР 73657. Дрожжевые энхансеры также применяются преимущественно с дрожжевыми промоторами.
Транскрипцию антител при использовании векторов в клетках хозяев-млекопитающих можно контролировать, например, с помощью промоторов, полученных из геномов вирусов, таких как вирус полиомы, вирус оспы домашней птицы, аденовирус (такой как Аденовирус 2), вирус бычьей папилломы, вирус саркомы птиц, цитомегаловирус, ретровирус, вирус гепатита В, обезьяний вирус-40 (SV40), или гетерологичных промоторов млекопитающих, например промотора гена актина или промотора гена иммуноглобулина, промоторов генов белков теплового шока, при условии, что такие промоторы совместимы с системами клетки-хозяина.
Ранний и поздний промоторы вируса SV40 обычно получают в виде рестрикционного фрагмента SV40, который также содержит SV вирусный ориджин репликации. Непосредственно ранний промотор цитомегаловируса человека обычно получают в виде рестрикционного фрагмента HindIII E. Система для экспрессии ДНК в клетках млекопитающих-хозяевах с применением вируса бычьей папилломы в качестве вектора раскрывается в патенте США No. 4419446. Модификация этой системы описана в патенте США No. 4601978. См. также Reyes et al., Nature 297: 598-601 (1982) об экспрессии кДНК человеческого β-интерферона в мышиных клетках под контролем промотора гена тимидинкиназы вируса простого герпеса. Или же в качестве промотора можно использовать длинный концевой повтор вируса саркомы Рауса.
Энхансер
Транскрипция ДНК, кодирующей антитело по данному изобретению, у высших эукариот часто повышается при введении энхансерной последовательности в вектор. В настоящее время известно множество энхансерных последовательностей из генов млекопитающих (глобина, альбумина, α-фетопротеина и инсулина). Обычно, однако, используют энхансер из эукариотического вируса. Примеры включают SV40 энхансер в поздней области ориджина репликации (н.о. 100-270), энхансер-ранний промотор цитомегаловируса, энхансер полиомы в поздней области ориджина репликации и энхансеры аденовирусов. См. также Yaniv, Nature 297: 17-18 (1982) об энхансерных элементах для активации эукариотических промоторов. Энхансер может быть сплайсирован в вектор в положение 5' или 3' к последовательности, кодирующей антитело, но, предпочтительно, локализован в сайте 5' от промотора.
Компонент терминации транскрипции
Экспрессирующие векторы, используемые в эукариотических клетках-хозяевах (клетках дрожжей, грибов, насекомых, растительных, животных, человеческих клетках или ядросодержащих клетках других многоклеточных организмов) также содержат последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Такие последовательности обычно имеются в 5' и, изредка, 3' нетранслируемых областях эукариотических вирусных ДНК или кДНК. Эти области содержат нуклеотидные сегменты, транскрибируемые в виде полиаденилированных фрагментов на нетранслируемом участке мРНК, кодирующей антитело. Одним применимым компонентом терминации транскрипции является область полиаденилирования гена бычьего гормона роста. См. Международную патентную заявку WO 94/11026 и описанный в ней экспрессирующий вектор.
Селекция и трансформация клеток-хозяев
Клетки-хозяева, пригодные для клонирования или экспрессии ДНК в векторах по данному описанию, представляют собой клетки прокариот, дрожжей или высших эукариот, описанные выше. Подходящие для этой цели прокариоты включают эубактерии, такие как грамотрицательные или грамположительные организмы, например энтеробактерии, такие как эшерихии (Escherichia), например Е.coli (кишечная палочка), Enterobacter, Erwinia, Klebsiella (клебсиеллы), Proteus, Salmonella (сальмонеллы), например Salmonella typhimurium, Serratia, например Serratia marcescans, и Shigella (шигеллы), а также Bacilli, такие как В. subtilis (сенная палочка) и В. Ucheniformis (например, В. Ucheniformis 41P, раскрываемая в патентной заявке ГДР 266710, опубликованной 12 апреля 1989 года), Pseudomonas, такие как Р. aeruginosa и Streptomyces. Предпочтительной Е.coli клеткой-хозяином для клонирования является клетка Е.coli 294 (АТСС 31446), хотя пригодны также другие штаммы, такие как Е.coli В, Е.coli X1776 (АТСС 31537) и Е.coli W3110 (АТСС 27325). Эти примеры являются скорее иллюстративными, нежели ограничивающими.
Полноразмерное антитело, белки слияния антител и фрагменты антител можно получать в бактериях, в частности, не требуется гликозилирование и Fc эффекторная функция, например, когда терапевтическое антитело конъюгируется с цитотоксическим агентом (например, токсином), которое само по себе проявляет эффективность, разрушающую опухолевую клетку. Полноразмерные антитела имеют более продолжительный период полужизни в кровотоке. Продуцирование в Е.coli осуществляется быстрее и более экономично. Об экспрессии фрагментов и полипептидов антитела в бактериях см., например, патенты США 5648237 (Carter et. al.), 5789199 (Joly et al.), 5840523 (Simmons et al.), в которых описаны последовательности области инициации трансляции (TIR) и сигнальные последовательности для оптимизации экспрессии и секреции. См. также Charlton, Methods in Molecular Biology, Vol.248 (B.K.C. Lo, ed., Humana Press, Totowa, N.T, 2003), pp.245-254, где описывается экспрессия фрагментов антитела в Е.coli. После экспрессии антитело можно выделять из клеточной пасты Е.coli в виде растворимой фракции и очищать, например, на колонке с белком А или G в зависимости от изотипа. Процесс окончательной очистки можно проводить аналогично процессу очистки антитела, экспрессированного в СНО клетках.
Помимо прокариот, эукариотические микробы, такие как нитевидные (филаментозные) грибы или дрожжи являются подходящими хозяевами для клонирования или экспрессии векторов, кодирующих антитела. Saccharomyces cerevisiae, или обычные пекарские дрожжи, являются наиболее часто употребляемыми среди низших эукариотических микроорганизмов-хозяев. Однако имеется также и применяется в данном описании ряд микроорганизмов других родов, видов и штаммов, таких как Schizosaccharomyces pombe; хозяева из рода Kluyveromyces, такие как K. lactis, K. fragilis (АТСС 12424), K. bulgaricus (АТСС 16045), K. wickeramii (АТСС 24178), K. waltii (АТСС 56500), K. drosophilarum (АТСС 36906), K. thermotolerans и K. marxianus; Yarrowia (Европейский патент ЕР 402226); Pichia pastoris (Европейский патент ЕР 183070); Candida; Trichoderma reesia (Европейский патент ЕР 244234); Neurospora crassa; Schwanniomyces, такие как Schwanniomyces occidentalis; и нитевидные грибы, например, такие как Neurospora, Penicillium, Tolypocladium, и хозяева из рода Аспергилл (Aspergillus), такие как A. nidulans и A. niger. Обзор, в котором обсуждается применение дрожжей и нитевидных грибов для получения терапевтических белков, см., например, Gemgross, Nat. Biolech. 22: 1409-1414 (2004).
Можно отбирать некоторые штаммы грибов и дрожжей, в которых пути гликозилирования "гуманизированы", что приводит к продуцированию антитела с частично или полностью человеческим паттерном гликозилирования. См., например, статью Li et al., Nat. Biotech. 24: 210-215 (2006) (в которой описывается "гуманизация" пути гликозилирования в Pichia pastoris), и Gemgross et al., supra.
Клетки-хозяева, применимые для экспрессии гликозилированного антитела, получают также из многоклеточных организмов (беспозвоночных и позвоночных). Примеры клеток беспозвоночных включают растительные клетки и клетки насекомых. Идентифицированы многочисленные штаммы и варианты бакуловирусов и соответствующие пермиссивные клетки насекомых-хозяев, таких как Spodoptera frugiperda (гусеница), Aedes aegypti (комар), Aedes albopictus (комар), Drosophila melanogaster (плодовая мушка) и Bombyx mori (тутовый шелкопряд). Имеются различные штаммы вирусов для трансфекции L-1 вариант Autographa californica NPV и штамм Bm-5 тутового шелкопряда Bombyx mori NPV, и такие вирусы можно применять в качестве вирусов по данному описанию для настоящего изобретения, в частности, для трансфекции клеток бабочки Spodoptera frugiperda.
В качестве хозяев можно также использовать культуры растительных клеток, таких как клетки хлопка, кукурузы, картофеля, сои, петуньи, томата, ряски (Lemnaceae), люцерны (М. truncatula) и табака. См., например, патенты США Nos. 5959177, 6040498, 6420548, 7125978 и 6417429 (описывающие технологию PLANTIBODIES™ для продуцирования антител в трансгенных растениях).
Клетки позвоночных можно использовать в качестве хозяев, а выращивание клеток позвоночных в культуре (тканевой культуре) стало обычной процедурой. Примерами подходящих клеточных линий млекопитающих-хозяев являются обезьяньи почечные клетки линии CV1, трансформированные с помощью SV40 (COS-7, ATCC CRL 1651); линия человеческих эмбриональных почечных клеток (клетки 293 или клетки 293, субклонированные для выращивания в суспензионной культуре, Graham et al., J. Gen Virol, 36: 59 (1977)); почечные клетки детеныша китайского хомячка (BHK, ATCC CCL 10); клетки Сертоли у мышей (ТМ4, Mather, Biol. Reprod. 23: 243-251 (1980)); почечные клетки обезьян (CV1 ATCC CCL 70); почечные клетки африканской зеленой мартышки (VERO-76, ATCC CRL-1587); клетки цервикальной карциномы человека (HELA, ATCC CCL 2); клетки псовых собак (MDCK, ATCC CCL 34); печеночные клетки крыс buffalo (BRL 3F, АТСС CRL 1442); легочные клетки человека (W138, ATCC CCL 75); гепатоциты человека (Hep G2, НВ 8065); клетки мышиной опухоли молочной железы (ММТ 060562, ATCC CCL51); клетки TRI (Mather et al., Annals N. Y. Acad. Sci. 383: 44-68 (1982)); клетки MRC 5; клетки FS4; и линия клеток гепатомы человека (Hep G2). Другие применимые клеточные линии млекопитающих-хозяев включают клетки яичников китайского хомячка (СНО), включая DHFR СНО клетки (Urlaub et al., Proc. Natl. Acad. Sci. USA 77: 4216 (1980)); и линии миеломных клеток, такие как NS0 и Sp2/0. Обзор некоторых линий клеток млекопитающих-хозяев, применимых для продуцирования антитела, см., например, в Yazaki and Wu, Methods in Molecular Biology, Vol.248 (B.K.C. Lo, ed., Humana Press, Totowa, NJ, 2003), pp.255-268.
Клетки-хозяева трансформируют вышеописанными экспрессирующими или клонирующими векторами с целью продуцирования антител и культивируют в обычной питательной среде, модифицированной соответствующим образом для индукции промоторов, селекции трансформантов или амплификации генов, кодирующих заданные последовательности.
Культивирование клеток-хозяев
Клетки-хозяева, используемые для продуцирования антител по изобретению, можно культивировать в различных средах. В продаже имеются такие среды, как среда Хэма F10 (Sigma), минимальная поддерживающая среда ((MEM), (Sigma), RPMI-1640 (Sigma) и модифицированная по способу Дульбекко среда Игла ((DMEM), Sigma), применимые для культивирования клеток-хозяев. Кроме того, любую из сред, описанных в Ham et al., Melh. Enz. 58: 44 (1979), Bames et al., Anal Biochem. 102: 255 (1980), патентах США No. 4767704; 4657866; 4927762; 4560655 или 5122469; Международной патентной заявке США WO 90/03430; WO 87/00195 или патент Re. США 30985, можно применять в качестве культуральных сред для клеток-хозяев. Любая из этих сред при необходимости может быть дополнена гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как хлорид натрия и фосфат кальция и магния), буферами (такими как HEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками (такими как препарат GENTAMYCIN™), микроэлементами (определяемыми как неорганические соединения, присутствующие обычно в микромолярных концентрациях) и глюкозой или эквивалентным источником энергии. Можно также включать любые другие необходимые добавки в соответствующих концентрациях, как известно специалистам в данной области техники. Условия культивирования, такие как температура, рН и т.п., являются такими же, как условия, которые применялись для клетки-хозяина, выбранной для экспрессии, и очевидны рядовому специалисту в данной области техники.
Очистки антитела
При использовании методов рекомбинантной ДНК антитело можно получать внутриклеточно, в периплазматическом пространстве, или непосредственно секретировать в среду. Если антитело получают внутриклеточно, на первой стадии крупнодисперсный дебрис (осадок), либо клеток-хозяев, либо лизированных фрагментов, удаляют, например, центрифугированием либо ультрафильтрацией. Carter et al., Bio/Technology 10: 163-167 (1992) описывают метод выделения антител, которые секретируются в периплазматическое пространство Е.coli. Коротко говоря, клеточную пасту оттаивают в присутствии ацетата натрия (рН 3.5), EDTA и фенилметилсульфонилхлорида (PMSF) в течение примерно 30 мин. Клеточный дебрис можно удалять центрифугированием. Если антитело секретируется в среду, супернатанты, полученные с применением таких экспрессирующих систем, обычно сначала концентрируют, используя продажный фильтр для концентрации белка, например ультрафильтрационное устройство фирм Amicon или Millipore Pellicon. На любой из вышеуказанных стадий можно ввести ингибитор протеаз, такой как PMSF, для ингибирования протеолиза, и антибиотики, для предупреждения увеличения количества случайных примесей.
Композицию антитела, полученную с использовании клеток, можно очищать, используя, например, хроматографию на гидроксилапатите, хроматографию гидрофобного взаимодействия, электрофорез в геле, диализ и аффинную хроматографию, причем аффинная хроматография является предпочтительной на стадии очистки. Пригодность белка А в качестве аффинного лиганда зависит от вида и изотипа иммуноглобулинового Fc домена, присутствующего в антителе. Белок А можно использовать для очистки антител на основе человеческих тяжелых цепей γ1, γ2 или γ4 (Lindmark et al., J. Immunol. Meth. 62: 1-13 (1983)). Белок G рекомендуется для всех мышиных изотипов и для человеческой γ3-цепи (Guss et al., EMBO J. 5: 1567-1575 (1986)). Матрицей, с которой связан аффинный лиганд, чаще всего является агароза, но имеются и другие матрицы. Механически устойчивые матрицы, такие как пористое стекло с контролируемым размером пор или поли(стиролдивинилбензол) позволяют повысить скорость потока и уменьшить время процессирования по сравнению с агарозой. Если антитело содержит домен CH3, для очистки применима смола Bakerbond ABX™ (J.T. Baker, Phillipsburg, NJ). Также имеются другие методы очистки, применяющиеся в зависимости от выделяемого антитела, в том числе: фракционирование на ионообменной колонке, преципитация этанолом, обращенно-фазовая ВЭЖХ, хроматография на силикагеле, хроматография на гепарин-сефарозе (SEPHAROSE™), хроматография на анионо- или катионообменной смоле (например, на колонке с полиаспарагиновой кислотой), хроматофокусирование, SDS-PAGE и осаждение (преципитация) сульфатом аммония.
После стадии (стадий) предварительной очистки любым методом можно провести хроматографию гидрофобного взаимодействия смеси, содержащей целевое антитело и примеси, при низких значениях рН, используя элюирующий буфер с рН примерно 2.5-4.5, предпочтительно, с низкими концентрациями солей (например, около 0-0.25 М соли)
Обычно различные методы получения антител для применения в исследовании, испытании и клинике общеизвестны в уровне техники, согласуются с вышеописанными методами и/или, как предполагает специалист в данной области техники, подходят для конкретного целевого антитела.
Фармацевтические рецептуры (препараты) и дозы
Композицию антитела можно приготовить, дозировать и вводить в соответствии с надлежащей медицинской практикой. Факторы, рассматриваемые в этом контексте, включают конкретное подлежащее лечению расстройство, конкретное подлежащее лечению животное, область доставки агента, способ введения, схему введения и другие факторы, известные практикующим врачам. Вводимое "терапевтически эффективное количество" антитела определяется этими соображениями и представляет собой минимальное количество, необходимое для предупреждения, уменьшения интенсивности симптомов или лечения заболевания или расстройства. Необязательно, но при желании, антитело готовят с одним или более агентов, применяемых в настоящее время для предупреждения или лечения соответствующего расстройства. Эффективное количество таких других агентов зависит от количества антитела в препарате, типа расстройства или лечения и других факторов, обсуждавшихся выше. Эти другие агенты обычно используются в тех же дозах и вводятся теми же путями, что и ранее в данном описании, или в количествах, составляющих, примерно, 1-99% от ранее принятых в практике доз. Обычно ослабление или лечение заболевания или расстройства включает уменьшение (ослабление) одного или более симптомов или медицинских проблем, связанных с заболеванием или расстройством. В случае ракового заболевания терапевтически эффективное количество лекарства может приводить к одному или комбинации нижеприведенных результатов; снижать число раковых клеток; уменьшать размер опухоли; ингибировать (т.е. уменьшать до некоторой степени и/или останавливать) инфильтрацию раковых клеток в периферические органы; ингибировать метастазирование опухоли; ингибировать, до некоторой степени, рост опухоли; и/или облегчать, до некоторой степени, один или более симптомов, ассоциированных с раковым заболеванием. В зависимости от того, до какой степени лекарство может предупреждать рост и/или убивать имеющиеся раковые клетки, оно может быть цитостатическим и/или цитотоксическим. В некоторых вариантах изобретения композицию по изобретению можно использовать для предупреждения начала или рецидива заболевания или расстройства у субъекта или млекопитающего.
Соответствующая доза антитела по изобретению для предупреждения или лечения заболевания (вводимая индивидуально или в комбинации с одним или более других терапевтических агентов) зависит от типа подлежащего лечению заболевания, типа антитела, тяжести и течения заболевания от того, вводится ли антитело с целью предупреждения или лечения, от анамнеза пациента и реакции его на антитело и от мнения лечащего врача. Антитело обычно вводят пациенту в виде одного препарата (одновременно) или по отдельности.
В некоторых вариантах изобретения, в зависимости от типа и тяжести заболевания, предполагаемая начальная доза антитела для введения пациенту составляет около 1 мкг/кг - 50 мг/кг (например, 0.1-20 мг/кг), либо однократно или в несколько приемов, либо непрерывной инфузией. В одном варианте изобретения предполагаемая начальная доза антитела для введения пациенту составляет около 1 мкг/кг - 15 мг/кг (например, 0.1 мг/кг - 10 мг/кг). Типичная суточная доза может составлять интервал примерно 1 мкг/кг - 100 мг/кг или более в зависимости от указанных выше факторов. Для повторного введения в течение нескольких дней или более, в зависимости от состояния, лечение продолжают до момента, когда будет наблюдаться требуемое ослабление симптомов заболевания.
Одна типичная доза антитела составляет интервал около 0.05 мкг/кг - 15 мг/кг. Так, пациенту можно вводить одну или более доз примерно 0.5 мг/кг, 2.0 мг/кг, 4.0 мг/кг, 7.5 мг/кг, 10 мг/кг или 15 мг/кг (или любую их комбинацию). Такие дозы можно вводить периодически, например каждый день, раз в три дня, раз в неделю или раз в две - три недели (например, таким образом, чтобы пациент получал около двух - двадцати доз или, например, около шести доз антитела). В одном варианте изобретения примерную дозу 10 мг/кг вводят раз в три дня. Можно вводить начальную повышенную ударную дозу, а затем одну или более низких доз. В одном варианте изобретения типичная схема приема лекарственного средства включает введение начальной ударной дозы примерно 4 мг/кг, а затем еженедельной поддерживающей дозы примерно 2 мг/кг антитела. Однако могут применяться другие схемы приема лекарства.
В некоторых вариантах изобретения схемы приема лекарства, обсуждаемые в данном описании, применяются в комбинации со схемой химиотерапии как терапии первой линии для лечения метастатического колоректального рака. В некоторых аспектах изобретения химиотерапевтическая схема включает традиционное периодическое введение высоких доз. В некоторых других аспектах изобретения химиотерапевтические агенты вводят в виде меньших и более частых доз, не прерывая схему лечения ("метрономная химиотерапия").
За ходом лечения по изобретению легко следить обычными методами и с помощью обычных анализов.
Антитело по изобретению (и любой дополнительный терапевтический агент или адъювант) можно вводить любым походящим способом, включая парентеральное, подкожное, интраперитонеальное, внутрилегочное и интраназальное введение и, если нужно для местного лечения, введение непосредственно в место поражения. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, интраперитонеальное или подкожное введение. Кроме того, антитело можно вводить в импульсном режиме, в частности при снижающихся дозах антитела. Введение доз можно осуществлять любым методом, например в виде инъекций, таких как внутривенные или подкожные инъекции, частично в зависимости от того, является введение кратковременным или длительным.
Фармацевтические препараты по данному описанию могут также содержать более одного активного соединения, что необходимо по конкретным показаниям, подлежащим лечению, предпочтительно, эти активные соединения проявляют комплементарную активность, которая не препятствует активности друг друга. Такие соединения (молекулы) присутствуют в комбинации в количествах, эффективных для достижения предполагаемой цели.
Фармацевтические препараты, содержащие антитело по изобретению, готовят для хранения, смешивая антитело нужной степени чистоты с необязательными фармацевтически приемлемыми носителями, эксципиентами или стабилизаторами (Remington: The Science and Practice of Pharmacy 20th edition (2000)) в виде водных растворов, лиофилизированных или иных высушенных препаратов. Приемлемые носители, эксципиенты или стабилизаторы не являются токсическими по отношению к реципиентам в применяемых дозах и концентрациях и включают буферы, такие как фосфатный, цитратный, гистидиновый и других органических кислот; антиоксиданты, включающие аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмония хлорид; гексаметония хлорид; бензалкония хлорид, бензэтония хлорид; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцин; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные (менее примерно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТА (EDTA); сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как ион натрия; комплексы металлов (например, комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как Твин™, Плуроникс™ или полиэтиленгликоль (ПЭГ, PEG).
Активные ингредиенты можно также заключать в микрокапсулу, приготовленную, например методами коацервации или межфазной полимеризации, например, микрокапсулу из гидроксиметилцеллюлозы или желатина или микрокапсулу из полиметилметакрилата, соответственно, в коллоидные системы доставки лекарств (например, липосомы, микросферы альбумина, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методы раскрываются в (Remington: The Science and Practice of Pharmacy 20th edition (2000)).
Препараты для использования с целью in vivo введения должны быть стерильными. Этого легко достичь, фильтруя через стерильные фильтрационные мембраны.
Можно приготовить препараты с пролонгированным высвобождением. Соответствующие примеры препаратов с пролонгированным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащих иммуноглобулин по изобретению, эти матрицы находятся в виде профилированных изделий, например пленок или микрокапсул. Примеры матриц с пролонгированным высвобождением включают полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поливиниловый спирт, полилактиды (патент США No. 3773919), сополимеры L-глутаминовой кислоты и γ-этил-L-глутамата, неразрушаемые (неразлагающиеся) сополимеры этилена с винилацетатом, разлагающиеся (разрушаемые) сополимеры молочной кислоты и гликолевой кислоты, такие как LUPRON DEPOT™ (микросферы для инъекций, состоящие из сополимера молочной кислоты с гликолевой кислотой и лейпролидацетата) и поли-D-(-)-3-гидроксимасляная кислота. В то время как полимеры, такие как сополимеры этилена с винилацетатом и молочной кислоты с гликолевой кислотой способны высвобождать молекулы в течение более чем 100 дней, некоторые гидрогели высвобождают белки за более короткий период времени. Когда инкапсулированные иммуноглобулины находятся в организме в течение длительного времени, они могут денатурироваться или агрегироваться под воздействием влаги при 37°С, что приводит к потере биологической активности и возможным изменениям иммуногенности. Для стабилизации, зависящей от механизма, можно разработать целесообразные стратегии. Например, если обнаруженный механизм агрегации представляет собой образование межмолекулярных S-S связей за счет тио-дисульфидного взаимодействия, стабилизацию можно осуществить, модификацией сульфгидрильных остатков, лиофилизацией из кислых растворов, контролем содержания влаги, применением соответствующих добавок и разработкой специфических композиций полимерной матрицы.
Методы
Терапевтические методы
Антитело по изобретению можно использовать, например, в терапевтических методах in vitro, ex vivo и in vivo.
В одном аспекте изобретение включает методы лечения или предупреждения опухоли, ракового заболевания и/или клеточно-пролиферативного расстройства (например, расстройства, ассоциированного с повышенной экспрессией и/или активностью VEGF), заключающиеся во введении эффективного количества антитела против VEGF субъекту, нуждающемуся в таком лечении.
В одном аспекте изобретение включает методы уменьшения, ингибирования, блокирования или предупреждения роста опухоли или рака, причем эти методы включают введение эффективного количества антитела против VEGF субъекту, нуждающемуся в таком лечении.
В одном аспекте изобретение включает методы ингибирования ангиогенеза, заключающиеся во введении эффективного количества антитела против VEGF субъекту, нуждающемуся в таком лечении.
В одном аспекте изобретение включает методы ингибирования сосудистой проницаемости, заключающиеся во введении эффективного количества антитела против VEGF субъекту, нуждающемуся в таком лечении.
В одном аспекте изобретение включает методы лечения патологического состояния, ассоциированного с ангиогенезом, заключающиеся во введении эффективного количества антитела против VEGF субъекту, нуждающемуся в таком лечении. В некоторых вариантах изобретения патологическое состояние, ассоциированное с ангиогенезом, представляет собой опухоль, рак и/или клеточно-пролиферативное расстройство.
Антитело по изобретению можно вводить человеку с целью терапии. В одном варианте изобретения антитело по изобретению применяют в методе связывания VEGF у индивидуума, страдающего расстройством, ассоциированным с повышенной экспрессией и/или активностью VEGF, причем этот метод включает введение индивидууму антитела с тем, чтобы связать VEGF у индивидуума. В одном варианте изобретения VEGF представляет собой человеческий VEGF, а индивидуум является человеком. Или же, индивидуум может являться млекопитающим, экспрессирующим VEGF, с которым связывается антитело по изобретению. Далее, индивидуум может являться млекопитающим, которому введен VEGF (путем введения VEGF или экспрессией трансгена, кодирующего VEGF).
В одном аспекте по меньшей мере некоторые из антител по изобретению могут связывать VEGF вида, отличного от человека. Соответственно, антитела по изобретению можно использовать для связывания активности специфического антигенна, например, в клеточной культуре, содержащей антиген, у человека или у других млекопитающих, содержащих антиген, с которым перекрестно реагирует антитело по изобретению (например, у обезьян шимпанзе, бабуинов, игрунок, макаков циномолгус и резус, свиней или мышей). В одном варианте изобретения антитело по изобретению можно применять для ингибирования активности антигена с помощью контактирования антитела с антигеном таким образом, чтобы ингибировалась активность антигена. Предпочтительно, антиген представляет собой молекулу человеческого белка.
Помимо этого, антитело по изобретению можно вводить отличному от человека млекопитающему, экспрессирующему VEGF, с которым антитело перекрестно реагирует (например, примат, свинья, крыса или мышь), с целью применения в ветеринарии или для использования этих животных в качестве животной модели человеческого заболевания. Что касается последнего, такие животные модели могут использоваться для оценки терапевтической эффективности антител по изобретению (например, тестирование доз и период действия вводимого лекарства).
Антитела по изобретению можно использовать для лечения, ингибирования, задержки прогрессирования, предупреждения/задержки рецидива или предупреждения заболеваний, расстройств или состояний, ассоциированных с экспрессией и/или активностью молекул одного или более антигенов.
Настоящее изобретение охватывает предупреждение и лечение метастазов опухолей и антиангиогенную терапию рака, новую стратегию лечения рака, направленную на ингибирование развития кровеносных сосудов в опухоли, обеспечивающих опухоль питательными веществами, необходимыми для роста опухоли. В частности, изобретение включает ингибирование роста неопластических клеток в месте образования первичной опухоли, а также предупреждение и/или лечение метастазирования опухолей в места образования вторичных опухолей, следовательно, содействие атаке опухоли другими терапевтическими средствами. Примеры рака, которые можно лечить (включая предупреждение) по данному описанию, включают, но без ограничения, карциному, лимфому, бластому, саркому и лейкоз или злокачественные новообразования лимфоидной ткани. Более конкретные примеры таких раковых заболеваний включают плоскоклеточный рак (например, эпителиальный плоскоклеточный рак), рак легкого, включая мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого и плоскоклеточную карциному легкого, рак брюшины, почечноклеточный рак, рак желудка, включая рак желудочно-кишечного тракта, стромальные опухоли желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, рак мочеполового тракта, гепатому, рак молочной железы, рак толстой кишки, ректальный рак, колоректальный рак, карциному эндометрия или матки, карциному слюнных желез, рак почки, рак предстательной железы, рак вульвы, рак щитовидной железы, гепатокарциному, карциному анального канала, карциному пениса, меланому, поверхностную меланому, меланому типа злокачественного лентиго, акральные лентигинозные меланомы, нодулярные (узловые) меланомы, множественную миелому и В-клеточную лимфому (включая низкой степени злокачественности/фолликулярную неходжкинскую лимфому (NHL); лимфому из малых лимфоцитов (лимфоцитарную лимфому) (SL) NHL; промежуточной степени злокачественности/фолликулярную NHL; промежуточной степени злокачественности диффузную NHL; высокой степени злокачественности иммунобластную NHL; высокой степени злокачественности лимфобластную NHL; высокой степени злокачественности мелкоклеточную NHL с нерасщепленными ядрами; генерализованную форму NHL; мантийноклеточную лимфому; лимфому, связанную со СПИДом; и макроглобулинемию Вальденстрома); хронический лимфоцитарный лейкоз (CLL); острый лимфобластный лейкоз (ALL); волосистоклеточный лейкоз; хронический миелобластный лейкоз; и посттрансплантационное лимфопролиферативное расстройство (PTLD); а также аномальную васкулярную пролиферацию, обусловленную факоматозами, отек (такой как отек, связанный с опухолями мозга), синдром Мейгса, рак головного мозга, а также рак головы и шеи и ассоциированные с ними метастазы. В некоторых вариантах изобретения раковые заболевания, которые поддаются лечению антителами по изобретению, включают рак молочной железы, колоректальный рак, ректальный рак, немелкоклеточный рак легкого, неходжкинскую лимфому (NHL), почечноклеточный рак, рак предстательной железы, рак печени, рак поджелудочной железы, саркому мягких тканей, саркому Калоши, карциноидную саркому, рак головы и шеи, рак яичника, мезотелиому и множественную миелому. В некоторых вариантах изобретения рак выбирают из группы, состоящей из мелкоклеточного рака легкого, нейробластом, меланомы, карциномы молочной железы, рака желудка, колоректального рака (CRC) и печеночноклеточной карциномы. В некоторых вариантах изобретения раковое заболевание выбирают из группы, состоящей из немелкоклеточного рака легкого, колоректального рака и карциномы молочной железы, включая метастатические формы этих типов рака.
В некоторых вариантах изобретения пациенту вводят иммуноконъюгат, содержащий антитело, конъюгированное с одним или более цитотоксических агентов, В некоторых вариантах изобретения иммуноконъюгат и/или конъюгат, с которым он связан, интернализуе(ю)тся клеткой, что вызывает повышенную терапевтическую эффективность иммуноконъюгата в киллинге клетки-мишени, с которой он связывается. В одном варианте изобретения цитотоксический агент нацелен на нуклеиновую кислоту или оказывает противодействие нуклеиновой кислоте в клетке-мишени. В одном варианте изобретения цитотоксический агент нацелен на полимеризацию микротрубочек или препятствует полимеризации микротрубочек. Примеры таких цитотоксических агентов включают любой из химиотерапевтических агентов, отмеченных в данном описании (такой как майтанзиноид, ауристатин, доластатин или калихеамипин), радиоактивный изотоп или рибонуклеазу или ДНК-эндонуклеазу.
В случае, если мишень для связывания антитела локализована в головном мозге, некоторые варианты изобретения включают антитело, позволяющее проходить через гематоэнцефалический барьер. В уровне техники имеется несколько методов переноса молекул через гематоэнцефалический барьер, включая, но без ограничения, физические методы, методы с применением липидов, методы с применением стволовых клеток и рецепторные методы и методы с использованием каналов.
Физические методы переноса антитела через гематоэнцефалический барьер включают, но без ограничения, введение, совершенно в обход гематоэнцефалического барьера, или создание проходов в гематоэнцефалическом барьере. Методы обхода гематоэнцефалического барьера включают, но без ограничения, непосредственную инъекцию в головной мозг (см., например, Papanastassiou et al., Gene Therapy 9: 398-406 (2002)), доставку с помощью инфузии/конвекции в интерстициальную (межуточную) ткань (см., например, Bobo el al., Proc. Natl. Acad. Sci. USA 91: 2076-2080 (1994)) и имплантацию устройства для доставки в головной мозг (см., например. Gill et al., Nature Med. 9: 589-595 (2003); и Gliadel Wafers™, Guildford Pharmaceutical). Методы создания проходов в барьере включают, но без ограничения, ультразвук (см., например, опубликованную патентную заявку США No. 2002/0038086), осмотическое давление (например, введением гипертонического раствора маннита (Neuwelt, E. A., Implication of the Blood-Brain Barrier and its Manipulation, Vols 1 & 2, Plenum Press, N.Y. (1989)), пермеабилизацию (превращение в проницаемый), например, с помощью брадикинина или пермеабилизатора А-7 (см., например, патенты США No. 5112596, 5268164, 5506206 и 5686416), и трансфекцию нейронов, которые обходят гематоэнцефалический барьер с помощью векторов, содержащих гены, кодирующие антитело (см., например, опубликованную патентную заявку США No. 2003/0083299).
Методы переноса антитела через гематоэнцефалический барьер с применением липидов включают, но без ограничения, инкапсулирование антитела в липосомы, которые соединяются со связывающими фрагментами антитела, связывающимися с рецепторами на сосудистом эндотелии гематоэнцефалического барьера (см., например, опубликованную патентную заявку США No. 20020025313), и нанесение на антитело слоя из частиц липопротеина низкой плотности (см., например, опубликованную патентную заявку США No. 20040204354) или аполипопротеина Е (см., например, опубликованную патентную заявку США No. 20040131692).
Методы транспорта антитела через гематоэнцефалический барьер с применением стволовых клеток включают получение методами генетической инженерии нервных клеток-предшественников (NPC) для экспрессии целевого антитела, а затем имплантацию стволовых клеток в мозг подлежащего лечению индивидуума. См. Behrstock el al. (2005) Gene Ther. дополнительная публикация он-лайн от 15 декабря 2005 года (сообщение о том, что генно-инженерные NPC для экспрессии нейротрофического фактора GDNF, имплантированные в головной мозг моделей грызунов и приматов, ослабляют симптомы болезни Паркинсона,
Методы транспорта антитела через гематоэнцефалический барьер с помощью рецепторов и каналов включают, но без ограничения, применение глюкокортикоидных блокаторов для повышения проницаемости гематоэнцефалического барьера (см., например, опубликованные патентные заявки США No. 2002/0065259, 2003/0162695 и 2005/0124533); активацию калиевых каналов (см., например, опубликованную патентную заявку США No. 2005/0089473), ингибирование ABC переносчиков лекарств (см., например, опубликованную патентную заявку США No. 2003/0073713); нанесение на антитела покрытия из трансферрина и модуляцию активности одного или более рецепторов трансферрина (см., например, опубликованную патентную заявку США No. 2003/0129186) и катионизацию антител (см., например, патент США No. 5004697).
Понятно, что любой из вышеописанных терапевтических методов можно осуществлять, используя иммуноконъюгат по изобретению вместо добавления антитела против VEGF.
Комбинированная терапия
Антитела по изобретению можно использовать в терапии либо самостоятельно, либо в комбинации с другими композициями. Например, антитело по изобретению можно вводить совместно с другим антителом, химиотерапевтическим(и) агентом (агентами), антиангиогенным(и) агентом(ами), цитокинами и/или ингибиторами роста. Если антитело по изобретению ингибирует рост опухоли, может быть особенно желательно объединять его с одним или более других терапевтических агентов, которые также ингибируют рост опухоли, например ангиогенных агентов и/или химиотерапевтических агентов. Или же, или помимо этого, пациент может получать комбинированную лучевую терапию (например, облучение внешним пучком в сочетании с меченным радиоактивной меткой агентом, таким как антитело). Указанная комбинированная терапия включает совместное введение (при котором два или более агентов входят в состав одного и того же препарата или в состав разных препаратов) и раздельное введение, в этом случае вводить антитело по изобретению можно до и/или после введения вспомогательного средства или вспомогательных средств.
В одном варианте изобретения антитело по изобретению можно вводить совместно по меньшей мере с одним дополнительным терапевтическим агентом и/или адъювантом. Например, антитела против VEGF применяют в комбинации с противораковыми терапевтическими средствами или терапевтическими средствами против неоваскуляризации для лечения различных неопластических или не-неопластических состояний. В одном варианте изобретения неопластическое или не-неопластическое состояние характеризуется патологическим расстройством, ассоциированным с аберрантным или нежелательным ангиогенезом. Антитело против VEGF можно вводить последовательно или в комбинации с другим агентом, эффективным для этих целей, либо в виде одной и той же композиции, либо в виде отдельных композиций. Или же, или помимо этого, можно вводить несколько ингибиторов VEGF.
Обычно антитела против VEGF и противораковые агенты применимы для лечения одного и того же заболевания или аналогичных заболеваний для блокирования или ослабления патологического расстройства, такого как опухоль, раковое заболевание или клеточно-пролиферативное расстройство. В одном варианте изобретения противораковый агент представляет собой антиангиогенный агент.
Множество антиангиогенных агентов идентифицировано и известно в уровне техники, включая перечисленные в данном описании, например, перечисленные в разделе "Определения", и приведенные, например, в Carmeliet and Jain, Nature 407: 249-257 (2000); Ferrara et al., Nature Reviews: Drug Discovery, 3: 391-400 (2004); и Sato Int. J. din. Oncol, 8: 200-206 (2003). см. также патентную заявку США US20030055006.
В одном варианте изобретения антитело против VEGF по настоящему изобретению применяют в комбинации с одним или более нейтрализующих антител против VEGF (или фрагментов), антагонистических к другому VEGF семейству (например, VEGF-B, VEGF-С, VEGF-D, плацентарного фактора роста (PLGF)) или с антагонистом рецептора VEGF, включая, но без ограничения, например, растворимый VEGF рецептор (например, VEGFR-1, VEGFR-2, VEGFR-3, фрагменты нейропилинов (например, NRP1, NRP2)), с аптамерами, способными блокировать VEGF или VEGFR, нейтрализующими антителами против VEGFR, низкомолекулярными ингибиторами VEGFR тирозинкиназ (RTK), антисмысловыми стратегиями по отношению к VEGF, рибозимами против VEGF или VEGF рецепторов, вариантами антагонистов к VEGF; или с любой их комбинацией.
В другом варианте изобретения антитело против VEGF по изобретению можно использовать в комбинации с низкомолекулярными ингибиторами рецепторных тирозинкиназ (RTKI), которые нацелены на один или более тирозинкиназных рецепторов, таких как VEGF рецепторы, FGF рецепторы, EGF рецепторы и PDGF рецепторы. В уровне технике известно множество низкомолекулярных RTKI, включая, но без ограничения, ваталаниб (РТК787), эрлотиниб (Тарцева, TARCEVA®), OSI-7904, ZD6474 (ZACTIMA®), ZD6126 (ANG453), ZD1839, сунитиниб (Сутент, SUTENT®), семаксиниб (SU5416), AMG706, AG013736, иматиниб (Гливек, GLEEVEC®), MLN-518, СЕР-701, PKC-412, лапатиниб (GSK572016), вел(ь)каде (VELCADE®), AZD2171, сорафениб (Нексавар, NEXAVAR®), XL880 и CHIR-265.
Другие терапевтические агенты, применимые для комбинированной противоопухолевой терапии с помощью антитела по изобретению, включают антагонист других факторов, участвующих в росте опухоли, таких как EGFR, ErbB2 (также известный как Her2) ErbB3, ErbB4 или TNF.
В некоторых вариантах изобретения, помимо антагониста VEGF и другого агента, необязательно, можно вводить пациенту совместно два или более ингибиторов ангиогенеза. Еще в одном варианте изобретения один или более дополнительных терапевтических агентов, например, противораковых агентов, можно вводить в комбинации с антителом против VEGF по настоящему изобретению, антагонистом к другому VEGF семейству и/или антиогенным агентом.
В некоторых аспектах изобретения другие терапевтические агенты, применимые для комбинированной противоопухолевой терапии с антителом против VEGF, включают другие средства борьбы с раком (например, хирургическое вмешательство, радиологические методы лечения (например, включающие облучение или введение радиоактивных веществ), химиотерапию, лечение противораковыми агентами, перечисленными в данном описании и известными в уровне техники, или их комбинацию). Иллюстрирующий и неограничивающий список рассматриваемых химиотерапевтических агентов приводится в данном описании в разделе "Определения".
Или же, или помимо этого, два или более антител, связывающих одно и то же или два или более различных антигенов по данному описанию, можно вводить пациенту совместно. Иногда может быть целесообразно вводить пациенту один или более цитокинов.
Эффективные количества терапевтических агентов, вводимых в комбинации с антителом против VEGF, определяются врачом или ветеринаром. Введение доз и их корректировку проводят для осуществления максимальных результатов в лечении состояния, подлежащего лечению. Помимо этого, доза зависит от таких факторов, как тип применяемого терапевтического агента и конкретного пролечиваемого пациента. Подходящими дозами противоракового агента являются дозы, применяемые в настоящее время, и их можно понижать вследствие комбинированного действия (синергии) противоракового агента и антитела против VEGF. В некоторых вариантах изобретения комбинация ингибиторов усиливает эффективность единственного ингибитора. Термин "усиливает" относится к повышению эффективности терапевтического агента в его обычной или утвержденной (одобренной) дозе. См. также раздел, озаглавленный Фармацевтические рецептуры и дозы по данному описанию.
Химиотерапевтические агенты
В одном аспекте изобретение включает метод лечения расстройства (такого как опухоль, рак или клеточное пролиферативное заболевание) путем введения эффективных количеств антитела против VEGF и/или ингибитора(ов) ангиогенеза и одного или более химиотерапевтических агентов. В комбинации с методами лечения по данному изобретению можно применять различные химиотерапевтические агенты. Типичный и неограничивающий перечень рассматриваемых химиотерапевтических агентов приводится в данном описании в разделе "Определения". Введение антитела против VEGF и химиотерапевтического агента можно проводить одновременно, например, в виде одной композиции или в виде двух раздельных композиций, используя один и тот же или разные пути введения. Или же, или помимо этого, введение можно проводить последовательно, в любом порядке. Или же, или помимо этого, стадии можно проводить как комбинацию последовательного и одновременного введения, в любом порядке. В некоторых вариантах изобретения интервалы между введением двух или более композиций составляют периоды от минут до дней, недель, месяцев. Например, химиотерапевтический агент можно вводить первым, затем антитело против VEGF. Однако также рассматривается одновременное введение или введение сначала антитела против VEGF. Соответственно, в одном аспекте изобретение включает методы, охватывающие введение антитела против VEGF (такого как антитело В20-4.1.1 или антитела B20-4.1.1RR) с последующим введением химиотерапевтического агента. В некоторых вариантах изобретения интервалы между введением двух или более композиций могут составлять от минут до дней, недель, месяцев.
Как понятно рядовому специалисту в данной области техники, соответствующие дозы химиотерапевтических агентов составляют обычно примерные дозы, применяемые в настоящее время при лечении в клинике, когда хХимиотерапевтические средства вводят самостоятельно или в комбинации с другими химиотерапевтическими средствами. Возможны вариации доз в зависимости от пролечиваемого состояния. Лечащий врач может определить соответствующую дозу для отдельного субъекта.
Рецидивирующий рост опухоли
Изобретение включает также методы и композиции для ингибирования или предупреждения рецидива роста опухоли или рецидива роста опухолевых клеток. Выражение рецидив роста опухоли или рецидив роста опухолевых клеток применяют для описания состояния, при котором пациенты, подвергающиеся лечению с помощью одного или более современных способов терапии (например, терапии противораковой терапии, такой как химиотерапия, лучевая терапия, хирургия, гормональная терапия и/или биологическая терапия/иммунотерапия, терапия антителом против VEGF, в частности, стандартная схема лечения конкретного типа рака), не являются клинически адекватными этому лечению или что эти пациенты нуждаются в дополнительной эффективной терапии. Это выражение по данному описанию относится также к состоянию "не реагирующего (на лечение)/резистентного" пациента, например, относится к пациентам, которые отвечают на терапию, но страдают от побочных эффектов, у них развивается резистентность к терапии, неудовлетворительно отвечают на терапию и т.д. В различных вариантах изобретения рак представляет собой рецидив роста опухоли или рецидив роста раковых клеток, когда число раковых клеток снижается недостаточно, или повышается, или размер опухоли уменьшается недостаточно, или увеличивается, или не удается далее уменьшить размер опухоли или число раковых клеток. Определить, обозначают ли раковые клетки рецидив роста опухоли или рецидив роста раковых клеток, можно in vitro или in vivo любым известным в уровне техники методом анализа эффективности лечения, при этом используются принятые в уровне техники значения слов "рецидив", или "резистентный", или "восприимчивый, реагирующий, чувствительный" в таком контексте. Опухоль, резистентная к лечению антителом против VEGF, является примером рецидива роста опухоли.
Изобретение включает методы блокирования или уменьшения рецидивирующего роста опухоли или рецидивирующего роста раковых клеток у субъекта путем введения одного или более антител против VEGF по настоящему изобретению для блокирования рецидивирующего роста опухоли или рецидивирующего роста раковых клеток у субъекта. В некоторых вариантах изобретения антитело можно вводить после противоракового терапевтического средства. В некоторых вариантах изобретения антитела против VEGF вводят одновременно с противораковой терапией. Или же, или помимо этого, терапия антителом против VEGF чередуется с другой противораковой терапией, которую можно проводить в любом порядке. Изобретение также охватывает методы введения одного или более ингибирующих антител для предупреждения начала или рецидива рака у пациентов, предрасположенных к заболеванию раком. Обычно субъекту проводили или одновременно проводят противораковую терапию. В одном варианте изобретения противораковая терапия представляет собой лечение агентом против ангиогенеза (антиангиогенным агентом), например антагонистом VEGF-C. Антиангиогенный агент включает, но без ограничения, антиангиогенные агенты, известные в уровне техники и перечисленные в разделе "Определения" в данном описании. В одном варианте изобретения антиангиогенный агент представляет собой нейтрализующее антитело против VEGF или его фрагмент (например, гуманизированное А4.6.1, AVASTIN (Genentech, South San Francisco, CA), Y0317, M4, G6, B20, 2C3 и т.д.). См., например, патенты США 6582959, 6884879, 6703020; Международные патентные заявки WO 98/45332; WO 96/30046; WO 94/10202; Европейская патентная заявка 0666868 В 1; патентные заявки США 20030206899, 20030190317, 20030203409 и 20050112126; Popkov et al., Journal of Immunological Methods 288: 149-164 (2004) и Международную патентную заявку WO2005012359. Дополнительные агенты можно вводить в комбинации с антителом против VEGF для блокирования или снижения рецидивирующего роста опухоли или рецидивирующего роста раковых клеток, см., например, раздел, озаглавленный Комбинированная терапия.
Диагностические методы и методы детекции
В одном аспекте изобретение включает способ диагностики расстройства, ассоциированного с повышенной экспрессией VEGF. В некоторых вариантах изобретения метод включает контактирование тестируемой клетки с антителом против VEGF; определение уровня экспрессии (либо количественно, либо качественно) VEGF в тестируемой клетке с помощью детекции связывания антитела против VEGF с VEGF и сравнение уровня экспрессии VEGF в тестируемой клетке с уровнем экспрессии VEGFв контрольной клетке (например, здоровой клетке из той же ткани, что и тестируемая клетка, которая экспрессирует VEGF с уровнями, сравнимыми с такой здоровой клеткой), причем повышенный уровень экспрессии VEGF в тестируемой клетке по сравнению с контрольной клеткой указывает на расстройство, ассоциированное с повышенной экспрессией VEGF. В некоторых вариантах изобретения тестируемую клетку получают от индивидуума, предположительно страдающего расстройством, ассоциированным с повышенной экспрессией VEGF. В некоторых вариантах изобретения расстройство представляет собой опухоль, рак и/или клеточно-пролиферативное расстройство.
Типичные расстройства, которые могут быть диагностированы с применением антитела по изобретению, включают, но без ограничения, плоскоклеточный рак, мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого, плоскоклеточную карциному легкого, рак брюшины, почечноклеточный рак, рак желудка, рак желудочно-кишечного тракта, стромальные опухоли желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, колоректальный рак, карциному эндометрия или матки, карциному слюнных желез, рак почки, рак печени, рак предстательной железы, рак вульвы, рак щитовидной железы, гепатокарциному и различные типы рака головы и шеи, меланому, поверхностную меланому, меланому типа злокачественного лентиго, акральные лентигинозные меланомы, нодулярные (узловые) меланомы. В-клеточную лимфому, хронический лимфоцитарный лейкоз (CLL); острый лимфобластный лейкоз (ALL); волосистоклеточный лейкоз; хронический миелобластный лейкоз; посттрансплантационное лимфопролиферативное расстройство (PTLD); аномальную васкулярную пролиферацию, обусловленную факоматозами, отек, связанный с опухолями мозга, или синдром Мейгса.
В другом аспекте изобретение включает комплекс любого из антител против VEGF по данному описанию и VEGF. В некоторых вариантах изобретения комплекс применяют in vivo или in vitro. В некоторых вариантах изобретения комплекс включает раковую клетку.
В другом аспекте изобретение включает метод обнаружения VEGF в биологическом образце. Термин "обнаружение" ("детекция", "определение") по данному описанию охватывает количественное или качественное определение (обнаружение).
В некоторых вариантах изобретения метод включает контактирование биологического образца с антителом против VEGF в условиях, допускающих связывание антитела против VEGF с VEGF, и определение, образовался ли комплекс между антителом против VEGF и VEGF.
Антитела против VEGF можно применять для детекции VEGF любым из ряда общеизвестных методов анализа. Например, биологический образец можно анализировать на VEGF: отбирая образец из заданного источника, смешивая образец с антителом против VEGF, чтобы способствовать образованию антителом комплекса антитело/VEGF с любым VEGF, присутствующим в смеси, и детектируя комплекс антитело/VEGF в смеси. Биологический образец можно приготовить для анализа методами, известными в уровне техники, подходящими для конкретного образца. Методы смешения образца с антителами и методы детекции комплекса антитело/VEGF выбирают в соответствии с применяемым анализом.
Во всех аналитических методах для VEGF используются один или более следующих реагентов: меченый аналог VEGF, иммобилизованный аналог VEGF, меченое антитело против VEGF и/или пространственные конъюгаты. Меченые реагенты известны также как "метки" ("индикаторы").
В некоторых вариантах изобретения антитело против VEGF метят таким образом, чтобы его можно было обнаружить. Применяемая метка представляет собой любую детектируемую функциональность, которая не препятствует связыванию VEGF и антитела против VEGF. Метки включают, но без ограничения, метки или частицы, которые детектируются непосредственно (такие как флуоресцентные, хромофорные, с (повышенной) электронной плотностью, хемилюминесцентные и радиоактивные метки), а также частицы, такие как ферменты или лиганды, которые детектируются опосредованно, например, с помощью ферментативной реакции или молекулярного взаимодействия. Типичные метки включают, но без ограничения, радиоизотопы32Р,14С,125I,3Н и131I, флуорофоры, такие как хелаты редкоземельных металлов или флуоресцеин и его производные, родамин и его производные, дансил, умбеллиферон, люциферазы, например люцифераза светляков и бактериальная люцифераза (патент США 4737456), люциферин, 2,3- дигидрофталазиндионы, пероксидаза хрена (HRP), щелочная фосфатаза, β-галактозидаза, глюкоамилаза, оксидазы сахаридов, например оксидаза глюкозы, оксидаза галактозы и глюкоза-6-фосфатдегидрогеназа, гетероциклические оксидазы, такие как уриказа и ксантиноксидаза, связывающиеся с ферментом, который использует пероксид водорода для окисления предшественника красителя, такого как HRP, лактопероксидаза или микропероксидаза, биотин/авидин, спиновые метки, бактериофаги-метки, стабильные свободные радикалы и т.п.
Имеются традиционные методы связывания этих меток с белками или пептидами ковалентной связью. Например, связывающие агенты, такие как диальдегиды, карбодиимиды, дималеимиды, бис-имидаты, бис-диазотированный бензидин и т.п., можно использовать для мечения антител вышеописанными флуоресцентной, хемилюминесцентной и ферментной метками. См., например, патенты США No. 3940475 (флуориметрия) и 3645090 (ферменты); Hunter et al, Nature, 144: 945 (1962); David et al., Biochemistry, 13: 1014-1021 (1974); Paine et. al, J. Immunol. Methods, 40: 219-230 (1981); и Nygren, J. Histochem. and Cytochem., 30: 407-412 (1982). Предпочтительными метками по данному описанию являются ферменты, такие как пероксидаза хрена и щелочная фосфатаза. Конъюгация такой метки, включающей ферменты, с антителом является стандартной процедурой для рядового специалиста в области иммуноанализа. См., например, O'Sullivan et al., "Methods for the Preparation of Enzyme-antibody Conjugates for Use in Enzyme Immunoassay," в Methods in Enzymology, ed. J.J, Langone and H. Van Vunakis, Vol.73 (Academic Press, New York, New York, 1981), pp.147-166.
В некоторых вариантах изобретения антитела иммобилизованы на нерастворимой матрице. Иммобилизация может повлечь за собой отделение антитела против VEGF от любого VEGF, который остается в растворе в свободном виде. Обычно эту процедуру проводят, либо иммобилизуя антитело против VEGF до проведения анализа, например, адсорбцией на нерастворимой в воде матрице или поверхности (Bennich et al., патент США 3720760), или связыванием ковалентной связью (например, используя сшивание с помощью глутаральдегида), или инсолюбилизацией антитела (превращением в нерастворимое) против VEGF после образования комплекса между антителом против VEGF и VEGF, например иммунопреципитацией.
Анализы, применяемые для обнаружения связывания антител против VEGF с VEGF, включают, но без ограничения, анализы связывания с антигеном, общеизвестные в уровне техники, такие как Вестерн-блоттинг, радиоиммунные анализы, ELISA (твердофазный иммуноферментный анализ), конкурентные и "сэндвич" анализы, иммунопреципитационные анализы, флуоресцентные иммуноанализы, иммуноанализы на Белке A immunoassays, иммуногистохимические (ИГХ, IHC) анализы и анализы ингибирования за счет стерических эффектов.
В одном варианте изобретения экспрессию белков в образце можно изучать, используя протоколы иммуногистохимии и окрашивания. Показано, что иммуногистохимическое окрашивание является надежным методом оценки или обнаружения белков в образце. В иммуногистохимических методах используется антитело для зондирования и визуализации клеточных антигенов in situ, обычно хромогенным или флуоресцентным методами. Для приготовления образца можно использовать образец ткани или клетки млекопитающего (обычно пациента- человека). Примеры образцов включают, но без ограничения, раковые клетки, такие как раковые клетки толстой кишки, молочной железы, предстательной железы, яичника, легкого, желудка, поджелудочной железы, лимфомы и лейкоза. Образец можно получать различными методами, известными в уровне техники, включая, но без ограничения, эксцизию (резекцию) хирургическим методом, аспирацию или биопсию. Ткань может быть свежей или замороженной. В одном варианте изобретения образец фиксируют и заключают в парафин или нечто подобное. Образец ткани можно фиксировать (т.е. консервировать) обычным методом. Рядовой специалист в данной области техники понимает, что выбор фиксатора определяется той целью, ради которой образец следует гистологически окрашивать или анализировать иным способом. Рядовой специалист в данной области техники понимает также, что продолжительность фиксации зависит от размера образца ткани и используемого фиксатора.
ИГХ (IHC) можно осуществлять в комбинации с другими методами, такими как морфологическое окрашивание и/или флуоресцентная in situ гибридизация. Существует два основных метода ИГХ: прямой и непрямой методы анализа. Согласно первому анализу связывание антитела с антигеном-мишенью (например, VEGF) определяют непосредственно. В этом прямом методе анализа используют меченый реагент, такой как флуоресцентная метка или меченное ферментом первичное антитело, которое можно визуализировать без взаимодействия с другим антителом. В типичном непрямом методе анализа неконъюгированное первичное антитело связывается с антигеном, а затем меченое вторичное антитело связывается с первичным антителом. Если вторичное антитело конъюгируется ферментной меткой, добавляют хромогенный или флуорогенный субстрат, чтобы обеспечить визуализацию антигена. Происходит амплификация сигнала, так как некоторые вторичные антитела могут реагировать с различными эпитопами на первичном антителе. Первичное и/или вторичное антитело, используемое для иммуногистохимического анализа, обычно мечено детектируемой меткой,
Помимо процедур приготовления образца, обсуждаемых выше, может потребоваться дополнительная обработка тканевых срезов до, во время или после ИГХ (IHC). Например, можно осуществлять методы демаскировки антигенных эпитопов, такие как нагревание образца ткани в цитратном буфере (см., например, Leong et al. Appl. Immunohistochem. 4(3): 201 (1996)).
После стадии оптимального блокирования тканевый срез экспонируют с первичным антителом в течение достаточного периода времени в подходящих условиях, так чтобы первичное антитело связалось с целевым белковым антигеном в тканевом образце. Условия, подходящие для того, чтобы этого достичь, можно определять с помощью стандартных экспериментов. Степень связывания антитела с образцом определяют, используя любую детектируемую метку, обсуждавшуюся выше. Предпочтительно, метка представляет собой ферментную метку (например, HRPO), которая катализирует химическое изменение хромогенного субстрата, такого как хромоген 3,3'-диаминобензидин. Предпочтительно, ферментная метка конъюгируется с антителом, которое специфически связывается с первичным антителом (например, первичное антитело представляет собой кроличье поликлональное антитело, а вторичное антитело представляет собой антитело козы против кроличьего антитела.
Полученные таким образом препараты можно покрывать заливочной средой и помещать на покровное стекло. Анализируют микроскопический препарат, например, под микроскопом, при этом можно применять критерии для оценки интенсивности окрашивания, обычно применяемые в уровне техники. Критерии для оценки интенсивности окрашивания могут быть следующими:
Обычно оценка паттерна окрашивания примерно 2+ или выше в ИГХ (IHC) анализе является диагностической и/или прогностической. В некоторых вариантах изобретения оценка паттерна окрашивания около 1+ или выше является диагностической и/или прогностической оценкой. В некоторых вариантах изобретения оценка паттерна окрашивания около 3+ или выше является диагностической и/или прогностической оценкой. Понятно, что когда методами ИГХ изучают клетки и/или ткань из опухоли или аденомы толстой кишки, обычно определяют или оценивают окрашивание в опухолевой клетке и/или ткани (в отличие от стромальной или соседней ткани, которые могут присутствовать в образце).
Другие методы анализа, известные как конкурентные или сэндвич-анализы, являются общепринятыми и широко применяются в обычной диагностике.
Конкурентные анализы основаны на способности меченого аналога VEGF конкурировать с тестируемым образцом VEGF за ограниченное число антигенсвязывающих сайтов антигена против VEGF. Антитело против VEGF обычно инсолюбилизируют (переводят в нерастворимую форму) до или после конкурентной реакции, а затем метку и VEGF, связанные с антителом против VEGF, отделяют от несвязанных метки и VEGF. Это разделение проводят декантацией (если партнер по связыванию был предварительно инсолюбилизирован) или центрифугированием (если партнер по связыванию осаждался (выпадал в виде осадка) после конкурентной реакции). Количество тестируемого образца VEGF обратно пропорционально количеству связанной метки, определяемому по количеству маркерного вещества. Строят кривые зависимости доза-эффект с известными количествами VEGF и сравнивают с результатами для тестируемого образца с целью определения количества VEGF в тестируемом образце. Когда в качестве детектируемых маркеров используют ферменты, то эти методы анализа носят название ELISA.
В другом виде конкурентного анализа, называемого "гомогенным" анализом, не требуется разделение фаз. В этом методе получают конъюгат фермента с VEGF и используют его таким образом, что когда антитело против VEGF связывается с VEGF, то наличие антитела против VEGF модифицирует активность фермента. В этом случае VEGF или его иммунологически активные фрагменты конъюгируются с ферментом, таким как пероксидаза, за счет бифункционального органического мостика. Конъюгаты для применения с антителом против VEGF отбирают таким образом, чтобы связывание антитела против VEGF ингибировало или усиливало активность метки. Этот метод в чистом виде широко применяется под названием EMIT.
Стерические (пространственные) конъюгаты применяют в методах гомогенного анализа пространственно затрудненных систем. Эти конъюгаты синтезируют, связывая ковалентной связью низкомолекулярный гаптен с малым VEGF-фрагментом таким образом, чтобы антитело к гаптену практически не могло связывать конъюгат одновременно с антителом против VEGF. В этом анализе VEGF в тестируемом образце связывается с антителом против VEGF, что позволяет антителу к гаптену связывать конъюгат, это приводит к изменению свойств гаптена конъюгата, например флуоресценции, если гаптен является флуорофором.
Сэндвич-анализы применяются, в частности, для определения VEGF или антител против VEGF. В последовательных сэндвич-анализах для адсорбции тестируемого образца VEGF применяют иммобилизованное антитело против VEGF, тестируемый образец удаляют отмывкой, связанный VEGF применяют для адсорбции второго, меченого антитела против VEGF, а затем связанный материал разделяют с остальной меткой. Количество связанной метки прямо пропорционально количеству тестируемого образца VEGF. В "синхронных" сэндвич-анализах тестируемый образец не отделяют перед добавлением меченого антитела против VEGF. Последовательный сэндвич-анализ с применением моноклонального антитела против VEGF в качестве одного антитела и поликлонального антитела против VEGF в качестве другого используется при тестировании образцов на VEGF.
Выше представлены только примеры анализов для детекции VEGF. Другие методы, разрабатываемые в настоящее время или позднее, в которых для определения VEGF используется антитело против VEGF, входят в объем изобретения.
Понятно, что любой из вышеописанных вариантов диагностики или детекции можно осуществлять, используя иммуноконъюгат по изобретению вместо или помимо антитела против VEGF.
Изделия
Другой вариант изобретения включает изделия, содержащие материалы, применимые для лечения, предупреждения и/или диагностики описанных выше расстройств. Изделие включает контейнер и этикетку или вкладыш в упаковку или листовку, прилагающуюся к контейнеру. Подходящие контейнеры включают, например, флаконы, виалы, шприцы и т.п. Контейнеры могут быть из различных материалов, таких как стекло или пластик. Контейнер содержит композицию, которая, сама по себе или в сочетании с другой композицией, эффективна для лечения, предупреждения и/или диагностики состояния, и может иметь стерильное отверстие (например, контейнер может представлять собой пакет (мешок) или виалу с раствором для внутривенного введения, с пробкой, в которую вводится гиподермическая игла для инъекций). По меньшей мере одним активным агентом в композиции является антитело или иммуноконъюгат по изобретению. На этикетке или на вкладыше в упаковку указано, что композиция используется для лечения состояния выбора. Кроме того, изделие может включать (а) первый контейнер с содержащейся в нем композицией, причем композиция включает антитело или иммуноконъюгат по изобретению; и (б) второй контейнер с содержащейся в нем композицией, причем композиция включает дополнительный цитотоксический или иной терапевтический агент. Изделие в данном варианте изобретения может дополнительно содержать вкладыш в упаковку, в котором указано, что композицию можно использовать для лечения конкретного состояния. Или же, или помимо этого, изделие может дополнительно включать второй (или третий) контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), фосфатно-солевой буферный раствор, раствор Рингера или раствор декстрозы. Кроме того, изделие может включать другие материалы, целесообразные с точки зрения производителя или потребителя, включая другие буферы, разбавители, фильтры, иглы и шприцы.
Нижеприведенные примеры предлагаются только для иллюстрации применения настоящего изобретения, но не с целью ограничения. Раскрытие всей патентной и научной литературы, цитируемой в данном описании, однозначно вводится ссылкой во всей полноте.
ПРИМЕРЫ
Пример 1
Получение и определение характеристик антител против VEGF
Синтетические фаговые библиотеки антител создают на основе единого каркаса (гуманизированного антитела против ErbB2, 4D5), вводя разнообразные области, определяющие комплементарность (гипервариабельные области) (CDR) тяжелых и легких цепей (Lee, С.V. et al., J Mol Biol 340, 1073-93 (2004)). Коротко говоря, фаг-дисплейные синтетические библиотеки антител строят на основе единого человеческого каркаса, вводя синтетическое многообразие в положениях, экспонируемых с растворителем в областях CDR. Для повышения продуктивности библиотеки создают библиотеки моновалентных и бивалентных антигенсвязывающих фрагментов (Fab) и изучают различные CDR-H3 разнообразия, варьируя аминокислотный состав и длину CDR. Затем расширяют библиотеку, повышая вариабельность длины CDR-H3 и используя и специально разработанные кодоны, которые имитируют аминокислотный состав природных CDR-H3 последовательностей. Используя эти библиотеки с полностью синтетическими областями CDR, визуализируемыми на одном каркасе, получают высокоаффинные антитела. Более подробно о стратегии и методах создания библиотек синтетических антител с единой матрицей см., например, Международную патентную заявку WO 2005/012359, опубликованную 10 февраля 2005 года, полное раскрытие которой однозначно вводится в данное описание в качестве ссылки.
Пэннинг растворенной фазы с применением наивных библиотек осуществляют против биотинилированного мышиного VEGF в растворе, а затем улавливают с помощью 5 мкг/мл нейтравидина, иммобилизованного на иммунопланшетах MaxiSorp™. После трех циклов селекции с уменьшением концентрации биотинилированного мышиного VEGF отбирают случайные клоны и специфические связывающие вещества идентифицируют методом ELISA для фагов. Для каждого позитивного фагового клона вариабельные области тяжелой и легкой цепей субклонируют в векторы экспрессии pRK, созданные для экспрессии полноразмерных IgG цепей. Конструкции тяжелой цепи и легкой цепи котрансфецируют в клетки 293 или СНО и экспрессированные антитела очищают от бессывороточной среды на аффинной колонке с Белком А. Для созревания аффинности с применением стратегии гибкой рандомизации создают фаговые библиотеки с различной комбинацией CDR петель (CDR-H1 и Н2, CDR-L1, L2 и L3), образованных из одного целевого клона, таким образом, чтобы остаток в каждом выбранном положении мутировал не до остатка дикого типа или чтобы сохранялся как остаток дикого типа с частотой 50:50 (Lee, С.V el al, Blood, 108: 3103-3111, 2006). Высокоэффективные клоны затем идентифицируют в четырех циклах пэннинга растворенной фазы против биотинилированного человеческого VEGF, как описано. Снижение концентрации биотинилированного антигена делает пэннинг более строгим.
Пример 2
Аффинность связывания антител против VEGF
Для определения аффинности связывания IgG против VEGF проводят измерения методом поверхностного плазменного резонанса (SRP) на приборе BIAcore™-3000. Биосенсорные чипы на основе карбоксиметилированного декстрана (СМ5, BIAcore Inc.) активируют гидрохлоридом N-этил-N'-(3-диметиламинопропил)-карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями производителя. Иммобилизуют человеческий или мышиный VEGF до достижения примерно 60 относительных единиц (RU) связанного белка. См. Фигуру 10. Для кинетических измерений двукратные серийные разведения IgG против VEGF (от 7.8 нМ до 500 нМ) инъецируют по отдельности в буфере РВТ (PBS с 0.05% (об/об) Tween 20) при 37°С и при скорости потока 25 мкл/мин. Константы ассоциации (kon) и константы диссоциации (koff) рассчитывают, используя модель бивалентного связывания (BIAcore Evaluation Software version 3.2). Равновесную константу скорости диссоциации (KD) рассчитывают по уравнению koff/kon.
Вследствие невозможности определить константу диссоциации В20.4.1, IgG иммобилизуют до достижения примерно 1000 относительных единиц (RU) связанного белка. См. Фигуру 11. Двукратные серийные разведения человеческого или мышиного VEGF (от 7.8 нМ до 500 нМ) инъецируют в РВТ буфере (PBS с 0.05% (об/об) Tween 20) при 37°С и при скорости потока 25 мкл/мин. Константы ассоциации (kon) и константы диссоциации (koff) рассчитывают, используя образец один к одному модели связывания один к одному Ленгмюра (BlAcore Evaluation Software version 3.2) для получения равновесной константы скорости диссоциации (KD).
Пример 3
Анализ включения тимидина в HUVEC
Для изучения функции антител против VEGF с помощью ингибирования VEGF-индуцированной пролиферации клеток проводят анализ включения тимидина в HUVEC. Человеческие эндотелиальные клетки пупочной вены (HUVEC) (Clontech, Mountain View, СА) выращивают и анализируют, как описано. Около 3000 HUVEC засевают в каждую лунку 96-луночного планшета для клеточных культур и инкубируют в модифицированной по способу Дульбекко среде Игла (ВМЕМ)/среде F12, дополненной 1.5% (об/об) фетальной бычьей сывороткой (среда для анализа), в течение 18 часов. Свежую среду для анализа с фиксированным количеством человеческого VEGF (конечная концентрация 0.1 нМ) определяют, сначала титруя VEGF, который может стимулировать субмаксимальный синтез ДНК, а затем к клеткам добавляют увеличивающиеся концентрации IgG против VEGF. После инкубации при 37°С в течение 18 часов клетки выдерживают в пульсовом режиме с 0.5 мкКи/лунка с [3Н] тимидином в течение 24 часов и собирают для подсчета с помощью сцинтилляционного счетчика для микропланшетов TopCount Microplate Scintillation counter, как описано.
Анализ включения тимидина в HUVEC показывает, что варианты В20 могут эффективно ингибировать клеточную пролиферацию HUVEC. На Фигуре 12 показано, что ингибирование с использованием В20-4.1.1 и B20-4.1.1RR аналогично ингибированию с помощью G6-31.
Пример 4
Анализ пролиферации эндотелиалъных клеток
Для определения специфичности связывания и блокирующей активности В20-4.1.1 проводят клеточный анализ, используя эндотелиальные клетки микрососудов почек (BRME), причем проверяют способность антитела блокировать клеточную пролиферацию, индуцируемую человеческим или мышиным VEGF. Клетки BRME засевают при плотности 500 клеток/лунка в 96-луночных планшетах в питательной среде (DMEM с низким содержанием глюкозы, дополненной 10% телячьей сывороткой, 2 мМ глутамина и антибиотиками). Для анализа ингибирования в лунки в тройном повторе добавляют В20-4.1.1 в указанной концентрации (нг/мл) (Фигура 13). Через 0.5 часа добавляют человеческий VEGF-A (hVEGF) или мышиный VEGF-A (mVEGF) до конечной концентрации 6 нг/мл. Через шесть-семь дней определяют клеточный рост с помощью красителя Alamar blue (BioSource; Invitrogen). Интенсивность флуоресценции проверяют при длине волны 530 нм (возбуждение) и при длине волны 590 нм (испускание).
Как показано на Фигуре 13, антитело В20-4.1.1 уменьшает способность как hVEGF, так и mVEGF инициировать пролиферацию BRME. Как показано на Фигуре 16, антитело авастин уменьшает способность hVEGF инициировать пролиферацию BRME. Антитело авастин не ингибирует пролиферацию, индуцированную mVEGF, так как ингибирование mVEGF не наблюдается при концентрации антитела авастина вплоть до 1500 нМ.
Пример 5
In vivo исследование ингибирования опухоли
Клетки А549 (человеческие раковые клетки легких) и клетки MDA-MB231 (человеческие раковые клетки молочной железы) выращивают в клеточной культуре и инъецируют подкожно 80 12-недельным "голым" мышам с врожденным отсутствием естественных клеток-киллеров при плотности клеток ~5×106 клеток/мышь. Через сорок восемь часов после инокуляции опухоли или когда опухоль увеличится до размера примерно 200 мм3, мышам (n=10) инъецируют интраперитонеально антитело В20-4.1.1 с концентрацией 5 мг/кг или буфер-носитель. Затем антитела вводят дважды в неделю. Объемы опухолей измеряют с помощью калипера в указанных временных точках.
Как показано на Фигурах 14 и 15, В20-4.1.1 эффективно уменьшает объем опухолей у мышей, инъецированных либо клетками А549 (Фигура 14), либо клетками MDA-MB231 (Фигура 15).
Хотя вышеприведенное описание изобретения иллюстрируется ссылками на некоторые варианты изобретения, оно не является ограничивающим. На самом деле различные модификации изобретения, помимо показанных и представленных в данном описании, станут очевидными для специалистов в данной области техники из вышеприведенного описания и входят в объем прилагаемой формулы изобретения.
Реферат
Изобретение относится к области иммунологии. Описаны антитела против VEGF, одно из которых содержит комплементарные регионы с аминокислотными последовательностями SEQ ID NO:1, 2, 3, 4, 6 и 7, другое содержит комплементарные регионы с аминокислотными последовательностями SEQ ID NO:1, 2, 3, 5, 6 и 7, раскрытыми в описании. Также описаны полинуклеотиды, кодирующие указанные антитела; экспрессионные векторы, содержащие указанные полинуклеотиды, и клетки-хозяева, предназначенные для получения антител по настоящему изобретению. Предложен способ получения антител против VEGF, включающий экспрессию вектора в клетке-хозяине и выделение антитела. Раскрыт способ получения иммуноконъюгата антитела против VEGF, включающий конъюгирование антитела с лекарством или цитотоксическим агентом. Описан способ обнаружения VEGF, включающий обнаружение комплекса VEGF-антитело против VEGF в биологическом образце. Кроме того, раскрыты композиции для лечения заболевания, ассоциированного с VEGF, одна из которых содержит эффективное количество антитела против VEGF, а другая - эффективное количество полинуклеотида, кодирующего указанное антитело. Также раскрыты способы: 1) лечения опухоли, рака или клеточно-пролиферативного заболевания, ассоциированного с VEGF; 2) ингибирования ангиогенеза у субъекта и 3) ингибирования сосудистой проницаемости; заключающиеся во введении субъекту эффективного количества антитела против VEGF по настоящему изобретению. Изобретение позволяет получить антитела против VEGF и применять их для лечения заболеваний, ассоциированных с VEGF. 14 н. и 17 з.п. ф-лы, 16 ил., 2 табл., 5 пр.
Формула
(1) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 1;
(2) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 2;
(3) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 3;
(4) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 4;
(5) HVR-L2, содержащую аминокислотную последовательностьSEQ ID NO:6; и
(6) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 7.
(1) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 1;
(2) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 2;
(3) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 3
(4) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 5;
(5) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 6; и
(6) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 7.

Комментарии