Способ получения замещенных ауронов - SU1138027A3
Код документа: SU1138027A3
Описание
изобретение относится к способу получения новых замещенных ауронов общей формулы « О где Ri-R одинаковые или разные и каждый-водород, галоген , алкил , меток си, циклогексил, трифто метил, ацетамидо, изопропилкарбоксамидо , ами но, диметиламино, циан, окси, карбоксил или -сн снсоЬн, или R.HR, вместе взятые группа формуль -СН СН-СН СН при условии, что по меньшей мере один из , обозначает кар боксил или -СН СНСОО обладающих фармакологической активностью , Известна двунатриевая соль 1,3бис (2-карбоксихромон-5-илокси)-2оксипропана , которая используется при лечении астмы и обладает антиал лергической активностью flj , Соединения общей формулы I получают основываясь на известной реакции 2 путем взаимодействия бензаль дегида рбщей формулы где , имеют указанные значения с бензофураном общей формулы где имеют указанные значения или-с СО -замещенньм ацетофеноном общей формулы R О CHjX IV 272 где Rj-Rj имеют указанные значения; X - обозначает легко уходящую группу, выбранную из галогенной или толуолсульфонильной Групп, в растворителе при 0-150с. К подходящим растворителям для этой реакции относятся эфирные растворители , например диоксан и тетрагидрофуран , и жидкие алканолы, например этанол. Вообще температура не имеет решающего значения и лишь обуславливает скорость реакции. Реакция может протекать при любой температуре от температуры окружающей среды до температуры рефлюкса реакционной смеси, например 25-150 С. Реакцию предпочтительно проводят в присутствии кислого или основного катализатора . К- пригодньп кислым катализаторам относятся минеральные кислоты , например хлористоводородная, и сильные органические кислоты, например И -толуолсульфокислоты, а к пригодным неорганическим или органическим основным катализаторам относятся щелочи, например едкий натр, едкое кали, карбонат натрия или триэтиламин . В соответствии с другим вариантом способ, получения соединений формулы I заключается во взаимодействии СО-замещенного ацетофенона формулы IV с соответствующим бензальдегидом формулы III. К подходящим растворителям для этой реакции относятся эфирные растворители, например диоксан и тетрагидрофуран, и жидкие алканолы, например этанол. Б данном случае реакцию предпочтительно про-. водят в присутствии основного катализатора с применением, например, едкого натра, едкого ,кали, или карбоната натрия. Реакцию можно проводить при 0-150 С. Найдено, что ауроны формулы I полезны при профилактическом лечении астмы у млекопитающих. Активность показана на морских свинках с применением теста Херцхаймер либо теста Рубленые легкие морской свинки.. Соединения проявляют также активность по перитонеальному анафилактическому тесту крыс, основанному на аллергической реакции в брюшной полости крысы. Тест Херцхаймер. основан на аллергическом бронхоспазме, вызванном у морских свинок, который очень похож на приступ астмы у человека. Медиаторы, вызывающие бронхоспазм, очень похожи на медиаторы, выделяющиеся при введении в сенсибилизированную легочную ткань человека аитигена . Соединения согласно изобретению проявляют активность по тесту Херцхаймера при дозах 25-200 мг/к
Соединения формулы I могут.быть введены различными способами, для этого готовят составы в различных видах, но они эффективны при оральном введении. Соединения могут быть введены орально, ректально, местно, парентерально, например путем инъекции , в виде таблеток, лепешек, таблеток под язык, ойлаток, эликсиров , суспензий, аэро.золей, мазей, содержащих например, до 10 вес.% активного соединения в подхо;фщей основе, мягких и жестких желатиновых капсул, свечей, растворов и суспензий для инъекций в физиологически приемлемой среде и стерильных порошков в упаковке, адсорбированных носителем, для приготовления растворов для инъекций.
Пример 1. (7.)-4-Карбоксил2-бензилйден-5-метильензолфуран-3 (2Н)-он.
Щ-Хлор-2-окси-5-метилацетофенон (8,73 г, 0,05 моль) и 4-карбоксибензальдегид (7,5 г, 0,05 моль) растворяют в этаноле (100 мл) и смесь наЛ
гревают до 60 С. Затем к смеси медленно добавляют при перемешивании гидрохлорид натрия (4 г, 0,1 моль) в воде (20 мл), смесь окрашивается в тёмно-красный цвет. После выдержки в течение 1 ч при 60 С образуется бледно-желтый осадок, который нагревают с рефлюксом в течение 1ч. Затем полученную таким образом суспензию охлаждают до О С и подкисляют соляной кислотой (5М). Полученное бледно-желтое твердое вещество отфильтровывают , промывают водой, высушивают при пониженном давлении и перекристаллизуют из диоксана, пoлyчaю соединение в виде бледно-желтых игл, т.пл. 288-290°С (разлаг.), выход 34%.
Примеры 2-5. Следующие сое- динения получены аналогично с применением соответствующих бензальдегида и хлорацетофенона.
(Z)-2 -Карбоксил-2-бензилиден-2метилбензофуран-3 (2И)-он; т.пл. 187189°С , выход 35%.
(Z)-2 -Карбоксил-2-бензилиден-6-метилбензрфуран-З (2Н)-он, т.пл. 196198 С (разлаг.), выход 67%.
(Z)-2 -Карбоксил-2-бензилиденнафто- (2,1-в)фуран-3(2Н)-он, т.пл. 207-208 С, выход 28%.
(Z)-4 -Карбоксил-2-бензилиден-5изопропилбензофуран-3 (2Н)-он, т.пл. 262-263 С, выход 38%.
Пример 6. (Z)-3-Kapбoкcил2-бензилиден-5-метоксибензофуран3 (2Н)-он.
5-Метоксибензофуран-3(2Н)-он (6,0 г, 0,036 моль) и 3-карбоксибензальдегид (5,4 г, 0,036 моль) растворяют в диоксане (50 мл) и добавляют концентрированную соляную кислоту (10.мл). Затем полученный желтый раствор нагревают с рефлюксом в течение 2 ч. После.охлаждения и добавления воды (20 мл) образуется желтый осадок. После перекристаллизации этого вещества из уксусной кислоты получают соединение в виде желтых игл, т.пл. 252-254с, выход 58%.
Примеры 7-36. Аналогично примеру 6, но с соответствующим изменением исходных бензофуранона и бензальдегида получены следующие соединения.
(Z)-2 -Карбоксил-2-бензилиден-6метоксибензофуран-3 (2Н)-он, т.пл. 217-220°С (разлаг.), выход 40%.
(Z)-3-Карбоксил-2-бензилиден-6метоксибензофуран-3 (2Н)-он, т.пл.. 258-260°С (разлаг.), выход 70%.
(2)-4-Карбоксил-2-бензилиден-6метоксибензофуран-3 (2Н)-он, т.пл. 2J3-275°C (разлаг.), выход 70%.
(Z)-3 -Карбоксил-2-бензилиден-5метилбензофуран-3 (2Н)-он, т.пл. 264265°С , выход 68%.
(Z)-3 -Карбоксил-2-бензилиден-6етилбензофуран-3 (2Н)-он, т.пл. 263264°С , выход 51%.
(Z)-4 -Карбоксил-2-бензилиден-6етилбензофуран-3 ()-он, т.пл. 288289с , выход 57%.
(Z)-3 -Карбоксил-4-окси-2-бензилден-6-метилбензофуран-3 (2Н)-он, .пл. 290-29l C, выход 62%.
(Z) - 3 -Карбоксил-4-окси-2-бенилиденбензофуран-3 (2Н)-он, т.пл. 268-270 С, выход 56%. ( Z) j4-Карбоксил-2-беязилиденбензофуранг-3 (2Н)-он, т.тт. 274-275 выход 83%. . (г)-3-Карбоксил-2-6ензипиден-6хлорбензрфуран-3 (2Н)-он, т.пл. 278280°С , выход 58%. . ( Z)-2 -Карбоксил 2-бензилиден-5хлорбензофуран-3 (2Н)-он, т..пл. 205206°С , выход 32%. (Z)-3-Kap6oKCHfl-2-6eH3HflHfleH-9хлорбензофуран-3 (2Н)-он, т.пл. 286288С , выход 72%. (Z)-4-Карбоксил-2-бензилиден-5хлорбензофуран-3 (2Н)-он, т.пл. 300 С выход 57%.. ( Z)-3-Карбоксил-2-бензилиден-5этилбензофуран-3 (2Н)-он, т.пл. 25А выход 34%. (Z)-3 -Карбоксил-2-бензилиденбен зофуран-3(2Н)-он, т.пп. 259-260 С, выход 57%. {Z)-4-Е-Карбоксивинил-2-бензилиден-5-метилбензофуран-3 (2Н)-он, т.ТТЛ. 275-276°С, выход 90%. (Z)-3-Карбоксил-2-бензилиден-5циклегексилбензофуран-3 (2Н)-он, т.пл. 252-253°С, выход 49%. (Z)-4-Карбоксил-2-бензилиден-6хлорбензофуран-3 (2Н)-он, т.пл. 300°С, выход 70%. (Z)-2 -Карбоксил-2-бензилиден-6хлорбензофуран-3 (2Н)-он, т.пл. 184 С выход 51л. ( Z)-4 (Е)-2Карбоксивинил -2бензилиден-6-оксибензофуран-3 (2Н)-о т.пл. 300 С разлаг.), выход 57%. (Z)-3-Kapбoкcил-2-бeнзилидeн-6оксибензофуран-3 (2Н)-он, т„пл. 320 (разлаг.), выход 49%. (Z)-2 -Карбоксил-2-бензилиден-6019сибензофуран-3 (2Н)-он, т.пл. 282283°С , выход 52%. (Z)-4 - (Е)-2-КарбоксивинилЗ-2-бензилиден-5 ,7-дихлорбензофуран-3(2Н он, т.пл.300°С, выход 30%. (Z)-3- (Е)-2-Карбоксивинил -2бензилиден-5 ,7-дихлорбензофуран3 (2Н)-он, т.пл. , выход 47%. (Z)-3 - (Е)-2-Карбоксивинил -2«бензилиден-6-оксибензофуран-3 (2Н)-он T.nJi. 300 С, выход 72%. ( Z)-3-(E)-2-Kapбoкcивинил -2 ,бензилиден-5-метоксибензофуран-3(2Н) он, т.пл. 242 С, выход 71%, (Z)-3 -Карбоксил-2-бензилиденнафто (1,2-в)фуран-3(2Н)-он, т.пл. 276-278°С, выход 48%. , ( Z)-3 -(Е)-2-Карбоксивинил -2бензилиденнафто (1,2-в)фуран-3(2Н)-он, т.пл. 280°С, выход 49%. (Z)-3 -Карбоксил-2-беизилиден-4оксибензофуран-3 (2Н)-он, т.пл. 285287®С , выход 32%. Пример 37. (Z)-4-(5-TeTpa-. золил)-2-бензилиден-5-хлорбензофуран3 (2Н)-он. 4-Цианбензальдегид (13,1 г, 0,1 моль), этиленгликоль (6,2 г, 0,1 моль) и толуол-4-сульфокислоту (19,0 г, 0,1 моль) нагревают с рефпюксом в бензоле (1бО мл) в течение 8 ч с применением прибора Дина и Старка. Затем бензол отгоняют досуха и получают 4-циан-(2-1,3-ДИоксолан)бензол в виде воскообразного бесцветного твердого вещества (т.пл. 4445 С), применяемого без дальнейшей очистки. Указанный диоксолан (17,1 г, 0,1 моль), азид натрия (6,5 г, 0,1 моль) и хлорид лития (6,5 г, 0,15 моль) нагревают с рефлюксом в 2-метоксиэтаноле (100 мл) в течение . 8 ч. Затем суспензию выливают в лед и соляную кислоту (5М). После стояния в растворе образуются белые кристаллы 4-(5-тетразолш1) бензальдегида, т.пл. 200 С, выход 83%, который приводят во взаимодействие с 5-хлорбензофуран-3 (2Н)-оном по методике примера 6, и получают соединение, Которое перекристаллизуют из диметилформамида , т.пл. 260°С (разлаг.), выход 68%. Примеры 38-41. Аналогично с применением соответствующих цианбензальдегида и бензофуранона получены следующие соединения. (Z)-3-(5-Тетразйлил)-2-бензилиден-5-метоксибензофуран-3 (2Н)-он, т.пл. 278-280 С, выход 75%. (Z)-3 -(5-Тетразолил)-2-бензилиден-6-оксибензофуран-3 (2Н)-он, т.пл. 300 С (разлаг.), выход 78%. (Z)-4 -(5-Тетразолил)-2 бензилиден-5-метоксибензофуран-3 (2Н)-он, т.пл. 268-270 С (разлаг.), выход 62%. (Z)-3-(5-Тетразолил)-2-бензилиден-5 ,7-дихлорбензофуран-З(2Н)-он, т.пл. 283-285с (разлаг.), выход 54%. Пример 42. (Z)-3-(5-TeTpaзолш1 )-2-бензилиден-5-этилбензофуран-3 (2Н)-он. 5-Этилбензофурак-3(2Н)-он (3,4 г, 0,02 моль) и 3-цианбензальдегид
(2,62 г, 0,02 моль) растворяют в диксане (100 мл) и добавляют концентированную соляную кислоту (5 мл). олученный желтый раствор нагревают с рефлюксом в течение 2 ч. После ох- 5 аждения образуются желтые иглы (Z).3 -циан-2-бензилиденбензофуран-3(2Н)иа , т.пл. ,. которые отделяют ильтрованием. Аурой (0,5 г, 0,0018 моль) и триметилсилилазид (1 г, 0,086 моль) нагревают вместе с рефлюксом в диметилформамиде в течение 6 ч. Охлажденный раствор выливают в лед и соляную кислоту. Затем суспензию нагревают до 70 С в 5 течение 30 мин и после охлаждения осадок отфильтровывают. Методом хроматографии устанавливают, что это желтое твердое вещество представляет собой указанное соединение 20 т.пл. 242-243°С, выход 48%.
Пример 43. (Z)-2-Карбоксил2-бензилиден-5-карбометокси -6-амин.обензофуран-3 (2Н)-он.
Метил-3-ацетил-4-окси-6-аминобензоат (8,0 г, 0,038 моль) в дихлорметане (250 мл) добавляют к трифторуксусному ангидриду (16 г, 0,076 моль) и раствор перемешивают при комнатной температуре в течение 15 ми|1. 30 После выпаривания бледно-желтого раствора получают З-ацетил-4-ацетокси6-трифторацетамидобензоат , т.пл. 130131°С , выход 98%.
Бромид меди (II) (17,0 г, 35 0,076 моль) суспендируют в этилацетате (300 мл) при быстром перемешивании , К этой суспензии добавляют полученный бензоат (11,5 г, 0,038 моль) в виде раствора в этилацетате (200 мл) 40 и полученную смесь перемешивают и нагревают с рефлюксом в течение 3ч. После охлаждения образовавшийся бледно-зеленьй бромид меди (I) отделяют фильтрованием, раствор выпари- 45 вают и получают бледно-желтое твердое вещество, которое после перекрис таллизации из смеси (петролейный эфир, 40-60 С) представляет собой метил-3-бромацетил-4-ацетокси-6-три- 50 фторорацетамидобензоат. в виде белых кристаллов, т.пл. 260-261 С, выход 72%.
Затем это соединение (1,9 г, 0,005 моль) и 2-карбоксибензальдегид 5 (0,75 г. 0,005 моль) в метаноле (100 мл) нагревают до 60 С. К раствору при перемешивании медленно до-
бавляют гидроксид натрия (0,6 г, iO,015 моль) в воде (20 мл). Полученный красный раствор нагревают с рефлюксом в течение 3 ч и затем выливают в лед и соляную кислоту (5М). Образующееся таким образом твердое вещество желтого цвета отфильтровывают и растворяют в 10%-но водном растворе бикарбоната натрия при 50 С. рН этого раствора доводят до 7 и добавляют амберлитовую ионообменную смолу 1РА-401 .в гидроксильной форме. Затем смолу отфильтровывают и промывают сначала водой, потом ледяной уксусной кислотой. Посл упаривания промывной уксусной кислоты получают соединение в виде желты призм, т.пл. 280 С (разлаг.), выход 48%.
Пример 44. (Z)-3-Карбокси2-бензилиден-5 ,7-дибром-4-оксибензофуран-3 (2Н)-он.
.1
Мелко измельченный бромид меди
(II) (88 г, 0,4 моль) суспендируют в 50:50 смеси этилацетата и хлороформа (200 мл). К указанной смеси добавляют 2,6-диоксиаЦетофенон (10 г, 0,0657 моль) в хлороформе (20 мл) и затем перемешивают с рефлюксом в течение 8 ч, при этом выделяется бромистый водород. После охлаждения полученный в ходе реакции бромид меди (I) отфильтровывают и раствор выпаривают до сухости для получения 3,5-дибром-2,6-диоксиСО-бромацетофенон , т.пл. 150 С. Ш-Бромацетофенон (8,2 г, 0,21 моль) и уксуснокислый натрий (20 г) нагревают с рефлюксом в 90% этаноле (100 мл) в течение 15 мин. После охлаждения и последуюг его добавления воды (100 мл) из желтого раствора выделяют зеленоватый твердый осадок который перекристаллизовывают из смеси этанола и воды с образованием 5,7-дибром-4-оксибензофуран-3(2Н)-он , т.пл. 185 С (разлаг.),
t
Бензофуран-3(2Н)-он приводят во взаимодействие с 2-карбоксилбенэальдегидом ло примеру 6 с образованием целевого соединения, т.пл. 300 С (разлаг.), выход 56%.
Примеры 45-46. Аналогично примеру 44 получают следунщие соединения с использованием надлежащего
бензальдегида. о
(2)-4-Карбоксил-2-бензилиден5 ,7-дибррм -4-оксибензофуран-3(2Н)он т.пл. (разлаг.), выход 68%.
(Z)-2-Карбоксш1-2-бензилиден5 ,7-ди6ром-4-оксибензофуран-3(2Н)- 5 он, т.пл. 258-260 С, выход 60%.
Пример 47. (Z)-4-t(E)-2Карбоксивинил -2-бензилиден-6-амино5-циaнoбeнзoфypaн-3 (2H)-oн.
4-Амино-5-циано-2-оксиацетофенон превращают в 4-трифторацетоамид-51иано-2-оксиацетофенон (т.пл. 214 С) с применением способа по примеру 43, выход 98%.
Ацетофенон бронируют с помощью бромида меди (II) по примеру 44 с образованием 4-трифторацетоамидо-5циано-2-окси-бромацетофенрна , т.пл. , выход 58%.
М -Бромацетофенон(3,8г,0,011 моль) растворяют в этаноле 50 мл и избыточньй уксуснокислый натрий (10 г) вводят вместе с водой (10 мл). Затем смесь нагревают с рефлюксом в течекие 20 мин и при охлаждении из нее выделяется оранжевый осадок, который перекристаллизовывают из смеси этанол/вода с образованием оранжевых пластинок 6-амино-5-цианобензофуран3 (2Н)-он, т.пл. 270°С (разлаг.), вы- 30 ход 60%.,
Бензофуран затем приводят во взаимодействие с (Е)-4-формш1Коричной кислотой с использованием способа. примера 6, при этом получают целевое 35 соединение в виде оранжевых кристаллов , т , пл. 7 , выход 72%.
Пример 48. (г)-з-Карбоксил2-бензилиден-5-циклогексибендофуран3 (2Н)-он. 40
Циклогексилфенол (88 г, О,5.моль) и ацетил хлорид (39 г, 0,5 моль) нагревают совместно при 170 С в течение 3 ч. Полученную таким образом светлую жидкость затем охлаждают 45 до 100 С и медленно добавляют хлорид алюминия (133 г, 1,0 моль). Затем коричневое вязкое масло нагревают при 130°С в течение 5 ч. После охлаждения добавляют лед и Соляную кисло- 50 ту ти фенол экстрагируют, хлороформом. Затем этот экстракт выпаривают досуха , остаток отгоняют с водяным паром и получают 2-ацетш1-4-циклогексилфенол . в виде прозрачного масла. 55 Затем фенол приводят во взаимодействие с бромидом меди (II) по методике примера 43. В результате реак ции получают 2-бромацетил-4-циклогексилфенол в виде желтого масла. Это масло растворяют в этаноле (100 мл) и добавляют ацетат натрия (44 г) и воду (20 мл).
Затем полученный раствор нагревают в рефлюксом в течение 10 мин, охлаждают и добавляют воду для осаждения коричневого масла, которое, экстрагируют хлоррформом. После выпаривания досуха хлороформного экстракта получают 5-циклогексилбензофуран-3 (2Н)-он, который приводят во взаимодействие с 3-карбоксибензальдегидом по методике примера 6, получают соединение в виде желтых кристаллов , т,.пл. 252-253°С.
.Пример 49. (г)-з,4 ,5 Триметокси-2-бензилиден-5-карбоксибензофуран-3 (2Н)-он.
Л. Тщательно перемешивают метил4-ацетоксибензоат (126 г, 0,65 моль) и хлорид алюминия (220 г, 1,63 моль) и приводят их во взаимодействие при . Неочищенньш твердый продукт, полученный после обработки кислотой, перемешивают с насьщ5енным раствором бикарбоната натрия и смесь отфильтровывают . Фильтрат осторожно подкисляют и получают З-ацетил-4-оксибензойную кислоту, которую отфильтровывают , промывают водой и сушат. Т.пл. 232°С.
Нерастворившееся твердое вещество оставшее после экстракции бикарбонатом натрия, растворяют в разбавленном растворе гидроксида натрия (2N) и осторожно подкисляют разбавленной соляной кислотой (5N), получают метил-З-ацетил-4-оксибензоат, которьй после фильтрования, промывки водой и сушки имеетт1пл. 90-92 С. В. Растворяют З-ацетил-4-оксибензойную кислоту (24,0 г, 0,133моль в диоксане (400 мл) при 40°С и добавляют по каплям при перемешивании бром (7,2 мл, 0,14 моль)./Вскоре окраска исчезает и через 45 прозрачньй вспльшший с нерастворимого вещества слой декантируют и выпаривают , получают твердое вещество светло-соломенного цвета, 3-бромацетил-4-оксибензойную кислоту, т.пл. 22бс. .
С. Продукт, полученный по примеру 49 В, растворяют в смеси этанолвода , добавляют ацетат натрия (30 г) и раствор перемешивают при в течение Ю мин. Полученньй темнооранжево-красный раствор охлаждают до , перемешивают и осторожно подкисляют 5N раствором соляной кис лоты. Полученный ярко-желтый pacTBo разбавляют равным объемом воды и хранят в холодильнике в течение ночи Отфильтровывают твердое кристаллические вещество желтого цвета, промывают его холодной водой, высушива ют и получают 5-карбоксибензофуран3 (2Н)-лн, т.пл. (разлаг.). D. Растворяют 5-карбоксибензофуран-3 (2Н)-он .(3,56 г, 0,02 моль) и 3,4,5-триметоксибензальдегид (3,92 г, 0,02 моль) в теплом диокса не (50 мл), добавляют концентрированную соляную кислоту, на паровой бане в течение 15 мин.После охлаждения и добавления равного объема воды отфильтровывают твердое кристаллическое вещество желтого цвета промывают его водой и высушивают. После перекристаллизации из ледяной уксусной кислоты получают соединение , т.пл. 290с, выход 3,1 г (44% Примеры 50-60. Следующие соединения получены аналогично при меру 49. (Z)-2-Бензилиден-5-карбоксибензофуран-3 (2Н)-он, т.пл. 280 С, выход 54%. (Е)-4-Хлор-2-бензилиден-5-карбоксибензофуран-3 (2Н)-он, т.пл. 300°С, выход 61%. (г)-2-Хлор-4-диметиламин-2-бен зилиден-5-карбоксибензофуран-3 (2Н) он, т.пл. 275 С (разлаг.)выход 24 ( г)-4-Бутил-2-бензилиден-5-карбоксифуран-3 (2Н)-он, т.пл. 252 С, выход 51%. (Z)-4-Диметиламин-Я-бензш1иденкарбоксибензофуран-3 (2Н)-он, т,пд, 295°С, выход 42%. (Z)-4-Метокси-2-бензилиден-5-ка боксибензофуран-3(2Н)-он, т.пл, 300°С, выход 40%. (г)-4-(Е)-2-Карбоксивинил -2бензилиден-5-карбоксибензофуран3 (2Н)-он, т.пл. , выход 45%. (2)-3-Карбоксил-4-окси-2-берзил иден-5-карбоксибензофуран-3(2Н)-он т.пл. , выход 41%. ( г)-4-Ацетамид-2-бензилиден-5карбоксибензофуран-3 (2Н)-о, т.пл. 300°С, выход 29%. (Z)-3-Tpифтopмeтил-2-бeнзилидeн-5карб6ксибензофуран-3 (2Н)-он, т.пл. 264°С, выход 46%. . ( Z)-3-(N-Изoпpoпилкapбoкcaмид)-2бензилиден-5-карбоксиб8нзофуран-3 (2Н) он, т.пл. 300 С, выход 44%. Пример 61.. 5-Карбоксил-6оксибензофуран-3 (2Н)-он. A.5-Ацетил-2,4-диметоксибензойную кислоту (21,1 г, 0,094 моль) перемешивают в диоксане (200 мл) при комнатной температуре и добавляют по каплям бром (5 мл, около О, 1 моль). Окраска брома постепенно в течение 30 мин исчезает, затем смесь осторожно нагревают на паровой бане в течение 30 мин, охлаждают и отгоняют диоксан под вакуумом. Твердый продукт обрабатывают кипящим этилацетатом , фильтруют в горячем состоянии, фильтрат выпаривают и получают 5бромацетил-2 ,4-диметоксибензойную кислоту, т.пл. 236°С. B.Продукт, полученный по примеру 61 А (21,6 г, 0,071 моль), перемешивают в дихлорметане (250 мл), охлаждают на ледяной бане и добавляют по кацлям трибромид бора (25мл). Затем раствор нагревают с рефлюксом на водяной бане в течение 4ч:. Смесь охлаждают и выливают в лед (1 кг). . После удаления дихлорметана полученное твердое вещество розового цвета отфильтровывают, промывают водой, отсасьшают досуха и растворяют в смеси этанол-вода (200/80 мл). Добавляют ацетат натрия (25 г) и раствор подогревают при в течение 30 мин. После охлаждения и удаления зтанола под вакуумом добавляют еще воду (150 мл). Раствор охлаждают на едяной бане и добавляют по каплям ри перемешивании раствор соляной ислоты (5N) до рН 2. После хранени} течение ночи в холодильнике от-, ильтровывают кристаллическое тверое вещество бледно-желтого цвета, ромьгоают водой, высушив.ают и полуают бензофуранон, т.пл. 21бс, ыход 11,8 г (86%). Пример 62. (2)-3-Карбоксил-бензилиден-5-карбоксил-6-оксибензоуран-3 (2Н)-он. Растворяют 5-карбокси-б-оксибенофуран-3 (2Н)-он (5,82 г, 0,03 моль) диоксане (75 мл), добавляют 3арбоксибензальдегид (4,50 г, ,03 моль), затем концентрированную
соляную кислоту (15 мл). Раствор осторожно 1 агревают на паровой бане в течение 30 мин при периодическом переме11швании. Твердую смесь охлаждают , .разбавляют равным объемом воды и хранят в холодильнике в течение 1 ч. Продукт отфильтровывают, промывают водой и сушат. После перекристаллизации из диметилформамида получают продукт, т.ш. (разлаг.), выход 4,5 г (46%)..
Примеры 63 и 64. Следующие соединения получены по методике примера 62.
(г)-3-Карбоксш1-4-окси-2-бензилиден-5-карбоксил-6-оксибензофуран3 (2Н)-он, т.пл. 332°С (разлаг.)j выход 47%.
(г)-4-(Тетразол-5-ил)-2-бензилиден-5- :арбоксил-6-оксибензофуран3 (2Н)-он, т.пл. 327-328С. (разлаг.), выход 59%. .
Пример 65. (2)-3-Карбоксил2-бензилиден-5-метоксикарбоксибензофуран-3 (2Н)-он. . : Метил-3-ацеТил-4-оксибензоат (5,39 г, 0,028 моль) перемешивают в диоксане (200 мл) при 40°С и добавляют по каплям бром (1,5 мл). Через 45 мин бесцветиьй раствор вьшаривают и получают масло соломенного цвета , которое растворяют в смеси этанол/вода (75/15 мл).. Добавляют ацетат натрия (6,0 г) и раствор перемешивают при комнатной температуре в течение 5 мин. Красный раствор выливают на лед (100 г) и экстрагируют хлороформом. После выпаривания хлороформного экстракта получают 5-метоксикарбонилбензрфуран-3(2Н)он в виде масла оранжево-красного цвета (65% чистота при определении методом ЯМР).Продукт сражу же растворяют в диоксане (50 мл-), добавляют 3-карбоксибензальдегид (4,5 г, 0,03 моль затем концентрированную соляную кислоту (10 мл) и раствор нагревают на паровой бане в течение 15 мин. ДосЛе обработки по методу примера 49 и ререкристаллизации из диметилформамида пор1учают аурон, т.пл. 280°С, выход 2,0 г (22%).
Пример 66. (г)-З-Карбоксил2-бензилиден-6-ацетамидбезофур1ан3 (2Н)-он.
А. 3-АминофеНол (54,5 г, Q,5моль н уксусный ангидрид (200 йл) перемешивают и нагревают на паровой бане в течение 2 ч. Жидкость соломенного цвета выпаривают в вакууме и получают вязкое масло, которое нагревают до 110-120с при постепенном добавлении при перемешивании хлорида алюми- ; ния (170 г, 1,27 моль). Через 30 мин твердый продукт слегка охлаждают и осторожно подвергают разложению смеСЬЮ воды со льдом (приблизительно 500 г), затем добавляют концентрированную соляную кислоту (200 мл), хорошо перемешивают и слабо подогревают на паровой бане. После охлаждения
отфильтровывают кристаллическое твердое вещество, промьшают водой, высушивают и получают 2-окси-4-ацетамидацетофенон , т.пл. 140 С.
В. Продукт, пояученньй по примеру 66 А (14,0 г, 0,072 моль), растворяют в этйлацетате (200 мл) и добавляют к перемешиваемой суспензии бромида меди (II) (32,0 г, 0,143 моль) в этйлацетате (100 мл). Смесь нагревают с рефлюксом в течение 4ч, затем отфильтровывают в горячем состояние и фильтрат выпаривают в вакууме и получают- масло, которое кристаллизуется . Это твердое вещество превращают в бензофуранон и приводят во взаимодействие с 3-карбоксибензальдегидом (как в примере 65). Однако в ходе этой реакции продукт частично диацилируется и его далее приводят
во взаимодействие с уксусным ангидридом (20 мл).с. рефлюксом для полного превращения в ацетилйрованное соединение .. Реакционную смесь вьшивают в лед (100 г) и избыток уксусного
ангидрида гидролизуют.. Полученное
твердое вещество отфильтровывают, перекристаллизуют из ;смеси ледяная уксусная кислота/вода (50% -объем/ -объем) и получают (Z)-3-карбоксил2-бензилиден-6-ацетамидобензоФуран3 (2Н)-он, т.пл. 305°С (разлаг.), выход 1,4 г (6%).
Пример 67. (Z)-4-Xnop-2бензш1Иден- 5-н-бутоксикарбонш1бензофуран-3 (2Н)-он.
(Z)-4-Хлор-2-бензилиден-5-карбоксилбензофуран-3 (2Н)-он (3,0 г, 0,01 моль) суспендируют в н-бутаноле (50 мл), добавляют по каплям концентрированную серную кислоту
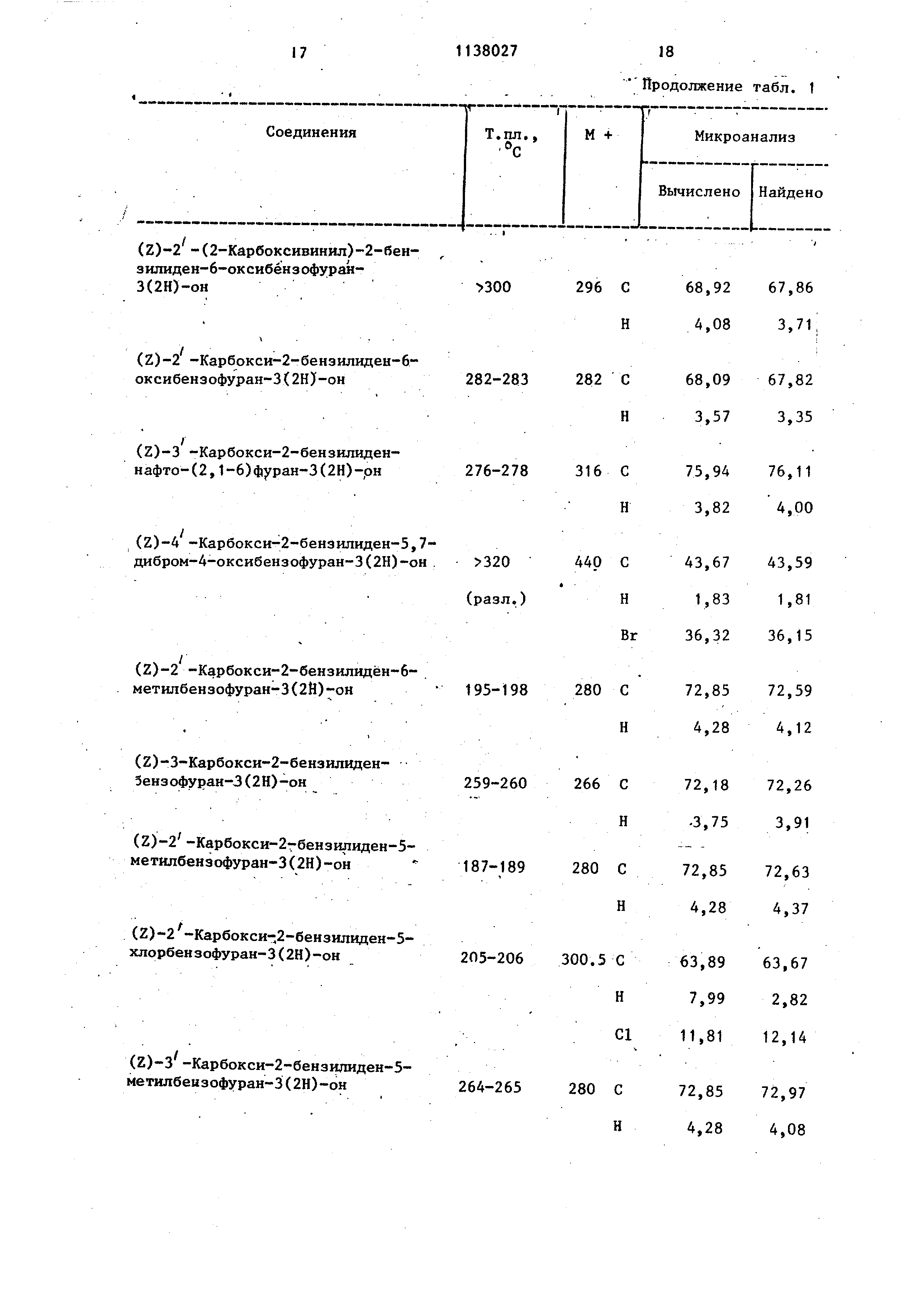
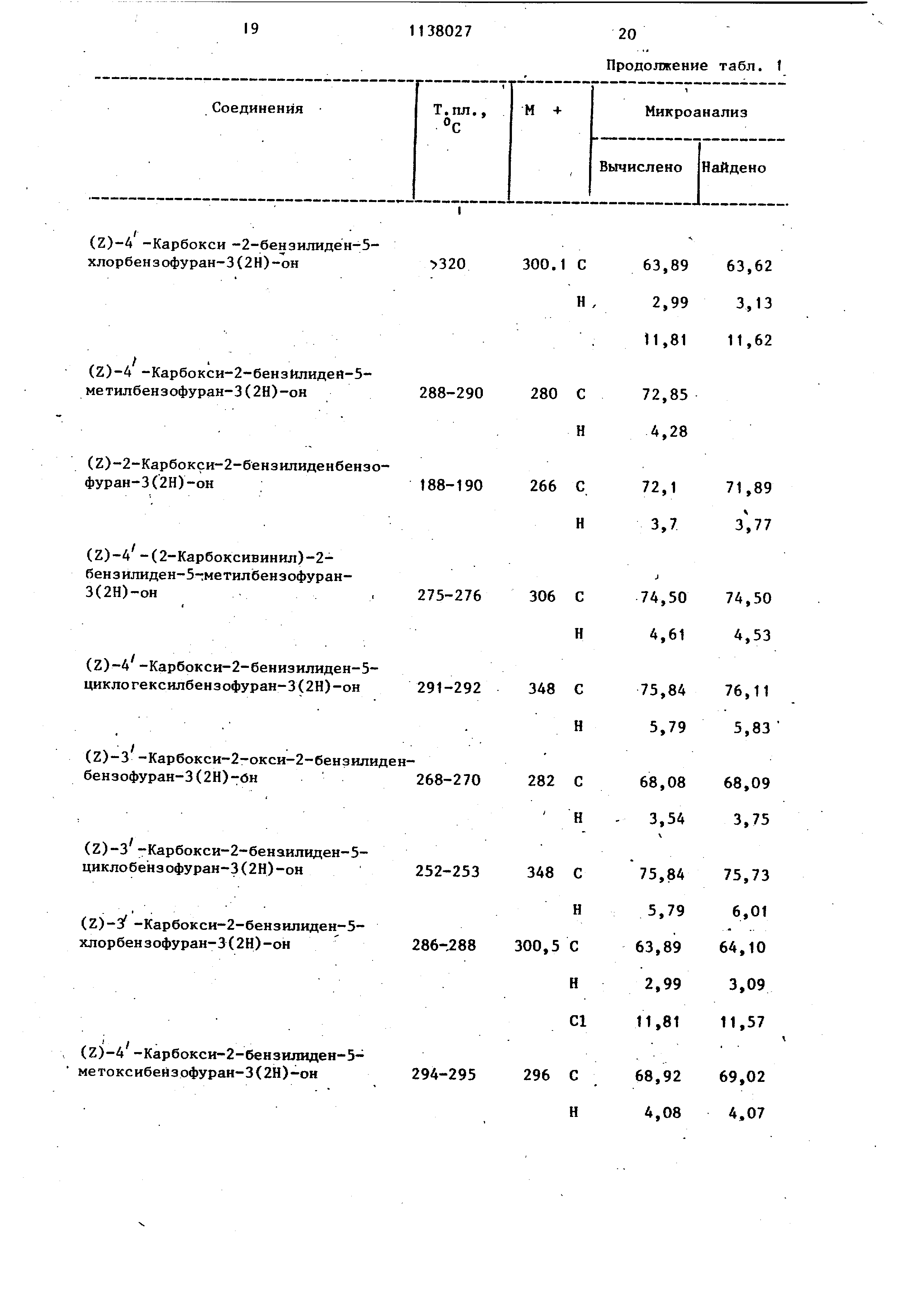
;(1,5 мл) при перемешивании и смесь На1 ревают с рефлюксом в течение 5 ч. Из полученного желтого раствора посJie охлаждения осаждаются желтые пу шистые игольчатые кристаллы требуемого н-бутилового эфира. Кристаллы отфильтровывают, промывают холодным н бутанолом, потом диэтиловым эфиром и сушат. Т.пл. , выход 2,7 г (76%). Пример 68. (Е)-4 -Хлор-2бензилйден-5-н-бутоксикарбонилбензофуран-3 (2Н)-он. (г)-4-Хлор-2-бензолиден-5-н-буток сикарбонилбензофуран-3(2Н)-он (1,0 г) растворяют в бензоле (800 мл) и подвергают облучению в 1 л фотохимического реактива Hanovig в течение 15 ч. Раствор выпаривают в вакууме и получают 1,0 г твердого вещества с Т.пл. около130 С и соотношением изомеров E/Z 75/25 (определенно мето дом ЯМР и жидкостной хроматографии). 500 мг этого твердого вещества хроматографируют на колонке с силикагелем сорбсил (Sorbs11) (200 г) с применением бензamp;ла в качестве проявителя и собирают фракции, содержащие более подвижный (Е)-изомер. Собранные фракции вьшаривают и желтое кристаллическое вещество, выход 350 мг с Т.пл. 142 С и соотношением изомеров E/Z 88/12. 200 мг этого твердого вещества перекристаллизовывают из смеси дихлорметан/петролейньй эфир (40-60 С) (1/3 по объему) и получают 130 мг кристаллического твердого вещества с Т.пл. 142 С и соотношением изомеров E/Z 92,5/7,5. Характеристика полученных соединений представлена в табл. 1. Соединения демонстрируют актив .ность при изучении отделенного легкого морской свинки, которое представляет собой опыт in vitroj обычно используемый для определения антйаллергической активности. При исследовании отделенного легкого морской свинки производится непосредственное измерение медленно реагирующего вещества в анафилаксисе (SRS-A), полученном в ответ на вызов. SRS-A продемонстрировало облегчение астматических явлений на легкие человека. Цифры в табл. 2 указывают на процентное снижение в производстве SRS-A после воздействия растворов, содержащих 10|11 г/кп изучаемых соединений В то же время двунатриевая соль 1,3бис (2-карбоксихромон-5-илокси)-2-гоксийропана при концентрации 10 мкг/мл не вызывает редукции SRS-A. Таблица 1














Реферат
1. СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ АУРОНОВ общей формулы I О D где Rj,R2,R R, R и R - одинаковые или разные и каждый водород , галоген, алкил С(-С4, метркси, циклогексил , трифторметил , ацетамидо, изопропилкарбоксамидо , амино, диметиламино , циан, окси, карбоксил или -СН СНСООН; или RJ и Rg вместе взятые группа формулы -СН СН-СН СН- при условии, что по меньшей мере один из R,R2,R,R4, R J и Rg обозначает карбоксил или -СН СНСООН, отличающийся тем, что бензальдегид общей формулы II R, онс где R,R5иRg имеют указанные зна- § чения, подвергают en взаимодействию с бензофураноном общей формулы III О где R,R2 и R - .имеют указанные значений или с Ц-замещенным ацетофеноном общей формулы IVQ CHjX I 3 где R., Re- имeюf указанные значения , X обозначает легкоуходящую группу, выбранную из галогенной или толуолсульфонильной групп, в растворителе при 0-150с.


Комментарии