Производные гиперфорина, их применение и содержащие их составы - RU2320636C2
Код документа: RU2320636C2
Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к производным гиперфорина и адгиперфорина и их применению в фармацевтической и/или пищевой областях, в особенности в лечении депрессии или болезни Альцгеймера.
Предпосылки изобретения
Цветущие верхушки Hypericum perforatum содержат некоторое количество классов веществ, различной структуры, которые действуют прямо или косвенно на центральную нервную систему. Механизмы действия этих соединений различны и включают анти-МАО (Suzuki OR. et al. Planta Med., 272-4, 1984), воздействие на высвобождение и повторное поглощение серотонина (Muller W.E. et al. Pharmacopsychiatry 30, 108-112, 1997).
Гиперфорин, производное флороглюцина, один из основных компонентов липофильной фракции цветущих верхушек Hypericum perforatum; упомянутая фракция также содержит адгиперфорин, более высокие гомологи гиперфорина, хотя в более низкой концентрации (Erdelmeier C.А.J., Pharmacopsychiatry, 31, 2-6, 1998).
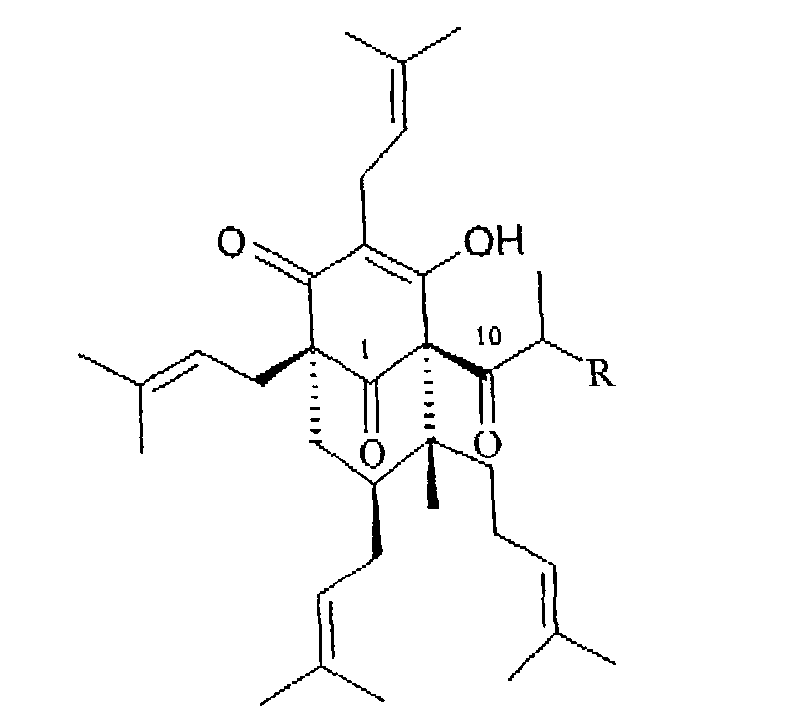
Гиперфорин R=CH3
Адгиперфорин R=СН2CH3
Гиперфорин до недавнего времени был объектом многочисленных исследований, в которых была установлена его роль как антидепрессанта (Pharmacopsychiatry, 31 Suppl., 1-60, 1998). Более того, признано, что экстракты Hypericum perforatum могут быть использованы для профилактики и лечения нейродегенеративных заболеваний и болезни Альцгеймера (WO/9940905, WO0057707). В особенности соли гиперфорина и адгиперфорина с неорганическими катионами или аммонийные соли были описаны для этого назначения (WO9941220).
Из литературы известно, что гиперфорин малоустойчив в обычных условиях экстракции и хранения; в соответствии с WO 97/13489 содержание гиперфорина в водно-спиртовом экстракте St. John,s Wort снижается уже после нескольких недель. В WO 97/13489 в дальнейшем речь о том, что, для того чтобы получить стабильный экстракт гиперфорина, антиоксиданты должны присутствовать в течение всей обработки (экстракция, очистка и хранения). Следовательно, очевидно, что высокая нестабильность гиперфорина делает получение фармацевтических композиций гиперфорина весьма затруднительным. Для того чтобы избежать упомянутого недостатка, соединения, более стабильные, чем гиперфорин, такие как соли, раскрыты в WO 99/41220 и гидроксифункциональные производные (WO 99/64388), указанные ранее, недавно были получены.
Кроме того, известно (Bystrov et al., Bioorg. Khim, 1978), что гиперфорин и адгиперфорин могут быть превращены в соответствующие октагидропроизводные, октагидрогиперфорин (Ia) и октагидроадгиперфорин (Ib), каталитическим восстановлением боковых изопреновых цепей
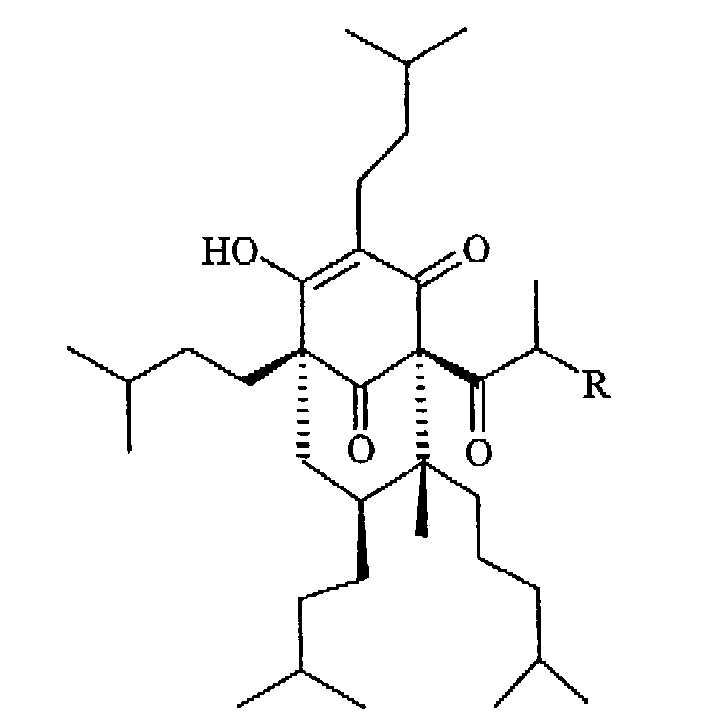
(Ia: R=СН3
Ib: R=СН2СН3)
или в соответствующие тетрагидропроизводные, тетрагидрогиперфорин (Ic) и тетрагидроадгиперфорин (Id), восстановлением гидридами металлов кетогрупп в 1- и 10-положениях до гидроксигрупп.
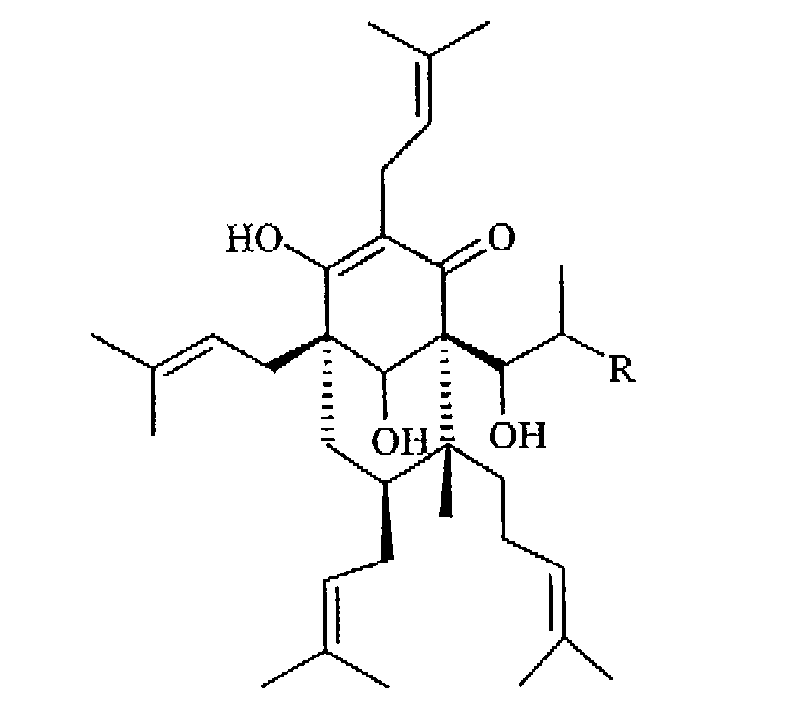
(Ic: R=СН3
Id: R=СН2СН3)
Подробное описание изобретения
Было установлено, что производные гиперфорина и адгиперфорина, получаемые восстановлением двойных связей изопреновых цепей и/или восстановлением кетогрупп в 1- и 10-положениях до гидроксильных групп, не только имеют высокую стабильность, но также обладают необычайно более высокой антидепрессантной, противотревожной, противонейродегенеративной активностью, чем гиперфорин и адгиперфорин.
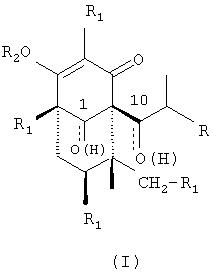
Следовательно, объектом настоящего изобретения является применение производных гиперфорина и адгиперфорина формулы (I)

в которых R представляет метил или этил, R2 представляет водород, катион фармацевтически приемлемых неорганических или органических оснований или прямой или разветвленный С2-С5 ацильный остаток и в которых альтернативно:
а) R1 представляет 3-метилбут-1-ил, и оксогруппы присутствуют в 1- и 10-положениях;
b) R1 представляет собой 3-метил-2-бутен-1-ил, и гидроксигруппы присутствуют в 1- и 10-положениях;
с) R1 представляет собой 3-метил-бут-1-ил, и гидроксигруппы присутствуют в 1-и 10-положениях;
для получения лекарственных средств, в особенности для получения лекарственных средств для лечения депрессии и болезни Альцгеймера.
Предпочтительны соединения формулы (I), как определено в а), в которых R2 представляет собой водород в определенных ниже октагидрогиперфорине (Ia) и октагидроадгиперфорине I(b):
(Ia: R=СН3
Ib: R=СН2СН3)
Предпочтительны соединения формулы (I), как определено в b), в которых R2 представляет собой водород (в определенных ниже тетрагидрогиперфорине (Ic) и тетрагидроадгиперфорине (Id)), тетрагидрогиперфорин Ic является наиболее предпочтительным:
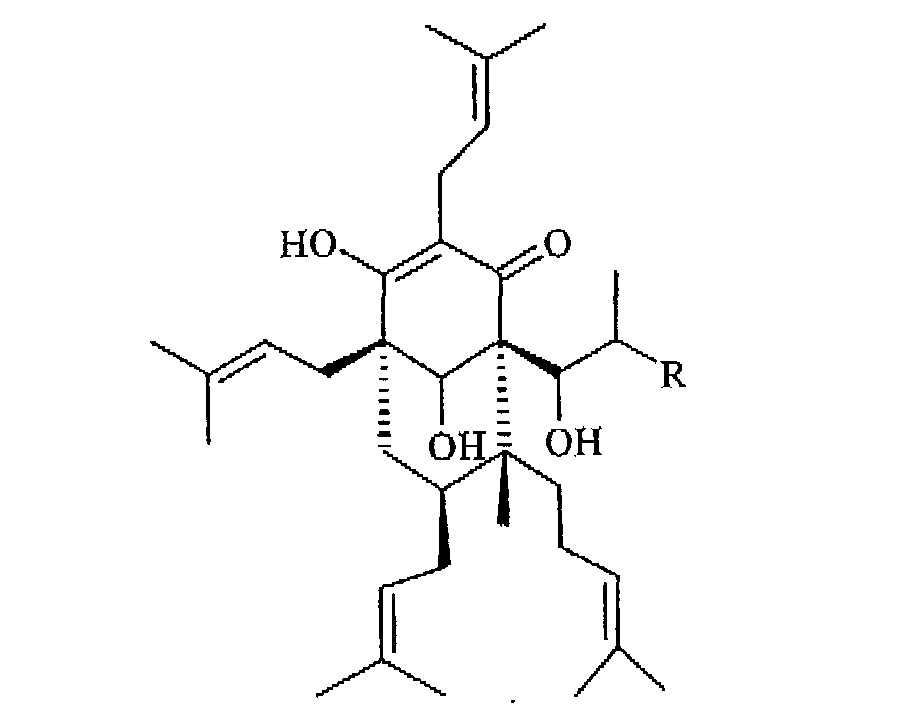
(Ic: R=СН3
Id: R=СН2СН3)
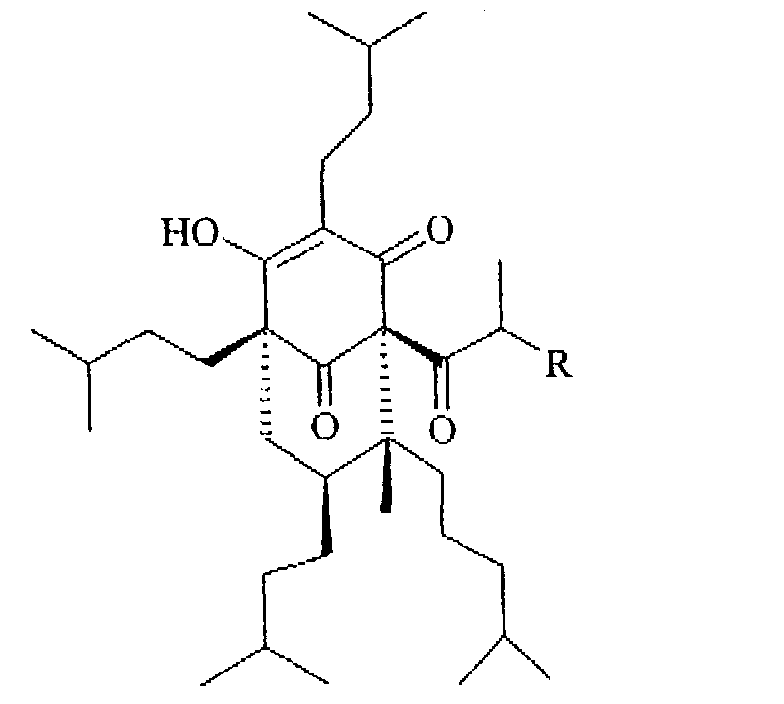
Предпочтительны соединения формулы (I), как определено в а), в которых R2 представляет собой водород (в определенных ниже додекагидрогиперфорине (Ie) и додекагидроадгиперфорине (If)), додекагидрогиперфорин Ie является наиболее предпочтительным:

(Ie: R=СН3
If: R=СН2 СН3)
Далее предпочтительны соединения формулы (I), как определено в а), в которых R2 представляет собой литий (литиевая соль октагидрогиперфорина Ig и тетрагидрогиперфорина Ih), литиевая соль октагидрогиперфорина (Ig) и тетрагидрогиперфорин Ic является наиболее предпочтительными:
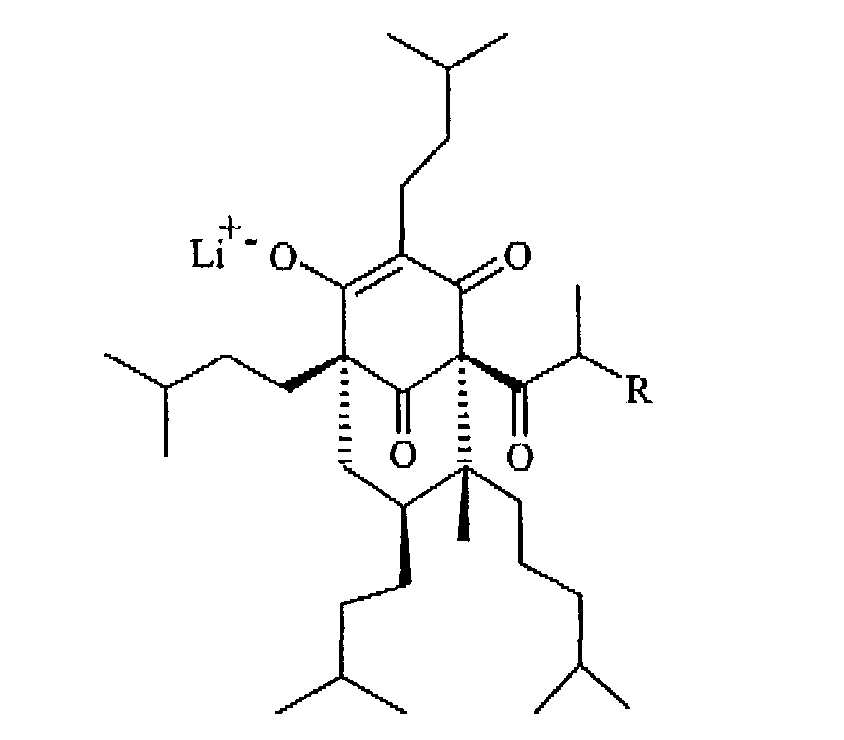
(Ig: R=СН3
Ih: R=СН2СН3)
Далее предпочтительны соединения формулы (I), как определено в а), в которых R2 представляет собой ацетил (ацетилоктагидрогиперфорин Ii и ацетилоктагидроадгиперфорин Il), ацетилоктагидрогиперфорин (Ii) и тетрагидрогиперфорин Ic является наиболее предпочтительным
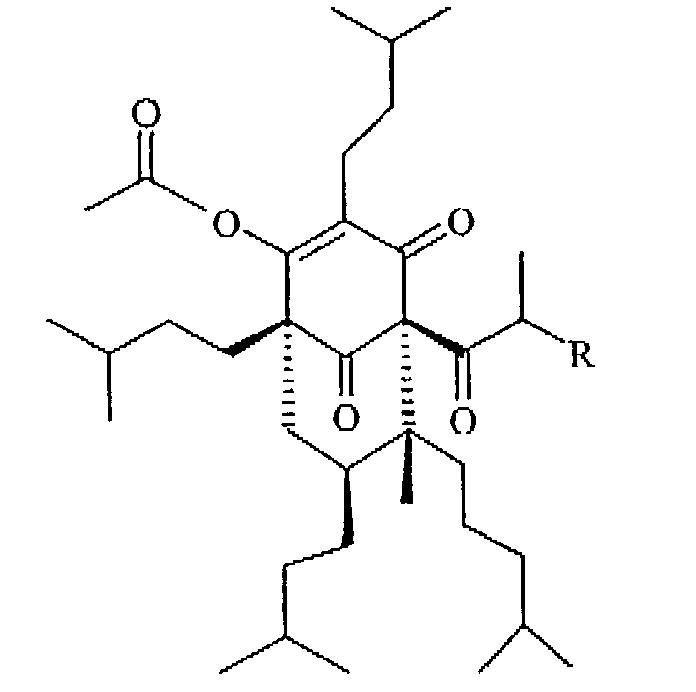
(Ii: R=СН3
Il: R=СН2СН3)
Додекагидрогиперфорин (Ie), додекагидроадгиперфорин (If), ацетилоктагидрогиперфорин (Ii) и ацетилоктагидроадгиперфорин (Il) представляют собой новые соединения и также являются частью настоящего изобретения.
Соединения формулы I(a) и I(b) получали восстановлением изопреновых боковых цепей каталитической гидрогенизацией, используя, например, палладий на древесном угле или никель Ренея.
Соединения формулы I(с) и I(d) получали восстановлением кетогрупп в 1- и 10-положениях гидридами, выбранными, например, из NaBH4, Redal®, Vitride®, LiAlH4.
Соединения формулы I(e) и I(f) получали сначала восстановлением изопреновых боковых цепей и затем кетогрупп в 1-и 10-положениях в соответствии с тем, как описано выше.
Соединения формулы (I), в которых R2 представляет собой катион неорганического или органического основания или ацильный остаток, могут быть получены из соединения формулы (I), в котором R2 является водородом, образованием соли или этерификацией стандартными способами.
Способ получения соединений изобретения, начинающийся с цветущих верхушек Hypericum perforatum, может быть кратко изложен следующим образом.
Цветущие верхушки Hypericum perforatum могут быть экстрагированы спиртами или алифатическими кетонами в чистом виде или в смеси с водой или газом в сверхкритических условиях; полученный экстракт распределяется между н-гексаном и водным раствором алифатических спиртов. Гексановый раствор экстрагируют щелочным метанолом, чтобы экстрагировать гиперфорин и адгиперфорин. Метанольный раствор подкисляют, затем обрабатывают слабоосновной ионообменной смолой, которая избирательно удерживает гиперфорин и адгиперфорин. Смолу элюируют метанолом и элюат концентрируют до малого объема, затем растворяют в воде и подвергают обратной экстракции н-гексаном. Гексановый раствор концентрируют до малого объема, и полученный концентрат готов для получения функциональных производных. Остаток переносят в хлорированные растворители и прибавляют подходящие реактивы в соответствии с методиками, описанными в примерах.
Соединения изобретения обладают антидепрессантным действием, которое было оценено на крысах в тесте с вынужденным плаванием; оцениваемые параметры: сопротивляемость, выплывание и плавание (в соответствии с тестом, который описан Cervo et al. в Neuropharmacology, 26, 14969-72, 1987). Соединения вводили в три приема: через 30 минут после предварительной выработки навыков, за 5 часов и за 30 минут перед исследованием.
Результаты опыта, приведенные в нижеследующей таблице, доказывают, что соединения изобретения более активны, чем исходный гиперфорина.
Доказано, что соединения изобретения также активны против болезни Альцгеймера, благодаря их способности увеличивать АРР, растворимую безвредную форму Alzheimer Precursor Protein (APP). Известно, что протеолитическое расщепление Alzheimer Precursor Protein (APP) опосредуется как β- и γ-секретазой, вызывающей увеличение выработки амилоидного пептида Ab1-42 (который также играет главную роль в возникновении болезни Альцгеймера), так и α-секретазой, порождающей растворимые АРР, которые не имеют патогенной активности (Esrl W.P., Wolfe M.S., Science, 293, 1449-54, 2001).
Действие соединений изобретения на высвобождение АРР, вырабатываемых α-секретазой, был оценен количественно в культуральной среде клеточной линии нейробластомы (SH-SY5Y) в соответствии с методикой, описанной Galbete J.L. et al. в Biochem J. 348, 307-313, 2000.
Результаты исследований в следующей таблице показывают, что исследованные соединения активируют метаболизм АРР, опосредуемый α-секретазой, вызывая увеличение АРР, выделяемого в культуральную среду:
Соединения этого изобретения могут быть включены в лекарственные формы в соответствии с общепринятыми приемами, например в соответствии с тем, что описано в Remington Pharmaceutical Science Handbook, XVII Ed. Mack Pub., N.Y., U.S.A, в форме мягких желатиновых капсул, твердых желатиновых капсул, таблеток, свечей; предпочтительно экстракт изобретения вводят в мягкие желатиновые капсулы или в составы с контролируемым высвобождением. Доза изменяется в пределах от 10 до 100 мг/разовая единичная доза для обычной лекарственной формы и выше 200 мг для состава с контролируемым высвобождением, в этом случае предлагаемая доза составляет 200 мг/доза в сутки. В дальнейшем соединения могут быть введены через кожу при контролируемом высвобождении, применяя состав в проксимальной области к направлению мозговой сонной артерии. Дозы соединений в этих составах лежат в пределах от 10 до 100 мг/доза в сутки.
Примеры, приведенные ниже, иллюстрируют изобретение более подробно.
Примеры
Пример 1. Получение гиперфорина
10 кг цветущих верхушек Hypericum perforatum и 30 л метанола экстрагировали в аппарате для экстракции с рабочим объемом 50 л и массу оставили в этом состоянии при комнатной температуре в течение 3 часов; экстракцию повторили еще 3 раза, затем объединенные экстракты концентрировали в вакууме до 5 кг и концентрат экстрагировали 3 × 5 л гексана. Водно-метанольный раствор отбросили, в то время как гексановую фракцию подвергли обратной экстракции щелочным метанолом (КОН) до исчерпания гиперфорина и адгиперфорина.
Этот раствор нейтрализовали и фильтровали через слабощелочной Амберлит, который избирательно удерживает гиперфорин и адгиперфорин; удержанный продукт элюировали повторно метанолом, подкисленным фосфорной кислотой; метанольный элюат концентрировали в вакууме при 25°С, разбавили водой и подвергли обратной экстракции н-гексаном до исчерпания гиперфорина.
Объединенные органические слои обесцвечивали 0,3% древесного угля, затем сушили над Na2SO4 и концентрировали ниже 40°С в вакууме с получением масла. После затвердевания масла образовывался воск (0,52 кг), содержащий приблизительно 90% гиперфорина.
Пример 2. Получение дициклогексиламмонийной соли октагидрогиперфорина
50 г гиперфорина, полученного как описано в Примере 1, растворили в 500 мл этилацетата в присутствии 2 г 5% палладия на древесном угле и гидрировали до окончания поглощения водорода. Катализатор отфильтровали, раствор концентрировали досуха под вакуумом и осадок растворили в н-гексане. К раствору прибавили стехиометрическое количество дициклогексиламина, достигли достаточно избирательной кристаллизации соответствующей соли.
Было получено 62 г дициклогексиламмонийной соли октагидрогиперфорина, имеющей следующие спектральные характеристики:
1H-NMR (300 МГц CDCl3): δ 3,03 (2Н, m, CH-DCHA), 2,55-2,30, 2,10-1,76 (20Н, m, CH2-DCHA), 1,70-1,10 (22Н, m, Н-4,Н-11, CH2-5, CH2-15, CH2-16, CH2-17, CH2-21, CH2-22, CH2-26, CH2-27, CH231, CH2-32), 0,97-0,83 (24Н, d, СН3-19, СН3-20, СН3-24, СН3-25, СН3-29, СН3-30, СН3-34, СН3-35), 1,19,1,12 (6Н, d, J=6,5 Гц СН3-12, СН3-13), 0,91 (3Н, s, СН3-14).
13С-NMR (75 МГц CDCl3): δ 213,1, 211,1, 186, 3, 183,6, 119,0, 82,5, 60,8, 53,5, 47,5, 44,2, 41,3, 41,0, 40,9, 38,2, 38,1, 37,8, 33,8, 31,0, 30,7, 30,0, 29,4, 28,8, 28,3, 27,9, 27,1, 25,4, 25,1, 24,9, 23,5, 23,2, 23,1, 22,9, 22,8, 22,7, 22,5, 13, 7. ESIMS m/z 567[M+Na+] (100), 1111 [2M+Na+] (91).
Пример 3. Получение тетрагидрогиперфорина
2 г гиперфорина (М.м. 536,01) растворили в 20 мл ТГФ при перемешивании магнитной мешалкой; к раствору прибавили LiAlH4 в значительном избытке (1 г, 0,026 моль, М.м.=38). Протекание реакции контролировали тонкослойной хроматографией (TCX) (петролейный эфир/этилацетат 9:1). Через 10 минут реакция была закончена.
Na2SO4·10Н2О, нанесенный на Целит (3:1 по массе), прибавили для разрушения избытка реактива: реакция высокоэкзотермичная, поэтому следует обеспечить охлаждение льдом. Часть растворителя выпарилась за счет выделяемого тепла. Смесь фильтровали через Целит и фильтрат промыли три раза 20 мл этилацетата. Раствор перенесли в 150 мл круглодонную колбу, и растворитель выпарили полностью.
Полученную смесь очищали колоночной хроматографией, используя 200 мл колонку, заполненную 100 мл силикагеля, и петролейный эфир/этилацетат 95:5 как элюирующую смесь. Элюат собирали фракциями приблизительно по 20 мл, и содержимое контролировали TCX (петролейный эфир/этилацетат 9:1). Более обогащенный продукт (1,5 г), кристаллизованный из метанола, имеет следующие спектральные свойства:
1H-NMR (300 МГц CDCl3): δ 5,11 (1Н, m, Н-22), 5,00 (3Н, m, Н-17, Н-27, Н-32), 3,11 (1Н, dd, J=14,0, 7,4 Гц, CH2-26), 2,92 (1Н, dd, J=14,0, 7,0 Гц, CH2-26), 2,50-1,35 (12Н, m, Н-4, Н-11, CH2-5, CH2-15, CH2-16, CH2-21, CH2-31), 1,80-1,52 (24Н, s, СН3-19, СН3-20, СН3-24, СН3-25, СН3-29, СН3-30, СН3-34, СН3-35), 1,19-0,95 (9Н,d, СН3-12, СН3-13, СН3-14).
13С-NMR (75 МГц CDCl3): δ 200,5, 174,3, 134,1, 132,6, 131,2, 130,6, 125,8, 123,9, 122,6, 120,5, 119,4, 79,2, 73,1, 39,6, 37,2, 30,5, 32,8, 31,3, 30,2, 26,1, 26,0, 25,8, 23,5, 23,1, 21,9, 20,0, 18,3, 18,1, 17,8, 15,6.
ESIMS m/z 1103 [2M+Na+] (100), 541 [M+Na+] (25), [M+Na+] (12).
Пример 4. Получение литиевой соли октагидроадгиперфорина
15 дициклогексиламмонийной соли октагидрогиперфорина элюировали на кислотной ионообменной смоле (Dowex 50x8, 300 г) 600 мл метанола. Было получено 11,01 г октагидрогиперфорина, который прибавили к 0,8745 г моногидрата LiOH, растворенного в воде. Смесь выпарили досуха, получили 11,41 г литиевой соли, имеющей следующие спектральные характеристики:
1H-NMR (300 МГц CDCl3): δ 1,93-1,00 (22Н, m, Н-4, Н-11, CH2-5, CH2-15, CH2 -16, CH2-17, CH2-21, CH2-22, CH2-26, CH2-27, CH2-31, CH2-32), 1,00-0,80 (24Н, d, СН3-19, СН3-20, СН3-24, СН3-25, СН3-29, СН3-30, СН3-34, СН3-35), 1,20, 1,06 (6Н, d, J=6,3 Гц, СН3-12, СН3-13), 0,91 (3Н,s, СН3-14).
13С-NMR (75 МГц CDCl3): δ 211,4, 191,3, 184,6, 82,7, 61,5, 51,3, 47,7, 41,5, 40,5, 38,2, 37,9, 37,7, 33,9, 30,5, 29,6, 28,7, 28,3, 28,1, 27,1, 23,3, 23,1, 23,0, 22,8, 22,7, 22,4, 22,0, 14,0.
ESIMS m/z 551 [M+Н+] (100), 557 [M+Li+] (40), 1102 [2M+Н+] (71), 1108 [M+Li+] (75).
Пример 5. Получение додекагидрогиперфорина
1,72 г октагидрогиперфорината дициклогексиламмония (М.м. 716; 2,41 ммоль) растворили в 20 мл ТГФ при перемешивании магнитной мешалкой; к раствору прибавили значительный избыток (3,5 г) LiAlH4 (М.м.=38; 0,092 моль). Протекание реакции контролировали TCX (петролейный эфир/этилацетат 9:1). Через 10 минут реакция была закончена.
Избыток реактива разрушили как описано в примере 5. Смесь фильтровали и осадок тщательно промыли этилацетатом. Растворитель выпарили досуха, сырой продукт реакции растворили в 15 мл смеси петролейный эфир/диэтиловый эфир 3:1, и раствор поместили в 150 мл делительную воронку. Органическую фазу промыли три раза 2N серной кислотой, а затем рассолом. Водную фазу отбросили, органическую фазу сушили над Na2SO4 и концентрировали досуха.
Полученный продукт очищали колоночной хроматографией на 75 г силикагеля, элюируя требуемое соединение смесью петролейный эфир/этилацетат 99:1. Было получено 0,9 г додекагидрогиперфорина со следующими спектральными характеристиками:
ESIMS m/z 548 [M]+.
Пример 6. Получение ацетилоктагидрогиперфорина
300 мг ацетилгиперфорина (М.м. 578; 0,52 ммоль) растворили в 3 мл метанола в двугорлой круглодонной колбе, затем прибавили катализатор (5% Pd на угле). Протекание реакции контролировали TCX (петролейный эфир/этилацетат 95:5 Rfp=0,43; Rfa=0,52). Через четыре часа реакция была завершена. Катализатор отфильтровали через слой Целита, затем выпарили метанол.
Продукт реакции очищали колоночной хроматографией на 30 г силикагеля, элюируя смесью с петролейный эфир/этилацетат 9:1. Кристаллизация из метанола дала 150 мг требуемого продукта со следующими спектральными характеристиками:
ESIMS m/z 586 [M]+.
Реферат
Описываются производные гиперфорина и адгиперфорина формулы (I), в которых R представляет метил или этил, R2 представляет водород, катион лития или дициклогексиламмония, прямой или разветвленный C2-C5-ацильный остаток, в которых альтернативно: a) R1 представляет собой 3-метилбут-1-ил, и оксогруппы находятся в 1- и 10-положениях; b) R1 представляет собой 3-метил-2-бутен-1-ил, и гидроксигруппы находятся в 1- и 10-положениях; c) R1 представляет собой 3-метилбут-1-ил, и гидроксигруппы находятся в 1- и 10-положениях. Соединения используются для получения лекарственных средств для применения в лечении депрессии и болезни Альцгеймера. Описывается также фармацевтическая композиция, обладающая антидепрессантным действием. 3 н. и 5 з.п. ф-лы, 2 табл.
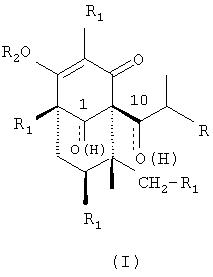
Формула

Комментарии