Профилактика, лечение и диагностика инфекции, вызванной бактериями p.gingivalis - RU2535898C2
Код документа: RU2535898C2
Чертежи






Описание
Область техники
Настоящее изобретение относится к пептидам и химерным или гибридным белкам и применению указанных белков для получения клеточного и гуморального ответа для профилактики и лечения состояний и заболеваний, вызываемых бактерией Р. Gingivalis.
Уровень техники
Хронический периодонтит представляет собой воспалительное заболевание опорных тканей зубов, приводящее к резорбции альвеолярных отростков и потере зубов. Это заболевание представляет собой острую проблему в области здравоохранения во всех странах и, по оценкам, затрагивает до 15% взрослого населения, при этом в 5-6% случаев оно принимает тяжелые формы.
Развитие и прогрессирование хронического периодонтита связывают с конкретными грамотрицательными бактериями поддесневой бляшки. Присутствие бактерий Porphyromonas gingivalis в поддесневой бляшке тесно связано с заболеванием.
Сообщалось, что продолжительное присутствие бактерии Р. gingivalis в поддесневой бляшке у пациентов с периодонтитом после лечения (удаления поддесневых отложений и полировки корней зуба) тесно связано с прогрессирующим разрушением альвеолярных отростков. Более того, было показано, что увеличение количества клеток бактерии Р. gingivalis в поддесневой бляшке коррелирует с тяжестью заболевания, которую определяют по потере прикрепления зуба, глубине периодонтитного кармана и кровотечению при зондировании.
Показано, что инфекция ротовой полости Р. gingivalis вызывает разрушение костей периодонта у мышей, крыс и приматов, отличных от человека. Также появляется все больше подтверждений взаимосвязи между периодонтитом и инфекцией Р. gingivalis и сердечно-сосудистыми заболеваниями и некоторыми типами рака.
Сообщалось, что ряд факторов вирулентности способствует патогенности Р. gingivalis, включая LPS, фимбрии, гемагглютинин, гемолизин и внеклеточные гидролитические ферменты (особенно Аrq-Х и Lys-X - специфичные протеиназы), известные как "трипсиноподобные ферменты Р. gingivalis".
Указанная проблема здравоохранения настолько велика, что существует потребность в разработке иммунной сыворотки, в частности специфических антител, которые обеспечивают сильный протективный ответ на инфекцию Р. Gingivalis, и средствах для ее обеспечения.
Одна из проблем состоит в том, что неясно, как получить сильный протективный ответ на инфекцию Р. gingivalis при том, что существует множество факторов вирулентности, из которых можно выбирать.
Остаются не до конца понятными и сравнительная иммуногенность эпитопов факторов вирулентности, а также сравнительная иммуногенность эпитопов конкретного фактора, в частности, когда неясно остаются ли еще неизвестные эпитопы.
Одна из конкретных проблем заключается в том, что многие факторы вирулентности состоят из множества доменов, и их трудно экспрессировать таким образом, чтобы факторы имели ту же конформацию, которую имеют факторы Р. gingivalis. Кроме того, при экспрессии этих доменов в виде отдельных единиц, т.е. по отдельности от других доменов факторов вирулентности, они склонны приобретать конформацию, отличную от той, которую имеют факторы Р. gingivalis.
Также неизвестно, какой из множества различных способов модификации иммуногенности фактора вирулентности с наибольшей вероятностью будет обеспечивать протективный иммунный ответ.
В ходе исследований, положенных в основу настоящего изобретения, авторы изобретения обнаружили пептиды, аминокислотная последовательность которых идентична или гомологична аминокислотной последовательности, которая образует участок трипсиноподобного фермента Р. gingivalis, где указанный участок определяет сайт указанного фермента для расщепления пептидной связи, расположенной на С-конце по отношению к остаткам Lys или Аrq в пептиде, содержащем Lys или Аrq, и встроили подобный пептид в химерный или гибридный белок, который при применении в качестве вакцины обеспечивает лучшую защиту тканей периодонта от разрушения, чем очищенный комплекс протеиназы и адгезина, образованный природным трипсиноподобным ферментом Р. Gingivalis, или убитые цельные клетки.
Краткое описание изобретения
Согласно одному аспекту в настоящем изобретении предложен химерый или гибридный белок для индуцирования иммунного ответа на инфекцию Р. gingivalis, при этом указанный белок содержит первый пептид, соединенный непосредственно или с помощью линкера со вторым пептидом, при этом:
(A) указанный первый пептид содержит:
(i) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности, представленной в SEQ ID No:1;
или
(ii) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности, представленной в SEQ ID No:2;
(B) указанный второй пептид содержит:
(i) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности адгезинового домена Lys-X-протеиназы бактерии Р. gingivalis; или
(ii) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности адгезинового домена Lys-X-протеиназы бактерии Р. Gingivalis; или
(iii) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности адгезинового домена НаqA бактерии Р. gingivalis.
Согласно другому аспекту настоящее изобретение обеспечивает химерный или гибридный белок для индуцирования иммунного ответа на инфекцию Р. gingivalis, причем указанный белок содержит первый пептид, соединенный непосредственно или с помощью линкера с полипептидом, при этом:
(A) указанный пептид содержит:
(i) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности, представленной SEQ ID No:1;
или
(ii) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности, представленной в SEQ ID No:2;
и
(B) указанный полипептид содержит:
(i) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности адгезинового домена Lys-X-протеиназы бактерии Р. Gingivalis; или
(ii) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности адгезинового домена Аrq-Х-протеиназы бактерии Р. Gingivalis; или
(iii) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности адгезинового домена НаqА бактерии Р. gingivalis.
Согласно другому аспекту, настоящее изобретение обеспечивает пептид для стимулирования иммунного ответа на инфекцию Р. gingivalis, при этом пептид содержит последовательность:
(i) которая является идентичной или гомологичной одной из последовательностей, представленных в SEQ ID No: 64-66; и
(ii) которая является идентичной или гомологичной последовательности, представленной в SEQ ID No: 67 или 68.
Согласно одному аспекту пептид, содержащий последовательность, которая является идентичной или гомологичной одной из последовательностей, представленных в SEQ ID No: 64-68, может быть обеспечен в форме химерного или гибридного белка, в котором пептид соединен непосредственно или с помощью линкера со вторым пептидом, при этом второй пептид содержит:
(i) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности адгезивного; домена Lys-X- протеиназы бактерии Р. gingivalis; или
(ii) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности адгезинового домена Аrg-Х-протеиназы бактерии Р. Gingivalis; или
(iii) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности адгезинового домена НаgА бактерии Р. gingivalis.
Согласно другому аспекту настоящее изобретение обеспечивает композицию, такую как антигенная композиция, в частности вакцинную композицию, содержащую химерный или гибридный белок или пептид, подробно описанный выше, возможно в комбинации со вспомогательным веществом.
Согласно данному аспекту настоящее изобретение также обеспечивает способ профилактики или снижения частоты или тяжести состояний или заболеваний, вызываемых инфекцией Р. gingivalis, у субъекта, который включает введение указанному субъекту химерного или гибридного белка согласно описанию выше или композиции согласно описанию выше.
Согласно данному аспекту настоящее изобретение также обеспечивает применение химерного или гибридного белка согласно описанию выше или композиции согласно описанию выше в составе лекарственного средства или для приготовления лекарственного средства для профилактики или снижения частоты или тяжести состояний или заболеваний, вызываемых инфекцией Р. gingivalis, у субъекта.
Согласно другому аспекту настоящее изобретение обеспечивает антитело, в частности моноклональное антитело, полученное против химерного или гибридного белка или пептида, подробно описанного выше.
Согласно данному аспекту настоящее изобретение также обеспечивает способ профилактики или снижения тяжести состояний или заболеваний, вызываемых инфекцией Р. gingivalis, у субъекта, который включает введение указанному субъекту антитела согласно описанию выше.
Согласно данному аспекту настоящее изобретение также обеспечивает применение антитела согласно описанию выше в составе лекарственного и средства или для приготовления лекарственного средства для профилактики или снижения частоты или тяжести заболеваний или состояний, вызываемых инфекцией Р. Gingivalis, у субъекта.
Согласно другому аспекту настоящее изобретение также обеспечивает молекулу нуклеиновой кислоты, содержащей последовательность нуклеотидов, кодирующую химерный или гибридный белок, как подробно описано выше, возможно, функционально соединенную с по меньшей мере одним регуляторным элементом.
Согласно данному аспекту настоящее изобретение также обеспечивает вектор, содержащий молекулу нуклеиновой кислоты, а также клетку прокариот или эукариот, содержащую указанную молекулу нуклеиновой кислоты.
Согласно данному аспекту настоящее изобретение также обеспечивает способ профилактики или снижения тяжести состояний или заболеваний вызываемых инфекцией Р. Gingivalis, у субъекта, который включает введение субъекту молекулы нуклеиновой кислоты согласно описанию выше, вектора согласно описанию выше или клетки, прокариот или эукариот согласно описанию выше.
Согласно данному аспекту настоящее изобретение также обеспечивает применение молекулы нуклеиновой кислоты согласно описанию выше, вектора согласно описанию выше или клетки прокариот или эукариот согласно описанию выше в составе лекарственного средства или для приготовления лекарственного средства для профилактики или снижении тяжести заболеваний или состояний, вызываемых инфекцией Р. Gingivalis, у субъекта.
Согласно другому аспекту настоящее изобретение обеспечивает способ диагностики или наблюдения за состоянием или заболеванием, вызываемым инфекцией Р. Gingivalis, у субъекта, который включает применение химерного или гибридного белка согласно описанию выше для определения антител к Р. gingivalis в образце биологического материала, полученном от указанного субъекта.
Согласно данному аспекту настоящее изобретение также обеспечивает применение химерного или гибридного белка согласно описанию выше для определения антител к Р. gingivalis в образце биологического материала, полученном от указанного субъекта.
Согласно другому аспекту настоящее изобретение обеспечивает способ диагностики или наблюдения за состоянием или заболеванием, вызываемым инфекцией Р. Gingivalis, у субъекта, который включает применение антитела согласно описанию выше для определения присутствия Р. gingivalis в образце биологического материала, полученном от указанного субъекта.
Согласно данному аспекту настоящее изобретение также обеспечивает применение антитела согласно описанию выше для определения присутствия Р. gingivalis в образце биологического материала, полученном от указанного субъекта.
Согласно другому аспекту настоящее изобретение обеспечивает применение пептида, содержащего часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности Lys-X или Аrg-Х-протеиназы бактерии Р. gingivalis, или нуклеиновой кислоты, кодирующей указанный пептид, для получения химерного или гибридного белка для стимулирования иммунного ответа на инфекцию Р. gingivalis. Согласно данному аспекту указанный пептид может содержать последовательность, представленную в одной из SEQ ID No: 17, 18, 25 или 26.
Краткое описание чертежей
На Фигуре 1 показаны результаты окрашивания Кумасси геля после SDS-PAGE с рекомбинантными белками Кдр. Полоса 1=KAS2-KLA1, полоса 2=KLA1, полоса 3=KsA1, полоса 4=KAS1-KsA1. Маркеры молекулярного веса указаны в кДа.
На Фигуре 2 показано распознавание антителом пептида KAS2 и убитых формальдегидом клеток Р. gingivalis W50. (А) Пептид KAS2 исследовали в реакции с сывороткой, выработанной на убитые формалином клетки Р. gingivalis W50 (FK-W50), рекомбинантными белками KAS1-KsA1, KAS2-KLA1, и синтетическим конъюгатом KAS2-DT и PBS методом ELISA. (В) убитые формалином клетки Р. gingivalis W50 исследовали в реакции с сывороткой, выработанной на убитые формалином клетки Р. gingivalis W50 (FK-W5D) рекомбинантными белками KAS1-KsA1, KAS2-KLA1, KLA1 PBS методом ELISA. Ответ антител выражали в полученном титре ELISA при OD415 за вычетомдвойного фонового уровня, каждое значение титра представляет собой среднее ± стандартное отклонение трех значений.
На Фигуре 3 показана резорбция костей моляров верхней челюсти в горизонтальной плоскости, вызванная инфекцией Р. Gingivalis, у мышей, иммунизированных по отдельности рекомбинантными белками и рекомбинантными химерными белками, убитыми формалином клетками Р. gingivalis и вспомогательным веществом (PBS, IFA), или неинфицированных перорально (неиммунизированных) мышей. На фигуре 3 KAS2-KLA1 изображен в виде AS2-LA1, KLA1 изображен в виде LA1, KAS1-KsA1 изображен в виде AS1-sA1, KsA1 изображен в виде sA1. Резорбцию костей выражали в квадратных миллиметрах (мм2) от цементно-эмалевого соединения (CEJ) до гребня альвеолярной кости (АВС) щечной стороны каждого моляра верхней челюсти с левой и правой стороны челюсти. Данные имели нормальное распределение согласно критерию однородности дисперсии Левена, и представлены в виде среднего (n=12) в мм2; их анализировали с помощью одностороннего анализа дисперсии и Т3-критерия Даннета. (* обозначает группу, в которой наблюдалась значительно (Р<0.001) меньшая резорбция кости по сравнению с контрольной (инфицированной) группой; t обозначает группу, в которой наблюдалась значительно (Р<0,001) большая резорбция кости по сравнению с группой AS2-LA1).
На Фигуре 4 показаны ответы подклассов антител сыворотки иммунизированных мышей в модели периодонтита. Сыворотки мышей: А (до пероральной иммунизации) и В (после пероральной иммунизации), иммунизированных рекомбинантными белками KsA1, KLA1, KAS1-KsA1 и KAS2-KLA1 и убитыми формалином клетками Р. gingivalis штамма W50, использовали для постановки анализа ELISA с убитыми формалином Р. gingivalis штамма W50 в качестве иммобилизированного антигена. Ответы антител IgG (черные полоски), lgG1 (серые полоски), lgG2a (белые полоски), lgG2b (полоски с горизонтальной исчерченностью), lgG3 (полоски с диагональной исчерченностью) выражали в виде полученного титра ELISA (log 2) за вычетом фонового уровня, каждое значение титра представляет собой среднее ± стандартное отклонение трех значений.
На Фигуре 5 показаны результаты анализа PEPSCAN пептид-специфичной реактивности антитела на перекрывающиеся пептиды, представляющие последовательность 433-468 пептида KAS2. (A) KAS2 перекрывающиеся пептиды (перекрывающиеся пептиды) в реакции с сыворотками KAS1-KsA1 (белые полоски), KAS2- KLA1 (черные полоски). (В) KAS2 перекрывающиеся пептиды (перекрывающиеся пептиды) в реакции с сывороткой к конъюгату KAS2-DT. Каждая полоска показывает реактивность антитела (оптическая плотность [OD] при 415 нм).
На Фигуре 6 показано, что гибрид AS2-LA1 вызывает иммунный ответ у аутбредных мышей, при котором распознаются целые клетки Р. Gingivalis и комплекс RgpA-Kgp.CD1 аутбредных мышей иммунизировали гибридом AS2-LA1 (50 мг/мышь) и полученные сыворотки использовали для постановки анализ ELISA с AS2-LA1 (А), убитыми формалином клетками Р. gingivalis штамма W50 (B) и комплексом RgpA-Kgp (С) в качестве иммобилизированных антигенов. На данной Фигуре KAS2-KLA1 изображен в виде AS2-LA1. Определяли титр каждого изотипа иммуноглобулина и полученные данные выражали в виде полученного титра ELISA ('000) за вычетом двойного фонового уровня, где каждое значение титра представляет собой среднее ± стандартное отклонение трех значений.
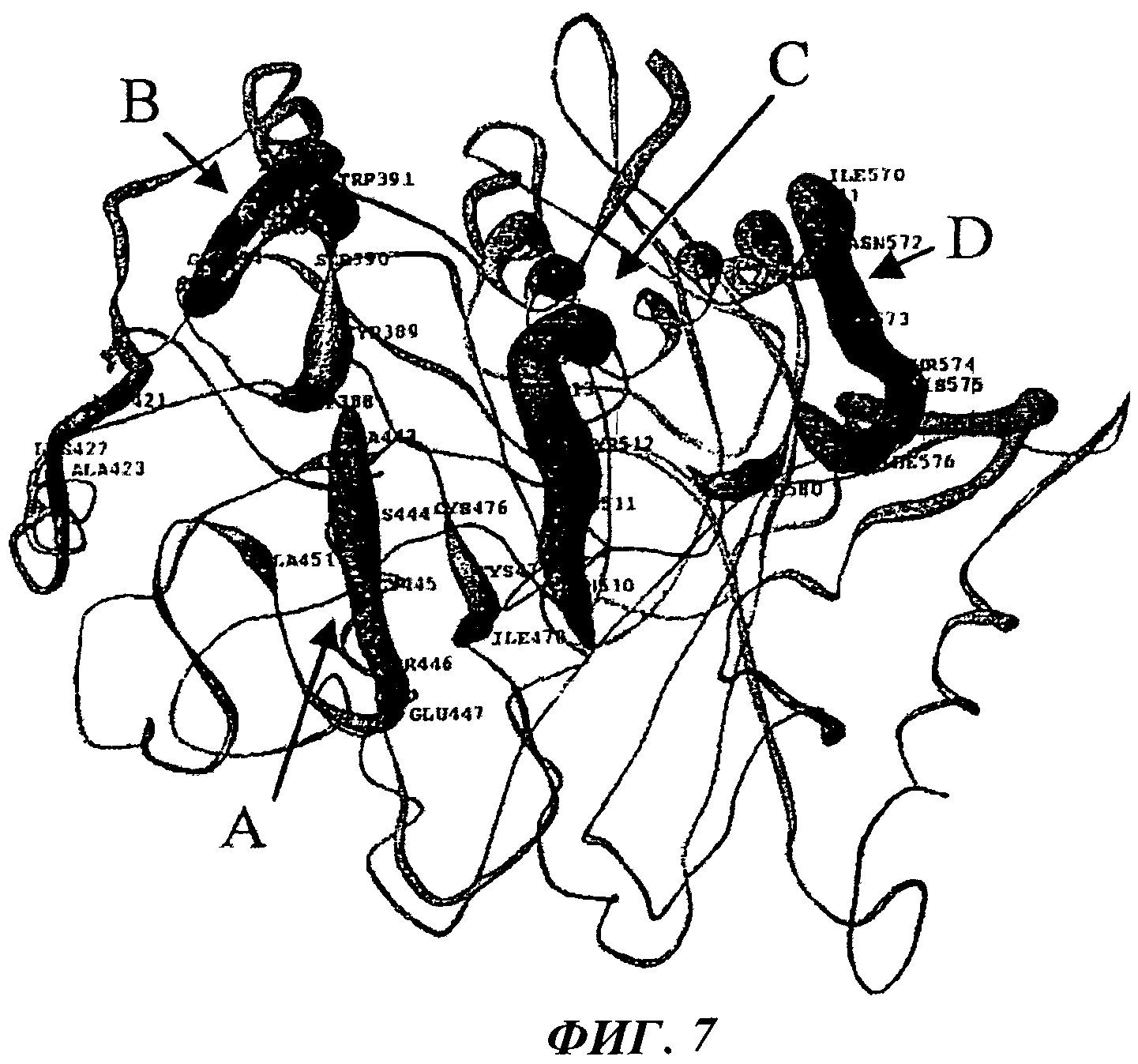
На Фигуре 7 изображена модель Кдр протеиназы. KAS2 [Asn433-Lys468], (A) KAS4 [Asp388-Val395] (В), KAS5 [Asn510-Asp516] (С) и KAS6 [lle570-Tyr580] (D).
Подробное описание изобретения
Следует понимать, что изобретение, раскрытое и определенное в данном описании, распространяется на все альтернативные комбинации двух или более отдельных признаков, упоминаемых или очевидных из текста или чертежей. Все указанные различные комбинации составляют различные альтернативные аспекты изобретения.
Авторы настоящего изобретения обнаружили, что участки трипсиноподобных ферментов бактерии Р. gingivalis, которые располагаются по обе стороны или иным образом определяют каталитический или активный сайт расщепления пептидной связи, обладают большой иммуногенностью и действительно достаточны для обеспечения гуморального ответа на инфекцию Р. gingivalis. В частности, было обнаружено, что химерный или гибридный белок, содержащий один или более подобных участков, обеспечивает защиту от разрушения альвеолярного отростка челюсти, большую, чем иммунная сыворотка, полученная против цельных клеток, и другие иммуногены. Это открытие является особенно неожиданным, т.к. до настоящего момента считали, что каталитический домен трипсиноподобных ферментов бактерии Р. gingivalis является сравнительно слабо иммуногенным.
Согласно одному аспекту настоящее изобретение обеспечивает химерный или гибридный белок для стимулирования ответа на инфекцию Р. gingivalis, причем указанный белок содержит первый пептид, соединенный непосредственно или с помощью линкера со вторым пептидом, при этом:
(A) указанный первый пептид содержит:
(i) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности, представленной в SEQ ID No:1;
или
(ii) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности, представленной в SEQ ID No:2;
и
(B) указанный второй пептид содержит:
(i) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности адгезинового домена Lys-X-протеиназы бактерии Р. gingivalis; или
(ii) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности адгезинового домена Агд-Х-протеиназы бактерии Р. gingivalis; или
(iii) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности адгезинового домена НаgА бактерии Р. gingivalis. В настоящем описании термин «пептид» обозначает последовательность, содержащую до 40 аминокислотных остатков, предпочтительно 5-40 аминокислотных остатков.
Согласно одному варианту реализации вместо термина «второй пептид» используется термин «полипептид». Термин «полипептид» обозначает аминокислотную последовательность, составляющую в длину по меньшей мере приблизительно 40 аминокислотных остатков.
Таким образом, согласно другому аспекту обеспечивается химерный или гибридный белок для стимулирования иммунного ответа на инфекцию Р. gingivalis, при этом указанный белок содержит пептид, соединенный непосредственно или с помощью линкера с полипептидом, при этом:
(A) указанный пептид содержит:
(i) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности, представленной в SEQ ID No:1;
или
(ii) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности, представленной в SEQ ID No:2;
и
(B) указанный полипептид содержит:
(i) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности адгезинового домена Lys-X-протеиназы бактерии Р. Gingivalis; или
(ii) часть последовательности или полнуюпоследовательность, которая является идентичной или гомологичной последовательности адгезинового домена Агд-Х-протеиназы бактерии Р. gingivalis; или
(iii) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности адгезинового домена НаgA бактерии Р. gingivalis.
Согласно другому аспекту настоящее изобретение обеспечивает пептид для стимулирования иммунного ответа на инфекцию Р. Gingivalis, выбранный из группы, состоящей из:
(i) последовательности, которая является идентичной или гомологичной последовательности, представленной в одной из SEQ ID No: 64-66; и
(ii) последовательности, которая является идентичной или гомологичной последовательности, представленной в SEQ ID No: 67 или 68.
Согласно одному аспекту изобретения, в котором пептид содержит последовательность SEQ ID No: 64-68, указанный пептид может быть обеспечен в виде химерного или гибридного белка, в котором пептид соединен непосредственно или с помощью линкера со вторым пептидом. Согласно этому варианту реализации второй пептид химерного или гибридного белка содержит:
(i) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности адгезинового домена Lys-X-протеиназы бактерии Р. gingivalis; или
(ii) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности адгезинового домена Аrg-Х-протеиназы бактерии Р. gingivalis; или
(iii) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности адгезинрвого домена Наq бактерии Р. gingivalis.
Согласно описанному выше варианту реализации термин «полипептид» используется вместо термина «второй пептид». Таким образом, согласно другому аспекту обеспечивается химерный или гибридный белок для стимулирования иммунного ответа на инфекцию Р. gingivalis, при этом указанный белок содержит пептид, соединенный непосредственно или с помощью линкера с полипептидом, при этом:
(А) указанный пептид содержит:
(i) последовательность, которая является идентичной или гомологичной последовательности, представленной в одной из SEQ ID No: 64-66; или
(ii) последовательность, которая является идентичной или гомологичной последовательности, представленной в SEQ ID No: 67 или 68; и
(В) указанный полипептид содержит:
(i) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности адгезинового домена Lys-X-протеиназы бактерии Р. gingivalis; или
(ii) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности адгезинового домена Аrg-Х-протеиназы бактерии Р. gingivalis; или
(iii) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности адгезинового домена НаgА бактерии Р. gingivalis.
В настоящем описании термин «гомолог» пептида или полипептида обозначает пептид или полипептид, содержащий аминокислотную последовательность, которая является гомологичной или имеет сходство с аминокислотной последовательностью указанного первого пептида или полипептида, предпочтительно по меньше мере на 90% последовательности предпочтительно по меньшей мере на 95% последовательности более предпочтительно по меньшей мере на 98% последовательности, при сравнении методом алгоритма BLAST, при этом параметры алгоритма подбирают таким образом, чтобы получить максимальное соответствие анализируемой последовательности по всей длине последовательности сравнения. Термин «сходство последовательности» обозначает точное соответствие между аминокислотами сравниваемых последовательностей. Подобные гомологи можно получать из природных вариантов или изолятов Lys-X- протеиназы или Аrg-Х-протеиназы Р. gingivalis. В другом случае гомолог может представлять собой вариант пептида или полипептида Lys-X-протеиназы или Аrg-Х-протеиназы Р. gingivalis, имеющий «консервативную замену», в котором один или более аминокислотный остаток заменен без изменения общей конформации функции пептида или полипептида, включая, но не ограничиваясь ими, замену аминокислоты на аминокислоту с похожими свойствами. Аминокислоты с похожими свойствами известны в данной области техники. Например, полярные/гидрофильные аминокислоты, которые могут быть взаимозаменяемыми, включают аспарагин, глутамин, серин, цистеин, треонин, лизин, аргинин, гистидин, аспарагиновую кислоту и глутаминовую кислоту; неполярные/гидрофобные аминокислоты, которые могут быть взаимозаменяемыми, включают глицин, аланин, валин, лейцин, изолейцин, пролин, тирозин, фенилаланин, триптофан и метионин; кислые аминокислоты, которые могут быть взаимозаменяемыми, включают аспарагиновую и глутаминовую кислоты, и основные аминокислоты, которые могут быть взаимозаменяемыми, включают гистидин, лизин и аргинин. Предпочтительно такие варианты с консервативными заменами имеют менее 20, более предпочтительно менее 15, более предпочтительно менее 10 и наиболее предпочтительно менее 5 замен аминокислот.
Участок трипсиноподобного фермента бактерии Р. Gingivalis, в частности Lys-X-протеиназы (Кgр) или Аrg-Х-протеиназы (RgpA), который определяет сайт для расщепления пептидной связи, можно определить согласно настоящему описанию, в частности относительно Фигуры 7 и Примера 9, в которых приводится пример методики для предсказания трехмерной конформации каталитического сайта в том виде, в котором он присутствует на Р. Gingivalis для Lys-X протеиназы. Пример 10 обеспечивает способ моделирования трехмерной, конформации Аrq-Х-протеиназы.
Согласно некоторым вариантам реализации изобретения, химерный или гибридный белок, или первая и вторая части пептида, могут быть образованы из пептидомиметика. Пептидомиметик представляет собой молекулу, которая имитирует одно или более свойство пептида, например конформацию, и которая состоит из аминокислотных остатков, некоторые из которых могут отсутствовать в природе.
Определив иммуногенные участки каталитического сайта, авторы изобретения определили последовательность различных пептидных иммуногенов, против которых может быть получен иммунный ответ. В частности, были определены следующие 6 участков, которые располагаются по обе стороны или иным образом, определяют каталитический сайт: KAS1/RAS1, KAS2/RAS2, KAS3/RAS3, KAS4/RAS4, KAS5/RAS5 и KAS6 (см. Таблицу 1). С учетом полученной информации, авторы изобретения проанализировали базы данных последовательностей белков для определения пептидов, которые имеют гомологию с аминокислотными последовательностями, которые образуют участки, расположенные по обе стороны от каталитического сайта, и поэтому представляют собой иммуногенные эпитопы, встречающиеся у Р. gingivalis. Последовательности этих пептидов определяются структурными формулами.
Таблица 1. Последовательности, которые расположены по обе стороны от активного сайта Кgp и RgpA.
Авторы изобретения обнаружили, что химерные белки, содержащие указанные пептиды, можно использовать различным образом. Например, согласно настоящему описанию, некоторые из них вызывают гуморальный ответ, который обеспечивает высокую защиту при лечении или профилактике разрушения костей, которое наблюдается при периодонтите. Эти пептиды также можно применять для проведения диагностических анализов, в которых они позволяют обнаружить или наблюдать за особенностями сыворотки пациента, что позволяет определить инфицирован ли пациент и, если он инфицирован, требуется ли лечение и, если лечение было проведено, - оказалось ли оно эффективным.
Следует понимать, что участок трипсиноподобного фермента Р. gingivalis, который определяет сайт фермента, ответственный за расщепление пептидной связи, расположенной на С-конце от остатков Lys или Аrq, не содержит полную последовательность Lys-X-протеиназы или Аrq-Х-протеиназы.
В настоящем описании термины «гетерологичный белок» или «химерный или гибридный белок» обозначают белок, который состоит из функциональных единиц, доменов, последовательностей или участков аминокислот, полученных из различных источников, или полученных из одного источника и собранных таким образом, что их организация отличается от организации молекулы, из котопой единица, домен, последовательность или участок были получены. Общей чертой химерных или гибридных белков согласно настоящему изобретению является то, что они содержат по меньшей мере один пептид, содержащий аминокислотную последовательность, которая совпадает или обладает гомологией с последовательностью трипсиноподобного фермента Р. gingivalis, которая определяет каталитический сайт, ответственный за расщепление пептидной связи.
Согласно предпочтительному варианту реализации, если первый пептид содержит пептид из участка Кgp [432-468], он предпочтительно представляет собой (i) пептид, который содержит последовательность, выбранную из: VSFANYT и VGFANYT, более предпочтительно, последовательность, выбранную из GVSFANYT, GVGFANYT, VSFANYTA и VGFANYTA; или (i, i) пептид, который содержит последовательность, выбранную из:1 ETAWAD, ETSWAD, TAWADP и TSWADP, предпочтительно, последовательность, выбранную из: SETAWAO, SETSWAD, ETAWADP, ETSWADP, TAWADPL и TSWADPL, более предпочтительно, последовательность, выбранную из: GSETAWAD, GSETSWAD, SETAWADP, SETSWADP, ETAWADPL, ETSWAD PL, TAWADP LL и TSWADPLL. Более предпочтительно, данный пептид выбирают среди пептидов KAS1 [432-454]; KAS2[433-468] и KAS3[436-455], показанных в Таблице 1. В другом случае, данный пептид может представлять собой пептид PAS1K[432-453], также известный, как PAS1(K48), описанный в международной заявке на патент PCT/AU 98/00311 (WO 98/049192). Указатели последовательностей, соответствующие данным пептидам, приведены в Таблице 3.
Аналогично, согласно другому предпочтительному варианту реализации, в котором первый пептид содержит пептид из участка RgpA [426-462], данный пептид предпочтительно выбирают среди пептидов RAS1[426-448], RAS2[427-462] и RAS3[430-449], показанных в Таблице 1. В другом случае первый пептид может представлять собой пептид PAS1 R[426-446], также известный как PAS1(R45), описанный в международной заявке на патент PCT/AU 98/00311 (WO 98/049192).
В химерном или гибридном белке согласно настоящему описанию второй пептид может представлять собой пептид адгезинового домена трипсиноподобного фермента бактерии Р. gingivalis, такого как Lys-X- протеиназа (Кgр) или Аrg-Х-протеиназа (RgpA) или НаgА (см. Таблицу 2). В некоторых случаях указанные домены известны под названием гемагглютинины. В Lys-X-протеиназе предпочтительными доменами являются КА1, КА2, КАЗ, КА4, КА5, показанные в Таблице 2. В Arg-X-протеиназе предпочтительными доменами являются RA1, RA2, RА3 и RA4, показанные в Таблице 2. В НаgА предпочтительными доменами являются НаqА1, НаqА1* и НаqА1**.
Таблица 2. Адгезиновые домены протеиназ Кgр и RgpA.
Кроме улучшения гуморального ответа на пептид согласно настоящему изобретению, такой как KAS1, KAS2, KAS3, KAS4, KAS5 и KAS6 или RAS1, RAS2 и RAS3, RAS4 и RAS5, при условии включения совместно с пептидом в состав химерного или гибридного белка, адгезиновый домен также содержит иммуногенные эпитопы, что создает различные особенности для запуска протективного иммунного ответа. Обнаружение того, что иммуногенные эпитопы адгезинового домена сохраняются в форме, соответствующей трипсиноподобному ферменту бактерии Р. gingivalis при обеспечении в составе химерного или гибридного белка, является неожиданным.
Следует понимать, что в данных вариантах реализации изобретения химерный или гибридный белок может содержать любой один или более пептид, выбранный среди KAS1/RAS1, KAS2/RAS2, KAS3/RAS3, KAS4/RAS4, KAS5/RAS5 и KAS6/RAS6, совместно с любым одним или более адгезиновым доменом трипсиноподобного фермента бактерии Р. gingivalis, в частности, с любым одним или более адгезиновым доменом Lys-X-протеиназы (КА1, КА2, КА3, КА4 и КА5) или Аrg-Х-протеиназы (RA1, RA2, RA3 и RA4) или доменами НаgА, НаgА1, НаgА1* и НаgА1**.
Также следует иметь в виду, что адгезиновый домен не обязательно должен быть полностью доменом трипсиноподобного фермента бактерии Р. Gingivalis. Например, адгезиновый домен может представлять собой фрагмент подобного домена, в частности, предпочтительными фрагментами являются фрагменты KsA1 и KLA1 домена А1 Lys-X-протеиназы (см. Таблицу 2). Если домен представляет собой фрагмент адгезинового домена, он обычно содержит один или более специфичный для адгезинового домена эпитоп. Указатели последовательностей, соответствующих адгезино связанным пептидам, приведены в Таблице 3.
Согласно одному варианту реализации второй пептид или полипептид содержит последовательность, представленную в одной или более из SEQ ID No: 69-79 или одной или более из SEQ ID No 83-85.
Химерный или гибридный белок согласно настоящему изобретению может содержать дополнительные пептиды, выбранные из участка Кgp [432-468]Lys-X- протеиназы, и/или один или более дополнительный пептид, выбранный из участка RgpA[426-462] Аrq-Х-протеиназы.
Согласно предпочтительным вариантам реализации настоящего изобретения химерный или гибридный белок содержит один или более из KAS1, KAS2, KAS3, KAS4, KAS5 и KAS6, или один или более из RAS1, RAS2, RAS3, RAS4 и RAS5 совместно с KsA1 или KLA1.
Таким образом, согласно некоторым вариантам реализации химерный или гибридный белок может содержать по меньшей мере один дополнительный пептид, при этом указанный дополнительный пептид содержит:
(i) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности, представленной SEQ ID No:1; или
(ii) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности, представленной в SEQ ID No:2; или
(iii) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности адгезинового домена Lys-X-протеиназы бактерии Р. gingivalis, или
(iv) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности адгезинового домена Аrg-Х-протеиназы бактерии Р. gingivalis; или
(v) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности адгезинового домена НаqА бактерии Р. gingivalis.
Другие примеры доменов, единиц, последовательностей или участков, которые можно включать в состав химерного или гибридного белка согласно настоящему описанию, включают домены для связывания с рецепторами или лигандами, такими как связывающий участок Fc или рецепторы Fc, домены для увеличения времени полураспада, такие как альбумин, или домены для облегчения экспрессии или выделения химерного или гибридного белка.
В химерных или гибридных белках согласно настоящему изобретению С-концевой остаток первого пептида может быть ковалентно связан с N-концевым остатком полипептида адгезинового домена, или N-концевой остаток первого пептида может быть ковалентно связан с С-концевым остатком адгезинового домена полипептида. Согласно этому варианту реализации первый пептид и полипептид адгезинового домена обозначают термином «непосредственно соединенные» или «прилегающие».
Согласно другим вариантам реализации химерный или гибридный белок содержит линкерную последовательность для соединения первого пептида с полипептидом адгезинового домена. Линкер как аминокислотный, так и не аминокислотный, может соединять пептид и полипептид. Предпочтительно, линкер не является иммуногенным. Подходящие линкеры могут содержать до 15 аминокислот в длину, однако предпочтительно содержат меньше пяти аминокислот в длину. Линкер может служить для приведения первого пептида и полипептида агезинового домена в более близкое пространственное расположение, чем характерное для трипсиноподобного фермента бактерии Р. gingivalis. В другом случае он может разносить первый пептид и полипептид, адгезинового домена.
Химерные или гибридные белки согласно настоящему изобретению можно получить с помощью систем экспрессии рекомбинантных молекул (например, методы рекомбинантной ДНК) или методом химического синтеза (например, твердофазного пептидного синтеза). Эти методы хорошо известны в данной области техники.
Гетерологичный или химерный белок является особенно перспективным, т.к. он улучшает гуморальный ответ по сравнению с ответом, вызванным при применении первого или второго пептидного компонента химерного или гибридного белка.
Авторы изобретения обнаружили, что химерные белки, содержащие такие пептиды, обладают множеством полезных свойств. Например, согласно настоящему описанию некоторые из них вызывают гуморальный ответ, который является высокопротективным для лечения или профилактики разрушения костей, которое наблюдается при хроническом периодонтите. Указанные пептиды также можно применять для проведения диагностических анализов, в которых они позволяют определить или наблюдать за особенностями сыворотки пациента, посредством чего определяется, инфицирован ли пациент, и если он инфицирован, то требуется ли лечение или, если лечение уже проведено, является ли оно эффективным.
Согласно одному варианту реализации химерный или гибридный белок вызывает защитный иммунный ответ, который по меньшей мере снижает до минимального уровня или ограничивает разрушение соединительной ткани, вызванное инфекцией Р. gingivalis. Согласно одному варианту реализации защитный иммунный ответ по меньшей мере снижает до минимального уровня или ограничивает разрушение костей, вызванное инфекцией Р. gingivalis. В настоящем описании обсуждается модельная система измерения разрушения кости, вызванного инфекцией Р. gingivalis. Обычно защитный иммунный ответ преимущественно представляет собой гуморальный ответ. Согласно некоторым вариантам реализации защитный иммунный ответ также включает клеточный ответ.
Настоящее изобретение также обеспечивает композицию, содержащую химерный или гибридный белок, подробно описанный выше. Обычно композиция является антигенной или иммуногенной. В частности, настоящее изобретение обеспечивает композицию, подходящую для стимулирования протективного или терапевтического иммунного ответа на инфекцию Р. gingivalis, содержащую химерный или гибридный белок, дополнительно вместе с адъювантом. Такая композиция также может содержать другой компонент для модулирования или усиления иммунного ответа. Согласно одному варианту реализации композиция представлена в форме вакцины.
Известны различные вспомогательные вещества, которые можно применять вместе с вакцинами. Вспомогательные вещества позволяют посредством модулирования иммунного ответа достигать выработки более надежного иммунитета при применении меньшего количества или доз антигена по сравнению с применением только вакцины. Примеры вспомогательных веществ включают неполное вспомогательное вещество Фрейнда (IFA), вспомогательное вещество 65 (содержащий арахисовое масло, моноолеат маннида и моностеарат алюминия), масляные эмульсии, вспомогательное вещество Риби, ПАВ полиолы, полиамины, авридин, Quil А, сапонин, MPL, QS-21, минеральные гели такие, как соли алюминия и кальция, наночастицы такие, как гидроксиапатит, фосфат кальция, соли алюминия, олигомеры Сахаров и полимеры, такие как маннан, хитозан. Другие примеры включают эмульсии «масло-в-воде», такие как SAF-1, SAF-0, MА59, Seppic ISA720, и другие аэрозольные вспомогательные вещества, такие как ISCOM™ и ISCOM matrix™. Обширный, но не исчерпывающий список примеров вспомогательных веществ представлен в Сох и Coulter 1992 [In: Wong WK (ed.) Animals parasite control utilising technology. Bocca Raton; CRC press, 1992; 49-112]. Помимо вспомогательного вещества, в состав композиции вакцины могут входить фармацевтически приемлемые носители, наполнители, буферы или разбавители, по мере необходимости. Одну или более дозу вакцины, содержащую вспомогательное вещество, можно вводить в профилактических или терапевтических целях для лечения развившегося периодонтита.
Согласно предпочтительному варианту реализации химерный или гибридный белок сочетают с мукозальным вспомогательным веществом и вводят перорально, трансбуккально или назально. К примерам мукозальных вспомогательных веществ относятся наночастицы, холерный токсин и термолабильный токсин Е. соli, нетоксичные В-субъединицы указанных токсинов, мутантные формы данных токсинов, которые имеют пониженную токсичность. Другие методы, которые можно применять для доставки антигенных белков перорально/трансбуккально/назально, включают встраивание белка в или абсорбцию белка на частицах биодеградируемого полимера (например, акрилатах или полиэфирах) методом микроинкапсулирования для улучшения поглощения микросфер из желудочно-кишечного тракта или других слизистых оболочек и для защиты белков от распада. Липосомы, ISCOM™, гидрогели представляют собой примеры возможных методов, которые можно улучшить с помощью включения направляющих молекул, таких как LTBJ СТВ, или пектинов для доставки антигенных белков к иммунной системе слизистых оболочек. Кроме антигенных, белков и мукозального вспомогательного вещества или системы доставки, в состав вакцины могут входить традиционные фармацевтически приемлемые носители, наполнители, оболочки, дисперсионные среды, антибактериальные или противогрибковые агенты и буферы или разбавители, при необходимости.
Согласно данному аспекту настоящее изобретение также обеспечивает способ профилактики или снижения частоты возникновения или тяжести состояния или заболевания, вызываемого инфекцией Р. Gingivalis, у субъекта, который включает введение указанному субъекту химерного или гибридного белка, согласно описанию выше, или композиции согласно описанию выше. Субъект может представлять собой человека или другие животное, и предпочтительно является человеком.
Обычно состояние или заболевание, вызываемое инфекцией Р. gingivalis, представляет собой хронический периодонтит, однако также оно может представлять собой разрушение костей, в частности, разрушение костей альвеолярного отростка или болезнь коронарных артерий.
Известно множество способов введения вакцинной композиции человеку или животному, включающее, но не ограничивающееся указанными, чрескожный, внутримышечный, внутрибрюшинный, внутривенный, подкожный, интраназальный подъязычный, трансбуккальный и пероральный способ введения. Указанные способы введения особенно полезны для вакцинации.
Согласно другому аспекту настоящее изобретение обеспечивает антитело, предпочтительно моноклональное антитело, полученное против химерного или гибридного белка согласно подробному описанию выше.
Указанные антитела можно получать стандартными способами и применять для пассивной иммунизации субъекта. Соответственно, согласно данному аспекту настоящее изобретение также обеспечивает способ профилактики или снижения тяжести состояния или заболевания, вызываемого Р. gingivalis, у пациента, который включает введение пациенту антитела согласно описанию выше.
Согласно другому аспекту настоящее изобретение обеспечивает молекулу нуклеиновой кислоты, включающую нуклеотидную последовательность, кодирующую химерный или гибридный белок согласно подробному описанию выше, дополнительно функционально соединенную по меньшей мере с одним регуляторным элементом. Согласно одному варианту реализации нуклеиновая кислота обеспечивается в выделенном или существенно очищенном виде.
Молекула нуклеиновой кислоты может быть, например, встроена в соответствующий вектор экспрессии для продукции химерного белка в виде рекомбинантного белка посредством введения вектора в прокариотическую или эукариотическую клетку - хозяина. Для успешной экспрессии рекомбинантного вектора необходимо, чтобы вектор экспрессии содержал регуляторные элементы транскрипции и трансляции, совместимые и распознаваемые конкретной клеткой-хозяином, используемой для экспрессии. Для экспрессии рекомбинантого белка можно использовать различные типы клеток-хозяев, которые включают, но не ограничиваются указанными, бактерии, трансформированные вектором на основе бактериофага, плазмидой и космидой; дрожжи, содержащие вектор дрожжей, грибы, содержащие векторы на основе грибов; линии клеток насекомых, инфицированные вирусом (например, бакловирусом), и линии клеток млекопитающих, трансфицированные векторами экспрессии на основе плазмид или вирусов, или инфицированные рекомбинантным вирусом (например, вирусом коровьей оспы, аденовирусом, аденоассоциированным вирусом, ретровирусом и т.д.).
Способами, известными в области молекулярной биологии, в вектор экспрессии можно вводить различные промоторы и энхансеры для повышения экспрессии рекомбинантного белка, при условии, что повышенная экспрессия аминокислотных последовательностей совместима (например, нетоксична) с конкретной используемой клеткой-хозяином.
Выбор промотора зависит от используемой системы экспрессии. Промоторы различаются по силе, т.е. способности усиливать транскрипцию. Обычно желательно использовать сильный промотор для достижения высокой уровня транскрипции кодирующей нуклеотидной последовательности экспрессии рекомбинантного белка. Например, известные в данной области техники промоторы бактерий, фагов или плазмид, при наличии которых наблюдали высокий уровень транскрипции в системе клетки-хозяина, включая Е. Соli, включают промотор lac-оперона, trp-оперона, промотор rесА, промотор рРНК, промоторы PR и PL, lacUV5, ompF, blа, lpp и т.п., и их можно использовать для обеспечения транскрипции встроенной нуклеотидной последовательности, кодирующей аминокислотные последовательности.
Другие регуляторные элементы эффективной транскрипции или трансляции включают энхансеры и регуляторные сигналы. Последовательности-энхансеры являются элементами ДНК, которые, по-видимому, увеличивают эффективность транскрипции сравнительно независимо от расположения и ориентации относительно ближайшей кодирующей нуклеотидной последовательности. Таким образом, в зависимости от используемой системы вектора экспрессии клетки-хозяина энхансер может располагаться в прямом или обратном направлении относительно встроенных кодирующих последовательностей для усиления эффективности транскрипции. Для регуляции экспрессии кодирующей последовательности можно использовать другие регуляторные последовательности, например, сигналы инициации транскрипции или трансляции.
Согласно другому варианту реализации вектор может представлять собой вирусный или бактериальный вакцинный вектор и может применяться для обеспечения рекомбинантной вирусной вакцины, рекомбинантной бактериальной вакцины, рекомбинантной аттенуированной бактериальной вакцины или инактивированной рекомбинантной вирусной вакцины. Вирус коровьей оспы является наиболее известным примером инфекционного вируса в данной области техники, который был изменен методами инженерии таким образом, что способен экспрессировать вакцинные антигены, полученные от других организмов. Рекомбинантный живой вирус коровьей оспы, который ослаблен или иным образом обработан так, что не вызывает заболевание сам по себе, используют для иммунизации хозяина. Последующая репликация рекомбинантного вируса в организме хозяина обеспечивает постоянную стимуляцию иммунной системы антигенами вакцины, с помощью чего обеспечивается длительный иммунитет.
Другие живые вакцинные векторы включают: аденовирус цитомегаловирус и, предпочтительно, поксвирусы, такие как вирус коровьей оспы [Paoletti and Panicali, US Patent No. 4603112] и аттенуированные штаммы Salmonella [Stocker et al., патент США 5210035; 4837151; и 4735801; и Curtiss et al., 1988, Vaccine 6:155-160]. Живые вакцины являются особенно предпочтительными, т.к. они постоянно стимулируют иммунную систему, что может обеспечивать очень длительный иммунитет. Если иммунный ответ является защитным в отношении последующей инфекции Р. gingivalis, саму живую вакцину можно использовать в профилактической вакцине против инфекции Р. gingivalis. В частности, живая вакцина может быть создана на основе комменсальной бактерии ротовой полости. Эту бактерию можно трансформировать вектором, несущим рекомбинантный химерный белок, и затем ее можно применять для заселения ротовой полости, в частности слизистой оболочки ротовой полости. После колонизации бактерией слизистой оболочки ротовой полости экспрессия рекомбинантного белка будет стимулировать выработку нейтрализующих антител лимфоидной тканью слизистой. Для дополнительной иллюстрации настоящего варианта реализации нуклеотидные последовательности, кодирующие химерные белки, с помощью методов молекулярной биологии, известных в данной области техники, можно вставить в геномную ДНК вакцинного вируса в сайт, который способствует экспрессии эпитопов, но не оказывает отрицательного действия на рост или репликацию вектора на основе вакцинного вируса. Полученный рекомбинантный вирус можно использовать в качестве иммуногена в составе вакцины. Аналогичные методы можно использовать для создания лекарственной формы инактивированной рекомбинантной вирусной вакцины, кроме тех случаев, когда рекомбинантный вирус инактивирован химическими методами, известными в данной области техники, перед использованием в качестве иммуногена и без существенного влияния на иммуногенность экспрессированного иммуногена. Инактивированные рекомбинантные вакцины можно приготовить с включением соответствующего вспомогательного вещества для усиления иммунного ответа на антигены вакцины.
Настоящее изобретение также обеспечивает применение молекулы нуклеиновой кислоты, содержащей последовательность нуклеотидов, кодирующую химерный или гибридный белок согласно изобретению непосредственно в виде лекарственной формы вакцины. Нуклеотидные последовательности, кодирующие химерные белки, функционально соединенные с одним или более регуляторным элементом, можно вводить непосредственно для вакцинации пациента («направленный перенос генов») против патогенных штаммов Р. gingivalis. Направленный перенос генов прививаемому пациенту, приводящий к экспрессии генетического материала в клетках привитого пациента, таких как клетки эндотелия, а также ткани крупных органов, был показан с помощью методов, известных в данной области техники, таких как внутривенная инъекция экспрессирующих плазмид: комплекс катионных липосом [Zhu et al., 1993, Science 261:209-211]. Другие эффективные способы доставки векторной ДНК в клетки-мишени известны в данной области техники. В одном примере очищенную рекомбинантную плазмидную ДНК, содержащую вирусные гены, использовали для введения парентерально, мукозально или методом генной пушки) в вакцину для стимулирования защитного иммунного ответа [Fynan et al., 1993, Proc Natl Acad Sci USA 90:11478-11482]. В другом примере клетки, полученные от пациента, можно трансфицировать или можно провести электропорацию стандартными методами, известными в данной области техники, что приводит к проникновению ДНК рекомбинантного вектора внутрь клетки-мишени. Клетки, содержащие ДНК рекомбинантного вектора, можно отобрать с помощью методов, известных в данной области техники, например, путем включения маркера селекции в вектор, и отобранные клетки можно вернуть в организм пациента для экспрессии рекомбинантного белка.
Согласно данному аспекту настоящее изобретение также обеспечивает способ профилактики или снижения частоты или тяжести состояния или заболевания, вызываемого инфекцией Р. gingivalis, у субъекта, который включает введение субъекту молекулы нуклеиновой кислоты, согласно описанию выше, вектора согласно описанию выше, или клетки прокариота или эукариота согласно описанию выше.
Согласно другим вариантам реализации предложена фармацевтическая композиция, содержащая химерный или гибридный белок или антитело согласно описанию выше. Указанная композиция может дополнительно содержать разбавитель, наполнитель, носитель или химиотерапевтический агент для лечения состояния или заболевания, вызываемого инфекцией Р. gingivalis, и может быть адаптирована для перорального введения. Композицию согласно настоящему заболеванию можно включить в состав пастилок или жевательных резинок и других продуктов, например, путем примешивания к теплой основе жевательной резинки или покрытия наружной поверхности основы жевательной резинки, примерами которых являются джелутонг, латекс, винилитовые смолы и т.д., желательно с традиционными пластификаторами или смягчителями, сахаром или другими подсластителями, такими как глюкоза, сорбит и т.п.
Пероральную композицию согласно настоящему изобретению, которая содержит перечисленные выше компоненты, можно приготовить и применять в различных формах, подходящих для перорального введения, таких как средства для ухода за зубами, включая зубные порошки и зубные эликсиры, ополаскиватели для полости рта, пастилки, жевательные резинки, пасты, крем для массажа десен, молочные продукты и другие продукты питания. Пероральная композиция согласно настоящему изобретению может дополнительно включать известные ингредиенты в зависимости от типа и формы конкретной пероральной композиции.
Согласно некоторым предпочтительным формам изобретения пероральная композиция, по существу, может представлять собой жидкость, например ополаскиватель для полости рта. В таких лекарственных средствах носитель обычно представляет собой водно-спиртовую смесь, желательно содержащую увлажняющий компонент согласно описанию ниже. Обычно отношение по массе воды к спирту находится в интервале приблизительно от 1:1 приблизительно до 20:1. Общее количество смеси водно-спиртовой смеси в лекарственных средства такого типа находится в пределах приблизительно, от 70 приблизительно до 99,9% по весу лекарственной формы. Спирт обычно представляет собой этанол или изопропанол, предпочтительно этанол.
рН таких жидких и других лекарственных форм согласно настоящему изобретению обычно находится в пределах от приблизительно 5 до приблизительно 9 и в основном от приблизительно 5.0 до приблизительно 7.0. Значение рН можно регулировать добавлением кислоты (например, лимонной или бензойной кислоты) или основания (например, гидроксида натрия) или буфера (например, цитрата, бензоата, карбоната или бикарбоната натрия, динатрийгидрофосфата, натрийгидрофосфата и т.п.).
В случае других желательных форм согласно настоящему изобретению фармацевтическая композиция может представлять собой, по существу, твердое вещество или пасту, например, зубной порошок, пастилку или зубную пасту (зубной крем) или гелеобразную зубную пасту. Носитель в таких твердых или пастообразных пероральных лекарственных формах обычно содержит приемлемый для зубов полирующий материал.
В зубной пасте жидкий носитель может содержать воду и увлажняющий компонент в количестве в пределах приблизительно от 10% до приблизительно 80% по весу лекарственной формы. Примерами соответствующих увлажняющих компонентов/носителей являются глицерин, пропиленгликоль, сорбитол и полипропиленгликоль. Также предпочтительными являются жидкие смеси воды глицерина и сорбитола. В прозрачных гелях, в которых важным показателем является коэффициент преломления, предпочтительно используется приблизительно 2.5-30% по весу воды, приблизительно 70% по весу глицерина и приблизительно 20-80% по весу сорбитола.
Зубные пасты, кремы и гели обычно содержат натуральный или синтетический загуститель или гелеобразующее средство в количестве приблизительно от 0.1 приблизительно до 10, предпочтительно приблизительно от 0.5 до приблизительно 5% по весу. Приемлемым загустителем является синтетический гекторит, синтетическая коллоидная глина, представляющая собой комплекс силиката магния и щелочного металла, известная под названием Лапонит (например, СР, SP 2002, D) выпускаемая фирмой Laрorte, Industrie Limited. Лапонит D содержит по весу приблизительно 58,00% по весу приблизительно 58,00% по весу SiО2, 25.40% по весу, MgO 3.05% по весу Na2О, 0.98% по весу Li2О, немного воды и металлы в следовых количествах. Его истинный удельный вес составляет 2.53, а кажущаяся объемная плотность равна 1.0 г/мл при 8% влажности.
Другие приемлемые загустители включают ирландский мох, йота-каррагинан, трагантовую камедь, крахмал, поливинилпорролидон, гидроксиэтипропилцеллюлозу, гидроксибутилметилцеллюлозу, гидроксипропилметилцеллюлозу, гидроксиэтилцеллюлозу (например, доступную под названием Натразол), натрийкарбоксиметилцеллюлозу и коллоидный диоксид кремния, такую как мелкоизмельченный Силоид (например, Силоид 244)). Также можно включать солюбилизаторы, такие как увлажняющий полиолы, например, пропиленгликоль, дипропиленгликоль и гексиленгликоль, целлозольвы, такие как метилцеллозольв и этилцеллозольв, растительные масла и воска, содержащие по меньшей мере 12 атомов углерода в прямой цепи, такие как оливковое масло, касторовое масло и петролатум, а также сложные эфиры, такие как амилацетат, этилацетат и бензилбензоат.
Необходимо указать, что, как обычно, пероральные препараты должны продаваться или иным путем распространяться в упаковках с соответствующими этикетками. Так, сосуд со средством для ополаскивания рта должен иметь этикетку, характеризующую средство по составу, способу применения для ополаскивания или промывания рта, а зубная паста, крем или гель должны содержаться в сминаемых тюбиках обычно из алюминия, свинца с покрытием или пластика или содержаться в сдавливаемых, закачанных или находящихся под давлением диспергаторах, отмеряющих содержимое и имеющих этикетки, характеризующие компонентный состав зубной пасты, геля или зубного крема.
Органические поверхностно-активные вещества применяют в композициях настоящего изобретения для достижения повышенного профилактического действия, для содействия полному распределению в полости рта активного агента, а также для того, чтобы сделать настоящие композиции более косметически приемлемыми. Органические поверхностно-активные вещества по своей природе предпочтительно являются анионными, неионными или амфолитными и предпочтительно не взаимодействуют с активным агентом. В качестве поверхностно-активного вещества рекомендуется применять детергенты, придающие композиции очищающие и пенообоазующие свойства. Подходящие примеры анионных поверхностно-активных веществ включают водорастворимые (соли моносульфатов моноглицеридов высших жирных кислот, таких как натриевая соль моносульфированного моноглицерида жирных кислот гидрированного кокосового масла, высших алкилсульфатов, таких как натрийлаурилсульфат, алкиларилсульфонатов, таких как найтридодецилбензолсульфонат, высших алкилсульфоацетатов, эфиров высших жирных кислот с 1,2 дигидроксипропансульфонатом и насыщенных высших алифатических ациламидов низших алифатических аминокарбоновых кислот, таких как содержащие 12-16 атомов углерода в жирнокислом, алкильном или ацильном радикале, и т.п. Примерами указанных последними амидов являются N-лауроилсаркозин, а также натриевые, калиевые и этаноламиновые соли N-лауроил-, N-миристоил или N-пальмитоилсаркозина, которые не должны содержать мыла или аналогичных производных высших жирных кислот. Примерами подходящих для применения водорастворимых неионных поверхностно-активных веществ являются продукты конденсации окиси этилена с различными вступающими в реакцию с ней соединениями, имеющими длинные гидрофобные (например, алифатические цепи приблизительно с 12-20 атомами углерода), и такие продукты конденсации ("этоксамеры") содержат гидрофильные полиоксиэтиленовые фрагменты, в их числе продукты конденсации полиэтиленоксида с жирными кислотами, жирными спиртами, жирными амидами, многоатомными спиртами (например, моностеарат сорбита) и полипропиленоксидом (например, плуроновые вещества).
Поверхностно-активное вещество обычно присутствует и количестве 0,1-5% по весу. Необходимо отметить, что поверхностно-активные вещества способствуют растворению активного агента согласно настоящему изобретению и, тем самым, уменьшают необходимые количества солюбилизирующего увлажнителя.
В пероральные препараты настоящего изобретения могут быть введены и различные другие вещества, такие как осветители, консерванты, силиконы, хлорофильные соединения и/или аммонийсодержащие соединения, например, мочевина, диаммонийфосфат и их смеси. Такие вспомогательные вещества в случае их присутствия вводят в препараты в количествах, не оказывающих нежелательного влияния на желаемые свойства и показатели. Необходимо избегать присутствия значительных количеств солей цинка, магния и других металлов, обычно растворимых, способных образовывать комплексы с активными компонентами настоящего изобретения.
Также могут быть использованы любые приемлемые ароматизирующие и подслащивающие вещества. Примеры приемлемых ароматизирующих компонентов включают ароматизирующие масла, например масло из кудрявой мяты, перечной мяты, винтегреновое масло, сассофрасовое масло, гвоздичное масло, шалфейное масло, эвкалиптовое масло, майорановое масло, коричное масло, лимонное масло и апельсиновое масло, а также метилсалицилаг. Приемлемые подслащивающие вещества включают сахарозу, лактозу, мальтозу, сорбит, ксилит, цикламат натрия, периллартин аспаратилфенилаланина (амф), сахарин и т.п. Желательно чтобы ароматизирующие и подслащивающие вещества по отдельности или вместе присутствовали в количестве от 0,1% до 5% или более на препарат.
Композиции для перорального введения можно приготовить любыми способами, известными в области изготовления фармацевтических композиций, при этом такие композиции могут содержать один или более агентов, выбранных из группы, состоящей из ароматизирующих и подслащивающих средств, красителей и консервантов, для обеспечения фармацевтически удачных и приятных на вкус лекарственных средств. Таблетки содержат активные ингредиенты с примесью нетоксичных фармацевтически приемлемых наполнителей, которые подходят для изготовления таблеток. Такие наполнители могут представлять собой, например, инертные разбавители, такие как карбонат кальция, бикарбонат натрия, лактозу, фосфат кальция или натрия гранулирующие агенты и разрыхлители, например кукурузный крахмал или альгинатную кислоту; связывающие агенты, например желатин или акацию, и смазывающие агенты, например стеарат магния, стеариновую кислоту или тальк. Таблетки могут быть не покрыты оболочкой или быть покрыты с помощью известных методов для задержки распада и всасывания в желудочно-кишечном тракте или периодонтальном кармане, посредством чего обеспечивается постоянное действие в течение долгого времени. Например, можно использовать материалы, задерживающие распад, такие как моностеарат глицерил или дистеарат глицерина.
Лекарственные формы для перорального введения также могут быть представлены в виде желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем, например, карбонатом кальция, фосфатом кальция или каолином, или в форме мягких желатиновых капсул, в которых активный компонент смешан с водой или маслом, например арахисовым маслом или оливковым маслом.
Водные суспензии содержат активные материалы в смеси с наполнителями, подходящими для получения водных суспензий. Такие наполнители представляют собой суспендирующие агенты, например, арбоксиметилцеллюлозу натрия, метилцеллюлозу, гидроксипропилметилцеллюлозу, альгинат натрия, поливинилпирролидон, трагакантовую камедь и камедь акации; диспергирующие или увлажняющие агенты могут представлять собой природные фосфатиды, например, лецитин или продукты конденсации оксидов алкиленов и жирных кислот, например, полиоксиэтилена стеарат, или продукты конденсации оксида этилена с длинноцепочечными алифатическими спиртами, например, гептадекаэтиленоксицетанол, или продукты конденсации оксида этилена с частичными сложными эфирами жирных кислот и гекситола, такие как полиоксиэтилен сорбитола моноолеат, или продукты конденсации оксида этилена с частичными сложными эфирами жирных кислот и ангидридов гекситола, например полиэтилен сорбитана моноолеат.
Водные суспензии могут содержать один или более консервантов или противомикробные агенты, например бензоаты, такие как этил- или н-пропил п-гидроксибензоал, другой пример - хлоргексидин глюконат, один или более красителей, один или более ароматизаторов, один или более подсластителей, таких как сахароза или сахарин.
Масляные суспензии можно приготовить посредством растворения активных ингредиентов в растительном масле, например арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, или в минеральных маслах, таких как жидкий парафин. Масляные суспензии могут содержать загуститель, например пчелиный воск, твердый парафин или цетиловый спирт. Подсластителями могут быть упомянутые выше агенты, при этом для получения приятных на вкус пероральных лекарственных средств можно добавлять ароматизаторы. Указанные композиции можно консервировать посредством добавления антиоксиданта, такого как аскорбиновая кислота.
Согласно другому аспекту настоящее изобретение обеспечивает способ диагностики или наблюдения за состоянием или заболеванием, вызываемые инфекцией Р. gingivalis, у субъекта, который включает применение химерного или гибридного белка согласно описанию выше для определения антител к Р. gingivalis в образце биологического материала, полученного от субъекта.
Согласно другому аспекту настоящее изобретение обеспечивает способ диагностики или наблюдения за состоянием или заболеванием, вызываемым инфекцией Р. gingivalis, у субъекта, который включает применение антитела согласно описанию выше для определения наличия Р. gingivalis в образце биологического материала, полученного от субъекта.
Согласно другому аспекту настоящее изобретение обеспечивает пептид для стимулирования иммунного ответа на Р. gingivallis, содержащий последовательность, представленную в одной из: SEQ ID No: 17, 18, 25 и 26. Согласно одному варианту реализации пептид содержит последовательность, гомологичную одной из: SEQ ID No: 17, 18, 25 и 26. Пептид может содержать в длину 5-40 аминокислот.
Согласно другому аспекту настоящее изобретение обеспечивает нуклеиновую кислоту, кодирующую пептид, содержащий последовательность, представленную в одной из: SEQ ID No: 17, 18, 25 и 26.
Согласно другому аспекту настоящее изобретение обеспечивает применение пептида, содержащего последовательность, представленную в одной из: SEQ ID No: 17, 18, 25 и 26, или нуклеиновую кислоту, кодирующую пептид, содержащий последовательность, представленную в одной из: SBQ ID No:.17, 18, 25 и 26, для получения химерного или гибридного белка для стимулирования иммунного ответа на инфекцию Р. gingivalis.
Согласно другому аспекту настоящее изобретение обеспечивает применение пептида, содержащего последовательность, представленную в одной из: SEQ ID No: 17, 18, 25 и 26, или нуклеиновую кислоту, кодирующую пептид, содержащий последовательность, представленную в одной из: SEQ ID No: 17, 18, 25 и 26, для стимулирования иммунного ответа на инфекцию Р. gingivalis. Согласно одному варианту реализации пептид вводят одновременно или последовательно с пептидом, содержащим:
(i) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности адгезинового домена Lys-X-протеиназы бактерии Р. gingivalis; или
(ii) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности адгезинового домена Аrg-Х-протеиназы бактерии Р. gingivalis; или
(iii) часть последовательности или полную последовательность, которая является идентичной или гомологичной последовательности адгезинового домена НаgА бактерии Р. gingivalis.
Таблица 3
Изложенные ниже примеры представлены с целью иллюстрации, но не ограничения, настоящего изобретения.
Пример 1
Материалы и методы.
Штаммы бактерий и условия культивирования. Лиофилизированные культуры Porphyromonas gingivalis W50 культивировали в анаэробных условиях при 37°С на кровяном агаре с добавлением 5 мкг/мл гемина, 0.5 мкг/мл цистеина (НВ агар, <10 пассажей). Через 3-4 дня колониями инокулировали среду для инфузии с экстрактами тканей мозга и сердца с добавлением 5 мкг/мл гемина, 0.5 мкг/мл цистеина (1). Периодические культуры культивировали в анаэробных условиях на рабочей станции МКЗ (Don Whitley Scientific Ltd., Adelaide, Australia). Клетки собирали во время экспоненциальной фазы роста методом центрифугирования (7500 д, 30 мин, 4°С) и дважды промывали буфером PG (50 мМ Tris-HCl, 150 мМ NaCl, 5 мМ CaCl2 и 5 мМ цистеина-HCl, рН 8.0) на анаэробной рабочей станции. Рост периодических культур контролировали при длине волны 650 нм на спектрофотометре (модель 295Е, Perkin-Elmer). Чистоту культур проверяли рутинным методом окрашивания по Грамму микроскопически и с помощью различных биохимических анализов согласно Slots (2).
Создание конструкций рЕТ28, содержащих последовательности адгезина и последовательности адгезина с добавленными на М-конце последовательностями Кgp протеиназы. Остатки Кдр, представляющие пептиды и химерные пептиды активного сайта (AS) и домена адгезина КдрА1 (А1), экспрессировали на повышенном уровне в Е. соli в виде рекомбинантных белков (г) с гекса-His метками с использованием векторов экспрессии рЕТ (Novagen). Рекомбинантные белки представляли собой rKAS2 и rKLA1, а r-химерные белки представляли собой rKAS2-KLA1, rKAS1-KsA1 и rKAS4-KAS3-KAS5-KAS6-KLA1 (также обозначаемые термином мультиКАS-KLAI). Аминокислотные последовательности, представляющие различные домены А1 и AS, представленые в Таблицах 1 и 2. Различные домены KAS и КА1 гена kgp амплифицировали на основе pNS1 (3.5 kb BamHI lys фрагмент в pUC18) или геномной ДНК Р. gingivalis, соответственно с использованием праймеров, указанных в Таблице 4, Taq ДНК-полимеразы (Invitrogen) и термоциклера PC-960 (Corbett Research Technologies). Для получения продуктов ПЦР, кодирующих KAS2 и KLA1, соответственно, использовали пары праймеров: КАS2-прямой и КАS2-обратный и KLA1-прямой и KLA1-обратный при следующих условиях реакции: 94°С, 3 мин, затем 28 циклов при 94°С, 45 с (денатурация); 62°С, 40 с (отжиг) и 72°С, 20 с (элонгация), затем последний цикл при 72°С, 5 мин.
Химерный продукт ПЦР KAS2-KLA1 получали мeтодом ПЦР SOЕing следующим образом: получали ПЦР продукты с использованием праймеров KAS2-прямой и KAS2-KLA1-химера-обратный и KAS2-KLA1-химера-прямой и KLA1-обратный при описанных выше условиях. Затем проводили отжиг ПЦР-продуктов и заключительную ПЦР с использованием праймеров: KAS2-пpямoй и KLA1-обратный 94°С, 2 мин, затем 28 циклов при 94°С, 30 с; 50°С, 30 с и 72°С, 40 с, затем заключительный цикл при 72°С, 5 мин.
Для получения ПЦР-продукта KAS1-KsA1 проводили две последовательные ПЦР с использованием праймера KAS1-KsA1-обратный с каждым из праймеров KAS1-KsA1-прямой 1 и 2 по очереди (условия реакции: 94°С, 2 мин, затем 35 циклов при 94°С, 15 с; 63°С, 30 с и 72°С, 2 мин для получения ПЦР-продукта, KAS1-KsA1. Праймеры KAS1-KsA1-прямой и KAS1-KsA1-прямой1 и KAS1-KsA1-прямой2 на 3'-конце содержат последовательность, перекрывающуюся с b'-концом предыдущего ПЦР-продукта.
Для получения фрагмента мульти-KAS-KLA1 PCR проводили 4 последовательные ПЦР с использованием праймера мульти-обратный с каждым из праймеров: мульти-прямой 1, 2, 3 и 4 по очереди (условия реакции 95°С, 2 мин, затем 35 циклов при 95°С, 20 с; 68°С, 1.5 мин) для получения ПЦР-продукта мульти-KAS-KLAI. Каждый праймер мульти-прямой на 3'-конце содержит последовательность, перекрывающуюся с 5'-концом предыдущего ПЦР-продукта.
Все ПЦР-продукты, кодирующие KAS2, KLA1, KAS2-KLA1, KAS1-KsA1 и мульти-KAS-KLAI, очищали на колонках (Qiagen), проводили лигирование ТА вектор клонирования pGem-T Easy (Promega) и трансформировали Е. соli JM109 согласно инструкции производителя. Очищенные рекомбинантные конструкции pGemT-Easy обрабатывали Ncol и Xhol, клонировали в обработанную Ncol/Xhdl pET28b (Novagen) и трансформировали клетку-хозяина, в которой не происходит экспрессия, Е. coli, JM109 [DH5a]. Рекомбинантные конструкции рЕТ28 очищали и трансформировали клетку-хозяина, в которой происходит экспрессия, Е. соli, BL21 (DE3) [HMS174(DE3)] (Novagen) и проводили отбор на среде LB, содержащей 50 мкг/мл канамицина согласно инструкции производителя. Целостность каждой вставки подтверждали методом секвенирования.
Конструировали олигонуклеотидные праймеры (Таблица 4) со встроенными сайтами рестрикции, стоп-кодонами и гекса-His метками при необходимости. Конструировали праймеры, использованные для rKAS2, rKLA1 и 1-KAS2-KLA1, с ограничением включения г-белки инородных кодирующих последовательностей до не более трех аминокислот и гекса-His метки. rKAS1 и rKLA1 конструировали таким образом, чтобы они содержали гекса-His метку на N-конце и С-конце соответственно, чтобы их можно было напрямую сравнивать с rKAS2- KLA1, который содержит гекса-His метку на N-конце и С-конце. В rKAS1-KsA1 и KAS-KLA1 His-метки расположены на С-концах.
Таблица 4. Олигонуклеотидные праймеры, использованные для амплификации нуклеотидных последовайтельностей, кодирующих фрагменты гибриды Кgp А1 и AS
* номера последовательностей нуклеотидов (nt) последовательности гена лизин-специфичной цистеиновой протеиназы номер доступа U75366
Экспрессия и очистка рекомбинантных белков
С конструкций pET28:KLA1 (KAS2, KAS2-LA1, KAS1-SA1, мульти-KAS-KLA1) с помощью изопропил р-галактозидазы (IPTG) индуцировали экспрессию рекомбинантных белков. Все рекомбинантные белки вырабатывались в виде гибридных белков с меткой гекса-His, и их очищали в успениях денатурации с помощью системы очистки NI-NTA (Invitrogen). Вкратце, отдельные колонии трансформированных E.coli (DE3) инокулировали в 20 мл среды Лурия-Бертани (LB), содержащей 50 мкг/мл канамицина при 37°С в течение ночи при перемешивании на орбитальном шейкере. Затем указанным инокулятом инокулировали 1 л среды LB, содержащей 50 мкг/мл канамицина. После достижения культурой оптической плотности 5.0-7.0 при 600 нм (средняя-логарифмическая фаза роста) индуцировали экспрессию белка IPTG 0,1 мМ в течение 2 часов при температуре 37°С при перемешивании при 200 об/мин. Собирали клетки (7,5 г) и ресуспендировали их в денатурирующем связывающем буфере (8 М мочевины, 20 нМ фосфата натрия, рН 8.0, 500 мМ NaCl), клетки разрушали обработкой ультразвуком в режиме 3 × 15 с с интервалом 30 с с помощью клеточного дезинтегратора Branson Sonifer 250 (Branson Ultronics Corporation, Danbury, CT) с микроносиком на установке 3, затем центрифугировали при 39,000 g в течение 30 мин при 4°С. Рекомбинанатные белки очищали из супернатанта путем нанесения на преуравновешенную агарозную колонку Ni-NTA, после чего промывали денатурирующим буфером для отмывки (8 М мочевины, 20 нМ фосфата натрия, рН 6.0, 500 мМ NaCl) для элюaции не связавшихся белков. Затем колонку промывали 10 объемами связывающего буфера В и элюировали рекомбинантный белок денатурирующим буфером для элюaции (8 М мочевины, 20 нМ фосфата натрия, рН 6.0, 500 мМ NaCl, 0.5 М имидазола). Очищенный белок диализировали против 2М мочевины-PBS и хранили при -80°С.
Образцы рекомбинантных белков анализировали методом SDS-PAGE и определяли их молекулярные массы с помощью ProtParam (http://au.expasv.ora/tools/protparam.html). Концентрацию белков в образцах определяли методом Bio-Rad Protein Assay с использованием BSA (бычий сывороточный альбумин) в качестве стандарта.
Иммунизация и мышиная модель периодонтита.
Эксперименты с мышами проводили, как было описано ранее (3)? с одобрения комитета по этике экспериментов над животными Университета Мельбурна. 6-8 недельных мышей BALB/c (no 12 мышей в группе), содержавшихся в микроизоляторах, иммунизировали подкожно (s.c. 100 мкл) 50 мкг одного из рекомбинантных белков, комплексом RgpA-Kgp или 2×109 убитыми формалином клетками Р. gingivalis штамма W50 или PBS; каждый антиген эмульгировали в неполном адъюванте Фрейнда (IFA). Через 30 дней мышам проводили бустеоную, инъекцию антигена (подкожная инъекция, эмульгированный в IFA) и 12 дней спустя забирали кровь из ретробульбарного венозного сплетения. Через 4 дня после второй иммунизации мышам вводили канамицин (Sigma-Aldrich, New South Wales, Australia) в концентрации 1 мг/мл в неионизированной воде ad libitum в течение 7 дней. Через 3 дня после введения антибиотика (через 2 дня после кровопускания) мышам инокулировали перорально 4 раза через каждые 2 дня 1 × 1010 живых Р. gingivalis W50 (25 мкг) в буфере PG (50 мМ Tris-HCl, 150 мМ NaCl, 5 мМ CaCl2 и 5 мМ цистеин-HCl, рН 8.0), содержащем 2% (вес/объем) карбоксиметилцеллюлозы (CMC; Sigma- Aldrich, New South Wales, Australia), контрольной группе вводили только буфер PG, содержащий 2% (вес/объем) CMC. Инокулум готовили в анаэробной камере и затем сразу же вводили в десневой край моляров верхней челюсти. Две недели спустя мышам вводили дополнительные 4 дозы (через 2 дня 1 × 1010 живых клеток Р. gingivalis W50 (25 мкл) в буфере PG, содержащем 2% (вес/объем) CMC. Количество живых бактерий в каждом инокулуме проверяли с помощью посева на кровяной агар. Мышей кормили порошковым кормом (Barastock, Australia) и содержали в клетках с сетчатым дном для предотвращения опасности кровотечения. Через 4 недели после введения последней дозы мышам пускали кровь из ретробульбарного сплетения, мышей забивали, забирали верхнюю челюсть и делили ее на две части, одну половину (правую) использовали для измерения резорбции альвеолярной кости, а вторую половину (левую) использовали для постановки ПЦР в режиме реального времени.
Правые половины верхней челюсти кипятили в течение 1 минуты в деионизированной воде, механически очищали от плоти и погружали в 2% (вес/объем) гидроксид калия (16 часов, 25°С). Затем половину челюсти промывали (дважды деионизированной водой) и погружали в 3% (вес/объем) раствор перекиси водорода (6 часов, 25°С). После промывки половины челюсти (два раза деионизированной водой) ее окрашивали 0.1% (вес/объем) водным раствором метиленового синего и делали снимки буккальной стороны каждой половины челюстей с помощью камеры Olympus DP12, установленной на микроскопе для диссекции, с использованием программного обеспечения OLYSIA BioReport версия 3.2 (Olympus Australia Pty Ltd., New South Wales, Australia) для оценки горизонтальной резорбции костей. Горизонтальная резорбция костей происходит в горизонтальной плоскости, перпендикулярной гребню альвеолярной кости (АВС), что приводит к уменьшению высоты гребня. Каждую половину верхней челюсти выравнивали таким образом, что снимки молярных буквальных язычных бугорков каждого зуба накладывались, и на снимки наносили микрометрическую шкалу для того, чтобы измерения можно было стандартизировать для каждого снимка. Область от цементоэмалевого соединения до АВС каждого коренного зуба измеряли с использованием программного обеспечения OLYSIA BioReport версия 3.2. Измерения резорбции кости проводились в двух повторностях одним экспертом в условиях рандомизированного двойного слепого исследования.
Каждую, половит
Определение подклассов антител методом ELISA.
Для определения ответов подклассов антител сыворотки мышей проводили твердофазный иммуноферментный анализ (ELISA) в трех повторностях, нанося на лунки плоскодонного поливинилового микротитровального планшета (Dynatech Laboratories, McLean, VA) суспензию убитых формалином клеток Р. gingivalis W50 в фосфатно-солевом буфере (PBS) (0.01 М Na2HPO4, 1.5 мМ КН2РO4, 0.15 М NaCl), рН 7.0, содержащем 0.1% (объемные) Tween 20 (PBST) с концентрацией 5 мкг/мл. После удаления покрывающего раствора в лунки вносили PBST, содержащий 2% (масса/объем) сухого молока, для блокирования непокрытого пластика в течение часа при комнатной температуре. Лунки трижды промывали PBST и в каждую лунку добавляли серийные разведения сыворотки мыши в PBST, содержащем 0,5% (масса/объем) обезжиренного сухого молока (SK-PBST), и инкубировали в течение 16 часов при комнатной температуре. После этого лунки промывали шесть раз PBST, в SK-PBST добавляли разведения 1/2,000 IgG козы к IgM, IgA, IgG1, IgG2a, IgG2b или IgG3 мыши (Sigma, New South Wales, Australia), и оставляли связываться в течение 2 часов при комнатной температуре. Планшеты промывали шесть раз PBST и в каждую лунку добавляли разведения 1/5,000 конъюгата пероксидазы хрена с антителами кролика, специфичными к иммуноглобулинам (Sigma, New South Wales, Australia) в SK-PBST, и инкубировали планшеты в течение 1 часа при комнатной температуре. После того как лунки шесть раз промывали PBST связавшиеся антитела определяли, добавляя 100 мкл субстрата ABTS [0.9 мМ 2,2'-азино-бис(3-этилбенз-тиазолин-6) сульфоновой кислоты в 80 мМ лимонной кислоты, содержащей 0.005% (объемные) перекиси водорода, рН 4.0] в каждую лунку. Оптическую плотность определяли на считывателе микротитровальных планшетов (Bio-Rad microplate reader, model 450) при длине волны 415 нм.
Гель-электрофорез в полиакриамидном геле в присутствии додецилсульфата натрия SDS-PAGE и Вестерн-блоттинг.
Проводили анализ рекомбинантных белков (10 мкг) с использованием системы для электрофореза XCell surelock Mini-Cell. Рекомбинантные клетки смешивали с 20 мкл буфера для образцов (10% [масса/объем] SDS, 0.05% [масса/объем] бромфенолового синего, 25% [объемные] глицерина и 0.05% [объемные] 2- меркаптоэтанола). рН доводили до значения 8.0 1.5 М Tris-HCI и затем нагревали раствор в течение 5 мин при 100°С. Рекомбинантные белки (10 мкг/лунка) наносили на Novex 12% (масса/объем) готовые минигели с Tris-глицином, и проводили электрофорез при силе тока 30-50 мА и разности потенциалов 125 V с использованием системы электрофореза Nоvех (Nоvех, San Diego, CA). Белки визуализировали с помощью 0.25% (масса/объем) красителя Кумасси синего R250.
Анализ эпитопов последовательности пептидов активного сайта Кдр-протеиназы (KAS-2).
Определяли сайты связывания антител пептидов активного сайта Lys-специфичной протеиназы KAS2 (433-468 SEQ ID No: 28) с помощью синтеза биотинилированных на М-конце перекрывающихся пептидов, состоящих из 8 остатков (отступ на 1, перекрывание по 7 остаткам) на мультистержневой системы синтеза пептидов (Chiron Technologies, Melbourne, Australia) с использованием стандартного протокола твердофазного синтеза Биотинилированные пептиды (мкг/мл) в 0.1 M PBS. рН 7.4 наносили на покрытые стрептавидином планшеты в течение ночи при 4°С (Nunc, NSW Australia). После этого лунки планшетов промывали 4 раза PBST и проводили картирование эпитопов пептидов, связавшихся с планшетом, методом анализа ELISA согласно инструкциям изготовителя Chiron Technologies с использованием сывороток мышей в разведении 1:1000 в 1% w/v обезжиренном сухом молоке в 0.1 М PBS, рН 7.4, содержащем 0.1% v/v Tween 20 (SK-PBST). После этого лунки промывали 6 раз PBST, добавляли разведения 1/2,000 IgG козы против IgG мыши (Sigma, New South Wales, Australia) в SK-PBST и оставляли в течение 2 часов при комнатной температуре. Планшеты промывали 6 раз PBST и в каждую лунку вносили разведения 1/5,000 конъюгата пероксидазы хрена с антителами кролика специфичными к иммуноглобулинам козы (Sigma, New South Wales, Australia) в SK PBST и инкубировали в течение 1 часа при комнатной температуре. После этого лунки планшета промывали 6 раз PBST, связавшиеся антитела определяли добавлением в каждую лунку по 100 мкл субстрата ABTS [0.9 мМ 2,2'-2,2'-азинобис(3-этилбензотиазолин 6) сульфоновая кислота в 80 мМ лимонной кислоты, содержащей 0.005% (объемные) перекиси водорода, рН 4.0]. Оптическую плотность при длине волны 415 нм определяли на ридере микротитровальных планшетов (Bio-Rad ридер микротитровальных планшетов, модель 450).
Статистический анализ. Данные резорбции костей обрабатывали с помощью однофакторного дисперсионного анализа (ANOVA) и Т3 теста Даннета (SPSS для Windows, версия 12). Титры антител подклассов IgA, IgM, и IgG статистически обрабатывали c иcпoльзoвaниeм t-кpитеpия Стьюдeнтa c помощью программного обеспечения SPSS (SPSS для Windows, версия 12).
Пример 2
Характеристика и очистка рекомбинантных белков (KsA1, KLA1, KAS1-KsA1 и KAS2-KLA1).
Для описания защитной способности фрагментов домена адгезина А1 Кдр и химерной конструкции Кgp-протеиназы и фрагментов домена адгезина А1 Кдр в отношении инфекции Р. gingivalis, получали и очищали рекомбинантные белки: KsA1 KLA1, KAS1-KSA1 и KAS2-KLA1. Рекомбинантные белки (КsА1 и КLA1) и рекомбинантные химерные белки (KAS1-KsA1 и KAS2-KLA1) очищали от телец включения методом Ni-хелатной аффинной хроматографии и очищенные белки анализировали с помощью SDS-PAGE (Фигура 1). Каждый очищенный рекомбинантный белок состоял из одной мажорной полосы белка с молекулярной массой 40, 36, 31 и 32 kDa, что соответствовало KAS2-KLA1, KLA1, KsA1 и KAS1-KsA1, и данные молекулярные массы соответствовали молекулярным массам рекомбинантных белков с His-меткой, определенным с помощью программы ProtParam. Для описания иммуногенности рекомбинантных белков, KsA1, KLA1, KAS1-KsA1 и KAS2-KLA1 использовали для иммунизации мышей, полученные сыворотки использовали в анализе с планшетами, покрытыми пептидом KAS2 и планшетами, покрытыми убитыми формалином клетками Р. gingivalis (Фигура 2). По результатам анализа оказалось, что сыворотка с рекомбинантными химерными белками KAS1-KsA1 и KAS2-KLA1 распознавала пептид KAS2 (Фигура 2А) на том же уровне, что и сыворотка, специфичная к KAS2 (конъюгат KAS2-дифтерийный токсин), а также убитые формалином клетки Р. gingivalis W60 (Фигура 2В). Однако сыворотка против рекомбинантного белка KLA1 распознавала только убитые формалином клетки Р. gingivalis W50 (Фигура 2В).
Пример 3
Влияние иммунизации рекомбинантными белками (KsA1, KLA1, KAS1-KsA1 и KAS2-KLA1) на резорбцию альвеолярной кости, вызванную P. gingivalis, на мышиной модели периодонтита.
Рекомбинантные белки KsA1, KLA1, KAS1-KsA1 и KAS2- KLA1, убитые формалином Р. gingivalis штамм W50 и комплекс RgpA-Kgp применяли для определения и сравнения степени защиты от резорбции альвеолярной кости, вызванной Р. gingivalis, с использованием измененной мышиной модели разрушения костей периодонта, предложенной Baker et al. (4). Мышей иммунизировали (в 0 день и на 30 день) рекомбинантными белками KsA1, KLA1, KAS1-KsA1 или KAS2-KLA1, RgpA-Kgp комплексом или убитыми формалином клетками Р. gingivalis штамма W50 (FK-VV50) или только адьютантом РВS мышам перорально вводили живые клетки Р. gingivalis W50. Иммунизация всеми указанными рекомбинантными антигенами, комплексом RgpA-Kgp и клетками FK-W50 защищала мышей BALB/c от резорбции альвеолярной кости, вызванной инфекцией Р. gingivalis, так как у указанных животных наблюдалась значительно (р<0.001) меньшая резорбция костей по сравнению с мышами из группы, иммунизированной PBS (Фигура 3). Однако у мышей, иммунизированных KAS2-KLA1, происходила меньшая резорбция костей, чем у мышей, иммунизированных KLA1 (р<0.01); KsA1 (р<0.001), комплексом RgpA-Kgp (р<0.001), клетками FK-W50 (р<0.001) и мышей, которым ничего не вводили (р<0.001). Отсутствовало значительное различие степени кости между мышами, иммунизированными KAS2-KLA1, и мышами, иммунизированными КАS1-КsA1. Более того у мышей, иммунизированных KAS1-KsA1, наблюдали значительно меньшую резорбцию костей по сравнению с мышами, которым ничего не вводили (р<0.01), и мышами, иммунизированными комплексом RgpA-Kgp (р<0.05), оно не отличалось от резорбции костей у мышей, иммунизированных KsA1, KLA1; комплексом RgpA-Kgp и FK-W50.
Пример 4
Ответы подклассов антител на иммунизацию рекомбинантными белками (KsA1, KLA1, KAS1-KsA1 и KAS2-KLA1) на мышиных моделях периодонтита.
До и после перорального введения живых клеток P. gingivalis машам пускали кровь и получали сыворотку крови с помощью центрифугирования. На Фигуре 4 показана реактивность подклассов антител по отношению к убитым формалином клеткам Р. gingivalis W50 для каждого иммуногена (KsA1, KLA1, KAS1-KsA1 или KAS2-KLA1 или убитым формалином клеткам Р. gingivalis штамма W50 (FK-W50)) на мышиной модели периодонтита. Все защитные иммуногены вызывали образование высокого титра антител IgG на FK-W50. Более того, каждый защитный антиген вызывал образование преимущественно антител подкласса lgG1, слабое образование антител lgG2a, lgG2b и lgG3, FK-50- специфичных антител (Фигура 4). Как до инокуляции (Фигура 4А), так и после инокуляции (Фигура 4 В) каждый иммуноген вызывал образование преимущественно антител подкласса lgG1.
Пример 5
Картирование эпитопов KAS2 (433-468).
Синтезировали биотинилированные перекрывающиеся пептиды, состоящие из 8 остатков (отступ на 1, перекрывание по 7 остаткам), для KAS2 (433-468) и их наносили на планшеты, покрытые стрептавидином. Затем определяли эпитопы, связывающие антитело, с использованием сыворотки мышей, иммунизированных KAS1-KsA1, KAS2-KLA1 и конъюгатом KAS2- дифтерийный токсин (Фигура 5). Двукратное увеличение оптической плотности (415 нм) по сравнению с фоном считали положительным ответом антитела (пороговая OD). Сыворотка распознавала следующие последовательности пептидов, полученные из SEQ ID No.28, а именно KAS1-KsA1, распознавал пептиды 435-442, 436-443, 445-452, 446-453 и 447-454 (пороговая OD=0.07, Фигура 5А) тогда, как KAS2 - KLA1 распознавал пептиды 435-442, 447-454 и 448-455 (пороговая] OD=0.07, Фигура 5А). Это позволяет предположить, что происходило распознование наименьшего количества эпитопов, а именно пептида 436-442 (VSFANYT и его вариант VGFANYT), пептида 447-452 (ETAWAD и его вариант ETSWAD) и пептида 448-453 (TAWADP и его вариант TSWADP). Пептиды, которые содержат эпитоп пептидов 436-442, включают GVSFANYT, GVGFANYT, VSFANYTA и VGFANYTA. Пептиды, которые содержат эпитопы пептидов 447-452 и/или 44&-453, включают SETAWAD, SETSWAD, ETAWADP, ETSWADP, TAWADPL и TSWADPL, в частности GSETAWAD, GSETSWAD, SETAWADP, SETSWADP, ETAWADPL, ETSWADPL, TAWADPLL и TSWADPLL.
Пример 6
Синтез пептидов KAS и RAS для конъюгации с белком
Пептиды синтезировали ручным способом или с использованием микроволновой системой синтеза пептидов СЕМ Microwave. При этом использовали стандартный протокол твердофазного синтеза пептидов Fmoc. Пептиды синтезировали в форме карбоксамида с использованием смолы Rink-AM-SURE (ААРРТЕС, KY, USA). Соединение выполняли с активацией HBTU/HOBt с использованием 4 экв. Fmoc-аминокислоты и 6 экв. DIPEA. Fmoc группу удаляли 20% пиперидином в 1М HOBVDMF.
Смолы, несущие пептиды KAS и RAS, разбухали в DMF и М-концевые группы Fmoc удаляли 2% v/v DBU в DMF, содержащем 2% v/v пиперидина. Затем N-концевую аминогруппу получали с помощью группы S-ацетилмеркаптоуксусной кислоты (ЗАМА) с использованием 5 экв. SAMA-OPfp и 5 экв. НОВt. За реакцией наблюдали с помощью анализа тринитробензол сульфоновой кислоты (TNМВSА). При получении отрицательной реакции на TNBSA смолу промывали (5 × DMF, 3 × DCM и 3 × диэтиловый эфир). Затем смолу высушивали под вакуумом. Отделение пептидов от смолы проводили с использованием смеси для расщепления FА:фенол:ТIРS:EDT:вода (92:2:2:2:2) в течение 2.5 ч в зависимости от содержания аргинина в пептиде. После расщепления смолу удаляли фильтрацией, и фильтрат концентрировали до объема приблизительно 1 мл в струе азота. После осаждения пептидных продуктов в ледяном эфире их центрифугировали и промывали три раза. Осадки с пептидами растворяли в 5-10 мл воды, содержащей 0.1% v/v TFA и нерастворимые остатки удаляли центрифугированием. Пептиды очищали с помощью обращенно-фазовой высокоэффективной жидкостной хроматографии (RP-HPLC) химические группы можно использовать для получения производных пептида для конъюгации с белками, они внесут реактивные группы такие группы, как галидные группы (бром, хлор, иод), малеимид, сукцинимидил, гидразин, оксим, тиол, которые затем могли использовать для соединения полученных производных пептида с белком таким, как КgpА1 через его природные остатки цистеина, или получали его производное, добавляя комплементарную реактивную группу, которая способствует механическому лигированию для образования конъюгата пептид-белок.
Конъюгация пептидов SAMA с КА1. В раствор, содержащий 10 мкг/мл рекомбинантного КА1 или другого домена адгезина комплекса RgpA-Kgp в фосфатно-солевом буфере (0.1М фосфат натрия, 0.9% NaCl, pH 7.4), добавляли 0.1 мл 1% w/v раствора эфира m-малеимид бензоил-М-гидроксисукцинимид (MBS) в DMF. Через 30 мин удаляли не вступивший в реакцию MBS и собирали модифицированный MBS КА1 с помощью гель-фильтрации с использованием колонки PD10 (Pharmacia, NSW, Australia), уравновешенной буфером для конъюгации (0.1М фосфат натрия, 5 мМ EDTA; pH 6.0). Очищенный SAMA-пептид (1.3 мМ) растворяли в 200 мл 6М гуанидин HCl, содержащем 0.5 М Tris; 2 мМ EDTA, рН 6.0 и растворяли в 800 мкл воды MilliQ, снимали защитную группу in-situ посредством добавления 25 мкл 2М NH2ОH (40 экв), растворенного в воде MilliQ. Собранный MBS-KA1 сразу же вводили в реакцию с лишенным защиты SAMA-пептидом и перемешивали в течение 1 часа при комнатной температуре. Конъюгат пептида-КА1 отделяли от не прореагировавшего пептида с помощью гель-фильтрации с использованием PDIO колонки, уравновешенной IPBS pH 7.4 и лиофилизировали. Реакцию контролировали с использованием анализа Эллмана.
Пример 7
Получение антител
Поликлональную сыворотку на рекомбинантные белки получали с помощью подкожной иммунизации мышей белками. Мышей иммунизировали в первый день 25 мкг белка в неполном адъюванте Фрейнда и на 30 день 25 мкг белка в неполном адъюванте Фрейнда. Иммунизацию проводили с использованием стандартных процедур. Получали поликлональную сыворотку, имеющую высокий титр против белков. При необходимости получали моноклональные антитела, направленные против определенных рекомбинантных белков с использованием стандартных методик.
Пример 8
Иммунизация для образования антител.
6-8-недельных мышей BALB/c или CD1 (аутбредные мыши породы Swiss) по 10 мышей в группе иммунизировали подкожно (s.c. 100 мкл) 50 мкг химерной конструкции KAS2-LA1 или антигеном, эмульгированном в неполном адъюванте Фрейнда (IFA). Через 30 дней мышам вводили антиген (s.c. инъекция, эмульгированная в IFA) и через 12 дней мышей забивали и проводили забор крови для получения сыворотки.
Определение подклассов антитела методом анализа ELISA. Для определения ответов подклассов антител сыворотки мышей проводили твердофазный иммуноферментный анализ (ELISA) в трех повторностях с использованием 5 мкг/мл раствора химерной конструкции KAS2-LA1 или убитых формалином клеток Р. gingivalis W50 или комплекса RgpA-Kgp в фосфатно-солевом буфере (PBS) (0.01 М Na2HPО4, 1.5 мМ KH2PО4, 0.15 М NaCl), рН 7.0, содержащем 0.1% (объемные) Tween 20 (PBST), которое наносили, на лунки плоскодонных поливиниловых микротитровальных планшетов (Dynatech Laboratories, McLean, VA). После удаления указанного буфера для сорбции в лунки добавляли PBST, содержащий 2% (масса/объем) сухого обезжиренного молока для блокирования непокрытого пластика в течение 1 ч при комнатной температуре. После этого лунки промывали 2 раза PBST, в каждую лунку добавляли серийные разведения сыворотки крови мыши в PBST, содержащего 0.5% (масса/объем) обезжиренного молока (SK-PBST) и инкубировали в течение 16 чв при комнатной температуре. После этого лунки промывали 6 раз PBST, в SK-PBST добавляли разведения 1/2,000 IgG козы к IgM IgA, lgG1, lgG2a, lgG2b, или lgG3 мыши (Sigma, New South Wales, Australia) и оставляли связываться течение 2 часов при комнатной температуре. Планшеты промывали 6 раз PBST, лунки вносили разведения 1/5,000 конъюгата пероксидазы хрена с антителами кролика специфичными к иммуноглобулинам козы (Sigma, New South Wales, Australia) в SK-PBST и инкубировали в течение 1 часа при комнатной температуре. После этого лунки промывали 6 раз PBST, связавшиеся антитела определяли, добавляя в каждую лунку по 100 мкл субстрата ABTS [0.9 мМ 2,2'-2,2'-азинобис(3-этилбензотиазолин-6) сульфонатовая кислота в 80 мМ лимонной кислоты, содержащей 0.005% (объемные) перекиси водорода, рН 4.0]. Оптическую плотность при длине волны 415 нм измеряли с помощью считывателя микротитровальных планшетов (Bio-Rad ридер микротитровальных планшетов, модель 450).
Ответы подклассов антител, вызванный иммунизацией рекомбинантным белком KAS2-KLA1 аутбредных мышей (CD1, Swiss).
Мышей CD1 (Swiss) иммунизировали KAS2-LA1, пускали им кровь и получали сыворотку методом центрифугирования. На Фигуре 6 показана реактивность подклассов антител на химерную конструкцию KAS2-LA1, убитые формалином клетки Р. gingivalis W50 и комплекс RgpA-Kgp. Белок KAS2-LA1 вызывал выработку антител IgG с доминированием lgG1, которые распознавали белок KAS2-LA1 и перекрестно взаимодействовали с убитыми формалином клетками Р. gingivalis W50 и комплексом RgpA-Kgp (Фигура 6). Более того, белок KAS2-LA1 вызывал образование только слабо иммунореактивных, lgG2a, lgG2 и lgG3 антиген-специфичных антител (Фигура 6).
Пример 9
Создание структурной модели Кgp и определение поверхностно доступных последовательностей активного сайта.
Данная работа показала, что пептиды активного сайта Кgp-протеиназы являются высоко иммуногенными и создают защиту на высоком уровне от резорбции кости, вызванной инфекцией Р. gingivalis. Для определения дополнительных пептидов активного сайта протеиназы, которые могут использоваться в вакцине, разработали модель каталитического домена Кgp с использованием набора программ Orchestrar Sybyl7.3 (Фигур 7). Данная модель основана на PDB структуре 1crv RgpB протеазы Р. gingivalis, указанные белки обладают 23,58% парной идентичностью и Z-показатель равен 25.09 (высоко достоверная модель). При использовании мета веб сервера Meta-PPisp для определения взаимодействия белков предположили существование двух поверхностей с белок-белковыми взаимодействиями в Кgp: поверхность для связывания субстрата (как в RgpB) и вторая поверхность, свойственная Кgp. Главные различия между моделями RgpB и Кgp заключаются в петлях, которые ограничивают вторую взаимодействующую поверхность, и промежуток из 19 остатков (Val526 - Phe545), который невозможно смоделировать в Кgp, который попадает в пределы второй поверхности взаимодействия. На Фигуре 7 изображена i модель Кgp, на которой толстые ленты обозначают поверхностно доступные последовательности, окружающие активный сайт Кgp, оказалось, что поверхностно доступные поверхности представляют собой Asp388-Gln394, Leu421-Ala423, Ala443- Glu447 с Ala451, Asn510-Trp513 и lle570-Gly577 with Tyr580. Исходя из модели (Фигура 6) очевидно, что наряду с KAS2 (А), выделяются три другие j последовательности KAS4 (Asp388- Val395) (В), KAS5 (Asn510-Asp516) (С) и KAS6 (Ile570-Tyr580) (D), также они имеют достаточную длину для того, чтобы стать мишенью вакцины. Таким образом, можно получить рекомбинантный химерный белок, который содержит каждый из указанных пептидов, и можно соединить его 6 N-концом KLA1 для получения мультиКА3-KLAI, который можно применять для стимулирования иммунного ответа и благодаря этому защищать от состояний или заболеваний, вызываемых инфекцией Р. gingivalis.
Пример 10
Процесс моделирования Аgp-Х-протеиназы для обнаружения иммуногенных участков, расположенных с обеих сторон от каталитического сайта.
Трехмерную структуру Аgp-Х-протеиназы определяли согласно Eichinger A, Beisel HG, Jacob U, Huber R, Medrano FJ, Banbula A, Potempa J, Travis J, Bode W. Crystal structure of gingipain R: an Arg-specific bacterial cysteine proteinasewith a caspase-like fold. EMBO J. 1999 Oct 15; 18(20):5453-62.
Пример 11
Ниже приведен пример состава в виде зубной пасты, содержащего антитела
Пример 12
Ниже приведен пример состава в виде зубной пасты.
Пример 13
Ниже приведен пример состава в виде зубной пасты.
Пример 14
Ниже приведен пример состава в виде зубной пасты.
Пример 15
Ниже приведен пример жидкого состава в виде зубной пасты.
Пример 16
Ниже приведен пример состава в виде ополаскивателя для полости рта
Пример 17
Ниже приведен пример состава в виде ополаскивателя для полости рта.
Пример 18
Ниже приведен пример состава в виде леденцов.
Пример 19
Ниже приведен пример состава в виде массажного крема для десен.
Пример 20
Ниже приведен пример состава в виде жевательной резинки.
Пример 21
Ниже приведен пример фармацевтического состава.
Пример 22
Ниже приведен пример состава в виде периодонтального геля.
Следует понимать, что несмотря на то, что настоящее изобретение описано в деталях, примеры приведены исключительно в целях иллюстрации. Другие модификации вариантов реализации настоящего изобретения, которые очевидны специалисту в области молекулярной биологии, стоматологической диагностики и родственных дисциплин, находятся в рамках настоящего изобретения.
Список литературы
1. МсКее A.S., A.S. McDermid A. Baskerville А.В. Dowsett D.С. Eliwood and P.D.Marsh. 1986. Effect of hemin on the physiology and virulence of Bacteroides gingivalis W50. Infect. Immun. 52:349-355.
2. Slots J. 1982. Importance of black-pigmented Bacteroides in human periodontal disease. Host parasite interactions in periodontal diseases. American Society for Microbiology.
3. O'Brien-Simpson N. M., R. Pathirana R. A. Paolini Y.-Y. Chen P.D. Veith T. V., R.N. Pike, N. Alley and E.C. Reynolds. 2005. An immiune response directed to proteinase and adhesin functional epitopes protects against Porphyromonas gingivalis-induced bone loss. Journal of Immunology 175:3980-3989.
4. Baker P.J., R.T. Evans and D.C. Roopenian. 1994. Oral infection with Porphyromonas gingivalis and induced alveolar bone loss in immunocompetent and severe combined immunodeficient mice. Arch Oral Вiоl 39:1035-1040.
Реферат
Изобретение относится к области биохимии, в частности к химерным или гибридным белкам для индуцирования иммунного ответа против Р. gingivalis. Раскрыта композиция для индуцирования иммунного ответа против Р. gingivalis, содержащая эффективное количество одного из вышеуказанных химерных или гибридных белков, способ профилактики состояния или заболевания, связанного с Р. Gingivalis, и способ снижения частоты или тяжести состояния или заболевания, связанного с Р. gingivalis с их использованием. Также раскрыто применение вышеуказанных химерных или гибридных белков для определения антител к Р. gingivalis в биологическом образце. Изобретение позволяет эффективно индуцировать иммунный ответ против Р. gingivalis. 7 н. и 9 з.п. ф-лы, 7 ил., 4 табл., 22 пр.
Формула
(а) указанный первый пептид характеризуется участком трипсиноподобного фермента Р. gingivalis, выбранным из группы, состоящей из SEQ ID NOs:1, 2, 27-34 и последовательностей, которые являются по меньшей мере на 90% идентичными указанным последовательностям;
(б) указанный второй полипептид характеризуется адгезиновым доменом Р. gingivalis или фрагментом указанного домена, выбранным из группы, состоящей из:
(i)SEQ ID NOs:35-37 и последовательностей, которые являются по меньшей мере на 90% идентичными указанным последовательностям;
(ii)SEQ ID NOs:38, 39, 46, 81 и 82,
причем указанный участок трипсиноподобного фермента Р. gingivalis и указанный адгезиновый домен Р. gingivalis или его фрагмент способны индуцировать иммунный ответ против Р. gingivalis.
(а) указанный первый пептид выбран из группы, состоящей из SEQ ID NOs:1, 2, 27-34 и последовательностей, которые являются по меньшей мере на 90% идентичными указанным последовательностям;
(б) указанный второй пептид выбран из группы, состоящей из SEQ ID NOs:71, 78, 79, 83, 84, 85 и последовательностей, которые являются по меньшей мере на 90% идентичными указанным последовательностям,
причем указанные первый и второй пептиды способны индуцировать иммунный ответ против Р. gingivalis.
(i) последовательностей SEQ ID NOS:35-37 или последовательностей, которые являются по меньшей мере на 90% идентичными указанным последовательностям, и
(ii) последовательностей SEQ ID NOS:38, 39, 46, 81 и 82, при этом указанный участок трипсиноподобного фермента Р. gingivalis и указанный адгезиновый домен Р. gingivalis или его фрагмент способны индуцировать иммунный ответ против Р. gingivalis.

Комментарии