Антитело, специфически связывающееся с muc1, и его применение - RU2746413C1
Код документа: RU2746413C1
Чертежи



























Описание
Область техники
Настоящее изобретение относится к анти-MUC1 антителу, специфически связывающемуся с муцином 1 (MUC1), и его применению, и конкретнее, к анти-MUC1 антителу или его антигенсвязывающему фрагменту, конъюгату антитело-лекарство или биспецифическому антителу, включающему антитело или его антигенсвязывающий фрагмент, фармацевтической композиции для профилактики или лечения рака, включающей указанное, нуклеиновой кислоте, кодирующей антитело или его антигенсвязывающий фрагмент, вектору и клетке-хозяину, включающим указанную нуклеиновую кислоту, и способу получения анти-MUC1 антитела или его антигенсвязывающего фрагмента с использованием указанного.
Уровень техники
Муцин 1 (MUC1) представляет собой трансмембранный гликопротеин, включающий ряд гликозилированных внеклеточных доменов. MUC1 имеет длину 200-500 нм на клеточной поверхности и локализуется в апикальной мембране здоровых эпителиальных клеток. MUC1 экспрессируется в линейных или люминальных эпителиальных клетках ряда органов, таких как молочные железы, желудок, пищевод, поджелудочная железа, матка, легкие, почки и желчный пузырь. В здоровых тканях отрицательно заряженные углеводы MUC1 образуют физические барьеры для защиты базального эпителия от дегидратации, изменений рН, пыльцы и микроорганизмов.
Ген MUC1 кодирует один транскрипт. После трансляции MUC1 саморасщепляется в мотивах GSVV, расположенных в домене SEA (белок энтерокиназы спермы морского ежа и домен агрин). Они состоят из двух пептидных фрагментов, т.е. N-концевой субъединицы (MUC1-N) и С-концевой субъединицы (MUC1-С).
N-концевая субъединица MUC1-N имеет переменное число тандемных повторов и состоит из доменов PTS (обогащенных пролином/треонином/серином) и доменов SEA. С-концевая субъединица MUC1-С состоит из 58-аминокислотных внеклеточных доменов (ECD), 28 трансмембранных доменов (TMD) и 72-аминокислотных цитоплазматических доменов (CD). MUC1 вызывает обильное О-соединенное гликозилирование во внеклеточном домене. В зависимости от степени N-гликозилирования, MUC1-С имеет размер 23-25 кДа и является 17-кДа, когда N-гликозилирование недостаточное. Как только MUC1 продуцируется, часть, связывающаяся с клетками, и часть, которая высвобождается из клеток, связаны через нековалентное взаимодействие. В этом случае расщепление вызывается ферментом, называемым «шеддаза». Комплекс MUC1 выделяется при стимуляции цитокинов, таких как INF-γ и TNF-α. MUC1-N высвобождается ферментами, включая TNF-альфа-конвертирующий фермент (ТАСЕ) и матриксную металлопротеазу (ММР). Эти ферменты расщепляют ECD MUC1-С на два фрагмента. Когда развивается рак, внеклеточный фрагмент выделяется из раковых клеток и плавает в крови организма, в то время как связанный с клеткой фрагмент постоянно остается связанным с раковыми клетками. MUC1 важен для роста раковых клеток, поскольку он играет критическую роль в пролиферации раковых клеток, посылая непрерывно сигнал клеточной пролиферации через связь с белками клеточной мембраны, которые ассоциируются с пролиферацией раковых клеток и присутствуют в других раковых клетках. Кроме того, этот фрагмент разделяет ту же судьбу, что и раковые клетки, до тех пор, пока раковые клетки растут и ликвидируются, действуя, таким образом, как хорошая мишень для детекции рака и как критический биомаркер удаления рака. Кроме того, в отличие от других частей MUC1, известно, что этот фрагмент является единственной частью, которая не гликозилирована, и рассматривается как отличительная часть, которая отличает MUC1 раковых клеток от MUC1 здоровых клеток. Соответственно, авторы настоящего изобретения разработали антитело по настоящему изобретению, основываясь на мнении, что этот фрагмент, который связывается с клетками MUC1 и разделяет участь рака и может отличать MUC1 здоровых клеток от MUC1 раковых клеток, способен служить в качестве оптимального антигена для антитела.
Между тем, получают конъюгат антитело-лекарство (АЛК) путем связывания цитотоксического лекарственного средства с антителом через линкер. Так как моноклональное антитело имеет мишень-специфические свойства, лекарственное средство в конъюгате антитело-лекарство может быть доставлено к опухоли, экспрессирующей антиген/мишень, которые распознаются моноклональным антителом, имеющим селективную нацеливанную способность. Превосходно, что конъюгат антитело-лекарство, который после введения принимает в крови форму пролекарства, может быть нетоксичным, и что, когда антитело связывается с мишенью антигеном опухоли и затем интернализуется в раковую клетку, лекарство высвобождается в активной форме и убивает раковую клетку.
Наиболее важным ключевым моментом для получения конъюгатов антитело-лекарство является определение мишени/антигена, с которыми связывается антитело. В частности, считается, что мишень/антиген, с которыми связывается антитело, является белком клеточной поверхности, который преимущественно экспрессируется в опухолевых клетках и превосходно экспрессируется (сверхэкспрессируется) специфически для раковых клеток.
При таком уровне техники авторы настоящего изобретения разработали антитело, специфически связывающееся с MUC1 раковых клеток, которое узнает часть, отличающуюся от MUC1, экспрессированного в здоровых клетках, и обнаружено, что анти-MUC1 антитело, связывающееся с «частью, связанной с клеткой», которое связывается с раковыми клетками и таким образом разделяет участь раковых клеток, основано на характеристиках АЛК для максимизации эффективности АЛК, и конъюгат антитело-лекарство, включающий его, способен специфически связываться с экспрессирующими MUC1 клетками и таким образом лечить заболевания, вызванные экспрессией MUC1. На основании этого заключения осуществлено настоящее изобретение.
Приведенная выше информация, раскрытая в этом разделе «Уровень техники», предлагается только для лучшего понимания предпосылок для настоящего изобретения и поэтому может не содержать сведений, которые формируют уровень техники, который уже известен специалистам в данной области, к которой относится настоящее изобретение.
Раскрытие
Техническая проблема
Целью настоящего изобретения является предоставление антитела или его антигенсвязывающего фрагмента, специфически связывающихся с частью MUC1, «связанной с клеткой», конъюгата антитело-лекарство, в котором лекарственное средство связано с антителом или его антигенсвязывающим фрагментом, и биспецифического антитела, включающего антитело или его антигенсвязывающий фрагмент.
Другой целью настоящего изобретения является гибридома (KCLRFBP 00395) для продуцирования анти-MUC1 антитела.
Еще одной целью настоящего изобретения является композиция для профилактики или лечения рака, включающая анти-MUC1 антитело или его антигенсвязывающий фрагмент, конъюгат антитело-лекарство или биспецифическое антитело, и способ лечения рака с ее использованием.
Еще одной целью настоящего изобретения является композиция для диагностики рака, включающая анти-MUC1 антитело или его антигенсвязывающий фрагмент, конъюгат антитело-лекарство или биспецифическое антитело, и способ диагностики рака с ее использованием.
Еще одной целью настоящего изобретения является иммуногенная композиция, включающая комплекс, в котором концевой участок MUC1, домен SEA MUC1 или С-концевой внеклеточный домен MUC1 и CpG-ДНК инкапсулирваны в липосоме.
Еще одной целью настоящего изобретения является способ получения анти-MUC1 моноклонального антитела, включающий инокуляцию мыши иммуногенной композицией.
Еще одной целью настоящего изобретения является нуклеиновая кислота, кодирующая анти-MUC1 антитело или его антигенсвязывающий фрагмент, вектор и клетка-хозяин, включающая нуклеиновую кислоту, и способ получения анти-MUC1 антитела или его антигенсвязывающего фрагмента с их использованием.
Техническое решение
Для достижения указанных выше целей настоящее изобретение предоставляет анти-MUC1 антитело или его антигенсвязывающий фрагмент, узнающие полипептид, включающий по меньшей мере пять последовательных аминокислот в С-концевом внеклеточном домене MUC1.
Предпочтительно анти-MUC1 антитело или его антигенсвязывающий фрагмент включает шесть определяющих комплементарность участков (CDR), причем антитело или его антигенсвязывающий фрагмент включает по меньшей мере одну последовательность, выбранную из группы, включающей CDR1 тяжелой цепи SEQ ID NO: 1 (GYTFTSYWMH); CDR2 тяжелой цепи SEQ ID NO: 2 (YINPGTGYIEYNQKFKD); CDR3 тяжелой цепи SEQ ID NO: 3 (STAPFDY); CDR1 легкой цепи SEQ ID NO: 4 (KASQDIKSYLS); CDR2 легкой цепи SEQ ID NO: 5 (YATRLAD) и CDR3 легкой цепи SEQ ID NO: 6 (LQYDESPYT).
Настоящее изобретение также относится к гибридоме (KCLRFBP 00395) для продуцирования анти-MUC1 антитела.
Настоящее изобретение также относится к конъюгату антитело-лекарство или биспецифическому антителу, включающему анти-MUC1 антитело или его антигенсвязывающий фрагмент.
Настоящее изобретение также относится к фармацевтической композиции для профилактики или лечения рака, включающей анти-MUC1 антитело или его антигенсвязывающий фрагмент, конъюгат антитело-лекарство или биспецифическое антитело, и способу лечения рака с ее использованием.
Настоящее изобретение также относится к применению анти-MUC1 антитела или его антигенсвязывающего фрагмента для профилактики или лечения рака.
Настоящее изобретение также относится к применению анти-MUC1 антитела или его антигенсвязывающего фрагмента для получения профилактического или терапевтического средства против рака.
Настоящее изобретение также относится к композиции для диагностики рака, включающей анти-MUC1 антитело или его антигенсвязывающий фрагмент, и способу диагностики рака с ее использованием.
Настоящее изобретение также относится к иммуногенной композиции, включающей (1) С-концевой участок MUC1, SEA домен MUC1 или С-концевой внеклеточный домен MUC1 и (2) CpG-ДНК, инкапсулированные в липосоме, и способу получения анти-MUC1 моноклонального антитела, включающему инокуляцию мыши иммуногенной композиции.
Настоящее изобретение также относится к нуклеиновой кислоте, кодирующей анти-MUC1 антитело или его антигенсвязывающий фрагмент, вектору и клетке-хозяину, включающим указанную нуклеиновую кислоту, и способу получения анти-MUC1 антитела или его антигенсвязывающего фрагмента с их использованием.
Описание чертежей
Фиг. 1а представляет собой график, показывающий общее количество IgG у мыши, иммунизированной белком rhMUC1-C.
Фиг. 1b и 1с показывают результаты скрининга гибридомных клеток, выделенных из иммунизированной мыши, конкретнее, фиг. 1b показывает результат скрининга с использованием среды НАТ, и фиг. 1с показывает результат скрининга с использованием среды НТ.
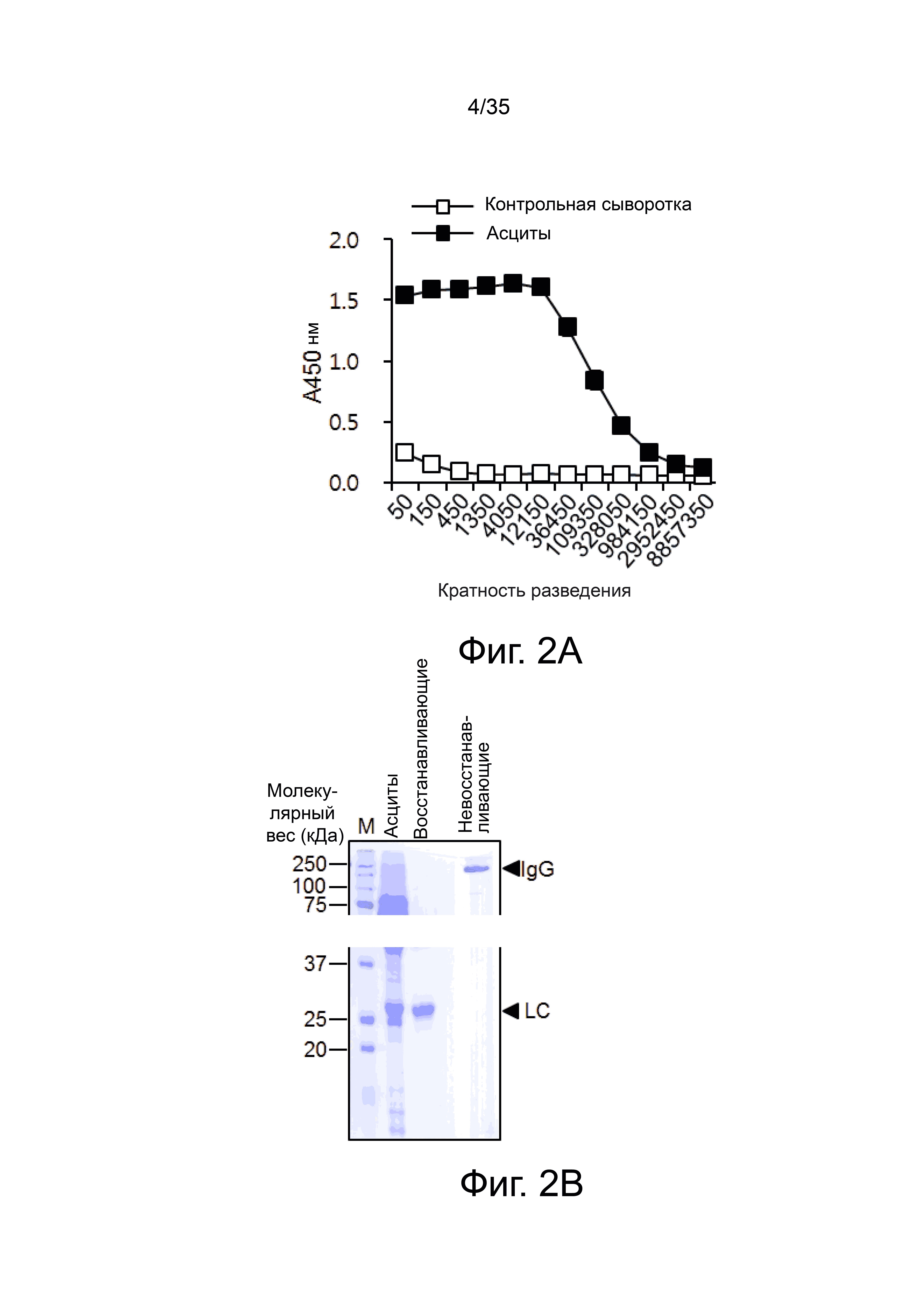
Фиг. 2а представляет собой график, показывающий результаты ELISA, выполненного на нескольких мышах, иммунизированных гибридомными клетками (клоны hMUC1-1H7), которые показывают присутствие rhMUC1-С-специфического антитела.
Фиг. 2b показывает результат анализа очищенного анти-MUC1 моноклонального антитела методом ДНС-ПААГ и окрашивания кумасси.
Фиг. 2с представляет собой график, показывающий результаты определения изотипа анти-MUC1 антитела ELISA.
Фиг. 3а показывает результаты вестерн-блоттинга с использованием анти-MUC1 моноклонального антитела и очищенного анти-MUC1-СТ антитела из клонов hMUC1-1Н7, в лизате клеток рака груди.
Фиг. 3b показывает результаты иммуноблоттинга с использованием анти-MUC1-СТ антитела после иммунопреципитации клеточных лизатов клеток MCF-7, MDA-MB-231, T47D и ZR75-1 с очищенными анти-hMUC1 моноклональными антителами из IgG здоровой мыши или клонов hMUC1-1H7.
Фиг. 3с показывает результаты обработки клеточного лизата T47D PNGазой F и последующего вестерн-блоттинга с использованием очищенного анти-hMUC1 моноклонального антитела из клонов hMUC1-1H7, для сравнения со случаем использования других антител.
Фиг. 3d показывает результаты иммунопреципитации клеточного лизата T47D, обработанного PNGазой F, с использованием очищенного анти-hMUC1 моноклонального антитела из клонов hMUC1-1H7, и последующего иммуноблоттинга с анти-MUC1-СТ или анти-MUC1-СТ2 антителом.
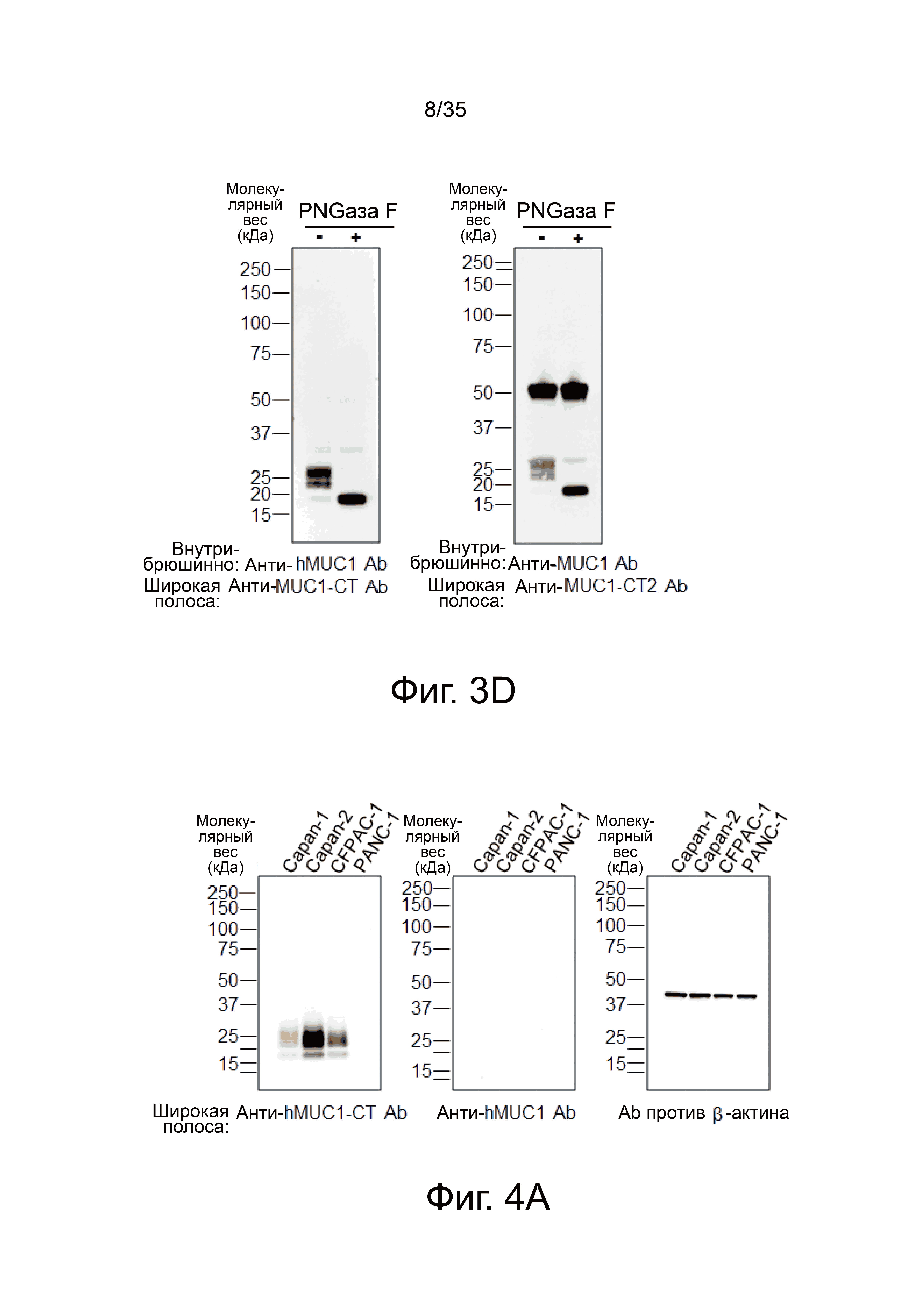
Фиг. 4а показывает результат вестерн-блоттинга лизата клеток рака поджелудочной железы с использованием анти-MUC1-СТ антитела, очищенного анти-hMUC1 антитела из клона hMUC1-1H7, или антитела против бета-актина.
Фиг. 4b показывает результаты иммунопреципитации лизата клеток рака поджелудочной железы с очищенным анти-hMUC1 моноклональным антителом из IgG здоровой мыши или клона hMUC1-1H7, и последующего иммуноблоттинга с использованием анти-MUC1-СТ антитела и анти-hMUC1 моноклонального антитела.
Фиг. 5А представляет флуоресцентное изображение, полученное обработкой клеток рака молочной железы при 4°С (поверхность) очищенным анти-hMUC1 антителом из клона hMUC1-1H7, или лизисом клеток с 0,1% тритоном Х-100 и последующей обработкой антителом (внутриклеточное).
Фиг 5В показывает флуоресцентное изображение, полученное обработкой клеток рака молочной железы очищенным анти-hMUC1 антителом из клона hMUC1-1H7, меченного флуоресцентным зондом, и последующим культивированием его при 37°С в течение 6 часов.
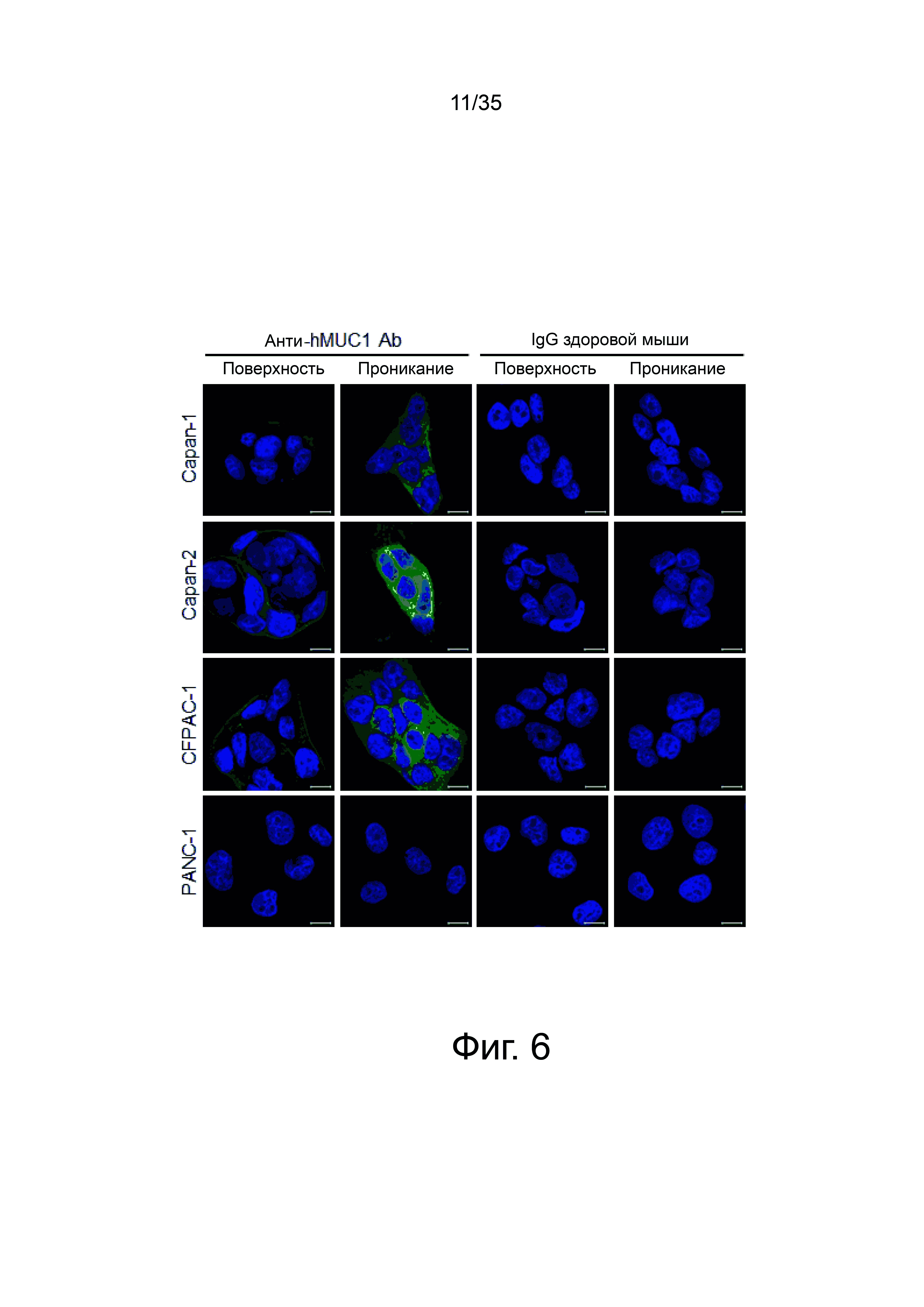
Фиг. 6 представляет флуоресцентное изображение, полученное обработкой при 4°С (поверхность) клеток рака поджелудочной железы очищенными анти-hMUC1 антителами из клона hMUC1-1H7, или лизисом клеток с 0,1% тритоном Х-100 и последующей обработкой антителом (внутриклеточное).
Фиг. 7 представляет флуоресцентное изображение, полученное обработкой клеток рака поджелудочной железы очищенным анти-hMUC1 антителом из клона hMUC1-1H7, меченного флуоресцентным зондом, и последующим культивированием его при 37°С в течение 24 часов.
Фиг. 8а представляет собой карту расщепления, схематически показывающую рекомбинантную экспрессирующую плазмиду pFabE-hMUC1-1H7.
Фиг. 8b схематически показывает рекомбинантные белки, экспрессированные с помощью рекомбинантной экспрессирующей плазмиды pFabE-hMUC1-1H7.
Фиг. 8с представляет флуоресцентное изображение, полученное обработкой клеток MCF-7, MDA-MB-231, T47D и ZR75-1 Fab-фрагментом анти-hMUC1 антитела, полученного из клона hMUC1-1H7.
Фиг. 9 представляет собой график, показывающий изменения клеточной пролиферации, когда клетки MDA-MB-231, T47D и ZR75-1 обрабатывают анти-hMUC1 антителом, полученным из клона hMUC1-1H7.
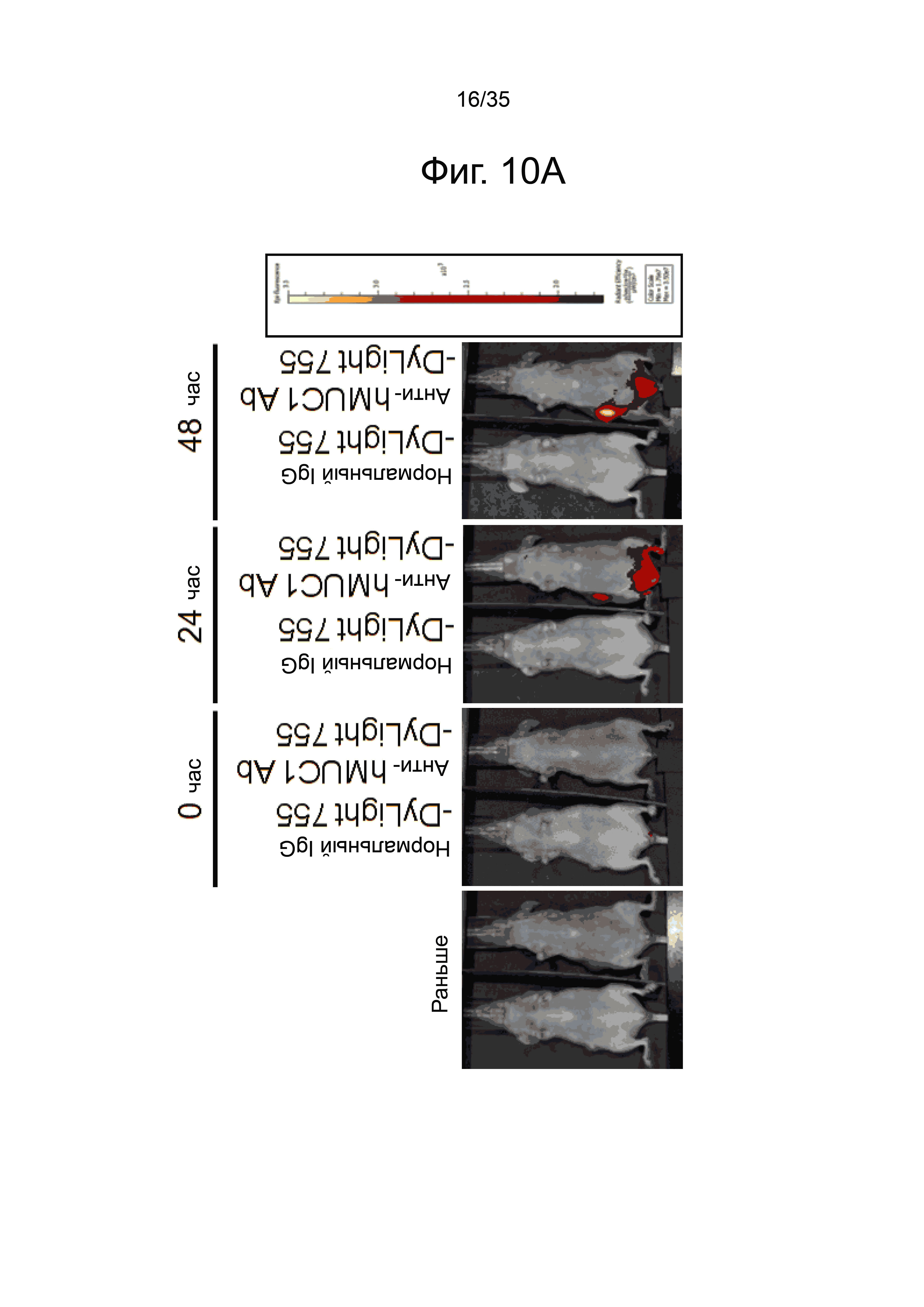
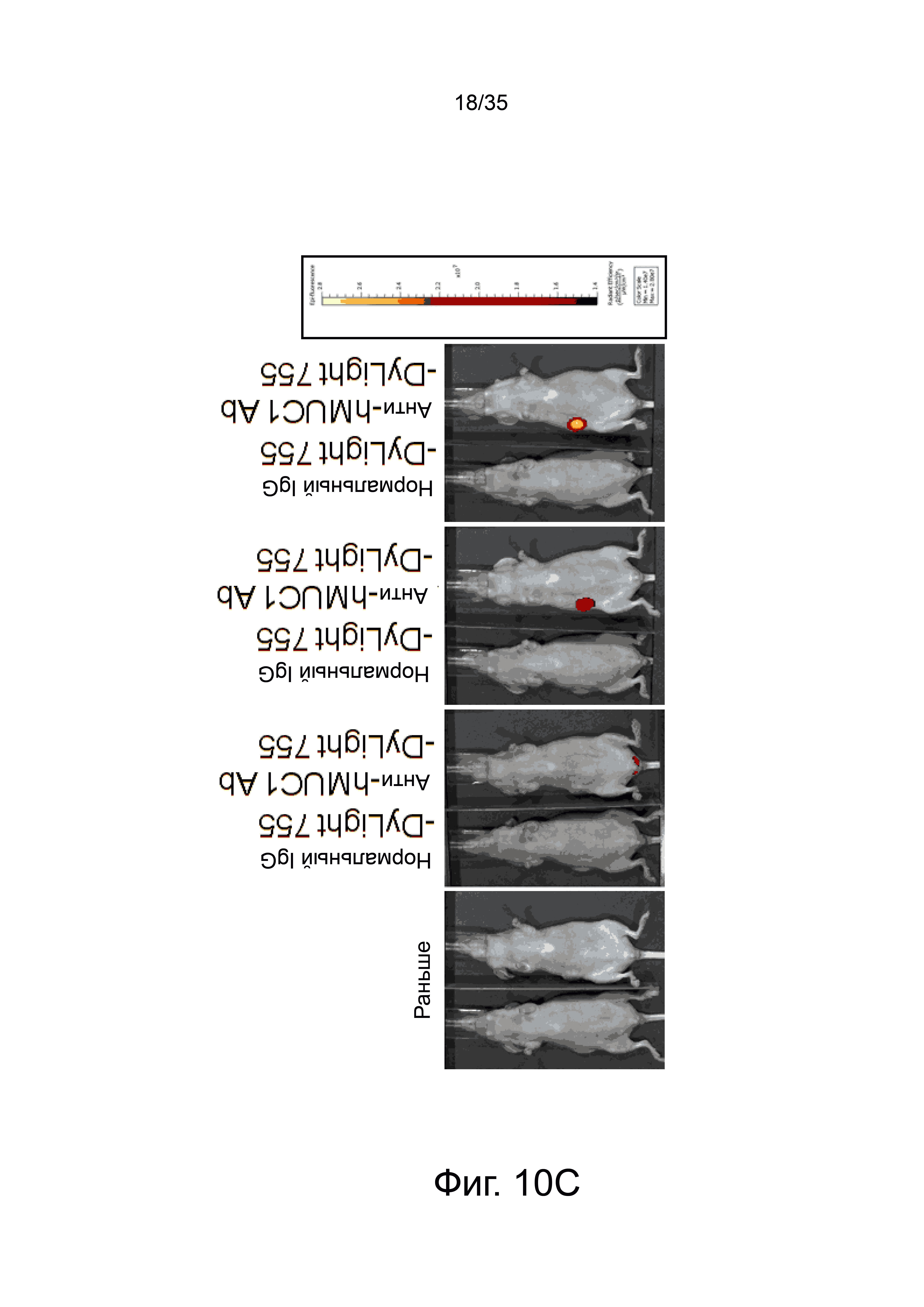
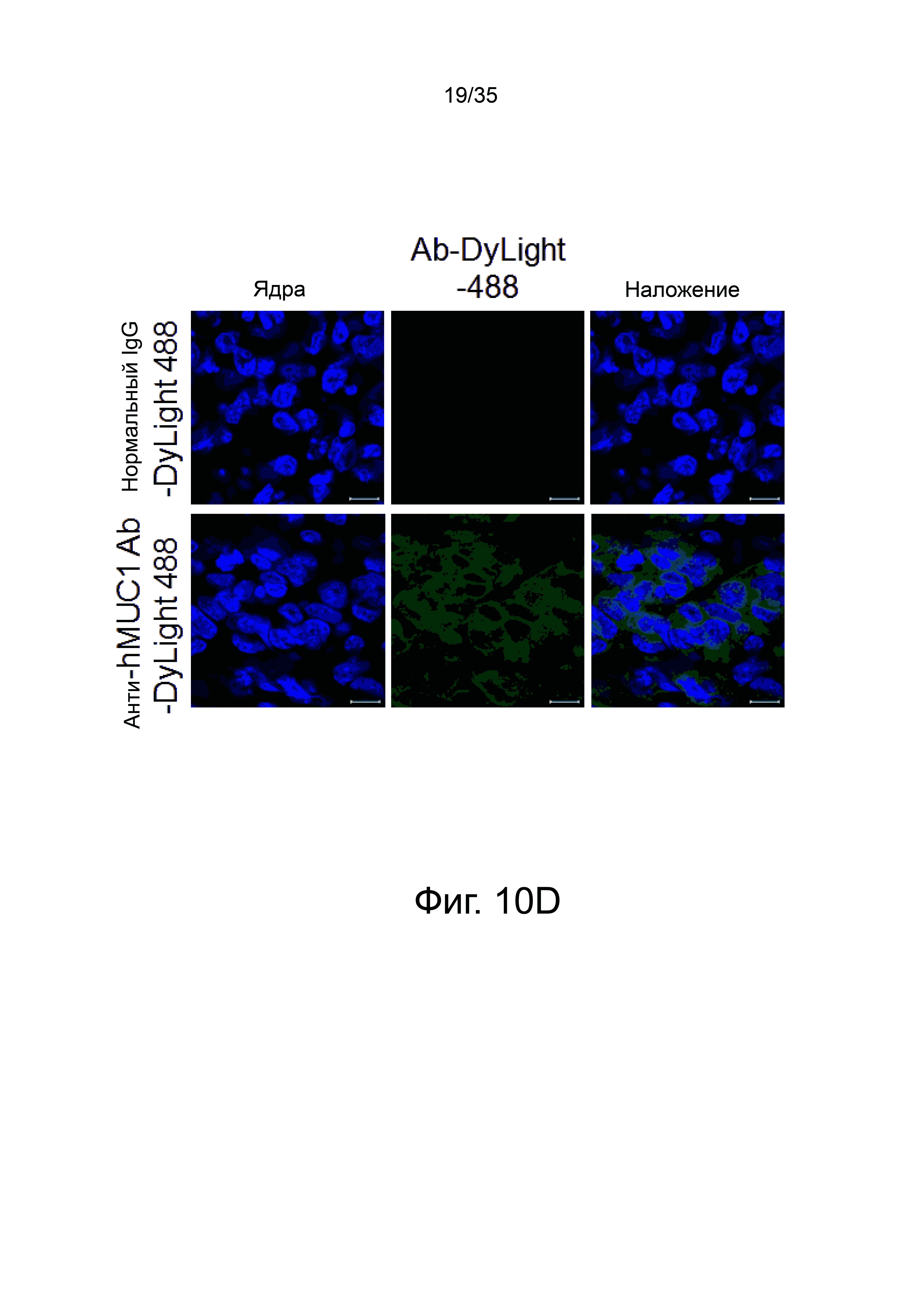
Фиг. 10а-10h представляют флуоресцентные изображения, полученные внутривенным введением мыши, имеющей рак молочной железы, анти-hMUC1 моноклонального антитела, полученного из меченного флуоресцентно клона hMUC1-1H7.
Фиг. 11а-11с представляют флуоресцентные изображения, полученные внутривенным введением мыши, имеющей рак поджелудочной железы, анти-hMUC1 моноклонального антитела, полученного из меченного флуоресцентно клона hMUC1-1H7.
Фиг. 12а показывает опухолевую ткань, экстрагированную из мышиной модели с ксенотрансплантатом.
Фиг. 12b представляет собой график, показывающий размер (ширина2 × длина/2) опухоли, экстрагированной из мышиной модели с ксенотрансплантатом, введенной с анти-hMUC1 моноклональным антителом, полученным из клона hMUC1-1H7.
Фиг. 12с представляет собой график, показывающий массу опухоли, экстрагированной из мышиной модели с ксенотрансплантатом, с введенным анти-hMUC1 моноклональным антителом.
Фиг. 12d представляет собой график, показывающий массу тела мышиной модели с ксенотрансплантатом, введенной с анти-hMUC1 моноклональным антителом.
Фиг. 13 показывает результат идентификации того, экспрессируется или нет белок MUC1 в тканях рака молочной железы.
Фиг. 14 показывает результат идентификации того, экспрессируется или нет белок MUC1 в тканях рака поджелудочной железы.
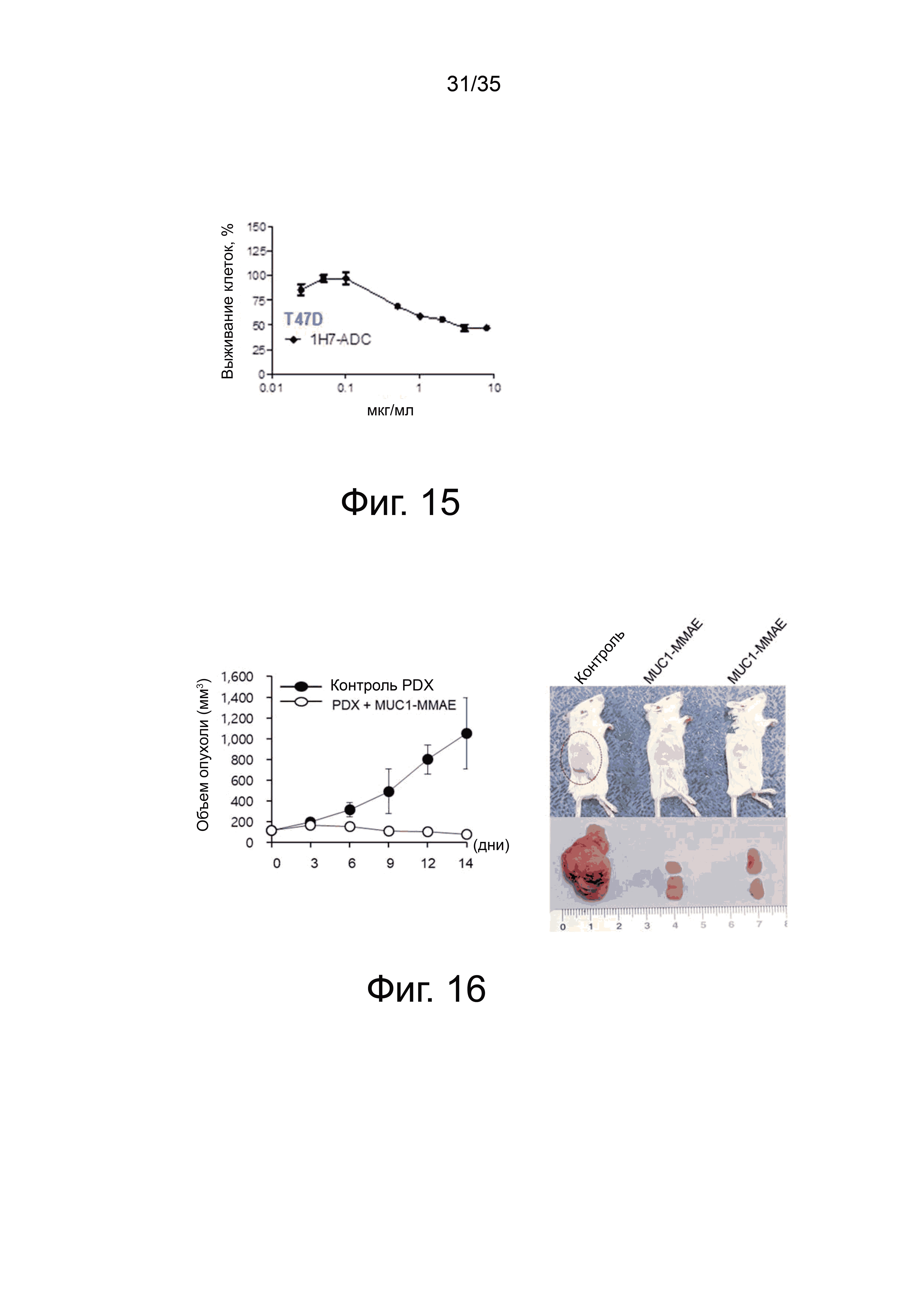
Фиг. 15 показывает цитотоксичность конъюгата антитело hMUC1-1Н7-лекарство в линиях клеток рака молочной железы.
Фиг. 16 показывает ингибирующее действие конъюгата антитело hMUC1-1Н7-лекарство на клеточную пролиферацию в тканях рака молочной железы.
Фиг. 17 показывает результат идентификации аффинности связывания гуманизированного антитела (hMUC1-G3) и hMUC1-С посредством ELISA.
Фиг. 18 показывает результат идентификации посредством ELISA гомологии эпитопов hMUC1-С, узнаваемых антителом hMUC1-G3 и антителом hMUC1-1Н7.
Фиг. 19 показывает результат проточной цитометрии, показывающий, что антитело hMUC1-G3 специфически узнает hMUC1, экспрессированный в клетках.
Фиг. 20 показывает результат проточной цитометрии, показывающий, что антитело hMUC1-G3 и антитело hMUC1-1Н7 специфически узнают hMUC1, экспрессированный в клетках рака молочной железы ZR75-1, в зависимости от концентрации.
Фиг. 21 показывает, что конъюгат антитело hMUC1-G3-лекарство селективно убивает клетки рака молочной железы в зависимости от экспрессии MUC1 в MUC1-экспрессирующих линиях клеток (ZR75-1, T47D) и в неэкспрессирующей MUC1 линии клеток рака молочной железы (MDA-MB-231).
Фиг. 22 показывает цитотоксичность конъюгата антитело hMUC1-G3-лекарство в линии клеток миелоидного лейкоза.
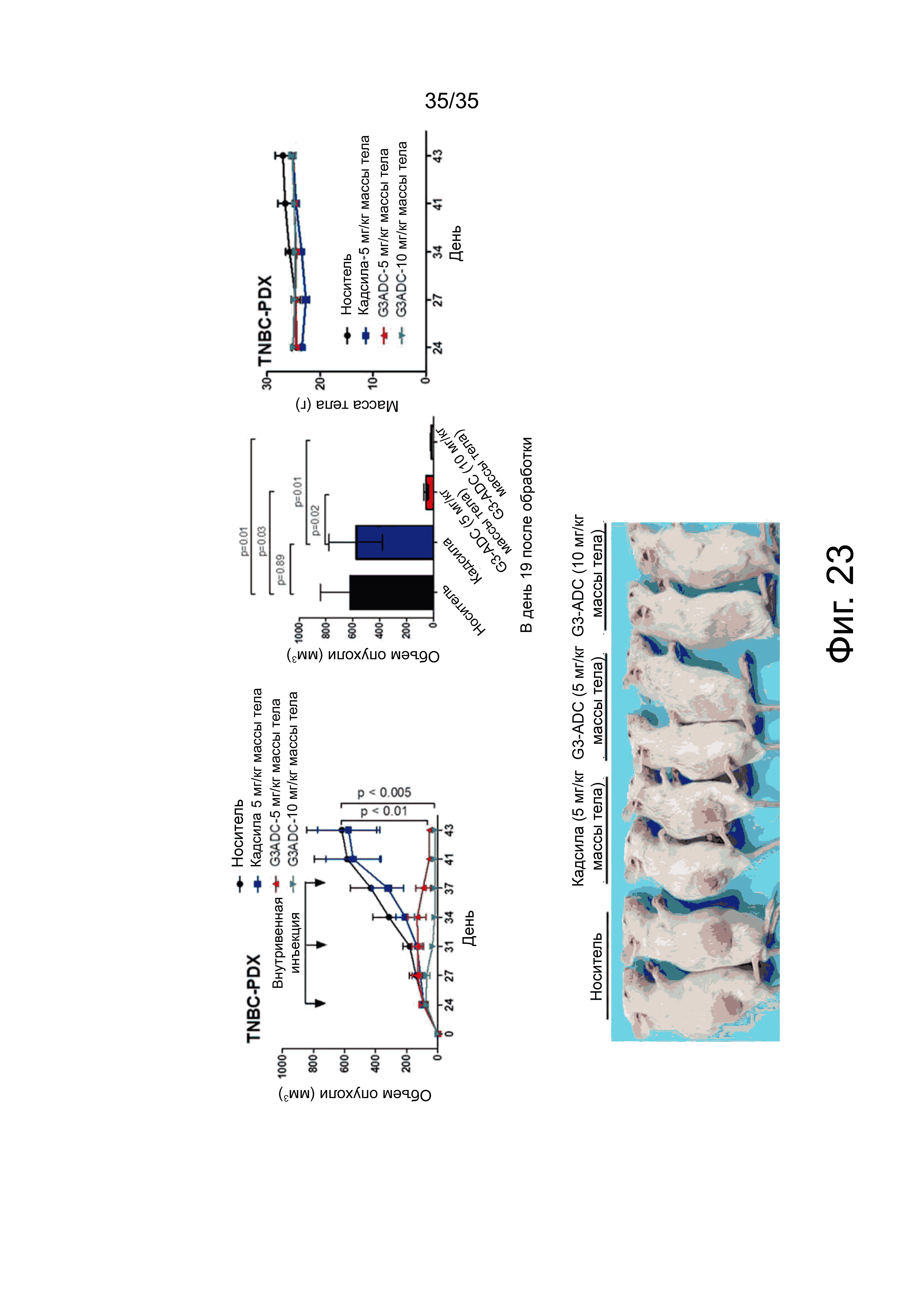
Фиг. 23 показывает действие селективного ингибирования раковых клеток конъюгата антитело hMUC1-G3-лекарство на мышиную модель с ксенотрансплантатом, полученную трансплантацией ткани трижды негативного РМЖ, взятой у пациентки, имеющей рак молочной железы.
Подробное описание примеров воплощения
Если не дается иного определения, все технические и научные термины, используемые в настоящем описании, имеют значения, придаваемые им специалистами в области техники, к которой относится настоящее изобретение. Как правило, номенклатура, используемая в настоящем описании, хорошо известна в уровне техники и используется обычным путем.
MUC1 (муцин 1) обычно экспрессируется на одной стороне (апикальной мембране) нормального эпителия и защищает базальный эпителий от высыхания, изменений рН, загрязнения и микроорганизмов. Однако MUC1 экспрессируется аномально на высоком уровне при различных карциномах человека, вовлекается в снижение степени гликозилирования, даже экспрессируется по всей поверхности клеток и вовлекается в промотирование пролиферации, инвазию, метастазирование и ангиогенез раковых клеток. Поэтому MUC1 является мишенью для специфических противораковых терапий.
MUC1 включает N-концевую субъединицу (MUC1-N) и С-концевую субъединицу (MUC1-С), причем MUC1-N и MUC1-С образуются за счет саморасщепления в сайте расщепления в домене SEA (белок энтерокиназы спермы морского ежа и домен агрин). Домен SEA вносит вклад в образование устойчивых гетеродимерных комплексов. Когда происходит расщепление MUC1, внеклеточный MUC1-N (N-концевая субъединица MUC1) может высвобождаться с изоляцией ряда анти-MUC1-SEA антител. Наиболее известные на сегодня анти-MUC1-SEA антитела известны как нацеленные на домены MUC1-N с повторяющимися последовательностями (Prinssen et al., 1998; Gillespie et al., 2000). Так как MUC1-N не обнаружен непосредственно на клеточной поверхности, но наблюдается в периферическом кровообращении, имеется такое ограничение, что только ограниченные анти-MUC1-N антитела в кровотоке можно использовать в MUC1-положительных опухолевых клетках. Также затруднительно выбрать эпитоп на MUC1-C (C-концевой субъединице MUC1). Причина этого в том, что в большинстве случаев домен MUC1-C является трансмембранным или локализуется в цитоплазме. Для того, чтобы преодолеть эту проблему, настоящее изобретение предоставляет новое антитело, специфически связывающееся с MUC1, которое нацелено на С-концевой участок MUC1-C (внеклеточный домен), остающийся на поверхности клетки после расщепления MUC1.
В одном аспекте настоящее изобретение относится к анти-MUC1 антителу, специфически связывающемуся с MUC1, или его антигенсвязывающему фрагменту, конкретнее, к анти-MUC1 антителу, узнающему полипептид, включающий по меньшей мере пять последовательных аминокислот в С-концевом внеклеточном домене MUC1, или его антигенсвязывающему фрагменту.
В частности, в настоящем изобретении используют антиген, представляющий в целом 192 аминокислоты от аминокислоты в позиции 961 до аминокислоты в позиции 1152 (включающий домен SEA), среди 1134 аминокислот целого белка человеческого муцина 1 (CD227), на основании метода «иммуностимулирующих композиций, включающих инкапсулированные в липосоме олигонуклеотид и эпитопы», раскрытого в патенте PCT/KR2010/003879. Муцин 1 имеет примерно в 100 раз более высокую экспрессию в различных клетках аденокарцином человека (Immunology, 2018, 225-240). Конкретно, муцин 1 синтезируется в клетках и затем расщепляется в домене SEA на две субъединицы, т.е. связанную с клеткой часть, включающую домен SEA, и остальную часть, которые связаны нековалентно. В здоровых клетках MUC1 гликозилируется с трудом, но эта часть преобладает в отсекаемой части, и не гликозилируется в части, связанной с клеткой. В настоящем изобретении на основании этого факта 190 аминокислот, связывающихся с клетками даже после расщепления, используются в качестве антигенов для экспрессии в E. coli, которые не подвергаются гликозилированию.
Так как антитело согласно настоящему изобретению продуцируется на основе антигена, экспрессированного в E. coli, оно узнает антиген, который негликозилирован. В настоящем изобретении антитело разработано с использованием метода мышиных гибридом, и, что интересно, обнаружено, что разработанное антитело узнает четвертичную структуру, а не первичную структуру аминокислотной последовательности.
В одном воплощении настоящего изобретения обнаружено, что когда выполняют сортировку клеток с активированной флуоресценцией (FACS) с использованием линий клеток рака молочной железы T47D и ZR75-1, MUC-1 узнается специфически, но клеточный лизат, полученный лизисом клеток, не распознается вестерн-блоттингом, выполняемым для исследования первичной структуры. Антиген обнаруживают по иммунопреципитации с использованием клеточного лизата и антитела согласно настоящему изобретению с последующим вестерн-блоттингом для того, чтобы подтвердить узнавание четвертичной структуры, что показывает, что антитело согласно настоящему изобретению специфически узнает третичную структуру.
В настоящем изобретении С-концевой внеклеточный домен MUC1 может иметь аминокислотную последовательность SEQ ID NO: 10 (SVV VQLTLAFREG TINVHDVETQ FNQYKTEAAS RYNLTISDVS VSDVPFPFSA QS).
Термин «антитело», используемый в настоящем описании, относится вообще к веществу, продуцируемому путем стимуляции антигена в иммунной системе, и его вид особо не ограничивается. Антитело обозначает молекулу иммуноглобулина, которая иммунологически реагирует со специфическим антигеном, и представляет собой белковую молекулу, действующую как рецептор, специфически узнающий антиген, и включает любое из поликлонального антитела, моноклонального антитела, полного антитела и фрагмента антитела. Антитело может быть получено не в природе, например, получено рекомбинантно или синтетически. Антитело может представлять собой антитело животного (например, мышиное антитело), химерное антитело, гуманизированное антитело или человеческое антитело. Антитело может представлять собой моноклональное антитело. Антитело также можно представлять как включающее антигенсвязывающий фрагмент антитела, имеющего антигенсвязывающую способность, если не конкретизировано иное.
В настоящем описании термин «определяющий комплементарность участок (CDR)» относится к сайту, который, среди вариабельных участков антитела, определяет специфичность связывания с антигеном. Антигенсвязывающий фрагмент антитела, описанный выше, может представлять собой фрагмент антитела, включающий по меньшей мере один из определяющих комплементарность участков.
В настоящем изобретении анти-MUC1 антитело можно получить из гибридомы hMUC1-1H7 (KCLRF-BP-00395). Кроме того, анти-MUC1 антитело или его антигенсвязывающий фрагмент имеет определяющие комплементарность участки (CDR-H1, CDR-H2, CDR-H3, CDR-L1, CDR-L2 и CDR-L3) или вариабельный участок тяжелой цепи и вариабельный участок легкой цепи антитела, полученного из гибридомы hMUC1-1H7 (KCLRF-BP-00395).
В одном аспекте анти-MUC1 антитело или его антигенсвязывающий фрагмент согласно настоящему изобретению включает шесть определяющих комплементарность участков (CDR). Антитело или его антигенсвязывающий фрагмент включает по меньшей мере один участок, выбранный из группы, включающей CDR1 тяжелой цепи SEQ ID NO: 1 (GYTFTSYWMH); CDR2 тяжелой цепи SEQ ID NO: 2 (YINPGTGYIEYNQKFKD); CDR3 тяжелой цепи SEQ ID NO: 3 (STAPFDY); CDR1 легкой цепи SEQ ID NO: 4 (KASQDIKSYLS); CDR2 легкой цепи SEQ ID NO: 5 (YATRLAD) и CDR3 легкой цепи SEQ ID NO: 6 (LQYDESPYT).
В настоящем изобретении антитело или его антигенсвязывающий фрагмент может включать CDR1 тяжелой цепи SEQ ID NO: 1; CDR2 тяжелой цепи SEQ ID NO: 2; CDR3 тяжелой цепи SEQ ID NO: 3; CDR1 легкой цепи SEQ ID NO: 4; CDR2 легкой цепи SEQ ID NO: 5 и CDR3 легкой цепи SEQ ID NO: 6.
В настоящем изобретении антитело или его антигенсвязывающий фрагмент может характеризоваться тем, что оно включает вариабельный участок тяжелой цепи SEQ ID NO: 22 или 24 и вариабельный участок легкой цепи SEQ ID NO: 23 или 25. Конкретнее, антитело или его антигенсвязывающий фрагмент включает вариабельный участок тяжелой цепи SEQ ID NO: 22 и вариабельный участок легкой цепи SEQ ID NO: 23 или вариабельный участок тяжелой цепи SEQ ID NO: 24 и вариабельный участок легкой цепи SEQ ID NO: 25.
В настоящем изобретении анти-MUC1 антитело или его антигенсвязывающий фрагмент имеет ингибирующее действие против MUC1.
Ген MUC1 кодирует один транскрипт, и после трансляции белок MUC1 саморасщепляется в «G» мотива GSVV, локализованного в домене SEA. В настоящем изобретении белок MUC1 может представлять собой человеческий белок MUC1, и, например, может иметь аминокислотную последовательность из GenBank, инвентарный № P15941 (SEQ ID NO: 7), или последовательность, гомологичную ей по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99%. Внеклеточный домен белка MUC1 может представлять собой внеклеточный домен человеческого белка MUC1, например, фрагмент белка (SEQ ID NO: 8), включающий 192 аминокислоты в целом от аминокислоты в позиции 961 до аминокислоты в позиции 1152 в аминокислотной последовательности из GenBank, инвентарный № P15941 (SEQ ID NO: 7). Внеклеточный домен белка MUC1 включает домен SEA. В одном примере домен SEA представляет собой фрагмент белка (SEQ ID NO: 9), включающий 119 аминокислот в целом от аминокислоты в позиции 1034 до аминокислоты в позиции 1152 в аминокислотной последовательности из GenBank, инвентарный № P15941 (SEQ ID NO: 7). «G» мотива GSVVV, присутствующего в домене SEA, является сайтом расщепления, и когда расщепление происходит в этом сайте, положение после «G» (в направлении C-конца) представляет собой C-концевой внеклеточный домен (также называемый «внеклеточным доменом с MUC1-C-конца (сайта)» или «субъединицей MUC1-C») (SEQ ID NO: 10) (таблица 1).
Таблица 1
В настоящем изобретении анти-MUC1 антитело или его антигенсвязывающий домен узнает или специфически связывается с полипептидом (эпитопом), включающим по меньшей мере 5, по меньшей мере 7, по меньшей мере 10, по меньшей мере 12 или предпочтительно по меньшей мере 15 аминокислот в белке MUC1 (например, SEQ ID NO: 7), конкретно C-концевой внеклеточный домен (например, SEQ ID NO: 10) белка MUC1. Анти-MUC1 антитело или его антигенсвязывающий домен узнает и/или специфически связывается с внеклеточным доменом белка MUC1 (например, SEQ ID NO: 8), доменом SEA белка MUC1 (например, SEQ ID NO: 9) или C-концевым внеклеточным доменом белка MUC1 (например, SEQ ID NO: 10).
Используемый в настоящем описании термин «MUC1-специфическое антитело» или «антитело, специфически связывающееся с MUC1» обозначает антитело, которое связывается с MUC1, вызывая ингибирование биологической активности MUC1, и используется взаимозаменяемо с термином «анти-MUC1 антитело».
Используемый в настоящем описании термин «анти-MUC1 антитело» относится к антителу животного (например, мышиному антителу), химерному антителу (например, химерному антителу мышь-человек) или гуманизированному антителу, и которое может представлять собой моноклональное антитело или поликлональное антитело, например, моноклональное антитело. Термин «анти-MUC1 антитело» охватывает как поликлональное антитело, так и моноклональное антитело, предпочтительно моноклональное антитело, и которое может иметь форму полного антитела. Целое антитело имеет две полноразмерные легкие цепи и две полноразмерные тяжелые цепи и включает константные участки, причем каждая легкая цепь связана с соответствующей тяжелой цепью дисульфидной связью.
Полное антитело анти-MUC1 антитела согласно настоящему изобретению включает IgA, IgD, IgE, IgM и формы IgG, и IgG включает подтипы IgG1, IgG2, IgG3 и IgG4.
Полное (целое) антитело IgG имеет структуру, имеющую две полноразмерные легкие цепи и две полноразмерные тяжелые цепи, причем каждая легкая цепь связана с соответствующей тяжелой цепью дисульфидной связью. Константный участок антитела делится на константный участок тяжелой цепи и константный участок легкой цепи. Константный участок тяжелой цепи имеет типы гамма (γ), мю (μ), альфа (α), дельта (δ) и эпсилон (ε) и подразделяется на гамма 1 (γ1), гамма 2 (γ2), гамма 3 (γ3), гамма 4 (γ4), альфа 1 (α1) и альфа 2 (α2). Константный участок легкой цепи имеет типы каппа (κ) и лямбда (λ).
Используемый в настоящем описании термин «тяжелая цепь» охватывает полноразмерную тяжелую цепь, которая включает вариабельный домен (VH), содержащий аминокислотную последовательность для придания специфичности к антигену, три константных участка (CH1, CH2и CH3) и шарнир, и ее фрагмент. Также используемый в настоящем описании термин «легкая цепь» охватывает полноразмерную легкую цепь, которая включает вариабельный домен (VL), содержащий аминокислотную последовательность, имеющую последовательность вариабельного участка, достаточную для придания специфичности к антигену, константный участок CL, и ее фрагмент.
Используемый в настоящем описании термин «участок, определяющий комплементарность (CDR)» относится к аминокислотной последовательности гипервариабельного участка тяжелых цепей и легких цепей иммуноглобулина. Тяжелые цепи и легкие цепи могут иметь, каждая, три участка CDR (CDRH1, CDRH2, CDRH3 и CDRL1, CDRL2, CDRL3). CDR могут обеспечивать основные контактные остатки для связывания антитела с антигеном или эпитопом.
Между тем, термин «специфическое связывание» или «специфическое узнавание» имеет то же значение, какое обычно известно специалистам в данной области техники, которое означает, что антиген и антитело иммунологически реагируют друг с другом через специфическое взаимодействие.
Термин «антигенсвязывающий фрагмент» анти-MUC1 антитела согласно настоящему описанию относится к фрагменту, который имеет способность связываться с антигеном анти-MUC1 антитела, т.е. MUC1, и включает Fab, Fab', F(ab')2, scFv, (scFv)2, scFv-Fc, Fv и т.п. В настоящем описании термин «антигенсвязывающий фрагмент» имеет то же значение, что и термин «фрагмент антитела», и используется взаимозаменяемо с ним. Антигенсвязывающий фрагмент может представлять собой, например, scFv, (scFv)2, Fab, Fab' или F(ab')2, но не ограничивается ими. Fab из указанных антигенсвязывающих фрагментов включает вариабельный участок каждой тяжелой цепи и легкой цепи, константный участок легкой цепи и первый константный участок (CH1) тяжелой цепи, и имеет один антигенсвязывающий центр. Fab' отличается от Fab в том, что дополнительно включает шарнирный участок, имеющий по меньшей мере один цистеиновый остаток в С-конце домена CH1 тяжелой цепи. F('2 антитела образуется дисульфидной связью между цистеиновыми остатками в шарнирном участке. Fv представляет собой минимальный фрагмент антитела, имеющий только вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, и в уровне техники хорошо известна рекомбинантная технология получения Fv-фрагментов. Двухцепочечный Fv имеет структуру, в которой вариабельный участок легкой цепи соединен с вариабельным участком тяжелой цепи через нековалентную связь, и одноцепочечный Fv имеет структуру, в которой вариабельный участок тяжелой цепи и вариабельный участок легкой цепи соединены ковалентной связью через пептидный линкер или непосредственно соединены по С-концу с образованием структуры, подобной димеру, подобно двухцепочечному Fv. Антигенсвязывающий фрагмент может быть получен с использованием протеазы (например, Fab можно получить рестрикцией-расщеплением целого антитела папаином, и фрагмент F(ab')2 можно получить рестрикцией-расщеплением целого антитела пепсином), и может быть получен генетическими рекомбинантными методами.
Используемый в настоящем описании термин «шарнирный участок» относится к участку, который включен в тяжелую цепь антитела, располагается между доменами СН1 и СН2 и функционирует, придавая гибкость антигенсвязывающему центру в антителе.
Анти-MUC1 антитело может представлять собой моноклональное антитело. Моноклональное антитело можно получить согласно способу, хорошо известному в уровне техники, например, методом фагового дисплея. С другой стороны, моноклональное антитело можно получить от мыши обычным способом с использованием анти-MUC1 антитела.
Между тем, отдельные моноклональные антитела можно скринировать на основании способности связываться с MUC1 с использованием типичного формата ELISA (твердофазный иммуноферментный анализ). Ингибирующую активность можно проверить через функциональный анализ, такой как конкурентный ELISA для проверки молекулярного взаимодействия на связанных веществах, и функциональный анализ, такой как клеточные анализы. Аффинность (величина Kd) к MUC1 отобранных моноклональных антител проверяют на основании сильной ингибирующей активности.
По меньшей мере один из CDR1 - CDR3 легкой и тяжелой цепей, содержащихся в анти-MUC1 антителе или его антигенсвязывающем фрагменте согласно настоящему изобретению, а также пептиды и аптамеры, имеющие по существу одинаковую связывающую способность и специфичность в отношении антигена MUC1, входят в объем анти-MUC1 антитела или его антигенсвязывающего фрагмента согласно настоящему изобретению.
В другом аспекте настоящее изобретение относится к гибридоме, продуцирующей анти-MUC1 антитело. В настоящем изобретении гибридома депонирована под инвентарным номером KCLRF-BP-00395.
Настоящее изобретение относится к анти-MUC1 антителу, продуцируемому гибридомой, или его антигенсвязывающему фрагменту. В другом примере настоящее изобретение относится к анти-MUC1 антителу или его антигенсвязывающему фрагменту, которые включают определяющий комплементарность участок тяжелой цепи (CDR-H1, CDR-H2, CDR-H3 или их комбинацию) или определяющий комплементарность участок легкой цепи (CDR-L1, CDR-L2, CDR-L3 или их комбинацию) анти-MUC1 антитела, продуцированного гибридомой, или их комбинации. В этом случае определяющий комплементарность участок можно определить любым удобным способом, например, через определение IMGT (http://www.imgt.org/IMGT_vquest/share/textes/) или определение по Кабат (http://www.bioinf.org.uk/abs/), но без ограничения.
В настоящем изобретении анти-MUC1 антитело или его антигенсвязывающий фрагмент специфически узнает С-концевой внеклеточный домен MUC1, так что MUC1-С-концевой внеклеточный домен экспрессируется на более высоком уровне, чем в здоровых клетках, и анти-MUC1 антитело или его антигенсвязывающий фрагмент специфически действует на менее гликозилированные раковые или опухолевые клетки и может узнать/связать белок MUC1, экспрессированный на всей поверхности клетки, а также на одной стороне клетки. Кроме того, анти-MUC1 антитело или его антигенсвязывающий фрагмент не только связывается с белком MUC1, в частности, MUC1-С-концевым внеклеточным доменом, но также интернализирует белок MUC1 в клетки (см. пример 9-8, пример 18), причем посредством этого эффективно ингибирует MUC1-опосредуемые пути и максимизирует фармакологическое действие. Кроме того, свойство интернализации анти-MUC1 антитела или его антигенсвязывающего фрагмента имеет преимущество эффективной доставки конъюгированного лекарства в клетки при применении в виде конъюгата антитело-лекарство (АЛК).
В другом аспекте настоящее изобретение относится к терапевтическому средству Т-клеткам с химерными антигенными рецепторами (CAR) и/или природным киллерным клеткам (NK) с химерными антигенными рецепторами (CAR), включающим анти-MUC1 антитело или его антигенсвязывающий фрагмент согласно настоящему изобретению. Форма антитела или его антигенсвязывающего фрагмента в CAR-Т или CAR-NK предпочтительно представляет собой scFv, но настоящее изобретение этим не ограничивается.
В другом аспекте настоящее изобретение относится к конъюгату антитело-лекарство (АЛК), в котором лекарственное средство конъюгировано с анти-MUC1 антителом или его антигенсвязывающим фрагментом.
В одном воплощении изобретения лекарственным средством конъюгата антитело-лекарство является монометилауристатин Е (ММАЕ). После связывания с экспрессирующей MUC1 клеткой конъюгат антитело-лекарство интернализуется в экспрессирующую MUC1 опухолевую клетку, и ММАЕ селективно высвобождается в мишень MUC1-клетку через протеолитическое расщепление. Когда высвобожденный ММАЕ связывается с тубулином, он расщепляет внутриклеточную сеть микротрубочек, индуцирует остановку клеточного цикла и приводит к расщеплению микротрубочек, сопровождаемую гибелью клеток (апоптозу).
Что касается конъюгата антитело-лекарство (АЛК), противораковое средство должно быть устойчиво связано с антителом до тех пор, пока противораковое средство доставляется в раковую клетку-мишень. Лекарственное средство, доставленное в мишень, должно освобождаться от антитела и индуцировать гибель клетки-мишени. Для этой цели лекарственное средство должно быть устойчиво связано с антителом и в то же время должно проявлять достаточную цитотоксичность для индукции гибели клетки-мишени, когда высвобождается в клетке-мишени.
В настоящем изобретении анти-MUC1 антитело или его антигенсвязывающий фрагмент и цитотоксическое вещество, включающее лекарство, такое как противораковое средство, связаны друг с другом (например, через ковалентную связь, пептидную связь или подобную) и таким образом может использоваться в виде конъюгата или слитого белка (когда цитотоксическое вещество и/или маркирующее вещество (маркер) представляет собой белок). Цитотоксическое вещество может представлять собой любое вещество, которое является токсичным для раковых клеток, в особенности клеток солидного рака, и может представлять собой по меньшей мере одно, выбранное из группы, включающей радиоизотопы, цитотоксические соединения (низкомолекулярные), цитотоксические белки и противораковые лекарственные средства, но настоящее изобретение ими не ограничивается. Цитотоксический белок выбирают из группы, включающей рицин, сапорин, гелонин, момордин, дебуганин, дифтерийный токсин, токсин синегнойной палочки и т.п., но настоящее изобретение ими не ограничивается. Радиоизотопом может быть по меньшей мере один, выбранный из группы, включающей 131I, 188Rh и 90Y, но настоящее изобретение ими не ограничивается. Цитотоксическое соединение может быть выбрано из группы, включающей дуокармицин, монометилауристатин Е (MMAE), монометилауристатин F (MMAF), N2’-диацетил-N2’-(3-меркапто-1-оксопропил)майтансин (DM1), димер PBD (пирролобензодиазепин) и т.п., но без ограничения.
В настоящем изобретении конъюгат антитело-лекарство можно получить согласно способу, хорошо известному в уровне техники.
В настоящем изобретении конъюгат антитело-лекарство может отличаться тем, что антитело или его антигенсвязывающий фрагмент связывается с лекарственным средством через линкер.
В настоящем изобретении линкер может представлять собой расщепляемый линкер или нерасщепляемый линкер.
Линкер представляет собой участок для соединения анти-MUC1 антитела с лекарственным средством. Например, линкер допускает возможность высвобождения лекарственного средства в расщепляемой форме во внутриклеточном состоянии, т.е. высвобождения через отщепление линкера от антитела во внутриклеточной среде.
Линкер может представлять собой пептидный линкер, который может быть расщеплен расщепляющим агентом, присутствующим во внутриклеточной среде, например, в лизосоме или эндосоме, и может быть расщеплен внутриклеточными пептидазами или протеазами, такими как лизосомные или эндосомные протеазы. Как правило, пептидный линкер имеет по меньшей мере две аминокислоты в длину. Расщепляющий агент может включать катепсин В, катепсин D и плазмин, который гидролизует пептид с высвобождением лекарственного средства в клетку-мишень. Пептидный линкер может быть расщеплен тиолзависимой протеазой катепсином В, которая экспрессируется в высокой степени в раковых тканях, и может, например, представлять собой линкер Phe-Leu или Gly-Phe-Leu-Gly. Кроме того, пептидный линкер может, например, представлять собой линкер Val-Cit или линкер Phe-Lys, которые могут быть расщеплены внутриклеточной протеазой.
В настоящем изобретении расщепляемый линкер чувствителен к рН и может быть чувствителен к гидролизу при определенной величине рН. Как правило, рН-чувствительный линкер является линкером, который можно гидролизовать в кислой среде. Примеры неустойчивых в кислой среде линкеров, которые можно гидролизовать в лизосомах, могут включать гидразон, семикарбазон, тиосемикарбазон, цис-аконитамид, ортоэфир, ацеталь, кеталь и т.п.
Линкер может быть расщеплен в условиях восстановления и может представлять собой, например, дисульфидный линкер. Ряд дисульфидных связей может образовываться с использованием N-сукцинимидил-S-ацетилтиоацетата (SATA), N-сукцинимидил-3-(2-пиридилдитио)пропионата (SPDP), N-сукцинимидил-3-(2-пиридилдитио)бутирата (SPDB) и N-сукцинимидилоксикарбонил-альфа-метил-альфа-(2-пиридилдитио)толуола (SMPT).
В настоящем изобретении лекарство и/или лекарство-линкер могут быть произвольно конъюгированы через лизин антитела или могут быть произвольно конъюгированы через цистеин, который подвергается воздействию, когда цепь дисульфидной связи восстанавливается. В некоторых случаях линкер-лекарство можно конъюгировать через цистеин, присутствующий в созданной генетически метке, например, пептиде или белке. Созданная генетически метка, например, пептид или белок, может включать аминокислотный мотив, который может быть узнан, например, изопропаноидтрансферазой. Пептид или белок имеет делецию в карбоксильном (С) конце пептида или белка или добавление на карбоксильном (С) конце пептида или белка через ковалентную связь спейсерного звена. Пептид или белок может быть ковалентно связан непосредственно с аминокислотным мотивом или может быть соединен с аминокислотным мотивом через ковалентную связь со спейсерным звеном. Аминокислотное спейсерное звено включает 1-20 аминокислот и предпочтительно помимо прочего является глициновым звеном.
Линкер может включать бета-глюкуронидный линкер, который присутствует в нескольких копиях в лизосоме или гидролизован бета-глюкуронидазой, которая сверхэкспрессируется в некоторых опухолевых клетках. В отличие от пептидного линкера, этот линкер имеет преимущество повышения растворимости композита антитело-лекарство из-за своей высокой гидрофильности, когда связан с лекарством, имеющим высокую гидрофобность.
В этом отношении в настоящем изобретении можно использовать бета-глюкуронидный линкер, раскрытый в публикации патента Кореи № 2015-0137015, например, бета-глюкуронидный линкер, включающий самоуничтожающуюся группу.
Кроме того, линкер может представлять собой, например, нерасщепляющийся линкер, и лекарственное средство может быть способно высвобождаться только через единственную стадию гидролиза антитела с получением, например, композита аминокислота-линкер-лекарство. Такой тип линкера может представлять собой простую тиоэфирную группу или малеимидокапроильную группу, и может сохранять устойчивость в крови.
В настоящем изобретении лекарственное средство может представлять собой химиотерапевтическое средство, токсин, микроРНК (миРНК), сиРНК, shRNA или радиоактивный изотоп. Лекарственное средство, как агент, имеющий фармакологическое действие, может быть конъюгировано с антителом.
Химиотерапевтическое средство может представлять собой цитотоксическое средство или иммуносупрессивное средство. Конкретно химиотерапевтическое средство может включать ингибитор микротубулина, митотический ингибитор, ингибитор топоизомеразы или химиотерапевтическое средство, способное функционировать как ДНК-интеркалятор. Химиотерапевтическое средство также может включать иммуномодулирующее соединение, противораковое средство, противовирусное средство, антибактериальное средство, противогрибковое средство, противогельминтное средство или их комбинацию.
Например, лекарственное средство может включать по меньшей мере одно, выбранное из группы, включающей maytansinoid, ауристатин, аминоптерин, актиномицин, блеомицин, талидомид, каптотецин, N8-ацетилспермидин, 1-(2-хлорэтил)-1,2-диметилсульфонилгидразид, эспермацин, этопозид, 6-меркатопурин, доластатин, трихотецен, калихеамицин, таксол, таксан, паклитаксел, доцетаксел, метотрексат, винкристин, винбластин, доксорубицин, мелфалан, митомицин A, митомицин C, хлорамбуцин, дуокармицин, L-аспаразиназу, меркптопурин, тиогуанин, гидроксимочевину, цитарабин, циклофосфамид, ифосфамид, нитрозомочевину, цисплатин, карбоплатин, митомицин, дакарбазин, прокарбазин, топотекан, азотный аналог горчичного газа, цитоксан, 5-фторурацил, бисхлорэтилнитрозомочевину (CNU), иринотекан, идарубицин, даунорубицин, дактиномицин, пликамицин, митоксантрон, аспарагиназу, винорелбин, хлорамбуцил, кармустин, ломустин, бусульфан, треосульфан, тенипозид, 9-аминокамтотецин, криснатол, триметрексат, микофенольную кислоту, тиазофурин, рибаварин, 5-этинил-1-бета-дрибофуранозилимидазол-4-карбоксамид (EICAR), дефероксамин, флоксуридин, доксифлуридин, ралтитрексед, цитарабин (ара С), цитозин-арабинозид, флударабин, тамоксифен, ралоксифен, мегестрол, гозерелин, лейпролида ацетат, флутамид, бикалутамид, EB1089, CB1093, KH1060, вертепорфин, фталоцианин, фотосенсибилизатор Pe4, деметоксигипокреллин A, интерферон-α, интерферон-γ, фактор некроза опухоли, гемицитабин, велкад, ревамид, таломид, ловастин, 1-метил-4-фенилпиридиний, стауроспорин, актиномицин D, дактиномицин, блеомицин A2, блеомицин B2, пепломицин, эпирубицин, пирарубицин, зорубицин, верапамил и тапсигаргин, нуклеазы и токсины, полученные из бактерий или растений и животных, но настоящее изобретение не ограничивается указанным.
В настоящем изобретении лекарственное средство может иметь нуклеофильную группу, выбранную из группы, включающей аминные, тиольные, гидроксильные, гидразидные, оксимовые, гидразиновые, тиосемикарбазоновые, гидразинкарбоксилатные и арилгидразидные группы, которые могут взаимодействовать с электрофильной группой линкера и линкерного реагента с образованием ковалентной связи.
В другом аспекте настоящее изобретение относится к биспецифическому антителу, включающему анти-MUC1 антитело или его антигенсвязывающий фрагмент.
Биспецифическим антителом называют антитело, в котором одно плечо из двух плеч антитела включает анти-MUC1 антитело или его антигенсвязывающий фрагмент согласно настоящему изобретению, и другое включает антитело или его антигенсвязывающий фрагмент, которые специфически связываются с антигеном иным, чем MUC1, предпочтительно ассоциированным с раком антигеном или антигеном белка иммунной контрольной точки, или антигеном, ассоциированным с иммунными эффекторными клетками.
Антиген, связанный с антителом иным, чем анти-MUC1 антителом, включенным в биспецифическое антитело согласно настоящему изобретению, предпочтительно выбирают из ассоциированного с раком антигена или антигенов белков иммунной контрольной точки, включая Her2, EGFR, VEGF, VEGF-R, CD-20, MUC16, CD30, CD33, CD52, PD-1, PD-L1, CTLA4, BTLA4, EphB2, E-селектин, EpCam, CEA, PSMA, PSA, ERB3, c-MET и т.п., и предпочтительно выбирают из антигенов, ассоциированных с иммунными эффекторными клетками, включая TCR/CD3, CD16(FcγRIIIa) CD44, CD56, CD69, CD64(FcγRI), CD89, CD11b/CD18(CR3) и т.п., но настоящее изобретение не ограничивается указанным.
В другом аспекте настоящее изобретение относится к фармацевтической композиции для профилактики и/или лечения ассоциированного с MUC1 заболевания, включающей анти-MUC1 антитело или его антигенсвязывающий фрагмент, конъюгат антитело-лекарство или биспецифическое антитело.
Ассоциированное с MUC1 заболевание может являться заболеванием, ассоциированным с экспрессией или сверхэкспрессией MUC1, экспрессией на всех поверхностях клеток поверхности MUC1 и/или снижением гликозилирования белка MUC1 по сравнению со здоровыми клетками, например, раком. Соответственно, MUC1-ассоциированным заболеванием предпочтительно является рак или опухоль, но заболевание этим не ограничивается.
Термин «рак» или «опухоль» типично относится к или обозначает физиологическое состояние млекопитающего, характеризующееся неконтролируемым ростом/пролиферацией клеток.
Рак или саркома, которые можно лечить композицией по настоящему изобретению, особо не ограничиваются и включают как солидный рак, так и рак крови. Примеры таких видов рака включают, но без ограничения, рак кожи, такой как меланома, рак печени, гепатоцеллюлярную карциному, рак желудка, рак молочной железы, рак легких, рак яичников, рак бронхов, рак носоглотки, рак гортани, рак поджелудочной железы, рак мочевого пузыря, колоректальный рак, рак толстой кишки, цервикальный рак, рак головного мозга, рак предстательной железы, рак костей, рак щитовидной железы, рак гипофиза, рак почек, рак пищевода, билиарный рак, тестикулярный рак, рак прямой кишки, рак головы и шеи, рак мочеточника, остеосаркому, нейробластому, фибросаркому, рабдомиосаркому, астроцитому и глиому.
Предпочтительнее рак характеризуется тем, что экспрессирует белок MUC1, и может представлять собой рак молочной железы, рак поджелудочной железы, рак предстательной железы, рак легких, рак щитовидной железы, рак желудка, рак яичников, колоректальный рак, рак печени, рак желчного пузыря, рак почек, цервикальный рак или рак мочевого пузыря, но без ограничения. Рак может являться первичным раком или метастастатическим раком.
Ассоциированное с MUC1 заболевание может представлять собой неалкогольный стеатогепатит (NАSG) или TGF-β-опосредованное иммунное заболевание, но без ограничения.
В одном воплощении настоящего изобретения в фармацевтической композиции, способе и применении для профилактики и/или лечения рака анти-MUC1 антитело или его антигенсвязывающий фрагмент могут быть предоставлены как единственный активный ингредиент, могут вводиться совместно с цитотоксическим веществом, таким как противораковое средство, или могут предоставляться в форме конъюгата антитело-лекарство (АЛК), конъюгированные с цитотоксическим веществом, таким как противораковое средство.
Кроме того, анти-MUC1 антитело или его антигенсвязывающий фрагмент согласно настоящему изобретению и фармацевтическая композиция, включающая анти-MUC1 антитело или его антигенсвязывающий фрагмент, могут использоваться в комбинации с обычным терапевтическим средством. Иными словами, анти-MUC1 антитело или его антигенсвязывающий фрагмент согласно настоящему изобретению и фармацевтическая композиция, включающая их, могут использоваться одновременно или последовательно с обычным средством, таким как противораковое средство.
В другом аспекте настоящее изобретение относится к способу профилактики и/или лечению ассоциированного с MUC1 заболевания, включающему введение пациенту, нуждающемуся в предупреждении или лечении ассоциированного с MUC1 заболевания, терапевтически эффективного количества анти-MUC1 антитела или его антигенсвязывающего фрагмента или конъюгата антитело-лекарство. Способ профилактики и/или лечения ассоциированного с MUC1 заболевания может перед введением дополнительно включать проверку пациента, нуждающегося в предупреждении или лечении ассоциированного с MUC1 заболевания.
Применение конъюгата антитела для локальной доставки лекарственного средства в композиции позволяет доставлять лекарственное средство в клетки, экспрессирующие антиген, на который нацелено анти-MUC1 антитело.
Фармацевтическая композиция может дополнительно содержать фармацевтически приемлемый носитель. Фармацевтически приемлемый носитель может являться носителем, обычно используемым для получения лекарственных средств, и может включать по меньшей мере один носитель, выбранный из группы, включающей лактозу, декстрозу, сахарозу, сорбит, маннит, крахмал, аравийскую камедь, фосфат кальция, альгинат, желатин, силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, воду, сироп, метилцеллюлозу, метилгидроксибензоат, пропилгидроксибензоат, тальк, стеарат магния, минеральное масло и т.п., но настоящее изобретение не ограничивается указанным. Также фармацевтическая композиция может дополнительно содержать по меньшей мере один компонент, выбранный из группы, включающей разбавитель, эксципиент, лубрикант, смачиватель, подсластитель, корригент, эмульгатор, суспендирующий агент и консервант, которые обычно используются для получения фармацевтических композиций.
Фармацевтическую композицию можно вводить перорально или парентерально. В случае парентерального введения фармацевтическую композицию можно вводить внутривенной инъекцией, подкожной инъекцией, внутримышечной инъекцией, интраперитонеальной инъекцией, интардермальным введением, интраназальным введением, внутрилегочно, интратекальным введением или топическим введением в места повреждения или подобным образом. После перорального введения белки или пептиды гидролизуются, так что пероральная композиция с активным лекарством может быть обеспечено покрытием или получена таким образом, чтобы защитить активное лекарство от разрушения в желудке. Кроме того, композицию можно вводить с использованием любого устройства, способного доставлять активное вещество к клеткам-мишеням.
Содержание или доза анти-MUC1 антитела или его антигенсвязывающего фрагмента в фармацевтической композиции может изменяться в зависимости от таких факторов, как способ получения, способ введения и возраст, масса тела, пол, патологические состояния, питание, время введения, интервал между введениями, путь введения, скорость выделения и восприимчивость пациента. Например, суточная доза анти-MUC1 антитела или его антигенсвязывающего фрагмента может находиться в интервале 0,001-1000 мг/кг, конкретно 0,01-100 мг/кг и конкретнее 0,1-50 мг/кг, даже конкретнее 0,1-20 мг/кг, но настоящее изобретение не ограничивается указанным. Суточную дозу можно получить путем получения стандартной лекарственной формы с единичной дозой, представленной в подходящей дозе или в упаковке в многодозовом контейнере.
Фармацевтическая композиция может находиться в форме раствора, суспензии, сиропа или эмульсии в масле или водной среде, или может быть получена в форме экстракта, порошка, гранулы, таблетки или капсулы. Фармацевтическая композиция может дополнительно содержать диспергатор или стабилизатор.
Пациентом, которому назначена фармацевтическая композиция, может быть млекопитающим, включая примата, включая человека, обезьяну или подобное, или грызуна, включая мышь, крысу или тому подобное.
В настоящем описании лечение рака может означать все противораковые действия для профилактики, облегчения или ослабления ухудшения симптомов рака или частичное или полное устранение рака, такое как ингибирование пролиферации раковых клеток, гибель раковых клеток или ингибирование метастазирования раковых клеток.
В другом аспекте настоящее изобретение относится к применению анти-MUC1 антитела или его антигенсвязывающего фрагмента для профилактики или лечения рака.
В другом аспекте настоящее изобретение относится к применению анти-MUC1 антитела или его антигенсвязывающего фрагмента для получения профилактического или терапевтического средства против рака.
Анти-MUC1 антитело или его антигенсвязывающий фрагмент специфически связывается с белком MUC1, в частности, с MUC1-С-концевым внеклеточным доменом, и, таким образом, может использоваться для детекции или идентификации белка MUC1 или MUC1-С-концевого внеклеточного домена. Таким образом, в еще одном аспекте настоящее изобретение относится к композиции для детекции белка MUC1, например, MUC1-С-концевого внеклеточного домена, включающей анти-MUC1 антитело или его антигенсвязывающий фрагмент, и способу детекции MUC1, включающему обработку биологического образца анти-MUC1 антителом или его антигенсвязывающим фрагментом.
Способ детекции может дополнительно включать идентификацию того, происходит ли или нет взаимодействие антиген-антитело после обработки. В способе детекции, когда обнаруживается взаимодействие антиген-антитело, MUC1, например, MUC1-С-концевый внеклеточный домен, можно определить как присутствующий в биологическом образце. Таким образом, способ детекции может дополнительно включать определение после идентификации того, что MUC1 присутствует в биологическом образце, когда детектируется взаимодействие антиген-антитело. Биологический образец может быть выбран из группы, включающей клетки, ткани, жидкости организма, их культуры и т.п., полученные (выделенные) из млекопитающего, такого как человек (такой как больной раком).
Экспрессия белка MUC1, такого как С-концевый участок белка MUC1 (или домен SEA или MUC1-С-концевый внеклеточный домен белка MUC1) ассоциируется с некоторыми заболеваниями, таким как рак. Таким образом, в другом аспекте настоящее изобретение относится к композиции для детекции или диагностики ассоциированного с белком MUC1 заболевания, такого как рак, включающей анти-MUC1 антитело или его антигенсвязывающий фрагмент, и способу детекции или диагностики рака или способу предоставления информации для детекции или диагностики рака, включающему введение анти-MUC1 антитела или его антигенсвязывающего фрагмента в биологический образец, взятый у субъекта.
Способ детекции или диагностики может дополнительно включать идентификацию после обработки того, происходит ли или нет взаимодействие антиген-антитело после обработки. В способе, когда взаимодействие антиген-антитело обнаруживается, ассоциированное с MUC1 заболевание, такое как рак, может быть определено как присутствующее в биологическом образце или у пациента, от которого получен биологический образец. Такие образом, способ может дополнительно включать после идентификации определение того, что биологический образец или пациент, от которого получен биологический образец, является пациентом, имеющим ассоциированное с MUC1 заболевание, такое как рак, когда обнаруживается взаимодействие антиген-антитело. Биологический образец может быть выбран из группы, включающей клетки, ткани, жидкости организма, их культуры и т.п., полученные (выделенные) из млекопитающего, такого как человек (такой как больной раком).
Идентификацию того, происходит ли или нет взаимодействие антиген-антитело, можно выполнить различными методами, известными в уровне техники, например, обычной ферментативной реакцией, флуоресцентной, люминисцентной и/или радиационной детекцией, конкретно, с помощью способа, выбранного из группы, включающей иммунохроматографию, иммуногистохимию, твердофазного иммуноферментный анализ (ELISA), радиоиммуноанализ (РИА), ферментный иммуноанализ (EIA), иммунофлуоресцентный анализ (ИФА), иммунолюминесцентный анализ (LIA), вестерн-блоттинг, анализ на микрочипах, анализ методом иммунопреципитации и т.п., но настоящее изобретение не ограничивается указанным.
В таком случае анти-MUC1 антитело или его антигенсвязывающий фрагмент может дополнительно включать маркер. Маркер может представлять собой по меньшей мере один маркер, выбранный из группы, включающей радиоактивные изотопы, флуоресцентные вещества, хромогенные и красящие вещества. Маркер может быть связан (соединен) с антителом или антигенсвязывающим фрагментом обычным методом (например, химической связью, такой как ковалентная связь, координационная связь или ионная связь). Связывание антитела (или антигенсвязывающего фрагмента) с маркером может происходить в соответствии с методами, хорошо известными в уровне техники.
В одном воплощении настоящего изобретения моноклональное антитело к MUC1 получают клонированием С-концевого участка MUC1 из линии клеток рака молочной железы и экспрессией клонов в компетентных клетках Rosetta. С-концевой участок MUC1 получают с CpG-ДНК (например, MB-ODN 4531 (O)), инкапсулируют в комплексе DOPE:CHEMS и затем используют для иммунизации мышей. Продуцирование MUC1-специфических моноклональных антител значительно повышается, когда мышей иммунизируют комплексом [C-концевой участок MUC1]-[MB-ODN 4531 (O)]-[DOPE:CHEMS]. Анти-hMUC1-SEA моноклональное антитело также получают слиянием клеток селезенки, полученных от мышей, иммунизированных комплексом [hMUC1-SEA]-[MB-ODN 4531(O)]-[DOPE:CHEMS], с клетками SP2/0.
Таким образом, в другом аспекте настоящее изобретение относится к иммуногенной композиции, включающей С-концевой участок MUC1, домен SEA MUC1 или С-концевой внеклеточный домен MUC1. Другое воплощение относится к иммуногенной композиции, включающей комплекс, включающий (1) С-концевой участок MUC1, домен SEA MUC1 или С-концевой внеклеточный домен MUC1, и (2) CpG-ДНК, инкапсулированную в липосоме. Иммуногенная композиция обозначает композицию, которая имеет способность продуцировать антитело путем индукции иммунного ответа, когда инъецирована (инокулирована) в живой организм.
В настоящем изобретении липосома может представлять собой катионную липосому, например, смесь диолеоилфосфатидилэтаноламина (DOPE) и холестерилгемисукцината (CHEMS) в молярном соотношении 1:0,5 - 1:2, конкретнее 1:0,67 - 1:1,5 (DOPE:CHEMS), например, молярном соотношении примерно 1:1, или может представлять собой продукт (такой как свободная от растворителя липидная пленка), полученный из них, но без ограничения.
В настоящем изобретении CpG-ДНК относится к олигодезоксинуклеотиду (ODN), содержащему в целом 10-20 нуклеотидов, включая один или несколько, например, один-три мотива CpG. В одном воплощении настоящего изобретения CpG-ДНК может включать, но без ограничения, нуклеотидную последовательность
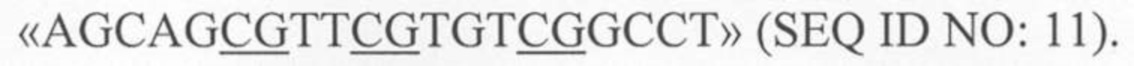
Липосома и олигодезоксинуклеотид могут функционировать как адъюванты. Адъювант вместе с иммунной системой способствует более легкому узнаванию антигена и улучшает иммунный ответ. Бактериальная ДНК, содержащая синтетический олигодезоксинуклеотид (ODN) и неметилированные динуклеотиды CpG, фланкированные специфическими основными последовательностями, оказывает важное иммуномодулирующее действие на В-лимфоциты, природные киллерные клетки, макрофаги и дендритные клетки.
Показано, что катионные липосомы (например, липофектамин и комплекс фосфатидил-бета-олеоил-гамма-пальмитоилэтаноламин (DOPE):гемисукцинат холестерина (CHEMS)) усиливают продуцирование антител, доставку антител и CTL реакцию. Следовательно, CpG-ДНК (липоплекс(О)), инкапсулированный в комплексе DOPE:CHEMS (соотношение 1:1), может промотировать эффективный иммунный ответ в человеческих и мышиных клетках.
В другом аспекте настоящее изобретение относится к способу получения анти-MUC1-SEA моноклонального антитела, включающему инокуляцию млекопитающего, например, мыши, С-концевым участком MUC1, доменом SEA MUC1 или С-концевым внеклеточным доменом MUC1, или комплексом, включающим (1) С-концевой участок MUC1, домен SEA MUC1 или С-концевой внеклеточный домен MUC1, и (2) CpG-ДНК, инкапсулированный в липосоме. Способ получения анти-MUC1-SEA моноклонального антитела после инокуляции может дополнительно включать выделение антитела из мышиной сыворотки и очистку его обычным способом.
В другом аспекте настоящее изобретение относится к нуклеиновой кислоте, кодирующей анти-MUC1 антитело согласно изобретению. При использовании в настоящем изобретении нуклеиновая кислота может присутствовать в клетке или клеточном лизате или может присутствовать в частично очищенной форме или в по существу чистой форме. Нуклеиновая кислота может быть «выделена» или «стать по существу чистой», когда очищается от других клеточных компонентов или других загрязнений, например, от нуклеиновых кислот или белков других клеток, стандартными методами, включая, например, обработку щелочью/SDS, связывание CsCl, колоночную хроматографию, электрофорез в агарозном геле и другие методы, хорошо известные в уровне техники. Нуклеиновая кислота по настоящему изобретению может представлять собой, например, ДНК или РНК, и может включать или не включать интронную последовательность.
В настоящем изобретении нуклеиновая кислота, кодирующая анти-MUC1 антитело, может включать по меньшей мере одну последовательность, выбранную из группы, включающей SEQ ID NO: 34 - SEQ ID NO: 45. Конкретно полинуклеотидная последовательность, кодирующая тяжелую цепь антитела согласно настоящему изобретению, представлена SEQ ID NO: 34 - 39, и/или полинуклеотидная последовательность, кодирующая легкую цепь антитела согласно настоящему изобретению, представлена SEQ ID NO: 40 - 45.
В другом аспекте настоящее изобретение относится к рекомбинантному экспрессирующему вектору, включающему нуклеиновую кислоту. Для экспрессии анти-MUC1 антитела или его антигенсвязывающего фрагмента согласно настоящему изобретению, ДНК, кодирующую неполные или полноразмерные легкую или тяжелую цепи, можно получить стандартными методами молекулярной биологии (например, ПЦР-амплификацией или клонированием кДНК с использованием гибридомы, экспрессирующей нужное антитело), и ДНК может быть «функционально соединена» с последовательностью для регуляции транскрипции и трансляции и встроена в экспрессирующий вектор.
Используемый в настоящем описании термин «функционально соединена» может означать, что ген, кодирующий антитело, лигирован в вектор так, что транскрипционные и трансляционные регулярные последовательности в пределах вектора выполняют предназначенную функцию регуляции транскрипции и трансляции гена антитела. Экспрессирующий вектор и экспрессирующие регулярные последовательности выбирают таким образом, чтобы они были совместимы с клеткой-хозяином, используемой для экспрессии. Полноразмерный ген антитела и ген тяжелой цепи антитела встраивают в отдельные векторы, или оба гена встраивают в один и тот же экспрессирующий вектор. Антитела встраивают в экспрессирующие векторы стандартными методами (например, лигированием фрагмента гена антитела и вектора по комплементарным сайтам ферментов рестрикции или лигирование по тупым концам, когда сайт фермента рестрикции отсутствует). В некоторых случаях рекомбинантный экспрессирующий вектор может кодировать сигнальный пептид, который облегчает секрецию цепи антитела из клетки-хозяина. Ген цепи антитела можно клонировать в вектор, так что сигнальный пептид присоединяется в аминоконцу гена цепи антитела в соответствии с рамкой. Сигнальный пептид может представлять собой сигнальный пептид иммуноглобулина или гетерологичный сигнальный пептид (т.е. сигнальный пептид, полученный из белка иного, чем иммуноглобулин). Кроме того, рекомбинантный экспрессирующий вектор имеет регулярную последовательность, которая регулирует экспрессию гена цепи антитела в клетке-хозяине. Термин «регулярная последовательность» может включать промоторы, энхансеры и другие регулирующие экспрессию элементы (например, сигналы полиаденилирования), которые регулируют транскрипцию или трансляцию гена цепи антитела. Специалистам в данной области техники будет понятно, что дизайн экспрессирующего вектора можно изменять путем селекции различных регулярных последовательностей в зависимости от таких факторов, как селекция клетки-хозяина, которую трансформируют, и уровень экспрессии белка.
В другом аспекте настоящее изобретение относится к клетке-хозяину, включающей нуклеиновую кислоту или вектор. Клетку-хозяина согласно настоящему изобретению предпочтительно выбирают из группы, включающей клетки животных, клетки растений, дрожжи, Escherichia coli и клеток насекомых, но не ограничиваясь этим.
Более конкретно, клетка-хозяин по изобретению может быть прокариотической клеток, такой как Escherichia coli, Bacillus subtilis, Streptomyces sp., Pseudomonas sp., Proteus mirabilis или Staphylococcus sp. Клетка-хозяин может быть эукариотической клеткой, выбранной из грибов, таких как Aspergillus sp., дрожжей, таких как Pichia pastoris, Saccharomyces cerevisiae, Schizosaccharomyces sp. и Neurospora crassa, клеток других низших эукариот и клеток высших эукариот, таких как клетки насекомых.
Клетка-хозяин также может быть получена из растений или от млекопитающих. Предпочтительно применимая клетка-хозяин может включать, но без ограничений, клетки почки обезьяны (COS7), клетки NSO, SP2/0, клетки яичника китайского хомячка (CHO), W138, клетки почки детеныша хомяка (BHK), MDCK, клеточные линии миеломы, клетки HuT 78, клетки HEK293 и т.п. Особенно предпочтительными применимыми клетками-хозяевами являются клетки CHO.
Нуклеиновую кислоту или вектор трансфицируют в клетку-хозяина. «Трансфекцию» можно выполнить с использованием различных методов, обычно используемых для введения чужеродных нуклеиновых кислот (ДНК или РНК) в прокариотические или эукариотические клетки-хозяев, например, электорофореза, преципитации фосфатом кальция, трансфекцией или липофекцией DEAE-декстрана. Можно использовать различные экспрессирующие комбинации хозяин/вектор для экспрессии антитела к глипиканам 3 согласно настоящему изобретению. Подходящие экспрессирующие векторы для эукариотических хозяев включают, например, но без ограничения, регулирующие экспрессию последовательности, полученные из SV40, вируса папилломы коровы, аденовируса, аденоассоциированного вируса, цитомегаловируса и ретровируса. Экспрессирующие векторы, которые можно использовать для бактериальных хозяев, включают бактериальные плазмиды, полученные из Escherichia coli (E. coli), такие как pET, pRSET, pBluescript, pGEX2T, векторы pUC, col E1, pCR1, pBR322, pMB9 и их производные, плазмиды, имеющие широкий ряд хозяев, такие как RP4, фаговую ДНК, которая может быть примером широкого ряда производных лямбда фагов, таких как λgt10, λgt11 и NM989, и другие фаги, содержащие ДНК, такие как M13, и нитевидные фаги, содержащие одноцепочечную ДНК. Экспрессирующие векторы, применимые для дрожжевых клеток, включают плазмиды 2μ и их производные. Вектором, применимым для клеток насекомых, является pVL 941.
В другом аспекте настоящее изобретение относится к способу получения анти-MUC1 антитела или его антигенсвязывающего фрагмента согласно настоящему изобретению, включающему культивирование клетки-хозяина для экспрессии анти-MUC1 антитела или его антигенсвязывающего фрагмента согласно настоящему изобретению.
Когда рекомбинантный экспрессирующий вектор, способный экспрессировать анти-MUC1 антитело или его антигенсвязывающий фрагмент, вводят в клетку-хозяина млекопитающего, антитело может продуцироваться путем культивирования клетки-хозяина в течение периода времени, достаточного для возможности экспрессии антитела в клетке-хозяине, предпочтительнее культивирования клетки-хозяина в течение периода времени, достаточного для возможности секреции антитела в культуральную среду.
В некоторых случаях экспрессированное антитело можно отделить от клетки-хозяина и очистить до однородного состояния. Отделение или очистку антитела можно выполнить с использованием методов сепарации и очистки, применяемых для обычных белков, например, хроматографии. Такая хроматография может включать, например, аффинную хроматографию, включающую колонку с белком А или колонку с белком G, ионообменную хроматографию или гидрофобную хроматографию. Антитело можно отделить и очистить, выполняя хроматографию в комбинации с фильтрацией, ультрафильтрацией, высаливанием, диализом и т.п.
Далее настоящее изобретение будет описываться подробнее с обращением к приведенным далее примерам. Однако для специалистов в данной области техники будет очевидно, что следующие далее примеры приводятся только для пояснения настоящего изобретения и не должны рассматриваться как ограничивающие объем настоящего изобретения.
Пример 1. Получение рекомбинантного белка hMUC1-C
Человеческую кДНК, кодирующую MUC1-C-конец (далее в настоящем описании называемый «белком hMUC1-C»; белок, включающий 192 аминокислоты от позиции 961 до позиции 1152 P15941, из которых 1034-1152 ак являются доменом MUC-SEA), получают из клеток MCF7 и затем амплифицируют ОТ-ПЦР с использованием следующих наборов праймеров:
смысловой праймер: hMUC1 C-Nco I-S3 5'-CC ATG GCC TCA GGC TCT GCA TC-3' (SEQ ID NO: 12); и
антисмысловой праймер: hMUC1 C-Xho I-AS4 5'-CTC GAG AGA CTG GGC AGA GAA AGG AAA T-3' (SEQ ID NO: 13).
Полученную последовательность, кодирующую hMUC1-С-концевой белок, идентифицируют ДНК-секвенированием, и результат показывает, что последовательность является такой же, как нуклеотидная последовательность, включающая 576 нуклеотидов от нуклеотида в позиции 2954 до нуклеотида в позиции 3529 последовательности из GenBank, инвентарный № J05582.1 (SEQ ID NO: 26).
Пример 2. Экспрессия и очистка рекомбинантного белка hMUC1-С (rhMUC1-С)
Фрагмент амплифицированной кДНК клонируют в экспрессирующий вектор pET-22b (Novagen, Darmstadt, Германия), содержащий C-концевую метку His. Полученные плазмиды переносят в компетентные клетки Escherichia coli Rosetta™ (Invitrogen, Carlsbad, CA) и индуцируют при 37°C с использованием 1 мM изопропил-D-1-тиоглюкопиранозида (IPTG, Sigma-Aldrich, Saint Louis, MO) в течение 8 часов. Полученные клетки растворяют с помощью ультразвука в ледяном буфере для фазы лизиса (50 мМ трис-HCl, 100 мМ NaCl, 5 мМ ЭДТК, 0,5% тритона X100, 1 μг/мл лизозима, ингибирующий коктейль для протеиназы). После центрифугирования фракцию телец включения смешивают с буфером B (100 мМ NaH2PO4, 10 мМ трис-HCl, 8 M мочевина, pH 8,0) и очищают с использованием системы с агарозой Ni-NTA (Qiagen, Valencia, CA). Полученную смесь загружают в колонку с Ni-NTA и промывают буфером для промывки C (100 мМ NaH2PO4, 10 мМ трис-HCl, 8 M мочевина, pH 6,3). Связанные белки элюируют буфером для элюции (100 мМ NaH2PO4, 10 мМ трис-HCl, 8 M мочевина, pH 4,5) и анализируют ДНС-ПААГ и вестерн-блоттингом. Вестерн-блоттинг выполняют с использованием анти-His-метка антитела (Santa Cruz).
Пример 3. Получение комплекса липоплекс (О)
MB-ODN 4531 включает 20 оснований, содержащих три мотива CpG (подчеркнуты)

Пример 4. Подготовка животных
Четырехнедельных самок мышей BALB/c (OrientBio, Inc., Сеул, Корея) и мышей BALB/cAnNCri-nu/nu (четырехнедельных) закупают у Nara Biotech, Inc (Сеул, Корея). Мышей содержат при 20-25°C и влажности 32-37% в асептических условиях без конкретного патогена. Все экспериментальные процедуры с животными одобрены Комитетом по содержанию и использованию животных при Университете Халлима и проводятся в соответствии с руководством по уходу и использованию лабораторных животных Национальной службы ветеринарных исследований и карантина Кореи. Мышей умерщвляют ингаляцией изофлурана, и предприняли всевозможные усилия для минимизации боли.
Пример 5. Иммунизация мышей
Мышей BALB/c иммунизируют путем интраперитонеальной инъекции четыре раза с 10-дневным интервалом липосомным комплексом, включающим комплекс, имеющий 50 мкг белка rhMUC1-C и 50 мкг CpG-ДНК 4531, совместно инкапсулированных в комплексе фосфатидил-бета-олеоил-гамма-пальмитоилэтаноламин : гемисукцинат холестерина (комплекс DOPE:CHEMS).
Пример 6. ЕLISA в отношении антигенспецифического Ig
Общее количество rhMUC1-C-специфического IgG измеряют с помощью ЕLISA. На 96-луночный иммунопланшет наносили покрытие из 10 мкг/мл белка rhMUC1-C (пример 2) и блокировали бычьим сывороточным альбумином (БСА) в ФСБ-T (ФСБ, содержащий 0,1% (об./об.) твина-20). Сыворотку мышей, иммунизированных в примере 5, супернатант гибридомной клеточной культуры или очищенное антитело разбавляют ФСБ-T и культивируют при комнатной температуре в течение 2 часов. Планшет промывают 3 раза ФСБ-T, и содержимое культивируют с вторичным антителом, конъюгированным с козьим антимышиным IgG-HRP, в течение 1 часа. Планшет проявляют с использованием растворов A и B субстрата TMB (соотношение 1:1) (Kirkegaard and Perry Laboratories, Gaithersburg, MD, США), измеряют поглощение при 450 нм с использованием микропланшетного ридера Spectra Max 250 (Molecular Devices, Sunnyvale, США), и выполняют колориметрический анализ.
Пример 7. Получение и очистка моноклонального анти-MUC1 антитела
Клетки селезенки мышей, иммунизированных белком rhMUC1-C в примере 5, сливали с клетками миеломы SP2/0 (ATCC) с использованием полиэтиленгликоля (PEG, Sigma-Aldrich). Слитые клетки культивировали и отбирали в среде гипоксантин-аминоптерин-тимидина (HAT, Sigma-Aldrich). Культуральный супернатант отобранных гибридомных клеток подвергали проверке на связывание с белком rhMUC1-C методом ELISA, и скринировали гибридомные клетки, которые положительны по связыванию, т.е. продуцировали специфическое к белку rhMUC1-C антитело. Гибридомные клоны скринировали согласно стандартной гибридомной технологии (Yokoyama et al. 2006). Полученный гибридомный клон (KCLRF-BP-00395; далее в настоящем описании гибридомные клетки или антитела, продуцированные в них, будут называться «hMUC1-1H7») культивировали в среде гипоксантин-тимидин (HT). ELISA-положительные популяции гибридомных клеток субклонировали. Для продуцирования моноклонального антитела гибридомные клетки (клоны hMUC1-1H7) интраперитонеально инъецировали мышам на начальной стадии и через 10 дней после интраперитонеальной инъекции. Через 10 дней перитонеальную жидкость собирали и центрифугировали при 3000 об/мин в течение 30 минут. Супернатант очищали с использованием анти-hMUC1 моноклонального антитела, связывающегося с белком rhMUC1-C, с использованием хроматографии на белке A (Repligen, Waltham, MA).
Пример 8. Идентификация изотипа IgG анти-hMUC1 моноклонального антитела
Для того, чтобы определить изотип IgG анти-hMUC1 моноклонального антитела, полученного в примере 7, 96-луночный иммунопланшет (Nalgene Nunc International, Penfield, USA) покрывали 1 мкг/мл белка rhMUC1-C и блокировали 0,05% твином-20 в ФСБ, содержащем 1% БСА (ФСБT). Анти-hMUC1-C моноклональные антитела добавляли в верхний ряд каждого планшета, и в следующем ряду размещали серии разведений 1:4 в ФСБT. Планшет инкубировали при комнатной температуре в течение 2 часов и промывали ФСБT. Затем в каждую лунку добавляли антимышиные целые антитела IgG, IgG1, IgG2a, IgG3b, IgG3, конъюгированные с пероксидазой из хрена (HRP: BD Pharmingen) (разведение 1:500), и культивировали при комнатной температуре в течение 1 часа. Общее количество анализировали с использованием растворов A и B субстрата TMB (соотношение 1:1, Kirkegaard and Perry Laboratories, Gaithersburg, MD), и измеряли поглощение при 450 нм с использованием микропланшетного ридера Spectra Max 250 (Molecular Devices, Sunnyvale, USA).
Пример 9. Тест на реактивность анти-hMUC1-C моноклонального антитела
Пример 9-1. Культивирование клеток
Линии клеток рака молочной железы человека (MCF-7, MDA-MB-231) и линии клеток рака поджелудочной железы (Capan-2, CFPAC-1) закупали в Американской коллекции типовых культур (ATCC, Manassas, VA), и линии клеток рака молочной железы человека (T47D, ZR75-1) и линии клеток рака поджелудочной железы (Capan-1, PANC-1) закупали в Корейском банке клеточных линий (KCLB, Сеул, Корея).
Клетки MCF-7 культивировали в минимальной поддерживающей среде Игла с добавлением 0,01 мг/мл человеческого рекомбинантного инсулина; клетки MDA-MB-231 культивировали в среде лейбовица L-15 (Thermo Fisher Scientific); и клетки T47D, ZR75-1 и Capan-1 культивировали в среде RPMI-1640 (Thermo Fisher Scientific). Клетки Capan-2 культивировали в среде Мак-Коя (McMcoy) 5A (Thermo Fisher Scientific), клетки CFPAC-1 культивировали в среде Дульбекко, модифицированной по способу Исков (IMDM, Thermo Fisher Scientific), и клетки PANC-1 культивировали в среде Игла, модифицированной по способу Дульбекко (DMEM, Thermo Fisher Scientific). Во все среды, используемые в данном случае, были добавлены 10% (мас./об.) фетальная сыворотка коровы (FBS, Thermo Fisher Scientific), 100 Е/мл пенициллина и 100 мг/мл стрептомицина. Клетки MCF-7, T47D, ZR75-1, Capan-1, Capan-2, CFPAC-1 и PANC-1 культивировали в присутствии 5% CO2 при 37°C, и клетки MDA-MB-231 культивировали в отсутствие CO2при 37°C.
Пример 9-2. Получение антител для проверки
Коммерчески доступные анти-MUC1-CT и анти-MUC1-CT2 антитела получали от Abcam (Cambridge, UK) для того, чтобы обнаружить MUC1 клеток путем вестерн-блоттинга и иммуноперципитации. Анти-MUC1-CT и анти-MUC1-CT2 антитела узнают цитоплазматический хвост MUC1. Антитело против бета-актина закупали у Sigma-Aldrich.
Пример 9-3. Анализ методом вестерн-блоттинга
Клетки растворяли в буфере для лизиса (20 мМ трис-HCl, pH 8,0, 150 мМ NaCl, 5 мМ ЭДТК, 100 мМ NaF, 2 мМ Na3Vo4, коктейль ингибиторов протеазы, 1% (мас./об.) NP-40) и центрифугировали при 4°C при 14000 об/мин в течение 20 минут. Такое же количество белка отделяли в градиентном геле 4-12% бис-трис (Thermo Fisher Scientific) и переносили на нитроцеллюлозную мембрану, блокированную 3% (мас./об.) БСА в ФСБ-T при комнатной температуре в течение 1 часа. Нитроцеллюлозную мембрану инкубировали в течение ночи при 4°C с анти-hMUC1 антителом (hMUC1-1H7; пример 7), анти-MUC1-CT антителом (Abacam, EPR1023), анти-MUC1-CT2 антителом (Abcam, ab80952) или антителом против бета-актина (Sigma-Aldrich). Иммунореактивные белки определяли с использованием вторичного антитела, конъюгированного с пероксидазой из хрена, и реагента усиленной хемилюминисценции (Thermo Fisher Scientific).
Пример 9-4. Анализ методом иммунопреципитации
Буфер для лизиса клеток (20 мМ трис-HCl, pH 8,0, 150 мМ NaCl, 5 мМ ЭДТК, 100 мМ NaF, 2 мМ Na3Vo4, коктейль ингибиторов протеазы, 1% (мас./об.) NP-40) инкубировали при 4°C в течение ночи с анти-hMUC1 антителом. К смеси добавляли гранулы белка А и культивировали при 4°C в течение 1 часа. Иммунокоплекс, собранный центрифугированием, промывали и анализировали вестерн-блоттингом. Мембрану культивировали с анти-hMUC1 антителом (hMUC1-1Н7), анти-MUC1-CT антителом (Abacam, EPR1023), анти-MUC1-CT2 антителом (Abcam, ab80952) или антителом против бета-актина (Sigma-Aldrich).
Пример 9-5. Анализ на дегликозилирование
Клеточные лизаты клеток T47D экстрагировали буфером для лизиса (0,5% (мас./об.) SDS, 1% (мас./об.) бета-меркаптоэтанола) и кипятили при 100°C в течение 10 минут. Затем образец культивировали с PNGазой F (Elpis-Biotech, Daejeon, Корея) при 37°C в течение 2 часов и кипятили при 100°C в течение 10 минут. Полученный образец разбавляли буфером для лизиса и подвергали иммунопреципитации с анти-hMUC1 моноклональным антителом. Полученный иммунный комплекс анализировали вестерн-блоттингом с анти-MUC-CT антителом или анти-MUC1-CT2 антителом.
Пример 9-6. Конфокальная микроскопия
Клетки культивировали на покровном стекле, покрытым поли-L-лизином, в 12-лунночном культуральном планшете. Для окрашивания клеточной поверхности клетки фиксировали 4% (мас./об.) параформальдегидом, блокировали 3% (мас./об.) БСА и окрашивали анти-hMUC1 антителом на льду в течение 2 часов. Для внутриклеточного окрашивания клетки фиксировали 4% (мас./об.) параформальдегидом, пропитывали 0,1% (мас./об.) тритоном Х-100, блокировали 3% (мас./об.) БСА и окрашивали при комнатной температуре анти-hMUC1 антителом в течение 2 часов. После промывки ФСБ-T полученные образцы клеток культивировали со вторичным антителом, конъюгированным с Alexa Fluor 488 (Invitrogen, Eugene, OR), в течение 1 часа. Ядра клеток окрашивали Hoechst 33258. Все образцы клеток устанавливали и наблюдали на лазерном сканирующем конфокальном микроскопе (CLSM, LSM 710, Carl Zeiss, Jena, Германия).
Пример 9-7. Анализ на интернализацию
Анти-hMUC1 моноклональное антитело метили DyLight 488 в соответствии с инструкциями изготовителя (Thermo Fisher Scientific). Клетки рака молочной железы и клетки рака предстательной железы обрабатывали меченным DyLight 488 анти-hMUC1 антителом и инкубировали при 37°C в течение указанного времени. Сигналы флуоресценции, генерированные клетками с интернализованными антителами, детектировали CLSM (LSM 710, Carl Zeiss).
Пример 10. Клонирование вариабельных участков анти-hMUC1 моноклонального антитела
Анти-hMUC1 моноклональное антитело (hMUC1-1Н7; пример 7) культивировали с использованием набора для типирования изотипа мышиного моноклонального антитела (формат Dipstick, Bibco BRL или Roche, Mannheim, Germany). Полную РНК экстрагировали из гибридомных клеток с использованием набора RNeasy Mini Kit (Qiagen), чтобы получить кДНК. Для того, чтобы клонировать вариабельный участок тяжелой цепи и вариабельный участок легкой цепи (VH и VL) анти-hMUC1 моноклонального антитела, полученного из hMUC1-1H7, полученную кДНК амплифицировали с использованием Vent полимеразы (NEB), имея следующий набор праймеров:
праймер для тяжелой цепи: IGG1(5'-GGA AGA TCT ATA GAC AGA TGG GGG TGT CGT TTT GGC-3'; SEQ ID NO: 14) и 5'MH2(5'-CTT CCG GAA TTC SAR GTN MAG CTG SAG TCW GG-3'; SEQ ID NO: 15)
праймер для легкой цепи (каппа-цепь): 3'Kc(5'-GGT GCA TGC GGA TAC AGT TGG TGC AGC ATC-3'; SEQ ID NO: 16) и 5'Mk(5'-GG GAG CTC GAY ATT GTG MTS ACM CAR WCT MCA-3'; SEQ ID NO: 17).
Выполняли стандартную реакцию ПЦР в течение 25 циклов. Полученный продукт ПЦР непосредственно лигировали с вектором pGEM-T Easy (Promega). Вставки клонированного мышиного Ig анализировали секвенированием ДНК.
Пример 11. Экспрессия антигенсвязывающего фрагмента (Fab) анти-hMUC1 моноклонального антитела
Последовательности, кодирующие вариабельный участок легкой цепи и вариабельный участок тяжелой цепи (VH и VL) анти-hMUC1 моноклонального антитела (hMUC1-1H7; пример 7), амплифицировали и субклонировали в бактериальный экспрессирующий вектор FabE с использованием SfiI и BstXI, соответственно (Jeon et al., Mol. Immunol., 44: 827-836 (2007), Kwon et al., Oncol. Rep., 18: 513-517 (2007)), и полученную таким образом рекомбинантную экспрессирующую плазмиду обозначали как «pFabE-hMUC1-1H7» (фиг. 8a).
В данном случае использовали указанные далее праймеры.
Последовательность, кодирующая праймер для амплификации вариабельного участка тяжелой цепи (393 по):
прямой праймер: 5'-ggc cca gcc ggc cat ggc cSA RGT NMA GCT GSA GSA GTC WGG-3' (SEQ ID NO: 18);
обратный праймер: 5'-GGC CGT GCT GGC CCC GAC AGA TGG GGG TGT CGT TTT GGC-3'(SEQ ID NO: 19).
Последовательность, кодирующая праймер для амплификации вариабельного участка легкой цепи (396 по):
прямой праймер: 5'-CCA TTG CAG TGG CAC TGG CTG GTT TCG CTA CCG TAG CAC AGG CAG CCG AYA TTG TGM TSA CMC ARW CTM CA-3' (SEQ ID NO: 20);
обратный праймер: 5'-CCA CCG TAC TGG CGG ATA CAG TTG GTG CAG CAT C-3' (SEQ ID NO: 21).
Рекомбинантную экспрессирующую плазмиду pFabE-hMUC1-1H7 идентифицировали рестрикционным анализом и секвенированием ДНК. Трансформировали pFabE-hMUC1-1H7 в клетки TG1 E. coli, оптимизировали экспрессию рекомбинантного белка, и идентифицировали pFabE-hMUC1-1H7 вестерн-блоттингом с использованием анти-His антитела.
Для массового производства и очистки рекомбинантного Fab (pFabE-hMUC1-1H7), 500 мл культуры гибридомного клона hMUC1-1H7 обрабатывали 0,5 мМ изопропилтиогалактозида и культивировали при 18°C в течение 16 часов. Культуральный раствор центрифугировали, собирали культуральный супернатант, помещали в аффинную колонку Ni-NTA (Clontech), и соответствующим образом уложенные и собранные белки Fab отделяли с использованием метки His в слитом белке VH-CH.
Рекомбинантный Fab, связанный на колонке, элюировали 10 мМ имидазолом (рН 8,0), и раствор белка центрифугировали (3500 ×g) при 4°С, диализовали с использованием Centricon® и концентрировали.
Пример 12. Анализ МТТ
Рост раковых клеток, обработанных анти-hMUC1 моноклональным антителом (10 мкг/мл), в течение 5 дней измеряли с использованием раствора бромида 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия (МТТ, Sigma-Aldrich). В указанное время раствор МТТ добавляли в каждую лунку, и планшет культивировали при 37°С еще в течение 4 часов. После удаления среды кристаллы формазана растворяли в ДМСО. Развитие окраски контролировали с использованием спектрофотометра при 595 нм с опорной длиной волны 650 нм.
Пример 13. Визуализация биораспределения
Инокулировали 4-недельных самцов мышей BALB/cAnCrj-nu/nu подкожно в правый бок со стороны спины клетками Capan-2 (5×106) в 50% (мас./об.) матригеле. Для инъекции линии клеток рака молочной железы мышам подкожно трансплантировали 17 гранул бета-эстрадиола (USA, FL, Sarasota, Innovative Research of America, гранула, 60-дневное высвобождение). На следующий день мышей подкожно инокулировали в правый бок со стороны спины 5×106 клетками (T47D, ZR75-1) в 50% (мас./об.) матригеле.
Когда объем опухоли достигал в среднем примерно 100 мм3, мышам внутривенно инъецировали IgG-DyLight 755 (5 мг/кг) здоровой мыши или анти-hMUC1 антитело-DyLight 755 (5 мг/кг). Затем изображения мишеней антитела контролировали с использованием системы визуализации in-vivo (IVIS 200, Xenogen Corporation, MA) в 0, 24, 48 часов. Для того, чтобы обнаружить внутриклеточную локализацию анти-hMUCl моноклонального антитела in vivo, инъецировали внутривенно меченное DyLight 488 анти-hMUC1 антитело (5 мг/кг). Через два дня собирали опухолевые ткани и получали замороженные срезы. Интернализацию антител детектировали в срезах опухолей с помощью CLSM (LSM 710, Carl Zeiss).
Пример 14. Получение мышиной модели рака предстательной железы
Для анализа ксенотрансплантата 5×106 клеток Capan-2 в 50% матригеле подкожно инокулировали в правый бок со стороны спины 16 мышам BALB/cAnCrj-nu/nu (n=8). Когда объем опухоли достигал 75 мм3, мышей произвольно делят для обработки на две группы (восемь мышей/группа), т.е. группу обработки ФСБ и группу обработки анти-hMUC1 моноклональным антителом. Антитело вводят внутривенно дважды в неделю в количестве 10 мг/кг. Диаметры опухолей измеряли с 7-дневными интервалами с использованием штангенциркуля и вычисляли объем опухолей с использованием следующего уравнения: (ширина2 × длина)/2. После обработки анти-hMUC1 моноклональным антителом в течение 11 недель мышей умерщвляли, и затем взвешивали опухоли.
Пример 15. Тканевая матрица и иммуногистохимия
Залитые парафином срезы ткани рака молочной железы человека закупали у ISU ABXIS (Seoul, Корея). Тканевые срезы обрабатывали ксилолом в течение 30 минут для удаления парафина, регидратировали с помощью этанола и инкубировали с 3% раствором пероксида водорода в течение 10 минут. Выполняли восстановление антигена в растворе лимонной кислоты (pH 6,0). Срезы блокировали сывороткой здоровой лошади в течение 30 минут и инкубировали с анти-hMUC1 антителом (1 мкг/слайд) при комнатной температуре в течение 2 часов. Срезы промывали и инкубировали с биотинилированным антителом антимышиным IgG (Vector Laboratories, Burlingame, CA) в течение 1 часа. Затем тканевые срезы промывали и инкубировали с HRP-стрептавидином в течение 30 минут. Детектировали иммунореактивность с использованием 3,3-диаминобензидина (DAB, Thermo Fisher Scientific), и тканевые срезы контрастно окрашивали гематоксилином (Muto Pure Chemicals, Tokyo, Япония). Все изображения проверяли с использованием микроскопа (Eclipse E-200, Nikon, Tokyo, Япония).
Пример 16. Характеризация анти-hMUC1 моноклонального антитела
Мышей иммунизировали ФСБ (контроль) или комплексом hMUC1-С и липокомплексом (О) (n=4) (см. пример 5), проводили третью иммунизацию, собирали мышиную сыворотку, и измеряли общее количество rhMUC1-C-специфического IgG с использованием ELISA (см. пример 6) для идентификации образования антител против rhMUC1-C. Результаты показаны на фиг. 1a. На фиг. 1a контроль представляет группа, инокулированная ФСБ, и rhMUC1-C-1, -2, -3 и -4 представляли отдельных мышей. Как можно видеть из фиг. 1a, rhMUC1-C-специфический IgG индуцирован в достаточной степени.
Далее, гибридомные клетки, выделенные из иммунизированных мышей, скринировали согласно примеру 7, и результаты показаны на фиг. 1b и 1с. Фиг. 1b показывает результат скрининга с использованием среды НАТ, и фиг. 1с показывает результат скрининга с использованием среды НТ. На фиг. 1b и 1с # представляет число 96-луночных планшетов, и А-Н представляет название горизонтальных секций планшета. По результатам на фиг. 1b и 1с клоны hMUC1-1Н7 выделяли как гибридомы, продуцирующие rhMUC1-C-специфические моноклональные антитела.
Выбранные гибридомные клетки hMUC1-1Н7 депонированы под инвентарным номером KCLRF-BP-00395 8 марта 2017 в Корейской научно-исследовательской организации по исследованию клеточных линий (KCLRF), расположенной в Yeongeon-dong, Jongno-gu, Seoul, Корея.
Далее, анти-hMUC1 моноклональное антитело очищали из выделенного гибридомного клона hMUC1-1Н7, и очищенное антитело анализировали с использованием ДНС-ПААГ и окрашивания кумасси. Фиг. 2A показывает результаты анализа ELISA по определению присутствия rhMUC1-C-специфического антитела в асцитах, собранных после инъекции гибридомного клона hMUC1-1H7 в перитонеальную полость мышей, причем контрольная сыворотка является результатом в группе, инокулированной ФСБ. Результат показывает, что rhMUC1-C-специфическое антитело присутствует в асцитах мышей, инъецированных клоном hMUC1-1H7, и rhMUC1-C-специфическое антитело выделяли и очищали. Выделенное и очищенное анти-hMUC1 моноклональное антитело анализировали ДНС-ПААГ и окрашиванием кумасси, и результаты показаны на фиг. 2B. На фиг. 2B HC представляет тяжелую цепь, и LC представляет легкую цепь.
Выполняли ELISA для нескольких изотипов IgG для идентификации изотипа полученного анти-MUC1 антитела (см. пример 8), и результат приводится на фиг. 2С. Как можно видеть из фиг. 2С, очищенное анти-hMUC1 антитело является типом IgG1.
Пример 17. Специфический тест на анти-MUC1 антитело в клетках рака молочной железы и клетках рака поджелудочной железы
Для того, чтобы идентифицировать узнает или нет полученное анти-hMUC1 моноклональное антитело белок MUC1 (в здоровых клетках белок MUC1 включает димер, состоящий из домена субъединицы MUC1-N и домена субъединицы MUC1-С, и является гипергликозилированным, но в раковых линиях клеток белок MUC1 преимущественно состоит из домена субъединицы MUC1-С и является гипогликозилированным), клеточные лизаты клеток рака молочной железы (MCF-7, MDA-MB-231, T47D и ZR75-1) отделяли с помощью ДНС-ПААГ, и проводили вестерн-блоттинг с использованием анти-hMUC1 моноклонального антитела и анти-MUC1-CT антитела (см. пример 9.4). Полученные результаты показаны на фиг. 3A. Результаты показывали, что анти-MUC1-CT антитело детектирует белок MUC1 в MCF-7, T47D и ZR75-1, но не обнаруживает в MDA-MB-231. С другой стороны, анти-hMUC1 моноклональное антитело не узнает белок MUC1 во всех образцах клеток. Так как белок MUC-1 не обнаружен в клетках MDA-MB-231, эта клеточная линия используется в качестве отрицательной контрольной группы во всех тестах.
Для того, чтобы определить может или нет анти-hMUC1 моноклональное антитело узнать эндогенный белок MUC1 в интактном (нативном) состоянии, клеточные лизаты клеток MCF-7, MDA-MB-231, T47D и ZR75-1 подвергали иммунопреципитации IgG здоровой мыши или анти-hMUC1 моноклональным антителом, проводили иммуноблоттинг с использованием анти-MUC1-CT антитела (см. пример 9.5), и результаты показаны на фиг. 3B. Как можно видеть из фиг. 3b, анти-hMUC1 моноклональное антитело может эффективно образовывать иммунопреципитат с белком MUC1 в интактном состоянии в клетках MCF-7, T47D и ZR75-1.
Результаты на фиг. 3а показывают, что анти-hMUC1 моноклональное антитело не узнает денатурированный белок MUC1, используемый в вестерн-блоттинге, в то время как результат на фиг.3b показывает, что анти-hMUC1 моноклональное антитело узнает интактный белок MUC1 при раке, что указывает на то, что анти-hMUC1 моноклональное антитело узнает интактную (свойственную) третичную структуру белка MUC1.
Внеклеточный домен MUC1 плотно гликозилирован до 200-500 нм от клеточной поверхности. Таким образом, определяли способно или нет анти-hMUC1 моноклональное антитело узнавать сердевину гликозилированного белка (см. пример 9.6). лизаты клеток T47D обрабатывали PNGазой F и подвергали вестерн-блоттингу с использованием анти-MUC1-CT антитела, анти-MUC1-CT2 антитела, анти-hMUC1 моноклонального антитела (пример 7) или антитела против бета-актина. Результаты показаны на фиг. 3c. Как можно видеть из фиг. 3c, анти-hMUC1 моноклональное антитело не обнаруживает белок MUC1. Между тем, фиг. 3D показывает результат иммунопреципитации лизата клеток T47D, обработанного PNGазой F, анти-hMUC1 моноклональным антителом и последующего его иммуноблоттинга с анти-MUC1-CT или анти-MUC1-CT2 антителом. Как можно видеть из фиг. 3d, анти-hMUCl моноклональное антитело способно образовывать иммунопреципитат с дегликозилированным белком MUC1 в клетках T47D. Эти результаты показывают, что анти-hMUC1 моноклональное антитело может успешно узнавать белок MUC1 в интактном (природном) состоянии вне зависимости от статуса гликозилирования.
Для того, чтобы проверить может или нет анти-hMUCl моноклональное антитело узнавать интактный белок MUC1 в клетках рака поджелудочной железы, разделяли клеточные лизаты клеток рака поджелудочной железы (Capan-1, Capan-2, CFPAC-1 и PANC-1) ДНС-ПААГ, выполняли вестерн-блоттинг с использованием анти-MUC1-CT антитела, анти-hMUC1 антитела или антитела против бета-актина, и результаты приведены на фиг. 4a. Как можно видеть из фиг. 4a, анти-hMUCl моноклональное антитело неспособно узнавать белок MUC1 во всех испытываемых образцах клеток.
Между тем, для того, чтобы определить может или нет анти-hMUCl моноклональное антитело узнавать внутренний белок MUC1 в интактном состоянии, клеточные лизаты различных клеток рака поджелудочной железы (Capan-1, Capan-2, CFPAC-1 и PANC-1) подвергали иммунопреципитации и иммунноблокировали с использованием анти-MUCl антитела и анти-hMUCl моноклонального антитела. Полученные результаты показаны на фиг. 4b. Как можно видеть из фиг. 4b, анти-hMUCl моноклональное антитело может эффективно образовывать иммунопреципитат с интактным белком MUC1 в клетках рака поджелудочной железы (Capan-1 и CFPAC-1).
Пример 18. Идентификация узнавания и интернализации белка MUC1 на клеточной поверхности и в клетке анти-hMUCl моноклональным антителом
Для того, чтобы идентифицировать может или нет анти-hMUCl моноклональное антитело узнавать и связывать белок MUC1 в интактных (неповрежденных) клетках, клетках рака молочной железы (MCF-7, MDA-MB-231, T47D и ZR75-1) и клетках рака поджелудочной железы (Capan-1, Capan-2, CFPAC-1 и PANC-1), осуществляли иммунофлуоресцентное окрашивание, и результаты анализировали конфокальной микроскопией (см. пример 9-7).
Конкретнее, клетки MCF-7, MDA-MB-231, T47D и ZR75-1 инкубировали с анти-hMUCl моноклональным антителом или IgG здоровой мыши при 4°С (для белка MUC1 на клеточной поверхности) или при комнатной температуре (для внутриклеточного белка MUC1) и затем инкубировали в течение 1 часа с вторичным антителом, конъюгированным с Alexa 488 (зеленый), и ядра клеток окрашивали Hoechst 33258 (синий). Полученные флуоресцентные изображения наблюдали в конфокальном микроскопе (CLSM, LSM 710, Carl Zeiss, Jena, Германия) и показаны на фиг. 5A (масштабная шкала 10 мкм). Кроме того, для того чтобы идентифицировать интернализацию анти-hMUC1 моноклонального антитела, клетки MCF-7, MDA-MB-231, T47D и ZR75-1 также окрашивали меченным DyLight 488 (зеленый) анти-hMUC1 моноклональным антителом и культивировали при 37°C в течение 6 часов. Ядра окрашивали Hoechst 33258, и полученные флуоресцентные изображения наблюдали с помощью конфокального микроскопа (CLSM, LSM 710, Carl Zeiss, Jena, Германия) и показаны на фиг. 5B (масштабная шкала 10 мкм).
Кроме того, проверяли связывание анти-hMUC1 моноклонального антитела с белками MUC1, локализованными на клеточной поверхности и во внутриклеточной области клеток рака поджелудочной железы. Линии клеток рака поджелудочной железы Capan-1, Capan-2, CFPAC-1 и PANC-1 культивировали с анти-hMUC1 моноклональным антителом или IgG здоровой мыши при 4°C (на клеточной поверхности) или при комнатной температуре (в клетках), культивировали с конъюгированным вторичным антителом в течение 1 часа, и ядра окрашивали Hoechst 33258. Полученные флуоресцентные изображения наблюдали с помощью конфокального микроскопа (CLSM, LSM 710, Carl Zeiss, Jena, Германия) и показаны на фиг. 6 (масштабная шкала 10 мкм).
Как можно видеть из результатов, представленных на фиг. 5 и 6, анти-hMUC1 антитело заметно окрашивает MUC1 в клетках рака молочной железы (MCF-7, T47D и ZR75-1) и в клетках рака поджелудочной железы (Capan-2 и CFPAC-1), и MUC1 локализован на клеточной поверхности и в клетках.
Эти результаты предполагают, что антитело узнает внеклеточный участок MUC1 С-концевой субъединицы. Эффективность антитела как терапевтического средства можно рассматривать как более зависящую от клеточной интернализации. Поэтому анти-hMUC1 антитело, связанное с DyLight 488, клетками рака молочной железы и клетками рака поджелудочной железы обрабатывали антителом в течение 6 часов, и идентифицировали клеточную интернализацию с помощью флуоресцентной визуализации. Клетки рака поджелудочной железы (Capan-1, Capan-2, CFPAC-1 и PANC-1) обрабатывали меченным DyLight 488 анти-hMUCl моноклональным антителом и культивировали при 37°C в течение 0, 30 минут, 1 часа, 3 часов, 6 часов, 12 часов и 24 часов. Ядра окрашивали Hoechst 33258. Полученные флуоресцентные изображения наблюдали с помощью конфокального микроскопа (CLSM, LSM 710, Carl Zeiss, Jena, Германия) и показывали на фиг. 7 (масштабная шкала 10 мкм). Клеточную интернализацию при раке молочной железы можно видеть на фиг. 5B.
Иными словами, результаты показывали, что анти-hMUC1 моноклональное антитело может нацеливаться на и интернализовать белок MUC1 в живые клетки.
Пример 19. Результаты клонирования вариабельных участков анти-hMUC1 моноклонального антитела
Вариабельные участки тяжелой и легкой цепей анти-hMUC1 моноклонального антитела клонировали из гибридомных клеток (hMUC1-1H7), продуцирующих анти-hMUC1 моноклональное антитело, и выполняли секвенирование ДНК (пример 10). Последовательности, идентифицированные секвенированием ДНК, анализировали с использованием программы BLAST (http://www.ncbi.nlm.nih.gov) для определения гомологии с известными последовательностями. кДНК (кДНК, кодирующая вариабельный участок тяжелой цепи: 393 п.о.; кДНК, кодирующая вариабельный участок легкой цепи: 396 п.о.), кодирующая вариабельный участок тяжелой цепи и легкой цепи hMUC1-1H7 антитела, имеет гомологию последовательностей 80-95% и 93-98% с кодирующей последовательностью вариабельных участков тяжелой цепи и легкой цепи, соответственно, известного мышиного иммуноглобулина (IgG1).
На основании полученных последовательностей ДНК CDR тяжелой и легкой цепей идентифицировали известным методом (определение CDR по Кабат) (таблица 2). Последовательности вариабельного участка тяжелой цепи и легкой цепи показаны ниже в таблице 3.
Таблица 2
Таблица 3
Пример 20. Проверка на идентификацию экспрессии рекомбинантного фрагмента Fab, полученного из анти-hMUC1 моноклонального антитела, и узнавание белка MUC1 раковых клеток рекомбинантным фрагментом Fab
Рекомбинантный фрагмент Fab экспрессировали в E. coli с использованием экспрессирующего вектора pFabE (пример 11).
Вектор pFabE включает два сайта клонирования BstX I и Sfi I, в которые встроены константный участок легкой цепи (CL), константный участок тяжелой цепи (CH1), вариабельный участок легкой цепи (VL) и вариабельный участок тяжелой цепи (VH). Конструировали рекомбинантную экспрессирующую плазмиду pFabE-hMUC1-1H7 путем последовательного субклонирования последовательностей VL и VH hMUC1-1H7 (фиг. 8a). Рекомбинантная плазмида индуцирует бицистронную экспрессию в E. coli слитого белка VL-CL и слитого белка VH-CHl под контролем промотора LacZ. Слитый белок VL-CL включает N-концевую метку OmpA и C-концевую метку Pre-S1, в то время как слитый белок VH-CHl включает N-концевую метку pelB и C-концевую метку His (фиг. 8b). Так как рекомбинантный слитый белок VH-CH1 включает метку His, массовое культивирование E. coli и очистку рекомбинантного Fab hMUC1-1H7 от культурального супернатанта выполняли с использованием аффинной колоночной хроматографии на Ni-NTA.
Для того, чтобы определить может или нет очищенный рекомбинантный Fab (далее в настоящем описании называемый «рекомбинантный Fab-hMUC1-1Н7») узнавать MUC1 раковых клеток, клетки рака молочной железы (MCF-7, MDA-MB-231, T47D и ZR75-7) подвергали иммунофлуоресцентному окрашиванию. Каждые из клеток рака молочной железы MCF-7, MDA-MB-231, T47D и ZR75-1 культивировали вместе с рекомбинантным Fab-hMUC1-1H7 и затем культивировали с вторичным антителом, конъюгированным с Alexa 488, и ядра окрашивали Hoechst 33258. Полученное флуоресцентное изображение наблюдали с помощью конфокального микроскопа (CLSM, LSM 710, Carl Zeiss, Jena, Германия) и показывали на фиг. 8c (масштабная шкала 10 мкм).
Как можно видеть из конфокального изображения на фиг. 8с, рекомбинантный Fab-hMUC1-1Н7 явно окрашивает MUC1 в раковых клетках (MCF-7, T47D и ZR75-7), что указывает, что рекомбинантный Fab-hMUC1-1Н7 узнает MUC1 в клетках рака молочной железы.
Пример 21. Ингибирующее действие анти-hMUC1 моноклонального антитела на пролиферацию клеток рака молочной железы
MUC1 сверхэкспрессируется в различных типах раковых тканей, промотируя пролиферацию клеток. Для того, чтобы определить эффективность анти-hMUC1 моноклонального антитела как противоракового терапевтического средства, проверяли действие анти-hMUC1 моноклонального антитела на пролиферацию клеток рака молочной железы.
Клетки MDA-MB-231, T47D и ZR75-1 обрабатывали анти-hMUC1 антителом (10 мкг/мл; пример 7) или IgG1 (10 мкг/мл) здоровой мыши, и проверяли действие антитела на пролиферацию клеток анализом MTT (пример 12).
Полученные результаты представлены на фиг. 9. На фиг. 9 контроль представляет группу, необработанную антителом. Как видно из фиг. 9, обнаружено, что обработка анти-hMUC1 антителом приводит к существенному замедлению пролиферации клеток T47D и ZR75-1 по сравнению с контрольной группой, обработанной IgG. С другой стороны, анти-hMUC1 антитело не изменяет пролиферацию клеток MDA-MB-231. Эти результаты показывают, что анти-hMUC1 моноклональное антитело имеет селективное противораковое действие против раковых клеток, экспрессирующих MUC1.
Пример 22. Идентификация локализации in-vivo анти-hMUC1 моноклонального антитела, инъецированного при раке молочной и поджелудочной железы
Для того, чтобы показать эффективность in-vivo анти-hMUC1 моноклонального антитела, меченный DyLight 755 нормальный IgG (5 мг/кг) или меченное DyLight 755 анти-hMUC1 моноклональное антитело (5 мг/кг) вводили внутривенно мышам BALB/C nu/nu, имеющим опухоли T47D, ZR75-1 или Capan-2, и выполняли общую флуоресцентную визуализацию (пример 13). Распределение меченного антитела оценивали количественно путем измерения общего потока (протон/с) за 0, 24 и 48 часов.
Полученные результаты показаны на фиг. 10а-10h (рак молочной железы), 11а-11с (рак поджелудочной железы).
Фиг. 10а-10d показывают результат индукции опухолей у мышей путем подкожной инъекции клеток T47D как клеток рака молочной железы, и фиг. 10е-10h показывают результат индукции опухолей у мышей путем подкожной инъекции клеток ZR75-1 как клеток рака молочной железы. На фиг. 10b и 10f показана визуализация иссеченных мышей с использованием системы визуализации IVIS 200 в реальном времени. Фиг. 10c и 10g показывают результаты распределения антител в различных отдельных органах и опухолях. Фиг. 10d и 10h показывают результат наблюдения конфокальной микроскопией (масштабная шкала 10 мкм) срезов опухолей с ядрами, окрашенными DAPI.
Результаты на фиг. 10а, 10b, 10e, 10f, 11a и 11b показывают, что анти-hMUC1 моноклональное антитело специфически локализуется в опухолевом участке. Кроме того, результаты на фиг. 10с и 10g показывают, что, когда опухоли и другие органы разделены, анти-hMUC1 моноклональное антитело локализуется только в опухолевых тканях без воздействия на другие важные органы.
Также результаты показывают, что меченное DyLight анти-hMUC1 моноклональное антитело показывает явное окрашивание в срезе опухоли, в то время как меченный DyLight нормальный IgG не имеет такого действия. Кроме того, конфокальные изображения на фиг. 10d, 10h и 11с также показывают, что анти-hMUC1 моноклональное антитело локализуется в опухолеспецифических клетках.
Эти результаты предполагают, что анти-hMUC1 моноклональное антитело можно использовать для специфического нацеливание на рак молочной железы и рак поджелудочной железы на животных моделях.
Пример 23. Проверка противоракового действия анти-hMUC1 моноклонального антитела на мышиной модели с ксенотрансплантатом
Действие анти-hMUC1 моноклональных антител на рост клеток рака поджелудочной железы проверяли in vivo с использованием мышиной модели с ксенотрансплантатом. Сначала для обеспечения роста опухоли клетки Capan-2 инъецировали подкожно в правый бок со стороны спины мышей NOR (n = 8). Когда размер опухоли достигал 75 мм3, мышам дважды в неделю вводили внутривенно анти-hMUCl моноклональное антитело, и контролировали размер опухоли в течение 11 недель. Получение мышиной модели с ксенотрансплантатом и проверку размера опухоли осуществляли согласно примеру 14.
Во время проверки мышиной модели с ксенотрансплантатом две из восьми мышей в группе с введенным ФСБ умерли, и умерла одна из восьми мышей в группе с введенным анти-hMUCl моноклональным антителом.
Опухолевая ткань, экстрагированная из мышиной модели с ксенотрансплантатом, показана на фиг. 12а, и размер опухоли ((ширина2×длина)/2) опухолей, их масса и масса тела мышей показаны на фиг. 12b, 12c и 12d, соответственно. Как можно видеть из фиг. 12а-12d, введение анти-hMUCl моноклонального антитела ингибирует развитие опухоли поджелудочной железы, и обработка антителом не оказывает вредного влияния на массу тела субъекта.
Пример 24. Проверка экспрессии белка MUC1 в тканях рака молочной железы и рака поджелудочной железы человека
Эксперссируется или нет белок MUC1 в тканях рака молочной железы и рака поджелудочной железы исследовали методами иммуногистохимии. Ткань рака молочной железы и ткани рака поджелудочной железы проверяли при сравнении со здоровыми тканями как контрольной группы. Результаты показаны на фиг. 13 (рак молочной железы) и фиг. 14 (рак поджелудочной железы). Как можно видеть из фиг. 13 и 14, MUC1 экспрессируется в большинстве тканей рака молочной железы и тканей рака поджелудочной железы, в то время как в здоровых тканях молочной железы MUC1 не экспрессируется.
Результаты иммуногистохимического анализа экспрессии MUC1 в ткани рака молочной железы и ткани рака поджелудочной железы показаны в таблице 4 (ткань опухоли молочной железы) и таблице 5 (ткань опухоли поджелудочной железы), соответственно.
Таблица 4
Таблица 5
Как видно из таблицы 4, результаты анализа 51 образца тканей рака молочной железы показывает, что 18% всех образцов положительны на MUC1 в более 75% опухолевых клеток. Положительны на экспрессию MUC1 14% и 25% образцов раковых клеток в 50-74% и 11-40% опухолевых клеток, соответственно. Однако 12% образцов клеток рака молочной железы не экспрессировали MUC1.
Кроме того, как видно из таблицы 5, в случае 33 образцов тканей рака поджелудочной железы 3% образцов положительны на MUC1 в 75% или более опухолевых клеток. Положительны на экспрессию MUC1 9,1% и 48,5% образцов раковых клеток в 50-74% и 11-49% опухолевых клеток, соответственно.
Эти результаты предполагают, что экспрессия MUC1 может применяться при диагностике и лечении рака молочной железы.
Пример 25. Идентификация цитотоксичности АЛК мышиного анти-hMUC1 антитела (1Н7)
АЛК получали путем связывания ММАЕ с антителом 1Н7 в Levene Biopharma (США). Отношение MMAE к антителу в полученном АЛК (отношение лекарства к антителу, DAR) составляет 5,80. Использовали три линии клеток MDA-MB-231, T47D и ZR75-1 для проверки цитотоксичности 1H7-АЛК. Каждую клеточную линию культивировали в 96-луночном планшете, и через 24 часа после начала культивирования обрабатывали 1H7-АЛК в предварительно установленной концентрации, как показано на фиг. 15. Выживание клеток сравнивали с использованием набора CCK-8 (Dojindo, США) через 72 часа после обработки 1H7-АЛК. Обработку CCK-8 выполняли согласно предлагаемому руководству, и измеряли поглощение с использованием микропланшетного ридера I3X (Molecular Devices, США). Выживание клеток T47D и ZR75-1, обработанных 1H7-АЛК, значительно ниже, чем выживание контрольной группы, необработанной 1H7-АЛК. Напротив, выживание клеток MDA-MB-231, обработанных 1H7-АЛК, существенно не отличается от контрольной группы. Эти результаты означали, что 1H7-АЛК имеет селективное противораковое действие на раковые клетки, экспрессирующие MUC1.
Пример 26. Ингибирующее действие анти-hMUC моноклонального антитела (1H7)-АЛК на пролиферацию рака в тканях, полученных от больной раком молочной железы
Ингибирующее действие 1H7-АЛК, упомянутого в примере 25, на пролиферацию рака идентифицировали на животных моделях. Ткань рака молочной железы (TNBC), полученную от пациентки со сверхэкспрессированным MUC1, закупленную у Jung-ah Biotech (Сеул, Корея), трансплантировали мышам NRGA, и в них вводили 1H7-АЛК инъекцией в сосуды, когда ткани рака молочной железы, трансплантированные мышам, выросли до определенного размера (100-200 мм3). Как видно из фиг. 16, объем раковых тканей у мышей, которым вводили 1H7-АЛК, снижался со временем, в то время как объем раковых тканей у контрольных мышей, которым 1H7-АЛК не вводили, повышался пропорционально времени. Результаты показывали, что 1H7-АЛК имеет действие ингибирования роста раковых клеток на уровне ткани в раковых тканях, полученных от больных, экспрессирующих MUC1.
Пример 27. Получение гуманизированного антитела на основе 1H7
Гуманизированные антитела получали на основе антитела 1H7, которое использовали для идентификации цитотоксичности и противоракового действия на животных моделях через получение АЛК. Гуманизированное антитело получали при поддержке Центра по разработке новых лекарственных средств в Osong High-Tech Medical Industry Promotion Foundation (Осон, Корея) и слитых антител (Fusion Antibodies) (Великобритания). Получали шесть последовательностей тяжелой цепи и шесть последовательностей легкой цепи, используя один и тот же сайт узнавания антигена антитела 1H7 и изменяя последовательность вариабельного участка иного, чем сайт узнавания антигена. Каждая аминокислотная последовательность показана в таблице 6.
Таблица 6
Пример 28. Измерение аффинности связывания гуманизированного антитела с hMUC1-C
Аффинность связывания анти-hMUC1-С гуманизированного антитела, полученного в примере 27, с белком hMUC1 измеряли методом ELISA. Анализ аффинности ELISA выполняли, сенсибилизируя 96-луночный иммунопланшет полученным анти-hMUC1-С гуманизированным антителом в одной и той же концентрации и блокируя его суперблокирующим раствором. Затем разбавляли белок МВР-hMUC1-С и добавляли в иммунопланшет, сенсибилизированный анти-hMUC1-С гуманизированным антителом, и оставляли при 37°С в инкубаторе для индукции связывания. Планшет промывали три раза раствором для промывки и вводили во взаимодействие с анти-МВР антителом, конъюгированным с HRP. Реакцию развивали с использованием раствора субстрата ТМВ, и реакцию обрывали, используя 2N HCl. Затем величину поглощения, полученную за счет реакции связывания антиген-антитело, измеряли миропланшетным ридером I3X (Molecular Devices, USA), и выполняли колориметрический анализ. Фиг. 17 показывает различие в аффинности связывания нанесенного гуманизированного антитела с MBP-hMUC1-C.
Пример 29. Идентификация гомологии эпитопов между анти-hMUC1-С гуманизированным антителом и анти-hMUC1-С мышиным антителом (1Н7)
Гомологию эпитопов полученного анти-hMUC1-С гуманизированного антитела и анти-hMUC1-С мышиного антитела идентифицировали конкурентным ELISA. Белок MBP-hMUC1-C разбавляли и наносили в различных концентрациях на 96-луночные иммунопланшеты. Затем 50 нМ меченного биотином анти-hMUC1-С гуманизированного антитела и анти-hMUC1-С мышиного антитела серийно разводили от 5 мкМ, одновременно добавляли в планшет, сенсибилизированный белком MBP-hMUC1-C, и оставляли стоять для индукции реакции. Меченный пероксидазой хрена стрептавидин обрабатывали при постоянной концентрации для детекции меченного биотином анти-hMUC1-С гуманизированного антитела. Раствор субстрата ТМВ, используемый для идентификации аффинности, использовали для колориметрического анализа. Поглощение за счет реакции измеряли и анализировали с использованием микропланшетного ридера I3X (Molecular Devices, США). Результат показан на фиг. 18, и поглощение снижается, когда концентрация анти-hMUC1-C мышиного антитела, немеченного биотином, возрастает, что указывает, что анти-hMUC1-C гуманизированное антитело и анти-hMUC1-C мышиное антитело узнают один и тот же эпитоп.
Пример 30. Анализ картины связывания клеток анти-hMUC1-C гуманизированным антителом к hMUC1-C (анализ FACS)
Анализ FACS выполняли для того, чтобы проанализировать картину связывания с клетками анти-hMUC1 гуманизированного антитела к hMUC1-C, на линиях клеток, известных как экспрессирующие hMUC1. Каждую клеточную линию культивировали в культуральной среде, и определенное предварительно число клеток делят по соответствующим пробиркам. Затем клетки фиксировали 4% параформальдегидом, центрифугировали и промывали один раз раствором для анализа FACS. Полученную клеточную линию обрабатывали анти-hMUC1 гуманизированным антителом и культивировали при 4°С для того, чтобы соответствующее гуманизированное антитело могло связаться с клетками. Затем клетки обрабатывали меченным FITC антителом к античеловеческому IgG, и выполняли анализ FACS с использованием BD FACS Canto (BD, США). Результаты анализа показаны на фиг. 19, и их сравнивали с результатами для человеческого IgG как контрольного вещества. Величины интенсивности флуоресценции повышаются из-за связывания между анти-hMUC1 гуманизированным антителом и hMUC1-C в трех линиях клеток, известных как экспрессирующие hMUC1, и величина интенсивности флуоресценции не изменяется в линии клеток MDA-MB-231, которая не экспрессирует hMUC1. Это показывает, что полученное анти-hMUC1 гуманизированное антитело специфически узнает hMUC1, экспрессированный в клетках.
Анализ FACS показывает, что при обработке линии клеток ZR75-1 находили, что при экспрессии hMUC1 с различными концентрациями анти-hMUC1-С гуманизированного антитела (G3) и анти-hMUC1 мышиного антитела (1Н7) величина интенсивности флуоресценции возрастает в зависимости от концентрации антитела. Результаты анализа показаны на фиг. 20.
Пример 31. Идентификация цитотоксичности анти-hMUC1 гуманизированного антитела АЛК (G3-АЛК)
Пример 31-1. Идентификация цитотоксичности в линии клеток рака молочной железы
АЛК получали связыванием ММАЕ с анти-hMUC1 гуманизированным антителом в Alteoxen (Тэджон, Корея). Отношение MMAE к антителу полученного АЛК (DAR) составляет 4,8. Три линии клеток MDA-MB-231 (MUC1-, HER2-), T47D (MUC1+, HER2+) и ZR75-1 (MUC1+, HER2+) использовали для определения цитотоксичности полученного АЛК. Каждую клеточную линию культивировали в 96-луночном планшете. Через 24 часа после начала культивирования клетки обрабатывали в соответствующих концентрациях MUC1-АЛК (G3-АЛК) и кадсилой (HER2-АЛК), используемой в качестве контрольной группы. Через 72 часа после обработки АЛК сравнивали выживание клеток с использованием набора CellTiterGlo (Promega, США). Способ обработки с CellTiterGlo выполняли согласно руководству, и измеряли поглощение с использованием микропланшетного ридера I3X (Molecular Devices, США). Объемы роста клеток T47D и ZR75-1, обработанных G3-АЛК, существенно меньше, чем объемы роста контрольной группы, необработанной G3-АЛК (фиг. 21). С другой стороны, выживание клеток MDA-MB-231, обработанных АЛК, несущественно отличается от выживания контрольной группы. Эти результаты показывали, что G3-АЛК оказывает селективное действие на раковые клетки, экспрессирующие MUC1. Кадсила, используемая в качестве контрольной группы, имеет низкую цитотоксичность по сравнению с G3-АЛК, как полагали, из-за низкого уровня экспрессии Her2 в испытываемых клетках.
Пример 31-2. Идентификация цитотоксичности в линиях клеток миелоидного лейкоза
Цитотоксичность в линиях клеток миелоидного лейкоза идентифицировали с использованием того же анти-hMUC1 гуманизированного антитела АЛК, что и в примере 31-1. Линии клеток миелоидного лейкоза, используемые в данном случае, были клетками двух типов штаммов K562 (MUC1+) и KG-1 (MUC1-). Каждую клеточную линию культивировали в 96-луночном планшете, и через 24 часа после начала культивирования клетки обрабатывали анти-hMUC1 гуманизированным антителом АЛК в соответствующих концентрациях. Выживание клеток (жизнеспособность, %) сравнивали в анализе МТТ через 72 часа после обработки анти-hMUC1 гуманизированным антителом АЛК. Выживание клеток, обработанных анти-hMUC1 гуманизированным антителом АЛК, существенно меньше, чем выживание необработанной контрольной группы. Этот результат показан на фиг. 22, и цитотоксичность обнаружена только в линии клеток K562, которая, как обнаружено, была одной из двух клеточных линий, которая экспрессирует MUC1.
Пример 32. Ингибирующее действие анти-hMUC1 гуманизированного антитела АЛК на пролиферацию рака в тканях рака молочной железы, полученных от пациентки
Ингибирующее действие на пролиферацию рака конъюгата анти-hMUC1-С гуманизированное антитело - лекарство, упомянутого выше в примере 31, идентифицировали на животных моделях. Ткани рака молочной железы (TNBC), полученные от пациенток, сверхэкспрессирующих MUC1, закупленные у Jung-ah Biotech (Сеул, Корея), трансплантировали 24 мышам NRGA. Когда ткани рака молочной железы, трансплантированные мышам, выросли до определенного размера (100-200 мм3), мышей произвольно отбирали и делили на 4 группы (n=5). Соответствующие группы были отрицательной контрольной группой, группой, которой вводили кадсилу (5 мг/кг), и группами, которым вводили анти-hMUC1-G3-АЛК (5 мг/кг и 10 мг/кг), введение которым осуществляли инъекцией в сосуды один раз в неделю в целом три раза. Как можно видеть из фиг. 23, объем раковых тканей у мышей, которым вводили конъюгат анти-hMUC1-С гуманизированное антитело - лекарство, уменьшался, в то время как объем раковых тканей у мышей контрольной группы, которым не вводили конъюгат анти-hMUC1-С гуманизированное антитело - лекарство, не показывал статистически значимого различия. Эти результаты показывают, что конъюгат анти-hMUC1-С гуманизированное антитело - лекарство имеет ингибирующее действие на рост раковых тканей, экспрессирующих MUC1, в частности, тканей рака молочной железы трижды негативного рака молочной железы. Не наблюдали статистически значимого изменения массы у какого-либо подопытного животного, и обнаружено, что рост раковых клеток эффективно ингибируется в зависимости от концентрации. Статистический анализ выполняли двухфакторным ANOVA.
Инвентарный номер
Уполномоченный орган для депонирования - Корейская научно-исследовательская организации по исследованию клеточных линий
Инвентарный номер KCLRFBP00395
Дата поступления 20170308
Промышленная применимость
Согласно настоящему изобретению, антитело, специфически связывающееся с MUC1, или его антигенсвязывающий фрагмент проявляли великолепную аффинность и связывающую способность в отношении MUC1, и конъюгат антитело-лекарство, в котором лекарственное средство конъюгировано с антителом или его антигенсвязывающим фрагментом, путем специфического связывания эффективно и специфически или селективно доставляет лекарственное средство в MUC1-экспрессирующие клетки. Соответственно, анти-MUC1 антитело и конъюгат антитело-лекарство согласно настоящему изобретению могут с пользой применяться для лечения MUC1-ассоциировнных заболеваний, таких как рак.
Хотя подробно описаны специфические формы настоящего изобретения, специалистам в данной области техники будет понятно, что данное описание предоставляется как предпочтительные воплощения и не должно рассматриваться как ограничивающее настоящее изобретение. Следовательно, объем настоящего изобретения по существу определен прилагаемой формулой изобретения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> PEPTRON, INC.
<120> ANTIBODY BINDING SPECIFICALLY TO MUC1 AND USE THEREOF
<130> 4240-489
<150> KR10-2017-0035622
<151> 2017-03-21
<150> KR10-2018-0032592
<151> 2018-03-21
<150> PCT/KR2018/003267
<151> 2018-03-21
<160> 26
<170> PatentIn version 3.5
<210> 1
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region CDR1
<400> 1
Gly Tyr Thr Phe Thr Ser Tyr Trp Met His
1 5 10
<210> 2
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region CDR2
<400> 2
Tyr Ile Asn Pro Gly Thr Gly Tyr Ile Glu Tyr Asn Gln Lys Phe Lys
1 5 10 15
<210> 3
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region CDR3
<400> 3
Ser Thr Ala Pro Phe Asp Tyr
1 5
<210> 4
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Light chain variable region CDR1
<400> 4
Lys Ala Ser Gln Asp Ile Lys Ser Tyr Leu Ser
1 5 10
<210> 5
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Light chain variable region CDR2
<400> 5
Tyr Ala Thr Arg Leu Ala Asp
1 5
<210> 6
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Light chain variable region CDR3
<400> 6
Leu Gln Tyr Asp Glu Ser Pro Tyr Thr
1 5
<210> 7
<211> 1255
<212> PRT
<213> Artificial Sequence
<220>
<223> MUC1
<400> 7
Met Thr Pro Gly Thr Gln Ser Pro Phe Phe Leu Leu Leu Leu Leu Thr
1 5 10 15
Val Leu Thr Val Val Thr Gly Ser Gly His Ala Ser Ser Thr Pro Gly
20 25 30
Gly Glu Lys Glu Thr Ser Ala Thr Gln Arg Ser Ser Val Pro Ser Ser
35 40 45
Thr Glu Lys Asn Ala Val Ser Met Thr Ser Ser Val Leu Ser Ser His
50 55 60
Ser Pro Gly Ser Gly Ser Ser Thr Thr Gln Gly Gln Asp Val Thr Leu
65 70 75 80
Ala Pro Ala Thr Glu Pro Ala Ser Gly Ser Ala Ala Thr Trp Gly Gln
85 90 95
Asp Val Thr Ser Val Pro Val Thr Arg Pro Ala Leu Gly Ser Thr Thr
100 105 110
Pro Pro Ala His Asp Val Thr Ser Ala Pro Asp Asn Lys Pro Ala Pro
115 120 125
Gly Ser Thr Ala Pro Pro Ala His Gly Val Thr Ser Ala Pro Asp Thr
130 135 140
Arg Pro Ala Pro Gly Ser Thr Ala Pro Pro Ala His Gly Val Thr Ser
145 150 155 160
Ala Pro Asp Thr Arg Pro Ala Pro Gly Ser Thr Ala Pro Pro Ala His
165 170 175
Gly Val Thr Ser Ala Pro Asp Thr Arg Pro Ala Pro Gly Ser Thr Ala
180 185 190
Pro Pro Ala His Gly Val Thr Ser Ala Pro Asp Thr Arg Pro Ala Pro
195 200 205
Gly Ser Thr Ala Pro Pro Ala His Gly Val Thr Ser Ala Pro Asp Thr
210 215 220
Arg Pro Ala Pro Gly Ser Thr Ala Pro Pro Ala His Gly Val Thr Ser
225 230 235 240
Ala Pro Asp Thr Arg Pro Ala Pro Gly Ser Thr Ala Pro Pro Ala His
245 250 255
Gly Val Thr Ser Ala Pro Asp Thr Arg Pro Ala Pro Gly Ser Thr Ala
260 265 270
Pro Pro Ala His Gly Val Thr Ser Ala Pro Asp Thr Arg Pro Ala Pro
275 280 285
Gly Ser Thr Ala Pro Pro Ala His Gly Val Thr Ser Ala Pro Asp Thr
290 295 300
Arg Pro Ala Pro Gly Ser Thr Ala Pro Pro Ala His Gly Val Thr Ser
305 310 315 320
Ala Pro Asp Thr Arg Pro Ala Pro Gly Ser Thr Ala Pro Pro Ala His
325 330 335
Gly Val Thr Ser Ala Pro Asp Thr Arg Pro Ala Pro Gly Ser Thr Ala
340 345 350
Pro Pro Ala His Gly Val Thr Ser Ala Pro Asp Thr Arg Pro Ala Pro
355 360 365
Gly Ser Thr Ala Pro Pro Ala His Gly Val Thr Ser Ala Pro Asp Thr
370 375 380
Arg Pro Ala Pro Gly Ser Thr Ala Pro Pro Ala His Gly Val Thr Ser
385 390 395 400
Ala Pro Asp Thr Arg Pro Ala Pro Gly Ser Thr Ala Pro Pro Ala His
405 410 415
Gly Val Thr Ser Ala Pro Asp Thr Arg Pro Ala Pro Gly Ser Thr Ala
420 425 430
Pro Pro Ala His Gly Val Thr Ser Ala Pro Asp Thr Arg Pro Ala Pro
435 440 445
Gly Ser Thr Ala Pro Pro Ala His Gly Val Thr Ser Ala Pro Asp Thr
450 455 460
Arg Pro Ala Pro Gly Ser Thr Ala Pro Pro Ala His Gly Val Thr Ser
465 470 475 480
Ala Pro Asp Thr Arg Pro Ala Pro Gly Ser Thr Ala Pro Pro Ala His
485 490 495
Gly Val Thr Ser Ala Pro Asp Thr Arg Pro Ala Pro Gly Ser Thr Ala
500 505 510
Pro Pro Ala His Gly Val Thr Ser Ala Pro Asp Thr Arg Pro Ala Pro
515 520 525
Gly Ser Thr Ala Pro Pro Ala His Gly Val Thr Ser Ala Pro Asp Thr
530 535 540
Arg Pro Ala Pro Gly Ser Thr Ala Pro Pro Ala His Gly Val Thr Ser
545 550 555 560
Ala Pro Asp Thr Arg Pro Ala Pro Gly Ser Thr Ala Pro Pro Ala His
565 570 575
Gly Val Thr Ser Ala Pro Asp Thr Arg Pro Ala Pro Gly Ser Thr Ala
580 585 590
Pro Pro Ala His Gly Val Thr Ser Ala Pro Asp Thr Arg Pro Ala Pro
595 600 605
Gly Ser Thr Ala Pro Pro Ala His Gly Val Thr Ser Ala Pro Asp Thr
610 615 620
Arg Pro Ala Pro Gly Ser Thr Ala Pro Pro Ala His Gly Val Thr Ser
625 630 635 640
Ala Pro Asp Thr Arg Pro Ala Pro Gly Ser Thr Ala Pro Pro Ala His
645 650 655
Gly Val Thr Ser Ala Pro Asp Thr Arg Pro Ala Pro Gly Ser Thr Ala
660 665 670
Pro Pro Ala His Gly Val Thr Ser Ala Pro Asp Thr Arg Pro Ala Pro
675 680 685
Gly Ser Thr Ala Pro Pro Ala His Gly Val Thr Ser Ala Pro Asp Thr
690 695 700
Arg Pro Ala Pro Gly Ser Thr Ala Pro Pro Ala His Gly Val Thr Ser
705 710 715 720
Ala Pro Asp Thr Arg Pro Ala Pro Gly Ser Thr Ala Pro Pro Ala His
725 730 735
Gly Val Thr Ser Ala Pro Asp Thr Arg Pro Ala Pro Gly Ser Thr Ala
740 745 750
Pro Pro Ala His Gly Val Thr Ser Ala Pro Asp Thr Arg Pro Ala Pro
755 760 765
Gly Ser Thr Ala Pro Pro Ala His Gly Val Thr Ser Ala Pro Asp Thr
770 775 780
Arg Pro Ala Pro Gly Ser Thr Ala Pro Pro Ala His Gly Val Thr Ser
785 790 795 800
Ala Pro Asp Thr Arg Pro Ala Pro Gly Ser Thr Ala Pro Pro Ala His
805 810 815
Gly Val Thr Ser Ala Pro Asp Thr Arg Pro Ala Pro Gly Ser Thr Ala
820 825 830
Pro Pro Ala His Gly Val Thr Ser Ala Pro Asp Thr Arg Pro Ala Pro
835 840 845
Gly Ser Thr Ala Pro Pro Ala His Gly Val Thr Ser Ala Pro Asp Thr
850 855 860
Arg Pro Ala Pro Gly Ser Thr Ala Pro Pro Ala His Gly Val Thr Ser
865 870 875 880
Ala Pro Asp Thr Arg Pro Ala Pro Gly Ser Thr Ala Pro Pro Ala His
885 890 895
Gly Val Thr Ser Ala Pro Asp Thr Arg Pro Ala Pro Gly Ser Thr Ala
900 905 910
Pro Pro Ala His Gly Val Thr Ser Ala Pro Asp Thr Arg Pro Ala Pro
915 920 925
Gly Ser Thr Ala Pro Pro Ala His Gly Val Thr Ser Ala Pro Asp Asn
930 935 940
Arg Pro Ala Leu Gly Ser Thr Ala Pro Pro Val His Asn Val Thr Ser
945 950 955 960
Ala Ser Gly Ser Ala Ser Gly Ser Ala Ser Thr Leu Val His Asn Gly
965 970 975
Thr Ser Ala Arg Ala Thr Thr Thr Pro Ala Ser Lys Ser Thr Pro Phe
980 985 990
Ser Ile Pro Ser His His Ser Asp Thr Pro Thr Thr Leu Ala Ser His
995 1000 1005
Ser Thr Lys Thr Asp Ala Ser Ser Thr His His Ser Ser Val Pro
1010 1015 1020
Pro Leu Thr Ser Ser Asn His Ser Thr Ser Pro Gln Leu Ser Thr
1025 1030 1035
Gly Val Ser Phe Phe Phe Leu Ser Phe His Ile Ser Asn Leu Gln
1040 1045 1050
Phe Asn Ser Ser Leu Glu Asp Pro Ser Thr Asp Tyr Tyr Gln Glu
1055 1060 1065
Leu Gln Arg Asp Ile Ser Glu Met Phe Leu Gln Ile Tyr Lys Gln
1070 1075 1080
Gly Gly Phe Leu Gly Leu Ser Asn Ile Lys Phe Arg Pro Gly Ser
1085 1090 1095
Val Val Val Gln Leu Thr Leu Ala Phe Arg Glu Gly Thr Ile Asn
1100 1105 1110
Val His Asp Val Glu Thr Gln Phe Asn Gln Tyr Lys Thr Glu Ala
1115 1120 1125
Ala Ser Arg Tyr Asn Leu Thr Ile Ser Asp Val Ser Val Ser Asp
1130 1135 1140
Val Pro Phe Pro Phe Ser Ala Gln Ser Gly Ala Gly Val Pro Gly
1145 1150 1155
Trp Gly Ile Ala Leu Leu Val Leu Val Cys Val Leu Val Ala Leu
1160 1165 1170
Ala Ile Val Tyr Leu Ile Ala Leu Ala Val Cys Gln Cys Arg Arg
1175 1180 1185
Lys Asn Tyr Gly Gln Leu Asp Ile Phe Pro Ala Arg Asp Thr Tyr
1190 1195 1200
His Pro Met Ser Glu Tyr Pro Thr Tyr His Thr His Gly Arg Tyr
1205 1210 1215
Val Pro Pro Ser Ser Thr Asp Arg Ser Pro Tyr Glu Lys Val Ser
1220 1225 1230
Ala Gly Asn Gly Gly Ser Ser Leu Ser Tyr Thr Asn Pro Ala Val
1235 1240 1245
Ala Ala Thr Ser Ala Asn Leu
1250 1255
<210> 8
<211> 192
<212> PRT
<213> Artificial Sequence
<220>
<223> MUC1 Extracellular domain
<400> 8
Ala Ser Gly Ser Ala Ser Gly Ser Ala Ser Thr Leu Val His Asn Gly
1 5 10 15
Thr Ser Ala Arg Ala Thr Thr Thr Pro Ala Ser Lys Ser Thr Pro Phe
20 25 30
Ser Ile Pro Ser His His Ser Asp Thr Pro Thr Thr Leu Ala Ser His
35 40 45
Ser Thr Lys Thr Asp Ala Ser Ser Thr His His Ser Ser Val Pro Pro
50 55 60
Leu Thr Ser Ser Asn His Ser Thr Ser Pro Gln Leu Ser Thr Gly Val
65 70 75 80
Ser Phe Phe Phe Leu Ser Phe His Ile Ser Asn Leu Gln Phe Asn Ser
85 90 95
Ser Leu Glu Asp Pro Ser Thr Asp Tyr Tyr Gln Glu Leu Gln Arg Asp
100 105 110
Ile Ser Glu Met Phe Leu Gln Ile Tyr Lys Gln Gly Gly Phe Leu Gly
115 120 125
Leu Ser Asn Ile Lys Phe Arg Pro Gly Ser Val Val Val Gln Leu Thr
130 135 140
Leu Ala Phe Arg Glu Gly Thr Ile Asn Val His Asp Val Glu Thr Gln
145 150 155 160
Phe Asn Gln Tyr Lys Thr Glu Ala Ala Ser Arg Tyr Asn Leu Thr Ile
165 170 175
Ser Asp Val Ser Val Ser Asp Val Pro Phe Pro Phe Ser Ala Gln Ser
180 185 190
<210> 9
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> MUC1 SEA domain
<400> 9
Pro Gln Leu Ser Thr Gly Val Ser Phe Phe Phe Leu Ser Phe His Ile
1 5 10 15
Ser Asn Leu Gln Phe Asn Ser Ser Leu Glu Asp Pro Ser Thr Asp Tyr
20 25 30
Tyr Gln Glu Leu Gln Arg Asp Ile Ser Glu Met Phe Leu Gln Ile Tyr
35 40 45
Lys Gln Gly Gly Phe Leu Gly Leu Ser Asn Ile Lys Phe Arg Pro Gly
50 55 60
Ser Val Val Val Gln Leu Thr Leu Ala Phe Arg Glu Gly Thr Ile Asn
65 70 75 80
Val His Asp Val Glu Thr Gln Phe Asn Gln Tyr Lys Thr Glu Ala Ala
85 90 95
Ser Arg Tyr Asn Leu Thr Ile Ser Asp Val Ser Val Ser Asp Val Pro
100 105 110
Phe Pro Phe Ser Ala Gln Ser
115
<210> 10
<211> 55
<212> PRT
<213> Artificial Sequence
<220>
<223> MUC1-C Extracellular domain
<400> 10
Ser Val Val Val Gln Leu Thr Leu Ala Phe Arg Glu Gly Thr Ile Asn
1 5 10 15
Val His Asp Val Glu Thr Gln Phe Asn Gln Tyr Lys Thr Glu Ala Ala
20 25 30
Ser Arg Tyr Asn Leu Thr Ile Ser Asp Val Ser Val Ser Asp Val Pro
35 40 45
Phe Pro Phe Ser Ala Gln Ser
50 55
<210> 11
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> CpG-DNA
<400> 11
agcagcgttc gtgtcggcct 20
<210> 12
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> sense primer
<400> 12
ccatggcctc aggctctgca tc 22
<210> 13
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<223> antisense primer
<400> 13
ctcgagagac tgggcagaga aaggaaat 28
<210> 14
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> primer
<400> 14
ggaagatcta tagacagatg ggggtgtcgt tttggc 36
<210> 15
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> primer
<220>
<221> misc_feature
<222> (18)..(18)
<223> n is a, c, g, or t
<400> 15
cttccggaat tcsargtnma gctgsagsag tcwgg 35
<210> 16
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> primer
<400> 16
ggtgcatgcg gatacagttg gtgcagcatc 30
<210> 17
<211> 32
<212> DNA
<213> Artificial Sequence
<220>
<223> primer
<400> 17
gggagctcga yattgtgmts acmcarwctm ca 32
<210> 18
<211> 42
<212> DNA
<213> Artificial Sequence
<220>
<223> forward primer
<220>
<221> misc_feature
<222> (25)..(25)
<223> n is a, c, g, or t
<400> 18
ggcccagccg gccatggccs argtnmagct gsagsagtcw gg 42
<210> 19
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> Reverse primer
<400> 19
ggccgtgctg gccccgacag atgggggtgt cgttttggc 39
<210> 20
<211> 71
<212> DNA
<213> Artificial Sequence
<220>
<223> Forward primer
<400> 20
ccattgcagt ggcactggct ggtttcgcta ccgtagcaca ggcagccgay attgtgmtsa 60
cmcarwctmc a 71
<210> 21
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Reverse primer
<400> 21
ccaccgtact ggcggataca gttggtgcag catc 34
<210> 22
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<223> hMUC1-1H7_Heavy chain variable region
<400> 22
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Val Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Gly Thr Gly Tyr Ile Glu Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Ser Thr Ala Pro Phe Asp Tyr Trp Gly Gln Gly Thr Thr Leu
100 105 110
Thr Val Ser Ser
115
<210> 23
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> hMUC1-1H7_Light chain variable region
<400> 23
Asp Ile Val Ile Thr Gln Ser Pro Ser Ser Met Tyr Ala Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Ile Lys Ser Tyr
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Trp Lys Ser Pro Lys Thr Leu Ile
35 40 45
Tyr Tyr Ala Thr Arg Leu Ala Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Gln Asp Tyr Ser Leu Thr Ile Ser Ser Leu Glu Ser
65 70 75 80
Asp Asp Thr Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp Glu Ser Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 24
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<223> G3_Heavy chain variable region
<400> 24
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Val Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Gln Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Gly Thr Gly Tyr Ile Glu Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Asp Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Ser Thr Ala Pro Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 25
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> G3_Light chain variable region
<400> 25
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ala Ser Gln Asp Ile Lys Ser Tyr
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Tyr Ala Thr Arg Leu Ala Asp Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Leu Gln Tyr Asp Glu Ser Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 26
<211> 576
<212> DNA
<213> Artificial Sequence
<220>
<223> hMUC1-C
<400> 26
gcctcaggct ctgcatcagg ctcagcttct actctggtgc acaacggcac ctctgccagg 60
gctaccacaa ccccagccag caagagcact ccattctcaa ttcccagcca ccactctgat 120
actcctacca cccttgccag ccatagcacc aagactgatg ccagtagcac tcaccatagc 180
tcggtacctc ctctcacctc ctccaatcac agcacttctc cccagttgtc tactggggtc 240
tctttctttt tcctgtcttt tcacatttca aacctccagt ttaattcctc tctggaagat 300
cccagcaccg actactacca agagctgcag agagacattt ctgaaatgtt tttgcagatt 360
tataaacaag ggggttttct gggcctctcc aatattaagt tcaggccagg atctgtggtg 420
gtacaattga ctctggcctt ccgagaaggt accatcaatg tccacgacgt ggagacacag 480
ttcaatcagt ataaaacgga agcagcctct cgatataacc tgacgatctc agacgtcagc 540
gtgagtgatg tgccatttcc tttctctgcc cagtct 576
<---
Реферат
Изобретение относится к области биотехнологии. Предложено антитело или его антигенсвязывающий фрагмент, специфически связывающиеся с муцином 1 (MUC1). Также представлены включающие указанное анти-MUC1 антитело конъюгат антитело-лекарство, биспецифическое антитело, Т-клетка, NK-клетка, фармацевтические композиции для профилактики или лечения рака. Также изобретение относится к нуклеиновой кислоте, кодирующей указанное антитело или его антигенсвязывающий фрагмент, вектору и клетке-хозяину, несущим указанную нуклеиновую кислоту, и способу получения анти-MUC1 антитела с использованием указанных вектора и клетки-хозяина. Изобретение обеспечивает исключительную аффинность и силу связывания антитела или его антигенсвязывающего фрагмента с MUC1 и может эффективно применяться для лечения связанного с MUC1 заболевания, например рака. 13 н. и 13 з.п. ф-лы, 45 ил., 6 табл., 32 пр.
Формула
Документы, цитированные в отчёте о поиске
Специфические к опухоли антитела и их применение




Комментарии