Анализ связывания с лигандом для обнаружения гиббереллинов - RU2748481C2
Код документа: RU2748481C2
Чертежи






Описание
Область техники
Настоящее изобретение относится к анализу связывания с лигандом, в частности, но не исключительно, настоящее изобретение относится к анализу связывания с лигандом для обнаружения гиббереллинов в ячмене.
Уровень техники
Гиббереллины или гиббереллиновые кислоты (ГК) представляют собой растительные гормоны, которые регулируют рост и влияют на различные процессы развития, включая выход в трубку, образование почки, покой, цветение, формирование пола, индукцию ферментов и старение листьев и плодов.
Все известные гиббереллины представляют собой тетрациклические дитерпеновые кислоты, которые синтезируются посредством терпеноидного пути в пластидах и затем модифицируются в эндоплазматической сети и цитозоле до тех пор, пока они не достигнут своей биологически активной формы. Все гиббереллины получены через энт-гиббереллановый скелет, но синтезируются через энт-каурен.
Проблема в данной области техники состоит в том, что тест для обнаружения гиббереллинов требует специального оборудования, что делает его дорогостоящим и трудозатратным.
Цель изобретения
Соответственно, целью настоящего изобретения является создание анализа связывания с лигандом для обнаружения гиббереллинов, который по меньшей мере частично облегчает проблему, связанную с предшествующим уровнем техники.
Сущность изобретения
В соответствии с первым аспектом изобретения предложен анализ связывания с лигандом для обнаружения наличия гиббереллинов в образце, включающий:
- мишень-связывающий элемент, выбранный для связывания с гиббереллинами; и
- мишень-связывающий элемент, связанный с визуальным индикатором, при этом визуальный индикатор показывает наличие гиббереллинов в образце, когда мишень-связывающий элемент связывается с гиббереллинами.
Гиббереллины представляют собой гибберелловые кислоты ГК1, ГК3, ГК4 или ГК7.
Мишень-связывающий элемент представляет собой целевой фрагмент. Фрагмент является аптамером.
Аптамер содержит 62 нуклеотида с последовательностью нуклеиновой кислоты 5’-NHMCVNNNHDGCTGAGGTATGCNNNHWNDYDDNDNNHHHNHNVVHNNNNNDNNDBNHNNNHD-3’ (SEQ ID NO: 12),
в которой Y представляет собой T или C;
в которой M представляет собой A или C;
в которой W представляет собой A или T;
в которой B представляет собой G или C или T;
в которой D представляет собой A или G или T;
в которой H представляет собой A или C или T;
в которой V представляет собой A или G или C;
в которой N представляет собой A или G или C или T, неизвестный или другой;
или ее комплементарную цепь, или РНК-эквивалент молекулы или ее комплементарной цепи.
Аптамер содержит 62 нуклеотида с последовательностью нуклеиновой кислоты 5'-TGAGGDVNVNGCTGAGGTATGCMAAYDHMHNVNNNNNHNNNNNNNNNNNNNNNNNNNDHNNN-3' (SEQ ID NO: 13)
в которой Y представляет собой T или C;
в которой M представляет собой A или C;
в которой D представляет собой A или G или T;
в которой H представляет собой A или C или T;
в которой V представляет собой A или G или C;
в которой N представляет собой A или G или C или T, неизвестный или другой;
или ее комплементарную цепь, или РНК-эквивалент молекулы или ее комплементарной цепи.
Аптамер может представлять собой последовательность нуклеиновой кислоты, имеющую по меньшей мере 90% гомологичность с последовательностью, выбранной из группы G1-G10, состоящей из следующих последовательностей нуклеиновой кислоты, выбранных из группы, состоящей из SEQ ID NO: 1-11, или ее комплементарной цепи, или РНК-эквивалента молекулы или ее комплементарной цепи.
Анализ связывания с лигандом может быть анализом в боковом или вертикальном потоке, в котором аптамеры связаны с носителем, и визуальный индикатор представлен в виде сигнала связывания от насыщения сайтов связывания аптамера на носителе.
Анализ в боковом или вертикальном потоке может представлять собой анализ ингибирования.
Носителем могут быть наночастицы золота, при этом наночастицы золота могут быть связаны с аптамером путем тиолирования.
Поверхностный плазмонный резонанс от строго локализованной концентрации наночастиц золота дает визуальный индикатор в отсутствие гиббереллинов в образце. Визуальный индикатор может представлять собой видимый красный сигнал на индикаторной части при анализе в боковом или вертикальном потоке.
Уменьшение сигнала связывания от насыщения сайтов связывания аптамера на наночастицах золота приводит к отсутствию красного сигнала при наличии гиббереллинов в образце.
Видимый красный сигнал является результатом того, что связанный с аптамером комплекс наночастиц золота насыщает сайты связывания на носителе и, таким образом, предотвращает агрегацию частиц золота.
Анализ связывания с лигандом может проводиться в форме одноразовой тест-системы с боковым или вертикальным потоком, при этом продукт наносится на мембрану одноразовой тест-системы.
Одноразовая тест-система с вертикальным потоком может представлять собой стандартный сэндвич-тест в вертикальном потоке или конкурентный анализ в вертикальном потоке.
Анализ связывания с лигандом может представлять собой анализ связывания с нерадиоактивным лигандом, который включает аптамеры, которые химически связаны с парой флуорофор/гаситель, при этом визуальный индикатор представлен в виде флуоресценции в присутствии гиббереллинов.
Пара флуорофор/гаситель может представлять собой нуклеиновокислотный краситель и флуоресцентный гибридизационный зонд.
Анализ связывания с лигандом включает аптамеры, которые химически связаны с парой донор-акцептор, про этом визуальный индикатор представлен в виде флуоресценции в присутствии гибберелинов.
Краткое описание сопроводительных чертежей
Один из вариантов осуществления изобретения описан ниже только в качестве неограничивающего примера и со ссылкой на прилагаемые чертежи, на которых:
Фигура 1 представляет собой график, иллюстрирующий профиль обогащения ответа библиотеки в отношении мишеней гиббереллина;
Фигура 2 таблица, отображающая наиболее часто встречающиеся последовательности аптамеров, полученные после двадцати циклов систематической эволюции лигандов экспоненциальным обогащением (SELEX);
Фигура 3 представляет собой таблицу, отображающую последовательности аптамеров из Фиг. 2, выровненных друг относительно друга и сгруппированных в пул на основе 90% гомологичности последовательностей;
Фигура 4 представляет собой схематическое изображение возможных последовательностей аптамеров класса "TGAGG";
Фигура 5 представляет собой схематическое изображение возможных последовательностей аптамеров класса "CCACC";
Фигура 6 представляет собой схематическое изображение возможной структуры последовательности представителя класса "TGAGG" в его наиболее стабильной форме;
Фигура 7 представляет собой схематическое изображение возможной структуры последовательности представителя класса "CCACC" в его различных состояниях;
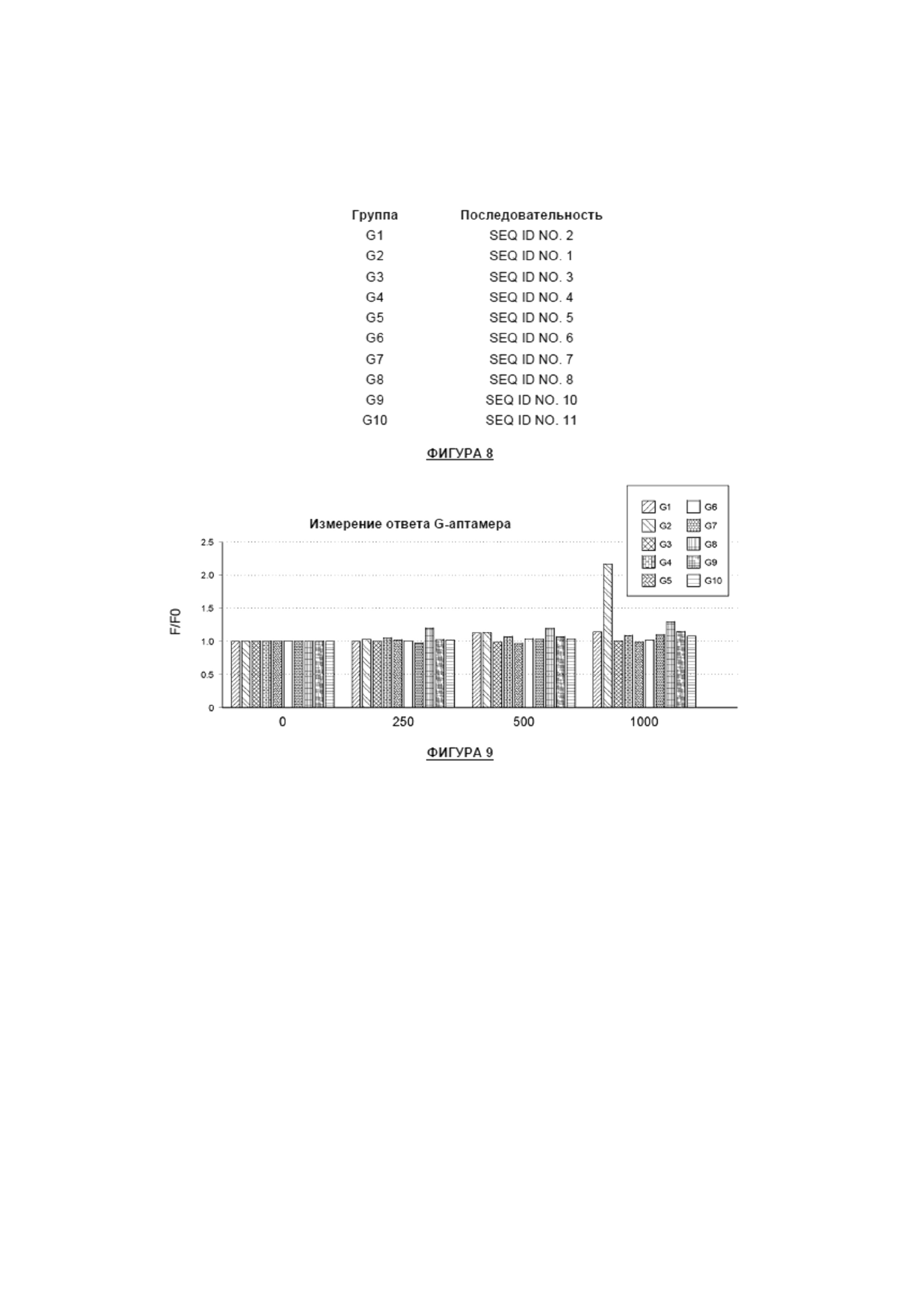
Фигура 8 представляет собой таблицу, отображающую последовательности представителей групп G1-G10;
Фигура 9 представляет собой график, отображающий реакцию связывания групп G1-G10 при различных концентрациях гиббереллинов;
Фигура 10 представляет собой график, отображающий объединенную реакцию связывания G2 с четырьмя гиббереллинами;
Фигура 11 - график, отображающий кривую чувствительности G2 к гиббереллину A1;
Фигура 12 - график, отображающий кривую чувствительности G2 к гиббереллину A3;
Фигура 13 - график, отображающий кривую чувствительности G2 к гиббереллину A4;
Фигура 14 - график, отображающий кривую чувствительности G2 к гиббереллину A7;
Фигура 15 - анализ конкурентного ингибирования; и
Фигура 16 иллюстрирует анализ флуоресценции и анализа флуоресцентного резонансного переноса энергии (FRET).
Подробное описание изобретения
Прорастание ячменя
Семена ячменя представляют собой живые органы растений, и их развитие для удобства можно разделить на три фазы, а именно: рост, созревание и прорастание. Однако невозможно четко определить переход от одной фазы к другой, поскольку существует значимое перекрытие между основными процессами, характерными для каждой фазы, и следующая фаза может начаться до завершения предыдущей фазы. Первые две фазы могут быть завершены только тогда, когда семена еще прикреплены к растению. Хотя начальные процессы прорастания, необходимые для окончательного прорастания, начинаются на растении во время более поздних стадий созревания, окончательное прорастание обычно происходит только после того, как семя оторвалось от растения. Для успешного прорастания семена должны достичь той стадии зрелости (потребительской зрелости / полного созревания), которая позволит им полностью прорасти после отделения от растения. После сбора семена ячменя находятся в пассивном состоянии (в состоянии покоя) до тех пор, пока условия окружающей среды не станут благоприятными для прорастания. Прорастание произойдет только в том случае, если семена полностью набухли. Набухание инициирует процессы прорастания в семени. Набухание сухих семян считается критическим периодом прорастания. Стресс, вызванный очень быстрым набуханием, может оказать негативное влияние на прорастание сухих семян. Семена, которые полностью набухают, но затем снова высыхают, также не прорастут успешно.
Это явление называется предварительным прорастанием. Предварительное прорастание снижает жизнеспособность хранящегося сухого семени, потому что оно включает частичное набухание семени, которое запускает окончательную реакцию прорастания, но не может поддерживать процесс, или ввиду того, что оно включает гормональные изменения, которые инициируют окончательное прорастание на данной стадии развития семени до того, как оно окончательно достигнет зрелости/ полного созревания. В обоих случаях некоторые запасные резервы и запасная информационная РНК в семени расходуются, что оставляет семя с недостаточными ресурсами для того, чтобы выдерживать длительные условия хранения. Как результат, ячмень прорастает преждевременно и не может быть использован в процессе ферментации. Невозможно визуально оценить семена, чтобы определить, произошло ли предварительное прорастание.
Гиббереллины и прорастание
Взаимодействие между фитогормонами, особенно между гиббереллинами (ГК) и абсцизовой кислотой (АБК), является важным фактором, контролирующим переход от эмбриогенеза к прорастанию в семенах. Во время прорастания зерен ячменя эмбрион выделяет ГК в слой алейрона, где он способствует синтезу нескольких гидролитических ферментов, которые участвуют в мобилизации запасов крахмала для поддержания растущего эмбриона. Синтез этих ферментов блокируется ABA во время развития семян, в "спящих" семенах и в проростках в неблагоприятных для прорастания условиях. Прорастание семени ячменя после хранения сильно подавляется предварительным прорастанием, состоянием, которое характеризуется преждевременным прорастанием семени, пока оно еще в колосе, также известным как "прорастание до сбора урожая". Это явление чаще всего обусловлено длительной выдержкой зрелых неубранных семян во влажную погоду. Такое преждевременное начало процессов, связанных с прорастанием, может оказать неблагоприятное влияние на баланс между ABA и GA и, таким образом, подавить прорастание после хранения. Предварительное прорастание может вызвать стресс у семян, вследствие чего концентрация ABA увеличивается одновременно с уменьшением концентрации GA перед хранением до неблагоприятных уровней.
Семена ячменя должны прорасти, чтобы их можно было использовать в процессе ферментации. Семена, которые не прорастают, не обладают достаточной энергией прорастания (ЭП) и поэтому не могут быть использованы в процессе ферментации. Поэтому важно определить, содержат ли семена ячменя требуемую ЭП. Корреляция между гиббереллинами и ЭП показана при обработке семян ячменя ингибитором синтеза ГК, которая приводит к сильному ингибированию прорастания. Результаты показали, что ГК-синтез играет важную роль в прорастании ячменя. Следовательно, измерение гиббереллинов может показать, достигли ли семена ячменя созревания или нет.
Обнаружение гиббереллинов
Для обнаружения гиббереллинов требуется специальное оборудование, что делает процесс дорогостоящим и трудоемким. Как правило, образец берется из партии и отправляется в лабораторию для тестирования с помощью ELISA (иммуноферментный анализ). ELISA-тестирование основано на связывании антител. Довольно распространенной проблемой, связанной с использованием быстрых поликлональных антител, полученных против низкомолекулярных соединений, таких как гиббереллины, является низкая афинность такого антитела к свободным гиббереллинам. Афинность к соединению, конъюгированному с белком-носителем, используемому для иммунизации, обычно недостаточно для обнаружения только соединения, так как свободное соединение недостаточно иммуногенно в качестве отдельного гаптена. Следовательно, антитела не способны быстро связываться с небольшим эпитопом, которыми являются гиббереллины. ELISA также требует нескольких часов инкубации и работы квалифицированного специалиста для проведения анализа. К моменту получения результата из лаборатории, возможно, в зависимости от условий хранения, что ЭП партии семян изменился.
Аптамеры представляют собой эффективную альтернативу антителам и могут преодолевать ограничения, возникающие при использовании антител для обнаружения гиббереллинов. Существуют три типа аптамеров: ДНК-, РНК- и белковые аптамеры. Все они имеют очень похожие свойства, оставаясь совершенно уникальными. Теоретически возможно применение аптамеров против любой молекулярной мишени. Аптамеры связываются с высокой специфичностью, точностью и афинностью со своими специфическими мишенями. Поскольку аптамеры подстраивают свою структуру для связывания с их мишенями, это дает аптамерам более широкий диапазон возможных мишеней по сравнению с антителами, которые требуют антигенов и эпитопов наряду с иммунным ответом для своих мишеней.
In vitro селекция аптамеров
В соответствии с вышеизложенным был разработан анализ связывания с лигандом для обнаружения присутствия гиббереллинов в образце. Анализ включает мишень-связывающий элемент, выбранный для связывания с гиббереллинами. Мишень-связывающий элемент ассоциирован с визуальным индикатором, при этом визуальный индикатор показывает присутствие гиббереллинов в образце, когда мишень-связывающий элемент связывается с гиббереллинами. Гиббереллины могут быть гиббереллиновыми кислотами ГК1, ГК3, ГК4 или ГК7, а мишень-связывающий элемент может представлять собой целевой фрагмент в виде аптамера.
In vitro селекция аптамеров осуществляли путем скрининга свободных гиббереллинов против собственной библиотеки аптамеров. Использовалась технология систематической эволюции лигандов на шариках методом экспоненциального обогащения (SELEX). Были определены аптамеры со сродством связывания с ГК1, ГК3, ГК4 и ГК7. Все четыре мишени были смешаны в один раствор до конечной концентрации 1 мМ каждая. Как упоминалось ранее, гиббереллины представляют собой растительные гормоны, синтезируемые из дитерпеноидных кислот через терпеноидный путь с образованием тетрациклических дитерпеновых кислот. Эти биологически активные молекулы участвуют в различных аспектах развития растений, однако, в рамках данного проекта, их обнаружение важно для мониторинга прорастания. Из всех известных гиббереллинов ГК1, ГК3, ГК4, и ГК7 являются наиболее биологически активными, поэтому их используют в качестве мишеней для селекции in vitro.
In vitro селекция аптамеров против четырех гиббереллинов проводили в течение 20 циклов технологии SELEX на шариках. Селекция изображена на Фиг. 1. Типичные эксперименты по селекции in vitro, как правило, завершаются в течение 10-15 циклов, однако для данного проекта было выполнено 20 циклов из-за медленного обогащения молекул аптамера. Первый признак успешного выделения аптамера наблюдался в конце 12-го цикла, поскольку скорость элюции ДНК с твердой подложки в присутствии гиббереллинов превышала скорость элюции ДНК в отсутствие гиббереллинов. В конце 12-го цикла библиотека была передана на глубокое секвенированиие. Однако данные секвенирования позволили предположить, что обогащение желаемых последовательностей только началось, и явного доминирования одной конкретной последовательности не наблюдалось. В результате in vitro селекция была продлена еще на 8 циклов. К концу 20-го цикла был виден четкий профиль обогащения ответа библиотеки в отношении мишеней гиббереллина, как показано на Фиг. 1. Эта библиотека была затем передана на глубокое секвенированиие.
Глубокое секвенирование
Система Illumina ® MiSeq использовалась для глубокого секвенирования в анализе циклов 14, 16, 18 и 20. Выполняя многократное секвенирование в течение нескольких последовательных циклов, можно отслеживать библиотеку на предмет последовательностей с различной степенью обогащения. Дополнительно можно отслеживать поведение 10 наиболее часто встречающихся последовательностей в течение всего цикла селекции. Анализ данных секвенирования начинается с анализа частоты специфических последовательностей в библиотеке. In vitro селекция - это форма конкуренции между последовательностями, при которой наиболее чувствительная последовательность избирательно обогащается, а малочисленные или неактивные последовательности отбрасываются. Чем чаще встречается последовательность, тем больше оснований предполагать, что такие молекулы будут иметь некую форму желаемой активности по отношению к мишеням гиббереллина.
На Фиг. 2 показаны последовательности, упорядоченные в соответствии с частотой встречаемости после 20 цикла обогащения. Во втором и третьем столбцах таблицы показаны соответствующие последовательности, чтобы было видно, каким образом они были ранжированы в циклах 18 и 16. Этот тип анализа способен отображать рост или распад молекул, поскольку они конкурируют с другими молекулами в течение многих циклов селекции. Например, последовательности, имеющие ранки 3 и 5, имели высокие ранки на более ранних циклах селекции in vitro, однако к 20-му циклу их популяция сократилась, так как начинают реплицироваться более активные последовательности. Последовательность, имеющая первый ранк, является примером высокой скорости роста. В 16-м цикле она имела 8-й ранк среди популяций, однако после всего лишь двух циклов (18-й цикл) она стала четвертой по численности популяцией, а затем стала самой доминирующей в последнем цикле. Это динамика является положительной, и она может указывать на активность аптамера.
На Фигуре 3 показаны все ранжированные последовательности, которые затем были выравнены друг относительно друга и объединены в группы на основе 90% сходства последовательностей. После объединения такой же анализ может быть выполнен для определения скорости обогащения или распада определенного класса в процессе селекции. В этом наборе данных класс, имеющий первый ранк, является второй по численности последовательностью (SEQ ID NO. 2), изображенной на Фигуре 2, в то время как наиболее распространенная последовательность (SEQ ID NO. 1) на Фигуре 2 занимает второй ранк по классификации. Есть две значимые тенденции, которые могут быть важны для определения активности аптамера. Первая - это высокая скорость, с которой класс, имеющий второй ранк, прогрессировал в циклах с 16 по 20. Вторая - большинство последовательностей и классов начинаются со специфического участка последовательности "TGAGG".
Структурный анализ
Фигуры 4 и 5 являются схематическими изображениями, предназначенными для дальнейшего анализа имеющего первый ранк класса "CCACC" и класса "TGAGG", соответственно. (Схематическое изображение было сгенерировано из следующей ссылки: 1) Crooks GE, Hon G, Chandonia JM, Brenner SE WebLogo: A sequence logo generator, Genome Research, 14:1188-1190, (2004) 2) Schneider TD, Stephens RM. 1990. Sequence Logos: A New Way to Display Consensus Sequences. Nucleic Acids Res. 18:6097-6100). Класс "CCACC" может быть обобщен как молекула аптамера из 62 нуклеотидов с последовательностью нуклеиновой кислоты 5'-NHMCVNNNHDGCTGAGGTATGCNNNHWNDYDDNDNNHHHNHNVVHNNNNNDNNDBNHNNNHD-3' (SEQ ID NO. 12), в которой Y представляет собой T или C, M представляет собой A или C, W представляет собой A или T, B представляет собой G или C или T, D представляет собой A или G или T, H представляет собой A или C или T, V представляет собой A или G или C, и N представляет собой A или G или C или T. Аналогичным образом, класс "TGAGG" может быть обобщен как молекула аптамера из 62 нуклеотидов с последовательностью нуклеиновой кислоты 5'-TGAGGDVNVNGCTGAGGTATGCMAAYDHMHNVNNNNNHNNNNNNNNNNNNNNNNNNNDHNNN-3' (SEQ ID NO. 13) в которой Y представляет собой T или C, M представляет собой A или C, D представляет собой A или G или T, H представляет собой A или C или T, V представляет собой A или G или C и N представляет собой A или G или C или T. Также могут быть эффективными обобщенные последовательности или комплементарные им цепи, или РНК-эквивалент молекулы.
"TGAGG" представлял собой высококонсервативную последовательность и был легко обнаружен в библиотеке секвенирования. Фактически, фрагмент "TGAGG" повторялся дважды в каждой последовательности, причем второй находился в сайте захвата.
Класс последовательностей "CCACC" не был таким ясно различимым, как семейство последовательностей "TGAGG". Наблюдались определенные позиции, которые указывают на консервативные сайты.
Структура представителей последовательности
На Фиг. 6 и 7 изображены результаты, полученные на основании анализа c помощью программы m-fold (http://unafold.rna.albany.edu/). На Фиг. 6 изображены структуры представителя последовательности класса "CCACC". Левая структура (A) представляет собой состояние до связывания/распознавания. В присутствии гиббереллинов структура изменится либо на среднюю (B), либо на правую форму (C) (обе из которых являются более стабильной конформацией). Таким образом, класс "CCACC" имел три возможных структурных конформаций с дельта G - 14,89, - 14,85 и - 14,01, что указывает на то, что структуры, обнаруженные в последовательности, более стабильны, чем у молекул "TGAGG". Кроме того, структуры предполагают наличие механизма переключения структур, который существует в двух состояниях. Первое состояние представляет собой структуру иммобилизации и распознавания, при которой последовательность аптамера гибридизуется с твердой подложкой и "готова" связывать гиббереллины. Второе состояние (более стабильная структура) предположительно соответствует образованию аптамера в присутствии гиббереллинов и диссоциации от твердых носителей.
Обоснование переключения структуры для класса "CCACC" вытекает из изменения в положениях нуклеотидов с 30 по 42. Этот участок последовательности используется для гибридизации с комплементарной последовательностью "захвата", которая иммобилизована на твердой подложке (магнитные шарики или агарозные шарики). В присутствии гиббереллинов последовательность превращается в более стабильную структуру и сдвигает последовательность захвата, тем самым освобождаясь от твердых носителей.
На Фиг. 6 показана структура представителя последовательности класса "TGAGG" в его наиболее стабильной форме, и, хотя существуют другие структуры, наиболее стабильная структура имела дельта G=-11,96 ккал/моль при 22 градусах Цельсия. Хотя для класса "TGAGG" не наблюдается четкой конформации с переключением структуры, существование шпилечных структур предполагает наличие возможного мотива, который может распознавать гиббереллины.
Начальный тест реакции на связывание
SEQ ID 1-8; 10 и 11, перечисленные на Фиг. 3, были химически синтезированы и очищены с использованием 10% денатурирующего электрофореза в полиакриламидном геле. SEQ ID еще раз перечислены на Фиг. 8 с соответствующим номером группы. Начальный тест реакции на связывание был оценен при трех различных концентрациях (250 мкМ, 500 мкМ и 1000 мкМ). Все значения были получены как минимум в трех повторах. В целом, последовательности продемонстрировали некоторую активность в отношении смеси гиббереллинов. G2 был выбран как лучший аптамер для дальнейшего исследования. Фиг. 9 иллюстрирует реакцию связывания групп G1-G10 при трех различных концентрациях гиббереллинов.
Связывание G2 с гиббереллинами
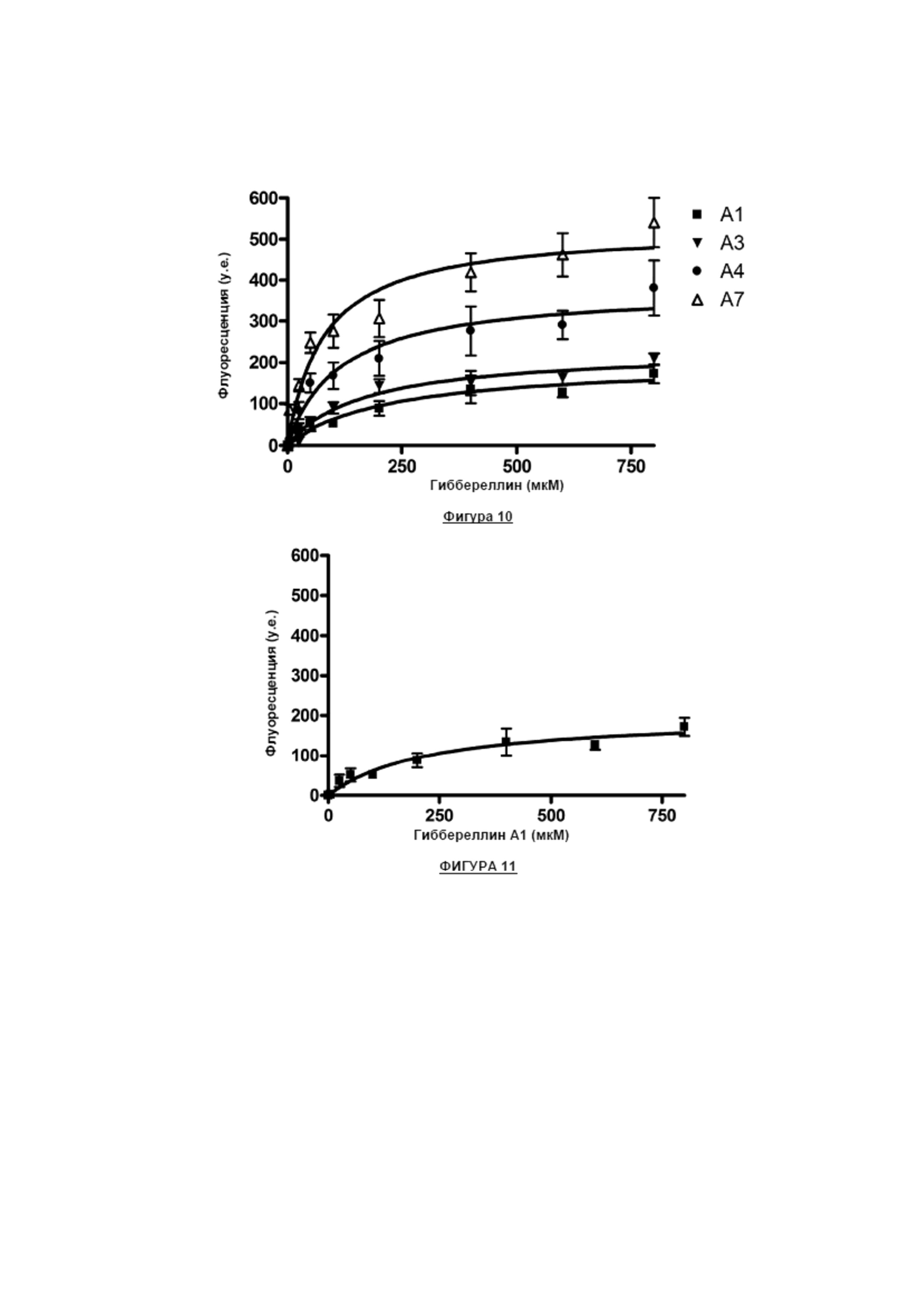
На Фиг. 10 показан комбинированный отклик связывания G2, вычисленный по отношению к отдельным гиббереллинам (А1, А3, А4 и А7) в концентрациях от 0 до 1 мМ. Измерения флуоресценции были основаны на количестве флуоресцентной ДНК, высвобожденной из твердой подложки.
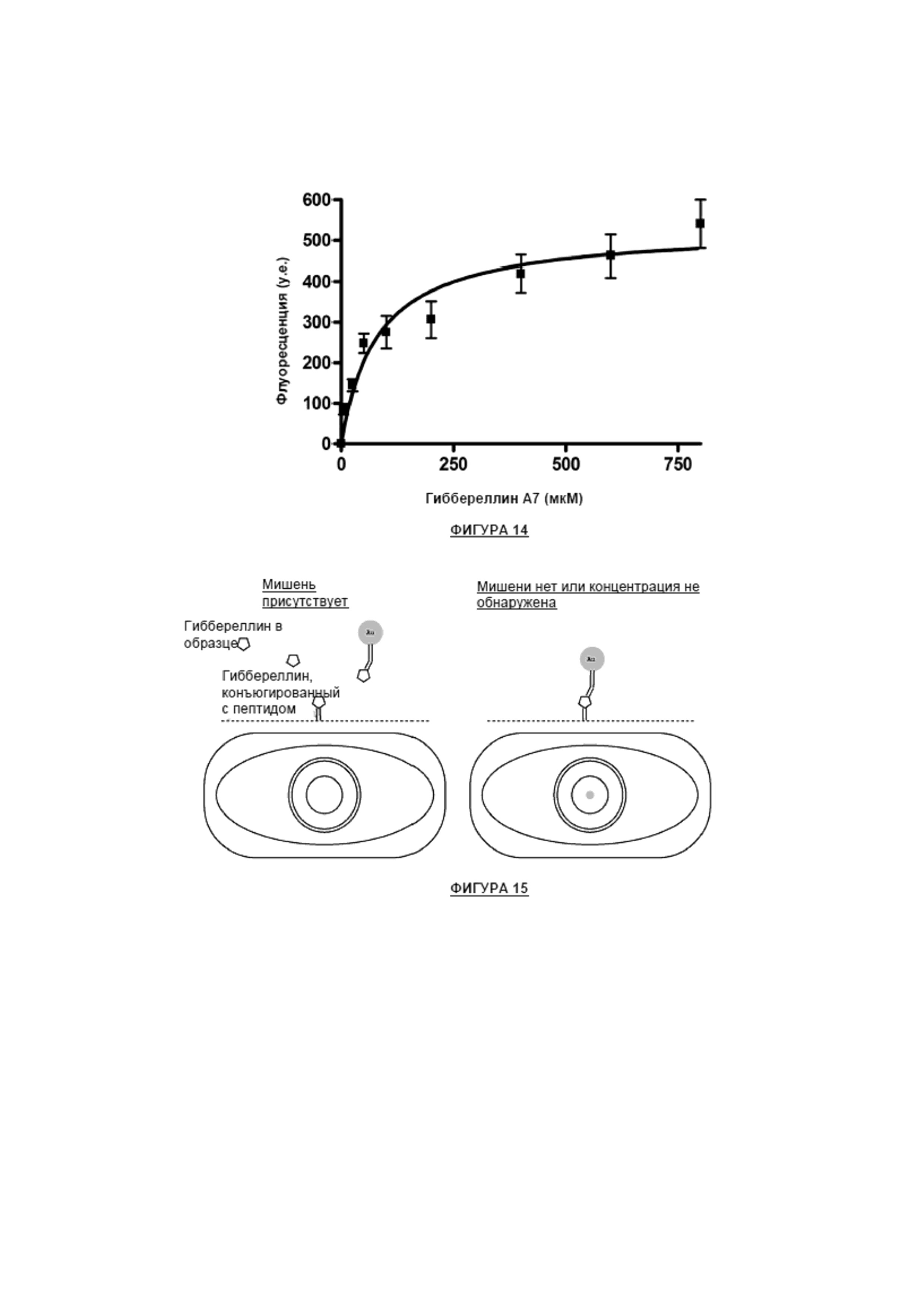
Как видно из Фиг. 10, аптамер G2 реагировал на смесь гиббереллинов. На Фиг. 11 - 14 показано, что аптамер G2 обладал самой высокой активностью в отношении гиббереллина А7 и самой низкой активностью в отношении гиббереллина А1. Приблизительные значения Kd следующие: гиббереллин А1 - 225 мкМ, гиббереллин А3 - 171 мкМ, гиббереллин А4 - 116 мкМ и гиббереллин А7 - 80 мкМ.
Вывод о процессе отбора аптамеров
Скрининг аптамеров в отношении гиббереллинов A1, A3, A4 и А7 был успешно проведен в течение 20 циклов экспериментов селекцией in vitro. При использовании всех четырех молекул-мишеней в одном пуле для селекции, конечный аптамер G2 смог распознать все четыре мишени.
Варианты воплощения
Первый вариант воплощения анализа связывания лиганда может представлять собой анализ в боковом или вертикальном потоке, который включает аптамеры, связанные с носителем. Носителем могут быть наночастицы золота, при этом наночастицы золота могут быть связаны с аптамером путем тиолирования. Индикатор представлен в виде сигнала связывания от насыщения сайтов связывания аптамера на носителе. Анализ в боковом или вертикальном потоке может представлять собой анализ ингибирования. По меньшей мере один тиолированный аптамер связан с золотом посредством взаимодействия между кристаллической решеткой наночастиц золота и тиольными группами на олигонуклеотиде аптамера.
Поверхностный плазмонный резонанс от строго локализованной концентрации наночастиц золота дает видимый индикатор в отсутствие гиббереллинов. Визуальный индикатор может представлять собой видимый красный сигнал на индикаторной части при анализе в боковом или вертикальном потоке. Уменьшение сигнала связывания от насыщения сайтов связывания аптамера на наночастицах золота приводит к отсутствию красного сигнала при наличии гиббереллинов в образце. Видимый красный сигнал является результатом того, что связанный с аптамером комплекс наночастиц золота насыщает сайты связывания на носителе и, таким образом, предотвращает агрегацию частиц золота.
Анализ связывания с лигандом может проводиться в форме одноразовой тест-системы с боковым или вертикальным потоком, при этом продукт наносится на мембрану одноразовой тест-системы. Одноразовая тест-система с вертикальным потоком может представлять собой стандартный сэндвич-тест в вертикальном потоке или конкурентный анализ в вертикальном потоке. Тест может включать приемы конкурентного ингибирования, где отрицательный контроль представляет собой видимую красную часть на мембране тест-системы. В конкурентном варианте, если в тестируемом образце присутствует мишень, это приведет к насыщению сайтов связывания на наночастицах золота с аптамерным покрытием, и наночастицы золота с аптамерным покрытием больше не будут связываться с мембраной, в которой овальбумин или другой пептид, конъюгированный с гиббереллином, используется для облегчения связывания с мембраной. Этот процесс обобщенно изображен на Фиг. 15.
Второй вариант осуществления анализа связывания лиганда может быть в виде анализа связывания с нерадиоактивным лигандом, включающего аптамеры, которые химически связаны с парой флуорофор/гаситель. В этом варианте осуществления визуальный индикатор представлен в виде флуоресценции раствора в присутствии гиббереллина. Пара флуорофор/гаситель может представлять собой нуклеиновокислотный краситель и флуоресцентный гибридизационный зонд. Из этого следует, что в присутствии гиббереллинов гаситель отщепляется от пары флуорофор/гаситель, что приводит к появлению сигнала флуоресценции, специфичному для флуорофора, как показано на Фиг. 16(A). Кроме того, увеличение сигнала связывания, таким образом, выявляет присутствие антигена, и в дальнейшем сигнал можно количественно измерить относительно стандарта.
Тест 1 на мишень проводили в буферном растворе, используемом для экстракции антигена из исходного материала образца. Буфер для экстракционного раствора может включать, без ограничения, TBS (Трис). Кроме того, флуориметр используется для обнаружения флуорофор-специфической флуоресценции и ее потенциальной количественной оценки в соответствии с предварительно откалиброванными стандартами или значениями.
Анализ связывания с лигандом может включать аптамеры, которые химически связаны с парой акцептор-донор, при этом визуальный индикатор представлен в виде флуоресценции раствора в присутствии гиббереллинов. В присутствии антигена акцептор отделяется от пары акцептор/донор, что приводит к изменению длины волны эмиссии, как показано на Фиг. 16(B). Следует отметить, что различие в длине волны эмиссии сигнала, таким образом, позволяет обнаружить присутствие антигена. Ввиду вышесказанного, разница между начальной и конечной длинами волн эмиссии может быть количественно определена при сравнении со стандартом и обеспечивает количественный анализ целевой концентрации.
Тест на мишень проводили в буферном растворе, используемом для экстракции антигена из исходного материала образца, при этом буферный раствор для экстракции мог включать, без ограничения, TBS (Трис). Кроме того, флуориметр используется для обнаружения флуорофор-специфической флуоресценции и ее потенциальной количественной оценки в соответствии с предварительно откалиброванными стандартами или значениями. Флуоресценция крайне чувствительна и может использоваться для обнаружения крайне низких концентраций аналита. Она также очень специфична, в силу высокой специфичности сигнала флуорофора. Это дает очень высококачественный сигнал с хорошим отношением сигнал/шум, так как флуорофоры излучают в очень узкой запрещенной зоне.
Предполагается, что изобретение обеспечит анализ связывания с лигандом в месте взятия проб для быстрого обнаружения гиббереллинов. В частности, анализ в месте взятия проб будет полезен для определения энергии прорастания семян, что обеспечит показатель качества.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Йоханнесбургский университет
<120> Анализ связывания с лигандом для обнаружения гиббереллинов
<130> 86#LPS
<160> 13
<210> 1
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 1
ccaccacaaa gctgaggtat gcgggtatgc agctgtaacg atgccgttgc tgtaggctgc 60
aa 62
<210> 2
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 2
tgagggacca gctgaggtat gcaaacgcca agtgtgtaca tgggagcatt tccatagtac 60
ca 62
<210> 3
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 3
tgagggaccg gctgaggtat gcaaacgcct gataagtaaa gtagatctct actgtgctca 60
ta 62
<210> 4
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 4
tgaggacaac gctgaggtat gcaaataaca acaattcaga ggctaggccc tctgaggatc 60
gt 62
<210> 5
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 5
cgaccaggca gctgaggtat gctgtaacac atagaattat ggtatatggc agtcgattac 60
ga 62
<210> 6
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 6
gcacccggaa gctgaggtat gccacaagtc agtggctatg acgaatcata gccgtgacct 60
cg 62
<210> 7
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 7
cgccaggcat gctgaggtat gctgtaacac atgagagtaa tgatatcggg acaggtacgc 60
cc 62
<210> 8
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 8
caccaaggca gctgaggtat gctgtaacac aaggtacaaa cgacttaagt ttggccctga 60
ct 62
<210> 9
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 9
tgccaagcat gctgaggtat gctgtaacac actagcctac ggtaaggaac gttgtggttg 60
ca 62
<210> 10
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 10
tgaggagcga gctgaggtat gccaacaaca cgtgttcagt acgtgtacta gaaacgcgtc 60
gt 62
<210> 11
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 11
ccggtagggt gctgaggtat gctgtaacac acaaaaattg cgtctacgca atctcggatg 60
ac 62
<210> 12
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 12
nhmcvnnnhd gctgaggtat gcnnnhwndy ddndnnhhhn hnvvhnnnnn dnndbnhnnn 60
hd 62
<210> 13
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 13
tgaggdvnvn gctgaggtat gcmaaydhmh nvnnnnnhnn nnnnnnnnnn nnnnnnndhn 60
nn 62
<---
Реферат
Изобретение относится к области биохимии, в частности к тест-системе связывания с лигандом для обнаружения присутствия гиббереллинов в образце. Изобретение позволяет эффективно обнаружить присутствие гиббереллинов в образце. 9 з.п. ф-лы, 1 табл., 1 пр., 16 ил.
Формула
Документы, цитированные в отчёте о поиске
Регулятор роста растений и его применение

Комментарии