Ингибиторы fgfr2 отдельно или в комбинации с иммуностимулирующими агентами в лечении рака - RU2745707C2
Код документа: RU2745707C2
Чертежи




















Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[001] Данная заявка заявляет приоритет по следующим трем предварительным заявкам на патент Соединенных Штатов Америки: № 62/258731, поданной 23 ноября 2015 г., № 62/314174, поданной 28 марта 2016 г. и № 62/379094, поданной 24 августа 2016 г., каждая из которых включена в данное описание посредством ссылки в полном объеме.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[002] Данная заявка подана со списком последовательностей в электронном формате. Список последовательностей представлен в виде файла с названием «2016-11-17_01134-0046-00PCT_SeqList_ST25.txt», созданный 17 ноября 2016 года, который имеет размер 103517 байт. Информация в электронном формате списка последовательностей включена в данный документ посредством ссылки в полном объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[003] Данная заявка относится к применению ингибиторов рецептора 2 фактора роста фибробластов (FGFR2) в лечения рака, в некоторых случаях, в комбинации с иммуностимулирующими агентами, такими как ингибиторы PD-1 или PD-L1.
УРОВЕНЬ ТЕХНИКИ
[004] Члены семейства факторов роста фибробластов (FGF) связываются с четырьмя известными рецепторами тирозинкиназы, рецепторами 1-4 фактора роста фибробластов (FGFR1-4) и их изоформами, причем различные FGF связывают разные FGFR с различной степенью (Zhang et al., J. Biol. Chem. 281:15694, 2006). Последовательность белка FGFR2 человека представлена, например, в GenBank Locus AF487553. Каждый FGFR состоит из внеклеточного домена (ECD), содержащего три иммуноглобулин (Ig) -подобных домена (D1, D2 и D3), одной трансмембранной спирали и внутриклеточного каталитического киназного домена (Mohammadi et al., Cytokine Growth Factor Revs, 16: 107, 2005). FGF связываются с рецепторами преимущественно через области в D2 и D3 рецепторов. В связующем звене между D1 и D2 имеется непрерывный участок кислых аминокислот, называемый «кислотным блоком» (AB). Считается, что область, содержащая D1 и AB, участвует в аутоингибировании рецептора, который освобождается путем связывания с лигандом.
[005] FGFR характеризуются множественным альтернативным сплайсингом их мРНК, что приводит к множеству изоформ (Ornitz et al., J. Biol. Chem. 271: 15292, 1996; см. также Swiss-Prot P21802 и изоформы P21802-1 -20 для последовательностей FGFR2 и его изоформ). Примечательно, что существуют формы, содержащие все три домена Ig (α-изоформа) или только два домена Ig D2 и D3 без D1 (β-изоформа). В FGFR1, FGFR2 и FGFR3 все формы содержат первую половину D3, обозначенную как IIIa, но для второй половины D3 могут использоваться два альтернативных экзона, приводящих к формам IIIb и IIIc. Для FGFR2, они соответственно обозначаются FGFR2-IIIb и FGFR2-IIIc (или только FGFR2b и FGFR2c); соответствующие бета-формы обозначаются FGFR2(бета)IIIb и FGFR2(бета)IIIc. Форма FGFR2-IIIb FGFR2 (также обозначаемая K-sam-II) является рецептором с высокой аффинностью как для членов семейства FGF1, так и для семейства KGF (фактор роста кератиноцитов) (FGF7, FGF10 и FGF22), тогда как FGFR2-IIIc (также обозначаемый K-sam-I) связывается как FGF1, так и FGF2, но не связывает членов семейства KGF (Miki et al., Proc. Natl. Acad. Sci. USA 89:246, 1992). Действительно, FGFR2-IIIb является единственным рецептором членов семейства KGF (Ornitz et al., 1996, op. cit.) и поэтому также обозначен как KGFR.
[006] FGFR и их изоформы дифференциально экспрессируются в различных тканях. FGFR2-IIIb (и формы IIIb FGFR1 и FGFR3) экспрессируются в эпителиальных тканях, тогда как FGFR2-IIIc экспрессируется в мезенхимальных тканях (Duan et al., J. Biol. Chem. 267:16076, 1992; Ornitz et al., 1996, в цитируемой работе). Некоторые из лигандов FGF этих рецепторов имеют противоположный характер экспрессии. Таким образом, члены подсемейства KGF, включая FGF7 (KGF), FGF10 и FGF22, связываются только с FGFR2-IIIb (Zhang et al., op. cit.) и экспрессируются в мезенхимальных тканях, поэтому могут быть паракринными эффекторами эпителиальных клеток (Ornitz et al., 1996, op. cit.). Напротив, члены подсемейства FGF4 FGF4-6 связываются с FGFR2-IIIc и экспрессируются как в эпителиальных, так и в мезенхимальных линиях клеток, поэтому могут иметь или аутокринную, или паракринную функции. На основании профилей экспрессии изоформ FGFR2 и их лигандов, FGFR2 играет роль в эпителиально-мезинхимальных взаимодействиях (Finch et al., Dev. Dyn. 203: 223, 1995), поэтому неудивительно, что нокаут FGFR2-IIIb у мышей приводит к тяжелым эмбриональным дефектам и летальности (De Moerlooze et al., Development 127: 483, 2000).
[007] KGF (FGF7) и KGFR (FGFR2-IIIb) сверхэкспрессируются во многих раковых опухолях поджелудочной железы (Ishiwata et al., Am. J. Pathol. 153: 213, 1998), и их коэкспрессия коррелирует с плохим прогнозом (Cho et al., Am. J. Pathol. 170:1964, 2007). Соматические мутации гена FGFR2 были обнаружены у 12% большой группы эндометриальных (маточных) карцином и в нескольких случаях были необходимы для выживаемости опухолевых клеток (Dutt et al., Proc. Natl. Acad. Sci. USA 105:8713, 2008). В двух опухолях было обнаружено, что мутация FGFR2 является той же заменой S252W, связанной с синдромом Апера. Амплификация и сверхэкспрессия FGFR2 связана с недифференцированным диффузным типом рака желудка, который имеет, в частности, неблагоприятный прогноз, а ингибирование активности FGFR2 низкомолекулярными соединениями сильно ингибирует пролиферацию таких раковых клеток (Kunii et al., Cancer Res. 68:2340, 2008; Nakamura et al., Gastroenterol. 131:1530, 2006).
[008] Ингибиторы FGFR2 могут включать антитела и домены ВКД FGFR2 или слитые молекулы ВКД FGFR2. Например, в патенте США № 8101723 B2 описаны, например, моноклональные антитела, которые связывают FGFR2-IIIb человека, но менее хорошо связываются или не связываются с FGFR2-IIIc и наоборот. В публикации патента США № 2015-0050273 A1 описаны некоторые афукозилированные антитела, которые связываются с FGFR2-IIIb. В патентной публикации США № US 2013-0324701 A1 описаны, например, конкретные слитые молекулы ВКД FGFR2, содержащие внеклеточный домен FGFR2-IIIc и партнера по слиянию. Дополнительные слитые молекулы FGFR ECD описаны в патенте США № 8338569 B2.
[009] Генетические изменения при раке обеспечивают разнообразный набор антигенов, которые могут опосредовать противоопухолевый иммунитет. Распознавание антигена посредством Т-клеточных рецепторов (TКР) инициирует Т-клеточные ответы, которые регулируются балансом между активирующими и ингибирующими сигналами. Ингибирующие сигналы или «иммунные контрольные точки» играют важную роль в нормальных тканях, предотвращая аутоиммунную реакцию. Усиление экспрессии белков иммунных контрольных точек может позволить раковым заболеваниям не поддаваться противоопухолевому иммунитету. Два белка иммунных контрольных точек были целью клинических противораковых иммунотерапевтических средств, цитотоксический T-лимфоцитарный антиген 4 (CTLA-4) и белок-1 запрограммированной смерти клетки (PD-1). Анти-CTLA-4 антитело и анти-PD-1 антитело были одобрены для лечения метастатической меланомы и в настоящее время находятся в процессе клинических испытаний для других видов рака. Анти-PD-L1 антитело, направленное на лиганд для PD-1, также в настоящее время находится в процессе клинического испытания.
[0010] Сообщалось, что ингибирование сигналинга FGFR улучшает противоопухолевый иммунитет и уменьшает метастазирование при раке молочной железы. (См., например, T. Ye et al., Breast Cancer Res. Treat. 143: 435-446 (2014).) Например, анти-FGFR2 антитела также исследовали на моделях рака желудка. Однако было неизвестно, может ли совместное введение ингибитора FGFR2 с ингибитором иммунной контрольной точки, таким как ингибитор PD-1 или PD-L1, дополнительно улучшать лечение в опухолевой модели. Авторы данного изобретения продемонстрировали, что комбинация ингибирующего FGFR2 антитела и ингибирующего PD-1 антитела демонстрирует по меньшей мере аддитивные эффекты в модели опухоли молочной железы мыши. Авторы изобретения также демонстрируют, что лечение только ингибирующим FGFR2 антителом приводит к увеличению экспрессирующих PD-L1 клеток, NK-клеток и CD3+, CD8+ и CD4+ T-клеток в опухолевой ткани в модели опухоли молочной железы мыши и приводит к увеличению соотношения лимфоидных и миелоидных клеток в опухолевой ткани. Кроме того, один ингибитор FGFR2, применяемый отдельно, также приносит пользу человеку, страдающему раком мочевого пузыря. Результаты в данном документе, взятые вместе, указывают на то, что ингибиторы FGFR2 могут изменять микроокружение опухоли и, следовательно, могут усиливать опухолеуничтожащие иммунные ответы, как самостоятельно, так и в комбинации с ингибитором PD-1/PD-L1.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0011] В некоторых вариантах осуществления предлагаются способы лечения рака у субъекта, включающие введение субъекту ингибитора FGFR2, такого как анти-FGFR2 антитело или ВКД FGFR2, или слитая молекула ВКД FGFR2, в комбинации с по меньшей мере одним иммуностимулирующим агентом. В некоторых вариантах осуществления иммуностимулирующий агент представляет собой ингибитор PD-1/PD-L1, такой как анти-PD-1 антитело, анти-PD-L1 антитело, слитая молекула PD-1 или полипептид PD-1. В некоторых вариантах осуществления иммуностимулирующий агент включает один или более агент, описанный в разделе ниже, озаглавленный «комбинации с другими иммуностимулирующими агентами». В некоторых вариантах осуществления ингибитор FGFR2 представляет собой антитело. В некоторых вариантах осуществления ингибитор FGFR2 представляет собой антитело, которое распознает FGFR2-IIIb. В некоторых вариантах осуществления антитело FGFR2-IIIb связывается с более низкой аффинностью к FGFR2-IIIc, чем к -IIIb, или детектируемо не связывается с FGFR2-IIIc. В некоторых вариантах осуществления ингибитор FGFR2 представляет собой ВКД FGFR2. В некоторых вариантах осуществления ингибитор FGFR2 представляет собой слитую молекулу ВКД FGFR2, содержащую ВКД FGFR2 и партнера по слиянию, такого как домен Fc, альбумин или полиэтиленгликоль (ПЭГ). В некоторых вариантах осуществления, где по меньшей мере один иммуностимулирующий агент включает ингибитор PD-1/PD-L1, ингибитор PD-1/PD-L1 представляет собой антитело. В некоторых вариантах осуществления ингибитор PD-1/PD-L1 представляет собой анти-PD-1 антитело или анти-PD-L1 антитело. В некоторых вариантах осуществления ингибитор PD-1/PD-L1 представляет собой полипептид PD-1, тогда как в некоторых вариантах осуществления ингибитор PD-1/PD-L1 представляет собой слитую молекулу PD-1.
[0012] В любом из вариантов осуществления способов и композиций в данном документе ингибитор PD-1/PD-L1 может иметь следующие характеристики. В некоторых вариантах осуществления ингибитор представляет собой анти-PD-1 антитело, содержащее CDR тяжелой цепи и легкой цепи антитела, выбранного из ниволумаба, пидилизумаба и пембролизумаба. В некоторых вариантах осуществления анти-PD-1 антитело содержит вариабельные области тяжелой цепи и легкой цепи антитела, выбранного из ниволумаба, пидилизумаба и пембролизумаба. В некоторых вариантах осуществления анти-PD-1 антитело выбрано из ниволумаба, пидилизумаба и пембролизумаба. В некоторых вариантах осуществления ингибитор PD-1/PD-L1 представляет собой анти-PD-L1 антитело. В некоторых вариантах осуществления анти-PD-L1 антитело содержит CDR тяжелой цепи и легкой цепи антитела, выбранного из BMS-936559, MPDL3280A (атезолизумаб), MEDI4736 и MSB0010718C (авелумаб). В некоторых вариантах осуществления антитело против PD-L1 содержит вариабельные области тяжелой цепи и легкой цепи антитела, выбранного из BMS-936559, MPDL3280A, MEDI4736 и MSB0010718C. В некоторых вариантах осуществления антитело против PD-L1 выбрано из BMS-936559, MPDL3280A, MEDI4736 и MSB0010718C. В некоторых вариантах осуществления ингибитор PD-1/PD-L1 представляет собой слитую молекулу. В некоторых вариантах осуществления слитая молекула представляет собой AMP-224. В некоторых вариантах осуществления ингибитор PD-1/PD-L1 представляет собой полипептид PD-1, такой как AUR-012.
[0013] В любой из композиций или способов, описанных в данном документе, в которых используется анти-PD-1 антитело, анти-PD-1 антитело может представлять собой гуманизированное антитело. В любой из композиций или способов, описанных в данном документе, анти-PD-1 антитело может быть выбрано из Fab, Fv, scFv, Fab'' и (Fab')2. В любой из композиций или способов, описанных в данном документе, анти-PD-1 антитело может представлять собой химерное антитело. В любой из композиций или способов, описанных в данном документе, анти-PD-1 антитело может быть выбрано из IgA, IgG и IgD. В любой из композиций или способов, описанных в данном документе, анти-PD-1 антитело может представлять собой IgG. В любом из способов, описанных в данном документе, антитело может представлять собой IgG1 или IgG2.
[0014] В любой из композиций или способов, описанных в данном документе, ингибитор FGFR2 может иметь следующие характеристики. В некоторых вариантах осуществления ингибитор представляет собой антитело к FGFR2. В некоторых вариантах осуществления антитело к FGFR2 представляет собой антитело к FGFR2-IIIb (также обозначаемое в данном документе как αFGFR2b). В некоторых вариантах осуществления антитело к FGFR2-IIIb связывается с FGFR2-IIIb с более высокой аффинностью, чем с FGFR2-IIIc, или, альтернативно, не связывается с FGFR2-IIIc. В некоторых вариантах осуществления антитело ингибирует связывание FGF2 и/или FGF7 с FGFR2.
[0015] В некоторых вариантах осуществления антитело FGFR2 имеет аминокислотные последовательности гипервариабельных областей (HVR) тяжелой и легкой цепи H1, H2, H3, L1, L2 и L3 моноклональных антител GAL-FR21, GAL-FR22 или GAL-FR23, описанных в патенте США № 8101723 B2. В некоторых вариантах вариабельная область тяжелой цепи антитела к FGFR2-IIIb содержит: (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 6; (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 7; и (iii) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 8; и вариабельная область легкой цепи содержит: (iv) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 9; (v) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 10; и (vi) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 11.
[0016] В некоторых вариантах осуществления антитело к FGFR2 включает антитело к FGFR2-IIIb, в котором вариабельный домен тяжелой цепи, который на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичен аминокислотной последовательности SEQ ID NO: 4, или который содержит аминокислотную последовательность SEQ ID NO: 4. В некоторых вариантах осуществления антитело к FGFR2 включает антитело к FGFR2-IIIb, в котором вариабельный домен легкой цепи на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичен аминокислотной последовательности SEQ ID NO: 5, или который содержит аминокислотную последовательность SEQ ID NO: 5. В некоторых вариантах осуществления вариабельный домен тяжелой цепи на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере 98%, или по меньшей мере 99% идентичен аминокислотной последовательности SEQ ID NO: 4, или который содержит аминокислотную последовательность SEQ ID NO: 4, и вариабельный домен легкой цепи на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере 98%, или по меньшей мере 99% идентичен аминокислотной последовательности SEQ ID NO: 5, или который содержит аминокислотную последовательность SEQ ID NO: 5. В некоторых вариантах осуществления антитело к FGFR2 включает антитело к FGFR2-IIIb, в котором тяжелая цепь на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентична аминокислотной последовательности SEQ ID NO: 2, или которая содержит аминокислотную последовательность SEQ ID NO: 2. В некоторых вариантах осуществления антитело к FGFR2 антитело включает антитело к FGFR2-IIIb, в котором легкая цепь на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере 98%, или по меньшей мере 99% идентична аминокислотной последовательности SEQ ID NO: 3, или которая содержит аминокислотную последовательность SEQ ID NO: 3. В некоторых вариантах осуществления тяжелая цепь на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере 98%, или по меньшей мере 99% идентична аминокислотной последовательности SEQ ID NO: 2, или которая содержит аминокислотную последовательность SEQ ID NO: 2, и легкая цепь на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере 98%, или по меньшей мере 99% идентична аминокислотной последовательности SEQ ID NO: 3, или которая содержит аминокислотную последовательность SEQ ID NO: 3.
[0017] В некоторых вариантах осуществления вариабельная область тяжелой цепи антитела к FGFR2-IIIb содержит: (i) CDR1, содержащую аминокислотную последовательность SEQ ID NO: 40; (ii) CDR2, содержащую аминокислотную последовательность SEQ ID NO: 41; и (iii) CDR3, содержащую аминокислотную последовательность SEQ ID NO: 42; и вариабельная область легкой цепи содержит: (iv) CDR1, содержащую аминокислотную последовательность SEQ ID NO: 44; (v) CDR2, содержащую аминокислотную последовательность SEQ ID NO: 45; и (vi) CDR3, содержащую аминокислотную последовательность SEQ ID NO: 46.
[0018] В некоторых вариантах осуществления антитело к FGFR2 включает антитело к FGFR2-IIIb, в котором вариабельный домен тяжелой цепи, который на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичен аминокислотной последовательности SEQ ID NO: 39, или который содержит аминокислотную последовательность SEQ ID NO: 39. В некоторых вариантах осуществления антитело к FGFR2 включает антитело к FGFR2-IIIb, в котором вариабельный домен легкой цепи на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичен аминокислотной последовательности SEQ ID NO: 43, или который содержит аминокислотную последовательность SEQ ID NO: 43. В некоторых вариантах осуществления вариабельный домен тяжелой цепи на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере 98%, или по меньшей мере 99% идентичен аминокислотной последовательности SEQ ID NO: 39, или который содержит аминокислотную последовательность SEQ ID NO: 39, и вариабельный домен легкой цепи на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере 98%, или по меньшей мере 99% идентичен аминокислотной последовательности SEQ ID NO: 43, или который содержит аминокислотную последовательность SEQ ID NO: 43.
[0019] В некоторых вариантах осуществления антитело к FGFR2 является афукозилированным. В некоторых вариантах осуществления антитело не содержит фукозу в Asn297. В некоторых вариантах осуществления антитело содержит константную область легкой цепи каппа. В некоторых вариантах осуществления антитело содержит константную область тяжелой цепи IgG1. В некоторых вариантах осуществления афукозилированное антитело обладает повышенной АЗКЦ (антителозависимой клеточной цитотоксичности) активностью in vitro и/или in vivo по сравнению с антителом, имеющим ту же самую аминокислотную последовательность, которая фукозилирована в Asn297. В некоторых вариантах осуществления афукозилированное антитело обладает повышенной аффинностью к Fc гамма RIIIA по сравнению с антителом, имеющим ту же самую аминокислотную последовательность, которая фукозилирована в положении Asn297. В некоторых вариантах осуществления афукозилированное антитело способно увеличивать количество одних или более из: PD-L1-положительных клеток, NK-клеток, CD3+ T-клеток, CD4+ T-клеток, CD8+ T-клеток и макрофагов в опухолевой ткани в мышиной ксенотрансплантатной модели опухоли и/или сингенной опухолевой модели по сравнению с контролем (например, по сравнению с контрольным антителом, которое не нацелено на FGFR2).
[0020] В некоторых вариантах осуществления ингибитор FGFR2 представляет собой ВКД FGFR2, такой как слитая молекула ВКД FGFR2. Слитые молекулы ВКД FGFR2 могут содержать партнеров по слиянию, такие как Fc-домен, альбумин или ПЭГ.
[0021] В некоторых вариантах осуществления и ингибитор FGFR2 способен связываться с FGFR2, а также с мутантом FGFR2 с активирующей мутацией, такой как мутация FGFR2-S252W, которая обнаружена в некоторых раковых клетках.
[0022] В любой из композиций или способов, описанных в данном документе, в которых используется антитело к FGFR2, антитело к FGFR2 может представлять собой гуманизированное антитело. В любой из композиций или способов, описанных в данном документе, антитело к FGFR2 может быть выбрано из Fab, Fv, scFv, Fab'' и (Fab')2. В любой из композиций или способов, описанных в данном документе, антитело к FGFR2 может представлять собой химерное антитело. В любой из композиций или способов, описанных в данном документе, антитело к FGFR2 может быть выбрано из IgA, IgG и IgD. В любой из композиций или способов, описанных в данном документе, антитело к FGFR2 может представлять собой IgG. В любом из способов, описанных в данном документе, антитело может представлять собой IgG1, IgG2, IgG3, или IgG4.
[0023] В некоторых вариантах осуществления ингибитор FGFR2 вводят в дозе по меньшей мере 0,1, 0,3, 0,5, 1, 2, 3, 4, 5, 10, 15, 20, 20 или 30 мг/кг или в диапазоне, ограниченного любыми двумя указанными дозами. В некоторых вариантах осуществления ингибитор PD-1/PD-L1 вводят в дозе по меньшей мере 0,1, 0,3, 0,5, 1, 2, 3, 4, 5 или 10 мг/кг или в диапазоне, ограниченном любыми двумя указанными дозами, например, в диапазоне 0,5-10 мг/кг. В некоторых вариантах осуществления ингибитор FGFR2 и по меньшей мере один иммуностимулирующий агент, такой как ингибитор PD-1/PD-L1, вводят по меньшей мере один раз в 1, 2, 3, 4 или 5 недель.
[0024] В некоторых вариантах осуществления рак сверхэкспрессирует FGFR2IIIb или с, или без амплификации гена FGFR2. В некоторых вариантах осуществления сверхэкспрессия FGFR2IIIb определяется при помощи иммуногистохимии (ИГХ). Например, сверхэкспрессию можно определить при помощи сигнала ИГХ, составляющего 1+, 2+ или 3+, по меньшей мере в 10% опухолевых клеток, например, по меньшей мере в 20%, 30%, 40% или 50% опухолевых клеток.
[0025] В некоторых вариантах осуществления рак выбирают из рака желудка, рака молочной железы, немелкоклеточного рака легкого, меланомы, плоскоклеточной карциномы головы и шеи, рака яичника, рака поджелудочной железы, почечно-клеточной карциномы, гепатоцеллюлярной карциномы, рака мочевого пузыря, холангиокарциномы, рака пищевода (включая аденокарциному гастроэзофагеального соединения) и рака эндометрия. В некоторых вариантах осуществления рак является рецидивирующим или прогрессирующим после терапии, выбранной из оперативного вмешательства, химиотерапии, лучевой терапии или их комбинации. В некоторых вариантах осуществления субъект является субъектом, недостаточно ответившим на лечение ингибитором PD-1/PD-L1. В некоторых вариантах осуществления субъект ранее получал лечение ингибитором PD-1/PD-L1.
[0026] В некоторых вариантах осуществления способ лечения рака дополнительно включает введение по меньшей мере одного дополнительного терапевтического агента, выбранного из препарата на основе платины, паклитаксела, ABRAXANE®, доцетаксела, гемцитабина, капецитабина, иринотекана, эпирубицина, FOLFOX, FOLFIRI, лейковорина, фторурацила, митомицина С, и доксорубицина гидрохлорида. В некоторых вариантах осуществления препарат на основе платины выбирают из цисплатина, оксалиплатина и карбоплатина. В некоторых вариантах осуществления способ лечения рака дополнительно включает введение паклитаксела. В некоторых вариантах осуществления способ лечения рака дополнительно включает введение цисплатин и/или 5-ФУ.
[0027] В некоторых вариантах осуществления ингибитор FGFR2 и ингибитор PD-1/PD-L1 вводят одновременно или последовательно. В некоторых вариантах осуществления ингибитор FGFR2 и иммуностимулирующий агент вводят одновременно. В некоторых вариантах осуществления одну или более доз иммуностимулирующего агента вводят перед введением ингибитора FGFR2. В некоторых вариантах осуществления субъект получил полный курс терапии иммуностимулирующим агентом перед введением ингибитора FGFR2. В некоторых вариантах осуществления ингибитор FGFR2 вводят во время второго курса терапии иммуностимулирующим агентом. В некоторых вариантах осуществления субъект получил по меньшей мере одну, по меньшей мере две, по меньшей мере три или по меньшей мере четыре дозы иммуностимулирующего агента переде введением ингибитора FGFR2. В некоторых вариантах осуществления по меньшей мере одну дозу иммуностимулирующего агента вводят одновременно с ингибитором FGFR2. В некоторых вариантах осуществления одну или более доз ингибитора FGFR2 вводят перед введением иммуностимулирующего агента. В некоторых вариантах осуществления субъект может получать по меньшей мере две, по меньшей мере три, по меньшей мере три или по меньшей мере четыре дозы ингибитора FGFR2 перед введением иммуностимулирующего агента. В некоторых вариантах осуществления по меньшей мере одну доза ингибитора FGFR2 вводят одновременно с иммуностимулирующим агентом.
[0028] В некоторых вариантах осуществления введение ингибитора FGFR2 и ингибитора PD-1/PD-L1 в мышиной ксенотрансплантатной модели опухоли и/или сингенной опухолевой модели приводит к аддитивному или синергическому ингибированию роста опухоли. В некоторых вариантах осуществления модель представляет собой модель рака молочной железы. В некоторых вариантах осуществления модель включает клетки 4T1.
[0029] В любом из вышеприведенных способов осуществления изобретения комбинация ингибитора FGFR2 и ингибитора PD-1/PD-L1 может ингибировать рост опухоли в мышиной ксенотрансплантатной модели опухоли и/или сингенной опухолевой модели в течение по меньшей мере 1 недели, 10 суток или 2 недель, например, на по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90% или по меньшей мере 95%. В любом из вышеприведенных способов осуществления изобретения комбинация ингибитора FGFR2 и иммуностимулирующего агента, такого как ингибитор PD-1/PD-L1, субъекту может уменьшить объем по меньшей мере одной опухоли у субъекта на по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90% или по меньшей мере 95%, например, в течение по меньшей мере одного месяца, двух месяцев, трех месяцев, шести месяцев или одного года.
[0030] В любом из вышеприведенных способов осуществления изобретения введение ингибитора FGFR2 в ксенотрансплантатной модели опухоли и/ или сингенной опухолевой модели может продемонстрировать увеличение NK-клеток, таких как NKp46+ клетки, увеличение PD-L1-экспрессирующих клеток, увеличение макрофагов, таких как F480+ макрофаги, увеличение одних или более из: CD3+, CD8+ и CD4+ T-клеток, и/или увеличение отношения лимфоидных клеток к миелоидным клеткам в опухолевой ткани по сравнению с контролем в течение периода по меньшей мере 1 суток, по меньшей мере 4 суток, по меньшей мере 1 недели, по меньшей мере 10 суток или по меньшей мере 2 недель, и, например, на по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90% или по меньшей мере 95%. В некоторых вариантах осуществления мышиная сингенная опухолевая модель представляет собой модель опухоли молочной железы 4T1. В некоторых вариантах осуществления контроль представляет собой носитель или представляет собой молекулу Ig-Fc или другое соединение, которое не ингибирует рост опухоли в модели.
[0031] Также в данном документе предложены способы увеличения количества NK-клеток, PD-L1-положительных клеток и/или CD3+, CD8+ и/или CD8+ T-клеток и/или макрофагов в опухолевой ткани субъекта с раком и/или способов увеличения соотношения лимфоидных клеток к миелоидным клеткам в опухолевой ткани субъекта с раком, включающий введение указанному субъекту эффективного количества ингибирующего антитело к FGFR2, такого как любое из антител к FGFR2, описанных в предыдущих абзацах. Увеличение в одних или более из: CD3+, CD8+ и CD4+ Т-клеток, и/или увеличение соотношения лимфоидных клеток к миелоидным клеткам в опухолевой ткани по сравнению с контролем в течение по меньшей мере 1 суток, по меньшей мере 4 суток, по меньшей мере 1 недели, по меньшей мере 10 суток или по меньшей мере 2 недель, и, например, на по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90% или по меньшей мере 95%. В некоторых вариантах осуществления антитело может иметь одно или более из следующих свойств: (а) отсутствует фукоза в положении Asn297; (b) содержит константную область легкой цепи κ; (c) содержит константную область тяжелой цепи IgG1; (d) имеет повышенную АЗКЦ активность in vitro по сравнению с антителом, имеющим ту же самую аминокислотную последовательность, которая фукозилирована в положении Asn297; и (e) имеет повышенную аффинность к Fc гамма RIIIA по сравнению с антителом, имеющим ту же самую аминокислотную последовательность, которая фукозилирована в положении Asn297. В некоторых вариантах осуществления афукозилированное антитело способно увеличивать количество одних или более из: PD-L1-положительных клеток, NK-клеток, CD3+ T-клеток, CD4+ T-клеток, CD8+ T-клеток и макрофагов в опухолевой ткани в мышиной ксенотрансплантатной модели опухоли и/или сингенной опухолевой модели по сравнению с контролем (например, по сравнению с контрольным антителом, которое не нацелено на FGFR2). В некоторых вариантах осуществления способ ингибирует рост опухоли или уменьшает объем по меньшей мере одной опухоли у субъекта. В некоторых вариантах осуществления субъект страдает от рака молочной железы, рака желудка, немелкоклеточного рака легкого, меланомы, плоскоклеточной карциномы головы и шеи, рака яичника, рака поджелудочной железы, почечно-клеточной карциномы, гепатоцеллюлярной карциномы, рака мочевого пузыря, холангиокарциномы, рака пищевода (включая аденокарциному гастроэзофагеального соединения) и рака эндометрия. В некоторых вариантах осуществления способ дополнительно включает получение по меньшей мере одного образца опухоли из субъекта, после введения антитела к FGFR2, и определение количества NK-клеток, PD-L1-положительных клеток и/или CD3+, CD8+ и/или CD4+ Т-клеток в образце и, если количество одного или более из этих типов клеток увеличивается относительно образца перед введением антитела к FGFR2 или относительно неопухолевого образца у субъекта, вводится ингибитор PD-1/PD-L1 субъекту. В некоторых вариантах осуществления способ дополнительно включает получение по меньшей мере одного образца опухоли из субъекта, после введения антитела к FGFR2, и определение соотношения лимфоидных клеток к миелоидным клеткам в образце и, если соотношение увеличивается относительно образца до введения антитела к FGFR2 или относительно неопухолевого образца у субъекта, введение по меньшей мере одного субъекту. По меньшей мере один иммуностимулирующий агент, такой как, по меньшей мере один ингибитор PD-1/PD-L1, из этих способов может быть любым из тех, которые описаны в предыдущих абзацах или описаны в разделе ниже, озаглавленном «комбинации с другими иммуностимулирующими агентами». В некоторых вариантах осуществления пациенту можно вводить комбинацию ингибитора FGFR2, ингибитора PD-1/PD-L1 и по меньшей мере одного другого иммуностимулирующего агента.
[0032] Также в данном документе предложены способы лечения рака у субъекта, включающие введение субъекту ингибитора FGFR2 и, если определено, что субъект имеет увеличенное количество NK-клеток, PD-L1-положительных клеток, макрофагов, CD3+ T-клеток, CD8+ T-клеток, и/или CD4+ Т-клеток по сравнению с контролем, таким как образец, перед введением антитела к FGFR2, или по сравнению с неопухолевым образцом у субъекта, введение субъекту по меньшей мере одного иммуностимулирующего агента, такого как ингибитор PD-1/PD-L1. Также в данном документе предложены способы лечения рака у субъекта, включающие введение субъекту ингибитора FGFR2 и, если определено, что субъект имеет увеличенное соотношение лимфоидных клеток к миелоидным клеткам относительно контроля, такого как образец, перед введением антитела к FGFR2 или относительно неопухолевого образца у субъекта, введение по меньшей мере одного иммуностимулирующего агента субъекту, такого как ингибитор PD-1/PD-L1. В таких способах ингибитор FGFR2 и иммуностимулирующий агент могут быть любыми из тех, которые описаны в предыдущих абзацах или в разделе ниже, озаглавленном «комбинации с другими иммуностимулирующими агентами». Кроме того, введение FGFR2 и иммуностимулирующего агента может быть в соответствии с ранее описанными способами, в которых введение иммуностимулирующего агента не начинается до тех пор, пока не будет введена по меньшей мере одна доза ингибитора FGFR2. В таких случаях тест для определения количества NK-клеток, PD-L1-положительных клеток, макрофагов, CD3+, CD8+ и/или CD4+ T-клеток, лимфоидных и/или миелоидных клеток может, например, проводят после введения ингибитора FGFR2, но перед началом введения комбинации FGFR2 и иммуностимулирующего агента.
[0033] Также предложены композиции, содержащие любой из описанных в данном документе ингибиторов FGFR2 и любой из описанных в данном документе иммуностимулирующих агентов. В таких композициях ингибитор FGFR2 и по меньшей мере один иммуностимулирующий агент могут быть расположены в отдельных контейнерах или отдельных отделениях одного и того же контейнера или, альтернативно, их можно смешивать вместе в том же контейнере или отделении. Такие композиции могут быть использованы, например, для лечения рака, такого как любой из описанных выше видов рака. В некоторых вариантах осуществления также могут быть включены инструкции по применению, такие как инструкции по применению в лечении рака.
[0034] В данном документе также предложены способы увеличения количества одних или более из: PD-L1-положительных клеток, NK-клеток, макрофагов, CD3+ T-клеток, CD4+ T-клеток и CD8+ T-клеток в опухолевой ткани субъекта, страдающего раком, включающие введение ингибитора FGFR2, причем ингибитор представляет собой антитело FGFR2 с повышенной АЗКЦ активностью. В некоторых таких вариантах осуществления иммуностимулирующий агент вводят с антителом к FGFR2. В некоторых таких вариантах осуществления введение антитела к FGFR2 в мышиной ксенотрансплантатной модели опухоли и/или сингенной опухолевой модели увеличивает количество одного или более типов PD-L1-положительных клеток, NK-клеток, макрофагов, CD3+ T-клеток, CD8+ T-клеток и CD4+ T клеток в опухолевой ткани по сравнению с контролем и/или увеличивает соотношение лимфоидных клеток к миелоидным клеткам в опухолевой ткани. В некоторых таких вариантах осуществления субъект страдает от рака молочной железы, рака желудка, немелкоклеточного рака легкого, меланомы, плоскоклеточной карциномы головы и шеи, рака яичника, рака поджелудочной железы, почечно-клеточной карциномы, гепатоцеллюлярной карциномы, рака мочевого пузыря, холангиокарциномы, рака пищевода (включая аденокарциному гастроэзофагеального соединения) или рака эндометрия, такого как рак мочевого пузыря.
[0035] В вышеуказанных способах антитело к FGFR2 может представлять собой антитело к FGFR2-IIIb, которое может иметь одно или более из следующих свойств: (а) связывается с FGFR2-IIIb с более высокой аффинностью, чем с FGFR2-IIIc или детектируемо не связывается с FGFR2 -IIIc; (b) ингибирует связывание FGF2 и/или FGF7 с FGFR2 человека; (c) ингибирует рост опухоли человека в мышиной ксенотрансплантатной модели опухоли и/или сингенной опухолевой модели; (d) индуцирует АЗКЦ активность; (e) обладает повышенной АЗКЦ активностью; и (f) является афукозилированным.
[0036] В некоторых вариантах осуществления вышеуказанного способа антитело к FGFR2 содержит вариабельные области тяжелой цепи и легкой цепи, причем вариабельная область тяжелой цепи содержит: (i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 6; (ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 7; и (iii) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 8;
и вариабельная область легкой цепи содержит: (iv) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 9; (v) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 10; и (vi) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 11.
[0037] В некоторых случаях вариабельный домен тяжелой цепи антитела к FGFR2 содержит аминокислотную последовательность по меньшей мере на 95% идентичную аминокислотной последовательности SEQ ID NO: 4 и/или вариабельный домен легкой цепи антитела к FGFR2 содержит аминокислотную последовательность по меньшей мере на 95% идентичную аминокислотной последовательности SEQ ID NO: 5. В некоторых случаях вариабельный домен тяжелой цепи антитела к FGFR2 содержит аминокислотную последовательность SEQ ID NO: 4 и/или вариабельный домен легкой цепи антитела к FGFR2 содержит аминокислотную последовательность SEQ ID NO: 5. В некоторых случаях тяжелая цепь антитела к FGFR2 содержит аминокислотную последовательность по меньшей мере на 95% идентичную аминокислотной последовательности SEQ ID NO: 2 и/или легкая цепь антитела к FGFR2 содержит аминокислотную последовательность по меньшей мере на 95% идентичную аминокислотной последовательности SEQ ID NO: 3. В некоторых случаях тяжелая цепь антитела к FGFR2 антитела содержит аминокислотную последовательность SEQ ID NO: 2 и/или легкая цепь антитела к FGFR2 содержит аминокислотную последовательность SEQ ID NO: 3. В некоторых случаях антитело к FGFR2 является химерным, гуманизированным или человеческим. В некоторых вариантах осуществления антитело к FGFR2 выбирают из Fab, Fv, scFv, Fab'' и (Fab')2. В некоторых вариантах осуществления антитело к FGFR2 имеет одно или более из следующих свойств: (а) отсутствует фукоза в положении Asn297; (b) содержит константную область легкой цепи κ; (c) содержит константную область тяжелой цепи IgG1; (d) имеет повышенную АЗКЦ активность in vitro по сравнению с антителом, имеющим ту же самую аминокислотную последовательность, которая фукозилирована в положении Asn297; и (e) имеет повышенную аффинность к Fc гамма RIIIA по сравнению с антителом, имеющим ту же самую аминокислотную последовательность, которая фукозилирована в положении Asn297. В некоторых вариантах осуществления афукозилированное антитело способно увеличивать количество одних или более из: PD-L1-положительных клеток, NK-клеток, CD3+ T-клеток, CD4+ T-клеток, CD8+ T-клеток и макрофагов в опухолевой ткани в мышиной ксенотрансплантатной модели опухоли и/или сингенной опухолевой модели по сравнению с контролем (например, по сравнению с контрольным антителом, которое не нацелено на FGFR2).
[0038] В любом из способов или применений, описанных в разделе «Сущность изобретения», рак может быть предварительно определен сверхэкспрессией FGFR2IIIb, или с, или без амплификации гена FGFR2. Альтернативно, любой из способов или применений, описанных в этом разделе, способ может дополнительно включать исследование рака у субъекта, например, до введения ингибитора FGFR2, для определения того, сверхэкспрессирует ли рак FGFR2IIIb и/или для определения того, ампифицируется ли ген FGFR2 в опухолевых клетках. В любом случае FGFR2IIIb необязательно может быть определен с помощью иммуногистохимии (ИГХ), и амплификация гена FGFR2 необязательно может быть определена с помощью флуоресцентной гибридизации in situ (метод FISH), например, с использованием зондов для локуса гена FGFR2 и центромеры хромосомы 10, в которой расположен ген FGFR2. В некоторых вариантах осуществления сигнал ИГХ. составляющий 1+, 2+ или 3+, по меньшей мере в 10% опухолевых клеток, например, по меньшей мере 20%, 30%, 40% или 50% опухолевых клеток указывает на сверхэкспрессию FGFR2IIIb. В некоторых вариантах осуществления соотношение FGFR2 к центромере хромосомы 10 (CEN10), большее или равное 2, означает амплификацию гена FGFR2.
[0039] В некоторых вариантах осуществления, в которых пациент страдает от рака желудка или мочевого пузыря, субъект может быть предварительно определен, чтобы иметь один из следующих профилей, или, альтернативно, способ лечения включает определение того, подходит ли пациент одному из следующих профилей в отношении экспрессии/амплификация гена FGFR2, и который может указывать на уровень ожидаемой чувствительности на лечение: а) в случае субъекта с раком желудка сигнал ИГХ, составляющий 3+, по меньшей мере в 10% опухолевых клеток; b) в случае субъекта с раком желудка сигнал ИГХ, составляющий 3+, по меньшей мере в 10% опухолевых клеток, а также амплификации гена FGFR2; c) в случае субъекта с раком желудка сигнал ИГХ, составляющий 3+, по меньшей мере в 10% опухолевых клеток без амплификации гена FGFR2; d) в случае субъекта с раком желудка сигнал ИГХ, составляющий 1+ или 2+, по меньшей мере в 10% опухолевых клеток; e) в случае субъекта с раком мочевого пузыря сигнал ИГХ, составляющий 1+, по меньшей мере в 10% опухолевых клеток; f) в случае субъекта с раком мочевого пузыря сигнал ИГХ, составляющий 2+, по меньшей мере в 10% опухолевых клеток; g) в случае пациента с раком мочевого пузыря показатель H больше 20; h) в случае субъекта с раком мочевого пузыря, показатель H равен 10-19; i) в случае субъекта с раком мочевого пузыря показатель H менее, чем 10.
[0040] Данное раскрытие также обеспечивает способы определения чувствительности к любому из ингибиторов FGFR2, методам лечения и применениям, описанным выше. Такие способы могут включать исследование рака у субъекта, чтобы определить, сверхэкспрессирует ли рак FGFR2IIIb, и/или определить, амплифицируется ли ген FGFR2 в опухолевых клетках. Сверхэкспрессия FGFR2IIIb необязательно может быть определена с помощью иммуногистохимии (ИГХ), и амплификация гена FGFR2 необязательно может быть определена с помощью флуоресцентной гибридизации in situ (метод FISH), например, с использованием зондов для локуса гена FGFR2 и центромеры хромосомы 10, в которой расположен ген FGFR2. В некоторых вариантах осуществления сигнал ИГХ, составляющий 1+, 2+ или 3+, по меньшей мере в 10% опухолевых клеток, например, по меньшей мере 20%, 30%, 40% или 50% опухолевых клеток указывает на сверхэкспрессию FGFR2IIIb. В некоторых вариантах осуществления соотношение FGFR2 к центромере хромосомы 10 (CEN10), большее или равное 2, означает амплификацию гена FGFR2.
[0041] В некоторых вариантах осуществления, в которых пациент страдает от рака желудка или мочевого пузыря, способ может включать определение того, относится ли рак у пациента к одной из следующих категорий, что может указывать на чувствительность к лечению или на композицию с ингибитором FGFR2: а) в случае субъекта с раком желудка сигнал ИГХ, составляющий 3+, по меньшей мере в 10% опухолевых клеток; b) в случае субъекта с раком желудка сигнал ИГХ, составляющий 3+, по меньшей мере в 10% опухолевых клеток, а также амплификации гена FGFR2; c) в случае субъекта с раком желудка сигнал ИГХ, составляющий 3+, по меньшей мере в 10% опухолевых клеток без амплификации гена FGFR2; d) в случае субъекта с раком желудка сигнал ИГХ, составляющий 1+ или 2+, по меньшей мере в 10% опухолевых клеток; e) в случае пациента с раком мочевого пузыря сигнал ИГХ, составляющий 1+, по меньшей мере в 10% опухолевых клеток; f) в случае субъекта с раком мочевого пузыря сигнал ИГХ, составляющий 2+, по меньшей мере в 10% опухолевых клеток; g) в случае пациента с раком мочевого пузыря, показатель H больше 20; h) в случае субъекта с раком мочевого пузыря показатель H равен 10-19; i) в случае субъекта с раком мочевого пузыря показатель H менее, чем 10.
[0042] Следует понимать, что как вышеизложенное общее описание, так и последующее подробное описание данного изобретения являются только иллюстративными и пояснительными, и не предназначаются для ограничения формулы изобретения. Названия разделов, используемые в данном документе, предназначены лишь для организационных целей, и их не следует толковать как ограничение описанного объекта изобретения. Все приведенные в данном документе ссылки, включая заявки на патенты и публикации, включены в настоящее описание посредством ссылки во всей их полноте для любых целей.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0043] На фиг. 1a-1b изображены изменения в объеме имплантированных опухолевых клеток 4T1 молочной железы у мышей BALB/c после лечения с помощью контроля Ig-Fc, афуколизированного анти-FGFR2b антитела (анти-FGFR2), содержащего HVR тяжелой и легкой цепи SEQ ID NO: 6-11 или анти-FGFR2b антитела с той же аминокислотной последовательностью, за исключением замены Q на N в положении аминокислоты 297 (анти-FGFR2-N297Q) для устранения эффекторной функции. (См. SEQ ID NO: 12 в приведенной ниже таблице последовательностей для описания этой мутации.) Как изображено на фиг. 1а и фиг. 1b, только анти-FGFR2 антитело продемонстрировало ингибирование роста опухоли 4T1. Статистическую значимость (P <0,05=*, P <0,01=**, P <0,001=***; P <0,001=****) определяли с помощью 1-факторного дисперсионного анализа с последующим критерием множественных сравнений Тьюки.
[0044] На фиг. 2a-2d изображены результаты окрашивания опухолевых клеток 4T1 на присутствие или NKp46 (фиг. 2a-2b), или PD-L1 (фиг. 2c-2d) по сравнению с окрашиванием DAPI (4', 6-диамидин-2-фенилиндол) ядер клеток или на 1-е сутки, или через сутки после однократной дозы с контролем-носителем или анти-FGFR2 (фиг. 2a и 2c), или на четвертые сутки, через одни сутки после второй из двух терапий, применяемых на нулевые сутки и третьи сутки с контролем-носителем или анти-FGFR2 (фиг. 2b и 2d). Каждое изображение получали из различных опухолей, и изображения собирали с использованием объектива 10X. Лечение анти-FGFR2 увеличивало количество NKp46+ клеток в опухоли 4T1 по сравнению с носителем на 1-е сутки, так и на 4-е сутки (фиг. 2a-2b) и увеличивало количество PD-L1+ клеток по сравнению с носителем как 1-е сутки, так и на 4-е сутки (фиг. 2c-2d).
[0045] На фиг. 3 изображен анализ влияния воздействия анти-FGFR2 на количество NKp46+ клеток в мышиных опухолях 4T1 на 4-е сутки. Лечение анти-FGFR2 увеличивало количество NK-клетки в опухолях по сравнению с контролем-носителем с P <0,05 по t-критерию.
[0046] На фиг. 4a-4b изображены изменения в объеме имплантированных опухолей 4T1 молочной железы у мышей BALB/c у мышей после лечения с помощью контроля Ig-Fc, анти-PD-1 антитела, афукозилированного анти-FGFR2b антитела, обозначенного как анти-FGFR2, и после комбинации лечения с анти-PD-1 антителом и афукозилированным анти-FGFR2b антителом. На каждом графике объем опухоли изображен как среднее значение мм3+/- СОС. Как изображено на фиг. 4а, комбинация анти-FGFR2 (10 мг/кг два раза в неделю) и анти-PD1 антитела (5 мг/кг раз в две недели) приводила к значительному ингибированию роста опухолей 4T1 по сравнению с контролем и или только антителом к 18 суткам. Как изображено на фиг. 4b на 18 сутки после имплантации опухоли комбинация продемонстрировала статистически значимое ингибирование роста опухолей 4T1 по сравнению с контролем Ig-Fc или анти-PD1 антителом. Статистическую значимость определяли с помощью 1-факторного дисперсионного анализа с последующим критерием множественных сравнений Тьюки.
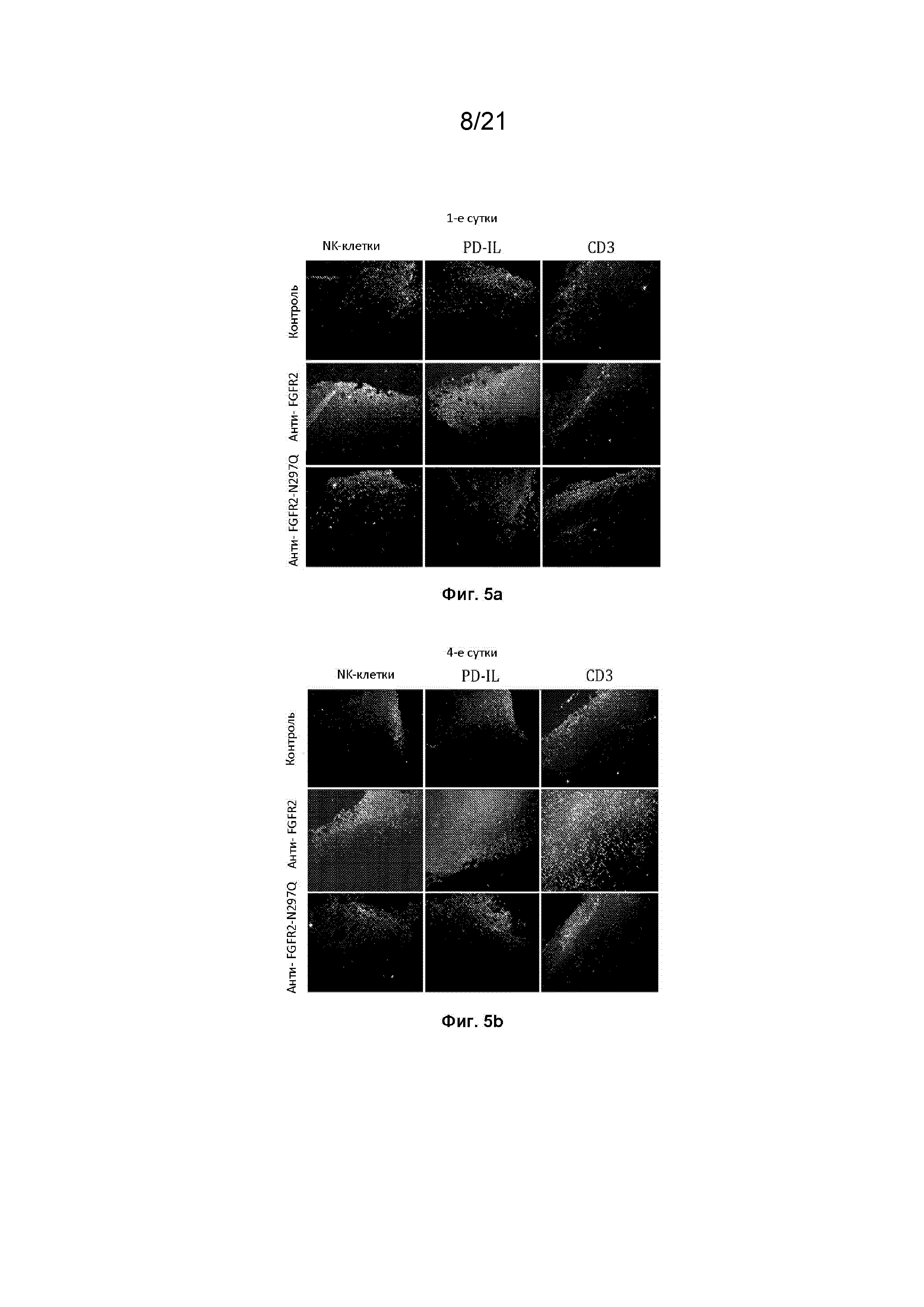
[0047] На фиг. 5a-5b изображены результаты окрашивания опухолевых клеток 4T1 на присутствие или NKp46 клеток, или PD-L1+ клеток или, CD3+ T-клеток или на 1 сутки (фиг. 5a), или через одни сутки после однократной дозы с контролем-носителем или анти-FGFR2, или анти-FGFR2 N297Q, или на 4 сутки, через одни сутки после второй из двух терапий, применяемых на нулевые сутки и третьи сутки с контролем-носителем или анти-FGFR2 (фиг. 5b). Каждое изображение получали из различных опухолей, и изображения собирали с использованием объектива 10X. Лечение анти-FGFR2 увеличивало количество NKp46+ клеток в опухоли 4T1 по сравнению с носителем как на 1-е сутки, так и на 4-е сутки и увеличивало количество клеток PD-L1+ по сравнению с носителем как на 1-е сутки, так и на 4-е сутки, причем большее количество клеток наблюдали на 4-е сутки, чем на 1-е сутки. CD3+ Т-клетки также проникали в опухоль на 4-е сутки после лечения анти-FGFR2.
[0048] На фиг. 6a-6b изображены результаты окрашивания опухолевых клеток 4T1 на присутствие CD3+ и CD8+ T-клеток (фиг. 6a) или CD3+ и CD4+ T-клеток (фиг. 6b) на 4-е сутки протокола лечения, прилегающим к клеткам с окрашенным DAPI ядром. На изображениях показано, что лечение анти-FGFR2 привело к увеличению количества всех трех типов Т-клеток в опухолевой ткани на 4-е сутки по сравнению с контролем и лечением анти-FGFR2 N297Q.
[0049] На фиг. 7а-7b изображены результаты анализа методом проточной цитометрии опухолевых клеток в модели сингенной опухоли 4T1 на 1-е сутки и 4-е сутки, соответственно. CD3+ Т-клетки обеспечивают для каждой из групп лечения в виде процента от CD45+ живых одиночных клеток. Как изображено на фигурах, группа анти-FGFR2 показала повышение процента CD3+ Т-клеток по сравнению с обеими группами контроля-носителя и анти-FGFR2 N297Q к 4-ым суткам. Это повышение также было статистически значимым в соответствии с t-критерием Стьюдента, что отмечено символами **, обозначающими P ≤ 0,01.
[0050] На фиг. 8a-8b изображены результаты анализа методом проточной цитометрии опухолевых клеток в модели сингенной опухоли 4T1 на 1-е сутки и 4-е сутки, соответственно. CD8+ Т-клетки обеспечивают для каждой из групп лечения в виде процента от CD45+ живых одиночных клеток. Как изображено на фигурах, группа анти-FGFR2 показала повышение процента CD8+ Т-клеток по сравнению с обеими группами контроля-носителя и анти-FGFR2 N297Q к 4-ым суткам. Это повышение также было статистически значимым в соответствии с t-критерием Стьюдента, что отмечено символами **, обозначающими P ≤ 0,01.
[0051] На фиг. 9a-9b изображены результаты анализа методом проточной цитометрии опухолевых клеток в модели сингенной опухоли 4T1 на 1-е сутки и 4-е сутки, соответственно. CD4+ Т-клетки обеспечивают для каждой из групп лечения в виде процента от CD45+ живых одиночных клеток. Как изображено на фигурах, группа анти-FGFR2 показала повышение процента CD4+ Т-клеток по сравнению с обеими группами контроля-носителя и анти-FGFR2 N297Q к 4-ым суткам. Это повышение также было статистически значимым в соответствии с t-критерием Стьюдента, что отмечено символами *, обозначающими P ≤ 0,5.
[0052] На фиг. 10а-10с изображены дополнительные результаты анализа методом проточной цитометрии опухолевых клеток в модели сингенной опухоли 4T1 на 4-е сутки. На фиг. 10а NKp46+ клетки обеспечивают для каждой из групп лечения в виде процента от CD45+ живых одиночных клеток. На фигуре изображено статистически значимое увеличение NKp46+ клеток в группе анти-FGFR2 по сравнению с другими группами, в соответствии с t-критерием Стьюдента, причем * обозначает P ≤ 0,5, ** обозначает P ≤ 0,01, и *** обозначает P ≤ 0,001. На фиг. 10b и 10c изображено, что количество миелоидных клеток значительно уменьшилось в группе анти-FGFR2, тогда как количество лимфоидных клеток значительно увеличилось, что свидетельствует о том, что по сравнению с другими группами соотношение лимфоидных к миелоидным клеткам увеличивается на 4-е сутки после лечения анти-FGFR2.
[0053] На фиг. 11 изображено окрашивание опухолевой ткани 4T1 в мышиной модели сингенной опухоли на 1 или 4 сутки после лечения контролем-носителем (верхние панели), анти-FGFR2 антителом (средние панели) или анти-FGFR2-N297Q антителом (нижние панели). На фигурах изображено окрашивание анти-F480 антителом для установления инфильтрации F480+ макрофагов в опухолевую ткань и соответствующего окрашивания ядер клеток, посредством DAPI. Как видно из фигуры, после лечения анти-FGFR2 F480+ макрофаги намного более многочисленны по сравнению с контролем (сравните верхнюю и среднюю панели на 4-е сутки). Не было обнаружено различий между панелями контроля и анти-FGFR2-N297Q (сравните верхнюю и нижнюю панели на 4-е сутки). Изображения собирали с использованием объектива 10X.
[0054] На фиг. 12 изображено окрашивание опухолевой ткани 4T1 в мышиной модели сингенной опухоли через 4 суток после лечения различными антителами: контрольное антитело (антитело Fc-G1) (верхние панели), кроличье анти-асиало-GM1 антитело - предназначенные для уменьшения числа NKp46 клеток (вторые панели), анти-FGFR2 антитело (третьи панели) и комбинация анти-FGFR2 антитела с анти-асиало-GM1 антителом (нижние панели). Ткань была окрашена реагентами для NKp46 или DAPI для окрашивания клеточных ядер (левой и правой панелей, соответственно). Анти-асиало-GM1 антитело вводили в дозе 1,25 мг/кг, и анти-FGFR2 антитело вводили в дозе 10 мг/кг. Изображения собирали с использованием объектива 10X. Как видно из четырех разных окрашивающих панелей NKp46, анти-асиало-GM1 антитело истощало NKp46 клетки в опухолевой ткани, тогда как анти-FGFR2 антитело увеличивало количество NKp46 клеток. (Сравните верхнюю и третью левую панели) Анти-FGFR2 антитело в комбинации с анти-асиало-GM1 антителом увеличивало количество NKp46 клеток по сравнению с анти-асиало-GM1 антителом (хотя и не по сравнению с контролем), что указывает на то, что анти-FGFR2 антитело может увеличить количество NKp46 в опухолевой ткани, даже когда эти клетки истощаются в присутствии конкурирующего антитела. (Сравните верхнюю, вторую и нижнюю левые панели.)
[0055] На фиг. 13 изображено окрашивание для CD3+ T-клеток и соответствующее окрашивание DAPI ядер клеток опухолевой ткани 4T1 в мышиной модели сингенной опухоли в течение 4 суток после лечения контрольным антителом (Fc-G1 антитело) (верхние панели), кроличьим анти-асиало-GM1 антителом (вторые панели), анти-FGFR2 антителом (третьи панели) и комбинация анти-FGFR2 антитела с анти-асиало-GM1 антителом (нижние панели). Анти-асиало-GM1 антитело вводили в дозе 1,25 мг/кг, и анти-FGFR2 антитело вводили в дозе 10 мг/кг. Изображения собирали с использованием объектива 10X. Как видно из сравнения четырех левых панелей фигуры, лечение анти-FGFR2 антителом увеличивало количество CD3+ Т-клеток в опухолевой ткани, но не при введении вместе с анти-асиало-GM1 антителом.
[0056] На фиг. 14 изображено окрашивание для PD-L1-положительных клеток и соответствующее окрашивание DAPI ядер клеток опухолевой ткани 4T1 в мышиной модели сингенной опухоли в течение 4 суток после лечения контрольным антителом (Fc-G1 антитело) (верхние панели), кроличьим анти-асиало-GM1 антителом (вторые панели), анти-FGFR2 антителом (третьи панели) и комбинация анти-FGFR2 антитела с анти-асиало-GM1 антителом (нижние панели). Анти-асиало-GM1 антитело вводили в дозе 1,25 мг/кг, и анти-FGFR2 антитело вводили в дозе 10 мг/кг. Изображения собирали с использованием объектива 10X. Как видно из сравнения четырех левых панелей фигуры, лечение анти-FGFR2 антителом увеличивало количество PD-L1-положительных клеток в опухолевой ткани, но не при введении вместе с анти-асиало-GM1 антителом.
[0057] На фиг. 15a и 15b изображен рост ортотопических опухолей 4T1 у мышей после введения контрольного фосфатно-солевого буферного раствора (PBS), анти-FGFR2 антитела, анти-асиало-GM1 антитела или комбинации анти-FGFR2 и анти-асиало-GM1 антител. На фиг. 15а изображен объем опухоли в течение 12 и 15 суток после введения. На фиг. 15b изображен график объема опухоли у отдельных мышей в каждой группе через 15 суток после введения. На фигуре изображено статистически значимое уменьшение объема опухоли в группе анти-FGFR2 по сравнению с контрольной группой и группами анти-асиало-GM1 в соответствии с Т-критерием Студента, причем * обозначает P ≤ 0,5 и ** обозначает P ≤ 0,01, как а также статистически значимое изменение объема опухоли между группой, получающей только анти-FGFR2 антитело, и группой, получающей комбинацию анти-FGFR2 и анти-асиало-GM1 антител.
[0058] На фиг. 16a, b, c и d изображен рост ортотопических опухолей 4T1 у мышей SCID после введения контроля-носителя или анти-FGFR2 антитела вплоть до 27 суток после инокуляции опухолевых клеток. На фиг. 16а изображен объем опухоли в зависимости от времени. Стрелками ниже графиков показаны дозы или носителя, или 20 мг/кг анти-FGFR2 антитела на 12-е и 15-е сутки после инокуляции. Звездочка (*) обозначает статистически значимые различия между ростом опухоли под влиянием носителя или анти-FGFR2 антитела в соответствии с t-критерием Стьюдента при уровне значимости P ≤ 0,5. На фиг. 16b изображен объем опухоли у отдельных мышей в каждой группе на 19-е сутки после инокуляции. Звездочка (*) обозначает статистически значимые различия между ростом опухоли в двух группах в соответствии с t-критерием Стьюдента при уровне значимости P ≤ 0,5. На фиг. 16c изображен объем опухоли у отдельных мышей в каждой группе на 23-е сутки после инокуляции. Звездочка (*) обозначает статистически значимые различия между ростом опухоли в двух группах в соответствии с t-критерием Стьюдента при уровне значимости P ≤ 0,5. На фиг. 16d изображен объем опухоли у отдельных мышей в каждой группе на 27-е сутки после инокуляции.
Описание конкретных вариантов осуществления изобретения
Определения
[0059] Если не указано иное, научные и технические термины, используемые в связи с данным изобретением, должны иметь значения, которые обычно понятны специалистами в данной области техники. Кроме того, если иное не требуется по контексту, термины в единственном числе включают формы в множественном числе и термины в множественном числе включают формы в единственном числе.
[0060] Иллюстративные методы, используемые в связи с рекомбинантной ДНК, олигонуклеотидным синтезом, культурой ткани и трансформацией (например, электропорацией, липофекцией), ферментативными реакциями и методами очистки, известны в данной области в техники. Многие такие методы и процедуры описаны, например, в Sambrook et al. Molecular Cloning: A Laboratory Manual (2nd ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989)), среди других источников Кроме того, иллюстративные методы химического синтеза, химического анализа, приготовления фармацевтического препарата, разработки состава, доставки лекарственной формы и лечения пациентов также известны в данной области техники.
[0061] В данной заявке использование «или» означает «и/или», если не указано иное. В контексте пункте формулы изобретения, зависящий от другого зависимого пункта, использование «или» относится только к нескольким предшествующим независимым или зависимым пунктам формулы изобретения только в альтернативе. Кроме того, такие термины как «элемент» или «компонент» охватывают как элементы, так и компоненты, содержащие одну единицу, а также элементы и компоненты, которые содержат более одной субъединицы, если специально не указано иное.
[0062] Используемые в соответствии с данным раскрытием, следующие термины, если не указано иное, понимаются как имеющие следующие значения:
[0063] Термины «молекула нуклеиновой кислоты» и «полинуклеотид» могут использоваться взаимозаменяемо и относятся к полимеру нуклеотидов. Такие полимеры нуклеотидов могут содержать природные и/или неприродные нуклеотиды и включают, но не ограничиваются ими, ДНК, РНК и ПНК. «Нуклеиновая кислотная последовательность» относится к линейной последовательности нуклеотидов, которые содержат молекулу нуклеиновой кислоты или полинуклеотид.
[0064] Термины «полипептид» и «белок», используемые взаимозаменяемо, относятся к полимеру аминокислотных остатков и не ограничиваются минимальной длиной. Такие полимеры аминокислотных остатков могут содержать природные или неприродные аминокислотные остатки и включают, но не ограничиваются ими, пептиды, олигопептиды, димеры, тримеры и мультимеры аминокислотных остатков. Как полноразмерные белки, так и их фрагменты охватываются данным определением. Термины также включают пост-экспрессионные модификации полипептида, например, гликозилирование, сиалирование, ацетилирование, фосфорилирование и тому подобное. Кроме того, для целей данного изобретения «полипептид» относится к белку, который содержит модификации, такие как делеции, добавления и замены (обычно консервативные по своей природе), по отношению к нативной последовательности, если белок поддерживает желаемую активность. Эти модификации могут быть преднамеренными, например, путем сайт-направленного мутагенеза или могут быть случайными, например, посредством мутаций хозяев, которые продуцируют белки или ошибок, связанных с ПЦР-амплификацией.
[0065] «FGFR2» относится к рецептору 2 фактора роста фибробластов, включая любые его альтернативно сплайсинговые формы, такие как формы сплайсинга IIIa, IIIb и IIIc. Термин FGFR2 охватывает FGFR2 дикого типа и встречающиеся в природе мутантные формы, такие как активирующие FGFR2 мутантные формы, такая как FGFR2-S252W, которая обнаруживается в некоторых раковых клетках. «FGFR2-IIIb» или «FGFR2b», используемые взаимозаменяемо, относятся к сплайсинговой форме рецептора 2 фактора роста фибробластов IIIb. Иллюстративный человеческий FGFR2-IIIb показан в GenBank, № доступа NP_075259.4 от 7 июля 2013 года. Неограниченная иллюстративная зрелая аминокислотная последовательность FGFR2-IIIb человека показана в SEQ ID NO: 1. ʺFGFR2-IIIcʺ или ʺFGFR2cʺ, используемые взаимозаменяемо, относятся к сплайсинговой форме рецептора 2 фактора роста фибробластов IIIc. Иллюстративный человеческий FGFR2-IIIc показан в GenBank, № доступа NP_000132.3 от 7 июля 2013 года. Неограниченная иллюстративная зрелая аминокислотная последовательность FGFR2-IIIc человека показана в SEQ ID NO: 12.
[0066] «ВКД FGFR2» относится к внеклеточному домену FGFR2, включая его природные и сконструированные варианты. Неограничивающие примеры ВКД FGFR2 включают SEQ ID NO: 13-23, 29 и 32 «Слитая молекула ВКД FGFR2» относится к молекуле, содержащей ВКД FGFR2 и партнера по слиянию, такого как домен Fc, альбумин или ПЭГ. Партнер по слиянию может быть ковалентно присоединен, например, к N- или С-концу ВКД FGFR2 или во внутреннем участке. Неограничивающие примеры слитые молекулы ВКД FGFR2 включают SEQ ID NO: 30, 31 и 33
[0067] «Ингибитор FGFR2» относится к молекуле, такой как антитело, которое связывает FGFR2, или такой как ВКД FGFR2 или слитой молекуле ВКД FGFR2, которая ингибирует связывание FGFR2 с одним или более его лигандами, такими как FGF1, FGF7 и/или FGF2. В некоторых вариантах осуществления и ингибитор FGFR2 способен связываться с FGFR2, а также с мутантом FGFR2 с активирующей мутацией, такой как мутация FGFR2-S252W.
[0068] Используемый в данном документе термин «иммуностимулирующий агент» относится к молекуле, которая стимулирует иммунную систему, или действуя как агонист иммуностимулирующей молекулы, включая костимулирующую молекулу, или действует как антагонист иммуноингибирующей молекулы, включая коингибирующую молекулу. Иммуномодулирующий агент может быть биологическим, таким как антитело или фрагмент антитела, другой белок или вакцина или может быть низкомолекулярным лекарственным средством.
[0069] Термины «белок программируемой клеточной гибели-1» и «PD-1» относятся к иммуноингибируемому рецептору, принадлежащему к семейству CD28. PD-1 экспрессируется преимущественно на ранее активированных Т-клетках in vivo и связывается с двумя лигандами PD-L1 и PD-L2. Используемый в данном документе термин «PD-1» включает человеческий PD-1 (hPD-1), варианты, изоформы и видовые гомологи hPD-1 и аналоги, имеющие по меньшей мере один общий эпитоп с hPD-1. Полную последовательность hPD-1 можно найти в GenBank, № доступа U64863. В некоторых вариантах осуществления PD-1 представляет собой PD-1 человека, имеющий аминокислотную последовательность SEQ ID NO: 34 (предшественник, с сигнальной последовательностью) или SEQ ID NO: 35 (зрелый, без сигнальной последовательности).
[0070] Термины «лиганд 1 белка программируемой клеточной гибели-1» и «PD-L1» относятся к одному из двух гликопротеиновых лигандов клеточной поверхности к PD-1 (другой - PD-L2), которые регулируют активацию Т-клеток и секрецию цитокинов при связывании с PD -1. Используемый в данном документе термин «PD-L1» включает человеческий PD-L1 (hPD-L1), варианты, изоформы и видовые гомологи hPD-L1 и аналоги, имеющие по меньшей мере один общий эпитоп с hPD-L1. Полную последовательность hPD-L1 можно найти в GenBank, № доступа Q9NZQ7. В некоторых вариантах осуществления PD-L1 представляет собой PD-L1 человека, имеющий аминокислотную последовательность SEQ ID NO: 37 (предшественник, с сигнальной последовательностью) или SEQ ID NO: 38 (зрелый, без сигнальной последовательности).
[0071] Термин «ингибитор PD-1/PD-L1» относится к фрагменту, который нарушает сигнальный путь PD-1/PD-L1. В некоторых вариантах осуществления ингибитор ингибирует сигнальный путь PD-1/PD-L1 путем связывания с PD-1 и/или PD-L1. В некоторых вариантах осуществления ингибитор также связывается с PD-L2. В некоторых вариантах осуществления ингибитор PD-1/PD-L1 ингибирует связывание PD-1 с PD-L1 и/или PD-L2. Неограничивающие иллюстративные ингибиторы PD-1/PD-L1 включают антитела, которые связываются с PD-1; антитела, которые связываются с PD-L1; слитые молекулы PD-1, такие как AMP-224; и полипептиды PD-1, такие как AUR-012.
[0072] Термин «антитело, которое ингибирует PD-1» относится к антителу, которое связывается с PD-1 или связывается с PD-L1 и тем самым ингибирует сигналинг PD-1 и/или PD-L1. В некоторых вариантах осуществления антитело, которое ингибирует PD-1, связывается с PD-1 и блокирует связывание PD-L1 и/или PD-L2 с PD-1. В некоторых вариантах осуществления антитело, которое ингибирует PD-1, связывается с PD-L1 и блокирует связывание PD-1 с PD-L1. Антитело, которое ингибирует PD-1 и которое связывается с PD-L1, можно назвать анти-PD-L1 антителом. Антитело, которое ингибирует PD-1 и которое связывается с PD-1, можно назвать анти-PD-1 антителом.
[0073] В отношении антител к FGFR2, ВКД FGFR2 и слитых молекул ВКД FGFR2, термины «блокирует связывание» или «ингибирует связывание» лиганда относятся к способности ингибировать взаимодействие между FGFR2 и лигандом FGFR2, таким как FGF1 или FGF2. Такое ингибирование может происходить посредством любого механизма, включая прямую интерференцию со связыванием лиганда, например, из-за перекрывающихся сайтов связывания на FGFR2 и/или конформационных изменений в FGFR2, индуцированных антителом, которые изменяют аффинность лиганда, или, например, в случае ВКД FGFR2 или слитой молекулы ВКД FGFR2, путем конкурирования за связывание с лигандами FGFR2.
[0074] В отношении анти-PD-1 антител и слитых молекул или полипептидов PD-1, термины «блокировать связывание» или «ингибировать связывание» лиганда, такого как PD-L1, и его грамматических вариантов, относятся к способности ингибировать взаимодействие между PD-1 и лигандом PD-1, таким как PD-L1. Такое ингибирование может происходить посредством любого механизма, включая прямую интерференцию со связыванием лиганда, например, из-за перекрывающихся сайтов связывания на PD-1 и/или конформационных изменений в PD-1, индуцированных антителом, которые изменяют аффинность лиганда и т.д., или путем конкурирования за связывание с лигандом PD-1.
[0075] Используемый в данном документе термин «антитело» относится к молекуле, содержащей по меньшей мере гипервариабельные области (HVR) H1, H2 и H3 тяжелой цепи и L1, L2 и L3 легкой цепи, причем молекула способна связываться с антигеном. Термин антитело включает, но не ограничивается ими, фрагменты, которые способны связывать антиген, такие как Fv, одноцепочечные Fv (scFv), Fab, Fab'' и (Fab')2. Термин антитело также включает, но не ограничивается ими, химерные антитела, гуманизированные антитела, человеческие антитела и антитела различных видов, таких как мыши, человека, яванского макака и т.д. Он также включает антитела, конъюгированные с другими молекулами, такими как низкомолекулярные лекарственные средства, биспецифические антитела и мультиспецифические антитела.
[0076] Термин «вариабельная область тяжелой цепи» относится к области, содержащей HVR1 тяжелой цепи, каркасную область (FR)2, HVR2, FR3 и HVR3. В некоторых вариантах осуществления вариабельная область тяжелой цепи также содержит по меньшей мере часть FR1 и/или по меньшей мере часть FR4.
[0077] Термин «константная область тяжелой цепи» относится к области, содержащей по меньшей мере три константных домена тяжелой цепи CH1, CH2 и CH3. Неограничивающие иллюстративные константные области тяжелой цепи включают γ, δ и α. Неограничивающие иллюстративные константные области тяжелой цепи также включают ε и μ. Каждая константная область тяжелой цепи соответствует изотипу антитела. Например, антитело, содержащее константную область γ представляет собой IgG-антитело, антитело, содержащее константную область δ представляет собой IgD-антитело, и антитело, содержащее константную область α представляет собой IgA-антитело. Кроме того, антитело, содержащее константную область μ представляет собой IgM-антитело, и антитело, содержащее константную область ε представляет собой IgE-антитело. Некоторые изотипы могут быть дополнительно подразделены на подклассы. Например, IgG-антитела включают, но не ограничиваются ими, IgG1 (содержащий константную область γ1), IgG2 (содержащий константную область γ2), IgG3 (содержащий константную область γ3) и IgG4 (содержащий константную область γ4); IgA-антитела включают, но не ограничиваются ими, IgA1 (содержащий константную область α1) и IgA2 (содержащий константную область α2); и IgM-антитела включают, но не ограничиваются ими, IgM1 и IgM2.
[0078] Термин «тяжелая цепь» относится к полипептиду, содержащему по меньшей мере вариабельную область тяжелой цепи с лидерной последовательностью или без нее. В некоторых вариантах осуществления тяжелая цепь содержит по меньшей мере часть константной области тяжелой цепи. Термин «полноразмерная тяжелая цепь» относится к полипептиду, содержащему вариабельную область тяжелой цепи и константную область тяжелой цепи с лидерной последовательностью или без нее.
[0079] Термин «вариабельная область легкой цепи» относится к области, содержащей HVR1 легкой цепи, каркасную область (FR)2, HVR2, FR3 и HVR3. В некоторых вариантах осуществления вариабельная область легкой цепи также содержит FR1 и/или FR4.
[0080] Термин «константная область легкой цепи» относится к области, содержащей константный домен легкой цепи CL. Неограничивающие иллюстративные константные области легкой цепи включают λ и κ.
[0081] Термин «легкая цепь» относится к полипептиду, содержащему по меньшей мере вариабельную область легкой цепи с лидерной последовательностью или без нее. В некоторых вариантах осуществления легкая цепь содержит по меньшей мере часть константной области легкой цепи. Термин «полноразмерная легкая цепь» относится к полипептиду, содержащему вариабельную область легкой цепи и константную область легкой цепи с лидерной последовательностью или без нее.
[0082] Термин «гипервариабельная область» или «HVR» относится к каждой из областей вариабельного домена антитела, которые являются гипервариабельными по последовательности и/или образуют структурно определенные петли («гипервариабельные петли»). Как правило, нативные четырехцепочечные антитела содержат шесть HVR; три в VH (H1, H2, H3), и три в VL (L1, L2, L3). Как правило, HVR содержат аминокислотные остатки из гипервариабельных петель и/или из «областей, определяющих комплементарность» (CDR), причем последние имеет самую высокую вариабельность последовательности и/или участвует в распознавании антигена. Иллюстративные гипервариабельные петли располагаются у аминокислотных остатков 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (H2) и 96-101 (H3). (Chothia and Lesk, J. Mol. Biol. 196:901-917 (1987).) Иллюстративные CDR (CDR-L1, CDR-L2, CDR-L3, CDR-H1, CDR-H2 и CDR-H3) располагаются у аминокислотных остатков 24-34 L1, 50-56 L2, 89-97 L3, 31-35В H1, 50-65 H2 и 95-102 H3. (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991)). Термины гипервариабельные области (HVR) и области, определяющие комплементарность, (CDR) относятся к частям вариабельной области, которые образуют антигенсвязывающие области.
[0083] Термин «аффинность» или «аффинность связывания» относится к силе суммарных общих нековалентных взаимодействий между одиночным сайтом связывания молекулы (например, антитела) и ее партнера по связыванию (например, антигена). В некоторых вариантах осуществления «аффинность связывания» относится к действительной аффинности связывания, которая отражает взаимодействие в соотношении 1: 1 между членами связывающей пары (например, антителом и антигеном). Аффинность молекулы X к ее партнеру Y в целом можно выразить в виде константы диссоциации (Kd).
[0084] «Антителозависимая клеточно-опосредованная цитотоксичность" или "АЗКЦ" относится к форме цитотоксичности, при которой секретируемый Ig связывается с Fc-рецепторами (FcR), которые присутствуют на определенных цитотоксических клетках (например, NK-клетках, нейтрофилах и макрофагах), обеспечивающими специфическое связывание этих эффекторных цитотоксических клеток с клеткой-мишенью, которая несет антиген, а затем клетка-мишень разрушается цитотоксинами. Первичные клетки для опосредования АЗКЦ, NK клетки, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII, и FcγRIII. Экспрессия FcR на гемопоэтических клетках суммирована в таблице 3 на странице 464 в Ravetch and Kinet, Annu. Rev. Immunol 9:457-92 (1991). Для оценки активности АЗКЦ представляющей интерес молекулы, может быть выполнен анализ АЗКЦ in vitro, как, например, описано в патенте США №№ 5500362 или 5821337, или патенте США № 6737056 (Presta). Подходящие эффекторные клетки для таких анализов включают МКПК (мононуклеарные клетки периферической крови) и NK-клетки. В альтернативном или дополнительном варианте АЗКЦ активность представляющей интерес молекулы может быть оценена in vivo, например, в животной модели такой, как та, которая описана в Clynes et al. Proc. Natl. Acad. Sci. (USA) 95:652-656 (1998). Дополнительные антитела с измененными аминокислотными последовательностями Fc-области и повышенной или пониженной АЗКЦ активностью описаны, например, в патенте США № 7923538, и патенте США № 7994290.
[0085] Антитело, имеющее «повышенную АЗКЦ активность», относится к антителу, которое является более эффективным при опосредовании АЗКЦ in vitro или in vivo по сравнению с исходным антителом, где антитело и исходное антитело отличаются по меньшей мере одним структурным аспектом и когда количества такого антитела и исходного антитела, используемых в анализе, по существу одинаковы. В некоторых вариантах осуществления антитело и исходное антитело имеют одинаковую аминокислотную последовательность, но антитело является афукозилированным, тогда как исходное антитело является фукозилированным. В некоторых вариантах осуществления АЗКЦ активность будет определяться с использованием анализа АЗКЦ in vitro, например, описанного в публикации США № 2015-0050273-A1, но другие анализы или способы определения АЗКЦ активности, например, на животной модели и т.д. В некоторых вариантах осуществления антитело с повышенной АЗКЦ активностью также обладает повышенной аффинностью к Fc гамма RIIIA. В некоторых вариантах осуществления антитело с повышенной АЗКЦ активностью обладает повышенной аффинностью к Fc гамма RIIIA (V158). В некоторых вариантах осуществления антитело с повышенной АЗКЦ активностью обладает повышенной аффинностью к Fc гамма RIIIA (F158).
[0086] «Повышенная аффинность к Fc гамма RIIIA» относится к антителу, которое имеет большую аффинность к Fc гамма RIIIA (также упоминается, в некоторых случаях, как CD16a), чем исходное антитело, причем антитело и исходное антитело отличаются по меньшей мере одним структурным аспектом. В некоторых вариантах осуществления антитело и исходное антитело имеют одинаковую аминокислотную последовательность, но антитело является афукозилированным, тогда как исходное антитело является фукозилированным. Можно использовать любой подходящий способ определения аффинности к Fc гамма RIIIA. В некоторых вариантах осуществления аффинность к Fc гамма RIIIA определяют способом, описанным в публикации США № 2015-0050273-A1. В некоторых вариантах осуществления антитело с повышенной аффинностью к Fc гамма RIIIA также имеет улучшенную АЗКЦ активность. В некоторых вариантах осуществления антитело с повышенной аффинностью к Fc гамма RIIIA имеет повышенную аффинность к Fc гамма RIIIA (V158). В некоторых вариантах осуществления антитело с повышенной аффинностью к Fc гамма RIIIA имеет повышенную аффинность к Fc гамма RIIIA (F158).
[0087] Используемое в данном документе «химерное антитело» относится к антителу, содержащему по меньшей мере одну вариабельную область от первого вида (такого как мышь, крыса, яванский макак и т.д.) и по меньшей мере одну константную область от второго вида (такого как человек, яванский макак и т.д.). В некоторых вариантах осуществления химерное антитело содержит по меньшей мере одну вариабельную область мыши и по меньшей мере одну константную область человека. В некоторых вариантах осуществления химерное антитело содержит по меньшей мере одну вариабельную область яванского макака и по меньшей мере одну константную область человека. В некоторых вариантах осуществления химерное антитело содержит по меньшей мере одну вариабельную область крысы и по меньшей мере одну константную область мыши. В некоторых вариантах осуществления все вариабельные области химерного антитела относятся к первому виду, а все константные области химерного антитела относятся ко второму виду.
[0088] Используемое в данном документе «гуманизированное антитело» относится к антителу, в котором по меньшей мере одна аминокислота в каркасной области нечеловеческой вариабельной области, была заменена соответствующей аминокислотой из человеческой вариабельной области. В некоторых вариантах осуществления гуманизированное антитело содержит по меньшей мере одну человеческую константную область или ее фрагмент. В некоторых вариантах осуществления гуманизированное антитело представляет собой Fab, scFv, a (Fab')2 и т.д.
[0089] Используемое в данном документе «человеческое антитело» относится к антителам, продуцируемым у людей, антителам, продуцируемым у животных, не относящихся к человеку, которые содержат гены иммуноглобулина человека, такие как XenoMouse®, и антитела, выбранные с использованием методов in vitro, таких как фаговый дисплей, в которых спектр антител основан на последовательностях иммуноглобулина человека.
[0090] «Афукозилированное» антитело или антитело, «лишенное фукозы», относится к IgG1 или IgG3 изотипическому антителу, которое не содержит фукозу в его гликозилированном константной области. Гликозилирование человеческого IgG1 или IgG3 происходит в Asn297 (N297) в виде гликозилирования олигосахаридного ядра биантеннарного комплекса, заканчивающегося 2 остатками Gal. В некоторых вариантах осуществления афукозилированное антитело не содержит фукозу в Asn297. Эти структуры обозначены как G0, G1 (α1,6 или α1,3) или остатки гликана G2, в зависимости от количества концевых остатков Gal. См., например, Raju, T. S., BioProcess Int. 1: 44-53 (2003). Гликозилирование типа CHO Fc антитела описано, например, в Routier, F. H., Glycoconjugate J. 14: 201-207 (1997). В популяции антител, антитела считаются афукозилированными, если <5% антител популяции содержат фукозу в Asn297.
[0091] «Эффекторные функции» относятся к видам биологической активности, присущей Fc-области антитела, которые изменяются в зависимости от изотипа антитела. Примеры эффекторных функций антитела включают: связывание Clq и комплементзависимую цитотоксичность (КЗЦ); связывание с рецептором Fc; антителозависимую клеточно-опосредованную цитотоксичность (АЗКЦ); фагоцитоз; снижение экспрессии клеточных поверхностных рецепторов (например, B-клеточного рецептора) и В-клеточную активацию.
[0092] «Антителозависимая клеточно-опосредованная цитотоксичность" или "АЗКЦ" относится к форме цитотоксичности, при которой секретируемый Ig связывается с Fc-рецепторами (FcR), которые присутствуют на определенных цитотоксических клетках (например, NK-клетках, нейтрофилах и макрофагах), обеспечивающими специфическое связывание этих эффекторных цитотоксических клеток с клеткой-мишенью, которая несет антиген, а затем клетка-мишень разрушается цитотоксинами. Первичные клетки для опосредования АЗКЦ экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII, и FcγRIII. Экспрессия FcR на гемопоэтических клетках суммирована в таблице 3 на странице 464 в Ravetch and Kinet, Annu. Rev. Immunol 9:457-92 (1991). Для оценки активности АЗКЦ представляющей интерес молекулы, может быть выполнен анализ АЗКЦ in vitro, как, например, описано в патенте США №№ 5500362 или 5821337, или патенте США № 6737056 (Presta). Подходящие эффекторные клетки для таких анализов включают МКПК (мононуклеарные клетки периферической крови) и NK-клетки. В альтернативном или дополнительном варианте АЗКЦ активность представляющей интерес молекулы может быть оценена in vivo, например, на животной модели такой, как та, которая описана в Clynes et al. Proc. Natl. Acad. Sci. (USA) 95:652-656 (1998). Дополнительные антитела с измененными аминокислотными последовательностями Fc-области и повышенной или пониженной АЗКЦ активностью описаны, например, в патенте США № 7923538, и патенте США № 7994290.
[0093] Антитело, имеющее «повышенную АЗКЦ активность», относится к антителу, которое является более эффективным при опосредовании АЗКЦ in vitro или in vivo по сравнению с исходным антителом с той же самой последовательностью, за исключением по меньшей мере одного структурного изменения, предназначенного для изменения АЗКЦ активности, когда количества такого антитела и исходного антитела, используемых в анализе, по существу одинаковы. В некоторых вариантах осуществления антитело и исходное антитело имеют одну и ту же аминокислотную последовательность, кроме мутации в Fc-домене, такую как аминокислотная замена, которая приводит к афукозилированию, причем исходное антитело является фукозилированным. В некоторых вариантах осуществления АЗКЦ активность будет определяться с использованием анализа АЗКЦ in vitro, как описано в данном документе, но другие анализы или способы для определения АЗКЦ активности, например, на животной модели и т.д. В некоторых вариантах осуществления антитело с повышенной АЗКЦ активностью обладает повышенной аффинностью к Fc гамма RIIIA. В некоторых вариантах осуществления антитело с повышенной АЗКЦ активностью обладает повышенной аффинностью к Fc гамма RIIIA (V158). В некоторых вариантах осуществления антитело с повышенной АЗКЦ активностью обладает повышенной аффинностью к Fc гамма RIIIA (F158).
[0094] «Повышенная аффинность к Fc гамма RIIIA» относится к антителу, которое имеет большую аффинность к Fc гамма RIIIA (также упоминается, в некоторых случаях, как CD16a), чем исходное антитело, причем антитело и исходное антитело отличаются по меньшей мере одним структурным аспектом. В некоторых вариантах осуществления антитело и исходное антитело имеют одинаковую аминокислотную последовательность, но антитело является афукозилированным, тогда как исходное антитело является фукозилированным. Можно использовать любой подходящий способ определения аффинности к Fc гамма RIIIA. В некоторых вариантах осуществления аффинность к Fc гамма RIIIA определяют способом, описанным в данном документе. В некоторых вариантах осуществления антитело с повышенной аффинностью к Fc гамма RIIIA обладает повышенной АЗКЦ активностью. В некоторых вариантах осуществления антитело с повышенной аффинностью к Fc гамма RIIIA имеет повышенную аффинность к Fc гамма RIIIA (V158). В некоторых вариантах осуществления антитело с повышенной аффинностью к Fc гамма RIIIA имеет повышенную аффинность к Fc гамма RIIIA (F158).
[0095] Термин «лидерная последовательность» относится к последовательности аминокислотных остатков, расположенных на N-конце полипептида, который облегчают секрецию полипептида из клетки млекопитающего. Лидерная последовательность может быть расщеплена при выделении полипептида из клетки млекопитающего, с образованием зрелого белка. Лидерные последовательности могут быть природными или синтетическими, и они могут быть гетерологичными или гомологичными белку, к которому они присоединены. Неограничивающие иллюстративные лидерные последовательности также включают лидерные последовательности из гетерологичных белков. В некоторых вариантах осуществления антитело не имеет лидерной последовательности. В некоторых вариантах осуществления антитело содержит по меньшей мере одну лидерную последовательность, которая может быть выбрана из нативных лидерных последовательностей антител и гетерологичных лидерных последовательностей.
[0096] Термин «вектор» используется для описания полинуклеотида, который может быть сконструирован таким образом, чтобы содержать клонированный полинуклеотид или полинуклеотиды, которые могут воспроизводиться в клетке-хозяине. Вектор может включать один или более из следующих элементов: точку начала репликации, одну или более регуляторных последовательностей (таких как, например, промоторы и/или энхансеры), которые регулируют экспрессию представляющего интерес полипептида и/или одного или более селектируемых маркерных генов (таких как, например, гены устойчивости к антибиотикам и гены, которые могут быть использованы в колориметрических анализах, например, β-галактозидаза). Термин «вектор экспрессии» относится к вектору, который используется для экспрессии представляющего интерес полипептида в клетке-хозяине.
[0097] «Клетка-хозяин» относится к клетке, которая может быть или является реципиентом вектора или выделенного полинуклеотида. Клетки-хозяева могут быть прокариотическими клетками или эукариотическими клетками. Иллюстративные эукариотические клетки включают клетки млекопитающих, такие как клетки приматов или животных, отличных от приматов; клетки грибов, такие как дрожжи; клетки растений; и клетки насекомых. Неограничивающие иллюстративные клетки млекопитающих включают, но не ограничиваются ими, клетки NSO, клетки PER.C6® (Crucell) и клетки 293 и CHO и их производные, такие как клетки 293-6E и DG44, соответственно.
[0098] Используемый в данном документе термин «выделенная» относится к молекуле, которая была отделена от по меньшей мере некоторых компонентов, с которыми она обычно встречается в природе. Например, полипептид называют «выделенным», когда он отделен от по меньшей мере некоторых компонентов клетки, в которой он был продуцирован. Когда полипептид секретируется клеткой после экспрессии, физическое отделение супернатанта, содержащего полипептид, от клетки, которая его продуцирует, считается «выделением» полипептида. Аналогично, полинуклеотид упоминается как «выделенный», если он не является частью более крупного полинуклеотида (например, геномной ДНК или митохондриальной ДНК, в случае полинуклеотида ДНК), в котором он обычно находится в природе, или отделен от по меньшей мере некоторых компонентов клетки, в которой он был продуцирован, например, в случае полинуклеотида РНК. Таким образом, полинуклеотид ДНК, который содержится в векторе внутри клетки-хозяина, может упоминаться как «выделенный», если этот полинуклеотид не обнаружен в этом векторе в природе.
[0099] Термин «повышенный уровень» означает более высокий уровень белка в конкретной ткани субъекта относительно такой же ткани в контроле, таком как индивидуум или индивидуумы, которые не страдают от рака или других патологических состояний, описанных в данном документе. Повышенный уровень может быть результатом любого механизма, такого как повышенная экспрессия, повышенная стабильность, сниженная деградации, повышенная секреция, сниженный клиренс и т.д. белка.
[00100] Термины «уменьшение» или «уменьшения» или «увеличение» или «увеличения» по отношению к белку или клеточному типу клетки означает изменение уровня этого белка или клеточного типа в определенной ткани субъекта, например, в опухоли, на по меньшей мере 10%. В некоторых вариантах осуществления агент, такой как ингибитор FGFR2 или PD-1/PD-L1, увеличивает или уменьшает уровень белка или клеточного типа в определенной ткани субъекта, такой как опухоль, на по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85% или по меньшей мере 90%. В некоторых вариантах осуществления уровень белка или клеточного типа уменьшается или увеличивается относительно уровня белка перед приведением в контакт с агентом, таким как ингибитор FGFR2 или PD-1/PD-L1, или относительно уровня контрольной терапии.
[00101] Термины "субъект" и «пациент», используемые в данном документе взаимозаменяемо, относятся к человеку. В некоторых вариантах осуществления также предложены способы лечения других млекопитающих, включая, но не ограничиваясь ими, грызунов, обезьян, кошек, собак, лошадей, коров, свиней, овец, коз, лабораторных животных-млекопитающих, сельскохозяйственных животных-млекопитающих, спортивных животных-млекопитающих и домашних животных-млекопитающих.
[00102] Используемый в данном документе термин «образец» относится к композиции, которая получена или взята из субъекта, который содержит клеточное и/или другое молекулярное соединение, которое должно быть охарактеризовано, количественно определено и/или идентифицировано, например, на основе физических, биохимических, химических и/или физиологических характеристик. Иллюстративный образец представляет собой образец ткани.
[00103] Термин «рак» относится к злокачественному пролиферативному расстройству, связанному с неконтролируемой пролиферацией клеток, неограниченному росту клеток и уменьшению гибели клеток посредством апоптоза. Примеры рака включают, но не ограничиваются этими, карциному, лимфому, бластому, саркому и лейкоз. Более конкретные неограничивающие примеры таких раковых заболеваний включают плоскоклеточный рак, мелкоклеточный рак легкого, рак гипофиза, рак пищевода (включая аденокарциному гастроэзофагеального соединения), астроцитому, саркому мягких тканей, немелкоклеточный рак легкого (включая плоскоклеточный немелкоклеточный рак легкого, аденокарциному легкого, плоскоклеточный рак легкого, рак брюшины, печеночноклеточный рак, рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, колоректальный рак, рак эндометрия или матки, карциному слюнных желез, рак почки, почечноклеточный рак, рак печени, рак предстательной железы, рак вульвы, рак щитовидной железы, гепатокарциному, рак мозга, рак эндометрия, рак яичка, холангиокарциному, карциному желчного пузыря, рак желудка, меланому и различные виды рака головы и шеи (включая плоскоклеточную карциному головы и шеи).
[00104] В некоторых вариантах осуществления рак представляет собой рак желудка (который включает гастроэзофагеальный рак). В некоторых вариантах осуществления рак представляет собой рак мочевого пузыря. Рак мочевого пузыря, как он определен в данном документе, включает формы заболевания, такие как рак мочевого пузыря (UBC) и переходно-клеточная карцинома (TCC), который также известен как уротелиальная карцинома (UC), а также непереходно-клеточные карциномы, которые развиваются в мочевом пузыре.
[00105] В некоторых вариантах осуществления рак содержит амплификацию гена FGFR2, тогда как в некоторых вариантах осуществления рак не содержит амплификацию FGFR2. В некоторых вариантах осуществления при которых происходит амплификация, амплификация FGFR2 содержит соотношение FGFR2: CEN10 (центромера хромосомы 10)> 3. В некоторых вариантах осуществления амплификация FGFR2 содержит соотношение FGFR2: CEN10 ≥ 2. Однако в других вариантах осуществления уровень FGFR2 включает соотношение FGFR2: CEN10 между 1 и 2, что указывает на то, что FGFR2 не амплифицируется. В некоторых вариантах осуществления мутации или транслокации могут вызывать амплификацию гена FGFR2. Амплификация гена может быть определена, например, методом флуоресцентной гибридизации in situ (метод FISH).
[00106] В некоторых вариантах осуществления, в которых рак содержит амплификацию гена FGFR2, рак сверхэкспрессирует FGFR2-IIIb. В некоторых вариантах осуществления рак, содержащий амплификацию FGFR2, сверхэкспрессирует FGFR2-IIIb в большей степени, чем FGFR2-IIIc. В некоторых вариантах осуществления рак, содержащий амплификацию FGFR2, экспрессирует FGFR2-IIIb на нормированном уровне, который более чем в 2 раза, в 3 раза, в 5 раз или в 10 раз превышает нормированный уровень экспрессии FGFR2-IIIc. В некоторых вариантах осуществления уровни экспрессии нормируют к GUSB (бета-глюкуронидаза). В некоторых вариантах осуществления рак сверхэкспрессирует FGFR2-IIIb, но не содержит амплификацию гена FGFR2.
[00107] В некоторых вариантах осуществления рак содержит FGFR2, такую как сверхэкспрессия белка FGFR2-IIIb, в то время как в некоторых других вариантах осуществления рак не включает сверхэкспрессию белка FGFR2 или FGFR2-IIIb. Сверхэкспрессия белка FGFR2-IIIb может быть определена любым подходящим способом в данной области техники, включая, но не ограничиваясь ими, способы на основе антител, такие как иммуногистохимия (ИГХ). В некоторых вариантах осуществления ИГХ окрашивание оценивают в соответствии со методами в данной области техники. Термины «сверхэкспрессия белка FGFR2-IIIb» и «сверхэкспрессия белков FGFR2IIIb» и тому подобное означают повышенные уровни белка FGFR2-IIIb независимо от причины таких повышенных уровней (то есть являются ли повышенные уровни результатом увеличенной трансляции и/или сниженной деградации белка, другого механизма или комбинации механизмов).
[00108] Уровень экспрессии FGFR2 или FGFR2IIIb с помощью ИГХ можно определить, представив образец опухоли по шкале ИГХ по шкале от 0 до 3. При этом оценка «0» дается, если реактивность не наблюдается или имеется мембранная реактивность только в <10% опухолевых клеток; оценка «1+» дается, если имеется слабая или едва заметная мембранная реактивность по меньшей мере в 10% опухолевых клеток или если клетки реактивны только в части их мембран; оценка «2+» дается, если есть слабая или умеренная полная, базолатеральная или латеральная мембранная реактивность по меньшей мере в 10% опухолевых клеток; и оценка «3+» дается, если имеется сильная полная базолатеральная или латеральная мембранная реактивность по меньшей мере в 10% опухолевых клеток. В некоторых вариантах осуществления 1+, 2+ или 3+ окрашивание опухолевых клеток с помощью ИГХ указывает на сверхэкспрессию FGFR2IIIb. В некоторых вариантах осуществления 2+ или 3+ окрашивание опухолевых клеток с помощью ИГХ указывает на сверхэкспрессию FGFR2IIIb. В некоторых вариантах осуществления 3+ окрашивание опухолевых клеток с помощью ИГХ указывает на сверхэкспрессию FGFR2IIIb. В некоторых вариантах осуществления рак желудка или мочевого пузыря содержит амплификацию гена FGFR2. В некоторых вариантах осуществления рак желудка или мочевого пузыря, содержащий амплификацию гена FGFR2, сверхэкспрессирует FGFR2-IIIb. В некоторых вариантах осуществления рак желудка или мочевого пузыря, содержащий амплификацию FGFR2, сверхэкспрессирует FGFR2-IIIb в большей степени, чем FGFR2-IIIc. В некоторых вариантах осуществления рак желудка или мочевого пузыря сверхэкспрессирует FGFR2-IIIb, но не содержит амплификацию гена FGFR2. В некоторых вариантах осуществления рак желудка или мочевого пузыря, содержащий амплификацию FGFR2, экспрессирует FGFR2-IIIb на нормированном уровне, который более чем в 2 раза, в 3 раза, в 5 раз или в 10 раз превышает нормированный уровень экспрессии FGFR2-IIIc. В некоторых вариантах осуществления уровни экспрессии нормируют к GUSB (бета-глюкуронидаза). В некоторых вариантах осуществления сверхэкспрессия представляет собой сверхэкспрессию мРНК. В некоторых вариантах осуществления сверхэкспрессия представляет собой сверхэкспрессию белка.
[00109] «Лечение», как используется в данном документе, относится как к терапевтическому лечению, так и к профилактическим или предупредительным мерам, целью которых является предотвращение или замедление (облегчение) целевого патологического состояния или расстройства. В некоторых вариантах осуществления термин «лечение» охватывает любое введение или применение терапевтического средства для заболевания у млекопитающего, включая человека, и включает подавление или замедление заболевания или прогрессирования заболевания; частичное или полное облегчение болезни, например, путем регрессии или возобновления или восстановления утраченной, отсутствующей или дефектной функции; стимулирование неэффективного процесса; или приводя к снижению степени тяжести основных проявлений болезни. Термин «лечение» также включает снижение степени тяжести любой фенотипического признака и/или уменьшение частоты, степени или вероятности этого признака. Те, кто нуждается в лечении, включают тех, у кого уже есть расстройство, а также те, у кого есть склонность к расстройству, или тех, у кого заболевание должно быть предотвращено.
[00110] Термин «эффективное количество» или «терапевтически эффективное количество» относится к количеству лекарственного средства, эффективного для лечения заболевания или расстройства у субъекта. В некоторых вариантах осуществления эффективное количество относится к эффективному количеству, в дозах и в течение периодов времени, необходимых для достижения желаемого терапевтического или профилактического результата. Терапевтически эффективное количество ингибитора FGFR2 и/или ингибитора PD-1/PD-L1 согласно изобретению может варьироваться в зависимости от таких факторов, как течения заболевания, возраст, пол и вес индивидуума, а также способность антитела или антител, чтобы вызвать желаемый ответ у индивидуума. Терапевтически эффективное количество включает количество, при котором любые токсичные или вредные эффекты антитела или антител перевешиваются терапевтически благоприятными эффектами. В некоторых вариантах осуществления выражение «эффективное количество» относится к количеству антитела, которое является эффективным в лечении рака.
[00111] Введение «в комбинации с» одним или более дополнительными терапевтическими агентами включает одновременное (параллельное) и последовательное (непрерывное) введение в любом порядке.
[00112] «Фармацевтически приемлемый носитель» относится к нетоксичному твердому, полутвердому или жидкому наполнителю, разбавителю, материалу для инкапсулирования, вспомогательному веществу лекарственной формы или носителю, обычно используемому в данной области техники для применения с терапевтическим агентом, которые вместе образуют «фармацевтическую композицию» для введения субъекту. Фармацевтически приемлемый носитель нетоксичен для реципиентов в используемых дозах и концентрациях и совместим с другими ингредиентами препарата. Фармацевтически приемлемый носитель подходит для применяемой лекарственной формы. Например, если терапевтический агент вводится перорально, носитель может представлять собой желатиновую капсулу. Если терапевтический агент вводится подкожно, носитель в идеальном варианте не раздражает кожу и не вызывает реакцию в месте инъекции.
[00113] Дополнительные определения приведены в следующих разделах.
Иллюстративные ингибиторы FGFR2
[00114] Ингибиторы FGFR2 согласно способам и композициям в данном документе могут представлять собой антитела к FGFR2, ВКД FGFR2 или слитые молекулы ВКД FGFR2.
Иллюстративные антитела к FGFR2
[00115] В любой из описанных данном документе композиций или способов, в которых используется антитело к FGFR2, антитело к FGFR2 может быть гуманизированным антителом, химерным антителом или человеческим антителом. В любой из композиций или способов, описанных в данном документе, антитело к FGFR2 может быть выбрано из Fab, Fv, scFv, Fab'' и (Fab')2. В любой из композиций или способов, описанных в данном документе, антитело к FGFR2 может быть выбрано из IgA, IgG и IgD. В любой из композиций или способов, описанных в данном документе, антитело к FGFR2 может представлять собой IgG. В любом из способов, описанных в данном документе, антитело может представлять собой IgG1 или IgG3.
[00116] Иллюстративные антитела к FGFR2 включают антитела, которые связывают FGFR2-IIIb. В некоторых вариантах осуществления антитела к FGFR2-IIIb связывают FGFR2-IIIc с более низкой аффинностью, чем они связываются с FGFR2-IIIb. В некоторых вариантах осуществления антитела к FGFR2-IIIb детектируемо не связываются с FGFR2-IIIc.
[00117] Иллюстративное антитело к FGFR2-IIIb для применения в вариантах осуществления данного изобретения представляет собой антитело к HuGAL-FR21, описанное в патенте США № 8101723 B2, опубликованном 24 января 2012 года, который специально включен в данный документ посредством ссылки. На фиг. 13 и 14 в патенте США № 8101723 В2 представлены аминокислотные последовательности вариабельных областей и цепей полноразмерных зрелых антител HuGAL-FR21, и включены в данный документ в посредством ссылки. Последовательности вариабельной области тяжелой цепи антитела HuGAL-FR21 подчеркнуты на фиг. 13 в патенте США № 8101723 B2 и специально включены в данный документ посредством ссылки. В некоторых вариантах осуществления антитело является афукозилированным. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, которое не содержит фукозу в Asn297. Дополнительные антитела, которые могут быть использованы в вариантах осуществления данного изобретения, включают те, которые описаны в патентной публикации США № 2015-0050273-A1, в которой описаны некоторые афукозилированные антитела к FGFR2-IIIb и которые включены в данный документ посредством ссылки.
[00118] В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит по меньшей мере одну, две, три, четыре, пять или шесть гипервариабельных областей (HVR, например, CDR), выбранных из (а) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 6; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 7; (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 8; (d) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 9; (e) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 10; и (f) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 11. В некоторых вариантах осуществления антитело является афукозилированным. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, которое не содержит фукозу в Asn297.
[00119] В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи. В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит по меньшей мере одну тяжелую цепь, содержащую вариабельную область тяжелой цепи и по меньшей мере часть константной области тяжелой цепи, и по меньшей мере одну легкую цепь, содержащую вариабельную область легкой цепи и по меньшей мере часть константной области легкой цепи. В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит две тяжелые цепи, причем каждая тяжелая цепь содержит вариабельную область тяжелой цепи и по меньшей мере часть константной области тяжелой цепи, и две легкие цепи, причем каждая легкая цепь содержит вариабельную область легкой цепи и по меньшей мере часть константной области легкой цепи. В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 4 и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 5. В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 2 и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 3. В некоторых вариантах осуществления антитело является афукозилированным. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, которое не содержит фукозу в Asn297.
[00120] В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит шесть HVR, включающих (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 6; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 7; (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 8; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 9; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 10; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 11. В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит шесть HVR, как описано выше, и связывается с FGFR2-IIIb. В некоторых вариантах осуществления антитело к FGFR-IIIb не связывается с FGFR2-IIIc. В некоторых вариантах осуществления антитело является афукозилированным. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, которое не содержит фукозу в Asn297.
[00121] В одном аспекте антитело к FGFR2-IIIb конкурирует с антителом к FGFR2-IIIb, содержащим шесть HVR, включающим (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 6; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 7; (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 8; (d) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 9; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 10; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 11. В некоторых вариантах осуществления антитело является афукозилированным. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, которое не содержит фукозу в Asn297.
[00122] В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит по меньшей мере одну, по меньшей мере две или все три последовательности VH HVR, выбранные из (а) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 6; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 7; и (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 8. В некоторых вариантах осуществления антитело является афукозилированным. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, которое не содержит фукозу в Asn297.
[00123] В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит по меньшей мере одну, по меньшей мере две или все три последовательности VL HVR, выбранные из (а) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 9; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 10; и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 11. В некоторых вариантах осуществления антитело является афукозилированным. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, которое не содержит фукозу в Asn297.
[00124] В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит (a) домен VH, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности VH HVR, выбранные из (i) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 6, (ii) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 7 и (iii) HVR-H3, содержащей аминокислотную последовательность, выбранную из SEQ ID NO: 8; и (b) домен VL, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности VL HVR, выбранные из (i) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 9, (ii) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 10 и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 11. В некоторых вариантах осуществления антитело является афукозилированным. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, которое не содержит фукозу в Asn297.
[00125] В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит последовательность вариабельного домена тяжелой цепи (VH), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с аминокислотной последовательностью SEQ ID NO: 4. В некоторых вариантах осуществления последовательность VH, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность, содержит замены (например, консервативные замены), вставки или делеции относительно эталонной последовательности, но антитело к FGFR2-IIIb, содержащее эту последовательность, сохраняет способность связываться с FGFR2-IIIb. В некоторых вариантах осуществления такое антитело к FGFR2-IIIb сохраняет способность селективно связываться с FGFR2-IIIb без детектируемого связывания с FGFR2-IIIc. В некоторых вариантах осуществления в общей сложности от 1 до 10 аминокислот были заменены, вставлены и/или удалены в SEQ ID NO: 4. В некоторых вариантах осуществления замены, вставки или делеции происходят в областях вне HVR (т.е., в FR). Необязательно, антитело к FGFR2-IIIb содержит последовательность VH в SEQ ID NO: 5, включая посттрансляционные модификации этой последовательности. В конкретном варианте осуществления VH содержит одну, две или три HVR, выбранные из: (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 6; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 7; и (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 8. В некоторых вариантах осуществления антитело является афукозилированным. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, которое не содержит фукозу в Asn297.
[00126] В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит вариабельный домен легкой цепи (VL), имеющий по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100% идентичность последовательности с аминокислотной последовательностью SEQ ID NO: 5. В некоторых вариантах осуществления последовательность VL, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность, содержит замены (например, консервативные замены), вставки или делеции относительно эталонной последовательности, но антитело к FGFR2-IIIb, содержащее эту последовательность, сохраняет способность связываться с FGFR2-IIIb. В некоторых вариантах осуществления антитело к FGFR2-IIIb сохраняет способность селективно связываться с FGFR2-IIIb без связывания с FGFR2-IIIc. В некоторых вариантах осуществления в общей сложности от 1 до 10 аминокислот были заменены, вставлены и/или удалены в SEQ ID NO: 5. В некоторых вариантах реализации изобретения замены, вставки или делеции встречаются вне областей HVR (т.е., в FR). Необязательно, антитело к FGFR2-IIIb содержит последовательность VL в SEQ ID NO: 4, включая посттрансляционные модификации этой последовательности. В конкретном варианте осуществления VL содержит одну, две или три HVR, выбранные из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 9; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 10; и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 11. В некоторых вариантах осуществления антитело является афукозилированным. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, которое не содержит фукозу в Asn297.
[00127] В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит последовательность вариабельного домена тяжелой цепи (VH), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с аминокислотной последовательностью SEQ ID NO: 4, и последовательность вариабельного домена легкой цепи (VL), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с аминокислотной последовательностью SEQ ID NO: 5. В некоторых вариантах осуществления последовательность VH, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность, содержит замены (например, консервативные замены), вставки или делеции относительно эталонной последовательности, и последовательность VL, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность, содержит замены (например, консервативные замены), вставки или делеции относительно эталонной последовательности, но антитело к FGFR2-IIIb, содержащее эту последовательность, сохраняет способность связываться с FGFR2-IIIb. В некоторых вариантах осуществления такое антитело к FGFR2-IIIb сохраняет способность селективно связываться с FGFR2-IIIb без связывания с FGFR2-IIIc. В некоторых вариантах осуществления в общей сложности от 1 до 10 аминокислот были заменены, вставлены и/или удалены в SEQ ID NO: 4. В некоторых вариантах осуществления в общей сложности от 1 до 10 аминокислот были заменены, вставлены и/или удалены в SEQ ID NO: 5. В некоторых вариантах осуществления замены, вставки или делеции происходят в областях вне HVR (т.е., в FR). Необязательно, антитело к FGFR2-IIIb содержит последовательность VH в SEQ ID NO: 4 и последовательность VL SEQ ID NO: 5, включая посттрансляционные модификации одной или обеих последовательностей. В конкретном варианте осуществления VH содержит одну, две или три HVR, выбранные из: (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 6; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 7; и (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 8; и VL содержит одну, две или три HVR, выбранные из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 9; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 10; и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 11. В некоторых вариантах осуществления антитело является афукозилированным. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, которое не содержит фукозу в Asn297.
[00128] В некоторых вариантах осуществления антитело к FGFR2-IIIb представляет собой VH, как в любом из вариантов осуществления изобретения, приведенных ранее, и VL, как в любом из вариантов осуществления изобретения, приведенных ранее. В одном варианте осуществления антитело содержит последовательности VH и VL в SEQ ID NO: 4, и SEQ ID NO: 5, соответственно, включая посттрансляционные модификации этих последовательностей. В некоторых вариантах осуществления антитело является афукозилированным. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, которое не содержит фукозу в Asn297.
[00129] В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит последовательность тяжелой цепи, имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с аминокислотной последовательностью SEQ ID NO: 2. В некоторых вариантах осуществления последовательность тяжелой цепи, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность, содержит замены (например, консервативные замены), вставки или делеции относительно эталонной последовательности, но антитело к FGFR2-IIIb, содержащее эту последовательность, сохраняет способность связываться с FGFR2-IIIb. В некоторых вариантах осуществления такое антитело к FGFR2-IIIb сохраняет способность селективно связываться с FGFR2-IIIb без детектируемого связывания с FGFR2-IIIc. В некоторых вариантах осуществления в общей сложности от 1 до 10 аминокислот были заменены, вставлены и/или удалены в SEQ ID NO: 2. В некоторых вариантах осуществления замены, вставки или делеции происходят в областях вне HVR (т.е., в FR). Необязательно, тяжелая цепь антитела к FGFR2-IIIb содержит последовательность VH в SEQ ID NO: 2, включая посттрансляционные модификации этой последовательности. В конкретном варианте осуществления тяжелая цепь содержит одну, две или три HVR, выбранные из: (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 6; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 7; и (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 8. В некоторых вариантах осуществления антитело является афукозилированным. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, которое не содержит фукозу в Asn297.
[00130] В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит легкую цепь, имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с аминокислотной последовательностью SEQ ID NO: 3. В некоторых вариантах осуществления последовательность легкой цепи, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность, содержит замены (например, консервативные замены), вставки или делеции относительно эталонной последовательности, но антитело к FGFR2-IIIb, содержащее эту последовательность, сохраняет способность связываться с FGFR2-IIIb. В некоторых вариантах осуществления такое антитело к FGFR2-IIIb сохраняет способность селективно связываться с FGFR2-IIIb без детектируемого связывания с FGFR2-IIIc. В некоторых вариантах осуществления в общей сложности от 1 до 10 аминокислот были заменены, вставлены и/или удалены в SEQ ID NO: 3. В некоторых вариантах реализации изобретения замены, вставки или делеции встречаются вне областей HVR (т.е., в FR). Необязательно, легкая цепь антитела к FGFR2-IIIb содержит последовательность VL в SEQ ID NO: 3, включая посттрансляционные модификации этой последовательности. В конкретном варианте осуществления легкая цепь содержит одну, две или три HVR, выбранные из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 9; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 10; и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 11. В некоторых вариантах осуществления антитело является афукозилированным. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, которое не содержит фукозу в Asn297.
[00131] В некоторых вариантах осуществления антитело к FGFR2-IIIb содержит последовательность тяжелой цепи, имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с аминокислотной последовательностью SEQ ID NO: 2 и последовательность легкой цепи, имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с аминокислотной последовательностью SEQ ID NO: 3. В некоторых вариантах осуществления последовательность тяжелой цепи, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность, содержит замены (например, консервативные замены), вставки или делеции относительно эталонной последовательности, но антитело к FGFR2-IIIb, содержащее эту последовательность, сохраняет способность связываться с FGFR2-IIIb. В некоторых вариантах осуществления такое антитело к FGFR2-IIIb сохраняет способность селективно связываться с FGFR2-IIIb без детектируемого связывания с FGFR2-IIIc. В некоторых вариантах осуществления последовательность легкой цепи, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность, содержит замены (например, консервативные замены), вставки или делеции относительно эталонной последовательности, но антитело к FGFR2-IIIb, содержащее эту последовательность, сохраняет способность связываться с FGFR2-IIIb. В некоторых вариантах осуществления такое антитело к FGFR2-IIIb сохраняет способность селективно связываться с FGFR2-IIIb без детектируемого связывания с FGFR2-IIIc. В некоторых вариантах осуществления в общей сложности от 1 до 10 аминокислот были заменены, вставлены и/или удалены в SEQ ID NO: 2. В некоторых вариантах осуществления в общей сложности от 1 до 10 аминокислот были заменены, вставлены и/или удалены в SEQ ID NO: 3. В некоторых вариантах осуществления замены, вставки или делеции происходят в областях вне HVR (т.е., в FR). Необязательно, тяжелая цепь антитела к FGFR2-IIIb содержит последовательность VH в SEQ ID NO: 2, включая посттрансляционные модификации этой последовательности, и легкая цепь антитела к FGFR2-IIIb содержит последовательность VL в SEQ ID NO: 3, включая посттрансляционные модификации этой последовательности. В конкретном варианте осуществления тяжелая цепь содержит одну, две или три HVR, выбранные из: (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 6; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 7; и (c) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 8; и легкая цепь содержит одну, две или три HVR, выбранные из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 9; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 10; и (c) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 11. В некоторых вариантах осуществления антитело является афукозилированным. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, которое не содержит фукозу в Asn297.
[00132] Дополнительные иллюстративные антитела к FGFR2 представляют собой антитела GAL-FR22 и GAL-FR23, описанные в патенте США № 8101723 B2, включенном в данный документ посредством ссылки. Например, вариабельные области легкой и тяжелой цепи GAL-FR22 представлены как SEQ ID NO: 7 и 8 в патенте N 8101723 В2, в то время как CDR по Кабату и вариабельные области легкой и тяжелой цепи также представлены на фиг. 16 этого патента, которые включены в данный документ посредством ссылки. GAL-FR21, GAL-FR22 и GAL-FR23, продуцируемые гибиридомами, депонированы в Американской коллекции типовых культур, PO Box 1549, Manassas VA, USA, 20108, в виде номеров ATCC 9586, 9587 и 9408, от 6 ноября, 6 ноября, и 12 августа 2008 года, соответственно. Таким образом, в некоторых вариантах осуществления антитело к FGFR2 представляет собой антитело, содержащее аминокислотную последовательность антитела, полученную из одного из этих трех штаммов гибридомы.
[00133] Вариабельные области тяжелой и легкой цепей GAL-FR22 также представлены в данном документе как SEQ ID NO: 39 и 43, тогда как CDR по Кабату представлены в данном документе как SEQ ID NO: 40-42 и 44-46 в данном документе. Таким образом, в некоторых вариантах осуществления вариабельная область тяжелой цепи антитела к FGFR2-IIIb содержит: (i) CDR1, содержащую аминокислотную последовательность SEQ ID NO: 40; (ii) CDR2, содержащую аминокислотную последовательность SEQ ID NO: 41; и (iii) CDR3, содержащую аминокислотную последовательность SEQ ID NO: 42; и вариабельная область легкой цепи содержит: (iv) CDR1, содержащую аминокислотную последовательность SEQ ID NO: 44; (v) CDR2, содержащую аминокислотную последовательность SEQ ID NO: 45; и (vi) CDR3, содержащую аминокислотную последовательность SEQ ID NO: 46.
[00134] В некоторых вариантах осуществления антитело к FGFR2 включает антитело к FGFR2-IIIb, в котором вариабельный домен тяжелой цепи, который на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичен аминокислотной последовательности SEQ ID NO: 39, или который содержит аминокислотную последовательность SEQ ID NO: 39. В некоторых вариантах осуществления антитело к FGFR2 включает антитело к FGFR2-IIIb, в котором вариабельный домен легкой цепи на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичен аминокислотной последовательности SEQ ID NO: 43, или который содержит аминокислотную последовательность SEQ ID NO: 43. В некоторых вариантах осуществления вариабельный домен тяжелой цепи на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере 98%, или по меньшей мере 99% идентичен аминокислотной последовательности SEQ ID NO: 39, или который содержит аминокислотную последовательность SEQ ID NO: 39, и вариабельный домен легкой цепи на по меньшей мере 95%, например, по меньшей мере 97%, по меньшей мере 98%, или по меньшей мере 99% идентичен аминокислотной последовательности SEQ ID NO: 43, или который содержит аминокислотную последовательность SEQ ID NO: 43. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 или IgG3, которое не содержит фукозу в Asn297.
Афукозилированные антитела к FGFR2
[00135] В некоторых вариантах осуществления антитела к FGFR2, например, антитела к FGFR2-IIIb, как описано выше, имеют углеводную структуру, которая не содержит фукозу, присоединенную (прямо или косвенно) к Fc-области (то есть к афукозилированным антителам), то есть антитела являются афукозилированными. В некоторых вариантах осуществления афукозилированное антитело представляет собой антитело IgG1 или IgG3, которое не содержит фукозу в Asn297.
[00136] В связи с этим антитела считаются афукозилированными, если множество таких антител включает по меньшей мере 95% афукозилированных антител. Количество фукозы может быть определено путем вычисления среднего количества фукозы в сахарной цепи в Asn297 относительно суммы всех углеводных структур, присоединенных к Asn 297 (например, сложные, гибридные и структуры с высоким содержанием маннозы). Неограничивающие иллюстративные способы обнаружения фукозы в антителе включают масс-спектрометрию MALDI-TOF (см., например, WO 2008/077546), анализ при помощи ВЭЖХ высвобожденных флуоресцентно меченных олигосахаридов (см., например, Schneider et al., ʺN-Glycan analysis of monoclonal antibodies and other glycoproteins using UHPLC with fluorescence detection,ʺ Agilent Technologies, Inc. (2012); Lines, J. Pharm. Biomed. Analysis, 14: 601-608 (1996); Takahasi, J. Chrom., 720: 217-225 (1996)), анализ при помощи капиллярного электрофореза высвобожденных флуоресцентно меченных олигосахаридов (см., например, Ma et al., Anal. Chem., 71: 5185-5192 (1999)) и ВЭЖХ с импульсным амперометрическим детектированием для анализа моносахаридной композиции (см., Например, Hardy, et al., Analytical Biochem., 170: 54-62 (1988)).
[00137] Asn297 относится к остатку аспарагина, расположенному в положении 297 в Fc-области (согласно нумерации ЕС остатков Fc-области Fc); при этом, в данной последовательности антитела, Asn297 также может быть расположен на около ± 3 аминокислот выше или ниже положения 297, т.е. между положениями 294 и 300, вследствие незначительных вариаций последовательностей в антителах. В антителе к FGFR2-IIIb, описанном в данном документе, Asn297 находится в последовательности QYNST и выделен жирным шрифтом и подчеркиванием в таблице последовательностей, показанной ниже, SEQ ID NO: 2.
[00138] Фукозилированные варианты могут обладать улучшенной функцией АЗКЦ. См., например, публикации патентов США №№. US 2003/0157108 (Presta, L.); US 2004/0093621 (Kyowa Hakko Kogyo Co., Ltd). Примеры публикаций, связанных с «афукозилированными» или «фукозодефицитными» антителами включают: US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO2005/053742; WO2002/031140; Okazaki et al. J. Mol. Biol. 336:1239-1249 (2004); Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004). Примеры клеточных линий, которые способны продуцировать афукозилированные антитела, включают клетки CHO Lec13, дефектные по фукозилированию белков (Ripka et al. Arch. Biochem. Biophys. 249: 533-545 (1986); заявка на патент США № US 2003/0157108 A1, Presta, L; и WO 2004/056312 A1, Adams et al., особенно в примере 11), и нокаутные линии клеток, такие как линии клетки, лишенные функционального гена альфа-1,6-фукозилтрансферазы, FUT8, например, нокаутные клетки СНО (см., например, Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004); Kanda, Y. et al., Biotechnol. Bioeng., 94(4):680-688 (2006); и WO2003/085107).
[00139] В данном документе антитела к FGFR2 также могут содержать разделенные олигосахариды, например, в которых двухантенный олигосахарид, присоединенный к Fc-области антитела, делится на части с помощью GlcNAc. Такие антитела могут иметь сниженное фукозилирование и/или улучшенную функцию АЗКЦ. Примеры таких антител описаны, например, в WO 2003/011878 (Jean-Mairet et al.); патенте США № 6602684 (Umana et al.,); и патенте США № 2005/0123546 (Umana et al.). В некоторых вариантах осуществления антитела к FGFR2 имеют по меньшей мере один остаток галактозы в олигосахариде, присоединенном к Fc-области. Такие антитела могут обладать улучшенной функцией КЗЦ. Такие антитела описаны, например, в WO 1997/30087 (Patel et al.); WO 1998/58964 (Raju, S.); и WO 1999/22764 (Raju, S.).
[00140] В некоторых вариантах осуществления изобретения афукозилированное антитело к FGFR2 опосредует АЗКЦ в присутствии эффекторных клеток человека более эффективно, чем антитело с той же аминокислотной последовательностью, которая содержит фукозу. Как правило, АЗКЦ активность может определяться с использованием анализа АЗКЦ in vitro, раскрытого в публикации № US 2015-0050273 A1, но другие анализы или способы определения АЗКЦ активности, например. в животной модели и т.д.
[00141] В некоторых вариантах осуществления антитело к FGFR2 содержит последовательности тяжелой и легкой цепей SEQ ID NO: 2 и 3. В некоторых вариантах осуществления антитело, содержащее последовательности тяжелой и легкой цепей SEQ ID NO: 2 и 3, является афукозилированным.
ВКД FGFR2 и слитые молекулы ВКД FGFR2
[00142] В некоторых вариантах осуществления ингибитор FGFR2 представляет собой ВКД FGFR2, такой как слитая молекула ВКД FGFR2. Слитые молекулы ВКД FGFR2 могут содержать партнеров по слиянию, такие как полимеры, полипептиды, липофильные фрагменты и сукцинильные группы. Иллюстративные полипептидные партнеры по слиянию включают сывороточный альбумин и Fc-домен антитела. Другими иллюстративными полимерные партнеры по слиянию включают, но не ограничиваются ими, полиэтиленгликоль, включая полиэтиленгликоли, имеющие разветвленные и/или линейные цепи. Некоторые иллюстративные партнеры по слиянию включают, но не ограничиваются ими, Fc-домен иммуноглобулина, альбумин и полиэтиленгликоль. Аминокислотные последовательности некоторых иллюстративных Fc-доменов показаны в SEQ ID NO: 24-26.
[00143] Иллюстративные ВКД FGFR2 и слитые молекулы ВКД FGFR2 включают те, которые описаны в публикации РСТ WO 2007/014123. ВКД FGFR2 и слитые молекулы ВКД FGFR2 могут содержать нативную аминокислотную последовательность ВКД, в том числе FGFR2-IIIb или FGFR2-IIIc BCD. Альтернативно, ВКД FGFR2 и слитые молекулы ВКД FGFR2 могут содержать ВКД FGFR2 с C-концевой делецией одного или более и до 22 аминокислотных остатков, отсчитываемых от С-конца, причем ВКД FGFR2 сохраняет по меньшей мере одну из его FGF лиганд- связывающих функций. В некоторых вариантах осуществления ВКД FGFR2 имеет до 22 аминокислот на удаленном С-конце. В некоторых вариантах осуществления делеция не распространяется на остаток валина с аминокислотным остатком 357 нативного полноразмерного FGFR2-IIIb или аминокислотного остатка 359 нативного полноразмерного FGFR2-IIIc.
[00144] Например, в некоторых вариантах осуществления ВКД FGFR2 или молекула слития ВКД FGFR2 содержит аминокислотную последовательность SEQ ID NO: 14, но в которой аминокислотные остатки были удалены из амино-конца и/или карбоксильного конца, и при этом полученная молекула способна связываться с FGF2. В некоторых вариантах осуществления ВКД FGFR2 или молекула слития ВКД FGFR2 содержит аминокислотную последовательность SEQ ID NO: 15, что соответствует аминокислотной последовательности SEQ ID NO: 14, но с удаленными последними тремя карбокси-концевыми аминокислотными остатками, YLE. Другие примеры таких вариантов включают те, у которых удалены 4 C-концевых аминокислотных остатка (SEQ ID NO: 16), у которых 5 С-концевых аминокислотных остатков удалены (SEQ ID NO: 17), у которых 8 С-концевых аминокислотных остатков удалены (SEQ ID NO: 18), у которых удалены 9 C-концевых аминокислотных остатков (SEQ ID NO: 19), у которых удалены 10 C-концевых аминокислотных остатков (SEQ ID NO: 20), у которых удалены 14 С-концевых аминокислотных остатков (SEQ ID NO: 21), у которых удалены 15 C-концевых аминокислотных остатков (SEQ ID NO: 22), у которых удалены 16 C-концевых аминокислотных остатков (SEQ ID NO: ID NO: 23), у которых удалены 17 C-концевых аминокислотных остатков (SEQ ID NO: 24), все по сравнению с нативной последовательностью FGFR2-IIIb или FGFR2-IIIc. Любой из вышеуказанных фрагментов ВКД FGFR2 может быть связан с любым из партнеров по слиянию, описанным выше, с образованием слитой молекулы ВКД FGFR2.
[00145] В некоторых вариантах осуществления по меньшей мере одна аминокислота в последовательности ВКД FGFR2 может быть мутирована для предотвращения гликозилирования в этом сайте в полипептиде. Неограничивающие иллюстративные аминокислоты ВКД FGFR2, которые могут быть гликозилированы, включают N62, N102, N207, N220, N244, N276, N297 и N310 в SEQ ID NO: 28.
[00146] Дополнительные иллюстративные ВКД FGFR2 и слитые молекулы ВКД FGFR2 включают те, которые описаны в публикации PCT № WO2010/017198. К ним относятся ВКД FGFR2 и слитые молекулы ВКД FGFR2 с мутациями в области «кислотных блоков» ВКД FGFR2. Такая кислотная область мутеина ВКД FGFR2 может использоваться или как ВКД FGFR2, или как слитая молекула ВКД FGFR2. В некоторых вариантах осуществления ВКД FGFR2 или слитая молекула ВКД FGFR2 содержит короткий кислотный бокс FGFR1 вместо короткого кислотного бокса FGFR2. Например, остатки ВКД FGFR2 с 111 по 118 (SEQ ID NO: 28) могут быть заменены остатками ВКД FGFR1 от 105 до 112 (SEQ ID NO: 29). В некоторых вариантах осуществления ВКД FGFR2 или молекула слития ВКД FGFR2 содержит аминокислотную последовательность SEQ ID NO: 30. В некоторых вариантах осуществления ВКД FGFR2 или молекула слития ВКД FGFR2 содержит аминокислотную последовательность любой из SEQ ID NO: 31-34. Любая из последовательностей «кислотного блока» мутанта ВКД FGFR2, такая как SEQ ID NO: 30, также может быть объединена с любой из вышеперечисленных последовательностей С-концевой делеции ВКД FGFR2, описанных выше (SEQ ID NO: 15-24), и, необязательно, с одной или более слитыми молекулами (например, SEQ ID NO: 32-34).
[00147] В некоторых вариантах осуществления ВКД FGFR2 или слитая молекула ВКД FGFR2 не имеет сигнального пептида. В некоторых вариантах осуществления ВКД FGFR2 содержит по меньшей мере один сигнальный пептид, который может быть выбран из нативного сигнального пептида FGFR2 и/или гетерологичного сигнального пептида, такого как FGFR1, FGFR3 или FGFR4.
[00148] В случае слитой молекулы ВКД FGFR2, партнер по слиянию может быть связан или с амино-концом, или с карбоксильным концом полипептида. В некоторых вариантах осуществления полипептид и партнер по слиянию ковалентно связаны. Если партнер по слиянию также представляет собой полипептид («полипептидный партнер по слиянию»), то полипептид и полипептидный партнер по слиянию могут быть частью непрерывной аминокислотной последовательности. В таких случаях полипептид и полипептидный партнер по слиянию могут быть транслированы как один полипептид из кодирующей последовательности, которая кодирует как полипептид, так и полипептидный партнер по слиянию. В некоторых вариантах осуществления слитая молекула ВКД FGFR2 содержит «GS» (глицин-сериновый) линкер между ВКД FGFR2 или кислотной областью мутеина ВКД FGFR2 и партнером по слиянию. В некоторых вариантах осуществления полипептид и партнер по слиянию ковалентно связаны другими способами, такими как, например, химическая связь, отличная от пептидной связи. В некоторых вариантах осуществления полипептид и партнер по слиянию нековалентно связаны между собой. В некоторых таких вариантах осуществления они могут быть связаны, например, с использованием пар связывания. Примеры пар связывания включают, но не ограничиваются ими, биотин и авидин или стрептавидин, антитело и его антиген и т.д.
Иллюстративные ингибиторы PD-1/PD-L1
[00149] Иллюстративные ингибиторы PD-1/PD-L1 включают антитела, которые ингибируют PD-1, такие как анти-PD-1 антитела и анти-PD-L1 антитела. Такими антителами могут быть гуманизированные антитела, химерные антитела, мышиные антитела, человеческие антитела и антитела, содержащие CDR тяжелой цепи и/или легкой цепи, рассмотренные в данном документе. Ингибиторы PD-1/PD-L1 также включают слитые молекулы, которые блокируют связывание PD-1 с PD-L1, например, AMP-224, и ингибирующие PD-1 полипептиды, такие как AUR-012, которые могут конкурировать с PD-1 за связывание с PD-L1.
Иллюстративные антитела к PD-1/PD-L1
[00150] PD-1 представляет собой ключевой рецептор иммунной контрольной точки, экспрессируемый активированными T- и B-клетками, и опосредующий иммуносупрессию. PD-1 является членом семейства рецепторов CD28, которое включает CD28, CTLA-4, ICOS, PD-1 и BTLA. Были идентифицированы два гликопротеиновых лиганда клеточной поверхности к PD-1, лиганд 1 белка программируемой клеточной гибели (PD-L1) и лиганд 2 белка программируемой клеточной гибели (PD-L2). Эти лиганды экспрессируются на антиген-презентирующих клетках, а также при многих видах раках человека и, как было показано, подавляют активацию Т-клеток и секрецию цитокинов при связывании с PD-1. Ингибирование взаимодействия PD-1/PD-L1 опосредует сильную противоопухолевую активность в доклинических моделях.
[00151] Человеческие моноклональные антитела (HuMAb), которые специфически связываются с PD-1 с высокой аффинностью, описаны в патенте США № 8008449. Другие анти-PD-1 мкАТ описаны, например, в патентах США №№ 6808710, 7488802, 8168757 и 8354509 и в публикации PCT № WO 2012/145493. Каждое из анти-PD-1 HuMAb, описанное в патенте США № 8 008 449: (а) связывается с PD-1 человека с KD 1 × 10-7 М или менее, как определено поверхностным плазмонным резонансом с использованием биосенсорной системы Biacore; (b) по существу не связывается с человеческим CD28, CTLA-4 или ICOS; (с) увеличивает пролиферацию Т-клеток в реакции смешанной культуры лимфоцитов (СКЛ); (d) увеличивает продукцию интерферона-γ в СКЛ-реакции; (e) увеличивает секрецию ИЛ-2 в СКЛ-реакции; (f) связывается с PD-1 человека и PD-1 яванского макака; (g) ингибирует связывание PD-L1 и/или PD-L2 с PD-1; (h) стимулирует ответ антиген-специфической памяти; (i) стимулирует образование антител; и/или (j) ингибирует рост опухолевых клеток in vivo. Анти-PD-1 антитела, используемые в данном изобретении, включают антитела, которые специфически связываются с PD-1 человека и проявляют по меньшей мере один, по меньшей мере два, по меньшей мере три, по меньшей мере четыре или по меньшей мере пять из предыдущих характеристик (а) - (к).
[00152] В одном варианте осуществления анти-PD-1 антитело представляет собой ниволумаб. Ниволумаб (также известный как «Opdivo®», ранее называвшийся 5C4, BMS-936558, MDX-1106 или ONO-4538) является полностью человеческим IgG4-антителом (S228P), ингибитором иммунной контрольной точки PD-1, которое селективно предотвращает взаимодействие с лигандами PD-1 (PD-L1 и PD-L2), тем самым блокируя понижающую регуляцию противоопухолевых Т-клеточных функций (патент США № 8008449, Wang et al., 2014 Cancer Immunol Res. 2(9):846-56).
[00153] В другом варианте осуществления изобретения анти-PD-1 антитело представляет собой пембролизумаб. Пембролизумаб (также известный как «Keytruda®», ламбролизумаб и MK-3475) представляет собой гуманизированное моноклональное антитело IgG4, направленное против рецептора клеточной поверхности PD-1 человека (белок программируемой гибели-1 или белок программируемой клеточной гибели-1). Пембролизумаб описан, например, в патенте США № 8900587; см. также сайт с адресом: «www» точка «cancer» точка «gov» косая черта «drugdictionary?cdrid=695789» (последний доступ: 14 декабря 2014 года). Пембролизумаб был одобрен FDA (Управление по контролю за продуктами питания и лекарственными средствами США) для лечения рецидивирующей или рефрактерной меланомы.
[00154] В других вариантах осуществления анти-PD-1 антитело представляет собой MEDI0608 (ранее называвшееся AMP-514), которое является моноклональным антителом против рецептора PD-1. MEDI0608 описан, например, в патенте США № 8609089 B2 или на интернет-сайте: «www» точка «cancer» точка «gov» косая черта «drugdictionary?cdrid=756047» (последний доступ: 14 декабря 2014 года).
[00155] В некоторых вариантах осуществления анти-PD-1 антитело представляет собой пидилизумаб (CT-011), который представляет собой гуманизированное моноклональное антитело. Пидилизумаб описан в патенте США № 8686119 B2 или WO 2013/014668 A1.
[00156] Анти-PD-1 антитела, используемые в раскрытых способах, также включают выделенные антитела, которые специфически связываются с PD-1 человека и перекрестно конкурируют за связывание с PD-1 человека с ниволумабом (см., например, патент США № 8008449, WO 2013/173223). Способность антител к перекрестной конкуренции за связывание с антигеном указывает на то, что эти антитела связываются с той же эпитопной областью антигена и стерически препятствуют связыванию других кросс-конкурирующих антител с этим конкретным эпитопом. Предполагается, что эти кросс-конкурирующие антитела обладают функциональными свойствами, очень похожими на свойства ниволумаба в силу их связывания с той же эпитопной областью PD-1. Кросс-конкурирующие антитела могут быть легко идентифицированы на основе их способности перекрестно конкурировать с ниволумабом в стандартных анализах связывания PD-1, таких как анализ Biacore, анализы ИФА или проточная цитометрия (см., например, WO 2013/173223).
[00157] В некоторых вариантах осуществления антитела, которые перекрестно конкурируют за связывание с PD-1 человека с, или связываются с той же эпитопной областью PD-1 человека, что и ниволумаб, являются моноклональными антителами. Для введения людям эти кросс-конкурирующие антитела могут быть химерными антителами или могут быть гуманизированными или человеческими антителами.
[00158] Анти-PD-1 антитела, используемые в способах раскрытого изобретения, также включают антигенсвязывающие части вышеуказанных антител. Примеры включают (i) Fab-фрагмент, моновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; (ii) фрагмент F (ab')2, двухвалентный фрагмент, содержащий два Fab-фрагмента, соединенных дисульфидным мостиком в шарнирной области; (iii) фрагмент Fd, состоящий из доменов VH и CH1; и (iv) фрагмент Fv, состоящий из доменов VL и VH одного плеча антитела.
[00159] Неограничивающая иллюстративная слитая молекула, которая является ингибитором PD-1/PD-L1, представляет собой AMP-224 (Amplimmune, GlaxoSmithKline). Неограничивающий иллюстративный полипептид, который является ингибитором PD-1/PD-L1, представляет собой AUR-012.
Иллюстративные константные области антитела
[00160] В некоторых вариантах осуществления FGFR2 или анти-PD-1, или анти-PD-L1 антитело, описанное в данном документе, содержит одну или более константных областей человека. В некоторых вариантах осуществления константная область тяжелой цепи человека относится к изотипу, выбранному из IgA, IgG и IgD. В некоторых вариантах осуществления константная область легкой цепи человека относится к изотипу, выбранному из κ и λ
[00161] В некоторых вариантах осуществления антитело, описанное в данном документе, содержит константную область IgG человека. В некоторых вариантах осуществления, если эффекторная функция является желательной, выбирают антитело, содержащее константную область тяжелой цепи IgG1 человека или константную область тяжелой цепи IgG3 человека. В некоторых вариантах осуществления антитело, описанное в данном документе, содержит константную область IgG1 человека. В некоторых вариантах осуществления антитело, описанное в данном документе, содержит константную область IgG1 человека, причем N297 не фукозилирован. В некоторых вариантах осуществления антитело, описанное в данном документе, содержит константную область IgG1 человека и легкую цепь κ человека.
[00162] В данном описании и формуле изобретения, если это явно не указано или не известно специалисту в данной области техники, нумерация остатков в тяжелой цепи иммуноглобулина соответствует индексу EU, как описано в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991), в явной форме включенной в данный документ посредством ссылки. "Индекс EU по Кабату" относится к нумерации остатков человеческого антитела IgG1 по EU.
[00163] В некоторых вариантах осуществления антитело согласно изобретению содержит вариант Fc-области, имеющий по меньшей мере одну аминокислотную замену по сравнению с Fc-областью IgG дикого типа или антителом дикого типа. В некоторых вариантах осуществления вариант Fc-области имеет две или более аминокислотных замен в Fc-области антитела дикого типа. В некоторых вариантах осуществления вариант Fc-области имеет три или более аминокислотных замен в Fc-области антитела дикого типа. В некоторых вариантах осуществления вариант Fc-области имеет по меньшей мере одну, две или три, или более аминокислотных замен Fc-области, описанные в данном документе. В некоторых вариантах осуществления Fc-область варианта в данном документе будет обладать по меньшей мере около 80% гомологией с Fc-областью нативной последовательности и/или с Fc-областью исходного антитела. В некоторых вариантах осуществления Fc-область варианта в данном документе будет обладать по меньшей мере около 90% гомологией с Fc-областью нативной последовательности и/или с Fc-областью исходного антитела. В некоторых вариантах осуществления Fc-область варианта в данном документе будет обладать по меньшей мере около 95% гомологией с Fc-областью нативной последовательности и/или с Fc-областью исходного антитела.
[00164] В некоторых вариантах осуществления антитело, предложенное в данном документе, изменено с целью увеличения или уменьшения степени гликозилирования антитела. Добавление или удаление сайтов гликозилирования в антителе, может быть легко выполнено путем изменения аминокислотной последовательности таким образом, что один или более сайтов гликозилирования создается или удаляется.
[00165] Если антитело содержит Fc-область, можно изменить присоединенный к ней углевод. Нативные антитела, вырабатываемые клетками млекопитающих, как правило, содержат разветвленный, биантеннальный олигосахарид, который в общем случае присоединен посредством N-связи к Asn297 домена CH2 Fc-области. См., например, Wright et al. TIBTECH 15:26-32 (1997). Олигосахарид может содержать различные углеводы, например, маннозу, N-ацетилглюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, присоединенную к GlcNAc в «коровой части» биантенной олигосахаридной структуры. В некоторых вариантах осуществления изобретения можно выполнить модификации олигосахарида в антителе согласно данному изобретению с целью создания антител с определенными улучшенными свойствами.
[00166] Антитела также могут иметь амино-концевые лидерные удлинения. Например, один или более аминокислотных остатков амино-концевой лидерной последовательности присутствуют на амино-конце любой из одной или более тяжелых или легких цепей антитела. Иллюстративное амино-концевое лидерное удлинение содержит или состоит из трех аминокислотных остатков, VHS, присутствующих на одной или обеих легких цепях антитела.
[00167] Время полужизни in vivo или в сыворотке человеческих FcRn высокоаффинных связывающих полипептидов может быть проанализировано, например, у трансгенных мышей, у людей или у приматов, отличных от человека, которым вводят полипептиды с вариантом Fc-области. См. также, например, Petkova et al. International Immunology 18(12):1759-1769 (2006).
Иллюстративные химерные антитела
[00168] В некоторых вариантах осуществления анти-FGFR2 или анти-PD-1, или анти-PD-L1 антитело, представленные в данном документе, представляет собой химерное антитело. Некоторые химерные антитела описаны, например, в патенте США № 4816567 и статье Morrison et al. (1984) Proc Natl. Acad. Sci. USA, 81: 6851-6855 (1984)). В одном примере химерное антитело содержит нечеловеческую вариабельную область (например, вариабельную область, полученную от антитела мыши, крысы, хомяка, кролика или отличного от человека примата, например, обезьяны) и константную область человека. В дополнительном примере, химерное антитело представляет собой антитело с "переключенным классом", у которого класс или подкласс был изменен по сравнению с исходным антителом. Термин «химерные антитела» включает антигенсвязывающие фрагменты таких антител.
[00169] Неограничивающие иллюстративные химерные антитела включают химерные антитела против FGFR2 или PD-1/PD-L1, включающие тяжелые цепи HVR1, HVR2 и HVR3 и/или последовательности HVR1, HVR2 и HVR3 легкой цепи, описанные в данном документе.
[00170] В некоторых вариантах осуществления химерное антитело, описанное в данном документе, содержит одну или более константных областей человека. В некоторых вариантах осуществления константная область тяжелой цепи человека относится к изотипу, выбранному из IgA, IgG и IgD. В некоторых вариантах осуществления константная область легкой цепи человека относится к изотипу, выбранному из κ и λ В некоторых вариантах осуществления химерное антитело, описанное в данном документе, содержит константную область IgG человека. В некоторых вариантах осуществления химерное антитело, описанное в данном документе, содержит константную область тяжелой цепи IgG4 человека. В некоторых вариантах осуществления химерное антитело, описанное в данном документе, содержит константную область IgG4 человека и легкую цепь κ человека.
[00171] Как отмечено выше, желательна или нежелательна эффекторная функция, может зависеть от конкретного способа лечения, осуществляемого антителом. Таким образом, в некоторых вариантах осуществления, если эффекторная функция является желательной, выбирают химерное антитело, содержащее константную область тяжелой цепи IgG1 человека или константную область тяжелой цепи IgG3 человека. В некоторых вариантах осуществления, если эффекторная функция нежелательна, выбирают химерное антитело, содержащее константную область тяжелой цепи IgG4 или IgG2 человека. В некоторых вариантах осуществления химерное антитело, описанное в данном документе, содержит константную область IgG1 человека, причем N297 не фукозилирован. В некоторых вариантах осуществления химерное антитело, описанное в данном документе, содержит константную область IgG1 человека и легкую цепь κ человека.
Иллюстративные гуманизированные антитела
[00172] В некоторых вариантах осуществления используются гуманизированные антитела, которые связывают FGFR2 или PD-1/PD-L1. Гуманизированные антитела полезны в качестве терапевтических молекул, потому что гуманизированные антитела уменьшают или устраняют иммунный ответ человека на нечеловеческие антитела (такие как образование человеческих антимышиных антител (HAMA)), что может приводить к иммунному ответу на терапевтическое антитело и снижение эффективности терапии.
[00173] В некоторых вариантах осуществления изобретения химерное антитело представляет собой гуманизированное антитело. Как правило, антитело нечеловеческого происхождения гуманизируют с целью снижения иммуногенности для человека, сохраняя при этом специфичность и аффинность исходного антитела нечеловеческого происхождения. Как правило, гуманизированное антитело содержит один или более вариабельных доменов, в которых HVR, или CDR (или их фрагменты) получают из нечеловеческого антитела, и FR (или их фрагменты) получают из последовательностей антитела человека. В некоторых случаях гуманизированное антитело также содержит по меньшей мере фрагмент константной области человека. В некоторых вариантах осуществления некоторые остатки FR гуманизированного антитела заменены соответствующими остатками из нечеловеческого антитела (например, антитела, из которого получены остатки HVR), например, для восстановления или улучшения специфичности антитела или аффинности.
[00174] Гуманизированные антитела и способы их получения рассматриваются, например, в Almagro and Fransson, (2008) Front. Biosci. 13: 1619-1633, и дополнительно описаны, например, в Riechmann et al., (1988) Nature 332:323-329; Queen et al., (1989) Proc. Natl Acad. Sci. USA 86: 10029-10033; патенты США №№ 5821337, 7527791, 6982321 и 7087409; Kashmiri et al., (2005) Methods 36: 25-34 (описание пересадки SDR (a-CDR)); Padlan, (1991) Mol. Immunol. 28:489-498 (описание ʺизменение поверхностиʺ); Dall'Acqua et al., (2005) Methods 36:43-60 (описание ʺперетасовки FRʺ); и Osbourn et al., (2005) Methods 36:61-68 и Klimka et al., (2000) Br. J. Cancer, 83:252-260 (описание подхода ʺнаправленной селекцииʺ к перетасовке FR).
[00175] Человеческие каркасные области, которые могут быть использованы для гуманизации, включают, но не ограничиваются этими, каркасные области, выбранные с использованием способа «наилучшего соответствия» (см., например, Sims et al. (1993) J. Immunol. 151: 2296); каркасные области, полученные из консенсусной последовательности антител человека конкретной подгруппы вариабельных областей легкой или тяжелой цепи (см., например, Carter et al. (1992) Proc. Natl. Acad. Sci. USA, 89:4285; и Presta et al. (1993) J. Immunol, 151:2623); зрелые (соматически мутированные) каркасные области человека или каркасные области зародышевой линии человека (см., например, Almagro and Fransson, (2008) Front. Biosci. 13:1619-1633); и каркасные области, полученные в результате скрининга библиотек FR (см., например, Baca et al., (1997) J. Biol. Chem. 272: 10678-10684 и Rosok et al., (1996) J. Biol. Chem. 271: 22611-22618).
[00176] В некоторых вариантах осуществления гуманизированные антитела содержат одну или более константных областей человека. В некоторых вариантах осуществления константная область тяжелой цепи человека относится к изотипу, выбранному из IgA, IgG и IgD. В некоторых вариантах осуществления константная область легкой цепи человека относится к изотипу, выбранному из κ и λ
[00177] В некоторых вариантах осуществления гуманизированное антитело, описанное в данном документе, содержит константную область IgG человека. В некоторых вариантах осуществления, если эффекторная функция является желательной, антитело содержит константную область тяжелой цепи IgG1 человека или константную область тяжелой цепи IgG3 человека. В некоторых вариантах осуществления гуманизированное антитело, описанное в данном документе, содержит константную область IgG1 человека. В некоторых вариантах осуществления гуманизрованное антитело, описанное в данном документе, содержит константную область IgG1 человека, причем N297 не является фукозилированным. В некоторых вариантах осуществления гуманизированное антитело, описанное в данном документе, содержит константную область IgG1 человека и легкую цепь κ человека.
Человеческие антитела
[00178] Человеческие антитела к FGFR2 или PD-1/PD-L1 могут быть получены любым подходящим способом. Неограничивающие иллюстративные способы включают создание человеческих антител в трансгенных мышах, которые содержат локусы иммуноглобулина человека. См., например, Jakobovits et al., Proc. Natl. Acad. Sci. USA 90: 2551-55 (1993); Jakobovits et al., Nature 362: 255-8 (1993); Lonberg et al., Nature 368: 856-9 (1994); и патенты США №№ 5545807; 6713610; 6673986; 6162963; 5545807; 6300129; 6255458; 5877397; 5874299; и 5545806.
[00179] Неограничивающие иллюстративные способы также включают создание человеческих антител с использованием библиотек фагового дисплея. См., например, Hoogenboom et al., J. Mol. Biol. 227: 381-8 (1992); Marks et al., J. Mol. Biol. 222: 581-97 (1991); и публикация РСТ № WO 99/10494.
[00180] В некоторых вариантах осуществления человеческое антитело содержит одну или более константных областей человека. В некоторых вариантах осуществления константная область тяжелой цепи человека относится к изотипу, выбранному из IgA, IgG и IgD. В некоторых вариантах осуществления константная область легкой цепи человека относится к изотипу, выбранному из κ и λ В некоторых вариантах осуществления человеческое антитело, описанное в данном документе, содержит константную область IgG человека. В некоторых вариантах осуществления человеческое антитело, описанное в данном документе, содержит константную область тяжелой цепи IgG4 человека. В некоторых таких вариантах осуществления человеческое антитело, описанное в данном документе, включает мутацию S241P в константной области IgG4 человека. В некоторых вариантах осуществления человеческое антитело, описанное в данном документе, содержит константную область IgG4 человека и легкую цепь κ человека.
[00181] В некоторых вариантах осуществления, если эффекторная функция является желательной, выбирают человеческое антитело, содержащее константную область тяжелой цепи IgG1 человека или константную область тяжелой цепи IgG3 человека. В некоторых вариантах осуществления, если эффекторная функция нежелательна, выбирают человеческое антитело, содержащее константную область тяжелой цепи IgG4 или IgG2 человека. В некоторых вариантах осуществления гуманизрованное антитело, описанное в данном документе, содержит константную область IgG1 человека, причем N297 не является фукозилированным. В некоторых вариантах осуществления гуманизированное антитело, описанное в данном документе, содержит константную область IgG1 человека и легкую цепь κ человека.
Иллюстративные конъюгаты антител
[00182] В некоторых вариантах осуществления антитело к FGFR2 или PD-1/PD-L1 конъюгировано с меткой и/или цитотоксическим агентом. Как используется в данном документе, метка представляет собой фрагмент, который облегчает выявление антитела и/или облегчает выявление молекулы, с которой связывается антитело. Неограничивающие иллюстративные метки включают, но не ограничиваются ими, радиоизотопы, флуоресцентные группы, ферментативные группы, хемилюминесцентные группы, биотин, эпитопные метки, метки, связывающие металл и т.д. Специалист в данной области техники может выбрать подходящую метку в соответствии с предполагаемым применением.
[00183] Используемый в данном документе цитотоксический агент представляет собой фрагмент, который снижает пролиферативный потенциал одной или более клеток. Клетка имеет сниженный пролиферативный потенциал, если клетка становится менее способной к пролиферации, например, потому что клетка подвергается апоптозу или иным образом умирает, клетка не проходит через клеточный цикл и/или не может делиться, клетка дифференцируется и т.д. Неограничивающие иллюстративные цитотоксические агенты включают, но не ограничиваются ими, радиоизотопы, токсины и химиотерапевтические агенты. Специалист в данной области техники может выбрать подходящий цитотоксический препарат в соответствии с предполагаемым применением.
[00184] В некоторых вариантах осуществления метка и/или цитотоксический агент конъюгируют с антителом с использованием химических методов in vitro. Неограничивающие иллюстративные химические способы конъюгации известны в данной области техники и включают оборудования, способы и/или реагенты, коммерчески доступные, например, из Thermo Scientific Life Science Research Produces (ранее Pierce, Рокфорд, Иллинойс), Prozyme (Хейуорд, Калифорния), SACRI Antibody Services (Калгари, Канада), AbD Serotec (Роли, Северная Каролина) и т.д. В некоторых вариантах осуществления, если метка и/или цитотоксический агент представляют собой полипептид, метка и/или цитотоксический агент могут быть экспрессированы из одного и того же вектора экспрессии по меньшей мере с одной цепью антитела с получением полипептида, содержащего метку и/или цитотоксический агент, слитый с цепью антитела. Специалист в данной области техники может выбрать подходящий способ конъюгирования метки и/или цитотоксического агента с антителом в соответствии с предполагаемым применением.
Молекулы нуклеиновых кислот, кодирующие антитела
[00185] Предложены молекулы нуклеиновой кислоты, содержащие полинуклеотиды, которые кодируют одну или более цепей антитела. В некоторых вариантах осуществления молекула нуклеиновой кислоты содержит полинуклеотид, который кодирует тяжелую цепь или легкую цепь антитела. В некоторых вариантах осуществления молекула нуклеиновой кислоты содержит как полинуклеотид, который кодирует тяжелую цепь, так и полинуклеотид, который кодирует легкую цепь антитела. В некоторых вариантах осуществления первая молекула нуклеиновой кислоты содержит первый полинуклеотид, который кодирует тяжелую цепь, а вторая молекула нуклеиновой кислоты содержит второй полинуклеотид, который кодирует легкую цепь.
[00186] В некоторых таких вариантах осуществления тяжелая цепь и легкая цепь экспрессируются из одной молекулы нуклеиновой кислоты или из двух отдельных молекул нуклеиновой кислоты в виде двух отдельных полипептидов. В некоторых вариантах осуществления, например, если антитело представляет собой scFv, один полинуклеотид кодирует один полипептид, содержащий как тяжелую цепь, так и легкую цепь, связанные вместе.
[00187] В некоторых вариантах осуществления полинуклеотид, кодирующий тяжелую цепь или легкую цепь антитела, содержит нуклеотидную последовательность, которая кодирует лидерную последовательность, которая при трансляции расположена на N-конце тяжелой цепи или легкой цепи. Как обсуждалось выше, лидерная последовательность может быть нативной лидерной последовательностью тяжелой или легкой цепи или может быть другой гетерологичной лидерной последовательностью.
[00188] Молекулы нуклеиновой кислоты могут быть сконструированы с использованием методов рекомбинантной ДНК, известных в данной области техники. В некоторых вариантах осуществления молекула нуклеиновой кислоты представляет собой вектор экспрессии, который подходит для экспрессии в выбранной клетке-хозяине.
Экспрессия и продуцирование антител
Векторы
[00189] Предложены векторы, содержащие полинуклеотиды, которые кодируют тяжелые цепи и/или легкие цепи антитела. Также предложены векторы, содержащие полинуклеотиды, которые кодируют тяжелые цепи и/или легкие цепи антитела. Такие векторы включают, но не ограничиваются ими, ДНК-векторы, фаговые векторы, вирусные векторы, ретровирусные векторы и т.д. В некоторых вариантах осуществления вектор содержит первую полинуклеотидную последовательность, кодирующую тяжелую цепь, и вторую полинуклеотидную последовательность, кодирующую легкую цепь. В некоторых вариантах осуществления тяжелая цепь и легкая цепь экспрессируются из вектора в виде двух отдельных полипептидов. В некоторых вариантах осуществления тяжелая цепь и легкая цепь экспрессируются как часть одного полипептида, такого как, например, когда антитело представляет собой scFv.
[00190] В некоторых вариантах осуществления первый вектор содержит полинуклеотид, который кодирует тяжелую цепь, а второй вектор содержит полинуклеотид, который кодирует легкую цепь. В некоторых вариантах осуществления первый вектор и второй вектор трансфицируют в клетки-хозяева в сходных количествах (таких как сходные молярные количества или сходные массовые количества). В некоторых вариантах осуществления мольное или массовое соотношение между 5:1 и 1:5 первого вектора и второго вектора трансфицируют в клетки-хозяева. В некоторых вариантах осуществления используется массовое соотношение между 1:1 и 1:5 для вектора, кодирующего тяжелую цепь, и вектора, кодирующего легкую цепь. В некоторых вариантах осуществления используется массовое соотношение 1:2 для вектора, кодирующего тяжелую цепь, и вектора, кодирующего легкую цепь.
[00191] В некоторых вариантах осуществления выбирают вектор, который оптимизирован для экспрессии полипептидов в клетках CHO или клетках, полученных из CHO, или в клетках NSO. Иллюстративные такие векторы описаны, например, в Running Deer et al., Biotechnol. Prog. 20:880-889 (2004).
[00192] В некоторых вариантах осуществления вектор выбирают для экспрессии in vivo тяжелых цепей антитела и/или легких цепей антитела у животных, включая, людей. В некоторых таких вариантах осуществления экспрессия полипептида находится под контролем промотора, который функционирует тканеспецифичным образом. Например, печень-специфичные промоторы описаны, например, в публикации РСТ № WO 2006/076288.
Клетки-хозяева
[00193] В различных вариантах осуществления тяжелые цепи и/или легкие цепи антитела могут быть экспрессированы в прокариотических клетках, таких как бактериальные клетки; или в эукариотических клетках, таких как клетки грибов (такие как дрожжи), клетки растений, клетки насекомых и клетки млекопитающих. Такая экспрессия может быть осуществлена, например, в соответствии с процедурами, известными в данной области техники. Иллюстративные эукариотические клетки, которые могут быть использованы для экспрессии полипептидов, включают, но не ограничиваются ими, клетки COS, включая клетки COS 7; клетки 293, включая клетки 293-6E; клетки CHO, включая клетки CHO-S и DG44; клетки PER.C6® (Crucell); и клетки NSO. В некоторых вариантах осуществления тяжелые цепи и/или легкие цепи антитела могут быть экспрессированы в дрожжах. См., например, публикацию США № US 2006/0270045 A1. В некоторых вариантах осуществления конкретная эукариотическая клетка-хозяин выбирается на основе ее способности осуществлять желаемые посттрансляционные модификации тяжелых цепей и/или легких цепей антитела. Например, в некоторых вариантах осуществления клетки СНО продуцируют полипептиды, которые имеют более высокий уровень сиалирования, чем тот же полипептид, продуцируемый в клетках 293.
[00194] Введение одной или более нуклеиновых кислот в желаемую клетку-хозяина может быть осуществлено любым способом, включая, но не ограничиваясь ими, кальций-фосфатная трансфекцию, опосредованную ДЭАЭ-декстраном трансфекцию, опосредованную катионными липидами трансфекцию, электропорацию, трансдукцию, инфекцию и т.д. Неограничивающие иллюстративные способы описаны, например, в Sambrook et al., Molecular Cloning, A Laboratory Manual, 3rd ed. Cold Spring Harbor Laboratory Press (2001). Нуклеиновые кислоты могут быть временно или стабильно трансфицированы в желаемых клетках-хозяевах в соответствии с любым подходящим способом.
[00195] В некоторых вариантах осуществления один или более полипептидов могут быть получены in vivo в животном организме, которые были сконструированы или трансфицированы одной или более молекулами нуклеиновой кислоты, кодирующими полипептиды, в соответствии с любым подходящим способом.
Очистка антител
[00196] Антитела могут быть очищены любым подходящим способом. Такие способы включают, но не ограничиваются ими, использование аффинных матриц или хроматографию гидрофобных взаимодействий. Подходящие аффинные лиганды включают антиген и лиганды, которые связывают константные области антитела. Например, белок A, белок G, белок A/G или колонка с иммобилизованными антителами могут быть использованы для связывания константной области и для очистки антитела. Хроматография гидрофобных взаимодействий, например, бутильная или фенильная колонка, также может быть пригодна для очистки некоторых полипептидов. Многие способы очистки полипептидов известны в данной области техники.
Бесклеточное получение антител
[00197] В некоторых вариантах осуществления антитело получают в бесклеточной системе. Неограничивающие иллюстративные бесклеточные системы описаны, например, в Sitaraman et al., Methods Mol. Biol. 498: 229-44 (2009); Spirin, Trends Biotechnol. 22: 538-45 (2004); Endo et al., Biotechnol. Adv. 21: 695-713 (2003).
Терапевтические композиции и способы
Способы лечения рака
[00198] В некоторых вариантах осуществления предложены способы лечения рака, включающие введение эффективного количества ингибитора FGFR2, описанного в данном документе. Некоторые из таких вариантов включают способы увеличения количества одних или более из: PD-L1-положительных клеток, NK-клеток, CD3+ T-клеток, CD4+ T-клеток и CD8+ T-клеток в опухолевой ткани субъекта, страдающего раком, включающий введение ингибитора FGFR2, причем ингибитор представляет собой антитело к FGFR2 с повышенной АЗКЦ активностью. В некоторых таких вариантах осуществления иммуностимулирующий агент вводят с антителом к FGFR2.
[00199] В некоторых других вариантах осуществления предложены способы лечения рака, включающие введение эффективного количества ингибитора FGFR2 и эффективное количество по меньшей мере одного иммуностимулирующего агента. В иллюстративном варианте осуществления по меньшей мере один иммуностимулирующий агент включает ингибитор PD-1/PD-L1. В некоторых вариантах осуществления ингибитор FGFR2 и по меньшей мере один иммуностимулирующий агент, такой как ингибитор PD-1/PD-L1, вводят одновременно. В некоторых вариантах осуществления ингибитор FGFR2 и по меньшей мере один иммуностимулирующий агент, такой как ингибитор PD-1/PD-L1, вводят последовательно. В некоторых вариантах осуществления вводят по меньшей мере одну, по меньшей мере две, по меньшей мере три дозы, по меньшей мере пять доз или по меньшей мере десять доз ингибитора FGFR2 перед введением по меньшей мере одного иммуностимулирующего агента, такого как ингибитор PD-1/PD-L1. В некоторых вариантах осуществления перед введением ингибитора FGFR2 вводят по меньшей мере одну, по меньшей мере две, по меньшей мере три дозы, по меньшей мере пять доз или по меньшей мере десять доз по меньшей мере одного иммуностимулирующего агента, такого как ингибитор PD-1/PD-L1. В некоторых вариантах осуществления последнюю дозу по меньшей мере одного иммуностимулирующего агента, такого как ингибитор PD-1/PD-L1, вводят за по меньшей мере одни, двое, трое, пять или десять суток, или одну, две, три, пять, двенадцать или двадцать четыре недели до первой дозы ингибитора FGFR2. В другом варианте осуществления последнюю дозу ингибитора FGFR2 вводят за по меньшей мере одни, двое, трое, пять или десять суток, или одну, две, три, пять, двенадцать или двадцать четыре недели до первой дозы по меньшей мере одного иммуностимулирующего агента, такого как ингибитор PD-1/PD-L1. В некоторых вариантах осуществления субъект получил или получает ингибитор PD-1/PD-L1, а ингибитор FGFR2 добавляют к схеме лечения.
[00200] В некоторых вариантах осуществления рак выбирают из рака желудка, рака молочной железы, плоскоклеточного рака, мелкоклеточного рака легкого, рака гипофиза, рака пищевода (включая аденокарциномы гастроэзофагеального соединения), астроцитомы, саркомы мягких тканей, немелкоклеточного рака легкого, аденокарциномы легкого, плоскоклеточного рака легкого, рака брюшины, печеночноклеточного рака, рака желудочно-кишечного тракта, рака поджелудочной железы, глиобластомы, рака шейки матки, рака яичников, рака печени, рака мочевого пузыря, гепатомы, рака молочной железы, рака толстой кишки, колоректального рака, рака эндометрия или матки, карциномы слюнных желез, рака почки, почечно-клеточного рака, рака печени, рака предстательной железы, рака вульвы, рака щитовидной железы, гепатокарциномы, рака мозга, рака эндометрия, рака яичка, холангиокарциномы, карциномы желчного пузыря, рака желудка, меланомы и различных видов рака головы и шеи. В некоторых вариантах осуществления рак легкого представляет собой немелкоклеточный рак легкого или плоскоклеточную карциному легкого. В некоторых вариантах осуществления лейкоз представляет собой острый миелоидный лейкоз или хронический лимфоцитарный лейкоз. В некоторых вариантах осуществления рак молочной железы представляет собой инвазивную карциному молочной железы. В некоторых вариантах осуществления рак яичника представляет собой серозную цистадокарциному яичника. В некоторых вариантах осуществления рак почки представляет собой светлоклеточный рак почки. В некоторых вариантах осуществления рак толстой кишки представляет собой аденокарциному толстой кишки. В некоторых вариантах осуществления рак мочевого пузыря представляет собой уротелиальную карциному мочевого пузыря. В некоторых вариантах осуществления рак выбирают из рака мочевого пузыря, рака шейки матки (например, плоскоклеточный рак шейки матки), плоскоклеточного рака головы и шеи, аденокарциномы прямой кишки, немелкоклеточного рака легкого, рака эндометрия, аденокарциномы предстательной железы, рака толстой кишки, рака яичника (такого как серозный эпителиальный рак яичника) и меланомы. В некоторых вариантах осуществления рак представляет собой рак желудка (который включает гастроэзофагеальный рак) или рак мочевого пузыря (такой как переходно-клеточная карцинома, также известная как уротелиальный рак).
[00201] В некоторых вариантах осуществления рак содержит амплификацию гена FGFR2, тогда как в некоторых вариантах осуществления рак не содержит амплификацию FGFR2. В некоторых вариантах осуществления метод флуоресцентной гибридизации in situ (метод FISH) используется для оценки амплификации гена, например, с помощью зондов для локуса гена FGFR2 и центромере хромосоме 10. В некоторых вариантах осуществления при которых происходит амплификация, амплификация FGFR2 содержит соотношение FGFR2: CEN10 (центромера хромосомы 10)> 3. В некоторых вариантах осуществления амплификация FGFR2 содержит соотношение FGFR2:CEN10 ≥ 2. Однако в других вариантах осуществления уровень FGFR2 включает соотношение FGFR2: CEN10 между 1 и 2, что указывает на то, что FGFR2 не амплифицируется.
[00202] В некоторых вариантах осуществления, в которых рак содержит амплификацию гена FGFR2, рак сверхэкспрессирует FGFR2-IIIb. В некоторых вариантах осуществления рак, содержащий амплификацию FGFR2, сверхэкспрессирует FGFR2-IIIb в большей степени, чем FGFR2-IIIc. В некоторых вариантах осуществления рак не содержит амплификацию гена, тем не менее FGFR2-IIIb сверхэкспрессируется. В некоторых вариантах осуществления рак, содержащий амплификацию FGFR2, экспрессирует FGFR2-IIIb на нормированном уровне, который более чем в 2 раза, в 3 раза, в 5 раз или в 10 раз превышает нормированный уровень экспрессии FGFR2-IIIc. В некоторых вариантах осуществления уровни экспрессии нормируют к GUSB (бета-глюкуронидаза). В некоторых вариантах осуществления рак сверхэкспрессирует FGFR2-IIIb, но не содержит амплификацию гена FGFR2. В некоторых вариантах осуществления рак желудка или мочевого пузыря содержит амплификацию гена FGFR2. В некоторых вариантах осуществления рак желудка или мочевого пузыря содержит амплификацию гена FGFR2, которая сверхэкспрессирует FGFR2-IIIb.
[00203] В некоторых вариантах осуществления рак желудка или мочевого пузыря, содержащий амплификацию FGFR2, сверхэкспрессирует FGFR2-IIIb в большей степени, чем FGFR2-IIIc. В некоторых вариантах осуществления рак желудка или мочевого пузыря не содержит амплификации гена, но FGFR2-IIIb сверхэкспрессируется. В некоторых вариантах осуществления рак желудка или мочевого пузыря, содержащий амплификацию FGFR2, экспрессирует FGFR2-IIIb на нормированном уровне, который более чем в 2 раза, в 3 раза, в 5 раз или в 10 раз превышает нормированный уровень экспрессии FGFR2-IIIc. В некоторых вариантах осуществления уровни экспрессии нормируют к GUSB (бета-глюкуронидаза). В некоторых вариантах осуществления рак желудка или мочевого пузыря сверхэкспрессирует FGFR2-IIIb, но не содержит амплификацию гена FGFR2. В некоторых вариантах осуществления сверхэкспрессия представляет собой сверхэкспрессию мРНК. В некоторых вариантах осуществления сверхэкспрессия представляет собой сверхэкспрессию белка. В некоторых вариантах осуществления точечная мутация или транслокация могут вызывать сверхэкспрессию FGFR2. Уровни экспрессии типов FGFR2 могут быть определены, например, с использованием ИГХ.
[00204] В некоторых вариантах осуществления сверхэкспрессия FGFR2 определяется при помощи иммуногистохимии (ИГХ). Например, сверхэкспрессию можно определить при помощи сигнала ИГХ, составляющего 1+, 2+ или 3+, по меньшей мере в 10% опухолевых клеток, например, по меньшей мере в 20%, 30%, 40% или 50% опухолевых клеток. Например, в некоторых таких вариантах осуществления рак представляет собой рак желудка, и пациенты, подлежащие лечение, могут иметь, например, сигнал ИГХ для FGFR2b, составляющий 3+, в по меньшей мере 10% опухолевых клеток (например, в клеточных мембранах). В некоторых вариантах осуществления пациент с диагнозом рака желудка может иметь сигнал, составляющий 2+ или 3+, в по меньшей мере 10% опухолевых клеток. В некоторых вариантах осуществления пациент с диагнозом рака желудка может иметь по меньшей мере сигнал, составляющий 1+, в по меньшей мере 10% опухолевых клеток.
[00205] В некоторых вариантах осуществления сверхэкспрессия FGFR2 может быть представлена в виде «оценки H». Например, в некоторых таких вариантах осуществления опухоль представляет собой рак мочевого пузыря. Чтобы определить показатель H, можно определить интенсивность окрашивания первой мембраны для клеток в фиксированном поле, например, посредством ИГХ, чтобы получить оценки 0, 1+, 2+ или 3+, а показатель H можно рассчитать, используя формулу следующим образом: 1x (% клеток, визуализированных с ИГХ интенсивностью 1+)+2x (% клеток, визуализированных с ИГХ интенсивностью 2+)+3x (% клеток, визуализированных с ИГХ интенсивностью 3+). Теоретически, показатель H может колебаться от 0 до 300 и равен 300, если все клетки в поле зрения имеют ИГХ окрашивание 3+. В некоторых вариантах осуществления пациент, подлежащий лечению, имеет начальный показатель H для FGFR2, такого как FGFR2b (например, FGFR2IIIb), >20, например, >30, >40, >50 или >100, или в диапазоне 20-300, 20-100, 20-50, 20-40 или 20-30. В некоторых вариантах осуществления пациент имеет показатель H > 10 или показатель H находится в диапазоне 10-20 или 15-20. В других вариантах осуществления пациент имеет показатель H равный 0-10, что может указывать на отсутствие сверхэкспрессии FGFR2. В некоторых таких вариантах осуществления пациент представляет собой пациента с раком мочевого пузыря.
[00206] В некоторых вариантах осуществления рак уже был определен как сверхэкспрессирующий FGFR2IIIb и/или как содержащий амплификацию гена FGFR2. В других вариантах осуществления способы, описанные в данном документе, сначала оценивают экспрессию FGFR2IIIb и/или амплификацию гена FGFR2 до того, как будет назначено лечение. Кроме того, в этом раскрытии представлены способы определения чувствительности на любой из ингибиторов FGFR2, терапий и применений, описанных выше, включая оценку экспрессии FGFR2IIIb и/или амплификации гена FGFR2 у больного раком.
[00207] В некоторых вариантах осуществления, в которых пациент страдает от рака желудка или мочевого пузыря, способ может включать определение того, относится ли рак у пациента к одной из следующих категорий, что может указывать на чувствительность к лечению или на композицию с ингибитором FGFR2: а) в случае субъекта с раком желудка сигнал ИГХ, составляющий 3+, по меньшей мере в 10% опухолевых клеток; b) в случае субъекта с раком желудка сигнал ИГХ, составляющий 3+, по меньшей мере в 10% опухолевых клеток, а также амплификации гена FGFR2; c) в случае субъекта с раком желудка сигнал ИГХ, составляющий 3+, по меньшей мере в 10% опухолевых клеток без амплификации гена FGFR2; d) в случае субъекта с раком желудка сигнал ИГХ, составляющий 1+ или 2+, по меньшей мере в 10% опухолевых клеток; e) в случае пациента с раком мочевого пузыря сигнал ИГХ, составляющий 1+, по меньшей мере в 10% опухолевых клеток; f) в случае субъекта с раком мочевого пузыря сигнал ИГХ, составляющий 2+, по меньшей мере в 10% опухолевых клеток; g) в случае пациента с раком мочевого пузыря, показатель H больше 20; h) в случае субъекта с раком мочевого пузыря показатель H равен 10-19; i) в случае субъекта с раком мочевого пузыря показатель H менее, чем 10.
[00208] В некоторых вариантах осуществления способов, описанных в данном документе, субъект представляет собой «субъекта, недостаточно ответившего на лечение» ингибитором PD-1/PD-L1. Субъект, который представляет собой субъекта, недостаточно отвечающего на лечение ингибитором PD-1/PD-L1, возможно ранее отвечавшего на лечение ингибитором PD-1/PD-L1, но, возможно, ставшего менее чувствительным к ингибитору PD-1/PD-L1, или субъекта, возможно, никогда не отвечавшего на лечение ингибитором PD-1/PD-L1. Недостаточный ответ на лечение ингибитором PD-1/PD-L1 означает, что аспекты состояния, которые, как ожидается, улучшатся после стандартной дозы ингибитора PD-1/PD-L1, не улучшаются, и/или улучшение происходит только в том случае, если вводится доза больше стандартной. В некоторых вариантах осуществления субъект, недостаточно ответивший на лечение ингибитором PD-1/PD-L1, испытывал или испытывает недостаточный ответ на ингибитор PD-1/PD-L1 после приема стандартной дозы в течение по меньшей мере двух недель, по меньшей мере трех недель, по меньшей мере четырех недель, по меньшей мере шести недель или по меньшей мере двенадцати недель. «Стандартная» доза определяется медицинским работником и может зависеть от возраста, веса, истории болезни, степени тяжести заболевания, частоты приема препарата и т.д. В некоторых вариантах осуществления субъект, недостаточно ответивший на лечение ингибитором PD-1/PD-L1, испытывал или испытывает недостаточный ответ на анти-PD-1 антитело и/или анти-PD-L1 антитело. В некоторых вариантах осуществления субъект, недостаточно ответивший на лечение ингибитором PD-1/PD-L1, испытывал или испытывает недостаточный ответ на AMP-224. В некоторых вариантах осуществления субъект, недостаточно ответивший на лечение ингибитором PD-1/PD-L1, испытывал или испытывает недостаточный ответ на ингибитор PD-1/PD-L1, выбранный из ниволумаба, пидилизумаба и пембролизумаба.
[00209] В любом из вышеприведенных способов осуществления комбинация ингибитора FGFR2 и по меньшей мере одного иммуностимулирующего агента, такого как ингибитор PD-1/PD-L1, может ингибировать рост опухоли в мышиной модели опухоли в течение 1 недели, 10 суток или 2 недель, например, на по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90% или по меньшей мере 95%. В любом из вышеприведенных способов осуществления изобретения комбинация ингибитора FGFR2 и ингибитора PD-1/PD-L1 субъекту может уменьшить объем по меньшей мере одной опухоли у субъекта на по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90% или по меньшей мере 95%, например, в течение по меньшей мере одного месяца, двух месяцев, трех месяцев, шести месяцев или одного года.
Антитела к FGFR2 увеличивают количество NK-клеток, PD-L1-экспрессирующих клеток, макрофагов и CD3+, CD8+ и CD4+ T-клеток, а также увеличивают соотношение лимфоидных клеток к миелоидным клеткам в опухолях
[00210] В любом из вышеуказанных способов осуществления введение ингибитора FGFR2 может продемонстрировать увеличение NK-клеток, таких как NKp46+ клетки, увеличение PD-L1-экспрессирующих клеток, увеличение CD3+, CD8+ и/или CD4+ T-клеток, увеличение макрофагов и/или увеличение соотношения лимфоидных к миелоидным клеткам по сравнению с контролем в опухолях, взятых из мышиной модели опухоли, такой как ксенотрансплантатная модель опухоли или модель сингенной опухоли, в течение по меньшей мере 1 суток, 4 суток, 1 недели, 10 суток или 2 недель и, например, и на по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90% или по меньшей мере 95%. В некоторых вариантах осуществления мышиная модель опухоли представляет собой модель опухоли 4T1.
[00211] Данные, представленные в приведенных в данном документе примерах, демонстрируют, что лечение сингенных опухолевых моделей мышей с использованием афукозилированного анти-FGFR2b антитела увеличивает количество NKp46+ клеток в ткани опухоли мыши, а также ингибирует рост опухоли. Аналогичное лечение антителом с мутацией при N297 и отсутствием АЗКЦ активности (анти-FGFR2-N297Q) не продемонстрировало увеличения NK-клеток и не повлияла на рост опухоли. (См. примеры 2a-b ниже).
[00212] Данные, представленные в приведенных в данном документе примерах, также демонстрируют, что лечение мышиных сингенных моделей с использованием афукозилированного антитела к FGFR2 увеличивает количество PD-L1-положительных клеток в опухолевой ткани. (См. пример 2а.) Это говорит о том, что ингибитор FGFR2 может хорошо комбинироваться с ингибитором PD-1/PD-L1 для лечения рака и что заявленные комбинации могут иметь по меньшей мере аддитивные и в некоторых случаях синергические эффекты в комбинации на объем опухоли или ингибирование роста опухоли. Дополнительные данные в данном документе демонстрируют, что лечение мышиных сингенных опухолевых моделей с использованием афукозилированного антитела к FGFR2 также увеличивает количество CD3+, CD8+ и CD4+ T-клеток в опухолевой ткани и увеличивает соотношение лимфоидных к миелоидным клеткам. Такие результаты не наблюдали для антитела к FGFR2, содержащего мутацию N297Q, предназначенную для предотвращения эффекторной функции. (См. пример 2b.) Дополнительные данные в данном документе демонстрируют, что лечение мышиных сингенных опухолевых моделей с использованием афукозилированного антитела к FGFR2 также увеличивает количество макрофагов в опухолевой ткани. (См. пример 2c.) Эти данные свидетельствуют о том, что ингибирование роста опухоли, наблюдаемое при использовании афукозилированного анти-FGFR2 антитела, частично облегчается опосредованной NK-клеточной АЗКЦ активностью. Кроме того, данные свидетельствуют о том, что эта АЗКЦ активность может увеличить количество PD-L1-экспрессирующих клеток в опухоли, что может привести к инфильтрации Т-клеток в опухоль. Увеличение соотношение лимфоидных к миелоидным клеткам дополнительно свидетельствует о том, что афукозилированное антитело к FGFR2 может иметь сильную противоопухолевую активность в качестве отдельно взятого агента, а также при использовании в комбинации с ингибитором PD-1 путем изменения микроокружения опухоли.
[00213] Соответственно, в данный документ также включен способ увеличения количества NK-клеток, PD-L1-положительных клеток, макрофагов, CD3+, CD8+ и/или CD4+ T-клеток и/или соотношения лимфоидных клеток к миелоидным клеткам в опухолевой ткани, включающий введение указанному субъекту эффективного количества ингибитора FGFR2, такого как антитело к FGFR2, такого как антитело к FGFR2 с повышенной АЗКЦ активностью. В некоторых вариантах осуществления, в которых вводят антитело к FGFR2, антитело является афукозилированным, например, афукозилированным в положении N297. В некоторых вариантах осуществления увеличение может наблюдаться после периода, составляющего по меньшей мере 1 сутки, 4 сутки, 1 недели, 10 суток или 2 недель, и может быть, например, увеличение на по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90% или по меньшей мере 95% по сравнению с контролем, таким как опухолевая ткань перед лечением или неопухолевая ткань. Ингибитор FGFR2 можно вводить, например, при режимах дозирования, описанных в данном документе в другом месте.
[00214] Кроме того, в данный документ включен способ увеличения количества NK-клеток, PD-L1-положительных клеток, макрофагов, CD3+, CD8+ и/или CD4+ T-клеток и/или соотношения лимфоидных клеток к миелоидным клеткам в опухолевой ткани субъекта, включающий введение указанному субъекту эффективного количества антитела с АЗКЦ активностью, например, с повышенной АЗКЦ активностью. В некоторых вариантах осуществления антитело обладает повышенной АЗКЦ активностью из-за афукозилирования в положении N297. В некоторых вариантах осуществления увеличение может наблюдаться после периода, составляющего по меньшей мере 1 сутки, 4 сутки, 1 недели, 10 суток или 2 недель, и может быть, например, увеличение на по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90% или по меньшей мере 95% по сравнению с контролем, таким как опухолевая ткань перед лечением или неопухолевая ткань. В общем, такое антитело можно вводить в количестве от около 10 мкг/кг массы тела до около 100 мг/кг массы тела на дозу. В некоторых вариантах осуществления антитело можно вводить в количестве от около 50 мкг/кг массы тела до около 5 мг/кг массы тела на дозу. В некоторых вариантах осуществления антитело можно вводить в количестве от около 100 мкг/кг массы тела до около 10 мг/кг массы тела на дозу. В некоторых вариантах осуществления антитело можно вводить в количестве от около 100 мкг/кг массы тела до около 20 мг/кг массы тела на дозу. В некоторых вариантах осуществления антитело можно вводить в количестве от около 0,5 мкг/кг массы тела до около 20 мг/кг массы тела на дозу. В некоторых вариантах осуществления антитело можно вводить в дозе от 0,1 до 10 мг/кг, например, в дозе по меньшей мере 0,1, 0,3, 0,5, 1, 2, 3, 4, 5 или 10 мг/кг, или в диапазоне доз, ограниченном любыми двумя из предыдущих чисел.
[00215] Данная заявка также включает способы определения количества NK-клеток, PD-L1-положительных клеток, макрофагов, CD3+, CD8+ и/или CD4+ T-клеток и/или соотношения лимфоидных клеток к миелоидным клеткам в опухолевой ткани субъекта до и/или после введения антитела с АЗКЦ активностью или повышенной АЗКЦ активностью, например, для определения того, оказывает ли антитело такое действие на по меньшей мере одну опухоль субъекта. Данная заявка также включает способы определения количества NK-клеток, PD-L1-положительных клеток, CD3+, CD8+ и/или CD4+ T-клеток и/или определения соотношения лимфоидных клеток к миелоидным клеткам в опухолевой ткани субъекта перед и/или после введения ингибитора FGFR2, или отдельно, или как части комбинации с ингибитором PD-1/PD-L1. Также в данный документ включены способы определения количества NK-клеток, PD-L1-положительных клеток, CD3+, CD8+ и/или CD4+ T-клеток и/или определения соотношения лимфоидных клеток к миелоидным клеткам в опухолевой ткани субъекта, получающего комбинацию ингибитора FGFR2 и ингибитора PD-1/PD-L1.
[00216] Определение количества NK-клеток, PD-L1-положительных клеток, макрофагов, CD3+, CD8+ и/или CD4+ T-клеток и/или определения соотношения лимфоидных клеток к миелоидным клеткам может быть осуществлено, например, путем биопсии ткани или другого способа получения образца из опухоли для таких исследований. Такая биопсия или другой образец обычно могут быть взяты, например, через 1, 2, 3, 4, 7, 17, 30, 45 или 90 суток после первого введения антитела с АЗКЦ активностью или ингибитора FGFR2. Количество NK-клеток, PD-L1-положительных клеток, макрофагов, CD3+, CD8+ и/или CD4+ T-клеток и/или соотношение лимфоидных клеток к миелоидным клеткам может быть определено, например, относительно контроля, такого как образец опухоли перед лечением или образец из неопухолевой ткани. В некоторых вариантах осуществления число может быть выражено как процент от конкретного типа клеток, такого как CD45+ отдельные клетки. В некоторых вариантах осуществления количество конкретных типов клеток может быть определено с помощью проточной цитометрии.
[00217] В некоторых вариантах осуществления, если увеличение в NK-клетках, PD-L1-положительных клетках, макрофагах, CD3+, CD8+ и/или CD4+ T-клетках и/или в соотношении лимфоидных клеток к миелоидным клеткам наблюдается в таком тесте по отношению к контролю, субъекту можно дополнительно вводить ингибитор PD-1/PD-L1. В некоторых вариантах осуществления, если увеличение не наблюдается или если значительного увеличения не наблюдается, доза ингибитора FGFR2 или антитела с АЗКЦ активностью может быть увеличена.
[00218] В некоторых вариантах осуществления такая оценка увеличения в NK-клетках, PD-L1-положительных клетках, макрофагах, CD3+, CD8+ и/или CD4+ T-клетках и/или в соотношении лимфоидных клеток к миелоидным клеткам может быть использована для определения того, следует ли назначать комбинированную терапию с ингибитором PD-1/PD-L1 или продолжать лечение без добавления ингибитора PD-1/PD-L1. Например, после введения ингибитора FGFR2 образец опухоли от субъекта может быть оценен на количество NK-клеток, PD-L1-положительных клеток, макрофагов, CD3+, CD8+ и/или CD4+ T-клеток и/или соотношение лимфоидных к миелоидным клеткам по сравнению с контролем, и, если в образце наблюдается увеличение одного или обоих этих типов клеток, ингибитор PD-1/PD-L1 можно вводить вместе с ингибитором FGFR2 в соответствии с любым из вариантов осуществления изобретения, описанных в данном документе
Пути введения, носители и дополнительные фармацевтические композиции
[00219] В различных вариантах осуществления антитела могут вводиться in vivo различными путями, включая, но не ограничиваясь ими, пероральный, внутриартериальный, парентеральный, интраназальный, внутривенный, внутримышечный, интракардиальный, интравентрикулярный, интратрахеальный, трансбуккальный, ректальный, внутрибрюшинный, внутрикожный, путем местного применения, трансдермальный и интратекальный, или иначе путем имплантации или ингаляции. Предложенные композиции могут быть составлены в виде препаратов в твердых, полутвердых, жидких или газообразных формах; включая, но не ограничиваясь ими, таблетки, капсулы, порошки, гранулы, мази, растворы, суппозитории, клизмы, инъекции, средства для ингаляции и аэрозоли. Молекулу нуклеиновой кислоты, кодирующую антитело, можно наносить на микрочастицы золота и доставлять внутрикожно при помощи устройства для бомбардировки частицами или «генной пушки», как описано в литературе (см., например, Tang et al., Nature 356: 152-154 (1992)). Соответствующая лекарственная форма и способ введения могут быть выбраны в соответствии с предполагаемым применением.
[00220] В различных вариантах осуществления композиции, содержащие антитела, представлены в лекарственных формах с широким спектром фармацевтически приемлемых носителей (см., например, Gennaro, Remington: The Science and Practice of Pharmacy with Facts and Comparisons: Drugfacts Plus, 20th ed. (2003); Ansel et al., Pharmaceutical Dosage Forms and Drug Delivery Systems, 7th ed., Lippencott Williams and Wilkins (2004); Kibbe et al., Handbook of Pharmaceutical Excipients, 3rd ed., Pharmaceutical Press (2000)). Доступны различные фармацевтически приемлемые носители, которые включают носители, адъюванты и разбавители. Кроме того, доступны различные фармацевтически приемлемые вспомогательные вещества, такие как средства для регулирования уровня рН и буферные агенты, агенты, регулирующие тоничность, стабилизаторы, смачивающие агенты и тому подобное. Неограничивающие иллюстративные носители включают солевой раствор, забуференный солевой раствор, декстрозу, воду, глицерин, этанол и их комбинации.
[00221] В различных вариантах осуществления композиции, содержащие антитела, могут быть составлены для инъекций, включая подкожное введение, путем растворения, суспендирования или эмульгирования их в водном или неводном растворителе, таком как растительные или другие масла, глицериды синтетических алифатических кислот, сложные эфиры высших алифатических кислот, или пропиленгликоль; и, при желании, с обычными добавками, такими как солюбилизаторы, изотонические агенты, суспендирующие агенты, эмульгаторы, стабилизаторы и консерванты. В различных вариантах осуществления композиции могут быть составлены для ингаляции, например, с использованием для пропеллентов под давлением, таких как дихлордифторметан, пропан, азот и тому подобное. Композиции также могут быть составлены в различных вариантах осуществления в микрокапсулы с замедленным высвобождением, такие как биоразлагаемые или бионеразлагаемые полимеры. Неограничивающий иллюстративный биоразлагаемый состав включает сополимер молочной и гликолевой кислот. Неограничивающая иллюстративная бионеразлагаемый состав включает сложный эфир полиглицерина и жирных кислот. Некоторые способы получения таких композиций описаны, например, в ЕР 1 125 584 А1.
[00222] Также предложены фармацевтические упаковки и наборы, содержащие один или более контейнеров, каждый из которых содержит одну или более доз антитела или комбинации антител. В некоторых вариантах осуществления предложена единичная лекарственная форма, в которой единичная лекарственная форма содержит предопределенное количество композиции, содержащей антитело или комбинацию антител, с одним или более дополнительными агентами или без них. В некоторых вариантах осуществления такая единичная лекарственная форма поставляется в одноразовом предварительно заполненном шприце для инъекций. В различных вариантах осуществления композиция, содержащаяся в единичная лекарственная форма, может содержать солевой раствор, сахарозу или тому подобное; буфер, такой как фосфат, или тому подобное; и/или приготовлена в пределах стабильного и эффективного диапазона рН. Альтернативно, в некоторых вариантах осуществления композиция может быть предложена в виде лиофилизированного порошка, который может быть восстановлен после добавления соответствующей жидкости, например, стерильной воды. В некоторых вариантах осуществления композиция содержит одно или более веществ, которые ингибируют агрегацию белка, включая, но не ограничиваясь ими, сахарозу и аргинин. В некоторых вариантах осуществления композиция согласно изобретению содержит гепарин и/или протеогликан.
[00223] Фармацевтические композиции вводят в количестве, эффективном для лечения или профилактики конкретного показания. Терапевтически эффективное количество, как правило, зависит от массы пациента, его физического состояния или состояния здоровья, степени тяжести патологического состояния, подлежащего лечению, или возраста пациента, которого лечат. В общем, антитела можно вводить в количестве от около 10 мкг/кг массы тела до 100 мг/кг массы тела на дозу. В некоторых вариантах осуществления антитела можно вводить в количестве от около 50 мкг/кг массы тела до около 5 мг/кг массы тела на дозу. В некоторых вариантах осуществления антитела можно вводить в количестве от около 100 мкг/кг массы тела до около 10 мг/кг массы тела на дозу. В некоторых вариантах осуществления антитела можно вводить в количестве от около 100 мкг/кг массы тела до около 20 мг/кг массы тела на дозу. В некоторых вариантах осуществления антитела можно вводить в количестве от около 0,5 мкг/кг массы тела до около 20 мг/кг массы тела на дозу.
[00224] В некоторых вариантах осуществления ингибитор PD-1/PD-L1, такой как антитело или слитая молекула, или полипептид, вводят в дозе от 0,1 до 100 мг/кг, например, в дозе 0,1, 0,3, 0,5, 1, 2, 3, 4, 5, 10, 15, 20, 25 или 30 мг/кг или в диапазоне доз, ограниченном любыми двумя из предыдущих чисел. В некоторых вариантах осуществления ингибитор FGFR2, такой как антитело или слитая молекула, или полипептид ВКД, вводят в дозе 0,1, 0,3, 0,5, 1, 2, 3, 4, 5 или 10 мг/кг, например, в диапазоне доз, ограниченном любыми двумя из предыдущих чисел.
[00225] Композиции антител можно вводить по мере необходимости субъектам. Определение частоты введения может производиться специалистами в данной области техники, такими как лечащий врач, на основании данных о патологическом состоянии, подлежащем лечению, возрасте подлежащего лечению субъекта, степени тяжести патологического состояния, подлежащего лечению, общем состоянии здоровья субъекта, подлежащего лечению, и тому подобного. В некоторых вариантах осуществления эффективная доза антитела вводится субъекту один или более раз. В различных вариантах осуществления эффективную дозу антитела вводят субъекту один раз в месяц, менее одного раза в месяц, например, каждые два месяца или каждые три месяца. В других вариантах осуществления эффективную дозу антитела вводят более одного раза в месяц, например, каждые три недели, каждые две недели или каждую неделю. В некоторых вариантах осуществления эффективную дозу антитела вводят один раз в 1, 2, 3, 4 или 5 недель. В некоторых вариантах осуществления эффективную дозу антитела вводят два или три раза в неделю. Эффективную дозу антитела вводят субъекту по меньшей мере один раз. В некоторых вариантах осуществления эффективная доза антитела может вводиться несколько раз, в том числе в течение по меньшей мере месяца, по меньшей мере шесть месяцев или по меньшей мере одного года.
[00226] Также предложены композиции, содержащие ингибитор FGFR2, как описано в данном документе, и ингибитор PD-1/PD-L1, как описано в данном документе. В некоторых вариантах осуществления ингибитор FGFR2 и ингибитор PD-1/PD-L1 содержатся, например, в отдельных контейнерах или в отдельных отделениях одного контейнера, так что они не смешиваются. В некоторых вариантах осуществления ингибитор FGFR2 и ингибитор PD-1/PD-L1 могут присутствовать в одном и том же контейнере или отделении и, таким образом, смешиваются друг с другом. В некоторых вариантах осуществления композиции содержат инструкции по применению, такие как инструкции по применению в лечении рака.
Комбинации с другими иммуностимулирующими агентами
[00227] В некоторых вариантах осуществления ингибитор FGFR2 комбинируют по меньшей мере с одним иммуностимулирующим агентом, отличным от ингибитора PD-1/PD-L1. Альтернативно, в некоторых вариантах осуществления комбинация ингибитора FGFR2 и ингибитора PD-1/PD-L1 может быть дополнительно объединена с эффективным количеством по меньшей мере одного дополнительного иммуностимулирующего агента.
[00228] Иммуностимулирующие агенты могут включать, например, низкомолекулярное лекарственное средство или высокомолекулярное лекарственное средство. Примеры биологических иммуностимулирующих агентов включают, но не ограничиваются ими, антитела, фрагменты антител, фрагменты полипептида рецептора или лиганда, например, которые блокируют связывание рецептор-лиганд, вакцины и цитокины.
[00229] В некоторых вариантах осуществления по меньшей мере один иммуностимулирующий агент включает агонист иммуностимулирующей молекулы, включая костимулирующую молекулу, тогда как в некоторых вариантах осуществления по меньшей мере один иммуностимулирующий агент включает антагониста иммуноингибирующей молекулы, включая коингибирующую молекулу. В некоторых вариантах осуществления по меньшей мере один иммуностимулирующий агент включает агонист иммуностимулирующей молекулы, включая костимулирующую молекулу, обнаруженную на иммунных клетках, таких как Т-клетки. В некоторых вариантах осуществления по меньшей мере один иммуностимулирующий агент включает антагонист иммуноингибирующей молекулы, включая коингибирующую молекулу, обнаруженную на иммунных клетках, таких как Т-клетки. В некоторых вариантах осуществления по меньшей мере один иммуностимулирующий агент включает агонист иммуностимулирующей молекулы, включая костимулирующую молекулу, обнаруженную на клетках, вовлеченных во врожденный иммунитет, таких как NK-клетки. В некоторых вариантах осуществления по меньшей мере один иммуностимулирующий агент включает антагонист иммуноингибирующей молекулы, включая коингибирующую молекулу, обнаруженную на клетках, вовлеченных во врожденный иммунитет, таких как NK-клетки. В некоторых вариантах осуществления комбинация усиливает антигенспецифический ответ Т-клеток у субъекта, получающего лечение, и/или усиливает ответ врожденного иммунитета у субъекта.
[00230] В некоторых вариантах осуществления комбинация ингибитора FGFR2 и по меньшей мере одного иммуностимулирующего агента приводит к улучшенному опухолевому ответу в модели рака животного, такой как мышиная ксенотрансплантатная модель опухоли и/или сингенная опухолевая модель, по сравнению с введением только ингибитора FGFR2. В некоторых вариантах осуществления комбинация ингибитора FGFR2 с по меньшей мере одним иммуностимулирующим агентом приводит к аддитивному или синергическому ответу в модели рака животного, такой как мышиная ксенотрансплантатная модель опухоли и/или сингенная опухолевая модель, по сравнению с введением только одного лекарственного средства.
[00231] В вариантах осуществления, включающих комбинацию ингибитора FGFR2, ингибитора PD-1/PD-L1 и по меньшей мере одного дополнительного иммуностимулирующего агента, комбинация приводит к улучшенному противоопухолевому ответу в модели рака животного, такой как мышиная ксенотрансплантатная модель опухоли и/или сингенная опухолевая модель, по сравнению с введением только ингибитора FGFR2. В некоторых вариантах осуществления комбинация ингибитора FGFR2 c дополнительными терапевтическими средствами приводит к аддитивному или синергическому ответу в модели рака животного, такой как мышиная ксенотрансплантатная модель опухоли и/или сингенная опухолевая модель, по сравнению с применением только отдельных терапевтических средств.
[00232] В некоторых вариантах осуществления иммуностимулирующий агент нацелен на стимулирующую или ингибирующую молекулу, которая является членом суперсемейства иммуноглобулинов (IgSF). Например, иммуностимулирующим агентом может быть агент, который нацелен (или специфически связывается) с другим членом семейства полипептидов B7. Иммуномодулирующим агентом может быть агент, который нацеливается на член TNF-семейства мембраносвязанных лигандов, или костимулирующий или коингибирующий рецептор, связывающийся специфически с членом TNF-семейства (TNF-фактор некроза опухоли). Типичные члены семейства TNF и TNFR (TNFR -рецептор фактора некроза опухоли), которые могут быть нацелены на иммуностимулирующие агенты, включают CD40 и CD40L, OX-40, OX-40L, GITR, GITRL, CD70, CD27L, CD30, CD30L, 4-1BBL, CD137 (4-1BB), TRAIL/Apo2-L, TRAILR1/DR4, TRAILR2/DR5, TRAILR3, TRAILR4, OPG, RANK, RANKL, TWEAKR/Fn14, TWEAK, BAFFR, EDAR, XEDAR, TACI, APRIL, BCMA, LTβR, LIGHT, DcR3, HVEM, VEGI/TL1A, TRAMP/DR3, EDAR, EDA1, XEDAR, EDA2, TNFR1, лимфотоксин α/ФНОβ, TNFR2, ФНОα, LTβR, лимфотоксин α 1β2, FAS, FASL, RELT, DR6, TROY и NGFR.
[00233] В некоторых вариантах осуществления иммуностимулирующий агент может включать (i) антагонист белка, который ингибирует активацию Т-клеток (например, ингибитор иммунной контрольной точки), такого как CTLA4, LAG-3, TIM3, галектин-9, CEACAM-1, BTLA, CD69, галектин-1, TIGIT, CD113, GPR56, VISTA, B7-H3, B7-H4, 2B4, CD48, GARP, PD1H, LAIR1, TIM-1, TIM-4 и ILT4 и/или может включать (ii) агониста белка, который стимулирует активацию Т-клеток, такого как B7-2, CD28, 4-1BB (CD137), 4-1BBL, ICOS, ICOS-L, OX40, OX40L, GITR, GITRL, CD70, CD27, CD40, CD40L, DR3 и CD28H.
[00234] В некоторых вариантах осуществления иммуностимулирующий агент может включать агент, который ингибирует или является антагонистом цитокина, который ингибирует активацию Т-клеток (например, ИЛ-6, ИЛ-10, ТФР-β (трансформирующий фактор роста), ФРЭС (фактор роста эндотелия сосудов) и другие иммуносупрессивные цитокины) и в некоторых вариантах осуществления иммуностимулирующий агент может включать агента, который является агонистом цитокина, таким как ИЛ-2, ИЛ-7, ИЛ-12, ИЛ-15, ИЛ-21 и ИФНα (например, сам цитокин), который стимулирует активацию Т-клеток. В некоторых вариантах осуществления иммуностимулирующие агенты могут включать антагонист хемокина, такого как CXCR2 (например, MK-7123), CXCR4 (например, AMD3100), CCR2 или CCR4 (могамулизумаб).
[00235] В некоторых вариантах осуществления иммуностимулирующие агенты могут включать антагонисты ингибирующих рецепторов на NK-клетках или агонистов активирующих рецепторов на NK-клетках. В некоторых вариантах осуществления по меньшей мере один иммуностимулирующий агент представляет собой антагониста KIR.
[00236] Иммуностимулирующие агенты могут также включать агенты, которые ингибируют сигналинг TGF-β, агенты, которые улучшают представление опухолевого антигена, например, дендритно-клеточных вакцины, вакцины на основе клеток, секретирующих ГМ-КСФ, CpG-олигонуклеотиды, и имиквимод, или терапевтические средства, которые усиливают иммуногенность опухолевых клеток (например, антрациклины).
[00237] Иммуностимулирующие агенты могут также включать определенные вакцины, такие как вакцины, нацеленные на мезотелин, или противораковые вакцины на основе ослабленных Listeria, такие как CRS-207.
[00238] Иммуностимулирующие агенты могут также включать агенты, которые истощают или блокируют регуляторные Т-клетки, таких как агенты, которые специфически связываются с CD25.
[00239] Иммуностимулирующие агенты могут также включать агенты, которые ингибируют метаболический фермент, такие как индоламин-диоксигеназа (IDO), диоксигеназа, аргиназа или синтетаза оксида азота.
[00240] Иммуностимулирующие агенты могут также включать агенты, которые ингибируют образование аденозина или ингибируют рецептор А2А аденозина.
[00241] Иммуностимулирующие агенты могут также включать агенты, которые изменяют/предотвращают анергию или истощение Т-клеток, которые вызывают активацию врожденного иммунитета и/или воспаление в месте опухоли.
[00242] В некоторых вариантах осуществления иммуностимулирующие агенты могут включать агонист CD40, такой как антитело к агонисту CD40. Комбинация ингибитора FGFR2 и ингибитора PD-1/PD-L1 также может дополнительно комбинироваться в комбинаторном подходе, который нацелен на множество элементов иммунного пути, таких как один или более из следующего: по меньшей мере один агент, который усиливает представление опухолевого антигена (например, дендритно-клеточная вакцина, вакцины на основе клеток, секретирующих ГМ-КСФ, CpG-олигонуклеотиды, имиквимод); по меньшей мере один агент, который ингибирует отрицательную иммунную регуляцию, например, путем ингибирования пути CTLA4 и/или истощения, или блокирования регуляторных Т-клеток или других иммуносупрессивных клеток; терапию, которая стимулирует положительную иммунную регуляцию, например, с агонистами, которые стимулируют путь CD-137, OX-40 и/или GITR, и/или стимулируют эффекторную функцию Т-клеток; по меньшей мере один агент, который системно увеличивает количество противоопухолевых Т-клеток; терапию, которая истощает или ингибирует регуляторные Т-клетки, такие как регуляторные Т-клетки в опухоли, например, с использованием антагониста CD25 (например, даклизумаба) или путем истощения ex vivo связанных с микрогранулами анти-CD25 антител; по меньшей мере, один агент, который воздействует на функцию супрессорных миелоидных клеток в опухоли; терапию, которая усиливает иммуногенность опухолевых клеток (например, антрациклинов); адаптивный перенос Т-лимфоцитов или NK-клеток, включая генетически модифицированные клетки, например, клетки, модифицированные химерными антигенными рецепторами (терапия CAR-T); по меньшей мере, один агент, который ингибирует метаболический фермент, такой как индоламиндиоксигеназа (IDO), диоксигеназа, аргиназа или синтетаза оксида азота; по меньшей мере один агент, который изменяет/предотвращает анергию или истощение Т-клеток; терапию, которая вызывает активацию врожденного иммунитета и/или воспаление в месте опухоли; введение иммуностимулирующих цитокинов или блокирование иммунорепрессивных цитокинов.
[00243] Например, по меньшей мере один иммуностимулирующий агент может включать один или более агонистический агент, который лигируют положительные костимулирующие рецепторы; один или более антагонист (блокирующий агент), который ослабляют сигналинг через ингибирующие рецепторы, такие как антагонисты, которые преодолевают различные иммуносупрессивные пути в микроокружении опухоли; один или более агентов, которые систематически увеличивают частоту встречаемости противоопухолевых иммунных клеток, таких как Т-клетки, истощают или ингибируют регуляторные Т-клетки (например, путем ингибирования CD25); один или более агентов, которые ингибируют метаболические ферменты, такие как IDO; один или более агентов, которые изменяют/предотвращают анергию или истощение Т-клеток; и один или более агентов, которые вызывают активацию врожденного иммунитета и/или воспаление в месте опухоли.
[00244] В одном варианте осуществления по меньшей мере один иммуностимулирующий агент включает антагонист CTLA4, такой как антагонистическое антитело к CTLA4. Подходящие антитела CTLA4 включают, например, YERVOY (ипилимумаб) или тремелимумаб.
[00245] В некоторых вариантах осуществления по меньшей мере один иммуностимулирующий агент включает антагонист LAG-3, такой как антагонистическое антитело к LAG-3. Подходящие антитела к LAG-3 включают, например, BMS-986016 (WO10/19570, WO14/08218) или IMP-731, или IMP-321 (WO08/132601, WO09/44273).
[00246] В некоторых вариантах осуществления по меньшей мере один иммуностимулирующий агент включает агонист CD137 (4-1BB), такого как агонистическое антитело к CD137. Подходящие антитела к CD137 включают, например, урелюмаб или PF-05082566 (WO12/32433).
[00247] В некоторых вариантах осуществления по меньшей мере один иммуностимулирующий агент включает агонист GITR, такого как агонистическое антитело к GITR. Подходящие антитела к GITR включают, например, TRX-518 (WO06/105021, WO09/009116), MK-4166 (WO11/028683) или антитело к GITR, раскрытое в WO 2015/031667.
[00248] В некоторых вариантах осуществления по меньшей мере один иммуностимулирующий агент включает агонист OX40, такого как агонистическое антитело к OX40. Подходящие антитела к OX40 включают, например, MEDI-6383, MEDI-6469 или MOXR0916 (RG7888, WO06/029879).
[00249] В некоторых вариантах осуществления по меньшей мере один иммуностимулирующий агент включает агониста CD27, такого как агонистическое антитело к CD27. Подходящие CD27-антитела включают, например, варлилумаб (CDX-1127).
[00250] В некоторых вариантах осуществления по меньшей мере один иммуностимулирующий агент содержит MGA271, который нацелен на B7H3 (WO11/109400).
[00251] В некоторых вариантах осуществления по меньшей мере один иммуностимулирующий агент включает антагонист KIR, такой как лирилумаб.
[00252] В некоторых вариантах осуществления по меньшей мере один иммуностимулирующий агент включает антагонист IDO. Антагонисты IDO включают, например, INCB-024360 (WO2006/122150, WO07/75598, WO08/36653, WO08/36642), индоксимод, NLG-919 (WO09/73620, WO09/1156652, WO11/56652, WO12/142237) или F001287.
[00253] В некоторых вариантах осуществления по меньшей мере один иммуностимулирующий агент включает агонист Toll-подобных рецепторов, например, агонист TLR2/4 (например, Bacillus Calmette-Guerin); агонист TLR7 (например, хилтонол или имиквимод); агонист TLR7/8 (например, резиквимод); или агонист TLR9 (например, CpG7909).
[00254] В некоторых вариантах осуществления по меньшей мере один иммуностимулирующий агент включает ингибитор ТФР-β, например, GC1008, LY2157299, TEW7197 или IMC-TR1.
Дополнительная комбинированная терапия
[00255] Ингибиторы можно вводить отдельно или с другими способами лечения. Они могут быть предоставлены до, по существу одновременно или после других способов лечения, например, оперативного вмешательства, химиотерапии, лучевой терапии или введения биологического средства, такого как другое терапевтическое антитело. В некоторых вариантах осуществления рак рецидивирует или прогрессирует после терапии, выбранной из оперативного вмешательства, химиотерапии и лучевой терапии, или их комбинации.
[00256] Для лечения рака ингибиторы могут вводиться в комбинации с одним или более дополнительными противораковыми агентами, такими как химиотерапевтический агент, ингибитор роста, агент против ангиогенеза и/или противоопухолевая композиция. Неограничивающие примеры химиотерапевтического агента, ингибитор роста, агента против ангиогенеза, противоопухолевого агента и противоопухолевой композиции, которые могут быть использованы в комбинации с антителами согласно данному изобретению, представлены в следующих определениях.
[00257] «Химиотерапевтический агент» представляет собой химическое соединение, применяемое в лечении рака. Примеры химиотерапевтических агентов включают, но не ограничиваются ими, алкилирующие агенты, такие как тиотепа или циклофосфамид ЦИТОКСАН®; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая альтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметиломеламин; ацетогенины (особенно буллатацин и буллатацинон); камптотецин (включая синтетический аналог топотекан); бриостатин; каллистатин; CC-1065 (включая его синтетические аналоги адозелезин, карзелезин и бизелезин); криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги KW-2189 и CB1-TM1); элеутеробин; панкратистатин; саркодиктин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, хлорофосфамид, эстрамустин, ифосфамид мехлорэтамин, мехлорэтамин оксид гидрохлорид, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урациловый иприт; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, особенно калихеамицин гамма 1I и калихеамицин омега I1 (см., например, Agnew, Chem Intl. Ed. Engl., 33: 183-186 (1994)); динемицин, включая динемицин А; бисфосфонаты, такие как клодронат; эсперамицин; а также хнеокарциностатиновый хромофор и родственные хромопротеиновые ендииновые антибиотические хромофоры), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карбабицин, карминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин Adriamycin® (включая морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролино-доксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин C, микофенольная кислота, ногаламицин, оливомицины, пепломицин, порфиромицин, пуромицин, келамицин, родорубицин, стрептогрин, стрептозоцин, туберцидин, убенимекс, циностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-ФУ); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; пуриновые аналоги, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; пиримидиновые аналоги, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флуксуридин; андрогены, такие как калустерон, дромоностанола пропионат, эпитиотонол, мепитиостан, тестолактон; антиадреналы, такие как аминоглютетимид, митотан, трилостан; заменитель фолиевой кислоты, такой как фолиновая кислота; ацеглатон; альдофосфамидгликозид; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бизантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элфорнитин; эллиптиний ацетат; эпотилон; этоглюцид; нитрат галлия; гидроксимочевина; лентинан; лонидаинин; майтанзиноиды, такие как майтанзин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; подофиллиновая кислота; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Юджин, Орегон); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2',2'-трихлортриэтиламин, трихотецены (особенно токсин Т-2, верракурин А, роридин А и ангидин), уретан, виндезин, дакарбазин, манномустин, митобронитол, митолактол, пипроброман, гацитозин, арабинозид («Ара-С»); циклофосфамид; тиотепа; таксаны, например, паклитаксел Taxol® (Bristol-Myers Squibb Oncology, Принстон, Нью-Джерси), Abraxane® Cremophor-free, композиции наночастиц, покрытые альбумином с паклитакселом (American Pharmaceutical Partners, Шаумберг, Иллинойс) и доксетаксел Taxotere® (Rhône-Poulenc Rorer, Антони, Франция); хлорамбуцил; гемцитабин Gemzar®; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин, оксалиплатин и карбоплатин; винбластин; платины; этопозид (VP-16); ифосфамид; митоксантрон; винкристин; винерелбин Navelbine®; новантрон; тенипозид; эдатрексат; дауномицин; аминоптерин; кселода; ибандронат; иринотекан (Camptosar, CPT-11) (включая схему лечения иринотеканом, 5-ФУ и лейковорином); ингибитор топоизомеразы RFS 2000; дифторметалгилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; капецитабин; комбретастатин; лейковорин (LV); оксалиплатин, включая схему лечения оксалиплатином (FOLFOX); ингибиторы PKC-альфа, Raf, H-Ras, EGFR (рецептор эпидермального фактора роста) (например, эрлотиниб (Tarceva®)) и ФРЭС-A, которые уменьшают пролиферацию клеток, и фармацевтически приемлемые соли, кислоты или производные любого из вышеуказанных.
[00258] Другие неограничивающие иллюстративные химиотерапевтические агенты включают антигормональные агенты, которые действуют для регулирования или ингибирования гормонального действия при онкологических заболеваниях, такие как антиэстрогены и селективные модуляторы рецепторов эстрогенов (SERM), включая, например, тамоксифен (включая тамоксифен Nolvadex®), ралоксифен, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен Fareston®; ингибиторы ароматазы, которые ингибируют фермент ароматазу, которая регулирует продуцирование эстрогенов в надпочечниках, такие как, например, 4 (5)-имидазолы, аминоглютетимид, мегестрол ацетат Megase®, экземестан Aromasin®, форместанин, фадрозол, ворозол Rivior®, летрозол Femara® и анастрозол Arimidex®; и антиандрогены, такие как флутамид, нилутамид, бикалутамид, лейпролид и госерелин; а также трокацитабин (аналог 1,3-диоксолан-нуклеозид-цитозина); антисмысловые олигонуклеотиды, особенно те, которые ингибируют экспрессию генов в сигнальных путях, вовлеченных в аберрантную пролиферацию клеток, такие как, например, PKC-альфа, Ralf и H-Ras; рибозимы, такие как ингибитор экспрессии ФРЭС (например, рибозим Angiozyme®) и ингибитор экспрессии HER2; вакцины, такие как геннотерапевтическая вакцина, например, вакцина Allovectin®, вакцина Leuvectin® и вакцина Vaxid®; Proleukin® rIL-2; ингибитор топоизомеразы 1 Lustotecan®; rmRH Abarelix®; и фармацевтически приемлемые соли, кислоты или производные любого из вышеуказанных.
[00259] «Антиангиогенный агент» или «ингибитор ангиогенеза» относится к веществу с малой молекулярной массой, полинуклеотиду (включая, например, ингибирующую РНК (РНКи или миРНК)), полипептиду, выделенному белку, рекомбинантному белку, антителу, или конъюгатам или их слитым белкам, которые ингибируют ангиогенез, васкулогенез или нежелательную сосудистую проницаемость, прямо или косвенно. Следует понимать, что антиангиогенный агент включает такие агенты, которые связывают и блокируют ангиогенную активность ангиогенного фактора или его рецептора. Например, антиангиогенный агент представляет собой антитело или другой антагонист к ангиогенному агенту, например, антитело к ФРЭС-A (например, бевацизумаб (Avastin®)) или к рецептору ФРЭС-A (например, рецептор KDR или рецептор Flt- 1), анти-PDGFR ингибиторы, такие как Gleevec® (иматиниб мезилат), небольшие молекулы, которые блокируют сигналинг рецептора ФРЭС (например, PTK787/ZK2284, SU6668, Sutent®/SU11248 (сунитиниб малат), AMG706 или те, которые описаны, например, в международной патентной заявке WO 2004/113304). Антиангиогенные агенты также включают нативные ингибиторы ангиогенеза, например, ангиостатин, эндостатин и т.д. См., например, Klagsbrun and D'Amore (1991) Annu. Rev. Physiol. 53:217-39; Streit and Detmar (2003) Oncogene 22:3172-3179 (например, в таблице 3 перечислены антиангиогенная терапия при злокачественной меланоме); Ferrara & Alitalo (1999) Nature Medicine 5(12):1359-1364; Tonini et al. (2003) Oncogene 22:6549-6556 (например, в таблице 2 перечислены известные антиангиогенные факторы); и Sato (2003) Int. J. Clin. Oncol. 8:200-206 (например, в таблице 1 перечислены антиангиогенные агенты, используемые в клинических испытаниях).
[00260] Термин "агент, ингибирующий рост", используемый в данном документе, относится к соединению или композиции, которая ингибирует рост клетки (такой как клетка, экспрессирующая ФРЭС) или in vitro, или in vivo. Таким образом, агент, ингибирующий рост, может быть таким, который значительно снижает процент клеток (таких как клетки, экспрессирующие ФРЭС) в S-фазе. Примеры агентов, ингибирующих рост, включают, но не ограничиваются ими, агенты, которые блокируют прохождение по клеточному циклу (в месте, отличном от S-фазы), такие как агенты, которые индуцируют блокировку G1 и блокировку М-фазы. Классические блокаторы М-фазы включают алкалоиды барвинка (винкристин и винбластин), таксаны и ингибиторы топоизомеразы II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Агенты, блокирующие G1, также приводят к остановке S-фазы, например, ДНК-алкилирующие агенты, например, тамоксифен, преднизолон, дакарбазин, мехлорэтамин, цисплатин, метотрексат, 5-фторурацил и ara-C. Дополнительную информацию можно найти в главе 1 под названием ʺCell cycle regulation, oncogenes, and antineoplastic drugsʺ, из The Molecular Basis of Cancer, Mendelsohn and Israel, eds., написанной Murakami. (W.B. Saunders, Philadelphia, 1995), например, с. 13. Таксаны (паклитаксел и доцетаксел) представляют собой протиопухолевые препараты, получаемые из тисового дерева. Доцетаксел (TAXOTERE®, Rhone-Poulenc Rorer), полученный из европейского тиса, представляет собой полусинтетический аналог паклитаксела (TAXOL®, Bristol-Myers Squibb). Паклитаксел и доцетаксел стимулируют сборку микротрубочек из димеров тубулина и стабилизируют микротрубочки путем предотвращения деполимеризации, что в результате приводит к ингибированию митоза в клетках.
[00261] Термин «противоопухолевая композиция» относится к композиции, пригодной для лечения рака, содержащая по меньшей мере один активный терапевтический агент. Примеры терапевтических агентов включают, но не ограничиваются ими, например, химиотерапевтические агенты, агенты, ингибирующие рост, цитотоксические агенты, агенты, используемые в лучевой терапии, анти-ангиогенные агенты, другие иммунотерапевтические средства против рака, кроме ингибиторов PD-1/PD-L1, апоптические агенты, антитубулиновые агенты и другие агенты для лечения рака, такие как анти-HER-2 антитела, анти-CD20 антитела, антагонист рецептора эпидермального фактора роста (РЭФР) (например, ингибитор тирозинкиназы), ингибитор HER1/РЭФР (например, эрлотиниб (Tarceva®), ингибиторы фактора роста тромбоцитов (например, Gleevec® (иматиниб мезилат)), ингибитор COX-2 (например, целекоксиб), интерфероны, ингибиторы CTLA-4 (например, анти-CTLA антитело ипилимумаб (YERVOY®)), ингибиторы PD-L2 (например, анти-PD-L2 антитела), ингибиторы TIM3 (например, анти-TIM3 антитела), цитокины, антагонисты (например, нейтрализующие антитела), которые связываются с одной или более следующими целями: ErbB2, ErbB3, ErbB4, PDGFR-бета, BlyS, APRIL, BCMA, PD-L2, CTLA- 4, TIM3 или ФРЭС рецептор(ы), TRAIL/Apo2 и другие биологически активные и органические химические вещества и т.д. Их комбинации также включены в изобретение.
Конкретные варианты осуществления изобретения
[00262] Некоторые конкретные варианты осуществления данного изобретения включают следующее:
[00263] 1. Способ лечения рака у субъекта, включающий введение субъекту ингибитора рецептора 2 фактора роста фибробластов (FGFR2) и по меньшей мере одного иммуностимулирующего агента, такого как по меньшей мере один ингибитор белка программируемой клеточной гибели 1 (PD-1)/лиганд 1 белка программируемой клеточной гибели (PD-L1).
[00264] 2. Способ по варианту осуществления 1, отличающийся тем, что по меньшей мере один иммуностимулирующий агент представляет собой ингибитор PD-1/PD-L1 и при этом ингибитор PD-1/PD-L1 представляет собой антитело.
[00265] 3. Способ по варианту осуществления 2, отличающийся тем, что ингибитор PD-1/PD-L1 представляет собой анти-PD-1 антитело.
[00266] 4. Способ по варианту осуществления 3, отличающийся тем, что анти-PD-1 антитело содержит CDR тяжелой цепи и легкой цепи антитела, выбранного из ниволумаба, пидилизумаба и пембролизумаба.
[00267] 5. Способ по варианту осуществления 4, отличающийся тем, что анти-PD-1 антитело содержит вариабельные области тяжелой цепи и легкой цепи антитела, выбранного из ниволумаба, пидилизумаба и пембролизумаба.
[00268] 6. Способ по варианту осуществления 5, отличающийся тем, что анти-PD-1 антитело выбирают из ниволумаба, пидилизумаба и пембролизумаба.
[00269] 7. Способ по варианту осуществления 2, отличающийся тем, что ингибитор PD-1/PD-L1 представляет собой анти-PD-L1 антитело.
[00270] 8. Способ по варианту осуществления 7, отличающийся тем, что анти-PD-L1 антитело содержит CDR тяжелой цепи и легкой цепи антитела, выбранного из BMS-936559, MPDL3280A, MEDI4736 и MSB0010718C.
[00271] 9. Способ по варианту осуществления 8, отличающийся тем, что анти-PD-L1 антитело содержит вариабельные области тяжелой цепи и легкой цепи антитела, выбранного из BMS-936559, MPDL3280A, MEDI4736 и MSB0010718C.
[00272] 10. Способ по варианту осуществления 9, отличающийся тем, что анти-PD-L1 антитело выбирают из BMS-936559, MPDL3280A, MEDI4736 и MSB0010718C.
[00273] 11. Способ по варианту осуществления 1, отличающийся тем, что по меньшей мере один иммуностимулирующий агент представляет собой ингибитор PD-1/PD-L1 и при этом ингибитор PD-1/PD-L1 представляет собой слитую молекулу PD-1.
[00274] 12. Способ по варианту осуществления 11, отличающийся тем, что слитая молекула представляет собой AMP-224.
[00275] 13. Способ по варианту осуществления 1, отличающийся тем, что по меньшей мере один иммуностимулирующий агент представляет собой ингибитор PD-1/PD-L1 и при этом ингибитор PD-1/PD-L1 представляет собой полипептид PD-1, такой как AUR-012.
[00276] 14. Способ по любому из вариантов осуществления 1-13, отличающийся тем, что ингибитор FGFR2 представляет собой антитело к FGFR2.
[00277] 15. Способ по варианту осуществления 14, отличающийся тем, что антитело к FGFR2 представляет собой антитело к FGFR2-IIIb.
[00278] 16. Способ по варианту осуществления 15, отличающийся тем, что антитело к FGFR2-IIIb имеет одно или более из следующих свойств:
a. связывается с FGFR2-IIIb с более высокой аффинностью, чем с FGFR2-IIIc или детектируемо не связывается с FGFR2-IIIc;
b. ингибирует связывание FGF2 с FGFR2 человека;
c. ингибирует связывание FGF7 с FGFR2 человека;
d. ингибирует рост опухоли человека в модели опухоли мыши;
e. индуцирует АЗКЦ активность;
f. обладает повышенной АЗКЦ активностью;
g. является афукозилированным; и
h. способно увеличивать количество одних или более из: PD-L1-положительных клеток, NK-клеток, CD3+ T-клеток, CD4+ T-клеток, CD8+ T-клеток и макрофагов в опухолевой ткани в модели опухоли мыши по сравнению с контролем.
[00279] 17. Способ по варианту осуществления 15 или варианту осуществления 16, отличающийся тем, что антитело к FGFR2 содержит вариабельные области тяжелой цепи и легкой цепи, причем вариабельная область тяжелой цепи содержит:
(i) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 6;
(ii) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 7; и
(iii) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 8;
и вариабельная область легкой цепи содержит:
(iv) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 9;
(v) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 10; и
(vi) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 11.
[00280] 18. Способ по варианту осуществления 17, отличающийся тем, что вариабельная область тяжелой цепи антитела к FGFR2 содержит аминокислотную последовательность на по меньшей мере 95% идентичную аминокислотной последовательности SEQ ID NO: 4.
[00281] 19. Способ по варианту осуществления 17 или 18, отличающийся тем, что вариабельная область легкой цепи антитела к FGFR2 содержит аминокислотную последовательность на по меньшей мере 95% идентичную аминокислотной последовательности SEQ ID NO: 5.
[00282] 20. Способ по любому из вариантов осуществления 17-19, отличающийся тем, что вариабельная область тяжелой цепи антитела к FGFR2 содержит аминокислотную последовательность SEQ ID NO: 4.
[00283] 21. Способ по любому из вариантов осуществления 17-20, отличающийся тем, что вариабельная область легкой цепи антитела к FGFR2 содержит аминокислотную последовательность SEQ ID NO: 5.
[00284] 22. Способ по варианту осуществления 17, отличающийся тем, что тяжелая цепь антитела к FGFR2 содержит аминокислотную последовательность на по меньшей мере 95% идентичную аминокислотной последовательности SEQ ID NO: 2.
[00285] 23. Способ по варианту осуществления 17 или 22, отличающийся тем, что легкая цепь антитела к FGFR2 содержит аминокислотную последовательность на по меньшей мере 95% идентичную аминокислотной последовательности SEQ ID NO: 3.
[00286] 24. Способ по любому из вариантов осуществления 17, 22 или 23, отличающийся тем, что тяжелая цепь антитела к FGFR2 содержит аминокислотную последовательность SEQ ID NO: 2.
[00287] 25. Способ по любому из вариантов осуществления 17 или 22-24, отличающийся тем, что легкая цепь антитела к FGFR2 содержит аминокислотную последовательность SEQ ID NO: 3.
[00288] 26. Способ по любому из вариантов осуществления 15-25, отличающийся тем, что антитело к FGFR2 является химерным, гуманизированным или человеческим.
[00289] 27. Способ по любому из вариантов осуществления 15-26, отличающийся тем, что антитело к FGFR2 выбирают из Fab, Fv, scFv, Fab'' и (Fab')2.
[00290] 28. Способ по любому из вариантов осуществления 17-27, отличающийся тем, что антитело к FGFR2 имеет одно или более из следующих свойств:
a. отсутствует фукоза в положении Asn297;
b. содержит константную область легкой цепи κ;
c. содержит константную область тяжелой цепи IgG1;
d. имеет повышенную АЗКЦ активность in vitro по сравнению с антителом, имеющим ту же самую аминокислотную последовательность, которая фукозилирована в положении Asn297;
e. имеет повышенную аффинность к Fc гамма RIIIA по сравнению с антителом, имеющим ту же самую аминокислотную последовательность, которая фукозилирована в положении Asn297; и
f. способно увеличивать количество одних или более из: PD-L1-положительных клеток, NK-клеток, CD3+ T-клеток, CD4+ T-клеток, CD8+ T-клеток и макрофагов в опухолевой ткани в модели опухоли мыши по сравнению с контролем.
[00291] 29. Способ по любому из вариантов осуществления 1-13, отличающийся тем, что ингибитор FGFR2 представляет собой внеклеточный домен (ВКД) FGFR2 или слитую молекулу ВКД FGFR2.
[00292] 30. Способ по варианту осуществления 29, отличающийся тем, что ингибитор FGFR2 представляет собой слитую молекулу ВКД FGFR2, содержащую ВКД FGFR2 и по меньшей мере одного партнера по слиянию, выбранного из Fc-домена, альбумина и полиэтиленгликоля.
[00293] 31. Способ по варианту осуществления 30, отличающийся тем, что ВКД FGFR2 или слитая молекула ВКД FGFR2 содержит аминокислотную последовательность любой из SEQ ID NO: 13-33 или 29-33.
[00294] 32. Способ по любому из вариантов осуществления 1-31, отличающийся тем, что ингибитор FGFR2 и иммуностимулирующий агент вводят одновременно или последовательно.
[00295] 33. Способ по варианту осуществления 32, отличающийся тем, что одну или более доз иммуностимулирующего агента вводят перед введением ингибитора FGFR2.
[00296] 34. Способ по варианту осуществления 33, отличающийся тем, что субъект получил полный курс терапии иммуностимулирующим агентом перед введением ингибитора FGFR2.
[00297] 35. Способ по варианту осуществления 34, отличающийся тем, что ингибитор FGFR2 вводят во время второго курса терапии иммуностимулирующим агентом.
[00298] 36. Способ по любому из вариантов осуществления 33-35, отличающийся тем, что субъект получил по меньшей мере одну, по меньшей мере две, по меньшей мере три или по меньшей мере четыре дозы по меньшей мере одного иммуностимулирующего агента перед введением ингибитора FGFR2.
[00299] 37. Способ по любому из вариантов осуществления 33-36, отличающийся тем, что по меньшей мере одну дозу по меньшей мере одного иммуностимулирующего агента вводят одновременно с ингибитором FGFR2.
[00300] 38. Способ по варианту осуществления 32, отличающийся тем, что одну или более доз ингибитора FGFR2 вводят перед введением иммуностимулирующего агента.
[00301] 39. Способ по варианту осуществления 38, отличающийся тем, что субъект получил по меньшей мере две, по меньшей мере три, по меньшей мере три или по меньшей мере четыре дозы ингибитора FGFR2 перед введением по меньшей мере одного иммуностимулирующего агента.
[00302] 40. Способ по варианту осуществления 38 или по варианту осуществления 39, отличающийся тем, что по меньшей мере одну дозу ингибитора FGFR2 вводят одновременно с иммуностимулирующим агентом.
[00303] 41. Способ по любому из вариантов осуществления 1-40, отличающийся тем, что ингибитор FGFR2 вводят в дозе по меньшей мере 0,1, 0,3, 0,5, 1, 2, 3, 4, 5, 6, 10, 15, 20, 25 или 30 мг/кг или в диапазоне, ограниченном любыми двумя указанными дозами в мг/кг, такими как 6-10 мг/кг, 10-15, мг/кг или 6-15 мг/кг.
[00304] 42. Способ по любому из вариантов осуществления 32-41, отличающийся тем, что по меньшей мере один иммуностимулирующий агент включает ингибитор PD-1/PD-L1.
[00305] 43. Способ по варианту осуществления 42, отличающийся тем, что ингибитор PD-1/PD-L1 вводят в дозе по меньшей мере 0,1, 0,3, 0,5, 1, 2, 3, 4, 5 или 10 мг/кг.
[00306] 44. Способ по любому из вариантов осуществления 1-43, отличающийся тем, что ингибитор FGFR2 и иммуностимулирующий агент вводят один раз в 1, 2, 3, 4 или 5 недель.
[00307] 45. Способ по любому из вариантов осуществления 1-44, отличающийся тем, что рак выбирают из рака молочной железы, рака желудка, немелкоклеточного рака легкого, меланомы, плоскоклеточной карциномы головы и шеи, рака яичника, рака поджелудочной железы, почечно-клеточной карциномы, гепатоцеллюлярной карциномы, рака мочевого пузыря, холангиокарциномы, рака пищевода и рака эндометрия.
[00308] 46. Способ по любому из вариантов осуществления 1-45, отличающийся тем, что рак является рецидивирующим или прогрессирующим после терапии, выбранной из оперативного вмешательства, химиотерапии, лучевой терапии или их комбинации.
[00309] 47. Способ по любому из вариантов осуществления 1-46, отличающийся тем, что (а) рак был ранее определен как сверхэкспрессирующий FGFR2IIIb или с, или без амплификации гена FGFR2, или (b) способ включает дополнительную стадию определения того, сверхэкспрессирует ли рак FGFR2IIIb, и необязательно также включает дополнительную стадию определения того, амплифицирован ли ген FGFR2 в опухолевых клетках.
[00310] 48. Способ по варианту осуществления 47, отличающийся тем, что сверхэкспрессию FGFR2IIIb определяют при помощи иммуногистохимии (ИГХ).
[00311] 49. Способ по варианту осуществления 48, отличающийся тем, что сверхэкспрессию определяют при помощи сигнала ИГХ, составляющего 1+, 2+ или 3+ по меньшей мере в 10% опухолевых клеток, например, по меньшей мере в 20%, 30%, 40% или 50% опухолевых клеток.
[00312] 50. Способ по любому из вариантов осуществления 47-49, отличающийся тем, что амплификацию гена FGFR2 определяют путем получения соотношения FGFR2 к центромере хромосомы 10 (CEN10) с использованием флюоресцентной гибридизации in situ (метод FISH), при этом ген FGFR2 считается амплифицированным, если соотношение FGFR2/CEN10, определяемое методом FISH, больше или равно 2.
[00313] 51. Способ по любому из вариантов осуществления 47-50, отличающийся тем, что рак представляет собой рак желудка или рак мочевого пузыря.
[00314] 52. Способ по любому из вариантов осуществления 48-50, отличающийся тем, что:
а) рак представляет собой рак желудка, рак имеет сигнал ИГХ, составляющий 3+, по меньшей мере в 10% опухолевых клеток;
b) рак представляет собой рак желудка, рак имеет сигнал ИГХ, составляющий 3+, по меньшей мере в 10% опухолевых клеток, и при этом ген FGFR2 является амплифицированным;
c) рак представляет собой рак желудка, рак имеет сигнал ИГХ, составляющий 3+, по меньшей мере в 10% опухолевых клеток, и при этом ген FGFR2 не является амплифицированным;
d) рак представляет собой рак желудка, и рак имеет сигнал ИГХ, составляющий 1+ или 2+, по меньшей мере в 10% опухолевых клеток;
e) рак представляет собой рак мочевого пузыря, и рак имеет сигнал ИГХ, составляющий 1+, по меньшей мере в 10% опухолевых клеток;
f) рак представляет собой рак мочевого пузыря, и рак имеет сигнал ИГХ, составляющий 2+, по меньшей мере в 10% опухолевых клеток;
g) рак представляет собой рак мочевого пузыря, и рак имеет показатель H равный 20 или выше;
h) рак представляет собой рак мочевого пузыря, и рак имеет показатель H равный 10-19; или
i) рак представляет собой рак мочевого пузыря, и рак имеет показатель H <10.
[00315] 53. Способ по любому из вариантов осуществления 1-52, отличающийся тем, что субъект представляет собой субъекта, недостаточно отвечающего на лечение ингибитором PD-1/PD-L1.
[00316] 54. Способ по любому из вариантов осуществления 1-53, отличающийся, тем введение ингибитора FGFR2 и ингибитора PD-1/PD-L1 в мышиной модели опухоли приводит к аддитивному или синергическому ингибированию роста опухоли.
[00317] 55. Способ по варианту осуществления 54, отличающийся тем, что рак представляет собой рак молочной железы, и мышиная модель опухоли включает клетки 4T1.
[00318] 56. Способ по любому из вариантов осуществления 1-55, отличающийся тем, что введение ингибитора FGFR2 в мышиной модели опухоли увеличивает количество NK-клеток в опухолевой ткани по сравнению с контролем.
[00319] 57. Способ по любому из вариантов осуществления 1-56, отличающийся тем, что введение ингибитора FGFR2 в мышиной модели опухоли увеличивает количество PD-L1-положительных клеток в опухолевой ткани по сравнению с контролем.
[00320] 58. Способ по любому из вариантов осуществления 1-57, отличающийся тем, что введение ингибитора FGFR2 в мышиной модели опухоли увеличивает количество CD3+, CD8+, и/или CD4+ T-клеток в опухолевой ткани по сравнению с контролем.
[00321] 59. Способ по любому из вариантов осуществления 1-58, отличающийся тем, что введение ингибитора FGFR2 в мышиной модели опухоли увеличивает соотношение лимфоидных клеток к миелоидным клеткам в опухолевой ткани по сравнению с контролем.
[00322] 60. Композиция, содержащая ингибитор FGFR2, как описано в любом из вариантов осуществления 14-31 и по меньшей мере один иммуностимулирующий агент, как описано в любом из вариантов осуществления 2-13, например, по меньшей мере один ингибитор PD-1/PD-L1.
[00323] 61. Композиция по варианту осуществления 60, отличающаяся тем, что ингибитор FGFR2 и по меньшей мере один иммуностимулирующий агент содержатся в отдельных контейнерах или отделениях.
[00324] 62. Композиция по варианту осуществления 60 или 61, дополнительно содержащая инструкции по применению в лечении рака.
[00325] 63. Композиция по любому из вариантов осуществления 60-62 для применения в лечении рака.
[00326] 64. Композиция по варианту осуществления 63, отличающийся тем, что рак выбирают из рака молочной железы, рака желудка, немелкоклеточного рака легкого, меланомы, плоскоклеточной карциномы головы и шеи, рака яичника, рака поджелудочной железы, почечно-клеточной карциномы, гепатоцеллюлярной карциномы, рака мочевого пузыря, холангиокарциномы, рака пищевода и рака эндометрия.
[00327] 65. Композиция по любому из вариантов осуществления 63-64, отличающаяся тем, что рак сверхэкспрессирует FGFR2IIIb или с, или без амплификации гена FGFR2.
[00328] 66. Композиция по варианту осуществления 65, отличающаяся тем, что сверхэкспрессию FGFR2IIIb определяют при помощи иммуногистохимии (ИГХ).
[00329] 67. Композиция по варианту осуществления 66, отличающаяся тем, что сверхэкспрессию можно определить при помощи сигнала ИГХ, составляющего 1+, 2+ или 3+, по меньшей мере в 10% опухолевых клеток, например, по меньшей мере в 20%, 30%, 40% или 50% опухолевых клеток.
[00330] 68. Композиция по любому из вариантов осуществления 63-67, отличающаяся тем, что рак имеет соотношение FGFR2/CEN10, определяемое при помощи метода FISH, большее или равное 2.
[00331] 69. Композиция по любому из вариантов осуществления 63-68, отличающаяся тем, что рак представляет собой рак желудка или рак мочевого пузыря.
[00332] 70. Композиция по любому из вариантов осуществления 63-69, отличающаюся тем, что:
а) рак представляет собой рак желудка, и рак имеет сигнал ИГХ, составляющий 3+, по меньшей мере в 10% опухолевых клеток;
b) рак представляет собой рак желудка, рак имеет сигнал ИГХ, составляющий 3+, по меньшей мере в 10% опухолевых клеток, и при этом ген FGFR2 является амплифицированным;
c) рак представляет собой рак желудка, рак имеет сигнал ИГХ, составляющий 3+, по меньшей мере в 10% опухолевых клеток, и при этом ген FGFR2 не является амплифицированным;
d) рак представляет собой рак желудка, и рак имеет сигнал ИГХ, составляющий 1+ или 2+, по меньшей мере в 10% опухолевых клеток;
e) рак представляет собой рак мочевого пузыря, и рак имеет сигнал ИГХ, составляющий 1+, по меньшей мере в 10% опухолевых клеток;
f) рак представляет собой рак мочевого пузыря, и рак имеет сигнал ИГХ, составляющий 2+, по меньшей мере в 10% опухолевых клеток;
g) рак представляет собой рак мочевого пузыря, и рак имеет показатель H равный 20 или выше;
h) рак представляет собой рак мочевого пузыря, и рак имеет показатель H равный 10-19; или
i) рак представляет собой рак мочевого пузыря, и рак имеет показатель H <10.
[00333] 71. Способ увеличения количества NK-клеток и/или PD-L1-положительных клеток в опухолевой ткани субъекта с раком, включающий введение указанному субъекту эффективного количества ингибитора FGFR2.
[00334] 72. Способ по варианту осуществления 71, отличающийся тем, что ингибитор FGFR2 представляет собой ингибитор по любому из вариантов осуществления 14-31.
[00335] 73. Способ по варианту осуществления 71 или 72, отличающийся тем, что указанный способ ингибирует рост опухоли или уменьшает объем по меньшей мере одной опухоли у субъекта.
[00336] 74. Способ по варианту осуществления 73, отличающийся тем, что рак выбирают из рака молочной железы, рака желудка, немелкоклеточного рака легкого, меланомы, плоскоклеточной карциномы головы и шеи, рака яичника, рака поджелудочной железы, почечно-клеточной карциномы, гепатоцеллюлярной карциномы, рака мочевого пузыря, холангиокарциномы, рака пищевода и рака эндометрия.
[00337] 75. Способ по любому из вариантов осуществления 71-74, отличающийся тем, что (а) рак был ранее определен как сверхэкспрессирующий FGFR2IIIb или с, или без амплификации гена FGFR2, или (b) способ включает дополнительную стадию определения того, сверхэкспрессирует ли рак FGFR2IIIb, и необязательно также включает дополнительную стадию определения того, амплифицирован ли ген FGFR2 в опухолевых клетках.
[00338] 76. Способ по варианту осуществления 75, отличающийся тем, что сверхэкспрессию FGFR2IIIb определяют при помощи иммуногистохимии (ИГХ).
[00339] 77. Способ по варианту осуществления 76, отличающийся тем, что сверхэкспрессию можно определяют при помощи сигнала ИГХ, составляющего 1+, 2+ или 3+ по меньшей мере в 10% опухолевых клеток, например, по меньшей мере в 20%, 30%, 40% или 50% опухолевых клеток.
[00340] 78. Способ по любому из вариантов осуществления 75-77, отличающийся тем, что амплификацию гена FGFR2 определяют путем получения соотношения FGFR2 к центромере хромосомы 10 (CEN10) с использованием флюоресцентной гибридизации in situ (метод FISH), при этом ген FGFR2 считается амплифицированным, если соотношение FGFR2/CEN10, определяемое методом FISH, больше или равно 2.
[00341] 79. Способ по любому из вариантов осуществления 75-78, отличающийся тем, что рак представляет собой рак желудка или рак мочевого пузыря.
[00342] 80. Способ по любому из вариантов осуществления 75-79, отличающийся тем, что:
а) рак представляет собой рак желудка, и рак имеет сигнал ИГХ, составляющий 3+, по меньшей мере в 10% опухолевых клеток;
b) рак представляет собой рак желудка, рак имеет сигнал ИГХ, составляющий 3+, по меньшей мере в 10% опухолевых клеток, и при этом ген FGFR2 является амплифицированным;
c) рак представляет собой рак желудка, рак имеет сигнал ИГХ, составляющий 3+, по меньшей мере в 10% опухолевых клеток, и при этом ген FGFR2 не является амплифицированным;
d) рак представляет собой рак желудка, и рак имеет сигнал ИГХ, составляющий 1+ или 2+, по меньшей мере в 10% опухолевых клеток;
e) рак представляет собой рак мочевого пузыря, и рак имеет сигнал ИГХ, составляющий 1+, по меньшей мере в 10% опухолевых клеток;
f) рак представляет собой рак мочевого пузыря, и рак имеет сигнал ИГХ, составляющий 2+, по меньшей мере в 10% опухолевых клеток;
g) рак представляет собой рак мочевого пузыря, и рак имеет показатель H равный 20 или выше;
h) рак представляет собой рак мочевого пузыря, и рак имеет показатель H равный 10-19; или
i) рак представляет собой рак мочевого пузыря, и рак имеет показатель H <10.
[00343] 81. Способ по любому из вариантов осуществления 71-80, отличающийся тем, что способ дополнительно включает получение по меньшей мере одного образца опухоли от субъекта, после введения антитела к FGFR2, и определение количества NK-клеток и/или PD-L1-положительных клеток, и/или CD8+ Т-клеток в образце, и, если количество NK-клеток и/или PD-L1-положительных клеток, и/или CD8+T-клеток увеличивается относительно образца перед введением антитела к FGFR2, введение субъекту по меньшей мере одного иммуностимулирующего агента, такого как по меньшей мере один ингибитор PD-1/PD-L1.
[00344] 82. Способ лечения рака у субъекта, включающий введение субъекту ингибитора FGFR2 и, если определено, что субъект имеет увеличенное количество NK-клеток и/или PD-L1-положительных клеток, и/или CD8+ Т-клеток по сравнению с образцом перед введением антитела к FGFR2, введение субъекту по меньшей мере одного иммуностимулирующего агента, такого как по меньшей мере один ингибитор PD-1/PD-L1.
[00345] 83. Способ по варианту осуществления 82, отличающийся тем, что ингибитор FGFR2 представляет собой ингибитор по любому из вариантов осуществления 14-31.
[00346] 84. Способ по варианту осуществления 82 или 83, отличающийся тем, что по меньшей мере один иммуностимулирующий агент включает по меньшей мере один ингибитор PD-1/PD-L1 в соответствии с любым из вариантов осуществления 2-13.
[00347] 85. Способ по любому из вариантов осуществления 82-84, отличающийся тем, что ингибитор FGFR2 и по меньшей мере один иммуностимулирующий агент вводят в соответствии со способом по варианту осуществления 38 или 39.
[00348] 86. Способ увеличения количества одних или более из: PD-L1-положительных клеток, NK-клеток, CD3+ T-клеток, CD4+ T-клеток, CD8+ T-клеток и макрофагов в опухолевой ткани субъекта, страдающего раком, включающий введение ингибитора FGFR2, причем ингибитор представляет собой антитело к FGFR2 с повышенной АЗКЦ активностью.
[00349] 87. Способ по варианту осуществления 86, отличающийся тем, что антитело представляет собой антитело в соответствии с любым из вариантов осуществления 15-28.
[00350] 88. Способ по варианту осуществления 86 или 87, отличающийся тем, что введение антитела к FGFR2 в мышиной модели опухоли увеличивает количество одних или более из: PD-L1-положительных клеток, NK-клеток, CD3+ T-клеток, CD8+ T-клеток, CD4+ T-клеток и макрофагов в опухолевой ткани по сравнению с контролем, и/или увеличивает соотношение лимфоидных клеток к миелоидным клеткам в опухолевой ткани.
[00351] 89. Способ по любому из вариантов осуществления 86-88, отличающийся тем, что субъект страдает от рака молочной железы, рака желудка, немелкоклеточного рака легкого, меланомы, плоскоклеточной карциномы головы и шеи, рака яичника, рака поджелудочной железы, почечно-клеточной карциномы, гепатоцеллюлярной карциномы, рака мочевого пузыря, холангиокарциномы, рака пищевода или рака эндометрия.
[00352] 90. Способ по любому из вариантов осуществления 86-89, отличающийся тем, что (а) рак был ранее определен как сверхэкспрессирующий FGFR2IIIb или с, или без амплификации гена FGFR2, или (b) способ включает дополнительную стадию определения того, сверхэкспрессирует ли рак FGFR2IIIb, и необязательно также включает дополнительную стадию определения того, амплифицирован ли ген FGFR2 в опухолевых клетках.
[00353] 91. Способ по варианту осуществления 90, отличающийся тем, что сверхэкспрессию FGFR2IIIb определяют при помощи иммуногистохимии (ИГХ).
[00354] 92. Способ по варианту осуществления 91, отличающийся тем, что сверхэкспрессию можно определяют при помощи сигнала ИГХ, составляющего 1+, 2+ или 3+ по меньшей мере в 10% опухолевых клеток, например, по меньшей мере в 20%, 30%, 40% или 50% опухолевых клеток.
[00355] 93. Способ по любому из вариантов осуществления 90-92, отличающийся тем, что амплификацию гена FGFR2 определяют путем получения соотношения FGFR2 к центромере хромосомы 10 (CEN10) с использованием флюоресцентной гибридизации in situ (метод FISH), при этом ген FGFR2 считается амплифицированным, если соотношение FGFR2/CEN10, определяемое методом FISH, больше или равно 2.
[00356] 94. Способ по любому из вариантов осуществления 89-93, отличающийся тем, что субъект страдает от рака желудка или рака мочевого пузыря.
[00357] 95. Способ по любому из вариантов осуществления 90-94, отличающийся тем, что:
а) рак представляет собой рак желудка, и рак имеет сигнал ИГХ, составляющий 3+, по меньшей мере в 10% опухолевых клеток;
b) рак представляет собой рак желудка, рак имеет сигнал ИГХ, составляющий 3+, по меньшей мере в 10% опухолевых клеток, и при этом ген FGFR2 является амплифицированным;
c) рак представляет собой рак желудка, рак имеет сигнал ИГХ, составляющий 3+, по меньшей мере в 10% опухолевых клеток, и при этом ген FGFR2 не является амплифицированным;
d) рак представляет собой рак желудка, и рак имеет сигнал ИГХ, составляющий 1+ или 2+, по меньшей мере в 10% опухолевых клеток;
e) рак представляет собой рак мочевого пузыря, и рак имеет сигнал ИГХ, составляющий 1+, по меньшей мере в 10% опухолевых клеток;
f) рак представляет собой рак мочевого пузыря, и рак имеет сигнал ИГХ, составляющий 2+, по меньшей мере в 10% опухолевых клеток;
g) рак представляет собой рак мочевого пузыря, и рак имеет показатель H равный 20 или выше;
h) рак представляет собой рак мочевого пузыря, и рак имеет показатель H равный 10-19; или
i) рак представляет собой рак мочевого пузыря, и рак имеет показатель H <10.
[00358] 96. Способ по любому из вариантов осуществления 86-95, отличающийся тем, что антитело к FGFR2 вводят в дозе по меньшей мере 0,1, 0,3, 0,5, 1, 2, 3, 4, 5, 6, 10, 15, 20, 25 или 30 мг/кг или в диапазоне, ограниченном любыми двумя указанными дозами в мг/кг, такими как 6-10 мг/кг, 10-15 мг/кг или 6-15 мг/кг, каждую неделю, каждые две недели, каждые три недели или один раз в месяц.
[00359] 97. Способ определения того, будет ли пациент с раком желудка или раком мочевого пузыря отвечать на лечение ингибитором FGFR2, включающий определение того, сверхэкспрессирует ли рак желудка или мочевого пузыря FGFR2IIIb при помощи ИГХ, причем сверхэкспрессию определяют при помощи сигнала ИГХ, составляющего 1+, 2+ или 3+, по меньшей мере в 10% опухолевых клеток рака, таких как по меньшей мере в 20%, 30%, 40% или 50% опухолевых клеток.
[00360] 98. Способ по варианту осуществления 97, отличающийся тем, что способ дополнительно включает определение того, амплифицируется ли ген FGFR2 при помощи получения соотношения FGFR2 к центромере хромосомы 10 (CEN10) с использованием флюоресцентной гибридизации in situ (метод FISH), при этом ген FGFR2 считается амплифицированным, если соотношение FGFR2/CEN10, определяемое методом FISH, больше или равно 2.
[00361] 99. Способ по варианту осуществления 97 или 98, отличающийся тем, что пациент определяется как отвечающий на лечение антителом к FGFR2IIIb, если:
а) рак представляет собой рак желудка, и рак имеет сигнал ИГХ, составляющий 3+, по меньшей мере в 10% опухолевых клеток;
b) рак представляет собой рак желудка, рак имеет сигнал ИГХ, составляющий 3+, по меньшей мере в 10% опухолевых клеток, и при этом ген FGFR2 является амплифицированным;
c) рак представляет собой рак желудка, рак имеет сигнал ИГХ, составляющий 3+, по меньшей мере в 10% опухолевых клеток, и при этом ген FGFR2 не является амплифицированным;
d) рак представляет собой рак желудка, и рак имеет сигнал ИГХ, составляющий 1+ или 2+, по меньшей мере в 10% опухолевых клеток;
e) рак представляет собой рак мочевого пузыря, и рак имеет сигнал ИГХ, составляющий 1+, по меньшей мере в 10% опухолевых клеток;
f) рак представляет собой рак мочевого пузыря, и рак имеет сигнал ИГХ, составляющий 2+, по меньшей мере в 10% опухолевых клеток;
g) рак представляет собой рак мочевого пузыря, и рак имеет показатель H равный 20 или выше;
h) рак представляет собой рак мочевого пузыря, и рак имеет показатель H равный 10-19; или
i) рак представляет собой рак мочевого пузыря, и рак имеет показатель H <10.
[00362] 100. Способ по любому из вариантов осуществления 97-99, отличающийся тем, что ингибитор FGFR2 представляет собой ингибитор по любому из вариантов осуществления 14-31.
[00363] 101. Способ по любому из вариантов осуществления 97-100, отличающийся тем, что лечение включает введение ингибитора FGFR2 в дозе по меньшей мере 0,1, 0,3, 0,5, 1, 2, 3, 4, 5, 6, 10, 15, 20, 25, или 30 мг/кг, или в диапазоне, ограниченном любыми двумя указанными дозами в мг/кг, такими как 6-10 мг/кг, 10-15, мг/кг или 6-15 мг/кг.
[00364] 102. Способ по любому из вариантов осуществления 97-101, отличающийся тем, что лечение включает осуществление способа согласно вариантам осуществления 71, 82 или 86.
[00365] 103. Способ по любому из вариантов осуществления 97-101, отличающийся тем, что лечение дополнительно включает введение субъекту субъекта по меньшей мере одного иммуностимулирующего агента.
[00366] 104. Способ по варианту осуществления 103, отличающийся тем, что по меньшей мере один иммуностимулирующий агент включает иммуностимулирующий агент по любому из вариантов осуществления 2-13.
[00367] Способ по варианту осуществления 103, отличающийся тем, что лечение включает введение ингибитора FGFR2 и по меньшей мере одного иммуностимулирующего агента в соответствии с любым из способов по вариантам осуществления 32-44, или при этом лечение включает введение композиции по любому из вариантов осуществления 60-62.
ПРИМЕРЫ
[00368] Примеры, приведенные ниже, предназначены только для иллюстративных целей и поэтому не должны рассматриваться как ограничивающие изобретение каким-либо образом. Примеры не предназначены для представления того, что эксперименты, приведенные ниже, являются всеми или единственными экспериментами, которые проводились. Предприняты меры для обеспечения точности в отношении применяемых чисел (например, количеств, температуры и т.д.), но следует учитывать наличие некоторых экспериментальных погрешностей и отклонений. Если не указано иное, части являются массовыми частями, молекулярная масса представляет собой среднюю молекулярную массу, температура представлена в градусах Цельсия, а давление равно или близко к атмосферному.
Пример 1: АЗКЦ активность необходима для ингибирования роста опухоли в мышиной модели опухоли молочной железы 4T1
[00369] Семьдесят самок мышей BALB/c восьминедельного возраста (категория IACUC (Институциональный комитет по уходу за животными и их использованию): AUP 2011 # 01-03) были приобретены у Charles River Laboratories (Уилмингтон, Массачусетс, США). Животным давали по меньшей мере 3-суточную акклиматизацию по прибытии и содержали по 5 животных на клетку со свободным доступом к пище и воде. После акклиматизации их взвешивали и брили для имплантации опухолевых клеток.
[00370] Линию опухоли молочной железы 4T1 из мышиного штамма BALB/cfC3H использовали в качестве модели опухоли и была получена из ATCC (Американская коллекция типовых культур) (Манассас, Виргиния, США: каталожный № CRL-2539). Клетки культивировали при 37°С в среде RPMI 1640 (Mediatech, Inc., Манассас, Виргиния, США; № 10-041-CV) с 10% фетальной бычьей сывороткой, 2 мМ L-глутамина и 1% Penn/Strep (пенициллин/стрептомицин).
[00371] Каждую мышь инокулировали 5 × 104 клеток 4T1 путем ортотопической инъекции под 4-й грудной сосок (сосок молочной железы) от головы мыши. Затем объем опухолей и массу тела мышей периодически контролировали до тех пор, пока объемы опухолей не достигли 100 мм3 +/- 25 мм3. Когда опухоли достигали 100 мм3 +/- 25 мм3, мышей сортировали по размеру опухоли на четыре группы по дозам. Первой группе вводили 20 мг/кг антитела Fc-G1 (интраперитонально (и/п), раз в две недели (BIW)), второй группе - 20 мг/кг афукозилированного антитела к FGFR2 (анти-FGFR2) с HVR тяжелой и легкой цепи SEQ ID NO: 6-11 (и/п, BIW) и третьей группе - 20 мг/кг антитела к FGFR2 с мутацией N297Q (анти-FGFR2-N297Q), что делает эту молекулу неспособной стимулировать АЗКЦ активность (и/п, BIW).
[00372] В целом, лечение анти-FGFR2 приводит к ~ 30% ингибированию (P <0,001) роста опухоли по сравнению с контрольным FcG1, тогда как лечение анти-FGFR2-N297Q не ингибирует рост опухоли по сравнению с контролем. (См. фиг. 1a-b.) Эти данные подтверждают роль АЗКЦ как механизма ингибирования анти-FGFR2 опухолевого роста.
Пример 2a: Воздействие анти-FGFR2 антитела приводит к увеличению количества NK-клеток и увеличению количества PD-L1-экспрессирующих клеток внутри опухолевой ткани
[00373] Для иммуногистохимического анализа BALB/cfC3H мышей инокулировали 5 × 104 клеток 4T1 путем ортотопической инъекции, как описано выше. После того, как опухоли достигли 100 мм3 +/- 25 мм3 (0 сутки), мышей сортировали в соответствии с размером опухоли на две дозовые группы: носитель или 10 мг/кг анти-FGFR2 (и/п). Каждая группа была поделена на (а) мышей, которые получали одну или две дозы на 0 сутки или (b) мышей, которые получали одну или две дозы на 3 сутки, и мышей подвергали эвтаназии через 24 часа после введения дозы на 1 или 4 сутки, соответственно, и подготавливали для гистологии или проточной цитометрии.
[00374] Для гистологии на 1-е сутки и 4-е сутки, через 24 часа после первой и второй терапии, соответственно, мышей подвергали эвтаназии с помощью CO2 и затем перфузировали фосфатно-солевом буферным раствором (PBS), при pH 7,4. Вкратце, грудную клетку мыши быстро вскрывали, и использовали шприц с иглой 20-го калибра для введения 40 мл PBS в аорту через разрез в левом желудочке. Кровь и PBS спускали через отверстие в правом предсердии. Ортотопические опухоли 4T1 удаляли и погружали в 10% забуференный нейтральный формалин при 4 ° С. Через 2 часа ткани промывали 3 раза PBS и затем переносили в 30% сахарозу в PBS на ночь. На следующий день опухоли замораживали в реактиве ОСТ и хранили при -80 °С.
[00375] Из каждой опухоли изготавливали серийные срезы толщиной 20-мкм. Срезы дегидратировали на предметных стеклах Superfrost Plus (VWR) в течение 1-2 часов. Образцы пермеабилизировали c PBS, содержащим 0,3% Тритон X-100, и инкубировали в 5% нормальной козьей сыворотке в PBS 0,3% Тритон X-100 (блокирующий раствор) в течение 1 часа при комнатной температуре для блокирования неспецифического связывания антител. Через 1 час блокирующий раствор удаляли и срезы инкубировали с первичными антителами в течение ночи. Для выявления NK-клеток, срезы секции инкубировали с крысиным анти-NKp46 (CD335, Biolegend, кат. № 137602), разведенным 1: 500 в блокирующем растворе. Для выявления PD-L1, срезы инкубировали с крысиным анти-PD-L1 (eBioscience, кат. № 14-5982-82), разбавленным 1: 500 в блокирующем растворе. Окрашивание NK-клеток и PD-L1 проводили в серийных срезах, так как оба первичных антитела были получены из крыс. Вторичные антитела только образцов отрицательного контроля инкубировали в 5% нормальной сыворотке, в отличие от первичных антител.
[00376] На следующий день после промывки PBS, содержащего 0,3% Тритон X-100, образцы инкубировали в течение 4 часов при комнатной температуре с мечеными Alexa Fluor 594 козьими антикрысиными (Jackson Immuno Research, кат. № 112-585-167) и мечеными Alexa Fluor 488 козьими антикроличьими (Jackson Immuno Research, кат. № 111-545-144) вторичными антителами, разведенными 1: 400 в PBS. После этого образцы промывали PBS, содержащим 0,3% Тритон X-100, затем фиксировали в 1% параформальдегиде (PFA), снова промывали PBS и фиксировали в Vectashield с DAPI (4', 6-диамидин-2-фенилиндол) (Vector, H-1200). DAPI использовали для окрашивания ядер клеток.
[00377] Образцы были обследованы с помощью флуоресцентного микроскопа Zeiss Axiophot® 2 plus, оснащенного камерой AxioCam® HRc. Типовые изображения для каждой экспериментальной группы, демонстрирующие количество и распределение NKp46+ и PD-L1+ клеток в опухоли, были собраны и изображены на фиг. 2a-2d.
[00378] В опухолях 4T1 от мышей, которым вводили носитель, были обнаружено небольшое количество рассеянных NKp46+ NK-клеток, и большинство из этих клеток были расположены на периферии опухоли. (фиг. 2a.) Для сравнения, после лечения анти-FGFR2 при 10 мг/кг в течение 1 суток NKp46+NK-клетки были более многочисленны. Хотя большинство из этих клеток были обнаружены по краям опухоли, некоторые из них проникли в центр опухоли. (См. фиг. 2a.) Аналогичные результаты наблюдали на 4-е сутки после второй дозы анти-FGFR2. (фиг. 2b.)
[00379] Окрашивание PD-L1 показало, что в опухолях 4T1 при лечении носителем в течение 1 суток иммунореактивность PD-L1 была обнаружена только в нескольких клетках в опухолях. (фиг. 2c.) В противоположность этому, через 24 часа после 1 дозы анти-FGFR2, PD-L1-положительные клетки были более многочисленны в центре опухоли. (фиг. 2c.) Аналогичные результаты наблюдали через 4 суток после начала лечения. (фиг. 2d.)
[00380] В качестве независимого анализа для увеличения количества NK-клеток, мы выполняли проточную цитометрию для мышей, имеющих опухоль 4T1, которые получали 2 дозы физиологического раствора или 10 мг/кг анти-FGFR2, как описано выше. Для проточной цитометрии опухоли разрезали на кусочки размером в 1-2 мм и помещали в DMEM (минимальная эссенциальная среда Игла, модифицированная по способу Дульбекко) с 10% FBS (фетальная бычья сыворотка), 50 ед/мл ДНКаза I и 250 ед/мл коллагеназа I (Worthington Biochemical Corporation, Лейквуд, Нью-Джерси) в инкубаторе-встряхивателе в течение 30 мин при 37 °С. Клетки пропускали через нейлоновый сетчатый фильтр с диаметром пор 70 мкм, и суспензии отдельных клеток окрашивали в соответствии со стандартными протоколами с использованием антител, приобретенных у BD Biosciences (Сан-Хосе, Калифорния): CD45 (клон 30-F11) и CD11b (1D3); Affymtrix eBioscience (Сан-Диего, Калифорния): CD16/32 (блокирование FC-рецептора, 93), CD335 (NKp46, 29A1.4), CD8a (53,67) и CD3e (145-2C11); R&D Systems (Миннеаполис, Миннесота): EphA2 (233720); или ThermoFisher Scientific (Гранд-Айленд, Нью-Йорк): набор Live/Dead Aqua. Клетки фиксировали и анализировали на следующий день на BD LSRII. Результаты были проанализированы с использованием FlowJo (V10, Ашленд, Орегон) со следующей стратегия гейтирования: CD45+ EphA2-, синглетные (FSC-H против FSC-A), живые клетки (отрицательные по Live/Dead) и CD11b- для выделения живых лимфоцитов. NK-клетки были гейтированы по NKp46+CD3- и выражены в процентах от CD45+живых одиночных клеток.
[00381] Как изображено на фиг. 3, опухоли при лечении анти-FGFR2 демонстрировали повышенные NK-клетки по сравнению с опухолями, обработанными контрольным физиологическим раствором.
Пример 2b: Воздействие анти-FGFR2-антитела, а не анти-FGFR2 N297Q приводит к увеличению NK-клеток, Т-клеток и увеличению PD-L1-экспрессирующих клеток внутри опухолевой ткани
[00382] BALB/cfC3H мышей инокулировали 5 × 104 клеток 4T1 путем ортотопической инъекции, как описано в примере 1. После того, как опухоли достигали 100 мм3 +/- 25 мм3 (0 сутки), мышей сортировали по размеру опухоли на три дозовые группы: носитель (контрольная группа), 10 мг/кг афукозилированного анти-FGFR2 антитела (и/п) (группа анти-FGFR2), и 10 мг/кг анти-FGFR2 N297Q антитела (группа анти-FGFR2 N297Q). Модификация N297Q представляет собой мутацию в Fc-области антитела, которая предназначена для устранения эффекторной функции антитела.
[00383] Каждая группа была поделена на (а) мышей, которые получали одну или две дозы на 0 сутки или (b) мышей, которые получали одну или две дозы на 3 сутки, и мышей подвергали эвтаназии через 24 часа после введения дозы на 1 или 4 сутки, соответственно, и подготавливали для гистологии или проточной цитометрии.
[00384] Для гистологии на 1-е сутки и 4-е сутки, через 24 часа после первой и второй терапии, соответственно, мышей подвергали эвтаназии с помощью CO2 и затем перфузировали фосфатно-солевом буферным раствором (PBS), при pH 7,4. Вкратце, грудную клетку мыши быстро вскрывали, и использовали шприц с иглой 20-го калибра для введения 40 мл PBS в аорту через разрез в левом желудочке. Кровь и PBS спускали через отверстие в правом предсердии. Ортотопические опухоли 4T1 удаляли и погружали в 10% забуференный нейтральный формалин при 4 ° С. Через 2 часа ткани промывали 3 раза PBS и затем переносили в 30% сахарозу в PBS на ночь. На следующий день опухоли замораживали в реактиве ОСТ и хранили при -80 °С.
[00385] Из каждой опухоли изготавливали серийные срезы толщиной 20-мкм. Срезы дегидратировали на предметных стеклах Superfrost Plus (VWR) в течение 1-2 часов. Образцы пермеабилизировали c PBS, содержащим 0,3% Тритон X-100, и инкубировали в 5% нормальной козьей сыворотке в PBS 0,3% Тритон X-100 (блокирующий раствор) в течение 1 часа при комнатной температуре для блокирования неспецифического связывания антител. Через 1 час блокирующий раствор удаляли и срезы инкубировали с первичными антителами в течение ночи. Для выявления NK-клеток, срезы секции инкубировали с крысиным анти-NKp46 (CD335, Biolegend, кат. № 137602), разведенным 1: 500 в блокирующем растворе. Для выявления PD-L1, срезы инкубировали с крысиным анти-PD-L1 (eBioscience, кат. № 14-5982-82), разбавленным 1: 500 в блокирующем растворе. Для выявления CD3+ Т-клеток, срезы инкубировали с анти-CD3 антителом хомяка (BD biosciences, кат. № 553058) при 1: 500 в блокирующем растворе. Для выявления CD4+ Т-клеток, срезы инкубировали с крысиным анти-CD4-антителом (AbD Serotec, кат. № MCA4635) при 1: 500 в блокирующем растворе. Для выявления CD8+ Т-клетки, срезы инкубировали с крысиным анти-CD8 антителом (Abcam, кат. № ab22378) при 1: 500 в блокирующем растворе. Окрашивание NK-клеток и PD-L1 проводили в серийных срезах, так как оба первичных антитела были получены из крыс. CD3 и CD4-положительные клетки окрашивали вместе на одном и том же срезе. Окрашивание CD3 и CD8 также выполнялось на тех же срезах. Вторичные антитела только образцов отрицательного контроля инкубировали в 5% нормальной сыворотке, в отличие от первичных антител.
[00386] На следующий день после промывки PBS, содержащего 0,3% Тритон X-100, образцы инкубировали в течение 4 часов при комнатной температуре с мечеными Alexa Fluor 594 козьим антикрысиным (Jackson Immuno Research, кат. № 112-585-167) и мечеными Alexa Fluor 488 козьими анти-хомячьими (Jackson Immuno Research, кат. № 127-545-160), вторичными антителами, разведенными 1: 400 в PBS. После этого образцы промывали PBS, содержащим 0,3% Тритон X-100, затем фиксировали в 1% параформальдегиде (PFA), снова промывали PBS и фиксировали в Vectashield с DAPI (Vector, H-1200). DAPI использовали для окрашивания ядер клеток.
[00387] Образцы были обследованы с помощью флуоресцентного микроскопа Zeiss Axiophot® 2 plus, оснащенного камерой AxioCam® HRc. Типовые изображения для каждой экспериментальной группы, демонстрирующие количество и распределение NKp46+ и PD-L1+ клеток в опухоли, были собраны и изображены на фиг. 5a-5b.
[00388] В опухолях 4T1 у мышей, которым вводили носитель или анти-FGFR2 N297Q, было обнаружено небольшое количество рассеянных NKp46+ NK-клеток после 1 суток лечения, и большинство из этих клеток были расположены на периферии опухоли. (фиг. 5a.) Для сравнения, после лечения анти-FGFR2 при 10 мг/кг в течение 1 суток NKp46+NK-клетки были более многочисленны. Хотя большинство из этих клеток были обнаружены по краям опухоли, некоторые из них проникли в центр опухоли. (См. фиг. 5a.) Аналогичные результаты наблюдали на 4-е сутки после второй дозы анти-FGFR2. (Фиг. 5b.)
[00389] Окрашивание PD-L1 показало, что в опухолях 4T1 при лечении носителем или анти-FGFR2 N297Q в течение 1 суток иммунореактивность PD-L1 была обнаружена только в нескольких клетках в опухолях. (фиг. 5a.) В противоположность этому, через 24 часа после 1 дозы анти-FGFR2, PD-L1-положительные клетки были более многочисленны в центре опухоли. Аналогичные результаты наблюдали через 4 суток после начала лечения. (Фиг. 5b.)
[00390] Окрашивание CD3, CD8 и CD4 показало, что в опухолях при лечении носителем или анти-FGFR2 N297Q в течение 1 суток или 4 суток инфильтрация Т-клеток сохранялась только на периферии опухолей. Напротив, на 4-е сутки опухоли при лечении анти-FGFR2 приводили к инфильтрации CD3, CD8 и CD4-положительных Т-клеток центр опухоли. (Фиг. 6a-6b.)
[00391] В качестве независимого анализа для увеличения количества NK-клеток, мы выполняли проточную цитометрию для мышей, имеющих опухоль 4T1, которые получали 2 дозы физиологического раствора, или 10 мг/кг анти-FGFR2 или анти-FGFR2 N297Q, как описано выше. Для проточной цитометрии опухоли разрезали на кусочки размером в 1-2 мм и помещали в DMEM (минимальная эссенциальная среда Игла, модифицированная по способу Дульбекко) с 10% FBS (фетальная бычья сыворотка), 50 ед/мл ДНКаза I и 250 ед/мл коллагеназа I (Worthington Biochemical Corporation, Лейквуд, Нью-Джерси) в инкубаторе-встряхивателе в течение 30 мин при 37 °С. Клетки пропускали через нейлоновый сетчатый фильтр с диаметром пор 70 мкм, и суспензии отдельных клеток окрашивали в соответствии со стандартными протоколами с использованием антител, приобретенных у BD Biosciences (Сан-Хосе, Калифорния): CD45 (клон 30-F11) CD4, (GK1.5), и CD11b (1D3); Affymtrix eBioscience (Сан-Диего, Калифорния): CD16/32 (блокирование FC-рецептора, 93), CD335 (NKp46, 29A1.4), CD8a (53,67) и CD3e (145-2C11); R&D Systems (Миннеаполис, Миннесота): EphA2 (233720); или ThermoFisher Scientific (Гранд-Айленд, Нью-Йорк): набор Live/Dead Aqua. Клетки фиксировали и анализировали на следующий день на BD LSRII. Результаты были проанализированы с использованием FlowJo (V10, Ашленд, Орегон) со следующей стратегией гейтирования: CD45+ EphA2-, синглетные (FSC-H против FSC-A), живые клетки (отрицательные по Live/Dead) и CD11b- для выделения живых лимфоцитов. NK-клетки были гейтированы как NKp46+CD3-. CD4 и CD8 клетки были гейтированы по CD3+ клеткам, и каждая субпопуляция был выражена в процентах от CD45+ живых одиночных клеток.
[00392] Как изображено на фиг. 10а, опухоли при лечении анти-FGFR2 продемонстрировали увеличение количества NK-клеток по сравнению с опухолями, обработанными контрольным физиологическим раствором или анти-FGFR2 N297Q. Кроме того, CD3, CD8 и CD4 Т-клетки были увеличены через 24 часа после второй дозы (фиг. 7-9), и наблюдалось преимущественное увеличение соотношения лимфоидных к миелоидным клеткам при лечении анти-FGFR2 по сравнению с носителем или анти-FGFR2 N297Q (фиг. 10b-c).
Пример 2c: Воздействие анти-FGFR2-антитела, а не антитела против FGFR2 N297Q, увеличивает количество F480+ макрофагов внутри опухолевой ткани
[00393] Для выявления макрофагов в опухолях 4T1 срезы инкубировали с крысиным анти-F480 антителом (Bio-Rad AbD Serotec Inc, кат. № MCA497R) при 1: 500 в блокирующем растворе. Окрашивание NK-клеток, PD-L1 и F480 проводили на серийных срезах, так как все эти первичные антитела были получены у крыс.
[00394] В опухолях 4T1 от мышей, получавших лечение контролем, были обнаружены значительной количество F480+ макрофагов во всех опухолях (фиг. 11, верхние панели). Для сравнения, после лечения анти-FGFR2 при 10 мг/кг в течение 4 суток количество F480+ клеток, обнаруженных в опухолях, было увеличено (фиг. 11, средние панели). Этот эффект не наблюдался у мышей, имеющих опухоль 4T1, получающих лечение анти-FGFR2 антителом при 10 мг/кг в течение 1 суток или мутантным анти-FGFR2 N297Q антителом в течение 1 или 4 суток (фиг. 11, нижние панели).
Пример 3: Комбинация антитела к FGFR2 и антитела к PD-1 в модели сингенной опухоли молочной железы 4T1
[00395] В этом примере противоопухолевые эффекты комбинации афукозилированного антитела к FGFR2 (анти-FGFR2) и анти-PD-1 антитела (Bio X Cell, Западный Лебанон, Нью-Хэмпшир, США, клон RMP1-14) оценивали в 4T1-сингенной мышиной модели рака молочной железы у иммунокомпетентных мышей. Модель 4T1 демонстрирует умеренную сверхэкспрессию FGFR2-IIIb, но не амплифицированного FGFR2.
[00396] Семьдесят самок мышей BALB/c в возрасте восьми недель были приобретены у Charles River Laboratories (Уилмингтон, Массачусетс, США). Животным давали по меньшей мере 3-суточную акклиматизацию по прибытии и содержали по 5 животных на клетку со свободным доступом к пище и воде. После акклиматизации их взвешивали и брили для имплантации опухолевых клеток.
[00397] Линию опухоли молочной железы 4T1 из мышиного штамма BALB/cfC3H использовали в качестве модели опухоли и была получена из ATCC (Американская коллекция типовых культур) (Манассас, Виргиния, США: каталожный № CRL-2539). Клетки культивировали при 37 °С в среде RPMI 1640 (Mediatech, Inc., Манассас, Виргиния, США; № 10-041-CV) с 10% фетальной бычьей сывороткой, 2 мМ L-глутамина и 1% Penn/Strep (пенициллин/стрептомицин).
[00398] Каждую мышь инокулировали 5 × 104 клеток 4T1 путем ортотопической инъекции под 4-й грудной сосок (сосок молочной железы) от головы мыши. Затем объем опухолей и массу тела мышей периодически контролировали до тех пор, пока объемы опухолей не достигли 150 мм3 +/- 25 мм3. Когда опухоли достигали 150 мм3 +/- 25 мм3, мышей сортировали по размеру опухоли на четыре группы по дозам. Первой группе вводили 10 мг/кг контрольного Ig-FC (интраперитонально (и/п)), раз в две недели (BIW)), второй группе - 5 мг/кг анти-PD-1 антитела (и/п, 0, 3 и 7 сутки), третьей группе - 10 мг/кг антитела к FGFR2 (и/п, BIW) и четвертой группе - комбинацию антител против PD-1 и FGFR2 в 5 и 10 мг/кг, соответственно.
[00399] Объемы опухолей измеряли через 12 суток после имплантации (0 сутки применения препарата), через 15 суток после имплантации и через 18 суток после имплантации. На фиг. 4a и b изображено, что на 18-е сутки антитело к FGFR2 значительно уменьшало объем опухоли 4T1 у мышей (P <0,001 или P=0,01 соответственно, по t-критерию) по сравнению с группой контрольного Ig-FC. Комбинация антитела к FGFR2 с анти-PD-1 антителом дополнительно уменьшала объем опухоли на 18-е сутки по сравнению с антителом к FGFR2, применяемым отдельно (P=0,08, соответственно). (См. фиг. 4a-b.) И комбинация антитела к FGFR2 с анти-PD-1 антителом дополнительно уменьшала объем опухоли на 18-е сутки по сравнению с анти-PD-1 антителом, применяемым отдельно (P <0,01).
[00400] В целом, лечение антителом к FGFR2 приводило к ~ 25% ингибированию роста опухоли по сравнению с IgFC, в то время как лечение анти-PD-1 антителом приводила к 0% -ному ингибированию роста опухоли по сравнению с контролем. Лечение анти-FGFR2 и анти-PD-1 антителами ингибировало рост опухоли на ~ 40%, что свидетельствует о том, что комбинированная терапия имеет по меньшей мере аддитивный эффект.
[00401] В приведенной ниже таблице показан анализ фракциональных объемов опухоли (FTV) по сравнению с контрольным Fc-G1.
a: FTV=фракциональный объем опухоли=среднее значение TV (объем опухоли) в группе лечения /среднее значение TV в контрольной группе
b: Сутки после имплантации опухолевых клеток
c: Ожидаемое=(среднее значение FTV при лекарственном средстве 1) x (среднее значение FTV при лекарственном средстве 2)
d: Наблюдаемое=среднее значение FTV для комбинации лекарственного средства 1 с лекарственным средством 2
e: Указанное значение=ожидаемое (c) ÷ наблюдаемое (d); значения> 1 указывают на синергический ответ, а значения=1 указывают на аддитивный ответ и значения <1 указывают на антагонистический ответ
[00402] В этом эксперименте изучалось влияние анти-FGFR2 антител на опухолевую ткань с истощенными NK-клетками. Линию опухоли молочной железы 4T1 из мышиного штамма BALB/cfC3H использовали в качестве модели опухоли и была получена из ATCC (Американская коллекция типовых культур) (Манассас, Виргиния, США: каталожный № CRL-2539). Клетки культивировали при 37 °С в среде RPMI 1640 (Mediatech, Inc., Манассас, Виргиния, США; № 10-041-CV) с 10% фетальной бычьей сывороткой, 2 мМ L-глутамина и 1% Penn/Strep (пенициллин/стрептомицин).
[00403] Каждую мышь инокулировали 5 × 104 клеток 4T1 путем ортотопической инъекции под 4-й грудной сосок (сосок молочной железы) от головы мыши. Затем объем опухолей и массу тела мышей периодически контролировали до тех пор, пока объемы опухолей не достигли 100 мм3 +/- 25 мм3. Когда опухоли достигали 125 мм3 +/- 25 мм3, мышей сортировали по размеру опухоли на четыре группы по дозам (0 сутки). Группе 1 вводили 10 мг/кг контрольного антитела Fc-G1 человека (интраперитонально (и/п) на 0 и 3 сутки). Группе 2 вводили 50 мг/кг кроличьего анти-асиало-GM1 антитела (Wako Chemicals, Осака, Япония), в/в один раз на 0 сутки, антитело предназначено для истощения NK-клеток у мышей BalbC. Группе 3 вводили 10 мг/кг анти-FGFR2 (и/п на 0 сутки и 3 сутки). Группе 4 вводили 50 мг/кг кроличьего анти-асиало-GM1 антитела (0 сутки) в комбинации с 10 мг/кг анти-FGFR2 (и/п на 0 сутки и 3 сутки).
[00404] Для гистологии на 4-е сутки, через 24 часа после второй терапии мышей подвергали эвтаназии с помощью CO2 и затем перфузировали фосфатно-солевом буферным раствором (PBS), при pH 7,4. Вкратце, грудную клетку мыши быстро вскрывали, и использовали шприц с иглой 20-го калибра для введения 40 мл PBS в аорту через разрез в левом желудочке. Кровь и PBS спускали через отверстие в правом предсердии. Ортотопические опухоли 4T1 удаляли и погружали в 10% забуференный нейтральный формалин при 4 ° С. Через 2 часа ткани промывали 3 раза PBS и затем переносили в 30% сахарозу в PBS на ночь. На следующий день опухоли замораживали в реактиве ОСТ и хранили при -80 °С.
[00405] Из каждой опухоли изготавливали серийные срезы толщиной 20-мкм. Срезы дегидратировали на предметных стеклах Superfrost Plus (VWR) в течение 1-2 часов. Образцы пермеабилизировали c PBS, содержащим 0,3% Тритон X-100, и инкубировали в 5% нормальной козьей сыворотке в PBS 0,3% Тритон X-100 (блокирующий раствор) в течение 1 часа при комнатной температуре для блокирования неспецифического связывания антител. Через 1 час блокирующий раствор удаляли и срезы инкубировали с первичными антителами в течение ночи. Для выявления NK-клеток, срезы секции инкубировали с крысиным анти-NKp46 (CD335, Biolegend, кат. № 137602), разведенным 1: 500 в блокирующем растворе. Для выявления PD-L1, срезы инкубировали с крысиным анти-PD-L1 (eBioscience, кат. № 14-5982-82), разбавленным 1: 500 в блокирующем растворе. Для выявления CD3+ Т-клеток, срезы инкубировали с анти-CD3 антителом хомяка (BD biosciences, кат. № 553058) при 1: 500 в блокирующем растворе. Окрашивание NK-клеток и PD-L1 проводили в серийных срезах, так все эти первичные антитела были получены из крыс. Вторичные антитела только образцов отрицательного контроля инкубировали в 5% нормальной сыворотке, в отличие от первичных антител.
[00406] На следующий день после промывки PBS, содержащего 0,3% Тритон X-100, образцы инкубировали в течение 4 часов при комнатной температуре с мечеными Alexa Fluor 594 козьим антикрысиным (Jackson Immuno Research, кат. № 112-585-167) и мечеными Alexa Fluor 488 козьими анти-хомячьими (Jackson Immuno Research, кат. № 127-545-160), вторичными антителами, разведенными 1: 400 в PBS. После этого образцы промывали PBS, содержащим 0,3% Тритон X-100, затем фиксировали в 1% параформальдегиде (PFA), снова промывали PBS и фиксировали в Vectashield с DAPI (Vector, H-1200). DAPI использовали для окрашивания ядер клеток.
[00407] Образцы были обследованы с помощью флуоресцентного микроскопа Zeiss Axiophot® 2 plus, оснащенного камерой AxioCam® HRc. Типовые изображения для каждой экспериментальной группы, демонстрирующие количество и распределение NKp46+, CD3+, и PD-L1+ клеток в опухоли, были собраны и изображены на фиг. 12-14.
[00408] В опухолях 4T1 у мышей, которым вводили контрольное антитело Fc-G1, в опухоли было обнаружено минимальное количество рассеянных NKp46+ NK-клеток (фиг. 12, верхние панели). Введение кроличьего анти-асиало-GM1 антитела, проводили в дозе 50 мг/кг, уменьшало количество NKp46+NK-клеток по сравнению с контролем (фиг. 12, вторые панели). После лечения анти-FGFR2 при 10 мг/кг в течение 4 суток NKp46+NK-клетки были более многочисленными. (См. фиг. 12, третьи панели.) Но это увеличение не наблюдали, если анти-FGFR2 комбинировали с кроличьим анти-асиало-GM1 антителом и анти-FGFR2. После комбинированного лечения количество инфильтрирующих NKp46+NK клеток было сопоставимо с контролем (фиг. 12, четвертые панели).
[00409] Окрашивание CD3 показало, что в опухолях 4T1 при лечении контролем в течение 4 суток в опухоли было обнаружено несколько рассеянных CD3+ T-клеток, и большинство из них было расположено на периферии опухоли (фиг. 13, верхние панели). Лечение кроличьим анти-асиало-GM1 антителом проводили в дозе 50 мг/кг, не влияло на количество CD3+ Т-клеток по сравнению с контролем (фиг. 13, вторые панели). После лечения анти-FGFR2 при 10 мг/кг в течение 4 суток увеличивалось количество инфильтрирующих CD3+ Т-клеток (фиг. 13, третьи панели). Для сравнения, когда анти-FGFR2 комбинировали с кроличьим анти-асиало-GM1 антителом, количество инфильтрирующих CD3+ T-клеток было сопоставимо с контролем (фиг. 13, четвертые панели).
[00410] Окрашивание PD-L1 показало, что в 4T1 опухолях, получавших контроль в течение 4 суток, иммунореактивность PD-L1 была обнаружена только в редко встречающихся клетках в опухолях (фиг. 14, верхние панели). Лечение кроличьим анти-асиало-GM1 антителом не влияло на иммунореактивность PD-L1 (фиг. 14, вторые панели). Лечение только анти-FGFR2 увеличивала количество PD-L1-положительных клеток (фиг. 14, третьи панели), но когда анти-FGFR2 комбинировали с кроличьим анти-асиало-GM1 антителом, окрашивание PD-L1 было похоже на контроль (фиг. 14, четвертые панели).
Пример 4b: Ингибирование роста опухоли анти-FGFR2 антителом ослабляется в присутствии агента, который истощает NK-клетки
[00411] В этом эксперименте изучали влияние истощения NK-клеток на эффективность анти-FGFR2 в модели сингенной опухоли 4T1. Линию опухоли молочной железы 4T1 из мышиного штамма BALB/cfC3H использовали в качестве модели опухоли и была получена из ATCC (Американская коллекция типовых культур) (Манассас, Виргиния, США: каталожный № CRL-2539). Клетки культивировали при 37 °С в среде RPMI 1640 (Mediatech, Inc., Манассас, Виргиния, США; № 10-041-CV) с 10% фетальной бычьей сывороткой, 2 мМ L-глутамина и 1% Penn/Strep (пенициллин/стрептомицин).
[00412] Каждую мышь инокулировали 5 × 104 клеток 4T1 путем ортотопической инъекции под 4-й грудной сосок (сосок молочной железы) от головы мыши. Затем объем опухолей и массу тела мышей периодически контролировали до тех пор, пока объемы опухолей не достигли 100 мм3 +/- 25 мм3. Когда опухоли достигали 100 мм3 +/- 25 мм3, мышей сортировали по размеру опухоли на четыре группы по дозам (0 сутки). Группе 1 вводили PBS в качестве контроля (интраперитонально (и/п) на 0 и 3 сутки). Группе 2 вводили 50 мг/кг кроличьего анти-асиало-GM1 антитела (Wako Chemicals, Осака, Япония), в/в один раз на 0 сутки, антитело предназначено для истощения NK-клеток у мышей BalbC. Группе 3 вводили 10 мг/кг анти-FGFR2 (и/п на 0 сутки и 3 сутки). Группе 4 вводили 50 мг/кг кроличьего анти-асиало-GM1 антитела (0 сутки) в комбинации с 10 мг/кг анти-FGFR2 (и/п на 0 сутки и 3 сутки) и объем опухоли контролировали раз в две недели.
[00413] В целом, лечение анти-FGFR2 приводит к ~ 35% -ному ингибированию (P <0,01) роста опухоли по сравнению с контрольной группой PBS и группой анти-асиало-GM1 антитела (P <0,05). Лечение анти-асиало-GM1 антителом не влияло на опухолевую нагрузку по сравнению с контрольной группой PBS. Комбинация анти-асиало-GM1 антитела с анти-FGFR2 приводила к ослаблению ингибирования роста опухоли по сравнению с группой анти-FGFR2 (P <0,05), предполагая, что NK-клетки и АЗКЦ активность являются комплексными в стимулировании ингибирования роста опухоли в модели сингенной опухоли 4T1. В комбинации с данными гистологии анти-FGFR2 ингибирует 4T1 опухолевую нагрузку путем изменения микроокружения опухоли посредством врожденной и адаптивной иммунной системы.
Пример 4c: Управляемое анти-FGFR2 ингибирование роста опухоли ослабляется у мышей SC17 SCID, которые не имеют адаптивной иммунной системы
[00414] Самки мышей CB17 SCID в возрасте восьми недель были приобретены у Charles River Laboratories (Уилмингтон, Массачусетс, США). Животным давали по меньшей мере 3-суточную акклиматизацию по прибытии и содержали по 5 животных на клетку со свободным доступом к пище и воде. После акклиматизации их взвешивали и брили для имплантации опухолевых клеток.
[00415] Линию сингенной опухоли молочной железы 4T1 из мышей использовали в качестве модели опухоли и была получена из ATCC (Американская коллекция типовых культур) (Манассас, Виргиния, США: каталожный № CRL-2539). Клетки культивировали при 37 °С в среде RPMI 1640 (Mediatech, Inc., Манассас, Виргиния, США; № 10-041-CV) с 10% фетальной бычьей сывороткой, 2 мМ L-глутамина и 1% Penn/Strep, являющимся пенициллином и стрептомицином.
[00416] Каждую мышь инокулировали 5 × 104 клеток 4T1 путем ортотопической инъекции под 4-й грудной сосок (сосок молочной железы) от головы мыши. Затем объем опухолей и массу тела мышей периодически контролировали до тех пор, пока объемы опухолей не достигли 80 мм3 +/- 25 мм3. На 12 сутки, если только опухоли достигали 80 мм3 +/- 25 мм3, мышей сортировали по размеру опухоли на две группы по дозам. Первой группе вводили контроль-носитель, второй группе - 20 мг/кг афукозилированного анти-FGFR2 антитела (интраперитонально (и/п), на 12 и 15 сутки).
[00417] В отличие от ~ 30%, Р <0,001 уменьшение объема опухоли у мышей BalbC (пример 1), лечение анти-FGFR2 антителом приводит к ~ 20% ингибированию, P <0,05 роста опухоли по сравнению с контролем-носителем у мышей CB17 SCID, имеющих интактную врожденную иммунную систему (NK-клетки и макрофаги), но лишены компонентов клеток адаптивной иммунной системы (Т-клетки и В-клетки).
[00418] Эти данные свидетельствуют о том, что анти-FGFR2 антитело может стимулировать врожденные иммунные клетки, чтобы инициировать немедленное уничтожение опухолевых клеток, но мыши CB17 SCID демонстрируют сниженный ответ на лечение анти-FGFR2 антителом, вероятно, потому что они не взаимодействуют с адаптивной иммунной системой. Это еще раз демонстрируют, что анти-FGFR2 антитело действует совместно с врожденной и адаптивной иммунной системой для внесение изменений в микроокружении опухоли, что приводит к устойчивому ингибированию роста опухоли у иммунокомпетентных мышей.
ПРИМЕР 5: Отрытое исследование фазы I больных раком с прогрессирующими солидными опухолями, получавших лечение анти-FGFR2 антителом
[00419] В исследовании с повышением дозы афукозилированного антитела к FGFR2, содержащего HVR тяжелой и легкой цепи SEQ ID NO: 6-11, около 30 пациентов с любой местнораспространенной или метастатической солидной опухолью, или лимфомой и для которых стандартные методы лечения были неэффективны, получали лечение антителом каждые 2 недели в 28-суточных циклах. В части 1А исследования шести когортам пациентов вводят шесть разных уровней дозы в исследовании с повышением дозы: 0,3 мг/кг, 1 мг/кг, 3 мг/кг, 6 мг/кг, 10 мг/кг и 15 мг/кг. Пациенты оцениваются на предмет наличия дозолимитирующей токсичности в 28-суточном цикле. При наличии клинических показаний могут выполняться дополнительные 28-суточные циклы.
[00420] В части 1B дальнейшее оценивания безопасности и эффективности проводятся у не более 30 пациентов с раком желудка и/или у пациентов, у которых, как известно, амплифицированы гены FGFR2 или сверхэкспрессирует белок FGFR2b. Субъекты в этой части первоначально получат один уровень дозы ниже текущего максимального уровня дозы шести когорт в части 1А, то есть 0,3, 1, 3 или 10 мг/кг, при увеличении до 15 мг/кг в части 1В, если максимальная переносимая доза не определена в части 1А.
[00421] После того, как референтная доза будет идентифицирована в частях 1А и 1В исследования, приступают к части 2. Часть 2 включает пациентов с гистологически подтвержденным раком желудка или гастроэзофагеальным раком, или другими гистологически или цитологически подтвержденными типами солидных опухолей со (a) сверхэкспрессией FGFR2b и амплификацией FGFR2; (b) сверхэкспрессией FGFR2b без амплификации FGFR2 или (c) без сверхэкспрессии FGFR2b и с локальный рецидивирующей или метастазирующей опухолью, которая прогрессировала после стандартного лечения, или не подходит для стандартного лечения, а также с измеряемыми проявлениями заболевания, как определено при помощи RECIST версии 1.1, Пациенты сгруппированы в три когорты. Около 30 пациентов имеют рак желудка со сверхэкспрессией FGFR2b (определяемой как 3+ при помощи ИГХ анализа) и амплификацией гена FGFR2 (соотношение FGFR2 к CEN10 ≥ 2, как определено при помощи анализа FISH). Около 30 пациентов имеют рак желудка со сверхэкспрессией FGFR2b (ИГХ 3+), но в отсутствии амплификации гена FGFR2b (соотношение FISH приблизительно 1). У около 10 пациентов не наблюдалась сверхэкспрессия FGFR2b (анализ ИГХ от 0 до 2+).
[00422] Подробные цели, протокол и критерии включения/исключения для исследования включают следующее:
[00423] Основными целями являются оценка профиля безопасности повышающихся доз антитела у пациентов с прогрессирующими солидными опухолями и определение максимальной переносимой дозы (МПД) и рекомендованной дозы (РД) (часть 1А); и оценка профиля безопасности повышающихся доз антител у пациентов с раком желудка или гастроэзофагеальным раком на поздней стадии (часть 1B), обобщенно называемые в данном документе как «рак желудка». Вторичные цели заключаются в следующем: (а) охарактеризовать ФК профиль однократной и многократной доз внутривенно вводимого антитела у пациентов с раком желудка и других пациентов с солидной опухолью; (b) оценить безопасность и переносимость долгосрочного воздействия вводимого антитела; (c) оценить частоту объективного ответа (ORR) у пациентов с FGFR2b-установленным раком желудка (только часть 2); и (d) оценить продолжительность ответа у пациентов с FGFR2b-установленным раком желудка, ответивших на лечение (только часть 2).
[00424] Некоторые исследовательские цели заключаются в следующем: оценить процент пациентов со стабилизацией заболевания и продолжительность заболевания у пациентов со FGFR2b-сверхэкспрессирующими опухолями желудка или с или без амплификации FGFR2 (только часть 2); для оценки выживаемости без прогрессирования (PFS) у пациентов с FGFR2b-сверхэкспрессирующими опухолями желудка, или c или без амплификации FGFR2 (только часть 2); и (c) исследовать связь между степенью сверхэкспрессии FGFR2b и амплификации FGFR2 в опухолевой ткани и клиническим исходом.
[00425] Это состоящее из трех частей, открытое исследование безопасности, переносимости и ФК. Пациенты участвуют или в части 1 (А или В), или в части 2 исследования, но не в 1 и 2 частях. После первоначального периода скрининга до 28 суток (4 недели), пациентов лечат антителом каждые 2 недели в 28-суточных циклах. В части 1А каждый включенный пациент наблюдается в течение 28 суток для оценки безопасности и возникновения дозолимитирующей токсичности (период наблюдения ДЛТ). Дополнительные терапии можно вводить каждые 2 недели в 28-суточных циклах при наличии клинических показаний (расширенный период лечения). В части 1B пациенты получают лечение каждые 2 недели в 28-суточных циклах при текущих уровнях дозы, рассчитанных по ДЛТ, части 1А. В части 2 пациенты получаю лечение анти-FGFR2 антителом каждые 2 недели в 28-суточных циклах с рекомендованной дозой (РД), выбранной после оценки данных, полученных в частях 1А и 1В.
[00426] Часть 1А представляет собой исследование с повышением дозы у пациентов с любой местнораспространенной или метастатической солидной опухолью, или лимфомой и для которых стандартные методы лечения были неэффективны. Предполагается приблизительно 6 дозовых когорт, при этом в каждую когорту включены как минимум 3 пациента. Предполагаемые уровни дозы: 0,3 мг/кг, 1 мг/кг, 3 мг/кг, 6 мг/кг, 10 мг/кг и 15 мг/кг. После оценки безопасности и ФК параметров можно принимать решения о добавлении когорт с альтернативными уровнями доз или схемами введения доз (например, менее частое введение доз) для достижения оптимального целевого воздействия. Все решения о повышении дозы основываются на оценке ДЛТ, общей безопасности и переносимости и будут сделаны после того, как последний пациент, включенный в каждую когорту, завершит первый цикл лечения. Решения о повышения дозы будут согласованы комиссией по анализу когорт (CRC), состоящей из спонсора и исследователей. Максимальная переносимая доза (МПД) определяется как максимальная доза, при которой <33% пациентов испытывают ДЛТ во время цикла 1 (период проведения оценки безопасности и ФК). Если ДЛТ наблюдается у 1 из 3 пациентов, тогда 3 дополнительных пациента будут включены на том же уровне дозы. Повышение дозы может продолжаться до тех пор, пока 2 из 3-6 пациентов, получавших лечение на уровне дозы, не испытывают ДЛТ. Следующая нижняя доза считается МПД (максимальная переносимая доза). Альтернативно, промежуточная доза между последним рассчитанным уровнем дозы и уровнем дозы, приводящим к> 33% ДЛТ, может быть исследована до того, как будет определено, что достигнута МПД. После достижения МПД или РД, 3-10 дополнительных пациентов с раком желудка могут быть добавлены до начала части 2, чтобы дополнительно изучить безопасность и ФК на этом уровне дозы.
[00427] Следующий алгоритм используется для принятия решений об увеличении дозы в части 1А:
[00428] В том случае, если не определена МПД, уровень воздействия препарата превышает количество, которое считается необходимым на основании доклинических данных фармакологии или клинического профиля ФК, спонсор и исследователи могут принять решение о прекращении повышения дозы.
[00429] По завершении цикла 1 (период оценки безопасности и оценки ФК) части 1A пациенты могут участвовать в необязательном расширенном периоде лечения, который начинается в первый день цикла 2. Анти-FGFR2 антитело вводят каждые 2 недели в течение 4-недельных циклов до прогрессирования заболевания, неприемлемой токсичности, требования пациента или врача прекратить лечение, смерти или прекращения исследования.
[00430] Цель части 1B заключается в дальнейшей оценке безопасности и оценки ФК анти-FGFR2-антитела у пациентов с раком желудка до начала части 2. Было показано, что клиренс некоторых антител (например, бевацизумаб и трастузумаб) является более быстрым у пациентов с раком желудка, чем у пациентов с другими солидными опухолями. Включенными пациентами могут быть пациенты с раком желудка, у которых опухоли будут исследоваться ретроспективно, или те, у которых, как известно, амплифицирован ген FGFR2 или экспрессирован белок FGFR2b. Со ступенчатым повышением дозы в части 1А, пациентов в части 1B включают в когорту с одним уровнем дозы ниже когорты, которая находится в самой высокой дозе, которая изучается в части 1A. Например, если текущий уровень дозы в изучаемой части 1А составляет 3 мг/кг, включение пациентов части 1B будет на уровне дозы 1 мг/кг; если текущий уровень дозы, изучаемый в части 1А, составляет 6 мг/кг, включение пациентов части 1B будет на уровне дозы 3 мг/кг.
[00431] В части 1B приблизительно 3 пациента могут быть включены на каждый уровень дозы, с выбором спонсора и исследователей для включения до 6 пациентов на когорту по дозе. Повышение дозы может продолжаться в части 1B до 15 мг/кг, если МПД в части 1A не определена.
[00432] Включение в часть 2 начинается, когда рекомендуемая доза (РД) была определена CRC на основании общей безопасности, переносимости, ФК и оценки эффективности воздействия, экстраполированных из доклинических данных. РД может или не может совпадать с МПД, определенной в части 1A. Например, если МПД не достигнута или если экспозиция в МПД намного выше уровня, который, как полагают, требуется для эффективности, или если данные пациентов части 1В или последующие циклы лечения из обеих частей 1 (А и В) дают дополнительную информацию о профиле безопасности, тогда РД может быть другой, хотя и не выше, чем МПД. После того, как РД была установлена, пациентов с раком желудка, выбранных на основе экспрессии FGFR2b, включают в часть 2 исследования. Пациентов части 2 включают и лечат в целях дополнительной оценки безопасности и предварительной эффективности в выбранной популяции больных раком с наибольшим потенциалом клинического результата от лечения антителами. Лечение может продолжаться до прогрессирования заболевания, неприемлемой токсичности, решения пациента или врача о прекращении, смерти или прекращении исследования.
[00433] Пациенты, включенные в часть 1 (A или B) или часть 2, должны отвечать всем следующим критериям включения:
1) Понять и подписать одобренную форму информированного согласия экспертного совета организации/независимого комитета по вопросам этики в соответствии с какой-либо оценкой, проводимой в соответствии с конкретными исследованиями;
2) Ожидаемая продолжительность жизни не менее 3 месяцев;
3) Показатель общего состояния от 0 до 1 согласно критериям ECOG;
4) ≥18-летний возраст на момент подписания формы информированного согласия, за исключением пациентов на Тайване, где возраст пациента должен быть равен ≥20 на момент подписания формы информированного согласия;
5) У сексуально активных пациентов (т. е. у женщин способных к деторождению, без менопаузы, как это определено 12 последовательными месяцами аменореи или которые подвергались процедуре постоянной стерилизации и мужчин, которых не было постоянной процедуры стерилизации), готовность использовать 2 эффективных методы контрацепции, из которых один должен быть физическим барьерным методом (презерватив, диафрагма, или цервикальный колпачок/колпачок купола влагалища) до 6 месяцев после последней дозы анти-FGFR2 антитела. Другими эффективными формами контрацепции являются постоянная стерилизация (гистероэктомия и/или двусторонняя овариэктомия, или двусторонняя перевязка маточных труб с хирургическим вмешательством или вазэктомия) по меньшей мере за 6 месяцев до скрининга. Пациенты женского пола способные к деторождению должны находиться на постоянной терапии посредством оральной контрацепции или внутриматочный или имплантационный контрацептив в течение по меньшей мере 90 суток до начала исследования или воздерживаться от полового акта как образа жизни.
6) Полноценная гематологическая и биологическая функция, подтвержденная следующими лабораторными показателями:
a) Функция костного мозга
i) АКН (абсолютное количество нейтрофилов) ≥1,5×109/л
ii) Тромбоциты >100×109/л
iii) Гемоглобин ≥9 г/дл
b) Функция печени
i) Аспартат-аминотрансфераза (АСТ) и аланинаминотрансфераза (АЛТ) ≤3 верхняя граница нормы (ВГН); если метастазы в печени, то ≤5 ВГН
ii) Билирубин ≤1,5 ВГН
c) Функция почек
i) Сывороточный креатинин≤1,5 ВГН
7) Опухолевая ткань, доступная для определения экспрессии FGFR2b и амплификации FGFR2 (необязательно для пациентов части 1A).
[00434] Пациенты, включенные в часть 1A (повышение дозы) исследования, должны также соответствовать следующим критериям включения:
8) Гистологически или цитологически подтвержденная солидная опухоль или лимфома, которая является местно-рецидивирующей или метастатической и прогрессирует после стандартного лечения или не подходит для стандартного лечения;
9) Измеряемое или неизмеряемое проявление болезни.
[00435] Пациенты, включенные в часть 1B исследования, должны также соответствовать следующим критериям включения:
10) Гистологически подтвержденный рак желудка или гастроэзофагеальный рак;
11) Опухолевая ткань для предполагаемого или ретроспективного определения экспрессии FGFR2b и амплификации FGFR2;
12) Местно-рецидивирующая или метастатическая опухоль, которая прогрессировала после стандартного лечения или не подходит для стандартного лечения;
13) Измеримое проявление заболевания, как определено в RECIST версии 1.1.
[00436] Пациенты, включенные в часть 2 (повышение дозы) исследования, должны также соответствовать следующим критериям включения:
14) Гистологически подтвержденный рак желудка или гастроэзофагеальный рак с
a) сверхэкспрессией FGFR2b и амплификацией FGFR2, или
b) сверхэкспрессией FGFR2b без амплификации FGFR2, или
c) без сверхэкспрессии FGFR2b;
15) Местно-рецидивирующая или метастатическая опухоль, которая прогрессировала после стандартного лечения или не подходит для стандартного лечения;
16) Измеримое проявление заболевания, как определено в RECIST версии 1.1.
[00437] Пациенты, включенные в часть 1 (A или B) или часть 2, будут исключены, если применимы один из следующих критериев:
1) Неконтролируемые или сопровождающиеся симптомами метастазы в центральную нервную систему (ЦНС). Пациенты с бессимптомными метастазами ЦНС имеют право на участие, если они клинически стабильны в течение как минимум 4 недель и не требуют вмешательства, такого как оперативное вмешательство, облучение или любая терапия кортикостероидами для лечения симптомов, связанных с заболеванием ЦНС.
2) Нарушение функции сердца или клинически значимое сердечное заболевание, включая одно из следующих:
a) Нестабильная стенокардия ≤6 месяцев до первой запланированной дозы антитела
b) Острый инфаркт миокарда ≤6 месяцы до первой запланированной дозы антитела
3) интервал QTc > 470 мсек
4) Известный вирус иммунодефицита человека (ВИЧ) или заболевания, связанные с синдромом приобретенного иммунодефицита (СПИД), или история хронического гепатита B или C.
5) Лечение любой противоопухолевой терапией или участие в другом терапевтическом клиническом исследовании с экспериментальными препаратами≤14 суток (≤28 суток для пациентов в Корее) перед первой дозой антитела.
6) Текущие нежелательные явления от предшествующего лечения >1 степени согласно классификации CTCAE NCI (Национального института онкологии США).
a) Заболевание сетчатки или история заболевания или отслоения сетчатки или, по мнению офтальмолога, повышенный риск отслоения сетчатки
b) Имеющиеся на сегодняшний день доказательства или анамнез окклюзии вены сетчатки (RVO) или центральной серозной ретинопатии.
c) Глаукома диагностирована в течение 1 месяца до 1-х суток исследования.
d) Продолжающаяся лекарственная терапия глаукомы.
e) Предшествующая интраокулярная инъекция или лазерное лечение макулярной дегенерации.
f) Дефицит роговицы, изъязвление роговицы, кератит, кератоконус, история трансплантации роговицы или другие известные аномалии роговицы, которые могут, по мнению офтальмолога, представляют риск при лечении анти-FGFR2 антителом.
g) Пациентов с НМРЛ (немелкоклеточный рак легкого) с мутацией экзона 19 или 21 EGFR или амплификацией ALK (киназа анапластической лимфомы), которые не получали TKI (ингибитор тирозинкиназы) EGFR или ALK, соответственно (только часть 1A).
h) Пациенты с раком желудка и раком молочной железы со сверхэкспрессией HER2, которые не получали анти-HER2-нацеленную терапию.
i) Основные хирургические операции не допускаются за ≤28 дней до введения анти-FGFR2 антитела. Во всех случаях пациент должен быть в достаточной степени здоров и стабилен до начала лечения.
j) Женщины, которые беременны или кормят грудью; женщины способные к деторождению не должны задумываться о том, чтобы забеременеть во время исследования.
k) Наличие любого серьезного или нестабильного сопутствующего системного расстройства, несовместимого с клиническим исследованием (например, злоупотребление психоактивными веществами, психическое расстройство или неконтролируемое интеркуррентное заболевание, включая активную инфекцию, артериальный тромбоз и симптоматическую легочную эмболию).
l) Наличие любого другого патологического состояния, которое может увеличить риск, связанный с участием в исследовании, или может помешать интерпретации результатов исследования, и, по мнению исследователя, сделает пациента неприемлемым для начала участия в исследовании.
7) Известная аллергия или гиперчувствительность к компонентам лекарственного состава с анти-FGFR2 антителом, включая полисорбат.
8) История предшествующей злокачественной опухоли, за исключением:
a) Рак кожи, отличный от меланомы, который лечили радикальными методами или
b) Солидную опухоль лечили радикальными методами более чем 5 лет назад без признаков рецидива или
c) История другой злокачественности, которая, по мнению исследователя, не повлияет на определение эффекта лечебного лечения.
9) В части 1B и 2 (повышение дозы) предшествующее лечение любым селективным ингибитором (например, AZD4547, BGJ398, JNJ-42756493, BAY1179470) пути FGF-FGFR.
[00438] Никакие отклонения от этих критериев включения или исключения не будут предоставлены.
[00439] В части 2 будут включены следующие когорты исследований A, C, D, E и F. В когорту A будут включены около 30 пациентов с раком желудка с сильной сверхэкспрессией FGFR2b, определяемой как ИГХ 3+ ≥ 10% окрашивания опухолевых мембран. Когорта C будет включать около 10-30 пациентов с раком желудка без сверхэкспрессии FGFR2b, как определено при помощи ИГХ=0. Когорты D-F также могут быть включены. Когорта D будет включать около 30 пациентов с раком желудка с умеренной сверхэкспрессией FGFR2b, определяемой как ИГХ 2+ ≥ 10% и/или ИГХ 3+ <10% окрашивания опухолевых мембран. Когорта E будет включать около 30 пациентов с раком желудка с низкой сверхэкспрессией FGFR2b, определяемой как ИГХ 1+ и/или ИГХ 2+ <10% окрашивания опухолевых мембран. Когорта F будет включать около 30 пациентов с солидными опухолями не желудка на каждый испытуемый тип опухоли. Для пациентов с раком мочевого пузыря будет две подгруппы. Подгруппа 1 будет иметь показатели H для FGFR2b 10-19, а подгруппа 2 будет иметь показатели H для FGFR2b 20 или более.
[00440] Исследуемый препарат: Анти-FGFR2 антитело поставляется в стерильном флаконе для разбавления в инфузионном мешке для введения в исследуемый участок. В части 1А пациенты получают 2 дозы анти-FGFR2 антитела, разделенных на 2 недели. Если это допускается без прогрессирования заболевания к концу первого цикла, пациенты могут продолжить исследование в расширенном периоде лечения и получать анти-FGFR2 антитела каждые 2 недели до прогрессирования заболевания или других причин отмены исследования.
[00441] Коррекция дозы: Снижения дозы могут быть разрешены для пациентов при лечении за пределами периода ДЛТ в части 1A или для любого пациента в частях 1B или 2 при обсуждении и одобрении спонсором. Пациенты могут пропустить до 2 последовательных доз (до 6 недель между дозами) при нежелательных или других явлениях; отсутствие дополнительных доз более 6 недель при нежелательных или других явлениях потребует выведения пациента из исследования, если это разрешено спонсором исследования. Не допускается индивидуальное повышение дозы выше начальной дозы для каждого пациента в части 1 (А и В) и части 2. Если доза пациента снижается по причине, которая больше не актуальна, повышение дозы до первоначально назначенной дозы может произойти после обсуждения и утверждения спонсором.
[00442] Сопутствующая лекарственная терапия: Поддерживающая терапия (например, противорвотное средство, анальгетики для обезболивания) может использоваться по усмотрению исследователя и в соответствии с институциональными процедурами. Гематопоэтические иммуностимулирующие агенты могут использоваться при наличии показаний. Сопутствующая противораковая терапия любого вида не допускается, кроме длительных поддерживающих терапий, таких как агенты, модулирующие гормон, высвобождающих лютеинизирующий гормон (LHRH), при раке молочной железы или предстательной железы, которые могут быть продолжены, если пациент принимал эти агенты и 1) продолжающееся использование вряд ли приведет к дополнительному уменьшению размеров опухолей и 2) считается стандартной терапией для пациента.
[00443] Критерии исключения: Пациент должен быть выведен из предписанной протоколом терапии, если выполнено одно из следующих действий:
Отзыв информированного согласия по запросу пациента или его законного уполномоченного представителя;
Прогрессия болезни пациента. Пациенты, получающие клиническую пользу, несмотря на прогрессирование отдельных заболеваний, могут продолжить исследование после обсуждения с медицинским наблюдателем;
Любое явление, которое представляет собой неприемлемый риск для безопасности пациента;
Сопутствующая болезнь, которая в значительной степени повлияет на оценку клинического состояния;
Положительный тест на беременность в любое время во время исследования;
По конкретному запросу спонсора или его уполномоченного представителя (например, если исследование прекращено по соображениям безопасности пациента.
[00444] Оценка фармакокинетических параметров: У пациентов, зарегистрированных в частях 1А и 1В, проводят забор проб крови для измерения концентрации анти-FGFR2 антител в сыворотке в течение 1-го цикла на 1, 2, 4 и 8 сутки. Кроме того, образцы крови забирают как до, так и в конце инфузии на 15-е сутки цикла 1 и 1-сутки циклов 2-5, и 1-е сутки каждого другого цикла, начиная с цикла 5, а также в конце лечения. Для пациентов в части 2, образцы крови из цикла 1 забирали как до, так и в конце 1-х суток инфузии, а также на 8-е сутки. Образцы крови забираются на 15-е сутки цикла 1 и 1-е сутки циклов 2-5 и 1-е сутки каждого другого цикла, начиная с цикла 5 как до, так и в конце каждой инфузии, а также в конце лечения для изучения ФК в выбранных пациентах с раком желудка с FGFR2b-сверхэкспрессирующими опухолями с или без амплификации FGFR2. Стандартные параметры ФК определяются на основе данных о концентрации анти-FGFR2 антитела в сыворотке в зависимости от времени.
[00445] Иммуногенность: У всех пациентов в исследовании проводился забор образцов до введения дозы на 1-е сутки циклов 1-5, и на протяжении каждого цикла от цикла 5 для измерения антител против анти-FGFR2 антитела.
[00446] Оценки эффективности: Показатели эффективности включают оценки опухолей, состоящие из клинического обследования и соответствующих методов визуализации, предпочтительно сканирование компьютерной томографии (КТ) грудной клетки, брюшной полости и таза с соответствующей толщины среза согласно RECIST; другие оценки (магнитно-резонансная томография [МРТ]), рентген-анализ, позитрон-эмиссионная томография (ПЭТ) и ультразвуковое исследование), если это необходимо. Оценивания опухоли проводят при скрининге, затем каждые 6 недель после первой дозы, в течение 24 недель, а затем примерно каждые 12 недель после этого. После того, как будет отмечен начальный полный ответ (CR) или частичный ответ (PR), подтверждающие сканирования должны быть выполнены через 4-6 недель.
[00447] Оценки безопасности: Показатели безопасности включают НЯ (нежелательные явления), общий анализ крови, клиническую биохимию, анализ мочи, основные показатели состояния организма, массу тела, сопутствующие лекарственные препараты/процедуры, общее состояние онкологического больного по шкале ECOG, целевой медицинский осмотр, ЭКГ, офтальмологическое исследование/исследование сетчатки и модификации дозы анти-FGFR2 антител.
[00448] Общий охват, запланированный для этого исследования, составляет приблизительно 100-130 пациентов: приблизительно 20-30 пациентов включены в Часть 1A. В части 1B регистрируется до 30 пациентов с раком желудка. Для части 2 исследовательская активность оценивается путем регистрации одной или более из:
Когорты A: Приблизительно 30 пациентов с раком желудка со сверхэкспрессией FGFR2b (ИГХ 3+) и амплификацией FGFR2 (соотношение FISH ≥ 2);
Когорты B: Приблизительно 30 пациентов с раком желудка со сверхэкспрессией FGFR2b (ИГХ 3+) и без амплификации FGFR2 (соотношение FISH=1), чтобы охарактеризовать прогностическую ценность отбора FGFR2.
Когорты С: Около 10-30 пациентов с раком желудка без сверхэкспрессии FGFR2b, как определено при помощи ИГХ=0 до 2+.
Когорты D: Около 30 пациентов с раком желудка с умеренной сверхэкспрессией FGFR2b, определяемой как ИГХ 2+ ≥ 10% и/или ИГХ 3+ <10% окрашивания опухолевых мембран.
Когорты E: Около 30 пациентов с раком желудка с низкой сверхэкспрессией FGFR2b, определяемой как ИГХ 1+ и/или ИГХ 2+ <10% окрашивания опухолевых мембран.
Когорты F: Около 30 пациентов с солидными опухолями не желудка на каждый испытуемый тип опухоли. Для пациентов с раком мочевого пузыря будет две подгруппы. Подгруппа 1 будет иметь показатели H для FGFR2b 10-19, а подгруппа 2 будет иметь показатели H для FGFR2b 20 или более.
Пример 6: Лечение пациента с раком мочевого пузыря с использованием анти-FGFR2 антитела
[00449] В этом примере описывается лечение 76-летнего мужчины, зарегистрированного в вышеуказанном исследовании (см. пример 5), у которого был диагностирован рак мочевого пузыря в июле 2014 года после представления его основному лечащему врачу с гематурией с использованием афукозилированного антитела к FGFR2, содержащим HVR тяжелой и легкой цепи SEQ ID NO: 6-11 исследования, описанного в примере 5. Пациенту была проведена диагностическая цистоскопия и биопсия, а затем была проведена резекция первичной опухоли. Ему был поставлен как T2, N2, M0 - опухоль, проникающая в мышечную стенку, и 3 из 6 отобранных лимфатических узлов были положительными, что сделало его субъектом с 4-й стадией. Он получил 4 цикла гемцитабина и цисплатина (SOC) в условиях адъювантной терапии. В марте 2015 года, примерно через 6 месяцев после завершения адъювантной химиотерапии, пациент регулярно наблюдался с помощью ПЭТ и КТ. КТ продемонстрировала несколько увеличенных лимфатических узлов в области таза и забрюшинного пространства, в то время как ПЭТ подтвердил, что они метаболически активны и соответствуют рецидивирующему метастатическому раку мочевого пузыря (UBC). Пациент начал получать анти-FGFR2 антителов дозе 3 мг/кг примерно каждые две недели. Затем отслеживали крупнейший лимфатический узел для оценки и общей аденопатии. При первоначальном скрининге и первой дозе FGFR2 в апреле 2015 года наибольший лимфатический узел был в размере 18×12 мм. Через шесть недель наибольший измеренный узел был 15×11 мм, и 12 недель спустя был размером 9×7 мм, таким образом уменьшившись примерно на половину. В августе 2014 года заметной аденопатии не наблюдалось. Subsequent re-staging scans have confirmed no appreciable lymphadenopathy and a PET performed in November 2015 showed no abnormal metabolic activity. В настоящее время пациент продолжает терапию анти-FGFR2 антителом.
Пример 7: Иммуногистохимический анализ образцов рака мочевого пузыря на сверхэкспрессию FGFR2b
[00450] Для оценки степени сверхэкспрессии FGFR2b в популяции рака мочевого пузыря использовалась иммуногистохимическое исследование (ИГХ). Иммуногистохимическое исследование (ИГХ) проводили на нормальных образцах мочевого пузыря и архивных образцах рака уротелия (UC) с использованием мышиного антитела к αFGFR2b, содержащего мышиные вариабельные области GAL-FR21 (см. патент США № 8101723 B2). 422 фиксированных формалином и залитых парафином среза UC, как первичной, так и метастатической, в виде целых срезов или в формате метода тканевых матриц, окрашивали и определяли с использованием хромогенного субстрата. Интенсивность окрашивания опухолевых клеток оценивали по шкале от 0 до 3 баллов, в которой «0» дается, если реактивность не наблюдается или имеется мембранная реактивность только в <10% опухолевых клеток; оценка «1+» дается, если имеется слабая или едва заметная мембранная реактивность по меньшей мере в 10% опухолевых клеток или если клетки реактивны только в части их мембран; оценка «2+» дается, если есть слабая или умеренная полная, базолатеральная или латеральная мембранная реактивность по меньшей мере в 10% опухолевых клеток; и оценка «3+» дается, если имеется сильная полная базолатеральная или латеральная мембранная реактивность по меньшей мере в 10% опухолевых клеток. Опухоли с 1+ мембранной реактивностью в ≥ 10% опухолевых клеток считались положительными в этом эксперименте.
[00451] Нормальный мочевой пузырь имеет слабое окрашивание переходного эпителия (<1+). Однако анализ ИГХ из 422 архивных образцах первичного UC показал, что FGFR2b сверхэкспрессируется в > 10% образцов с интенсивностью экспрессии по крайней мере 1+.
[00452] Кроме того, в образце первичной опухоли у пациента с чувствтительным к анти-FGFR2 раком мочевого пузыря (см. пример 6) из хирургической резекции было 15% 2+ ИГХ окрашивания и 35% 1+ окрашивания антителом к FPR2-D. Это отличается от предыдущих данных пациентов с раком желудка, у которых были отобраны образцы опухоли пациентов с 3+ окрашиванием и наблюдались объективные ответы. Ответ этого пациента на анти-FGFR2 антитело (см. пример 6) и положительное ИГХ окрашивание в образцах UC в совокупности свидетельствуют о том, что этот рак мочевого пузыря является дополнительным показателем, того, что он может быть чувствительным к лечению анти-FGFR2 антителом.
Пример 8: Открытое исследование фаза I анти-FGFR2 антитела в комбинации с ниволумабом у пациентов с прогрессирующими солидными опухолями
[00453] Двухчастное, открытое, многоцентровое исследование с повышением дозы и расширением числа пациентов, получающих лечение МПД, будет проведено для оценки безопасности, переносимости, фармакокинетики (ФК), фармакодинамики (ФД) и предварительной эффективности афукозилированного антитела FGFR2, содержащего HVR тяжелой и легкой цепей SEQ ID NO: 6-11 в комбинации с ниволумабом у пациентов с прогрессирующими солидными опухолями. Каждая часть исследования будет состоять из 3 периодов: скрининг (до 28 суток), лечение и последующее наблюдение (до 100 суток). Анти-FGFR2 антитело и ниволумаб будут даваться в 1-е сутки каждого 14-суточного цикла лечения. Анти-FGFR2 антитело будет вводиться в виде в/в инфузии в течение 30 минут с последующим 30-минутным перерывом, а затем будет вводиться ниволумаб в виде в/в инфузии в течение 30 минут. Если наблюдается какая-либо реакция на инфузию 3-й или более высокой степени во время инфузии любого препарата при предлагаемой скорости инфузии, скорость инфузии будет увеличена до 60 минут для всех текущих и последующих пациентов на протяжении всего этого исследования. После завершения лечения и последующих периодов исследования будет проводиться последующее наблюдение выживаемости всех пациентов.
[00454] Исследование будет включать часть 1 с повышением дозы и часть 2 с расширением числа пациентов. Часть 1 состоит из двух запланированных дозовых когорт анти-FGFR2 антител в комбинации с ниволумабом у пациентов с раком желудка или раком гастроэзофагеального соединения (обобщенно называемые как рак желудка). Фенотипическая характеристика не потребуется для включения в исследование в часть повышения дозы этого исследования, но будет выполнена ретроспективно. Эта фенотипическая характеристика будет включать, но не ограничивается этим, анализ экспрессии FGFR2b и PD-L1 с помощью иммуногистохимического исследования (ИГХ). Каждый пациент, включенный в часть 1, будет наблюдаться в течение 28 суток (или по завершении двух 14-суточных циклов) для оценки безопасности и возникновения дозолимитирующей токсичности (период наблюдения ДЛТ). При первом появлении отсроченной ДЛТ у любого пациента, зарегистрированного в часть 1 (определяется как любое НЯ, которое возникает между 4-6 неделями после введения исследуемого препарата), все текущие и последующие периоды ДЛТ будут расширены до 42 суток (или после завершения трех 14-суточных циклов) для всех остальных и последующих пациентов, включенных в часть 1. Дополнительные терапии можно вводить каждые 2 недели в 14-суточных циклах при наличии клинических показаний (расширенный период лечения).
[00455] Часть 2 состоит из двух расширенных когорт с пациентами с прогрессирующим раком желудка. Включение в часть 2 исследования потребует проспективный ИГХ анализ экспрессии FGFR2b с использованием валидированного анализа. Пациенты, у которых опухоли положительны по FGFR2b при ИГХ, будут допущены к регистрации, если будут соблюдены другие критерии отбора. Две когорты в части 2 исследования будут определяться уровнем ИГХ-позитивности по FGFR2b в опухоли пациента. Когорта 2а будет включать пациентов, опухоли которых окрашиваются с интенсивностью 1+ или 2+ по меньшей мере в 10% опухолевых клеток. Когорта 2а будет включать пациентов, опухоли которых окрашиваются с интенсивностью 3+ по меньшей мере в 10% опухолевых клеток. Открытие каждой из этих когорт будет происходить по усмотрению спонсора. Часть исследования части 2 с расширением числа пациентов, получающих лечение МПД, является открытой. Пациенты, отвечающие всем критериям приемлемости, будут получать лечение каждые 2 недели в 14-суточных циклах анти-FGFR2 антителом в комбинации с 3 мг/кг ниволумаба в рекомендуемой дозе (РД), выбранной после оценки данных, полученных в части 1. Пациенты будут включены в часть 1 или часть 2 исследования, но не в обе.
[00456] В части 1 предполагаются две дозовые когорты, в которые включены как минимум 6 пациентов с раком желудка в каждой когорте. Запланированные уровни дозы следующие: первый пациент будет включен в уровень дозы 1:
Уровень дозы -1: 6 мг/кг анти-FGFR2 антитела+3 мг/кг ниволумаба (один раз в 2 недели)
Уровень дозы 1: 10 мг/кг анти-FGFR2 антитела+3 мг/кг ниволумаба (один раз в 2 недели)
Уровень дозы 2: 15 мг/кг анти-FGFR2 антитела+3 мг/кг ниволумаба (один раз в 2 недели)
[00457] Все решения о повышении дозы будут основаны на оценке ДЛТ, общей безопасности и переносимости и будут сделаны после того, как последний пациент, включенный в каждую когорту, завершит предписанный период наблюдения ДЛТ. Решения о повышения дозы будут согласованы комиссией по анализу когорт (CRC), состоящей из спонсора и исследователей. После оценки безопасности и ФК параметров можно принимать решения о добавлении когорт с альтернативными уровнями доз для достижения оптимального целевого воздействия. Уровень дозы -1 будет детально исследован только в том случае, если ДЛТ будет наблюдаться на уровне дозы 1, что требует изучения более низкой дозы анти-FGFR2 антитела. Самый высокий уровень дозы с наблюдаемым ≤1 ДЛТ будет считаться рекомендуемой дозой фазы 2 (РДФ2). Еще 8 пациентов будут включены в часть 1 исследования после определения РДФ2. Таким образом, в часть 1 будет включено около 20 пациентов.
[00458] По завершении периода наблюдения ДЛТ, пациенты части 1 могут участвовать в необязательном расширенном периоде лечения, который начинается в 1-е сутки цикла 2. Анти-FGFR2 антитело продолжать вводить в комбинации с ниволумабом при одинаковых дозах каждые 2 недели в течение 4-недельных циклов до прогрессирования заболевания, неприемлемой токсичности, требования пациента или врача прекратить лечение, смерти или прекращения исследования.
[00459] Чтобы дополнительно охарактеризовать безопасность и эффективность анти-FGFR2 антитела в комбинации с ниволумабом, в части 2 будет зарегистрировано приблизительно 40 пациентов с раком желудка в двух когортах, по 20 пациентов на когорту. Эти две когорты будут отличаться по степени ИГХ-позитивности опухоли на FGFR2b. Пациенты, опухоли которых оцениваются как 1+ или 2+ в ≥ 10% опухолевых клеток путем централизованной проверки (низкая или умеренная сверхэкспрессия), будут включены в когорту 2А; пациенты, чьи опухоли оцениваются как 3+ ≥ 10% опухолевых клеток, будут включены в когорту 2B. Включение в часть 2 начинается, когда рекомендуемая доза (РД) была определена CRC на основании общей безопасности и переносимости. РД может или не может совпадать с МПД, определенной в части 1 Анти-FGFR2 антитело будут вводить в комбинации с ниволумабом в РД 2 недели в течение 4-недельных циклов до прогрессирования заболевания, неприемлемой токсичности, требования пациента или врача прекратить лечение, смерти или прекращения исследования.
[00460] Если после включения и оценки первых 20 пациентов, достаточная активность, как считается, заслуживает дальнейшего исследования, то будет открыто включение для еще 20 пациентов на когорту. Открытие каждой когорты и добавление 20 пациентов к любой когорте будет происходить по усмотрению спонсора.
[00461] Пациенты, включенные в часть 2, будут иметь свою опухолевую ткань (архивную и/или недавнюю), ретроспективно протестированную на экспрессию PD-L1, с использованием проверенного иммуногистохимического анализа (ИГХ). Биопсия первичного очага опухоли или метастатического очага будет получена (насколько это возможно) до лечения и во время лечения для изучения иммунных инфильтратов и экспрессии выбранных опухолевых маркеров. Необязательная биопсия может быть получена из опухолей, которые ответили и/или прогрессировали во время или после лечения, для понимания механизмов резистентности.
[00462] Снижение дозы для анти-FGFR2 антител может быть разрешено для пациентов во время лечения лечение за пределами периода ДЛТ в части 1 или для любого пациента в части 2 в соответствии с рекомендациями, изложенными в протоколе.
[00463] В данное исследование планируется включить до 60 субъектов в из Северной Америки и Европы. Она включает 20 пациентов в части 1 с повышением дозы и приблизительно 40 пациентов в части 2 с расширением числа пациентов, получающих лечение МПД.
Критерии включения
[00464] Пациенты, включенные в часть 1 или часть 2, должны отвечать всем следующим критериям включения:
1. Понять и подписать одобренную форму информированного согласия экспертного совета организации/независимого комитета по вопросам этики в соответствии с какой-либо оценкой, проводимой в соответствии с конкретными исследованиями
2. Ожидаемая продолжительность жизни не менее 3 месяцев
3. Показатель общего состояния от 0 до 1 согласно критериям ECOG
4. ≥18-летний возраст на момент подписания формы информированного согласия
5. У сексуально активных пациентов (т. е. у женщин способных к деторождению, без менопаузы, как это определено 12 последовательными месяцами аменореи или которые подвергались процедуре постоянной стерилизации и мужчин, которых не было постоянной процедуры стерилизации), готовность использовать 2 эффективных методы контрацепции, из которых один должен быть физическим барьерным методом (презерватив, диафрагма, или цервикальный колпачок/колпачок купола влагалища) до 6 месяцев после последней дозы анти-FGFR2 антитела. Другими эффективными формами контрацепции являются постоянная стерилизация (гистероэктомия и/или двусторонняя овариэктомия, или двусторонняя перевязка маточных труб с хирургическим вмешательством или вазэктомия) по меньшей мере за 6 месяцев до скрининга. Женские пациенты детородного возраста должны находиться на устойчивой оральной контрацептивной терапии или внутриматочном или имплантационном устройстве в течение по крайней мере 90 дней до начала исследования или воздерживаться от полового акта как образа жизни.
6. Полноценная гематологическая и биологическая функция, подтвержденная следующими лабораторными показателями:
a) Функция костного мозга
АКН ≥ 1,5×109/л
Тромбоциты >100×109/л
Гемоглобин ≥ 9 г/дл
b) Функция печени
Аспартат-аминотрансфераза (АСТ) и аланинаминотрансфераза (АЛТ) ≤ 3 верхняя граница нормы (ВГН); если метастазы в печени, то ≤ 5 ВГН
Билирубин ≤ 1,5 ВГН
c) Функция почек
Креатинин сыворотки ≤ 1,5 ВГН
7. Гистологически или цитологически подтвержденным раком желудка или гастроэзофагеальный раком, который является местно-рецидивирующим или метастатическим и прогрессирует после стандартного лечения или не подходит для стандартного лечения
Пациенты, включенные в часть 1 (повышения дозы) исследования, должны также соответствовать следующим критериям включения:
7. Измеримое или пригодное для оценки заболевание
Пациенты, включенные в часть 2 (повышение дозы) исследования, должны также соответствовать следующим критериям включения:
8. Измеримое проявление заболевания, как определено в RECIST версии 1.1.
9. Опухоль положительна по экспрессии FGFR2b, как определено валидированным анализом ИГХ
10. Опухолевая ткань (архивная или недавняя) для ретроспективного определения экспрессии PD-L1
Критерии исключения
[00465] Пациенты, включенные в часть 1 или часть 2, будут исключены, если применимы один из следующих критериев:
1. Неконтролируемые или сопровождающиеся симптомами метастазы в центральную нервную систему (ЦНС). Пациенты с бессимптомными метастазами ЦНС имеют право на участие, если они клинически стабильны в течение как минимум 4 недель и не требуют вмешательства, такого как оперативное вмешательство, облучение или любая терапия кортикостероидами для лечения симптомов, связанных с заболеванием ЦНС.
2. Нарушение функции сердца или клинически значимое сердечное заболевание, включая одно из следующих:
o Нестабильная стенокардия ≤ 6 месяцев до первой запланированной дозы анти-FGFR2 антитела
o Острый инфаркт миокарда ≤ 6 месяцев до первой запланированной дозы анти-FGFR2 антитела
3. интервал QTc > 470 мсек
4. Известный факт тестирования с положительным результатом на вирус иммунодефицита человека (ВИЧ) 1 или 2 или известного синдрома приобретенного иммунодефицита (СПИД)
5. Положительный тест на поверхностный антиген вируса гепатита В (HBsAg) или обнаруживаемая рибонуклеиновая кислота вируса гепатита С (РНК ВГС), указывающие на острую или хроническую инфекцию
6. Положительный тест на латентный туберкулез (ТБ) при скрининге (квантифероновый тест) или симптомы активного туберкулеза
7. Симптоматическое интерстициальное заболевание легких или воспалительный пневмонит
8. Активное, известное или предполагаемое аутоиммунное заболевание. Пациенты с сахарным диабетом I типа, гипотиреоз, требующие только гормон-заместительную терапию, заболевания кожи (такие как витилиго, псориаз или алопеция), не требующих системного лечения, или патологические состояния, которые прогнозируемо не рецидивируют без внешнего триггера, допускаются для участия в исследовании.
9. Любое неконтролируемое воспалительное заболевание ЖКТ, включая болезнь Крона и язвенный колит
10. Антитела к лекарственному средству в анамнезе, тяжелая аллергическая, анафилактическая или другая связанная с инфузией реакция на ранее получаемый биологический агент
11. Применение иммуносупрессивных доз системных средств для лечения, таких как стероиды или местно применяемые абсорбируемые стероиды (дозы > 10 мг/сут преднизона или эквивалента ежедневно) необходимо прекратить по меньшей мере за 2 недели до введения лекарственного препарата, за исключением случаев лечения НЯ, связанных с опухолью. Пациенты с патологическим состоянием, требующим постоянного системного лечения или кортикостероидами (ингаляционными или местно применяемыми стероидами и заместительная терапия дозами адреналовых стероидов > эквивалентом преднизона в дозе 10 мг/сут), или другими иммунодепрессантами в течение 2 недель лечения допускаются при отсутствии активного аутоиммунного заболевания (за исключением пациентов с глиомой).
12. Неонкологические вакцинные терапии для профилактики инфекционных заболеваний (например, вакцины против ВПЧ) в течение 4 недель после введения лекарственного препарата. Инактивированная сезонная вакцина против гриппа может быть назначена пациентам до лечения и во время терапии без ограничений. Вакцины против гриппа, содержащие живой вирус или другие клинически показанные прививки для инфекционных заболеваний (например, пневмовакс, ветряная оспа и т.д.), могут быть разрешены, но должны обсуждаться с медицинским наблюдателем спонсора и может потребоваться период вымывания исследуемого лекарственного средства до и после введения вакцины.
13. Лечение любой противораковой терапией или участие в другом терапевтическом клиническом исследовании с исследуемыми препаратами ≤ 14 суток до первой дозы введения лекарственного препарата.
14. Текущие тяжелые нежелательные явления от предшествующего лечения >1 степени согласно классификации CTCAE NCI.
15. Пациенты с раком желудка со сверхэкспрессией HER2, которые не получали анти-HER2-нацеленную терапию.
16. Основные хирургические операции не допускаются за ≤28 суток до введения FPA144. Во всех случаях пациент должен быть в достаточной степени здоров и стабилен до начала лечения.
17. Женщины, которые беременны или кормят грудью; женщины способные к деторождению не должны задумываться о том, чтобы забеременеть во время исследования.
18. Наличие любого серьезного или нестабильного сопутствующего системного расстройства, несовместимого с клиническим исследованием (например, злоупотребление психоактивными веществами, психическое расстройство или неконтролируемое интеркуррентное заболевание, включая активную инфекцию, артериальный тромбоз и симптоматическую легочную эмболию).
19. Наличие любого другого патологического состояния, которое может увеличить риск, связанный с участием в исследовании, или может помешать интерпретации результатов исследования, и, по мнению исследователя, сделает пациента неприемлемым для начала участия в исследовании.
20. Известная аллергия или гиперчувствительность к компонентам лекарственных составов с анти-FGFR2 антителом или ниволумабом, включая полисорбат.
21. Предшествующее лечение любым селективным ингибитором (например, AZD4547, BGJ398, JNJ-42756493, BAY1179470) пути FGF-FGFR.
22. История предшествующей злокачественной опухоли, за исключением:
a) Рак кожи, отличный от меланомы, который лечили радикальными методами или
b) Солидную опухоль лечили радикальными методами более чем 5 лет назад без признаков рецидива или
c) История другой злокачественности, которая, по мнению исследователя, не повлияет на определение эффекта лечебного лечения.
[00466] Для фармакокинетического анализа образцы крови будут забирать у всех пациентов. Стандартные параметры ФК будут определять на основе данных о концентрации анти-FGFR2 антитела в зависимости от времени. Образцы крови также будут забирать для анализа на антитела к лекарственному средству (АЛС) против анти-FGFR2 антитела и ниволумаба.
[00467] Показатели эффективности включают оценки опухолей, включающие клинические обследования и соответствующих методов визуализации, предпочтительно сканирование компьютерной томографии (КТ) грудной клетки, брюшной полости и таза с соответствующей толщины среза согласно RECIST 1.1; другие оценки (магнитно-резонансная томография (МРТ), рентген-анализ, позитрон-эмиссионная томография (ПЭТ) и ультразвуковое исследование), если это необходимо. Исследования опухоли будут проводит при скрининге, затем каждые 6 недель после первой дозы, в течение 24 недель, а затем примерно каждые 12 недель после этого. После того, как будет отмечен начальный полный ответ (CR) или частичный ответ (PR), подтверждающие сканирования должны быть выполнены через 4-6 недель.
[00468] Биопсии опухолей, обязательные по возможности, будут выполнены до лечения и или через 15 суток, или через 29 суток после лечения для всех пациентов в части 2. Реализация в каждый момент времени будет оцениваться исследователем и должна включать оценку безопасности пациентов. Пациенты могут также иметь необязательную биопсию в ходе лечения после подтвержденного ответа опухоли и/или необязательную биопсию после лечения с момента подтвержденного прогрессирования опухоли после обсуждения со спонсором.
[00469] Размер выборки до приблизительно 60 субъектов основывается на дизайне исследования повышения дозы в части 1 и 20 пациентов на группу в группе лечения в части 2. Каждая отдельная группа в 2-ой части этого исследования будет продолжена двухстадийным дизайном Симонса. Предполагаемая наблюдаемая частота ответа ниволумаба в виде монотерапии при прогрессирующем раке желудка, невыбранном по экспрессии PD-L1 составляет 12%; ORR (частота объективного ответа) для анти-FGFR2 антитела может быть различным в зависимости от уровня экспрессии FGFR2b, наблюдаемого в опухоли. Для когорты 2А предполагаемый ORR для анти-FGFR2 антитела составляет 0%. Для когорты 2B ORR для монотерапии анти-FGFR2 антителом составляет 30%. Таким образом, когорта 2А не будет расширена на 20 пациентов, если из первых 20 пациентов наблюдаются <2 ответов. Для когорты 2B расширение на 20 пациентов не будет открыто, если <6 пациентов достигнут объективного ответа среди первых 20 зарегистрированных пациентов.
таблица последовательностей
[00470] В таблице ниже приведен список определенных последовательностей, приведенных в данном документе.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> FIVE PRIME THERAPEUTICS, INC.
<120> ИНГИБИТОРЫ FGFR2 ОТДЕЛЬНО ИЛИ В КОМБИНАЦИИ С
ИММУНОСТИМУЛИРУЮЩИМИ АГЕНТАМИ В ЛЕЧЕНИИ РАКА
<130> 01134-0046-00PCT
<150> US 62/258731
<151> 2015-11-23
<150> US 62/314174
<151> 2016-03-28
<150> US 62/379094
<151> 2016-08-24
<160> 46
<170> PatentIn версии 3.5
<210> 1
<211> 801
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<223> Зрелый человеческий FGFR2-IIIb
<400> 1
Arg Pro Ser Phe Ser Leu Val Glu Asp Thr Thr Leu Glu Pro Glu Glu
1 5 10 15
Pro Pro Thr Lys Tyr Gln Ile Ser Gln Pro Glu Val Tyr Val Ala Ala
20 25 30
Pro Gly Glu Ser Leu Glu Val Arg Cys Leu Leu Lys Asp Ala Ala Val
35 40 45
Ile Ser Trp Thr Lys Asp Gly Val His Leu Gly Pro Asn Asn Arg Thr
50 55 60
Val Leu Ile Gly Glu Tyr Leu Gln Ile Lys Gly Ala Thr Pro Arg Asp
65 70 75 80
Ser Gly Leu Tyr Ala Cys Thr Ala Ser Arg Thr Val Asp Ser Glu Thr
85 90 95
Trp Tyr Phe Met Val Asn Val Thr Asp Ala Ile Ser Ser Gly Asp Asp
100 105 110
Glu Asp Asp Thr Asp Gly Ala Glu Asp Phe Val Ser Glu Asn Ser Asn
115 120 125
Asn Lys Arg Ala Pro Tyr Trp Thr Asn Thr Glu Lys Met Glu Lys Arg
130 135 140
Leu His Ala Val Pro Ala Ala Asn Thr Val Lys Phe Arg Cys Pro Ala
145 150 155 160
Gly Gly Asn Pro Met Pro Thr Met Arg Trp Leu Lys Asn Gly Lys Glu
165 170 175
Phe Lys Gln Glu His Arg Ile Gly Gly Tyr Lys Val Arg Asn Gln His
180 185 190
Trp Ser Leu Ile Met Glu Ser Val Val Pro Ser Asp Lys Gly Asn Tyr
195 200 205
Thr Cys Val Val Glu Asn Glu Tyr Gly Ser Ile Asn His Thr Tyr His
210 215 220
Leu Asp Val Val Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly
225 230 235 240
Leu Pro Ala Asn Ala Ser Thr Val Val Gly Gly Asp Val Glu Phe Val
245 250 255
Cys Lys Val Tyr Ser Asp Ala Gln Pro His Ile Gln Trp Ile Lys His
260 265 270
Val Glu Lys Asn Gly Ser Lys Tyr Gly Pro Asp Gly Leu Pro Tyr Leu
275 280 285
Lys Val Leu Lys His Ser Gly Ile Asn Ser Ser Asn Ala Glu Val Leu
290 295 300
Ala Leu Phe Asn Val Thr Glu Ala Asp Ala Gly Glu Tyr Ile Cys Lys
305 310 315 320
Val Ser Asn Tyr Ile Gly Gln Ala Asn Gln Ser Ala Trp Leu Thr Val
325 330 335
Leu Pro Lys Gln Gln Ala Pro Gly Arg Glu Lys Glu Ile Thr Ala Ser
340 345 350
Pro Asp Tyr Leu Glu Ile Ala Ile Tyr Cys Ile Gly Val Phe Leu Ile
355 360 365
Ala Cys Met Val Val Thr Val Ile Leu Cys Arg Met Lys Asn Thr Thr
370 375 380
Lys Lys Pro Asp Phe Ser Ser Gln Pro Ala Val His Lys Leu Thr Lys
385 390 395 400
Arg Ile Pro Leu Arg Arg Gln Val Thr Val Ser Ala Glu Ser Ser Ser
405 410 415
Ser Met Asn Ser Asn Thr Pro Leu Val Arg Ile Thr Thr Arg Leu Ser
420 425 430
Ser Thr Ala Asp Thr Pro Met Leu Ala Gly Val Ser Glu Tyr Glu Leu
435 440 445
Pro Glu Asp Pro Lys Trp Glu Phe Pro Arg Asp Lys Leu Thr Leu Gly
450 455 460
Lys Pro Leu Gly Glu Gly Cys Phe Gly Gln Val Val Met Ala Glu Ala
465 470 475 480
Val Gly Ile Asp Lys Asp Lys Pro Lys Glu Ala Val Thr Val Ala Val
485 490 495
Lys Met Leu Lys Asp Asp Ala Thr Glu Lys Asp Leu Ser Asp Leu Val
500 505 510
Ser Glu Met Glu Met Met Lys Met Ile Gly Lys His Lys Asn Ile Ile
515 520 525
Asn Leu Leu Gly Ala Cys Thr Gln Asp Gly Pro Leu Tyr Val Ile Val
530 535 540
Glu Tyr Ala Ser Lys Gly Asn Leu Arg Glu Tyr Leu Arg Ala Arg Arg
545 550 555 560
Pro Pro Gly Met Glu Tyr Ser Tyr Asp Ile Asn Arg Val Pro Glu Glu
565 570 575
Gln Met Thr Phe Lys Asp Leu Val Ser Cys Thr Tyr Gln Leu Ala Arg
580 585 590
Gly Met Glu Tyr Leu Ala Ser Gln Lys Cys Ile His Arg Asp Leu Ala
595 600 605
Ala Arg Asn Val Leu Val Thr Glu Asn Asn Val Met Lys Ile Ala Asp
610 615 620
Phe Gly Leu Ala Arg Asp Ile Asn Asn Ile Asp Tyr Tyr Lys Lys Thr
625 630 635 640
Thr Asn Gly Arg Leu Pro Val Lys Trp Met Ala Pro Glu Ala Leu Phe
645 650 655
Asp Arg Val Tyr Thr His Gln Ser Asp Val Trp Ser Phe Gly Val Leu
660 665 670
Met Trp Glu Ile Phe Thr Leu Gly Gly Ser Pro Tyr Pro Gly Ile Pro
675 680 685
Val Glu Glu Leu Phe Lys Leu Leu Lys Glu Gly His Arg Met Asp Lys
690 695 700
Pro Ala Asn Cys Thr Asn Glu Leu Tyr Met Met Met Arg Asp Cys Trp
705 710 715 720
His Ala Val Pro Ser Gln Arg Pro Thr Phe Lys Gln Leu Val Glu Asp
725 730 735
Leu Asp Arg Ile Leu Thr Leu Thr Thr Asn Glu Glu Tyr Leu Asp Leu
740 745 750
Ser Gln Pro Leu Glu Gln Tyr Ser Pro Ser Tyr Pro Asp Thr Arg Ser
755 760 765
Ser Cys Ser Ser Gly Asp Asp Ser Val Phe Ser Pro Asp Pro Met Pro
770 775 780
Tyr Glu Pro Cys Leu Pro Gln Tyr Pro His Ile Asn Gly Ser Val Lys
785 790 795 800
Thr
<210> 2
<211> 444
<212> Белок
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь анти-FGFR2b
<220>
<221> MISC_FEATURE
<222> (294)..(294)
<223> Asn297
<400> 2
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Thr Tyr
20 25 30
Asn Val His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ser Ile Tyr Pro Asp Asn Gly Asp Thr Ser Tyr Asn Gln Asn Phe
50 55 60
Lys Gly Arg Ala Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser
115 120 125
Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys
130 135 140
Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu
145 150 155 160
Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu
165 170 175
Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr
180 185 190
Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val
195 200 205
Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 3
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> легкая цепь анти-FGFR2b
<400> 3
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Gly Val Ser Asn Asp
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln His Ser Thr Thr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 4
<211> 114
<212> Белок
<213> Искусственная последовательность
<220>
<223> Вариабельная область тяжелой цепи анти-FGFR2b
<400> 4
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Thr Tyr
20 25 30
Asn Val His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ser Ile Tyr Pro Asp Asn Gly Asp Thr Ser Tyr Asn Gln Asn Phe
50 55 60
Lys Gly Arg Ala Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 5
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Вариабельная область легкой цепи анти-FGFR2b
<400> 5
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Gly Val Ser Asn Asp
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln His Ser Thr Thr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 6
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR1 тяжелой цепи (HC) анти-FGFR2b
<400> 6
Thr Tyr Asn Val His
1 5
<210> 7
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR2 HC анти-FGFR2b
<400> 7
Ser Ile Tyr Pro Asp Asn Gly Asp Thr Ser Tyr Asn Gln Asn Phe Lys
1 5 10 15
Gly
<210> 8
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR3 HC анти-FGFR2b
<400> 8
Gly Asp Phe Ala Tyr
1 5
<210> 9
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR1 легкой цепи (LC) анти-FGFR2b
<400> 9
Lys Ala Ser Gln Gly Val Ser Asn Asp Val Ala
1 5 10
<210> 10
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR2 LC анти-FGFR2b
<400> 10
Ser Ala Ser Tyr Arg Tyr Thr
1 5
<210> 11
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> HVR3 LC анти-FGFR2b
<400> 11
Gln Gln His Ser Thr Thr Pro Tyr Thr
1 5
<210> 12
<211> 444
<212> Белок
<213> Искусственная последовательность
<220>
<223> тяжелая цепь анти-FGFR2b N297Q
<220>
<221> MISC_FEATURE
<222> (294)..(294)
<223> N297Q
<400> 12
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Thr Tyr
20 25 30
Asn Val His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ser Ile Tyr Pro Asp Asn Gly Asp Thr Ser Tyr Asn Gln Asn Phe
50 55 60
Lys Gly Arg Ala Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser
115 120 125
Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys
130 135 140
Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu
145 150 155 160
Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu
165 170 175
Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr
180 185 190
Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val
195 200 205
Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Tyr Gln Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 13
<211> 800
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<223> Зрелый человеческий FGFR2-IIIc
<400> 13
Arg Pro Ser Phe Ser Leu Val Glu Asp Thr Thr Leu Glu Pro Glu Glu
1 5 10 15
Pro Pro Thr Lys Tyr Gln Ile Ser Gln Pro Glu Val Tyr Val Ala Ala
20 25 30
Pro Gly Glu Ser Leu Glu Val Arg Cys Leu Leu Lys Asp Ala Ala Val
35 40 45
Ile Ser Trp Thr Lys Asp Gly Val His Leu Gly Pro Asn Asn Arg Thr
50 55 60
Val Leu Ile Gly Glu Tyr Leu Gln Ile Lys Gly Ala Thr Pro Arg Asp
65 70 75 80
Ser Gly Leu Tyr Ala Cys Thr Ala Ser Arg Thr Val Asp Ser Glu Thr
85 90 95
Trp Tyr Phe Met Val Asn Val Thr Asp Ala Ile Ser Ser Gly Asp Asp
100 105 110
Glu Asp Asp Thr Asp Gly Ala Glu Asp Phe Val Ser Glu Asn Ser Asn
115 120 125
Asn Lys Arg Ala Pro Tyr Trp Thr Asn Thr Glu Lys Met Glu Lys Arg
130 135 140
Leu His Ala Val Pro Ala Ala Asn Thr Val Lys Phe Arg Cys Pro Ala
145 150 155 160
Gly Gly Asn Pro Met Pro Thr Met Arg Trp Leu Lys Asn Gly Lys Glu
165 170 175
Phe Lys Gln Glu His Arg Ile Gly Gly Tyr Lys Val Arg Asn Gln His
180 185 190
Trp Ser Leu Ile Met Glu Ser Val Val Pro Ser Asp Lys Gly Asn Tyr
195 200 205
Thr Cys Val Val Glu Asn Glu Tyr Gly Ser Ile Asn His Thr Tyr His
210 215 220
Leu Asp Val Val Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly
225 230 235 240
Leu Pro Ala Asn Ala Ser Thr Val Val Gly Gly Asp Val Glu Phe Val
245 250 255
Cys Lys Val Tyr Ser Asp Ala Gln Pro His Ile Gln Trp Ile Lys His
260 265 270
Val Glu Lys Asn Gly Ser Lys Tyr Gly Pro Asp Gly Leu Pro Tyr Leu
275 280 285
Lys Val Leu Lys Ala Ala Gly Val Asn Thr Thr Asp Lys Glu Ile Glu
290 295 300
Val Leu Tyr Ile Arg Asn Val Thr Phe Glu Asp Ala Gly Glu Tyr Thr
305 310 315 320
Cys Leu Ala Gly Asn Ser Ile Gly Ile Ser Phe His Ser Ala Trp Leu
325 330 335
Thr Val Leu Pro Ala Pro Gly Arg Glu Lys Glu Ile Thr Ala Ser Pro
340 345 350
Asp Tyr Leu Glu Ile Ala Ile Tyr Cys Ile Gly Val Phe Leu Ile Ala
355 360 365
Cys Met Val Val Thr Val Ile Leu Cys Arg Met Lys Asn Thr Thr Lys
370 375 380
Lys Pro Asp Phe Ser Ser Gln Pro Ala Val His Lys Leu Thr Lys Arg
385 390 395 400
Ile Pro Leu Arg Arg Gln Val Thr Val Ser Ala Glu Ser Ser Ser Ser
405 410 415
Met Asn Ser Asn Thr Pro Leu Val Arg Ile Thr Thr Arg Leu Ser Ser
420 425 430
Thr Ala Asp Thr Pro Met Leu Ala Gly Val Ser Glu Tyr Glu Leu Pro
435 440 445
Glu Asp Pro Lys Trp Glu Phe Pro Arg Asp Lys Leu Thr Leu Gly Lys
450 455 460
Pro Leu Gly Glu Gly Cys Phe Gly Gln Val Val Met Ala Glu Ala Val
465 470 475 480
Gly Ile Asp Lys Asp Lys Pro Lys Glu Ala Val Thr Val Ala Val Lys
485 490 495
Met Leu Lys Asp Asp Ala Thr Glu Lys Asp Leu Ser Asp Leu Val Ser
500 505 510
Glu Met Glu Met Met Lys Met Ile Gly Lys His Lys Asn Ile Ile Asn
515 520 525
Leu Leu Gly Ala Cys Thr Gln Asp Gly Pro Leu Tyr Val Ile Val Glu
530 535 540
Tyr Ala Ser Lys Gly Asn Leu Arg Glu Tyr Leu Arg Ala Arg Arg Pro
545 550 555 560
Pro Gly Met Glu Tyr Ser Tyr Asp Ile Asn Arg Val Pro Glu Glu Gln
565 570 575
Met Thr Phe Lys Asp Leu Val Ser Cys Thr Tyr Gln Leu Ala Arg Gly
580 585 590
Met Glu Tyr Leu Ala Ser Gln Lys Cys Ile His Arg Asp Leu Ala Ala
595 600 605
Arg Asn Val Leu Val Thr Glu Asn Asn Val Met Lys Ile Ala Asp Phe
610 615 620
Gly Leu Ala Arg Asp Ile Asn Asn Ile Asp Tyr Tyr Lys Lys Thr Thr
625 630 635 640
Asn Gly Arg Leu Pro Val Lys Trp Met Ala Pro Glu Ala Leu Phe Asp
645 650 655
Arg Val Tyr Thr His Gln Ser Asp Val Trp Ser Phe Gly Val Leu Met
660 665 670
Trp Glu Ile Phe Thr Leu Gly Gly Ser Pro Tyr Pro Gly Ile Pro Val
675 680 685
Glu Glu Leu Phe Lys Leu Leu Lys Glu Gly His Arg Met Asp Lys Pro
690 695 700
Ala Asn Cys Thr Asn Glu Leu Tyr Met Met Met Arg Asp Cys Trp His
705 710 715 720
Ala Val Pro Ser Gln Arg Pro Thr Phe Lys Gln Leu Val Glu Asp Leu
725 730 735
Asp Arg Ile Leu Thr Leu Thr Thr Asn Glu Glu Tyr Leu Asp Leu Ser
740 745 750
Gln Pro Leu Glu Gln Tyr Ser Pro Ser Tyr Pro Asp Thr Arg Ser Ser
755 760 765
Cys Ser Ser Gly Asp Asp Ser Val Phe Ser Pro Asp Pro Met Pro Tyr
770 775 780
Glu Pro Cys Leu Pro Gln Tyr Pro His Ile Asn Gly Ser Val Lys Thr
785 790 795 800
<210> 14
<211> 356
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<223> ВКД FGFR2
<400> 14
Arg Pro Ser Phe Ser Leu Val Glu Asp Thr Thr Leu Glu Pro Glu Glu
1 5 10 15
Pro Pro Thr Lys Tyr Gln Ile Ser Gln Pro Glu Val Tyr Val Ala Ala
20 25 30
Pro Gly Glu Ser Leu Glu Val Arg Cys Leu Leu Lys Asp Ala Ala Val
35 40 45
Ile Ser Trp Thr Lys Asp Gly Val His Leu Gly Pro Asn Asn Arg Thr
50 55 60
Val Leu Ile Gly Glu Tyr Leu Gln Ile Lys Gly Ala Thr Pro Arg Asp
65 70 75 80
Ser Gly Leu Tyr Ala Cys Thr Ala Ser Arg Thr Val Asp Ser Glu Thr
85 90 95
Trp Tyr Phe Met Val Asn Val Thr Asp Ala Ile Ser Ser Gly Asp Asp
100 105 110
Glu Asp Asp Thr Asp Gly Ala Glu Asp Phe Val Ser Glu Asn Ser Asn
115 120 125
Asn Lys Arg Ala Pro Tyr Trp Thr Asn Thr Glu Lys Met Glu Lys Arg
130 135 140
Leu His Ala Val Pro Ala Ala Asn Thr Val Lys Phe Arg Cys Pro Ala
145 150 155 160
Gly Gly Asn Pro Met Pro Thr Met Arg Trp Leu Lys Asn Gly Lys Glu
165 170 175
Phe Lys Gln Glu His Arg Ile Gly Gly Tyr Lys Val Arg Asn Gln His
180 185 190
Trp Ser Leu Ile Met Glu Ser Val Val Pro Ser Asp Lys Gly Asn Tyr
195 200 205
Thr Cys Val Val Glu Asn Glu Tyr Gly Ser Ile Asn His Thr Tyr His
210 215 220
Leu Asp Val Val Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly
225 230 235 240
Leu Pro Ala Asn Ala Ser Thr Val Val Gly Gly Asp Val Glu Phe Val
245 250 255
Cys Lys Val Tyr Ser Asp Ala Gln Pro His Ile Gln Trp Ile Lys His
260 265 270
Val Glu Lys Asn Gly Ser Lys Tyr Gly Pro Asp Gly Leu Pro Tyr Leu
275 280 285
Lys Val Leu Lys Ala Ala Gly Val Asn Thr Thr Asp Lys Glu Ile Glu
290 295 300
Val Leu Tyr Ile Arg Asn Val Thr Phe Glu Asp Ala Gly Glu Tyr Thr
305 310 315 320
Cys Leu Ala Gly Asn Ser Ile Gly Ile Ser Phe His Ser Ala Trp Leu
325 330 335
Thr Val Leu Pro Ala Pro Gly Arg Glu Lys Glu Ile Thr Ala Ser Pro
340 345 350
Asp Tyr Leu Glu
355
<210> 15
<211> 353
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<223> ВКД FGFR2 дельта-3
<400> 15
Arg Pro Ser Phe Ser Leu Val Glu Asp Thr Thr Leu Glu Pro Glu Glu
1 5 10 15
Pro Pro Thr Lys Tyr Gln Ile Ser Gln Pro Glu Val Tyr Val Ala Ala
20 25 30
Pro Gly Glu Ser Leu Glu Val Arg Cys Leu Leu Lys Asp Ala Ala Val
35 40 45
Ile Ser Trp Thr Lys Asp Gly Val His Leu Gly Pro Asn Asn Arg Thr
50 55 60
Val Leu Ile Gly Glu Tyr Leu Gln Ile Lys Gly Ala Thr Pro Arg Asp
65 70 75 80
Ser Gly Leu Tyr Ala Cys Thr Ala Ser Arg Thr Val Asp Ser Glu Thr
85 90 95
Trp Tyr Phe Met Val Asn Val Thr Asp Ala Ile Ser Ser Gly Asp Asp
100 105 110
Glu Asp Asp Thr Asp Gly Ala Glu Asp Phe Val Ser Glu Asn Ser Asn
115 120 125
Asn Lys Arg Ala Pro Tyr Trp Thr Asn Thr Glu Lys Met Glu Lys Arg
130 135 140
Leu His Ala Val Pro Ala Ala Asn Thr Val Lys Phe Arg Cys Pro Ala
145 150 155 160
Gly Gly Asn Pro Met Pro Thr Met Arg Trp Leu Lys Asn Gly Lys Glu
165 170 175
Phe Lys Gln Glu His Arg Ile Gly Gly Tyr Lys Val Arg Asn Gln His
180 185 190
Trp Ser Leu Ile Met Glu Ser Val Val Pro Ser Asp Lys Gly Asn Tyr
195 200 205
Thr Cys Val Val Glu Asn Glu Tyr Gly Ser Ile Asn His Thr Tyr His
210 215 220
Leu Asp Val Val Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly
225 230 235 240
Leu Pro Ala Asn Ala Ser Thr Val Val Gly Gly Asp Val Glu Phe Val
245 250 255
Cys Lys Val Tyr Ser Asp Ala Gln Pro His Ile Gln Trp Ile Lys His
260 265 270
Val Glu Lys Asn Gly Ser Lys Tyr Gly Pro Asp Gly Leu Pro Tyr Leu
275 280 285
Lys Val Leu Lys Ala Ala Gly Val Asn Thr Thr Asp Lys Glu Ile Glu
290 295 300
Val Leu Tyr Ile Arg Asn Val Thr Phe Glu Asp Ala Gly Glu Tyr Thr
305 310 315 320
Cys Leu Ala Gly Asn Ser Ile Gly Ile Ser Phe His Ser Ala Trp Leu
325 330 335
Thr Val Leu Pro Ala Pro Gly Arg Glu Lys Glu Ile Thr Ala Ser Pro
340 345 350
Asp
<210> 16
<211> 352
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<223> ВКД FGFR2 дельта-4
<400> 16
Arg Pro Ser Phe Ser Leu Val Glu Asp Thr Thr Leu Glu Pro Glu Glu
1 5 10 15
Pro Pro Thr Lys Tyr Gln Ile Ser Gln Pro Glu Val Tyr Val Ala Ala
20 25 30
Pro Gly Glu Ser Leu Glu Val Arg Cys Leu Leu Lys Asp Ala Ala Val
35 40 45
Ile Ser Trp Thr Lys Asp Gly Val His Leu Gly Pro Asn Asn Arg Thr
50 55 60
Val Leu Ile Gly Glu Tyr Leu Gln Ile Lys Gly Ala Thr Pro Arg Asp
65 70 75 80
Ser Gly Leu Tyr Ala Cys Thr Ala Ser Arg Thr Val Asp Ser Glu Thr
85 90 95
Trp Tyr Phe Met Val Asn Val Thr Asp Ala Ile Ser Ser Gly Asp Asp
100 105 110
Glu Asp Asp Thr Asp Gly Ala Glu Asp Phe Val Ser Glu Asn Ser Asn
115 120 125
Asn Lys Arg Ala Pro Tyr Trp Thr Asn Thr Glu Lys Met Glu Lys Arg
130 135 140
Leu His Ala Val Pro Ala Ala Asn Thr Val Lys Phe Arg Cys Pro Ala
145 150 155 160
Gly Gly Asn Pro Met Pro Thr Met Arg Trp Leu Lys Asn Gly Lys Glu
165 170 175
Phe Lys Gln Glu His Arg Ile Gly Gly Tyr Lys Val Arg Asn Gln His
180 185 190
Trp Ser Leu Ile Met Glu Ser Val Val Pro Ser Asp Lys Gly Asn Tyr
195 200 205
Thr Cys Val Val Glu Asn Glu Tyr Gly Ser Ile Asn His Thr Tyr His
210 215 220
Leu Asp Val Val Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly
225 230 235 240
Leu Pro Ala Asn Ala Ser Thr Val Val Gly Gly Asp Val Glu Phe Val
245 250 255
Cys Lys Val Tyr Ser Asp Ala Gln Pro His Ile Gln Trp Ile Lys His
260 265 270
Val Glu Lys Asn Gly Ser Lys Tyr Gly Pro Asp Gly Leu Pro Tyr Leu
275 280 285
Lys Val Leu Lys Ala Ala Gly Val Asn Thr Thr Asp Lys Glu Ile Glu
290 295 300
Val Leu Tyr Ile Arg Asn Val Thr Phe Glu Asp Ala Gly Glu Tyr Thr
305 310 315 320
Cys Leu Ala Gly Asn Ser Ile Gly Ile Ser Phe His Ser Ala Trp Leu
325 330 335
Thr Val Leu Pro Ala Pro Gly Arg Glu Lys Glu Ile Thr Ala Ser Pro
340 345 350
<210> 17
<211> 351
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<223> ВКД FGFR2 дельта-5
<400> 17
Arg Pro Ser Phe Ser Leu Val Glu Asp Thr Thr Leu Glu Pro Glu Glu
1 5 10 15
Pro Pro Thr Lys Tyr Gln Ile Ser Gln Pro Glu Val Tyr Val Ala Ala
20 25 30
Pro Gly Glu Ser Leu Glu Val Arg Cys Leu Leu Lys Asp Ala Ala Val
35 40 45
Ile Ser Trp Thr Lys Asp Gly Val His Leu Gly Pro Asn Asn Arg Thr
50 55 60
Val Leu Ile Gly Glu Tyr Leu Gln Ile Lys Gly Ala Thr Pro Arg Asp
65 70 75 80
Ser Gly Leu Tyr Ala Cys Thr Ala Ser Arg Thr Val Asp Ser Glu Thr
85 90 95
Trp Tyr Phe Met Val Asn Val Thr Asp Ala Ile Ser Ser Gly Asp Asp
100 105 110
Glu Asp Asp Thr Asp Gly Ala Glu Asp Phe Val Ser Glu Asn Ser Asn
115 120 125
Asn Lys Arg Ala Pro Tyr Trp Thr Asn Thr Glu Lys Met Glu Lys Arg
130 135 140
Leu His Ala Val Pro Ala Ala Asn Thr Val Lys Phe Arg Cys Pro Ala
145 150 155 160
Gly Gly Asn Pro Met Pro Thr Met Arg Trp Leu Lys Asn Gly Lys Glu
165 170 175
Phe Lys Gln Glu His Arg Ile Gly Gly Tyr Lys Val Arg Asn Gln His
180 185 190
Trp Ser Leu Ile Met Glu Ser Val Val Pro Ser Asp Lys Gly Asn Tyr
195 200 205
Thr Cys Val Val Glu Asn Glu Tyr Gly Ser Ile Asn His Thr Tyr His
210 215 220
Leu Asp Val Val Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly
225 230 235 240
Leu Pro Ala Asn Ala Ser Thr Val Val Gly Gly Asp Val Glu Phe Val
245 250 255
Cys Lys Val Tyr Ser Asp Ala Gln Pro His Ile Gln Trp Ile Lys His
260 265 270
Val Glu Lys Asn Gly Ser Lys Tyr Gly Pro Asp Gly Leu Pro Tyr Leu
275 280 285
Lys Val Leu Lys Ala Ala Gly Val Asn Thr Thr Asp Lys Glu Ile Glu
290 295 300
Val Leu Tyr Ile Arg Asn Val Thr Phe Glu Asp Ala Gly Glu Tyr Thr
305 310 315 320
Cys Leu Ala Gly Asn Ser Ile Gly Ile Ser Phe His Ser Ala Trp Leu
325 330 335
Thr Val Leu Pro Ala Pro Gly Arg Glu Lys Glu Ile Thr Ala Ser
340 345 350
<210> 18
<211> 348
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<223> ВКД FGFR2 дельта-8
<400> 18
Arg Pro Ser Phe Ser Leu Val Glu Asp Thr Thr Leu Glu Pro Glu Glu
1 5 10 15
Pro Pro Thr Lys Tyr Gln Ile Ser Gln Pro Glu Val Tyr Val Ala Ala
20 25 30
Pro Gly Glu Ser Leu Glu Val Arg Cys Leu Leu Lys Asp Ala Ala Val
35 40 45
Ile Ser Trp Thr Lys Asp Gly Val His Leu Gly Pro Asn Asn Arg Thr
50 55 60
Val Leu Ile Gly Glu Tyr Leu Gln Ile Lys Gly Ala Thr Pro Arg Asp
65 70 75 80
Ser Gly Leu Tyr Ala Cys Thr Ala Ser Arg Thr Val Asp Ser Glu Thr
85 90 95
Trp Tyr Phe Met Val Asn Val Thr Asp Ala Ile Ser Ser Gly Asp Asp
100 105 110
Glu Asp Asp Thr Asp Gly Ala Glu Asp Phe Val Ser Glu Asn Ser Asn
115 120 125
Asn Lys Arg Ala Pro Tyr Trp Thr Asn Thr Glu Lys Met Glu Lys Arg
130 135 140
Leu His Ala Val Pro Ala Ala Asn Thr Val Lys Phe Arg Cys Pro Ala
145 150 155 160
Gly Gly Asn Pro Met Pro Thr Met Arg Trp Leu Lys Asn Gly Lys Glu
165 170 175
Phe Lys Gln Glu His Arg Ile Gly Gly Tyr Lys Val Arg Asn Gln His
180 185 190
Trp Ser Leu Ile Met Glu Ser Val Val Pro Ser Asp Lys Gly Asn Tyr
195 200 205
Thr Cys Val Val Glu Asn Glu Tyr Gly Ser Ile Asn His Thr Tyr His
210 215 220
Leu Asp Val Val Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly
225 230 235 240
Leu Pro Ala Asn Ala Ser Thr Val Val Gly Gly Asp Val Glu Phe Val
245 250 255
Cys Lys Val Tyr Ser Asp Ala Gln Pro His Ile Gln Trp Ile Lys His
260 265 270
Val Glu Lys Asn Gly Ser Lys Tyr Gly Pro Asp Gly Leu Pro Tyr Leu
275 280 285
Lys Val Leu Lys Ala Ala Gly Val Asn Thr Thr Asp Lys Glu Ile Glu
290 295 300
Val Leu Tyr Ile Arg Asn Val Thr Phe Glu Asp Ala Gly Glu Tyr Thr
305 310 315 320
Cys Leu Ala Gly Asn Ser Ile Gly Ile Ser Phe His Ser Ala Trp Leu
325 330 335
Thr Val Leu Pro Ala Pro Gly Arg Glu Lys Glu Ile
340 345
<210> 19
<211> 347
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<223> ВКД FGFR2 дельта-9
<400> 19
Arg Pro Ser Phe Ser Leu Val Glu Asp Thr Thr Leu Glu Pro Glu Glu
1 5 10 15
Pro Pro Thr Lys Tyr Gln Ile Ser Gln Pro Glu Val Tyr Val Ala Ala
20 25 30
Pro Gly Glu Ser Leu Glu Val Arg Cys Leu Leu Lys Asp Ala Ala Val
35 40 45
Ile Ser Trp Thr Lys Asp Gly Val His Leu Gly Pro Asn Asn Arg Thr
50 55 60
Val Leu Ile Gly Glu Tyr Leu Gln Ile Lys Gly Ala Thr Pro Arg Asp
65 70 75 80
Ser Gly Leu Tyr Ala Cys Thr Ala Ser Arg Thr Val Asp Ser Glu Thr
85 90 95
Trp Tyr Phe Met Val Asn Val Thr Asp Ala Ile Ser Ser Gly Asp Asp
100 105 110
Glu Asp Asp Thr Asp Gly Ala Glu Asp Phe Val Ser Glu Asn Ser Asn
115 120 125
Asn Lys Arg Ala Pro Tyr Trp Thr Asn Thr Glu Lys Met Glu Lys Arg
130 135 140
Leu His Ala Val Pro Ala Ala Asn Thr Val Lys Phe Arg Cys Pro Ala
145 150 155 160
Gly Gly Asn Pro Met Pro Thr Met Arg Trp Leu Lys Asn Gly Lys Glu
165 170 175
Phe Lys Gln Glu His Arg Ile Gly Gly Tyr Lys Val Arg Asn Gln His
180 185 190
Trp Ser Leu Ile Met Glu Ser Val Val Pro Ser Asp Lys Gly Asn Tyr
195 200 205
Thr Cys Val Val Glu Asn Glu Tyr Gly Ser Ile Asn His Thr Tyr His
210 215 220
Leu Asp Val Val Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly
225 230 235 240
Leu Pro Ala Asn Ala Ser Thr Val Val Gly Gly Asp Val Glu Phe Val
245 250 255
Cys Lys Val Tyr Ser Asp Ala Gln Pro His Ile Gln Trp Ile Lys His
260 265 270
Val Glu Lys Asn Gly Ser Lys Tyr Gly Pro Asp Gly Leu Pro Tyr Leu
275 280 285
Lys Val Leu Lys Ala Ala Gly Val Asn Thr Thr Asp Lys Glu Ile Glu
290 295 300
Val Leu Tyr Ile Arg Asn Val Thr Phe Glu Asp Ala Gly Glu Tyr Thr
305 310 315 320
Cys Leu Ala Gly Asn Ser Ile Gly Ile Ser Phe His Ser Ala Trp Leu
325 330 335
Thr Val Leu Pro Ala Pro Gly Arg Glu Lys Glu
340 345
<210> 20
<211> 346
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<223> ВКД FGFR2 дельта-10
<400> 20
Arg Pro Ser Phe Ser Leu Val Glu Asp Thr Thr Leu Glu Pro Glu Glu
1 5 10 15
Pro Pro Thr Lys Tyr Gln Ile Ser Gln Pro Glu Val Tyr Val Ala Ala
20 25 30
Pro Gly Glu Ser Leu Glu Val Arg Cys Leu Leu Lys Asp Ala Ala Val
35 40 45
Ile Ser Trp Thr Lys Asp Gly Val His Leu Gly Pro Asn Asn Arg Thr
50 55 60
Val Leu Ile Gly Glu Tyr Leu Gln Ile Lys Gly Ala Thr Pro Arg Asp
65 70 75 80
Ser Gly Leu Tyr Ala Cys Thr Ala Ser Arg Thr Val Asp Ser Glu Thr
85 90 95
Trp Tyr Phe Met Val Asn Val Thr Asp Ala Ile Ser Ser Gly Asp Asp
100 105 110
Glu Asp Asp Thr Asp Gly Ala Glu Asp Phe Val Ser Glu Asn Ser Asn
115 120 125
Asn Lys Arg Ala Pro Tyr Trp Thr Asn Thr Glu Lys Met Glu Lys Arg
130 135 140
Leu His Ala Val Pro Ala Ala Asn Thr Val Lys Phe Arg Cys Pro Ala
145 150 155 160
Gly Gly Asn Pro Met Pro Thr Met Arg Trp Leu Lys Asn Gly Lys Glu
165 170 175
Phe Lys Gln Glu His Arg Ile Gly Gly Tyr Lys Val Arg Asn Gln His
180 185 190
Trp Ser Leu Ile Met Glu Ser Val Val Pro Ser Asp Lys Gly Asn Tyr
195 200 205
Thr Cys Val Val Glu Asn Glu Tyr Gly Ser Ile Asn His Thr Tyr His
210 215 220
Leu Asp Val Val Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly
225 230 235 240
Leu Pro Ala Asn Ala Ser Thr Val Val Gly Gly Asp Val Glu Phe Val
245 250 255
Cys Lys Val Tyr Ser Asp Ala Gln Pro His Ile Gln Trp Ile Lys His
260 265 270
Val Glu Lys Asn Gly Ser Lys Tyr Gly Pro Asp Gly Leu Pro Tyr Leu
275 280 285
Lys Val Leu Lys Ala Ala Gly Val Asn Thr Thr Asp Lys Glu Ile Glu
290 295 300
Val Leu Tyr Ile Arg Asn Val Thr Phe Glu Asp Ala Gly Glu Tyr Thr
305 310 315 320
Cys Leu Ala Gly Asn Ser Ile Gly Ile Ser Phe His Ser Ala Trp Leu
325 330 335
Thr Val Leu Pro Ala Pro Gly Arg Glu Lys
340 345
<210> 21
<211> 342
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<223> ВКД FGFR2 дельта-14
<400> 21
Arg Pro Ser Phe Ser Leu Val Glu Asp Thr Thr Leu Glu Pro Glu Glu
1 5 10 15
Pro Pro Thr Lys Tyr Gln Ile Ser Gln Pro Glu Val Tyr Val Ala Ala
20 25 30
Pro Gly Glu Ser Leu Glu Val Arg Cys Leu Leu Lys Asp Ala Ala Val
35 40 45
Ile Ser Trp Thr Lys Asp Gly Val His Leu Gly Pro Asn Asn Arg Thr
50 55 60
Val Leu Ile Gly Glu Tyr Leu Gln Ile Lys Gly Ala Thr Pro Arg Asp
65 70 75 80
Ser Gly Leu Tyr Ala Cys Thr Ala Ser Arg Thr Val Asp Ser Glu Thr
85 90 95
Trp Tyr Phe Met Val Asn Val Thr Asp Ala Ile Ser Ser Gly Asp Asp
100 105 110
Glu Asp Asp Thr Asp Gly Ala Glu Asp Phe Val Ser Glu Asn Ser Asn
115 120 125
Asn Lys Arg Ala Pro Tyr Trp Thr Asn Thr Glu Lys Met Glu Lys Arg
130 135 140
Leu His Ala Val Pro Ala Ala Asn Thr Val Lys Phe Arg Cys Pro Ala
145 150 155 160
Gly Gly Asn Pro Met Pro Thr Met Arg Trp Leu Lys Asn Gly Lys Glu
165 170 175
Phe Lys Gln Glu His Arg Ile Gly Gly Tyr Lys Val Arg Asn Gln His
180 185 190
Trp Ser Leu Ile Met Glu Ser Val Val Pro Ser Asp Lys Gly Asn Tyr
195 200 205
Thr Cys Val Val Glu Asn Glu Tyr Gly Ser Ile Asn His Thr Tyr His
210 215 220
Leu Asp Val Val Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly
225 230 235 240
Leu Pro Ala Asn Ala Ser Thr Val Val Gly Gly Asp Val Glu Phe Val
245 250 255
Cys Lys Val Tyr Ser Asp Ala Gln Pro His Ile Gln Trp Ile Lys His
260 265 270
Val Glu Lys Asn Gly Ser Lys Tyr Gly Pro Asp Gly Leu Pro Tyr Leu
275 280 285
Lys Val Leu Lys Ala Ala Gly Val Asn Thr Thr Asp Lys Glu Ile Glu
290 295 300
Val Leu Tyr Ile Arg Asn Val Thr Phe Glu Asp Ala Gly Glu Tyr Thr
305 310 315 320
Cys Leu Ala Gly Asn Ser Ile Gly Ile Ser Phe His Ser Ala Trp Leu
325 330 335
Thr Val Leu Pro Ala Pro
340
<210> 22
<211> 341
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<223> ВКД FGFR2 дельта-15
<400> 22
Arg Pro Ser Phe Ser Leu Val Glu Asp Thr Thr Leu Glu Pro Glu Glu
1 5 10 15
Pro Pro Thr Lys Tyr Gln Ile Ser Gln Pro Glu Val Tyr Val Ala Ala
20 25 30
Pro Gly Glu Ser Leu Glu Val Arg Cys Leu Leu Lys Asp Ala Ala Val
35 40 45
Ile Ser Trp Thr Lys Asp Gly Val His Leu Gly Pro Asn Asn Arg Thr
50 55 60
Val Leu Ile Gly Glu Tyr Leu Gln Ile Lys Gly Ala Thr Pro Arg Asp
65 70 75 80
Ser Gly Leu Tyr Ala Cys Thr Ala Ser Arg Thr Val Asp Ser Glu Thr
85 90 95
Trp Tyr Phe Met Val Asn Val Thr Asp Ala Ile Ser Ser Gly Asp Asp
100 105 110
Glu Asp Asp Thr Asp Gly Ala Glu Asp Phe Val Ser Glu Asn Ser Asn
115 120 125
Asn Lys Arg Ala Pro Tyr Trp Thr Asn Thr Glu Lys Met Glu Lys Arg
130 135 140
Leu His Ala Val Pro Ala Ala Asn Thr Val Lys Phe Arg Cys Pro Ala
145 150 155 160
Gly Gly Asn Pro Met Pro Thr Met Arg Trp Leu Lys Asn Gly Lys Glu
165 170 175
Phe Lys Gln Glu His Arg Ile Gly Gly Tyr Lys Val Arg Asn Gln His
180 185 190
Trp Ser Leu Ile Met Glu Ser Val Val Pro Ser Asp Lys Gly Asn Tyr
195 200 205
Thr Cys Val Val Glu Asn Glu Tyr Gly Ser Ile Asn His Thr Tyr His
210 215 220
Leu Asp Val Val Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly
225 230 235 240
Leu Pro Ala Asn Ala Ser Thr Val Val Gly Gly Asp Val Glu Phe Val
245 250 255
Cys Lys Val Tyr Ser Asp Ala Gln Pro His Ile Gln Trp Ile Lys His
260 265 270
Val Glu Lys Asn Gly Ser Lys Tyr Gly Pro Asp Gly Leu Pro Tyr Leu
275 280 285
Lys Val Leu Lys Ala Ala Gly Val Asn Thr Thr Asp Lys Glu Ile Glu
290 295 300
Val Leu Tyr Ile Arg Asn Val Thr Phe Glu Asp Ala Gly Glu Tyr Thr
305 310 315 320
Cys Leu Ala Gly Asn Ser Ile Gly Ile Ser Phe His Ser Ala Trp Leu
325 330 335
Thr Val Leu Pro Ala
340
<210> 23
<211> 340
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<223> ВКД FGFR2 дельта-16
<400> 23
Arg Pro Ser Phe Ser Leu Val Glu Asp Thr Thr Leu Glu Pro Glu Glu
1 5 10 15
Pro Pro Thr Lys Tyr Gln Ile Ser Gln Pro Glu Val Tyr Val Ala Ala
20 25 30
Pro Gly Glu Ser Leu Glu Val Arg Cys Leu Leu Lys Asp Ala Ala Val
35 40 45
Ile Ser Trp Thr Lys Asp Gly Val His Leu Gly Pro Asn Asn Arg Thr
50 55 60
Val Leu Ile Gly Glu Tyr Leu Gln Ile Lys Gly Ala Thr Pro Arg Asp
65 70 75 80
Ser Gly Leu Tyr Ala Cys Thr Ala Ser Arg Thr Val Asp Ser Glu Thr
85 90 95
Trp Tyr Phe Met Val Asn Val Thr Asp Ala Ile Ser Ser Gly Asp Asp
100 105 110
Glu Asp Asp Thr Asp Gly Ala Glu Asp Phe Val Ser Glu Asn Ser Asn
115 120 125
Asn Lys Arg Ala Pro Tyr Trp Thr Asn Thr Glu Lys Met Glu Lys Arg
130 135 140
Leu His Ala Val Pro Ala Ala Asn Thr Val Lys Phe Arg Cys Pro Ala
145 150 155 160
Gly Gly Asn Pro Met Pro Thr Met Arg Trp Leu Lys Asn Gly Lys Glu
165 170 175
Phe Lys Gln Glu His Arg Ile Gly Gly Tyr Lys Val Arg Asn Gln His
180 185 190
Trp Ser Leu Ile Met Glu Ser Val Val Pro Ser Asp Lys Gly Asn Tyr
195 200 205
Thr Cys Val Val Glu Asn Glu Tyr Gly Ser Ile Asn His Thr Tyr His
210 215 220
Leu Asp Val Val Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly
225 230 235 240
Leu Pro Ala Asn Ala Ser Thr Val Val Gly Gly Asp Val Glu Phe Val
245 250 255
Cys Lys Val Tyr Ser Asp Ala Gln Pro His Ile Gln Trp Ile Lys His
260 265 270
Val Glu Lys Asn Gly Ser Lys Tyr Gly Pro Asp Gly Leu Pro Tyr Leu
275 280 285
Lys Val Leu Lys Ala Ala Gly Val Asn Thr Thr Asp Lys Glu Ile Glu
290 295 300
Val Leu Tyr Ile Arg Asn Val Thr Phe Glu Asp Ala Gly Glu Tyr Thr
305 310 315 320
Cys Leu Ala Gly Asn Ser Ile Gly Ile Ser Phe His Ser Ala Trp Leu
325 330 335
Thr Val Leu Pro
340
<210> 24
<211> 339
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<223> ВКД FGFR2 дельта-17
<400> 24
Arg Pro Ser Phe Ser Leu Val Glu Asp Thr Thr Leu Glu Pro Glu Glu
1 5 10 15
Pro Pro Thr Lys Tyr Gln Ile Ser Gln Pro Glu Val Tyr Val Ala Ala
20 25 30
Pro Gly Glu Ser Leu Glu Val Arg Cys Leu Leu Lys Asp Ala Ala Val
35 40 45
Ile Ser Trp Thr Lys Asp Gly Val His Leu Gly Pro Asn Asn Arg Thr
50 55 60
Val Leu Ile Gly Glu Tyr Leu Gln Ile Lys Gly Ala Thr Pro Arg Asp
65 70 75 80
Ser Gly Leu Tyr Ala Cys Thr Ala Ser Arg Thr Val Asp Ser Glu Thr
85 90 95
Trp Tyr Phe Met Val Asn Val Thr Asp Ala Ile Ser Ser Gly Asp Asp
100 105 110
Glu Asp Asp Thr Asp Gly Ala Glu Asp Phe Val Ser Glu Asn Ser Asn
115 120 125
Asn Lys Arg Ala Pro Tyr Trp Thr Asn Thr Glu Lys Met Glu Lys Arg
130 135 140
Leu His Ala Val Pro Ala Ala Asn Thr Val Lys Phe Arg Cys Pro Ala
145 150 155 160
Gly Gly Asn Pro Met Pro Thr Met Arg Trp Leu Lys Asn Gly Lys Glu
165 170 175
Phe Lys Gln Glu His Arg Ile Gly Gly Tyr Lys Val Arg Asn Gln His
180 185 190
Trp Ser Leu Ile Met Glu Ser Val Val Pro Ser Asp Lys Gly Asn Tyr
195 200 205
Thr Cys Val Val Glu Asn Glu Tyr Gly Ser Ile Asn His Thr Tyr His
210 215 220
Leu Asp Val Val Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly
225 230 235 240
Leu Pro Ala Asn Ala Ser Thr Val Val Gly Gly Asp Val Glu Phe Val
245 250 255
Cys Lys Val Tyr Ser Asp Ala Gln Pro His Ile Gln Trp Ile Lys His
260 265 270
Val Glu Lys Asn Gly Ser Lys Tyr Gly Pro Asp Gly Leu Pro Tyr Leu
275 280 285
Lys Val Leu Lys Ala Ala Gly Val Asn Thr Thr Asp Lys Glu Ile Glu
290 295 300
Val Leu Tyr Ile Arg Asn Val Thr Phe Glu Asp Ala Gly Glu Tyr Thr
305 310 315 320
Cys Leu Ala Gly Asn Ser Ile Gly Ile Ser Phe His Ser Ala Trp Leu
325 330 335
Thr Val Leu
<210> 25
<211> 232
<212> Белок
<213> Искусственная последовательность
<220>
<223> Fc C237S
<400> 25
Glu Pro Lys Ser Ser Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
1 5 10 15
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
20 25 30
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
35 40 45
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
50 55 60
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
65 70 75 80
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
85 90 95
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
100 105 110
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
115 120 125
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr
130 135 140
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
145 150 155 160
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
165 170 175
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
180 185 190
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
195 200 205
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
210 215 220
Ser Leu Ser Leu Ser Pro Gly Lys
225 230
<210> 26
<211> 228
<212> Белок
<213> Искусственная последовательность
<220>
<223> Fc
<400> 26
Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val
1 5 10 15
Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
20 25 30
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
35 40 45
His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
50 55 60
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
65 70 75 80
Phe Arg Val Val Ser Val Leu Thr Val Val His Gln Asp Trp Leu Asn
85 90 95
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Pro
100 105 110
Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln
115 120 125
Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val
130 135 140
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
145 150 155 160
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
165 170 175
Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
180 185 190
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
195 200 205
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
210 215 220
Ser Pro Gly Lys
225
<210> 27
<211> 229
<212> Белок
<213> Искусственная последовательность
<220>
<223> Fc
<400> 27
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 28
<211> 8
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<223> FGFR2(111-118)
<400> 28
Asp Asp Glu Asp Asp Thr Asp Gly
1 5
<210> 29
<211> 8
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<223> FGFR1(105-112)
<400> 29
Glu Asp Asp Asp Asp Asp Asp Asp
1 5
<210> 30
<211> 356
<212> Белок
<213> Искусственная последовательность
<220>
<223> ВКД FGFR2 с R2(111-118) заменен R1(105-112)
<400> 30
Arg Pro Ser Phe Ser Leu Val Glu Asp Thr Thr Leu Glu Pro Glu Glu
1 5 10 15
Pro Pro Thr Lys Tyr Gln Ile Ser Gln Pro Glu Val Tyr Val Ala Ala
20 25 30
Pro Gly Glu Ser Leu Glu Val Arg Cys Leu Leu Lys Asp Ala Ala Val
35 40 45
Ile Ser Trp Thr Lys Asp Gly Val His Leu Gly Pro Asn Asn Arg Thr
50 55 60
Val Leu Ile Gly Glu Tyr Leu Gln Ile Lys Gly Ala Thr Pro Arg Asp
65 70 75 80
Ser Gly Leu Tyr Ala Cys Thr Ala Ser Arg Thr Val Asp Ser Glu Thr
85 90 95
Trp Tyr Phe Met Val Asn Val Thr Asp Ala Ile Ser Ser Gly Glu Asp
100 105 110
Asp Asp Asp Asp Asp Asp Ala Glu Asp Phe Val Ser Glu Asn Ser Asn
115 120 125
Asn Lys Arg Ala Pro Tyr Trp Thr Asn Thr Glu Lys Met Glu Lys Arg
130 135 140
Leu His Ala Val Pro Ala Ala Asn Thr Val Lys Phe Arg Cys Pro Ala
145 150 155 160
Gly Gly Asn Pro Met Pro Thr Met Arg Trp Leu Lys Asn Gly Lys Glu
165 170 175
Phe Lys Gln Glu His Arg Ile Gly Gly Tyr Lys Val Arg Asn Gln His
180 185 190
Trp Ser Leu Ile Met Glu Ser Val Val Pro Ser Asp Lys Gly Asn Tyr
195 200 205
Thr Cys Val Val Glu Asn Glu Tyr Gly Ser Ile Asn His Thr Tyr His
210 215 220
Leu Asp Val Val Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly
225 230 235 240
Leu Pro Ala Asn Ala Ser Thr Val Val Gly Gly Asp Val Glu Phe Val
245 250 255
Cys Lys Val Tyr Ser Asp Ala Gln Pro His Ile Gln Trp Ile Lys His
260 265 270
Val Glu Lys Asn Gly Ser Lys Tyr Gly Pro Asp Gly Leu Pro Tyr Leu
275 280 285
Lys Val Leu Lys Ala Ala Gly Val Asn Thr Thr Asp Lys Glu Ile Glu
290 295 300
Val Leu Tyr Ile Arg Asn Val Thr Phe Glu Asp Ala Gly Glu Tyr Thr
305 310 315 320
Cys Leu Ala Gly Asn Ser Ile Gly Ile Ser Phe His Ser Ala Trp Leu
325 330 335
Thr Val Leu Pro Ala Pro Gly Arg Glu Lys Glu Ile Thr Ala Ser Pro
340 345 350
Asp Tyr Leu Glu
355
<210> 31
<211> 588
<212> Белок
<213> Искусственная последовательность
<220>
<223> ВКД FGFR2 с R2(111-118) заменен R1(105-112) + Fc
<400> 31
Arg Pro Ser Phe Ser Leu Val Glu Asp Thr Thr Leu Glu Pro Glu Glu
1 5 10 15
Pro Pro Thr Lys Tyr Gln Ile Ser Gln Pro Glu Val Tyr Val Ala Ala
20 25 30
Pro Gly Glu Ser Leu Glu Val Arg Cys Leu Leu Lys Asp Ala Ala Val
35 40 45
Ile Ser Trp Thr Lys Asp Gly Val His Leu Gly Pro Asn Asn Arg Thr
50 55 60
Val Leu Ile Gly Glu Tyr Leu Gln Ile Lys Gly Ala Thr Pro Arg Asp
65 70 75 80
Ser Gly Leu Tyr Ala Cys Thr Ala Ser Arg Thr Val Asp Ser Glu Thr
85 90 95
Trp Tyr Phe Met Val Asn Val Thr Asp Ala Ile Ser Ser Gly Glu Asp
100 105 110
Asp Asp Asp Asp Asp Asp Ala Glu Asp Phe Val Ser Glu Asn Ser Asn
115 120 125
Asn Lys Arg Ala Pro Tyr Trp Thr Asn Thr Glu Lys Met Glu Lys Arg
130 135 140
Leu His Ala Val Pro Ala Ala Asn Thr Val Lys Phe Arg Cys Pro Ala
145 150 155 160
Gly Gly Asn Pro Met Pro Thr Met Arg Trp Leu Lys Asn Gly Lys Glu
165 170 175
Phe Lys Gln Glu His Arg Ile Gly Gly Tyr Lys Val Arg Asn Gln His
180 185 190
Trp Ser Leu Ile Met Glu Ser Val Val Pro Ser Asp Lys Gly Asn Tyr
195 200 205
Thr Cys Val Val Glu Asn Glu Tyr Gly Ser Ile Asn His Thr Tyr His
210 215 220
Leu Asp Val Val Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly
225 230 235 240
Leu Pro Ala Asn Ala Ser Thr Val Val Gly Gly Asp Val Glu Phe Val
245 250 255
Cys Lys Val Tyr Ser Asp Ala Gln Pro His Ile Gln Trp Ile Lys His
260 265 270
Val Glu Lys Asn Gly Ser Lys Tyr Gly Pro Asp Gly Leu Pro Tyr Leu
275 280 285
Lys Val Leu Lys Ala Ala Gly Val Asn Thr Thr Asp Lys Glu Ile Glu
290 295 300
Val Leu Tyr Ile Arg Asn Val Thr Phe Glu Asp Ala Gly Glu Tyr Thr
305 310 315 320
Cys Leu Ala Gly Asn Ser Ile Gly Ile Ser Phe His Ser Ala Trp Leu
325 330 335
Thr Val Leu Pro Ala Pro Gly Arg Glu Lys Glu Ile Thr Ala Ser Pro
340 345 350
Asp Tyr Leu Glu Glu Pro Lys Ser Ser Asp Lys Thr His Thr Cys Pro
355 360 365
Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe
370 375 380
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
385 390 395 400
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
405 410 415
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
420 425 430
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
435 440 445
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
450 455 460
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
465 470 475 480
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
485 490 495
Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
500 505 510
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
515 520 525
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
530 535 540
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
545 550 555 560
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
565 570 575
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
580 585
<210> 32
<211> 587
<212> Белок
<213> Искусственная последовательность
<220>
<223> ВКД FGFR2 дельта-3 + GS линкер + Fc
<400> 32
Arg Pro Ser Phe Ser Leu Val Glu Asp Thr Thr Leu Glu Pro Glu Glu
1 5 10 15
Pro Pro Thr Lys Tyr Gln Ile Ser Gln Pro Glu Val Tyr Val Ala Ala
20 25 30
Pro Gly Glu Ser Leu Glu Val Arg Cys Leu Leu Lys Asp Ala Ala Val
35 40 45
Ile Ser Trp Thr Lys Asp Gly Val His Leu Gly Pro Asn Asn Arg Thr
50 55 60
Val Leu Ile Gly Glu Tyr Leu Gln Ile Lys Gly Ala Thr Pro Arg Asp
65 70 75 80
Ser Gly Leu Tyr Ala Cys Thr Ala Ser Arg Thr Val Asp Ser Glu Thr
85 90 95
Trp Tyr Phe Met Val Asn Val Thr Asp Ala Ile Ser Ser Gly Asp Asp
100 105 110
Glu Asp Asp Thr Asp Gly Ala Glu Asp Phe Val Ser Glu Asn Ser Asn
115 120 125
Asn Lys Arg Ala Pro Tyr Trp Thr Asn Thr Glu Lys Met Glu Lys Arg
130 135 140
Leu His Ala Val Pro Ala Ala Asn Thr Val Lys Phe Arg Cys Pro Ala
145 150 155 160
Gly Gly Asn Pro Met Pro Thr Met Arg Trp Leu Lys Asn Gly Lys Glu
165 170 175
Phe Lys Gln Glu His Arg Ile Gly Gly Tyr Lys Val Arg Asn Gln His
180 185 190
Trp Ser Leu Ile Met Glu Ser Val Val Pro Ser Asp Lys Gly Asn Tyr
195 200 205
Thr Cys Val Val Glu Asn Glu Tyr Gly Ser Ile Asn His Thr Tyr His
210 215 220
Leu Asp Val Val Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly
225 230 235 240
Leu Pro Ala Asn Ala Ser Thr Val Val Gly Gly Asp Val Glu Phe Val
245 250 255
Cys Lys Val Tyr Ser Asp Ala Gln Pro His Ile Gln Trp Ile Lys His
260 265 270
Val Glu Lys Asn Gly Ser Lys Tyr Gly Pro Asp Gly Leu Pro Tyr Leu
275 280 285
Lys Val Leu Lys Ala Ala Gly Val Asn Thr Thr Asp Lys Glu Ile Glu
290 295 300
Val Leu Tyr Ile Arg Asn Val Thr Phe Glu Asp Ala Gly Glu Tyr Thr
305 310 315 320
Cys Leu Ala Gly Asn Ser Ile Gly Ile Ser Phe His Ser Ala Trp Leu
325 330 335
Thr Val Leu Pro Ala Pro Gly Arg Glu Lys Glu Ile Thr Ala Ser Pro
340 345 350
Asp Gly Ser Glu Pro Lys Ser Ser Asp Lys Thr His Thr Cys Pro Pro
355 360 365
Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro
370 375 380
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
385 390 395 400
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
405 410 415
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
420 425 430
Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
435 440 445
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
450 455 460
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
465 470 475 480
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp
485 490 495
Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
500 505 510
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
515 520 525
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
530 535 540
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
545 550 555 560
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
565 570 575
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
580 585
<210> 33
<211> 353
<212> Белок
<213> Искусственная последовательность
<220>
<223> ВКД FGFR2 дельта-3 с R2(111-118) заменен R1(105-112)
<400> 33
Arg Pro Ser Phe Ser Leu Val Glu Asp Thr Thr Leu Glu Pro Glu Glu
1 5 10 15
Pro Pro Thr Lys Tyr Gln Ile Ser Gln Pro Glu Val Tyr Val Ala Ala
20 25 30
Pro Gly Glu Ser Leu Glu Val Arg Cys Leu Leu Lys Asp Ala Ala Val
35 40 45
Ile Ser Trp Thr Lys Asp Gly Val His Leu Gly Pro Asn Asn Arg Thr
50 55 60
Val Leu Ile Gly Glu Tyr Leu Gln Ile Lys Gly Ala Thr Pro Arg Asp
65 70 75 80
Ser Gly Leu Tyr Ala Cys Thr Ala Ser Arg Thr Val Asp Ser Glu Thr
85 90 95
Trp Tyr Phe Met Val Asn Val Thr Asp Ala Ile Ser Ser Gly Glu Asp
100 105 110
Asp Asp Asp Asp Asp Asp Ala Glu Asp Phe Val Ser Glu Asn Ser Asn
115 120 125
Asn Lys Arg Ala Pro Tyr Trp Thr Asn Thr Glu Lys Met Glu Lys Arg
130 135 140
Leu His Ala Val Pro Ala Ala Asn Thr Val Lys Phe Arg Cys Pro Ala
145 150 155 160
Gly Gly Asn Pro Met Pro Thr Met Arg Trp Leu Lys Asn Gly Lys Glu
165 170 175
Phe Lys Gln Glu His Arg Ile Gly Gly Tyr Lys Val Arg Asn Gln His
180 185 190
Trp Ser Leu Ile Met Glu Ser Val Val Pro Ser Asp Lys Gly Asn Tyr
195 200 205
Thr Cys Val Val Glu Asn Glu Tyr Gly Ser Ile Asn His Thr Tyr His
210 215 220
Leu Asp Val Val Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly
225 230 235 240
Leu Pro Ala Asn Ala Ser Thr Val Val Gly Gly Asp Val Glu Phe Val
245 250 255
Cys Lys Val Tyr Ser Asp Ala Gln Pro His Ile Gln Trp Ile Lys His
260 265 270
Val Glu Lys Asn Gly Ser Lys Tyr Gly Pro Asp Gly Leu Pro Tyr Leu
275 280 285
Lys Val Leu Lys Ala Ala Gly Val Asn Thr Thr Asp Lys Glu Ile Glu
290 295 300
Val Leu Tyr Ile Arg Asn Val Thr Phe Glu Asp Ala Gly Glu Tyr Thr
305 310 315 320
Cys Leu Ala Gly Asn Ser Ile Gly Ile Ser Phe His Ser Ala Trp Leu
325 330 335
Thr Val Leu Pro Ala Pro Gly Arg Glu Lys Glu Ile Thr Ala Ser Pro
340 345 350
Asp
<210> 34
<211> 587
<212> Белок
<213> Искусственная последовательность
<220>
<223> ВКД FGFR2 дельта-3 с R2(111-118) заменен R1(105-112) + GS
линкер + Fc (также называемый FGFR2ECD(FGFR2(111-118):FGFR1(105-112):
дельта3)-GS линкер-Fc и R2(111-118):R1(105-112))
<400> 34
Arg Pro Ser Phe Ser Leu Val Glu Asp Thr Thr Leu Glu Pro Glu Glu
1 5 10 15
Pro Pro Thr Lys Tyr Gln Ile Ser Gln Pro Glu Val Tyr Val Ala Ala
20 25 30
Pro Gly Glu Ser Leu Glu Val Arg Cys Leu Leu Lys Asp Ala Ala Val
35 40 45
Ile Ser Trp Thr Lys Asp Gly Val His Leu Gly Pro Asn Asn Arg Thr
50 55 60
Val Leu Ile Gly Glu Tyr Leu Gln Ile Lys Gly Ala Thr Pro Arg Asp
65 70 75 80
Ser Gly Leu Tyr Ala Cys Thr Ala Ser Arg Thr Val Asp Ser Glu Thr
85 90 95
Trp Tyr Phe Met Val Asn Val Thr Asp Ala Ile Ser Ser Gly Glu Asp
100 105 110
Asp Asp Asp Asp Asp Asp Ala Glu Asp Phe Val Ser Glu Asn Ser Asn
115 120 125
Asn Lys Arg Ala Pro Tyr Trp Thr Asn Thr Glu Lys Met Glu Lys Arg
130 135 140
Leu His Ala Val Pro Ala Ala Asn Thr Val Lys Phe Arg Cys Pro Ala
145 150 155 160
Gly Gly Asn Pro Met Pro Thr Met Arg Trp Leu Lys Asn Gly Lys Glu
165 170 175
Phe Lys Gln Glu His Arg Ile Gly Gly Tyr Lys Val Arg Asn Gln His
180 185 190
Trp Ser Leu Ile Met Glu Ser Val Val Pro Ser Asp Lys Gly Asn Tyr
195 200 205
Thr Cys Val Val Glu Asn Glu Tyr Gly Ser Ile Asn His Thr Tyr His
210 215 220
Leu Asp Val Val Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly
225 230 235 240
Leu Pro Ala Asn Ala Ser Thr Val Val Gly Gly Asp Val Glu Phe Val
245 250 255
Cys Lys Val Tyr Ser Asp Ala Gln Pro His Ile Gln Trp Ile Lys His
260 265 270
Val Glu Lys Asn Gly Ser Lys Tyr Gly Pro Asp Gly Leu Pro Tyr Leu
275 280 285
Lys Val Leu Lys Ala Ala Gly Val Asn Thr Thr Asp Lys Glu Ile Glu
290 295 300
Val Leu Tyr Ile Arg Asn Val Thr Phe Glu Asp Ala Gly Glu Tyr Thr
305 310 315 320
Cys Leu Ala Gly Asn Ser Ile Gly Ile Ser Phe His Ser Ala Trp Leu
325 330 335
Thr Val Leu Pro Ala Pro Gly Arg Glu Lys Glu Ile Thr Ala Ser Pro
340 345 350
Asp Gly Ser Glu Pro Lys Ser Ser Asp Lys Thr His Thr Cys Pro Pro
355 360 365
Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro
370 375 380
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
385 390 395 400
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
405 410 415
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
420 425 430
Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
435 440 445
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
450 455 460
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
465 470 475 480
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp
485 490 495
Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
500 505 510
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
515 520 525
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
530 535 540
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
545 550 555 560
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
565 570 575
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
580 585
<210> 35
<211> 288
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<223> предшественник PD-1 человека (с сигнальной последовательностью)
<400> 35
Met Gln Ile Pro Gln Ala Pro Trp Pro Val Val Trp Ala Val Leu Gln
1 5 10 15
Leu Gly Trp Arg Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp
20 25 30
Asn Pro Pro Thr Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp
35 40 45
Asn Ala Thr Phe Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val
50 55 60
Leu Asn Trp Tyr Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala
65 70 75 80
Ala Phe Pro Glu Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg
85 90 95
Val Thr Gln Leu Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg
100 105 110
Ala Arg Arg Asn Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu
115 120 125
Ala Pro Lys Ala Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val
130 135 140
Thr Glu Arg Arg Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro
145 150 155 160
Arg Pro Ala Gly Gln Phe Gln Thr Leu Val Val Gly Val Val Gly Gly
165 170 175
Leu Leu Gly Ser Leu Val Leu Leu Val Trp Val Leu Ala Val Ile Cys
180 185 190
Ser Arg Ala Ala Arg Gly Thr Ile Gly Ala Arg Arg Thr Gly Gln Pro
195 200 205
Leu Lys Glu Asp Pro Ser Ala Val Pro Val Phe Ser Val Asp Tyr Gly
210 215 220
Glu Leu Asp Phe Gln Trp Arg Glu Lys Thr Pro Glu Pro Pro Val Pro
225 230 235 240
Cys Val Pro Glu Gln Thr Glu Tyr Ala Thr Ile Val Phe Pro Ser Gly
245 250 255
Met Gly Thr Ser Ser Pro Ala Arg Arg Gly Ser Ala Asp Gly Pro Arg
260 265 270
Ser Ala Gln Pro Leu Arg Pro Glu Asp Gly His Cys Ser Trp Pro Leu
275 280 285
<210> 36
<211> 268
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<223> человеческий PD-1 (зрелый, без сигнальной последовательности)
<400> 36
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val Val Gly Val Val Gly Gly Leu Leu Gly Ser
145 150 155 160
Leu Val Leu Leu Val Trp Val Leu Ala Val Ile Cys Ser Arg Ala Ala
165 170 175
Arg Gly Thr Ile Gly Ala Arg Arg Thr Gly Gln Pro Leu Lys Glu Asp
180 185 190
Pro Ser Ala Val Pro Val Phe Ser Val Asp Tyr Gly Glu Leu Asp Phe
195 200 205
Gln Trp Arg Glu Lys Thr Pro Glu Pro Pro Val Pro Cys Val Pro Glu
210 215 220
Gln Thr Glu Tyr Ala Thr Ile Val Phe Pro Ser Gly Met Gly Thr Ser
225 230 235 240
Ser Pro Ala Arg Arg Gly Ser Ala Asp Gly Pro Arg Ser Ala Gln Pro
245 250 255
Leu Arg Pro Glu Asp Gly His Cys Ser Trp Pro Leu
260 265
<210> 37
<211> 290
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<223> предшественник PD-L1 человека (с сигнальной последовательностью)
<400> 37
Met Arg Ile Phe Ala Val Phe Ile Phe Met Thr Tyr Trp His Leu Leu
1 5 10 15
Asn Ala Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr
20 25 30
Gly Ser Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu
35 40 45
Asp Leu Ala Ala Leu Ile Val Tyr Trp Glu Met Glu Asp Lys Asn Ile
50 55 60
Ile Gln Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser
65 70 75 80
Tyr Arg Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn
85 90 95
Ala Ala Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr
100 105 110
Arg Cys Met Ile Ser Tyr Gly Gly Ala Asp Tyr Lys Arg Ile Thr Val
115 120 125
Lys Val Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val
130 135 140
Asp Pro Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr
145 150 155 160
Pro Lys Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser
165 170 175
Gly Lys Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn
180 185 190
Val Thr Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr
195 200 205
Cys Thr Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu
210 215 220
Val Ile Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Thr His
225 230 235 240
Leu Val Ile Leu Gly Ala Ile Leu Leu Cys Leu Gly Val Ala Leu Thr
245 250 255
Phe Ile Phe Arg Leu Arg Lys Gly Arg Met Met Asp Val Lys Lys Cys
260 265 270
Gly Ile Gln Asp Thr Asn Ser Lys Lys Gln Ser Asp Thr His Leu Glu
275 280 285
Glu Thr
290
<210> 38
<211> 272
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<223> PD-L1 человека (зрелый, без сигнальной последовательности)
<400> 38
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Ile Val Tyr Trp Glu Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Arg Cys
85 90 95
Met Ile Ser Tyr Gly Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Thr His Leu Val
210 215 220
Ile Leu Gly Ala Ile Leu Leu Cys Leu Gly Val Ala Leu Thr Phe Ile
225 230 235 240
Phe Arg Leu Arg Lys Gly Arg Met Met Asp Val Lys Lys Cys Gly Ile
245 250 255
Gln Asp Thr Asn Ser Lys Lys Gln Ser Asp Thr His Leu Glu Glu Thr
260 265 270
<210> 39
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> Вариабельная область тяжелой цепи анти-FGFR2 Gal-FR22
<400> 39
Gln Val Gln Leu Lys Gln Ser Gly Pro Gly Leu Val Gln Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Ser Phe
20 25 30
Gly Val His Trp Val Arg Gln Ser Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Ser Gly Gly Ser Thr Asp Tyr Asn Ala Asp Phe Arg
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Asn Ser Lys Ser Gln Ile Phe Phe
65 70 75 80
Lys Met Asn Ser Leu Gln Pro Asp Asp Thr Ile Ala Tyr Cys Ala Asn
85 90 95
Phe Tyr Tyr Gly Tyr Asp Asp Tyr Val Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser
115
<210> 40
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR1 тяжелой цепи анти-FGFR2 Gal-FR22
<400> 40
Ser Phe Gly Val His
1 5
<210> 41
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR2 тяжелой цепи анти-FGFR2 Gal-FR22
<400> 41
Val Ile Trp Ser Gly Gly Ser Thr Asp Tyr Asn Ala Asp Phe Arg Ser
1 5 10 15
<210> 42
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR3 тяжелой цепи анти-FGFR2 Gal-FR22
<400> 42
Phe Tyr Tyr Gly Tyr Asp Asp Tyr Val Met Asp Tyr
1 5 10
<210> 43
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Вариабельная область легкой цепи анти-FGFR2 Gal-FR22
<400> 43
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Gly Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Ile Lys Asn Tyr
20 25 30
Ile Ala Trp Tyr Gln His Lys Pro Gly Lys Ser Pro Arg Leu Leu Ile
35 40 45
His Tyr Thr Ser Thr Leu Gln Pro Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Arg Asp Tyr Ser Phe Ser Ile Ser Asn Leu Glu Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp Asp Asp Leu Tyr
85 90 95
Met Phe Gly Gly Gly Thr Lys Leu Asp Ile Lys
100 105
<210> 44
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR1 легкой цепи анти-FGFR2 Gal-FR22
<400> 44
Lys Ala Ser Gln Asp Ile Lys Asn Tyr Ile Ala
1 5 10
<210> 45
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR2 легкой цепи анти-FGFR2 Gal-FR22
<400> 45
Tyr Thr Ser Thr Leu Gln Pro
1 5
<210> 46
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR3 легкой цепи анти-FGFR2 Gal-FR22
<400> 46
Leu Gln Tyr Asp Asp Leu Tyr Met
1 5
<---
Реферат
Изобретение относится к области биотехнологии, конкретно к cпособу лечения рака, экспрессирующего рецептор 2 фактора роста фибробластов (FGFR2) IIIb. Предложенный способ, включающий введение антитела к рецептору 2 фактора роста фибробластов (FGFR2) IIIb и ингибитора белка программируемой клеточной гибели 1 (PD-1) или ингибитора лиганда 1 белка программируемой клеточной гибели (PD-L1), может быть применён для изменения микроокружения опухоли и усиления опухолеуничтожащих иммунных ответов в эффективной терапии экспрессирующей FGFR2-IIIb опухоли. 2 н. и 39 з.п. ф-лы, 16 ил., 3 табл., 8 пр.

Комментарии