Способ получения производных имидазола - SU908249A3
Код документа: SU908249A3
Описание
ГЗ) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ИМИДАЗОЛА
I
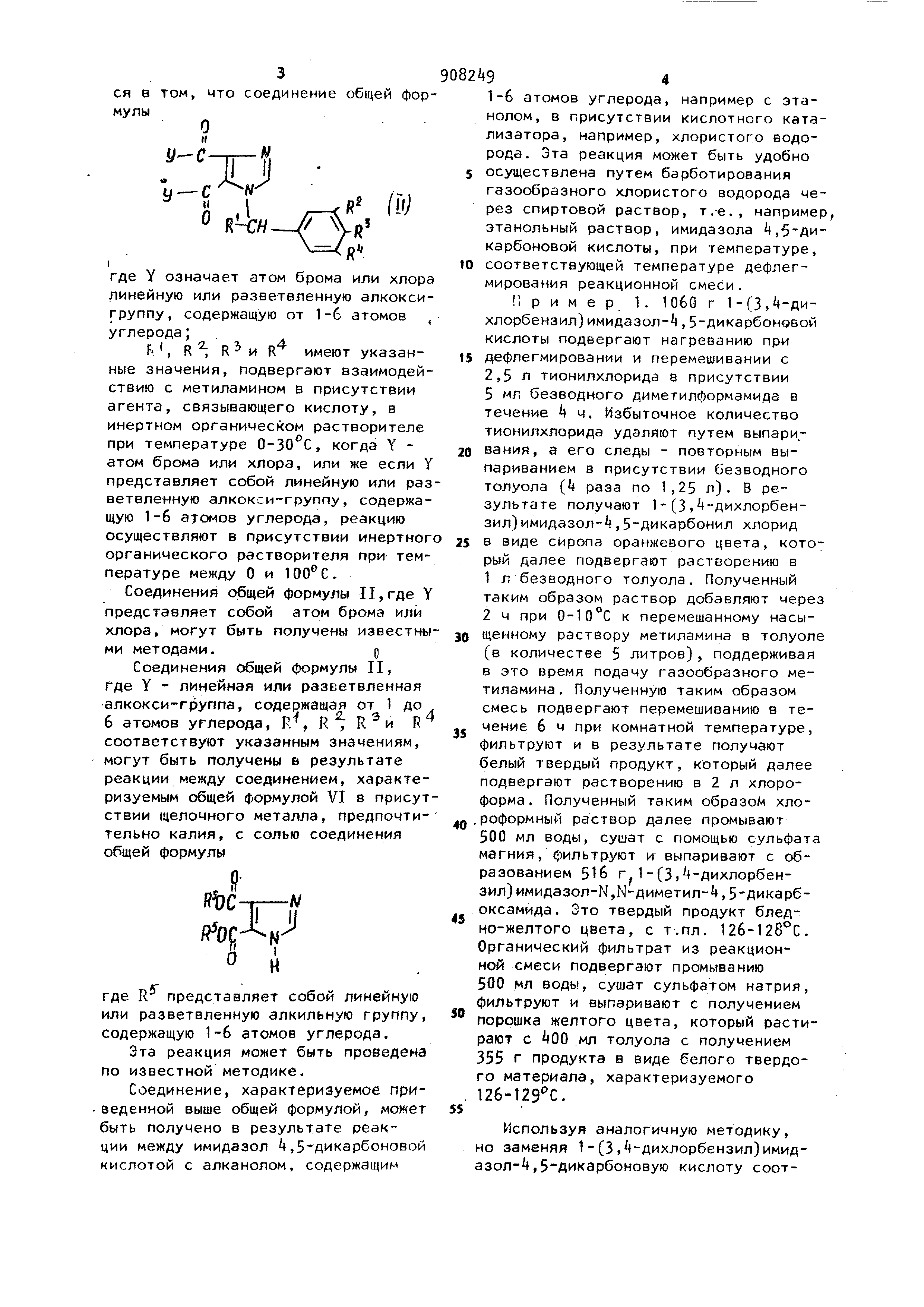
Изобретение относится к получению новых производных имидазола общей формулы
CH,tiHOC-rr-, CH,NHOC
где R - атом водорода, линейная или разветвленная алкильная группа, содержащая 1-10 атомов углерода,линейная или разветвленная алкенильная или алкинигьная группы, содержащие 2-1П атомоь углерода;
R , Ни РЛмогут быть одинаковыми или различными и каждый из них может представлять собой атом водорода или галогена, или трифторметокси-группу , или метил-, этил, пропил- , или изопропил-группы, не замещенные или замещенные одним или
несколькими атомами фтора, или один из Р , R и R представляет собой метокси-группу и, по крайней мере, один из R2-, R. R пpeдcfaвляeт собой атом галогена, трифторметоксигруппу , или метил-, этил-, пропил или изопропил-группу, не замещенные или замещенные одним или несколькими атомами фтора, и, по крайней мере, один из R, R , R и
)0 R не является атомол водорода, обладающих гербицидными свойствами.
Известна реакция образования амидов езаимодейст вием ангидридов кислот с аминами LI J.
15
Цель изобретения - синтез новых производных амидазола, обладающих гербицидной активностью.
20
Поставленная цель достигается предлагаемым способом получения соединений общей формулы , основанным на известной реакции и заключающимся в том, что соединение общей формулы где Y означает атом брома или хлора линейную или разветвленную алкоксигруппу , содержащую от 1-6 атомов , углерода; Я , R R и R имеют указанные значения, подвергают взаимодействию с метиламином в присутствии агента, связывающего кислоту, в инертном органическом растворителе при температуре , когда Y атом брома или хлора, или же если Y представляет собой линейную или раз ветвленную алкокси-группу, содержащую 1-6 атомов углерода, реакцию осуществляют в присутствии инертног органического растворителя при температуре между О и . Соединения общей формулы II,где У представляет собой атом брома или хлора, могут быть получены известны ми методами.О Соединения Общей формулы II, Где У - линейная или разветвленная алкокси-группа, содержащая от 1 до 6 атомов углерода, Р. , R , R и R соответствуют указанным знамениям, могут быть получены в результате реакции между соединением, характеризуемым общей формулой VI в присут ствии щелочного металла, предпочтительно калия, с солью соединения общей формулы li где R представляет собой линейную или разветвленную алкильную группу, содержащую 1-6 атомов углерода. Эта реакция может быть проведена по известной методике. Соединение, характеризуемое приведенной выше общей формулой, может быть получено в результате реакции между имидазол 4,5 дикар6оновой кислотой с алканолом, содержащим S4 1-6 атомов углерода, например с этанолом , в присутствии кислотного катализатора , например, хлористого водорода . Эта реакция может быть удобно осуществлена путем барботирования газообразного хлористого водорода через спиртовой раствор, т.-е., например, этанольный раствор, имидазола .б-дикарбоновой кислоты, при температуре, соответствующей температуре дефлегмирования реакционной смеси. 1 р и м е р 1 . 1060 г 1-(3,-ДИхлорбензил ) имидазол-, 5 дикарбоновой кислоты подвергают нагреванию при дефлегмировании и перемешивании с 2,5 л тионилхлорида в присутствии 5 мл безводного диметилформамида в течение ч. Избыточное количество тионилхлорида удаляют путем выпаривания , а его следы - повторным выпариванием в присутствии безводного толуола (( раза по 1,25 л). В результате получают 1 - (3 ,+-дихлорбензил )имидазол-,5 дикарбонил хлорид в виде сиропа оранжевого цвета, который далее подвергают растворению в 1л безводного толуола. Полученный таким образом раствор добавляют через 2ч при 0-10 С к перемешанному насы (ценному раствору метиламина в толуоле ( в количестве 5 литров), поддерживая в это время подачу газообразного метиламина . Полученную таким образом смесь подвергают перемешиванию в течение 6 ч при комнатной температуре, фильтруют и в результате получают белый твердый продукт, который далее подвергают растворению в 2 л хлороформа . Полученный таким образов хлороформный раствор далее промывают 500 мл воды, сушат с помощью сульфата магния, фильтруют и выпаривают с образованием 516 (3,-дихлорбензил ) имидазол-М,Г -диметил-, 5-Дикарбоксамида . Это твердый продукт бледно-желтого цвета, с т.пл. 12б-128 С. Органический фильтрат из реакционной смеси подвергают промыванию 500 мл воды, сушат сульфатом натрия, фильтруют и выпаривают с получением порошка желтого цвета, который растирают с АОО мл толуола с получением 355 г продукта в виде белого твердого материала, характеризуемого 12б-129С. Используя аналогичную методику, но заменяя 1-(3, -дихлорбензил)имидазол- , 5 дикарбоновую кислоту соот5 ветствующей замещенной имидазол-t ,5 -дикарбоновой кислотой, получают следующие соединения. . 1 -(3-Фтopбeнзил)имидaзoл-N,N-диметил-it ,5-дикар6оксамид с т.пл. 103 (после кристаллизации из этанола ), полученный из 1-(3-фторбензил )имидазол-+,5-дикарбоновой кисло 1 - (it-Оторбензил) имидазол-Ы,М-диметил-4 ,5-дикарбоксамид с т.пл. 9 95 С (после кристаллизации из гексана ) .полученный из 1-(-фторбензил )имидазол-,5-Дикарбоновой кислоты . ,I 1- (3-Хлорбензил)имидазол-К,Н-диметил- ,5-дикарбоксамид с т.пл. 121 121,5С (после кристаллизации из этанола), полученный из 1-(3-хлорбензил )имидазол-4,5-дикарбоновой кислоты.f 1- ( -Хлорбензил)имидазол-М,К-диметил- ,5-Дикарбоксамид с т.пл. 131 132 С (после кристаллизации из этанола ) ,. полученный из 1- ( -хлорбензил )имидазол-,5-Дикарбоновой ки лоты.f 1-(3-Бромбензил)имидазол-К,П-диметил- ,5 АИкарбоксамид с т.пл. П (после кристаллизации из этанола ), полученный из 1-(3-бромбензил )имидазол-,5-дикарбоновой ки лоты . 1-(-Бромбензил)имидазол-Х,Г -диметил-А ,5-Дикарбоксамид с т.пл. , полученный из 1-(-бромбензил ) имидазол-, 5-дикарбоновой кисло ты. 1-(3-Иодбензил)имидазол-N,N-диметил- ,5 дикарбоксамид с т.пл. 112 (после кристаллизации из этанола ), полученный из 2-(3 иод6енэил имидазол-, 5-Дикарбоновой кислоты 1 - (it-Иодбензил) имидазол-N,N-диметил- ,5-ДИкарбоксамид с т.пл. 15 (после кристаллизации из этанола ), полученный из 1-(4-иод6ензил ) имйдазол-4,5-дикарбоновой . 1 - (3, «-Дибромбензмл) имидазол-Н ,К-диметил-,5-ДИкарбоксамид с т.пл. 118-11S°C (после кристаллизации из этанола), полученный из 1-(3)-Дибромбензил)имидазол-+,5-дикарбоновой кислоты. V -(3,5-Дихлорбензил)имидазол-Ы ,Ы-диметил- 1,5-ДИкарбоксамид с т.кип. 135-136 С (после кристаллиза ции из этанола), полученный из 1 96 - (3,5-Дихлорбензил)имидазол-4,5-дикарбоновой кислоты. / 1 - (3-Me тилбeнзил)имидaзoл-N,N-димeтил-A , 5 дикарбоксамид с т.кип. (после кристаллизации из простого эфира), полученный из 1 -(3-метилбензил)имидазол-,5 Дикарбоновой кислоты.., 1 -(4-Метилбензил)имидaзoл-N,N-диметил-+ ,5-Дикарбоксамид с т.пл. С (после кристаллизации из водного этанола), полученный из 1 - ( -мeтилбeнзил)имидaзoл-t ,5-Дикарбоновой кислоты. / Т-(-Этилбензил)имидазол-Н,Н-диметил-4 ,5-Дикарбоксамид с т.пл. 6869 (после кристаллизации из циклогексана ), полученный из 1-(-этилбензил ) имидазол-,5-Дикарбоновой кислоты . 17 ( зопропилбензил) имидазол- 1 ,К-диметил-4,5-Дикарбоксамид с т.пл. С (после кристаллизации из гексана), полученный из l- t-изопропилбензил )имидазол-),5-Дикарбоковой кислоты. 17 f 3 , -Диметилбензил) имидазол-N ,N-диметил- 1,5-Дикарбоксамид с т.пл. 1б8-170С (после кристаллизации из смеси, состоящей из толуола и петролейного эфира и имеющей т.кип. 60-80С) , полученный из 1 (3,-диметилбензил)имидазол- ,5-ДИкарбоновой кислоты. 1 -(3-Трифторметилбензил)имидазол-К ,М-диметил-4,5-Дикарбоксамид с т.пл. 108-110°С (после кристаллизации из смеси, состоящей из гексана и этанола), полученный из 1-(3-трифторметилбензил )имидазол-, S -дикарбоновой кислоты. - (/ -Трифторметилбензил) имидазол-К ,К-диметил- ,5-дикарбоксамид с т.пл. 13-U2°C (после кристаллизации из циклогексана), полученный ИЗ 1 - С -трифторметилбензил)имидазол- .5-Дикар6оновой кислоты. - (1 -ТрифторметоксиббНЗИл)имидазол-Н ,К-диметил-,5-Аикарбоксамид с т.пл. 110.5 С (гюсле кристаллизации из этанола), полученный из -(k-трифторметокси Сензил)имидазол-,5-дикарбоновой кислоты. 1 -(3-Хг,оро- -метоксибензил)имидазол-Ы ,1ч-диметил-,5-Дикарбоксамид с т.пл. 122-123 0 (после кристаллизации из смеси, состоящей из толуола и циклогексана), полученный из. 1 -(3 хлоро-т-метоксиСензил)имидазо 5 дикар(:оновой кислоты. (-)(3 ДихлорОенил)этил имидазол-Ы,Н Диметил-А,5-дикарбокс С т.пв. (после кристалли зации из метанола), полученный из (i)-1 -f 1 - (3 ,4-дихлорфенил) азол-4,5-дикарбоновой кислоты. Бе найми да ,5-Дикарбоновый кислоты, используемые в качестве исходных материалов при получении указанных соединений, получают сле дующим образом. 2180 г 1-(3, -Дихлорбензил)-,5 -дицианоимидазола нагревают при дефлегмировании и перемешивании в растворе, состоящем из 1260 г гидр окиси натрия 8 смеси, состоящей 5 из этанола и 4, л воды в течение В ч. Охлажденную смесь, полученную таким образом, разбавляют 20 л воды, промывают 2 л диэтилового эфира и далее подкисляют 3,5 л кон центрированной хлористоводородной кислоты при охлаждении в ледяной бане. Образовавшийся твердый осадо бледно-желтого цвета отфильтровывают , промывают водой и растворяют порциями в 150 л воды, содержащей 700 г бикарбоната натрия. Получен ный в результате раствор подвергаю jфильтрации и подкислению концентри рованной хлористоводородной кислотой , с получением 1157 г,1-(3, -дихлорбензил ) имидазол-, 5-Дикарбо новой кислоты с т.пл. 258 С (с раз в виде белого порошка. Используя аналогичную методику, но заменяя 1-(3,ДИxлopбeнзил)- ,5 Дициaнoимидaзoл соответствую ,щими бензилдицианоимидазолами, получают следующие соединения. 1 -(3 Фтopбeнзил)имидaзoл-i,5Дикapбoнoвaя кислота с т.пл. 22k,О С (с разл.).полученная из 1-(3-фторбензил ) -, 5-дицианоимидазола. 1-(-Фторбензил)имидазол-А,5 -дикарбоновая кислота с т.пл. 2 8-252 0 (с разл.), полученная из 1- (-фторбензил)-k,5-дицианоимидазола . 11-(3-Хлорбензил)имидазол- ,5 -дикарбоновая кислота с т.пл. 2 48249 С (с разл.), полученная из 1-(3-хлорбензил)-4,5-дицианоимидазо 1-(|-Хдорбензил)имидазол- ,5-ДИкарбоновая кислота с т.пл. 25825:8 , (с разл.), полученная из 1 - (-хлорбензил)- ,5-ДИЦианоимидазо1 - (3 Бромбензил)имидазол-4,5-дикарбоновая кислота с т.пл. 223226 0 (с разл.), полученная из 1- (3-бромбензил) -, 5-дицианоимидазола. 1 - (4-Бромбензил) имидазол-, 5 йикарбоновая кислота с т.пл. (с разл.), полученная из 1-(-бромбензил)-А,5-дицианоимидазола . 1 - (Зиодбензил)имидазол-4,5 дикарбоновая кислота с т.пл. 211°С., (с разл.), полученная из 1-(3-иодбензил )-Ц,5-дицианоимидазола. 1 -( -Иодбензил)имидазол-4,5 Дикарбоновая кислота с т.пл. (с разл.), полученная из 1-(4-иодбензил )-f, 5 дицианоимидазола . 1 - (3 ,-Дибромбензил) имидазол-, 5 -дикарбоновая кислота с т.пл. (с разл.), полученная из 1-(ЗЛ-дибромбензил ) , 5-дицианоимидазола . 1 -(3 ,5-Дихлорбензил)имидазол-,5-дикарбоновая кислота с т.кип. 2б72б9 С (с разл.), полученная из 1 - (3,5 ДИхлорбензил) ,5 дициaнoимидaзoлa . 1-(3 Метилбензил)имидазол-,5-дикарбоновая кислота с т.пл. (с разл.), полученная из 1-(3-метилбензил ) -t, 5-дицианоимидазола. 1 - (4-Метилбензил)имидазол- ,5-дикарбоновая кислота с т.пл. 2 48250 С (с разл.), полученная из 1-(-метилбензил )-,5 дицианоимидазола. 1 - С -Этилбензил)имидазол-,5 дикарбоновая кислота с т.пл. 211-212°С (с разл.), полученная из 1-( -этилбензил )-,5 дицианомидазола. 1 -(Д-Изопропилбензил)-имидазол4 5-дикарбоновая кислота с т.пл. 189191 С (с разл.), полученная из 1- (-изопропилбензил) -i, 5-дицианоимидазола . 1(3.Диметилбензил)имидазол- ,5-дикарбоновая кислота с т.пл. 2582бО С (с разл.), полученная из 1 (3,-диметилбензил)-,5 дицианомидазола . 1 -(3 Трифторметилбензил)имидазол .5 дикарбоновая кислота с т.пл. 226227 С (с разл.), полученная из 1 (3-трифторметилбензил) - ,5-дициано- , имидазола. 1 -(4-Трифторметилбензил)имидазол 5 дикарбоновая кислота с т.пл. (с разл.), полученная из 9 1 - (t-трифторметилбензил} -, 5-Дициан имидазола. 1 - (4-Трифторметоксибензил)имидазол-4 ,5-дикарбоновая кислота с т.пл, 214-21З С (с разя.), полученная из 1-(Д-трифторметоксибензил) ,5-дицианоимидазола. 1-(3-Хлоро- -метоксибензил)имидазол- ,5 дикар6оновая кислота с т.г.л. 223°С (с разл.), полученная иь 1-(3-xлopo- -мeтoкcибeнзил) . 5 дициансимидазола. (±)-1 -(3,-Дихлорфенил)этилимидазол-4 ,5 дикарбоновая кислота с т.пл. (с разл.), полученная из (-)-1-Cl-(3.-дихлорфенилЗ- тил -k,5-дицианоимидазола. Бензилдицианоимидаэолы, используемые в качестве исходных материалов при получении указанных соединений , получают следующим образом. 93 г 4,5 дицианоимидазола растворяют при перемешивании в 500 мл безводного диметилформамида. К полу ченному таким образом раствору част ми добавляют 20 г гидрида натрия,пр чем добавление производят с такой скоростью, чтобы после него температура раствора равнялась .Посл того, как процесс бурного выделения газа (вспенивания) прекращается, по лученный раствор нагревают в парово бане в течение 15 мин, а затем охлаждают до . 230 г 3,1-Аихлорбензилхлорида добавляют в течение 30 мин к получе ному ранее раствору, который сначал нагревают в паровой бане в течение 6 ч, а затем в течение 10 минут доводят температуру до 150 С. Охлажде ную реакционную см°есь выливают в воду (2 л) и образовавшийся коричневый твердый продукт отфильтровыва и поомывают водой. Этот влажный тве дый продукт далее подвергают рекристаллизации из 1 л этанола,получая 11Д г 1-{3, -Дихлорбензил)-,5-дицианоимидазола с т.пл. 132-13 С в виде белого кристаллического материала . Применяя аналогичную методику,но используя вместо 3,-Дихлорбензилхя рида соответствующий замещенный бензилгалид, получают следующие сое динения. 1-(3-Фторбензил)-,5-ДИЦианоимид азол с т.пя. 97, (после кристаллизации из этанола), полученный из 3-фторбензилхлорида. 9 1 - (4-Фторбензил),5-дицианоимидазол с т.пл. (после кристаллизациисиз водного этанола),полученный из -фторбензилхлорида. 1 -(3 Хлорбензил)-4,5-Дицианоимидазол с т.пл. 110-111 С (после кристаллизации из водного этанола).полученный из 3 хлорбензилхлорида. 1 - (-Хлорбензил) -, 5-Дицианоимидазол с т.пл. 119,5-120°С (после кристаллизации из этанола), полученный из -хлорбензилхлорида. 1 - (3-Бромбензил)- ,5-дицианоимидазол с т.пл. 101 ,5-102,5С (после кристаллизации из этанола),полученный из 3 бромбензилхлорида. 1 - (Ц-Бромбензил- ,5-дицианоимидазол с т.пл. 118-119°С (после кристаллизации из водного этанола), полученный из -бромбензилхлорида. - 1-(Иодбензил) - ,5-Дицианоимидазол с т.пл. 9б-98 С (после кристаллизации из этанола), полученный из 3-иод6ензил бромида. 1 - (4-Иодбензил) ,5-Дицианоимидазол с т.пл. 111-112 С (после кристаллизации из этанола), полученный из it-иодбензилбромида. 1 - (3 , t-Дибромбензил) -4,5-Дицианоимидазол с т.пл. С, полученный из 3,4 дибромбензилхлорида. 1 - (3,5 Дихлорбензил) - ,5-Аицианомидазол с т.пл. 13 -135°С (после кристаллизации из этанола), полученный из 3,5-Дихлорбензилхлорида. 1 - (3-Метилбензил) ,5-дицианоимидазол .представляющий собой масло коричневого цвета, которое не подвергалось дистилляции, полученный из 3-метилбензилхлорида. 1 - (4-Метилбензил) -4,5 дицианоимидазол с т.пл. 158-161°С (после кристаллизации из водного этанола), полученкый из -метилбензилхлорида. 1 - ( -Этилбензил) ,5-дициано .имидазол, представляющий собой коричневый полутвердый продукт, полученный из -зтилбензиЛхлорида. 1 - (14-Изопропилбензил) ,5-Дицианоимидазол ,представляющий собой масло коричневого цвета и полученный из -изопропилбензилхлорида. 1 (3, Диметилбензил)-, 5-ДИцианоимидазол с т.пл. 113-115 С (после кристаллизации из этанола), полученный из 3,-Диметилбензилхлорида .1 -(3-Трифторметилбензил)-4,5-дицианоимидазол с т.пл. С . (после кристаллизации из водного этанола), полученный из Зтрифторметилбензилхлорида . 1 - (i-Трифторметилбензил) -, 5-дицианоимидазол с т.пл. 101-102 С (после кристаллизации из этанола), полученный из -трифторметилбензилхлорида . 1-(-Трифторметоксибензил)-,5-дицианоимидазол с т.пл. б2, (после кристаллизации из этанола), полученный из 4-трифторметоксибензилхлорида . 1 -(3-Хлоро-4-метоксибензил)-4,5-дицианоимидазол с т.пл. (после кристаллизации из этанола), полученный из 3-хлоро- -метоксибензилхлорида . (i) 1 l (3 ,-Дихлорфенил)этил ,5 Дицианоимидазол с т.пл. 166- . (после кристаллизации из толуола ), полученный из (i)-1-(3, -дихлорфенил ) этилхлоридг. 3,-Дибромбензилхлорид, использованный в одном из указанных процессов , приготавливают следующим образом. 28 г 3 . -Дибромбензойной кислоты суспендируют при перемешивании в 150 мл толуола при . Далее дигидро-бис- (2-метоксиэтокси)ал1дмииат натрия (70 вес. к объемным в 52 мл толуола) добавляют в течение 30 мин при . Полученную таким образом смесь нагревают в паровой бане в течение 1 ч, затем охлаждают до и подвергают гидролизу, добавляя при охлаждении 150 мл 6 и. хлористоводородной кислоты. Полученную таким образом смесь отделяют, и зодную фазу экстрагируют 100 мл диэтилового эфира. Смешанные органические экстракты промывают насыщенным раствором бикарбоната натрия и водой, сушат с помощью сульфа та натрия, фильтруют и выпаривают, получая 19 г 3 , -Дибромбеизиловогр спирта в виде светло-красного масла Неочищенный спирт растворяют в 60 мл хлороформа и полученный раствор нагревают при дефлегмировании. 20 мл тиоиилхлорида добавляют по циями в течение 20 мин к полученной ранее реакционной смеси, и полученный в результате раствор нагревают при дефлегмировании в течение 1 ч. Полученную реакционную смесь далее выпаривают с получением светлого маслообразного остатка, которы 912 затем повторно разбавляют хлороформом (3 раза по 50 мл) и смешанные хлороформные растворы выпаривают. Полученный остаток растворяют в ди этиловом простом эфире, промывают насыщенным раствором бикарбоната натрия , сушат сульфатом натрия,фильтруют и выпаривают. В результате получают 20 г 3,-дибромбензилхлорида, представляющего собой чистое подвижное масло удовлетворительной чистоты , пригодное для последующих реакций . Применяя аналогичную методику, но используя вместо 3,-дибромбензойной кислоты -трифторметоксибензойную кислоту, получают t-трифторметоксибензилхлорид , который также используют в одном из указанных процессов, в виде чистого подвижного масла. Пример 2. 0,9 г диэтил-1- (3 ,«-Дихлорбёнзил) имидазол-, 5-дикарСоксилата в этанольном метиламине (5 об.% 12 мл) нагревают в закрыток емкости до в течение 2 ч. Полученную реакционную смесь охлаждают, разбавляют 20 мл воды с образованием 0,5 г осадка 1-(3,4-дихлорбензил )имидазол-1М,К -диметил-4 ,5-ДИкарбоксамида с т.пл. 125126 С в виде кристаллов белого цвета. Диэтил-1 -(3,-дихлорбензил)имидазол- ,5-Дикарбоксилат, необходимый для получения указанного соединения, получают следующим образом. При комнатной температуре 10,9 г трет-бутилата добавляют при перемешивании к раствору 20 г диэтилимидазол-4 ,5-Дикарбоксилата в 300 мл безводного диметилформамида.Полученную таким образом смесь перемешивают в течение 0 мин. З. -Дихлорбензилхлорид (20, г) добавляют к полученной ранее реакционной смеси и эту смесь затем нагревают при дефлегмировании в течение 11 ч.Полученную таким образом реакционную смесь охлаждают, выливают в 500 мл ледяной воды и экстрагируют хлороформом (2 раза по 200 мл).Объединенные экстракты промывают водой (3 раза по 300 мл), сушат сзльфатом магния, фильтруют и выпаривают до получения сухого продукта. Образо- , вавшийся твердый осадок кристаллизуют из 100 мл метанола с получением в результате 13 г диэтил-1-(3 . -Дихлорбензил )имидазол-,5-дикарбоксилата т.пл. ЮЗ-ЮУ С) в виде бесцвет ного материала. П р и м е р 3. Используя методи ку, аналогичную описанной в примере 1, но применяя вместо 1-(3, ДИхлор6ензил )имидазол-+, 5-Дикарбоновой кислоты соответствующие замещен ные имидазол-4,5-дикарбоновые кислоты , получают следующие соединения 1 -(4-Бромо-3-хлорбензил)имидазоя -М,М-диметил- ,5-Дикарбоксамид, с т.пл. С (после кристаллизации из этанола), полученный из 1 -(-бромо-3-хлообензил)имидазол-4 ,5-дикарбоновой кислоты. 1 J(3-Cpoмo-i -мeтилбeнзил)имидaзo -N,N-димeтил-t ,5-Дикар6оксамид с т.пл. 121, С (после кристаллизации из этанола), полученный из 1 -(3-6ромо- -метил6ензил)имидазол- 5-Дикар6оновой кислоты. V 1 у(3-Хлор-4-метилбензил)имидазол -Ы,1-диметил-,5-дикар6оксамид с т.пл. .1 10 ,5-1 11 . (после кристаллизации из смеси,состоящей из толуо ла и петролейного эфира с т.кип. 60 ) , полученный из 1-(3-хлор- -ме тилбензилЗимидазол- Б-Дикарбоновой кислоты. 1 -(-Хлор-3-метилбензил)имидазол -Ы,.иметил-4,5-дикарбоксамид с т.пл. I SISI C (после кристаллизации из этанола), полученный из 1-(4-хлор-3-метилбензил)имидазол .5-Дикарбоновой кислоты. (±)-1 - 1 -(З-Хлорфенил)этилДимидазол-Ы ,М-диметил-4,5-Дикарбоксамид с т.пл. 8ь-88 С (после кристаллизац из этанола), полученный из (i:) (З-хлорОенил) этил имидазол-А, 5 дикарбоновой кислоты. fi)-1 -D-(-Хлорфенил)этил имидазол-М ,1 -диметил- ,5-ДИкарбоксамид с т.пл. 129-130 С (после кристаллизации из этанола) ,полученный из (1:) -1 -tl- С -хлорфенил)этилЗимидазол ,5 дикар6оновой кислоты. (i)-1 -D (3,-Дибромфенил)этил имидазол-Н,М-диметил-, 5-Дикарбоксамид с т.пл. 118-120 С (после кристаллизации из циклогексана), полученный из (4)(3, -Дибромфенил этил3имидазол-|,5 дикарбоновой кислоты . (+) -1 -Cl -(3-Трифторметилфенил) этилЗимидазол-1 1,М-диметил-,5-ДИкарбоксамид с т.кип.197-199 С (при давлении 0,3 мм рт.ст.), полученный из (±)-1-р-(З-трифторметилфенилЗэтилЗимидазол- , 5 дикарбоновой кислоты. ( ir)-1 (Ц-Трифторметилфенил) этилЗ имидазол-К,М-диметил-,5-дикарбоксамид с т.пл. (после кристаллизации, из циклогексана), полученный из (i:)1-р-С -трифторметилфенил ) этилЗимидазол-, 5 ДИкарбоновой кислоты. (±) -1 - 1 - (3, -дихлорфенил) пропил имкдазол-диметйл-,5-Дикарбоксамид с т.пл. (после кристаллизации из циклогексана), пояученный из (i:)(3, -дихлррфенил) пропилЗимидазол-, 5-ДикарСоновой кислоты. (t) - (3 ,Л-йихлор(5)енил)бутилЗ имидазол-М,К диметил- ,5-Дикарбоксамид с т.пл. 1 (после кристаллизации из толуола), полученный из (±)-1-(3, -Дихлорфенил) Сутилимидазол-, 5-дикарСоновой кислоты , Используемые в качестве исходных материалов бензилимидазол- ,5 дикарбоновые кислоты в указанных процессах получают е соответствии с методикой, аналогичной описанной в примере 1 и предназначенной для получения 1 -(3,-дихлорбензил)-имидазол- ,5-дикарбоновой кислоты, но, заменяя 1 -(3.-дихлорбензил)-,5 дицианоимидазол соответствующими бензилдицианоимидазолами. 1-(-Кромо-3-хлорбензил)имидазол- (,5-дикарСоновая кислота с т.пл. 2б2С (с разл.), полученная из 1-(t-бpoм-3-xлopбeнзил)-+,5-дициaнoимидaзoлa . I - (3-Бромо- -метилбензил) имидазол-4 ,5-дикарбоновая кислота с т.пл. 259°С (с разл.), полученная 1-(3-бромо-4-метилбензил)-,5 -дицианоимидазола. 1-(3-Хлор-4-метилбензил)имидазол .5 Дикарбоновая кислота с т.пл. 251-253(с разл.), полученная из 1 - (3-хлор-М-метилбензил) - ,5-дицианоимидазола . 1 - (1-Хлор-3-метилбензил)имидазол- ,5 ДикарСоновая кислота с Т.ПЛ. (с разл.), полученная из 1 - (4-хлор-3 метилбензоил) -i ,5 -дицианоимидазола. (i) (3-Хлорфенил)этилЦимид- . азол-А,5-Дикарбоновая кислота с т.пл. 173°С (с разл.), полученная 15 из (±)(3-хлорфенил)этилЗ-4,5-дицианоимидазола . (±)-1 -С -Хлорфенил)этилЗимидазол- ,5 дикарбоновая кислота с т.пл. (с разл.)9 полученная из (l)-l-Il (4-хлорфенил)этилЗ-М,5-дицианоимидазола . (±)-1- 0-(3, -Дибромфенил)этилЗ имидазол-4,5 дикар6оновая кислота с т,пл. 172 89(с разл.) полученная из (±) -1 - (3 , -дибромфенил) этил ,5 дицианоимидазола. (i:)-1 - 1-(3-Трифторметилфенил) этилЗимидазол-,5-Дикар6оновая кислота с т.пл. 183°С (с разл.)) полученная из (t)(ЗТрифторметилфенил ),5 дицианоимидазола. (±) - ((-Трифторметилфенил) этил -имидазол-,5 дикар6оновая кис лота с т.пл. (с разл.),полученная из (i)-1 - (4-трифторметилфени этил-,5 дицианоимидазола. (+)-1 -р -(3 ,-Дихлорфенил)пропил имидазол- ; ,5 дикарбоновая кислота с т.пл. 185C (с разл.), полученная из (±)-1 -D-(3,-дихлорфенил)пропил 4 ,5-ДИцианоимидазола). (i)-1 D (3,-Дихлорфенил)бутил имидазол-,5-дикарбоновая кислота с T.nn.l73-17 C (с разл.),получен ная из 1)-1- 1 - (3 ,дихлорф ил) бутил-,5 дицианоимидазола. Бензилдицианоимидазолы,используемые в качестве исходных материалов при проведении процессов получения указанных соединений, полу ,чают в соответствии с Методикой, описанной в примере 1 и предназначенной для получения 1-(3,-Дихлорбензил )-4,5-Дицианоимидазола, но используя вместо 3 -дихлорбензилхлорида соответствующие замещенные бензилгалиды: 1 -(4-Бромо-3 хлорбензил)- ,5-дицианоимидазол с т.пл. 133133 С (после кристаллизации из этанола), полученный из 4-бромо-Зхлорбензилбромида ,
1 - (3-Вромо-4-метилбензил) -4,5-дицианоимидазол с т.пл. 113 0114 , (после кристаллизации из водного этанола), полученный из 3-бромо- -метилбензилхлорида .
1 -(З-Хлор-4-метилбензил)-,5-ДИ цианоимидазол с т.пл. 120-121 С (после кристаллизации из водного этанола), полученный из З-хлор-4-метилбензилхлорида .
3-Бромо- -метилбензилхлорид в виде чистого подвижного масла,полученный из 3-бромо-А-метилбензилового спирта.
(jj) -1 - (3. -Дибромфенил) этилхлорид с т.кип. 90-100 С (при давлении 0,25 мм рт.ст.), полученный из (i)-1 -(3,А-дибромфенил)этанола.
(i)-1-(3 Дихлорфенил)пропилхлорид с т.кип. 82-85 С (при давлении 9 1 - С -Хлор-З-метилбензил)-4,5-дицианоимидазол с т.пл. 82,5-83, (после кристаллизации из водного этанола), полученный из -хлор-3-метилбензилхлорида . (i) -1 (3-Хлорфенил) этилJ-, 5-дицианоимидазол с т.пл. , полученный из (1-)-1 - (З-хлорфениЛ) этилхлорида. (j:)-1 - (-Xлopфeнил)этилJ- ,5-дицианоимидазол с т.пл. 92-S3°C, полученный из А;)-1-(4-хлорфенил) этилхлори.а.-i ( i)-1-р-(3,-Дибромфенил) ,5-дицианоимидазол с т.пл. 175 177°С (после кристаллизации из толуола ), полученный из (db)(3 ,+ ДибромСенил )этилхлорида. (±)-1-Ц(3-Трифторметилфенил) . ,5-дицианоимидазол с т.кип. 188-130 С (при давлении 0,15 мм рт.ст.), полученный из jr) -1 - (З-Трифторметилфенил)этилброида (-)-1 - 1 - (it-Трифторметилфенил) этилД- ,5-Дицианоимидазол с т.кип. 182-18. С (при давлении 0,1 мм рт.ст.), полученный из (-t) (-трифторметилфенил)этилбромида. (+-)-1-р - (3 .-Дихлорфенил) пропил ,5 дицианоимидазол с т.пл. 95 (после кристаллизации из петролейного эфира, имеющего т.кип. 100IZO C ), полученный из (I)-1 - (3 , -дихлорфенил )пропилхлорида. (i) -1 - (3 ,4-Дихлорфенил) бутил 5 дицианоимидазол в виде масла коричневого цвета, полученный из (t) -1 - (3 , 4-дихлорфенил) бутилхлорида. Бензилгалиды, используемые в качестве исходных материалов при получении указанных соединений, получают следующим образом. (а) В соответствии с методикой, аналогичной описанной в примере 1 и предназначенной для получения 3,-дибромбензилхлорида, но заменяя 3,Дибромбензиловый спирт соответствующим бензиловым спиртом; 0,23 мм рт.ст.), полученный из ±)-1 - (3 , 4-дихлорфенил) пропанола . (±) -1 - (3 ,.ихлорфенил)6утилхлорид , представляющий собой светло коричневое масло, полученной из (±)-1 -(3 «-дихлорфенил)Сутана. С to 32,5 г или Ю, мл брома добавляют в течение 15 мин к переменн смеси, состоящей из 38 г (±)-V-(3-трифторметилфенил )-этанола, 5б г трифенилфосфина и 200 г безводного диметилформамида в атмосфере азота Температуру реакционной смеси поддерживают равной 40-50 С с помощью охлаждения льдом. Далее производят добавление по каплям брома с получением постоянной оранжевой окраски , и после перемешивания в течение 15 мин реакционную смесь выливают в смесь, состоящую из 1 л ледяной воды и 500 мл гексана. Полученную в результате смесь фильтруют и тверды материал тщательно промывают гексаном . Гексановые растворы объединяют промывают водой ( раза по 100 мл) сушат сульфатом натрия и подвергают дистилляции с получением (i)-1-(3 -трифторметилфенил)этилбромида с т.кип. 98-105 0 (при давлении 15 мм рт.ст.), представляющего собой чистое подвижное масло. Используя аналогичную методику, но заменяя (±)-1-(3-трифторметилфенил )этанол соответствующим бензиловым спиртом, получают следующие соединения. (1:)-1 - (Ц-Трифторметилфенил) -этил бромид с т. кип. 81-84С (при давлении 13 мм рт.ст.), полученный из (t)-1 - С -трифторг етилфенил) этанола ( с) 31,8 г -бромо-3-хлортолуола .нагревают вместе с 27,5 г N-бромсукцинимида и г перекиси бензоила в 75 мл четырехлористого углерода при проведении дефлегмирования в течение 10 ч. Полученный таким образом раствор охлаждают, подвергают фильтрации, промывают водным растворм сульфата двухвалент ного железа, сушат сульфатом магния фильтруют и выпаривают до получения сухого продукта. В результате получают k г i-бромо-З-хлоробенэибромида , в виде бледно-оранжевого масла. Бензиловые спирты, используемые в качестве исходных материалов в ме тодиках (а) и (Ь) получают следующим образом. () В соответствии с методикой, описанной в примере 1 и предназначенной длА получения 3,-Дибромбензилового спирта,но заменяя 3, -дибромбензойную кислоту 3 бромо- -метилбензойной кислотой, получают 3 бром-А-метилбензиловый спирт в виде чистого масла оранжевого цвета достаточной чистоты,пригодный для последующей реакции. (li) г борогидрида натрия добавляют частями в течение 30 мин к 65,3 г перемешанного раствора 3,-Дихлорбутирофенона при температуре . Полученную та,ким образом реакционную смесь нагревают при дефлегмировании в течение 2 ч, далее охлаждают, затем производят добавление 300 мл 2 н. раствора гидроокиси натрия и полученную таким эбразом реакционную смесь нагревают при дефлегмировании в течение 30 мин. Метанол удаляют выпариванием , а водный раствор экстрагируют диэтиловым эфиром (5 раз по 200 мл). Смешанные экстракты промывают 200 мл воды 2 н. хлористоводородной кислотой (200 мл) и водой (5 раз по 200 мл), сушат сульфатом магния и выпаривают до получения сухого продукта. В результате получают 65 г (i:)-1-(3,+ дихлорфенил)бутана в виде светло-коричневого масла достаточной чистоты,которое может быть использовано для последующей реакции. Пример . Используя методику , аналогично описанной в примере 1, но заменяя 1-3,-дихлорбензилимидазол- ,5 дикарбоновой кислоты соответствующими замещенными имидазол- 4 ,5-ДИкарбоновыми кислотами ,получают следующие соединения. 1-(3, -Диxлopбeнзил)имидaзoл-N ,N-димeтил-4,5-дикapбoкcaмид с т.пл. 155-156°С (после кристаллизации из этанола), полученный из 1-(3,-дииодбензил)имидазол-,5-Дикарбоновой кислоты. 1 -(3,5-Tpиxлopбeнзиn)имидaзoл-N ,N-димeтил-4, 5-Дикарбоксамид с т.пл. 128-130°С (после кристаллизации из этанола), полученный из 1-(3,+,5 -трихлорбензил)имидазол-4,5-дикарбоновой кислоты. 1 -(3,5-бис-(трифторметил)бензилимидазол-N ,Ы-диметил-,5-Дикарбоксамид с т.пл. (после кристаллизации из циклогексана) ,получен: ный из Т-(3,5-бис-(трифторметил) бензилимидазола-4,5 дикар6оновой кислоты, (± )1 D С Иодфенил)этил имидазол-Ь ,К-диметил-4,5-ДИкарбоксамид с T.nJi. 132-13 °С (после кристаллизации из водного этанола), полученный из (i:) - С4-иодфенил)этил} имидазол-4 ,5-Дикар6оно8ой кислоты. (±)-1-р-(-Трифторметоксифенил) этилj-имидaзoл-N,N-димeтил-,5-Дикарбоксамид с т.пл. 78-78 С (после кристаллизации из петролейного эфир с т,кип. 60-80°С), полученный из (i;) -1 - l - (ft-трифторметоксифенил) этил -имидазола-,5-ДИкарбоновой кислоты. (±)-1 -D-(3,5-бис(трифторметил) фенил)этил -имидазрл-М,Ы-диметил- 4 ,5 дикарбоксамид с т.пл. 13213 °С (после кристаллизации из циклогексана) , полученный из () ,(трифторметил)фенил этил имидазола i) ,5 дикарбоновой кис . лоты. (i) -1 -t (3 , -Дихлорфенил)пентил имидазол-Г ,Н-диметил-, 5-ДИкарбоксамид с т.пл. 142-1 3 0 (после кристаллизации из петролейного эфира с т.кип. 60-80 С) , полученный из (±)-1-|l- (3 ,Л-дихлорфенил)пентил имид -азол-k ,5-дикарбоновой кислотй. (+)(3,-Дихлорфенил)гексил . имидазол-К,М-диМетил-4,5-Дикарбоксамид с т.пл. 114-115 С (после кристаллизации из петролейного эфира с т.кип. бО-.) , полученный из (t) 3,4-дихлорфенил)гексил имидазол-4 ,5 дикарбоновой кисло ты. ri)1-II-(3,4-Дихлорфенил)гептил -имидазол-1М,Ы-диметил-4 ,5 дикарбокс амид с т.пл. 97, (после кристаллизации из петролейного эфира с т.кип. 60-80 С), полученный из (i)-1 - (3 ,4-дихлорфенил) гептил 3 имидазол-г,5дикарбоновой кислоты. (±)-1 -(3 ,4-Дихлорфенил) нонилЗ имидазол-Ы,М-диметил-4,5-дикарбоксамид с т.пл. , (после кристаллизации из петролейного эфира с т. кип. бО-ВО С) , полученный из (J:) -1 - LI - (3 4-дихлорфенил) нонил имидазол-4 ,5 дикарбоновой кислоты. Бекзилимидазол-4,5 дикарбоновая кислота, используемая в качестве ис ходного материала в указанных реакциях , может быть получена в условия описанных в примере 1, для получени (3,ч-дихлорбензил)имидазол-4, 920 карбоновой кислоты, но вместо 1- (3,4-дихлорбензил)-4,5-дицианоимидазола используют соответствующие бензилдицианоимидазолы. Бензилдицианоимидазолы могут быть получены аналогично способам,описанным в примере 1 , для получения 1-(3.4-Дихлорбензил)-4,5-дицианоимидазола , при условии замены 3,4-дихлорбензилхлорида на соответственно замещенный бензилгалид. Бензилгалиды, использованные в качестве исходных продуктов при получении указанных соединений, получают следующим образом. (с() В соответствии с методикой, аналогичной описанной в примере 1 для получения 3,4-дибромбензилхлорида , но применяя вместо 3,4-дибром-. бензилового спирта (±)-1-(3,4-дихлорфенил )гептанол, получают: ( i)-1 -(3,4-Дихлорфенил)гептилхлорид в виде бесцветного масла. Ъ) Используя методику, аналогичную описанной в ,примере 3 в и предназначенную для получения ft)-1-(3 -трифторметилфенил)этилбромида, но заменяя (+)-1 -(3 трифторметилфенил) этанол соответствующим спиртом получают: ( i)1(4-Иодфенил)этилбромид в виде масла оранжевого цвета, полученный из (i:)-1-(4-иодфенил)этанола. (i) -1 -(4-Трифторметоксифенил)этилбромид в виде масла оранжевого цвета , полученный из ((4-трифторметоксифенил )этанола. (i:) ГЗ ,(трифторметил) 1 -. | . фенил этилбромид с т.кип. 97-9С С (при давлении 10 мм рт.ст.), полученный из (i),(трифторметил ) -фенил этанола. (±)-1-(3,4-Дихлорфенил)пентилбромид в виде масла светло-оранжевого цвета, полученный из (i)-l (3,4-дихлорфенил)пентанола. (ir) -1 - (3 4-Дихлорфенил) гексилбромид в виде масла желтого цвета,полученны из (±)-1-(3 ,4-дихлорфенил) гексанола. (±)1 - (3,4-Дихлорфенил)нонилбромид в виде масла желтого цвета,полученный из (i) 1 - (3.4-дихлорфенил) нонанола. (с) Используя методику, аналогичную описанной в примере 3 с,и предназначенную для получения 4-бромо-3 хлорбензилбромида , но применяя вместо 4-бромо-3 хлортолуола 3 4 диодтолуол , получают 3 , Диодбензилбромид с т.пл. 85°С - 87°С. Некоторые из бензиловых спиртов, которые использовались в качестве исходных материалов при получении указанных соединений, получают в соответствии с методикой, описанной в примере 3 (l-t) и предназначенной для получения (t)-1 - (3 . дихлорфенил )бутанрла, но используя вместо 3, «-дихлорбутирофенона соответствую щий алканофенон: ( i:)1 (Иодфенил)этанол в виде масла оранжевогос.цвета, полученный из 4-иодацетофенона. (±:) -1 -(3, Дихлорфенил)пентанол, полученный из З, V-дихлорвалерофенон ( i) -1 (3 , -Дихлорфенил) гексанол в виде масла бледно-желтого цвета, полученный из 3 , Дихлоргексанофенона . il:)-1 -(3 ,+-Дихлорфенил) гептанол в виде почти бесцветного масла,полу ченный, из З,1-дихлоргептанофенона С1:)1 (3, -Дихлорфенил) нонанол в виде почти Сесцетного масла,полученный из З, -дихлорнонанофенона ( i)-1-( -Трифторметоксифенил) этанол получают следующим образом. Метилмагний иодид, полученный из 3,5 г магния и 20,5 г метилиодида в 50 мл диэтилового эфира, подве гают обработке раствором 20 г 4-трифторметоксибензальдегида в 25 м диэтилового эфира (25 мл) при дефле мировании и перемешивании. После до бавления полученную смесь подвергают нагреванию при дефлегмировании в течение 6 ч. Полученную в резуль тате смесь охлаждают и обрабатываю раствором 36 г хлорида аммония в .100 мл воды при С-5°С. Органический слой отделяют и водный слой промывают диэтиловым эфиром (3 раза по 50 мл). Эфирный раствор и растворы полученные в результате промывания смешивают, промывают водой (2 раза по 100 мл), сушат сульфатом натрия и выпаривают до получения сухого продукта. В результате получают 20,3 г i)-1-(4-трифторметоксифенил ) этанола в виде чистого бесцветного масла со степенью чистоты достаточной для проведения последу щей реакции. 3, -Дихлорвалерофенон, использовавшийся в одной из указанных операций, получают следующим образом . 922 60,3 г валерилхлорида добавляют к тщательно перемешанному раствору 70 г хлорк да алюминия в 73,5 г ортодихлорбензола . В результате температура повышается с 25 до . Полученный раствор осторожно подогревают в паровой бане в течение 3 ч, охлаждают и выливают в смесь, состоящую из 500 г льда и 100 мл концентрированной хлористоводородной кислоты. Полученные таким образом, слои разделяют и водную фазу экстрагируют диэтиловым эфиром (3 раза по 250 мл). Полученные органические фазы и эфирные экстракты смешивают,промывают водой (2 раза по 250 мл), насыщенным водным раствором карбоната натрия ( раза по 100 мл) и водой (3 раза по 250 мл), сушат сульфатом натрия и выпаривают до получения сухого продукта., Образовавшийся твердый остаток кристаллизуют из 150 мл петролейного эфира с т.кип. 60-БП С с получением I г З,+ дихлорвалерофенона с т.пл. в виде кристаллов светло-коричневого цвета. Используя аналогичную методику, но применяя вместо валериЛхлорида соответствующие алканоилхлориды,получают: 3 ,-Дихлоргексанофенон с т.кип. П5-150С (при давлении 0,2 мм рт.ст. и т.пл. меньшей 35С) , полученный из гексаноилхлорида. З, -Дихлоргептанофенон с т.пл. 1fO-20C°C (при давлении 0,3 мм рт.ст.), полученный из гептаноил хлорида, З ,4 -Дихлорнонанофенон с т.кип. 155-157С (при давлении 0,25 мм рт.ст.), полученный из нонаноилхлорида . Пример 5- Бензилдицианоимидазолы , используемые в качестве исходных материалов при получении промежуточных продуктов заключительной стадии процесса по описанному способу, получают следующим образом. 10,7 г 2-амино-3(3, -дихлорбензиламино ) малеонитрила нагревают в течение 1 ч на паровой бане в смеси, состоящей из k мл этанола и 12 г триэтилортоформата, содержащего 0,02 мл концентрированной серной кислоты. Полученный раствор выпаривают до получения безводного полутвердого -продукта , который кристаллизуют из 50 мл этанола с образованием 3,0 г 1-(3,-дихлорСензия)- ,5-Дицианоимидазола с т.пл. 131132 ,5С в виде кристаллов бледножелтого цвета. Используя аналогичную методику, но применяя вместо 2-амино-3-(3 , -дихлорбензиламино ) ма леонитрила (±)-2-амино-3- Г|-(|-хлорфенил)этиламино малеонитрил , получают (±)-1- р -(;хлорфенил)этилД-,5-дицианоимидазол с т.пл. 95-S6 C (после кри таллизации из смеси, состоящей из € 100 мл диэтилового эфира и 100 мл гексана. 2-Амино-З-бензилами-О-малеонитри лы, использованные при получении указанных соединений, получают следующим образом. 53 г 2-амино-3-(3. Дихлорбензил динамино)малеоиитрила растворяют в смеси, состоящей из 300 мл метанола и 500 мл тетрагидрофурана. Пол ценный таким образом раствор обрабатывают порциями борогидрида натри ( 7,6 г) в течение 1 ч при комнатной температуре. Далее полученный раствор отстаивают в течение 1 ч и затем выливают воду (3 л). Образовавшийся твердый продукт коричневого цвета, который отделя1фт филь рацией, подвергают кристаллизации из смеси, состоящей из 600 мл толуо ла и 50 мл этанола, с получением 28,5 г 2-амино-3-(3, ДИХлорбензиламиио )малеонитрила с т.пл. 158-160 в виде кристаллов желто-коричневого цвета. Используя аналогичную методику, но применяя вместо 2-амино-3-( -дихлор6ензилидинамино)малеонитрила 2-амино-2- 1 -(г-хлорфенилЗатилидинамино малеонитрил , получают (±)-2-амино-3-р- (-хлорфенил)-этиламино малеонитрил с т.пл. С (посл кристаллизации из толуола). Азометины (азометилидины),необхо димые для использования в качестве исходных материалов при получении указанных соединений, получают следующим образом. 27 г раствора диаминомалеонитрил в 250 мл тетрагидрофурана, содержащего 10 капель концентрированной серной кислоты, обрабатывают 3, хлорбензальдегидом. Получр;нной сме.с дают отстояться ночь, разбавляют петролейным эфиром (т,кип, 60-Г)0 С, 230 мл) и охлаждают до .. UK пе 924 фильтрации получают желтые кристаллы 2-амино-З-(3,4-дихлорбензилидинамино )малеонитрила (53 г, т.пл. 237240 С ) . . Применяя методику, аналогичную указанной, но заменяя З,-дихлорбензальдегид-4-хлорацетофенононом , получают 2-амино-3-С 1 -(4-хлорфенил) этилиденамино малеонитрил (т.пл. С) после кристаллизации из 200 мл диэtилoвoгo эфира. Формула изобретения Способ получения производных имидазола общей формулы ICHjNHOCCH NHOC где R - атом водорода, линейная или разветвленная алкильная группа, содержащая 1-10 атомов углерода, линейная или разветвленная алкенильная или алкинильная группы, содержащие 2-10 атомов углерода Р Р.и R могут быть одинаковыми или различными и каждый из них может представлять собой атом водорода или атом галогена или трифторметокси-группу , или метил-, этил-, пропил-, или изопропил-группы, не замещенные или замещенные одним или нескольк ми атомами фтора, или один из R, R и Р. представляет обой метокси-группу и, по крайней мере, из них представляет собой атом галогена, трифторметокси-группу,метил- , этил-, пропил- или изопропилгруппу , не замещенные или замещенные одним или несколькими атомами фтора, и по крайней мере, один из R,R , R и Тг не является атомом водорода, отличающийся тем, что соединение общей формулы II I N 1l1 ,Ли где У - атом Орома или атом хлора, инейный или разветвленный алкокси259082 926
радикал, содержащий от 1 до 6 атомовпри температуре между О и , ,
углерода, „ .когда Y представляет собой линейR , R , Р. и R имеют указанные ную или розветвленную алкоксй-группу,
значения,содержащую 1-6 атомов углерода, с
подвергают взаимодействию с метил- $выделением целевого продукта, амином в присутствии агента, связывающего кислоту, в инертном органи-Источники информации,
ческом растворителе при температу-принятые во внимание при экспертизе ре 0-30 С, когда Y представляет со- 1. Бюллер К., Пирсон Д. Органибой атом брома или хлора, или в юческие синтезы, ч. II. М., Мир,
инертном органическом растворителе1973, с. 388.












Реферат

Формула


Комментарии