Способ получения производных бензоциклоалкенилдигидрооксиалкановых кислот - RU2012554C1
Код документа: RU2012554C1
Чертежи


















Описание
Изобретение относится к способу получения новых производных бензоциклоалкенилдигидроксиалканойных кислот.
Известно, что некоторые производные 3,5-дигидрокси-3-метилпентанойной кислоты, известной под названием "мевалониновой" кислоты, являются ингибиторами энзима 3-гидрокси-3-метилглютарил коэнзима А редуктазы, который ответственен за биосинтез холестерола (см. Singer et coll. Proc. Sc. Exper. Biol. Med. 102, 275, 1959).
Недавно было предложено соединение - производное мевалониновой кислоты, названное "ловастатин", ранее название "мевинолин", в качестве активного составляющего медикаментозных композиций, применяемых при лечении гиперхолестеролемий (см. патент US 423938 от имени фирмы Мерк).
В настоящее время было установлено, что новые производные бензоциклоалкенил-дигидроксиалконойных кислот обладают гиперхолестеролинемическими, противотромбозными и противогрибковыми свойствами.
Данное изобретение, в частности, относится к соединениям формулы I, которая пронумерована для
лучшего понимания изобретения и только в качестве примера указано ниже:



R1 и R2, которые могут быть идентичными или различными, представляют атомы водорода или алкильные радикалы с 1-3 атомами углерода;
R1 и R2 могут также вместе образовывать алкиленовую цепь -(СН2)n-, в необходимых случаях симметрично замещенную одним или двумя алкильными радикалами с 1-3 атомами углерода, а число n в цепи иметь величины 4 или 5.
R3 и R4, которые могут быть идентичными или различными, представляют атомы водорода, атомы галогена (фтор, хлор или бром), радикалы: трифторметил, N, N-диалкиламина с 1-3 атомами углерода, алкил с 1-4 атомами углерода, алкокси с 1-5 атомами углерода, алкилтио с 1-3 атомами углерода или фенил, в случае необходимости замещенный не более двумя заместителями, которые могут быть идентичными или различными и представлять собой радикалы; алкил с 1-3 атомами углерода, алкокси с 1-3 атомами углерода или атомы галогена (фтор или хлор), при условии, что, если один из заместителей R3 или R4 представляет радикалы: трифторметил, N, N-диалкиламина, фенил или замещенный фенил, то он находится в вершинах 3', 4' или 5' (мета или пара) в формуле I, а другой заместитель представляет атом водорода.
R5 и R6, которые могут быть идентичными или различными, представляют атомы водорода, атомы галогена (фтор, хлор или бром), радикалы: трифторметил, алкил с 1-3 атомами углерода, алкокси С1-С3 или радикал фенил, в случае необходимости замещенный не более, чем двумя заместителями, которые могут быть идентичными или различными и представляют собой радикалы: алкил с 1-3 атомами углерода, алкокси с 1-3 атомами углерода, или галогены (хлор или фтор), при условии, что, если один из заместителей R5 или R6 представляет радикалы: трифторметил, фенил или замещенный фенил, то он находится в вершинах 6 и 7 в формуле I, а другой заместитель обозначает атом водорода.
Заместители R3 и R4 и соответственно R5 и R6 могут также образовывать вместе, при условии нахождения на соседних вершинах, бирадикалы: диэтилен, алкилен или алкилендиокси формулы : -СН= СН-СН= СН-, -(СН2)m-, -O(CH2 )pO-, в которых m может иметь величины 3 или 4 и p величины 1 или 2, и при условии, что, если R3 и R4 и соответственно R5 и R6 образуют бирадикал алкилендиокси, то этот радикал соединен с вершинами 3' и 4' или 4' и 5' и соответственно с вершинами 6 и 7 согласно формуле I.
Заместители R7 и R8 каждый представляет собой атом водорода или образуют вместе и с существующей связью С-С двойную связь с транс-геометрией (Е).
Каждый из заместителей R9 и R10 представляет собой атом водорода или они образуют вместе диалкилметиленовую группу с 1-3 атомами углерода.
R11 может быть гидроксильным радикалом, в этом случае соединения формулы I являются карбоновыми кислотами в свободном состоянии.
Соединения формулы I могут быть получены в виде эфиров или амидов, которые также являются частью изобретения.
Особенно предпочтительными являются эфиры и амиды, которые физиологически приемлемы для формулы I, в которой заместитель R11является алкоксирадикалом с 1-4 атомами углерода, радикалом бензилокси, алкиламино или N, N-диалкиламина с 1-3 атомами углерода, имино с 4-6 атомами углерода, циклоалкиламина с 3-6 атомами углерода или радикалами амино или бензиламино.
Соединения формулы I в виде солей, т. е. в формуле которых заместитель R11 представляет группу формулы -O-M+, в которой M+обозначает фармацевтически приемлемый катион, также является частью изобретения, среди таких соединений особенно предпочтительными являются соли натрия, калия, магния и аммония.
Соединения формулы I могут существовать в виде δ -лактонов, когда заместитель R11 образует с заместителем R9 простую связь, соединения формулы I в форме лактонов также являются частью изобретения.
В соответствии с предпочтительной формой изобретения, предметом изобретения являются соединения формулы I, в которой заместители R1 и R2являются идентичными или образуют незамещенную алкиленовую цепь -(CH2)n-, в которой число звеньев n равно 4 или 5.
Предпочтительным значением заместителей R1 и R2, когда они обозначают алкильные радикалы с 1-3 атомами углерода, является, например, метил.
Предпочтительной величиной n, когда заместители R1 и R2 образуют алкиленовую цепь -(СН2)n-, является, например 4.
Конкретными значениями для одного или другого заместителя R3 и R4являются, только
в качестве примера,
если этот заместитель является галогеном: фтор или хлор,
если он представляет алкильный радикал с 1-4 атомами углерода: метил или этил,
если он
представляет радикал алкокси с 1-5 атомами углерода: метокси или этокси,
если он представляет радикал алкилтио с 1-3 атомами углерода: метилтио,
если он представляет замещенный
фенильный радикал: фенил, замещенный в пара атомом фтора, радикалом метил или метокси. Конкретной величиной m, когда заместители R5 и R4 образуют бирадикал -(СН2)m-, является, например, 4.
Конкретной величиной p, когда заместители R3 и R4 образуют бирадикал алкилендиокси -O(CH2)pO-, является, например, 1.
Предпочтительными значениями радикалов R3 и R4 являются, когда R3 и R4 обозначают алкильные радикалы с 1-4 атомами углерода и/или атомами галогена, или атом галогена и радикал алкокси с 1-5 атомами углерода; когда один из заместителей R3 или R4 является атомом галогена или алкильным радикалом с 1-4 атомами углерода, или радикалом алкокси с 1-5 атомами углерода, или радикалом алкилтио с 1-3 атомами углерода, а другой представляет атом водорода.
Специфическим сочетанием радикалов R3 и R4 являются, например, когда они представляют метильные радикалы в положениях 3' и 5' атом фтора в положении 4' и метил в положении 3', атомы фтора в положениях 3' и 4', атом фтора в положении 3' или 4' и атом водорода, метильный или этильный радикал в положении 4' и атом водорода, радикал метокси в положении 3' или 4', и атом водорода, атом хлора в положении 3' или 4' и атом водорода, или атомы водорода.
Типичным значением какого-либо из заместителей R5 и R6 является, в качестве примера:
атом галогена: фтор или хлор;
алкильный радикал с 1-3 атомами углерода: метил;
радикал алкокси с 1-3 атомами углерода: метокси;
замещенный фенильный радикал: фенильный радикал, замещенный в
параположении атомом фтора или хлора, или радикалом метокси.
Когда заместители R5 и R6 образуют вместе алкиленовую цепь -(СН2)m-, то число m является, в частности, 4.
Когда заместители R5 и R6 образуют вместе цепочку алкилендиокси -O(CH2)pO-, то величина p является, в частности, 1.
Наиболее предпочтительными значениями радикалов R5 и R6 являются, например, атомы галогена (фтор, хлор, бром), алкильные радикалы с 1-3 атомами углерода или радикалы алкокси с 1-3 атомами углерода или когда один из заместителей R5 или R6 представляет атом галогена, которым может быть фтор, хлор или бром, или представляет алкильный радикал с 1 -3 атомами углерода, или радикал алкокси с 1-3 атомами углерода, а другим заместителем является атом водорода.
Специфическими сочетаниями значений радикалов R5 и R6 являются, например, метильные радикалы в положениях 5 и 7, атом хлора в положении 6 и атом водорода, радикал метокси в положении 6 и атом водорода; атом фтора в положении 6 или 7 и атом водорода; метильный радикал в положении 6 или 7 и атом водорода; радикал 4-фторфенил в положении 6 или 7 и атом водорода, или два атома водорода.
Значением заместителей R9 и
R10, когда они образуют группу диалкилметилен, является, например, диметилметилен. Конкретными значениями заместителя R11 являются, в качестве примера:
радикал алкокси с
1-4 атомами углерода: метокси или этокси;
радикал алкиламина с 1-3 атомами углерода: метиламина, этиламино или изопропиламино;
радикал N, N-диалкиламино с 1-3 атомами углерода:
диэтиламино, радикал имино с 4-6 атомами углерода: пирролидино.
Соединения формулы I, в которой заместители R7 и R8 образуют вместе связь, являются предпочтительными по отношению к соответствующим соединениям формулы I, в которых каждый из заместителей R7 и R8 является атомом водорода.
При всех прочих одинаковых радикалах соединения формулы I, в которой каждый заместитель R9 и R10 означает атом водорода, являются предпочтительными, по сравнению с соединениями, у которых заместители R9и R10 образуют диалкилметиленовую группу.
При всех одинаковых радикалах соединения формулы I нелактоновые являются предпочтительными по отношению к δ -бактоновым соединениям.
Среди нелактоновых соединений формулы I эфиры, амиды и соли являются предпочтительными, по сравнению со свободными кислотами.
При всех одинаковых радикалах, эритростереоизомеры являются предпочтительными по отношению к треостереоизомерам (термины эритро и трео относятся к относительной ориентации групп OR9 и OR10 ).
Из δ -лактоновых соединений формулы I, стереоизомеры транс являются предпочтительными по отношению к стереоизомерам цис (термины цис и транс относятся к относительным радикальным или экваториальным положениям двух заместителей δ -лактонового цикла).
Особенно предпочтительные группы соединений в соответствии с изобретением включают соединения
формулы I, в которой
A) X обозначает атомы кислорода или серы, или метиленовую группу, R1 и R2 каждый обозначает метильный радикал или они вместе образуют
тетраметиленовую цепь -(CH2)4-, и только один из радикалов R3 или R4 и соответственно R5 или R6 является водородом, R7 и
R8 образуют вместе связь и каждый из R9 и R10 является атомом водорода.
B) X, R1, R2, R7, R8, R9 и R10 имеют значения, данные выше в A), один из заместителей R3 и R4 означает атом водорода, а другой - атом фтора или хлора, и только один из заместителей R5 или R6 является атомом водорода.
С) X, R1, R2, R7, R8, R9 и R10 имеют значения, приведенные выше в A), один из заместителей R3 и R4 является атомом водорода, а другой - атомом фтора или хлора, и каждый из заместителей R5 и R6 является атомом водорода.
D) X, R1, R2, R7, R8, R9 и R10 имеют особые значения, данные выше в A), два заместителя R3 и R4 являются атомами водорода и один из радикалов R5 и R6 является атомом водорода.
Е) X, R3, R4, R5, R6, R7, R8, R9, R10 имеют значения, приведенные выше в С), и R1 и R2 образуют вместе тетраметиленовую цепь -(CH2)4-.
F) X, R1, R2, R7, R8, R9, R10 имеют значения, приведенные выше в Е), и каждый из заместителей R3, R4, R5, R6 является атомом водорода.
В каждом из соединений формулы I имеется по меньшей мере два центра асимметрии, которыми являются два атома углерода, носители групп OR9 или OR10, когда заместители R9 и R10 каждый является атомом водорода или они вместе образуют диалкилметиленовую группу, или же ими являются гидроксилированный углерод и третичный углерод, находящийся в положении альфа межциклического атома кислорода, когда заместители R9 и R10 вместе образуют связь.
Из этого следует, что каждое соединение, свободная кислота, эфир, амид, соль или δ -лактон, соответствующие формуле I, может существовать по меньшей мере в форме четырех стереоизомеров, два по два диастереоизомера, которые обозначаются с использованием обычных конфигурационных обозначений R и S, т. е. RR, SS, RS и SR, или в виде диастереоизомерных рацематных смесей, RR-SS и RS-SR.
Все эти стереоизомеры также являются частью изобретения. В соединениях формулы I может быть более двух центров асимметрии, в частности, когда заместители R1 и R2 различные, за счет этого возникают дополнительные стереоизомеры, которые также являются частью изобретения.
Выделение или синтез оптически активной формы соединения формулы I осуществляют известными специалисту методами, например путем раздвоения рацемата или путем получения в начале синтеза оптически активного соединения, и затем определяют биологические свойства полученных изомеров в соответствии с описанными ниже испытаниями.
Под термином "физиологически приемлемого эфира или амида" подразумевают эфир или амид соединения в соответствии с изобретением, который при гидролизе в физиологических условиях образуют в этих условиях физиологически приемлемый спирт или амин, т. е. не токсичный в желаемых дозах.
Под термином "алкил" подразумевают насыщенную углеводородную цепочку, линейную или разветвленную, производную от соответствующего алкана, при удалении атома водорода.
Под термином "алкокси" подразумевают алкильный радикал, как он определен выше, связанный с материнской молекулой атомом кислорода.
Под термином "алкиламино" подразумевают атом азота, замещенный атомом водорода или алкильным радикалом, как это определено выше, при этом свободная валентность используется для создания связи с материнской молекулой.
Под термином "N, N-диалкиламино" подразумевают алкиламиновый радикал, как определено выше, в котором атом водорода замещен алкильным радикалом, как он определен выше.
Под термином "имино" подразумевают радикал диалкиламино, как он определен выше, в котором два алкильных радикала образуют вместе алкиленовую цепь.
Выражение "диалкил. . . с 1-x атомами углерода" обозначает, что каждый из двух
алкильных радикалов, образующих диалкильную группу, может содержать независимо от 1 до x атомов углерода. В качестве характерных соединений в соответствии с изобретением можно только в качестве
примера привести следующие соединения, структурные формулы которых приведены в приложении:
Соединение 1: (+, -)-6Е-эритро-7-(4-(4-фторфенил)-спиро-3(2Н-бензопиран-1,2,1'- циклопентил))-3,
5-дигидрокси-6-гептеноат этила.
Соединение 2: (+, -)-6Е-эритро-7-(1,2-дигидро-2,2-диметил-4-фенил-3-нафтил)-3,5- дигидрокси-6-гептен-оат метила.
Соединение 3: (+, -)-6Е-эритро-7-(4-(4-хлорфенил)-2,2-диметил-2Н-3-бензотиапи-ран-ил)- 3,5-дигидрокси-6-гептен-оат метила.
Соединение 4: (+, -)-эритро-7-[4-(4-фторфенил)-спиро-3-(2Н-бензопиран-1,2, 1'-цик- лопентил)] -3,5-дигидроксигептаноат этила.
Соединение 5: (+, -)-6Е-эритрo-7-[4-(4-фторфенил)-спиро-3-(2Н-бензопиран-1,2,1'-циклопентил )] -3,5-дигидрокси-6-гептен-оат натрия.
Соединение 6: (+, -)-6Е-эритро-7-(4-(4-фторфенил)-спиро-3-(2Н-бензопиран-1,2,1'-циклопентил ))-3,5-дигидрокси-6-гептен-оат бензила.
Соединение 7: (+, -)-6Е-эритро-7-(4-(4-фторфенил)-спиро-3-(2Н-бензопиран- 1,2,1'-циклопентил))-3/5-дигидрокси-N-метил-6-гептенамид. Соединение 8: (+, -)-транс-6-6-{ 1Е-2-[4-(4-фторфенил)-спиро-3-(2Н-бензопиран-1-2, 1'-циклопе нтил)] -этенил} -4-гидрокси-3/4/5/6-тетрагидро-2-пиранон.
Соединение 9: (+, -)-транс-4-гидрокси-3,4,5,6-тетрагидро-6(2-(4-(4-фторфенил)-спи- ро-3-(2Н-бензопиран-1-2, 1'-циклопентил)- этил)-2-пиранон.
Соединение 10: (+, -)-эритро-7-(4-(4-фторфенил)-спиро-3-(2Н-бензопиран-1-2,1'-циклопентил)) -3,5-дигидроксигептаноат натрия.
Соединение 11: (+, -)-6-(1E-2-[4-(4-фторфенил)-спиро-3-(2Н-бензопиран-1-2,1'-цик- лопентил)] - этенил-(2,2-диметил-1,3-диоксан-4-ил)-ацетат этила.
Соединение 12: (+, -)-6Е-эритро-3, 5-дигидрокси-7-(4-фенилспиро-3-(2Н-бензопи-ран-1-2,1'- циклопентил))-6-гептеноат этила.
Соединение 13: (+, -)-6Е-эритро-7-[4-(4-этилфенил)-спиро-3-(2Н-бензопиран-1-2,1'-циклопентил )] -3,5-дигидрокси-6-гептеноат этила.
Соединение 14: (+, -)-6Е-эритро-3,5-дигидрокси-7[6-метил-4-фенилспиро-3(2Н-бен- зопиран-1-2,1'- циклопентил)] -6-гептен-оат этила.
Соединение 15: (+, -)-6Е-эритро-7-[7-фтор-4-фенил-спиро-3-(2Н-бензопиран-1-2,1 - циклопентил)] -3,5-дигидрокси-6-гептен-оат метила.
Соединение 16: (+, -)-6Е-эритро-3, 5-дигидрокси-7-[4-(4-метилфенил)-3-спиро(2Н-бензопиран-1-2 , 1'-циклопентил)] -6-гептен-оат этила.
Соединение 17: (+, -)-6Е-эритро-7-[4-(3-фторфенил)-3-спиро-(2Н-бензопиран-1,2, 1'-циклопентил )] -3/5-дигидрокси-6-гептен-оат этила.
Соединение 18: (+, -)-6Е-эритро-3,5-дигидрокси-7-[4-(4-метоксифенил)-3-спиро (2Н-бензопиран-1-2,1'-циклопентил)] -6-гептен-оат этила.
Соединение 19: (+, -)-6Е-эритро-7-[4-(4-хлорфенил)-3-спиро(2Н-бензопирaн-1-2,1'-цик- лопентил)] -3,5-дигидрокси-6-гептен-оат этила.
Соединение 20: (+, -)-6Е-эритро-3,5-дигидрокси-7-[4-(1-нафтил)-3-спиро(2Н-бензо- пиран-1-2,1'-циклопентил)] -6-гептен-оат этила.
Соединение 21: (+, -)-6Е-эритро-3,5-дигидрокси-7-[4-(3, 5-диметилфенил)-3-спиро- (2Н-бензопиран-1-2,1'-циклопентил)] -6-гептен-оат этила.
Соединение 22: (+, -)-6Е-эритро-7-[4-(4-фторфенил)-5,7-диметил-3-спиро(2Н-бензо- пиран-1-2, 1'-циклопентил)] -3,5-дигидрокси-6-гептен-оат этила.
Соединение 23: (+, -)-6Е-эритро-7-[4-(4-этокси-фенил-3-спиро-(2Н-бензопиран-1-2, 1'-циклопентил)] -3,5-дигидрокси-6-гептен-оат метила.
Соединение 24: (+, -)-6Е-эритро-3,5-дигидрокси-7-[4-(4-изопропилоксифенил)-3- спиро(2Н-бензопиран-1-2,1'-циклопентил)] -6-гептен-оат метила.
Соединение 25: (+, -)-6Е-эритро-7-[4-(4-фторфенил)-6-метокси-3-спиро(2Н-бензопиран-1-2,1'-ци клопентил)] -3/5-дигидрокси-6-гептен-оат метила.
Соединение 26: (+, -)-6Е-эритро-7-(4-(4-трифторметилфенил)-3-спиро(2Н-бензопи- ран-1-2,1'-циклопентил))-3,5-дигидрокси-6-гептен-оат этила.
Соединение 27: (+, -)-6Е-эритро-3, 5-дигидрокси-7[4-(4-n-пентилоксифенил)-3-спи- ро(2Н-бензопиран-1-2,1'-циклопентил)] -6- гептен-оат метила.
Соединение 28: (+, -)-6Е-эритро-7-[4-(4-фторфенил)-3-спиро(2Н-нафто(б)пиран-1-2, 1'-циклопентил)] -3,5-дигидрокси-6-гептен-оат метила.
Соединение 29: (+, -)-6Е-эритро-3, 5-дигидрокси-7-[4-(4-метилтиофенил)-3-спиро- (2Н-бензопиран-1-2,1'-циклопентил)] -6-гептен-оат метила.
Соединение 30: (+, -)-6Е-эритро-7-(4-(4-трет-бутилфенил)-3-спиро(2Н-бензопиран-1-2,1'-циклоп ентил)-3/5-дигидрокси-6-гептен-оат этила.
Соединение 31: (+, -)-6Е-эритро-7-((4-(4-фторфенил)-3-спиро(2Н-бензопиран-1-2,1'-циклогексил ))-3/5-дигилрокси-6-гептен-оат этила.
Соединение 32: (+, -)-6Е-эритро-7-(4-(4-фторфенил)-7-изопропилокси-3-спиро(2Н-бензопиран-1-2 , 1'-циклопентил))-3/5-дигидрокси-6-гептен-оат метила.
Соединение 33: (+, -)-6Е-эритро-7-[(4-фторфенил)-3-спиро(2Н-бензопиран-1-2,1'-циклопентил)] - 3,5-дигидрокси-6-гептенамид.
Соединение 34: (+, -)-6Е-эритро-7-[4-(4-фторфенил)-3-спиро(2Н-бензопиран-1-2, 1'-циклопентил) ] -3,5-дигидрокси-N-изопропил-6-гептенамид.
Соединение 35: (+, -)-6Е-эритро-7-[4-(1,1-бифенил-4-ил)-3-спиро(2Н-бензопиран-1-2, 1'-циклопентил)] -3,5-дигидрокси-N, N-тетраметилен-6-гептенамид.
Соединение 36: (+, -)-6Е-эритро-7-[4-(4-фторфенил)-3-спиро(2Н-бензопиран-1-2,1'-циклопентил) ] -3/5-дигидрокси-N-циклогексил-6-гептенамид.
Соединение 37: (+, -)-6Е-эритро-N-бензил-7-[4-(4-фторфенил)-3-спиро(2Н-бензопиран-1-2,1'-цик лопентил)] -3/5-дигидрокси-6-гептенамид.
Соединение 38: (+, -)-6Е-эритро-7-[4-(4-этилфенил)-3-спиро(2Н-бензопиран-1-2,1'-циклопентил) ] -6-гептен-оат натрия.
Соединение 39: (+, -)-6Е-эритро-3, 5-дигидрокси-7-[4-(6-метилфенил)-3-спиро(2Н-бензопиран-1-2 , 1'-6-гептен-оат натрия.
Соединение 40: (+, -)-6Е-эритро-3,5-дигидрокси-7-[4-(4-изопропилфенил-3-спиро- (2Н-бензопиран-1-2, 1'-циклопентил)] -6-гептен-оат натрия.
Соединение 41: (+, -)-6Е-эритро-3,5-дигидрокси-7-[(4-фенил-3-спиро(2Н-бензопи-ран-1-2,1'-цик лопентил)] -6-гептен-оат натрия.
Соединение 42: (+/-)-6Е-эритро-7-[4-(4-хлорфенил)-3-спиро(2Н-бензопиран-1-2,1'-циклопентил) ] -3/5-дигидрокси-6-гептен-оат натрия.
Соединение 43: (+, -)-6Е-эритро-3, 5-дигидрокси-7-(4-фенил-2Н-1-бензопиран-3- ил) -6-гептен-оат этила.
Соединение 44: (+, -)-6Е-эритро-7-[4-(4-фторфенил)-2,2-диметил-2Н-11-бензопи- ран-3-ил)-3,5-дигидрокси-6-гептен-оат метила.
Соединение 45: (+, -)-6Е-эритро-7-(4-(4-фторфенил)-2-изопропил-2Н-1-бензопиран -3-ил)-3,5-дигидрокси-6-гептен-оат этила.
Соединение 46: (+, -)-транс-4-гидрокси-3,4,5,6-тетрагидро-2-[1E-4Е-фенил-3-спиро- (2Н-бензопиран-1-2,1'-циклопентил)-этенил] - 6-2Н-2-пиранон.
Соединение 47: (+, -)-транс-6{ 1Е-2[4-(4-фторфенил)-6-метокси-3-спиро(2Н-бензопи- ран-1-2,1'-циклопентил)] -этанил} -4-гидро- кси-3,4,5,6-тетрагидро-2Н-2-пиранон.
Соединение 48: (+, -)-транс-6-[1E-2-(1,2-дигидро-2, 2-диметил-4-фенил-3-нафтил)- этенил] -4-гидрокси-3,4,5,6-тетрагидро-2Н-2-пиранон.
Соединение 49: (+, -)-транс-4-гидрокси-3,4,5,6-тетрагидро-6-[1E-2-(2H-2, 2-диметил-4-фенил-3- бензотиапиранил)-этенил] -2Н-2-пиранон.
Соединение 50: (+/-)-6Е-эритро-3,5-дигидрокси-7-[(4-фенил-3-спиро(1,2-дигидро-2,1'-нафтален циклопентил)] -6-гептен-оат метила.
Соединение 51: (+, -)-6Е-эритро-7-[4-(4-фторфенил)-1,2-дигидро-2,2-диметил-3-на- фтил)] -3,5-дигидрокси-6-гептеноат метила.
Соединение 52: (+, -)-6Е-эритро-7-(1,2-дигидро-2,2-диметил-4-фенил-3-нафтил)-3,5-дигидрокси- 6 -гептен-оат метила.
Соединение 53: (+, -)-6Е-эритро-7-[4-(4-фтор-фенил)-3-спиро(1,2-дигидро-2, 1'-нафта- ленциклопентил)] -3,5-дигидрокси-6-гептен-оат метила.
Соединение 54: (+, -)-6Е-эритро-7-[4-(4-хлорфенил)-3-спиро(1,2-дигидро-2,1'-нафта- ленциклопентил)] -3, 5-дигидрокси-6-гептeн -оат метила.
Соединение 55: (+, -)-6Е-эритро-7-(4-хлорфенил)-1,2-дигидро-2,2-диметил-3-нафтил) -3,5-дигидрокси-6-гептен-оат метила.
Соединение 56: (+, -)-6Е-эритро-7-(4-(3-фторфенил)-3-спиро(1,2-дигидро-2,1'-нафта- ленциклопентил))-3,5-дигидрокси-6-гептен-оат метила.
Соединение 57: (+, -)-6Е-эритро-7-(4-(4-фторфенил)-1, 2-дигидро-3-нафтил)-3,5-дигидрокси -6-гептен-оат натрия.
Соединение 58: (+, -)-6Е-эритро-7-(1,2-дигидро-2-изопропил-4-фенил-3-нафтил)-3, 5-дигидрокси-6-гептен-оат метила.
Соединение 59: (+, -)-6Е-эритро-7-(1,2-дигидро-2-метил-4-фенил-3-нaфтил)-3,5-ди- гидрокси-6-гептен-оат метила.
Соединение 60: (+, -)-6Е-эритро-3, 5-дигидрокси-7-(8-метил-4-(4-метилфенил)-3- спиро(1,2-дигидро-2,1'-нафталенциклопен- тил))-6-гептен-оат метила.
Соединение 61: (+, -)-6Е-эритро-7-[6-хлор-4-(4-хлорфенил)-3-спиро(1, 2-дигидро-2,1'-нафталенц иклопентил)] -3/5-дигидрокси-6-гептен-оат метила.
Соединение 62: (+/-)-6Е-эритро-3,5-дигидрокси-7-[(8-метил-4-(4-метоксифенил)-3-спиро(1,2-ди гидро-2/1'-нафталенциклопентил)] -6-гептен-оат метила.
Соединение 63: (+, -)-6Е-эритро-7-[6-хлор-4-(4-фторфенил)-3-спиро(1,2-дигидро-2,1'- нафтален-циклопентил)] -3, 5-дигидрокси-6-гептен-оат метила.
Соединение 64: (+, -)-6Е-эритро-7-(1,2-дигидро-2,2-диметил-7-метокси-3-нафтил) -3,5-дигидрокси-6-гептен-оат метила.
Соединение 65: (+, -)-6Е-эритро-3,5-дигидрокси-7-(4-фенил-3-спиро(2Н-бензотиа- пиран-1-2,1'-циклопентил))-6-гептен-оат натрия.
Соединение 66: (+, -)-6Е-эритро-3, 5-дигидрокси-7-[4-(4-метилфенил)-3-спиро(2Н-бензотиапиран- 1- 2,1'-циклопентил)] -6-гептен-оат метила.
Соединение 67: (+, -)-6Е-эритро-3,5-дигидрокси-7-(4-фенил-2, 2-диметил-2Н-3-бен- зотиапиранил)-67-гептен-оат метила.
Соединение 68: (+, -)-6Е-эритро-3,5-дигидрокси-7-(4-фенил-2,2-диметил-2Н-3-бен- зотиапиранил)-6-гептен-оат натрия.
Изобретение относится к способам получения соединений в соответствии с изобретением, отличающихся тем, что они включают в себя по меньшей мере:
a) восстановление кетоэфира общей
формулы 4, в которой X, R1, R2, R3, R4, R5, R6, R7, R8 и R11 имеют указанные выше значения,



b) трансэтерификацию соединений формулы 1 или алкоголиз соединений формулы 1 в форме δ -лактонов, или алкилирование соединений формулы I в форме солей,
с) гидролиз соединений формулы 1 в форме эфиров или δ -лактона,
d) когда R7 и R8 и соответственно R9 и R11 образуют простую связь, то обрабатывают соответствующие соединения формулы I в форме солей третичным хлорамином,
е) когда R7, R8 и R10 обозначают атом водорода и R9 и R11 образуют связь, то каталитически восстанавливают δ -лактоновые соединения формулы 1, в которой R7 и R8 образуют связь, или осуществляют лактонизацию соответствующих кислых соединений формулы 1, в которой R7, R8 и R10 обозначают атом водорода,
f) аминолиз соединений формулы 1 в форме сложного эфира или δ -лактона,
g) если R9 и R10 вместе образуют диалкилметиленовую группу, то осуществляют циклизацию соответствующих соединений формулы 1, в которой R9 и R10 каждый обозначает атом водорода, с помощью алкоксиалкена.
Соединения формулы 1, в которой X, R1, R2, R3, R4, R5, R6, R7, R8имеют определенные выше значения, и в которой заместители R9 и R10каждый обозначает атом водорода, могут быть получены в форме эфиров путем приведенной ниже на схеме I последовательности реакций.
СХЕМА I
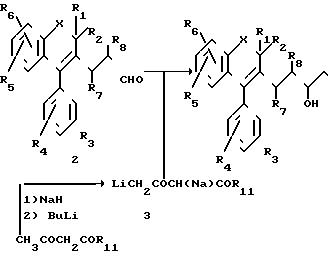


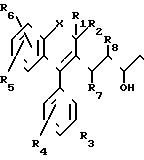


Как показано на Cхеме I, альдегидные соединения формулы 2, в которой заместители R1, R2, R3, R4, R5, R6, R7 и R8 имеют определенные выше значения, подвергают альдольной конденсации с соответствующим ацетоацетатом в форме смешанной двойной соли натрия и лития формулы 3, в которой F11 имеет значения, которые определены выше, в полярном растворителе, как, например, ТГФ (см. Kraus ot coll. J. Org. Chem. , 48, 2111, 1983) и получают замещенные в положении 7 5-гидрокси-3-оксо-6-гептен-оаты общей формулы 4.
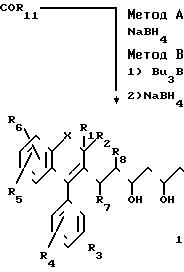
Эфиры 4, в виде раствора в инертном растворителе, как, например ТГФ или эфире, обрабатывают щелочным боргидридом, предпочтительно боргидридом натрия (метод A), что приводит к соединениям 1 в форме смеси изомеров трео и эритро, которые затем могут быть разделены обычными физико-химическими методами, как, например хроматографией.
Метод B является предпочтительным вариантом метода A и позволяет получить соединения в соответствии с изобретением в форме эритро. Метод B состоит в том, что предварительно перед восстановлением щелочным боргидридом, обрабатывают эфиры 4 в соответствующем растворителе, например в ТГФ, комплексообразующим агентом, предпочтительно триалкилбораном, например трибутилбораном (см. Narasaka, Chem. letters, 1415-1418, 1980) или алкоксидиалкилбораном, например метоксидиэтилбораном см. Chenet Coll. Tetrahed. Lett. , 28(2), 155-158, 1987).
Соединения формулы 2, в которой заместители R7 и R8 образуют вместе связь, могут быть получены в соответствии с последовательностью реакций, представленной на схеме II.
СХЕМА II


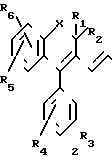
Как показано на схеме II, соединения формулы 5, в которой X, R1, R2, R3, R4, R5 и R6 имеют приведенные выше значения, подвергают реакции Вилсмейера с N, N-диметиламино-3-акролеином (см. Ullrich, Breitmaier, Synthesis, 8, 641-645, 1983) в инертном растворителе, например ацетонитриле, при температуре от 20оС до температуры обратного холодильника/ и получают соединения 2 геометрии транс/ как это подтверждается ЯРМ-спектроскопией.
Другой способ получения альдегидов формулы 2/ в которой R7 и R8 образуют вместе связь/ иллюстрируется следующей схемой III.
СХЕМА III


Как показано на схеме III, соединения формулы 5 подвергают реакции бромирования при помощи N-бромсукцинимида (NBS) в растворителе N, N-диметилформамид (ДМФ) или в хлорированном растворителе, например, в четыреххлористом углероде или метиленхлориде, и получают соответствующие 3-бромированные соединения 6, которые последовательно обрабатывают бутиллитием в соответствующем растворителе, предпочтительно эфире, например в диэтилэфире, затем 3-этоксиакролеином или N, N-диметиламино-3-акролеином, и получают альдегиды 2 в транс-форме, как на это указывает ЯМР-спектроскопия.
Приведенная ниже схема IV иллюстрирует альтернативное получение альдегидных промежуточных продуктов формулы 2, в которой R7 и R8образуют
вместе связь:


Когда X обозначает серу, то для получения промежуточных соединений формулы 8 особенно предпочтительным является альтернативная реакция, которая состоит в проведении реакции бромистого соединения формулы 6 с алкилакрилатом, предпочтительно метилакрилатом или этилакрилатом, в присутствии основания, например триэтиламина или бикарбоната натрия, диспергированного на угле палладия или производного палладия, как, например дихлорида палладия или его ацетата, и лиганда, предпочтительно триарилфосфина, например триортотолилфосфина, в подходящем растворителе, например в N, N-диметилформамиде.
Эфиры 8 восстанавливают с помощью гидрида диизобутилалюминия (DIBAL) в растворителе, обычно в диэтиловом эфире или ТГФ, в соответствующие 3-замещенные транс-пропанолы, которые затем окисляют с помощью оксалилхлорида в ДМСО (см. Swern et coll. , J. Org. Chem. 43, 2480, 1978), или с помощью двуокиси марганца в соответствующем растворителе, например ТГФ, и получают альдегиды формулы 2-транс-геометрии.
Альдегиды формулы 2, в которой заместители R7 и R8 каждый представляют атом водорода, могут быть получены с помощью показанной ниже последовательности реакций.
СХЕМА V

В соответствии с реакционной последовательностью схемы V, альдегиды формулы 2, в которой R7 и R8 образуют двойную связь, подвергают реакции ацетализации, например, с помощью ортоформиата формулы HC(OR12)3, в которой R12 представляет алкильный радикал с 1-4 атомами углерода, предпочтительно метил или этил, в присутствии кислой смолы, или проводят кислотокатализируемую реакцию со спиртом формулы R12OH, в которой R12имеет указанные выше значения или может представлять радикал формулы -(CH2)qOH, в которой q = 2 или 3, и получают соединения 10, при этом метиленовый радикал - R12. . . R12 - образует с атомами кислорода, к которым он присоединен, цикл из 5 или 6 звеньев.
Затем проводят гидрирование соединений 10, предпочтительно при пониженном давлении и в присутствии металлического катализатора, например диспергированного на угле палладия, в соответствующем растворителе, например в ТГФ или в спирте, например метаноле, до соответствующих 3-замещенных ацеталей пропанальдегидов 11, которые затем могут быть дезацетализированы в пропанальдегиды 2 с помощью обычных методов дезацетализации, например обработкой ацетала кислой смолой в смеси ацетон-вода, или, в общем случае, с помощью кислого катализатора в растворителе или в смеси соответствующих растворителей.
Альтернативой получения альдегидных соединений формулы 2, в которой каждый заместитель R7 и R8 обозначает атом водорода, состоит в проведении реакции бромистых соединений формулы 6 с аллиловым спиртом, в присутствии основания, например триэтиламина или бикарбоната натрия, диспергированного на угле палладия или производного палладия, например двухлористого палладия или его ацетата, и лиганда, предпочтительно триарилфосфина, например, триортотолилфосфин, в подходящем растворителе, например N, N-диметилформамиде.
Соединения формулы 5 могут быть получены с помощью последовательности реакций, приведенных на схеме VI,
СХЕМА VI
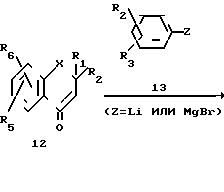

Соединения формулы 12/ в которой Х представляет атомы кислорода и серы/ R1/ R2/ R5и R6 имеют указанные выше значения/ получают по методу Кабе (Kabbe et coll. , Synthesis, 12, 886, 1978).
Соединения формулы 12/ в которой Х представляет метиленовую группу и R1/ R2/ R5 и R6 имеют указанные выше значения/ получают, согласно последовательности реакции/ показанной на схеме VII.
СХЕМА VII


Соединения формулы 1 в форме эфиров могут быть также получены путем трансэтерификации соединений формулы 1, различающихся заместителем R11, или путем алкоголиза соединений формулы 1 в форме δ -лактонов, или путем О-алкилирования соединений формулы 1 в форме солей, предпочтительно, солей натрия, с помощью бромида или йодида формулы R11-Br(1), в которой R11 имеет определенные выше значения.
Эфиры, соответствующие формуле 1, в которой каждый из заместителей R7 и R8 представляет атом водорода, могут быть получены путем гидрогенизации соответствующих эфиров формулы 1, в которой заместители R7 и R8 образуют связь, предпочтительно при пониженном давлении, в присутствии металлического катализатора, например палладия или окиси платины, в соответствующем растворителе, например ТГФ.
Соединения формулы 1 в форме солей могут быть получены с помощью щелочного гидролиза, например, с помощью щелочи натрия или щелочи калия, в соответствующем растворителе, предпочтительно, в спирте, соответствующих соединений формулы 1 в форме эфиров, предпочтительно метиловых или этиловых эфиров, или в форме δ -лактонов.
δ -лактоновые соединения формулы 1, в которой заместители R7 и R8вместе образуют связь, могут быть получены путем проведения реакции соответствующих соединений формулы 1 в форме солей предпочтительно солей натрия, с хлорамином, предпочтительно с 2-хлорэтил-N, N-диэтиламином, в соответствующем растворителе, предпочтительно, в карбональном, например, в ацетоне или бутаноне. δ -лактоновые соединения формулы 1, в которых R7, R8 и R10 каждый представляет атом водорода, получают путем лактонизации соответствующих кислот формулы 1, т. е. формулы, где R11представляет гидроксильный радикал: реакцию лактонизации проводят предпочтительно путем нагрева кислот в инертном ароматическом растворителе, таком как бензол, толуол, ксилол или их смесь, в необходимом случае в присутствии дегидратирующего реагента, например, паратолуолсульфоновой кислоты; другой, специфический способ получения δ -лактоновых соединений формулы 1, в которой R7, R8 и R10 означает атом водорода, состоит в гидрировании в гетерогенной фазе, соответствующих ненасыщенных соединений формулы 1, т. е. соединений, в формуле которых R7и R8 и соответственно R9 и R11 образуют вместе связь, в присутствии металлического катализатора, предпочтительно, диспергированного на угле палладия или оксида платины, в соответствующем растворителе, предпочтительно, в эфире, например в ТГФ, или в спирте, как, например метанол или этанол.
Кислые соединения формулы 1, в которой R9 и R10 каждый обозначает атом водорода, могут быть получены путем подкисления соответствующих соединений формулы 1 в форме солей, или путем гидрогенолиза, в присутствии диспергированного на угле палладия, соответствующих бензиловых эфиров, т. е. соединений формулы 1, в которых R11 представляет группу бензилокси.
Соединения формулы 1 в форме амидов получают путем аминолиза, при избытке амина в полярном растворителе, предпочтительно в метаноле или этаноле, соответствующих эфиров формулы 1, предпочтительно, метиловых или этиловых эфиров, или соответствующих соединений формулы 1 в форме δ -лактона.
Соединения формулы 1, в которой заместители R9 и R10 образуют вместе диалкилметиленовую группу с C1-3, получают путем проведения реакции соответствующих соединений формулы 1, в которой R9 и R10обозначают каждый атом водорода, с соответствующим алкоксиалкеном (термин алкоксиалкен означает алкен с 3-7 атомами углерода, замещенный по двойной связи радикалом алкокси, определенным выше, предпочтительно, метокси), в соответствующем растворителе, например, в N, N-диметилформамиде, в присутствии кислотного катализатора, например, паратолуолсульфоновой кислоты.
Следует заметить, что соединения в соответствии с изобретением в разных формах: кислоты, соли, эфиры, амиды или лактоны, могут быть конвертированы в соответствии с описанными выше способами, следовательно, эти различные формы являются также промежуточными для синтеза соединений в соответствии с изобретением.
Смеси стереоизомеров (цис-, транс-, трео-, эритро-, энантомеры) могут быть разделены обычными методами, на стадиях синтеза, которые являются наиболее подходящими.
Под обычными методами предполагают совокупность методов, известных специалисту, например, перекристаллизация, хроматография или образование комбинации с оптически активными соединениями.
Промежуточные соединения синтеза, отвечающие формулам 2, 4, 5, 6, 7, 8, 9, 10, 11, 14, также являются частью изобретения, за исключением продуктов формулы 5, в которой R1 и R2 представляют H и X представляет S или CH2, некоторые из этих соединений известны по работе Дегани (Degani, Ann. Chem. (Rome) 1971, 61(2), 793-813) и Пена (Penn, J. Magn. Res. 1975, 18(1), 6-11).
Настоящее изобретение относится также к способам получения этих промежуточных соединений синтеза.
Соединения формулы 1 обладают свойством ингибировать 3-гидрокси-3-метилглутарил, коэнзим А, редуктазу, и, следовательно, они оказывают сильное гипохолестеролинемическое действие.
Соединения формулы 1 способны также быть антагонистами рецепторов тромбоксана A2, это свойство проявляется в антиагрегирующем действии на тромбоциты.
Такие свойства соединений в соответствии с данным изобретением делает их особенно интересными для применения в качестве лекарств при лечении различных заболеваний сердечной мышцы, например тромботические проявления диабета, атеросклероз, гиперлипопротеинемии.
Кроме того, соединения в соответствии с изобретением обладают противогрибковыми свойствами, что представляет большой интерес применения в качестве противогрибковых препаратов.
Фармакологические свойства соединений в соответствии с изобретением были доказаны проведением следующих исследований.
Тест A: измерения гепатического14С-холестерогенеза ин виво у крыс, по методике, описанной Бухером (Bucher et coll. , J. Biol. Chem. , 222, 1-15, 1956) и Албертсом (Albets et coll. , Proc. Natl. Acad. Sci. USA, 77(7), 3957-3961, 1980).
Тест B: измеряют общую холестеролимию "ин виво" у крыс при внутривенной обработке тритоном WR 1339 по методике, описанной Эндо (Endo et coll. Biochem. Biophys. Acta, 575, 226, 1979).
Тест С: измеряют агрегирование тромбоцитов, вызванное агонистом рецепторов ТХА2 у морских свинок, следующим методом: богатую тромбоцитами плазму (PRP) получают аортной пункцией у анестезированных животных, кровь (9 об. ) собирают в 106 мМ раствора трехнатриевого цитрата (1 об. ), чтобы не происходило коагуляции. PRP изолируют путем медленного центрифугирования (10 мин, 380 г) и инкубируют в течение не менее 3 мин (37оС, при медленном перемешивании), в агрегометре типа CHRONOLOG-400. Агрегирование тромбоцитов вызывают путем добавления прямого агониста рецепторов ТХА2, например, соединения, известного под кодом U46619 (при концентрации 20nM), в соответствии с методикой Мальмштейна (Malmstein, Life Sci. , 18, 169-178, 1976); соединения в соответствии с изобретением исследовали "ин витро".
Например, для соединений 1, 2, 19 и 65 были получены в тесте A cоответственно значения ДЕ 50: 0,17, 0,6 мг/кг, 0,09 и 0,38 мг/кг, а для Ловастатина в тех же условиях величина ДЕ 50 равнялась 0,39 мг/кг.
Для тех же соединений в тесте B были получены значения ДЕ 25 соответственно 29, 100, 110 и 74 мг/кг, а для Ловастатина в тех же условиях ДЕ 25-130 мг/кг.
В тесте С для соединений 1 и 19 получены величины Cl 50: 91 и 28.10-6 моль/л.
Настоящее изобретение относится также к лекарствам, состоящим из соединений общей формулы I, взятых, как они есть, в чистом виде или в сочетании с любым другим веществом, приемлемым с фармацевтической точки зрения, которое может быть инертным или физиологически активным.
Эти медикаменты могут вводиться в любой позологической форме, в виде таблеток, пилюль, капсул, порошков, гранул и т. д. В этих композициях активное вещество смешивается с одним или несколькими инертными разбавителями, как, например лактоза или крахмал, кроме того, в эти композиции, кроме разбавителей, могут входить смазывающие вещества, как тальк или стеарат магния; если хотят получить водные суспензии, эликсиры или сиропы для орального введения, то главное активное вещество может в них сочетаться с различными подслащивающими или ароматизирующими веществами, в необходимых случаях с эмульгаторами и/или с веществами, создающими суспензию, одновременно с разбавителями, как вода, этанол, пропиленгликоль и другие подобные вещества.
Фармацевтические композиции в соответствии с изобретением для орального введения для одноразового приема содержит 1-500 мг активного вещества.
Следующий пример, приведенный в качестве неограничивающего, иллюстрирует состав подобного типа.
П р и м е р.
Состав, мг: Активное вещество 10 Лактоза 104 Зерновой крахмал 30 Тальк 2,5 Поливидон, связывающее 3 Стеарат магния 0,5
Данное изобретение иллюстрируется ниже неограничивающими примерами, в
которых:
стадии выпаривания осуществляют, если нет иных указаний, во вращающемся испарителе при пониженном давлении;
температура указана в градусах Цельсия (оС);
если указана "комнатная температура", то это температура от 18 до 25оС;
если нет иных указаний, то протекание реакции контролируется тонкослойной хроматографией (ТСХ).
Новые соединения характеризуются в необходимых случаях их физическими константами; температурой плавления и температурой кипения, в необходимых случаях, указывается давление, выраженное в миллибарах.
Выход указывается только в качестве иллюстрации и не является возможно высоким выходом.
Спектры ядерного магнитного резонанса, если нет иных указаний, являются протонными спектрами и снимались при 60 МГц, в качестве внутреннего эталона использовался тетраметилсилан, химические сдвиги выражены в ppm (долей на миллион), спектры описываются с помощью следующих сокращений: c - синглет, д - дублет, дд - двойной дублет, тр - триплет, кв - квартет, м - мультиплет.
Инфракрасные спектры соединений снимались на образцах, диспергированных в бромиде калия в случае твердых веществ, или в пленках - в случае жидких образцов.
П р и м е р 1. (+, -)-6Е-эритро-7-[4-(4-фторфенил)-3-спиро(2Н-бензопиран-1-2,1'- циклопентил)] -3, 5-дигидрокси-6-гептен-оат этила (соединение 1) - формула 1: X = O; R1-R2 = -(CH2)4-; R3 = 4'F, R4 = R5 = R6 = R9 = R10 = H, R7-R8 = связь, R11 = OC2H5.
Стадия I
4-(4-Фторфенил)-3,
4-дигидро-4-гидро-ксиспиро(2Н-бензопиран-1-2,1'- циклопентан) (Схема VI - формула 14).
Работают в атмосфере азота в защищенном от влаги реакторе. К 6,07 г (0,25 г x атом) стружек магния, суспензированных в 130 см3диэтилэфира, добавляют так, чтобы поддержать небольшой сток эфира в обратном холодильнике, 43,75 г (0,25 моль) 1-бром-4-фторбензола, растворенных в 200 см3 диэтилэфира.
Смесь выдерживают в обратном холодильнике в течение 4 ч, затем охлаждают до комнатной температуры и при этой температуре добавляют раствор 20 г (0,1 моль) спиро(2Н-бензопиран-1-2,1'-4-циклопента- нона) (получают по методике Каббе (Kabbe et coll. , Synthesis, 12, 886, 1978)) в 60 см3 диэтилэфира, с необходимым дебитом, чтобы поддерживать небольшой сток в обратном холодильнике.
Перемешивают смесь в течение 2 ч при комнатной температуре, затем ее выливают в ледяной водный раствор хлорида аммония в большом избытке по отношению к стехиометрии, добавляют соляную кислоту в количестве, достаточном для полного растворения суспензии, затем декантируют органическую фазу, эту фазу промывают водой до получения нейтральной величины pH, затем высушивают над сульфатом натрия, фильтруют и выпаривают растворитель; получают 30 г масла, которое используют, как оно есть, в дальнейшем синтезе.
Стадия II.
4-(4-Фторфенил)-спиро(2Н-бензопиран- 1-2,1'-циклопентан) (схема VI - формула 5).
При пониженном давлении (16 мм рт. ст. ), при температуре 120оС, в течение 30 мин нагревают смесь 30 г (0,1 моль) продукта этапа 1 и 3 г KHSO4 (0,1 масса обрабатываемого соединения). Остаток растворяют в достаточном количестве дихлорметана, затем этот раствор промывают водой, потом сушат над сульфатом натрия, фильтруют и выпаривают растворитель, полученное твердое вещество диспергируют в метиловом спирте.
Т. пл. = 76-78оС (диизопропилэфир). Выход 75% .
(Тонкослойная хроматография: этилацетат (AcOEt)-гексан: 5-95 (пятно).
Элементный анализ: С19Н17FO. Мол. масса 280, 33.
Рассчитано, % : С 81,40; Н 6,11; F 6,78.
Получено, % : С 81,53; Н 6,20; F 6,76.
ЯМР (CDCl3): 1,25-2,70 (м, 8Н), 5,73 (с, 1Н), 6,50-7, 87 (м, 8Н).
Стадия III. 2Е-3-(4-(4-фторфенил)-3-спиро(2Н-бен-зопиран-1-2,1'-циклопентил))-2-пропенал ь (схема II - формула 2).
Работают в атмосфере азота, в реакторе, защищенном от влажности. Если нет иных указаний, то в течение последующих операций температуру реакционной смеси поддерживают равной -20оС. К раствору 20,9 г (0,2 моль) N, N-3-диметиламинакрилеина в 200 см3 ацетонитрила добавляют в течение 30 мин, при перемешивании, 29,1 г (0,19 моль) оксихлорида фосфора, перемешивание проводят еще в течение 10 мин, затем добавляют, в течение 15 мин 11,2 г (0,04 моль) соединения стадии II в растворе в 100 см3 ацетонитрила. Затем температуру смеси доводят до комнатной, затем ее нагревают с обратным холодильником до исчезновения исходного продукта, который контролируется тонкослойной хроматографией, в представленном случае необходимое время нагрева 40 ч.
Смесь выпаривают, затем остаток выливают в 1000 см3 ледяной воды, нейтрализуют (pH = 9) путем добавления достаточного количества концентрированной щелочи натрия, раствор перемешивают в течение 15 мин, затем экстрагируют 1000см3 метиленхлорида (2 x 500 см3). Органический слой промывают водой, высушивают над сульфатом натрия, фильтруют, добавляют 1000 см3 гексана и перемешивают в присутствии 100 г силикагеля. После фильтрования и выпаривания получают масло, которое кристаллизуют в твердое желтое вещество путем диспергирования в гексане.
Т. пл. 108-111оС (диизопропилэфир). Выход 8,4 г (63% ).
ТСХ: AcOEt - гексан 1: 9: 1 (пятно).
Элементный анализ: С22Н19FO2. Мол. масса 334,37.
Рассчитано, % : С 79,02; Н 5,73; F 5,68.
Получено, % : С 78,82; Н 5,75; F 5,65.
ИК, ν СНО: 1670 см-1.
ЯМР (CDCl3) 1,25-2,87 (м, 8Н), 5,98 (дд, 1Н, J = 17 Гц и 7 Гц), 6,37-7,5 (м, 9Н), 9,25 (д, 1Н, J = 7 Гц).
Стадия IV. (+, -)-6Е-7[4-(4-фторфенил)-3-спиро(2Н-бензопиран-1-2, 1'- циклопентил)] -5-гидрокси-3-оксо-6-гептен-оат этила (схема I - формула 4).
Работают в атмосфере азота, при отсутствии влажности, если нет иных указаний, то температура смеси равна -20оС.
К суспензии 1,2 г (0,05 моль) гидрида натрия в 300 см3 тетрагидрофурана (ТГФ) добавляют 5,6 г (0,043 моль) этилацетоацетата в растворе в 25 см3 ТГФ, смесь перемешивают в течение 20 мин, затем к ней добавляют за время 15-20 мин 27 см3 1,6 н. раствора бутиллития в гексане (т. е. 0,043 моль BuLi), перемешивание продолжают в течение 20 мин, затем каплями добавляют раствор 8,7 г (0,026 моль) альдегида стадии 3 в 140 см3 ТГФ. Смесь перемешивают в течение 3 час, затем каплями добавляют к ней, при температуре от -20 до 10оС, 40 мл 3 н. раствора соляной кислоты. Экстрагируют этилацетатом, промывают органическую фазу водой до получения pH 7, высушивают над сульфатом натрия, выпаривают досуха, получают масло, которое кристаллизуется при диспергировании в гексане.
Т. пл. 87-90оС (этилацетат). Выход 110 г (90,9% ).
(ТСХ: силикагель, AcOEt-гексан: 1-2: 1 пятно).
Элементный анализ: С28Н29FO5. Мол. масса 464,51.
Рассчитано, % : С 72,40; Н 6,29; F 4,09.
Получено, % : С 72,33; Н 6,31; F 4,05.
ИК, ν ОН: 3420 см-1; ν СО: 1740 и 1710 см-1.
ЯМР (CDCl3): 1,326 (т, 3Н), 1,5-2,35 (м, 8Н), 2,52 (д, 2Н), 3,92-4,65 (м, 3Н), 5,30 (дд, 1Н, J = 15,8 Гц и 5,5 Гц), 6,00 (д, 1Н, J = 15,8 Гц), 6,25-7,50 (м, 8Н). фией, в представленном случае необходимое время нагрева 40 ч.
Смесь выпаривают, затем остаток выливают в 1000 см3 ледяной воды, нейтрализуют (pH = 9) путем добавления достаточного количества концентрированной щелочи натрия, раствор перемешивают в течение 15 мин, затем экстрагируют 1000 см3 метиленхлорида (2 x 500 см3). Органический слой промывают водой, высушивают над сульфатом натрия, фильтруют, добавляют 1000 см3 гексана и перемешивают в присутствии 100 г силикагеля. После фильтрования и выпаривания получают масло, которое кристаллизуют в твердое желтое вещество путем диспергирования в гексане.
Т. пл. 108-111оС (диизопропилэфир). Выход 8,4 г (63% ).
ТСХ: AcOEt - гексан 1: 9: 1 (пятно).
Элементный анализ: С22Н19FO2. Мол. масса 334, 37.
Рассчитано, % : С 79,02; Н 5,73; F 5,68.
Получено, % : С 78,82; Н 5,75; F 5,65.
ИК, ν СНО: 1670 см-1.
ЯМР (CDCl3) 1,25-2,87 (м, 8Н), 5,98 (дд, 1Н, J = 17 Гц и 7 Гц), 6,37-7,5 (м, 9Н), 9,25 (д, 1Н, J = 7 Гц).
Стадия IV.
(+, -)-6Е-7[4-(4-фторфенил)-3-спиро(2Н-бен- зопиран-1-2,1'- циклопентил)] -5-гидрокси-3-оксо-6-гептен-оат этила (схема I - формула 4).
Работают в атмосфере азота, при отсутствии влажности, если нет иных указаний, то температура смеси равна -20оС.
К суспензии 1,2 г (0,05 моль) гидрида натрия в 300 см3тетрагидрофурана (ТГФ) добавляют 5,6 г (0,043 моль) этилацетоацетата в растворе в 25 см3 ТГФ, смесь перемешивают в течение 20 мин, затем к ней добавляют за время 15-20 мин 27 см3 1,6 н. раствора бутиллития в гексане (т. е. 0, 043 моль BuLi), перемешивание продолжают в течение 20 мин, затем каплями добавляют раствор 8,7 г (0,026 моль) альдегида стадии 3 в 140 см3 ТГФ. Смесь перемешивают в течение 3 час, затем каплями добавляют к ней, при температуре от -20 до 10оС, 40 мл 3 н. раствора соляной кислоты. Экстрагируют этилацетатом, промывают органическую фазу водой до получения pH 7, высушивают над сульфатом натрия, выпаривают досуха, получают масло, которое кристаллизуется при диспергировании в гексане.
Т. пл. 87-90оС (этилацетат). Выход 110 г (90,9% ).
(ТСХ: силикагель, AcOEt-гексан: 1-2: 1 пятно).
Элементный анализ: С28Н29FO5. Мол. масса 464,51.
Рассчитано, % : С 72,40; Н 6,29; F 4,09.
Получено, % : С 72,33; Н 6,31; F 4,05.
ИК, ν ОН: 3420 см-1; ν СО: 1740 и 1710 см-1.
ЯМР (CDCl3): 1,326 (т, 3Н), 1,5-2,35 (м, 8Н), 2,52 (д, 2Н), 3,92-4,65 (м, 3Н), 5,30 (дд, 1Н, J = 15,8 Гц и 5,5 Гц), 6,00 (д, 1Н, J = 15,8 Гц), 6,25-7,50 (м, 8Н).
Стадия V
(+,
-)-6Е-эритро-7-[4-(4-фторфенил)-3-спи- ро(2Н-бензопиран-1,2,1'-циклопентил)] -3, 5-дигидрокси-6-гептен-оат этила (соединение 1).
Работают в атмосфере азота, в защищенном от влаги реакторе. Если нет иных указаний, то при указанных ниже операциях температуру реакционной смеси поддерживают -70оС.
К раствору 3,25 г (0,007 моль) кетоэфира стадии IV в смеси 65 см3ТГФ и 15 см3 метанола добавляют за время 5 мин, при перемешивании, 7,7 см3 1 н. раствора диэтилметоксиборанa в ТГФ (т. е. 0,007 моль + 10% борана). Перемешивание продолжают в течение 40 мин, затем добавляют 0,29 г (0,007 моль + 10% ) боргидрида натрия. Смесь перемешивают в течение 5 ч, затем ее подкисляют путем добавления 6,5 см3 уксусной кислоты, после чего добавляют 80 см3 этилацетата.
Температуру смеси доводят до комнатной, затем смесь промывают водным насыщенным раствором бикарбоната натрия (2x200 см3), затем водой, органическую фазу декантируют, высушивают над сульфатом натрия, потом растворитель выпаривают. Полученное масло растворяют в 60 см3метанола, этот раствор перемешивают при 35оС в течение 20 мин, затем его выпаривают досуха. Эту операцию повторяют до тех пор, пока не получат постоянный вес, в описываемом случае операция повторялась 4 раза.
Таким способом получают 3,1 г твердого вещества, которое диспергируют в диизопропилэфире.
Т. пл. 112-114оС (этилацетат). Выход 2,48 г (76% ).
(ТСХ: силикагель: AcOEt-гексан 1-1: 1 пятно).
Элементный анализ: С28Н31FO5. Мол. масса 466,55.
Рассчитано, % : С 72,08; Н 6,70; F 4,07.
Получено, % : С 71,82; H 6,83; F 3,90.
ИК: ν OH: 3390 см-1; ν СO: 1715 см-1.
ЯМР (CDCl3 )-(200 МГц): 1,27 (т, 3Н), 1,20-1,58 (м, 2Н), 1.60-2,29 (м, 8Н), 2,36-2,44 (м, 2Н), 4,17 (кв, 2Н), 4,00-4,29 (м, 2Н), 5,34 (дд, 1Н, J = 16,1 Гц и J = 6,3 Гц), 5,94 (дд, 1Н, J = 16,1 и 1,2 Гц), 6,54 (дд, 1Н,40J = 7,7 Гц и 1,5 Гц), 6,70-6,85 (м, 2Н), 7,00-7,20 (м, 5Н).
ЖХВД (жидкостная хроматография высокого давления):
колонка окиси кремния 5 и сферосил 25 см;
детектор УФ-254 нм (нанометров);
подвижная фаза: AcOEt: гексан: AcOH 35: 65: 0,01.
1 пик (11,1 мин).
П р и м е р 2. (+, -)-6Е-эритро-7(1, 2-дигидро-2,2-диметил-4-фенил-3-нафтил)-3,5 -ди-гидрокси-6-гептен-оат метила (соединение 2, формула 1, X = CH2, R1 = R2 = CH3, R3 = R4 = R5 = R6 = R9 = R10 = H, R7 и R8 - связь R11 = OCH3).
Стадия I
2-(2,
2-Диметил-3-фенилпропил)-циана- цетат этила (схема VII, формула 15).
К суспензии 19,2 г (0,79 г · ат) магния в виде стружек в 100 см3эфира добавляют так, чтобы был слабый сток в обратном холодильнике, раствор 100 г (0,79 моль) бензилхлорида в 400 см3 эфира. Смесь нагревают с обратным холодильником в течение 15 мин, затем добавляют так, чтобы был слабый сток в обратном холодильнике, раствор 101,1 г (0,66 моль) изопропилиденцианацетат этила в 130 см3 простого эфира. Смесь нагревают с обратным холодильником в течение 2 ч, затем ее охлаждают и медленно добавляют 400 см3 воды, затем 100 см3 20% -ной H2SO4.
Смесь перемешивают в течение 30 мин, затем органическую фазу декантируют. Водную фазу экстрагируют эфиром, высушивают эфирные собранные фазы над сульфатом натрия, фильтруют и дистиллируют.
Eb0,3 = 115-121оС. Выход 147 г (90% ).
ИК: ν C= O: 1740 см-1, ν CN: 2250 см-1.
ЯМР (CDCl3): 1-1,5 (м, 9Н), 2,75 (с, 2Н), 3,25 (с, 1Н), 4,2 (кв, 2Н), 6, 7-7,6 (м, 5Н).
Стадия II
3,3-Диметил-4-фенилбутановая кислота (схема VII - формула 16).
К 70 г (0,285 моль) соединения стадии I добавляют, не охлаждая, раствор 70 г щелочи калия в 230 см3 этиленгликоля. Смесь нагревают с обратным холодильником (140оС) в течение 3 ч 15 мин. Летучие растворители выпаривают при 15 мм рт. ст. , затем нагревают при обратном холодильнике (197оС) в течение 6 ч. Смесь охлаждают, добавляют к ней 500 см3 воды и экстрагируют эфиром.
Водную фазу подкисляют добавлением концентрированной соляной кислоты и экстрагируют бензолом.
Бензоловую фазу промывают водой, высушивают над сульфатом натрия, фильтруют и выпаривают досуха.
Таким образом выделяют 48,7 г масла, которое используют как оно есть в дальнейшем синтезе. Выход 89% .
ИК: ν C= O: 1700 см-1.
ЯМР (CDCl3 ): 1 (с, 6Н), 2,2 (с, 2Н), 2,65 (с, 2Н), 6,8-7,5 (м, 5Н).
Стадия III
1,2,3,4-Тетрагидро-3,3-диметил-1-оксо-нафталин (схема VII - формула 12).
Нагревают при температуре от 70 до 80оС смесь 292 г полифосфорной кислоты и 860 см3 ксилола, добавляют при этой температуре 48,7 г (0,253 моль) соединения стадии 2 в растворе в 550 см3 ксилола. Смесь нагревают с обратным холодильником в течение 6 ч 30 мин, затем охлаждают, декантируют ксилоловую фазу, к оставшейся минеральной фазе добавляют 2000 см3 воды и экстрагируют ксилолом.
Собирают органические фазы, промывают 10% -ным раствором щелочи натрия, затем водой, сушат над сульфатом натрия. Фильтруют, выпаривают растворитель и дистиллируют остаточное масло.
Eb0,2 = 72-90оС. Выход 87,5% .
ИК, ν С= O: 1680 см-1.
ЯМР (CDCl3): 0,8-1,8 (м, 1Н), 2,5 (с, 2Н), 7-7,7 (м, 3Н), 8 (дд, 1Н).
Стадия IV
1,2,3,4-Тетрагидро-1-гидрокси-3,3-диметил-1-фенилнафталин (схема VI - формула 14).
К 8,07 г (1,16 г. ат) лития в суспензии в 200 см3 эфира добавляют так, чтобы был слабый сток эфира в обратном холодильнике, раствор 86,95 г (0,55 моль) бромбензола в 150 см3 эфира. Смесь нагревают в обратном холодильнике в течение 45 мин, затем к ней добавляют при температуре 5-10оС 38,6 г (0,19 моль) соединения стадии III в растворе в 150 см3 эфира.
Смесь перемешивают при комнатной температуре в течение 4 ч, затем добавляют 150 см3 воды, поддерживая температуру 5-10оС. Перемешивают в течение 15 мин, затем органическую фазу декантируют, промывают водой, высушивают над сульфатом натрия, фильтруют, выпаривают растворитель.
Получают твердое желтое вещество, которое диспергируют в гексане, обезвоживают и высушивают.
Т. пл. 107-110оС. Выход 47,4 г (85% ).
Стадия V.
1,1-Дигидро-2,2-диметил-4-нафталин (схема VI - формула 5) получают из соединения cтадии IV по методике для стадии II примера 1.
Eb0,1 = 103-105оС. Т. пл. 82-84оС. Выход 89% .
Элементный анализ: С18Н18. Мол. масса 234,34.
Рассчитано, % : С 92,26; Н 7,74.
Получено, % : С 92,42; Н 7,64.
ЯМР (CDCl3): 1,05 (с, 6Н), 2,7 (с, 2Н), 5,7 (с, 1Н), 6,75-7,4 (м, 9Н).
Стадия VI
3-Бром-1,2-дигидро-2,2-диметил-4-фе-нилнафталин (схема III - формула 6).
К перемешиваемой суспензии 27,3 г (0,117 моль) соединения стадии 5 в 120 см3 ДМФА добавляют, при дебите таком, чтобы температура смеси не превысила 30оС, 25 г (0,14 моль) N-бромсукцинимида в растворе в 120 см3ДМФА.
Перемешивание проводят при комнатной температуре еще 24 ч, затем оставляют на 48 ч, потом смесь выливают на 800 см3 ледяной воды, проводят экстрагирование 400 см3 эфира (2 x 200 см3), собранные экстракты промывают водой, затем сушат над сульфатом натрия, выпаривают эфир и проводят хроматографирование остаточного масла на силикагеле, используя в качестве элюента гексан. После выпаривания гексана получают масло, которое используют как оно есть, для дальнейшего синтеза.
Выход 32,4 г (89% ).
ЯМР (CDCl3): 1,2 (c, 6H), 2,95 (c, 2H), 6,3-7,5 (м, 9Н).
Стадия VII
3Е-3-(1,2-Дигидро-2,2-диметил-4-фенил
-3-нафтил)-2-пропеналь (схема III - формула 2).
Если нет иных указаний, то описанные ниже операции проводят при температуре -50оС.
К раствору 6,26 г (0,02 моль) соединения стадии 6 в 100 см3 эфира, охлажденного до -50оС и соответственно перемешиваемому, добавляют 13,8 г 1,6 н. раствора бутиллития в гексане (т. е. 0,022 моль BuLi). Затем температура повышается до комнатной, и раствор нагревают с обратным холодильником в течение 1 ч 20 мин, потом охлаждают до температуры от -50 до -60оС и добавляют 2 г 3-N, N-диметиламинакролеина в растворе в 30 см3 эфира. Продолжают перемешивать смесь при -50оС в течение 1 ч 30 мин, затем температура повышается до комнатной, продолжают перемешивание 30 мин, затем все выливают на 300 см3 10% -ной соляной кислоты при перемешивании. Органическую фазу декантируют и затем промывают водой, водную фазу экстрагируют хлорметиленом, экстракт промывают водой; собирают все органические фазы, высушивают над сульфатом натрия, выпаривают растворители и кристаллизуют остаточное масло в пентане.
Т. пл. 105-108оС. Выход 2,6 г (45% ).
ИК, ν С = 0: 1680 см-1.
ЯМР (CDCl3): 1,2 (с, 6Н), 2,8 (с, 2Н), 6,05 (дд: J = 16,5 и 7,5, 1H), 6,4-7,5 (м, 10Н), 9,5 (д: J = 7,5, 1Н).
Стадия VIII. (+, -)-6Е-7-(1,2-Дигидро-2,2-диметил-4-фенил-3-нафтил)-5-гидрокси- 3-оксо-6-гептен-оат метила (схема I - формула 4).
Получают из соединения стадии VII по методике стадии IV примера 1. Соединение получают в виде масла. Выход 87% .
ЯМР (CDCl3): 1,1 (с, 6Н), 1,9-2,6 (м, 3Н), 2,72 (с, 2Н), 3,3 (с, 2Н), 3,65 (с, 3Н), 3,45-4,5 (м, 2Н), 4,8-5,35 (м, 1Н), 6 (д, J = 15,75, 1H), 6,35-7,5 (м, 5Н).
Стадия IX.
(+, -)-6Е-Эритро-7-(1,2-дигидро-2, 2-диме- тил-4-фенил-3-нафтил)-3,5- дигидрокси-6-гептен-оат метила (соединение 2).
Получают из соединения стадии VIII по методике стадии V примера 1. Твердое вещество желтого цвета.
Т. пл. 101-103оС. Выход 2,2 г (67% ).
Элементный анализ: C26H30O4. Мол. масса 406,52.
Рассчитано, % : С 76, 82; Н 7,44.
Получено, % : С 76,57; Н 7,43.
П р и м е р 3. (+, -)-6Е-эритро-7-[4-(4-хлорфенил)-2,2-диметил-2Н-бензотиа-3-пира- нил)] -3,5- дигидрокси-6-гептен-оат метила (соединение 3, формула 1: X = S, R2 = CH3, R3 = 4'Cl, R4 = R5 = R6 = R9 = R10 = H, R7 и R8= = связь, R11 = OCH3).
Стадия I
4-(4-Хлорфенил)-3,4-дигидро-4-гидрокси-2,2-диметил-2Н-бензопиран (схема VI - формула 14) получают из 2,
3-дигидро-2,2-диметил-4Н-4-бензотиапиранона по методике стадии 4 примера 2, используют без очистки в дальнейшем синтезе.
Стадия II
4-(4-Хлорфенил)-2,2-диметил-2Н-бензо- пиран
(схема VI - формула 5) получают из соединения стадии I по методике стадии II примера 1.
Т. пл. 100-102оС (диизопропилэфир). Выход 50% .
Элементный анализ: С17Н15ClS. Мол. масса 286,81.
Рассчитано, % : С 71,19; Н 5,27; Cl 12,36; S 11,18.
Получено, % : С 70,94; Н 5,42; Cl 12,60; S 10,90.
ЯМР (CDCl3): 2 (с, 6Н), 5,75 (с, 1Н), 6,75-7,5 (м, 8Н).
Стадия III
3-Бром-4-(4-хлорфенил)-2,2-диметил-2Н-бензопиран (схема III - формула 6) получают из
соединения стадии II по методике стадии VI примера 2; после выпаривания эфира получают твердое вещество, которое диспергируют в достаточном количестве охлажденного до -20оС метанола, затем
полученное твердое вещество обезвоживают и высушивают.
Т. пл. 150-156оС. Выход 88% .
ЯМР (CDCl3): 1,6 (с, 6Н), 6,2-7,8 (м, 8Н).
Стадия IV.
2Е-3-(4-хлорфенил)-2,2-диметил-2Н-3-бензопиранил)-2-пропен-оат этила (схема IV - формула 8).
Операции проводят в атмосфере азота, в защищенном от влаги реакторе. В течение 4 ч нагревают с обратным холодильником смесь 20,1 г (0,055 моль) соединения стадии III, 27,5 см3 (0,254 моль) этилакрилата, 130 см3 N, N-диметилформамида, 130 см3 триэтиламина, 1 г триортотолилфосфина и 0,25 г диацетата палладия, смесь выливают на смесь лед - вода и экстрагируют достаточным количеством эфира, этот экстракт попеременно промывают соляной кислотой и водой до получения pH 7, затем высушивают над сульфатом натрия, выпаривают эфир, диспергируют остаток в охлажденном до -20оС гексане, обезвоживают полученное твердое вещество и высушивают.
Т. пл. 97-99оС. Выход 91% .
Элементный анализ: С22Н21ClO2S. Мол. масса 384,91.
Рассчитано, % : С 68,65; Н 5,50; Cl 9,21; S 8,33.
Получено, % : С 68,58; Н 5,79; Cl 9,45; S 8,30.
ЯМР (CDCl3): 1-1,75 (м, 9Н), 3,75-4,5 (9, 2Н), 5,3-5,75 (д, 1Н), 6,5-7,5 (м, 9Н).
Стадия V
2Е-3-[4-(4-Хлорфенил)-2,2-диметил-2Н, 3-бензотиапиранил)] -2-пропенол (схема IV - формула 9).
Операции проводят в атмосфере азота в защищенном от влаги реакторе. К раствору 18,9 г (0,049 моль) соединения стадии 4 в 180 см3охлажденного до -20оС тетрагидрофурана добавляют 196 см3 1 н. раствора гидрида диизобутилалюминия в тетрагидрофуране (т. е. 0,049 x 4 моль DIBAL), смесь перемешивают при комнатной температуре в течение 1 ч, затем к смеси добавляют 200 см3 воды, такое добавление экзотермическое, поэтому дебит регулируют так, чтобы температура смеси была меньше 30оС, затем смесь подкисляют до pH 1 путем добавления достаточного количества концентрированной соляной кислоты, потом проводят экстрагирование эфиром. Эфирную фазу промывают водой до получения нейтральной реакции, затем высушивают над сульфатом натрия, после фильтрования и выпаривания эфира получают масло, которое диспергируют в достаточном количестве охлажденного до 5оС гексана, полученное твердое вещество обезвоживают и просушивают.
Т. пл. 105-108оС (гексан). Выход 87% .
Элементный анализ: С20Н19ClOS. Мол. масса 342,87.
Рассчитано, % : С 70,06; Н 5,59; Cl 10,34; S 9, 35.
Получено, % : С 69,91; Н 5,78; Cl 10,52; S 9,30.
Стадия VI 2Е-3-[4-(4-хлорфенил)-2,2-диметил-2Н-3-бензотиапиранил)] -2-пропеналь (схема IV - формула 2).
Операции проводят в защищенном от влаги реакторе. При комнатной температуре перемешивают в течение 48 ч смесь 14,63 г (0,0427 моль) соединения стадии 5, 22,26 г (0,0427 x 6 моль) двуокиси марганца и 300 см3 дихлорметана, затем смесь фильтруют, выпаривают дихлорметан фильтрата, полученный твердый остаток диспергируют в достаточном количестве диизопропилэфира, обезвоживают и высушивают.
Т. пл. = 132-134оС (CH3CO2C2H5). Выход 82% .
Элементный анализ: С20Н17ClOS. Мол. масса 340,86.
Рассчитано, % : C 70,47; Н 5,03; Cl 10,40; S 9,41.
Получено, % : С 70,27; Н 4,98; Cl 10,51; S 9,85.
ЯМР (CDCl3): 1,5 (с, 6Н), 5,75-6,25 (9, 1Н), 6,75-7,5 (м, 9Н), 9,25-9,5 (д, 1Н).
Стадия VII (+, -)-6Е-7-(4-(4-хлорфенил)-2,2-диметил-2Н-3-бензотиапиранил)-5-гидрокси- 3-оксо-6-гептеноат метила (схема I - формула 14). Получают из соединения стадии VI по методике стадии IV примера 1.
Т. пл. = 86-88оС (СН3OH). Выход 94% .
ИК: ν С = O: 1740 и 1700 см-1.
ЯМР (CDCl3): 1,5 (с, 6Н), 2,25-2,75 (м, 3Н), 3,3 (с, 2Н), 3,75 (с, 3Н), 4,25-4,5 (м, 1Н), 5-5,55 (дд, 1Н), 5,75-6,25 (д, 1Н), 6,5-7,5 (м, 8Н).
Стадия VIII (+, -)-6Е-эритро-7-(4-хлорфенил)-2,2-диметил-2Н-3-бензотиапиранил))-3,5-дигид -рокси-6-гептеноат метила (схема I - формула 1) получают из соединения стадии VII по методике стадии V примера 1.
Т. пл. = 115-117оС (диизопропилэфир). Выход 58% .
Элементный анализ: С25Н27ClO4S. Мол. масса 458, 99.
Рассчитано, % : С 65,42; Н 5,93; Cl 7,72; S 6,98.
Получено, % : С 65,52; Н 6,02; Cl 7,80; S 7,09.
ИК: ν CO = 1720 см-1, ν OH = 3400 см-1.
ЯМР (CDCl3): 1,5 (с, 6Н), 2,5 (д, 2Н), 3-3,75 (м, 2Н), 3,75 (с, 3Н), 4-4,5 (м, 2Н), 5-5,5 (дд, 1Н), 5,75-6,25 (д, 1Н), 6,5-7,5 (м, 8Н).
П р и м е р 4. (+, -)-Эритро-7-(4-(4-фторфенил)-спиро-3-(2Н-бензопиран-1-2,1'-цикло- пентил))-3,5-дигидрокси-гептеноат этила (соединение 4 - формула 1): X = O, R1-R2 = (CH2)4-, R3 = 4'F, R4 = R5 = R6 = R7 = R8 = R9 = R10 = H, R11 = OC2 H5).
Стадия I 3Е-3(4-(4-фторфенил)-спиро-3-(2Н-бензопиран-1, -2,1'-циклопентил))-2-пропенал ь, диметилацеталь (схема V - формула 10).
Операции проводят в атмосфере азота, в защищенном от влаги реакторе. В течение 7 ч, при комнатной температуре, перемешивают смесь 16,75 г (0,05 моль) 3Е-3-(4-(4-фторфенил)-спиро-3-(2Н-бензопиран-1-2, 1'-циклопентил))-2-пропенал ь, который был получен из спиро (2Н-бензопиран-1-2,1'-4-циклопентатон) по методике стадий I, II, III примера 1, и 2,25 смолы Амберлист 15, в 625 см3 метилортоформиата.
Снова добавляют 2,25 г смолы Амберлист и смесь перемешивают при комнатной температуре в течение 12 ч. Такую обработку повторяют 4 раза последовательно одну за другой, выпаривают избыток метилортоформиата, выделяют белое твердое вещество, которое диспергируют в гексане, обезвоживают и высушивают.
Т. пл. 112-114оС. Выход 16,3 г (88% ).
ЯМР (CDCl3): 2,1-2,2 (м, 8Н), 3,07 (с, 6Н), 6,05 (д, 1Н, J = 5 Гц), 5,3 (дд, 1Н, J = 5 и 16 Гц), 6,05 (д, 1Н, J = 16 Гц), 6,3-7,2 (м, 8Н).
Стадия
II
3-[4-(4-Фторфенил)-спиро-3-(2Н-бензо- пиран-1-2,1'-циклопентил)] -пропанал, диметилацеталь (схема V - формула 11).
Производят гидрирование, при нормальном давлении и при комнатной температуре 3,8 г (0,01 моль) соединения стадии I в растворе в 100 см3ТГФ, в присутствии 0,5 г диспергированного на угле палладия. Когда будет достигнут теоретический объем поглощенного водорода, смесь фильтруют и выпаривают ТГФ, получают масло, которое с течением времени кристаллизуется, полученное таким образом твердое вещество диспергируют в гексане, затем обезвоживают и высушивают.
Т. пл. = 83-85оС. Выход 3,2 г (84% ).
(Тонкосл. хроматография: силикагель, AcOEt - гексан-1-9: 1 пятно).
ЯМР (CDCl3): 1,9-2,5 (м, 12Н), 3,2 (с, 6Н), 4,15 (т, 1Н, J = 5 Гц), 6,3-7,25 (м, 8Н).
Стадия III
3-[4-(4-Фторфенил)-спиро-3-(2Н-бензо- пиран-1-2,
1'-циклопентил))-пропаналь (схема V - формула 2).
При комнатной температуре в течение 96 ч перемешивают смесь 2 г (0,0052 моль) соединения стадии 2 и 2 г смолы Амберлист 15 отфильтровывают смолу, выпаривают фильтрат досуха, поглощают остаток 40 см3 метиленхлорида, промывают водой и высушивают над сульфатом натрия, фильтруют и выпаривают досуха, таким способом получают 0,9 г масла.
Т. пл. = 118-120оС (диизопропилэфир).
ИК: ν C = O: 1720 см-1.
ЯМР (CDCl3): 1-2,5 (м, 10Н), 6,2-7,2 (м, 8Н), 9,55 (с, 1Н).
Элементный анализ: С22Н21FO2. Мол. масса 336,39.
Рассчитано, % : С 78,55; Н 6,29; F 5,65.
Получено, % : С 78,33; Н 6,04; F 5,57.
Стадия IV
(+, -)-4-(4-Фторфенил)-7-спиро-3-(2Н- бензопиран-1-2,1'-циклопентил)-5- гидрокси-3-оксогептаноат этила (схема I
- формула 4, R7 = R8 = H).
Получают из соединения стадии 3 и по способу стадии 4 примера 1.
Соединение получают в виде масла (выход 51% ), оно используется, как оно есть, для дальнейшего синтеза.
Стадия V (+, -)-Эритро-7-(4-(4-фторфенил)-спиро-3-(2Н-бензопиран-1,2,1' -циклопентил))-3,5дигидрокси-гептаноат этила (соединение 4). Получают путем восстановления соединения стадии 4 по методике стадии 5 примера 1.
Соединение белого цвета.
Т. пл. = 103-105оС (диизопропилэфир). Выход 65% .
Элементный анализ: С28Н33FO5. Мол. масса 468,54.
Рассчитано, % : С 71,77; Н 7,10; F 4,05.
Получено, % : С 71, 63; Н 7,11; F 3,98.
ЯМР (CDCl3): 0,9-2,25 (м, 17Н), 2,35 (д, 2Н, J = 6 Гц), 3-3,5 (м, 2Н), 3,5-3,9 (м, 1Н), 3,9-4,4 (м, 3Н), 6,2-7,2 (м, 8Н).
П р и м е р 5. (+, -)-6Е-эритро-7-[4-(4-фторфенил)-спиро-3-(2Н-бензопиран-1,2,1'-цик- лопентил)] -3,5-дигидрокси-6-гептеноат натрия (соединение 5, формула 1: X = O, R1-R2= (CH2 )4-, R3 = 4'F, R4 = R5 = R6 = R9 = R10 = H, R7 и R8= связь, R11 = -O-Na+).
При 60оС нагревают так чтобы получился прозрачный раствор, 2,14 г (0,0046 моль) соединения 4 в 30 см3 этанола, затем этот раствор охлаждают до комнатной температуры и добавляют в него водный раствор щелочи натрия, заранее приготовленный путем растворения 0,18 г (0,0046 моль) щелочи натрия в гранулах в 100 см3 воды. Смесь перемешивают в течение 30 мин, фильтруют и выпаривают досуха, остаток высушивают нагреванием при 60оС при пониженном давлении (0,5 мм рт. ст. ) в течение 1 ч.
Т. пл. не определена. Выход 2,04 г (96% ).
ТСХ: силикагель, AcOEt-гексан: 1-1+ 3% AcOH: 1 (пятно).
Элементный анализ: C26Н26FNaO5 Мол. вес =
460,47
Рассчитано, % : С 67,82; Н 5,69; F 4,13; Na 4,99.
Получено, % : С 67,44, Н 5,71; F 3,91; Na 5,11.
П р и м е р 6. (+, -) 6Е-эритро-7-(4-(4-фторфенил)спиро-3-(2Н-бензопиран-1-2,1'-циклопентил))-3/5- дигидрокси-6-гептеноат-бензола (соединение 6 - формула 1: X = O, R1-R2= -(CH2)-, R3 = 4'F, R4= R5 = R6 = R9 = R10 = H, R7 и R8 = связь, R11 = C6H5CH2 O-).
К раствору 1,55 г (0,00337 моль) соединения 5 в 40 см3метилэтилкетона добавляют 0,638 г (0,00337 моль + 10% ) бромида бензола, затем смесь нагревают с обратным холодильником в течение 3 ч. Снова добавляют 0,638 г бромида бензола и нагревают смесь с обратным холодильником в течение 8 ч.
Смесь фильтруют, выпаривают фильтрат, растворяют остаток в достаточном количестве этилацетата, этот раствор промывают водой, высушивают над сульфатом натрия, фильтруют и выпаривают досуха.
Проводят хроматографию остаточного масла на 15 г силикагеля, используя смесь этилацетат-гексан: 30-70% .
Собранная II фракция после выпаривания растворителей дает твердое вещество, которое диспергируют в диизопропилэфире. Твердое вещество обезвоживают и высушивают.
Т. пл. = 81-83оС. Выход 1,17 г (66% ).
Элементный анализ: С33Н33FO5. Мол. масса = 528, 59.
Рассчитано, % : С 74,98; Н 6,29; F 3,59.
Получено, % : С 74,91; Н 6,23; F 3,55.
ЯМР (CDCl3): 1,1-2,3 (м, 10Н), 2,45 (д, 2Н, J = 6,7 Гц), 2,7-3,2 (м, 1Н, D2O), 3,3-3,6 (м, 1Н D2O), 3,8-4,5 (м, 2Н), 5,0-5,6 (с+д, 3Н), 5,9 (д, 1Н, J = 15,7 Гц), 6,3-7,7 (м, 13Н).
П р и м е р 7. (+, -)-6Е-эритро-7-(4-(4-фторфенил)-спиро-3-(2Н-бензопиран-1-2,1'-цик- лопентил))-3,5-дигидрокси-N-метил-6-гептен-амид (соединение 7 - формула 1: X = O; R1-R2 = -(CH2)4-; R3 = 4'F; R4 = R5 = R6 = R9 = R10 = H; R7 и R8 = связь; R11 = CH3NH-).
При комнатной температуре, в течение 24 час перемешивают раствор 0,67 г (0,00165 моль) соединения 1 в 25 см3 33% -ного раствора метиламина в этаноле. Растворитель выпаривают и остаток диспергируют в 8 см3этилацетата, обезвоживают и сушат.
Т. пл. 150-152оС. Выход 0,52 г (70% ).
Элементный анализ: С27Н30FNO4. Мол. масса 451,54.
Рассчитано, % : С 71,66; H 6,90; N 3,10; F 4,20.
Получено, % : С 71,47; Н 6,76; N 2,93; F 4,08.
П р и м е р 8. (+, -)-Транс-6-(1Е-2-(4-(4-фторфенил)-спиро-3-(2Н-бензопиран-1-2,1'-циклопент ил))-этенил)-4-гидрокси-3,4,5,6-тетрагидро-2Н-2-пиранон (соединение 8 - формула 1: X = O; R1-R2 = -(CH2)4-, R3 = 4'F; R4 = R5= R6 = R10 = H; R7 и R8 = связь; R9 и R11= = связь).
Работают в защищенной от влаги атмосфере.
В течение 3 ч нагревают с обратным холодильником смесь 6 г (0,0135 моль) соединения 4 и 1,94 г (0,0135 моль) 2-хлорэтил-диэтиламина в 120 см3 ацетона. Выпаривают ацетон и остаток растворяют в достаточном количестве этилацетата. Раствор промывают водой до pH 7, а затем сушат над сульфатом натрия. Фильтруют и выпаривают этилацетат.
Получают твердое вещество, которое прямо перекристаллизовывают из 120 см3 этилацетата.
Т. пл. = 188-191оС. Выход 4,27 г (79% ).
Элементный анализ: С26Н25FO4. Мол. масса 420,49.
Рассчитано, % : C 74,27; H 5,99; F 4,52.
Получено, % : С 74,07; Н 6,04; F 4,49.
ЯМР (DMSO d6) - 200 МГц: 1,45-2,20 (м, 10Н), 2,34 (дд, 1Н, J = 16 Гц и 3,45 Гц), 3,93-4,10 (м, 1Н), 4,85-5,0 (м, 1Н), 5,11 (д, 1Н, J = 3,3 Гц), 4,42 (дд, 1Н, J = 16,3 и 6,7 Гц), 6,02 (д, 1Н, J= 16,3 Гц). 6,42-6,54 (м, 1Н), 6,72-6,83 (м, 2Н), 7,07-7,34 (м, 5Н).
П р и м е р 9. (+, -)-Транс-4-гидрокси-3,4,5, 6-тетрагидро-6-{ 2-[4-(4-фторфенил)-спи- ро-3-(2Н-бензопиран-1-2,1'-циклопентил)] -этил} -2-пиранон (соединение 9 - формула 1: X = O; R1-R2 = -(CH2)4-; R3 = 4'F; R4 = R5 = R6 = R7 = R8= R10 = H; R9 и R11 = связь).
При нормальном давлении и при комнатной температуре гидрируют 1,72 г (0,00409 моль) соединения 8 в 70 см3 ТГФ в присутствии 0,1 г диспергированного на угле палладия. Когда получают теоретический объем поглощенного водорода, смесь фильтруют, фильтрат выпаривают и полученный остаток диспергируют в диизопропилэфире. Полученное твердое вещество обезвоживают и высушивают.
Т. пл. = 156-157оС (диизопропилэфир). Выход 0,7 г (41% ).
Элементный анализ: С26Н27FO4. Мол. масса 422,50.
Рассчитано, % : С 73,91; Н 6,44; F 4,50.
Получено, % : С 75,83; H 6,32; F 4,40.
ЯМР (DMSOd6)-200 МГц: 1,38-2,21 (м, 14Н), 2,39 (дд, 1Н, J = 17,2 Гц и 2,8 Гц), 2,57 (дд, 1Н, J = 17, 2 и 4,6 Гц), 3,96-4,11 (м, 1Н), 4,25-4,46 (м, 1Н), 5,04 (д, 1Н, J = 3,2 Гц), 6,31-6,41 (м. 1Н), 6,69-6,85 (м, 2Н), 7,02-7,34 (м, 5Н).
П р и м е р 10. (+, -)-Эритро-7-(4-(4-фторфенил)-спиро-3-(2Н-бензопиран-1-2,1'-цик- лопентил))-3,5-дигидроксигептаноат натрия (соединение 10 - формула 1: X = O, R1-R2 = -(CH2)4 -, R3 = 4'F, R4 = R5 = R6 = R7 = R8 = R9 = R10 = H, R11 = -ONa+).
При комнатной температуре перемешивают смесь 0,22 г (0,00052 моль) соединения 9 и 0,52 см3 (0,00052 моль- 5% ) 1 N водной щелочи натрия в 25 см3 этанола. Этанол испаряют, остаток диспергируют в эфире, обезвоживают и высушивают полученное тверое вещество.
(ТСХ: силикагель, AcOEt-гексан: 1-1 + 3% AcOH: 1 пятно).
Т. пл. не определена, выход 0,12 г (50% ).
Элементный анализ: С27Н28FNaO5. Мол. масса 462,48.
Рассчитано, % : С 67,52; Н 6,10; F 4,11; Na 4,97.
Получено, % : С 67,30; H 5,92; F 3,90; Na 5,00.
П р и м е р 11. (+, -)-Эритро-7-(4-(4-фторфенил)-спиро-3-(2Н-бензопиран-1-2,1'-цик- лопентил))-3,5-дигидроксигептоноат этила (соединение 4).
Гидрируют при нормальном давлении 1,4 г (0,003 моль) соединения 1, растворенного в 100 см3 ТГФ в присутствии 0,6 г диспергированного на угле палладия. Когда будет достигнут теоретический объем поглощенного водорода, смесь фильтруют, выпаривают досуха и диспергируют остаток в гексане, затем обезвоживают и сушат.
Т. пл. = 103-105о С (диизопропилэфир). Выход 1 г (71% ).
П р и м е р 12. (+, -)-Транс-6-(1Е-2-(4-(4-фторфенил)-спиро-3-(2Н-бензопиран-1-2,1'-циклопент ил))-этенил)-2/2-диметил-1-3-диоксан-4-ил) этилацетата (соединение 11 - формула 1: Х = O, R1-R2 = -(CH2)4-, R3 = 4'F, R4 = R5 = R6 = H, R7 и R8 = связь, R9-R10 = (CH3)2C-, R11 = OC2H5).
При комнатной температуре, в течение 48 ч перемешивают смесь 2 г (0,0043 моль) соединения 1, 0,7 г 2-метоксипропена и 8 мг моногидратированной n-толуолсульфоновой кислоты в 25 см3 ДМФ. Добавляют 125 см3 простого эфира, промывают водным насыщенным раствором бикарбоната натрия, затем водой. Органическую фазу высушивают над сульфатом натрия, фильтруют и выпаривают досуха. Получают масло, которое кристаллизуют в гексане. Обезвоживают, сушат и проводят хроматографию на 20 г силикагеля, используя смесь гексан-этилацетат: 1-1 в качестве растворителя и элюента. Собранные фракции I и II выпаривают, остаток кристаллизуют в гексане, обезвоживают и высушивают.
Т. пл. = 103-105оС. Выход 0,95 г (44% ).
Элементный анализ: С31Н35FO5. Мол. масса = 506,61.
Рассчитано, % : С 73,50; Н 6,96; F 3,75.
Получено, % : С 73,64; H 6,98; F 3,73.
ЯМР (CDCl3): 0,9-2,5 (м, 16Н), 3,9-4,5 (м, 2Н), 4,05 (кв, 2Н), 5,95 (д, 1Н), 6,2-7,25 (м, 8Н).
В приведенных ниже примерах соединений в соответствии с изобретением применяются следующие сокращения: Me - метил, Et - этил, Pr - пропил, Bz - бензил, Pe - пентил, tBu - трет-бутил, iPr - изопропил, Phe - фенил, Pyr - пиролидино.
П р и м е р 13. Используя методики, описанные в примерах 1-12, получают соединения (табл. ниже), в формуле 1 которых X = O; R1 и R2образуют цепочку -(CH2)n-, R7 и R8 образуют вместе простую связь, R9 и R10 каждый обозначает водород (табл. 1).
П р и м е р 14. Используя описанные в примерах 1-12 методики, получают соединения (таблица ниже) формулы 1, в которой X = O, R4 = R5 = R9 = R10 = H, R7 и R8 образуют связь (см. табл. 2).
П р и м е р 15. Используя описанные в примерах 1-12 методики, получают соединения (таблица ниже) формулы 1, в которой R4 = R6 = R10 = H, R7 и R8, соответственно R9 и R11, образуют вместе простую связь (см. табл. 3).
П р и м е р 16. Применяя описанные в примерах 1-12 методики, получают соединения (таблица ниже) формулы 1, в которой X = CH2 или S, R4 = R6 = R9 = R10 = H, R7 и R8 образуют простую связь (см. табл. 4).
П р и м е р 16 (продолжение). Используя методики для промежуточных стадий в примерах с 1 по 4, получают промежуточные соединения, которые приведены ниже (см. табл. 5).
П р и м е р 17. Промежуточные соединения общей формулы 4, в которой X = O, R1 и R2 образуют цепь: -(СН2)n-, R7 и R8 образуют вместе связь, R9 обозначает атом водорода (см. табл. 6).
П р и м е р 18. Промежуточные соединения общей формулы 4, в которой X = O, R4 = R5 = R6 = R9 = H, R7 и R8 образуют связь (см. табл. 7).
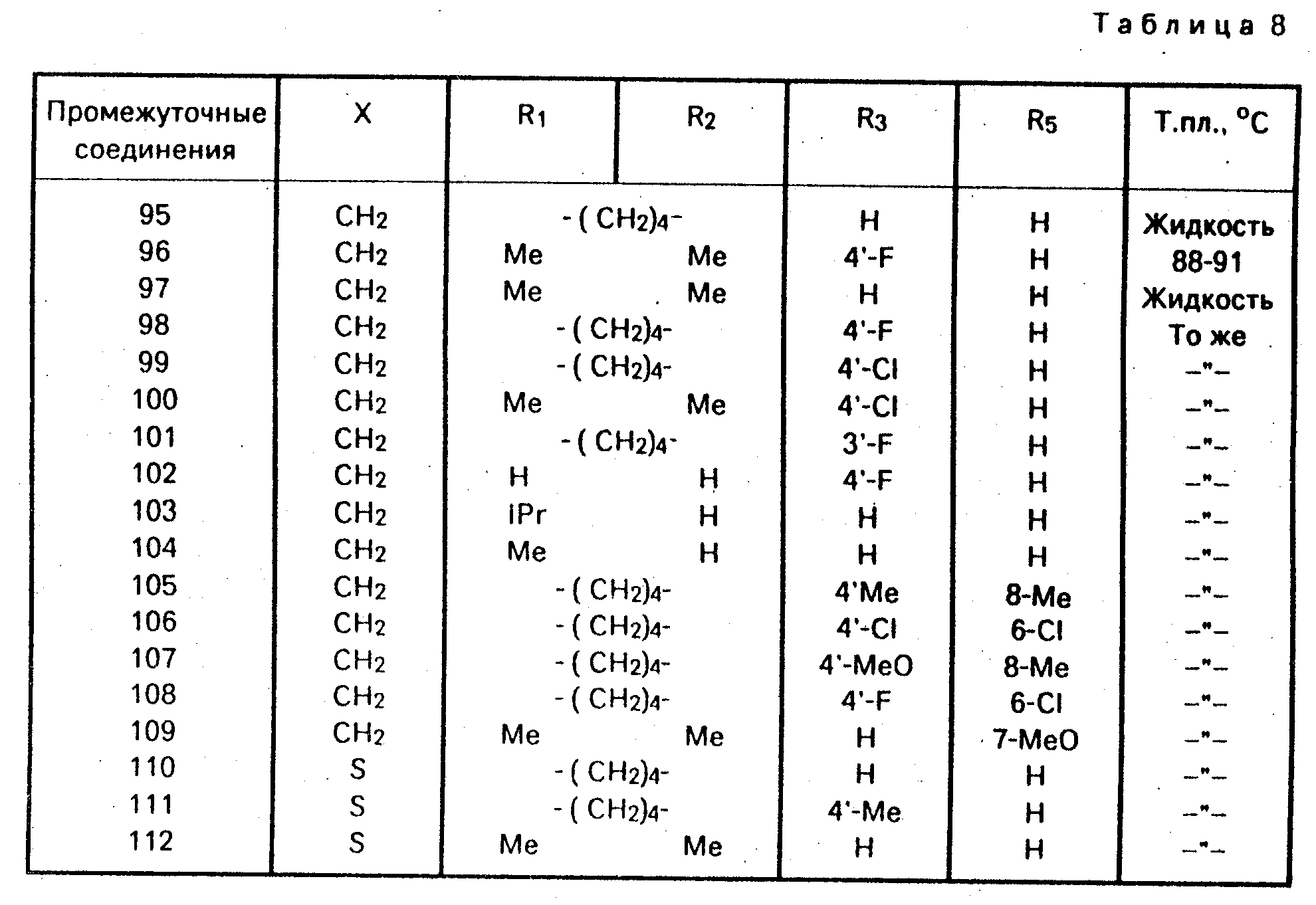
П р и м е р 19. Промежуточные соединения общей формулы 4, в которой X = CH2 или S, R4 = R6 = R9 = H, R7 и R8 образуют связь, R11 - метокси (см. табл. 8).
П р и м е р 20. Промежуточные соединения общей формулы 2, в которой X = O, R1 и R2 образуют цепь -(СН2)n-, R7 и R8 образуют связь (см. табл. 9).
П р и м е р 21. Промежуточные соединения общей формулы 2, в которой X = CH2 или O, S, R4 = R6 = H и R7 и R8 образуют вместе связь (см. табл. 10).
П р и м е р 22. Промежуточные соединения общей формулы 6, в которой X = CH2 или S, R4 = R6 = H (см табл. 11).
П р и м е р 23. Промежуточные соединения общей формулы 5, в которой X = O, R1 и R2 образуют тетраметиленовую цепь -(CH2)4- (см. табл. 12).
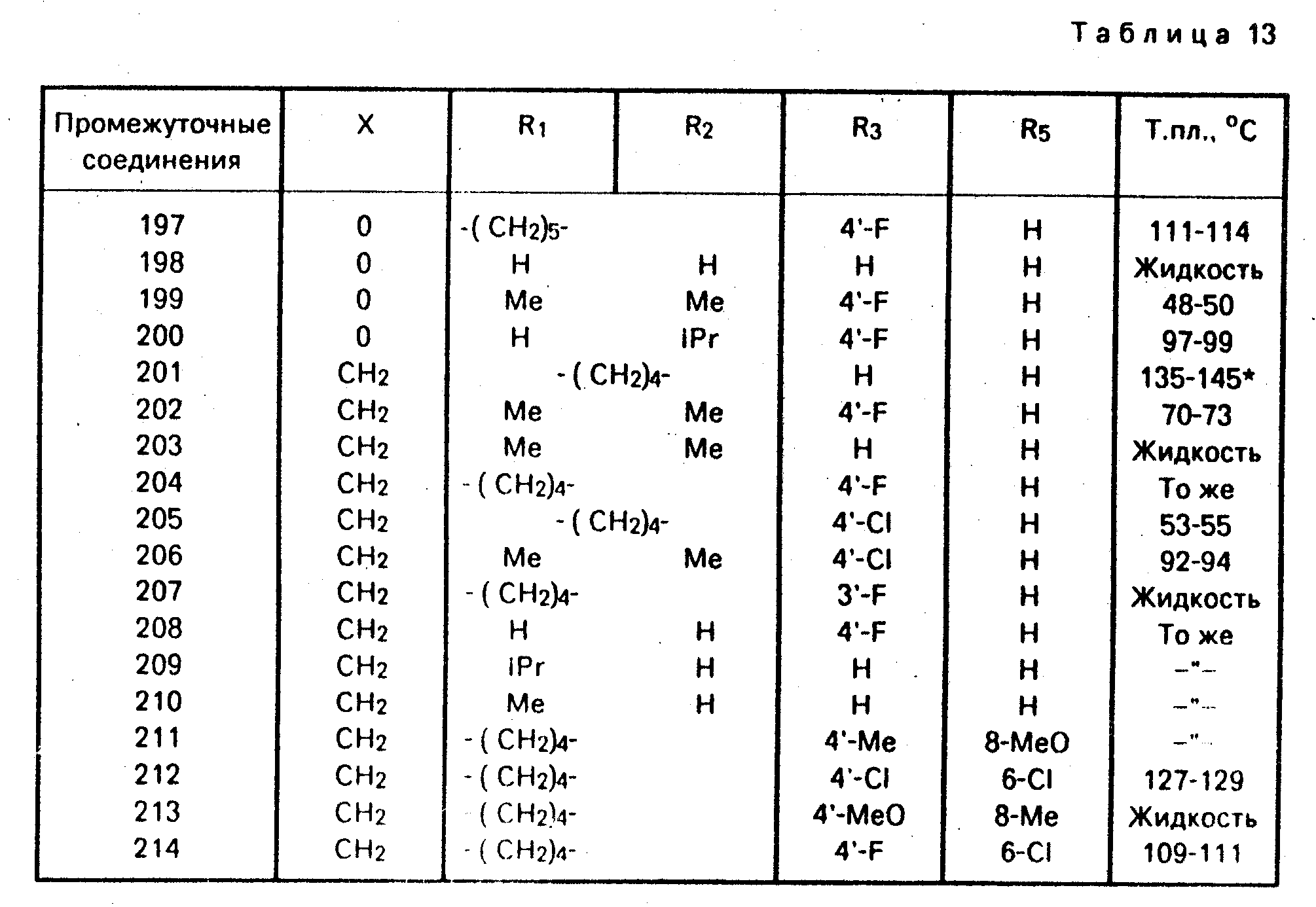
П р и м е р 24. Промежуточные соединения общей формулы 5, в которой R4 = R6 = H (см. табл. 13).
П р и м е р 25. Промежуточные соединения общей формулы 9, в которой X = S и R4 = R6 = H (см. табл. 14).
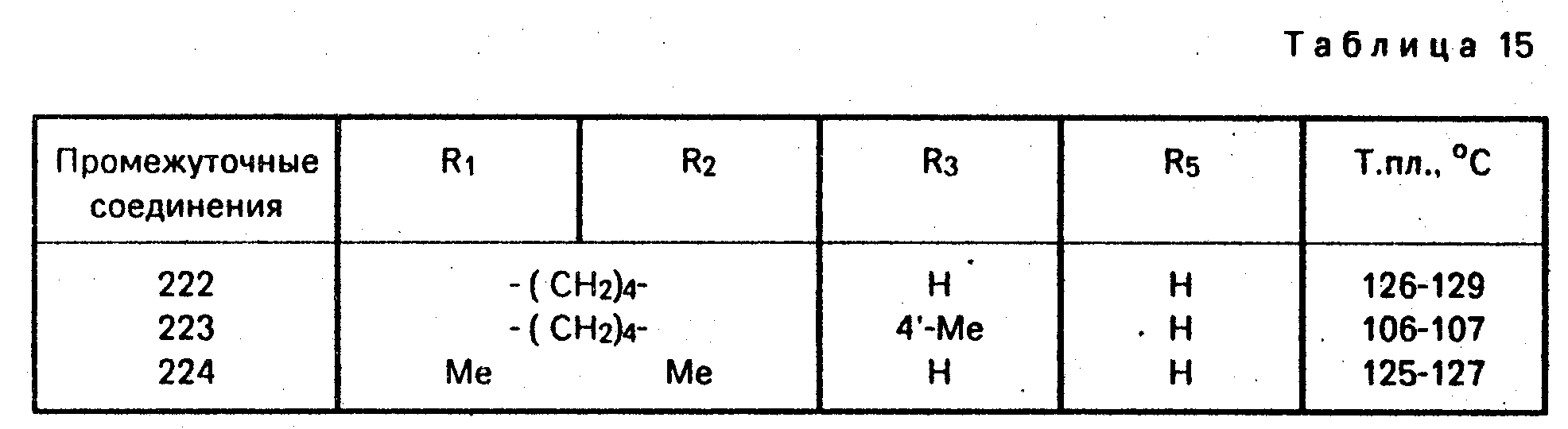
П р и м е р 26. Промежуточные соединения общей формулы 8, в которой X = S, R4 = = R6 = H, R = C2H5 (см. табл. 15).
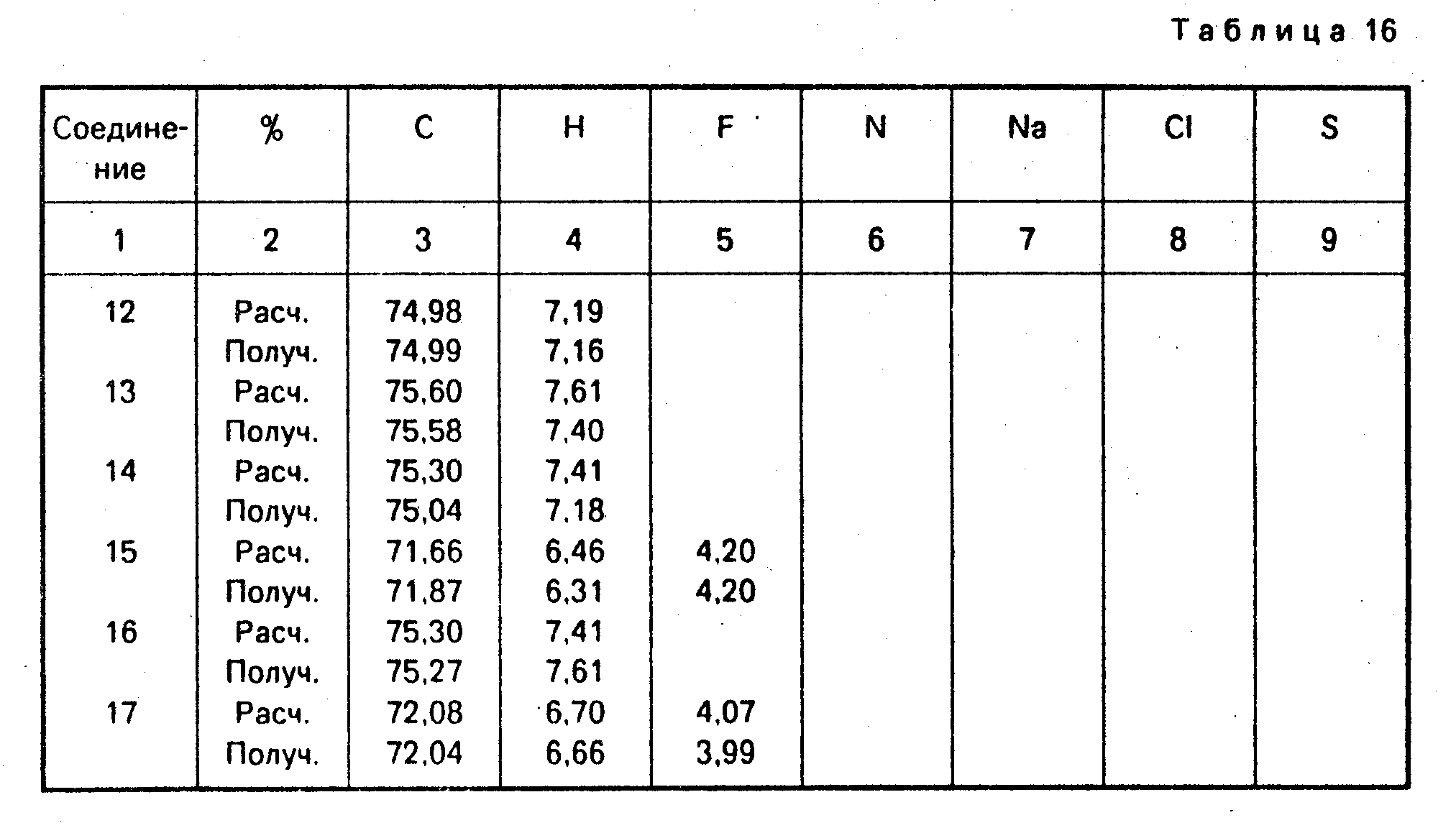
Элементный анализ представлен в табл. 16.
Ловастин, отвечает следующей формуле:

Можно констатировать, что, если ловастатин является соединением, которое, по сведениям заявителя, структурно наиболее близко к соединениям в соответствии с изобретением, то тем не менее, в конечном счете, его структура далека от структуры соединений по изобретению.
Более того, в настоящей заявке показано, что ловастин обладает менее хорошими антихолестеринемическими свойствами (тест B), чем соединения в соответствии с изобретением NN 1,2,19, и 65.
Кроме того, соединения NN 5, 9, 41 и 42 также были испытаны в соответствии с тестами A и B. Результаты этих испытаний представлены в табл. 17, приведенной ниже.
Величины ДЕ50 в каждом случае меньше (в тестах A и B) для соединений в соответствии с изобретением по отношению к ДЕ50 для ловастатина.
С другой стороны, все соединения в соответствии с изобретением являются антиагрегатными тромбоцитов, что, согласно, патенту США 4231938, не присуще ловастатину, что и составляет положительный эффект всех соединений в соответствии с настоящим изобретением.
Все соединения в соответствии с изобретением чрезвычайно малотоксичны. Это, в частности, относится к случаю соединений типа сложных эфиров, лактонов и амидов. Соли кислот обычно имеют DL50 немного более слабые, но их терапевтическое действие остается превосходным.
В качестве примера, ниже представлены несколько значений DL50, полученных для крыс при оральном введении (см. табл. ).
Новый пример.
Используя соответствующие способы из примеров 1-12, получили соединения (приведены ниже в таблице), в которых R1 и R2 образуют цепь -(CH2)-, R4 = R6 = R9 = R10 = H; R7 и R8 образуют связь, а X, R3, R5 и R11 имеют следующие значения, представленные в табл. 18.
Получение кислот соли (+, -)-6Е-эритро-7-[4-(4-фторфенил)-3-спиро-(2Н-бензопирен-1,2,1'-циклопентил )] -3,5-дигидрокси-6-гептеновой кислоты (формула I: X = O, R1-R2 = -(CH2)4-, R3 = 4'-F, R4= H, R5= R6 = R9 = R10 = H; R7 и R8 = связь, R11= OH).
К суспензии 2,30 г (0,005 моль) (+, -)-6Е-7-[4-(4-фторфенил)-3-спиро(2Н-бензопиран-1, 2,1'-циклопентил)] -3,5-дигидрокси-6-гептаноатэтилу в 20 мл тетрагидрофурана прикапывают при комнатной температуре 5 мл (0,00535 моль) водного раствора 1,07 н. хлорводородной кислоты.
Перемешивают полученный раствор в течение 10 мин при комнатной температуре, затем экстрагируют 200 мл этилацетата, промывают органический экстракт водой до нейтрализации. Сушат над сульфатом натрия и затем отгоняют растворитель. Выделяют целевой продукт в виде масла. Выход 1,8 г (82% ).
Физико-химические характеристики:
Хроматография в тонком слое:
гель двуокиси кремния, AcOEt-гексан 1: 1, одно пятно,
Rf = 0,05.
ИК, ν СО = 1712 см-1, ν СО = 3411 см-1.
Элементарный анализ: C26H27FO5.
Мол. масса. 438,49.
Рассчитано, % : C 71,22; Р 6,21.
Найдено, % : C 71,10; Н 6,48.
Биологическая активность:
Согласно тесту A, полученный продукт имеет
дозу DL50 (доза, необходимая для снижения холэстерогенеза на 50% ), составляющую 0,23 мг/кг. (56) Патент США N 4231938, кл. C 07 D 309/30, 1980.
Реферат
Использование: в медицине, в качестве гиперхолестеролинемического, противотромбозного и противогрибкового средства. Сущность изобретения: продукт: производные бензоциклоалкенилдигидрооксиалкановых кислот ф-лы I, указанной в описание изобретения, в которой X = CH2O или O, или S; R1 и R2 - идентичные или различные, представляют собой H, алкил в C1-C3 , или они образуют вместе цепочку - (CH2)n - (n = 4 или 5), в необходимом случае симметрично замещенные одним или двумя алкильными радикалами в C1-C3. R3 и R4, идентичные или различные: H, CF3 , галоген (Cl, F, Br), N, N-диалкиламино в C1-C5 , алкил в C1-C4 , алкокси в C1-C5 , алкилтио в C1-C3 или фенил, в необходимом случае замещенный не более, чем двумя заместителями, которые могут быть идентичными или различными и представляют радикалы алкил в C1-C3 , алкокси в C1-C3 , или галогены (F, Cl), подразумевается, что, когда один из R3 , R4 представляет радикалы: CF3 , N, N-диалкиламино, C6H5 или замещенный фенил, то он находится в положениях 3', 4' или 5' по формуле I, а другой означает атом водорода. R5,R6 (которые могут быть идентичными или различными) представляют H, галоген (F, Cl, Br), CF3 , алкил в C1-C3 , алкокси в C1-C3 , C6H5 , в необходимом случае замещенный не более, чем двумя заместителями, которые могут быть различными или идентичными и представляют радикалы: алкил в C1-C3 , алкокси в C1-C3 , или атомы галогена (F, Cl), при условии, что, когда один из R5 , R6 представляет CF3 , C6H5 или замещенный фенил, то он находится в положении 6 или 7, а другой обозначает атом водорода. Заместители R3 и R4 и соответственно R5 и R6 могут также образовывать вместе, при условии нахождения в двух прилегающих положениях, бирадикалы формул - CH = CH - CH = CH, (CH2)m - , - O(CH2)p, в которых m = 3 или 4, p = 1 или 2, подразумевается, что, когда R5 и R6 образуют цепь O(CH2)pO , то она связана с вершинами 3', 4' или 4', 5' и соответственно 6 и 7 в соответствии с формулой I. R7 и R8 = H или они образуют вместе с существующей связью C - C двойную связь геометрии транс; R9 и R10 = H или образуют вместе диалкилметиленовую группу в C1-C3/ . В виде свободных кислот, солей, эфиров, амидов или δ -латонов. Реагент 1: кетоэфир ф-лы II, указанной в описании изобретения, где X , R1R8 и R11 имеют вышеуказанные значения. Реагент 2: комплексующий агент типа производного бора, таким как триалкилборан или диалкоксиалкилборан. Условия реакции: низкая температура с последующей обработкой боргидридом щелочного металла в течение 5 - 8 ч с последующим превращением одного целевого продукта в другой целевой продукт. Соединения I в дозе 0,23 мг/кг снижает холэстерогенез на 50% и превосходит препарат ловастатин LD50 3200 мг/кг.
Формула
1


где X - CH2, кислород или сера;
R1 и R2, идентичные или разные, - водород или алкильный радикал, содержащий 1 - 3 атомов углерода, R1 и R2 могут также вместе образовывать алкиленовую цепь - (CH2)n-, в которой число звеньев n может быть равно 4 или 5;
R3 и R4, идентичные или разные, - водород или галоген, такой, как хлор, фтор и бром, радикалы: CF3, N, N-диалкиламино-, содержащий 1 - 3 атома углерода, алкильный, содержащий 1 - 4 атомов углерода, алкокси-, содержащий 1 - 5 атомов углерода, фенильный, причем когда один из заместителей R3 или R4 представляют собой радикал CF3, N, N-диалкиламино- и фенильный, то он находится в положениях 3', 4' или 5', а другой заместитель является водородом;
R5 или R6 идентичные или разные, - водород или галоген, такой как хлор, фтор или бром, радикалы: алкильный C1 - C3, алкокси- C1 - C3 или фенильный, при необходимости замещенный не более двумя атомами фтора или хлора, при условии, что когда один из заместителей R5 или R6 представляет собой радикал, фенильный или замещенный фенильный, то он находится в положении 6 или 7, а другой заместитель является водородом, заместители R3 и R4 и соответственно R5 и R6 могут также вместе образовывать, при условии, что они находятся в смежных положениях, бирадикалы с формулой -CH= CH-CH= CH-;
R7 и R8 - каждый водород или образуют вместе с существующей связью C-C двойную связь с геометрией транс-формы (E);
R9 и R10 - каждый водород или образуют вместе диалкилметиленовый остаток, содержащий 1 - 3 атома углерода;
R11 вместе с группой CO, с которой он связан, образует функцию свободной кислоты, сложного эфира, амида, соли кислоты или образует с радикалом R9 цикл δ-лактона,
отличающийся тем, что кетоэфир общей формулы II
2



где X, R1 - R8 и R11 имеют указанные значения,
подвергают восстановлению в растворе инертного растворителя при обработке в течение 40 мин - 1 ч комплексующим агентом типа производного бора, таким, как триалкилборан или диалкоксиалкилборан, при низкой температуре, затем при обработке боргидридом щелочного металла в течение 5 - 8 ч и при необходимости осуществляют с целью получения соединения общей формулы I, где R11 вместе с группой CO, с которой он связан, образует функцию сложного эфира, алкоголиз соединения общей формулы I, где R9 и R11 образуют связь, растворенного в избытке спирта при температуре между комнатной температурой и температурой флегмы указанного спирта, и при необходимости в присутствии каталитического количества основания типа алкоголята щелочного металла, такого, как метилат натрия, или третичного амина, алкилирование соединения общей формулы I, где R11 вместе с группой CO, с которой он связан, образует функцию соли кислоты, в растворе растворителя-кетона, такого, как метилэтилкетон, в присутствии иодида или бромида, такого, как бензилбромид, при температуре флегмы указанного растворителя-кетона, или с целью получения соединения общей формулы I в виде соли гидролиз соединения общей формулы I в виде сложного эфира, или, в котором R9 и R11 образуют связь, в растворе инертного растворителя, преимущественно спирта, при действии основного агента, такого, как гидроксид натрия или калия, при температуре между комнатной температурой и температурой флегмы указанного растворителя; или с целью получения соединения общей формулы I, где R9 и R11 образуют связь, лактонизацию соединения общей формулы I, где R11 вместе с группой CO, с которой он связан, образует функцию свободной кислоты, при обработке в инертном растворителе типа карбонильных растворителей, таких, как ацетон или бутанон, или типа ароматических растворителей, таких, как бензол, толуол или ксилол, при помощи агента лактинизации типа третичного хлорамина, такого, как хлорэтилдиэтиламин, или агента дегидратации типа паратолуолсульфокислоты; или с целью получения соединения общей формулы I, где R7 и R8 - водород, а R9 и R11 образуют связь, гидрирование соединения общей формулы I, где R7 и R8 соответственно с R9 и R11 образуют связь, в растворе инертного растворителя типа тетрагидрофурана или в растворе спирта с низкой температурой кипения, такого, как метанол или этанол, в присутствии металлического катализатора, такого как палладий, при комнатной температуре; или с целью получения соединения общей формулы I в виде амида, аминолиз соединений общей формулы I в виде сложного эфира или в которых R9 и R11 образуют связь, в растворе инертного растворителя, преимущественно гидроксилированного, типа спирта в присутствии избытка амина и при комнатной температуре; или с целью получения соединения общей формулы I, в которой R9 и R10 образуют вместе диалкилалкиленовый остаток, реакция соединений с соответствующей формулой I, где R9 и R10 - каждый водород с алкеном, содержащим 3 - 7 атомов углерода, замещенным при двойной связи алкоксирадикалом, преимущественно метокси-, в растворителе типа диметилформамида в присутствии кислотного катализатора типа паратолуолсульфокислоты при комнатной температуре.

Комментарии