Способ получения циклических дикетонов - RU2316544C2
Код документа: RU2316544C2
Описание
Настоящее изобретение относится к способу получения производных циклического 1,3-дикетона, содержащих карбонильную группу в положении 2.
Методы получения циклических 1,3-дикетонов, замещенных в положении 2 арилкарбонильной группой, описаны, например, в WO 00/15615, WO 00/37437, WO 01/66522 и WO 01/94339. Эти соединения обладают гербицидным действием.
Однако недостаток известных методов состоит в целом в сложности получения некоторых исходных циклических 1,3-дикетонов, не замещенных в положении 2, и прежде всего исходных бициклических 1,3-дикетонов, а их производные обычно удается получать лишь в несколько сложных стадий синтеза и последующей очистки.
Помимо этого в известных методах выделение конечных продуктов и прежде всего 2-бензоильных, 2-пиридилкарбонильных и 2-гетероарилкарбонильных производных связано с высокими затратами, поскольку подобную процедуру обычно требуется проводить в несколько стадий. В соответствии с этим известные методы часто не обеспечивают получения циклических 1,3-дикетонов с достаточно высокой чистотой и достаточно высоким выходом.
Исходя из вышеизложенного в основу настоящего изобретения была положена задача разработать новый общий способ получения производных моноциклических и бициклических 1,3-дикетонов, прежде всего 2-бензоильных, 2-изоникотиноильных и 2-никотиноильных производных, который позволял бы получать подобные соединения с высоким выходом и высокого качества проведением простых реакций при малых затратах и который не имел бы указанных выше недостатков, присущих известным методам.
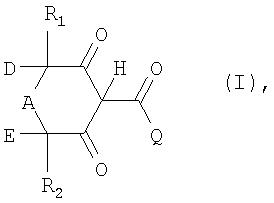
В соответствии с этим в изобретении предлагается способ получения соединений формулы I
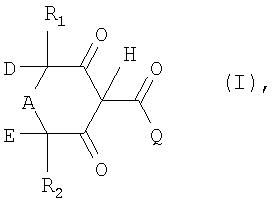
в которой Q обозначает органический заместитель, выбранный таким образом, чтобы значение рК соединения формулы I составляло от 1 до 5,
D обозначает водород или R3,
Е обозначает водород или R4 или
D и Е совместно обозначают С2-С3алкилен, который может быть моно- или полизамещен радикалом R6,
А обозначает С1-С2алкилен, который может быть моно- или полизамещен радикалом R5, либо, если D и Е отличны от С2-С3алкилена, А может также обозначать карбонил, кислород или группу -NR7-,
R1, R2, R3, R4, R5 и R6 каждый независимо друг от друга обозначает водород, С1-С4алкил, фенил, С1-С4алкоксигруппу, галоген, гидроксигруппу, цианогруппу, гидроксикарбонил или С1-С4алкоксикарбонил и
R7 обозначает С1-С4алкил, алкоксикарбонил или С1-С4 алкилкарбонил,
заключающийся в том, что
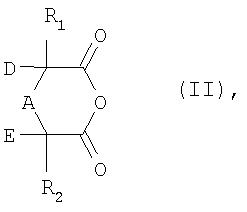
а) соединение формулы II
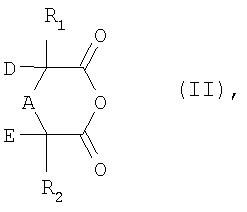
в которой R1, R2, A, D и Е имеют указанные выше для формулы I значения,
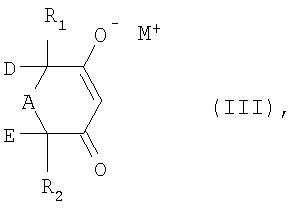
превращают либо в присутствии аминового основания и каталитического количества цианида, либо в присутствии алкоголята щелочного металла или алкоголята щелочноземельного металла в соль формулы III
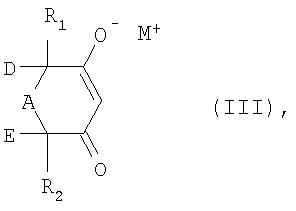
в которой R1, R2, А, D и Е имеют указанные выше для формулы I значения, а М+ обозначает ион щелочного металла, ион щелочноземельного металла или ион аммония,
б) это соединение подвергают взаимодействию с соединением формулы IV
X-C(O)-Q (IV),
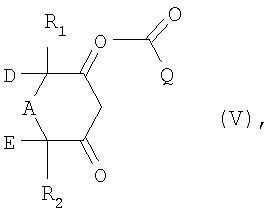
в которой Х обозначает уходящую группу, a Q имеет то же значение, что и указанное выше для формулы (I), с получением соединения формулы V
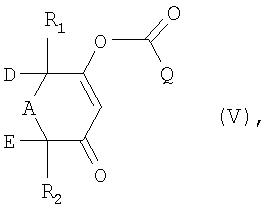
в которой R1, R2, А, D, Е и Q имеют указанные выше для формулы (I) значения, и
в) это соединение превращают в присутствии каталитического количества цианид-ионов и в присутствии основания в соединение формулы I.
Поскольку соединения формулы I существуют преимущественно в енольных формах или в форме солей, предлагаемый в изобретении способ подразумевает также получение подобных енольных форм соединений формул Ia, Ib, Ic и Id, в которых Me+ обозначает водород или ион щелочного металла, ион щелочноземельного металла либо ион аммония:
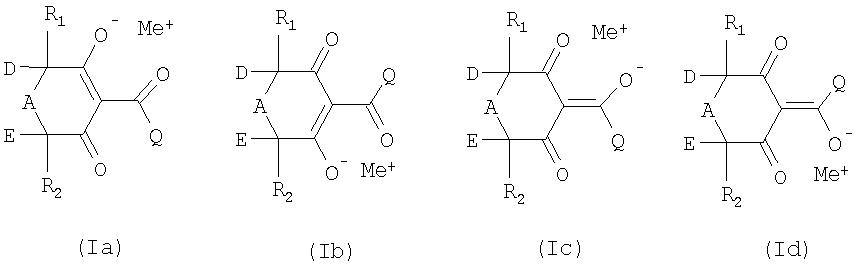
Поскольку соединения формулы I могут содержать асимметрические атомы углерода, как, например, в случае атома углерода, несущего R1, D и А, в объем настоящего изобретения включены также все возможные стереоизомерные формы указанных соединений. Сказанное соответственно относится и ко всем возможным таутомерным и стереоизомерным формам соединений формул II, III, IV и V, используемых в качестве промежуточных продуктов.
Q обозначает прежде всего органический заместитель, выбранный таким образом, чтобы значение рК соединения формулы I составляло от 2,5 до 4.
Органический заместитель Q может представлять собой заместитель любой структуры, при условии, что он является практически инертным в реакционных условиях, используемых при осуществлении предлагаемого в изобретении способа.
Q предпочтительно обозначает моно- либо полизамещенную фенильную, пиридильную или гетероарильную группу, предпочтительно ди- либо тризамещенную фенильную группу, или дизамещенную 2-пиридильную либо 3-пиридильную группу, при этом схема замещения таких групп выбирается произвольно, при одном лишь условии, что подобные группы должны быть практически инертными в реакционных условиях, используемых при осуществлении предлагаемого в изобретении способа. Предпочтительны при этом фенильные, 3-пиридильные и гетероарильные группы, несущие по меньшей мере один заместитель, который наиболее предпочтительно находится в орто-положении.
Предлагаемым в изобретении способом предпочтительно получать соединения формулы I, в которой
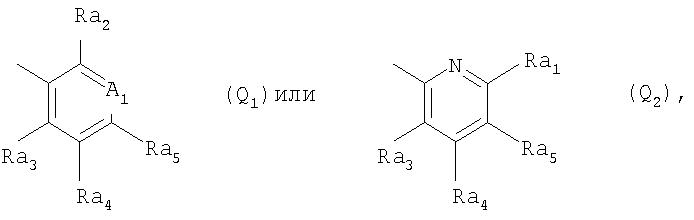
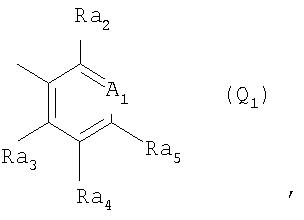
Q обозначает группу
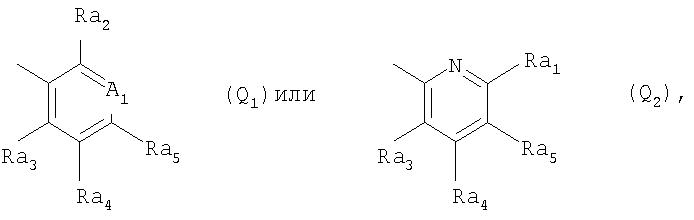
где A1 обозначает CRa1 или N-(O)p,
р обозначает 0 или 1,
Ra1 обозначает водород, C1-С6алкил, гидроксигруппу, C1-С6алкоксигруппу, C1-С6галоалкоксигруппу, С3-С6алкенилоксигруппу, С3-С6галоалкенилоксигруппу, С3-С6алкинилоксигруппу, С1-С4 алкилкарбонилоксигруппу, С1-С4алкилсульфонилоксигруппу, фенилсульфонилоксигруппу, C1-С6алкилтиогруппу, C1-С6алкилсульфинил, C1-С6алкилсульфонил, C1-С6алкиламиногруппу, ди(C1-С6алкил)аминогруппу, С1-С3алкокси-С1-С3 алкиламиногруппу, С1-С3алкокси-С1-С3алкил-N(С1-С3алкил)-, С1-С4алкоксикарбонил, C1-С6 галоалкил, формил, цианогруппу, галоген, фенил или феноксигруппу, при этом фенилсодержащие группы в свою очередь могут быть замещены C1-С3алкилом, C1-С3 галоалкилом, C1-С3алкоксигруппой, C1-С3галоалкоксигруппой, галогеном, цианогруппой или нитрогруппой, или
Ra1 обозначает 3-10-членную моноциклическую либо совместно с Ra2 или Ra5 сконденсированную бициклическую систему, которая может быть однократно или до трехкратно прервана гетероциклическими заместителями, выбранными из группы, включающей кислород, серу, S(О), SO2, N(Ra6), карбонил и C(=NORa7), при этом, если такая циклическая система не является сконденсированной, то она присоединена к атому углерода заместителя A1 либо непосредственно, либо через С1-С4алкиленовый, С2-С4алкениленовый или С2-С4алкиниленовый мостик, который может быть прерван кислородом, -N(С1-С4алкилом)-, серой, сульфинилом или сульфонилом, и такая циклическая система не может содержать более двух атомов кислорода и более двух атомов серы и в свою очередь может быть моно-, ди- или тризамещена C1-С6алкилом, C1-С6галоалкилом, C1-С6алкенилом, C1-С6галоалкенилом, С3-С6алкинилом, С3-С6галоалкинилом, C1-С6 алкоксигруппой, C1-С6галоалкоксигруппой, С3-С6алкенилоксигруппой, С3-С6алкинилоксигруппой, C1-С6алкилтиогруппой, C1-С6галоалкилтиогруппой, С3-С6алкенилтиогруппой, С3-С6галоалкенилтиогруппой, С3-С6алкинилтиогруппой, С1-С4алкокси-С1-С3алкилтиогруппой, С1-С4алкилкарбонил-С1-С3алкилтиогруппой, С1-С4 алкоксикабонил-С1-С2алкилтиогруппой, циано-С1-С4алкилтиогруппой, С1 -С6алкилсульфинилом, C1-С6 галоалкилсульфинилом, C1-С6алкилсульфонилом, C1-С6галоалкилсульфонилом, аминосульфонилом, С1-С4алкиламиносульфонилом, ди(С1 -С4алкил)аминосульфонилом, ди(С1-С4алкил)аминогруппой, галогеном, цианогруппой, нитрогруппой, фенилом, бензилоксигруппой и/или бензилтиогруппой, при этом фенилсодержащие группы в свою очередь могут быть замещены в фенильном кольце C1-С3алкилом, C1-С3галоалкилом, C1-С3алкоксигруппой, C1-С3галоалкоксигруппой, галогеном, цианогруппой или нитрогруппой, причем заместители у атома азота в гетероциклическом кольце отличны от галогена, или
Ra1 обозначает группу -Х5-Х7 или группу -Х6-Х5-Х7, где
Х5 обозначает кислород, -О(СО)-, -(СО)О-, -O(СО)O-, -Н(С1-С4алкил)-O-,
-O-N(С1-С4алкил), серу, сульфинил, сульфонил, -SO2N(C1-C4алкил),
-N(С1 -С4алкил)SO2-, -N(С1-С2алкокси-С1-С2алкил)SO2- или
-N(С1-С4алкил),
Х6 обозначает C1-С6алкиленовую, С3-С6алкениленовую или С3-С6алкиниленовую цепь, которая может быть моно- или полизамещена галогеном или радикалом X8, при этом ненасыщенные связи цепи не присоединены непосредственно к радикалу Х5,
Ra6 обозначает водород, С1-С4алкил, С1-С4алкилтио-С1-С4алкилкарбонил, С1-С4алкилсульфинил-С1-С4алкилкарбонил, С1-С4алкилсульфонил-С1-С4алкилкарбонил, С1-С4алкоксикарбонил, С1-С4алкилкарбонил, фенилкарбонил или фенил, при этом фенильные группы в свою очередь могут быть замещены С1-С4алкилом, С1-С4галоалкилом, С1-С4алкоксигруппой, С1-С4галоалкоксигруппой, С1-С4алкилкарбонилом, С1-С4алкоксикарбонилом, С1-С4алкиламиногруппой, ди(С1-С4алкил)аминогруппой, С1 -С4алкилтиогруппой, С1-С4алкилсульфинилом, группой С1-С4алкил-SO2, группой С1-С4алкил-S(O)2O, С1-С4галоалкилтиогруппой, С1-С4галоалкилсульфинилом, группой С1-С4галоалкил-SO2, группой С1-С4 галоалкил-S(O)2O, группой С1-С4алкил-S(O)2NH, С1-С4алкил-S(O)2N(С1-С4алкилом)-, галогеном, нитрогруппой или цианогруппой,
Ra7 обозначает водород, С1-С4алкил, С3-С4алкенил, С3-С4алкинил или бензил,
Ra2 обозначает водород, C1-С6алкил, C1-С6галоалкил, С2-С6алкенил, С2-С6галоалкенил, замещенный С1-С2алкоксикарбонилом или фенилом винил, С2-С6алкинил, С2-С6галоалкинил, замещенный триметилсилилом, гидроксигруппой, C1-С6алкоксигруппой, С1-С4алкоксикарбонилом или фенилом этинил, С3-С6алленил, С3-С6циклоалкил, замещенный галогеном или C1-С3алкоксиметилом С3-С6циклоалкил, C1-С6алкоксигруппу, С3-С6алкенилоксигруппу, С3 -С6алкинилоксигруппу, C1-С6галоалкоксигруппу, С3-С6галоалкенилоксигруппу, циано-С1-С4алкоксигруппу, С1-С4алкокси-С1-С4алкоксигруппу, С1-С4алкилтио-С1-С4алкоксигруппу, С1-С4алкилсульфинил-С1-С4алкоксигруппу,С1-С4алкилсульфонил-С1-С4алкоксигруппу, С1-С4алкоксикарбонил-С1-С4алкоксигруппу, C1-С6алкилтиогруппу, С1-С6алкилсульфинил, С1-С6алкилсульфонил, С1-С6галоалкилтиогруппу, C1-С6 галгеналкилсульфинил, C1-С6галоалкилсульфонил, С1-С4алкоксикарбонил- С1-С4алкилтиогруппу, С1-С4 алкоксикарбонил-С1-С4алкилсульфинил, С1-С4алкоксикарбонил-С1-С4алкилсульфонил, С1-С6алкиламиногруппу, ди(С1-С6алкил)аминогруппу, С1-С3алкокси-С1-С3алкиламиногруппу, С1-С3алкокси-С1-С3алкил-N(С1-С3алкил), С1-С6алкиламиносульфонил, ди(С1-С6алкил)аминосульфонил, С1-С4алкилсульфонилоксигруппу, С1 -С4галоалкилсульфонилоксигруппу, С1-С4алкилсульфониламиногруппу, С1-С4алкилсульфонил-N(С1-С4алкил), цианогруппу, карбамоил, С1-С4алкоксикарбонил, формил, галоген, роданогруппу, аминогруппу, гидрокси-С1-С4алкил, С1-С4алкокси-С1-С4алкил, С1-С4алкилтио-С1-С4алкил, С1-С4алкилсульфинил- С1-С4алкил, С1-С4алкилсульфонил-С1-С4алкил, циано-С1-С4алкил, С1-С6алкилкарбонилокси-С1-С4алкил, С1-С4алкоксикарбонил- С1-С4алкил, С1-С4алкоксикарбонилокси- С1-С4алкил, родано-С1-С4алкил, фенил-С1-С4алкил, фенокси-С1-С4алкил, бензилокси-С1-С4алкил, бензоилокси-С1-С4алкил, (2-оксиранил)-С1-С4алкил, С1-С4алкиламино-С1-С4алкил, ди(С1-С4алкил)амино-С1-С4алкил, С1-С12алкилтиокарбонил-С1-С4 алкил или формил-С1-С4алкил либо бензилтиогруппу, бензилсульфинил, бензилсульфонил, бензилоксигруппу, бензил, фенил, феноксигруппу, фенилтиогруппу, фенилсульфинил или фенилсульфонил, при этом фенилсодержащие группы в свою очередь могут быть замещены C1-С3алкилом, C1-С3галоалкилом, C1-С3алкоксигруппой, C1-С3галоалкоксигруппой, галогеном, цианогруппой или нитрогруппой, или
Ra2 обозначает 3-10-членную моноциклическую либо сконденсированную бициклическую систему, которая может быть ароматической, насыщенной или частично насыщенной и может содержать от 1 до 4 гетероатомов, выбранных из азота, кислорода и серы, при этом такая циклическая система присоединена к группе Q1 или Q2 С1-С4алкиленовым, С2-С4алкениленовым или С2-С4алкиниленовым мостиком, который может быть прерван кислородом, -N(С1-С4алкилом)-, серой, сульфинилом, сульфонилом или карбонилом, и каждая циклическая система не может содержать более двух атомов кислорода и более двух атомов серы и в свою очередь может быть моно-, ди- или тризамещена C1-С6алкилом, C1-С6галоалкилом, С2-С6алкенилом, С2-С6галоалкенилом, С2-С6алкинилом, С2-С6галоалкинилом, С1-С6алкоксигруппой, С1-С6 галоалкоксигруппой, С3-С6алкенилоксигруппой, С3-С6алкинилоксигруппой, гидроксигруппой, меркаптогруппой, C1-С6алкилтиогруппой, C1-С6галоалкилтиогруппой, С3-С6алкенилтиогруппой, С3-С6галоалкенилтиогруппой, С3-С6алкинилтиогруппой, С1 -С4алкокси-С1-С3алкилтиогруппой, С1-С4алкилкарбонил-С1-С3алкилтиогруппой, С1-С4алкоксикарбонил-С1-С3алкилтиогруппой, циано-С1-С3алкилтиогруппой, C1-С6алкилсульфинилом, С1-С6галоалкилсульфинилом, С1 -С6алкилсульфонилом, C1-С6галоалкилсульфонилом, аминосульфонилом, С1-С4алкиламиносульфонилом, ди(С1-С4 алкил)аминосульфонилом, ди(С1-С4алкил)аминогруппой, галогеном, цианогруппой, нитрогруппой, фенилом и/или бензилтиогруппой, при этом фенильные и бензилтиогруппы в свою очередь могут быть замещены в фенильном кольце C1-С3алкилом, C1-С3галоалкилалкилом, C1-С3алкоксигруппой, C1-С3 галоалкоксигруппой, галогеном, цианогруппой или нитрогруппой, причем заместители у атома азота в гетероциклическом кольце отличны от галогена, или
Rа2 обозначает группу -Х2-Х3- или группу -X1-Х2-Х3-, где
X1 обозначает кислород, -О(СО)-, -(СО)О-, -O(СО)O-, -N(С1-С4 алкил)-O-,
-O-N(С1-С4алкил)-, тиогруппу, сульфинил, сульфонил,
-SO2N(С1-С4алкил)-, -N(С1-С4 алкил)SO2-,
-N(С1-С2алкокси-С1-С2алкил)SO2- или -N(С1-С4алкил)-,
X2 обозначает C1-С6алкиленовую, С3-С6алкениленовую или С3-С6алкиниленовую цепь, которая может быть моно- или полизамещена галогеном или радикалом Х4, при этом ненасыщенные связи не присоединены непосредственно к заместителю X1,
Х3 и Х7 каждый независимо друг от друга обозначает С1-С8алкильную, С3-С6алкенильную или С3-С6алкинильную группу, которая может быть моно- или полизамещена галогеном, гидроксигруппой, аминогруппой, формилом, нитрогруппой, цианогруппой, меркаптогруппой, карбамоилом, C1-С6алкоксигруппой, C1-С6алкоксикарбонилом, С2 -С6алкенилом, С2-С6галоалкенилом, С2-С6алкинилом, С2-С6галоалкинилом, С3-С6циклоалкилом, галогензамещенным С3-С6циклоалкилом, С3-С6алкенилоксигруппой, С3-С6алкинилоксигруппой, C1-С6галоалкоксигруппой, С3-С6галоалкенилоксигруппой, циано-C1-С6алкоксигруппой, С1-С6алкокси-С1-С6алкоксигруппой, С1-С6алкокси-С1-С6алкокси-С1-С6алкоксигруппой, С1-С6алкилтио-С1-С6алкоксигруппой, С1-С6 алкилсульфинил-С1-С6алкоксигруппой, С1-С6алкилсульфонил-С1-С6алкоксигруппой, С1-С6алкоксикарбонил, С1 -С6алкоксигруппой, С1-С6алкоксикарбонилом, С1-С6алкилкарбонилом, С1-С6алкилтиогруппой, С1-С6 алкилсульфинилом, С1-С6алкилсульфонилом, С1-С6галоалкилтиогруппой, С1-С6галоалкилсульфинилом, С1-С6 галоалкилсульфонилом, необязательно замещенным С1-С6алкилом оксиранилом, необязательно замещенной С1-С6алкилом (3-оксетанил)оксигруппой, бензилоксигруппой, бензилтиогруппой, бензилсульфинилом, бензилсульфонилом, С1-С6алкиламиногруппой, ди(С1-С6алкил)аминогруппой, группой С1-С4 алкил-S(O)2O, ди(С1-С4алкил)аминосульфонилом, роданогруппой, фенилом, феноксигруппой, фенилтиогруппой, фенилсульфинилом или фенилсульфонилом, при этом фенил- или бензилсодержащие группы в свою очередь могут быть замещены одним или несколькими заместителями, выбранными из группы, включающей С1-С6алкил, С1-С6галоалкил, С1-С6алкоксигруппу, С1-С6галоалкоксигруппу, галоген, цианогруппу, гидроксигруппу и нитрогруппу, или
Х3 и Х7 каждый независимо друг от друга обозначает фенил, который может быть моно- или полизамещен С1-С6алкилом, С1-С6галоалкилом, С1-С6 алкоксигруппой, С1-С6галоалкоксигруппой, галогеном, цианогруппой, гидроксигруппой или нитрогруппой, или
Х3 и Х7 каждый независимо друг от друга обозначает С3-С6циклоалкил, замещенный С1-С6алкоксигруппой либо С1-С6алкилом С3-С6циклоалкил, 3-оксетанил или замещенный С1-С6лкилом 3-оксетанил, или
Х3 и Х7 каждый независимо друг от друга обозначает 3-10-членную моноциклическую или сконденсированную бициклическую систему, которая может быть ароматической, насыщенной или частично насыщенной и которая может содержать от 1 до 4 гетероатомов, выбранных из азота, кислорода и серы, при этом такая циклическая система присоединена к заместителю X1 или Х5 непосредственно либо через C1-алкиленовую, С2-С4алкениленовую, С2-C4алкиниленовую, -N(С1-С4алкил)-С1-С4алкиленовую, -S(O)-С1-С4алкиленовую или -SO2-С1-С4алкиленовую группу и каждая циклическая система не может содержать более двух атомов кислорода и более двух атомов серы и в свою очередь может быть моно-, ди- или тризамещена С1 -С6алкилом, С1-С6галоалкилом, С2-С6алкенилом, С2-С6галоалкенилом, С2-С6алкинилом, С3-С6галоалкинилом, С1-С6алкоксигруппой, гидроксигруппой, С1-С6галоалкоксигруппой, С3-С6алкенилоксигруппой, С3-С6алкинилоксигруппой, меркаптогруппой, С1-С6алкилтиогруппой, С1-С6галоалкилтиогруппой, С3-С6алкенилтиогруппой, С3 -С6галоалкенилтиогруппой, С3-С6алкинилтиогруппой, С1-С3алкокси-С1-С3алкилтиогруппой, С1-С4 алкилкарбонил-С1-С2алкилтиогруппой, С1-С4алкоксикарбонил-С1-С2алкилтиогруппой, циано-С1-С3алкилтиогруппой, С1-С6алкилсульфинилом, С1-С6галоалкилсульфинилом, С1-С6алкилсульфонилом, С1-С6галоалкилсульфонилом, аминосульфонилом, C1-С2алкиламиносульфонилом, ди(С1-С2алкил)аминосульфонилом, ди(С1-С4алкил)аминогруппой, С1-С6 карбониламиногруппой, галогеном, цианогруппой, нитрогруппой, фенилом, бензилоксигруппой и/или бензилтиогруппой, при этом фенильные группы в свою очередь могут быть замещены в фенильном кольце C1-С3алкилом, C1-С3галоалкилом, C1-С3алкоксигруппой, C1-С3галоалкоксигруппой, галогеном, цианогруппой или нитрогруппой, причем заместители у атома азота в гетероциклическом кольце отличны от галогена, и
Х4 и X8 каждый независимо друг от друга обозначает гидроксигруппу, С1 -С6алкоксигруппу, (С3-С6циклоалкил)оксигруппу, С1-С6алкокси-С1-С6алкоксигруппу, С1-С6алкокси-С1-С6алкокси-С1-С6алкоксигруппу или С1-С6алкилсульфонилоксигруппу,
Ra3 обозначает водород, С1-С6алкил, С1-С6галоалкил, С2-С6алкенил, С2-С6галоалкенил, С2-С6алкинил, С2-С6 галоалкинил, С3-С6циклоалкил, С1-С6алкоксигруппу, С1-С6галоалкоксигруппу, С1-С6алкилтиогруппу, С1 -С6алкилсульфинил, С1-С6алкилсульфонил, С1-С6галоалкилтиогруппу, С1-С6галоалкилсульфинил, С1-С6 галоалкилсульфонил, аминогруппу, С1-С6алкиламиногруппу, ди(С1-С6алкил)аминогруппу, С1-С4алкилсульфонил-N(С1-С4 алкил)-, С1-С6алкиламиносульфонил, ди(С1-С6алкил)аминосульфонил, цианогруппу, галоген, С1-С4алкокси-С1-С4алкил, С1-С4алкилтио-С1-С4алкил, С1-С4алкилсульфинил-С1-С4алкил, С1-С4алкилсульфонил-С1 -С4алкил, фенил, фенилтиогруппу, фенилсульфинил, фенилсульфонил или феноксигруппу, при этом фенильные группы в свою очередь могут быть замещены C1-С3алкилом, C1-С3галоалкилом, C1-С3алкоксигруппой, C1-С3галоалкоксигруппой, галогеном, цианогруппой или нитрогруппой,
Ra4 обозначает водород, С1-С6алкил, гидроксигруппу, С1-С6алкоксигруппу, С1-С6галоалкоксигруппу, С3-С6 алкенилоксигруппу, С3-С6галоалкенилоксигруппу, С3-С6алкинилоксигруппу, С1-С4алкилкарбонилоксигруппу, С1-С4 алкилсульфинилоксигруппу, фенилсульфонилоксигруппу, С1-С4алкилтиогруппу, С1-С4алкилсульфинил, С1-С4алкилсульфонил, С1-С4алкиламиногруппу, ди(С1-С4алкил)аминогруппу, С1-С4алкоксикарбонил, С1-С4галоалкил, формил, цианогруппу, галоген, фенил или феноксигруппу, при этом фенилсодержащие группы в свою очередь могут быть замещены C1-С3алкилом, C1-С3галоалкилом, C1-С3алкоксигруппой, C1-С3галоалкоксигруппой, галогеном, цианогруппой или нитрогруппой, или
Ra4 обозначает 3-10-членную моноциклическую либо совместно с Ra3 или Ra5 сконденсированную бициклическую систему, которая может содержать от 1 до 4 гетероатомов, выбранных из азота, кислорода и серы, при этом, если такая циклическая система не является сконденсированной, то она присоединена к группе Q1 или Q2 либо непосредственно, либо через С1-С4алкиленовый, С2-C4алкениленовый или С3-С4алкиниленовый мостик, который может быть прерван кислородом, -N(С1-С4алкилом)-, серой, сульфинилом, сульфонилом или карбонилом, и циклическая система не может содержать более двух атомов кислорода и более двух атомов серы и в свою очередь может быть моно-, ди- или тризамещена С1-С6алкилом, С1-С6 галоалкилом, С2-С6алкенилом, С2-С6галоалкенилом, С2-С6алкинилом, С2-С6галоалкинилом, С1-С6 алкоксигруппой, С1-С6галоалкоксигруппой, С3-С6алкенилоксигруппой, С3-С6алкинилоксигруппой, С1-С6алкилтиогруппой, С1-С6галоалкилтиогруппой, С3-С6алкенилтиогруппой, С3-С6галоалкенилтиогруппой, С3-С6алкинилтиогруппой, С1-С4алкокси-С1-С2алкилтиогруппой, С1-С4алкилкарбонил-С1-С2алкилтиогруппой, С1-С4 алкоксикарбонил-С1-С2алкилтиогруппой, циано-С1-С4алкилтиогруппой, С1-С6алкилсульфинилом, С1-С6 галоалкилсульфинилом, С1-С6алкилсульфонилом, С1-С6галоалкилсульфонилом, аминосульфонилом, С1-С4алкиламиносульфонилом, ди(С1 -С4алкил)аминосульфонилом, аминогруппой, С1-С4алкиламиногруппой, ди(С1-С4алкил)аминогруппой, галогеном, цианогруппой, нитрогруппой, фенилом и/или бензилтиогруппой, при этом фенильные и бензилтиогруппы в свою очередь могут быть замещены в фенильном кольце C1-С3алкилом, C1-С3галоалкилом, C1 -С3алкоксигруппой, C1-С3галоалкоксигруппой, галогеном, цианогруппой или нитрогруппой, причем заместители у атома азота в гетероциклическом кольце отличны от галогена, и
Ra5 обозначает водород, С1-С6алкил, С1-С6галоалкил, С2-С6алкенил, С2-С6галоалкенил, С2-С6алкинил, С2-С6галоалкинил, С1-С6циклоалкил, С1-С6алкоксигруппу, С1-С6 галоалкоксигруппу, С1-С6алкилтиогруппу, С1-С6алкилсульфинил, С1-С6алкилсульфонил, С1-С6галоалкилтиогруппу, С1-С6галоалкилсульфинил, С1-С6галоалкилсульфонил, С1-С6алкилсульфонилоксигруппу, гидроксигруппу, меркаптогруппу, аминогруппу, С1 -С6алкиламиногруппу, ди(С1-С6алкил)аминогруппу, С1-С4алкилсульфониламиногруппу, С1-С4алкилсульфонил-N(С1-С4алкил)-, С1-С6алкиламиносульфонил, ди(С1-С6алкил)аминосульфонил, цианогруппу, галоген, С1-С4алкокси-С1-С4 алкил, С1-С4алкилтио-С1-С4алкил, С1-С4алкилсульфинил-С1-С4алкил, С1-С4алкилсульфонил-С1-С4алкил, триазолил, фенил, фенилтиогруппу, фенилсульфинил, фенилсульфонил или феноксигруппу, при этом фенилсодержащие группы в свою очередь могут быть замещены C1-С3алкилом, C1-С3галоалкилом, C1-С3алкоксигруппой, C1-С3галоалкоксигруппой, галогеном, цианогруппой или нитрогруппой, а также агрономически приемлемые соли/N-оксиды/изомеры/энантиомеры этих соединений.
Алкильные группы в приведенных выше значениях заместителей могут иметь прямую или разветвленную цепь и представляют собой, например, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил или трет-бутил. Алкоксильные, алкенильные и алкинильные группы являются производными указанных выше алкильных групп. Алкенильные и алкинильные группы могут быть моно- или полиненасыщенными. Алкоксигруппа представляет собой, например, метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу, н-бутоксигруппу, изобутоксигруппу, втор-бутоксигруппу или трет-бутоксигруппу. В качестве примеров алкоксикарбонила можно назвать метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, н-бутоксикарбонил, изобутоксикарбонил, втор-бутоксикарбонил или трет-бутоксикарбонил, предпочтительны при этом метоксикарбонил или этоксикарбонил.
М+ обозначает ион щелочного металла, ион щелочноземельного металла или ион аммония, например катион натрия, калия, кальция, магния, триэтиламмония и диизопропилэтиламмония.
Галоген обычно представляет собой фтор, хлор, бром или йод. То же самое относится и к галогену, являющемуся частью других групп и соединений, как, например, в случае галоалкила или галофенила. Галоалкильные группы имеют цепь длиной от 1 до 6 атомов углерода и представляют собой, например, фторметил, дифторметил, хлордифторметил, трифторметил, хлорметил, дихлорметил, трихлорметил, 2,2,2-трифторэтил, 1-фторэтил, 2-фторэтил, 2-хлорэтил, 2-фторпроп-2-ил, пентафторэтил, 1,1-дифтор-2,2,2-трихлорэтил, 2,2,3,3-тетрафторэтил и 2,2,2-трихлорэтил, пентафторэтил, гептафтор-н-пропил или перфтор-н-гексил.
Алкенильные и алкинильные группы могут быть моно- или полиненасыщенными и к ним относятся также алкильные, алкенильные или алкинильные цепи с одной или более двойными или тройными связями. Алкенил представляет собой, например, винил, аллил, изобутен-3-ил, СН2=СН-СН2-СН=СН-, СН2=СН-СН2-СН2-СН=СН- или СН3-СН=СН-СН2-СН=СН-. Предпочтительным алкинилом является, например, пропаргил, а предпочтительным алленилом является СН2=С=СН2-.
Алкиленовая цепь может быть замещена одной или несколькими C1-С3алкильными группами, прежде всего метильными группами. Такие алкиленовые цепи и алкиленовые группы предпочтительно являются незамещенными. То же самое относится и ко всем С3-С6циклоалкил-, С3-С5оксациклоалкил-, С3-С5тиациклоалкил-, С3-С4диоксациклоалкил-, С3 -С4дитиациклоалкил- или С3-С4оксатиациклоалкилсодержащим группам, которые, например, могут представлять собой часть кислород- и серосодержащих гетероциклических систем, указанных в качестве значений радикалов Ra1 и Ra2.
С1-С4алкиленовая, С2-С4алкениленовая или С2-С4 алкиниленовая цепь, которая может быть прервана кислородом, -N(С1-С4алкилом)-, серой, сульфинилом или сульфонилом, или указанная в качестве значений для Х2 или Х6 C1-С6алкиленовая, С3-С6алкениленовая или С3-С6алкиниленовая цепь, которая может быть моно- или полизамещена галогеном или радикалом Х4 либо Х8 соответственно, при этом ненасыщенные связи в цепи не присоединены непосредственно к заместителям X1 и Х3 соответственно, представляет собой, например, -СН2-, -СН2СН2-, -СН2СН2СН2-, -СН2СН2СН2СН2-, -СН(СН3)-, -СН2СН(СН3)-, -СН2СН(СН3)СН2-, -СН2СН(Cl)СН2-, -СН2СН(ОСН3)СН2-, -СН2O-, -ОСН2-, -СН2OCH2-, -ОСН2СН2-, -ОСН2СН2СН2-, -СН2OCH2СН2-, -СН2 OCH(СН3)СН2-, -SCH2-, -SCH2CH2-, -SCH2CH2CH2-, -CH2S-, -CH2SCH2-, -CH2S(O)CH2-, -CH2SO2CH2-, -CH2SCH2CH2-, -CH2S(O)CH2CH2-, -CH2SO2 CH2CH2-, -CH2SO2NH-, -CH2N(CH3)SO2CH2CH2-, -N(SO2Me)CH2CH2-, -CH2C(O)NH- или -CH2NHC(O)CH2-. Соответственно С2-С4алкениленовая цепь, которая необязательно может быть прервана кислородом, представляет собой, например, -СН=СН-CH2-, -СН=СН-СН2СН2- или -СН=СНСН2OCH2-, а С2-С4алкиниленовая цепь, которая необязательно может быть прервана кислородом, представляет собой, например, -С≡С-, -С≡ССН2-, -С≡ССН2О-, -С≡ССН2OCH2- или -ОС≡ССН2-.
Указанная в качестве значения Ra1 или Ra2 3-10-членная моноциклическая или бициклическая система, которая может быть однократно или до трехкратно прервана заместителями, выбранными из группы, включающей кислород, серу, S(O), SO2, N(Ra6), карбонил и C(=NORa7), и которая присоединена к атому углерода заместителя A1 или к группе Q1 или Q2 либо непосредственно, либо через С1-С4алкиленовый, С2-С4алкениленовый или С2-С4 алкиниленовый мостик, который может быть прерван кислородом, -N(С1-С4алкилом)-, серой, сульфинилом или сульфонилом, представляет собой, например, 1-метил-1Н-пиразол-3-ил, 1-этил-1H-пиразол-3-ил, 1-пропил-1H-пиразол-3-ил, 1H-пиразол-3-ил, 1,5-диметил-1H-пиразол-3-ил, 4-хлор-1-метил-1H-пиразол-3-ил, 1H-пиразол-1-ил, 3 -метил-1H-пиразол-1 -ил, 3,5-диметил-1Н-пиразол-1-ил, 3-изоксазолил, 5-метил-3-изоксазолил, 3-метил-5-изоксазолил, 5-изоксазолил, 1Н-пиррол-2-ил, 1-метил-1Н-пиррол-2-ил, 1Н-пиррол-1-ил, 1 -метил-1H-пиррол-3-ил, 2-фуранил, 5-метил-2-фуранил, 3-фуранил, 5-метил-2-тиенил, 2-тиенил, 3-тиенил, 1-метил-1Н-имидазол-2-ил, 1Н-имидазол-2-ил, 1-метил-1Н-имидазол-4-ил, 1-метил-1Н-имидазол-5-ил, 4-метил-2-оксазолил, 5-метил-2-оксазолил, 2-оксазолил, 2-метил-5-оксазолил, 2-метил-4-оксазолил, 4-метил-2-тиазолил, 5-метил-2-тиазолил, 2-тиазолил, 2-метил-5-тиазолил, 2-метил-4-тиазолил, 3-метил-4-изотиазолил, 3-метил-5-изотиазолил, 5-метил-З-изотиазолил, 1-метил-1Н-1,2,3-триазол-4-ил, 2-метил-2Н-1,2,3-триазол-4-ил, 4-метил-2Н-1,2,3-триазол-2-ил, 1-метил-1Н-1,2,4-триазол-3-ил, 1,5-диметил-1Н-1,2,4-триазол-3-ил, 3-метил-1Н-1,2, 4-триазол-1-ил, 5-метил-1Н-1,2,4-триазол-1-ил, 4,5-диметил-4Н-1,2,4-триазол-3-ил, 4-метил-4Н-1,2,4-триазол-3-ил, 4Н-1,2,4-триазол-4-ил, 5-метил-1,2,3-оксадиазол-4-ил, 1,2,3-оксадиазол-4-ил, 3-метил-1, 2,4-оксадиазол-5-ил, 5-метил-1,2,4-оксадиазол-3-ил, 4-метил-3-фуразанил, 3-фуразанил, 5-метил-1,2,4-оксадиазол-2-ил, 5-метил-1,2,3-тиадиазол-4-ил, 1,2,3-тиадиазол-4-ил, 3-метил-1,2,4-тиадиазол-5-ил, 5-метил-1,2,4-тиадиазол-3-ил, 4-метил-1,2,5-тиадиазол-3-ил, 5-метил-1,3,4-тиадиазол-2-ил, 1-метил-1Н-тетразол-5-ил, 1H-тетразол-5-ил, 5-метил-1Н-тетразол-1-ил, 2-метил-2Н-тетразол-5-ил, 2-этил-2Н-тетразол-5-ил, 5-метил-2Н-тетразол-2-ил, 2Н-тетразол-2-ил, 2-пиридил, 6-метил-2-пиридил, 4-пиридил, 3-пиридил, 6-метил-3-пиридазинил, 5-метил-3-пиридазинил, 3-пиридазинил, 4, 6-диметил-2-пиримидинил, 4-метил-2-пиримидинил, 2-пиримидинил, 2-метил-4-пиримидинил, 2-хлор-4-пиримидинил, 2,6-диметил-4-пиримидинил, 4-пиримидинил, 2-метил-5-пиримидинил, 6-метил-2-пиразинил, 2-пиразинил, 4,6-диметил-1,3,5-триазин-2-ил, 4,6-дихлор-1,3,5-триазин-2-ил, 1,3,5-триазин-2-ил, 4-метил-1,3,5-триазин-2-ил, 3-метил-1,2,4-триазин-5-ил, 3-метил-1,2,4-триазин-6-ил,
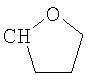
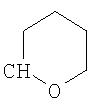
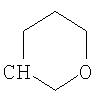
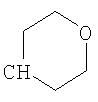
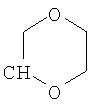
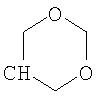
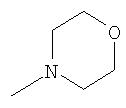
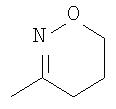
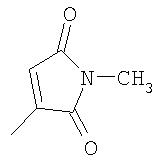
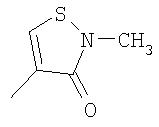
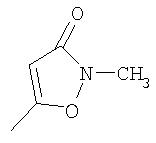
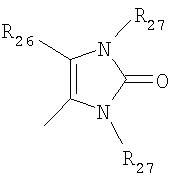
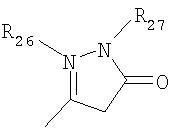
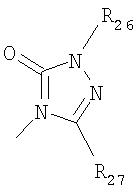
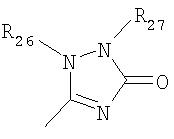
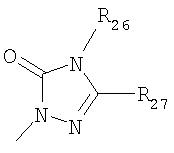
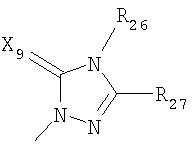
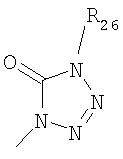
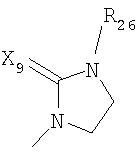
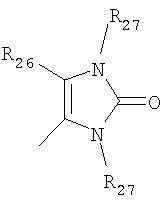
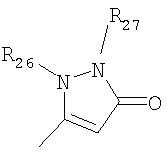
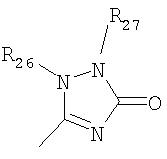
где R26 в каждом случае обозначает метил, R27 в каждом случае независимо обозначает водород, C1-С3алкил, C1-С3алкоксигруппу, C1-С3алкилтиогруппу или трифторметил, а Х9 обозначает кислород или серу.
Под другой сконденсированной моно- или бициклической системой, которая образована, например, двумя соседними заместителями Ra1 и Ra2 или Ra1 и Ra5 и необязательно однократно или до трехкратно прервана заместителями, выбранными из группы, включающей кислород, серу, S(O), SO2, -N(Ra6 )-, карбонил и C(=NORa7), и которая дополнительно может быть замещена одним или несколькими заместителями, подразумевается, например, сконденсированная бидентатная циклическая система формулы
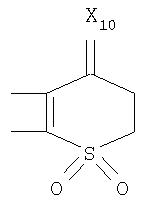
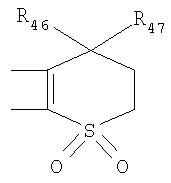
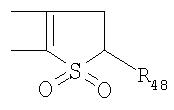
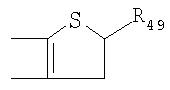
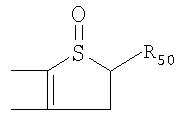
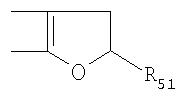
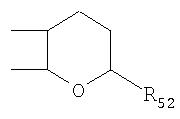
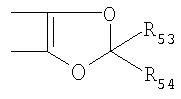
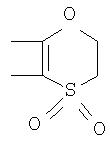
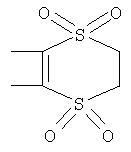
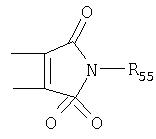
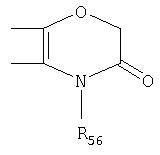
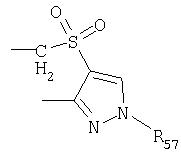
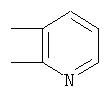
где, в частности, R46 обозначает водород, галоген, С1-С4алкил, С1-С4галоалкил, С1-С4алкоксигруппу или С1-С4алкилитиогруппу, R47 обозначает водород, галоген, С1-С4алкил или С1-С4алкоксигруппу, R50, R51, R52, R53, R54, R55, R56, R57, R58 и R59 обозначают водород или С1-С4алкил, а Х10 обозначает кислород или NOR59.
Гетероарильная группа Q, замещенная по меньшей мере в орто-положении, представляет собой прежде всего одну из указанных выше 5- или 6-членных ароматических гетероарильных групп, дополнительно моно-тризамещенную у атомов азота и/или атомов углерода радикалами, выбранными среди значений, указанных для Ra1, Ra2, Ra3 или Ra4 и Ra5.
Предлагаемым в изобретении способом наиболее предпочтительно получать циклогександионовые гербициды, описанные в WO 00/15615, WO 00/37437, WO 01/66522 и WO 01/94339.
Предлагаемый в изобретении способ пригоден, в частности, для получения соединений формулы I, в которой
R1 и R2 обозначают водород,
А обозначает незамещенный С1-С2алкилен,
D и Е совместно обозначают незамещенный С2-С3алкилен,
Q обозначает Q1, при этом A1 обозначает CRa1 или N-(O)p,
р обозначает 0,
Ra1 обозначает водород, C1-С6алкил, гидроксигруппу, C1-С6алкоксигруппу,
C1-С6галоалкоксигруппу, С3-С6алкенилоксигруппу,
С3-С6 галоалкенилоксигруппу, С3-С6алкинилоксигруппу,
С1-С4алкокси-С1-С2алкоксигруппу,
С1-С4алкокси-С1-С2алкокси-С1-С2алкоксигруппу,
(С3-С6циклоалкил)-С1-С2алкоксигруппу, (1, 3-диоксолан-2-ил)-С1-С2алкоксигруппу, (тетрагидрофуран-2-ил)-С1-С2алкоксигруппу, (тетрагидрофуран-3-ил)оксигруппу, (оксетан-3-ил)оксигруппу, (С3 -С6циклоалкил)оксигруппу, С1-С4алкилсульфонилоксигруппу, С1-С4алкилтиогруппу, С1-С4алкилсульфонил, С1-С4алкиламиногруппу, ди(С1-С4алкил)аминогруппу, С1-С2алкоксиэтиламиногруппу, С1-С2алкоксиэтил-(N-метил)аминогруппу, морфолиногруппу, С1-С4алкилкарбониламиноэтоксигруппу, С1-С4алкоксикарбонил, гидроксиметил, C1-С6алкоксиметил, C1-С6галоалкоксиметил, С3-С6алкенилоксиметил, С3-С6галоалкенилоксиметил, С3-С6алкинилоксиметил, С1-С4 алкокси-С1-С2алкоксиметил, (С3-С6циклоалкил)метоксиметил, (1,3-диоксолан-2-ил)метоксиметил, (тетрагидрофуран-2-ил)метоксиметил, (тетрагидрофуран-3-ил)оксиметил, (оксетан-3-ил)оксиметил, (С3-С6циклоалкил)оксиметил, С1-С4алкилкарбониламино-С1-С2алкоксигруппу, С1-С4галоалкил, цианогруппу, галоген, фенил или бензилоксигруппу, при этом фенилсодержащая группа в свою очередь может быть замещена C1-С3алкилом, C1-С3галоалкилом, C1-С3алкоксигруппой, C1-С3галоалкоксигруппой, галогеном, цианогруппой или нитрогруппой,
Ra2 обозначает C1-С6алкил, C1-С6галоалкил, С2-С6алкенил, С2-С6галоалкенил, С2-С6алкинил, С3-С6циклоалкил, замещенный галогеном или C1-С2алкоксиметилом С3-С6циклоалкил, C1-С6алкоксигруппу, С3-С6алкенилоксигруппу, С3-С6алкинилоксигруппу, C1-С6галоалкоксигруппу, С3-С6галоалкенилоксигруппу, С1-С4 алкокси-С1-С4алкоксигруппу, С1-С4алкилтио-С1-С4алкоксигруппу, С1-С4алкилсульфинил- С1-С4 алкоксигруппу, С1-С4алкилсульфонил-С1-С4алкоксигруппу, С1-С4алкоксикарбонил-С1-С4алкоксигруппу, С1 -С4алкилтиогруппу, C1-С6алкилсульфинил, C1-С6алкилсульфонил, C1-С6галоалкилтиогруппу, C1-С6 галоалкилсульфинил, C1-С6галоалкилсульфонил, C1-С6алкиламиносульфонил, ди(C1-С6алкил)аминосульфонил, С1-С4 алкилсульфонилоксигруппу, С1-С4галоалкилсульфонилоксигруппу, С1-С4алкилсульфониламиногруппу, С1-С4алкилсульфонил-N(С1-С4алкил), цианогруппу, галоген, гидрокси-С1-С4алкил, С1-С4алкокси-С1-С4алкил, С1-С4алкилтио-С1 -С4алкил, С1-С4алкилсульфинил-С1-С4алкил, С1-С4алкилсульфонил-С1-С4алкил, циано-С1-С4алкил, С1-С6алкилкарбонилокси- С1-С4алкил, С1-С4алкоксикарбонил-С1-С4алкил, С1-С4 алкоксикарбонилокси- С1-С4алкил, фенокси-С1-С4алкил, бензилокси-С1-С4алкил, бензилоксигруппу, бензилтиогруппу, феноксигруппу или фенилтиогруппу, при этом фенилсодержащие группы в свою очередь могут быть замещены C1-С3алкилом, C1-С3галоалкилом, C1-С3алкоксигруппой, C1-С3галоалкоксигруппой, галогеном, цианогруппой или нитрогруппой, или
Ra2 обозначает группу -X1-Х3 или группу -Х2 -Х1-Х3, где X1, Х2 и Х3 имеют указанные выше значения,
Ra3 обозначает водород,
Ra4 обозначает водород или метил,
Ra5 обозначает C1-С6галоалкил, С3-С6галоалкенил, C1-С6алкоксигруппу, C1-С6галоалкоксигруппу, C1-С6алкилтиогруппу, C1-С6алкилсульфинил, C1-С6алкилсульфонил, C1-С6галоалкилтиогруппу, C1-С6галоалкилсульфинил, C1-С6галоалкилсульфонил, C1-С6алкилсульфонилоксигруппу, С1-С4алкиламиносульфонил, ди(С1-С4алкил)аминосульфонил, С1-С4алкилсульфониламиногруппу, С1-С4алкилсульфонил-N(С1-С4алкил)-, цианогруппу, галоген, С1-С4алкоксиметил, С1-С4алкилтиометил, С1-С4алкилсульфинилметил, С1-С4алкилсульфонилметил или 1Н-1,2, 4-триазол-1-ил.
Более предпочтительно предлагаемым в изобретении способом получать соединения формулы I, в которой R1 и R2 обозначают водород, А обозначает метилен, D и Е совместно обозначают этилен, Q обозначает Q1, где A1обозначает азот, Ra3 и Ra4 обозначают водород, Ra5 обозначает С1-С3галоалкил,предпочтительно трифторметил, дифторхлорметил или дифторметил, прежде всего трифторметил, и Ra2 обозначает С1-С4алкил, С1-С4 галоалкил, С1-С4алкокси- С1-С4алкил или С1-С4алкокси-С1-С2алкокси-С1-С2алкил, предпочтительно метил, этил, метоксиметил, этоксиметил, метоксипропил или метоксиэтоксиметил, прежде всего метоксиэтоксиметил.
Наиболее предпочтительно предлагаемым в изобретении способом получать соединения формулы I, в которой R1 и R2 обозначают водород, А обозначает метилен, D и Е совместно обозначают этилен, Q обозначает Q1, где A1 обозначает азот, Ra3 и Ra4 обозначают водород, Ra5 обозначает трифторметил и Ra2 обозначает С1-С4алкокси-С1-С2алкокси-С1-С2алкил, наиболее предпочтительно метоксиэтоксиметил.
Особое преимущество предлагаемого в изобретении способа состоит в возможности простого получения исходных соединений формулы II. В том случае, если D и Е совместно имеют отличное от С2-С3алкилена значение, то такие исходные соединения известны, например, из J. Gen. Chem. USSR, 34 (1964), с. 3509 (англ. перевод 34 (1964), с. 3553); Tetrahedron Letters, 25 (1984), с. 3179; J.A.C.S. 109 (1987), с. 6385; Journal of Organic Chemistry, 53 (1988), с. 4923; Arm. Khim. Zh, 29 (1976), с. 342, или их можно получать по описанным в указанных публикациях методам, либо, если прежде всего D совместно с Е образует С2-С3алкиленовую цепь, их можно получать окислением соединения формулы VI
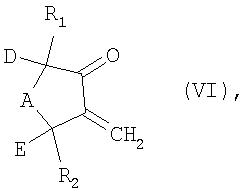
в которой R1, R2, А, D и Е имеют указанные для формулы I значения, при этом полученные соединения формулы II для их применения в предлагаемом в изобретении способе обычно не требуется выделять, и они могут реагировать непосредственно в реакционной смеси. Соединения формулы VI являются известными или их можно получать по известным методам, например добавлением формальдегида при одновременном удалении воды. Получение соединения формулы VI, в которой R1 и R2 обозначают водород, А обозначает метилен, a D и Е совместно обозначают этилен (метиленноркамфора), описано, например, в JP 10-265415.
Пригодными окислителями для превращения соединений формулы VI в соединения формулы II являются органические надкислоты, например надуксусная кислота, трифторнадуксусная кислота, надмуравьиная кислота, надпропионовая кислота, надбензйная кислота, м-хлорнадбензойная кислота или монопероксифталевая кислота, пероксид водорода или же пероксид водорода в присутствии каталитических количеств диоксида селена, при определенных условиях в присутствии дополнительного количества основания в инертном растворителе в интервале температур от -20 до 50°С. В качестве примера пригодных для применения в указанных целях оснований можно назвать ацетат натрия, ацетат калия, карбонат натрия, гидрокарбонат натрия, карбонат калия, карбонат кальция, оксид бария, гидрофосфат калия и дигидрофосфат калия. Пригодными для применения в указанных целях растворителями являются, например, дихлорметан, дихлорэтан, уксусная кислота, уксусный ангидрид и их смеси, например дихлорметана и уксусной кислоты либо уксусной кислоты и уксусного ангидрида.
Для превращения соединения формулы II в соль формулы III алкоголяты щелочных и щелочноземельных металлов можно использовать в каталитических или стехиометрических количествах. При использовании указанных веществ в каталитических количествах необходимо добавлять дополнительное основание. Такое основание можно добавлять в стехиометрических количествах или в избытке. Более предпочтительно добавлять основание в количестве от стехиометрического до небольшого избытка. В качестве таких дополнительных оснований можно использовать, например, неорганические основания, такие как карбонаты, например карбонат калия, оксиды, например оксид бария, и гидриды, например гидрид натрия. Под каталитическими количествами алкоголятов щелочных и щелочноземельных металлов подразумеваются количества, составляющие от 0,0001 до 25%, предпочтительно от 0,1 до 10%.
В предпочтительном варианте осуществления предлагаемого в изобретении способа алкоголяты щелочных и щелочноземельных металлов, прежде всего алкоголяты лития, натрия и калия, используют без добавления дополнительного основания в стехиометрических количествах или в избытке, наиболее предпочтительно в стехиометрических количествах.
Предпочтительными алкоголятами щелочных и щелочноземельных металлов являются алкоголяты лития, натрия и калия, прежде всего метаноляты и этаноляты. Наиболее предпочтительными алкоголятами щелочных и щелочноземельных металлов являются метанолят натрия, этанолят натрия, изопропанолят натрия, н-бутанолят натрия, трет-бутанолят калия, н-пентанолят натрия, трет-амилат натрия и 2-метоксиэтанолят натрия, прежде всего метанолят натрия.
Указанное выше превращение предпочтительно проводить в присутствии растворителя или, что более предпочтительно, в смеси растворителей. Пригодными для этой цели растворителями являются толуол, ксилол, хлорбензол, метилнафталин, спирты, такие как метанол, этанол, изопропанол, амиловый спирт, тетрагидрофуран или диоксан, апротонные растворители, такие как пропионитрил, диметилформамид, N-метилпирролидон или диметилсульфоксид, или 2-метил-5-этилпиридин и т.п. или же смеси этих растворителей, например толуола и диметилформамида или толуола и N-метилпирролидона.
При проведении реакционной стадии а) наиболее предпочтительно использовать толуол, а также диметилформамид или N-метилпирролидон в качестве дополнительного основания, поскольку в этом случае соединения формулы III, в чем состоит особое преимущество, выпадают из реакционной смеси в осадок, что позволяет по существу избежать дополнительных вторичных реакций, катализируемых основаниями.
На реакционной стадии а) растворитель или смесь растворителей используют в количестве, при котором соль соединения формулы III, предпочтительно натриевая соль, выпадает из реакционной смеси в осадок в легко кристаллизуемой форме при одновременном сохранении легкой перемешиваемости реакционной смеси. Для превращения соединений формулы II в соединения формулы III, в которой М+ обозначает катион щелочного металла, предпочтительно катион натрия, предпочтительно использовать смеси толуола с 1-15% диметилформамида или с 1-15% N-метилпирролидона, при этом наиболее предпочтительной является смесь толуола с 3-8% диметилформамида.
В зависимости от используемого растворителя превращение осуществляют в интервале температур приблизительно от 0°С до температуры кипения, предпочтительно в отсутствие влаги. В наиболее предпочтительном варианте осуществления предлагаемого в изобретении способа указанное химическое превращение проводят в толуоле с использованием метанолята натрия в качестве основания при температуре от 80°С до температуры кипения, при этом образующийся метанол непрерывно отгоняют во избежание вторичных реакций.
Так, в частности, первым в реакционный аппарат можно загружать метанолят натрия в виде 30%-ного метанольного раствора в смеси толуола с приблизительно 1-15% диметилформамида, затем за счет нагрева такого раствора и поддержания температуры в головной части колонны не выше приблизительно 105-110°С отгонять из него в первую очередь метанол и лишь после этого добавлять по каплям растворенное в небольшом количестве толуола соединение формулы II таким образом, чтобы обеспечить непрерывное удаление из реакционной смеси образующегося метанола путем его дальнейшей отгонки и тем самым обеспечить возможность выпадения соли формулы III из реакционной смеси в осадок в виде чистого, легко перемешиваемого кристаллизата.
Преимущество, связанное с проведением химического превращения с использованием алкоголят-анионов в качестве катализатора, состоит в том, что соответствующий образующий алкоголят катион используется также в качестве основания для осаждения енолята формулы I. Алкоголят щелочного металла предпочтительно использовать в количестве от 1,0 до 2,5 эквивалента, прежде всего от 1,0 до приблизительно 1,5 эквивалента. В качестве основания наиболее предпочтительно использовать метанолят натрия в количестве от 1,0001 до 1,1 эквивалента.
В другом варианте осуществления предлагаемого в изобретении способа на реакционной стадии а) используют каталитическое количество цианид-ионов в присутствии дополнительного аминового основания. Пригодными для использования в этих целях основаниями являются прежде всего третичные амины, такие как триалкиламины, например триметиламин, триэтиламин, диизопропилэтиламин (основание Хюнига), три-н-бутиламин, N,N-диметиланилин и N-метилморфолин. В качестве источника цианид-ионов предпочтительно использовать цианиды щелочных металлов, например цианид натрия или калия, либо цианид меди(I) или же органические циангидрины, такие как ацетонциангидрин, триалкилсилилцианиды, такие как триметилсилилцианид, или третичные аммониевые основания, такие как цианид тетраэтиламмония. В этом варианте осуществления предлагаемого в изобретении способа цианид щелочного металла используют в количествах, варьирующихся от малого количества до небольшого избытка. Так, в частности, цианиды используют в количествах, составляющих от 0,1 до приблизительно 25%, предпочтительно от 1 до приблизительно 15%, в присутствии дополнительного основания, такого как прежде всего триэтиламин или основание Хюнига, в количестве от 1 до 6 эквивалентов, предпочтительно от 1,1 до приблизительно 2,5 эквивалента.
В этом варианте предлагаемый в изобретении способ предпочтительно проводят в инертном растворителе, таком как н-гептан, толуол, ксилол, дихлорметан, дихлорэтан, диметоксиэтан, тетрагидрофуран, диоксан, трет-бутилметиловый эфир, этилацетат, ацетон, 2-бутанон, ацетонитрил, пропионитрил, диметилформамид или N-метилпирролидон, при температуре от -5 до приблизительно 80°С, наиболее предпочтительно в ацетонитриле или дихлорметане при температуре от приблизительно 10 до приблизительно 60°С.
В зависимости от используемых растворителей в таких реакциях необязательно можно применять добавки, такие, например, как хлорид лития, бромид лития, или межфазные катализаторы, такие, например, как бромид тетрабутиламмония или прежде всего цианид тетраэтиламмония, либо необязательно можно применять осушители, такие как сульфат магния или молекулярные сита, однако обычно использование подобных добавок не требуется.
Реакционная стадия б)
Соединение формулы III, полученное в стадии а), предпочтительно подвергать взаимодействию с соединением формулы IV непосредственно, без выделения промежуточных продуктов. Подобная методика проведения реакций является особо предпочтительной при осуществлении предлагаемого в изобретении способа.
Реакционную смесь, полученную на реакционной стадии а), охлаждают до температуры в пределах от 10 до 50°С и к ней добавляют соединение формулы IV, необязательно в виде раствора в соответствующем растворителе или смеси растворителей, например в толуоле, тетрагидрофуране или ацетонитриле. Соединение формулы V можно затем выделять переработкой реакционной смеси по обычным методам путем экстракции органическим растворителем и промывкой разбавленным щелочным раствором с рН от 7 до 9.
В одном из предпочтительных вариантов осуществления предлагаемого в изобретении способа на реакционной стадии а) в качестве основания используют метанолят натрия в количестве от 1 до 1,5 эквивалента, наиболее предпочтительно от 1,0001 до 1,1 эквивалента, а соединение формулы IV добавляют в количестве от стехиометрического до небольшого избытка, составляющего от 1,0001 до 1,1 эквивалента. Уходящей группой Х в этом варианте является прежде всего фтор, хлор, бром, триазолил, имидазолил или цианогруппа, наиболее предпочтительно хлор.
Соединения формулы IV либо являются известными соединениями, либо их можно получать известными в данной области методами. Так, например, соединения формулы IV и методы их получения описаны, в частности, в WO 00/15615, WO 00/37437, WO 01/66522 и WO 01/94339.
Реакционная стадия в)
Согласно наиболее предпочтительному варианту осуществления предлагаемого в изобретении способа реакцию на стадии в) проводят без выделения промежуточных продуктов, т.е. полученное на стадии б) соединение формулы V обрабатывают in situ цианид-ионами в присутствии основания.
Цианид-ионы предпочтительно используют в количестве от 0,01 до 15%. Практически сразу же после начала реакции, предпочтительно при температуре приблизительно 20°С, можно обнаружить, например, с помощью тонкослойной хроматографии, образование промежуточного продукта формулы V, при этом реакцию можно довести до конца за счет последующего добавления каталитических количеств цианид-ионов и при необходимости дополнительного количества основания, например от 0,1 до 2,5 эквивалента триэтиламина или основания Хюнига, а соединения формулы I можно выделять и очищать переработкой по обычным методам (например, промывкой и экстракцией, а также кристаллизацией). Пригодными источниками цианид-ионов являются, например, цианид натрия, цианид калия, цианид меди(I), ацетонциангидрин или триметилсилилцианид, предпочтительно цианид калия. Подобные перегруппировки эфиров енолов известны, например, из ЕР-А-0186117.
В наиболее предпочтительном варианте осуществления предлагаемого в изобретении способа реакции на стадиях а), б) и в) проводят в одном реакционном сосуде без выделения промежуточных продуктов.
В другом, также предпочтительном варианте осуществления предлагаемого в изобретении способа реакции на стадиях а) и б) проводят в одном реакционном сосуде, а затем нейтральный промежуточный продукт формулы IV сначала на дополнительной стадии промывки и очистки очищают от примесей и лишь после этого используют в реакции на стадии в) (промышленная каскадная реакция).
Ниже предлагаемый в изобретении способ проиллюстрирован на примерах получения конкретных соединений.
Пример Р 1. Получение триэтиламмонийной соли 4-гидроксибицикло[3.2.1]окт-3-ен-2-она из 4-метилен-3-оксабицикло[3.2.1]октан-2-она
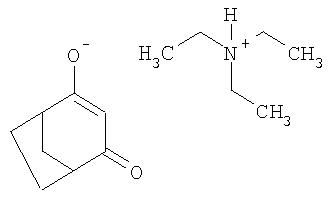
2,76 г (20 ммолей) 4-метилен-3-оксабицикло[3.2.1]октан-2-она нагревают до 55°С и выдерживают при этой температуре в течение 2,5 ч в присутствии 2,23 г (20 ммолей) триэтиламина и 0,13 г (2 ммоля) цианида калия в 20 мл ацетонитрила. Мутную реакционную смесь фильтруют через Hyflo® и упаривают досуха. Таким путем получают триэтиламмонийную соль 4-гидроксибицикло[3.2.1]окт-3-ен-2-она в виде смолистого гигроскопичного продукта.
Пример Р2. Получение этилдиизопропиламмонийной соли 4-гидроксибицикло[3.2.1]окт-3-ен-2-она из 4-метилен-З-оксабицикло [3.2.1] октан-2-она
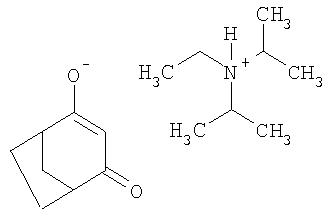
Аналогично примеру Р1 1,38 г (10 ммолей) 4-метилен-З-оксабицикло[3.2.1]октан-2-она перемешивают в течение 12 ч в присутствии 1,29 г (10 ммолей) основания Хюнига и 0,13 г цианида калия в 10 мл ацетонитрила. Твердые компоненты (соли калия) отфильтровывают и фильтрат упаривают досуха с получением этилдиизопропиламмонийной соли 4-гидроксибицикло[3.2.1]окт-3-ен-2-она в виде смолы.
Пример Р3. Получение натриевой соли 4-гидроксибицикло[3.2.1]окт-3-ен-2-она
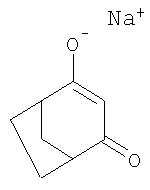
К раствору 190 мл толуола и 10 мл диметилформамида при 110°С по каплям добавляют 30%-ный раствор 12,1 г (0,22 моля) метанолята натрия в метаноле, непрерывно удаляя метанол отгонкой. К образовавшейся суспензии в течение 30 мин по каплям добавляют 20,7 г (0,15 моля) 4-метилен-З-оксабицикло[3.2.1]октан-2-она, растворенного в 20 мл толуола, продолжая отгонять метанол. После 2-часового перемешивания реакционной смеси при температуре кипения ей затем дают охладиться, выпавший в осадок продукт отфильтровывают и промывают толуолом.
Пример Р4. Получение 4-оксобицикло[3.2.1]окт-2-ен-2-ил-2-онового эфира 2-метокси-4-метилсульфанилбензойной кислоты из 4-метилен-3-оксабицикло[3.2.1 ]октан-2-она
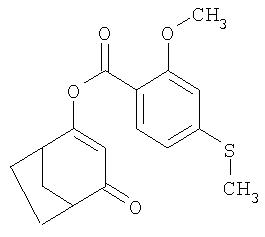
1,38 г (0,01 моля) 4-метилен-3-оксабицикло[3.2.1]октан-2-она перемешивают в течение 12 ч в присутствии 1,29 г (0,01 моля) основания Хюнига и 0,13 г цианида калия в 10 мл ацетонитрила. После этого твердые компоненты, выпавшие в осадок из реакционной смеси, отфильтровывают. Затем при температуре 20°С в реакционную смесь вводят, контролируя температуру, 1,73 г (8 ммолей) твердого 2-метокси-4-метилсульфанилбензоилхлорида (tкип 72-72,5°С), свежеприготовленного из 2-метокси-4-метилсульфанилбензойной кислоты взаимодействием с тионилхлоридом. После 30-минутного перемешивания реакционную смесь экстрагируют этилацетатом в противотоке воды и концентрируют путем упаривания. Остаток (3,12 г) очищают колоночной хроматографией (элюэнт: этилацетат/гексан в соотношении 1:3). Таким путем получают 1,78 г 4-оксобицикло[3.2.1]окт-2-ен-2-ил-2-онового эфира 2-метокси-4-метилсульфанилбензойной кислоты в виде смолистого продукта (выход 55,9% в пересчете на исходный 4-метилен-3-оксабицикло[3.2.1]октан-2-он или 69,9% в пересчете на исходный 2-метокси-4-метилсульфанилбензоилхлорид).
1Н-ЯМР (CDCl3) в част./млн: 7,46 (d, 1Н); 6,83 (d, 1H); 6,82 (s, 1H); 5,68 (s, 1H); 3,93 (s, 3H); 3,04 (m, 1H); 2,96 (m, 1H); 2,52 (s, 3H); 2,0-2,3 (4H); 1,7 (2H).
Пример Р5. Получение 4-гидрокси-3-(2-метокси-4-метилсульфанилбензоил)бицикло[3.2.1]окт-3-ен-2-она
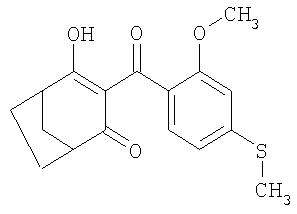
Полученное в примере Р4 соединение при температуре 20°С обрабатывают в присутствии 2 эквивалентов триэтиламина каталитическим количеством ацетонциангидрина в ацетонитриле. Таким путем получают 4-гидрокси-3-(2-метокси-4-метилсульфанилбензоил)бицикло[3.2.1]окт-3-ен-2-он (соединение формулы I, в которой Q обозначает 2-метокси-4-метилтиобензоил).
1Н-ЯМР (CDCI3) в част./млн: 17,18 (s, ОН); 7,24 (d, 1H); 6,84 (d, 1H); 6,73 (s, 1H); 3,73 (s, 3H); 3,1 (m, 1H); 2,9 (m, 1H); 2,50 (s, 3H); 1,6-2,3 (6H).
Пример Р6. Получение 4-оксобицикло[3.2.1]окт-2-ен-2-илового эфира 4-метансульфонил-2-нитробензойной кислоты (известного из US 5608101) из 4-метилен-3-оксабицикло[3.2.1]октан-2-она
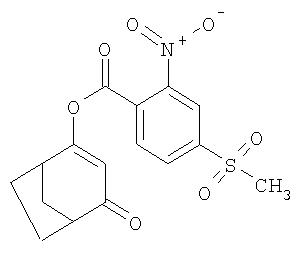
1,38 г (0,01 моля) 4-метилен-3-оксабицикло[3.2.1]октан-2-она перемешивают в течение 12 ч при температуре 20°С в присутствии 1,11 г (0,01 моля) триэтиламина и 65 мг (1 ммоль) цианида калия в 20 мл ацетонитрила, при этом частично выкристаллизовывается образующаяся триэтиламмонийная соль 4-гидроксибицикло[3.2.1]окт-3-ен-2-она. После этого при температуре 20°С в образовавшуюся суспензию вводят, контролируя температуру, 2,64 г (0,01 моля) свежеприготовленного 4-метансульфонил-2-нитробензоилхлорида. После 30-минутного перемешивания при температуре 20°С смесь экстрагируют этилацетатом в противотоке 5%-ного раствора гидрокарбоната натрия, а затем промывают однократно разбавленной соляной кислотой и однократно водой и упаривают досуха. Остаток (3,2 г) фильтруют через небольшое количество силикагеля (элюэнт: этилацетат/гексан в соотношении 1:1), получая 4-оксобицикло[3.2.1]окт-2-ен-2-иловый эфир 4-метансульфонил-2-нитробензойной кислоты в виде вязкого масла с выходом 2,48 г (67,9%).
1H-ЯМР (CDCI3) в част./млн: 8,84 (s, 1Н); 8,34 (d, 1H); 8,03 (d, 1H); 5,90 (s, 1H); 3,17 (s, 3H); 3,0-3,15 (2H); 1,6-2,3 (6H).
Пример Р7. Получение 4-гидрокси-3-(4-метансульфонил-2-нитробензоил)бицикло[3.2.1]окт-3-ен-2-она (известного из US 5801120)
2,48 г полученного в примере Р6 соединения при температуре 20°С обрабатывают в течение 1 ч в присутствии одного эквивалента триэтиламина каталитическим количеством цианида калия (10 мол.%) в ацетонитриле. Таким путем получают 4-гидрокси-3-(4-метансульфонил-2-нитробензоил)бицикло[3.2.1]окт-3-ен-2-он (соединение формулы I, в которой Q обозначает 2-нитро-4-метансульфонил). Выход 1,41 г или 56,8% в пересчете на исходный 4-гидроксибицикло[3.2.1]окт-3-ен-2-он.
Пример Р8. Получение 4-гидрокси-3-(4-метансульфонил-2-нитробензоил)бицикло[3.2.1]окт-3-ен-2-она из 4-метилен-З-оксабицикло[3.2.11октан-2-она
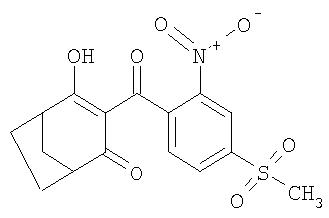
а) 2,76 г (0,02 моля) 93%-ного 4-метилен-3-оксабицикло[3.2.1]октан-2-она и 4,45 г (0,044 ммоля) триэтиламина перемешивают в течение 7 ч при комнатной температуре в 50 мл ацетонитрила в присутствии 130 мг (2 ммоля) цианида калия. Затем добавляют 4,22 г (0,16 моля) свежеприготовленного 4-метансульфонил-2-нитробензоилхлорида и перемешивают в течение 12 ч при температуре 20°С. Если при контроле за протеканием реакции тонкослойной хроматографией все еще удается обнаружить сравнительно большое количество промежуточного 4-оксобицикло[3.2.1]окт-2-ен-2-илового эфира 4-метансульфонил-2-нитробензойной кислоты (известного из US 5801120), то дополнительно добавляют 130 мг (2 ммоля) цианида калия и перемешивание продолжают еще в течение 2 ч до полного завершения реакции. После этого реакционную смесь растворяют в этилацетате и экстрагируют при значении рН 13 в противотоке воды. Водную фазу затем подкисляют соляной кислотой, экстрагируют при значении рН, равном примерно 4, свежим этилацетатом, сушат над Na2SO4 и концентрируют лишь до небольшого уменьшения объема. Продукт, растворенный в теплом этилацетате, обрабатывают активированным углем и отделяют вакуум-фильтрацией (с использованием вакуум-фильтра) через небольшое количество силикагеля, после чего вновь концентрируют и кристаллизуют добавлением небольшого количества гексана. Таким путем получают 1,69 г чистого 4-гидрокси-3-(4-метансульфонил-2-нитробензоил)бицикло[3.2.1]окт-3-ен-2-она с температурой плавления 170-170,5°С. Из маточного раствора можно получить дополнительное количество продукта (1,65 г) перекристаллизацией. Общий выход составляет 3,34 г или 49,1% в пересчете на исходный 4-метилен-3-оксабицикло[3.2.1]октан-2-он или 57,1% в пересчете на исходную 4-метансульфонил-2-нитробензойную кислоту.
1H-ЯМР (CDCI3) в част./млн: 15,94 (s, 1Н); 8,74 (s, 1H); 8,24 (d, 1H); 7,48 (d, 1H); 3,20 (m, 1H); 3,19 (s, 3H); 2,84 (m, 1H); 2,0-2,3 (m, 4H); 1,6-1,8 (2H).
б) 2,76 г (0,02 моля) 93%-ного 4-метилен-3-оксабицикло[3.2.1]октан-2-она и 4,45 г (0,044 ммоля) триэтиламина перемешивают в течение 6 ч при температуре 20°С в 50 мл ацетонитрила в присутствии 170 мг (2 ммоля) ацетонциангидрина. Затем добавляют 4,22 г (0,16 моля) 4-метансульфонил-2-нитробензоилхлорида и продолжают перемешивать еще в течение 12 ч при температуре 20°С. Далее дополнительно добавляют 170 мг (2 ммоля) ацетонциангидрина и перемешивание продолжают в течение еще 30 мин до полного завершения реакции. После этого реакционную смесь растворяют в этилацетате и экстрагируют в противотоке воды при значении рН, равном 13. Водную фазу подкисляют и экстрагируют свежим этилацетатом однократно при значении рН, равном 5, и однократно при значении рН, равном 4, сушат и концентрируют упариванием. Таким путем получают 3,05 г 4-гидрокси-3-(4-метансульфонил-2-нитробензоил)бицикло[3.2.1]окт-3-ен-2-она с достаточно высокой степенью чистоты. Выход составляет 44,9% в пересчете на исходный 4-метилен-3-оксабицикло[3.2.1]октан-2-он или 52,2% в пересчете на исходную 4-метансульфонил-2-нитробензойную кислоту.
Пример Р9. Получение 4-гидрокси-3-(2-метил-6-трифторметилпиридин-3-карбонил)бицикло[3.2.1]окт-3-ен-2-она (известного из WO 00/15615) из 4-метилен-3-оксабицикло[3.2.1]октан-2-она
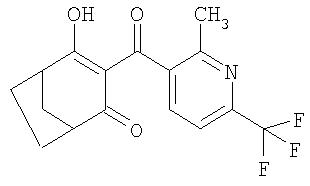
2,07 г (0,015 моля) перегнанного 4-метилен-3-оксабицикло[3.2.1]октан-2-она и 3,34 г (0,033 моля) триэтиламина перемешивают в течение 2,5 ч при температуре 60°С в 50 мл ацетонитрила в присутствии 98 мг (1,5 ммоля) цианида калия. После этого смесь охлаждают до температуры 20°С и добавляют 2,35 г (0,11 моля) растворенного в небольшом количестве ацетонитрила 2-метил-6-трифторметилникотиноилхлорида, свежеприготовленного в соответствии с методом, описанным в WO 00/15615. Полное превращение 4-оксобицикло[3.2.1]окт-2-ен-2-илового эфира 2-метил-6-трифторметилникотиновой кислоты (описанного в WO 00/15615), образовавшегося in situ в качестве промежуточного продукта, завершается за 3,5 ч (по данным контроля за протеканием реакции с помощью тонкослойной хроматографии). После этого реакционную смесь подкисляют разбавленной соляной кислотой, экстрагируют этилацататом в противотоке воды при значении рН, равном 2, сушат над Na2SO4 и концентрируют упариванием. Полученный таким путем продукт очищают колоночной хроматографией (элюэнт: этилацетат/гексан в соотношении 4:1), получая 3,16 г 90%-ного 4-гидрокси-3-(2-метил-6-трифторметилпиридин-3-карбонил)бицикло[3.2.1]окт-3-ен-2-она (58,3% в пересчете на исходный 4-метилен-3-оксабицикло[3.2.1]октан-2-он или 83,3% в пересчете на исходный 2-метил-6-трифторметилникотиноилхлорид).
1H-ЯМР (CDCI3) в част./млн: 17,2 (s, 1H); 7,48 (m, 2H); 3,2 (m, 1H); 2,9 (m, 1H); 2,47 (s, 3H); 1, 4-1,7 (6H).
Пример P10. Получение 4-гидрокси-3-(2-метил-7-метилсульфанилбензофуран-4-карбонил)бицикло[3.2.1]окт-3-ен-2-она из 4-метилен-3-оксабицикло[3.2.1]октан-2-она
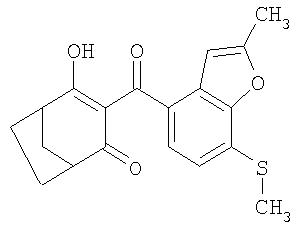
1,01 г (7,3 ммоля) 4-метилен-3-оксабицикло[3.2.1]октан-2-она и 1,52 г (15 ммолей) триэтиламина в 50 мл ацетонитрила перемешивают в течение 7 ч при температуре 20°С в присутствии 48 мг (0,7 ммоля) цианида калия. Далее добавляют 1,75 г (7,3 ммоля) 2-метил-7-метилсульфанилбензофуран-4-карбонилхлорида (tпл 123,5-124°С), свежеприготовленного из 2-метил-7-метилсульфанилбензофуран-4-карбоновой кислоты (tпл 235-235, 5°С) взаимодействием с оксалилхлоридом, и перемешивают в течение 12 ч. Если при контроле за протеканием реакции тонкослойной хроматографией все еще удается обнаружить сравнительно большое количество образовавшегося in situ промежуточного 4-оксобицикло[3.2.1]окт-2-ен-2-илового эфира 2-метил-7-метилсульфанилбензофуран-4-карбоновой кислоты, то для полного превращения этого соединения дополнительно добавляют 3 капли ацетонциангидрина и смесь перемешивают еще в течение 1,5 ч при температуре 40°С. После этого смесь разбавляют этилацетатом и экстрагируют водой при рН 9. Водную фазу экстрагируют свежим этилацетатом однократно при значении рН, равном 6, и однократно при значении рН, равном 4, после чего фазы объединяют и концентрируют упариванием. Таким путем получают 1,27 г (90,8%) 4-гидрокси-3-(2-метил-7-метилсульфанилбензофуран-4-карбонил)бицикло[3.2.1]окт-3-ен-2-она в виде смолистого продукта.
1Н-ЯМР (CDCI3) в част./млн: 7,48 (d, 1Н); 7,02 (d, 1H); 6,52 (s, 1H); 3,05 (b, 2H); 2,64 (s, 3Н); 2,48 (s, ЗН); 1,6-2,3 (6Н).
При необходимости этот продукт можно подвергать взаимодействию непосредственно на последующей стадии окисления, например, с йодатом натрия в метаноле с получением 4-гидрокси-3-(7-метансульфонил-2-метилбензофуран-4-карбонил)бицикло[3.2.1]окт-3-ен-2-она (tпл 243-243,5°С).
Пример Р11. Получение 4-гидрокси-3-(7-метансульфонил-2-метилбензофуран-4-карбонил)бицикло[3.2.1]окт-3-ен-2-она из 4-метилен-3-оксабицикло[3.2.1 ]октан-2-она
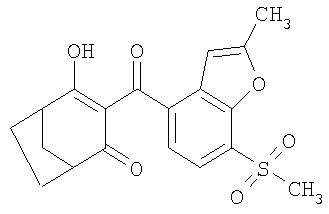
530 мг 4-гидрокси-3-(7-метансульфонил-2-метилбензофуран-4-карбонил)бицикло[3.2.1]окт-3-ен-2-она технической степени чистоты получают аналогично примеру Р10 проведением процесса в одном реакционном сосуде без выделения промежуточных продуктов из 200 мг (1,5 ммоля) 4-метилен-З-оксабицикло[3.2.1]октан-2-она в 50 мл ацетонитрила в присутствии 304 мг (3 ммоля) триэтиламина, 10 мг (0,15 ммоля) цианида калия и 410 мг (1,5 ммоля) 2-метил-7-метилсульфанилбензофуран-4-карбонилхлорида (tпл 145,5-146°С), свежеприготовленного из 2-метил-7-метилсульфанилбензофуран-4-карбоновой кислоты (tпл 228-228, 5°С) взаимодействием с оксалилхлоридом, при этом продукт выделяют из водной фазы при рН, равном 2, с использованием этилацетата. После хроматографической очистки с использованием этилацетата и метанола в соотношении 9:1 получают 410 мг (75,5% в пересчете на 4-метилен-3-оксабицикло[3.2.1]октан-2-он) чистого 4-гидрокси-3-(7-метансульфонил-2-метилбензофуран-4-карбонил)бицикло[3.2.1]окт-3-ен-2-она с температурой плавления 258,5-259°С.
1H-ЯМР (CDCI3) в част./млн: 17,08 (s, ОН); 7.78 (d, 1H); 7,39 (d, 1H); 6,49 (s, 1H); 3,32 (s, 3Н); 3,2 (m, 1H); 2,96 (m, 1H); 2,53 (s, 3Н); 1,6-2,3 (6Н).
Пример P12. Получение З-циклопропанкарбонил-4-гидроксибицикло[3.2.1]окт-3-ен-2-она из 4-метилен-3-оксабицикло[3.2.1]октан-2-она
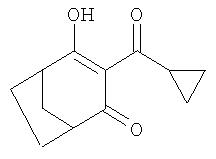
Аналогично примеру Р10 из 829 мг (6 ммолей) 4-метилен-З-оксабицикло[3.2.1]октан-2-она, 1,2 г (12 ммолей) триэтиламина в 15 мл ацетонитрила в присутствии 39 мг (0,6 ммоля) цианида калия и 627 мг (6 ммолей) хлорангидрида циклопропанкарбоновой кислоты проведением реакций в одном реакционном сосуде без выделения промежуточных продуктов получают 1,12 г (90, 5%) 3-циклопропанкарбонил-4-гидроксибицикло[3.2.1]окт-3-ен-2-она с технической степенью чистоты, температура плавления которого после его перекристаллизации из смеси этилацетат/гексан составляет 71, 5-72°С.
1Н-ЯМР (CDCI3) в част./млн: 18,33 (s, ОН); 3,61 (m, 1H); 2,99 (m, 2H); 1,5-2,2 (6Н); 1,1-1,3 (4Н).
Пример Р13. Получение 4-оксобицикло[3.2.1]окт-2-ен-2-илового эфира 2,3-дихлор-4-метансульфонилбензойной кислоты (известного из US 5801120) из 4-метилен-3 -оксабицикло [3.2.1] октан-2-она
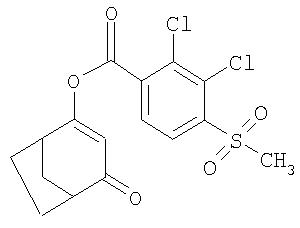
3,6 г (0,22 моля) 30%-ного раствора метанолята натрия нагревают в смеси из 19 мл толуола и 1 мл диметилформамида до достижения температурой в головной части колонны 108°С, непрерывно удаляя при этом метанол отгонкой. Затем, продолжая отгонять метанол, по каплям добавляют 2,76 г (0,02 моля) 4-метилен-3-оксабицикло[3.2.1]октан-2-она, растворенного в 3 мл толуола. После перемешивания в течение одного часа реакционную смесь охлаждают до температуры 20°С и, непрерывно контролируя температуру, добавляют раствор 6,32 г (0,022 моля) 2,3-дихлор-4-метансульфонилбензоилхлорида, свежеприготовленного взаимодействием с оксалилхлоридом, в смеси толуола с ацетонитрилом в соотношении 1:1. После кратковременного перемешивания экстрагируют небольшим количеством этилацетата в противотоке слабоконцентрированного водно-щелочного раствора со значением рН, равным 10. Таким путем получают 4-оксобицикло[3.2.1]окт-2-ен-2-иловый эфир 2,3-дихлор-4-метансульфонилбензойной кислоты в виде аморфного кристаллизата с выходом 5,5 г (71%).
1H-ЯМР (ДМСО-d6) в част./млн: 8,19 (2Н); 5,85 (s, 1H); 3,48 (s, 3H); 3,07 (m, 1H); 2,84 (m, 1H); 1,9-2,2 (4Н); 1,7 (2Н).
Реферат
Изобретение относится к способу получения соединения формулы I, a также агрономически приемлемых солей/N-оксидов/изомеров/энантиомеров этого соединения. Способ включает превращение соединения формулы II либо в присутствии аминового основания и каталитического количества цианида, либо в присутствии алкоголята щелочного металла или алкоголята щелочноземельного металла в соль формулы III, взаимодействие этого соединения с соединением формулы X-C(O)-Q (IV), в которой Х обозначает уходящую группу, с получением соединения формулы V, превращение этого соединения в присутствии каталитического количества цианид-ионов и основания в соединение формулы I. Способ позволяет получить производные моноциклических и бициклических 1,3-дикетонов с высоким выходом и высокого качества.
Значение заместителей R1, R2, R3, A, D, Е, Q, M+ указаны в формуле изобретения. 3 з.п. ф-лы.
Формула
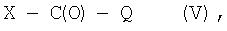

Комментарии