3-окси-2-циклобутен-1-он-основные соли и способ их получения - RU2078757C1
Код документа: RU2078757C1
Описание
Изобретение относится к новым
основным солям 3-окси-2-циклобутен-1-она общей формулы I

и способу их получения. Предлагаемые соединения могут найти применение в качестве промежуточного продукта в синтезе квадратной кислоты.
Новые 3-окси-2-циклобутен-1-оновые соли согласно формуле I являются ценными устойчивыми веществами, заменителями ценного синтетического, но разлагающегося при комнатной температуре, 1,3-циклобутандиона и промежуточными продуктами в новом процессе синтеза квадратной кислоты.
Квадратная кислота представляет собой интересный промежуточный продукт в получении лекарственных красителей (см. Журнал Angew. Chem. 20. 1966, с. 931) и гербицидов (см. патент Швейцарии N 609 837).
Из литературы известны различные способы получения квадратной кислоты.
Некоторые из них исходят из гексахлор-1,3-бутадиена, который циклизуют до хлорированного производного циклобутена с помощью метилата натрия. Полученные таким образом промежуточные продукты гидролизуются до квадратной кислоты с помощью серной или других кислот (см. Roedig A и Bernemann P. Liebigs Ann. Chem. 1956, 600, с. 1; Maahs G. Liebigs Ann. Chem. 1965, 686, с. 55; Angew. Chemie, 1963, 75, с. 982; Uehara A. и Tsuchiya R. Sci. Rep. Kanazawa Univ. 1980, 25, c. 83; Fan R. et al. Chemical Abstracts. 1987, 106, 103798 с). Вместо метилата натрия можно применять морфолин (Maahs G. и Hegenberg P. Angew. Chemie, 1966г.78,стр.927; Schmidt A.H. и Ried W. Synthessis, 1978 г.стр.869; Gadek T.R. et al. 1976г. патент США 4 104 308; Paine A. J. Tetrahedron Letters, 1984г.25,стр.135). Реакция циклизации может быть осуществлена и только под воздействием тепла W 1976 г. патент ФРГ 26 18 557; W 1976 г. патент ФРГ 25 23 836; Maahs G. и RomBusch D. 1978г. патент ФРГ 28 24 558; Rombusch K.и Maahs G. 1983г. выкладка ФРГ 33 14 431).
Недостатки всех этих способов заключаются либо в низких выходах, либо в высоких затратах (например, на перегонку с экстремальным флегмовым числом), а также в особых мерах предосторожности, необходимых в обращении с канцерогенным исходным продуктом гексахлор 1,3-бутадиеном.
Согласно другому способу (Bellus D. et al. Helv.Chim. Acta 61, 1978г. стр. 1784) из монилиформина, представляющего собой метаболит грибков, путем бромирования и гидролиза получают квадратную кислоту с выходом в 70% Однако монилиформин встречается в природе только в незначительных количествах. Более того известные его синтезы трудоемки и дают только низкие выходы.
Другой способ получения квадратной кислоты восстановительная тетрамеризация окиси углерода электрохимическим путем требует большого аппаратурного оформления и дает смесь продуктов, из которой только с трудом удается выделить квадратную кислоту в чистом виде (Silvestri G.et al. Gazz. Chim.It. 1972 102, стр. 818; выкладка ФРГ 2235882; патент США 4461681; патент США 4523980; Fabre P.L. et al. Bull. Soc.Chim.Fr. 1988г. стр.933).
В связи с отсутствием доступного способа возникла необходимость в изыскании нового синтеза квадратной кислоты исходя из легко доступных исходных продуктов с получением целевого продукта с высокими выходами и чистотой при малых затратах материала, энергии и труда.
Задача изобретения обнаружение новых промежуточных продуктов, получаемых из легко доступных исходных продуктов, из которых без высоких затрат можно получить квадратную кислоту.
Согласно изобретению предлагаются основные соли 2-циклобутен-1-она общей формулы

где R атом щелочного металла либо аммониевую группу общей формулы

где R1, R2 и R3 имеют одинаковое или разное значение и означают атом водорода, низший алкил или циклоалкил. Остатки R1, R2 и R3 аммониевой группы предпочтительно означают атом водорода, низший алкил C1-4 или циклогексил, в частности атом водорода, метил или этил, или циклогексил. Если R означает этом щелочного металла, то в качестве щелочного металла предпочитаются натрий и калий.
Указанные соли формулы I могут быть использованы как промежуточные продукты в синтезе квадратной кислоты.
Предпочитаются
следующие соединения формулы I:
3-окси-2-циклобутен-1-он-диэтиламмониевая соль;
3-окси-2-циклобутен-1-он-циклогексиламмониевая соль;
3-окси-2-циклобутен-1-он-циклогексилдиметиламмониевая соль;
3-окси-2-циклобутен-1-он-дициклогексиламмониевая соль;
3-окси-2-циклобутен-1-он-дициклогексилметиламмониевая соль;
3-окси-2-циклобутен-1-он-аммониевая соль;
3-окси-2-циклобутен-1-он-натриевая соль;
3-окси-2-циклобутен-1-он-калиевая соль.
Объектом изобретения также является способ получения основных солей 3-окси-2-циклобутен-1-она формулы I, заключающийся во взаимодействии 3-ацетокси-2-циклобутен-1-она или 1,3-циклобутадиона с соответствующим основанием.
В
качестве исходного продукта способа используют 1,3-циклобутандион или 3-ацетокси-2-циклобутен-1-он, называемый далее трикетеном, который при необходимости может быть использован в виде кубового
остатка производства дикетена, в котором целесообразное содержание трикетена составляет 5 60 мас. преимущественно 22 44 мас. В качестве основания целесообразно использовать либо амин общей формулы

где R1, R2 и R3 имеют вышеуказанное значение, либо алкоголят или гидроокись щелочного металла. В качестве аминов общей формулы III применяются предпочтительно циклогексилдиметиламин, дициклогексиламин, диэтиламин, циклогексилдиметиламин, дициклогексилметиламин или аммиак.
В случае использования трикетена в качестве исходного вещества целесообразно осуществлять реакцию взаимодействия, используя 0,5 4 моль амина общей формулы III, считая на 1 моль трикетена.
В случае использования 1,3-циклобутандиона в качестве исходного вещества целесообразно осуществить реакцию, используя 0,5-4 моля, предпочтительно 0,5-1,5 моля амина формулы III, считая на 1 моль 1,3-циклобутандиона.
Реакцию, как правило, осуществляют при температуре от -40 до 50oC, предпочтительно при 10 25oC. По истечении времени реакции от 15 мин до 5 ч обычными приемами обработки продукта реакции, например фильтрацией, получают целевой продукт формулы I.
В качестве растворителей можно использовать низкокипящие алифатические спирты, карбоновые кислоты с числом атомов C от одного до четырех и их эфиры, низкокипящие простые эфиры и кетоны, нитрилы и ароматические углеводороды. Представителями этих растворителей являются, например, ацетон, толуол, диэтиловый эфир, диизопропиловый эфир, трет.-бутилметиловый эфир и дихлорметан, этанол, ацетонитрил, уксусная кислота и этилацетат, предпочтительно применять этилацетат, этанол или ацетонитрил.
3-Окси-2-циклобутен-1-оновые соли формулы I получают реакцией исходных веществ с 0,8 2,5 моль алкоголятов или гидроокисей щелочных металлов, например гидроокисей, метилата или этилата натрия или калия, считая на 1 моль исходного вещества, но предпочтительно путем реакции с 0,8 1,2 моль гидроокиси натрия, гидроокиси калия, метилата или этилата натрия.
Аналогично вышеуказанной реакции, реакцию взаимодействия исходного вещества с амином формулы III, целесообразно осуществлять при температуре от -40 до 50oC, предпочтительно при 10 25oC. По истечении времени реакции (15 мин 5 ч) обычными приемами обработки продукта реакции, например, фильтрацией, получают целевой продукт формулы I.
В качестве растворителей можно использовать те, которые описывались выше.
Новые 3-окси-2-циклобутен-1-оновые соли можно получить также двухстадийным способом. При этом на первой стадии трикетен подвергают кислому гидролизу, в результате чего получают 1,3-циклобутандион, который на второй стадии переводят в 3-окси-2-циклобутен-1-оновую соль вышеописанным путем.
В качестве кислоты можно использовать серную, соляную, муравьиную, трифторуксусную. Предпочтительно применяется избыток муравьиной кислоты.
Реакция гидролиза обычно осуществляется при температуре 0 30oC, предпочтительно 15 30oC.
По истечении времени реакции, составляющего обычно от 15 мин до 24 ч, 1, 3- циклобутандион получают обычными приемами обработки продукта реакции, например экстракцией и перекристаллизацией.
Новые 3-окси-2-циклобутен-1-оновые соли согласно формуле I пригодны для получения квадратной кислоты, которая при этом выделяется с высоким выходом и чистотой, или же их применяют для получения 1,3-циклобутандиона.
В целях получения квадратной кислоты 3-окси-2-циклобутен-1-оновые соли формулы I на первой стадии галогенируют, а затем на второй стадии их гидролизуют до квадратной кислоты.
Первую стадию галогенирование 3-окси-2-циклобутен-1-оновой соли целесообразно осуществлять с применением 2 4 моль брома, хлора или сульфурилхлорида, предпочтительно 2,5 3,5 моль брома, считая на 1 моль исходного вещества. Но галогенирование можно также провести с применением 0,25 1 моль брома, а затем 2,0 3,0 моль хлора или сульфурилхлорида.
Реакцию галогенирования обычно осуществляют при температуре от -40 до 40oC, предпочтительно от -25 до 25oC. Время реакции обычно составляет от 30 мин до 4 ч. По завершении реакции полученный галогенированный циклобутенон выделяют с хорошим выходом и его непосредственно можно гидролизовать до квадратной кислоты. В качестве растворителей можно использовать карбоновые кислоты с числом атомов C 1 4, их этиловые эфиры, ангидриды карбоновых кислот и хлоруглеводороды. Представителями этих растворителей являются, например, уксусная кислота, этилацетат, ацетангидрид, тетрахлорметан, метиленхлорид, хлороформ. Предпочтительно используют уксусную кислоту, этилацетат или метиленхлорид.
Вторую стадию гидролиз до квадратной кислоты осуществляют с применением минеральных кислот, например серной, соляной, бромистоводородной или фосфорной, а также сульфокислот, например водной метансульфокислоты, воды или карбоновых кислот, например, водной муравьиной и водной трифторуксусной. Предпочтительно использовать избыток минеральных кислот, например концентрированной серной или соляной, карбоновых кислот, например водной муравьиной, сульфокислоты, например водной метансульфокислоты.
Реакцию гидролиза целесообразно осуществлять при температуре 50 - 150oC, предпочтительно 90 100oC. Реакцию гидролиза до квадратной кислоты осуществляют при температуре дефлегмации. По завершении реакции через 2 48 ч получают квадратную кислоту с хорошим выходом.
Пример 1. Получение 1,3-дициклобутандиона, исходя из трикетена.
4,1 г трикетена (33 ммоль) растворяют в 10 г серной кислоты и 30 г льда. Через 15 мин смесь экстрагируют метиленхлоридом (2 раза по 25 мл), высушивают хлоридом кальция, фильтруют и выпаривают. В 10 мл диэтилового эфира взвешивают 2,1 г концентрированного твердого вещества. Полученную смесь фильтруют и перекристаллизовывают в 13 мл ацетонитрила. После перекристаллизации получают 1,57 г (18,7 ммоль) 1, 3-циклобутандиона, что соответствует выходу 57 считая на исходный трикетен.
Пример 2. Получение 3-окси-2-циклобутен-1-он-диэтиламмониевой соли.
а) В 40 г этилацетата взвешивают 2,1 г (23,0 ммоль) 1,3-циклобутандиона. К этой взвеси при 20oC в течение 15 мин по каплям добавляют раствор 1,84 г (25,0 ммоль) диэтиламина в 10 г этилацетата.
После перемешивания в течение 1 ч при комнатной температуре фильтруют полученную взвесь и высушивают ее. В результате (по данным ВСЖХ) получают 3,05 г целевого продукта со степенью чистоты 93,7 что соответствует выходу 79,2 считая на циклобутандион.
Т. пл. 93 94oC.
б) К раствору 3,25 г 3-ацетокси-2-циклобутенон-1-она (содержание трикетена 97 25,0 ммоль) в 40 г этилацетата в течение 18 мин при 20oC по каплям добавляют раствор 3,67 г диэтиламина (99,5 50,0 ммоль) в 10 г этилацетата. Реакционную смесь перемешивают еще 1 ч при комнатной температуре, после чего ее фильтруют и высушивают в вакууме.
В результате получают 3,75 г целевого продукта со степенью чистоты 94,1 (по данным ВСЖХ), что соответствует выходу в 89,8 считая на 3-ацетокси-2-циклобутен-1-он.
Т. пл. 94 96oC.
Данные1Н-ЯМР-анализа (CDCl3, 300 МГц), дельта, миллионные доли: 1,38 т, J 9 Гц, 3H; 3,01 кв, J 9 Гц, 2H; 2,90 с, 2H; 4,35 с, 1H; 9,5 шир. 2H.
Пример 3. Получение 3-окси-2-циклобутен-1-он-циклогексилдиметиламмониевой соли.
а) К взвеси 2,1 г 1, 3-циклобутандиона (91,9 23,0 ммоль) в 40 г этилацетата в течение 15 мин при 20oC по каплям добавляют 3,21 г N,N-диметилциклогексиламина (99 25,0 ммоль) в 10 г этилацетата. Взвесь перемешивают 1 ч при комнатной температуре, после чего ее фильтруют и высушивают в вакууме. Получают 4,27 г целевого продукта (по данным ВСЖХ), что соответствует выходу в 83,3 считая на циклобутандион.
Т. пл. 88 90oC.
Данные1Н-ЯМР-анализа (CDCl3, 300 МГц), дельта, миллионные доли: 1,10 1,49, м, 5H; 1,65 1,80, шир. д, 1H; 1,88 2,01, шир. д, 2H; 2,04 2,13, шир. д, 2H, 2,78 2,91, м, 1H; 2,66, шир. 6H; 13,2, шир. 1H.
б) 3,24 г 3-ацетокси-2-циклобутен-1-она (трикетена, 25,0 ммоль) растворяют в 1,90 г (41,3 ммоль) абс. метанола и 40 г этилацетата. К полученному раствору в течение 20 мин при 20oC по каплям добавляют 6,45 г циклогексилдиметиламина (99 50,0 ммоль), растворенного в 10 г этилацетата. После перемешивания в течение 2 ч при комнатной температуре полученную взвесь фильтруют и высушивают ее в вакууме. В результате получают 4,09 г целевого продукта со степенью чистоты 94,5 (по данным ВСЖХ), что соответствует выходу в 73,2 считая на 3-ацетокси-2-цикло-бутен-1-он (трикетен).
Т. пл. 91,5 92,4oC
Пример 4. Получение
3-окси-2-циклобутен-1-он-дициклогексилметиламмониевой соли.
а) К взвеси 2,11 г (23,0 ммоль) 1,3-циклобутандиона при 20oC по каплям добавляют раствор 4,99 г (25,0 ммоль) дициклогексилметиламина в 10 г этилацетата и перемешивают ее в течение 1 ч. Взвесь перемешивают еще 30 мин при 5oC, после чего ее фильтруют и высушивают в вакууме. В результате получают 5, 53 г целевого продукта со степенью чистоты 94,7 (по данным ВСЖХ), что соответствует выходу 81,4 считая на циклобутандион.
Т. пл. 91,4 92,6oC.
б) 3,24 г (25, 0 ммоль) 3-ацетокси-2-циклобутен-1-она (трикетена, 97,5) растворяют в 1,9 г (41,3 ммоль) этанола и 40 г этилацетата. К раствору в течение 15 мин при 20oC по каплям добавляют 9,83 г (50,0 ммоль) дициклогексилметиламина (98,9), растворенного в 10 г этилацетата, и перемешивают в течение 1 ч при комнатной температуре. Взвесь перемешивают еще 1 ч при 5oC, после чего ее фильтруют и высушивают в вакууме. В результате получают 3,21 г целевого продукта со степенью чистоты 94,5 (по данным ВСЖХ), что соответствует выходу в 43,5% считая на 3-ацетокси-2-циклобутен-1-он.
Т. пл. 91,4 92,4oC.
Данные1Н-ЯМР-анализа (CDCl3, 300 МГц), дельта, миллионные доли: 1,09 1,42, м, 6H; 1,42 1,66, шир. д. 4H; 1,67 1,78, шир. д. 2H; 1,88 2,03, шир. д, 4H; 2,04 2,16, шир. д, 4H; 2,64 с. 3H; 2,93, шир. 2H; 3,13 м, 2H; 4,33, шир. 1H.
Пример 5. Получение 3-окси-2-циклобутен-1-он-дициклогексиламмониевой соли.
а) К взвеси 3,0 г (34,6 ммоль) 1,3-циклобутандиона (97) в 52,2 мл этилацетата в течение 15 мин при 20oC по каплям добавляют раствор 7,1 г (38,3 ммоль) дициклогексиламина (98) в 15 мл этилацетата. Взвесь перемешивают 1 ч при комнатной температуре, после чего ее промывают 4 раза этилацетатом и высушивают в вакууме. В результате получают 9,4 г целевого продукта со степенью чистоты 94,7 (по данным ВСЖХ), что соответствует выходу 96,7 считая на циклобутандион.
Т. пл. 188 188,7oC.
б) 1000 г кубового остатка, полученного в производстве дикетена и содержащего 22,0 (1,74 ммоль) 3-ацетокси-2-циклобутен-1-она, растворяют в 1078 мл (970 г) этилацетата. К полученному черному раствору в течение 60 мин при 10oC по каплям добавляют 707,4 г (3,81 ммоль) дициклогексиламина (98). Взвесь перемешивают в течение 90 мин при 10oC, после чего ее фильтруют, 3 раза взвешивают в этилацетате и высушивают в вакууме. В результате получают 518 г целевого продукта со степенью чистоты 65,5 (по данным ВСЖХ), что соответствует выходу в 73,4 считая на 3-ацетокси-2-циклобутенон-1-он.
Т. пл. 169,7 172,4oC.
Очистка продукта: 259 г (0,64 ммоль) неочищенной 3-окси-2-циклобутен-1-он-дициклогексиламмониевой соли
(65,5) взвешивают в 207,2 г ледяной уксусной кислоты и 310,8
г этилацетата и перемешивают 2 ч при комнатной температуре. Полученный продукт промывают 3 раза этилацетатом и высушивают в вакууме.
Получают 176 г целевого продукта со степенью чистоты 90,2 (по
данным ВСЖХ), что соответствует выходу 93,6
Т. пл. 188 190oC.
Данные1Н-ЯМР-анализа (CD3OD, 300 МГц), дельта, миллионные доли: 1,13 1,49, м, 10H; 1,66 1,80, шир.д, 2H; 1,80 1,97, шир.д, 4H; 2,81, c, 2H; 4,29, c, 1H; 3,09 3,27, м, 2H.
Пример 6. Получение 3-окси-2-циклобутен-1-он-аммониевой соли.
а) К раствору 2,16 г (2,50 ммоль) 1,3-циклобутандиона (97) в 25 г ацетонитрила в течение 10 мин при 20oC по каплям добавляют раствор 0,425 г (25 ммоль) газообразного аммиака в 25 г ацетонитрила. Взвесь перемешивают 30 мин при комнатной температуре, после чего ее отфильтровывают, промывают 10 мл ацетонитрила и высушивают в вакууме. В результате получают 1,48 г целевого продукта со степенью чистоты 78 (по данным ВСЖХ), что соответствует выходу 47,0 считая на циклобутандион.
Т. пл. 94 96oC.
б) В раствор 6,5 г (50,0 ммоль) 3-ацетокси-2-циклобутен-1-она (трикетена; 97) в 58,5 г ацетонитрила в течение 30 мин при 2oC вводят 3,1 г (182,3 ммоль) газообразного аммиака. Реакционную массу перемешивают еще 30 мин при 2oC, после чего ее фильтруют, промывают 20 мл ацетонитрила и высушивают в вакууме. В результате получают 4,88 г целевого продукта со степенью чистоты 94 (по данным ВСЖХ), что соответствует выходу 90,7 считая на 3-ацетокси-2-циклобутен-1-он.
Т. пл. 109 110oC.
Данные1H-ЯМР-анализа (d6DMSO), дельта, миллионные доли: 2,49 с, 2H; 3,91, c, 1H; 7,25, шир. 4H.
Пример 7. Получение 3-окси-2-циклобутен-1-он-натриевой соли.
а) К раствору 1,74 г (20,0 ммоль) 1,3-циклобутандиона (97) в 20 г ацетонитрила в течение 20 мин при 20oC по каплям добавляют раствор метилата натрия, содержащего 0,506 г (22 ммоль) натрия в 15 г абс. этанола. Реакционную массу перемешивают в течение 15 мин при комнатной температуре, затем ее фильтруют и высушивают в вакууме. В результате получают 1,58 г целевого продукта со степенью частоты 92,6 (по данным ВСЖХ), что соответствует выходу 69,0 считая не циклобутандион.
Т. пл. > 280oC.
Данные1H-ЯМР-анализа (d6 DMSO), дельта, миллионные доли: 2,49, с. 2H; 9,32, с, 1H.
б) К раствору 3,23 г (25,0 ммоль) 3-ацетокси-2-циклобутен-1-она (трикетена, 97,5 ) в 20 г ацетонитрила в течение 15 мин при 20oC по каплям добавляют раствор 1,099 г (27 ммоль) гидроокиси натрия в 10 г абс. этанола. После перемешивания в течение 2 ч взвесь при комнатной температуре фильтруют, промывают 5 мл ацетонитрила и высушивают в вакууме. В результате получают 2,38 г целевого продукта со степенью чистоты 87,2 (по данным ВСЖХ), что соответствует выходу 89,8 считая на 3-ацетокси-2-циклобутен-1-он.
в) К раствору 28,4 г кубового остатка, полученного в производстве дикетена и содержащего 44,4 3-ацетокси-2-циклобутен-1-она (трикетена; 98 ммоль), в 250 г этилацетата в течение 45 мин при 10oC по каплям добавляют раствор 4,6 г (115 ммоль) гидроокиси натрия в 75 г абс. этанола. Взвесь фильтруют, а остаток высушивают в вакууме. В результате получают 17,1 г целевого продукта со степенью чистоты 46,7 (по данным ВСЖХ), что соответствует выходу 75,3% считая на 3-ацетокси-2-циклобутен-1-он.
Пример 8. Получение 3-окси-2-циклобутен-1-он-калиевой соли.
К раствору 3,23 г (25 ммоль) 3-ацетокси-2-уиклобутен-1-она (трикетена, 97,5) в 20 г ацетонитрила в течение 10 мин при комнатной температуре по каплям добавляют раствор 1,8 г (27,5 ммоль) гидроокиси калия в 40 г абс. этанола. После перемешивания в течение 30 мин взвесь фильтруют при комнатной температуре, промывают 5 мл ацетонитрила и высушивают в вакууме. В результате получают 1,99 г целевого продукта со степенью частоты 81,5 (по данным ВСЖХ), что соответствует выходу 53,1 считая на 3-ацетокси-2-циклобутен-1-он.
Т. пл. > 260oC.
Пример 9. Получение квадратной кислоты.
а) 3,66 г (50 ммоль) 3-окси-2-циклобутен-1-он-дициклогексиламмониевой соли взвешивают в 100 мл метиленхлорида и охлаждают до -20oC. Затем массу вводят 10,63 г (150 ммоль) газообразного хлора. По истечении реакционного времени (30 мин), перемешивая, нагревают массу до комнатной температуры, отгоняют метиленхлорид в ротационном испарителе и добавляют 100 мл этилацетата. Полученный остаток отфильтровывают, а маточный раствор концентрируют в ротационном испарителе. Полученный таким образом остаток (11,63г) перемешивают с серной кислотой (25 мл) в течение 15 ч при 100oC. После охлаждения на ледяной бане фильтруют осадок, промывают его 3 раза ацетоном (20 мл) и высушивают его в течение 152 ч при 50oC под давлением 50 мбар. В результате получают 1,22 г серного порошка с содержанием квадратной кислоты 88 что соответствует выходу 19 считая на 3-окси-2-циклобутен-1-он-циклогексиламмониевую соль.
б) 73,2 г (1 моль) 3-окси-2-циклобутен-1-он-дициклогексиламмониевой соли взвешивают в 1,5 л этилацетата и затем охлаждают до 0oC. С перемешиванием добавляют 474,5 г (3 моль) брома в 500 мл этилацетата. Через 30 мин осадок отфильтровывают и промывают его 2 раза 250 мл этилацетата. Маточный и промывные растворы объединяют и концентрируют. Получают 442,75 г остатка. 415,25 г этого остатка добавляют к 34 г воды и 500 мл серной кислоты. Массу перемешивают в течение 12 ч при комнатной температуре, после чего отфильтровывают осадок и промывают его 2 раза 100 мл ацетона. В результате получают 111,47 г белого целевого продукта с содержанием квадратной кислоты 94,6 что соответствует выходу 92,45 считая на исходную 3-окси-2-циклобутен-1-он дициклогексиламмониевую соль.
в) 3,66 г (50 ммоль) 3-окси-2-циклобутен-1-он-дициклогексиламмониевой соли взвешивают в 100 мл этилацетата. Затем с перемешиванием при комнатной температуре по каплям добавляют 20,25 г (150 ммоль) сульфурилхлорида. По истечении реакционного времени (1 ч) взвешивают массу в 50 мл этилацетата и фильтруют ее. Полученный фильтрат концентрируют в ротационном испарителе. Остается 11,7 г полужидкого остатка.
11,7 г этого материала добавляют к 25 мл концентрированной серной кислоты и 1,7 г воды. По истечении реакционного времени (2 ч) осадок фильтруют и промывают его 4 раза 5 мл ацетона. Получают 1,3 г целевого продукта с содержанием квадратной кислоты 92,29 что соответствует выходу 23,14 считая на исходную 3-окси-2-циклобутен-1-он-дициклогексиламмониевую соль.
г) 3,66 г (50 ммоль) 3-окси-2-циклобутен-1-он-дициклогексиламмониевой соли взвешивают в 100 мл этилацетата. После добавления в течение 20 мин 3,95 г (25 ммоль) брома в течение 30 мин по каплям добавляют 16,87 г (125 ммоль) сульфурилхлорида. По истечении общего реакционного времени в 105 мин осадок промывают 2 раза 50 мл этилацетата, затем объединяют маточный и промывные растворы и концентрируют их. Остаток (11,32 г) добавляют к 25 мл концентрированной серной кислоты и 1,7 г воды при 100oC. По истечении реакционного времени (2 ч) остаток фильтруют и промывают его 4 раза 5 мл ацетона. Получают 5,26 г белого целевого продукта с содержанием квадратной кислоты 92,7 что соответствует выходу 85,4 считая на исходную 3-окси-2-циклобутен-1-он-дициклогексиламмониевую соль.
Пример 10. Получение 1,3-циклобутандиона, исходя из 1,3-циклобутандиондициклогексиламмониевой соли.
146,0 (0,5 ммоль) 1,3-циклобутандион-дициклогексиламмониевой соли со степенью чистоты 90,9 (по данным ВСЖХ) взвешивают в 1400 мл ацетонитрила и охлаждают до 10oC. В эту светло-коричневую взвесь в течение 20 мин вводят 21, г (0,573 моль) хлористоводородного газа. Затем реакционную массу перемешивают в течение 30 мин при 10oC и фильтруют ее. Затем промывают аминогидрохлорид 100 мл ацетонитрила. Массу концентрируют в вакууме до 220 г, охлаждают в течение 30 мин на ледяной бане, фиксируют, промывают 2 раза 100 мл диэтилового эфира и высушивают в течение 10 мин при комнатной температуре под давлением 20 мбар. В результате получают 32,07 г целевого продукта со степенью частоты 89,8 (по данным ВСЖХ), что соответствует выходу 68,5 считая на циклобутандиондициклогексиламинную соль.
Т. пл. 103 105oC с разл.).
Данные1H-ЯМР-анализа (d6-DMSO), дельта, миллионные доли: 3,06 с, 2H; 4,75, с, 1H; 9,5 12,5, шир. 1H.
Реферат
Описаны 3-окси-2-циклобутен-1-оновые соли общей формулы

где R означает либо аммониевую группу общей формулы

где R1, R2 и R3, имея одинаковое или разное значение, означают атом водорода, низший алкил или циклоалкил, либо атом щелочного металла. Соли формулы I получают взаимодействием с основанием чистого 3-ацетокси-2-циклобутен-1-она, 1,3,-циклобутандиона или кубового остатка, получаемого в производстве дикетена и содержащего 3-ацетокси-2-циклобутен-1-он. В качестве основания используется амин общей формулы

где R1, R2 и R3 имеют вышеуказанное значение, или алкоголят или гидроокись щелочного металла. Соли формулы I пригодны для получения квадратной кислоты, причем на первой стадии они галогенируются, а на второй - гидролизуются до квадратной кислоты. 11 с. и 5 з. п. ф-лы.
Формула

где R атом щелочного металла или аммониевая группа формулы II

где R1, R2, R3, одинаковые или различные, водород, низший алкил, циклоалкил.
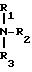
где R1, R2, R3 имеют указанные значения.

где R атом щелочного металла или аммониевая группа формулы II

где R1, R2, R3, одинаковые или различные, водород, низший алкил, циклоалкил,
в качестве промежуточного продукта в синтезе квадратной кислоты.

Комментарии