Новые циклоалкановые альдегиды, способ их получения и применение их в парфюмерии - RU2640584C2
Код документа: RU2640584C2
Описание
Настоящее изобретение относится к новым соединениям циклоалкановых альдегидов, способу их получения и применению их в химической промышленности и, в частности, в парфюмерии, косметике и при производстве моющих средств, указанным соединениям, имеющим особенный аромат.
Производство духов и ароматизаторов всегда в поиске новых органолептических соединений, которые проявляют интенсивную обонятельную активность, в то же время поддерживая производственные затраты как можно ниже. Некоторые типы органолептических соединений получить труднее, чем другие, такие как, например, соединения, которые имеют морские и/или озоновые ноты.
Среди соединений, описанных в предшествующем уровне техники, как имеющих морские и/или озоновые ноты, найдены, среди наиболее часто используемых, производные бензодиоксепинона (Helvetica Chimica Acta, 2007, 90, 1245-1265), такие как Калон® или такие как Азурон® (Givaudan) или 7-(3-метилбутил)бензо[B][1,4]диоксепин-3-он (патент EP1136481).
Также известно, что некоторые соединения из семейства альдегидов проявляют данный тип морских и озоновых нот. Например, можно привести Мелозон® (гексагидро-1-карбоксальдегид-4,7-метаноиндан, патент DE19817042), который добавляет альдегидные ноты в дополнение к морским и озоновым нотам. Или Геральдегид® (5,9-диметил-4,8-декадиеналь, патенты FR13677165 и FR2005165), который добавляет лимонные ноты, или Флоралозон® (3-(4-этилфенил)-2,2-диметилпропаналь, Perfumer & Flavorist, 2009, 34, 18-19), который добавляет цветочные ноты.
Однако соединения из предшествующего уровня техники, которые имеют оригинальную морскую или озоновую ноту, имеют в качестве основного недостатка их высокие производственные затраты, которые обусловлены в значительной мере количеством стадий синтеза или стоимостью сырьевых материалов. В качестве иллюстрации способ синтеза 7-метил-3,4-дигидро-2Н-1,5-бензодиоксепин-3-она описан в патенте США 3517031, содержит три стадии, который является значительным. Кроме того, исходный субстрат, пирокатехин, является существенно дорогим сырьевым материалом. Подобным образом способ синтеза 3-метил-6-(2,2,3-триметилциклопентил)-гексаналя (описанный как морской и озоновый в заявке на патент EP1930317) содержит пять стадий синтеза из камфоленового альдегида.
Для того чтобы преодолеть недостатки предшествующего уровня техники, заявитель неожиданно обнаружил, что циклоалкановые альдегиды, соответствующие следующей общей формуле (I),
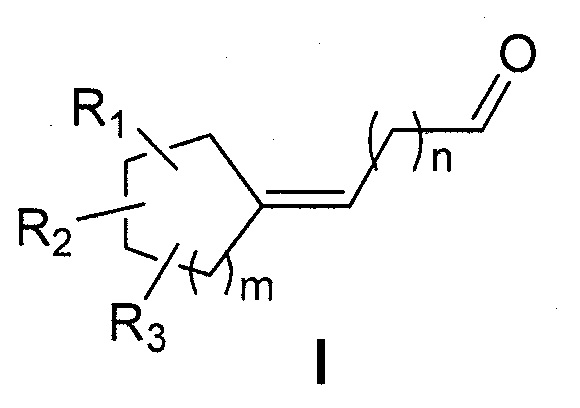
проявляли очень интенсивные морские и/или озоновые ноты и были получены с помощью простого способа, проводимого в 2 стадии из простых и недорогих исходных соединений.
Некоторые циклоалкановые альдегиды, соответствующие предшествующей общей формуле (I), были раскрыты в предшествующем уровне техники, но никогда как проявляющие морские и/или озоновые ноты. Это следующие соединения:
- 6-циклогептилиденгексаналь,
- 4-(4-метилциклогексилиден)-бутаналь,
- 4-(4-трет-бутилциклогексилиден)-бутаналь,
- 4-(3,3,5-триметилциклогексилиден)-бутаналь.
Соединение 6-циклогептилиденгексаналь описано в статье Тьетц и соавт. (Chem. Ber. 121, 499-506, 1988) в качестве простого продукта интермедиата, не имеющего прямого промышленного применения, органолептических или иных свойств. Что касается 3 других соединений, раскрытых в предшествующем уровне техники, все они описаны в патенте Naarden (FR2038865). В данном патенте 4-(4-метилциклогексилиден)-бутаналь описывается как проявляющий свежие травяные ноты, которые напоминают ноту ландыша; 4-(4-трет-бутилциклогексилиден)-бутаналь описывается как имеющий ярко выраженный цветочный аромат; и 4-(3,3,5-триметилциклогексилиден)-бутаналь описывается как имеющий древесный цветочный аромат, который сильно напоминает ландыш.
Следовательно, ни одно из соединений, соответствующих общей формуле (I), и, в частности, ни одно из вышеуказанных 4 альдегидных соединений не описано в предшествующем уровне техники как проявляющее морские и/или озоновые ноты.
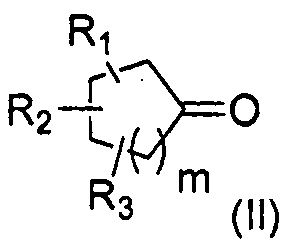
Первая цель настоящего изобретения представляет собой, следовательно, соединение следующей общей формулы (I):
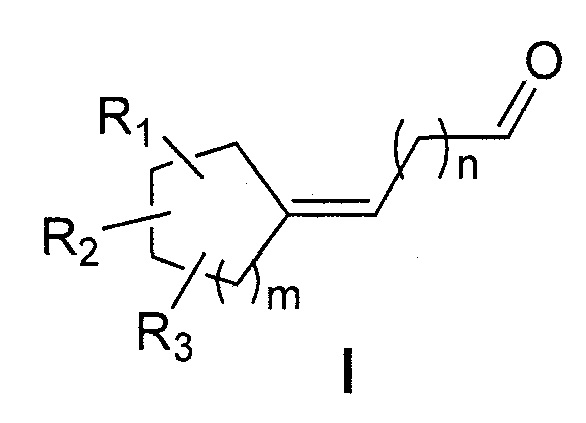
в которой:
- R1, R2 и R3 каждый независимо представляет собой атом водорода или насыщенную или ненасыщенную, разветвленную или неразветвленную С1-С5алкильную группу;
- m представляет собой целое число от 1 до 4;
- n представляет собой целое число от 2 до 4;
отличающееся тем, что кольцо является насыщенным и содержит от 5 до 8 атомов углерода, что общее число атомов углерода в кольце и радикалах R1, R2 и R3 представляет собой от 7 до 11,
и следует понимать, что вышеуказанное соединение формулы (I) не представляет собой:
- 6-циклогептилиденгексаналь,
- 4-(4-метилциклогексилиден)-бутаналь,
- 4-(4-трет-бутилциклогексилиден)-бутаналь,
- 4-(3,3,5-триметилциклогексилиден)-бутаналь.
Данные соединения обладают морской, озоновой, водной или даже фруктовой (граничит с дыней, арбузом) или цветочной нотой, которая является очень сильной и распространяющейся, а также со значительной стойкостью. Кроме того, их получают с помощью способа, проводимого в 2 простые стадии.
Термин «C1-C5алкил» в контексте настоящего изобретения, как понимают, означает любой одновалентный радикал, полученный из насыщенной или ненасыщенной, линейной или разветвленной углеродной цепи, содержащей от 1 до 5 атомов углерода. C1-C5алкилы предпочтительно выбирают из метильных, этильных, н-пропильных, изопропильных, н-бутильных, изобутильных, трет-бутильных и пентильных групп.
В первом варианте осуществления настоящее изобретение относится к соединениям общей формулы (I), в которой m равно 1, т.е. кольцо представляет собой циклопентан.
Во втором варианте осуществления настоящее изобретение относится к соединениям общей формулы (I), в которой n равно 4. Третий вариант осуществления содержит n, равный 2.
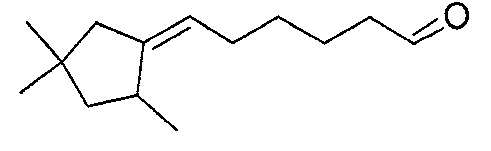
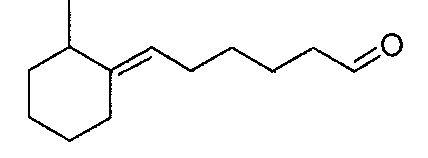
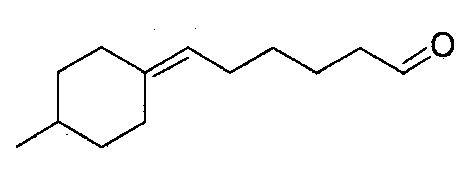
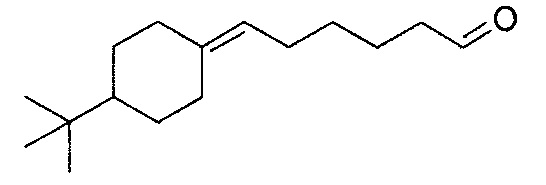
В предпочтительном варианте осуществления соединения в соответствии с изобретением выбраны из 5-(2,4,4-триметилциклопентилиден)-пентаналя, 6-(2,4,4-триметилциклопентилиден)-гексаналя, 6-(2-метилциклогексилиден)-гексаналя, 6-(4-метилциклогексилиден)-гексаналя, 6-(4-трет-бутилциклогексилиден)-гексаналя, 6-(4-трет-амилциклогексилиден)-гексаналя, 6-циклооктилиденгексаналя, 6-(3,3-диметилциклогексилиден)гексаналя, 4-(2,4,4-триметилциклопентилиден)бутаналя, 4-(2-пентилциклопентилиден)-бутаналя, 4-(3,3-диметилциклогексилиден)-бутаналя, 5-(4,4-диэтилциклогексилиден)-пентаналя и 5-циклогептилиденпентаналя.
В частности, изобретение относится к соединениям формулы (I), представленным в Таблице 1 ниже.
Изобретение содержит все энантиомеры и диастереомеры соединений формулы (I), отдельно или в виде смеси. В частности, изобретение содержит соединения, представленные общей формулой (I) в виде смесей энантиомеров в различных пропорциях, в частности рацемических смесей. Смеси энантиомеров или смеси чистых форм получают с помощью способов, известных специалисту в данной области техники с использованием, например, оптически обогащенных или оптически чистых исходных продуктов.
Соединения формулы (I) обладают тем преимуществом, что они доступны с помощью получения, которое является надежным и недорогим, поскольку оно может быть проведено за 2 стадии из недорогих исходных соединений.
Вторая цель настоящего изобретения относится к композиции, содержащей, по меньшей мере, одно соединение общей формулы (I), за исключением соединений 6-циклогептилиденгексаналя, 4-(4-метилциклогексилиден)-бутаналя, 4-(4-трет-бутилциклогексилиден)-бутаналя и 4-(3,3,5-триметилциклогексилиден)-бутаналя в виде изомера или смеси изомеров, энантиомера или смеси энантиомеров, или рацемической смеси, или диастереомера или смеси диастереомеров.
В соответствии с одним из вариантов осуществления композиция отличается тем, что она дополнительно содержит, по меньшей мере, одно другое ароматизированное вещество.
Эффективное количество соединений формулы (I) в соответствии с изобретением, включенное в композицию, будет варьироваться в зависимости от природы композиции, необходимого ароматизированного эффекта и природы других соединений, ароматизированных или нет, которые могут присутствовать, и может быть легко определено специалистом в данной области техники, зная, что оно может варьироваться в очень широком диапазоне, от 0,1 до 99 масс.%, в частности от 0,1 до 50 масс.% и, в частности, от 0,1 до 30 масс.%.
Изобретение также относится, в частности, к косметической композиции, в частности крему для лица и тела, гигиеническому тальку, маслу для волос или для тела, шампуню, лосьону для волос, соли для ванн, маслу для ванн, гелю для душа, гелю для ванн, туалетному мылу, антиперспиранту для тела, дезодоранту для тела, лосьонам, крему для бритья, мылу для бритья, крему, зубной пасте, жидкости для полоскания рта, мази, содержащей, по меньшей мере, одно соединение формулы (I) или по меньшей мере, одну композицию, содержащую, по меньшей мере, одно соединение формулы (I), при этом понимается, что соединения формулы (I) не представляют собой соединения 6-циклогептилиденгексаналя, 4-(4-метилциклогексилиден)-бутаналя, 4-(4-трет-бутилциклогексилиден)-бутаналя и 4-(3,3,5-триметилциклогексилиден)-бутаналя.
Изобретение также относится к чистящему средству, в частности мягчительному средству, моющему средству, стиральному порошку, освежителю воздуха, содержащему, по меньшей мере, одно соединение формулы (I) или по меньшей мере, одну композицию, содержащую, по меньшей мере, одно соединение формулы (I), при этом следует понимать, что соединения формулы (I) не представляют собой соединения 6-циклогептилиденгексаналя, 4-(4-метилциклогексилиден)-бутаналя, 4-(4-трет-бутилциклогексилиден)-бутаналя и 4-(3,3,5-триметилциклогексилиден)-бутаналя.
Соединения в соответствии с изобретением могут быть использованы отдельно или в комбинации, так как они представляют собой или могут быть включены или в инертный носитель, или в материал, который может содержать другие активные ингредиенты конечной композиции. Большое разнообразие материалов-носителей может быть использовано, включая, например, полярные растворители, масла, жировые вещества, мелкодисперсные твердые вещества, циклодекстрины, мальтодекстрины, камеди, смолы и любые другие известные материалы-носители для таких композиций.
Третья цель настоящего изобретения относится к способу получения соединения формулы (I), в котором циклоалканон и илид фосфора вступают в реакцию Виттига с последующей стадией восстановления и/или окисления в зависимости от используемого ранее илида.
Способ в соответствии с изобретением содержит, в частности, стадии:
i) добавление илида фосфора формулы (III) к циклоалканону формулы (II) в соответствии с реакцией Виттига:
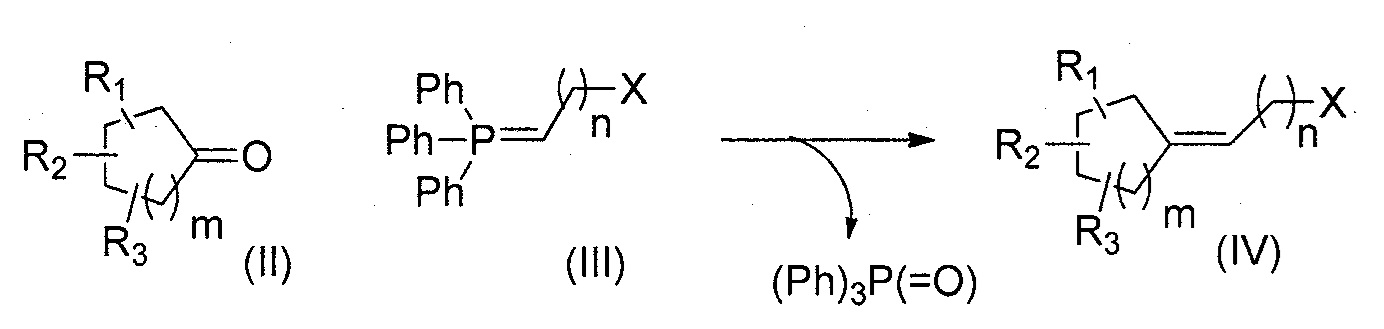
R1, R2, R3, n и m представляют собой, как определено выше, и X представляет собой функциональную группу нитрила, сложного эфира карбоновой кислоты или спирта; и
ii) превращение функциональной группы Х полученного соединения (IV) в альдегид с помощью восстановления и/или окисления, в результате которого получают соединение формулы (I).
В соответствии с одним вариантом осуществления способ согласно изобретению содержит, по меньшей мере, следующие стадии:
• стадию добавления илида фосфора в циклоалканон для получения интермедиата соединения, причем указанный илид фосфора содержит:
- в общей сложности 3 атома углерода и функциональную группу нитрила для получения соединения формулы I, для которого боковая цепь содержит в общей сложности 4 атома углерода (n=2), или
- в общей сложности 5 атомов углерода и функциональную группу сложного эфира для получения соединения формулы I, для которого боковая цепь содержит в общей сложности 5 атомов углерода (n=3), или
- в общей сложности 6 атомов углерода и функциональную группу спирта с получением соединения формулы I, для которого боковая цепь содержит в общей сложности 6 атомов углерода (n=4),
с последующей одной стадией или двумя стадиями, состоящими из превращения указанного интермедиата соединения в соответствующий альдегид с помощью восстановления и/или окисления.
Когда соединение интермедиата представляет собой нитрил (n = 2), стадия, которая делает возможным получение соответствующего альдегида I настоящего изобретения, заключается в восстановлении при использовании гидрида диизобутилалюминия в соответствии с протоколами, известными специалисту в данной области техники.
Когда соединение интермедиата представляет собой сложный эфир (n=3), стадия омыления делает возможным получение соответствующего спирта в соответствии с методиками эксплуатации, известными специалисту в данной области техники.
Когда соединение интермедиата представляет собой спирт (n=3 или 4), стадия, которая делает возможным получение альдегида I настоящего изобретения, заключается в окислении в соответствии с методиками эксплуатации, известными специалисту в данной области техники. Например, можно отметить использование TEMPO и гипохлорита натрия (окисление Анелли), или окисление Сверна или Десса-Мартина, или использование поддерживаемых переходных металлов (углерода, в частности) в атмосфере кислорода или воздуха.
Последняя цель изобретения представляет собой применение, по меньшей мере, одного соединения формулы (I) в соответствии с изобретением за исключением соединений 6-циклогептилиденгексаналя, 4-(4-метилциклогексилиден)-бутаналя, 4-(4-трет-бутилциклогексилиден)-бутаналя и 4-(3,3,5- триметилциклогексилиден)-бутаналя в виде ароматизированного агента, или соединения в виде маскирующего запах агента, или в виде нейтрализующего запах агента. Термины «ароматный», «ароматизированный» используются в настоящем описании взаимозаменяемо для обозначения любого органолептического соединения, стимулирующего приятным образом чувство обоняния. Термин «маскирующий агент» или «маскирующий» подразумевает сокращение или устранение восприятия неприятного запаха, генерируемого одной или несколькими молекулами, входящими в композицию продукта.
Кроме того, указанное соединение может быть использовано отдельно или в комбинации, по меньшей мере, с одним другим ароматизирующим или отдушивающим ингредиентом, и/или, по меньшей мере, одним растворителем, и/или, по меньшей мере, одной добавкой. Дополнительный ароматизированный агент(ы) может быть соединениями формулы (I) или другими ароматизированными агентами, известными специалисту в данной области техники, который сможет сделать выбор в зависимости от желаемого эффекта.
Как правило, соединения в соответствии с изобретением будут использованы в области парфюмерии. «Парфюмерия» подразумевает не только парфюмерию в обычном понимании данного термина, но также другие области, в которых аромат продуктов имеет важное значение. Это может касаться парфюмерных композиций в обычном понимании данного термина, таких как парфюмерные основы и концентраты, одеколоны, туалетные воды, духи и подобные продукты; композиций для местного применения - в частности, косметических средств – таких как кремы для лица и тела, гигиенические тальки, масла для волос, шампуни, лосьоны для волос, соли и масла для ванн, гели для душа и ванн, туалетные мыла, антиперспиранты и дезодоранты для тела, лосьоны и кремы для бритья, мыла, кремы, зубные пасты, жидкости для полоскания рта, мази и подобные продукты; и чистящих средств, таких как мягчительные средства, моющие средства, стиральные порошки, освежители воздуха и подобные продукты.
Определенный вариант осуществления изобретения относится к применению соединения формулы (I) за исключением соединений 6-циклогептилиденгексаналя, 4-(4-метилциклогексилиден)-бутаналя, 4-(4-трет-бутилциклогексилиден)-бутаналя и 4-(3,3,5-триметилциклогексилиден)-бутаналя для придания, изменения или увеличения органолептических свойств вещества, композиции или продукта.
Под «органолептическими свойствами» понимают любое свойство, вероятно, для изменения, улучшения или увеличения органолептического восприятия вещества, композиции или продукта пользователем. Таким образом, в качестве предпочтительного примера органолептический агент в соответствии с изобретением может содержаться в ароматизирующей добавке, вероятно, для придания, изменения, улучшения или увеличения обонятельного восприятия вещества, композиции или продукта.
Общий принцип изобретения основан на получении и применении в парфюмерии соединений формулы I, описанных выше. Следующие примеры иллюстрируют определенный способ получения соединений изобретения, также как обонятельный профиль каждого из соединений, приведенных в качестве примера (см. таблицу 1 для описаний запаха). Данные примеры приведены только в иллюстративных целях и не должны рассматриваться как ограничивающие общий объем изобретения.
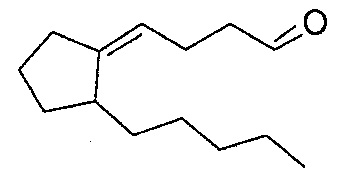
Пример 1: Получение 4-(2-пентилциклопентилиден)-бутаналя
Эквивалент 4-хлорбутиронитрила и эквивалент трифенилфосфина в дибутиловом эфире при 140°С помещают в колбу. После 20 часов перемешивания в данных условиях и как только возвращается температура окружающей среды, образованный 3-(цианопропил)-трифенилфосфония хлорид отфильтровывают через фритту, промывают метил-трет-бутиловым эфиром (МТБЭ), затем высушивают под вакуумом.
1 эквивалент 3-(цианопропил)-трифенилфосфония хлорида и 1,2 эквивалента трет-бутилата калия в сухом ТГФ помещают в колбу. Данную суспензию перемешивают при 60°С в течение 2 часов. Затем добавляют 1 эквивалент 2-пентилциклопентанона. Перемешивание проводят при 60°С до тех пор, пока, по меньшей мере, не превратится 90% 2-пентилциклопентанона. Реакционную среду возвращают до температуры окружающей среды. Затем выливают в 10% раствор HCl. Фазы разделяют. Водную фазу дважды экстрагируют МТБЭ. Объединенные органические фазы промывают насыщенным водным раствором бикарбоната натрия и затем соленой водой. После высушивания над сульфатом магния, фильтрования на бумаге и испарения растворителя неочищенный продукт помещают в МТБЭ в холодильник на ночь. Осадок отфильтровывают через фритту и промывают МТБЭ. Фильтрат концентрируют и затем неочищенный продукт, состоящий из двух изомеров 4-(2-пентилциклопентилиден)-бутаннитрила в соотношении 52:48, дистиллируют при пониженном давлении (т. кип. = 98°C/0,5 Торр).
1 эквивалент 4-(2-пентилциклопентилиден)-бутаннитрила в соотношении 52:48 в толуоле при приблизительно 10°С затем помещают в колбу. 1,2 эквивалента 1,0 М раствора ДИБАЛ (диизобутилалюминийгидрида) в толуоле медленно добавляют таким образом, чтобы поддерживать температуру раствора ниже 40°С. В конце добавления смесь доводят до 70°С в течение 2 часов и затем оставляют охлаждаться при температуре окружающей среды. Реакционную среду осторожно выливают при перемешивании в смесь уксусная кислота/лед. Фазы разделяют. Водную фазу экстрагируют 3 раза МТБЭ. Объединенные органические фазы промывают насыщенным раствором бикарбоната натрия и затем соленой водой. После высушивания над сульфатом магния, фильтрования на бумаге и испарения растворителя неочищенный продукт, содержащий два изомера в соотношении 52:48 4-(2-пентилциклопентилиден)-бутаналя, обессмаливают с помощью молекулярной дистилляции перед дистилляцией более высококачественной при пониженном давлении: его температура кипения представляет собой 75°С при 0,4 Торр.
Полученный таким образом 4-(2-пентилциклопентилиден)-бутаналь проявляет следующие спектральные характеристики:
Большинство изомера (52%):
МС [e/m (%)]: 208 (M+, 2), 164 (42), 149 (10), 147 (17), 138 (11), 137 (17), 135 (48), 134 (65), 133 (18), 121 (45), 120 (25), 119 (54), 110 (12), 109 (31), 108 (28), 107 (30), 105 (15), 97 (32), 96 (20), 95 (74), 94 (52), 93 (79), 92 (19), 91 (94), 83 (10), 82 (32), 81 (81), 80 (22), 79 (93), 78 (11), 77 (48), 69 (16), 68 (13), 67 (100), 65 (19), 57 (10), 55 (60), 53 (24), 43 (27), 41 (82), 39 (30).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 14,12, 22,07, 22,75, 23,98, 30,34, 31,87, 32,05, 33,38, 34,95, 40,29, 44,23, 118,01, 149,15, 202,58.
Меньшинство изомера (48%):
МС [e/m (%)]: 208 (M+, 23), 164 (39), 147 (17), 137 (18), 135 (46), 134 (65), 133 (18), 121 (44), 120 (27), 119 (60), 110 (13), 109 (30), 108 (29), 107 (29), 105 (17), 97 (33), 96 (20), 95 (79), 94 (55), 93 (86), 92 (20), 91 (100), 82 (32), 81 (84), 80 (22), 79 (97), 78 (13), 77 (50), 69 (16), 68 (12), 67 (100), 65 (19), 57 (10), 55 (63), 53 (25), 43 (28), 41 (85), 39 (29).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 14,12, 22,37, 22,71, 24,09, 29,28, 30,34, 32,16, 32,71, 34,44, 43,90, 44,34, 117,11, 148,79, 202,73.
2 суперналоженных изомера:
1Н-ЯМР (200 МГц, CDCl3): δ (м.д.) 0,89 (т, J=8,0 Гц, 3H), 1,28 (м, 7H), 1,43-1,63 (м, 3H), 1,70-1,91 (м, 2H), 2,18-2,40 (м, 4H), 2,45-2,53 (м, 3H), 5,10-5,17 (м, 1H), 9.77 (нал. 2т, J=2,0 Гц, 1H).
ИК (пленка, см-1): 839w, 1053w, 1379w, 1466m, 1726s, 2714w, 2856m, 2926s, 2953s.
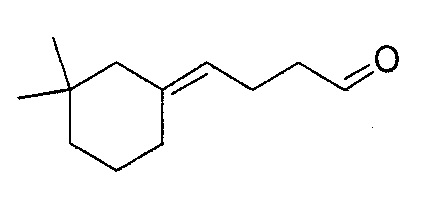
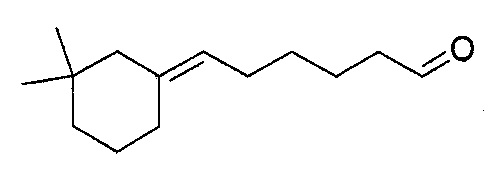
Пример 2: Получение 4-(3,3-диметилциклогексилиден)-бутаналя
4-(3,3-диметилциклогексилиден)-бутаналь получают в соответствии с методикой, описанной в Примере 1, с использованием 3,3-диметилциклогексанона вместо 2-пентилциклопентанона. Неочищенный продукт, состоящий из двух изомеров 4-(3,3-диметилциклогексилиден)-бутаналя в соотношении 74:26, дистиллируют при пониженном давлении: его температура кипения представляет собой 85°C при 0,4 Торр.
Полученный таким образом 4-(3,3-диметилциклогексилиден)-бутаналь проявляет следующие спектральные характеристики:
Большинство изомера (74%):
1Н-ЯМР (200 МГц, CDCl3): δ (м.д.) 0,84 (с, 6H), 1,33-1,36 (м, 2H), 1,43-1,56 (м, 2H), 1,82 (с, 2H), 1,96-2,10 (м, 2H), 2,29-2,51 (м, 4H), 5,00 (т, J=7,0 Гц, 1H), 9,76 (т, J=2,0 Гц, 1H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 20,02, 22,88, 27,88, 28,07, 36,34, 39,30, 44,07, 49,99, 120,04, 138,88, 202,37.
МС [e/m (%)]: 180 (M+, 1), 165 (12), 162 (26), 147 (38), 137 (11), 136 (32), 121 (35), 119 (12), 109 (39), 107 (19), 105 (15), 97 (18), 96 (10), 95 (25), 93 (40), 91 (27), 82 (13), 81 (56), 80 (13), 79 (36), 77 (25), 70 (10), 69 (100), 68 (20), 67 (37), 65 (12), 55 (40), 53 (22), 43 (14), 41 (72), 39 (28).
Меньшинство изомера (26%):
1Н-ЯМР (200 МГц, CDCl3): δ (м.д.) 0,88 (с, 6H), 1,33-1,36 (м, 2H), 1,43-1,56 (м, 2H), 1,91 (с, 2H), 1,96-2,10 (м, 2H), 2,29-2,51 (м, 4H), 5,15 (т, J=7,0 Гц, 1H), 9,76 (т, J=2,0 Гц, 1H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 19,79, 23,81, 28,21, 32,42, 35,57, 39,51, 41,61, 49,99, 120,12, 139,06, 202,37.
МС [e/m (%)]: 180 (M+, 1), 162 (24), 147 (35), 136 (29), 121 (33), 119 (12), 109 (36), 107 (15), 105 (15), 97 (18), 95 (22), 93 (38), 91 (24), 82 (10), 81 (48), 80 (11), 79 (31), 77 (21), 70 (10), 69 (100), 68 (18), 67 (31), 65 (10), 55 (38), 53 (18), 43 (12), 41 (65), 39 (23).
ИК (пленка, см-1): 859w, 975w, 975w, 1053w, 1365m, 1456m, 1725s, 2715w, 2841m, 2865m, 2925s, 2948s.
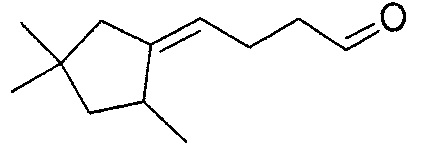
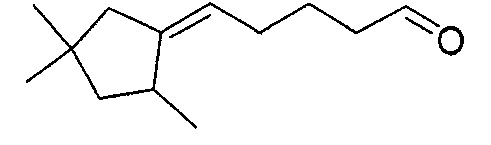
Пример 3: Получение 4-(2,4,4-триметилциклопентилиден)-бутаналя
4-(2,4,4-триметилциклопентилиден)-бутаналь получают в соответствии с методикой, описанной в Примере 1, с использованием 2,4,4-триметилциклопентанона вместо 2-пентилциклопентанона. Неочищенный продукт, состоящий из двух изомеров 4-(2,4,4-триметилциклопентилиден)-бутаналя в соотношении 70:30, дистиллируют при пониженном давлении: его температура кипения представляет собой 70°C при 0,4 Торр.
Полученный таким образом 4-(2,4,4-триметилциклопентилиден)-бутаналь проявляет следующие спектральные характеристики:
Большинство изомера (70%):
1Н-ЯМР (200 МГц, CDCl3): δ (м.д.) 1,02 (с, 6H), 0,91-1,06(нал. д, 3H), 1,10-1,15 (м, 1H), 1,64-1,86 (м, 2H), 2,02-2,47 (м, 5H), 2,62-2,80 (м, 1H), 5,07-5,17 (м, 1H), 9,76 (т, J=1,6 Гц, 1H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 21,34, 21,43, 26,83, 28,81, 33,85, 37,69, 44,15, 48,96, 50,00, 118,90, 149,58, 202,49.
МС [e/m (%)]: 180 (M+, 1), 162 (18), 147 (41), 137 (13), 136 (68), 123 (12), 122 (11), 121 (100), 119 (13), 111 (16), 109 (34), 107 (19), 105 (15), 97 (11), 95 (37), 93 (33), 91 (28), 81 (37), 79 (33), 77 (26), 69 (15), 68 (12), 67 (32), 65 (11), 55 (34), 53 (20), 43 (12), 41 (47), 39 (25).
Меньшинство изомера (30%):
1Н-ЯМР (200 МГц, CDCl3): δ (м.д.) 0,81 (с, 6H), 0,91-1,06 (нал. д, 3H), 1,10-1,15 (м, 1H), 1,64-1,86 (м, 2H), 2,02-2,47 (м, 5H), 2,62-2,80 (м, 1H), 5,07-5,12 (m, 1H), 9,76 (т, J=1,6 Гц, 1H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 19,40, 22,32, 28,06, 29,51, 37,02, 37,12, 43,84, 44,46, 49,73, 117,57, 149,61, 202,62.
МС [e/m (%)]: 180 (M+, 1), 162 (18), 147 (37), 137 (14), 136 (72), 123 (12), 122 (11), 121 (100), 119 (12), 109 (34), 107 (18), 105 (14), 97 (10), 95 (36), 93 (31), 91 (27), 81 (35), 79 (31), 77 (24), 69 (14), 68 (11), 67 (30), 65 (11), 55 (32), 53 (18), 43 (12), 41 (44), 39 (23).
ИК (пленка, см-1): 830w, 1365m, 1460m, 1725s, 2716w, 2866m, 2927s, 2951s.
Пример 4: Получение 5-(2,4,4-триметилциклопентилиден)-пентаналя
Эквивалент 5-бромпентанола и эквивалент трифенилфосфина в нагретом с обратным холодильником этаноле помещают в колбу. После 72 часов перемешивания в данных условиях и как только возвращается температура окружающей среды, этанол испаряют под вакуумом и осадок помещают в толуол при 4°С в течение ночи. Образованный (5-гидроксипентил)трифенилфосфония бромид отфильтровывают через фритту, промывают метил-трет-бутиловым эфиром, затем высушивают под вакуумом.
1 эквивалент (5-гидроксипентил)трифенилфосфония бромида и 1,2 эквивалента трет-бутилата калия в сухом толуоле помещают в колбу. Данную суспензию перемешивают при 70°С в течение 2 часов. Затем возвращают температуру окружающей среды перед добавлением 2,4,4-триметилциклопентанона. Перемешивание проводят при 70°С до тех пор, пока, по меньшей мере, не превратится 90%. Реакционную среду возвращают до температуры окружающей среды. Затем ее выливают в 10% раствор HCl. Фазы разделяют. Органическую фазу промывают насыщенным водным раствором бикарбоната натрия и затем соленой водой. После высушивания над сульфатом магния, фильтрования на бумаге и испарения растворителя неочищенный продукт помещают в МТБЭ в холодильник на ночь. Осадок отфильтровывают через фритту и промывают МТБЭ. Фильтрат концентрируют и затем неочищенный продукт, состоящий из двух изомеров 5-(2,4,4-триметилциклопентилиден)пентан-1-ола в соотношении 68:32, дистиллируют при пониженном давлении (т. кип. = 66°C/0,2 Торр).
В дальнейшем 2,5 эквивалента PDC (дихромата пиридиния) и 1 эквивалент 5-(2,4,4-триметилциклопентилиден)-пентан-1-ола в соотношении 68:32 в дихлорметане помещают в колбу. Суспензию интенсивно перемешивают при температуре окружающей среды в течение ночи. Когда превращение является достаточным (>95%), реакционную среду отфильтровывают через Целит® и затем через диоксид кремния. Полученный таким образом фильтрат промывают 1% водным раствором HCl, и затем насыщенным водным раствором бикарбоната натрия, и затем водой. После высушивания над сульфатом магния, фильтрования на бумаге и испарения растворителя неочищенный продукт, содержащий два изомера в соотношении 68:32 5-(2,4,4-триметилциклопентилиден)-пентаналя, дистиллируют при пониженном давлении: его температура кипения представляет собой 52°С при 0,3 Торр.
Полученный таким образом 5-(2,4,4-триметилциклопентилиден)-пентаналь проявляет следующие спектральные характеристики:
Большинство изомера (68%):
1Н-ЯМР (200 МГц, CDCl3): δ (м.д.) 0,84 (с, 3H), 1,02-1,06 (нал. с, 6H), 1,11-1,17 (м, 1H), 1,64-1,77 (м, 4H), 1,81-2,08 (м, 3H), 2,40-2,45 (м, 2H), 2,66-2,64 (м, 1H), 5,09-5,16 (м, 1H), 9,77 (т, J=1,8 Гц, 1H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 21,21, 22,41, 26,88, 27,69, 28,82, 33,82, 36,94, 43,37, 49,02, 50,03, 120,13, 149,08, 202,73.
МС [e/m (%)]: 194 (M+, 12), 179 (29), 176 (13), 161 (61), 151 (21), 150 (66), 137 (10), 135 (80), 133 (22), 123 (24), 121 (25), 119 (31), 111 (16), 110 (12), 109 (56), 108 (15), 107 (38), 105 (19), 96 (10), 95 (100), 94 (18), 93 (36), 91 (35), 83 (25), 82 (13), 81 (67), 80 (10), 79 (72), 77 (33), 70 (10), 69 (34), 68 (10), 67 (47), 65 (14), 57 (10), 55 (42), 53 (24), 43 (16), 41 (56), 39 (22).
Меньшинство изомера (32%):
1Н-ЯМР (200 МГц, CDCl3): δ (м.д.) 0,93 (с, 3H), 1,02-1,06 (нал. с, 6H), 1,11-1,17 (м, 1H), 1,64-1,77 (м, 4H), 1,81-2,08 (м, 3H), 2,40-2,45 (м, 2H), 2,66-2,64 (м, 1H), 5,33-5,40 (1H), 9,77 (т, J=1,8 Гц, 1H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 19,51, 22,15, 28,04, 28,67, 29,51, 37,09, 37,64, 43,28, 44,48, 49,76, 118,70, 149,33, 202,73.
МС [e/m (%)]: 194 (M+, 13), 179 (31), 176 (145), 161 (69), 151 (20), 150 (64), 137 (11), 135 (76), 133 (24), 123 (24), 121 (24), 119 (36), 111 (20), 110 (12), 109 (59), 108 (17), 107 (38), 105 (22), 95 (100), 94 (17), 93 (37), 91 (38), 83 (24), 82 (12), 81 (70), 79 (72), 77 (35), 70 (12), 69 (37), 68 (12), 67 (46), 65 (14), 57 (10), 55 (41), 53 (25), 43 (17), 41 (58), 39 (26)
ИК (пленка, см-1): 838w, 1365m, 1459m, 1726s, 2715w, 2866m, 2928s, 2951s.
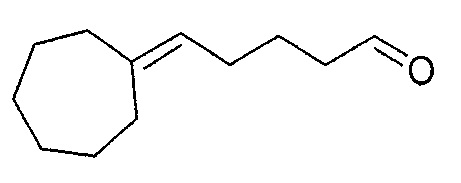
Пример 5: Получение 5-циклогептилиденпентаналя
Эквивалент 5-бромпентилпивалата и эквивалент трифенилфосфина в толуоле при 110°С помещают в колбу. После 72 часов перемешивания в данных условиях и как только возвратится температура окружающей среды, толуол испаряют и образованный трифенил (5-(пивалоилокси)пентил)фосфония бромид непосредственно используют для следующей стадии.
1 эквивалент трифенил(5-(пивалоилокси)пентил)фосфония бромида и 1,2 эквивалента трет-бутилата калия в сухом ТГФ помещают в колбу. Данную суспензию перемешивают при 60°С в течение 2 часов. Затем добавляют циклогептанон. Перемешивание проводят при 60°С до тех пор, пока, по меньшей мере, не превратится 90%. Реакционную среду возвращают до температуры окружающей среды и затем выливают в 10% раствор HCl. Фазы разделяют. Водную фазу дважды экстрагируют МТБЭ. Органические фазы промывают насыщенным водным раствором бикарбоната натрия и затем соленой водой. После высушивания над сульфатом магния, фильтрования на бумаге и испарения растворителя неочищенный продукт помещают в МТБЭ в холодильник на ночь. Осадок отфильтровывают через фритту и промывают МТБЭ. Фильтрат концентрируют и затем неочищенный продукт, состоящий из 5- циклогептилиденпентила, дистиллируют при пониженном давлении (т. кип. = 104°C/0,7 Торр).
5-циклогептилиденпентилпивалат затем помещают в нагретом с обратным холодильником этаноле с 0,1 эквивалента гидроксида калия в течение двадцати часов. Реакционную среду затем возвращают до температуры окружающей среды. Затем выливают в 10% раствор HCl. Фазы разделяют. Водную фазу дважды экстрагируют МТБЭ. Органические фазы промывают насыщенным водным раствором бикарбоната натрия и затем соленой водой. После высушивания над сульфатом магния, фильтрования на бумаге и испарения растворителя неочищенный продукт, состоящий из 5-циклогептилиденпентан-1-ола, дистиллируют при пониженном давлении (т. кип. = 78°C/0,6 Торр).
Полученный таким образом спирт затем окисляют (см., например, последнюю стадию Примера 4) с получением 5-циклогептилиденпентаналя после очистки при пониженном давлении: его температура кипения представляет собой 80°C при 0,4 Торр.
Полученный таким образом 5-циклогептилиденпентаналь проявляет следующие спектральные характеристики:
1Н-ЯМР (200 МГц, CDCl3): δ (м.д.) 0,93 (с, 3H), 1,02-1,06 (superimposed с, 6H), 1,11-1,17 (м, 1H), 1,64-1,77 (м, 4H), 1,81-2,08 (м, 3H), 2,40-2,45 (м, 2H), 2,66-2,64 (м, 1H), 5,33-5,40 (1H), 9,77 (т, J=1,8 Гц, 1H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 19,51, 22,15, 28,04, 29,51, 37,09, 37,64, 43,28, 44,48, 49,76, 118,70, 149,33, 202,73.
МС [e/m (%)]: 180 (M+, 3), 162 (14), 137 (11), 136 (69), 121 (64), 111 (16), 108 (40), 107 (39), 98 (13), 96 (10), 95 (58), 94 (31), 93 (39), 91 (21), 82 (42), 81 (94), 80 (23), 79 (64), 77 (27), 69 (22), 68 (28), 67 (100), 66 (10), 65 (15), 55 (59), 54 (23), 53 (29), 41 (76), 39 (36).
ИК (пленка, см-1): 1057w, 1442m, 1724s, 2713W, 2850m, 2919s.
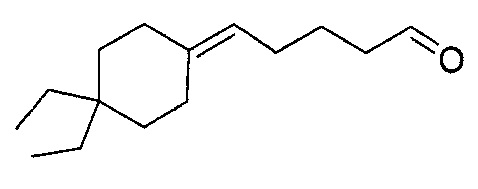
Пример 6: Получение 5-(4,4-диэтилциклогексилиден)-пентаналя
5-(4,4-диэтилциклогексилиден)-пентаналь получают в соответствии методикой, описанной в Примере 5, с использованием 4,4-диэтилциклогексанона вместо циклогептанона. Неочищенный продукт дистиллируют при пониженном давлении: его температура кипения представляет собой 80°C при 0,4 Торр.
Полученный таким образом 5-(4,4-диэтилциклогексилиден)-пентаналь проявляет следующие спектральные характеристики:
1Н-ЯМР (200 МГц, CDCl3): δ (м.д.) 0,93 (с, 3H), 1,04-1,06 (нал. с, 6H), 1,34-1,46 (м, 2H), 1,56-2,05 (м, 7H), 2,16-2,23 (м, 1H), 2,43 (т, J=7,4 Гц, 2H), 2,66 (кв, J=7,0 Гц, 1H), 5,10-5,18 (м, 1H), 9,75 (т, J=1,8 Гц, 1H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 19,49, 21,59, 26,81, 28,79, 28,97, 29,14, 36,85, 36,97, 44,39, 48,94, 49,78, 148,15, 202,34.
МС [e/m (%)]: 208 (M+, 19), 193 (59), 176 (13), 175 (84), 165 (22), 147 (15), 135 (12), 133 (11), 125 (10), 124 (10), 123 (44), 122 (13), 121 (21), 119 (20), 111 (10), 110 (16), 109 (99), 108 (14), 107 (38), 105 (15), 95 (100), 93 (42), 91 (33), 84 (15), 83 (16), 82 (16), 81 (69), 80 (13), 79 (38), 77 (32), 69 (33), 67 (46), 66 (11), 55 (28), 53 (18), 52 (10), 43 (15), 41 (41), 39 (14).
ИК (пленка, см-1): 844w, 1365m, 1459m, 1727s, 2714w, 2865m, 2927s, 2950s.
Пример 7: Получение 6-(2,4,4-триметилциклопентилиден)-гексаналя
Эквивалент ацетата бромгексила и эквивалент трифенилфосфина помещают в нагретом с обратным холодильником этаноле в колбу. После 72 часов перемешивания в данных условиях и как только возвращается температура окружающей среды, образованный этанол и этилацетат испаряют под вакуумом и осадок помещают в толуол при температуре 4°С в течение ночи. Образованный (6-гидроксипентил)трифенилфосфония бромид отфильтровывают через фритту, промывают метил-трет-бутиловым эфиром (МТБЭ), затем высушивают под вакуумом.
1 эквивалент (6-гидроксигексил)трифенилфосфония бромида и 1,2 эквивалента трет-бутилата калия в сухом толуоле помещают в колбу. Данную суспензию перемешивают при 70°С в течение 2 часов и затем добавляют 2,4,4-триметилциклопентанон. Перемешивание проводят при 70°С до тех пор, пока, по меньшей мере, не превратится 90%. Реакционную среду возвращают до температуры окружающей среды. Затем выливают в 10% раствор HCl. Фазы разделяют. Органическую фазу промывают насыщенным водным раствором бикарбоната натрия и затем соленой водой. После высушивания над сульфатом магния, фильтрования на бумаге и испарения растворителя неочищенный продукт помещают в МТБЭ в холодильник на ночь. Осадок отфильтровывают через фритту и промывают МТБЭ. Фильтрат концентрируют и затем неочищенный продукт, состоящий из двух изомеров 6-(2,4,4-триметилциклопентилиден)-гексан-1-ола в соотношении 70:30, дистиллируют при пониженном давлении (т. кип. = 89°C/0,1 Торр).
В дальнейшем 2,5 эквивалента PDC (дихромата пиридиния) и 1 эквивалент 6-(2,4,4-триметилциклопентилиден)-гексан-1-ола в соотношении 70:30 в дихлорметане помещают в колбу. Суспензию интенсивно перемешивают при температуре окружающей среды в течение ночи. Когда превращение является достаточным (>95%), реакционную среду отфильтровывают через Целит® и затем через диоксид кремния. Полученный таким образом фильтрат промывают 1% водным раствором HCl, и затем насыщенным водным раствором бикарбоната натрия, и затем водой. После высушивания над сульфатом магния, фильтрования на бумаге и испарения растворителя неочищенный продукт, содержащий два изомера в соотношении 70:30 6-(2,4,4-триметилциклопентилиден)-гексаналя, дистиллируют при пониженном давлении: его температура кипения представляет собой 59°C при 0,2 Торр.
Полученный таким образом 6-(2,4,4-триметилциклопентилиден)-гексаналь проявляет следующие спектральные характеристики:
Большинство изомера (70%):
1Н-ЯМР (200 МГц, CDCl3): δ (м.д.) 0,83 (с, 3H), 1,04-1,06 (с нал., 6H), 1,34-1,46 (м, 2H), 1,56-2,05 (м, 7H), 2,16-2,23 (м, 1H), 2,42 (т, J=7,2 Гц, 2H), 2,66 (кв, J=7,0 Гц, 1H), 5,10-5,18 (м, 1H), 9,75 (т, J=1,8 Гц, 1H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 21,45, 21,67, 26,81, 28,03, 28,79, 29,47, 33,74, 37,58, 43,70, 48,94, 50,04, 120,81, 147,99, 202,29.
МС [e/m (%)]: 208 (M+, 8), 194 (10), 193 (50), 190 (22), 175 (63), 165 (18), 147 (14), 137 (13), 133 (13), 124 (11), 123 (55), 122 (12), 121 (25), 119 (18), 110 (18), 109 (74), 108 (16), 107 (25), 105 (20), 95 (100), 93 (36), 91 (31), 83 (12), 81 (52), 79 (41), 77 (25), 69 (32), 68 (10), 67 (33), 65 (13), 55 (30), 53 (19), 43 (16), 41 (52), 39 (16).
Меньшинство изомера (30%):
1Н-ЯМР (200 МГц, CDCl3): δ (м.д.) 0,93 (с, 3H), 1,04-1,06 (нал. с, 6H), 1,34-1,46 (м, 2H), 1,56-2,05 (м, 7H), 2,16-2,23 (м, 1H), 2,43 (т, J=7,4 Гц, 2H), 2,66 (кв, J=7,0 Гц, 1H), 5,10-5,18 (м, 1H), 9,75 (т, J=1,8 Гц, 1H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 19,49, 21,59, 26,81, 28,79, 28,97, 29,14, 36,85, 36,97, 44,39, 48,94, 49,78, 148,15, 202,34.
МС [e/m (%)]: 208 (M+, 19), 193 (59), 176 (13), 175 (84), 165 (22), 147 (15), 135 (12), 133 (11), 125 (10), 124 (10), 123 (44), 122 (13), 121 (21), 119 (20), 111 (10), 110 (16), 109 (99), 108 (14), 107 (38), 105 (15), 95 (100), 93 (42), 91 (33), 84 (15), 83 (16), 82 (16), 81 (69), 80 (13), 79 (38), 77 (32), 69 (33), 67 (46), 66 (11), 55 (28), 53 (18), 52 (10), 43 (15), 41 (41), 39 (14).
ИК (пленка, см-1): 844w, 1365m, 1459m, 1727s, 2714w, 2865m, 2927s, 2950s.
Пример 8: Получение 6-(2-метилциклогексилиден)-гексаналя
6-(2-метилциклогексилиден)-гексаналь получают в соответствии с методикой, описанной в Примере 7, с использованием 2-метилциклогексанона вместо 2,4,4-триметилциклопентанона. Неочищенный продукт, состоящий из двух изомеров в соотношении 70:30, дистиллируют при пониженном давлении: его температура кипения представляет собой 71°С при 0,3 Торр.
Полученный таким образом 6-(2-метилциклогексилиден)-гексаналь проявляет следующие спектральные характеристики:
Большинство изомера (70%):
1Н-ЯМР (200 МГц, CDCl3): δ (м.д.) 0,99-1,06 (нал. д, 3H), 1,33-1,44 (м, 5H), 1,48-1,71 (м, 7H), 1,98-2,09 (м, 3H), 2,44 (тд, J=6,0 Гц, J=1,8 Гц, 2H), 4,96-5,06 (m, 1H), 9,76 (т, J=1,8 Гц, 1H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 18,63, 21,63, 25,45, 28,10, 28,15, 29,70, 36,74, 38,37, 43,77, 117,90, 144,07, 202,73.
МС [e/m (%)]: 194 (M+, 9), 176 (15), 161 (20), 147 (15), 110 (10), 109 (50), 108 (22), 107 (11), 97 (12), 96 (67), 95 (81), 94 (14), 93 (25), 91 (19), 82 (15), 81 (100), 80 (13), 79 (25), 77 (18), 69 (14), 68 (15), 67 (75), 65 (11), 55 (44), 53 (16), 41 (39), 39 (17).
Меньшинство изомера (30%):
1Н-ЯМР (200 МГц, CDCl3): δ (м.д.) 0,99-1,06 (нал. д, 3H), 1,33-1,44 (м, 5H), 1,48-1,71 (м, 7H), 1,98-2,09 (м, 3H), 2,44 (тд, J=6,0 Hz, J=1,8 Hz, 2H), 4,96-5,06 (м, 1H), 9,76 (т, J=1,8 Гц, 1H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 18,12, 20,93, 26,38, 26,69, 28,56, 29,62, 30,13, 32,44, 33,19, 120,55, 202,73.
МС [e/m (%)]: 194 (M+, 5), 176 (19), 161 (21), 147 (17), 133 (12), 110 (10), 109 (47), 108 (22), 107 (11), 97 (13), 96 (39), 95 (76), 94 (15), 93 (27), 91 (19), 82 (14), 81 (100), 80 (12), 79 (41), 77 (18), 69 (14), 68 (15), 67 (75), 55 (45), 53 (16), 41 (41), 39 (15).
ИК (пленка, см-1): 896w, 1368w, 1456m, 1725s, 2714w, 2852m, 2923s.
Пример 9: Получение 6-(4-метилциклогексилиден)-гексаналя
6-(4-метилциклогексилиден)-гексаналь получают в соответствии с методикой, описанной в Примере 7, с использованием 4-метилциклогексанона вместо 2,4,4-триметилциклопентанона. Неочищенный продукт, содержащий 6-(4-метилциклогексилиден)-гексаналь, дистиллируют при пониженном давлении: его температура кипения представляет собой 69°C при 0,35 Торр.
Полученный таким образом 6-(4-метилциклогексилиден)-гексаналь проявляет следующие спектральные характеристики:
1Н-ЯМР (200 МГц, CDCl3): δ (м.д.) 0,89 (д, J=6,6 Гц, 3H), 0,98-1,02 (м, 1H), 1,35-1,40 (м, 3H), 1,58-1,77 (м, 6H), 1,99-2,11 (м, 4H), 2,42-2,57 (м, 3H), 5,05 (т, J=7,2 Гц, 2H), 9,76 (с, 1H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 21,59, 22,05, 26,78, 27,88, 29,58, 32,84, 35,97, 36,41, 36,81, 43,77, 139,63, 202,71.
МС [e/m (%)]: 194 (M+, 5), 176 (35), 161 (13), 147 (19), 135 (10), 123 (13), 109 (11), 108 (13), 107 (14), 96 (10), 95 (65), 94 (22), 93 (30), 91 (18), 82 (10), 81 (100), 80 (12), 79 (40), 77 (22), 69 (13), 68 (21), 67 (55), 65 (12), 55 (36), 53 (17), 41 (40), 39 (18).
ИК (пленка, см-1): 847w, 1081w, 1373w, 1456m, 1725s, 2714w, 2846m, 2912s, 2948s.
Пример 10: Получение 6-(4-трет-бутилциклогексилиден)-гексаналя
6-(4-трет-бутилциклогексилиден)-гексаналь получают в соответствии с методикой, описанной в Примере 7, с использованием 4-трет-бутилциклогексанона вместо 2,4,4-триметилциклопентанона. Неочищенный продукт, содержащий 6-(4-трет-бутилциклогексилиден)-гексаналь, дистиллируют при пониженном давлении: его температура кипения представляет собой 100°C при 0,3 Торр.
Полученный таким образом 6-(4-трет-бутилциклогексилиден)-гексаналь проявляет следующие спектральные характеристики:
1Н-ЯМР (200 МГц, CDCl3): δ (м.д.) 1,03 (с, 9H), 1,10-1,16 (м, 2H), 1,32-1,44 (м, 3H), 1,56-1,68 (м, 3H), 1,80-1,86 (м, 2H), 1,99-2,03 (м, 3H), 2,16-2,24 (м, 1H), 2,42 (тд, J=7,2 Гц, J=1,8 Гц, 2H), 2,61 (дкв, J=13,6 Гц, J=2,4 Гц, 1H), 5,04 (т, J=7,2 Гц, 1H), 9,76 (т, J=1,8 Гц, 1H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 21,63, 26,77, 27,59, 28,42, 28,47, 29,23, 29,59, 32,41, 36,96, 43,78, 48,46, 120,19, 140,03, 202,78.
МС [e/m (%)]: 236 (M+, 8), 218 (18), 179 (11), 162 (20), 147 (20), 135 (11), 133 (12), 123 (13), 121 (10), 119 (17), 109 (25), 107 (10), 105 (15), 97 (12), 96 (13), 95 (44), 94 (15), 93 (30), 92 (10), 91 (29), 83 (14), 82 (12), 81 (48), 80 (20), 79 (65), 77 (30), 69 (17), 67 (46), 65 (10), 57 (100), 55 (31), 53 (12), 43 (19), 41 (60), 39 (12).
ИК (пленка, см-1): 848w, 1365m, 1443m, 1726s, 2714w, 2861m, 2940s.
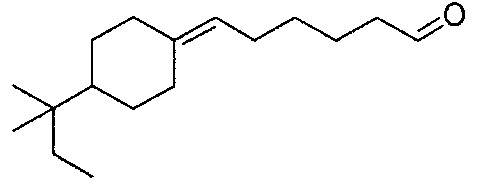
Пример 11: Получение 6-(4-трет-амилциклогексилиден)-гексаналя
6-(4-трет-амилциклогексилиден)-гексаналь получают в соответствии с методикой, описанной в Примере 7, с использованием 4-трет-амилциклогексанона вместо 2,4,4-триметилциклопентанона. Неочищенный продукт, содержащий 6-(4-трет-амилциклогексилиден)-гексаналь, очищают на колонке с диоксидом кремния с помощью элюента, состоящего из 5% гексана и 95% этилацетата.
Полученный таким образом 6-(4-трет-амилциклогексилиден)-гексаналь проявляет следующие спектральные характеристики:
1Н-ЯМР (200 МГц, CDCl3): δ (м.д.) 0,78 (с, 6H), 0,80 (т, J=7,0 Гц, 3H), 1,00 (квд, J=12,0 Гц, J=4,0 Гц, 2H), 2H), 1,20-1,40 (м, 6H), 1,56-1,68 (м, 3H), 1,71-1,80 (м, 3H), 1,99-2,05 (м, 3H), 2,16-2,65 (м, 2H), 2,42 (тд, J=8,0 Гц, J=2,0 Гц, 2H), 5,03 (т, J=7,0 Гц, 1H), 9,76 (т, J=2,0 Гц, 1H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 8,14, 21,67, 24,36, 26,81, 28,05, 28,59, 28,85, 29,64, 29,79, 32,74, 34,73, 37,09, 43,84, 45,66, 120,19, 140,18, 202,86.
МС [e/m (%)]: 250 (M+, 1), 162 (15), 161 (23), 147 (13), 119 (11), 109 (15), 105 (10), 95 (28), 94 (13), 93 (21), 91 (23), 81 (43), 80 (15), 79 (40), 77 (15), 71 (100), 70 (26), 69 (14), 67 (40), 55 (33), 53 (10), 43 (82), 41 (51), 39 (12).
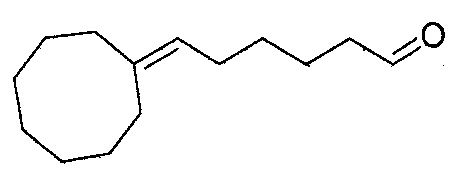
Пример 12: Получение 6-циклооктилиденгексаналя
6-циклооктилиденгексаналь получают в соответствии с методикой, описанной в Примере 7, с использованием циклооктана вместо 2,4,4-триметилциклопентанона. Неочищенный продукт, содержащий циклооктилиденгексаналь, дистиллируют при пониженном давлении: его температура кипения представляет собой 94°С при 0,2 Торр.
Полученный таким образом 6-циклооктилиденгексаналь проявляет следующие спектральные характеристики:
1Н-ЯМР (200 МГц, CDCl3): δ (м.д.) 1,25-1,69 (м, 14H), 2,00-2,17 (м, 6H), 2,43 (тд, J=10,0 Hz, J=2,0 Гц, 2H), 5,09-5,58 (м, 1H), 9,77 (т, J=2,0 Гц, 1H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 19,74, 24,14, 26,30, 26,34, 26,57, 28,92, 29,21, 29,77, 32,04, 47,83, 65,58, 125,14, 142,69, 211,33.
МС [e/m (%)]: 208 (M+, 9), 190 (13), 162 (41), 161 (10), 147 (13), 135 (12), 133 (12), 122 (15), 121 (15), 110 (11), 109 (51), 108 (15), 107 (21), 97 (20), 96 (40), 95 (81), 94 (25), 93 (28), 91 (25), 84 (11), 83 (20), 82 (36), 81 (100), 80 (26), 79 (57), 77 (23), 70 (10), 69 (28), 68 (23), 67 (94), 65 (13), 55 (60), 54 (16), 53 (24), 43 (13), 41 (70), 39 (26).
ИК (пленка, см-1): 971w, 1447m, 1468m, 1726s, 2712w, 2852m, 2920s.
Пример 13: Получение 6-(3,3-диметилциклогексилиден)гексаналя
6-(3,3-диметилциклогексилиден)гексаналь получают в соответствии с методикой, описанной в Примере 7, с использованием 3,3-диметилциклогексанона вместо 2,4,4-триметилциклопентанона. Неочищенный продукт, состоящий из двух изомеров в соотношении 60:40, дистиллируют при пониженном давлении: его температура кипения представляет собой 75°C при 0,46 Торр.
Полученный таким образом 6-(3,3-диметилциклогексилиден)гексаналь проявляет следующие спектральные характеристики:
Большинство изомера (60%):
1Н-ЯМР (200 МГц, CDCl3): δ (м.д.) 0,82 (с, 6H), 1,25-1,5 (м, 6H), 1,5-1,75 (м, 3H), 1,79 (с, 2H), 1,9-2,1 (м, 3H), 2,40 (дт, J=7,36, 1,83 Гц, 2H), 4,97 (т, J=7,32 Гц, 1H), 9,73 (т, J=1,86 Гц, 1H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 21,57; 23,19; 26,83; 28,10; 28,32; 29,61; 32,56; 39,62; 43,73; 50,36; 122,12; 137,81; 202,7.
Меньшинство изомера (40%):
1Н-ЯМР (200 МГц, CDCl3): δ (м.д.) 0,85 (с, 6H), 1,25-1,5 (м, 6H), 1,5-1,75 (м, 3H), 1,86 (с, 2H), 1,9-2,1 (м, 3H), 2,40 (дт, J=7,36, 1,83 Гц, 2H), 5,12 (тт, J=7,24 Гц, 1,1 Гц, 1H), 9,73 (т, J=1,86 гц, 1H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 21,72; 24,11; 26,76; 28,45; 29,61; 32,69; 36,66; 39,84; 41,87; 43,76; 122,23; 137,92; 202,7.
Пример 14: Парфюмерная композиция B, содержащая 6-(2,4,4-триметилциклопентилиден)гексаналь, полученный в соответствии с Примером 7
Сравнительные обонятельные оценочные испытания, распространяющиеся на изучение воздействия указанных соединений в различных формулах, проводят следующим образом. Одинаковую формулу или сочетание ароматических нот выпускают, с одной стороны, без какого-либо сырьевого материала, принадлежащего к заявленным соединениям формулы (I), и, с другой стороны, с одним из соединений формулы (I), в дозе, которая подходит для его обонятельной способности. Полученные таким образом формулы или сочетания ароматических нот, в свою очередь, подвергаются слепой сравнительной оценке.
Следующие два сочетания ароматических нот были подготовлены: тамаринд сочетание ароматических нот А, затем то же самое тамаринд сочетание ароматических нот А, дополнительно содержащее 6-(2,4,4-триметилциклопентилиден)-гексаналь с получением сочетания ароматических нот B. Их составы описываются ниже и используются в качестве парфюмерных оснований: они включены в 1 масс.% в готовый к использованию гель для душа.
Сравнительная оценка сочетаний ароматических нот А и В при 1 масс.% на основе геля для душа показывает, что добавление 6-(2,4,4-триметилциклопентилиден)-гексаналя при содержании 0,9% в сочетание ароматических нот B обеспечивает заметный и очень полезный эффект: он подчеркивает фруктовый мандариновый аспект основного запаха, в частности, по сравнению с сочетанием ароматических нот А.
Пример 15: Парфюмерная композиция Е, содержащая 6-(2,4,4-триметилциклопентилиден)гексаналь, полученный в соответствии с Примером 7
Сравнительные обонятельные оценочные испытания, распространяющиеся на изучение воздействия указанных соединений в формулах, проводят в соответствии с испытанием, описанным в Примере 7. В данном примере третью формулу получали, включая в состав один из сырьевых материалов, который является с точки зрения запаха сравнимым с соединениями формулы (I): Калон® (или 7-метил-3,4-дигидро-2Н-1,5-бензодиоксепин-3-он), в той же самой дозе.
Туалетную воду для женщин получали с помощью включения в состав 10 масс.% трех ароматизирующих формул, описанных ниже, одна из которых содержит 6-(2,4,4-триметилциклопентилиден)-гексаналь и одна из которых содержит Калон®:
Сравнительная оценка сочетаний ароматических нот C, D и Е при 10 масс.% на спиртовой основе: добавление 2% Калон® придает сочетанию ароматических нот D морской аспект. Добавление 2% 6-(2,4,4-триметилциклопентилиден)-гексаналя в сочетание ароматических нот Е придает очень интересный эффект, обеспечивая действенность духов, и в частности, мускусными, солнечными нотами и придавая большую округлость и изящность по сравнению с сочетанием ароматических нот С.
Пример 16: Парфюмерная композиция G, содержащая 6-(2,4,4-триметилциклопентилиден)гексаналь, полученный в соответствии с Примером 7
Сравнительные обонятельные оценочные испытания, распространяющиеся на изучение воздействия указанных соединений в формулах, проводят в соответствии с испытанием, описанным в Примере 7.
Сочетание ароматических нот F ландыша - груши, затем то же самое сочетание ароматических нот, содержащее 6-(2,4,4-триметилциклопентилиден)-гексаналь с получением сочетания ароматических нот G, составы из которых описаны ниже, используются в качестве парфюмерных оснований: они получены и затем включены в 1 масс.% в готовое к использованию мягчительное средство:
Сравнительная оценка сочетаний ароматических нот F и G при 1 масс.% на мягчительной основе показывает, что добавление только 0,1% 6-(2,4,4-триметилциклопентилиден)-гексаналя в мягчительную основу в сочетании ароматических нот G придает очень заметный эффект с помощью подчеркивания зеленого, растительного, водного аспекта по сравнению с сочетанием ароматических нот F.
Реферат
Изобретение относится к новым соединениям общей формулы (I), которые могут быть использованы в парфюмерии, косметике и при производстве моющих средств, к ароматической композиции, содержащей по меньшей мере одно соединение общей формулы I, в виде изомера или смеси изомеров, энантиомера или смеси энантиомеров, или в виде рацемической смеси, или в виде диастереомера или смеси диастереомеров, к способу получения соединения формулы I, а также к применению по меньшей мере одного соединения формулы I в качестве ароматизирующего вещества и маскирующего или нейтрализующего запах агента.В формуле I R1, R2 и R3 каждый независимо представляет собой атом водорода или насыщенную, разветвленную или неразветвленную С-Салкильную группу; m представляет собой целое число от 1 до 4; n представляет собой целое число от 2 до 4; кольцо является насыщенным и содержит от 5 до 8 атомов углерода, общее число атомов углерода в кольце и радикалах R1, R2 и R3 представляет собой от 7 до 11. При этом соединение формулы I не представляет собой: 6-циклогептилиденгексаналь, 4-(4-метилциклогексилиден)-бутаналь, 4-(4-трет-бутилциклогексилиден)-бутаналь, 4-(3,3,5-триметилциклогексилиден)-бутаналь. 5 н. и 19 з.п. ф-лы, 1 табл., 16 пр.
Формула
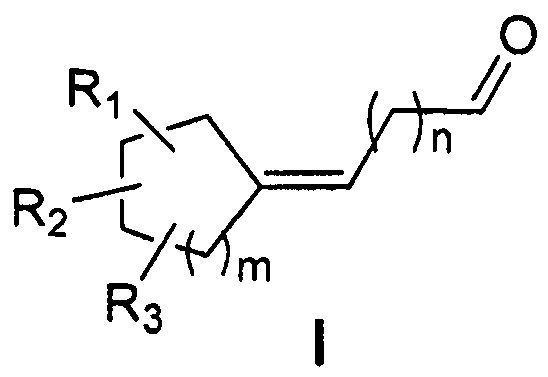
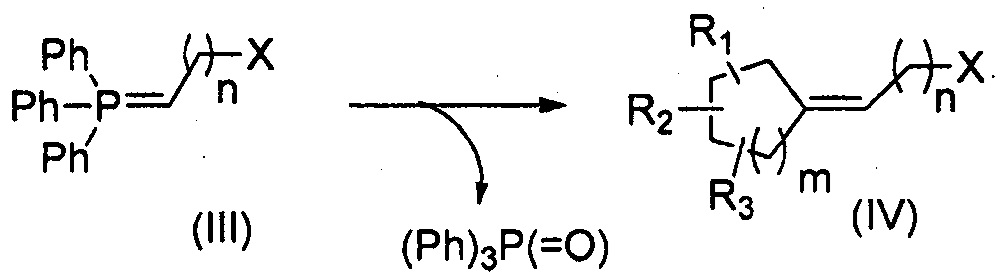
Документы, цитированные в отчёте о поиске
Способ получения -ненасыщенных альдегидов

Комментарии