Способ получения алициклических ненасыщенных сложных эфиров - SU578300A1
Код документа: SU578300A1
Описание
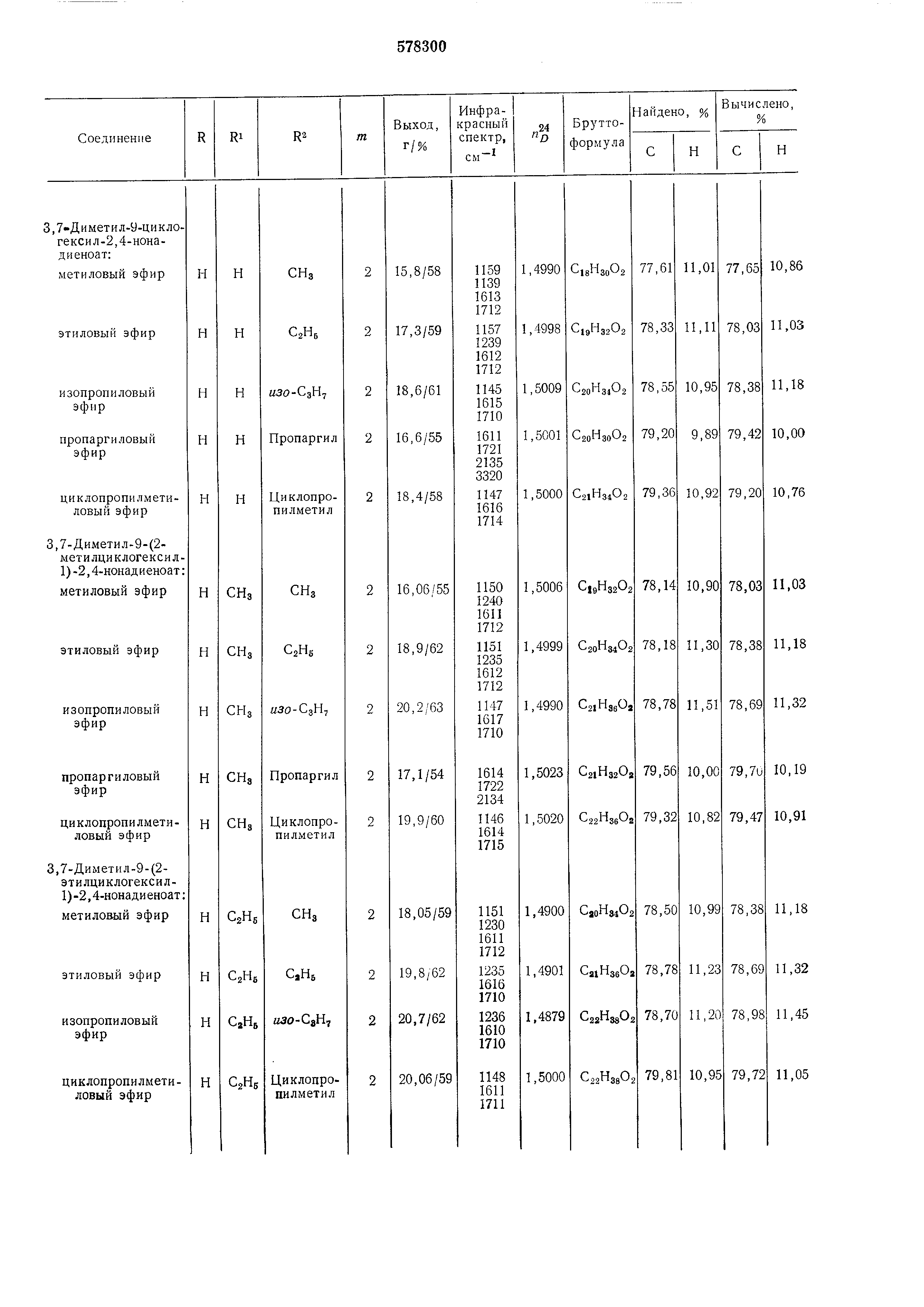
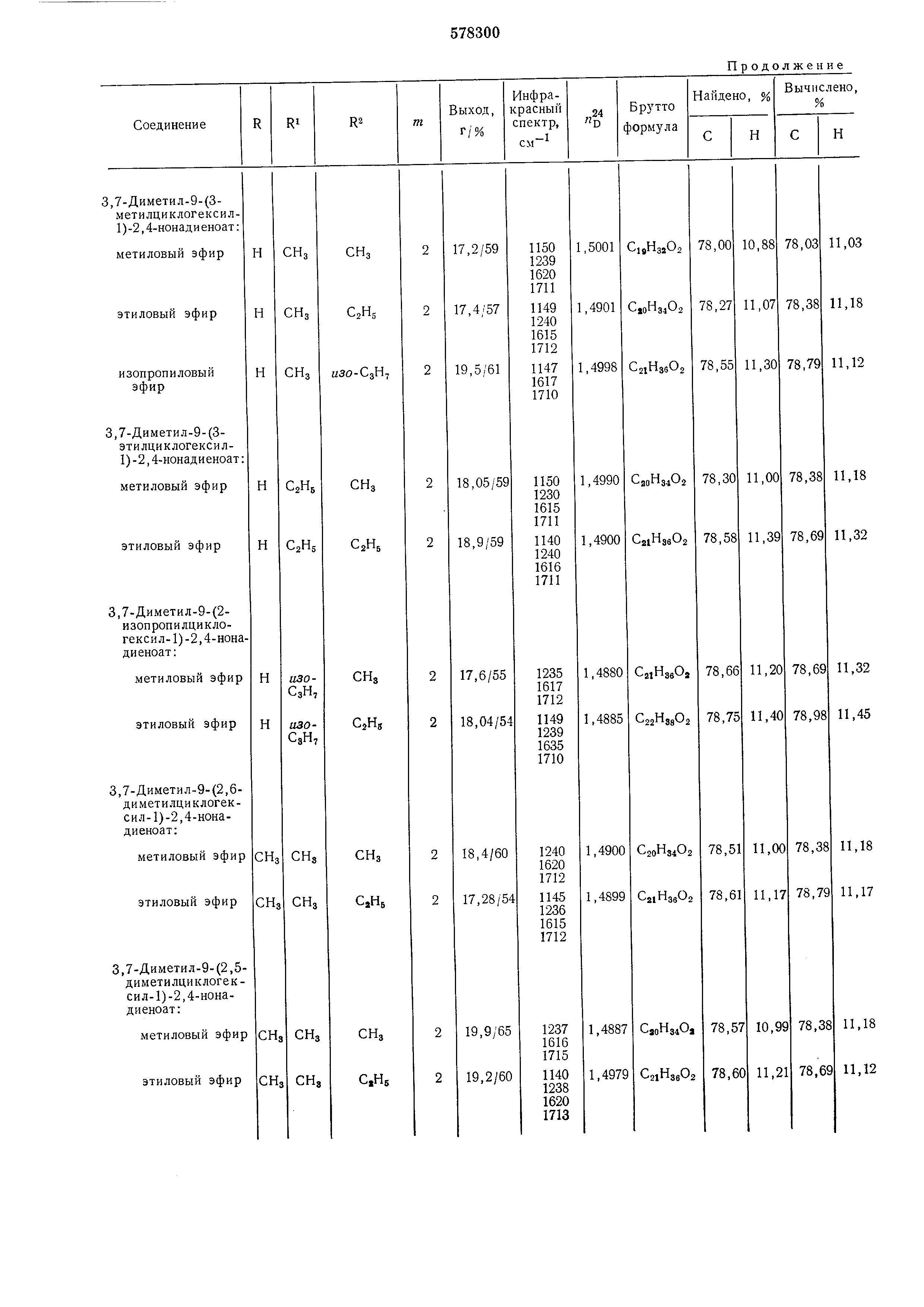
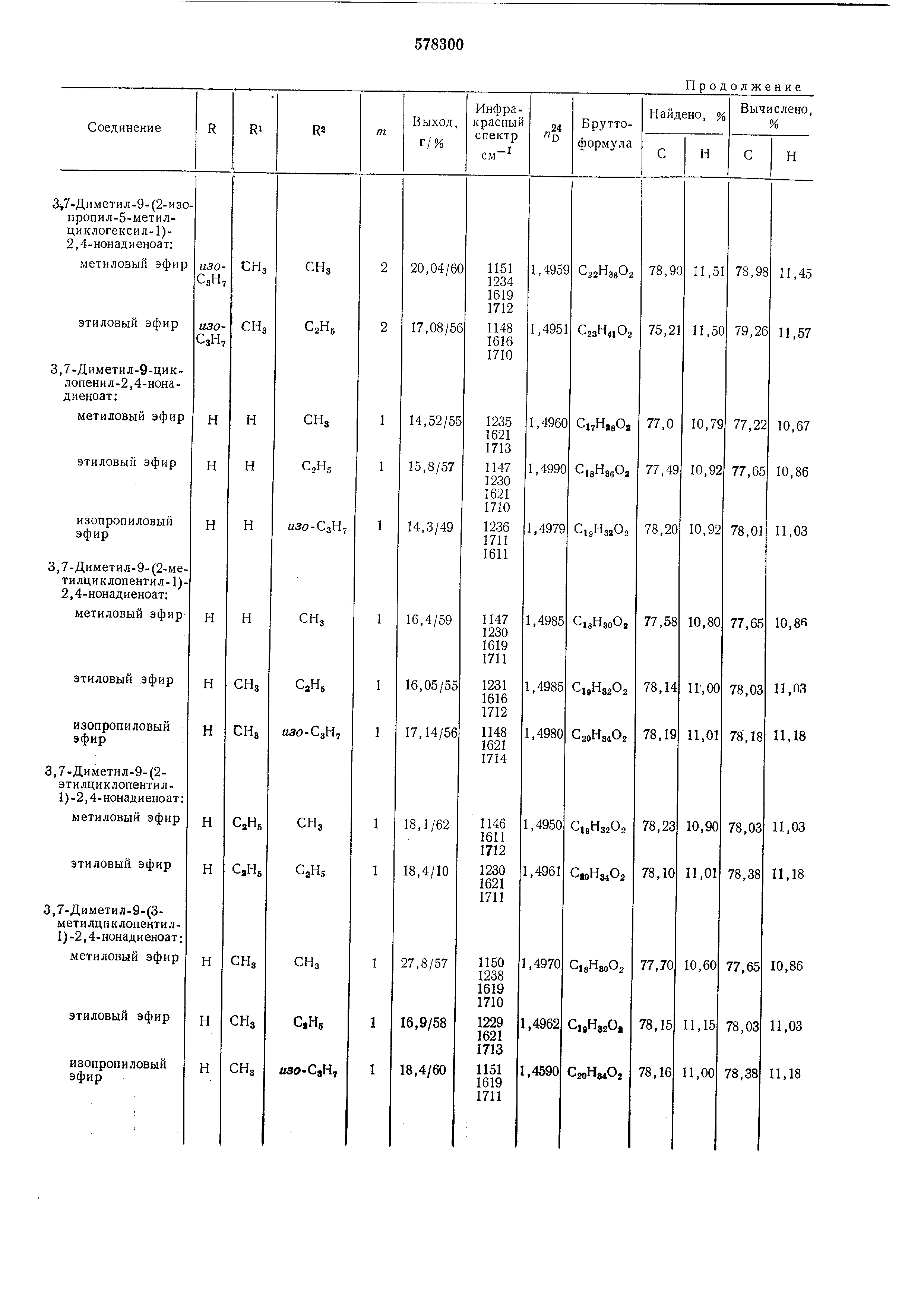
Исходный альдегид общей формулы (II) получают взаимодействием галогенида общей формулы Л где R, R и m имеют указанные значения, X- бром, йод, сначала с ма1гнием в эфире или смеси эфира с бензолом, а затем с кротоновым альдегидом, получая ненасыщенный спирт общей формулы где R, R и m имеют указанные значения. Затем взаимодействием ненасыщенного спирта общей формулы (V) с избытком триметил- или триэтилортоа.цетата при 135-140°С в присутствии слабых кислот, например пропионовой , получают соответствующий эфир общей формулы Е где R, R и m имеют указанные значения, R -метил, этил, в котором слол :ноэфирную группу восстанавливают гидридом металла, а затем гидрируют в присутствии катализатора, например платины. Полученный при этоМ спирт общей формулы где R, R и m имеют указанные значения, окисляют , например, в присутствии трег-бутилхромата . Пример 1. Этил-3,7-диметил-9-циклогексил-2 ,4-нонадиеноат (I; R R H, т 2, R2.C2H5). А. Циклогексилпропенилкарбинол (V; R R H,). К металлическому ма|гнию (2,60 г) в эфире (20:мл) добавляют раствор циклогексилбромида (19,0 1г) в эфире (30 мл), нагревают 30 мин до кипения и затем добавляют кротоновый альдегид (8,0 г) в эфире (15 мл). Смесь оставляют стоять 30 мин при 18-25°С, затем выливают в ледяную воду, насыщенную нащатырным спиртом, и отделяют органический слой. Водный слой встряхивают с эфиром (дважды, всего 60 мл), эфирную часть встряхивают с бикарбонатом натрия, сущат, эфир отгоняют и сухой остаток фракционируют. Продукт содержится во фракции с т. кип. 145-150°С/15 мм рт. ст., «g 1,4775. ИК-спектр: 970, 1380, 1692 и 3610 см-. Б. Этил-3-метил-5-циклогексил-4 - пентеноат (VI; H, , ). Смесь циклопропенилкарбинола (8,70 г), триэтилортоацетата (65,0 с) и проиионовой кислоты (0,30 г) нагревают 1 ч до 135- 140°С при одновременной отгонке этанола. По окончании реакции смесь фракционируют и получают эфир с т. кип. 145-150°С/12 мм рт. ст., п 1,4598. ИК-спектр: 970, 1176 и 1735 CM-I. В. Этил-3-:метил-5-циклогексилпентаноат. Раствор этил-3-метил-5-цикло1гексил - 4-пентеноата (6,40 г) в ментоле (30 мл) гидрируют при атмосферно;м давлении в присутствии катализатора 5%-но:го Pd/СаСОз. Расход водорода равен количеству, необходимому для гидрирования двойной связи. Затем продукт гидрирования растворяют и выделяют после отгонки метанола и отделения катализатора. Г. 3-Метил-5-циклогексил-1-пентанол (VII; R Ri H, , Х СН2ОН). Раствор зтил-3-метил - 5-циклогексилпентеноата (6,30 г) в безводном эфире (15 мл) при комнатной температуре прикапывают к суспензии литийалюминийгидрида (1,10 г) в безводном эфире и смесь перемешивают при комнатной температуре 1 ч. Избыток гидрида устраняют добавлением холодной воды, смесь подкисляют 10%-ной серной кислотой и встряхивают с эфиром. Затем соединенные эфирные части встряхивают с насыщенным водным раствором бикарбоната натрия, водой, высущивают безводным сульфатом натрия и эфир ОТ1ГОНЯЮТ. Из сухого остатка после отгонки растворителя при пониженном давлении получают продукт с т. кип. 165°С/,10 мм рт. ст., «2, 1,4659. ИК-спектр: 1058 и 3620 см-. Д. З-Метил-5-циклогексилпентапаль (II; H, m 2, ). К раствору 3-метил-5-;ЦИклогексил-1-пентанола (0,18 1г) в четыреххлористом углероде (1 мл) прикапывают 25%-ный раствор трегбутилхромата в четыреххлористом углероде (1 мл) и смесь оставляют стоять при 18-25С 30 мин, затем разбавляют эфиром (10 мл) и встряхивают с насыщенным раствором щавелевой кислоты, а потом с насыщенным раствором бикарбоната натрия, высущивают сульфатом натрия и ОТ1ГОНЯЮТ растворитель. Остаток перегоняют в вакууме, получая продукт с т. кип. 118-120°С/12 мм рт. ст., п ,1,4623. Е. Этил-3,7-диметил - 9-циклогексил-2,4-нонандиеноат (I; R Ri H, , R2 C2H5). К суспензии гидрида натрия (0,10 г) в диметиловом эфире этиленгликоля (8,0 мл) при перемешивании и 0°С под атмосферой азота добавляют триэтилфосфоносенециат (1,10 г) в диметиловом эфире этилентликоля (8 мл) (III; ),npH этой температуре перемешивают I ч. Затем при аналогичных условиях прикапывают раствор З-метил-5-циклогексилпентанала (0,50 г) в диметиловом эфире этиленгликоля (8 мл) и перемешивают лри 18-25°С 2 ч. После охлаждения к смеси добавляют насыщенную хлористым натрием воду (6 мл) и органические части встряхивают с эфиром трижды (всего 60 мл), сушат сульфатом натрия и эфир отгоняют. Из сухого остатка (1,47 г) после очистки с номошью хроматографии на (нейтральный, активность III), элюирования смесью бензин-эфир (15: 1) и дистилляции получают целевой продукт с т. кип. 175-177С/12 мм рт. ст., п 1,4998. Пример 2. Изопропил-3,7-диметил-9-циклагексил-2 ,4-нонадиеноат (I; R R H, m 2, К2 НЗО-СзН7). Аналогично способам примера 1А-Д из циклогексилбромида получают З-метил-5-пиклогексилпентаналь (II; R R, , Х СПО), который затем реакцией с триизопропилфосфоносенециатом III; «зо-СзН7 аналогично примеру IE дает целевой продукт с т. кип. 185-188°С/15 мм рт. ст., п 1,5009. Пример 3. Этил-3,7-диметил-9-циклопентил-2 ,4-нонадиеноат (I; H, , ). Аналогично способам примера 1А-Д из циклопентилбромида получают З-метил-5-циклопентилпентаналь (II; R R H, , Х СПО), который обрабатывают триэтнлфосфоносенецианатом (III; C2H5) аналогично примеру IE, получая продукт с т. кип. 170-172°С/15 мм рт. ст., п 1,4990. Пример 4. Метпл-3,7-диметил-9-(2-метилциклогексил-1 )-2,4-нонадиеноат (I; R H, R , m 2). Аналогично способам примера 1А-Д из 2метил;циклогексилбро:мида получают 3-метил5- (2-метилциклогексил-1)-пенталь (II; R H, R CH3, /n 2, ), который затем обрабатывают тpимeтилфocфoнoceнeциaтo (III; R2 ) аналогично примеру IE, получают продукт с т. кип. 155-156°С/12 мм рт. ст., « 1,5006. Пример 5. Этил-3,7-диметил- (2,2,6-триметилциклогексил-1 )-2,4-нонадиеноат. Аналогично примеру 1Д из З-метил-5-(2,2,6триметилциклогексил-1 )-центанола (II; R H, Ri CH3, m 2, Х СН20Н) окислением получают альдегид II (Х СНО), который реакцией с триэтилфосфоносенециатом (III; R R3.Q,, аналогично примеру IE дает целевой эфир с т. кип. 135-137°С/б,5 мм рт. ст., /zf 1,5001. В таблице приведены соединения общей формулы (I), полученные аналогичным способом , и их характеристики.
Продолжение
Продолжение
Формула изобретения
Ri
Опособ получения алвдиклических ненасыщенных сложных эфиров общей формулы
(Н)
(СЕ
COjR
(I)
где R и R - водород, алкил с 1-4 атома-ми углерода или
R -геминальный диалкил; R2 - алкил, алкенил, алкинил, содержащий 1-4 атома углерода, или циклоалкил, содержащий 3-5 атомов углерода; т-1 или 2, отличающийся тем, что, альдегид общей формулы
где R, R и m имеют указанные значения; X-СНО, под. взаимодействию с реак10 тивом Виттига общей формулы
(),Р(0),
и
С0,11
где R2 и т имеют указанные значения, , в среде полярнаго растворителя в присутствии конденсирующего агента, например гидрида щелочного металла, с последующим выделением целевого продукта.
Источники информации, принятые во внимание При экспертизе 1. Trippett S. Advances in organic chemistry. Metods and results, 1960, v. 1, № 5, p. 83.



Реферат

Формула


Комментарии