Замещенные 2-фенил-1-(3,4-дигидрокси-5-нитрофенил)-1-этаноны, способ лечения некоторых нарушений центральной и периферической нервной системы и фармацевтическая композиция, содержащая указанные вещества - RU2232748C2
Код документа: RU2232748C2
Чертежи




Описание
Наиболее эффективным методом симптоматического лечения болезни Паркинсона является введение L-β-3,4-дигидроксифенилаланина (L-DOPA), ближайшего предшественника допамина. Перорально вводимый L-DOPA в ходе обмена веществ под действием карбоксилазы ароматических аминокислот (AADC) в основном метаболизирует в периферической системе в допамин, который может вызывать серьезные побочные эффекты, такие как рвота, ортостатическая гипотензия и сердечная аритмия. Поэтому L-DOPA обычно вводят в сочетании с ингибитором AADC периферической системы (бензеразид или карбидопа). При введении вместе с такими ингибиторами в периферической системе образуется мало допамина, но при этом лишь небольшая часть перорально вводимой дозы L-DOPA достигает мозга, так как значительное количество лекарственного средства подвергается метилированию с образованием 3-О-метил-L-DOPA (

В последние годы значительные усилия были направлены на создание новых ингибиторов такого фермента, как катехол-O-метилтрансфераза (СОМТ), в связи с появлением гипотезы о том, что ингибирование этого фермента может вызывать клинические улучшения у пациентов, страдающих болезнью Паркинсона, которые принимают L-DOPA вместе с ингибитором AADC периферической системы. Эффективность ингибиторов СОМТ можно объяснить их способностью подавлять O-метилирование L-DOPA с образованием 3-О-метил-L-DOPA. Ингибирование СОМТ замедляет выделение L-DOPA из плазмы, увеличивая таким образом период полувыведения (увеличение площади под кривой [AUC] без изменения содержания L-DOPA в плазме в зависимости от времени до пиковой или максимальной концентрации). Таким образом, фармакокинетические изменения могут быть весьма благоприятными при увеличении дозы L-DOPA, но это способствует также увеличению AUC, что дополнительно ведет к повышению пиковых концентраций. В свою очередь увеличение пиковых концентраций вызывает такие вредные побочные эффекты, как дискинезия, которая возникает сразу же после введения ингибиторов СОМТ и которую можно ослабить, уменьшая дозу L-DOPA или увеличивая периоды времени между приемами лекарственного средства. Результаты ингибирования СОМТ также отличаются от эффекта, достигаемого введением препарата L-DOPA с регулируемым высвобождением, который замедляет поглощение и уменьшает биологическую доступность. Фармакокинетические изменения, вызываемые ингибированием СОМТ, позволяют сократить дневную дозу L-DOPA путем уменьшения доз или увеличения периодов времени между их введением. В случае периодического введения доз L-DOPA через каждые 2-6 часов при одновременном ингибировании СОМТ средняя концентрация L-DOPA в плазме повышается, при этом общие концентрации пропорционально увеличиваются в большей степени, чем пиковые концентрации, несмотря на уменьшение дозы L-DOPA. Принимая во внимание более медленное выведение L-DOPA, можно сделать вывод о том, что ингибирование СОМТ увеличивает продолжительность действия отдельных доз L-DOPA против болезни Паркинсона (Nutt, J.G., Lancet, 351:1221-1222, 1998).
Наиболее сильнодействующие и избирательные ингибиторы СОМТ, обнаруженные до настоящего времени, являются очень активными и не взаимодействуют с другими ферментами, рецепторами, ионными каналами и транспортерами вплоть до очень высоких доз. Установлено, что некоторые из них оказывают благоприятное действие как в экспериментальных моделях паркинсонизма, так и при лечении пациентов, страдающих болезнью Паркинсона. Указанные ингибиторы СОМТ можно использовать для лечения других заболеваний, в частности депрессии или состояния тревоги, в виде гастрозащищенных лекарственных средств, а также мочегонных и гипотензивных средств.
Наиболее сильнодействующими ингибиторами СОМТ, известными в настоящее время, являются 3,4-дигидрокси-4’-метил-5-нитробензофенон (толкапон, патент Австралии AU-B-69764/87) и (Е)-2-циано-N,N-диэтил-3-(3,4-дигидрокси-5-нитрофенил)акриламид (энтакапон, патент Германии DE 3740383 А 1), для которых характерны ингибиторные константы в низком диапазоне содержания, выраженном в нМ. Толкапон отличается от энтакапона тем, что он является более сильнодействующим ингибитором СОМТ в периферической системе и лучше проникает в мозг, где ингибирует СОМТ. Не установлено, какой из этих двух ингибиторов более полезен для лечения болезни Паркинсона. Можно предположить, что соединения, способные проникать через гематоэнцефалический барьер, являются более эффективными, так как теоретически обосновано, что они могут уменьшать метилирование допамина с образованием 3-метокситирамина и гомованилиновой кислоты. И наоборот, ингибирование в центральной нервной системе может не иметь существенного значения, если более важным действием является защита L-DOPA от разрушения в периферической системе. Это отличие может иметь практические значения, так как использование ингибиторов СОМТ, выводимых из мозга, позволяет избежать нежелательных побочных эффектов в центральной нервной системе, вызываемых этими средствами.
В этой связи интересно отметить, что толкапон не оказывает лечебного действия на болезнь Паркинсона при введении отдельно (Hauser, R.A. et al. Mov. Disord., 1998, 13, 643-647) и у пациентов, принимающих L-DOPA вместе с толкапоном, часто наблюдается повышенная стимуляция допамина, выражающаяся прежде всего в дискинезии и спутанности сознания (Nutt, J.G., Lancet, 351:1221-1222, 1998). Из вышеизложенного следует, что воздействие ингибирования СОМТ на центральную нервную систему является очень незначительным при отдельном введении этого ингибитора, но при введении вместе с L-DOPA ингибирование СОМТ в мозге может быть связано с риском появления симптомов, относящихся к повышенной стимуляции допамина, что может потребовать прекращения лечения.
Другая важная проблема, касающаяся ингибиторов СОМТ, связана с их относительно коротким периодом полувыведения (толкапон, 2 часа [Dingemanse, J. et al. Clin. Pharmacol. Ther., 57:508-517, 1995]; энтакапон, 0,3 часа [Keranen, Т. et al. Eur. J. Clin. Pharmacol., 46:151-157, 1994]). Для устранения этой проблемы толкапон и энтакапон рекомендуется вводить 3 раза в день; поскольку период полувыведения энтакапона значительно короче, чем у толкапона, то рекомендуемая доза энтакапона в два раза превышает дозу толкапона.
Как указывалось выше, 3,4-дигидрокси-5-нитрофенильная группа признана активным фармакофором и одновременно с этим установлено, что присутствие карбонильной группы (например, в толкапоне) или еноновой группы (например, в энтакапоне), сопряженной с фармакофором молекулы, обычно усиливает ингибирование катализируемого СОМТ переноса метильной группы из кофермента S-аденозил-L-метионина в субстрат, содержащий катехольную функциональную группу. Из множества испытанных соединений, содержащих 3,4-дигидрокси-5-нитробензоильную группу, соответствующие бензофеноны признаны наиболее сильнодействующими ингибиторами СОМТ при ED50 < 1 мг/кг (крысы, пероральное введение) (Borgulya J. et al. Helvetica Chimica Acta 72, 952-968, 1989).
Получение гомологов известных биологически активных соединений в качестве потенциально усовершенствованных лекарственных средств хорошо известно и применяется главным образом для оптимизации активности структурно-неспецифических лекарственных средств или для внесения изменений в основное биологическое действие структурно-специфических лекарственных средств (Korolkovas A. Essentials of Medicinal Chemistry, p. 76, 1988 by Wiley & Sons, Inc.). С другой стороны, гомологи не оказывают прогнозируемого влияния на период полувыведения соединения.
Авторы этого изобретения доказали, что нижеследующий высший гомолог 3, 4-дигидрокси-5-нитробензофенона, то есть соединение с еще одной метиленовой группой между замещенной бензоильной группой и фенильной группой, характеризуется избирательным и продолжительным ингибированием СОМТ и что этот эффект является уникальным для ряда высших гомологов.
Это изобретение относится к замещенным 2-фенил-1-(3,4-дигидрокси-5-нитрофенил)-1-этанонам формулы I

где R1 и R2 имеют одинаковые или разные значения и обозначают атомы водорода или группы, гидролизуемые в физиологических условиях, необязательно замещенный низший алканоил или ароил, необязательно замещенный низший алкил или арилсульфонил, необязательно замещенный низший алкилкарбамоил либо вместе взятые они обозначают низшую алкилиденовую или циклоалкилиденовую группу; R3, R4 и R5 имеют одинаковые или разные значения и обозначают водород, необязательно замещенный, насыщенный или частично ненасыщенный низший углеводородный остаток, гидроксил, необязательно замещенную низшую алкокси- или арилоксигруппу, необязательно замещенный арил, необязательно замещенную алканоильную или ароильную группу, низшую алканоиламиногруппу, низшую диалканоиламиногруппу, карбоксил, необязательно замещенную низшую алкилоксикарбонильную или арилоксикарбонильную группу, необязательно замещенный карбамоил, галоген, нитро, амино, низшую алкиламиногруппу либо низшую диалкиламино- или цианогруппу, либо вместе взятые они обозначают алифатические или гетероалифатические кольца, ароматические или гетероароматические кольца, и их фармацевтически приемлемым солям; к применению указанных соединений для профилактики или лечения конкретных патологических состояний у человека и к получению фармацевтических композиций, содержащих указанные соединения.
Термин "низший" означает остатки, имеющие максимум 8, предпочтительно максимум 4 атома углерода. Термин "алкил", отдельно или в сочетании с такими терминами, как "алканоил, алкоксикарбонил, алкилиден, циклоалкилиден, алкоксикарбонилокси, алкиламино", означает насыщенные углеводородные остатки с прямой или разветвленной цепью. Термин "галоген" означает фтор, хлор, бром и йод. Термин "арил" означает карбоциклическую ароматическую группу, предпочтительно моно- или бициклические группы.
Чтобы получить фармацевтические композиции, содержащие соединения формулы I, инертные фармацевтически приемлемые носители смешивают с активными соединениями. Фармацевтически приемлемые носители могут быть твердыми или жидкими веществами.
Твердые препараты включают порошки, таблетки, диспергируемые гранулы и капсулы. Твердый носитель может содержать одно или несколько веществ, которые могут также быть разбавителями, ароматизаторами, солюбилизаторами, смазывающими веществами, суспендирующими средствами, связывающими веществами или дезинтеграторами таблеток; в качестве носителя можно также использовать инкапсулирующий материал.
Фармацевтический препарат предпочтительно является унифицированной лекарственной формой, например упакованным препаратом, причем в упаковке могут находиться раздельно упакованные дозированные формы, такие как упакованные таблетки, капсулы и порошки в пузырьках или ампулах.
Дозы могут изменяться в зависимости от потребностей пациента, серьезности заболевания и конкретного используемого соединения. Общую дневную дозу можно разделить для удобства и вводить порциями в течение всего дня. Необходимая доза в зависимости от конкретной ситуации должна быть определена специалистами в области медицины.
Ниже дано описание прилагаемых чертежей.
На фиг.1 изображен график активности СОМТ в мозге в различные периоды времени после перорального введения соединения В (закрашенные квадраты), энтакапона (незакрашенные кружки) или толкапона (незакрашенные квадраты).
На фиг.2 изображен график активности СОМТ в печени в разные периоды времени после перорального введения соединения В (закрашенные квадраты), энтакапона (незакрашенные кружки) или толкапона (незакрашенные квадраты).
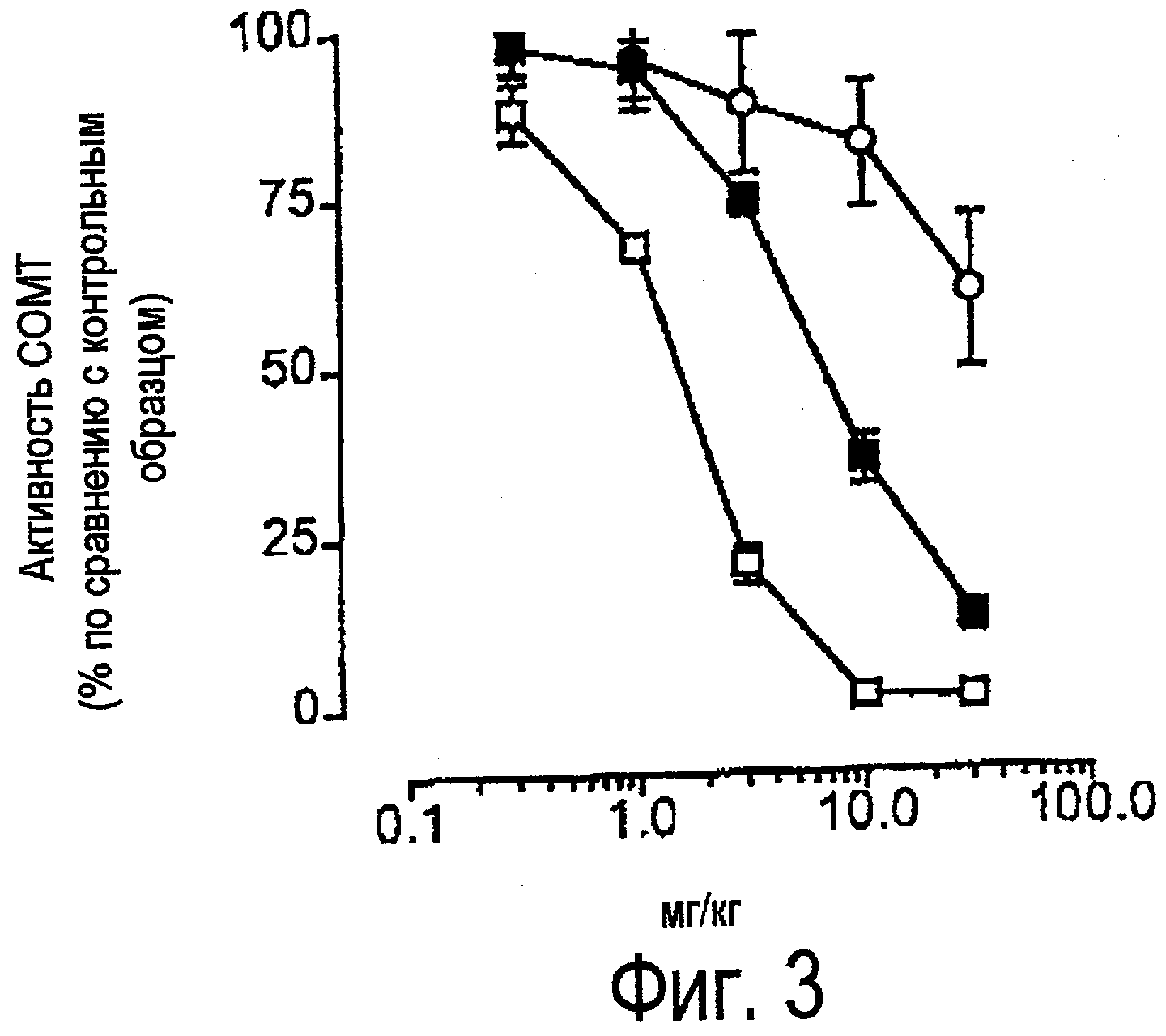
На фиг.3 изображен график ингибирования активности СОМТ в мозге в зависимости от концентрации через один час после перорального введения соединения В (закрашенные квадраты), энтакапона (незакрашенные кружки) или толкапона (незакрашенные квадраты).
На фиг.4 изображен график ингибирования активности СОМТ в печени в зависимости от концентрации через один час после перорального введения соединения В (закрашенные квадраты), энтакапона (незакрашенные кружки) или толкапона (незакрашенные квадраты).
На фиг.5 изображен график активности в горизонтальной плоскости, обусловленной амфетамином, в зависимости от концентрации после перорального введения наполнителя (незакрашенные столбцы), толкапона (закрашенные столбцы), энтакапона (заштрихованные столбцы) и соединения В (перекрестие заштрихованные столбцы).
На фиг.6 изображен график стереотипов поведения, обусловленных амфетамином, в зависимости от концентрации после перорального введения наполнителя (незакрашенные столбцы), толкапона (закрашенные столбцы), энтакапона (заштрихованные столбцы) и соединения В (перекрестно заштрихованные столбцы).
На фиг.1 и 2 каждая точка является средним значением для четырех-восьми экспериментов, выполненных в одной группе, и вертикальные линии соответствуют стандартной ошибке средней (SEM).
На фиг.3 и 4 каждая точка является средним значением для восьми экспериментов, выполненных в одной группе, и вертикальные линии соответствуют стандартной ошибке средней (SEM).
На фиг.5 и 6 каждый столбец представляет среднее значение для восьми экспериментов, выполненных в одной группе, и вертикальные линии соответствуют стандартной ошибке средней (SEM).
Материалы и методы
Анализ активности СОМТ
Во всех экспериментах использовали печень и мозг самцов крыс Wistar в возрасте 60 дней с массой тела 240-260 г (Harlan-Interfauna Iberica, Barcelona, Spain), которых содержали по двое в одной клетке в контролируемых условиях окружающей среды (12-часовой цикл чередования света и темноты при комнатной температуре 24°С). Крыс обезглавливали, органы сразу же удаляли и гомогенизировали в 5 мМ фосфатного буфера с рН 7,8. Активность СОМТ определяли по его способности метилировать адреналин с образованием метанефрина. Дликвоты 0,5 мл гомогенатов печени и всего мозга предварительно инкубировали в течение 20 мин в 0,4 мл фосфатного буфера (5 мМ); затем реакционную смесь инкубировали в течение 15 минут с возрастающими концентрациями эпинефрина (от 0,1 до 2000 мкМ; 0,1 мл) в присутствии насыщающей концентрации S-аденозил-L-метионина, донора метила (мозг 100 мкМ; печень 500 мкМ); инкубационная среда содержала также паргилин (100 мкМ), MgCl2 (100 мкМ) и EGTA (1 мМ). Предварительную и основную инкубацию осуществляли при 37°С в защищенном от света месте при непрерывном встряхивании и без насыщения кислородом.
В экспериментах, выполняемых с целью исследования ингибирующего действия ингибиторов СОМТ на активность фермента, реакционную смесь предварительно инкубировали в течение 20 минут с возрастающими концентрациями испытуемых соединений (от 0,5 до 1000 нМ); инкубацию производили в присутстувии адреналина, концентрация которого была в 5 раз выше соответствующего значения Кm, определенного в экспериментах по насыщению.
В экспериментах, направленных на определение биологической доступности при пероральном введении, периода полувыведения и доступа в мозг, испытуемые соединения вводили при помощи желудочного зонда крысам, голодавшим в течение ночи. Затем через определенные периоды времени животных обезглавливали, удаляли печень и мозг и использовали эти органы для определения активности СОМТ в соответствии с приведенным выше описанием.
В конце инкубационного периода (мозг - 15 минут; печень - 5 минут) пробирки переносили на лед и реакцию прекращали, добавляя 200 мкл 2 М раствора перхлорной кислоты. Образцы центрифугировали (200× градиент, 4 мин, 4°С) и 500 мкл аликвоты супернатанта, которые фильтровали через фильтровальные трубки Spin-X с размером пор 0,22 мкм (Costar), использовали для анализа метанефрина.
Метанефрин анализировали жидкостной хроматографией высокого давления с электрохимическим обнаружением. Нижние пределы обнаружения метанефрина составляли от 350 до 500 фмоль (0,5-1,0 пмоль/мг белка/ч).
Значения Km и Vmах для активности СОМТ рассчитывали на основании анализа нелинейной регрессии, выполняемого при помощи статистического программного обеспечения GraphPad Prism (Motulsky, H.G. et al. GraphPad Prisms, GraphPad Prism Software Inc., San Diego, 1994). Для вычисления значений IC50 параметры уравнения для ингибирования одного участка приводили в соответствие с экспериментальными данными. Геометрические средние приведены в 95% границах доверительного интервала и арифметические средние приведены со стандартной ошибкой средней (SEM). Статистический анализ выполняли при помощи направленного дисперсионного анализа (ANOVA), используя для сравнения результатов множественный тест сравнительной оценки Ньюмана-Кеулса.
Содержание белка в гомогенатах определяли по методу Брэдфорда (Bradford, M.M. Anal. Biochem., 72:248-254, 1976), используя в качестве эталона сывороточный альбумин человека. Содержание белка было одинаковым во всех образцах (примерно 5 мг/500 мкл гомогената).
Анализ поведения
Экспериментальная методика, используемая в данном исследовании, направлена на определение обусловленной амфетамином гиперактивности допаминергических систем мозга под действием ингибиторов СОМТ. С этой целью 128 крыс распределяли в 16 групп и вводили им наполнитель или один из трех ингибиторов СОМТ, испытанных за 6 часов до оценки поведения. Во всех группах анализ поведения начинали через 15 минут после подкожной инъекции наполнителя или возрастающих доз амфетамина (0,5, 2,0 или 4,0 мг/кг).
В день испытания за 7 часов до начала эксперимента животных помещали в слабо освещенное помещение с плохой звукопроницаемостью, расположенное отдельно от помещения, в котором находились клетки с остальными животными; температура и влажность были такими же, как и в помещении с остальными животными. Спонтанную двигательную активность измеряли при помощи монитора активности грызунов San Diego Instruments (модель Flex Field, San Diego Instruments, San Diego, CA), используя 48 инфракрасных датчиков движения. Нижняя рама размером 50,5×50,5 см с 32 фотоэлементами (расположенными на расстоянии 2,5 см друг от друга) была установлена в продольном направлении на высоте 5 см от пола. Верхняя рама размером 50,5×50,5 см с 16 фотоэлементами (расположенными на расстоянии 2,5 см друг от друга) была установлена в продольном направлении на высоте 15 см от пола. В качестве испытательного поля была использована акриловая камера с внутренними размерами 40×40×37 см. Десятиминутную регистрацию активности начинали сразу же после помещения испытуемого объекта в центр камеры. Активность измеряли автоматически при помощи персонального компьютера с использованием программы Flex Field (San Diego Instruments), в которой предусмотрены определяемые пользователем интервалы всех прерываний. Регистрировали три параметра обычных спонтанных движений: активность в горизонтальной плоскости, активность в вертикальной плоскости и время нахождения в центре. Количественное определение стереотипного поведения (интенсивное обнюхивание, повторяющиеся движения головы и лап, лизание и кусание в соответствии с определением Feldman, R.S., Meyer, J.S., Quenzer, L.F. Principles of Neuropharmacology, 1997, Sinauer Associates, Inc. Publishers, Sunderland, MA) производил независимый наблюдатель после того, как оно было записано на пленку при помощи видеомагнитофона (VP200, HVS Image, Ltd), расположенного на высоте 70 см над испытательным полем. Животные привыкали к окружению испытательного поля в течение одного часа до анализа поведения.
Результаты
Исследование ингибирования СОМТ in vitro
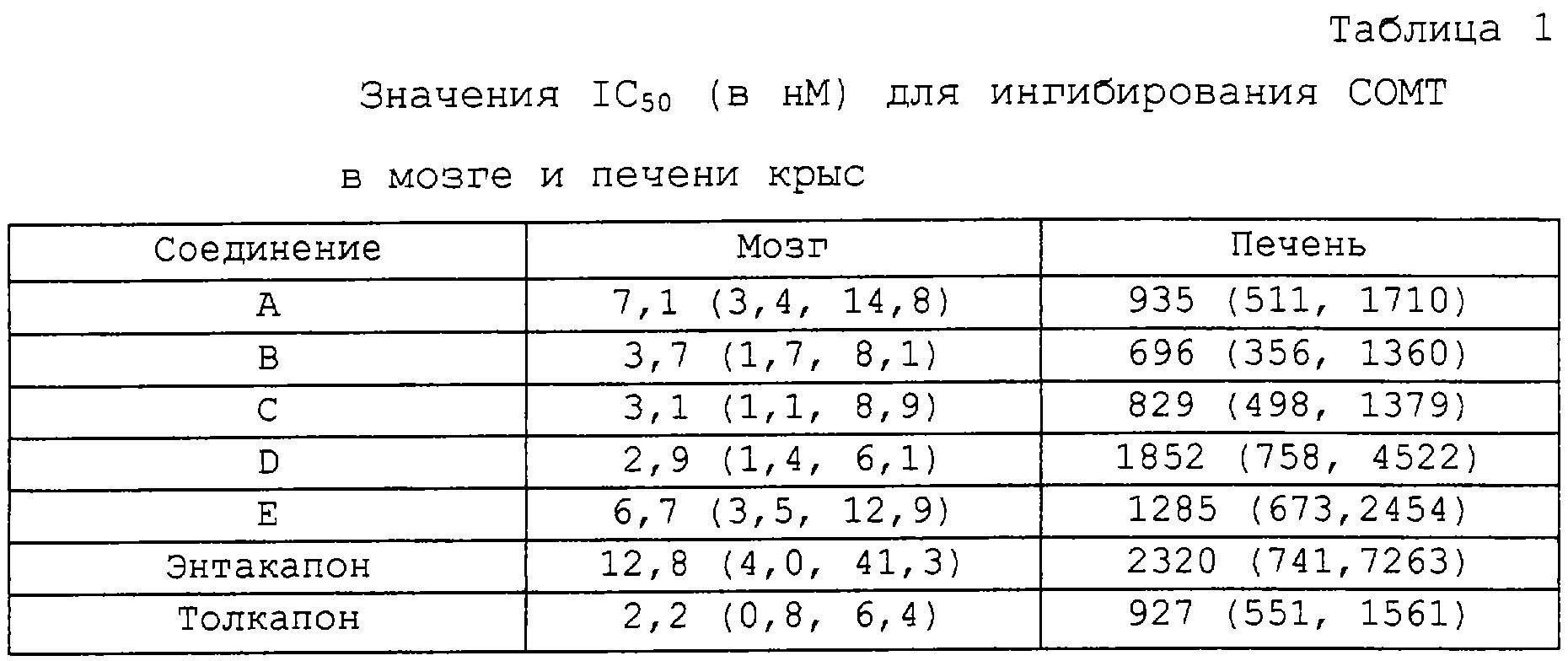
Инкубация гомогенатов печени и всего мозга в присутствии возрастающих концентраций адреналина вызывала образование метанефрина в зависимости от концентрации, в результате чего были получены значения Кm(в мкМ) и Vmax (в нмоль мг белка-1 ч-1), равные соответственно 0,7 (0,5, 0,9; 95% доверительные интервалы) и 1,31 ± 0,02 для мозга и 238,5 (128,5; 348,5) и 61,6 ±3,8 для печени. На основании этих кинетических параметров выбирали насыщающую концентрацию адреналина для исследований ингибирования (печень, адреналин = 1000 мкМ; мозг, адреналин = 100 мкМ). Соединения формул А-Е,

которые испытывали вместе с энтакапоном и толкапоном (эталонные соединения), вызывали зависящее от концентрации уменьшение O-метилирования адреналина со значениями IC50 в низком диапазоне, выраженном в нМ, для мозга и в диапазоне, выраженном в мкМ, для печени (см. таблицу 1).
Установлено, что соединения формул А-Е являются сильнодействующими ингибиторами СОМТ в мозге и печени, причем максимальное ингибирующее действие достигается через 30 минут после перорального введения этих соединений (таблица 2). Для соединения А характерен одинаковый профиль ингибирования СОМТ в мозге и печени, в то время как соединение Е более эффективно воздействует на СОМТ печени, чем на СОМТ мозга. Аналогичным образом соединение В является гораздо более сильным ингибитором СОМТ в периферической системе, чем в мозге. Соединения с более длинными углеродными цепями менее эффективно ингибируют СОМТ мозга по сравнению с их воздействием на СОМТ печени. Это различие может иметь непосредственное отношение к трудностям, связанным с поступлением лекарственного средства в мозг. Соединения с короткими углеродными цепями (А, В и С) не одинаково эффективно ингибируют СОМТ в периферической и центральной нервной системе, но это различие не является таким же значительным, как в случае соединений с длинными углеродными цепями. При рассмотрении продолжительности ингибирующего действия на СОМТ печени становится очевидно, что соединение В (цепь из 2 атомов углерода) обладает особенно продолжительным действием. Ингибирование СОМТ печени этим соединением через 9 часов после перорального введения составляет почти 70%, в то время как соединения с более короткими и более длинными углеродными цепями не отличаются таким продолжительным действием. Толкапон через 6 и 9 часов после введения вызывает значительное ингибирование СОМТ мозга и печени. Как показано на фиг.1 и 2, через девять часов после введения соединение В и толкапон в равной степени эффективно ингибируют СОМТ печени, в то время как энтакапон почти совсем не ингибирует СОМТ через этот период времени. С другой стороны, соединение В и энтакапон в гораздо меньшей степени, чем толкапон, ингибируют СОМТ мозга.

Соединения F-J (см. ниже) также испытывали через 6 и 9 часов после введения, при этом было установлено, что профиль ингибирования у этих соединений аналогичен описанному для соединения В (Таблица 3).

Эффективность соединения В, толкапона и энтакапона в отношении ингибирования СОМТ в мозге и печени определяли в результате выполнения экспериментов, в которых крысам вводили возрастающие дозы испытуемых соединений (от 0/3 до 30 мг/кг). При выполнении этих экспериментов крыс умерщвляли через 1 час после введения соединений (при tmax) и определяли активность СОМТ в соответствии с вышеописанным методом. Полученные результаты приведены на фиг.3 и 4, показывают, что соединение В и толкапон в равной степени эффективно ингибируют СОМТ в печени и имеют значения ED50, соответственно равные 0,7±1/1 и 0,7±0,1; энтакапон является несколько менее эффективным и имеет значение ED50, равное 1,9±0,2 мг/кг. Однако соединение В менее эффективно, чем толкапон, ингибирует СОМТ в мозге, при этом значения ED50 соответственно равны 5,3±1,1 и 1,6±0,1 мг/кг. При введении наибольшей испытанной дозы (30 мг/кг) энтакапон не достигает 50% уровня ингибирования.

Анализ поведения
Амфетамин является сильнодействующим психостимулятором, который в зависимости от введенной дозы повышает двигательную активность и различное стереотипное поведение. Одна низкая доза амфетамина, введенная крысам, вызывает характерную реакцию, отличительной особенностью которой является повышенная двигательная активность, подъем на задние лапы, обнюхивание и кивательный гиперкинез головы. Постепенное увеличение дозы амфетамина вызывает понижение двигательной активности и менее частый подъем на задние лапы, которые сменяются сосредоточенным стереотипом (бесцельные движения, повторяемые в относительно неизменной манере), ограниченным небольшим участком пода клетки (Feldman, R.S., Meyer, J.S., Quenzer, L.F. Principles of Neuropharmacology, 1997, Sinauer Associates, Inc. Publishers, Sunderland, MA). Допаминергическая система мозга традиционно имеет важное значение для стимуляции амфетамином двигательной активности и стереотипного поведения. Что касается анатомических субстратов действия амфетамина, то известно, что стимуляция допаминергической активности в прилегающей к ядру области имеет непосредственное отношение к вызываемой амфетамином двигательной активности, в то время как стимуляция допаминергической активности в хвостатом ядре связана со стереотипами сосредоточенного поведения, обусловленными высокими дозами амфетамина.
В соответствии с прогностическими данными установлено, что низкие дозы амфетамина (0,5 и 2,0 мг/кг, подкожная инъекция) вызывают зависящее от дозы увеличение активности в горизонтальной плоскости и более частый подъем на задние лапы, при этом отсутствуют признаки стереотипного поведения (фиг.5 и 6). В отличие от этого установлено, что высокая доза амфетамина (4,0 мг/кг, подкожная инъекция) не вызывает дальнейшего повышения двигательной активности, а ведет к возникновению стереотипии, которая продолжается в течение 250 секунд из 600 секунд периода наблюдения. Установлено, что толкапон (30 мг/кг, пероральное введение), введенный за 6 часов до введения амфетамина, значительно увеличивает двигательную активность у крыс, получивших 0,5 и 2,0 мг/кг амфетамина. В отличие от этого у крыс, которым вводили 4,0 мг/кг амфетамина, толкапон вызывал значительное сокращение двигательной активности и в два раза увеличивал продолжительность стереотипного поведения. У крыс, которым вводили энтакапон (30 мг/кг, пероральное введение) или соединение В за шесть часов до введения амфетамина, наблюдалась картина двигательной активности и стереотипного поведения, характерная для соответствующих контрольных препаратов.
Выводы
Соединения формулы I являются сильнодействующими ингибиторами катехол-O-метилтрансферазы (СОМТ) и обладают ценными фармацевтическими свойствами для лечения некоторых нарушений центральной и периферической нервной системы, таких как болезнь Паркинсона и относящиеся к паркинсонизму нарушения, желудочно-кишечные расстройства, отеки и гипертензия, при лечении которых благоприятное действие может оказать подавление O-метилирования катехоламинов. Возможность использовать ингибитор СОМТ продолжительного действия с ограниченным доступом в мозг, такой как соединение В, открывает новые перспективы для указанных методов лечения благодаря улучшению избирательности и более длительному ингибированию СОМТ. Это особенно важно для лечения пациентов, страдающих болезнью Паркинсона и принимающих L-DOPA вместе с ингибитором AADC периферической системы. Вследствие того, что ингибиторы СОМТ, которые легко проникают в мозг, могут вызывать чрезмерную допаминергическую стимуляцию, выражающуюся, в частности, в дискинезии и спутанности сознания у пациентов, принимавших L-DOPA, предполагается, что использование такого вещества, как соединение В, позволит избежать неблагоприятных эффектов при сохранении преимуществ вещества продолжительного действия.
Описываемое здесь изобретение проиллюстрировано нижеследующими примерами получения, которые не ограничивают объем настоящего изобретения. Специалистам в этой области должны быть очевидны альтернативные способы и аналогичные структуры.
Пример 1. 1-(3, 4-Дигидрокси-5-нитрофенил)-2-фенил-1-этанон
Раствор 20 г (82,64 ммоль) O-бензилванилина в 200 мл сухого тетрагидрофурана медленно добавляют к перемешиваемому раствору бензилмагнийхлорида (103,30 ммоль) в 150 мл диэтилового эфира при 10°С в течение 20 минут, после чего реакционную смесь кипятят в течение 10 минут, охлаждают, гасят смесью льда и разбавленной хлористоводородной кислоты и упаривают при пониженном давлении. Остаток растворяют в дихлорметане, раствор промывают насыщенным раствором соли, сушат сульфатом натрия и растворитель выпаривают при пониженном давлении с получением кристаллического остатка, который перекристаллизовывают из диэтилового эфира и петролейного эфира. Получают 1-(4-бензилокси-3-метоксифенил)-2-фенил-1-этанол в виде белых кристаллов, т.п.97-98°С.
Раствор 10 г (30 ммоль) вышеуказанного вторичного спирта в 90 мл дихлорметана и 30 мл диэтилового эфира охлаждают до 0°С и, перемешивая, добавляют 7,5 г целита (Сеlite®) и 9 г (90 ммоль) триоксида хрома. Реакционную смесь перемешивают в течение ночи при комнатной температуре, фильтруют и фильтрат упаривают при пониженном давлении. Кристаллический остаток перекристаллизовывают из смеси дихлорметана и диэтилового эфира, что дает 1-(4-бензилокси-3-метоксифенил)-2-фенил-1-этанон в виде белых кристаллов, т.п.134-135°С.
Раствор 5,9 г (17,8 ммоль) вышеуказанного кетона в смеси дихлорметана (60 мл) и 30% бромистоводородной кислоты в уксусной кислоте (27 мл) перемешивают в течение 1,5 часов при комнатной температуре, дихлорметан выпаривают при пониженном давлении и реакционную смесь выливают в 200 мл смеси воды со льдом. Образовавшийся осадок отфильтровывают и сушат в вакууме, что дает 1-(4-гидрокси-3-метоксифенил)-2-фенил-1-этанон в виде бежевых кристаллов, т.п.107-108°С.
К раствору 3,87 г (16 ммоль) вышеуказанного промежуточного соединения в 40 мл уксусной кислоты добавляют 1,4 мл (17,6 ммоль) 12,6 М раствора азотной кислоты, охлаждаемого до 10°С, реакционную смесь перемешивают в течение 30 минут при комнатной температуре и выливают в смесь воды со льдом. Образовавшийся осадок отфильтровывают, промывают водой и сушат, что дает 1-(4-гидрокси-3-метокси-5-нитрофенил)-2-фенил-1-этанон в виде желтого порошка, т.п. 129-130°С.
Вышеуказанное нитропроизводное соединение (3,76 г, 13 ммоль) кипятят со смесью азеотропной бромистоводородной кислоты (37 мл) и 30% НВr в уксусной кислоте (18 мл) в течение 16 часов и охлажденную реакционную смесь выливают в смесь воды со льдом. Образовавшийся осадок отфильтровывают, тщательно промывают водой и перекристаллизовывают из уксусной кислоты, что дает целевой продукт в виде желтых кристаллов, т.п.181-182°С.
Примеры 2-12
В соответствии с вышеописанным способом и подобными методиками, известными специалистам в этой области, при использовании соответствующих металлорганических реагентов получают нижеследующие соединения:
1-(3,4-дигидрокси-5-нитрофенил)-2-(4-гидроксифенил)-1-этанон;
1-(3, 4-дигидрокси-5-нитрофенил)-2-(2-метилфенил)-1-этанон;
1-(3,4-дигидрокси-5-нитрофенил)-2-(3-метилфенил)-1-этанон;
1-(3,4-дигидрокси-5-нитрофенил)-2-(4-метилфенил)-1-этанон;
1-(3,4-дигидрокси-5-нитрофенил)-2-(4-бутилфенил)-1-этанон;
1-(3,4-дигидрокси-5-нитрофенил)-2-(3,4-диметилфенил)-1-этанон;
1-(3, 4-дигидрокси-5-нитрофенил)-2-(3,4-диметоксифенил)-1-этанон;
1-(3,4-дигидрокси-5-нитрофенил)-2-(4-бутилоксифенил)-1-этанон;
1-(3, 4-дигидрокси-5-нитрофенил)-2-(1-метил-5-индолил)-1-этанон;
1-(3,4-дигидрокси-5-нитрофенил)-2-(3,4-метилендиоксифенил)-1-этанон;
1-(3,4-дигидрокси-5-нитрофенил)-2-(2,4, 6-триметилфенил)-1-этанон.
Пример 13. 1-(3,4-Дигидрокси-5-нитрофенил)-2-(2-метилфенил)-1-этанон
К смеси гваякола (1,24 г, 10 ммоль) о-толилуксусной кислоты (1,50 г, 10 ммоль) и ZnCl2 (5 г, 36,7 ммоль) добавляют РОСl3 (15 мл, 161 ммоль), полученную суспензию перемешивают и нагревают до 80°С в течение 1,5 часов. Реакционную смесь охлаждают и выливают в смесь воды со льдом, полученную суспензию перемешивают при комнатной температуре в течение 1 часа и экстрагируют этилацетатом. Органический слой отделяют, промывают насыщенным раствором соли и сушат сульфатом натрия. Летучие вещества выпаривают при пониженном давлении и остаток растворяют в диэтиловом эфире. Раствор дважды экстрагируют 50 мл 2 N водного раствора NaOH, объединенные водные слои объединяют и подкисляют хлористоводородной кислотой до рН 2. Полученную эмульсию экстрагируют этилацетатом, органический слой промывают насыщенным раствором соли, сушат и растворитель выпаривают при пониженном давлении. Остаток хроматографируют на колонке из силикагеля смесью петролейного эфира и этилацетата, что дает 1-(4-гидрокси-3-метоксифенил)-2-(2-метилфенил)-1-этанон в виде не совсем белых кристаллов, т.п.79-81°С.
К раствору 4,01 г (16 ммоль) вышеуказанного промежуточного соединения в 40 мл уксусной кислоты добавляют 1,4 мл (17,6 ммоль) 12,6 М раствора азотной кислоты, охлаждаемого до 10°С, реакционную смесь перемешивают в течение 30 минут при комнатной температуре и выливают в смесь воды со льдом. Образовавшийся осадок отфильтровывают, промывают водой и сушат, что дает 1-(4-гидрокси-3-метокси-5-нитрофенил)-2-(2-метилфенил)-1-этанон в виде желтого порошка, т.п.150-151°С.
Вышеуказанное нитропроизводное соединение (3,91 г, 13 ммоль) кипятят со смесью азеотропной бромистоводородной кислоты (37 мл) и 30% НВr в уксусной кислоте (18 мл) в течение 16 часов и охлажденную реакционную смесь выливают в смесь воды со льдом. Образовавшийся осадок отфильтровывают, тщательно промывают водой и перекристаллизовывают из уксусной кислоты, что дает целевой продукт в виде желтых кристаллов, т.п.128-129°С.
Пример 14-21
В соответствии с вышеописанным способом и подобными методиками, известными специалистам в этой области, при использовании должным образом замещенных фенилуксусных кислот получают нижеследующие соединения:
1-(3,4-дигидрокси-5-нитрофенил)-2-(4-карбоксифенил)-1-этанон;
1-(3, 4-дигидрокси-5-нитрофенил)-2-(2-нитрофенил)-1-этанон;
1-(3,4-дигидрокси-5-нитрофенил)-2-(4-бифенил)-1-этанон;
1-(3,4-дигидрокси-5-нитрофенил)-2-(3-цианофенил)-1-этанон;
1-(3,4-дигидрокси-5-нитрофенил)-2-(1-нафтил)-1-этанон;
1-(3,4-дигидрокси-5-нитрофенил)-2-(2-нафтил)-1-этанон;
1-(3, 4-дигидрокси-5-нитрофенил)-2-(2-хлорфенил)-1-этанон;
1-(3,4-дигидрокси-5-нитрофенил)-2-(4-хлорфенил)-1-этанон.
Пример 22. 1-(3, 4-Диацетокси-5-нитрофенил)-2-фенил-1-этанон
Суспензию 9,20 г (33,6 ммоль) 1-(3,4-дигидрокси-5-нитрофенил)-2-фенил-1-этанона в 90 мл дихлорметана обрабатывают 7,85 г (100 ммоль) ацетилхлорида, 7,51 г (95 ммоль) пиридина и каталитическим количеством 4-диметиламинопиридина. Смесь перемешивают в течение 1 часа при комнатной температуре и полученный раствор последовательно промывают охлаждаемым льдом, 0,2 N раствором хлористоводородной кислоты, 1% водным раствором бикарбоната натрия и насыщенным раствором соли. Высушенный (Na2SO4) раствор упаривают при пониженном давлении, остаток перекристаллизовывают из смеси диэтилового эфира и петролейного эфира, что дает целевой продукт в виде желтых кристаллов, т.п.94-95°С.
Примеры 23-27
В соответствии с вышеописанным способом и подобными методиками, известными специалистам в этой области, при использовании должным образом замещенных 1-(3, 4-дигидрокси-5-нитрофенил)-2-фенил-1-этанонов и галогенидов или ангидридов кислот получают нижеследующие соединения:
1-(3,4-диметоксиметилокси-5-нитрофенил)-2-фенил-1-этанон;
1-(3,4-дибутирилокси-5-нитрофенил)-2-фенил-1-этанон;
1-(3,4-ди(4-толилсульфонилокси)-5-нитрофенил)-2-фенил-1-этанон;
1-(3, 4-дибутирилоксикарбонилокси-5-нитрофенил)-2-фенил-1-этанон;
1-(3,4-диацетокси-5-нитрофенил)-2-(4-ацетоксифенил)-1-этанон.
Реферат
Изобретение относится к области органической химии, конкретно к замещенным 2-фенил-1-(3,4-дигидрокси–5-нитрофенил)-1-этанонам. Описывается соединение формулы I:

где R1 и R2 имеют одинаковые или разные значения и обозначают атомы водорода или необязательно замещенный низший алканоил; R3, R4 и R5 имеют одинаковые или разные значения и обозначают водород, насыщенный низший углеводородный остаток, галоген или ароматические кольца и его фармацевтически приемлемые соли. Также описывается способ лечения пациента, страдающего некоторыми нарушениями центральной и периферической нервной системы, в котором снижение O-метилирования катехоламинов может оказывать благоприятное лечебное действие на такие заболевания, как болезнь Паркинсона и нарушения, относящиеся к паркинсонизму, желудочно-кишечные расстройства, отеки и гипертензия. Кроме того, описывается фармацевтическая композиция, обладающая СОМТ действием. Технический результат – получены новые соединения, обладающие полезными биологическими свойствами. 6 н. и 1 з.п.ф-лы, 6 ил., 4 табл.

Формула


Комментарии