Новое циклогексановое производное, его пролекарство и его соль и содержащее их терапевтическое средство от диабета - RU2394015C2
Код документа: RU2394015C2
Описание
Область техники
Настоящее изобретение относится к циклогексановым производным, их пролекарствам и их фармацевтически приемлемым солям, которые являются полезными в качестве лекарственных средств. В частности, настоящее изобретение относится к циклогексановым производным, их пролекарствам и их солям, которые являются полезными в качестве профилактических или терапевтических средств, которые вызывают эффект путем ингибирования Na+-глюкозного котранспортера 2 (SGLT2), от диабета, такого как инсулин-зависимый сахарный диабет (диабет типа I) и инсулин-независимый сахарный диабет (диабет типа II), диабетических осложнений и таких заболеваний, как ожирение, вызванное гипергликемией.
Уровень техники
В последние годы количество диабетических пациентов увеличилось из-за предпочтений питания по западному типу и постоянного недостатка в физических нагрузках и т.п. У диабетических пациентов снижены как секреция инсулина, так и чувствительность к инсулину в результате хронической гипергликемии, и это способствует дальнейшему повышению уровня сахара в крови, ухудшая состояние больного. В качестве терапевтических средств от диабета использовали бигуанидные лекарственные средства, лекарственные средства на основе сульфонилмочевины, лекарственные средства-ингибиторы гликозидазы, средства, улучшающие резистентность к инсулину, и т.п. Однако, что касается побочных эффектов, связанных с этими средствами, для бигуанидных лекарственных средств есть сведения о молочном ацидозе, для лекарственных средств на основе сульфонилмочевины есть сведения о гипогликемии, а для ингибиторов гликозидазы есть сведения о диарее, и поэтому в настоящее время существует ситуация, когда действительно необходима разработка терапевтических средств от диабета, имеющих новый механизм действия, отличный от механизма перечисленных лекарственных средств.
Сообщалось (см. Непатентный Документ 1), что флоризин, производное глюкозы природного происхождения, ингибирует повторное поглощение избыточного количества глюкозы в почках путем ингибирования натрий-зависимого глюкозного котранспортера 2 (SGLT2), присутствующего на SI участке проксимального извитого почечного канальца, и способствует экскреции глюкозы, таким образом, снижая уровень сахара в крови, и с этого времени стали широко проводиться исследования терапевтических средств от диабета, основанных на ингибировании SGLT2.
Например, в Японской Патентной Публикации 2000-080041 A (Патентный Документ 1), Международной Публикации №№ WO01/068660 (Патентный Документ 2), WO04/007517 (Патентный Документ 3) и т.п. сообщается о соединениях, используемых в качестве ингибиторов SGLT2. Однако, поскольку флоризин и соединения, описанные в указанных выше Патентных заявках, содержат глюкозный фрагмент как общую часть их структуры, что считается проблемой для перорального введения, эти соединения легко гидролизуются под действием глюкозидазы, присутствующей в тонком кишечнике или т.п., и их фармакологическое действие быстро прекращается. В случае флоризина есть сообщения, что флоретин, агликон флоризина, сильно ингибирует легкодиффундирующий тип транспортера сахара. Например, сообщалось о неблагоприятном эффекте снижения внутримозговой концентрации глюкозы при внутривенном введении флоризина крысам см., например, Непатентный Документ 2).
Затем в целях предотвращения такого разложения и улучшения абсорбции были предприняты попытки преобразования таких соединений в их пролекарства. Когда вводят пролекарство, желательно, чтобы это пролекарство подходящим образом метабилизировалось в органе, являющимся мишенью, или вблизи него с преобразованием в активное соединение. Однако, поскольку в живом организме присутствуют различные метаболические ферменты и разница между отдельными организмами существенна, во многих случаях трудно стабильно обеспечивать действие пролекарства. Кроме того, были предприняты попытки преобразования гликозидной связи соединения в углерод-углеродную связь (см. Патентные Документы 4 - 8). Однако необходимо дальнейшее улучшение свойств, необходимых для лекарственных средств, включая активность, метаболическую стабильность и т.п.
Патентный Документ 1: Японская Патентная Публикация 2000-080041 A
Патентный Документ 2: Международная Публикация No.WO01/068660, Брошюра
Патентный Документ 3: Международная Публикация No. WO04/007517, Брошюра
Патентный Документ 4: Патентная Публикация США 2001/041674 A
Патентный Документ 5: Патентная Публикация США 2002/137903 A
Патентный Документ 6: Международная Публикация No. WO01/027128, Брошюра
Патентный Документ 7: Международная Публикация No.WO02/083066, Брошюра
Патентный Документ 8: Международная Публикации No.WO0/013118, Брошюра
Непатентный Документ 1: J. Clin. Invest., 93, 1037 (1994)
Непатентный Документ 2: Stroke, 14, 388 (1983)
Раскрытие изобретения
Задача, решаемая настоящим изобретением
Целью настоящего изобретения является обеспечение циклогексановых производных, обладающих подходящими свойствами, необходимыми для лекарственных средств.
Целью настоящего изобретения является, в частности, обеспечение циклогексановых производных, которые обладают действием, направленным на снижение уровня сахара в крови, и, кроме того, обладают подходящими свойствами, необходимыми для лекарственных средств, такими как пролонгированное действие, метаболическая стабильность и безопасность.
Кроме того, целью настоящего изобретения является обеспечение фармацевтических композиций, которые используют для профилактики или лечения диабета, такого как инсулин-зависимый сахарный диабет (диабет типа I) и инсулин-независимый сахарный диабет (диабет типа II), диабетических осложнений, и заболеваний, таких как ожирение, вызванное гипергликемией.
Средства для решения задач
В результате глубоких исследований, проведенных авторами настоящего изобретения для решения указанных выше задач, авторы настоящего изобретения обнаружили, что циклогексановые производные, представленные формулой (I), обладают отличным действием по ингибированию SGLT2, что привело к созданию настоящего изобретения.
А именно в соответствии с одним аспектом настоящего изобретения, обеспечивается циклогексановое производное, представленное формулой (I):
Формула 1

где
A представляет собой -O-, -CH2- или -NH-;
n представляет собой целое число, выбранное из 0 и 1;
R6 и R7, каждый независимо, представляет собой атом водорода или C1-C6 алкильную группу;
m представляет собой целое число, выбранное из 1-3;
Q выбран из Q1-Q5, представленных следующими формулами:
Формула 2

где
R1, R2, R3, R4 и R5, каждый независимо, выбран из атома водорода, гидроксигруппы, C1-C6 алкильной группы, которая может быть замещена одним или несколькими Ra, C1-C6 алкоксигруппы, которая может быть замещена одним или несколькими Ra, C7-C14 аралкилоксигруппы, которая может быть замещена одним или несколькими Rb, и -OC(=O)Rx;
Rx представляет собой C1-C6 алкильную группу, которая может быть замещена одним или несколькими Ra, арильную группу, которая может быть замещена одним или несколькими Rb, гетероарильную группу, которая может быть замещена одним или несколькими Rb, C1-C6 алкоксигруппу, которая может быть замещена одним или несколькими Ra, или -NReRf,
Ar1 представляет собой ариленовую группу, которая может быть замещена одним или несколькими Rb, или гетероариленовую группу, которая может быть замещена одним или несколькими Rb, где гетероариленовая группа может образовывать конденсированное кольцо с ароматическим карбоциклом или ароматическим гетероциклом;
Ar2 представляет собой арильную группу, которая может быть замещена одним или несколькими Rb, или гетероарильную группу, которая может быть замещена одним или несколькими Rb;
Ra, каждый независимо, выбран из атома галогена, гидроксигруппы, цианогруппы, нитрогруппы, карбоксигруппы, C1-C6 алкоксигруппы, которая может быть замещена одним или несколькими Rс, арильной группы, которая может быть замещена одним или несколькими Rd, арилоксигруппы, которая может быть замещена одним или несколькими Rd, гетероарильной группы, которая может быть замещена одним или несколькими Rd, гетероарилоксигруппы, которая может быть замещена одним или несколькими Rd, меркаптогруппы, C1-C6 алкилтиогруппы, C1-C6 алкилсульфинильной группы, C1-C6 алкилсульфонильной группы, -NRfRg и C1-C6 алкилкарбонильной группы, которая может быть замещена одним или несколькими Rс;
Rb, каждый независимо, выбран из C1-C6алкильной группы, которая может быть замещена одним или несколькими Rс, C1-C6алкенильной группы, которая может быть замещена одним или несколькими Rс, C3-C8 циклоалкильной группы, которая может быть замещена одним или несколькими Rс, С7-С14 аралкильной группы, которая может быть замещена одним или несколькими Rd, атома галогена, гидроксигруппы, цианогруппы, нитрогруппы, карбоксигруппы, C1-C6алкоксигруппы, которая может быть замещена одним или несколькими Rс, арильной группы, которая может быть замещена одним или несколькими Rd, арилоксигруппы, которая может быть замещена одним или несколькими Rd, гетероарильной группы, которая может быть замещена одним или несколькими Rd, гетероарилоксигруппы, которая может быть замещена одним или несколькими Rd, меркаптогруппы, C1-C6алкилтиогрупп, C1-C6алкилсульфинильной группы, C1-C6алкилсульфонильной группы, -NRfRg, C1-C6алкилкарбонильной группы, которая может быть замещена одним или несколькими Rс, C1-C3алкилендиоксигруппы, гетероциклильной группы, -CO2Ri и -CONRiRj;
Rс, каждый независимо, выбран из атома галогена, гидроксигруппы, цианогруппы, нитрогруппы, карбоксигруппы, C1-C6 алкоксигруппы, которая может быть замещена одним или несколькими атомами галогена, арильной группы, которая может быть замещена одним или несколькими Rd, арилоксигруппы, которая может быть замещена одним или несколькими Rd, гетероарильной группы, которая может быть замещена одним или несколькими Rd, гетероарилоксигруппы, которая может быть замещена одним или несколькими Rd, аминогруппы, C1-C6алкиламиногруппы и ди(C1-C6 алкил)аминогруппы;
Rd, каждый независимо, выбран из C1-C6алкильной группы, которая может быть замещена одним или несколькими атомами галогена, C1-C6алкоксигруппы, которая может быть замещена одним или несколькими атомами галогена, C7-C14 аралкильной группы, которая может быть замещена одним или несколькими атомами галогена, атома галогена, гидроксигруппы, цианогруппы, нитрогруппы, аминогруппы, C1-C6алкиламиногруппы и ди(C1-C6 алкил)аминогруппы;
Re представляет собой атом водорода, C1-C6алкильную группу, которая может быть замещена одним или несколькими Rс, арильную группу, которая может быть замещена одним или несколькими Rd, или гетероарильную группу, которая может быть замещена одним или несколькими Rd;
Rf представляет собой атом водорода или C1-C6алкильную группу, которая может быть замещена одним или несколькими Rс;
Rg представляет собой атом водорода, C1-C6алкильную группу, которая может быть замещена одним или несколькими Rс, C1-C6алкилкарбонильную группу, которая может быть замещена одним или несколькими Rс, арильную группу, которая может быть замещена одним или несколькими Rd, гетероарильную группу, которая может быть замещена одним или несколькими Rd, карбамоильную группу, C1-C6алкоксикарбоксигруппу, которая может быть замещена одним или несколькими Rс, или C1-C6алкилсульфонильную группу, которая может быть замещена одним или несколькими Rс;
Re и Rf, и Rf и Rg соответственно, вместе с атомом азота, с которым они связаны, могут образовывать 4-7-членный гетероцикл; и
Ri и Rj, каждый независимо, выбран из атома водорода, C1-C6 алкильной группы, которая может быть замещена одним или несколькими Rс, C3-C8 циклоалкильной группы, которая может быть замещена одним или несколькими Rс, и C7-C14 аралкильной группы, которая может быть замещена одним или несколькими Rd, или его пролекарство, или фармацевтически приемлемая соль.
В соответствии с другим аспектом настоящего изобретения обеспечивается циклогексановое производное, представленное формулой (I), где n имеет значение 1, или его пролекарство или фармацевтически приемлемая соль. В данном случае A, предпочтительно, представляет собой -O- или -NH-. Кроме того, система замещения в Ar1, предпочтительно, представляет собой такую, в которой заместитель -(CR6R7)m-Ar2 связан с кольцевым атомом, являющимся смежным с кольцевым атомом, с которым связан заместитель A. Например, когда Ar1 представляет собой фениленовую группу, предпочтительным является орто-замещение, и, например, когда Ar1 представляет собой тиениленовую группу, предпочтительным является 2,3-замещение или 3,4-замещение, и, кроме того, например, когда Ar1 представляет собой пиридиниленовую группу, предпочтительным является 2,3-замещение, 3,4-замещение, 4,5-замещение или 5,6-замещение. Кроме того, когда Ar1 представляет собой пиразолиленовую группу, предпочтительным является 3,4-замещение, 4,5-замещение или 1,5-замещение. Заместитель A и заместитель -(CR6R7)m-Ar2 могут быть связаны с кольцевым атомом азота.
В соответствии со следующим аспектом настоящего изобретения обеспечивается циклогексановое производное, представленное формулой (I), где n имеет значение 0, или его пролекарство, или фармацевтически приемлемая соль. В данном случае система замещения в Ar1, предпочтительно, представляет собой такую, в которой заместитель -(CR6R7)m-Ar2 связан со вторым кольцевым атомом, отстоящим от кольцевого атома, с которым связан Q. Например, когда Ar1 представляет собой фениленовую группу, предпочтительным является мета-замещение, а, например, когда Ar1 представляет собой пиридиниленовую группу, предпочтительным является 2,4-замещение, 3,5-замещение, 4,6-замещение или 1,6-замещение. Кроме того, когда Ar1 представляет собой индолиленовую группу, предпочтительным является 1,3-замещение, 3,4-замещение, 4,6-замещение или 5,7-замещение. Кроме того, когда Ar1 представляет собой пиразолиленовую группу, предпочтительным является 1,3-замещение, 3,5-замещение или 1,4-замещение. Заместитель A и заместитель -(CR6R7)m-Ar2 могут быть связаны с кольцевым атомом азота.
В описанной выше формуле (I) m, предпочтительно, имеет значение 1. Кроме того, Ar1, предпочтительно, представляет собой фениленовую группу, нафтиленовую группу, тиениленовую группу, пиридиниленовую группу, индолиленовую группу или пиразолиленовую группу, и особенно предпочтительными являются фениленовая группа, тиениленовая группа, пиридиниленовая группа и индолиленовая группа (и эти группы могут быть замещены одним или несколькими Rb).
В описанной выше формуле (I) m, предпочтительно, имеет значение 1, и, кроме того, Ar2, предпочтительно, представляет собой фенильную группу, нафтильную группу, тиенильную группу, бензофуранильную группу, бензотиенильную группу, бензодиоксолильную группу, 2,3-дигидробензофуранильную группу или 2,3-дигидробензотиенильную группу, и особенно предпочтительными являются фенильная группа, бензодиоксолильная группа и 2,3-дигидробензофуранильная группа (и эти группы могут быть замещены одним или несколькими Rb).
В описанных выше Q1-Q5, предпочтительно, когда R1, R2, R3, R4 и R5, каждый независимо, выбран из гидроксигруппы и -OC(=O)Rx.
В соответствии со следующим аспектом настоящего изобретения, обеспечивается соединение описанной выше формулы (I), где m имеет значение 1; n имеет значение 1; А представляет собой -O- или -NH-; Ar1 представляет собой фениленовую группу, нафтиленовую группу, тиениленовую группу, пиридиниленовую группу, индолиленовую группу или пиразолиленовую группу (и эти группы могут быть замещены одним или несколькими Rb); Ar2 представляет собой фенильную группу, нафтильную группу, тиенильную группу, бензофуранильную группу, бензотиенильную группу, бензодиоксолильную группу, 2,3-дигидробензофуранильную группу или 2,3-дигидробензотиенильную группу (и эти группы могут быть замещены одним или несколькими Rb); и R1, R2, R3, R4 и R5, каждый независимо, выбран из гидроксигруппы и -OC(=O)Rx, или его пролекарство, или фармацевтически приемлемая соль.
В соответствии с еще одним аспектом настоящего изобретения обеспечивается соединение описанной выше формулы (I), где m имеет значение 1; n имеет значение 0; Ar1 представляет собой фениленовую группу, нафтиленовую группу, тиениленовую группу, пиридиниленовую группу, индолиленовую группу или пиразолиленовую группу (и эти группы могут быть замещены одним или несколькими Rb); Ar2 представляет собой фенильную группу, нафтильную группу, тиенильную групп, бензофуранильную группу, бензотиенильную группу, бензодиоксолильную группу, 2,3-дигидробензофуранильную группу или 2,3-дигидробензотиенильную группу (и эти группы могут быть замещены одним или несколькими Rb); и R1, R2, R3, R4 и R5, каждый независимо, выбран из гидроксигруппы и -OC(=О)Rx, или его пролекарство, или фармацевтически приемлемая соль.
В соответствии с еще одним аспектом настоящего изобретения обеспечивается соединение, выбранное из следующей группы:
[2-(4-метоксибензил)фенил]-5a-карба-β-D-глюкопиранозид;
[1S,2R,3R,4R,6S]-4-гидроксиметил-6-[3-(4-метоксибензил)-фенил]циклогексан-1,2,3-триол;
[2-(4-трифторметоксибензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-циклопентилбензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-хлорбензил)фенил]-5a-карба-β-D-глюкопиранозид;
(2-бензилфенил)-5a-карба-β-D-глюкопиранозид;
[2-(4-изопропилбензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-циклопропилбензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-н-пропилбензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-трифторметилбензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-метилсульфанилбензил)фенил]-5a-карба-β-D-глюкопиранозид;
[3-фтор-2-(4-метоксибензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(3-трифторметилбензил)фенил]-5a-карба-β-D- глюкопиранозид;
[2-(4-метоксибензил)-4-метилфенил]-5a-карба-β-D-глюкопиранозид;
[2-(3-метоксибензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-метоксибензил)-4-метоксифенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-метоксибензил)-6-метилфенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-метоксибензил)-4-фторфенил]-5a-карба-β-D-глюкопиранозид;
[2-(3-фторбензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(3-метилбензил)фенил]-5a-карба-β-D-глюкопиранозид;
[5-фтор-2-(4-метоксибензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-метилсульфонилбензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-фторбензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(3,4-диметоксибензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-этилбензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-гидроксибензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-цианобензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(3-трифторметоксибензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-аминометилбензил)фенил]-5a-карба-β-D-глюкопиранозид;
[5-метокси-2-(4-метоксибензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-метоксикарбонилбензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-карбамоилбензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-N,N-диметилкарбамоилбензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-этоксибензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-дифторметоксибензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-трет-бутилбензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-метилбензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-метоксибензил)фенил]-5-трифторметилтиофен-3-ил]-5a- карба-β-D-глюкопиранозид;
[3-метокси-2-(4-метоксибензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-метоксибензил)-3-метилфенил]-5a-карба-β-D-глюкопиранозид;
[2-(3-фтор-4-метоксибензил)фенил]-5a-карба-β-D-глюкопиранозид;
[4-(4-циклопропилбензил)пиридин-3-ил]-5a-карба-β-D-глюкопиранозид;
[2-(4-карбоксибензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-винилбензил)фенил]-5a-карба-β-D-глюкопиранозид;
{2-[4-(2,2-дифторвинил)бензил]фенил}-5a-карба-β-D-глюкопиранозид;
[2-(2,3-дигидробензофуран-5-илметил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(3-фтор-4-метилбензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-метокси-3-метилбензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-пиразол-1-илбензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(3-хлор-4-метоксибензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(3,4-метилендиоксибензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-циклобутилбензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-ацетилбензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-метоксибензил)-5-метилфенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-этилбензил)тиофен-3-ил]-5a-карба-β-D-глюкопиранозид;
[2-(бензотиофен-2-ил)метилфенил]-5a-карба-β-D-глюкопиранозид;
(R)-{2-[1-(4-циклопропилфенил)этил]фенил}-5a-карба-β-D-глюкопиранозид;
(S)-{2-[1-(4-циклопропилфенил)этил]фенил}-5a-карба-β-D- глюкопиранозид;
[2-(4-циклопропилбензил)-5-метилтиофен-3-ил]-5a-карба-β-D глюкопиранозид;
[2-(4-этилбензил)-5-метилтиофен-3-ил]-5a-карба-β-D-глюкопиранозид;
[5-хлор-2-(4-циклопропилбензил)тиофен-3-ил]-5a-карба-β-D- глюкопиранозид;
(1R,2S,3R,6R)-6-[2-(4-циклопропилбензил)фенокси]-4-
(гидроксиметил)циклогекс-4-ен-1,2,3-триол;
(1R,2S,3R,6R)-4-гидроксиметил-6-[2-(4-метоксибензил)-фенокси]циклогекс-4-ен-1,2,3-триол;
(1R,2S,3S,6R)-4-[3-(4-этилбензил)фенил]-6-(гидрокси-метил)циклогекс-4-ен-1,2,3-триол;
(1R,2R,3S,4R,5R)-1-[3-(4-этилбензил)-4-метоксифенил]-5-(гидроксиметил)циклогексан-1,2,3,4-тетраол;
(1R,2R,3S,4S,6R)-4-[3-(4-этилбензил)-4-метоксифенил]-6-(гидроксиметил)циклогексан-1,2,3-триол;
(1R,2R,3S,4R,5R)-1-[2-этокси-5-(4-этилбензил)фенил]-5-(гидроксиметил)циклогексан-1,2,3,4-тетраол;
(1R,2R,3S,4S,6R)-4-[2-этокси-5-(4-этилбензил)фенил]-6-(гидроксиметил)циклогексан-1,2,3-триол;
(1R,2R,3S,4R,5R)-1-[5-(4-этилбензил)-2,4-диметокси-фенил]-5-(гидроксиметил)циклогексан-1,2,3,4-тетраол;
(1R,2R,3S,4S,6R)-4-[5-(4-этилбензил)-2,4-диметоксифенил]-6-(гидроксиметил)циклогексан-1,2,3-триол;
(1R,2R,3S,4R,5R)-1-[5-(4-этилбензил)-2-метилфенил]-5-(гидроксиметил)циклогексан-1,2,3,4-тетраол;
(1R,2R,3S,4S,6R)-4-[5-(4-этилбензил)-2-метилфенил]-6-(гидроксиметил)циклогексан-1,2,3-триол;
(1R,2R,3S,4R,5R)-1-[5-(4-этилбензил)-2-метоксифенил]-5-(гидроксиметил)циклогексан-1,2,3,4-тетраол;
(1R,2R,3S,4S,6R)-4-[5-(4-этилбензил)-2-метоксифенил]-6-(гидроксиметил)циклогексан-1,2,3-триол;
(1R,2R,3S,4R,5R)-1-[5-(4-этилбензил)-2-трифторметокси-фенил]-5-(гидроксиметил)циклогексан-1,2,3,4-тетраол;
(1R,2R,3S,4S,6R)-4-[5-(4-изопропилбензил)-2-метоксифенил]-6-(гидроксиметил)циклогексан-1,2,3-триол;
(1R,2R,3S,4S,6R)-4-[3-(4-этилбензил)фенил]-6-(гидрокси-метил)циклогексан-1,2,3-триол;
(1R,2R,3S,4S,6R)-4-[3-(4-гидроксибензил)фенил]-6-(гидроксиметил)циклогексан-1,2,3-триол;
(1R,2R,3S,4S,6R)-4-[5-(4-этилбензил)-2-гидроксифенил]-6-(гидроксиметил)циклогексан-1,2,3-триол;
(1R,2R,3S,4S,6R)-4-[3-(4-циклопропилбензил)фенил]-6-(гидроксиметил)циклогексан-1,2,3-триол;
(1R,2R,3S,4R,5R)-1-[5-(4-этилбензил)-2-фторфенил]-5-(гидроксиметил)циклогексан-1,2,3,4-тетраол;
(1S,2R,3S,4R,5R)-1-[5-(4-этилбензил)-2-фторфенил]-5-(гидроксиметил)циклогексан-1,2,3,4-тетраол;
(1R,2R,3S,4R,5R)-5-гидроксиметил-1-[3-(4-метоксибензил)-фенил]циклогексан-1,2,3,4-тетраол;
(lS,2R,3S,4R,5R)-5-гидроксиметил-1-[3-(4-метоксибензил)-фенил]циклогексан-1,2,3,4-тетраол и
(1R,2R,3S,4S,6R)-4-[l-(4-этилбензил)-1Н-индол-3-ил]-6-(гидроксиметил)циклогексан-1,2,3-триол,
или его пролекарство или фармацевтически приемлемая соль.
В соответствии с другим аспектом настоящего изобретения обеспечивается фармацевтическая композиция, включающая соединение описанной выше формулы (I), которое используют в качестве ингибитора Na+-глюкозного котранспортера.
В соответствии с еще одним аспектом настоящего изобретения обеспечивается фармацевтическая композиция, включающая соединение описанной выше формулы (I), которое используют для профилактики или лечения диабета, такого как инсулин-зависимый сахарный диабет (диабет типа I) и инсулин-независимый сахарный диабет (диабет типа II), диабетических осложнений, вызванных гипергликемией, или ожирения.
В соответствии со следующим аспектом настоящего изобретения обеспечивается способ профилактики или лечения диабета, такого как инсулин-зависимый сахарный диабет (диабет типа I) и инсулин-независимый сахарный диабет (диабет типа II), диабетических осложнений, вызванных гипергликемией, и ожирения, который включает введение пациенту эффективного количества соединения описанной выше формулы (I) или его фармацевтически приемлемой соли.
В описанных выше Q1-Q5 группы, представленные R1, R2, R3, R4 и R5, могут представлять собой, каждый независимо, например, гидроксигруппу, С1-С6 алкилоксигруппу, C7-C14 аралкилоксигруппу или -OC(=O)Rx, и, в частности, предпочтительно, когда R1, R2, R3, R4 и R5все представляют собой гидроксигруппы.
В соединениях по настоящему изобретению, n, предпочтительно, имеет значение 1, и в этом случае A, предпочтительно, представляет собой -O- или -NH- и, особенно предпочтительно, представляет собой -O-.
В описанной выше формуле (I) Ar1 и Ar2 могут быть замещены одним-четырьмя заместителями Rb, и в качестве Rb предпочтительным является атом галогена; гидроксигруппа; С1-С6алкильная группа и С3-С8 циклоалкильная группа, которая может быть замещена одним-четырьмя заместителями, выбранными из атома галогена, гидроксигруппы и аминогруппы; С1-С6алкилоксигруппа и С1-С6алкилтиогруппа, которая может быть замещена одним-четырьмя заместителями, выбранными из атома галогена, гидроксигруппы и аминогруппы; цианогруппа; С1-С6алкилсульфонильная группа; нитрогруппа; карбоксигруппа; -NReRf (где Re представляет собой атом водорода, С1-С6алкильную группу, С1-С6алкилкарбонильную группу, карбамоильную группу, С1-С6алкилсульфонильную группу или С1-С6алкоксикарбонильную группу и Rf представляет собой атом водорода или C1-C6 алкильную группу); 5- или 6-членная гетероарильная группа; или 4- 6-членная гетероциклильная группа.
Из групп, представленных Ar1, ариленовая группа представляет собой двухвалентную группу, состоящую из ароматического карбоцикла, предпочтительно, ароматического карбоцикла, содержащего 6-10 атомов углерода, и включает, например, фениленовую группу и нафтиленовую группу. Гетероариленовая группа представляет собой двухвалентную группу, состоящую из ароматического гетероцикла, предпочтительно, 6-10-членного ароматического гетероцикла, и включает, например, гетероариленовую группу, содержащую пиррольное кольцо, индольное кольцо, тиофеновое кольцо, бензотиофеновую группу, фурановое кольцо, бензофурановое кольцо, пиридиновое кольцо, хинолиновое кольцо, изохинолиновую группу, тиазольное кольцо, бензотиазольное кольцо, изотиазольное кольцо, бензоизотиазольное кольцо, пиразольное кольцо, индазольное кольцо, оксазольное кольцо, бензоксазольное кольцо, изоксазольное кольцо, бензоизоксазольное кольцо, имидазольное кольцо, бензоимидазольное кольцо, триазольное кольцо, бензотриазольное кольцо, пиримидиновое кольцо, уридиновое кольцо, пиразиновое кольцо или пиридазиновое кольцо. В качестве Ar1предпочтительными, в частности, являются фениленовая группа, нафтиленовая группа и гетероариленовая группа, содержащая пиридиновое кольцо, пиррольное кольцо, индольное кольцо, тиофеновое кольцо, бензотиофеновое кольцо, фурановое кольцо, бензофурановое кольцо или пиразольное кольцо, и более предпочтительными являются фениленовая группа, тиениленовая группа, пиридиниленовая группа и индолиеновая группа.
Из групп, представленных Ar2, арильная группа представляет собой фенильную группу, нафтильную группу или азуленильную группу, и гетероарильная группа представляет собой пирролильную группу, индолильную группу, пиридильную группу, хинолильную группу, изохинолильную группу, тиенильную группу, бензотиенильную группу, фурильную группу, бензофуранильную группу, тиазолильную группу, бензотиазолильную группу, изотиазолильную группу, бензоизотиазолильную группу, пиразолильную группу, индазолильную группу, оксазолильную группу, бензоксазолильную группу, изоксазолильную группу, бензоизоксазолильную группу, имидазолильную группу, бензимидазолильную группу, триазолильную группу, бензотриазолильную группу, пиримидинильную группу, урацилильную группу, пиразинильную группу, пиридазинильную группу или т.п., и в качестве Ar2предпочтительной является фенильная группа, нафтильная группа, тиенильная группа, бензотиенильная группа, бензодиоксолильная группа, фурильная группа, бензофуранильная группа или 2,3-дигидробензофуранильная группа, и более предпочтительной является фенильная группа, бензодиоксолильная группа или 2,3-дигидробензофуранильная группа.
Термин "С1-С6алкильная группа", как он используется в настоящей заявке, означает линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода, и включает, например, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, 3-метилбутил, 2-метилбутил, 1-метилбутил, 1-этилпропил, н-гексил, 4-метилпентил, 3-метилпентил, 2-метилпентил, 1-метилпентил, 3-этилбутил и 2-этилбутил, и предпочтительные С1-С6алкильные группы включают, например, линейные или разветвленные алкильные группы, содержащие от одного до трех атомов углерода, и особенно предпочтительными являются метил и этил.
Термин “С3-С8 циклоалкильная группа", как он используется в настоящей заявке, означает циклическую алкильную группу, содержащую от 3 до 8 атомов углерода, и включает, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, и циклооктил.
Термин "С1-С6алкоксигруппа", как он используется в настоящей заявке, означает алкилоксигруппу, содержащую линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода в качестве алкильного фрагмента, и включает, например, метокси, этокси, н-пропокси, изопропокси, н-бутокси, втор-бутокси, изобутокси, трет-бутокси, н-пентокси, 3-метилбутокси, 2-метилбутокси, 1-метилбутокси, 1-этилпропокси, н-гексилокси, 4-метилпентокси, 3-метилпентокси, 2-метилпентокси, 1-метилпентокси и 3-этилбутокси.
Термин "арильная группа", как он используется в настоящей заявке, означает арильную группу, содержащую ароматическое углеводородное кольцо, содержащее от 6 до 10 атомов углерода, и включает, например, фенил, 1-нафтил и 2-нафтил.
Термин "C7-C14 аралкильная группа", как он используется в настоящей заявке, означает арилалкильную группу, содержащую от 7 до 14 атомов углерода и содержащую определенную выше арильную группу, и включает, например, бензил, 1-фенетил, 2-фенетил, 1-нафтилметил и 2-нафтилметил.
Термин "C7-C14 аралкилоксигруппа", как он используется в настоящей заявке, означает арилалкилоксигруппу, содержащую от 7 до 14 атомов углерода и содержащую определенную выше аралкильную группу, и включает, например, бензилокси, 1-фенетилокси, 2-фенетилокси, 1-нафтилметилокси и 2-нафтилметилокси.
Термин "гетероарильная группа", как он используется в настоящей заявке, означает 5-10-членную ароматическую гетероциклильную группу, содержащую один или несколько гетероатомов, независимо выбранных из атома кислорода, атома азота и атома серы, и включает, например, фурил, тиенил, пирролил, имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, оксадиазолил, тиадиазолил, триазолил, тетразолил, пиридил, пиримидинил, пиразинил, пиридазинил, индолил, хинолинил и изохинолинил. Предпочтительными гетероарильными группами являются 5-6- членные гетероарильные группы, такие как пирролильная группа, пиразолильная группа, имидазолильная группа и пиридильная группа, и особенно предпочтительной является пиразолильная группа.
Термин "арилоксигруппа", как он используется в настоящей заявке, означает арилоксигруппу, содержащую определенную выше ароматическую углеводородную группу, содержащую от 6 до 10 атомов углерода, в качестве арильного фрагмента, и включает, например, фенокси, 1-нафтокси и 2-нафтокси.
Термин "гетероарилоксигруппа", как он используется в настоящей заявке, означает гетероарилоксигруппу, содержащую определенную выше 5-10-членную ароматическую гетероциклильную группу, которая содержит один или несколько гетероатомов, выбранных из атома кислорода, атома азота и атома серы, в качестве гетероарильного фрагмента, и включает, например, фурилокси, тиенилокси, пирролилокси, имидазолилокси, пиразолилокси, оксазолилокси, изоксазолилокси, тиазолилокси, изотиазолилокси, оксадиазолилокси, тиадиазолилокси, триазолилокси, тетразолилокси, пиридинилокси, пиримидинилокси, пиразинилокси, пиридазинилокси, индолилокси, хинолинилокси и изохинолинилокси. Предпочтительными гетероарилоксигруппами являются 5-6-членные гетероарилоксигруппы.
Термин "С1-С6алкиламиногруппа", как он используется в настоящей заявке, означает алкиламиногруппу, содержащую линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода, в качестве алкильного фрагмента, и включает, например, метиламино, этиламино, н-пропиламино, изопропиламино, н-бутиламино, втор-бутиламино, изобутиламино, трет-бутиламино, н-пентиламино, 3-метилбутиламино, 2-метилбутиламино, 1-метилбутиламино, 1-этилпропиламино, н-гексиламино, 4-метилпентиламино, 3-метилпентиламино, 2-метилпентиламино, 1-метилпентиламино, 3-этилбутиламино и 2-этилбутиламино.
Термин "ди(С1-С6алкил)аминогруппа", как он используется в настоящей заявке, означает диалкиламиногруппу, содержащую линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода, в качестве двух алкильных фрагментов, которые могут быть одинаковыми или отличными друг от друга. "Ди(С1-С6алкил)аминогруппа" включает, например, диметиламино, диэтиламино, ди-н-пропиламино, диизопропиламино, ди-н-бутиламино, метил-н-бутиламино, метил-втор-бутиламино, метилизобутиламино, метил-трет-бутиламино, этил-н-бутиламино, этил-втор-бутиламино, этилизобутиламино и этил-трет-бутиламино.
Термин "С1-С6алкилтиогруппа", как он используется в настоящей заявке, означает алкилтиогруппу, содержащую линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода, в качестве алкильного фрагмента, и включает, например, метилтио, этилтио, н-пропилтио, изопропилтио, н-бутилтио, втор-бутилтио, изобутилтио, трет-бутилтио, н-пентилтио, 3-метилбутилтио, 2-метилбутилтио, 1-метилбутилтио, 1-этилпропилтио, н-гексилтио, 4-метилпентилтио, 3-метилпентилтио, 2-метилпентилтио, 1-метилпентилтио, 3-этилбутилтио и 2-этилбутилтио.
Термин “С1-С6алкилсульфинильная группа", как он используется в настоящей заявке, означает алкилсульфинильную группу (-SO-R), содержащую линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода, в качестве алкильного фрагмента, и включает, например, метилсульфинил, этилсульфинил, н-пропилсульфинил, изопропилсульфинил, н-бутилсульфинил, втор-бутилсульфинил, изобутилсульфинил, трет-бутилсульфинил, н-пентилсульфинил, 3-метилбутилсульфинил, 2-метилбутилсульфинил, 1-метилбутилсульфинил, 1-этилпропилсульфинил, н-гексилсульфинил, 4-метилпентилсульфинил, 3-метилпентилсульфинил, 2-метилпентилсульфинил, 1-метилпентилсульфинил, 3-этилбутилсульфинил и 2-этилбутилсульфинил.
Термин "С1-С6алкилсульфонильная группа", как он используется в настоящей заявке, означает алкилсульфонильную группу, содержащую линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода, в качестве алкильного фрагмента, и включает, например, метилсульфонил, этилсульфонил, н-пропилсульфонил, изопропилсульфонил, н-бутилсульфонил, втор-бутилсульфонил, изобутилсульфонил, трет-бутилсульфонил, н-пентилсульфонил, 3-метилбутилсульфонил, 2-метилбутилсульфонил, 1-метилбутилсульфонил, 1-этилпропилсульфонил, н-гексилсульфонил, 4-метилпентилсульфонил, 3-метилпентилсульфонил, 2-метилпентилсульфонил, 1-метилпентилсульфонил, 3-этилбутилсульфонил и 2-этилбутилсульфонил.
Группа "-OC(=O)-Rx", как используется в настоящей заявке, включает, например, С1-С6алкилкарбонилоксигруппу, C7-C14 аралкилкарбонилоксигруппу, С1-С6алкоксикарбонилоксигруппу и C7-C14 аралкилоксикарбонилоксигруппу. В данном случае С1-С6алкилкарбонилоксигруппа включает, например, ацетилоксигруппу, пропионилоксигруппу, бутилилоксигруппу и пивалоилоксигруппу, и особенно предпочтительной является ацетилоксигруппа. C7-C14 аралкилкарбонилоксигруппа включает, например, бензилкарбонилоксигруппу и нафтилметилкарбонилоксигруппу, и предпочтительной является бензилкарбонилоксигруппа.
С1-С6алкоксикарбонилоксигруппа включает, например, метоксикарбонилоксигруппу и этоксикарбонилоксигруппу, и предпочтительной является метоксикарбонилоксигруппа. C7-C14 аралкилоксикарбонилоксигруппа включает, например, бензилоксикарбонилоксигруппу и нафтилметилоксикарбонилоксигруппу, и предпочтительной является бензилоксикарбонилоксигруппа.
Термин "атом галогена", как он используется в настоящей заявке, включает, например, атом фтора, атом хлора, атом брома и атом иода.
Термин "4-7-членный гетероцикл", как он используется в настоящей заявке, означает гетероцикл, который может быть полностью насыщенным или частично или полностью ненасыщенным и содержит один атом азота и может, кроме того, содержать один или несколько гетероатомов, независимо выбранных из атома кислорода, атома азота и атома серы, и включает, например, азетидин, пирролидин, пиперидин и морфолин, и предпочтительным является пиперидин.
Термин "ароматический карбоцикл", как он используется в настоящей заявке, означает 6-10-членный ароматический карбоцикл и включает, например, бензольное кольцо и нафталиновое кольцо.
Термин "ароматический гетероцикл", как он используется в настоящей заявке, означает 5-6-членный ароматический гетероцикл, содержащий один или несколько гетероатомов, независимо выбранных из атома кислорода, атома азота и атома серы, и включает, например, пиррольное кольцо, индольное кольцо, тиофеновое кольцо, бензотиофеновое кольцо, фурановое кольцо, бензофурановое кольцо, пиридиновое кольцо, хинолиновое кольцо, изохинолиновое кольцо, тиазольное кольцо, бензотиазольное кольцо, изотиазольное кольцо, бензоизотиазольное кольцо, пиразольное кольцо, индазольное кольцо, оксазольное кольцо, бензоксазольное кольцо, изоксазольное кольцо, бензоизоксазольное кольцо, имидазольное кольцо, бензоимидазольное кольцо, триазольное кольцо, бензотриазольное кольцо, пиримидиновое кольцо, урациловое кольцо, пиразиновое кольцо и пиридазиновое кольцо.
Термин "гетероциклильная группа", как он используется в настоящей заявке, означает 4-7-членную гетероциклильную группу, которая содержит один или несколько гетероатомов, независимо выбранных из атома кислорода, атома азота и атома серы, и может быть полностью насыщенной или частично или полностью ненасыщенной и включает, например, азетидинил, пирролидинил, пиперидинил, пиперазинил, пирролил, имидазолил, имидазолинил, пиразолил, пиразолинил, оксазолинил, морфолинил, тиоморфолинил, пиридил, пиразинил, пиримидинил, пиридазинил, гексаметиленимино, фурил, тетрагидрофурил, тиенил, тетрагидротиенил, диоксоланил, оксатиоланил и диоксанил. Положение замещения в гетероциклильной группе конкретно не ограничено, при условии, что оно представляет собой замещаемое положение по атому углерода или атому азота.
Термин "C1-C3 алкилендиоксигруппа", как он используется в настоящей заявке, означает двухвалентную группу, представленную формулой: -О-(С1-С3 алкилен)-O-, и включает, например, метилендиоксигруппу, этилендиоксигруппу и диметилметилендиоксигруппу.
Кроме того, соединения по настоящему изобретению включают смеси различных типов таутомеров, стереоизомеров, таких как оптические изомеры и их выделенные изомеры.
Соединения по настоящему изобретению могут образовывать кислотно-аддитивные соли. Кроме того, в зависимости от типа заместителя они могут образовывать соли с основаниями. Такие соли включают, например, кислотно-аддитивные соли неорганических кислот, таких как хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, азотная кислота и фосфорная кислота; органических кислот, таких как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, винная кислота, лимонная кислота, метансульфоновая кислота и этансульфоновая кислота; аминокислот кислотного типа, таких как аспарагиновая кислота и глутаминовая кислота. Кроме того, соли, образованные с основаниями, включают соли с неорганическими основаниями, такие как соли натрия, калия, магния, кальция и алюминия; соли с органическими основаниями, такими как метиламин, этиламин и этаноламин; соли с аминокислотами основного типа, такими как лизин и орнитин; и соли аммония.
Кроме того, соединения по настоящему изобретению включают гидраты и различные фармацевтически приемлемые сольваты, полиморфы и т.п.
Кроме того, соединения по настоящему изобретению не ограничиваются соединениями, описанными далее в Примерах, и включают все циклогексановые производные, представленные описанной выше формулой (I), и их фармацевтически приемлемые соли.
Кроме того, настоящее изобретение включает соединения, которые преобразуются в соединения, представленные описанной выше формулой (I), в результате метаболизма в живом организме, и их фармацевтически приемлемые соли, т.е. так называемые “пролекарства”. Группы, которые образуют пролекарства соединений по настоящему изобретению, включают, например, группы, описанные в Prog. Med., 5, 2157-2161(1985), и группы, описанные в Development of Drugs (Molecular Designing) 7, 163-198, Hirokawa Shoten, 1990.
Соединения по настоящему изобретению можно получить с использованием различных известных способов синтеза, в зависимости от их отличительных признаков, на основании типа их основного скелета или заместителя. В том случае, когда группа, предпочтительно, является замещенной подходящей защитной группой на стадии исходного вещества или промежуточного соединения, с технологической точки зрения, такую защитную группу можно удалить на более поздних стадиях с получением желаемого соединения. Группы, для которых необходима защита в процессе стадии получения соединений, включают, например, гидроксигруппу и карбоксигруппу, и защитные группы для этих групп включают защитные группы, описанные в Greene and Wuts: Protective Groups in Organic Synthesis, 2nd ed. Используемые защитные группы и реакционные условия для введения и удаления защитных групп подходящим образом выбирают на основании известных методов, таких как описанные в указанных выше документах.
Соединения по настоящему изобретению обладают активностью ингибирования натрий-зависимого транспортера глюкозы 2 (SGLT2) (J. Clin. Invest., 93, 397(1994)), имеющего отношение к почечной реабсорбции глюкозы. За счет ингибирования SGLT2 реабсорбция глюкозы снижается, избыточное количество глюкозы выводится из организма и гипергликемия вылечивается, без создания нагрузки на β-клетки поджелудочной железы, обеспечивая терапевтический эффект в отношении диабета и эффект улучшения в отношении резистентности к инсулину.
Таким образом, в соответствии с одним аспектом настоящего изобретения обеспечивается лекарственное средство для профилактики или лечения заболевания или состояния, которое может быть улучшено путем ингибирования активности SGLT2, например диабета, связанных с диабетом заболеваний и диабетических осложнений.
Термин "диабет", как он используется в настоящей заявке, включает диабет типа I, диабет типа II и другие типы диабета, вызываемые специфическими причинами. Кроме того, термин "связанные с диабетом заболевания", как он используется в настоящей заявке, включает, например, ожирение, гиперинсулинемию, нарушение сахарного обмена, гиперлипидемию, гиперхолестеринемию, гипертриглицеридемию, нарушение липидного обмена, гипертензию, застойную сердечную недостаточность, отек, гиперурикемию и подагру.
Кроме того, термин "диабетические осложнения", как он используется в настоящей заявке, включает как острые осложнения, так и хронические осложнения. "Острые осложнения" включают, например, гипергликемию (кетоацидоз и т.п.) и инфекционные заболевания (например, кожные, мягких тканей, желчных путей, дыхательной системы и мочевых путей), и "хронические осложнения" включают, например, микроангиопатию (нефропатию и ретинопатию), артериосклероз (например, атеросклероз, инфаркт миокарда, церебральный тромбоз и закупорка артерий нижних конечнойстей), невропатию (например, сенсорного нерва, двигательного нерва и пучка вегетативных нервных волокон) и гангрену стопы. Основные диабетические осложнения включают, например, диабетическую ретинопатию, диабетическую нефропатию и диабетическую невропатию.
Кроме того, соединения по настоящему изобретению можно использовать в комбинации со средством для лечения диабета, средством для лечения диабетических осложнений, средством для лечения гиперлипидемии, средством для лечения гипертензии или т.п., механизм действия которого отличен от механизма действия ингибиторов активности SGLT2. При комбинировании соединений по настоящему изобретению с другими средствами можно ожидать получения дополнительного эффекта по сравнению с эффектом, получаемым при применении каждого средства в отдельности для лечения указанных выше заболеваний.
"Средства для лечения диабета и средства для лечения диабетических осложнений", которые используют в комбинации, включают, например, средства, усиливающие чувствительность к инсулину (такие как агонист PPAR γ, агонист PPAR α/γ, агонист PPAR δ и агонист PPAR α/γ/δ), ингибиторы гликозидазы, бигуанидные лекарственные средства, средства, стимулирующие секрецию инсулина, препараты инсулина, антагонисты рецепторов глюкагона, средства, стимулирующие киназу рецептора инсулина, ингибиторы трипептидилпептидазы II, ингибиторы дипептидилпептидазы IV, ингибиторы протеинтирозин фосфатазы-1B, ингибиторы гликогенфосфорилазы, ингибиторы глюкоза-6-фосфатазы, ингибиторы глюконеогенеза, ингибиторы бисфосфотазы фруктозы, ингибиторы пируватдегидрогеназы, активаторы глюкокиназы, D-хиро-инозит, ингибиторы киназы 3 синтеза гликогена, глюкагон-подобный пептид 1, аналоги глюкагон-подобного пептида-1, агонисты глюкагон-подобного пептида-1, амирин, аналоги амирина, агонисты амирина, антагонисты глюкокортикоидного рецептора, ингибиторы 11β-гидроксистероид-дегидрогеназы, ингибиторы альдозаредуктазы, ингибиторы протеинкиназы С, антагонисты рецептора γ-аминомасляной кислоты, антагонисты натриевых каналов, ингибиторы фактора транскрипции NF-kB, ингибиторы IKK β, ингибиторы липидо-пероксидазы, ингибиторы N-ацетилированной-α-связанной-кислотной-дипептидазы, инсулиноподобный фактор роста-I, тромбоцитарный фактор роста (PDGF), аналоги тромбоцитарного фактора роста (PDGF), эпидермальный фактор роста (EGF), фактор роста нервов, производные карнитина, уридин, 5-гидрокси-1-метилгидантоин, EGB-761, бимокломол, сулодексид, Y-128 и TAR-428.
В качестве средств для лечения диабета и средств для лечения диабетических осложнений для иллюстрации приводятся следующие средства.
"Бигуанидные лекарственные средства" включают, например, метформин гидрохлорид и фенформин.
Из "средств, стимулирующих секрецию инсулина" средства на основе сульфонилмочевины включают, например, глибурид (глибенкламид), глипизид, гликлазид и хлорпропамид, а несульфонилмочевинные средства включают, например, натеглинид, репаглинид и митиглинид.
"Препараты инсулина" включают рекомбинантный человеческий инсулин и инсулин животного происхождения и подразделяются на три группы в зависимости от времени действия, а именно типа немедленного действия (человеческий инсулин и человек нейтральный инсулин), среднего типа (водная суспензия инсулина-человеческого изофанового инсулина, водная суспензия человеческого нейтрального инсулина-человеческого изофанового инсулина, водная суспензия человеческого цинк-инсулина и водная суспензия цинк-инсулина) и типа пролонгированного действия (суспензия человеческого кристаллического цинк-инсулина).
"Ингибиторы гликозидазы" включают, например, акарбозу, воглибозу и миглитол.
Агонисты PPAR γ, относящиеся к "средствам, усиливающим чувствительность к инсулину", включают, например, троглитазон, пиоглитазон и розиглитазон, и агонисты двойного действия PPAR α/γ включают, например, MK-767 (KRP-297), тезаглитазар, LM 4156, LY 510929, DRF-4823 и TY-51501, а агонисты PPAR δ включают, например, GW-501516.
"Ингибиторы трипептидилпептидазы II" включают, например, UCL-139.
"Ингибиторы дипептидилпептидазы IV" включают, например, NVP-DPP728A, LAF-237, MK-0431, P32/98 и TSL-225.
"Ингибиторы альдозаредуктазы" включают, например, аскорбил галоменат, толрестат, эпалрестат, фидарестат, сорбинил, поналрестат, ризарестат и зенарестат.
"Антагонисты рецептора γ-аминомасляной кислоты" включают, например, топирамат.
"Антагонисты натриевых каналов" включают, например, мексилетин гидрохлорид.
"Ингибиторы фактора транскрипции NF-кВ" включают, например, декслипотам.
"Ингибиторы липопероксидазы" включают, например, тирилазад мезилат.
"Ингибиторы N-ацетилированной-α-связанной-кислотной-дипептидазы" включают, например, GPI-5693.
"Производные карнитина" включают, например, карнитин и левацекарнин гидрохлорид.
"Средства для лечения гиперлипидемии и средства для лечения гипертензии", которые можно использовать в комбинации, включают, например, ингибиторы кофермента A гидроксиметилглутарилредуктазы, фибратные соединения, агонисты β3-адреналинового рецептора, активаторы AMPK, ингибиторы ацил-кофермент A: холестеринацилтрансферазы, пробукол, агонисты рецептора тиреоидного гормона, ингибиторы абсорбции холестерина, ингибиторы липазы, ингибиторы белка переноса триглицеридов в микросомах, ингибиторы липоксигеназы, ингибиторы карнитинпальмитоилтрансферазы, ингибиторы скваленсинтазы, активаторы рецептора липопротеинов низкой плотности, производные никотиновой кислоты, адсорбенты желчных кислот, ингибиторы конъюгированного с натрием транспортера желчных кислот, ингибиторы белка переноса сложного эфира холестерина, ингибиторы ангиотензин-превращающего фермента, антагонисты рецептора ангиотензина II, ингибиторы эндотелин-превращающего фермента, антагонисты рецептора эндотелина, диуретики, антагонисты кальция, сосудорасширяющие гипотензивные средства, блокаторы, действующие на симпатическую нервную систему, гипотензивные средства центрального действия, агонисты α2-адренергического рецептора, противотромбоцитные средства, ингибиторы образования мочевой кислоты, стимуляторы экскреции мочевой кислоты, средства подщелачивания мочи, средства, снижающие аппетит, агонисты рецептора адипонектина, агонисты GPR40 и антагонисты GPR40.
В качестве средств для лечения гиперлипемии и средств для лечения гипертензии для иллюстрации приводятся следующие средства.
"Ингибиторы кофермента A гидроксиметилглутарилредуктазы" включают, например, флувастатин, ловастатин, правастатин, церивастатин и питавастатин.
"Фибратные соединения" включают, например, безафибрат, беклобрат и бинифибрат.
"Ингибиторы скваленсинтазы" включают, например, TAK-475, α-фосфоносульфонатные производные (описанные в Патенте США No. 5712396).
"Ингибиторы ацил-кофермент A: холестеринацилтрансферазы" включают, например, CI-1011, NTE-122, FCE-27677, RP-73163, MCC-147 и DPU-129.
"Активаторы рецепторов липопротеинов низкой плотности" включают, например, MD-700 и LY-295427.
"Ингибиторы белка переноса триглицеридов в микросомах (ингибиторы МТР)" включают, например, соединения, описанные в Патентах США №№ 5739135, 5712279, 5760246 и т.п.
"Средства, снижающие аппетит" включают, например, агонисты адреналина-норадреналина (мазиндол, эфедрин и т.п.), агонисты серотонина (селективные ингибиторы повторного поглощения серотонина, такие как флувоксамин), агонисты адреналина-серотонина (сибутрамин и т.п.), агонисты рецептора меланокортина 4 (MC4R) и α-меланоцит-концентрирующие гормоны (α-MCH), лептин, кокаин- и амфетамин-регулируемый транскрипт (CART) и т.п.
"Агонисты рецептора тиреоидного гормона" включают, например, лиотиронин натрий и левотироксин натрий.
"Ингибиторы адсорбции холестерина" включают, например, эзетимиб.
"Ингибиторы липазы" включают, например, орлистат.
"Ингибиторы карнитинпальмитоилтрансферазы" включают, например, этомоксир.
"Производные никотиновой кислоты" включают, например, никотиновую кислоту, никотинамид, никомол и никорандил.
"Адсорбенты желчных кислот" включают, например, холестирамин, колестилан и холесевалам гидрохлорид.
"Ингибиторы ангиотензин-превращающего фермента" включают, например, каптоприл, эналаприл малеинат, арацеприл и цилазаприл.
"Антагонисты рецептора ангиотензина II" включают, например, кандесартан цилексетил, лосартан калий и эпросартан мезилат.
"Ингибиторы эндотелин-превращающего фермента" включают, например, CGS-31447 и CGS-35066.
"Антагонисты рецептора эндотелина" включают, например, 1-749805, TBC-3214 и BMS-182874.
Например, при лечении диабета и т.п. является подходящим, когда соединения по настоящему изобретению используют вместе с одним или несколькими средствами, выбранными из группы, включающей средства, усиливающие чувствительность к инсулину (агонисты PPAR γ, агонисты PPAR α/γ, агонисты PPAR δ, агонисты PPAR α/γ/δ и т.п.), ингибиторы гликозидазы, бигуанидные лекарственные средства, средства, стимулирующие секрецию инсулина, препараты инсулина и ингибиторы дипептидилпептидазы IV.
Кроме того, является подходящим, когда соединения по настоящему изобретению используют вместе с одним или несколькими средствами, выбранными из группы, включающей ингибиторы кофермента A гидроксиметилглутарилредуктазы, фибратные соединения, ингибиторы скваленсинтетазы, ингибиторы ацильного кофермента A: холестеринацилтрансферазы, активаторы рецептора липопротеинов низкой плотности, ингибиторы белка переноса триглицеридов в микросомах и средства, снижающие аппетит.
Лекарственные средства по настоящему изобретению можно вводить системно или путем местного введения, или перорально, или парентерально, например, ректальным, подкожным, внутримышечным, внутривенным или чрескожным путем.
Соединения по настоящему изобретению, которые используют в качестве лекарственных средств, могут быть в любой форме: в твердой композиции, жидкой композиции и другой композиции, и наиболее подходящий выбор осуществляют по мере возникновения необходимости. Лекарственные средства по настоящему изобретению можно получить путем включения фармацевтически приемлемого носителя в соединения по настоящему изобретению. В частности, эксципиент, наполнитель, связующее, разрыхлитель, агент покрытия, сахарное покрытие, регулятор pH или солюбилизирующее средство, которые традиционно используют, или водный или неводный растворитель добавляют к соединениям по настоящему изобретению для получения таблеток, пилюль, капсул, гранул, распыляемых порошков, порошков, жидкостей и растворов, эмульсий, суспензий, препаратов для инъекций или т.п. традиционными способами, используемыми для формулирования фармацевтических композиций. Эксципиенты и наполнители включают, например, лактозу, стеарат магния, крахмал, тальк, желатин, агар, пектин, аравийскую камедь, оливковое масло, кунжутное масло, масло какао, этиленгликоль и другие вещества, которые обычно используют.
Кроме того, соединения по настоящему изобретению можно сформулировать в композиции путем образования клатратных соединений с α-, β- или γ-циклодекстрином или метилированным циклодекстрином.
Доза соединений по настоящему изобретению варьируется в зависимости от заболевания, тяжести заболевания, веса, возраста, пола и пути введения и, предпочтительно, она составляет от 0,1 до 1000 мг/кг веса тела/день, более предпочтительно - от 10 до 200 мг/кг веса тела/день, и ее можно вводить раз в сутки или раздельными дозами несколько раз в сутки.
Соединения по настоящему изобретению можно синтезировать, например, при помощи способов получения, показанных на приведенных ниже Схемах. "Bn" на приведенных ниже Схемах означает бензильную группу.
2,3,4,6-Тетра-О-бензил-5a-карба-α-D-глюкопиранозу (IV), ключевое промежуточное соединение, можно получить, например, следующим путем.
Схема 1
Формула 3

Сначала, после защиты первичной гидроксигруппы D-глюкаля (например, защиты трет-бутил-диметилсилильной группой), две вторичные гидроксигруппы защищают при помощи бензильных групп, а затем защитную группу первичной гидроксигруппы удаляют (например, когда защитная группа представляет собой трет-бутилдиметилсилильную группу, ее удаляют при помощи тетрабутиламмонийфторида) и, таким образом, синтезируют 3,4-ди-O-бензил-D-глюкаль (II).
Затем соединение (II) можно преобразовать, в пять стадий, в 3,4,6-три-О-бензил-5a-карба-D-глюкопиранозу (III) [Chem. Commun., p.925 (1998)].
Соединение (III) можно преобразовать, в две стадии, в 2,3,4,6-тетра-О-бензил-5a-карба-α-D-глюкопиранозу (IV) [Liebigs. Ann. Chemi., p.267 (1995)].
Соединение (V) можно получить способом, описанным в документе [J. Chem. Soc. Perkin Trans. 1, 3287 (1991)]. Кроме того, как показано на приведенной ниже Схеме 2, соединение (V) также можно получить из соединения (IV) при помощи подходящего окислителя (например, активированный DMSO в способе Swern или PCC, PDC, периодинан Десса-Мартина или т.п.)
Схема 2
Формула 4

Соединение (IV) можно преобразовать в соединение (VII), как показано ниже.
Схема 3
Формула 5

Соединение (IV) может быть преобразовано в 2,3,4,6-тетра-О-бензил-5a-карба-β-D-глюкопиранозу (VI), например, путем осуществления гидролиза после реакции Мицунобу с бензойной кислотой.
Затем соединение (VII), в котором X представляет собой атом галогена, можно получить, обеспечивая воздействие подходящего галогенирующего агента (например, оксихлорида фосфора, оксибромида фосфора, трихлорида фосфора, трибромида фосфора, тетрахлорида углерода-трифенилфосфина, тетрабромида углерода-трифенилфосфина, N-хлорсукцинимид-трифенилфосфина, N-бромсукцинимид-трифенилфосфина, иод-трифенилфосфина или т.п.) на соединение (VI).
Затем соединение (VII), в котором X представляет собой метансульфонилоксигруппу, п-толуолсульфонилоксигруппу, трифторметансульфонилоксигруппу или т.п., можно получить, обеспечивая воздействие метансульфонилхлорида, п-толуолсульфонилхлорида, безводной трифторметансульфоновой кислоты или т.п., на соединение (IV) в подходящем растворителе в щелочных условиях.
Например, соединение следующей формулы:
Формула 6

где R11 имеет такое же значение, как указано выше для Rb; и Ar2имеет указанное выше значение, которое является промежуточным соединением соединения формулы (I), может быть синтезировано со ссылкой на следующие документы: Международные Публикации №№ WO01/68660, WO01/074834, WO01/074835, WO02/28872, WO02/44192, WO02/064606, WO03/011880 и WO04/014931.
Например, следующие соединения:
Формула 7

где R12 имеет такое же значение, как указано выше для Rb; и Ar2 имеет указанное выше значение, которые являются промежуточными соединениями соединения формулы (I), могут быть синтезированы со ссылкой на следующий документ: Международная Публикация № WO04/007517.
Например, следующее соединение:
Формула 8

где R13 имеет такое же значение, как указано выше для Rb; и Ar2 имеет указанное выше значение, которое является промежуточным соединением соединения формулы (I), может быть синтезировано со ссылкой на следующие документы: Международные Публикации №№ WO01/16147, WO02/36602, WO02/053573, WO02/068439, WO02/068440, WO02/088157, WO02/098893, WO03/020737 и WO03/090783.
Например, следующее соединение:
Формула 9

где X1, X2, X3 и X4 каждый представляет собой атом азота или C-R14, и один или два из X1, X2, X3 и X4 представляют собой атом азота; и R14 имеет такое же значение, как указано выше для Rb, которое является промежуточным соединением соединения формулы (I), можно синтезировать со ссылкой на следующий документ: Международная Публикация № WO03/000712.
Например, следующее соединение:
Формула 10

где R15 имеет такое же значение, как указано выше для Rb; и Ar2 имеет указанное выше значение, которое является промежуточным соединением соединения формулы (I), можно получить в соответствии со следующей Схемой 4.
Схема 4
Формула 11

где R1 имеет такое же значение, как указано выше для Rb; M-алкил и M-арил, каждый, представляет собой металлоорганический реагент, такой как н-бутиллитий, фениллитий и фенилмагнийбромид; Х представляет собой галоген, такой как хлор, бром и иод; и Ar2имеет указанное выше значение.
А именно соединение (XIII) может быть синтезировано путем обеспечения воздействия подходящего металлоорганического реагента (н-бутиллитий, фениллитий, фенилмагнийбромид или т.п.) на соединение (XIV), с последующим взаимодействием полученного соединения с Ar2-CHO для преобразования в соединение (XV), и с осуществлением после этого подходящей реакции восстановления (каталитическое гидрирование с использованием палладиевого катализатора или т.п.).
Соединения по настоящему изобретению можно получить, например, в соответствии со Схемой 5, как показано ниже.
Схема 5
Формула 12

где R11имеет такое же значение, как указано выше для Rb; и Ar2 имеет указанное выше значение.
А именно соединение по настоящему изобретению можно получить путем конденсации соединения (IV) с соединением (VIII) в условиях реакции Мицунобу с использованием азореагента и фосфина, осуществляя затем удаление защиты в условиях каталитического гидрирования с использованием палладиевого катализатора или т.п., или осуществляя удаление защиты при помощи трифторида бора-диметилсульфида или т.п. Азореагенты, которые можно использовать в синтезе соединений по настоящему изобретению, включают, например, диэтилазодикарбоксилат, тетраметилазодикарбоксамид и 1,6-диметил-1,5,7-гексагидро-1,4,6,7-тетразоцин-2,5-дион, и фосфины включают, например, трифенилфосфин, трибутилфосфин, 2-(дициклогексилфосфинo)бифенил и три(трет-бутил)фосфин. Кроме того, соединения по настоящему изобретению также можно синтезировать при помощи реакции Мицунобу с использованием фосфоранового реагента. Фосфорановый реагент, который можно использовать в этом случае, включает, например, (цианометилен)трибутилфосфоран и (цианометилен) триметилфосфоран. Кроме того, заместитель R11 в соединении (XVII) или заместитель у Ar2 (галоген или гидроксигруппа после преобразования в трифлат или т.п.) также можно преобразовать при помощи оловосодержащего реагента, борной кислоты или т.п., в присутствии палладиевого катализатора.
Кроме того, соединения по настоящему изобретению также можно получить, например, в соответствии со Схемой 6, как показано ниже.
Схема 6
Формула 13
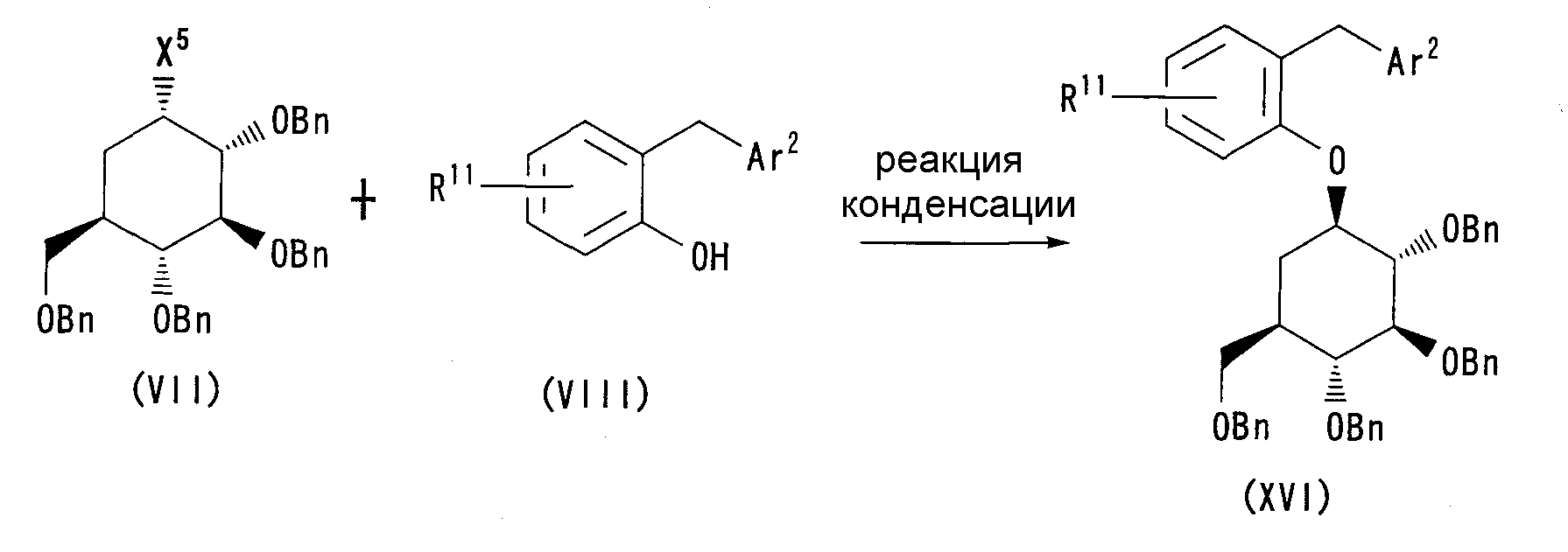
где X представляет собой галоген, такой как хлор, бром и иод, или удаляемую группу, такую как метансульфонат и трифторметансульфонат; R11 имеет такое же значение, как указано выше для Rb; и Ar2 имеет указанное выше значение.
А именно соединение (XVI) можно получить путем конденсации соединения (VII) с соединением (VIII) в подходящем растворителе в щелочных условиях. Основания, которые можно использовать в данном случае, включают, например, гидрид натрия, карбонат калия и трет-бутоксид калия.
Кроме того, соединения по настоящему изобретению также можно получить, например, в соответствии со Схемой 7, как показано ниже.
Схема 7
Формула 14

где R11 имеет такое же значение, как указано выше для Rb; R" представляет собой C1-C6 алкильную группу, C7-C14 аралкильную группу или арильную группу и Ar2 имеет указанное выше значение.
А именно соединение (XVII) по настоящему изобретению можно получить путем конденсации соединения (IV) с соединением (XVIII) в условиях реакции Мицунобу с использованием азореагента и фосфина, затем преобразования алкоксикарбонильной группы полученного соединения в формильную группу традиционным способом с получением соединения (XX), обеспечивая затем воздействие Ar2-M (где M представляет собой литий, магнийгалогенид или т.п.) на соединение (XX) с преобразованием его в соединение (XXI), с последующим удалением гидроксигруппы и бензильных групп одновременно в условиях каталитического гидрирования или их постадийным удалением путем восстановления гидроксигруппы при помощи триметилсилана или т.п., а затем удаления бензильных групп при помощи трифторида бора-диметилсульфида.
Кроме того, соединения по настоящему изобретению также можно получить, например, в соответствии со Схемой 8, как показано ниже.
Схема 8
Формула 15

где X11 представляет собой атом галогена; R11 имеет такое же значение, как указано выше для Rb; и Ar2 имеет указанное выше значение.
А именно соединение (XXI) может быть синтезировано путем преобразования соединения (IV) и соединения (XXII) в соединение (XXIII) при помощи реакции Мицунобу, обеспечивая затем воздействие металлоорганического реагента (низший алкиллитий, такой как н-бутиллитий или т.п.) на соединение (XXIII) для взаимодействия с Ar2-CHO.
Кроме того, соединения по настоящему изобретению также можно получить, например, в соответствии со Схемой 9, как показано ниже.
Схема 9
Формула 16

где X21 и X22, каждый, представляет собой атом галогена; R" независимо выбран из C1-C6 алкильной группы; R11 имеет такое же значение, как указано выше для Rb; и Ar2 имеет указанное выше значение.
А именно обеспечивают воздействие соединения гексаалкилдиолова на соединение (XXIII) в присутствии палладиевого катализатора для преобразования в соединение (XXIV), которое затем взаимодействует с Ar2-CH2X22 в присутствии палладиевого катализатора для синтеза соединения (XVI). Соединение гексаалкилдиолова, как оно используется в настоящей заявке, включает, например, гексаметилдиолово и гексабутилдиолово и палладиевый катализатор включает, например, тетракистрифенилфосфинпалладий (0) и 1,2-бис(дифенилфосфориноэтан)дихлорпалладий (II).
Кроме того, соединения по настоящему изобретению также можно получить, например, в соответствии со Схемой 10, как показано ниже.
Схема 10
Формула 17

где R12 имеет такое же значение, как указано выше для Rb; и Ar2 имеет указанное выше значение.
А именно соединение (IV) подвергают конденсации с соединением (IX) в условиях реакции Мицунобу с использованием азореагента и фосфина для преобразования в соединение (XXV) и после этого одновременно осуществляют восстановление кетона и удаление бензильных групп в условиях каталитического гидрирования с использованием палладиевого катализатора или т.п., или постадийно осуществляют восстановление кетона при помощи борогидрида натрия или т.п., а затем удаление бензильных групп с использованием палладиевого катализатора с получением соединения (XXVI) по настоящему изобретению.
Кроме того, соединения по настоящему изобретению также можно получить, например, в соответствии со Схемой 11, как показано ниже.
Схема 11
Формула 18

где R12 имеет такое же значение, как указано выше для Rb; и Ar2 имеет указанное выше значение.
А именно соединение (IV) подвергают конденсации с соединением (X) в условиях реакции Мицунобу с использованием азореагента и фосфина для преобразования в соединение (XXVII), а затем обеспечивают воздействие Ar2-M (где M представляет собой литий, магнийгалогенид или т.п.) на соединение (XXVII) для преобразования его в соединение (XXVIII), после этого одновременно или постадийно осуществляют удаление гидроксигруппы и бензильных групп в условиях каталитического гидрирования с использованием палладиевого катализатора или т.п. с получением соединения (XXVI) по настоящему изобретению.
Кроме того, соединения по настоящему изобретению также можно получить, например, в соответствии со Схемой 12, как показано ниже.
Схема 12
Формула 19

где X5 имеет указанное выше значение; R13 имеет такое же значение, как указано выше для Rb; и Ar2 имеет указанное выше значение.
А именно соединение (XXX) по настоящему изобретению можно получить путем взаимодействия соединения (VII) с соединением (XI) в подходящем растворителе, в присутствии основания, для преобразования в соединение (XXIX) с осуществлением после этого удаления бензильных групп в условиях каталитического гидрирования с использованием палладиевого катализатора или т.п. с получением желаемого соединения.
Кроме того, в способе получения, показанном на Схеме 10, соединение (XXXI) (где X1, X2, X3 и X4 и Ar2 имеют указанное выше значение) по настоящему изобретению может быть синтезировано с использованием соединения (XII) вместо соединения (IX).
Формула 20

Кроме того, соединения по настоящему изобретению также можно получить, например, в соответствии со Схемой 13, как показано ниже.
Схема 13
Формула 21

где X представляет собой атом галогена; R17 имеет такое же значение, как указано выше для Rb; и Ar2 имеет указанное выше значение.
А именно соединение (XXXV) по настоящему изобретению можно получить, подвергая соединение (IV) реакции Мицунобу с фталимидом, обеспечивая обработку полученного соединения гидразином или метиламином с получением соединения (XXXII), затем осуществляя реакцию сочетания с соединением (XXXIII) в присутствии палладиевого катализатора [например, трис(дибензилиденацетон)дипалладия (0) или 1,1'-бис(дифенилфосфинoферроцен)дихлорпалладия (II)] или реагента на основе меди [например, иодид меди (I)] с преобразованием соединения (XXXII) в соединение (XXXIV) с последующим удалением бензильных групп в условиях каталитического гидрирования с использованием палладиевого катализатора или т.п.
Кроме того, соединение (XXXII) может быть синтезировано путем осуществления реакции Мицунобу соединения (IV) с азидом натрия или т.п. с последующей обработкой полученного соединения трифенилфосфином или т.п.
Кроме того, соединение (XXXIII) можно получить в соответствии со Схемой 14, обеспечивая воздействие Ar2-M на соединение (XXXVI), для преобразования в соединение (XXXVII) с последующей обработкой соединения (XXXVII) триэтилсиланом в присутствии комплекса трифторид бора-диэтиловый эфир, трифторуксусной кислоты или т.п.
Схема 14
Формула 22

где X имеет указанное выше значение; R17 имеет такое же значение, как указано выше для Rb; и Ar2 имеет указанное выше значение.
Кроме того, соединения по настоящему изобретению также можно получить, например, в соответствии со Схемой 15, как показано ниже.
Схема 15
Формула 23

где R18 имеет такое же значение, как указано выше для Rb; и Ar имеет указанное выше значение.
А именно соединение (XXXX-I) можно получить путем воздействия подходящего алкиллитиевого соединения (например, н-бутиллития или т.п.) на соединение (XXXVIII) для взаимодействия с соединением (V) и каталитического гидрирования полученного соединения (XXXIX-I) с использованием палладиевого катализатора или т.п. Таким же способом соединение (XXXX-II) может быть непосредственно получено путем каталитического гидрирования соединения (XXXIX-II) при помощи палладиевого катализатора, или его можно получить путем ацетилирования гидроксигруппы с последующим удалением ацетоксигруппы и бензильных групп путем реакции каталитического гидрирования с использованием палладиевого катализатора или т.п. (если необходимо, добавляют кислоту, такую как хлористоводородная кислота). В этом случае соединение (XXXVIII) может быть синтезировано, например, способом, описанным в Международной Публикации № WO01/27128.
Соединение (XXXX) также можно получить, например, в соответствии со способом, представленным на Схеме 16, как показано ниже.
Схема 16
Формула 24

где X23 и X24 представляют собой атомы галогена; R18 имеет такое же значение, как указано выше для Rb; и Ar2 имеет указанное выше значение.
А именно обеспечивают воздействие подходящего алкиллитиевого соединения (например, н-бутиллития или т.п.) на соединение (XXXXI) и взаимодействие этого соединения с соединением (V) для получения соединения (XXXXII), и образовавшуюся гидроксигруппу преобразовывают в тиокарбонилоксигруппу путем метилтиокарбонилирования или имидазолилтиокарбонилирования, затем осуществляют деоксигенирирование воздействием радикального реагента (например, реагента, представляющего собой гидрид олова, такого как гидрид трибутилолова, силанового реагента, такого как дифенилсилан, сочетания дифосфористой кислоты или диэтилфосфит с третичным амином) на соединение (XXXXII) в присутствии подходящего радикального инициатора (например, 2,2'-азобисизобутиронитрил, бензоилпероксид или т.п.) для синтеза соединения (XXXXIII). Затем соединение (XXXXIII) преобразовывают в бензилгалогенид (XXXXIV) в подходящих условиях галогенирования (например, при помощи N-бромсукцинимида, брома, бромистого водорода или т.п.), и бензилгалогенид (XXXXIV) подвергают взаимодействию с арилгалогенидом (включая гетероарилгалогенид) в присутствии подходящего катализатора [например, тетракистрифенилфосфинпалладия (0), 1,2-бис(дифенилфосфинoэтан)-дихлорпалладия (II) или т.п.] и после этого осуществляют дебензилирование с получением соединения (XXXX).
Промежуточное соединение (XXXXIV) можно получить способом, представленным на Схеме 17, как показано ниже.
Схема 17
Формула 25

где R18 имеет такое же значение, как указано выше для Rb; Р представляет собой защитную группу; X представляет собой атом галогена и Ar2 имеет указанное выше значение.
А именно после защиты гидроксигруппы соединения (XXXXVI] при помощи подходящей защитной группы (например, трет-бутилдиметилсилильной группы, тетрагидропиранильной группы или т.п.) полученное соединение обрабатывают подходящим алкиллитиевым соединением (например, н-бутиллитием или т.п.) и подвергают взаимодействию с соединением (V) с получением соединения (XXXXVII). Затем третичную гидроксигруппу преобразовывают, например, в тиокарбонилоксигруппу путем метилтиокарбонилирования или имидазолилтиокарбонилирования, а затем обеспечивают воздействие радикального реагента (например, реагента, представляющего собой гидрид олова, такого как гидрид трибутилолова, силанового реагента, такого как дифенилсилан, сочетания дифосфористой кислоты или диэтилфосфита с третичным амином) на полученное соединение в присутствии подходящего радикального инициатора (например, 2,2'-азобисизобутиронитрила, бензоилпероксида) для преобразования в соединение (XXXXVIII). Затем осуществляют удаление защиты с получением соединения (XXXXIX) и после этого при помощи подходящих условий галогенирования (например, когда X представляет собой атом брома, эти условия включают использование N-бромсукцинимида, брома, тетрабромида углерода или т.п. в присутствии трифенилфосфина) может быть синтезировано соединение (XXXXIV).
Соединение (L) также можно получить, например, в соответствии со Схемой 18, как показано ниже.
Схема 18
Формула 26

где R11 имеет такое же значение, как указано выше для Rb; и Ar2 имеет указанное выше значение.
А именно соединение (L) по настоящему изобретению можно получить с использованием соединения (LI) или соединения (LII) вместо соединения (IV) в способе получения, представленном на Схеме 5. Соединение (LI) может быть синтезировано способом, описанным в документе [J. Org. Chem., 63, 5668 (1998)], а соединение (LII) может быть синтезировано способом, описанным в документе [Tetrahedron, 56, 7109 (2000)].
Кроме того, соединения по настоящему изобретению также можно получить, например, в соответствии со Схемой 19, как показано ниже.
Схема 19
Формула 27

где R17 имеет такое же значение, как указано выше для Rb; X имеет указанное выше значение; Tf представляет собой трифторметансульфонильную группу и Ar2 имеет указанное выше значение.
А именно соединение (LV) можно получить обработкой соединения (LIV), полученного путем преобразования соединения (V) в трифлатное соединение, вместе с соединением (LVII), полученным путем обеспечения воздействия подходящего алкиллитиевого соединения (н-бутиллития или т.п.) на соединение (XXXIII), подлежащего обработке эфиром борной кислоты (триметилборатом или т.п.), в присутствии палладиевого катализатора (тетракистрифенилфосфинпалладия или т.п.). Соединение (LVI) можно получить путем обработки этого соединения (LV) трихлоридом бора или т.п. в присутствии пентаметилбензола или т.п.
Способ получения соединений по настоящему изобретению не ограничивается описанными выше способами. Соединения по настоящему изобретению можно синтезировать, например, путем подходящего сочетания стадий, включенных в Схемы 1-19.
Технический результат настоящего изобретения
Соединения по настоящему изобретению не только обладают активностью ингибирования SGLT2, но также обладают подходящими свойствами как лекарственные средства, такими как метаболическая стабильность, пероральная абсорбируемость, продолжительность действия лекарственного средства и безопасность. Таким образом, настоящим изобретением обеспечиваются фармацевтические композиции, обладающие действием по снижению уровня сахара в крови, которые используют для профилактики или лечения диабета, такого как инсулин-зависимый сахарный диабет (диабет типа I) и инсулин-независимый сахарный диабет (диабет типа II), диабетических осложнений и ожирения, вызванного гипергликемией.
ПРИМЕРЫ
Содержание настоящего изобретения далее раскрывается более подробно при помощи представленных ниже примеров и экспериментального примера, но настоящее изобретение не ограничивается их содержанием.
Каждая аббревиатура в представленных ниже примерах имеет следующее значение.
ЯМР: спектр ядерного магнитного резонанса (TMS внутренний стандарт);
MS: данные масс-спектрометрического анализа;
ВЭЖХ: высокоэффективная жидкостная хроматография.
Данные ЯМР, MS и ВЭЖХ получают с использованием следующего оборудования.
ЯМР: JOEL JNM-EX-270 (270 МГц), Varian Mercury 300 (300 МГц) или JOEL JNM-ECP 400 (400 МГц);
MS: LCQ от фирмы Thermo Finigan или Micromass ZQ от фирмы Waters;
ВЭЖХ: 2690/2996 (Детектор) от фирмы Waters.
Условия измерения для ВЭЖХ следующие, если не указано иное.
Колонка: YMC-Pack ODS-A 6,0×150 мм, 5 мкм.
Подвижная фаза: Элюирование с использованием градиента от 0,1% TFA/MeCN (5%) плюс 0,1% TFA/H2O (95%) до 0,1% TFA/MeCN (100%) в течение 20 минут и после этого в тех же условиях [0,1% TFA/MeCN (100%)] в течение пяти минут.
Скорость потока: 1,5 мл/минута.
Температура колонки: комнатная температура.
Условия детекции: весь диапазон длин волн от 230 до 400 нм.
Пример 1
[2-(4-Метоксибензил)фенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез метилового эфира 2-(2,3,4,6-тетра-O-бензил-5a-карба-β-D-глюкопиранозил)бензойной кислоты
К раствору в ТГФ (400 мкл) метилсалицилата (72 мкл, 0,557 ммоль) добавляли трифенилфосфин (146 мг, 0,557 ммоль) и 2,3,4,5,6-тетра-О-бензил-5a-карба-α-D-глюкопиранозу (200 мг, 0,371 ммоль), к полученной смеси добавляли по каплям диэтилазодикарбоксилат (DEAD, 88 мкл, 0,557 ммоль) и полученный смешанный раствор перемешивали при комнатной температуре в течение 10 часов. Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали препаративной тонкослойной хроматографией (ТСХ) [элюент=этилацетат:н-гексан (1:3)] с получением указанного в заголовке соединения (123 мг, 49%).
1H-NMR (CDCl3) δ: 1,60-1,80 (2H, м), 2,15-2,24 (1H, м), 3,48-3,64 (4H, м), 3,75-3,90 (1H, м), 3,83 (3H, с), 4,43 (3H, с), 4,53 (1H, д, J=10,7 Гц), 4,51-4,98 (6H, м), 6,95-7,02 (1H, м), 7,10-7,50 (22H, м), 7,78 (1H, дд, J=1,65, 7,75 Гц)
MS (ESI+): 695 [M+Na]+
(2) Синтез 2-(2,3,4,6-тетра-O-бензил-5a-карба-β-D-глюкопиранозил)бензилового спирта
Литийалюминийгидрид (10,4 мг, 0,274 ммоль) добавляли небольшими порциями к раствору в ТГФ (360 мкл) метилового эфира 2-(2,3,4,6-тетра-O-бензил-5a-карба-β-D-глюкопиранозил)бензойной кислоты (123 мг, 0,183 ммоль) и реакционную смесь перемешивали на масляной бане (55°C) в течение трех часов. Реакционную смесь охлаждали до комнатной температуры, затем к полученной смеси добавляли воду и экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали препаративной ТСХ [элюент=этилацетат:н-гексан (1:3)] с получением указанного в заголовке соединения (95 мг, 81%).
1H-NMR (CDCl3) δ: 1,60-1,80 (2H, м), 2,16-2,22 (1H, м), 3,46-3,74 (5H, м), 4,43 (3H, с), 4,54 (1H, д, J=10,7 Гц), 4,66 (2H, ушир.с), 4,81-4,96 (5H, м), 6,94-7,31 (24H, м)
MS (ESI+): 667 [M+Na]+
(3) Синтез 2-(2, 3, 4,6-тетра-O-бензил-5a-карба-β-D-глюкопиранозил)бензальдегида
К раствору в дихлорметане (1,5 мл) 2-(2,3,4,6-тетра-О-бензил-5a-карба-β-D-глюкопиранозил)бензилового спирта (95 мг, 0,147 ммоль) добавляли реагент Десса-Мартина (94 мг, 0,221 ммоль) и полученный смешанный раствор перемешивали при комнатной температуре в течение 45 минут. Нерастворимые вещества удаляли из реакционной смеси фильтрованием и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали препаративной ТСХ [элюент=этилацетат:н-гексан (1:3)] с получением указанного в заголовке соединения (77 мг, 81%).
1H-NMR (CDCl3) δ: 1,60-1,80 (2H, м), 2,17-2,23 (1H, м), 3,48-3,78 (5H, м), 4,44 (3H, с), 4,54 (1H, д, J=10,7 Гц), 4,73-4,97 (5H, м), 7,00-7,32 (22H, м), 7,50 (1Н, дд, J=1,48, 7,83 ГЦ), 7,83 (1H, дд, J=1,49, 7,58 Гц), 10,4 (1H, с)
(4) Синтез [2-(2,3,4,6-тетра-O-бензил-5a-карба-β-D-глюкопиранозил)фенил]-4-метоксифенилметанола
К раствору в диэтиловом эфире (120 мкл) 2-(2,3,4,6-тетра-О-бензил-5a-карба-β-D-глюкопиранозил)бензальдегида (77 мг, 0,119 ммоль) добавляли раствор 0,5 M 4-метоксифенилмагния в ТГФ (480 мкл, 0,238 ммоль) и полученный смешанный раствор перемешивали при комнатной температуре в течение 13 часов. К полученной смеси добавляли насыщенный водный раствор хлорида аммония и смесь экстрагировали этилацетатом. Органический слой сушили (безводный сульфат магния) и растворитель концентрировали при пониженном давлении. Полученный остаток очищали препаративной ТСХ [элюент=этилацетат:н-гексан (1:3)] с получением указанного в заголовке соединения (66 мг, 74%).
1H-NMR (CDCl3) δ: 1,60-1,80 (2H, м), 1,95-2,09 (1H, м), 2,66 (1H, д, J=4,78 Гц), 3,38-3,79 (5H, м), 3,65 (1,2H, с), 3,69 (1,8H, с), 4,33-4,93 (9H, м), 5,96-6,16 (1H, м), 6,73-7,42 (28H, м)
MS (ESI+): 773 [M+Na]+
(5) Синтез [2-(4-метоксибензил)фенил]-5a-карба-β-D-глюкопиранозида
К [2-(2,3,4,6-тетра-О-бензил-5a-карба-β-D-глюкопиразил)фенил]-4-метоксифенилметанолу (66 мг, 0,0879 ммоль) добавляли метанольный раствор хлористоводородной кислоты (2 мл), содержащий 20% гидроксид палладия на углероде (10 мг), и реакционную смесь перемешивали в атмосфере водорода в течение трех часов. По завершении реакции реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении и полученный остаток очищали препаративной ТСХ [элюент=метанол:дихлорметан (1:10)] с получением указанного в заголовке соединения (20 мг, 61%).
1H-NMR (CD3OD) δ: 0,89-1,03 (1H, м), 1,40-1,60 (1H, м), 2,02-2,10 (1H, м), 3,18-3,34 (2H, м), 3,45-3,51 (2H, м), 3,67-3,71 (1H, м), 3,73 (3H, с), 3,82-3,99 (2H, м), 4,13-4,22 (1H, м), 6,78 (2H, д, J=8,57 Гц), 6,80-6,86 (1H, м), 6,99-7,16 (5H, м)
MS (ESI+): 397 [M+Na]+
Время удерживания ВЭЖХ: 10,6 минут
Пример 2
[1S,2R,3R,4R,6S]-4-Гидроксиметил-6-[3-(4-метоксибензил)-фенил]циклогексан-1,2,3-триол
(1) Синтез [2R,3S,4R,5R]-2,3,4-трисбензилокси-5-бензилоксиметил-1-[3-(4-метоксибензил)фенил]циклогексанола
К раствору 3-(4-метоксибензил)-1-бромбензола (155 мг, 0,559 ммоль) в ТГФ (0,80 мл) добавляли по каплям раствор 2,44 M н-бутиллития в гексане (0,23 мл, 0,559 ммоль) при -78°C и полученный смешанный раствор перемешивали в течение 25 минут. Затем к полученной смеси добавляли по каплям раствор 2,3,4-трибензилокси-5-(бензилоксиметил)циклогексанона (200 мг, 0,373 ммоль) в ТГФ (0,70 мл) и реакционную смесь перемешивали в течение 75 минут. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония, смесь экстрагировали этилацетатом, органический слой промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом магния. Растворитель концентрировали и полученный остаток очищали хроматографией на силикагеле [элюент=этилацетат:н-гексан (2:5)] с получением указанного в заголовке соединения (80 мг, 27%) в виде смеси 1R-изомера и 1S-изомера.
1H-NMR (CDCl3) δ: 1,82-1,92 (1H, м), 2,39-2,44 (1H, м), 2,56-2,64 (1H, м), 3,34-3,39 (1H, м), 3,55-3,80 (2H, м), 3,66 (3H, с), 3,78 (2H, с), 3,87-3,94 (2H, м), 4,42-5,04 (8H, м), 6,61-6,84 (4H, м), 7,06-7,40 (23H, м), 7,55-7,66 (1H, м)
(2) Синтез [2R,3S,4R,5R]-2,3,4-трис-бензилокси-5-бензилоксиметил-1-[3-(4-метоксибензил)фенил]циклогексилового эфира уксусной кислоты
К раствору [2R,3S,4R,5R]-2,3,4-трисбензилокси-5-бензилоксиметил-1-[3-(4-метоксибензил)фенил]циклогексанола (20 мг), триэтиламина (0,008 мл) и 4-диметиламинопиридина (0,7 мг) в дихлорметане (0,10 мл) добавляли при охлаждении льдом уксусный ангидрид (0,003 мл) и реакционную смесь перемешивали при комнатной температуре в течение двух часов. Затем к полученной смеси добавляли ацетилхлорид (0,003 мл) при охлаждении льдом и реакционную смесь перемешивали при комнатной температуре в течение 30 минут. К полученной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, смесь экстрагировали дихлорметаном и органический слой сушили над безводным сульфатом магния. Растворитель концентрировали и полученный остаток очищали препаративной ТСХ [элюент=этилацетат:н-гексан (2:5)] с получением указанного в заголовке соединения (4,2 мг).
1H-NMR (CDCl3) δ: 1,85 (3H, с), 2,03-2,17 (2H, с), 3,20-3,49 (3H, м), 3,60-3,72 (2H, м), 3,67 (3H, с), 3,87 (2H, с), 4,07 (1H, д, J=9,9 Гц), 4,39-4,95 (8H, м), 6,72 (2H, д, J=8,6 Гц), 6,99-7,40 (24H, м), 7,54 (1H, д, J=7,8 Гц), 7,65 (1H, с)
MS (ESI+): 794 [M+H2О]+
(3) Синтез [1S, 2R,3R,4R,6S]-4-гидроксиметил-6-[3-(4-метоксибензил)фенил]циклогексан-1,2,3-триола
К раствору в метаноле (0,2 мл)-ТГФ (0,2 мл) [2R,3S,4R,5R]-2,3,4-трисбензилокси-5-бензилоксиметил-1-[3-(4-метоксибензил)фенил]циклогексилового эфира уксусной кислоты (4,2 мг) добавляли 20% гидроксид палладия на углероде (3 мг) и полученный смешанный раствор перемешивали в атмосфере водорода в течение трех часов. Реакционную смесь фильтровали, фильтрат концентрировали и полученный остаток очищали препаративной ТСХ [элюент=дихлорметан:метанол (9:1)] с получением указанного в заголовке соединения (1,7 мг) в виде одного диастереомера.
1H-NMR (ДМСО-d6) δ: 1,24 (1H, дд, J=12,9, 12,6 Гц), 1,48 (1H, м), 1,65 (1H, дт, J=13,8, 3,3 Гц), 2,43 (1H, дт, J=10,4, 4,2 Гц), 3,05-3,17 (2H, м), 3,26-3,40 (2H, м), 3,60 (1H, м), 3,71 (3H, с), 3,83 (2H, с), 4,15 (1H, д, J=4,8 Гц), 4,21 (1H, т, J=5,1 Гц), 4,45 (1H, ушир.), 4,60 (1H, ушир.), 6,84 (2H, м), 6,93-7,08 (3H, м), 7,10-7,20 (3H, м)
MS (ESI+): 376 [M+H2О]+
Пример 3
[2-(4-Трифторметоксибензил)фенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез (2-бензилоксифенил)-(трифторметоксифенил)-метанола
В потоке азота раствор н-бутиллития в гексане (1,59 M, 8,7 мл) добавляли по каплям к раствору 1-бензилокси-2-бромбензола (3,3 г, 12,64 ммоль) в ТГФ (126 мл) при -78°C и полученный смешанный раствор перемешивали при указанной температуре в течение 15 минут. К этому раствору добавляли по каплям при -78°C раствор 4-трифторметоксибензальдегида (2,0 г, 10,52 ммоль) в ТГФ (42 мл). Реакционную смесь перемешивали при указанной температуре в течение 40 минут и при 0°C в течение 45 минут, затем к полученной смеси добавляли насыщенный водный раствор хлорида аммония и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), а затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)] с получением указанного в заголовке соединения (3,03 г, 77%) в виде бесцветного масла.
1H-NMR (CDCl3) δ: 2,98 (1H, д, J=5,8 Гц), 5,01 (2H, с), 6,02 (1H, д, J=5,6 Гц), 6,84-7,00 (2H, м), 7,03-7,37 (11H, м)
(2) Синтез 2-(4-трифторметоксибензил)фенола
Катализатор 20% гидроксид палладия (150 мг) добавляли к раствору (2-бензилоксифенил)-(4-трифторметоксифенил)метанола (1,5 г, 4,01 ммоль) в метаноле (27 мл) и затем к полученной смеси добавляли 36% раствор HCl (0,33 мл). Полученный смешанный раствор перемешивали в атмосфере водорода в течение 16 часов, а затем охлаждали до 0°C, к полученной смеси добавляли карбонат калия (0,54 г) и смесь перемешивали в течение 30 минут, а затем катализатор удаляли фильтрованием. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)] с получением указанного в заголовке соединения в виде белого твердого вещества (1,05 г, 97%).
1H-NMR (CDCl3) δ: 3,98 (2H, с), 4,83 (1H, с), 6,77 (1H, д, J=7,7 Гц), 6,89 (1H, т, J=7,3 Гц), 6,99-7,13 (4H, м), 7,23 (2H, д, J=8,1 Гц)
(3) Синтез [2-(4-трифторметоксибензил)фенил]-5a-карба-β-D-глюкопиранозида
В потоке азота 2,3,4,6-тетра-O-бензил-5a-карба-α-D-глюкопиранозу (400 мг, 0,74 ммоль) и трибутилфосфин (0,28 мл, 1,11 ммоль) добавляли при охлаждении льдом к раствору 2-(4-три-фторметоксибензил)фенола (298 мг, 1,11 ммоль) в толуоле (2,5 мл), затем добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 191 мг, 1,11 ммоль). Реакционную смесь перемешивали в течение ночи, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)], а затем препаративной ТСХ [элюент=этилацетат:н-гексан (1:5)]. Полученный неочищенный продукт растворяли в смешанном растворе тетрагидрофуран (1,4 мл)-метанол (2,8 мл), к полученной смеси добавляли катализатор 20% гидроксид палладия (40 мг) и смесь перемешивали в атмосфере водорода в течение 1,75 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали препаративной ТСХ [элюент=метиленхлорид:метанол (10:1)] с получением указанного в заголовке соединения (67 мг, 21%).
1H-NMR (CD3OD) δ: 0,85-0,99 (1H, м), 1,44-1,61 (1H, m), 2,00-2,11 (1H, м), 3,12-3,33 (2H, м), 3,38-3,48 (2H, м), 3,64-3,73 (1H, м), 3,93 (1H, д, J=14,8 Гц), 4,07 (1H, д, J=14,8 Гц), 4,12-4,23 (1H, м), 6,86 (1H, т, J=7,3 Гц), 6,96-7,17 (5H, м), 7,29 (2H, д, J=8,6 Гц)
MS (ESI+): 428 [M]+
Время удерживания ВЭЖХ: 12,7 минут
Пример 4
[2-(4-Циклопентилбензил)фенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез (2-бензилоксифенил)-(4-бромфенил)метанола
В потоке азота раствор н-бутиллития в гексане (1,59 M, 11,57 мл) добавляли по каплям к раствору 1-бензилокси-2-бромбензола (4,4 г, 16,72 ммоль) в ТГФ (168 мл) при -78°C и полученный смешанный раствор перемешивали при указанной температуре в течение 15 минут. К этому раствору добавляли по каплям при -78°C раствор 4-бромбензальдегида (2,47 г, 13,34 ммоль) в ТГФ (50 мл). Реакционную смесь перемешивали при указанной температуре в течение 30 минут и при 0°C в течение 30 минут, затем к полученной смеси добавляли насыщенный водный раствор хлорида аммония и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)] с получением указанного в заголовке соединения (4,08 г, 83%) в виде бесцветного масла.
1H-NMR (CDCl3) δ: 2,96 (1H, д, J=6,1 Гц), 5,01 (2H, с), 5,97 (1H, д, J=5,9 Гц), 6,86-6,99 (2H, м), 7,09-7,39 (11H, м)
(2) Синтез 1-бензилокси-2-(4-бромбензил)бензола
В потоке азота триэтилсилан (1,84 мл, 11,55 ммоль) и комплекс трифторид бора-диэтиловый эфир (1,33 мл, 10,5 ммоль) добавляли к раствору (2-бензилоксифенил)-(4-бромфенил)метанола (3,88 г, 10,5 ммоль) в ацетонитриле (19,5 мл) при -40°C и смесь перемешивали при указанной температуре в течение 0,5 часа. К реакционной смеси добавляли насыщенный водный раствор карбоната калия и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)] с получением указанного в заголовке соединения (2,86 г, 77%).
1H-NMR (CDCl3) δ: 3,95 (2H, с), 5,03 (2H, с), 6,81-6,92 (2H, м), 6,96-7,36 (11H, м)
(3) Синтез 1-[4-(2-бензилоксибензил)фенил]циклопентанола
В потоке азота раствор н-бутиллития в гексане (1,59 M, 294 мл) добавляли по каплям к раствору 1-бензилокси-2-(4-бромбензил)бензола (1,5 г, 4,25 ммоль) в ТГФ (16,5 мл) при -78°C и смесь перемешивали при указанной температуре в течение 30 минут. К этой смеси добавляли по каплям при -78°C раствор циклопентанона (357 мг, 4,2 5 ммоль) в ТГФ (4 мл). Реакционную смесь перемешивали при указанной температуре в течение 50 минут и при 0°C в течение одного часа, затем к полученной смеси добавляли насыщенный водный раствор хлорида аммония и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)] с получением указанного в заголовке соединения (1,14 г, 75%) в виде бесцветного масла.
1H-NMR (CDCl3) δ: 1,47-2,02 (8H, м), 4,00 (2H, с), 5,03 (2H, с), 6,79-6,89 (2H, м), 7,02-7,36 (11H, м)
(4) Синтез 2-(4-циклопентилбензил)фенола
К раствору 1-[4-(2-бензилоксибензил)фенил]циклопентанола (1,14 г, 3,19 ммоль) в метаноле (21 мл) добавляли катализатор 20% гидроксид палладия (114 мг), затем к полученной смеси добавляли 36% раствор HCl (0,255 мл). Смесь перемешивали в атмосфере водорода в течение ночи, а затем охлаждали до 0°C, к полученной смеси добавляли карбонат калия (425 мг) и смесь перемешивали в течение 20 минут, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:20)] с получением указанного в заголовке соединения (744 мг, 92%) в виде белого твердого вещества.
1H-NMR (CDCl3) δ: 1,44-1,84 (6H, м), 1,93-2,09 (2H, м), 2,84-3,00 (1H, м), 3,95 (2H, с), 4,76 (1H, с), 6,76 (1H, д, J=8,1 Гц), 6,87 (1H, т, J=7,3 Гц), 7,02-7,20 (6H, м)
(5) Синтез [2-(4-циклопентилбензил)фенил]-5a-карба-β-D- глюкопиранозида
В потоке азота 2,3,4,6-тетра-O-бензил-5a-карба-α-D-глюкопиранозу (500 мг, 0,93 ммоль) и трибутилфосфин (0,35 мл, 1,39 ммоль) добавляли к раствору 2-(4-циклопентилбензил)фенола (351 мг, 1,39 ммоль) в толуоле (3,1 мл) при охлаждении льдом, затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 239 мг, 1,39 ммоль). Реакционную смесь перемешивали в течение ночи, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=н-гексан:дихлорметан:ацетон (12:3:1)] с получением неочищенного продукта (555 мг). Полученный неочищенный продукт растворяли в смешанном растворе тетрагидрофуран (0,9 мл)-метанол (1,8 мл), к полученной смеси добавляли катализатор 20% гидроксид палладия (12,6 мг) и смесь перемешивали в атмосфере водорода в течение семи часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали препаративной ТСХ [элюент=метиленхлорид:метанол (10:1)] с получением указанного в заголовке соединения (40 мг, 58%).
1H-NMR (CD3OD) δ:,79-0,96 (1H, м), 1,44-1,86 (7H, м), 1,93-2,07 (3H, м), 2,84-2,99 (1H, м), 3,12-3,31 (2H, м), 3,37-3,48 (2H, м), 3,62-3,71 (1H, м), 3,86 (1H, д, J=14,8 Гц), 3,98 (1H, д, J=14,8 Гц), 4,08-4,20 (1H, м), 6,83 (1H, т, J=7,3 Гц), 6,93-7,14 (7H, м)
MS (ESI+): 413 [M+H]+
Время удерживания ВЭЖХ: 14,5 минут
Пример 5
[2-(4-Хлорбензил)фенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез (2-бензилоксифенил)-(4-хлорфенил)-метанола
В потоке азота раствор н-бутиллития в гексане (2,44 M, 10,3 мл) добавляли по каплям к раствору 1-бензилокси-2-бромбензола (6,0 г, 22,8 ммоль) в ТГФ (228 мл) при -78°C и смесь перемешивали при указанной температуре в течение 30 минут. К этому раствору добавляли по каплям при -78°C раствор 4-хлорбензальдегида (2,67 г, 19,0 ммоль) в ТГФ (76 мл). Реакционную смесь перемешивали при указанной температуре в течение двух часов и затем при 0°C в течение одного часа. К полученной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5)] с получением указанного в заголовке соединения (4,76 г, 77%).
1H-NMR (CDCl3) δ: 2,94 (1H, с), 5,01 (2H, с), 5,99 (1H, с), 6,92-7,00 (22H, м), 7,17-7,41 (11H, м)
(2) Синтез 1-бензилокси-2-(4-хлорбензил)бензола
В потоке азота триэтилсилан (2,8 мл, 17,6 ммоль) и комплекс трифторид бора-диэтиловый эфир (1,84 мл, 14,6 ммоль) добавляли к раствору (2-бензилоксифенил)-(4-хлорфенил)метанола (4,76 г, 14,6 ммоль) в ацетонитриле (150 мл) при -40°C и реакционную смесь перемешивали при указанной температуре в течение 2 часов, а затем при 0°C в течение одного часа. К полученной смеси добавляли воду и смесь экстрагировали метиленхлоридом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)] с получением указанного в заголовке соединения (3,85 г, 85%).
1H-NMR (CDCl3) δ: 3,97 (2H, с), 5,03 (2H, с), 6,87-6,92 (2H, м), 7,08-7,37 (11H, м)
(3) Синтез 2-(4-хлорбензил)фенола
В потоке азота диметилсульфид (105,1 мкл, 2,43 ммоль) и комплекс трифторид бора-диэтиловый эфир (51,3 мкл, 0,4 ммоль) добавляли при охлаждении льдом к раствору 1-бензилокси-2-(4-хлорбензил)бензола (50,0 мг, 0,16 ммоль) в метиленхлориде (2,0 мл) и реакционную смесь перемешивали в течение 19 часов, при этом постепенно повышая ее температуру до комнатной температуры. После этого к полученной смеси добавляли воду при охлаждении льдом и смесь экстрагировали метиленхлоридом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5)] с получением указанного в заголовке соединения (33,4 мг, 94%).
1H-NMR (CDCl3) δ: 3,95 (2H, с), 4,60 (1H, с), 6,75-6,78 (1H, м), 6,86-6,92 (1H, м), 7,07-7,27 (6H, м)
(4) Синтез [2-(4-хлорбензил)фенил]-5a-карба-β-D-глюкопиранозида
В потоке азота 2,3,4,6-тетра-O-бензил-5a-карба-α-D-глюкопиранозу (500 мг, 0,93 ммоль) и трибутилфосфин (0,35 мл, 1,39 ммоль) добавляли при охлаждении льдом к раствору 2-(4-хлорбензил)фенола (304 мг, 1,55 ммоль) в толуоле (2 мл), затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 239 мг, 1,29 ммоль). Реакционную смесь перемешивали в течение 20 часов, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)]. Полученный неочищенный продукт растворяли в метиленхлориде (8 мл) и к полученной смеси добавляли при охлаждении льдом диметилсульфид (2,17 мл, 50,2 ммоль) и комплекс трифторид бора-диэтиловый эфир (1,08 мл, 8,51 ммоль). Реакционную смесь перемешивали в течение 25 часов, при этом постепенно повышая ее температуру до комнатной температуры, затем к полученной смеси добавляли воду при охлаждении льдом и смесь экстрагировали метиленхлоридом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), а затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид:метанол (10:1)] с получением указанного в заголовке соединения (122,6 мг, 35%).
1H-NMR (CD3OD) δ: 0,95 (1H, дд, J=13,2, l1,1 Гц), 1,53 (1H, м), 2,00-2,09 (1H, м), 3,20 (1H, д, J=8,7 Гц), 3,25 (1H, д, J=5,1 Гц), 3,43-3,51 (2H, м), 3,68-3,71 (1H, дд, J=3,9, 3,9 Гц), 3,91 (1H, д, J=14,7 Гц), 3,99 (1H, д, J=15 Гц), 4,15-4,23 (1H, м), 6,85 (1H, т, J=7,5 Гц), 7,03 (1H, д, J=9,0 Гц), 7,08-7,23 (6H, м)
MS (ESI+): 379 [M+H]+
Время удерживания ВЭЖХ: 11,7 минут
Пример 6
(2-Бензилфенил)-5a-карба-β-D-глюкопиранозид
(1) Синтез 2-бензилфенола
К раствору 2-(4-хлорбензил)фенола (618,5 мг, 2,83 ммоль) в метаноле (20 мл) добавляли катализатор 20% гидроксид палладия (240 мг). Смесь перемешивали в атмосфере водорода в течение трех дней, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:4)] с получением указанного в заголовке соединения (348,4 мг, 67%).
1H-NMR (CDCl3) δ: 3,99 (2H, с), 4,65 (1H, с), 6,79 (1H, д, J=8,1 Гц), 6,89 (1H, т, J=7,5 Гц), 7,09-7,31 (6H, м)
(2) Синтез (2-бензилфенил)-5a-карба-β-D-глюкопиранозида
В потоке азота 2,3,4,6-тетра-О-бензил-5a-карба-α-D-глюкопиранозу (500 мг, 0,93 ммоль) и трибутилфосфин (0,35 мл, 1,39 ммоль) добавляли к раствору 2-бензилфенола (256,5 мг, 1,39 ммоль) в толуоле (2 мл) при охлаждении льдом, затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 239 мг, 1,39 ммоль). Реакционную смесь перемешивали в течение 21 часов, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)]. Полученный неочищенный продукт растворяли в смешанном растворе метанол-ТГФ (1:1) (14 мл) и к полученной смеси добавляли катализатор 20% гидроксид палладия (118,8 мг) и смесь перемешивали в атмосфере водорода в течение 15 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид:метанол (10:1)] с получением указанного в заголовке соединения (84 мг, 26%).
1H-NMR (CD3OD) δ: 0,95 (1H, дд, J=12,0, 11,7 Гц), 1,49-1,59 (1H, м), 2,03-2,09 (1H, м), 3,20 (1H, д, J=9,0 Гц), 3,25 (1H, д, J=5,7 Гц), 3,34 (4H, с), 3,44-3,50 (2H, м), 3,68 (1H, дд, J=3,9, 4,2 Гц), 3,94 (1H, д, J=15 Гц), 4,0 (1H, д, J=15 Гц), 4,13-4,22 (1H, м), 6,84 (1H, т, J=6,3 Гц), 7,03 (1H, д, J=6,3 Гц), 7,06-7,24 (7H, м)
MS (ESI+): 345 [M+H]+
Время удерживания ВЭЖХ: 10,6 минут
Пример 7
[2-(4-Изопропилбензил)фенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез (2-бензилоксифенил)-(4-изопропилфенил)метанола
В потоке азота раствор н-бутиллития в гексане (2,44 M, 5,14 мл) добавляли по каплям к раствору 1-бензилокси-2-бромбензола (3,0 г, 11,4 ммоль) в ТГФ (114 мл) при -78°C и реакционную смесь перемешивали при указанной температуре в течение 30 минут. К этому раствору добавляли по каплям при -78°C раствор 4-изопропилбензальдегид (1,41 г, 9,49 ммоль) в ТГФ (38 мл). Реакционную смесь перемешивали при указанной температуре в течение одного часа и затем при 0°C в течение одного часа. К полученной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5)] с получением указанного в заголовке соединения (2,63 г, 84%).
1H-NMR (CDCl3) δ: 1,26 (6H, д, J=7,8 Гц), 2,84-2,94 (1H, м), 5,02 (2H, с), 6,02 (1H, с), 6,90-7,00 (2H, м), 7,15-7,34 (11H, м)
(2) Синтез 2-(4-изопропилбензил)фенола
К раствору (2-бензилоксифенил)-(4-изопропилфенил)метанола (2,63 г, 7,92 ммоль) в метаноле (50 мл) добавляли катализатор 20% гидроксид палладия (263 мг), затем к полученной смеси добавляли 2 н. раствор HCl (0,4 мл) и полученный смешанный раствор перемешивали в атмосфере водорода в течение 15 часов, а затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:4)] с получением указанного в заголовке соединения (1,31 г, 73%).
1H-NMR (CDCl3) δ: 1,24 (6H, д, J=7,8 Гц), 2,82-2,92 (1H, м), 3,96 (2H, с), 4,67 (1H, с), 6,79 (1H, д, J=9,0 Гц), 6,88 (1Н, т, J=8,4 Гц), 7,10-7,15 (6H, м)
(3) Синтез [2-(4-изопропилбензил)фенил-5a-карба-β-D-глюкопиранозида
В потоке азота 2,3,4,6-тетра-O-бензил-5a-карба-α-D-глюкопиранозу (500 мг, 0,93 ммоль) и трибутилфосфин (0,35 мл, 1,39 ммоль) добавляли к раствору 2-(4-изопропилбензил)фенола (315,1 мг, 1,39 ммоль) в толуоле (2 мл] при охлаждении льдом, затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 239 мг, 1,39 ммоль). Реакционную смесь перемешивали в течение 20 часов, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)]. Полученный неочищенный продукт растворяли в смешанном растворе метанол-ТГФ (1:1) (14 мл), к полученной смеси добавляли катализатор 20% гидроксид палладия (127,8 мг) и смесь перемешивали в атмосфере водорода в течение 15 часов, а затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид:метанол (10:1)] с получением указанного в заголовке соединения (97,1 мг, 27%).
1H-NMR (CD3OD) δ: 0,94 (1H, дд, J=12,9, 12,0 Гц), 1,22 (6H, д, J=6,9 Гц), 1,48-1,58 (1H, м), 2,02-2,09 (1H, дт, J=3,9, 4,2 Гц), 2,78-2,87 (1H, м), 3,12-3,24 (2H, м), 3,43-3,49 (2H, м), 3,68 (1H, дд, J=6,6, 4,2 Гц), 3,89 (1H, д, J=14,4 Гц), 4,01 (1H, д, J=14,7 Гц), 4,13-4,21 (1H, м), 6,84 (1H, т, J=6,3 Гц), 7,02 (1H, д, J=6,3 Гц), 7,06-7,15 (6H, м)
MS (ESI+): 387 [M+H]+
Время удерживания ВЭЖХ: 13,1 минуты
Пример 8
[2-(4-Циклопропилбензил)фенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез (2-бензилоксифенил)-(4-циклопропилфенил)метанола
В потоке азота раствор н-бутиллития в гексане (2,6 M, 3,5 мл) добавляли по каплям к раствору 1-бензилокси-2-бромбензола (2,2 г, 8,3 ммоль) в ТГФ (83 мл) при -78°C и смесь перемешивали при указанной температуре в течение 30 минут. К этому раствору добавляли по каплям при -78°C раствор 4-циклопропилбензальдегида (1,1 г, 6,9 ммоль) в ТГФ (280 мл). Реакционную смесь перемешивали при указанной температуре в течение одного часа. К полученной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5)] с получением указанного в заголовке соединения (1,7 г, 75%).
1H-NMR (CDCl3) δ: 0,65-0,69 (2H, м), 0,92-0,97 (2H, м), 1,86-1,90 (1H, м), 2,88 (1H, д, J=6 Гц), 5,03 (2H, с), 6,03 (1H, д, J=6 Гц), 7,17-7,26 (5H, м), 7,32-7,35 (4H, м)
MS (ESI+): 315 [M+Na]+
(2) Синтез 1-бензилоксифенил-2-(4-циклопропилбензил)бензола
В потоке азота триэтилсилан (0,73 мл, 4,6 ммoль) и комплекс трифторид бора-диэтиловый эфир (0,5 мл, 4,0 ммоль) добавляли к раствору (2-бензилоксифенил)-(4-циклопропилфенил)метанола (1,3 г, 4,0 ммоль) в ацетонитриле (7 мл) при -40°C и полученный смешанный раствор перемешивали при указанной температуре в течение 1,5 часов, а затем при 0°C в течение 30 минут. К полученной смеси добавляли воду и смесь экстрагировали метиленхлоридом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:7)] с получением указанного в заголовке соединения (1,2 г, 95%).
1H-NMR (CDCl3) δ: 0,63-0,67 (2H, м), 0,89-0,94 (2H, м), 1,84-1,87 (1H, м), 3,98 (2H, с), 5,06 (2H, с), 6,87-6,97 (4H, м), 7,08-7,26 (4H, м), 7,31-7,37 (5H, м)
MS (ESI+): 332 [M+H2O]+
(3) Синтез 2-(4-циклопропилбензил)фенола
В потоке азота диметилсульфид (2,2 мл, 51,7 ммоль) и комплекс трифторид бора-диэтиловый эфир (1,1 мл, 8,8 ммоль) добавляли к раствору 1-бензилокси-2-(4-цикло-пропилбензил)бензола (1,1 г, 3,5 ммоль) в метиленхлориде (24 мл) при охлаждении льдом и реакционную смесь перемешивали в течение 23 часов, при этом постепенно повышая ее температуру до комнатной температуры. К полученной смеси добавляли воду при охлаждении льдом и смесь экстрагировали метиленхлоридом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:4)] с получением указанного в заголовке соединения (620,7 мг, 79%).
1H-NMR (CDCl3) δ: 0,65-0,67 (2H, м), 0,90-0,94 (2H, м), 1,85-1,86 (1H, м), 3,95 (2H, с), 4,90 (1H, с), 6,79 (1H, д, J=8,1 Гц), 6,88 (1H, т, J=7,7 Гц), 7,11 (2H, д, J=8,1 Гц), 7,20 (4H, д, J=7,7 Гц)
MS (ESI+): 247 [M+Na]+
(4) Синтез [2-(4-циклопропилбензил)фенил]-5a-карба-β-D-глюкопиранозида
В потоке азота 2,3,4,6-тетра-O-бензил-5a-карба-α-D-глюкопиранозу (557 мг, 1,03 ммоль) и трибутилфосфин (0,37 мл, 1,55 ммоль) добавляли к раствору 2-(4-циклопропилбензил)фенола (348 мг, 1,55 ммоль) в толуоле (3,5 мл) при охлаждении льдом, затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 267 мг, 1,55 ммоль). Реакционную смесь перемешивали в течение 15 часов, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)]. Полученный неочищенный продукт растворяли в метиленхлориде (3,5 мл) и к полученной смеси добавляли диметилсульфид (1,3 мл, 30,3 ммоль) и комплекс трифторид бора-диэтиловый эфир (0,65 мл, 5,1 ммоль). Реакционную смесь перемешивали в течение 14 часов, при этом постепенно повышая ее температуру до комнатной температуры, затем к полученной смеси добавляли воду при охлаждении льдом и смесь экстрагировали метиленхлоридом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид:метанол (9:1)] с получением указанного в заголовке соединения (97,8 мг, 25%).
1H-NMR (CD3OD) δ: 0,57-0,61 (2H, м), 0,81-0,95 (3H, м), 1,50 (1H, с), 1,79-1,85 (1H, м), 1,99-2,03 (1H, м), 3,15-3,33 (2H, м), 3,42-3,48 (2H, м), 3,66-3,72 (1H, м), 3,81-3,99 (2H, кв., J=14,7 Гц), 4,41-4,85 (1H, м), 6,80-7,15 (8H, м)
MS (ESI+): 407 [M+Na]+
Время удерживания ВЭЖХ: 12,3 минут
Пример 9
[2-(4-н-Пропилбензил)фенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез [2-(4-н-пропилбензил)фенил]-5a-карба-β-D-глюкопиранозида
1-Бензилокси-2-(4-циклопропилбензил)бензол (640,8 мг, 2,0 ммоль), синтезированный в Примере 8, растворяли в 2,2-диметилпропаноле (12 мл), к полученной смеси добавляли катализатор 20% гидроксид палладия (64 мг) и смесь перемешивали в течение двух часов в атмосфере водорода, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:4)]. К раствору полученного неочищенного продукта (348 мг) в толуоле (3,5 мл) добавляли при охлаждении льдом 2,3,4,6-тетра-О-бензил-5a-карба-α-D-глюкопиранозу (557 мг, 1,03 ммоль) и трибутилфосфин (0,39 мл, 1,55 ммоль), затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAC 267 мг, 1,55 ммоль). Реакционную смесь перемешивали в течение 20 часов, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5)]. Полученный неочищенный продукт растворяли в 2,2-диметилпропаноле (15 мл), к полученной смеси добавляли катализатор 20% гидроксид палладия (159 мг), смесь перемешивали в атмосфере водорода в течение 17 часов и катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид:метанол (9:1)] с получением указанного в заголовке соединения (164,4 мг).
1H-NMR (CD3OD) δ: 0,88-0,94 (4H, м), 1,48-1,63 (3H, м), 2,05-2,09 (1H, м), 2,52 (2H, т, J=7,7 Гц), 3,13-3,30 (2H, м), 3,46 (2H, м), 3,70 (1H, м), 3,87 (1H, д, J=15 Гц), 3,98 (1H, д, J=15 Гц), 4,60-4,88 (1H, м), 6,84 (1H, т, J=7,3 Гц), 7,00-7,16 (7H, м)
MS (ESI+): 387 [M+H]+
Время удерживания ВЭЖХ: 13,3 минут
Пример 10
[2-(4-Трифторметилбензил)фенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез (2-бензилоксифенил)-(4-трифторметилфенил)метанола
В потоке азота раствор н-бутиллития в гексане (2,44 M, 4,0 мл) добавляли по каплям к раствору 1-бензилокси-2-бромбензола (2,6 г, 9,9 ммоль) в ТГФ (100 мл) при -78°C и реакционную смесь перемешивали при указанной температуре в течение 30 минут. К этому раствору добавляли по каплям при -78°C 4-трифторметилбензальдегид (1,6 г, 9,0 ммоль). Реакционную смесь перемешивали при указанной температуре в течение двух часов, затем к полученной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5)] с получением указанного в заголовке соединения (2,6 г, 82%).
1H-NMR (CDCl3) δ: 3,01 (1H, д, J=6,3 Гц), 5,02 (2H, дд, J=11,4, 4,8 Гц), 6,05 (1H, д, J=6,3 Гц), 6,94-7,02 (2H, м), 6,96-7,16 (2H, м), 7,24-7,33 (5H, м), 7,44 (2H, д, J=7,1 Гц), 7,53 (2H, д, J=8,7 Гц)
MS (ESI+): 359 [M+H]+
(2) Синтез 2-(4-трифторметилбензил)фенола
К раствору (2-бензилоксифенил)-(4-трифторметилфенил)-метанола (2,46 г, 6,85 ммоль) в метаноле (68,5 мл) добавляли катализатор 20% гидроксид палладия (246 мг), затем к полученной смеси добавляли 36% раствор HCl (0,59 мл) и полученный смешанный раствор перемешивали в атмосфере водорода в течение 3,5 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:8)] с получением указанного в заголовке соединения (1,49 г, 86%).
1H-NMR (CDCl3) δ: 4,03 (2H, с), 4,72 (1H, с), 6,77 (1H, д, J=6,0 Гц), 6,89 (1H, т, J=4,8 Гц), 7,08-7,15 (2H, м), 7,33 (2H, д, J=6,0 Гц), 7,52 (2H, д, J=6,0 Гц)
MS (ESI+): 275 [M+Na]+
(3) Синтез [2-(4-трифторметилбензил)фенил]-5a-карба-β-D-глюкопиранозида
В потоке азота 2,3,4,6-тетра-O-бензил-5a-карба-α-D-глюкопиранозу (500 мг, 0,93 ммоль) и трибутилфосфин (0,35 мл, 1,39 ммоль) добавляли к раствору 2-(4-трифторметилбензил)фенола (351 мг, 1,39 ммоль) в толуоле (3 мл) при охлаждении льдом, затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 239 мг, 1,39 ммоль). Реакционную смесь перемешивали в течение 20 часов, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)]. Полученный неочищенный продукт растворяли в смешанном растворе метанол-ТГФ (1:1) (5 мл), к полученной смеси добавляли катализатор 20% гидроксид палладия (20 мг) и смесь перемешивали в атмосфере водорода в течение 2 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид:метанол (10:1)] с получением указанного в заголовке соединения (74 мг, 19%).
1H-NMR (CD3OD) δ: 0,89 (1H, дд, J=11,7, 12,9 Гц), 1,48-1,61 (1H, м), 2,05 (1H, дт, J=13,2, 4,2 Гц), 3,15-3,34 (2H, м), 3,42-3,49 (2H, м), 3,69 (1H, дд, J=3,9, 10,5 Гц), 3,96-4,15 (2H, дд, J=14,7, 28,2 Гц), 4,17-4,24 (1H, м), 6,87 (1H, дт, J=1,2, 7,5 Гц), 7,02-7,20 (3H, м), 7,38 (2H, д, J=8,1 Гц), 7,51 (2H, д, J=8,4 Гц)
MS (ESI+): 435 [M+Na]+
Время удерживания ВЭЖХ: 12,3 минут
Пример 11
[2-(4-Метилсульфанилбензил)фенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез (2-бензилоксифенил)-(4-метилсульфанилфенил)-метанола
В потоке азота раствор н-бутиллития в гексане (1,59 M, 6,92 мл) добавляли по каплям к раствору 1-бензилокси-2-бромбензола (2,89 г, 11,0 ммоль) в ТГФ (38 мл) при -78°C и полученный смешанный раствор перемешивали при указанной температуре в течение 30 минут. К этому раствору добавляли по каплям при -78°C раствор 4-метилсульфанилбензальдегид (1,67 г, 11,0 ммоль) в ТГФ (12 мл). Реакционную смесь перемешивали при указанной температуре в течение одного часа, затем к полученной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5)] с получением указанного в заголовке соединения (2,14 г, 58%).
1H-NMR (CDCl3) δ: 2,47 (3H, с), 2,92 (1H, д, J=6,0 Гц), 5,03 (2H, с), 6,02 (1H, д, J=6,0 Гц), 6,92-7,00 (2H, м), 7,21-7,34 (11H, м)
(2) Синтез 1-бензилокси-2-(4-метилсульфанилбензил)бензола
В потоке азота триэтилсилан (1,23 мл, 7,72 ммоль) и комплекс трифторид бора-диэтиловый эфир (0,88 мл, 5,48 ммоль) добавляли к раствору (2-бензилоксифенил)-(4-метилсульфанилфенил)метанола (2,13 г, 6,3 ммоль) в ацетонитриле (15 мл) при -40°C и полученный смешанный раствор перемешивали при указанной температуре в течение 1,5 часов, а затем при 0°C в течение 30 минут, затем к полученной смеси добавляли воду и смесь экстрагировали метиленхлоридом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)] с получением указанного в заголовке соединения (1,9 г, 95%).
1H-NMR (CDCl3) δ: 2,46 (3H, с), 3,97 (2H, с), 5,05 (2H, с), 6,85-6,95 (2H, м), 7,10-7,35 (11H, м)
(3) Синтез 2-(4-метилсульфанилбензил)фенола
В потоке азота диметилсульфид (7,25 мл, 138 ммоль) и комплекс трифторид бора-диэтиловый эфир (2,1 мл, 8,8 ммоль) добавляли к раствору 1-бензилокси-(4-метилсульфанилбензил)-бензола (1,9 г, 5,9 ммоль) в метиленхлориде (15 мл) при охлаждении льдом и реакционную смесь перемешивали в течение 48 часов, при этом постепенно повышая ее температуру до комнатной температуры. К полученной смеси добавляли воду при охлаждении льдом и смесь экстрагировали метиленхлоридом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5)] с получением указанного в заголовке соединения (1,19 г, 91%).
1H-NMR (CDCl3) δ: 2,46 (3H, с), 3,95 (2H, с), 4,65-4,75 (1H, ушир.с), 6,78 (1H, д, J=7,6 Гц), 6,89 (1H, т, J=7,6 Гц), 7,09-7,21 (6H, м)
(4) Синтез [2-(4-метилсульфанилбензил)фенил]-5a-карба-β-D-глюкопиранозида
В потоке азота 2,3,4,6-тетра-O-бензил-5a-карба-α-D-глюкопиранозу (500 мг, 0,93 ммоль) и трибутилфосфин (0,35 мл, 1,39 ммоль) добавляли к раствору 2-(4-метилсульфанилбензил)фенола (320 мг, 1,39 ммоль) в толуоле (2 мл) при охлаждении льдом, затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 239 мг, 1,39 ммоль). Реакционную смесь перемешивали в течение 20 часов, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)]. Полученный неочищенный продукт растворяли в метиленхлориде (10 мл) и к полученной смеси добавляли при охлаждении льдом диметилсульфид (3,28 мл, 63 ммоль) и комплекс трифторид бора-диэтиловый эфир (0,94 мл, 5,9 ммоль). Реакционную смесь перемешивали в течение 20 часов, при этом постепенно повышая ее температуру до комнатной температуры, затем добавляли воду при охлаждении льдом и смесь экстрагировали метиленхлоридом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид:метанол (10:1)] с получением указанного в заголовке соединения (102 me 28%).
1H-NMR (CD3OD) δ: 0,80-0,95 (1H, м), 1,45-1,60 (1H, м), 2,00-2,10 (1H, м), 2,42 (3H, с), 3,12-3,33 (2H, м), 3,40-3,50 (2H, м), 3,63-3,70 (1H, м), 3,86 (1H, д, J=15 Гц), 4,00 (1H, д, J=15 Гц), 4,15-4,23 (1H, м), 6,84 (1H, т, J=7,0 Гц), 7,00-7,18 (7H, м)
MS (ESI+): 391 [M+H]+
Время удерживания ВЭЖХ: 11,6 минут
Пример 12
[3-Фтор-2-(4-метилбензил)фенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез (2-бензилокси-6-фторфенил)-(4-метоксифенил)-метанола
К раствору в ТГФ (50 мл) 2-бензилокси-6-фторбензальдегида (2,25 г, 9,8 ммоль), описанного в Международной Публикации WO 04/048335, добавляли по каплям в потоке азота при комнатной температуре раствор 4-метоксифенилмагнийбромида в ТГФ (0,5 M, 21,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1,5 часов, затем к полученной смеси добавляли насыщенный водный раствор хлорида аммония при охлаждении льдом и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5)] с получением указанного в заголовке соединения (2,82 г, 85%).
1H-NMR (CDCl3) δ: 3,78 (1H, д, J=12 Гц), 3,80 (3H, с), 4,98 (1H, д, J=12 Гц), 5,05 (1H, д, J=12 Гц), 6,20 (1H, д, J=12 Гц), 6,74-6,84 (4H, м), 7,11-7,31 (8H, м)
(2) Синтез 3-фтор-2-(4-метокси)фенола
К раствору (2-бензилокси-6-фторфенил)-(4-метоксифенил)метанола (2,54, 7,51 ммоль) в метаноле (20 мл) добавляли катализатор 20% гидроксид палладия (381 мг), затем к полученной смеси добавляли 2 н. раствор HCl (2 мл). Полученный смешанный раствор перемешивали в атмосфере водорода в течение 24 часов, а затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:4)] с получением указанного в заголовке соединения (1,48 г, 85%).
1H-NMR (CDCl3) δ: 3,76 (3H, с), 3,96 (2H, с), 4,90 (1H, ушир.с), 6,57 (1H, д, J=8,0 Гц), 6,67 (1H, т, J=8,0 Гц), 6,82 (2H, д, J=9,0 Гц), 7,06 (1H, дд, J=8,0, 8,0 Гц), 7,19 (2H, д, J=9,0 Гц)
(3) Синтез [3-фтор-2-(4-метоксибензил)фенил]-5a-карба-β-D-глюкопиранозида
В потоке азота 2,3,4,6-тетра-O-бензил-5a-карба-α-D-глюкопиранозу (500 мг, 0,93 ммоль) и трибутилфосфин (0,35 мл, 1,39 ммоль) добавляли к раствору 3-фтор-2-(4-метоксибензил)фенола (323 мг, 1,39 ммоль) в толуоле (2 мл) при охлаждении льдом, затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 239 мг, 1,39 ммоль). Реакционную смесь перемешивали в течение 20 часов, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)]. Полученный неочищенный продукт растворяли в смешанном растворе метанол-ТГФ (1:4) (5 мл) и к полученной смеси добавляли катализатор 20% гидроксид палладия (63 мг). Смесь перемешивали в атмосфере водорода в течение 24 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид-метанол (10:1)] с получением указанного в заголовке соединения (86 мг 24%).
1H-NMR (CD3OD) δ: 0,90-1,05 (1H, м), 1,45-1,60 (1H, м), 2,00-2,10 (1H, м), 3,17-3,35 (2H, м), 3,45-3,52 (2H, м), 3,65-3,70 (1H, м), 3,72 (3H, с), 3,93 (2H, с), 4,15-4,25 (1H, м), 6,67 (1H, т, J=8,0 Гц), 6,76 (2H, д, J=9,0 Гц), 6,86 (1H, д, J=8,0 Гц), 7,09-7,18 (3H, м)
MS (ESI-): 391 [M+H]-
Время удерживания ВЭЖХ: 10,8 минут
Пример 13
[2-(3-Трифторметилбензил)фенил]-5a-карба-β-D-глюко-
пиранозид
(1) Синтез (2-бензилоксифенил)-(3-трифторметилфенил)-метанола
В потоке азота раствор н-бутиллития в гексане (2,7 M, 3,4 мл) добавляли по каплям к раствору 1-бензилокси-2-бромбензола (2,0 г, 7,6 ммоль) в ТГФ (50 мл) при -78°C и полученный смешанный раствор перемешивали при указанной температуре в течение 30 минут. К этому раствору добавляли по каплям при -78°C 4-трифторметилбензальдегид (2,0 г, 11,4 ммоль). Реакционную смесь перемешивали при указанной температуре в течение трех часов, затем к полученной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:4)] с получением указанного в заголовке соединения (2,2 г, 80%).
1H-NMR (CDCl3) δ: 3,03 (1H, д, J=6,3 Гц), 4,97-5,07 (2H, м), 6,06 (1H, д, J=6,3 Гц), 6,95-7,03 (2H, м), 7,16-7,20 (2Н, м), 7,26 (1Н, дд, J=7,7, 2,0 Гц), 7,29-7,36 (4H, м), 7,39 (1H, д, J=7,7 Гц), 7,46-7,55 (2H, м), 7,67 (1H, с)
(2) Синтез 2-(3-трифторметилбензил)фенола
К раствору (2-бензилоксифенил)-(3-трифтор-метилфенил)метанола (3,32 г, 9,3 ммоль) в метаноле (50 мл) добавляли катализатор 20% гидроксид палладия (166 мг), затем к полученной смеси добавляли 36% раствор HCl (0,2 мл). Полученный смешанный раствор перемешивали в атмосфере водорода в течение 72 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:4)3 с получением указанного в заголовке соединения (2,26 г, 96%).
1H-NMR (CDCl3) δ: 4,04 (2H, с), 4,90 (1H, д, J=2,0 Гц), 6,76 (1H, д, J=8,1 Гц), 6,86-6,90 (1H, м), 7,09-7,16 (2H, м), 7,34-7,46 (3H, м), 7,50 (1H, с)
(3) Синтез [2-(3-трифторметилбензил)фенил]-5a-карба-β-D-глюкопиранозида
В потоке азота 2,3,4,6-тетра-O-бензил-5a-карба-α-D-глюкопиранозу (500 мг, 0,93 ммоль) и трибутилфосфин (0,35 мл, 1,39 ммоль) добавляли к раствору 2-(3-три-фторметилбензил)фенола (351 мг, 1,39 ммоль) в толуоле (3 мл) при охлаждении льдом, затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 239 мг, 1,39 ммоль). Реакционную смесь перемешивали в течение 20 часов, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)]. Полученный неочищенный продукт растворяли в смешанном растворе метанол-ТГФ (5:2) (7 мл), к полученной смеси добавляли катализатор 20% гидроксид палладия (45 мг) и смесь перемешивали в атмосфере водорода в течение 15 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид:метанол (10:1)] с получением указанного в заголовке соединения (56 мг, 14%).
1H-NMR (CD3OD) δ: 0,88-1,02 (1H, м), 1,52-1,68 (1H, м), 2,10 (1H, дт, J=13,4, 3,9 Гц), 3,20-3,38 (2H, м), 3,45-3,55 (2H, м), 3,74 (1H, дд, J=4,1, 10,8 Гц), 3,99 (1H, д, J=14,7 Гц), 4,18 (1H, д, J=15,4 Гц), 4,20-4,32 (1H, м), 6,89-6,95 (1H, м), 7,08 (1H, д, J=7,7 Гц), 7,16-7,26 (2H, м), 7,42-7,58 (4H, м)
MS (ESI+): 413 [M+H]+
Время удерживания ВЭЖХ: 12,0 минут
Пример 14
[2-(4-Метоксибензил)-4-метилфенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез 1-бензилокси-2-бром-4-метилбензола
К раствору 2-бром-4-метилфенола (1,5 г, 8,0 ммоль) в N,N-диметилформамиде (40 мл) добавляли карбонат калия (1,32 г, 9,6 ммоль), затем к полученной смеси добавляли бензилбромид (1,05 мл, 8,8 ммоль). Полученный смешанный раствор перемешивали при комнатной температуре в течение 12 часов, затем к полученной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:4)] с получением указанного в заголовке соединения (1,72 г, 77%).
1H-NMR (CDCl3) δ: 2,30 (3H, с), 5,12 (2H, с), 6,82 (1H, д, J=8,4 Гц), 6,99-7,03 (1H, м), 7,28-7,41 (4H, м), 7,45-7,48 (2H, м)
(2) Синтез-(2-бензилокси-5-метилфенил)-(4-метоксифенил)метанола
В потоке азота раствор н-бутиллития в гексане (2,7 M, 2,75 мл) добавляли по каплям к раствору 1-бензилокси-2-бром-4-метилбензола (1,72 г, 6,2 ммоль) в ТГФ (50 мл) при -78°C и полученный смешанный раствор перемешивали при указанной температуре в течение 30 минут. К этому раствору добавляли по каплям при -78°C 4-метоксибензальдегид (1,27 г, 9,3 ммоль). Реакционную смесь перемешивали при указанной температуре в течение двух часов, затем к полученной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:4)] с получением указанного в заголовке соединения (1,46 г, 70%).
1H-NMR (CDCl3) δ: 2,28 (3H, с), 2,88 (1H, д, J=9,2 Гц), 3,80 (3H, с), 5,00 (2H, с), 5,99 (1H, д, J=5,6 Гц), 6,80-6,88 (3H, м), 7,00-7,05 (1H, м), 7,13 (1H, д, J=1,8 Гц), 7,19-7,34 (7Н, м)
(3) Синтез 2-(4-метоксибензил)-4-метилфенола
К раствору (2-бензилокси-5-метоксифенил)-(4-метоксифенил)-метанола (1,46 г, 4,3 ммоль) в метаноле (20 мл) добавляли катализатор 20% гидроксид палладия (73 мг), затем к полученной смеси добавляли 36% раствор HCl (0,1 мл). Смесь перемешивали в атмосфере водорода в течение 72 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:4)] с получением указанного в заголовке соединения (0,8 г, 80%).
1H-NMR (CDCl3) δ: 2,24 (3H, с), 3,77 (3H, с), 3,89 (2H, с), 4,55-4,56 (1H, м), 6,65-6,69 (1H, м), 6,80-6,86 (2H, м), 6,88-6,94 (2H, м), 7,11-7,16 (2H, м)
(4) Синтез [2-(4-метоксибензил)-4-метилфенил]-5a-карба-β-D-глюкопиранозида
В потоке азота 2,3,4,6-тетра-O-бензил-5a-карба-α-D-глюкопиранозу (500 мг, 0,93 ммоль) и трибутилфосфин (0,35 мл, 1,39 ммоль) добавляли к раствору 2-(4-метоксибензил)-4-метилфенола (317 мг, 1,39 ммоль) в толуоле (3 мл) при охлаждении льдом, затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 239 мг, 1,39 ммоль). Реакционную смесь перемешивали в течение 20 часов, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)]. Полученный неочищенный продукт растворяли в смешанном растворе метанол-ТГФ (5:2) (7 мл), к полученной смеси добавляли катализатор 20% гидроксид палладия (44 мг) и смесь перемешивали в атмосфере водорода в течение 4 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид:метанол (10:1)] с получением указанного в заголовке соединения (88 мг, 24%).
1H-NMR (CD3OD) δ: 0,88-1,02 (1H, м), 1,42-1,60 (1H, м), 2,04 (1H, дт, J=13,4, 4,0 Гц), 2,21 (3Н, с), 3,17-3,32 (2H, м), 3,43-3,51 (2H, м), 3,70 (1H, дд, J=4,1, 10,7 Гц), 3,74 (3Н, с), 3,82 (1H, д, J=14,7 Гц), 3,92 (1H, д, J=14,7 Гц), 4,06-4,16 (1H, м), 6,77-6,82 (2H, м), 6,86-6,96 (3H, м), 7,06-7,15 (2H, м)
MS (ESI+): 389 [M+H]+
Время удерживания ВЭЖХ: 11,2 минут
Пример 15
[2-(3-Метоксибензил)фенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез (2-бензилоксифенил)-(3-метоксифенил)метанола
К раствору 2-бензилоксибензальдегида (3,0 г, 14,1 ммоль) в ТГФ (50 мл) добавляли по каплям в потоке азота раствор 4-метоксифенилмагнийбромида в ТГФ (1,0 M, 17,0 мл) при охлаждении льдом. Смесь перемешивали при комнатной температуре в течение одного часа, затем к полученной смеси добавляли при охлаждении льдом насыщенный водный раствор хлорида аммония и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:4)3 с получением указанного в заголовке соединения (4,92 г, 100%).
1H-NMR (CDCl3) δ: 2,97 (1H, дд, J=1,1, 6,0 Гц), 3,73 (3H, с), 4,98-5,10 (2H, м), 6,03 (1H, д, J=6,0 Гц), 6,77-6,82 (1H, м), 6,88-7,01 (4H, м), 7,19-7,35 (9H, м)
(2) Синтез 2-(3-метоксибензил)фенола
К раствору (2-бензилоксифенил)-(3-метоксифенил)метанола (1,68 г, 5,24 ммоль) в метаноле (50 мл) добавляли катализатор 20% гидроксид палладия (168 мг), затем к полученной смеси добавляли 36% раствор HCl (0,2 мл). Смесь перемешивали в атмосфере водорода в течение 24 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:4)] с получением указанного в заголовке соединения (1,29 г, 100%).
1H-NMR (CDCl3) δ: 3,76 (3H, с), 3,97 (2H, с), 4,69 (1H, с), 6,73-6,92 (5H, м), 7,10-7,23 (3H, м)
(3) Синтез [2-(3-метоксибензил)фенил]-5a-карба-β-D-глюкопиранозида
В потоке азота 2,3,4,6-тетра-O-бензил-5a-карба-α-D-глюкопиранозу (500 мг, 0,93 ммоль) и трибутилфосфин (0,35 мл, 1,39 ммоль) добавляли при охлаждении льдом к раствору 2-(3-метоксибензил)фенола (298 мг, 1,39 ммоль) в толуоле (3 мл), затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 239 мг, 1,39 ммоль). Реакционную смесь перемешивали в течение 20 часов, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)]. Полученный неочищенный продукт растворяли в смешанном растворе метанол-ТГФ (5:2) (7 мл), к полученной смеси добавляли катализатор 20% гидроксид палладия (55 мг) и смесь перемешивали в атмосфере водорода в течение четырех часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид:метанол (10:1)] с получением указанного в заголовке соединения (111 мг, 32%).
1H-NMR (CD3OD) δ: 0,97-1,11 (1H, м), 1,52-1,68 (1H, м), 2,12 (1H, дт, J=13,4, 4,0 Гц), 3,22-3,39 (2H, м), 3,49-3,56 (2H, м), 3,72-3,78 (1H, м), 3,78 (3H, с), 3,92 (1H, д, J=14,8 Гц), 4,05 (1H, д, J=14,8 Гц), 4,18-4,27 (1H, м), 6,72-6,92 (4H, м), 7,05-7,22 (4H, м)
MS (ESI+): 375 [M+H]+
Время удерживания ВЭЖХ: 10,6 минут
Пример 16
[2-(4-Метоксибензил)-4-метоксифенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез 2-бензилокси-5-метоксибензальдегида
К раствору 2-гидрокси-5-метоксибензальдегида (3,0 г, 19,7 ммоль) в N,N-диметилформамиде (50 мл) добавляли карбонат калия (3,27 г, 23,6 ммоль), затем к полученной смеси добавляли бензилбромид (2,6 мл, 21,7 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 24 часов, затем к полученной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:4)] с получением указанного в заголовке соединения (4,8 г, 100%).
1H-NMR (CDCl3) δ: 3,80 (3H, с), 5,15 (2H, с), 6,99 (1H, д, J=9,0 Гц), 7,11 (1H, дд, J=3,4, 9,1 Гц), 7,32-7,44 (6H, м), 10,50 (1H, с)
(2) Синтез (2-бензилокси-5-метоксифенил)-(4-метоксифенил)метанола
В потоке азота к раствору 2-бензилокси-5-метоксибензальдегида (2,0 г, 8,25 ммоль) в ТГФ (50 мл) добавляли по каплям при охлаждении льдом раствор 4-метоксифенилмагнийбромида в ТГФ (0,5 M, 19,8 мл). Полученный смешанный раствор перемешивали при комнатной температуре в течение одного часа, затем к полученной смеси добавляли при охлаждении льдом насыщенный водный раствор хлорида аммония и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:1)] с получением указанного в заголовке соединения (2,9 г, 100%).
1H-NMR (CDCl3) δ: 2,85 (1H, д, J=5,4 Гц), 3,76 (3H, с), 3,79 (3H, с), 4,96 (2H, с), 5,99 (1H, д, J=5,4 Гц), 6,74 (1H, дд, J=2,8, 9,0 Гц), 6,81-6,87 (3H, м), 6,94 (1H, д, J=4,1 Гц), 7,19-7,36 (7H, м)
(3) Синтез 2-(4-метоксибензил)-4-метоксифенола
К раствору (2-бензилокси-5-метоксифенил)-(4-метоксифенил)метанола (2,54 г, 7,25 ммоль) в метаноле (50 мл) добавляли катализатор 20% гидроксид палладия (250 мг), затем к полученной смеси добавляли 36% раствор HCl (0,25 мл). Смесь перемешивали в атмосфере водорода в течение 14 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:4)] с получением указанного в заголовке соединения (1,62 г, 91%).
1H-NMR (CDCl3) δ: 3,74 (3H, с), 3,78 (3H, с), 3,90 (2H, с), 4,41 (1H, ушир.с), 6,64-6,86 (5H, м), 7,11-7,16 (2H, м)
(4) Синтез [2-(4-метоксибензил)-4-метоксифенил]-5a-карба-β-D-глюкопиранозида
В потоке азота 2,3,4,6-тетра-O-бензил-5a-карба-α-D-глюкопиранозу (500 мг, 0,93 ммоль) и трибутилфосфин (0,35 мл, 1,39 ммоль) добавляли к раствору 2-(4-метоксибензил)-4-метоксифенола (340 мг, 1,39 ммоль) в толуоле (3 мл) при охлаждении льдом, затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 239 мг, 1,39 ммоль). Реакционную смесь перемешивали в течение 20 часов, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)]. Полученный неочищенный продукт растворяли в смешанном растворе метанол-ТГФ (5:2) (7 мл), к полученной смеси добавляли катализатор 20% гидроксид палладия (40 мг) и смесь перемешивали в атмосфере водорода в течение 6 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид:метанол (10:1)] с получением указанного в заголовке соединения (128 мг, 34%).
1H-NMR (CD3OD) δ: 0,94-1,08 (1H, м), 1,45-1,62 (1H, м), 2,06 (1H, дт, J=13,0, 4,0 Гц), 3,20-3,34 (2H, м), 3,46-3,56 (2H, м), 3,70-3,80 (1H, м), 3,73 (3H, с), 3,79 (3H, с), 3,88 (1H, д, J=14,8 Гц), 3,96 (1H, д, J=14,8 Гц), 4,04-4,14 (1H, м), 6,67 (1H, д, J=3,1 Гц), 6,74 (1H, дд, J=3,1, 8,7 Гц), 6,80-6,88 (2H, м), 7,00 (1H, д, J=8,7 Гц), 7,12-7,18 (2H, м)
MS (ESI+): 405 [M+H]+
Время удерживания ВЭЖХ: 10,2 минут
Пример 17
[2-(4-Метоксибензил)-6-метилфенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез 2-бензилокси-3-метилбензальдегида
К раствору 2-гидрокси-3-метилбензальдегида (3,0 г, 22,07 ммоль) в N,N-диметилформамиде (50 мл) добавляли карбонат калия (3,65 г, 26,4 ммоль), затем к полученной смеси добавляли бензилбромид (2,9 мл, 24,2 ммоль). Смесь перемешивали при комнатной температуре в течение 26 часов, затем к полученной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:4)3 с получением указанного в заголовке соединения (5,0 г, 100%).
1H-NMR (CDCl3) δ: 2,36 (3H, с), 4,97 (2H, с), 7,16 (1Н, т, J=7,4 Гц), 7,36-7,49 (6H, м), 7,68 (1H, дд, J=1,4, 7,8 Гц), 10,26 (1H, д, J=0,5 Гц)
(2) Синтез (2-бензилокси-3-метилфенил)-(4-метоксифенил)метанола
В потоке азота к раствору 2-бензилокси-3-метилбензальдегида (1,87 г, 8,25 ммоль) в ТГФ (50 мл) добавляли по каплям при охлаждении льдом раствор 4-метоксифенилмагнийбромида в ТГФ (0,5 M, 19,8 мл). Смесь перемешивали при комнатной температуре в течение одного часа, затем к полученной смеси добавляли при охлаждении льдом насыщенный водный раствор хлорида аммония и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), а затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5)] с получением указанного в заголовке соединения (2,76 г, 100%).
1H-NMR (CDCl3) δ: 2,36 (3H, с), 2,63 (1Н, д, J=5,0 Гц), 3,78 (3H, с), 4,64-4,73 (2H, м), 6,02 (1Н, д, J=5,0 Гц), 6,77-6,86 (2H, м), 7,02-7,08 (1Н, м), 7,15-7,21 (2H, м), 7,22-7,28 (2H, м), 7,34-7,40 (5H, м)
(3) Синтез 2-(4-метоксибензил)-6-метилфенола
К раствору (2-бензилокси-3-метилфенил)-(4-метоксифенил)-метанола (2,76 г, 8,25 ммоль) в метаноле (30 мл) добавляли катализатор 20% гидроксид палладия (276 мг), затем к полученной смеси добавляли концентрированную хлористоводородную кислоту (0,27 мл). Смесь перемешивали в атмосфере водорода в течение 18 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:4)] с получением указанного в заголовке соединения (1,75 г, 93%).
1H-NMR (CDCl3) δ: 2,22 (3H, с), 3,78 (3H, с), 3,93 (2H, с), 4,63 (1H, ушир.с), 6,77-6,86 (3H, м), 6,96-7,05 (2H, м), 7,11-7,17 (2H, м)
(4) Синтез [2-(4-метоксибензил)-6-метилфенил]-5-a-карба-β-D-глюкопиранозида
В потоке азота 2,3,4,6-тетра-O-бензил-5a-карба-α-D-глюкопиранозу (500 мг, 0,93 ммоль) и трибутилфосфин (0,35 мл, 1,39 ммоль) добавляли к раствору 2-(4-метоксибензил)-6-метилфенола (318 мг, 1,39 ммоль) в толуоле (3 мл) при охлаждении льдом, затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 239 мг, 1,39 ммоль). Реакционную смесь перемешивали в течение 48 часов, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)]. Полученный неочищенный продукт растворяли в смешанном растворе метанол-ТГФ (5:2) (7 мл), к полученной смеси добавляли катализатор 20% гидроксид палладия (72 мг) и смесь перемешивали в атмосфере водорода в течение 4 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид:метанол (10:1)] с получением указанного в заголовке соединения (180 мг, 50%).
1H-NMR (CD3OD) δ: 1,16-1,35 (2H, м), 1,74-1,88 (1H, м), 2,33 (3H, с), 3,16-3,26 (2H, м), 3,42-3,52 (1H, м), 3,54-3,68 (2H, м), 3,74 (3H, с), 3,92-4,02 (2H, м), 4,08 (1H, д, J=15,3 Гц), 6,77-6,83 (2H, м), 6,86-6,91 (2H, м), 6,96-7,04 (1H, м), 7,05-7,12 (2H, м)
MS (ESI+): 411 [M+Na]+
Время удерживания ВЭЖХ: 10,8 минут
Пример 18
[2-(4-Метоксибензил)-4-фторфенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез (2-бензилокси-5-фторфенил)-(4-метоксифенил)метанола
В потоке азота раствор н-бутиллития в гексане (2,44 M, 2,4 мл) добавляли по каплям к раствору 1-бензилокси-2-бром-4-фторбензола (1,5 г, 5,33 ммоль) в ТГФ (60 мл) при -78°C и смесь перемешивали при указанной температуре в течение 30 минут. К этому раствору добавляли по каплям при -78°C раствор 4-метоксибензальдегида (0,6 г, 4,42 ммоль) в ТГФ (20 мл). Реакционную смесь перемешивали при указанной температуре в течение одного часа, затем к полученной смеси добавляли насыщенный водный раствор хлорида аммония и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5)] с получением указанного в заголовке соединения (0,98 г, 66%).
1H-NMR (CDCl3) δ: 2,66 (1H, дд, J=0,8, 4,9 Гц), 3,80 (3H, с), 4,98 (2H, с), 6,01 (1H, д, J=4,9 Гц), 6,83-6,90 (4H, м), 7,14 (1H, дд, J=3,0, 9,0 Гц), 7,20-7,34 (7H, м)
(2) Синтез 4-фтор-2-(4-метоксибензил)фенола
К раствору (2-бензилокси-5-фторфенил)-(4-метоксифенил)-метанола (0,98 г, 2,90 ммоль) в метаноле (18,6 мл) добавляли катализатор 20% гидроксид палладия (98 мг), затем к полученной смеси добавляли 2 н. раствор HCl (1 мл). Смесь перемешивали в атмосфере водорода в течение 15 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:6)] с получением указанного в заголовке соединения (0,55 г, 82%).
1H-NMR (CDCl3) δ: 3,78 (3H, с), 3,89 (2H, с), 4,65 (1H, ушир.с), 6,68-6,73 (1H, м), 6,77-6,87 (4H, м), 7,11-7,12 (2Н, м)
(3) Синтез [2-(4-метоксибензил)-4-фторфенил]-5a-карба-β-D- глюкопиранозида
В потоке азота 2,3,4,6-тетра-O-бензил-5a-карба-α-D-глюкопиранозу (500 мг, 0,93 ммоль) и трибутилфосфин (0,35 мл, 1,39 ммоль) добавляли к раствору 2-(4-метоксибензил)-4-фторфенол (323 мг, 1,39 ммоль) в толуоле (3 мл) при охлаждении льдом, затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 239 мг, 1,39 ммоль). Реакционную смесь перемешивали в течение 48 часов, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)]. Полученный неочищенный продукт растворяли в смешанном растворе метанол-ТГФ (5:2) (7 мл), к полученной смеси добавляли катализатор 20% гидроксид палладия (22 мг) и смесь перемешивали в атмосфере водорода в течение четырех часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид:метанол (10:1)] с получением указанного в заголовке соединения (103 мг, 29%).
1H-NMR (CD3OD) δ: 0,99-1,13 (1H, м), 1,50-1,65 (1H, м), 2,08 (1H, дт, J=13,4, 4,O Гц), 3,22-3,35 (2H, м), 3,50-3,57 (2H, м), 3,75 (1H, дд, J=4,0, 10,7 Гц), 3,79 (3H, с), 3,87-4,02 (2H, м), 4,11-4,21 (1H, м), 6,79 (1H, дд, J=3,1, 9,4 Гц), 6,83-6,92 (3H, м), 7,06 (1H, дд, J=4,7, 8,9 Гц), 7,12-7,20 (2H, м)
MS (ESI+): 415 [M+Na]+
Время удерживания ВЭЖХ: 10,9 минут
Пример 19
[2-(3-Фторбензил)фенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез (2-бензилоксифенил)-(3-фторфенил)метанола
В потоке азота раствор н-бутиллития в гексане (2,44 M, 5,65 мл) добавляли по каплям к раствору 1-бензилокси-2-бромбензола (3,3 г, 12,5 ммоль) в ТГФ (40 мл) при -78°C и полученный смешанный раствор перемешивали при указанной температуре в течение 30 минут. К этой смеси добавляли по каплям при -78°C раствор 3-фторбензальдегида (1,40 г, 11,3 ммоль) в ТГФ (5 мл). Реакционную смесь перемешивали при указанной температуре в течение одного часа, затем к полученной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)] с получением указанного в заголовке соединения (2,26 г, 65%).
1H-NMR (CDCl3) δ: 3,00 (1H, д, J=6,3 Гц), 5,57 (1H, д, J=11,5 Гц), 5,60 (1H, д, J=11,5 Гц), 6,01 (1H, д, J=6,3 Гц), 6,85-7,15 (5H, м), 7,17-7,4 (7H, м)
MS (ESI+): 308 [M]+
(2) Синтез 2-(3-фторбензил)фенола
К раствору (2-бензилоксифенил)-(3-фторфенил)метанола (2,54 г, 7,51 ммоль) в метаноле (30 мл) добавляли катализатор 20% гидроксид палладия (300 мг), затем к полученной смеси добавляли 2 н. раствор HCl (0,3 мл). Полученный смешанный раствор перемешивали в атмосфере водорода в течение пяти дней, а затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)] с получением указанного в заголовке соединения (620 мг, 42%).
1H-NMR (CDCl3) δ: 3,98 (2H, с), 4,70 (1H, с), 6,75-7,3 (8H, м)
MS (ESI+): 201 [M+H]+
(3) Синтез [2-(3-фторбензил)фенил]-5a-карба-β-D-глюкопиранозида
В потоке азота 2,3,4,6-тетра-O-бензил-5a-карба-α-D-глюкопиранозу (400 мг, 0,743 ммоль) и трибутилфосфин (0,278 мл, 1,11 ммоль) добавляли к раствору 2-(3-фторбензил)фенола (225 мг, 1,11 ммоль) в толуоле (2,5 мл) при охлаждении льдом, затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 192 мг, 1,11 ммоль). Реакционную смесь перемешивали в течение 14 часов, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)]. Полученный неочищенный продукт растворяли в смешанном растворе метанол-ТГФ (5:2) (7 мл), к полученной смеси добавляли катализатор 20% гидроксид палладия (40 мг), смесь перемешивали в атмосфере водорода в течение 24 часов и катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид:метанол (10:1)] с получением указанного в заголовке соединения (76 мг, 28%).
1H-NMR (CD3OD) δ: 0,99 (1H, дд, J=24,7, 13,2 Гц), 1,45-1,62 (1H, м), 2,09 (1H, дт, J=12,6, 4 Гц), 3,16-3,3 (2H, м), 3,4-3,55 (2H, м), 3,71 (1H, дд, J=10,7, 3,8 Гц), 3,93 (1H, д, J=14,9 Гц), 4,05 (1H, д, J=14,9 Гц), 4,1-4,3 (1H, м), 6,8-6,95 (3H, м), 7,0-7,06 (2H, м), 7,08-7,27 (3H, м),
MS (ESI+): 363 [M+H]+, 385 [M+Na]+
Время удерживания ВЭЖХ: 10,9 минут
Пример 20
[2-(3-Метилбензил)фенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез [2-(3-метилбензил)фенил]-5a-карба-β-D-глюкопиранозида
В потоке азота 2,3,4,6-тетра-O-бензил-5a-карба-β-D-глюкопиранозу (413 мг, 0,743 ммоль) и трибутилфосфин (0,233 мл, 1,15 ммоль) добавляли при охлаждении льдом к раствору в толуоле (2,5 мл) 2-(3-метилбензил)фенола (228 мг, 1,15 ммоль), описанного в Uzbekskii Khimicheskii Zhurnal (1984), 6, 31-4 и т.п., затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 198 мг, 1,15 ммоль). Реакционную смесь перемешивали в течение 15 часов, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)]. Полученный неочищенный продукт растворяли в смешанном растворе (2:5) метанол-ТГФ (7 мл), к полученной смеси добавляли катализатор 20% гидроксид палладия (40 мг) и смесь перемешивали в атмосфере водорода в течение шести часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид:метанол (10:1)] с получением указанного в заголовке соединения (109 мг, 40%).
1H-NMR (CD3OD) δ: 0,95 (1H, дд, J=24,4, 12,9 Гц), 1,45-1,62 (1H, м), 2,06 (1H, дт, J=13,1, 4,0 Гц), 2,27 (3H, с), 3,15-3,30 (2H, м), 3,42-3,52 (2H, м), 3,70 (1H, дд, J=10,7, 3,9 Гц), 3,87 (1H, д, J=14,8 Гц), 3,98 (1H, д, J=14,8 Гц), 4,1-4,25 (1H, м), 6,81-6,88 (1H, м), 6,9-7,2 (7H, м)
MS (ESI+): 376 [M+NH4]+, 359 [M+H]+
Время удерживания ВЭЖХ: 11,4 минут
Пример 21
[5-Фтор-2-(4-метоксибензил)фенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез 2-бензилокси-1-бром-4-фторбензола
Карбонат калия (2,61 г, 18,8 ммоль) добавляли к раствору 2-бром-5-фторфенола (3,0 г, 15,7 ммоль) в ДМФА (15,7 мл) и смесь перемешивали в потоке азота при комнатной температуре в течение 15 минут. К этому раствору добавляли по каплям при указанной температуре бензилбромид (2,69 г, 15,7 ммоль) и полученный смешанный раствор перемешивали при указанной температуре в течение ночи. К реакционной смеси добавляли водный раствор бисульфата калия и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (элюент=н-гексан) с получением указанного в заголовке соединения (4,31 г, 98%) в виде бесцветного масла.
1H-NMR (CDCl3) δ: 5,14 (2H, с), 6,56-6,72 (2H, м), 7,31-7,52 (6H, м)
(2) Синтез (2-бензилокси-4-фторфенил)-(4-метоксифенил)метанола
В потоке азота раствор н-бутиллития в гексане (1,59 M, 3,14 мл) добавляли по каплям к раствору 2-бензилокси-1-бром-4-фторбензола (1,4 г, 5,0 ммоль) в ТГФ (50 мл) при -78°C и смесь перемешивали при указанной температуре в течение 15 минут. К этому раствору добавляли по каплям при -78°C раствор 4-метоксибензальдегида (680 мг, 4,99 ммоль) в ТГФ (15 мл) и смесь перемешивали при указанной температуре в течение 1,5 часов, затем к полученной смеси добавляли насыщенный водный раствор хлорида аммония и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=н-гексан:дихлор-метан:ацетон (12:3:1)] с получением указанного в заголовке соединения (1,41 г, 83%) в виде бесцветного масла.
1H-NMR (CDCl3) δ: 2,67 (1H, д, J=5,0 Гц), 3,79 (3H, с), 4,99 (2H, с), 6,00 (1H, д, J=3,8 Гц), 6,62-6,70 (2H, м), 6,81-6,86 (2H, м), 7,19-7,38 (8H, м)
(3) Синтез 2-(4-метоксибензил)-5-фторфенола
К раствору (2-бензилокси-4-фторфенил)-(4-метоксифенил)-метанола (2,095 г, 6,19 ммоль) в метаноле (20 мл) добавляли катализатор 20% гидроксид палладия (200 мг), затем к полученной смеси добавляли 2 н. раствор HCl (0,3 мл). Смесь перемешивали в атмосфере водорода в течение 16 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5)] с получением указанного в заголовке соединения (489 мг, 34%).
1H-NMR (CDCl3) δ: 3,78 (3H, с), 3,89 (2H, с), 4,88 (1H, с), 6,50-6,40 (2H, м), 6,80-6,88 (2H, м), 7,04 (1H, дд, J=6,6, 8,2 Гц), 7,08-7,15 (2H, м)
MS (ESI-): 231 [M-H]-
(4) Синтез [5-фтор-2-(4-метоксибензил)фенил]-5a-карба-β-D-глюкопиранозида
В потоке азота 2,3,4,6-тетра-O-бензил-5a-карба-β-D-глюкопиранозу (500 мг, 0,928 ммоль) и трибутилфосфин (0,346 мл, 1,39 ммоль) добавляли к раствору 2-(4-метоксибензил)-5-фторфенола (323 мг, 1,39 ммоль) в толуоле (2,5 мл) при охлаждении льдом, затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 240 мг, 1,39 ммоль). Реакционную смесь перемешивали в течение 17 часов, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)]. Полученный неочищенный продукт растворяли в смешанном растворе (2:5) метанол-ТГФ (7 мл), к полученной смеси добавляли катализатор 20% гидроксид палладия (40 мг) и смесь перемешивали в атмосфере водорода в течение 22 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид:метанол (10:1)] с получением указанного в заголовке соединения (59 мг, 16%).
1H-NMR (CD3OD) δ: 1,00 (1H, дд, J=24,4, 12,9 Гц), 1,5-1,65 (1H, м), 2,04 (1H, дт, J=13,4, 4,1 Гц), 3,17-3,35 (2H, м), 3,43-3,55 (2H, м), 3,65-3,75 (1H, м), 3,73 (3H, с), 3,81 (1H, д, J=15,1 Гц), 3,90 (1H, д, J=15,1 Гц), 4,1-4,22 (1H, м), 6,56 (1H, дт, J=8,5, 2,7 Гц), 6,75-6,88 (3H, м), 7,0-7,13 (3H, м)
MS (ESI+): 415 [M+Na]+
Время удерживания ВЭЖХ: 11,0 минут
Пример 22
[2-(4-Метилсульфонилбензил)фенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез (2-бензилоксифенил)-(4-метилсульфанилфенил)-метанола
В потоке азота раствор 4-метилсульфанилфенилмагнийбромида в ТГФ (0,5 M, 35 мл) добавляли по каплям к раствору 2-бензилоксибензальдегида (2,60 г, 12,2 ммоль) в ТГФ (24 мл) при 0°C и смесь перемешивали при комнатной температуре в течение двух часов, затем к полученной смеси добавляли при охлаждении льдом насыщенный водный раствор хлорида аммония и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле[элюент=этилацетат:н-гексан (1:4)] с получением указанного в заголовке соединения (3,91 г, 95%).
1H-NMR (CDCl3) δ: 2,47 (3H, с), 2,91 (1H, д, J=5,8 Гц), 5,03 (2H, с), 6,01 (1H, д, J=6,0 Гц), 6,90-7,00 (2H, м), 7,15-7,35 (11H, м)
(2) Синтез (2-бензилоксифенил)-(4-метансульфонилфенил)метанола
В потоке азота м-хлорпербензойную кислоту (4,40 г, 22,2 ммоль) добавляли при 0°C к раствору (2-бензилоксифенил)-(4-метилсульфанилфенил)метанола (3,00 г, 8,92 ммоль) в метиленхлориде (25 мл) и реакционную смесь перемешивали при указанной температуре в течение 30 минут. Осадок удаляли фильтрованием и фильтрат промывали 2 н. водным раствором гидроксида натрия. Промывочный раствор экстрагировали метиленхлоридом и объединенный органический слой промывали водой и насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении с получением указанного в заголовке соединения (3,18 г, 97%).
1H-NMR (CDCl3) δ: 3,02 (3H, с), 3,03 (1H, д, J=6,3 Гц), 5,00 (1H, J=11,4 Гц), 5,04 (1H, д, J=11,5 Гц), 6,09 (1H, д, J=6,2 Гц), 6,95-7,03 (2H, м), 7,16-7,22 (2H, м), 7,24-7,38 (5H, м), 7,53 (2H, д, J=8,1 Гц), 7,84 (2H, д, J=8,6 Гц)
(3) Синтез 2-(4-метансульфонилбензил)фенола
В потоке азота катализатор 20% гидроксид палладия (299 мг) и 36% раствор HCl (150 мкл, 1,78 ммоль) добавляли к раствору (2-бензилоксифенил)-(4-метансульфонилфенил)метанола (3,00 г, 8,14 ммоль) в смеси метанола (30 мл) и этилацетата (30 мл) и смесь перемешивали в атмосфере водорода в течение шести часов. К реакционной смеси добавляли гидрокарбонат натрия и смесь перемешивали в течение 30 минут для ее нейтрализации, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:2)] с получением указанного в заголовке соединения (1,81 г, 85%).
1H-NMR (CDCl3) δ: 3,02 (3H, с), 4,06 (2H, с), 5,00 (1H, с), 6,77 (1H, д, J=7,9 Гц), 6,89 (1H, дт, J=7,5, 1,2 Гц), 7,08-7,17 (2H, м), 7,42 (2H, д, J=8,6 Гц), 7,82 (2H, д, J=8,4 Гц)
(4) Синтез [2-(4-метансульфонилбензил)фенил]-5a-карба-β-D-глюкопиранозида
В потоке азота 2,3,4,6-тетра-O-бензил-5a-карба-α-D-глюкопиранозу (500 мг, 0,928 ммоль) и трибутилфосфин (0,35 мл, 1,39 ммоль) добавляли к раствору 2-(4-метилсульфанилбензил)фенола (365 мг, 1,39 ммоль) в смеси толуола (2 мл) и ТГФ (1 мл) при охлаждении льдом, затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 242 мг, 1,41 ммоль). Реакционную смесь перемешивали в течение 25 часов, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:4 to 1:2)]. Полученный неочищенный продукт растворяли в смеси метанола (3 мл) и ТГФ (2 мл), к полученной смеси добавляли катализатор 20% гидроксид палладия (27,2 мг) и одну каплю 2 н. раствора хлористоводородной кислоты и смесь перемешивали в атмосфере водорода в течение 2,5 часов. К реакционной смеси добавляли водный раствор гидрокарбоната натрия для нейтрализации смеси, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид: метанол (8:1)] с получением указанного в заголовке соединения (120 мг, 31%).
1H-NMR (CD3OD) δ: 0,91 (1H, ддд, J=13,0, 13,0, 13,0 Гц), 1,53 (1H, м), 2,03 (1H, ддд, J=13,0, 4,0, 4,0 Гц), 3,07 (3H, с), 3,19 (1H, дд, J=8,9, 8,9 Гц), 3,28 (1H, дд, J=9,0, 9,0 Гц), 3,43 (1H, дд, J=9,0, 9,0 Гц), 3,50 (1H, дд, J=10,7, 6,1 Гц), 3,67 (1H, дд, J=10,7, 4,0 Гц), 4,02 (1H, д, J=14,5 Гц), 4,16 (1H, д, J=14,5 Гц), 4,14-4,26 (1Н, м), 6,88 (1H, т, J=6,2 Гц), 7,04 (1H, д, J=8,1 Гц), 7,17 (1H, д, J=7,5 Гц), 7,18 (1H, т, J=7,5 Гц), 7,48 (1H, д, J=8,4 Гц), 7,80 (1H, д, J=8,4 Гц)
MS (ESI+): 423 [M+H]+, 440 [M+NH4]+, 445 [M+Na]+
Время удерживания ВЭЖХ: 9,0 минут
Пример 23
[2-(4-Фторбензил)фенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез 2-(4-фторбензил)фенола
В потоке азота раствор н-бутиллития в гексане (1,59 M, 4,9 мл) добавляли по каплям к раствору 1-бензилокси-2-бромбензола (2,04 г, 7,75 ммоль) в ТГФ (60 мл) при -78°C и смесь перемешивали при указанной температуре в течение 20 минут. К этому раствору добавляли по каплям при -78°C раствор 4-фторбензальдегида (801 мг, 6,45 ммоль) в ТГФ (10 мл). Смесь перемешивали при указанной температуре в течение 1,5 часов, затем к полученной смеси добавляли насыщенный водный раствор хлорида аммония и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении с получением неочищенного продукта (2,35 г) указанного в заголовке соединения. К раствору полученного неочищенного продукта в метаноле (15 мл) добавляли катализатор 20% гидроксид палладия (186 мг), затем к полученной смеси добавляли 2 н. раствор HCl (400 мкл). Смесь перемешивали в атмосфере водорода в течение трех часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5)] с получением указанного в заголовке соединения (996 мг, 77%).
1H-NMR (CDCl3) δ: 3,95 (2H, с), 4,72 (1H, с), 7,77 (1Н, дд, J=7,9, 1,1 Гц), 6,88 (1H, тд, J=7,5, 1,1 Гц), 6,96 (1H, дд, J=8,7, 8,7 Гц), 7,06-7,20 (4H, м)
(2) Синтез [2-(4-фторбензил)фенил]-5a-карба-β-D-глюкопиранозида
В потоке азота 2,3,4,6-тетра-O-бензил-5a-карба-α-D-глюкопиранозу (500 мг, 0,928 ммоль) и трибутилфосфин (0,35 мл, 1,40 ммоль) добавляли к раствору 2-(4-фторбензил)фенола (284 мг, 1,40 ммоль) в толуоле (3 мл) при охлаждении льдом, затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 241 мг, 1,40 ммоль). Реакционную смесь перемешивали в течение 21 часа, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:8 → 1:3)]. Полученный неочищенный продукт растворяли в смеси растворителей метанол (4 мл)-ТГФ (2 мл) и к полученной смеси добавляли катализатор 20% гидроксид палладия (18,4 мг) и каплю 2 н. раствора хлористоводородной кислоты и смесь перемешивали в атмосфере водорода в течение 1,5 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия для нейтрализации смеси и катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент-метиленхлорид:метанол (10:1 до 8:1)] с получением указанного в заголовке соединения (153 мг, 46%).
1H-NMR (CD3OD) δ: 0,99 (1H, ддд, J=12,9, 12,9, 12,9 Гц), 1,55 (1Н, м), 2,08 (1H, ддд, 3=13,2, 3,9, 3,9 Гц), 3,22 (1H, дд, J=9,0, 9,0 Гц), 3,30 (1H, дд, J=9,0, 9,O Гц), 3,48 (1H, дд, J=8,7, 8,7 Гц), 3,51 (1H, дд, J=10,8, 6,O Гц), 3,70 (1H, дд, J=10,8, 4,2 Гц), 3,90 (1H, д, J=14,7 Гц), 4,02 (1H, д, J=14,7 Гц), 4,20 (1H, ддд, J=11,4, 9,0, 4,8 Гц), 6,85 (1H, т, J=7,5 Гц), 6,93 (1H, дд, J=8,9, 8,9 Гц), 7,02 (1H, д, J=8,1 Гц), 7,06-7,23 (4H, м)
MS (ESI+): 363 [M+H]+
Время удерживания ВЭЖХ: 10,9 минут
Пример 24
[2-(3,4-Диметоксибензил)фенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез 2-(3,4-диметоксибензил)фенола
В потоке азота раствор н-бутиллития в гексане (1,59 M, 4,4 мл) добавляли по каплям к раствору 1-бензилокси-2-бромбензола (1,74 г, 6,61 ммоль) в ТГФ (30 мл) при -78°C и полученный смешанный раствор перемешивали при указанной температуре в течение одного часа. К этому раствору добавляли по каплям при -78°C раствор 3,4-диметоксибензальдегида (1,00 г, 6,02 ммоль) в ТГФ (8 мл). Реакционную смесь перемешивали при указанной температуре в течение 1,5 часов, затем к полученной смеси добавляли насыщенный водный раствор хлорида аммония и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), а затем растворитель отгоняли при пониженном давлении с получением неочищенного продукта (2,38 г). Полученный неочищенный продукт растворяли в метаноле (20 мл) и добавляли катализатор 20% гидроксид палладия (196 мг), затем к полученной смеси добавляли 2 н. раствор HCl (30 мкл). Полученный смешанный раствор перемешивали в атмосфере водорода в течение 23 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5)] с получением указанного в заголовке соединения (653 мг, 44%).
1H-NMR (CDCl3) δ: 3,82 (3H, с), 3,85 (3H, с), 3,94 (2H, с), 4,73 (1H, с), 6,74-6,82 (2H, м), 6,78 (1H, с), 6,89 (1H, тд, J=7,5, 1,1 Гц), 7,08-7,17 (2H, м)
(2) Синтез [2-(3,4-диметоксибензил)фенил]-5a-карба-β-D-глюкопиранозида
В потоке азота 2,3,4,6-тетра-O-бензил-5a-карба-α-D-глюкопиранозу (504 мг, 0,936 ммоль) и трибутилфосфин (0,35 мл, 1,40 ммоль) добавляли при охлаждении льдом к раствору 2-(3,4-диметоксибензил)фенола (342 мг, 1,40 ммоль) в смеси толуола (2,5 мл) и ТГФ (1,0 мл), затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 242 мг, 1,41 ммоль). Реакционную смесь перемешивали в течение 22 часов, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:3)]. Полученный неочищенный продукт растворяли в смеси растворителей метанол (2 мл)-ТГФ (2 мл) и к полученной смеси добавляли катализатор 20% гидроксид палладия (21,9 мг). Полученный смешанный раствор перемешивали в атмосфере водорода в течение пяти часов, затем катализатор отфильтровывали. Растворитель отгоняли в при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид: метанол (10:1)] с получением указанного в заголовке соединения (108 мг, 38%).
1H-NMR (CD3OD) δ: 1,01 (1H, ддд, J=13,1, 13,1, 11,6 Гц), 1,55 (1H, м), 2,08 (1H, ддд, J=13,3, 3,8, 3,8 Гц), 3,21 (1Н, дд, J=9,2, 9,2 Гц), 3,29 (1H, дд, J=8,9, 8,9 Гц), 3,48 (1H, дд, J=9,2, 9,2 Гц), 3,49 (1H, дд, J=10,7, 6,3 Гц), 3,70 (1H, дд, J=10,7, 4,1 Гц), 3,76 (3H, с), 3,78 (3H, с), 3,87 (1H, д, J=14,8 Гц), 3,96 (1H, д, J=14,8 Гц), 4,19 (1H, ддд, J=11,5, 9,0, 4,6 Гц), 6,73 (1H, дд, J=8,3, 2,0 Гц), 6,81 (1H, с), 6,82 (1H, д, J=8,3 Гц), 6,84 (1H, тд, J=7,5, 1,2 Гц), 7,02 (1H, д, J=7,5 Гц), 7,08 (1H, дд, J=7,5, 1,S Гц), 7,14 (1H, тд, J=7,2, 1,7 Гц)
MS (ESI+): 405 [M+H]+
Время удерживания ВЭЖХ: 9,7 минут
Пример 25
[2-(4-Этилбензил)фенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез [2-(4-этилбензил)фенил]-5a-карба-β-D-глюкопиранозида
В потоке азота 2,3,4,6-тетра-O-бензил-5a-карба-α-D-глюкопиранозу (400 мг, 0,74 ммоль) и трибутилфосфин (0,28 мл, 1,11 ммоль) добавляли при охлаждении льдом к раствору в толуоле (2,5 мл) 2-(4-этилбензил)фенола (236 мг, 1,11 ммоль), описанного в Международной Публикации №№ WO04/052902, WO01/074834 и т.п., затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 191 мг, 1,11 ммоль). Реакционную смесь перемешивали в течение 25 часов, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)]. Полученный неочищенный продукт растворяли в смешанном растворе метанол-ТГФ (1:2) (4 мл) и к полученной смеси добавляли катализатор 20% гидроксид палладия (20 мг). Смесь перемешивали в атмосфере водорода в течение 1,5 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали при помощи ТСХ [элюент=метиленхлорид:метанол (10:1)] с получением указанного в заголовке соединения (40 мг, 14%).
1H-NMR (CD3OD) δ: 0,86-1,00 (1H, м), 1,19 (3H, т, J=7,6 Гц), 1,45-1,62 (1H, м), 2,00-2,11 (1H, м), 2,57 (2H, кв., J=7,6 Гц), 3,16-3,30 (2H, м), 3,43-3,49 (2H, м), 3,70 (1H, дд, J=10,6, 4,1 Гц), 3,84-4,02 (2H, м), 4,12-4,24 (1H, м), 6,83 (1H, т, J=7,4 Гц), 6,99-7,16 (7H, м)
MS (ESI+): 395 [M+Na]+
Время удерживания ВЭЖХ: 12,3 минут
Пример 26
[2-(4-Гидроксибензил)фенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез [2-(4-гидроксибензил)фенил]-5a-карба-β-D-глюкопиранозида
В атмосфере азота раствор трибромида бора в дихлорметане (1,0 M, 0,80 мл, 0,80 ммоль) добавляли к раствору [2-(4-метоксибензил)фенил]-5a-карба-β-D-глюкопиранозида (100 мг, 0,27 ммоль), полученного в Примере 1, в дихлорметане (1,3 мл) при -78°C. Охлаждающую баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение одного часа. Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали при помощи ВЭЖХ (элюент=метанол:20 мМ водный раствор ацетата аммония) с получением указанного в заголовке соединения (45 мг, 47%).
1H-NMR (CD3OD) δ: 0,92-1,06 (1H, м), 1,47-1,67 (1H, м), 2,03-2,11 (1H, м), 3,18-3,34 (2H, м), 3,45-3,52 (2H, м), 3,71 (1H, дд, J=10,7, 4,1 Гц), 3,79-3,95 (2H, м), 4,12-4,22 (1H, м), 6,65 (2H, д, J=8,4 Гц), 6,83 (1H, т, J=7,3 Гц), 6,99-7,16 (5H, м)
MS (ESI+): 361 [M+H]+
Время удерживания ВЭЖХ: 8,9 минут
Пример 27
[2-(4-Цианобензил)фенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез [2-(4-цианобензил)фенил]-5a-карба-β-D-глюкопиранозида
В потоке азота 2,3,4,6-тетра-O-бензил-5a-карба-α-D-глюкопиранозу (500 мг, 0,93 ммоль) и трибутилфосфин (0,35 мл, 1,39 ммоль) добавляли к раствору 2-(4-цианобензил)фенола (291 мг, 1,39 ммоль) в смеси толуола (2 мл) и ТГФ (1 мл) при охлаждении льдом, затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 239 мг, 1,39 ммоль). Реакционную смесь перемешивали в течение 14 часов, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5)] и препаративной ТСХ [элюент=этилацетат:н-гексан (1:3)] с получением неочищенного продукта (130 мг). Полученный неочищенный продукт (55 мг) растворяли в метиленхлориде (0,50 мл) и к полученной смеси добавляли при охлаждении льдом диметилсульфид (0,19 мл, 4,4 ммоль) и комплекс трифторид бора-диэтиловый эфир (0,095 мл, 0,75 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение пяти часов, затем к полученной смеси добавляли воду при охлаждении льдом и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи ТСХ [элюент=метиленхлорид:метанол (10:1)] с получением указанного в заголовке соединения (17,5 мг, 12%).
1H-NMR (CD3OD) δ: 0,83-0,96 (1H, м), 1,44-1,60 (1H, м), 1,99-2,07 (1H, м), 3,14-3,32 (2H, м), 3,38-3,50 (2H, м), 3,67 (1H, дд, J=10,7, 4,0 Гц), 3,93-4,13 (2H, м), 4,15-4,22 (1H, м), 6,85 (1H, т, J=7,3 Гц), 7,01 (1H, д, J=7,9 Гц), 7,11-7,18 (2H, м), 7,37 (2H, д, J=8,2 Гц), 7,55 (2H, д, J=8,1 Гц)
MS (ESI+): 392 [M+Na]+
Время удерживания ВЭЖХ: 10,2 минут
Пример 28
[2-(3-Трифторметоксибензил)фенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез 2-(3-трифторметоксибензил)фенола
В потоке азота раствор н-бутиллития в гексане (2,44 M, 4,3 мл) добавляли по каплям к раствору 1-бензилокси-2-бромбензола (2,5 г, 9,5 ммоль) в ТГФ (95 мл) при -78°C и смесь перемешивали при указанной температуре в течение 30 минут. К этой смеси добавляли по каплям при -78°C раствор 3-трифторметоксибензальдегида (1,5 г, 7,9 ммоль) в ТГФ (32 мл). Реакционную смесь перемешивали при указанной температуре в течение двух часов, а затем при 0°C в течение одного часа, затем к полученной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), а затем растворитель отгоняли при пониженном давлении. Полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5)]. Полученный неочищенный продукт растворяли в метаноле (20 мл) и добавляли катализатор 20% гидроксид палладия (200 мг), затем к полученной смеси добавляли 2 н. раствор HCl (0,187 мл). Смесь перемешивали в атмосфере водорода в течение 13 часов. К реакционной смеси добавляли карбонат калия (850 мг) и смесь перемешивали при комнатной температуре в течение 30 минут, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5)] с получением указанного в заголовке соединения (1,40 г, 99%).
1H-NMR (CDCl3) δ: 3,99 (2H, с), 4,71 (1H, ушир.с), 6,76 (1H, д, J=7,9 Гц), 6,92-6,86 (1H, м), 7,02-7,15 (5H, м), 7,29 (1H, д, J=7,3 Гц)
(2) Синтез [2-(3-трифторметоксибензил)фенил]-5a-карба-β-D-глюкопиранозида
В потоке азота 2,3,4,6-тетра-O-бензил-5a-карба-α-D-глюкопиранозу (500 мг, 0,93 ммоль) и трибутилфосфин (0,35 мл, 1,39 ммоль) добавляли при охлаждении льдом к раствору 2-(3-трифторметоксибензил)фенола (373 мг, 1,39 ммоль) в толуоле (2 мл), затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 239 мг, 1,39 ммоль). Реакционную смесь перемешивали в течение 20 часов, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)]. Полученный неочищенный продукт растворяли в смеси растворителей метанол-ТГФ (1:2) (10 мл), к полученной смеси добавляли катализатор 20% гидроксид палладия (100 мг) и реакционную смесь перемешивали в атмосфере водорода в течение 13 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали при помощи ТСХ [элюент=метиленхлорид:метанол (10:1)] с получением указанного в заголовке соединения (104 мг, 26%).
1H-NMR (CD3OD) δ: 0,86-1,00 (1H, м), 1,45-1,60 (1H, м), 2,01-2,09 (1H, м), 3,15-3,31 (2H, м), 3,41-3,48 (2H, м), 3,68 (1H, дд, J=10,7, 4,1 Гц), 3,88-4,11 (2H, м), 4,13-4,95 (1H, м), 6,82-6,87 (1H, м), 7,00-7,30 (7H, м)
MS (ESI+): 429 [M+H]+
Время удерживания ВЭЖХ: 12,4 минут
Пример 29
[2-(4-Аминометилбензил)фенил]-5a-карба-β-D-глюкопиранозид, соль уксусной кислоты
(1) Синтез [2-(4-аминометилбензил)фенил]-5a-карба-β-D-глюкопиранозида, соли уксусной кислоты.
Неочищенный продукт (63 мг) [2-(4-цианобензил)фенил]- 2,3,4,6-тетра-О-бензил-5a-карба-β-D-глюкопиранозида, полученного в Примере 27, растворяли в смеси растворителей метанол-ТГФ (1:2) (1 мл), к полученной смеси добавляли катализатор 20% гидроксид палладия и полученный смешанный раствор перемешивали в атмосфере водорода в течение 23 часов. Катализатор отфильтровывали и растворитель отгоняли при пониженном давлении с получением неочищенного продукта [2-(4-аминометилбензил)фенил]-2,3,4,6-тетра-О-бензил-5a-карба-β-D-глюкопиранозида. Этот неочищенный продукт растворяли в метиленхлориде (0,55 мл) и к полученной смеси добавляли при охлаждении льдом диметилсульфид (0,22 мл, 5,1 ммоль) и комплекс трифторид бора-диэтиловый эфир (0,11 мл, 0,86 ммоль) и смесь перемешивали при комнатной температуре в течение 22 часов. Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали при помощи ВЭЖХ (элюент=метанол:20 мМ водный раствор ацетата аммония) с получением указанного в заголовке соединения (19 мг).
1H-NMR (CD3OD) δ: 0,85-0,99 (1H, м), 1,42-1,58 (1H, м), 1,88 (3H, с), 1,93-2,01 (1H, м), 3,14-3,67 (5H, м), 3,87-4,07 (2H, м), 4,01 (2H, с), 4,11-4,20 (1H, м), 6,79-6,85 (1H, м), 6,99 (1H, д, J=4,1H), 7,01-7,16 (2H, м), 7,25 (2H, д, J=8,4 Гц), 7,29 (2H, д, J=8,5 Гц)
MS (ESI+): 374 [M+H]+
Время удерживания ВЭЖХ: 7,3 минут
Пример 30
[5-Метокси-2-(4-метоксибензил)фенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез [5-метокси-2-(4-метоксибензил)фенил]-5a-карба-β-D-глюкопиранозида
В потоке азота 2,3,4,6-тетра-O-бензил-5a-карба-α-D-глюкопиранозу (500 мг, 0,93 ммоль) и трибутилфосфин (0,35 мл, 1,39 ммоль) добавляли к раствору 5-метокси-2-(4-метоксибензил)фенола (340 мг, 1,39 ммоль), описанного в Международной Публикации №№ W004/058682, WO02/064606, WO02/044192 или т.п., в толуоле (3 мл) при охлаждении льдом, затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 239 мг, 1,39 ммоль). Реакционную смесь перемешивали в течение 17 часов, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:3)]. Полученный неочищенный продукт растворяли в смеси растворителей метанол-ТГФ (1:2) (5 мл) и к полученной смеси добавляли катализатор 20% гидроксид палладия (50 мг), реакционную смесь перемешивали в атмосфере водорода в течение трех часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали при помощи ТСХ [элюент=метиленхлорид:метанол (10:1)] с получением указанного в заголовке соединения (119 мг, 32%).
1H-NMR (CD3OD) δ: 0,84-0,98 (1H, м), 1,44-1,60 (1H, м), 1,98-2,06 (1H, м), 3,13-3,47 (5H, м), 3,77 (3H, с), 3,82 (3H, с), 3,71-3,88 (2H, м), 4,06-4,16 (1H, м), 6,41 (1H, дд, J=2,3, 8,2 Гц), 6,58 (1H, д, J=2,1 Гц), 6,75 (2H, д, J=8,7 Гц), 6,94 (1H, д, J=8,2 Гц), 7,05 (2H, д, J=8,6 Гц)
MS (ESI+): 405 [M+H]+
Время удерживания ВЭЖХ: 10,7 минут
Пример 31
[2-(4-Метоксикарбонилбензил)фенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез метилового эфира 4-[(2-бензилоксифенил)гидроксиметил]бензойной кислоты
В потоке азота раствор н-бутиллития в гексане (2,71 M, 12,1 мл) добавляли по каплям к раствору 1-бензилокси-2-бромбензола (7,84 г, 29,8 ммоль) в ТГФ (300 мл) при -78°C и реакционную смесь перемешивали при указанной температуре в течение 30 минут. К этой смеси добавляли по каплям при -78°C раствор 4-метил эфир-бензальдегид (4,78 г, 29,1 ммоль) в ТГФ (100 мл). Реакционную смесь перемешивали при указанной температуре в течение одного часа, затем к полученной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5)] с получением указанного в заголовке соединения (4,15 г, 41%).
1H-NMR (CDCl3) δ: 3,06 (1H, д, J=6,2 Гц), 3,91 (3H, с), 5,02 (2H, дд, J=5,8, 11,4 Гц), 6,07 (1H, д, J=6,2 Гц), 6,94-7,00 (2Н, м), 7,18-7,42 (9Н, м), 7,96 (2Н, д, J=8,4 Гц)
(2) Синтез метилового эфира 4-(2-бензилоксибензил)бензойной кислоты
В потоке азота триэтилсилан (2,27 мл, 13,5 ммоль) и комплекс трифторид бора-диэтиловый эфир (1,52 мл, 11,88 ммоль) добавляли к раствору метилового эфира 4-[(2-бензилоксифенил)-гидроксиметил]бензойной кислоты (4,15 г, 11,9 ммоль) в ацетонитриле (22,7 мл) при -40°C и полученный смешанный раствор перемешивали при указанной температуре в течение 1,5 часов, а затем при 0°C в течение 30 минут. К полученной смеси добавляли воду и смесь экстрагировали метиленхлоридом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10) с получением указанного в заголовке соединения (2,39 г, 62%).
1H-NMR (CDCl3) δ: 3,89 (3H, с), 4,05 (2H, с), 5,02 (2H, д, J=5,8 Гц), 6,92 (2H, д, J=7,9 Гц), 7,12-7,36 (9H, м), 7,91 (2H, д, J=8,0 Гц)
MS (ESI+): 333 [M+H]+
(3) Синтез метилового эфира 4-(2-гидроксибензил)бензойной кислоты
К раствору метилового эфира 4-(2-бензилоксибензил)бензойной кислоты (2,39 г, 7,19 ммоль) в метаноле (70 мл) добавляли катализатор 20% гидроксид палладия (239 мг). Смесь перемешивали в атмосфере водорода в течение пяти часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении с получением указанного в заголовке соединения (1,16 г, 96%).
1H-NMR (CDCl3) δ: 3,89 (3H, с), 4,04 (2H, с), 4,76 (1H, с), 6,77 (1H, д, J=8,0 Гц), 6,89 (1H, т, J=7,3 Гц), 7,13 (2H, м), 7,29 (2H, д, J=8,4 Гц), 7,94 (2H, д, J=8,0 Гц)
MS (ESI+): 243 [M+H]+
(4) Синтез [2-(4-метоксикарбонилбензил)фенил]-2,3,4,6-тетра-О-бензил-5a-карба-β-D-глюкопиранозида
В потоке азота 2,3,4,6-тетра-O-бензил-5a-карба-α-D-глюкопиранозу (1,10 г, 2,04 ммоль) и трибутилфосфин (0,77 мл, 3,06 ммоль) добавляли к раствору метилового эфира 4-(2-гидроксибензил)бензойной кислоты (741,4 мг, 3,06 ммоль) в толуоле (6,9 мл) при охлаждении льдом, затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 526,5 мг, 3,06 ммоль). Реакционную смесь перемешивали в течение 20 часов, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)] с получением указанного в заголовке соединения (429,0 мг, 28%).
1H-NMR (CD3OD) δ: 1,40 (1H, дд, J=12,0, 12,0 Гц), 1,65-1,74 (1H, м), 2,00-2,09 (1H, м), 3,43-3,59 (2H, м), 3,84 (3H, с), 4,00 (2H, с), 4,32-3,92 (8H, м), 6,91 (1H, т, J=8,0 Гц), 7,04-7,32 (25H, м), 7,87 (2H, д, J=8,0 Гц)
(5) Синтез [2-(4-метоксикарбонилбензил)фенил]-5a-карба-β-D-глюкопиранозида
[2-(4-Метоксикарбонилбензил)фенил]-2,3,4,6-тетра-O-бензил-5a-карба-β-D-глюкопиранозу (38,1 мг, 0,05 ммоль) растворяли в смеси растворителей метанол-ТГФ (2:1) (1,5 мл) и к полученной смеси добавляли катализатор 20% гидроксид палладия (5 мг). Смесь перемешивали в атмосфере водорода в течение 24 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид:метанол (10:1)] с получением указанного в заголовке соединения (12,9 мг, 65%).
1H-NMR (CD3OD) δ: 0,89-1,00 (1Н, м), 1,47-1,62 (1H, м), 2,03-2,09 (1H, м), 3,16-3,23 (2H, м), 3,42-3,49 (2H, м), 3,51-3,87 (1H, м), 3,95 (3H, с), 4,00-4,17 (2H, м), 4,19-4,23 (1H, м), 6,87 (1Н, д, J=7,4 Гц), 7,31 (1H, д, J=7,6 Гц), 7,12-7,20 (2H, м), 7,32 (2H, д, J=8,4 Гц), 7,88 (2H, д, J=8,4 Гц)
MS (ESI+): 403 [M+Na]+
Пример 32
[2-(4-Карбамоилбензил)фенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез [2-(4-карбоксибензил)фенил]-2,3,4,6-тетра-О-бензил-5a-карба-β-D-глюкопиранозида
В атмосфере азота 5 н. водный раствор гидроксида натрия (0,15 мл) добавляли при комнатной температуре к раствору [2-(4-метоксикарбонилбензил)фенил]-2,3,4,6-тетра-O-бензил-5a-карба-β-D-глюкопиранозы (100,0 мг, 0,13 ммоль) в смеси растворителей этанол-ТГФ (4:1) (1,5 мл) и полученный смешанный раствор перемешивали в течение 22 часов. После этого к реакционной смеси добавляли при охлаждении льдом 5 н. водный раствор хлористоводородной кислоты для нейтрализации смеси. Полученную смесь экстрагировали метиленхлоридом и сушили (сульфат натрия) и концентрировали при пониженном давлении с получением указанного в заголовке соединения (91,3 мг, 94%).
1H-NMR (CDCl3) δ: 1,42 (1H, ддд, J=12,4, 12,4, 12,4 Гц), 1,55-1,67 (1H, м), 2,00-2,04 (1H, м), 3,41-3,61 (2H, м), 4,02 (2H, с), 4,35-3,92 (8H, м), 6,92 (1H, т, J=7,3 Гц), 7,05-7,32 (25H, м), 7,92 (2H, д, J=7,7 Гц)
MS (ESI+): 749 [M+H]+
(2) Синтез [2-(4-карбоксибензил)фенил]-2,3,4,6-тетра-О-бензил-5a-карба-β-D-глюкопиранозида
В атмосфере азота моногидрат 1-гидроксибензотриазола (9,0 мг, 0,07 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (12,0 мг, 0,07 ммоль) добавляли к раствору [2-(4-гидроксикарбонилбензил)фенил]-2,3,4,6-тетра-O-бензил-5a-карба-β-D-глюкопиранозида (45,0 мг, 0,06 ммоль) в N,N-диметилформамиде (1,2 мл) при комнатной температуре и реакционную смесь перемешивали в течение одного часа, затем к смеси при охлаждении льдом добавляли водный раствор аммиака (0,5 мл) и смесь перемешивали в течение 27 часов. Реакционную смесь концентрировали при пониженном давлении и очищали при помощи ТСХ (элюент=метанол:метиленхлорид (1:10)) с получением указанного в заголовке соединения (39,1 г, 89%).
1H-NMR (CDCl3) δ: 1,31-1,49 (1H, м), 1,62-1,76 (1H, м), 1,96-2,08 (1H, м), 3,39-3,66 (2H, м), 4,02 (2H, с), 4,33-4,96 (8H, м), 6,88-6,97 (1H, м), 7,04-7,39 (25H, м), 7,54-7,61 (2H, м)
MS (ESI+): 748 [M+H]+
(3) Синтез [2-(4-карбамоилбензил)фенил]-5а-карба-β-D-глюкопиранозида
К раствору (3 мл) [2-(4-карбамоилбензил)фенил]-2,3,4,6-тетра-O-бензил-5a-карба-β-D-глюкопиранозида (39,1 мг, 0,05 ммоль) в растворителе метанол-ТГФ (2:1) (3 мл) добавляли катализатор 20% гидроксид палладия (5 мг). Полученный смешанный раствор перемешивали в атмосфере водорода в течение 24 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали при помощи ТСХ [элюент=метанол:метиленхлорид (1:5)] с получением указанного в заголовке соединения (19,2 г, 99%).
1H-NMR (CD3OD) δ: 0,92 (1H, дд, J=11,7, l1,7 Гц), 1,48-1,62 (1H, м), 1,96-2,08 (1H, м), 3,16-3,33 (4H, м), 3,42-3,59 (2H, м), 3,65-3,73 (1H, м), 3,93-4,26 (3H, м), 6,87 (1H, т, J=7,3 Гц), 7,02-7,21 (3H, м), 7,31 (2H, д, J=8,2 Гц), 7,74 (2H, д, J=8,1 Гц)
MS (ESI+): 388 [M+H]+
Время удерживания ВЭЖХ: 8,0 минут
Пример 33
[2-(4-N,N-Диметилкарбамоилбензил)фенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез [2-(4-N,N-диметилкарбамоилбензил)фенил]-2,3,4,6-тетра-О-бензил-5a-карба-β-D-глюкопиранозида
В атмосфере азота моногидрат 1-гидроксибензотриазола (9,0 мг, 0,07 ммоль) и гидрохлорид 1-этил-3-(3-диметил-аминопропил)карбодиимида (12,0 мг, 0,07 ммоль) добавляли при комнатной температуре к раствору [2-(4-карбоксибензил)фенил]-2,3,4,6-тетра-О-бензил-5a-карба-β-D-глюкопиранозида (45,0 мг, 0,06 ммоль), полученного в Примере 32, в N,N-диметилформамиде (1,2 мл) и реакционную смесь перемешивали в течение одного часа. К полученной смеси добавляли при охлаждении льдом водный раствор N,N-диметиламина (0,5 мл) и смесь перемешивали в течение 27 часов. Реакционную смесь концентрировали при пониженном давлении и очищали препаративной ТСХ (элюент=метанол:метиленхлорид=1:10) с получением указанного в заголовке соединения (44,1 мг, 96%).
1H-NMR (CDCl3) δ: 1,42-1,52 (1H, м), 1,66-1,78 (1H, м), 2,05-2,14 (1H, м), 2,83 (3H, с), 3,04 (3H, с), 3,44-3,68 (5H, м), 3,99 (2H, с), 4,35-4,53 (1H, м), 4,68 (2H, с), 4,83-4,94 (3H, м), 6,91 (1H, т, J=7,3 Гц), 7,04-7,36 (27H, м)
MS (ESI+): 776 [M+H]+
(2) Синтез [2-(4-N,N-диметилкарбамоилбензил)фенил]-5a-карба-β-D-глюкопиранозида
К раствору в смеси метанол-ТГФ (2:1) (3 мл) [2-(4-N,N-диметилкарбамоилбензил)фенил]-2,3,4,6-тетра-O-бензил-5a-карба-β-D-глюкопиранозида (44,1 мг, 0,06 ммоль) добавляли катализатор 20% гидроксид палладия (5 мг). Полученный смешанный раствор перемешивали в атмосфере водорода в течение 24 часов, а затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали при помощи ТСХ [элюент=метанол:метиленхлорид (1:5)] с получением указанного в заголовке соединения (20,1 мг, 87%).
1H-NMR (CD3OD) δ: 0,86-1,00 (1H, м), 1,45-1,58 (1H, м), 1,98-2,06 (1H, м), 2,95 (3H, с), 3,03 (3H, с), 3,13-3,49 (5H, м), 3,62-3,68 (1H, м), 3,88-4,21 (3H, м), 6,91 (1H, т, J=7,2 Гц), 6,98-7,15 (3H, м), 7,26 (4H, с)
MS (ESI+): 416 [M+H]+
Время удерживания ВЭЖХ: 8,9 минут
Пример 34
[2-(4-Этоксибензил)фенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез 2-(4-этоксибензил)фенола
В потоке азота раствор н-бутиллития в гексане (2,71 M, 3,8 мл) добавляли по каплям при -78°C к раствору 1-бензилокси-2-бромбензола (2,5 г, 9,5 ммоль) в ТГФ (90 мл) и полученный смешанный раствор перемешивали при указанной температуре в течение 30 минут. К этой смеси добавляли по каплям при -78°C раствор 4-этоксибензальдегид (1,29 мл, 1,86 ммоль) в ТГФ (30 мл). Реакционную смесь перемешивали при указанной температуре в течение двух часов, затем к полученной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5)]. К раствору в метаноле (26,8 мл) полученного неочищенного продукта добавляли катализатор 20% гидроксид палладия (147 мг), затем к полученной смеси добавляли 36% раствор HCl (0,4 мл). Смесь перемешивали в атмосфере водорода в течение 24 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5)] с получением указанного в заголовке соединения (828,1 мг, 38%).
1H-NMR (CDCl3) δ: 1,39 (3H, т, J=7,0 Гц), 3,93 (2H, с), 3,99 (2H, кв., J=7,0 Гц), 6,77-6,90 (4H, м), 7,09-7,14 (4H, м)
(2) Синтез [2-(4-этоксибензил)фенил]-5a-карба-β-D-глюкопиранозида
В потоке азота 2,3,4,6-тетра-O-бензил-5a-карба-α-D-глюкопиранозу (500 мг, 0,93 ммоль) и трибутилфосфин (0,35 мл, 1,39 ммоль) добавляли при охлаждении льдом к раствору 2-(4-этоксибензил)фенола (319,6 мг, 1,4 ммоль) в толуоле (3,2 мл), затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 239 мг, 1,39 ммоль). Реакционную смесь перемешивали в течение 20 часов, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)]. Полученный неочищенный продукт растворяли в метаноле (5 мл), к полученной смеси добавляли катализатор 20% гидроксид палладия (56 мг) и реакционную смесь перемешивали в атмосфере водорода в течение 24 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид:метанол (10:1)] с получением указанного в заголовке соединения (133,5 мг, 36%).
1H-NMR (CD3OD) δ: 0,89-1,03 (1H, м), 1,35 (3H, т, J=7,1 Гц), 1,48-1,62 (1H, м), 2,02-2,11 (1H, м), 3,18-3,33 (3H, м), 3,35 (2H, с), 3,44-3,52 (2H, м), 3,68-3,74 (1H, м), 3,81-4,02 (4H, м), 4,13-4,23 (1H, м), 6,74-6,87 (4H, м), 6,99-7,17 (4Н, м)
MS (ESI+): 411 [M+Na]+
Время удерживания ВЭЖХ: 11,4 минут
Пример 35
[2-(4-Дифторметоксибензил)фенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез 2-(4-дифторметоксибензил)фенола
В потоке азота раствор н-бутиллития в гексане (2,71 M, 3,8 мл) добавляли по каплям к раствору 1-бензилокси-2-бромбензола (2,5 г, 9,5 ммоль) в ТГФ (90 мл) при -78°C и полученный смешанный раствор перемешивали при указанной температуре в течение 30 минут. К этому раствору добавляли по каплям при -78°C раствор 4-дифторметоксибензальдегида (1,23 мл, 1,86 ммоль) в ТГФ (30 мл). Реакционную смесь перемешивали при указанной температуре в течение двух часов, затем к полученной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент-этилацетат:н-гексан (1:5)] с получением неочищенного продукта. К раствору полученного неочищенного продукта в метаноле (26,8 мл) добавляли катализатор 20% гидроксид палладия (147 мг), затем к полученной смеси добавляли концентрированную хлористоводородную кислоту (0,4 мл). Полученный смешанный раствор перемешивали в атмосфере водорода в течение 24 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5)] с получением уазанного в заголовке соединения (1,03 г, 42%).
1H-NMR (CDCl3) δ: 3,97 (2H, с), 6,46 (1H, т, J=74,4 Гц), 6,77 (1H, д, J=8,0 Гц), 6,87-6,91 (1H, т, J=7,3 Гц), 7,03 (2H, д, J=8,4 Гц), 7,09-7,15 (2H, м), 7,21 (2H, д, J=8,0 Гц)
(2) Синтез [2-(4-дифторметоксибензил)фенил]-5a-карба-β-D-глюкопиранозида
В потоке азота 2,3,4,6-тетра-O-бензил-5a-карба-α-D-глюкопиранозу (500 мг, 0,93 ммоль) и трибутилфосфин (0,35 мл, 1,39 ммоль) добавляли к раствору 2-(4-ди-фторметоксибензил)фенола (350,0 мг, 1,4 ммоль) в толуоле (3,2 мл) при охлаждении льдом, затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 239 мг, 1,39 ммоль). Реакционную смесь перемешивали в течение 20 часов, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)]. Полученный неочищенный продукт растворяли в метаноле (5 мл), к полученной смеси добавляли катализатор 20% гидроксид палладия (69 мг), полученный смешанный раствор перемешивали в атмосфере водорода в течение 24 часов и катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид:метанол (10:1)] с получением указанного в заголовке соединения (153,1 мг, 40%).
1H-NMR (CD3OD) δ: 0,87-1,01 (1H, м), 1,48-1,62 (1H, м), 2,01-2,11 (1H, м), 3,17-3,34 (2H, м), 3,43-3,54 (2H, м), 3,67-3,73 (1H, м), 3,96 (2H, дд, J=22,9, 14,7 Гц), 4,14-4,26 (1H, м), 6,72 (1H, т, J=74,5 Гц), 6,83-7,25 (8H, м)
MS (ESI+): 433 [M+Na]+
Время удерживания ВЭЖХ: 11,6 минут
Пример 36
[2-(4-трет-бутилбензил)фенил]-5a-карба-β-D-глюкопиранозид (1) Синтез (2-бензилоксифенил)-(4-трет-бутилфенил)метанола
В потоке азота раствор н-бутиллития в гексане (2,44 M, 5,65 мл) добавляли по каплям к раствору 1-бензилокси-2-бромбензола (3,3 г, 12,5 ммоль) в ТГФ (126 мл) при -78°C и полученный смешанный раствор перемешивали при указанной температуре в течение 30 минут. К этому раствору добавляли при -78°C раствор 4-трет-бутилбензальдегида (1,68 г, 10,4 ммоль) в ТГФ (42 мл). Реакционную смесь перемешивали при указанной температуре в течение одного часа, затем к полученной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5)] с получением указанного в заголовке соединения (2,17 г, 60%).
1H-NMR (CDCl3) δ: 1,32 (9H, с), 2,86 (1H, ушир.с), 5,02 (2H, с), 6,03 (1H, с), 6,03-7,00 (2H, м), 7,13-7,39 (11H, м)
(2) Синтез 2-(4-трет-бутилбензил)фенола
К раствору (2-бензилоксифенил)-(4-трет-бутилфенил)метанола (2,17 г, 6,26 ммоль) в метаноле (27 мл) добавляли катализатор 20% гидроксид палладия (217 мг), затем к полученной смеси добавляли 2 н. раствор HCl (0,52 мл). Смесь перемешивали в атмосфере водорода в течение 24 часов, затем катализатор отфильтровывали. Растворитель отгоняли и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)] с получением указанного в заголовке соединения (1,3 г, 86%).
1H-NMR (CDCl3) δ: 1,29 (9H, с), 3,96 (2H, с), 4,65 (1H, с), 6,75-6,91 (2H, м), 7,09-7,32 (6H, м)
(3) Синтез [2-(4-трет-бутилбензил)фенил]-5a-карба-β-D-глюкопиранозида
В потоке азота 2,3,4,6-тетра-О-бензил-5a-карба-α-D-глюкопиранозу (500 мг, 0,93 ммоль) и трибутилфосфин (0,35 мл, 1,39 ммоль) добавляли при охлаждении льдом к раствору 2-(4-трет-бутилбензил)фенола (334 мг, 1,39 ммоль) в толуоле (2 мл), затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 239 мг, 1,39 ммоль). Реакционную смесь перемешивали в течение 20 часов, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)]. Полученный неочищенный продукт растворяли в смеси растворителей метанол-ТГФ (1:1) (12 мл) и к полученной смеси добавляли катализатор 20% гидроксид палладия (60 мг) и смесь перемешивали в атмосфере водорода в течение 24 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид:метанол (10:1)] с получением указанного в заголовке соединения (57 мг, 15%).
1H-NMR (CD3OD) δ: 0,89-1,01 (1H, м), 1,29 (9H, с), 1,53-1,59 (1H, м), 2,04-2,11 (1H, м), 3,19-3,34 (2H, м), 3,45-3,51 (2H, м), 3,71 (1H, дд, J=10,8, 4,5 Гц), 3,95 (2H, м), 4,19 (1H, м), 6,84 (1H, м), 7,01-7,17 (5H, м), 7,26-7,28 (2H, м)
MS (ESI+): 401 [M+H]+
Время удерживания ВЭЖХ: 13,7 минут
Пример 37
[2-(4-Метилбензил)фенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез (2-бензилоксифенил)-п-толилметанола
В потоке азота раствор н-бутиллития в гексане (2,44 M, 5,65 мл) добавляли по каплям при -78°C к раствору 1-бензилокси-2-бромбензола (3,3 г, 12,54 ммоль) в ТГФ (126 мл) и смесь перемешивали при указанной температуре в течение 30 минут. К этой смеси добавляли при -78°C раствор 4-метилбензальдегида (1,28 г, 10,6 ммоль) в ТГФ (42 мл). Реакционную смесь перемешивали при указанной температуре в течение одного часа, затем к полученной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), а затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5)] с получением указанного в заголовке соединения (2,3 г, 71%).
1H-NMR (CDCl3) δ: 2,33 (3H, с), 2,87 (1H, с), 5,02 (2H, с), 6,03 (1H, с), 6,09-6,99 (2H, м), 7,09-7,34 (11H, м)
(2) Синтез 2-(4-метилбензил)фенола
К раствору (2-бензилоксифенил)-п-толилметанола (1,5 г, 4,43 ммоль) в метаноле (27 мл) добавляли катализатор 20% гидроксид палладия (150 мг), затем к полученной смеси добавляли 2 н. раствор HCl (0,37 мл). Смесь перемешивали в атмосфере водорода в течение 24 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)] с получением указанного в заголовке соединения (617 мг, 70%).
1H-NMR (CDCl3) δ: 1,55 (3H, с), 3,95 (2H, с), 4,65 (1H, с), 6,75-6, 90 (2H, м), 7,09-7,25 (6H, м)
(3) Синтез [2-(4-метилбензил)фенил]-5a-карба-β-D-глюкопиранозида
В потоке азота 2,3,4,6-тетра-O-бензил-5a-карба-α-D-глюкопиранозу (500 мг, 0,93 ммоль) и трибутилфосфин (0,35 мл, 1,39 ммоль) добавляли при охлаждении льдом к раствору 2-(4-метилбензил)фенола (275 мг, 1,39 ммоль) в толуоле (2 мл), затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 239 мг, 1,39 ммоль). Реакционную смесь перемешивали в течение 20 часов, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении и полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)]. Полученный неочищенный продукт растворяли в смеси растворителей метанол-ТГФ (1:1) (8 мл), к полученной смеси добавляли катализатор 20% гидроксид палладия (44 мг), смесь перемешивали в атмосфере водорода в течение 24 часов и катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид:метанол (10:1)] с получением указанного в заголовке соединения (20 мг, 6%).
1H-NMR (CD3OD) δ: 0,84-0,97 (1H, м), 1,44-2,03 (1H, м), 1,96-2,03 (1H, м), 2,22 (3H, с), 3,13-3,30 (2H, м), 3,39-3,46 (2H, м), 3,64 (1H, дд, J=10,8, 4,5 Гц), 3,95 (2H, м), 4,12 (1H, м), 6,76-6,81 (1H, м), 6,92-7,03 (5H, м), 7,06-7,11 (2H, м)
MS (ESI+): 381 [M+Na]+
Время удерживания ВЭЖХ: 11,4 минут
Пример 38
[2-(4-Метоксибензил)-5-трифторметилтиофен-3-ил]-5a-карба-β-D-глюкопиранозид
(1) Синтез 3-бензилокси-2-(4-метоксибензил)-5-трифторметилтиофена
К раствору (3-бензилокси-5-трифторметилтиофен-2-ил)-(4-метоксифенил)метанона (220,2 мг, 0,56 ммоль), синтезированного способом, описанным в Международной Публикации № WO04/007517, и триэтилсилана (1,34 мл, 8,41 ммоль) в дихлорметане (1,1 мл) добавляли при 0°C трифторуксусную кислоту (3 мл) в потоке азота в течение пяти минут. Реакционную смесь перемешивали при указанной температуре в течение 6,75 часов и затем к полученной смеси добавляли триэтилсилан (0,9 мл, 5,61 ммоль). Реакционную смесь перемешивали при указанной температуре в течение 16,75 часов и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)] с получением указанного в заголовке соединения (108,8 мг, 51%).
1H-NMR (CDCl3) δ: 3,79 (3H, с), 3,96 (2H, с), 5,04 (2H, с), 6,82 (2H, д, J=8,6 Гц), 7,11 (2H, д, J=8,6 Гц), 7,16 (1H, с), 7,30-7,41 (5H, м)
(2) Синтез 2-(4-метоксибензил)-5-трифторметилтиофен-3-ола
К раствору (3-бензилокси-2-(4-метоксибензил)-5-трифторметилтиофена (170,5 мг, 0,45 ммоль) в дихлорметане (4,5 мл) добавляли при -78°C в потоке азота раствор комплекса трибромид бора-диметилсульфид в дихлорметане (0,47 мл, 0,47 ммоль). Реакционную смесь перемешивали при указанной температуре в течение пяти минут, а затем при 0°C в течение 11 часов. К реакционной смеси добавляли воду и полученную смесь экстрагировали метиленхлоридом. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия и сушили (безводный сульфат натрия), а затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5)] с получением указанного в заголовке соединения (117,0 мг 90%).
1H-NMR (CDCl3) δ: 3,80 (3H, с), 3,97 (2H, с), 4,47 (1H, с), 6,87 (2H, д, J=8,6 Гц), 6,98 (1H, с), 7,19 (2H, д, J=8,6 Гц)
(3) Синтез [2-(4-метоксибензил)-5-трифторметилтиофен-3-ил]-2,3,4,6-тетра-O-бензил-5a-карба-β-D-глюкопиранозида
В потоке азота 2,3,4,6-тетра-O-бензил-5a-карба-α-D-глюкопиранозу (146 мг, 0,27 ммоль) и трибутилфосфин (0,10 мл, 0,41 ммоль) добавляли при охлаждении льдом к раствору 2-(4-метилбензил)-5-трифторметилтиофен-3-ола (117 мг, 0,41 ммоль) в толуоле (0,85 мл), затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 70 мг, 0,41 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18,5 часов. Реакционную смесь обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10 до 1:8)]. Полученный продукт очищали препаративной ТСХ [элюент=этилацетат:н-гексан (1:8)] с получением указанного в заголовке соединения (47,2 мг).
1H-NMR (CDCl3) δ: 1,56-1,80 (2H, м), 1,96-2,10 (1H, м), 3,40-3,70 (5H, м), 3,75 (3H, с), 3,96 (2H, с), 3,96-4,16 (1H, м), 4,44 (2H, с), 4,53 (1H, д, J=11,0 Гц), 4,70-5,00 (5H, м), 6,79 (2H, д, J=8,6 Гц), 7,06-7,38 (23H, м)
(4) Синтез [2-(4-метоксибензил)-5-трифторметилтиофен-3-ил]-5a-карба-β-D-глюкопиранозида
В потоке азота [2-(4-метоксибензил)-5-трифторметилтиофен-3-ил]-2,3,4,6-тетра-O-бензил-5a-карба-β-D-глюкопиранозид (45,2 мг, 0,056 ммоль) растворяли в метиленхлориде (0,5 мл) и к полученной смеси добавляли при охлаждении льдом диметилсульфид (0,145 мл, 3,35 ммоль) и комплекс трифторид бора-диэтиловый эфир (0,07 мл, 0,56 ммоль). Реакционную смесь перемешивали при указанной температуре в течение пяти минут, а затем при комнатной температуре в течение 19 часов, затем к полученной смеси добавляли при охлаждении льдом насыщенный водный раствор гидрокарбоната натрия и воду и экстрагировали метиленхлоридом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат натрия), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи ТСХ [элюент=н-гексан:ацетон (1:1)] с получением указанного в заголовке соединения (12,2 мг, 49%).
1H-NMR (CD3OD) δ: 1,15-1,35 (1H, м), 1,40-1,65 (1H, м), 1,95-2,15 (1H, м), 3,15-3,35 (2H, ra), 3,35-3,60 (2H, м), 3,65-3,80 (1H, м), 3,75 (3H, м), 3,90-4,06 (1H, м), 4,01 (2H, м), 6,84 (2H, д, J=8,3 Гц), 7,16 (2H, д, J=8,3 Гц), 7,40 (1H, с)
MS (ESI+): 448 [M]+
Время удерживания ВЭЖХ: 12,4 минут
Пример 39
[3-Метокси-2-(4-метоксибензил)фенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез бензилового эфира 2-бензилокси-6-метоксибензойной кислоты
При перемешивании смеси 6-метоксисалициловой кислоты (5,07 г, 30,15 ммоль) и гидрида натрия (60% мас./мас., 3,02 г, 75,38 ммоль) к полученной смеси при охлаждении льдом добавляли ДМФА (30 мл). Полученный смешанный раствор перемешивали при указанной температуре в течение 10 минут, затем к полученной смеси добавляли в течение 5 минут бензилбромид (8,95 мл, 75,38 ммоль) и реакционную смесь перемешивали при указанной температуре в течение 30 минут и при комнатной температуре в течение 2,5 часов. К реакционной смеси добавляли при охлаждении льдом насыщенный водный раствор хлорида аммония и воду и смесь экстрагировали простым эфиром. Органический слой промывали водой и насыщенным водным раствором хлорида аммония и сушили (безводный сульфат натрия), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10 до 1:5)] с получением указанного в заголовке соединения (6,24 г, 59%).
1H-NMR (CDCl3) δ: 3,81 (3H, с), 5,08 (2H, с), 5,35 (2H, с), 6,55 (1H, д, J=5,9 Гц), 6,58 (1H, д, J=5,9 Гц), 7,15-7,45 (11H, м)
(2) (2-Бензилокси-6-метоксифенил)метанол
В потоке азота к суспензии литийалюминийгидрида (0,88 г, 23,14 ммоль) в простом эфире (35 мл) добавляли при комнатной температуре в течение 15 минут раствор бензилового эфира 2-бензилокси-6-метоксибензойной кислоты (6,2 г, 17,80 ммоль) в простом эфире (20 мл). Реакционную смесь перемешивали в течение двух часов при нагревании до температуры кипения с обратным холодильником. К реакционной смеси при охлаждении льдом добавляли по каплям этилацетат (2 мл), затем к полученной смеси добавляли по каплям насыщенный водный раствор соли Rochelle (20 мл) и смесь перемешивали при комнатной температуре в течение 20 часов. Реакционную смесь подвергали фильтрованию через целит, к фильтрату добавляли насыщенный водный раствор соли Rochelle (15 мл) и смесь экстрагировали простым эфиром. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат натрия), а затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=простой эфир:н-гексан (1:1)] с получением указанного в заголовке соединения (4,75 г, 100%).
1H-NMR (CDCl3) δ: 2,48 (1H, т, J=6,8 Гц), 3,85 (3H, с), 4,84 (2H, д, J=6,8 Гц), 5,10 (2H, с), 6,58 (1H, д, J=8,4 Гц), 6,62 (1H, д, J=8,2 Гц), 7,20 (1H, дд, J=8,4, 8,2 Гц), 7,28-7,47 (5H, м)
(3) Синтез (2-бензилокси-6-метоксифенил)-(4-метоксифенил)метанола
В потоке азота раствор (2-бензилокси-6-метоксифенил)-метанола (3,52 г, 14,41 ммоль) и N-оксида N-метилморфолина (NMO, 2,53 г, 21,61 ммоль) в дихлорметане (14,5 мл) охлаждали на водяной бане и к полученной смеси добавляли перрутенат тетра-н-пропиламмония (TPAP, 152 мг, 0,43 ммоль). Реакционную смесь перемешивали в течение 20 минут при указанной температуре и при комнатной температуре в течение 1,75 часов, а затем подвергали фильтрованию через целит и растворитель отгоняли при пониженном давлении. Полученный остаток обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:3 → 1:2,5)]. Полученное соединение растворяли в ТГФ и охлаждали на водяной бане и к полученной смеси добавляли по каплям в потоке азота раствор 4-метоксифенилмагнийбромида в ТГФ (0,5 M, 30,3 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1,25 часа, затем к полученной смеси добавляли при комнатной температуре насыщенный водный раствор хлорида аммония и смесь экстрагировали простым эфиром. Органический слой промывали насыщенным водным раствором хлорида аммония и сушили (безводный сульфат натрия), а затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:4 →1:3,5)] с получением указанного в заголовке соединения (3,66 г, 72%).
1H-NMR (CDCl3) δ: 3,78 (3H, с), 3,81 (3H, с), 4,28 (1H, д, J=11,7 Гц), 4,99 (1H, д, J=11,5 Гц), 5,06 (1H, д, J=11,5 Гц), 6,33 (1H, д, J=11,7 Гц), 6,61 (1H, д, J=7,6 Гц), 6,64 (1H, д, J=7,6 Гц), 6,80 (2H, д, J=8,7 Гц), 7,10-7,40 (8H, м)
(4) 3-Метокси-2-(4-метоксибензил)фенол
К раствору (2-бензилокси-6-метоксифенил)-(4-метоксифенил)-метанола (2,13 г, 6,08 ммоль) в метаноле (50 мл) добавляли катализатор 20% гидроксид палладия (0,32 г) и затем к полученной смеси добавляли 2 н. раствор HCl (1,8 мл). Реакционную смесь перемешивали в атмосфере водорода в течение 24 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:4)] с получением указанного в заголовке соединения (1,31 г, 89%).
1H-NMR (CDCl3) δ: 3,76 (3H, с), 3,82 (3H, с), 3,98 (2Н, с), 4,67 (1Н, с), 6,45 (1H, д, J=8,1 Гц), 6,52 (1H, д, J=8,2 Гц), 6,79 (1H, д, J=8,6 Гц), 7,07 (1H, дд, J=8,1, 8,2 Гц), 7,17 (1H, д, J=8,6 Гц)
(5) Синтез [3-метокси-2-(4-метоксибензил)фенил]-5a-карба-β-D-глюкопиранозида
В потоке азота к раствору 3-метокси-2-(4-метоксибензил)фенола (343 мг, 1,40 ммоль) в смеси растворителей толуол-ТГФ (толуол 2,5 мл, ТГФ 0,3 мл) добавляли при охлаждении льдом 2,3,4,6-тетра-O-бензил-5a-карба-α-D-глюкопиранозу (504 мг, 0,94 ммоль) и трибутилфосфин (0,35 мл, 1,40 ммоль) и к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 242 мг, 1,40 ммоль). Реакционную смесь перемешивали в течение 1,25 часов при охлаждении льдом, а затем при комнатной температуре в течение 22 часов. Реакционную смесь обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10→1:5)]. Полученный неочищенный продукт растворяли в смешанном растворе метанол-ТГФ (1:4) (10 мл), к полученной смеси добавляли катализатор 20% гидроксид палладия (94 мг) и полученный смешанный раствор перемешивали в атмосфере водорода в течение 5 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид:метанол (15:1 → 10:1)] с получением указанного в заголовке соединения (121 мг, 32%).
1H-NMR 0,85-1,05 (1H, м), 1,40-1,65 (1H, м), 1,95-2,15 (1H, м), 3,10-3,30 (2H, м), 3,40-3,55 (2H, м), 3,60-3,75 (1H, м), 3,71 (3H, с), 3,79 (3H, с), 3,92 (2H, с), 4,05-4,25 (1Н, м), 6,59 (1H, д, J=8,2 Гц), 6,65-6,75 (3H, м), 7,05-7,15 (3H, м)
MS (ESI+): 405 [M+H]+
Время удерживания ВЭЖХ: 10,6 минут
Пример 40
[2-(4-Метоксибензил)-3-метилфенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез (2-бензилокси-6-метоксифенил)метанола
В потоке азота к суспензии литийалюминийгидрида (0,82 г, 21,50 ммоль) в простом эфире (30 мл) добавляли при комнатной температуре в течение 10 минут раствор этилового эфира 2-бензилокси-6-метилбензойной кислоты (4,47 г, 16,54 ммоль) в простом эфире (15 мл). Реакционную смесь перемешивали при нагревании до температуры кипения с обратным холодильником в течение одного часа. К реакционной смеси при охлаждении льдом добавляли по каплям этилацетат (2 мл), затем к полученной смеси добавляли по каплям насыщенный водный раствор соли Rochelle (20 мл) и смесь перемешивали при комнатной температуре в течение одного часа. Реакционную смесь подвергали фильтрованию через целит. К фильтрату добавляли насыщенный водный раствор соли Rochelle (10 мл) и смесь экстрагировали простым эфиром. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат натрия), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:4)] с получением указанного в заголовке соединения (3,84 г, 100%).
1H-NMR (CDCl3) δ: 2,20 (1H, д, J=6,6 Гц), 2,40 (3H, с), 4,79 (2H, д, J=6,6 Гц), 5,11 (2H, с), 6,83 (2H, д, J=7,9 Гц), 7,15 (1H, т, J=7,9 Гц), 7,25-7,50 (5H, м)
(2) Синтез 2-бензилокси-6-метилбензальдегида
В потоке азота раствор (2-бензилокси-6-метоксифенил)-метанола (3,46 г, 15,16 ммоль) и N-оксида N-метилморфолина (NMO, 2,66 г, 22,73 ммоль) в дихлорметане (10 мл) охлаждали на водяной бане и к полученной смеси добавляли перрутенат тетра-н-пропиламмония (TPAP, 152 мг, 0,43 ммоль). Реакционную смесь перемешивали при указанной температуре в течение 1,75 часа, а затем подвергали фильтрованию через целит и растворитель отгоняли в при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5)] с получением указанного в заголовке соединения (3,08 г, 90%).
1H-NMR (CDCl3) δ: 2,59 (3H, с), 5,16 (2H, с), 6,82 (1H, д, J=7,3 Гц), 6,90 (1H, д, J=8,4 Гц), 7,25-7,50 (6H, м), 10,73 (1H, с)
(3) Синтез (2-бензилокси-6-метилфенил)-(4-метоксифенил)метанола
В потоке азота раствор 2-бензилокси-6-метоксибензальдегида (3,08 г, 13,6 ммоль) в ТГФ (10 мл) охлаждали на водяной бане и к полученной смеси добавляли по каплям раствор 4-метоксифенилмагнийбромида ТГФ (0,5 M, 30,3 мл). Полученный смешанный раствор перемешивали при комнатной температуре в течение 1,75 часов, затем к полученной смеси добавляли при охлаждении льдом насыщенный водный раствор хлорида аммония и смесь экстрагировали простым эфиром. Органический слой промывали насыщенным водным раствором хлорида аммония и сушили (безводный сульфат натрия), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:6→1:5)] с получением указанного в заголовке соединения (4,75 г, 100%).
1H-NMR (CDCl3) δ: 2,38 (3H, с), 3,80 (3H, с), 4,09 (1H, д, J=11,2 Гц), 4,88 (1H, д, J=11,5 Гц), 5,00 (1H, д, J=11,5 Гц), 6,03 (1Н, д, J=11,2 Гц), 6,75-6,90 (4H, м), 6,90-7,05 (2H, м), 7,10-7,35 (6H, м)
(4) Синтез 2-(4-метоксибензил)-3-метилфенола
К раствору (2-бензилокси-6-метилфенил)-(4-метоксифенил)-метанола (2,39 г, 7,15 ммоль) в метаноле (50 мл) добавляли катализатор 20% гидроксид палладия (0,36 г), затем к полученной смеси добавляли 36% раствор HCl (0,36 мл). Смесь перемешивали в атмосфере водорода в течение 11 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5)] с получением указанного в заголовке соединения (1,40 г, 86%).
1H-NMR (CDCl3) δ: 2,28 (3H, с), 3,76 (3H, с), 3,99 (2H, с), 4,61 (1H, с), 6,67 (1H, д, J=8,1 Гц), 6,70-6,85 (3H, м), 6,95-7,15 (3H, м)
(5) Синтез [2-(4-метоксибензил)-3-метилфенил]-5a-карба-β-D-глюкопиранозида
В потоке азота к раствору 2-(4-метоксибензил)-3-метилфенола (318 мг, 1,39 ммоль) в смеси растворителей толуол-ТГФ (толуол 1 мл, ТГФ 0,1 мл) добавляли при охлаждении льдом 2,3,4,6-тетра-О-бензил-5а-карба-α-D-глюкопиранозу (500 мг, 0,93 ммоль) и трибутилфосфин (0,35 мл, 1,39 ммоль) и к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 242 мг, 1,40 ммоль). Реакционную смесь перемешивали в течение 10 минут при охлаждении льдом, а затем при комнатной температуре в течение 23 часов. Реакционную смесь обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:7 → 1:6)]. Полученный неочищенный продукт растворяли в смеси растворителей метанол-ТГФ (1:3) (4 мл), к полученной смеси добавляли катализатор 20% гидроксид палладия (66 мг) и полученный смешанный раствор перемешивали в атмосфере водорода в течение 6,5 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид:метанол (10:1)] с получением указанного в заголовке соединения (55 мг, 15%).
1H-NMR (CD3OD) δ: 0,85-1,05 (1H, м), 1,45-1,65 (1H, м), 2,00-2,15 (1H, м), 2,21 (3H, с), 3,15-3,30 (2H, м), 3,40-3,55 (2H, м), 3,65-3,75 (1H, м), 3,72 (3H, с), 3,94 (1H, д, J=15,0 Гц), 4,06 (1H, д, J=15,0 Гц), 4,05-4,20 (1H, м), 6,70-6,80 (3H, м), 6,91 (1H, д, J=8,2 Гц), 6,95-7,10 (3H, м)
MS (ESI+): 411 [M+Na]+
Время удерживания ВЭЖХ: 11,2 минут
Пример 41
[2-(3-Фтор-4-метоксибензил)фенил]-5a-карба-α-D-глюкопиранозид
(1) Синтез (2-бензилоксифенил)-(3-фтор-4-метоксифенил)-метанола
В потоке азота раствор н-бутиллития в гексане (1,54 M, 6,79 мл) добавляли по каплям к раствору 1-бензилокси-2-бромбензола (2,5 г, 9,50 ммоль) в ТГФ (30 мл) при -78°C и смесь перемешивали при указанной температуре в течение 30 минут. К этому раствору добавляли по каплям при -78°C раствор 3-фтор-4-метоксибензальдегид (1,32 г, 8,56 ммоль) в ТГФ (8 мл). Смесь перемешивали при указанной температуре в течение одного часа, затем к полученной смеси добавляли насыщенный водный раствор хлорида аммония, смесь экстрагировали этилацетатом, органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5)] с получением указанного в заголовке соединения (2,79 г, 96%).
1H-NMR (CDCl3) δ: 2,92 (1H, д, J=5,8 Гц), 3,87 (3H, с), 5,03 (2H, с), 5,98 (1H, д, J=6,0 Гц), 6,85-7,10 (5H, м), 7,21-7,35 (7H, м)
(2) Синтез 2-(3-фтор-4-метоксибензил)фенола
К раствору (2-бензилоксифенил)-(3-фтор-4-метоксифенил)-метанола (1,50 г, 4,43 ммоль) в метаноле (29 мл) добавляли катализатор 20% гидроксид палладия (150 мг), затем к полученной смеси добавляли 2 н. раствор HCl (2 мл). Смесь перемешивали в атмосфере водорода в течение 15 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5)] с получением указанного в заголовке соединения (0,95 г, 92%).
1H-NMR (CDCl3) δ: 3,85 (3H, с), 3,91 (2H, с), 4,69 (1H, ушир.с), 6,77 (1H, дд, J=1,1, 8,O Гц), 6,84-6,97 (4H, м), 7,09-7,16 (2H, м)
(3) Синтез [2-(3-фтор-4-метоксибензил)фенил]-5a-карба-β-D-глюкопиранозида
В потоке азота к раствору 2-(3-фтор-4-метоксибензил)фенола (323 мг, 1,39 ммоль) в толуоле (3 мл) добавляли при охлаждении льдом 2,3,4,6-тетра-О-бензил-5a-карба-α-D-глюкопиранозу (500 мг, 0,93 ммоль) и трибутилфосфин (0,35 мл, 1,39 ммоль) и к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (TMAD, 242 мг, 1,40 ммоль). Реакционную смесь перемешивали в течение 40,5 часов, при этом постепенно повышая ее температуру до комнатной температуры. Реакционную смесь обрабатывали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:6)]. Полученный неочищенный продукт растворяли в смеси растворителей метанол-ТГФ (1:2) (6 мл), к полученной смеси добавляли катализатор 20% гидроксид палладия (65 мг) и смесь перемешивали в атмосфере водорода в течение двух часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид:метанол (10:1)] с получением указанного в заголовке соединения (78 мг, 21%).
1H-NMR (CD3OD) δ: 0,85-1,05 (1H, м), 1,40-1,65 (1H, м), 1,95-2,15 (1H, м), 3,35-3,60 (2H, м), 3,60-4,00 (3H, м), 3,81 (3H, с), 4,05-4,25 (1H, м), 6,70-7,20 (7H, м)
MS (ESI+): 392 [M]+
Время удерживания ВЭЖХ: 10,7 минут
Пример 42
[4-(4-Циклопропилбензил)пиридин-3-ил]-5a-карба-β-D-глюкопиранозид
(1) Синтез 3-(2-триметилсилилэтоксиметокси)пиридина
Гидрид натрия (3,85 г, 96,3 ммоль) промывали гексаном и к полученной смеси добавляли диметоксиэтан (90 мл). К полученной смеси при охлаждении льдом добавляли в течение 10 минут 3-гидроксипиридин (4,97 г, 52,3 ммоль) и реакционную смесь перемешивали в течение 10 минут, затем к полученной смеси добавляли при охлаждении льдом в течение 25 минут 2-(триметилсилил)этоксиметилхлорид (10,0 мл, 56,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 14,5 часов. К реакционной смеси при охлаждении льдом добавляли воду, смесь экстрагировали простым эфиром и органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной флэш-хроматографией на силикагеле [элюент=н-гексан:этилацетат (3:1)] с получением указанного в заголовке продукта (10,8 г, 92%).
1H-NMR (CDCl3) δ: 0,00 (9H, с), 0,93-0,98 (2H, м), 3,73-3,79 (2H, м), 5,24 (2H, с), 7,18-7,23 (1H, м), 7,34-7,38 (1H, м), 8,25 (1H, дд, J=4,7, 1,4 Гц), 8,40 (1H, дд, J=3,0, 0,6 Гц)
(2) Синтез (4-циклопропилфенил)-[3-(2-триметил-силилэтоксиметокси)пиридин-4-ил]метанола
В потоке азота раствор трет-бутиллития в н-пентане (1,47 M, 6,20 ммоль) добавляли по каплям к раствору 3-(2-триметилсилилэтоксиметокси)пиридина (1,77 г, 7,85 ммоль) в безводном ТГФ (31 мл) при -78°C в течение 25 минут. Смесь перемешивали при -70°C в течение одного часа, затем к полученной смеси добавляли в течение 25 минут раствор 4-циклопропилбензальдегида (1,49 г, 10,19 ммоль) в простом эфире (10 мл) и реакционную смесь перемешивали при -70°C в течение двух часов и при комнатной температуре в течение двух часов. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония, смесь экстрагировали простым эфиром и органический слой сушили над безводным сульфатом магния. После фильтрации растворитель отгоняли при пониженном давлении и полученный остаток очищали при помощи колоночной флэш-хроматографии на силикагеле [элюент=н-гексан:этилацетат (2:1)] с получением указанного в заголовке продукта (2,17 г, 74%).
1H-NMR (CDCl3) δ: -0,04 (9H, с), 0,61-0,66 (2H, м), 0,84-0,96 (4H, м), 1,79-1,90 (1H, м), 3,48-3,59 (2H, м), 5,13 (2H, дд, J=22,8, 6,9 Гц), 6,00 (1H, с), 6,97-6,99 (2H, м), 7,20-7,23 (2H, м), 7,48 (1H, д, J=4,9 Гц), 8,18 (1H, д, J=4,9 Гц), 8,27 (1H, с)
(3) Синтез (4-циклопропилфенил)-[3-(2-триметилсилил-этоксиметокси)пиридин-4-ил]метанона
В потоке азота периодинан Десса-Мартина (2,71 г, 6,39 ммоль) добавляли к раствору (4-циклопропилфенил)-[3-(2-триметилсилилэтоксиметокси)пиридин-4-ил]метанола (2,17 г, 5,84 ммоль) в метиленхлориде (31 мл) и реакционную смесь перемешивали при комнатной температуре в течение 1,5 часов. Затем к реакционной смеси добавляли периодинан Десса-Мартина (0,27 г, 0,64 ммоль) и полученную смесь перемешивали в течение 1,5 часов. Нерастворимые вещества отфильтровывали и фильтрат промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором хлорида натрия и сушили над безводным сульфатом магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи хроматографии с силикагелем для разделения амина [элюент=этилацетат:н-гексан (1:1)] с получением указанного в заголовке продукта (1,96 г, 91%),
1H-NMR (CDCl3) δ: -0,04 (9H, с), 0,76-0,90 (4H, м), 1,05-1,12 (2H, м), 1,92-1,98 (1H, м), 3,56-3,62 (2H, м), 5,17 (2H, с), 7,09-7,13 (2H, м), 7,19-7,21 (1H, м), 7,67-7,71 (2H, м), 8,40 (1H, д, J=4,67 Гц), 8,65 (1H, с)
(4) Синтез (4-циклопропилфенил)-(3-гидроксипиридин-4-ил)метанона
Моногидрат п-толуолсульфоновой кислоты (3,03 г, 15,9 ммоль) добавляли к раствору (4-циклопропилфенил)-[3-(2-триметилсилилэтоксиметокси)пиридин-4-ил]метанона (1,96 г, 5,30 ммоль) в ТГФ (49 мл) и полученный смешанный раствор перемешивали при 65°C в течение одного часа. Реакционную смесь охлаждали до комнатной температуры, добавляли насыщенный водный раствор гидрокарбоната натрия, смесь экстрагировали простым эфиром и органический слой сушили над безводным сульфатом магния. После фильтрации растворитель отгоняли при пониженном давлении и полученный остаток очищали при помощи колоночной флэш-хроматографией на силикагеле [элюент=н-гексан:этилацетат (2:3)] с получением указанного в заголовке продукта (1,10 г, 87%).
1H-NMR (CDCl3) δ: 0,80-0,86 (2H, м), 1,09-1,16 (2H, м), 1,97-2,03 (1H, м), 7,18-7,22 (2H, м), 7,42 (1H, дд, J=5,2, 0,6 Гц), 7,63-7,68 (2H, м), 8,24 (1H, д, J=5,2 Гц), 8,59 (1H, д, J=0,6 Гц), 11,15 (1H, с)
(5) Синтез (4-циклопропилфенил)-[3-((1R,2S,3S,4R,5R)-2,3,4-трисбензилокси-5-бензилоксиметилциклогексилокси)пиридин-4-ил]метанона
В потоке азота диизопропилазодикарбоксилат (0,14 мл, 0,72 ммоль) медленно добавляли по каплям к смеси (4-циклопропилфенил)-(3-гидроксипиридин-4-ил)метанона (0,18 г, 0,74 ммоль), (1S,2S,3S,4R,5R)-2,3,4-трисбензилокси-5-бензилоксиметилциклогексанола (0,20 г, 0,37 ммоль), трифенилфосфина (0,19 г, 0,74 ммоль) и толуола (1,3 мл) при охлаждении льдом. Реакционную смесь перемешивали при комнатной температуре в течение трех часов, затем растворитель отгоняли при пониженном давлении и полученный остаток очищали при помощи колоночной флэш-хроматографией на силикагеле [элюент=н-гексан:этилацетат (2:3)] с получением указанного в заголовке продукта (0,20 г, 71%).
1H-NMR (CDCl3) δ: 0,67-0,73 (2H, м), 1,00-1,06 (2H, м), 1,39-1,47 (1H, м), 1,81-1,88 (1H, м), 2,09-2,16 (1H, м), 3,37-3,58 (5H, м), 4,36-4,51 (6H, м), 4,76-4,86 (3H, м), 6,98-7,07 (4H, м), 7,13-7,35 (19H, м), 7,62-7,66 (2H, м), 8,34 (1H, д, J=4,9 Гц), 8,54 (1H, с)
(6) Синтез (4-циклопропилфенил)-[3-((1R,2S,3S,4R,5R)-2,3,4-трисбензилокси-5-бензилоксиметилциклогексилокси)пиридин-4-ил]метанола
Борогидрид натрия (40 мг, 1,06 ммоль) добавляли к раствору (4-циклопропилфенил)-[3-((1R,2S,3S,4R,5R)-2,3,4-трисбензилокси-5-бензилоксиметилциклогексилокси)пиридин-4-ил]метанона (0,20 г, 0,26 ммоль) в ТГФ (1,37 мл) и воде (0,67 мл) при охлаждении льдом и реакционную смесь перемешивали при комнатной температуре в течение 14,5 часов. К реакционной смеси добавляли ТГФ, затем добавляли при охлаждении льдом концентрированную серную кислоту (0,2 мл) и реакционную смесь перемешивали в течение 10 минут. К полученной реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь перемешивали при комнатной температуре в течение 10 минут. Полученную смесь экстрагировали этилацетатом и органический слой сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (3:2)] с получением указанного в заголовке продукта (0,20 г, 100%) в виде диастереомерной смеси.
1H-NMR (CDCl3) δ: 0,47-0,53 (1H, м), 0,58-0,63 (1H, м), 0,80-0,92 (2H, м), 1,09-1,27 (2H, м), 1,68-1,84 (2H, м), 3,32-3,64 (5H, м), 4,34-4,53 (4H, м), 4,70-4,88 (5H, м), 5,84 (0,5H, с), 5,96 (0,5H, с), 6,85-6,97 (3H, м), 7,05-7,35 (21H, м), 7,43-7,48 (1H, м), 8,20-8,24 (2H, м)
MS (ESI+): 762 [M+H]+
(7) Синтез 4-[хлор-(4-циклопропилфенил)метил-3-((1R,2S,3S,4R,5R)-2,3,4-трисбензилокси-5-бензилоксиметил-циклогексилокси)пиридина
В потоке азота тионилхлорид (0,05 мл, 0,68 ммоль) добавляли к раствору (4-циклопропилфенил)-[3-((1R,2S,3S,4R,5R)-2,3,4-трисбензилокси-5-бензилоксиметилциклогексилокси)пиридин-4-ил]метанола (0,20 г, 0,26 ммоль) в метиленхлориде (3,0 мл) при охлаждении льдом и смесь перемешивали при комнатной температуре в течение двух часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, смесь экстрагировали метиленхлоридом и органический слой сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:1)] с получением указанного в заголовке продукта (0,20 г, 100%) в виде диастереомерной смеси.
1H-NMR (CDCl3) δ: 0,51-0,53 (1H, м), 0,61-0,64 (1H, м), 0,83-0,93 (2H, м), 1,10-1,18 (1H, м), 1,66-1,77 (3H, м), 2,15-2,27 (1H, м), 3,30-3,66 (5H, м), 4,38-4,55 (4H, м), 4,83-4,91 (4H, м), 6,23 (0,5H, с), 6,39 (0,5H, с), 6,85-6,96 (3H, м), 7,11-7,33 (21H, м), 7,54-7,58 (1H, м), 8,26-8,42 (2H, м)
MS (ESI+): 780 [M+H]+
(8) Синтез 4-(4-циклопропилбензил)-3-((1R,2S,3S,4R,5R)-2,3,4-трисбензилокси-5-бензилоксиметилциклогексилокси)пиридина
В потоке азота к раствору 4-[хлор-(4-циклопропилфенил)-метил]-3-((1R,2S,3S,4R,5R)-2,3,4-трисбензилокси-5-бензилоксиметилциклогексилокси)пиридина (0,22 г, 0,28 ммоль) в метиленхлориде (4,1 мл) и уксусной кислоте (12,4 мл) добавляли цинк (0,14 г, 2,14 ммоль) и полученный смешанный раствор перемешивали при комнатной температуре в течение 14 часов. К реакционной смеси добавляли этилацетат и смесь промывали насыщенным водным раствором гидрокарбоната и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:1)] с получением указанного в заголовке продукта (0,14 г, 67%).
1H-NMR (CDCl3) δ: 0,57-0,62 (2H, м), 0,86-0,92 (2H, м), 1,51-1,59 (1H, м), 1,70-1,85 (2H, м), 2,08-2,15 (1H, м), 3,44 (1H, дд, J=9,1, 2,5 Гц), 3,53-3,70 (4H, м), 3,87 (2H, д, J=1,6 Гц), 4,42-4,54 (4H, м), 4,71 (2H, дд, J=17,6, 10,7 Гц), 4,83-4,93 (3H, м), 6,90-7,34 (25H, м), 8,11 (1H, д, J=4,7 Гц), 8,35 (1H, с)
(9) Синтез [4-(4-циклопропилбензил)пиридин-3-ил]-5a-карба-β-D-глюкопиранозида
В потоке азота пентаметилбензол (0,40 г, 2,70 ммоль) и раствор трихлорида бора в метиленхлориде (1,0 M, 1,00 мл, 1,00 ммоль) добавляли к раствору 4-(4-циклопропилфенил)-[3-((1R,2S,3S,4R,5R)-2,3,4-трисбензилокси-5-бензилоксиметилциклогексилокси)пиридина (136 мг 0,18 ммоль) в метиленхлориде (7,1 мл) при -78°C и смесь перемешивали при -78°C в течение 3,5 часов. К реакционной смеси добавляли метанол (1,7 мл), затем к полученной смеси добавляли раствор метоксида натрия в метаноле (1,0 M, 4 мл) и реакционную смесь перемешивали при комнатной температуре в течение 10 минут. Нерастворимые вещества отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид:метанол (5:1)] с получением указанного в заголовке продукта (66 мг, 95%).
1H-NMR (CD3OD) δ: 0,60-0,65 (2H, м), 0,88-0,95 (2H, м), 1,06-1,19 (1H, м), 1,56-1,61 (1H, м), 1,81-1,88 (1H, м), 2,05-2,12 (1H, м), 3,20-3,27 (2H, м), 3,47-3,55 (2H, м), 3,72 (1H, дд, J=10,7, 3,8 Гц), 3,90-4,03 (2H, м), 4,28-4,36 (1H, м), 6,97 (2H, тд, J=8,2, 1,9 Гц), 7,07-7,10 (3H, м), 8,00 (1H, д, J=4,7 Гц), 8,30 (1H, с)
MS (ESI+): 386 [M+H]+
Время удерживания ВЭЖХ: 8,40 минут
Пример 43
[2-(4-Карбоксибензил)фенил]-5a-карба-β-D-глюкопиранозид
К раствору в метаноле-ТГФ (10 мл-5 мл) [2-(4-метоксикарбонилбензил)фенил]-5a-карба-β-D-глюкопиранозида (72,0 мг, 0,1 ммоль), полученного в Примере 31, добавляли катализатор 20% гидроксид палладия (7,2 мг). Смесь перемешивали в атмосфере водорода в течение 15 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении с получением указанного в заголовке соединения (38,2 мг, 100%).
1H-NMR (CD3OD) δ: 0,86-1,00 (1H, м), 1,51-1,58 (1H, м), 2,01-2,11 (1H, м), 3,16-3,34 (2H, м), 3,43-3,50 (2H, м), 3,67-3,73 (1H, м), 3,95-4,88 (3H, м), 6,87 (1H, т, J=13,5 Гц), 7,03 (1H, д, J=7,4 Гц), 7,12-7,21 (2H, м), 7,30 (2H, д, J=8,1 Гц), 7,88 (2H, д, J=8,1 Гц)
MS (ESI+): 389 [M+H]+
Время удерживания ВЭЖХ: 10,6 минут
Пример 44
[2-(4-Винилбензил)фенил]-5a-карба-β-D-глюкопиранозид
(1) Синтез 2-(4-бромбензил)фенола
В потоке азота диметилсульфид (1,83 мл, 42,46 ммоль) и комплекс трифторид бора-диэтиловый эфир (0,9 мл, 7,07 ммоль) добавляли к раствору 1-бензилокси-2-(4-бромбензил)бензола (1,0 г, 2,83 ммоль) в метиленхлориде (30,0 мл) при охлаждении льдом. Реакционную смесь перемешивали в течение 19 часов, при этом постепенно повышая ее температуру до комнатной температуры, затем к полученной смеси при охлаждении льдом добавляли воду и смесь экстрагировали метиленхлоридом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5)] с получением указанного в заголовке соединения (527 мг, 70,8%).
1H-NMR (CDCl3) δ: 3,92 (2H, с), 4,62 (1H, с), 6,73-6,76 (1H, м), 6,85-6,99 (1H, м), 7,06-7,14 (4H, м), 7,35-7,40 (2H, м)
(2) Синтез (1S,2R,3S,4R,5R)-трисбензилокси-5-(бензилоксиметил)циклогексилового эфира трифторметансульфоновой кислоты
Пиридин (205 мкл, 2,53 ммоль) добавляли к раствору (1S,2R,3S,4R,5R)-трис-бензилокси-5-(бензилоксиметил)-циклогексанола (300 мг, 0,557 ммоль) в метиленхлориде (5,5 мл) и смесь охлаждали до 0°C, затем к полученной смеси добавляли ангидрид трифторметансульфоновой кислоты (210 мкл, 1,25 ммоль). Реакционную смесь перемешивали при указанной температуре в течение одного часа, затем к полученной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали метиленхлоридом. Объединенный органический слой промывали насыщенным водным раствором бисульфата калия и насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. Растворитель отгоняли с получением неочищенного продукта (380 мг).
1H-NMR (CDCl3) δ: 1,83 (1H, дд, J=15,9, 14,0 Гц), 2,00-2,14 (2H, м), 3,39 (1H, дд, J=9,2, 2,3 Гц), 3,50 (1H, дд, J=9,6, 2,6 Гц), 3,56 (1H, дд, J=10,2, 9,3 Гц), 3,75 (1H, дд, J=9,2, 3,4 Гц), 3,86 (1H, дд, J=9,5, 9,3 Гц), 4,40 (2H, с), 4,50 (1H, д, J=10,8 Гц), 4,62 (1H, д, J=11,4 Гц), 4,79 (1H, дд, J=10,7 Гц), 4,82 (1H, д, J=11,5 Гц), 4,89 (1H, д, J=10,7 Гц), 4,92 (1H, д, J=10,7 Гц), 5,33 (1H, ушир.), 7,15-7,30 (20H, м)
(3) Синтез [2-(4-бромбензил)фенил]-5a-карба-β-D-глюкопиранозида
В потоке азота раствор 1-бензилокси-2-(4-бромбензил)бензола (386 мг, 1,46 ммоль) в ДМФА (1 мл) охлаждали на ледяной бане к полученной смеси добавляли и NaH (60%, 52 мг). Реакционную смесь перемешивали при указанной температуре в течение 10 минут, а затем эту реакционную смесь добавляли по каплям к суспензии (1S,2R,3S,4R,5R)-трисбензилокси-5-(бензилоксиметил)циклогексилового эфира трифторметансульфоновой кислоты (655 мг, 0,97 ммоль) в ДМФА (2,5 мл) при -40°C. Реакционную смесь перемешивали при указанной температуре в течение двух минут, при температуре от -40°C до 0°C в течение 30 минут, а затем при 0°C в течение одного часа. К реакционной смеси добавляли насыщенный водный раствор хлорида натрия и воду. Полученный раствор экстрагировали простым эфиром, органический слой промывали водой и насыщенным водным раствором хлорида натрия и сушили над сульфатом натрия. Остаток, полученный путем отгонки растворителя, подвергали грубой очистке при помощи колоночной хроматографии на силикагеле [элюент=этилацетат:н-гексан (1:5)] с получением неочищенного продукта (200 мг). Полученный неочищенный продукт растворяли в метиленхлориде (2,5 мл) в потоке азота. К полученной смеси добавляли при охлаждении льдом диметилсульфид (0,6 мл, 13,48 ммоль) и комплекс трифторид бора-диэтиловый эфир (284 мкл, 2,2 ммоль). Реакционную смесь перемешивали в течение 25 часов, при этом постепенно повышая ее температуру до комнатной температуры, затем к полученной смеси добавляли воду при охлаждении льдом и смесь экстрагировали метиленхлоридом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид:метанол (10:1)] с получением указанного в заголовке продукта (40,0 мг, 42,9%).
1H-NMR (CD3OD) δ: 0,85 (1H, кв., J=13,2, J=l1,1 Гц), 1,44-1,59 (1H, м), 2,03-2,09 (1H, м), 3,13 (1H, д, J=8,7 Гц), 3,19 (1H, д, J=5,1 Гц), 3,23-3,26 (2H, м), 3,37-3,45 (2H, м), 3,63-3,68 (1H, дд, J=10,6, 3,9 Гц), 3,81 (1H, д, J=14,4 Гц), 4,10 (1H, д, J=14,4 Гц), 4,09-4,18 (1H, м), 6,79 (1H, т, J=7,5 Гц), 6,96 (1H, д, J=9,0 Гц), 7,03-7,13 (4H, м), 7,27-7,32 (2H, м)
(4) Синтез [2-(4-винилбензил)фенил]-5a-карба-β-D-глюкопиранозида
В потоке азота [2-(4-бромбензил)фенил]-5a-карба-β-D-глюкопиранозид (40 мг, 0,094 ммоль) растворяли в толуоле (2 мл) и к полученной смеси добавляли трибутилвинилолово (36 мг, 0,11 ммоль), тетракис(трифенилфосфин)палладий (0) (2,7 мг) и 2,6-ди-трет-бутил-4-метилфенол и смесь кипятили с обратным холодильником при 110°C в течение 15 часов. Реакционную смесь охлаждали до комнатной температуры и растворитель отгоняли при пониженном давлении. Полученный остаток очищали при помощи препаративной ТСХ [элюент=метанол:метиленхлорид (1:10)] с получением указанного в заголовке продукта (9 мг, 25,7%).
1H-NMR (CD3OD) δ: 0,86 (1H, кв., J=12,0, 11,7), 1,42-1,55 (1H, м), 1,96-2,03 (1H, м), 3,10-3,19 (2H, м), 3,22-3,25 (2H, м), 3,36-3,44 (2H, м), 3,63 (1H, дд, J=10,6, 4,1 Гц), 3,81-4,08 (2H, м), 4,09-4,16 (1H, м), 5,07 (1H, дд, J=11,0, 1,2 Гц), 5,63 (1H, дд, J=18,0, 1,2 Гц), 6,61 (1H, дд, J=18,0, 11,0 Гц), 6,78 (1H, т, J=7,3 Гц), 7,03 (1H, д, J=6,3 Гц), 7,02-7,24 (6H, м)
MS (ESI+): 370 [M]+
Время удерживания ВЭЖХ: 11,8 минут
Пример 45
{2-[4-(2,2-Дифторвинил)бензил]фенил}-5a-карба-β-D-глюкопиранозид
(1) Синтез 1-диэтоксиметил-4-(2,2-дифторвинил)бензола
В потоке азота раствор н-бутиллития в гексане (2,44 M, 9,94 мл) добавляли по каплям к диизопропиламину (3,40 мл, 24,2 ммоль), охлажденному на ледяной бане, затем к полученной смеси добавляли ТГФ (20 мл). Полученную смесь охлаждали до -78°C и к полученной смеси добавляли по каплям диэтил(дифторметил)фосфонат (3,62 мл, 23,1 ммоль). Реакционную смесь перемешивали при указанной температуре в течение пяти минут, затем к полученной смеси добавляли по каплям терефталальдегид монодиэтилацеталь (4,2 мл, 21,0 ммоль). Реакционную смесь перемешивали при указанной температуре в течение 50 минут, при комнатной температуре в течение 20 минут и при температуре 70-75°C в течение 34 часов. После охлаждения реакционной смеси к реакционной смеси добавляли насыщенный водный раствор хлорида аммония и воду и полученную смесь экстрагировали простым эфиром. Органический слой промывали насыщенным водным раствором хлорида аммония и сушили над сульфатом натрия. Остаток, полученный путем отгонки растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:20)] с получением указанного в заголовке соединения (1,10 г, 22%).
1H-NMR (CDCl3) δ: 1,24 (6H, т, J=7,1 Гц), 3,45-3,68 (4H, м), 5,27 (1H, дд, J=26,4, 3,8 Гц), 5,49 (1H, с), 7,32 (2H, д, J=8,4 Гц), 7,44 (2H, д, J=8,4 Гц)
(2) Синтез 4-(2,2-дифторвинил)бензальдегида
В потоке азота водный раствор 2 M хлористоводородной кислоты (2,5 мл) добавляли к раствору 1-диэтоксиметил-4-(2,2-дифторвинил)бензола (998,1 мг, 4,12 ммоль) в простом эфире (4 мл), охлажденному на ледяной бане, и реакционную смесь перемешивали при указанной температуре в течение трех минут и при комнатной температуре в течение 3,75 часа. Реакционную смесь экстрагировали простым эфиром и органический слой промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия и сушили над сульфатом натрия. Растворитель отгоняли при пониженном давлении с получением неочищенного соединения.
1H-NMR (CDCl3) δ: 5,37 (1H, дд, J=25,7, 3,5 Гц), 7,49 (2H, д, J=8,4 Гц), 7,85 (2H, д, J=8,4 Гц), 9,98 (1H, с)
(3) Синтез (2-бензилоксифенил)-[4-(2,2-дифторвинил)фенил]метанола
В потоке азота раствор 2-бензилоксибромбензола (1,63 г, 6,18 ммоль) в ТГФ (4 мл) охлаждали до -78°C и к полученной смеси добавляли по каплям раствор н-бутиллития в гексане (2,44 М, 2,66 мл). Реакционную смесь перемешивали при указанной температуре в течение 25 минут, затем к полученной смеси добавляли по каплям раствор полученного ранее 4-(2,2-дифторвинил)бензальдегида в ТГФ (1 мл). Реакционную смесь перемешивали при указанной температуре в течение 1,25 часа, затем к полученной смеси добавляли насыщенный водный раствор хлорида аммония и воду. Полученную смесь экстрагировали простым эфиром и органический слой промывали насыщенным водным раствором хлорида аммония и сушили над сульфатом натрия. Остаток, полученный путем отгонки растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5)] с получением указанного в заголовке соединения (1,17 г, 81%).
1H-NMR (CDCl3) δ: 2,94 (1H, д, J=6,1 Гц), 4,98-5,04 (2H, м), 5,26 (1H, дд, J=26,4, 3,8 Гц), 6,03 (1H, д, J=6,1 Гц), 6,88-7,04 (2H, м), 7,14-7,38 (11H, м)
(4) Синтез 1-бензилокси-2-[4-(2,2-дифторвинил)-бензил]бензола
В потоке азота раствор (2-бензилоксифенил)-[4-(2,2-фторвинил)фенил]метанола (1,14 г, 3,24 ммоль) в метиленхлориде (10 мл) охлаждали до -78°C и к полученной смеси добавляли триэтилсилан (5,17 мл, 32,35 ммоль). К реакционной смеси добавляли по каплям в течение пяти минут комплекс трифторид бора-диэтиловый эфир (0,49 мл, 3,88 ммоль) и реакционную смесь перемешивали при -78°C в течение пяти минут, а затем при охлаждении льдом в течение 10 минут. К полученной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и воду и полученный раствор экстрагировали метиленхлоридом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом натрия. Остаток, полученный путем отгонки растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:30)] с получением указанного в заголовке соединения (984,5 мг, 90%).
1H-NMR (CDCl3) δ: 4,00 (2H, с), 5,05 (2H, с), 5,23 (1H, дд, 3=26,2, 3,8 Гц), 6,85-6,95 (2H, м), 7,05-7,40 (11H, м)
(5) Синтез 2-[4-(2,2-дифторвинил)бензил]фенола
В потоке азота раствор 1-бензилокси-2-[4-(2,2-дифторвинил)бензил]бензола (984,5 мг, 2,93 ммоль) в метиленхлориде (12 мл) охлаждали до -78°C и к полученной смеси добавляли по каплям раствор трибромида бора-диметилсульфида в метиленхлориде (1,0 M, 7,32 мл). Реакционную смесь перемешивали при указанной температуре в течение двух минут и при охлаждении льдом в течение двух часов, затем к полученной смеси добавляли по каплям раствор трифторида бора-диметилсульфида в метиленхлориде (4,39 мл). Реакционную смесь перемешивали при указанной температуре в течение 3,5 часов, затем к полученной смеси добавляли водный раствор гидроксида натрия и насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали метиленхлоридом, органический слой промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом натрия. Остаток, полученный путем отгонки растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:7)] с получением указанного в заголовке соединения (647,5 мг 90%).
1H-NMR (CDCl3) δ: 3,98 (2H, с), 4,62 (1H, с), 5,24 (1H, дд, J=26,2, 3,8 Гц), 6,78 (1H, д, J=8,1 Гц), 6,84-6,94 (1H, м), 7,04-7,32 (6H, м)
(6) Синтез {2-[4-(2,2-дифторвинил)бензил]фенил}-5a-карба-β-D-глюкопиранозида
В потоке азота раствор 2-[4-(2,2-дифторвинил)бензил]фенола (80 мг, 0,324 ммоль) в ДМФА (1 мл) охлаждали на ледяной бане и к полученной смеси добавляли NaH (60%, 13 мг). Реакционную смесь перемешивали при указанной температуре в течение 10 минут, а затем эту реакционную смесь добавляли по каплям к суспензии (1S,2R,3S,4R,5R)-трисбензилокси-5-(бензилокси-метил)циклогексилового эфира трифторметансульфоновой кислоты (181 мг, 0,270 ммоль) в ДМФА (2,5 мл) при -40°C. Реакционную смесь перемешивали при указанной температуре в течение двух минут, при температуре от -40°C до 0°C в течение 30 минут и при 0°С в течение одного часа. К реакционной смеси добавляли насыщенный водный раствор хлорида натрия и воду и смесь экстрагировали простым эфиром, органический слой промывали водой и насыщенным водным раствором хлорида натрия и сушили над сульфатом натрия. Остаток, полученный путем отгонки растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:7)] с получением целевого продукта (180,7 мг). В потоке азота 65 мг (0,0848 ммоль) этого продукта смешивали с пентаметилбензолом (188 мг, 1,27 ммоль) в потоке азота и растворяли в метиленхлориде (2,5 мл). После охлаждения раствора полученной смеси до -78°C к полученной смеси добавляли по каплям раствор трихлорида бора в метиленхлориде (1,0 M, 0,42 мл). Реакционную смесь перемешивали при указанной температуре в течение 2,25 часов, затем к полученной смеси добавляли по каплям метанол (0,5 мл). При указанной температуре добавляли по каплям раствор метоксида натрия в метаноле (1 M, 1,26 мл) и реакционную смесь перемешивали при комнатной температуре в течение 15 минут. Смесь фильтровали и фильтрат концентрировали при пониженном давлении и полученный остаток очищали препаративной ТСХ [элюент=метанол:метиленхлорид (1:10)] с получением указанного в заголовке продукта (22,1 мг, 64%).
1H-NMR (CD3OD) δ: 0,82-1,04 (1Н, м), 1,44-1,64 (1H, м), 1,98-2,12 (1H, м), 3,12-3,28 (2H, м), 3,40-3,54 (2H, м), 3,69 (1H, дд, J=10,7, 4,0 Гц), 3,89 (1H, д, J=14,8 Гц), 4,02 (1H, д, J=14,8 Гц), 4,10-4,26 (1H, м), 5,40 (1H, дд, J=27,0, 4,0 Гц), 6,78-6,90 (1H, м), 6,96-7,30 (7H, м)
MS (ESI+): 406 [M]+
Время удерживания ВЭЖХ: 18,51 минут
Условия измерения для ВЭЖХ
Колонка: YMC-Pack ODS-A 6,0х150 мм, 5 мкм
Подвижная фаза: элюирование с применением градиента от 10 мМ AcONH4/H2O (95%) плюс 10 мМ AcONH4/MeOH (5%) до 10 мМ AcONH4/MeOH (100%) в течение 20 минут, а затем в тех же условиях [10 мМ AcONH4/MeOH (100%)] в течение пяти минут
Скорость потока: 1,5 мл/минута
Температура колонки: комнатная температура
Условия детекции: весь участок всей длины волны от 230 до 400 нм
Примеры 46-58
Целевое соединение получали путем осуществления таких же действий, как указано в описанных выше Примерах, с использованием соответствующих исходных веществ и реагентов соответственно.
Пример 46
[2-(2,3-Дигидробензофуран-5-илметил)фенил]-5a-карба-β-D-глюкопиранозид
1H-NMR (CD3OD) δ: 0,93 (1H, кв., J=13,2 Гц, J=11,4 Гц), 1,49-1,58 (1H, м), 2,01-2,07 (1H, дт, J=13,2, 4,5 Гц), 3,12 (1H, т, J=8,4 Гц), 3,20 (1H, д, J=9,3 Гц), 3,25 (1H, д, J=4,8 Гц), 3,30-3,53 (2H, ra), 3,69 (1H, дд, J=6,6, 4,2 Гц), 3,85 (1H, д, J=15 Гц), 3,91 (1H, д, J=15 Гц), 4,13-4,21 (1H, м), 4,47 (2H, т, J=8,7 Гц), 6,59 (1H, д, J=8,4 Гц), 6,83 (1H, т, J=7,2 Гц), 6,89 (1H, д, J=8,1 Гц), 6,99-7,15 (4H, м)
MS (ESI+): 386 [M]+
Время удерживания ВЭЖХ: 10,5 минут
Пример 47
[2-(3-Фтор-4-метилбензил)фенил]-5a-карба-β-D-люкопиранозид
1H-NMR (CD3OD) δ: 0,99 (1H, кв., J=12,6 Гц), 1,48-1,59 (1H, м), 2,04-2,10 (1H, дт, J=13,2, 4,2 Гц), 2,18 (3H, с), 3,18-3,32 (2H, м), 3,44-3,51 (2H, м), 3,68 (1H, дд, J=6,9, 3,9 Гц), 3,89 (1H, д, J=15 Гц), 3,97 (1H, д, J=15 Гц), 4,14-4,22 (1H, м), 6,81-6,90 (3H, м), 7,00-7,17 (4H, м)
MS (ESI+): 376,4 [M]+
Время удерживания ВЭЖХ: 11,7 минут
Пример 48
[2-(4-Метокси-3-метилбензил)фенил]-5a-карба-β-D-глюкопиранозид
1H-NMR (CD3OD) δ: 0,94 (1H, кв., J=12,9, 11,7 Гц), 1,47-1,57 (1H, м), 2,01-2,08 (1H, дт, J=13,2, 4,2 Гц), 2,12 (3H, с), 3,18-3,34 (2H, м), 3,45-3,52 (2H, м), 3,68 (1H, дд, J=6,6, 4,2 Гц), 3,75 (3H, с), 3,84 (1H, д, J=14,7 Гц), 3,90 (1H, д, J=14,7 Гц), 4,14-4,21 (1H, м), 6,76 (1H, д, J=8,7 Гц), 6,83 (1H, т, J=7,5 Гц), 6,95-7,15 (5H, м)
MS (ESI+): 389 [M+H]+
Время удерживания ВЭЖХ: 11,5 минут
Пример 49
[2-(4-Пиразол-1-илбензил)фенил]-5a-карба-β-D-глюкопиранозид
1H-NMR (CD3OD) δ: 0,95 (1H, кв., J=12,9, 11,4 Гц), 1,49-1,59 (1H, м), 2,02-2,09 (1H, дт, J=12,3, 4,2 Гц), 3,20 (1H, д, J=9,0 Гц), 3,23 (1H, д, J=6,3 Гц), 3,43-3,53 (2H, м), 3,67 (1H, дд, J=6,6, 4,2 Гц), 3,98 (1H, д, J=14,7 Гц), 4,07 (1H, д, J=15 Гц), 4,16-4,24 (1Н, м), 6,49 (1H, с), 6,87 (1H, т, J=7,5 Гц), 7,05 (1H, д, J=8,1 Гц), 7,14 (2H, д, J=7,5 Гц), 7,35 (2H, д, J=8,4 Гц), 7,56 (2H, д, J=8,4 Гц), 7,68 (1H, с), 8,12 (1H, с)
MS (ESI+): 411 [M+H]+
Время удерживания ВЭЖХ: 10,5 минут
Пример 50
[2-(3-Хлор-4-метилбензил)фенил]-5a-карба-β-D-глюкопиранозид
1H-NMR (CD3OD) δ: 0,94 (1H, дд, J=24,4, 13,2 Гц), 1,5-1,65 (1H, м), 2,05 (1H, дт, J=13,5, 4,I Гц), 3,18-3,35 (2H, м), 3,43-3,55 (2H, м), 3,70 (1H, дд, J=10,7, 4,1 Гц), 3,82 (3H, с), 3,82 (1H, д, J=14,8 Гц), 3,97 (1H, д, J=14,8 Гц), 4,15-4,25 (1H, м), 6,86 (1H, тд, J=7,4, 1,1 Гц), 6,92 (1H, д, J=8,2 Гц), 7,0-7,2 (5H, м)
MS (ESI+): 409 [M+H]+, 431 [M+Na]+
Время удерживания ВЭЖХ: 11,25 минут
Пример 51
[2-(3,4-Метилендиоксибензил)фенил]-5a-карба-β-D-глюкопиранозид
1H-NMR (CD3OD) δ: 1,01 (1H, кв., J=12,7 Гц), 1,45-1,64 (1H, м), 2,04-2,13 (1H, м), 3,19-3,35 (4H, м), 3,46-3,54 (2H, м), 3,69-3,74 (1H, м), 3,89 (2H, кв., J=16,1 Гц), 4,15-4,22 (1H, м), 5,86 (2H, с), 6,68 (3H, с), 6,85 (1H, т,J=6,1 Гц), 7,00-7,18 (3H, м)
MS (ESI+): 389 [M+H]+
Время удерживания ВЭЖХ: 10,6 минут
Пример 52
[2-(4-Циклобутилбензил)фенил]-5a-карба-β-D-глюкопиранозид
1H-NMR (CD3OD) δ: 0,81-0,96 (1H, м), 1,45-1,61 (1H, м), 1,78-2,37 (7H, м), 3,15-3,34 (5H, м), 3,40-3,55 (2H, м), 3,66-4,76 (1Н, м), 3,95 (2H, кв., J=13,7 Гц), 4,13-4,24 (1H, м), 6,87 (1H, т, J=8,1 Гц), 6,97-7,17 (7H, м)
MS (ESI+): 425 [M+Na]+
Время удерживания ВЭЖХ: 13,6 минут
Пример 53
[2-(4-Ацетилбензил)фенил]-5a-карба-β-D-глюкопиранозид
1H-NMR (CD3OD) δ: 0,84-0,98 (1H, м), 1,50-1,56 (1H, м), 2,00-2,08 (1H, м), 2,55 (3H, с), 3,15-3,32 (3H, м), 3,42-3,50 (2H, м), 3,65-3,70 (1H, м), 3,94-4,24 (3H, м), 4,89 (2H, с), 6,86 (1H, т, J=7,3 Гц), 7,03 (1H, д, J=8,1 Гц), 7,12-7,20 (2H, м), 7,34 (2H, д, J=8,1 Гц), 7,86 (2H, д, J=8,1 Гц)
MS (ESI+): 386 [M+1]+
Время удерживания: 9,8 минут
Пример 54
[2-(4-Метоксибензил)-5-метилфенил]-5a-карба-β-D-глюкопиранозид
1H-NMR (CD3OD) δ: 0,92-1,06 (1Н, м), 1,51-1,66 (1H, м), 2,08 (1H, дт, J=13,2, 4,0 Гц), 2,32 (3H, с), 3,21-3,40 (2H, м), 3,47-3,56 (2H, м), 3,71-3,78 (1H, м), 3,77 (3H, с), 3,84 (1H, д, J=14,2 Гц), 3,95 (1H, д, J=14,2 Гц), 4,14-4,26 (1H, м), 6,68-6,72 (1H, м), 6,78-6,85 (2H, м), 6,86-6,91 (1H, м), 6,97 (1H, д, J=7,8 Гц), 7,10-7,16 (2H, м)
MS (ESI+): 388 [M]+
Время удерживания ВЭЖХ: 11,26 минут
Пример 55
[2-(4-Этилбензил)тиофен-3-ил]-5a-карба-β-D-глюкопиранозид
1H-NMR (CD3OD) δ: 1,20 (1H, т, J=7,6 Гц), 1,40-1,80 (1H, м), 2,04-2,09 (1H, м), 2,59 (2H, кв., J=7,58 Гц), 3,19-3,55 (5H, м), 3,88-3,96 (1Н, м), 3,99 (2H, м), 6,89 (2H, д, J=5,4 Гц), 7,06-7,15 (5H, м)
MS (ESI+): 378 [M]+
Время удерживания ВЭЖХ: 11,9 минут
Пример 56
[(Бензотиофен-2-ил)метилфенил]-5a-карба-β-D-глюкопиранозид
1H-NMR (CD3OD) δ: 1,04 (1H, м), 1,40-1,80 (1H, м), 2,08-2,16 (1H, м), 3,14-3,67 (5H, м), 4,14 (1H, д, J=15,7 Гц), 4,19-4,27 (1H, м), 4,36 (1H, д, J=15,5 Гц), 6,89 (1H, дд, J=8,1, 6,6 Гц), 7,02 (1H, с), 7,07 (1H, д, J=8,1 Гц), 7,17-7,28 (4H, м), 7,63 (1H, д, J=7,6 Гц), 7,71 (1H, д, J=7,6 Гц)
MS (ESI+): 400 [M]+
Время удерживания ВЭЖХ: 12,0 минут
Пример 57
{2-[1-(4-Циклопропилфенил)этил]фенил}-5a-карба-β-D-глюкопиранозид [менее полярный изомер, выделенный препаративной ТСХ (элюент:метанол:метиленхлорид= 1:10)]
1H-NMR (CD3OD) δ: 0,40 (1H, дд, J=9,3, 9,0 Гц), 0,56-0,66 (2H, м), 0,84-0,96 (2H, м), 1,36-1,54 (1H, м), 1,52 (3H, д, J=6,6 Гц), 1,76-1,88 (2H, м), 3,04-3,12 (1Н, дд, J=10,8, 9,9 Гц), 3,25 (1H, т, J=10,8 Гц), 3,26-3,40 (1H, м), 3,42 (1H, т, J=9,9 Гц), 3,64 (1H, дд, J=10,4, 4,8 Гц), 4,08-4,22 (1H, м), 4,50 (1H, дд, J=12,0, 6,3 Гц), 6,84-6,99 (4H, м), 6,99-7,06 (2H, м), 7,06-7,28 (1H, м), 7,20-7,26 (1H, м)
MS (ESI+): 399 [M+H]+
Время удерживания ВЭЖХ: 12,7 минут
Пример 58
{2-[1-(4-Циклопропилфенил)этил]фенил}-5a-карба-β-D-глюкопиранозид [более полярный изомер, выделенный препаративной ТСХ (элюент:метанол:метиленхлорид=1:10)]
1H-NMR (CD3OD) δ: 0,56-0,66 (2H, м), 0,84-0,96 (2H, м), 1,10 (1H, дд, J=9,6, 9,0 Гц), 1,44-1,64 (1H, м), 1,53 (3H, д, J=6,6 Гц), 1,76-1,88 (1H, м), 2,13 (1H, ддд, J=12,2, 4,5, 3,3 Гц), 3,20-3,28 (2H, м), 3,44 (1H, т, J=10,5 Гц), 3,53 (1H, дд, J=11,4, 6,6 Гц), 3,73 (1H, дд, J=11,4, 2,4 Гц), 4,06-4,22 (1H, м), 4,50 (1H, дд, J=12,0, 6,3 Гц), 6,82-7,03 (4H, м), 7,06-7,16 (4H, м)
MS (ESI+): 399 [M+H]+
Время удерживания ВЭЖХ: 12,7 минут
Пример 59
[2-(4-Циклопропилбензил)-5-метилтиофен-3-ил]-5a-карба-β-D-глюкопиранозид
(1) Синтез (4-циклопропилфенил)-(3-метокси-5-метилтиофен-2-ил)метанона
Метилиодид (2,53 мл, 40,6 ммоль) добавляли в атмосфере азота к раствору (4-циклопропилфенил)-(3-метокси-5-тиофен-2-ил)метанона (1,05 г, 4,06 ммоль), синтезированного таким же способом, как указано в Примере 38, в ТГФ (20 мл). Этот раствор охлаждали до -78°C и к полученной смеси добавляли в течение 20 минут раствор диизопропиламида лития в смеси гептан-ТГФ-этилбензол (2,0 M, 2,44 мл, 4,88 ммоль). Реакционную смесь перемешивали при указанной температуре в течение трех часов. К этому раствору затем добавляли в течение 20 минут раствор диизопропиламида лития в смеси гептан-ТГФ-этилбензол (2,0 M, 2,44 мл, 4,88 ммоль), реакционную смесь перемешивали в течение двух часов и к полученной смеси добавляли насыщенный раствор хлорида аммония. Полученную смесь экстрагировали этилацетатом и органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), а затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5)] с получением указанного в заголовке соединения (589 мг, 53%).
1H-NMR (CDCl3) δ: 0,74-0,80 (2H, м), 1,00-1,06 (2H, м), 1,91-1,97 (1H, м), 2,49 (3H, с), 3,81 (3H, с), 6,62 (1H, с), 7,08 (2H, д, J=7,9 Гц), 7,68 (2H, д, J=8,3 Гц)
(2) Синтез (4-циклопропилфенил)-(3-гидрокси-5-метилтиофен-2-ил)метанона
В потоке азота раствор трихлорида бора в метиленхлориде (1,0 M, 6,4 мл, 6,4 ммоль) добавляли к раствору (4-циклопропилфенил)-(3-метокси-5-метилтиофен-2-ил)метанона (582 мг, 2,14 ммоль) в метиленхлориде (12 мл) при -15°C и реакционную смесь перемешивали в течение одного часа. К полученной смеси добавляли воду и смесь экстрагировали метиленхлоридом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), а затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метанол:метиленхлорид (1:100)] с получением указанного в заголовке соединения (497 мг, 90%).
1H-NMR (CDCl3) δ: 0,76-0,82 (2H, м), 1,03-1,10 (2H, м), 1,93-1,98 (1H, м), 2,49 (3H, с), 6,57 (1H, с), 7,15 (2H, д, J=8,4 Гц), 7,85 (2H, д, J=8,4 Гц), 12,80 (1H, с)
(3) Синтез (4-циклопропилфенил)-[5-метил-3-((1R,2S,3S,4R,5R)-2,3,4-трисбензилокси-5-бензилоксиметилциклогексилокси)тиофен-2-ил]метанона
В потоке азота диизопропилазодикарбоксилат (0,27 мл, 1,39 ммоль) добавляли по каплям к смеси (4-циклопропилфенил)-(3-гидрокси-5-метилтиофен-2-ил)метанона (360 мг, 1,39 ммоль), (1S,2S,3S,4R,5R)-2,3,4-трисбензилокси-5-бензилоксиметилциклогексанола (500 мг, 0,93 ммоль), трифенилфосфина (365 мг, 1,39 ммоль) и толуола (3,1 мл) при охлаждении льдом. Смесь перемешивали при комнатной температуре в течение 15 часов, затем растворитель отгоняли при пониженном давлении и полученный остаток очищали при помощи колоночной флэш-хроматографией на силикагеле [элюент=н-гексан:этилацетат (4:1)] с получением указанного в заголовке соединения (237 мг, 33%).
1H-NMR (CDCl3) δ: 0,70-0,73 (2H, м), 0,99-1,02 (2H, м), 1,35-1,50 (1H, м), 1,64-1,72 (1H, м), 1,87-1,94 (1H, м), 2,07-2,14 (1H, м), 2,44 (3H, с), 3,36-3,56 (5H, м), 4,07-4,13 (1H, м), 4,33-4,88 (8H, м), 6,61 (1H, с), 7,01 (2H, д, J=7,9 Гц), 7,05-7,35 (22H, м), 7,62 (2H, д, J=8,2 Гц)
(4) Синтез 2-(4-циклопропилбензил)-5-метил-3-[(1R,2S,3S,4R,5R)-2,3,4-трисбензилокси-5-(бензилоксиметил)-циклогексилокси]тиофена
В потоке азота хлортриметилсилан (0,46 мл, 3,56 ммоль) и цианоборогидрид натрия (230 мг, 3,65 ммоль) добавляли к раствору (4-циклопропилфенил)-[5-метил-3-((1R,2S,3S,4R,5R)-2,3,4-трисбензилокси-5-бензилоксиметилциклогексилокси)тиофен-2-ил]метанона (237 мг, 0,30 ммоль) в ацетонитриле (5 мл) при охлаждении льдом и реакционную смесь перемешивали при 0°C в течение одного часа. К полученной смеси добавляли метиленхлорид, смесь подвергали фильтрованию через целит и растворитель фильтрата отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)] с получением указанного в заголовке соединения (135 мг, 58%).
1H-NMR (CDCl3) δ: 0,58-0,65 (2H, м), 0,86-0,94 (2H, м), 1,23-1,28 (1H, м), 1,57-1,65 (1H, м), 1,77-1,86 (1H, м), 2,06-2,12 (1H, м), 2,33 (3H, с), 3,43-3,65 (5H, м), 3,93 (2H, с), 3,98-4,08 (1H, м), 4,44 (2H, с), 4,51 (1H, д, J=10,8 Гц), 4,75-4,97 (5H, м), 6,55 (1H, с), 6,92 (2H, д, J=8,1 Гц), 7,10 (2H, д, J=8,1 Гц), 7,18-7,37 (20H, м)
(5) Синтез [2-(4-циклопропилбензил)-5-метилтиофен-3-ил]-5a-карба-β-D-глюкопиранозида
В потоке азота пентаметилбензол (390 мг, 2,63 ммоль) и раствор трихлорида бора в метиленхлориде (1,0 M, 0,88 мл, 0,88 ммоль) добавляли к раствору 2-(4-циклопропилбензил)-5-метил-3-[(1R,2S,3S,4R,5R)-2,3,4-трисбензилокси-5-(бензилоксиметил)-циклогексилокси]тиофена (134 мг, 0,18 ммоль) в метиленхлориде (6 мл) при -78°C и реакционную смесь перемешивали при -78°C в течение одного часа. К реакционной смеси добавляли метанол и растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид:этанол (20:1)] с получением указанного в заголовке соединения (35 мг, 49%).
1H-NMR (CD3OD) δ: 0,62-0,68 (2H, м), 0,90-0,97 (2H, м), 1,10-1,21 (1H, м), 1,43-1,56 (1H, м), 1,82-1,95 (1H, м), 2,03-2,11 (1H, м), 2,36 (3H, с), 3,25-3,90 (6H, м), 3,94 (2H, м), 6,63 (1H, м), 6,98 (2H, д, J=8,4 Гц), 7,11 (2H, д, J=7,9 Гц)
MS (ESI-): 403 [М-Н]-
Пример 60
[2-(4-Этилбензил)-5-метилтиофен-3-ил]-5a-карба-β-D-глюкопиранозид
Целевое соединение получали путем осуществления таких же действий, как указано в Примере 59, с использованием соответствующих исходных веществ и реагентов.
1H-NMR (CD3OD) δ: 1,10-1,22 (4H, м), 1,40-1,54 (1H, м), 2,02-2,09 (1H, м), 2,33 (3H, с), 2,58 (2H, д, J=7,6 Гц), 3,22-3,25 (2H, м), 3,28-3,35 (2H, м), 3,39-3,45 (1H, м), 3,52 (1H, дд, J=10,7, 6,2 Гц), 3,71 (1H, дд, J=10,7, 4,0 Гц), 3,83-3,90 (1H, м), 6,60 (1H, с), 7,06 (2H, д, J=8,2 Гц), 7,11 (2H, д, J=8,2 Гц)
MS (ESI+): 393 [M+H]+, 415 [M+Na]+
Пример 61
[5-Хлор-2-(4-циклопропилбензил)тиофен-3-ил]-5a-карба-β-D-глюкопиранозид
(1) Синтез 4-циклопропил-N-метокси-N-метилбензамида
В потоке азота раствор н-бутиллития в гексане (1,6 M, 6,0 мл, 9,59 ммоль) добавляли по каплям к раствору 1-бром-4-циклопропилбензола (1,8 г, 9,13 ммоль) в безводном ТГФ (30 мл) при -78° С в течение 15 минут. Этот раствор перемешивали при -78°C в течение 10 минут и к полученной смеси добавляли по каплям раствор N,N'-диметокси-N,N'-диметилмочевины (1,42 г, 9,59 ммоль) в ТГФ (15 мл). Реакционную смесь перемешивали при комнатной температуре в течение 30 минут. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония, смесь экстрагировали простым эфиром и органический слой сушили над безводным сульфатом магния. После фильтрации растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=н-гексан:этилацетат (4:1)] с получением указанного в заголовке соединения (875 мг, 95%).
1H-NMR (CDCl3) δ: 0,73-0,78 (2H, м), 0,97-1,03 (2H, м), 1,87-1,94 (1H, м), 3,34 (3H, с), 3,56 (3H, с), 7,08 (2H, д, J=8,3 Гц), 7,60 (2H, д, J=8,3 Гц)
(2) Синтез (5-хлор-3-метокситиофен-2-ил)-(4-циклопропилфенил)метанона
В потоке азота раствор н-бутиллития в н-гексане (1,6 M, 2,43 мл, 3,88 ммоль) добавляли по каплям к раствору 2-бром-5-хлор-3-метокситиофена (882 мг, 3,88 ммоль), синтезированного способом, описанным в документе [L. Org. Chem., 58, 4629-4633 (1993)], в безводном ТГФ (15 мл) при -78°C. Эту смесь перемешивали при -78°C в течение десяти минут и к полученной смеси добавляли по каплям раствор 4-циклопропил-N-метокси-N-метилбензамид (875 мг, 4,26 ммоль) в ТГФ (3 мл). Реакционную смесь перемешивали при -78°C в течение 30 минут. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония, полученную смесь экстрагировали этилацетатом и органический слой сушили над безводным сульфатом магния. После фильтрации растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=н-гексан:этилацетат (4:1)] с получением указанного в заголовке соединения (714 мг, 63%).
1H-NMR (CDCl3) δ: 0,75-0,81 (2H, м), 1,02-1,08 (2H, м), 1,92-1,98 (1H, м), 3,80 (3H, с), 6,78 (1H, с), 7,10 (2H, д, J=8,3 Гц), 7,68 (2H, д, J=8,3 Гц)
(3) Синтез [5-хлор-2-(4-циклопропилбензил)тиофен-3-ил]-5a-карба-β-D-глюкопиранозида
Целевое соединение получали путем осуществления таких же действий, как указано в Примере 59, с использованием синтезированного (5-хлор-3-метокситиофен-2-ил)-(4-цикло-пропилфенил)метанона и соответствующих реагентов.
1H-NMR (CD3OD) δ: 0,63-0,66 (2H, м), 0,88-0,93 (2H, м), 1,15-1,21 (1H, м), 1,61-1,67 (1H, м), 1,82-1,87 (1H, м), 1,99-2,03 (1H, м), 3,22-3,57 (4H, м), 3,70-3,74 (1H, м), 3,87-3,91 (1H, м), 3,92 (2H, с), 6,86 (1H, с), 6,97 (2H, д, J=8,1 Гц), 7,09 (2H, д, J=8,1 Гц)
MS (ESI+): 425 [M+H]+
Пример 62
(1R,2S,3R,6R)-6-[2-(4-циклопропилбензил)фенокси]-4-(гидроксиметил)циклогекс-4-ен-1,2,3-триол
(1) Синтез 1-(4-циклопропилфенил)метил-2-[(1R,4R,5S,6S)-4,5,6-трисбензилокси-3-(бензилоксиметил)циклогекс-2-енилокси]бензола
В потоке азота 2-(4-циклопропилбензил)фенол и трибутилфосфин (70 мкл, 0,28 ммоль) добавляли к раствору (1S,4R,5S,6S)-4,5,6-трис(бензилокси)-3-бензилоксиметил)циклогекс-2-eнола (51 мг, 0,095 ммоль), описанного в документе [J. Org. Chem., 63, 5668-5671 (1998)], в толуоле (300 мкл) при охлаждении льдом, затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (48 мг, 0,28 ммоль). Реакционную смесь перемешивали при указанной температуре в течение 20 часов, затем к полученной смеси добавляли гексан, осадок фильтровали и растворитель фильтрата отгоняли. Полученный остаток очищали препаративной ТСХ [элюент=этилацетат:н-гексан (1:5) с получением указанного в заголовке соединения (44 мг, 62%).
1H-NMR (CDCl3) δ: 0,54 (2H, м), 0,84 (2H, м), 1,75 (1H, м), 3,82-3,92 (3H, м), 3,93 (2H, с), 4,19 (1H, д, J=12,5 Гц), 4,35 (1H, ушир.), 4,41 (1H, д, J=11,7 Гц), 4,46 (1H, д, J=11,8 Гц), 4,61 (1H, д, J=10,7 Гц), 4,68 (1H, д, J=10,2 Гц), 4,72 (1H, д, J=10,5 Гц), 4,79 (1H, д, J=10,8 Гц), 4,85 (1H, д, J=10,7 Гц), 4,99 (1H, д, J=11,0 Гц), 5,04 (1H, ушир.), 5,65 (1H, с), 6,8-7,4 (28H, м)
(2) Синтез (1R,2S,3R,6R)-6-[2-(4-циклопропилбензил)фенокси]-4-(гидроксиметил)циклогекс-4-ен-1,2,3-триола
В потоке азота раствор 1,0 M трихлорида бора в метиленхлориде (160 мкл, 0,16 ммоль) добавляли к раствору 1-(4-циклопропилфенил)метил-2-[(1R,4R,5S,6S)-4,5,6-трис-бензилокси-3-(бензилоксиметил)-циклогекс-2-енилокси]бензола (12 мг, 0,016 ммоль) и пентаметилбензола (24 мг, 0,17 ммоль) в метиленхлориде (300 мкл) при -78°C и смесь перемешивали при указанной температуре в течение 1,5 часов. После добавления метанола температуру полученного раствора повышали до комнатной температуры и растворитель отгоняли при пониженном давлении. Полученный остаток очищали препаративной ТСХ [элюент=метанол:метиленхлорид (1:8)] с получением указанного в заголовке соединения (4,1 мг, 70%).
1H-NMR (CD3OD) δ: 0,61 (2H, м), 0,89 (2H, м), 1,83 (1H, м), 3,55 (1H, дд, J=10,5, 7,8 Гц), 3,72 (1H, дд, J=10,5, 7,8 Гц), 3,89 (1H, д, J=14,8 Гц), 3,93 (1H, д, J=14,9 Гц), 4,11 (2H, ушир.с), 4,15 (1H, д, J=7,8 Гц), 4,80 (1H, д, J=7,6 Гц), 5,60 (1H, т, J=1,5 Гц), 6,84 (1H, т, J=7,3 Гц), 6,93 (2H, д, J=8,1 Гц), 7,06 (1H, д, J=8,2 Гц), 6,97-7,18 (3H, м)
MS (ESI+): 405 [M+Na]+
Время удерживания ВЭЖХ: 12,5 минут
Пример 63
(1R,2S,3R,6R)-4-Гидроксиметил-6-[2-(4-метоксибензил)-фенокси]циклогекс-4-ен-1,2,3-триол
(1) Синтез 1-(4-метоксифенил)метил-2-[(1R,4R,5S,6S)-4,5,6-трисбензилокси-3-(бензилоксиметил)циклогекс-2-енилокси]бензола
В потоке азота 2-(4-метоксибензил)фенол (299 мг, 1,40 ммоль) и трибутилфосфин (380 мкл, 1,53 ммоль) добавляли к раствору (1S,3S,4S,5R,6R)-4,5,6-трисбензилокси-1-(бензилоксиметил)циклогексан-1,3-диола (561 мг, 1,01 ммоль), описанного в документе [Tetrahedron, 56, 7109-7122 (2000)], в толуоле (3 мл) при охлаждении льдом, затем к полученной смеси добавляли при указанной температуре тетраметилазодикарбоксамид (261 мг, 1,52 ммоль). Реакционную смесь перемешивали при указанной температуре в течение 20 часов, затем к полученной смеси добавляли гексан и осадок отфильтровывали и растворитель фильтрата отгоняли. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:7 → 1:1) с получением указанного в заголовке соединения (312 мг, 42%).
1H-NMR (CDCl3) δ: 3,64 (3H, с), 3,80-3,95 (3H, м), 3,92 (2H, с), 4,19 (1H, д, J=13,6 Гц), 4,36 (1H, ушир.), 4,41 (1H, д, J=11,9 Гц), 4,46 (1H, д, J=11,8 Гц), 4,64 (1H, д, J=11,0 Гц), 4,69 (1H, д, J=10,8 Гц), 4,71 (1H, д, J=10,8 Гц), 4,79 (1H, д, J=10,8 Гц), 4,85 (1H, д, J=11,0 Гц), 4,99 (1H, д, J=11,0 Гц), 5,05 (1H, ушир.), 5,67 (1H, с), 6,71 (2H, д, J=8,7 Гц), 6,80-7,40 (26H, м)
MS (ESI+): 755 [M+Na]+
(2) Синтез (1R,2S,3R,6R)-4-гидроксиметил-6-[2-(4-метоксибензил)фенокси]циклогекс-4-ен-1,2,3-триола
В потоке азота раствор 1,0 M трихлорида бора в метиленхлориде (6,0 мл, 6,0 ммоль) добавляли к раствору 1-(4-метоксифенил)метил-2-[(1R,4R,5S,6S)-4,5,6-трисбензилокси-3-(бензилоксиметил)циклогекс-2-енилокси]бензола (312 мг, 0,426 ммоль) в метиленхлориде (12 мл) при -78°C и смесь перемешивали при этой температуре в течение 1,5 часов. После добавления метанола температуру полученного раствора повышали до комнатной температуры и растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метанол:метиленхлорид (1:8)] с получением указанного в заголовке соединения (37,9 мг, 24%).
1H-NMR (CD3OD) δ: 3,56 (1H, дд, J=10,5, 8,0 Гц), 3,73 (1H, м), 3,73 (3H, с), 3,88 (1H, д, J=14,9 Гц), 3,92 (1H, д, J=14,9 Гц), 4,11 (2H, ушир.с), 4,16 (1H, м), 4,81 (1H, м), 5,61 (1H, т, J=1,7 Гц), 6,77 (2H, д, J=8,7 Гц), 6,84 (1H, т, J=7,3 Гц), 6,99 (1H, д, J=8,1 Гц), 7,04 (1H, д, J=7,5 Гц), 7,10 (2H, д, J=8,9 Гц), 7,13 (1H, м)
MS (ESI+): 395 [M+Na]+
Время удерживания ВЭЖХ: 10,8 минут
Пример 64
(1R,2S,3S,6R)-4-[3-(4-Этилбензил)фенил]-6-(гидроксиметил)циклогекс-4-ен-1,2,3-триол
(1) Синтез 3-(4-этилбензил)фенилбороновой кислоты
В потоке азота раствор 1-бром-3-(4-этилбензил)бензола (2,19 г, 7,96 ммоль) в ТГФ (20 мл) охлаждали до -78°C, к полученной смеси добавляли по каплям раствор н-бутиллития в гексане (2,44 M 3,42 мл) и полученный смешанный раствор перемешивали при указанной температуре в течение 20 минут. После добавления триметилбората (2,68 мл, 23,87 ммоль) реакционную смесь перемешивали при этой температуре в течение пяти минут и при комнатной температуре в течение 12,5 часов. После охлаждения реакционной смеси на ледяной бане к полученной смеси добавляли по каплям концентрированную серную кислоту (10 мл) и полученный смешанный раствор перемешивали при указанной температуре в течение одного часа. Смесь экстрагировали простым эфиром и органический слой промывали водой, а затем сушили над сульфатом натрия. К твердому веществу белого цвета, полученному путем отгонки растворителя при пониженном давлении, добавляли гексан-этилацетат (10:1) (5 мл), смесь фильтровали, а затем полученное твердое вещество промывали смесью гексан-этилацетат (10:1). Полученный белый порошок сушили при пониженном давлении с получением указанного в заголовке соединения (604,2 мг, 32%).
1H-NMR (CDCl3) δ: 1,22 (3Н, т, J=7,6 Гц), 2,62 (2Н, кв., J=7,6 Гц), 4,07 (2H, с), 7,10-7,20 (4H, м), 7,36-7,44 (2H, м), 8,00-8,10 (2H, м)
(2) Синтез (3R,4R,5S,6R)-4,5,6-трисбензилокси-3-(бензилоксиметил)циклогекс-1-енилового эфира трифторметансульфоновой кислоты
В потоке азота раствор н-бутиллития в гексане (322 мкл, 0,787 ммоль) добавляли по каплям к диизопропиламину (113 мкл, 0,806 ммоль), охлажденному на ледяной бане, и к полученной смеси добавляли ТГФ (0,8 мл). Полученный раствор охлаждали до -78°C, добавляли по каплям раствор (2R,3S,4R,5R)-2,4,5-трисбензилокси-5-(бензилоксиметил)циклогексанона (205,9 мг, 0,384 ммоль) в ТГФ (1 мл) и смесь перемешивали при указанной температуре в течение 12 минут. К полученной смеси добавляли по каплям раствор N-(5-хлор-2-пиридил)трифлимида (452 мг, 1,15 ммоль) в ТГФ (1,2 мл) и реакционную смесь перемешивали при указанной температуре в течение 2,5 часов. К полученной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и воду для остановки реакции и полученную смесь экстрагировали простым эфиром. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10 → 1:8) с получением указанного в заголовке соединения (161,4 мг, 63%).
1H-NMR (CDCl3) δ: 2,60-2,70 (1Н, м), 3,40-3,58 (2H, м), 3,70 (1H, дд, J=9,9, 9,7 Гц), 3,90 (1H, дд, J=9,7, 7,1 Гц), 4,32-4,54 (4H, м), 4,70-4,94 (5H, м), 5,76-5,83 (1H, м), 7,10-7,40 (20H, м)
(3) Синтез 1-(4-этилбензил)-3-[(3R,4R,5S,6S)-4,5,6-трисбензилокси-3-(бензилоксиметил)циклогекс-1-енил]бензола
В потоке азота диоксан-воду (10:l)(12 мл) добавляли к смеси (3R,4R,5S,6R)-4,5,6-трисбензилокси-3-(бензилоксиметил)циклогекс-1-енилового эфира трифторметансульфоновой кислоты (656 мг, 0,981 ммоль), K3PO3 (250 мг, 1,18 ммоль), KBr (140 мг, 1,18 ммоль), 3-(4-этилбензил)фенилбороновой кислоты (283 мг, 1,18 ммоль) и Pd(PPh3)4 (56,6 мг, 0,049 ммоль) и реакционную смесь нагревали и перемешивали при температуре 100-105°C в течение 26 часов. После охлаждения реакционной смеси к полученной смеси добавляли насыщенный водный раствор хлорида натрия и воду. Полученный раствор экстрагировали простым эфиром и органический слой промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10 → 1:8) с получением указанного в заголовке соединения (510,0 мг, 73%).
1H-NMR (CDCl3) δ: 1,19 (3H, т, J=7,6 Гц), 2,58 (2H, кв., J=7,6 Гц), 2,64-2,75 (1H, м), 3,54 (1H, дд, J=8,9, 5,9 Гц), 3,64 (1H, дд, J=8,9, 3,5 Гц), 3,68-3,79 (1H, м), 3,92 (2H, с), 4,07 (1H, дд, J=9,7, 7,3 Гц), 4,31 (1H, д, J=10,6 Гц), 4,45 (2H, с), 4,48 (1H, д, J=10,6 Гц), 4,54 (1H, д, J=10,9 Гц), 4,79-5,00 (4H, м), 5,85-5,92 (1H, м), 6,73-6,82 (2H, м), 6,98-7,42 (26H, м)
(4) Синтез (1R,2S,3S,6R)-4-[3-(4-этилбензил)фенил]-6-(гидроксиметил)циклогекс-4-ен-1,2,3-триола
В потоке азота раствор 1-(4-этилбензил-3-[(3R,4R,5S,6S)-4,5,6-трисбензилокси-3-(бензилоксиметил)циклогекс-2-енилокси]бензола (494,5 мг, 0,692 ммоль) и пентаметилбензола (1,05 г, 7,06 ммоль) в метиленхлориде (38 мл) охлаждали до -78°C и к полученной смеси добавляли по каплям раствор BCl3 в метиленхлориде (1,0 M, 7,54 мл). Реакционную смесь перемешивали при этой температуре в течение десяти минут и при -70°C в течение 1,5 часов, затем к полученной смеси добавляли метанол (20 мл). Остаток, полученный путем отгонки растворителя при пониженном давлении, подвергали грубой очистке при помощи колоночной хроматографи на силикагеле [элюент=метанол:метиленхлорид (1:20 →1:10), а затем очищали препаративной ТСХ [элюент=метанол:метиленхлорид (1:10)] с получением указанного в заголовке соединения (46,2 мг, 19%).
1H-NMR (CD3OD) δ: 1,19 (3H, т, J=7,6 Гц), 2,27-2,44 (1H, м), 2,58 (2H, кв., J=7,6 Гц), 3,44-3,68 (3H, м), 3,76-3,94 (3H, м), 4,45-4,57 (1H, м), 5,74-5,84 (1H, м), 6,95-7,25 (8H, м)
MS (ESI+): 372 [M+H2O]+
Время удерживания ВЭЖХ: 18,37 минут
Условия измерения для ВЭЖХ
Колонка: YMC-Pack ODS-A 6,0x150 мм, 5 мкм
Подвижная фаза: элюирование с применением градиента от 10 мМ AcONH4/H2O (95%) плюс 10 мм AcONH4/MeOH (5%) до 10 мМ AcONH4/MeOH (100%) в течение 20 минут, а затем в тех же условиях [10 мМ AcONH4/MeOH (100%)] в течение пяти минут
Скорость потока: 1,5 мл/минут
Температура колонки: комнатная температура
Условия детекции: весь участок всей длины волны от 230 до 400 нм
Пример 65
(1R,2R,3S,4R,5R)-1-[3-(4-Этилбензил)-4-метоксифенил]-5-(гидроксиметил)циклогексан-1,2,3,4-тетраол
(1) Синтез (1R,2R,3S,4R,5R)-2,3,4-трисбензилокси-5-(бензилоксиметил)-1-[3-(4-этилбензил)-4-метоксифенил]циклогексанола и (1S,2R,3S,4R,5R)-2,3,4-трисбензилокси-5-(бензилоксиметил)-1-[3-(4-этилбензил)-4-метоксифенил]циклогексанола
В потоке азота раствор н-бутиллития в гексане (2,70 M, 1,03 мл) добавляли по каплям к раствору 4-бром-2-(4-этилбензил)-1-метоксибензола (908 мг, 2,98 ммоль) в ТГФ (10 мл) при охлаждении до -78°C. Реакционную смесь перемешивали при указанной температуре в течение 10 минут. К этому раствору добавляли по каплям раствор (2R,3S,4R,5R)-2,3,4-трисбензилокси-5-(бензилоксиметил)циклогексанона (1,00 г, 1,86 ммоль) в ТГФ (2 мл) и полученный раствор перемешивали при -78°C в течение 30 минут. Реакцию останавливали добавлением насыщенного водного раствора хлорида аммония и воды. Полученный раствор экстрагировали этилацетатом и органический слой промывали водой, а затем сушили над сульфатом натрия. Остаток, полученный путем отгонки растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:5 → 1:1) с получением (1R,2R,3S,4R,5R)-2,3,4-трис-бензилокси-5-(бензилоксиметил)-1-[3-(4-этилбензил)-4-метоксифенил]циклогексанола (0,32 г, 23%) и (1S,2R,3S,4R,5R)-2,3,4-трисбензилокси-5-(бензилоксиметил)-1-[3-(4-этилбензил)-4-метоксифенил]циклогексанола (0,89 г, 64%).
(1R)-изомер:1H-NMR (CDCl3) δ: 1,17 (3H, т, J=7,6 Гц), 1,80-2,00 (2H, м), 2,20-2,36 (1H, м), 2,55 (2H, д, J=7,6 Гц), 2,91 (1H, д, J=2,0 Гц), 3,35-3,42 (1H, м), 3,65-4,05 (10H, м), 4,41-4,45 (3H, м), 4,59 (1H, д, J=10,7 Гц), 4,81 (1H, д, J=10,7 Гц), 4,87 (1H, д, J=10,7 Гц), 4,90 (1H, д, J=10,7 Гц), 6,78-6,84 (3H, м), 6,99-7,20 (6H, м), 7,20-7,40 (18H, м)
(1S)-изомер:1H-NMR (CDCl3) δ: 1,12 (3H, т, J=7,6 Гц), 1,40-1,54 (2H, м), 1,78-1,88 (1H, м), 2,35 (1H, дд, J=3,3, 13,7 Гц), 2,43 (1H, с), 2,47 (2H, кв., J=7,6 Гц), 3,34 (1H, дд, J=0,9, 8,9 Гц), 3,53-3,72 (4H, м), 3,80 (3H, с), 3,86-3,93 (2H, м), 4,41 (2H, с), 4,49 (1H, д, J=10,7 Гц), 4,67-4,79 (2H, м), 4,83 (1H, д, J=10,7 Гц), 5,02 (1H, д, J=11,7 Гц), 6,78 (1H, д, J=8,4 Гц), 7,00 (2H, д, J=7,9 Гц), 7,10 (2H, д, J=7,9 Гц), 7,14-7,20 (2H, м), 7,21-7,40 (18H, м), 7,56-7,63 (2H, м)
(2) Синтез (1R,2R,3S,4R,5R)-1-[3-(4-этилбензил)-4-метоксифенил]-5-(гидроксиметил)циклогексан-1,2,3,4-тетраола
К раствору (1R,2R,3S,4R,5R)-2,3,4-трисбензилокси-5-(бензилоксиметил)-1-[3-(4-этилбензил)-4-метоксифенил]циклогексанола (50,0 мг, 0,067 ммоль) в ТГФ (0,5 мл) и метаноле (2 мл) добавляли катализатор 20% гидроксид палладия (10 мг) и смесь перемешивали в атмосфере водорода при комнатной температуре в течение 15 часов. После того как катализатор отфильтровывали, фильтрат концентрировали при пониженном давлении. Полученный остаток очищали препаративной ТСХ [элюент=метанол:метиленхлорид (1:10)] с получением указанного в заголовке соединения (20 мг, 74%).
1H-NMR (CD3OD) δ: 1,22 (3H, т, J=7,6 Гц), 1,65-1,84 (2H, м), 2,01-2,14 (1H, м), 2,60 (2H, кв., J=7,6 Гц), 3,39-3,46 (1H, м), 3,62-3,75 (4H, м), 3,82 (3H, с), 3,94 (2H, с), 6,94 (1H, д, J=8,4 Гц), 7,06 (2H, д, J=8,2 Гц), 7,13 (2H, д, J=8,2 Гц), 7,30-7,38 (2H, м)
MS (ESI+): 420 [M+H2О]+
Время удерживания ВЭЖХ: 17,70 минут
Условия измерения для ВЭЖХ
Колонка: YMC-Pack ODS-A 6,0x150 мм, 5 мкм
Подвижная фаза: элюирование с применением градиента от 10 мМ AcONH4/H2O (95%) плюс 10 мМ AcONH4/MeOH (5%) до 10 мМ AcONH4/MeOH (100%) в течение 20 минут, а затем в тех же условиях [10 мМ AcONH4/MeOH (100%)] в течение пяти минут
Скорость потока: 1,5 мл/минута
Температура колонки: комнатная температура
Условия детекции: весь участок всей длины волны от 230 до 400 нм
Пример 66
(1R,2R,3S,4S,6R)-4-[3-(4-Этилбензил)-4-метоксифенил]-6-(гидроксиметил)циклогексан-1,2,3-триол
(1) Синтез 2-(4-этилбензил)-1-метокси-4-[(1S,2S,3R,4R,5R)-2,3,4-трисбензилокси-5-(бензилоксиметил)циклогексил]бензола
Раствор (1S,2R,3S,4R,5R)-2,3,4-трисбензилокси-5-(бензилоксиметил)-1-[3-(4-этилбензил)-4-метоксифенил]-циклогексанола (124 мг, 0,16 ммоль), полученного в Примере 65, в метиленхлориде (2 мл) охлаждали до -5°C и к полученной смеси добавляли триэтилсилан (0,39 мл, 2,44 ммоль). К смеси добавляли триoфторуксусную кислоту (0,12 мл, 1,6 ммоль) и реакционную смесь перемешивали при -5°C в течение одного часа, затем к полученной смеси добавляли насыщенный раствор гидрокарбоната натрия. Полученную смесь экстрагировали метиленхлоридом и органический слой промывали насыщенным водным раствором хлорида натрия, а затем сушили над сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:9)] с получением указанного в заголовке соединения (10 мг, 8%).
1H-NMR (CDCl3) δ: 1,17 (3H, т, J=7,6 Гц), 1,58-1,96 (3H, м), 2,56 (2H, кв., J=7,6 Гц), 2,55-2,70 (1H, м), 3,43-3,62 (5H, м), 3,78-4,00 (6H, м), 4,43 (2H, с), 4,44 (1H, д, J=9,9 Гц), 4,56 (1H, д, J=10,8 Гц), 4,82-4,93 (3H, м), 6,75-6,82 (3H, м), 6,99-7,18 (9H, м), 7,20-7,38 (15H, м)
(2) Синтез (1R,2R,3S,4S,6R)-4-[3-(4-этилбензил)-4-метоксифенил]-6-(гидроксиметил)циклогексан-1,2,3-триола
К раствору 2-(4-этилбензил)-1-метокси-4-[(lS,2S,3R,4R,5R)-2,3,4-трис-бензилокси-5-(бензилоксиметил)циклогексил]бензола (10 мг, 0,013 ммоль) в ТГФ (0,2 мл) и метаноле (1 мл) добавляли катализатор 20% гидроксид палладия (10 мг) и смесь перемешивали в атмосфере водорода при комнатной температуре в течение 13 часов. После того как катализатор отфильтровывали, фильтрат концентрировали при пониженном давлении. Полученный остаток очищали препаративной ТСХ [элюент=метанол:метиленхлорид (1:10)] с получением указанного в заголовке соединения (3,9 мг, 75%).
1H-NMR (CD3OD) δ: 1,23 (3H, т, J=7,4 Гц), 1,34-1,48 (1H, м), 1,60-1,76 (1H, м), 1,83 (1H, дт, J=13,5, 3,5 Гц), 2,48-2,66 (3H, м), 3,30-3,38 (2H, м), 3,42-3,52 (1H, м), 3,58-3,65 (1H, м), 3,77 (1H, д, J=4,0 Гц), 3,82 (3H, с), 3,92 (2H, с), 6,91 (1H, д, J=8,2 Гц), 7,02-7,14 (6H, м)
MS (ESI+): 406 [M+H2О]+
Время удерживания ВЭЖХ: 12,53 минут
Условия измерения для ВЭЖХ
Колонка: YMC-Pack ODS-A 6,0x150 мм, 5 мкм
Подвижная фаза: элюирование с применением градиента от 10 мМ AcONH4/H2O (95%) плюс 10 мМ AcONH4/MeOH (5%) до 10 мМ AcONH4/MeOH (100%) в течение 20 минут, а затем в тех же условиях [10 мМ AcONH4/MeОH (100%)] в течение пяти минут
Скорость потока: 1,5 мл/минута
Температура колонки: комнатная температура
Условия детекции: весь участок всей длины волны от 230 до 400 нм
Пример 67
(1R,2R,3S,4R,5R)-1-[2-Этил-5-(4-этилбензил)фенил]-5-(гидроксиметил)циклогексан-1,2,3,4-тетраол
(1) Синтез (3-бром-4-этоксифенил)-(4-этилфенил)метанола
ТГФ (10 мл) добавляли к магнию (353 мг, 14,5 ммоль), затем к полученной смеси добавляли по каплям 1-бром-4-этилбензол (2 мл, 14,5 ммоль) и смесь нагревали до температуры кипения с обратным холодильником в течение одного часа. Реакционную смесь охлаждали до 0°C, к полученной смеси добавляли раствор 3-бром-4-этоксибензальдегида (2,21 г, 9,68 ммоль) в ТГФ (5 мл) и реакционную смесь перемешивали при указанной температуре в течение 1,5 часов. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. Остаток, полученный путем отгонки растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [элюент=н-гексан → н-гексан:этилацетат (3:1)] с получением указанного в заголовке соединения (2,83 г, 88%).
1H-NMR (CDCl3) δ: 1,22 (3H, т, J=7,6 Гц), 1,45 (3H, т, J=7,0 Гц), 2,14 (1H, д, J=3,5 Гц), 2,63 (2H, кв., J=7,5 Гц), 4,07 (2H, кв., J=7,0 Гц), 5,74 (1H, д, J=3,5 Гц), 6,83 (1H, д, J=8,4 Гц), 7,17 (2H, д, J=8,1 Гц), 7,20-7,30 (3H, м), 7,56 (1H, д, J=2,1 Гц)
(2) Синтез 2-бром-1-этокси-4-(4-этилбензил)бензола
Триэтилсилан (2,7 мл, 16,9 ммоль) и комплекс трифторид бора-диэтиловый эфир (1,2 мл, 9,47 ммоль) добавляли к раствору (3-бром-4-этоксифенил)-(4-этилфенил)метанола (2,83 г, 8,44 ммоль) в метиленхлориде (20 мл) при 0°C и смесь перемешивали в течение трех часов. К реакционной смеси добавляли метанол (50%)-воду (4 мл) и полученную смесь экстрагировали метиленхлоридом. Экстракт промывали насыщенным водным раствором хлорида натрия и затем сушили над сульфатом магния. Остаток, полученный путем отгонки растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле {элюент=н-гексан → н-гексан-этилацетат [4%(об./об.)]} с получением указанного в заголовке соединения (2,69 г, 100%).
1H-NMR (CDCl3) δ: 1,22 (3H, т, J=7,6 Гц), 1,45 (3H, т, J=7,0 Гц), 2,62 (2H, кв., J=7,6 Гц), 3,85 (2H, с), 4,06 (2H, кв., J=7,0 Гц), 6,79 (1H, д, J=8,4 Гц), 7,00-7,15 (3H, м), 7,36 (1H, д, J=2,1 Гц)
(3) Синтез (1R,2R,3S,4R,5R)- и (1S,2R,3S,4R,5R)-2,3,4-трисбензилокси-5-бензилоксиметил-1-[2-этокси-5-(4-этилбензил)фенил]циклогексанола
В потоке азота раствор н-бутиллития в гексане (1,59 M, 2,30 мл, 3,66 ммоль) добавляли по каплям к раствору 2-бром-1-этокси-4-(4-этилбензил)бензол (1,18 г, 3,70 ммоль) в ТГФ (9 мл) при охлаждении до -78°C. Реакционную смесь перемешивали при указанной температуре в течение одного часа, затем к полученной смеси добавляли по каплям раствор (2R,3S,4R,5R)-2,3,4-трисбензилокси-5-(бензилоксиметил)циклогексанона (1,50 г, 2,80 ммоль) в ТГФ (4,5 мл) и реакционную смесь перемешивали при -78°C в течение 10 минут. К полученной смеси добавляли насыщенный водный раствор хлорида аммония для остановки реакции. Полученную смесь экстрагировали этилацетатом, органический слой промывали насыщенным водным раствором хлорида натрия и затем сушили над сульфатом магния. Остаток, полученный путем отгонки растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:4)] с получением (1R)-изомера (884 мг, 41%) и (1S)-изомера (740 мг, 34 %).
(1R)-изомер:1H-NMR (CDCl3) δ: 1,23 (3H, т, J=7,6 Гц), 1,37 (3H, т, J=7,0 Гц), 1,70 (1H, дд, J=14,3, 4,1 Гц), 2,20-2,35 (1H, м), 2,62 (2H, кв., J=7,6 Гц), 2,67-2,82 (1H, м), 3,0-3,3 (1H, ушир.), 3,43 (1H, дд, J=8,8, 2,O Гц), 3,71 (1H, дд, J=9,8, 9,8 Гц), 3,83 (1H, дд, J=8,9, 4,O Гц), 3,86-4,10 (3H, м), 3,91 (2H, с), 4,44 (2H, с), 4,48 (1H, д, J=10,3 Гц), 4,58 (1H, ушир.), 4,63 (1H, д, J=10,3 Гц), 4,85 (1H, д, J=11,0 Гц), 4,88 (1H, д, J=11,0 Гц), 4,95 (1H, д, J=10,8 Гц), 6,75 (1H, д, J=8,4 Гц), 6,79 (2H, д, J=7,0 Гц), 7,00-7,40 (24H, м), 7,53 (1H, д, J=2,0 Гц)
(1S)-изомер:1H-NMR (CDCl3) δ: 1,12 (3H, т, J=7,6 Гц), 1,30 (3H, т, J=7,2 Гц), 1,40-1,55 (1H, м), 1,76 (1H, дд, J=13,3, 13,3 Гц), 2,50 (2H, кв., J=7,6 Гц), 2,74 (1Н, дд, J=13,7, 3,2 Гц), 3,38 (1H, дд, J=9,0, 2,8 Гц), 3,54 (1H, дд, J=9,0, 5,3 Гц), 3,64 (1H, дд, J=10,8, 8,7 Гц), 3,86 (1H, дд, J=9,5, 9,5 Гц), 3,89 (2H, с), 4,0-4,1 (2H, м), 4,39 (2H, с), 4,53 (1H, дд, J=11,0 Гц), 4,64-4,72 (3H, м), 4,77 (1H, д, J=11,7 Гц), 4,79 (1H, д, J=10,5 Гц), 4,87 (1Н, д, J=10,8 Гц), 4,98 (1H, д, J=11,7 Гц), 6,98-7,42 (25H, м), 7,67 (1H, д, J=1,8 Гц)
(4) Синтез (1R,2R,3S,4R,5R)-1-[2-этокси-5-(4-этилбензил)фенил]-5-(гидроксиметил)циклогексан-1,2,3,4-тетраола
К раствору (1R,2R,3S,4R,5R)-2,3,4-трисбензилокси-5-(бензилоксиметил)-1-[2-этокси-5-(4-этилбензил)фенил]-циклогексанола (600 мг, 0,772 ммоль) в ТГФ (6 мл) и метаноле (3 мл) добавляли катализатор 20% гидроксид палладия (60 мг) и смесь перемешивали в атмосфере водорода в течение 2,5 часов. После того как катализатор отфильтровывали, фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле {элюент=метилен → метиленхлорид метанол [12%(об./об.)]} с получением указанного в заголовке соединения (197 мг, 61%).
1H-NMR (CD3OD) δ: 1,18 (3H, т, J=7,6 Гц), 1,43 (3H, т, J=7,0 Гц), 1,60 (1H, дд, J=14,3, 4,1 Гц), 2,01 (1H, м), 2,43 (1H, дд, J-14,0, 13,0 Гц), 2,57 (2H, кв., J=7,5 Гц), 3,39 (1H, дд, J=10,5, 9,3 Гц), 3,60-3,68 (3H, м), 3,85 (2H, с), 4,03 (2H, м), 4,34 (1H, д, J=9,2 Гц), 6,82 (1H, д, J=8,2 Гц), 6,99 (1H, дд, J=8,4 Гц, 2,3 Гц), 7,45 (1H, д, J=2,3 Гц)
MS (ESI+): 434 [M+H2O]+
Время удерживания ВЭЖХ: 18,71 минут
Условия измерения для ВЭЖХ
Колонка: YMC-Pack ODS-A 6,0x150 мм, 5 мкм
Подвижная фаза: элюирование с применением градиента от 10 мМ AcONH4/H2O (95%) плюс 10 мМ AcONH4/МеОН (5%) до 10 мМ AcONH4/MeOH (100%) в течение 20 минут, а затем в тех же условиях [10 мМ AcONH4/MeOH (100%)] в течение пяти минут
Скорость потока: 1,5 мл/минута
Температура колонки: комнатная температура
Условия детекции: весь участок всей длины волны от 230 до 400 нм
Пример 68
(1R,2R,3S,4S,6R)-4-[2-Этокси-5-(4-этилбензил)фенил]-6-(гидроксиметил)циклогексан-1,2,3-триол
(1) Синтез (1R,2R,3S,4S,6R)-4-[2-этокси-5-(4-
этилбензил)фенил]-6-(гидроксиметил)циклогексан-1,2,3-триол
К раствору в ТГФ (4 мл) и метаноле (2 мл) (1S,2R,3S,4R,5R)-2,3,4-трис-бензилокси-5-бензилоксиметил-1-[2-этокси-5-(4-этилбензил)фенил]циклогексанола (402 мг, 0,517 ммоль), полученного в Примере 67, добавляли катализатор 20% гидроксид палладия (78 мг) и полученный смешанный раствор перемешивали в атмосфере водорода в течение 19 часов. После того как катализатор отфильтровывали, фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид:метанол (10:1)] с получением указанного в заголовке соединения (42 мг 20%).
1H-NMR (CD3OD) δ: 1,18 (3H, т, J=7,6 Гц), 1,25-1,50 (1H, м), 1,38 (3H, т, J=7,0 Гц), 1,62 (1H, м), 1,78 (1H, м), 2,57 (2H, кв., J=7,6 Гц), 2,95-3,15 (1H, ушир.), 3,25-3,33 (2H, м), 3,54 (1H, дд, J=10,8, 6,1 Гц), 3,73 (1H, дд, J=10,8, 3,8 Гц), 3,65-3,85 (1Н, м), 3,83 (2H, с), 4,00 (2H, кв., J=7,0 Гц), 6,81 (1H, д, J=8,4 Гц), 6,94 (1H, дд, J=8,3, 2,1 Гц), 7,04 (1H, д, J=1,7 Гц), 7,06 (4H, с)
MS (ESI+): 401 [M]+
Время удерживания ВЭЖХ: 12,98 минут
Примеры 69-74
Целевые соединения получали путем осуществления таких же действий, как указано в Примере 67 или Примере 68, с использованием соответствующих исходных веществ и реагентов соответственно.
Пример 69
(1R,2R,3S,4R,5R)-1-[5-(4-Этилбензил)-2,4-диметоксифенил]-5-(гидроксиметил)циклогексан-1,2,3,4-тетраол
1H-NMR (CD3OD) δ: 1,17 (3H, т, J=7,6 Гц), 1,61 (1H, дд, J=13,9, 3,8 Гц), 1,90-2,10 (1H, м), 2,22 (1H, дд, J=13,9, 13,2 Гц), 2,55 (2H, кв., J=7,6 Гц), 3,32-3,42 (1H, м), 3,58-3,70 (3H, м), 3,76-3,88 (2H, м), 3,80 (3H, с), 3,84 (3H, с), 4,19 (1H, д, J=9,1 Гц), 6,58 (1H, с), 7,00 (2H, д, J=8,2 Гц), 7,06 (2H, д, J=8,2 Гц), 7,35 (1H, с)
MS (ESI+): 455 [M+Na]+
Время удерживания ВЭЖХ: 17,83 минут
Условия измерения для ВЭЖХ
Колонка: YMC-Pack ODS-A 6,0x150 мм, 5 мкм
Подвижная фаза: элюирование с применением градиента от 10 мМ AcONH4/H2O (95%) плюс 10 мМ AcONH4/MeOH (5%) до 10 мМ AcONH4/MeOH (100%) в течение 20 минут, а затем в тех же условиях [10 мМ AcONH4/MeOH (100%)] в течение пяти минут
Скорость потока: 1,5 мл/минута
Температура колонки: комнатная температура
Условия детекции: весь участок всей длины волны от 230 до 400 нм
Пример 70
(1R,2R,3S,4S,6R)-4-[5-(4-Этилбензил)-2,4-диметоксифенил]-6-(гидроксиметил)циклогексан-1,2,3-триол
1H-NMR (CD3OD) δ: 1,17 (3H, т, J=7,6 Гц), 1,24-1,48 (1H, м), 1,52-1,82 (2H, м), 2,56 (2H, д, J=7,6 Гц), 2,86-3,08 (1H, м), 3,24-3,29 (1H, м), 3,48-3,67 (2H, м), 3,68-3,84 (3H, м), 3,79 (3H, с), 3,81 (3H, с), 6,56 (1H, с), 6,93 (1H, с), 7,01 (2H, д, J=8,6 Гц), 7,05 (2H, д, J=8,6 Гц)
MS (ESI+): 416 [M]+
Время удерживания ВЭЖХ: 18,26 минут
Условия измерения для ВЭЖХ
Колонка: YMC-Pack ODS-A 6,0x150 мм, 5 мкм
Подвижная фаза: элюирование с применением градиента от 10 мМ AcONH4/H2O (95%) плюс 10 мМ AcONH4/MeOH (5%) до 10 мМ AcONH4/MeOH (100%) в течение 20 минут, а затем в тех же условиях [10 мМ AcONH4/MeOH (100%)] в течение пяти минут
Скорость потока: 1,5 мл/минута
Температура колонки: комнатная температура
Условия детекции: весь участок всей длины волны от 230 до 400 нм
Пример 71
(1R,2R,3S,4R,5R)-1-[5-(4-Этилбензил)-2-метилфенил]-5-(гидроксиметил)циклогексан-1,2,3,4-тетраол
1H-NMR (CD3OD) δ: 1,19 (3H, т, J=7,6 Гц), 1,70 (1H, м), 1,94 (1H, м), 2,05 (1H, м), 2,53 (3H, с), 2,58 (2H, кв., J=7,6 Гц), 3,40 (1H, д, J=9,2 Гц), 3,67 (2H, д, J=4,6 Гц), 3,73 (1H, д, J=9,2 Гц), 3,87 (2H, с), 4,01 (1H, д, J=9,2 Гц), 6,91 (1H, дд, J=7,6, 1,S Гц), 7,01 (1H, д, J=7,6 Гц), 7,07 (4H, м), 7,42 (1H, с)
MS (ESI+): 409 [M+Na]+
Пример 72
(1R,2R,3S,4S,6R)-4-[5-(4-Этилбензил)-2-метилфенил]-6-(гидроксиметил)циклогексан-1,2,3-триол
1H-NMR (CD3OD) δ: 1,19 (3H, т, J=7,6 Гц), 1,24-1,37 (1H, м), 1,59-1,81 (2H, м), 2,30 (3H, с), 2,57 (2H, кв., J=7,6 Гц), 2,93 (1H, м), 3,34 (2H, м), 3,50-3,63 (2H, м), 3,75 (1H, дд, J=10,7, 4,2 Гц), 3,86 (2H, с), 6,87 (1H, д, J=7,6 Гц), 7,03 (1H, д, J=7,6 Гц, 2,1 Гц), 7,07 (4H, с), 7,11 (1H, с)
MS (ESI-): 369 [M-H]-
Пример 73
(1R,2R,3S,4R,5R)-1-[5-(4-Этилбензил)-2-метоксифенил]-5-(гидроксиметил)циклогексан-1,2,3,4-тетраол
1H-NMR (CD3OD) δ: 1,13 (3H, т, J=7,6 Гц), 1,56 (1H, дд, J=14,1, 3,9 Гц), 1,94-2,04 (1H, м), 2,24 (1H, дд, J=13,9, 13,2 Гц), 2,51 (2H, кв., J=7,5 Гц), 3,24-3,37 (1H, м), 3,57-3,63 (3H, м), 3,74 (3H, с), 3,80-3,90 (2H, м), 4,22 (1H, д, J=9,1 Гц), 6,80 (1H, д, J=8,4 Гц), 6,95-7,01 (5H, м), 7,41 (1H, д, J=1,2 Гц)
MS (ESI+): 425 [M+Na]+
Время удерживания ВЭЖХ: 11,69 минут
Пример 74
(1R,2R,3S,4S,6R)-4-[5-(4-Этилбензил)-2-метоксифенил]-6-(гидроксиметил)циклогексан-1,2,3-триол
1H-NMR (CD3OD) δ: 1,18 (3H, т, J=7,6 Гц), 1,24-1,50 (1H, м), 1,54-1,85 (2H, м), 2,57 (2H, д, J=7,6 Гц), 2,90-3,18 (1H, м), 3,24-3,34 (2H, м), 3,54 (1H, дд, J=10,7, 5,9 Гц), 3,60-3,78 (2H, м), 3,76 (3H, с), 3,83 (2H, с), 6,82 (1H, д, J=8,4 Гц), 6,96 (1H, дд, J=8,4, 2,0 Гц), 7,01-7,11 (5H, м)
MS (ESI+): 404 [M+H2O]+
Время удерживания ВЭЖХ: 12,33 минуты
Пример 75
(1R,2R,3S,4R,5R)-1-[5-(4-Этилбензил)-2-трифторметоксифенил]-5-(гидроксиметил)циклогексан-1,2,3,4-тетраол
Целевое соединение получали путем осуществления таких же действий, как указано в Примере 67, с использованием соответствующих исходных веществ и реагентов.
1H-NMR (CD3OD) δ: 1,17 (3H, т, J=7,6 Гц), 1,73 (1H, д, J=10,1 Гц), 2,00-2,12 (2H, м), 2,58 (2H, кв., J=7,5 Гц), 3,35 (1H, дд, J=9,3, 9,3 Гц), 3,58-3,72 (2H, м), 3,66 (1H, дд, J=9,2, 9,2 Гц), 3,93 (2H, с), 3,99 (1H, д, J=8,9 Гц), 7,09 (4H, с), 7,13 (2H, м), 7,69 (1H, д, J=1,4 Гц)
MS (ESI+): 474 [M+Na]+
Время удерживания ВЭЖХ: 13,09 минут
Примеры 76-78
Целевые соединения получали путем осуществления таких же действий, как указано в Примере 68, с использованием соответствующих исходных веществ и реагентов соответственно.
Пример 76
(1R,2R,3S,4S,6R)-4-[5-(4-Изопропилбензил)-2-метоксифенил]-6-(гидроксиметил)циклогексан-1,2,3-триол
1H-NMR (CD3OD) δ: 1,21 (6H, д, J=6,9 Гц), 1,29-1,42 (1H, м), 1,59-1,81 (2H, м), 2,78-2,89 (1H, м), 3,06-3,10 (1H, м), 3,26-3,34 (2H, м), 3,55 (1H, дд, J=10,7, 6,0 Гц), 3,62-3,85 (5H, м), 3,84 (2H, с), 6,82 (1H, д, J=8,5 Гц), 6,96 (1H, дд, J=8,2, 2,2 Гц), 7,05-7,11 (5H, м)
MS (ESI+): 400 [M]+
Время удерживания ВЭЖХ: 13,07 минут
Пример 77
(1R,2R,3S,4S,6R)-4-[3-(4-Этилбензил)фенил]-6-(гидроксиметил)циклогексан-1,2,3-триол
1H-NMR (CD3OD) δ: 1,24 (3H, т, J=7,5 Гц), 1,43-1,53 (1H, м), 1,61-1,78 (1H, м), 1,85 (1H, дт, J=13,4, 3,7 Гц), 2,56-2,68 (3H, м), 3,29-3,40 (2H, м), 3,50-3,66 (2H, м), 3,80 (1H, дд, J=10,9, 3,9 Гц), 3,94 (2H, с), 7,04-7,27 (8H, м)
MS (ESI+): 357 [M]+
Время удерживания ВЭЖХ: 12,12 минут
Пример 78
(1R,2R,3S,4S,6R)-4-[3-(4-Гидроксибензил)фенил]-6-(гидроксиметил)циклогексан-1,2,3-триол
1H-NMR (CD3OD) δ: 1,43-1,52 (1H, м), 1,64-1,78 (1H, м), 1,85 (1H, дт, J=12,5, 3,7 Гц), 2,55-2,66 (1H, м), 3,33-3,40 (2H, м), 3,50-3,64 (2H, м), 3,76-3,84 (1H, м), 3,88 (2H, с), 6,68-6,74 (2H, м), 7,00-7,14 (5H, м), 7,20-7,25 (1H, м)
MS (ESI+): 362 [M+H2O]+
Время удерживания ВЭЖХ: 13,70 минут
Пример 79
(1R,2R,3S,4S,6R)-4-[5-(4-Этилбензил)-2-гидроксифенил-6-(гидроксиметил)циклогексан-1,2,3-триол
В потоке азота раствор (1R,2R,3S,4S,6R)-4-[5-(4-этилбензил)-2-метоксифенил]-6-(гидроксиметил)циклогексан-1,2,3-триола (40 мг, 0,1 ммоль), полученного в Примере 74, в метиленхлориде (1 мл) охлаждали до -78° и к полученной смеси добавляли по каплям раствор BBr3 в метиленхлориде (1,0 M, 0,31 мл) и смесь перемешивали при указанной температуре в течение 10 минут и при охлаждении льдом в течение двух часов. Затем к полученной смеси снова добавляли по каплям раствор BBr3 в метиленхлориде (0,2 мл) и полученный смешанный раствор перемешивали при указанной температуре в течение 3,5 часов, а затем добавляли раствор гидроксида натрия в метаноле (0,93 мл). Остаток, полученный путем отгонки растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:4)] с получением уазанного в заголовке соединения (3,5 мг, 9,1%).
1H-NMR (CD3OD) δ: 0,87-0,98 (1H, с), 1,19 (3H, т, J=7,8 Гц), 1,39-1,52 (1H, м), 1,59-1,66 (1H, м), 1,78-1,83 (1H, dt, J=13,5, 3,6 Гц), 2,56 (2H, кв., J=7,8, 7,5 Гц), 2,96-3,07 (1H, м), 3,34 (1H, с), 3,54-3,59 (1H, м), 3,62-3,69 (1H, м), 3,72 (1H, дд, J=6,6, 3,9 Гц), 3,80 (2H, с), 6,68 (1H, д, J=8,4 Гц), 6,80 (1H, дд, J=8,4, 2,0 Гц), 6,99 (1H, с), 7,05 (4H, с)
MS (ESI+): 372 [M]+
Время удерживания ВЭЖХ: 11,2 минут
Пример 80
(1R,2R,3S,4S,6R)-4-[3-(4-Циклопропилбензил)фенил-6-(гидроксиметил)циклогексан-1,2,3-триол
(1) Синтез 4-[3-((3aS,4S,5aR,9aR,9bR)-2,2,8,8-тетраметил-гексагидро[1,3]диоксолo[4',5':3,4]бензо-[1,2-d][1,3]диоксин-4-ил)бензил]фенола
(1R,2R,3S,4S,6R)-4-[3-(4-Гидроксибензил)фенил-6-(гидроксиметил)циклогексан-1,2,3-триол (47 мг, 0,136 ммоль), полученный в Примере 78, растворяли в N,N-диметилформамиде (1 мл) и полученную смесь перемешивали при охлаждении льдом. К реакционной смеси добавляли 2,2-диметоксипропан (142 мг, 1,36 ммоль), а затем гидрат п-толуолсульфоновой кислоты (2 мг). Полученную смесь перемешивали при комнатной температуре в течение 30 минут и добавляли насыщенный водный раствор хлорида аммония для остановки реакции. Смесь экстрагировали этилацетатом и органический слой промывали водой и сушили над сульфатом натрия. Остаток, полученный путем отгонки растворителя при пониженном давлении, очищали препаративной ТСХ [элюент=этилацетат:н-гексан (1:4)] с получением указанного в заголовке соединения (34 мг, 59%).
1H-NMR (CDCl3) δ: 1,11-1,24 (1H, м), 1,42 (6H, с), 1,46 (3H, с), 1,53 (3H, с), 1,73 (1H, дт, J=13,7, 3,9 Гц), 1,80-1,93 (1H, м), 2,94 (1H, дт, J=4,0, 11,0 Гц), 3,59-3,92 (7H, м), 4,85 (1H, с), 6,71-6,76 (2H, м), 7,00-7,08 (5H, м), 7,19-7,23 (1H, м)
(2) Синтез 4-[3-((3aS,4S,5aR,9aR,9bR)-2,2,8,8-тетраметил-гексагидро-[1,3]диоксолo[4',5':3,4]бензо[1,2-d][l,3]диоксин-4-ил)бензил]фенилового эфира трифторметансульфоновой кислоты
4-[3-((3aS,4S,5aR,9aR,9bR)-2,2,8,8-Тетраметилгексагидро-[1,3]диоксолo[4',5':3,4]бензо[1,2-d][1,3]диоксин-4-ил)бензил]фенол (34 мг, 0,08 ммоль) растворяли в метиленхлориде (0,8 мл) и смесь перемешивали при охлаждении льдом. К полученной смеси добавляли пиридин (15 мг, 0,19 ммоль), 2-[N,N-бис(трифторметансульфонил)амино]пиридин (34 мг, 0,096 ммоль), а затем N,N-диметиламинопиридин (1 мг), реакционную смесь перемешивали при комнатной температуре в течение 30 минут и к смеси добавляли воду для остановки реакци. Смесь экстрагировали метиленхлоридом и органический слой промывали водой и сушили над сульфатом натрия. Остаток, полученный путем отгонки растворителя при пониженном давлении, очищали препаративной ТСХ [элюент=этилацетат:н-гексан (1:4)] с получением указанного в заголовке соединения (37 мг, 83%).
1H-NMR (CDCl3) δ: 1,11-1,24 (1H, м), 1,42 (6H, с), 1,43 (3H, с), 1,53 (3H, с), 1,74 (1H, дт, J=13,7, 3,9 Гц), 1,80-1,93 (1H, м), 2,96 (1H, дт, J=l1,1, 3,6 Гц), 3,59-3,92 (5H, м), 3,98 (2H, с), 7,00-7,03 (2H, м), 7,10-7,35 (6H, м)
(3) Синтез (3aS,4S,5aR,9aR,9bR)-4-[3-(4-циклопропилбензил)фенил]-2,2,8,8-тетраметилгексагидро-[1,3]диоксолo[4',5':3,4]бензо[1,2-d][l,3]диоксина
В потоке азота к смеси 4-[3-((3aS,4S,5aR,9aR,9bR)-2,2,8,8-тетраметилгексагидро[l,3]диоксолo[4',5':3,4]бензо[1,2-d][1,3]диоксин-4-ил)бензил]фенилового эфира трифторметансульфоновой кислоты (38 мг, 0,068 ммоль), K3PO4 (65 мг, 0,31 ммоль), бромида натрия (7 мг, 0,068 ммоль), циклопропилбороновой кислоты (9 мг, 0,10 ммоль) и Pd(PPh3)4 (8,0 мг, 0,007 ммоль) добавляли смесь толуол (0,5 мл)-вода (0,017 мл) и реакционную смесь нагревали при 100°C и перемешивали в течение шести часов. Реакционную смесь охлаждали до 0°C и к полученной смеси добавляли воду. Полученный раствор экстрагировали этилацетатом и органический слой промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток очищали препаративной ТСХ [элюент=этилацетат:н-гексан(l:4)] с получением указанного в заголовке соединения (10 мг, 33%).
1H-NMR (CDCl3) δ: 0,62-0,68 (2H, м), 0,89-0,96 (2H, м), 1,10-1,24 (1H, м), 1,42 (3H, с), 1,43 (3H, с), 1,46 (3Hf с), 1,54 (3H, с), 1,74 (1H, дт, J=13,7, 3,9 Гц), 1,80-1,93 (2H, м), 2,94 (1H, дт, J=10,9, 3,6 Гц), 3,59-3,96 (8H, м), 6,96-7,07 (7H, м), 7,16-7,25 (1H, м)
(4) Синтез (1R,2R,3S,4S,6R)-4-[3-(4-циклопропилбензил)фенил]-6-(гидроксиметил)циклогексан-1,2,3-триола
Раствор (3aS,4S,5aR,9aR,9bR)-4-[3-(4-циклопропилбензил)фенил)-2,2,8,8-тетраметилгексагидро[1,3]-диоксолo[4',5':3,4]бензо[1,2-d][l,3]диоксина (10 мг, 0,022 ммоль) в диоксане (0,2 мл) охлаждали до 0°C и к полученной смеси добавляли по каплям 2 н. раствор хлористоводородной кислоты (0,2 мл). Реакционную смесь перемешивали при указанной температуре в течение трех часов, затем к полученной смеси добавляли насыщенный водный раствор гидрокарбоната натрия. Полученный раствор экстрагировали метиленхлоридом и органический слой промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом натрия. Остаток, полученный путем отгонки растворителя при пониженном давлении, очищали препаративной ТСХ [элюент=метанол:метиленхлорид (1:10)] с получением указанного в заголовке соединения (4,5 мг, 51%).
1H-NMR (CD3OD) δ: 0,63-0,68 (2H, м), 0,91-0,98 (2H, м), 1,42-1,52 (1H, м), 1,62-1,78 (1H, м), 1,80-1,94 (2H, м), 2,54-2,66 (1H, м), 3,33-3,40 (2H, м), 3,50-3,68 (2H, м), 3,79 (1H, дд, J=10,9, 3,9 Гц), 3,93 (2H, с), 6,85-7,16 (7H, м), 7,21-7,26 (1H, м)
MS (ESI+): 386 [M+H2O]+
Время удерживания ВЭЖХ: 18,49 минут
Условия измерения для ВЭЖХ
Колонка: YMC-Pack ODS-A 6,0х150 мм, 5 мкм
Подвижная фаза: элюирование с применением градиента от 10 мМ AcONH4/H2O (95%) плюс 10 мМ AcONH4/MeOH (5%) до 10 мМ AcONH4/MeOH (100%) в течение 20 минут, а затем в тех же условиях [10 мМ AcONH4/MeOH (100%)] в течение пяти минут
Скорость потока: 1,5 мл/минута
Температура колонки: комнатная температура
Условия детекции: весь участок всей длины волны от 230 до 400 нм
Пример 81
(1R,2R,3S,4R,5R)-1-[5-(4-Этилбензил)-2-фторфенил]-5-(гидроксиметил)циклогексан-1,2,3,4-тетраол
(1) Синтез (1R,2R,3S,4R,5R)- и (1S,2R,3S,4R,5R)-2,3,4-трисбензилокси-5-бензилоксиметил-1-[5-(4-этилбензил)-2-фторфенил]циклогексанола
В потоке азота раствор н-бутиллития в гексане (2,44 M, 0,368 мл) добавляли по каплям к раствору 2-бром-4-(4-этилбензил)-1-фторбензола (0,263 г, 0,9000 ммоль) в простом эфире (3,0 мл) при -78°C и полученный смешанный раствор перемешивали при указанной температуре в течение двух часов. К этому раствору добавляли раствор 2,3,4-трис-бензилокси-5-метилциклогексана (0,483 г, 0,900 ммоль) в ТГФ (1,5 мл) и реакционную смесь перемешивали в течение двух часов. Реакцию останавливали добавлением насыщенного водного раствора хлорида аммония и полученную смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), а затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:4)] с получением (1R)-изомера (0,117 г, 17,3%) и (1S)-изомера (0,311 г, 46,1%) уазанного в заголовке соединения.
(1R)-изомер:1H-NMR (CDCl3) δ: 1,15-1,32 (3H, м), 1,81-1,92 (1H, ушир.), 2,20-2,38 (2H, ушир.), 2,62 (2H, кв., J=9,8 Гц), 3,07 (1H, ушир.), 3,40-3,55 (1H, м), 3,66-3,80 (2H, м), 3,84-4,06 (4H, м), 4,28 (1H, д, J=12,3 Гц), 4,45 (2H, с), 4,58 (2H, т, J=12,1 Гц), 4,80-4,96 (3H, м), 6,76-6,84 (2H, м), 6,86-7,00 (1H, м), 7,02-7,44 (23H, м), 7,52-7,60 (1H, м)
(1S)-изомер:1H-NMR (CDCl3) δ: 1,13 (3H, т, J=1,5 Гц), 1,34-1,55 (1H, ушир.), 1,84 (1H, т, J=2,4 Гц), 2,50 (2H, кв., J=1,5 Гц), 2,75 (1H, дд, J=2,4, 0,9 Гц), 2,93 (1H, д, J=0,9 Гц), 3,37 (1H, дд, J=10,5, 6,6 Гц), 3,57-3,78 (3H, м), 3,86-4,06 (3H, м), 4,40-5,00 (8H, м), 6,80-7,60 (26H, м), 7,72-7,84 (1H, м)
(2) Синтез (1R,2R,3S,4R,5R)-1-[5-(4-этилбензил)-2-фторфенил]-5-(гидроксиметил)циклогексан-1,2,3,4-тетраола
К раствору (1R,2R,3S,4R,5R)-2,3,4-трисбензилокси-5-бензилоксиметил-1-[5-(4-этилбензил)-2-фторфенил]циклогексанола (271 мг, 0,361 ммоль) в смеси растворителей метанол-ТГФ (1:1) (20 мл) добавляли катализатор 20% гидроксид палладия (40 мг). Смесь перемешивали в атмосфере водорода в течение 30 минут, а затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метанол:метиленхлорид (1:10)] с получением указанного в заголовке соединения (44,6 мг, 31,6%).
1H-NMR (CD3OD) δ: 1,18 (3H, т, J=7,2 Гц), 1,15-1,26 (1H, м), 1,48 (1H, дд, J=13,5, 13,2 Гц), 2,57 (2H, кв., J=7,8 Гц), 2,73 (1H, дд, J=13,5, 3,0 Гц), 3,30-3,80 (1H, м), 3,50 (1H, дд, J=9,9, 5,7 Гц), 3,53-3,66 (2H, м), 3,83-3,92 (3H, м), 6,94 (1H, дд, J=12,3, 8,1 Гц), 7,00-7,25 (5H, м), 7,95 (1H, дд, J=7,8, 1,8 Гц)
MS (ESI+): 413 [M+Na]+
Время удерживания ВЭЖХ: 10,9 минут
Пример 82
(1S,2R,3S,4R,5R)-1-[5-(4-Этилбензил)-2-фторфенил]-5-(гидроксиметил)циклогексан-1,2,3,4-тетраол
К раствору (1S,2R,3S,4R,5R)-2,3,4-трисбензилокси-5-бензилоксиметил-1-[5-(4-этилбензил)-2-фторфенил]циклогексанола (33 мг, 0,044 ммоль), полученного в Примере 81, в смеси метанол-ТГФ (1:1) (1,4 мл) добавляли катализатор 20% гидроксид палладия (7,5 мг). Смесь перемешивали в атмосфере водорода в течение 2,5 часов, затем катализатор отфильтровывали. Растворитель отгоняли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метанол:метиленхлорид (1:10)] с получением указанного в заголовке соединения (17,5 мг, 100%).
1H-NMR (CD3OD) δ: 1,18 (3H, т, J=7,5 Гц), 1,70-1,79 (1H, м), 1,98-2,11 (2H, м), 2,57 (2H, кв., J=7,8 Гц), 3,32-3,45 (1H, м), 3,60-3,71 (3H, м), 3,90 (2H, с), 3,94 (1H, д, J=9,0 Гц), 6,91 (1H, дд, J=12,3, 8,I Гц), 7,02-7,12 (5H, м), 7,53 (1H, дд, J=7,8, 2,4 Гц)
MS (ESI+): 413 [M+Na]+
Время удерживания ВЭЖХ: 11,7 минут
Пример 83
(1R,2R,3S,4R,5R)-5-Гидроксиметил-1-[3-(4-метоксибензил)-фенил]циклогексан-1,2,3,4-тетраол
Целевое соединение получали путем осуществления таких же действий, как указано в Примере 81, с использованием соответствующих исходных веществ и реагентов.
1H-NMR (CD3OD) δ: 1,62-1,80 (2H, м), 1,94-2,10 (1H, м), 3,40 (1H, дд, J=10,5, 8,7 Гц), 3,62-3,72 (4H, м), 3,73 (3H, с), 3,89 (2H, с), 6,70-6,82 (2H, м), 7,00-7,03 (2H, м), 7,06-7,12 (2H, м), 7,22 (1H, т, J=7,8 Гц), 7,27-7,32 (1H, м), 7,34-7,37 (1H, м)
MS (ESI+): 375 [M+H]+
Время удерживания ВЭЖХ: 9,53 минут
Пример 84
(1S,2R,3S,4R,5R)-5-Гидроксиметил-1-[3-(4-метоксибензил)-фенил]циклогексан-1,2,3,4-тетраол
Целевое соединение получали путем осуществления таких же действий, как указано в Примере 81, с использованием соответствующих исходных веществ и реагентов.
1H-NMR (CD3OD) δ: 1,28-1,44 (1H, м), 1,56 (1H, т, J=13,2 Гц), 2,35 (1H, дт, J=13,5, 3,O Гц), 3,45 (1H, дд, J=l1,1, 6,0 Гц), 3,60-3,70 (3H, м), 3,73 (3H, с), 3,89 (2H, с), 6,77-6,82 (2H, м), 7,00-7,05 (1H, м), 7,06-7,13 (2H, м), 7,20 (1H, т, J=7,8 Гц), 7,60-7,65 (1H, м), 7,68-7,70 (1H, м)
MS (ESI+): 397 [M+Na]+
Время удерживания ВЭЖХ: 14,6 минут
Пример 85
(1R,2R,3S,4S,6R)-4-[l-(4-Этилбензил)-1Н-индол-3-ил]-6-(гидроксиметил)циклогексан-1,2,3-триол
(1) Синтез 1-(4-этилбензил)-1H-индола
К раствору индола (4,0 г, 34,1 ммоль) добавляли раствор гидроксида калия (2,40 г, 42,6 ммоль) в этаноле (200 мл) и полученный смешанный раствор перемешивали при комнатной температуре в течение двух часов. Растворитель отгоняли при пониженном давлении. Остаток растворяли в ацетоне (200 мл) и к полученной смеси добавляли 1-хлорметил-4-этилбензол (5,28 г, 34,1 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение всего дня и ночи, а затем подвергали фильтрованию через целит и фильтрат подвергали дистилляции при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:500)] с получением указанного в заголовке соединения (3,8 г, 47%).
1H-NMR (CDCl3) δ: 1,19 (3H, т, J=7,6 Гц), 2,60 (2H, кв., J=7,6 Гц), 5,27 (2H, с), 6,53 (1H, дд, J=3,1, 0,7 Гц), 7,03 (2H, д, J=7,6 Гц), 7,07-7,22 (5H, м), 7,29 (1H, д, J=8,0 Гц), 7,64 (1H, д, J=6,8 Гц)
(2) Синтез 3-бром-1-(4-этилбензил)-1Н-индола
Раствор 1-(4-этилбензил)-1Н-индола (2,0 г, 8,50 ммоль) в ДМФА (20 мл) добавляли по каплям при комнатной температуре к раствору брома (0,46 мл, 8,93 ммоль) в ДМФА (20 мл). Реакционную смесь перемешивали в течение двух часов, а затем выливали в охлажденный льдом водный раствор пиросульфата натрия. Полученную смесь экстрагировали этилацетатом и органический слой промывали насыщенным водным раствор гидрокарбоната натрия и насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Остаток перекристаллизовывали из этилацетата и н-гексана с получением указанного в заголовке соединения (1,68 г, 63%).
1H-NMR (CDCl3) δ: 1,20 (3H, т, J=7,6 Гц), 2,61 (2H, кв., J=7,6 Гц), 5,23 (2H, с), 7,05 (2H, дд, J=8,0 Гц), 7,11-7,22 (5H, м), 7,30 (1H, дд, J=6,5, 1,9 Гц), 7,57 (1H, дд, J=6,5, 1,9 Гц)
(3) Синтез (2R,3S,4R,5R)-2,3,4-трисбензилокси-5-бензилоксиметил-1-[1-(4-этилбензил)-1Н-индол-3-ил]-циклогексанола
В потоке азота раствор 3-бром-1-(4-этилбензил)-1Н-индола (427 мг, 1,36 ммоль) в ТГФ (8 мл) охлаждали до -78°C и к полученной смеси добавляли раствор н-бутиллития в гексане (1,6 M, 0,89 мл, 1,43 ммоль). Реакционную смесь перемешивали при указанной температуре в течение пяти минут. К этому раствору добавляли по каплям раствор (2R,3S,4R,5R)-2,3,4-трисбензилокси-5-(бензилоксиметил)циклогексанона (875 мг, 1,63 ммоль) в ТГФ (5,6 мл) и смесь перемешивали при -78°C в течение двух часов. Реакцию останавливали добавлением насыщенного водного раствора хлорида аммония. Полученную смесь экстрагировали этилацетатом и органический слой промывали водой, а затем сушили над сульфатом натрия. Остаток, полученный путем отгонки растворителя, очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:10)] с получением менее полярного изомера (354 мг, 34%) и более полярного изомера (115 мг, 11%) указанного в заголовке соединения.
Менее полярный изомер:1H-NMR (CDCl3) δ: 1,18 (3H, т, J=7,2 Гц), 1,93 (2H, м), 2,40 (1H, м), 2,61 (2H, кв., J=7,2 Гц), 3,40-5,22 (15H, м), 7,02-7,40 (28H, м), 7,93 (1H, д, J=8,0 Гц)
Более полярный изомер:1H-NMR (CDCl3) δ: 1,18 (3H, т, J=7,6 Гц), 2,40 (1H, м), 2,38 (2H, м), 2,58 (2H, кв., J=7,6 Гц), 3,41-5,24 (15H, м), 6,83 (1H, д, J=8,0 Гц), 7,03-7,34 (27H, м), 7,75 (1H, д, J=7,6 Гц)
(4) Синтез 1-(4-этилбензил)-3-[(1S,2S,3R,4R,5R)-2,3,4-трисбензилокси-5-(бензилоксиметил)циклогексил]-1H-индола
В потоке азота триэтилсилан (0,21 мл, 1,22 ммоль) добавляли по каплям к раствору (2R,3S,4R,5R)-2,3,4-трисбенилокси-5-бензилоксиметил-1-[1-(4-этилбензил)-1H-индол-3-ил]циклогексанола (469 мг, 0,61 ммоль) в метиленхлориде (6 мл) при 0°C. К полученной смеси добавляли по каплям в течение пяти минут комплекс трифторид бора-диэтиловый эфир (0,093 мл, 0,73 ммоль) и реакционную смесь перемешивали при 0°C в течение двух часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и полученную смесь экстрагировали метиленхлоридом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом натрия. Остаток, полученный путем отгонки растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле [элюент=этилацетат:н-гексан (1:15)] с получением указанного в заголовке соединения (232 мг, 51%).
1H-NMR (CDCl3) δ: 1,17 (3H, т, J=7,6 Гц), 1,87 (2H, м), 2,27 (1H, м), 2,58 (2H, кв., J=7,6 Гц), 3,36 (1H, дд, J=9,0, 1,7 Гц), 3,59-3,70 (2H, м), 3,88-4,00 (2H, м), 4,12 (1H, т, J=8,6 Гц), 4,38 (2H, с), 4,47 (1H, д, J=11,4 Гц), 4,54 (1H, д, J=2,7 Гц), 4,58 (1H, д, J=3,1 Гц), 4,80 (1H, д, J=10,7 Гц), 4,89 (1H, д, J=10,7 Гц), 4,98 (1H, д, J=10,7 Гц), 5,25 (2H, д, J=4,9 Гц), 6,97 (2H, д, J=8,4 Гц), 7,05 (2H, д, J=8,0 Гц), 7,08-7,35 (24H, м), 7,62 (1H, д, J=7,2 Гц)
(5) Синтез (1R,2R,3S,4S,6R)-4-[1-(4-этилбензил)-1H-индол-3-ил]-6-(гидроксиметил)циклогексан-1,2,3-триола
В потоке азота диметилсульфид (0,72 мл) и комплекс трифторид бора-диэтиловый эфир (0,36 мл, 2,8 ммоль) добавляли при охлаждении льдом к раствору 1-(4-этилбензил)-3-[(1S,2S,3R,4R,5R)-2,3,4-трис-бензилокси-5-(бензилоксиметил)-циклогексил]-1H-индола (213 мг, 2,28 ммоль) в метиленхлориде (4,7 мл). Полученный смешанный раствор перемешивали при комнатной температуре в течение 64 часов, затем к полученной смеси при охлаждении льдом добавляли воду и полученный раствор экстрагировали метиленхлоридом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили (безводный сульфат магния), затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [элюент=метиленхлорид:метанол (50:1)] с получением указанного в заголовке соединения (45 мг, 41%).
1H-NMR (CD3OD) δ: 1,17 (3H, т, J=7,6 Гц), 1,66 (1H, м), 1,79 (1H, м), 2,16 (1H, м), 2,58 (2H, кв., J=7,6 Гц), 3,33 (1H, м), 3,57 (1H, дд, J=10,7, 6,I Гц), 3,69 (1H, дд, J=10,7, 4,2 Гц), 3,76-3,88 (3H, м), 5,29 (2H, с), 6,98-7,11 (6H, м), 7,24 (1H, д, J=8,0 Гц), 7,30 (1H, с), 7,62 (1H, д, J=7,6 Гц)
MS (ESI+): 396 [M+H]+
Структурные формулы соединений описанных выше Примеров представлены в Таблице 1-Таблице 10.










Экспериментальный Пример 1
Испытание для подтверждения ингибирующего воздействия на Na+-глюкозные котранспортеры человека (SGLT1 и SGLT2)
(1) Получение вектора экспрессии SGLT1 человека
ПЦР осуществляли с использованием KOD+ДНК полимеразы (продукт фирмы Toyobo Co., Ltd.), где в качестве матрицы использовали библиотеку кДНК, выделенной из тонкого кишечника человека (продукт фирмы Clontech), с использованием синтезированного ДНК-праймера для амплификации кДНК SGLT1 человека. Затем амплифицированный фрагмент клонировали в вектор pcRII-Topo с использованием набора Topo ТА Cloning Dual Promoter kit (продукт фирмы Invitrogen) и вводили в компетентные клетки E. coli (ТОР10, продукт фирмы Invitrogen), и клоны, которые демонстрировали резистентность к ампициллину, пролиферировали в LB среде, содержащей ампициллин (50 мг/л). Используя обычный способ, из пролиферированой E. coli очищали плазмиду (см. Maniatis et al., Molecular Cloning). Эту плазмиду брали в качестве матрицы и осуществляли ПЦР при помощи KOD+ДНК полимеразы с использованием синтетического ДНК праймера, в который были включены сайты распознавания фермента рестрикции, для амплификации кДНК SGLT1 человека (фрагмент, добавленный с сайтом распознавания EcoRI слева и сайтом распознавания Hind III справа). Этот амплифицированный фрагмент подвергали расщеплению EcoRI и Hind III и расщепленные фрагменты связывали с сайтами распознавания вектора экспрессии pсДНК 3,1(-) (продукт фирмы Invitrogen) с использованием набора Rapid DNA Ligation (продукт фирмы Roche Diagonostic). Связанный вектор экспрессии вводили в компетентные клетки E. coli (DH5α, продукт фирмы Invitrogen) и пролиферировали в ампициллин-содержащей среде LB с получением вектора экспрессии SGLT1 человека в соответствии с обычным способом.
(2) Получение вектора экспрессии SGLT2 человека
ПЦР осуществляли при помощи KOD+ДНК полимеразы, где в качестве матрицы использовали библиотеку кДНК, выделенной из почки человека (продукт фирмы Clontech), с использованием синтезированного ДНК-праймера для амплификации кДНК SGLT2 человека. Затем амплифицированный фрагмент клонировали в вектор pcRII-Topo с использованием набора Topo ТА Cloning Dual Promoter и вводили в компетентные клетки E. coli (TOP10), и клоны, которые демонстрировали резистентность к ампициллину, пролиферировали в LB среде, содержащей ампициллин (50 мг/л). Используя обычный способ, из пролиферированой E. coli очищали плазмиду. Эту плазмиду брали в качестве матрицы и осуществляли ПЦР при помощи KOD+ДНК полимеразы с использованием синтетического ДНК праймера, в который были включены сайты распознавания фермента рестрикции, для амплификации кДНК SGLT2 человека (фрагмент, добавленный с сайтом распознавания Xho I слева и сайтом распознавания Hind III справа). Этот амплифицированный фрагмент подвергали расщеплению Xho I и Hind III и расщепленные фрагменты связывали с сайтами распознавания вектора экспрессии pсДНК 3,1(-) с использованием набора Rapid DNA Ligation. Связанный вектор экспрессии вводили в компетентные клетки E. coli (DH5α) и пролиферировали в ампициллин-содержащей среде LB с получением вектора экспрессии SGLT2 человека в соответствии с обычным способом.
(3) Получение клеток, стабильно экспрессирующих SGLT1 человека, и клеток, стабильно экспрессирующих SGLT2 человека
Вектор экспрессии SGLT1 человека и вектор экспрессии SGLT2 человека, расщепленный ферментом рестрикции Pvu I, вводили в клетки CHO-K1 при помощи FuGene (продукт фирмы Roche Diagonostics). После введения гена клетки инкубировали в среде DMEM (продукт фирмы Gibco), содержащей пенициллин (50 Ед./мл, продукт фирмы Sigma), стрептомицин (50 мг/л, продукт фирмы Sigma), Geneticin (200 мг/л, продукт фирмы Nakalai Tesque) и 20% фетальной бычьей сыворотки, в присутствии 5% CO2при 37°C в течение примерно трех недель, для получения Genticin-резистентных клонов. Из этих клонов отбирали и получали клетки, способные стабильно экспрессировать SGLT1 человека, и клетки, способные стабильно экспрессировать SGLT2 человека, используя в качестве показателя натрий-зависимую активность поглощения сахара (метил-α-D-глюкопиранозида).
(4) Измерение активности ингибирования поглощения метил-α-D-глюкопиранозида
Клетки, стабильно экспрессирующие SGLT1 человека, или клетки, стабильно экспрессирующие SGLT2 человека, высевали в 96-луночный планшет до плотности 30000 - 40000 клеток/лунка и инкубировали в течение времени от четырех до шести дней. Затем среду культурального планшета удаляли и добавляли буфер для предварительной обработки (буфер, содержащий 140 мМ холинхлорида, 2 мМ хлорида калия, 1 мМ хлорида кальция, 1 мМ хлорида магния, 10 мМ 2-[4-(2-гидроксиэтил)-1-пиперазинил]этансульфоновой кислоты и трис(гидроксиметил)-аминометана, и имеющий значение pH = 7,4) в количестве 150 мкл на лунку, а затем оставляли выстаиваться при 37°C в течение 20 минут. Буфер для предварительной обработки удаляли и снова добавляли буфер для предварительной обработки в количестве 50 мкл на лунку, а затем оставляли выстаиваться при 37°C в течение 20 минут. К 100 мл буфера (буфер, содержащий 140 мМ хлорида натрия, 1 мМ хлорида калия, 1 мМ хлорида магния, 1 мМ метил-α-D-глюкопиранозида, 10 мМ 2-[4-(2-гидроксиэтил)-1-пиперазинил]этансульфоновой кислоты и трис(гидроксиметил)аминометана, и имеющий значение pH = 7,4) добавляли и смешивали с ним 6,3 мл метил-α-D-(U-14C)глюкопиранозида (200 мКи/л, продукт фирмы Amersham Pharmacia Biotech) для получения поглощающего буфера, испытываемое соединение растворяли в этом поглощающем буфере и полученный раствор использовали в качестве буфера для определения ингибиторной активности. Кроме того, в качестве контроля использовали поглощающий буфер, не содержащий испытываемого соединения. Кроме того, для определения базового поглощения в отсутствие испытываемого соединения и натрия получали таким же способом базовый поглощающий буфер, содержащий 140 мМ холинхлорида вместо хлорида натрия, и использовали для определения. Буфер для предварительной обработки удаляли из лунок культурального планшета и добавляли буфер для определения ингибиторной активности в количестве 35 мкл на лунку и оставляли выстаиваться при 37°C в течение 45 минут. Затем буфер для определения ингибиторной активности удаляли и добавляли промывочный буфер (буферный раствор, содержащий 140 мМ холинхлорида, 2 мМ хлорида калия, 1 мМ хлорида кальция, 1 мМ хлорида магния, 10 мМ метил-α-D-глюкопиранозида, 10 мМ 2-[4-(2-гидроксиэтил)-1-пиперазинил]этансульфоновой кислоты и трис-(гидроксиметил)аминометана, и имеющий значение pH = 7,4) в количестве 300 мкл на лунку и сразу удаляли. Эту операцию промывки повторяли снова и добавляли солюбилизирующий клетки раствор (1 M гидроксида натрия и 0,1% лаурилсульфата натрия) в количеств 30 мкл на лунку для солюбилизации клеток. К полученному раствору добавляли 15 мкл 2 M хлористоводородной кислоты, и 40 мкл полученного раствора переносили на пластину Luma (продукт фирмы Packard) и оставляли выстаиваться в течение ночи при комнатной температуре для выпаривания растворителя. Радиоактивность образца на пластине определяли при помощи Topcount (изготовитель фирма Packard). Концентрацию испытываемого соединения (значение ИК50), которая ингибировала 50% поглощения, где величину, полученную путем вычитания базового поглощения из поглощения контроля, принимали за 100%, рассчитывали на основании кривой концентрация-ингибирование с использованием арифметической программы (Elfit, ver.3). В результате соединения по настоящему изобретению продемонстрировали замечательное действие по ингибированию SGLT2. Значения ИК50для ингибирования SGLT2, полученные для репрезентативных соединений по настоящему изобретению, представлены в Таблице 11.
Промышленная применимость
Настоящим изобретением могут обеспечиваться циклогексановые соединения, которые проявляют действие по ингибированию активности SGLT2, или их фармацевтически приемлемые соли. Соединения по настоящему изобретению являются полезными в качестве профилактических или терапевтических средств от диабета, связанных с диабетом заболеваний или диабетических осложнений.
Реферат
Настоящее изобретение относится к новым циклогексановым производным формулы (I) или их фармацевтически приемлемым солям, обладающим ингибиторной активностью в отношении Na+-глюкозного котранспортера (SGLT2), а также к фармацевтическим композициям на их основе и к их использованию для профилактики или лечения диабета, диабетических осложнений, вызванных гипергликемией, или ожирения. ! ! где А представляет собой -O-; n представляет собой целое число, выбранное из 0 и 1; R6 и R7, каждый независимо, представляет собой атом водорода или C1-С6алкильную группу, m представляет собой целое число, выбранное из 1-3; Q выбран из Q1-Q5, представленных Формулой 2. 5 н. и 10 з.п. ф-лы, 11 табл.
Формула
Формула 1

где А представляет собой -O-;
n представляет собой целое число, выбранное из 0 и 1;
R6 и R7, каждый независимо, представляет собой атом водорода или C1-С6алкильную группу,
m представляет собой целое число, выбранное из 1-3;
Q выбран из Q1-Q5, представленных следующими формулами:
Формула 2





где R1, R2, R3 и R4, каждый независимо, выбран из атома водорода, гидроксигруппы и бензилоксигруппы;
R5 выбран из атома водорода и гидроксигруппы;
Ar1 представляет собой фениленовую группу или 5,6-членную гетероариленовую группу, содержащую один гетероатом, выбранный из атома азота и атома серы, где гетероариленовая группа может образовывать конденсированное кольцо с бензольным кольцом, причем Ar1 может быть замещена одним или несколькими Rb;
Ar2 представляет собой фенильную группу, бензотиенильную группу, бензодиоксолильную группу или 2,3-дигидробензофуранильную группу, причем Ar2 может быть замещена одним или несколькими Rb;
Rb, каждый независимо, выбран из C1-С6алкильной группы, которая может быть замещена одним или несколькими Rc, C1-С6алкенильной группы, которая может быть замещена одним или несколькими Rc, С3-С3циклоалкильной группы, атома галогена, гидроксигруппы, цианогруппы, C1-С6алкоксигруппы, которая может быть замещена одним или несколькими Rc, 5-членной гетероарильной группы, содержащей два атома азота, C1-С6алкилтиогруппы, C1-С6алкилсульфонильной группы, C1-С6алкилкарбонильной группы, -CO2Ri, и -CONRiRj;
Rc, каждый независимо, выбран из атома галогена и аминогруппы;
Ri и Rj, каждый независимо, выбран из атома водорода и C1-С6алкильной группы,
или его фармацевтически приемлемая соль.
или его фармацевтически приемлемая соль.
или его фармацевтически приемлемая соль.
[2-(4-метоксибензил)фенил]-5а-карба-β-D-глюкопиранозид;
[1S,2R,3R,4R,6S]-4-гидроксиметил-6-[3-(4-метоксибензил)-фенил]циклогексан-1,2,3-триол;
[2-(4-трифторметоксибензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(4-циклопентилбензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(4-хлорбензил)фенил]-5а-карба-β-D-глюкопиранозид;
(2-бензилфенил)-5а-карба-β-D-глюкопиранозид;
[2-(4-изопропилбензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(4-циклопропилбензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(4-н-пропилбензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(4-трифторметилбензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(4-метилсульфанилбензил)фенил]-5а-карба-β-D-глюкопиранозид;
[3-фтор-2-(4-метоксибензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(3-трифторметилбензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(4-метоксибензил)-4-метилфенил]-5а-карба-β-D-глюкопиранозид;
[2-(3-метоксибензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(4-метоксибензил)-4-метоксифенил]-5а-карба-β-D-глюкопиранозид;
[2-(4-метоксибензил)-6-метилфенил]-5а-карба-β-D-глюкопиранозид;
[2-(4-метоксибензил)-4-фторфенил]-5а-карба-β-D-глюкопиранозид;
[2-(3-фторбензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(3-метилбензил)фенил]-5а-карба-β-D-глюкопиранозид;
[5-фтор-2-(4-метоксибензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(4-метилсульфонилбензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(4-фторбензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(3,4-диметоксибензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(4-этилбензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(4-гидроксибензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(4-цианобензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(3-трифторметоксибензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(4-аминометилбензил)фенил]-5а-карба-β-D-глюкопиранозид;
[5-метокси-2-(4-метоксибензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(4-метоксикарбонилбензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(4-карбамоилбензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(4-N,N-диметилкарбамоилбензил)фенил]-5a-карба-β-D-глюкопиранозид;
[2-(4-этоксибензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(4-дифторметоксибензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(4-трет-бутилбензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(4-метилбензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(4-метоксибензил)фенил]-5-трифторметилтиофен-3-ил]-5а-карба-β-D-глюкопиранозид;
[3-метокси-2-(4-метоксибензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(4-метоксибензил)-3-метилфенил]-5а-карба-β-D-глюкопиранозид;
[2-(3-фтор-4-метоксибензил)фенил]-5а-карба-β-D-глюкопиранозид;
[4-(4-циклопропилбензил)пиридин-3-ил]-5а-карба-β-D-глюкопиранозид;
[2-(4-карбоксибензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(4-винилбензил)фенил]-5а-карба-β-D-глюкопиранозид;
{2-[4-(2,2-дифторвинил)бензил]фенил}-5а-карба-β-D-глюкопиранозид;
[2-(2,3-дигидробензофуран-5-илметил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(3-фтор-4-метилбензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(4-метокси-3-метилбензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(4-пиразол-1-илбензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(3-хлор-4-метоксибензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(3,4-метилендиоксибензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(4-циклобутилбензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(4-ацетилбензил)фенил]-5а-карба-β-D-глюкопиранозид;
[2-(4-метоксибензил)-5-метилфенил]-5а-карба-β-D-глюкопиранозид;
[2-(4-этилбензил)тиофен-3-ил]-5а-карба-β-D-глюкопиранозид;
[2-(бензотиофен-2-ил)метилфенил]-5а-карба-β-D-глюкопиранозид;
(R)-{2-[1-(4-циклопропилфенил)этил]фенил}-5a-карба-β-D-глюкопиранозид;
(S)-{2-[1-(4-циклопропилфенил)этил]фенил}-5а-карба-β-D-глюкопиранозид;
[2-(4-циклопропилбензил)-5-метилтиофен-3-ил]-5а-карба-β-Dглюкопиранозид;
[2-(4-этилбензил)-5-метилтиофен-3-ил]-5а-карба-β-D-глюкопиранозид;
[5-хлор-2-(4-циклопропилбензил)тиофен-3-ил]-5а-карба-β-D-глюкопиранозид;
(1R,2S,3R,6R)-6-[2-(4-циклопропилбензил)фенокси]-4-(гидроксиметил)циклогекс-4-ен-1,2,3-триол;
(1R,2S,3R,6R)-4-гидроксиметил-6-[2-(4-метоксибензил)-фенокси]циклогекс-4-ен-1,2,3-триол;
(1R,2S,3S,6R)-4-[3-(4-этилбензил)фенил]-6-(гидроксиметил)циклогекс-4-ен-1,2,3-триол;
(1R,2R,3S,4R,5R)-1-[3-(4-этилбензил)-4-метоксифенил]-5-(гидроксиметил)циклогексан-1,2,3,4-тетраол;
(1R,2R,3S,4S,6R)-4-[3-(4-этилбензил)-4-метоксифенил]-6-(гидроксиметил)циклогексан-1,2,3-триол;
(1R,2R,3S,4R,5R)-1-[2-этокси-5-(4-этилбензил)фенил]-5-(гидроксиметил)циклогексан-1,2,3,4-тетраол;
(1R,2R,3S,4S,6R)-4-[2-этокси-5-(4-этилбензил)фенил]-6-(гидроксиметил)циклогексан-1,2,3-триол;
(1R,2R,3S,4R,5R)-1-[5-(4-этилбензил)-2,4-диметоксифенил]-5-(гидроксиметил)циклогексан-1,2,3,4-тетраол;
(1R,2R,3S,4S,6R)-4-[5-(4-этилбензил)-2,4-диметоксифенил]-6-(гидроксиметил)циклогексан-1,2,3-триол;
(1R,2R,3S,4R,5R)-1-[5-(4-этилбензил)-2-метилфенил]-5-(гидроксиметил)циклогексан-1,2,3,4-тетраол;
(1R,2R,3S,4S,6R)-4-[5-(4-этилбензил)-2-метилфенил]-6-(гидроксиметил)циклогексан-1,2,3-триол;
(1R,2R,3S,4R,5R)-1-[5-(4-этилбензил)-2-метоксифенил]-5-(гидроксиметил)циклогексан-1,2,3,4-тетраол;
(1R,2R,3S,4S,6R)-4-[5-(4-этилбензил)-2-метоксифенил]-6-(гидроксиметил)циклогексан-1,2,3-триол;
(1R,2R,3S,4R,5R)-1-[5-(4-этилбензил)-2-трифторметоксифенил]-5-(гидроксиметил)циклогексан-1,2,3,4-тетраол;
(1R,2R,3S,4S,6R)-4-[5-(4-изопропилбензил)-2-метоксифенил]-6-(гидроксиметил)циклогексан-1,2,3-триол;
(1R,2R,3S,4S,6R)-4-[3-(4-этилбензил)фенил]-6-(гидроксиметил)циклогексан-1,2,3-триол;
(1R,2R,3S,4S,6R)-4-[3-(4-гидроксибензил)фенил]-6-(гидроксиметил)циклогексан-1,2,3-триол;
(1R,2R,3S,4S,6R)-4-[5-(4-этилбензил)-2-гидроксифенил]-6-(гидроксиметил)циклогексан-1,2,3-триол;
(1R,2R,3S,4S,6R)-4-[3-(4-циклопропилбензил)фенил]-6-(гидроксиметил)циклогексан-1,2,3-триол;
(1R,2R,3S,4R,5R)-1-[5-(4-этилбензил)-2-фторфенил]-5-(гидроксиметил)циклогексан-1,2,3,4-тетраол;
(1S,2R,3S,4R,5R)-1-[5-(4-этилбензил)-2-фторфенил]-5-(гидроксиметил)циклогексан-1,2,3,4-тетраол;
(1R,2R,3S,4R,5R)-5-гидроксиметил-1-[3-(4-метоксибензил)-фенил]циклогексан-1,2,3,4-тетраол;
(1S,2R,3S,4R,5R)-5-гидроксиметил-1-[3-(4-метоксибензил)-фенил]циклогексан-1,2,3,4-тетраол; и
(1R,2R,3S,4S,6R)-4-[1-(4-этилбензил)-1Н-индол-3-ил]-6-(гидроксиметил)-циклогексан-1,2,3-триол,
или его фармацевтически приемлемая соль.

Комментарии