Бициклическое ароматическое соединение, фармацевтическая и косметическая композиции - RU2134256C1
Код документа: RU2134256C1
Чертежи


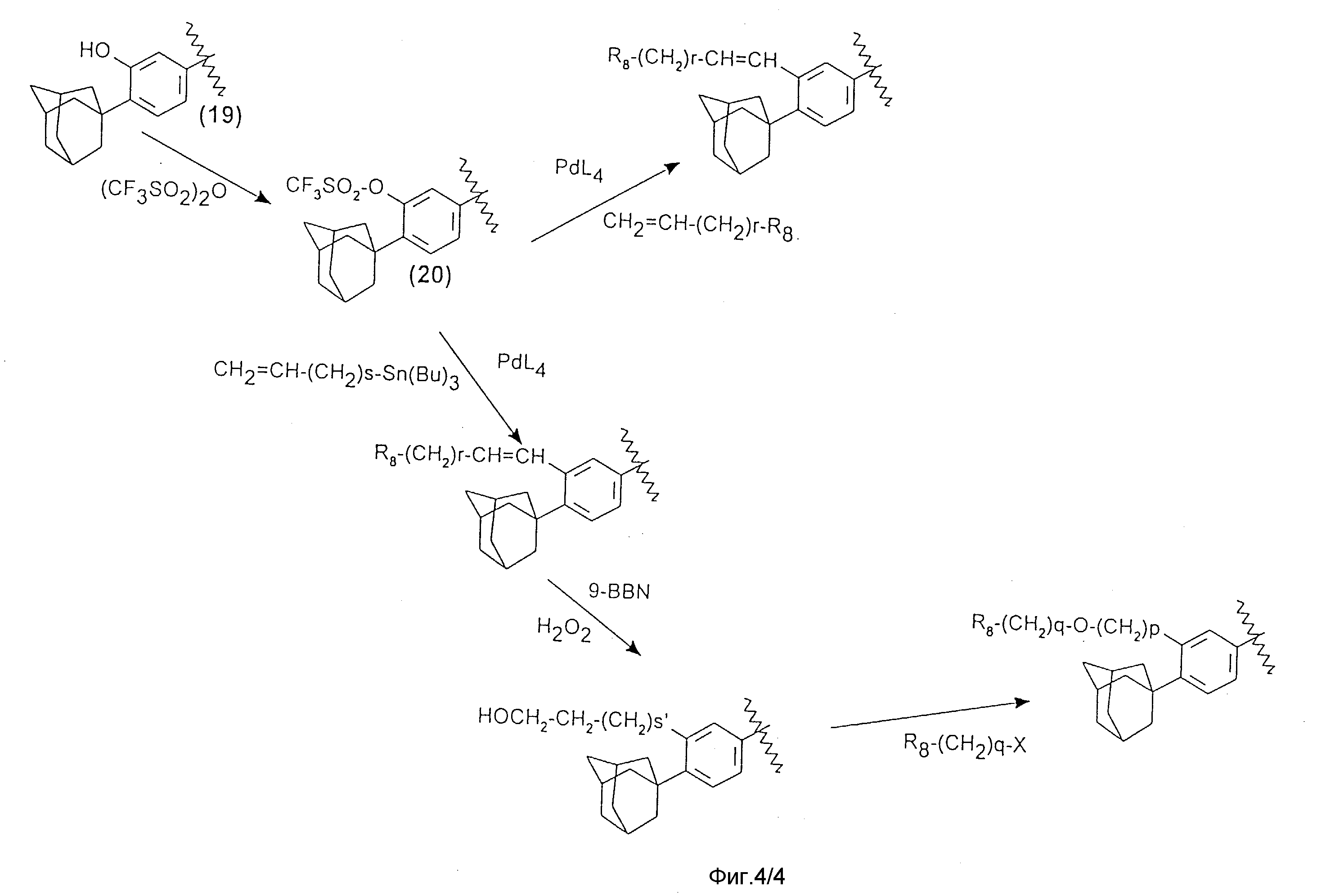
Описание
Изобретение относится к биароматическим соединениям в качестве новых и пригодных промышленных продуктов, которые находят применение в фармацевтических композициях, предназначенных для использования в медицине или ветеринарии, а также в косметических композициях.
Соединения согласно изобретению обладают заметной активностью в областях дифференциации и пролиферации клеток, и особенно находят применение при лечении нарушения кератинизации, дерматологических (или других) заболеваний с воспалительным и/или иммуноаллергическим компонентом, и дермических или эпидермических пролифераций, являющихся либо доброкачественными, либо злокачественными. Кроме того, эти соединения можно использовать при лечении заболеваний перерождения соединительной ткани, для борьбы против старения кожи, которое происходит либо вследствие фотоиндуцирования, либо за счет возрастных факторов, и для лечения при нарушении зарубцовывания. Они находят применение, кроме того, в области офтальмологии, особенно при лечении корнеопатий.
Соединения согласно изобретению также можно использовать для гигиены тела и ухода за волосами.
Соединения согласно изобретению могут быть представлены следующей общей формулой (I):

в которой R1 обозначает: (I) радикал -CH3, (II) радикал -(CH2)n-O-R4, (III) радикал -O-(CH2 )m-(CO)n-R5; (IV) радикал -CO-R6, (V) радикал -CO-O-R7, причем значения m и n, а также значения различных радикалов R4-R7 приводятся ниже;
R2 обозначает атом водорода, галогена, линейный или разветвленный алкильный радикал с 1-20 атомами углерода, радикал -OR4, радикал -O-CH2 -O-CH2-CH2-O-CH3;
R3 обозначает: (I) радикал -Y-(CH2)p-Y-(CH2)q-R8; (II) радикал - (CH2)p-(Y)-(CH2))q-R8; (III) радикал -Y-(CH2)q-R8; (IV) радикал -CH=CH-(CH2)r-R8; причем значения р, q, r, s и радикалов Y и R8 приводятся ниже;
X обозначает связи нижеследующих формул (a) - (m), которые могут быть связаны двояким образом:
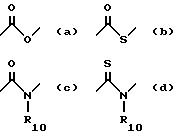



Ar обозначает радикал, выбираемый среди радикалов следующих формул (a) - (f):


где m обозначает целое число, равное 1, 2 или 3;
n обозначает целое число, равное 0 или 1;
p обозначает целое число, находящееся в пределах 1-12 включительно;
q обозначает целое число, находящееся в пределах 0-12 включительно;
r обозначает целое число, находящееся в пределах 0-10 включительно;
s обозначает целое число, равное 0 или 1;
f обозначает целое число, равное 0,1 или 2;
Y обозначает атом кислорода или радикал S(O)t;
w обозначает атом кислорода, радикал s(O)t или радикал N-R10;
R4 обозначает атом водорода, низший алкильный радикал или радикал -CO-R11;
R5 обозначает низший алкил или гетероцикл;
R6 обозначает атом водорода, низший алкильный радикал или радикал:

в котором R' и R'' обозначают атом водорода, низший алкильный радикал, моно- или полигидроксиалкильный радикал, возможно замещенный арильный радикал или остаток аминокислоты или пептида или сахара или, взятые вместе, образуют гетероцикл;
R7 обозначает атом водорода, линейный или разветвленный алкильный радикал с 1-20 атомами углерода, алкенильный радикал, моно- или полигидроксиалкильный радикал, возможно замещенный арильный или аралкильный радикал или остаток сахара или остаток аминокислоты или пептида;
R8 обозначает атом водорода, разветвленный алкильный радикал с 1-20 атомами углерода, циклоалифатический радикал с 3- 6 атомами углерода, моногидроксиалкильный радикал или полигидроксиалкильный радикал, гидроксильные группы которого возможно защищены в форме метокси-, ацетокси- или ацетонид -группы, арильный радикал, алкенильный радикал, алкинильный радикал, радикал -CO-R6, радикал -CO-O-R7, аминоалкильный радикал, аминная функция которого возможно замещена одной или двумя низшими алкильными группами, гетероцикл;
R9 обозначает атом водорода или галогена, линейный или разветвленный алкильный радикал с 1-20 атомами углерода, радикал -OR4 или радикал -O-CH2-O-CH2-CH2 -O-CH3;
R10 - которые могут быть одинаковые или разные, обозначают атом водорода, низший алкильный радикал;
R11 обозначает низший алкильный радикал;
причем когда X обозначает связь формулы (e) и R3 обозначает радикал (III), где Y представляет атом кислорода и R8 обозначает атом водорода, тогда q должен быть выше 6.
Изобретение также относится к солям соединений формулы (1), когда R1 или R8 обозначает карбоксильную функцию и когда R8 обозначает аминную функцию, хиральным аналогам и геометрическим изомерам вышеуказанных соединений формулы (I). Когда соединения согласно изобретению находятся в форме солей, за счет присоединения кислоты, то речь идет о фармацевтически или косметически приемлемых солях, получаемых путем присоединения неорганической или органической кислоты, в особенности соляной кислоты, серной кислоты, уксусной кислоты, лимонной кислоты, фумаровой кислоты, гемиянтарной кислоты, малеиновой кислоты и миндальной кислоты. Когда соединения согласно изобретению находятся в форме солей присоединения основания, то речь идет о солях щелочного или щелочноземельного металла или еще о солях цинка или органического амина.
Согласно настоящему изобретению, под низшим алкильным радикалом понимают радикал с 1-12, предпочтительно 1-9, атомами углерода, в особенности метильной, этильный, изопропильный, бутильный, трет.- бутильный, гексильный, нонильный и додецильный радикалы.
Под линейным алкильным радикалом с 1-20 атомами углерода понимают особенно метильный, этильный, пропильный, 2-этил-гексильный, октильный, додецильный, гексадецильный и октадецильный радикалы.
Под разветвленным алкильным радикалом с 1-20 атомами углерода понимают особенно 2-метил-бутильный, 2-метил-пентильный, 1-метил-гексильный, 3-метил-гептильный радикалы.
Из
моногидроксиалкильных радикалов предпочтителен радикал с
2 или 3 атомами углерода, особенно 2-гидрокси-3-этильный, 2- гидрокси-пропильный или 3-гидрокси-пропильный радикал.
Из полигидроксиалкильных радикалов предпочтителен радикал с 3-6 атомами углерода и 2-5 гидроксильными группами, как 2,3- гидрокси-пропильный, 2,3,4-тригидрокси-бутильный, 2,3,4, 5-тетрагидрокси-пентильный радикалы или остаток пентаэритритола.
Из арильных радикалов предпочтителен фенильный радикал, возможно замещенный по крайней мере одним атомом галогена, гидроксильным радикалом или нитро-группой.
Из аралкильных радикалов предпочтителен бензильный или фенетильный радикал, возможно замещенный по крайней мере одним атомом галогена, гидроксилом или нитро-группой.
Из алкенильных радикалов предпочтителен радикал с 1-5 атомами углерода, содержащий одну или несколько этиленовых ненасыщенностей (двойных связей), такой, как особенно аллильный радикал.
Под остатком сахара понимают остаток, происходящий особенно от глюкозы, галактозы или маннозы, или еще глюкуроновой кислоты.
Под остатком аминокислоты понимают особенно остаток, происходящий от лизина, глицина или аспарагиновой кислоты, а под остатком пептида понимают в особенности депептидный или трипептидный остаток, образующийся в результате сочетания аминокислот.
Наконец, под гетероциклом понимают предпочтительно пиперидино-, морфолино-, пирролидино- или пиперазино-радикал, возможно замещенный в положении 4 алкильным радикалом с 1-6 атомами углерода или моно- или полигидроксиалкильным радикалом, как указанные выше.
Под аминоалкильным радикалом понимают радикал предпочтительно с 1-6 атомами углерода, особенно аминометильный, 3-амино-пропильный, 6- амино-гексильный радикалы.
Из алкинильных радикалов предпочтителен радикал с 2-6 атомами углерода, особенно пропаргильный радикал.
Из циклоалифатических радикалов с 3-6 атомами углерода можно назвать предпочтительно циклопропильный радикал и циклогексильный радикал.
Когда радикалы R2 и R9 обозначают атом галогена, то им предпочтительно является атом фтора, брома или хлора.
Из соединений вышеприведенной формулы (I), входящих в
рамки настоящего изобретения, особенно можно
назвать следующие: 4-[4-(1-aдaмaнтил)-3-мeтoкcибeнзoилoкcи]бeнзoйнaя кислота;
(E) -4-[[2-[4-(1-адамантил)-3-гидроксифенил]этенил]]бензойная
кислота;
(E)-4-[[2-[4-(1-адамантил)
-3-пропилоксифенил]этенил]]бензойная кислота;
(E)- 4-[[2-[4-(1-адамантил)-3-гептилоксифенил]этенил]]бензойная кислота;
(Е)-4-[[2-[4-(1-адамантил)-3- метоксифенил]этенил]]бензойная
кислота;
-4-[4-(1-адамантил)-3- метоксиэтоксиметоксифенилэтинил] бензойная кислота;
(E)-4-[[2-[4- (1-адамантил)-3-(5-карбамоилпентилокси)фенил] этенил бензойная кислота;
(E)
-4-[[2-[4-(1-адамантил)-3-метоксифенил]-1- пропенил]]бензойная кислота;
(E)
-4-[[2-[4-(1-адамантил)-3- (3-гидроксипропилокси)фенил]этенил]]бензойная кислота;
(E)
-4- [[2-4-(1-адамантил)-3-(6-гидроксигексилокси)фенил] этенил]]бензойная кислота;
4-[[3-oкco-3-[4-(1-адамантил)-3- мeтoкcифeнил] -1-пpoпeнил] ] бeнзойная кислота;
4-[4-(1-адамантил)
-3-метоксиэтоксиметоксибензоилтио бензойная кислота;
4-[4-(1- адамантил)-3-метоксиэтоксиметоксибензоилокси/бензойная кислота;
4-[4-(1-адамантил)-3-метоксиэтоксиметоксибензамидо]бензойная кислота;
(E)
-4-[2-(4-(1-адамантил)-3-метоксиэтоксиметоксифенил) этенил]бензойная кислота;
(E)
-4-[2-(4-(1-адамантил)-3- метоксиэтоксиметоксифенил)-1-пропенил]бензойная кислота;
(Z)-4- [2-(4-(1-адамантил)-3-метоксиэтоксиметоксифенил)-1-пропенил]бензойная кислота;
4-[4-(1-адамантил)-3- метоксиэтоксиметоксибензоилметилокси] -бензойная кислота;
4-[[3- oкco-3-[4-(1-адамантил)-3-метоксиэтоксиметоксифенил]-1- пропинил] ]бензойная кислота;
4-[[3-гидpoкcи-3-[4-(1-адамантил)-3- метоксиэтоксиметоксифенил] -пропинил]]бензойная кислота;
(E) -4- [[3-oкco-3-[4-(1-адамантил)-3-метоксиэтоксифенил]-1- пропенил]] бензойная кислота;
4-[[3-гидрокси-3-[4-(1-адамантил)- 3-метоксиэтоксиметоксифенил-1-пропенил]]бензойная кислота;
аллил-4-[4-(1-адамантил)-3-метоксиэтоксиметокситиобензамидо]- бензоат;
4-[[3-гидрокси-3-[4-(1-адамантил)-3-метоксифенил] -1- пропинил]]-бензойная кислота;
2-гидрокси-4-[[3-гидрокси-3-[4-(1- адамантил)-3-метоксифенил] -1-пропинил]]бензойная кислота;
2- гидpoкcи-4-[[3-гидpoкcи-3-[4-(1-адамантил)-3-метоксиэтокси- метоксифенил]-1-пропинил]]бензойная кислота;
4-[[3-гидрокси-3- [4-(1-адамантил)-3-метоксиэтоксиметоксифенил]
-1- пропинил]]бензойная кислота;
4-[[3-гидрокси-3-[4-(1-адамантил)- 3-метоксиэтоксиметоксифенил]-1-пропинил]]бензолметанол;
N-этил-4- [4-(1-адамантил)-3-метоксиэтоксиметоксифенилэтинил]-бензамид;
N-(4-гидроксифенил)-4-[4-(1-адамантил)-3-метоксиэтоксиметоксифенилэтинил]- бензамид;
4-[4-(1-адамантил)-3- метоксиэтоксиметоксифенилэтинил]фенол.
Cогласно настоящему изобретению более предпочтительными соединениями формулы (I) являются такие, в случае которых
выполняется одно, и предпочтительно все, из следующих условий: -R1 обозначает радикал -COO-R7 и -CO-R6;
R3 обозначает радикал -Y-(CH2
)p-Y-(CH2)q-R8; -(CH2)p-(Y)n-(CH2)q-R8;
-(CH2)p-(Y)n-(CH2)q-R8.
X обозначает связь формулы (a), (h), (i), (j), (k) или (m).
Ar обозначает радикал формулы (а) или (b).
Предметом настоящего изобретения также являются способы получения соединений формулы (I), в особенности согласно приводимым на фиг. 1, 2, 3 и 4 реакционным схемам.
Так, соединения формулы I(а) могут быть получены (фиг. 1) путем введения во взаимодействие, в безводной среде, в органическом растворителе, предпочтительно в ТГФ, и в присутствии третичного амина (например, триэтиламин или пиридин), активированной формы бензойной кислоты (2), например, хлорангидрида кислоты (3), с фенолом формулы (7).
Соединения формулы I(b) могут быть получены (фиг. 1) путем введения во взаимодействие, в безводной среде, в органическом растворителе, предпочтительно в ТГФ, и в присутствии третичного амино (например, триэтиламин или пиридин), активированной формы бензойной кислоты (2), например, хлорангидрида кислоты (3), с тиофенолом формулы (8).
Соединения формулы I(с) могут быть получены (фиг. 1) путем введения во взаимодействие, в безводной среде, в органическом растворителе, предпочтительно в ТГФ, и в присутствии третичного амина (например, триэтиламин или пиридин), активированной формы ароматической карбоновой кислоты (2), например, хлорангидрида кислоты (3), с амино-соединением формулы (9).
Соединения формулы I(d) могут быть получены (фиг. 1) из соединений формулы I(с) путем взаимодействия с реагентом Лавессона.
Соединения формулы I(е) могут быть получены (фиг. 1) из бензиловых спиртов (5) путем превращения в бром-производные (6) с помощью трибромида фосфора, затем введения во взаимодействие, в присутствии карбоната калия или гидрида щелочного металла (гидрид натрия) или за счет переноса фазы, используя, например, тетрабутиламмонийбромид в качестве четвертичной соли, с соединением формулы (10), содержащим гидроксильную или тиольную или амино-функцию.
Соединения формулы I(f) могут быть получены (фиг. 2) из ацетофенонов (11) путем превращения в бром-производное (12) с помощью брома, затем путем введения во взаимодействие, в присутствии карбоната калия или гидрида щелочного металла (гидрид натрия) или за счет переноса фазы, используя, например, тетрабутиламмоний-бромид в качестве четвертичной соли, с соединением формулы (10), содержащим гидроксильную или тиольную или амино-функцию. Соединения формулы I(g) могут быть получены из производного формулы I(f) путем реакции с боргидридом натрия в спирте.
Соединения формулы I(h) могут быть получены (фиг. 2) из ацетофенонов (11) путем введения во взаимодействие с ароматическими альдегидами формулы (13) в присутствии метилата натрия или гидроксида натрия в спирте, таком, как метанол. Из этих соединений путем взаимодействия их с боргидридом натрия в присутствии трихлорида цезия получают соединения формулы I(i).
Соединения формулы I(j) могут быть получены (фиг. 2) из ароматических альдегидов формулы (4) путем взаимодействия их с триметилсилилацетиленидом лития, затем путем удаления защитной группы с помощью тетрабутиламмонийфторида для получения альфагидроксиацетиленовых производных (14). Затем осуществляют реакцию сочетания с галогенпроизводными (15), предпочтительно иодопроизводными, в присутствии катализатора на основе палладия (например, как бис-(трифенилфосфин)-палладий-(П)- хлорид) в растворителе, таком, как триэтиламин. Oкисление этих соединений с помощью либо пиридинийхромата, либо оксида марганца или реагента Swern приводит к производным формулы 1(k).
Соединения формулы I(m) могут быть получены (фиг. 3) из ароматических альдегидов формулы (4) путем взаимодействия их с тетрабромидом углерода и трифенилфосфином с получением производных 2', 2'-дибромстирола (16), которые затем превращают в ацетиленовые производные (17) путем воздействия н-бутиллития в растворителе, таком, как ТГФ. После этого проводят реакцию сочетания с галогенпроизводными (15), предпочтительно иодпроизводными, в присутствии катализатора на основе палладия (например, как бис-(трифенилфосфин) палладий-(1)-хлорид) в растворителе, таком, как триэтиламин.
Соединения формулы I(p) и формулы 1(h) могут быть получены (фиг. 3), соответственно, из ароматических альдегидов формулы (4) и ацетофенонов формулы (11) по реакции Хорнера-Эммонса или Виттига с ароматическими фосфонатами формулы (18) или ароматическими фосфинами.
Когда R3 обозначает радикалы -(CH2)p-(Y)n-(CH2)q-R8 или
-CH=CH-(CH2)-R8, то соединения могут быть получены (фиг. 4, где p равно 2) из фенолов формулы (19), которые превращают в
трифлатные производные формулы (20), затем проводят
нуклеофильное замещение в присутствии катализатора на основе палладия согласно общим условиям, описанным в следующих литературных источниках:
-S. Cacchi и др.. Tetrahedron Letter, 1986, 2],
3931-3934.
-W.J. Scott и др., J.Org.Chem., 1985, 50, 2302-2308.
-J.K. Stille и др., J.Am.Chem.Soc., 1987, 109, 5478-5486.
Когда R1 обозначает радикал -COOH, соединения получают, защищая R1 защитной группой алкильного, аллильного, бензильного или трет.-бутильного типа.
Удаление защитных групп (переход к свободной
форме) можно осуществлять:
- в случае алкильной защитной группы - с помощью гидроксида натрия или гидроксида лития в спирте, таком,
как метанол, или в ТГФ;
- в случае аллильной
защитной группы - с помощью катализатора, такого, как некоторые комплексы переходных металлов, в присутствии вторичного амина, такого, как
морфолин;
- в случае бензильной защитной группы
- путем дебензилирования в присутствии водорода и при использовании катализатора, такого, как палладий-на- угле;
- в случае защитной
группы трет.-бутильного типа - с помощью
триметилсилилиодида.
Предметом настоящего изобретения также являются соединения вышеуказанной формулы (I) в качестве лекарственного средства.
Эти соединения обладают
активностью в тесте дифференциации клеток (F9) эмбриональной тератокарциномы мыши (Cancer
Research 43, с. 5268, 1983) и/или в тесте по
ингибированию орнитиндекарбоксилазы после индуцирования
с помощью ТРА у мыши Cancer Research, 38, с. 793-801, 1978). Эти тесты показывают активность этих соединений, соответственно, в областях
дифференциации и пролиферации клеток. В тесте по дифференциации
клеток (F9) можно оценить агонистическую активность как антагонистическую активность в отношении рецепторов ретиноевой кислоты. В самом
деле, антагонист является неактивным, когда он один в этом тесте,
однако, он ингибирует частично или полностью воздействие, оказываемое ретиноидным агонистом на морфологию и на секрецию
плазминогенного активатора. Некоторые из этих соединений также обладают
активностью в тесте, который заключается в идентификации молекул-антагонистов RARs, таком, который описывается в заявке на
патент Франции 95-07302, поданной заявителем 19 июня 1995 г. Этот тест
включает следующие стадии: (i) на участок кожи млекопитающего топически наносят достаточное количество молекулы-агониста RAR,
(ii) этому же самому млекопитающему или на тот же самый участок кожи
млекопитающего, до, во время или после стадии (i), системным или топическим путем вводят молекулу, которая способна обладать
антагонистической активностью в отношении RARs; и (iii) оценивают ответ на
таким образом обработанном участке кожи млекопитающего. Так, ответ на нанесение топическим путем на ухо млекопитающего
молекулы- агониста RARs, который соответствует увеличению толщины этого уха,
может быть ингибирован за счет введения системным или топическим путем молекулы-антагониста RARs.
Соединения согласно изобретению особенно хорошо пригодны в следующих областях лечения
(обработки):
1) для лечения дерматологических заболеваний, связанных с нарушением кератинизации при
дифференциации и пролиферации, особенно для лечения обыкновенных, комедоновых, полиморфных,
эритематозных акне; узелковых, конглобатных (conglobata) акне; старческих акне; вторичных акне, таких как
солнечная, медикаментозная или профессиональная акне;
2) для лечения других типов
нарушений кератинизации, особенно ихтиозов, ихтиозоподобных состояний, болезни Дарье, паль-моплантарных
кератодермий, лейкоплазий и лейкоплазоподобных состояний, кожного лишая или лишая слизистых
оболочек (как слизистая оболочка рта);
3) для лечения других дерматологических заболеваний,
связанных с нарушением кератинизации с воспалительным и/или иммуноаллергическим компонентом, и
особенно любых форм псориаза, как кожный, ногтевой псориаз или псориаз слизистых оболочек, и даже
псириатического ревматизма, или еще кожной атопии, такой как экзема, или респираторной атопии, или еще
десенной гипертрофии; соединения также можно применять в случае некоторых воспалительных
заболеваний, протекающих без нарушения кератинизации;
4) для лечения дермических или эпидермических
пролифераций, как доброкачественных, так и злокачественных, вирусного или нет
происхождения, таких, как обычные бородавки, плоские юношеские бородавки и бородавкообразная эпидермодисплазия, ротовые
или фторидные папилломатозы; и пролифераций, которые могут быть вызваны
ультрафиолетовым излучением, особенно в случае базо- и спиноцеллюарных эпителиом;
5) для лечения других
дерматологических нарушений, таких, как буллезные дерматозы и коллагеновые болезни;
6) для лечения некоторых офтальмологических расстройств, особенно корнеопатий;
7) для регенерации
или борьбы против старения кожи, вызываемого за счет фотоиндукции или вследствие
возрастных факторов, или для уменьшения пигментаций и актинических кератозов, или любых патологий, ассоциированных с
хронологическим (возрастным) или актиническим старением;
8) для
профилактики или вылечивания стигматов эпидермической и/или дермической атрофии, вызываемой локальными или системными
кортикостероидами, или любой другой формы кожной атрофии;
9) для
профилактики или лечения нарушений зарубцовывания или для профилактики или регенерации рубцов на коже при ее растяжении;
10) для борьбы против расстройств жировой функции, таких, как
гиперсеборея акне или простая себорея;
11) для лечения или профилактики канцерозных или предканцерозных состояний;
12) для лечения воспалительных заболеваний, таких, как артрит;
13) для лечения любого заболевания вирусного происхождения в случае кожи или общего типа;
14) для профилактики или
лечения алопеции;
15) для лечения дерматологических или
общего характера заболеваний с иммунологическим компонентом;
16) для лечения заболеваний сердечно-сосудистой системы, таких,
как артериосклероз.
В вышеуказанных областях терапии, соединения согласно изобретению можно предпочтительно использовать в сочетании с другими соединениями, обладающими активностью ретиноидного типа, с витаминами D или их производными, с кортикостероидами, с веществами против свободных радикалов, альфа- гидрокси- или альфа-кето-кислотами или их производными, или еще с блокаторами ионных каналов. Под витаминами D или их производными понимают, например, производные витамина D2 или D3 и в особенности .1,25-дигидрокси-витамин D3. Под веществами против свободных радикалов понимают, например, альфа-токоферол, дисмутаза-пероксид, убиквинол или некоторые хелаты металлов. Под альфа-гидрокси- или альфа-кето-кислотами или их производными понимают, например, молочную, яблочную, лимонную, гликолевую, миндальную, винную, глицериновую или аскорбиновую кислоты или их соли, амиды или сложные эфиры. Наконец, под блокаторами ионных каналов понимают, например, Миноксидил (2, 4- диамино-6-пипериди-но-пиримидин-3-оксид) и его производные.
Предметом настоящего изобретения также являются лекарственные композиции, содержащие по крайней мере одно соединение формулы (I), такое, как указанное выше, один из его оптических или геометрических изомеров или одну из его солей.
Предметом настоящего изобретения, таким образом, является новая лекарственная композиция, предназначенная особенно для лечения вышеуказанных заболеваний, отличающаяся тем, что она включает в фармацевтически приемлемом носителе, совместимом с используемым для этой композиции способом введения, по крайней мере одно соединение формулы (I), один из его оптических или геометрических изомеров или одну из его солей.
Введение соединений согласно изобретению можно осуществлять энтеральным, парентеральным, топическим или окулярным путем.
При введении энтеральным путем лекарственные средства могут находиться в виде таблеток, желатиновых капсул (с лекарством), драже, сиропов, суспензий, растворов, порошков, гранулятов, эмульсий, микросфер или наносфер, или липидных или полимерных пузырьков, позволяющих происходить контролируемому высвобождению лекарства. При введении парентеральным путем композиции могут находиться в форме растворов или суспензий для перфузии или для инъекции.
Соединения согласно изобретению обычно вводят при суточной дозе около 0,01-100 мг/кг массы тела, за 1-3 приема.
При введении топическим путем фармацевтические композиции на основе соединений согласно изобретению в основном предназначены для обработки кожи и слизистых оболочек и в этом случае могут находиться в виде мазей, кремов, молочка, унгиентов, порошков, пропитанных тампонов, растворов, гелей, препаратов для пульверизации, лосьонов или суспензий. Они также могут быть в форме микросфер или наносфер или липидных или полимерных пузырьков или полимерных "лоскутов" и гидрогелей, которые позволяют происходить контролируемому высвобождению лекарства. Эти композиции при введении топическим путем, кроме того, могут быть в безводной форме или в водной форме, в зависимости от клинического показания.
При введении окулярным путем эти композиции представляют собой в основном глазные капли.
Эти композиции для топического или окулярного применения содержат по крайней мере одно соединение формулы (I), такое, как указанное выше, или один из его оптических или геометрических изомеров или еще одну из его солей, в концентрации предпочтительно 0,001-5 мас. %, в расчете на общую массу композиции.
Соединения формулы (I) согласно изобретению также находят применение в области косметики, в особенности в случае гигиены тела и для ухода за волосами и особенно для обработки кожи с тенденцией к акне, для нового роста волос, против выпадения волос, для борьбы против жирного внешнего вида кожи или волос, при защите от вредоносных воздействий солнечных лучей и для обработки физиологически сухих кож, для профилактики и/или для борьбы против фотоиндуцируемого старения кожи.
В области косметики соединения согласно изобретению, кроме того, предпочтительно можно применять в сочетании с другими соединениями, обладающими активностью ретиноидного типа, с витаминами D или их производными, с кортикостероидами, с веществами против свободных радикалов, с альфа-гидрокси- или альфа-кето-кислотами или их производными, или еще с блокаторами ионных каналов, причем все эти различные продукты являются такими, как вышеуказанные.
Настоящее изобретение, следовательно, также относится к косметрической композиции, отличающейся тем, что она включает в косметически приемлемом носителе, который пригоден для топического применения, по крайней мере одно соединение вышеуказанной формулы (I) или один из его оптических или геометрических изомеров или одну из его солей, причем эта косметическая композиция может быть в виде крема, молочка, лосьона, геля, микросфер или наносфер, или липидных или полимерных пузырьков, мыла или шампуня.
Концентрация соединения формулы (I) в косметических композициях согласно изобретению предпочтительно составляет 0,001-3 мас.%, в расчете на всю совокупность композиции.
Лекарственные
и косметические
композиции согласно изобретению, кроме того, могут содержать инертные или даже фармакологически или косметически активные добавки или сочетания этих добавок, и особенно: смачиватели;
диспигментирующие
агенты, такие как гидрохинон, азелаиновая кислота, кофеиновая кислота или койевая кислота;
пластификаторы; гидратирующие агенты, как глицерин, полиэтилен-гликоль с
молекулярной массой 400,
тиаморфолинон и его производные или мочевина;
антисеборейные агенты или агенты против акне, такие как s-карбоксиметилцистеин, s-бензил-цистеамин, их соли или их производные,
или бензоилпероксид;
антибиотики, как эритромицин и его сложные эфиры, неомицин, клиндамицин и его сложные эфиры; тетрациклины; противогрибковые агенты, такие, как кетоконазол или полиметилен-4,
5-изотиазолид-3-оны;
благоприятствующие новому росту волос агенты, как миноксидил (2,4-диамино-6-пиперидино-пиримидин-3- оксид) и его производные, диазоксид (7-хлор-3-метил-1,2,
4- бензотиадиазин-1,1-диоксид) и
Фенитоин (5,5-дифенил-имидазолидин-2,4- дион); противовоспалительные агенты нестероидного типа; каротиноиды и особенно β- каротин; агенты против псориаза,
такие, как антралин и его производные;
и, наконец, эйкоза-5,8,11,14-тетраиноевая и эйкоза- 5,8,11-трииноевая кислота, их сложные эфиры и амиды.
Композиции согласно изобретению также могут содержать улучшающие вкус агенты, консерванты, такие, как сложные эфиры п-гидроксибензойной кислоты, стабилизаторы, регулирующие влажность агенты, регулирующие pH агенты, модификаторы осмотического давления, эмульгаторы, УФ-А и УФ-Б фильтры, антиоксиданты, такие, как альфа-токоферол, бутилгидроксианизол или бутилгидрокситолуол.
Ниже приводятся в качестве иллюстрации и не носящие никакого ограничительного характера в отношении объема защиты изобретения, несколько примеров получения активных соединений формулы (I) согласно изобретению, также, как различных конкретных формулировок на основе таких соединений.
Пример 1: 4-[4-(1-Адамантил)-3-метоксибензоилокси]бензойная кислота
(а) 2-(1-Адамантил)-5-бромфенол
В
колбу вводят 17 г (0,1 моль) 3- бромфенола, 15,2 г (0,1 моль)
1-адамантанола и 50 мл дихлорметана. Прикапывают 5 мл концентрированной серной кислоты и перемешивают в течение 24 часов при комнатной
температуре. Реакционную среду выливают в воду со льдом,
нейтрализуют гидрокарбонатом натрия, экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния, выпаривают.
Полученный остаток очищают путем хроматографии на колонке с
диоксидом кремния, элюируя смесью дихлорметана к гексаном в соотношении 50:50. Получают 15,2 г (50%) целевого фенола с т.пл. 112- 114oC.
(б)
4-(1-Адамантил)-1-бром-3-метокси-бензол
В трехгорлую колбу вводят 1,6 г (53 ммоль) гидрида натрия (80%-ный в масле) и 50 мл ДМФ. Прикапывают раствор 15 г (49
ммоль) 2-(адамантил)-5-бромфенола
в 100 мл ДМФ и перемешивают вплоть до прекращения выделения газов. Затем при охлаждении на бане со льдом добавляют 3 мл (40 ммоль) метилиодида и перемешивают в
течение 6 часов при комнатной
температуре. Реакционную среду выливают в воду, экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния, выпаривают. Полученный остаток
порошкуют в гексане,
отфильтровывают, высушивают. Получают 12,6 г (80%) целевого продукта с т.пл. 155-160oC.
(в) 4-(1-Адамантил)-3-метоксибензойная кислота
Вышеполученное соединение (11,
3 г, 35 ммоль) растворяют в 200 мл ТГФ. Полученный раствор прикапывают к магнию (1,3 г, 52,5 ммоль) и добавляют кристаллик иода. По окончании добавления кипятят с
обратным холодильником в течение двух
часов, охлаждают до -78oC и в течение 1 часа пропускают ток диоксида углерода. Реакционную среду оставляют стоять для повышения температуры до
комнатной, затем выливают в водный насыщенный
раствор хлорида аммония, экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния, выпаривают. Полученный остаток
очищают путем хроматографии на колонке с диоксидом
кремния, элюируя смесью дихлорметана с диэтиловым эфиром в соотношении 90:10. Получают 5,1 г (51%) целевого продукта с т.пл. 259-260o
C.
(г)
4-(Адамантил)-3-метоксибензоилхлорид
В колбу вводят 2,1 г (7,34 ммоль) 4-(1-адамантил)-3-мето-ксибензойной кислоты и 20 мл тионилхлорида и кипятят с обратным
холодильником вплоть до
прекращения выделения газов. Реакционную среду выпаривают досуха и получают 2,2 г (100%) хлор-ангидрида кислоты, который используют таким, какой есть, в следующей стадии
синтеза.
(д)
Бензил-4-[4-(1-адамантил)-3- метоксибензоилокси]бензоат
В колбу вводят 1,67 г (7,34 ммоль) бензил-4-гидроксибензоата, 1 мл (7,34 ммоль) триэтиламина и 40 мл ТГФ.
Прикапывают раствор 2,2 г (7,
34 ммоль) 4-(1-адамантил)-3- метоксибензоил-хлорида и перемешивают при комнатной температуре в течение 8 часов. Реакционную среду выливают в воду, экстрагируют диэтиловым
эфиром, органическую фазу
декантируют, сушат над сульфатом магния, выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью дихлорметана с гексаном в
соотношении 60: 40. После
выпаривания растворителей получают 3,1 г (85%) целевого сложного бензилового эфира с т.пл. 128-129oC.
(е)
4-[4-(1-Адамантил)-3-метоксибензоилокси]бензойная кислота
В реактор вводят 1,8 г (3,6 ммоль) бензил 4-[4-(1-адамантил)-3- метоксибензоилокси] ] бензоата и 50 мл диоксана. После продувки
азотом вводят 1 г палладия-на-угле (10%), затем водород под давлением 7,
5 бара. Перемешивают при комнатной температуре в течение 3 часов, катализатор отфильтровывают, фильтрат выпаривают. Полученный
остаток порошкуют в 40 мл диэтилового эфира и отфильтровывают. Получают 1,
1 г (71%) целевой кислоты с т.пл. 273-274oC.
Пример 2 :
(E)-4-[[2-[4-(1-Адамантил)-3- гидроксифенил]этенил]]-бензойная кислота
(а)
4-(1-Адамантил)-1-бром-3-трет.-бутилдиметилсилилоксибензол
В колбу последовательно вводят 15,36 г (50
ммоль) 2-(1- адамантил)-5-бромфенола, 150 мл ДМФ, 7,7 мл (55 ммоль) триэтиламина, 305 мг
4-диметиламинопиридина и добавляют раствор 8,3 г (55 ммоль) трет.-бутилдиметилсилиланхлорида и перемешивают
при комнатной температуре в течение 12 часов. Реакционную среду выливают в воду,
экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния, выпаривают. Полученное
твердое вещество перекристаллизуют из ацетона и получают 19,9 г (94%) целевого
продукта с т.пл. 86-88oC.
(б) 4-(1-Адамантил)-3-трет.
бутилдиметилсилилоксибензолкарбоксальдегид
Следуя методике примера 6 (а), но исходя из 19,8 г ( 47 ммоль)
4-(1-адамантил) -1-бром-3-трет.-бутилдиметилсилилокси-бензола, получают 14,8 г (85%)
целевого альдегида с т.пл. 114-116oC.
(в) Этил-(E)-4
-[[2-[4-(1-адамантил)-3-гидроксифенил]этенил]]-бензоат
В трехгорлую колбу и в токе азота вводят 724 мг (24
ммоль) гидрида натрия (80%-ный в масле) и 50 мл ТГФ. Прикапывают раствор из 7,4 г
(20 ммоль) 4-(1-адамантил)-3- трет. -бутилдиметил-силилоксибензолкарбоксальдегида, 7,2 г (24 ммоль)
диэтил-4-этоксикарбонилбензилфосфоната и 885 мг 12-краун-6 в 150 мл ТГФ и перемешивают при комнатной
температуре в течение 8 часов. Реакционную среду выливают в воду, экстрагируют диэтиловым эфиром,
органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Полученный остаток очищают
путем хроматографии на колонке с диоксидом кремния, элюируя смесью этилацетата с гептаном в
соотношении 5:95. После выпаривания растворителей получают 4,8 г (46%)
этил-(E)-4-[[2-[4-(1-адамантил)-3-трет. -бутилдиметилсилилоксифенил] этенил] ] бензоата с т.пл. 140-141oC и 2,22 г
(28%) этил-(E)-4-[[2-4-(1-адамантил)-3-гидроксифенил/этенил] ]- -бензоата
с т.пл. 228-229oC.
(г) (E)-4-[[2-[4-(1-Адамантил)-3- гидроксифенил]этенил]]бензойная кислота
В колбу вводят 258 мг (0,5 ммоль)
этил-(E)-[[2-[4-(1-адамантил)-3- гидроксифенил] этенил] ] бензоата, 105 мг (2,5 ммоль) гидроксида лития и 10 мл ТГФ. Перемешивают при комнатной температуре в
течение 12 часов, реакционную среду
выливают в воду, нейтрализуют соляной кислотой, экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Полученный
остаток порошкуют в смеси
дихлорметана с гексаном, отфильтровывают и высушивают. Получают 95 мг (51%) целевой кислоты с т.пл. 334-335oC.
Пример 3: (E)-[[4-[2-(4-Адамантил)
-3-пропилоксифенил]-этенил]]бензойная кислота
(а) Этил-(E) -4-[[2-[4-(1-адамантил)-3-пропилоксифенил]этенил]]-бензоат
В колбу вводят 66 мг (2,2 ммоль) гидрида натрия (80%-ный в
масле) и 10 мл ДМФ. Прикапывают раствор 805 мг (2 ммоль) этил-(E)-4-[[2-[4- (1-адамантил)-3-гидроксифенил] этенил] ]бензоата в 20 мл ДМФ и перемешивают вплоть до прекращения выделения газов. Затем
добавляют 200 мкл (2,2 ммоль) 1-бромпропана и перемешивают при комнатной температуре в течение 8 часов, реакционную среду выливают в воду, экстрагируют диэтиловым эфиром, органическую фазу
декантируют,
сушат над сульфатом магния и выпаривают. Полученный остаток порошкуют в гептане, отфильтровывают и высушивают. Получают 826 мг (93%) целевого сложного этилового эфира с т.пл. 143-144oC.
(б) (E)-4-[[2-[4-(1-Адамантил)-3- пропилоксифенил] этенил] ]-бензойная кислота
Согласно методике примера 2(г), но исходя из 818 мг (1,84 ммоль) вышеполученного
сложного этилового
эфира, получают 390 мг (51%) целевой кислоты с т.пл. 291- 293oC.
Пример 4: (E)-4-[[2-[4-(1-Адамантил)-3-гептилоксифенил] этенил]]бензойная кислота
(а)
Этил-(E)-4-[[2-[4-(1-адамантил)-3- гептилоксифенил]этенил]]-бензоат
Следуя методике примера 3 (а), путем взаимодействия 805 мг (2 ммоль)
этил-(E)-4-[[2-[4-(1-адамантил)-3- гидроксифени]
этенил]]бензоата с 346 мкл (2,2 ммоль) 1-бромгептана, получают 872 мг (87%) целевого сложного этилового эфира с т.пл. 123- 124oC.
(б)
(E)-4-[[2-[4-(1-Адамантил)-3- гептилоксифенил]этенил]]бензойная кислота
Следуя методике примера 2(г), но исходя из 865 мг (1,73 ммоль) вышеполученного сложного этилового эфира,
получают 620
мг (76%) целевой кислоты с т.пл. 262- 263oC.
Пример 5: (E)-[[4-[2-(1-Адамантил)-3-метоксифенил]этенил]] бензойная кислота
(а)
Этил-(E)-4-[[2-[4-(1-адамантил)-3- метоксифенил]этенил]]бензоат
Следуя методике примера 3(а), путем взаимодействия 805 мг (2 ммоль) этил-(E)-4-[[2-[4-(1-адамантил)-3- гидроксифенил]этенил]]
бензоата с 137 мкл (2,2 ммоль) метилиодида получают 768 мг (92%) целевого сложного этилового эфира с т.пл. 152- 153oC.
(б)
(E)-4-[[2-[4-(1-Адамантил)-3- метоксифенил]этенил]]бензойная кислота
Следуя методике примера 2(г), но исходя из 763 мг (1,83 ммоль) вышеполученного сложного этилового эфира, получают 615 мг
(87%) целевой кислоты с т.пл. 284-286oC.
Пример 6: 4-[[2-[4-(1-Адамантил)-3-метоксиэтоксиметоксифенил] этинил]] бензойная кислота
(а)
4-(1-Адамантил)-3-метоксиэтоксиметоксифенилкарбоксальдегид
В трехгорлую колбу и в токе азота вводят 18 г (45,5 ммоль) 4-(1- адамантил)-1-бром-3-метоксиэтоксиметоксибензола и 100 мл ТГФ. При
-78oC прикапывают 20 мл 2,5 М раствора н-бутиллития в гексане и перемешивают в течение 30 минут. Затем прикапывают 3,5 мл ДМФ и оставляют стоять до повышения температуры до комнатной.
Реакционную среду выливают в водный раствор хлорида аммония, экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Полученный остаток очищают путем
хроматографии на колонке с диоксидом кремния, элюируя смесью дихлорметана с гептаном в соотношении 30:70. После выпаривания растворителей получают 12,7 г (81%) целевого альдегида с т.пл. 87-89oC.
(б) 2',2'-Дибром-4-(1-адамантил)-3-метоксиэтоксиметоксистирол
В колбу вводят 5 г (14,5 ммоль) 4-(1-адамантил)-3-метоксиэтоксиметоксифенилкарбоксальдегида и 30 мл
дихлорметана. Добавляют последовательно 9,6 г (29 ммоль) тетрабромида углерода, 7,6 г (29 ммоль) трифенилфосфина и 1,9 г (29 ммоль) цинкового порошка и перемешивают в течение двух часов при комнатной
температуре. Реакционную среду выпаривают и полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью дихлорметана с гептаном в соотношении 40:60. Получают 3 г
(40%) целевого продукта.
(в) 4-(1-Адамантил)-3- метоксиэтоксиметоксифенилацетилен
В трехгорлую колбу и в токе азота вводят 3 г (6 ммоль) 2',2'-дибром-4-(
1-адамантил)-3- метоксиэтоксиметоксистирола и 50 мл ТГФ. При -78oC прикапывают 4,8 мл (12 ммоль) 2,5 М раствора н-бутиллития в гексане и оставляют стоять до повышения температуры до
комнатной. Реакционную среду выливают в воду, экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Остаток порошкуют в гептане, отфильтровывают и
высушивают. Получают 1,5 г (73%) целевого ацетиленового производного с т. пл. 86-88oC. (г) Метил-4-[[2-[4-(1-адамантил) -3-метоксиэтоксиметоксифенил]-этинил]]бензоат
В трехгорлую
колбу вводят 1,3 г (3,8 ммоль) метил-4-(1-адамантил)-3- метоксиэтоксифенилацетилена, 1 г (3,8 ммоль) метил-4-иодбензоата и 15 мл триэтиламина. Реакционную среду продувают азотом в течение 15 минут и
добавляют 100 мг иодида меди и 260 мг (0,37 ммоль) бис- (трифенилфосфин)-палладий-(П)-хлорида и перемешивают при комнатной температуре в течение 12 часов. Реакционную среду выпаривают досуха,
обрабатывают водой и диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя
смесью дихлорметана с гептаном в соотношении 20:80. После выпаривания растворителей получают 1,3 г (72%) целевого сложного метилового эфира.
(д)
4-[[2-[4-(1-Адамантил)-3- метоксиэтоксиметоксифенил]этинил]]-бензойная кислота
Следуя методике примера 2(г), но исходя из 400 мг (0,8 ммоль) вышеполученного сложного метилового эфира,
получают 250 мг (64%) целевой кислоты с т. пл. 215-217oC.
Пример 7: (E)-4-[[2-[4-(1-Адамантил)-3-(5-карбамоилпентилокси)фенил] этенил]] -бензойная кислота
(а)
Этил-(E)-4-[[2-[4-(1-адамантил)-3-(5- карбамоилпентилокси-фенил] этенил]]бензоат
В колбу вводят 805 мг (2 ммоль) этил-(E)-4-[[2-[4-(1-адамантил)-3- гидроксифенил] этенил] ] бензоата, 388 мг
(2 ммоль) 6-бром-гексиламида, 331 мг карбоната калия и 30 мл ДМФ. Нагревают при 70oC в течение 3 дней, реакционную среду выливают в воду, экстрагируют диэтиловым эфиром, органическую фазу
декантируют, сушат над сульфатом магния и выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью этилацетата с гептаном в соотношении 80:20. После
выпаривания растворителей получают 586 мг (57%) целевого сложного этилового эфира с т.пл. 160-161oC.
(б) (E)-4-[[2-[4-(1-Адамантил)-3-(5-карбамоилпентилокси)
фенил]-этенил]]
бензойная кислота
В колбу вводят 575 мг (1,1 моль) вышеполученного сложного этилового эфира и 20 мл этанола. Добавляют 483 мг (12 ммоль) гидроксида натрия и нагревают в
течение 2 часов при
40oC. Реакционную среду выливают в воду, подкисляют до pH 1 с помощью соляной кислоты, экстрагируют этилацетатом, органическую фазу декантируют, сушат над сульфатом
магния и выпаривают.
Полученное твердое вещество порошкуют в минимальном количестве диэтилового эфира, отфильтровывают и высушивают. Получают 465 мг (88%) целевой кислоты с т.пл. 261-262o
C.
Пример 8: (E)-4-[[2-[4-(l-Aдaмaнтил)-3-мeтoкcифeнил]-1- пропенил]]бензойная кислота
(а) 4-(1-Адамантил)-3-метоксиацетофенон
В трехгорлую колбу и в токе азота
вводят 7,3 г (25,5
ммоль) 4-(1-адамантил)-3- метоксибензойной кислоты и 300 мл безводного диэтилового эфира. При -20oC прикапывают 32 мл (51 ммоль) 1,6 М раствора метиллития в эфире, затем
перемешивают в
течение трех часов при комнатной температуре. Реакционную среду выливают в насыщенный водный раствор хлорида аммония, органическую фазу декантируют, сушат над сульфатом магния и
выпаривают. Полученное
твердое вещество порошкуют в гексане, отфильтровывают и высушивают. Получают 5,05 г (70%) целевого аце- тофенона с т.пл. 101-102oC.
(б)
(E)-4-[[2-[4-(1-Адамантил)
-3-метоксифенил]-1-пропенил]]-бензойная кислота
Следуя методике примера 2 (в), путем взаимодействия 1,9 г (6,6 ммоль) 4-(1-адамантил)-3-метоксиацетофенона с 2,2 г
(7,33 ммоль)
диэтил-4- этоксикарбонилбензилфосфоната получают 112 мг (E)-4-[[2-[4-(1- адамантил)-3-метоксифенил]-1-пропенил]]бензойной кислоты с т.пл. 243-245oC.
Пример 9:
(E)-4-[[2-[4-(1-Aдaмaнтил)-3-(3-гидpoкcипpoпилокси) фенил]этенил]]бензойная кислота
(а) Метил-(E)-4-[[2-[4-(1-адамантил)-3-(3- гидроксипропилокси)-фенил] этенил]]бензоат
Следуя
методике примера 7 (а), путем взаимодействия 1 г (2,6 ммоль) метил-(E)-4-[[2-[4-(1- адамантил)-3-гидроксифенил] этенил] ] бензоата с 537 мг (3,8 ммоль) 3- бром-пропанола получают 472 мг (41%)
целевого
сложного метилового эфира с т.пл. 163-165oC.
(б) (E)-4-[[2-[4-(1-Адамантил)-3-(3- гидроксипропилокси)фенил]-этенил]] бензойная кислота
Следуя методике
примера 7(б),
но исходя из 464 мг (1,04 ммоль) вышеполученного сложного метилового эфира, получают 364 мг (84%) целевой кислоты с т.пл. 268-270oC.
Пример 10:
(E)-4-[[2-[4-(l-Aдaмaнтил)-3-(6-гидpoкcигeксилокси) фенил]этенил]]бензойная кислота
(а) Этил-(E)-4-[[2-[4-(1- адамантил)-3-(6-гидроксигексилокси)-фенил] этенил]]бензоат
Следуя
методике примера 7 (а), путем взаимодействия 1 г 2,5 ммоль) метил-(E) -4-[[2-[4-(1-адамантил)-3-гидроксифенил] -этенил] ] бензоата с 710 мг (3,8 ммоль) 6-бром-гексанола получают 1,12 г (89%) целевого
сложного метилового эфира с т.пл. 105-107oC.
(б) (E) -4-[[2-[4-(1-Адамантил)-3-(6-гидроксигексилокси)фенил]- этенил]] бензойная кислота
Следуя методике примера
7(б),
но исходя из 1,09 г (2,23 ммоль) вышеполученного сложного метилового эфира, получают 943 мг (89%) целевой кислоты с т.пл. 238- 240oC.
Пример 11:
4-[[3-Окco-3-[4-(1-aдaмaнтил)-3-мeтoкcифeнил]-1- пропенил]] бензойная кислота
(а) 2-(1-Адамантил)-5-бромфенол
В колбу вводят 41 г (0,237 ммоль) 3-бромфенола, 38 г (0,25 моль)
адамантан-1-ола и 500 мл дихлорметана. Добавляют 12,5 мл концентрированной серной кислоты и перемешивают при комнатной температуре в течение 8 часов. Реакционную среду выливают в воду, органическую
фазу декантируют, промывают водой, сушат над сульфатом магния и выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя дихлорметаном. После выпаривания
растворителей получают 45 г (62%) целевого продукта с т. пл. 112-114oC.
(б) 2-(1-Адамантил)-5-броманизол
В трехгорлую колбу и в токе азота вводят 20 г (65 ммоль)
2-(1-адамантил)-5-бром-фенола и 700 мл ДМФ. Добавляют маленькими порциями 1,9 г (65 ммоль) гидрида натрия (80%-ный в масле) и перемешивают вплоть до прекращения выделения газов. Затем добавляют 5,3
мл
(84,5 ммоль) иодметана и перемешивают в течение трех часов при комнатной температуре. Реакционную среду выливают в воду, экстрагируют диэтиловым эфиром, органическую фазу декантируют, промывают
водой,
сушат над сульфатом магния и выпаривают. Получают 20,8 г (100%) целевого продукта.
(в) 4-(1-Адамантил)-3-метоксибензойная кислота
Вышеполученное соединение (11,3 г, 35
ммоль)
растворяют в 200 мл ТГФ. Полученный раствор прикапывают к магнию (1,3 г, 52,5 ммоль) и добавляют кристаллик иода. По окончании добавления, кипятят с обратным холодильником в течение двух часов,
охлаждают до -78oC и в течение 1 часа пропускают ток диоксида углерода. После повышения температуры до комнатной, реакционную среду выливают в водный насыщенный раствор хлорида аммония,
экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью
дихлорметана с диэтиловым эфиром в соотношении 90: 10. Получают 5,1 г (51%) целевой кислоты с т.пл. 259-260oC.
(г) 4-(1-Адамантил)-3-метоксиацетофенон
В трехгорлую
колбу и в токе азота вводят 2,8 г (10 ммоль) 4-(1-адамантил)-3-метоксибензойной кислоты и 100 мл безводного диэтилового эфира. При -20oC прикапывают 15,3 мл (25 ммоль) 1,6 М раствора
метиллития в эфире, затем перемешивают в течение трех часов при комнатной температуре. Реакционную среду выливают в насыщенный водный раствор хлорида аммония, органическую фазу декантируют, сушат над
сульфатом магния и выпаривают. Получают 2,5 г (90%) целевого ацетофенона с т.пл. 89-90oC.
(д) 4-[[3-Окco-3-[4- (1-адамантил)-3-метоксифенил]-1-пропенил]]-бензойная
кислота
В колбу вводят 1,4 г (4,9 ммоль) 4-(1-адамантил)-3-метокси-фенона, 810 мг (4,9 ммоль) 4-формилбензойной кислоты и 100 мл метанола. Добавляют 20 мл (20 ммоль) 1н. раствора гидроксида
натрия и перемешивают в течение 12 часов при комнатной температуре. Выпаривают досуха, реакционную среду обрабатывают водой, подкисляют до pH 1, экстрагируют диэтиловым эфиром, органическую фазу
декантируют, сушат над сульфатом магния и выпаривают. Твердое вещество порошкуют в диизопропиловом эфире, отфильтровывают, высушивают. Получают 480 мг
4-[[3-oкco-3-[4-(1-адамантил)-3-метоксифенил]-1- пропенил]]бензойной кислоты с т.пл. 277-279oC.
Пример 12: 4-[4-(1-Адамантил)-3-метоксиэтоксиметоксибензоилтио]бензойная
кислота
(а) 4-(1-Адамантил)-1-бром-3-метоксиэтоксиметоксибензол
Следуя методике примера 11(б), путем взаимодействия 72,94 г (0,237 моль) 2- (1-адамантил)-5-бромфенола с 32,5 мл (0,
284 моль) метоксиэтоксиметилхлорида получают 86,9 г (93%) 4-(1-адамантил)-1- бром-метоксиэтоксиметоксибензола с т.пл. 72-73oC.
(б)
4-(1-Адамантил)-3-метоксиэтоксиметоксибензойная кислота
В трехгорлую колбу и в токе азота вводят 43,5 г (0,11 моль) 4-(1-адамантил)-1-бром-3-метоксиэтоксиметоксибензола и 450 мл ТГФ. При
-78oC прикапывают 48 мл (0,12 моль) 2,5 М раствора н-бутиллития в гексане и перемешивают в течение 1 часа при этой температуре. При -70oC в течение 30 минут пропускают ток
диоксида углерода. После повышения температуры до комнатной, реакционную среду выливают в насыщенный раствор хлорида аммония, экстрагируют этилацетатом, органическую фазу декантируют, сушат над
сульфатом магния и выпаривают. Полученное твердое вещество порошкуют в гексане, отфильтровывают, высушивают. Получают 27,8 г (82%) целевой кислоты с т.пл. 145-147oC.
(в) 4-(1-Адамантил)-3-метоксиэтоксиметоксибензоилхлорид.
В колбу вводят раствор 8 г (22 ммоль) 4-(1-адамантил)-3-
метоксиэтоксиметокси-бензойной кислоты в 80 мл безводного
дихлорметана и добавляют 4,45 мл (22 ммоль) дициклогексиламина и перемешивают в течение часа. Затем добавляют 1,6 мл (22 ммоль) тионилхлорида и перемешивают в течение 1 часа. Выпаривают досуха,
обрабатывают безводным диэтиловым эфиром, отфильтровывают соль дициклогексил-амина и фильтрат выпаривают. Получают 8,5 г (100%) сырого хлорангидрида кислоты, который используют таким, какой есть, в
следующей стадии синтеза.
(г) 4-[4-(1-Адамантил)-3- метоксиэтоксиметоксибензоилтио] бензойная кислота
В колбу вводят 850 мг (5,5 ммоль) 4-меркапто-бензойной кислоты и 20 мл
пиридина. Прикапывают раствор 2,08 г (5,5 ммоль) 4-(1-адамантил)-3- метоксиэтоксиметоксибензоилхлорида, полученного выше, и перемешивают в течение 6 часов при комнатной температуре. Выпаривают досуха,
остаток обрабатывают водой и этил-ацетатом, подкисляют до pH 5, органическую фазу декантируют, промывают водой, сушат над сульфатом магния и выпаривают. Полученное твердое вещество очищают путем
хроматографии на колонке с диоксидом кремния, элюируя смесью дихлорметана с метанолом в соотношении 98:2. Получают 1,5 г (57%) 4-[4-(1-адамантил)-3- метоксиэтоксиметоксибензоилтио]бензойной кислоты с
т. пл. 219-221oC.
Пример 13: 4-[4-(1-Адамантил) -3-метоксиэтоксиметоксибензоилокси]бензойная кислота
(а)
Аллил-4-[[4-(1-адамантил)-3- метоксиэтоксиметоксибензоилокси]бензоат
В трехгорлую колбу и в токе азота вводят 1,26 г (5,5 ммоль) 4-гидроксибензоата и 20 мл ТГФ. Добавляют маленькими порциями
181 г (6,1 ммоль) гидрида натрия (80%- ный в масле) и перемешивают вплоть до прекращения выделения газов. Затем прикапывают раствор 2,08 г (5,5 ммоль)
4-(1-адамантил)-3- метоксиэтоксиметоксибензоилхлорида, полученного в примере 12 (в), и перемешивают в течение 6 часов при комнатной температуре. Реакционную среду выливают в воду, экстрагируют
диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Полученное твердое вещество порошкуют в смеси гексана с диэтиловым эфиром, отфильтровывают и высушивают.
Получают 2,47 г (79%) целевого сложного бензилового эфира с т.пл. 107-108oC.
(б) 4-[4-(1-Адамантил)-3- метоксиэтоксиметоксибензоилокси]бензойная кислота
В раствор
вводят 2,46 г (4,3 ммоль) аллил-4-[[4-(1-адамантил)-3- метоксиэтоксиметоксибензоилокси бензоата, 40 мл диоксана и 492 мг палладия-на-угле (10%). Гидрируют при 40oC и при давлении 7 бар в
течение трех часов. Катализатор отфильтровывают, фильтрат выпаривают досуха. Полученное твердое вещество перекристаллизуют из метанола, отфильтровывают и высушивают. Получают 157 г (76%) целевой
кислоты с т.пл. 212-214oC.
Пример 14: 4-4-(1-Адамантил)-3-метоксиэтоксиметоксибензамидо] бензойная кислота
(а)
Аллил-4-[4-(1-адамантил)-3- метоксиэтоксиметоксибензамидо]-бензоат
В колбу вводят 1,95 г (11 ммоль) аллил-4-аминобензоата, 1,7 мл (12 ммоль) триэтиламина и 50 мл ТГФ. Прикапывают раствор 4,
16
г (11 ммоль) 4-(1-адамантил)-3- метоксиэтоксиметоксибензоилхлорида и перемешивают при комнатной температуре в течение 4 часов. Реакционную среду выливают в воду, экстрагируют диэтиловым эфиром,
органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя дихлорметаном. Получают 4,45 г (78%)
целевого сложного аллилового эфира в виде масла.
(б) 4-[[4-(1-Адамантил)-3-метоксиэтоксиметоксибензамидо]бензойная кислота
В колбу в токе азота вводят 107 мг (3,5 ммоль)
гидрида натрия (80%-ный в масле) и 5 мл ТГФ. Затем прикапывают 535 мкл (3,5 ммоль) диэтилмалоната и перемешивают вплоть до прекращения выделения газов. Этот раствор прикапывают к смеси 1,67 г (3,2
ммоль) аллил-4-[4-(1- адамантил)-3-метоксиэтоксиметоксибензамидо]бензоата, 40 мл ТГФ и 184 мг (0,18 ммоль) тетракис-(трифенилфосфин)-палладий (O) и перемешивают в течение трех часов при комнатной
температуре. Реакционную среду выливают в воду, экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Полученный остаток очищают путем хроматографии
на колонке с диоксидом кремния, элюируя смесью дихлорметана с этилацетатом в соотношении 80: 20. После выпаривания растворителей получают 630 мг (41%)
4-[4-(1-адамантил)-3-метоксиэтоксиметоксибензамидо]бензойной кислоты с т.пл. 189-191oC.
Пример 15: (E)-4-[2-(4-(1-Адамантил)-3-метоксиэтоксиметоксифенил)этенил] бензойная
кислота
(а) 4-(1-Адамантил)-3-метоксиэтоксиметоксибензальдегид
В трехгорлую колбу и в токе азота вводят 43,1 г (0,109 моль) 4-(1- адамантил)-1-бром-3-метоксиэтоксиметоксибензола и
450 мл ТГФ. При -78oC прикапывают 48 мл (0,12 моль) 2,5 М раствора н-бутиллития в гексане и перемешивают при этой температуре в течение 1 часа. При -70oC затем вводят 9,25 мл (0,
12 моль) ДМФ. После повышения температуры до комнатной реакционную среду выливают в насыщенный раствор хлорида аммония, экстрагируют этилацетатом, органическую фазу декантируют, сушат над сульфатом
магния и выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя дихлорметаном. Получают 27,8 г (74%) целевого альдегида с т.пл. 87-89oC.
(б) Метил-(E)-4-[2-(4-(1-адамантил)-3- метоксиэтоксиметоксифенил)этенил] бензоат
В трехгорлую колбу и в токе азота вводят 1,72 г (5 ммоль)
4-(1-адамантил)-3- метоксиэтоксиметоксибензальдегида, 1,55 г (6 ммоль) диметил-4- метоксикарбонилбензилфосфоната, 40 мл ТГФ и 224 мг 15-краун-5. Затем добавляют маленькими порциями 181 мг (6 ммоль)
гидрида натрия (80%-ный в масле) и перемешивают в течение 12 часов при комнатной температуре. Реакционную среду выливают в воду, экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат
над сульфатом магния и выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя дихлорметаном. Получают 1,82 г (76%) целевого сложного метилового эфира с
т.пл. 113-114oC.
(в) (E)-4-[2-(1-Адамантил)-3-метоксиэтоксиметоксифенил)-этенил] бензойная кислота
В колбу вводят 1,8 г (3,8 ммоль) вышеполученного сложного
метилового эфира, 1,5 г (38 ммоль) гидроксида натрия и 50 мл метанола. Кипятят с обратным холодильником в течение трех часов, реакционную среду выпаривают досуха. Полученный остаток обрабатывают
водой,
подкисляют до pH 1, экстрагируют этилацетатом, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Твердое вещество порошкуют в минимальном количестве диэтилового эфира,
отфильтровывают и высушивают. Получают 1,63 г (93%) (E)-4-[2-(4-(1-адамантил)-3-метоксиэтоксиметоксифенил) этенил]бензойной кислоты с т.пл. 219-221oC.
Пример 16:
(E)-4-[2-(4-(1-Адамантил)-3- метоксиэтоксиметоксифенил)-1-пропенил]бензойная кислота
(а) 4-(1-Адамантил)-3-метоксиэтоксиметоксиацетофенон
В трехгорлую колбу и в токе азота вводят 19,
8 г (55 ммоль) 4-(1- адамантил)-3-метоксиэтоксиметоксибензойной кислоты и 200 мл безводного диэтилового эфира. При 20oC прикапывают 70 мл (0,13 моль) 1,6 М раствора метиллития в эфире,
затем перемешивают в течение трех часов при комнатной температуре. Реакционную среду выливают в водный насыщенный раствор хлорида аммония, органическую фазу декантируют, сушат над сульфатом магния и
выпаривают. Получают 19,7 г (100%) целевого ацетофенона в виде масла слегка желтоватого цвета.
(б) Метил-(E)-4-[2-(4-(1-Адамантил)-3- метоксиэтоксиметоксифенил)-1-пропенил]бензоат
Следуя методике примера 15(б), путем взаимодействия 3,58 г (10 ммоль) 4-(1-адамантил)- 3-метоксиэтоксиметоксиацетофенона с 3,13 г (12 ммоль) диметил-4- метоксикарбонилбензилфосфоната, после
хроматографии на колонке с диоксидом кремния, элюируя смесью гептана с этилацетатом в соотношении 80: 20, получают 380 мг (15%)
метил-(E)-4-[2-(4-(1- адамантил)-3-метоксиэток-симетоксифенил)-1-пропенил] бензоата с т.пл. 84-86oC и 550 мг (22%) метил-(Z)-4-[2-(4-(1-адамантил)
-3-метоксиэтоксиметоксифенил)-1-пропенил]бензоата с т.пл. 77-78oC.
(в) (E)-4-[2-(4-(1-Адамантил) -3-метоксиэтоксиметоксифенил)-1-пропенил] бензойная кислота
Следуя
методике примера 15(в), но исходя из 330 мг (0,67 ммоль) метил-(E) -4-[2-(4-(1-адамантил)-3- метоксиэтоксиметоксифенил)-1-пропенил]бензоата, получают 243 мг (76%)
(E)-4-[2-(4-(1-адамантил)-3-метоксиэтоксиметоксифенил)-1- пропенил]бензойной кислоты с т.пл. 193-194oC.
Пример 17:
(Z)-4-[2-(4-(1-Адамантил)-3- метоксиэтоксиметоксифенил)-1-пропенил]бензойная кислота
Следуя методике примера 15(в), но исходя из 540 мг (1,1 ммоль)
метил-(Z)-4-[2-(4-(1-адамантил)-3-метоксиэтоксиметоксифенил)-1- пропенил]бензоата, получают 437 мг (83%) (Z)-4-[2-(4-(1-адамантил)- 3-метоксиэтоксиметоксифенил)-1-пропенил]бензойной кислоты с т.пл.
191-192oC.
Пример 18: 4-[4-(1-Aдaмaнтил)-3- мeтoкcиэтoкcимeтoкcибeнзоилметилокси] бензойная кислота
(а) 2'-Бром-4-(1-адамантил)-3-гидроксиацетофенон
В
колбу вводят 4,47 г (20 ммоль) бромида меди-(П) и 45 мл хлороформа. Кипятят с обратным холодильником и прикапывают раствор 3,57 г (10 ммоль) 4-(1- адамантил)-3-метоксиэтоксиметоксиацетофенона в 50 мл
этилацетата. Продолжают кипятить с обратным холодильником в течение 4 часов, потом реакционную среду отфильтровывают и выпаривают досуха. Остаток очищают путем хроматографии на колонке с диоксидом
кремния, элюируя дихлорметаном. Получают 2,51 г (72%) 2'-бром-4-(1-адамантил)-3- гидроксиацетофенона с
т.пл. 200-202oC.
(б)
Метил-4-[4- (1-адамантил)-3-гидроксибензоилметилокси]бензоат
В колбу вводят 2,15 г (6,1 ммоль) 2'-бром-4-(1-адамантил)-3-гидроксиацетофенона, 934 мг метил-4-гидроксибензоата, 1 г (7,37
ммоль)
карбоната калия и 60 мл метилэтилкетона. Кипятят с обратным холодильником в течение 4 часов, реакционную среду выливают в 1н. соляную кислоту, экстрагируют диэтиловым эфиром, органическую фазу
декантируют, сушат над сульфатом магния, выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью гептана с этилацетатом в соотношении 70:30. Получают
1,55 г (69%) целевого продукта с т.пл. 209-210oC.
(в) Метил-4-[4-(1-адамантил)-3- метоксиэтоксиметоксибензоилметилокси] бензоат
Следуя методике примера 11(б),
путем взаимодействия 472 мг (1,12 ммоль) мeтил-4-[4-(1-aдaмaнтил)-3- гидpoкcибeнзoилмeтилокси] бензоата с 154 мкл (1,35 ммоль) метоксиэтоксиметилхлорида получают 217 мг (38%) целевого сложного
метилового эфира в виде масла желтого цвета.
(г) 4-[4-(1-Адамантил) -3-метоксиэтоксиметоксибензоилметилокси] -бензойная кислота
Следуя методике примера 15(в), но исходя из
551 мг (1,08 ммоль) вышеполученного сложного метилового эфира, получают 230 мг (46%) 4- [4-(1-адамантил)-3-метоксиэтоксиметоксибензоилметилокси] бензойной кислоты с т.пл. 235-236oC.
Пример 19: 4-[[3-Окco-3-[4-(1-aдaмaнтил)-3-мeтoкcиэтoкcиметоксифенил]-1- пропенил]]бензойная кислота
В колбу вводят 1,8 г (5 ммоль)
4-(1-адамантил)-3- метоксиэтоксиметоксиацетофенона, полученного в примере 16(а), 820 мг (5 ммоль) метил-4-формилбензоата и 20 мл метанола. Добавляют 10 мг 18- краун-6 и 200 мг гидроксида натрия в
пастилках и перемешивают в течение 4 часов при комнатной температуре. Выпаривают досуха, остаток обрабатывают водой, подкисляют до pH 3 с помощью 1н. соляной кислоты, экстрагируют диэтиловым эфиром,
органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя дихлорметаном. Получают 432 мг (17%)
мeтил-4-[[3-oкco-3-[4-(1-aдaмaнтил)-3- мeтoкcиэтoкcиметоксифенил]-1-пропенил]]бензоата с т.пл. 95-96oC и 636 мг (26%) 4-[[3-oкco-3-[4-(1-адамантил)
-3-метоксиэтоксиметоксифенил]-1-пропенил]]бензойной кислоты с т.пл. 183-185oC.
Пример 20:
4-[[3-Гидpoкcи-3-[4-(1-aдaмaнтил)-3- мeтoкcиэтоксиметоксифенил]-1-пропенил]]бензойная кислота
(а) Meтил-4-[[3-гидpoкcи-3-[4-(1-адамантил)-3- метоксиэтоксиметоксифенил]-1-пропенил]]бензоат
В колбу вводят 425 мг (0,84 ммоль) мeтил-4-[[3-oкco-3-[4-(1-адамантил)-3- метоксиэтоксиметоксифенил] -1-пропенил] ] бензоата, полученного в примере 19, 246 мг хлорида церия и 10 мл метанола.
Перемешивают при комнатной температуре в течение часа, затем добавляют 16 мг (0,42 ммоль) боргидрида натрия и перемешивают в течение 4 часов. Выпаривают досуха, остаток обрабатывают водой,
экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния, выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя
дихлорметаном. Получают 344 мг (81%) целевого сложного метилового эфира в виде масла.
(б) 4-[[3-Гидpoкcи-3-[4- (1-адамантил)-3-метоксиэтоксиметоксифенил]-1-пропенил]]бензойная
кислота
Следуя методике примера 15(в), но исходя из 308 мг (0,61 ммоль) вышеполученного сложного метилового эфира, получают 91 мг (30%)
4-[[3-гидpoкcи-3-[4-(1-адамантил)-3-метоксиэтоксиметоксифенил] -1- пропенил] ] бензойной кислоты с т.пл. 127-129oC.
Пример 21:
Аллил-4-[4-(1-адамантил)-3-метоксиэтоксиметокситиобензамидо] бензоат
В колбу вводят 2,9 г (5,6 ммоль) аллил-4-[4-(1-адамантил)-3- метоксиэтоксиметоксибензамидо] бензоата, 30 мл толуола и
добавляют 1,14 г (2,8 ммоль) реагента Лавессона. Кипятят с обратным холодильником в течение трех часов, реакционную среду выпаривают досуха. Полученный остаток обрабатывают водой и ди- хлорметаном,
органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью гептана с этилацетатом в
соотношении 80: 20. После выпаривания растворителей получают 1 г (33%) целевого сложного аллилового эфира в виде масла оранжевого цвета.
Пример 22:
В этом примере
иллюстрируют различные конкретные формулировки на основе соединений согласно изобретению.
A-Для введения оральным путем:
(а) Таблетка весом 0,2 г:
соединение
примера
1 - 0,001 г
крахмал - 0,114 г
дикальцийфосфат - 0,020 г
диоксид кремния - 0,020 г
лактоза - 0,030 г
тальк - 0,010 г
стеарат магния - 0,
005 г
(б) Суспензия для питья в ампулах по 5 мл:
соединение примера 2 - 0,001 г
глицерин - 0,500 г
70%-ный сорбитол - 0,500 г
сахаринат натрия - 0,010 г
метил-парагидроксибензоат - 0,040 г
ароматизирующий агент - достаточное количество
очищенная вода - достаточное количество до 5 мл
(в) Таблетка весом 0,8 г:
соединение примера 6 - 0,500 г
предварительно желатинизированный крахмал - 0,100 г
микрокристаллическая целлюлоза - 0,115 г
лактоза - 0,075 г
стеарат магния - 0,
010
г
(г) Суспензия для питья в ампулах по 10 мл:
соединение примера 4 - 0,05 г
глицерин - 1,000
70%-ный сорбитол - 1,000 г
сахаринат натрия - 0,010 г
метил-парагидроксибензоат - 0,080 г
ароматизирующий агент - достаточное количество
очищенная вода - достаточное количество до 10 мл
Б- Для введения топическим
путем:
(а) Мазь (унгиент):
соединение примера 1 - 0,020 г
изопропилмиристат - 81,700
жидкое вазелиновое масло - 9,100 г
диоксид кремния ("Аэросил 200",
выпускаемый фирмой
ДEГУССА) - 9,180 г
(б) Мазь (унгиент):
соединение примера 6 - 0,300 г
медицинский вазелин - 100 г
(в) Крем вода-в-масле, неионный:
соединение примера 1 - 0,
100 г
смесь эмульсионных ланолиновых спиртов, восков и масел ("Eucerine anhydre", выпускаемый фирмой BDF) - 39,900г
метил-парагидроксибензоат - 0,075 г
пропил-парагидроксибензоат - 0,075 г
деминерализованная стерильная вода - достаточное количество до 100 г
(г) Лосьон:
соединение примера 1 - 0,100 г
полиэтиленгликоль (ПЭГ 400) - 69,900 г
95%-ный этанол - 30,000 г
(д) Гидрофобная мазь (унгиент):
соединение примера 2 - 0,300 г
изопропилмиристат - 36,400 г
силиконовое масло ("Rhodorsil 47 V 300", выпускаемый фирмой РОН-ПУЛЕНК) - 36,400 г
пчелиный воск - 13,600 г
силиконовое масло ("Abil 300 000 cst", выпускаемый фирмой
ГОЛЬДШМИДТ)
- 100 г
(е) Крем масло-в-воде, неионный:
соединение примера 4 - 0,500 г
цетиловый спирт - 4,000 г
глицеринмоностеарат - 2,500 г
стеарат ПЭГ 50
- 2,500 г
масло сального дерева (масло каритэ) - 9,200 г
пропиленгликоль - 2,000 г
метил-парагидроксибензоат - 0,075 г
пропил-парагидроксибензоат - 0,075 г
деминерализованная стерильная вода - 100 гр
Реферат
Изобретение относится к новым биоароматическим соединениям общей формулы I, где значения R1, R2, R3, X и Ar указаны в п.1 формулы. Они обладают активностью в областях дифференциации и пролиферации клеток. Описывается также фармацевтическая композиция, предназначенная для лечения дерматологических, ревматических, респираторных, сердечно-сосудистых и офтальмологических заболеваний, а также и косметическая композиция для гигиены тела и для ухода за волосами. 3 с. и 13 з.п.ф-лы, 4 ил.

Формула

в которой R1 обозначает радикал -COR6-, радикал -CO-O-R7, причем значения радикалов R6 - R7 приводятся ниже;
R2 обозначает атом водорода или галогена, линейный или разветвленный алкильный радикал с 1 - 20 атомами углерода, радикал -OR4 или радикал -O-CH2-O-CH2-CH2-O-CH3;
R3 обозначает радикал -Y-(CH2)p-Y-(CH2)q-R8; радикал -Y-(CH2)q-R8, причем значения p, g и радикалов Y и R8 приводятся ниже;
Х обозначает связи нижеследующих формул (а), (в), (с), (d), (е), (j), (k) - (m), которые могут быть связаны двояким образом:
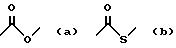



Ar обозначает радикал формулы а

имея в виду, что в вышеуказанном
р обозначает целое число, находящееся в пределах 1 - 12 включительно;
q обозначает целое число, находящееся в пределах 0 - 12 включительно;
Y обозначает атом кислорода;
W обозначает атом кислорода;
R4 обозначает атом водорода, низший алкильный радикал,
R6 обозначает атом водорода, низший алкильный радикал;
R7 обозначает атом водорода, линейный или разветвленный алкильный радикал с 1 - 20 атомами углерода, аллил;
R8 обозначает атом водорода, разветвленный алкильный радикал с 1 - 20 атомами углерода, моногидроксиалкильный радикал, гидроксильные группы которого возможно защищены в форме метокси; группа COR6, где R6-NR'R'', причем R' и R'' - водород или низший алкильный радикал;
R9 обозначает атом водорода или галогена, линейный разветвленный алкильный радикал с 1 - 20 атомами углерода, радикал - OR4, радикал -OCH2-O-CH2-CH2-O-CH3;
R10 одинаковые или различные, обозначают атом водорода, низший алкильный радикал,
или их соли, или их оптические и геометрические изомеры.
4-[4-(1-адамантил)-3-метоксибензоилокси]бензойная кислота;
(E)-4-[[2-[4-(1-адамантил)-3-гидроксифенил]этенил]]бензойная кислота;
(E)-4-[[2-[4-(1-адамантил)-3-пропилоксифенил]этенил]]бензойная кислота;
(E)-4-[[2-[4-(1-адамантил)-3-гептилоксифенил]этенил]]бензойная кислота;
(E)-4-[[2-[4-(1-адамантил)-3-метоксифенил]этенил]]бензойная кислота;
4-[4-(1-адамантил)-3-метоксиэтоксиметоксифенилэтинил]бензойная кислота;
(E)-4-[[2-[4-(1-адамантил)-3-(5-карбамоилпентилокси)фенил]этенил]]бензойная кислота;
(E)-4-[[2-[4-(1-адамантил)-3-метоксифенил)-1-пропенил] ] бензойная кислота;
(E)-4-[[2-[4-(1-адамантил)-3-(3-гидроксипропилокси)фенил] этенил] ] бензойная кислота;
(E)-4-[[2-[4-(1-адамантил)-3-(6-гидроксигексилокси)фенил] этенил] ] бензойная кислота;
4[[3-оксо-3-[4-(1-адамантил)-3-метоксифенил]-1-пропенил]]-бензойная кислота;
4-[4-(1-адамантил)-3-метоксиэтоксиметоксибензоилтио]бензойная кислота;
4-[4-(1-адамантил)-3-метоксиэтоксиметоксибензоилокси]бензойная кислота;
4-[4-(1-адамантил)-3-метоксиэтоксиметоксибензамидо]бензойная кислота;
(E)-4-[2-(4-(1-адамантил)-3-метоксиэтоксиметоксифенил)этенил] -бензойная кислота;
(E)-4-[2-[4-(1-адамантил)-3-метоксиэтоксиметоксифенил)-1-пропенил] бензойная кислота;
(Z)-4-[2-(4-(1-адамантил)-3-метоксиэтоксиметоксифенил)-1-пропенил] бензойная кислота;
4-[4-(1-адамантил)-3-метоксиэтоксиметоксибензоилметилокси]бензойная кислота;
4-[[3-оксо-3-[4-(1-адамантил)-3-метоксиэтоксиметоксифенил]-1-пропионил]] бензойная кислота;
4-[[3-гидрокси-3-[4-(1-адамантил)-3-метоксиэтоксиметоксифенил]-пропинил] ]бензойная кислота;
(Е)-(4)-[[3-оксо-3-[4-(1-адамантил)-3-метоксиэтоксиметоксифенил] -1-пропенил]]бензойная кислота;
4-[[3-гидрокси-3-[4-(1-адамантил)-3-метоксиэтоксиметоксифенил] -1-пропенил]]бензойная кислота;
аллил-4-[4-(1-адамантил)-3-метоксиэтоксиметокситиобензамидо]-бензоат;
4-[[3-гидрокси-3-[4-(1-адамантил)-3-метоксифенил]-1-пропинил]]-бензойная кислота;
2-гидрокси-4-[[3-гидрокси-3-[4-(1-адамантил)-3-метоксифенил]-1-пропинил] ]бензойная кислота;
2-гидрокси-4-[[3-гидрокси-3-[4-(1-адамантил)-3-метоксиэтоксиметоксифенил]-1-пропинил]]бензойная кислота;
4-[[3-гидрокси-3-[4-(1-адамантил)-3-метоксиэтоксиметоксифенил] -1-пропинил]]бензальдегид;
4-[[3-гидрокси-3-[4-(1-адамантил)-3-метоксиэтоксиметоксифенил] -1-пропинил]]бензолметанол;
N-этил-4-[4-(1-адамантил)-3-метоксиэтоксиметоксифенил-этинил]-бензамид;
N-(4-гидроксифенил)-4-[4-(1-адамантил)-3-метоксиэтоксиметоксифенилэтинил]бензамид;
4-[4-(1-адамантил)-3-метоксиэтоксиметоксифенилэтинил]фенол.
R1 обозначает радикал -COO-R7 и -CO-R6;
R3 обозначает радикал -Y-(CH2)p-Y-(CH2)

Х обозначает связь формулы (a), (j), (k) или (m);
Ar обозначает радикал формулы (a).

Комментарии