Производные хлордифторметоксифенила и жидкокристаллическая композиция для электрооптических устройств на их основе - RU2070191C1
Код документа: RU2070191C1
Чертежи






Описание
Изобретение относится к органической химии, в частности, к новым органическим соединениям, обладающим
жидкокристаллическими свойствами и предназначенным для использования в качестве компонентов жидкокристаллического материала, а также к жидкокристаллическим материалам для электрооптических устройств,
например, для индикаторов микрокалькуляторов, индикаторных панелей автомобилей и т.д. Близкими по структуре к заявленным соединениям являются производные фенилциклогексана формулы I [1]
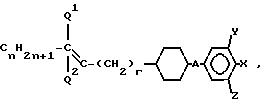
где n 0-7;
Q1 и Q2 H или один из них СН3;
r 0-5, А Транс-1,4-циклогексилен, 1,4-фенилен, 3-фтор-1,4-фенилен или простая связь;
X F, Cl, CF3, CN, OCF3 или ОСHF2;
Y или Z каждый в отдельности или оба Н или F, если А простой связи, то Q1 Q2 H и одновременно Х CN, Y и/или Z являются F.
Соединения, имеющие вышеуказанную структуру и содержащие группу ОСНF2, являются жидкокристаллическими веществами, имеющими малую объемную вязкость, широкий интервал существования мезофазы и высокую температуру прояснения.
Однако эти вещества обладают сравнительно небольшой величиной диэлектрической анизотропии, что приводит к повышению порогового напряжения.
Известны также гетероциклы формулы II [2]

где n 1-10;

кольцо А транс-1,4-циклогексилен;
в случае если

и/или Y Z F, когда А 1,4-фенил, Х CN, Cl, CF3, OCF3 или ОСHF2.
Соединения формулы II, имеющие группу ОСНF2, являются также жидкокристаллическими веществами, отличающимися сравнительно небольшой величиной диэлектрической анизотропии.
Задачей изобретения является изыскание новых соединений, содержащих дифторзамещенную метоксигруппу и обладающих улучшенным показателем диэлектрической анизотропии.
Поставленная задача достигается синтезированием производных хлордифторметоксифенила общей формулы:

где А1 и А2 независимо друг от друга представляют собой транс-1,4-циклогексил, транс-1,3-диоксан-2,5-диил, тетрагидрохинолин, пиридин-2,5-диил, незамещенный 1,4-фенил;
Z1 и Z2 независимо друг от друга представляют собой простую связь, -СН2O; -COO-; -OOC-, C≡C; R алкил; X1 водород, Х2 и X3 водород, или фтор при условии, что, когда кольцо А2 (гетеро)ароматическое, тогда кольцо А1 ненасыщенное кольцо.
Предложенные соединения формулы I могут быть получены посредством известной последовательности реакций исходя из функциональных хлордифторметоксибензольных производных. Синтез таких производных наглядно показан на схеме I.

Соединения IVa, IVb, IVc, IVd получают из соответствующих исходных аналогично соединению IV. (X1 X2 и X3 имеют вышеуказанные значения).
Из вышеуказанных соединений формулы II, IV, IVa, IVb, IVc, IVd посредством химических реакций, традиционно используемых в синтезе жидкокристаллических веществ, получают соединения формулы I.
Например, из полупродуктов типа II путем реакции кросс-сочетания (см. схему 2) получают соединения формулы I, в которых А1 1,4-фенилен или 1,4-циклогексилен и Z-простая связь или ацетиленовый мостик.

(R, A1, Z1, Z2, A2, X1, X2 и Х3 имеют вышеуказанные значения). Жидкокристаллический материал, содержащий жидкокристаллические соединения с дифторметоксифениловой группой, характеризуется недостаточно низким значением порогового напряжения.
Задачей изобретения является понижение порогового напряжения жидкокристаллического материала.
Задача решается жидкокристаллической композицией, состоящей по меньшей мере из двух жидкокристаллических веществ, включающих жидкокристаллическое вещество, содержащее дифторзамещенную метоксифенильную группу, причем в качестве вещества, содержащего дифторзамещенную метоксифенильную группу, она содержит производные хлордифторметоксифенила по п. 1 в количестве 10-35 мас. от общей массы жидкокристаллической композиции. Жидкокристаллические композиции, содержащие указанные соединения, характеризуются низким пороговым напряжением. Если соединение формулы I берут в количестве менее 10 мас. то будет большой величина порогового напряжения, а при содержании его более 95% ухудшаются вязкостные свойства.
Нижеследующие примеры иллюстрируют данное изобретение.
1. Получение
исходных соединений для синтеза соединений формулы I
Пример 1. Получение 2 фтор-хлордифторметоксибензола.
В 3-горлую кварцевую колбу, снабженную обратным холодильником, мешалкой и трубкой для ввода газа, помещают 24,3 г (0,15 мол) 2-фтор-дифторметоксибензола и 300 мл безводного четыреххлористого углерода. Нагревают раствор до кипения и пропускают сухой хлор при облучении реакционной массы УФ-светом. После охлаждения реакционной массы растворитель отгоняют, а остаток фракционируют в вакууме (83- 85oC, 80 мм рт.ст.). Выделяют 16,2 г (выход 55%) 2-фтор-хлордифторметоксибензола, n 1,4730.
Пример 2. Получение 2-фтор-4-бром-хлордифторметоксибензола.
В колбу, снабженную мешалкой, термометром, обратным холодильником и капельной воронкой помещают 9,8 г (0,05 мол) 2-фтор-хлордифторметоксибензола,
40 мл безводного четыреххлористого углерода, 15 г хлорида железа (III) и при температуре 30-35oC прикапывают 8,1 г (0,0506 мол) брома и продолжают перемешивание до прекращения выделения
бромистого водорода. Затем раствор охлаждают, осадок FeCl3 отфильтровывают, фильтрат промывают водой и 5%-ным раствором бисульфата натрия, потом снова водой и высушивают сульфатом магния.
Затем отгоняют растворитель и остаток фракционируют перегонкой (81-83oC, 15 мм рт.ст.), выделяют 8,8 г 2-фтор-4-бром-хлордифторметоксибензола (выход 64%), n
Пример 3. Получение 4-бром-хлордифторметоксибензола.
Процесс проводят по методике
примера 2, но берут 14,3 г (0,08 мол) хлордифторметоксибензола и прикапывают 13,12 г (0,082 мол) брома. Фракционирование перегонкой проводят при 67-68oC, 11 мм рт.ст.). Получают 13,4 г
(выход 65%) 4-бром-хлордифторметоксибензола, n
Аналогичным способом могут быть получены 2,3-дифтор-4 бром-хлордифторметоксибензол и 2,6-дифтор-4-бром-хлордифторметоксибензол.
Пример 4. Получение 4-хлордифторметоксибензонитрила
В 3-горлую кварцевую
колбу, снабженную обратным холодильником, мешалкой и трубкой для ввода газа, помещают 6,76 г (0,04 мол) 4-дифторметоксибензонитрила и 150 мл безводного четыреххлористого углерода. Нагревают до кипения
и пропускают хлор, облучая УФ-светом в течение 4-5 ч. По окончании реакции растворитель отгоняют остаток фракционируют в вакууме (115-117oC 22 мм рт.ст.) Получают 5,85 г
4-хлордифторметоксибензонитрила (выход 72%) n
Аналогичным способом могут быть получены следующие соединения: 2-фтор-4-хлордифторметоксибензонитрил; 2,3-дифтор-4-хлордифторметоксибензонитрил; 2,6-дифтор-4-хлордифторметоксибензонитрил.
Пример 5. Получение хлорангидрида 4-хлордифторметоксибензойной кислоты.
Метод А. В 3-горлую кварцевую колбу, снабженную обратным холодильником, мешалкой и трубкой для ввода газа, помещают 20,65 г (0,1 мол) хлорангидрида 4-дифторметоксибензойной кислоты и 400 мл безводного четыреххлористого углерода. Реакционную смесь нагревают до кипения и хлорируют, пропуская хлор в течение 15-18 ч при облучении УФ-светом. Затем реакционную смесь охлаждают, отгоняют растворитель, остаток фракционируют в вакууме (101-103oC, 13 мм рт. ст.). Получают 20,3 г (выход 84%) хлорангидрида 4-хлордифторметоксибензойной кислоты.
Аналогичным способом могут быть получены следующие соединения: хлорангидрид 2-фтор-4-хлордифторметобензойной кислоты; хлорангидрид 2, 3-дифтор-4-хлордифторметоксибензойной кислоты; хлорангидрид 2,6-дифтор-4-хлордифторметоксибензойной кислоты.
Метод Б. В 3-горлую кварцевую колбу, снабженную обратным холодильником, мешалкой и трубкой для ввода газа, помещают 17,2 г (0,1 мол) 4-дифторметоксибензальдегида и 350 мл безводного CCl4. Реакционную смесь нагревают до кипения и пропускают хлор при облучении УФ-светом в течение 25 ч. Затем отгоняют растворитель и остаток фракционируют при 101-103oC и 13 мм рт.ст. Получают 19,5 г (выход 81%) хлорангидрида 4-хлордифторметоксибензойной кислоты.
Пример 6. Получение 4-хлордифторметоксиацетофенона
В колбу, снабженную обратным холодильником, мешалкой и капельной воронкой, помещают 0,013 г•ат. Mg и 10 мл
тетрагидрофурана. При кипении прикапывают 0,013 мол йодистого метила в 5 мл эфира. После растворения магния реакционную массу охлаждают и прикапывают к раствору 0,013 мл ZnCl2 в 13 мл эфира
при 0oC. При этой температуре перемешивают, а затем к реакционной массе добавляют раствор 0,013 мол хлорангидрида 4-дифторхлорметоксибензойной кислоты в 6,5 мл эфира и 0,2 г PdCl2
(dppf). Затем температуру реакционной массы поднимают до комнатной и перемешивают. Полученную реакционную массу разлагают насыщенным водным раствором хлористого аммония при комнатной температуре.
Органическую фазу отделяют, водную экстрагируют эфиром. Комбинированные органические вытяжки сушат MgSO4, фильтруют и после отгонки растворителя перегоняют. Получают целевой продукт с Тк
93oC/2 мм рт.ст. с выходом 70% n
Пример 7. Получение 4-хлордифторметоксифенола.
В 4-горлую колбу, снабженную мешалкой, воздушным холодильником, капельной воронкой и термометром, загружают 0,025 мол 4-хлордифторметоксиацетофенона, 50 мл муравьиной кислоты и прикапывают смесь 7,5 мл Н2O2 и 18,5 мл муравьиной кислоты. Об окончании реакции судят по исчезновению исходного ацетофенона, определяемого с помощью тонкослойной хроматографии. По завершении реакции полученную смесь разбавляют водой и льдом и экстрагируют 4-хлордифторметоксиацилоксибензол хлористым метиленом. Экстракт промывают водой и отгоняют хлористый метилен. В остаток добавляют воду, этанол и кипятят 2 ч. Затем массу охлаждают, подкисляют соляной кислотой и экстрагируют хлористым метиленом. Отгоняют растворитель и выделяют целевой продукт с 25%-ным выходом.
II. Получение соединений формулы I по изобретению.
Пример 8. Получение 4-дифторхлорметокси-4'-(4-транспропилциклогексил)бифенила.
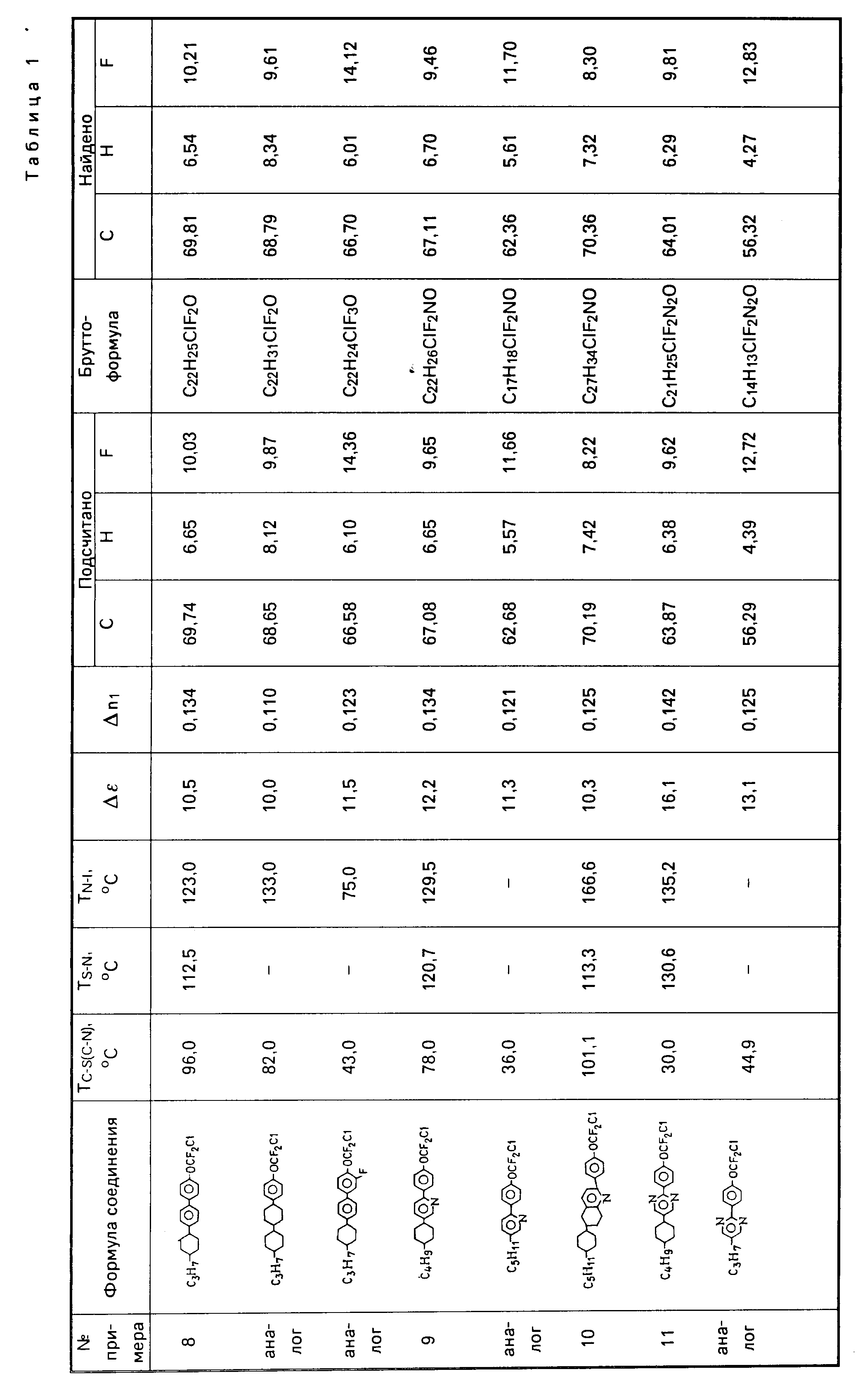
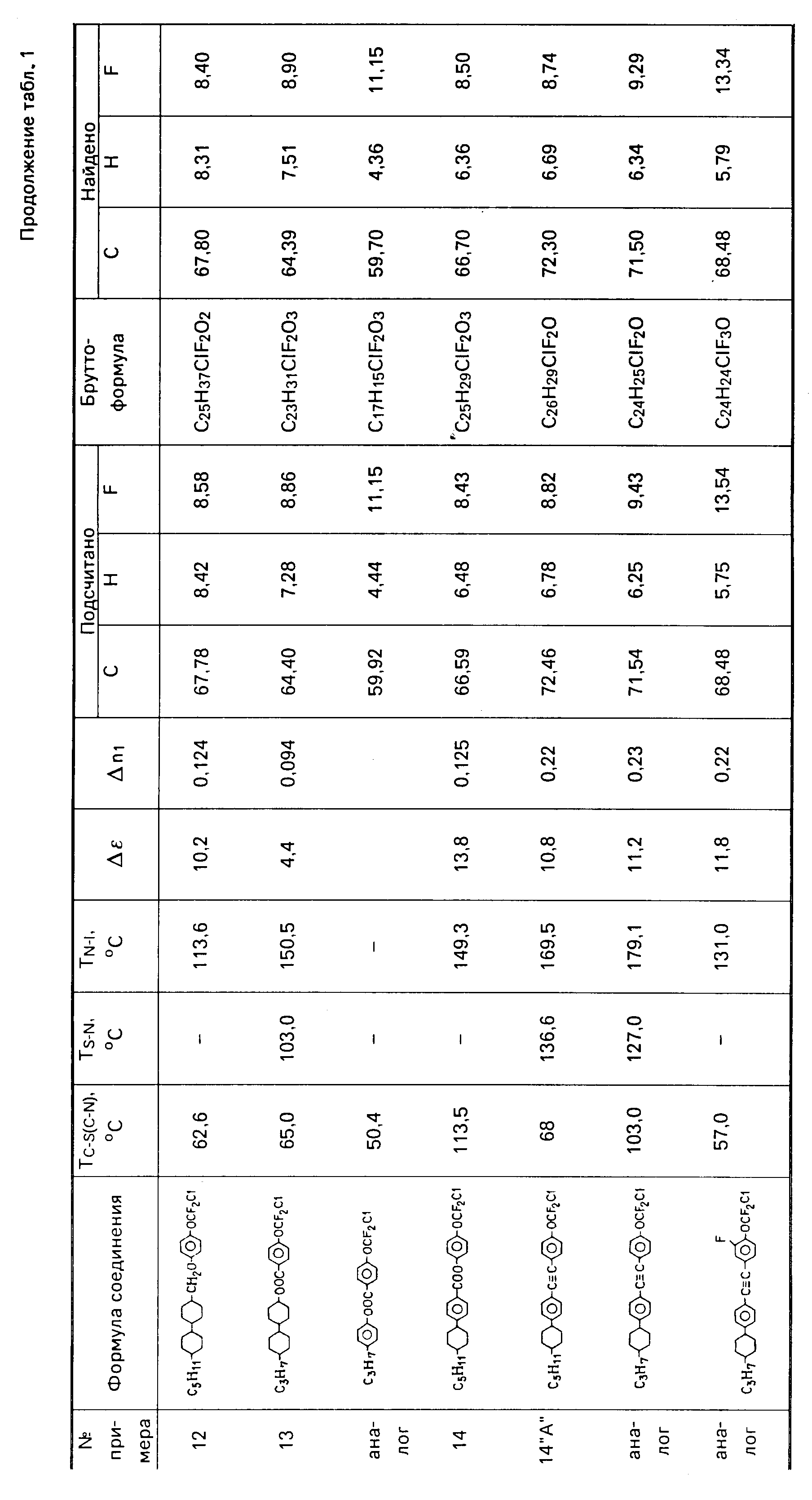
В смесь из 1,25 г магниевой стружки и 25 мл осушенного тетрагидрофурана добавляют раствор 0,05 мол (12,8 г) 4-(4-транс-пропилциклогексил)бромбензола в 50 мл тетрагидрофурана. Смесь выдерживают в течение 1 ч. Затем охлаждают до 0oC, добавляют 0,9 г PdCl2 (dppf) и раствор 0,05 мол (13,8 г) 4-дифторхлорметоксибромбензола в тетрагидрофуране. Смесь выдерживают 30 мин, а затем кипятят в течение 1 ч, затем охлаждают до комнатной температуры, и разлагают насыщенным водным раствором хлористого аммония. Реакционную массу многократно экстрагируют бензолом, отделенную органическую фазу сушат сернокислым магнием, отгоняют растворитель. Затем очищают хроматографически на SiO2, гексан-элюент. В результате последующей кристаллизации из спирта получают 6,6 г 4-хлордифторметокси-4'-(4-транспропилциклогексил)бифенила. Свойства полученного соединения приведены в табл. 1.
Аналогичным путем могут быть получены: 3-фтор-4-хлордифторметокси-4'-(4-транс-пропилциклогексил)бифенил (свойства см. в табл. 1); 1-[транс-4(транс-4-пропилциклогексил)-циклогексил] -4-хлордифторметоксибензол (свойства см. в табл. 1).
Пример 9. Смешивают 0,03 мол 1-акрилоил-4-хлордифторметоксибензола с 0,03 мол 1-[2-транс-4 бутилциклогексил)винил]пиперидина при температуре 0oC и выдерживают смесь в течение 2 ч при комнатной температуре. Затем к смеси добавляют 90 мл этанола, 10 мл воды и 0,14 мол гидрохлорида гидроксиламина, 5 мл концентрированной соляной кислоты и полученную смесь нагревают при кипении в течение 8 ч. Затем отгоняют 2/3 объема растворителя, остаток разбавляют 150 мл воды и подщелачивают до pН 8 водным раствором карбоната натрия, экстрагируют бензолом, промывают бензольный экстракт водой до нейтральной реакции промывных вод, сушат над сульфатом натрия и фильтруют через слой SiO2 в системе бензол:гексан 1:1 и кристаллизуют из гексана и спирта. Получают 2-(4-хлордифторметоксифенил)-5(транс-бутилциклогексил)пиридин. Свойства полученного соединения приведены в табл. 1.
Аналогичным путем был получен 2-(4-хлордифторметоксифенил)-5-пентилпиридин, свойства которого приведены в табл. 1.
Пример 10. Получение 2-(4-хлордифторметоксифенил) транс-6-пентилциклогексил-5,6,7, 8-тетрагидрохинолина.
Смесь 0,01 мол хлоргидрата 1-(3-диметиламинопропионил)-4-хлордифторметоксибензола, 0,02 мол транс-4-пентилциклогексилциклогексанола нагревают при температуре 160-170oC в течение 2 ч. Реакционную смесь охлаждают разбавляют 100 мл этанола и 10 мл воды, добавляют 0,05 мол HN2OH•HCl и кипятят 8 ч. Отгоняют 2/3 объема растворителя, остаток разбавляют 100 мл воды, подщелачивают до рН приблизительно 9 и экстрагируют бензолом. Экстракт промывают водой до нейтральной реакции, сушат сульфатом магния, растворитель отгоняют и остаток хроматографируют в системе гексан:бензол 1:1 на колонке SiO2. Затем растворитель отгоняют, а остаток перекристаллизовывают из спирта и гексана. Свойства полученного соединения приведены в табл. 1.
Пример 11. Получение 2-(4-хлордифторметоксифенил)-5-(транс-4-бутилциклогексил)пиримидина
К раствору 0,43 мол 3-этокси-2(транс-4-бутилциклогексил)акролеина и 0,54 мол
хлоргидрата 4-хлордифторметоксибензамина в 150 мл метанола прикапывают при комнатной температуре 1,85 г натрия в метаноле. Затем реакционную смесь размешивают в течение 15 ч при комнатной температуре.
Смесь после размешивания подкисляют соляной кислотой до pН 4 и выпаривают. Оставшуюся смесь разбавляют водой, экстрагируют бензолом и объединенный органический экстракт промывают водой. Затем остаток
хроматографируют на SiO2 в присутствии уксусного эфира и толуола с получением 2-(4-хлордифторметоксифенил)-5-(транс-4-пропилгексил)-пиримидина. Свойства полученного соединения приведены в
табл. 1.
Аналогичным путем был получен 2-(4-хлордифторметоксифенил)-5-пропил-пиримидин (cвойства cм.в табл. 1).
Пример 12. Получение
1-[транс-4(транс-4-пентил-циклогексил)циклогексил] -метокси-4 -хлордифторметоксибензола
Смесь 0,05 мол 4-хлордифторметоксифенола, 0,05 молей
транс-4-(транс-4-пентилциклогексил)циклогексилметилтозилата, 15 г карбоната калия и 250 мл метилэтилкетона нагревают в течение двух дней в условиях противотока. Затем реакционную смесь охлаждают,
выливают в воду и экстрагируют хлористым метиленом. Объединенный органический экстракт промывают водой, сушат сульфатом магния, фильтруют и концентрируют. Полученный остаток хроматографируют на
SiO2 в системе уксусный эфир гексан и получают 1-[транс-4-(транс-4-пентилциклогексил)циклогексил] метокси-4 -хлордифторметоксибензол (свойства приведены в табл. 1).
Пример 13. Получение транс-4-(транс-4'-пропилциклогексил)циклогексилового эфира 4-хлордифторметоксибензойной кислоты.
В раствор 2,6 г 4-хлордифторметоксибензоилхлорида в 5 мл пиридина добавляют 2,3 г транс-4-(транс-4'-пропилциклогексил)циклогексанола и размешивают в течение 12 ч. После этого реакционную смесь выливают в ледяную воду и экстрагируют диэтиловым эфиром. Органический слой экстрагируют последовательно 10%-ной соляной кислотой, насыщенным раствором карбоната натрия и водой. Затем высушивают сульфатом магния, фильтруют и концентрируют. Далее хроматографируют в системе этилацетат-петролейный эфир (3:97) с получением транс-4-(транс-4'-пропилциклогексил)циклогексилового эфира 4-хлордифторметоксибензойной кислоты, свойства которого приведены в табл.1.
Аналогичным путем был получен 4-пропилфениловый эфир 4-хлордифторметоксибензойной кислоты (свойства см. в табл. 1).
Пример 14. Получение 4-хлордифторметоксифенилового эфира 4(транс-4'-пентилциклогексил)бензойной кислоты.
В раствор 3 г 4(транс-4'-пентилциклогексил)бензоилхлорида в 5 мл пиридина добавляют 1,9 г 4-хлордифторметоксифенола и размешивают в течение 12 ч. Затем реакционную смесь выливают в ледяную воду и экстрагируют диэтиловым эфиром. Органический слой экстрагируют последовательно 10%-ной соляной кислотой, насыщенным раствором карбоната натрия и водой. Сушат сульфатом магния, фильтруют и концентрируют. Затем хроматографируют на SiO2 в системе этилацетат-петролейный эфир (3:97) и получают 4-хлордифторметоксифениловый эфир 4-(транс-4'-пентилциклогексил)бензойной кислоты. Свойства этого соединения приведены в табл. 1.
Пример 14 "А". Получение 1-(4'-хлордифторметоксифенил)-2
4-(4'-трансамилциклогексил)фенил)ацетилена
Раствор, содержащий 4-(4'-трансамилфенил)ацетилен-0,85 г (0,00334 мол 1-бром-4-хлордифторметоксибензол-0,86 г (0,00334 мол), PdCl2
(Ph3P)2 33,4 мг, Ph3P 66,7 мг, Еt3N 33,4 мл и CuI 10 мг, перемешивают в токе азота 2 ч при комнатной температуре и далее кипятят 5 ч. Отгоняют Et3
N, остаток растворяют в бензоле и хроматографируют на SiO2 в системе бензол:гексан (1: 2). Получают целевое вещество с выходом 35% физико-химические свойства которого указаны в табл.1
(продолжение).
Аналогично получают ацетилен и 1-(4-хлордифторметокси-3-фторфенил)-2-[(4-(4' -транспропилциклогексил)фенил]-ацетилен.
III. Получение жидкокристаллического материала (ЖКМ).
Пример 15.


Исходные соединения помещают в сосуд, нагревают до 80-85oC, тщательно перемешивают, охлаждают и получают готовый к употреблению ЖКМ. Характеристики ЖКМ V10, Toff измеряли в ячейках TN при расстоянии между пластинами 8 мкм и t 22oС; время срабатывания измеряли при 2, 5-кратной величине V10.
Параллельно измеряли показатели ЖКМ, содержащего жидкокристаллическое соединение с группой ОСНF2.
Результаты измерений приведены в табл. 2.
Примеры 16-21. ЖКМ готовят аналогично примеру 15. Характеристики полученных ЖКМ измеряют в соответствии с методикой примера 15. Составы исследуемых ЖКМ и результаты измерений приведены в табл. 2.
Таким образом, как видно из табл.1 и 2, новые производные хлордифторметоксифенила обладают увеличенной диэлектрической анизотропией (10-16 против 8-14 по прототипу), а жидкокристаллические материалы, включающие эти соединения, обладают уменьшенным пороговым напряжением (1,37-1,9 против 1,47-2,1 по прототипу).
Реферат
Использование: в качестве индикаторов в электрооптических устройствах. Сущность: производные хлордифторметоксифенила формулы I, где А1 и А2 - 1,4-циклогексил, транс-1,3-диоксан-2,5-диил, тетрагидрохинолин, пиридин-2,5-диил, пиримидин-2, 5-диил, незамещенный 1,4-фенил, Z1 и Z2 - простая связь, -СН2O, -COO, -OOC, -C≡C; R - алкил, X1 - водород, Х2 и X3 - водород, фтор, при условии, что когда А2 - (гетеро)ароматическое, то А1 - ненасыщенное. Жидкокристаллическая композиция, включающая 10-35 мас.% соединения формулы I. 2 табл.

Формула

где A1 и A2 независимо друг от друга представляют собой транс-1,4-циклогексил; транс-1,3-диоксан-2,5-диил; тетрагидрохинолин, пиридин-2,5-диил, пиримидин-2,5-диил, незамещенный 1,4-фенил; Z1 и Z2 независимо друг от друга представляют собой простую связь, -CH2O; -COO; OOC; -C ≡ C;
R алкил;
X1 водород;
X2 и X3 водород или фтор при условии, что когда кольцо A2 (гетеро)ароматическое, тогда кольцо A1- ненасыщенное.

Комментарии