В качестве предложенных согласии иаиирсгению соединений, соответствующих общей
формуле I следует, например, назвать:65 auviui tt vpv. ..
чение 20 мин осторожно добавляют 0,34 г (0,0077 моль) 55%-ной дисперсии гидрида
3
причем и означает низшую алкил-, низшую
а -° -Ь и-и-п -нлзлию алкокси-, низшую а ь НИИ 94:6 получают чистый 5 - (6 - изопентилокеигексилокси
) - пеитил - пиперониловыи эфир в виде бесцветного масла. Удельный
вес при температуре 20°С равен 1,4897 Вычд сл е1ш...:°/п,: C..ZQ.fi Ы 9 Q
Прнмер 55. 4 - Изопроиоксибутанол получают , используя в качестве псходных соединений
1,4 - бутандиол и изопропилбромпд. Температура кипения 90°С при 30 мм рт. ст.
Вычпслеио. %: С 63,6; Н 12,2, CyHigOo (Молекулярный вес 132,2). Найдено, %: С 63,7: Н 12,2.
Пример 56. 5 - Бутоксппентаиол. К 19,8 г (0,19 моль) 1,5 - пентад1 ола ппи
комнатной темпепатуре в атмосфере азота добавляют 5,05 г (0,126 моль) порошкообразной
гидроокиси натрия, при этом температура в колбе повышалась до 36°С. Смесь подогревают
до 50°С и после капельного введения 17,4 г (0,127 моль) п-бутилбромида перемешали в
течение 18 часов ири 65°С. Охлажденную смесь разбавляют водой и экстрагируют эфиром
. Для удаления избыточного пентадиола экстракта три раза промывают водой, просушивают
над сульфатом магния и упаривают. Остаток промывают смесью гексана и этилацетата
В отношении 9 : 1 на 150 г силикагеля. При фракционироваННой дистилляции .получают
чистый 5 - п - бутокси1пентаиол в в.иде бесщветного масла с точкой кипения 137-139°С
при 30 ММ рт. ст. Bbi4HiC4eHO. %: С 67,5; Н 12,6. С9Н2о02 (Молекулярный вес 160,3).
Найдено, %: С 67,1; Н 12,8. Пример 57. 5 - АЛЛИЛО.КСИ - 2 - гекса-нол.
12,0 г (0,25 моль) 50%-ной дисперсии гидрида натрия в минеральном масле гексаном
освобождают от минерального масла и залис F
т с
где RI, R2, Rs, Rj, RS также как и w имеют вышеуказанные значения и М2 - водород,
.-.агпий млц каЛИЙ, предиочтительно натрИ
S41428
Таблица 3 Аналогично примеру 39 могут быть также получены следующие соединения общей формулы
II. Пример 40. 1 - Бром-(4 - изопентилоксиГЛ ГГТЛ .,, л л,вают
150 мл абсолютного 1.2-диметоксиэтана, К образовавшейся суспензии добавляют при
помешивании этри 5-10°С в течение 90 мин раствор, состоящий из 35.4 г (0,3 моль) 2,5-гександиола
в 60 .мл абсолютного 1,2-диметоксиэтана . После 2 час перемешивания при 50°С к охлажденной
до 10°С CMecH по каплям примешивают 24,2 г (0,2 моль) аллилбромида в
40 мл сухого 1,2 - диметокоэтаиа. Омесь медленно нагревают до 60°С и при этой темшературе
.перемешивают в течение 16 час. После этого реакционную смесь охлаждают до комнатной
температуры. После добавки по 200 г эфира и воды смесь сильно перемешивают и
органическую фазу отделяют с помощью делительной воронки. Эфирный экстракт про мьгвают
насыщенным раствором поваренной соли, осушали через сульфат натрия и упаривают.
Остаток очищали методом хроматографии на силикагеле с гексаном и этилацетатом в отношении
2:1, при этом 5 - аллилокси-2-1гексанол получают как хроматографически однородное
беспветное 1масло. Удельный вес при 20°С ipaeeH 1,4423, точка кипения 62-63°С
при 0,75 мм рт. ст. Вычислено, %: С 68,3; Н 11.5; О 20,2. C9Hi8O2 (Молекулярный вес 158,2).
Найдено, %: С 68,4; Н 11,1; О 20,3. Аналогично примеру 56 могут также получены
соединения обп1ей формулы IV (примеры 58-67), приведенные в та-бл. 3.
Применяемые для шолучеиия соединений общей формулы I .и VI исходные соединения общей
формулы VII могут быть получены аналогичны .м образом, что и соединения общей формулы II.
Пример 68. I - Бром-б-циклопентилоксипентан .
68 г (1.,0 1моль) циклопентанола осторожно смешивают в атмосфере азота тгри помешивании
в течение -15 мин с 3 г (0,1 моль) 80%-ной дисперсии гидрида натрия в масле. При 60°С
по каплям добавляют 17,7 МЛ (0,13 моль) 1,5 т дибромпентана и омесь далее перемешивают
в течение 20 час при 60°С. При комнатной температуре осторожно добаеляют «ем«ого
воды и продукт экстрагировали эфиром. Эфировые экстракты промывают водой и насыщенным
раствором хлорида натрия, просушивают сульфатом магния и выпаривают.
При хроматографии остатка на силикагеле с гексаном и этилацетатом в отношении 99 : 1
получают 1 - бром-З-цвклопентилоксипентан, .который далее очищают дробной дистилляцией
. Точка кипения 54-58°С при 0,06 .мм рт. ст.
Вычислено, %: С 51,1; Н 8,1; Вг 34,0.
CioHigBrO (Молекулярный вес 235,2).
Найдено, %: С 51,5; Н 8,3; Вг 33,5.
Аналогично примеру 68 можно также получить следующие соединения общей формулы VII.
Пример 69. 1 - Бром-5-(2-метилбутилокси ) - пентан получают способом, аналогичным
описанному в примере 68, однако исходными соединениями служили 2 - метилбутанол и 1,5 - дибрОМпентан.
Точка кипения 112- 114°С при 12 мм рт, ст.
Вычислено, %: С 50,7; Н 8,9; Вг 33,7.
CioH2iBrO (Молекулярный вес 237,2).
Найдено, %: 51,7; Н 9,1; Вг 32,7.
Пример 70. 1 - Бром-4-изопропоксибутан получают аналогично 1примеру 68, но исходными
соединениями являются изопрапанол и 1,4дибромбутан с применением натрия вместо
гидрида «атрия. Точка кипения 90-91°С при 34 ,рт. ст.
Вычислено, %: С 43,1; Н 7,7; Вг 41,0.
CrHisBrO (Молекулярный вес 195,1).
Найдено, %: С 43,2; Н 7,6; Вг 41,3.
Пример 71. б - Бром-6-изопропоксигвксан
получают аналогичпо примеру 68, но исходными соединениями служат изопропанол и 1,6дибромгексан
и вместо гидрида натрия применен натрий. Точка кипения 96-98°С при 15 мм рт. ст.
Вычислено, %: С 48,4; Н 8,6; Вг 35,8.
CgHjgBrO (Молекулярный вес 223,2).
Найдено, %: 48,7; 8,4; Вг 35,9.
Исходные соединения общей формулы VII
могут быть получены, например, следующими способами.
Пример 72. 1 - Бром - 4 - изопентилоксибутан .
К раствору, содержащему 27,5 г (0,174 моль) 4 - изопентилоксибутанола (получение сравн.
в примере 15) и 1,36 г (0,0172 моль) пиридина в 150 мл абсолютного хлороформа по каплям
добавляют при. помешивании при 0°С в течение 20 .мин 6,1 мл (0,0636 моль) трибромида
фосфата. Охлаждающую ванну удаляют, омесь через 1 час нагревают до 60°С и при
этой температуре перемешивают в течение 18 час. Реакционную смесь приливают в ледяяой
раствор бикарбоната натрия, фазу хлороформа отделяют в делительной воронке,
промывают водой и насыщенным раствором хлористого натрия, высушивают над сульфатом
магния и упаривают. Остаток фильтруют на силикагеле с гексаном и этилацетатом
(98:2) при фракционированной дистилляции упаренного фильтрата получают чистый
1-бром - 4 - изонентилоксибутан с точкой кипения 96-97°С при 12 мм рт. ст.
Вычислено, %: С 48,4; Н 8,6; Вг 35,8; О 7,2. CgHjgBrO (Молекулярный вес 223,2).
Найдено, %: С Н 8,6; Вг 35,4; О 7,4.
Пример 73. 1 - Бром-6-изопентилоксигексан
.
Это соединение 1получают аналогично примеру
72, но исходным соединением служит 6 - изопентилоксигексанол (пример 54). Точка
кипения 123-129°С при 11 мм рт. ст. Вычислено, %: С 52,6; Н 9,2; Вг 31,8.
CiiH23BrO (Молекулярный вес 251,2). Найдено, %: С 52,2; Н 8,7; Вг 31,1.
Пример 74. 1 - Бром-6-бутилоксигексан синтезируют аналогично примеру 72, но исходным
соединением служит б - бутилоксигексанол . При фракционированной дистилляции получают
чистый I - бром-6-бутилоксигексан с точкой кипения 130-132°С при 16 мм рт. ст.
Вычислено, %: С 50,7; Н 8,9; Вг 33,7. CioHjiBrO (Молекулярный вес 237,2).
Найдено, %: С Н 9,0; Вг 31,4. Пример 75. 1 - Бром-5-изопентилоксииентан
получают аналогичпо примеру 74, но исходным соединением служит 5 - изопентилоксипентанол
. Точка кипения 133-137°С при 30 мм рт. ст.
Вычислено, %: С 50,6; Н 8,9; Вг 33,7. CioHoiBrO (Молекулярный вес 237.2).
Найдено, %: С 51,0; Н 8,9; Вг 34,1. Н сходные соединения общей формулы VII,
где LS - тозильный остаток, могут быть синтезированы следующим образом.
П р и м е р 76. 6 - Изопентилоксигексилтозилат получают тозилированием б - изопентилоксигексанола
аналогично примеру 42. Нормальная плотность при 20°С равна 1,4901.
Вычислено, %: С 63,1; Н 8,8; S 9,4. С18НзоО4 (Молекулярный вес 342,5).
Найдено, %: С 63,3; Н 8,8; S 9,4.
Формула изобретения
Способ получения простых гликолевых эфиров общей формулы I
К4
RrO-C-(CH,)-C-0-(CH,),-X-Ar (О
RS где Ri означает нормальный или в случае .1еобходи ости разветвленный ал1кил с 1-9
итомами углерода, «ормальный или разеенвленный нонасыщеиный радикал с одной или
несколькими -овязямн, содержащий 3- 9 атомов углерода, неза1мещснный или замещенный
«.изшим аЛ|Килом диклоалкил с 5-7 атомами углерода в кольце;
Ra, Rs, R4, RS независимо друг от друга означают водО(род, разветвленный или неразветвлеиный
с 1-4 атома-ми углерода алкильный остаток; W - целые числа от 2 до 4;
Z - целые числа от 2 до 6; -ОСНа-или X - сера, кислород, груииы
-SCH2-; Аг представляет собой грушпы -/XV ( CRyKg)/
J или Л. иричем и означает .низшую алкил-, «изшую алкенил-, фенил-, низшую алкокси-, низшую
алкенилокси-, формил-, «изшую алкилкарбоНИЛ- , низшую алкоксикарбонил-, моно- или
дизамеш,енную «из.шим алкилом карбамоил-, низшую алкоксиметилен-, низшую алкилтио-,
циано-, или .нитрогрушиу или хлор или бром; R и Rs независимо друг от друга означают
водород или низшую алкильную группу и Г, означают 1 или 2;
Составитель М. Миркулова
Редактор Л. Герасимова Техред А. Камышникова
Заказ 625/1Изд. .М 1883Тираж 575Подписное
ЦНИИПИ Государственного комитета Совета Министров СССР
по делам изобретений и открытий 113035, Москва, Ж-35, Раушская наб., д. 4/5
Тинография, пр. Сапунова, 2
Корректор Е. Хмелева
q означает 0,1 или 2 и отдельные заместители и могут быть различными между собой,
отличающийся тем, что соединение формулы II Ri-o-c-(CH2);,-c-o-(CH2)z-L /7 3RSг где RI, R2, Rs, R4, RS, а также W и Z имеют
вышеуказанные значения и LI означает хлор, бром лли тозило1статок или группу -O(S)Mi
где MI - водород, натрий или калий, подвергают взаи1модействию с соеди11е)1ием обндей формулы 111
где Аг - имеет вышеуказанные значения; Y - ХМ или груниа L2-СН2-, где
X и MI имеют вышеуказанные значения; 1,2 - хлор или бром, причем если значения
LI в соединениях формулы II равны -0(S)Mi или С1(Вг), или ТОЗИЛ-, остаток, то
значение У в соединениях формулы III соответственно означают L -СН2- или -XMi
нри темиературе О-100°С с последующим выделением целевого продукта.
2. Сиасоб ino н. 1, отличающийся тем, что в случае, если в и-сходных соединениях II
или III значения MI представляет водород, процесс ведут в присутствии связывающего
галоид|ВОдород средства.
Date : 30/07/2001
Number of pages : 4
Previous document : SU 541428
Next document : SU 541430
о П и с А Н И Е
ИЗОБРЕТЕНИЯ
К ПАТЕНТУ
(61) Дополнительный к патенту -
(22)Заявлено 12.11.74 (21) 1935342/2074752/
(23)Приоритет 29.06.73 (32) 01.07.72
(31) Р 2232457.8(33) ФРГ
Опубликовано 30.12.76. Бюллетень A 48
Дата опубликования описания 08.08.77 ( 72) Авторы изобретения
Ансгар Лерх ( 71) Заявитель
(54) СПОСОБ ПОЛУЧЕНИЯ
ПРОИЗВОДНБ1Х З-АЛКИЛ-4-СУЛЬФАМОИЛАНИЛИНА ИЛИ ИХ СОЛЕЙ
1
Изобретение относится к способу получения
не опнсанных в литературе производных 3-алк1 л-4-сульфамоиланилина общей формулы I
. .((,
Н,К02
где RI - фенильный, фурильный или тиенильный остаток;
- карбоксильная группа или тетразолил- (5)-остаток;
R4 - линейный или разветвленный алкильный остаток, содержащий от 2 до 5 атомов
углерода, а п обозначает число 1 или 2,
или их солей, обладающих биологической
активностью.
Известен способ получения производных
4-сульфамоил-л1-толуидина, заключающийся во взаимодействии соответствующего 3-метил4-сульфамоильного
производного с амином, обладающих биологической активностью.
Однако в литературе отсутствуют сведения о способе получения соединений общей формулы
I, отличающихся от известных наличием более тяжелого алкильного остатка.
541429
(11)
(51) М. Кл.2 С 07С 143/80
С 07С 87/52
/04
(53) УДК 547.541.521
233.07(088.8)
Эти соединения проявляют более высокую
физиологическую активность и могут найти применение в медицине в качестве фармацевтических
препаратов.
Согласно данному изобретению описывается
способ получения соединеннй общей формулы 1 пли их солей, заключающийся в том, что
соединение общей формулы И
NH,
П
Y-HNOj Е
где Ra имеет значения, указанные вьиие для
Ra или представляет собой группу, .которая может быть переведена в Ra;
R4 имеет выщеуказанное значение;
Y - водород или ацпльный остаток, подвергают
взаимодействию с соединением общей формулы III
Z-(CH2)n-R,,III
где Ri и п имеют выщеуказанное значение, а Z - реакционноспособная сложноэфирная
группа при температуре 60-180°С, с последуьфред Попелак, Эгон Роеш и Клаус Хардебек
«Бёрингер Маннхайм 1 Т Иностранцы (ФРГ)
и Курт Штах ( Австрия) Иностранная фирма
Д 5.ibi,fcpT(ji
ющим выделением целевого продукта в виде
основания или соли, причем в случае, когда Кз представляет собой группу, которая может
быть переведена в карбоксильную или в тетразолиль- (5)-ную группу, ее превращают в остаток
R2, а когда Y представляет собой ацильный остаток, его отпдепляют известным способом .
Остаток, который может быть переведен в карбоксильную группу, преимущественно
представляет собой этерифицированную карбоксильную группу, карбоксиамидную группу
или нитрильню группу, а кроме того, карбоксильную группу в форме ее соли с неорганическими
и органическими основаниями. Труппой , которая может быть переведена в тетразолиль-
(5)-ный остаток, является преимущественно нитрильная группа, имидоэфирная группа или амидиновая группа.
Соединениями общей формулы III с реакционноспособной сложноэфирной группой Z являются
галогениды, четвертичные соли присоединения этих соединений, например с пиридином
, и легко расщепляемые сложные эфиры сульфокислот, например тозилаты, брозилаты.
Исходные соединения, соответствующие общей формуле II, могут быть получены, например
, в результате сульфоамидирования 4-алкил-2-нитробензойной кислоты или производных
этой кислоты с последующим восстановлением . Соответствующие тетразолильные соединения
получаются в результате взаимодействия нитрилов с азидами.
Описываемый способ осуществляют при температурах , лежащих в интервале между 60 и
, причем наиболее благоприятно проводить реакцию в присутствии избыточного количества
компонента реакции, обладающего основными свойствами. Избыточное количество
основного компонента реакции одновременно служит для связывания кислоты, выделяющейся
в свободиом состоянии в процессе реакции . Однако для этой цели также могут
быть использованы и другие неорганические или органические основания, или соединения,
реагирующие подобно основаниям. В качестве примера могут быть указаны углекислые соли
щелочных металлов, окись кальция, триэтиламин , диметиланилин и пиридин. Взаимодействие
компонентов реакции может быть осуществлено как в отсутствии, так и в присутствии
инертных растворителей или разбавителей, причем наиболее целесообразно использовать
для указанной цели ароматические углеводороды , этиленгликоль, монометиловый эфир
этиленгликоля, диметиловый эфир диэтиленгликоля , диметилформамид и диметилсульфоксид .
В том случае, когда Ra представляет собой этерифицированную карбоксильную, карбоксиамидную
или нитрильную группу, то эту группу непосредственно после проведения реакции
переводят в карбоксильную группу известными способами посредством гидролиза, предпочтительно
в щелочной среде.
Когда желательно получить соответствующее
формуле I соединение с R2, представляющим собой тетразолиль-(5)-пую группу, соответствующие
соединения, в которых Rs обозначает нитрильную группу, имидоэфирную
группу или амидиновую группу, можно обработать непосредственно после проведения реакции
азотистоводородной кислотой, предпочтительно солями этой кислоты. Взаимодействие
проводят в среде инертного растворителя, предпочтительно в среде диметилформамида.
Отщепление ацильного остатка Y производят посредством щелочного омыления, предпочтительно
гидроокисями щелочных металлов.
Неочищенные продукты, соответствующие
по формуле I, могут быть очищены посредством растворения в гидроокисях щелочных
металлов с последующим осаждением разбавленными минеральными кислотами.
Полученные в соответствии с описываемым способом продукты посредством обработки
неорганическими или органическими основаниями известными способами могут быть переведены
в соответствующие соли. Физиологически безвредными солями являются, в частности
, соли щелочных металлов, щелочно-земельных металлов и аммонийные соли, которые
могут быть получены известными способами , например, в результате взаимодействия
с гидроокисью натрия, гидроокисью калия, водным раствором аммиака или с соответствующими
углекислыми солями.
Соответствующий настоящему изобретению
способ более подробно поясняют приводимые ниже примеры.
Пример 1. 4-Изопропил-2-бензилампно-5сульфамоилбензойная кислота.
1 г 4-изопропил-5-сульфамоилантраниловой кислоты нагревают в течение 3 час ири температуре
120°С с 2 мл беизилхлорида в 10 мл диметилформамида. После охлаждения реакционную
смесь разбавляют 10 мл воды, доводят до щелочной реакции посредством прибавления
2 н. раствора соды и производят экстрагирование эфиром. Водную фазу обрабатывают
активированным углем, производят фильтрование и фильтрат подкисляют соляной
кислотой. Неочищенный продукт отфильтровывают и перекристаллизовывают из смеси метилового
спирта и воды.
Выход 0,70 г (52% от теории). Температура
плавления продукта 233-234°С.
Применяемые в качестве исходного материала
4-изопропил-5-сульфамоилантраниловую кислоту получают следующим образом.
5 г 4-изопропил - 2-бром - сульфамоилбензойной кислоты вводят в взаимодействие в автоклаве
с 60 мл жидкого аммиака, причем реакцию проводят в течение 12 час при 100°С. Реакционную
смесь растворяют в воде, обрабатывают активированным углем, производят
фильтрование и фильтрат доводят до кислой реакции посредством прибавления 2 н. раствора
соляной кислоты. Выделившийся в осадок неочищенный продукт растворяют в этиловом
эфире уксусной кислоты, органическую фазу промывают водой, сушат и подвергают сильному
упариванию. В результате прибавления хлороформа происходит кристаллизация 4-изопропил-5-сульфамоилантраниловой
кислоты. Температура плавления полученного продукта составляет 235-238°С (разл.).
Аналогичным образом получаются:
4-этил-2-фурфуриламино-5 - сульфамоилбензойная
кислота; т. пл. 228°С;
4-этил - 2-тениламино-5 - сульфамоилбензойная
кислота; т. пл. 227-228°С (из этилового спирта);
3-этил - 4-сульфамоил - 6-тетразолил(5)-1Ыфурфуриланилин; т. пл. 179-180°С (из этилового спирта);
3 - этил-4 - сульфамоил-6 - тетразолил(5)-Ыбензиланилин; т. пл. 237-239°С (из смеси
ацетона и этилового спирта);
4-изопропил-2-фурфуриламино - 5-сульфамоилбензойная
кислота; т. пл. 180-183°С (разл.) (из метилового спирта и воды);
4-изопропил-2 - тениламино - 5-сульфамоилбензойная кислота; т. пл. 194-197°С (разл.)
(из смеси метилового спирта и воды);
4-бутил-2-фурфуриламино - 5-сульфамоилбензойная
кислота; т. пл. 239-240°С (из смеси ацетона и этилового спирта);
4-бутил-2-(2-фурилэтиламино)-5 - сульфамоилбензойная кислота; т. пл. 227-228°С (из
смеси ацетона и этилового спирта);
Б. 4-Алкил-2-бромбензойная кислота.
50 г 4-алкил-2-бромбензонитрила нагревают в течение 1 час при температуре 130°С со смесью
, состояш,ей из 130 мл концентрированной серной кислоты и 40 мл воды. После этого к
реакционной смеси прибавляют еш;е 100 мл воды и в течение 2 час поддерживают температуру
на уровне 160°С. Затем реакционной смеси дают возможность охладиться, выливают
в ледяную воду и отфильтровывают образовавшийся при этом осадок. Еше влажный
продукт растворяют в 300 мл 2 н. раствора гидроокиси натрия, производят экстрагирование
хлористым метиленом, водную фазу обрабатывают животным углем и затем подкисляют соляной кислотой.
Полученный продукт отфильтровывают, промывают водой и сушат.
4-бутпл - 2-тениламино-5-сульфамоилбензойная кислота; т. пл. 229-230°С (из смеси ацетона
и этилового спирта); З-этил-4-сульфамоил - 6-тетразолил(5)-М-тениланилин;
т. пл. 196-198°С (из смеси этилового спирта и воды);
3-изопропил - 4-сульфамоил-6-тетразолил (5) N-тениланилин; т. пл. 194-195°С (разл.) (из
этилового эфира уксусной кислоты).
Исходные соединения получают по следующей
методике.
А. 4-Алкил-2-бромбензонитрпл.
1 моль 4-алкил-2-броманилина диазотируют в растворе серной кислоты при температуре от
О до 5°С. Затем прозрачный охлажденный льдом раствор диазониевой соли прибавляют
по каплям к нагретому до 60°С раствору цианида меди, который приготавливают из
1,5 моль кристаллического сульфата меди и
6 молей цианида натрия. Затем смесь дополнительно
перемешивают в течение 2 час при температуре 60°С и оставляют стоять в течение
ночи. Окрашенный в коричневый цвет осадок отсасывают и сразу подвергают перегонке
с водяным паром. Дестиллат экстрагируют хлористым метиленом. Объединенные метиленхлоридные
растворы промывают 1 н. раствором гидроокиси натрия и непосредственно после
этого водой и сушат. Остаток, образовавщийся после упаривания растворителя, подвергают
фракционной перегонке в вакууме.
В. 4-алкил-2-бром-5 - сульфамоилбензойная
кислота.
50 г 4-алкил-2-бромбензойной кислоты нагревают
в течение 2 час при температуре 100°С совместно с 150 мл хлорсульфоновой кислоты.
После охлаждения реакционную смесь выливают в лед и отфильтровывают выделившийся
в осадок сульфохлорид. Полученный продукт еще во влажном состоянии вводят при температуре
20°С в 500 мл концентрированного раствора аммиака и смесь выдерживают в течение
ночи. Затем прозрачный раствор обрабатывают активированным углем и некоторое
время уиаривают в вакууме с целью удаления основного количества аммиака. Затем раствор
подкисляют соляной кислотой, отфильтровывают выделившийся в осадок неочищенный продукт
, после чего перекристаллизовывают его из разбавленного этилового спирта.
Г. З-алкпл-6-тетразолил (5)-бромбензол.
0,1 моль 4-алкил-2-бромбензоннтрила растворяют
в 200 мл диметилформамида, к приготовленному раствору прибавляют 20 мл воды,
0,12 моль азида натрия и 0,12 моля хлористого аммония и полученную смесь нагревают при
перемешивании в течение 15 час при температуре 100°С. Непосредственно после этого производят
отгонку растворителя в вакууме и полученный остаток растворяют в 1 н. растворе
гидроокиси натрия. Полученный раствор экстрагируют хлористым метиленом, обрабатывают
углем и подкисляют ледяной уксусной кислотой . Выделившийся в осадок неочищенный
продукт отфильтровывают и сушат.
Формула изобретения
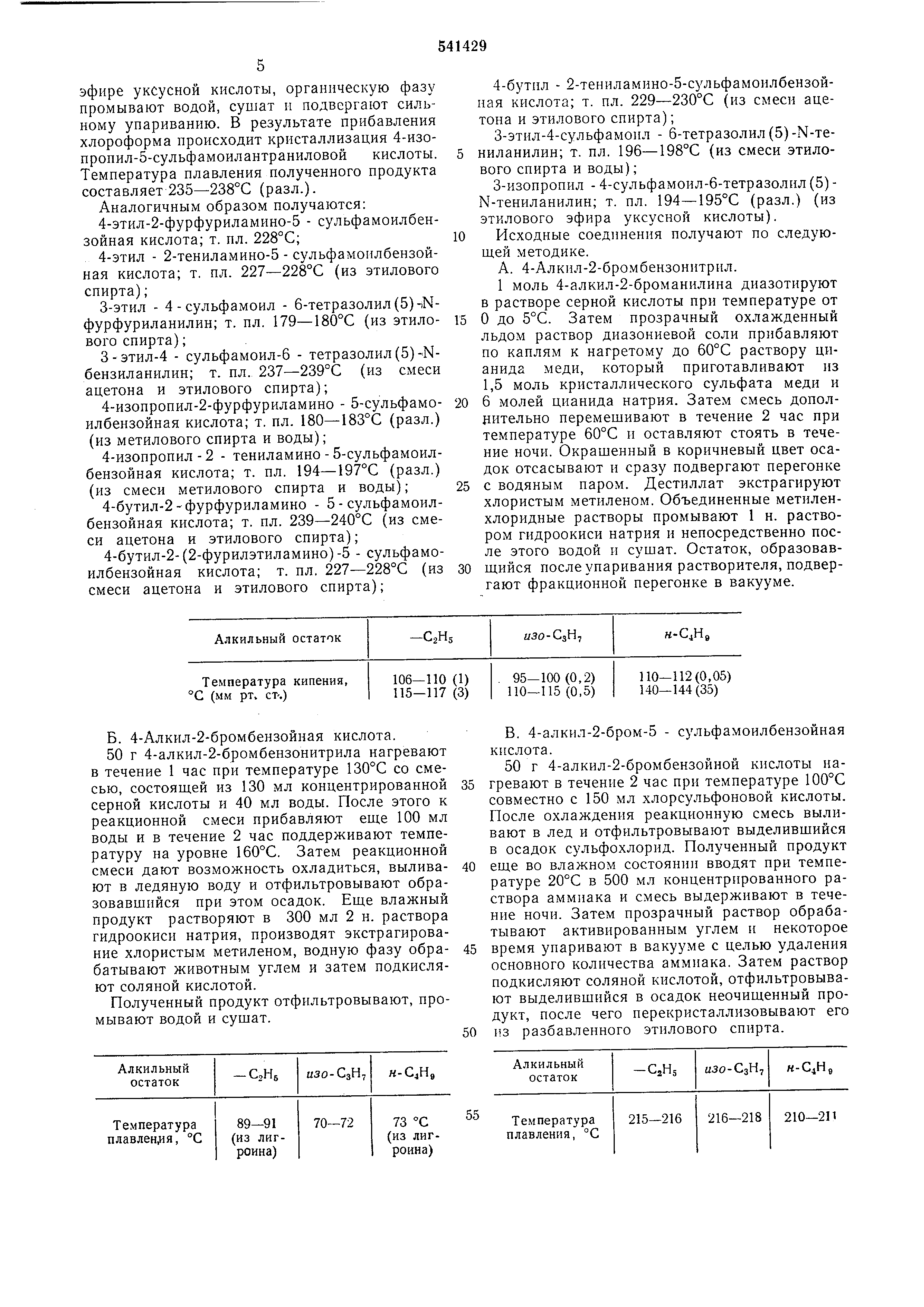
Способ получения производных З-алкил-4сульфамоиланилина общей формулы
где RI
фенильный, фурильный или тиенильный остаток;
R2 - карбоксильная группа или тетразолил- (5)-остаток;
R4 - линейный или разветвленный алкильный остаток, содержащий от 2 до 5 атомов
углерода, а п обозначает число 1 или 2, пли их солей, отличающийся тем, что соединение общей формулы
Д. 3-алкил-4-сульфамоил-6 - тетразолил(5)бромбензол .
З-алкил-6-тетразолил (5) -бромбензол сульфохлорируют двукратным весовым количеством
хлорсульфоиовой кислоты. После иолного завершения реакции реакционную смесь выливают
в лед и отфильтровывают выделившийся в осадок сульфохлорид. Еще влажный продукт
при температуре 20°С вводят в коицеитрированный раствор аммиака и смесь выдерживают
в течение ночи. Прозрачный раствор обрабатывают активированным углем, отфильтровывают
и фильтрат несколько упаривают в вакууме . Затем раствор подкисляют соляной
кислотой, отфильтровывают выделившийся в осадок продукт и перекристаллизовывают его
из смеси метилового спирта и воды. jL I
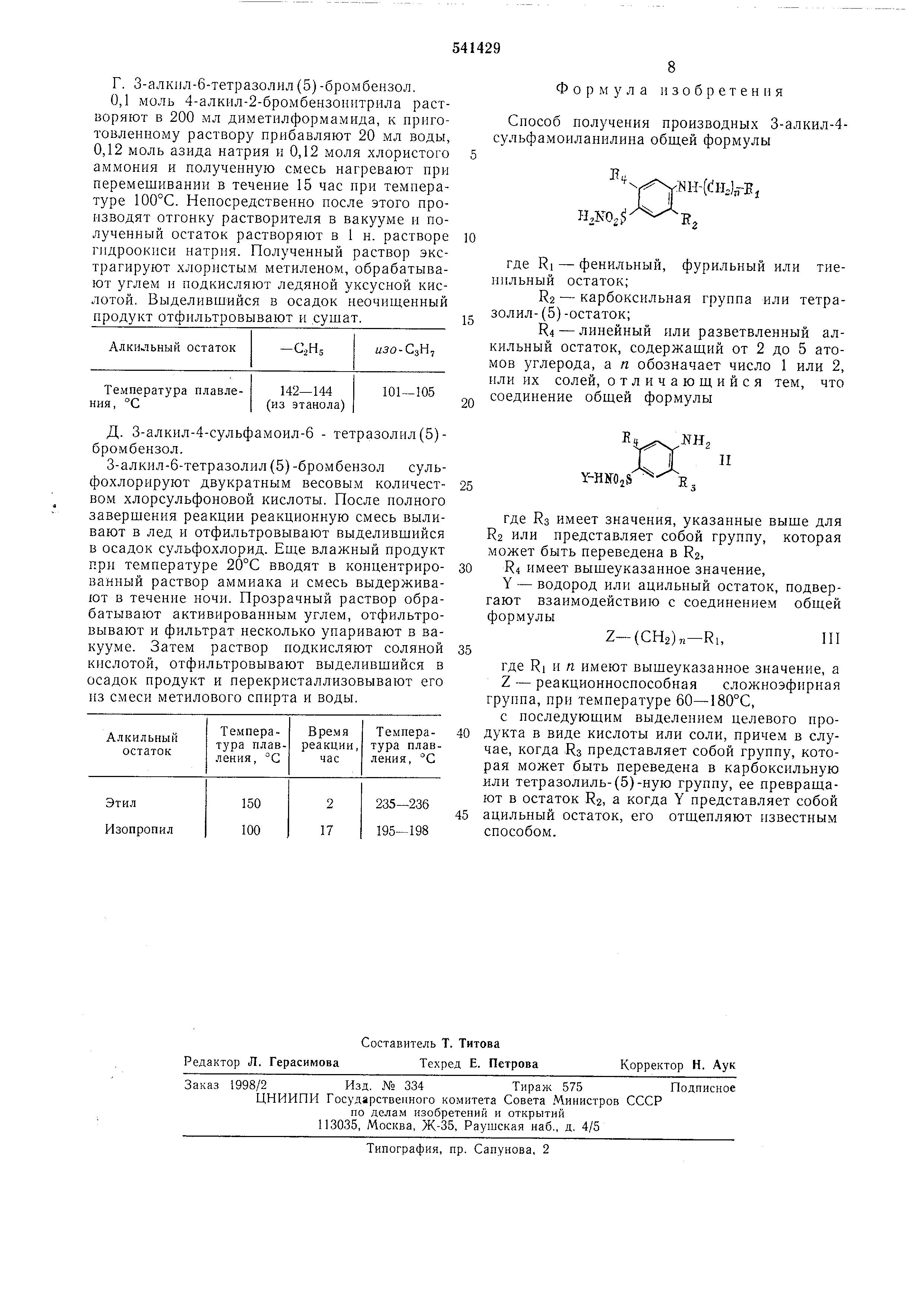
, где Кз имеет значения, указанные выше для R2 или представляет собой группу, которая
может быть переведена в R2, R4 имеет вышеуказанное значение,
Y - водород или ацильный остаток, подвергают взаимодействию с соединением общей формулы
Z-(CH2)n-R,,III где Ri и п имеют выщеуказанное значение, а Z - реакциониоспособная сложноэфирная
группа, при температуре 60-180°С, с последующим выделением целевого продукта
в виде кислоты или соли, причем в случае , когда :R3 представляет собой группу, которая
может быть переведена в карбоксильную или тетразолиль-(5)-ную группу, ее превращают
в остаток R2, а когда Y представляет собой ацильный остаток, его отщепляют известным способом.













Комментарии