Способ получения (гало)фторуглеводорода, α-фторэфиры, способ их получения - RU2120935C1
Код документа: RU2120935C1
Чертежи








Описание
Это изобретение относится к способу получения фторуглеводородов из α-фторэфиров и способу получения α-фторэфиров и новых α-фторэфиров, приемлемых для использования в получении фторуглеводородов, в частности к способу получения фторалканводородов.
В последние годы было установлено, что хлорфторуглеводороды, которые широко использовались во всем мире, оказывают разрушительное действие на озоновый слой и способствуют глобальному потеплению. Хрорфторуглеводороды используются, например, как охлаждающие агенты, вспенивающие агенты, очищающие растворители и пропелленты для аэрозолей, множество применений которых практически не ограничено. Следовательно, ведется большая работа, чтобы найти подходящие заменители для хлорфторуглеводородов, которые бы удовлетворяли многим применениям хлорфторуглеводородов, но не обладали бы вышеуказанными вредными воздействиями на окружающую среду. Один подход в поиске подходящих заменителей направлен на получение фторуглеродов, которые не содержат хлор, но могут содержать водород, т.е. фторуглеводородов, из которых многие могут быть подходящими заменителями.
Известен способ получения (гало)фторуглеводорода разложением соответствующего α-фторэфира при повышенной температуре (200 и 650o C), предпочтительно в присутствии фтороводорода или катализатора (Изв. АН СССР N 10, 1972, с. 2242-2247).
Настоящее изобретение предлагает способ получения фторуглеводородов и способ получения галофторуглеводородов без хлора.
В соответствии с этим предлагается способ получения (гало)фторуглеводорода, который включает нагревание α-фторэфира (фторзамещенного простого эфира) в паровой фазе при повышенной температуре.
Под α-фторэфиром подразумевается эфир с атомом фтора, присоединенным к атому углерода в α-позиции по отношению к атому кислорода, т.е. эфир, содержащий группу -C-O-CF и, следовательно, эфир с общей формулой R-O-CFR1R2, где R, R1 и R2 - как определено ниже.
Мы выявили, что α-фторэфиры формулы R-O-CF-R1R2 можно разложить при нагревании и получить (гало)фторуглеводород R-F и соединение, содержащее карбонильную группу, обычно R1R2CO альдегида. Очевидно эфир разлагается переносом атома α-фтора из одного атома α-углерода в другой атом α-углерода, чтобы получить (гало)фторуглеводород (именуемый далее продукт обмена фтора). В некоторых случаях эфир может также разлагаться переносом атома α-водорода, так что получается (гало)фторуглеводород R-H (именуемый в дальнейшем как продукт обмена водорода). Следовательно, фторэфиры можно использовать как полезные исходные материалы для получения (гало)фторалканводородов.
В α -фторэфира R-O-CF-R1 R2, группа R может обычно иметь любую форму при условии, что она включает по меньшей мере один атом углерода, и группа R может быть например, насыщенной или ненасыщенной, циклической или ациклической. Кроме того, группа R может быть алифатической или ароматической, также замещенной группой, такой как галозамещенная группа.
Способ изобретения полезен, в частности, для получения фторалканводородов из эфиров, в которых R группа является алкильной группой, которая может включать один, два или даже несколько атомов углерода, например, до 6 и даже больше. Алкильная группа R представляет собой обычно алкильную группу с прямой цепью, хотя может быть и с разветвленной. Группа R может включать только углерод и водород или также другие атомы, такие как атомы галогена; обычно группа R будет фторированной группой.
α-фторэфиром как правило будет α-фторалкиловый простой эфир, т.е. эфир формулы R-O-CF-R1R2, в котором R1 и R2 каждый представляет атом водорода или алкила или замещенную алкильную группу, которая может включать один, два или даже несколько атомов углерода, скажем до 6 или даже больше атомов углерода, при условии, что если R1 и R2 оба водород, R не является группой -CH2F. Алкильные группы R1 и R2 будут обычно группами с прямой цепью, хотя могут быть группами и с разветвленной цепью. Группа R1 и R2 могут включать только углерод и водород, хотя они могут быть замещенными алкильными группами; обычно группы R1 и R2 будут фторированными группами. Как правило, по меньшей мере один из R1 и R2 будет атомом водорода.
В соответствии с предпочтительным вариантом изобретения предлагается способ получения (гало)фторалканводородов, который включает нагревание α-фторэфира с формулой R-OCF-R1R2, в которой R - алкил или замещенная алкильная группа, включающая от 1 до 6 атомов углерода и R1 и R2 каждый представляет собой H или алкильную группу, содержащую от 1 до 6 атомов углерода.
α -фторэфиром является предпочтительно α -фторметилэфир, R-O-CFH2 или тетрафторэтилэфир R-O-CFH-CF3, поскольку эти α -фторэфиры легко получить и при нагревании в паровой фазе до повышенной температуры они дают особенно нужные фторуглеводороды.
α -фторметилэфиром может быть, например, FCH2-O-CH3 (фторметил-метилэфир), FCH2-O-CH2CF2H (1,1-дифторэтил-фторметиловый эфир) или FCH2 -O-CH2CF3 (1,1,1-трифторэтил-фторметилэфир), который при нагревании в паровой фазе до повышенной температуры может дать соответственно следующие фторалканводороды, CH3F, CHF2 CH2F и CF3CH2F. Тетрафторэтилэфиром может быть, например, CF3CHF-O-CH2CF3 или CF3CFH-O-CH3 (который при нагревании в паровой фазе до повышенной температуры может дать 1,1,1,2-тетрафторэтан) или CF3CFH-O-CFHCF3 или CF3CHF-O-CH2F (который при нагревании в паровой фазе до повышенной температуры может дать CF3 CF2H и/или CF3CFH2).
В соответствии с вариантом изобретения предусматривается способ получения 1,1,1,2-тетрафторэтана, включающий нагревание α -фторалкилэфира, выбранного из группы, состоящей из FCH2-O-CH2CF3, FCH2-O-CHFCF3 , CF3CHF-O-CH2CF3 и CF3CFH-O-CH3 в паровой фазе при повышенной температуре.
В соответствии с другим вариантом изобретения предусматривается способ получения пентафторэтана, включающий нагревание CF3CFH-O-CFHCF3 или CF3CFH-O-CH2F в паровой фазе при повышенной температуре.
Нагревание α-фторэтана может проводиться в присутствии пара фтороводорода, поскольку мы выявили, что наличие фтористого водорода по меньшей мере с некоторыми α -фторэфирами имеет тенденцию повышать выход полученного (гало)фторуглеводорода.
Нагревание α-фторэфира может преимущественно проводиться в присутствии катализатора. Преобразование α -фторэфира и селективность к (гало)фторалканводороду зависит от катализатора, в присутствии которого нагревается α-фторэфир. Мы выявили, что некоторые катализаторы способствуют высокой степени селективности к продукту обмена фтора, в то время как другие способствуют высокой степени селективности к продукту обмена водорода. Еще один класс катализаторов дает смеси и продуктов обмена фтора, и продуктов обмена водорода. Более того, то что продукт обмена фтора или продукт обмена водорода промотируются определенным катализатором, также зависит по меньшей мере в некоторой степени от определенного α -фторэфира. Так, с определенными α-фторэфирами определенный катализатор может промотировать обмен фтора, в то время как с другими α-фторэфирами тот же катализатор может способствовать обмену водорода.
Следует понимать, что способ изобретения может дать продукт, включающий смесь (гало)фторалканводородов из одного α-фторэфира. Так, например, если α -фторэфиром является CH2F-0-CH2CF3, продукт может быть смесью CH3CF3 или CF3CH2F. Более того, нужные смеси фторалканводородов можно получить при желании использованием смесей α-фторэфиров. Так, например, если смесь CH2 F-O-CH2F и CF3CH2 -O-CH2F нагреть до повышенной температуры, продукт может включать смесь CH2F2, CH3F и CF3 CH2F.
Катализатором может быть, например, металл, например металл, выбранный из группы, состоящей из никеля, железа, меди и хрома, или сплав оксида, фторида или оксифторида этих металлов, например окись хрома или алюминия, фторид хрома или алюминия или фторокись металла.
Мы выявили, что в общем продукт обмена фтора можно получить с очень высокой селективностью, если используемый катализатор - металл, выбранный из группы, состоящей из никеля, железа, меди или хрома, и в частности, если он является сплавом по меньшей мере одного из этих металлов. Особенно предпочтительно использовать сплав всех этих металлов, например Hastelloy или нержавеющую сталь.
Предпочтительно, чтобы сплавы до использования обрабатывались воздухом, т. е. чтобы они нагревались до повышенной температуры в присутствии воздуха, например, температуры в пределах от 300oC до 500oC. В другом случае или дополнительно к этому предварительная обработка катализатора может включать нагревание катализатора в присутствии фтороводорода.
Другим предпочтительным катализатором является окись хрома, которая, хотя может и не способствовать высокой степени селективности к продукту обмена фтора, является очень прочным катализатором. Окись хрома можно предварительно обрабатывать до использования.
Катализаторы, которые в общем ведут к получению продукта обмена водорода с высокой степенью селективности, включают, например, катализаторы, содержащие цинк на окиси хрома или окись хрома, насыщенную цинком.
Температура, до которой нагревается α-фторэфир, чтобы получить (гало)фторалканводород, такова, что α-фторэфир находится в паровой фазе и поэтому температура зависит от конкретного используемого α -фторэфира. Обычно температура составляет по меньшей мере 80oC, предпочтительно по меньшей мере 200oC, а лучше 350oC. Нет необходимости использовать боле высокую температуру, чем 500oC, хотя при необходимости можно использовать и около 700oC.
Температура нагревания α-фторэфира также зависит до некоторой степени и от того, при наличии или отсутствии катализатора проводится нагревание. Если нагревание проводится в присутствии катализатора, температура зависит от конкретного используемого катализатора; обычно, если присутствует один из упомянутых сплавов или металлов, температура не будет такой высокой, как в отсутствие указанных металлов или сплавов.
Как правило, температура бывает не выше 450oC, если катализатор используется в присутствии фтороводорода. Так, например, если нагревание проводится в присутствии нержавеющей стали и фтороводорода, температура составляет около 250oC, а более предпочтительно около 300oC, но не выше 400oC, обычно не выше 350oC. Однако, если катализатором фторирования является окись хрома в присутствии фтороводорода, температура предпочтительно составляет от 180oC до около 320oC, более предпочтительно от 200o до 280oC.
Способ по изобретению обычно проводится при давлении окружающей среды, хотя при желании можно использовать суператмосферное или субатмосферное давление. Суператмосферные давления до 10 бар при более низких температурах обычно предпочтительнее, так как при таких условиях выход (гало)фторуглеводородов обычно повышается.
После завершения реакции (гало)фторуглеводород можно отделить от неизменных исходных материалов и нежелательных побочных продуктов с использованием обычных процедур, например дистилляции.
Наиболее удобно оперировать способом изобретения в непрерывном процессе, когда неизменный α-фторэфир и фторводород, присутствующие в потоке продукта (гало)фторуглеводорода, рециркулируются в зону реакции.
Наиболее удобны и таким образом предпочтительным общим методом получения α-фторэфира является реакция не-енолизируемого альдегида с фторводородом (в жидкой фазе или паровой фазе) и реакция полученного промежуточного соединения со спиртом или галогенирующим агентом, чтобы получить α-фторэфир.
Не-енолизируемый альдегид требуется для того, чтобы альдегид не полимеризовался во фтороводороде, когда они вместе реагируют.
По предпочтительному варианту изобретения предлагается способ получения (гало) фторуглеводорода, который включает (a) реакцию не-енолизируемого альдегида с фтороводородом, чтобы получить промежуточное соединение, и реакцию промежуточного соединения со спиртом или галогенирующим агентом, чтобы получить α-фтороэфир и (b) обработку α-фторэфира для получения (гало)фторалканводорода. Обработка α-фторэфира для получения (гало)фторалкановодорода может, например, включать нагревание при повышенной температуре в паровой фазе.
Промежуточное соединение, полученное реакцией не-енолизируемого альдегида с фтороводородом, может реагировать со спиртом или галогенирующим агентом множеством способов. Альдегид и фтороводород могут реагировать в присутствии спирта или галогенирующего агента. В другом случае альдегид и фтороводород могут реагировать с получением равновесной смеси, содержащей промежуточное соединение, и спирт или галогенирующий агент могут добавляться к равновесной смеси. В модификации этого варианта промежуточное соединение может отделяться от равновесной смеси до того, как она прореагирует со спиртом или галогенирующим агентом.
Следует понимать, что промежуточное соединение, произведенное от не-енолизируемого альдегида и фтороводорода, само по себе может быть α-фторэфиром и что неполная реакция такого промежуточного соединения со спиртом или галогенирующим агентом может дать смесь α-фторэфиров. Хотя промежуточный α-фторэфир не является исходным материалом для использования в способе получения (гало)фторуглеводорода по изобретению, смесь α-фторэфиров, содержащая непрореагировавший промежуточный α-фторэфир, является приемлемым исходным материалом для использования в изобретении.
α-фторэфиры, содержащие другой галоген, кроме фтора, в частности хлор или бром, могут использоваться как исходные материалы для получения галофторуглеводородов, содержащих другой атом галогена, кроме фтора. Такие α-фторэфиры могут быть получены реакцией промежуточного соединения, полученного от не-енолизируемого альдегида и фтороводорода с подходящим галогенирующим агентом для проведения обмена фтора другим галогеном кроме фтора. Галогенирующий агент может быть галогенсодержащей кислотой Льюиса, такой как пятихлористая сурьма, пятихлористый ниобий, хлорид алюминия и бромид натрия.
Не-енолизируемый альдегид предпочтительно представляет собой формальдегид или трифторацетальдегид, предпочтителен формальдегид. В варианте изобретения и формальдегид, и трифторацетальдегид реагируют с фтороводородом, чтобы получить смесь CF3CFH-O-CH2F и CH2 F-O-CH2F. Смесь альдегид образует in situ. Спирт и полученную смесь α-фторэфира можно преобразовать во фторалканводороды. При желании к смеси можно добавить отдельно спирт для получения других α-фторэфиров.
В варианте изобретения, включающем этапы (a) получения α -фторэфиры и (b) нагревания α-фторэфира в паровой фазе при повышенной температуре для получения (гало)фторуглеводорода, и оба этапа (a) и (b) используют повышенную температуру и оба могут использовать катализатор, так чтобы на практике по меньшей мере часть

Не-енолизируемый альдегид можно получить в любой из известных форм. Так, например, это одна из его полимерных форм, параформальдегид, или триоксан или мономерная форма, которую можно получить, например, из потока процесса, в котором он был только что получен, например, окислением метанола. Трифторацетальдегид можно получить, например, в его гидрированной форме CF3CH[OH]2 или дегидрированной форме CF3CHO.
Соответственно, термин не-енолизируемый альдегид, используемый в этом описании, следует понимать как включающий не-енолизируемые альдегиды в любой из их известных форм.
В общем, там, где формальдегид используется как не-анолизируемый альдегид, предпочтительна полимерная форма формальдегида, такая как параформальдегид, где формальдегид растворен в жидком фтороводороде. Параформальдегид и триоксан легко растворяются в жидком фтороводороде и получение промежуточного соединения для α-фторэтана можно удобно проводить растворением параформальдегида или триоксана в жидком фтороводороде при комнатной температуре и атмосферном давлении.
Молярное соотношение не-енолизируемого альдегида к фтороводороду может существенно меняться, например, в пределах от 1:0,5 до 1:50, однако предпочтителен стехиометрический избыток фтороводорода. Обычно молярное соотношение не-енолизируемого альдегида к фтороводороду будет в пределах от 1:2 до 1:10.
В одном варианте изобретения не-енолизируемый формальдегид реагирует с фтороводородом в присутствии спирта. Таким образом, например, полагают, что реакция трифторацетальдегида не-енолизируемого альдегида с фтороводородом дает спирт CF3CHFOH, который может затем конденсироваться до α-фторэфира CF3 CFH-O-CFHCF3.
Большой диапазон α-фторэфиров можно получить добавлением отдельного спирта. Если добавляется отдельно спирт, он может добавляться в то же время, что и фтороводород и не-енолизуруемый альдегид, или его можно добавлять последовательно к смеси альдегида и фтороводорода. Более того, спирт можно сначала добавить к фтороводороду, а затем к этой реакционной смеси альдегид. Следовательно порядок добавления фтороводорода, альдегида и спирта не является критическим.
Если спирт добавляется отдельно, предпочтителен первичный спирт, который может иметь общую формулу R-OH, где R - как описано выше. Спирт должен быть инертным к фтороводороду и α -фторэфиру. Группа R становится группой полученного эфира R с общей формулой R-O-CF-R1R2, группы R1 и R2 - те же, что указаны выше.
Группа R обычно будет алкилом с прямой цепью или замещенной алкильной группой, хотя она также может быть группой с разветвленной цепью. R группа может включать только водород и углерод, например R группа может быть CH3 или C2H5. Однако, лучше, если R группа будет фторированной, например FCH2CH2-, HCF2CH2-, CF3 CH2-, /CF3/2CH-, или CF2HCF2 CH2-. Спирт R-OH- предпочтительно первичный спирт и может быть, например, метанолом, этанолом, 2-монофторэтанолом, 2,2-дифторэтанолом, 2,2,2-трифтороэтанолом, гексафтороизопропанолом или 1, 1,2,2-тетрафторопропанолом. По меньшей мере некоторые из спиртов можно получить на месте, например, добавлением эпоксида к смеси не-енолизируемого альдегида/фтороводорода. Так, например, 2-монофторэтанол можно получить добавлением этиленгликоля, который реагирует с фтороводородом, для получения 2-монофтороэтанола.
Если спирт добавляется отдельно, он может добавляться такими же пропорциями, как не-енолизируемый альдегид, т.е. в молярном соотношении спирта к фтороводороду в пределах от 1:0,5 до 1:50, но обычно предпочтителен стехиометрический избыток фтороводорода. Оптимальная пропорция добавляемого спирта может зависеть от конкретного используемого спирта, поскольку мы выявили, что с некоторыми спиртами, добавление слишком большой пропорции спирта ведет к образованию нежелательного ацеталя, а не требуемого α -фторэфира. Как правило, молярное соотношение спирта к фтороводороду будет составлять от 1:2 до 1:10.
Ряд α
-фторэфиров, полученных способом настоящего изобретения, представляют собой новые соединения
и это следующие
α-фторэфиры:
Фторметил-фторэтиловый эфир формулы CH2FCH2OCH2F, масс-спектр которого показан на фиг. 1.
Фторметил-дифтроэтиловый эфир формулы CHF2CH2OCH2F, масс-спектр которого показан на фиг. 2.
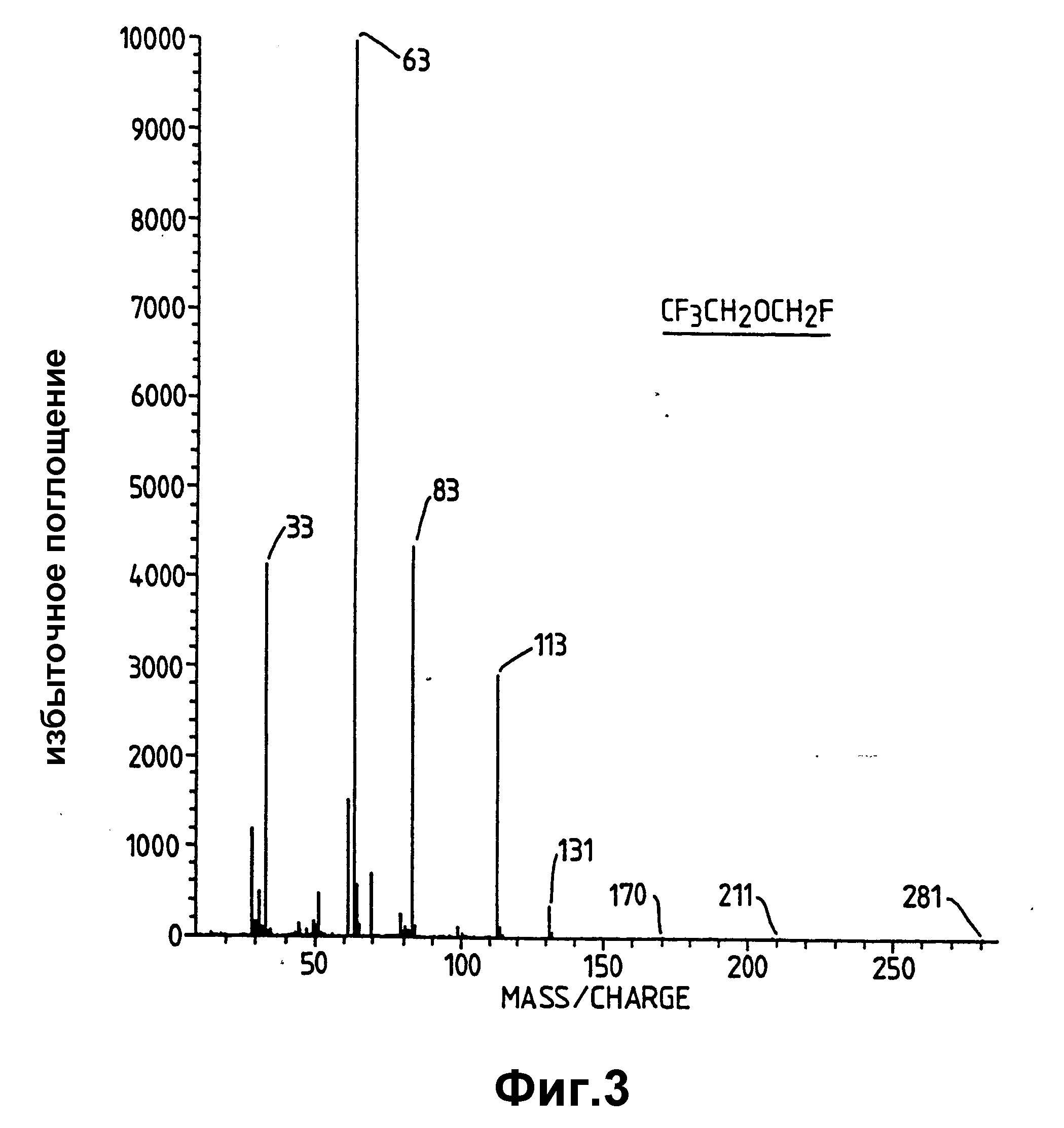
Фторметил-трифторэтиловый эфир формулы CF3 CH2OCH2F, масс-спектр которого показан на фиг. 3.
Фторметил-тетрафторпропиловый эфир формулы CHF2F2CH2OCH2F, масс-спектр которого показан на фиг. 4.
Фторэтил-тетрафторэтиловый эфир формулы CF3CHFOCH2 CH2F, масс-спектр которого показан на фиг. 5.
Фторметил-хлорметиловый эфир формулы CH2FOCH2Cl, масс-спектр которого показан на фиг. 6.
Фторметил-бромометиловый эфир формулы CH2FOCH2Br, масс-спектр которого показан на фиг. 7.
На фиг. 8 показан масс-спектр фторметил-тетрафторэтилового эфира формулы CF3CHFOCH2F. Этот эфир был изолирован из смеси, в которой он получен, и его температура кипения была определена как 47,5oC.
α-фторэфир можно выделить из смеси, в которой он получен, и побочных продуктов до того, как α-фторэфир нагревается до повышенной температуры. Эфир может быть изолирован, например, добавлением щелочи к смеси и нагреванием полученного щелочного раствора, например до 50oC, с тем, чтобы отделить α-фторэфир. В другом случае α-фторэфир можно легко изолировать контактированием потока продукта с водой при температуре в пределах от 50 до 80oC. Затем его можно собрать холодной ловушкой, пропустить непосредственно в нагретую зону.
α-фторэфир можно ввести в нагретую зону в неразбавленной форме, хотя обычно удобнее ввести его вместе с разбавителем, таким как инертный газ-носитель, например азот.
В варианте изобретения, в котором α-фторэфир генерируется растворением не-енолизируемого альдегида в жидком фтороводороде и реагированием полученного промежуточного соединения со спиртом, α-фторэфир и фтороводород, в котором он растворяется, могут вместе испаряться в нагретую зону вместе с непрореагировавшим альдегидом в растворе. В этом случае это может быть смесь α-фторэфиров, которая испаряется в зону нагревания, так что смесь фторалканводородов получается нагреванием смеси α-фторэфиров до повышенной температуры. Мы особое предпочтение отдаем тому, что α-фторэфир и возможно фтороводород отделялись от воды, которая также генерируется реакцией не-енолизируемого альдегида с фтороводородом. Таким образом, α-фторэфир и возможно фтороводород пропускаются к зоне нагревания практически без воды.
Отделения α -фторэфира и возможно фтороводорода от воды можно достичь любым удобным способом, например выпариванием α-фторэфира и возможно фтороводорода из смеси продукта или контактированием смеси продукта с твердым высушивающим агентом. Так, например, через смесь продукта можно пропускать поток инертного газа, например азота.
В другом варианте изобретения предусмотрен соответственно способ получения фторалканводорода, который включает этапы (a) реакции не-енолизируемого альдегида с жидким фтороводородом и реакции полученного промежуточного соединения со спиртом, чтобы получить α-фторэфир, (b) отделения по меньшей мере части воды от продукта этапа (a), и (c) пропускания α-фторэфира и фтороводорода из этапа (b) в паровой фазе в зону реакции при повышенной температуре.
В варианте, где не-енолизируемый альдегид, фтороводород и спирт реагируют в паровой фазе для получения α -фторэфира, поток продукта может пропускаться непосредственно к второй зоне реакции, при желании после высушивания возможно вместе с дополнительным фтороводородом и разбавителем, таким как азот.
Если α-фторэфир генерируется в жидкой фазе, жидкая смесь не-енолизируемый альдегид/фтороводород/спирт предпочтительно поддерживается в жидкой фазе, чтобы предотвратить преждевременное разложение α-фторэфира так, как это может случиться в паровой фаз. Поэтому температура жидкой смеси поддерживается ниже температуры кипения смеси продукта, лучше при температуре от -10 до 20oC.
Изобретение иллюстрируется, но не ограничивается следующими примерами.
Получение α -фторэфиров
Пример 1.
24 г
безводного жидкого фтороводорода добавлялось с
охлаждением к 5 г триоксана и к этой смеси добавлялось 0,042 моль метанола. Из смеси сразу отбирался образец и анализировался
газхроматографией/масс-спектрометрией. Объемный % состав смеси
составил:
Компонент - об.% состава
Метанол - 1,61
CH3-O-CH2F - 14,4
CH2F-O-CH2F - 66,8
CH3-O-CH2-O-CH3 - 13,7
Триоксан - 3,4
Пример 2.
Была повторена процедура примера 1 за
исключением того, что использовались 0,073 М этанола. Определенный
объем % состава смеси был следующим:
Компонент - об.% состава
Этанол - 5,7
CH3CH2
-O-CH2F - 17,8
CH2F-O-CH2F
- 36,5
CH3CH2-O-CH2-O-CH2CH3 - 35,2
Триоксан - 2,1
Пример 3.
Была повторена процедура примера 1 за исключением того, что использовались 0,073 М 2-фторэтанола.
Объемный % состав смеси был следующим:
Компонент
- об.% состава
2-фторэтанол - 5,7
CH2
FCH2-O-CH2F - 29,0
CH2F-O-CH2F - 45,0
CH2FCH2
-O-CH2-O-CH2CH2F - 10,0
Триоксан - 4,7
Пример 4.
Была повторена процедура примера 1 за исключением того, что использовались 0,073 М 2, 2-дифторэтанола.
Объемный % состав был
следующим:
Компонент - об.% состава
2,2-дифторэтанол - 4,7
CF2HCH2-O-CH2F
- 59,2
CH2F-O-CH2F - 30,8
CF2HCH2-O-CH2-O-CH2CF2H - 3,6
Триоксан - 0,0
Пример 5.
Была повторена процедура примера 1 за исключением того, что использовалось 0,073 М 2,2,2-трифторэтанола.
Объемный % состав был следующим:
Компонент - об.%
состава
2,2,
2-трифторэтанол - 11,1
CF3CH2-O-CH2F - 62,3
CH2F-O-CH2F - 17,0
CF3CH2
-O-CH2-O-CH2CF3 - 9,5
Триоксан - 0,
0
Пример 6.
Была повторена процедура примера 1, за исключением того, что использовалось 0,042 М 1,1,2, 2-тетрафторпропанола.
Объемный % состав был
следующим:
Компонент - об.% состава
1,1,2,2-тетрафторпропанол - 7,85
CF2CHF2CH2
-O-CH2F - 59,6
CH2F-O-CH2F - 29,3
CF2HCF2CH2-O-CH2-O-CH2CF2 CF2
H - 1,
4
Триоксан - 1,9
Пример 7.
0, 5 см3 трифторацетальдегида в форме его гидрата CF3CH/OH/2 было добавлено к 6 см3 безводного жидкого фтороводорода и смесь анализировалась ядерным резонансом. Анализ показал, что основным продуктом был эфир CF3CHF-O-CHFCF3.
Пример 8.
6 см3 безводного жидкого фтороводорода было добавлено с охлаждением к 1,25 г параформальдегида и к этой смеси было добавлено 0,5 см3 CF3CH(OH)2. Газовая хроматография и масс-спектрометрия показали, что эфиры CF3CHF-O-CH2F и CH2F-O-CH2F было основными продуктами.
Разложение эфиров
Пример 9.
Смесь продукта примера 1
барботировалась азотом со скоростью потока 50 см3 в минуту и продутая смесь подавалась в трубку Inconel с насадкой из 200 см3
Hastelloy C и нагревалась до повышенной
температуры. Отходы газа скрубировались водой и анализировались газовой хроматографией. При 257oC состав отходов газа был:
Компонент - %
об/об.
CH3F
- 19,2
CH2F2 - 60,8
CH2F-O-CH2F - 20,0
Пример 10.
Была
повторена процедура
примера 9 за исключением того, что
смесь продукта примера 5 барботировалась азотом и трубка Inconel была с насадкой из 200 см3 гранул окиси хрома. При 350oC
состав отходов газа
был:
Компонент - %
об/об.
CH3F - 31,5
CH2F2 - 46,6
CF3CH2F - 13,9
CF3CH3
- 0,4
CH2F-O-CH2F - 1,0
Другие - 6,6
Пример 11.
Повторялась процедура примера 9 за исключением того, что смесь продукта примера 6 барботировалась азотом. Масс-спектрометрия показала, что основным продуктом был 1,1,2,2,3-пентафторпропан.
Пример 12.
Повторялась процедура
примера 9, за исключением
того, что смесь продукта
примера 4 барботировалась азотом и трубка была с насадкой из 115 м л (70 г) колец нержавеющей стали, которые обрабатывались воздухом нагреванием
колец до 350oC в
потоке воздуха 4 часа. При
350oC состав отходов газа был:
Компонент - % об/об.
CH2F2 - 4,5
CF2HCH2F - 23,8
CF2HCH2OH - 4,2
CH2F-O-CH2F - 44,5
CF2HCH2-O-CH2F - 21,1
Другие - 1,9
Пример
13.
0,4 г (0,
012 М) метанола добавлялось к 1,7 г (0,021 М) BFME (БФМЭ) с перемешиванием и охлаждением 10 мл (0,5 М). Добавлялся HF или 98% H2
SO4 и смесь
перемешивалась при комнатной
температуре до анализа ГХ и масс-спектрометрией. Выявлено: % (ГХ)
Бис-фторметиловый эфир (БФМЭ) - 55,0
Фторметиловый эфир - 27,
3
Метанол - 7,
05
Бис/фторметокси/метан - 0,62
Диметоксиметан - 8,0
Триоксан - 1,64
Пример 14.
Триоксан добавлялся (10 г, 0,33 М) к HF (48 г, 2,4 М) с перемешиванием. По каплям осторожно добавлялся этанол (1,72 г, 0,037 М) с перемешиванием и охлаждением.
Анализ продуктов масс-спектрометрией показал, что основными компонентами являются БФМЭ и ацеталь диэтоксиметан. Были определены также фторметилэтиловый эфир, C2H5OCH2F.
Пример 15.
2-фторэтанол
(4,67 г, 0,073
М) добавлялся к смеси
триоксана (5 г, 0,167 М) в HF (24 г, 1,2 М). После перемешивания в течение 30 минут продукты анализировались:
Выявлено - % (ГХ)
БФМЭ - 32,1
Фторметилметиловый эфир - 1,4
2-фторэтанол - 58,5
Фторметил 2-фторэтиловый эфир - 6,3
Бис(фторметокси)метан - 0,06
Триоксан - 1,0
Пример 16.
1,5 г (0,018 М) 2, 2-дифторэтанола добавлялось к 1,7 г (0,021 М) БФМЭ. 0,25 мл (0,0125 М) HF или 98% H2SO4 добавлялись и смесь перемешивалась 20 - 30 минут до взятия образца.
Выявлено: - % (ГХ)
БФМЭ - 31,8
Фторметил 2,2-дифторэтиловый эфир - 27,3
2,2-дифторэтанол - 1,6
Бис(фторметокси)метан - 3,1
CHF2
CH2
OCH2OCH2F - 3,9
Триоксан - 1,2
Пример 17.
3,7 г (0,037 М) 2,2,2-трифторэтанола добавлялось к 3,4 г (0,021 М) БФМЭ с охлаждением и перемешиванием. Добавлялось 0,3 мл (0,015 М) HF или 98% H2SO4 и образец смеси отбирался после перемешивания при комнатной температуре 20 - 30 минут.
Выявлено:
- %
(ГХ)
БФМЭ - 15,9
Фторометил-2,2,2-трифторэтиловый эфир - 63,4
Трифторэтанол - 1,5
CF3CH2OCH2OCH2F - 5,8
CF3CH2OCH2OCH2OCH2F - 12,3
Пример 18.
10 г 1H,1H,3H-тетрафторпропанола добавлялось к смеси 6 г триоксана в 20 г HF. После перемешивания смесь анализировалась.
Выявлено: - % (ГХ)
БФМЭ - 23,6
Фторметил 2,2,3,3-тетрафторпропиловый эфир - 67,0
1H,1H,
3H-тетрафторпропанол - 4,
3
Бис(фторметокси)метан - 1,3
CF2HCF2CH2OCH2OCH2F - 2,15
Триоксан - 1,5
Пример
19.
Триоксан (1 г, 0,033 М) добавлялся к HF (5 г, 0,25 М) и смесь охлаждалась. Гексафторизопропанол (2,38 г, 0,0142 М) добавлялся и продукты анализировались после 5-минутного перемешивания.
Выявлено: - %
(ГХ)
БФМЭ - 22,2
/CF3/2CHOCH2F - 4,9
Пример 20.
SbCl5 (1,1 г, 0, 0051 М) был добавлен в охлажденный реактор, содержащий БФМЭ (2,0 г, 0,0244 М) и перемешивался.
Содержимое напора над раствором анализировалось после 1 часа.
Эксперимент был повторен с добавлением 2 г HF (см. табл. 1).
Пример 21.
NbCl5 (0,3 г, 0,0016 М) добавлялся к БФМЭ (1,7 г, 0,021 М) и пространство напора анализировалось после перемешивания в течение часа.
Выявлено: - % (с помощью ИК)
БФМЭ - 88,6
Дифторметан - 0,034
Метилфторид - 0,012
Фторметилметиловый эфир - 0,57
Хлорметилфторметиловый эфир - 10,5
Бис(хлорметиловый) эфир - 0,28
Пример 22.
Хлорид алюминия добавлялся (0,5 г, 0,06 М) к
БФМЭ (2,0 г, 0,0244 М) с перемешиванием.
Напорное пространство анализировалось инфракрасной спектроскопией. Эксперимент затем повторялся с дальнейшим добавлением HF (0,2 г, 0,01 М). (см. табл. 2)
Пример 23.
10 г параформальдегида было добавлено к 48 г HF и смесь перемешивалась. Было добавлено 15 г бромида натрия, порциями по 5 г. По добавлении последних 5 г смесь разделялась на два слоя. Нижний слой при анализе показал содержание смеси БФМЗ, бромометилфторметилового эфира и бис(бромометилового) эфира.
Эксперимент повторялся с использованием БФ МЭ и HBR. HBR пропускался через БФМЭ (4,0 г, 0,049 М) 5 - 10 минут. Был виден один слой, он анализировался масс-спектроскопией и содержал БФ МЭ и бромометилфторметиловый эфир в качестве основных продуктов с небольшим количеством бис/бромометокси/метана.
Примеры 24 - 27.
В этих примерах эфиры разбрызгивались непосредственно из равновесной смеси триоксана/HF+спирт и подавались вместе с БФМЭ. Поэтому продукты реакции содержали CH2F2 и CH3F из этого источника.
Пример 24.
На катализатор Hastelloy C
(20 мл) в трубке 1 при 257oC разбрызгивалась следующая композиция, %:
CH3OH - 1,61
БФМЭ - 66,8
CH3
OCH2F - 14,4
Диметоксиметан - 13,7
Триоксан - 3,4
Отходы газов скрубировались водой до анализа ГХ.
Выявлено - % (ГХ)
CH3F
- 19,2
CH2F2 - 60,8
БФМЭ - 20,0
Пример 25.
На кольца из нержавеющей стали (115 1) при 324oC разбрызгивалась следующая
композиция, %:
БФМЭ - 14,5
2,2-дифторэтанол - 42,3
Фторметил-2,2-дифторэтиловый эфир - 41,4
Выявлено - % (ГХ)
CH2F2 - 4,4
CH2FCHF2 - 23,5
БФМЭ - 44,05
Фторметилметиловый эфир - 1,9
2,2-дифторэтанол - 4,1
Фторметил-2,2-дифторэтиловый эфир - 20,9
Пример
26.
На катализатор из окиси
хрома (200 мл) при 350oC разбрызгивалась следующая композиция, %:
CF3CH2OCH2F - 61,3
БФМЭ
- 16,8
Трифторэтанол - 11,0
CF3CH2OCH2OCH2F - 9,4
Триоксан - 1,6
Выявлено - % (ГХ)
CH3F - 31,5
CH2F2 - 46,6
БФМЭ - 1,0
CH3CF3 - 0,4
CF3CH2F - 13,9
Другие - 6,6
Пример 27.
Эфир/БФМЭ был отделен от
равновесной
смеси и CF2HCF2CH2OH и на Hastelloy C (120 мл) при 259oC разбрызгивалась следующая композиция, % (ИК):
БФМЭ - 4,1
Фторметил 2,
2,3,
3-тетрапропиловый эфир - 68,5
Бис(фторметокси)эфир - 2,1
1H,1H,3H тетрафторпропанол - 4,3
CF2HCF2CH2OCH2OCH2F
- 20,
8
Выявлено - % (ИК)
Фторметил 2,2,3,3-тетрафторпропиловый эфир - 60,3
1H,1H,3H-тетрафторпропанол - 1,0
CH3F
- 1,2
CH2F2
- 0,7
CH2FCF2CH2F - 12,8
Другие - 24,0
Пример 28.
Фторальгидрат (0,5 г, 0,0043 М) добавлялся к смеси параформальдегида (1, 25 г, 0,0417 М) и HF (6,0 г, 0,3 М) и смесь анализировалась после 30-минутного перемешивания.
Выявлено - % (масс-спектр)
БФМЭ
- 59,5
Фторальгидрат - 0,37
CF3CHFOCH2F - 27,8
CF3CHFOCH2CH3 - 0,29
CH2FOCH2OCH2F - 1,5
Триоксан - 1,79
Пример 29.
Метанол (0,6 г, 0,0187 М) добавлялся к фторальгидрату (1,7 г, 0,0146 М) с перемешиванием и охлаждением. Добавлялся HF (2,2 г, 0,11 М) и продукт реакции анализировался после перемешивания.
Выявлено - % (ИК)
Метанол - 3,6
Фторальгидрат - 46,4
Метил 1,2,2,2-тетрафторэтиловый эфир
- 48,3
Этил-1,2,2,2-тетрафторэтиловый эфир
- 1,7
Пример 30.
К формальгидрату (2,6 г, 0,022 М) с перемешиванием и охлаждением добавлялся этанол (1,9 г, 0,041 М). Затем добавлялся HF (2,0 г, 0,1 М) и смесь анализировалась после 30-минутного перемешивания.
Выявлено - % (ИК)
Этанол - 94,9
Фторальгидрат - 1,6
Этил-1,2,
2,
2-тетрафторэтиловый эфир - 3,65
Пример 31.
К фторальгидрату (4,3 г, 0,037 М) с перемешиванием и охлаждением добавлялся 2-фторэтанол (3,0 г, 0,047 М). Добавлялся HF (5,0 г, 0, 25 М) и смесь анализировалась после 30-минутного перемешивания.
Выявлено - % (ИК)
Фторальгидрат - 65,1
Метанол - 3,5
Ацетальдегид - 2,8
Трифторэтанол - 0,8
2-фторэтанол - 27,
2
2'-фторэтил-1,2,2,2-тетрафторэтиловый эфир - 0,62
Пример 32. Получение фторметил-2,2,2-трифторэтилового эфира.
100 г безводного HF добавлялись к 20 г триоксана в пластиковой бутылке, охлажденной в измельченном льду. К раствору добавлялось 50 г трифторэтанола. Полученный раствор медленно добавлялся к 500 см3 измельченного льда для получения водного и органического слоя. Органический слой отделялся и дистиллировался для получения 99% чистого эфира (ГХ/МС, ЯМР).
Получение катализатора для разложения эфира.
Катализаторы просеивались через сито для получения частиц размером от 1,18 мм до 0,25 мм и затем насаживались в трубку из нержавеющей стали. Они предварительно обрабатывались фтором пропусканием HF с азотом со скоростью потока 50 см3 в минуту и пропусканием паров через катализатор при 350oC в течение 4 часов.
Разложение эфира
5 г эфира растворялось в
15 г HF и разбрызгивалось над катализатором с азотом со скоростью потока 20 см3 в минуту. Отходы газа очищались водой и
анализировались ГХ (см. табл. 3).
Пример 33. Получение фторметил-1,2,2,2-тетрафторэтилового эфира, CF3CHFOCH2F.
С перемешиванием и охлаждением триоксан (10 г, 0,33 М) добавлялся к безводному HF (150 г, 7,5 М). Фторальгидрат (10 г, 0,086 М) добавлялся к смеси, которая анализировалась после 24 часов.
Выявлено (%
масс-спектрометрией)
БФМЭ - 46,6
CF3CHFOCH2F - 41,05
CF3CHFOCH2OCH2 - 5,8
Не определено - 5,2
CF3CHFOCH3 - 1,3
Пример 34.
Этанол (3,24 г, 0,0704 М) добавлялся к охлажденной перемешанной смеси триоксана (5 г, 0,166 М) в HF (24 г, 2,2 М). Продукты анализировались ГХ и масс-спектрометрией.
Выявлено - (%
масс-спектр)
БФМЭ - 36,5
Диэтоксиэтан - 35,2
Фторметил эфир эфир - 17,8
Этанол
- 5,7
БФММ - 2,8
Триоксан - 2,06
Пример 35.
Гексафторизопропанол (2,38 г, 0,0142 М) добавлялся к охлажденной перемешанной смеси триоксана (1 г, 0,0133 М) в HF (5 г, 0,25 М). После 5-минутного перемешивания смесь анализировалась масс-спектрометрией.
Гексафторизопропанол - 71,6
БФМЭ - 22,2
/CF3/2
CHOCH2F - 4,9
/CF3/2CHOCH2OCH2F - 1,3г
Реферат
Изобретение относится к способу получения (гало) фторуглеводородов, используемых как охлаждающие агенты, вспенивающие агенты, растворители и пропелленты. Способ включает нагревание соответствующего α-фторэфира в первой фазе при повышенной температуре. α-Фторэфиры получают реакцией не-енолизируемого альдегида с образованием промежуточного соединения с реакцией последнего со спиртом или галогенирезующим агентом. Предлагаются также новые α-фторэфиры. Способ прост в осуществлении. Изобретение способствует поиску подходящих заменителей хлорфторуглеводородов. 4 с. и 24 з.п.ф-лы, 8 ил., 3 табл.

Формула
R - O - CF R1R2,
где R обозначает алифатическую или ароматическуюю группу;
R1 и R2 каждый - водород или алкил,
причем R, R1 и/или R2 необязательно замещены по меньшей мере одним атомом фтора.
R - O - (CH2)nF,
где R - группа, выбранная из -CH2FCH2, -CH2F2CH, -CH2-CF3, -CH2-CF2 - CHF2, -CHF - CF3, - CH2Cl, -CH2Br;
n = 1 или 2 при условии, что n = 2 только, когда R - CHF - CF3 .
CHF2CH2 OCH2 F.
CF3CH2OCH2F.
CHF2CF2CH2 OCH2F.
CH2FOCH2Cl.
CH2FOCH2Br.
CH2FCH2OCH2F.

Комментарии