Способ функционализации полиолов путем тандемной реакции гидроформилирования-ацетализации с применением водорастворимой каталитической системы - RU2708256C1
Код документа: RU2708256C1
Чертежи
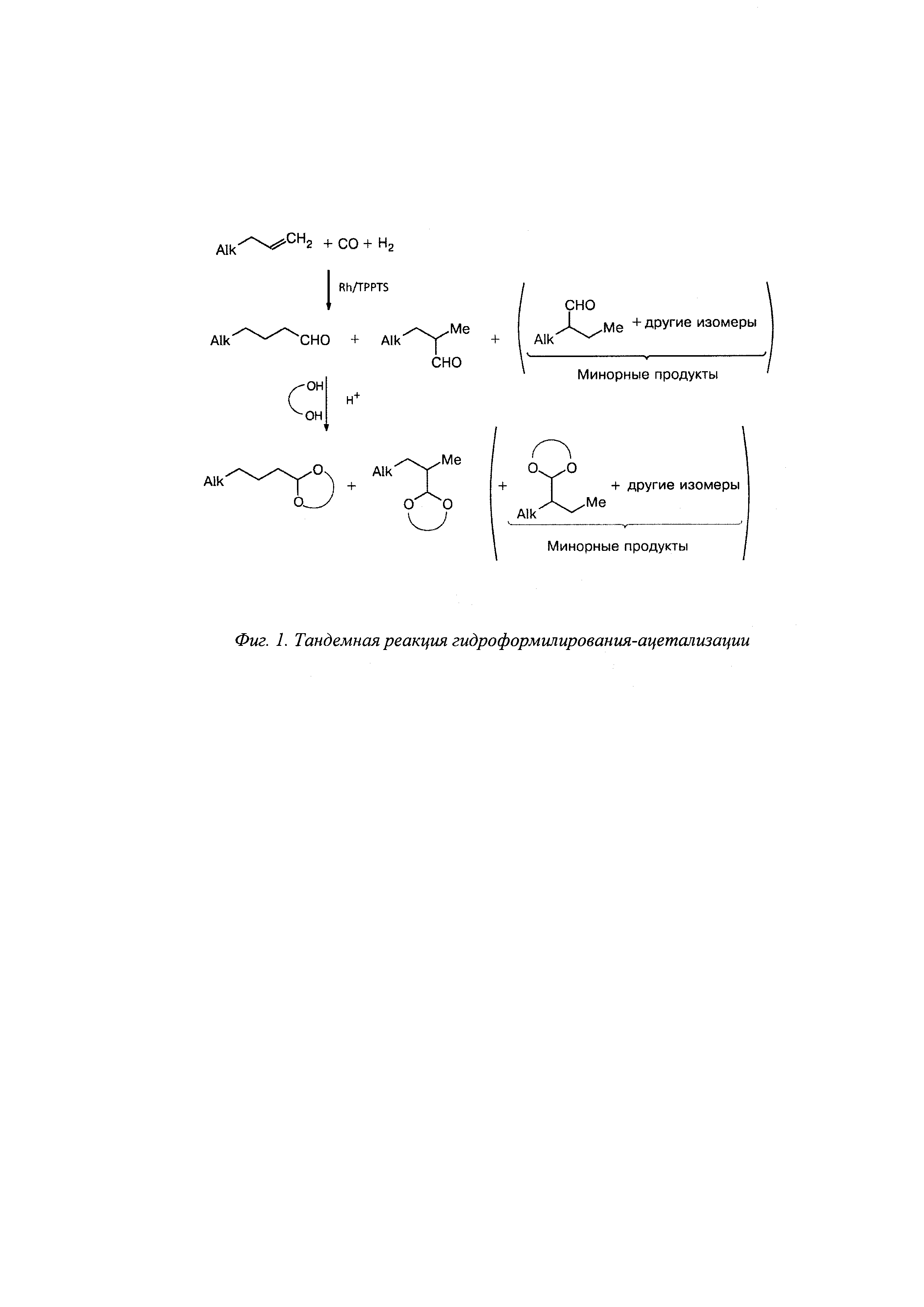

Описание
Область техники
Изобретение относится к области функционализации полиолов для получения класса кислородсодержащих соединений - циклических ацеталей. Также изобретение относится к способу получения циклических ацеталей, который заключается в проведении гидроформилирования непредельного соединения с получением соответствующих альдегидов, при этом альдегиды без стадии выделения и очистки вовлекаются во вторую стадию тандемной реакции - ацетализацию, в результате чего альдегиды взаимодействуют с полиолами, образуя циклические ацетали. Получение ацеталей из непредельных соединений и ацеталей осуществляется с использованием каталитической системы, содержащей водорастворимый комплекс родия и кислоту, при этом каталитическая система находится в водной фазе и не смешивается с продуктами реакции, находящимися в органической фазе, отделяется и используется многократно. Изобретение может быть использовано в органическом и нефтехимическом синтезе для получения соединений класса ацетали при переработке непредельного сырья и полиолов.
Уровень техники
Гидрофобизация полиолов, являющихся компонентами возобновляемого сырья, отходами сахарной промышленности, индивидуальными веществами или их производными, является актуальной практической задачей. В результате проведения гидрофобизации полиолов могут быть получены соединения класса ацетали с 5- и 6-членным циклическим фрагментом. Циклические ацетали могут применяться в качестве растворителей, детергентов, эмульгаторов, компонентов косметических средств или технических добавок, например, для смазочных материалов и гидравлических масел [Pat. US 4537980 A (publ. 1979). Acetals; Pat. WO 2009100854 A2 (publ. 2008). Method for producing acetals.], а также ароматических веществ [Pat. ЕР 1316553 B1 (publ. 2001). Fragrances based on cyclic acetals]. Ацетали на основе полиолов имеют перспективы использования в агрохимии: они способны значительно снижать поверхностное натяжение без образования пены, поэтому их добавление в агрохимические композиции, например, содержащие гербициды, инсектициды, фунгициды или промоторы роста растений, улучшает способность активных веществ оставаться на поверхности и затем проникать в листья растений [Pat. ЕР 2305662 B1 (publ. 2009). Alkoxylated glycerol acetals and their derivatives]. Перспективным представляется использование смесей ацеталей в качестве добавок к углеводородным топливам для двигателей внутреннего сгорания - бензинам и дизельным топливам. Ацетали могут быть использованы для увеличения октанового числа бензинов [Пат. РФ 2365617 (опубл. 2009). Октаноповышающая добавка к бензину], для улучшения свойств биодизеля (вязкости, стойкости к окислению, температуры вспышки и т.д.) или как антифризы биодизеля [Belen
Классические способы получения циклических ацеталей заключаются в проведении реакции ацетализации на кислотных катализаторах с азеотропной отгонкой воды [Climent М. J., Corma A., Iborra S. // Green Chem. 2014. V. 16. P. 516-547]. Эти способы требуют использования в качестве сырья дорогостоящих альдегидов и высокоэффективных, предпочтительно гетерогенных, катализаторов, поэтому не представляются перспективными для внедрения в промышленности. Существуют способы функционализации полиолов их взаимодействием с кетонами [Химия биомассы: биотоплива и биопластики / А.Р. Аблаев, В.И. Быков, С.Д. Варфоломеев и др. - Научный мир Москва, 2017. - 790 с]. Для реализации данных процессов наиболее рационально использование в качестве сырья глицерина и наиболее доступного карбонильного соединения - ацетона, в результате чего могут быть синтезированы соответствующие циклические кетали, область применения которых может быть смежной с областью применения циклических ацеталей. Однако, в отличие от процесса кетализации глицерина ацетоном, предлагаемый в данном патенте способ функционализации включает использование в качестве сырья широкого круга непредельных субстратов, а также полиолов, что позволяет регулировать структуру образующегося ацеталя и получать широкий ассортимент конечной продукции. Способ основан на проведении каскада реакций гидроформилирования-ацетализации. Первая стадия - гидроформилирование непредельных соединений - является широко изученной, внедренной в промышленности [А.

Раскрытие изобретения
Задачей настоящего изобретения является разработка способа получения циклических ацеталей из непредельных соединений и полиолов, где полиол выбирается из следующих: этиленгликоль, глицерин, пентаэритрит, пинакон, 1,3-пропандиол, 1,4-бутандиол, ксилит, сорбит, ксилоза, глюкоза; непредельные соединения могут представлять собой линейные олефины с длиной цепи C2-С14, стирол, аллилбензол, норборнилен, терпены, циклогексен, октадиен-1,8, лимонен, тримеры пропилена, димеры бутилена, промышленные олигомеры этилена, продукты синтеза Фиреша-Тропша, олефинсодержащие газы процессов каталитического крекинга, пиролиза, оксикрекинга, а способ получения ацеталей из указанных субстратов представляет собой последовательность тандемных реакций гидроформилирования-ацетализации, протекающих в одной реакторе без стадии выделения промежуточных соединений, при этом используется каталитическая система, содержащая комплекс родия, который может представлять собой Rh(acac)(CO)2 (асас=ацетилацетон), HRh(PPh3)3(CO), RhCl(CO)(PPh3)3, Rh(cod)2BF4(cod=циклооктадиен), Rh[(cod)Cl]2, водорастворимый лиганд сульфированный трифенилфосфин (TPPTS), который может получен по известному способу [US4668824A (publ. 1983). Preparation of tri-(m-sulfophenyl)-phosphine], и кислоту (HCl, H2SO4, p-TSA, твердые кислоты - Amberlyst-15, Nafion, Wofatit 200 KPS, КУ-2). На первой стадии при взаимодействии олефина с синтез-газом в присутствии родиевого катализатора образуются альдегиды, которые взаимодействуют с полиолом, за счет наличия в системе кислотного катализатора, образуя циклические ацетали (фиг. 1). Возможно протекание побочных реакций изомеризации положения двойной цепи исходного олефина, что приводит, в большинстве случаев, к получению смеси циклических продуктов.
Техническим результатом является разработка способа получения циклических ацеталей различного строения путем тандемной реакции гидроформилирования-ацетализации с использованием водорастворимой каталитической системы, получаемой при модификации родиевого комплекса трисульфированным трифенилфосфином, отделяемой от продуктов реакции и используемой многократно (фиг. 2).
Способ характеризуется тем, что в автоклаве смешивают олефин (А), ацетилацетонатодикарбонил родия Rh(acac)(CO)2 (Б), при соотношении Б:А от 1:500 до 1:10000 в массовых долях, водорастворимый лиганд TPPTS (В), при соотношении В:Б от 3:1 до 50:1 в мольных долях, полиол (Г), взятый при мольном соотношении Г:А от 1:1 до 5:1; воду, взятую при массовом соотношении вода:полиол от 0,2:1 до 3:1, 70% раствор серной кислоты (Д) при соотношении Г:Д от 10:1 до 200:1 в массовых долях; а также толуол, взятый в объемном соотношении толуол:вода от 0,1:1 до 2:1; создают в автоклаве давление синтез-газа (СО/Н2=1:1) 0,1-10 МПа, нагревают смесь до 30-120°С, при этом синтез ведут при перемешивании механической мешалкой при 500-1000 об/мин в течение 2-20 часов, при этом получают основные продукты - циклические ацетали, после завершения реакции автоклав охлаждают, сбрасывают давление синтез-газа, затем отделяют каталитическую систему, содержащую воду, комплекс родия с водорастворимым лигандом, кислоту и остаточный полиол посредством разделения фаз, органическую фазу разделяют на компоненты способом вакуумной разгонки, а водную фазу используют для получения ацеталей повторно. Состав продуктов реакции определяют методами спектроскопии ЯМР и газо-жидкостной хроматографии. Предложенным способом могут быть получены индивидуальные циклические ацетали или смеси циклических ацеталей. Активность каталитической системы в единицах TOF (ч-1) составляет 500-2000, что сопоставимо с активностью каталитических систем многих нефтехимических процессов, или превосходит их. Селективность по целевым продуктам (ацеталям) при этом составляет 50-99%, конверсия исходного олефина составляет 80-95%. Вымывание родия в органическую фазу в каждом каталитическом цикле составляет не более 1% (определяется методом элементного анализа ICP-AES), что делает процесс выгодным с точки зрения экономии катализатора.
Осуществление изобретения
Спектры ЯМР1Н,13С и31Р регистрировали на приборе Bruker Avance 400, химические сдвиги приведены в шкале δ относительно ТМС (1Н и13С) и 85%-ной Н3РО4(31Р); при отнесении сигналов в спектрах использовали данные корреляций COSY и спектров ЯМР13С APT.
Анализ состава смесей продуктов каталитических реакций осуществляли методом газо-жидкостной хроматографии на хроматографе HP G1530A с пламенно-ионизационным детектором, капиллярной колонкой (30 м), заполненной фазой SE-30, при программировании температуры от 60 до 230°С, газ-носитель - гелий.
Коммерчески доступные реагенты использовали без дополнительной очистки. Растворители очищали и абсолютировали в соответствии со стандартными методиками [«Лабораторная техника органической химии» под ред. Б. Кейла, изд. «МИР», 1966].
Реакции проводили в стальном автоклаве объемом 1 л, снабженном механической мешалкой и устройством для термостатирования при температурах до 300°С. В автоклав загружали органический растворитель - толуол (30 мл), компоненты водорастворимой каталитической системы - Rh(acac)(CO)2 (150 мг, 0,58 ммоль), TPPTS (2 г, 3,5 ммоль), водный 1М раствор H2SO4 (40 мл), и субстраты - олефин (0,65 моль) и полиол (0,8 моль). Автоклав продували синтез-газом, затем заполняли синтез-газом (СО:Н2=1:1) до давления 6,0 МПа и нагревали 8 ч при 80°С при постоянном перемешивании. После завершения реакции автоклав охлаждали до комнатной температуры, сбрасывали давление, и выгружали органическую фазу. Контроль состава органической фазы проводили методами ГЖХ и ЯМР1Н и13С. К водной фазе, находящейся в автоклаве добавляли новую порцию полиола (80% от предыдущей загрузки), непредельный субстрат (0,65 моль) и толуол (30 мл). Объединенные органические фазы подвергали вакуумной разгонке для отделения непрореагировавших олефинов, альдегидов, и толуола, с получением смесей ацеталей, чистоту которых контролировали методами ГХЖ и спектроскопии ЯМР.
Пример 1. Получение циклических ацеталей из октена-1 и этиленгликоля
В стальной автоклав объемом 1 л, снабженный механической мешалкой и устройством для термостатирования загружают органический растворитель - толуол (30 мл), компоненты водорастворимой каталитической системы - Rh(acac)(CO)2 (150 мг, 0,58 ммоль), TPPTS (2 г, 3,5 ммоль), водный 1М раствор H2SO4 (40 мл), и субстраты - октен-1 (0,65 моль) и этиленгликоль (0,8 моль). Автоклав продувают синтез-газом, затем заполняют синтез-газом (СО:Н2=1:1) до давления 6,0 МПа и нагревают 8 ч при 80°С при постоянном перемешивании. После завершения реакции автоклав охлаждают до комнатной температуры, сбрасывают давление, и выгружают органическую фазу. Контроль состава органической фазы проводят методами ГЖХ и ЯМР1Н и13С. Органическую фазу разделяют на компоненты способом вакуумной разгонки с получением циклических ацеталей в качестве целевого продукта. Конверсия октена-1 составляет 97%, селективность по ацеталям - 90%.
Пример 2. Повторное использование каталитической системы для получения ацеталей из этиленгликоля и октена-1
К водной фазе, находящейся в автоклаве после проведения опыта по примеру 1, добавляют новую порцию этиленгликоля (80% от предыдущей загрузки), октен-1 (0,65 моль) и толуол (30 мл). Далее проводят эксперимент аналогично тому, как это описано в примере 1. После реакции ацетали выделяют способом как в примере 1. Конверсия октена-1 составляет 95%, селективность по ацеталям - 85%.
Пример 3. Получение циклических ацеталей из октена-1 и глицерина
Эксперимент проводят аналогично примеру 1, но вместо этиленгликоля берут глицерин (0,8 моль). Контроль состава органической фазы проводят методами ГЖХ и ЯМР1Н и13С. Органическую фазу разделяют на компоненты способом вакуумной разгонки с получением циклических ацеталей в качестве целевого продукта. Конверсия октена-1 составляет 96%, селективность по ацеталям - 70%.
Пример 4. Повторное использование каталитической системы для получения ацеталей из глицерина и октена-1
К водной фазе, находящейся в автоклаве после проведения опыта по примеру 3, добавляют новую порцию глицерина (80% от предыдущей загрузки), октен-1 (0,65 моль) и толуол (30 мл). Далее проводят эксперимент аналогично тому, как это описано в примере 3. После реакции ацетали выделяют способом как в примере 3. Конверсия октена-1 составляет 95%, селективность по ацеталям - 65%.
Пример 5. Получение циклических ацеталей из октена-1 и сорбита
Эксперимент проводят аналогично примеру 1, но вместо этиленгликоля берут сорбит (0,8 моль). Контроль состава органической фазы проводят методами ГЖХ и ЯМР1Н и13С. Органическую фазу разделяют на компоненты способом вакуумной разгонки с получением циклических ацеталей в качестве целевого продукта. Конверсия октена-1 составляет 96%, селективность по ацеталям - 55%.
Пример 6. Повторное использование каталитической системы для получения ацеталей из октена-1 и сорбита
К водной фазе, находящейся в автоклаве после проведения опыта по примеру 5, добавляют новую порцию сорбита (80% от предыдущей загрузки), октен-1 (0,65 моль) и толуол (30 мл). Далее проводят эксперимент аналогично тому, как это описано в примере 5. После реакции ацетали выделяют способом как в примере 5. Конверсия октена-1 составляет 94%, селективность по ацеталям - 50%.
Пример 7. Получение циклических ацеталей из этилена и глицерина
Эксперимент проводят аналогично примеру 1, но вместо октена-1 в автоклав загружают этилен до давления 1,5 МПа (0,65 моль), а вместо этиленгликоля берут глицерин (0,8 моль). Контроль состава органической фазы проводят методами ГЖХ и ЯМР1Н и13С. Органическую фазу разделяют на компоненты способом вакуумной разгонки с получением циклических ацеталей в качестве целевого продукта. Конверсия этилена составляет 90%, селективность по ацеталям - 85%.
Пример 8. Повторное использование каталитической системы для получения ацеталей из этилена и глицерина
К водной фазе, находящейся в автоклаве после проведения опыта по примеру 7, добавляют новую порцию глицерина (80% от предыдущей загрузки), этилен (0,65 моль) и толуол (30 мл). Далее проводят эксперимент аналогично тому, как это описано в примере 7. После реакции ацетали выделяют способом как в примере 7. Конверсия октена-1 составляет 94%, селективность по ацеталям - 50%.
Реферат
Изобретение относится к способу функционализации полиолов алкильными фрагментами путем тандемной реакции гидроформилирования-ацетализации с использованием водорастворимой каталитической системы для получения циклических ацеталей, характеризующемуся тем, что в автоклаве смешивают олефин (А), ацетилацетонатодикарбонил родия Rh(acac)(CO)(Б), при соотношении Б:А от 1:500 до 1:10000 в массовых долях, водорастворимый лиганд TPPTS (В), при соотношении В:Б от 3:1 до 50:1 в мольных долях, полиол (Г), взятый при мольном соотношении Г:А от 1:1 до 5:1; воду, взятую при массовом соотношении вода:полиол от 0,2:1 до 3:1, 70% раствор серной кислоты (Д) при соотношении Г:Д от 10:1 до 200:1 в массовых долях; а также толуол, взятый в объемном соотношении толул : вода от 0,1:1 до 2:1; создают в автоклаве давление синтез-газа (СО/H=1:1) 0,1-10 МПа, нагревают смесь до 30-120°С, синтез ведут при перемешивании механической мешалкой при 500-1000 об/мин в течение 2-20 часов, при этом получают основные продукты - циклические ацетали, после завершения реакции автоклав охлаждают, сбрасывают давление синтез-газа, затем отделяют каталитическую систему, содержащую воду, комплекс родия с водорастворимым лигандом, кислоту и остаточный полиол посредством разделения фаз, органическую фазу разделяют на компоненты способом вакуумной разгонки, а водную фазу используют для получения ацеталей повторно; в качестве сырья для процесса из полиолов могут быть использованы этиленгликоль, глицерин, пентаэритрит, пинакон, 1,3-пропандиол, 1,3-бутандиол, ксилит, сорбит, ксилоза, глюкоза, в качестве непредельных субстратов могут быть использованы линейные олефины с длиной цепи С-С, стирол, аллилбензол, норборнилен, терпены, циклогексен, октадиен-1,8, лимонен, олигомеры низших олефинов (тримеры пропилена, димеры бутилена, промышленные олигомеры этилена), олефинсодержащие газы (с процессов каталитического крекинга, пиролиза, оксикрекинга), каталитическая система для проведения процесса содержит родиевый комплекс (Rh(acac)(CO)(асас=ацетилацетон), HRh(PPh)(CO), RhCl(CO)(PPh), Rh(cod)BF(cod=циклооктадиен), Rh[(cod)Cl]), водорастворимый фосфиновый лиганд TPPTS и кислоту (HCl, HSO, p-TSA, твердые кислоты - Amberlyst-15, Nafion, Wofatit 200 KPS, КУ-2). При этом каталитическая система, находящаяся в водной фазе, может быть отделена от продуктов реакции, которые экстрагируются в органическую фазу, и, таким образом, каталитическая система может быть использована многократно. Технический результат – разработан новый способ получения циклических ацеталей, которые могут быть использованы в качестве растворителей, детергентов, ароматических соединений, смазок, компонентов топлив, а также возобновляемых компонентов бионефти. 2 ил., 8 пр.
Формула
Документы, цитированные в отчёте о поиске
Способ получения циклических ацеталей

Комментарии