Способ получения ацилированных алкоксилатов вторичных спиртов и алкоксилатов вторичных спиртов - RU2510964C2
Код документа: RU2510964C2
Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к способу получения ацилированных алкоксилатов вторичных спиртов и алкоксилатов вторичных спиртов.
УРОВЕНЬ ТЕХНИКИ
Широкий круг продуктов, применимых, например, в качестве неионных ПАВ, смачивающих и эмульгирующих агентов, растворителей и химических интермедиатов, получают с помощью реакций присоединения (реакций алкоксилирования) алкиленоксидов (эпоксидов) к органическим соединениям, имеющим один или несколько активных атомов водорода.
Например, этоксилаты спиртов можно получать взаимодействием этиленоксида с алифатическими спиртами, включающими от 6 до 30 атомов углерода. Подобные этоксилаты и в меньшей степени соответствующие пропоксилаты, а также соединения, содержащие как оксиэтиленовые, так и оксипропиленовые группы, широко применяются в качестве неионных моющих компонентов в чистящих составах и средствах личной гигиены.
В US 2008/0167215 A1 раскрыты определенные ацилированные алкоксилаты спиртов, предназначенные для применения в качестве ПАВ с низким пенообразованием.
У сульфатированных алкоксилатов спиртов также имеется широкий круг применений, особенно в качестве анионных ПАВ. Сульфатированные этоксилаты высших вторичных спиртов (SAES) в широкой области применений обеспечивают свойства, сравнимые со свойствами анионных ПАВ, например линейных алкилбензолсульфонатов и этоксисульфатов первичных спиртов, а также сульфонатов метиловых эфиров. Эти вещества можно применять в производстве бытовых моющих средств, в т.ч. стиральных порошков, жидких средств для стирки, жидких средств для мытья посуды и других бытовых моющих средств, а также смягчающих веществ и композиций для личной гигиены, и, кроме того, в качестве ПАВ для (разбавления) поверхностно-активного состава при заводнении нефтяных скважин и в качестве поверхностно-активного компонента, применяемого, например, в щелочных, поверхностно-активных и полимерсодержащих смесях, подходящих для улучшения нефтеотдачи.
Один из типовых способов получения алкоксилированных спиртов, например алкоксилатов линейных или разветвленных первичных спиртов, заключается в гидроформилировании олефинов с получением оксоспиртов и последующем алкоксилировании полученного спирта реакцией с подходящим алкиленоксидом, например этиленоксидом или пропиленоксидом. Однако способы, включающие гидроформилирование, являются дорогостоящими, и гидроформилирование вызывает образование линейных или разветвленных первичных спиртов (в зависимости от вида реакции получения оксоспиртов), которые затем необходимо подвергать алкоксилированию.
Для некоторых областей применения лучший результат могут обеспечить смеси алкоксилатов вторичных спиртов (например, при улучшении нефтеотдачи (EOR), в связи со способностью растворять нефть).
Алкоксилаты вторичных спиртов обычно получают путем окисления/гидроксилирования парафинов, например, по реакции Башкирова, с последующим алкоксилированием.
Однако окисление парафинов до вторичных спиртов и их последующее алкоксилирование, как правило, представляет сложный двухстадийный процесс и, следовательно, является дорогостоящим путем синтеза.
Указанный способ включает получение вторичных спиртов непосредственно из парафинов путем окисления с применением борной кислоты в качестве катализатора. Строго говоря, соединение бора не является катализатором, т.к. оно расходуется в ходе реакции. Его функция заключается в защите продукта окисления (вторичного спирта) за счет образования устойчивого к окислению эфира борной кислоты. В процессе в целом, включая повторное выделение борной кислоты из реакционной смеси, борная кислота действительно играет роль «катализатора», поскольку ее вторая функция заключатся в увеличении скорости окисления. В ходе реакции образуются эфиры борной кислоты и вторичных спиртов, и их можно отделить от парафинов перегонкой, если число атомов углерода (число атомов углерода в углеродной цепи спирта) спирта составляет 14 или менее. Однако, если число атомов углерода равно 15 или более, необходимая для перегонки температура равна температуре разложения эфира борной кислоты или превышает ее, и поэтому обычный способ перегонки может оказаться неэффективным.
Кроме того, окисление парафинов в присутствии производных борной кислоты ведет к образованию диолов в качестве одного из основных побочных продуктов (смотрите N.Kurata and K.Koshida, Hydrocarbon Processing, 1978, 57(1), 145-151 и N.J.Stevens and J.R.Livingston, Chem.Eng.Progress, 1968, 64(7), 61-66). Таким образом, следует ожидать, что только после очень тщательной очистки от упомянутых загрязняющих диолов вторичные спирты окажутся пригодными для алкоксилирования и что стоимость подобной очистки может сделать данный способ синтеза в целом непригодным с экономической точки зрения.
Альтернативный путь получения алкоксилатов вторичных спиртов, описанный в US 6 017 875 A, включает катализируемое кислотами присоединение олигоэтиленгликолей к олефинам с внутренними двойными связями. Однако указанный путь является трудоемким, т.к. он приводит к образованию также диалкилзамещенных олигоалкиленгликолей и олигомеров олефинов с внутренней двойной связью в качестве побочных продуктов. Таким образом, этот путь также является дорогостоящим.
В современной практике промышленного производства этоксилаты вторичных спиртов производят дорогостоящим двухстадийным способом. На первой стадии к вторичному спирту присоединяют два-три этиленоксидные группы, используя кислотный катализатор (кислоту Льюиса), получая первичный гидроксилсодержащий этоксилат небольшой молекулярной массы (низкомолекулярный). На второй стадии, после удаления кислотного катализатора (в основном путем нейтрализации), в реакцию с этоксилатом низкой молекулярной массы (преимущественно в смеси с первичным спиртом) вводят желаемое дополнительное количество этиленокси-фрагментов, используя основной катализатор, например гидроксид калия. Этот двухстадийный способ обладает тем преимуществом, что неизбежно образующийся побочный продукт этоксилирования при катализе кислотой (Льюиса) - 1,4-диоксан - можно эффективно удалить мгновенным испарением или отгонкой после удаления или нейтрализации кислотного катализатора из промежуточного этоксилата низкой молекулярной массы, до превращения промежуточного продукта в конечный продукт с желаемым уровнем этоксилирования.
Однако было бы желательно разработать простой и экономичный способ получения алкоксилатов вторичных спиртов, не сопряженный с образованием 1,4-диоксана и алкоксилатов с очень широким распределением молекулярной массы алкоксилатных фрагментов.
В связи с этим необходимо отметить, что реакции присоединения алкиленоксидов, как известно, приводят к получению смеси продуктов с различными алкоксилатными группами, включающими различное количество присоединенных фрагментов алкиленоксида (оксиалкиленовых аддуктов). Количество присоединенных фрагментов является фактором, который во многих отношениях определяет свойства молекул алкоксилатов, и предпринимаются усилия по приведению в соответствие среднего числа присоединенных фрагментов алкиленоксида в продукте и/или распределения этого числа в различных молекулах продукта с предполагаемой сферой применения продукта.
В технике сообщалось о смесях алкоксилатов, в которых довольно значительная доля молекул имела число присоединенных фрагментов алкиленоксида (n), находящееся в пределах относительно узкого диапазона значений, как о предпочтительных продуктах для применения в некоторых моющих составах (GB-A-1462134; Research Disclosure No 194010). Кроме того известно, что алкоксилаты с узким диапазоном значений n являются особенно ценными химическими интермедиатами в синтезе некоторых карбоксиалкилированных алкиловых полиэфиров (US-A-4098818) и некоторых сульфатов алкиловых эфиров (GB-A-1553561).
Следовательно, было бы полезно разработать альтернативный способ получения алкоксилатов вторичных спиртов и в особенности алкоксилатов спиртов с узким диапазоном, с тем чтобы не только избежать необходимости применения гидроформилирования, но также избежать применения в качестве интермедиата достаточно нестабильных вторичных спиртов (которые могут вновь превращаться в олефины с внутренней двойной связью).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В соответствии со сказанным выше настоящее изобретение относится к способу получения ацилированных алкоксилатов вторичных спиртов, где указанный способ включает:
(i) взаимодействие одного или нескольких олефинов с внутренней двойной связью (в дальнейшем для простоты изложения именуемых «внутренними олефинами») с одной или несколькими карбоновыми кислотами в присутствии каталитической композиции с получением одного или нескольких эфиров карбоновых кислот;
(ii) взаимодействие одного или нескольких эфиров карбоновых кислот, полученных на стадии (i), с одним или несколькими алкиленоксидами в присутствии каталитически эффективного количества каталитической композиции, включающей:
(a) одну или несколько солей щелочноземельных металлов и карбоновых кислот или гидроксикарбоновых кислот и/или гидратов первых;
(b) кислородсодержащую кислоту, выбранную из серной кислоты и ортофосфорной кислоты;
(c) спирт и/или сложный эфир;
и/или продукты взаимодействия (a),(b) и/или (c)
с получением одного или нескольких ацилированных алкоксилатов вторичных спиртов.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Стадия (i) способа по настоящему изобретению включает взаимодействие одного или нескольких внутренних олефинов с одной или несколькими карбоновыми кислотами в присутствии каталитической композиции с образованием одного или нескольких эфиров карбоновых кислот.
Указанные внутренние олефины предпочтительно выбраны из олефинов, включающих 8-32 атома углерода, более предпочтительно 10-28 атомов углерода и наиболее предпочтительно 12-24 атома углерода.
Внутренние олефины, применяемые на стадии (i) способа по настоящему изобретению, могут являться замещенными или незамещенными алифатическими внутренними олефинами.
На замещающие группы замещенных алифатических внутренних олефинов не накладывается конкретных ограничений, и они могут включать заместители, выбранные из фенильных групп, 1-нафтильных групп, 2-нафтильных групп, пиридильных групп, нитрогрупп, аминогрупп, амидогрупп, атомов галогенов, карбоксильных групп, алкоксигрупп (например, метоксигрупп, этоксигрупп, феноксигрупп), аралкильных групп и гетероциклических групп.
Примеры внутренних олефинов, которые подходят для применения в способе по настоящему изобретению, включают смеси внутренних олефинов, образующиеся в секции изомеризации-диспропорционирования способа фирмы Shell для получения высших олефинов (SHOP), необязательно после прохождения через установку изомеризации олефинов (OIU) для увеличения степени разветвления главным образом линейных внутренних олефинов, выходящих из ID секции, до приблизительно одного разветвления на алкильную цепь, например, смеси C8-C10 внутренних олефинов, внутренние олефины C10, смеси C11-C12 внутренних олефинов, смеси C11-C14 внутренних олефинов, смеси C15-C16 внутренних олефинов и смеси C15-C18 внутренних олефинов. Кроме того, примеры внутренних олефинов, которые можно с успехом применять в способе по настоящему изобретению, включают смеси внутренних олефинов, полученные в способе конверсии парафинов фирмы UOP (PACOL) в потоке парафинов, образующихся в процессе превращения газ-жидкость (GTL) или из процесса депарафинизации. Кроме того, в способе по настоящему изобретению можно с успехом применять смеси олефинов, образующиеся непосредственно в способе синтеза парафинов, олефинов и оксопроизводных по Фишеру-Тропшу.
На карбоновые кислоты, которые могут успешно применяться на стадии (i) способа по настоящему изобретению, не накладывается ограничений. Указанные карбоновые кислоты могут быть необязательно замещены одной или несколькими инертными функциональными группами, т.е. функциональными группами, которые не должны мешать протеканию реакции на стадии (i). Примеры инертных функциональных групп, которые могут входить в состав кислот, включают атомы хлора и брома, нитрогруппы и алкоксигруппы, например метоксигруппы.
Предпочтительно, указанные карбоновые кислоты могут быть выбраны из разветвленных и неразветвленных карбоновых кислот, включающих от 2 до 18 атомов углерода, более предпочтительно от 2 до 12 атомов углерода и еще более предпочтительно от 2 до 8 атомов углерода.
Примеры алифатических карбоновых кислот, которые подходят для применения по настоящему изобретению, включают уксусную кислоту, пропионовую кислоту, масляную кислоту и изомасляную кислоту.
Примеры ароматических карбоновых кислот, которые подходят для применения по настоящему изобретению, включают бензойную кислоту, анисовую кислоту, фенилуксусную кислоту, о-толуиловую кислоту, фталевую кислоту, изофталевую кислоту и терефталевую кислоту.
Взаимодействие олефинов с карбоновыми кислотами известно в технике и описано, например, в “Organic Syntheses”, Collective Volume 4, ed. N.Rabjohn, John Wiley and Sons, New York, 1963, pp.261 и в Chem.Commun. 2004, pp.1620. Типовые методики получения эфиров карбоновых кислот из олефинов включают применение серной кислоты в качестве катализатора, а также применение различных соединений металлов, например соединений, включающих металлы, выбранные из меди, серебра, золота и рутения. В Chem.Commun., 2008, pp.777-779 описан ряд способов получения эфиров карбоновых кислот из олефинов. На реакцию стадии (i) не накладывается каких-либо ограничений, и можно с успехом применять любой из известных в технике способов.
Однако в предпочтительном варианте осуществления настоящего изобретения стадию (i) можно проводить в соответствии с методикой, описанной в WO-A-2007/094211. Т.е. в предпочтительном варианте осуществления настоящего изобретения, каталитическая композиция, применяемая на стадии (i), включает (a) как минимум одно соединение металла, где указанный металл выбран из железа, кобальта и никеля; и (b) кислотное соединение.
На соединение металла (a) в указанной каталитической композиции не накладывается ограничений, и подходящее соединение можно выбрать, например, из соединений, имеющих общую формулу FeXn (где n означает 2 или 3), Fe(CO)5, Fe3(CO)12, Fe(CO)3(EN), Fe(CO)3DE, Fe(DE)2, CpFeX(CO)2, [CpFe(CO)2]2, [Cp*Fe(CO)2]2, Fe(acac)3, Fe(OAc)n, (где n означает 2 или 3), CoX2, Co2(CO)8, Co(acac)n (где n означает 2 или 3), Co(OAc)2, CpCo(CO)2, Cp*Co(CO)2, NiX2, Ni(CO)4, Ni(DE)2, Ni(acac)2 и Ni(OAc)2.
В приведенных выше формулах X означает атом водорода, атом галогена, предпочтительно хлора, гидроксильную группу, цианогруппу, алкоксигруппу, карбоксигруппу или тиоцианатную группу, Cp означает циклопентадиенильную группу, acac означает остаток ацетилацетона, DE означает норборнадиен, 1,5-циклооктадиен или 1,5-гексадиен, EN означает этилен или циклооктен, и OAc означает ацетатную группу.
Соединения металла (a), предпочтительные для применения в составе каталитической композиции на стадии (i) способа по настоящему изобретению, представляют собой соединения железа. В каталитической композиции на стадии (i) способа по настоящему изобретению особенно предпочтительно применение хлорида железа.
Кислотное соединение (b), подходящее для применения в каталитической композиции на стадии (i) способа по настоящему изобретению, предпочтительно выбрано из кислот Бренстеда или солей трифторметансульфоновой кислоты с металлами.
Хотя и не существует конкретных ограничений на кислотное соединение (ii), предпочтительные кислоты Бренстеда включают HCl, H2SO4, CF3SO3H, п-[CH3(CH2)11](C6H4)SO3H и кислоту, продаваемую под торговым наименованием “NAFION” компанией E.I.du Pont de Nemours & Co., Inc.
Примеры солей трифторметансульфоновой кислоты с металлами, которые подходят для применения в способе по настоящему изобретению, включают Na(OSO2CF3), Li(OSO2CF3), Ag(OSO2CF3), Cu(OSO2CF3)2, Zn(OSO2CF3)2, La(OSO2CF3)3 и Sc(OSO2CF3)3.
Кислотой Бренстеда, предпочтительной для применения в каталитической композиции на стадии (i) способа по настоящему изобретению, является трифторметансульфоновая кислота, и предпочтительной солью трифторметансульфоновой кислоты с металлом, подходящей для применения в каталитической композиции на стадии (i) способа по настоящем изобретению, является серебряная соль трифторметансульфоновой кислоты.
На количество кислотного соединения (b), применяемого в каталитической композиции на стадии (i) способа по настоящему изобретению, не накладывается конкретных ограничений, но количество указанного кислотного соединения по отношению к количеству соединения металла (a), в мольном выражении, предпочтительно находится в диапазоне от 1/300 до 10 и более предпочтительно в диапазоне от 1/50 до 3.
Катализатор, предназначенный для применения на стадии (i) способа по настоящему изобретению, предпочтительно представляет собой комбинацию упомянутого выше соединения металла (a) и кислотного соединения (b). Однако в одном из вариантов осуществления каждый из компонентов, т.е. соединение металла (a) и кислотное соединение (b), можно получать отдельно и добавлять к реакционной смеси на стадии (i). В качестве альтернативы, как описано в Chem.Commun., 2008, pp. 777-779, соединение металла (a) и кислотное соединение (b) также можно вводить в реакцию заблаговременно, вне реакционной смеси стадии (i) с тем, чтобы, например, можно было использовать соль металла и трифторметансульфоновой кислоты. Примеры таких солей включают Fe(OSO2CF3)3, которую можно получить способом, описанным в Can.J.Chem., 1981, 59, 669-678.
На условия проведения реакции на стадии (i) способа по настоящему изобретению не накладывается ограничений. Однако в предпочтительном варианте осуществления настоящего изобретения стадию (i) можно проводить при температуре в диапазоне от 20 до 300°С и более предпочтительно при температуре в диапазоне от 60 до 200°С.
Реакцию стадии (i) способа по настоящему изобретению можно проводить в присутствии одного или нескольких инертных растворителей, т.е. растворителей, которые не препятствуют протеканию реакции стадии (i). В качестве альтернативы указанную реакцию можно проводить в отсутствие растворителей.
Инертные растворители, которые подходят для применения на стадии (i) способа по настоящему изобретению, включают, например, углеводороды и простые эфиры, более конкретно, бензол, толуол, гексан, тетрагидрофуран, диэтиловый эфир, дибутиловый эфир и диоксан.
Стадия (ii) способа по настоящему изобретению включает взаимодействие одного или нескольких эфиров карбоновой кислоты, полученных на стадии (i), с одним или несколькими алкиленоксидами в присутствии каталитически эффективного количества каталитической композиции, включающей (a) одну или несколько солей щелочноземельных металлов и карбоновых и/или гидроксикарбоновых кислот и/или гидратов первых, (b) кислородсодержащую кислоту, выбранную из серной кислоты и ортофосфорной кислоты, (c) спирт и/или сложный эфир и/или продукты взаимодействия компонентов (a), (b) и/или (c), с образованием одного или нескольких ацилированных алкоксилатов спиртов.
Каталитическая композиция, предназначенная для применения на стадии (ii) способа по настоящему изобретению, может быть получена по способу, описанному в WO-A-02/38269. Указанная каталитическая композиция предпочтительно имеет форму визуально гомогенной жидкой суспензии или гомогенной пасты.
Указанная каталитическая композиция предпочтительно включает одну или несколько солей щелочноземельных металлов и карбоновых и/или гидроксикарбоновых кислот и/или гидратов первых и кислородсодержащую кислоту, выбранную из серной кислоты и ортофосфорной кислоты, в общем количестве от 10 до 65% по массе (масс.%) от общей массы указанной каталитической композиции.
Если каталитическая композиция, применяемая на стадии (ii), включает только компоненты (a)-(c) и/или продукты взаимодействия компонентов (a),(b) и/или (c), более предпочтительно, чтобы указанные компоненты присутствовали в количествах, находящихся в диапазонах от 16 до 26 масс.% для (a), от 4 до 7 масс.% для (b) и от 67 до 80 масс.% для (c), в каждом случае по отношению к общей массе каталитической композиции.
Следует иметь в виду, что точные количества компонентов (a)-(c) выбирают из указанных выше диапазонов таким образом, чтобы их общее количество составляло 100 масс.%.
Упомянутая выше каталитическая композиция может быть получена в виде концентрата в форме визуально гомогенной жидкости или пасты путем смешивания до достижения однородности т.н. активных ингредиентов каталитической композиции (a) и (b), с последующим добавлением полученной гомогенной смеси к спиртам или эфирам (c), где указанные активные ингредиенты частично или полностью нерастворимы в спиртах или эфирах, применяемых для получения концентрата катализатора, а также в сложных эфирах карбоновых кислот, которые являются исходными реагентами, подвергаемыми алкоксилированию на стадии (ii).
Однако, хотя эфиры карбоновых кислот, получаемые на стадии (i) способа по настоящему изобретению, могут быть эффективно алкоксилированы на стадии (ii) способа по настоящему изобретению с применением указанных выше катализаторов и условий реакции согласно WO-A-02/038269 и WO-A-2005/115964, образующиеся ацилированные алкоксилаты спиртов, в частности этоксилаты метиловых эфиров (MEE), могут демонстрировать заметное окрашивание, в частности пожелтение.
Соответственно, неожиданно оказалось, что в предпочтительном варианте осуществления настоящего изобретения можно модифицировать каталитическую композицию, предназначенную для применения на стадии (ii), с тем чтобы получать ацилированные алкоксилаты спиртов, обладающие, кроме того, улучшенными цветовыми свойствами, т.е. без какого-либо заметного окрашивания. Эти улучшенные цветовые свойства значительно повышают гибкость при производстве моющих средств, где обычно стремятся получить бесцветные, как вода, жидкие моющие составы или порошкообразные моющие составы белого цвета.
Следовательно, особенно предпочтительно, чтобы каталитическая композиция, предназначенная для применения на стадии (ii) способа по настоящему изобретению, включала (a) одну или несколько солей щелочноземельного металла и карбоновых и/или гидроксикарбоновых кислот и/или гидратов первых, (b) кислородсодержащую кислоту, выбранную из серной кислоты и ортофосфорной кислоты, (c) спирт и/или сложный эфир, (d) пероксикислоту и/или ее соль, и/или продукты взаимодействия компонентов (a),(b),(c) и/или (d).
Указанная каталитическая композиция неожиданно дает возможность получения на стадии (ii) ацилированных алкоксилатов спиртов, предпочтительно алкоксилатов эфиров жирных кислот и более предпочтительно алкоксилатов эфиров жирных кислот с узким диапазоном, для необязательного последующего гидролиза или переэтерификации (известной также, как трансацилирование) на стадии (iii), где полученные ацилированные алкоксилаты спиртов обладают улучшенными цветовыми свойствами, в частности уменьшенной желтизной.
В указанном предпочтительном варианте осуществления, если указанная каталитическая композиция включает компоненты (a)-(d) и/или продукты взаимодействия (a), (b), (c) и/или (d), то предпочтительно, чтобы указанная композиция включала: (a) одну или несколько солей щелочноземельного металла и карбоновых и/или гидроксикарбоновых кислот и/или гидратов первых в количестве, находящемся в диапазоне от 8 до 53 масс.%, более предпочтительно в диапазоне от 16 до 26 масс.%, от общей массы каталитической композиции; (b) кислородсодержащую кислоту, выбранную из серной кислоты и ортофосфорной кислоты, в количестве, находящемся в диапазоне от 2 до 13%, более предпочтительно в диапазоне от 4 до 7 масс.% от общей массы каталитической композиции; (c) спирт и/или сложный эфир в количестве, находящемся в диапазоне от 34 до 90 масс.%, более предпочтительно в диапазоне от 67 до 80 масс.% от общей массы каталитической композиции; и (d) пероксикислоту и/или ее соль в количестве, находящемся в диапазоне от 10 до 10 000 частей на млн (масса/масса), более предпочтительно в диапазоне от 30 до 3000 частей на млн (масса/масса) и наиболее предпочтительно в диапазоне от 100 до 1000 частей на млн (масса/масса) от общей массы каталитической композиции, и/или продукты взаимодействия компонентов (a), (b), (c) и/или (d).
Следует иметь в виду, что точные количества компонентов (a)-(d) выбирают из указанных выше диапазонов, так чтобы их суммарное количество составляло 100 масс.%.
Соли щелочноземельных металлов (a), которые подходят для применения в каталитической композиции для стадии (ii) способа по настоящем изобретению, включают соли кальция или магния и карбоновых и/или гидроксикарбоновых кислот и/или гидраты первых.
Если соли щелочноземельного металла (a) являются солями карбоновых кислот, особенно предпочтительно, чтобы указанные соли являлись производными той же или тех же карбоновых кислот, которые применялись на стадии (i) способа по настоящему изобретению.
Соли, которые подходят для применения в качестве компонента (a) каталитической композиции для стадии (ii) способа по настоящему изобретению, являются солями карбоновых и/или гидроксикарбоновых кислот низкой молекулярной массы, т.е. карбоновых и/или гидроксикарбоновых кислот, включающих 1-18 атомов углерода.
Предпочтительные соли являются солями карбоновых кислот, включающих 1-7 атомов углерода, и/или солями гидроксикарбоновых кислот, включающих 2-7 атомов углерода.
Более предпочтительными солями являются соли карбоновых кислот, включающих 2-4 атома углерода и/или соли гидроксикарбоновых кислот, включающих 2-4 атома углерода.
Примеры солей, которые могут применяться в качестве компонента (a) в каталитической композиции для стадии (ii) способа по настоящему изобретению, включают соли муравьиной кислоты, уксусной кислоты, пропионовой кислоты, молочной кислоты, изомасляной кислоты, 2-гидрокси-2-метилпропановой кислоты и бензойной кислоты.
Предпочтительными являются кальциевые соли карбоновых и/или гидроксикарбоновых кислот, включающих 1-18 атомов углерода, предпочтительно 1-7 атомов углерода, более предпочтительно 2-4 атома углерода и/или гидраты первых.
Примеры таких кальциевых солей включают ацетат кальция, и/или лактат кальция, и/или гидрат первой.
Конкретными примеры кислородсодержащих кислот, подходящих для применения в каталитической композиции, являются концентрированная (85%) ортофосфорная кислота и концентрированная (95-97%) серная кислота.
Спирт, который может применяться в качестве компонента (c) в каталитической композиции для стадии (ii) способа по настоящему изобретению, может представлять собой первичный, вторичный или третичный спирт.
Спирт и/или сложный эфир, применяемый в качестве компонента (c) в каталитической композиции для стадии (ii) способа по настоящему изобретению, предпочтительно является спиртом, включающим от 1 до 6 атомов углерода и/или эфиром карбоновой кислоты, включающим от 2 до 39 атомов углерода. В особенно предпочтительном варианте осуществления настоящего изобретения, сложноэфирный компонент (c) может быть алкоксилирован.
Примеры спиртов и сложных эфиров, которые подходят для применения в качестве компонента (c) в каталитической композиции для стадии (ii) способа по настоящему изобретению, включают метанол, этанол, пропанол, 2-пропанол (изопропиловый спирт), бутанол, 2-бутанол (втор-бутиловый спирт) и 2-метил-2-пропанол (трет-бутиловый спирт), пентанол, 2-пентанол, 3-пентанол, 3-метил-1-бутанол (изоамиловый спирт), 2,2-диметил-1-пропанол (неопентиловый спирт), 2-метил-2-бутанол (трет-амиловый спирт), гексанол, 2-гексанол, 3-гексанол, метилформиат, этилформиат, пропилформиат, изопропилформиат, бутилформиат, втор-бутилформиат, изобутилформиат, пентилформиат, изоамилформиат, гексилформиат, циклогексилформиат, гептилформиат, бензилформиат, октилформиат, нонилформиат, 1-децилформиат, эфиры муравьиной кислоты и втор-дециловых спиртов, например 2-деканола, 3-деканола, 4-деканола и 5-деканола и их смесей, эфиры муравьиной кислоты и смеси втор-ундециловых спиртов и втор-додециловых спиртов, 1-додецилформиат, эфиры муравьиной кислоты и втор-додециловых спиртов, например 2-додеканола, 3-додеканола, 4-додеканола, 5-додеканола и 6-додеканола и их смесей, эфиры муравьиной кислоты и смеси втор-тридециловых спиртов и втор-тетрадециловых спиртов, эфиры муравьиной кислоты и смеси линейных или разветвленных втор-пентадециловых спиртов и втор-гексадециловых спиртов или смеси линейных или разветвленных втор-пентадециловых спиртов, втор-гексадециловых спиртов, втор-гептадециловых спиртов и втор-октадециловых спиртов, эфиры муравьиной кислоты и смеси втор-нонадециловых спиртов, втор-эйкозиловых спиртов, втор-генэйкозиловых спиртов, втор-докозиловых спиртов, втор-трикозиловых спиртов, втор-тетракозиловых спиртов, втор-пентакозиловых спиртов, втор-гексакозиловых спиртов, втор-гептакозиловых спиртов, втор-октакозиловых спиртов, втор-нонакозиловых спиртов, втор-триаконтиловых спиртов, втор-гентриаконтиловых спиртов или втор-дотриаконтиловых спиртов, метилацетат, этилацетат, пропилацетат, изопропилацетат, бутилацетат, втор-бутилацетат, изобутилацетат, трет-бутилацетат, пентилацетат, 2-пентилацетат, 3-пентилацетат, изоамилацетат, трет-амилацетат, гексилацетат, циклогексилацетат, гептилацетат, бензилацетат, октилацетат, нонилацетат, децилацетат, эфиры уксусной кислоты и вторичных спиртов, например 2-деканола, 3-деканола, 4-деканола и 5-деканола и их смеси, эфиры уксусной кислоты и смеси втор-ундециловых спиртов и втор-додециловых спиртов, 1-додецилацетат, эфиры уксусной кислоты и втор-додециловых спиртов, например 2-додеканола, 3-додеканола, 4-додеканола, 5-додеканола и 6-додеканола и их смеси, эфиры уксусной кислоты и смеси втор-тридециловых спиртов и втор-тетрадециловых спиртов, эфиры уксусной кислоты и смеси линейных или разветвленных втор-пентадециловых спиртов и втор-гексадециловых спиртов или смеси линейных или разветвленных втор-пентадециловых спиртов, втор-гексадециловых спиртов, втор-гептадециловых спиртов и втор-октадециловых спиртов, эфиры уксусной кислоты и смеси втор-нонадециловых спиртов, втор-эйкозиловых спиртов, втор-генэйкозиловых спиртов, втор-докозиловых спиртов, втор-трикозиловых спиртов, втор-тетракозиловых спиртов, втор-пентакозиловых спиртов, втор-гексакозиловых спиртов, втор-гептакозиловых спиртов, втор-октакозиловых спиртов, втор-нонакозиловых спиртов, втор-триаконтиловых спиртов, втор-гентриаконтиловых спиртов или втор-дотриаконтиловых спиртов, метилизобутират, этилизобутират, пропилизобутират, изопропилизобутират, бутилизобутират, втор-бутилизобутират, изобутилизобутират, трет-бутилизобутират, пентилизобутират, 2-пентилизобутират, 3-пентилизобутират, изоамилизобутират, трет-амилизобутират, гексилизобутират, циклогексилизобутират, гептилизобутират, бензилизобутират, октилизобутират, нонилизобутират, децилизобутират, эфиры изомасляной кислоты и втор-дециловых спиртов, например, 2-деканола, 3-деканола, 4-деканола и 5-деканола и их смеси, эфиры изомасляной кислоты и смеси втор-ундециловых спиртов и втор-додециловых спиртов, 1-додецилизобутират, эфиры изомасляной кислоты и втор-додециловых спиртов, например 2-додеканола, 3-додеканола, 4-додеканола, 5-додеканола и 6-додеканола и их смеси, эфиры изомасляной кислоты и смеси втор-тридециловых спиртов и втор-тетрадециловых спиртов, эфиры изомасляной кислоты и смеси линейных или разветвленных втор-пентадециловых спиртов и втор-гексадециловых спиртов или смеси линейных или разветвленных втор-пентадециловых спиртов, втор-гексадециловых спиртов, втор-гептадециловых спиртов и втор-октадециловых спиртов, эфиры изомасляной кислоты и смеси втор-нонадециловых спиртов, втор-эйкозиловых спиртов, втор-генэйкозиловых спиртов, втор-докозиловых спиртов, втор-трикозиловых спиртов, втор-тетракозиловых спиртов, втор-пентакозиловых спиртов, втор-гексакозиловых спиртов, втор-гептакозиловых спиртов, втор-октакозиловых спиртов, втор-нонакозиловых спиртов, втор-триаконтиловых спиртов, втор-гентриаконтиловых спиртов или втор-дотриаконтиловых спиртов, метилбензоат, этилбензоат, пропилбензоат, изопропилбензоат, бутилбензоат, втор-бутилбензоат, изобутилбензоат, трет-бутилбензоат, пентилбензоат, 2-пентилбензоат, 3-пентилбензоат, изоамилбензоат, трет-амилбензоат, гексилбензоат, циклогексилбензоат, гептилбензоат, бензилбензоат, октилбензоат, нонилбензоат, децилбензоат, эфиры бензойной кислоты и втор-дециловых спиртов, например 2-деканола, 3-деканола, 4-деканола и 5-деканола, и их смеси, эфиры бензойной кислоты и смеси втор-ундециловых спиртов и втор-додециловых спиртов, 1-додецил бензоат, эфиры бензойной кислоты и втор-додециловых спиртов, например 2-додеканола, 3-додеканола, 4-додеканола, 5-додеканола и 6-додеканола и их смеси, эфиры бензойной кислоты и смеси втор-тридециловых спиртов и втор-тетрадециловых спиртов, эфиры бензойной кислоты и смеси линейных или разветвленных втор-пентадециловых спиртов и втор-гексадециловых спиртов или смеси линейных или разветвленных втор-пентадециловых спиртов, втор-гексадециловых спиртов, втор-гептадециловых спиртов и втор-октадециловых спиртов, эфиры бензойной кислоты и смеси втор-нонадециловых спиртов, втор-эйкозиловых спиртов, втор-генэйкозиловых спиртов, втор-докозиловых спиртов, втор-трикозиловых спиртов, втор-тетракозиловых спиртов, втор-пентакозиловых спиртов, втор-гексакозиловых спиртов, втор-гептакозиловых спиртов, втор-октакозиловых спиртов, втор-нонакозиловых спиртов, втор-триаконтиловых спиртов, втор-гентриаконтиловых спиртов или втор-дотриаконтиловых спиртов, метилкапроат, этилкапроат, изопропилкапроат, метилкаприлат, этилкаприлат, изопропилкаприлат, метилкапрат, этилкапрат, изопропилкапрат, метиллаурат, этиллаурат, изопропиллаурат, метилмиристат, этилмиристат, изопропилмиристат, метилпальмитат, этилпальмитат, изопропилпальмитат, метилстеарат, этилстеарат, изопропилстеарат, метилолеат, этилолеат, изопропилолеат, метиллинолеат, этиллинолеат, изопропиллинолеат, метиллиноленат, этиллиноленат, изопропиллиноленат, метиларахидат, этиларахидат, изопропиларахидат, метилбегенат, этилбегенат, изопропилбегенат и их смеси.
В одном из вариантов осуществления настоящего изобретения, каталитическая композиция, применяемая на стадии (ii), включает в качестве компонента (c) сложный эфир, который совпадает с подвергаемым алкоксилированию сложным эфиром карбоновой кислоты, полученным на стадии (i).
Пероксикислота, которую необязательно можно применять в качестве компонента (d) в каталитической композиции для стадии (ii) способа по настоящему изобретению, может быть успешно выбрана из перкарбоновых кислот, пергалогеновых кислот, гипогалогеновых кислот, надугольной кислоты, перборной кислоты, перфосфорной кислоты, надсерной кислоты и их смесей.
Соли пероксикислот, которые подходят для применения, включают соли аммония, щелочных металлов и/или щелочноземельных металлов. Примеры предпочтительных солей щелочных металлов и щелочноземельных металлов включают соли натрия, калия магния и бария.
Примерами особенно предпочтительных солей пероксикислот являются персульфаты аммония, щелочных металлов и щелочноземельных металлов, в частности персульфаты аммония, натрия, калия и бария. Предпочтительным является персульфат аммония (известный также, как пероксидисульфат аммония, (NH4)2S2O8). Указанные соли имеются в продаже.
Как было указано выше по тексту, в предпочтительном варианте осуществления настоящего изобретения, каталитическая композиция, применяемая на стадии (ii) способа по настоящему изобретению, имеет форму визуально гомогенной жидкой суспензии или гомогенной пасты.
В одном из вариантов осуществления, каталитическая композиция, применяемая на стадии (ii) способа по настоящему изобретению, может применяться в виде свежеприготовленной, тонкоизмельченной (например, в коллоидной мельнице, в шаровой мельнице или с помощью ультразвукового гомогенизатора, например, “Labsonic P” с максимальной мощностью 400 W, изготовленного Sartorius AG, Goettingen, Germany) смеси компонентов (a)-(c) и необязательно (d).
Например, если указанная каталитическая композиция включает компоненты (a)-(d) и/или продукты взаимодействия (a), (b), (c) и/или (d), то указанная каталитическая композиция по настоящему изобретению может быть с успехом приготовлена, во-первых, путем смешивания пероксикислоты и/или ее соли с кислородсодержащей кислотой с получением пероксисодержащего кислотного раствора, включающего пероксикислоту или пероксисоль в количестве, находящемся в диапазоне от 0,02 до 20 масс.%, более предпочтительно в диапазоне от 0,06 до 6 масс.% и наиболее предпочтительно в диапазоне от 0,2 до 2 масс.% от суммарной массы пероксикислоты и/или ее соли и кислородсодержащей кислоты.
Этот пероксисодержащий кислый раствор медленно при интенсивном перемешивании смешивают с суспензией одной или нескольких солей щелочноземельных металлов и карбоновых и/или гидроксикарбоновых кислот и/или гидратов первых, в спирте и/или сложном эфире при температуре, как правило, находящейся в диапазоне от 283 до 368 К, предпочтительно при температуре менее 313 К.
Например, в предпочтительном варианте осуществления, 0,55 масс.% раствора пероксидисульфата аммония в концентрированной (95-97%) серной кислоте можно смешать с суспензией моногидрата ацетата кальция или лактата кальция при энергичном перемешивании с такой скоростью, чтобы температура не поднималась выше 313 К, еще более предпочтительно с такой скоростью, чтобы температура находилась ниже 303 К.
В особенно предпочтительном варианте осуществления, 0,55 масс.% раствора пероксидисульфата аммония в концентрированной (95-97%) серной кислоте можно смешать с суспензией моногидрата ацетата кальция при энергичном перемешивании с такой скоростью, чтобы температура не поднималась выше 303 К, после чего обработать суспензию ультразвуковым перемешивающим устройством при температуре ниже 303 К в течение 1 минуты.
В особенно предпочтительном варианте осуществления настоящего изобретения, указанная каталитическая композиция включает (a) одну или несколько солей щелочных металлов и карбоновых и/или гидроксикарбоновых кислот и/или гидратов первых, (b) кислородсодержащую кислоту, выбранную из серной кислоты и ортофосфорной кислоты, (c) спирт и/или сложный эфир и (d) пероксикислоту и/или ее соль, и/или продукты взаимодействия компонентов (a), (b), (c) и/или (d), где указанная композиция получена гомогенизацией, причем компоненты (a) и (b) присутствуют в количествах, находящихся в диапазоне от 10 до 65 масс.% по отношению к общей массе каталитической композиции, которая рассчитана из долей компонентов (a)-(d), применяемых при получении катализатора.
Каталитическая композиция, предназначенная для применения на стадии (ii) способа по настоящему изобретению, может применяться в каталитически эффективном количестве, т.е. в количестве, достаточном для ускорения реакции алкоксилирования или влияния на распределение количества алкиленоксидных фрагментов в молекулах продукта. Хотя конкретное количество катализатора не имеет решающего значения для способа по настоящему изобретению, предпочтительно применять указанную каталитическую композицию на стадии (ii) в количестве не менее 0,05 масс.%, хотя для типовых вариантов осуществления более предпочтительно количество в диапазоне от 0,2 до 5 масс.% и наиболее предпочтительно количество в диапазоне от 0,5 до 2 масс.%. Указанные процентные величины соответствуют массе каталитической композиции, введенной в реакционную смесь, по отношению к общей массе продукта стадии (i) после удаления летучих компонентов (например, растворителя и/или избытка карбоновой кислоты) из указанной реакционной смеси стадии (i).
На стадии (ii) могут применяться значительно большие количества указанной каталитической композиции, например, до 10 масс.% или более. Как правило, чем выше желаемое количество алкиленоксидных фрагментов в алкоксилатном продукте и чем выше желаемая скорость реакции, тем больше необходимое количество катализатора.
В реакции алкоксилирования на стадии (ii) способа по настоящему изобретению подходящие алкиленоксидные (эпоксидные) реагенты могут быть выбраны из одного или нескольких вицинальных алкиленоксидов, в частности низших алкиленоксидов, и более конкретно, включающих 2-4 атома углерода. В общем, эти алкиленоксиды могут быть представлены формулой

где каждый из фрагментов R1,R2,R3 и R4 индивидуально выбран из группы, состоящей из водорода и алкильных групп. Более предпочтительными являются реагенты, которые включают этиленоксид, пропиленоксид или смеси этиленоксида и пропиленоксида, особенно такие, которые состоят в основном из этиленоксида и пропиленоксида. Алкиленоксидные реагенты, состоящие в основном из этиленоксида, считаются наиболее предпочтительными с точки зрения коммерческих возможностей практической реализации процесса алкоксилирования, а также с точки зрения получения продуктов с узким диапазоном распределения количества этиленоксидных заместителей.
Предпочтительные эфиры карбоновых кислот, получаемые на стадии (i) и предназначенные для последующего введения в реакцию на стадии (ii) способа по настоящему изобретению, включают эфиры муравьиной кислоты, уксусной кислоты, пропионовой кислоты, масляной кислоты, изомасляной кислоты, пентановой кислоты, капроновой кислоты и необязательно замещенных бензойных кислот, включая такие кислоты, в которых один или несколько атомов водорода бензольного кольца замещены одной или несколькими инертными функциональными группами, т.е. функциональными группами, которые не принимают участия в реакции на стадии (ii). Примеры инертных функциональных групп, которые могут присутствовать в качестве заместителей, включают атомы хлора и брома, нитрогруппы и алкоксигруппы, например метоксигруппы.
Более предпочтительными эфирами карбоновых кислот, получаемыми на стадии (i) и предназначенными для дальнейшего введения в реакцию на стадии (ii) способа по настоящему изобретению, являются эфиры уксусной кислоты, эфиры изомасляной кислоты, эфиры бензойной кислоты и эфиры жирных кислот.
Примеры указанных эфиров жирных кислот включают эфиры капроновой кислоты, каприловой кислоты, каприновой кислоты, лауриновой кислоты, миристиновой кислоты, пальмитиновой кислоты, стеариновой кислоты, олеиновой кислоты, линолевой кислоты, линоленовой кислоты, арахиновой кислоты, бегеновой кислоты и их смесей.
Эфиры карбоновых кислот и, в частности, эфиры жирных кислот, которые подходят для применения в процессе алкоксилирования на стадии (ii) способа по настоящему изобретению, после их получения на стадии (i), включают, например, втор-бутиловые эфиры, втор-амиловые эфиры и трет-амиловые эфиры, втор-дециловые эфиры, например 2-дециловые, 3-дециловые, 4-дециловые и 5-дециловые эфиры и их смеси, втор-ундециловые эфиры, втор-додециловые эфиры, например 2-ундециловые, 3-ундециловые, 4-ундециловые, 5-ундециловые, 2-додециловые, 3-додециловые, 4-додециловые, 5-додециловые и 6-додециловые эфиры и их смеси, втор-тридециловые эфиры и втор-тетрадециловые эфиры, например 2-тридециловые, 3-тридециловые, 4-тридециловые, 5-тридециловые, 6-тридециловые, 2-тетрадециловые, 3-тетрадециловые, 4-тетрадециловые, 5-тетрадециловые, 6-тетрадециловые, 7-тетрадециловые эфиры и их смеси, втор-пентадециловые эфиры, втор-гексадециловые эфиры, втор-гептадециловые эфиры, втор-октадециловые эфиры и их смеси, втор-нонадециловые эфиры, втор-эйкозиловые эфиры, втор-генэйкозиловые эфиры, втор-докозиловые эфиры, втор-трикозиловые эфиры, втор-тетракозиловые эфиры, втор-пентакозиловые эфиры, втор-гексакозиловые эфиры, втор-гептакозиловые эфиры, втор-октакозиловые эфиры, втор-нонакозиловые эфиры, втор-триаконтиловые эфиры, втор-гентриаконтиловые эфиры, втор-дотриаконтиловые эфиры и их смеси.
Предпочтительные эфиры карбоновых кислот, которые подходят для применения в процессе алкоксилирования на стадии (ii) способа по настоящему изобретению, после их получения на стадии (i), включают втор-бутил, втор-амил, трет-амил, втор-децил, например 2-децил, 3-децил, 4-децил и 5-децил, втор-ундецил, втор-додецил, например 2-ундецил, 3-ундецил, 4-ундецил, 5-ундецил, 2-додецил, 3-додецил, 4-додецил, 5-додецил и 6-додецил, втор-тридецил, втор-тетрадецил, например 2-тридецил, 3-тридецил, 4-тридецил, 5-тридецил, 6-тридецил, 2-тетрадецил, 3-тетрадецил, 4-тетрадецил, 5-тетрадецил, 6-тетрадецил, 7-тетрадецил, втор-пентадецил, втор-гексадецил, втор-гептадецил, втор-октадецил, втор-нонадецил, втор-эйкозил, втор-генэйкозил, втор-докозил, втор-трикозил, втор-тетракозил, втор-пентакозил, втор-гексакозил, втор-гептакозил, втор-октакозил, втор-нонакозил, втор-триаконтил, втор-гентриаконтил и втор-дотриаконтил ацетаты и их смеси.
Другой класс предпочтительных эфиров карбоновых кислот, которые могут подходить для применения в реакции алкоксилирования на стадии (ii) способа по настоящему изобретению, после их получения на стадии (i), включает втор-бутил, втор-амил, трет-амил, втор-децил, например 2-децил, 3-децил, 4-децил и 5-децил, втор-ундецил, втор-додецил, например 2-ундецил, 3-ундецил, 4-ундецил, 5-ундецил, 2-додецил, 3-додецил, 4-додецил, 5-додецил и 6-додецил, втор-тридецил, втор-тетрадецил, например 2-тридецил, 3-тридецил, 4-тридецил, 5-тридецил, 6-тридецил, 2-тетрадецил, 3-тетрадецил, 4-тетрадецил, 5-тетрадецил, 6-тетрадецил, 7-тетрадецил, втор-пентадецил, втор-гексадецил, втор-гептадецил, втор-октадецил, втор-нонадецил, втор-эйкозил, втор-генэйкозил, втор-докозил, втор-трикозил, втор-тетракозил, втор-пентакозил, втор-гексакозил, втор-гептакозил, втор-октакозил, втор-нонакозил, втор-триаконтил, втор-гентриаконтил и втор-дотриаконтил изобутираты и их смеси.
Еще один класс предпочтительных эфиров карбоновых кислот, которые могут подходить для применения в процессе алкоксилирования на стадии (ii) способа по настоящему изобретению, после их получения на стадии (i), включает втор-бутил, втор-амил, трет-амил, втор-децил, например 2-децил, 3-децил, 4-децил и 5-децил, втор-ундецил, втор-додецил, например 2-ундецил, 3-ундецил, 4-ундецил, 5-ундецил, 2-додецил, 3-додецил, 4-додецил, 5-додецил и 6-додецил, втор-тридецил, втор-тетрадецил, например 2-тридецил, 3-тридецил, 4-тридецил, 5-тридецил, 6-тридецил, 2-тетрадецил, 3-тетрадецил, 4-тетрадецил, 5-тетрадецил, 6-тетрадецил, 7-тетрадецил, втор-пентадецил, втор-гексадецил, втор-гептадецил, втор-октадецил, втор-нонадецил, втор-эйкозил, втор-генэйкозил, втор-докозил, втор-трикозил, втор-тетракозил, втор-пентакозил, втор-гексакозил, втор-гептакозил, втор-октакозил, втор-нонакозил, втор-триаконтил, втор-гентриаконтил и втор-дотриаконтил бензоаты и их смеси.
Что касается методики проведения реакции, алкоксилирование на стадии (ii) способа по настоящему изобретению можно проводить в основном обычным способом. Например, каталитическую композицию, применяемую на стадии (ii), совместно с жидким эфиром карбоновой кислоты, полученным на стадии (i), можно ввести в контакт предпочтительно при перемешивании с алкиленоксидом, который обычно вводят в газообразной форме, по крайней мере в случае низших алкиленоксидов.
Дополнительное количество жидкого эфира карбоновой кислоты, полученного на стадии (i), необязательно можно добавлять в любое время до введения алкиленоксида. Таким образом, можно получать концентрированную реакционную смесь с катализатором и ее можно использовать частями по необходимости.
В предпочтительных вариантах осуществления способа по настоящему изобретению, алкиленоксидный реагент представляет собой этиленоксид, или пропиленоксид, или смесь этиленоксида и пропиленоксида.
В особенно предпочтительном варианте осуществления, на стадии (ii) этиленоксид вводят в контакт и во взаимодействие с эфиром карбоновой кислоты, полученным на стадии (i), предпочтительно эфиром жирной кислоты, в присутствии каталитически эффективного количества каталитической композиции для алкоксилирования, описанной в настоящей заявке. При проведении стадии (ii) в любой момент можно необязательно добавить дополнительную порцию жидкого эфира карбоновой кислоты, полученного на стадии (i).
В другом варианте осуществления настоящего изобретения реакцию алкоксилирования на стадии (ii) можно проводить по способу, описанному в WO-A-2005/115964, который включен в настоящую заявку с помощью ссылки.
Т.е. в одном из вариантов осуществления, реакция алкоксилирования на стадии (ii) способа по настоящему изобретению включает введение алкиленоксидного реагента в реактор, в котором находится эфир карбоновой кислоты, полученный на стадии (i), в присутствии каталитической композиции, описанной в тексте настоящей заявки, причем реактор заполнен частью (x') предусмотренного общего количества (X) эфира карбоновой кислоты, полученного на стадии (i), которое предполагается подвергнуть алкоксилированию, и всем заранее запланированным количеством (Y) указанной каталитической композиции, после чего в реактор вводят другую порцию (z') общего заранее запланированного количества (Z) алкиленоксидного реагента, с целью активации упомянутой каталитической композиции и инициирования реакции, и после того, как введенное количество (z') алкиленоксидного реагента претерпевает полное или частичное превращение, пополняют порцию эфира карбоновой кислоты дополнительным количеством эфира карбоновой кислоты, полученным на стадии (i), до заранее запланированного количества (X) и продолжают подавать алкиленоксидный реагент до введения заранее предусмотренного количества (Z), причем предпочтительно, чтобы порция (x') эфира карбоновой кислоты, полученного на стадии (i), введенная на начальной стадии синтеза, была как можно меньше по отношению к общему заранее предусмотренному количеству эфира карбоновой кислоты (X), полученному на стадии (i), т.е. это количество приблизительно равно минимальному количеству, установленному для данного реактора, что означает, что величина частного от деления x'/X является минимально возможной.
Хотя описанная выше методика относится к периодическому процессу синтеза, способ по настоящему изобретению равным образом применим к непрерывному процессу.
В общем, два реагента на стадии (ii) применяют в заранее определенных количествах для получения продукта алкоксилирования с желаемым средним количеством присоединенных фрагментов. Это среднее количество присоединенных фрагментов в продукте не играет решающей роли в способе по настоящему изобретению. Продукты, получаемые по способу настоящего изобретения, обычно имеют среднее число присоединенных фрагментов в диапазоне от менее 1 до 30 или более.
Говоря в общем, температуры и давления, которые подходят для проведения реакции алкоксилирования на стадии (ii) способа по настоящему изобретению, являются такими же, как и в обычных реакциях алкоксилирования между теми же реагентами с применением обычных катализаторов. Как правило, с точки зрения скорости реакции предпочтительны температуры не менее 90°C, в частности не менее 120°C и более конкретно не менее 130°C, в то время как температура менее 250°C, в частности менее 210°C и, более конкретно, менее 190°C, обычно желательна для минимизации разрушения продукта. Как известно в технике, температуру реакции можно оптимизировать для конкретных реагентов, принимая во внимание указанные выше факторы.
Для проведения стадии (ii) предпочтительно давление, превышающее атмосферное, например избыточное давление в диапазоне от 0,7 до 1 МПа (от примерно 10 до примерно 150 фунтов на кв.дюйм), и этого давления, как правило, достаточно для поддержания эфира карбоновой кислоты, полученного на стадии (i), в основном в жидком состоянии при проведении реакции на стадии (ii).
Если эфир карбоновой кислоты, полученный на стадии (i), является жидкостью и алкиленоксид, применяемый на стадии (ii), находится в газообразном состоянии, то алкоксилирование на стадии (ii) удобно проводить путем введения алкиленоксида в находящийся под давлением реактор, содержащий жидкий эфир карбоновой кислоты и каталитическую композицию. По соображениям безопасности реакции, алкиленоксидный реагент предпочтительно разбавляют инертным газом, таким как азот, например, до концентрации в газовой фазе примерно 50 объемных процентов или менее. Однако реакцию на стадии (ii) можно безопасно проводить при более высоких концентрациях алкиленоксида, более высоком общем давлении и более высоком парциальном давлении алкиленоксида, если предпринять надлежащие меры предосторожности, известные в технике, для предупреждения опасности взрыва.
Время, необходимое для завершения реакции алкоксилирования на стадии (ii), зависит как от желаемой степени алкоксилирования (т.е. от среднего числа алкиленоксидных фрагментов в продукте), так и от скорости реакции алкоксилирования (которая, в свою очередь, зависит от температуры, количества катализатора, количества катализатора и природы реагентов). Типовое время проведения реакции в предпочтительных вариантах осуществления, в частности, для случая, когда алкиленоксид является газообразным, составляет менее 12 часов. Если в качестве алкиленоксида применяется этиленоксид, типовое время проведения реакции составляет менее 5 часов. Если в качестве алкиленоксида применяется пропиленоксид, типовое время проведения реакции составляет менее 8 часов.
После завершения реакции алкоксилирования на стадии (ii) продукт предпочтительно охлаждают. Если это желательно, можно удалить из продукта каталитическую композицию. В тех вариантах осуществления настоящего изобретения, где один или несколько ацилированных алкоксилатов вторичных спиртов, полученных на стадии (ii), предполагается ввести в последующую необязательную стадию (iii) для гидролиза или переэтерификации упомянутых одного или нескольких ацилированных алкоксилатов вторичных спиртов с целью получения одного или нескольких алкоксилатов вторичных спиртов, удаление катализатора до осуществления стадии (iii) не является необходимым.
Остатки катализатора можно отделить от одного или нескольких ацилированных алкоксилатов вторичных спиртов, полученных на стадии (ii), например, фильтрованием, осаждением или экстракцией. Было обнаружено, что ряд конкретных способов физической или химической обработки способствует удалению остатков катализатора из жидкого продукта стадии (ii). Эти способы включают контакт продукта алкоксилирования с сильными кислотами, например фосфорной и/или щавелевой кислотой или с твердыми органическим кислотами, например, продаваемыми под торговыми наименованиями “NAFION” H+ (E.I.du Pont de Nemours & Co., Inc.) и “AMBERLITE” IR 120H (Rohm & Haas Co.) от Sigma-Aldrich; контакт с карбонатами и бикарбонатами щелочных металлов; контакт с цеолитами, например цеолитами типа Y или морденитом; или контакт с некоторыми глинами. Как правило, за указанной обработкой следует фильтрование или осаждение твердых веществ из продукта. Во многих случаях фильтрование, осаждение или центрифугирование наиболее эффективно при повышенной температуре.
Предпочтительными композициями ацилированных алкоксилатов вторичных спиртов, которые могут быть получены при проведении стадий (i) и (ii) способа по настоящему изобретению, для необязательного последующего гидролиза или переэтерификации (известной также под названием «трансацилирование») на стадии (iii), являются те композиции, которые включают один или несколько ацилированных алкоксилатов вторичных спиртов, в частности алкоксилированных эфиров жирных кислот, имеющих формулу (I):
R1-C(O)-(OA)n-OR2 (I)
где R1 является линейной или разветвленной алкильной группой, включающей от 1 до 30 атомов углерода, необязательно замещенной циклоалкильной группой, включающей от 5 до 30 атомов углерода, или необязательно замещенной арильной группой, включающей от 6 до 30 атомов углерода, OA означает один или несколько оксиалкиленовых фрагментов, которые могут являться одинаковыми или различными, n означает целое число в диапазоне от 0 до 70, и R2 является линейной или разветвленной алкильной группой, включающей от 4 до 32 атомов углерода, необязательно замещенной циклоалкильной группой, включающей от 5 до 32 атомов углерода, или необязательно замещенной бициклоалкильной группой, включающей от 7 до 32 атомов углерода.
Особенно предпочтительными ацилированными алкоксилатами вторичных спиртов, включая алкоксилаты эфиров жирных кислот, которые могут быть получены при проведении стадий (i) и (ii) способа по настоящему изобретению, для необязательного последующего гидролиза на стадии (iii), являются такие алкоксилаты, в которых R1 означает линейную или разветвленную алкильную группу, включающую 1-22 атома углерода или необязательно замещенную фенильную группу, фрагмент OA независимо выбран из оксиэтиленового и оксипропиленового фрагмента, n означает целое число в диапазоне от 1 до 30, и R2 является линейной или разветвленной алкильной группой, включающей от 4 до 32 атомов углерода.
Ацилированные алкоксилаты вторичных спиртов, которые можно получить при проведении стадий (i) и (ii) способа по настоящему изобретению, для последующего необязательного гидролиза на стадии (iii), и которые являются особенно предпочтительными для получения моющих средств, представляют собой такие соединения формулы (I), в которых R1 означает необязательно замещенную фенильную группу, предпочтительно фенильную группу, водород или алкильную группу, включающую 1-22 атома углерода, предпочтительно 1 атом углерода, фрагмент OA независимо выбран из оксиэтиленового или оксипропиленового фрагмента, n означает целое число в диапазоне от 1 до 30, и R2 является линейной или разветвленной алкильной группой, включающей от 4 до 32 атомов углерода.
В одном из вариантов осуществления настоящего изобретения, предпочтительные ацилированные алкоксилаты вторичных спиртов представляют собой композиции алкоксилатов эфиров уксусной кислоты, т.е. соединений формулы (I), в которых R1 означает метильную группу, фрагмент OA независимо выбран из оксиэтиленового и оксипропиленового фрагмента, n означает целое число в диапазоне от 1 до 30, и R2 является линейной или разветвленной алкильной группой, включающей от 4 до 32 атомов углерода.
Алкоксилаты эфиров жирных кислот, которые можно получить при проведении стадий (i) и (ii) способа по настоящему изобретению, для последующего необязательного гидролиза на стадии (iii), и которые являются особенно предпочтительными для получения моющих средств, представляют собой такие соединения формулы (I), в которых R1 означает алкильную группу, включающую от 6 до 22 атомов углерода, предпочтительно от 9 до 15 атомов углерода, фрагмент OA независимо выбран из оксиэтиленового и оксипропиленового фрагмента, n означает целое число в диапазоне от 1 до 30, и R2 является линейной или разветвленной алкильной группой, включающей от 4 до 32 атомов углерода, предпочтительно от 4 до 6 атомов углерода.
В формуле (I) различные фрагменты OA могут быть случайным образом распределены вдоль алкоксидной цепи или же они могут быть представлены в цепи в виде блок(со)полимеров.
Можно осуществлять необязательную стадию (iii), включающую гидролиз или переэтерификацию (известную также, как трансацилирование) для высвобождения одного или нескольких алкоксилатов вторичных спиртов из одного или нескольких ацилированных алкоксилатов вторичных спиртов, полученных на стадии (ii).
Стадию (iii) можно проводить в условиях, хорошо известных в технике для реакций гидролиза и переэтерификации. Температура, при которой можно с успехом проводить данную стадию, находится в диапазоне от 0 до 200°C, предпочтительно в диапазоне от 50 до 150°C. Давление, при котором можно успешно осуществлять реакцию, как правило, является атмосферным давлением, хотя можно также применять повышенное или пониженное давление. Как правило, для повышения скорости реакции переэтерификации применяются кислотные или основные катализаторы в количествах <10% (моль/моль) (по отношению к количеству ацилированного алкоксилата вторичного спирта). Примерами кислотных катализаторов являются п-толуолсульфоновая кислота, серная кислота и ортофосфорная кислота, и примером основного катализатора служит трет-бутоксид калия. Спирты, которые подходят для переэтерификации одного или нескольких ацилированных алкоксилатов вторичных спиртов, полученных на стадии (ii), включают метанол, этанол, изопропиловый спирт и трет-бутиловый спирт.
Алкоксилаты вторичных спиртов, полученные на стадии (iii) способа по настоящему изобретению, можно сульфатировать с получением алкоксисульфатов вторичных спиртов.
Соответственно, в другом варианте осуществления настоящего изобретения, дополнительно разработан способ получения алкоксисульфатов вторичных спиртов, включающий сульфатирование алкоксилатов вторичных спиртов, полученных, как описано выше.
Т.е. в настоящем изобретении, помимо прочего, разработан способ получения алкоксисульфатов вторичных спиртов, включающий стадии:
- получения алкоксилатов вторичных спиртов описанным выше способом; и
- сульфатирования алкоксилатов вторичных спиртов.
Сульфатирующие агенты, которые подходят для применения, включают агенты, содержащие триоксид серы, комплексы триоксида серы с основаниями (Льюиса), например комплекс триоксида серы с пиридином и комплекс триоксида серы с триметиламином, хлорсульфоновую кислоту и сульфамовую кислоту.
Реакцию сульфатирования можно проводить при температуре предпочтительно не более 80°C. Сульфатирование можно проводить при низкой температуре, равной приблизительно -20°C, однако более высокие температуры целесообразнее с экономической точки зрения. Например, сульфатирование можно успешно проводить при температуре в диапазоне от 20 до 70°C, предпочтительно в диапазоне от 20 до 60°C и более предпочтительно в диапазоне от 20 до 50°C. Триоксид серы является наиболее экономически выгодным сульфатирующим агентом.
Алкоксилаты вторичных спиртов можно вводить во взаимодействие с газовой смесью, которая помимо, как минимум, одного инертного газа содержит от 1 до 8 процентов по объему (объемн.%) от объема газовой смеси, газообразного триоксида серы, предпочтительно от 1,5 до 5 объемн.%. В принципе имеется возможность применять газовые смеси, включающие менее 1 объемного % триоксида серы, но при этом недопустимо понижается объемно-временной выход. Применение смесей с инертным газом, содержащих более 8 объемн.% триоксида серы, как правило, может приводить к проблемам, связанным с неравномерным сульфатированием, неустойчивостью температуры и повышенным образованием нежелательных побочных продуктов. Хотя для проведения реакции подходят и другие инертные газы, предпочтительными являются воздух или азот, как правило, из-за их высокой доступности.
Взаимодействие алкоксилата вторичного спирта с триоксидом серы, содержащимся в инертном газе, можно проводить в реакторах с нисходящей пленкой жидкости. В реакторах такого типа используется жидкая пленка, стекающая тонким слоем по охлажденной стенке, которая приведена в контакт с постоянным потоком газа. В качестве возможных реакторов могли бы подходить каскады реакторных емкостей. Другие типы реакторов включают емкости с перемешиванием, которые могут применяться в том случае, если сульфатирование проводят с использованием сульфамовой кислоты или комплекса триоксида серы и основания (Льюиса), например комплекса триоксида серы с пиридином или комплекса триоксида серы с триметиламином. Эти сульфатирующие агенты могли бы дать возможность увеличения времени сульфатирования без риска разрушения этоксилатной цепи и элиминирования олефина при катализе кислотой (Льюиса).
Мольное соотношение триоксида серы и алкоксилата может находиться в диапазоне от 1,4 до 1 или менее, в т.ч. в диапазоне от 0,8 до 1 моля триоксида серы на моль OH групп алкоксилата, и последнее соотношение является предпочтительным. Для сульфатирования алкоксилатов можно применять триоксид серы, и температура может находиться в диапазоне от -20 до 50°C, предпочтительно от 5 до 40°C, и абсолютное давление может находиться в диапазоне от 100 до 150 кПа. Реакцию можно проводить в непрерывном или периодическом режиме. Время протекания реакции сульфатирования может находиться в пределах от 0,5 секунд до 10 часов, но предпочтительно составляет от 0,5 секунд до 20 минут.
Сульфатирование можно проводить с применением хлорсульфоновой кислоты при температуре в пределах от -20 до 50°C, предпочтительно от 0 до 30°C. Мольное соотношение между алкоксилатом и хлорсульфоновой кислотой может находиться в пределах от 1:0,8 до 1:1,2, предпочтительно от 1:0,8 до 1:1. Реакцию можно проводить в непрерывном или периодическом режиме в течение периода времени от долей секунды (т.е. 0,5 секунды) до 20 минут.
Следует исключить применение в реакции сульфатирования серной кислоты и олеума, в том случае, если эти реагенты используются только для генерации газообразного триоксида серы. Воздействие этих реагентов на любой алкоксилат, например этоксилат, ведет к разрыву эфирной связи - элиминированию 1,4-диоксана (циклизации) - и в конечном счете превращению вторичного спирта во внутренний олефин.
При получении этоксисульфата первичного спирта нейтрализацию полуэфира серной кислоты следует осуществлять как можно быстрее, поскольку в ином случае будет происходить элиминирование триоксида серы. Это может привести к разрушению этоксилатной цепи с одновременным образованием 1,4-диоксана и укорочением этоксилатного фрагмента или к конечному образованию спиртов или олефинов, в зависимости от условий проведения реакции. В случае этоксилатов вторичных спиртов и особенно с низким средним числом звеньев EO, т.е. низкомолекулярных этоксилатов вторичных спиртов, которые получаются по способу настоящего изобретения, следует избегать избытка кислоты Льюиса, т.е. триоксида серы, на любом этапе реакции, т.к. иначе в зависимости от условий проведения реакции, будет образовываться значительное количество побочных продуктов, например внутренних олефинов, 1,4-диоксана, триоксида серы или серной кислоты. Предполагается, что это предварительное условие ограничит уровень превращения при сульфатировании этоксилатов вторичных спиртов, или же необходимо выявить альтернативный путь решения этой проблемы, присущей сульфатированию низкомолекулярных этоксилатов вторичных спиртов при использовании кислот (Льюиса).
После сульфатирования жидкую реакционную смесь можно нейтрализовать, используя водный раствор гидроксида щелочного металла, например гидроксид натрия или гидроксид калия, водный гидроксид щелочноземельного металла, например гидроксид магния или гидроксид кальция или такие основания, как гидроксид аммония, гидроксид замещенного аммония, карбонат натрия или гидрокарбонат калия. Реакцию нейтрализации можно проводить в широком диапазоне температуры и давления. Например, реакцию нейтрализации можно проводить при температуре в диапазоне от 0 до 65°C и абсолютном давлении в диапазоне от 100 до 200 кПа. Время нейтрализации может составлять от 0,5 часа до 1 часа, но при необходимости можно проводить реакцию в течение большего или меньшего времени.
Далее по тексту настоящее изобретение будет проиллюстрировано примерами, которые никоим образом не предназначены для ограничения объема изобретения.
ПРИМЕРЫ
(i) Получение катализатора
Катализатор 1
Моногидрат ацетата кальция (5,5 г) (с чистотой 99%, приобретенный у фирмы Aldrich) при комнатной температуре и атмосферном давлении добавляли к 23 мл изопропилового спирта (IPA со степенью чистоты PA, приобретенного у фирмы Merck). В эту смесь при энергичном перемешивании магнитной мешалкой вводили примерно 0,8 мл концентрированной серной кислоты (95-97%, приобретенной у фирмы Merck), с такой скоростью, чтобы температура оставалась ниже 40°C. После этого смесь, которая представляла собой молочно-белую суспензию, перемешивали в течение еще 30 минут и после этого непосредственно применяли в качестве катализатора присоединения алкиленоксида («Катализатора 1»).
Катализатор 2
Моногидрат ацетата кальция (5,5 г) (с чистотой 99%, приобретенный у фирмы Aldrich) при комнатной температуре и атмосферном давлении добавляли к 23 мл изопропилового спирта (IPA со степенью чистоты PA, приобретенного у фирмы Merck). В эту смесь при энергичном перемешивании магнитной мешалкой вводили примерно 0,8 мл концентрированной серной кислоты (95-97%, приобретенной у фирмы Merck), к которой было добавлено 0,55 масс.% персульфата аммония (приобретенного у фирмы Aldrich) с такой скоростью, чтобы температура оставалась ниже 40°C. После этого смесь, которая представляла собой молочно-белую суспензию, перемешивали в течение еще 30 минут и после этого непосредственно применяли в качестве катализатора присоединения алкиленоксида («Катализатора 2»).
(ii) Ацетоксилирование
Хотя в примерах 1 и 2 проводили ацетоксилирование α-олефинов, а не соответствующих внутренних олефинов C12, специалист в данной области техники поймет, что аналогичные эфирные продукты могли бы быть получены с использованием таких внутренних олефинов.
ПРИМЕР 1 (Ацетоксилирование 1-додекана)
1-додекан (77,2 г, 0,46 моль) и 55,4 г уксусной кислоты помещали в круглодонную колбу. Смесь нагревали при 120°C на масляной бане. После того как смесь становилась прозрачной, добавляли 0,4 мл H2SO4. Смесь быстро превращалась в коричневый раствор. Смесь оставляли для прохождения реакции на 33 часа. После охлаждения до комнатной температуры смесь экстрагировали водой для удаления уксусной кислоты и катализатора. Органический слой анализировали ГХ и ЯМР (смотрите Таблицу 1 для ознакомления с данными ЯМР). Эти анализы показали, что смесь состояла из 35% масс./масс. сложного эфира (в основном 2-додецилацетата и небольшого количества 3-додецилацетата) и 65 масс./масс.% не вступившего в реакцию 1-додекана и продуктов его изомеризации с другим расположением двойной связи. Эту смесь использовали как есть, без какой-либо дальнейшей очистки, для эксперимента по этоксилированию, описанного в примере 4.
ПРИМЕР 2 (Ацетоксилирование 1-додекана)
В 500-мл круглодонную колбу в указанном порядке помещали 120,8 г уксусной кислоты (2 моля), 1,55 г FeCl3 (9,5 ммоль), 1,45 г трифторметилсульфоновой кислоты, т.е. CF3SO3H (9,7 ммоль) и 160,0 г 1-додецена (0,95 моль). Использованные реагенты приобретали у фирмы Aldrich, за исключением ледяной уксусной кислоты, которая была получена у Merck. Полученную смесь перемешивали при 80°C на масляной бане в течение 48 часов. Затем температуру повышали до 100°C и давали пройти реакции в течение еще 55 часов. По ходу реакции отбирали образцы и следили за превращением с помощью ГХ. После того как реакция продолжалась в общей сложности в течение 103 часов, смесь охлаждали до комнатной температуры и 3 раза экстрагировали водой для удаления не вступившей в реакцию уксусной кислоты и катализатора. В результате получали органический слой коричневого цвета. ГХ и ЯМР анализы показали, что смесь состояла из 33% масс./масс. 2-додецилацетата, 4% масс./масс. 3-додецилацетата и ~57% масс./масс. олефинов (1-С12= и изомеризованных C12=), а также ~2% масс./масс. хлордодекана.
Полученную смесь подвергали отгонке при пониженном давлении (при 2 мбар в течение 2 часов при 150°C) для максимально возможного удаления не вступивших в реакцию олефинов. Остаток состоял из 60% масс./масс. 2-додецилацетата, 6% масс./масс. 3-додецилацетата и ~26% масс./масс. C12-олефинов.
(iii) Алкоксилирование
Хотя описанное ниже алкоксилирование проводили с использованием сложноэфирного продукта примера 1, специалист в данной области техники поймет, что описанную ниже реакцию алкоксилирования можно проводить аналогичным образом с использованием аналогичного эфирного продукта, полученного из соответствующего внутреннего олефина.
ПРИМЕР 3 (Пропоксилирование 1-додецилацетата)
В пробирку для проведения реакций под давлением, продаваемую под торговым наименованием “Ace” фирмы Ace Glass Inc., помещали 10 г додецилацетата (приобретенного у фирмы Aldrich), 0,2 г катализатора 1 и 0,5 мл пропиленоксида и перемешивали в течение 24 часов (3×8 часов) при 180°C, осуществляя нагревание на масляной бане. Анализ с применением1H-ЯМР показал, что примерно 35% пропиленкоксида (PO) претерпело превращение в продукт присоединения. Наличие мультиплета при δ=5,0 м.д. показало образование 2-ацетоксипропилового эфира и внедрение пропиленоксида по сложноэфирной связи.
ПРИМЕР 4 (Этоксилирование продукта примера 1, т.е. продукта ацетоксилирования 1-додецена)
Смесь продуктов, полученных в примере 1, использовали как таковую, без какой-либо дальнейшей очистки, для описанного ниже эксперимента по этоксилированию.
40 г упомянутой выше смеси продуктов примера 1 и 0,82 г суспензии катализатора (катализатора 1) добавляли в 120 мл автоклав (из нержавеющей стали). Автоклав закрывали и три раза заполняли азотом под давлением (избыточное давление 4-5 баров) для удаления газа из пустого пространства автоклава, и нагревали до 130°C. При 130°C автоклав продували азотом (10-15 л/мин) в течение 30 мин для высушивания содержимого. Затем избыточное давление в автоклаве повышали до 5 баров путем введения азота и повышали температуру до 165°C.
При 165°C порциями вводили этиленоксид (при избыточном давлении 10-25 бар (EO/N2<1 объем/объем)) с применением поршневого насоса высокого давления, который можно приобрести у Teledyne Isco, Inc. По соображениям безопасности каждое добавление EO не должно было давать концентрацию в смеси с азотом более 50% объем/объем (как правило, каждая добавленная порция содержала 2-3 г этиленоксида). После добавления первой порции этиленоксида наблюдался короткий индукционный период продолжительностью приблизительно 5 минут. Затем начиналась реакция и давление в автоклаве быстро понижалось. Когда давление стабилизировалось (через 15-20 минут), вводили следующую порцию этиленоксида. Новые порции вводили до тех пор, пока не было завершено добавление всего желаемого количества этиленоксида (39,0 г).
После добавления всего этиленоксида, реакции давали пройти в течение дополнительных 30 минут, чтобы во взаимодействие вступил весь оставшийся EO. После этого автоклав охлаждали до 80°C и при этой температуре его содержимое продували азотом в течение 20 минут для удаления последних следов растворенного свободного этиленоксида, и затем открывали автоклав. Вслед за этим температуру понижали до комнатной, чтобы получить возможность безопасно извлечь смесь продуктов реакции.
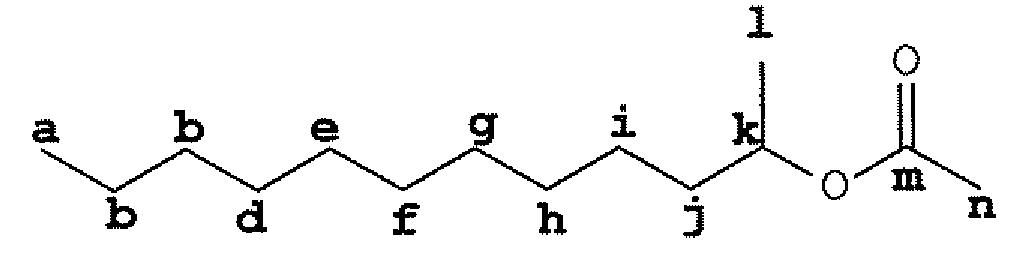
Большая часть смеси не изменила своего внешнего вида (коричневая жидкость), однако небольшая часть (приблизительно 5-10% от общего количества продукта) превратилась в не совсем белое клейкое твердое вещество. В соответствии с массовым балансом и данными ГХ смеси продуктов некоторая часть этиленоксида (EO) вступила в реакцию. С помощью спектроскопии1H-ЯМР (CDCl3, 300 МГц) было получено подтверждение, что не совсем белое клейкое твердое вещество является продуктом присоединения EO к втор-додецилацетату, поскольку был обнаружен характеристический сигнал фрагмента -CH2-, расположенного рядом с фрагментом -O(C=O)CH3 при 4,2 м.д. (в положении A на фиг. 1). Эту структуру подтвердили данными анализа ЖХ-МС.
Фиг. 1: Продукт включения EO во втор-додецилацетат

Реферат
Изобретение относится к способу получения ацилированного алкоксилата вторичного спирта формулы (I), в которой Rявляется линейной или разветвленной алкильной группой, включающей от 1 до 30 атомов углерода, необязательно замещенной циклоалкильной группой, включающей от 5 до 30 атомов углерода, или необязательно замещенной арильной группой, включающей от 6 до 30 атомов углерода, ОА означает один или несколько оксиалкиленовых фрагментов, которые могут являться одинаковыми или различными, n означает целое число в диапазоне от 0 до 70, и Rявляется линейной или разветвленной алкильной группой, включающей от 4 до 32 атомов углерода, необязательно замещенной циклоалкильной группой, включающей от 5 до 32 атомов углерода, или необязательно замещенной бициклоалкильной группой, включающей от 7 до 32 атомов углерода, где указанный способ включает: (i) взаимодействие одного или нескольких олефинов с внутренней двойной связью с одной или несколькими карбоновыми кислотами в присутствии каталитической композиции с получением одного или нескольких эфиров карбоновой кислоты; (ii) взаимодействие одного или нескольких эфиров карбоновой кислоты, полученных на стадии (i), с одним или несколькими алкиленоксидными реагентами в присутствии каталитически эффективного количества каталитической композиции, включающей: (a) одну или несколько солей щелочноземельных металлов и карбоновых кислот и/или гидроксикарбоновых кислот, включающих 1-18 атомов углерода, и/или гидратов первых; (b) кислородсодержащую кислоту, выбранную из серной кислоты и ортофосфорной кислоты; (c) спирт, содержащий от 1 до 6 атомов углерода, и/или сложный эфир, содержащий от 2 до 39 а
Формула

где R1 является линейной или разветвленной алкильной группой, включающей от 1 до 30 атомов углерода, необязательно замещенной циклоалкильной группой, включающей от 5 до 30 атомов углерода, или необязательно замещенной арильной группой, включающей от 6 до 30 атомов углерода, ОА означает один или несколько оксиалкиленовых фрагментов, которые могут являться одинаковыми или различными, n означает целое число в диапазоне от 0 до 70, и R2 является линейной или разветвленной алкильной группой, включающей от 4 до 32 атомов углерода, необязательно замещенной циклоалкильной группой, включающей от 5 до 32 атомов углерода, или необязательно замещенной бициклоалкильной группой, включающей от 7 до 32 атомов углерода, где указанный способ включает:
(i) взаимодействие одного или нескольких олефинов с внутренней двойной связью с одной или несколькими карбоновыми кислотами в присутствии каталитической композиции с получением одного или нескольких эфиров карбоновой кислоты;
(ii) взаимодействие одного или нескольких эфиров карбоновой кислоты, полученных на стадии (i), с одним или несколькими алкиленоксидными реагентами в присутствии каталитически эффективного количества каталитической композиции, включающей:
(a) одну или несколько солей щелочноземельных металлов и карбоновых кислот и/или гидроксикарбоновых кислот, включающих 1-18 атомов углерода, и/или гидратов первых;
(b) кислородсодержащую кислоту, выбранную из серной кислоты и ортофосфорной кислоты;
(c) спирт, содержащий от 1 до 6 атомов углерода, и/или сложный эфир, содержащий от 2 до 39 атомов углерода;
и/или продукты взаимодействий (a), (b) и/или (c)
с получением одного или нескольких ацилированных алкоксилатов вторичных спиртов.
(a) одну или несколько солей щелочноземельных металлов и карбоновых кислот и/или гидроксикарбоновых кислот, содержащих от 1 до 18 атомов углерода, и/или гидратов первых;
(b) кислородсодержащую кислоту, выбранную из серной кислоты и ортофосфорной кислоты;
(c) спирт, содержащий от 1 до 6 атомов углерода, и/или сложный эфир, содержащий от 2 до 39 атомов углерода;
(d) пероксикислоту и/или ее соль;
и/или продукты взаимодействий (a), (b), (c) и/или (d).
(a) как минимум одно соединение металла, где указанный металл выбран из железа, кобальта и никеля; и
(b) кислотного соединения.
- получения одного или более ацилированных алкоксилатов вторичных спиртов на стадиях (i) и (ii) способа по любому из пп.1-3; и
(iii) гидролиза или переэтерификации одного или нескольких ацилированных алкоксилатов вторичных спиртов для получения одного или более алкоксилатов вторичных спиртов.
- получения алкоксилатов вторичных спиртов способом по п.9; и
- сульфатирования алкоксилатов вторичных спиртов.

Комментарии