Способ получения трепростинила - RU2709200C2
Код документа: RU2709200C2
Чертежи









Описание
Настоящее изобретение относится к получению трепростинила формулы I и его аморфных безводных, моногидратных и полигидратных солей, получаемых с помощью оснований, к промежуточным соединениям трепростинила общих формул III, IV, V, VI, VII, VIII, IX, X, XI, XII, XIII, XIV и XV и к их получению.

Трепростинил представляет собой синтетическое производное простациклина с активностью ингибирования агрегации тромбоцитов и сосудорасширяющей активностью, его можно вводить в формах для подкожного, внутривенного, ингаляционного или перорального введения.
Его терапевтическая область представляет собой лечение легочной артериальной гипертензии (Pulmonary Arterial Hypertension, PAH). (Drugs, 2012, 72 (18) 2351-2363).
Известно несколько способов образования бензинденовой структурной части трепростинила. Краткое описание применяемых до настоящего времени описанных способов синтеза, опубликовано в Drugs of the Future, 2001, 26 (4) 364-374.
При сравнении способов синтеза оказалось, что циклизация Паусона-Ханда - описанная в заявке на патент WO 99/21830 A1 - представляет собой наиболее эффективный способ образования кольцевой системы.
Согласно примеру, раскрытому в заявке на патент WO 99/21830 A1 (US 6441245 B1), ключевое промежуточное соединение бензиндена синтезируют с помощью пути реакции, изложенного на фигуре 1.
Фигура 1 показана в конце описательной части перед примерами.
Ключевое промежуточное соединение затем преобразуют в трепростинил с помощью известных химических реакций, как продемонстрировано на фигуре 2, показанной в конце описательной части перед примерами.
В заявке на патент WO 2009/158010 A1 раскрыто получение дейтерированных производных трепростинила.
Закрытие кольца осуществляют посредством циклизации Паусона-Ханда. Кроме того, в данном случае цепь с тройной связью состоит по меньшей мере из семи атомов углерода. Молекула, полученная в результате циклизации Паусона-Ханда, уже содержит боковую цепь трепростинила (фигура 3).
Фигура 3

- где Z(1,3,4)и Y(1,2,3)означают водород или дейтерий;
- где R1представляет собой пентильную группу, необязательно содержащую один или несколько атомов дейтерия.
Отличия между способами, описанными в заявках на патент WO 2011/153363 A1 и WO 99/21830 A1, являются следующими:
связывание боковой цепи, содержащей тройную связь с альдегидом, осуществляют в присутствии хирального катализатора ((+)-N-метилэфедрина), таким образом в одну стадию получают хиральный спирт без образования рацемического спирта. Таким образом, исключают одну стадию окисления и стереоселективное восстановление.
Количество октакарбонила дикобальта снижалось (вместо эквимолярного отношения применяли лишь 2-15 мол. %) и закрытие кольца осуществляют под давлением монооксида углерода. Полная схема синтеза представлена на фигуре 4 в конце описательной части перед примерами.
В синтезе, описанном в заявке на патент WO 2012/009816 A1, также применяется циклизация Паусона-Ханда для образования бензинденового кольца. Новизна синтеза заключается в том, что фенольная гидроксильная группа защищена п-метоксибензильной (PMB) защитной группой. Также в данном случае боковая цепь с тройной связью содержит по меньшей мере семь атомов углерода.
Молекула, получаемая в результате циклизации Паусона-Ханда, уже будет содержать боковую цепь трепростинила.
Полная схема синтеза представлена на фигуре 5 в конце описательной части перед примерами.
Синтез соли трепростинила подробно изложен в заявке на патент WO 2009/078965 (PCT/US2008/013686) (United Therapeutics). В ней описывается получение кристаллической диэтаноламиновой соли.
Согласно способу бензинденнитрил получают посредством алкилирования ароматической гидроксильной группы бензинденовой структуры. (Фигура 6)
Фигура 6

Бензинденнитрил гидролизуют до трепростинила и преобразуют, без выделения, в кристаллическую диэтаноламиновую соль. (Фигура 7)
Фигура 7


Из диэтаноламиновой соли трепростинила трепростинил выделяют путем обработки кислотой. (Фигура 8)
Фигура 8

После разделения фаз фазу этилацетата выпаривают, остаток кристаллизуют водным раствором этанола, собирают путем фильтрации и высушивают.
Очистка с помощью диэтаноламиновой соли является настолько эффективной, что очистки производного бензинденнитрила посредством хроматографии не требуется.
Трепростинил высокой чистоты может быть преобразован с применением различных оснований в необходимые соли высокой чистоты.
Подробное описание образования натриевой соли описано в заявке на патент WO 2012/088607.
Согласно описанию производное бензиндена алкилируют сложным метиловым эфиром бромуксусной кислоты и полученный в результате сложный метиловый эфир трепростинила гидролизуют без очистки до трепростинила путем применения гидроксида калия в смеси растворителей метанол-вода.
Реакционную смесь затем подкисляют хлористоводородной кислотой, осажденное белое твердое вещество отфильтровывают, промывают смесью метанол-вода, высушивают в вакууме и преобразуют в натриевую соль. (Фигура 9)
Фигура 9

Авторы настоящего изобретения стремились разработать способ, в котором хиральный центр в нижней цепи строится только в конце синтеза, и при этом способ является надежным и хорошо масштабируемым.
Целью настоящего изобретения является способ получения трепростинила формулы I и его аморфных безводных солей, получаемых с помощью оснований, а также их моногидратов и полигидратов,

I
отличающийся тем, что
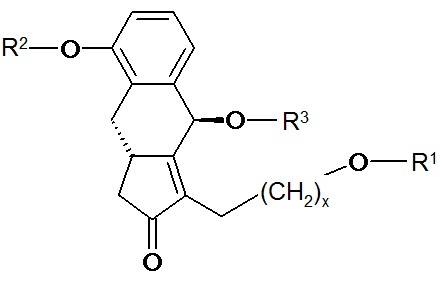
a.) соединение общей формулы XVII,

XVII
- где в формуле
R1 представляет собой защитную группу, содержащую атом кремния, тетрагидропиранильную, тритильную, метоксиметильную, этоксиметильную, метоксиэтоксиметильную, метилтиометильную, бензилоксиметильную группу,
при условии, что защитная группа R1 должна быть селективно удаляемой относительно R2 и R4, и x представляет собой 0 или 2,
и соединение общей формулы XVI,

где в формуле
R2 представляет собой -(CH2)nY, где
Y представляет собой атом водорода, атом галогена, фенильную, нитрильную группу, группу -OR5 или -COOR5, где
R5 означает C1-4алкильную, тетрагидропиранильную, три(C1-4 )алкилсилильную или (C1-4)алкил-ди(C6-10)арилсилильную группу, и n означает 1, 2, 3, 4,
a1.) вводят в реакцию в присутствии реактива Гриньяра, и полученное в результате соединение общей формулы XV,

где в формуле значения x, R1 и R2 являются такими, как определено выше, окисляется, и
полученное в результате соединение общей формулы XIV,

где в формуле значения x, R1 и R2 являются такими, как определено выше, селективно восстанавливается, или
a2.) подвергают реакции в присутствии хирального основания и цинковой соли, и
соединение общей формулы XIII, полученного на стадии a1.) или a2.)

где в формуле значения x, R1 и R2 являются такими, как определено выше,
вводят в реакцию с соединением, пригодным для введения группы R3, где R3 представляет собой защитную группу, содержащую атом кремния, тетрагидропиранильную, тритильную, метоксиметильную, этоксиметильную, метоксиэтоксиметильную, метилтиометильную, бензилоксиметильную или C1-13ацильную группу,
b.) полученное в результате соединение общей формулы XII,

где в формуле значения x, R1, R2 и R3 являются такими, как определено выше, подвергают внутримолекулярной циклизации,
c.) полученное в результате соединение общей формулы XI,
где в формуле значения x, R1, R2 и R3 являются такими, как определено выше, каталитически гидрогенизируют, и в случае если
x=0, изомеризуют,
d.) полученное в результате соединение общей формулы X,

где в формуле значения x, R1, R2 являются такими, как определено выше, восстанавливают,
e.) полученное в результате соединение общей формулы IX,

где в формуле значения x, R1 и R2 являются такими, как определено выше,
вводят в реакцию с соединением, пригодным для введения группы R4, где R4 представляет собой защитную группу, содержащую атом кремния, тритильную, метокситритильную, п-метоксибензильную, метоксиметильную, этоксиметильную, метоксиэтоксиметильную, метилтиометильную, бензилоксиметильную или C1-13ацильную группу, при условии, что защитная группа R4 должна быть селективно удаляемой относительно R2, и R1 должна быть селективно удаляемой относительно R4,
f.) из полученного в результате соединения общей формулы VIII,

где в формуле значения x, R1, R2 и R4 являются такими, как определено выше, защитную группу R1 отщепляют в кислой среде,
g) полученное в результате соединение общей формулы VII,

где в формуле значения x, R2 и R4 являются такими, как определено выше,
окисляют,
h.) полученное в результате соединение общей формулы VI,

где в формуле значения x, R2 и R4являются такими, как определено выше,
h1.) в случае если x означает 0, вводят в реакцию в условиях реакции Виттига с соединением общей формулы
CH3-(CH2)4-CO-CH2-PO(OR6)2
где в формуле R6 представляет собой C1-4алкильную или фенильную группу, и
полученное в результате соединение общей формулы V,

где в формуле значения R2 и R4 являются такими, как определено выше,
селективно восстанавливают, защитную группу полученного в результате соединения общей формулы IVa.,

где в формуле значения R2 и R4 являются такими, как определено выше,
R4 удаляют, полученное в результате соединение общей формулы III,

где в формуле значение R2 является таким, как определено выше, гидрогенизируют, или
h2.) в случае если x означает 2, вводят в реакцию с металлоорганическим реагентом в присутствии хирального катализатора, и
защитную группу R4 полученного в результате соединения общей формулы IVb.,

IVb.
где в формуле значения R2 и R4 являются такими, как определено выше, то R4 удаляют,
i) соединение общей формулы II, полученное на стадиях h1.) или h2.),

где в формуле значение R2 является таким, как определено выше, преобразуют посредством известного способа в трепростинил формулы I, и при необходимости, в его аморфные безводные, моногидратные и полигидратные соли, получаемые с помощью оснований.
В качестве защитной группы R1 предпочтительно могут применяться метоксиметильная, метоксиэтоксиметильная или тетрагидропиранильная группы, в качестве защитной группы R2 может применяться метильная группа, в качестве защитной группы R3 может применяться защитная группа, содержащая атом кремния, предпочтительно трет-бутилдиметилсилильная группа, в качестве защитной группы R4 может применяться п-фенилбензоильная группа.
Кроме того, настоящее изобретение относится к получению оптически активных соединений общей формулы II,

где в формуле
R2 представляет собой -(CH2)nY, где
Y представляет собой атом водорода, атом галогена, фенильную, нитрильную группу, группу -OR5 или -COOR5, где
R5 означает C1-4алкильную, тетрагидропиранильную, три(C1-4)алкилсилильную или (C1-4)алкил-ди(C6-10)арилсилильную группу, и n означает 1, 2, 3, 4.
В соответствии с настоящим изобретением могут быть получены соединения общей формулы II, так что соединение общей формулы III,

где в формуле значение R2 является таким, как определено выше, гидрогенизируют,
или защитную группу R4 соединения общей формулы IVb.,

где в формуле значение R2 является таким, как определено выше, и
R4 представляет собой защитную группу, содержащую атом кремния, тритильную, метокситритильную, п-метоксибензильную, метоксиметильную, этоксиметильную, метоксиэтоксиметильную, метилтиометильную, бензилоксиметильную или C1-13ацильную группу, при условии, что защитная группа R4 должна быть селективно удаляемой относительно R2, удаляют.
Гидрогенизацию соединения общей формулы III осуществляют в присутствии катализатора.
В качестве катализатора могут применяться оксид платины, катализатор Pd/C, предпочтительно катализатор Pd/C.
Соединения общей формулы III,

являются новыми, где в формуле
R2 представляет собой -(CH2)n Y, где
Y представляет собой атом водорода, атом галогена, фенильную, группу -OR5 или -COOR5, где
R5 означает C1-4алкильную, тетрагидропиранильную, три(C1-4)алкилсилильную или (C1-4)алкил-ди(C6-10)арилсилильную группу, и n означает 1, 2, 3, 4, при условии, что R5 в -COOR5 не может представлять собой C1-4алкил.
Могут быть получены соединения общей формулы III, так что защитную группу R4 соединений общей формулы IVa.,

где в формуле
R2 имеет значение, определенное выше, и
R4 представляет собой защитную группу, содержащую атом кремния, тритильную, метокситритильную, п-метоксибензильную, метоксиметильную, этоксиметильную, метоксиэтоксиметильную, метилтиометильную, бензилоксиметильную или C1-13ацильную группу, при условии, что защитная группа R4 должна быть селективно удаляемой относительно R2, -R4 удаляют.
Защитная группа R4, содержащая атом кремния, предпочтительно представляет собой фенилдиметилсилильную, триэтилсилильную, триизопропилсилильную, трет-бутилдиметилсилильную или трет-бутилдифенилсилильную группу.
Удаление защитной группы R4 осуществляют путем метанолиза в присутствии основания.
Соединения общей формулы IV,

где в формуле
R2 представляет собой -(CH2)nY, где
Y представляет собой атом водорода, атом галогена, фенильную, нитрильную группу, группу -OR5 или -COOR5, где
R5 означает C1-4алкильную, тетрагидропиранильную, три(C1-4)алкилсилильную или (C1-4)алкил-ди(C6-10)арилсилильную группу,
n означает 1, 2, 3, 4,
R4 представляет собой защитную группу, содержащую атом кремния, тритильную, метокситритильную, п-метоксибензильную, метоксиметильную, этоксиметильную, метоксиэтоксиметильную, метилтиометильную, бензилоксиметильную или C1-13ацильную группу, при условии, что защитная группа R4 должна быть селективно удаляемой относительно R2, и
пунктирная линия представляет собой одинарную или двойную связь, представляют собой новые соединения.
Могут быть получены новые соединения общей формулы IVa.,

где в формуле
R2 представляет собой -(CH2)nY, где
Y представляет собой атом водорода, атом галогена, фенильную, нитрильную группу, группу -OR5 или -COOR5, где
R5 означает C1-4алкильную, тетрагидропиранильную, три(C1-4)алкилсилильную или (C1-4)алкил-ди(C6-10)арилсилильную группу,
n означает 1, 2, 3, 4, и
R4 представляет собой защитную группу, содержащую атом кремния, тритильную, метокситритильную, п-метоксибензильную, метоксиметильную, этоксиметильную, метоксиэтоксиметильную, метилтиометильную, бензилоксиметильную или C1-13ацильную группу, при условии, что защитная группа R4 должна быть селективно удаляемой относительно R2,
так что соединение общей формулы V,

где в формуле значения R2 и R4 являются такими, как определено выше, селективно восстанавливают.
Восстановление соединения формулы V осуществляют с помощью соединения борана в присутствии оксазаборолидинового катализатора.
В качестве соединения борана применяют катехинборан, боран-диэтиланилиновый комплекс, боран-диметилсульфидный комплекс, предпочтительно боран-диметилсульфидный комплекс.
Соединения общей формулы V являются новыми.
Могут быть получены новые соединения общей формулы V, так что соединение общей формулы VIa.,

где в формуле значения R2 и R4 являются такими, как определено выше, подвергают реакции в условиях реакции Виттига с соединением общей формулы
CH3-(CH2)4-CO-CH2-PO(OR6)2
где в формуле R6 представляет собой C1-4алкильную или фенильную группу.
Могут быть получены новые соединения общей формулы IVb.,

где в формуле
R2 представляет собой -(CH2)nY, где
Y представляет собой атом водорода, атом галогена, фенильную, нитрильную группу, группу -OR5 или -COOR5, где
R5 означает C1-4алкильную, тетрагидропиранильную, три(C1-4)алкилсилильную или (C1-4)алкил-ди(C6-10)арилсилильную группу,
n означает 1, 2, 3, 4, и
R4 представляет собой защитную группу, содержащую атом кремния, тритильную, метокситритильную, п-метоксибензильную, метоксиметильную, этоксиметильную, метоксиэтоксиметильную, метилтиометильную, бензилоксиметильную или C1-13ацильную группу, при условии, что защитная группа R4 должна быть селективно удаляемой относительно R2,
так что соединение общей формулы VIb.,

где в формуле
R2 и R4 имеют значения, определенные выше, вводят в реакцию с металлоорганическим реагентом в присутствии хирального катализатора.
В качестве металлоорганического реагента можно применять дипентилцинк или пентилмагния бромид, в качестве хирального катализатора можно применять (2S)-3-екзо-(морфолино)изоборнеол.
Соединения общих формул VIa. и VIb. являются новыми.
Могут быть получены соединения общей формулы VI,

где в формуле
R2 представляет собой -(CH2)nY, где
Y представляет собой атом водорода, атом галогена, фенильную, нитрильную группу, группу -OR5 или -COOR5, где
R5 означает C1-4алкильную, тетрагидропиранильную, три(C1-4)алкилсилильную или (C1-4)алкил-ди(C6-10)арилсилильную группу,
n означает 1, 2, 3, 4,
R4 представляет собой защитную группу, содержащую атом кремния, тритильную, метокситритильную, п-метоксибензильную, метоксиметильную, этоксиметильную, метоксиэтоксиметильную, метилтиометильную, бензилоксиметильную или C1-13ацильную группу, при условии, что защитная группа R4 должна быть селективно удаляемой относительно R2,
и x означает 0 или 2, так что соединение общей формулы VII,

где в формуле
x, R2 и R4 имеют значения, определенные выше, окисляют.
Окисление соединения формулы VII осуществляют с помощью PCC (пиридиния хлорхромата), или в условиях Сверна (оксалилхлорид/DMSO/органическое основание) или с TEMPO (свободный радикал 2,2,6,6-тетраметил-1-пиперидинилокси), или в условиях Пфитцнера-Моффата (DCC (дициклогексилкарбодиимид)/DMSO/кислота).
Соединения общей формулы VII являются новыми.
Могут быть получены новые соединения общей формулы VII, так что защитную группу R1 соединения общей формулы VIII,

- где в формуле
R1 представляет собой защитную группу, содержащую атом кремния, тетрагидропиранильную, тритильную, метоксиметильную, этоксиметильную, метоксиэтоксиметильную, метилтиометильную, бензилоксиметильную группу, при условии, что защитная группа R1 должна быть селективно удаляемой относительно R2 и R4,
x, R2 и R4 имеют значения, определенные выше, удаляют в кислой среде.
Защитная группа R1, которая содержит атом кремния, предпочтительно представляет собой фенилдиметилсилильную, триэтилсилильную, триизопропилсилильную, трет-бутилдиметилсилильную или трет-бутилдифенилсилильную группу.
Соединения общей формулы VIII являются новыми.
Могут быть получены новые соединения общей формулы VIII, так что соединение общей формулы IX,

где в формуле
x, R1 и R2 имеют значения, определенные выше, вводят в реакцию с соединением, пригодным для введения группы R4.
В качестве соединений, пригодных для введения группы R4, предпочтительно применяют п-фенилбензоилхлорид.
Соединения общей формулы IX являются новыми.
Могут быть получены новые соединения общей формулы IX, так что соединение общей формулы X,

- где в формуле
x, R1 и R2 имеют значения, определенные выше, восстанавливают.
Восстановление соединения общей формулы X можно осуществлять с помощью гидрида диизобутилалюминия, алюмогидрида лития, изопропилата алюминия или борогидрида натрия, предпочтительно борогидрида натрия.
Могут быть получены новые соединения общей формулы X, так что соединение общей формулы XI,

где в формуле
x, R1 и R2 имеют значения, определенные выше,
R3 представляет собой защитную группу, содержащую атом кремния, тетрагидропиранильную, тритильную, метоксиметильную, этоксиметильную, метоксиэтоксиметильную, метилтиометильную, бензилоксиметильную или C1-13ацильную группу, каталитически гидрогенизируют, а
в случае если x=0, изомеризуют.
Для гидрогенизации соединения формулы XI в качестве катализатора может применяться катализатор Pd/C или оксид платины, предпочтительно катализатор Pd/C.
Соединения общей формулы XI являются новыми.
Могут быть получены новые соединения общей формулы XI, так что соединение общей формулы XII,

- где в формуле
x, R1, R2 и R3 имеют значения, определенные выше, подвергают внутримолекулярной циклизации.
Для внутримолекулярной циклизации предпочтительно применяют способ циклизации Паусона-Ханда. Циклизацию Паусона-Ханда осуществляют с использованием октакарбонила дикобальта.
Октакарбонил дикобальта можно применять в эквимолярных, или менее, чем эквимолярных, или более, чем эквимолярных отношениях.
Реакцию предпочтительно осуществляют в атмосфере монооксида углерода с использованием этилацетата в качестве растворителя.
Могут быть получены новые соединения общей формулы XII, так что соединение общей формулы XIII,

где в формуле
x, R1 и R2 имеют значения, определенные выше, вводят в реакцию с соединением, пригодным для введения группы R3.
Могут быть получены новые соединения общей формулы XIII, так что
a.) соединение общей формулы XIV,

где в формуле
x, R1 и R2 имеют значения, определенные выше, селективно восстанавливают, или
b.) соединение общей формулы XVI,

где в формуле
R2 имеет значение, определенное выше, вводят в реакцию с соединением общей формулы XVII,

XVII
- где в формуле
R1 и x имеют значения, определенные выше, в присутствии хирального основания и цинковой соли.
Восстановление соединения общей формулы XIV осуществляют с помощью соединения борана в присутствии хирального оксазаборолидинового катализатора.
В качестве соединения борана можно применять боран-диметилсульфидный комплекс, катехинборан или боран-диэтиланилиновый комплекс, предпочтительно боран-диметилсульфидный комплекс, а в качестве хирального основания можно применять хиральные аминоспирты или диамины, предпочтительно (+)-N-метилэфедрин.
В реакции соединений общих формул XVI и XVII в качестве цинковой соли можно применять предпочтительно трифлат цинка.
Могут быть получены новые соединения общей формулы XIV, так что соединение общей формулы XV,

где в формуле
x, R1 и R2 имеют значения, определенные выше, окисляют.
Окисление соединения формулы XV осуществляют с помощью PCC (хлорхромата пиридиния) или в условиях реакции Сверна (оксалилхлорид/DMSO/органическое основание).
Могут быть получены новые соединения общей формулы XV, так что соединение общей формулы XVI,

где в формуле
R2 имеет значение, определенное выше, вводят в реакцию с соединением общей формулы XVII,

XVII
где в формуле
R1 имеет значение, определенное выше, и x означает 0 или 2, в присутствии реактива Гриньяра.
В качестве реактива Гриньяра можно применять бромид метил-, этил-, пропил-, бутил-, циклогексилмагния, предпочтительно бромид метилмагния.
Следующей целью настоящего изобретения является новый способ получения аморфных безводных, моногидратных и полигидратных солей трепростинила формулы I, получаемых с помощью оснований.
Соли трепростинила, среди них и натриевая соль трепростинила, в общей форме описаны в WO 99/25357 (United Therapeutics), без их характеристики с помощью физико-химических показателей. Первый раз в приложении 1 заявления автора EP1628654 (United Therapeutics) упоминается, что точка плавления натриевой соли трепростинила составляет 56°C.
В WO 2012/088607 (Alphora) описан новый способ получения натриевой соли трепростинила, в котором трепростинил растворяют в смешиваемом с водой органическом растворителе с образованием раствора трепростинила, затем раствор вводят в реакцию с водным раствором, содержащим катион щелочного металла с образованием реакционной смеси, содержащей соль трепростинила, обеспечивают кристаллизацию соли и собирают образованную соль.
В соответствии с настоящим изобретением аморфные безводные, моногидратные и полигидратные соли трепростинила формулы I, получаемые с помощью оснований, получают посредством способа, в котором трепростинил растворяют в полярном растворителе, в раствор добавляют твердое основание, реакционную смесь перемешивают и после завершения образования соли раствор фильтруют, концентрируют, растворитель концентрата заменяют на органический растворитель для кристаллизации и соль трепростинила кристаллизуют.
Для получения солей трепростинила формулы I, получаемых с помощью оснований, в качестве полярного растворителя можно применять органический спирт с открытой или разветвленной C1-5цепью, предпочтительно этанол, в качестве основания можно применять не содержащее растворителя органическое или неорганическое основание, которое содержит катион необходимой соли, например, органическое или неорганическое основание, содержащее катион щелочного металла или катион щелочноземельного металла, например, моногидрат карбоната натрия, гидрокарбонат натрия или метилат натрия, предпочтительно гидрат карбоната натрия.
Реакционную смесь перемешивают в инертной атмосфере до завершения образования соли.
В соответствии с одним вариантом осуществления настоящего изобретения в качестве органического растворителя для кристаллизации можно применять водный растворитель эфирного, сложноэфирного или кетонного типа, т. е. в качестве растворителя эфирного типа можно применять простой или смешанный эфир с открытой или разветвленной цепью, предпочтительно трет-бутилметиловый эфир.
Кристаллизацию предпочтительно осуществляют при температуре от 50°C до (-40°C).
В результате приведенного выше способа с использованием органического или неорганического основания, содержащего катион натрия, получают белый кристаллический моногидрат натриевой соли трепростинила (форма A), который представляет собой новое соединение.
В соответствии с другим вариантом осуществления настоящего изобретения, если органический растворитель для кристаллизации представляет собой не содержащий воду растворитель эфирного, сложноэфирного или кетонного типа, то получают аморфную натриевую соль трепростинила, которая представляет собой новое соединение.
В соответствии с настоящим изобретением безводную натриевую соль трепростинила (форма B) можно получить путем осуществления приведенного выше способа до стадии кристаллизации и осуществления кристаллизации при 60-100°C или в вакууме. Другой возможный способ заключается в том, что моногидрат натриевой соли поглощают и перемешивают при 60-90°C в течение 1-6 часов в растворителе, который не растворяет или лишь в незначительной степени растворяет соль. В качестве растворителя предпочтительно могут применяться гексан, гептан, толуол, этилацетат.
Если моногидрат или ангидрид натриевой соли трепростинила выдерживают в атмосфере с содержанием влаги 60% в течение 48 часов или на воздухе в течение 5-8 дней, то получают новый полигидрат натриевой соли трепростинила (форма C).
Спектры DSC и рентгеновской порошковой дифрактометрии (XRPD) разных форм показаны на фигурах 14-22.
Данные приведенные выше формы солей демонстрируют подходящую стабильность и применимость для получения фармацевтических составов.
В предпочтительном варианте осуществления настоящего изобретения:
пропаргиловый спирт защищен метоксиметиловой группой.
Защищенный пропаргиловый спирт (XVII) вводят в реакцию с 2-аллил-3-метоксибензальдегидом (XVI) в присутствии реактива Гриньяра в виде метилмагния бромида. Полученный таким образом рацемический спирт (XV) окисляют.
Окисление осуществляют, например, посредством способа окисления по Сверну или посредством окисления с применением хрома(VI).
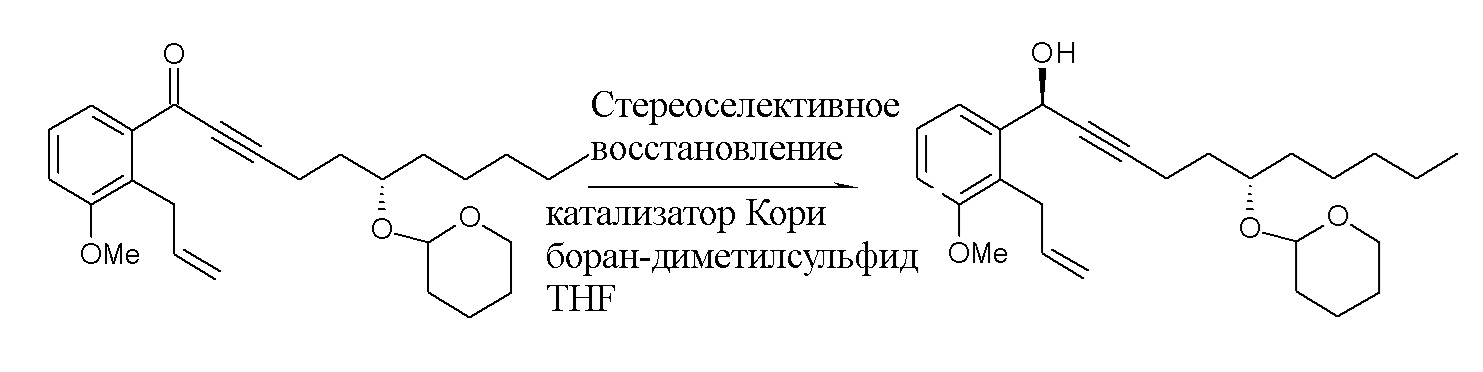
Стереоселективное восстановление кетона XIV обеспечивает в результате хиральный спирт XIII.
Стереоселективное восстановление можно осуществлять, например, с помощью боран-диметилсульфидного комплекса в присутствии катализатора Кори.
Хиральный спирт XIII может быть непосредственно получен посредством осуществления реакции защищенного пропаргилового спирта (XVII) с 2-аллил-3-метоксибензальдегидом (XVI) в присутствии хирального основания, например, (+)-N-метилэфедрина и трифлата цинка.
Гидроксильная группа защищают трет-бутилдиметилсилильной группой, силиловый эфир (XII) циклизируют в реакции Паусона-Ханда в присутствии октакарбонила дикобальта. В результате реакции образуется трицикл (XI) путем введения молекулы CO.
Циклизацию можно осуществлять с использованием эквимолярного количества октакарбонила дикобальта или более предпочтительно с каталитическим количеством октакарбонила дикобальта в атмосфере монооксида углерода.
Силилокси-группа удаляется посредством каталитической гидрогенизации и двойная связь пятичленного кольца насыщается. Стереоструктура трициклического кетона (X) образуется путем изомеризации с применением основания (диазабициклононан/этанол).
Оксо-группа восстанавливается (IX), полученная в результате вторичная гидроксильная группа защищена п-фенилбензоильной (PPB) группой (VIII).
Метоксиметильная защитная группа отщепляется посредством обработки кислотой (VII).
Первичная гидроксильная группа окисляется (VI).
Полученный в результате альдегид VI, без выделения, подвергают реакции с 2-оксогептилфосфонатом.
Полученный таким образом енон V восстанавливают посредством способа селективного восстановления, например, с помощью боран-диметилсульфидного комплекса в присутствии катализатора Кори.
п-Фенилбензоильная защитную группу полученного в результате соединения формулы IV удаляют путем метанолиза в присутствии основания.
Насыщение двойной связи енола формулы III путем каталитической гидрогенизации обеспечивает в результате производное бензиндена формулы II.
В соответствии с другим предпочтительным вариантом осуществления настоящего изобретения вместо защищенного пропаргилового спирта в качестве исходного материала применяют 2-пент-4-инокситетрагидропиран. Боковая цепь строится стереоселективно в присутствии хирального катализатора посредством реакции с дипентилцинком или пентилмагния бромидом.
Бензинден формулы II представляет собой ключевое промежуточное соединение трепростинила, его преобразуют в трепростинил посредством известных химических стадий.
Первая химическая стадия представляет собой расщепление метилового эфира. Удаление метильной группы осуществляют с помощью меркаптана в присутствии галогенида алюминия.
Что касается галогенида алюминия для получения тригидрокси-производного был выбран трихлорид алюминия, что касается меркаптана вместо обычно применяемого этантиола был выбран не имеющий запаха додекантиол. (Фигура 10)
Фигура 10

Следующая стадия представляет собой алкилирование ароматической гидроксильной группы с помощью сложного эфира галогензамещенной уксусной кислоты, например, сложного этилового или метилового эфира бром- или хлоруксусной кислоты. В способе по настоящему изобретению тригидрокси-производное алкилируют с помощью сложного этилового эфира бромуксусной кислоты. (Фигура 11)
Фигура 11

Гидролиз производного сложного этилового эфира обеспечивает в результате кристаллический трепростинил.
В способе по настоящему изобретению гидролиз осуществляют с помощью водного раствора гидроксида натрия в тетрагидрофуране.
После завершения реакции реакционную смесь промывают трет-бутилметиловым эфиром. pH водной фазы регулируют до pH≤ 3 путем добавления водного раствора кислоты. Трепростинил экстрагируют с помощью трет-бутилметилового эфира, раствор продукта промывают и выпаривают. (Фигура 12)
Фигура 12

Для образования соли трепростинил растворяют в этаноле и к нему добавляют твердый моногидрат карбоната натрия. (Фигура 13).
Фигура 13

Раствор фильтруют через микрофильтр, этанол заменяют на трет-бутилметиловый эфир, который был насыщен водой, и натриевую соль трепростинила кристаллизуют при комнатной температуре.
Преимущества способа по настоящему изобретению:
• образование трицикла бензиндена не требует дорогостоящего хирального исходного материала;
• образование боковой цепи осуществляют посредством хорошо масштабируемых и надежных химических стадий (реакция Виттига или модифицированная реакция Виттига), которые применяют в химии простагландинов, или осуществляют стереоселективно путем применения металлоорганического соединения в присутствии хирального катализатора;
• енон, полученный в ходе реакции Виттига может быть преобразован в необходимый энантиомер в стереоселективной реакции с достаточным выходом;
• используемая п-фенилбензоильная группа (PPB-группа) легко детектируется в УФ-излучении;
• PPB-группа повышает способность к кристаллизации промежуточных соединений и таким образом облегчает их очистку.
Фигуры 1, 2, 4 и 5 показаны ниже:
Фигуры 1, 2, 4, 5:









где P1 и P2 представляют собой спирт-защитные группы, R представляет собой (CH2)mCO2R1, m равняется 1, 2, 3 и
R1 представляет собой алкил, или THP, или TBDMS, или замещенную или незамещенную бензильную группу.


где PMB представляет собой п-метоксибензил, Bn представляет собой бензил,
Z представляет собой карбоксильную группу или производное карбоновой кислоты, X представляет собой атом галогена.
Следующие подробности способов по настоящему изобретению показаны с помощью примеров без ограничения настоящего изобретения данными примерами.
Примеры
Пример 1.
1a.)
Получение 3-(метоксиметокси)-1-пропина (MOM-пропинол, TREPO-1)

2,27 мл пропаргилового спирта и 8 мл диметоксиметана растворяли в 8 мл толуола. К раствору добавляли 0,66 г п-толуолсульфоновой кислоты и 0,33 г бромида лития. Реакционную смесь перемешивали при комнатной температуре в течение 20 часов, промывали раствором гидрокарбоната натрия и водой. Органическую фазу высушивали и раствор применяли на следующей стадии без выпаривания.
Выход: cca. 2 г (50%) продукта в растворе.
Данные ЯМР: (DMSO-d6), 1H ЯМР (500 МГц): 4,62 ppm (H-4, 2), s; 4,16 ppm (H-3, 2), d, J=2,3 Гц; 3,41 ppm (H-1, 1), t, J=2,3 Гц; 3,26 ppm (H-5, 3), s; 13C ЯМР (125,8 МГц): 94,15 ppm (C-4), 79,90 ppm (C-2), 76,97 ppm (C-1), 54,97 ppm (C-5), 53,60 ppm (C-3).
1b.) Получение 1-(2-аллил-3-метоксифенил)-4-метоксиметоксибут-2-ин-1-ола (TREP-1) (неселективное алкинилирование)
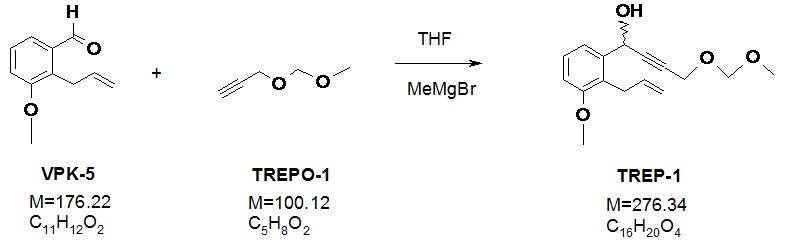
64 г (0,64 моль) 3-(метоксиметокси)-1-пропина (TREPO-1) растворяли в атмосфере азота в 600 мл не содержащего воду тетрагидрофурана и раствор нагревали до 60-65°C. К реакционной смеси медленно добавляли 220 мл раствора этилмагния бромида (3 M раствор в диэтиловом эфире) (0,66 моль). В конце добавления реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 45 минут, затем после охлаждения до 0-5°C раствор 100 г 2-аллил-3-метоксибензальдегида (VPK-5) (0,57 моль) по каплям добавляли в 100 мл не содержащего воду тетрагидрофурана. Смесь перемешивали при комнатной температуре. После завершения реакции смесь охлаждали до 0°C и к ней добавляли раствор NaHSO4 (гидросульфата натрия). После перемешивания фазы разделяли, водный слой экстрагировали с помощью этилацетата. Объединенную органическую фазу промывали раствором NaHCO3 (гидрокарбоната натрия) и высушивали над сульфатом натрия. Высушиваемый материал отфильтровывали, отфильтрованный раствор выпаривали в вакууме. Неочищенный продукт применяли на следующей стадии без очистки.
Выход: 156,8 г (100%) светло-коричневого масла.
Данные ЯМР: (CDCl3), 1H ЯМР (500 МГц): 7,32 ppm (H-6, 1), dd, J=7,8 Гц и 0,8 Гц; 7,24 ppm (H-5, 1), m (t), J= 7,9 Гц, 6,87 ppm (H-4, 1), d (dd), J= 7,8 Гц и ~1,0 Гц; 5,98 ppm (H-14, 1), ddt, J= 17,1 Гц, 10,2 Гц и 5,8 Гц; 5,67 ppm (H-7, 1), m (dt), J=5,4 Гц и 1,6 Гц; 4,985 ppm (H-15a, 1), dq, J=10,1 Гц и 1,6 Гц; 4,93 ppm (H-15b, 1), dq, J=17,1 Гц и 1,8 Гц; 4,69 ppm (H-11, 2), s; 4,28 ppm (H-10, 2), d, J= 1,7 Гц; 3,82 ppm (H-16, 3), s; 3,61 ppm (H-13a, 1), ddt, J=15,7 Гц, 5,8 Гц и 1,6 Гц; 3,55 ppm (H-13b, 1), ddt, J=15,7 Гц, 5,8 Гц и 1,6 Гц; 3,36 ppm (H-12, 3), s; 2,55 ppm (OH-7, 1), d, J= 5,5 Гц; 13C ЯМР (125,8 МГц): 157,75 ppm (C-3), 139,93 ppm (C-1), 136,99 ppm (C-14), 127,59 ppm (C-5), 125,97 pm (C-2), 119,31 ppm (C-6), 114,89 ppm (C-15), 110,93 ppm (C-4), 94,93 ppm (C-11); 86,25 ppm (C-8), 82,01 ppm (C-9), 61,98 ppm (C-7), 55,88 ppm (C-16); 55,63 ppm (C-12), 54,59 ppm (C-10), 29,53 ppm (C-13).
1c.) Получение 1-(2-аллил-3-метоксифенил)-4-метоксиметоксибут-2-ин-1-она (TREP-2)
1c1. Способ (окисление с помощью PCC)

200 г силикагеля суспендировали в 1,5 л этилацетата и к нему добавляли 470 г (2,18 моль) хлорхромата пиридиния (PCC). К суспензии оранжевого цвета добавляли раствор 150 г (0,54 моль) TREP-1 в 0,5 л этилацетата при перемешивании при 25±5°C. Реакционную смесь перемешивали при 35±5°C. В конце реакции к смеси добавляли диизопропиловый эфир и силикагель. Суспензию фильтровали, твердый материал промывали этилацетатом. Жидкий фильтрат выпаривали в вакууме. Неочищенный продукт очищали посредством хроматографии на силикагеле с использованием элюента гексан:этилацетат.
Выход: 88,1 г (59,2%) светло-коричневого масла.
1c2. Способ (окисление по Сверну)

93 мл оксалилхлорида растворяли в 1,7 л дихлорметана и осуществляли реакцию при
-75/-85°C со 148 мл диметилсульфоксида (DMSO). К смеси добавляли 179 г
TREP-1 при -75/-85°C. Через 1 час перемешивания реакционную смесь гасили 621 мл триэтиламина и раствора NaHSO4. Органическую фазу экстрагировали с помощью дихлорметана, объединенную органическую фазу промывали 1 M раствором NaHCO3. Неочищенный продукт очищали посредством хроматографии на силикагеле.
Выход: 140 г (79%) светло-коричневого масла.
Данные ЯМР: (CDCl3), 1H ЯМР (500 МГц): 7,75 ppm (H-6, 1), dd, J=7,8 Гц и 0,9 Гц; 7,305 ppm (H-5, 1), t, J=8,0 Гц; 7,08 ppm, (H-4, 1), d (dd), J=8,1 Гц и ~1,0 Гц; 5,96 ppm (H-14, 1), ddt, J=17,1 Гц, 10,1 Гц и 6,2 Гц; 5,01-4,92 ppm (H-15, 2), m (в: 4,98 ppm (H-15b, 1), dq, J=17,2 Гц и 1,7 Гц и 4,94 ppm (H-15a, 1), dq, J=10,1 Гц и 1,6 Гц); 4,745 ppm (H-11, 2), s; 4,45 ppm (H-10, 2), s; 3,85 ppm (H-16, 3), s; 3,78 ppm (H-13, 2), dt, J=6,2 Гц и 1,5 Гц; 3,40 ppm (H-12, 3), s; 13C ЯМР (125,8 МГц): 179,21 ppm (C-7), 158,21 ppm (C-3), 136,66 ppm (C-14); 133,60 ppm (C-1); 130,29 ppm (C-2), 126,98 ppm (C-5), 124,98 ppm (C-6), 115,42 ppm (C-4), 114,93 ppm (C-15), 95,38 ppm (C-11), 88,69 ppm (C-9), 85,73 ppm (C-8), 56,16 ppm (C-16), 55,87 ppm (C-12), 54,32 ppm (C-10), 29,78 ppm (C-13).
1d.) Получение (1S)-1-(2-аллил-3-метоксифенил)-4-(метоксиметокси)бут-2-ин-1-ола (TREP-3)
1d1. Способ (селективное восстановление)

В 600 мл не содержащего воду тетрагидрофурана (THF) в атмосфере азота растворяли 85 г TREP-2 (0,31 моль). Раствор охлаждали до 0-5°C и к нему добавляли 370 мл (0,37 моль) раствора оксазаборолидина (1 M раствора в толуоле). Смесь охлаждали до (-30)°C и добавляли к нему по каплям 50 мл (0,52 моль) боран-диметилсульфидного комплекса при (-30)°C. Реакционную смесь перемешивали при данной температуре. В конце реакции обеспечивали нагревание смеси до (-15)°C, аккуратно добавляли 200 мл метанола (сильное пенообразование и выделение тепла). После добавления метанола реакционную смесь перемешивали в течение 30 минут, затем добавляли раствор NH4Cl при 0-5°C и гашенную реакционную смесь экстрагировали с помощью 3×2,5 л этилацетата. Объединенную органическую фазу промывали водой и высушивали над сульфатом натрия. Высушиваемый материал отфильтровывали, фильтрат выпаривали.
Выход: 85,6 г (100%) светло-коричневого масла.
1d2. Способ (селективное алкинилирование)

В реакционный сосуд загружали 216 мг (0,59 ммоль) трифлата цинка и добавляли 82 мг (0,45 ммоль) (+)-N-метилэфедрина, продуваемого газообразным азотом в течение 10 минут, затем 1 мл дист. толуола и 63 мкл (0,45 ммоль) триэтиламина. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа, затем добавляли 250 мкл (0,45 ммоль) раствора TREPO-1 и через 15 минут перемешивания добавляли 24 мкл VPK-5 (2-аллил-3-метоксибензальдегида) (0,14 ммоль). Через 24 часа перемешивания при комнатной температуре реакционную смесь гасили с помощью 1 мл насыщенного раствора NH4Cl. Водную фазу экстрагировали с помощью толуола, объединенную органическую фазу последовательно промывали раствором NaHCO3 и насыщенным раствором NaCl, затем выпаривали.
Выход: 30 мг (78%) светло-коричневого масла.
Данные ЯМР: (CDCl3), 1H ЯМР (500 МГц): 7,32 ppm (H-6, 1), dd, J=7,8 Гц и 0,9 Гц; 7,25 ppm (H-5, 1), m (t), J= 8,0 Гц, 6,875 ppm (H-4, 1), d (dd), J= 7,8 Гц и ~1,0 Гц; 5,98 ppm (H-14, 1), ddt, J= 17,1 Гц, 10,2 Гц и 5,8 Гц; 5,68 ppm (H-7, 1), широкий; 4,99 ppm (H-15a, 1), dq, J=10,1 Гц и 1,6 Гц; 4,93 ppm (H-15b, 1), dq, J=17,1 Гц и 1,8 Гц; 4,70 ppm (H-11, 2), s; 4,285 ppm (H-10, 2), d, J= 1,8 Гц; 3,82 ppm (H-16, 3), s; 3,62 ppm (H-13a, 1), ddt, J=15,7 Гц, 5,8 Гц и 1,6 Гц; 3,545 ppm (H-13b, 1), ddt, J=15,7 Гц, 5,8 Гц и 1,6 Гц; 3,36 ppm (H-12, 3), s; 2,34 ppm (OH-7, 1), широкий; 13C ЯМР (125,8 МГц): 157,79 ppm (C-3), 139,90 ppm (C-1), 137,06 ppm (C-14), 127,67 ppm (C-5), 125,99 pm (C-2), 119,35 ppm (C-6), 114,96 ppm (C-15), 110,98 ppm (C-4), 94,99 ppm (C-11); 86,18 ppm (C-8), 82,13 ppm (C-9), 62,10 ppm (C-7), 55,93 ppm (C-16); 55,70 ppm (C-12), 54,62 ppm (C-10), 29,57 ppm (C-13).
1e.) Получение [(1S)-1-(2-аллил-3-метоксифенил)-4-(метоксиметокси)бут-2-инокси]-трет-бутилдиметилсилана (TREP-4)

В 850 мл толуола растворяли 85 г (0,31 моль) TREP-3 и 26,6 г (0,39 моль) имидазола. Раствор охлаждали до 5-10°C и добавляли 56,8 г (0,38 моль) трет-бутилдиметилсилилхлорида (TBDMSCl). Реакционную смесь перемешивали при комнатной температуре в течение 4 часов, затем добавляли 500 мл воды при перемешивании. Фазы разделяли, водный слой экстрагировали с помощью толуола, объединенную органическую фазу выпаривали в вакууме. Неочищенный продукт хроматографировали на силикагеле с использованием элюента гексан:этилацетат.
Выход: 104,2 г (86,7%) светло-коричневого масла.
Данные ЯМР: (CDCl3), 1H ЯМР (500 МГц): 7,27 ppm (H-6, 1), m (dd), J=7,9 Гц и 1,1 Гц, 7,225 ppm (H-5, 1), t, J=7,9 Гц; 6,83 ppm (H-4, 1), dd, J=7,9 Гц и 1,0 Гц; 5,95 ppm (H-14, 1), dddd, J=17,0 Гц, 10,3 Гц, 6,5 Гц и 5,3 Гц; 5,64 ppm (H-7, 1), t, J=1,5 Гц; 5,00-4,91 ppm (H-15, 2), m ( 4,98 ppm (H-15a, 1), dq, J=10,1 Гц и 1,6 Гц; 4,94 ppm (H-15b, 1), dq, J=17,1 Гц и 1,8 Гц); 4,67 ppm (H-11, 2), s; 4,22 ppm (H-10, 2), m ; 3,82 ppm (H-16, 3); s; 3,62 ppm (H-13a, 1), ddt, J=15,7 Гц, 5,1 Гц и 1,9 Гц; 3,49 ppm (H-13b, 1), ddt, J=15,7 Гц, 6,5 Гц и 1,5 Гц; 3,34 ppm (H-12, 3), s; 0,91 ppm (H-20, H-21 и H-22, 9), s; 0,13 ppm, (H-17/H-18, 3), s; 0,085 (H-18/H-17, 3), s; 13C ЯМР (125,8 МГц): 157,50 ppm (C-3), 141,44 ppm (C-1), 136,55 (C-14), 127,32 (C-5), 124,78 ppm (C-2), 118,73 ppm (C-6), 114,71 ppm (C-15), 110,10 ppm (C-4), 94,80 ppm (C-11), 87,16 (C-8), 80,71 ppm (C-9), 62,27 ppm (C-7), 55,82 ppm (C-16), 55,63 (C-12), 54,60 ppm (C-10), 29,59 ppm (C-13), 25,93 ppm (C-20, C-21 и C-22), 18,40 ppm (C-19), -4,45 ppm (C-17/C-18), -4,74 ppm (C-18/C-17).
1f.) Получение (3aS,9R)-9-[трет-бутил(диметил)силил]окси-5-метокси-1-(метоксиметоксиметил)-3,3a,4,9-тетрагидроциклопента[b]нафталин-2-она (TREP-5)

1f1. Способ (с 100 мол. % октакарбонила дикобальта)
93 г (0,24 моль) TREP-4 растворяли в атмосфере азота в 930 мл этилацетата и к раствору добавляли 85,5 г (0,25 моль) октакарбонила дикобальта. Реакционную смесь перемешивали при комнатной температуре в течение 2,5 часов и затем нагревали до 60-70°C. Выделяющийся газообразный монооксид углерода выводили из закрытой системы. В конце реакции смесь охлаждали до комнатной температуры и барботировали воздух в течение 12 часов. Реакционную смесь фильтровали, осадок промывали этилацетатом. Объединенный отфильтрованный раствор выпаривали в вакууме. Неочищенный продукт хроматографировали на силикагеле с использованием элюента гексан:этилацетат.
Выход: 64,6 г (64,8%) светло-коричневого масла.
1f2. Способ (с 10 мол. % октакарбонила дикобальта+газообразный монооксид углерода)
93 г (0,24 моль) TREP-4 растворяли в 930 мл этилацетата в атмосфере азота и к нему добавляли 8,55 г (0,025 моль) октакарбонила дикобальта. Сосуд продували монооксидом углерода, реакционную смесь перемешивали при комнатной температуре в течение 2,5 часов и затем нагревали до 60-70°C. В конце реакции смесь охлаждали до комнатной температуры, фильтровали, осадок промывали этилацетатом. Объединенный отфильтрованный раствор выпаривали в вакууме. Неочищенный продукт хроматографировали на силикагеле с использованием элюента гексан:этилацетат.
Выход: 85 г (85%) светло-коричневого масла.
Данные ЯМР: (CDCl3), 1H ЯМР (500 МГц): 7,24 ppm (H-22, 1), m (t), J=8,0-7,4 Гц, 6,92 ppm (H-23, 1), d, J=7,3 Гц; 6,79 ppm (H-21, 1), d, J=7,8 Гц; 5,775 ppm (H-7, 1), s; 4,68-.453 ppm (H-15, 2), m, (в: 4,62 ppm (H-15a, 1), d, J=5,6 Гц и 4,59 ppm (H-15b, 1), d, J=5,6 Гц); 4,30 ppm (H-13, 2), m ; 3,815 ppm (H-2, 3), s; 3,55 ppm (H-4a, 1), dd, J=16,9 Гц и 7,3 Гц; 3,45 ppm (H-9, 1), m (ddd), J~7,8-7,0 Гц; 3,33 ppm (H-17, 3), s; 2,75 ppm (H-10a, 1), dd, J=18,7 Гц и 5,8 Гц; 2,33-2,15 ppm (H-10b и H-4b, 2), m, (в: 2,27 ppm (H-10b, 1), d, J~19,5 Гц и 2,22 ppm (H-4b, 1), dd, J=16,8 Гц и 10,2 Гц); 0,82 ppm (H-27, H-28 и H-29, 9), s; 0,15 ppm (H-24/H-25, 3), s; 0,10 ppm (H-24/H-25, 3), s; 13C ЯМР (125,8 МГц): 208,44 ppm (C-11), 176,76 ppm (C-8), 156,93 ppm (C-3), 138,31 ppm (C-6), 132,99 ppm (C-12), 127,61 ppm (C-22), 124,88 ppm (C-5), 122,07 ppm (C-23), 109,41 ppm (C-21), 96,42 ppm (C-15), 65,25 ppm (C-7), 59,07 ppm (C-13), 55,55 ppm (C-17), 55,47 ppm (C-2), 42,32 ppm (C-10), 33,49 ppm (C-4), 32,61 ppm (C-9), 25,75 ppm (C-27, C-28 и C-29), 18,20 ppm (C-26), -4,19 ppm (C-24/C-25), -4,32 ppm (C-25/C-24).
1g.) Получение (1S,9aS)-5-метокси-1-(метоксиметоксиметил)-1,3,3a,4,9,9a-гексагидроциклопента[b]нафталин-2-она (TREP-6)

63 г (0,15 моль) TREP-5 растворяли в 630 мл этилацетата и в раствор добавляли 19 мл пиридина. Реакционную смесь гидрогенизировали над 25 г 10% катализатора палладий на угле под давлением 6 бар. В конце реакции катализатор отфильтровывали и промывали этилацетатом. Фильтрат выпаривали в вакууме. Неочищенный продукт хроматографировали на силикагеле с использованием смеси гексан:этилацетат в качестве элюента. Выпаренную основную фракцию кристаллизовали при 0°C из смеси гексан-этилацетат и собирали путем фильтрации. Выпаренную остаточную жидкость с целью изомеризации растворяли в смеси 100 мл толуола и 60 мл этанола. 12 мл DBN регента (2,3,4,6,7,8-гексагидропирроло[1,2-a]пиримидина) добавляли к ней при 0°C и смесь перемешивали в течение 15 минут. Реакционную смесь затем гасили с помощью раствора NaHSO4, экстрагировали с помощью трет-бутилметилового эфира и выпаривали. Остаток хроматографировали на силикагеле с использованием смеси гексан:этилацетат в качестве элюента. Выпаренную основную фракцию кристаллизовали при 0°C из смеси гексан-этилацетат. Кристаллы собирали путем фильтрации и объединяли с полученными ранее кристаллами.
Выход: 30,2 г (69,1%) белых кристаллов. Mp: 65-67°C.
Данные ЯМР: (CDCl3), 1H ЯМР (500 МГц): 7,13 ppm (H-22, 1), m (t), J=7,9 Гц, 6,78 ppm (H-23, 1), d, J=7,6 Гц; 6,71 ppm (H-21, 1), d, J=8,2 Гц; 4,62-4,56 ppm (H-15, 2), m, (в: 4,60 ppm (H-15a, 1), d, J=6,5 Гц и 4,58 ppm (H-15b, 1), d, J=6,5 Гц); 3,86 ppm (H-13a, 1), dd, J= 9,8 Гц и 4,2 Гц; 3,81 ppm (H-2, 3), s; 3,67 ppm (H-13b, 1), m (dd), J=9,8 Гц и 3,6 Гц, 3,35 ppm (H-17, 3), s; 3,09 ppm (H-7a, 1), dd, J=16,6 Гц и 6,5 Гц; 3,03 ppm (H-4a, 1), dd, J=17,3 Гц и 7,1 Гц, 2,82 ppm (H-7b, 1), m (dd), J=16,6 Гц и 3,6 Гц, 2,715 ppm (H-8, 1), m (dtd), J=10,3 Гц, 6,8 Гц и 3,7 Гц, 2,605 ppm (H-9, 1), m (dqd), J~8,7 Гц, ~7,3 Гц и 3,1 Гц; 2,47 ppm (H-10a, 1), m (dd), J=18,1 Гц и 7,6 Гц, 2,29-2,205 ppm (H-4b и H-10b, 2), m ; 2,07 ppm (H-12, 1), m (ddd), J=10,5 Гц и ~3,6 Гц; 13C ЯМР (125,8 МГц): 218,28 ppm (C-11), 156,96 ppm (C-3), 136,27 ppm (C-6), 126,58 ppm (C-22), 124,50 ppm (C-5), 121,34 ppm (C-23), 107,60 ppm (C-21), 96,65 ppm (C-15), 64,64 ppm (C-13), 55,40 ppm (C-2), 55,31 ppm (C-17), 51,68 ppm (C-12), 46,46 ppm (C-10), 35,99 ppm (C-8), 31,06 ppm (C-7), 30,61 ppm (C-9), 25,59 ppm (C-4).
1h.) Получение (1S,2R,9aS)-5-метокси-1-(метоксиметоксиметил)-2,3,3a,4,9,9a-гексагидро-1H-циклопента[b]нафталин-2-ола (TREP-7)

22 г (75,8 ммоль) TREP-6 растворяли в 100 мл толуола, к нему добавляли 100 мл этанола и раствор охлаждали до (-)15-(-)25°C. К раствору добавляли 3 г (79,3 ммоль) борогидрида натрия (NaBH4) и реакционную смесь перемешивали, поддерживая при этом приведенную выше температуру. В конце реакции pH регулировали до pH=4-6 с помощью раствора NaHSO4. Перемешивание продолжали в течение 30 минут, затем фазы разделяли. Водную фазу экстрагировали с помощью толуола. Объединенную органическую фазу последовательно промывали раствором NaHCO3 и водой, затем высушивали над сульфатом натрия. Высушиваемый материал отфильтровывали, отфильтрованный раствор выпаривали в вакууме.
Выход: 22,15 г (100%) бесцветного масла.
Данные ЯМР: (CDCl3), 1H ЯМР (500 МГц): 7,10 ppm (H-22, 1), t, J=7,8 Гц; 6,79-6,73 ppm (H-21 и H-22, 2), m (в: 6,765 ppm (H-23, 1), d, J=7,3 Гц и 6,76 ppm (H-21, 1), d, J=8,2 Гц); 4,64 ppm (H-15, 2), s; 3,91 ppm (H-11, 1), td, J=9,8 Гц и 6,4 Гц; 3,83-3,74 ppm (H-2 и H-13a, 4), m (в: 3,81 ppm (H-2, 3), s и 3,80 ppm (H-13a, 1), dd, J=9,2 Гц и 4,7 Гц); 3,59 ppm (H-13b, 1), t (dd), J=9,0 Гц; 3,38 ppm (H-17, 3), s; 2,79-2,69 ppm (H-4a и H-7a, 2), m (в: 2,76 ppm (H-4a, 1), dd, J=14,7 Гц и 6,2 Гц и 2,72 ppm (H-7a, 1), dd, J=14,2 Гц и 6,2 Гц); 2,61-2,53 ppm (H-4b и OH-11, 2), m (в: 2,58 ppm (OH-11, 1), широкий и 2,56 ppm (H-4b, 1), dd, J=14,7 Гц и 6,2 Гц); 2,45 ppm (H-7b, 1), dd, J=14,3 Гц и 6,2 Гц; 2,31 ppm (H-9, 1), m (tdt), J=10,6 Гц, 7,4 Гц и 6,3 Гц; 2,20 ppm (H-10a, 1), ddd, J=12,0 Гц, 7,3 Гц и 6,4 Гц; 1,96 ppm (H-8, 1), tt, J=10,4 Гц и 6,1 Гц; 1,60 ppm (H-12, 1), qd/dddd, J=9,2 Гц и 4,8 Гц; 1,20 ppm (H-10b, 1), dt, J=11,9 Гц и 10,5 Гц; 13C ЯМР (125,8 МГц): 156,72 ppm (C-3), 140,18 ppm (C-6), 126,89 (C-5), 126,34 ppm (C-22), 120,60 ppm (C-23), 108,64 ppm (21), 96,73 ppm (C-15), 76,30 ppm (C-11), 70,75 ppm (C-13), 55,69 ppm (C-2), 55,43 ppm (C-17), 51,91 ppm (C-12), 40,45 ppm (C-10), 37,82 ppm (C-8), 33,37 ppm (C-7), 33,20 ppm (C-9), 25,62 ppm (C-4).
1i.) Получение [(1S,2R,9aS)-5-метокси-1-(метоксиметоксиметил)-2,3,3a,4,9,9a-гексагидро-1H-циклопента[b]нафталин-2-ил] 4-фенилбензоата (TREP-8)

22 г (75 ммоль) TREP-7 растворяли в 50 мл пиридина в атмосфере азота и к нему добавляли 17,9 г (82 ммоль) п-фенилбензоилхлорида (PPB-Cl) при температуре максимум 50oC. Реакционную смесь перемешивали при 50-60°C. В конце реакции добавляли этанол и воду и смесь охлаждали до 0/5oC. Через 3 часа перемешивания кристаллы отфильтровывали и промывали смесью этанол-вода.
Выход: 34,1 г (96%) белых кристаллов. Mp: 106-107°C.
Данные ЯМР: (CDCl3), 1H ЯМР (500 МГц): 8,06 ppm (H-26 и H-26', 2), m (d), J=8,5 Гц; 7,65-7,59 ppm (H-27, H-27', H-30 и H-30', 4), m, (в: 7,63 ppm (H-27 и H-27', 2), m (d), J=8,5 Гц и 7,61 ppm (H-30 и H-30', 2), m (d), J~7,5 Гц); 7,47 ppm (H-31 и H-31', 2), m (t), J~7,5 Гц; 7,39 ppm (H-32, 1), m (t/tt), J=7,4 Гц; 7,15 ppm (H-22, 1), t, J=7,8 Гц; 6,83 ppm (H-23, 1), d, J=7,5 Гц; 6,79 ppm (H-21, 1), d, J=8,1 Гц; 5,23 ppm (H-11, 1), td, J=8,7 Гц и 6,2 Гц; 4,64 ppm (H-15, 2), m (s); 3,83 ppm (H-2, 3), s; 3,72-3,63 ppm (H-13, 2), m (в: 3,69 ppm (H-13a, 1), dd, J=9,9 Гц и 4,8 Гц и 3,66 ppm (H-13b, 1), dd, J=9,9 Гц и 5,3 Гц); 3,35 ppm (H-17, 3), s; 2,87 ppm (H-4a и H-7a, 2), m (dd), J=14,7 Гц и 6,1 Гц; 2,68-2,58 ppm (H-4b и H-7b, 2), m (в: 2,65 ppm (H-7b, 1), dd, J=15,1 Гц и 6,3 Гц и 2,62 ppm (H-4b, 1), dd, J=15,5 Гц и 6,2 Гц); 2,53-2,40 ppm (H-9 и H-10a, 2), m (в: 2,475 ppm (H-10a, 1), m и 2,465 ppm (H-9, 1), m ); 2,305 ppm (H-8, 1), m (tt), J=9,4 Гц и 6,3 Гц; 2,01 ppm (H-12, 1), m (tt), J=8,9 Гц и 4,9 Гц; 1,41 ppm (H-10b, 1), m ; 13C ЯМР (125,8 МГц): 166,40 ppm (C-24), 156,74 ppm (C-3), 145,65 ppm (C-28), 140,18 ppm (C-29), 140,03 ppm (C-6), 130,20 ppm (C-26 и C-26', 2), 129,35 ppm (C-25), 129,03 ppm (C-31 и C-31', 2), 128,22 ppm (C-32), 127,39 ppm (C-30 и C-30', 2), 127,10 ppm (C-27 и C-27', 2), 126,69 (C-5), 126,38 ppm (C-22), 120,71 ppm (C-23), 108,46 ppm (21), 96,72 ppm (C-15), 76,16 ppm (C-11), 67,41 ppm (C-13), 55,65 ppm (C-2), 55,32 ppm (C-17), 50,16 ppm (C-12), 37,93 ppm (C-10), 37,55 ppm (C-8), 33,70 ppm (C-9), 33,28 ppm (C-7), 25,72 ppm (C-4).
1j.) Получение [(1S,2R,9aS)-1-(гидроксиметил)-5-метокси-2,3,3a,4,9,9a-гексагидро-1H-циклопента[b]нафталин-2-ил] 4-фенилбензоата (TREP-9)

28 г (59,2 ммоль) TREP-8 растворяли в 140 мл тетрагидрофурана и к раствору добавляли 280 мл метанола.
В способе 1i1. К смеси добавляли 140 мл 5 M хлористоводородной кислоты и перемешивали при 45-50oC.
В способе 1i2. К смеси добавляли 14 г моногидрата п-толуолсульфоновой кислоты и перемешивали при 45-50oC.
В конце реакции смесь нейтрализовали с помощью раствора NaHCO3, органические растворители отгоняли. Остаток экстрагировали с помощью этилацетата, объединенную органическую фазу промывали водой, высушивали над сульфатом натрия. Неочищенный продукт хроматографировали на силикагеле с использованием смеси гексан:этилацетат в качестве элюента.
Выход: 23,4 г (92%) бесцветного масла.
Данные ЯМР: (CDCl3), 1H ЯМР (500 МГц): 8,05 ppm (H-26 и H-26', 2), m (d), J=8,5 Гц; 7,65-7,58 ppm (H-27, H-27', H-30 и H-30', 4), m, (в: 7,63 ppm (H-27 и H-27', 2), m (d), J=8,5 Гц и 7,60 ppm (H-30 и H-30', 2), m (d), J~7,4 Гц); 7,46 ppm (H-31 и H-31', 2), m (t), J~7,5 Гц; 7,39 ppm (H-32, 1), m (t/tt), J=7,3 Гц; 7,14 ppm (H-22, 1), t, J=7,8 Гц; 6,82-6,76 ppm (H-21 и H-23, 2), m (в: 6,792 ppm (H-23, 1), d, J~7,3 Гц и 6,788 ppm (H-21, 1), d, J~8,4 Гц); 5,21 ppm (H-11, 1), td, J=9,3 Гц и 6,5 Гц; 3,84 ppm (H-2, 3), s; 3,71 ppm (H-13, 2), m ; 2,86-2,76 ppm (H-4a и H-7a, 2), m (в: 2,82 ppm (H-7a, 1), dd, J=14,6 Гц и 6,3 Гц и 2,80 ppm (H-4a, 1), dd, J=15,0 Гц и 6,2 Гц); 2,73-2,64 ppm (H-4b и OH-13, 2), m (в: 2,70 ppm (H-4b, 1), dd, J=15,1 Гц и 5,8 Гц и 2,67 ppm (OH-13, 1), широкий); 2,56 ppm (H-7b, 1), dd, J=14,6 Гц и 5,6 Гц; 2,45 ppm (H-9, 1), m ; 2,40-2,31 ppm (H-8 и H-10a, 2), m (в: 2,365 ppm (H-10a, 1), m, J~11,9 и 7,0 и 2,35 ppm (H-8, 1), m, J=10,4 Гц и 7,1 Гц); 1,71 ppm (H-12, 1), m tt, J=9,2 Гц и 4,1 Гц; 1,53 ppm (H-10b, 1), dt, J=12,1 Гц и 9,5 Гц; 13C ЯМР (125,8 МГц): 167,40 ppm (C-24), 156,86 ppm (C-3), 146,01 ppm (C-28), 140,08 ppm (C-29), 139,79 ppm (C-6), 130,34 ppm (C-26 и C-26', 2), 129,06 ppm (C-31 и C-31', 2), 128,83 ppm (C-25), 128,32 ppm (C-32), 127,41 ppm (C-30 и C-30', 2), 127,16 ppm (C-27 и C-27', 2), 126,51 (C-5), 126,42 ppm (C-22), 120,88 ppm (C-23), 108,52 ppm (C-21), 75,40 ppm (C-11), 61,16 ppm (C-13), 55,69 ppm (C-2), 52,83 ppm (C-12), 37,56 ppm (C-10), 36,32 ppm (C-8), 33,01 ppm (C-9), 32,71 ppm (C-7), 25,48 ppm (C-4).
1k.) Получение [(1R,2R,3aS,9aS)-5-метокси-1-[(E)-3-оксоокт-1-енил]-2,3,3a,4,9,9a-гексагидро-1H-циклопента[b]нафталин-2-ил] 4-фенилбензоата (TREP-11)
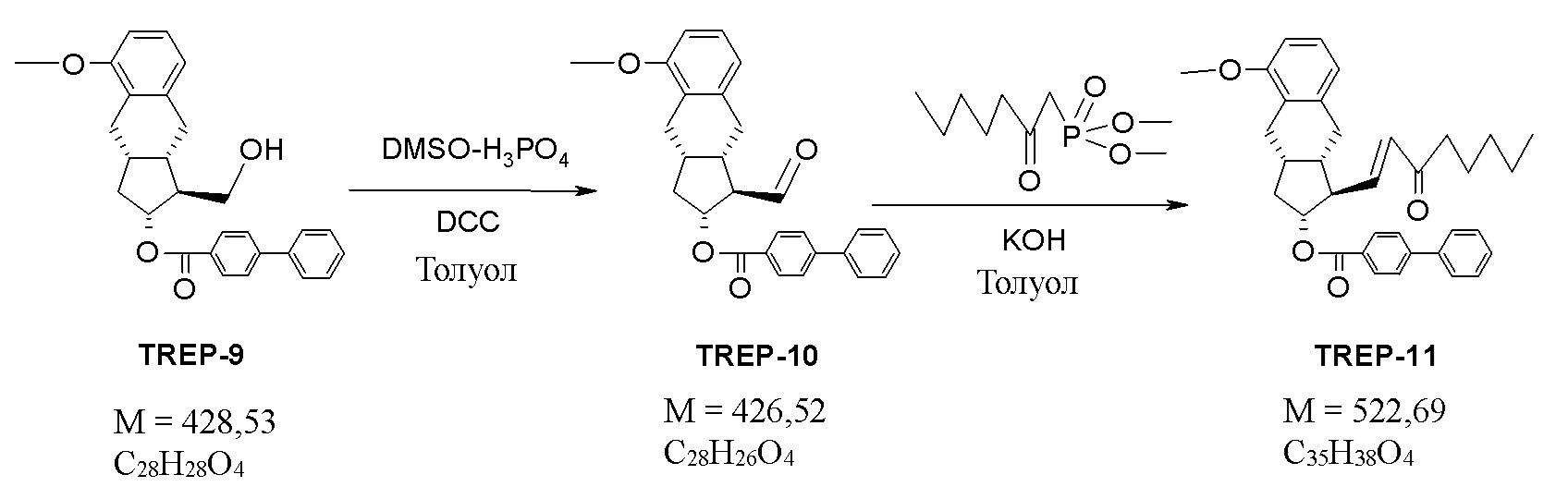
20 г (46,7 ммоль) TREP-9 растворяли в инертной атмосфере в 200 мл не содержащего воду толуола. 30 г дициклогексилкарбодиимида (DCC) и добавляли 10 мл диметилсульфоксида в фосфорной кислоте. Реакционную смесь нагревали до 50°C и частями добавляли следующие 5 мл диметилсульфоксида в фосфорной кислоте. После завершения окисления реакционную смесь охлаждали до -10°C и при данной температуре добавляли 4 г (71 ммоль) гидроксида калия, а затем добавляли 10,9 г (49 ммоль) сложного диметилового эфира 2-оксогептилфосфорной кислоты в растворе толуола. В конце реакции при перемешивании смесь выливали в раствор кислоты. Осажденные кристаллы отфильтровывали и промывали. Фазы фильтрата разделяли, органическую фазу промывали 1 M раствором гидрокарбоната натрия, а затем разбавленным раствором хлористоводородной кислоты. Органическую фазу выпаривали и очищали посредством хроматографии на колонке с силикагелем с использованием элюента толуол:гексан.
Выход: 23 г (94,3%) светло-коричневого масла.
Альтернативный способ 1k/2
20 г (46,7 ммоль) TREP-9 растворяли в 200 мл толуола и к раствору добавляли 0,9 г бромида калия и 0,2 г TEMPO/(2,2,6,6-тетраметилпиперидин-1-ил)оксила/катализатора. Реакционную смесь охлаждали до температуры в диапазоне 0°C - (+10°C) и добавляли 150 мл раствора гипохлорита натрия (содержание активного хлора составляло 6-14%) и смесь перемешивали при данной температуре. После завершения окисления фазы реакционной смеси разделяли, органическую фазу промывали водным раствором Na2S2O3, водным раствором KBr и в конце водой.
В органическую фазу добавляли 10,9 г (49 ммоль) сложного диметилового эфира 2-оксогептилфосфорной кислоты и 100 мл 3 M раствора гидроксида калия. Реакционную смесь перемешивали при комнатной температуре. После завершения реакции фазы разделяли и органическую фазу промывали 1 M раствором гидросульфата натрия и 15% раствором NaCl.
Органическую фазу выпаривали и очищали посредством хроматографии на колонке с силикагелем с использованием элюента толуол:гексан.
Выход: 23 г (94,35%) светло-коричневого масла.
Данные ЯМР: (CDCl3), 1H ЯМР (500 МГц): 8,00 ppm (H-26 и H-26', 2), m (d), J=8,3 Гц; 7,64-7,56 ppm (H-27, H-27', H-30 и H-30', 4), m, (в: 7,61 ppm (H-27 и H-27', 2), m (d), J=8,4 Гц и 7,59 ppm (H-30 и H-30', 2), m (d), J~7,7 Гц); 7,45 ppm (H-31 и H-31', 2), m (t), J~7,5 Гц; 7,38 ppm (H-32, 1), m (t/tt), J=7,3 Гц; 7,165 ppm (H-22, 1), t, J=7,9 Гц; 6,83-6,76 ppm (H-13, H-21 и H-23, 3), m (в: 6,80 ppm (H-21 и H-23, 2), d, J=7,9 Гц и 6,80 ppm (H-13, 1), dd, J=15,8 Гц и 8,3 Гц); 6,12 ppm (H-14, 1), d, J=15,8 Гц; 5,18 ppm (H-11, 1), td, J=9,6 Гц и 6,2 Гц; 3,83 ppm (H-2, 3), m (s); 2,79-2,70 ppm (H-4 и H-7a, 3), m (в: 2,75 ppm (H-7a, 1), dd, J=14,7 Гц и 5,9 Гц и 2,73 ppm (H-4, 2), d, J=5,5 Гц); 2,62-2,48 ppm (H-7b, H-9, H-10a и H-16, 5), m (в: 2,565 ppm (H-9, 1), m ; 2,55 ppm (H-16, 1), t, J=7,4 Гц; 2,53 ppm (H-10a, 1), m ; 2,515 ppm (H-7b, 1), m ); 2,40-2,27 ppm (H-8 и H-12, 2), m (в: 2,36 ppm (H-12, 1), m и 2,31 ppm (H-8, 1), m ); 1,67-1,53 ppm (H-17, 2), m (tt), J=7,4 Гц, 1,38-1,22 ppm (H-10b, H-18 и H-19, 5), m (в: 1,34 ppm (H-10b, 1), m (dt), J~11,8 Гц и 9,6 Гц; 1,29 ppm (H-19, 2) m и 1,28 ppm (H-18, 2) m ); 0,87 ppm (H-20, 3), m (t), J=6,9 Гц; 13C ЯМР (125,8 МГц): 200,85ppm (C-15), 166,23 ppm (C-24), 156,99 ppm (C-3), 146,53 ppm (C-13), 145,89 ppm (C-28), 140,14 ppm (C-29), 139,28 ppm (C-6), 131,85 ppm (C-14), 130,22 ppm (C-26 и C-26', 2), 129,05 ppm (C-31 и C-31', 2), 128,93 ppm (C-25), 128,28 ppm (C-32), 127,41 ppm (C-30 и C-31', 2), 127,14 ppm (C-27 и C-27', 2), 126,70 (C-22), 126,23 ppm (C-5), 120,93 ppm (C-23), 108,76 ppm (C-21), 77,31 ppm (C-11), 55,69 ppm (C-2), 53,49 ppm (C-12), 40,24 ppm (C-8), 40,16 ppm (C-16), 37,89 ppm (C-10), 33,16 ppm (C-9), 31,88 ppm (C-7), 31,58 ppm (C-18), 25,32 ppm (C-4), 24,08 ppm (C-17), 22,60 ppm (C-19), 14,05 ppm (C-20).
Получение сложного диметилового эфира 2-оксогептилфосфоновой кислоты

Получение диизопропиламида лития (LDA)
В атмосфере азота при перемешивании 3,017 г диизопропиламина растворяли в 13,6 мл тетрагидрофурана (THF) и к нему добавляли при 0±5°C раствор 17,9 мл бутиллития в гексане (BuLi) (1,6 M раствор в гексане). Смесь перемешивали в течение 1 часа при комнатной температуре.
Образование фосфоната
В атмосфере азота 1,85 г диметилметилфосфоната и 1,77 мл метилгексаноата растворяли в 10,2 мл тетрагидрофурана (THF) при перемешивании. Раствор охлаждали до 0/-5°C и при данной температуре за период примерно 30 минут по каплям добавляли раствор диизопропиламида лития (LDA). Реакционную смесь перемешивали при 0/-5°C в течение 1 часа, а затем добавляли 37 мл 2 M раствора NaHCO3. Перемешивание продолжали при комнатной температуре в течение 1 часа, фазы разделяли, водную фазу экстрагировали с помощью трет-бутилметилового эфира (TBME). Объединенную органическую фазу промывали насыщенным раствором хлорида натрия, выпаривали в вакууме и высушивали посредством отгонки толуола из него в Rotadest на водяной бане при 45±5°C.
Выход: 2,718 г (90%) желтого масла.
Данные ЯМР: (DMSO), 1H ЯМР (500 МГц): 3,65 ppm (H-9 и H-10, 6), d, J=11,2 Гц; 3,26 ppm (H-1, 2), m (d), J=22,1 Гц, 2,555 ppm (H-3, 2), t, J=7,2 Гц; 1,45 ppm (H-4, 2), qui (tt), J=7,3 Гц; 1,32-1,15 ppm (H-5 и H-6, 4), m, (в: 1,26 ppm (H-6, 2), m и 1,20 ppm (H-5, 2), m ); 0,85 ppm (H-7, 3), t, J=7,2 Гц; 13C ЯМР (125,8 МГц): 202,23 ppm (C-2), d, J=5,9 Гц; 52,47 ppm (C-9 и C-10, 2), d, J=6,3 Гц; 43,04 ppm (C-3), d, J=1,4 Гц; 40,21 ppm (C-1), d, J=125,5 Гц, 30,50 ppm (C-5); 22,40 ppm (C-4); 21,82 ppm (C-6), 13,72 ppm (C-7); 31P ЯМР (202,46 МГц): 23,52 ppm (P-8), m.
1l.) Получение [(1R,2R,3aS,9aS)-1-[(E,3S)-3-гидроксиокт-1-енил]-5-метокси-2,3,3a,4,9,9a-гексагидро-1H-циклопента[b]нафт-2-ил] 4-фенилбензоата (TREP-12)

19 г (36,3 ммоль) TREP-11 растворяли в атмосфере азота в 190 мл не содержащего воду тетрагидрофурана. Раствор охлаждали до 0-5°C и добавляли 36,3 мл (36,3 ммоль) раствора оксазаборолидина (1 M раствор в толуоле). Смесь охлаждали до
(-30)°C и, поддерживая при этом данную температуру, по каплям добавляли 9,5 мл (99 ммоль) боран-диметилсульфидного комплекса. Реакционную смесь перемешивали при данной температуре. В конце реакции обеспечивали нагревание смеси до (-15)°C и к ней аккуратно добавляли метанол (сильное пенообразование и выделение тепла). Смесь перемешивали в течение 30 минут, а затем к ней добавляли раствор NaHSO4 при 0-5°C. Осажденные кристаллы отфильтровывали и промывали толуолом. Жидкий фильтрат экстрагировали с помощью 3×50 мл толуола. Объединенную органическую фазу промывали водой и высушивали над сульфатом натрия. Высушиваемый материал отфильтровывали и фильтрат выпаривали.
Выход: 18,2 г (95,4%) светло-коричневого масла.
Данные ЯМР: (CDCl3), 1H ЯМР (500 МГц): 8,02 ppm (H-26 и H-26', 2), m (d), J=8,4 Гц; 7,63-7,56 ppm (H-27, H-27', H-30 и H-30', 4), m, (в: 7,60 ppm (H-27 и H-27', 2), m (d), J=8,3 Гц и 7,59 ppm (H-30 и H-30', 2), m (d), J~7,1 Гц); 7,45 ppm (H-31 и H-31', 2), m (t), J~7,4 Гц; 7,38 ppm (H-32, 1), m (t/tt), J=7,3 Гц; 7,15 ppm (H-22, 1), m (t), J=7,8 Гц; 6,83-6,76 ppm (H-21 и H-23, 2), m (в: 6,79 ppm (H-21 и H-23, 2), m ); 5,635 ppm (H-13, 1), dd, J=15,4 Гц и 7,6 Гц; 5,54 ppm (H-14, 1), m (dd), J=15,4 Гц и 6,4 Гц, 5,09 ppm (H-11, 1), td, J=9,5 Гц и 6,1 Гц, 4,085 ppm (H-15, 1), m (q), J=6,4 Гц, 3,82 ppm (H-2, 3), m (s), 2,79-2,70 ppm (H-4a и H-7a, 2), m (в: 2,74 ppm (H-4a и H-7a, 2), m (dd), J~13,8 Гц и ~5,5 Гц); 2,665 ppm (H-4b, 1), m (dd), J=14,9 Гц и 5,2 Гц, 2,57-2,41 ppm (H-7b, H-9 и H-10a, 3), m (в: 2,51 ppm (H-7, 1), m (dd), J=14,6 Гц и 4,6 Гц; 2,48 ppm (H-9, 1), m ; 2,47 ppm (H-10a, 1), m ); 2,25-2,11 ppm (H-8 и H-12, 2), m, (в: 2,20 ppm (H-12, 1), m и 2,18 ppm (H-8, 1), m ); 1,68 ppm (OH-15, 1), широкий; 1,60-1,39 ppm (H-16, 2), m, (в: 1,51 ppm (H-16a, 1), m и 1,45 ppm (H-16b, 1), m ); 1,38-1,18 ppm (H-10b, H-17, H-18 и H-19, 7), m, (в: 1,31 ppm (H-10b и H-17a, 2), m ; 1,25 ppm (H-17b, H-18 и H-19, 5) m ); 0,85 ppm (H-20, 3), m (t), J=6,8 Гц 13C ЯМР (125,8 МГц): 166,50 ppm (C-24), 156,90 ppm (C-3), 145,71 ppm (C-28), 140,18 ppm (C-29), 139,89 ppm (C-6), 135,69 ppm (C-13), 131,52 ppm (C-14), 130,18 ppm (C-26 и C-26', 2), 129,26 ppm (C-25), 129,03 ppm (C-31 и C-31', 2), 128,22 ppm (C-32), 127,38 ppm (C-30 и C-30', 2), 127,10 ppm (C-27 и C-27', 2), 126,55 ppm (C-5), 126,49 (C-22), 120,87 ppm (C-23), 108,58 ppm (C-21), 77,84 ppm (C-11), 72,76 ppm (C-15), 55,68 ppm (C-2), 53,53 ppm (C-12), 40,14 ppm (C-8), 37,66 ppm (C-10), 37,26 ppm (C-16), 33,00 ppm (C-9), 32,02 ppm (C-7), 31,86 ppm (C-18), 25,53 ppm (C-4), 25,12 ppm (C-17), 22,71 ppm (C-19), 14,14 ppm (C-20).
1m.) Получение (1R,3aS,9aS)-1-[(E)-3-гидроксиокт-1-енил]-5-метокси-2,3,3a,4,9,9a-гексагидро-1H-циклопента[b]нафталин-2-ола (TREP-13)

17 г (32,4 ммоль) TREP-12 растворяли в 70 мл метанола, добавляли 4,2 г (30,3 ммоль) K2CO3 и смесь перемешивали при 40°C до конца реакции. После достижения необходимого преобразования реакционную смесь охлаждали до 0°C и к ней частями добавляли раствор фосфорной кислоты. Осажденный сложный п-фенилбензоилметиловый эфир (сложный PPB-метиловый эфир) отфильтровывали и промывали. Фильтрат концентрировали, к нему добавляли воду и толуол и фазы разделяли. Водную фазу экстрагировали с помощью толуола, органическую фазу высушивали над Na2SO4, высушиваемый материал отфильтровывали, фильтрат выпаривали и очищали посредством хроматографии на колонке с силикагелем (с использованием смеси гексан:трет-бутилметиловый эфир в качестве элюента). Основную фракцию кристаллизовали из смеси гексана и трет-бутилметилового эфира. Осажденные кристаллы отфильтровывали, промывали и высушивали.
Выход: 8 г (72%) белых кристаллов. Mp: 75-77°C.
Данные ЯМР: (CDCl3), 1H ЯМР (500 МГц): 7,10 ppm (H-22, 1), t, J=7,8 Гц; 6,78-6,70 ppm (H-21 и H-23, 2), m (в: 6,75 ppm (H-21, 1), m (d), J=8,3 Гц и 6,73 ppm (H-23, 1), m (d), J=7,4 Гц); 5,52-5,42 ppm (H-13 и H-14, 2), m (в: 5,47 ppm (H-13 и H-14, 2), m ); 4,04 ppm (H-15, 1), m, J=6,5 Гц и 3,2 Гц; 3,80 ppm (H-2, 3), s; 3,70 ppm (H-11, 1), td, J=10,1 Гц и 6,1 Гц; 2,70-2,46 ppm (H-4a, H-7a, H-7b, OH-11 и OH-15, 5), m (в: 2,66 ppm (H-4a, 1), m (dd), J=14,9 Гц и 6,2 Гц; 2,63 ppm (H-7a, 1), m (dd), J~14,9 Гц и ~6,1 Гц; 2,59 ppm (H-4b, 1), m (dd), J=14,7 Гц и 5,6 Гц; 2,57 ppm (OH-11 и OH-15, 2), m (широкий)); 2,40-2,27 ppm (H-7b и H-9, 2), m (в: 2,37 ppm (H-7b, 1), m (dd), J=14,3 Гц и 5,4 Гц; 2,32 ppm (H-9, 1), m ); 2,23-2,13 ppm (H-10a, 1), m, (в: 2,19 ppm (H-10a, 1), m (ddd), J=12,1 Гц, 7,4 Гц и 6,4 Гц); 2,02 ppm (H-8, 1), m (tt), J=10,9 Гц и 5,5 Гц; 1,71 ppm (H-12, 1), m ; 1,57 ppm (H-16a, 1), m ; 1,48 ppm (H-16b, 1), m ; 1,43-1,23 ppm (H-17, H-18 и H-19, 6), m, (в: 1,37 ppm (H-17a, 1), m ; 1,33 ppm (H-19, 2), m ; 1,325 ppm (H-17b, 1), m ; 1,32 ppm (H-18, 2), m ); 1,08 ppm (H-10b, 1) m (dt/q), J=11,7 Гц и 10,5 Гц; 0,91 ppm (H-20, 3), m (t), J=6,9 Гц; 13C ЯМР (125,8 МГц): 156,81 ppm (C-3), 140,33 ppm (C-6), 136,20 ppm (C-14), 133,38 ppm (C-13), 126,87 ppm (C-5), 126,38 (C-22), 120,77 ppm (C-23), 108,58 ppm (C-21), 75,87 ppm (C-11), 73,32 ppm (C-15), 56,94 ppm (C-12), 55,71 ppm (C-2), 40,61 ppm (C-8), 40,49 ppm (C-10), 37,29 ppm (C-16), 32,73 ppm (C-9), 32,21 ppm (C-7), 31,85 ppm (C-18), 25,54 ppm (C-4), 25,37 ppm (C-17), 22,78 ppm (C-19), 14,18 ppm (C-20).
1n.) Получение (1R,3aS,9aS)-1-(3-гидроксиоктил)-5-метокси-2,3,3a,4,9,9a-гексагидро-1H-циклопента[b]нафталин-2-ола (TREP-14)

В смеси 77 мл метилэтилкетона и 154 мл этанола растворяли 7,7 г (22,3 ммоль) TREP-13. Реакционную смесь гидрогенизировали под давлением 6 бар над 0,77 г 10% катализатора палладий на угле, деактивированного нитритом натрия. В конце реакции катализатор отфильтровывали, промывали этилацетатом, фильтрат выпаривали в вакууме и остаток кристаллизовали из смеси гексан:этилацетат.
Выход: 6,4 г (83%) белых кристаллов. Mp: 71-72°C.
Данные ЯМР: (CDCl3), 1H ЯМР (500 МГц): 7,09 ppm (H-22, 1), t, J=7,8 Гц; 6,78-6,71 ppm (H-21 и H-23, 2), m (в: 6,75 ppm (H-23, 1), m (d), J~7,4 Гц и 6,74 ppm (H-21, 1), m (d), J=8,1 Гц); 3,80 ppm (H-2, 3), s; 3,71 ppm (H-11, 1), td, J=9,6 Гц и 6,1 Гц; 3,59 ppm (H-15, 1), m ; 2,83-2,69 ppm (H-4a и H-7a, 2), m (в: 2,79 ppm (H-4a, 1), m (dd), J=14,7 Гц и 6,1 Гц; 2,74 ppm (H-7a, 1), m (dd), J=14,3 Гц и 6,2 Гц); 2,51-2,40 ppm (H-4b és H-7b, 2), m (в: 2,47 ppm (H-4b, 1), m (dd), J=14,8 Гц и 6,5 Гц; 2,44 ppm (H-7b, 1), m (dd)), J=14,4 Гц и 6,6 Гц); 2,40-2,19 ppm (H-9 и OH-11/OH-15, 2), m (в: 2,31 ppm (OH-11/OH-15, 1), широкий и 2,22 ppm (H-9, 1), m, J=10,2 Гц и ~7,0 Гц); 2,19-1,97 ppm (H-10a и OH-11/OH-15, 2), m, (в: 2,155 ppm (H-10a, 1), m (ddd), J=11,7 Гц, 7,4 Гц и 6,1 Гц и 2,08 ppm (OH-11/OH-15, 1), широкий); 1,92-1,74 ppm (H-8 и H-11/H-15/вода, 2), m, (в: 1,87 ppm (H-8, 1), m (tt), J=10,0 Гц и 6,4 Гц и 1,81 ppm (OH-11/OH-15, 1), широкий); 1,69-1,50 ppm (H-13 и H-14, 4), m (в: 1,62 ppm (H-13a и H-14a, 2) m ; 1,57 ppm (H-13b, 1), m и 1,55 ppm (H-14b, 1), m ); 1,50-1,38 ppm (H-16 и H-17a, 3), m (в: 1,47 ppm (H-16a, 1), m и 1,435 ppm (H-16b, 1), m и 1,43 ppm (H-17a, 1), m ); 1,38-1,22 ppm (H-12, H-17b, H-18 и H-19, 6), m (в: 1,32 ppm (H-19, 2), m ; 1,31 ppm (H-17b, 1), m ; 1,30 ppm (H-12 и H-18, 3), m ); 1,14 ppm (H-10b, 1), m (dt), J=11,5 Гц и 10,1 Гц; 0,90 ppm (H-20, 3), m (t), J=6,9 Гц; 13C ЯМР (125,8 МГц): 156,64 ppm (C-3), 140,65 ppm (C-6), 127,09 ppm (C-5), 126,26 (C-22), 120,60 ppm (C-23), 108,51 ppm (C-21), 77,51 ppm (C-11), 72,70 ppm (C-15), 55,72 ppm (C-2), 52,40 ppm (C-12), 41,54 ppm (C-10), 41,44 ppm (C-8), 37,58 ppm (C-16), 35,14 ppm (C-14), 33,82 ppm (C-7), 32,96 ppm (C-9), 32,05 ppm (C-18), 28,77 ppm (C-13), 25,88 ppm (C-4), 25,52 ppm (C-17), 22,78 ppm (C-19), 14,18 ppm (C-20).
1o.) Получение (1R,2R,3aS,9aS)-1-[(3S)-3-гидроксиоктил]-2,3,3a,4,9,9a-гексагидро-1H-бенз[f]инден-2,5-диола (TREP-15)

К 2,4 л 1-додекантиол в атмосфере азота добавляли 400 г не содержащего воду хлорида алюминия. Смесь охлаждали до 0-5°C и к ней добавляли раствор 200 г TREP-14 в 560 мл дихлорметана. Реакционную смесь перемешивали при комнатной температуре. В конце реакции смесь выливали в 4 л воды, а затем добавляли 664 мл 2 M гидросульфата натрия. Фазы разделяли, водную фазу экстрагировали с помощью этилацетата. Органическую фазу промывали насыщенным раствором хлорида натрия, высушивали над сульфатом натрия и выпаривали. Остаток кристаллизовали из гексана. Кристаллы отфильтровывали, промывали и повторно кристаллизовали из смеси гексан:этилацетат.
Выход: 182 г (95%) белых кристаллов. Mp: 113-115°C.
Данные ЯМР: (CDCl3), 1H ЯМР (500 МГц): 6,99 ppm (H-22, 1), t, J=7,7 Гц; 6,73 ppm (H-23, 1), d, J=7,4 Гц; 6,65 ppm (H-21, 1), d, J=8,0 Гц; 4,95 ppm (OH-3, 1), s; 3,75 ppm (H-11, 1), td, J=9,4 Гц и 6,2 Гц; 3,62 ppm (H-15, 1), m ; 2,78-2,675 ppm (H-4a и H-7a, 2), m (в: 2,735 ppm (H-7a, 1), m (dd), J=14,0 Гц и 7,0 Гц; 2,72 ppm (H-4a, 1), m (dd), J=14,6 Гц и 6,5 Гц); 2,51-2,42 ppm (H-4b и H-7b, 2), m (в: 2,47 ppm (H-4b, 1), m (dd), J=14,6 Гц и 6,3 Гц; 2,46 ppm (H-7b, 1), m (dd)), J=14,2 Гц и 6,2 Гц); 2,28 ppm (H-9, 1), m, J=10,3 Гц, ~7,3 Гц и ~6,5 Гц; 2,175 ppm (H-10a, 1), m (ddd/dt), J=12,0 Гц, 7,3 Гц и 6,4 Гц; 1,95-1,85 ppm (H-8, 1), m (в: 1,90 ppm (H-8, 1), m (tt), J=10,0 Гц и 6,2 Гц); 1,72-1,61 ppm (H-13a и H-14a, 2), m (в: 1,655 ppm (H-14a, 1), m и 1,65 ppm (H-14a, 1), m ); 1,61-1,51 ppm (H-13b и H-14b, 2), m (в: 1,56 ppm (H-14b, 1), m и 1,55 ppm (H-13b, 1), m ); 1,51-1,385 ppm (H-16 и H-17a, 3), m (в: 1,48 ppm (H-16a, 1), m и 1,44 ppm (H-16b и H-17a, 2), m ); 1,385-1,22 ppm (H-12, H-17b, H-18 и H-19, 6), m (в: 1,32 ppm (H-19, 2), m ; 1,31 ppm (H-17b, 1), m ; 1,305 ppm (H-18, 2), m ; 1,285 ppm (H-12, 1), m ); 1,16 ppm (H-10b, 1), dt, J=11,8 Гц и 10,2 Гц; 0,90 ppm (H-20, 3), m (t), J=6,9 Гц;
13C ЯМР (125,8 МГц): 152,65 ppm (C-3), 141,00 ppm (C-6), 126,39 (C-22), 124,60 ppm (C-5), 120,67 ppm (C-23), 113,15 ppm (C-21), 77,56 ppm (C-11), 72,79 ppm (C-15), 52,30 ppm (C-12), 41,50 ppm (C-10), 41,41 ppm (C-8), 37,58 ppm (C-16), 35,09 ppm (C-14), 33,74 ppm (C-7), 33,00 ppm (C-9), 32,05 ppm (C-18), 28,78 ppm (C-13), 26,12 ppm (C-4), 25,52 ppm (C-17), 22,79 ppm (C-19), 14,20 ppm (C-20).
1p.) Получение сложного этилового эфира 2-[[(1R,2R,3aS,9aS)-2,3,3a,4,9,9a-гексагидро-2-гидрокси-1-[(3S)-3-гидроксиоктил]-1H-бенз[f]инден-5-ил]окси]уксусной кислоты (TREP-16 )

170 г (0,51 моль) TREP-15 растворяли в 3,4 л ацетона. К раствору добавляли 340 г (2,46 моль) безводного карбоната калия и 89,6 г (0,536 моль) сложного этилового эфира бромуксусной кислоты и смесь перемешивали при 30-35°C. В конце реакции реакционную смесь фильтровали, фильтрат выпаривали. Из остатка продукт кристаллизовали с помощью смеси TBME (трет-бутилметилового эфира):гексана, отфильтровывали, промывали и высушивали.
Выход: 203 г (95%) белых кристаллов. Mp: 53-55oC.
Данные ЯМР:
(CDCl3, 1H ЯМР (500 МГц): 7,03 ppm (H-22, 1), t, J=7,8 Гц; 6,78 ppm (H-23, 1), d, J=7,4 Гц; 6,605 ppm (H-21, 1), d, J=8,2 Гц; 4,58 ppm (H-2, 2), s; 4,23 ppm (H-24, 2), q, J=7,1 Гц; 3,66 ppm (H-11, 1), td, J=9,6 Гц и 6,2 Гц; 3,55 ppm (H-15, 1), m ; 2,87 ppm (H-4a, 1), dd, J=14,7 Гц и 6,1 Гц; 2,80-2,455 ppm (H-4b, H-7a, OH-11 и OH-15, 4), m (в: 2,72 ppm (H-7a, 1), dd, J=14,2 Гц и 6,2 Гц; 2,67 ppm (OH-11 и OH-15, 2), 2,50 ppm (H-4b, 1), dd, J=14,7 Гц и 6,7 Гц); 2,42 ppm (H-7b, 1), dd, J=14,2 Гц и 6,8 Гц; 2,25-2,07 ppm (H-9 и H-10a, 2), m, (в: 2,20 ppm (H-9, 1), m, J=10,2 Гц, ~6,5-7,1 Гц; 2,125 ppm (H-10a, 1), m (ddd/dt), J~12,0 Гц, ~7,2 Гц и ~6,2 Гц), 1,83 ppm (H-8, 1), m (tt), J=9,9 Гц и 6,6 Гц; 1,70-1,57 ppm (H-13a и H-14a, 2), m (в: 1,635 ppm (H-14a, 1), m и 1,625 ppm (H-14a, 1), m ); 1,57-1,36 ppm (H-13b, H-14b, H-16 и H-17a, 5), m (в: 1,50 ppm (H-14b, 1), m ; 1,48 ppm (H-13b, 1), m ; 1,435 ppm (H-16a, 1), m ; 1,415 ppm (H-17a, 1), m, 1,40 ppm (H-16b, 1), m ); 1,36-1,19 ppm (H-12, H-17b, H-18, H-19 и H-25, 9), m (в: 1,295 ppm (H-19, 2), m ; 1,28 ppm (H-17b, 1), m ; 1,275 ppm (H-18, 2), m ; 1,27 ppm (H-25, 3), t, J=7,1 Гц; 1,24 ppm (H-12, 1), m ); 1,14 ppm (H-10b, 1), dt, J=11,6 Гц и 10,2 Гц; 0,88 ppm (H-20, 3), t, J=6,9 Гц;
13C ЯМР (125,8 МГц): 169,32 ppm (C-1), 154,94 ppm (C-3), 141,15 ppm (C-6), 127,92 (C-5), 126,11 ppm (C-22), 121,55 ppm (C-23), 109,76 ppm (C-21), 77,16 ppm (C-11), 72,47 ppm (C-15), 66,12 ppm (C-2), 61,26 ppm (C-24), 52,31 ppm (C-12), 41,27 ppm (C-8), 41,25 ppm (C-10), 37,49 ppm (C-16), 35,06 ppm (C-14), 33,88 ppm (C-7), 32,80 ppm (C-9), 31,99 ppm (C-18), 28,63 ppm (C-13), 26,08 ppm (C-4), 25,47 ppm (C-17), 22,71 ppm (C-19), 14,22 (C-25), 14,13 ppm (C-20).
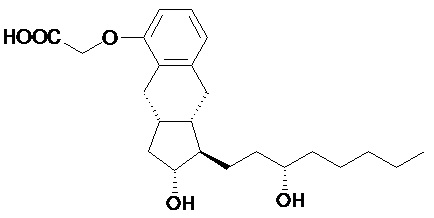
1q.) Получение 2-[[(1R,2R,3aS,9aS)-2,3,3a,4,9,9a-гексагидро-2-гидрокси-1-[(3S)-3-гидроксиоктил]-1H-бенз[f]инден-5-ил]окси]уксусной кислоты (трепростинила)

180 г (0,43 моль) TREP-16 (сложного этилового эфира) растворяли в 650 мл тетрагидрофурана. В атмосфере азота при комнатной температуре добавляли 2,7 л 0,5 M раствора гидроксида натрия и реакционную смесь перемешивали при комнатной температуре. В конце реакции смесь промывали дистиллированным трет-бутилметиловым эфиром. К водной щелочной фазе добавляли трет-бутилметиловый эфир и pH смеси регулировали до pH ≤3 1 M раствором гидросульфата натрия. Водную кислую фазу затем экстрагировали с помощью трет-бутилметилового эфира, объединенную органическую фазу промывали водой и выпаривали.
Выход: 165 г (98%) кристаллизующегося масла.
Данные ЯМР (d6-DMSO), 1H ЯМР (400 МГц): 12,915 (COOH-1, 1), широкий; 7,03 ppm (H-22, 1), t, J=7,8 Гц; 6,76 ppm (H-23, 1), d, J=7,4 Гц; 6,68 ppm (H-21, 1), d, J=8,2 Гц; 4,62 ppm (H-2, 2), s; 4,47 ppm (OH-11, 1), широкий; 4,21 ppm (OH-15, 1), широкий; 3,47 ppm (H-11, 1), m (q), J~8,0 Гц; 3,35 ppm (H-15, 1), m, 2,80-2,60 ppm (H-4a и H-7a, 2), m (в: 2,725 ppm (H-4a, 1), dd, J=14,7 Гц и 6,2 Гц; 2,67 ppm (H-7a, 1), dd, J=14,2 Гц и 6,2 Гц); 2,48-2,34 ppm (H-4b и H-7b, 2), m (в: 2,49 ppm (H-4b, 1), dd, J=14,6 Гц и 6,6 Гц; 2,39 ppm (H-7b, 1), dd, J=14,2 Гц и 6,5 Гц); 2,11 ppm (H-9, 1), m (tq), J~10,1 Гц и ~6,7 Гц; 1,955 ppm (H-10a, 1), m (ddd/dt), J=12,1 Гц и 6,7 Гц; 1,76 ppm (H-8, 1), m (tt), J=10,0 Гц и 6,2 Гц; 1,61 ppm (H-13a, 1) m ; 1,53-1,33 ppm (H-14, H-16a и H-17a, 4), m (в:1,46 ppm (H-14a, 1), m ; 1,43 ppm (H-14b, 1), m ; 1,38 ppm (H-17a, 1), m ; 1,35 ppm (H-16a, 1), m ); 1,33-1,15 ppm (H-13b, H-16b, H-17b, H-18 и H-19, 7), m (в: 1,32 ppm (H-13b, 1), m ; 1,30 ppm (H-16b, 1), m ; 1,275 ppm (H-19, 2), m ; 1,26 ppm (H-17b, 1), m ; 1,25 ppm (H-18, 2), m ); 1,15-0,93 ppm (H-10b и H-13, 2), m (в: H-1,09 ppm (H-12, 1), m (tt), J=9,0 Гц и 6,1 Гц; 1,00 ppm (H-10b, 1), m (ddd/dt), J=11,7 Гц и 10,2 Гц); 0,87 ppm (H-20, 3), m (t), J=6,9 Гц;
13C ЯМР (100 МГц): 170,36 ppm (C-1), 154,63 ppm (C-3), 140,56 ppm (C-6), 126,75 ppm (C-5), 125,85 (C-22), 120,65 ppm (C-23), 109,37 ppm (C-21), 75,44 ppm (C-11), 70,13 ppm (C-15), 64,96 ppm (C-2), 51,49 ppm (C-12), 41,15 ppm (C-10), 40,48 ppm (C-8), 37,06 ppm (C-16), 35,03 ppm (C-14), 33,37 ppm (C-7), 32,42 ppm (C-9), 31,53 ppm (C-18), 28,36 ppm (C-13), 25,62 ppm (C-4), 24,96 ppm (C-17), 22,18 ppm (C-19), 13,96 ppm (C-20).
1s.) Получение натриевой соли (1R,2R,3aS,9aS)-2-[2-гидрокси-1-[3(S)-гидроксиоктил]-2,3,3a,4,9,9a-гексагидро-1H-бенз[f]инден-5-илокси]уксусной кислоты (натриевой соли трепростинила)

1s1.) 150 г (0,384 моль) трепростинила растворяли в 2 л этанола. К нему добавляли моногидрат карбоната натрия 26,2 г (0,211 моль) и в инертной атмосфере смесь перемешивали при комнатной температуре. Если pH фильтрованного образца достигал значения 7-9, смесь фильтровали через фильтр с размером пор 5 мкм. Отфильтрованный раствор концентрировали на Rotadest до примерно 225 г. Концентрат растворяли в трет-бутилметиловом эфире, который был насыщен водой, и обеспечивали кристаллизацию при комнатной температуре. Кристаллы отфильтровывали, промывали при комнатной температуре и высушивали в вакууме при 20-50°C.
Выход: 158 г (100%) моногидрата натриевой соли трепростинила (формы „A"), белые кристаллы. Mp: 95-99°C.
1s2.) 150 г (0,384 моль) трепростинила растворяли в 2 л этанола. К нему добавляли 35,5 г (0,422 моль) гидрокарбоната натрия и в инертной атмосфере смесь перемешивали при комнатной температуре. Если pH фильтрованного образца достигал значения 7-8, смесь фильтровали через фильтр с размером пор 5 мкм и отфильтрованный раствор концентрировали на Rotadest до примерно 225 г. Концентрат растворяли в трет-бутилметиловом эфире, который был насыщен водой, и обеспечивали кристаллизацию при комнатной температуре. Кристаллы отфильтровывали, промывали при комнатной температуре и высушивали в вакууме при 20-50°C.
Выход: 158 г (100%) моногидрата натриевой соли трепростинила (формы „A"), белые кристаллы. Mp: 95-99°C.
1s3.) 150 г (0,384 моль) трепростинила растворяли в 2 л этанола. К нему добавляли 21 г (0,39 моль) метилата натрия и в инертной атмосфере смесь перемешивали при комнатной температуре до растворения. Раствор фильтровали через фильтр с размером пор 5 мкм. Отфильтрованный раствор концентрировали на Rotadest до примерно 225 г. Концентрат растворяли в трет-бутилметиловом эфире, который был насыщен водой, и обеспечивали кристаллизацию при комнатной температуре. Кристаллы отфильтровывали, промывали при комнатной температуре и высушивали в вакууме при 20-50°C.
Выход: 158 г (100%) моногидрата натриевой соли трепростинила (формы „A"), белые кристаллы. Mp: 95-99°C.
1s4.) 24 г (61,45 ммоль) трепростинила растворяли в 360 мл этанола и к нему добавляли 7,62 г (61,45 ммоль) моногидрата карбоната натрия. Смесь перемешивали в инертной атмосфере при комнатной температуре до полного растворения. Раствор затем фильтровали через фильтр с размером пор 5 мкм и отфильтрованный раствор концентрировали на Rotadest. В концентрат добавляли этанол и раствор снова концентрировали. Концентрат растворяли в трет-бутилметиловом эфире и обеспечивали кристаллизацию при комнатной температуре. Кристаллы собирали путем фильтрации, промывали и высушивали в вакууме при 20-50°C.
Выход: 22,8 г (90%) натриевой соли трепростинила, белое твердое вещество (аморфная форма).
Mp: 65-90°C
Аналитическая характеристика моногидрата натриевой соли трепростинила (форма „A"):
Mp: 81-109°C
Пик DSC: 94-99°C
Чистота: 99,9% площади HPLC
15-эпи-трепростинил: 0,0% площади HPLC
Содержание воды: 4,3%
Удельное оптическое вращение (c=1%, метанол, 25°C):+41°
Сульфатированная зола: 16,8%
Данные ЯМР: (d6-DMSO), 1H ЯМР (500 МГц): 6,95 ppm (H-22, 1), t, J=7,8 Гц; 6,65 ppm (H-23, 1), d, J=7,4 Гц; 6,61 ppm (H-21, 1), d, J=8,2 Гц; 4,97-3,93 ppm (H-2, OH-11 и OH-15, 4), m (в: 4,54 ppm (OH-11, 1), широкий; 4,32 ppm (OH-15, 1), широкий; 4,13 ppm (H-2, 2), s); 3,47 ppm (H-11, 1), td, J=9,4 Гц и 6,2 Гц; 3,35 ppm (H-15, 1), m (tt), J~7,0 Гц и 4,3 Гц; 2,75 ppm (H-4a, 1), dd, J=14,5 Гц и 6,1 Гц; 2,65 ppm (H-7a, 1), dd, J=14,1 Гц и 6,1 Гц; 2,42-2,32 ppm (H-4b и H-7b, 2), m (в: 2,38 ppm (H-4b, 1), dd, J=14,5 Гц и 6,8 Гц; 2,355 ppm (H-7b, 1), dd, J=14,1 Гц и 6,9 Гц); 2,08 ppm (H-9, 1), m (tq), J~10,1 Гц и ~7,0 Гц; 1,96 ppm (H-10a, 1), m (ddd/dt), J=12,1 Гц и 6,6 Гц; 1,73 ppm (H-8, 1), m (tt), J=9,8 Гц и 6,7 Гц; 1,61 ppm (H-13a, 1) m ; 1,52-1,32 ppm (H-14, H-16a и H-17a, 4), m (в:1,455 ppm (H-14a, 1), m ; 1,42 ppm (H-14b, 1), m ; 1,38 ppm (H-17a, 1), m ; 1,34 ppm (H-16a, 1), m ); 1,32-1,16 ppm (H-13b, H-16b, H-17b, H-18 и H-19, 7), m (в: 1,31 ppm (H-13b, 1), m ; 1,285 ppm (H-16b, 1), m ; 1,275 ppm (H-19, 2), m ; 1,26 ppm (H-17b, 1), m ; 1,25 ppm (H-18, 2), m ); 1,11 ppm (H-12, 1), m (tt), J=9,0 Гц и 6,3 Гц, 1,02 ppm (H-10b, 1), m (ddd/dt), J=11,3 Гц и 10,3 Гц); 0,865 ppm (H-20, 3), m (t), J=6,9 Гц;
13C ЯМР (125,8 МГц): 171,55 ppm (C-1), 155,89 ppm (C-3), 139,91 ppm (C-6), 126,38 ppm (C-5), 125,52 (C-22), 119,30 ppm (C-23), 109,74 ppm (C-21), 75,53 ppm (C-11), 70,14 ppm (C-15), 68,29 ppm (C-2), 51,58 ppm (C-12), 41,26 ppm (C-10), 40,63 ppm (C-8), 37,06 ppm (C-16), 35,07 ppm (C-14), 33,59 ppm (C-7), 32,55 ppm (C-9), 31,54 ppm (C-18), 28,40 ppm (C-13), 25,82 ppm (C-4), 24,97 ppm (C-17), 22,19 ppm (C-19), 13,98 ppm (C-20).
Диаграмма DSC моногидрата натриевой соли трепростинила (формы „A") показана на фигурах 15 и 16.
Диаграмма XRPD моногидрата натриевой соли трепростинила (формы „A") показана на фигуре 20.
1t.) Получение безводной натриевой соли трепростинила (формы „B") Mp.: 125-129°C):
1t1.) Можно следовать любым процедурам из примеров 1s1-1s2-1s3, за тем исключением, что:
полученные кристаллы отфильтровывали, промывали и высушивали в вакууме при 60-100°C.
1t2.) Можно следовать любым процедурами из примеров 1s1-1s2-1s3, полученные кристаллы высушивали в вакууме при 60-100°C.
1t3.) Моногидрат натриевой соли трепростинила перемешивали в суспензии при 60-90°C в течение 1-6 часов в растворителе, который не растворяет или лишь в незначительной степени растворяет его. Растворитель может представлять собой, например, гексан, гептан, толуол или этилацетат.
Диаграмма DSC безводной натриевой соли трепростинила (формы „B") показана на фигурах 17 и 18.
Диаграмма XRPD безводной натриевой соли трепростинила (формы „B") показана на фигуре 21.
1v.) Получение полигидрата натриевой соли трепростинила (формы „C"):
1v1.) Моногидрат натриевой соли трепростинила (форму „A") выдерживали в манипуляторе в атмосфере с содержанием влаги 60% в течение 48 часов или моногидрат натриевой соли трепростинила выдерживали на воздухе в течение 5-8 дней.
1v2.) Безводную натриевую соль трепростинила (форму „B") выдерживали в манипуляторе в атмосфере с содержанием влаги 60% в течение 48 часов или выдерживали на воздухе в течение 5-8 дней.
Диаграмма DSC полигидрата натриевой соли трепростинила (формы „C") показана на фигуре 19.
Диаграмма XRPD полигидрата натриевой соли трепростинила (формы „C") показана на фигуре 22.
Диаграмма DSC натриевой соли трепростинила (аморфной формы) показана на фигуре 14.
Характеристика натриевых солей трепростинила:
Термогравиметрический анализ (TGA) осуществляли с помощью прибора TGA/SDTA851e,
Mettler Toledo.
Дифференциальный сканирующий калориметрический анализ осуществляли с помощью системы DSC 1 Stare, Mettler Toledo.
Анализ XRPD осуществляли с помощью прибора XPERT-PRO-PANalytical.
Применяли следующие условия эксперимента:
название рентгеновской трубки: PW3373/10 Cu, материал анода: Cu.
Применяемая длина волны: предполагаемый тип длины волны: Kα, Kα1 (Å): 1,540598.
Диапазон сканирования (°): 20000-400014.
Пример 2.)
2a.) Получение 2-пент-4-инокситетрагидропирана (MPKO-1)

В 5,5 л дистиллированного толуола растворяли 552 г 4-пентин-1-ола. К раствору добавляли 677 мл дигидропирана и раствор 19,5 г пара-толуолсульфоновой кислоты (PTSA) в 120 мл тетрагидрофурана. Реакционную смесь перемешивали при комнатной температуре. В конце реакции смесь гасили триэтиламином, промывали раствором гидрокарбоната натрия и водой. Органическую фазу выпаривали. Неочищенный продукт применяли на следующей стадии без очистки.
Выход: 1062 г (96%) бесцветного масла.
Данные ЯМР:
(CDCl3), 1H ЯМР (500 МГц): 4,59 ppm (H-6, 1), dd, J=4,0 Гц и 3,1 Гц; 3,90-3,79 ppm (H-1a и H-10a, 2), m, (в: 3,86 ppm (H-10a, 1), ddd, J=11,3 Гц, 8,2 Гц и 3,2 Гц; 3,82 ppm (H-1a, 1), dt, J=9,8 Гц и 6,2 Гц); 3,54-3,44 ppm (H-1b и 10Hb, 2), m, (в: 3,50 ppm (H-10b, 1), m ; 3,48 ppm (H-1b, 1), dt, J=9,8 Гц и 6,2 Гц); 2,31 ppm (H-3, 2), m (tdd), J=7,1 Гц, 2,5 Гц и 1,5 Гц; 1,94 ppm (H-5, 1), t, J=2,6 Гц; 1,87-1,765 ppm (H-2 и H-8a, 3), m (tt/qui), (в: 1,81 ppm (H-2, 2), qui/tt, J=6,6 Гц; 1,82 ppm (H-8a, 1), m ); 1,70 ppm (H-7a, 1), m ; 1,615-1,47 ppm (H-7a, H-8a, H-9, 4), m, (в: 1,58 ppm (H-7b, 1), m ; 1,57 ppm (H-9a, 1), m, 1,525 ppm (H-9b, 1), m ; 1,52 ppm (H-8b, 1), m );
13C ЯМР (125,8 МГц): 98,95 ppm (C-6), 84,13 ppm (C-4), 68,56 ppm (C-5), 65,93 ppm (C-1), 62,35 ppm (C-10), 30,81 ppm (C-7), 28,84 ppm (C-2), 25,61 ppm (C-9), 19,65 ppm (C-8), 15,48 ppm (C-3).
2b.) Получение 1-(2-аллил-3-метоксифенил)-6-тетрагидропиран-2-илоксигекс-2-ин-1-ола (MPK-1)

В инертной атмосфере 1062 г MPKO-1 растворяли в 8,5 л безводного тетрагидрофурана, а затем при 60-65°C медленно добавляли 1920 мл раствора этилмагния бромида (3 M раствор в эфире). Реакционную смесь перемешивали в течение 45 минут, охлаждали, а затем к ней добавляли раствор 927 г VPK-5 (2-аллил-3-метоксибензальдегида) в 930 мл тетрагидрофурана. В конце реакции смесь гасили 1 M раствором NaHSO4, водную фазу экстрагировали с помощью этилацетата, объединенную органическую фазу промывали 0,5 M раствором NaHCO3 и 15% раствором NaCl, высушивали и концентрировали до 2,4 кг. Концентрированный неочищенный продукт применяли на следующей стадии без очистки.
Выход: 100% (1812 г) MPK-1 в виде светло-коричневого масла.
Данные ЯМР:
(CDCl3), 1H ЯМР (500 МГц): 7,34 ppm (H-6, 1), dd, J=7,8 Гц и 0,7 Гц; 7,24 ppm (H-5, 1), m (t), J= 8,0 Гц, частично перекрывается пиком остаточного растворителя CDCl3; 6,86 ppm (H-4, 1), d (d широкий), J= 8,0 Гц; 5,985 ppm (H-14, 1), ddt, J= 17,1 Гц, 10,2 Гц и 5,9 Гц; 5,62 ppm (H-7, 1), широкий; 4,98 ppm (H-15a, 1), dq (ddt), J=10,1 Гц, 1,8 Гц и 1,6 Гц; 4,93 ppm (H-15b, 1), dq (ddt), J=17,1 Гц, 1,8 Гц и 1,7 Гц; 4,57 ppm (H-17, 1), m, J=2,5 Гц; 3,88-3,77 ppm (H-12a, H-16 és H-21a, 5), m, (в: 3,85 ppm (H-21a, 1), m ; 3,82 ppm (H-16, 3), s; 3,81 ppm (H-12a, 1), dd, 15,9 Гц и 6,2 Гц); 3,625 ppm (H-13a, 1), ddt, J=15,7 Гц, 5,8 Гц и 1,6 Гц; 3,55 ppm (H-13b, 1), ddt, J=15,7 Гц, 5,9 Гц и 1,6 Гц; 3,505-3,43 ppm (H-12b и H-21b, 2), m, (в: 3,47 ppm (H-21b, 1), m ; 3,46 ppm (H-12b, 1), m ); 2,37 ppm (H-10, 2), td, J=7,1 Гц и 1,8 Гц; 2,30 ppm (OH-7, 1), широкий; 1,87-1,75 ppm (H-11 и H-19a, 3), m, (в: 1,815 ppm (H-11, 2), tt (qui), J=6,7 Гц; 1,81 ppm (H-19a, 1), m ); 1,69 ppm (H-18a, 1), m ; 1,62-1,45 ppm (H-18b, H-19b и H-20, 4), m, (в: 1,565 ppm (H-18b, 1), m ; 1,56 ppm (H-20a, 1), m ; 1,51 ppm (H-20b, 1), m ; 1,505 ppm (H-19b, 1) m );
13C ЯМР (125,8 МГц): 157,74 ppm (C-3), 140,75 ppm (C-1), 137,20 ppm (C-14), 127,52 ppm (C-5), 125,94 pm (C-2), 119,32 ppm (C-6), 114,86 ppm (C-15), 110,74 ppm (C-4), 98,90 ppm (C-17); 86,66 ppm (C-9), 80,55 ppm (C-8), 66,03 ppm (C-12), 62,32 ppm (C-21), 62,23 ppm (C-7), 55,91 ppm (C-16); 30,77 ppm (C-18), 29,56 ppm (C-13), 28,82 ppm (C-11), 25,57 ppm (C-20), 19,63 ppm (C-19), 15,93 ppm (C-10).
2c.) Получение 1-(2-аллил-3-метоксифенил)-6-тетрагидропиран-2-илоксигекс-2-ин-1-она (MPK-2)

К 12 л этилацетата в инертной атмосфере добавляли 4 кг пиридиния хлорхромата (PCC), а затем 1,7 кг безводного ацетата натрия. Суспензию перемешивали при комнатной температуре в течение 15 минут, затем добавляли 2,4 кг раствора MPK-1, полученного на предыдущей стадии. В конце реакции к смеси добавляли диизопропиловый эфир и силикагель. Через 15-20 минут перемешивания смесь фильтровали, силикагель промывали этилацетатом и отфильтрованный раствор выпаривали. Неочищенный продукт очищали посредством хроматографии на колонке с силикагелем с использованием градиентных смесей гексан:этилацетат в качестве элюента. Фракции, которые содержали продукт, собирали, концентрировали, промывали водой, высушивали над сульфатом натрия, высушиваемый материал отфильтровывали и отфильтрованный раствор выпаривали.
Выход: 1246 г (69%) светло-коричневого масла.
Данные ЯМР:
(CDCl3), 1H ЯМР (500 МГц): 7,73 ppm (H-6, 1), dd, J=7,8 Гц и 0,7 Гц; 7,29 ppm (H-5, 1), t, J= 8,0 Гц; 7,04 ppm (H-4, 1), d (d широкий), J= 8,0 Гц; 5,97 ppm (H-14, 1), ddt, J= 17,1 Гц, 10,1 Гц и 6,2 Гц; 4,985 ppm (H-15b, 1), dq (ddt), J=17,1 Гц и 1,7 Гц; 4,94 ppm (H-15a, 1), dq (ddt), J=10,1 Гц и 1,6 Гц; 4,60 ppm (H-11, 1), m (dd), J=4,0 Гц и 2,9 Гц; 3,91-3,81 ppm (H-12a, H-16 и H-21a, 5), m, (в: 3,86 ppm (H-12a, 1), m, 3,855 ppm (H-21a, 1), m ; 3,85 ppm (H-16, 3), s); 3,78 ppm (H-13, 2), dt, J=6,2 Гц и 1,5 Гц; 3,55-3,46 ppm (H-12b и H-21b, 2), m, (в: 3,51 ppm (H-12b, 1), m (dt), J=9,9 Гц и 6,0 Гц; 3,50 ppm (H-21b, 1), m ); 2,585 ppm (H-10, 2), td, J=7,1 Гц и 1,4 Гц; 1,925 ppm (H-11, 2), tt (qui), J=6,6 Гц; 1,82 ppm (H-19a, 1), m ; 1,71 ppm (H-18a, 1), m ; 1,64-1,46 ppm (H-18b, H-19b и H-20, 4), m, (в: 1,575 ppm (H-18b, 1), m ; 1,57 ppm (H-20a, 1), m ; 1,53 ppm (H-20b, 1), m ; 1,52 ppm (H-19b, 1) m ); 13C ЯМР (125,8 МГц): 180,21 ppm (C-7), 158,20 ppm (C-3), 137,53 ppm (C-1), 136,90 ppm (C-14), 130,04 pm (C-2), 126,85 ppm (C-5), 124,75 ppm (C-6), 115,01 ppm (C-4), 114,89 ppm (C-15), 99,05 ppm (C-17); 95,03 ppm (C-9), 81,97 ppm (C-8), 65,84 ppm (C-12), 62,46 ppm (C-21), 56,20 ppm (C-16); 30,78 ppm (C-18), 29,89 ppm (C-13), 28,23 ppm (C-11), 25,58 ppm (C-20), 19,68 ppm (C-19), 16,38 ppm (C-10).
2d.) Получение (1S)-1-(2-аллил-3-метоксифенил)-6-тетрагидропиран-2-илоксигекс-2-ин-1-ола (MPK-3)

В инертной атмосфере 1246 г MPK-2 растворяли в 6,3 л безводного тетрагидрофурана. Раствор охлаждали до 0-5°C и добавляли 5,73 л R-(+)-2-метил-CBS-оксазаборолидина в 1 M растворе толуола. Смесь затем охлаждали до
(-40)-(-35)°C и добавляли 925 мл боран-диметилсульфидного комплекса. В конце реакции смесь гасили метанолом и 5% раствором NH4Cl, водную фазу экстрагировали с помощью этилацетата, органическую фазу промывали водой, высушивали, фильтровали и выпаривали. Неочищенный продукт очищали посредством хроматографии на колонке с силикагелем с использованием смесей элюентов гексан:этилацетат.
Выход: 1178 г (94%) светло-коричневого масла.
Данные ЯМР:
(CDCl3), 1H ЯМР (500 МГц): 7,35 ppm (H-6, 1), d, J=7,8 Гц, 7,24 ppm (H-5, 1), m (t), J= 8,0 Гц, 6,86 ppm (H-4, 1), d, J= 8,1 Гц; 5,99 ppm (H-14, 1), ddt, J= 17,1 Гц, 10,3 Гц и 5,7 Гц; 5,62 ppm (H-7, 1), t, J=1,8 Гц; 4,98 ppm (H-15a, 1), dq, J=10,1 Гц és 1,8 Гц; 4,94 ppm (H-15b, 1), dq, J=17,2 Гц и 1,7 Гц; 4,57 ppm (H-17, 1), m, J=2,4 Гц; 3,91-3,74 ppm (H-12a, H-16 и H-21a, 5), m, (в: 3,84 ppm (H-21a, 1), m ; 3,82 ppm (H-16, 3), s; 3,82 ppm (H-12a, 1), m ); 3,63 ppm (H-13a, 1), ddt, J=15,6 Гц, 5,8 Гц и 1,7 Гц; 3,55 ppm (H-13b, 1), ddt, J=15,6 Гц, 5,8 Гц и 1,7 Гц; 3,51-3,41 ppm (H-12b и H-21b, 2), m, (в: 3,475 ppm (H-21b, 1), m ; 3,47 ppm (H-12b, 1), m (dt), J=9,7 Гц и 6,1 Гц); 2,44-2,20 ppm (OH-7 и H-10, 3), m, (в: 2,37 ppm (H-10, 2), td, J=7,1 Гц и 1,6 Гц; 2,30 ppm (OH-7, 1), широкий); 1,90-1,75 ppm (H-11 и H-19a, 3), m, (в: 1,815 ppm (H-11, 2), tt (qui), J=6,7 Гц; 1,81 ppm (H-19a, 1), m ); 1,69 ppm (H-18a, 1), m ; 1,62-1,44 ppm (H-18b, H-19b и H-20, 4), m, (в: 1,57 ppm (H-18b, 1), m ; 1,56 ppm (H-20a, 1), m ; 1,515 ppm (H-20b, 1), m ; 1,51 ppm (H-19b, 1) m );
13C ЯМР (125,8 МГц): 157,76 ppm (C-3), 140,77 ppm (C-1), 137,20 ppm (C-14), 127,51 ppm (C-5), 125,96 pm (C-2), 119,33 ppm (C-6), 114,85 ppm (C-15), 110,75 ppm (C-4), 98,91 ppm (C-17); 86,66 ppm (C-9), 80,57 ppm (C-8), 66,03 ppm (C-12), 62,32 ppm (C-21), 62,24 ppm (C-7), 55,91 ppm (C-16); 30,77 ppm (C-18), 29,56 ppm (C-13), 28,83 ppm (C-11), 25,58 ppm (C-20), 19,63 ppm (C-19), 15,93 ppm (C-10).
2e.) Получение [(1S)-1-(2-аллил-3-метоксифенил)-6-тетрагидропиран-2-илоксигекс-2-ин-1-окси]трет-бутилдиметилсилана (MPK-4)

Неочищенный MPK-3, полученный на предыдущей стадии (теоретическое количество 1253 г), растворяли в 10 л толуола и к раствору добавляли 409 г имидазола. Реакционную смесь охлаждали до 5-10°C и добавляли 2,02 л трет-бутилдиметилхлорсилана (TBDMS-Cl) в 50% растворе толуола. Смесь перемешивали при комнатной температуре. В конце реакции к смеси добавляли воду и нерастворимые примеси отфильтровывали. Отфильтрованный остаток промывали толуолом, фазы фильтрата разделяли, органическую фазу выпаривали. Неочищенный продукт очищали посредством хроматографии на колонке с силикагелем с использованием смеси гексан:этилацетат в качестве элюента.
Выход: 1515 г (91%) светло-коричневого масла.
Данные ЯМР:
(CDCl3), 1H ЯМР (500 МГц): 7,27 ppm (H-6, 1), m (d/dd), J=8,0 Гц и 1,0 Гц, 7,21 ppm (H-5, 1), t, J= 8,0 Гц; 6,81 ppm (H-4, 1), d(dd), J= 8,1 Гц и 0,7 Гц; 5,95 ppm (H-14, 1), dddd, J= 16,9 Гц, 10,3 Гц, 6,4 Гц и 5,4 Гц; 5,575 ppm (H-7, 1), t, J=1,7 Гц; 5,00-4,90 ppm (H-15, 2), m, (в: 4,97 ppm (H-15a, 1), dq, J~10,2 Гц и 1,6 Гц; 4,94 ppm (H-15b, 1), dq, J~16,9 Гц и 1,8 Гц); 4,55 ppm (H-17, 1), m ; 3,87-3,73 ppm (H-12 два диастереомера, H-16 и H-21a, 5), m, (в: 3,83 ppm (H-21a, 1), m ; 3,81 ppm (H-16, 3), s; 3,780 ppm и 3,778 ppm (H-12a, 1), dt, J=9,8 Гц и 6,3 Гц); 3,61 ppm (H-13a, 1), ddt, J=15,6 Гц, 5,2 Гц и 1,8 Гц; 3,55-3,38 ppm (H-12b, H-13b и H-21b, 3), m, (в: 3,505 ppm (H-13b, 1), m (dd), J=15,6 Гц и 6,4 Гц; 3,46 ppm (H-21b, 1), m ; 3,42 ppm (H-12b, 1), dt, J=9,8 Гц и 6,3 Гц); 2,295 ppm (H-10, 2), m (td), J=7,2 Гц и 1,9 Гц; 1,86-1,73 ppm (H-11 и H-19a, 3), m, (в: 1,805 ppm (H-19a, 1), m ; 1,77 ppm (H-11, 2), tt (qui), J=6,7 Гц); 1,68 ppm (H-18a, 1), m ; 1,64-1,45 ppm (H-18b, H-19b és H-20, 4), m, (в: 1,56 ppm (H-20a, 1), m ; 1,55 ppm (H-18b, 1), m ; 1,51 ppm (H-20b, 1), m ; 1,50 ppm (H-19b, 1) m ); 0,91 ppm (H-24, H-25 и H-26, 9), m (s), 0,12 ppm (H-22/H-23, 3), s, 0,09 ppm (H-23/H-22, 3), s.
13C ЯМР (125,8 МГц): 157,47 ppm (C-3), 142,27 ppm (C-1), 136,71 ppm (C-14), 127,20 ppm (C-5), 124,75 pm (C-2), 118,64 ppm (C-6), 114,61 ppm (C-15), 109,88 ppm (C-4), 98,95 ppm (C-17); 85,12 ppm (C-9), 81,51 ppm и 81,50 ppm (C-8), 66,15 ppm и 66,13 ppm (C-12), 62,45 ppm (C-21), 62,30 ppm (C-7), 55,81 ppm (C-16); 30,79 ppm (C-18), 29,58 ppm (C-13), 28,86 ppm и 28,84 (C-11), 25,99 ppm (C-25, C-26 и C-27, 3), 25,60 ppm (C-20), 19,67 ppm (C-19), 18,45 ppm (C-24), 15,93 ppm (C-10), -4,36 ppm (C-22/C-23), -4,69 ppm (C-23/C-22).
2f.) Получение (9R)-9-[трет-бутил(диметил)силил]окси-5-метокси-1-(3-тетрагидропиран-2-илоксипропил)-3,3a,4,9-тетрагидроциклопента[b]нафталин-2-она
(MPK-5)

В 11,5 л диметоксиэтана в инертной атмосфере растворяли 1427 г MPK-4, а затем добавляли 1070 г октакарбонила дикобальта. Реакционную смесь перемешивали при комнатной температуре в течение 2,5 часов, затем ее нагревали до 60-70°C и перемешивали в течение 3 часов. В конце реакции через смесь барботировали воздух. Барботирование продолжали в течение ночи. Реакционную смесь затем фильтровали, промывали этилацетатом и выпаривали. Неочищенный продукт очищали посредством хроматографии на колонке с силикагелем с использованием смеси гексан:диизопропиловый эфир в качестве элюента.
Выход: 1363 г (90%) светло-коричневого масла.
Данные ЯМР:
(CDCl3), 1H ЯМР (500 МГц): 7,22 ppm (H-22, 1), t, J= 7,9 Гц; 6,96-6,87 ppm (H-23, 1), m (в: 6,93 ppm (H-23, 0,5) d, J=7,7 Гц; 6,90 ppm (H-23, 0,5), d, J=7,7 Гц); 6,78 ppm (H-21, 1), d, J= 8,1 Гц; 5,55 ppm (H-7, 0,5), s; 5,21 ppm (H-7, 0,5), s; 4,50 ppm (H-24, 0,5), m (dd), J=4,1 Гц и 2,9 Гц; 4,26 ppm (H-24, 0,5), m (dd), J=4,1 Гц и 2,9 Гц; 3,84-3,74 ppm (H-2, H-28, 3,5), m (в: 3,81 ppm (H-2, 3), s; 3,78 ppm (H-28, 0,5), m (ddd), J=11,3 Гц, 8,2 Гц и 3,2 Гц); 3,70 ppmn (H-28, 0,5), ddd, J=11,3 Гц, 8,0 Гц и 3,2 Гц; 3,66-3,55 ppm (H-15a, 1), m (в: 3,63 ppm (H-15a, 0,5), dt, J=9,9 Гц и 5,3 Гц; 3,58 ppm (H-15a, 0,5), ddd, J=9,9 Гц, 7,4 Гц и 5,6 Гц); 3,55-3,47 ppm (H-4a, 1), m (в: 3,52 ppm (H-4a, 0,5), dd, J=17,1 Гц и 7,4 Гц; 3,51 ppm (H-4a, 0,5), dd, J=17,0 и 7,4 Гц); 3,43-3,27 ppm (H-9, H-15b, H-28b, 2,5), m (в: 3,38 ppm (H-28b, 1), m ; 3,35 ppm (H-9, 1), m ; 3,315 ppm (H-15b, 0,5), m (dt), J=9,9 Гц и 5,9 Гц); 3,06 ppm (H-15b, 0,5), ddd, J=9,5 Гц, 8,6 Гц и 4,8 Гц; 2,745-2,65 ppm (H-10a, 1), m (в: 2,702 ppm (H-10a, 0,5), dd, J=18,8 Гц и 6,4 Гц; 2,700 ppm (H-10a, 0,5), dd, J=18,8 Гц и 6,4 Гц); 2,46-2,30 ppm (H-13, 2), m (в: 2,42 ppm (H-13a, 0,5), m ; 2,40 ppm (H-13a, 0,5), m ; 2,385 ppm (H-13b, 0,5), m ; 2,34 ppm (H-13b, 0,5), m ); 2,25-2,18 ppm (H-10b, 1), m (в: 2,212 ppm (H-10b, 0,5), dd, J=18,8 Гц и 1,3 Гц; 2,210 ppm (H-10b, 0,5), dd, J=18,8 Гц и 1,3 Гц); 2,175-2,07 ppm (H-4b, 1), m (в: 2,13 ppm (H-4b, 0,5), dd, J=17,1 Гц и 8,9 Гц; 2,115 ppm (H-4b, 0,5), dd, J=17,1 и 8,9 Гц); 1,875-1,72 ppm (H-14a и H-26, 2), m (в: 1,80 ppm (H-26, 1), m ; 1,78 ppm (H-14a, 0,5), m ; 1,75 ppm (H-14a, 0,5), m ); 1,72-1,58 ppm (H-14b и H-25a, 2), m (в: 1,64 ppm (H-25a, 1), m ; 1,63 ppm (H-14b, 1), m ); 1,58-1,38 ppm (H-25b, H-26b и H-27, 4), m (в: 1,53 ppm (H-25b, 1), m ; 1,51 ppm (H-27b, 1) m ; 1,48 ppm (H-26b, 1), m ; 1,41 ppm (H-27b, 1), m ); 0,82 ppm (H-32, H-33 и H-34, 9), s; 0,16-0,12 ppm (H-29/H-30, 3), m (s) (в: 0,143 ppm (H-29/H-30, 1,5), s; 0,135 ppm (H-29/H-30, 1,5), s); 0,10-0,055 ppm (H-30/H-29, 3), m (в: 0,082 ppm (H-30/H-29, 1,5), s, 0,077 ppm (H-30/H-29, 1,5), s, 13C ЯМР (125,8 МГц): 209,78 ppm (C-11), 173,52 ppm и 173,25 ppm (C-8), 156,95 ppm и 156,92 ppm (C-3), 138,43 ppm и 138,36 ppm (C-6), 136,94 ppm и 136,64 ppm (C-12), 127,45 ppm и 127,39 ppm (C-22), 125,11 pm и 125,10 ppm (C-5), 122,25 ppm и 122,12 ppm (C-23), 109,32 ppm и 109,31 ppm (C-21), 98,82 ppm и 98,73 ppm (C-24), 66,64 ppm и 65,97 ppm (C-15), 65,34 ppm и 65,23 ppm (C-7), 62,36 ppm и 62,26 ppm (C-28), 55,45 ppm (C-2); 42,32 ppm и 42,29 ppm (C-10), 33,76 ppm и 33,50 ppm (C-4), 32,33 ppm и 32,31 ppm (C-9), 30,87 ppm и 30,84 ppm (C-25), 28,56 ppm и 28,21 ppm (C-14), 25,77 ppm (C-32, C-33 и C-34, 3), 25,58 ppm (C-27), 19,80 ppm и 19,68 ppm (C-26), 18,21 ppm и 18,20 ppm (C-31), -4,01 ppm и -4,03 ppm (C-29/C-30), -4,15 ppm (C-30/C-29).
2g.) Получение (9aS)-5-метокси-1-(3-тетрагидропиран-2-илоксипропил)-1,3,3a,4,9,9a-гексагидроциклопента[b]нафт-2-она (MPK-6)

1363 г MPK-5 растворяли в 5,5 л этилового спирта, добавляли 60 г карбоната калия и 480 г 10% катализатора Pd(C) и после соответствующей инертизации реакционную смесь перемешивали под давлением водорода 6 бар при комнатной температуре. В конце реакции катализатор отфильтровывали, промывали этиловым спиртом и отфильтрованный раствор выпаривали. Неочищенный продукт очищали посредством хроматографии на колонке с силикагелем с использованием смеси гексан:этилацетат в качестве элюента.
Выход: 703 г (70%) светло-коричневого масла.
Данные ЯМР:
(CDCl3), 1H ЯМР (500 МГц): 7,10 ppm (H-22, 1), t, J=7,9 Гц, 6,74-6,64 ppm (H-21 и H-23, 2), m (в: 6,69 ppm (H-21, 1) d, J~8,4 Гц; 6,71 ppm (H-23, 1), d, J~8,3 Гц), 4,60 ppm (H-24, 1), m (dd), J=4,1 Гц и 3,0 Гц; 3,93-3,76 ppm (H-2, H-15a и H-28a, 5), m (в: 3,87 ppm (H-28a, 1), m ; 3,82 ppm (H-2, 3), s; 3,805 ppm (H-15a, 1), m ), 3,575-3,335 ppm (H-15b и H-28b, 2), m (в: 3,51 ppm (H-28b, 1), m ; 3,44 ppm (H-15b, 1), m ), 2,95 ppm (H-4a, 1), m (dd), J=18,3 Гц и 7,4 Гц, 2,80 ppm (H-4b, 1), d, J=18,2 Гц; 2,77-2,625 ppm (H-7a и H-9, 2), m (в: 2,74 ppm (H-7a, 0,5), m (dd), J=16,7 Гц и 5,9 Гц; 2,73 ppm (H-7a, 0,5), m (dd), J=16,7 Гц и 5,9 Гц; 2,68 ppm (H-9, 1), m ), 2,56 ppm (H-8, 1), m (tt/qui), J=5,9 Гц и 5,5 Гц, 2,50-2,37 ppm (H-10a и H-12, 2), m (в: 2,44 ppm (H-10a, 1), dd, J=18,8 Гц и 8,2 Гц; 2,41 ppm (H-12, 1), m (ddd), J=5,5 Гц), 2,23 ppm (H-7b, 1), dd, J=16,5 Гц и 11,7 Гц, 2,00-1,79 ppm (H-10b, H-13a и H-26a, 3), m (в: 1,93 ppm (H-10b, 1), dd, J=18,9 Гц и 12,1 Гц; 1,905 ppm (H-13a, 1), m ; 1,84 ppm (H-26a, 1), m ), 1,79-1,64 ppm (H-14 и H-25a, 3), m (в: 1,79 ppm (H-25a, 1), m ; 1,76 ppm (H-14a, 1), m ; 1,71 ppm (H-14b, 1), m ), 1,64-1,39 ppm (H-13b, H-25b, H-26b и H-27, 5), m (в: 1,59 ppm (H-25b, 1), m ; 1,57 ppm (H-27a, 1), m ; 1,53 ppm (H-26b, 1), m ; 1,52 ppm (H-27b, 1), m ; 1,45 ppm (H-13b, 1), m ), 13C ЯМР (125,8 МГц): 219,34 ppm (C-11), 157,72 ppm (C-3), 136,06 и 136,04 ppm (C-6) 126,29 ppm (C-22), 123,37 ppm (C-5), 121,19 ppm (C-23), 107,46 ppm (C-21), 99,09 ppm и 98,96 ppm (C-24), 67,57 ppm и 67,45 ppm (C-15), 62,48 ppm (C-28), 56,82 ppm (C-12), 55,34 ppm (C-2), 41,86 ppm (C-10), 35,51 ppm (C-8), 31,69 ppm (C-9), 30,90 ppm и 30,87 ppm (C-25), 28,32 ppm и 28,28 ppm (C-14), 26,65 ppm (C-7), 25,60 ppm (C-27), 24,55 ppm (C-4), 21,48 ppm и 21,43 ppm (C-13), 19,77 ppm (C-26).
2h.) Получение (1R,2R,9aS)-5-метокси-1-(3-тетрагидропиран-2-илоксипропил)-2,3,3a,4,9,9a-гексагидро-1H-циклопента[b]нафт-2-ола (MPK-7)

703 г MPK-6 растворяли в 14 л этилового спирта, раствор охлаждали и при (-)15-(-)10°C добавляли 42 г борогидрида натрия. Реакционную смесь перемешивали. В конце реакции смесь гасили уксусной кислотой и этиловый спирт отгоняли. После добавления воды и этилацетата фазы разделяли, водную фазу экстрагировали с помощью этилацетата. Объединенную органическую фазу промывали 1 M раствором NaHCO3 и водой, высушивали, фильтровали и выпаривали. Неочищенный продукт применяли на следующей стадии без очистки.
Выход: 636 г (90%) светло-коричневого масла.
Данные ЯМР:
(CDCl3), 1H ЯМР (500 МГц): 7,125-7,04 ppm (H-22, 1), m (в: 7,09 ppm (H-22, 0,5), t, J=7,8 Гц; 7,08 ppm (H-22, 0,5), t, J=7,8 Гц); 6,79-6,71 ppm (H-21 и H-23, 2), m (в: 6,760 ppm (H-21, 0,5), m (d), J=7,6 Гц; 6,754 ppm (H-21, 0,5), m (d), J=7,6 Гц; 6,738 ppm (H-23, 0,5), m (d), J~8,3 Гц; 6,735 ppm (H-23, 0,5), m (d), J=7,8 Гц); 4,63-4,52 ppm (H-24, 1), m (в: 4,585 ppm (H-24, 0,5), m (dd), J=4,1 Гц и 3,1 Гц; 4,56 ppm (H-24, 0,5), m (dd), J=4,3 Гц и 2,9 Гц); 3,87 ppm (H-28a, 0,5), m (ddd); 3,84-3,67 ppm (H-2, H-11, H-15a и H-28a, 5,5), m (в: 3,805 ppm (H-28a, 0,5), m ; 3,80 ppm (H-2, 3), s; 3,795 ppm (H-15a, 0,5), m ; 3,75 ppm (H-15a, 0,5), m ; 3,715 ppm (H-11, 1), td, J=9,8 Гц и 6,2 Гц); 3,54-3,46 ppm (H-28b, 1), m (в: 3,50 ppm (H-28b, 0,5), m ; 3,48 ppm (H-28b, 0,5), m ); 3,46-3,36 ppm (H-15b, 1), m (в: 3,43 ppm (H-15b, 0,5), dt, J=9,6 Гц и 6,2 Гц; 3,40 ppm (H-15b, 0,5), dt, J=9,6 Гц и 6,5 Гц); 2,82-2,70 ppm (H-4a и H-7a, 2), m (в: 2,775 ppm (H-4a, 1), dd, J=14,6 Гц и 6,1 Гц; 2,746 ppm (H-7a, 0,5), m (dd), J=14,1 Гц и 6,2; 2,741 ppm (H-7a, 0,5), m (dd), J=14,3 Гц и 6,2); 2,54-2,41 ppm (H-4b и H-7b, 2), m (в: 2,497 ppm (H-4b, 0,5), m (dd), J=14,7 Гц и 6,5 Гц; 2,492 ppm (H-4b, 0,5), m (dd), J=14,7 Гц и 6,4 Гц; 2,455 ppm (H-7b, 1), dd, J=14,3 Гц и 6,4 Гц); 2,30-2,04 ppm (H-9, H-10 и OH-11, 2,5), m (в: 2,249 ppm (H-9, 0,5), m (tt), J=10,3 Гц и 6,9 Гц; 2,214 ppm (H-9, 0,5), m (tt), J=10,0 Гц и 6,8 Гц; 2,16 ppm (H-10a, 1), m (dt/ddd), J=12,0 Гц, 7,1 Гц и 6,3 Гц; 2,15 ppm (OH-11, 0,5), широкий); 2,00 ppm (OH-11, 0,5), 1,93-1,64 ppm (H-8, H-14, H-25a и H-26a, 5), m (в: 1,88 ppm (H-8, 1), m (tt), J=10,0 Гц и 6,3 Гц; 1,82 ppm (H-26a, 0,5), m ; 1,795 ppm (H-14a, 1), m ; 1,79 ppm (H-26a, 0,5), m ; 1,755 ppm (H-14b, 1), m ; 1,695 ppm (H-25a, 1), m ); 1,64-1,44 ppm (H-13, H25b, H-26b и H-27, 6), m (в: 1,58 ppm (H-13a, 1), m ; 1,565 ppm (H-25b, 1), m ; 1,56 ppm (H-13b, 1), m ; 1,555 ppm (H-27a, 1), m ; 1,53 ppm (H-26b, 0,5), m ; 1,505 ppm (H-27b, 1), m ; 1,50 ppm (H-26b, 0,5), m ); 1,38-1,20 ppm (H-12, 1), m (в: 1,32 ppm (H-12, 0,5), m, J~9,2 Гц и 6,6 Гц; 1,29 ppm (H-12, 0,5), m ; J~9,2 Гц и 6,6 Гц), 1,19-1,08 ppm (H-10, 1), m (в: 1,16 ppm (H-10b, 0,5), m (ddd), J~10,0 Гц; 1,12 ppm (H-10b, 0,5), m (ddd), J~10,0 Гц);
13C ЯМР (125,8 МГц): 156,23 ppm (C-3), 140,64 ppm и 140,55 ppm (C-6), 127,04 ppm и 127,02 ppm(C-5) 126,20 ppm (C-22), 120,58 ppm (C-23), 108,43 ppm и 108,41 ppm (C-21), 99,09 ppm и 99,07 ppm (C-24), 77,37 ppm (C-11), 68,39 ppm и 68,36 ppm (C-15), 62,52 ppm и 62,42 ppm (C-28), 55,67 ppm (C-2), 51,96 ppm (C-12), 41,61 ppm и 41,41 ppm (C-8), 41,56 ppm и 41,53 ppm (C-10), 33,81 ppm и 33,76 ppm (C-7), 32,94 ppm (C-9), 30,81 ppm и 30,76 ppm (C-25), 29,90 ppm и 29,74 ppm (C-13), 27,73 ppm и 27,66 ppm (C-14), 25,83 ppm (C-4), 25,55 ppm и 25,52 ppm (C-27), 19,79 ppm и 19,69 ppm (C-26).
2i.) Получение [(1R,9aS)-5-метокси-1-(3-тетрагидропиран-2-илоксипропил)-2,3,3a,4,9,9a-гексагидро-1H-циклопента[b]нафт-2-ил] 4-фенилбензоата (MPK-8)

В инертной атмосфере 636 г MPK-7 растворяли в 1,4 л пиридина и к раствору добавляли 508 г п-фенилбензоилхлорида. Реакционную смесь перемешивали при 50-60°C. В конце реакции добавляли воду и трет-бутилметиловый эфир, фазы разделяли, водную фазу экстрагировали с помощью трет-бутилметилового эфира. Объединенную органическую фазу последовательно промывали раствором NaHSO4, раствором K2CO3 и водой, высушивали, фильтровали и выпаривали. Неочищенный продукт очищали посредством хроматографии на силикагеле с использованием смеси гексан:этилацетат в качестве элюента.
Выход: 763 г (80%) белых кристаллов. Mp: 140-143oC.
Данные ЯМР:
(CDCl3), 1H ЯМР (500 МГц): 8,06 ppm (H-31 и H-31', 2), d, J=8,4 Гц; 7,66-7,58 ppm (H-32, H-32', H-35 и H-35', 4), m (в: 7,63 ppm (H-32 и H-32', 2), m (d), J=8,5 Гц; 7,61 ppm (H-35 и H-35', 2), m (d), J=7,3 Гц); 7,46 ppm (H-36 и H-36', 2), m (t), J=7,5 Гц; 7,39 ppm (H-37, 1), m (t), J=7,4 Гц; 7,14 ppm (H-22, 1), t, J=7,8 Гц; 6,82 ppm (H-23, 1), m (d/d широкий), J=7,4 Гц; 6,77 ppm (H-21, 1), d, J=8,2 Гц; 5,03 ppm (H-11, 1), td, J=8,4 Гц и 6,3 Гц; 4,565 ppm (H-24, 1), m ; 3,895-3,79 ppm (H-2 и H-28a, 4), m (в: 3,85 ppm (H-28a, 1), m ; 3,82 ppm (H-2, 3), s); 3,79-3,72 ppm (H-15a, 1), m (в: 3,758 ppm (H-15a, 0,5), dt, J=9,7 Гц и 6,6 Гц; 3,752 ppm (H-15a, 0,5), dt, J=9,7 Гц и 6,5 Гц); 3,48 ppm (H-28b, 1), m ; 3,45-3,375 ppm (H-15b, 1), m (в: 3,416 ppm (H-15b, 0,5), dt, J=9,6 Гц и 6,6 Гц; 3,410 ppm (H-15b, 0,5), dt, J=9,6 Гц и 6,4 Гц); 2,95-2,81 ppm (H-4a и H-7a, 2), m (в: 2,91 ppm (H-4a, 1), dd, J=14,9 Гц и 6,2 Гц; 2,85 ppm (H-7a, 1), dd, J=14,5 Гц и 6,3); 2,635-2,34 ppm (H-4b, H-7b, H-9 и H-10a, 4), m (в: 2,589 ppm (H-7b, 0,5), m (dd), J=14,4 Гц и 6,9 Гц; 2,587 ppm (H-7b, 0,5), m (dd), J=14,6 Гц и 7,0 Гц; 2,535 ppm (H-4b, 1), dd, J=14,9 Гц и 7,2 Гц; 2,48 ppm (H-10a, 1), m (ddd), J=6,4 Гц; 2,40 ppm (H-9, 1), m, J~7,7 Гц); 2,03 ppm (H-8, 1), m (tt), J=9,1 Гц и 6,8 Гц; 1,88-1,45 ppm (H-12, H-13, H-14, H-25, H-26 и H-27, 11), m (в: 1,83 ppm (H-12, 1), m ; 1,81 ppm (H-26a, 1), m ; 1,77 ppm (H-14a, 1), m ; 1,74 ppm (H-14b, 1), m ; 1,69 ppm (H-25a, 1), m ; 1,63 ppm (H-13a, 1), m ; 1,60 ppm (H-13b, 1), m ; 1,57 ppm (H-25b, 1), m ; 1,55 ppm (H-27a, 1), m ; 1,51 ppm (H-27b, 1), m ; 1,50 ppm (H-26b, 1), m ); 1,385 ppm (H-10b, 1), dt, J=12,3 Гц и 8,7 Гц; 13C ЯМР (125,8 МГц): 166,44 ppm (C-29), 156,64 ppm (C-3), 145,64 ppm (C-33), 140,26 ppm (C-6); 140,21 ppm (C-34),130,20 ppm (C-31 és C-31', 2), 129,44 ppm (C-30), 129,03 ppm (C-36 и C-36', 2), 128,21 ppm (C-37), 127,39 ppm (C-35 и C-35', 2), 127,12 ppm (C-32 и C-32', 2), 126,83 ppm (C-5), 126,33 ppm (C-22), 120,58 ppm и 120,57 ppm (C-23),108,42 ppm (C-21), 99,02 ppm (C-24), 80,04 ppm и 80,00 ppm
(C-11), 67,88 ppm и 67,84 ppm (C-15), 62,51 ppm и 62,49 ppm (C-28), 55,65 ppm (C-2), 49,58 ppm (C-12), 41,00 ppm и 40,99 ppm (C-8), 38,00 ppm (C-10), 33,85 ppm (C-9), 33,80 ppm (C-7), 30,89 ppm и 30,88 ppm (C-25), 29,61 ppm и 29,58 ppm (C-13), 27,91 ppm и 27,89 ppm (C-14), 25,92 ppm (C-4), 25,61 ppm (C-27), 19,81 ppm и 19,80 ppm (C-26).
2j.) Получение [(1R,2R,9aS)-1-(3-гидроксипропил)-5-метокси-2,3,3a,4,9,9a-гексагидро-1H-циклопента[b]нафт-2-ил] 4-фенилбензоата (MPK-9)

574 г MPK-8 растворяли в 1,2 л тетрагидрофурана. Добавляли 4,6 л метанола, а затем аккуратно добавляли смесь 145 мл конц. хлористоводородной кислоты и 145 мл воды. В конце реакции смесь гасили 1 M раствором NaHCO3 и растворители отгоняли. Остаточную водную фазу экстрагировали с помощью этилацетата, объединенную органическую фазу промывали водой, высушивали, фильтровали и выпаривали. Выпаренный неочищенный продукт очищали посредством хроматографии на силикагеле.
Выход: 376 г (78%) бесцветного масла.
Данные ЯМР:
(CDCl3), 1H ЯМР (500 МГц): 8,05 ppm (H-31 и H-31', 2), d, J=8,4 Гц; 7,67-7,57 ppm (H-32, H-32', H-35 и H-35', 4), m (в: 7,63 ppm (H-32 и H-32', 2), m (d), J=8,4 Гц; 7,605 ppm (H-35 и H-35', 2), m (d), J=7,2 Гц); 7,46 ppm (H-36 и H-36', 2), m (t), J=7,5 Гц; 7,39 ppm (H-37, 1), m (t), J=7,3 Гц; 7,14 ppm (H-22, 1), t, J=7,8 Гц; 6,81 ppm (H-23, 1), d, J=7,4 Гц; 6,78 ppm (H-21, 1), d, J=8,2 Гц; 5,05 ppm (H-11, 1), td, J=8,3 Гц и 6,3 Гц; 3,82 ppm (H-2, 3), s, 3,66 ppm (H-15, 2), m ; 2,94-2,80 ppm (H-4a и H-7a, 2), m (в: 2,90 ppm (H-4a, 1), dd, J=14,9 Гц и 6,1 Гц; 2,845 ppm (H-7a, 1), dd, J=14,5 Гц и 6,3); 2,63-2,50 ppm (H-4b и H-7b, 2), m (в: 2,58 ppm (H-7b, 1), dd, J=14,6 Гц и 6,8 Гц; 2,55 ppm (H-4b, 1), dd, J=15,0 Гц и 7,0 Гц); 2,50-2,35 ppm (H-9 и H-10a, 2), m (в: 2,465 ppm (H-10a, 1), m (ddd), J=12,3 Гц, 7,6 Гц и 6,3 Гц; 2,40 ppm (H-9, 1), m, J~7,6 Гц); 2,03 ppm (H-8, 1), m (tt), J=8,9 Гц и 6,9 Гц, 1,81 ppm (H-12, 1), m (tt), J=8,2 Гц и 6,7 Гц; 1,77-1,45 ppm (H-13 и H-14, 4), m (в: 1,73 ppm (H-14a, 1), m ; 1,70 ppm (H-14b, 1), m ; 1,625 ppm (H-13a, 1), m ; 1,60 ppm (H-13b, 1), m ), 1,39 ppm (H-10b, 1), dt, J=12,2 Гц и 8,6 Гц,
13C ЯМР (125,8 МГц): 166,50 ppm (C-29), 156,66 ppm (C-3), 145,72 ppm (C-33), 140,16 ppm (C-6 и C-34, 2); 130,20 ppm (C-31 и C-31', 2), 129,33 ppm (C-30), 129,04 ppm (C-36 и C-36', 2), 128,24 ppm (C-37), 127,39 ppm (C-35 и C-35', 2), 127,16 ppm (C-32 и C-32', 2), 126,78 ppm (C-5), 126,37 ppm (C-22), 120,58 ppm (C-23), 108,45 ppm (C-21), 79,86 ppm (C-11), 63,29 ppm (C-15), 55,65 ppm (C-2), 49,36 ppm (C-12), 40,96 ppm (C-8), 37,98 ppm (C-10), 33,76 ppm (C-9), 33,69 ppm (C-7), 30,77 ppm (C-14), 28,98 ppm (C-13), 25,88 ppm (C-4).
2k.) Получение [(1R,9aS)-5-метокси-1-(3-оксопропил)-2,3,3a,4,9,9a-гексагидро-1H-циклопента[b]нафт-2-ил] 4-фенилбензоата (MPK-10)

В инертной атмосфере 140 мл оксалилхлорида растворяли в 4,2 л дихлорметана. Раствор охлаждали до (-)-60°C и добавляли 227 мл раствора диметилсульфоксида в 1130 мл дихлорметана, а затем, после перемешивания, добавляли 376 г MPK-9 в 690 мл раствора дихлорметана. Перемешивание продолжали до (-)-60°C. В конце реакции смесь гасили путем добавления 830 мл триэтиламина. Смесь перемешивали в течение 1 часа без охлаждения, затем температуру повышали до 10°C и добавляли 1 M раствор NaHSO4. Водную фазу экстрагировали с помощью дихлорметана, объединенную органическую фазу промывали водой, высушивали и выпаривали. Неочищенный продукт вначале очищали посредством хроматографии на колонке с силикагелем с использованием смеси гексан:этилацетат в качестве элюента, затем путем кристаллизации из смеси толуол:гексан.
Выход: 374 г (100%) белых кристаллов. Mp: 94-96°C.
Данные ЯМР:
(CDCl3), 1H ЯМР (500 МГц): 9,78 ppm (H-15, 1), t, J=1,3 Гц; 8,05 ppm (H-31 и H-31', 2), m (d), J=8,5 Гц; 7,68-7,57 ppm (H-32, H-32', H-35 и H-35', 4), m (в: 7,64 ppm (H-32 и H-32', 2), m (d), J=8,5 Гц; 7,61 ppm (H-35 и H-35', 2), m (d), J=7,0 Гц); 7,46 ppm (H-36 и H-36', 2), m (t), J=7,6 Гц; 7,39 ppm (H-37, 1), m (t), J=7,4 Гц; 7,15 ppm (H-22, 1), t, J=7,8 Гц, 6,82 ppm (H-23, 1), d, J=7,4 Гц; 6,78 ppm (H-21, 1), d, J=8,2 Гц, 5,02 ppm (H-11, 1), td, J=8,3 Гц и 6,3 Гц; 3,82 ppm (H-2, 3), s; 2,935-2,79 ppm (H-4a и H-7a, 2), m (в: 2,865 ppm (H-4a, 1), dd, J=14,9 Гц и 6,1 Гц; 2,835 ppm (H-7a, 1), dd, J=14,4 Гц и 6,3); 2,65-2,53 ppm (H-4b, H-7b и H-14, 4), m (в: 2,61 ppm (H-14, 2), ddd, J=7,6 Гц, 6,5 Гц и 1,1 Гц; 2,576 ppm (H-7b, 1), dd, J=14,5 Гц и 6,3 Гц; 2,568 ppm (H-4b, 1), dd, J=14,9 Гц и 6,5 Гц); 2,53-2,36 ppm (H-9 и H-10β, 2), m (в: 2,485 ppm (H-10β, 1), ddd, J=12,1 Гц, 7,6 Гц и 6,4 Гц; 2,42 ppm (H-9, 1), m ); 2,075-1,89 ppm (H-8 и H-13a, 2), m (в: 2,02 ppm (H-8, 1), m, 1,94 ppm (H-13a, 1), m ); 1,85-1,73 ppm (H-12 и H-13b, 2), m (в: 1,80 ppm (H-14b, 1), m ; 1,79 ppm (H-12, 1), m ); 1,345 ppm (H-10α, 1), dt, J=12,2 Гц и 8,8 Гц, 13C ЯМР (125,8 МГц): 202,22 ppm (C-15), 166,33 ppm (C-29), 156,71 ppm (C-3), 145,85 ppm (C-33), 140,11 ppm (C-34); 139,82 ppm (C-6), 130,20 ppm (C-31 и C-31', 2), 129,11 ppm (C-30), 129,06 ppm (C-36 и C-36', 2), 128,28 ppm (C-37), 127,40 ppm (C-35 и C-35', 2), 127,21 ppm (C-32 и C-32', 2), 126,60 ppm (C-5), 126,46 ppm (C-22), 120,66 ppm (C-23), 108,54 ppm (C-21), 79,48 ppm (C-11), 55,65 ppm (C-2), 48,70 ppm (C-12), 41,95 ppm (C-14), 40,79 ppm (C-8), 37,91 ppm (C-10), 33,53 ppm (C-9), 33,29 ppm (C-7), 25,73 ppm (C-4), 24,69 ppm (C-13).
2l1.) Получение [(1R,2R,9aS)-1-[(3S)-3-гидроксиоктил]-5-метокси-2,3,3a,4,9,9a-гексагидро-1H-циклопента[b]нафт-2-ил] 4-фенилбензоата (PPB-TREP-14)

К 4,5 л дистиллированного толуола в инертной атмосфере добавляли 7,5 г катализатора MIB*, а затем 1800 мл дипентилцинка. Смесь перемешивали при комнатной температуре. Через 1 час перемешивания добавляли раствор 300 г MPK-10 в 1,5 л дистиллированного толуола при комнатной температуре и смесь перемешивали, пока продолжалась реакция сочетания. Затем при интенсивном перемешивании реакционную смесь выливали в раствор хлористоводородной кислоты. Перемешивание продолжали до полного распада солей цинка, затем продукт экстрагировали с помощью этилацетата. Органическую фазу промывали водой и насыщенным раствором хлорида натрия, а затем выпаривали. Неочищенный продукт очищали посредством градиентной хроматографии на колонке с силикагелем с использованием смеси толуол:трет-бутилметиловый эфир в качестве элюента.
Выход: 300 г (86%) желтого масла.
Данные ЯМР:
(CDCl3), 1H ЯМР (500 МГц): 8,05 ppm (H-31 и H-31', 2), m (d), J=8,3 Гц; 7,68-7,53 ppm (H-32, H-32', H-35 и H-35', 4), m (в: 7,63 ppm (H-32 и H-32', 2), m (d), J=8,3 Гц; 7,605 ppm (H-35 и H-35', 2), m (d), J=7,5 Гц), 7,46 ppm (H-36 и H-36', 2), m (t), J=7,6 Гц, 7,39 ppm (H-37, 1), m (t), J=7,3 Гц, 7,14 ppm (H-22, 1), t, J=7,8 Гц, 6,82 ppm (H-23, 1), d, J=7,4 Гц; 6,78 ppm (H-21, 1), d, J=8,2 Гц, 5,05 ppm (H-11, 1), td, J=8,2 Гц и 6,4 Гц, 3,82 ppm (H-2, 3), s, 3,61 ppm (H-15, 1), m ; 2,955-2,80 ppm (H-4a и H-7a, 2), m (в: 2,905 ppm (H-4a, 1), dd, J=14,9 Гц и 6,1 Гц; 2,85 ppm (H-7a, 1), dd, J=14,5 Гц и 6,3), 2,66-2,51 ppm (H-4b и H-7b, 2), m (в: 2,585 ppm (H-7b, 1), dd, J=14,5 Гц и 6,8 Гц; 2,54 ppm (H-4b, 1), dd, J=15,1 Гц и 7,0 Гц), 2,51-2,35 ppm (H-9 и H-10a, 2), m (в: 2,47 ppm (H-10a, 1), ddd, J=12,3 Гц, 7,6 Гц и 6,4 Гц; 2,41 ppm (H-9, 1), m ), 2,03 ppm (H-8, 1), m (tt), J=9,0 Гц и 6,8 Гц, 1,81 ppm (H-12, 1), m, 1,75-1,48 ppm (H-13 и H-14, 4), m (в: 1,675 ppm (H-13a, 1), m ; 1,62 ppm (H-14a, 1), m ; 1,59 ppm (H-13b, 1), m ; 1,545 ppm (H-14b, 1), m ); 1,48-1,33 ppm (H-10b, H-16, H-17a и OH-15, 5), m (в: 1,43 ppm (H-16a, 1), m ; 1,41 ppm (H-17a, 1), m ; 1,40 ppm (H-16b, 1), m ; 1,39 ppm (H-10b, 1), m ), 1,33-1,17 ppm (H-17b, H-18 и H-19, 5), m (в: 1,28 ppm (H-19, 2), m ; 1,27 ppm (H-17b, 1), m ; 1,26 ppm (H-18, 2), m ), 0,86 ppm (H-20, 3), m (t), J=6,8 Гц,
13C ЯМР (125,8 МГц): 166,46 ppm (C-29), 156,67 ppm (C-3), 145,70 ppm (C-33), 140,21 ppm/140,14 ppm (C-6/C-34), 130,20 ppm (C-31 и C-31', 2), 129,39 ppm (C-30), 129,04 ppm (C-36 и C-36', 2), 128,24 ppm (C-37), 127,40 ppm (C-35 и C-35', 2), 127,13 ppm (C-32 и C-32', 2), 126,82 ppm (C-5), 126,36 ppm (C-22), 120,60 ppm (C-23), 108,45 ppm (C-21), 79,83 ppm (C-11), 73,13 ppm (C-15), 55,66 ppm (C-2), 49,41 ppm (C-12), 40,94 ppm (C-8), 38,03 ppm (C-10), 37,55 ppm (C-16), 35,11 ppm (C-14), 33,78 ppm (C-9), 33,67 ppm (C-7), 32,02 ppm (C-18), 28,53 ppm (C-13), 25,92 ppm (C-4), 25,43 ppm (C-17), 22,76 ppm (C-19), 14,16 ppm (C-20).
катализатор *MIB: (2S)-3-экзо-(морфолино)изоборнеол, M: 239,35, C14H25NO2

Получение дипентилцинка
К 550 г вазелина добавляли 267 г сплава цинк-медь (10% меди, 90% цинка). В инертной атмосфере смесь нагревали примерно до 60°C, затем начинали перемешивание и смесь нагревали до 160°C. При непрерывном нагревании с обратным холодильником и интенсивном охлаждении добавляли смесь 188 мл 1-пентилйодида и 186 мл 1-пентилбромида. После добавления перемешивание продолжали в течение 1 часа, поддерживая при этом температуру. Затем смесь охлаждали примерно до 60°C. Продукт отгоняли при внутренней температуре 110-150°C в вакууме 0,5-1,5 мбар.
2l.2) Получение [(1R,2R,9aS)-1-[(3S)-3-гидроксиоктил]-5-метокси-2,3,3a,4,9,9a-гексагидро-1H-циклопента[b]нафт-2-ил] 4-фенилбензоата (PPB-TREP-14)
В 16 мл дихлорметана растворяли 1,3 мл Ti(OiPr)4 и после охлаждения до
(-)70°C к смеси добавляли 1,1 мл (2,2 ммоль) пентилмагния бромида
(2 M раствор в диэтиловом эфире). В 4 мл дихлорметана растворяли 100 мг (0,22 ммоль) MPK-10, 10 мг (R)-(+)-1,1′-Bi(2-нафтола) и 0,4 мл Ti(OiPr)4, раствор охлаждали до 0/+5°C и к нему добавляли раствор реагента пентилмагния бромида. Перемешивание продолжали при 0/+5°C. В конце реакции аккуратно добавляли 2 мл смеси 1:1 хлористоводородной кислоты-воды. Фазы разделяли, органическую фазу промывали 5 мл воды, высушивали и выпаривали. Неочищенный продукт содержал
0-20% изомера 15-эпи-PPB-TREP-14. Продукт очищали посредством хроматографии на силикагеле с использованием смеси гексан:этилацетат в качестве элюента.
Выход: 90 мг (77%) желтого масла.
2m.) Получение
(1R,2R,3aS,9aS)-1-[(3S)-3-гидроксиоктил]-5-метокси-2,3,3a,4,9,9a-гексагидро-1H-циклопента[b]нафт-2-ола (TREP-14)

В 1 л тетрагидрофурана растворяли 250 г PPB-TREP-14, к раствору добавляли 2,5 л метанола и 150 г карбоната калия и смесь перемешивали при 45°C. В конце реакции pH смеси регулировали до 2-4 разбавленной фосфорной кислотой, осажденные кристаллы отфильтровывали и промывали метанолом. Отфильтрованный раствор концентрировали, к концентрированному продукту добавляли раствор этилацетата, фазы разделяли, водную фазу экстрагировали с помощью этилацетата, объединенную органическую фазу промывали раствором хлорида натрия и выпаривали. Неочищенный продукт очищали посредством хроматографии на колонке с силикагелем с использованием смеси гексан:этилацетат в качестве элюента. Выпаренную основную фракцию кристаллизовали в смеси диизопропиловый эфир:гексан.
Выход: 125 г (76%) белых кристаллов. Mp: 71-72°C.
Реферат
В настоящем изобретении представлен новый способ получения трепростинила формулы (I) и его солей с использованием нескольких новых промежуточных соединений в ходе построения кольцевой системы, как указано в п. 1 формулы. Изобретение относится к новому соединению – моногидрату натриевой соли трепростинила формулы (I). 17 н. и 37 з.п. ф-лы, 22 ил., 1 табл., 2 пр.I
Формула


































Комментарии