Фенольные соединения, производные диалкоксиэтаналей и способ их получения - RU2257372C2
Код документа: RU2257372C2
Описание
Настоящее изобретение касается новых фенольных соединений, являющихся производными диалкоксиэтаналей, способа их получения и их применения.
Ценность новых фенольных соединений-производных диалкоксиэтаналей двойная. Во-первых, можно получать новые фенольные соединения с защищенной альдегидной группой, которые могут быть использованы в качестве промежуточных продуктов синтеза. Во-вторых, можно получать сшивающие агенты фенольного типа, но с тем преимуществом, что в процессе их синтеза или их использования они не выделяют формальдегид. Чтобы иметь представление о пользе таких сшивающих агентов, можно обратиться к обзору по фенольным смолам, опубликованному в энциклопедии Kirk-Othmer, vol.18, 4eme edition, Wiley Interscience, 1996, р.603-644.
Таким образом, объектом изобретения являются новые фенольные соединения, производные диалкоксиэтаналей, формулы(I)

в которой:
- R обозначает диалкоксиметильную группу, содержащую от 3 до 17 атомов углерода, 1,3-диоксолан-2-ил, возможно, замещенный в положениях 4 и/или 5 одной или несколькими алкильными группами, содержащими от 1 до 8 атомов углерода, или 1, 3-диоксан-2-ил, возможно, замещенный в положениях 4, и/или 5, и/или 6 одной или несколькими алкильными группами, содержащими от 1 до 8 атомов углерода;
n принимает значения 1, 2 или 3 и группа или группы

находятся в орто-положении и/или в пара-положении по отношению к ОН группе цикла;
- m принимает значения от 0 до 4-n и Х обозначает функциональную группу, такую как гидроксил или атом галогена, такой как хлор, фтор, бром, иод, или алкильную, или алкоксильную группу, содержащую от 1 до 8 атомов углерода, или арил, содержащий от 5 до 12 атомов углерода и, в известных случаях, 1 или 2 гетероатома, такие как азот или кислород, или карбоксильную группу, или группу - CO-Y, в которой Y обозначает алкильный или алкоксильный радикал, содержащий от 1 до 8 атомов углерода, или амидогруппу, или аминогруппу, или тиольную группу, за исключением соединения 1, описанного в статье J. Gardent, J. Likforman, Recent Results Cancer Res., 1966, 22, 23-26,

а также их соли со щелочными металлами, щелочноземельными металлами и аминами.
Более конкретно, объектом настоящего изобретения являются новые фенольные соединения, производные диалкоксиэтаналей, формулы (I), в которой:
- R обозначает диалкоксиметильную группу, содержащую от 3 до 10, в частности от 3 до 7 атомов углерода, предпочтительно, диметоксиметильную или диэтоксиэтильную группу;
- n равно 2 или предпочтительно 1; группа

находится в орто-положении и/или в пара-положении по отношению к ОН группе цикла;
- m обозначает 0 или 1;
- Х обозначает гидроксильную группу, или атом галогена, такой как хлор, или алкильную группу, такую как метил, этил или трет-бутил, или алкоксигруппу, такую как метоксигруппа или этоксигруппа, или карбоксильную группу, такую как метилкарбоксилат или этилкарбоксилат.
В других предпочтительных условиях, когда присутствуют несколько групп X, они являются идентичными. Алкильные группы, содержащие от 1 до 8 атомов углерода, предпочтительно содержат от 1 до 5 атомов углерода, в частности от 1 до 3 атомов углерода.
Еще более конкретно, объектом изобретения являются новые фенольные соединения, производные диалкоксиэтаналей, общей формулы (I) и, более конкретно, следующие соединения:
- 4-(1-гидрокси-2,2-диметоксиэтил)фенол
- 2-(1-гидрокси-2, 2-диметоксиэтил)фенол
- 4-хлор-2-(1-гидрокси-2,2-диметоксиэтил)фенол
- 2-(1-гидрокси-2,2-диметоксиэтил)-4-метилфенол
- 4-трет-бутил-2-(1-гидрокси-2, 2-диметоксиэтил)фенол
- 3-(1-гидрокси-2,2-диметоксиэтил)-4-гидроксиметилбензоат.
Объектом изобретения является также способ получения фенольных соединений, производных диалкоксиэтаналей, формулы (I), а также их солей со щелочными металлами, щелочноземельными металлами и аминами, отличающийся тем, что в присутствии основания в реакцию вводят:
- фенол формулы (II)

в которой R1, R2, R3, R4 , R5 могут представлять собой гидроксил, атом галогена, такой как хлор, фтор, бром, иод, или алкильный радикал, содержащий от 1 до 8 атомов углерода, или арил или алкоксильный радикал, содержащий от 1 до 8 атомов углерода, или сложноэфирную группу, содержащую от 1 до 8 атомов углерода, или амидную группу, или аминогруппу, или тиольную группу, при условии, что по меньшей мере одно из положений, орто- или пара-, фенольного цикла должно быть замещено атомом водорода, и
- альдегид формулы (III)
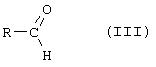
в которой R обозначает диалкоксиметил, 1,3-диоксолан-2-ил, возможно, замещенный в положениях 4 и/или 5 одной или несколькими алкильными группами, или 1, 3-диоксан-2-ил, возможно, замещенный в положениях 4, и/или 5, и/или 6 одной или несколькими алкильными группами, в результате чего получают ожидаемое соединение.
В предпочтительных условиях осуществления изобретения фенольные соединения, производные из диалкоксиэтаналей, получают следующим образом: в колбу вводят 1 моль фенола формулы (II), от 0,1 до 10 молей альдегида формулы (III) и от 0,1 до 2 молей основания. Содержимое колбы заставляют реагировать при данной температуре в течение данного времени. Получают неочищенный продукт реакции, из которого, если этого желают, выделяют ожидаемый продукт или ожидаемые продукты.
В других предпочтительных условиях осуществления изобретения в реакцию, осуществляемую в присутствии от 0,1 до 1 моля основания, на 1 моль фенола формулы II вводят от 0,1 до 5 молей альдегида формулы III.
Всегда, в описанных предпочтительных условиях осуществления изобретения, основание, необходимое для катализа реакции, должно представлять собой третичный амин, такой как трибутиламин или триэтиламин, или гидроксид щелочного металла, такой как гидроксид натрия или гидроксид калия, или карбонат щелочного металла, такой как карбонат натрия или карбонат калия.
Также в других предпочтительных условиях осуществления изобретения, альдегид формулы III может представлять собой диметоксиацетальдегид, диэтоксиацетальдегид, дибутоксиацетальдегид, 2-формил-1,3-диоксолан или 5,5-диметил-2-формил-1/3-диоксан.
Фенольные соединения, формулы (I), а также их соли со щелочными металлами, щелочноземельными металлами и аминами, являющиеся предметом настоящего изобретения, могут быть использованы предпочтительно в качестве промежуточных продуктов синтеза в фармации или в фитофармации. Равным образом, они могут служить для получения фенольных смол без формальдегида, для получения сшивающих агентов, не содержащих формальдегида, для различных субстратов, таких как целлюлозные субстраты, нетканые субстраты, найлон, полиэфир, стекло.
Наконец, объектом настоящего изобретения являются фенольные соединения, производные диалкоксиэтаналей, формулы (I), a также их соли со щелочными металлами, щелочноземельными металлами и аминами, либо в качестве промежуточного продукта синтеза, либо в качестве промежуточного продукта для получения фенольных смол без формальдегида, либо в качестве сшивающего агента, не содержащего формальдегида, для образования связей с подложкой, которая может представлять собой целлюлозную подложку, нетканую подложку, подложку из найлона, сложного полиэфира или стекла.
Примеры, следующие ниже, позволят лучше понять изобретение.
На чертеже представлено изменение модуля эластичности при изгибе в зависимости от температуры.
ПРИМЕР 1
В колбу объемом 1 л вводят
- 475,3 г (5 молей) 99%-ного фенола
- 86,7 г (0,5 моля) диметоксиэтаналя в виде 60%-ного водного раствора
- 93,4 г (0,5 моля) трибутиламина.
Реакционную смесь нагревают до 50°С и следят за протеканием реакции методом ВЭЖХ. После 24 часов реакции смесь охлаждают до комнатной температуры.
Получают 655 г неочищенного раствора, содержащего избыток фенола, трибутиламин и смесь 4-(1-гидрокси-2,2-диметоксиэтил)фенола 2 и 2-(1-гидрокси-2,2-диметоксиэтил)фенола 3 с выходами по отношению к диметоксиэтаналю 71% для п-изомера соединения 2 и 27% для о-изомера соединения 3, или с общим выходом 98%.
Можно осуществить очистку реакционной смеси, нейтрализуя эту последнюю при помощи 990 г 20%-ного водного раствора гидроксида натрия (5 молей гидроксида натрия). В таком случае получают две фазы, которые разделены.
Верхняя органическая фаза (90 г) более чем на 98% состоит из трибутиламина. Нижнюю водную фазу (1547 г) вновь подкисляют до рН 5-6 при помощи 860 г 20%-ного водного раствора НСl.
Среда декантируется в таком случае самостоятельно. Затем эту подкисленную водную фазу 2 раза экстрагируют 500 мл простого метил-трет-бутилового эфира (МТБЭ). Полученные органические фазы объединяют и концентрируют в вакууме с получением 445 г смеси ожидаемых продуктов 2 и 3 и фенола. Фенол удаляют путем высоковакуумной перегонки (5 мм рт.ст. при 50° С). Оставшуюся смесь, содержащую по меньшей мере 5% фенола, перекристаллизовывают из смеси простого изо-пропилового эфира с изо-пропанолом.
Осадок, полученный в таком случае, фильтруют, промывают простым изопропиловым эфиром и сушат, в результате чего получают 10,7 г (выход 10,2%) ожидаемого п-изомера соединения 2.
Второе выделение из маточных растворов приводит в тех же самых условиях к дополнительным 15,6 г (выход 15,8%) п-изомера соединения 2.
Анализы методами ЯМР1H, ЯМР13С и масс-спектрометрии согласуются с ожидаемым п-изомером соединения 2

Описание спектра ЯМР1H соединения 2
3,12 м. д. (с; 3Н; O-СН3)
3,30 м.д. (с; 3Н; O-СН3)
4,19 м.д. (д; J=6,6 Гц; 1Н; СН-(ОСН3)2
4,33 м.д. (дд; J=4,3 Гц и J=6,3 Гц; 1Н; СН-ОН)
5,15 м.д. (д; J=4,7 Гц; 1Н; СН-ОН)
6,87 м.д. (система АВ; JAB=8,6 Гц; 4Н; 4Нф)
9,31 м.д. (с; 1Н; φ -ОН)
Описание спектра ЯМР13С соединения 2
53,9 м.д.; (1 СН3; ОСН3)
54,9 м.д.; (1 СН3; ОСН3)
72,6 м.д.; (1 СН; СН-ОН)
107,4 м.д.; (1Н; СН-(ОСН3)2)
114,5 м.д.; (2 СН; 2 СНφ в орто-положении от Сч-ОН)
128,5 м.д.; (2 СН; 2 СНφ в мета-положении от Сч-ОН)
132,2; (1 Сч; Счφ-СН)
156,4; ( Сч; Сч φ-ОН)
Температура плавления этого п-изомера соединения 2 равна 90,4° С.
Оставшиеся маточные растворы (198 г) представляют собой смесь, обогащенную о-изомером соединения 3. Эта смесь содержит 29,2% п-изомера соединения 2 и 14,5% о-изомера соединения 3. Анализ этой смеси методом ЯМР1H согласуется с присутствием о-изомера соединения 3

Описание спектра ЯМР1H соединения 3
3,17 м.д. (с; 3Н; ОСН3)
3,30 м.д. (с; 3Н; ОСН3)
4,39 м.д. (д; J-5,9 Гц; 1Н; СН-(ОСН3)2
4,86 м.д. (дд; J=5,5 Гц и J=5, 5 Гц; 1Н; СН-ОН)
5,16 м.д. (д; J=5,5 Гц; 1Н; СН-ОН)
6,76 м.д. (массив; 2Н; H1 и Н3)
7,02 м.д. (м; J=7,0 Гц и J=2,0 Гц; Н2)
7,25 м.д. (дд; J=2,0 Гц и J-8,2 Гц; Н4)
9,26 м.д. (с; 1Н; φ -ОН)
Описание спектра ЯМР13С соединения 3
54,2 м.д.; (1 СН3; ОСН3)
54,3 м.д.; (1 СН3; ОСН3)
67,4 м.д.; (1 СН; СН-ОН)
106,4 м.д.; (1Н; СН-(ОСН3)2)
115,1 м.д.; (1 СН; СНφ ; C1;
118,7 м.д.; (1 Сч; СНφ ; С3)
127,8 м.д.; (1 СН и 1 Сч; Счφ-СН и СНφ в С2)
128,4 м.д.; (1 СН; СНφ в С4)
154,6; ( Сч; Счφ-ОН)
ПРИМЕР 2
Исходя из:
- 1 моля фенола,
- 5 молей диметоксиэтаналя в виде 60%-ного водного раствора и
- 1 моля гидроксида натрия в виде 30%-ного водного раствора,
и нагревая реакционную среду в течение 5 часов при 60° С, затем охлаждая ее до комнатной температуры, получают неочищенный раствор, содержащий 58,5% 4-(1-гидрокси-2,2-диметоксиэтил)фенола 2 и 5% 2-(1-гидрокси-2, 2-диметоксиэтил)фенола 3, или в общей сложности выход продуктов 63,5% по отношению к введенному фенолу.
ПРИМЕР 3
Исходя из:
- 5 молей фенола,
- 1 моля диметоксиэтаналя в виде 60%-ного водного раствора и
- 1 моля 100%-ного гидроксида натрия в виде таблеток,
и нагревая реакционную среду в течение 2 часов в колбе с обратным холодильником, получают неочищенный раствор, содержащий 35% 4-(1-гидрокси-2,2-диметоксиэтил)фенола 2 и 44% 2-(1-гидрокси-2,2-диметоксиэтил)фенола 3, или в общей сложности выход продуктов 79% по отношению к введенному диметоксиэтаналю.
ПРИМЕР 4
Исходя из:
- 1 моля фенола,
- 5 молей диметоксиэтаналя в виде 60%-ного водного раствора и
- 1 моля 100%-ного гидроксида натрия в виде таблеток,
и нагревая реакционную среду в течение 3 часов в колбе с обратным холодильником, получают неочищенный раствор, содержащий 54% 4-(1-гидрокси-2,2-диметоксиэтил)фенола 2 по отношению к введенному фенолу.
ПРИМЕР 5
В колбу объемом 500 мл вводят
- 262,4 г (2 моля) п-хлорфенола
- 34,7 г (0,2 моля) диметоксиэтаналя в виде 60%-ного водного раствора
- 37,4 г (0,2 моля) трибутиламина.
Реакционную смесь нагревают до 60° С и оставляют реагировать при 60° С в течение 14 часов. Охлаждают смесь до комнатной температуры и добавляют 404 г 20%-ного водного раствора едкого натра, затем 100 мл воды.
Водную фазу экстрагируют с помощью 200 мл МТБЭ, затем второй раз с помощью 100 мл МТБЭ. Затем водную фазу нейтрализуют до рН 5 20%-ным раствором НСl и экстрагируют сначала с помощью 200 мл, а затем 100 мл МТБЭ. Полученную органическую фазу концентрируют при пониженном давлении и получают 318 г неочищенного продукта реакции. Из этого неочищенного продукта реакции при пониженном давлении отгоняют избыток хлорфенола. Тогда получают новый неочищенный продукт реакции, содержащий 26% 4-хлор-2-(1-гидрокси-2,2-диметоксиэтил)фенола 4, по отношению к введенному диметоксиэтаналю, а также остаточный хлорфенол. Соединение 4 может быть очищено путем перекристаллизации из толуола (выход кристаллизации: 61%) с получением белого твердого вещества, обладающего следующими характеристиками:

- Температура плавления: 58° С
Описание спектра ЯМР1Н соединения 4
3,21 м.д. (с; 3Н; ОСН3)
3,30 м.д. (с; 3Н; ОСН3)
4,37 м.д. (д; J=5,1 Гц; 1Н; СН-(ОСН3)2
4,86 м.д. (дд; J=5,5 Гц и J=5,1 Гц; 1Н; СН-ОН)
5,30 м.д. (д; J=5,1 Гц; 1Н; СН-ОН)
6,77 м.д. (д; J=8,6 Гц; 1Н; Н3)
7,08 м.д. (дд; J=8,6 Гц и J=2,7 Гц; 1Н; Н2)
7,26 м.д. (д; J=2,7 Гц; 1Н; H1)
9,62 м.д. (с; 1Н; φ -ОН)
Описание спектра ЯМР13С соединения 4
54,4 м.д.; (1 СН3; ОСН3)
54,5 м.д.; (1 СН3; ОСН3)
66,7 м.д.; (1 СН; СН-ОН)
106,1 м.д.; (1Н; СН-(ОСН3)2)
116,6 м.д.; (1 СН; СНφ в 3)
122,3 м.д.; (1 Сч; Счφ-C1)
127,4 м.д.; (1 СН; СНφ ; С2)
128,0 м.д.; (1 СН; СНφ ; С1)
130,2 мд; (1 Сч; Счφ-СН)
153,5; (Сч; Счφ-ОН)
ПРИМЕР 6
В колбу объемом 250 мл вводят
- 108 г (1 моль) п-крезола
- 34,7 г (0,2 моля) диметоксиэтаналя в виде 60%-ного водного раствора
- 37,4 г (0,2 моля) трибутиламина.
Реакционную смесь нагревают до 60° С и оставляют реагировать при 60° С в течение 25 часов. Охлаждают до комнатной температуры и добавляют 198,5 г 20%-ного водного раствора едкого натра. Находящуюся на поверхности воды органическую фазу, содержащую в основном трибутиламин, удаляют. Тогда полученную водную фазу 2 раза экстрагируют 100 мл МТБЭ. Затем водную фазу нейтрализуют до рН 5 20%-ным водным раствором НСl, после чего экстрагируют 100 мл МТБЭ.
После концентрирования органической фазы при пониженном давлении получают 117,5 г неочищенного продукта реакции, содержащего 2-(1-гидрокси-2,2-диметоксиэтил)-4-метилфенол 5, с выходом 36% по отношению к введенному диметоксиэтаналю, и избыток п-крезола.
После отгонки избытка п-крезола при пониженном давлении получают ожидаемое соединение 5 с выходом 29% по отношению к введенному диметоксиэтаналю

Его спектральные характеристики следующие:
Описание спектра ЯМР1H соединения 5
2,19 м.д. (с; 3Н; φ -СН3)
3,18 м.д. (с; 3Н; ОСН3)
3,32 м.д. (с; 3Н; ОСН3)
4,39 м.д. (д; J=5,5 Гц; 1Н; СН-(ОСН3)2
4,33 м.д. (д; J=5,9 Гц; 1Н; СН-ОН)
5,12 м.д. (шир.с; 1Н; СН-ОН)
6,66 м.д. (д; J=8,2 Гц; 1Н; Н3)
6,85 м.д. (дд; J=7,8 Гц и J=1,6 Гц; 1Н; Н2)
7,06 м.д. (д; J=1,6 Гц; 1Н; H1)
9,03 м.д. (с; 1Н; φ -ОН)
Описание спектра ЯМР13С соединения 5
20,3 м.д.; (1 СН3; φ -СН3)
54,1 м.д.; (2 СН3; ОСН3)
67,5 м.д.; (1 СН; СН-ОН)
106,3 м.д.; (1Н; СН-(ОСН3)2)
114,9 м.д.; (1 СН; СНφ в С3)
126,8 м.д.; (1 Сч ; Счφ)
127,4 м.д.; (1 Сч; Счφ)
128,1 м.д.; (1 СН; СНφ ; С2)
128,7 м.д.; (1 СН; СНφ ; С1)
152,3; (Сч; Счφ-ОН)
ПРИМЕР 7
В колбу вводят
- 150 г (1 моль) п-третбутилфенола
- 34,7 г (0,2 моля) диметоксиэтаналя в виде 60%-ного водного раствора
- 37,4 г (0,2 моля) трибутиламина.
Реакционную смесь нагревают до 60° С и оставляют реагировать при 60° С в течение 28 часов. Получают неочищенный продукт реакции, содержащий 41%, по отношению к введенному диметоксиэтаналю, 4-третбутил-2-(1-гидрокси-2,2-диметоксиэтил)-фенола 6. Охлаждают этот неочищенный продукт реакции до комнатной температуры и добавляют 1600 г воды, затем 170 г 20%-ного водного раствора гидроксида натрия. Водную фазу три раза экстрагируют 200 мл МТБЭ, затем нейтрализуют ее до рН 5 20%-ным водным раствором НСl.
Затем водную фазу экстрагируют 500 мл МТБЭ, полученную в результате этого органическую фазу концентрируют при пониженном давлении. В таком случае получают 91,7 г неочищенного продукта реакции, содержащего избыток п-третбутилфенола и ожидаемый продукт 6.
После отгонки избытка п-третбутилфенола при пониженном давлении получают ожидаемый продукт 6 с выходом 34% по отношению к введенному диметоксиэтаналю. После перекристаллизации из циклогексана получают ожидаемый продукт 6 с выходом 28% по отношению к введенному диметоксиэтаналю
Его спектральные характеристики следующие.
- Температура плавления: 86° С
Описание спектра ЯМР1H соединения 6
1,23 м.д. (с; 9Н; φ -(СН3)3)
3,17 м.д. (с; 3Н; ОСН3)
3,30 м.д. (с; 3Н; ОСН3)
4,39 м.д. (д; J=5,9 Гц; 1Н; СН-(ОСН3)2
4,83 м.д. (дд; J=5,5 Гц и J=5,5 Гц; 1Н; СН-ОН)
5,15 м.д. (д; 1Н; J=5,1 Гц; СН-ОН)
6,66 м.д. (д; J=8,6 Гц; 1Н; Н3)
7,07 м.д. (дд; J=7,8 Гц и J=2,7 Гц; 1Н; Н2)
7,28 м.д. (д; J=2,2 Гц; 1Н; H1)
9,04 м.д. (с; 1Н; φ -ОН)
Описание спектра ЯМР13С соединения 6
31,4 м.д.; (3 СН3; φ -(СН3)3)
33,7 м.д.; (1 Сч; Сч трет-бутила)
54,2 м.д.; (2 СН3; ОСН3)
67,8 м.д.; (1 СН; СН-ОН)
106,3 м.д.; (1Н; СН-(ОСН3)2)
114,5 м.д.; (1 СН; СНφ ; С3)
124,3 м.д.; (1 СН; СНφ ; С2)
125,0 м.д.; (1 СН; СНφ ; С1)
126,7 м.д.; (1 Сч; Счφ -СН)
140,5 м.д.; (1 Сч; Счφ)
152,2; (Сч; Счφ-ОН)
ПРИМЕР 8
В колбу вводят
- 17,3 г (0,1 моля) диметоксиэтаналя в виде 60%-ного водного раствора
- 125,4 г (1 моль) гваякола
- 18,7 г (0,1 моля) трибутиламина.
Нагревают до 60° С и оставляют реагировать при этой температуре при постоянном перемешивании в течение 24 часов. После охлаждения получают 161 г неочищенного продукта реакции, содержащего, в частности, избыток гваякола, трибутиламин и продукты конденсации, присутствующие в форме двух изомеров, вероятно, о-изомера и п-изомера относительно гидроксильной группы фенола, в соотношении 72/28.
Берут 65 г этого неочищенного продукта реакции и концентрируют при пониженном давлении для того, чтобы в максимальной степени удалить воду, затем избыток гваякола и трибутиламин, в результате чего получают 7,6 г коричневого маслянистого остатка, обогащенного ожидаемыми соединениями, которые затем могут быть проанализированы с использованием комбинации хроматография в газовой фазе/масс-спектрометрия (методом хромато-масс-спектрометрии), которая дает спектры, приведенные ниже:

1-й изомер (присутствующий в большинстве) 7а:
м/е: 228 (М+)
Основные фрагменты: 210, 196, 167, 165, 153, 151, 137, 133, 125, 109, 93, 81, 75, 65, 53, 47.
2-й изомер (присутствующий в меньшинстве) 7b:
м/е: 228 (М+)
Основные фрагменты: 210, 196, 167, 165, 153, 151, 137, 133, 125, 109, 93, 81, 75, 65, 53, 47.
ПРИМЕР 9
В колбу вводят
- 35,1 г (0,2 моля) диметоксиэтаналя в виде 60%-ного водного раствора
- 153,7 г (1 моль) метил-п-гидроксибензоата
- 37,4 г (0,2 моля) трибутиламина.
Оставляют реагировать при постоянном перемешивании при 60° С в течение 23 часов, затем дополнительно в течение 27 часов при 70-75° С. Охлаждают до комнатной температуры. Избыток метил-п-гидроксибензоата выпадает в осадок. После фильтрования получают 92 г фильтрата коричневого цвета, обогащенного 3-(1-гидрокси-2,2-диметоксиэтил)-4-гидроксиметилбензоатом 8, спектральные характеристики которого следующие:
Описание спектра ЯМР1H соединения 8
3,19 м. д. (с; 3Н; ОСН3)
3,30 м.д. (с; 3Н; ОСН3)
3,78 м.д. (с; 3Н; СООСН3)
4,37 м.д. (д; J=5,1 Гц; 1Н; СН-(ОСН3)2
4,9 м.д. (д; J=5,5 Гц; 1Н; СН-ОН)
6,84 м.д. (д; J=8,6 Гц; 1Н; Н5)
7,69 м.д. (дд; J=8,4 Гц и J=2,2 Гц; 1Н; Н6)
7,94 м.д. (д; J=2,0 Гц; 1Н; Н2)
Описание спектра ЯМР13С соединения 8
51,6 м.д.; (1 СН3; СООСН3)
54,4 м.д.; (1 СН3; ОСН3)
54,5 м.д.; (1 СН3; ОСН3)
66,7 м.д.; (1 СН; СН-ОН)
106,4 м.д.; (1Н; СН-(ОСН3)2)
115,0 м.д.; (1 СН; СНφ ; С5)
120,3 м.д.; (1 Сч; Счφ-СООМе; С1)
128,3 м.д.; (1 Сч; Счφ-СН; С3)
129,6 м.д.; (1 СН; СНφ ; С2 или С6)
130,3 м.д.; (1 СН; СНφ ; С6 или С2)
159,2 м.д.; (Сч; Счφ-ОН; С4)
166,1 м.д.; (1 Сч; СООМе)
ПРИМЕР 10
Примеры имеют целью показать термосшивающие свойства фенольных соединений, производных диалкоксиэтаналей, формулы (I), а также их солей со щелочными металлами, щелочноземельными металлами и аминами.
а) Приготовление образцов
Образец 1
В 5 г дистиллированной воды растворяют 5 г кристаллического соединения, описанного в примере 1. Затем полученным раствором (рН около 5) пропитывают бумагу Whatman №1. С бумаги, пропитанной один раз, удаляют капли, после чего ее сушат 12 часов при комнатной температуре, затем в течение часа при 40° С.
Образец 2
В 4,4 г дистиллированной воды растворяют 4,4 г кристаллического соединения, описанного в примере 1, и 0,3 г гексагидратированного хлорида магния.
Затем полученным раствором пропитывают бумагу Whatman №1. С бумаги, пропитанной один раз, удаляют капли, после чего ее сушат 12 часов при комнатной температуре, затем в течение часа при 40° С.
Образец 3
Бумагу Whatman №1 пропитывают неочищенным раствором, полученным в примере 4.
С бумаги, пропитанной один раз, удаляют капли, после чего ее сушат 12 часов при комнатной температуре, затем в течение часа при 40° С.
Образец 4
В 100 г неочищенного раствора примера 4 растворяют 4,2 г гексагидратированного хлорида магния.
Затем полученным раствором пропитывают бумагу Whatman №1. С бумаги, пропитанной один раз, удаляют капли, после чего ее сушат 12 часов при комнатной температуре, затем в течение часа при 40° С.
б) Измерение приготовленных образцов методом динамического термомеханического анализа (DTMA)
Различные образцы бумаги затем испытывают в приборе для динамического термомеханического анализа (ATMD) в следующих условиях:
- прибор: ATMD MKIII (Rheometrics);
- зонд: смешанный до 500° С;
- метод: "Метод двойной опоры" (Кантилевер с двойным изгибом);
- частота: 1 Гц;
- скорость нагрева, температура: 4,0° С/мин, от 30° С до 240° С;
- размеры образца: 2× 10× 0,2 мм.
Сшивание выявляют по изменению модуля Е' (модуль упругости) в зависимости от температуры: смотри прилагаемые кривые.
Во всех случаях замечают, по увеличению и изменению наклона кривой log(E’), что сшивание имеет место при температурах выше 110° С.
Для образцов 1 и 2, соответственно без катализатора и с катализатором, сшивание начинается при 135° С -140° С; для образцов 3 и 4, соответственно без катализатора и с катализатором, сшивание начинает происходить при 165° С и 175° С.
Отмечают, что одна бумага Whatman №1 не подвергается никаким изменениям модуля того же типа в тех же самых условиях.
Реферат
Изобретение относится к фенольным соединениям производным диалкоксиэтаналей, которые являются промежуточными продуктами в органическом синтезе, а также они могут быть использованы как сшивающие агенты фенольного типа, не выделяющие формальдегид. Фенольные соединения описываются формулой (I)

в которой:
- R обозначает (С3-С17)-диалкоксиметил, 1,3-диоксолан-2-ил, возможно, замещенный в положениях 4 и/или 5 одним или несколькими (С1-С8)-алкилами, или 1,3-диоксан-2-ил, возможно, замещенный в положениях 4, и/или, 5 и/или 6 одним или несколькими (С1-С8)-алкилами,
- n принимает значения 1, 2 или 3, и группа или группы -CH(OH)-R находятся в орто-положении и/или в пара-положении по отношению к ОН группе цикла;
- m принимает значения от 0 до 4-n, Х обозначает функциональную группу, такую как ОН или Hal, или (С1-С8)-алкил или (С1-С8)-алкоксил, или (С5-С12 )-арил, содержащий, в известных случаях, 1 или 2 гетероатома, такие как азот или кислород или карбоксигруппу, или группу - CO-Y, в которой Y обозначает (С1-С8)-алкил или (С1-С8)-алкоксил, или амидогруппу, или аминогруппу, или тиольную группу, при условии, что по меньшей мере одно из положений, орто- или пара-, фенольного цикла должно быть замещено атомом водорода, а также их соли со щелочными металлами, щелочноземельными металлами и аминами.
Способ получения указанных фенольных соединений заключается во взаимодействии соответствующего замещенного фенола, в котором по меньшей мере одно из положений, орто- или пара-, фенольного цикла должно быть замещено атомом водорода, с замещенным альдегидом в присутствии основания.
Технический результат - получение новых соединений, которые могут быть использованы в качестве сшивающих агентов, не выделяющих формальдегид, а также в качестве промежуточных соединений в органическом синтезе. 2 н. и 11 з.п. ф-лы, 1 ил.

Формула





Комментарии