Улучшенный синтез гонокиола - RU2727202C2
Код документа: RU2727202C2
Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет и преимущества предварительных заявок на патент США 62/245,490, поданной 23 октября 2015 года, и 62/316,291, поданной 31 марта 2016 года, содержание которых полностью включено в настоящую заявку посредством отсылки.
УРОВЕНЬ ТЕХНИКИ
[0002] Экстракты из коры растений видов рода Магнолия, например, Магнолии крупноцветковой (Magnolia grandiflora) и Магнолии лекарственной (Magnolia officinalis) (семейство Магнолиевые), как уже давно известно, обладают ценными лекарственными и терапевтическими свойствами. Экстракты из коры магнолии, как было показано, обладают успокаивающими, противовоспалительными, противомикробными, антиоксидантными, антиагрегантными и нейротрофическими свойствами. Множество традиционных японских и китайских растительных лекарственных средств получено из различных видов магнолий и долго использовались для лечения тревожных и невротических расстройств. Такие растительные составы включают Houpu Tang, Xiao Zhengai Tang, Ping Wei San и Shenmi Tang из Китая и Hange-koboku-to и Sai-boku-to из Японии. Эти составы традиционно изготавливают из коры таких видов как Магнолия лекарственная и Магнолия обратнояйцевидная (Magnolia obovata).
[0003] Двумя основными действующими веществами, обнаруженными в экстрактах коры магнолии, являются магнолол и гонокиол, которые являются позиционными изомерами. Гонокиол представляет собой 3'5-диаллил-2,4'-бифенилдиол (CAS [35354-74-6]), а магнолол - 5,5'-диаллил-2,2'-бифенилдиол (CAS [528-43-8]), как показано ниже:

[0004] В недавнем исследовании эти соединения были выделены из экстрактов, при этом было показано, что они обладают мощным лекарственным действием, включая антипролиферативное, противовоспалительное, противобактериальное, успокаивающее, хондропротекторное, нейротрофическое и нейропротективное действие. Гонокиол, в частности, всесторонне исследовали в качестве потенциального средства для лечения рака, заболеваний сердца, рассеянного склероза, артрита и остеопороза. Гонокиол также нашел применение в таких потребительских товарах, как зубные пасты и жидкости для полоскания рта, омолаживающие кремы, и в качестве пищевой добавки. Исследования показали, что гонокиол является мощным стимулятором роста нейритов и может повышать жизнеспособность и способствовать развитию нейронов в первичных культурах. Гонокиол также является мощным антипролиферативным средством против клеток SVR в культуре и может селективно ингибировать рост первичных эндотелиальных клеток человека по сравнению с фибробластами. Как было показано, гонокиол эффективен против ангиосаркомы у голых мышей in vivo и демонстрирует не только ингибирование ангиогенеза, но и вызывает апоптоз опухоли. Фактически гонокиол расценивают как альтернативное средство для лечения рака, которое не имеет побочных эффектов традиционных химиотерапевтических средств.
[0005] В дополнение к применению гонокиола в качестве потенциального терапевтического средства, гонокиол также востребован в качестве предшественника производных гонокиола, которые также могут обладать активными биологическими или терапевтическими свойствами. Например, дигидрогонокиол и тетрагидрогонокиол являются минорными компонентами экстракта природной магнолии, которые также демонстрируют активные фармацевтические свойства. Эти соединения могут быть получены синтетическим путем в результате восстановления одной или двух аллильных групп гонокиола, соответственно. Например, следующие два изомерных дигидрогонокиола, как было показано, обладают мощным анксиолитическим действием на животных:

[0006] Другие производные гонокиола, исследуемые на биологическую активность, включают продукты, в которых одна или обе двойных связи превращены в циклопропановые кольца, эпоксидные кольца, тиирановые кольца или азиридиновые кольца, или соединения, в которых одна или обе гидроксильные группы превращены в простые алкиловые эфиры, трифторметиловые эфиры, сложные алкилфосфатные эфиры или сложные дихлорацетатные эфиры. Например, диэпоксид гонокиола, как сообщали, обладает мощным антипролиферативным действием и является потенциальным средством для лечения рака:

[0007] Как и в ситуации с другими природными продуктами, массовое получение гонокиола для применения в производстве фармацевтической продукции и потребительских товаров, либо непосредственно в качестве промежуточного соединения, не будет рентабельным, если оно основано на выделении из природных источников. Кроме того, выделение из природного источника влечет за собой крайне высокий риск того, что нежелательные близкородственные химические соединения будут присутствовать в качестве примесей в конечном продукте. Вместо этого рентабельность продуктов на основе гонокиола требует эффективного, малозатратного, высокопродуктивного способа химического синтеза. Однако этой цели также трудно достичь вследствие образования изомерных соединений, которые сложно отделить от требуемого соединения, гонокиола. Например, обычные способы синтеза дают, в дополнение к гонокиолу, изомерный и сложно отделяемый побочный продукт, изогонокиол:

[0008] Многие опубликованные способы синтеза включают другие недостатки, такие как затратные процедуры очистки, дорогостоящие исходные материалы, дорогостоящие химические реагенты, низкие общие выходы, большую длительность реакции и токсичные остаточные соединения металлов, которые сложно удалить из конечного продукта.
[0009] Например, Reddy с соавт. в Tetrahedron Letters 55 (2014) 1049-1051 раскрывают 6-стадийный способ синтеза, начинаемый с циклогексан-1,4-дион моноэтилен кеталя, который дает смесь 2:3 гонокиола и изогонокиола, которые являются крайне сложноразделяемыми позиционными изомерами (общий выход гонокиола 12%). Кроме того, исходный материал является относительно дорогостоящим (больше $1000/кг). Srinivas с соавт. в Tetrahedron Letters 55 (2014) 4295-4297 раскрывают 6-стадийный способ, начинаемый с 2-броманизола и включающий две стадии катализируемого палладием арильного сочетания, которое дает гонокиол с общим выходом приблизительно 68%. Катализируемые палладием реакции нежелательны вследствие очень высокой стоимости реактивов палладия (например, больше $50000/кг) и сложности удаления палладийсодержащих примесей из конечного продукта. Harada с соавт. в Tetrahedron Letters 55 (2014) 6001-6003 приводят подобный шестистадийный способ, в котором используются две катализируемых палладием стадии сочетания и который начинается с 4-гидроксибензолбороновой кислоты. Последнее соединение не только дорогостоящее (больше $4000/кг), но и обладает низкой устойчивостью (что влияет на эффективность реакции, очистку промежуточных соединений и хранение исходного материала). Кроме того, использование двух стадий, катализируемых дорогостоящими реактивами палладия, также делает способ Харады плохо подходящим для коммерческого применения.
[00010] Таким образом, существует потребность в улучшенном способе синтеза для получения гонокиола, который обеспечивает высокий выход, является эффективным и рентабельным.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[00011] В настоящем описании предложены новые высокоэффективные способы синтеза гонокиола. В способах применяется новая высокоэффективная, катализируемая металлом реакция кросс-сочетания для создания бифенильного ядра. Оба способа могут применяться для промышленного производства в поддержку рентабельного производства фармацевтической продукции и потребительских товаров, содержащих гонокиол.
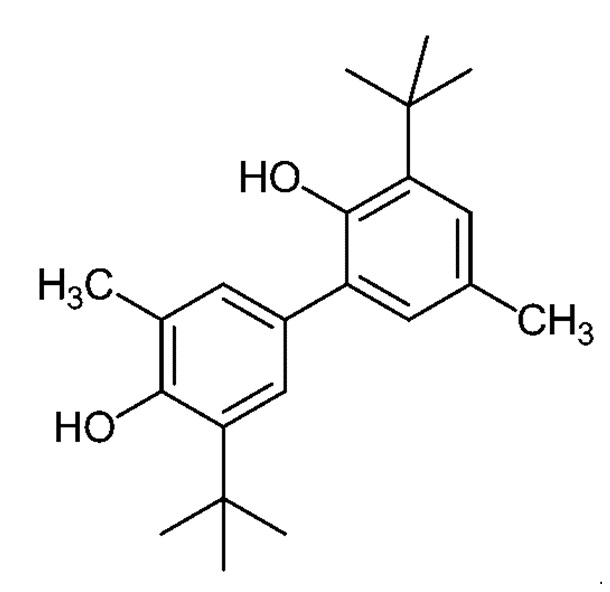
[00012] В первом аспекте настоящего описания предложен Способ 1, способ получения гонокиола. Способ 1 требует пяти стадий и использования недорогостоящих исходных материалов и реагентов, и обеспечивает высокие выходы эффективно очищенного продукта. В родственном варианте осуществления настоящего описания также предложен Способ 2, способ получения нового промежуточного соединения 3,3'-ди-трет-бутил-5,5'-диметил-[1,1'-бифенил]-2,4'-диола.
[00013] Во втором аспекте настоящего описания предложен Способ 3, способ получения гонокиола. Способ 3 требует шести стадий, в нем также используются недорогостоящие исходные материалы и реагенты, и он обеспечивает высокие выходы эффективно очищенного продукта. В Способе 2 используются три последних стадии методики Харады (Harada, Tetrahedron Letters 55 (2014) 6001-6003), но он позволяет преодолеть наиболее серьезные недостатки путем применения новой трехстадийной последовательности для получения промежуточного бис-анизола. Кроме того, предложены улучшенные условия для трех последних стадий методики Харады. В родственном варианте осуществления настоящего описания также предложен Способ 4, способ получения промежуточного соединения 3,3',5,5'-тетра-трет-бутил-5,5'-[1,1'-бифенил]-2,4'-диола.
[00014] В настоящем описании также предложены новые полезные промежуточные химические соединения, например, 3,3'-ди-трет-бутил-5,5'-диметил-[1,1'-бифенил]-2,4'-диол, 3',5-диметил-[1,1'-бифенил]-2,4'-диол и 2,4'-диметокси-3',5-диметил-1,1'-бифенил, а также высокоэффективные способы их синтеза и способы их применения в синтезе гонокиола.
[00015] В настоящем описании предложен способ (Способ 1) получения гонокиола, включающий реакцию 2-трет-бутил-6-метилфенола с 2-трет-бутил-4-метилфенолом, с получением 3,3'ди-трет-бутил-5,5'-диметил-[1,1'-бифенил]-2,4'-диола (Соединение I):

а также включающий выделение гонокиола. В определенных вариантах осуществления настоящего описания предложен:
1.1 Способ 1, где реакция включает применение катализатора на основе металла (например, катализатора на основе хрома, меди, железа, марганца, рутения или ванадия).
1.2 Способ 1.1, где катализатор на основе металла включает атом металла в комплексе с ацетилацетонатным каркасом или аминовым или иминовым каркасом, например, салановым или саленовым каркасом.
1.3 Способ 1.2, где катализатор на основе металла включает комплекс хрома-салена.
1.4 Способ 1.2, где катализатором на основе металла является Cr-сален-Cy или ацетилацетонат марганца.
1.5 Способ 1 или любой из 1,1 и последующих, где реакция дополнительно включает окислитель.
1.6 Способ 1 или любой из 1,1 и последующих, где окислителем является кислород.
1.7 Способ 1 или любой из 1,1 и последующих, где окислителем является ацетат серебра (I) или ди(трет-бутил)-пероксид.
1.8 Способ 1 или любой из 1,1 и последующих, где растворителем является толуол.
1.9 Способ 1 или любой из 1,1 и последующих, где температура реакции составляет от 70°C до 140°C, например, от 80°C до 90°C.
1.10 Способ 1 или любой из 1,1 и последующих, дополнительно включающий, в любом порядке, одну или более следующих стадий:
a. деалкилирование трет-бутильных групп Соединения I,
b. алкилирование фенольных кислородов Соединения I или II,
c. бензильное галогенирование метильных групп Соединения I, II или III,
d. замещение галогенов Соединения IV или галогенпроизводного Соединения I, II или III винильным реагентом (например, винилметаллоорганическим реагентом), и
e. деалкилирование алкилэфирных групп Соединения V или аллильных производных Соединения I, II, III.
1.11 Способ 1 или любой из 1,1 и последующих, дополнительно включающий деалкилирование (например, обратное алкилирование Фриделя-Крафтса) Соединения I с получением Соединения II:
1.12 Способ 1 или любой из 1,1 и последующих, где реакция включает применение катализатора на основе кислоты Льюиса (например, катализатора на основе галогенида металла).
1.13 Способ 1.12, где катализатором на основе кислоты Льюиса является хлорид алюминия.
1.14 Способ 1 или любой из 1,1 и последующих, где реакция кросс-сочетания и реакция деалкилирования проходят в одном реакционном сосуде без выделения промежуточного Соединения I.
1.15 Способ 1 или любой из 1,1 и последующих, дополнительно включающий метилирование Соединения II с получением Соединения III:

1.16 Способ 1 или любой из 1,1 и последующих, где метилирование включает применение метилиодида или метилсульфата и подходящего основания (например, карбоната калия).
1.17 Способ 1 или любой из 1,1 и последующих, где реакция кросс-сочетания, реакция деалкилирования и реакция метилирования проходят в одном реакционном сосуде без выделения промежуточных Соединений I и II.
1.18 Способ 1 или любой из 1,1 и последующих, дополнительно включающий бензильное галогенирование Соединения III с получением Соединения IV, где X является бромом, хлором или иодом:

1.19 Способ 1 или любой из 1,1 и последующих, где X является бромом.
1.20 Способ 1 или любой из 1,1 и последующих, где реакция включает применение N-бромсукцинимида с инициатором радикальной реакции (например, азобисизобутиронитрилом).
1.21 Способ 1 или любой из 1,1 и последующих, дополнительно включающий сочетание винилметаллоорганического агента с Соединением IV с получением диаллильного соединения V:

1.22 Способ 1 или любой из 1,1 и последующих, где винилметаллоорганический агент выбран из группы, состоящей из: винилмагнийбромида, винилмагнийхлорида, винилмагнийиодида, виниллития и дивинилмедьлития.
1.23 Способ 1 или любой из 1,1 и последующих, где реакция дополнительно включает катализатор на основе соединения меди (I) (например, иодид меди (I), бромид меди (I) или хлорид меди (I)).
1.24 Способ 1 или любой из 1,1 и последующих, дополнительно включающий деметилирование Соединения V с получением гонокиола:

и выделение гонокиола из реакционной смеси.
1.25 Способ 1 или любой из 1,1 и последующих, где реакция включает применение трибромида бора, необязательно в растворителе дихлорметане, дихлорэтане или толуоле.
1.26 Способ 1 или любой из 1,1 и последующих, где реакция включает применение комплекса трибромида бора-диметилсульфида.
[00016] В другом аспекте настоящего описания предложен способ (Способ 2) получения 3,3'ди-трет-бутил-5,5'-диметил-[1,1'-бифенил]-2,4'-диола (Соединения I), включающий реакцию 2-трет-бутил-6-метилфенола с 2-трет-бутил-4-метилфенолом:

и, необязательно, дополнительно включающий выделение Соединения I из реакционной смеси. В определенных вариантах осуществления настоящего описания предложен:
2.1 Способ 2, где реакция включает применение катализатора на основе металла (например, катализатора на основе хрома, меди, железа, марганца, рутения или ванадия).
2.2 Способ 2 или 2.1, где катализатор на основе металла включает атом металла в комплексе с ацетилацетонатным каркасом, или аминовым или иминовым каркасом, например, салановым или саленовым каркасом.
2.3 Способ 2.2, где катализатор на основе металла включает комплекс хрома-салена.
2.4 Способ 2.2, где катализатором на основе металла является Cr-сален-Cy или ацетилацетонат марганца.
2.5 Способ 2 или любой из 2,1 и последующих, где реакция дополнительно включает окислитель.
2.6 Способ 2 или любой из 2,1 и последующих, где окислителем является кислород.
2.7 Способ 2 или любой из 2,1 и последующих, где окислителем является ацетат серебра (I) или ди(трет-бутил)-пероксид.
2.8 Способ 2 или любой из 2,1 и последующих, где растворителем является толуол.
2.9 Способ 2 или любой из 2,1 и последующих, где температура реакции составляет от 70°C до 140°C, например, от 80°C до 90°C.
[00017] В другом аспекте в настоящем описании также предложено:
3.1 Соединение I:

3.2 Соединение II:

3.3 Соединение III:

3.4 Соединение IV:

где X выбран из брома, хлора или иода (например, где X является бромом).
3.5 Соединение, выбранное из Соединения I, Соединения II, Соединения III или Соединения IV, как показано в 3.1-3.4.
3.6 Применение любого одного или более из Соединений I, II, III или IV (например, где X является бромом, хлором или иодом), в получении гонокиола.
3.7 Любое одно или более из Соединения I, Соединения II, Соединения III или Соединения IV (например, где X является бромом, хлором или иодом) для применения в производстве лекарственного средства, включающего гонокиол.
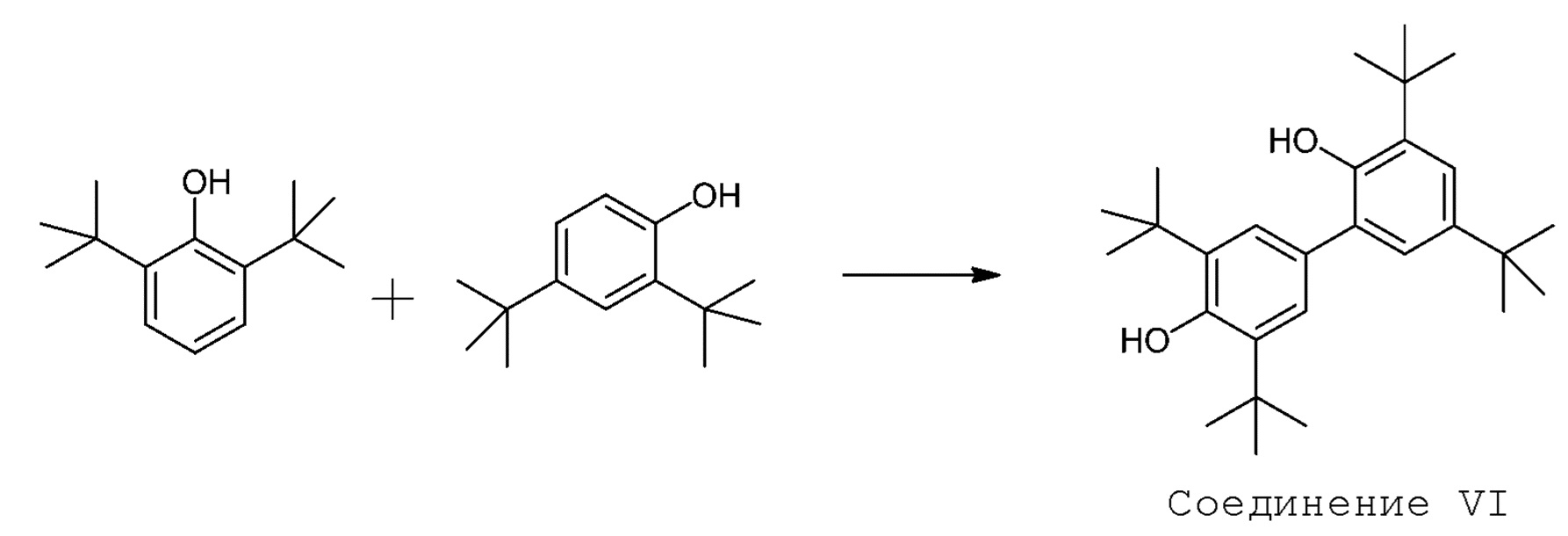
[00018] В другом аспекте настоящего описания предложен способ (Способ 3) получения гонокиола, включающий реакцию 2,6-ди-трет-бутил-6-фенола с 2,4-ди-трет-бутил-4-фенолом с получением 3,3',5',5'-тетра-трет-бутил-5,5'-[1,1'-бифенил]-2,4'-диола (Соединения VI):

и дополнительно включающий выделение гонокиола. В определенных вариантах осуществления настоящего описания предложен:
3.1 Способ 3, где реакция включает применение катализатора на основе металла (например, катализатора на основе хрома, меди, железа, марганца, рутения или ванадия).
3.2 Способ 3.1, где катализатор на основе металла включает атом металла в комплексе с ацетилацетонатным каркасом или аминовым или иминовым каркасом, например, салановым или саленовым каркасом.
3.3 Способ 3.2, где катализатор на основе металла включает комплекс хрома-салена, комплекс железа-салена или комплекс рутения-салена.
3.4 Способ 3.2, где катализатором на основе металла является Cr-сален-Cy, Fe-сален-Cy или Ru-сален-H.
3.5 Способ 3 или любой из 3,1 и последующих, где реакция дополнительно включает окислитель.
3.6 Способ 3 или любой из 3,1 и последующих, где окислителем является кислород.
3.7 Способ 3 или любой из 3,1 и последующих, где окислителем является ацетат серебра (I) или ди(трет-бутил)-пероксид.
3.8 Способ 3 или любой из 3,1 и последующих, где растворителем является толуол или хлорбензол.
3.9 Способ 3 или любой из 3,1 и последующих, где температура реакции составляет от 70°C до 140°C, например, от 80°C до 130°C, или приблизительно 80°C или приблизительно 130°C.
3.10 Способ 3 или любой из 3,1 и последующих, дополнительно включающий, в любом порядке, одну или более следующих стадий:
a. деалкилирование четырех трет-бутильных групп Соединения VI,
b. алкилирование двух фенольных кислородов Соединения VI или VII,
c. электрофильное ароматическое галогенирование Соединения VI, VII или VIII,
d. замещение галогенов Соединения IX или галогенпроизводного Соединения VI, VII или VIII аллильным реагентом (например, аллилметаллоорганическим реагентом или аллилгалогенидом), и
e. деалкилирование алкилэфирных групп Соединения V или аллильных производных Соединения VI, VII, VIII.
3.11 Способ 3 или любой из 3,1 и последующих, дополнительно включающий деалкилирование (например, обратное алкилирование Фриделя-Крафтса) Соединения VI с получением Соединения VII:

3.12 Способ 3 или любой из 3,1 и последующих, где реакция включает применение кислотного катализатора, такого как кислота Льюиса (например, катализатора на основе галогенида металла) или кислота Брэнстеда.
3.13 Способ 3.12, где катализатором на основе кислоты Льюиса является хлорид алюминия.
3.14 Способ 3.12, где кислотой Брэнстеда является метансульфоновая кислота.
3.15 Способ 3 или любой из 3,1 и последующих, где реакция кросс-сочетания и реакция деалкилирования проходят в одном реакционном сосуде без выделения промежуточного Соединения VI.
3.16 Способ 3 или любой из 3,1 и последующих, дополнительно включающий метилирование Соединения VII с получением Соединения VIII:

3.17 Способ 3 или любой из 3,1 и последующих, где метилирование включает применение метилиодида или метилсульфата и подходящего основания (например, карбоната калия).
3.18 Способ 3 или любой из 3,1 и последующих, где реакция кросс-сочетания, реакция деалкилирования и реакция метилирования проходят в одном реакционном сосуде без выделения промежуточных Соединений VI и VII.
3.19 Способ 3 или любой из 3,1 и последующих, дополнительно включающий электрофильное ароматическое галогенирование Соединения VIII с получением Соединения IX, где X является бромом, хлором или иодом:

3.20 Способ 3 или любой из 3,1 и последующих, где X является бромом.
3.21 Способ 3 или любой из 3,1 и последующих, где реакция включает применение брома и инициатора радикальной реакции (например, перекиси водорода, трет-бутилпероксида или AIBN).
3.22 Способ 3 или любой из 3,1 и последующих, дополнительно включающий сочетание аллильного реагента (например, аллилметаллоорганического агента) или аллилгалогенида (например, аллилбромида) с Соединением IX с получением диаллильного соединения V:
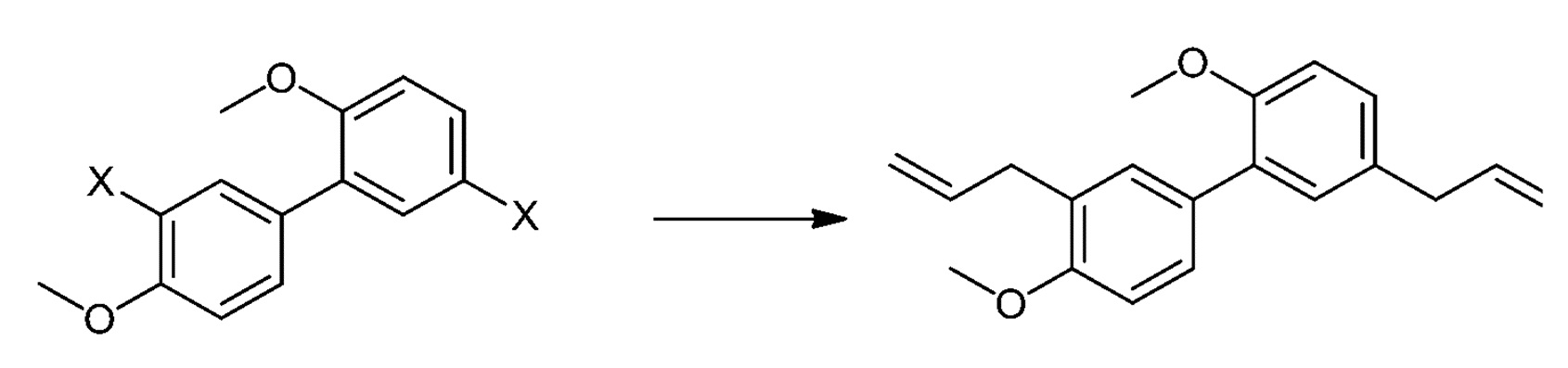
3.23 Способ 3 или любой из 3,1 и последующих, где сочетание аллильного реагента с Соединением IX включает следующие стадии: (1) превращение ароматических галогенидов Соединения IX в металлгалогениды (например, MgBr, MgCl, MgI) и (2) замещение металлгалогенида аллильной группой аллилгалогенида (например, аллилбромида) в катализируемом палладием сочетании (например, с использованием катализатора на основе палладия (0)).
3.24 Способ 3.23, где стадия (1) включает применение магния и каталитического количества иода в подходящем растворителе (например, ТГФ)
3.25 Способ 3.23 или 3.24, где стадия (2) включает применение тетракис(трифенилфосфин)палладия (0). Способ 3 или любой из 3,1 и последующих, где сочетание аллильного реагента с Соединением IX включает следующие стадии: (1) реакцию с аллилметаллоорганическим реагентом (например, аллиллитием, аллилмагнийхлоридом, аллилмагнийиодидом или аллилмагнийбромидом), в присутствии палладиевого катализатора (например, ацетата палладия), необязательно дополнительно включающего лиганд (например, фосфиновый лиганд, такой как X-Phos или BrettPhos), и, необязательно, (2) последующую реакцию с аллилгалогенидным реагентом (например, аллилхлоридом, аллилбромидом или аллилиодидом).
3.26 Способ 3.25, где стадия (1) сочетания включает применение аллилмагнийхлорида или аллилмагнийбромида.
3.27 Способ 3.25 или 3.26, где стадия (2) сочетания включает применение ацетата палладия и лиганда X-Phos.
3.28 Способ 3.27, дополнительно включающий последующую реакцию с аллилхлоридом или аллилбромидом.
3.29 Способ 3 или любой из 3,1 и последующих, дополнительно включающий деметилирование Соединения V с получением гонокиола:

и выделение гонокиола из реакционной смеси.
3.30 Способ 3 или любой из 3,1 и последующих, где реакция включает применение трибромида бора, необязательно в растворителе дихлорметане, дихлорэтане или толуоле.
3.31 Способ 3 или любой из 3,1 и последующих, где реакция включает применение комплекса трибромида бора-диметилсульфида, необязательно в растворителе ДХЭ.
[00019] В другом аспекте настоящего описания предложен способ (Способ 4) получения 3,3',5',5'-тетра-трет-бутил-5,5'-[1,1'-бифенил]-2,4'-диола (Соединения VI), включающий реакцию 2,6-ди-трет-бутил-6-фенола с 2,4-ди-трет-бутил-4-фенолом:

и необязательно дополнительно включающий выделение Соединения VI из реакционной смеси. В определенных вариантах осуществления настоящего описания предложен:
4.1 Способ 4, где реакция включает применение катализатора на основе металла (например, катализатора на основе хрома, меди, железа, марганца, рутения или ванадия).
4.2 Способ 4.1, где катализатор на основе металла включает атом металла в комплексе с ацетилацетонатным каркасом или аминовым или иминовым каркасом, например, салановым или саленовым каркасом.
4.3 Способ 4.2, где катализатор на основе металла включает комплекс хрома-салена, комплекс железа-салана или комплекс рутения-салена.
4.4 Способ 4.2, где катализатором на основе металла является Cr-сален-Cy, Fe-сален-Cy или Ru-сален-H.
4.5 Способ 4 или любой из 4,1 и последующих, где реакция дополнительно включает окислитель.
4.6 Способ 4 или любой из 4,1 и последующих, где окислителем является кислородом.
4.7 Способ 4 или любой из 4,1 и последующих, где окислителем является ацетат серебра (I) или ди(трет-бутил)-пероксид.
4.8 Способ 4 или любой из 4,1 и последующих, где растворителем является толуол или хлорбензол.
4.9 Способ 4 или любой из 4,1 и последующих, где температура реакции составляет от 70°C до 140°C, например, от 80°C до 130°C, или приблизительно 80°C или приблизительно 130°C.
[00020] В другом аспекте настоящего описания предложен способ (Способ 5) получения тетразамещенного бисфенола (Соединения X), включающий реакцию двух дизамещенных фенолов, где реакция включает применение катализатора на основе металла:

где каждый R1, R2, R3 и R4 независимо является C1-10 алкилом, C1-10 алкиленом или C1-10 алкиниленом, который необязательно замещен эфирными, сульфидными, сложноэфирными, амидными, галогеновыми, нитрильными или аминогруппами, и где C1-10 скелет необязательно является нормальным или разветвленным, и необязательно дополнительно включающий выделение соединения X из реакционной смеси.
В определенных вариантах осуществления настоящего описания предложен:
5.1 Способ 5, где каждый R1, R2, R3 и R4 независимо является C1-10 алкилом.
5.2 Способ 5.1, где каждый R1, R2, R3 и R4 независимо является C1-4 алкильной группой, необязательно нормальной или разветвленной (например, метилом, этилом, пропилом, изопропилом, бутилом, изобутилом, втор-бутилом или трет-бутилом).
5.3 Способ 5 или любой из 5,1 и последующих, где катализатор на основе металла выбран из катализатора на основе хрома, меди, железа, марганца, рутения или ванадия.
5.4 Способ 5.3, где катализатор на основе металла включает атом металла в комплексе с ацетилацетонатным каркасом или аминовым или иминовым каркасом, например, салановым или саленовым каркасом.
5.5 Способ 5.4, где аминовый или иминовый каркас является салановым или саленовым каркасом.
5.6 Способ 5.5, где катализатор на основе металла включает комплекс хрома-салена, комплекс железа-салена, комплекс марганца-салена, рутения-салена, меди-салена, кобальта-салена, ванадия-салена, комплекс хрома-салана, комплекс железа-салана, комплекс марганца-салана, рутения-салана, меди-салана, кобальта-салана или комплекс ванадия-салана.
5.7 Способ 5.5, где катализатором на основе металла является Cr-сален-Cy, Fe-салан-Cy или Ru-сален-H, Ru-салан-H, Co-сален-Х, V-салан-Cy или Cr-салан-Cy.
5.8 Способ 5.4, где катализатором на основе металла является ацетилацетонат марганца.
5.9 Способ 5 или любой из 5,1 и последующих, где реакция дополнительно включает окислитель.
5.10 Способ 5 или любой из 5,1 и последующих, где окислитель выбран из кислорода, пероксидов, гидропероксидов, пероксикислот или неорганических окислителей.
[00021] В некоторых вариантах осуществления настоящего описания также предложено применение способа в синтезе производных гонокиола, таких как дигидрогонокиолы, тетрагидрогонокиол, моно- и диэпоксиды гонокиола и другие производные.
ПОДРОБНОЕ ОПИСАНИЕ
[00022] Каждая ссылка, процитированная в настоящем описании, полностью включена посредством отсылок.
[00023] Все процентные значения и отношения, используемые в настоящем описании, указаны по весу композиции для ухода за полостью рта, если не указано иное. Все измерения выполнены при 25°C, если не указано иное.
[00024] По всему тексту настоящего описания и формулы изобретения, указание определенного числового значения (например, температуры, весового процента компонентов и т.д.) должно означать такое значение плюс или минус дополнительное значение, что будет очевидно средним специалистам в данной области, в зависимости от случайной ошибки и степени ошибки измерения, обычно связанной с таким значением. Например, среднему специалисту в данной области будет известно, что данная температура включает 10% вариабельность с учетом прибора, используемого для измерения температуры.
[00025] При использовании в настоящем описании, "экстрагировать" или "экстракция" твердого или жидкого материала означает контакт материала с соответствующим материалом, таким как растворитель, для удаления вещества (веществ), которое необходимо выделить из материала. Такая экстракция может быть выполнена с помощью стандартных средств, известных специалисту в данной области, например, при помощи аппарата для экстракции, такого как аппарат Сокслета, в котором твердый материал помещают в патрон, и при этом растворитель может течь через материал; или при смешивании растворителя и материала вместе и последующем разделении жидкой и твердой фаз или двух несмешивающихся жидких фаз, например, с помощью фильтрации или осаждения и декантирования.
[00026] В настоящем описании предложен способ (Способ 1) получения гонокиола, включающий реакцию 2-трет-бутил-6-метилфенола с 2-трет-бутил-4-метилфенолом, с получением 3,3'-ди-трет-бутил-5,5'-диметил-[1,1'-бифенил]-2,4'-диола (Соединения I), как показано ниже:

с последующим выделением Гонокиола.
[00027] Эта реакция является примером каталитического окислительного кросс-сочетания фенолов между 2,6-дизамещенным фенолом и 2,4-дизамещенным фенолом. Реакция является сложной, поскольку катализатор должен инициировать реакцию кросс-сочетания со значительно более высокой скоростью, чем две конкурирующих реакции гомо-сочетания.
[00028] Подходящие катализаторы для реакции окислительного кросс-сочетания фенолов (включая катализаторы из Способов 1-5, 1.1-1.23, 2.1-2.6, 3.1-3.27, 4.1-4.6 и 5.1-5.10) включают системы катализаторов на основе металлов, в которых металл может легко подвергаться повторному окислению молекулярным кислородом, пероксидом или другим подходящим окислителем. Такие металлы включают хром (Cr), медь (Cu), железо (Fe), марганец (Mn), рутений (Ru) и ванадий (V). В отдельных вариантах осуществления металлом является хром или марганец. Металл применяется в качестве части комплекса, в котором металл связан координационной связью с аминовым или иминовым каркасом или с ацетилацетонатным каркасом, например, салановым (N,N'-этиленбис-(салициламиновым)) или саленовым (N,N'-этиленбис-(салициламиновым) каркасом. В некоторых вариантах осуществления фенильные кольца саланового или саленового лиганда замещены орто-алкильной группой, например, орто-трет-бутильной группой. В некоторых вариантах осуществления этиленовый мостик каркаса замещен, например, 1,2-транс-диалкилом, 1,2-транс-диарилом или 1,2-транс-конденсированным циклоалканом. В отдельных вариантах осуществления каркасом является салан-Ph или сален-Ph (1,2-транс-дифенильный мостик) или салан-Cy или сален-Cy (1,2-транс-конденсированный циклогексановый мостик). В одном варианте осуществления комплекс катализатора выбран из Cr-сален-Cy, Mn-сален-Ph или Cu-сален-Cy. Это относительно недорогостоящие катализаторы на основе соединений металлов. Например, катализатором может быть Cr-сален-Cy, показанный ниже, который доступен в продаже по цене меньше $20/кг:

В других вариантах осуществления катализатором может быть ацетилацетонат марганца (III) (также известный как ацетилацетонат марганца или Mn(acac)3).
[00029] Реакцию окислительного кросс-сочетания фенолов проводят в подходящем растворителе или смеси растворителей и в присутствии окислителя. Подходящие растворители включают дихлорэтан (ДХЭ), тетрахлорэтан (ТХЭ), четыреххлористый углерод, бензол, толуол, трифторметилбензол, хлорбензол, дихлорбензол и другие сильно неполярные алифатические и ароматические растворители или их смеси. В некоторых вариантах осуществления растворителем является дихлорэтан. Механизм реакции кросс-сочетания включает превращение активного металлсодержащего центра (металл в высокой степени окисления) в неактивный металлсодержащий центр (металл в более низкой степени окисления). Например, если катализатором кросс-сочетания является катализатор на основе хрома, реакция включает превращение активных атомов Cr(IV) в неактивные атомы Cr(III). В результате реакционная смесь должна включать окислитель, который способен повторно окислять расходованный в реакции металлсодержащий центр (например, Cr(III)) обратно в состояние его более высокой степени окисления (например, Cr(IV)). Окислителем могут быть любые молекулы, способные производить такое окисление, например, воздух, молекулярный кислород (O2), озон, пероксиды (например, перекись водорода, ди-трет-бутилпероксид), гидропероксиды (например, трет-бутилгидропероксид), пероксикислоты (например, надуксусная кислота, пероксимоносерная кислота, мета-хлорпероксибензойная кислота, трифторнадуксусная кислота, надмуравьиная кислота), неорганические окислители (например, гипохлорит натрия, хлорит натрия, хлорат натрия, перхлорат натрия, перманганат калия, диоксид марганца, диоксид селена, хроматные соли, дихроматные соли, ацетат серебра (I), периодат натрия, бромат натрия и т.д.) и другие органические окислители (например, иодозобензол, иодоксибензойная кислота и другие гипервалентные иодсодержащие реагенты). В отдельных вариантах осуществления окислителем является кислород.
[00030] В некоторых вариантах осуществления Способ 1 дополнительно включает, в любом порядке, одну или более следующих стадий: деалкилирование трет-бутильных групп Соединения I, алкилирование фенольных кислородов Соединения I или II, бензильное галогенирование метильных групп Соединения I, II или III, замещение галогенов Соединения IV или галогенпроизводного Соединения I, II или III винильным реагентом (например, винилметаллоорганическим реагентом) с получением моно- или диаллильного соединения, деалкилирование алкилэфирных групп Соединения V или моно- или диаллильных производных Соединения I, II, III, и выделение продукта Гонокиола.
[00031] В конкретном варианте Способ 1 дополнительно включает следующие стадии в порядке, показанном на схеме ниже: деалкилирование трет-бутильных групп Соединения I с получением Соединения II, алкилирование фенольных кислородов Соединения II с получением Соединения III-A, бензильное галогенирование Соединения III-A с получением Соединения IV-A, винильное замещение Соединения IV-A с получением Соединения V-A и деалкилирование Соединения V-A с получением Гонокиола, и его выделение. В Соединениях III-A, IV-A и V-A, R может быть любой C1-6алкильной группой, включающей нормальную, разветвленную цепь и/или замещенную, например, замещенную одним или более C1-6алкиловыми эфирами или замещенную одним или более C1-6алкиловым или ариловым эфиром, или смешанными силиловыми эфирами. Примеры таких групп R включают, без ограничения перечисленными, метил, этил, пропил, изопропил, трет-бутил, бензил, метоксиметил, бензилоксиметил, 2-метоксиэтоксиметил, 1-этоксиэтил, 2-триметилсилилэтил, триметилсилил, триэтилсилил, триизопропилсилил, трет-бутилдиметилсилил, трет-бутилдифенилсилил, дифенилметилсилил, ди-трет-бутилметилсилил и т.п.

[00032] В некоторых вариантах осуществления Способ 1 дополнительно включает деалкилирование Соединения I с получением Соединения II (например, обратное алкилирование Фриделя-Крафтса):

[00033] Обратная реакция алкилирования Фриделя-Крафтса проходит с использованием катализатора на основе кислоты Льюиса, например, катализатора на основе галогенида металла (например, хлорида алюминия, содержащего хлорид железа (III)) в подходящем растворителе. Подходящие растворители включают безводные растворители, такие как бензол, толуол, ДХЭ, ТХЭ, четыреххлористый углерод и хлорбензол. В некоторых вариантах осуществления обратное алкилирование Фриделя-Крафтса и кросс-сочетание фенолов проводят в одну стадию в одном сосуде, то есть после того как кросс-сочетание проходит до необходимой степени, непосредственно в существующую реакционную смесь добавляют реагент (например, трихлорид алюминия) и продолжают реакцию, пока обратная реакция Фриделя-Крафтса не проходит до нужной степени.
[00034] В некоторых вариантах осуществления Способ 1 дополнительно включает "однореакторную" комбинацию стадий фенольного сочетания и деалкилирования, как описано в предыдущих параграфах, где промежуточное соединение (Соединение I) не выделяют.
[00035] В некоторых вариантах осуществления Способ 1 дополнительно включает алкилирование (например, метилирование) фенольных кислородов Соединения II с получением Соединения III:

[00036] Реакцию метилирования могут проводить при использовании условий, известных специалистам в данной области, как правило, включающих основание и метилирующий агент в подходящем растворителе. Подходящие метилирующие агенты включают метилиодид, метилсульфат (диметилсульфат), метилтрифлат, метилбромид и т.п. Подходящие основания включают неорганические основания (такие как карбонат натрия, бикарбонат натрия, карбонат калия, бикарбонат калия, карбонат цезия и т.п.), и органические основания (такие как триэтиламин, диэтилизопропиламин, DBU, DBN, пиридин, метилморфолин и т.п.). Подходящие растворители включают полярные протонные и полярные апротонные растворители, такие как ацетонитрил, ацетон, тетрагидрофуран, диоксан, диметоксиэтан и т.п.
[00037] В некоторых вариантах осуществления Способ 1 дополнительно включает "однореакторную" комбинацию стадий фенольного сочетания, трет-бутил-деалкилирования и O-алкилирования, как описано в предыдущих параграфах, где промежуточные соединения (Соединения I и II) не выделяют. В конкретном варианте в такой однореакторной комбинации используется ацетилацетонат марганца и кислород в толуоле для стадии сочетания, хлорид алюминия для деалкилирования и диметилсульфат с карбонатом калия в ацетоне для O-алкилирования.
[00038] В некоторых вариантах осуществления Способ 1 дополнительно включает бензильное галогенирование, например бензильное бромирование, хлорирование или иодирование, Соединения III с получением Соединения IV, где X является бромом, хлором или иодом:

[00039] Реакция бензильного галогенирования является реакцией свободнорадикального галогенирования. Реакцию галогенирования могут проводить при использовании условий, известных специалистам в данной области, и, как правило, они включают инициатор свободнорадикальной реакции и источник галогена, и подходящий растворитель. Подходящие инициаторы свободнорадикальной реакции включают химические инициаторы (например, азобисизобутиронитрил или ди-трет-бутилпероксид) и физические инициаторы (например, ультрафиолетовое излучение). Подходящие источники галогена включают любые соединения, способные к образованию радикалов галогена (например, радикала брома, радикала хлора или радикала иода). Такие источники галогена включают молекулярные галогены (например, бром, хлор, иод) и соединения, которые образуют молекулярные галогены (например, N-бромсукцинимид, N-хлорсукцинимид, N-иодсукцинимид). Подходящие растворители включают неполярные растворители и полярные апротонные растворители, такие как ацетонитрил, тетрагидрофуран, диоксан, четыреххлористый углерод, ТХЭ, дихлорэтан, бензол и хлорбензол и т.п.
[00040] В некоторых вариантах осуществления Способ 1 дополнительно включает сочетание винилметаллоорганического агента с Соединением IV с получением диаллильного соединения V:

[00041] Реакцию сочетания могут проводить при использовании условий, известных специалистам в данной области, и, как правило, они включают винилметаллоорганический агент и, необязательно, катализатор на основе металла. Типичные виниловые реагенты включают винилмагнийбромид, винилмагнийхлорид, винилмагнийиодид, виниллитий и реагенты винилмеди (например, дивинилмедьлитий). Типичные катализаторы на основе металла включают соли меди (I), такие как иодид меди (I), хлорид меди (I) и бромид меди (I), соли никеля (II), комплексы палладия и комплексы железа (III). Подходящие растворители включают неполярные растворители и полярные апротонные растворители, такие как ацетонитрил, тетрагидрофуран, диоксан, диметоксиэтан, диэтиловый эфир, четыреххлористый углерод, ТХЭ, дихлорэтан и бензол и т.п.
[00042] В некоторых вариантах осуществления Способ 1 дополнительно включает деметилирование Соединения V с получением гонокиола и выделение гонокиола из реакционной смеси:

[00043] Реакцию деметилирования могут проводить при использовании условий, известных специалистам в данной области. Типичные реагенты включают иодоводород, бромоводород, трибромид бора (например, комплекс трибромида бора-дихлорметана или комплекс трибромида бора-диметилсульфида), трихлорид бора, хлорид алюминия, смесь хлорида алюминия/диметилсульфида, трифторид бора и иодтриметилсилан, а также комбинации и смеси с источниками галогенида, такими как иодид натрия. Подходящие растворители для реакции являются различными и зависят от выбранного реагента, но могут включать, например, дихлорметан, ацетонитрил, дихлорэтан, толуол и четыреххлористый углерод.
[00044] В некоторых вариантах осуществления Способ 1 включает каждую из вышеуказанных стадий согласно деталям, описанным выше.
[00045] В некоторых вариантах осуществления гонокиол, полученный в соответствии со Способом 1, как описано выше (или Способом 3, как описано ниже), применяется в качестве промежуточного химического соединения в синтезе полезных производных гонокиола, таких как дигидрогонокиолы, тетрагидрогонокиол, моно- и диэпоксиды гонокиола и другие производные, а также их производных.
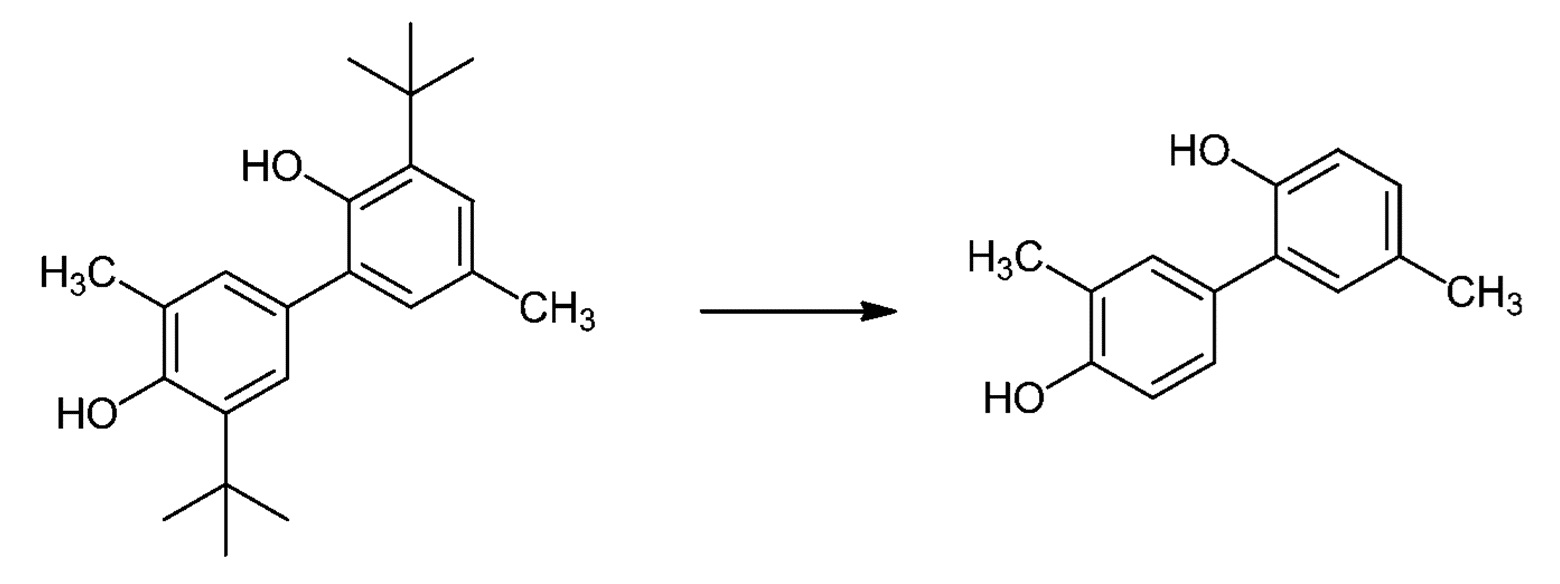
[00046] В другом варианте осуществления настоящего описания предложен способ получения гонокиола, включающий применение 3,3'-ди-трет-бутил-5,5'-диметил-[1,1'-бифенил]-2,4'-диола (Соединения I):
[00047] В другом варианте осуществления настоящего описания предложено применение Соединения I в получении гонокиола.
[00048] В другом варианте осуществления настоящего описания предложен способ получения гонокиола, включающий применение 3',5-диметил-[1,1'-бифенил]-2,4'-диола (Соединения II):

[00049] В другом варианте осуществления настоящего описания предложено применение Соединения II в получении гонокиола.
[00050] В другом варианте осуществления настоящего описания предложен способ получения гонокиола, включающий применение 2,4'-диметокси-3',5-диметил-1,1'-бифенила (Соединениия III):

[00051] В другом варианте осуществления настоящего описания предложено применение Соединения III в получении гонокиола.
[00052] В другом варианте осуществления настоящего описания предложен способ получения гонокиола, включающий применение 3',5-бис(галогенметил)-2,4'-диметокси-1,1'-бифенила (Соединения IV), где X является бромом, хлором или иодом:

[00053] Например, способ получения гонокиола, включающий применение 3',5-бис(бромметил)-2,4'-диметокси-1,1'-бифенила (Соединения IVa):

[00054] В другом варианте осуществления настоящего описания предложено применение Соединения IV, где X является бромом, хлором или иодом, например Соединения IVa, в получении гонокиола.
[00055] В другом аспекте настоящего описания предложен способ (Способ 2) получения 3,3'ди-трет-бутил-5,5'-диметил-[1,1'-бифенил]-2,4'-диола (Соединения I), включающий реакцию 2-трет-бутил-6-метилфенола с 2-трет-бутил-4-метилфенолом, как показано ниже:

[00056] Эта реакция является примером каталитического окислительного кросс-сочетания фенолов между 2,6-дизамещенным фенолом и 2,4-дизамещенным фенолом. Реакция является сложной, поскольку катализатор должен инициировать реакцию кросс-сочетания со значительно более высокой скоростью, чем две конкурирующих реакции гомо-сочетания.
[00057] Подходящие катализаторы для этой реакции окислительного кросс-сочетания фенолов включают системы катализаторов на основе металлов, в которых металл легко подвергается повторному окислению молекулярным кислородом. Такие металлы включают хром (Cr), медь (медь), железо (Fe), марганец (Mn), рутений (Ru) и ванадий (V). В отдельных вариантах осуществления металлом является хром или марганец. Металл применяется в качестве части комплекса, в котором металл связан координационными связями с аминовым или иминовым каркасом, например, салановым (N,N'-этиленбис(салициламиновым)) или саленовым (N,N'-этиленбис(салициламиновым)) каркасом. В некоторых вариантах осуществления фенильные кольца саланового или саленового лиганда замещены орто-алкильной группой, например, орто-трет-бутильной группой. В некоторых вариантах осуществления этиленовый мостик каркаса замещен, например, 1,2-транс-диалкилом, 1,2-транс-диарилом или 1,2-транс-конденсированным циклоалканом. В отдельных вариантах осуществления каркасом является салан-Ph или сален-Ph (1,2-транс-дифенильный мостик), или салан-Cy или сален-Cy (1,2-транс-конденсированный циклогексановый мостик). В одном варианте осуществления комплекс катализатора выбран из Cr-сален-Cy, Mn-сален-Ph или Cu-сален-Cy. Это относительно недорогостоящие катализаторы на основе металлов. В отдельных вариантах осуществления катализатором является Cr-Сален-Cy.
[00058] Реакцию окислительного кросс-сочетания фенолов проводят в подходящем растворителе или смеси растворителей и в присутствии окислителя. Подходящие растворители включают дихлорэтан (ДХЭ), тетрахлорэтан (ТХЭ), четыреххлористый углерод, бензол, толуол, трифторметилбензол, хлорбензол, дихлорбензол и другие сильно неполярные алифатические и ароматические растворители или их смеси. В некоторых вариантах осуществления растворителем является дихлорэтан. Реакционная смесь должна включать окислитель, который способен повторно окислять расходованный в реакции металлсодержащий центр (например, Cr(III)) обратно в состояние его более высокой степени окисления (например, Cr(IV)). Окислителем могут быть любые молекулы, способные производить такое окисление, например, воздух, молекулярный кислород (O2), озон, пероксиды (например, перекись водорода, ди-трет-бутилпероксид), гидропероксиды (например, трет-бутилгидропероксид), пероксикислоты (например, надуксусная кислота, пероксимоносерная кислота, мета-хлорпероксибензойная кислота, трифторнадуксусная кислота, надмуравьиная кислота), неорганические окислители (например, гипохлорит натрия, хлорит натрия, хлорат натрия, перхлорат натрия, перманганат калия, диоксид марганца, диоксид селена, хроматные соли, дихроматные соли, ацетат серебра (I), периодат натрия, бромат натрия и т.д.) и другие органические окислители (например, иодозобензол, иодоксибензойная кислота и другие гипервалентные иодсодержащие реагенты). В отдельных вариантах осуществления окислителем является кислород.
[00059] В некоторых вариантах осуществления Способ 2 дополнительно включает обратное алкилирование Фриделя-Крафтса Соединения I с получением Соединения II:

[00060] Обратная реакция алкилирования Фриделя-Крафтса проходит при использовании катализатора на основе кислоты Льюиса, например, катализатора на основе галогенида металла (например, хлорида алюминия, содержащего хлорид железа (III)) в подходящем растворителе. Подходящие растворители включают безводные растворители, такие как бензол, толуол, ДХЭ, ТХЭ, четыреххлористый углерод и хлорбензол. В некоторых вариантах осуществления обратная реакция алкилирования Фриделя-Крафтса и кросс-сочетание фенолов проходят в однореакторной реакции, то есть после того, как кросс-сочетание прошло до необходимой степени, непосредственно в существующую реакционную смесь добавляют реагент (например, трихлорид алюминия) и продолжают реакцию, пока обратная реакция Фриделя-Крафтса не пройдет до необходимой степени.
[00061] В другом аспекте настоящего описания предложено новое соединение, выбранное из Соединения I, Соединения II и/или Соединения III. В другом аспекте настоящего описания предложено новое соединение со структурой Соединения IV, где X является бромом, хлором или иодом.
[00062] В другом аспекте настоящего описания предложено любое одно или более из Соединения I, Соединения II, Соединения III или Соединения IV (например, где X является бромом, хлором или иодом) для применения в производстве Гонокиола.
[00063] В другом аспекте настоящего описания предложено любое одно или более из Соединения I, Соединения II, Соединения III или Соединения IV (например, где X является бромом, хлором или иодом) для применения в производстве лекарственного средства, включающего Гонокиол. В некоторых вариантах осуществления такое лекарственное средство является потребительским товаром, например, средством для ухода за полостью рта, средством личной гигиены или средством для ухода на дому, например, средством для ухода за зубами, зубной пастой, пероральным гелем, средством для полоскания рта, ополаскивателем для рта, зубным порошком, солнцезащитным кремом, антиперспирантом, дезодорантом, шампунем, твердым мылом, мылом для тела, средством для мытья тела, кремом для кожи, лосьоном для кожи, увлажняющим лосьоном, жидким мылом, жидкостью для мытья посуды, моющим средством для стирки или бытовой очищающей жидкостью.
[00064] В другом варианте осуществления настоящего описания предложен способ (Способ 3) получения гонокиола, включающий реакцию 2,6-ди-трет-бутилфенола с 2,4-ди-трет-бутилфенолом, с получением 3,3',5,5'-тетра-трет-бутил-[1,1'-бифенил]-2,4'-диола (Соединения VI), как показано ниже:
с последующим выделением Гонокиола.
[00065] Эта реакция также является примером каталитического окислительного кросс-сочетания фенолов между 2,6-дизамещенным фенолом и 2,4-дизамещенным фенолом. Как и в случае с реакцией для получения Соединения I, реакция для получения Соединения VI является сложной, поскольку катализатор должен инициировать реакцию кросс-сочетания со значительно более высокой скоростью, чем две конкурирующих реакции гомо-сочетания. Условия для этой реакции описаны выше.
[00066] В некоторых вариантах осуществления Способ 3 дополнительно включает, в любом порядке, одну или более следующих стадий: деалкилирование четырех трет-бутильных групп Соединения VI, алкилирование двух фенольных кислородов Соединения VI или VII, электрофильное ароматическое галогенирование Соединения VI, VII или VIII, замещение галогенов Соединения IX или галогенпроизводного Соединения VI, VII или VIII аллильным реагентом (например, аллилметаллоорганическим реагентом или аллилгалогенидом) и деалкилирование алкилэфирных групп Соединения V или аллильных производных Соединения VI, VII, VIII.
[00067] В конкретном варианте осуществления Способ 3 дополнительно включает следующие стадии в порядке, показанном на схеме ниже: деалкилирование трет-бутильных групп Соединения VI с получением Соединения VII, алкилирование фенольных кислородов Соединения VII с получением Соединения VIII-A, электрофильное ароматическое галогенирование Соединения VIII-A с получением Соединения IX-A, аллильное замещение Соединения IX-A с получением Соединения V-A и деалкилирование Соединения V-A с получением Гонокиола, и его выделение. В Соединениях VIII-A, IX-A и V-A, R может быть любой C1-6алкильной группой, включающей нормальную, разветвленную цепь и/или замещенную, например, замещенную одним или более C1-6алкиловыми эфирами или замещенную одним или более C1-6алкиловым или ариловым эфиром, или смешанными силиловыми эфирами. Примеры таких групп R включают, без ограничения перечисленными, метил, этил, пропил, изопропил, трет-бутил, бензил, метоксиметил, бензилоксиметил, 2-метоксиэтоксиметил, 1-этоксиэтил, 2-триметилсилилэтил, триметилсилил, триэтилсилил, триизопропилсилил, трет-бутилдиметилсилил, трет-бутилдифенилсилил, дифенилметилсилил, ди-трет-бутилметилсилил и т.п.

[00068] В некоторых вариантах осуществления Способ 3 дополнительно включает деалкилирование Соединения VI с получением Соединения VII (например, обратное алкилирование Фриделя-Крафтса):
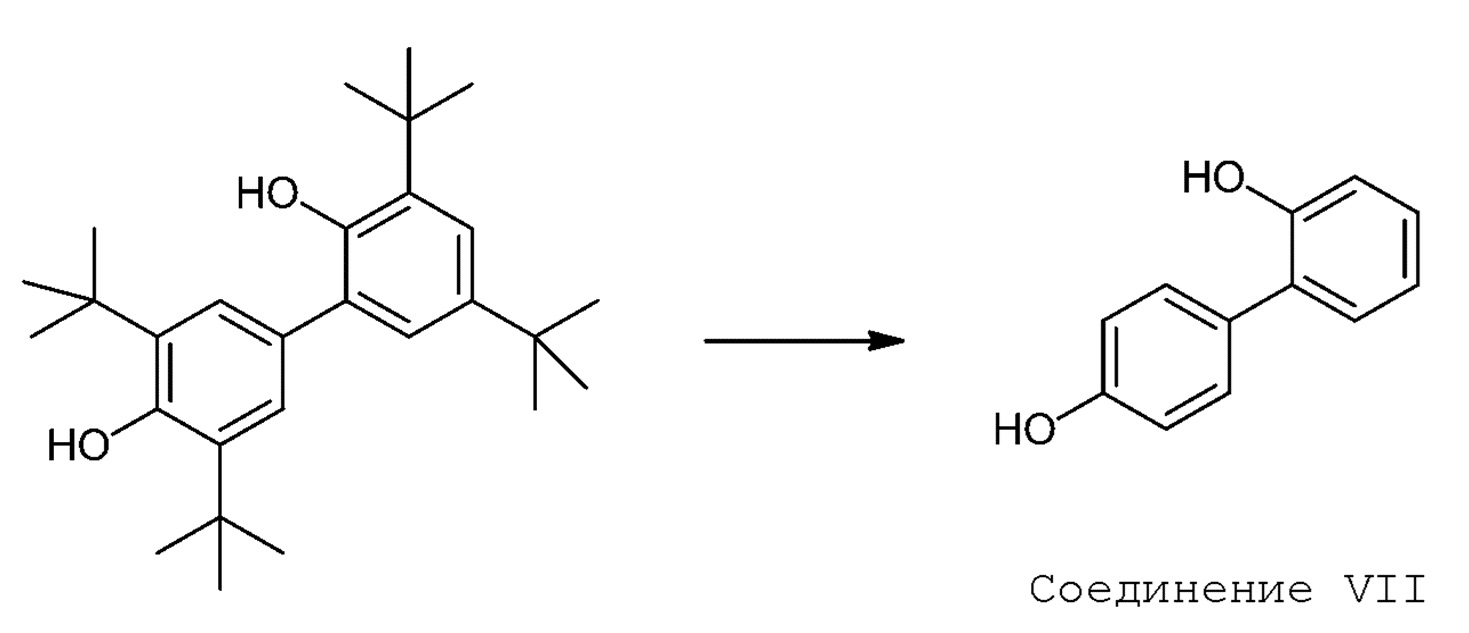
[00069] Обратная реакция алкилирования Фриделя-Крафтса может проходить при использовании катализатора на основе кислоты Льюиса, например, катализатора на основе галегенида металла (например, хлорида алюминия, содержащего хлорид железа (III)), или катализатора на основе кислоты Брэнстеда (например, метансульфоновой кислоты, толуолсульфоновой кислоты, трифторуксусной кислоты), в подходящем растворителе. Подходящие растворители включают безводные растворители, такие как бензол, толуол, ДХЭ, ТХЭ, четыреххлористый углерод и хлорбензол. В некоторых вариантах осуществления, обратное алкилирование Фриделя-Крафтса и кросс-сочетание фенолов проходят в однореакторной реакции, то есть после того, как кросс-сочетание прошло до необходимой степени, непосредственно в существующую реакционную смесь добавляют реагент (например, трихлорид алюминия) и продолжают реакцию, пока обратная реакция Фриделя-Крафтса не проходит до необходимой степени.
[00070] В некоторых вариантах осуществления Способ 3 дополнительно включает "однореакторную" комбинацию стадий фенольного сочетания и деалкилирования, как описано в предыдущих параграфах, где промежуточное соединение (Соединение VI) не выделяют.
[00071] В некоторых вариантах осуществления Способ 3 дополнительно включает алкилирование (например, метилирование) фенольных кислородов Соединения VII с получением Соединения VIII:

[00072] Реакция метилирования может быть проведена при использовании условий, известных специалистам в данной области, как правило, включающих основание и метилирующий агент в подходящем растворителе. Подходящие метилирующие агенты включают метилиодид, метилсульфат (диметилсульфат), метилтрифлат, метилбромид и т.п. Подходящие основания включают неорганические основания (такие как карбонат натрия, бикарбонат натрия, карбонат калия, бикарбонат калия, карбонат цезия и т.п.) и органические основания (такие как триэтиламин, диэтилизопропиламин, DBU, DBN, пиридин, метилморфолин и т.п.). Подходящие растворители включают полярные протонные и полярные апротонные растворители, такие как ацетонитрил, ацетон, тетрагидрофуран, диоксан, диметоксиэтан и т.п.
[00073] В некоторых вариантах осуществления Способ 3 дополнительно включает "однореакторную" комбинацию стадий фенольного сочетания, трет-бутил-деалкилирования и O-алкилирования, как описано в предыдущих параграфах, где промежуточные соединения (Соединения VI и VII) не выделяют.
[00074] В некоторых вариантах осуществления Способ 3 дополнительно включает электрофильное ароматическое галогенирование, например бромирование, хлорирование или иодирование, Соединения VIII с получением Соединения IX, где X является бромом, хлором или иодом:

[00075] Реакция ароматического галогенирования может быть проведена при использовании условий, известных специалистам в данной области, и часто включает инициатор радикальной реакции и источник галогена, и подходящий растворитель. Подходящие инициаторы радикальных реакций включают химические инициаторы (например, азобисизобутиронитрил, перекись водорода или ди-трет-бутилпероксид). Подходящие источники галогенов включают молекулярные галогены (например, бром, хлор, иод), а также галгенидные соли (например, галогениды железа (III)) и соединения, которые образуют молекулярные галогены (например, N-бромсукцинимид, N-хлорсукцинимид, N-иодсукцинимид). Подходящие растворители включают кислотные растворители, такие как уксусную кислоту.
[00076] В некоторых вариантах осуществления Способ 3 дополнительно включает сочетание аллильного реагента с Соединением IX, с получением диаллильного соединения V:
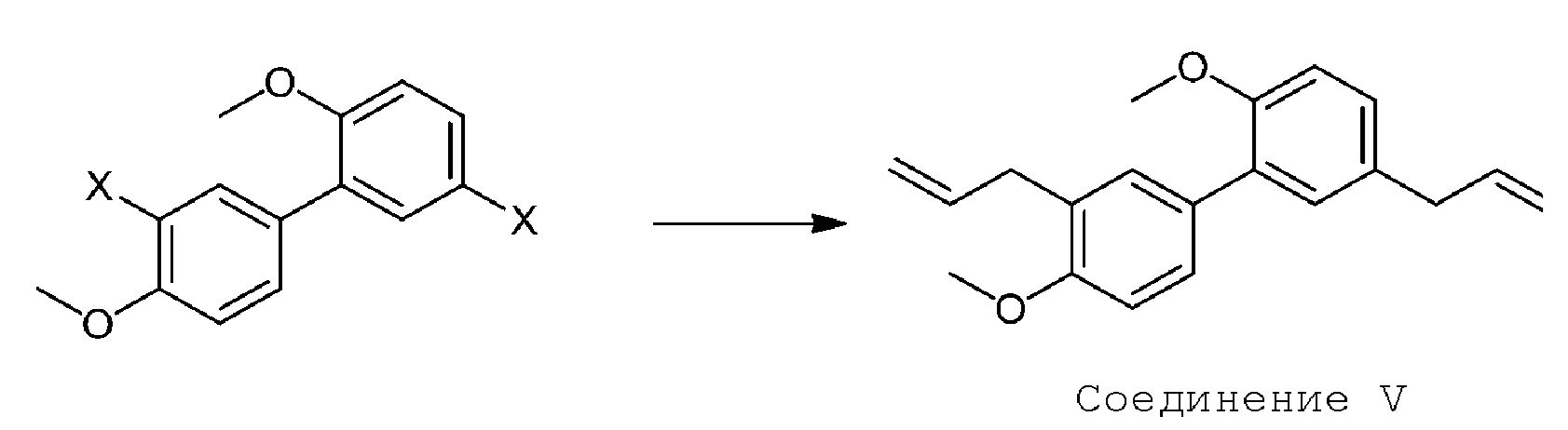
[00077] Реакция сочетания может быть проведена при использовании условий, известных специалистам в данной области. В одном варианте осуществления реакция является сочетанием Кумара-Гриньяра/Кумады аллильного типа. В этой реакции ароматический галагенид (например, бромид) превращают в металлоорганический реагент (например, галогенид лития или магния, например, магнийбромид) в реакции с подходящим реагентом (например, магнием и каталитическим иодом). Реакционноспособный металлоорганический реагент затем можно подвергать сочетанию с аллилгалогенидом, таким как аллилбромид, при использовании палладиевого (0) катализатора, такого как тетракис-(трифенилфосфин)палладий, в подходящем растворителе, таком как ТГФ.
[00078] В другом варианте осуществления аллильное сочетание проводят путем реакции ароматического бромида с аллилметаллоорганическим агентом (например, аллиллитием, аллилмагнийбромидом, аллилмагнийхлоридом или аллилмагнийиодидом) в присутствии палладиевого катализатора и, необязательно, лиганда. В одной стадии реакции палладиевый реагент катализирует замещение ароматического галогенида аллильной группой. Подходящие палладиевые реагенты включают ацетат палладия, необязательно с подходящим лигандом, таким как фосфиновый лиганд (например, X-Phos или BrettPhos). В другом варианте осуществления эта реакция сопровождается последующей обработкой аллилгалогенидом, например аллилбромидом. В некоторых вариантах осуществления обработка аллилметаллоорганическим агентом (например, аллилмагнийбромидом или хлоридом) приводит к превращению некоторой части расположенных в параположении бром-групп Соединения IX в металлоорганическую группу. Например, обработка аллилмагнийбромидом приводит к образованию некоторой части магнийбромидного соединения, т.е. происходит вставка металла, а не прямое сочетание. Когда это происходит, тем не менее, обработка реакционной смеси дополнительным количеством аллилгалогенида (например, аллилбромида или аллилхлорида) приводит к превращению такого промежуточного металлоорганического соединения в требуемый продукт прямого сочетания, как показано ниже.

[00079] В некоторых вариантах осуществления Способ 3 дополнительно включает деметилирование Соединения V с получением гонокиола, как описано выше.
[00080] В другом варианте осуществления настоящего описания предложен способ получения гонокиола, включающий применение 3,3',5,5'-ди-трет-бутил-5,5'-[1,1'-бифенил]-2,4'-диола (Соединения VI):

[00081] В другом варианте осуществления настоящего описания предложено применение Соединения VI в получении гонокиола.
[00082] В другом варианте осуществления настоящего описания предложен способ получения гонокиола, включающий применение 1,1'-бифенил-2,4'-диола (Соединения VII):

[00083] В другом варианте осуществления настоящего описания предложено применение Соединения VII в получении гонокиола.
[00084] В другом аспекте настоящего описания предложен способ (Способ 4) получения 3,3',5,5'-ди-трет-бутил-[1,1'-бифенил]-2,4'-диола (Соединения VI), включающий реакцию 2,6-ди-трет-бутилфенола с 2,4-ди-трет-бутилфенолом, как показано ниже:

[00085] Данная реакция является примером каталитического окислительного кросс-сочетания фенолов между 2,6-дизамещенным фенолом и 2,4-дизамещенным фенолом. Условия этой реакции описаны выше.
[00086] В некоторых вариантах осуществления Способ 4 дополнительно включает обратное алкилирование Фриделя-Крафтса Соединения VI с получением Соединения VII:

[00087] Условия обратного алкилирования Фриделя-Крафтса для получения Соединения VII описаны выше.
[00088] В другом аспекте настоящего описания предложено Соединение VI для применения в производстве Гонокиола. В другом аспекте настоящего описания предложено Соединение VI для применения в производстве лекарственного средства, включающего Гонокиол. В некоторых вариантах осуществления такое лекарственное средство является потребительским товаром, например, средством для ухода за полостью рта, средством личной гигиены или средством для ухода на дому, например, средством для ухода за зубами, зубной пастой, пероральным гелем, средством для полоскания рта, ополаскивателем для рта, зубным порошком, солнцезащитным кремом, антиперспирантом, дезодорантом, шампунем, твердым мылом, мылом для тела, средством для мытья тела, кремом для кожи, лосьоном для кожи, увлажняющим лосьоном, жидким мылом, жидкостью для мытья посуды, моющим средством для стирки или бытовой очищающей жидкостью.
[00089] В другом аспекте настоящего описания предложен способ (Способ 5) получения тетразамещенного бисфенола (Соединения X), включающий реакцию дизамещенного фенола со вторым дизамещенным фенолом, как показано ниже:

где реакция включает применение катализатора на основе металла, и где каждый R1, R2, R3 и R4 независимо является C1-10 алкилом, C1-10 алкиленом или C1-10 алкиниленом, который необязательно замещен эфирной, сульфидной, сложноэфирной, амидной, галогеновой, нитрильной или аминогруппой, и где C1-10 скелет необязательно является нормальным или разветвленным. В некоторых вариантах осуществления каждый R1, R2, R3 и R4 независимо является C1-10 алкилом. В некоторых вариантах осуществления каждый R1, R2, R3 и R4 независимо является C1-4 алкильной группой, необязательно нормальной или разветвленной (например, метилом, этилом, пропилом, изопропилом, бутилом, изобутилом, втор-бутилом или трет-бутилом).
[00090] Данная реакция является примером каталитического окислительного кросс-сочетания фенолов между 2,6-дизамещенным фенолом и 2,4-дизамещенным фенолом. Условия этой реакции описаны выше.
[00091] Изобретение будет описано более подробно посредством конкретных примеров. Следующие примеры предложены в иллюстративных целях и не должны каким-либо образом ограничивать объем изобретения. Специалисты в данной области легко сумеют оценить множество некритических параметров, которые могут быть изменены или модифицированы для получения практически таких же результатов.
ПРИМЕРЫ
[00092] Реакция, описанная в настоящем документе, может быть проведена, как описано в следующих параграфах. Соединения, описанные в настоящем документе, могут быть получены согласно методикам, описанным в следующих параграфах.
Пример 1
[00093] Соединение II (3',5-диметил-[1,1'-бифенил]-2,4'-диол)

В колбу объемом 100 мл, снабженную обратным холодильником, добавляли 2-трет-бутил-6-метилфенол (657 мг, 4,0 ммоль), 2-трет-бутил-4-метилфенол (788 мг, 4,8 ммоль), катализатор Cr-сален-Cy (63 мг, 0,1 ммоль) и перегнанный толуол (20 мл, 0,2 М). Реакционную смесь барботировали кислородом и нагревали до 90°C под атмосферой кислорода в течение 20 ч. Смесь охлаждали до температуры окружающей среды. К полученному раствору Соединения I (3,3'-ди-трет-бутил-5,5'-диметил-[1,1'-бифенил]-2,4'-диола) медленно добавляли хлорид алюминия (1,1 г, 8,8 ммоль) в течение 5 минут при 0°C и оставляли смесь нагреваться в течение 30 минут до температуры окружающей среды. После перемешивания при температуре окружающей среды еще в течение 2 ч, реакцию останавливали, добавляя в реакционную смесь 30 мл раствора 1Н HCl при 0°C. Затем смесь тщательно экстрагировали дихлорметаном (2×20 мл). Объединенные органические слои выпаривали на роторном испарителе. Полученный остаток очищали с помощью хроматографии (силикагель) при использовании 5% этилацетата/гексана в качестве элюента с получением Соединения II (728 мг, 3,4 ммоль, выход 85%) в виде коричневого кристаллического вещества:1H-ЯМР (500 МГц, CDCl3) δ 7,21 (д, J=2,0 Гц, 1H), 7,16 (дд, J=8,5, 2,0 Гц, 1H), 7,03 (дд, J=8,5 Гц, 2,0 Гц, 1H), 7,01 (д, J=2,0 Гц, 1H), 6,87 (д, J=8,0 Гц, 2H), 5,07 (с, 1H), 4,91 (с, 1H), 2,30 (с, 6H);13C-ЯМР (125 МГц, CDCl3) δ 153,6, 150,2, 131,7, 130,6, 129,8, 129,5, 129,2, 127,8, 127,6, 124,8, 115,6, 115,4, 20,5, 15,8; ИК (пленка) 3402, 3026, 2922, 1611, 1496, 1456, 1384, 1118, 818 см-1; МСВР (ЭРИ) m/z=213,0916 вычисл. для C14H13O2 [M-H]-, получено 213,0924.
Пример 2-1
[00094] Соединение III (2,4'-диметокси-3',5-диметил-1,1'-бифенил)

К перемешиваемому раствору Соединения II (728 мг, 3,4 ммоль) в ацетоне (17 мл, 0,2 М) добавляли безводный карбонат калия (1,4 г, 10,2 ммоль, 3,0 экв.). После перемешивания при температуре окружающей среды в течение 10 мин, добавляли диметилсульфат (0,81 мл, 8,5 ммоль, 2,5 экв.) и перемешивали реакционную смесь в течение 5 часов при температуре окружающей среды. Реакцию останавливали деионизированной водой (50 мл) и удаляли ацетон на роторном испарителе. Добавляли этилацетат (20 мл) и отделяли органический слой. Водный слой экстрагировали дополнительным количеством этилацетата (2×20 мл). Объединенные органические слои промывали водой и рассолом, сушили (сульфат натрия) и выпаривали на роторном испарителе. Остаток очищали с помощью колоночной хроматографии (силикагель) при использовании гексана/этилацетата (9:1) в качестве элюента, с получением Соединения III (758 мг, 3,13 ммоль, 92%) в виде белого твердого вещества:1H-ЯМР (500 МГц, CDCl3) δ 7,37 (дд, J=8,0 Гц, 2,0 Гц, 1H), 7,29 (д, J=2,0 Гц, 1H), 7,10 (д, J=2,0 Гц, 1H), 7,07 (дд, J=8,0 Гц, 2,0 Гц, 1H), 6,87 (д, J=1,5 Гц, 1H), 6,86 (д, J=1,5 Гц, 1H), 3,89 (с, 3H), 3,81 (с, 3H), 2,36 (с, 3H), 2,30 (с, 3H);13C-ЯМР (125 МГц, CDCl3) δ 157,0, 154,6, 132,0, 131,6, 130,8, 130,5, 130,1, 128,4, 128,0, 126,2, 111,4, 109,7, 55,9, 55,5, 20,7, 16,5; ИК (пленка) 3437, 2949, 2834, 1609, 1495, 1463, 1242, 1135, 1033, 810, 741 см-1; МСВР (ЭРИ) m/z=243,1385 вычисл. для C16H19O2 [M+H] +, получено 243,1384.
Пример 2-2
[00095] Соединение III (2,4'-диметокси-3',5-диметил-1,1'-бифенил)

В колбу объемом 500 мл, снабженную обратным холодильником, добавляли 2-трет-бутил-6-метилфенол (4,9 г, 30 ммоль), 2-трет-бутил-4-метилфенол (5,9 г, 36 ммоль), Mn(acac)3 (1,0 г, 3,0 ммоль) и перегнанный толуол (150 мл, 0,2 М). Реакционную смесь барботировали кислородом и нагревали до 90°C под атмосферой кислорода в течение 3 дней. Затем смесь охлаждали до температуры окружающей среды с получением раствора Соединения I.
К полученному раствору Соединения I медленно добавляли хлорид алюминия (8,8 г, 66 ммоль) в течение 5 минут при 0°C и оставляли смесь нагреваться в течение 30 минут до температуры окружающей среды. После перемешивания при комнатной температуре в течение 2 часов, реакцию останавливали, добавляя в реакционную смесь 30 мл раствора 1Н HCl при 0°C. Смесь экстрагировали CH2Cl2 (2×50 мл) и объединенные органические слои выпаривали на роторном испарителе с получением неочищенного Соединения II.
К перемешиваемому раствору неочищенного Соединения II в ацетоне (150 мл, 0,2 М) добавляли безводный карбонат калия (11,6 г, 84 ммоль). После перемешивания при температуре окружающей среды в течение 10 мин, добавляли диметилсульфат (7,1 мл, 75 ммоль) и перемешивали реакционную смесь в течение 4 часов при температуре окружающей среды. Реакцию останавливали деионизированной водой (50 мл) и удаляли ацетон на роторном испарителе. Добавляли этилацетат (50 мл) и отделяли органический слой. Водный слой экстрагировали этилацетатом (2×50 мл). Объединенные органические слои промывали рассолом (100 мл), сушили сульфатом натрия и выпаривали на роторном испарителе. Остаток очищали с помощью колоночной хроматографии при использовании гексана/этилацетата (9:1) в качестве элюента с получением Соединения III (5,7 г, 23,5 ммоль, общий выход 78%) в виде бледно-желтой жидкости:1H-ЯМР (500 МГц, CDCl3) δ 7,37 (дд, J=8,0 Гц, 2,0 Гц, 1H), 7,29 (д, J=2,0 Гц, 1H), 7,10 (д, J=2,0 Гц, 1H), 7,07 (дд, J=8,0 Гц, 2,0 Гц, 1H), 6,87 (д, J=1,5 Гц, 1H), 6,86 (д, J=1,5 Гц, 1H), 3,89 (с, 3H), 3,81 (с, 3H), 2,36 (с, 3H), 2,30 (с, 3H);13C-ЯМР (125 МГц, CDCl3) δ 157,0, 154,6, 132,0, 131,6, 130,8, 130,5, 130,1, 128,4, 128,0, 126,2, 111,4, 109,7, 55,9, 55,5, 20,7, 16,5; ИК (пленка) 3437, 2949, 2834, 1609, 1495, 1463, 1242, 1135, 1033, 810, 741 см-1; МСВР (ЭРИ) m/z=243,1385 вычисл. для C16H19O2 [M+H]+, получено 243,1384.
Пример 3
[00096] Соединение IVa (3',5-бис(бромметил)-2,4'-диметокси-1,1'-бифенил)

Соединение III (758 мг, 3,13 ммоль), азобисизобутиронитрил (26 мг, 0,16 ммоль) и N-бромсукцинимид (1,11 г, 6,26 ммоль, кристаллизованный из воды) растворяли в четыреххлористом углероде (15 мл). Реакционную смесь нагревали до 85°C и перемешивали в течение 2 ч под атмосферой аргона. Раствор фильтровали и удаляли растворитель на роторном испарителе. Остаток очищали с помощью колоночной хроматографии (силикагель) при использовании 5% этилацетата/гексана в качестве элюента с получением Соединения IVa (720 мг, 1,8 ммоль, выход 57%) в виде желтого твердого вещества:1H-ЯМР (500 МГц, CDCl3) δ 7,50 (д, J=2,3 Гц, 1H), 7,47 (дд, J=8,5 Гц, 2,3 Гц, 1H), 7,34-7,32 (м, 2H), 6,94 (д, J=8,5 Гц, 1H), 6,92 (д, J=8,5 Гц, 1H), 4,62 (с, 2H), 4,54 (с, 2H), 3,94 (с, 3H), 3,82 (с, 3H);13C-ЯМР (125 МГц, CDCl3) δ 156,7, 156,5, 132,0, 131,5, 131,2, 130,2, 130,1, 130,0, 129,2, 125,6, 111,3, 110,6, 55,7, 33,9, 29,1; ИК (пленка) 3437, 2959, 1608, 1495, 1462, 1251, 1216, 1147, 1027, 818, 738 см-1.
Пример 4-1 (малый масштаб)
[00097] Соединение V (3',5-диаллил-2,4'-диметокси-1,1'-бифенил)

К раствору иодида меди (I) (26 мг, 0,14 ммоль) и Соединения IVa (110 мг, 0,28 ммоль) в перегнанном тетрагидрофуране (10 мл) при -10°C медленно добавляли 1,0 М раствор винилмагнийбромида в тетрагидрофуране (1,1 мл) под атмосферой аргона. Смесь перемешивали при температуре окружающей среды в течение 4 часов. Затем реакцию останавливали добавлением 15 мл деионизированной воды. Смесь экстрагировали диэтиловым эфиром (2×15 мл). Объединенные органические слои сушили безводным сульфатом натрия и фильтровали. После удаления растворителя на роторном испарителе, остаток очищали с помощью колоночной хроматографии (силикагель) при использовании 5% этилацетата/гексана в качестве элюента с получением Соединения V (50 мг, 0,17 ммоль, выход 62%) в виде прозрачного масла:1H-ЯМР (500 МГц, CDCl3) δ 7,37 (дд, 1H, J=8,5, 2,0 Гц), 7,31 (д, 1H, J=2,0 Гц), 7,11 (д, 1H, J=2,0 Гц), 7,09 (дд, 1H, J=8,5, 2,0 Гц), 6,91 (с, 1H), 6,89 (с, 1H), 5,96-6,01 (м, 2H), 5,03-5,11 (м, 4H), 3,86 (с, 3H), 3,78 (с, 3H), 3,43 (д, 2H, J=6,5 Гц), 3,37 (д, 2H, J=6,5 Гц).
Пример 4-2 (крупный масштаб)
[00098] Соединение V (3',5-диаллил-2,4'-диметокси-1,1'-бифенил)

К раствору CuI (286 мг, 1,5 ммоль) и Соединения IV (1,2 г, 3,0 ммоль) в сухом ТГФ (15 мл) при -78°C медленно добавляли раствор винилмагнийбромида (12 мл, 1,0 М в ТГФ) со скоростью 3 мл/мин при помощи шприцевого насоса под атмосферой аргона. Полученной смеси позволяли нагреться до температуры окружающей среды и перемешивали в течение 8 ч. Затем реакцию останавливали добавлением 15 мл насыщенного раствора NH4Cl. Смесь экстрагировали диэтиловым эфиром (2×15 мл). Объединенные органические слои сушили безводным Na2SO4 и фильтровали. После удаления растворителя на роторном испарителе остаток очищали с помощью колоночной хроматографии (силикагель) при использовании 5% этилацетата/гексана в качестве элюента, с получением Соединения V (665 мг, 2,25 ммоль, выход 75%) в виде прозрачного масла.1H-ЯМР (500 МГц, CDCl3) δ 7,39 (дд, J=8,4 Гц, 2,2 Гц, 1H), 7,33 (д, J=2,3 Гц, 1H), 7,14 (д, J=2,2 Гц, 1H), 7,09 (дд, J=8,4 Гц, 2,0 Гц, 1H), 6,91 (д, J=8,4 Гц, 2H), 6,01-5,96 (м, 2H), 5,03-5,11 (м, 4H), 3,86 (с, 3H), 3,78 (с, 3H), 3,43 (д, J=6,5 Гц, 2H), 3,37 (д, J=6,5 Гц, 2H);13C-ЯМР (125 МГц, CDCl3) δ 156,4, 154,9, 137,8, 137,0, 132,2, 131,0, 130,9, 130,7, 130,5, 128,3, 128,1, 127,9, 115,5, 115,3, 111,3, 109,9, 55,7, 55,4, 39,4, 34,3; ИК (пленка) 3435, 2938, 2836, 1638, 1606, 1493, 1463, 1245, 1134, 1029, 914, 815 см-1; МСВР (ЭРИ) m/z=295,1698 вычисл. для C20H23O2 [M+H]+, получено 295,1705.
Пример 5-1
[00099] Гонокиол (3',5-диаллил-[1,1'-бифенил]-2,4'-диол), при использовании BBr3-ДХМ

К раствору Соединения V (50 мг, 0,17 ммоль) в перегнанном дихлорметане (1 мл) добавляли раствор BBr3 (0,4 мл, 1М в дихлорметане) при -40°C под атмосферой аргона. Полученной смеси позволяли нагреться до температуры окружающей среды и перемешивали в течение 5 часов. Реакцию останавливалии насыщенным раствором бикарбоната натрия и экстрагировали дихлорметаном (3×10 мл). Объединенные органические слои промывали рассолом (10 мл), сушили над Na2SO4 и фильтровали. Растворитель выпаривали на роторном испарителе и очищали остаток с помощью колоночной хроматографии (силикагель) при использовании 20% этилацетата/гексана в качестве элюента, с получением гонокиола (32 мг, 0,12 ммоль, выход 73%) в виде белого твердого вещества;1H-ЯМР (500 МГц, CDCl3) δ 7,23 (дд, 1H, J=8,0, 2,0 Гц), 7,21 (д, 1H, J=2,1 Гц), 7,05 (дд, 1H, J=8,0, 2,0 Гц), 7,02 (д, 1H, J=2,1 Гц), 6,93 (д, 1H, J=3,8 Гц), 6,90 (д, 1H, J=8,2 Гц), 5,93-6,08 (м, 2H), 5,17-5,24 (м, 3H), 5,03-5,11 (м, 3H) 3,46 (д, 2H, J=6,5 Гц), 3,35 (д, 2H, J=6,7 Гц).
Пример 5-2
[000100] Гонокиол (3',5-диаллил-[1,1'-бифенил]-2,4'-диол), при использовании BBr3-ДМС

К раствору Соединения V (400 мг, 1,36 ммоль) в перегнанном 1,2-дихлорэтане (7 мл) медленно добавляли комплекс BBr3⋅ДМС (1,0 г, 3,26 ммоль). Реакционный сосуд герметично закрывали под атмосферой аргона и нагревали до 65°C в течение 15 ч. Реакцию останавливали насыщенным раствором NaHCO3 (15 мл) и экстрагировали дихлорметаном (3×15 мл). Объединенные органические слои промывали рассолом (15 мл), сушили над Na2SO4 и фильтровали. Растворитель выпаривали на роторном испарителе и очищали остаток с помощью колоночной хроматографии (силикагель) при использовании 20% этилацетата/гексана в качестве элюента, с получением гонокиола (345 мг, 1,29 ммоль, выход 95%) в виде белого твердого вещества;1H-ЯМР (500 МГц, CDCl3) δ 7,23 (дд, J=8,0 Гц, 2,0 Гц, 1H), 7,21 (д, J=2,1 Гц, 1H), 7,05 (дд, J=8,0 Гц, 2,0 Гц, 1H), 7,02 (д, J=2,1 Гц, 1H), 6,93 (д, J=8,2 Гц, 1H), 6,90 (д, J=8,2 Гц, 1H), 5,93-6,08 (м, 2H), 5,17-5,24 (м, 3H), 5,03-5,11 (м, 3H) 3,46 (д, J=6,5 Гц, 2H), 3,35 (д, J=6,7 Гц, 2H);13C-ЯМР (125 МГц, CDCl3) δ 153,9, 150,7, 137,8, 136,0, 132,2, 131,1, 130,2, 129,6, 128,8, 128,6, 127,7, 126,4, 116,9, 116,6, 115,6, 115,5, 39,4, 35,1; МСВР (ЭРИ) m/z=265,1229 вычисл. для C18H17O2 [M-H]-, получено 265,1223.
Пример 6-1
[000101] Соединение VI (3,3',5,5'-ди-трет-бутил-[1,1'-бифенил]-2,4'-диол), при использовании AgOAc

В пробирку объемом 5 мл для микроволнового реактора добавляли раствор 2,6-ди-трет-бутилфенола (20,6 мг, 0,1 ммоль) и 2,4-ди-трет-бутилфенола (30,9 мг, 0,15 ммоль) в 2 мл хлорбензола и AgOAc (33 мг, 0,2 ммоль). Пробирку закрывали обжимным колпачком и перемешивали при 80°C в течение 3 дней. Затем смесь выпаривали в вакууме и очищали остаток с помощью колоночной флеш-хроматографии на силикагеле (гексаны/метиленхлорид=30:1→10:1), с получением Соединения VI в виде желтого твердого вещества (39 мг, 0,095 ммоль, выход 95%).1H-ЯМР (500 МГц, CDCl3) 7,34 (д, 1H, J=2,5 Гц), 7,25 (с, 2H), 7,12 (д, 1H, J=2,5 Гц), 5,45 (с, 1H), 5,34 (с, 1H), 1,49 (с, 18H), 1,47 (с, 9H), 1,35 (с, 9H);13C-ЯМР (125 МГц, CDCl3) δ 153,79, 149,11, 141,91, 137,10, 135,09, 129,06, 128,64, 126,50, 125,03, 123,44, 35,30, 34,70, 34,51, 31,84, 30,48, 29,89.
Пример 6-2
[000102] Соединение VI (3,3',5,5'-ди-трет-бутил-[1,1'-бифенил]-2,4'-диол), при использовании Cr катализатора

В пробирку объемом 5 мл для микроволнового реактора добавляли раствор 2,6-ди-трет-бутилфенола (20,6 мг, 0,1 ммоль) и 2,4-ди-трет-бутилфенола (30,9 мг, 0,15 ммоль) в 2 мл хлорбензола и катализатор Cr-сален-Cy (6,6 мг, 0,01 ммоль). Кислород добавляли при активном барботировании. Пробирку закрывали обжимным колпачком и перемешивали при 80°C в течение ночи. Затем смесь выпаривали в вакууме и очищали остаток с помощью колоночной флеш-хроматографии на силикагеле (гексаны/метиленхлорид=30:1→10:1), с получением Соединения VI в виде желтого твердого вещества (32 мг, выход 78%):1H-ЯМР (500 МГц, CDCl3) δ 7,34 (д, 1H, J=2,5 Гц), 7,25 (с, 2H), 7,12 (д, 1H, J=2,5 Гц), 5,45 (с, 1H), 5,34 (с, 1H), 1,49 (с, 18H), 1,47 (с, 9H), 1,35 (с, 9H);13C-ЯМР (125 МГц, CDCl3) δ 153,79, 149,11, 141,91, 137,10, 135,09, 129,06, 128,64, 126,50, 125,03, 123,44, 35,30, 34,70, 34,51, 31,84, 30,48, 29,89.
Пример 6-3
[000103] Соединение VI (3,3',5,5'-ди-трет-бутил-[1,1'-бифенил]-2,4'-диол), при использовании DTBP

В пробирку объемом 5 мл для микроволнового реактора добавляли раствор 2,6-ди-трет-бутилфенола (103 мг, 0,5 ммоль) и 2,4-ди-трет-бутилфенола (154 мг, 0,75 ммоль) в 2 мл хлорбензола и ди-трет-бутилпероксид (87 мг, 0,6 ммоль). Пробирку закрывали обжимным колпачком и перемешивали при 130°C. Через 8 ч к раствору добавляли дополнительную порцию ди-трет-бутилпероксида (22 мг, 0,15 ммоль), пробирку снова закрывали и перемешивали при 130°C в течение еще 16 ч. Затем смесь выпаривали в вакууме и очищали остаток с помощью колоночной флеш-хроматографии на силикагеле (гексаны/метиленхлорид=30:1→10:1), с получением Соединения VI в виде желтого твердого вещества (159 мг, выход 76%):1H-ЯМР (500 МГц, CDCl3) δ 7,34 (д, 1H, J=2,5 Гц), 7,25 (с, 2H), 7,12 (д, 1H, J=2,5 Гц), 5,45 (с, 1H), 5,34 (с, 1H), 1,49 (с, 18H), 1,47 (с, 9H), 1,35 (с, 9H);13C-ЯМР (125 МГц, CDCl3) δ 153,79, 149,11, 141,91, 137,10, 135,09, 129,06, 128,64, 126,50, 125,03, 123,44, 35,30, 34,70, 34,51, 31,84, 30,48, 29,89.
Пример 7
[000104] Соединение VII ([1,1'-бифенил]-2,4'-диол) из Соединения VI

К раствору Соединения VI (41 мг, 0,1 ммоль) в толуоле (2 мл) добавляли метансульфоновую кислоту (144 мг, 97 мкл, 1,5 ммоль) при 100°C. После того как исходный материал прореагировал, реакцию останавливали добавлением воды и затем смесь экстрагировали EtOAc (3×50 мл). Смесь выпаривали в вакууме и очищали остаток с помощью колоночной флеш-хроматографии на силикагеле (гексаны/этилацетат=10:1→6:1), с получением Соединения VII в виде желтого твердого вещества (17 мг, выход 92%):1H-ЯМР (500 МГц, ацетон-d6) δ 8,35 (с, 1H), 8,12 (с, 1H), 7,45-7,41 (м, 2H), 7,25 (дд, 1H, J=7,8, 2,0 Гц), 7,12 (тд, 1H, J=7,8, 2,0 Гц), 6,95 (дд, 1H, J=8, 1,0 Гц), 6,91-6,85 (м, 3H),;13C-ЯМР (125 МГц, ацетон-d6) δ 157,04, 154,71, 131,06, 130,97, 130,61, 129,12, 128,44, 120,59, 116,66, 115,56, 115,47.
Пример 8-1
[000105] Соединение VII ([1,1'-бифенил]-2,4'-диол), однореакторный синтез с использованием AgOAc

В колбу объемом 100 мл, снабженную обратным холодильником, добавляли 2,6-ди-трет-бутилфенол (2,06 г, 10 ммоль), 2,4-ди-трет-бутилфенол (3,09 г, 15 ммоль), AgOAc (3,32 г, 20 ммоль) и перегнанный толуол (50 мл, 0,2 М). Реакционную смесь нагревали до 90°C под атмосферой кислорода в течение 3 дней. Смесь охлаждали до температуры окружающей среды. К полученному раствору 3,3',5,5'-тетра-трет-бутил-[1,1'-бифенил]-2,4'-диола медленно добавляли метансульфоновую кислоту (14,4 г, 150 ммоль) в течение 5 минут при 0°C и нагревали раствор до 100°C в течение 24 ч. После перемешивания при температуре окружающей среды в течение еще 2 ч, реакцию останавливали, добавляя в реакционную смесь 100 мл деионизированной воды при 0°C. Смесь тщательно экстрагировали EtOAc (3×200 мл). Объединенные органические слои выпаривали в вакууме и очищали остаток с помощью хроматографии (силикагель) при использовании 15% этилацетата/гексана в качестве элюента с получением Соединения VII (1,5 г, 8,1 ммоль, выход 81%) в виде белого твердого вещества:1H-ЯМР (500 МГц, ацетон-d6) δ 8,35 (с, 1H), 8,12 (с, 1H), 7,45-7,41 (м, 2H), 7,25 (дд, 1H, J=7,8, 2,0 Гц), 7,12 (тд, 1H, J=7,8, 2,0 Гц), 6,95 (дд, 1H, J=8, 1,0 Гц), 6,91-6,85 (м, 3H);13C-ЯМР (125 МГц, ацетон-d6) δ 157,04, 154,71, 131,06, 130,97, 130,61, 129,12, 128,44, 120,59, 116,66, 115,56, 115,47.
Пример 8-2
[000106] Соединение VII ([1,1'-бифенил]-2,4'-диол), однореакторный синтез с Cr катализатором

В колбу объемом 100 мл, снабженную обратным холодильником, добавляли 2,6-ди-трет-бутилфенол (3,09 г, 15 ммоль), 2,4-ди-трет-бутилфенол (4,6 г, 22,5 ммоль), катализатор Cr-сален-Cy (495 мг, 0,75 ммоль) и перегнанный толуол (100 мл, 0,15 М). Реакционную смесь нагревали до 90°C под атмосферой кислорода в течение 17 ч. Смесь охлаждали до температуры окружающей среды. К полученному раствору 3,3',5,5'-тетра-трет-бутил-[1,1'-бифенил]-2,4'-диола медленно добавляли хлорид алюминия (15,7 г, 120 ммоль) в течение 30 минут при 0°C, после чего смесь перемешивали в течение 5 ч при комнатной температуре. Реакцию останавливали, добавляя в реакционную смесь 100 мл деионизированной воды при 0°C. Смесь тщательно экстрагировали EtOAc (3×200 мл). Объединенные органические слои выпаривали в вакууме и очищали остаток с помощью хроматографии (силикагель) при использовании 15% этилацетата/гексана в качестве элюента с получением Соединения VII (2,42 г, 13 ммоль, выход 87%) в виде белого твердого вещества:1H-ЯМР (500 МГц, ацетон-d6) δ 8,35 (с, 1H), 8,12 (с, 1H), 7,45-7,41 (м, 2H), 7,25 (дд, 1H, J=7,8, 2,0 Гц), 7,12 (тд, 1H, J=7,8, 2,0 Гц), 6,95 (дд, 1H, J=8, 1,0 Гц), 6,91-6,85 (м, 3H);13C-ЯМР (125 МГц, ацетон-d6) δ 157,04, 154,71, 131,06, 130,97, 130,61, 129,12, 128,44, 120,59, 116,66, 115,56, 115,47.
Пример 8-3
[000107] Соединение VII ([1,1'-бифенил]-2,4'-диол), однореакторный синтез с использованием DTBP

В колбу объемом 100 мл, снабженную обратным холодильником, добавляли 2,6-ди-трет-бутилфенол (2,06 г, 10 ммоль), 2,4-ди-трет-бутилфенол (3,09 г, 15 ммоль), ди-трет-бутилпероксид (2,19 г, 15 ммоль) и перегнанный толуол (50 мл, 0,2 М). Реакционную смесь нагревали до 130°C под воздушной атмосферой. Через 15 ч добавляли дополнительную порцию ди-трет-бутилпероксида (2,19 г, 15 ммоль) и перемешивали смесь еще в течение 9 ч под воздухом при 130°C. Смесь охлаждали до температуры окружающей среды. К полученному раствору 3,3',5,5'-тетра-трет-бутил-[1,1'-бифенил]-2,4'-диола медленно добавляли метансульфоновую кислоту (14,4 г, 150 ммоль) в течение 5 минут при 0°C и нагревали раствор до 100°C в течение 8 ч. После перемешивания при температуре окружающей среды еще в течение 2 ч реакцию останавливали, добавляя в реакционную смесь 100 мл деионизированной воды при 0°C. Затем смесь тщательно экстрагировали EtOAc (3×200 мл). Объединенные органические слои выпаривали в вакууме и очищали остаток с помощью хроматографии (силикагель) при использовании 15% этилацетата/гексана в качестве элюента, с получением Соединения VII (1,62 г, 8,7 ммоль, выход 88%) в виде белого твердого вещества:1H-ЯМР (500 МГц, ацетон-d6) δ 8,35 (с, 1H), 8,12 (с, 1H), 7,45-7,41 (м, 2H), 7,25 (дд, 1H, J=7,8, 2,0 Гц), 7,12 (тд, 1H, J=7,8, 2,0 Гц), 6,95 (дд, 1H, J=8, 1,0 Гц), 6,91-6,85 (м, 3H);13C-ЯМР (125 МГц, ацетон-d6) δ 157,04, 154,71, 131,06, 130,97, 130,61, 129,12, 128,44, 120,59, 116,66, 115,56, 115,47.
Пример 9
[000108] Соединение VIII (2,4'-диметокси-1,1'-бифенил)

К перемешиваемому раствору Соединения VII (1,5 г, 8,1 ммоль) в ацетоне (50 мл, 0,16 М) добавляли безводный карбонат калия (3,28 г, 24 ммоль). После перемешивания при температуре окружающей среды в течение 10 минут, добавляли диметилсульфат (2,54 г, 20,2 ммоль) и перемешивали реакционную смесь в течение 18 ч при температуре окружающей среды. Реакцию останавливали деионизированной водой (50 мл) при температуре окружающей среды и удаляли ацетон на роторном испарителе. Добавляли этилацетат (50 мл) и отделяли органический слой, а водный слой дополнительно экстрагировали EtOAc. Объединенные органические слои промывали рассолом (50 мл) и сушили сульфатом магния. Остаток выпаривали в вакууме с получением Соединения VIII в виде бледно-желтой жидкости (1,73 г, выход >99%):1H-ЯМР (500 МГц, CDCl3) δ 7,53 (д, 2H, J=9 Гц), 7,38-7,30 (м, 2H), 7,06 (тд, 1H, J=7,5 Гц, 1 Гц), 7,03-6,97 (м, 2H), 3,88 (с, 3H), 3,85 (с, 3H);13C-ЯМР (125 МГц, CDCl3) δ 158,84, 156,63, 131,08, 130,87, 130,80, 130,50, 128,37, 121,01, 113,68, 111,36, 55,71, 55,44.
Пример 10
[000109] Соединение IX ((3',5-дибром-2,4'-диметокси-1,1'-бифенил)

К перемешиваемому раствору Соединения VIII (856 мг, 4 ммоль) в уксусной кислоте (15 мл, 0,27 М) добавляли 1 мл раствора 30% (в/в) H2O2 в H2O при 0°C. После перемешивания при 0°C в течение 30 минут, медленно добавляли бром (752 мг, 4,8 ммоль) и оставляли реакционную смесь перемешиваться в течение 4 ч при 0°C. После перемешивания при температуре окружающей среды в течение еще 1 ч, осадок отфильтровывали и промывали уксусной кислотой и деионизированной водой. Остаток сушили в вакууме с получением Соединения IX в виде желтоватого кристаллического вещества (1,31 г, выход 89%):1H-ЯМР (500 МГц, CDCl3) δ 7,71 (д, 1H, J=2,0 Гц), 7,43-7,37 (м, 3H), 6,94 (д, 1H, J=8,5 Гц), 6,84 (д, 1H, J=9,5 Гц), 3,93 (с, 3H), 3,80 (с, 3H);13C-ЯМР (125 МГц, CDCl3) δ 155,62, 155,31, 134,22, 133,13, 131,26, 130,96, 130,87, 129,62, 113,13, 113,01, 111,53, 111,36, 56,39, 55,94.
Пример 11
[000110] Соединение V (3',5-диаллил-2,4'-диметокси-1,1'-бифенил) из Соединения IX

К перемешиваемому раствору Соединения IX (1,47 г, 4 ммоль) в ТГФ (10 мл, 0,4 М) добавляли раствор Pd(OAc)2 (44 мг, 0,2 ммоль) и лиганда XPhos (95 мг, 0,2 ммоль) в ТГФ (5 мл). После перемешивания в течение 30 минут при температуре окружающей среды, к смеси медленно добавляли раствор аллилмагнийбромида (1,0 М в Et2O, 20 мл, 20 ммоль) и перемешивали раствор в течение 15 ч при 40°C. Затем медленно добавляли аллилбромид (2,4 г, 12 ммоль) при комнатной температуре и перемешивали полученную смесь еще в течение 2 ч. Реакцию останавливали водным NH4Cl (30 мл) и экстрагировали EtOAc (3×100 мл). Объединенные органические слои выпаривали в вакууме и очищали остаток с помощью хроматографии (силикагель) при использовании 3% этилацетата/гексан в качестве элюента, с получением Соединения V (1,06 г, 3,6 ммоль, выход 89%) в виде бесцветной жидкости:1H-ЯМР (500 МГц, CDCl3) δ 7,39 (дд, J=8,4 Гц, 2,2 Гц, 1H), 7,33 (д, J=2,3 Гц, 1H), 7,14 (д, J=2,2 Гц, 1H), 7,09 (дд, J=8,4 Гц, 2,0 Гц, 1H), 6,91 (д, J=8,4 Гц, 2H), 6,01-5,96 (м, 2H), 5,03-5,11 (м, 4H), 3,86 (с, 3H), 3,78 (с, 3H), 3,43 (д, J=6,5 Гц, 2H), 3,37 (д, J=6,5 Гц, 2H);13C-ЯМР (125 МГц, CDCl3) δ 156,4, 154,9, 137,8, 137,0, 132,2, 131,0, 130,9, 130,7, 130,5, 128,3, 128,1, 127,9, 115,5, 115,3, 111,3, 109,9, 55,7, 55,4, 39,4, 34,3; ИК (пленка) 3435, 2938, 2836, 1638, 1606, 1493, 1463, 1245, 1134, 1029, 914, 815 см-1; МСВР (ЭРИ) m/z=295,1698 вычисл. для C20H23O2 [M+H]+, получено 295,1705.
Пример 12-1
[000111] Гонокиол (3',5-диаллил-[1,1'-бифенил]-2,4'-диол), с использованием BBr3-ДМС
К раствору Соединения V (1,06 г, 3,6 ммоль) в перегнанном дихлорэтане (12 мл) добавляли раствор BBr3⋅ДМС (1М в дихлорметане, 8 мл, 8 ммоль) при комнатной температуре под атмосферой аргона. Полученную смесь перемешивали в течение 15 ч при 65°C. Реакцию останавливали насыщенным раствором бикарбоната натрия и экстрагировали дихлорметаном (3×100 мл). Объединенные органические слои промывали рассолом (10 мл), сушили над Na2SO4 и фильтровали. Фильтрат выпаривали на роторном испарителе и очищали остаток с помощью колоночной хроматографии (силикагель) при использовании 20% этилацетата/гексана в качестве элюента, с получением гонокиола (820 мг, 3,1 ммоль, выход 91%) в виде белого твердого вещества;1H-ЯМР (500 МГц, CDCl3) δ 7,23 (дд, J=8,0 Гц, 2,0 Гц, 1H), 7,21 (д, J=2,1 Гц, 1H), 7,05 (дд, J=8,0 Гц, 2,0 Гц, 1H), 7,02 (д, J=2,1 Гц, 1H), 6,93 (д, J=8,2 Гц, 1H), 6,90 (д, J=8,2 Гц, 1H), 5,93-6,08 (м, 2H), 5,17-5,24 (м, 3H), 5,03-5,11 (м, 3H) 3,46 (д, J=6,5 Гц, 2H), 3,35 (д, J=6,7 Гц, 2H);13C-ЯМР (125 МГц, CDCl3) δ 153,9, 150,7, 137,8, 136,0, 132,2, 131,1, 130,2, 129,6, 128,8, 128,6, 127,7, 126,4, 116,9, 116,6, 115,6, 115,5, 39,4, 35,1; МСВР (ЭРИ) m/z=265,1229 вычисл. для C18H17O2 [M-H]-, получено 265,1223.
Пример 12-2
[000112] Гонокиол (3',5-диаллил-[1,1'-бифенил]-2,4'-диол), с использованием BBr3-ДМС
К раствору Соединения V (186 мг, 0,63 ммоль) в перегнанном толуоле (3 мл) медленно добавляли комплекс BBr3⋅ДМС (473 мг, 1,51 ммоль). Реакционный сосуд закрывали и нагревали до 65°C в течение 15 ч. Реакцию останавливали насыщенным раствором NaHCO3 (7 мл) и экстрагировали дихлорметаном (3×7 мл). Объединенные органические слои промывали рассолом (10 мл), сушили над Na2SO4 и фильтровали. Растворитель выпаривали на роторном испарителе и очищали остаток с помощью колоночной хроматографии (силикагель) при использовании 20% этилацетата/гексана в качестве элюента, с получением гонокиола (135 мг, 0,57 ммоль, выход 80%) в виде белого твердого вещества.
[000113] Каждый патент, заявка на патент и печатная публикация, указанные в настоящем патентном документе, полностью включены посредством отсылки.
[000114] Как будет очевидно специалистам в данной области техники, в варианты осуществления, описанные в настоящем документе, могут быть внесены многочисленные изменения и модификации без отступления от сущности изобретения. Предполагается, что все такие варианты включены в объем заявленного изобретения.
Реферат
Настоящее изобретение относится к вариантам способа получения гонокиола, который является потенциальным средством для лечения рака, заболеваний сердца, рассеянного склероза, артрита и остеопороза, а также к промежуточным соединениям и к способам их получения и к вариантам применения промежуточных соединений. Один из вариантов способа получения гонокиола включает реакцию 2-трет-бутил-6-метилфенола с 2-трет-бутил-4-метилфенолом в присутствии катализатора на основе металла, где металл выбирают из хрома, меди, железа, марганца, рутения и ванадия, и окислителя, представляющего собой кислород, с получением 3,3'ди-трет-бутил-5,5'-диметил-[1,1'-бифенил]-2,4'-диола и выделение гонокиола. Предлагаемое изобретение позволяет получить гонокиол с высоким выходом. 7 н. и 11 з.п. ф-лы, 20 пр.
Формула





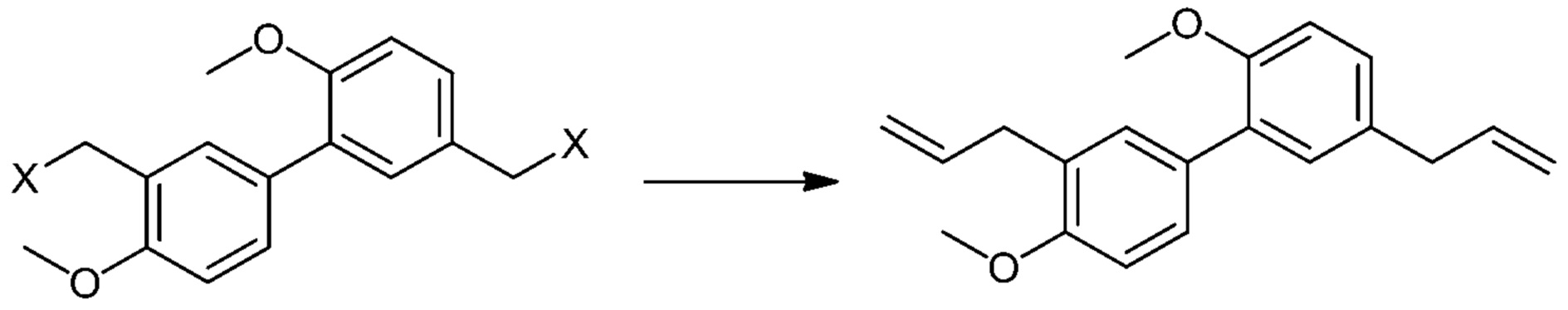

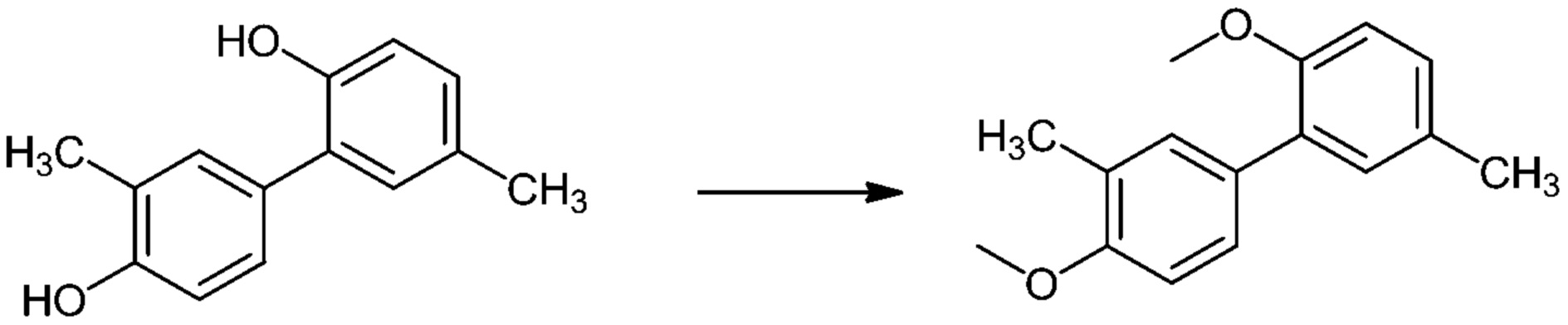






Документы, цитированные в отчёте о поиске
Синтез магнолола и его аналогов

Комментарии